Простациклин – это метаболит, который синтезируется эндотелием. Его выработка происходит постоянно, он выделяется через луминальную поверхность в кровь. Полного разрушения данного гормона не происходит, в отличии от простагландинов, и поэтому из-за увеличения его локальной концентрации могут наблюдаться системные эффекты.
Основной функцией простациклина является препятствие развития тромбоцитарных агрегатов в сосудах и их распространение за участок повреждения при наличии какой-либо патологии. Таким образом, простациклин ограничивает процесс образование тромбов, что крайне важно для организма. Кроме того, данный гормон усиливает действие гормона гепарина, направленного на снижение свертываемости крови, также он способен вызывать сокращения гладких мышц тонкой кишки и ингибировать всасывание ионов натрия в почечный каналец.
Данный гормон был открыт не так давно – в 1976 году в виде стабильного вещества, хотя попытки изучения простациклина начались еще в 60-е годы прошлого столетия. А в 1982 году ученый Джон Вейн получил Нобелевскую премию по физиологии и медицине за свое открытие, связанное с простациклинами и простагландинами.
Уровень простациклина у здорового человека очень низкий, но он может увеличиваться из-за гипоксии, поврежденного гипоксии , под воздействием вазоактивных веществ (эндотелин, ангиотензин, брадикинин, гистамин, адреналин), гемодинамических факторов и т.д.
Специальность:
Хирургия, Травматология, Онкология, Маммология
подробнее
Образование:
Окончил Витебский государственный медицинский университет по специальности «Хирургия». В университете возглавлял Совет студенческого научного общества. Повышение квалификации в 2010 году ‑ по специальности «Онкология» и в 2011 году ‐ по специальности «Маммология, визуальные формы онкологии».
Опыт работы:
Работа в общелечебной сети 3 года хирургом (Витебская больница скорой медицинской помощи, Лиозненская ЦРБ) и по совместительству районным онкологом и травматологом. Работа фарм представителем в течении года в компании «Рубикон».
Представил 3 рационализаторских предложения по теме «Оптимизация антибиотикотерапиии в зависимости от видового состава микрофлоры», 2 работы заняли призовые места в республиканском конкурсе-смотре студенческих научных работ (1 и 3 категории).
Rec.INN
зарегистрированное ВОЗ
Лекарственное взаимодействие
Входит в состав препаратов:
список
Фармакологическое действие
Антиагрегантное средство, аналог простациклина. Ингибирует агрегацию тромбоцитов, адгезию тромбоцитов и реакции высвобождения растворимых молекул адгезии; расширяет артериолы и венулы; увеличивает плотность капилляров и снижает повышенную сосудистую проницаемость, вызванную такими медиаторами как серотонин или гистамин на уровне микроциркулярного русла; стимулирует эндогенную фибринолитическую активность; оказывает противовоспалительные эффекты, такие как ингибирование адгезии лейкоцитов после повреждения эндотелия и лейкоцитарной инфильтрации в поврежденных тканях, а также уменьшение высвобождения ФНОα.
При ингаляционном применении наблюдается прямая вазодилатация легочного артериального русла с последующим значительным улучшением таких показателей как давление в легочных артериях, легочное сосудистое сопротивление, сердечный выброс, а также насыщение кислородом смешанной венозной крови. Влияние на системное сосудистое сопротивление и системное АД минимально.
Фармакокинетика
После в/в инфузии Css достигается через 10-15 мин (время достижения линейно зависит от скорости инфузии). Cmax при скорости инфузии 3 нг/кг/мин — 135±24 пг/мл. После окончания инфузии концентрация в плазме быстро снижается (вследствие высокой интенсивности метаболизма). Через 2 ч после прекращения инфузии концентрация активного вещества составляет менее 10% от Css.
Распределение
Связывание с альбуминами плазмы — 60%. Метаболический клиренс — 20±5 мл/кг/мин. T1/2 в конечной фазе распределения — 1/2 ч.
Метаболизм
Метаболизируется, главным образом, путем бета-окисления боковой карбоксильной цепи и образования основного фармакологически неактивного метаболита тетранорилопроста.
Выведение
Выводится, в основном, почками (80% — в виде тетранорилопроста и четырех конъюгированных его форм — диастереоизомеров), 20% — с желчью. Выведение метаболитов из плазмы и с мочой имеет двухфазный характер: T1/2 из плазмы в первую фазу — около 2 ч, во вторую фазу — около 5 ч, а для мочи — соответственно 2 и 18 ч.
Фармакокинетика в особых клинических случаях
Фармакокинетические параметры не зависят от возраста и пола. При циррозе печени и почечной недостаточности, требующей проведения диализа, клиренс уменьшается в 2-4 раза.
Показания активного вещества
ИЛОПРОСТ
В/в в виде инфузий: облитерирующий тромбангиит (в поздних стадиях при критической ишемии конечностей в случаях отсутствия показаний к реваскуляризации); облитерирующий эндартериит (тяжелые формы, особенно в случаях риска ампутации и при невозможности хирургической операции на сосудах или ангиопластики); синдром Рейно (в поздних стадиях, ведущих к инвалидизации, не поддающихся действию других лекарственных средств).
В виде ингаляций: лечение среднетяжелой и тяжелой стадии легочной гипертензии в случае идиопатической (первичной) артериальной легочной гипертензии, семейной артериальной легочной гипертензии; в случае артериальной легочной гипертензии, обусловленной заболеванием соединительной ткани или действием лекарственных средств или токсинов; в случае легочной гипертензии вследствие хронических тромбозов и/или эмболии легочной артерии при отсутствии возможности хирургического лечения.
Режим дозирования
В/в, в виде инфузий, ежедневно в виде 6-часовой инфузии в периферическую вену или установленный в центральной вене катетер. Скорость введения (доза) зависит от индивидуальной переносимости и составляет 0.5-2 нг/кг/мин.
В течение первых 2-3 дней определяют индивидуальную переносимость лекарственного средства под контролем ЧСС и АД (следует определять в начале инфузии и после каждого увеличения дозы): лечение начинают со скорости введения 0.5 нг/кг/мин в течение 30 мин, затем дозу ступенчато увеличивают на 0.5 нг/кг/мин через каждые 30 мин. Точную скорость инфузии рассчитывают, исходя их массы тела и максимально переносимой дозы, в пределах 0.5-2 нг/кг/мин, с учетом средства используемого для введения.
Длительность лечения — до 4 нед. У больных с синдромом Рейно, для достижения непродолжительной ремиссии (несколько недель) часто достаточно более коротких курсов лечения — 3-5 дней.
В случае возникновения таких побочных эффектов, как головная боль, тошнота или снижение АД, скорость инфузии следует уменьшать до максимальной переносимой. При развитии тяжелых побочных эффектов инфузию необходимо прервать. Лечение возобновляют обычно через 4 недели в дозах, которые пациент хорошо переносил в первые 2-3 дня предыдущего курса лечения.
При почечной недостаточности, требующей диализа, и при циррозе печени рекомендуемую дозу уменьшают в 2 раза.
При ингаляционном применении в соответствующей лекарственной форме разовая доза составляет 2.5-5 мкг. Частота и длительность применения определяются клинической ситуацией. При нарушениях функции печени или почек требуется коррекция режима дозирования.
Побочное действие
Со стороны нервной системы: часто — головокружение, головная боль, парестезии, гиперестезия, звон в ушах, беспокойство, возбуждение, заторможенность, апатия, сонливость; нечасто — тремор, цереброваскулярные расстройства, депрессия, галлюцинации, мигрень, обморок, длительная потеря сознания, нарушение четкости зрительного восприятия, раздражение и боль в глазах; редко — вестибулярные нарушения; частота неизвестна — спутанность сознания.
Со стороны сердечно-сосудистой системы: часто — снижение АД, брадикардия, приливы крови к коже и ощущение жара; нечасто — аритмия (в т.ч. экстрасистолия), ишемия миокарда, инфаркт миокарда, тромбоз глубоких вен, эмболия легочной артерии; частота неизвестна — повышение АД, тахикардия; в единичных случаях (у больных преклонного возраста с выраженным атеросклерозом) — отек легких.
Со стороны дыхательной системы: нечасто — бронхиальная астма; редко — кашель; в единичных случаях (у больных преклонного возраста с выраженным атеросклерозом) — сердечная недостаточность.
Со стороны пищеварительной системы: очень часто — тошнота, рвота; часто — анорексия, диарея, дискомфорт в животе, абдоминальная боль; нечасто — сухость во рту, изменение вкуса, тенезмы, запор, отрыжка, дисфагия, диарея, мелена, ректальное кровотечение, желтуха.
Со стороны костно-мышечной системы: часто — боль в жевательных мышцах, тризм, миалгия, артралгия, мышечная слабость; нечасто — тетания, судорожные подергивания мышц, гипертонус.
Со стороны мочевыделительной системы: боль в пояснице, почечная колика, изменение клеточного состава мочи, дизурия.
Местные реакции: часто — гиперемия кожи, боль, флебит в месте введения.
Прочие: очень часто — потливость; часто — локальные боли, генерализованная боль, гипертермия, кожный зуд, повышенная утомляемость, жажда; частота неизвестна — аллергические реакции.
Противопоказания к применению
Патологические состояния с повышенным риском кровотечения (в т.ч. язвенная болезнь желудка или двенадцатиперстной кишки в фазе обострения, геморрагический инсульт), тяжелая ИБС (нестабильная стенокардия, инфаркт миокарда в течение последних 6 мес); острая или хроническая сердечная недостаточность II-IV ст., тяжелые аритмии, беременность, период лактации (грудного вскармливания), повышенная чувствительность к илопросту.
Применение при беременности и кормлении грудью
Противопоказан при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
При нарушениях функции печени требуется коррекция режима дозирования.
Применение при нарушениях функции почек
При нарушениях функции почек требуется коррекция режима дозирования.
Особые указания
Применяют только в условиях тщательного мониторирования в стационаре или амбулаторных учреждениях, располагающих соответствующими возможностями.
Перед началом лечения у женщин следует исключить беременность.
Следует избегать приема лекарственного вещества внутрь, на слизистые оболочки и кожу (может привести к длительной и безболезненной эритеме). При попадании лекарственного вещества на какой-либо участок кожи его следует немедленно промыть большим количеством воды или 0.9% раствора натрия хлорида.
Не следует откладывать хирургическую операцию больным, нуждающимся в экстренной ампутации ноги (например, при инфицированной газовой гангрене).
Больным следует настоятельно рекомендовать отказаться от курения.
Во время терапии у больных с артериальной гипотензией необходимо принять меры против дальнейшего снижения АД.
Больные с тяжелыми заболеваниями сердца должны находиться под тщательным мониторным наблюдением.
После окончания курса лечения следует учитывать возможность развития ортостатической гипотензии при переходе больного из горизонтального положения в вертикальное.
Случайное введение неразбавленного раствора в окружающие сосуд ткани может привести к их повреждению.
Проводить постоянные инфузии в течение нескольких дней не рекомендуется из-за возможности развития тахифилаксии, выражающейся в ослаблении действия на тромбоциты и возможности возникновения «синдрома рикошета», проявляющегося в повышении склонности к агрегации тромбоцитов при завершении курса терапии (сообщения о клинических осложнениях, связанных с этими феноменами, отсутствуют).
Лекарственное взаимодействие
Усиливает гипотензивное действие бета-адреноблокаторов, блокаторов медленных кальциевых каналов, сосудорасширяющих средств, ингибиторов АПФ (в клинических исследованиях на добровольцах данные не подтверждены).
ГКС в эксперименте усиливают сосудорасширяющее действие илопроста, не изменяя характер антиагрегантного действия (клинический эффект не выявлен).
Гепарин, антикоагулянты непрямого действия (производные кумарина), теоретически могут повысить риск кровотечения (инфузию препарата следует прекратить).
Антиагрегантное действие усиливают другие ингибиторы агрегации тромбоцитов (ацетилсалициловая кислота и другие НПВС, ингибиторы фосфодиэстеразы, нитраты и молсидомин).
Иломедин — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
П N015572/01
Торговое наименование препарата:
Иломедин®
Международное непатентованное наименование:
Илопрост
Лекарственная форма:
Концентрат для приготовления раствора для инфузий
Состав:
активное вещество: 1 мл водного раствора содержит 27 мкг илопроста трометамола (что эквивалентно 20 мкг илопроста).
2,5 мл водного раствора содержит 67 мкг илопроста трометамола (что эквивалентно 50 мкг илопроста).
вспомогательные вещества: трометамол, этанол 96%, натрия хлорид, хлористоводородная кислота 1М, вода для инъекций.
Описание:
Прозрачный, бесцветный или почти бесцветный раствор.
Фармакотерапевтическая группа:
Антиагрегантное средство.
Код АТХ:
B01AC11
Фармакологические свойства
Фармакодинамика
Илопрост является синтетическим аналогом простациклина, ингибирует агрегацию, адгезию и реакцию высвобождения тромбоцитов; расширяет артериолы и венулы; повышает плотность капилляров (восстанавливает нарушенную микроциркуляцию при помощи индукции вазодилятации, торможения активации тромбоцитов, восстановления и защиты эндотелия, активации эндогенного фибринолиза и корректировки дисбаланса в системе цитокинов) и снижает повышенную сосудистую проницаемость, обусловленную медиаторами, такими как серотонин или гистамин, в системе микроциркуляции; активирует эндогенный фибринолиз; проявляет противовоспалительный эффект: подавляет адгезию и миграцию лейкоцитов после повреждения эндотелия, а также накопление лейкоцитов в поврежденной ткани, уменьшает выработку фактора некроза опухоли (ФНО альфа).
Фармакокинетика
Равновесная концентрация в плазме крови достигается очень быстро, через 10-20 минут после начала внутривенной инфузии. Время ее достижения линейно зависит от скорости инфузии, при скорости инфузии 3 нг/кг/мин достигается концентрация, приблизительно равная 135±24 пг/мл. После окончания инфузии концентрация илопроста в плазме очень быстро снижается (это обусловлено очень высокой интенсивностью его метаболизма). Метаболический клиренс составляет примерно 20±5 мл/кг/мин. Период полувыведения из плазмы крови в терминальной фазе распределения составляет около 0,5 часа. Через два часа после прекращения инфузии содержание лекарственного вещества составляет менее 10% от равновесной концентрации. Связь с альбуминами плазмы крови составляет 60%.
Илопрост метаболизируется, главным образом, путем ß-окисления боковой карбоксильной цепи. В неизмененном виде вещество из организма не выделяется. Главный метаболит — тетранорилопрост, обнаруживается в моче в свободном виде и в четырех конъюгированных формах диастереоизомеров. Как показали эксперименты на животных, тетранорилопрост фармакологически неактивен. Результаты исследований in vitro указывают на сходный характер метаболизма илопроста в легких после внутривенного введения или вдыхания.
Выведение илопроста после внутривенной инфузии у субъектов с нормальной функцией почек и печени в большинстве случаев характеризуется двухфазным профилем со средними периодами полувыведения продолжительностью, соответственно, 3-5 минут и 15-30 минут. Общий клиренс илопроста равен приблизительно 20 мл/кг/мин, указывая на то, что метаболизм илопроста происходит частично вне печени.
Было проведено исследование баланса массы с использованием илопроста, меченного 3H, у здоровых субъектов. После внутривенной инфузии выведение общей радиоактивности составило 81%, при этом 68% было выведено с мочой, а 12% — с фекалиями. Элиминация метаболитов из плазмы и выведение их с мочой имеют двухфазный характер, причем время полувыведения из плазмы составляет в первую фазу около 2 часов, во вторую — около 5 часов, а для мочи — соответственно 2 и 18 часов.
При почечной недостаточности
В исследовании с использованием внутривенных инфузий илопроста было показано, что у пациентов с терминальной стадией почечной недостаточности, периодически получающих лечение диализом, клиренс значительно ниже (средний клиренс = 5±2 мл/мин/кг), чем у пациентов с почечной недостаточностью, которые не получают лечение диализом (средний клиренс = 18±2 мл/мин/кг).
При дисфункции печени
Поскольку илопрост интенсивно метаболизируется в печени, изменения печеночной функции влияют на концентрацию препарата в плазме крови. Результаты исследования с внутривенным введением препарата включали данные 8 пациентов, страдающих циррозом печени. Средний клиренс илопроста составил по расчетам 10 мл/мин/кг.
Возраст и пол:
Фармакокинетика илопроста не зависит от возраста и пола больного.
Показания к применению
- Облитерирующий тромбангиит (болезнь Бюргера) на поздних стадиях при критической ишемии конечностей в случаях отсутствия показаний к реваскуляризации.
- Тяжелые формы окклюзионного заболевания периферических артерий, особенно в случаях риска ампутации и при невозможности хирургической операции на сосудах или ангиопластики.
- Тяжелый синдром Рейно, ведущий к инвалидизации, не поддающийся терапии другими лекарственными средствами.
Противопоказания
- Беременность, период лактации
- Повышенная чувствительность к илопросту или другим компонентам препарата
- Патологические состояния, при которых действие илопроста на тромбоциты может повысить риск кровотечения (например, язвенная болезнь желудка или двенадцатиперстной кишки в стадии обострения, травма, внутричерепное кровотечение).
- Тяжелая ишемическая болезнь сердца или нестабильная стенокардия; инфаркт миокарда в течение последних 6 месяцев; острая сердечная недостаточность или хроническая застойная сердечная недостаточность II-IV стадии (по классификации Нью-Йоркской кардиологической ассоциации); тяжелые нарушения ритма сердечных сокращений.
- Подозрение на застойные явления в малом круге кровообращения.
С осторожностью
У пациентов с нарушением мозгового кровообращения за последние 3 месяца (например, преходящее ишемическое нарушение, инсульт). Такие пациенты нуждаются в тщательной оценке соотношения пользы и риска лечения (см. также «Противопоказания»: риск кровотечения, например, внутричерепного кровотечения).
При почечной недостаточности, требующей диализа, и при циррозе печени выведение илопроста снижается (см. Способ применения и дозы).
Необходимо принять меры против дальнейшего снижения АД у пациентов с исходно (до начала терапии Иломедином) низкими цифрами АД; пациенты с тяжелыми заболеваниями сердца должны находиться под тщательным мониторным контролем.
Следует учитывать возможность развития ортостатической гипотензии при переходе пациентов из горизонтального положения в вертикальное после окончания введения Иломедина.
Применение во время беременности и кормления грудью
Иломедин не следует назначать женщинам в период беременности и лактации. Данные о применении илопроста у беременных женщин отсутствуют.
Согласно доклиническим исследованиям илопрост оказывает токсическое действие на плод у крыс, но не у кроликов и обезьян.
Так как потенциальный риск терапевтического применения илопроста при беременности не известен, при лечении илопростом женщины фертильного возраста должны использовать надежные средства контрацепции.
В настоящее время отсутствуют сведения о проникновении илопроста в грудное молоко у человека, однако, поскольку есть сведения о том, что илопрост может в небольшом количестве проникать в молоко у крыс, его не следует вводить кормящим матерям.
Применение у детей
В настоящее время имеются лишь единичные отчеты о применении данного препарата у детей и подростков.
Способ применения и дозы
Длительность лечения — до 4 недель.
Иломедин должен применяться только в условиях тщательного мониторного контроля в больницах или амбулаторных учреждениях, располагающими соответствующими техническими возможностями.
Перед началом лечения у женщин следует исключить беременность.
Иломедин должен применяться только после разведения.
Раствор должен быть свежеприготовленным.
Содержимое ампулы и растворитель должны быть тщательно перемешаны.
Разведение
Необходимо строго соблюдать метод разведения в зависимости от способа введения раствора.
При использовании инфузомата (инфузионный насос)
Содержимое ампулы 1 мл концентрата для приготовления раствора для инфузий разводят стерильным 0,9% раствором натрия хлорида или 5% раствором глюкозы (декстрозы) для инъекций до объема 100 мл.
Содержимое ампулы 2,5 мл концентрата для приготовления раствора для инфузий разводят стерильным 0,9% раствором натрия хлорида или 5% раствором глюкозы (декстрозы) для инъекций до объема 250 мл.
При использовании автоматического шприца
Содержимое ампулы 1 мл концентрата для приготовления раствора для инфузий разводят стерильным 0,9% раствором натрия хлорида или 5% раствором глюкозы (декстрозы) для инъекций до объема 10 мл.
Содержимое ампулы 2,5 мл концентрата для приготовления раствора для инфузий разводят стерильным 0,9% раствором натрия хлорида или 5% раствором глюкозы (декстрозы) для инъекций до объема 25 мл.
После разведения Иломедин вводят ежедневно в виде 6-часовой инфузии в периферическую вену или установленный в центральной вене катетер. Скорость введения (доза) зависит от индивидуальной переносимости и составляет 0,5-2,0 нг на 1 кг массы тела в минуту.
Необходимо контролировать артериальное давление и ЧСС в начале инфузии и при каждом увеличении дозы препарата.
В течение первых 2-3 дней определяют индивидуальную переносимость препарата — лечение начинают со скорости введения 0,5 нг/кг/мин в течение 30 мин. После этого дозу ступенчато увеличивают на 0,5 нг/кг/мин примерно через каждые 30 мин. Точную скорость инфузии рассчитывают исходя из массы тела при максимальной переносимой дозе в пределах от 0,5 до 2,0 нг/кг/мин. (см. ниже, таблицы скорости инфузии при использовании инфузомата или автоматического шприца).
В зависимости от частоты таких побочных действий, как головная боль, тошнота или снижение АД, скорость инфузии следует уменьшать до максимально переносимой. При развитии тяжелых побочных действий инфузию необходимо прервать. Лечение должно быть продолжено обычно в течение 4 недель, применяя дозы, которые хорошо переносились в первые 2-3 дня предыдущего курса лечения.
Скорость инфузии (мл/час) для введения различных доз при использовании инфузомата (инфузионного насоса)
Следующая таблица может использоваться для расчета скорости инфузии, соответствующей массе тела конкретного пациента и дозе, которую требуется ввести.
Таблица 1
| Масса тела (кг) | Доза (нг/кг/мин) | |||
| 0,5 | 1,0 | 1,5 | 2,0 | |
| Скорость инфузии (мл/час) | ||||
| 40 | 6,0 | 12 | 18,0 | 24 |
| 50 | 7,5 | 15 | 22,5 | 30 |
| 60 | 9,0 | 18 | 27,0 | 36 |
| 70 | 10,5 | 21 | 31,5 | 42 |
| 80 | 12,0 | 24 | 36,0 | 48 |
| 90 | 13,5 | 27 | 40,5 | 54 |
| 100 | 15,0 | 30 | 45,0 | 60 |
| 110 | 16,5 | 33 | 49,5 | 66 |
Скорость инфузии (мл/час) для введения различных доз при использовании автоматического шприца
Следующая таблица может использоваться для расчета скорости инфузии, соответствующей массе тела конкретного пациента и дозе, которую требуется ввести.
Таблица 2
| Масса тела (кг) | Доза (нг/кг/мин) | |||
| 0,5 | 1,0 | 1,5 | 2,0 | |
| Скорость инфузии (мл/час) | ||||
| 40 | 0,60 | 1,2 | 1,80 | 2,4 |
| 50 | 0,75 | 1,5 | 2,25 | 3,0 |
| 60 | 0,90 | 1,8 | 2,70 | 3,6 |
| 70 | 1,05 | 2,1 | 3,15 | 4,2 |
| 80 | 1,20 | 2,4 | 3,60 | 4,8 |
| 90 | 1,35 | 2,7 | 4,05 | 5,4 |
| 100 | 1,50 | 3,0 | 4,50 | 6,0 |
| 110 | 1,65 | 3,3 | 4,95 | 6,6 |
У пациентов с системной склеродермией, страдающих синдромом Рейно, для достижения улучшения, продолжающегося несколько недель, часто достаточно более короткого курса лечения (3-5 дней).
Не рекомендуется проводить непрерывные инфузии в течение нескольких дней из-за возможности развития тахифилаксии, выражающейся в ослаблении действия на тромбоциты, и возможности возникновения «синдрома рикошета», проявляющегося в повышении склонности к агрегации тромбоцитов при завершении курса терапии. Вместе с тем сообщения о каких бы то ни было клинических осложнениях, связанных с этими феноменами, отсутствуют.
При почечной недостаточности, требующей диализа, и при циррозе печени выведение илопроста снижается. В этих случаях необходимо снизить рекомендуемую дозу в 2 раза.
Побочное действие
Наиболее часто наблюдающимися нежелательными реакциями (>10 %), отмеченными при применении Иломедина в клинических исследованиях, являлись головная боль, приливы, тошнота, рвота, гипергидроз. Обычно эти побочные эффекты возникают в начале лечения при подборе максимально переносимой дозы и быстро исчезают с уменьшением дозы.
Наиболее серьезными нежелательными реакциями, отмеченными при применении Иломедина, являлись цереброваскулярные нарушения, инфаркт миокарда, тромбоэмболия легочной артерии, сердечная недостаточность, судороги, гипотензия, тахикардия, бронхиальная астма, стенокардия, одышка и отек легких.
Другая группа побочных действий связана с реакциями в месте введения. Так, в месте введения может возникнуть покраснение и боль, а дилатация кожных сосудов иногда может привести к возникновению эритемы в виде полоски над местом инфузии.
Нежелательные побочные эффекты, отмеченные при применении Иломедина в ходе клинических исследований, распределены по частоте возникновения в соответствии со следующей градацией: очень частые (>1/10), частые (>1/100 и <1/10), нечастые (>1/1000 и <1/100), редкие (>1/10000 и <1/1000), очень редкие (<1/10000).
Профиль безопасности Иломедина оценивается на основе объединенных данных клинических исследований и постмаркетингового применения. Приблизительные показатели частоты основаны на суммарной базе данных по 3325 пациентам, получавшим илопрост в ходе как контролируемых, так и неконтролируемых клинических исследований, или в рамках программы благотворительно-испытательного использования. Данные получены главным образом у пожилых пациентов и пациентов с множественной патологией, страдающих от окклюзионной болезни периферических артерий в III и IV стадиях, а также у пациентов с облитерирующим тромбангиитом.
| Система организма | Очень частые | Частые | Нечастые | Редкие |
| Нарушения метаболизма и питания | Снижение аппетита | |||
| Нервная система | Головная боль | Апатия, спутанное сознание, головокружение/ вертиго, парестезия/ повышенная кожная чувствительность / гиперестезия/ чувство жжения, беспокойство/ возбуждение, заторможенность, сонливость | Судороги*, обмороки, тремор, беспокойство, депрессия, галлюцинации, мигрень | |
| Орган зрения | Нарушение четкости зрения, раздражение слизистой оболочки глаз, боль в глазах. | |||
| Орган слуха | Вестибулярные нарушения | |||
| Сердечно-сосудистая система | Приливы | Гипотензия*, тахикардия*, брадикардия, стенокардия*, повышенное артериальное давление | Инфаркт миокарда*, сердечная недостаточность*, аритмия/ экстрасистолия, цереброваскулярные расстройства*/ цереброваскулярная ишемия, эмболия легочной артерии*, тромбоз глубоких вен. | |
| Кровь и лимфатическая система | Тромбоцитопения | |||
| Органы дыхания | Одышка* | Бронхиальная астма*, отек легких*. | Кашель | |
| Желудочно-кишечный тракт | Тошнота, рвота. | Диарея, абдоминальный дискомфорт/ боль. | Диарея с кровью, ректальное кровотечение, диспепсия, ректальные тенезмы, запор, отрыжка, дисфагия, сухость во рту/ изменение вкуса. | Проктит |
| Гепатобилиарная система | Желтуха | |||
| Кожа и подкожная ткань | Гипергидроз | Зуд | ||
| Опорно-двигательная система | Боль в жевательных мышцах/ тризм, миалгия/ артралгия. | Тетания/ мышечные спазмы, гипертонус. | ||
| Почки и мочевыделительная система | Боль в области почек, везикальные тенезмы, изменения в показателях мочи, дизурия, нарушения со стороны мочевыводящих путей. | |||
| Общая патология и нарушения в месте введения | Боль, гипертермия/ повышение температуры тела, ощущение тепла, общая слабость/ недомогание, озноб, утомляемость/ усталость, жажда, местные реакции (эритема, боль, флебит). | Реакции гиперчувствительности |
* Сообщалось об угрожающих жизни последствиях или летальном исходе.
Илопрост может провоцировать стенокардию, особенно у пациентов с ишемической болезнью сердца.
Применение илопроста в комбинации с ингибиторами агрегации тромбоцитов, гепарином или антикоагулянтами непрямого действия (производными кумарина) повышает риск кровотечения.
Передозировка
- Симптомы передозировки
Может ожидаться снижение АД, а также головная боль, приток крови к лицу, тошнота, рвота и диарея. Возможны повышение АД, брадикардия или тахикардия, боль в голенях или в спине. - Лечение при передозировке
Рекомендуется прерывание инфузии, дальнейшее мониторирование пациентов и симптоматическая терапия. Специфические антидоты неизвестны.
Взаимодействие с другими лекарственными средствами и другие формы взаимодействия
Из-за возможного взаимодействия нельзя смешивать Иломедин в одном растворе с другими лекарственными препаратами.
Илопрост усиливает антигипертензивное действие ß-адреноблокаторов, блокаторов «медленных» кальциевых каналов и всех сосудорасширяющих средств, а также ингибиторов АПФ. Если же возникает значительная артериальная гипотензия, АД удается скорректировать, уменьшив дозу илопроста.
Поскольку илопрост подавляет функции тромбоцитов, его применение в комбинации с гепарином или антикоагулянтами непрямого действия (производными кумарина) или другими ингибиторами агрегации тромбоцитов (ацетилсалициловой кислотой, нестероидными противовоспалительными препаратами, ингибиторами фосфодиэстеразы и вазодилятаторами из группы нитратов, например, молсидомином), может повысить риск кровотечения. В подобном случае инфузию Иломедина следует прекратить.
Применение ацетилсалициловой кислоты в дозе до 300 мг в сутки курсом 8 дней, предшествующее применению Иломедина, не оказывало никакого влияния на фармакокинетику илопроста. В исследовании на животных было обнаружено, что илопрост может вызывать снижение равновесной концентрации препаратов тканевого активатора плазминогена (ТАП) в плазме. Результаты исследований у человека показывают, что инфузии илопроста не затрагивают фармакокинетику многократных пероральных доз дигоксина у пациентов, и что при одновременном применении с препаратами ТАП илопрост не оказывает влияния на его фармакокинетику.
В экспериментах на животных сосудорасширяющее действие илопроста ослаблялось, если подопытные животные предварительно получали глюкокортикостероиды, однако ингибирующее действие на агрегацию тромбоцитов при этом не изменялось. Значение этих данных для клиники пока не установлено.
Хотя клинических исследований не проводилось, исследования in vitro, в ходе которых изучался ингибирующий потенциал илопроста в отношении активности ферментов системы цитохрома Р450, выявили, что существенное подавление метаболизма лекарственных средств этими ферментами в результате воздействия на них илопроста маловероятно.
Особые указания
В надежде на успех консервативной терапии илопростом не следует откладывать хирургическую операцию больным, нуждающимся в экстренной ампутации ноги (например, при инфицированной газовой гангрене).
Пациентам следует настоятельно рекомендовать отказаться от курения.
Случайное введение неразбавленного раствора Иломедина в близлежащие ткани может привести к их локальному изменению в месте инъекции (покраснение, боль, зуд, чувство жара).
Следует избегать приема препарата внутрь и его попадания на слизистые оболочки. Попадая на кожу, илопрост может привести к длительной, хотя и безболезненной, эритеме. Поэтому необходимо соблюдать осторожность и избегать контакта препарата с кожей. При попадании илопроста на какой-либо участок кожи его следует немедленно промыть большим количеством воды или физиологическим раствором натрия хлорида.
Влияние на способность управлять транспортными средствами и механизмами
Форма выпуска
Концентрат для приготовления раствора для инфузий 20 мкг/мл.
По 1 мл и 2,5 мл в ампулы вместимостью соответственно 1 мл и 3 мл из бесцветного гидролитического стекла типа 1.
По 1 или 5 ампул в картонный поддон. 1 поддон с 1 или 5 ампулами или 4 поддона с 5 ампулами вместе с инструкцией по применению помещают в картонную пачку.
Условия хранения
Хранить при температуре не выше 30°С.
Хранить в недоступном для детей месте.
Срок годности
4 года.
Не использовать по истечении срока годности.
Условия отпуска
По рецепту.
Производитель
Берлимед С.А., Испания
ул. Франсиско Алонсо, 6/н Полигон Санта-Роза 28806 Алькала-де-Энарес (Мадрид), Испания
Berlimed S.A., Spain
C/ Francisco Alonso, s/n Poligono Santa Rosa 28806 Alcala de Henares (Madrid), Spain
Юридическое лицо, на имя которого выдано регистрационное удостоверение
Байер Фарма АГ, Мюллерштрассе 178, 13353 Берлин, Германия
Bayer Pharma AG, Mullerstrasse 178, 13353 Berlin, Germany
За дополнительной информацией и с претензиями обращаться по адресу:
107113 Москва, 3-я Рыбинская ул., д. 18 стр. 2
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Актуальность
Острый респираторный дистресс-синдром (ОРДС) приводит к низкому содержанию кислорода в крови, он может начать развиваться, когда жидкость накапливается в легких из-за воспаления. Прямые или непрямые травмы легких могут вызвать ОРДС у детей и взрослых. Такие травмы включают сепсис (тяжелое состояние, при котором тело реагирует на инфекцию поражением своих собственных тканей и органов), вирусные инфекции, ожоги, массивные переливания крови, множественные травмы, заброс содержимого желудка в дыхательную систему, воспаление поджелудочной железы, травмы при вдыхании или ингаляции, передозировки лекарств и, неполное утопление (когда человек почти утонул). ОРДС является одной из основных причин смерти у критически больных людей.
Простациклин можно вводить в виде аэрозоля тяжело больным взрослым и детям с ОРДС для повышения уровня кислорода в крови и улучшения выживаемости. Простациклин — это простагландин естественного происхождения, который расслабляет кровеносные сосуды, предотвращает свертывание крови (агрегацию тромбоцитов) и обладает противовоспалительными свойствами в легких.
Характеристика исследований
Этот обзор был обновлен в 2017 году. Мы включили два рандомизированных контролируемых испытания (РКИ; клинические исследования, в которых люди случайно попадают в одну из двух или более групп лечения). В одном исследовании участвовали 14 тяжелобольных детей с ОРДС, а в другом — 67 взрослых в критическом состоянии с ОРДС. В этих испытаниях не измеряли тяжесть болезни, разрешение дисфункции органов, продолжительность пребывания в отделении интенсивной терапии или больницы и качество жизни. Авторы исследований не отчитались о таких побочных эффектах, как кровотечения, нарушение функции органов, реактивность дыхательных путей, или о побочных эффектах, не относившихся к этому вмешательству.
Источник финансирования исследования
Ни в одном из включенных испытаний не сообщили о получении денег от фармацевтических компаний.
Основные результаты
Только в РКИ с участием детей, представили данные о смертях, но без четкой разницы между применением простациклина и без него.
В РКИ, в которых участвовали взрослые, сообщили о тенденции к повышению уровня кислорода в крови у участников, которых лечили алпростадилом (простагландином E1).
Поэтому мы не смогли выявить явное преимущество использования аэрозольного простациклина у тяжело (критически) больных детей или взрослых с низким уровнем кислорода в крови.
Качество доказательств
Качество доказательств было очень низким из-за ограниченного числа участников и плохого дизайна исследования. В РКИ с участием детей использовали перекрестный дизайн, при котором одна группа сначала получала аэрозольный простациклин, а другая — физиологический (солевой) раствор. После перекреста лечение в группах меняли на альтернативное. В обоих испытаниях было недостаточно информации о влиянии лечения на смерть.
Мы пришли к выводу, что существует необходимость в проведении широкомасштабного клинического испытания с низким риском смещения (вводящей в заблуждение информации) для изучения преимуществ и вреда простациклина у критически больных людей.
Заметки по переводу:
Перевод: Лиенхард Дина Айратовна. Редактирование: Зиганшина Лилия Евгеньевна. Координация проекта по переводу на русский язык: Казанский федеральный университет — аффилированный центр в Татарстане Северного Кокрейновского Центра. По вопросам, связанным с этим переводом, пожалуйста, обращайтесь к нам по адресу: lezign@gmail.com
From Wikipedia, the free encyclopedia
 |
|
 |
|
| Clinical data | |
|---|---|
| Trade names | Flolan, Veletri |
| AHFS/Drugs.com | Monograph |
| License data |
|
| Pregnancy category |
|
| ATC code |
|
| Legal status | |
| Legal status |
|
| Pharmacokinetic data | |
| Elimination half-life | 42 seconds |
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| IUPHAR/BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEMBL |
|
| CompTox Dashboard (EPA) |
|
| Chemical and physical data | |
| Formula | C20H32O5 |
| Molar mass | 352.471 g·mol−1 |
| 3D model (JSmol) |
|
|
SMILES
|
|
|
InChI
|
|
| |
Prostacyclin (also called prostaglandin I2 or PGI2) is a prostaglandin member of the eicosanoid family of lipid molecules. It inhibits platelet activation and is also an effective vasodilator.
When used as a drug, it is also known as epoprostenol.[1] The terms are sometimes used interchangeably.[2]
Function[edit]
Prostacyclin (PGI2) chiefly prevents formation of the platelet plug involved in primary hemostasis (a part of blood clot formation). It does this by inhibiting platelet activation.[3] It is also an effective vasodilator. Prostacyclin’s interactions contrast with those of thromboxane (TXA2), another eicosanoid. Both molecules are derived from arachidonic acid, and work together with opposite platelet aggregatory effects. These strongly suggest a mechanism of cardiovascular homeostasis between these two hormones in relation to vascular damage.
Medical uses[edit]
It is used to treat pulmonary arterial hypertension (PAH),[4][5] pulmonary fibrosis,[6] as well as atherosclerosis.[6] Specifically, epoprostenol is given to patients with class III or class IV PAH.[citation needed]
Degradation[edit]
Prostacyclin, which has a half-life of 42 seconds,[7] is broken down into 6-keto-PGF1, which is a much weaker vasodilator.
A way to stabilize prostacyclin in its active form, especially during drug delivery, is to prepare prostacyclin in alkaline buffer. Even at physiological pH, prostacyclin can rapidly form the inactive hydration product 6-keto-prostaglandin F1α.[8]
Mechanism[edit]
-
Prostacyclin effect Mechanism Cellular response Classical
functionsVessel tone ↑cAMP, ↓ET-1
↓Ca2+, ↑K+↓SMC proliferation
↑VasodilationAntiproliferative ↑cAMP
↑PPARgamma↓Fibroblast growth
↑ApoptosisAntithrombotic ↓Thromboxane-A2
↓PDGF↓Platelet aggregation
↓Platelet adherence to vessel wallNovel
functionsAntiinflammatory ↓IL-1, IL-6
↑IL-10↓Proinflammatory cytokines
↑Antiinflammatory cytokinesAntimitogenic ↓VEGF
↓TGF-β↓Angiogenesis
↑ECM remodeling
As mentioned above, prostacyclin (PGI2) is released by healthy endothelial cells and performs its function through a paracrine signaling cascade that involves G protein-coupled receptors on nearby platelets and endothelial cells. The platelet Gs protein-coupled receptor (prostacyclin receptor) is activated when it binds to PGI2. This activation, in turn, signals adenylyl cyclase to produce cAMP. cAMP goes on to inhibit any undue platelet activation (in order to promote circulation) and also counteracts any increase in cytosolic calcium levels that would result from thromboxane A2 (TXA2) binding (leading to platelet activation and subsequent coagulation). PGI2 also binds to endothelial prostacyclin receptors, and in the same manner, raises cAMP levels in the cytosol. This cAMP then goes on to activate protein kinase A (PKA). PKA then continues the cascade by promoting the phosphorylation of the myosin light chain kinase, which inhibits it and leads to smooth muscle relaxation and vasodilation. It can be noted that PGI2 and TXA2 work as physiological antagonists.
Members[9][edit]
| PROSTACYCLINS | |||
|---|---|---|---|
| Flolan (epoprostenol sodium) for Injection |
Continuously infused | 2 ng/kg/min to start, increased by 2 ng/kg/min every 15 minutes or longer until suitable efficacy/tolerability balance is achieved | Class III Class IV |
| Veletri (epoprostenol) for Injection |
Continuously infused | 2 ng/kg/min to start, increased by 2 ng/kg/min every 15 minutes or longer until suitable efficacy/tolerability balance is achieved | Class III Class IV |
| Remodulin SC§ (treprostinil sodium) Injection |
Continuously infused | 1.25 ng/kg/min to start, increased by up to 1.25 ng/kg/min per week for 4 weeks, then up to 2.5 ng/kg/min per week until suitable efficacy/tolerability balance is achieved | Class II Class III Class IV |
| Ventavis (iloprost) Inhalation Solution |
Inhaled 6–9 times daily | 2.5 μg 6–9 times daily to start, increased to 5.0 μg 6–9 times daily if well tolerated | Class III Class IV |
Pharmacology[edit]
Ball-and-stick model of prostacyclin
Synthetic prostacyclin analogues (iloprost, cisaprost) are used intravenously, subcutaneously or by inhalation:
- as a vasodilator in severe Raynaud’s phenomenon or ischemia of a limb;
- in pulmonary hypertension.
- in primary pulmonary hypertension (PPH)
The production of prostacyclin is inhibited by the action of NSAIDs on cyclooxygenase enzymes COX1 and COX2. These convert arachidonic acid to prostaglandin H2 (PGH2), the immediate precursor of prostacyclin. Since thromboxane (an eicosanoid stimulator of platelet aggregation) is also downstream of COX enzymes, one might think that the effect of NSAIDs would act to balance. However, prostacyclin concentrations recover much faster than thromboxane levels, so aspirin administration initially has little to no effect but eventually prevents platelet aggregation (the effect of prostaglandins predominates as they are regenerated). This is explained by understanding the cells that produce each molecule, TXA2 and PGI2. Since PGI2 is primarily produced in a nucleated endothelial cell, the COX inhibition by NSAID can be overcome with time by increased COX gene activation and subsequent production of more COX enzymes to catalyze the formation of PGI2. In contrast, TXA2 is released primarily by anucleated platelets, which are unable to respond to NSAID COX inhibition with additional transcription of the COX gene because they lack DNA material necessary to perform such a task. This allows NSAIDs to result in PGI2 dominance that promotes circulation and retards thrombosis.
In patients with pulmonary hypertension, inhaled epoprostenol reduces pulmonary pressure, and improves right ventricular stroke volume in patients undergoing cardiac surgery. A dose of 60 μg is hemodynamically safe, and its effect is completely reversed after 25 minutes. No evidence of platelet dysfunction or an increase in surgical bleeding after administration of inhaled epoprostenol has been found.[10] The drug has been known to cause flushing, headaches and hypotension.[11]
Synthesis[edit]
Biosynthesis[edit]
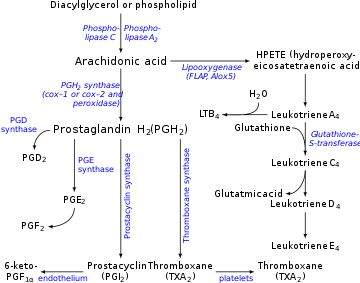
Eicosanoid synthesis. (Prostacyclin near bottom center.)
Prostacyclin is produced in endothelial cells, which line the walls of arteries and veins,[12] from prostaglandin H2 (PGH2) by the action of the enzyme prostacyclin synthase. Although prostacyclin is considered an independent mediator, it is called PGI2 (prostaglandin I2) in eicosanoid nomenclature, and is a member of the prostanoids (together with the prostaglandins and thromboxane). PGI2, derived primarily from COX-2 in humans, is the major arachidonate metabolite released from the vascular endothelium. This is a controversial point, some assign COX 1 as the major prostacyclin producing cyclooxygenase in the endothelial cells of the blood vessels.[13]
The series-3 prostaglandin PGH3 also follows the prostacyclin synthase pathway, yielding another prostacyclin, PGI3.[14] The unqualified term ‘prostacyclin’ usually refers to PGI2. PGI2 is derived from the ω-6 arachidonic acid. PGI3 is derived from the ω-3 EPA.
Artificial synthesis[edit]
Prostacyclin can be synthesized from the methyl ester of prostaglandin F2α.[15] After its synthesis, the drug is reconstituted in saline and glycerin.[16]
Because prostacyclin is so chemically labile, quantitation of their inactive metabolites, rather than the active compounds, is used to assess their rate of synthesis.[17]
History[edit]
During the 1960s, a UK research team, headed by Professor John Vane, began to explore the role of prostaglandins in anaphylaxis and respiratory diseases. Working with a team from the Royal College of Surgeons, Vane discovered that aspirin and other oral anti-inflammatory drugs work by inhibiting the synthesis of prostaglandins. This critical finding opened the door to a broader understanding of the role of prostaglandins in the body.
A team at The Wellcome Foundation led by Salvador Moncada had identified a lipid mediator they called «PG-X,» which inhibits platelet aggregation. PG-X, later known as prostacyclin, is 30 times more potent than any other then-known anti-aggregatory agent. They did this while searching for an enzyme that generates a fellow unstable prostanoid, Thromboxane A2[18]
In 1976, Vane and fellow researchers Salvador Moncada, Ryszard Gryglewski, and Stuart Bunting published the first paper on prostacyclin in Nature.[19] The collaboration produced a synthesized molecule, which was named epoprostenol. But, as with native prostacyclin, the epoprostenol molecule is unstable in solution and prone to rapid degradation.[citation needed] This presented a challenge for both in vitro experiments and clinical applications.
To overcome this challenge, the research team that discovered prostacyclin continued the research. The research team synthesized nearly 1,000 analogues.[citation needed]
References[edit]
- ^ «epoprostenol» at Dorland’s Medical Dictionary
- ^ Kermode J, Butt W, Shann F (August 1991). «Comparison between prostaglandin E1 and epoprostenol (prostacyclin) in infants after heart surgery». British Heart Journal. 66 (2): 175–178. doi:10.1136/hrt.66.2.175. PMC 1024613. PMID 1883670.
- ^ Pathologic Basis of Disease, Robbins and Cotran, 8th ed. Saunders Philadelphia 2010
- ^ «Epoprostenol Sodium Monograph for Professionals». Drugs.com. AHFS. 6 April 2020. Retrieved 22 October 2020.
- ^ «Flolan- epoprostenol sodium injection, powder, lyophilized, for solution Diluent- water solution». DailyMed. 15 November 2019. Retrieved 22 October 2020.
- ^ a b Stitham J, Midgett C, Martin KA, Hwa J (13 May 2011). «Prostacyclin: an inflammatory paradox». Frontiers in Pharmacology. Frontiers Media S.A. 2: 24. doi:10.3389/fphar.2011.00024. PMC 3108482. PMID 21687516.
- ^ Cawello W, Schweer H, Müller R, Bonn R, Seyberth HW (1994). «Metabolism and pharmacokinetics of prostaglandin E1 administered by intravenous infusion in human subjects». European Journal of Clinical Pharmacology. 46 (3): 275–277. doi:10.1007/BF00192562. PMID 8070511. S2CID 25410558.
- ^ Lewis PJ, Dollery CT (July 1983). «Clinical pharmacology and potential of prostacyclin». British Medical Bulletin. 39 (3): 281–4. doi:10.1093/oxfordjournals.bmb.a071834. PMID 6354353.
- ^ ^ REM_RefGuideWC_AUG07v.1
- ^ Haché M, Denault A, Bélisle S, Robitaille D, Couture P, Sheridan P, et al. (March 2003). «Inhaled epoprostenol (prostacyclin) and pulmonary hypertension before cardiac surgery». The Journal of Thoracic and Cardiovascular Surgery. 125 (3): 642–649. doi:10.1067/mtc.2003.107. PMID 12658208.
- ^
Nickson, C. (2015, October 28). Prostacyclin or Epoprostenol. Retrieved November 16, 2015, from http://lifeinthefastlane.com/ccc/prostacyclin-or-epoprostenol/ - ^ prostacyclin. (n.d.) Miller-Keane Encyclopedia and Dictionary of Medicine, Nursing, and Allied Health, Seventh Edition. (2003). Retrieved November 17, 2015 from http://medical-dictionary.thefreedictionary.com/prostacyclin
- ^ Kirkby NS, Lundberg MH, Harrington LS, Leadbeater PD, Milne GL, Potter CM, et al. (October 2012). «Cyclooxygenase-1, not cyclooxygenase-2, is responsible for physiological production of prostacyclin in the cardiovascular system». Proceedings of the National Academy of Sciences of the United States of America. 109 (43): 17597–17602. Bibcode:2012PNAS..10917597K. doi:10.1073/pnas.1209192109. PMC 3491520. PMID 23045674.
- ^ Fischer S, Weber PC (September 1985). «Thromboxane (TX)A3 and prostaglandin (PG)I3 are formed in man after dietary eicosapentaenoic acid: identification and quantification by capillary gas chromatography-electron impact mass spectrometry». Biomedical Mass Spectrometry. 12 (9): 470–476. doi:10.1002/bms.1200120905. PMID 2996649.
- ^ Johnson RA, Lincoln FH, Nidy EG, Schneider WP, Thompson JL, Axen U (1978). «Synthesis and characterization of prostacyclin, 6-ketoprostaglandin F1.alpha., prostaglandin I1, and prostaglandin I3». Journal of the American Chemical Society. 100 (24): 7690–7705. doi:10.1021/ja00492a043.
- ^
Nickson C (15 October 2015). «Prostacyclin or Epoprostenol». Life in the Fast Lane. Archived from the original on 28 March 2015. Retrieved 16 November 2015. - ^ Collins PW, Djuric SW (1993). «Synthesis of therapeutically useful prostaglandin and prostacyclin analogs». Chemical Reviews. 03 (4): 1533–1564. doi:10.1021/cr00020a007.
- ^ Kermode J, Butt W, Shann F (August 1991). «Comparison between prostaglandin E1 and epoprostenol (prostacyclin) in infants after heart surgery». British Heart Journal. 66 (2): 175–178. doi:10.1016/s0002-9149(99)80377-4. PMC 1024613. PMID 1883670.
- ^ Moncada S, Gryglewski R, Bunting S, Vane JR (October 1976). «An enzyme isolated from arteries transforms prostaglandin endoperoxides to an unstable substance that inhibits platelet aggregation». Nature. 263 (5579): 663–665. Bibcode:1976Natur.263..663M. doi:10.1038/263663a0. PMID 802670. S2CID 4279030.
External links[edit]
- «Epoprostenol». Drug Information Portal. U.S. National Library of Medicine.
- «Epoprostenol sodium». Drug Information Portal. U.S. National Library of Medicine.