Радионуклидная диагностика — это метод лучевой диагностики, основанный на регистрации излучения введённых в организм искусственных радиоактивных веществ (радиофармпрепаратов). Это исследование помогает изучить как организм в целом, так и клеточный метаболизм, что очень важно при онкологии.

Что такое радионуклидная диагностика?
Радионуклидная диагностика в медицине ― исследование, суть которого заключается в радиометрическом излучении. Радиация источается внутренними органами и тканями после введения специальных радиофармацевтических средств (РФП) внутрь пациента.
Эти средства отличаются радиоактивностью и не дают фармакодинамического эффекта на организм. Изотопные атомы накапливаются и рассредоточиваются в организме, таким образом отражая динамику протекающих процессов.
Данная методика позволяет визуализировать орган, качественно и количественно оценить показатели паренхимы. Однако она не воздействует на нормальные или аномальные процессы человеческого организма.
Виды обследования:
- ОФЭКТ (компьютерная томография);
- радиоизотопная диагностика;
- гамма-камеры.
Преимуществами процедуры являются:
- точность и информативность;
- безболезненность;
- малотравматичность;
- низкий риск осложнений;
- скорость обследования.
О том, что такое радионуклидная диагностика, можно узнать из видео от канала Отделение опухолей.
Показания к проведению диагностики
Показания для обследования:
- поражение миокарда;
- пороки сердца;
- нарушение сердечной гемодинамики;
- эмболия;
- рубцовые изменения на сердце;
- метастазы;
- инфекционные и воспалительные болезни;
- болезнь Альцгеймера;
- болезнь Паркинсона;
- деменция;
- аномалия щитовидной железы;
- работа почек и их кровоснабжения;
- онкологические заболевания ЖКТ;
- гепатобилиарная система.
Противопоказания к назначению обследования
Процедура имеет несколько противопоказаний:
- личная непереносимость к радиофармацевтическим средствам;
- беременность;
- лактация;
- высокая температура;
- острые заболевания психики;
- респираторные болезни;
- почечная и печеночная недостаточность.
Методы радионуклидной диагностики
К типам исследования относят методики in vivo и in vitro.
In vitro
Диагностика с использованием этой методики не предполагает введение внутрь организма РФП. Этот вариант отличается безопасностью, потому что метода основывается на извлечении паренхимы и жидкостей. Больной не получает даже минимума облучения, поэтому методика имеет широкое применение в онкологии.
In vivo
Тесты in vivo проводятся внутри организма пациента. Врачу нет необходимости делать забор биологического материала. Пациент вынужден принять радиофармацевтические средства.
Способы введения радионуклидов
Введение внутрь организма больного осуществляется несколькими способами:
- Энтеральный. В этом случае вещества всасываются в кровь через кишечник. Находит применение для диагностирования аномалий щитовидной и паращитовидной желез.
- Внутривенный. При помощи этого вида удается изучить внутренние органы и паренхиму.
- Подкожный. С его помощью осуществляется изучение работы сосудистой и лимфатической систем. Радиофармацевтический препарат в некоторых случаях может быть введен прямо в лимфоузел.
- Ингаляционный. Способ визуализации, при помощи которого можно исследовать состояние легких и кровообращение в головном мозге.
- Внутримышечный. С помощью этого способа исследуется кровообращение в организме.
- Спинномозговой. Осуществляется посредством введения в канал спинного мозга специальной иглы с препаратом.
Способы регистрации распределения радиоактивных веществ
Виды диагностики:
- сцинтиграфия;
- сканирование;
- радиометрия;
- радиография;
- томография.
Сцинтиграфия
При помощи этого способа врач может визуализировать и тщательно изучить внутренний орган, а также исследовать степень накопления в нем препарата. Это позволяет вовремя обнаружить аномалии органов и различные патологические процессы.
Диагностирование происходит посредством гамма-камеры, которая при помощи йодида натрия фиксирует излучение радиофармацевтических препаратов.
Сканирования
При помощи сканирования можно получить двухмерную качественную картинку рассредоточения радионуклида по организму. Приспособление улавливает и фиксирует все излучения, а затем видоизменяет, превращая в штрихи-сканограммы, которые наносятся на обычную бумагу.
Метод сканирования с каждым годом теряет свою популярность, так как он занимает больше времени, чем сцинтиграфия.
Радиометрия
Радиометрия ― способ диагностики, при помощи которого врач может провести функциональный анализ органа.
Радиометрия может быть:
- Лабораторная. В этом случае делается забор биологического материала.
- Клиническая. Исследует одновременно все ведущие системы организма или определенный внутренний орган.
В лабораторном исследовании биологический образец устанавливается рядом со счетчиком, где радиометр фиксирует на бумаге результат. Пробы являются конкретными и точными и не требуют дополнительной консультации и вторичных тестов.
В медицинском исследовании радиоизотоп вводится непосредственно внутрь организма пациента. После этого счетчик радиометра записывает полученные данные, и информация выдается на приборе и оценивается в процентах.
Для обследования всего тела одновременно используется несколько детекторов. Они перемещаются вдоль тела пациента и определяют данные об уровне работы всех систем и внутренних органов.
Радиометрия не способна зафиксировать быстропротекающие процессы (кровоток, вентиляцию легких).
Радиография
Радиография применяется для регистрации скорости перемещения РФП. Излучение записывается детекторами и заносится на бумагу. Диагностика отличается простотой, однако нужно постараться, чтобы установить детекторы непосредственно на границах изучаемого внутреннего органа. Минус метода в том, нельзя провести визуальный осмотр, поэтому расшифровка результатов может быть сложной.
Томография
Радионуклидная томография может быть двух видов:
- однофотонная эмиссионная;
- позитронная эмиссионная.
Первый способ применяется в кардиологии и неврологии. Во время обследования вокруг пациента вращаются гамма-камеры, которые регистрируют излучение с разных проекционных точек. На монитор выводится качественное изображение. С его помощью можно анализировать рассредоточение радиоактивного вещества.
Второй способ возник относительно недавно. Отличается тем, что имеется возможность установить не только размер и форму органов, но уровень обмена веществ и степень функционирования. Этот способ уникален, ведь он позволяет определить патологию до того, как появится возможность диагностировать ее стандартными методами. Зачастую используется для обнаружения рака и наблюдения за его развитием.
У позитропных препаратов очень маленький период полураспада.
Поэтому их нельзя перевозить на большие расстояния. Рядом с позитронным томографом всегда должен находиться циклотрон для добычи соответствующих радиоактивных изотопов.
Нужна ли подготовка к обследованию?
Специальная подготовка нужна лишь в двух случаях:
- для щитовидной железы;
- для легких.
Особенности для обследования щитовидной железы:
- за два месяца до мероприятия исключить все йодсодержащие продукты;
- за месяц до назначенного срока нельзя употреблять L-тироксин и аналогичные средства.
Особенности для обследования легких:
- последний прием пищи за шесть — восемь часов до обследования;
- за 2-3 часа непосредственно перед процедурой нельзя курить;
- за месяц до мероприятия пациент должен проконсультироваться со специалистом о приеме лекарств;
- диагностика проводится только спустя неделю после эндоскопии (если она была назначена пациенту).
Длительность процедуры
Радионуклидная диагностика длится не более тридцати минут. Этого времени достаточно для сбора нужной информации. Длительность зависит от характера болезни и ее течения.
Как проводят радионуклидное обследование
Все помещения лаборатории должны ежедневно подвергаться радиационному и дозиметрическому контролю.
Процедура осуществляется только непосредственно в медицинском центре с участием высококвалифицированных врачей.
Этапы:
- Испытуемому вводят радиофармацевтический препарат.
- После этого пациента размещают на диагностическом оборудовании.
- Дальнейшие действия зависят от выбранной методики.
- После процедуры пациенту рекомендуется обильное питье.
Фотогалерея
Снимки исследования.
Исследование щитовидной железы Радиоизотопный метод исследования почек Радиологическое исследование печени Онкологическое обследование при помощи гамма-камеры
Расшифровка результатов исследования
Расшифровка полученных результатов осуществляется высококвалифицированным специалистом радиологом. Окончательный диагноз, который основан на анализе всех собранных данных, выносится врачом, направившим пациента на обследование.
Безопасны ли радиофармпрепараты?
В целях исследования пациенту вводят специальный препарат. Доза подбирается таким образом, чтобы нанести больному как можно меньше вреда. Воздействие радиоактивных изотопов на организм во много раз меньше, чем при классическом рентгенологическом обследовании.
Вещество быстро распространяется по организму и выводится, не нанося вреда. Препараты, применяемые врачами, не содержат токсинов, которые могут оставлять после распада вредные остатки.
Сколько стоит радионуклидная и радиоизотопная диагностика?
Стоимость процедуры варьируется в зависимости от региона.
| Регион | Стоимость | Фирма |
| Москва | от 5800 руб. | «ЦКБ РАН» |
| Челябинск | от 745 руб. | «Эвимед» |
| Краснодар | от 850 руб. | «ККБ Скал» |
Видео
Подбороднее о том, какие есть методы диагностики, можно узнать из видео от канала PediatrRussia.
Ранняя диагностика злокачественных новообразований остаётся одной из наиболее актуальных задач современной медицины, поскольку позволяет своевременно использовать все доступные средства лечения онкологических заболеваний.
Метод радионуклидной диагностики основан на применении радиоактивных индикаторов. Радиофармпрепараты (короткоживущие радионуклиды, обеспечивающие минимальную лучевую нагрузку) вводятся в организм человека и с помощью специальной аппаратуры позволяют качественно и количественно оценить функциональные возможности исследуемых органов. Диапазон исследования велик: от изучения клеточного метаболизма до исследования функции органа или системы в целом. Эти исследования не имеют аналогов в других методах и способах диагностики, особенно в онкологии. В онкологии радионуклидные исследования позволяют количественно определить уровень активности опухолевой ткани, что достоверно определяет распространённость опухолевого процесса, объективно оценивает эффективность проводимого лечения, своевременно выявляет рецидивы заболевания.
Достоинства методов радионуклидной диагностики:
- высокая информативность,
- уникальный характер получаемой информации,
- максимальная атравматичность,
- отсутствие аллергических реакций,
- простота выполнения,
- хорошая воспроиизводимость,
- универсальность (широта аспектов применения),
- непрерывное развитие и улучшение диагностической технологии,
- максимум диагностической информации при минимальном облучении.
Избирательное поглощение или выведение различными органами и тканями химических соединений, меченых радиоактивными изотопами лежит в основе метода. Регистрация і-излучения (редко І-излучения), испускаемого при распаде изотопа, методом сцинтиграфии, позволяет получить изображение исследуемого органа или поражённых тканей.
Статическая сцинтиграфия позволяет составить представление о размерах, структуре, топографоанатомических особенностях исследуемого органа. Для этого используются препараты, которые относительно длительно задерживаются и медленно перераспределяются в исследуемом органе и поражённых тканях.
Оценка функционального состояния исследуемого органа или системы возможна при применении тех радиофармпрепаратов, концентрация которых в органе быстро изменяется во времени.
Радиоизотопное сканирование применяется как с целью решения проблем первичной диагностики, так и уточнённой диагностики. Основными задачами радиоизотопного сканирования в клинической онкологии являются:
- диагностика первичной опухоли;
- изучение распространённости опухолевого процесса;
- оценка эффективности лечения онкологического больного;
- выявление рецидивов заболевания.
Одними из наиболее востребованных в онкологии методов радионуклидной диагностики являются остеосцинтиграфия и лимфосцинтиграфия.
Сканирование скелета с целью выявления метастазов — чувствительный диагностический метод. Благодаря своей высокой чувствительности остеосцинтиграфия наиболее часто используется для выявления метастазов злокачественных опухолей в кости. Исследования проводят с помощью фосфатных комплексов Tc99m. Метастазы злокачественных опухолей в кости обычно сопровождаются повышением остеобластической активности и визуализируются как зоны повышенного накопления РФП. Метод позволяет выявить метастазы в костях на 2-12 месяцев раньше, чем это возможно при рентгенологическом исследовании и даже компьютерной томографии.
Позитивная лимфосцинтиграфия (сканирование) основана на том, что тумуротропные РФП накапливаются в злокачественных новообразованиях в больших количествах, чем в окружающих здоровых тканях, благодаря чему визуализируются в виде очагов повышенного содержания препарата. Применяется для определения степени распространённости патологического процесса и степени поражения лимфоузлов, для выбора метода лечения онкологического больного, объёма оперативного вмешательства, оптимальных полей облучения.
Хорошие результаты получены при выявлении поражения лимфатических узлов (злокачественными лимфомами, метастазами) при внутривенном введении цитрата галлия-67. С этим тумуротропным препаратом можно получить изображение опухолей в виде горя чих очагов большинства органов, особенно ценен этот метод в диагностике заболеваний лимфоидной ткани (лимфогрануломатоз, лимфосаркома).Это связано с тем, что при системном заболевании надо оценить состояние всех групп лимфоузлов выше и ниже диафрагмы. Такое возможно только при использование цитрата галлия, когда после однократного введения препарата визуализируются только пораженные лимфоузлы, независимо от их локализации. Другие методы исследования (медиастиноскопия, прямая и непрямая лимфография, томография, ультразвуковая диагностика) позволяют исследовать только отдельные группы лимфоузлов. Кроме того, при исследовании с цитратом галлия удается в некоторых случаях определить и органное поражение желудка, печени, лёгких. Исследование с цитратом галлия эффективнодля контроля за проведенным лечением.
Лаборатория радионуклидной диагностики УЗ «Могилёвский областной онкологический диспансер» оснащена современной радиодиагностической аппаратурой, в том числе сцинцилляционной гамма-камерой «Nukline X—Ring» (Mediso, Венгрия) с компьютерным управлением и пакетом прикладных программ для обработки получаемой информации, что позволяет проводить все вышеописанные методы на высоком диагностическом уровне.
Наталья Денисова
«Наука из первых рук» №5–6, 2018
Слово «ядерная» в приложении к чему-либо обычного человека всегда настораживает. И диагностическая ядерная медицина в этом смысле не исключение. Автор этой статьи, не медик, но научный сотрудник с физическим образованием, следит за развитием этой активно развивающейся области современного здравоохранения в силу своих научных интересов, связанных с математическим моделированием. Одна из главных целей этой публикации не просто познакомить широкого читателя с самыми передовыми диагностическими технологиями, но и обосновать необходимость создания в России мультидисциплинарного исследовательского центра ядерной медицины, которого в нашей стране пока нет.
Об авторе
Наталья Васильевна Денисова — доктор физико-математических наук, ведущий научный сотрудник лаборатории физики быстропротекающих процессов Института теоретической и прикладной механики имени С. А. Христиановича СО РАН (Новосибирск), профессор кафедры лазерных систем Новосибирского государственного технического университета. Автор и соавтор более 90 научных работ.
Ядерная медицина — так называют раздел клинической медицины, который использует в диагностике и лечении радиоактивные фармацевтические препараты. Современными методами диагностики в ядерной медицине являются позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОЭКТ). Сегодня их широко используют в онкологии, кардиологии и нейрологии. В последнее десятилетие особое внимание в мировой клинической практике уделялось методу ПЭТ, который на сегодня признан «золотым стандартом» в диагностике раковых заболеваний.
За последние годы и в России построено более десятка ПЭТ-центров, в первую очередь в Москве и Санкт-Петербурге. Федеральная сеть центров ядерной медицины расширяется, охватывая различные регионы страны: уже построены ПЭТ-центры в Уфе, Хабаровске, Челябинске, Красноярске, Ханты-Мансийске, Казани, Екатеринбурге, Белгороде, Тольятти.
В мае 2018 г. на Петербургском международном экономическом форуме было подписано соглашение о стратегическом партнерстве Новосибирской области и ООО «Лечебно-диагностический центр Международного института биологических систем имени Сергея Березина» по созданию центра ядерной медицины в Новосибирске. Стоимость проекта составит более 1 млрд рублей, а сам центр планируется ввести в эксплуатацию в ближайшие годы.
В связи с этим возникает ряд вопросов, которые интересны не только специалистам, но и широкой общественности. Например, какую информацию несут изображения, полученные с помощью диагностических методов ядерной медицины? В чем состоит их преимущество при онкологических заболеваниях? Какова лучевая нагрузка на пациента при обследованиях методами ПЭТ и ОЭКТ? Сколько стоит такое обследование, и кто будет за него платить?
От морфологии — к физиологии
К стандартным и широко известным методам диагностики сегодня можно отнести рентгеновскую компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ), каждый из этих методов имеет свою нишу приложения.
С помощью КТ регистрируют степень поглощения рентгеновского излучения биологическими тканями, которая зависит от плотности среды. Эти изображения имеют высокую контрастность в случае соседства сред с существенно различающейся плотностью, например, «мягкие ткани — кости», из-за чего КТ наиболее широко используется для диагностики травм и болезней костей и оценки состояния легких. А с использованием контрастных веществ КТ применяют и для исследования кровеносных сосудов, в том числе для выявления инсульта.
Метод МРТ основан на явлении ядерного магнитного резонанса. С его помощью получают изображение пространственного распределения протонов (ядер атомов водорода, входящих в состав молекулы H2O), которое наиболее контрастно для мягких тканей с различным содержанием воды. МРТ используют для исследования головного и спинного мозга, диагностики опухолей, заболеваний нервной системы.
И КТ, и МРТ позволяют получать высококачественные «анатомические изображения» с высокой (менее 1 мм) степенью разрешения. Однако при онкологических заболеваниях необходимо различать нормальные и аномальные структуры в пределах одного и того же органа, и в таких случаях этим методам часто недостает чувствительности, особенно на ранних стадиях болезни.
Усилить чувствительность методов КТ и МРТ можно с помощью контрастных веществ. Большинство опухолей, особенно злокачественных, имеют лучшее кровоснабжение, чем здоровые ткани, и контрастное вещество будет накапливаться в них в большей концентрации. Однако эти отличия не всегда настолько значимы, чтобы на основе визуальных оценок можно было поставить диагноз.
Оба этих метода дают изображения, основанные преимущественно на морфологических различиях тканей. Принципиальное отличие диагностических методов ядерной медицины состоит в том, что они позволяют визуализировать метаболические процессы (химические реакции, необходимые для поддержания жизни), протекающие в организме на клеточном уровне.
Метим опухоль
Диагностические методы ядерной медицины, и ПЭТ и ОЭКТ, используют радиофармпрепараты, состоящие из рабочего вещества с присоединенной к нему радиоактивной «меткой». Рабочее вещество — это специально подобранное молекулярное соединение, которое участвует в естественных метаболических процессах в организме человека.
Например, в кардиологии для оценки кровоснабжения миокарда методом ОЭКТ широко применяется препарат Тс99m-МИБИ на основе метокси-изобутил-изонитрила, который захватывается здоровыми клетками миокарда. Метка накапливается в областях с ненарушенным кровоснабжением, и только в неповрежденных клетках, что позволяет диагностировать патологии кровоснабжения миокарда и выявлять области некротического повреждения.
В онкологии метод ОЭКТ в последние годы уступает свои позиции ПЭТ. В этой области медицины практически все ПЭТ-обследования проводят с помощью препарата фтордезоксиглюкоза, по составу близкому к обыкновенной глюкозе и меченному изотопом фтора 18F. Глюкоза — универсальный источник энергии, поэтому раковые клетки, отличающиеся усиленным метаболизмом, накапливают этот препарат в более высоких концентрациях, чем здоровые. И на ПЭТ-изображениях очаги поражения видны в виде ярких пятен.
В ОЭКТ и ПЭТ используются разные радионуклиды-метки. В первом случае это радиоактивные вещества, которые при распаде испускают гамма-кванты. Радионуклиды, использующиеся при ПЭТ-диагностике, испускают позитроны — античастицы электронов. В биологических тканях присутствует много свободных электронов, поэтому позитрон встречается с электроном, пройдя расстояние менее 1–2 мм. Частицы аннигилируют, выделяя энергию в виде двух гамма-квантов, вылетающих в противоположных направлениях, которые и регистрируются детекторами. Поток гамма-квантов при ПЭТ существенно выше, что и обеспечивает более высокое качество получаемых изображений.
В чем преимущества метода ПЭТ в сравнении с другими видами томографии для диагностики рака? Во-первых, он позволяет не только дифференцировать доброкачественные и злокачественные образования, но и обнаруживать опухоль на самой ранней стадии развития, когда шансов на успех излечивания существенно больше. Во-вторых, это единственный метод, с помощью которого можно просканировать все тело после обнаружения первичной опухоли, чтобы диагностировать наличие или отсутствие метастазов, что чрезвычайно важно для определения тактики лечения. Наконец, только ПЭТ дает самую раннюю оценку эффективности проводимого лечения, а также позволяет отличить рецидив от морфологических повреждений ткани после хирургических и лучевых процедур.
ПЭТ-исследования используют и для контроля опухолевого процесса уже после курса терапии. Например, при изначально гормонопозитивном раке молочной железы опухоль иногда прогрессирует после окончания стандартной 5-летней гормонотерапии. Но в рутинной клинической практике онкологи часто пренебрегают возможностью повторного установления диагноза, особенно при внутригрудной и внутрибрюшинной локализации метастазов. Это непросто сделать даже с помощью ПЭТ-диагностики из-за низкой метаболической активности очагов вследствие небольших размеров. Однако эти ограничения можно преодолеть за счет использования нового препарата — 18F-фторэтилтирозина, который еще только входит в практику передовых клиник.
Нужно отметить, что «молекулярные изображения», полученные с помощью диагностических методов ядерной медицины, не обладают той высокой четкостью, которая присуща анатомическим изображениям КТ и МРТ. В самом начале своего развития этот раздел получил даже шутливое название unclear medicine вместо nuclear medicine. Чтобы привязать очаги поражения к анатомическому строению, в современной диагностической ядерной медицине используют гибридные ПЭТ/КТ- и ПЭТ/МРТ-системы, при которых изображения, полученные разными методами, накладываются друг на друга.
Решают кадры
«Проблема России не в томографах, проблема России — в мозгах, в катастрофическом недостатке специалистов и исследований в этой области». Эта цитата из приветственного доклада хирурга-онколога академика М. И. Давыдова на конференции по медицинской физике в 2010 г. остается актуальной и доныне.
В Европе, США, Японии и Китае быстрое развитие ядерной медицины в последние годы привело к росту числа исследований в этой области, увеличению численности и повышению уровня подготовки специалистов. Текущую ситуацию в России можно оценить как критическую. Чтобы решить проблему подготовки кадров для рутинной и исследовательской работы в области ядерной медицины, нужно вводить соответствующие курсы на действующих кафедрах медицинских вузов, а также готовить немедицинских специалистов: радиохимиков, медицинских физиков, математиков, биологов.
Назрела необходимость быстро решать вопрос образовательной подготовки специалистов для ядерной медицины, так как было бы стратегической ошибкой закупать дорогостоящее высокотехнологичное оборудование и при этом не иметь грамотных специалистов, которые могут на нем работать.
С учетом все возрастающей сложности медицинских технологий визуализации задача интерпретации полученных изображений становится все более трудной для врачей. К решению этой проблемы сегодня подключаются исследователи в области «больших данных» и искусственного интеллекта, специалисты в области решения обратных некорректных задач, создатели новых радиофармацевтических препаратов. Такой подход требует создания сильных исследовательских групп, объединяющих врачей, инженеров, физиков, химиков, биологов, математиков.
Будущее ядерной медицины определяется, прежде всего, мультидисциплинарными фундаментальными исследованиями, направленными на разработку более эффективных радиофармпрепаратов, обеспечение радиационной безопасности и создание новых аппаратных средств регистрации гамма-излучения, а также на совершенствование математических методов обработки полученной информации. Кстати сказать, в мире фундаментальные исследования в этой области ведутся сегодня настолько интенсивно и широко, что основной Европейский журнал по ядерной медицине и молекулярной визуализации (EJNMMI) даже разделился на несколько дисциплинарных журналов.
Ниже мы коснемся только одного из направлений, близкого автору по роду его научной деятельности, которое связано с применением математического моделирования и компьютерных имитаций в области диагностической ядерной медицины. Необходимость такого подхода диктуется невозможностью из-за лучевой нагрузки проводить исследования на людях, тогда как эксперименты на мелких животных не могут решить проблем, возникающих при диагностике человека.
Матмоделирование в помощь
Томографические исследования в новосибирском Институте теоретической и прикладной механики (ИТПМ) СО РАН были инициированы д. ф.-м. н. Н. Г. Преображенским еще в 1980-е гг. с целью использовать их для диагностики газа и плазмы. В начале 2000-х гг. специалисты института совместно с врачами НМИЦ им. академика Е. Н. Мешалкина (Новосибирск) начали применять математическое моделирование для компьютерной имитации процедуры обследования кардиологических больных методом ОЭКТ. Сейчас эти исследования продолжаются в сотрудничестве с Институтом вычислительной математики и математической геофизики СО РАН, а также Национальным медицинским исследовательским центром кардиологии (Москва), Венским медицинским университетом и отделением ядерной медицины Центральной клинической больницы Вены (Австрия) при поддержке РФФИ и Австрийского научного фонда.
Математическое моделирование процедуры ОЭКТ и ПЭТ — это сложная физико-математическая проблема, состоящая из ряда задач: создания математических моделей (фантомов), описывающих распределение радиофармпрепарата в органах пациента; моделирования процесса формирования «сырых» проекционных данных, регистрируемых детекторами; разработки метода решения обратной задачи реконструкции изображений из «сырых» данных. Фактически при компьютерном моделировании математический фантом служит виртуальным «пациентом», а реальная томографическая установка заменяется виртуальной системой.
Эти исследования позволяют выявить причины возникновения на изображениях «ложных дефектов», приводящих к неправильному диагнозу, а также оценить предельные размеры патологических очагов, которые можно визуализировать в зависимости от их локализации и индивидуальных особенностей анатомического строения пациента. С помощью этого подхода можно также тестировать новые алгоритмы реконструкции изображений и выполнять исследования по оптимизации протокола сбора данных.
В России подобная работа пока ведется только в ИТПМ СО РАН. Несколько лет тому назад совместно с отделением томографии НМИЦ им. ак. Е. Н. Мешалкина был разработан первый отечественный 3D-математический фантом для исследований в области диагностической ядерной кардиологии. Этот фантом описывает распределение препарата Тс99m-МИБИ в органах грудной клетки среднестатистического пациента мужского пола при исследовании перфузии (кровоснабжения) миокарда методом ОЭКТ. Рассчитанные для него проекционные данные хорошо согласуются с данными реальных клинических обследований. Фантом использовался в различных исследованиях, в том числе по снижению дозы радиофармпрепарата с целью уменьшения лучевой нагрузки на пациента.
Существует два подхода к развитию фантомов: на основе методов компьютерной графики и на основе простых фигур, описываемых уравнениями пространственной геометрии. С самого начала мы хотели построить фантомы, которые можно было бы легко трансформировать, меняя размеры и положение органов, чтобы исследовать влияние анатомического строения пациентов на качество изображений.
Например, в течение более 20 лет оставалась непонятой причина появления «ложных дефектов» на изображениях в верхушечной зоне миокарда при исследовании его перфузии. Эти артефакты имитируют или маскируют поражения миокарда, что затрудняет интерпретацию изображений и вынуждает назначать дополнительные дорогостоящие обследования. По результатам исследований на основе численных методов с использованием нашего фантома были предложены рекомендации по внесению изменений в протокол обследований пациентов.
Сегодня в процессе создания находится фантом для компьютерной имитации процедуры обследования «всего тела» методом ПЭТ.
Ядерная медицина с самого начала создавалась исследовательскими коллективами, где «плечо к плечу» работали врачи, физики, химики, математики и биологи, и сегодня она продолжает активно развиваться как мультидисциплинарное направление.
У Новосибирска имеется огромный научный потенциал в области диагностической, терапевтической и интервенционной ядерной медицины: перспективные разработки и хорошие заделы по разным направлениям наряду с большим опытом сотрудничества есть и в институтах СО РАН, и в медицинских учреждениях. Достаточно упомянуть лишь о методе бор-нейтронозахватной терапии рака, который успешно развивается в Институте ядерной физики СО РАН совместно с другими научными и медицинскими организациями. Создание в Новосибирске мультидисциплинарного исследовательского центра ядерной медицины даст крепкую основу для развития фундаментальных и прикладных исследований в этой области.
Литература
1. Беляев В. Н., Климанов В. А. Физика ядерной медицины. М.: НИЯУ МИФИ, 2012, Ч. 2, 248 с.
2. Климанов В. А. Физика ядерной медицины. М.: НИЯУ МИФИ, 2012, Ч. 1, 308 с.
3. Колядина И. В., Абдуллаев А. Г., Танишина Н. Б. и др. Мультимодальный подход к дифференциальной диагностике метастатического поражения при раке молочной железы: описание клинического случая // Злокачественные опухоли. 2017. Т. 7. № 3. С. 31–36.
4. Denisova N. V., Terekhov I. N. A study of myocardial perfusion SPECT imaging with reduced radiation dose using maximum likelihood and entropy-based maximum a posteriori approaches // Biomed. Phys. Eng. Express. 2016. V. 2. № 5. P. 055015 (12).
5. Denisova N. V., Ansheles A. A. A study of false apical defects in myocardial perfusion imaging with SPECT/CT // Biomed. Phys. Eng. Express. 2018. V. 4. № 6. P. 065018 (12).
6. Jones D. S., Podolsky S. H., Greene J. A. et al. The Burden of Disease and the Changing Task of Medicine // N. Engl. J. Med. 2012. V. 366. P. 2333–2338.

В издании кратко и лаконично представлены основные радионуклидные диагностические методики, применяемые в настоящее время в практической ядерной медицине. Вся представленная информация данных методических рекомендаций разбита по клиническим разделам.
Данные методические рекомендации (автор — заведующий отделением радионуклидной диагностики Санкт-Петербургской городской клинической больницы № 31 Виктор Алексеевич Поспелов) предназначены для улучшения ориентации врачей-клиницистов в вопросах, касающихся определения показаний, особенностей подготовки к радионуклидному исследованию и вариантов трактовки его результатов, а также использования этого метода молекулярной визуализации в выборе тактики проводимого лечения и оценке его результатов, анализа прогностической значимости информации получаемой от врача-радиолога.
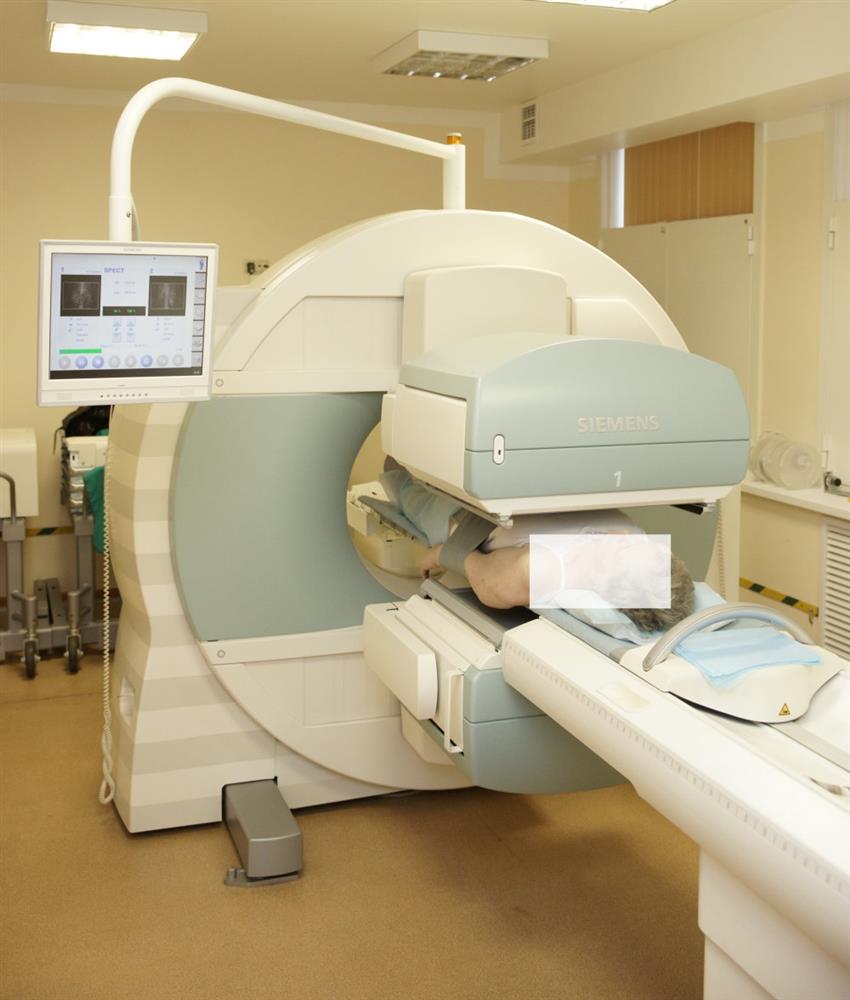
- Сцинтиграфия в планарном и полнопозиционном режимах
- ОФЭКТ-КТ
Эти исследования связаны с ионизирующим излучением и/или введением в организм радиофарм-препаратов, которые позволяют получить данные о функциональных изменениях.
Пациенту внутривенно вводят радиофармпрепарат. В качестве радионуклидной «метки» используется Tс 99m с периодом полураспада 6,01 часа. Для полного выведения из организма радиоактивности необходимо 10 периодов полураспада, то есть около 2,5 суток. Первые сутки не рекомендуется находиться рядом с детьми до 18 лет.
Подготовка к исследованию: специальной подготовки к исследованию не требуется, также нет ограничений в приеме пищи.
После введения радиофармпрепарата пациент обязан находиться в комнате для ожидания и выполнять требования среднего медицинского персонала. Запрещено покидать отделение без разрешения.
Время исследования занимает от 1 до 6 часов.
Обследование
Для проведения обследования пациента укладывают на стол и помещают внутрь гамма-камеры. Во время всего исследования врач ведет наблюдение с помощью телекамеры или визуально. Основным условием для качества получаемых изображений является возможность неподвижно в течение 20 минут находиться внутри гамма-камеры. При обследовании маленьких детей, а также взрослых с болевым синдромом, которые не могут лежать спокойно, необходимо заранее обсудить вопрос о возможности выполнения процедуры с врачом-анестезиологом.
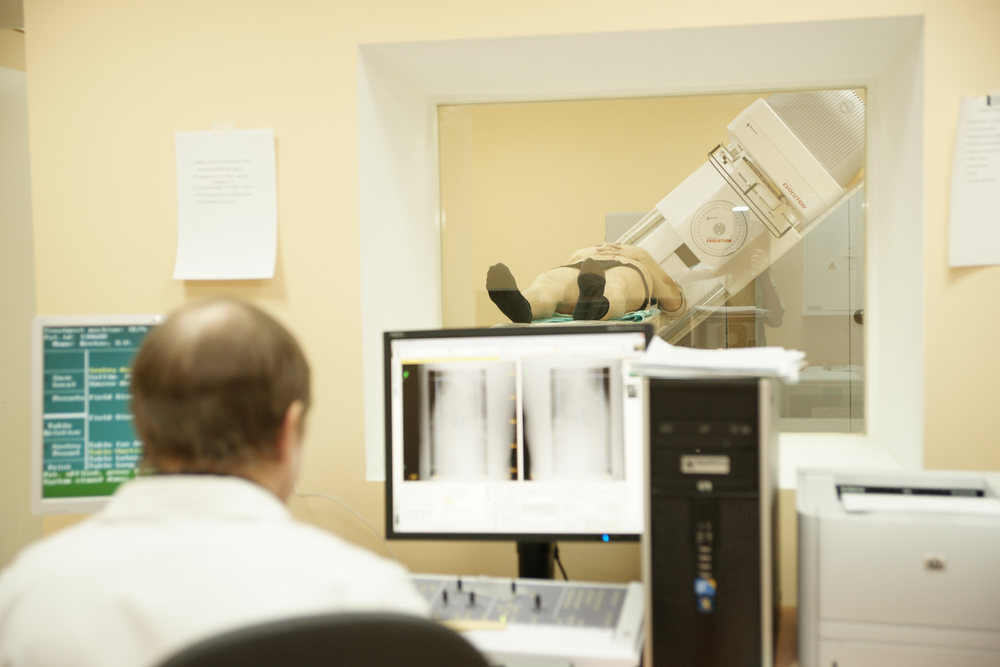
Обычно процедура не сопровождается какими-либо неприятными ощущениями или побочными реакциями.
В зависимости от исследования, полученная пациентом эффективная доза составляет от 0,3 до 15 мЗв. Результаты обследования готовы через 24 часа после окончания процедуры. Возможна запись на CD-диск (оговаривается отдельно).
Первые сутки после обследования мы не рекомендуем находиться рядом с детьми до 18 лет. При пересечении Государственной границы РФ, а также в пунктах досмотра пассажиров необходимо будет представить справку о проведенном радионуклидном исследовании, которую можно получить в регистратуре отделения.








