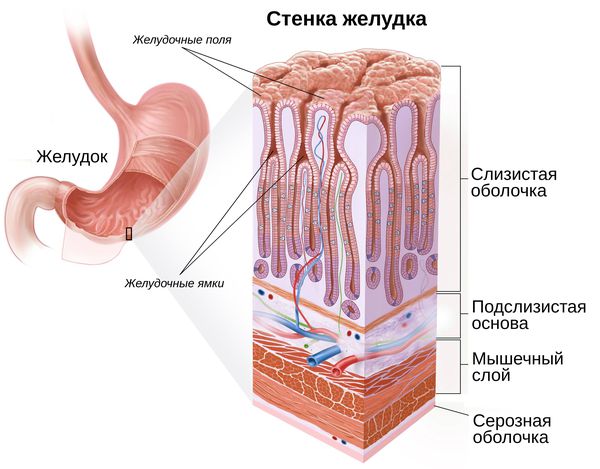
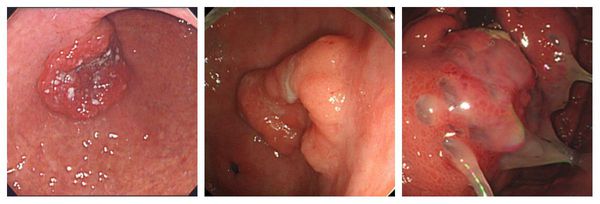
3.1 Эндоскопическое лечение раннего рака желудка
Рекомендуется выполнять лечение «раннего рака желудка» с помощью эндоскопических методов у отобранной группы больных [4, 5, 6, 7], см. критерии отбора больных для эндоскопической резекции слизистой оболочки (A, Ib).
Комментарии: важной клинической особенностью раннего рака желудка является низкая частота лимфогенного метастазирования. Общая частота поражения регионарных лимфатических узлов при опухолях категории Т1 не превышает 10–15%. При инвазии в пределах слизистого слоя этот показатель составляет около 3%, а при вовлечении подслизистого достигает 20%. При сочетании таких признаков как инвазия в пределах слизистой оболочки, размеры опухоли до 2 см, I, IIa–b тип роста (см. выше), высокая или умеренная степень дифференцировки, метастазы в лимфатических узлах практически не встречаются.
Однако даже при опухолях большей протяженности и инвазии подслизистого слоя поражение лимфатических узлов, как правило, ограничивается одним лимфатическим бассейном, при этом метастазирование в лимфатические узлы второго порядка наблюдается крайне редко, что позволяет выполнять экономные резекции желудка с ограниченным объемом вмешательства на лимфатических путях.
Критерии отбора больных для эндоскопической резекции слизистой оболочки:
-
инвазия в пределах слизистой оболочки (включая рак in situ; T1a);
-
аденокарцинома высокой или умеренной степени дифференцировки;
-
I, IIа–b тип опухоли размером до 2 см без изъязвления;
-
отсутствие клинически определяемых (эндоУЗИ, РКТ) метастазов в регионарные лимфоузлы;
-
отсутствие лимфоваскулярной инвазии.
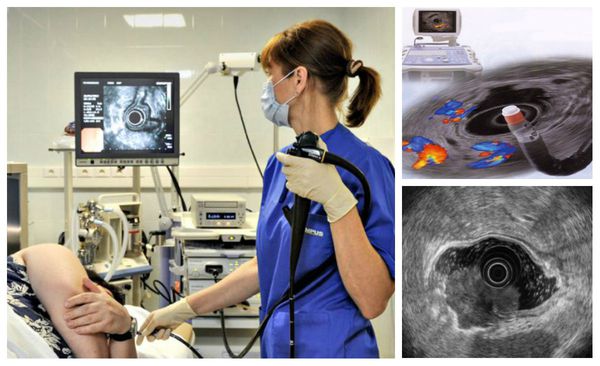
Показания к эндоскопическому лечению могут быть расширены у больных с высоким риском хирургического вмешательства. При планировании эндоскопического лечения всем больным выполняют комплексное эндоскопическое обследование с использованием современных методик (РКТ, увеличительная эндоскопия, NBI, хромоэндоскопия, эндосонография) для оценки глубины инвазии и определения истинных границ поражения, включая очаги тяжелой дисплазии.
Варианты эндоскопического лечения:
-
Эндоскопическая резекция слизистой (EMR);
-
Эндоскопическая резекция слизистой с диссекцией подслизистого слоя (ESD) – позволяет выполнять резекцию en bloc при опухолях большей протяженности и более радикально иссекать подслизистый слой;
Наиболее частые осложнения эндоскопического лечения – кровотечение и перфорация, поэтому больной должен быть подготовлен к эндоскопической резекции слизистой как к открытой операции. В большинстве случаев кровотечение удается оставить с помощью эндоскопических методов гемостаза. После операции назначают ингибиторы протонной помпы до полного рубцевания образовавшегося дефекта слизистой.
Удаленный фрагмент слизистой оболочки подвергают плановому гистологическому исследованию. При обнаружении инвазии опухоли в подслизистый слой, опухолевых клеток по краю резекции, выявлении низкодифференцированных форм или наличии лимфовенозной инвазии показано хирургическое лечение.
3.2 Хирургическое лечение
-
Рекомендуется выполнять хирургическое лечение рака желудка T1-4NxM0 [28] (A, Ia).
Комментарии: абсолютные онкологические противопоказания при раке желудка – наличие отдаленных метастазов. Операцию в этих случаях выполняют только по витальным показаниям больным с осложненным течением опухолевого процесса (перфорация, кровотечение, стеноз) в резекционном объеме, лимфодиссекция не показана.
Относительные противопоказания: изолированное метастатическое поражение яичников.
При непосредственном распространении опухоли на соседние органы и анатомические структуры (печень, поджелудочную железу, ободочную кишку, диафрагму) выполняют комбинированные операции.
Планирование и реализация хирургического лечения при раке желудка включает несколько этапов: выбор оперативного доступа, выбор объёма операции на органе, вмешательство на лимфатических путях (лимфодиссекция), выбор способа реконструкции.
Выбор оперативного доступа зависит от уровня распространения опухоли на пищевод и функционального состояния больного.
-
При раке желудка без вовлечения кардиоэзофагеального перехода и пищевода операцию выполняют из срединного лапаротомного доступа.
-
При ограниченных опухолях, вовлекающих розетку кардии и переходящих на дистальный отдел пищевода, может использоваться тораколапаротомный доступ слева либо широкая диафрагмотомия из лапаротомного доступа.
-
При раке с тотальным поражением желудка и переходом на пищевод или раке тела, распространившимся на проксимальный отдел желудка и пищевод, комбинированный абдоминоторакальный доступ не улучшает отдаленные результаты в связи с ранним лимфогенным метастазированием в брюшной полости. В этих случаях рекомендуется абдомино-медиастинальный доступ ( в ряде случаев, при высоком пересечении пищевода, с целью безопасного формирования пищеводно-кишечного соустья, возможно применение торакотомии слева по VI межреберью).
Выбор объёма операции на желудке
Основные радикальные операции при раке желудка — гастрэктомия, субтотальная дистальная и субтотальная проксимальная резекции желудка. Объём радикальной операции по поводу рака желудка должен включать:
-
удаление единым блоком поражённого желудка (или соответствующей его части) с обоими сальниками, клетчаткой и лимфатическими узлами регионарных зон;
-
пересечение органа на расстоянии не менее 5 см от макроскопически определяемого края опухоли с отграниченным (типы I-II по Borrmann) типом роста и не менее 6-7 см при раке язвенно-инфильтративного и диффузного типов (типы III-IV по Borrmann). Для подтверждения радикальности операции выполняют срочное морфологическое исследование краёв резекции по линии пересечения органов.
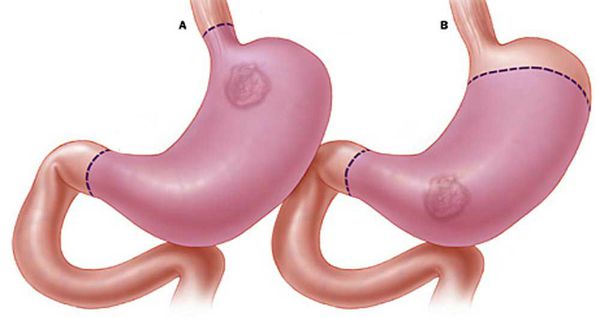
Дистальная субтотальная резекция желудка (ДСРЖ) показана при раке антрального отдела желудка при отсутствии очагов тяжёлой дисплазии и рака in situ в остающейся части желудка.
Допустимо выполнение дистальной субтотальной резекции у больных с низкими функциональными резервами при распространении опухоли на нижнюю треть тела желудка, если она имеет экзофитную или смешанную формы роста (I-II типы по Borrmann); Лимфатические узлы, не удаляемые при данной операции (левые паракардиальные, узлы в воротах селезёнки), при раке нижней трети желудка поражаются крайне редко.
Проксимальная субтотальная резекция желудка (ПСРЖ) показана при раке кардиоэзофагеального перехода, а также при небольших опухолях верхней трети желудка экзофитной или смешанной формы роста.
Гастрэктомия (ГЭ) – полное удаление желудка с регионарными лимфатическими узлами – показана во всех остальных случаях. При резектабельном раке желудка типа linitis plastica, недифференцированных формах рака, синдроме наследственного рака желудка диффузного типа выполняют только гастрэктомию.
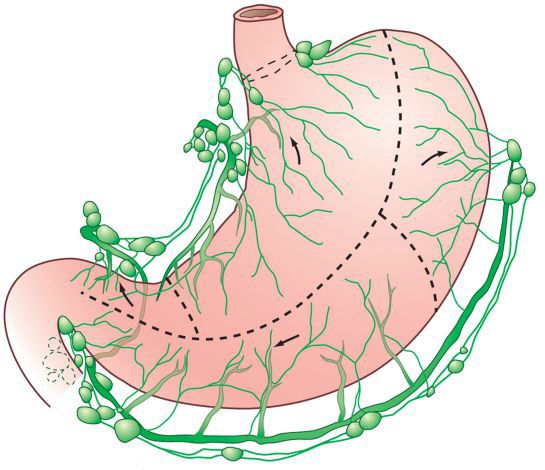
Лимфодиссекция
Рекомендуется выполнять стандартный объем лимфодиссекции – D2 при хирургическом лечении рака желудка [8, 9, 10, 11, 12, 13] (A, Ia).
Комментарии: поражение регионарных лимфатических узлов при раке желудка – один из ведущих прогностических факторов. Общая частота лимфогенного метастазирования при раке желудка достигает 47,7% и напрямую зависит от глубины инвазии. При опухолях T1 частота поражения лимфатических узлов не превышает 10–15%, а при опухолях категории T4b достигает 90%. Наиболее часто при раке желудка поражаются лимфатические узлы 1 и 2 порядка (№ 1–11) – 15,7 и 20,3% соответственно (IB).
Стандартным объёмом вмешательства на лимфатической системе при раке желудка в настоящее время считают удаление лимфатических узлов 1 и 2 порядка (расширенная лимфодиссекция D2) [8, 9, 10, 11, 12, 13]. Рутинное выполнение парааортальной лимфаденэктомии (D3) нецелесообразно (А), поскольку она не улучшает выживаемость больных и сопровождается большей частотой осложнений (IA).
Выполнение во всех случаях спленэктомии при раке желудка в настоящее время признано нецелесообразным (А), поскольку не оказывает влияния на прогноз и повышает частоту осложнений и летальность [14, 15, 15] (IA).
Показания к спленэктомии (С):
-
непосредственное распространение опухоли на селезёнку;
-
_локализация T3-4 опухоли на задней стенке и большой кривизне верхней трети тела желудка;
-
интраоперационная травма;
-
наличие определяемых метастазов в лимфатических узлах ворот селезёнки
-
инвазия опухолью хвоста поджелудочной железы и селезеночных сосудов.
Хирургическое лечение при раннем раке желудка
-
Рекомендуется выполнять хирургическое лечение раннего рака желудка у больных, не соответствующих критериям отбора для эндоскопического исследования (29-33) (A, Ia).
Комментарии: при раннем раке желудка, не соответствующим критериям отбора для эндоскопического лечения (подслизистая инвазия, большая протяженность, низкодифференцированные формы, изъязвленные опухоли), показано хирургическое вмешательство (А).
Стандартный объём операции при лечении раннего рака аналогичен более распространенным формам и включает субтотальную резекцию желудка или гастрэктомию с лимфаденэктомией. Учитывая низкую частоту поражения лимфатических узлов второго порядка, согласно рекомендациям Японской ассоциации по раку желудка (А) адекватным и достаточным объемом лимфаденэктомии при опухолях T1 является удаление перигастральных лимфатических узлов, а также лимфатических узлов №7; 8а; 9 (лимфаденэктомия D1+).
Лапароскопическая дистальная субтотальная резекция при раннем раке желудка обеспечивает лучшие непосредственные результаты и не ухудшает прогноз (IA). Аналогичные результаты получены и в отношении лапароскопической гастрэктомии (IB). Лапароскопические операции при раннем раке желудка могут быть рекомендованы как стандартный вариант хирургического лечения наряду с обычными открытыми вмешательствами (А).
3.3. Комбинированное лечение
При отсутствии противопоказаний пациентам с T2-4NлюбоеM0 рекомендуется проведение комбинированного лечения по одному из вариантов: 1). периоперационная химиотерапия (предпочтительнее) [18, 19, 40] (A, IA); 2). адъювантная химиотерапия (A, Ib); 3). Адъювантная химиолучевая терапия (после R1/2 резекций), (A, Ib).
Комментарии: Периоперационная химиотерапия
В двух рандомизированных исследованиях показано, что проведение химиотерапии (режимы CF или ECF) на протяжении 8-9 недель до и после хирургического вмешательства приводит к достоверному значимому повышению частоты R0-резекций, БРВ и ОВ по сравнению с одним хирургическим лечением [18, 19]. Абсолютный выигрыш в 5-летней ОВ составил 13-14%. В германском исследовании AIO проведение по 4 курса химиотерапии по программе FLOT до и после хирургии привело к достоверному увеличению общей выживаемости по сравнению с периоперационной химиотерапией режимом ECF [40].
Адъювантная химиотерапия
В рандомизированных исследованиях показано, что назначение после хирургического лечения с D2–лимфодиссекцией перорального фторпиримидина S1 в течение 12 мес. при II-III стадиях рака желудка привело к достоверному улучшению 3–летней ОВ с 70,1 до 80,1%, а назначение после операции режима XELOX на протяжении 6 мес – (Ib) к увеличению 3–летней БРВ с 59 до 74% (p<0,0001) при всех стадиях распространенности: II, IIIA, IIIB [17] (1b).
Адъювантную химиотерапию по схемам XELOX (CAPOX) (A) начинают через 4-6 недель после операции при отсутствии тяжелых осложнений и после нормализации клинико-лабораторных показателей. Продолжительность адъювантной химиотерапии составляет 6 месяцев. Роль трастузумаба в адъювантной терапии HER2+ рака желудка изучается.
Послеоперационная химиолучевая терапия
Послеоперационная химиолучевая терапия долгие годы являлась стандартом лечения в США на основании исследования, сравнивавшего адъювантную химиолучевую терапию с наблюдением [20]. Однако негативные результаты исследования CRITICS [41], не показавшего улучшения ОВ от добавления лучевой терапии к периоперационной терапии, и позитивные результаты исследований по периоперационной химиотерапии [8, 19, 40] привели к потери интереса к проведению адъювантной химиолучевой терапии. Проведение послеоперационной химиолучевой терапии может быть рекомендовано в случае нерадикального (R1/2) хирургического вмешательства.
3.4. Лекарственная терапия местно-распространенной нерезектабельной и диссеминированной аденокарциномы желудка и пищеводно-желудочного соустья (ПЖС)
-
Рекомендуется назначение системной химиотерапии при местно-распространенном нерезектабельном и диссеминированном раке желудка и пищеводно-желудочного соустья (ПЖС) [34, 35, 36] (A, Ia).
Комментарии: основным методом лечения диссеминированного рака желудка является лекарственный.
Лекарственная терапия первой линии
Рекомендуется назначение в первой линии лечения диссеминированного РЖ комбинированной ХТ, которая по сравнению с монотерапией достоверно улучшает показатели выживаемости больных [37] (A, Ia).
Комментарии: стандартом ХТ первой линии при диссеминированном РЖ является комбинация производных платины с фторпиримидинами (А), т.е. режимы CF, CX, XELOX, альтернативной комбинацией являются IF (1a), FOLFOX. Данные режимы являются равноэффективными, различаясь лишь по профилю токсичности. Cравнение иринотекана в комбинации с 5-ФУ и Лв (IF) с режимом цисплатин + 5-ФУ (CF) показало их равную эффективность. Трехкомпонентные режимы с включением доцетаксела, производных платины и фторурацила (DCF, mDCF, FLOT) приводит к улучшению ОВ, но ассоциированы с большей токсичностью (42-44).
При наличии метастазов рака желудка в кости помимо химиотерапии могут быть назначены бисфосфонаты (золедроновая кислота), по показаниям – лучевая терапия с анальгезирующей целью.
Таким образом, в качестве стандарта химиотерапии распространенного РЖ в первой линии рекомендован широкий спектр комбинированных режимов. Выбор конкретной комбинации зависит от состояния пациента, характера и тяжести сопутствующих заболеваний. Для больных пожилого возраста или отягощенных сопутствующими заболеваниями наиболее приемлемой является комбинация XELOX. При отсутствии сопутствующих заболеваний, нарушения функции внутренних органов и молодом возрасте больным могут быть предложены трехкомпонентные режимы. Больным со статусом ECOG=2 и/или отягощенным сопутствующими заболеваниями возможно начало лечения с монохимиотерапии с последующим использованием комбинированных режимов при улучшении состояния или с режима XELOX.
При ECOG 3, наличии тяжелых сопутствующих заболеваний больным показана симптоматическая терапия.
Продолжительность химиотерапии
-
Рекомендуется проведение цикловой химиотерапии первой линии на протяжении 18 недель (т.е. 6-8 трехнедельных или 9-12 двухнедельных циклов) с последующим динамическим наблюдением до прогрессирования болезни [37] (A, Ib).
Комментарии: при длительности интервала наблюдения (т.е. от момента окончания последнего цикла химиотерапии до регистрации прогрессирования болезни) более 3 месяцев во II линии лечения возможна реиндукция режима первой линии.
При прогрессировании болезни на фоне или в течение 3 месяцев после окончания химиотерапии I линии и удовлетворительном общем состоянии пациента рекомендуется химиотерапия II линии препаратами, не вошедшими в 1 линию лечения.
В случае прогрессирования болезни на фоне проведения адъювантной химиотерапии или в первые 6 месяцев после ее окончания, адъювантную ХТ следует считать I линией лечения, что требует изменения режима последующей лекарственной терапии II линии. Если прогрессирование болезни регистрируется через 6 и более месяцев после окончания адъювантной химиотерапии, то возможно возобновление лечения по той же схеме.
Лечение диссеминированного HER2+ рака желудка
-
Рекомендуется применение трастузумаба с химиотерапией в первой линии [38] (A, Ib).
Комментарии: Трастузумаб в комбинации с 6–8 курсами химиотерапии с последующей поддерживающей терапией трастузумабом до прогрессирования болезни достоверно увеличивает ОВ. В дальнейшем в зависимости от сроков развития прогрессирования болезни (до или после 3 мес. поддерживающей терапии) может быть рекомендована либо химиотерапия 2 линии, либо реиндукция режима 1 линии.
Лекарственная терапия второй линии
-
Рекомендуется проведение монохимиотерапии второй линии пациентам с ECOG PS=0-2 при отсутствии противопоказаний [39] (A, Ib).
Комментарии: сравнение доцетаксела и иринотекана во второй линии химиотерапии показало их равную эффективность [45]. Еженедельный паклитаксел обладает схожей с иринотеканом эффективностью, но лучшей переносимостью [46]. Добавление к еженедельному паклитакселу рамуцирумаба (анти-VEGFR-2 антитело) достоверно улучшает объективный эффект, выживаемость без прогрессирования болезни и ОВ по сравнению с одним паклитакселом [47]. Рамуцирумаб в монотерапии также продемонстрировал достоверное улучшение ОВ по сравнению с оптимальной симптоматической терапией [48], однако предпочтительнее его назначение в комбинации с паклитакселом. По данным рандомизированного исследования иммунотерапия ниволумабом во II-III линиях терапии увеличивает ОВ по сравнению с симптоматической терапией [49]. Наибольший выигрыш от применения анти-PD1 терапии (ниволумаб, пембролизумаб) наблюдается у пациентов с высоким уровнем микросателлитной нестабильности (MSI-high).
Принципы системной химиотерапии
-
режимы химиотерапии, рекомендуемые для лечения аденокарциномы желудка и ПЖС, являются равноэффективными и взаимозаменяемыми;
-
при выборе режима лекарственной терапии необходимо учитывать общее состояние больного, количество и тяжесть сопутствующих заболеваний, токсический профиль режимов, а также HER2-статус опухоли;
-
трехкомпонентные режимы химиотерапии могут быть назначены сохранным больным в удовлетворительном общем состоянии (статус ECOG=0-1), не обремененным сопутствующими заболеваниями, без нарушения функции внутренних органов, обязательным условием является возможность еженедельного мониторинга побочных эффектов и своевременное назначение сопроводительной терапии;
-
при наличии индивидуальных противопоказаний для назначения режимов 1-го уровня достоверности предпочтительно использование равноэффективных комбинаций, обладающих более благоприятным токсическим профилем из разряда модификаций режимов 1 категории или комбинаций 2А — 2В категории;
-
необходимо соблюдение рекомендованных доз, режимов и продолжительности введения препаратов, составляющих комбинацию, с необходимой коррекцией их в процессе лечения;
-
допускается назначение альтернативных комбинаций и режимов противоопухолевых препаратов с учетом доступности лекарств, практических предпочтений и противопоказаний;
-
предпочтительно инфузионное, а не струйное назначение 5-ФУ;
-
эквивалентом инфузионному введению 5-ФУ является капецитабин;
-
цисплатин и оксалиплатин являются взаимозаменяемыми препаратами, выбор препарата осуществляется на основе токсического профиля;
-
для операбельных форм рака желудка и ПЖС предпочтителен мультидисциплинарный подход
Режимы комбинированной химиотерапии первой линии
Трехкомпонентные
ECF (1а, А)
Эпирубицин 50 мг/м2 (или доксорубицин 40 мг/м2) в/в струйно в день 1 + Цисплатин 60 мг/м2 в/в капельно в день 1 на фоне гипергидратации и антиэметиков + 5-ФУ по 200 мг/м2/сут х 24 часа в/в инфузия с 1 по 21 дни
Повтор каждые 3 недели
Модификации ECF(1b, А)
EСX
эпирубицин 50 мг/м2 (или доксорубицин 40 мг/м2) в/в струйно в день 1 + Цисплатин 60 мг/м2 в/в капельно в день 1 на фоне гипергидратации и антиэметиков + капецитабин по 625 мг/м2х 2 р/сут внутрь c 1 по 21 дни
Повтор каждые 3 недели
EOX
эпирубицин 50 мг/м2 (или доксорубицин 40 мг/м2) в/в струйно в день 1 + оксалиплатин 130 мг/м2 в/в капельно в день 1 + капецитабин по 625 мг/м2х 2 р/сут внутрь c 1 по 21 дни
Повтор каждые 3 недели
DCF (1b, А)
Доцетаксел 75 мг/м2 в/в капельно в день 1 + Цисплатин 75 мг/ м2 в/в капельно на фоне гипергидратации и антиэметиков в день 1 + 5-фторурацил по 750 мг/ м2 в сутки х24-часовая инфузия в дни 1–5
Повтор каждые 3 недели.
FLOT
Доцетаксел 50 мг/м2 в/в капельно в день 1 + Оксалиплатин 85 мг/м2 в день 1 + Лейковорин 200 мг/м2 2-часа в/в инфузия в день 1 + 5-ФУ 2600 мг/м2 х в/в инфузия 24-часа (допустима инфузия той же суммарной дозы 5-ФУ в течение 48 часов) в день 1
Повтор каждые 2 недели
Двухкомпонентные режимы
CF, PF (1b, А)
Цисплатин 75 мг/м2 в/в капельно в день 1 на фоне гипергидратации и антиэметиков + 5-ФУ по 1000 мг/м2/сут 24-часовая в/в инфузия в 1–5-й день.
Повтор каждые 4 недели.
FOLFIRI (2B)
Иринотекан 180мг/м2 в 1 день + Лейковорин 400мг/мх 2-часа в/в инфузия в 1 день + 5-ФУ 400мг/м2 в/в струйно +5-ФУ 2000-2600мг/м2 х 48 час в/в инфузия 1 день
Повтор каждые 2 недели
XP (1b, A)
Капецитабин по 1000мг/ м2 х 2 раза в день внутрь с 1 по 14 дни цикла или с вечера первого дня по утро 15 дня цикла + Цисплатин 80 мг/м2 в/в капельно на фоне гипергидратации и антиэметиков в 1 день.
Повтор каждые 3 недели.
XELOX (CAPOX)(1b, A)
Капецитабин по 1000мг/ м2 х 2 раза в день внутрь с 1 по 14 дни цикла или с вечера первого дня по утро 15 дня цикла + Оксалиплатин 100-130 мг/м2 в /в капельно в 1 день.
Повтор каждые 3 недели.
mFOLFOX6 (2B)
Оксапиплатин 85 мг/м2 в день 1 +Лейковорин 200 мг/м2 2-часа в/в инфузия в день 1 + 5-ФУ 400 мг/м2 в/в струйно +5-ФУ 2400мг/м2 х в/в инфузия 46 часов в день 1
Повтор каждые 2 недели
T-XP (1b, A)
(только при наличии гиперэкспрессии/амплификации HER-2 в опухоли)
Трастузумаб 8 мг/кг в 1 день первого курса, затем по 6 мг/кг в 1 день +
Капецитабин по 1000мг/ м2х 2 раза в день внутрь с 1го по 14 дни цикла или с вечера первого дня по утро 15 дня цикла +
Цисплатин 80 мг/м2 в/в капельно в 1 день на фоне гипергидратации и антиэметиков.
Повтор каждые 3 недели.
Другие комбинированные режимы (неоптимальные) (2B)
ELF
Этопозид по 120 мг/м2 в/в капельно в дни 1—3 + Лейковорин по 50 мг в/в струйно в 1—3 дни + 5-ФУ по 500 мг/м2 в/в струйно в 1—3 дни.
Повтор каждые 3-4 нед.
Монохимиотерапия (1a) первой линии
-
5-фторурацил: по 800 мг/м2/сут х 24 часа в 1–5 дни каждые 3–4 недели
-
Лейковорин 200 мг/м2 2-часа в/в инфузия в день 1 + 5-ФУ 400 мг/м2 в/в струйно +
5-ФУ 2400мг/м2 х в/в инфузия 46 часов в день 1-2
Повтор каждые 2 недели
-
Капецитабин: по 2000 мг/м2/сут, р.о. (в 2 приема) с 1 по 14 дни, каждые 3 недели
-
Иринотекан по 150-180 мг/м2 1 раз в 2 недели
-
Иринотекан по 250-300 мг/м2 1 раз в 3 недели
-
Доцетаксел по 60-75 мг/м2 1 раз в 3 недели
-
Паклитаксел по 80 мг/м2 в 1; 8; 15 дни каждые 4 недели
-
Паклитаксел по 135-175 мг/м2 1 раз в 3 недели
Терапия второй линии (2B)
Монотерапия
Иринотекан по 150-180 мг/м2 1 раз в 2 недели
Иринотекан по 250-300 мг/м2 1 раз в 3 недели
Доцетаксел по 60-75 мг/м2 1 раз в 3 недели
Паклитаксел по 80 мг/м2 в 1; 8; 15 дни каждые 4 недели
Паклитаксел по 135-175 мг/м2 1 раз в 3 недели
Рамуцирумаб 8 мг/кг 1 раз в 2 недели
Ниволумаб 3 мг/кг каждые 2 недели
Комбинированные режимы
Паклитаксел по 80 мг/м2 в 1; 8; 15 дни + рамуцирумаб 8 мг/кг в 1; 15 дни каждые 4 недели
ELF
Этопозид по 120 мг/м2 в/в капельно в дни 1–3 +
Лейковорин по 50 мг в/в струйно в дни 1–3 +
5-ФУ по 500 мг/м2 в/в струйно в дни 1–3
Повтор каждые 3-4 недели
XELIRI
Иринотекан 200мг/м2 в день 1 + Капецитабин по 850 мг/ м2 х 2 раза в день внутрь с 1 по 14 дни цикла или с вечера первого дня по утро 15 дня цикла
Повтор каждые 3 недели
3.5. Симптоматическая терапия
Целью ОСТ (от англ. Best supportive care) является профилактика и облегчение симптомов заболевания, поддержание качества жизни пациентов и их близких, независимо от стадии заболевания и потребности в других видах терапии. В случае рака желудка, меры, направленные на облегчение основных симптомов, способствуют увеличению продолжительности жизни [36]
Кровотечение является частым осложнением рака желудка. Пациентам с острым кровотечение (рвота кровью или мелена) необходимо выполнить срочное эндоскопическое исследование. В зависимости от результатов исследования производят эндоскопическую остановку кровотечения, при ее неэффективности — или хирургическое вмешательство
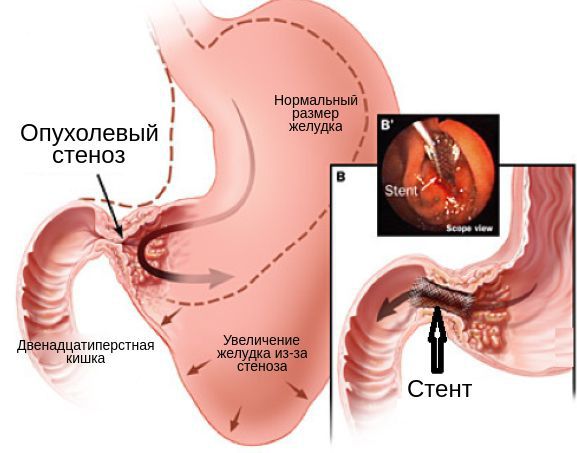
Опухолевый стеноз
-
Эндоскопическое устранение обструкции (реканализация, бужирование).
-
Баллонная дилятация.
-
Установка саморасправляющегося стента в зону опухолевого стеноза.
-
Оперативное лечение (гастроеюностомия, паллиативная резекция/гастрэктомия у отдельных пациентов).
-
Чрезкожная эндоскопическая или интервенционная гастростомия для питания больных с дисфагией.
-
Эндоскопическая или хирургическая еюностомия у больных со стенозом на уровне средней или нижней трети желудка.
Лечение болевого синдрома
-
Дистанционная лучевая терапия.
-
Медикаментозная терапия.
-
Локорегионарная анестезия.
Лечение асцита
-
Диуретики.
-
Лапароцентез.
-
Внутрибрюшинное введение химиотерапии. Обычно применяется цисплатин в дозе 50-80 мг.
Рак желудка
Версия: Клинические протоколы МЗ РК — 2022 (Казахстан)
Категории МКБ:
Злокачественное новообразование желудка (C16)
Разделы медицины:
Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от 21 ноября 2022 года
Протокол №174
Рак желудка – это злокачественное новообразование желудка, злокачественная опухоль, формирующаяся из клеток внутреннего слизистого слоя желудочной стенки.
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
РАК ЖЕЛУДКА
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
| Код | Название |
| С 16 | Злокачественное новообразование желудка |
| С 16.0 |
Злокачественное новообразование кардиального отдела желудка. |
| С 16.1 | Злокачественное новообразование дна желудка. |
| С 16.2 | Злокачественное новообразование тела желудка. |
| С 16.3 | Злокачественное новообразование антрального отдела желудка. |
| С 16.4 |
Злокачественное новообразование пилорического отдела желудка. |
| С 16.8 |
Злокачественное новообразование желудка, выходящие за пределы одной и более вышеуказанных локализаций. |
| С 16.9 | Злокачественное новообразование желудка, неуточненное. |
Дата разработки/пересмотра протокола: 2015 г. (пересмотр 2018 г/2022 г.)
Сокращения, используемые в протоколе:
| ЗНО | злокачественное новообразование |
| КТ | компьютерная томография |
| МРТ | магнитно-резонансная томография |
| ССС | сердечно-сосудистая система |
| ПЭТ | позитронно-эмиссионная томография |
| УЗИ | ультразвуковое исследование |
| ФЭГДС | фиброэзофагогастродуоденоскопия |
| ЭГС | эзофагогастроскопия |
| ЭКГ | электрокардиография |
| GIST | гастроинтестинальная стромальная опухоль |
| XELOX | схема химиотерапии: кселода + оксалиплатин |
| TNM | Tumor Nodulus Metastasis — международная классификация стадий злокачественных новообразований |
| ВОЗ | всемирная организация здравоохранения |
Пользователи протокола: онкологи (онкохирурги, химиотерапевты, радиологи), общие хирурги, гастроэнтерологи, врачи общей практики, врачи скорой и неотложной помощи, патологоанатомы, морфологи.
Категория пациентов: взрослые.
Шкала уровня доказательности:
Таблица 1 – Уровни доказательств в соответствии с международными критериями.
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
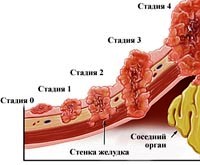
Классификация [5]
Гистологическая классификация опухолей желудка [5]
Злокачественные эпителиальные опухоли желудка:
- Аденокарцинома — наиболее частая форма (95%): а. папиллярная;
б.тубулярная;
в. Муцинозная;
г. перстневидно-клеточный рак.
- Железисто-плоскоклеточный рак;
- Плоскоклеточнй рак;
- Недифференцируемый рак;
- Мелкоклеточный рак.
Макроскопическая классификация опухолей желудка [5]:
- Полиповидный рак;
- Изъязвленный рак с четкими границами;
- Изъязвленный рак с нечеткими границами;
- Диффузно-инфильтративный.
Международная классификация TNM:
Правила для классификации.
Классификация распространяется только на карциному. Должно быть гистологическое подтверждение болезни. Рак, связанный с эзофагогастральным соединением (ЭГС), эпицентром которого является в проксимальные 2 см кардии (типы Siewert I / II) должны быть поставлены как рак пищевода. Опухоли, эпицентр которых находится на расстоянии более 2 см от ЭГС, будут проводиться с использованием TNM и стадии рака желудка, даже если задействован ЭГС.
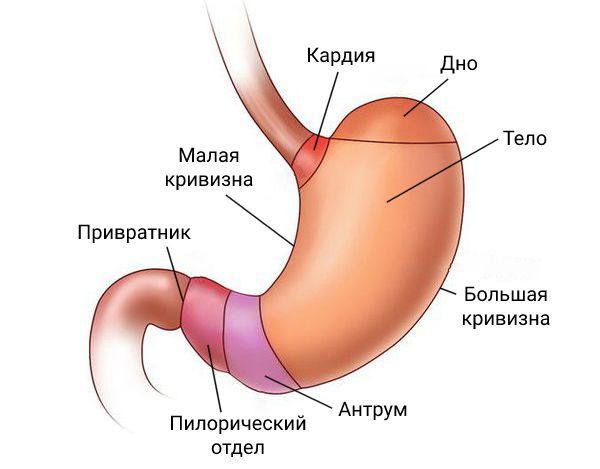
Анатомические области:
- Кардиальный отдел;
- Дно;
- Тело;
- Антральный и пилорический отделы.
- Регионарные лимфатические узлы
Регионарными лимфатическими узлами для желудка являются лимфатические узлы, расположенные вдоль малой (1, 3, 5) и большой (2, 4а, 4б, 6) кривизны, вдоль левой желудочной (7), общей печеночной (8), селезеночной (10, 11) и чревной (9) артерий, а также гепатодуоденальные узлы (12). Поражение других внутрибрюшинных лимфатических узлов, таких как ретропанкреатические, мезентериальные и парааортальные, классифицируются как отдаленные метастазы.
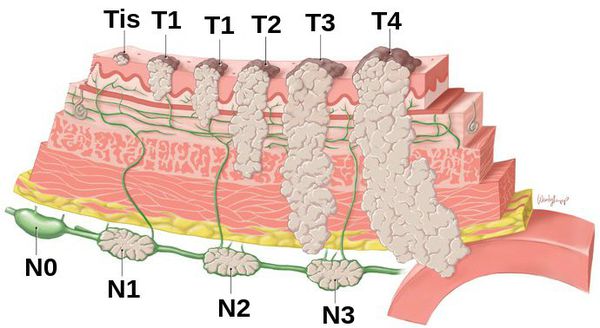
Клиническая классификация TNM 8-е издание 2017г [5]
Т – Первичная опухоль;
Тх – Первичная опухоль не может быть оценена;
То – Отсутствие данных о первичной опухоли;
Tis – Карцинома in situ, интраэпителиальная опухоль без инвазии в собственную пластинку слизистой оболочки, тяжелая дисплазия;
Т1а – Опухоль прорастает в собственную пластинку слизистой оболочки или мышечную пластинку слизистой оболочки;
T1b – Опухоль прорастает в подслизистую
основу; Т2 – Опухоль прорастает в мышечную оболочку;
Т3 – Опухоль прорастает в подсерозную основу без инвазии в висцеральную брюшину или соседних структур1;
Т4а – Опухоль прорастает в серозную оболочку (висцеральная брюшина); T4b – Опухоль врастает в соседние структуры2.
Примечание:
1 Опухоль, которая распространяется на желудочно-ободочную или желудочно- печѐночную связку, большой или малый сальник, но не прорастает в висцеральную брюшину, классифицируют как Т3.
2 Соседними структурами для желудка являются селезѐнка, поперечная ободочная кишка, печень, диафрагма, поджелудочная железа, брюшная стенка,
надпочечники, почки, тонкая кишка, забрюшинное пространство.
N – Региональные лимфатические узлы;
NX – Региональные лимфатические узлы не могут быть оценены;
N0 – Нет метастазов в региональных лимфатических узлах;
N1 –Метастазы в 1 – 2 региональных лимфатических узлах;
N2 – Метастазы в 3—6 региональных лимфатических узлах;
N3 – Метастазы в 7 и более региональных лимфатических узлах.
М – Отдаленные метастазы;
М0 – Нет отдаленных метастазов;
М1 – Есть отдаленные метастазы или наличие опухолевых клеток в асцитической жидкости.
Гастроинтестинальная стромальная опухоль [5]
Классификация TNM:
Т – Первичная опухоль;
ТХ – Первичная опухоль не может быть оценена;
ТО – Отсутствие данных о первичной опухоли;
Т1 – Опухоль не более 2 см;
Т2 – Опухоль более 2 см, но не более 5 см в наибольшем измерении;
Т3 – Опухоль более 5 см, но не более 10 см в
наибольшем измерении;
Т4 – Опухоль более 10 см в наибольшем измерении;
N – Региональные лимфатические узлы;
NX — Региональные лимфатические узлы не могут быть оценены;
N0 — Метастазы региональных лимфатических узлов отсутствуют;
N1 — Метастазы в 1-2 региональных лимфатических узлах;
N2 — Метастазы в 3-6 региональных лимфатических узлах;
N3 — Метастазы в 7 или более региональных лимфатических узлах;
N3a — Метастазы в 7-15 региональных лимфатических узлах;
N3b – Метастазы в 16 или более региональных лимфатических узлах;
*При GIST региональные лимфатические узлы вовлекаются редко, поэтому те случаи, когда статус лимфатических узлов не может быть оценен клинически или морфологически, рассматривают как N0 вместо NX или pNX.
М – Отдаленные метастазы;
М0 – Нет отдаленных метастазов;
М1 – Есть отдаленные метастазы.
Патогистологическая классификация pTNM:
Требования к определению категорий pT, pN, pM соответствуют требованиям к определению категорий T, N, M.
Примечание: pN0 гистологическое исследование включает обычно 15 и более регионарных лимфатических узлов.
G – гистопатологическая дифференцировка;
GX – степень дифференцировки не может быть установлена;
G1 – высокая степень дифференцировки;
G2 – средняя степень дифференцировки; G3 — низкая степень дифференцировки;
G4 — недифференцируемый рак.
| Группировка по стадиям: | |||
| Стадия | T | N | M |
| СТАДИЯ 0 | Tis | N0 | М0 |
| СТАДИЯ IА | Т1 | N0 | М0 |
| СТАДИЯ IB | Т1 | N1 | М0 |
| Т2 | N0 | М0 | |
| СТАДИЯ IIA | Т1 | N2 | М0 |
| Т2 | N1 | М0 | |
| Т3 | N0 | М0 | |
| СТАДИЯ IIIА СТАДИЯ IIIB | Т1 | N3 | М0 |
| Т2 | N2 | М0 | |
| Т3 | N1 | М0 | |
| Т4a | N0 | М0 | |
| СТАДИЯ IIIC | Т2 | N3 | М0 |
| Т3 | N2 | М0 | |
| Т4a | N1 | М0 | |
| СТАДИЯ IIIА | Т3 | N3 | М0 |
| Т4a | N2 | М0 | |
| Т4b | N0-1 | М1 | |
| Т4a | N3 | М0 | |
| Т4b | N2-3 | М0 | |
| СТАДИЯ IIIB | Любая Т | Любая N | М1 |
Прогностические факторы
| Прогностические факторы | Связанные с опухолью | Связанные с организмом |
Связанные с окружающей средой |
| Основные |
N категория M категория Статус HER2 |
Остаточная болезнь: R0, R1 or R2 | |
| Дополнительные |
Со стороны опухоли: кардиа или дистальный желудок Гистологический тип Инфильтрация сосудов |
Возраст | Степень резекции |
| Новые и перспективные | Молекулярный профиль | Расса: Азиат или не Азиат |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [7, 20]
Диагностические критерии:
Жалобы и анамнез:
Патогномоничных симптомов рака желудка не установлено.
Жалобы пациента могут соответствовать проявлениям различных заболеваний желудка (хронический гастрит, язвенная болезнь желудка и т.д.).
- Боли в эпигастральной области;
- Дисфагию;
- Тошноту;
- Рвоту (в том числе «кофейной гущей»);
- Потеря аппетита;
- Снижение веса.
Физикальное обследование:
- Положение больного при поздних стадиях рака желудка, чаще вынужденное с выраженной адинамией.
- При осмотре лица – может встречаться уменьшение блеска и живости глаз.
- Бледность кожных покровов может быть указанием на желудочно-кишечное кровотечение. Восковидный или землистый оттенок приобретают кожные покровы у больных с поздними стадиями рака желудка.
- В некоторых случаях при развитии метастазов в симпатические узлы брюшной полости можно наблюдать и выраженную диффузную гиперпигментацию кожных покровов.
- В далеко зашедших стадиях рака желудка отмечаются также сухость кожи и снижение ее тургора.
- Выраженное похудание, достигающее степени кахексии, встречается при раке дистального отдела желудка. В таких случаях у больных появляются и безбелковые отеки.
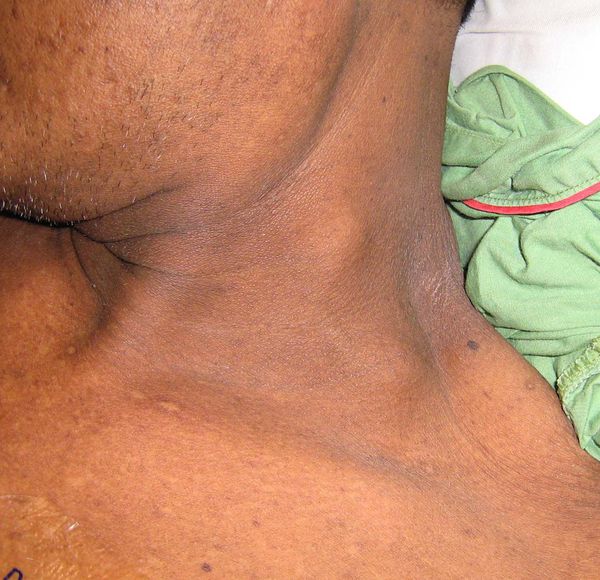
- В поздних стадиях в надключичной области слева между ножками грудиноключично-сосцевидной мышцы иногда удается определить плотный лимфатический узел с неровной поверхностью, не спаянный с прилегающей кожей (метастаз Вирхова).
- При осмотре полости рта у пациентов с раком желудка может появиться зловонный запах изо рта – признак распада злокачественной опухоли желудка.
- Выбухание стенки живота в подложечной области наблюдается при запущенных формах рака желудка. При резком похудании в ряде случаев удается визуально определить контуры желудка, его малую и большую кривизну.
- При развитии опухолевого стеноза привратника у некоторых пациентов определяются периодические волнообразные движения, приподнимающие в ограниченных участках переднюю брюшную стенку, которые становятся более отчетливыми после предварительного легкого поколачивания брюшной стенки в эпигастральной области.
- При пальпации передней брюшной стенки опухоли желудка отчетливо пальпируются в тех случаях, если они располагаются преимущественно в дистальных отделах желудка (антральном, пилорическом) и достигают нескольких сантиметров в диаметре.
- При перкуссии можно уточнить положение нижней границы желудка, обнаружить изменение пространства Траубе (при раке субкардиального отдела желудка).
Лабораторные исследования [20]:
Цитологическое исследование (увеличение размеров клетки вплоть до гигантских, изменение формы и количества внутриклеточных элементов, увеличение размеров ядра, его контуров, разная степень зрелости ядра и других элементов клетки, изменение количества и формы ядрышек)
Гистологическое исследование (крупные полигональные или шиповидные клетки с хорошо выраженной цитоплазмой, округлыми ядрами с четкими ядрышками, с наличием митозов, клетки располагаются в виде ячеек и тяжей с или без образования кератина, наличие опухолевых эмболов в сосудах, выраженность лимфоцитарно-плазмоцитарной инфильтрации, митотическая активность опухолевых клеток):
- HER-2
- Cytokeratin 7
- Cytokeratin 8/18
- CD45
Комплексное геномное профилирование пациентов, у пациентов с тяжелым клиническим течением, агрессивными опухолями, с высоким риском прогрессирования, отсутствием эффекта от традиционных методов противоопухолевого лечения.
Инструментальные исследования [20]:
- фиброэзофагогастродуоденоскопия (позволяет увидеть дефект слизистой, определить его размеры и характер, взять кусочек ткани для гистологического исследования);
- рентгеноскопическое исследование пищевода с контрастированием, рентгеноскопическое исследование желудка с контрастированием (двойное контрастирование) (позволяет определить распространенность и протяженность ЗНО желудка, а также определить тактику хирургического вмешательства);
- ультразвуковая диагностика комплексная (печень, желчный пузырь, поджелудочная железа, селезенка, почек, надключичных л/узлов) (эхогенное наличие увеличенных л/узлов брюшной полости и забрюшинного пространства, наличие метастазов в брюшной полости, а также прорастание ЗНО желудка в соседние структуры);
- компьютерная томография органов брюшной полости и забрюшинного пространства (более четка визуализация наличий, увеличенных л/узлов брюшной полости и забрюшинного пространства, наличий метастазов в брюшной полости, а также прорастание ЗНО желудка в соседние структуры).
- морфологическое исследование – основной метод дифференциальной диагностики рака желудка с другими заболеваниями. Обнаружение в биоптате злокачественных клеток однозначно свидетельствует о раке пищевода, хотя отсутствие признаков опухоли в однократно полученном материале не исключает это заболевание. Только при многократных отрицательных результатах наряду с динамическим наблюдением можно считать патологический процесс доброкачественным.
Показания для консультации специалистов:
- консультация кардиолога (пациентам 50 лет и старше, так же пациенты моложе 50 лет при наличии сопутствующей патологии со стороны ССС или патологических изменении на ЭКГ);
- консультация невропатолога (при сосудистых мозговых нарушениях, в том числе инсультах, травмах головного и спинного мозга, эпилепсии, миастении, нейроинфекционных заболеваниях, а также во всех случаях потери сознания);
- консультация нейрохирурга (при наличии метастазов головной мозг, позвоночник);
- консультация эндокринолога (при наличии сопутствующей патологии эндокринных органов, например – сахарный диабет).
- консультация других специалистов по поводу наличия сопутствующих патологий: гинеколога (острые и хронические заболевания женских половых органов), фтизиатра (туберкулез в анамнезе), инфекционист (хронический гепатиты) и др.
- консультация нефролога (при наличии сопутствующей патологии со стороны почек, гиперазотемия).
Дифференциальный диагноз
Дифференциальный диагноз:
|
Диагноз |
Обоснование для дифференциальной диагностики |
Обследования |
Критерии исключения диагноза |
|
Язвенная болезнь |
Для исключения злокачественного характера язвы необходима множественная биопсия по краям дефекта и из дна язвы. |
обязательно выполняют ФЭГДС и |
Необходимо помнить о возможности заживления |
|
Полипы желудка |
Для исключения злокачественного характера полипов необходима биопсия. |
Размер полипов варьирует от небольшого выбухания до крупных полипоидных масс, имитирующих рак желудка. |
Полипы, как правило, бывают случайной |
|
Лимфома желудка |
Часто связана с инфекцией Helicobacter pylori. |
Характерны |
Для верификациии типирования необходима глубокая биопсия с иммуно- гистохимическим исследованием, наиболее часто речь идѐт о В-клеточной лимфоме. |
|
Саркома желудка |
Наиболее часто представлена лейомиосаркомой, занимающей переднюю или заднюю стенку желудка. |
Для верификации и типирования |
Характеризуется медленным ростом, |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [16, 17]
Немедикаментозное лечение [16]:
-
Соблюдение диеты №1 для пациентов с раком желудка — пожизненное.
-
Ношение бандажа, ограничение физической нагрузки – в течении 6-и месяцев;
Медикаментозное лечение [17]:
Химиотерапия – это медикаментозное лечение злокачественных раковых опухолей, направленное на уничтожение или замедление роста раковых клеток с помощью специальных препаратов, цитостатиков. Лечение рака химиотерапией происходит систематически по определенной схеме, которая подбирается индивидуально. Как правило, схемы химиотерапии опухолей состоят из нескольких курсов приема определенных комбинаций препаратов с паузами между приемами, для восстановления поврежденных тканей организма.
Перечень основных лекарственных средств (имеющих 100 % вероятность применения): нет.
Перечень дополнительных лекарственных средств (менее 100 % вероятности применения):
|
Фармакотерапевтическая группа |
МНН |
Способ применения |
УД |
|
Фторпиримидины |
Капецитабин |
2000 мг/м2, 1-14 дни, таблетки, внутрь |
А |
Хирургическое лечение: нет.
Дальнейшее ведение: нет.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе: нет.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [5, 9, 16,17]
Карта наблюдения пациента, маршрутизация пациента: нет.
Цели лечения:
-
полное или частичное удаление органа со злокачественным новообразованием; достижение полной или частичной регрессии, стабилизации опухолевого процесса
Выбор методов лечения рака желудка зависит от многих факторов, в том числе размеров самой опухоли, вовлечения в процесс других органов, тканей, лимфатических узлов. Важным моментом является наличие у пациента сопутствующих заболеваний (тяжелые болезни сердца, легких, почек).
Специалисты учитывают все эти факторы. Для пациента разрабатывают индивидуальный план, который может состоять из хирургического лечения и/или химиотерапии.
Лечение в зависимости от стадии; Стадии 0, I А, I В, IIА, IIВ:
-
Дистальная субтотальная гастрэктомия.
-
Проксимальная субтотальная гастрэктомия.
-
Лапароскопическая дистальная гастрэктомия (при наличия соответствующего оборудования)
-
Гастрэктомия (тотальная).
-
Эндоскопическая мукозэктомия (Tis или T1а) при условии овладения техники проведения операций).
-
Обязательным компонентом стандартных операций является лимфодиссекция в объеме D2. Стадии заболевания Т3, N1-2 предполагают курсы адъювантной полихимиотерапии.
Стадии IIIА, IIIВ, IIIС
-
Гастрэктомия.
-
Обязательным компонентом стандартных операций является лимфодиссекция в объеме D2. Установление до операции местнораспространенной формы (Т3- Т4), наличие метастазов в регионарных (N1-N2), а также низкодифференцированные гистологические формы опухолевого процесса предполагает проведение курсов (2- 3) неоадъювантной лекарственной терапии при условии согласия пациентов на проведение лекарственной терапии в предоперационном режиме, а также отсутствием противопоказаний к ней (опухолевые стенозы, кровотечения и др.).
-
Адъювантные курсы полихимиотерапии с учетом ответа опухоли на проводимую предоперационную лекарственную терапию.
Стадия IV
-
Оперативное лечение с паллиативной целью, например, при опухолевой обструкции, перфорации или сильного кровотечения. Может быть выполнена циторедуктивная гастрэктомия, гастро-энтероанастомоз. Лимфодиссекция не выполняется. Могут рассматриваться варианты гастростомии и/или еюностомии, а также стентирование при желудочной обструкции.
-
Адъювантные курсы полихимиотерапии;
-
Самостоятельные курсы паллиативной полихимиотерапии.
Рецидив
Хирургические вмешательства (индивидуализированно):
-
различные по объему радикальные и паллиативные оперативные вмешательства;
-
эндоскопическое разрушение опухоли;
-
установка стентов.
Паллиативная химиотерапия (индивидуализированно).
Критерии эффективности лечения
Эффект от проведенного лечения оценивается по критериям ВОЗ:
Полный эффект – исчезновение всех очагов поражения на срок не менее 4х недель.
Частичный эффект – большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов.
Стабилизация – (без изменений) уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения.
Прогрессирование – увеличение размеров одной или более опухолей более 25% либо появление новых очагов поражения.
Немедикаментозное лечение [5, 9, 16, 17]:
Режим:
Двигательные режимы, используемые в больницах и госпиталях, делятся на: I — строгий постельный, II — постельный, III — палатный (полупостельный) и IV — свободный (общий).
При проведении неоадъювантной или адъювантной химиотерапии — режим III (палатный). В раннем послеоперационном периоде — режим I (строгий постельный), с дальнейшим его расширением до II, III по мере улучшения состояния и заживления швов.
Диета: для пациентов в послеоперационном периоде – голод, с переходом на стол №1, 1а. Для пациентов получающих химиотерапию стол — №1, 1а.
Соблюдение диеты в послеоперационном периоде, для больных раком желудка — пожизненное.
Медикаментозное лечение [5, 9, 16, 17]:
Химиотерапия – это медикаментозное лечение злокачественных раковых опухолей, направленное на уничтожение или замедление роста раковых клеток с помощью специальных препаратов, цитостатиков. Лечение рака химиотерапией происходит систематически по определенной схеме, которая подбирается индивидуально. Как правило, схемы химиотерапии опухолей состоят из нескольких курсов приема определенных комбинаций препаратов с паузами между приемами, для восстановления поврежденных тканей организма.
Существует несколько видов химиотерапии, которые отличаются по цели назначения:
- неоадъювантная химиотерапия опухолей назначается до операции, с целью уменьшения неоперабельной опухоли для проведения операции, а также для выявления чувствительности раковых клеток к препаратам для дальнейшего назначения после операции.
- адъювантная химиотерапия назначается после хирургического лечения для предотвращения метастазирования и снижения риска рецидивов.
- лечебная химиотерапия назначается для уменьшения метастатических раковых опухолей.
В зависимости от локализации и вида опухоли химиотерапия назначается по разным схемам и имеет свои особенности.
Показания к химиотерапии:
- гистологически верифицированные ЗНО желудка;
- при лечении нерезектабельных опухолей;
- отдаленные метастазы или отдаленных лимфатических узлах;
- рецидив опухоли;
- удовлетворительная картина крови у пациента: нормальные показатели гемоглобина и гемокрита;
- сохраненная функция печени, почек, дыхательной системы и ССС;
- возможность перевода неоперабельного опухолевого процесса в операбельный;
- отказ пациента от операции;
- улучшение отдаленных результатов лечения при неблагоприятных гистотипах опухоли (низкодифференцированный, недифференцированный).
Противопоказания к химиотерапии:
Противопоказания к химиотерапии можно разделить на две группы: абсолютные и относительные.
Абсолютные противопоказания:
- гипертермия >38 градусов;
- заболевание в стадии декомпенсации (сердечно – сосудистой системы, дыхательной системы печени, почек);
- наличие острых инфекционных заболеваний;
- психические заболевания;
- неэффективность данного вида лечения, подтвержденная одним или несколькими специалистами;
- распад опухоли (угроза кровотечения);
- тяжелое состояние пациента по шкале Карновского (таблица см. приложение 1) 50% и меньше.
Относительные противопоказания:
- беременность;
- интоксикация организма;
- активный туберкулез легких;
- стойкие патологические изменения состава крови (анемия, лейкопения, тромбоцитопения);
- кахексия.
ПРЕДОПЕРАЦИОННАЯ ХИМИОТЕРАПИЯ
Предпочтительные режимы (УД-А):
- Фторурацил и оксалиплатин: Оксалиплатин 85 мг/м2 в/в в 1 день;
Кальция фолинат (или натрия фолинат) 400 мг/м2 в/в в 1 день;
Фторурацил 400 мг/м2 в/в струйно в 1й день;
Фторурацил 1200 мг/м2 в непрерывной в/в инфузии в течение 24 часов ежедневно в дни 1 и 2 дни — цикл каждые 14 дней.
Оксалиплатин 85 мг/м2 в/в в 1 день;
Кальция фолинат (или натрия фолинат) 200 мг/м2 в/в в 1-й день
Фторурацил 2600 мг/м2 в/в в непрерывной инфузии в течение 24 часов в 1 день — цикл каждые 14 дней;
Капецитабин 1000 мг/м2 внутрь в 1-14 дни; Оксалиплатин 130 мг/м2 в/в в 1-й день; Цикл каждые 3 недели.
- FLOT (в качестве периоперативного режима)
Фторурацил 2600 мг/м2 в/в в непрерывной инфузии в течение 24 часов в 1 день; Кальция фолинат (или натрия фолинат) 200 мг/м2 в/в в 1 день;
Оксалиплатин 85 мг/м2 в/в в 1 день; Доцетаксел 50 мг/м2 в/в в 1-й день;
Цикл каждые 14 дней, 4 цикла предоперационно и 4 цикла после операции в общей сложности 8 циклов.
Другие рекомендуемые режимы (УД-В):
1. Фторурацил и цисплатин
Фторурацил 2000 мг/м2 в/в в непрерывной инфузии в течение 48 часов в 1-2 дни; Цисплатин 50 мг/м2 в/в в 1-й день;
Цикл каждые 14 дней, 4-6 циклов до операции и 4-6 циклов после операции — всего 12 курсов.
- В режимах, включающих фторурацил, возможно применение как кальция фолината, так и динатрия фолината и динатрия левофолината по причине их абсолютной биоэквивалентности. При применении динатрия левофолината доза фолината уменьшается в два раза.
ПРЕДОПЕРАЦИОННАЯ ХИМИОЛУЧЕВАЯ ТЕРАПИЯ
Предпочтительные режимы (УД — А)
- Паклитаксел и карбоплатин Паклитаксел 50 мг/м2 в/в в 1 день; Карбоплатин AUC 2 в/в в 1-й день; Еженедельно в течение 5 недель.
- Фторурацил и оксалиплатин Оксалиплатин 85 мг/м2 в/в в 1 день;
Кальция фолинат (или натрия фолинат) 400 мг/м2 в 1 день; Фторурацил 400 мг/м2 в/в струйно в 1-й день;
Фторурацил 800 мг/м2 в виде непрерывной в/в инфузии в течение 24 часов ежедневно в 1 и 2 дни;
Цикл каждые 14 дней — 3 цикла совместно лучевой терапией и 3 цикла после.
- Капецитабин и оксалиплатин
Оксалиплатин 85 мг/м2 в/в в 1, 15 и 29 дни;
Капецитабин 625 мг/м2 внутрь, в 1-5 дни в течение 5 недель.
Другие рекомендуемые режимы (УД — В):
- Фторурацил и цисплатин
Цисплатин 75-100 мг/м2 в/в в 1 и 29 дни;
Фторурацил 750-1000 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов, ежедневно в дни 1-4 и 29-32;
Цикл 35 дней.
Цисплатин 15 мг/м2 в/в ежедневно в 1-5 дни;
Фторурацил 800 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1-5 дни;
Интервалом каждые 21 день — 2 курса.
- Капецитабин и цисплатин Цисплатин 30 мг/м2 в/в в 1 день;
Капецитабин 800 мг/м2 внутрь в 1-5 дни в течение 5 недель;
- Паклитаксел и Фторурацил
Паклитаксел 45-50 мг/м2 в/в в 1 день;
Фторурацил 300 мг/м2 в/в в виде непрерывной инфузии ежедневно в 1-5 дни; Еженедельно в течение 5 недель.
Паклитаксел 45-50 мг/м2 в/в в 1-й день;
Капецитабин 625-825 мг/м2 внутрь, в 1-5 дни в течение 5 недель.
ПОСТОПЕРАЦИОННАЯ ХИМИОЛУЧЕВАЯ ТЕРАПИЯ
1.Фторурацил (болюс) и Кальция фолинат (или натрия фолинат) (УД — А)
Циклы 1, 3 и 4 (до и после облучения)
Кальция фолинат (или натрия фолинат) 20 мг / м2 в/в струйно на 1-5 дни; Фторурацил 425 мг/м2 в/в струйно ежедневно в 1-5 дни;
Цикл каждые 28 дней.
Цикл 2 (с облучением)
Кальция фолинат (или натрия фолинат) 20 мг/м2 в/в струйно на 1-4 дни и 31-33 дни; Фторурацил 400 мг/м2 в/в струйно ежедневно на 1-4 и 31-33 дни;
Цикл каждые 35 дней.
- цикл до и 2 цикла после химиолучевой теарпии:
Капецитабин 750-1000 мг/м2 внутрь, в 1-14 дни. Цикл каждые 28 дней.
- цикла до и 4 цикла после химиолучевой терапии:
Кальция фолинат (или натрия фолинат) 400 мг/м2 в/в в 1-й день; Фторурацил 400 мг/м2 в/в струйно в 1-й день;
Фторурацил 2400 мг/м2 в/в в виде непрерывной инфузии в течение 46 часов в день в первый день;
Цикл каждые 14 дней.
Совместно с лучевой терапией:
Фторурацил 200-250 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1-5 или 1-7 дни;
Еженедельно в течение 5 недель.
Совместно с лучевой терапией:
Капецитабин 625-825 мг/м2 внутрь в 1-5 или 1-7 дни в течение 5 недель.
ПОСЛЕОПЕРАЦИОННАЯ ХИМИОТЕРАПИЯ
(для пациентов, подвергшихся первичной диссекции лимфатических узлов D2).
- Капецитабин и оксалиплатин
Капецитабин 1000 мг/м2 внутрь в 1-14 дни; Оксалиплатин 130 мг/м2 в/в в 1-й день; Цикл каждые 21 день — 8 курсов.
СИСТЕМНАЯ ТЕРАПИЯ ДЛЯ МЕТАСТАТИЧЕСКОГО ИЛИ МЕСТНО- РАСПРОСТРАНЕННОГО РАКА (ПРОВЕДЕНИЕ ЛОКАЛЬНОГО ЛЕЧЕНИЯ НЕ ПОКАЗАНО)
Первая линия терапии (УД — А):
- Трастузумаб (с химиотерапией)
Трастузумаб 8 мг/кг в/в нагрузочная доза на 1-й день, затем 6 мг/кг в/в, каждые 21 день (для HER позитивного рака) или Трастузумаб 6 мг/кг в/в нагрузочная доза в 1 день, затем 4 мг/кг в/в каждые 14 дней (для HER позитивного рака). Данные режимы рекомендовано проводить в комбинации с фторпиримидинами (фторурацил или капецитабин) и препаратами платины (оксалиплатин либо цисплатин).
- Ниволумаб* (PD-L1 CPS≥5), при HER-2 негативном варианте, в комбинации с фторпиримидинами (фторурацил или капецитабин) и оксалиплатином.
* не зарегистрирован на территории Республики Казахстан
Предпочтительные режимы (УД-А):
- Фторурацил и цисплатин
Цисплатин 75-100 мг/м2 в/в в 1 день;
Фторурацил 750-1000 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно 1-4 в дни.
Цикл каждые 28 дней.
Цисплатин 50 мг/м2 в/в ежедневно в 1 день;
Кальция фолинат (или натрия фолинат) 200 мг/м2 в/в в 1 день;
Фторурацил 2000 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов в 1 день; Цикл каждые 14 дней.
Цисплатин 80 мг/м2 в/в ежедневно в 1 день; Капецитабин 1000 мг/м2 внутрь в 1-14 дни; Цикл каждые 21 день.
- Фторурацил и оксалиплатин
Оксалиплатин 85 мг/м2 в/в в 1 день;
Кальция фолинат (или натрия фолинат) 400 мг/м2 в/в в 1 день; Фторурацил 400 мг/м2 в/в струйно в 1 день;
Фторурацил 1200 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1 и 2 дни;
Цикл каждые 14 дней.
Оксалиплатин 85 мг/м2 в/в в 1 день;
Кальция фолинат (или натрия фолинат) 200 мг/м2 в/в в 1 день.
Фторурацил 2600 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов в 1 день; Цикл каждые 14 дней.
Капецитабин 1000 мг/м2 внутрь, в 1-14 дни; Оксалиплатин 130 мг/м2 в/в в 1-й день;
Цикл каждые 21 день.
- В режимах, включающих фторурацил, возможно применение как кальция фолината, так и динатрия фолината и динатрия левофолината по причине их абсолютной биоэквивалентности. При применении динатрия левофолината доза фолината уменьшается в два раза.
Другие рекомендуемые режимы (УД-В):
- Паклитаксел с цисплатином или карбоплатином Паклитаксел 135-200 мг/м2 в/в в 1 день;
Цисплатин 75 мг/м2 в/в в 2 день; Цикл каждые 21 день.
Паклитаксел 90 мг/м2 в/в в 1 день; Цисплатин 50 мг/м2 в/в в 1 день; Цикл каждые 14 дней.
Паклитаксел 200 мг/м2 в/в в 1 день; Карбоплатин AUC 5 в/в в 1 день; Цикл каждые 21 день.
- Доцетаксел и цисплатин Доцетаксел 70-85 мг/м2 в/в в 1 день; Цисплатин 70-75 мг/м2 в/в в 1 день; Цикл каждые 21 день.
- Фторпиримидины:
Кальция фолинат (или натрия фолинат) 400 мг/м2 в/в в 1-й день; Фторурацил 400 мг/м2 в/в струйно в 1-й день;
Фторурацил 1200 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1 и 2 дни;
Цикл каждые 14 дней.
Фторурацил 800 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1-5 дни;
Цикл каждые 28 дней.
Капецитабин 1000-1250 мг/м2 внутрь, на 1-14 дни; Цикл каждые 21 день.
- Таксаны:
Доцетаксел 75-100 мг/м2 в/в в 1 день; Цикл каждые 21 день.
Паклитаксел 135-250 мг/м2 в/в в 1 день; Цикл каждые 21 день.
Паклитаксел 80 мг/м2 в/в в 1 день, еженедельно; Цикл каждые 28 дней.
- Фтороурацил и иринотекан
Иринотекан 180 мг/м2 в/в в 1 день;
Кальция фолинат (или натрия фолинат) 400 мг/м2 в/в в 1-й день;
Фторурацил 400 мг/м2 в/в струйно в 1-й день;
Фторурацил 1200 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1 и 2 дни;
Цикл каждые 14 дней.
- Модифицированный DCF Доцетаксел 40 мг/м2 в/в в 1-й день;
Кальция фолинат (или натрия фолинат) 400 мг/м2 в/в в 1-й день; Фторурацил 400 мг/м2 в/в в 1-й день;
Фторурацил 1000 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1 и 2 дни;
Цисплатин 40 мг/м2 в/в в 3 день; Цикл каждые 14 дней.
Доцетаксел 50 мг/м2 в/в в 1-й день; Оксалиплатин 85 мг/м2 в/в в 1-й день;
Фторурацил 1200 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1 и 2 дни;
Цикл каждые 14 дней.
Доцетаксел 75 мг/м2 в/в в 1 день;
Карбоплатин AUC 6 в/в во 2-й день;
Фторурацил 1200 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1-3 дни;
Цикл каждые 21 день.
- ECF
Эпирубицин 50 мг/м2 в/в в 1 день; Цисплатин 60 мг/м2 в/в в 1 день;
Фторурацил 200 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1-21 дни
Цикл каждые 21 день.
- Модифицированная ECF Эпирубицин 50 мг/м2 в/в в 1 день; Оксалиплатин 130 мг/м2 в/в в 1 день;
Фторурацил 200 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1-21 дни;
Цикл каждые 21 день.
Эпирубицин 50 мг/м2 в/в в 1 день; Цисплатин 60 мг/м2 в/в в 1 день;
Капецитабин 625 мг/м2 внутрь, в 1-21 дни; Цикл каждые 21 день.
Эпирубицин 50 мг/м2 в/в в 1 день; Оксалиплатин 130 мг/м2 в/в в 1 день;
Капецитабин 625 мг/м2 внутрь в 1-21 дни; Цикл каждые 21 день.
ВТОРАЯ И ПОСЛЕДУЮЩИЕ ЛИНИИ ТЕРАПИИ
Предпочтительные режимы (УД — А):
- Рамуцирумаб и паклитаксел (категория 1)
Рамуцирумаб 8 мг/кг в/в в 1 и 15 дни; Паклитаксел 80 мг/м2 в 1, 8 и 15 дни; Цикл каждые 28 дней.
- Таксаны:
Доцетаксел 75-100 мг/м2 в/в в 1 день; Цикл каждые 21 день.
Паклитаксел 135-250 мг/м2 в/в в 1 день; Цикл каждые 21 день.
Паклитаксел 80 мг/м2 в/в в 1 день, еженедельно; Цикл каждые 28 дней.
Паклитаксел 80 мг/м2 в/в в 1, 8 и 15 дни; Цикл каждые 28 дней.
- Иринотекан
Иринотекан 250-350 мг/м2 в/в в 1 день; Цикл каждый 21 день.
Иринотекан 150-180 мг/м2 в/в в 1 день; Цикл каждые 14 дней.
Иринотекан 125 мг/м2 в/в в 1 и 8 дни; Цикл каждый 21 день.
- Фторурацил и иринотекан
Иринотекан 180 мг/м2 в/в в 1 день;
Кальция фолинат (или натрия фолинат) 400 мг / м2 в/в в 1-й день; Фторурацил 400 мг/м2 в/в струйно в 1-й день;
Фторурацил 1200 мг/м2 в/в в виде непрерывной инфузии в течение 24 часов ежедневно в 1 и 2 дни;
Цикл каждые 14 дней.
- Трифлуридина / типирацила в дозе 35 мг / м2 2 раза в день в 1–5 й и 8–12 й дни (третья и последующие линии лечения (категория 1)
Цикл каждые 28 дней
- Пембролизумаб (при второй линии ** полезен в определенных состояниях: высокой мутационной нагрузке TMB high (≥10 мутаций на мега-базу) или высоком уровне MSI-H.
**- показание не зарегистрировано в РК).
- Пембролизумаб
(для третьей**или последующих линий с PD-L1-положительной экспрессией по СPS≥1. **- показание не зарегистрировано в РК)
Пембролизумаб 200 мг в/в в 1 день; Цикл каждые 21 день.
Другие рекомендуемые режимы:
- Рамуцирумаб (категория 1)
Рамуцирумаб 8 мг / кг в/в в 1 день; Цикл каждые 14 дней.
- Иринотекан и цисплатин Иринотекан 65 мг/м2 в/в в 1 и 8 дни; Цисплатин 25-30 мг/м2 в/в в 1 и 8 дни; Цикл каждые 21 день.
- Рамуцирумаб 8 мг/кг в/в, FOLFIRI (Иринотекан 150–180 мг/м² в/в, Кальция фолинат 400 мг/м² в/ в, 5‑фторурацил 400 мг/м² в/в струйно + 2400 мг/м²
в в 46–48 часов) в 1 и 15 день 28 дневного цикла
- Рамуцирумаб и иринотекан (в случае если пациент уже ранее получал препараты таксанового ряда)
Рамуцирумаб 8 мг/кг в/в в 1 и 15 дни.
Иринотекан 150 мг/м2 в/в 1 и 15 дни.
Цикл каждые 28 дней.
- Доцетаксел и иринотекан Доцетаксел 35 мг/м2 в/в в 1 и 8 дни; Иринотекан 50 мг/м2 в/в в 1 и 8 дни; Цикл каждые 21 день.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
| № п/п | МНН ЛС | Доза, кратность, способ введения | УД |
| Алкилирующие агенты – комплексные соединения платины | |||
| 1. | цисплатин | 75 мг/м2 1-й день, в/в | А |
| 2. | карбоплатин | АUC 5-6 1-й день, в/в | А |
| Препараты растительного и природного происхождения | |||
| Микротрубочковые ингибиторы – таксаны | |||
| 3. | доцетаксел | 75 мг/м2 1-й день, в/в | А |
| 4. | паклитаксел | 175 мг/м2 1-й день, в/в | А |
| Антагонисты пиримидина – фторпиримидины | |||
| 5. | капецитабин | 2000 мг/м2, 1-14дни, таблетки, внутрь | А |
| Моноклональные антитела к факторам роста и их рецепторам | |||
| 7. |
трастузумаб |
нагрузочная и поддерживающие дозы 1 раз в 3 недели до прогрессирования, в/в | А |
| 8. | рамуцирумаб | 8 мг/кг в/в в | А |
| Моноклональные антитела к рецепторам PD-1 | |||
| 10. | пембролизумаб | 200 мг в/в в 1 день | А |
| Ингибиторы топоизомеразы 1 | |||
| 11. | иринотекан | 140 мг/м2 в 1-й день, в/в | А |
| Ингибиторы топоизомеразы 11 | |||
| 12. | этопозид | 100 мг/м2 1-5 дни, в/в | С |
| Комплексные соединения платины | |||
| 13. | оксалиплатин | 130 мг/м2 в 1-й день, в/в | А |
| Противоопухолевые антибиотики – флеомицины | |||
| 14. | фторурацил | 400 мг/м2 в/в болюсное введение | А |
| Аналог соматостатина. | |||
| 15. | октреотид | 0,1 мг п/к 3 раза в сутки | С |
| 16. | лантреотид |
90 мг каждые 28 дней в течение 2 месяцев 120 мг каждые 28 дней (4 недели) 60 мг каждые 28 дней (4 недели) |
С |
| Иммуносупрессивным и противоопухолевым действием, является ингибитором mTOR | |||
| 17. | эверолимус | 10 мг внутрь | С |
| Ингибитор протеинтирозинкиназы | |||
| 18. | иматиниб | 400-800мг/сут., перорально, длительно | А |
| 19. | сунитиниб | 25-50 мг/сут., перорально, длительно | А |
Перечень дополнительных лекарственных средств (имеющих 100% вероятности применения):
|
№ п/п |
МНН ЛС | Доза, кратность, способ введения | УД |
| Препараты, снижающие токсичность противоопухолевой терапии | |||
| 1. | кальция фолинат | 400 мг/м2 в/в или 200 мг/м2 в/в | В |
| 2. | динатрия фолинат | 400 мг/м2 в/в или 200 мг/м2 в/в | С |
| 3. | динатрия левофолинат | 200 мг/м2 в/в или 100 мг/м2 в/в | С |
Функционирующие НЭО G1-G3: аналоги соматостатина (симптомная терапия).
Октреотид 0,1 мг п/к 3 раза в сутки в течение короткого периода времени (примерно 2 недели) с целью оценки его эффективности и общей переносимости, затем Октреотид 20 мг внутримышечно 1 раз/28 дней.
Если в течение 3 месяцев обеспечивается адекватный контроль клинических проявлений и биологических маркеров заболевания – октреотид 10 мг внутримышечно 1раз/28 дней.
Если в течение 3 месяцев обеспечивается только частичный контроль клинических проявлений и биологических маркеров заболевания – октреотид 30 мг внутримышечно каждые 4 недели.
Ланреотид рекомендуемая начальная доза составляет 90 мг каждые 28 дней в течение 2 месяцев. В дальнейшем дозу следует подбирать в зависимости от достигнутого уменьшения симптоматики. В случае недостаточного ответа, оцениваемого по клиническим симптомам («приливы» и мягкий стул), доза может быть увеличена до 120 мг каждые 28 дней (4 недели). В случае достаточного ответа, оцениваемого по клиническим симптомам («приливы» и мягкий стул), доза может быть снижена до 60 мг каждые 28 дней (4 недели).
Нефункционирующие НЭО Ki67<2-10%, G1/G2:
- аналоги соматостатина,
- эверолимус 10мг внутрь ежедневно до прогрессирования,
- эверолимус 10мг внутрь ежедневно в комбинации с октреотид 1раз/28 дней, до прогрессирования
Ki67 3-20%, G1/G2:
- фторурацил+эверолимус,
- темозоломид+капецитабин,
- аналоги соматостатина
Ki67>20%, G3:
- карбоплатин/цисплаин+этопозид,
- темозоломид+бевацизумаб,
- темозоломид+капецитабин+бевацизумаб,
- аналоги соматостатина
Схемы химиотерапии, химиотаргетной, иммунотерапии:
- Цисплатин — 80 мг/м² в/в капельно в 1-й день. Этопозид — 120мг/м² в/в капельно в 1-3-й день. Повторение цикла каждые 4 недели;
- Карбоплатин – AUC 4-5. Этопозид100мг/м² в/в 1-3-й день. Повторение цикла каждые 4 недели;
- Дакарбазин – 200 мг/м² в/в в 1-3-й день Эпирубицин – 25 мг/м² в/в в 1-3-й день Фторурацил – 250 мг/ м² в/в в 1-3-й день Повторение цикла каждые 3 недели;
- Темозоломид — 150 мг/ м² /сут внутрь 7 дней, перерыв 7 дней Бевацизумаб – 5 мг/кг в/в 1 раз в 2 недели
Продолжительность курса 22 недели;
- Темозоломид — 150 мг/ м² /сут внутрь в 1 — 5-й день Капецитабин – 2 г/ м² /сут внутрь в 1 – 14-й день Бевацизумаб – 5 мг/кг в/в 1 раз в 2 недели
Повторение цикла каждые 28 дней;
- XELOX: оксалиплатин 130 мг/м2 в 1й день, капецитабин 2000 мг/м2 в сутки (разделить в 2 приема, утором и вечером) в 1-14 й дни;
Особый раздел неэпителиальных опухолей представляют GIST- недавно выделенная самостоятельная нозологическая единица, имеющая индивидуальные гистологические, иммуногистохимические и молекулярно-генетические признаки. Подавляющее большинство GIST (>90%) являются злокачественными. Подтверждением диагноза стромальных опухолей служит выявление в опухолевых клетках экспрессии рецептора Kit (CD117) иммуногистохимическим методом. В случаях первично операбельных GIST показано радикальное удаление опухоли. Использование иматиниба с адъювантной целью 400 мг/сут внутрь в течение 1 года или до прогрессирования.
При резистентности к иматинибу целесообразно увеличение дозы препарата до 800мг/сут. Получены обнадеживающие результаты использования после прогрессирования на фоне лечения иматинибом во второй линии терапии сунитиниба (в монорежиме или в комбинации с иматинибом).
Сунитиниб применяют в дозе 50мг/сут перорально ежедневно в течение 4 нед, затем следует 2-недельный перерыв с возобновлением терапии.
Хирургическое вмешательство [5, 9, 16,17]:
Виды хирургических вмешательств:
- Комбинированная расширенная гастрэктомия с лимфодиссекцией D-2;
- Внутриплевральная проксимальная субтотальная гастрэктомия с резекцией нижней трети пищевода при кардиоэзофагеальном раке, из комбинированного левостороннего торакофренолапаротомного доступа (Osawa- Garlok).
- Внутриплевральная гастрэктомия с резекция нижней трети пищевода при раке проксимального отдела желудка с распространением на абдоминальный отдел пищевода, из комбинированного левостороннего торакофренолапаротомного доступа (Osawa- Garlok).
- Проксимальная субтотальная гастрэктомия;
- Дистальная субтотальная гастрэктомия;
- Лапароскопическая дистальная субтотальная гастрэктомия (при наличии соответственного оборудования).
Показания к хирургическому лечению:
- гистологически верифицированные операбельные ЗНО желудка;
- при отсутствии противопоказании к хирургическому лечению.
Противопоказания к хирургическому лечению при ЗНО желудка:
- наличие у пациента признаков неоперабельности и тяжелой сопутствующей патологии;
- при отделенных метастазах (в печень, легкие, головной мозг и т.д.);
- при отделенных метастазах в лимфатические узлы шеи;
- при наличии опухолевых клеток в асцитической жидкости;
- обширные гематогенные метастазирования, диссеминированного опухолевого
- процесса;
- хронические декомпенсированные и/или острые функциональные нарушения дыхательной, сердечно-сосудистой, мочевыделительной системы;
- аллергия на препараты, используемые при общей анестезии.
Дальнейшее ведение:
Динамическое наблюдение:
- первый год – 1 раз в 3 мес.;
-
второй год – 1 раз в 6 мес.;
- в последующем, пожизненно — 1 раз в год.
Методы обследования:
- фиброгастроскопия;
- рентгенконтрастное исследование пищевода, анастомоза;
- УЗИ органов брюшной полости;
- Рентгенологическое исследование легких;
- УЗИ периферических лимфатических узлов;
- пальцевое исследование прямой кишки;
- осмотр гинеколога (у женщин);
- общий анализ крови.
По показаниям:
- Фиброколоноскопия;
- Ирригоскопия;
- КТ органов брюшной полостей и грудной клетки;
- Ангиография сосудов брюшной полости;
- МРТ органов брюшной полостей и грудной клетки;
- Сцинтиграфия костей скелета;
- Позитронно-эмиссионная томография (ПЭТ) + компьютерная томография всего тела.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
- «ответ опухоли» — регрессия опухоли после проведенного лечения;
Полный эффект – исчезновение всех очагов поражения на срок не менее 4х недель.
Частичный эффект – большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов.
Стабилизация – (без изменений) уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения.
Прогрессирование – увеличение размеров одной или более опухолей более 25% либо появление новых очагов поражения [7] (УД – А).
- безрецидивная выживаемость (трех и пятилетняя);
- «качество жизни» включает кроме психологического, эмоционального и социального функционирования человека, физическое состояние организма больного.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ:
Показания для плановой госпитализации:
-
Наличие у больного морфологически верифицированного ЗНО желудка, подлежащего специализированному лечению.
Показания для экстренной госпитализации: нет.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2022
- 1. Руководство по химиотерапии опухолевых заболеваний под редакцией Н.И.Переводчиковой, В.А. Горбуновой. Москва 2015г;
2. Brierley JD, Gospodarowicz MK, Wittekind C. TNM Classification of malignant tumours. Eighth edition. – 2019:63;
3. Давыдов М.И., Туркин И.Н., Давыдов М.М.. Энциклопедия хирургии рака желудка: Давыдов М.И. (ed.). М.; ЭКСМО, 2016. – С. 536.
4. Bartley A.N., Washington M.K., Colasacco C. et al. HER2 testing and clinical decision making in gastroesophageal adenocarcinoma: guideline from the College of American Pathologists, American Society of Clinical Pathology, and American Society of Clinical Oncology. J Clin Oncol 2017; 35(4):446–64.
5. Поддубная И.В., Каприн А.Д., Лядов В.К. Классификация опухолей TNM. 8-я ред. Руководство и атлас. Т. I: Опухоли торакоабдоминальной локализации. М.; Практическая медицина, 2018. – 424 с.
6. Spolverato G., Ejaz A., Kim Y. et al. Use of endoscopic ultrasound in the preoperative staging of gastric cancer: a multi-institutional study of the US gastric cancer collaborative. J Am Coll Surg 2015;220(1):48–56.
7. Bartley A.N., Washington M.K., Colasacco C. et al. HER2 testing and clinical decision making in gastroesophageal adenocarcinoma: guideline from the College of American Pathologists, American Society of Clinical Pathology, and American Society of Clinical Oncology. J Clin Oncol 2017; 35(4):446–64.
8. Leake P.A., Cardoso R., Seevaratnam R. et al. A systematic review of the accuracy and indications for diagnostic laparoscopy before curative-intent resection of gastric cancer. Gastric Cancer 2019;15(Suppl. 1):S38–47.
9. ESMO (клинические рекомендации, г.Барселона, 2019 г.)
10. Bethesda Handbook of Clinical Oncolology (James Abraham, James L.Gulley, Carmen J.Allegra, 2010)
11. Oxford Handbook of Oncology (Jim Cassidy, Donald Bisset, Roy A.J.Spence, Miranda Payne, 2010)
12. LeeS.W., EtohT., OhyamaT. etal. Short-term outcomes from a multi-institutional, phase III study of laparoscopic versus open distal gastrectomy with D2 lymph node dissection for locally advanced gastric cancer (JLSSG0901). J Clin Oncol 35;15_suppl:4029–29. DOI: 10.1200/JCO.2017.35.15_suppl.4029.
13. NCCN guidelines 2021 ttps://www.nccn.org/professionals/physician_gls/pdf/colon.pdf
14. GLOBOCAN 2018: Estimated cancer incidence, mortality and prevalence worldwide in 2017. Accessed November 4th, 2018.
15. Yao JC, et al. Gastrointestinal Cancers Symposium; January 20‐22, 2011; San Francisco, CA. Abstract 159
16. Pavel ME, Hainsworth JD, Baudin E, et al. Everolimus plus octreotide long-acting repeatable for the treatment of advanced neuroendocrine tumours associated with carcinoid syndrome (Radianr -2): a randomized, placebo-controlled, phase 3 study. Lancet 2011;378:2005-2012.Available at: http://www.ncbi.nih.gov/pubmed/22119496.
17. ESMO Upper Gastrointestinal Cancers Guidelines 2014/ Ann Oncol 2013: 24 (Suppl): vi57-63
18. Moehler M., Shitara K., Garrido M., Salman P., Shen L., Wyrwicz L., et al. Nivolumab (NIVO) plus chemotherapy (chemo) versus chemo as first-line (1l) treatment for advanced gastric cancer/gastroesophageal junction cancer (GC/GEJC)/esophageal adenocarcinoma (EAC): First results of the CheckMate 649 study. Annals of Oncology, Volume 31 Supplement 4, September 2020.Abstract LBA6_PR.
19. Murphy B.A Carcinoma of the head and neck. In: Handbook of cancer chemotherapy. Skeel R.Т., Khleif S.N.(eds). 8 th Edition. Lippincott Williams & Wilkins.2011: 69- 63.
20. Руководство по химиотерапии опухолевых заболеваний. Под редакцией Н.И. Переводчиковой, В.А. Горбуновой. 4-е издание, расширенное и дополненное. Практическая медицина. Москва 2015г.
21. Санитарно-эпидемиологические требования к объектам здравоохранения
22. //Постановление Правительства Республики Казахстан от 17 января 2012 года № 87.
23. Санитарно-эпидемиологические требования к обеспечению радиационной безопасности от 3 февраля 2012 года № 202 Санитарные правила «Санитарно- эпидемиологические требования к обеспечению радиационной безопасности», №202 от 03.02.2012
24. Ge L, Wang HJ, Yin D, Lei C, Zhu JF, Cai XH, Zhang GQ. Effectiveness of 5- flurouracil-based neoadjuvant chemotherapy in locally-advanced gastric/gastroesophageal cancer: a meta-analysis. World J Gastroenterol. 2012 Dec 28;18(48):7384-93. http://www.ncbi.nlm.nih.gov/pubmed/23326149
25. Nagaraja V, Eslick GD. HER2 expression in gastric and oesophageal cancer: a meta- analytic review J Gastrointest Oncol. 2015 Apr;6(2):143-54. http://www.ncbi.nlm.nih.gov/pubmed/25830034
26. Gu J, Zheng L, Wang Y, Zhu M, Wang Q, Li X. Prognostic significance of HER2 expression based on trastuzumab for gastric cancer (ToGA) criteria in gastric cancer: an updated meta-analysis. Tumour Biol. 2014 Jun;35(6):5315-21 http://www.ncbi.nlm.nih.gov/pubmed/2455754
27. Sano T, Coit D, Kim HH, et al. for the IGCA Staging Project. Proposal of a new stage grouping of gastric cancer for TNM classification: International Gastric Cancer
28. Association Staging Project. Gastric Cancer 2016; in press.
29. Kohei Shitara, Toshihiko Doi, Mikhail Dvorkin, Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomised, double-blind, placebo-controlled, phase 3 trial Lancet Oncology 2018: 19: 1437-1448 https://pubmed.ncbi.nlm.nih.gov/30355453/
30. Практические рекомендации по лечению злокачественных опухолей Российского общества клинической онкологии 2020г. https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-21.pdf
- 1. Руководство по химиотерапии опухолевых заболеваний под редакцией Н.И.Переводчиковой, В.А. Горбуновой. Москва 2015г;
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА:
Список разработчиков протокола с указание квалификационных данных:
- Ижанов Ерген Бахчанович – доктор медицинских наук, онколог Центра абдоминальной онкологии АО «Казахский научно-исследовательский институт онкологии и радиологии»;
- Савхатова Акмарал Доспуловна – кандидат медицинских наук, радиационный онколог, заведующая отделением дневного стационара лучевой терапии АО «Казахский научно-исследовательский институт онкологии и радиологии»;
- Смагулова Калдыгуль Кабаковна – кандидат медицинских наук, онколог (химиотерапевт), заведующая отделением дневного стационара химиотерапии АО «Казахский научно – исследовательский институт онкологии и радиологии»;
- Каримбаева Еркеш Мухтаровна – клинический фармаколог, руководитель отдела клинической фармации ГКП на ПХВ «Многопрофильный медицинский центр акимата города Нур-Султан».
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
- Арзыкулов Жеткерген Анесович — доктор медицинских наук, онколог, профессор, академик Российской Академии наук (РАН).
- Есентаева Сурия Ертугыровна – доктор медицинских наук, онколог, заведующая кафедрой онкологии и маммологии с курсом визуальной диагностики НАО «Казахстанско-Российский Медицинский Университет».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Скачать PDF здесь Смотреть в браузере PDF
Клинические рекомендации Рак желудка МКБ 10: C16 Год утверждения (частота пересмотра): 2018 (пересмотр каждые 3 года) ID: КР574 URL
Профессиональные ассоциации
- Ассоциация онкологов России Российское общество клинической онкологии
Оглавление
- Ключевые слова
- Список сокращений
- Термины и определения
- 1. Краткая информация
- 2. Диагностика
- 3. Лечение
- 4. Реабилитация
- 5. Профилактика
- 6. Дополнительная информация, влияющая на течение и исход заболевания
- Критерии оценки качества медицинской помощи
- Список литературы
- Приложение А1. Состав рабочей группы
- Приложение А2. Методология разработки клинических рекомендаций
- Приложение А3. Связанные документы
- Приложение Б. Алгоритмы ведения пациента
- Приложение В. Информация для пациентов
- Приложение Г
Источник: Минздрав РФ
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России;
ГБУЗ Ярославской области «Ярославская областная клиническая онкологическая больница»
Кайбышева В.О.
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
Крайнова Е.А.
ГБУЗ Ярославской области «Ярославская областная клиническая онкологическая больница»
Иваников И.О.
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России;
ФГБУ «Центральная клиническая больница с поликлиникой» Управления делами Президента Российской Федерации
Федоров Е.Д.
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
- SPIN РИНЦ: 6785-9959
- Scopus AuthorID:
7004381289 - ORCID:
0000-0002-6036-7061
Основные положения новых европейских рекомендаций «Принципы диагностики, лечения и наблюдения пациентов с предраковыми состояниями и изменениями желудка». Значение рекомендаций для российских специалистов
Авторы:
Кашин С.В., Кайбышева В.О., Крайнова Е.А., Иваников И.О., Федоров Е.Д.
Как цитировать:
Кашин С.В., Кайбышева В.О., Крайнова Е.А., Иваников И.О., Федоров Е.Д. Основные положения новых европейских рекомендаций «Принципы диагностики, лечения и наблюдения пациентов с предраковыми состояниями и изменениями желудка». Значение рекомендаций для российских специалистов. Доказательная гастроэнтерология.
2020;9(3):16‑31.
Kashin SV, Kaibysheva VO, Krainova EA, Ivanikov IO, Fedorov ED. The main statements from new European recommendations «Management of epithelial precancerous conditions and lesions in the stomach». The importance of recommendations for Russian specialists. Russian Journal of Evidence-Based Gastroenterology. 2020;9(3):16‑31. (In Russ.)
https://doi.org/10.17116/dokgastro2020903116

Материалы к публикации подготовлены рабочей группой Российского эндоскопического общества в составе А.М. Нечипая (Москва), С.В. Кашина (Ярославль) и Е.Л. Никонова (Москва) на основе данных отечественной литературы и Европейских рекомендаций «Guidelines for the Management of Precancerous Conditions and Lesions in the Stomach (MAPS)», опубликованных в 2019 г. [1].
Рак желудка является одной из наиболее актуальных проблем современной медицины и занимает пятое место в мире в структуре заболеваемости и третье место по смертности от онкологических заболеваний. В нашей стране, согласно данным официальной статистики «Состояние онкологической помощи населению России в 2018 г.», рак желудка по показателям заболеваемости (у обоих полов) занимает 6-е ранговое место (5,9%) после рака кожи (12,6%, с меланомой — 14,4%), молочной железы (11,4%), трахеи, бронхов, легких (9,9%), ободочной кишки (6,9%) и предстательной железы (6,8%). В 2018 г. вновь выявлено 34 157 случаев заболевания. Для рака желудка характерна высокая летальность (59%) на первом году с момента установления диагноза. В структуре заболеваемости злокачественными новообразованиями мужского населения России рак желудка занимает 4-е место (7,4%), а в структуре заболеваемости женского населения — 6-е место (4,6%) (рис. 1, 2) [2].

Рис. 1. Структура заболеваемости мужского населения России злокачественными новообразованиями в 2018 г.

Рис. 2. Структура заболеваемости женского населения России злокачественными новообразованиями в 2018 г.
В структуре смертности населения России от злокачественных новообразований рак желудка занимает второе место (9,5%) после рака трахеи, бронхов, легких (17,3%). В течение последних 50 лет заболеваемость и смертность от этой патологии снижается, в том числе и в нашей стране (рис. 3).

Рис. 3. Динамика заболеваемости населения России раком желудка в 2008—2018 гг.
Причинами снижения заболеваемости раком желудка являются улучшение социально-экономических условий, питания, сокращение употребления веществ, обладающих канцерогенным действием, а также снижение уровня заболеваемости Helicobacter pylori ассоциированным гастритом. По времени снижение смертности совпадает с широким применением методов эндоскопической и эндобиоптической диагностики раннего рака, имеющего значительно лучший прогноз по сравнению с выраженными формами. Однако, по мнению И.С. Стилиди и соавт., связь тенденции к уменьшению заболеваемости и смертности от рака желудка с повышением эффективности лечения и с улучшением результатов диагностики не столь очевидна [3]. Несмотря на рост диагностических возможностей, оснащение медицинских учреждений диагностическим оборудованием, развитие и внедрение в повседневную практику новых диагностических методик, доля активно выявленных больных и доля больных, у которых заболевание выявлено на ранней стадии опухолевого процесса, остаются достаточно низкими. Рак желудка более чем в 50% случаев выявляется в III—IV стадиях заболевания (22,9% и 33,9% соответственно), что предопределяет неудовлетворительные результаты лечения и плохой прогноз [4]. Поэтому понимание причин и механизмов развития опухолевого процесса, а также определение наиболее эффективных методов диагностики и лечения предопухолевой патологии имеют большое значение для определения всего комплекса противораковых мероприятий [5].
Общепринято мнение о том, что аденокарцинома желудка развивается в патологически измененной слизистой оболочке. На сегодняшний день принято различать предраковые состояния и изменения слизистой оболочки желудка. К предраковым состояниям относятся заболевания, которые могут привести к развитию рака (атрофический гастрит с метаплазией), к предраковым изменениям — гистологически доказанные диспластические изменения слизистой оболочки желудка, свидетельствующие о развитии процесса в сторону злокачественного роста, но недостаточные для установления диагноза рака в настоящий момент. Своевременное выявление, эндоскопическое наблюдение, адекватное лечение предраковых изменений и состояний — приоритетные задачи современной гастроэнтерологии и эндоскопии.
В настоящее время развитие рака желудка (в первую очередь кишечного типа по классификации P. Lauren [6]) рассматривается как многоступенчатый процесс, включающий в себя последовательность изменений слизистой оболочки: хроническое воспаление, атрофию, кишечную метаплазию, дисплазию и аденокарциному [7]. Инфекция H. pylori является важным участником формирования этих патологических процессов [8]. Диагностика и своевременная терапия этих предопухолевых состояний и изменений слизистой оболочки желудка приведут к снижению заболеваемости и смертности от рака желудка. Из всех методов эндоскопическое исследование желудка — гастроскопия является наиболее эффективным методом в диагностике предопухолевой патологии. В связи с этим вопросы совершенствования эндоскопических методов диагностики, повышения качества эндоскопического исследования остаются в центре внимания широкого круга онкологов, гастроэнтерологов, эндоскопистов. В настоящее время гастроскопия, проводимая с целью диагностики предраковых изменений и ранних форм рака желудка, предполагает использование современных технологий (хромоскопии, узкоспектральной и увеличительной эндоскопии), позволяющих выявлять патологические образования даже самых небольших размеров. Клиническое применение этих диагностических методов и детальная визуализация минимальных патологических изменений желудка возможны только при безусловном соблюдении методичности исследования. Важным условием обеспечения эффективного применения эндоскопических методов, повышающих качество гастроскопии, может стать использование в рутинной практике современного диагностического алгоритма, позволяющего улучшить результаты диагностики и повысить популярность эндоскопического исследования верхних отделов пищеварительного тракта у пациентов, подлежащих скринингу (рис. 4).

Рис. 4. Алгоритм ведения пациентов с предраковыми изменениями и состояниями желудка.
Таким образом, основными путями к снижению распространенности рака желудка по-прежнему являются прецизионная диагностика, своевременная терапия предопухолевой патологии и динамическое наблюдение за пациентами, входящими в группы риска развития рака желудка. Необходима выработка единого подхода к ведению пациентов с предраковыми состояниями и изменениями слизистой оболочки желудка.
В 2019 г. пересмотрены опубликованные в 2012 г. рекомендации Европейского общества гастроинтестинальной эндоскопии (ESGE), Европейской группы по изучению Helicobacter рylori и микробиоты (EHMSG), Европейского общества патологов (ESP) и Португальского общества гастроинтестинальной эндоскопии (SPED) по ведению пациентов с предраковыми состояниями и изменениями желудка (Guidelines for the Management of Precancerous Conditions and Lesions in the Stomach — MAPS II) (см. таблицу).
Таблица. Различия в рекомендациях MAPS I (2011 г.) и MAPS II (2019 г.)
|
MAPS I |
MAPS II |
|
Определения |
|
|
Пациенты с хроническим атрофическим гастритом и кишечной метаплазией должны рассматриваться как группа высокого риска развития рака желудка |
Пациенты с хроническим атрофическим гастритом или кишечной метаплазией составляют группу высокого риска развития аденокарциномы желудка. Уровень доказательности: высокий |
|
— |
Кишечная метаплазия, подтвержденная данными гистологического исследования биоптатов, является наиболее достоверным маркером атрофии слизистой оболочки желудка Уровень доказательности: высокий |
|
— |
Пациенты с атрофическим гастритом и/или кишечной метаплазией, захватывающими антральный отдел и тело желудка одновременно, имеют наиболее высокий риск развития аденокарциномы желудка Уровень доказательности: умеренный; степень рекомендации: сильная |
|
При ведении пациентов с хроническим атрофическим гастритом и кишечной метаплазией развитие дисплазии высокой степени и инвазивный рак желудка должны быть определены как исходы, которые необходимо предотвратить |
Дисплазия высокой степени и инвазивный рак желудка являются исходами, развитие которых возможно и необходимо предотвратить при ведении пациентов с хроническим атрофическим гастритом и кишечной метаплазией Уровень доказательности: умеренный; степень рекомендации: сильная |
|
Пациентам с видимым при эндоскопии патологическим участком дисплазии высокой степени или рака показано определение стадии процесса и дальнейшее адекватное ведение |
Пациентам с видимым при эндоскопии патологическим участком дисплазии легкой или тяжелой степени, а также раннего рака показано определение стадии процесса и эндоскопическая резекция Уровень доказательности: высокий; степень рекомендации: сильная |
|
Диагностика и определение стадии |
|
|
Обычное эндоскопическое исследование в белом свете не позволяет точно дифференцировать и диагностировать предраковые состояния/изменения слизистой оболочки желудка |
— |
|
Увеличительная хромоэндоскопия и узкоспектральная эндоскопия (как с увеличением, так и без него) улучшают диагностику изменений слизистой оболочки желудка |
Эндоскопия высокого разрешения с хромоэндоскопией является более точным методом диагностики предраковых состояний/изменений слизистой оболочки желудка по сравнению с эндоскопией в белом свете Уровень доказательности: высокий |
|
Диагностическая эндоскопия верхних отделов желудочно-кишечного тракта должна включать выполнение биопсии |
При проведении биопсии для стадирования атрофических и метапластических изменений слизистой оболочки желудка, а также для выявления очагов неопластических изменений с целью осуществления прицельной биопсии по возможности должна быть использована виртуальная хромоскопия (с увеличением или без) Уровень доказательности: средний; степень рекомендации: сильная |
|
Атрофия и кишечная метаплазия, как правило, неравномерно распределены по слизистой оболочке желудка. Для правильного определения стадии и классификации предраковых состояний желудка рекомендуется выполнение биопсии по крайней мере из четырех произвольных точек двух отделов желудка (по малой и большой кривизне антрального отдела и тела желудка) в отдельные препараты. При выявлении патологических участков рекомендовано выполнение дополнительно отдельной биопсии |
Для адекватного стадирования и классификации предраковых состояний желудка эндоскопическое исследование верхних отделов пищеварительного тракта, проводимое впервые, должно обязательно сопровождаться биопсией слизистой оболочки желудка, в том числе для диагностики инфекции H. pylori Уровень доказательности: средний; степень рекомендации: сильная |
|
— |
Биопсия должна быть выполнена по крайней мере из двух отделов желудка (по два биоптата из тела и антрального отдела — по малой и большой кривизне). Биоптаты из тела и антрального отдела необходимо четко маркировать и помещать в отдельные контейнеры. Из каждого видимого патологического участка слизистой оболочки желудка биопсия должна быть выполнена отдельно |
|
Для оценки степени риска развития рака желудка необходимо использовать системы определения гистопатологической стадии (например, OLGA или OLGIM) |
Для определения тяжести атрофического гастрита необходимо использовать системы гистопатологического стадирования (например, OLGA или OLGIM). В случае оценки риска развития рака желудка с помощью систем OLGA или OLGIM рекомендовано проведение дополнительного забора биоптатов из угла желудка |
|
Уровень пепсиногенов в сыворотке крови позволяет прогнозировать распространенный атрофический гастрит |
— |
|
У пациентов с низким уровнем пепсиногенов рекомендовано проведение серологической диагностики H. pylori для дальнейшего выявления субъектов с высоким риском развития рака желудка |
Низкий уровень сывороточного пепсиногена I и/или низкое значение соотношения пепсиногенов I/II служат предикторами выраженных стадий атрофического гастрита. Пациентам с низкими значениями сывороточного пепсиногена I рекомендовано проведение эзофагогастродуоденоскопии, особенно в случае негативного результата серологической диагностики на инфекцию H. pylori |
|
Семейный анамнез рака желудка должен быть принят во внимание при наблюдении пациентов с предраковыми состояниями |
— |
|
Несмотря на проведенные исследования, посвященные оценке возраста, пола, факторов вирулентности H. pylori, а также генетических вариаций, нельзя рекомендовать индивидуальные программы наблюдения и диагностики на основе этих факторов |
Несмотря на большое число исследований, изучающих влияние возраста, пола, факторов вирулентности инфекции H. pylori, генетических предрасположенностей индивида, не разработаны клинические рекомендации по тактике диагностики или наблюдения за пациентами с учетом факторов риска или индивидуальных особенностей организма Уровень доказательности: низкий; степень рекомендации: слабая |
|
Наблюдение |
|
|
Пациентам с дисплазией низкой степени в отсутствие видимого при эндоскопии патологического участка показано наблюдение в течение 1 года после установления диагноза. В случае наличия видимого при эндоскопии патологического участка показана эндоскопическая резекция для получения более точного гистологического диагноза |
Пациентам с дисплазией слизистой оболочки желудка в отсутствие видимого при эндоскопии патологического участка показано немедленное повторное эндоскопическое исследование высокого качества с использованием современной аппаратуры высокого разрешения и хромоэндоскопией. В случае если при проведении эндоскопии высокого качества не удается выявить видимые патологические участки слизистой оболочки желудка, рекомендованы повторная биопсия для стадирования гастрита (если не проведена ранее) и эндоскопическое наблюдение 1 раз в 6 мес (при дисплазии высокой степени) или 1 раз в 12 мес (при дисплазии низкой степени). Уровень доказательности: низкий; степень рекомендации: сильная |
|
В случае наличия дисплазии высокой степени в отсутствие эндоскопически видимого патологического участка в срочном порядке показано повторное эндоскопическое исследование с выполнением множественной биопсии и дальнейшее наблюдение с интервалом 6—12 мес |
— |
|
Эндоскопическое наблюдение показано пациентам с распространенной атрофией и/или кишечной метаплазией (например, атрофия и/или кишечная метаплазия антрального отдела и тела желудка) |
Пациентам с легкой и умеренной степенью атрофии слизистой оболочки, ограниченной только антральным отделом желудка, наблюдение не рекомендовано Уровень доказательности: умеренный; степень рекомендации: сильная |
|
— |
Несмотря на повышенный риск развития рака желудка, пациентам с единичным участком кишечной метаплазии в большинстве случаев не требуется наблюдение, особенно если эндоскопическое исследование высокого качества с несколькими биопсиями позволило исключить распространенные стадии атрофического гастрита Уровень доказательности: умеренный; степень рекомендации: сильная |
|
— |
При наличии отягощенного семейного анамнеза по развитию рака желудка, неполной кишечной метаплазии, персистирующей инфекции H. pylori у пациентов с единичным участком кишечной метаплазии рекомендовано эндоскопическое наблюдение с хромоэндоскопией и прицельной биопсией 1 раз в 3 года Уровень доказательности: низкий; степень рекомендации: слабая |
|
Пациентам с распространенной атрофией и/или кишечной метаплазией следует проходить контрольный осмотр каждые 3 года после установления диагноза |
— |
|
В настоящее время нет доказательных данных, чтобы рекомендовать наблюдение пациентам с легкой и умеренной атрофией / кишечной метаплазией слизистой оболочки, ограниченной только антральным отделом желудка |
Пациентам с распространенными стадиями атрофического гастрита (тяжелые атрофические изменения и/или кишечная метаплазия в теле и антральном отделе желудка — OLGA/OLGIM III/IV) рекомендовано эндоскопическое наблюдение (эндоскопия высокого качества) каждые 3 года Уровень доказательности: низкий; степень рекомендации: сильная |
|
— |
Пациентам с распространенными стадиями атрофического гастрита с отягощенным наследственным анамнезом по раку желудка рекомендовано более интенсивное эндоскопическое наблюдение (1 раз в 1—2 года) Уровень доказательности: низкий; степень рекомендации: слабая |
|
— |
Пациентам с аутоиммунным гастритом рекомендовано наблюдение 1 раз в 3—5 лет. Уровень доказательности: низкий; степень рекомендации: слабая |
|
Лечение |
|
|
Эрадикация H. pylori способствует излечению от хронического неатрофического гастрита и может привести к частичной регрессии атрофического гастрита |
Эрадикационная терапия рекомендована при хроническом неатрофическом и атрофическом гастрите. При хроническом неатрофическом и атрофическом гастрите эрадикация инфекции H. pylori приводит к разрешению воспалительных изменений, к частичной регрессии атрофических изменений слизистой оболочки желудка, снижает риск развития рака желудка Уровень доказательности: высокий; степень рекомендации: сильная |
|
Эрадикация H.pylori у пациентов с кишечной метаплазией не приводит к обратному развитию кишечной метаплазии, но рекомендуется как мера, способная замедлить прогрессирование до неоплазии |
Эрадикационная терапия рекомендована при атрофическом гастрите с развитием кишечной метаплазии При атрофическом гастрите с развитием кишечной метаплазии эрадикация H. pylori не приводит к существенному снижению риска развития рака желудка (по крайней мере в краткосрочной перспективе), однако способствует снижению выраженности воспалительных и атрофических изменений в слизистой оболочке Уровень доказательности: низкий; степень рекомендации: слабая |
|
Эрадикация H. pylori рекомендуется пациентам с ранее выявленной неоплазией после эндоскопического или хирургического лечения |
Эрадикационная терапия рекомендована после эндоскопического лечения новообразований желудка Уровень доказательности: высокий; степень рекомендации: сильная |
|
В настоящее время использование ингибиторов ЦОГ-2 не должно применяться в качестве метода снижения риска прогрессирования предраковой патологии желудка |
Не рекомендуется использовать ингибиторы ЦОГ-1 и ЦОГ-2 с целью канцеропревенции у больных с предраковыми состояниями желудка |
|
Использование пищевых добавок с антиоксидантами (аскорбиновая кислота и β-каротин) не является эффективной тактикой лечения, снижающей риск развития и прогрессирования атрофии и кишечной метаплазии |
У определенных групп пациентов возможно использование низких доз аспирина для профилактики развития неоплазий различной локализации, в том числе рака желудка |
|
Экономическая эффективность скрининга и наблюдения |
|
|
Эрадикация H. pylori после выполнения эндоскопической резекции раннего рака желудка является экономически эффективной |
В регионах со средней и высокой распространенностью рака желудка скрининг и наблюдение пациентов с предраковыми состояниями являются экономически эффективными |
|
Имеющиеся в настоящее время данные не позволяют точно оценить экономическую эффективность наблюдения пациентов с предраковой патологией желудка |
— |
Ключевые пункты документа касаются диагностики, наблюдения и лечения предраковых изменений и состояний желудка и включают следующие положения [1]:
— Пациенты с хроническим атрофическим гастритом или кишечной метаплазией составляют группу риска развития аденокарциномы желудка. Необходимы своевременная диагностика, выделение групп риска и адекватное наблюдение больных хроническим гастритом.
— В диагностике и стадировании предраковых состояний и изменений слизистой оболочки желудка возможности эндоскопии высокого разрешения в сочетании с хромоскопией выше, чем возможности эндоскопии в белом световом режиме. Виртуальная хромоскопия должна по возможности быть использована при проведении биопсии для стадирования атрофического процесса, а также для выявления подозрительных участков неоплазии и проведения прицельной биопсии.
— Для адекватной оценки предраковых заболеваний желудка во время эндоскопического исследования необходимо выполнение биопсии по меньшей мере из четырех точек: из антрального отдела и тела желудка по малой и большой кривизне. Биоптаты из тела и антрального отдела желудка следует размещать в отдельные маркированные флаконы. Для лучшего выявления участков атрофии, метаплазии и неоплазий, проведения таргетной биопсии необходимо использовать виртуальную хромоскопию.
— Пациентам с умеренными атрофическими изменениями (наличием участков атрофии и/или кишечной метаплазии), поражающими только антральный отдел желудка, дальнейшее динамическое эндоскопическое наблюдение не требуется.
— Пациентам с единичными очагами кишечной метаплазии, но имеющим отягощающие факторы (неблагоприятный наследственный анамнез по раку желудка, неполная кишечная метаплазия, персистирующая инфекция Helicobacter pylori), показано эндоскопическое наблюдение 1 раз в 3 года с использованием хромоскопии и проведением прицельной биопсии. Пациентам с распространенными стадиями атрофического гастрита (с множественными участками атрофии и/или кишечной метаплазии слизистой оболочки желудка) рекомендовано эндоскопическое исследование экспертного уровня 1 раз в 3 года.
— Пациентам с дисплазией без видимого при эндоскопии патологического участка необходимо безотлагательное проведение повторного эндоскопического исследования с хромоскопией.
— Пациентам с видимым при эндоскопии патологическим участком дисплазии высокой и низкой степени или раннего рака желудка показано стадирование неопластического процесса и проведение для этой цели эндоскопической резекции патологического очага.
— В случае выявления инфекции H. pylori проведение эрадикации рекомендуется больным с неатрофическим и атрофическим гастритом, а также больным после эндоскопического лечения неоплазий желудка. Целью эрадикационной терапии является регрессия воспалительных и атрофических изменений, предотвращение прогрессии неопластических изменений.
— В регионах со средней и высокой распространенностью рака желудка скрининг и наблюдение за больными с предраковыми изменениями и состояниями признаны экономически эффективной стратегией.
Основные положения документа
Определения и профилактические цели
Канцерогенез
Положение 1. Пациенты с хроническим атрофическим гастритом или кишечной метаплазией составляют группу высокого риска по развитию аденокарциномы желудка.
Уровень доказательности: высокий; согласие экспертов: 100%.
Положение 2. Кишечная метаплазия, подтвержденная данными гистологического исследования биоптатов, является наиболее достоверным маркером атрофии слизистой оболочки желудка.
Уровень доказательности: высокий; согласие экспертов: 100%.
Положение 3. Пациенты с атрофическим гастритом и/или кишечной метаплазией с их локализацией одновременно в антральном отделе и в теле желудка имеют наиболее высокий риск развития аденокарциномы желудка.
Уровень доказательности: умеренный; степень рекомендации: сильная; уровень согласия участников: 94%.
Положение 4. Дисплазия высокой степени и инвазивный рак желудка являются исходами, развитие которых возможно и необходимо предотвратить при ведении пациентов с хроническим атрофическим гастритом и кишечной метаплазией.
Уровень доказательности: умеренный; степень рекомендации: сильная; уровень согласия участников: 100%.
Предраковые изменения и ранний рак желудка
Положение 5. Пациентам, у которых определяется эндоскопически видимый патологический участок (дисплазия низкой или высокой степени, ранний рак), необходимо провести стадирование опухолевого процесса и выполнить надлежащее лечение.
Уровень доказательности: высокий; степень рекомендации: сильная; уровень согласия участников: 94%.
Диагностика и стадирование опухолевого процесса
Эндоскопия
Положение 6. Эндоскопия высокого разрешения с хромоскопией является более точным методом диагностики предраковых состояний/изменений слизистой оболочки желудка по сравнению с эндоскопией в белом световом режиме (рис. 5—9).

Рис. 5. Эндоскопическая диагностика хронического антрального атрофического гастрита с помощью эндоскопической системы Olympus EVIS EXERA III (эндоскоп с оптическим 70-кратным увеличением изображения и узкоспектральным режимом NBI HQ 190).
а — эндоскопия высокого разрешения в белом световом режиме определяет неровный рельеф поверхности слизистой оболочки антрального отдела желудка, множественные участки бледно-розового цвета и очаги гиперемии; б — эндоскопия с использованием узкоспектрального режима (новое поколение NBI) — определяются участки с серой окраской поверхности эпителия; в — увеличительная эндоскопия в режиме близкого фокуса в комбинации с узкоспектральным режимом NBI позволяет визуализировать участки кишечной метаплазии с виллезным типом рисунка поверхности эпителия и «серо-голубыми гребнями», характерными для кишечной метаплазии; г — гистологическое исследование (окраска гематоксилином и эозином; ×150): кишечная метаплазия.

Рис. 6. а, б, в, г, д — эндоскопическое исследование с применением системы Olympus EVIS EXERA III и узкоспектральным режимом осмотра NBI: атрофический гастрит антрального отдела и области угла желудка с очагами кишечной метаплазии, диагностика очагов кишечной метаплазии в теле желудка; е — гистологическое исследование: хронический атрофический мультифокальный гастрит с фокусами кишечной метаплазии, фокус фовеолярной гиперплазии (1) и фокус кишечной метаплазии (2) в пределах одного биоптата.

Рис. 7. Эндоскопическая диагностика атрофического гастрита с кишечной метаплазией в процессе динамического наблюдения за пациенткой после успешной эрадикационной терапии инфекции Helicobacter pylori (опыт Ярославской областной клинической онкологической больницы).
а — диагностика очагов и площади кишечной метаплазии в антральном отделе желудка с помощью 0,5% раствора красителя метиленового синего; б, в — контроль в процессе динамического наблюдения после успешной эрадикации через 1 год и через 10 лет: отсутствие прогрессии и увеличения площади кишечной метаплазии в антральном отделе желудка (диагностика с помощью окраски 0,5% раствором метиленового синего).

Рис. 8. Диагностика патологического участка неоплазии с помощью хромоскопии.
а — осмотр в белом световом режиме: очаг гиперемии слизистой оболочки области границы тела и антрального отдела желудка без четких границ; б, в — уточняющая диагностика характера патологического процесса с помощью хромоскопии с красителем индиго карминовым 0,2%: патологический участок имеет четкую демаркационную линию, неровные границы, разрушенный рисунок поверхности эпителия, характерные для раннего рака желудка.

Рис. 9. Диагностика хронического мультифокального атрофиечсокго гастрита с кишечной метаплазией с помощью эндоскопического системы Pentax EPK-i7010 OPTIVISTA и эндоскопом с функцией оптического узкоспектрального режима (OE-optical enhancement) и оптического 130-кратного увеличения изображения.
а, б — обнаружение патологических участков в антральном отделе желудка; в, г — уточняющая диагностика кишечной метаплазии с помощью оптического увеличения изображения: определение серо-голубых гребней, типичного признака кишечной метаплазии (light blue crests — LBC) — тонкие светло-синие линии на гребнях эпителия или борозд (феномен, возникающий вследствие отражения волны короткой длины (400-430 нм) от поверхности ткани, имеющий реснитчатую поверхность); д — выполнение прицельной биопсии при использовании «виртуальной хромоскопии»; е — гистологическое исследование биоптатов: хронический атрофический мультифокальный гастрит с фокусами кишечной метаплазии.
Уровень доказательности: высокий; уровень согласия участников: 94%.
Положение 7. При проведении биопсии для стадирования атрофических и метапластических изменений слизистой оболочки желудка, а также для выявления очагов неопластических изменений с целью осуществления прицельной биопсии по возможности должна быть использована виртуальная хромоскопия (с увеличением получаемого изображения или без увеличения).
Уровень доказательности: средний; степень рекомендации: сильная; уровень согласия участников: 94%.
Забор биоптатов
Положение 8. Для адекватного стадирования и классификации предраковых состояний желудка эндоскопическое исследование верхних отделов пищеварительного тракта, проводимое впервые, должно обязательно сопровождаться биопсией слизистой оболочки желудка, в том числе и для диагностики инфекции H. pylori.
Уровень доказательности: средний; степень рекомендации: сильная; уровень согласия участников: 88%.
Положение 9. Биопсия должна быть проведена по крайней мере из двух отделов желудка (по два биоптата из тела и антрального отдела — по малой и большой кривизне). Биоптаты из тела и антрального отдела необходимо четко промаркировать и поместить в отдельные контейнеры. Из каждого видимого патологического участка слизистой оболочки желудка биопсия должна быть выполнена отдельно.
Уровень доказательности: средний; степень рекомендации: сильная; уровень согласия участников: 94%.
Положение 10. Для определения тяжести атрофического гастрита необходимо использовать системы гистопатологического стадирования (например, OLGA или OLGIM). В случае оценки риска развития рака желудка с помощью систем OLGA или OLGIM рекомендовано проведение дополнительного забора биоптатов из угла желудка.
Уровень доказательности: средний; степень рекомендации: слабая; уровень согласия участников: 88%.
Неинвазивная диагностика
Положенние 11. Низкий уровень сывороточного пепсиногена I и/или низкое значение соотношения пепсиногенов I/II служат предикторами выраженных стадий атрофического гастрита. Пациентам с низкими уровнями сывороточного пепсиногена I рекомендовано проведение эзофагогастродуоденоскопии (ЭГДС), особенно в случае негативного результата серологической диагностики на наличие инфекции H. pylori.
Уровень доказательности: средний; степень рекомендации: сильная; уровень согласия участников: 88%.
Факторы риска
Положение 12. Несмотря на большое число исследований, изучающих влияние возраста, пола, факторов вирулентности инфекции H. pylori, генетических предрасположенностей индивида, не разработаны клинические рекомендации по тактике диагностики или наблюдения за пациентами с учетом факторов риска или индивидуальных особенностей организма.
Уровень доказательности: низкий; степень рекомендации: слабая; уровень согласия участников: 100%.
Наблюдение
Дисплазия
Положение 13. Пациентам с дисплазией слизистой оболочки желудка в отсутствие эндоскопически видимого патологического участка показано немедленное повторное эндоскопическое исследование экспертного уровня с использованием современной аппаратуры высокого разрешения и хромоэндоскопией. В случае если при проведении эндоскопии такого уровня не удается выявить видимые патологические участки слизистой оболочки желудка, рекомендованы повторная биопсия для стадирования гастрита (если не проведена ранее) и эндоскопическое наблюдение 1 раз в 6 мес (при дисплазии высокой степени) или 1 раз в 12 мес (при дисплазии низкой степени).
Уровень доказательности: низкий; степень рекомендации: сильная; уровень согласия участников: 88%.
Атрофический гастрит/кишечная метаплазия
Положение 14. Пациентам с легкой и умеренной степенью атрофии слизистой оболочки, ограниченной только антральным отделом желудка, наблюдение не рекомендовано.
Уровень доказательности: умеренный; степень рекомендации: сильная; уровень согласия участников: 100%.
Положение 15. Несмотря на повышенный риск развития рака желудка, пациенты с единичным участком кишечной метаплазии в большинстве случаев не нуждаются в наблюдении, особенно если эндоскопическое исследование экспертного уровня с проведением нескольких биопсий позволило исключить распространенные стадии атрофического гастрита.
Уровень доказательности: умеренный; степень рекомендации: сильная; уровень согласия участников: 100%.
Положение 16. При наличии отягощенного семейного анамнеза по развитию рака желудка, неполной кишечной метаплазии, персистирующей инфекции H. pylori у пациентов с единичным участком кишечной метаплазии рекомендовано эндоскопическое наблюдение с хромоэндоскопией и прицельной биопсией 1 раз в 3 года.
Уровень доказательности: низкий; степень рекомендации: слабая; уровень согласия участников: 82%.
Положение 17. Пациентам с распространенными стадиями атрофического гастрита (тяжелые атрофические изменения и/или кишечная метаплазия в теле и антральном отделе желудка — OLGA/OLGIM III/IV) рекомендовано эндоскопическое наблюдение (эндоскопия экспертного уровня) каждые 3 года.
Уровень доказательности: низкий; степень рекомендации: сильная; уровень согласия участников: 100%.
Положение 18. Пациентам с распространенными стадиями атрофического гастрита с отягощенным наследственным анамнезом по раку желудка рекомендовано более интенсивное эндоскопическое наблюдение (1 раз в 1—2 года).
Уровень доказательности: низкий; степень рекомендации: слабая; уровень согласия участников: 82%.
Аутоиммунный гастрит
Положение 19. Пациентам с аутоиммунным гастритом рекомендовано наблюдение 1 раз в 3—5 лет.
Уровень доказательности: низкий; степень рекомендации: слабая; уровень согласия участников: 82%.
Лечение
Эрадикация инфекции Helicobacter pylori
Положение 20. Эрадикационная терапия рекомендована при хроническом неатрофическом и атрофическом гастрите. При хроническом неатрофическом и атрофическом гастрите эрадикация инфекции H. pylori приводит к разрешению воспалительных изменений, к частичной регрессии атрофических изменений слизистой оболочки желудка, снижает риск развития рака желудка. Уровень доказательности: высокий; степень рекомендации: сильная; уровень согласия участников: 87%.
Положение 21. Эрадикационная терапия рекомендована при атрофическом гастрите с развитием кишечной метаплазии. При атрофическом гастрите с развитием кишечной метаплазии эрадикация H. pylori не приводит к существенному снижению риска развития рака желудка (по крайней мере в краткосрочной перспективе), однако способствует снижению выраженности воспалительных и атрофических изменений в слизистой оболочке.
Уровень доказательности низкий; степень рекомендации: слабая; уровень согласия участников: 87%.
Положение 22. Эрадикационная терапия рекомендована после эндоскопического лечения новообразований желудка.
Уровень доказательности: высокий; степень рекомендации: сильная; уровень согласия участников: 100%.
Альтернативные методы лечения
Положение 23. Не рекомендуется использовать ингибиторы циклооксигеназы (ЦОГ-1 и ЦОГ-2) с целью снижения риска прогрессирования предраковых состояний желудка.
Уровень доказательности: низкий; степень рекомендации: слабая; уровень согласия участников: 100%.
Положение 24. У определенных групп пациентов возможно использование низких доз аспирина для профилактики развития неоплазий различной локализации, в том числе рака желудка.
Уровень доказательности: умеренный; степень рекомендации: слабая; уровень согласия участников: 94%.
Экономическая эффективность скрининга и наблюдения
Положение 25. В регионах со средней и высокой распространенностью рака желудка скрининг и наблюдение пациентов с предраковыми состояниями являются экономически эффективными.
Уровень доказательности: умеренный; уровень согласия участников: 100%.
Разработка и внедрение практических мер по профилактике рака желудка в России признаны крайне важными. В качестве общих мер по оздоровлению населения следует рассматривать борьбу с курением и злоупотреблением алкоголем, популяризацию здорового питания и физической активности. В качестве наиболее эффективной меры профилактики рака желудка с точки зрения современной гастроэнтерологии следует расценивать эрадикационную терапию инфекции H. pylori при хроническом гастрите, в том числе при атрофическом гастрите [9].
В настоящее время достаточно хорошо известны причины возникновения рака, что дает возможность предотвратить не менее 30% всех случаев заболевания. Несмотря на рост диагностических возможностей, оснащенности медицинских организаций высокоэффективным диагностическим оборудованием, развитие новых диагностических методик, доля активно выявленных опухолей и доля больных, заболевание у которых выявлено на ранней стадии опухолевого процесса, остаются достаточно низкими. Правильно организованные профилактические мероприятия могут привести в будущем к значительному сокращению (в 3—4 раза) затрат на лечение и реабилитацию онкологических больных [10].
Заключение
Таким образом, основными путями к снижению распространенности рака желудка по-прежнему являются прецизионная диагностика, своевременная терапия предопухолевой патологии и динамическое наблюдение за пациентами, входящими в группы риска развития рака желудка. Необходима выработка единого подхода к ведению пациентов с предраковыми состояниями и изменениями слизистой оболочки желудка.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Рак желудка – это злокачественная эпителиальная опухоль слизистой оболочки желудка. Признаками рака желудка служат снижение аппетита, похудание, слабость, боль в эпигастрии, тошнота, дисфагия и рвота, быстрое насыщение при приеме пищи, вздутие живота, мелена. Установлению диагноза способствует проведение гастроскопии с биопсией, рентгенографии желудка, УЗИ органов брюшной полости, эндосонографии, определение опухолевых маркеров, исследование кала на скрытую кровь. В зависимости от распространенности рака желудка производится частичная или тотальная резекция желудка; возможно проведение химиотерапии и лучевой терапии.
Общие сведения
Рак желудка – злокачественное новообразование, в большинстве случаев исходящее из железистых эпителиальных клеток желудка. Среди злокачественных опухолей желудка в 95% выявляются аденокарциномы, реже – другие гистологические формы – лимфомы, плоскоклеточный рак, лейомиосаркомы, карциноид, аденоакантомы. Мужчины болеют раком желудка в 1,7 раза чаще женщин; обычно заболевание развивается в возрасте 40-70 лет (средний возраст 65 лет). Рак желудка склонен к быстрому метастазированию в органы пищеварительного тракта, часто прорастает в соседние ткани и органы через стенку желудка (в поджелудочную железу, тонкий кишечник), часто осложняется некрозом и кровотечением. С током крови метастазирует преимущественно в легкие, печень; по сосудам лимфатической системе — в лимфоузлы.
Рак желудка
Причины
В настоящее время гастроэнтерология недостаточно знает о механизмах развития и причинах возникновения рака желудка. Современная теория развития рака желудка предполагает, что заметную роль в его возникновении играет инфицированность Helicobacter Pylori. Среди факторов риска отмечают следующие: курение, хронический гастрит, операции на желудке, пернициозная анемия, генетическая предрасположенность. Состояниями с высоким риском развития рака является аденома желудка, атрофический гастрит, хроническая язва желудка.
Чаще всего рак развивается у лиц среднего возраста и старше, заболевают чаще мужчины. Однако отсутствие факторов риска не гарантирует полностью избегания рака желудка. Равно как и у людей с сочетанием нескольких канцерогенных факторов рак желудка возникает далеко не всегда.
Классификация
Рак желудка классифицируется по стадиям согласно международной классификации злокачественных новообразований: классификация TNM, где T – состояние (стадия развития) первичной опухоли (от нулевой стадии предрака до четвертой стадии прорастания опухоли в соседние ткани и органы), N – присутствие метастазов в региональных лимфоузлах (от N0- отсутствия метастазов, до N3 – заражения метастазами более 15 региональных лимфоузлов), M – наличие метастазов в отдаленных органах и тканях (М0 – нет, М1 – есть).
Симптомы рака желудка
Ранняя стадия развития рака желудка часто протекает без клинических проявлений, симптоматика начинает развиваться, как правило, уже при опухоли второй-третьей стадии (прорастание в подслизистые слои и далее).
С развитием заболевания выявляются следующие симптомы: боль в эпигастрии (первоначально умеренная), тяжесть в желудке после приема пищи, снижение аппетита и похудание, тошнота вплоть до рвоты (рвота, как правило, сигнализирует о снижении проходимости желудка – закупорке опухолью привратникового отдела). При развитии рака в области кардии возможна дисфагия (нарушение глотания).
На третьей стадии рака (когда опухоль поражает все слои стенки желудка вплоть до мышечного и серозного) возникает синдром раннего насыщения. Это связано со снижением растяжимости желудка.
При прорастании опухли в кровеносные сосуды могут возникать желудочные кровотечения. Следствия рака: анемия, снижение питания, раковая интоксикация приводят к развитию общей слабости, высокой утомляемости. Присутствие каких либо из вышеперечисленных симптомов не является достаточным для диагностирования рака желудка, таким образом могут проявляться и другие заболевания желудка и органов пищеварения. Диагноз «рак желудка» устанавливают только на основании данных исследования биоптата.
Однако выявления подобных симптомов требует немедленного обращения к врачу-гастроэнтерологу для прохождения обследования и максимально раннего обнаружения злокачественного новообразования.
Диагностика
Единственным основанием для установления диагноза «рак желудка» является результаты гистологического исследования новообразования. Но для выявления опухоли, выяснения ее размеров, характеристики поверхности, локализации и осуществления эндоскопической биопсии проводят гастроскопию.
Наличие увеличенных лимфоузлов средостения и метастазов в легких можно выявить при рентгенографии легких. Контрастная рентгенография желудка визуализирует присутствие новообразования в желудке.
УЗИ органов брюшной полости проводят для выяснения распространения опухолевого процесса. С теми же целями (детальная визуализация новообразования) проводят мультиспиральную компьютерную томографию (МСКТ). В определении распространения злокачественного процесса помогает ПЭТ — позитронно-эмиссионная томография (вводимая в организм радиоактивная глюкоза собирается в тканях опухоли, визуализируя вышедший за пределы желудка злокачественный процесс).
МРТ живота. Большое эндофитное объемное образование в стенке тела желудка; метастаз в печени
При лабораторном исследовании крови выявляют специфические онкомаркеры. Кал проверяют на присутствие скрытой крови. Детальное исследование опухоли, возможность ее хирургического удаления определяют при диагностической лапароскопии, при этом также возможен забор биоптата для исследования.
Лечение рака желудка
Тактика лечебных мероприятий зависит от стадии развития рака желудка, размера опухоли, прорастания в соседние области, степени заселения злокачественными клетками лимфоузлов, поражения метастазами других органов, общего состояния организма, сопутствующих заболеваний органов и систем.
При раке желудка могут применять три основных методики лечения злокачественных образований: хирургическое удаление, химиотерапию и лучевую терапию. В большинстве случаев используется сочетание методик. Тактика лечения определяется специалистом-онкологом, после комплексного обследования пациента, получения рекомендаций смежных специалистов.
В случаях раннего выявления опухоли (на стадиях 0 и 1), когда метастазы отсутствуют, прорастание в стенку не достигает подслизистых слоев, возможно полное хирургическое удаление рака. Проводится удаление участка стенки желудка, пораженного раком, часть окружающих тканей, близлежащие лимфоузлы. Иногда, в зависимости от степени поражения желудка опухолью, производится частичная или тотальная резекция желудка.
После такого рода операций общий объем желудка заметно уменьшается, либо, если желудок полностью удален, пищевод соединяется с тонким кишечником напрямую. Поэтому пациенты после резекции желудка могут употреблять ограниченное количество пищи за один прием.
Лучевую терапию (облучение пораженных опухолью органов и тканей ионизирующим излучением) производят для остановки роста и уменьшения опухоли в предоперационном периоде и в качестве средства, подавляющего активность раковых клеток и уничтожения вероятных очагов рака после удаления опухоли.
Химиотерапия – медикаментозное подавление роста злокачественных образований. Комплекс химиотерапевтических препаратов включает в себя высокотоксичные средства, разрушающие опухолевые клетки. После операции по удалению злокачественного новообразования химиотерапию применяют для подавления активности оставшихся раковых клеток, чтобы исключить вероятность рецидива рака желудка. Зачастую химиотерапия комбинируется с лучевой терапией для усиления эффекта. Хирургическое лечения также, как правило, сочетается с тем или иным способом подавления активности раковых клеток.
Пациенты, страдающие раком желудка, должны хорошо, полноценно питаться на протяжении всего лечения. Организму, борющемуся со злокачественной опухолью, требуется большое количество белка, витаминов, микроэлементов, необходима достаточная калорийность суточного рациона. Трудности возникают в случае выраженного угнетения психики (апатии, депрессии) и отказа от пищи. Иногда возникает необходимость в парентеральном введении питательных смесей.
Осложнения
Тяжелые осложнения, значительно ухудшающие течение заболевания, могут быть как непосредственным результатом наличия злокачественной опухоли, так и стать следствием весьма тяжелопереносимых методов противоопухолевой терапии. При раке желудка зачастую возникают кровотечения из сосудов поврежденной стенки, что способствует развитию анемии. Крупные опухоли могут некротизироваться, ухудшая общее состояние организма выделением в кровь продуктов некротического распада. Потеря аппетита и усиленное потребление опухолевой тканью питательных веществ способствует развитию общей дистрофии.
Продолжительная лучевая терапия может способствовать развитию выраженного лучевого ожога, а так же лучевого дерматита и лучевой болезни. Побочными эффектами химиотерапии является общая слабость, тошнота (вплоть до регулярной рвоты), диарея, алопеция (облысение), сухость кожи, дерматиты, экзема, ломкость ногтей, деформация ногтевых пластин, расстройства половой сферы.
Одним из распространенных осложнений может быть присоединившаяся инфекция. Вследствие подавленного иммунитета течение инфекционного процесса может быть весьма тяжелым.
Прогноз и профилактика
Рак желудка диагностируется, как правило, уже на стадии неизлечиваемой опухоли. Только в сорока процентах случаев выявляется новообразование, при котором есть вероятность излечения (рак на ранней стадии без метастазирования либо с метастазами в близлежащих лимфоузлах). Таким образом, при выявлении рака третьей и четвертой стадии, при его склонности к быстрому течению и осложнениям прогноз кране неблагоприятен.
Оперативное лечение в сочетании с тем или иным методом противоопухолевой терапии дает пятилетнюю выживаемость после операции у 12% пациентов. В случае раннего обнаружения рака (поверхностное распространение без прорастания в подслизистые слои стенки желудка) выживаемость увеличивается до 70% случаев. При озлокачествленной язве желудка вероятность выживаемости – от 30 до 50%.
Наименее благоприятный прогноз у неоперабельных опухолей, поразивших насквозь все слои желудочной стенки и проникших в окружающие ткани. Неблагоприятно течение рака, если выявлены метастазы в легких и печени. При неоперабельных опухолях желудка терапия направлена на облегчение симптомов и максимально возможное снижение скорости прогрессирования заболевания.
Основными мерами профилактики рака желудка являются: своевременное лечение заболеваний, которые являются предраковыми состояниями, регулярное правильное питание, отказ от курения. Значимой мерой в профилактике развития злокачественных новообразований является контроль состояния слизистой желудка и своевременное выявление зарождающихся опухолевых процессов.
Дата публикации 28 октября 2019Обновлено 18 августа 2021
Определение болезни. Причины заболевания
Рак желудка — это злокачественная опухоль, которая развивается из клеток слизистой оболочки желудка. В мире он занимает четвёртое место по распространённости среди всех онкологических заболеваний и второе место среди причин смертности от злокачественных опухолей [1]. В России рак желудка, по данным на 2017 год, находится на четвёртом месте по распространённости среди всех онкологических заболеваний у мужчин и на шестом месте у женщин [2].
Заболеваемость раком желудка постепенно снижается, но при этом растёт число случаев, когда опухоль выявляют на IV стадии. Зачастую у таких пациентов плохой прогноз. Причина поздней диагностики — длительное бессимптомное течение болезни [1][3].
Точные причины развития рака желудка, как и других онкозаболеваний, пока неизвестны. И хотя установлено, что клетка становится злокачественной после определённых мутаций, в каждом конкретном случае сложно сказать, почему они произошли.
С возрастом риск развития рака желудка повышается. Наибольшее число случаев болезни диагностируется в возрасте 50–70 лет. У людей младше 30 лет она встречается крайне редко [4].
Значимым фактором риска развития рака желудка считается инфекция H. pylori. У хронически инфицированных людей вероятность развития злокачественной опухоли выше в 2-3 раза. Врачи стали более успешно выявлять и лечить хеликобактерную инфекцию. Возможно, именно по этой причине распространённость рака желудка снижается [4].
Другие факторы риска:
- Атрофический гастрит и язвенная болезнь желудка. Эти заболевания также связаны с H. pylori.
- Нехватка овощей и фруктов в рационе. В них содержатся вещества, которые, вероятно, защищают слизистую оболочку желудка от злокачественного перерождения: витамины C, E, каротиноиды, селен.
- Обилие солёной пищи. Считается, что именно из-за этого рак желудка часто встречается в некоторых азиатских странах: там вместо заморозки хранят продукты методом засолки.
- Нитраты и нитриты. Из них в желудке образуются канцерогенные соединения, которые могут стимулировать перерождение клеток желудка. Эти вещества, как правило, поступают в организм с овощами, консервированным мясом и питьевой водой.
- Пернициозная анемия — болезнь, связанная с дефицитом витамина B12, который приводит к нарушению кроветворения. Одна из возможных причин — нарушение выработки клетками желудка особого вещества — внутреннего фактора, который необходим для усвоения витамина B12 из пищи. У людей с этим типом анемии повышен риск развития рака желудка.
- Курение. Его роль в формировании рака желудка пока не до конца ясна. Одни исследования показали, что табачный дым способствует развитию злокачественных опухолей желудка, другие такой связи не обнаружили.
- Вирус Эпштейна — Барр. Некоторые исследователи выделили данный вирус из злокачественных опухолей желудка. Но его роль как фактора риска развития болезни неоднозначна.
- Вторая группа крови (A). По неизвестным причинам рак желудка чаще встречается у людей именно с этой группой крови.
- Некоторые наследственные заболевания. Риск развития заболевания повышается при наследственном раке желудка диффузного типа, синдроме Линча (наследственном неполипозном раке толстой кишки), семейном аденоматозном полипозе, синдроме Ли — Фраумени и др. [4][5][6].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы рака желудка
Долгое время рак желудка может не вызывать симптомов. Поэтому раннюю стадию рака диагностируют, как правило, случайно во время гастроскопии, выполненной по другим показаниям.
В некоторых странах, например в Японии, эндоскопическую диагностику используют в качестве скрининга — профилактического обследования здорового населения. Благодаря ранней диагностике смертность от рака в этой стране — одна из самых низких, несмотря на очень высокую распространённость заболевания. В других странах, например в США, такой подход не практикуется. И всё же каждому человеку можно порекомендовать хотя бы раз в жизни, ближе к 50 годам, пройти гастроскопию. Это поможет своевременно выявить изменения на слизистой оболочке желудка.
Первые симптомы рака желудка чаще всего неспецифичны: они напоминают гастрит или язвенную болезнь. Пациента беспокоят дискомфорт, чувство тяжести и распирания в верхней части живота, наступает быстрое насыщение после приёма пищи [6][7].
На более поздних стадиях появляются боли в животе, у больного пропадает аппетит, он сильно теряет в весе. При желудочном кровотечении возникает рвота с примесью алой крови или по типу «кофейной гущи». Иногда возникает скрытое кровотечение, которое приводит к анемии. Она проявляется в виде слабости, бледности, головных болей.
Частая упорная рвота может свидетельствовать о том, что опухоль привела к стенозу привратника — перекрыла участок желудка в месте перехода в двенадцатиперстную кишку и нарушает прохождение пищи [6].
Из-за того, что симптомы возникают на поздних стадиях и маскируются под другие заболевания, у 80 % пациентов рак желудка выявляется на поздних стадиях [6].
Патогенез рака желудка
Развитие злокачественной опухоли в желудке — длительный и довольно сложный процесс. Ему предшествует каскад предраковых изменений, который обычно протекает на фоне инфекции H. pylori [6].
Болезнетворные бактерии вызывают воспаление слизистой оболочки желудка, которое может протекать десятилетиями. В итоге развивается атрофия желёз желудка — так называемый «атрофический гастрит» [6].
Далее возникает кишечная метаплазия — перерождение ткани. Клетки слизистой оболочки желудка изменяются, и она начинает напоминать слизистую тонкого, а затем толстого кишечника. Это уже предраковое состояние.
Вслед за кишечной метаплазией развивается дисплазия: клетки приобретают нехарактерный внешний вид (становятся атипичными), быстро размножаются, из-за чего нарушается структура слизистой оболочки [6].
Выделяют три степени дисплазии слизистой желудка: лёгкую умеренную и тяжёлую. Две первые степени обратимы. Третья степень характеризуется стойкими изменениями, по сути её уже можно рассматривать как злокачественную опухоль.
В конечном итоге дисплазия приводит к развитию рака. Новообразование приобретает классические свойства злокачественных опухолей: оно может прорастать в соседние ткани, метастазировать с образованием вторичных очагов в различных органах [6].
В качестве предраковых заболеваний рассматриваются полипы желудка. Они бывают разных видов, наиболее опасны аденоматозные полипы. Если их обнаружили во время гастроскопии, то необходимо провести полипэктомию — удалить полипы [7].
К фоновым заболеваниям, при которых обычно развивается рак желудка, относятся:
- хронический атрофический гиперпластический гастрит, аутоиммунный метапластический атрофический гастрит;
- пернициозная анемия;
- перенесённая операция, во время которой была удалена часть желудка;
- аденоматозные полипы;
- болезнь Менетрие [7][8].
Классификация и стадии развития рака желудка
Рак желудка имеет разное микроскопическое строение. В зависимости от этого выделяют его гистологические типы. Большинство злокачественных опухолей (90-95 %) представлены аденокарциномами. Они развиваются из железистых клеток [9].
Согласно классификации 2010 года, выделяют четыре основных гистологических типа рака желудка:
- Тубулярные аденокарциномы — наиболее распространённый тип рака. Они выглядят, как полипы или «грибы» на ножке. Под микроскопом в опухоли видны канальцы разных размеров, в которых может находиться слизь.
- Папиллярные карциномы — также довольно распространённый тип опухоли. Как правило, они развиваются в верхнем отделе желудка у пожилых людей. Эти опухоли часто распространяются в лимфоузлы и метастазируют в печень.
- Муцинозные аденокарциномы — составляют около 10 % всех случаев рака желудка. Микроскопически они выглядят, как желе из слизи, в котором находятся опухолевые клетки.
- Перстневидноклеточные аденокарциномы — представлены клетками, внутри которых находится слизь. Она смещает ядро на периферию, из-за чего клетки под микроскопом выглядят, как перстни. Эти опухоли нередко находятся в нижнем отделе желудка, склонны к распространению в двенадцатиперстную кишку [1][10].
Реже в желудке встречаются другие злокачественные опухоли: лимфомы (новообразования из лимфоидной ткани), гастроинтестинальные стромальные опухоли, карциноидные опухоли (из клеток, вырабатывающих гормоны), плоскоклеточный и мелкоклеточный рак, лейомиосаркомы (злокачественные опухоли из мышечной ткани) [9].
В зависимости от места расположения выделяют злокачественные опухоли кардии, тела, дна, антрума и привратника желудка, малой и большой кривизны, а также неуточнённой локализации [8].
Стадирование рака
Стадию рака желудка определяют согласно общепринятой системе TNM. Буква «T» обозначает признаки первичной опухоли, «N» — распространение в лимфоузлы, «M» — отдалённые метастазы. В зависимости от степени распространения рака в организме каждой букве присваивается числовое обозначение [9]:
| T | T0 | Первичная опухоль отсутствует |
|---|---|---|
| Tis | Рак на месте — опухоль, которая находится в слизистой оболочке и не распространяется глубже |
|
| T1 | Опухоль, которая прорастает вглубь, но не достигает мышечного слоя стенки желудка |
|
| T2 | Прорастание опухоли в мышечный слой | |
| T3 | Опухоль, которая прорастает через всю толщу стенки органа, но не проникает в висцеральную брюшину — тонкую оболочку из соединительной ткани, покрывающую желудок |
|
| T4a | Опухоль прорастает в висцеральную брюшину | |
| T4b | Опухоль прорастает в соседние органы | |
| N | N0 | Опухолевых очагов в регионарных лимфоузлах нет |
| N1 | Поражены 1–2 лимфоузла | |
| N2 | Поражены 3–6 лимфоузлов | |
| N3 | Поражено 7 и более регионарных лимфоузлов | |
| M | M0 | Отдалённых метастаз нет |
| M1 | Отдалённые метастазы обнаружены |
В зависимости от сочетания показателей T, N и M, выделяют четыре стадии рака желудка. В общих чертах их можно охарактеризовать следующим образом:
- Стадия I: опухоль, которая прорастает не глубже мышечного слоя и может распространяться в 1-2 ближайших лимфоузла.
- Стадия II: опухоль, которая прорастает глубже, вплоть до висцеральной брюшины, или распространяется на большее количество ближайших лимфоузлов.
- Стадия III: опухоль, которая прорастает в висцеральную брюшину, соседние органы, или поражает больше лимфоузлов, чем в предыдущих стадиях.
- Стадия IV: обнаружены отдалённые метастазы [8].
Осложнения рака желудка
Главное осложнение рака желудка — метастазирование. С током крови метастазы (раковые клетки) чаще всего проникают в печень, реже — в лёгкие и кости. Иногда они локализуются в яичниках (опухоль Крукенберга) и лимфатическом узле над ключицей (метастаз Вирхова) [11][12].
Нередко первые симптомы рака желудка связаны именно с метастазами [6]:
- При поражении печени: боль и дискомфорт под правым ребром, снижение аппетита, тошнота, потеря веса, слабость, повышенная температура и утомляемость, механическая желтуха.
- При поражении лёгких: упорный кашель, одышка, боли в грудной клетке, отхождение мокроты с примесью крови.
- При поражении костей: упорные боли, которые усиливаются во время нагрузок и длительном пребывании в однообразном положении, патологические переломы. Возможно такое серьёзное осложнение, как гиперкальциемия — повышение уровня кальция в крови из-за разрушения костной ткани.
Нередко рак напрямую прорастает в поджелудочную железу, диафрагму, большой сальник, подвздошную и двенадцатиперстную кишку. При проникновении раковых клеток в брюшную полость и распространении по её внутренней оболочке — брюшине — развивается её карциноматоз (обширное поражение метастазами). Прогноз для пациента резко ухудшается: это осложнение может стать причиной асцита (скопления жидкости в брюшной полости) и кишечной непроходимости.
При раке на поздних стадиях развивается непроходимость желудка, места его соединения с пищеводом, двенадцатиперстной кишкой.
Другим распространённым осложнением является желудочное кровотечение[13]. Как правило, оно возникает на III-IV стадии болезни из-за разрыва сосуда, в который проросла опухоль. Может быть скрытым, т. е. обнаружиться только во время диагностики, или проявляться в виде рвоты с примесью крови или дёгтеобразного стула.
Диагностика рака желудка
Наиболее информативный метод диагностики злокачественных опухолей желудка — гастроскопия. Во время этого обследования врач может осмотреть слизистую оболочку, увидеть патологические образования и провести биопсию — получить фрагмент подозрительной ткани и отправить его в лабораторию для гистологического и цитологического исследования [14].
Современные аппараты для эндоскопической диагностики позволяют выполнить эндоУЗИ (эндосонографию) — ультразвуковое исследование через стенку желудка с помощью миниатюрного датчика. Этот метод помогает оценить глубину прорастания опухоли, её распространение в соседние структуры и лимфоузлы [14].
Если результаты биопсии подтвердили злокачественность новообразования, назначают обследование, которое помогает уточнить стадию заболевания и определиться с тактикой лечения:
- Рентгенография с контрастным раствором, который пациенту необходимо выпить. Выявляет поражение пищевода, двенадцатиперстной кишки, степень стеноза (сужение просвета органа).
- УЗИ органов брюшной полости помогает обнаружить метастазы в печени, лимфоузлах, распространение опухоли в соседние органы.
- УЗИ шеи и надключичных областей проводится для исключения метастаза Вирхова.
- Рентгенография грудной клетки позволяет определить наличие метастазов в лёгких.
- Компьютерная томография применяется для поиска метастазов в области груди и живота. Её также можно провести с контрастированием.
- Магнитно-резонансную томографию (МРТ) применяют для оценки распространённости опухоли и поиска метастазов.
- Колоноскопия — эндоскопическое исследование толстой кишки — может быть назначена при подозрении на кишечные осложнения.
- Позитронно-эмиссионная томография (ПЭТ) – современный оптимальный метод поиска отдалённых метастазов. Во время исследования в организм пациента вводят слабый радиоактивный препарат, который накапливается в опухолевых клетках. Затем выполняют снимки с помощью специального аппарата: на них хорошо видны все метастатические очаги.
- Лапароскопия — обследование через небольшой прокол в брюшной полости с помощью лапароскопа — выполняется для оценки распространённости опухоли и возможности её удаления [8][14][15].
Из лабораторных исследований назначают общий анализ крови для выявления анемии, анализ стула на скрытую кровь, а также биохимический анализ крови, который помогает оценить работу печени и поджелудочной железы [15].
Лечение рака желудка
Тактика лечения рака желудка в первую очередь зависит от его стадии, общего состояния здоровья пациента и наличия сопутствующих заболеваний.
Радикальный метод лечения рака желудка — удаление опухоли. Существуют разные виды операций. Выбор зависит от того, на какой стадии диагностировано заболевание и какая часть желудка поражена. Радикальное хирургическое вмешательство возможно, если соблюдаются три условия:
- рак желудка резектабелен, т. е. его действительно можно удалить;
- нет отдалённых метастазов;
- состояние здоровья пациента позволяет перенести хирургическое вмешательство [14].
Если опухоль не успела сильно прорасти в стенку желудка и не распространилась в регионарные лимфоузлы, её можно удалить эндоскопически. Такая операция проводится без разреза на животе, прямо во время гастроскопии. К сожалению, рак желудка редко диагностируют на ранних стадиях, поэтому такие вмешательства показаны немногим больным [14].
В остальных случаях выполняют один из следующих вариантов операции:
- Дистальная субтотальная резекция желудка — удаление желудка, при котором остаётся лишь 2-3 см его верхней части. Проводится при злокачественных опухолях в нижней части органа — антральном отделе.
- Проксимальная субтотальная резекция — удаление верхней части желудка вместе со сфинктером, который разделяет пищевод и желудок. Показана при поражении данного сфинктера и небольших опухолях в верхней части желудка.
- Гастрэктомию — полное (тотальное) удаление желудка — выполняют во всех остальных случаях.
Нередко операцию дополняют лимфодиссекцией — удалением близлежащих лимфатических узлов. Обычно американские хирурги стараются удалять не менее 15 ближайших лимфоузлов, японские — ещё больше. Считается, что объём лимфодиссекции напрямую связан с эффективностью лечения [14][16].
При неоперабельных опухолях прибегают к паллиативным операциям. Они помогают контролировать течение заболевания, купировать некоторые симптомы и справиться с осложнениями:
- Удаление части желудка помогает справиться с кровотечением, устранить стеноз (сужение), вызванный опухолью.
- Если опухоль блокирует нижнюю часть желудка, проводят шунтирование: между желудком и тонкой кишкой создают искусственное отверстие — обходной путь для пищи.
- У людей, которые не могут перенести операцию, для борьбы с кровотечением и стенозом прибегают к эндоскопической аблации: опухолевую ткань разрушают с помощью лазера.
- Стентирование позволяет устранить опухолевый стеноз. Стент — короткую трубку с сетчатой стенкой из металла или пластика — устанавливают в месте сужения. Он обеспечивает нормальную проходимость органа.
- Гастростомию выполняют у пациентов, которые не могут самостоятельно питаться из-за непроходимости соединения пищевода и желудка. Через отверстие из желудка на поверхность кожи выводят трубку. Через неё подают питательные смеси [16].
Химиотерапию при раке желудка проводят до операции, чтобы сократить размеры опухоли и облегчить её удаление, а также после, чтобы снизить риск рецидива. При неоперабельном раке она становится одним из основных методов лечения. В таких случаях обычно назначают несколько химиопрепаратов с разными механизмами действия [14][16].
Лучевую терапию также назначают до и после операции, а на поздних стадиях проводят в качестве самостоятельного метода лечения. Иногда её сочетают с химиопрепаратами — проводят химиолучевую терапию. Она более эффективно уничтожает опухолевые клетки, но чаще может вызвать серьёзные побочные эффекты [14][16].
Примерно у 20 % пациентов с раком желудка повышена активность HER2 — белка-рецептора, который находится на поверхности клеток и стимулирует их размножение. В таких случаях эффективен трастузумаб — таргетный препарат, блокирующий HER2. Его вводят внутривенно раз в 2-3 недели. До начала лечения нужно убедиться, что активность HER2 в опухолевой ткани повышена. Для этого проводят молекулярно-генетические исследования [14][16].
При асците проводят лапароцентез — удаление жидкости из брюшной полости через прокол и введение химиопрепаратов. При карциноматозе брюшины у некоторых пациентов может быть выполнена гипертермическая интраперитонеальная («горячая») химиотерапия. Во время вмешательства удаляют все крупные опухолевые узлы в брюшной полости, затем её промывают подогретым раствором химиопрепарата — это помогает уничтожить оставшиеся опухолевые клетки [14][17].
Так как многих пациентов с раком желудка беспокоят мучительные боли, для борьбы с ними применяются разные препараты и методики. Современный оптимальный способ — «лестница обезболивания». Она рекомендована экспертами Всемирной организации здравоохранения. В соответствии с ней, в зависимости от силы боли применяют все более мощные препараты [18].
Прогноз. Профилактика
Обычно прогноз для онкобольных оценивают по показателю пятилетней выживаемости — проценту пациентов, которые продолжают жить в течение пяти лет с момента постановки диагноза.
Средняя пятилетняя выживаемость при раке желудка составляет 31 %. Она зависит от того, как рано диагностирована злокачественная опухоль:
- на локализованной стадии — когда рак не распространился за пределы желудка — 68 %;
- на местно-распространённой стадии — когда злокачественная опухоль распространилась на соседние органы и ближайшие лимфоузлы — 31 %.
- на распространённой стадии — когда есть отдалённые метастазы — 5 % [19].
Главные меры профилактики рака желудка:
- своевременная диагностика и лечение инфекции H. Pylori;
- изменение рациона питания — употребление в пищу большого количества овощей, фруктов, ограничение соли.
Люди с предраковыми состояниями — атрофическим гастритом, метаплазией и дисплазией — должны регулярно наблюдаться у врача, проходить гастроскопию [6].