Описание препарата Релвар Эллипта (порошок для ингаляций дозированный, 22 мкг+184 мкг/доза) основано на официальной инструкции, утверждено компанией-производителем в 2014 году
Дата согласования: 24.10.2014
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок
24.10.2014
Действующее вещество
ATX
Фармакологическая группа
Состав
| Порошок для ингаляций дозированный, 22 + 92 мкг/доза | 1 доза/ячейка* |
| Стрип с вилантеролом | |
| активное вещество: | |
| вилантерола трифенатат микронизированный | 40 мкг |
| (эквивалентно 25 мкг** вилантерола) | |
| вспомогательные вещества: магния стеарат — 125 мкг; лактозы моногидрат — до 12,5 мг | |
| Стрип с флутиказона фуроатом | |
| активное вещество: | |
| флутиказона фуроат микронизированный | 100 мкг** |
| вспомогательное вещество: лактозы моногидрат — до 12,5 мг |
| Порошок для ингаляций дозированный, 22 + 184 мкг/доза | 1 доза/ячейка* |
| Стрип с вилантеролом | |
| активное вещество: | |
| вилантерола трифенатат микронизированный | 40 мкг |
| (эквивалентно 25 мкг** вилантерола) | |
| вспомогательные вещества: магния стеарат — 125 мкг; лактозы моногидрат — до 12,5 мг | |
| Стрип с флутиказона фуроатом | |
| активное вещество: | |
| флутиказона фуроат микронизированный | 200 мкг** |
| вспомогательное вещество: лактозы моногидрат — до 12,5 мг | |
| * При производстве готового препарата смеси действующих и вспомогательных веществ могут закладываться в конечный продукт с избытком до 8% для компенсации потерь при наполнении ячеек. | |
| ** Указано номинальное количество действующего вещества, закладываемое в процессе производства; доставленное количество составляет 22 мкг вилантерола, 92 и 184 мкг флутиказона фуроата, что соответствует указанным дозировкам. |
Описание лекарственной формы
Порошок: белого цвета.
Фармакологическое действие
Фармакологическое действие
—
бронходилатирующее, противовоспалительное.
Фармакодинамика
Механизм действия
Вилантерол и флутиказона фуроат относятся к двум различным классам лекарственных препаратов — синтетический ГКС и селективный бета2-адреномиметик длительного действия.
Фармакодинамические эффекты
Вилантерол относится к классу селективных бета2-адреномиметиков длительного действия (ДДБА). Фармакологические эффекты агонистов бета2-адренорецепторов, включая вилантерол, по крайней мере, частично связаны со стимуляцией внутриклеточной аденилатциклазы — фермента, который катализирует превращение АТФ в цАМФ. Повышение уровня цАМФ приводит к расслаблению гладкой мускулатуры бронхов и угнетению высвобождения из клеток (в первую очередь из тучных клеток) медиаторов реакций гиперчувствительности немедленного типа.
Флутиказона фуроат является синтетическим трехфтористым ГКС с выраженным противовоспалительным действием. Точный механизм действия, позволяющий купировать симптомы бронхиальной астмы и ХОБЛ, неизвестен. ГКС продемонстрировали широкий спектр действия на различные типы клеток (например эозинофилы, макрофаги, лимфоциты) и медиаторы (например цитокины и хемокины, участвующие в процессе воспаления). Между ГКС и ДДБА происходят молекулярные взаимодействия, в результате которых стероидные гормоны активируют ген бета2-адренорецептора, повышая число восприимчивых адренорецепторов. ДДБА связываются с ГКС-рецептором, обеспечивая его стероидозависимую активацию и стимулируя транслокацию в ядро клетки. Эти синергические взаимодействия приводят к усилению противовоспалительной активности, что выявляется в экспериментах in vitro и in vivo с различными клетками воспаления, участвующими в патофизиологических процессах развития бронхиальной астмы и ХОБЛ. Результаты клинических исследований с использованием биоптатов дыхательных путей также продемонстрировали синергию ГКС и ДДБА, возникающую при назначении этих препаратов пациентам с ХОБЛ в терапевтических дозах.
Фармакокинетика
Всасывание
Абсолютная биодоступность вилантерола и флутиказона фуроата при ингаляционном введении комбинации вилантерола и флутиказона фуроата составила в среднем 15,2 и 27,3% соответственно. Пероральная биодоступность обоих веществ была низкой и в среднем составляла 1,26 и <2% соответственно. Принимая во внимание низкую пероральную биодоступность, системное действие вилантерола и флутиказона фуроата после ингаляционного приема в первую очередь обусловлено всасыванием части ингаляционной дозы, поступившей в легкие.
Распределение
После в/в введения вилантерол и флутиказона фуроат активно распределяются в организме, при этом средние Vss составляют 165 и 661 л, соответственно. Оба вещества обладают низкой способностью связываться с эритроцитами. В исследованиях in vitro связывание вилантерола и флутиказона фуроата с белками плазмы человека было высоким и достигало в среднем >93,9 и 99,6%, соответственно. Степень связывания с белками плазмы in vitro не уменьшалась у пациентов с нарушениями функции печени и почек. Несмотря на то, что вилантерол и флутиказона фуроат являются субстратами Р-гликопротеина (P-gp), при одновременном назначении комбинации вилантерола и флутиказона фуроата с ингибиторами P-gp изменение системной экспозиции вилантерола или флутиказона фуроата считается маловероятным, т.к. оба вещества обладают хорошей абсорбционной способностью.
Метаболизм
На основании in vitro экспериментов можно заключить, что ключевые пути метаболизма вилантерола и флутиказона фуроата в организме человека в первую очередь опосредуются через изофермент цитохрома CYP3A4.
Вилантерол преимущественно метаболизируется путем О-деалкилирования с образованием целого ряда метаболитов, обладающих существенно более низкой бета1— и бета2-адреномиметической активностью.
Флутиказона фуроат преимущественно метаболизируется путем гидролиза S-фторметилкарботиоатной группы с образованием метаболитов, имеющих значительно более низкую ГКС-активность.
Было проведено клиническое исследование лекарственных взаимодействий препарата с изоферментом цитохрома CYP3A4 при длительном введении комбинации вилантерола и флутиказона фуроата (22 + 184 мкг/доза) и сильного ингибитора изофермента цитохрома CYP3A4 — кетоконазола (400 мг) — на примере здоровых добровольцев. Совместное введение препаратов привело к повышению средней AUC0–24 и средней Cmax флутиказона фуроата на 36 и 33%, соответственно. Увеличение экспозиции флутиказона фуроата было ассоциировано со снижением средней концентрации сывороточного кортизола на 27%, измеренного за период 0–24 ч. Совместное введение комбинации вилантерола и флутиказона фуроата и кетоконазола привело к повышению средних AUC0–t и Cmax вилантерола на 65 и 22% соответственно. Увеличение экспозиции вилантерола не приводило к усилению характерных для бета-агонистов системных эффектов — влияние на ЧСС, содержание калия в крови или корригированный интервал QT (QTcF).
Выведение
После перорального приема флутиказона фуроат в организме человека главным образом метаболизировался с образованием метаболитов, которые преимущественно выводились через ЖКТ, за исключением дозы радиоактивного вещества <1%, выведенной с мочой. Предполагаемый T1/2 из плазмы флутиказона фуроата после ингаляционного приема препарата составлял в среднем 24 ч.
После перорального приема вилантерол в организме человека главным образом метаболизировался с образованием метаболитов, которые экскретировались с мочой и фекалиями, в соотношении приблизительно 70 и 30% дозы радиоактивного вещества, соответственно. T1/2 из плазмы вилантерола после ингаляционного приема препарата составлял в среднем 2,5 ч.
Особые группы пациентов
В ходе третьей фазы клинических исследований проводился популяционный мета-анализ фармакокинетики вилантерола и флутиказона фуроата у пациентов с бронхиальной астмой и ХОБЛ. В рамках данного анализа оценивалось влияние демографических ковариат (возраст, пол, масса, индекс массы тела (ИМТ), расовая и этническая принадлежность) на фармакокинетику вилантерола и флутиказона фуроата.
Раса. У пожилых пациентов с бронхиальной астмой или ХОБЛ оценивалась AUC0–24 флутиказона фуроата. Согласно полученным данным, пациенты восточно-азиатской, японской и южно-азиатской рас (12–14% пациентов) имели в среднем более высокие показатели AUC0–24 (выше не более чем на 53%) в сравнении с пациентами европеоидной расы. Тем не менее, в этих популяциях признаков более высокой системной экспозиции, проявляющейся более выраженным влиянием на экскрецию кортизола с мочой за 24-часовой период, не обнаружено. У пациентов, страдающих ХОБЛ, влияние расовой принадлежности на фармакокинетические параметры вилантерола не выявлено. В среднем, по результатам оценки Cmax вилантерола была на 220–287% выше, a AUC0–24 была сопоставима у пациентов азиатского происхождения с показателями у других расовых групп. Тем не менее, более высокая Cmax вилантерола не имела клинически значимое влияние на ЧСС.
Дети. Для подростков (12 лет или старше) рекомендации по изменению режима дозирования отсутствуют. Фармакокинетика комбинации вилантерола и флутиказона фуроата у пациентов младше 12 лет не изучалась. Безопасность и эффективность применения комбинации вилантерола и флутиказона фуроата у детей младше 12 лет пока не установлена.
Пациенты пожилого возраста. Влияние возраста на фармакокинетику вилантерола и флутиказона фуроата изучалось в третьей фазе клинических исследований, включавших пациентов с ХОБЛ и бронхиальной астмой. У пациентов с бронхиальной астмой не было обнаружено признаков влияния возраста (12–84 года) на фармакокинетический профиль флутиказона фуроата и вилантерола. Несмотря на увеличение (37%) AUC0–24 вилантерола, у пациентов с ХОБЛ на протяжении всего наблюдаемого возрастного диапазона от 41 до 84 лет, признаков влияния возраста пациентов на фармакокинетический профиль флутиказона фуроата не выявлено. У пожилого пациента (в возрасте 84 года) с низкой массой тела (35 кг) AUC0–24 вилантерола будет на 35% выше результата, рассчитанного для популяции (в среднем, пациент с ХОБЛ в возрасте 60 лет и массой тела 70 кг), в то время как Cmax вилантерола останется неизмененной. Маловероятно, что эти различия являются клинически релевантными.
Нарушение функции почек. По данным клинико-фармакологического исследования, тяжелое нарушение функции почек (Cl креатинина <30 мл/мин) не приводит к значительному увеличению системной экспозиции вилантерола или флутиказона фуроата или к развитию более выраженных системных эффектов ГКС или бета2-агонистов в сравнении со здоровыми добровольцами. Индивидуальный подбор дозы для пациентов с нарушением функции почек не требуется. Влияние гемодиализа не изучалось.
Нарушение функции печени. После непрерывного приема комбинации вилантерола и флутиказона фуроата в течение 7 дней у пациентов с нарушением функции печени наблюдалось увеличение системной экспозиции флутиказона фуроата (по измеренной AUC0–24 до трех раз) в сравнении со здоровыми добровольцами (согласно классификации цирроза печени по Чайлд-Пью: стадии цирроза А, В или С). Повышение системной экспозиции флутиказона фуроата (при назначении комбинации вилантерола и флутиказона фуроата в дозировке 22 + 184 мкг/доза) у пациентов с нарушением функции печени средней тяжести (стадия В по классификации Чайлд-Пью) было ассоциировано со снижением концентрации сывороточного кортизола в среднем на 34% в сравнении со здоровыми добровольцами. Показатели нормализованной по дозе системной экспозиции флутиказона фуроата у пациентов с нарушением функции печени средней и тяжелой степени (стадии В и С по классификаций Чайлд-Пью) были сходными. Следовательно, хотя больным с нарушением функции печени не требуется индивидуальный подбор дозы, следует соблюдать осторожность при назначении им данного лекарственного препарата. После непрерывного приема комбинации вилантерола и флутиказона фуроата в течение 7 дней у пациентов с нарушением функции печени легкой, средней или тяжелой степени (стадии А, В и С по классификации Чайлд-Пью) не отмечалось значительного увеличения системной экспозиции вилантерола (по Cmax и AUC0–24). В сравнении со здоровыми добровольцами у пациентов с нарушением функции печени легкой или средней степени (принимавшие вилантерол в дозе 22 мкг) или тяжелой степени (принимавшие вилантерол в дозе 11 мкг) не наблюдалось клинически значимых бета-адренергических системных эффектов (изменение ЧСС или концентрации сывороточного калия), вызванных приемом комбинации вилантерола и флутиказона фуроата.
Пол, масса тела, ИМТ. По данным третьей фазы популяционного анализа фармакокинетики, включавшего 1213 пациентов с бронхиальной астмой (712 женщин) и 1225 пациентов с ХОБЛ (392 женщины), признаков влияния пола, массы тела или ИМТ на фармакокинетический профиль флутиказона фуроата не обнаружено. По данным популяционного анализа фармакокинетики с участием 856 пациентов с бронхиальной астмой (500 женщин) и 1091 пациента с ХОБЛ (340 женщин), признаков влияния пола, массы тела или ИМТ на фармакокинетический профиль вилантерола не обнаружено. Не требуется индивидуальный подбор дозы на основании данных о половой принадлежности, массе тела или ИМТ.
Показания
бронхиальная астма (препарат Релвар Эллипта применяется в качестве поддерживающей терапии бронхиальной астмы);
хроническая обструктивная болезнь легких (препарат Релвар Эллипта применяется в качестве поддерживающей терапии обструкции дыхательных путей у пациентов с хронической обструктивной болезнью легких, включая хронический бронхит и/или эмфизему легких). Применение препарата Релвар Эллипта позволяет сократить число обострений хронической обструктивной болезни легких у пациентов с повторными обострениями в анамнезе.
Противопоказания
тяжелые аллергические реакции на молочный белок или повышенная чувствительность к действующим веществам или любому другому компоненту, входящему в состав препарата в анамнезе;
дети до 12 лет (для лечения бронхиальной астмы);
препарат Релвар Эллипта в дозе 22 + 184 мкг/доза не показан для лечения хронической обструктивной болезни легких.
С осторожностью: при приеме симпатомиметиков, включая препарат Релвар Эллипта, со стороны ССС могут наблюдаться такие нежелательные явления, как аритмия (например наджелудочковая тахикардия и экстрасистолия). В связи с этим пациентам, страдающим тяжелыми формами сердечно-сосудистых заболеваний, препарат Релвар Эллипта следует назначать с осторожностью. Как и другие ЛС, в состав которых входят ГКС, препарат Релвар Эллипта следует с осторожностью назначать пациентам с туберкулезом легких, а также пациентам с хроническими или невылеченными инфекциями.
Применение при беременности и кормлении грудью
Данные о применении препарата во время беременности ограничены. Применение препарата Релвар Эллипта у беременных женщин допустимо только в том случае, если потенциальная польза для матери превышает возможный риск для плода.
Данных об экскреции вилантерола или флутиказона фуроата или их метаболитов в грудное молоко человека недостаточно. Однако другие ГКС и бета2-агонисты определяются в грудном молоке. Риск проникновения препарата вместе с молоком в организм новорожденного или ребенка не может быть исключен.
Принимая во внимание соотношение пользы терапии для матери и грудного вскармливания для ребенка, необходимо решить вопрос либо об отмене препарата, либо о прекращении грудного вскармливания.
Фертильность
Данные по влиянию на фертильность человека отсутствуют. В доклинических исследованиях воздействие вилантерола и флутиказона фуроата на фертильность не обнаружено.
Способ применения и дозы
Ингаляционно.
Препарат Релвар Эллипта следует применять 1 раз в сутки в одно и то же время, утром или вечером. После ингаляции следует прополоскать рот водой, не проглатывая.
Бронхиальная астма
Пациент должен быть проинформирован о необходимости регулярного применения препарата Релвар Эллипта даже в случае бессимптомного течения заболевания. При возникновении симптомов заболевания в период между приемами препарата в качестве неотложной терапии следует применять ингаляционные формы бета2-агонистов короткого действия. Врач должен регулярно оценивать состояние пациента, чтобы обеспечить своевременное назначение оптимальной дозировки препарата Релвар Эллипта. Дозировка может быть изменена только по рекомендации врача.
Взрослые и подростки 12 лет и старше. Рекомендуемая доза препарата Релвар Эллипта: одна ингаляция 22 мкг вилантерола и 92 мкг флутиказона фуроата 1 раз в сутки или одна ингаляция 22 мкг вилантерола и 184 мкг флутиказона фуроата 1 раз в сутки.
Начальная доза препарата Релвар Эллипта 22 мкг вилантерола и 92 мкг флутиказона фуроата назначается пациентам, которым требуются низкие или средние дозы ингаляционных ГКС, применяемых в комбинации с бета2-агонистами длительного действия.
Препарат Релвар Эллипта в дозировке 22 мкг вилантерола и 184 мкг флутиказона фуроата следует назначать пациентам, которым требуется более высокая доза ингаляционных ГКС, применяемых в комбинации с бета2-агонистами длительного действия. Если препарат Релвар Эллипта в дозировке 22 мкг вилантерола и 92 мкг флутиказона фуроата не обеспечивает адекватного контроля заболевания, рассматривается вопрос об увеличении дозы до 22 мкг вилантерола и 184 мкг флутиказона фуроата, что может улучшить уровень контроля над течением бронхиальной астмы.
Дети. Безопасность и эффективность применения препарата Релвар Эллипта у детей младше 12 лет не установлена.
ХОБЛ
Взрослые. Рекомендуемая доза препарата Релвар Эллипта: одна ингаляция 22 мкг вилантерола и 92 мкг флутиказона фуроата 1 раз в сутки.
Препарат Релвар Эллипта в дозировке 22 мкг вилантерола и 184 мкг флутиказона фуроата не показан для лечения пациентов с ХОБЛ.
Дети. Препарат по показанию ХОБЛ у детей не применяется.
Особые группы пациентов
Пациенты пожилого возраста. Пациентам старше 65 лет не требуется индивидуальный подбор дозы препарата (см. «Фармакокинетика», Особые группы пациентов).
Пациенты с нарушением функции почек. Пациентам с нарушением функции почек не требуется индивидуальный подбор дозы препарата (см. «Фармакокинетика»).
Пациенты с нарушением функции печени. По данным клинико-фармакологического исследования у пациентов с нарушениями функции печени легкой, средней и тяжелой степени наблюдается трехкратное возрастание степени системной экспозиции флутиказона фуроата (с увеличением таких показателей, как Cmax и AUC) (см. «Фармакокинетика»). Пациентам с нарушениями функции печени следует назначать препарат с осторожностью, т.к. эта группа больных имеет более высокий риск развития системных нежелательных реакций, вызванных приемом ГКС.
Рекомендации но применению
При первом использовании ингалятора Эллипта нет необходимости в проверке правильности его работы или специальной подготовки ингалятора к эксплуатации. Следует последовательно соблюдать рекомендации по применению, указанные ниже.
Ингалятор Эллипта упакован в контейнер, содержащий влагопоглощающий пакетик с силикагелем, который не предназначен для еды или ингаляций. Данный пакетик следует утилизировать. После извлечения ингалятора из контейнера, его крышка находится в закрытом положении. Не следует открывать ее до приема препарата.
Подробные инструкции использования ингалятора Эллипта
При открытии и закрытии крышки ингалятора Эллипта без приема лекарственного препарата происходит потеря одной дозы. Эта доза остается закрытой внутри ингалятора, но она будет недоступна для приема. Невозможно случайно получить большую дозу или двойную дозу за одну ингаляцию.
Одна доза лекарственного препарата готова к ингаляции после каждого открытия крышки.
Счетчик доз показывает, сколько доз лекарственного препарата осталось в ингаляторе. Перед началом использования ингалятора счетчик доз показывает число 30. При каждом открытии крышки количество доз уменьшается на 1. Когда остается менее 10 доз, половина счетчика становится красной. После того, как израсходована последняя доза препарата, половина счетчика выделена красным цветом, счетчик показывает цифру 0. Это означает, что ингалятор пуст. При открытии крышки после этого, счетчик доз станет полностью красным.
Подготовка дозы
Не следует открывать крышку до готовности к приему препарата. Не следует встряхивать ингалятор.
1. Опустить крышку вниз до щелчка.
2. Доза препарата готова к ингаляции, и в подтверждение этого счетчик уменьшает число доз на единицу.
3. Если счетчик не уменьшил число доз после щелчка, то ингалятор не готов к подаче дозы лекарственного препарата. В этом случае следует обратиться по телефону или адресу, указанному в подразделе «За дополнительной информацией обращаться».
4. Не следует встряхивать ингалятор.
Ингаляция лекарственного препарата
1. Удерживая ингалятор на некотором расстоянии ото рта, сделать выдох максимальной глубины. Не следует выдыхать в ингалятор.
2. Поместить мундштук между губами и плотно обхватить его губами. Не закрывать пальцами вентиляционное отверстие.
Губы должны точно повторять форму мундштука ингалятора.
3. Сделать один глубокий, долгий, равномерный вдох. Задержать дыхание насколько возможно (по крайней мере на 3–4 с).
4. Убрать ингалятор изо рта.
5. Медленно и спокойно выдохнуть.
При правильном использовании ингалятора пациент может не почувствовать вкус или не ощутить поступление лекарственного препарата.
Закрытие ингалятора и полоскание ротовой полости
При необходимости очистить мундштук, перед закрытием крышки следует использовать сухую бумажную салфетку.
1. Поднять крышку до упора, добившись полного закрытия мундштука.
2. После ингаляции следует прополоскать рот водой. Это снизит вероятность появления таких побочных эффектов, как боль в горле и полости рта.
Побочные действия
Для определения частоты развития нежелательных явлений, связанных с приемом препарата Релвар Эллипта, использовались данные крупных клинических исследований среди пациентов с ХОБЛ и бронхиальной астмой. Программа клинической разработки препарата для лечения бронхиальной астмы включала 7034 пациента, у которых проводилась комплексная оценка нежелательных явлений. В программе клинической разработки препарата для лечения ХОБЛ принимали участие 6237 пациентов, у которых также проводилась комплексная оценка нежелательных явлений. Исключая такие нежелательные явления, как пневмония и переломы, профили безопасности препарата у пациентов с ХОБЛ и бронхиальной астмой были схожи. По данным клинических исследований, пневмония и переломы более часто наблюдались у пациентов, страдающих ХОБЛ. Нежелательные явления, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100); редко (≥1/10000 и <1/1000); очень редко (<1/10000, включая отдельные случаи).
Инфекционные и паразитарные заболевания: часто — пневмония, инфекции верхних дыхательных путей, бронхит, грипп, кандидоз полости рта и глотки.
Со стороны нервной системы: очень часто — головная боль.
Со стороны сердца: нечасто — экстрасистолия.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — назофарингит; часто — орофарингеальная боль, синусит, фарингит, ринит, кашель, дисфония.
Со стороны ЖКТ: часто — боль в животе.
Со стороны скелетно-мышечной и соединительной ткани: часто — артралгия, боль в спине, переломы.
Общие расстройства и нарушения в месте введения: часто — лихорадка.
Взаимодействие
При назначении препарата в терапевтических дозах клинически значимые лекарственные взаимодействия вилантерола или флутиказона фуроата считаются маловероятными вследствие низких плазматических концентраций последних при ингаляционном введении. Бета-адреноблокаторы могут ослаблять или антагонизировать действие бета2-адреномиметиков. Следует избегать одновременного приема неселективных и селективных бета-блокаторов, исключая случаи, когда их назначение строго необходимо.
Вилантерол и флутиказона фуроат подвергаются быстрому первичному метаболизму в печени посредством изофермента системы цитохрома CYP3A4. При одновременном назначении препарата с сильными ингибиторами изофермента цитохрома CYP3A4 (например, кетоконазол, ритонавир) следует соблюдать осторожность, поскольку возможно повышение системного воздействия вилантерола и флутиказона фуроата, что в свою очередь может привести к повышению риска развития нежелательных реакций (см. «Фармакокинетика»).
Вилантерол и флутиказона фуроат являются субстратами P-gp. По результатам клинико-фармакологического исследования с участием здоровых добровольцев, которым одновременно назначались вилантерол и сильный ингибитор P-gp и умеренный ингибитор изофермента цитохрома CYP3A4 верапамил, значимого влияния на фармакокинетику вилантерола не выявлено. Клинико-фармакологические исследования совместного назначения специфического ингибитора P-gp и флутиказона фуроата не проводились.
Передозировка
Симптомы: при проведении клинических исследований не были получены данные о передозировке комбинации вилантерола и флутиказона фуроата. Возможно развитие симптомов и признаков, обусловленных действием отдельных компонентов препарата и характерных для передозировки бета2-агонистами и ингаляционными ГКС (см. «Особые указания»).
Лечение: специфическое лечение отсутствует. Назначается симптоматическая терапия и, при необходимости, обеспечивается соответствующее наблюдение за больным. Применение кардиоселективных бета-адреноблокаторов следует рассматривать только в случаях сильно выраженных эффектов передозировки вилантерола, которые клинически проявляются невосприимчивостью к поддерживающей терапии. Кардиоселективные бета-адреноблокаторы следует с осторожностью назначать пациентам, у которых наблюдались эпизоды бронхоспазма в анамнезе.
Особые указания
Препарат Релвар Эллипта не предназначен для купирования острых симптомов бронхиальной астмы или обострения ХОБЛ, в таких случаях требуется назначение бронходилататоров короткого действия. Увеличение частоты приема бронходилататоров короткого действия с целью купирования симптомов свидетельствует об ухудшении контроля над заболеванием и необходимости консультации врача. Пациентам с бронхиальной астмой или ХОБЛ не следует прекращать лечение препаратом Релвар Эллипта без наблюдений врача, т.к. отмена терапии может привести к обострению заболевания.
Как и при других видах ингаляционной терапии, после приема препарата может развиться парадоксальный бронхоспазм, сопровождающийся быстрым нарастанием свистящих хрипов. В этом случае показаны неотложное назначение ингаляционного бронходилататора короткого действия и немедленная отмена препарата Релвар Эллипта. Пациент должен быть осмотрен врачом, и ему при необходимости может быть назначена альтернативная терапия.
На фоне лечения препаратом Релвар Эллипта могут развиваться нежелательные явления, связанные с течением бронхиальной астмы или обострением заболевания. Пациентам следует рекомендовать продолжить лечение. В случае отсутствия контроля над заболеванием или ухудшения состояния после начала терапии препаратом Релвар Эллипта необходима консультация врача.
При применении ингаляционных ГКС (особенно при длительном приеме в высоких дозах) могут развиваться системные побочные эффекты. Такие побочные эффекты развиваются значительно реже, чем при пероральном приеме ГКС. К проявлениям возможного неблагоприятного системного действия относятся: подавление функции гипоталамо-гипофизарно-надпочечниковой системы, снижение минеральной плотности костей, замедление скорости роста у детей и подростков, катаракта и глаукома.
У пациентов с ХОБЛ, получающих препарат Релвар Эллипта, наблюдалось повышение частоты развития пневмонии, а также частоты возникновения тяжелых форм пневмонии, требующих госпитализации пациента. В некоторых случаях клинические эпизоды пневмонии имели летальный исход. Врачам следует помнить о возможности развития пневмонии у пациентов с ХОБЛ, не забывая о том, что клинические признаки такого инфекционного заболевания маскируются симптомами обострения ХОБЛ. Наиболее высокий риск развития пневмонии на фоне приема препарата Релвар Эллипта имеют следующие группы пациентов с ХОБЛ: курящие пациенты, пациенты, ранее перенесшие пневмонию, пациенты с ИМТ <25 кг/м2 и пациенты с объемом форсированного выдоха за первую секунду (ОФВ1) <50% от должных величин. При назначении терапии препаратом Релвар Эллипта следует учитывать вышеуказанные факторы, в случае возникновения пневмонии лечение должно быть пересмотрено.
У пациентов с бронхиальной астмой случаи развития пневмонии наблюдались нечасто. Пациенты с бронхиальной астмой, получавшие препарат Релвар Эллипта в дозировке 22 + 184 мкг/доза, возможно, имели более высокий риск развития пневмонии в сравнении с пациентами, получавшими более низкую дозу препарата Релвар Эллипта (22 + 92 мкг/доза), или с группой плацебо. Факторы риска не установлены.
В ходе проведения клинических исследований у пациентов, страдающих ХОБЛ, была выявлена низкая частота возникновения переломов костей во всех лечебных группах, но при этом во всех группах, получавших комбинацию вилантерола и флутиказона фуроата, она была несколько выше (2%), чем в группе, получавших монотерапию вилантеролом 22 мкг (<1%).
Влияние на способность управлять транспортными средствами и работать с механизмами. Исследования по изучению влияния препарата Релвар Эллипта на способность к вождению автотранспорта и работе с механизмами не проводились. Исходя из данных фармакологии вилантерола или флутиказона фуроата, неблагоприятное влияние препарата на эти виды деятельности не предполагается.
Форма выпуска
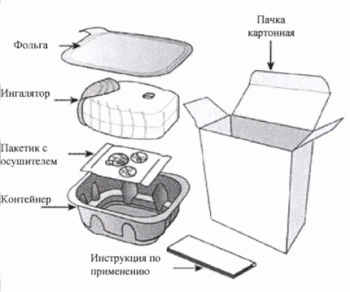
Порошок для ингаляций дозированный, 22 + 92 мкг/доза, 22 + 184 мкг/доза. В пластиковом ингаляторе с корпусом светло-серого цвета, бледно-голубой крышкой мундштука и счетчиком доз, 30 доз. Ингалятор содержит 2 алюминиевых ламинированных стрипа, каждый из которых состоит из 30 ячеек, которые содержат порошок белого цвета. Ингалятор помещен в многослойный контейнер из алюминиевой фольги, содержащий влагопоглощающий пакетик. Контейнер запечатан легко открывающейся фольгой. 1 контейнер в картонной пачке.
Производитель
«Глаксо Оперэйшенс Великобритания Лимитед». Хертфордшир, Вэа, Прайори стрит, Великобритания.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение: ЗАО «ГлаксоСмитКляйн Трейдинг». 119180, Москва, Якиманская наб., 2.
За дополнительной информацией обращаться: ЗАО «ГлаксоСмитКляйн Трейдинг». 121614, Москва, ул. Крылатская, 17, корп. 3, эт. 5, Бизнес-Парк «Крылатские холмы».
Тел.: (495) 777-89-00; факс: (495) 777-89-04.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
После вскрытия алюминиевого контейнера – 6 нед.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Релвар Эллипта (Relvar Ellipta) инструкция по применению
📜 Инструкция по применению Релвар Эллипта
💊 Состав препарата Релвар Эллипта
✅ Применение препарата Релвар Эллипта
📅 Условия хранения Релвар Эллипта
⏳ Срок годности Релвар Эллипта
Описание лекарственного препарата
Релвар Эллипта
(Relvar Ellipta)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2018
года, дата обновления: 2018.07.31
Код ATX:
R03AK10
(Вилантерол и флутиказона фуроат)
Лекарственные формы
| Релвар Эллипта |
Порошок д/ингаляций дозированный, 22 мкг+184 мкг/1 доза: ингалятор 30 доз рег. №: ЛП-002451 |
|
|
Порошок д/ингаляций дозированный, 22 мкг+92 мкг/1 доза: ингалятор 30 доз рег. №: ЛП-002451 |
Форма выпуска, упаковка и состав
препарата Релвар Эллипта
Порошок для ингаляций дозированный 22 мкг+92 мкг/доза белого цвета.
Стрип с вилантеролом (30 ячеек)
Вспомогательные вещества: магния стеарат — 125 мкг, лактозы моногидрат — до 12.5 мг.
Стрип с флутиказона фуроатом (30 ячеек)
Вспомогательные вещества: лактозы моногидрат — до 12.5 мг.
30 доз — ингаляторы пластиковые со счетчиком доз (1) с двумя стрипами алюминиевыми ламинированными (каждый по 30 ячеек) — контейнеры многослойные из фольги алюминиевой (1) с легко открывающейся крышкой — пачки картонные.
Порошок для ингаляций дозированный 22 мкг+184 мкг/доза белого цвета.
Стрип с вилантеролом (30 ячеек)
Вспомогательные вещества: магния стеарат — 125 мкг, лактозы моногидрат — до 12.5 мг.
Стрип с флутиказона фуроатом (30 ячеек)
Вспомогательные вещества: лактозы моногидрат — до 12.5 мг.
30 доз — ингаляторы пластиковые со счетчиком доз (1) с двумя стрипами алюминиевыми ламинированными (каждый по 30 ячеек) — контейнеры многослойные из фольги алюминиевой (1) с легко открывающейся крышкой — пачки картонные.
* при производстве готового препарата смеси действующих и вспомогательных веществ могут закладываться в конечный продукт с избытком до 8% для компенсации потерь при наполнении ячеек.
** указано номинальное количество действующего вещества, закладываемое в процессе производства.
Фармакологическое действие
Механизм действия
Вилантерол и флутиказона фуроат относятся к двум различным классам лекарственных препаратов — синтетический глюкокортикоид и селективный бета2-адреномиметик длительного действия.
Фармакодинамические эффекты
Вилантерола трифенатат относится к классу селективных бета2-адреномиметиков длительного действия (ДДБА).
Фармакологические эффекты агонистов β2-адренорецепторов, включая вилантерола трифенатат, по крайней мере, частично связаны со стимуляцией внутриклеточной аденилатциклазы — фермента, который катализирует превращение аденозинтрифосфата (АТФ) в циклический 3′,5′-аденозинмонофосфат (циклический АМФ). Повышение уровня циклического АМФ приводит к расслаблению гладкой мускулатуры бронхов и угнетению высвобождения из клеток (в первую очередь из тучных клеток) медиаторов реакций гиперчувствительности немедленного типа.
Флутиказона фуроат является синтетическим трехфтористым глюкокортикоидом с выраженным противовоспалительным действием. Точный механизм действия, позволяющий купировать симптомы бронхиальной астмы и хронической обструктивной болезни легких (ХОБЛ), неизвестен. Глюкокортикоиды продемонстрировали широкий спектр действия на различные типы клеток (например, эозинофилы, макрофаги, лимфоциты) и медиаторы (например, цитокины и хемокины, участвующие в процессе воспаления).
Между глюкокортикоидами и ДДБА происходят молекулярные взаимодействия, в результате которых стероидные гормоны активируют ген β2-адренорецептора, повышая число восприимчивых адренорецепторов. ДДБА связываются с глюкокортикоидным рецептором, обеспечивая его стероидозависимую активацию и стимулируя транслокацию в ядро клетки. Эти синергические взаимодействия приводят к усилению противовоспалительной активности, что было продемонстрировано в экспериментах in vitro и in vivo с различными клетками воспаления, участвующими в патофизиологических процессах развития бронхиальной астмы и ХОБЛ. Результаты клинических исследований с использованием биоптатов дыхательных путей также продемонстрировали синергию глюкокортикоидов и ДДБА, возникающую при назначении этих препаратов пациентам с ХОБЛ в терапевтических дозах.
Фармакокинетика
Всасывание
Абсолютная биодоступность вилантерола и флутиказона фуроата при ингаляционном введении комбинации вилантерола и флутиказона фуроата составила в среднем 27.3% и 15.2% соответственно. Пероральная биодоступность вилантерола и флутиказона фуроата была низкой, и в среднем составляла <2% и 1.26% соответственно. Принимая во внимание низкую пероральную биодоступность, системное действие вилантерола и флутиказона фуроата после ингаляционного приема в первую очередь обусловлено всасыванием части ингаляционной дозы, поступившей в легкие.
Распределение
После в/в введения вилантерол и флутиказона фуроат активно распределяются в организме, при этом средние Vd в равновесном состоянии составляют 165 л и 661 л соответственно.
Оба вещества — вилантерол и флутиказона фуроат — обладают низкой способностью связываться с эритроцитами. В исследованиях in vitro связывание вилантерола и флутиказона фуроата с белками плазмы человека было высоким и достигало в среднем 93.9% и >99.6% соответственно. Степень связывания с белками плазмы in vitro не уменьшалась у пациентов с нарушениями функции печени или почек.
Несмотря на то, что вилантерол и флутиказона фуроат являются субстратами Р-гликопротеина (P-gp), при одновременном введении комбинации вилантерола и флутиказона фуроата с ингибиторами P-gp изменение системной экспозиции вилантерола или флутиказона фуроата считается маловероятным, т.к. оба вещества обладают хорошей абсорбционной способностью.
Метаболизм
На основании данных in vitro экспериментов можно заключить, что основные пути метаболизма вилантерола и флутиказона фуроата в организме человека в первую очередь опосредованы изоферментом CYP3A4.
Вилантерол преимущественно метаболизируется путем О-деалкилирования с образованием ряда метаболитов, обладающих существенно более низкой бета1— и бета2-адреномиметической активностью.
Флутиказона фуроат преимущественно метаболизируется путем гидролиза S-фторметилкарботиоатной группы с образованием метаболитов, имеющих значительно более низкую глюкокортикоидную активность.
Было проведено клиническое исследование лекарственных взаимодействий препарата с изоферментом цитохрома CYP3A4 при непрерывном введении комбинации вилантерола и флутиказона фуроата (22 мкг+184 мкг/доза) и сильного ингибитора изофермента цитохрома CYP3A4 — кетоконазола (400 мг) на примере здоровых добровольцев. Введение комбинации вилантерола и флутиказона фуроата привело к увеличению средней AUC(0-24) и средней Cmax флутиказона фуроата на 36% и 33% соответственно. Увеличение экспозиции флутиказона фуроата было ассоциировано со снижением средней концентрации сывороточного кортизола на 27%, измеренного за период 0-24 ч.
Введение комбинации вилантерола и флутиказона фуроата и кетоконазола привело к увеличению средних значений AUC(0-t) и Cmax вилантерола на 65% и 22% соответственно. Увеличение экспозиции вилантерола не приводило к усилению характерных для бета-агонистов системных эффектов в отношении ЧСС, содержания калия в крови или корригированного интервала QT (QTcF).
Выведение
После перорального приема флутиказона фуроат в организме человека метаболизировался, главным образом с образованием метаболитов, которые преимущественно выводились через ЖКТ, за исключением дозы радиоактивного вещества <1%, выведенной с мочой. T1/2 из плазмы флутиказона фуроата после ингаляционного приема препарата составлял в среднем 24 ч.
После перорального приема вилантерол в организме человека главным образом метаболизировался с образованием метаболитов, которые экскретировались с мочой и фекалиями, в соотношении приблизительно 70% и 30% дозы радиоактивного вещества, соответственно. T1/2 из плазмы вилантерола после ингаляционного приема комбинации вилантерола и флутиказона фуроата составлял в среднем 2.5 ч.
Особые группы пациентов
В ходе третьей фазы клинических исследований проводился популяционный мета-анализ фармакокинетики вилантерола и флутиказона фуроата у пациентов с бронхиальной астмой и ХОБЛ. В рамках популяционного фармакокинетического анализа оценивалось влияние демографических ковариат (возраст, пол, вес, ИМТ, расовая и этническая принадлежность) на фармакокинетику вилантерола и флутиказона фуроата.
Раса
Пациенты с бронхиальной астмой и ХОБЛ восточноазиатского, японского и юго-восточноазиатского происхождения (12–14% пациентов) имели в среднем более высокие показатели AUC(0–24) (выше не более чем на 53%) в сравнении с пациентами европеоидной расы. Тем не менее, в этих популяциях не обнаружено признаков более высокой системной экспозиции, связанной с более выраженным влиянием на экскрецию кортизола с мочой за 24-часовой период. У пациентов, страдающих ХОБЛ, влияние расовой принадлежности на фармакокинетические параметры вилантерола не выявлено.
В среднем, по результатам оценки Cmax вилантерола была на 220-287% выше, a AUC(0-24) была сопоставима у пациентов азиатского происхождения по сравнению с показателями у других расовых групп. Тем не менее, более высокая Cmax вилантерола не имела клинически значимого влияния на ЧСС.
Дети
Для подростков (12 лет или старше) рекомендации но изменению режима дозирования отсутствуют.
Фармакокинетика комбинации вилантерола и флутиказона фуроата у пациентов младше 12 лет не изучалась. Безопасность и эффективность применения комбинации вилантерола и флутиказона фуроата у детей младше 12 лет пока не установлена.
Пациенты пожилого возраста
Влияние возраста на фармакокинетику вилантерола и флутиказона фуроата изучалось в третьей фазе клинических исследований, включавших пациентов с ХОБЛ и бронхиальной астмой.
У пациентов с бронхиальной астмой, не было обнаружено признаков влияния возраста (12-84 лет) на фармакокинетический профиль флутиказона фуроата и вилантерола.
Несмотря на увеличение (37%) AUC(0-24) вилантерола у пациентов с ХОБЛ на протяжении всего наблюдаемого возрастного диапазона от 41 до 84 лет, признаков влияния возраста пациентов на фармакокинетический профиль флутиказона фуроата не выявлено. У пожилого пациента (в возрасте 84 года) с низкой массой тела (35 кг) AUC(0-24) вилантерола ожидается на 35% выше результата, рассчитанного для популяции (в среднем, пациент с ХОБЛ в возрасте 60 лет и массой тела 70 кг), в то время как Cmax вилантерола останется неизмененной. Маловероятно, что эти различия являются клинически релевантными.
Пациенты с нарушением функции почек
По данным клинико-фармакологического исследования для вилантерола и флутиказона фуроата тяжелое нарушение функции почек (КК <30 мл/мин) не приводит к значительному увеличению системной экспозиции вилантерола или флутиказона фуроата или к развитию более выраженных системных эффектов глюкокортикостероидов или бета2-агонистов в сравнении со здоровыми добровольцами. Коррекции дозы для пациентов с нарушением функции почек не требуется.
Влияние гемодиализа не изучалось.
Пациенты с нарушением функции печени
После непрерывного приема комбинации вилантерола и флутиказона фуроата в течение 7 дней у пациентов с нарушением функции печени (согласно классификации цирроза печени по Чайлд-Пью: стадии цирроза А, В или С) наблюдалось увеличение системной экспозиции флутиказона фуроата (по измеренной AUC(0–24) до трех раз) в сравнении со здоровыми добровольцами. Повышение системной экспозиции флутиказона фуроата (при назначении комбинации вилантерола и флутиказона фуроата в дозировке 22 мкг+184 мкг/доза) у пациентов с нарушением функции печени средней степени (стадия В по классификации Чайлд-Пью) было ассоциировано со снижением концентрации сывороточного кортизола в среднем на 34% в сравнении со здоровыми добровольцами. У пациентов с нарушением функции печени тяжелой степени (стадия С по классификации Чайлд-Пью), получавших более низкую дозу 11 мкг+92 мкг, не наблюдалось снижения концентрации сывороточного кортизола. Для пациентов с нарушением функции печени средней и тяжелой степени максимальная доза составляет 22 мкг+92 мкг.
После непрерывного приема комбинации вилантерола и флутиказона фуроата в течение 7 дней у пациентов с нарушением функции печени легкой, средней или тяжелой степени (стадии А, В и С по классификации Чайлд-Пью) не отмечалось значительного увеличения системной экспозиции вилантерола (по Cmax и AUC).
В сравнении со здоровыми добровольцами пациентов с нарушением функции печени легкой или средней степени (принимавших вилантерол в дозе 22 мкг) или тяжелой степени (принимавших вилантерол в дозе 11 мкг) не наблюдалось клинически значимых бета-адренергических системных эффектов (изменение ЧСС или концентрации сывороточного калия), вызванных приемом комбинации вилантерола и флутиказона фуроата.
Пол, масса тела, ИМТ
Согласно результатам популяционного фармакокинетического анализа данных третьей фазы клинических исследований, включавшей 1213 пациентов с бронхиальной астмой (712 женщин) и 1225 пациентов с ХОБЛ (392 женщины), признаков влияния пола, массы тела или ИМТ на фармакокинетический профиль флутиказона фуроата не обнаружено.
По данным популяционного анализа фармакокинетики с участием 856 пациентов с бронхиальной астмой (500 женщин) и 1091 пациента с ХОБЛ (340 женщин) признаков влияния пола, массы тела или ИМТ на фармакокинетический профиль вилантерола не обнаружено.
Не требуется коррекции дозы на основании данных о половой принадлежности, массе тела или ИМТ.
Показания препарата
Релвар Эллипта
- бронхиальная астма (в качестве поддерживающей терапии);
- ХОБЛ (в качестве поддерживающей терапии обструкции дыхательных путей у пациентов с ХОБЛ, включая хронический бронхит и/или эмфизему легких). Применение препарата Релвар Эллипта позволяет сократить число обострений ХОБЛ у пациентов с повторными обострениями в анамнезе.
Режим дозирования
Препарат Релвар Эллипта предназначен только для ингаляционного применения.
Препарат Релвар Эллипта следует применять 1 раз/сут в одно и то же время, утром или вечером.
После ингаляции следует прополоскать рот водой, не проглатывая.
Бронхиальная астма
Пациент должен быть проинформирован о необходимости регулярного применения препарата Релвар Эллипта даже в случае бессимптомного течения заболевания.
При возникновении симптомов заболевания в период между приемами препарата в качестве неотложной терапии следует применять ингаляционные формы бета2-агонистов короткого действия.
Врач должен регулярно оценивать состояние пациента, чтобы обеспечить своевременное назначение оптимальной дозы препарата Релвар Эллипта. Доза может быть изменена только по рекомендации врача.
Взрослые и подростки 12 лет и старше
Рекомендуемая доза препарата Релвар Эллипта:
- 1 ингаляция 22 мкг+92 мкг 1 раз/сут
или
- 1 ингаляция 22 мкг+184 мкг 1 раз/сут.
Начальная доза препарата Релвар Эллипта 22 мкг+92 мкг назначается пациентам, которым требуются низкие или средние дозы ингаляционных глюкокортикоидов, применяемых в комбинации с бета2-агонистами длительного действия.
Препарат Релвар Эллипта в дозировке 22 мкг+184 мкг следует назначать пациентам, которым требуется более высокая доза ингаляционных ГКС, применяемых в комбинации с бета2-агонистами длительного действия.
Если препарат Релвар Эллипта в дозировке 22 мкг+92 мкг не обеспечивает адекватного контроля заболевания, рассматривается вопрос об увеличении дозы до 22 мкг+184 мкг, что может улучшить уровень контроля над течением бронхиальной астмы.
Дети
Безопасность и эффективность применения препарата Релвар Эллипта у детей младше 12 лет не установлена.
ХОБЛ
Взрослые
Рекомендуемая доза препарата Релвар Эллипта 1 ингаляция 22 мкг+92 мкг 1 раз/сут.
Препарат Релвар Эллипта в дозировке 22 мкг+184 мкг не показан для лечения пациентов с ХОБЛ.
Дети
Препарат по показанию ХОБЛ у детей не применяется.
Особые группы пациентов
Пациентам пожилого возраста (старше 65 лет) не требуется коррекция дозы препарата.
Пациентам с нарушением функции почек не требуется коррекция дозы препарата.
По данным клинико-фармакологического исследования у пациентов с нарушениями функции печени легкой, средней и тяжелой степени наблюдается трехкратное возрастание степени системной экспозиции флутиказона фуроата (AUC). Препарат следует назначать с осторожностью пациентам с нарушениями функции печени, у которых риск развития системных нежелательных реакций, вызванных приемом ГКС, более высок. Для пациентов с нарушением функции печени средней и тяжелой степени максимальная доза составляет 22 мкг+92 мкг.
Рекомендации по применению
При первом использовании ингалятора Эллипта нет необходимости в проверке правильности его работы или специальной подготовки ингалятора к эксплуатации. Просто необходимо последовательно соблюдать рекомендации но применению.
Ингалятор Эллипта упакован в контейнер. Не открывайте контейнер до тех пор, пока не будете готовы осуществить ингаляцию лекарственного препарата. Когда будете готовы использовать ингалятор, снимите крышку с контейнера. Контейнер содержит пакетик с осушителем для снижения влажности. Не вскрывайте пакетик, он не предназначен для еды или ингаляций, его следует выбросить.
Когда Вы достаете ингалятор из контейнера, его крышка находится в закрытом положении. Не открывайте ее до тех пор, пока Вы не будете готовы к приему препарата.
В специально отведенном поле «Использовать до» на этикетке ингалятора напишите дату, которая будетсоответствовать дате вскрытия плюс 6 недель. Не следует использовать ингалятор после этой даты.
Ниже приведены пошаговые инструкции использования ингалятора Эллипта:
I. Прочитайте следующую информацию перед использованием
При открытии и закрытии крышки ингалятора Эллипта без приема лекарственного препарата происходит потеря одной дозы. Эта доза остается закрытой внутри ингалятора, но она будет недоступна для приема. Невозможно случайно получить большую дозу или двойную дозу за одну ингаляцию.
Одна доза лекарственного препарата готова к ингаляции после каждого открытия крышки.
Счетчик доз показывает, сколько доз лекарственного препарата осталось в ингаляторе.
Перед началом использования ингалятора счетчик доз показывает число 30.
При каждом открытии крышки количество доз уменьшается на 1.
Когда остается менее 10 доз, половина счетчика становится красной.
После того, как израсходована последняя доза препарата, половина счетчика выделена красным цветом, счетчик показывает цифру 0. Это означает, что ингалятор пуст.
Если Вы откроете крышку после этого, счетчик доз станет полностью красным.
II. Подготовка дозы
Не открывайте крышку, пока Вы не будете готовы к приему препарата. Не встряхивайте ингалятор.
1. Опустите крышку вниз до щелчка.
2. Доза препарата готова к ингаляция, и в подтверждение этого счетчик доз уменьшает число доз на единицу.
3. Если счетчик доз не уменьшил число доз после того, как Вы услышали щелчок, то ингалятор не готов к подаче дозы лекарственного препарата. В этом случае следует обратиться по телефону или адресу, указанному в разделе «За дополнительной информацией обращаться».
4. Никогда не встряхивайте ингалятор.
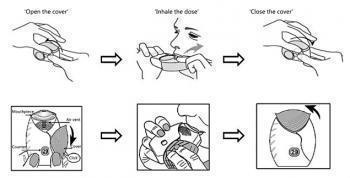
III. Ингаляция лекарственного препарата
1. Удерживая ингалятор на некотором расстоянии ото рта. сделайте выдох максимальной глубины. Не выдыхайте в ингалятор.
2. Поместите мундштук между губами и плотно обхватите его губами. Не закрывайте пальцами вентиляционное отверстие.
3. Сделайте один глубокий, долгий, равномерный вдох через рот. Задержите дыхание насколько возможно (по крайней мере, на 3—4 сек).
4. Уберите ингалятор изо рта.
5. Медленно и спокойно выдохните.
Вы можете не почувствовать вкус или не ощутить поступление лекарственного препарата даже при правильном использовании ингалятора.
IV. Закрытие ингалятора и полоскание ротовой полости
Если Вы хотите протереть мундштук, используйте сухую салфетку перед закрытием крышки.
1. Поднимите крышку до упора, добившись полного закрытия мундштука.
2. После ингаляции следует прополоскать рот водой. Это снизит вероятность развития таких побочных явлений, как боль в горле и полости рта.
При хранении в холодильнике ингалятор следует выдержать при комнатной температуре не менее часа перед использованием.
Побочное действие
Для определения частоты развития нежелательных реакций, связанных с приемом препарата Релвар Эллипта, использовались данные крупных клинических исследований среди пациентов с ХОБЛ и бронхиальной астмой. Программа клинической разработки препарата для лечения бронхиальной астмы включала 7034 пациента, у которых проводилась комплексная оценка нежелательных реакций. В программе клинической разработки препарата для лечения ХОБЛ принимали участие 6237 пациентов, у которых проводилась комплексная оценка нежелательных реакций.
Исключая пневмонию и переломы, профили безопасности препарата у пациентов с ХОБЛ и бронхиальной астмой были схожи. По данным клинических исследований пневмония и переломы более часто наблюдались у пациентов, страдающих ХОБЛ.
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости, согласно классификации ВОЗ определяется следующим образом: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10 000 и <1/1000), очень редко (<1/10 000, включая отдельные случаи).
Частота встречаемости нежелательных реакций
Инфекционные и паразитарные заболевания: часто — пневмония, инфекции верхних дыхательных путей, бронхит, грипп, кандидоз полости рта и глотки.
Со стороны нервной системы: очень часто — головная боль.
Со стороны сердечно-сосудистой системы: нечасто — экстрасистолия.
Со стороны дыхательной системы: очень часто — назофарингит; часто — орофарингеальная боль, синусит, фарингит, ринит, кашель, дисфония.
Со стороны пищеварительной системы: часто — боль в животе.
Со стороны костно-мышечной системы: часто — артралгия, боль в спине, переломы.
Общие расстройства и нарушения в месте введения: часто — лихорадка.
Данные пострегистрационного наблюдения
Со стороны иммунной системы: редко — реакции гиперчувствительности, в т.ч. анафилаксия, ангионевротический отек, сыпь, крапивница.
Нарушения психики: редко — тревожность.
Со стороны нервной системы: редко — тремор.
Со стороны сердечно-сосудистой системы: редко — учащенное сердцебиение, тахикардия.
Со стороны дыхательной системы: редко — парадоксальный бронхоспазм.
Со стороны костно-мышечной системы: часто — мышечный спазм.
Противопоказания к применению
- пациентам, имеющим в анамнезе тяжелые аллергические реакции на молочный белок или повышенную чувствительность к действующим веществам или любому другому компоненту, входящему в состав препарата;
- детям до 12 лет для лечения бронхиальной астмы;
- препарат Релвар Эллипта в дозе 22 мкг+184 мкг/доза не показан для лечения ХОБЛ.
С осторожностью: при приеме симпатомиметиков, включая препарат Релвар Эллипта, со стороны сердечно-сосудистой системы могут наблюдаться такие нежелательные явления, как аритмия (например, наджелудочковая тахикардия и экстрасистолия). В связи с этим пациентам, страдающим тяжелыми формами сердечно-сосудистых заболеваний, препарат Релвар Эллипта следует назначать с осторожностью.
Как и другие лекарственные средства, в состав которых входят ГКС, препарат Релвар Эллипта следует с осторожностью назначать пациентам с туберкулезом легких, а также пациентам с хроническими или невылеченными инфекциями.
Применение при беременности и кормлении грудью
Фертильность
Данные по влиянию на фертильность человека отсутствуют. В доклинических исследованиях воздействия вилантерола и флутиказона фуроата на фертильность не обнаружено.
Беременность
Данные о применении препарата во время беременности ограничены.
Применение препарата Релвар Эллипта у беременных женщин допустимо только в том случае, если потенциальная польза для матери превышает возможный риск для плода.
Период грудного вскармливания
Данных об экскреции вилантерола или флутиказона фуроата или их метаболитов в грудное молоко человека недостаточно. Однако другие глюкокортикоиды и бета2-агонисты определяются в грудном молоке. Риск проникновения препарата вместе с молоком в организм новорожденного или ребенка не может быть исключен.
Принимая во внимание соотношение пользы терапии для матери и грудного вскармливания для ребенка, необходимо решить вопрос либо об отмене препарата, либо о прекращении грудного вскармливания.
Применение при нарушениях функции печени
Препарат следует назначать с осторожностью пациентам с нарушениями функции печени, у которых риск развития системных нежелательных реакций, вызванных приемом глюкокортикостероидов, более высок.
Применение при нарушениях функции почек
Пациентам с нарушением функции почек не требуется индивидуальный подбор дозы препарата.
Применение у детей
Применение препарата детям в возрасте до 12 лет противопоказано.
Применение у пожилых пациентов
Пациентам старше 65 лет не требуется индивидуальный подбор дозы препарата.
Особые указания
Обострения
Препарат Релвар Эллипта не предназначен для купирования острых симптомов бронхиальной астмы или обострения ХОБЛ, в таких случаях требуется назначение бронходилататоров короткого действия. Увеличение частоты приема бронходилататоров короткого действия с целью купирования симптомов свидетельствует об ухудшении контроля над заболеванием и необходимости консультации врача.
Пациентам с бронхиальной астмой или ХОБЛ не следует прекращать лечение препаратом Релвар Эллипта без наблюдений врача, т.к. отмена терапии может привести к возобновлению симптомов.
На фоне лечения препаратом Релвар Эллипта могут развиваться нежелательные явления, связанные с течением бронхиальной астмы или обострением заболевания. Пациентам следует рекомендовать продолжить лечение. В случае отсутствия контроля над заболеванием или ухудшения состояния после начала терапии препаратом Релвар Эллипта необходима консультация врача.
Парадоксальный бронхоспазм
Как и при других видах ингаляционной терапии, после приема препарата может развиваться парадоксальный бронхоспазм, сопровождающийся быстрым нарастанием свистящих хрипов. В этом случае показаны неотложное назначение ингаляционного бронходилататора короткого действия и немедленная отмена препарата Релвар Эллипта. Пациент должен быть осмотрен врачом, и ему, при необходимости, может быть назначена альтернативная терапия.
Нарушение функции печени
Пациентам с нарушением функции печени средней и тяжелой степени следует назначать дозу 22 мкг+92 мкг, таким пациентам следует находиться под наблюдением врача для контроля над системными побочными реакциями, связанными с применением ГКС.
Системные эффекты ГКС
При применении ингаляционных ГКС (особенно при длительном приеме в высоких дозах) могут развиваться системные побочные реакции. Такие побочные реакции развиваются значительно реже, чем при пероральном приеме ГКС. К проявлениям возможного неблагоприятного системного действия относятся: подавление функции гипоталамо-гипофизарно-надпочечниковой системы, снижение минеральной плотности костей, замедление скорости роста у детей и подростков, катаракта и глаукома.
Пневмония
У пациентов с ХОБЛ, получающих препарат Релвар Эллипта, наблюдалось повышение частоты развития пневмонии, а также частоты возникновения тяжелых форм пневмонии, требующих госпитализации пациента. В некоторых случаях клинические эпизоды пневмонии имели летальный исход. Врачам следует помнить о возможности развития пневмонии у пациентов с ХОБЛ, не забывая о том, что клинические признаки такого инфекционного заболевания маскируются симптомами обострения ХОБЛ. Более высокий риск развития пневмонии на фоне приема препарата Релвар Эллипта имеют следующие группы пациентов с ХОБЛ: курящие пациенты, пациенты, ранее перенесшие пневмонию, пациенты с ИМТ <25 кг/м2 и пациенты с объемом форсированного выдоха (ОФВ1) <50% от должных величии. При назначении терапии препаратом Релвар Эллипта следует учитывать вышеуказанные факторы, в случае возникновения пневмонии лечение должно быть пересмотрено.
У пациентов с бронхиальной астмой случаи развития пневмонии наблюдались нечасто. Пациенты с бронхиальной астмой, получавшие препарат Релвар Эллипта в дозировке 22 мкг+184 мкг/доза, возможно, имели более высокий риск развития пневмонии в сравнении с пациентами, получавшими более низкую дозу препарата Релвар Эллипта (22 мкг+92 мкг/доза), или с группой плацебо. Факторы риска не установлены.
В ходе проведения клинических исследований у пациентов, страдающих ХОБЛ, была выявлена низкая частота возникновения переломов костей во всех лечебных группах, но при этом во всех группах, получавших комбинацию вилантерола и флутиказона фуроата, она была несколько выше (2%), чем в группе, получавших монотерапию вилантеролом 22 мкг (<1%).
Влияние на способность к управлению транспортными средствами и механизмами
Исследования по изучению влияния препарата Релвар Эллипта на способность к вождению автотранспорта и работе с механизмами не проводились. Исходя из данных фармакологии вилантерола или флутиказона фуроата, неблагоприятное влияние препарата на эти виды деятельности не предполагается.
Передозировка
Симптомы
При проведении клинических исследований не было получено данных о передозировке комбинацией вилантерола и флутиказона фуроата.
Передозировка препарата Релвар Эллипта может вызывать развитие симптомов и признаков, обусловленных действием отдельных компонентов препарата и характерных для передозировки бета2-агонистами и ингаляционными ГКС (см. раздел «Особые указания»).
Лечение
Специфическое лечение передозировки комбинацией вилантерола и флутиказона фуроата отсутствует. В случае развития передозировки назначается симптоматическая терапия и, при необходимости, обеспечивается соответствующее наблюдение за больным.
Применение кардиоселективных бета-адреноблокаторов следует рассматривать только в случаях сильно выраженных эффектов передозировки вилантеролом, которые клинически проявляются невосприимчивостью к поддерживающей терапии. Кардиоселективные бета-адреноблокаторы следует с осторожностью назначать пациентам, у которых наблюдались эпизоды бронхоспазма в анамнезе.
Лекарственное взаимодействие
При назначении препарата в терапевтических дозах клинически значимое лекарственное взаимодействие вилантерола пли флутиказона фуроата считается маловероятным вследствие низких плазматических концентраций последних при ингаляционном введении.
Бета-адреноблокаторы могут ослаблять или антагонизировать действие бета2-адреномиметиков. Следует избегать одновременного приема неселективных и селективных бета-блокаторов, исключая случаи, когда их назначение строго необходимо.
Вилантерол и флутиказона фуроат подвергаются быстрому первичному метаболизму в печени посредством изофермента системы цитохрома CYP3A4. При одновременном назначении препарата с сильными ингибиторами изофермента цитохрома CYP3A4 (например, кетоконазол, ритонавир) следует соблюдать осторожность, поскольку возможно повышение системного воздействия вилантерола и флутиказона фуроата, что в свою очередь может привести к повышению риска развития нежелательных реакций.
Вилантерол и флутиказона фуроат являются субстратами P-gp. По результатам клинико-фармакологического исследования с участием здоровых добровольцев, которым одновременно назначались вилантерол и сильный ингибитор P-gp и умеренный ингибитор изофермента цитохрома CYP3A4 верапамил, значимого влияния на фармакокинетику вилантерола не выявлено. Клинико-фармакологические исследования совместного назначения специфического ингибитора P-gp и флутиказона фуроата не проводились.
Условия хранения препарата Релвар Эллипта
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Релвар Эллипта
Срок годности не вскрытого алюминиевого контейнера — 2 года; вскрытого алюминиевого контейнера — 6 недель.
Не применять после истечения срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ГЛАКСОСМИТКЛЯЙН ТРЕЙДИНГ АО
(Россия)

|
|
125167 Москва |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Релвар Эллипта — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП 002451 — 070217
Торговое наименование препарата:
Релвар Эллипта®.
Группировочиое наименование:
вилантерол + флутиказона фуроат / vilanterol fluticasone furoate.
Лекарственная форма:
порошок для ингаляций дозированный.
Состав на 1 дозу
|
Наименование компонентов |
Количество в одной ячейке , мкг |
|
|
22 мкг + 92 мкг/доза |
22 мкг + 184 мкг/доза |
|
|
Стрип с вилантеролом |
||
|
Действующее вещество: |
||
|
Вилантерола трифенатат микронизированный (в пересчете на вилантерол) |
40 (25)2 |
40 (25)2 |
|
Вспомогательные вещества: |
||
|
Магния стеарат |
125 |
125 |
|
Лактозы моногидрат |
до 12.5 мг |
до 12,5 мг |
|
Стрип с флутиказона фуроатом |
||
|
Действующее вещество: |
||
|
Флутиказона фуроат микронизированный |
1002 |
2002 |
|
Вспомогательное вещество: |
||
|
Лактозы моногидрат |
до 12.5 мг |
до 12.5 мг |
Примечание:
1. При производстве готового препарата смеси действующих и вспомогательных веществ могут закладываться в конечный продукт с избытком до 8 % для компенсации потерь при наполнении ячеек.
2. Указано номинальное количество действующего вещества, закладываемого в процессе производства, доставленное количество составляет 22 мкг вилантерола, 92 мкг и 184 мкг флутиказона фуроата, что соответствует указанным дозировкам.
Описание
Пластиковый ингалятор с корпусом светло серого цвета, бледно-голубой крышкой мундштука и счетчиком доз, упакованный в контейнер из фольги, содержащий пакетик с осушителем. Контейнер запечатан легко открывающейся фольгой. Ингалятор содержит два стрипа, каждый стрип состоит из 30 равномерно распределенных ячеек, каждая из которых содержит порошок белого цвета
Фармакотерапевтическая группа
Бронходилатирующее средство комбинированное (бета2-адреномиметик селективный + глюкокортикостероид местный).
Код АТХ: R03AK10
Фармакологические свойства
Фармакодинамика
Механизм действия
Вилантерол и флутиказона фуроат относятся к двум классам лекарственных средств — синтетический глюкокортикостероид и селективный бета2-адреномиметик .
Фармакодинамические эффекты
Вилантерола трифенатат относится к классу селективных бета2-адреномиметиков длительного действия (ДДБА). Фармакологические эффекты агонистов бета-адренорецепторов, включая вилантерола трифенатат, по крайней мере, частичносвязаны со стимуляцией внутриклеточной аденилатциклазы — фермента, который катализирует превращение аденозинтрифосфата (АТФ) в циклический 3′,5′-аденозинмонофосфат (циклический АМФ). Повышение уровня циклического АМФ приводит к расслаблению гладкой мускулатуры бронхов и угнетению высвобождения из клеток (в первую очередь из тучных клеток) медиаторов реакций гиперчувствительности немедленного типа.
Флутиказона фуроат является синтетическим трехфтористым глюкокортикостероидом с выраженным противовоспалительным действием. Точный механизм действия, позволяющий купировать симптомы бронхиальной астмы и хронической обструктивной болезни легких (ХОБЛ), неизвестен. Глюкокортикостероиды продемонстрировали широкий спектр действия на различные типы клеток (например, эозинофилы, макрофаги, лимфоциты) и медиаторы (например, цитокины и хемокины, участвующие в процессе воспаления).
Между глюкокортикостероидами и ДДБА происходят молекулярные взаимодействия, в результате которых стероидные гормоны активируют ген бета2-адренорецептора, повышая количество восприимчивых адренорецепторов. ДДБА связываются с глюкокортикостероидным рецептором, обеспечивая его стероидозависимую активацию и стимулируя транслокацию в ядро клетки. Эти синергические взаимодействия приводят к усилению противовоспалительной активности, что было продемонстрировано в экспериментах in vitro и in vivo с различными клетками воспаления, участвующими в патофизиологических процессах развития бронхиальной астмы и ХОБЛ. В мононуклеарных клетках периферической крови у пациентов с ХОБЛ наблюдалось более выраженное противовоспалительное действие в присутствии комбинации вилантерола с флутиказона фуроатом по сравнению с одним флутиказона фуроатом в концентрациях, достигаемых при применении в клинических дозах.
Фармакокинетика
Всасывание
Абсолютная биодоступность вилантерола и флутиказона фуроата при ингаляционном введении комбинации вилантерола и флутиказона фуроата составила в среднем 27,3 % и 15,2 %, соответственно. Пероральная биодоступность вилантерола и флутиказона фуроата была низкой и в среднем составляла < 2 % и 1,26 %, соответственно. Принимая во внимание низкую пероральную биодоступность, системное действие вилантерола и флутиказона фуроата после ингаляционного приема в первую очередь обусловлено всасыванием части ингаляционной дозы, поступившей в легкие.
Распределение
После внутривенного введения вилантерол и флутиказона фуроат активно распределяются в организме, при этом средние объемы распределения в равновесном состоянии составляют 165 л и 661 л, соответственно. Оба вещества— вилантерол и флутиказона фуроат— обладают низкой способностью связываться с эритроцитами. В исследованиях in vitro связывание вилантерола и флутиказона фуроата с белками плазмы крови человека было высоким и достигало в среднем 93,9 % и > 99,6 %, соответственно. Степень связывания с белками плазмы крови in vitro не уменьшалась у пациентов с нарушениями функции печени или почек.
Несмотря на то, что вилантерол и флутиказона фуроат являются субстратами Р-гликопротеина (P-gp), при одновременном введении комбинации вилантерола и флутиказона фуроата с ингибиторами P-gp
изменение системной экспозиции вилантерола или флутиказона фуроата считается маловероятным, так как оба вещества обладают хорошей абсорбционной способностью.
Метаболизм
На основании данных экспериментов in vitro можно заключить, что основные пути метаболизма вилантерола и флутиказона фуроата в организме человека в первую очередь опосредованы изоферментом CYP3A4.
Вилантерол преимущественно метаболизируется путем О-деалкилирования с образованием ряда метаболитов, обладающих существенно более низкой бета1 и бета2-адреномиметической активностью.
Флутиказона фуроат преимущественно метаболизируется путем гидролиза S-фторметилкарботиоатной группы с образованием метаболитов, имеющих значительно более низкую глюкокортикостероидную активность.
Было проведено клиническое исследование лекарственных взаимодействий препарата с изоферментом CYP3A4 при непрерывном введении комбинации вилантерола и флутиказона фуроата (22 мкг + 184 мкг/доза)
и сильного ингибитора изофермента CYP3A4 — кетоконазола (400 мг) здоровым добровольцам.
Введение комбинации вилантерола и флутиказона фуроата привело к увеличению средней площади под фармакокинетической кривой (AUQo—24) и средней максимальной концентрации (Сmах) флутиказона фуроата на 36 % и 33 %, соответственно. Увеличение экспозиции флутиказона фуроата сопровождалось снижением средней концентрации сывороточного кортизола на 27 %, измеренной за период 0-24 часа.
Введение комбинации вилантерола и флутиказона фуроата и кетоконазола привело к увеличению средних значений AUQ 0-24 и Сmах вилантерола на 65 % и 22 %, соответственно. Увеличение экспозиции вилантерола не приводило к усилению характерных для бета-агонистов системных эффектов в отношении частоты сердечных сокращений, содержания калия в крови или корригированного интервала QT (QTcF).
Выведение
После перорального приема флутиказона фуроат в организме человека метаболизировался главным образом с образованием метаболитов, которые преимущественно выводились через желудочно-кишечный тракт, за исключением дозы радиоактивного вещества < 1 %, выведенной с мочой. Период полувыведения из плазмы крови для флутиказона фуроата после ингаляционного приема препарата составлял в среднем 24 часа.После перорального приема вилантерол в организме человека главным образом метаболизировался с образованиемметаболитов, которые экскретировались с мочой и фекалиями в соотношении приблизительно 70 % и 30 % дозы радиоактивного вещества, соответственно. Период полувыведения из плазмы крови для вилантерола после ингаляционного приема комбинации вилантерола и флутиказона фуроата составлял в среднем 2,5 часа.
Особые группы пациентов
В ходе третьей фазы клинических исследований проводился популяционный мета-анализ фармакокинетики вилантерола ифлутиказона фуроата у пациентов с бронхиальной астмой и ХОБЛ. В рамках популяционного фармакокинетического анализа оценивалось влияние демографических ковариат (возраст, пол, вес, индекс массы тела (ИМТ), расовая и этническая принадлежность) на фармакокинетику вилантерола и флутиказона фуроата.
Раса
Пациенты с бронхиальной астмой и ХОБЛ восточноазиатской, японской и юго-восточноазиатской рас (12-14% пациентов) имели в среднем более высокие показатели
AUC(0-24) (выше не более чем на 53 %) в сравнении с пациентами европеоидной расы. Тем не менее, в этих популяциях не обнаружено признаков более высокой системной экспозиции, связанной с более выраженным влиянием на экскрециют кортизола с мочой за 24-часовой период. У пациентов, страдающих ХОБЛ, влияние
расовой принадлежности на фармакокинетические параметры вилантерола не выявлено.
В среднем, по результатам оценки Сmах вилантерола была на 220-287 % выше, а AUC(0-24) была сопоставима у пациентов азиатского происхождения по сравнению с показателями у других расовых групп. Тем не менее, более высокая Сmах вилантерола не оказывала клинически значимого влияния на частоту сердечных сокращений.
Дети
Для подростков (12 лет или старше) рекомендации по изменению режима дозирования отсутствуют. Фармакокинетика комбинации вилантерола и флутиказона фуроата у пациентов младше 12 лет не изучалась. Безопасность и эффективность применения комбинации вилантерола и флутиказона фуроата у детей младше 12 лет пока не установлена.
Пациенты пожилого возраста
Влияние возраста на фармакокинетику вилантерола и флутиказона фуроата изучалось в третьей фазе клинических исследований, включавших пациентов с ХОБЛ и бронхиальной астмой.
У пациентов с бронхиальной астмой не было обнаружено признаков влияния возраста (12-84 лет) на фармакокинетический профиль флутиказона фуроата и вилантерола.
Несмотря на увеличение (37 %) AUC(o_24) вилантерола у пациентов с ХОБЛ в возрастном диапазоне от 41 до 84 лет, признаков влияния возраста пациентов на фармакокинетический профиль флутиказона фуроата не выявлено. У пожилого пациента (в возрасте 84 лет) с низкой массой тела (35 кг) прогнозируется, что AUC(0-24) вилантерола будет на 35 % выше результата, рассчитанного для популяции (в среднем, пациент с ХОБЛ в возрасте 60 лет и массой тела 70 кг), в то время как Стах вилантерола останется неизмененной. Маловероятно, что эти различия являются клинически релевантными.
Пациенты с нарушением функции почек
По данным клинико-фармакологического исследования для вилантерола и флутиказона фуроата тяжелое нарушение функции почек (клиренс креатинина < 30 мл/мин) не приводит к значительному увеличению системной экспозиции вилантерола или флутиказона фуроата или к развитию более выраженных системных эффектов глюкокортикостероидов или бетаг-агонистов в сравнении со здоровыми добровольцами. Коррекции дозы для пациентов с нарушением функции почек не требуется.
Влияние гемодиализа не изучалось.
Пациенты с нарушением функции печени
После непрерывного приема комбинации вилантерола и флутиказона фуроата в течение 7 дней у пациентов с нарушением функции печени (согласно классификации цирроза печени по Чайлд-Пью: стадии цирроза А, В или С) наблюдалось увеличение системной экспозиции флутиказона фуроата (по измеренной AUC(0-24) до трех раз) в сравнении со здоровыми добровольцами. Повышение системной экспозиции флутиказона фуроата (при назначении комбинации вилантерола и флутиказона фуроата в дозировке 22 мкг + 184 мкг/доза) у пациентов с нарушением функции печени средней степени тяжести (стадия В по классификации Чайлд-Пью) сопровождалось снижением концентрации сывороточного кортизола в среднем на 34 % в сравнении со здоровыми добровольцами. У пациентов с нарушением функции печени тяжелой степени (стадия С по классификации Чайлд Пью), получавших более низкую дозу 11 мкг + 92 мкг, не наблюдалось снижения концентрации сывороточного кортизола. Для пациентов с нарушением функции печени средней и тяжелой степени максимальная доза составляет 22 мкг + 92 мкг (см. раздел «Способ применения и дозы»).
После непрерывного приема комбинации вилантерола и флутиказона фуроата в течение 7 дней у пациентов с нарушением функции печени легкой, средней или тяжелой степени (стадии А, В и С по классификации Чайлд-Пью) не отмечалось значительного увеличения системной экспозиции вилантерола (Смах и AUC). В сравнении со здоровыми добровольцами у пациентов с нарушением функции печени легкой или средней степени (принимавших вилантерол в дозе 22 мкг) или тяжелой степени (принимавших вилантерол в дозе 11 мкг) не наблюдалось клинически значимых бета-адренергических системных эффектов (изменение частоты сердечных сокращений или концентрации сывороточного калия), вызванных приемом комбинации вилантерола и флутиказона фуроата.
Пол, масса тела, индекс массы тела (ИМТ)
Согласно результатам популяционного фармакокинетического анализа данных третьей фазы клинических исследований, включавшей 1213 пациентов с бронхиальной астмой (712 женщин) и 1225 пациентов с ХОБЛ (392 женщины), признаков влияния пола, массы тела или ИМТ на фармакокинетический профиль флутиказона фуроата не обнаружено.
По данным популяционного анализа фармакокинетики с участием 856 пациентов с бронхиальной астмой (500 женщин) и 1091 пациента с ХОБЛ (340 женщин)признаков влияния пола, массы тела или ИМТ на фармакокинетический профиль вилантерола не обнаружено.
Не требуется коррекции дозы на основании данных о половой принадлежности, массе тела или ИМТ.
Показания к применению
Бронхиальная астма
Препарат Релвар Эллипта применяется в качестве поддерживающей терапии бронхиальной астмы.
ХОБЛ (хроническая обструктивная болезнь легких)
Препарат Релвар Эллипта* применяется в качестве поддерживающей терапии обструкции дыхательных путей у пациентов с ХОБЛ, включая хронический бронхит и/или эмфизему легких. Применение препарата Релвар Эллипта* позволяет сократить число обострений ХОБЛ у пациентов с повторными обострениями в анамнезе.
Противопоказания
Препарат Релвар Эллипта противопоказан:
- пациентам, имеющим в анамнезе тяжелые аллергические реакции на молочный белок или повышенную чувствительность к действующим веществам или любому другому компоненту; входящему в состав препарата;
- детям до 12 лет для лечения бронхиальной астмы.
- Препарат Релвар Эллипта в дозе 22 мкг + 184 мкг/доза не показан для лечения ХОБЛ.
С осторожностью
При приеме симпатомиметиков, включая препарат Релвар Эллипта , со стороны сердечно-сосудистой системы могут наблюдаться такие нежелательные явления, как аритмия (например, наджелудочковая тахикардия и экстрасистолия). В плацебо-контролируемомклиническом исследовании у пациентов с ХОБЛ и повышенным риском развития сердечно сосудистых заболеваний или с сердечно сосудистым заболеванием, принимающих препарат Релвар Эллипта , не отмечалось повышения риска развития сердечно сосудистых явлений, серьезных сердечно сосудистых явлений или летального исхода по причине сердечно-сосудистой патологии по сравнению с пациентами, принимающими плацебо. Однако пациентам, страдающим тяжелыми формами сердечно-сосудистых заболеваний, препарат Релвар Эллипта следует назначать с осторожностью.
Как и другие лекарственные средства, в состав которых входят глюкокортикостероиды, препарат Релвар Эллипта® следует с осторожностью назначать пациентам с туберкулезом легких, а также пациентам с хроническими или невылеченными инфекциями.
Применение при беременности и в период грудного вскармливания
Фертильность
Данные по влиянию на фертильность человека отсутствуют. В доклинических исследованиях воздействия вилантерола и флутиказона фуроата на фертильность не обнаружено.
Беременность
Данные о применении препарата во время беременности ограничены.
Применение препарата Релвар Эллипта* у беременных женщин допустимо только в том случае, если потенциальная польза для матери превышает возможный риск для плода.
Период грудного вскармливания
Данных об экскреции вилантерола или флутиказона фуроата или их метаболитов в грудное молоко человека недостаточно. Однако другие глюкокортикостероиды и бета2-агонисты определяются в грудном молоке. Риск проникновения препарата вместе с молоком в организм новорожденного или ребенка не может быть исключен.
Принимая во внимание соотношение пользы терапии для матери и грудного вскармливания для ребенка, необходимо решить вопрос либо об отмене препарата, либо о прекращении грудного вскармливания.
Способ применения и дозы
Препарат Релвар Эллипта предназначен только для ингаляционного применения.
Препарат Релвар Эллипта следует применять один раз в сутки в одно и то же время, утром или вечером.
После ингаляции следует прополоскать рот водой, не проглатывая.
Бронхиальная астма
Пациент должен быть проинформирован о необходимости регулярного применения препарата Релвар Эллипта даже в случае бессимптомного течения заболевания.
При возникновении симптомов заболевания в период между приемами препарата в качестве неотложной терапии следует применять ингаляционные формы бета2-агонистов короткого действия.
Врач должен регулярно оценивать состояние пациента, чтобы обеспечить своевременное назначение оптимальной дозировки препарата Релвар Эллипта.
Дозировка может быть изменена только но рекомендации врача.
Взрослые и подростки 12 лет и старше
Рекомендуемая доза препарата Релвар Эллипта: одна ингаляция 22 мкг + 92 мкг один раз в сутки или одна ингаляция 22 мкг+ 184 мкг один раз в сутки.
Начальная доза препарата Релвар Эллипта 22 мкг + 92 мкг назначается пациентам. которым требуются низкие или средние дозы ингаляционных глюкокортикостсроидов. применяемых в комбинации с бета2-агонистами длительного действия.
Препарат Релвар Эллипта в дозировке 22 мкг + 184 мкг следует назначать пациентам, которым требуется более высокая доза ингаляционных глюкокортикостероидов, применяемых в комбинации с бета2-агонистами длительного действия.
Если препарат Релвар Эллипта» в дозировке 22 мкг + 92 мкг не обеспечивает адекватного контроля заболевания, рассматривается вопрос об увеличении дозы до 22 мкг +184 мкг. что может улучшить уровень контроля над течением бронхиальной астмы.
Дети
Безопасность и эффективность применения препарата Релвар Эллипта* у детей младше 12 лет не установлена.
ХОБЛ
Взрослые
Рекомендуемая доза препарата Релвар Эллипта®: одна ингаляция 22 мкг + 92 мкг один раз в сутки.
Препарат Релвар Эллипта в дозировке 22 мкг+ 184 мкг не показан для лечения пациентов с ХОБЛ.
Дети
Препарат по показанию ХОБЛ у детей не применяется.
Особые группы пациентов
Пациенты пожилого возраста
Пациентам старше 65 лет не требуется коррекция дозы препарата (см. раздел «Фармакокинетика», подраздел «Особые
группы пациентов»).
Пациенты с нарушением функции почек
Пациентам с нарушением функции почек не требуется коррекция дозы препарата (см. раздел «Фармакокинетика»).
Пациенты с нарушением функции печени
По данным клинико-фармакологического исследования у пациентов с нарушениями функции печени легкой, средней и тяжелой степени наблюдается трехкратное возрастание степени системной экспозиции флутиказона фуроата (AUC) (см. раздел «Фармакокмнстика»).
Препарат следует назначать с осторожностью пациентам с нарушениями функции печени, у которых риск развития системных нежелательных реакций, вызванных приемом глюкокортикостеропдов, более высок. Для пациентов с нарушением функции печени средней и тяжелой степени максимальная доза составляет 22мкг + 92мкг (см. раздел «Фармакокинетика»).
Рекомендации по применению
При первом использовании ингалятора Эллипта нет необходимости в проверке правильности его работы или специальной подготовке ингалятора к эксплуатации. Просто последовательно соблюдайте рекомендации по применению, указанные ниже.
В пачке картонной ингалятора Эллипта содержатся:

Ингалятор Эллипта упакован в контейнер. Не открывайте контейнер до тех пор, пока не будете готовы осуществить ингаляцию лекарственного препарата. Когда Вы будете готовы использовать ингалятор, снимите фольгу с контейнера. Контейнер содержит пакетик с осушителем для снижения влажности. Не вскрывайте данный пакетик, он не предназначен для еды или ингаляций, его следует выбросить.
Когда Вы достаете ингалятор из контейнера, его крышка находится в закрытом положении. Не открывайте ее до тех пор, пока Вы не будете готовы осуществить ингаляцию лекарственного препарата. В специально отведенноми поле «Использовать до» на этикетке ингалятора напишите дату, которая будет соответствовать дате вскрытия плюс 6 недель. Не следует использовать ингалятор после этой даты.
Ниже приведены пошаговые инструкции использования ингалятора Эллипта :
I.Прочитайте информацию использованием
При открытии и закрытии крышки ингалятора Эллипта без приема лекарственного препарата происходит потеря одной дозы. Эта доза остается закрытой внутри ингалятора, но она будет недоступна для приема. Невозможно случайно получить большую дозу или двойную дозу за одну ингаляцию.
II. Подготовка дозы
Не открывайте крышку, пока Вы не будете готовы к приему препарата.
Не встряхивайте ингалятор.
1. Опустите крышку вниз до щелчка.
2. Доза препарата готова к ингаляции, и в подтверждение этого счетчик доз уменьшает число доз на единицу.
3. Если счетчик доз не уменьшил число доз после того, как Вы услышали щелчок, то ингалятор не готов к подаче дозы лекарственного препарата. В этом случае следует обратиться по телефону или адресу, указанному в разделе «За дополнительной информацией обращаться».
4. Никогда не встряхивайте ингалятор.
III. Ингаляция препарата
1. Удерживая ингалятор на некотором расстоянии ото рта, сделайте выдох максимальной глубины. Не выдыхайте в ингалятор.
2. Поместите мундштук между губами и плотно обхватите его губами. Не закрывайте пальцами вентиляционное отверстие
3. Сделайте один долгий, равномерный, глубокий вдох через рот. Задержите дыхание насколько возможно (по крайней мере, на 3-4 секунды).
4. Уберите ингалятор изо рта.
5. Медленно и спокойно выдохните.
Вы можете не почувствовать вкус или не ощутить поступление лекарственного препарата даже при правильном использовании ингалятора.
Если Вы хотите протереть мундштук, сделайте это до закрытия крышки, используя сухую салфетку.
IV. Закрытие ингалятора и полоскание ротовой полости
1. Поднимите крышку до упора, добившись полного закрытия мундштука.
2. После ингаляции следует прополоскать рот водой. Это снизит вероятность развития таких побочных явлений, как боль в горле и полости рта
Побочное действие
Данные клинических исследований
Для определения частоты развития нежелательных реакций, связанных с приемом препарата Релвар Эллипта ,
использовались данные крупных клинических исследований среди пациентов с ХОБЛ и бронхиальной астмой. Программа клинической разработки препарата для лечения бронхиальной астмы включала 7 034 пациента, у которых проводилась комплексная оценка нежелательных реакций. В программе клинической разработки препарата для лечения ХОБЛ принимали участие 6 237 пациентов, у которых проводилась комплексная оценка нежелательных реакций. Исключая пневмонию и переломы, профили безопасности препарата у пациентов с ХОБЛ и бронхиальной астмой были схожи. По данным клинических исследований, пневмония и переломы более часто наблюдались у пациентов, страдающих ХОБЛ.
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется согласно классификации Всемирной организации здравоохранения следующим образом: очень часто (> 1/10), часто (> 1/100 и < 1/10), нечасто (> 1/1 000 и < 1/100), редко (> 1/10 000 и < 1/1 000), очень редко (< 1/10 000, включая отдельные случаи).
Частота встречаемости нежелательных реакций
Инфекционныеипаразитарные заболевания
Часто: пневмония, инфекции верхних дыхательных путей, бронхит, грипп, кандидоз полости рта и глотки.
Нарушения со стороны нервной системы
Очень часто: головная боль,
Нарушения со стороны сердца
Нечасто: экстрасистолия.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Очень часто: назофарингит.
Часто: орофарингеальная боль, синусит, фарингит, ринит, кашель, дисфония.
Нарушения со стороны желудочно-кишечного тракта
Часто: боль в животе.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Часто: артралгия, боль в спине, переломы.
Общие расстройства и нарушения в месте введения
Часто: лихорадка.
Данные пострегистрационного наблюдения
Нарушения со стороны иммунной системы
Редко: реакции гиперчувствительности, в том числе анафилаксия, ангионевротический отек, сыпь, крапивница.
Нарушения психики
Редко: тревога.
Нарушения со стороны нервной системы
Редко: тремор.
Нарушения со стороны сердца
Редко: учащенное сердцебиение, тахикардия.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Часто: мышечный спазм.
Нарушения со стороны дыхательной системы, органов средостения
Редко: парадоксальный бронхоспазм.
Передозировка
Симптомы
При проведении клинических исследований не было получено данных о передозировке комбинацией вилантерола и флутиказона фуроата.
Передозировка препаратом Релвар Эллипта» может вызывать развитие симптомов и признаков, обусловленных действием отдельных компонентов препарата и характерных для передозировки бета2-агонистами и ингаляционными глюкокортикостероидами (см. раздел «Особые указания»).
Лечение
Специфическое лечение передозировки комбинацией вилантерола и флутиказона фуроата отсутствует. В случае развития передозировки назначается симптоматическая терапия и, при необходимости, обеспечивается соответствующее наблюдение за больным.
Применение кардиоселективных бета-адреноблокаторов следует рассматривать только в случаях сильно выраженных эффектов передозировки вилантеролом, которые клинически проявляются невосприимчивостью к поддерживающей терапии. Кардиоселективные бета-адреноблокаторы следует с осторожностью назначать пациентам, у которых наблюдались эпизоды бронхоспазма в анамнезе.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ
При назначении препарата в терапевтических дозах клинически значимые лекарственные взаимодействия вилантерола или флутиказона фуроата считаются маловероятными вследствие низких плазматических концентраций последних при ингаляционном введении.
Бета-адреноблокаторы могут ослаблять или антагонизировать действие бета2-адреномиметиков. Следует избегать одновременного приема неселективных и селективных бета-блокаторов. исключая случаи, когда их назначение строго необходимо.
Вилантерол и флутиказона фуроат подвергаются быстрому первичному метаболизму в печени посредством изофермента системы цитохрома CYP3A4.
При одновременном назначении препарата с сильными ингибиторами изофермента цитохрома CYP3A4 (например, кетоконазол, ритонавир) следует соблюдать осторожность, поскольку возможно повышение системного воздействия вилантерола и флутиказона фуроата, что в свою очередь может привести к повышению риска развития нежелательных реакций (см. раздел «Фармакокинетика»).
Вилантерол и флутиказона фуроат являются субстратами P-gp. По результатам клинико-фармакологического исследования с участием здоровых добровольцев, которым одновременно назначались вилантерол и сильный ингибитор P-gp и умеренный ингибитор изофермента цитохрома CYP3A4 верапамил, значимого влияния на фармакокинетику вилантерола не выявлено. Клинико-фармакологические исследования совместного назначения специфического ингибитора P-gr и флутиказона фуроата не проводились.
ОСОБЫЕ УКАЗАНИЯ
Обострения
Препарат Релвар Эллипта не предназначен для купирования острых симптомов бронхиальной астмы или обострения ХОБЛ, в таких случаях требуется назначение бронходилататоров короткого действия.
Увеличение частоты приема бронходилататоров короткого действия с целью купирования симптомов свидетельствует об ухудшении контроля над заболеванием и необходимости консультации врача.
Пациентам с бронхиальной астмой или ХОБЛ не следует прекращать лечение препаратом Релвар Эллипта без наблюдения врача, так как отмена терапии может привести к возобновлению симптомов.
На фоне лечения препаратом Релвар Эллипта могут развиваться нежелательные явления, связанные с течением бронхиальной астмы или обострением заболевания. Пациентам следует рекомендовать продолжить лечение. В случае отсутствия контроля над заболеванием или ухудшения состояния после начала терапии препаратом Релвар Эллипта необходима консультация врача.
Парадоксальный бронхоспазм
Как и при других видах ингаляционной терапии, после приема препарата может развиваться парадоксальный бронхоспазм, сопровождающийся быстрым нарастанием свистящих хрипов. В этом случае показаны неотложное назначение ингаляционного бронходилататора длительного действия и немедленная отмена препарата Релвар Эллипта. Пациент должен быть осмотрен врачом, и ему, при необходимости, может быть назначена альтернативная терапия.
Пациенты с нарушением функции печени
Пациентам с нарушением функции печени средней и тяжелой степени следует назначать дозу 22 мкг + 92 мкг, таким пациентам следует находиться под наблюдением врача для контроля над системными побочными реакциями, связанными с применением глюкокортикостероидов.
Системныеэффекты глюкокортикостероидов
При применении ингаляционных глюкокортикостероидов (особенно при длительном приеме в высоких дозах) могут развиваться системные побочные реакции. Такие побочные реакции развиваются значительно реже, чем при пероральном приеме глюкокортикостероидов. К проявлениям возможного неблагоприятного системного действия относятся: подавление функции гипоталамо-гипофизарно-надпочечниковой системы, снижение минеральной плотности костей, замедление скорости роста у детей и подростков, катаракта и глаукома.
Пневмония
У пациентов с ХОБЛ, получающих препарат Релвар Эллипта , наблюдалось повышение частоты развития пневмонии, а также частоты возникновения тяжелых форм пневмонии, требующих госпитализации пациента. В некоторых случаях клинические эпизоды пневмонии имели летальный исход. Врачам следует помнить о возможности развития пневмонии у пациентов с ХОБЛ, не забывая о том, что клинические признаки такого инфекционного заболевания маскируются симптомами обострения ХОБЛ. Более высокий риск развития пневмонии на фоне приема препарата Релвар Эллипта имеют следующие группы пациентов с ХОБЛ: курящие пациенты, пациенты, ранее перенесшие пневмонию, пациенты с индексом массы тела < 25 кг/м и пациенты с объемом форсированного выдоха (ОФВ0 < 50 % от должных величин. При назначении терапии препаратом Релвар Эллипта следует учитывать вышеуказанные факторы, в случае возникновения пневмонии лечение должно быть пересмотрено.
У пациентов с бронхиальной астмой случаи развития пневмонии наблюдались нечасто. Пациенты с бронхиальной астмой, получавшие препарат Релвар Эллипта в дозировке 22 мкг + 184 мкг/доза, возможно, имели более высокий риск развития пневмонии в сравнении с пациентами, получавшими более низкую дозу препарата Релвар Эллипта (22 мкг + 92 мкг/доза), или с группой плацебо. Факторы риска не установлены.
В ходе проведения клинических исследований у пациентов, страдающих ХОБЛ, была выявлена низкая частота возникновения переломов костей во всех лечебных группах, но при этом во всех группах, получавших комбинацию вилантерола и флутиказона фуроата, она была несколько выше (2 %), чем в группе, получавших монотерапию вилантеролом 22 мкг (< 1 %).
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Исследования по изучению влияния препарата Релвар Эллипта на способность к вождению автотранспорта и работе с механизмами не проводились. Исходя из данных фармакологии вилантерола или флутиказона фуроата, неблагоприятное влияние препарата на эти виды деятельности не предполагается.
Форма выпуска
Порошок для ингаляций дозированный, 22 мкг + 92 мкг/доза, 22 мкг + 184 мкг/доза.
По 30 доз в пластиковый ингалятор с корпусом светло-серого цвета, бледно-голубой крышкой мундштука и счетчиком доз. Ингалятор содержит два алюминиевых ламинированных стрипа, каждый из которых состоит из 30 ячеек, которые содержат порошок белого цвета. Ингалятор помещен в многослойный контейнер из алюминиевой фольги, содержащий пакетик с осушителем. Контейнер запечатан легко открывающейся фольгой. По 1 контейнеру вместе с инструкцией по применению в пачку картонную.
Срок годности
Не вскрытый алюминиевый контейнер: 2 года.
Вскрытый алюминиевый контейнер: 6 недель.
В специально отведенном поле «Использовать до» на этикетке ингалятора напишите дату. Дату следует указать сразу после того, как ингалятор был извлечен из контейнера.
Не применять после истечения срока годности, указанного на упаковке.
Условия хранения
Хранить при температуре не выше 25°С. Хранить в недоступном для детей месте.
Условия отпуска
По рецепту.
Производитель
«Глаксо Оперэйшенс Великобритания Лимитед» / Glaxo Operations UK Limited
SGI2 ODJ, Хертфордшир, Вэа, Прайори стрит, Великобритания / Priory Street, Ware, Hertfordshire, SGI2 ODJ. United Kingdom
НАИМЕНОВАНИЕ И АДРЕС ЮРИДИЧЕСКОГО ЛИЦА, НА ИМЯ КОТОРОГО ВЫДАНО РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ
ЗАО «ГлаксоСмитКляйн Трейдинг» 119180, г. Москва, Якиманская наб., д. 2
За дополнительной информацией обращаться:
ЗАО «ГлаксоСмитКляйн Трейдинг»
121614, г. Москва, ул. Крылатская, д. 17, корп. 3, эт. 5
Бизнес-Парк «Крылатские холмы»
Купить Релвар Эллипта в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Фармакологические свойства
Релвар Эллипта является лекарственным противовоспалительным средством, действие которого обусловлено двумя активными компонентами – вилантеролом и флутиказона фуроатом. Разные по природе и механизму воздействия препараты определяют терапевтический эффект медикамента.
Вилантерол является избирательным стимулятором бета-2-адренорецепторов. Вещество оказывает длительное стимулирующее влияние на аденилатциклазу, благодаря которому активизируется синтез циклического АМФ. Вследствие этих процессов достигается расслабляющее действие на гладкие мускулы бронхов, и улучшается проходимость дыхательных путей.
Противовоспалительное воздействие достигается благодаря наличию флутиказона фуроата. Он блокирует приступы астмы, снимает воспаление.
Немного фактов
Сочетание флутиказона фуроата с избирательными стимуляторами бета-2-адренорецепторов включено в некоторые национальные списки жизненно важных медикаментов.
Состав и форма выпуска
В состав Релвара Эллипта входит два активных компонента в виде микронизированного трифената вилантерола и флутиказона фуроата микронизированного. Препарат производят в двух дозировках флутиказона фуроата по 92 и 184 мкг на дозу при стабильном количестве вилантерола трифената в 22 мкг на дозу. В качестве эксципиентов используются стеарат магния и моногидрат лактозы.
Ингалятор с крышкой-мундштуком светлого голубого цвета снабжен счетчиком. Запакованный в контейнер с запаянной многослойной крышкой ингалятор помещается в картонный коробок совместно с инструкцией по применению.
Показания к применению
Главным показанием к употреблению Релвара Эллипта является сохраняющая терапия при бронхиальной астме.
Препарат употребляют для лечения хронических заболеваний: обструкционной болезни легких, эмфиземы, бронхита.
Побочные эффекты
Вероятные нежелательные действия наиболее часто возникают в дыхательных путях. Они проявляются в виде пневмонии, бронхита, инфекционных воспалительных процессов.
Часто возникают боли в абдоминальной области, головные боли, лихорадка, артралгии, боль в спине.
Нечасто формируются сбои сердечного ритма.
Противопоказания
Противопоказано принимать медикамент при наличии непереносимости к любому из компонентов.
Строгим противопоказанием является педиатрический возраст до 12 лет.
Дозу 22 + 184 мкг запрещено употреблять для излечения ХОБЛ.
С осмотрительностью и под присмотром доктора нужно осуществлять терапию больных с наличием заболеваний сердца, при туберкулезе легких.
Способ и особенности применения
Инструкция рекомендует применение медикамента Релвар Эллипта один раз в день, придерживаясь выбранного времени суток.
Лечение астмы предусматривает прием дозировки в 22 мкг вилантерола и 92 или 184 мкг флутиказона фуроата, зависимо от рекомендаций врача. Возраст пациентов, которым разрешен прием Релвара Эллипта для терапии астмы, начинается в 12 лет. Больным до 12 лет принимать этот медикамент нельзя. Больные старшего возраста не нуждаются в коррекции дозы.
Терапия ХОБЛ требует использования ингаляции, доза которой содержит 92 мкг флутиказона фуроата. Высокую концентрацию при терапии ХОБЛ не используют. Терапию с Релвар Эллипта не осуществляют в педиатрии при диагнозе ХОБЛ.
Извлечение и использование ингалятора
Пакет, в котором запакован ингалятор, хранит также влагопоглощающий силикагель в маленьком пакете, силикагель нужно выбросить. Ингалятор, извлеченный из пакета, сразу готов к использованию. Не нужно трясти. Открывать его можно только перед непосредственным употреблением препарата. Каждое открытие влечет потерю лекарственной дозы.
До использования ингалятора на счетчике 30 доз. Открытие крышки уменьшает это число на 1. Счетчик информирует о сокращении числа доз, при остатке 10 штук, половина его загорается красным цветом. Когда ингалятор пуст, счетчик становится полностью красным.
Крышку ингалятора надо опустить вниз до упора, пока не услышите щелчок, счетчик должен показать на 1 меньшее количество доз, это значит, что очередная порция готова.
Глубоко вдохните вдали от ингалятора.
Затем нужно плотно прижать мундштук ко рту, повторяя губами его форму, спокойно глубоко и медленно вдохнуть, задержать дыхание на 3-4 секунды.
Забрав ингалятор изо рта, надо сделать спокойный медленный выдох. Если все сделано четко по инструкции, вы не почувствуете вкус и поступление лекарства.
Затем нужно очистить мундштук, закрыть ингалятор.
Сразу после употребления лекарства нужно прополоскать рот и выплюнуть воду.
Использование при беременности
Употребление Релвара Эллипта возможно у пациенток с беременностью разрешено по предписанию врача и при превышении потенциальной пользы для матери над вредом для малыша.
Лактацию на время терапии нужно прекратить.
Совместимость с алкоголем
Употребление алкоголя не рекомендуется.
Взаимодействие с другими лекарствами
Не рекомендуется одновременный прием с бета-блокаторами, кетоконазолом, ритонавиром.
Передозировка
Медикамент разработан так, что принять две порции или увеличенную порцию за один прием ингаляции невозможно.
При получении нескольких доз возможно развитие побочных эффектов, тогда прописывают симптоматическую терапию и, если есть надобность, устраивают наблюдение за пациентом.
Аналоги
Аиртек, Аэрофлюсал, Салмерикс, Серетид Дискус.
Условия продажи
Отпускают по рецепту врача.
Условия хранения
При температуре не выше 25 градусов тепла в оригинальной упаковке храните вдали от влаги до 6 недель после вскрытия пластиковой упаковки.
Цены на Релвар Эллипта в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 1 960 руб.
Сертификаты и лицензии
Средства для лечения обструктивных заболеваний дыхательных путей. Адренергические средства в комбинации с кортикостероидами или прочими средствами, за исключением антихолинергических. Код ATX: R03AK10.
Фармакологические свойства
Фармакодинамика
Механизм действия
Флутиказона фуроат и вилантерол представляют собой два класса лекарственных препаратов (синтетический кортикостероид и селективный агонист бета2-рецепторов длительного действия).
Фармакодинамическое действие
Флутиказона фуроат
Флутиказона фуроат представляет собой синтетический трифторированный кортикостероид с выраженным противовоспалительным действием. Точный механизм воздействия флутиказона фуроата на симптомы астмы и хронической обструктивной болезни легких (ХОБЛ) неизвестен. Известно, что кортикостероиды широко воздействуют на многие типы клеток (например, эозинофилы, макрофаги, лимфоциты) и медиаторы (например, цитокины и хемокины, вовлеченные в воспалительный процесс).
Вилантерола трифенатат
Вилантерола трифенатат представляет собой селективный длительно действующий бета2-агонист (ДДБА).
Фармакологическое действие агонистов бета2-адренорецепторов, включая вилантерола трифенатат, как минимум отчасти обусловлено стимуляцией внутриклеточной аденилциклазы — фермента, являющегося катализатором превращения аденозинтрифосфата (АТФ) в циклический-3’,5’-аденозинмонофосфат (циклический АМФ). Повышенные показатели уровня АМФ вызывают расслабление гладких мышц бронхов и ингибирование высвобождения медиаторов гиперчувствительности немедленного типа из клеток, в особенности из тучных клеток.
Между кортикостероидами и ДДБА происходит молекулярное взаимодействие, в результате чего стероиды активируют ген бета2-рецепторов, тем самым повышая количество и чувствительность рецепторов. ДДБА подготавливают глюкокортикоидный рецептор к стероидозависимой активации и усиливают ядерную транслокацию в клетках. Данные синергидные взаимодействия находят отражение в повышенном противовоспалительном действии, наблюдавшемся in vitro и in vivo в ряде воспалительных клеток, имеющих отношение к патофизиологии как астмы, так и ХОБЛ. В мононуклеарных клетках периферической крови у пациентов с ХОБЛ более выраженное противовоспалительное действие наблюдалось в присутствии комбинации флутиказона фуроата/вилантерола по сравнению с одним флутиказона фуроатом в концентрациях, достигаемых при применении клинических дозах. Усиленный противовоспалительный эффект компонента ДДБА был схож с таковым, наблюдаемым при применении других комбинаций ИКС/ДДБА.
Клиническая эффективность и безопасность
Астма
В ходе трех рандомизированных двойных слепых исследований III фазы (HZA106827, HZA106829 и HZA106837) различной продолжительности оценивались безопасность и эффективность комбинации флутиказона фуроат/вилантерол у взрослых пациентов и подростков с персистирующей астмой. Все пациенты принимали ИКС (ингаляционный кортикостероид) с или без ДДБА на протяжении минимум 12 недель до посещения 1. В исследовании HZA106837 у всех пациентов отмечалось как минимум одно обострение в течение года, предшествовавшего посещению 1, при котором требовалась терапия пероральными кортикостероидами. Продолжительность исследования HZA106827 составляла 12 недель. В ходе исследования оценивалась эффективность комбинации флутиказона фуроат/вилантерол 92/22 мкг [n=201] и флутиказона фуроата 92 мкг [n=205]) по сравнению с плацебо [n=203]. Все препараты принимались один раз в сутки. Продолжительность исследования HZA106829 составляла 24 недели. В ходе исследования оценивалась эффективность комбинации флутиказона фуроат/вилантерол 184/22 мкг [n=197] и флутиказона фуроата 184 мкг [n=194]) при применении один раз в сутки по сравнению с флутиказона пропионатом 500 мкг два раза в сутки [n=195].
В исследованиях HZA106827/HZA106829 комбинированными первичными конечными точками оценки эффективности были изменение минимального показателя ОФВ1 в ходе клинического визита (до применения бронхолитического средства и до начала дозирования) в конце периода лечения у всех пациентов по сравнению с исходным уровнем и взвешенное среднее значение серийного ОФВ1 через 0-24 часа после приема дозы, вычисленное для подгруппы пациентов в конце периода терапии. Изменение процентного соотношения 24-часовых периодов без препаратов экстренной помощи по сравнению с исходным уровнем было вторичной конечной точкой. Результаты в отношении первичных и ключевых вторичных конечных точек данных исследований приведены в Таблице 1.
Таблица 1. Результаты в отношении первичных и ключевых вторичных конечных точек исследований HZA106827 и HZA106829
| № исследования | HZA106829 | HZA106827 | ||
| Доза ФФ/ВИ* (микрограммы) | ФФ/ВИ 184/22 один раз в сутки и ФФ 184 один раз в сутки | ФФ/ВИ 184/22 один раз в сутки и ФП 500 два раза в сутки | ФФ/ВИ 92/22 один раз в сутки и ФФ 92 один раз в сутки | ФФ/ВИ 92/22 один раз в сутки и плацебо один раз в сутки |
| Изменение минимального показателя ОФВ1 с переносом вперед данных последнего наблюдения (ПВДПН) по сравнению с исходным уровнем | ||||
| Различия между препаратамиВеличина Р(95%-й ДИ) | 193 мл р<0,001 (108, 277) | 210 мл р<0,001 (127,294) | 36 мл р=0,405 (-48, 120) | 172 мл р<0,001 (87,258) |
| Взвешенное среднее значение серийного ОФВ1 через 0-24 часа после приема дозы | ||||
| Различия между препаратамиВеличина Р(95%-й ДИ) | 136 мл р=0,048 (1,270) | 206 мл р=0,003 (73, 339) | 116 мл р=0,06 (-5,236) | 302 мл р<0,001 (178,426) |
| Изменение процентного соотношения 24-часовых периодов без препаратов экстренной помощи по сравнению с исходным уровнем | ||||
| Различия между препаратамиВеличина Р(95%-й ДИ) | 11,7% р<0,001(4.9, 18.4) | 6,3% р=0,067 (-0.4, 13.1) | 10,6% р<0,001 (4.3, 16.8) | 19,3% р<0,001 (13.0,25.6) |
| Изменение процентного соотношения 24-часовых периодов без проявления симптомов по сравнению с исходным уровнем | ||||
| Различия между препаратами | 8,4% | 4,9% | 12,1% | 18,0% |
| Величина Р(95%-й ДИ) | р=0,010(2.0, 14.8) | р=0,137(-1.6, 11.3) | р<0,001(6.2, 18.1) | р<0,001(12.0,23.9) |
| Изменение утренней пиковой скорости выдоха по сравнению с исходным уровнем | ||||
| Различия между препаратамиВеличина Р(95%-й ДИ) | 33,5 л/мин р<0,001(22.3,41.7) | 32,9 л/мин р<0,001(24.8,41.1) | 14,6 л/мин р<0,001(7.9,21.3) | 33,3 л/мин р<0,001(26.5, 40.0) |
| Изменение вечерней пиковой скорости выдоха по сравнению с исходным уровнем | ||||
| Различия между препаратамиВеличина Р(95%-й ДИ) | 30,7 л/мин р<0,001(22.5, 38.9) | 26,2 л/минр<0,001(18.0,34.3) | 12,3 л/мин р<0,001(5.8, 18.8) | 28,2 л/мин р<0,001(21.7,34.8) |
* ФФ/ВИ = комбинация флутиказона/вилантерол
ФП = флутиказона пропионат
В исследовании HZA106837 применялась различная длительность терапии (минимальная продолжительность 24 недели, максимальная — 76 недель; у большинства пациентов продолжительность лечения составила минимум 52 недели). В исследовании HZA106837 пациенты были рандомизированы для получения комбинации флутиказона фуроат/вилантерол 92/22 мкг [n=1009] или ФФ 92 мкг [n=1010]. Оба препарата принимались один раз в сутки. В исследовании HZA106837 первичной конечной точкой было время до первого тяжелого обострения астмы. Тяжелое обострение астмы определялось как ухудшение астмы, требующее применения системных кортикостероидов на протяжении не менее 3 дней, госпитализации в стационар или посещения отделения неотложной помощи вследствие астмы, требовавшей применения системных кортикостероидов. Скорректированное среднее изменение минимального ОФВ1 по сравнению с исходным уровнем также оценивалось как вторичная конечная точка.
В исследовании HZA106837 риск возникновения тяжелого обострения астмы у пациентов, получавших комбинацию флутиказона фуроат/вилантерол 92/22 мкг, снизился на 20% по сравнению с пациентами, получавшими только ФФ 92 мкг (отношение рисков 0.795, р=0.036 95%-й ДИ 0.642, 0.985). Коэффициент возникновения тяжелого обострения астмы у каждого пациента в год составил 0,19 в группе ФФ 92 мкг (приблизительно 1 в каждые 5 лет) и 0,14 в группе комбинации флутиказона фуроат/вилантерол 92/22 мкг (приблизительно 1 в каждые 7 лет). Соотношение частоты возникновения обострений при приеме комбинации флутиказона фуроат/вилантерол 92/22 мкг и ФФ 92 мкг составило 0.755 (95-й ДИ 0.603, 0.945). Отсюда следует, что снижение частоты возникновения тяжелых обострений астмы у пациентов, получавших комбинацию флутиказона фуроат/вилантерол 92/22 мкг, составило 25% по сравнению с пациентами, получавшими ФФ 92 мкг (р=0,014). 24-часовое бронхорасширяющее действие комбинации флутиказона фуроат/вилантерол сохранялось на протяжении периода терапии длительностью один год. Признаки потери эффективности не отмечались (тахифилаксия отсутствовала). При применении комбинации флутиказона фуроат/вилантерол 92/22 мкг наблюдалось устойчивое улучшение минимального показателя ОФВ1 от 83 мл до 95 мл на 12-й, 36-й и 52-й неделе, а также в конечной точке по сравнению с показателями при применении ФФ 92 мкг (р<0,001 95%-й ДИ 52, 126 мл в конечной точке). У 44% пациентов в группе флутиказона фуроат/вилантерол 92/22 мкг астма была хорошо контролируемой (ACQ7 <0,75) на момент окончания терапии. У пациентов в группе ФФ 92 мкг данный показатель составил 36% (р<0,001 95%-й ДИ 1.23, 1.82).
Исследования сравнения с комбинацией салметерол/флутиказона пропионат
В ходе исследования продолжительностью 24 недели (HZA113091) у взрослых пациентов и подростков с неконтролируемой персистирующей астмой улучшение легочной функции по сравнению с исходным уровнем наблюдалось как при применении комбинации флутиказона фуроат/вилантерол 92/22 мкг один раз в сутки вечером, так и при применении комбинации салметерол/ФП 50/250 мкг два раза в сутки. Скорректированные средние показатели повышения взвешенного среднего значения ОФВ1 за период 0-24 часа на 341 мл на фоне терапии по сравнению с исходным уровнем (комбинация флутиказона фуроат/вилантерол) и на 377 мл (комбинация салметерол/ФП) свидетельствовали об общем улучшении легочной функции на протяжении 24 часов при применении обоих видов терапии. Скорректированное среднее значение разницы в зависимости от вида терапии между группами, составившее 37 мл, не являлось значимым со статистической точки зрения (р=0,162). В отношении минимального показателя ОФВ1 у пациентов в группе комбинации флутиказона фуроат/вилантерол наблюдалось изменение предела среднего значения по сравнению с исходным уровнем на 281 мл, а у пациентов в группе салметерол/ФП — на 300 мл; (разница в отношении скорректированного среднего значения -19 мл (95%-й ДИ:-0.073, 0.034) не являлась значимой со статистической точки зрения (р=0.485).
Рандомизированное двойное слепое исследование, продолжительностью 24 недели (201378), проведенное в параллельных группах, продемонстрировало не меньшую эффективность (используя предел в -100 мл в отношении минимального показателя ОФВ1) комбинации флутиказона фуроат/вилантерол 92/22 мкг один раз в сутки в сравнении с комбинацией салметерол/ФП 50/250 мкг два раза в сутки у взрослых и подростков, которые достигли контроля астмы через 4 недели в ходе открытого лечения комбинацией салметерол/ФП 50/250 мкг два раза в сутки (N=1504). У пациентов, принимающих комбинацию флутиказона фуроат/вилантерол один раз в сутки, параметры легочной функции были сравнимы с параметрами у пациентов, принимающих комбинацию салметерол/ФП два раза в сутки [разница в отношении минимального показателя ОФВ1 -19 мл (95% CI:-11, 49)].
Сравнительные исследования с комбинациями салметерол/ФП или других ИКС/ДЦБА, где бы надлежащим образом сравнивались эффекты на обострения астмы, не проводились.
Монотерапия флутиказона фуроатом
В ходе рандомизированного двойного слепого плацебо-контролируемого исследования продолжительностью 24 недели (FFA112059) оценивались безопасность и эффективность ФФ 92 мкг один раз в сутки [n= 114] и ФП 250 мкг два раза в сутки [n=114] по сравнению с плацебо [n=115] у взрослых пациентов и подростков с персистирующей астмой. Все пациенты должны были получать стабильную дозу ИКС на протяжении не менее 4 недель до визита 1 (скрининговый визит). Применение ДДБА не разрешалось на протяжении 4 недель после визита 1. Первичной конечной точкой эффективности было изменение минимального показателя ОФВ1 во время клинического визита (до применения бронхолитического средства и до начала дозирования) в конце периода лечения по сравнению с исходным уровнем. Изменение процентного соотношения 24-часовых периодов без купирующей терапии по сравнению с исходным уровнем на протяжении периода лечения продолжительностью 24 недели было вторичной конечной точкой временной точке 24 недели ФФ и ФП повысили минимальное значение ОФВ1 на 146 мл (95%-й ДИ 36, 257 мл, р=0,009) и 145 мл (95%-й ДИ 33, 257 мл, р=0,011), соответственно, по сравнению с плацебо. Оба препарата (ФФ и ФП) повысили процентное соотношение 24-часовых периодов без купирующей терапии на 14,8% (95%-й ДИ 6.9, 22.7, р<0,001) и 17,9% (95%-й ДИ 10.0, 25.7, р<0,001), соответственно, по сравнению с плацебо.
Исследование реакции на провокационный тест с аллергеном
Бронхопротекторное действие комбинации флутиказона фуроат/вилантерол 92/22 мкг на ранний и поздний астматический ответ на вдыхаемый аллерген оценивалось в ходе плацебо-контролируемого перекрестного исследования многократных доз с четырьмя периодами (HZA113126) у пациентов с легкой формой астмы. Пациенты были рандомизированы для получения комбинации флутиказона фуроат/вилантерол 92/22 мкг, ФФ 92 мкг, вилантерола 22 мкг или плацебо один раз в сутки на протяжении 21 дня; через 1 час после последней дозы осуществлялся ингаляционный тест с аллергеном. Использовались следующие аллергены: клещ домашней пыли, кошачья перхоть или пыльца березы. Отбор производился на основании скрининговых тестов. Результаты измерений серийного ОФВ1 сравнивались с показателями, полученными после ингаляции физиологического раствора до теста с аллергеном (исходный уровень). В целом, наибольшее влияние на ранний астматический ответ наблюдалось при применении комбинации флутиказона фуроат/вилантерол 92/22 мкг, по сравнению с ФФ 92 мкг или вилантеролом 22 мкг в виде монотерапии. Как комбинация флутиказона фуроат/вилантерол 92/22 мкг, так и ФФ 92 мкг фактически ликвидировали поздний астматический ответ по сравнению с вилантеролом в виде монотерапии. Применение комбинации флутиказона фуроат/вилантерол 92/22 мкг обеспечивало значительно большую защиту от гиперреактивности бронхов, вызванной аллергенами, чем монотерапия ФФ или вилантеролом. Оценка производилась в День 22 посредством провокационной пробы с метахолином.
Хроническая обструктивная болезнь легких
В программу клинических исследований ХОБЛ были включены следующие рандомизированные контролируемые исследования: одно продолжительностью 12 недель (HZC113107), два продолжительностью 6 месяцев (HZC112206, HZC112207), два исследования продолжительностью один год (HZC102970, HZC102871) и одно исследование продолжительностью > 1 года (SUMMIT) с участием пациентов с клиническим диагнозом ХОБЛ. В данных исследованиях изучались показатели функции легких, одышки, а также умеренных и тяжелых обострений заболевания.
Исследования продолжительностью 6 месяцев
HZC112206 и HZC112207 были рандомизированными двойными слепыми плацебо-контролируемыми исследованиями с параллельными группами продолжительностью 24 недели, в ходе которых проводилось сравнение действия комбинации с действием отдельно вилантерола и ФФ, а также плацебо. В исследовании HZC112206 оценивалась эффективность комбинации флутиказона фуроат/вилантерол 46/22 мкг [n=206] и комбинации флутиказона фуроат/вилантерол 92/22 мкг [n=206] в сравнении с эффективностью ФФ 92 мкг [n=206], вилантерола 22 мкг [n=205] и плацебо [n=207], все препараты принимались один раз в сутки. В исследовании HZC112207 оценивалась эффективность комбинации флутиказона фуроат/вилантерол 92/22 мкг [n=204] и комбинации флутиказона фуроат/вилантерол 184/22 мкг [n=205] в сравнении с ФФ 92 мкг [n=204], ФФ 184 мкг [n=203] и вилантеролом 22 мкг [n=203] и плацебо [n=205], все препараты принимались один раз в сутки.
Пациентам, участвовавшим в исследованиях, предъявлялись следующие требования: анамнез курения минимум 10 пачко-лет; соотношение ОФВ1/ФЖЕ после применения сальбутамола менее или равное 0.70; показатель ОФВ1 после применения сальбутамола менее или равный 70% от прогнозируемого значения, а также одышка ≥ 2 (шкала от 0 до 4) по модифицированной шкале опросника Британского медицинского исследовательского совета (mMRC) на этапе скрининга. Во время скрининга среднее значение ОФВ1 до применения бронхолитического средства составило 42,6% и 43,6% от прогнозируемого значения, средний показатель обратимости составил 15,9% и 12,0% в исследованиях HZC112206 и HZC112207, соответственно. Первичными конечными точками в обоих исследованиях были взвешенные средние значения ОФВ1 от нуля до 4 часов после получения дозы препарата в День 168 и изменение от исходного значения минимального показателя ОФВ1 до получения дозы препарата в День 169.
На основании полного анализа обоих исследований был сделан вывод, что применение комбинации флутиказона фуроат/вилантерол 92/22 мкг приводит к клинически значимому улучшению функции легких. В День 169 применение комбинации флутиказона фуроат/вилантерол 92/22 мкг и вилантерола привело к увеличению откорректированного среднего минимального показателя ОФВ1 на 129 мл (95%-й ДИ: 91, 167 мл, р<0,001) и 83 мл (95%-й ДИ: 46, 121 мл, р<0,001), соответственно, в сравнении с плацебо. Использование комбинации флутиказона фуроат/вилантерол 92/22 мкг привело к увеличению минимального показателя ОФВ1 на 46 мл в сравнении с вилантеролом (95%-й ДИ: 8, 83 мл, р= 0,017). В День 168 применение комбинации флутиказона фуроат вилантерол 92/22 мкг и вилантерола привело к увеличению откорректированного взвешенного среднего значения ОФВ1 на протяжении 0-4 часов на 193 мл
230 мл, р<0,001) и 145 мл (95%-й ДИ: 108, 181 мл, р<0,001), соответственно, в сравнении с плацебо. Применение комбинации флутиказона фуроат/вилантерол 92/22 мкг привело к росту скорректированного среднего взвешенного среднего значения ОФВ1 на протяжении 0-4 часов на 148 мл в сравнении с применением отдельно ФФ (95%-й ДИ: 112, 184 мл, р<0,001).
Исследования продолжительностью 12 месяцев
Исследования HZC102970 и HZC102871 были рандомизированными двойными слепыми исследованиями с параллельными группами продолжительностью 52 недели, в ходе которых проводилось сравнение действия комбинации флутиказона фуроат/вилантерол 184/22 мкг, комбинации флутиказона фуроат/вилантерол 92/22 мкг, комбинации флутиказона фуроат/вилантерол 46/22 мкг и вилантерола 22 мкг (все препараты применялись один раз в сутки) на годовой показатель развития умеренных/тяжелых обострений болезни у пациентов с ХОБЛ с анамнезом курения минимум 10 пачко-лет; соотношением ОФВ1/ ФЖЕ после применения сальбутамола менее или равным 0,70; показателем ОФВ1 после применения сальбутамола менее или равным 70% от прогнозируемого значения и документально подтвержденной историей ≥ 1 обострения ХОБЛ, при котором потребовалась терапия антибиотиками и/или пероральными кортикостероидами или госпитализация за период в 12 месяцев до визита 1. Первичной конечной точкой был годовой показатель развития умеренных и тяжелых обострений болезни. Умеренные/тяжелые обострения определялись как усиление симптомов, которое потребовало терапии пероральными кортикостероидами и/или антибиотиками или госпитализации в стационар. В обоих исследованиях был 4-недельный вводный период, в течение которого все испытуемые получали немаскированную комбинацию салметерол/ФП 50/250 два раза в сутки с целью стандартизовать фармакотерапию ХОБЛ и стабилизировать заболевания до рандомизации для применения маскированного исследуемого лекарственного препарата в течение 52 недель. До начала вводного периода участники исследования прекращали прием ранее использованных лекарственных препаратов для терапии ХОБЛ за исключением бронхолитических средств короткого действия. Использование одновременно применяемых ингалируемых бронхолитических средств длительного действия (бета2-агонистов и антихолинергических средств), комбинированных препаратов, содержащих ипратропий, сальбутамол пероральных бета2-агонистов и препаратов теофиллина не разрешалась в течение всего периода терапии. Допускалось использование пероральных кортикостероидов и антибиотиков для неотложного лечения обострений ХОБЛ в соответствии с особыми рекомендациями. В течение исследований участники по мере необходимости применяли сальбутамол. Результаты обоих исследований свидетельствуют, что терапия комбинацией флутиказона фуроат/вилантерол 92/22 мкг один раз в сутки приводит к снижению годового показателя развития умеренных/тяжелых обострений ХОБЛ в сравнении с терапией вилантеролом (Таблица 2).
Таблица 2: Анализ частоты возникновения обострений через 12 месяцев терапии
| Конечная точка | HZC102970 | HZC102871 | HZC102970 и HZC102871 (интегрированный анализ) | |||
| Вилантерол(n=409) | флутиказона фуроат/ вилантерол 92/22 (n=403) | Вилантерол(n=409) | флутиказона фуроат/ вилантерол 92/22 (n=403) | Вилантерол(n=818) | флутиказона фуроат/вилантерол 92/22 (n=806) | |
| Умеренные и тяжелые обострения | ||||||
| Скорректированный средний годовой уровень | 1,14 | 0,90 | 1,05 | 0,70 | 1,11 | 0,81 |
| Соотношение с ВИ 95%-й ДИ величина р % снижения (95%-й ДИ) | 0,79 (0.64,0.97)0,02421(3,36) | 0,66 (0.54,0.81) <0,00134(19,46) | 0,73 (0.63,0.84) <0,00127(16,37) | |||
| Абсолютная разница в количестве в год по сравнению с вилантеролом (95%-й ДИ) | 0,24(0.03,0.41) | 0,36(0.20, 0.48) | 0,30(0.18,0.41) | |||
| Время до первого обострения:Отношение рисков(95%-й ДИ)% снижения риска величина р | 0,80(0.66,0.99)200,036 | 0,72(0.59, 0.89)280,002 | 0,76(0.66,0.88)24р<0,001 |
По результатам интегрированного анализа исследований HZC102970 и HZC102871, на неделе 52 при применении комбинации флутиказона фуроат/вилантерол 92/22мкг наблюдалось улучшение скорректированного среднего показателя минимального ОФВ1 по сравнению с вилантеролом 22 мкг (42 мл 95%-й ДИ: 19, 64 мл, р<0,001) 24-часовое бронхорасширяющее действие комбинации флутиказона фуроат/вилантерол сохранялось с момента приема первой дозы и на протяжении периода терапии длительностью один год. Признаки потери эффективности не отмечались (тахифилаксия отсутствовала).
В совокупности в двух исследованиях сердечно-сосудистые заболевания в анамнезе или факторы риска их возникновения были отмечены у 2009 (62%) пациентов в процессе отбора. Частота сердечно-сосудистых заболеваний/факторов риска была идентичной во всех группах терапии, при этом чаще всего отмечались следующие заболевания: гипертензия (46%), гиперхолестеринемия (29%) и сахарный диабет (12%). Сходное снижение частоты умеренных и тяжелых обострений наблюдалось в данной подгруппе по сравнению со всей популяцией. У пациентов с сердечно-сосудистыми заболеваниями и факторами риска в анамнезе применение комбинации флутиказона фуроат/вилантерол 92/22 мкг привело к значительному снижению ежегодной частоты возникновения среднетяжелых/тяжелых обострений ХОБЛ по сравнению с вилантеролом (скорректированные средние годовые показатели частоты возникновения 0,83 и 1,18, соответственно, 30%-е снижение (95%-й ДИ 16, 42%, р<0,001)). На неделе 52 при применении комбинации флутиказона фуроат/вилантерол 92/22 мкг также наблюдалось улучшение скорректированного среднего показателя минимального ОФВ1 по сравнению с вилантеролом 22 мкг (44 мл 95%-й ДИ: 15, 73 мл, (р= 0,003)).
Исследования продолжительностью > 1 года
SUMMIT представляло собой многоцентровое, рандомизированное, двойное слепое исследование с оценкой влияния применения флутиказона фуроата/вилантерола 92/22 мкг на выживаемость по сравнению с плацебо у 16485 пациентов. Первичной конечной точкой исследования являлась смертность по всем причинам, вторичной конечной точкой — комбинированные сердечно-сосудистые нежелательные явления (смерть по причине сердечно-сосудистой патологии, инфаркт миокарда, инсульт, нестабильная стенокардия или транзиторная ишемическая атака).
Перед рандомизацией участникам исследования было необходимо прекратить предыдущее лечение ХОБЛ, которое включало бронходилятаторы длительного действия совместно с ингаляционными кортикостероидами (28%), монотерапию бронхо дилятаторами длительного действия (11%) и монотерапию ингаляционными кортикостероидами (4%). Участники исследования были рандомизированы на получение флутиказона фуроата/вилантерола 92/22 мкг вилантерола 22 мкг или плацебо и проходили лечение в среднем в течение 1,7 лет (СО=0,9 лет).
У пациентов была ХОБЛ средней степени (среднее значение ОФВ1 при скрининге после применения бронходилятатора составляло 60% (СО =6%)) и анамнез или повышенный риск развития сердечно-сосудистого заболевания. В течение 12 месяцев перед исследованием у 61% пациентов не наблюдалось обострений ХОБЛ и у 39% пациентов было отмечено ≥ 1 умеренного/тяжелого обострения ХОБЛ.
Смертность по всем причинам составила: 6,0 % при применении флутиказона фуроата/вилантерола; 6,7 % при применении плацебо; 6,1 % при применении флутиказона фуроата и 6,4 % при применении вилантерола. Скорректированная по экспозиции смертность по всем причинам на 100 пациентов/год (%/год) составила: 3.1 %/год в группе флутиказона фуроата/вилантерола, 3.5%/год в группе плацебо, 3.2 %/год в группе флутиказона фуроата, 3.4 %/год в группе вилантерола. Не было выявлено значимой разницы в риске наступления смерти при применении флутиказона фуроата/вилантерола по сравнению с плацебо (отношение рисков (ОР) 0,88; 95 % ДИ: 0,74; 1,04; р = 0,137), флутиказона фуроатом (ОР 0,96; 95 % ДИ: 0,81; 1,15; р = 0,681) или вилантеролом (ОР 0,91; 95 % ДИ: 0,77; 1,09; р = 0,299).
Не было выявлено значимой разницы в риске комбинированного сердечно-сосудистого явления при применении флутиказона фуроата/вилантерола по сравнению с применением плацебо (ОРО,93; 95% ДИ: 0,75; 1,14), ФФ (ОР 1,03; 95% ДИ: 0,83; 1,28) или ВИ (ОР 0,94; 95 % ДИ: 0,76; 1,16).
Исследования сравнения с комбинацией салметерол/флутиказона пропионат
В ходе исследования продолжительностью 12 недель (HZC113107) у пациентов с ХОБЛ улучшение легочной функции по сравнению с исходным уровнем наблюдалось как при применении комбинации флутиказона фуроат/вилантерол 92/22 мкг один раз в сутки утром, так и при применении комбинации салметерол/ФП 50/500 мкг два раза в сутки. Скорректированные средние показатели повышения взвешенного среднего значения ОФВ1 за период 0-24 часа на 130 мл на фоне терапии по сравнению с исходным уровнем (комбинация флутиказона фуроат/вилантерол) и на 108 мл (комбинация салметерол/ФП) свидетельствовали об общем улучшении легочной функции на протяжении 24 часов при применении обоих видов терапии. Скорректированное среднее значение разницы в зависимости от вида терапии между группами 22 мл (95%-й ДИ: -18, 63 мл) не являлось статистически значимым (р=0,282). Скорректированное среднее изменение минимального ОФВ1 по сравнению с исходным уровнем в момент времени День 85 составило 111 мл в группе комбинации флутиказона фуроат/вилантерол и 88 мл в группе комбинации салметерол/ФП; разница, составлявшая 23 мл (95%-й ДИ: -20, 66) между группами терапии не была значимой с клинической или статистической точки зрения (р<0,294).
Сравнительные исследования с комбинациями салметерол/ФП или другими общепринятыми бронхолитическими средствами, где бы надлежащим образом сравнивалось действие на обострения ХОБЛ, не проводились.
Дети
Европейское агентство по оценке лекарственных средств отказалось от обязательного представления результатов исследований препарата Релвар Эллипта во всех подмножествах педиатрической популяции по ХОБЛ (информацию по применению у пациентов детского возраста смотрите в разделе «Способ применения и дозы»).
Европейское агентство по оценке лекарственных средств отложило обязательное представление результатов исследований препарата Релвар Эллипта во всех подмножествах педиатрической популяции в отношении астмы (информацию по применению у пациентов детского возраста смотрите в разделе «Способ применения и дозы»).
Фармакокинетика
Всасывание
Абсолютная биодоступность флутиказона фуроата и вилантерола при ингаляционном применении в виде комбинации флутиказона фуроат/вилантерол в среднем составила 15,2% и 27,3%, соответственно. Биодоступность флутиказона фуроата и вилантерола при приеме внутрь была низкой и в среднем составляла 1,26% и < 2%, соответственно. С учетом низкой биодоступности при приеме внутрь системное воздействие флутиказона фуроата и вилантерола при ингаляционном введении в первую очередь обусловлено всасыванием части ингаляционной дозы, поступившей в легкие.
Распределение
После внутривенного введения флутиказона фуроат и вилантерол широко распределяются по организму. Средние показатели объема распределения в равновесном состоянии составляют 661 л и 165 л, соответственно.
Оба препарата — флутиказона фуроат и вилантерол — имеют слабую связь с эритроцитами. In vitro связывание с белками плазмы крови человека флутиказона фуроата и вилантерола было высоким и в среднем составляло > 99,6% и 93,9%, соответственно. Снижение степени связывания с белками плазмы у пациентов с почечной или печеночной недостаточностью не наблюдалось.
Флутиказона фуроат и вилантерол являются субстратами Р-гликопротеина (Р-гп). Тем не менее, считается, что одновременное применение комбинации флутиказона фуроат/вилантерол с ингибиторами Р-гп не изменяет системное воздействие флутиказона фуроата или вилантерола, поскольку оба препарата представляют собой хорошо абсорбируемые молекулы.
Биотрансформация
На основании in vitro данных, основные пути метаболизма флутиказона фуроата и вилантерола у человека преимущественно опосредованы CYP3A4.
Флутиказона фуроат метаболизируется главным образом посредством гидролиза группы S-фторметилового эфира карботиокислоты в метаболиты со значительно сниженной активностью кортикостероидов. Вилантерол метаболизируется преимущественно посредством О-деалкилирования в ряд метаболитов со значительно сниженной активностью β1- и β2-агонистов.
Выведение
После приема внутрь у человека флутиказона фуроат выводится преимущественно в виде метаболитов, которые выделяются практически исключительно с калом. С мочой выводится < 1% дозы.
После приема внутрь у человека вилантерол выводится преимущественно посредством метаболизма. Метаболиты выделяются с мочой и калом (70% и 30% дозы, соответственно). Период полувыведения вилантерола из плазмы после однократного ингаляционного введения комбинации флутиказона фуроат/вилантерол составил в среднем 2,5 часа. Эффективный период полувыведения для накопления вилантерола составляет 16,0 часов у пациентов с астмой и 21,3 часа у пациентов с ХОБЛ, что было установлено в результате ингаляционного введения многократных доз вилантерола 25 мкг.
Дети
У подростков (12 лет или старше) изменение дозировки не рекомендуется.
Фармакокинетика комбинации флутиказона фуроат/вилантерол у пациентов в возрасте младше 12 лет не изучена. Безопасность и эффективность комбинации флутиказона фуроат/вилантерол у детей в возрасте младше 12 лет не установлены.
Особые группы пациентов
Пациенты пожилого возраста (>65 лет)
Влияние возраста на фармакокинетику флутиказона фуроата и вилантерола было установлено в исследованиях III фазы с участием пациентов с ХОБЛ и астмой. Нет доказательств того, что возраст (12-84) влияет на фармакокинетику флутиказона фуроата и вилантерола у пациентов с астмой.
Нет доказательств того, что возраст влияет на фармакокинетику флутиказона фуроата у пациентов с ХОБЛ, тогда как отмечалось повышение (37%) покажет AUC (0-24) вилантерола в возрастном диапазоне от 41 до 84 лет. У пациента пожилого возрастании (84 года) с низкой массой тела (35 кг) предполагается, что показатель AUC (0-24) вилантерола будет на 35% выше предполагаемого значения по популяции (пациент с ХОБЛ в возрасте 60 лет и массой тела 70 кг), тогда как показатель Сmах оставался неизменным. Маловероятно, что данные различия являются значимыми с клинической точки зрения. Рекомендации по изменению режима дозирования у пациентов с астмой и пациентов с ХОБЛ отсутствуют.
Почечная недостаточность
Исследование клинической фармакологии комбинации флутиказона фуроат/вилантерол показало, что тяжелая почечная недостаточность (клиренс креатинина <30 мл/мин) не приводила к значительно большей экспозиции флутиказона фуроата или вилантерола или более выраженному системному воздействию кортикостероидов или бета2-агонистов по сравнению с показателями у пациентов с нормальной функцией почек.
Коррекции режима дозирования у пациентов с почечной недостаточностью не требуется. Влияние гемодиализа не изучено.
Печеночная недостаточность
После применения многократных доз комбинации флутиказона фуроат/вилантерол на протяжении 7 дней наблюдалось усиление системного воздействия флутиказона фуроата (до трехкратного увеличения по измерению показателя AUC(0-24)) у пациентов с печеночной недостаточностью (А, В или С по классификации Чайлд-Пью) по сравнению со здоровыми субъектами. Усиление системного воздействия флутиказона фуроата у пациентов с умеренной печеночной недостаточностью (В по классификации Чайлд-Пью; комбинация флутиказона фуроат/вилантерол 184/22 микрограмма) ассоциировалось со средним снижением уровня кортизола в сыворотке на 34% по сравнению со здоровыми субъектами. Нормализованное по дозе системное воздействие флутиказона фуроата было идентичным у пациентов с умеренной и тяжелой печеночной недостаточностью (В или С по классификации Чайлд-Пью).
После применения многократных доз комбинации флутиказона фуроат/вилантерол на протяжении 7 дней не наблюдалось существенного усиления системного воздействия вилантерола (Сmах и AUC) у пациентов с легкой, умеренной или тяжелой печеночной недостаточностью (А, В или С по классификации Чайлд-Пью).
Комбинация флутиказона фуроат/вилантерол не оказывает значимое с клинической точки зрения воздействие на бета-адренергические системные эффекты (частота сердечных сокращений или концентрация калия в сыворотке) у пациентов с легкой или умеренной печеночной недостаточностью (вилантерол, 22 микрограмма) или с тяжелой печеночной недостаточностью (вилантерол, 12,5 микрограмма) по сравнению со здоровыми субъектами.
Другие особые группы пациентов
У пациентов из Восточной Азии, Японии или Юго-Восточной Азии с астмой (12-13% пациентов) предполагаемое значение AUC(0-24) флутиказона фуроата было в среднем на 33%-53% выше по сравнению с представителями других расовых групп. Тем не менее, не было получено доказательств того, что более высокое системное воздействие у пациентов данной популяции связано с более сильным влиянием на выделение кортизола с мочой за 24 часа. В среднем, предполагается, что показатель Сmах вилантерола будет на 220-287% выше, а показатель AUC(0-24) у пациентов азиатского происхождения будет сопоставим с аналогичным показателем у пациентов из других расовых групп. Тем не менее, не было получено доказательств того, что данный более высокий показатель Сmах вилантерола приводил к клинически значимому влиянию на частоту сердечных сокращений.
У пациентов из Восточной Азии, Японии или Юго-Восточной Азии с ХОБЛ (13-14% пациентов) предполагаемое значение AUC(0-24) флутиказона фуроата было в среднем на 23%-30% выше по сравнению с представителями европеоидной расы. Тем не менее, не было получено доказательств того, что более высокое системное воздействие у пациентов данной популяции связано с более сильным влиянием на выделение кортизола с мочой за 24 часа. У пациентов с ХОБЛ расовая принадлежность не оказывала влияния на расчетные фармакокинетические параметры вилантерола.
Пол, масса тела и ИМТ
В результате популяционного фармакокинетического анализа III фазы не были получены доказательства того, что пол, масса тела или ИМТ (индекс массы тела) влияют на фармакокинетику флутиказона фуроата. Анализ проводился на основании данных у 1213 пациентов с астмой (712 женщин) и 1225 пациентов с ХОБЛ (392 женщины).
В результате популяционного фармакокинетического анализа не были получены доказательства того, что пол, масса тела или ИМТ влияют на фармакокинетику вилантерола. Анализ проводился на основании данных у 856 пациентов с астмой (500 женщин) и 1091 пациентов с ХОБЛ (340 женщин).
Коррекции режима дозирования на основании пола, массы тела или ИМТ не требуется.