Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Риоцигуат
-
Нозологическая классификация
-
Код CAS
-
Характеристика
-
Фармакология
-
Применение вещества Риоцигуат
-
Противопоказания
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Риоцигуат
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Источники информации
-
Торговые названия с действующим веществом Риоцигуат
Русское название
Риоцигуат
Английское название
Riociguat
Латинское название
Riociguatum (род. Riociguati)
Химическое название
метил N-[4,6-диамино-2-[1-[(2-фторфенил)метил]пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил]-N-метилкарбамат
Брутто формула
C20H19FN8O2
Фармакологическая группа вещества Риоцигуат
Нозологическая классификация
Код CAS
625115-55-1
Характеристика
Кристаллическое негигроскопичное вещество от белого до желтоватого цвета с молекулярной массой 422,42 г/моль. В твердом виде устойчив к температуре, свету и влажности.
Растворимость при 25 °C в воде — 4 мг/л, в этаноле — 800 мг/л, в 0,1 HCl (pH 1) — 250 мг/л и в буфере (фосфатном), pH 7 — 3 мг/л. В диапазоне pH от 2 до 4 растворимость сильно зависит от pH. Растворимость увеличивается при более низких значениях pH.
Фармакология
Фармакодинамика
Риоцигуат является стимулятором растворимой гуанилатциклазы (рГЦ), фермента сердечно-легочной системы и рецептора оксида азота (NО).
При связывании NО с рГЦ фермент катализирует синтез сигнальной молекулы циклического гуанозинмонофосфата (цГМФ). Внутриклеточный цГМФ играет важную роль в регуляции процессов, влияющих на тонус сосудов, пролиферацию, фиброз и воспаление.
Легочная гипертензия ассоциируется с эндотелиальной дисфункцией, нарушением синтеза оксида азота и недостаточной стимуляцией метаболического пути NO-рГЦ-цГМФ. Риоцигуат имеет двойной механизм действия. Он сенсибилизирует рГЦ к эндогенному NО путем стабилизации связи NO-рГЦ. Риоцигуат также напрямую стимулирует рГЦ через другой участок связи, независимо от NO.
Риоцигуат восстанавливает метаболический путь NO-рГЦ-цГМФ и вызывает увеличение продукции цГМФ с последующей вазодилатацией.
Существует прямая связь между концентрацией риоцигуата в плазме крови и гемодинамическими параметрами, такими как системное сосудистое сопротивление, сАД, легочное сосудистое сопротивление (ЛСС) и сердечный выброс.
Гемодинамические параметры были оценены у пациентов с хронической тромбоэмболической легочной гипертензией (ХТЭЛГ) в исследовании CHEST-1. Катетеризация правых отделов сердца была выполнена в начале и в конце исследования 233 пациентам. Статистически значимое снижение ЛСС (−246 дин·с·см-5) было показано в группе пациентов, получавших риоцигуат, по сравнению с плацебо. Наблюдалось также улучшение других гемодинамических параметров (не указанных заранее в качестве конечных точек), в т.ч. снижение давления в легочной артерии, увеличение сердечного индекса.
Гемодинамические параметры были оценены у пациентов с легочной артериальной гипертензией (ЛАГ) в исследовании PATENT-1. Катетеризация правых отделов сердца проведена в начале и в конце исследования 339 пациентам.
Статистически значимое снижение ЛСС (−226 дин·с·см-5) было показано в группе индивидуального титрования риоцигуата (до максимальной дозы 2,5 мг 3 раза в сутки) по сравнению с плацебо. Отмечено также улучшение других гемодинамических параметров (не указанных заранее в качестве конечных точек) для группы с индивидуальным титрованием дозы по сравнению с плацебо, в т.ч. снижение давления в легочной артерии и увеличение сердечного индекса.
Биомаркеры
В исследовании CHEST-1 при приеме риоцигуата отмечено существенное снижение N-концевого фрагмента предшественника натрийуретического пептида головного мозга (NT-proBNP), изменение с поправкой на плацебо от исходного уровня −444 нг/л, 95% ДИ: от −843 до −45. В исследовании PATENT-1 риоцигуат продемонстрировал статистически значимое снижение NT-proBNP, изменение с поправкой на плацебо от исходного уровня — 432 нг/л, 95% ДИ: от −782 до −82.
Фармакокинетика
Фармакокинетика риоцигуата пропорциональна дозе в диапазоне от 0,5 до 2,5 мг. Межиндивидуальная вариабельность экспозиции риоцигуата (AUC) для всех доз составляет приблизительно 60%, индивидуальная вариабельность — примерно 30%.
Всасывание и распределение
Абсолютная биодоступность риоцигуата — около 94%. Cmax в плазме крови достигается в течение 1,5 ч после приема внутрь. Прием пищи не влияет на биодоступность риоцигуата.
Биодоступность (AUC и Cmax) измельченных таблеток, суспендированных в яблочном пюре или в воде, сопоставима с биодоступностью цельных таблеток.
Vss составляет приблизительно 30 л. Связывание с белками крови — около 95%. Основными связывающими компонентами являются альбумин сыворотки крови и альфа1-кислый гликопротеин.
Метаболизм и выведение
Риоцигуат метаболизируется преимущественно с участием изоферментов CYP1A1, CYP3A4, CYP3A5 и CYP2J2. Образование основного активного метаболита M1 (фармакологическая активность от 1/10 до 1/3 риоцигуата) катализируется CYP1A1, который индуцируется полициклическими ароматическими углеводородами, такими как те, что присутствуют в сигаретном дыме. Далее M1 метаболизируется до неактивного N-глюкуронида. Концентрация M1 в плазме крови у пациентов с ЛАГ примерно вдвое ниже, чем концентрация риоцигуата.
После перорального приема радиоактивно меченого риоцигуата здоровыми добровольцами примерно 40 и 53% общей радиоактивности выводилось почками и через кишечник соответственно. По-видимому, существует значительная вариабельность доли метаболитов и неизмененного риоцигуата, выводимого из организма, но метаболиты были основными компонентами экскретируемой дозы у большинства добровольцев.
Средний системный клиренс риоцигуата составлял около 1,8 л/ч у пациентов с ЛАГ и около 3,4 л/ч у здоровых добровольцев. Конечный T1/2 составлял около 12 ч у пациентов и 7 ч у здоровых людей.
Риоцигуат является субстратом транспортных белков P-gp и BCRP.
Зависимость параметров фармакокинетики от некоторых факторов
Клинически значимого влияния возраста, пола, массы тела, расы/этнической принадлежности на фармакокинетику риоцигуата или M1 не наблюдается. Коррекции дозы не требуется.
Доклиническая токсикология
Канцерогенность, мутагенность, влияние на фертильность
Канцерогенность. Исследования канцерогенности риоцигуата проводились на мышах и крысах. У мышей при пероральном применении риоцигуата (до 25 мг/кг/сут у самцов и 32 мг/кг/сут у самок) в течение периода до 2 лет признаков канцерогенности не отмечено. Плазменная экспозиция (AUC) несвязанного риоцигуата у мышей при максимальной дозе в 6 раз превышала экспозицию у человека.
У крыс при пероральном применении риоцигуата (до 20 мг/кг/сут) сроком до 2 лет не было выявлено признаков канцерогенности. Плазменная экспозиция (AUC) несвязанного риоцигуата у них в максимальной дозе в 7 раз превышала экспозицию у человека.
Мутагенность. Риоцигуат и M1 не проявляли генотоксичности в in vitro тесте оценки обратных мутаций у бактерий (тест Эймса), in vitro тесте на хромосомные аберрации на V79 клетках китайского хомячка и in vivo в микроядерном тесте у мышей.
Влияние на фертильность. Не наблюдалось влияния риоцигуата на фертильность самцов и самок крыс при пероральном применении риоцигуата (до 30 мг/кг/сут) до и в течение всего периода спаривания у самцов до, во время спаривания и в течение 7 дней беременности у самок. Доза, не вызывавшая побочных эффектов, в 37 раз превышала МРДЧ, исходя из площади поверхности тела.
Токсикология у животных
У растущих крыс отмечалось влияние на формирование костей, включая утолщение пластин роста, дезорганизацию губчатой кости и диффузный гиперостоз.
Клинические исследования
ХТЭЛГ
Эффективность риоцигуата была оценена в рандомизированном двойном слепом плацебо-контролируемом международном многоцентровом исследовании (CHEST-1), которое включало 261 пациента с ХТЭЛГ. Пациенты включались в исследование, если они были неоперабельны для проведения легочной эндартерэктомии, с ЛСС >300 дин·с·см-5 и давлением в легочной артерии >25 мм рт.ст., измеренном не менее чем через 90 дней после начала полной антикоагуляции или имели рецидивирующую или персистирующую легочную гипертензию, определяемую как ЛСС >300 дин·с·см-5, измеренное не менее чем через 180 дней после проведения легочной эндартерэктомии.
Пациенты были рандомизированы для приема риоцигуата в дозе до 2,5 мг 3 раза в сутки (n=173) или плацебо (n=88). Начальная доза для всех пациентов составляла 1 мг 3 раза в сутки. Пациенты с сАД <95 мм рт. ст. были исключены из исследования. Дозу риоцигуата титровали каждые 2 нед в зависимости от сАД пациента и признаков или симптомов гипотензии. Стабильные дозы пероральных антикоагулянтов, диуретиков, дигиталиса, БКК и кислорода были разрешены, но не допускалась одновременная терапия донорами NO, антагонистами рецепторов эндотелина, аналогами простациклина, специфическими ингибиторами ФДЭ-5 (такими как силденафил, тадалафил или варденафил) и неспецифическими ингибиторами ФДЭ (например, дипиридамол или теофиллин).
Первичной конечной точкой исследования было изменение дистанции от исходного уровня в тесте 6-минутной ходьбы (6МХД) к 16-й нед. Средний возраст пациентов составлял 59 лет (от 18 до 80 лет). В исследовании 72% пациентов имели неоперабельную ХТЭЛГ, 28% — рецидивирующую или персистирующую легочную гипертензию после легочной эндартерэктомии. Большинство пациентов имели функциональный класс (по классификации ВОЗ) II (31%) или III (64%) в начале исследования. Средний исходный 6МХД составлял 347 метров. В исследовании у 77% пациентов доза была доведена до максимальной — 2,5 мг 3 раза в сутки; у 13, 6, 4 и 1% пациентов подобранные поддерживающие дозы риоцигуата составляли 2; 1,5; 1 и 0,5 мг 3 раза в сутки соответственно.
По результатам теста 6МХД, в течение 16 нед в исследовании CHEST-1 улучшение показателей было очевидным начиная со 2-й нед лечения. К 16-й неделе среднее увеличение показателей 6МХД с поправкой на плацебо в группе пациентов, получавших риоцигуат, составило 46 м (95% ДИ: от 25 м до 67 м; p<0,0001). В CHEST-1 разница медиан (непараметрическая оценка Ходжеса-Лемана) в тесте 6МХД составила 39 м (95% ДИ: от 25 до 54 м).
В целом улучшение в тесте 6МХД наблюдалось у 143 пациентов, получавших риоцигуат (83%), по сравнению с 50 пациентами (57%), получавшими плацебо.
Улучшение функционального класса по ВОЗ в исследовании CHEST-1 было отмечено у 57 (33%) пациентов в группе, принимавшей риоцигуат (n=173), по сравнению с 13 (15%) пациентов группы плацебо (n=87), сохранение того же класса у 107 (62%) и 68 (78%) и ухудшение у 9 (5%) и 6 (7%).
Долговременное лечение ХТЭЛГ
Открытое расширенное исследование (CHEST-2) включало 237 пациентов, завершивших исследование CHEST-1. На дату окончания исследования CHEST-2 средняя продолжительность лечения для всей популяции составляла 1077 дней (±433). Выживаемость пациентов через 1 и 2 года составила 97 и 93% соответственно. Однако ввиду отсутствия контрольной группы эти данные следует интерпретировать с осторожностью.
ЛАГ
Рандомизированное двойное слепое плацебо-контролируемое международное многоцентровое исследование (PATENT-1) было проведено с участием 443 пациентов с ЛАГ, ЛСС составляло >300 дин·с·см-5 и давление в легочной артерии — >25 мм рт.ст.
Пациенты были рандомизированы в одну из трех групп лечения: риоцигуат с титрованием дозы до 1,5 мг (n=63), 2,5 мг (n=254) или плацебо (n=126) 3 раза в сутки. Пациенты с сАД <95 мм рт. ст. были исключены из исследования. Начальная доза риоцигуата составляла 1 мг 3 раза в сутки. Дозу увеличивали каждые 2 нед в зависимости от сАД пациента и признаков или симптомов гипотензии. Разрешалось применение пероральных антикоагулянтов, диуретиков, дигиталиса, БКК и кислорода. В этом исследовании 50% пациентов ранее не получали лечения, 44% ранее получали лечение антагонистами рецепторов эндотелина (АРЭ), 6% получали предварительное лечение аналогами простациклина (АП) (ингаляционно, перорально или п/к). Пациенты, прошедшие предварительное лечение, определялись как пациенты, которые получали стабильное лечение в течение 3 мес либо — АРЭ или АП; риоцигуат применяли в сочетании с фоновой терапией.
Первичной конечной точкой исследования было изменение от исходного уровня в сравнении с плацебо в тесте 6МХД после 12 нед лечения в группе, получавшей риоцигуат в дозе 2,5 мг. Средний возраст пациентов составлял 51 год, примерно 80% составляли женщины. Этиология ЛАГ была различной: идиопатическая ЛАГ (61%), наследственная (2%), ЛАГ, ассоциированная с заболеванием соединительной ткани (25%), врожденным пороком сердца (8%), портальной гипертензией (3%) или употреблением анорексигена или амфетамина (1%). Большинство пациентов в начале исследования имели функциональный класс II (42%) или III (54%) по ВОЗ. Общий средний исходный показатель 6МХД составлял 363 метра. Примерно у 75% пациентов доза была повышена до максимальной — 2,5 мг 3 раза в сутки к 12-й нед; 15, 6, 3 и 2% получали подобранные поддерживающие дозы 2; 1,5; 1 и 0,5 мг 3 раза в сутки соответственно.
По результатам исследования PATENT-1, у 193 пациентов, получавших риоцигуат (76%), наблюдалось улучшение в тесте 6МХД по сравнению с 74 пациентами (59%), получавшими плацебо.
Улучшения в тесте 6МХД были очевидны начиная со 2-й недели. К 12-й неделе среднее увеличение 6МХД с поправкой на плацебо в группе пациентов, получавших риоцигуат, составило 36 м (95% ДИ: от 20 м до 52 м; p <0,0001). В исследовании PATENT-1 разница медиан (непараметрическая оценка Ходжеса-Лемана) в тесте 6МХД составила 29 м (95% ДИ, 17–40 м). Данные исследования титрования дозы в одной из групп (n=63) не предполагают дополнительного эффекта при увеличении дозы с 1,5 до 2,5 мг 3 раза в сутки.
Оценка функционального класса по ВОЗ в группе индивидуального титрования дозы исследования PATENT-1 показала, что улучшение было отмечено у 53 (21%) пациентов в группе, принимавшей риоцигуат (n=254), по сравнению с 18 (14%) пациентов группы плацебо (n=125), сохранение того же класса у 192 (76%) и 89 (71%) и ухудшение у 9 (4%) и 18 (14%).
Время до клинического ухудшения было комбинированной конечной точкой, определяемой как смерть (смертность от всех причин), трансплантация сердца/легких, предсердная септостомия, госпитализация из-за стойкого обострения легочной гипертензии, начало нового лечения ЛАГ, стойкое снижение 6МХД и стойкое ухудшение функционального класса по ВОЗ.
Анализ влияния риоцигуата в исследовании PATENT-1 на случаи клинического ухудшения показал, что в группе пациентов, получавших риоцигуат (n=254) наблюдалось значительно меньше случаев клинического ухудшения к 12-й нед (последний визит) по сравнению с плацебо (n=126). Любое клиническое ухудшение* было отмечено у 3 (1,2%) пациентов в сравнении с 8 (6,3%) в группе плацебо, смерть — у 2 (0,8%) и 3 (2,4%), госпитализация в связи с легочной гипертензией — у 1 (0,4%) и 4 (3,2%), снижение 6МХД из-за из-за легочной гипертензии — у 1 (0,4%) и 2 (1,6%), стойкое ухудшение функционального класса на фоне ЛАГ — у 0 1 (0,8%), начало нового лечения ЛАГ — у 1 (0,4%) и 5 (4,0%).
* p-значение = 0,0285 (оценка Mantel-Haenszel).
У пациентов, получавших риоцигуат, была значительная задержка во времени до клинического ухудшения по сравнению с пациентами, получавшими плацебо (p=0,0046; стратифицированный логранговый критерий).
Долгосрочное лечение ЛАГ
Открытое расширенное исследование (PATENT-2) включало 396 пациентов, завершивших исследование PATENT-1. На дату окончания исследования PATENT-2 продолжительность лечения для всей популяции составляла 1146 дней (±479). Вероятность выживания через 1 и 2 года составила 97 и 93% соответственно. Без контрольной группы эти данные следует интерпретировать с осторожностью.
Применение вещества Риоцигуат
По данным rxlist.com (2020), риоцигуат показан для лечения следующих заболеваний.
Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ)
Риоцигуат показан для лечения у взрослых персистирующей или рецидивирующей ХТЭЛГ (группа 4 по классификации ВОЗ) после оперативного лечения или неоперабельной ХТЭЛГ для улучшения переносимости физической нагрузки и функционального класса по ВОЗ.
Легочная артериальная гипертензия (ЛАГ)
Риоцигуат показан для лечения ЛАГ у взрослых (группа 1 по классификации ВОЗ) для улучшения переносимости физической нагрузки, функционального класса по ВОЗ и отсрочки клинического ухудшения.
Эффективность была показана у пациентов, получавших монотерапию риоцигуатом или в комбинации с антагонистами рецепторов эндотелина или простаноидами. Исследования, подтверждающие эффективность, включали преимущественно пациентов с функциональным классом II–III по ВОЗ и этиологией идиопатической или наследственной ЛАГ (61%) или ЛАГ, ассоциированной с болезнями соединительной ткани (25%).
Противопоказания
Гиперчувствительность, одновременное применение с нитратами или донаторами оксида азота (такими как амилнитрит) в любой лекарственной форме (см. «Взаимодействие»); одновременное применение со специфическими ингибиторами ФДЭ-5 (такими как силденафил, тадалафил, варденафил) и неспецифическими ингибиторами ФДЭ (такими как дипиридамол, теофиллин) (см. «Взаимодействие»); легочная гипертензия, ассоциированная с идиопатическими интерстициальными пневмониями (ЛГ-ИИП); беременность и период грудного вскармливания (см. «Применение при беременности и кормлении грудью» и «Меры предосторожности»).
Применение при беременности и кормлении грудью
Беременность
Обобщение имеющихся данных
На основании данных исследований репродукции у животных, риоцигуат может оказывать токсическое действие на эмбрион и плод и вызывать выкидыш при применении беременной женщиной и противопоказан во время беременности (см. «Противопоказания»). Имеются ограниченные доступные данные об использовании риоцигуата у беременных женщин.
В исследованиях репродукции на животных показано, что при пероральном применении у беременных крыс во время органогенеза риоцигуат оказывал тератогенное и эмбриотоксическое действие при экспозиции, превышающей примерно в 8 и 2 раза соответственно экспозицию у человека. В исследованиях репродукции у беременных кроликов при пероральном применении во время органогенеза риоцигуат вызывал выкидыши и интоксикацию плода при экспозиции, превышающей примерно в 4 и 13 раз соответственно таковую при МРДЧ.
Если риоцигуат применяется во время беременности или беременность наступила в период лечения риоцигуатом, пациентку следует проинформировать о потенциальной опасности для плода. Предполагаемый фоновый риск развития серьезных врожденных дефектов и выкидыша у женщин неизвестен. При любой беременности существует фоновый риск развития врожденного порока, выкидыша или других неблагоприятных исходов. В общей популяции в США оцениваемый фоновый уровень риска серьезных врожденных пороков развития и выкидыша при клинически установленной беременности составляет 2–4 и 15–20% соответственно.
Данные исследований на животных
У крыс при пероральном применении риоцигуата (1, 5 и 25 мг/кг/сут) на протяжении органогенеза наблюдался повышенный риск развития дефекта межжелудочковой перегородки сердца при максимальной тестируемой дозе. При максимальной дозе отмечена токсичность для матери (снижение массы тела). Постимплантационные потери статистически значимо увеличивались по сравнению с таковыми при применении дозы 5 мг/кг/сут. Экспозиция в плазме при самой низкой дозе, при которой не наблюдалось побочных эффектов, была примерно в 0,4 раза выше, чем у человека при МРДЧ 2,5 мг 3 раза в сутки при расчете на основании AUC несвязанного риоцигуата у крыс и человека. Плазменная экспозиция при наивысшей дозе (25 мг/кг/сут) примерно в 8 раз превышала экспозицию у человека при МРДЧ, в то время как экспозиция при дозе (5 мг/кг/сут) была примерно в 2 раза выше, чем у человека при МРДЧ. У кроликов, получавших дозы 0,5; 1,5 и 5 мг/кг/сут, наблюдалось увеличение самопроизвольных выкидышей, начиная с дозы 1,5 мг/кг, и увеличение частоты резорбции плода при дозе 5 мг/кг/сут. Плазменная экспозиция при этих дозах была выше в 4 и 13 раз соответственно, чем экспозиция у человека при МРДЧ.
Кормление грудью
Обобщение имеющихся данных
Нет данных о присутствии риоцигуата в грудном молоке женщин, его влиянии на грудного ребенка или выработку молока. Риоцигуат присутствует в молоке крыс. Из-за возможности серьезных побочных реакций риоцигуата, таких как гипотензия, у младенцев, находящихся на грудном вскармливании, рекомендуется прекратить грудное вскармливание во время лечения риоцигуатом.
Тест на беременность
У пациенток с репродуктивным потенциалом должен быть отрицательный тест на беременность до начала лечения риоцигуатом, ежемесячно во время лечения и в течение 1 мес после прекращения лечения (см. «Меры предосторожности»).
Побочные действия вещества Риоцигуат
Следующие серьезные побочные реакции описаны в разделе «Меры предосторожности»:
— эмбриофетальная токсичность;
— гипотензия;
— кровотечение.
Результаты клинических испытаний
Поскольку клинические испытания проводятся с различным набором условий, частота побочных реакций, наблюдаемая в этих клинических испытаниях, может не совпадать с полученной в других клинических исследованиях и наблюдаемой в клинической практике.
Представленные ниже данные по безопасности отражают экспозицию риоцигуата в двух рандомизированных двойных слепых плацебо-контролируемых исследованиях у пациентов с неоперабельной или рецидивирующей/персистирующей ХТЭЛГ (CHEST-1) и пациентов с ЛАГ, ранее не получавших лечения или получавших лечение (PATENT-1). Возраст пациентов (риоцигуат: n=490; плацебо: n=214) составлял от 18 до 80 лет (см. Клинические исследования).
Профили безопасности риоцигуата у пациентов с неоперабельной или рецидивирующей/персистирующей ХТЭЛГ (CHEST-1) и пациентов с ЛАГ, ранее не получавших или получавших лечение (PATENT-1), были сходны. Поэтому нежелательные лекарственные реакции (НЛР), выявленные в 12- и 16-недельных плацебо-контролируемых исследованиях ЛАГ и ХТЭЛГ соответственно и возникавшие чаще при приеме риоцигуата, чем при приеме плацебо (≥3%), были объединены. Большинство побочных реакций связаны с вазодилататирующим действием риоцигуата.
Общая частота прекращения приема из-за нежелательных явлений в основных плацебо-контролируемых исследованиях составила 2,9% для риоцигуата и 5,1% для плацебо (объединенные данные).
Побочные реакции, возникающие чаще (≥3%) при приеме риоцигуата, чем при приеме плацебо (по результатам исследований CHEST-1 и PATENT-1)
В скобках — частота побочных эффектов при приеме плацебо.
Головная боль — 27% (18%).
Диспепсия и гастрит — 21% (8%).
Головокружение — 20% (13%).
Тошнота — 14% (11%).
Диарея — 12% (8%).
Гипотензия — 10% (4%).
Рвота — 10% (7%).
Анемия, включая лабораторные показатели — 7% (2%).
ГЭРБ — 5% (2%).
Запор — 5% (1%).
Другими эффектами, которые наблюдались чаще при приеме риоцигуата по сравнению с плацебо и, возможно, связанными с лечением, были сердцебиение, заложенность носа, носовое кровотечение, дисфагия, вздутие живота и периферические отеки. При более длительном наблюдении в неконтролируемых долгосрочных расширенных исследованиях профиль безопасности был аналогичен профилю безопасности, наблюдаемому в плацебо-контролируемых исследованиях фазы 3.
Взаимодействие
Фармакодинамическое взаимодействие
Нитраты. Одновременное применение риоцигуата и нитратов или донаторов оксида азота (таких как амилнитрит) в любой лекарственной форме противопоказано в связи с развитием гипотензии (см. «Противопоказания»). Риоцигуат в дозе 2,5 мг в форме таблеток усиливает эффект снижения АД нитроглицерином (0,4 мг сублингвально), принятым через 4 и 8 ч после приема риоцигуата. У некоторых пациентов был зарегистрирован обморок.
Ингибиторы ФДЭ-5. В исследовании взаимодействия с участием 7 пациентов с ЛАГ, получавших постоянное лечение силденафилом (20 мг 3 раза в сутки), однократные дозы риоцигуата (0,5 и 1 мг последовательно) приводили к аддитивным гемодинамическим эффектам.
У пациентов с ЛАГ, получавших постоянное лечение силденафилом (20 мг 3 раза в сутки) и риоцигуатом (от 1 до 2,5 мг 3 раза в сутки), был отмечен один смертельный случай, возможно, связанный с комбинацией этих ЛС, и высокая частота отмены терапии вследствие гипотензии.
Ингибиторы ФДЭ. Одновременное применение риоцигуата со специфическими ингибиторами ФДЭ-5 (такими как силденафил, тадалафил, варденафил) и неспецифическими ингибиторами ФДЭ (такими как дипиридамол, теофиллин) противопоказано из-за риска развития гипотензии (см. «Противопоказания»). Не следует применять силденафил, по крайней мере, в течение 24 ч до приема риоцигуата. Не следует применять риоцигуат за 24 ч до или в течение 48 ч после тадалафила.
Прием риоцигуата необходимо прекратить, по крайней мере, за 24 ч до применения ингибитора ФДЭ-5.
Клинический опыт совместного применения риоцигуата и других ингибиторов ФДЭ (например, милринон, цилостазол, рофлумиласт) ограничен.
Варфарин. Одновременное применение риоцигуата и варфарина не влияло на ПВ.
Ацетилсалициловая кислота. Одновременное применение риоцигуата и ацетилсалициловой кислоты не влияло на время кровотечения и агрегацию тромбоцитов.
Фармакокинетическое взаимодействие
Курение. Концентрация риоцигуата в плазме крови у курильщиков ниже на 50–60% по сравнению с некурящими людьми. Основываясь на фармакокинетическом моделировании, для курильщиков можно рассмотреть применение доз выше 2,5 мг 3 раза в сутки, чтобы достичь экспозиции, наблюдаемой у некурящих пациентов. Безопасность и эффективность применения риоцигуата в дозах выше 2,5 мг 3 раза в сутки не установлены. Следует рассмотреть возможность снижения дозы у пациентов, которые бросают курить.
Сильные ингибиторы CYP и P-gp/BCRP. Одновременное применение риоцигуата с сильными ингибиторами изоферментов CYP и ингибиторами P-gp/BCRP, такими как азольные противогрибковые средства (например, кетоконазол, итраконазол) или ингибиторы протеазы ВИЧ (например, ритонавир), увеличивает экспозицию риоцигуата и может привести к развитию гипотензии. При назначении риоцигуата пациентам, получающим сильные ингибиторы CYP и P-gp/BCRP, следует рассмотреть возможность применения начальной дозы риоцигуата 0,5 мг 3 раза в сутки. Необходимо наблюдение за пациентами для выявления признаков и симптомов развития гипотензии в начале и во время лечения сильными ингибиторами CYP и P-gp/BCRP. Следует снижать дозу у пациентов, которые могут быть толерантны к гипотензивному эффекту риоцигуата.
Сильные индукторы CYP3А. Сильные индукторы CYP3A (например, рифампицин, фенитоин, карбамазепин, фенобарбитал или зверобой) могут значительно снижать экспозицию риоцигуата. Данные по дозированию риоцигуата при одновременном применении сильных индукторов CYP3A отсутствуют.
Антациды. Антациды, такие как алюминия гидроксид/магния гидроксид, снижают всасывание риоцигуата, поэтому их следует принимать не ранее чем через 1 ч после приема риоцигуата.
Влияние риоцигуата на другие ЛС
Риоцигуат не влияет на фармакокинетику мидазолама, варфарина, силденафила.
Риоцигуат (2,5 мг 3 раза в сутки) не оказывал влияния на системную экспозицию комбинированных пероральных контрацептивов, содержащих левоноргестрел и этинилэстрадиол, при одновременном применении здоровыми добровольцами женского пола.
Передозировка
В случае передозировки следует проводить тщательный мониторинг АД и поддерживать его при необходимости. Поскольку риоцигуат обладает высокой степенью связывания с белками плазмы крови, предполагается, что он не выводится с помощью диализа.
Способ применения и дозы
Внутрь. Начальная доза — 1 мг 3 раза в сутки на протяжении 2 нед. Дозу титруют в зависимости от значений сАД и наличия симптомов артериальной гипотензии. Максимальная суточная доза — 7,5 мг/сут.
Меры предосторожности
Эмбриофетальная токсичность
На основании данных исследований репродукции у животных, риоцигуат может оказывать токсическое действие на эмбрион и плод при применении беременной женщиной и противопоказан во время беременности. Пациентку следует проинформировать о потенциальной опасности для плода. У женщин с репродуктивным потенциалом необходимо исключить беременность до начала лечения, оценивать ежемесячно во время лечения и в течение 1 мес после прекращения лечения. Чтобы предотвратить беременность, женщины репродуктивного потенциала должны использовать эффективные методы контрацепции во время лечения и в течение, по крайней мере, 1 мес после прекращения лечения (см. «Применение при беременности и кормлении грудью»).
В США для всех пациенток женского пола риоцигуат доступен только при регистрации в Adempas REMS Program — Программа оценки рисков и смягчения последствий (REMS).
Гипотензия
Риоцигуат снижает АД. Необходимо учитывать возможность развития симптоматической гипотензии или ишемии у пациентов с гиповолемией, тяжелой обструкцией путей оттока из левого желудочка, исходной артериальной гипотензией, вегетативной дисфункцией, при сопутствующем лечении гипотензивными средствами или сильными ингибиторами CYP и P-gp/BCRP (см. «Взаимодействие»). При появлении у пациента признаков или симптомов гипотензии может понадобиться снижение дозы риоцигуата.
Кровотечение
В плацебо-контролируемых клинических испытаниях серьезные кровотечения возникли у 2,4% пациентов, принимавших риоцигуат, по сравнению с 0% пациентов, получавших плацебо. Серьезное кровохарканье развилось у 5 (1%) пациентов, принимавших риоцигуат, по сравнению с 0 пациентами, принимавшими плацебо, включая одно событие со смертельным исходом. Серьезные геморрагические осложнения также включали 2 пациенток с вагинальным кровотечением, 2 — с кровотечением из места установки катетера и по 1 пациенту — с субдуральной гематомой, гематемезисом и внутрибрюшным кровотечением.
Веноокклюзионная болезнь легких
Легочные вазодилататоры могут значительно ухудшить статус ССС пациентов с веноокклюзионной болезнью легких (ВОБЛ), поэтому применение риоцигуата таким пациентам не рекомендуется. При появлении признаков отека легких следует думать о возможности развития ассоциированной ВОБЛ и в случае подтверждения прекратить лечение риоцигуатом.
Дети
Безопасность и эффективность применения риоцигуата у педиатрических пациентов не установлены.
Применение в гериатрии
Из общего числа пациентов в клинических исследованиях риоцигуата 23% были в возрасте 65 лет и старше, 6% — 75 лет или старше. Не обнаружено различий в безопасности или эффективности риоцигуата у этих пациентов и более молодых пациентов. В других клинических исследованиях также не было выявлено различий между пожилыми и более молодыми пациентами, но нельзя исключать более высокую чувствительность некоторых пожилых людей. У пожилых пациентов отмечается более высокая экспозиция риоцигуата.
Нарушение функции почек
Безопасность и эффективность риоцигуата не были изучены у пациентов с клиренсом креатинина <15 мл/мин или находящимися на гемодиализе.
Нарушение функции печени
Безопасность и эффективность риоцигуата не были продемонстрированы у пациентов с тяжелой печеночной недостаточностью (класс С по шкале Чайлд-Пью).
Источники информации
rxlist.com, 2020 г.
Торговые названия с действующим веществом Риоцигуат
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Адемпас® |
от 64376.00 до 66361.00 |
Адемпас — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-002639
Торговое наименование:
Адемпас®
Международное непатентованное наименование:
риоцигуат
Лекарственная форма:
таблетки, покрытые пленочной оболочкой
Состав
Одна таблетка, покрытая пленочной оболочкой, 0,5 мг содержит:
Действующее вещество: риоцигуат микронизированный 0,50 мг.
Вспомогательные вещества: целлюлоза микрокристаллическая 35,00 мг; кросповидон 6,00 мг; гипромеллоза 5 сП 3,00 мг; лактозы моногидрат 39,80 мг; магния стеарат 0,60 мг; натрия лаурилсульфат 0,10 мг;
пленочная оболочка: гидроксипропилцеллюлоза 1,10 мг, гипромеллоза 3 сП 0,36 мг, пропиленгликоль 0,21 мг, титана диоксид 0,83 мг.
Одна таблетка, покрытая пленочной оболочкой, 1,0 мг содержит:
Действующее вещество: риоцигуат микронизированный 1,00 мг.
Вспомогательные вещества: целлюлоза микрокристаллическая 35,00 мг; кросповидон 6,00 мг; гипромеллоза 5 сП 3,00 мг; лактозы моногидрат 39,20 мг; магния стеарат 0,60 мг; натрия лаурилсульфат 0,20 мг;
пленочная оболочка: гидроксипропилцеллюлоза 1,10 мг, гипромеллоза 3 сП 0,36 мг, пропиленгликоль 0,21 мг, титана диоксид 0,82 мг, краситель железа оксид желтый 0,01 мг.
Одна таблетка, покрытая пленочной оболочкой, 1,5 мг содержит:
Действующее вещество: риоцигуат микронизированный 1,50 мг.
Вспомогательные вещества: целлюлоза микрокристаллическая 35,00 мг; кросповидон 6,00 мг; гипромеллоза 5 сП 3,00 мг; лактозы моногидрат 38,70 мг; магния стеарат 0,60 мг; натрия лаурилсульфат 0,20 мг;
пленочная оболочка: гидроксипропилцеллюлоза 1,10 мг, гипромеллоза 3 сП 0,36 мг, пропиленгликоль 0,21 мг, титана диоксид 0,73 мг, краситель железа оксид желтый 0,10 мг.
Одна таблетка, покрытая пленочной оболочкой, 2,0 мг содержит:
Действующее вещество: риоцигуат микронизированный 2,00 мг.
Вспомогательные вещества: целлюлоза микрокристаллическая 35,00 мг; кросповидон 6,00 мг; гипромеллоза 5 сП 3,00 мг; лактозы моногидрат 38,20 мг; магния стеарат 0,60 мг; натрия лаурилсульфат 0,20 мг;
пленочная оболочка: гидроксипропилцеллюлоза 1,10 мг, гипромеллоза 3 сП 0,36 мг, пропиленгликоль 0,21 мг, титана диоксид 0,61 мг, краситель железа оксид желтый 0,20 мг, краситель железа оксид красный 0,02 мг.
Одна таблетка, покрытая пленочной оболочкой, 2,5 мг содержит:
Действующее вещество: риоцигуат микронизированный 2,50 мг.
Вспомогательные вещества: целлюлоза микрокристаллическая 35,00 мг; кросповидон 6,00 мг; гипромеллоза 5 сП 3,00 мг; лактозы моногидрат 37,70 мг; магния стеарат 0,60 мг; натрия лаурилсульфат 0,20 мг;
пленочная оболочка: гидроксипропилцеллюлоза 1,10 мг, гипромеллоза 3 сП 0,36 мг, пропиленгликоль 0,21 мг, титана диоксид 0,35 мг, краситель железа оксид желтый 0,40 мг, краситель железа оксид красный 0,08 мг.
Описание
Таблетки, покрытые пленочной оболочкой, 0,5 мг: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, белого цвета, на одной стороне методом выдавливания нанесено «R» и «0.5», на другой стороне логотип компании Байер в виде креста.
Таблетки, покрытые пленочной оболочкой, 1,0 мг: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, бледно-желтого цвета, на одной стороне методом выдавливания нанесено «R1», на другой стороне логотип компании Байер в виде креста.
Таблетки, покрытые пленочной оболочкой, 1,5 мг: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, желтого цвета, на одной стороне методом выдавливания нанесено «R» и «1.5», на другой стороне логотип компании Байер в виде креста.
Таблетки, покрытые пленочной оболочкой, 2,0 мг: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, бледно-оранжевого цвета, на одной стороне методом выдавливания нанесено «R2», на другой стороне логотип компании Байер в виде креста.
Таблетки, покрытые пленочной оболочкой, 2,5 мг: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, коричневато-оранжевого цвета, на одной стороне методом выдавливания нанесено «R» и «2.5», на другой стороне логотип компании Байер в виде креста.
Фармакотерапевтическая группа
Гипотензивное средство — гуанилатциклазы стимулятор.
Код АТХ:
C02KX05.
Фармакологические свойства
Фармакодинамика
Механизм действия
Риоцигуат является стимулятором растворимой гуанилатциклазы (рГЦ), фермента сердечно-легочной системы и рецептора оксида азота (NO).
При связывании NO с рГЦ фермент катализирует синтез сигнальной молекулы циклического гуанозинмонофосфата (цГМФ). Внутриклеточный цГМФ играет важную роль в регуляции процессов, влияющих на тонус сосудов, пролиферацию, фиброз и воспаление.
Легочная гипертензия ассоциируется с эндотелиальной дисфункцией, нарушением синтеза оксида азота и недостаточной стимуляцией метаболического пути NO-рГЦ-цГМФ. Риоцигуат имеет двойной механизм действия. Он сенсибилизирует рГЦ к эндогенному NO путем стабилизации связи NO-рГЦ. Риоцигуат также напрямую стимулирует рГЦ через другой участок связи, независимо от NO.
Риоцигуат восстанавливает метаболический путь NO-рГЦ-цГМФ и вызывает увеличение продукции цГМФ.
Клиническая эффективность
Эффективность у пациентов с хронической тромбоэмболической легочной гипертензией (ХТЭЛГ)
Эффективность оценивалась в ходе рандомизированного двойного слепого международного многоцентрового плацебо-контролируемого исследования III фазы (CHEST-1), включавшего неоперабельных пациентов или пациентов, с персистирующей или рецидивирующей ХТЭЛГ после проведенной легочной эндартерэктомии (n = 261; 31 % пациентов ФК II ВОЗ; 64 % — ФК III ВОЗ).
В ходе лечения достигнуты результаты по первичной и ряду вторичных конечных точек:
— изменение дистанции в тесте 6 минутной ходьбы (Д6МХ) к 16 неделе от исходного в сравнении с плацебо — первичная конечная точка (р < 0,0001);
— существенное снижение легочного сосудистого сопротивления (ЛСС) (р<0,0001);
— существенное снижение N-терминального фрагмента предшественника мозгового натрийуретического пептида (NT-proBNP) (р<0,0001); существенное улучшение как минимум на один ФК по классификации ВОЗ (р = 0,0026).
Наблюдалось улучшение комплекса гемодинамических параметров в группе риоцигуата по сравнению с плацебо: статистически значимое снижение ЛСС, среднего давления в легочной артерии (сДЛА) (р<0,0001) и увеличение сердечного индекса (СИ) (р<0,0001). Также наблюдались другие улучшения на фоне терапии риоцигуатом: индекс одышки по Боргу (р = 0,0035); EQ-5D (р<0,0001).
Долговременное лечение ХТЭЛГ. Исследование CHEST-2 включало 237 пациентов, которые завершили исследование CHEST-1.
Выживаемость пациентов составила 97 % после 1 года и 93 % — после двух лет применения препарата Адемпас®.
Эффективность у пациентов с легочной артериальной гипертензией (ЛАГ)
Эффективность оценивалась в ходе рандомизированного двойного слепого международного многоцентрового плацебо-контролируемого исследования III фазы PATENT-1- (n = 443; 42 % пациентов ФК II, 54 % ФК III по классификации ВОЗ) Больные ранее не получали лечения, либо получали терапию антагонистами рецепторов эндотелина (ЭРА) или аналогами простациклина (АП) (ингаляционно, внутрь или подкожно).
В ходе лечения достигнуты результаты по первичной и ряду вторичных конечных точек:
— изменение Д6МХ к 12 неделе в группе риоцигуата на 36 м по сравнению с плацебо (р<0,0001) — первичная конечная точка;
— снижение ЛСС (р<0,0001); снижение NT-proBNP (р<0,0001); улучшение ФК по классификации ВОЗ (р = 0,0033); увеличение времени до развития клинического ухудшения (р = 0,0046); снижение одышки по шкале Борга (р = 0,0022).
Также отмечалось улучшение качества жизни больных (LPH) (р = 0,0019). Кроме снижения ЛСС, наблюдалось улучшение других важнейших гемодинамических параметров в группе риоцигуата по сравнению с плацебо, таких как: сДЛА (р<0,0001) и увеличение СИ (р<0,0001).
Долговременное лечение ЛАГ. Исследование PATENT-2 включало 396 пациента, которые завершили исследование PATENT-1.
Выживаемость пациентов составила 97% после 1 года и 93% после 2 лет применения препарата Адепмас®.
RESPITE. Исследование у пациентов с ЛАГ, которых переводили с терапии ингибиторами ФДЭ-5 на препарат Адемпас®
Было проведено 24-недельное многоцентровое открытое исследование с включением взрослых пациентов с ЛАГ (n = 61; III ФК по ВОЗ), получающих стабильную терапию силденафилом (n = 40) или тадалафилом (n = 21) на протяжении по крайней мере 90 дней; 82% этих пациентов получали также терапию антагонистами рецепторов эндотелина. Все пациенты в исследовании были переведены с иФДЭ-5 на препарат Адемпас® (медиана продолжительности периода без лечения — 1 день для силденафила и 3 дня для тадалафила) (см. раздел «Противопоказания»).
Некоторые изменения, наблюдаемые у пациентов, завершивших исследование через 24 недели, приведены в таблице 1.
Таблица 1:
Эффекты применения препарата Адемпас® у пациентов, переведенных с терапии ингибиторами ФДЭ-5
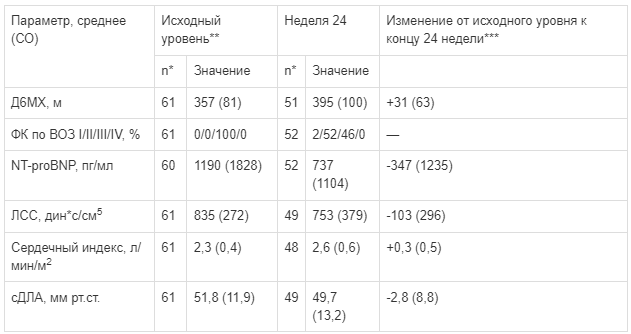
** Исходный уровень: последнее документированное значение на фоне применения ингибитора ФДЭ-5; данные представлены в виде среднего значения (СО).
*** Изменение от исходного уровня для пациентов с имеющимися данными исходно и на Неделе 24.
Пациенты с легочной гипертензией, ассоциированной с идиопатическими интерстициальными пневмониями (ЛГ-ИИП)
Рандомизированное двойное слепое плацебо-контролируемое исследование у пациентов с легочной гипертензией, ассоциированной с идиопатическими интерстициальными пневмониями (ЛГ-ИИП, группа 3 ВОЗ), сравнивающее риоцигуат и плацебо, было прекращено преждевременно из-за повышенного риска смертности и серьезных нежелательных явлений у пациентов, получающих риоцигуат, и отсутствия эффективности (см. раздел «Противопоказания »).
Фармакокинетика
Всасывание
Абсолютная биодоступность риоцигуата высокая (94 %). Риоцигуат быстро всасывается, максимальная концентрация в плазме крови (Cmax) достигается через 1-1,5 часа после приема внутрь. Всасывание риоцигуата происходит на всем протяжении желудочно-кишечного тракта (ЖКТ), преимущественно в верхних отделах. В дистальных отделах ЖКТ всасывание снижается.
Применение препарата одновременно с приемом пищи не влияло на значение площади под фармакокинетической кривой «концентрация-время» (AUC) риоцигуата, Cmax снижалась в незначительной степени (снижение на 35 %). Данное изменение считается клинически незначимым.
Биодоступность (AUC и Cmax) измельченных таблеток, суспендированных в яблочном пюре или в воде, сопоставима с биодоступностью цельных таблеток (см. раздел «Способ применения и дозы»).
Распределение
Связь с белками крови высокая и составляет приблизительно 95 %. Основными связывающими компонентами являются альбумин сыворотки крови и альфа-1-кислый гликопротеин.
Объем распределения является средним, при этом в равновесном состоянии он составляет приблизительно 30 л.
Метаболизм
N-деметилирование, катализируемое изоферментами CYP1A1, CYP3A4, CYP3A5 и CYP2J2, является основным путем метаболизма риоцигуата, приводящим к образованию его основного циркулирующего метаболита (фармакологическая активность: от 1/10 до 1/3 риоцигуата), который в дальнейшем метаболизируется в фармакологически неактивный N-глюкуронид.
Изофермент CYP1A1 катализирует образование основного метаболита риоцигуата в печени и легких. Этот процесс усиливается полициклическими ароматическими углеводородами, например, содержащимися в дыме от сигарет (см. раздел «Особые указания»).
Выведение
Весь риоцигуат (исходный препарат и метаболиты) выводится почками (3345 %) и через кишечник (48-59 %). Приблизительно от 4 до 19 % введенной дозы выводится в неизмененном виде почками, приблизительно 9-44 % -через кишечник.
На основании данных in vitro установлено, что риоцигуат и его основной метаболит являются субстратами для транспортных белков P-gp (Р-гликопротеин) и BCRP (белок резистентности рака молочной железы).
Риоцигуат является препаратом с низким клиренсом (системный клиренс равен приблизительно 3-6 л/час). Период полувыведения составляет примерно 7 часов у здоровых добровольцев и около 12 часов у пациентов.
Фармакокинетика у различных групп пациентов
Пациенты пожилого возраста
У пожилых пациентов (65 лет и старше) отмечалась более высокая концентрация риоцигуата в плазме крови, чем у молодых, при этом показатели AUC были приблизительно на 40 % выше у пожилых, главным образом, вследствие кажущегося снижения общего и почечного клиренса (см. раздел «Способ применения и дозы»).
Пациенты с нарушением функции печени
У пациентов с циррозом печени, сопровождающимся легкой степенью печеночной недостаточности (5 — 6 баллов по шкале Чайлд-Пью, класс А) не отмечалось клинически значимых изменений концентраций препарата.
У пациентов с циррозом печени, сопровождающимся умеренной печеночной недостаточностью (7 — 9 баллов по шкале Чайлд-Пью, класс В), средняя AUC риоцигуата увеличивалась на 50-70 % в сравнении со здоровыми добровольцами из группы контроля (см. раздел «Способ применения и дозы»).
Применение риоцигуата у пациентов с тяжелой печеночной недостаточностью (10 — 15 баллов по шкале Чайлд-Пью, класс С) противопоказано, поскольку клинические данные для таких пациентов отсутствуют (см. раздел «Противопоказания»).
Пациенты с нарушением функции почек
В целом у пациентов с почечной недостаточностью, средние величины концентраций риоцигуата (нормализованные по дозе и массе) были выше, чем у пациентов с нормальной функцией почек. Соответствующие показатели для основного метаболита были выше у пациентов с почечной недостаточностью в сравнении со здоровыми добровольцами. У некурящих пациентов с легким (клиренс креатинина 80-50 мл/мин), умеренным (клиренс креатинина менее 50-30 мл/мин) или тяжелым (клиренс креатинина менее 30 мл/мин) нарушением функции почек, концентрация риоцигуата в плазме крови (AUC) увеличивалась на 53 %, 139 % и 54 %, соответственно. Нет данных для пациентов с клиренсом креатинина менее 15 мл/мин или находящихся на гемодиализе. Следовательно, применение препарат противопоказано у пациентов с клиренсом креатинина менее 15 мл/мин или находящихся на диализе (см. раздел «Противопоказания»).
Поскольку риоцигуат обладает высокой степенью связывания с белками плазмы крови, возможность выведения его с помощью диализа представляется маловероятной.
Пол, этническая принадлежность, масса тела
Не выявлено существенных различий плазменных концентраций риоцигуата в зависимости от пола, этнической группы или массы тела пациента.
Показания к применению
Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ, группа 4 по классификации ВОЗ):
Адемпас® назначается для лечения взрослых пациентов при:
Легочная артериальная гипертензия (ЛАГ), группа 1 по классификации ВОЗ: Адемпас® назначается для лечения взрослых пациентов с ЛАГ для улучшения переносимости физической нагрузки, функционального класса ВОЗ и задержки клинического ухудшения.
II — III ФК по классификации ВОЗ (в монотерапии либо в комбинации с антагонистами рецепторов эндотелина или простаноидами):
Противопоказания
С осторожностью
Необходимо соблюдать дополнительную осторожность при назначении препарата в следующих ситуациях:
Применение при беременности и в период грудного вскармливания
Беременность
При беременности препарат Адемпас® противопоказан.
Период грудного вскармливания
Нет клинических данных о применении препарата Адемпас® в период грудного вскармливания. Доклинические исследования показали, что риоцигуат выделяется в грудное молоко.
Препарат Адемпас® не должен применяться женщинами в период грудного вскармливания из-за возможности развития серьезных нежелательных реакций у детей, находящихся на грудном вскармливании. Решение о прекращении грудного вскармливания или отмены/воздержания от приема препарата в период грудного вскармливания должно приниматься с учетом значимости терапии препаратом для матери.
Фертильность
Не проводилось специальных исследований с применением риоцигуата для оценки его влияния на фертильность человека.
Во время проведения лечения препаратом Адемпас® женщины репродуктивного возраста должны применять эффективные методы контрацепции.
Тератогенность и эмбриотоксичность
В исследованиях на крысах не наблюдалось воздействия на мужскую и женскую фертильность. Изучение эмбриотоксичности на моделях крыс и кроликов продемонстрировало репродуктивную токсичность риоцигуата. В исследовании на крысах наблюдался повышенный риск развития пороков сердца, так же как и уменьшение частоты наступления беременности в связи с ранней резорбцией плода при системной экспозиции препарата в организме матери, которое примерно в 8,1 раз превышало экспозицию у человека (АUС несвяз. 207 мкг*ч/л при 2,5 мг 3 раза в день). В исследовании у кроликов, начиная с уровня системной экспозиции, превышающей экспозицию препарата у человека в 3,8 раза (АиС несвяз. 207 мкг*ч/л при 2,5 мг 3 раза в день), наблюдались выкидыши и эмбриотоксичность.
Способ применения и дозы
Для приема внутрь.
Препарат Адемпас® может приниматься одновременно с приемом пищи или независимо от времени приема пищи.
Начало терапии: рекомендуемая начальная доза составляет 1,0 мг 3 раза в день на протяжении 2 недель. Таблетки должны приниматься три раза в день с интервалом примерно 6-8 часов одновременно с приемом пищи или независимо от времени приема пищи.
Если систолическое артериальное давление составляет 95 мм рт. ст. и выше и у пациента при этом не отмечается симптомов артериальной гипотензии, дозу следует увеличивать на 0,5 мг каждые 2 недели до максимальной суточной дозы (по 2,5 мг 3 раза в день).
Если систолическое артериальное давление менее 95 мм рт. ст., дозировку следует оставить прежней при условии, что у пациента не отмечается симптомов артериальной гипотензии.
Если в любой момент на этапе титрования дозы систолическое артериальное давление менее 95 мм рт. ст. и у пациента при этом отмечаются признаки артериальной гипотензии, текущую дозу следует уменьшить на 0,5 мг 3 р/д, то есть, рекомендовать назначить ранее принимаемую и хорошо переносимую дозу.
Поддерживающая доза
Подобранная индивидуальная доза должна поддерживаться, если только не развиваются симптомы артериальной гипотензии.
Максимальная суточная доза препарата Адемпас® составляет 7,5 мг. В случае пропуска очередной дозы препарата следует принять следующую дозу в соответствии с назначенной схемой применения.
В случае развития нежелательных реакций (непереносимости) после применения назначенной дозы препарата, она может быть снижена в любой момент проведения лечения.
Измельчение таблеток
Если пациент не способен проглотить таблетку целиком, таблетка Адемпас® может быть измельчена и смешана с водой или жидким питанием, например, яблочным пюре, непосредственно перед приемом.
Отмена лечения
В случае необходимости перерыва в лечении на 3 дня и более, необходимо вернуться к начальной дозе и возобновить прием препарата, начиная с дозы 1 мг 3 раза в день на протяжении 2 недель; продолжить лечение с последующим титрованием дозы, как это описано выше.
Особые группы пациентов
Перевод пациентов на терапию препаратом Адемпас® и наоборот
Прекратить прием силденафила по крайней мере за 24 часа до назначения препарата Адемпас® (см. разделы «Противопоказания», «Фармакологические свойства»).
Прекратить прием тадалафила по крайней мере за 48 часов до назначения препарата Адемпас®. При инициации терапии рекомендуется следить за признаками и симптомами гипотензии (см. разделы «Противопоказания», «Фармакологические свойства»).
Прекратить прием препарата Адемпас® по крайней мере за 24 часа до назначения ингибитора ФДЭ-5. При инициации терапии рекомендуется следить за признаками и симптомами гипотензии (см. разделы «Противопоказания», «Фармакологические свойства»).
Дети
Безопасность и эффективность препарата Адемпас® не была изучена у пациентов моложе 18 лет. Поскольку доступные данные о применении препарата Адемпас® у детей отсутствуют, он противопоказан пациентам до 18 лет (см. раздел «Противопоказания»).
Пациенты пожилого возраста
У пожилых (65 лет и старше) пациентов следует соблюдать особую осторожность, в том числе и при подборе дозы.
Пациенты с нарушением функции почек
В настоящее время недостаточно данных о пациентах с тяжелым нарушением функции почек (клиренс креатинина менее 15 мл/мин), данные по пациентам на гемодиализе отсутствуют. Поэтому применение препарата Адемпас® у таких пациентов не рекомендуется (см. раздел «Особые указания»).
У пациентов с легким и умеренным нарушением функции почек (клиренс креатинина менее 80 — 30 мл/мин) отмечались более высокие концентрации этого лекарственного препарата (см. раздел «Фармакологические свойства»). У пациентов с нарушением функции почек существует повышенный риск гипотензии, поэтому при подборе индивидуальной дозы у таких пациентов следует соблюдать особую осторожность.
Пациенты, получающие стабильные дозы мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома/Р-гликопротеина (P-gp) и белка резистентности рака молочной железы (BCRP)
Совместное применение препарата Адемпас® с мощными ингибиторами множественных метаболических путей с участием изоферментов цитохрома и P-gp/BCRP, такими как азоловые противомикробные препараты (например, кетоконазол, позаконазола, итраконазол) или ингибиторами протеазы ВИЧ (например, ритонавир), приводит к увеличению экспозиции препарата Адемпас® (см. раздел «Взаимодействие с другими лекарственными средствами»). При инициировании терапии препаратом Адемпас® у пациентов, получающих стабильные дозы мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома и P-gp/BCRP, следует рассмотреть начальную дозу 0,5 мг три раза в сутки, чтобы снизить риск развития гипотонии. Пациент должен находиться под наблюдением в целях выявления признаков и симптомов гипотонии при инициации лечения и в дальнейшем. Следует рассмотреть снижение дозы для пациентов, получающих препарат Адемпас® в дозах, превышающих или равных 1,0 мг, в том случае, если у пациента появляются признаки или симптомы гипотонии (см. разделы «Способ применения и дозы», «Особые указания» и «Взаимодействие с другими лекарственными средствами»).
Пациенты с нарушением функции печени
Концентрации риоцигуата в плазме крови у пациентов с легким нарушением функции печени (класс А по шкале Чайлд-Пью) сходны с концентрациями риоцигуата в плазме крови у здоровых добровольцев.
У пациентов с умеренным нарушением функции печени (класс В по шкале Чайлд-Пью) отмечалась более высокая плазменная концентрация риоцигуата (см. раздел «Фармакологические свойства»). При подборе дозы у таких пациентов следует соблюдать особую осторожность.
Применение препарата Адемпас® у пациентов с тяжелым нарушением функции печени (по шкале Чайлд-Пью, класс С) противопоказано, так как исследования у таких пациентов не проводились (см. раздел «Противопоказания»).
Табакокурение
Курящим пациентам настоятельно рекомендуется отказаться от табакокурения, поскольку концентрация риоцигуата в плазме крови у курящих пациентов существенно снижена в сравнении с некурящими. Может потребоваться коррекция дозы, в случае если пациент начинает или прекращает курить в процессе лечения препаратом Адемпас® (см. раздел «Особые указания»).
Побочное действие
Нежелательные явления, представленные ниже, перечислены в соответствии с частотой встречаемости в клинических исследованиях. Частота встречаемости определяется следующим образом: очень часто (≥ 1/10), часто (> 1/100 и < 1/10), нечасто (> 1/1 000 и < 1/100), редко (> 1/10 000 и < 1/1 000), очень редко (< 1/10 000).
Инфекционные и паразитарные заболевания
Часто: гастроэнтерит.
Нарушения со стороны крови и лимфатической системы
Часто: анемия (включая соответствующие лабораторные показатели).
Нарушения со стороны нервной системы
Очень часто: головокружение, головная боль.
Нарушения со стороны сердца и сосудов
Часто: учащенное сердцебиение, снижение артериального давления.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Часто: кровохарканье, носовое кровотечение, заложенность носа.
Нечасто: легочное кровотечение*.
* сообщалось о случае фатального легочного кровотечения в рамках долговременного исследования без группы контроля.
Нарушения со стороны желудочно-кишечного тракта (ЖКТ)
Очень часто: диспепсия, диарея, тошнота, рвота.
Часто: гастрит, гастроэзофагеальная рефлюксная болезнь, дисфагия, боль в разных отделах ЖКТ, запор, вздутие живота.
Общие расстройства и нарушения в месте введения
Очень часто: периферические отеки.
Передозировка
Симптомы
Сообщалось о непреднамеренной передозировке 9-25 мг риоцигуата в течение 2-32 дней. Нежелательные реакции были аналогичны наблюдавшимся при приеме более низких доз (см. раздел «Побочное действие»).
Лечение
Специфический антидот неизвестен.
В случае передозировки следует применять стандартные поддерживающие меры в соответствии с клинической необходимостью.
При развитии выраженного снижения артериального давления может потребоваться активная гемодинамическая поддержка.
Поскольку риоцигуат обладает высокой степенью связывания с белками плазмы крови, возможность выведения его с помощью диализа представляется маловероятной.
Взаимодействие с другими лекарственными средствами
Фармакокинетические взаимодействия
Риоцигуат выводится в основном через окислительный метаболизм, опосредованный системой изоферментов цитохрома Р450 (изоферменты CYP1A1, CYP3A4, CYP3A5, CYP2J2), а также в неизмененном виде через кишечник или почками в процессе клубочковой фильтрации.
На основании исследований in vitro было выявлено, что риоцигуат является субстратом для мембранных транспортных белков P-gp/BCRP (Р- гликопротеина / белка резистентности рака молочной железы). Ингибиторы или индукторы этих ферментов или транспортных белков могут повлиять на плазменные концентрации риоцигуата.
Совместное применение с мощными ингибиторами множественных метаболических путей с участием изоферментов цитохрома и P-gp/BCRP.
Противогрибковые препараты
In vitro было показано, что кетоконазол, классифицируемый как мощный ингибитор изофермента CYP3A4 и P-gp, является ингибитором множественных метаболических путей с участием системы изоферментов цитохрома и P-gp/BCRP, участвующих в метаболизме и экскреции риоцигуата. Одновременное применение кетоконазола в дозе 400 мг один раз в сутки приводило к увеличению на 150 % (диапазон до 370%) средней AUC риоцигуата и увеличению Cmax на 46 %. Конечный период полувыведения увеличивался с 7,3 до 9,2 часов, а общий клиренс риоцигуата снижался с 6,1 до 2,4 л/ч.
При инициации применения препарата Адемпас®, у пациентов, получающих стабильные дозы мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома и P-gp/BCRP, например, кетоконазола или итраконазола, следует рассмотреть возможность применения начальной дозы препарата Адемпас® 0,5 мг три раза в сутки, чтобы снизить риск развития гипотонии. Пациент должен находиться под наблюдением в целях выявления признаков и симптомов гипотонии при инициации лечения и в дальнейшем. Следует рассмотреть снижение дозы для пациентов, получающих препарат Адемпас® в дозах, превышающих или равных 1,0 мг, в том случае, если у пациента появляются признаки или симптомы гипотонии (см. разделы «Способ применения и дозы», «Особые указания»).
У пациентов, получающих стабильные дозы препарата Адемпас®, инициация применения мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома и P gp/BCRP не рекомендуется, поскольку в связи с ограниченностью данных не могут быть предоставлены рекомендации по дозированию. Следует рассмотреть альтернативные методы лечения.
Высокоактивная антиретровирусная терапия (ВААРТ)
In vitro абакавир, рилпивирин, эфавиренз, ритонавир, кобицистат и элвитегравир ингибировали изофермент CYP1A1 и метаболизм риоцигуата, при этом абакавир был самым мощным ингибитором, а активность ингибиторов убывала в указанном порядке. Кобицистат, ритонавир, атазанавир и дарунавир дополнительно классифицируются как ингибиторы изоферментов CYP3A. Кроме того, ритонавир подавлял P-gp.
Влияние ВААРТ (включая различные комбинации абакавира, атазанавира, кобицистата, дарунавира, долутегравира, эфавиренза, элвитегравира, эмтрицитабина, ламивудина, рилпивирина, ритонавира и тенофовира) на экспозицию риоцигуата было изучено в специальном исследовании у ВИЧ-инфицированных пациентов. Сопутствующее применение комбинированной ВААРТ приводило к увеличению средних значений AUC риоцигуата приблизительно до 160 % и увеличению Cmax приблизительно на 20 %. Профиль безопасности, наблюдаемый у пациентов с ВИЧ-инфекций, получивших однократную дозу риоцигуата 0,5 мг совместно с различными комбинациями препаратов для лечения ВИЧ-инфекции, используемых в ВААРТ, в целом был сопоставим с таковым, наблюдаемым в других популяциях пациентов.
При инициации применения препарата Адемпас® у пациентов, получающих стабильные дозы мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома и P-gp/BCRP, например, препаратов ВААРТ, следует рассмотреть возможность применения начальной дозы риоцигуата 0,5 мг три раза в сутки, чтобы снизить риск развития гипотонии. Пациент должен находиться под наблюдением в целях выявления признаков и симптомов гипотонии при инициации лечения и в дальнейшем. Следует рассмотреть снижение дозы для пациентов, получающих препарат Адемпас® в дозах, превышающих или равных 1,0 мг, в том случае, если у пациента появляются признаки или симптомы гипотонии (см. разделы «Способ применения и дозы», «Особые указания»).
У пациентов, получающих стабильные дозы препарата Адемпас®, инициация применения мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома и P gp/BCRP не рекомендуется, поскольку в связи с ограниченностью данных не могут быть предоставлены рекомендации по дозированию. Следует рассмотреть альтернативные методы лечения.
Совместное применение с другими ингибиторами CYP и P-gp/BCRP
Препараты, сильно ингибирующие P-gp/BCRP, такие как иммунодепрессант циклоспорин А, должны применяться с осторожностью (см. раздел «Особые указания»).
Из рекомбинантных изоферментов цитохрома, исследованных in vitro, изофермент CYP1A1 наиболее эффективно катализировал образование основного метаболита риоцигуата. Препараты класса ингибиторов тирозинкиназы являются мощными ингибиторами изофермента CYP1A1, при этом эрлотиниб и гефитиниб проявляли наибольшую ингибиторную активность in vitro. Таким образом, одновременное применение с препаратами, являющимися ингибиторами изофермента CYP1A1 может приводить к увеличению концентрации риоцигуата, особенно у курящих пациентов. Следовательно, мощные ингибиторы изофермента CYP1A1 следует применять с осторожностью (см. раздел «Особые указания»).
Одновременное применение кларитромицина (500 мг 2 раза в сутки), отнесенного к мощным и селективным ингибиторам изофермента CYP3A4, также являющегося немощным ингибитором P-gp, умеренно повышало среднюю AUC риоцигуата на 41 % без существенного изменения Cmax. Такие изменения клинически незначимы.
Совместное применение лекарственных средств, повышающих рН желудочно-кишечного тракта
Одновременное применение препаратов, повышающих рН желудочно-кишечного тракта, может привести к более низкой биодоступности при приеме внутрь, поскольку растворимость риоцигуата снижается при нейтральной рН по сравнению с кислой средой.
Назначение до и во время терапии риоцигуатом ингибитора протонной помпы омепразола (40 мг один раз в сутки) снижает среднюю AUC риоцигуата на 26 %, а среднюю Cmax на 35 %. Данные изменения клинически незначимы.
Антациды необходимо принимать, по меньшей мере, через час после приема риоцигуата, поскольку одновременное применение антацидов на основе алюминия гидроксида и/или магния гидроксида снижает среднюю AUC риоцигуата на 34 %, а среднюю Cmax на 56 %.
Совместное применение с индукторами CYP3A4
Бозентан, который является умеренным индуктором изофермента CYP3A4, вызывает снижение равновесной концентрации риоцигуата в плазме крови у пациентов с ЛАГ на 27 %, не оказывая при этом влияния на эффективность комбинации.
Одновременное применение риоцигуата и мощных индукторов изофермента CYP3A4 (например, фенитоина, карбамазепина, фенобарбитала или препаратов, содержащих Зверобой продырявленный) может также привести к снижению концентрации риоцигуата в плазме крови.
Влияние риоцигуата на другие вещества
Риоцигуат и его основной метаболит не являются ни ингибиторами, ни индукторами основных изоферментов цитохрома (включая изофермент CYP3A4) или транспортных белков (например, P-gp/BCRP) при терапевтических концентрациях в условиях in vitro.
Отсутствие фармакокинетических взаимодействий между риоцигуатом и маркерным субстратом изофермента CYP3A4 мидазоламом было продемонстрировано in vivo.
Препарат Адемпас® противопоказан во время беременности, поэтому следует избегать наступления беременности при применении препарата (см. раздел «Противопоказания»). Риоцигуат (2,5 мг три раза в день) не имел клинически значимого влияния на действие комбинированных пероральных контрацептивов, содержащих левоноргестрел и этинилэстрадиол при одновременном применении здоровыми добровольцами женского пола.
Было выявлено, что in vitro риоцигуат и его основной метаболит являются мощными ингибиторами изофермента CYP1A1. Таким образом, нельзя исключить клинически значимые лекарственные взаимодействия с одновременно принимаемыми препаратами, которые в значительной мере выводятся путем метаболизма, опосредованного изоферментом CYP1A1, такими как эрлотиниб или гранисетрон.
Фармакодинамические взаимодействия
Нитраты
Одновременное применение риоцигуата и нитратов или донаторов оксида азота (таких как амилнитрит) в любой лекарственной форме противопоказано, поскольку при применении риоцигуата в дозировке 2,5 мг в форме таблеток, наблюдалось усиление гипотензивного эффекта нитроглицерина (0,4 мг, сублингвально), принятого через 4 и 8 часов после приема риоцигуата (см. раздел «Противопоказания»).
Ингибиторы ФДЭ-5
В исследованиях на животных было продемонстрировано снижение системного артериального давления при сочетании риоцигуата с силденафилом или варденафилом (аддитивный эффект). При применении увеличенных доз в ряде случаев наблюдалось дополнительное снижение системного артериального давления.
В исследовании лекарственных взаимодействий с участием 7 пациентов с ЛАГ, получавших постоянное лечение силденафилом (20 мг 3 раза в сутки), однократный прием риоцигуата (0,5 мг и 1 мг последовательно) привел к суммированию влияния препаратов на гемодинамику. Дозы риоцигуата свыше 1,0 мг в этом исследовании не изучались.
Было проведено 12-недельное исследование применения комбинации стабильной дозы силденафила (20 мг 3 р/сут) и риоцигуата (в дозе 1,0-2,5 мг 3 р/сут) по сравнению с монотерапией силденафилом у 18 пациентов с ЛАГ. В продленной фазе исследования (в отсутствие группы контроля) одновременное применение силденафила и риоцигуата приводило к более высокой частоте отмены терапии, преимущественно вследствие артериальной гипотензии. Не было получено доказательств благоприятного клинического эффекта данной комбинации в исследуемой популяции.
Одновременный прием риоцигуата и ингибиторов ФДЭ-5 (таких как силденафил, тадалафил, варденафил) противопоказан (см. разделы «Противопоказания», «Способ применения и дозы», «Фармакологические свойства»).
Варфарин
Одновременное лечение риоцигуатом и варфарином не влияло на протромбиновое время. Предполагается, что одновременное применение риоцигуата с другими производными кумарина также не будет оказывать влияние на протромбиновое время.
Отсутствие фармакокинетических взаимодействий между риоцигуатом и субстратом изофермента CYP2C9 варфарином было продемонстрировано в условиях in vivo.
Ацетилсалициловая кислота
Риоцигуат не вызывал удлинения времени кровотечения, вызванного приемом ацетилсалициловой кислоты в качестве антиагрегантного средства, а также не влиял на агрегацию тромбоцитов у человека.
Особые указания
Веноокклюзионная болезнь легких
Применение препарата Адемпас® у пациентов с веноокклюзионной болезнью легких (ВОБЛ) не рекомендовано, поскольку легочные вазодилататоры могут существенно ухудшить клиническое состояние таких пациентов. При появлении симптомов отека легких следует думать о возможности развития ассоциированной ВОБЛ, лечение препаратом Адемпас® в таком случае должно быть прекращено.
Кровотечения из дыхательных путей
У пациентов с легочной гипертензией существует повышенная вероятность кровотечения из дыхательных путей, особенно среди пациентов, получающих антикоагулянтную терапию.
Рекомендуется пристальное наблюдение за пациентами, которые принимают антикоагулянты, в соответствии с обычной медицинской практикой.
При лечении препаратом Адемпас® риск серьезных и/или фатальных кровотечений из дыхательных путей может увеличиваться, особенно в присутствии факторов риска, таких как недавний эпизод серьезного кровохарканья, включая его лечение при помощи бронхиальной артериальной эмболизации. У пациентов с серьезным кровохарканьем в анамнезе, а также у лиц, которым ранее была проведена эмболизация бронхиальных артерий, следует избегать назначения риоцигуата. В случае кровотечений из дыхательных путей врач, назначающий препарат, должен регулярно оценивать соотношение риск-польза для продолжения лечения. Серьезные кровотечения возникли у 2,4 % (12/490) пациентов, которые принимали риоцигуат, по сравнению с 0/214 среди пациентов в группе плацебо. Серьезное кровохарканье развилось у 1 % (5/490) пациентов, которые принимали риоцигуат по сравнению с 0/214 у пациентов, которые принимали плацебо, при этом одно из этих событий имело фатальный исход. Серьезные геморрагические осложнения также включали 2 пациентов с вагинальными кровотечениями, 2 с кровотечениями из места установки катетера, и по 1 пациенту с каждым из следующих состояний — с субдуральной гематомой, рвотой с кровью и внутрибрюшным кровотечением.
Сосудорасширяющий эффект
Препарат Адемпас® обладает сосудорасширяющими свойствами, что может привести к снижению артериального давления. До назначения препарата Адемпас® врач должен тщательно оценить риск возникновения нежелательных сосудорасширяющих эффектов у пациентов с конкретными сопутствующими заболеваниями (например, у пациентов, получающих гипотензивную терапию, или у пациентов с исходной артериальной гипотензией, гиповолемией, тяжелой обструкцией путей оттока из левого желудочка или вегетативной дисфункцией).
Сочетанное применение с другими лекарственными препаратами
Одновременное применение препарата Адемпас® с мощными ингибиторами изоферментов цитохрома и P-gp/BCRP, такими как азоловые противогрибковые препараты (например, кетоконазол, позаконазол, итраконазол) или ингибиторы ВИЧ-протеазы (например, ритонавир) приводит к выраженному увеличению экспозиции препарата Адемпас® (см. раздел «Взаимодействие с другими лекарственными средствами»).
Прежде чем назначать применение препарата Адемпас® у пациентов, получающих стабильные дозы мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома и ингибиторов P-gp/BCRP, следует индивидуально оценить соотношение пользы и рисков для каждого пациента. Следует рассмотреть возможность применения начальной дозы препарата Адемпас® 0,5 мг три раза в сутки, чтобы снизить риск развития гипотонии. Пациент должен находиться под наблюдением в целях выявления признаков и симптомов гипотонии при инициации лечения и в дальнейшем. Следует рассмотреть снижение дозы для пациентов, получающих препарат Адемпас® в дозах, превышающих или равных 1,0 мг, в том случае, если у пациента появляются признаки или симптомы гипотонии (см. разделы «Способ применения и дозы» и «Взаимодействие с другими лекарственными средствами»).
У пациентов, получающих стабильные дозы препарата Адемпас®, инициация применения мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома и P gp/BCRP не рекомендуется, поскольку в связи с ограниченностью данных не могут быть предоставлены рекомендации по дозированию. Следует рассмотреть альтернативные методы лечения.
Одновременное применение препарата Адемпас® с мощными ингибиторами изофермента CYP1A1, такими как ингибитор тирозинкиназы эрлотиниб, и мощными ингибиторами P-gp/BCRP, такими как иммунодепрессант циклоспорин А, может увеличить экспозицию риоцигуата (см. раздел «Взаимодействие с другими лекарственными средствами»). Эти препараты следует применять с осторожностью. Следует контролировать артериальное давление и рассмотреть возможность снижения дозы препарата Адемпас®.
Популяции пациентов, исследования у которых не проводились
Адемпас® не был изучен в следующих группах пациентов, а, следовательно, его применение у них противопоказано:
Информация для отдельных групп пациентов
У курящих пациентов действие риоцигуата уменьшается на 50-60 % (см. раздел «Фармакологические свойства»). Таким пациентам настоятельно рекомендуется бросить курить.
Влияние на способность управлять транспортными средствами, механизмами
Сообщалось о случаях головокружения у некоторых пациентов (см. раздел «Побочное действие»), поэтому следует соблюдать осторожность при управлении транспортными средствами и при работе с другими механизмами.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 0,5 мг, 1,0 мг, 1,5 мг, 2,0 мг, 2,5 мг.
По 21 таблетке в блистер из фольги алюминиевой и полипропилена, по 2 или 4 блистера с инструкцией по применению помещают в картонную пачку, снабженную контролем первого вскрытия.
Условия хранения
Хранить при температуре не выше 30 °С.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускается по рецепту.
Производитель
Байер АГ, Кайзер-Вильгельм-Аллее, 51368 Леверкузен, Германия
Bayer AG, Kaiser-Wilhelm-Allee, 51368 Leverkusen, Germany
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Байер АГ, Кайзер-Вильгельм-Аллее, 1,
51373 Леверкузен, Германия
Bayer AG, Kaiser-Wilhelm-Allee, 1,
51373 Leverkusen, Germany
С претензиями и за дополнительной информацией обращаться:
АО «БАЙЕР»
107113 Москва, 3-я Рыбинская ул., д.18, стр.2
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Rec.INN
зарегистрированное ВОЗ
Лекарственное взаимодействие
Входит в состав препаратов:
список
Фармакологическое действие
Гипотензивное средство, стимулятор гуанилатциклазы.
Риоцигуат является стимулятором растворимой гуанилатциклазы (рГЦ), фермента сердечно-легочной системы и рецептора оксида азота (NO).
При связывании NO с рГЦ фермент катализирует синтез сигнальной молекулы циклического гуанозинмонофосфата (цГМФ). Внутриклеточный цГМФ играет важную роль в регуляции процессов, влияющих на тонус сосудов, пролиферацию, фиброз и воспаление.
Легочная гипертензия ассоциируется с эндотелиальной дисфункцией, нарушением синтеза оксида азота и недостаточной стимуляцией метаболического пути NO-рГЦ-цГМФ. Риоцигуат имеет двойной механизм действия. Он сенсибилизирует цГМФ к эндогенному NO путем стабилизации связи NO-цГМФ. Риоцигуат также напрямую стимулирует рГЦ через другой участок связи, независимо от NO.
Риоцигуат восстанавливает метаболический путь NO-рГЦ-цГМФ и вызывает увеличение продукции цГМФ.
Фармакокинетика
Риоцигуат быстро всасывается, Cmax в плазме крови достигается через 1-1.5 ч после приема внутрь. Всасывание риоцигуата происходит на всем протяжении ЖКТ, преимущественно в верхних отделах. В дистальных отделах ЖКТ всасывание снижается. Абсолютная биодоступность риоцигуата высокая (94%).
Связывание с белками крови высокое и составляет приблизительно 95%. Основными связывающими компонентами являются альбумин сыворотки крови и альфа1-кислый гликопротеин.
Vd является средним, при этом в равновесном состоянии он составляет приблизительно 30 л.
Основным путем метаболизма риоцигуата является N-деметилирование при участии изоферментов CYP1A1, CYP3A4, CYP2C8 и CYP2J2, является , приводящим к образованию его основного циркулирующего метаболита (фармакологическая активность: от 1/10 до 1/3 риоцигуата), который в дальнейшем метаболизируется в фармакологически неактивный N-глюкуронид.
Изофермент CYP1A1 катализирует образование основного метаболита риоцигуата в печени и легких. Этот процесс усиливается полициклическими ароматическими углеводородами, например, содержащимися в дыме от сигарет.
T1/2 составляет примерно 7 ч у здоровых добровольцев и около 12 ч у пациентов. Весь риоцигуат (исходный препарат и метаболиты) выводится почками (33-45%) и через кишечник (48-59%). От 4 до 19% введенной дозы выводится в неизмененном виде почками, приблизительно 9-44% — через кишечник.
На основании данных in vitro установлено, что риоцигуат и его основной метаболит являются субстратами для транспортных белков P-gp (Р-гликопротеин) и BCRP (белок резистентности рака молочной железы). Риоцигуат является препаратом с низким клиренсом (системный клиренс равен приблизительно 3-6 л/мин).
Фармакокинетика у особых групп пациентов
У пациентов пожилого возраста (65 лет и старше) отмечалась более высокая концентрация риоцигуата в плазме крови, чем у молодых, при этом показатели AUC были приблизительно на 40% выше у пожилых, главным образом, вследствие кажущегося снижения общего и почечного клиренса.
У пациентов с циррозом печени, сопровождающимся печеночной недостаточностью легкой степени (5-6 баллов по шкале Чайлд-Пью, класс А) не отмечалось клинически значимых изменений действия препарата. У пациентов с циррозом печени, сопровождающимся умеренной печеночной недостаточностью (7-9 баллов по шкале Чайлд-Пью, класс В), средняя AUC риоцигуата увеличивалась на 50-70% в сравнении со здоровыми добровольцами из группы контроля. Применение риоцигуата у пациентов с печеночной недостаточностью тяжелой степени (10-15 баллов по шкале Чайлд-Пью, класс С) противопоказано, поскольку клинические данные для таких пациентов отсутствуют.
У пациентов с почечной недостаточностью в сравнении с пациентами с нормальной функцией почек, средние величины нормализованного по дозе и интенсивности действия риоцигуата были выше. Соответствующие показатели для основного метаболита были выше у пациентов с почечной недостаточностью в сравнении со здоровыми добровольцами. У пациентов с КК 80-50 мл/мин, 49-30 мл/мин и менее 30 мл/мин концентрация риоцигуата в плазме крови (AUC) увеличивалась на 43%, 104% или 44%, соответственно. Нет данных для пациентов с КК <15 мл/мин или находящихся на гемодиализе. Следовательно, применение препарата противопоказано у пациентов с КК <15 мл/мин или находящихся на гемодиализе.
Поскольку риоцигуат обладает высокой степенью связывания с белками плазмы крови, возможность выведения его с помощью диализа представляется маловероятной.
Не выявлено существенных различий эффективности риоцигуата в зависимости от пола, этнической группы или массы тела пациента.
Показания активного вещества
РИОЦИГУАТ
Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ), группа 4 по классификации ВОЗ: неоперабельная ХТЭЛГ, персистирующая или рецидивирующая ХТЭЛГ после оперативного лечения (для улучшения переносимости физической нагрузки, улучшения ФК ВОЗ).
Легочная артериальная гипертензия (ЛАГ), группа 1 по классификации ВОЗ (для улучшения переносимости физической нагрузки, улучшения ФК ВОЗ и задержки клинического ухудшения).
II-III ФК по классификации ВОЗ (в качестве монотерапии либо в комбинации с антагонистами рецепторов эндотелина или простаноидами): идиопатическая ЛАГ; наследственная ЛА; ЛАГ, ассоциированная с болезнями соединительной ткани.
Режим дозирования
Принимают внутрь.
Начальная доза — по 1 мг 3 раза/сут.
Поддерживающую дозу подбирают индивидуально под контролем АД и клинического состояния пациента.
Максимальная доза — 7.5 мг/сут.
Побочное действие
Инфекционные и паразитарные заболевания: часто — гастроэнтерит.
Со стороны крови и лимфатической системы: часто — анемия (включая соответствующие лабораторные показатели).
Со стороны нервной системы: очень часто — головокружение, головная боль.
Со стороны сердечно-сосудистой системы: часто — учащенное сердцебиение, снижение АД.
Со стороны дыхательной системы: часто — кровохарканье, носовое кровотечение, заложенность носа; нечасто — легочное кровотечение.
Со стороны пищеварительной системы: очень часто — диспепсия, диарея, тошнота, рвота; часто — гастрит, ГЭРБ, дисфагия, боль в разных отделах ЖКТ, запор, вздутие живота.
Общие расстройства: очень часто — периферические отеки.
Противопоказания к применению
Повышенная чувствительность к риоцигуату; тяжелые нарушения функции печени (класс С по шкале Чайлд-Пью); тяжелая артериальная гипотензия на момент начала терапии (систолическое АД менее 95 мм рт.ст.); тяжелые нарушения функции почек (КК менее 15 мл/мин) и применение у пациентов, находящихся на гемодиализе; легочная гипертензия, ассоциированная с идиопатическими интерстициальными пневмониями (ЛГ-ИИП); одновременный прием с нитратами или донаторами оксида азота (такими, как амилнитрит) в любой лекарственной форме; одновременное применение с ингибиторами ФДЭ 5, такими, как силденафил, варденафил, тадалафил; беременность, период грудного вскармливания; возраст до 18 лет.
С осторожностью
У пациентов с легочной гипертензией, имеющих дополнительные факторы риска кровотечения из дыхательных путей, особенно у тех, кто получает антикоагулянтную терапию; у пациентов, получающих гипотензивную терапию, или у пациентов с исходной артериальной гипотензией, гиповолемией либо тяжелой обструкцией путей оттока из левого желудочка или вегетативной дисфункцией; при одновременном применении с мощными ингибиторами изоферментов CYP и P-гликопротеина/BCRP, такими как азоловые противогрибковые средства (например, кетоконазол, итраконазол) или ингибиторами протеазы ВИЧ (например, ритонавир) в связи с выраженным увеличением экспозиции риоцигуата; при одновременном применении с мощными ингибиторами изофермента CYP1A1, такими как ингибитор тирозинкиназы эрлотиниб, и мощными ингибиторами P-гликопротеина/BCRP, такими как циклоспорин А, может увеличиваться экспозиция риоцигуата; у пациентов с нарушениями функции почек (КК менее 80 мл/мин, но более 15 мл/мин); у пациентов с умеренным нарушением функции печени ( класс В по шкале Чайлд-Пью); у пациентов пожилого возраста (65 лет и старше).
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Тяжелые нарушения функции печени (класс С по шкале Чайлд-Пью).
С осторожностью: у пациентов с умеренным нарушением функции печени ( класс В по шкале Чайлд-Пью).
Применение при нарушениях функции почек
Противопоказания: нарушения функции почек (КК менее 15 мл/мин) и применение у пациентов, находящихся на гемодиализе.
С осторожностью у пациентов с нарушениями функции почек (КК менее 80 мл/мин, но более 15 мл/мин).
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
С осторожностью применять у пациентов пожилого возраста (65 лет и старше).
Особые указания
Применение риоцигуата у пациентов с веноокклюзионной болезнью легких (ВОБЛ) не рекомендовано, поскольку легочные вазодилататоры могут существенно ухудшить клиническое состояние таких пациентов. При появлении симптомов отека легких следует учитывать возможность развития ассоциированной ВОБЛ, лечение риоцигуатом в таком случае должно быть прекращено.
У пациентов с легочной гипертензией существует повышенная вероятность кровотечения из дыхательных путей, особенно среди пациентов, получающих антикоагулянтную терапию.
Рекомендуется тщательное наблюдение за пациентами, которые принимают антикоагулянты, в соответствии с обычной медицинской практикой.
При лечении риоцигуатом риск серьезных и/или фатальных кровотечений из дыхательных путей может увеличиваться, особенно в присутствии факторов риска, таких как недавний эпизод серьезного кровохарканья, включая его лечение при помощи бронхиальной артериальной эмболизации. У пациентов с серьезным кровохарканьем анамнезе, а также у лиц, которым ранее была проведена эмболизация бронхиальных артерий, следует избегать назначения риоцигуата. Серьезные геморрагические осложнения включали серьезное кровохарканье, вагинальное кровотечение, кровотечение из места установки катетера, субдуральная гематома, рвота с кровью и внутрибрюшным кровотечением.
При необходимости применения риоцигуата врач должен тщательно оценить риск возникновения нежелательных сосудорасширяющих эффектов у пациентов с конкретными сопутствующими заболеваниями (например, у пациентов, получающих гипотензивную терапию, или у пациентов с исходной артериальной гипотензией, гиповолемией, тяжелой обструкцией путей оттока из левого желудочка или вегетативной дисфункцией).
У курящих пациентов действие риоцигуата уменьшается на 50-60%. Таким пациентам настоятельно рекомендуется бросить курить.
Влияние на способность к управлению транспортными средствами и механизмами
На фоне применения риоцигуата возможно развитие головокружения. Пациенты должны соблюдать осторожность при управлении транспортными средствами и работе с механизмами.
Лекарственное взаимодействие
In vitro было показано, что кетоконазол, являющийся мощным ингибитором изофермента CYP3A4 и P-гликопротеина, является ингибитором множественных метаболических путей с участием системы изоферментов цитохрома и Р-гликопротеина/BCRP, участвующих в метаболизме и экскреции риоцигуата. Одновременное применение кетоконазола в дозе 400 мг 1 раз/сут приводило к увеличению на 150% (диапазон до 370%) средней AUC риоцигуата и увеличению Cmax на 46%. Конечный T1/2 увеличивался с 7.3 до 9.2 ч, а общий клиренс риоцигуата снижался с 6.1 до 2.4 л/ч. В начале применения риоцигуата у пациентов, получающих стабильные дозы мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома и Р-гликопротеина/BCRP, например, кетоконазола или итраконазола может потребоваться коррекция начальной дозы риоцигуата, чтобы уменьшить риск развития артериальной гипотензии. Пациент должен находиться под наблюдением в целях выявления признаков и симптомов артериальной гипотензии в начале лечения риоцигуатом и в дальнейшем.
У пациентов, получающих стабильные дозы риоцигуата не рекомендуется начинать применение мощных ингибиторов множественных метаболических путей с участием изоферментов цитохрома и Р-гликопротеина/BCRP, поскольку в связи с ограниченностью данных не могут быть предоставлены рекомендации по дозированию. Следует рассмотреть альтернативные методы лечения.
In vitro абакавир, рилпивирин, эфавиренз, ритонавир, кобицистат и элвитегравир ингибировали изофермент CYP1A1 и метаболизм риоцигуата, при этом абакавир был самым мощным ингибитором, а активность ингибиторов убывала в указанном порядке. Кобицистат, ритонавир, атазанавир и дарунавир дополнительно классифицируются как ингибиторы изоферментов CYP3A. Кроме того, ритонавир подавлял P-гликопротеин.
Влияние высокоактивной антиретровирусной терапии (ВААРТ) (включая различные комбинации абакавира, атазанавира, кобицистата, дарунавира, долутегравира, эфавиренза, элвитегравира, эмтрицитабина, ламивудина, рилпивирина, ритонавира и тенофовира) на экспозицию риоцигуата было изучено в специальном исследовании у ВИЧ- инфицированных пациентов. Сопутствующее применение комбинированной ВААРТ приводило к увеличению средних значений AUC риоцигуата приблизительно до 160% и увеличению Cmax приблизительно на 20%. Профиль безопасности, наблюдаемый у пациентов с ВИЧ-инфекций, получивших однократную дозу риоцигуата 0.5 мг совместно с различными комбинациями препаратов для лечения ВИЧ-инфекции, используемых ВААРТ, в целом был сопоставим с таковым, наблюдаемым в других популяциях пациентов.
Препараты класса ингибиторов тирозинкиназы являются мощными ингибиторами изофермента CYP1A1, при этом эрлотиниб и гефитиниб проявляли наибольшую ингибиторную активность in vitro. Таким образом, одновременное применение с препаратами, являющимися ингибиторами изофермента CYP1A1, может приводить к увеличению концентрации риоцигуата, особенно у курящих пациентов. Следовательно, мощные ингибиторы изофермента CYP1A1 следует применять с осторожностью одновременно с риоцигуатом.
Одновременное применение препаратов, повышающих рН в ЖКТ, может привести к более низкой биодоступности при приеме внутрь, поскольку растворимость риоцигуата снижается при нейтральной рН по сравнению с кислой средой.
Антациды необходимо принимать, по меньшей мере, через час после приема риоцигуата, поскольку одновременное применение антацидов на основе алюминия гидроксида и/или магния гидроксида снижает среднюю AUC риоцигуата на 34%, а среднююCmax на 56%.
Бозентан, который является умеренным индуктором изофермента CYP3A4, вызывает снижение Css риоцигуата в плазме крови у пациентов с ЛАГ на 27%, не оказывая при этом влияния на эффективность комбинации.
Одновременное применение риоцигуата и мощных индукторов изофермента CYP3A4 (например, фенитоина, карбамазепина, фенобарбитала или препаратов, содержащих зверобой продырявленный) может также привести к снижению концентрации риоцигуата в плазме крови.
In vitro риоцигуат и его основной метаболит являются мощными ингибиторами изофермента CYP1A1. Поэтому нельзя исключить клинически значимое лекарственное взаимодействие с одновременно принимаемыми препаратами, которые в значительной мере метаболизируется при участии изофермента СYP1A1, такими как эрлотиниб или гранисетрон.
Одновременное применение риоцигуата и нитратов или донаторов оксида азота (таких как амилнитрит) в любой лекарственной форме противопоказано, поскольку при применении риоцигуата в дозировке 2.5 мг в форме таблеток наблюдалось усиление гипотензивного эффекта нитроглицерина (0.4 мг, сублингвально), принятого через 4 и 8 ч после приема риоцигуата.
В исследованиях на животных было продемонстрировано снижение системного АД при сочетании риоцигуата с силденафилом или варденафилом (аддитивный эффект). При применении увеличенных доз в ряде случаев наблюдалось дополнительное снижение системного АД.
В исследовании лекарственного взаимодействия с участием 7 пациентов с ЛАГ, получавших постоянное лечение силденафилом (20 мг 3 раза/сут), однократный прием риоцигуата (0.5 мг и 1 мг последовательно) привел к суммированию влияния препаратов на гемодинамику.
При одновременном применении силденафила и риоцигуата повышен риск развития артериальной гипотензии. Одновременный прием риоцигуата и ингибиторов ФДЭ 5 (в т.ч. силденафила, тадалафила, варденафила) противопоказан.
Адемпас®
0,5 мг таблетки, покрытые пленочной оболочкой
Каждая
таблетка, покрытая пленочной оболочкой, содержит 0,5 мг риоцигуата.
Адемпас®
1 мг таблетки, покрытые пленочной оболочкой
Каждая
таблетка, покрытая пленочной оболочкой, содержит 1,0 мг риоцигуата.
Адемпас®
1,5 мг таблетки, покрытые пленочной оболочкой
Каждая
таблетка, покрытая пленочной оболочкой, содержит 1,5 мг риоцигуата.
Адемпас®
2 мг таблетки, покрытые пленочной оболочкой
Каждая
таблетка, покрытая пленочной оболочкой, содержит 2,0 мг риоттитуятя.
Адемпас®
2,5 мг таблетки, покрытые пленочной оболочкой
Каждая
таблетка, покрытая пленочной оболочкой, содержит 2,5 мг риоцигуата.
Вспомогательные
вещества, с известными свойствами наличие которых необходимо учитывать в
составе лекарственного препарата:
Адемпас®
0,5 мг таблетки, покрытые пленочной оболочкой
Каждая
таблетка, покрытая пленочной оболочкой, дозировкой 0,5 мг содержит 37,8 мг
лактозы (моногидрат).
Адемпас®
1 мг таблетки, покрытые пленочной оболочкой
Каждая
таблетка, покрытая пленочной оболочкой, дозировкой 1 мг содержит 37,2 мг
лактозы (моногидрат).
Адемпас®
1,5 мг таблетки, покрытые пленочной оболочкой
Каждая таблетка, покрытая пленочной оболочкой, дозировкой 1,5 мг
содержит 36,8 мг лактозы (моногидрат).
Адемпас® 2 мг таблетки, покрытые пленочной оболочкой
Каждая
таблетка, покрытая пленочной оболочкой, дозировкой 2 мг содержит 36,3. мг
лактозы (моногидрат).
Адемпас® 2,5 мг
таблетки, покрытые пленочной оболочкой
Каждая
таблетка, покрытая пленочной оболочкой, дозировкой 2,5 мг содержит 35,8 мг
лактозы (моногидрат).
Полный
список вспомогательных веществ см. в разделе «Фармакологические свойства»
Таблетки,
покрытые пленочной оболочкой, 0,5 мг: круглые
двояковыпуклые таблетки, покрытые пленочной оболочкой, белого цвета, на одной
стороне методом выдавливания нанесено «R» и «0.5», на другой стороне логотип компании Байер в виде креста.
Таблетки,
покрытые пленочной оболочкой, 1 мг: круглые
двояковыпуклые таблетки, покрытые пленочной оболочкой, бледно-желтого цвета, на
одной стороне методом выдавливания нанесено «R1», на другой стороне
логотип компании Байер в виде креста.
Таблетки,
покрытые пленочной оболочкой, 1,5 мг: круглые
двояковыпуклые таблетки, покрытые пленочной оболочкой, желтого цвета, на одной
стороне методом выдавливания нанесено «R» и «1.5», на другой стороне логотип компании Байер в виде креста.
Таблетки,
покрытые пленочной оболочкой, 2 мг: круглые
двояковыпуклые таблетки, покрытые пленочной оболочкой, бледно-оранжевого цвета,
на одной стороне методом выдавливания нанесено «R2», на другой стороне
логотип компании Байер в виде креста.
Таблетки,
покрытые пленочной оболочкой, 2,5 мг: круглые
двояковыпуклые таблетки, покрытые пленочной оболочкой, коричневато-оранжевого
цвета, на одной стороне методом выдавливания нанесено «R» и «2.5», на другой
стороне логотип компании Байер в виде креста.
Хроническая
тромбоэмболическая легочная гипертензия (ХТЭЛГ)
Адемпас®
показан для лечения взрослых пациентов с функциональным классом (ФК) ВОЗ от II
до III при:
— неоперабельной ХТЭЛГ,
— персистирующей или рецидивирующей ХТЭЛГ после оперативного лечения.
Для
улучшения переносимости физической нагрузки (см. раздел «Фармакологические
свойства»),
Легочная
артериальная гипертензия (ЛАГ)
Адемпас® в виде монотерапии или в комбинации с антагонистами рецепторов
эндотелина показан для лечения взрослых пациентов с легочной артериальной
гипертензией (ЛАГ) с функциональным классом (ФК) ВОЗ II — III для улучшения
переносимости физической нагрузки.
Эффективность была продемонстрирована в популяции ЛАГ, включая
этиологию идиопатической или наследственной ЛАГ или ЛАГ, связанной с
заболеванием соединительной ткани (см. раздел «Фармакологические свойства»).
Лечение должен инициировать и контролировать только врач, имеющий опыт
лечения ХТЭЛГ или ЛАГ.
Режим дозирования
Препарат Адемпас® может приниматься одновременно с приемом пищи или
независимо от времени приема пищи.
Титрование дозы
Рекомендуемая
начальная доза составляет 1 мг 3 раза в день на протяжении 2 недель. Таблетки
должны приниматься три раза в день с интервалом примерно 6-8 часов (см. раздел «Фармакологические
свойства»).
Если систолическое артериальное давление составляет 95 мм рт. ст. и
выше и у пациента при этом не отмечается симптомов артериальной гипотензии, дозу следует увеличивать на 0,5 мг каждые 2 недели до максимальной
суточной дозы (по 2,5 мг 3 раза в день). У некоторых пациентов с ЛАГ адекватный
ответ на дистанции 6-минутной ходьбы (6MWD) может быть достигнут при дозе 1,5 мг три раза в день (см. раздел
«Фармакологические свойства»).
Если систолическое артериальное давление менее 95 мм рт. ст., дозировку следует оставить прежней при условии, что у пациента не
отмечается симптомов артериальной гипотензии.
Если в любой момент на этапе титрования дозы систолическое артериальное
давление менее 95 мм рт. ст. и у пациента при этом отмечаются признаки
артериальной гипотензии, текущую дозу следует
уменьшить на 0,5 мг 3 р/д, то есть, рекомендовать назначить ранее принимаемую и
хорошо переносимую Дозу.
Поддерживающая доза
Подобранная индивидуальная доза должна поддерживаться, если только не
развиваются симптомы артериальной гипотензии.
Максимальная суточная доза препарата Адемпас® составляет 7,5 мг. В случае
пропуска очередной дозы препарата следует принять следующую дозу в соответствии
с назначенной схемой применения.
В случае непереносимости после применения назначенной дозы препарата,
она может быть снижена в любой момент проведения лечения.
Прием пищи
Таблетки обычно можно принимать вне зависимости от приема пищи. Для
пациентов, склонных: к гипотонии, в качестве меры предосторожности переключение
между приемом препарата Адемпас® после еды и натощак не рекомендуется из-за
повышенных пиковых уровней риоцигуата в плазме натощак по сравнению с
состоянием после еды (см. раздел «Фармакологические свойства»).
Отмена
лечения
В случае
необходимости перерыва в лечении на 3 дня и более, необходимо вернуться к
начальной дозе и возобновить прием препарата, начиная с дозы 1 мг 3 раза в день
на протяжении 2 недель; продолжить лечение с последующим титрованием дозы, как
это описано выше.
Переход
между ингибиторами фосфодиэстеразы-5 (ФДЭ5) и риоцигуатом
Прием
силденафила необходимо прекратить по крайней мере за 24 часа до приема
риоцигуата.
Прием
тадалафила необходимо прекратить не менее чем за 48 часов до приема риоцигуата.
Прием
риоцигуата необходимо прекратить по крайней мере за 24 часа до введения
ингибитора ФДЭ5.
После
любого перехода рекомендуется следить за признаками и симптомами гипотензии
(см. разделы «Противопоказания», «Взаимодействие с другими лекарственными
препаратами и другие формы взаимодействия» и «Фармакологические свойства»).
Особые
группы пациентов
Индивидуальный
подбор дозы в начале лечения позволяет корректировать дозу в соответствии с
потребностями пациента.
Пациенты
пожилого возраста
У
пожилых пациентов (65 лет и старше) существует более высокий риск гипотонии,
поэтому при индивидуальном поборе дозы следует проявлять особую осторожность (см.
раздел «Фармакологические свойства»).
Пациенты
с нарушением функции печени
Применение
препарата Адемпас® у пациентов с тяжелым нарушением функции печени (по шкале
Чайлд-Пью, класс С) противопоказано, так как исследования у таких пациентов не
проводились (см. раздел «Противопоказания»). У пациентов с умеренным
нарушением функции печени (класс В по шкале Чайлд-Пью) отмечалась более высокая
плазменная концентрация риоцигуата (см. раздел «Фармакологические свойства»).
При подборе дозы у таких пациентов следует соблюдать особую осторожность.
Пациенты с нарушением
функции почек
В настоящее время недостаточно данных о пациентах с тяжелым нарушением
функции почек (клиренс креатинина менее 30 мл/мин), данные по пациентам на
гемодиализе отсутствуют. Поэтому применение препарата Адемпас® у таких
пациентов не рекомендуется (см. раздел «Особые указания и меры
предосторожности»).
У пациентов с легким и умеренным нарушением функции почек (клиренс
креатинина менее 80 — 30 мл/мин) отмечались более высокие концентрации
лекарственного препарата (см. раздел «Фармакологические свойства»). У пациентов
с нарушением функции почек существует повышенный риск гипотензии, поэтому при
подборе индивидуальной дозы у таких пациентов следует соблюдать особую
осторожность.
Пациенты, получающие стабильные дозы сильных многопутевых ингибиторов CYP/P-гликопротеина (P-gp) ингибиторов и белка
резистентности рака молочной железы (BCRP)
При инициировании терапии препаратом Адемпас® у пациентов, получающих
стабильные дозы сильных многопутевых ингибиторов СYР и P-gp/BCRP„ таких как азольные
противомикробные препараты (например, кетоконазол, позаконазола, итраконазол)
или ингибиторами протеазы ВИЧ (например, ритонавир), следует рассмотреть
начальную дозу 0,5 мг три раза в сутки, чтобы снизить риск развития гипотонии.
Пациент должен находиться под наблюдением в целях выявления признаков и
симптомов гипотонии при инициации лечения и в дальнейшем. Следует рассмотреть
снижение дозы для пациентов, получающих препарат Адемпас® в дозах, превышающих
или равных 1,0 мг, в том случае, если у пациента появляются признаки или
симптомы гипотонии (см. разделы «Особые указания и меры предосторожности» и
«Взаимодействие с другими лекарственными препаратами и другие формы
взаимодействия).
Дети
Безопасность
и эффективность препарата Адемпас® не была изучена у пациентов моложе 18 лет.
Клинические данные отсутствуют. Доклинические данные демонстрируют
нежелательное воздействие на растущую кость (см. раздел «Фармакологические
свойства»). До получения большей информации о последствиях этих результатов,
следует избегать использования риоцигуата у детей и растущих подростков.
Курящие
Курящим пациентам настоятельно рекомендуется отказаться от
табакокурения, поскольку концентрация риоцигуата в плазме крови у курящих
пациентов существенно снижена в сравнении с некурящими. Пациентам, которые
курят или начинают курить во время лечения, может потребоваться увеличение дозы
до максимальной суточной дозы 2,5 мг три раза в день (см. разделы
«Взаимодействие с другими лекарственными препаратами и другие формы
взаимодействия» и «Фармакологические свойства»).
Пациентам,
бросившим курить, может потребоваться снижение дозы.
Способ применения
Для приема внутрь.
Измельчение таблеток
Если пациент не способен проглотить таблетку целиком, таблетка Адемпас®
может быть измельчена и смешана с водой или жидким питанием, например, яблочным
пюре, непосредственно перед приемом (см. раздел «Фармакологические свойства»).
• одновременное применение с ингибиторами ФДЭ-5 (такими как силденафил,
тадалафил, варденафил) (см. раздел «Режим дозирования и способ применения» и «Взаимодействие
с другими лекарственными препаратами и другие формы взаимодействия»);
• тяжелые нарушения функции печени (класс С по классификации Чайлд-Пью);
• повышенная чувствительность к
риоцигуату или любому другому компоненту, приведенному в разделе «Фармакологические
свойства»;
• беременность (см. раздел «Особые
указания и меры предосторожности при применении», «Взаимодействие с другими
лекарственными препаратами и другие формы взаимодействия», «Фертильность,
беременность и лактация»);
• одновременный прием с нитратами или донаторами оксида азота (такими,
как амилнитрит) в любой лекарственной форме (см. раздел «Взаимодействие с
другими лекарственными препаратами и другие формы взаимодействия»);
• легочная гипертензия,
ассоциированная с идиопатическими интерстициальными пневмониями (ЛГ-ИИП) (см.
раздел «Фармакологические свойства»)
• систолическое артериальное давление
менее 95 мм рт. ст, в начале лечения;
При легочной артериальной гипертензии исследования риоцигуата в
основном проводились в формах, связанных с идиопатической или наследственной
ЛАГ и ЛАГ, связанной с заболеванием соединительной ткани. Использование
риоцигуата при других неизученных формах ПАУ не рекомендуется (см. раздел «Фармакологические
свойства»).
При хронической тромбоэмболической легочной гипертензии легочная
эндартерэктомия является методом выбора, так как это потенциально излечивающий
вариант. Согласно общепринятой медицинской практике до начала, лечения
риоцигуатом необходимо провести экспертную оценку операбельности.
Веноокклюзионная болезнь легких
Применение препарата Адемпас® у пациентов с веноокклюзионной болезнью
легких (ВОБЛ) не рекомендовано, поскольку легочные вазодилататоры могут
существенно ухудшить клиническое состояние таких пациентов. При появлении
симптомов отека легких следует думать о возможности развития ассоциированной ВОБЛ,
лечение препаратом Адемпас® в таком случае должно быть прекращено.
Кровотечения из дыхательных путей
У пациентов с легочной гипертензией существует повышенная вероятность
кровотечения из дыхательных путей, особенно среди пациентов, получающих
антикоагулянтную терапию. Рекомендуется пристальное наблюдение за пациентами,
которые принимают антикоагулянты, в соответствии с обычной медицинской
практикой.
При
лечении препаратом Адемпас® риск серьезных и/или фатальных кровотечений из
дыхательных путей может увеличиваться, особенно в присутствии факторов риска,
таких как недавний эпизод серьезного кровохарканья, включая его лечение при
помощи бронхиальной артериальной эмболизации. У пациентов с серьезным
кровохарканьем в анамнезе, а также у лиц, которым ранее была проведена
эмболизация бронхиальных артерий, следует избегать назначения риоцигуата. В
случае кровотечений из дыхательных путей врач, назначающий препарат, должен
регулярно оценивать соотношение риск-польза для продолжения лечения.
Серьезные кровотечения возникли у 2,4 % (12/490) пациентов, которые
принимали риоцигуат, по сравнению с 0/214 среди пациентов в группе плацебо.
Серьезное кровохарканье развилось у 1 % (5/490) пациентов, которые принимали
риоцигуат по сравнению с 0/214 у пациентов, которые принимали плацебо, при этом
одно из этих событий имело фатальный исход. Серьезные геморрагические
осложнения также включали 2 пациентов с вагинальными кровотечениями, 2 с
кровотечениями из места установки катетера, и по 1 пациенту с каждым из
следующих состояний — с субдуральной гематомой, рвотой с кровью и внутрибрюшным
кровотечением.
Гипотензия
Препарат Адемпас® обладает сосудорасширяющими свойствами, что может
привести к снижению артериального давления. До назначения препарата Адемпас®
врач должен тщательно оценить риск возникновения нежелательных
сосудорасширяющих эффектов у пациентов с конкретными сопутствующими
заболеваниями (например, у пациентов, получающих гипотензивную терапию, или у
пациентов с исходной артериальной гипотензией, гиповолемией, тяжелой
обструкцией путей оттока из левого желудочка или вегетативной дисфункцией).
Риоцигуат нельзя применять пациентам с систолическим артериальным
давлением ниже 95 мм рт.ст. (см. раздел «Противопоказания»). Пациенты
старше 65 лет подвержены повышенному риску гипотензии. Таким образом, следует
соблюдать осторожность при назначении риоцигуата таким пациентам.
Почечная недостаточность
Данные о пациентах с тяжелой почечной недостаточностью (клиренс
креатинина <30 мл/мин) ограничены, отсутствуют данные о пациентах,
находящихся на диализе, поэтому риоцигуат не рекомендуется для применения этими
пациентам. Пациенты с легкой и умеренной почечной недостаточностью были
включены в основные исследования. У этих пациентов наблюдается повышенная
экспозиция риоцигуата (см. раздел «Фармакологические свойства»). У этих
пациентов повышен риск гипотензии, поэтому при индивидуальном подборе дозы
следует соблюдать особую осторожность.
Печеночная недостаточность
Нет опыта у пациентов с тяжелой печеночной недостаточностью (Чайлд-Пью
С); таким пациентам риоцигуат противопоказан (см. раздел «Противопоказания»).
Данные РК демонстрируют, что более высокая степень экспозиции риоцигуата
наблюдалась у пациентов с умеренной печеночной недостаточностью (Чайлд- Пью В) (см.
раздел «Фармакологические свойства»). Особую осторожность следует соблюдать при
индивидуальном подборе дозы. Клинический опыт применения риоцигуата у пациентов
с повышенным уровнем аминотрансфераз печени (> 3 х верхний предел нормы (ULN)) или с повышенным прямым
билирубином (> 2 х ULN) до начала лечения отсутствует; риоцигуат не рекомендуется этим
пациентам.
Беременность / контрацепция
Адемпас® противопоказан во время беременности (см. раздел
«Противопоказания»). Следовательно, пациентки с потенциальным риском
беременности должны использовать эффективный метод контрацепции. Рекомендуются
ежемесячные тесты на беременность.
Курильщики
Концентрация риоцигуата в плазме у курящих пациентов снижена по
сравнению с некурящими пациентами. У пациентов, которые начинают или бросают
курить во время лечения риоцигуатом, может потребоваться корректировка дозы (см.
разделы «Режим дозирования и способ применения» и «Фармакологические свойства»).
Одновременное
применение с другими лекарственными препаратами
• Одновременное применение препарата
Адемпас® с мощными ингибиторами изоферментов цитохрома и P-gp/BCRP, такими как азольные
противогрибковые препараты (например, кетоконазол, позаконазол, итраконазол)
или ингибиторы ВИЧ-протеазы (например, ритонавир) приводит к выраженному
увеличению экспозиции препарата Адемпас® (см. раздел «Взаимодействие с другими
лекарственными препаратами и другие формы взаимодействия» и «Фармакологические
свойства»).
• Прежде чем назначать применение
препарата Адемпас® у пациенток получающих стабильные дозы мощных ингибиторов
множественных метаболических путей с участием изоферментов цитохрома и
ингибиторов P-gp/BCRP, следует индивидуально
оценить соотношение пользы и рисков для каждого пациента. Чтобы снизить риск
гипотензии, следует рассмотреть возможность снижения дозы и наблюдения за
признаками и симптомами гипотензии (см. разделы «Режим дозирования и способ
применения» и «Взаимодействие с другими лекарственными препаратами и другие
формы взаимодействия»).
• У пациентов, получающих стабильные
дозы препарата Адемпас®, инициация применения мощных ингибиторов множественных
метаболических путей с участием изоферментов цитохрома и Р gp/BCRP не рекомендуется, поскольку в связи с ограниченностью данных не могут
быть предоставлены рекомендации по дозированию. Следует рассмотреть
альтернативные методы лечения.
• Одновременное применение препарата
Адемпас® с мощными ингибиторами изофермента CYP1A1, такими как ингибитор
тирозинкиназы эрлотиниб, и мощными ингибиторами P-gp/BCRP, такими как иммунодепрессант циклоспорин А, может увеличить экспозицию риоцигуата
(см. раздел «Взаимодействие с другими лекарственными препаратами и другие формы
взаимодействия» и «Фармакологические свойства»). Эти препараты следует
применять с осторожностью. Следует контролировать артериальное давление и
рассмотреть возможность снижения дозы препарата Адемпас®.
Адемпас®
содержит лактозу
Пациентам
с редкими наследственными проблемами непереносимости галактозы, полной
лактазной недостаточностью или мальабсорбцией глюкозы и галактозы не следует
принимать данный препарат.
Адемпас®
содержит натрий
Данный
препарат содержит менее 1 ммоль натрия (23 мг) на дозу, то есть практически не
содержит натрия.
Фармакодинамические
взаимодействия
Нитраты
Одновременное
применение риоцигуата и нитратов или донаторов оксида азота (таких как
амилнитрит) в любой лекарственной форме противопоказано, поскольку при
применении риоцигуата в дозировке 2,5 мг в форме таблеток, наблюдалось усиление
гипотензивного эффекта нитроглицерина (0,4 мг, сублингвально), принятого через
4 и 8 часов после приема риоцигуата (см. раздел «Противопоказания»).
Ингибиторы
ФДЭ-5
В
доклинических исследованиях на животных было продемонстрировано снижение
системного артериального давления при сочетании риоцигуата с
силденафилом или варденафилом (аддитивный эффект). При применении увеличенных
доз в ряде случаев наблюдалось дополнительное снижение системного артериального
давления.
В
исследовании лекарственных взаимодействий с участием 7 пациентов с ЛАГ,
получавших постоянное лечение силденафилом (20 мг 3 раза в сутки), однократный
прием риоцигуата (0,5 мг и 1 мг последовательно) привел к суммированию влияния
препаратов на гемодинамику. Дозы риоцигуата свыше 1,0 мг в этом исследовании не
изучались.
Было проведено 12-недельное исследование применения комбинации
стабильной дозы силденафила (20 мг 3 p/день) и риоцигуата (в дозе 1,0-2,5 мг 3 p/день) по сравнению с монотерапией силденафилом у
18 пациентов с ЛАГ. В продленной фазе исследования (в отсутствие группы
контроля) одновременное применение силденафила и риоцигуата приводило к более
высокой частоте отмены терапии, преимущественно вследствие артериальной
гипотензии. Не было получено доказательств благоприятного клинического эффекта
данной комбинации в исследуемой популяции.
Одновременный прием риоцигуата и ингибиторов
ФДЭ-5 (таких как силденафил, тадалафил, варденафил) противопоказан (см. разделы
«Противопоказания», «Режим дозирования и способ применения» и «Фармакологические
свойства»). RESPITE представляло собой
24-недельное неконтролируемое исследование по изучению перехода с ингибиторов
ФДЭ5 на риоцигуат у 61 взрослого пациента с ЛАГ, принимавшего стабильные
ингибиторы ФДЭ5. Все пациенты относились к функциональному классу III по
классификации ВОЗ, 82% получали фоновую терапию антагонистом рецепторов
эндотелина (ERA). При переходе от
ингибиторов ФДЭ5 к риоцигуату среднее время без лечения для силденафила
составляло 1 день, а для тадалафила — 3 дня. В целом профиль безопасности,
наблюдаемый в исследовании, был сопоставим с профилем безопасности, наблюдаемым
в основных исследованиях, без серьезных нежелательных явлений в течение
переходного периода.
Шесть пациентов (10%) испытали по крайней мере одно клиническое)
ухудшение, включая 2 смерти, не связанные с исследуемым препаратом.
Изменения по сравнению с исходным уровнем предполагали благоприятные
эффекты у отдельных пациентов, например улучшение при 6MWD (+ 31м), уровни N-концевого прогормона
натрийуретического пептида мозга’ (NT- proBNP) (-347 пг/мл) и ФК ВОЗ I / II / III / IV, % (2/52/46/0),
сердечный индекс (+0,3 л/мин/м2).
Варфарин/фенпрокумон
Одновременное лечение риоцигуатом и варфарином не влияло на
протромбиновое время. Предполагается, что одновременное применение риоцигуата с
другими производными кумарина (например, фенпрокумоном) также не будет
оказывать влияние на протромбиновое время.
Отсутствие
фармакокинетических взаимодействий между риоцигуатом и субстратом изофермента CYP2C9 варфарином было продемонстрировано в условиях in vivo.
Ацетилсалициловая
кислота
Риоцигуат
не вызывал удлинения времени кровотечения, вызванного приемом ацетилсалициловой
кислоты, а также не влиял на агрегацию тромбоцитов у человека.
Влияние
других веществ на риоцигуат
Риоцигуат
выводится в основном через окислительный метаболизм, опосредованный системой
изоферментов цитохрома Р450 (изоферменты CYP1A1, CYP3A4, CYP3A5, CYP2J2), а также в неизмененном
виде через кишечник или почками в процессе клубочковой фильтрации.
Совместное
применение с мощными ингибиторами множественных метаболических путей с участием
изоферментов цитохрома и P-gp/BCRP.
На основании исследований in vitro было выявлено, что риоцигуат
является субстратом для мембранных транспортных белков P-gp/BCRP (Р- гликопротеина / белка резистентности рака молочной железы).
Ингибиторы или индукторы этих ферментов или транспортных белков могут повлиять
на плазменные концентрации риоцигуата.
Высокоактивная
антиретровирусная терапия (ВААРТ)
In vitro абакавир, рилпивирин,
эфавиренз, ритонавир, кобицистат и элвитегравир ингибировали изофермент CYP1A1 и метаболизм риоцигуата, при этом абакавир был самым мощным
ингибитором, а активность ингибиторов убывала в указанном порядке. Кобицистат,
ритонавир, атазанавир и дарунавир дополнительно классифицируются как ингибиторы
изоферментов CYP3A. Кроме того, ритонавир подавлял P-gp.
Влияние ВААРТ (включая различные комбинации абакавира, атазанавира,
кобицистата, дарунавира, долутегравира, эфавиренза, элвитегравира,
эмтрицитабина, ламивудина, рилпивирина, ритонавира и тенофовира) на экспозицию
риоцигуата было изучено в специальном исследовании у ВИЧ- инфицированных
пациентов. Сопутствующее применение комбинированной ВААРТ приводило к
увеличению средних значений AUC риоцигуата приблизительно до 160 % и увеличению Сmax
приблизительно на 20 %. Профиль безопасности, наблюдаемый у пациентов с
ВИЧ-инфекций, получивших однократную дозу риоцигуата 0,5 мг совместно с
различными комбинациями препаратов для лечения ВИЧ-инфекции, используемых в
ВААРТ, в целом был сопоставим с таковым, наблюдаемым в других популяциях
пациентов.
При инициации применения препарата Адемпас® у пациентов, получающих
стабильные дозы мощных ингибиторов множественных метаболических путей с
участием изоферментов цитохрома (особенно CYP1A1 и CYP3A4) и P-gp/BCRP, например, препаратов
ВААРТ, следует рассмотреть возможность снижения начальной дозы. У этих
пациентов рекомендуется наблюдать за признаками и симптомами гипотонии (см.
разделы «Режим дозирования и способ применения» и «Особые указания и меры
предосторожности при применении»).
Противогрибковые препараты
In vitro было показано, что кетоконазол,
классифицируемый как мощный ингибитор изофермента CYP3A4 и P-gp, является ингибитором множественных метаболических путей с участием
системы изоферментов цитохрома и P-gp/BCRP, участвующих в метаболизме и экскреции риоцигуата. Одновременное
применение кетоконазола в дозе 400 мг один раз в сутки приводило к увеличению
на 150% (диапазон до 370%) средней AUC риоцигуата и увеличению Сmах на 46 %. Конечный
период полувыведения увеличивался с 7,3 до 9,2 часов, а общий клиренс
риоцигуата снижался с 6,1 до 2,4 л/ч.
При инициации применения препарата Адемпас®, у пациентов, получающих
стабильные дозы мощных ингибиторов множественных метаболических путей с
участием изоферментов цитохрома (особенно CYP1A1 и CYP3A4) и P-gp/BCRP, например, кетоконазола,
позаконазола или итраконазола, следует рассмотреть возможность снижения
начальной дозы. У этих пациентов рекомендуется наблюдать за признаками и
симптомами гипотонии (см. разделы «Режим дозирования и способ применения» и
«Особые указания и меры предосторожности при применении»).
Совместное
применение с другими ингибиторами CYP и P-gp/BCRP
Препараты, сильно ингибирующие P-gp/BCRP, такие как иммунодепрессант циклоспорин А, должны применяться с осторожностью
(см. раздел «Особые указания и меры предосторожности» и «Фармакологические
свойства»). Ингибиторы УДФ-гликозилтрансфераз (UGT) 1А1 и 1А9 потенциально
могут увеличивать экспозицию метаболита риоцигуата M1, который является фармакологически активным
(фармакологическая активность: от 1/10 до 1/3 риоцигуата). При одновременном
применении с этими веществами следуйте рекомендациям по титрованию дозы (см.
раздел «Режим дозирования и способ применения»).
Из рекомбинантных изоферментов цитохрома, исследованных in vitro, изофермент CYP1Al наиболее эффективно катализировал образование
основного метаболита риоцигуата. Препараты класса ингибиторов тирозинкиназы
являются мощными ингибиторами изофермента CYP1A1, при этом эрлотиниб и
гефитиниб проявляли наибольшую ингибиторную активность in vitro. Таким образом,
одновременное применение с препаратами, являющимися ингибиторами изофермента CYP1A1 может приводить к увеличению концентрации риоцигуата, особенно у
курящих пациентов (см. раздел «Фармакологические свойства»). Следовательно,
мощные ингибиторы изофермента CYP1A1 следует применять с
осторожностью (см. раздел «Особые указания и меры предосторожности»).
Совместное применение лекарственных средств, повышающих pH
желудочно-кишечного тракта
Одновременное применение препаратов, повышающих pH желудочно- кишечного
тракта, может привести к более низкой биодоступности при приеме внутрь, поскольку
растворимость риоцигуата снижается при нейтральной pH по сравнению с кислой
средой.
Одновременное
применение антацидов на основе алюминия гидроксида и/или магния гидроксида
снижает среднюю AUC риоцигуата на 34 %, а среднюю Сmах на 56% (см.
раздел «Режим дозирования и способ применения»). Антациды необходимо
принимать, по меньшей мере, за два часа до и через час после приема риоцигуата.
Совместное
применение с индукторами CYP3A4
Бозентан,
который является умеренным индуктором изофермента CYP3A4,. вызывает снижение
равновесной концентрации риоцигуата в плазме крови у пациентов с ЛАГ на 27 %,
не оказывая при этом влияния на эффективность комбинации (см. раздел «Режим
дозирования и способ применения»).
Одновременное
применение риоцигуата и мощных индукторов изофермента CYP3A4 (например, фенитоина,
карбамазепина, фенобарбитала или препаратов, содержащих Зверобой
продырявленный) может также привести к снижению концентрации риоцигуата в плазме
крови. При одновременном применении с сильными индукторами CYP3A4 следуйте рекомендациям по титрованию дозы (см. раздел «Режим
дозирования и способ применения»).
Курение
У
курильщиков сигарет экспозиция риоцигуата снижается на 50 — 60 % (см. раздел «Фармакологические
свойства»). Поэтому пациентам рекомендуется бросить курить (см. раздел «Режим
дозирования и способ применения»).
Влияние риоцигуата на другие вещества
Риоцигуат и его основной метаболит являются мощными ингибиторами
изофермента CYP1A1 в условиях in vitro. Таким образом, нельзя
исключить клинически значимые лекарственные взаимодействия с одновременно
принимаемыми препаратами, которые в значительной мере выводятся путем
метаболизма, опосредованного изоферментом CYP1A1, такими как эрлотиниб или
гранисетрон.
Риоцигуат и его основной метаболит не являются ни ингибиторами, ни
индукторами основных изоферментов цитохрома (включая изофермент CYP3A4) или транспортных белков (например, P-gp/BCRP) при терапевтических концентрациях в условиях in vitro.
Препарат
Адемпас® противопоказан во время беременности, поэтому следует избегать
наступления беременности при применении препарата (см. раздел
«Противопоказания»). Риоцигуат (2,5 мг три раза в день) не имел
клинически значимого влияния на действие комбинированных пероральных
контрацептивов, содержащих левоноргестрел и этинилэстрадиол при одновременном
применении здоровыми добровольцами женского пола. На основании этого
исследования и поскольку риоцигуат не является индуктором какого-либо из
соответствующих метаболических ферментов, также не ожидается фармакокинетического
взаимодействия с другими гормональными контрацептивами.
Женщины
детородного возраста/контрацепция
Женщины
детородного возраста должны использовать эффективные средства контрацепции во
время лечения препаратом Адемпас®.
Беременность
Данные
о применении риоцигуата беременными женщинами отсутствуют. Исследования на животных показали репродуктивную токсичность и проникновение
препарата через плаценту (см. раздел «Фармакологические свойства»). Поэтому Адемпас®
противопоказан во время беременности (см. раздел «Противопоказания»).
Рекомендуются ежемесячное проведение тестов на беременность.
Период
грудного вскармливания
Данные о
применении риоцигуата у женщин, кормящих грудью, отсутствуют. Данные исследований
на животных свидетельствуют о том, что риоцигуат выделяется с грудным молоком.
Из-за потенциала развития серьезных побочных реакций у младенцев, находящихся
на грудном вскармливании, лекарственный препарат Адемпас® не следует
использовать в период кормления грудью. Нельзя исключить риск для грудных
детей. В период лечения данным лекарственным препаратом грудное вскармливание
следует прекратить.
Фертильность
Не проводилось специальных исследований с применением риоцигуата для оценки
его влияния на фертильность человека. В исследовании репродуктивной токсичности
на крысах наблюдалось снижение массы яичек, но оно не влияло на фертильность
(см. раздел «Фармакологические свойства»). Релевантность данного наблюдения для
людей неизвестна.
Адемпас®
умеренно влияет на способность управлять транспортными средствами и работать с
механизмами. Сообщалось о случаях головокружения, которое может повлиять на способность
управлять транспортными средствами и работать с механизмами (см. раздел
«Нежелательные реакции»). Пациенты должны знать о своей реакции на
данный препарат, прежде чем управлять транспортными средствами и работать с
механизмами.
Краткое описание профиля
безопасности
Безопасность
препарата Адемпас® оценивали в исследованиях III фазы с (участием 681 пациента
с ХТЭЛГ и ЛАГ, получавших не менее одной дозы риоцигуата (см. раздел «Фармакологические
свойства»).
Большинство
нежелательных реакций вызвано расслаблением гладкомышечных клеток в сосудистой
сети или желудочно-кишечном тракте. Наиболее частыми нежелательными реакциями,
возникающими у ≥ 10 % пациентов, получавших лекарственный препарат Адемпас® (до
2,5 мг три раза в день), были головная боль, головокружение, диспепсия,
периферические отеки, тошнота, диарея и рвота.
У пациентов
с ХТЭЛГ или ЛАГ, получавших Адемпас®, наблюдались серьезные кровохарканья и
легочные кровотечения, в том числе случаи со смертельным исходом (см. раздел
«Особые указания и меры предосторожности при применении»).
Профиль безопасности лекарственного препарата Адемпас® у пациентов с
ХТЭЛГ и ЛАГ оказался схожим, поэтому нежелательные реакции, выявленные в
плацебо-контролируемых клинических исследованиях продолжительностью 12 и 16
недель, представлены с объединенной частотой в таблице, приведенной ниже (см.
Таблицу 1).
Перечень нежелательных реакций в виде таблицы
Нежелательные
реакции, зарегистрированные при приеме препарата Адемпас®, перечислены в таблице
ниже по классам систем и органов MedDRA и по частоте возникновения. Частота встречаемости определяется
следующим образом: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1 000 и <1/100), редко (≥1/10 000 и <1/1 000), очень редко (<1/10 000) и неизвестно (невозможно
оценить по имеющимся данным).
Таблица 1: Нежелательные реакции, зарегистрированные при применении
препарата Адемпас® в исследованиях фазы III
|
Системно-органный класс MedDRA |
Очень часто |
Часто |
Нечасто |
|
Инфекции и инвазии |
Гастроэнтерит |
||
|
Нарушения со стороны крови и лимфатической системы |
Анемия (включая соответствующие лабораторные показатели |
||
|
Нарушения со стороны нервной системы |
Учащенное сердцебиение |
||
|
Нарушения со стороны сосудов |
Снижение артериального давления |
||
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Кровохарканье, Носовое кровотечение, Заложенность носа |
Легочное кровотечение ⃰ | |
|
Нарушения со стороны желудочно-кишечного тракта |
Диспепсия, Диарея, Тошнота, Рвота |
Гастрит, Гастроэзофагеальная рефлюксная болезнь, Дисфагия, Боль в разных отделах ЖКТ, Запор, Вздутие живота |
|
|
Общие расстройства и нарушения в месте введения |
Периферические отеки |
* сообщалось о случае
фатального легочного кровотечения в рамках долговременного исследования без группы контроля.
Сообщение о подозреваемых
нежелательных реакциях
Важно
сообщать о подозреваемых нежелательных реакциях после регистрации
лекарственного препарата с целью обеспечения непрерывного мониторинга
соотношения «польза-риск» лекарственного препарата. Медицинским работникам
рекомендуется сообщать о любых подозреваемых нежелательных реакциях согласно
рекомендациям УП «Центра экспертиз и испытаний в здравоохранении» Министерства
Здравоохранения Республики Беларусь, размещенным на портале ЦЭИЗ по эл. адресу http://www.rceth.by.
Сообщалось о
непреднамеренной передозировке при общей суточной дозе от 9 до 25 мг риоцигуата
в течение 2-32 дней. Нежелательные реакции были аналогичны наблюдавшимся при
приеме более низких доз (см. раздел «Нежелательные реакции»).
В случае
передозировки следует применять стандартные поддерживающие меры в соответствии
с клинической необходимостью.
При
развитии выраженного снижения артериального давления может потребоваться
активная гемодинамическая поддержка.
Поскольку
риоцигуат обладает высокой степенью связывания с белками плазмы крови,
возможность выведения его с помощью диализа представляется маловероятной.
Антигипертензивные средства (гипотензивные средства при легочной артериальной гипертензии).
Код ATX: С02КХ05
Фармакодинамические
свойства
Механизм действия Риоцигуат является стимулятором растворимой гуанилатциклазы (рГЦ),
фермента сердечно-легочной системы и рецептора оксида азота (NO).
При
связывании NO с рГЦ фермент катализирует
синтез сигнальной молекулы циклического гуанозинмонофосфата (цГМФ). Внутриклеточный
цГМФ играет важную роль в регуляции процессов, влияющих на тонус сосудов,
пролиферацию, фиброз и воспаление.
Легочная
гипертензия ассоциируется с эндотелиальной дисфункцией, нарушением синтеза
оксида азота и недостаточной стимуляцией метаболического пути NO-рГЦ-цГМФ. Риоцигуат имеет
двойной механизм действия. Он сенсибилизирует рГЦ к эндогенному NO путем стабилизации связи NO-рГЦ. Риоцигуат также напрямую
стимулирует рГЦ через другой участок связи, независимо от NO.
Риоцигуат
восстанавливает метаболический путь NO-рГЦ-цГМФ и вызывает увеличение продукции цГМФ.
Фармакодинамическое
действие
Риоцигуат
восстанавливает путь NO-sGC-cGMP, что приводит к значительному улучшению гемодинамики легочных сосудов и
повышению физической работоспособности.
Существует
прямая зависимость между концентрацией риоцигуата в плазме и гемодинамическими
параметрами, такими как системное и легочное сосудистое сопротивление,
систолическое артериальное давление и сердечный выброс.
Клиническая
эффективность и безопасность
Эффективность
у пациентов с ХТЭЛГ
Было
проведено рандомизированное двойное слепое многонациональное исследование III
фазы с контролем плацебо (CHEST-I) с участием 261 взрослого
пациента с неоперабельной хронической тромбоэмболической легочной гипертензией
(ХТЭЛГ) (72 %) или стойкой или рецидивирующей ХТЭЛГ после легочной
эндартерэктомии (ЛЭА; 28 %). В течение первых 8 недель дозу риоцигуата повышали
каждые 2 недели в зависимости от систолического артериального давления пациента
и признаков или симптомов гипотонии до оптимальной индивидуальной дозы (от 0,5
мг до 2,5 мг три раза в сутки), которой затем придерживались в течение
следующих 8 недель. Первичной конечной точкой исследования было изменение по
сравнению с исходным уровнем, скорректированное по плацебо, в тесте 6- минутной
ходьбы (6МХ) во время последнего визита (16-я неделя).
На момент последнего визита
увеличение в тесте 6МХ у пациентов, получавших риоцигуат, составило 46 м (95 %
доверительный интервал (ДИ): от 25 до 67 м; р <0,0001) по сравнению с
плацебо. Результаты были непротиворечивыми в основных изученных подгруппах
(анализ ITТ- популяции, см. Таблицу 2).
Таблица 2: Влияние риоцигуата на тест 6МХ на момент последнего визита в исследовании
CHEST-1
|
Вся популяция пациентов |
Риоцигуат (n=173) |
Плацебо (n=88) |
|
Исходный уровень (м) [CO] |
342 [82] |
356 [75] |
|
Среднее изменение от исходного уровня (м) [СО] |
39 [79] |
-6 [84] |
|
Разница, скорректированная по плацебо (м) 95% ДИ, [р-значение] |
46 25-67 [<0,0001] |
|
|
Популяция пациентов III ФК |
Риоцигуат (n=107) |
Плацебо (n=60) |
|
Исходный уровень (м) [CO] |
326 [81] |
345 [73] |
|
Среднее изменение от исходного уровня (м) [CO] |
38 [75] |
-17 [95] |
|
Разница, скорректированная по плацебо (м) 95% ДИ |
56 29-83 |
|
|
Популяция пациентов II ФК |
Риоцигуат (n=55) |
Плацебо (n=25) |
|
Исходный уровень (м) [СО] |
387 [59] |
386 [64] |
|
Среднее изменение от исходного уровня (м) [СО] |
45 [82] |
20 [51] |
|
Разница, скорректированная по плацебо (м) 95% ДИ |
25 -10-61 |
|
|
Популяция неоперабельных пациентов |
Риоцигуат (n=121) |
Плацебо (n=68) |
|
Исходный уровень (м) [СО] |
335 [83] |
351 [75] |
|
Среднее изменение от исходного уровня (м) [CO] |
44 [84] |
-8 [88] |
|
Разница, скорректированная по плацебо (м) 95% ДИ |
54 29-79 |
|
|
Популяция пациентов с ХТЭЛГ после ЛЭА |
Риоцигуат (n=52) |
Плацебо (n=20) |
|
Исходный уровень (м) [СО] |
360 [78] |
374 [72] |
|
Среднее изменение от исходного уровня (м) [СО] |
27 [68] |
1,8 [73] |
|
Разница, скорректированная по плацебо (м) 95% ДИ |
27 -10-63 |
Улучшение способности к
физической нагрузке сопровождалось улучшением по нескольким клинически значимым
вторичным конечным точкам. Данные результаты соответствовали улучшениям по
дополнительным гемодинамическим показателям.
Таблица 3: Влияние риоцигуата на ЛСС, NT-proBNP и функциональный класс по
ВОЗ на момент последнего визита в исследовании CHEST-1
|
ЛСС |
Риоцигуат (n=151) |
Плацебо (n=82) |
|
Исходное (дин·с·см-5) [СО] |
790,7 [431,6] |
779,3 [400,9] |
|
Среднее изменение от исходного уровня (дин·с·см-5) [СО] |
-225,7 [247,5] |
23,1 [273,5] |
|
Разница, скорректированная по плацебо (дин·с·см-5) 95% ДИ, [р-значение] |
-246,4 от-303,3 до -189,5 [<0,0001] |
|
|
NT-proBNP |
Риоцигуат (n=150) |
Плацебо (n=73) |
|
Исходный уровень (нг/л) [СО] |
1508,3 [2337,8] |
1705 [2567,2] |
| Среднее изменение от исходного уровня (нг/л) [CO] |
-290,7 [1716,9] |
76,4 [1446,6] |
|
Разница, скорректированная по плацебо (нг/л) 95% ДИ, [р-значение] |
-444,0 от -843,0 до -45,0 [0,0001] |
|
|
Изменение функционального класса по ВОЗ |
Риоцигуат (n=173) |
Плацебо (n=87) |
| Улучшение | 57 (32,9%) | 13 (14,9%) |
| Стабильность | 107 (61,8%) | 68 (78,2%) |
| Ухудшение | 9 (5,2%) | 6 (6,9%) |
| р-значение | 0,0026 |
PVR = легочное сосудистое сопротивление
Нежелательные
явления, приводившие к прекращению терапии, возникали с одинаковой частотой в
обеих группах лечения (индивидуальный подбор дозы (ИПД) риоцигуата 1,0-2,5 мг,
2,9%; плацебо, 2,3%).
Долгосрочное
лечение
В открытое дополнительные
исследование (CHEST-2) было включено 237
пациентов, завершивших исследование CHEST-1. В исследовании CHEST-2 все пациенты получали индивидуализированную дозу риоцигуата в размере
не более 2,5 мг три раза в сутки.
В тесте 6МХ среднее
изменение от исходного уровня до 12-й недели (последнее наблюдение до 12-й
недели) в исследовании CHEST-2 (28 недель участия в исследованиях CHEST-1 + CHEST-2) составило 57 м в бывшей группе приема риоцигуата в дозе 1,0-2,5 мг и 43
м в бывшей группе плацебо. Улучшения в тесте 6МХ сохранялись в течение 2 лет по
результатам исследования CHEST-2.
Среднее
изменение от исходного уровня для всей популяции (N=237) составило 57 м через
6 месяцев (n=218), 51м через 9 месяцев (n=219), 52 м через 12 месяцев (11=209) и 48 м через
24 месяца (n=193).
Вероятность
выживания через 1 год составила 97 %, через 2 года — 93 % и через 3 года — 89
%. Выживаемость у пациентов с функциональным классом II по ВОЗ на исходном
уровне через 1, 2 и 3 года составила 97 %, 94 % и 90 %, соответственно, а у
пациентов с функциональным классом III по ВОЗ на исходном уровне — 97 %, 93 % и
88 %, соответственно.
Эффективность у пациентов с ЛАГ
Было проведено рандомизированное двойное слепое многонациональное исследование
III фазы с контролем плацебо (PATENT-1) с участием 443 взрослых пациентов с ЛАГ (индивидуальный подбор дозы
риоцигуата не более 2,5 мг три раза в сутки; n=254, плацебо: n=126,
«ограниченное» увеличение дозы (ОУ) риоцигуата не более 1,5 мг (группа по
выбору дозы, статистический анализ не проводился: n=63)). Пациенты либо
ранее не получали лечения (50 %), либо предварительно получали антагонисты
эндотелиновых рецепторов (ЭР) (43 %) или аналог простациклина (для
ингаляционного (илопрост), перорального (берапрост) или подкожного
(трепростинил) применения: 7 %), и им был поставлен диагноз идиопатическая или
наследственная ЛАГ (63,4 %), ЛАГ, ассоциированная с заболеванием соединительной
ткани (25,1%) и врожденный порок сердца (7,9 %).
В течение первых 8 недель дозу
риоцигуата повышали каждые 2 недели в зависимости от систолического
артериального давления пациента и признаков или симптомов гипотонии до
оптимальной индивидуальной дозы (от 0,5 мг до 2,5 мг три раза в сутки), которой
затем придерживались в течение следующих 4 недель. Первичной конечной точкой
исследования являлось изменение, скорректированное по плацебо, по сравнению с
исходным значением в тесте 6МХ на момент последнего визита (12-я неделя).
На момент последнего визита увеличение в тесте 6МХ при индивидуальном.
подборе дозы (ИПД) риоцигуата составило 36 м (95% ДИ: от 20 до 52 м; р
<0,0001) по сравнению с плацебо. У пациентов, ранее не получавших лечения (n=189),
наблюдалось улучшение на 38 м, а у пациентов, предварительно получивших лечение
(n=191), — на 36 м (анализ ITТ-популяции,
см. Таблицу 4). Дальнейший исследовательский анализ в подгруппах выявил эффект
от лечения в размере 26 м (95% ДИ: от 5 м до 46 м) у пациентов, ранее
получавших антагонисты ЭР (n=167), и эффект лечения в размере 101м (95% ДИ: от
27 м до 176 м) у пациентов, ранее получавших аналоги простациклина (n=27).
Таблица
4: Влияние риоцигуата на результаты теста 6МХ на
момент последнего визита в исследовании PATENT-1
|
Вся популяция пациентов |
Риоцигуат ИПД (n=254) |
Плацебо (n=126) |
Риоцигуат ОУ (n=63) |
|
Исходный уровень (м) [CO] |
361 [68] |
368 [75] |
363 [67] |
|
Среднее изменение от исходного уровня (м) [CO] |
30 [66] |
-6 [86] |
31 [79] |
|
Разница, скорректированная по плацебо (м) 95% ДИ, [р- значение] |
36 20-52 [0,0001] |
||
|
Пациенты III ФК |
Риоцигуат ИПД (n=140) |
Плацебо (n=58) |
Риоцигуат ОУ (n=39) |
|
Исходный уровень (м) [СО] |
338 [70] |
347 [78] |
351 [68] |
|
Среднее изменение от исходного уровня (м) [CO] |
31 [64] |
-27 [98] |
29 [94]
|
|
Разница, скорректированная по плацебо (м) 95% ДИ |
58 35-81 |
||
|
Пациенты II ФК |
Риоцигуат ИПД (n=108) |
Плацебо (n=60) |
Риоцигуат ОУ (n=19) |
|
Исходный уровень (м) [СО] |
392 [51] |
393 [61] |
378 [64] |
|
Среднее изменение от исходного уровня (м) [СО] |
29 [69] |
19 [63] |
43 [50] |
|
Разница, скорректированная по плацебо (м) 95% ДИ |
10 от -11 до 31 |
||
|
Пациенты, ранее не получавшие лечения |
Риоцигуат ИПД (n=123) |
Плацебо (n=66) |
Риоцигуат ОУ (n=32) |
|
Исходный уровень (м) [СО] |
370 [66] |
360 [80] |
347 [72] |
|
Среднее изменение от исходного уровня (м) [CO] |
32 [74] |
-6 [88] |
49 [47] |
|
Разница, скорректированная по плацебо (м) 95% ДИ |
38 14-62 |
||
|
Пациенты, предварительно получившие лечение |
Риоцигуат ИПД (n=131) |
Плацебо (n=60) |
Риоцигуат ОУ (n=31) |
|
Исходный уровень (м) [СО] |
353 [69] |
376 [68] |
380 [57] |
|
Среднее изменение от исходного уровня (м) [CO] |
27 [58] |
-5 [83]
|
12 [100]
|
|
Разница, скорректированная по плацебо (м) 95% ДИ |
36 15-56 |
Улучшение способности
к физической нагрузке сопровождалось постоянным улучшением по нескольким
клинически значимым вторичным конечным точкам. Данные результаты
соответствовали улучшениям по дополнительным гемодинамическим показателям (см.
Таблица 5)
Таблица
5: Влияние риоцигуата на ЛСС и NT-proBNP на момент последнего визита в исследовании PATENT-1
|
ЛСС |
Риоцигуат ИПД (n=232) |
Плацебо (n=107) |
Риоцигуат ОУ (n=58) |
|
Исходное
(дин·с·см-5) |
791 [452,6] |
834,1 [476,7] |
847,8 [548,2] |
|
Среднее изменение от исходного уровня ЛСС (дин·с·см-5) [CO] |
-223 [260,1] |
-8,9 [316,6] |
-167,8 [320,2] |
|
Разница, скорректированная по плацебо (дин·с·см-5) 95% ДИ, [р- значение] |
-225,7 от-281,4 до-170,1 [<0,0001] |
||
|
NT-proBNP |
Риоцигуат ИЦД (n=228) |
Плацебо (n=106) |
Риоцигуат ОУ (n=54) |
|
Исходный уровень (нг/л) [СО] |
1026,7 [1779,2] |
1228,1 [1774,9] |
1189,7 [1404,7] |
|
Среднее изменение от исходного уровня (нг/л) [CO] |
-197,9 [1721,3] |
232,4 [1011,1] |
-471,5 [913,0] |
|
Разница, скорректированная по плацебо (нг/л) 95% ДИ, [р- значение] |
-431,8 от-781,5 до 82,1 [<0,0001] |
||
|
Изменение, функционального класса по ВОЗ |
Риоцигуат ИИД (n=254) |
Плацебо (n=125) |
Риоцигуат ОУ (n=63) |
| Улучшение | 53 (20,9%) | 18(14,4%) | 15 (23,8%) |
| Стабильность | 192 (75,6%) | 89 (71,2%) | 43 (68,3%) |
| Ухудшение | 9 (3,6%) | 18 (14,4%) | 5 (7,9%) |
| p- значение | 0,0033 |
У
пациентов, получавших риоцигуат, отмечалась значительная задержка во времени до
клинического ухудшения по сравнению с пациентами, получавшими плацебо (р=0,0046;
стратифицированный логарифмически ранговый критерий) (см. Таблицу б).
Таблица 6. Влияние риоцигуата на явления клинического ухудшения в исследовании PATENT-1
|
Явления клинического ухудшения |
Риоцигуат ИПД (n=254) |
Плацебо (n=126) |
Риоцигуат ОУ (n=63) |
|
Пациенты с любым клиническим ухудшением |
3(1,2%) | 8 (6,3%) | 2 (3,2%) |
| Смерть | 2 (0,8%) | 3 (2,4%) | 1 (1,6%) |
|
Госпитализация на фоне ЛГ |
1 (0,4%) | 4 (3,2%) | 0 |
|
Снижение результата в тесте 6МХ на фоне ЛГ |
1 (0,4%) | 2 (1,6%) | 1 (1,6%) |
|
Стойкое ухудшение по функциональному классу на фоне ЛГ |
01 | 1 (0,8%) | 0 |
|
Начало нового лечения от ЛГ |
1 (0,4%) | 5 (4,0%) | 1 (1,6%) |
У пациентов, получавших
риоцигуат, было продемонстрировано значительное улучшение одышки по 10-балльной
шкале Борга (среднее изменение от исходного уровня (СО):
риоцигуат -0,4 (2), плацебо 0,1 (2); р=0,0022). Нежелательные явления, из-за
которых была прекращена терапия, возникали реже в обеих группах лечения
риоцигуатом, чем в группе плацебо (риоцигуат ИПД 1,0-2,5 мг, 3,1%; риоцигуат ОУ
1,6%; плацебо, 7,1%).
Долгосрочное лечение
В открытое
дополнительное исследование (PATENT-2) было включено 396 пациентов, прошедших полный курс лечения в
исследовании PATENT-1 на дату прекращения
сбора данных. В исследовании PATENT-2 все пациенты получали индивидуализированную дозу риоцигуата в размере
не более 2,5 мг три раза в сутки. Среднее изменение от исходного уровня до 12-й
недели в тесте 6МХ (последнее наблюдение до 12-й недели) в исследовании PATENT- 2 (24 недели участия в
исследованиях PATENT-1 + PATENT-2) составило 52 м в бывшей
группе приема риоцигуата в дозе 1,0-2,5 мг, 45 м в бывшей группе плацебо и 52 м
в бывшей группе приема риоцигуата в дозе 1,0-1,5 мг. Улучшения в тесте 6МХ
сохранялись в течение 2 лет по результатам исследования PATENT-2. Среднее изменение от
исходного уровня для всей популяции (N=396) составило 53 м через 6 месяцев (n=366), 52 м через 9
месяцев (n=354), 50 м через 12 месяцев (n=351) и 46 м через 24 месяца (n=316).
Вероятность выживания через 1 год составила 97 %, через 2 года — 93 % и через 3
года — 88 %. Выживаемость у пациентов с функциональным классом II по ВОЗ на
исходном уровне через 1, 2 и 3 года составила 98 %, 96 % и 93 %,
соответственно, а у пациентов с функциональным классом III по ВОЗ на исходном
уровне — 96 %, 91 % и 84 %, соответственно.
Пациенты с легочной гипертензией, связанной с идиопатической
интерстициальной пневмонией (ЛГ ИИП)
Рандомизированное двойное слепое исследование
II фазы с контролем плацебо (RISE-IIР) по оценке эффективности и безопасности риоцигуата у пациентов с
симптоматической легочной гипертензией, ассоциированной с идиопатической
интерстициальной пневмонией (ЛГ ИИП), было прекращено досрочно из-за
повышенного риска смертности и развития серьезных нежелательных явлений у
пациентов, получавших риоцигуат, а также из-за отсутствия эффективности. Больше
пациентов, принимавших риоцигуат умерли (11 % по сравнению с 4 %) и
имели серьезные нежелательные явления (37 % по сравнению с 23 %) во время
основной фазы исследования. Во время долгосрочной дополнительной фазы умерло
больше пациентов, перешедших из группы плацебо на риоцигуат (21 %), чем тех,
кто продолжал принимать риоцигуат (3 %).
Таким образом, риоцигуат противопоказан пациентам с легочной
гипертензией, ассоциированной с идиопатической интерстициальной пневмонией (см.
раздел «Противопоказания»).
Дети
Европейское агентство лекарственных средств дало отсрочку на
обязательное предоставление результатов исследований применения лекарственного
препарата Адемпас® в одной или нескольких подгруппах пациентов детского
возраста при лечении легочной гипертензии.
См. раздел
«Режим дозирования и способ применения» для информации об использовании у детей».
Фармакокинетические свойства
Всасывание
Абсолютная биодоступность риоцигуата высокая (94 %). Риоцигуат быстро
всасывается, максимальная концентрация в плазме крови (Сmax)
достигается через 1-1,5 часа после приема внутрь. Всасывание риоцигуата
происходит на всем протяжении желудочно-кишечного тракта (ЖКТ), преимущественно
в верхних отделах. В дистальных отделах ЖКТ всасывание снижается.
Применение
препарата одновременно с приемом пищи несколько снижает AUC риоцигуата, Сmax
снижается на 35 %.
Биодоступность
(AUC и Сmах) измельченных таблеток, суспендированных в яблочном пюре или в воде,
сопоставима с биодоступностью цельных таблеток (см. раздел «Режим дозирования и
способ применения» для информации об использовании у детей»).
Распределение
Связь с
белками крови высокая и составляет приблизительно 95 %. Основными связывающими
компонентами являются альбумин сыворотки крови и альфа-1-кислый гликопротеин.
Объем
распределения является средним, при этом в равновесном состоянии он составляет
приблизительно 30 л.
Метаболизм
N-деметилирование, катализируемое изоферментами CYP1A1, CYP3A4, CYP3A5 и CYP2J2, является основным путем метаболизма риоцигуата, приводящим к
образованию его основного циркулирующего метаболита (фармакологическая
активность: от 1/10 до 1/3 риоцигуата), который в дальнейшем метаболизируется в
фармакологически неактивный N- глюкуронид.
Изофермент
CYP1A1 катализирует образование основного метаболита риоцигуата в печени и
легких. Этот процесс усиливается полициклическими ароматическими
углеводородами, например, содержащимися в дыме от сигарет.
Выведение
Весь риоцигуат (исходный препарат и метаболиты) выводится почками
(33-45 %) и через кишечник (48-59 %). Приблизительно от 4 до 19 % введенной
дозы выводится в неизмененном виде почками, приблизительно 9-44 % — через
кишечник. На основании данных in vitro установлено, что риоцигуат
и его основной метаболит являются субстратами для транспортных белков P-gp (Р- гликопротеин) и BCRP (белок резистентности рака молочной железы).
Риоцигуат
является препаратом с низким клиренсом (системный клиренс равен приблизительно 3-6
л/час). Период полувыведения составляет примерно 7 часов у здоровых
добровольцев и около 12 часов у пациентов.
Линейность
Фармакокинетика
риоцигуата линейна в дозах от 0,5 до 2,5 мг. Межиндивидуальная вариабельность
(КВ) экспозиции риоцигуата (AUC) для всех доз составляет примерно 60 %.
Особые
категории пациентов
Пол
Фармакокинетические данные не демонстрируют существенных различий в
экспозиции риоцигуата в зависимости от пола.
Дети
Исследования
фармакокинетики риоцигуата у детей не проводились.
Пациенты
пожилого возраста
У пожилых пациентов (65 лет и старше)
отмечалась более высокая концентрация риоцигуата в плазме крови, чем у молодых,
при этом показатели AUC были приблизительно на 40 % выше у пожилых, главным образом, вследствие
кажущегося снижения общего и почечного клиренса.
Межэтнические
различия
Фармакокинетические данные не демонстрируют значимых межэтнических
различий.
Разные
весовые категории
Фармакокинетические данные не демонстрируют значимых различий в
экспозиции риоцигуата в зависимости от массы тела.
Пациенты с нарушением функции печени
У пациентов с циррозом (некурящих) со слабой печеночной
недостаточностью (класс А по шкале Чайлда-Пью) средняя AUC риоцигуата увеличивалась на 35 % по сравнению со
здоровыми лицами из группы контроля, что находится в пределах нормальной
межиндивидуальной вариабельности. У пациентов с циррозом (некурящих) с
умеренной печеночной недостаточностью (класс В по шкале Чайлда-Пью) средняя AUC риоцигуата увеличивалась
на 51 % по сравнению со здоровыми лицами из группы контроля. Данных о пациентах
с тяжелой печеночной недостаточностью (класс С по шкале Чайлда-Пью) не имеется.
Пациенты с АЛТ>З-х ВГН и билирубином>
2х ВГН не изучались (см. раздел «Особые указания и меры предосторожности при
применении»).
Пациенты с нарушением функции почек
В целом у пациентов с почечной
недостаточностью, средние величины концентраций риоцигуата (нормализованные по
дозе и массе) были выше, чем у пациентов с нормальной функцией почек.
Соответствующие показатели для основного метаболита были выше у пациентов с
почечной недостаточностью в сравнении со здоровыми добровольцами. У некурящих
пациентов с легким (клиренс креатинина 80-50 мл/мин), умеренным (клиренс
креатинина менее 50-30 мл/мин) или тяжелым (клиренс креатинина менее 30 мл/мин)
нарушением функции почек, концентрация риоцигуата в плазме крови (AUC) увеличивалась на 53 %,
139 % и 54 %, соответственно.
Данные о пациентах с клиренсом креатинина <30 мл/мин ограничены;
данные о пациентах, находящихся на диализе, отсутствуют.
Вследствие интенсивного связывания с белками плазмы риоцигуат не
удаляется при помощи диализа.
Данные доклинических
исследований безопасности
На основании доклинических данных, полученных
в рамках стандартных исследований фармакологической безопасности при однократном
применении, фототоксичности, генотоксичности и канцерогенности, каких-либо
особых рисков для человека не выявлено. Эффекты, наблюдаемые в исследованиях
токсичности при многократном введении, были в основном связаны с чрезмерной
фармакодинамической активностью риоцигуата (гемодинамические эффекты и
расслабляющее действие на гладкую мускулатуру).
У
растущих, ювенильных и молодых крыс наблюдалось влияние на формирование костей.
У ювенильных крыс изменения заключались в утолщении губчатой кости и
гиперостозе и изменении конструкции метафизарных и диафизарных сегментов
костей, тогда как у молодых крыс наблюдалось, общее увеличение костной массы. У
взрослых особей данные эффекты не наблюдались.
В
исследовании фертильности на крысах снижение массы яичек возникало при
системном воздействии примерно в 7 раз больше, чем воздействие у человека, при
этом влияния на фертильность самцов и самок не наблюдалось. Наблюдалось
умеренное прохождение через плацентарный барьер. Исследования эмбриотоксичности
у крыс и кроликов продемонстрировали наличие репродуктивной токсичности у
риоцигуата. У крыс наблюдалась повышение частоты пороков развития сердца, а
также снижение частоты наступления беременности из-за ранней резорбции при
системном воздействии на беременную самку, примерно в 7 раз превышающем
воздействие у человека (2,5 мг три раза в сутки). У кроликов, начиная с
системного воздействия, примерно в 3 раза превышающего воздействие у человека
(2,5 мг три раза в сутки), наблюдались выкидыши и токсичность для плода.
Фармацевтические
свойства
Перечень вспомогательных
веществ
Ядро таблетки:
кросповидон
(тип В)
гипромеллоза
5 сП
магния
стеарат
лактозы
моногидрат
натрия
лаурилсульфат
Пленочная
оболочка:
гидроксипропилцеллюлоза
гипромеллоза
3 сП
пропиленгликоль
(Е 1520)
титана
диоксид (Е 171)
железа
оксид желтый (Е 172) (только в таблетках 1 мг, 1,5 мг, 2 мг и 2,5 мг)
железа
оксид красный (Е 172) (только в таблетках 2 мг и 2,5 мг)
Несовместимость
Не
применимо.
3 года.
Не
применять по истечении срока годности.
Хранить
при температуре не выше 30 °C.
Хранить в недоступном
для детей месте.
Таблетки,
покрытые пленочной оболочкой, 0,5 мг, 1 мг, 1,5 мг, 2 мг, 2,5 мг.
По 21
таблетке в блистер из фольги алюминиевой и полипропилена, по 2 блистера с
инструкцией по применению помещают в картонную пачку, снабженную контролем
первого вскрытия.
Особые
меры предосторожности при уничтожении использованного лекарственного препарата
или отходов, полученных после применения лекарственного препарата или работы с
ним
Неиспользованный
лекарственный препарат или отходы должны быть утилизированы в соответствии с
локальными требованиями.
Отпускается по рецепту
Держатель
регистрационного удостоверения
Байер АГ,
Кайзер-Вильгельм-Аллее, 1, 51373 Леверкузен, Германия
Bayer AG, Kaiser-Wilhelm-Allee, 1, 51373 Leverkusen, Germany
Производитель
Байер АГ,
Кайзер-Вильгельм-Аллее, 51368 Леверкузен, Германия
Представитель держателя регистрационного
удостоверения
Претензии
потребителей направлять по адресу:
220089, г.
Минск, пр. Дзержинского 57, помещение 54
Тел.: +375 17 239 -54-20
Адемпас® (2,5 мг)
МНН: Риоцигуат
Производитель: Байер АГ
Анатомо-терапевтическо-химическая классификация: Риоцигуат
Номер регистрации в РК:
№ РК-ЛС-5№021626
Информация о регистрации в РК:
27.07.2020 — 27.07.2030
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
10 000 KZT
- Скачать инструкцию медикамента
Торговое название
Адемпас
Международное непатентованное название
Риоцигуат
Лекарственная форма
Таблетки, покрытые пленочной оболочкой
Состав
активное вещество — риоцигуат микронизированный 0,5 мг; 1,0 мг; 1,5 мг; 2,0 мг; 2,5 мг,
вспомогательные вещества: целлюлоза микрокристаллическая, кросповидон, гипромеллоза 5 сР (гидроксипропилметилцеллюлоза 2910), лактозы моногидрат, магния стеарат, натрия лаурилсульфат,
пленочная оболочка: гидроксипропилцеллюлоза, гипромеллоза 5 сР (гидроксипропилметилцеллюлоза 2910), пропиленгликоль, титана диоксид (Е171), железа оксид желтый (Е171), железа оксид красный (Е171).
Описание
Таблетки, покрытые пленочной оболочкой, 0,5 мг:
таблетки круглой формы, с двояковыпуклой поверхностью, покрытые пленочной оболочкой белого цвета, с маркировкой «R» над «0.5» на одной стороне и фирменным байеровским крестом на другой стороне.
Таблетки, покрытые пленочной оболочкой, 1,0 мг:
таблетки круглой формы, с двояковыпуклой поверхностью, покрытые пленочной оболочкой бледно-желтого цвета, с маркировкой «R» и «1» на одной стороне и фирменным байеровским крестом на другой стороне. Таблетки, покрытые пленочной оболочкой, 1,5 мг:
таблетки круглой формы, с двояковыпуклой поверхностью, покрытые пленочной оболочкой желто-оранжевого цвета, с маркировкой «R» над «1.5» на одной стороне и фирменным байеровским крестом на другой стороне.
Таблетки, покрытые пленочной оболочкой, 2,0 мг:
таблетки круглой формы, с двояковыпуклой поверхностью, покрытые пленочной оболочкой бледно-оранжевого цвета, с маркировкой «R» и «2» на одной стороне и фирменным байеровским крестом на другой стороне. Таблетки, покрытые пленочной оболочкой, 2,5 мг:
таблетки круглой формы, с двояковыпуклой поверхностью, покрытые пленочной оболочкой красно-оранжевого цвета, с маркировкой «R» над «2.5» на одной стороне и фирменным байеровским крестом на другой стороне.
Фармакотерапевтическая группа
Гипотензивные препараты. Прочие гипотензивные препараты. Риоцигуат
Код АТХ C02KX05
Фармакологические свойства
Фармакокинетика
Всасывание
Абсолютная биодоступность риоцигуата высокая (94 %). Риоцигуат быстро всасывается, максимальная концентрация в плазме крови (Cmax) достигается через 1–1,5 часа после приема таблетки.
Прием таблетки с пищей не влиял на значение площади под фармакокинетической кривой «концентрация-время» (AUC) риоцигуата. Cmax снижалась до минимального предела (снижение на 35 %). Данное изменение не считается клинически значимым. Распределение
Связь с белками плазмы в организме человека высокая. Степень связывания составляет примерно 95 %. Основными связывающими компонентами являются альбумин сыворотки и альфа-1-кислый гликопротеин.
Объем распределения является средним, при этом в равновесном состоянии он составляет приблизительно 30 л.
Метаболизм
N-деметилирование, катализируемое изоферментами CYP1A1, CYP3A4, CYP2C8 и CYP2J2, является основным путем биотрансформации риоцигуата, приводящим к образованию его основного циркулирующего метаболита (фармакологическая активность: от 1/10 до 1/3 риоцигуата), который в дальнейшем метаболизируется в фармакологически неактивный N-глюкуронид.
Изофермент CYP1A1 катализирует образование основного метаболита риоцигуата в печени и легких. Этот процесс усиливается полициклическими ароматическими углеводородами, например, содержащимися в дыме сигарет (см. раздел «Особые указания»).
Выведение
Весь риоцигуат (исходный препарат и метаболиты) выводится почками (33–45 %) и через кишечник (48–59 %). От 4 до 19 % введенной дозы выводится в неизмененном виде почками, приблизительно 9–44 % —через кишечник.
На основании данных in vitro установлено, что риоцигуат и его основной метаболит являются субстратами для транспортных белков P-gp (Р-гликопротеин) и BCRP (белок резистентности рака молочной железы).
Риоцигуат является препаратом с низким клиренсом (системный клиренс равен приблизительно 3–6 л/мин). Период полувыведения составляет примерно 7 часов у здоровых добровольцев и около 12 часов у пациентов.
Фармакокинетика у различных групп пациентов
Пациенты пожилого возраста
У пожилых пациентов (65 лет и старше) отмечалась более высокая концентрация риоцигуата в плазме, чем у молодых, при этом показатели AUC были приблизительно на 40 % выше у пожилых, главным образом, вследствие кажущегося снижения общего и почечного клиренса (см. раздел «Способ применения и дозы»).
Пациенты с нарушением функции печени
У пациентов с циррозом печени, сопровождающимся легкой степенью печеночной недостаточности (класс А по классификации Чайлд-Пью) не отмечалось клинически значимых изменений действия препарата.
У пациентов с циррозом печени, сопровождающимся умеренной печеночной недостаточностью (класс В по классификации Чайлд-Пью), средняя AUC риоцигуата увеличивалась на 50–70 % в сравнении со здоровыми добровольцами из группы контроля (см. раздел «Способ применения и дозы»).
Не рекомендовано применение риоцигуата у пациентов с тяжелой печеночной недостаточностью (класс С по классификации Чайлд-Пью), поскольку клинические данные для таких пациентов отсутствуют (см. разделы «Способ применения и дозы», «Особые указания»).
Пациенты с нарушением функции почек
У пациентов с почечной недостаточностью в сравнении с пациентами с нормальной функцией почек средние величины нормализованного по дозе и интенсивности действия риоцигуата были выше. Соответствующие показатели для основного метаболита были выше у пациентов с почечной недостаточностью в сравнении со здоровыми добровольцами. У лиц с клиренсом креатинина 80–50 мл/мин, 49–30 мл/мин и менее 30 мл/мин концентрация риоцигуата в плазме (AUC) увеличивалась на 43 %, 104 % или 44 %, соответственно (см. раздел «Способ применения и дозы»).
Нет данных для пациентов с клиренсом креатинина менее 15 мл/мин или находящихся на диализе. Следовательно, применение препарата не рекомендовано у пациентов с клиренсом креатинина менее 15 мл/мин или находящихся на диализе (см. разделы «Способ применения и дозы» и «Особые указания»).
Поскольку риоцигуат обладает высокой степенью связывания с белками плазмы, возможность выведения его с помощью диализа представляется маловероятной.
Пол, этническая принадлежность, масса тела
Не выявлено существенных различий эффективности риоцигуата в зависимости от пола, этнической группы или массы тела пациента.
Фармакодинамика
Механизм действия
Риоцигуат является стимулятором растворимой гуанилатциклазы (рГЦ), фермента сердечно-легочной системы и рецептора оксида азота (NO).
При связывании NO с рГЦ фермент катализирует синтез сигнальной молекулы циклического гуанозинмонофосфата (цГМФ). Внутриклеточный цГМФ играет важную роль в регуляции процессов, влияющих на тонус сосудов, пролиферацию, фиброз и воспаление.
Легочная гипертензия ассоциируется с эндотелиальной дисфункцией, нарушением синтеза оксида азота и недостаточной стимуляцией метаболического пути NO-рГЦ-цГМФ. Риоцигуат имеет двойной механизм действия. Он сенсибилизирует цГМФ к эндогенному NO путем стабилизации связи NO-цГМФ. Риоцигуат также напрямую стимулирует рГЦ через другой участок связи, независимо от NO.
Риоцигуат восстанавливает метаболический путь NO-рГЦ-цГМФ и вызывает увеличение продукции цГМФ.
Показания к применению
Адемпас показан для улучшения переносимости физической нагрузки у взрослых пациентов с функциональным классом II-III по классификации ВОЗ при:
— хронической тромбоэмболической легочной гипертензии (ХТЭЛГ, группа 4 по классификации ВОЗ)
-
неоперабельной ХТЭЛГ
-
персистирующей или рецидивирующей ХТЭЛГ после оперативного лечения;
— легочной артериальной гипертензии (ЛАГ, группа 1 по классификации ВОЗ) идиопатической и наследственной этиологии, или связанной с заболеваниями соединительной ткани, в качестве монотерапии либо в комбинации с антагонистами рецепторов эндотелина или простаноидами.
Способ применения и дозы
Для приема внутрь
Адемпас можно принимать во время еды или независимо от приема пищи. Но пациентам со склонностью к артериальной гипотензии, в качестве меры предосторожности следует применять препарат постоянно либо натощак, либо после приема пищи, чтобы избежать колебаний уровня риоцигуата в плазме крови
Начало терапии
Рекомендуемая начальная доза препарата составляет 1,0 мг 3 раза в сутки на протяжении 2 недель. Таблетки следует принимать 3 раза в сутки с интервалом примерно 6–8 часов.
Если систолическое артериальное давление составляет 95 мм рт. ст. и выше, и у пациента при этом не отмечается симптомов гипотензии, дозу следует увеличивать на 0,5 мг каждые 2 недели до максимальной дозы 2,5 мг 3 раза в сутки.
Если систолическое артериальное давление опускается ниже 95 мм рт. ст., дозировку следует оставить прежней при условии, что у пациента не отмечается симптомов гипотензии.
Если в любой момент на этапе титрования дозы систолическое давление опускается ниже 95 мм рт. ст. и у пациента при этом отмечаются признаки гипотензии, текущую разовую дозу следует уменьшить на 0,5 мг, то есть, вернуться на один шаг назад.
Поддерживающая доза
Установленную индивидуальную дозу следует поддерживать, если только не развиваются симптомы гипотензии.
Максимальная суточная доза препарата Адемпас составляет 7,5 мг. В случае пропуска приема таблетки, следует принять следующую таблетку в соответствии с установленной схемой приема.
В случае возникновения непереносимости подобранной дозы, она может быть снижена в любой момент проведения лечения.
Отмена лечения
В случае необходимости перерыва в лечении на 3 дня и более необходимо вернуться к начальной дозе и возобновить прием препарата начиная с дозы 1 мг 3 раза в сутки на протяжении 2 недель и продолжить лечение с последующим титрованием дозы, как это описано выше.
Дополнительная информация для особых категорий пациентов Дети
Безопасность и эффективность препарата Адемпас не была изучена у пациентов моложе 18 лет. Поскольку доступные данные о применении Адемпас у детей отсутствуют, препарат не следует применять пациентам до 18 лет.
Пациенты пожилого возраста
У пожилых (65 лет и старше) пациентов имеется высокий риск развития артериальной гипотензии и поэтому следует соблюдать особую осторожность, в том числе и при подборе дозы.
Пациенты с нарушением функции печени
Концентрации риоцигуата в плазме у пациентов с легким нарушением функции печени (класс А по классификации Чайлд-Пью) сходны с концентрациями риоцигуата в плазме у здоровых добровольцев.
У пациентов с умеренным нарушением функции печени (класс В по классификации Чайлд-Пью) отмечалось более сильное действие препарата Адемпас® (см. раздел «Фармакокинетика»). При подборе дозы у таких пациентов следует соблюдать особую осторожность.
Применение препарата Адемпас у пациентов с тяжелым нарушением функции печени (класс С по классификации Чайлд-Пью) не рекомендуется, так как исследования у таких пациентов не проводились (см. раздел «Особые указания»).
Пациенты с нарушением функции почек
У пациентов с клиренсом креатинина 50-30 мл/мин отмечался более выраженный эффект препарата Адемпас, поэтому при подборе дозы у таких пациентов следует соблюдать особую осторожность ввиду высокого риска развития артериальной гипотензии.
Не рекомендуется применение препарата Адемпас у пациентов с клиренсом креатинина менее 30 мл/мин или находящихся на гемодиализе, поскольку исследования у таких пациентов ограничены либо не проводились (см. раздел «Особые указания»).
Курение
Курящим пациентам настоятельно рекомендуется отказаться от курения, поскольку концентрация риоцигуата в плазме у курящих пациентов снижена в сравнении с некурящими. Может потребоваться коррекция дозы, в случае если пациент начинает или прекращает курить в процессе лечения препаратом Адемпас (см. раздел «Особые указания»).
Побочные действия
Безопасность препарата Адемпас была оценена в исследованиях III фазы более чем на 650 пациентах с ХТЭЛГ или ЛАГ, получивших, по крайней мере, одну дозу риоцигуата.
Профиль безопасности Адемпаса в обеих популяциях был одинаковым. В этой связи ниже представлена объединенная частота побочных реакций, выявленных в ходе плацебо-контролируемых клинических исследований длительностью 12 и 16 недель. Наиболее часто сообщалось о таких побочных реакциях как: головные боли, головокружение, диспепсия, периферические отеки, тошнота, рвота и диарея, которые встречались с частотой ≥10% у пациентов, находящихся на лечении Адемпасом в дозе до 2,5 мг три раза в день).
Более продолжительные наблюдения в процессе длительных неконтролируемых расширенных исследований выявили профиль безопасности идентичный данным плацебо-контролируемых исследований III фазы.
Выраженное кровохарканье и легочное кровотечение, включая случаи с фатальным исходом, наблюдались у пациентов с ХТЭЛГ или ЛАГ, получавших лечение Адемпасом (см. раздел «Особые указания»).
Побочные явления, представленные ниже, классифицированы в соответствии со словарем MedDRA и перечислены в соответствии с частотой встречаемости в клинических исследованиях.
Частота встречаемости определяется следующим образом:
очень часто (≥ 1/10), часто (≥ 1/100 и < 1/10), нечасто (≥ 1/1 000 и < 1/100), редко (≥ 1/10 000 и < 1/1 000), очень редко (< 1/10 000).
очень часто (≥ 1/10):
— головокружение, головная боль
— диспепсия, диарея, тошнота, рвота
— периферические отеки
часто (≥ 1/100 и < 1/10):
— гастроэнтерит, гастрит, гастроэзофагеальная рефлюксная болезнь, дисфагия, боль в животе и по ходу желудочно-кишечного тракта, запор, вздутие живота
— анемия (включая соответствующие лабораторные показатели)
— учащенное сердцебиение, снижение артериального давления
— кровохарканье, носовое кровотечение, заложенность носа
нечасто (≥ 1/1 000 и < 1/100):
— легочное кровотечение (сообщалось о случае фатального легочного кровотечения в рамках долговременного исследования без группы контроля).
Противопоказания
— гиперчувствительность к риоцигуату или любому другому компоненту, входящему в состав препарата;
— беременность и период лактации (см. раздел «Особые указания);
— одновременный прием с нитратами или донаторами оксида азота (такими, как амилнитрит) в любой форме (см. раздел «Лекарственные взаимодействия»);
— одновременное применение с препаратами группы ингибиторов фосфодиэстеразы — 5 (ФДЭ-5), такими, как силденафил, варденафил, тадалафил
— детский и подростковый возраст до 18 лет (поскольку безопасность и эффективность препарата в данной возрастной группе не изучалась).
— тяжелая печеночная недостаточность (класс С по классификации Чайлд-Пью)
— пациенты с систолическим давлением менее 95 мм.рт. ст. во время инициирования лечения
Лекарственные взаимодействия
Фармакокинетические взаимодействия
Риоцигуат выводится в основном через окислительный метаболизм, опосредованный цитохромом Р450 (CYP1A1, CYP3A4, CYP2C8, CYP2J2), а также в неизмененном виде через кишечник или почками в процессе клубочковой фильтрации.
На основании исследований in vitro было выявлено, что риоцигуат является субстратом для мембранных транспортных белков P-gp / BCRP (Р-гликопротеина / белка резистентности рака молочной железы). Ингибиторы или индукторы этих ферментов и/или транспортных белков могут повлиять на эффективность риоцигуата.
In vitro было показано, что кетоконазол, классифицируемый как сильный ингибитор CYP3A4 и P-gp, является ингибитором множественных метаболических путей с участием CYP и P-gp / BCRP, участвующих в метаболизме и экскреции риоцигуата. Одновременное применение кетоконазола в дозе 400 мг один раз в сутки приводило к увеличению на 150 % (диапазон до 370 %) средней AUC риоцигуата и увеличению Cmax на 46 %. Конечный период полувыведения увеличивался с 7,3 до 9,2 часов, а общий клиренс риоцигуата снижался с 6,1 до 2,4 л/ч.
Таким образом, не рекомендовано одновременное применение препарата Адемпас® с сильными ингибиторами множественных метаболических путей с участием CYP и P-gp/BCRP, такими как азоловые противогрибковые препараты (например, кетоконазол, итраконазол) или ингибиторы ВИЧ-протеазы (например, ритонавир) (см. раздел «Особые указания»).
Препараты, сильно ингибирующие P-gp / BCRP, такие как иммунодепрессант циклоспорин А, должны применяться с осторожностью (см. раздел «Особые указания»).
Из рекомбинантных изоформ CYP, исследованных in vitro, CYP1A1 наиболее эффективно катализировал образование основного метаболита риоцигуата. Препараты класса ингибиторов тирозинкиназы являются сильными ингибиторами CYP1A1, при этом эрлотиниб и гефитиниб проявляли наибольшую ингибиторную активность in vitro. Таким образом, одновременное применение с препаратами, являющимися ингибиторами CYP1A1 может приводить к усилению эффекта риоцигуата, особенно у курящих пациентов. Следовательно, сильные ингибиторы CYP1A1 следует применять с осторожностью (см. раздел «Особые указания»).
Одновременное применение кларитромицина (500 мг 2 раза в сутки), отнесенного к сильным ингибиторам CYP3A4, также являющегося ингибитором P-gp, умеренно повышало среднюю AUC риоцигуата на 41 % без существенного изменения Cmax. Такие изменения не считаются клинически значимыми.
Одновременное применение препаратов, повышающих рН желудочно-кишечного тракта, может привести к более низкой биодоступности при пероральном приеме, поскольку растворимость риоцигуата снижается при нейтральной рН по сравнению с кислой средой.
Назначение до и во время терапии риоцигуатом ингибитора протонной помпы омепразола (40 мг один раз в сутки) снижает среднюю AUC риоцигуата на 26 %, а среднюю Cmax на 35 %. Изменения не имеют клинического значения.
Антациды необходимо принимать, по меньшей мере, через час после приема риоцигуата, поскольку одновременное применение антацидов на основе гидроксида алюминия и/или гидроксида магния снижает среднюю AUC риоцигуата на 34 %, а среднюю Cmax на 56 %.
Бозентан, который является умеренным ингибитором CYP3A4, вызывает снижение равновесной концентрации риоцигуата в плазме у пациентов с ЛАГ на 27 %, не оказывая при этом влияния на эффективность комбинации.
Одновременное применение риоцигуата и сильных индукторов CYP3A4 (например, фенитоина, карбамазепина, фенобарбитала или препаратов, содержащих зверобой) может также привести к снижению концентрации риоцигуата в плазме.
Влияние риоцигуата на другие вещества
Риоцигуат и его основной метаболит не являются ни ингибиторами, ни индукторами основных изоформ CYP (включая CYP 3А4) или транспортных белков (например, P-gp/BCRP) при терапевтических концентрациях в условиях in vitro.
Отсутствие фармакокинетических взаимодействий между риоцигуатом и маркерным субстратом CYP3A4 мидазоламом было продемонстрировано in vivo.
Было выявлено, что in vitro риоцигуат и его основной метаболит являются сильными ингибиторами CYP1A1. Таким образом, нельзя исключить клинически значимые лекарственные взаимодействия с одновременно принимаемыми препаратами, которые в значительной мере выводятся при помощи биотрансформации, опосредованной CYP1A1, такими как эрлотиниб или гранисетрон.
Фармакодинамические взаимодействия
Нитраты
Одновременное применение риоцигуата и нитратов или донаторов оксида азота (таких как амилнитрит) в любой форме противопоказано, поскольку при применении риоцигуата в дозировке 2,5 мг в форме таблеток покрытых пленочной оболочкой наблюдалось усиление гипотензивного эффекта нитроглицерина (0,4 мг, сублингвально), принятого через 4 и 8 часов после приема риоцигуата (см. раздел «Противопоказания»).
Ингибиторы ФДЭ-5
В исследованиях на животных было продемонстрировано снижение системного артериального давления при сочетании риоцигуата с силденафилом или варденафилом. При применении увеличенных доз в ряде случаев наблюдалось дополнительное снижение системного артериального давления.
В экстрополяционном исследовании лекарственных взаимодействий с участием 7 пациентов с легочной артериальной гипертензией, получавших постоянное лечение силденафилом (20 мг 3 раза в сутки), однократный прием риоцигуата (0,5 мг и 1 мг последовательно) привел к суммированию влияния препаратов на гемодинамику. Дозы риоцигуата свыше 1,0 мг в этом исследовании не изучались.
Было проведено 12-недельное исследование применения комбинации стабильной дозы силденафила (20 мг 3 р/сут) и риоцигуата (в дозе 1,0–2,5 мг 3 р/сут) по сравнению с монотерапией силденафилом у 18 пациентов с ЛАГ. В продленной фазе исследования (в отсутствие группы контроля) одновременное применение силденафила и риоцигуата приводило к более высокой частоте отмены риоцигуата, преимущественно вследствие гипотензии. Не было получено доказательств благоприятного клинического эффекта данной комбинации в исследуемой популяции.
Одновременный прием риоцигуата и ингибиторов ФДЭ-5 (таких как силденафил, тадалафил, варденафил) противопоказан (см. раздел «Противопоказания»).
Варфарин
Одновременное лечение риоцигуатом и варфарином не влияло на протромбиновое время. Предполагается, что одновременное применение риоцигуата с другими производными кумарина также не будет оказывать влияние на протромбиновое время.
Отсутствие фармакокинетических взаимодействий между риоцигуатом и субстратом CYP2C9 варфарином было продемонстрировано в условиях in vivo.
Ацетилсалициловая кислота
Риоцигуат не вызывал удлинение времени кровотечения, вызванного приемом ацетилсалициловой кислоты, а также не влиял на агрегацию тромбоцитов у человека.
Особые указания
Необходимо соблюдать дополнительную осторожность при назначении препарата Адемпасв следующих ситуациях:
— у пациентов с легочной гипертензией, имеющих дополнительные факторы риска кровотечения из дыхательных путей, особенно у тех, кто получает антикоагулянтную терапию
— у пациентов, получающих гипотензивную терапию или имеющих исходную гипотензию, гиповолемию, либо тяжелую обструкцию путей оттока из левого желудочка или вегетативную дисфункцию
— при одновременном применении с сильными ингибиторами CYP1A1, такими как ингибитор тирозинкиназы эрлотиниб, и сильными ингибиторами P-gp / BCRP, такими как иммуносупрессивный препарат циклоспорин А (см. раздел «Лекарственные взаимодействия»);
— у пациентов с клиренсом креатинина 80–15 мл/мин;
— у пациентов с умеренным нарушением функции печени (класс В по классификации Чайлд-Пью);
— у пациентов пожилого возраста (65 лет и старше).
Клинические исследования, определяющие эффективность препарата, включали преимущественно пациентов с функциональным классом II-III по классификации ВОЗ с идиопатической ЛАГ, наследственной ЛАГ, ЛАГ, ассоциированной с болезнями соединительной ткани, ХТЭЛГ.
Веноокклюзионная болезнь легких
Применение препарата Адемпас у пациентов с веноокклюзионной болезнью легких (ВОБЛ) не рекомендовано, поскольку легочные вазодилататоры могут существенно ухудшить клиническое состояние таких пациентов. При появлении симптомов отека легких следует думать о возможности развития ассоциированной ВОБЛ, лечение препаратом Адемпас® в таком случае должно быть прекращено.
Кровотечения из дыхательных путей
У пациентов с легочной гипертензией существует повышенная вероятность кровотечения из дыхательных путей, особенно среди пациентов, получающих антикоагулянтную терапию.
При лечении препаратом Адемпас риск серьезных и/или фатальных кровотечений из дыхательных путей может увеличиваться, особенно в присутствии факторов риска, таких как недавний эпизод серьезного кровохарканья, включая его лечение при помощи бронхиальной артериальной эмболизации. Врач, назначающий препарат, должен регулярно оценивать соотношение риск-польза у каждого отдельного пациента.
Сосудорасширяющий эффект
Препарат Адемпас обладает сосудорасширяющими свойствами, что может привести к снижению артериального давления. До назначения препарата Адемпас врач должен тщательно оценить риск возникновения у пациентов с конкретными сопутствующими заболеваниями нежелательных сосудорасширяющих эффектов (например, у пациентов, получающих гипотензивную терапию или с исходной гипотензией, гиповолемией, тяжелой обструкцией путей оттока из левого желудочка или вегетативной дисфункцией).
Сочетанное применение с другими лекарственными препаратами
Одновременное применение препарата Адемпас с сильнодействующими ингибиторами изоферментов CYP и P-gp / BCRP, такими как азоловые противогрибковые препараты (например, кетоконазол, итраконазол) или ингибиторы ВИЧ-протеазы (например, ритонавир), не рекомендовано вследствие выраженного усиления действия препарата Адемпас® (см. раздел «Лекарственные взаимодействия»).
Одновременное применение препарата Адемпас с мощными ингибиторами CYP1A1, такими как ингибитор тирозинкиназы эрлотиниб, и сильными ингибиторами P-gp/BCRP, такими как иммунодепрессант циклоспорин А, могут усилить действие препарата Адемпас (см. раздел «Лекарственные взаимодействия»). Эти препараты следует применять с осторожностью. Следует контролировать артериальное давление и рассмотреть возможность снижения дозы препарата Адемпас.
Популяции пациентов, исследования у которых не проводились
Адемпас не был изучен в следующих группах пациентов, а, следовательно, его применение у них не рекомендуется:
— Пациенты с систолическим артериальным давлением менее 95 мм рт. ст. на момент начала лечения;
— пациенты с тяжелой печеночной недостаточностью (класс С по классификации Чайлд-Пью);
— пациенты с клиренсом креатинина менее 15 мл/мин или находящиеся на гемодиализе.
Информация для отдельных групп пациентов
У курящих пациентов действие риоцигуата уменьшается на 50–60 % (см. раздел «Фармакокинетика»). Таким пациентам настоятельно рекомендуется бросить курить.
Применение в педиатрии
Безопасность и эффективность препарата Адемпас не была изучена у пациентов моложе 18 лет. Поскольку доступные данные о применении препарата Адемпас® у детей отсутствуют, препарат не следует применять пациентам до 18 лет.
Фертильность
Не проводилось специальных исследований с применением риоцигуата для оценки его влияния на фертильность человека.
Во время проведения лечения препаратом Адемпас женщины репродуктивного возраста должны применять эффективные методы контрацепции.
Беременность и период лактации
Беременность
При беременности препарат Адемпас противопоказан.
Период лактации
Препарат Адемпас не следует применять в период лактации из-за возможности развития серьезных нежелательных реакций у детей, находящихся на грудном вскармливании. Решение о прекращении грудного вскармливания или отмены и/или воздержания от приема препарата должно приниматься с учетом оценки соотношения риск-польза.
Особенности влияния лекарственного средства на способность управлять автотранспортом и потенциально опасными механизмами.
Сообщалось о случаях головокружения у некоторых пациентов (см. раздел «Побочные действия»), поэтому следует соблюдать осторожность при управлении транспортными средствами и при работе с другими механизмами
Передозировка
Симптомы: сообщалось о непреднамеренной передозировке 9–25 мг риоцигуата в течение 2–32 дней. Нежелательные реакции были аналогичны наблюдавшимся при приеме более низких доз (см. раздел «Побочные действия»).
Лечение: специфический антидот неизвестен.
В случае передозировки следует применять стандартные поддерживающие меры в соответствии с клинической необходимостью.
При развитии выраженной гипотензии может потребоваться активная гемодинамическая поддержка.
Поскольку риоцигуат обладает высокой степенью связывания с белками плазмы, возможность выведения его с помощью диализа представляется маловероятной.
Форма выпуска и упаковка
По 21 таблетке помещают в контурную ячейковую упаковку из пленки полипропиленовой и фольги алюминиевой.
По 2 или 4 контурной ячейковой упаковке вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона.
Условия хранения
Хранить при температуре не выше 30 ºС.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не применять по истечении срока годности.
Условия отпуска из аптек
По рецепту
Владелец регистрационного удостоверения
Байер Фарма АГ, Берлин, Германия
Производитель/Упаковщик
Байер Фарма АГ, D 51368 Леверкузен, Германия
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукта (товара)
ТОО «Байер КАЗ» ул. Тимирязева, 42, бизнес-центр «Экспо-Сити», пав. 15
050057 Алматы, Республика Казахстан,
тел. +7 727 258 80 40, факс: +7 727 258 80 39,
e-mail: kz.claims@bayer.com
| 240011561477976423_ru.doc | 100 кб |
| 058773521477977622_kz.doc | 134.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
