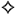- Инструкция по применению Рамилонг
- Состав препарата Рамилонг
- Показания препарата Рамилонг
- Условия хранения препарата Рамилонг
- Срок годности препарата Рамилонг
Код ATX:
Сердечно-сосудистая система (C) > Препараты, влияющие на ренин-ангиотензиновую систему (C09) > Ингибиторы ангиотензин-превращающего фермента (АПФ) (C09A) > Ингибиторы АПФ (C09AA) > Ramipril (C09AA05)
Форма выпуска, состав и упаковка
таб. 5 мг: 30 или 60 шт.
Рег. №: 20/08/1777 от 18.08.2020 — Срок действия рег. уд. не ограничен
Таблетки белого или почти белого цвета, плоскоцилиндрической формы, с фаской и риской; линия разлома для упрощения разделения.
Вспомогательные вещества: крахмал кукурузный прежелатинизированный, гипромеллоза 2910, натрия крахмала гликолат (тип А), натрия стеарилфумарат, целлюлоза микрокристаллическая.
10 шт. — упаковки ячейковые контурные (ПВХ/алюминиевая фольга) (3) — пачки картонные.
10 шт. — упаковки ячейковые контурные (ПВХ/алюминиевая фольга) (6) — пачки картонные.
15 шт. — упаковки ячейковые контурные (ПВХ/алюминиевая фольга) (2) — пачки картонные.
15 шт. — упаковки ячейковые контурные (ПВХ/алюминиевая фольга) (4) — пачки картонные.
таб. 10 мг: 30 или 60 шт.
Рег. №: 20/08/1777 от 18.08.2020 — Срок действия рег. уд. не ограничен
Таблетки белого или почти белого цвета, плоскоцилиндрической формы, с фаской и риской; риска предназначена для упрощения разделения.
Вспомогательные вещества: крахмал кукурузный прежелатинизированный, гипромеллоза 2910, натрия крахмала гликолат (тип А), натрия стеарилфумарат, целлюлоза микрокристаллическая.
10 шт. — упаковки ячейковые контурные (ПВХ/алюминиевая фольга) (3) — пачки картонные.
10 шт. — упаковки ячейковые контурные (ПВХ/алюминиевая фольга) (6) — пачки картонные.
Описание лекарственного препарата РАМИЛОНГ основано на официально утвержденной инструкции по применению препарата и сделано в 2015 году. Дата обновления: 04.04.2013 г.
Фармакологическое действие
Рамиприлат, активный метаболит рамиприла, является ингибитором АПФ. В плазме крови и тканях этот фермент катализирует переход ангиотензина I в ангиотензин II (активное сосудосуживающее вещество) и расщепление активного вазодилататора брадикинина. Уменьшение образования ангиотензина II и повышение активности брадикинина приводит к расширению сосудов и обуславливает кардиопротекторное и эндотелиопротекторное действие рамиприла. Ангиотензин II стимулирует высвобождение альдостерона, в связи с этим рамиприл вызывает снижение секреции альдостерона.
Прием рамиприла приводит к значительному уменьшению периферического сопротивления, в целом не вызывая изменений в почечном кровотоке и СКФ. Прием рамиприла вызывает снижение АД как в положении лежа, так и в положении стоя без компенсаторного увеличения ЧСС. Антигипертензивный эффект наблюдается через 1-2 ч после приема внутрь разовой дозы препарата. Гипотензивный эффект сохраняется в течение 24 ч. Максимальное гипотензивное действие Рамилонга развивается обычно к 3-4 неделе постоянного приема препарата и поддерживается в течение 2 лет. Внезапное прекращение приема препарата не приводит к быстрому и значительному увеличению АД.
В дополнение к общепринятой терапии диуретиками и сердечными гликозидами (необязательно), показана эффективность рамиприла у пациентов с функциональными классами сердечной недостаточности по классификации NYHA. Препарат оказывает положительное влияние на сердечную гемодинамику (снижает давление наполнения левого и правого желудочков, снижает ОПСС, повышает сердечный выброс и улучшает сердечный индекс). Он также снижает нейроэндокринную активацию.
Фармакокинетика
Всасывание
После приема внутрь быстро всасывается в ЖКТ (50-60%). Пища не влияет на степень всасывания, но замедляет его. Являясь пролекарством, рамиприл подвергается интенсивному пресистемному метаболизму (главным образом в печени путем гидролиза), в результате которого образуется его единственный активный метаболит — рамиприлат. Кроме образования этого активного метаболита, при глюкуронировании рамиприла и рамиприлата образуются неактивные метаболиты: рамиприл дикетопиперазин и рамиприлат дикетопиперазин. Рамиприлат примерно в 6 раз более активно ингибирует АПФ, чем рамиприл. Cmax рамиприла и рамиприлата достигается в плазме крови через 1 ч и 3 ч, соответственно.
Распределение
После ежедневного, однократного в течение дня приема препарата в дозе 5 мг Css рамиприлата в плазме крови достигается к 4 дню. Снижение плазменной концентрации рамиприлата происходит в несколько этапов: фаза начального распределения и выведения с Т1/2 рамиприлата приблизительно 3 ч, затем — промежуточная фаза с Т1/2 рамиприлата приблизительно 15 ч и конечная фаза с очень низкой концентрацией рамиприлата в плазме крови и Т1/2 рамиприлата приблизительно 4-5 дней. Эта конечная фаза связана с медленной диссоциацией рамиприлата из связи с рецепторами АПФ. Несмотря на продолжительную конечную фазу при однократном в течение суток приеме рамиприла в дозе 2.5 мг и более Css рамиприлата достигается приблизительно через 4 дня лечения. При курсовом назначении препарата Т1/2 составляет 13-17 ч.
Связывание с белками плазмы крови составляет для рамиприла 73%, а для рамиприлата — 56%. Vd рамиприла и рамиприлата составляет приблизительно 90 л и 500 л, соответственно.
В исследованиях на животных было показано, что рамиприл проникает в материнское молоко.
Выведение
При приеме внутрь около 60% препарата выводится с мочой и около 40% с желчью, причем менее 2% выводится в неизменном виде.
Фармакокинетика в особых клинических случаях
При нарушениях функции почек выведение рамиприла и его метаболитов замедляется пропорционально снижению клиренса креатинина (КК). Это приводит к повышению плазменных концентраций рамиприлата и их более медленному снижению по сравнению с пациентами с нормальной функцией почек.
У больных с заболеваниями печени, замедляется превращение рамиприла в рамиприлат, концентрация рамиприла в плазме крови может увеличиваться в 3 раза, при этом Cmax в плазме крови рамиприлата не изменяется.
При сердечной недостаточности отмечается повышение концентрации рамиприлата в 1.5-1.8 раза.
У лиц пожилого возраста фармакокинетика препарата существенно не изменяется.
Показания к применению
— артериальная гипертензия (в качестве монотерапии или в комбинации с другими антигипертензивными препаратами);
— сердечная недостаточность (в составе комбинированной терапии), в т.ч. развившаяся в течение первых нескольких дней после острого инфаркта миокарда;
— диабетическая нефропатия и недиабетическая нефропатия — доклинические и клинически выраженные стадии, в т.ч. с выраженной протеинурией, особенно в сочетании с артериальной гипертензией;
— снижение риска развития инфаркта миокарда, инсульта или «коронарной смерти» у пациентов с ИБС, с повышенным риском сердечно-сосудистых заболеваний, включая пациентов, перенесших инфаркт миокарда, чрескожную транслюминальную коронарную ангиопластику, аортокоронарное шунтирование.
Реклама
Режим дозирования
Препарат принимают внутрь, независимо от приема пищи (т.е. до, во время или после еды). Таблетки следует запивать достаточным количеством (1/2 стакана) воды. Прием пищи не оказывает существенного влияния на всасывание рамиприла. Нельзя разжевывать или измельчать таблетки перед приемом.
При необходимости приема рамиприла в дозе 1.25 мг следует использовать лекарственное средство другого производителя.
Лечение препаратом Рамилонг обычно является длительным, продолжительность лечения в каждом конкретном случае определяется врачом.
Дозу подбирают в зависимости от терапевтического эффекта и переносимости препарата.
Возможно чрезмерное снижение АД в начале лечения препаратом, особенно, у больных с низким содержанием солей и жидкости в организме (например, рвота, диарея, лечение диуретиками), сердечной недостаточностью (особенно после острого инфаркта миокарда) или тяжелой гипертензией.
Дефицит солей и жидкости в организме следует корректировать до начала лечения препаратом. Диуретики следует предварительно ограничить или отменить не позднее чем за 2-3 дня.
При злокачественной гипертензии и в случае сердечной недостаточности, в частности, после острого инфаркта миокарда, лечение препаратом следует начинать в стационарных условиях.
При артериальной гипертензии начальная доза, как правило, составляет 2.5 мг рамиприла утром. Эта доза является и поддерживающей дозой. Если при такой дозе в течение 3 недель и более не происходит нормализации АД, то дозу можно увеличить до 5 мг/сут. Максимальная доза — 10 мг/сут.
Если при дозе 5 мг/сут гипотензивный эффект недостаточен, следует рассмотреть возможность дополнительного применения, например, диуретиков или блокаторов кальциевых каналов. Благодаря этому можно увеличить гипотензивный эффект рамиприла.
При сердечной недостаточности легкой и средней степеней тяжести (II и III функциональные классы по NYHA) после острого (2-9-дневного) инфаркта миокарда подбор дозы рамиприла можно проводить только в стационарных условиях у пациентов со стабильной гемодинамикой.
Пациентов с сопутствующей антигипертензивной терапией подвергают очень тщательному мониторингу во избежание падения АД. Обычно начальная доза – по 2.5 мг (утром и вечером), суточная доза — 5 мг.
Доза может быть увеличена в зависимости от состояния пациента. Ее можно удваивать каждые 1-2 дня до максимальной суточной дозы — по 5 мг рамиприла утром и вечером, т.е. суточная доза — 10 мг.
После острого инфаркта миокарда пациенты с сердечной недостаточностью должны приступить к приему назначенной суточной дозы, разделив ее на 2 приема (утром и вечером). В остальных случаях всю суточную дозу можно принимать за один прием, утром. При остром инфаркте миокарда, осложнившемся развитием сердечной недостаточности, лечение препаратом следует начинать не ранее, чем на 2-й день после инфаркта, но не позднее 10-го дня. Препарат рекомендуется принимать не менее 15 месяцев.
При диабетической и недиабетической нефропатии начальная доза — 1.25 мг утром. Поддерживающая доза составляет, как правило, 2.5 мг/сут. Максимальная доза — 5 мг/сут.
Для снижения риска развития инфаркта миокарда, инсульта или смерти от сердечно-сосудистых заболеваний у больных с повышенным кардиоваскулярным риском рекомендуемая начальная доза — по 2.5 мг (1/2 таб. 5 мг) 1 раз/сут. В зависимости от переносимости, дозу постепенно увеличивают. Через неделю рекомендуется удвоить дозу, а еще через 3 недели довести ее до обычной поддерживающей дозы, равной 10 мг.
У пациентов с нарушением функции почек суточная доза рамиприла назначается с учетом КК.
При КК >60 мл/мин нет необходимости корректировать начальную дозу (2.5 мг ежедневно), максимальная суточная доза — 10 мг. При КК 30-60 мл/мин нет необходимости в коррекции начальной дозы (2.5 мг ежедневно), максимальная суточная доза — 5 мг. При КК 10-30 мл/мин начальная доза составляет 1.25 мг ежедневно, максимальная суточная доза — 5 мг.
У пациентов с артериальной гипертензией, подвергающихся гемодиализу: рамиприл слабо диализируется; начальная доза составляет 1.25 мг ежедневно, максимальная суточная доза — 5 мг; препарат необходимо принимать через несколько часов после процедуры гемодиализа.
У пациентов с нарушением функции печени лечение проводится с особой осторожностью и только под медицинским наблюдением. Максимальная допустимая суточная доза в таких случаях составляет 2.5 мг рамиприла.
У пациентов пожилого возраста препарат следует применять в более низкой начальной дозе. Увеличивать дозу следует более медленно из-за повышенного риска возникновения побочных реакций, особенно у ослабленных пациентов. Рекомендуемая начальная суточная доза составляет 1.25 мг рамиприла.
Побочные действия
При терапии рамиприлом возможны постоянный сухой кашель и гипотензивные реакции. Серьезные побочные реакции включают ангионевротический отек, гиперкалиемию, ухудшение функций почек и печени, панкреатит, некоторые кожные реакции и нейтропению/агранулоцитоз.
Определение частоты нежелательных реакций: очень часто (>1/10), часто (>1/100, <1/10), нечасто (>1/1000, <1/100), редко (>1/10 000, <1/1000), очень редко (<1/10 000), неизвестно (нельзя определить на основании имеющихся данных). Внутри каждой группы определенного критерия частоты побочные реакции представлены в порядке убывания их тяжести.
Со стороны сердечно-сосудистой системы: нечасто — ишемия миокарда, включая стенокардию или инфаркт миокарда, нарушение сердечного ритма, аритмия, учащенное сердцебиение, периферические отеки.
Со стороны системы кроветворения: нечасто — эозинофилия; редко — уменьшение числа лейкоцитов (включая нейтропению и агранулоцитоз), уменьшение числа эритроцитов, снижение уровня гемоглобина, уменьшение числа тромбоцитов; частота неизвестна — угнетение костномозгового кроветворения, панцитопения, гемолитическая анемия.
Со стороны нервной системы: часто — головная боль, головокружение; нечасто — головокружение, парестезия, агевзия (потеря вкуса), дисгевзия (нарушение вкуса); редко — тремор, нарушение равновесия; частота неизвестна — церебральная ишемия, включая ишемический инсульт и преходящее ишемическое нарушение мозгового кровообращения, нарушение психомоторных функций (нарушенная реакция), ощущение жжения, нарушения обоняния.
Со стороны психики: нечасто — депрессивное настроение, беспокойство, нервозность, возбужденное состояние, нарушение сна, включая сонливость (гиперсомния); редко — спутанность сознания; частота неизвестна — расстройство внимания.
Со стороны органов чувств: нечасто — зрительные нарушения, включая неясное зрение; редко — конъюнктивит, нарушение слуха, шум в ушах.
Со стороны дыхательной системы: часто — сухой, непродуктивный кашель, бронхит, синусит, диспноэ; нечасто — бронхоспазм, включая обострение астмы, насморк.
Со стороны пищеварительной системы: часто — воспалительные реакции ЖКТ, нарушение пищеварения, желудочно-кишечный дискомфорт, диспепсия, диарея, тошнота, рвота; нечасто — панкреатит, повышение активности ферментов поджелудочной железы, ангионевротический отек тонкой кишки, боли в животе, гастрит, непроходимость кишечника, сухость во рту; редко — глоссит; частота неизвестна — афтозный стоматит (воспалительные реакции ротовой полости).
Со стороны печени: нечасто — повышение активности печеночных ферментов и/или концентрации билирубина в крови; редко — холестатическая желтуха, гепатоцеллюлярное нарушение; частота неизвестна — нарушение функции печени, холестатический или цитолитический гепатит.
Со стороны мочевыделительной системы: нечасто — нарушение функции почек, включая острую почечную недостаточность, усиление существующей протеинурии, повышение уровня мочевины в крови, повышение уровня креатинина в крови.
Со стороны кожи и подкожной клетчатки: часто — высыпания; нечасто — зуд, повышенное потоотделение; редко — эксфолиативный дерматит, онихолизис; очень редко — фотосенсибилизация; частота неизвестна — токсический эпидермальный некролиз, синдром Стивенса-Джонсона, многоформная эритема, пузырчатка, ухудшение течения псориаза, псориазоформный дерматит, пемфигоидные и лихеноидные экзантемы или энантемы, алопеция.
Со стороны костно-мышечной системы: часто мышечные спазмы (мышечные судороги), миалгия; нечасто — артралгия.
Со стороны иммунной системы: частота неизвестна — повышение уровня антинуклеарных антител.
Аллергические реакции: нечасто — ангионевротический отек; редко — крапивница; частота неизвестна — анафилактические или анафилактоидные реакции.
Со стороны обмена веществ: часто — повышение содержания калия в крови; нечасто — анорексия, снижение аппетита; частота неизвестна — снижение содержания натрия в крови.
Со стороны репродуктивной системы и молочных желез: нечасто — снижение эрекции и полового влечения; частота неизвестна — гинекомастия.
Общие реакции: часто — боль в груди, усталость; нечасто — лихорадка (жар); редко — астения (слабость).
Противопоказания к применению
— повышенная чувствительность к рамиприлу, другим ингибиторам АПФ и другим компонентам препарата;
— ангионевротический отек в анамнезе (риск быстрого развития ангионевротического отека, в т.ч. на фоне приема ингибиторов АПФ);
— почечная недостаточность тяжелой степени (КК<20 мл/мин при площади поверхности тела 1.73 м2);
— гемодиализ;
— гемодинамически значимый стеноз почечных артерий (двухсторонний, или единственной почки);
— артериальная гипотензия (систолическое АД менее 90 мм рт. ст.) или состояния с нестабильными показателями гемодинамики;
— гемодинамически значимый стеноз аортального или митрального клапана или гипертрофическая обструктивная кардиомиопатия;
— первичный гиперальдостеронизм;
— нефропатия, лечение которой проводится ГКС, НПВП, иммуномодуляторами и/или цитотоксическими препаратами;
— хроническая сердечная недостаточность в стадии декомпенсации (опыт клинического применения недостаточен);
— беременность;
— период лактации (грудного вскармливания);
— возраст до 18 лет (эффективность и безопасность не установлены);
— комбинация с лекарственными препаратами, содержащими алискирен, у пациентов с сахарным диабетом 1 или 2 типа или с почечной недостаточностью средней и тяжелой степени (СКФ<60 мл/мин/1.73 м2).
Применение при беременности и кормлении грудью
Применение препарата не рекомендуется в I триместре беременности.
Применение препарата противопоказано во II и III триместрах беременности.
Эпидемиологические данные о риске проявления тератогенности при приеме ингибиторов АПФ в I триместре беременности не позволяют сделать окончательное заключение, однако некоторое повышение риска не исключается. За исключением тех случаев, когда невозможно произвести замену ингибитора АПФ на иную альтернативную терапию, пациентки, планирующие беременность, должны быть переведены на антигипертензивную терапию лекарственными средствами, у которых профиль безопасности для беременных женщин является хорошо изученным. При наступлении беременности прием ингибитора АПФ должен быть прекращен незамедлительно и при необходимости назначена иная антигипертензивная терапия.
При применении ингибиторов АПФ во II и III триместрах беременности установлено проявление фетотоксического действия (нарушение функции почек, олигогидрамнион, задержка окостенения костей черепа) и неонатальной токсичности (почечная недостаточность, гипотензия, гиперкалиемия). В случае если прием ингибитора АПФ осуществлялся со II триместра беременности, рекомендуется УЗИ функции почек и костей черепа. У новорожденных, матери которых принимали ингибиторы АПФ, необходимо тщательно контролировать АД для предотвращения возможного развития гипотензии.
В связи с недостаточным количеством информации в отношении применения рамиприла в период лактации предпочтительно назначение альтернативных методов терапии с установленным профилем безопасности применения во время кормления грудью. При необходимости применения препарата в период лактации следует прекратить грудное вскармливание.
Применение при нарушениях функции печени
У пациентов с нарушением функции печени лечение проводится с особой осторожностью и только под медицинским наблюдением. Максимальная допустимая суточная доза в таких случаях составляет 2.5 мг рамиприла.
Применение при нарушениях функции почек
Противопоказания: почечная недостаточность тяжелой степени (КК<20 мл/мин при площади поверхности тела 1.73 м2); гемодиализ; гемодинамически значимый стеноз почечных артерий (двухсторонний, или единственной почки).
Применение у пожилых пациентов
У пациентов пожилого возраста препарат следует применять в более низкой начальной дозе. Увеличивать дозу следует более медленно из-за повышенного риска возникновения побочных реакций, особенно у ослабленных пациентов. Рекомендуемая начальная суточная доза составляет 1.25 мг рамиприла.
Особые указания
Лечение рамиприлом обычно является длительным, его продолжительность в каждом конкретном случае определяется врачом.
При назначении Рамилонга требуется регулярный врачебный контроль, в частности, у пациентов с нарушенной функцией печени и почек.
Рекомендуется до начала лечения скорректировать дегидратацию, гиповолемию или солевую недостаточность. При крайней необходимости лечение препаратом можно начинать или продолжать лишь в том случае, если одновременно приняты соответствующие меры предосторожности для предотвращения чрезмерного снижения АД и нарушения функции почек.
Необходимо наблюдение за функцией почек, особенно в течение первых недель лечения. У пациентов с заболеванием сосудов почек (например, при стенозе почечных артерий /еще клинически не значимым/, либо с односторонним гемодинамически значимым стенозом почечной артерии), в случаях имевшегося ранее нарушения функции почек, а также у пациентов, перенесших пересадку почки, необходимо особо тщательное наблюдение.
Следует регулярно контролировать концентрацию калия и натрия в сыворотке крови. У пациентов с нарушением функции почек требуется более частный контроль их концентраций в сыворотке крови.
Необходим контроль числа лейкоцитов с целью быстрого диагностирования лейкопении.
При появлении признаков нарушения иммунитета, обусловленного лейкопенией (например, лихорадки, увеличения лимфатических узлов, тонзиллита), необходим срочный контроль картины периферической крови.
В случае появления признаков кровоточивости (петехий, красно-коричневых высыпаний на коже и слизистых) необходим также контроль числа тромбоцитов в периферической крови.
До и во время лечения необходим контроль АД, функции почек, уровня гемоглобина в периферической крови, креатинина, мочевины, концентрации электролитов и активности печеночных ферментов в крови.
Необходимо соблюдать осторожность при назначении препарата пациентам, находящимся на малосолевой или бессолевой диете (повышенный риск развития артериальной гипотензии).
У пациентов со сниженным ОЦК (в результате терапии диуретиками) при ограничении потребления натрия, при диарее и рвоте возможно развитие симптоматической артериальной гипотензии.
Транзиторная артериальная гипотензия не является противопоказанием для продолжения лечения после стабилизации АД. В случае повторного возникновения выраженной артериальной гипотензии следует уменьшить дозу или отменить препарат.
Следует соблюдать осторожность при выполнении физических упражнений или жаркой погоде из-за риска дегидратации и артериальной гипотензии, вследствие уменьшения объема жидкости.
Не рекомендуется употреблять алкоголь.
Перед хирургическим вмешательством (включая стоматологию) необходимо предупредить хирурга/анестезиолога о применении ингибиторов АПФ.
Если в анамнезе есть указания на развитие ангионевротического отека, не связанного с приемом ингибиторов АПФ, то у таких больных все-таки существует повышенный риск его развития при приеме Рамилонга.
При возникновении отеков, например в области лица (губы, веки) или языка, либо нарушения глотания или дыхания пациент должен немедленно прекратить прием препарата. Ангионевротический отек в области языка, глотки, или гортани (возможные симптомы: нарушение глотания или дыхания) может угрожать жизни и приводить к необходимости оказания неотложной помощи.
После приема первой дозы, а также при увеличении дозировки мочегонного средства и/или рамиприла, больные должны находиться в течение 8 ч под врачебным наблюдением во избежание развития неконтролируемой гипотензивной реакции.
У больных с хронической сердечной недостаточностью прием препарата может привести к развитию выраженной артериальной гипотензии, которая в ряде случаев сопровождается олигурией или азотемией и редко — развитием острой почечной недостаточности. Больные злокачественной артериальной гипертензией или сопутствующей тяжелой сердечной недостаточностью должны начинать лечение в условиях стационара.
При использовании ингибиторов АПФ (см. также инструкции производителей мембран) опасные для жизни, быстро развивающиеся анафилактоидные реакции повышенной чувствительности, иногда вплоть до развития шока, были описаны у больных в ходе проведения гемодиализа с использованием определенных высокопроточных мембран (например, полиакрилонитриловые мембраны). Необходимо избегать совместного использования Рамилонга и такого рода мембран, например, для срочного гемодиализа или гемофильтрации. В данном случае предпочтительно использование других мембран или исключение приема ингибиторов АПФ. Сходные реакции наблюдались при аферезе ЛПНП с применением сульфата декстрана. Поэтому данный метод не следует применять для пациентов, при лечении которых использовали ингибиторы АПФ.
Двойная блокада РААС ассоциируется с повышенным риском развития артериальной гипотензии, гиперкалиемии и нарушениями функции почек (включая острую почечную недостаточность), по сравнению с монотерапией. Двойная блокада РААС с применением ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена не рекомендуется, особенно пациентам с диабетической нефропатией.
В отдельных случаях, когда совместное применение ингибиторов АПФ и блокаторов рецепторов ангиотензина II абсолютно показано, необходимо тщательное медицинское наблюдение и обязательный мониторинг функции почек, водно-электролитного баланса, АД. Это относится к применению кандесартана или валсартана в качестве дополнительной терапии к ингибиторам АПФ у пациентов с хронической сердечной недостаточностью. Проведение двойной блокады РААС под тщательным наблюдением специалиста и обязательным мониторингом функции почек, водно-электролитного баланса и АД, возможно у пациентов с хронической сердечной недостаточностью при непереносимости антагонистов альдостерона (спиронолактона), у которых наблюдается персистирование симптомов хронической сердечной недостаточности, несмотря на проведение иной адекватной терапии.
При лечении ингибиторами АПФ отмечался непродуктивный, стойкий кашель, проходящий после прекращения терапии. Это следует учитывать при проведении дифференциальной диагностики кашля.
Влияние на способность к вождению автотранспорта и управлению механизмами
В период лечения необходимо воздерживаться от занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, т.к. возможно головокружение, особенно после начальной дозы ингибитора АПФ у больных, принимающих диуретические средства.
Передозировка
Симптомы: выраженное снижение АД, шок, выраженная брадикардия, нарушения водно-электролитного равновесия, острая почечная недостаточность, ступор.
Лечение: промывание желудка, прием адсорбентов, натрия сульфата (при возможности в течение первых 30 мин). В случае развития артериальной гипотензии к терапии по восполнению ОЦК и восстановлению солевого баланса может быть добавлено введение альфа1-адреномиметиков (норэпинефрин, допамин) и ангиотензина II (ангиотензинамид).
Лекарственное взаимодействие
Нерекомендуемые комбинации
Одновременное применение с солями калия, калийсберегающими диуретиками (например, амилорид, триамтерен, спиронолактон) приводит к гиперкалиемии (необходим контроль концентрации калия в сыворотке крови).
Одновременное применение с антигипертензивными средствами (например, диуретики) и другими препаратами, снижающими АД, приводит к усилению действия рамиприла.
Одновременное применение со снотворными, опиоидными и обезболивающими средствами может вызвать резкое снижение АД.
Одновременное применение с вазопрессорными симпатомиметическими препаратами (эпинефрин) и эстрогенами может вызвать ослабление действия рамиприла.
Одновременное применение с аллопуринолом, прокаинамидом, цитостатическими средствами, иммунодепрессантами, системными ГКС может изменить картину крови (в частности, снизить число лейкоцитов).
Одновременное применение с литием вызывает повышение концентрации сывороточного лития и в результате усиление кардио- и невротического действия лития.
Одновременное применение с пероральными гипогликемическими средствами (производные сульфонилмочевины, бигуаниды), инсулином усиливает гипогликемию.
Одновременное применение с НПВС (индометацин, ацетилсалициловая кислота) может ослаблять действие рамиприла.
Одновременное применение с гепарином может повышать концентрации калия в сыворотке крови.
Одновременное применение с поваренной солью ослабляет действие рамиприла.
Одновременное применение с этанолом усиливает гипотензивный эффект рамиприла.
Двойная блокада РААС с применением ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена не рекомендуется, особенно пациентам с диабетической нефропатией.
В отдельных случаях, когда совместное применение ингибиторов АПФ и блокаторов рецепторов ангиотензина II абсолютно показано, необходимо тщательное медицинское наблюдение и обязательный мониторинг функции почек, водно-электролитного баланса, АД.
Комбинация противопоказана
Пациентам с сахарным диабетом и/или почечной недостаточностью средней и тяжелой степени (СКФ<60 мл/мин/1.73 м2) одновременное применение алискирена с ингибиторами АПФ или блокаторами рецепторов ангиотензина II противопоказано.
Условия хранения препарата
Препарат следует хранить в недоступном для детей, защищенном от влаги и света месте при температуре не выше 25°С.
Срок годности препарата
Срок годности – 2 года. Не использовать по истечении срока годности, указанного на упаковке.
Контакты для обращений
ЛЕКФАРМ СООО, представительство, (Республика Беларусь)

г. Логойск, ул. Минская 2а, комн. 301
Тел./факс: (375-17) 745-38-01
E-mail: office@lekpharm.by
www.lekpharm.by
Состав:
Применение:
Применяется при лечении:
Страница осмотрена фармацевтом Федорченко Ольгой Валерьевной Последнее обновление 2020-03-24
Внимание!
Информация на странице предназначена только для медицинских работников!
Информация собрана в открытых источниках и может содержать значимые ошибки!
Будьте внимательны и перепроверяйте всю информацию с этой страницы!
Топ 20 лекарств с такими-же компонентами:
Топ 20 лекарств с таким-же применением:
Терапевтические показания
Предоставленная в разделе Терапевтические показания Romilarинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Romilar. Будьте
внимательны и обязательно уточняйте информацию по разделу Терапевтические показания
в инструкции к лекарству Romilar непосредственно из упаковки или у фармацевта в аптеке.
more…
Острые и хронические заболевания органов дыхания, сопровождающиеся сухим раздражающим кашлем.
Способ применения и дозы
Предоставленная в разделе Способ применения и дозы Romilarинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Romilar. Будьте
внимательны и обязательно уточняйте информацию по разделу Способ применения и дозы
в инструкции к лекарству Romilar непосредственно из упаковки или у фармацевта в аптеке.
more…
Внутрь. Взрослым — 2–5 пастилок 3–4 раза в день. Максимальная суточная доза — 20 пастилок. Детям от 4 до 6 лет — 1 пастилка 3–4 раза в день, максимальная суточная доза — 4 пастилки, от 7 до 12 лет — 1–2 пастилки 3–4 раза в день, максимальная суточная доза — 8 пастилок.
Противопоказания
Предоставленная в разделе Противопоказания Romilarинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Romilar. Будьте
внимательны и обязательно уточняйте информацию по разделу Противопоказания
в инструкции к лекарству Romilar непосредственно из упаковки или у фармацевта в аптеке.
more…
повышенная чувствительность к одному из компонентов препарата;
бронхиальная астма;
беременность;
период грудного вскармливания;
детский возраст до 4 лет.
С осторожностью:
нарушения функции печени.
Побочные эффекты
Предоставленная в разделе Побочные эффекты Romilarинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Romilar. Будьте
внимательны и обязательно уточняйте информацию по разделу Побочные эффекты
в инструкции к лекарству Romilar непосредственно из упаковки или у фармацевта в аптеке.
more…
Сонливость, тошнота, головокружение, зуд, крапивница.
Передозировка
Предоставленная в разделе Передозировка Romilarинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Romilar. Будьте
внимательны и обязательно уточняйте информацию по разделу Передозировка
в инструкции к лекарству Romilar непосредственно из упаковки или у фармацевта в аптеке.
more…
Симптомы: возбуждение, головокружение, угнетение дыхания, понижение АД, тахикардия, диспептические расстройства.
Лечение: искусственная вентиляция легких, симптоматическая терапия.
Специфический антидот — Налоксон (может применяться при превышении дозы в 100 раз и более).
Фармакодинамика
Предоставленная в разделе Фармакодинамика Romilarинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Romilar. Будьте
внимательны и обязательно уточняйте информацию по разделу Фармакодинамика
в инструкции к лекарству Romilar непосредственно из упаковки или у фармацевта в аптеке.
more…
Декстрометорфан оказывает противокашлевое действие. Угнетая возбудимость кашлевого центра, подавляет кашель любого происхождения. Не обладает наркотическим, обезболивающим и снотворным действием.
Терпингидрат оказывает отхаркивающее действие, повышает секреторную функцию эпителиальных желез дыхательных путей, увеличивает объем секреции и понижает вязкость выделяемого секрета.
Левоментол оказывает умеренное спазмолитическое действие. Облегчает состояние при проявлении симптомов острого ринита, фарингита, ларингита и бронхита.
Начало действия — через 10–30 мин после приема, продолжительность — в течение 5–6 ч у взрослых и до 6–9 ч — у детей.
Фармакокинетика
Предоставленная в разделе Фармакокинетика Romilarинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Romilar. Будьте
внимательны и обязательно уточняйте информацию по разделу Фармакокинетика
в инструкции к лекарству Romilar непосредственно из упаковки или у фармацевта в аптеке.
more…
После приема внутрь декстрометорфан полностью всасывается в ЖКТ, метаболизируется в печени. Cmax в плазме крови достигается через 2 ч. До 45% декстрометорфана выводится с мочой.
Терпингидрат быстро всасывается из ЖКТ после приема внутрь. Препарат циркулирует в крови в неизмененном виде и выводится через дыхательные пути, с мочой и потом, которым он придает специфический запах. Часть препарата подвергается в организме окислению и выводится с мочой в виде фенолов вместе с глюкуроновой кислотой.
Фармокологическая группа
Предоставленная в разделе Фармокологическая группа Romilarинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Romilar. Будьте
внимательны и обязательно уточняйте информацию по разделу Фармокологическая группа
в инструкции к лекарству Romilar непосредственно из упаковки или у фармацевта в аптеке.
more…
- Противокашлевые средства в комбинациях
Взаимодействие
Предоставленная в разделе Взаимодействие Romilarинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Romilar. Будьте
внимательны и обязательно уточняйте информацию по разделу Взаимодействие
в инструкции к лекарству Romilar непосредственно из упаковки или у фармацевта в аптеке.
more…
Синергическое взаимодействие с наркотическими противокашлевыми препаратами и другими ЛС, угнетающими ЦНС. Не исключается возможность взаимодействия декстрометорфана с ингибиторами МАО.
Желательно исключить препарат Алекс Плюс у пациентов, принимающих ингибиторы МАО.
Источники:
- https://www.drugs.com/search.php?searchterm=romilar
- https://pubmed.ncbi.nlm.nih.gov/?term=romilar
Доступно в странах
Найти в стране:
А
Б
В
Г
Д
Е
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ч
Ш
Э
Ю
Я
Донормил® (Donormyl®) инструкция по применению
📜 Инструкция по применению Донормил®
💊 Состав препарата Донормил®
✅ Применение препарата Донормил®
📅 Условия хранения Донормил®
⏳ Срок годности Донормил®
Описание лекарственного препарата
Донормил®
(Donormyl®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2020 года.
Дата обновления: 2019.12.10
Код ATX:
R06AA09
(Доксиламин)
Лекарственная форма
| Донормил® |
Таб., покр. пленочной оболочкой, 15 мг: 10 или 30 шт. рег. №: П N008683/01 |
Форма выпуска, упаковка и состав
препарата Донормил®
Таблетки, покрытые пленочной оболочкой белого цвета, прямоугольные, с риской на обеих сторонах.
Вспомогательные вещества: лактозы моногидрат — 100 мг, кроскармеллоза натрия — 9 мг, целлюлоза микрокристаллическая — 15 мг, магния стеарат — 2 мг.
Состав пленочной оболочки: макрогол 6000 — 1 мг, гипромеллоза — 2.3 мг, Сеписперс АР 7001 (гипромеллоза — 2-4%, титана диоксид CI 77891 — 25-31%, пропиленгликоль — 30-40%, вода — до 100%) — 0.7 мг.
10 шт. — тубы полипропиленовые (1) — пачки картонные.
30 шт. — тубы полипропиленовые (1) — пачки картонные.
Фармакологическое действие
Блокатор гистаминовых Н1-рецепторов из группы этаноламинов. Препарат оказывает снотворное, седативное и м-холиноблокирующее действие. Сокращает время засыпания, повышает длительность и качество сна, при этом не изменяет фазы сна. Длительность действия — 6-8 ч.
Фармакокинетика
Всасывание и распределение
Cmax в среднем достигается через 2 ч после приема внутрь. Абсорбция высокая.
Метаболизм и выведение
Хорошо проникает через гистогематические барьеры (включая ГЭБ). Метаболизируется в печени. T1/2 — около 10 ч. Выводится на 60% почками в неизменном виде, частично — через ЖКТ.
Фармакокинетика у особых групп пациентов
У пациентов старше 65 лет, а также при печеночной и почечной недостаточности T1/2 может удлиняться.
При повторении курсов лечения стабильная концентрация препарата и его метаболитов в плазме крови достигается позже и на более высоком уровне.
Показания препарата
Донормил®
- преходящие нарушения сна.
Режим дозирования
Внутрь. По 1/2-1 таб./сут, запивая небольшим количеством жидкости, за 15-30 мин до сна. Если лечение неэффективно, по рекомендации врача доза может быть увеличена до 2 таб.
Продолжительность лечения от 2 до 5 дней; если бессонница сохраняется, необходимо обратиться к врачу.
Пациенты с почечной и печеночной недостаточностью: в связи с данными об увеличении концентрации в плазме и уменьшении плазменного клиренса доксиламина, рекомендуется коррекция дозы в сторону уменьшения.
Пациенты пожилого возраста старше 65 лет: блокаторы гистаминовых Н1-рецепторов следует с осторожностью назначать данной группе пациентов в связи с возможным головокружением и замедленными реакциями с опасностью падения (например, при ночных пробуждениях после приема снотворных). Ввиду данных об увеличении концентрации в плазме, уменьшении плазменного клиренса и увеличении T1/2 рекомендуется коррекция дозы в сторону уменьшения.
Побочное действие
Со стороны пищеварительной системы: запор, сухость во рту.
Со стороны сердечно-сосудистой системы: ощущение сердцебиения.
Со стороны органа зрения: нарушения зрения и аккомодации, нечеткое зрение.
Со стороны мочевыделительной системы: задержка мочи.
Со стороны нервной системы: сонливость в дневное время (в этом случае доза препарата должна быть уменьшена); спутанность сознания, галлюцинации.
Со стороны костно-мышечной системы: рабдомиолиз.
Со стороны лабораторных показателей: увеличение уровня КФК.
Если любые из указанных выше побочных эффектов усугубляются или появляются другие побочные эффекты, не указанные в инструкции, пациент должен сообщить об этом врачу.
Противопоказания к применению
- повышенная чувствительность к доксиламину и другим компонентам препарата, или к другим антигистаминным средствам;
- закрытоугольная глаукома или семейный анамнез закрытоугольной глаукомы;
- заболевания уретры и предстательной железы, сопровождающиеся нарушением оттока мочи;
- врожденная галактоземия, глюкозо-галактозная мальабсорбция, дефицит лактазы;
- детский и подростковый возраст до 15 лет.
С осторожностью: пациентам со случаями апноэ в анамнезе — в связи с тем, что доксиламина сукцинат может усугублять синдром ночного апноэ (внезапная остановка дыхания во сне); пациентам старше 65 лет — в связи с возможными головокружениями и замедленными реакциями с опасностью падений (например, при ночных пробуждениях после приема снотворных), а также в связи с возможным увеличением T1/2; пациентам с почечной и печеночной недостаточностью (T1/2 может увеличиваться).
Применение при беременности и кормлении грудью
На основании адекватных и хорошо контролируемых исследований доксиламин может применяться у беременных женщин на протяжении всего периода беременности. В случае назначения препарата на поздних сроках беременности следует принимать во внимание атропиноподобные и седативные свойства доксиламина при наблюдении за состоянием новорожденного.
Неизвестно, проникает ли доксиламин в грудное молоко. В связи с возможностью развития седативного или возбуждающего эффекта у ребенка кормить грудью при применении препарата не следует.
Применение при нарушениях функции печени
Применять с осторожностью пациентам с печеночной недостаточностью (T1/2 может увеличиваться).
Применение при нарушениях функции почек
Применять с осторожностью пациентам с почечной недостаточностью (T1/2 может увеличиваться).
Применение у детей
Противопоказан в детском и подростковом возрасте до 15 лет.
Применение у пожилых пациентов
С осторожностью: пациентам старше 65 лет — в связи с возможными головокружениями и замедленными реакциями с опасностью падения (например, при ночных пробуждениях после приема снотворных).
Особые указания
Следует принимать во внимание, что бессонница может быть вызвана рядом причин, при которых нет необходимости в назначении данного лекарственного препарата.
Препарат оказывает седативное действие, подавляет когнитивные способности и замедляет психомоторные реакции. Первое поколение блокаторов гистаминовых H1-рецепторов может оказывать м-холиноблокирующий, α-адреноблокирующий и антисеротониновый эффекты, что может вызывать сухость во рту, запор, задержку мочи, нарушения аккомодации и зрения.
Как все снотворные или седативные препараты, доксиламина сукцинат может усугублять синдром ночного апноэ (внезапная остановка дыхания во сне) — увеличивая число и продолжительность приступов апноэ.
Возможное злоупотребление блокаторами гистаминовых H1-рецепторов первого поколения, включая доксиламин, может приводить к физической и психологической зависимости, о которой сообщалось на фоне преднамеренного приема более высоких доз препарата, чем рекомендованные.
В одной таблетке препарата содержится 100 мг лактозы моногидрата, что следует принимать во внимание у пациентов с редкой врожденной непереносимостью галактозы, дефицитом лактазы lapp или глюкозо-галактозной мальабсорбцией.
Влияние на способность к управлению транспортными средствами и механизмами
В связи с возможной сонливостью в дневное время суток следует избегать управления автотранспортом, работы с механизмами и иных видов деятельности, требующих быстрых психических и двигательных реакций.
Передозировка
Симптомы: дневная сонливость, возбуждение, расширение зрачка (мидриаз), нарушения аккомодации, сухость во рту, покраснение кожи лица и шеи (гиперемия), повышение температуры тела (гипертермия), синусовая тахикардия, расстройство сознания, галлюцинации, снижение настроения, тревога, нарушение координации движений, дрожь (тремор), непроизвольные движения (атетоз), судороги (эпилептический синдром), кома. Непроизвольные движения иногда являются предвестниками судорог, что может свидетельствовать о тяжелой степени отравления. Даже при отсутствии судорог тяжелые отравления доксиламином могут вызвать развитие рабдомиолиза, который часто сопровождается острой почечной недостаточностью. В таких случаях показана стандартная терапия с постоянным контролем уровня КФК.
При появлении симптомов отравления следует немедленно обратиться к врачу.
Лечение: симптоматическое (м-холиномиметики и др.), в качестве средства первой помощи показан прием активированного угля (в количестве 50 г — для взрослых и 1 г/кг массы тела для детей).
Лекарственное взаимодействие
При одновременном приеме препарата Донормил® с седативными антидепрессантами (амитриптилин, доксепин, миансерин, миртазапин, тримипрамин), барбитуратами, бензодиазепинами, клонидином, производными морфина (анальгетиками, противокашлевыми препаратами), нейролептиками, анксиолитиками, блокаторами гистаминовых Н1-рецепторов с седативным действием, центральными антигипертензивными препаратами, талидомидом, баклофеном, пизотифеном усиливается угнетающее действие на ЦНС.
При одновременном приеме с м-холиноблокирующими средствами (атропин, имипраминовые антидепрессанты, антипаркинсонические препараты, атропиновые спазмолитики, дизопирамид, фенотиазиновые нейролептики) повышается риск возникновения таких побочных эффектов, как задержка мочи, запор, сухость во рту.
Т.к. алкоголь усиливает седативный эффект большинства блокаторов гистаминовых Н1-рецепторов, в т.ч. и препарата Донормил®, необходимо избегать его одновременного употребления с алкогольными напитками и лекарственными препаратами, содержащими алкоголь.
Условия хранения препарата Донормил®
Препарат следует хранить в недоступном для детей месте при температуре от 15 до 25°С.
Срок годности препарата Донормил®
Срок годности — 3 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
БРИСТОЛ-МАЙЕРС СКВИББ
(США)

|
|
BRISTOL-MYERS SQUIBB Представительство в России |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Доксиламин
(БИОКОМ, Россия)
Доксиламин
(ПРОМОМЕД РУС, Россия)
Доксиламин
(ФАРМТЕХНОЛОГИИ, Россия)
Доксиламин Органика
(ОРГАНИКА, Россия)
Доксиламин-СЗ
(СЕВЕРНАЯ ЗВЕЗДА, Россия)
Доксиламин-Форп
(ФОРП, Россия)
Изислип®
(АТОЛЛ, Россия)
Реслип®
(АЛИУМ, Россия)
Слипзон®
(KRKA d.d., Novo mesto, Словения)
Все аналоги
Рамилонг 2,5 мг:
Таблетки белого или почти белого цвета, плоскоцилиндрической формы, с фаской.
Рамилонг 5 мг и 10 мг:
Таблетки белого или почти белого цвета, плоскоцилиндрической формы, с фаской и риской. Линия разлома (риска) предназначена исключительно для упрощения разделения таблетки и ее проглатывания, а не для разделения на равные дозы.
Каждая таблетка 2,5 мг содержит:
активное вещество: рамиприл – 2,5 мг.
вспомогательные вещества: крахмал кукурузный (модифицированный Starch 1500), гипромеллоза, натрия крахмалгликолят, магния стеарат, целлюлоза микрокристаллическая.
Каждая таблетка 5 мг и 10 мг содержит:
активное вещество: рамиприл – 5 мг или 10 мг.
вспомогательные вещества: кукурузный крахмал прежелатинизированный, гипромеллоза (2910), натрия крахмалгликолят (тип А), натрия стеарила фумарат, целлюлоза микрокристаллическая.
Средства, влияющие на ренин-ангиотензиновую систему. Ингибиторы ангиотензин-превращающего фермента (АПФ).
Код ATX: С09АА05
Лечение артериальной гипертензии: для снижения артериального давления как в режиме монотерапии, так и в комбинации с другими антигипертензивными препаратами.
Предупреждение потенциально летальных сердечно-сосудистых осложнений (см. также «Способ применения и дозы»: снижение количества сердечно-сосудистых осложнений (инфаркта миокарда, инсульта и смерти) у пациентов с:
— проявлениями атеротромботических сердечно-сосудистых заболеваний (наличие ишемической болезни сердца или инсульта в анамнезе, облитерирующие заболевания артерий нижних конечностей) или
— сахарным диабетом и с хотя бы одним фактором сердечно-сосудистого риска (см. Фармакологические свойства).
Вторичная профилактика у пациентов с острым инфарктом миокарда: снижение риска смерти, начиная с острой стадии инфаркта миокарда, у пациентов с клиническими признаками сердечной недостаточности при назначении через 48 часов после начала заболевания.
Лечение гломерулярных заболеваний почек:
начальная стадия диабетической нефропатии, проявляющаяся наличием микроальбуминурии;
— выраженная диабетическая нефропатия с наличием макропротеинурии у пациентов с хотя бы одним фактором риска сердечно-сосудистых заболеваний (см. Фармакологические свойства);
— выраженная недиабетическая нефропатия с наличием макропротеинурии > 3 г/день (см. «Фармакологические свойства»).
Лечение сердечной недостаточности с клиническими проявлениями.
Рекомендуется принимать препарат каждый день в одно и то же время.
Таблетки следует принимать независимо от приема пищи (то есть, таблетки могут приниматься как до, так и во время или после еды) и запивать достаточным количеством (1/2 стакана) воды. Нельзя разжевывать или измельчать таблетки перед приемом. Доза подбирается в зависимости от терапевтического эффекта и переносимости препарата пациентом. Данное лекарственное средство не обеспечивает дозировку 1,25 мг, при необходимости применения рамиприла в дозе 1,25 мг необходимо воспользоваться лекарственным средством другого производителя. Лечение препаратом Рамилонг обычно является длительным, а его продолжительность в каждом конкретном случае определяется врачом.
Возможно чрезмерное снижение артериального давления в начале лечения препаратом, особенно, у больных с низким содержанием солей и жидкости в организме (например, рвота, понос, лечение диуретиками), сердечной недостаточностью (особенно, после острого инфаркта миокарда) или тяжёлой гипертензией.
Нехватка солей и жидкости в организме подлежит предварительному корректированию до начала лечения препаратом – диуретики следует предварительно ограничить или отменить, не позднее, чем за 2-3 дня.
Лечение пациентов, которым не отменили прием диуретиков, следует начинать с дозы 1,25 мг. Необходимо контролировать функцию почек и содержание калия в сыворотке крови. Последующая дозировка лекарственного средства Рамилонг должна корректироваться в соответствии с целевыми уровнями артериального давления.
При злокачественной гипертензии и в случае сердечной недостаточности, в частности, после острого инфаркта миокарда, лечение препаратом следует начинать в стационарных условиях.
Если не назначается иначе, то при нормальной функции почек и печени рекомендуются представленные далее режимы дозирования.
При артериальной гипертензии
Обычно, начальная доза – 2,5 мг рамиприла утром. Эта доза является и поддерживающей дозой. Если при такой дозировке в течение 3 недель и более не удаётся нормализовать давление, то дозу можно увеличить до 5 мг рамиприла в день. Максимальная доза – 10 мг рамиприла в день.
Если гипотензивный эффект суточной дозы 5 мг рамиприла недостаточен, следует взвесить возможность дополнительного применения, например, диуретиков или кальциевых антагонистов. Благодаря этому можно увеличить гипотензивный эффект рамиприла.
У пациентов с сильно активированной ренин-ангиотензин-альдостерон системой может наблюдаться чрезмерное снижение артериального давления после приема первоначальной дозы. Для таких пациентов рекомендуемая начальная доза составляет 1,25 мг, а начало лечения должно проходить под наблюдением врача.
Суточную дозу препарата принимают один раз в день.
Вторичная профилактика у пациентов после острого инфаркта миокарда с сердечной недостаточностью
Начальная доза
После 48 часов, следующих за инфарктом миокарда у клинически и гемодинамически стабильных пациентов, рекомендуемая начальная доза составляет 2,5 мг дважды в день в течение трех дней. Если начальная доза 2,5 мг не переносится пациентом, необходимо назначить дозу 1,25 мг дважды в сутки в течение 2 дней перед увеличением дозы до 2,5 мг и 5 мг два раза в сутки. Если доза не может быть увеличена до 2,5 мг два раза в сутки, лечение следует отменить. (См. также назначение дозировок у пациентов, проходивших лечение диуретиками).
Титрация и индивидуальная поддерживающая доза
Суточную дозу последовательно увеличивают, удваивая ее с интервалом в 1-3 дня до достижения целевой поддерживающей дозы 5 мг дважды в день. Поддерживающую суточную дозу рекомендуется делить на 2 приема. Максимальная суточная доза – 10 мг.
Если принято решение проводить терапию рамиприлом у больного с тяжелой (IV степень по шкале NYHA) хронической сердечной недостаточностью после инфаркта миокарда, рекомендовано начинать с дозы – 1,25 мг один раз в день. Увеличивать дозу следует с особой осторожностью.
Лечение заболеваний почек
У пациентов с диабетом и микроальбуминурией:
Начальная доза
Рекомендуемая начальная доза – 1,25 мг рамиприла один раз в день.
Титрация индивидуальной поддерживающей дозы
Дозу последовательно увеличивают в зависимости от переносимости пациентом активного вещества. Рекомендуется удвоить суточную дозу до 2,5 мг через 2 недели лечения, а затем до 5 мг по прошествии следующих 2 недель.
У пациентов с диабетом и как минимум одним Фактором риска сердечно-сосудистых заболеваний.
Начальная доза
Рекомендуемая начальная доза – 2,5 мг рамиприла один раз в день.
Титрация индивидуальной поддерживающей дозы
Дозу последовательно увеличивают в зависимости от переносимости пациентом активного вещества. Рекомендуется удвоить суточную дозу до 5 мг через 2 недели лечения, а затем до 10 мг по прошествии следующих 2-3 недель. Максимальная суточная доза – 10 мг.
У пациентов с недиабетической нефропатией с наличием макропротеинурии > 3 г/день
Начальная доза
Рекомендуемая начальная доза – 1,25 мг рамиприла в день.
Титрация индивидуальной поддерживающей дозы
Дозу последовательно увеличивают в зависимости от переносимости пациентом активного вещества. Рекомендуется удвоить суточную дозу до 2,5 мг через 2 недели лечения, а затем до 5 мг по прошествии следующих 2 недель.
Предупреждение потенциально летальных сердечно-сосудистых осложнений
Начальная доза
Рекомендуемая начальная доза – 2,5 мг рамиприла один раз в день.
Титрация индивидуальной поддерживающей дозы
Дозу постепенно увеличивают в зависимости от переносимости пациентом активного вещества. Рекомендуется удвоить дозу через 1-2 недели лечения, а через следующие 2-3 недели – увеличить поддерживающую дозу до 10 мг рамиприла ежедневно.
Лечение сердечной недостаточности с клиническими проявлениями
Начальная доза
Для пациентов, получающих терапию диуретиками, рекомендуемая начальная доза – 1,25 мг рамиприла один раз в день.
Титрация индивидуальной поддерживающей дозы
Рекомендуется удваивать дозу рамиприла каждые две недели до максимальной суточной дозы 10 мг. Предпочтительно разделить суточную дозу на 2 приема.
Особые группы пациентов
Пациенты с нарушением функции почек
Суточная доза для пациентов с нарушением функции почек назначается с учетом клиренса креатинина:
— если клиренс креатинина > 60 мл/мин, нет необходимости корректировать начальную дозу (2,5 мг ежедневно), максимальная суточная доза – 10 мг;
— если клиренс креатинина находится в пределах 30 — 60 мл/мин, нет необходимости корректировать начальную дозу (2,5 мг ежедневно), максимальная суточная доза – 5 мг;
— если клиренс креатинина находится в пределах 10 — 30 мл/мин, начальная доза составляет 1,25 мг ежедневно, и максимальная суточная доза – 5 мг;
— у пациентов с гипертензией, подвергающихся гемодиализу: рамиприл слабо диализируется; начальная доза составляет 1,25 мг ежедневно, и максимальная суточная доза – 5 мг; препарат необходимо принимать через несколько часов после осуществления гемодиализа.
Пациенты с нарушением функции печени
Лечение таких пациентов должно осуществляться с особой осторожностью и только под медицинским наблюдением. Максимальная допустимая суточная доза в таких случаях — 2,5 мг рамиприла.
Пожилые пациенты
Начальные дозы должны быть ниже, их введение должно проходить более постепенно из- за повышенного риска возникновения побочных реакций, особенно у пожилых и ослабленных пациентов. Рекомендуемая начальная суточная доза – 1,25 мг рамиприла.
Дети
Не рекомендуется использование препарата в педиатрии, в связи с отсутствием достаточного количества соответствующих данных по безопасности и эффективности препарата.
При терапии рамиприлом могут проявляться такие побочные явления, как постоянный сухой кашель и гипотензивные реакции. Серьезные побочные реакции включают ангионевротический отек, гиперкалиемию, ухудшение функций почек и печени, панкреатит, некоторые кожные реакции и нейтропению/агранулоцитоз.
Частоту встречаемости побочных реакций определяют следующим образом: очень частые (> 1/10), частые (> 1/100, < 1/10), нечастые (> 1/1000, < 1/100), редкие (> 1/10000, < 1/1000), очень редкие (< 1/10000) и частота неизвестна (не могут быть оценены по доступным данным). Внутри каждой группы определённого критерия частоты побочные реакции представлены в порядке убывания их тяжести.
Со стороны сердечно-сосудистой системы:
нечасто – ишемия миокарда, включая стенокардию или инфаркт миокарда, нарушение сердечного ритма, аритмия, учащенное сердцебиение, периферические отеки.
Со стороны крови и лимфатической системы:
нечасто – эозинофилия; редко – уменьшение числа лейкоцитов (включая нейтропению и агранулоцитоз), уменьшение числа эритроцитов, снижение уровня гемоглобина, уменьшение числа тромбоцитов; частота неизвестна – угнетение костного мозга, панцитопения, гемолитическая анемия.
Со стороны нервной системы: часто – головная боль, головокружение; нечасто – головокружение, парестезия, агевзия (потеря вкуса), дисгевзия (нарушение вкуса); редко – тремор, нарушение равновесия; частота неизвестна – церебральная ишемия, включая ишемический инсульт и преходящее ишемическое нарушение мозгового кровообращения, нарушение психомоторных функций (нарушенная реакция), ощущение жжения, нарушения обоняния.
Со стороны органов чувств: нечасто – зрительные нарушения, включая неясное зрение; редко – конъюнктивит, нарушение слуха, шум в ушах.
Со стороны органов дыхания, грудной клетки и средостения: часто – сухой, непродуктивный кашель, бронхит, синусит, диспноэ; нечасто – бронхоспазм, включая обострение астмы, насморк.
Со стороны желудочно-кишечного тракта: часто – воспалительные реакции желудочно- кишечного тракта, нарушение пищеварения, желудочно-кишечный дискомфорт, диспепсия, диарея, тошнота, рвота; нечасто – панкреатит, повышение энзимов поджелудочной железы, ангионевротический отек тонкой кишки, боли желудочно- кишечного тракта, включая гастрит, непроходимость кишечника, сухость во рту; редко – глоссит; частота неизвестна – афтозный стоматит (воспалительные реакции ротовой полости).
Со стороны почек и мочевыделительной системы:
нечасто – нарушение функции почек, включая острую почечную недостаточность, усиление существующей протеинурии, повышение уровня мочевины в крови, повышение уровня креатинина в крови.
Со стороны кожи и подкожной клетчатки: часто – высыпания; нечасто – ангионевротический отек, зуд, повышенное потоотделение; редко – эксфолиативный дерматит, крапивница, онихолизис; очень редко – светочувствительные реакции; частота неизвестна — токсический эпидермальный некролиз, синдром Стивенса-Джонсона, многоформная эритема, пузырчатка, ухудшение течения псориаза, псориазоформный дерматит, пемфигоидные и лихеноидные экзантемы или энантемы, алопеция.
Со стороны опорно-двигательного аппарата и соединительной ткани: часто – мышечные спазмы (мышечные судороги), миалгия; нечасто – артралгия.
Со стороны иммунной системы: частота неизвестна – анафилактические или анафилактоидные реакции, повышение уровня антинуклеарных антител.
Со стороны печени: нечасто – повышение уровня энзимов печени и/или билирубина; редко – холестатическая желтуха, гепатоцеллюлярное нарушение; частота неизвестна – нарушение функции печени, холестатический или цитолитический гепатит.
Со стороны обмена веществ и питания: часто – повышение содержания калия в крови; нечасто – анорексия, снижение аппетита; частота неизвестна – снижение содержания натрия в крови.
Со стороны репродуктивной системы и молочных желез: нечасто – снижение эрекции и полового влечения; частота неизвестна – гинекомастия.
Со стороны психики: нечасто – депрессивное настроение, беспокойство, нервозность, возбужденное состояние, нарушение сна, включая сонливость (гиперсомния); редко – спутанность сознания; частота неизвестна – расстройство внимания.
Общие нарушения: часто – боль в груди, усталость; нечасто – лихорадка (жар); редко – астения (слабость).
Рамилонг противопоказан в следующих случаях:
— повышенная чувствительность к действующему веществу рамиприлу, другим ингибиторам АПФ и другим компонентам препарата;
— пациенты, у которых согласно анамнестическим данным, ранее наблюдался ангионевротический отек (риск быстрого развития ангионевротического отека, в том числе, на фоне приема ингибиторов АПФ);
— гемодинамически значимый стеноз почечных артерий (двухсторонний, в случае одной почки – односторонний);
— артериальная гипотензия (систолическое АД менее 90 мм рт. ст.) или состояния с нестабильными показателями гемодинамики;
— гемодинамически значимый стеноз аортального или митрального клапана, или гипертрофическая обструктивная кардиомиопатия;
— первичный гиперальдостеронизм;
— беременность (подлежит выявлению до начала лечения, в случае назначения препарата необходима контрацепция);
— грудное вскармливание (необходимо прекратить);
— возраст до 18 лет (эффективность и безопасность не установлены);
— в комбинации с лекарственными средствами, содержащими Алискирен, у пациентов с сахарным диабетом (тип I или II) или с умеренной и тяжелой почечной недостаточностью (скорость клубочковой фильтрации менее 60 мл/мин/1,73 м2);
— нефропатия, лечение которой проводится глюкокортикостероидами, нестероидными противоспалительными препаратами, иммуномодуляторами и/или другими цитотоксическими препаратами;
— хроническая сердечная недостаточность в стадии декомпенсации (опыт клинического применения недостаточен);
— одновременное применение с антагонистами рецепторов ангиотензина II (АРА II) у пациентов с диабетической нефропатией;
— экстракорпоральные методы лечения, при которых имеет место контакт крови с отрицательно заряженными поверхностями.
Применение препарата не рекомендуется в первом триместре беременности. Применение препарата противопоказано во втором и третьем триместрах беременности.
Беременность
Эпидемиологические данные о риске проявления тератогенности при приеме ингибиторов АПФ в первом триместре беременности не позволяют сделать окончательное заключение, однако некоторое повышение риска не исключается. За исключением тех случаев, когда невозможно произвести замену ингибиторов АПФ на иную альтернативную терапию, пациентки, планирующие беременность, должны быть переведены на антигипертензивную терапию лекарственными средствами, у которых профиль безопасности для беременных женщин является хорошо изученным. При наступлении беременности прием ингибитора АПФ должен быть прекращен незамедлительно и при необходимости назначена иная антигипертензивная терапия.
При применении ингибиторов АПФ во втором и третьем триместрах беременности установлено проявление фетотоксического действия (нарушение функции почек, олигогидрамниоз, задержка окостенения костей черепа) и неонатальной токсичности (почечная недостаточность, гипотензия, гиперкалиемия). В случае если прием ингибитора АПФ осуществлялся со второго триместра беременности, рекомендуется УЗИ функции почек и костей черепа. У новорожденных, матери которых принимали ингибиторы АПФ, необходимо тщательно контролировать артериальное давление для предотвращения возможного развития гипотензии.
Период грудного вскармливания
Не рекомендуется назначать рамиприл в период кормления грудью из-за недостатка информации. Желательно отдавать предпочтение другим лекарственным средствам, применение которых при грудном вскармливании является более безопасным.
Лечение рамиприлом обычно является длительным, его продолжительность в каждом конкретном случае определяется врачом. Оно также требует регулярного врачебного контроля, в частности, у пациентов с нарушенной функцией печени и почек. Обычно рекомендуется до начала лечения скорректировать дегидратацию, гиповолемию или солевую недостаточность. При крайней необходимости лечение препаратом можно начинать или продолжать лишь в том случае, если одновременно приняты соответствующие меры предосторожности для предотвращения чрезмерного снижения АД и нарушения функции почек.
Необходимо наблюдение за функцией почек, особенно в течение первых недель лечения. У пациентов, страдающих заболеванием сосудов почек (например, при стенозе почечных артерий еще клинически не значимым, либо с односторонним гемодинамически значимым стенозом почечной артерии), в случаях имевшегося ранее нарушения функции почек, а также у пациентов, перенесших пересадку почки, необходимо особо тщательное наблюдение.
Следует регулярно контролировать концентрацию калия и натрия в сыворотке крови. У пациентов с нарушением функции почек требуется более частный контроль за их концентрациями в сыворотке крови. Необходим контроль за числом лейкоцитов с целью быстрого диагностирования лейкопении.
При появлении признаков нарушения иммунитета, обусловленного лейкопенией (например, лихорадки, увеличения лимфатических узлов, тонзиллита), необходим срочный контроль картины периферической крови. В случае появления признаков кровоточивости (мельчайших петехий, красно-коричневых высыпаний на коже и слизистых) необходим также контроль за числом тромбоцитов в периферической крови.
До и во время лечения необходим контроль АД, функции почек, уровня гемоглобина в периферической крови, креатинина, мочевины, концентрации электролитов и активности «печеночных» ферментов в крови. Необходимо соблюдать осторожность при назначении препарата пациентам, находящимся на малосолевой или бессолевой диете (повышенный риск развития артериальной гипотензии). У больных со сниженным объемом циркулирующей крови (в результате терапии диуретиками) при ограничении потребления натрия, при диарее и рвоте возможно развитие симптоматической артериальной гипотензии. Транзиторная артериальная гипотензия не является противопоказанием для продолжения лечения после стабилизации АД. В случае повторного возникновения выраженной артериальной гипотензии следует уменьшить дозу или отменить препарат. Если в анамнезе есть указания на развитие ангионевротического отека, не связанного с приемом ингибиторов АПФ, то у таких больных все-таки существует повышенный риск его развития при приеме Рамилонга.
В период лечения необходимо воздерживаться от занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, т.к. возможно головокружение, особенно после начальной дозы ингибитора АПФ у больных, принимающих диуретические средства.
Следует соблюдать осторожность при выполнении физических упражнений или жаркой погоде из-за риска дегидратации и артериальной гипотензии, вследствие уменьшения объема жидкости. Не рекомендуется употреблять этанол. Перед хирургическим вмешательством (включая стоматологию) необходимо предупредить хирурга/анестезиолога о применении ингибиторов АПФ. При возникновении отеков, например, в области лица (губы, веки) или языка, либо нарушения глотания или дыхания пациент должен немедленно прекратить прием препарата. Ангионевротический отек в области языка, глотки, или гортани (возможные симптомы: нарушение глотания или дыхания) может угрожать жизни и приводить к необходимости оказания неотложной помощи.
После приема первой дозы, а также при увеличении дозировки мочегонного средства и/или рамиприла, больные должны находиться в течение 8 часов под врачебным наблюдением во избежание развития неконтролируемой гипотензивной реакции. У больных с хронической сердечной недостаточностью прием препарата может привести к развитию выраженной артериальной гипотензии, которая в ряде случаев сопровождается олигурией или азотемией и редко — развитием острой почечной недостаточности. Больные злокачественной артериальной гипертензией или сопутствующей тяжелой сердечной недостаточностью должны начинать лечение в условиях стационара.
При использовании ингибиторов АПФ (см. также инструкции производителей мембран) опасные для жизни, быстро развивающиеся, аллергоподобные (анафилактоидные) реакции повышенной чувствительности, иногда вплоть до развития шока, были описаны у больных в ходе проведения гемодиализа с использованием определенных высокопроточных мембран (например, полиакрилонитриловые мембраны). Необходимо избегать совместного использования Рамилонга и такого рода мембран, например, для срочного гемодиализа или гемофильтрации. В данном случае предпочтительно использование других мембран или исключение приема ингибиторов АПФ. Сходные реакции наблюдались при аферезе липопротеидов низкой плотности с применением сульфата декстрана. Поэтому данный метод не следует применять для пациентов, при лечении которых использовали ингибиторы АПФ.
Двойная блокада ренин-ангиотензин-альдостероновой системы ассоциируется с повышенным риском развития гипотонии, гиперкалиемии и нарушениями функции почек (включая острую почечную недостаточность) в сравнении с монотерапией. Двойная блокада РААС с применением ингибиторов АПФ, блокаторов рецепторов АТ II (БРА II), или Алискирена не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией.
В отдельных случаях, когда совместное применение ингибиторов АПФ и БРА II абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции почек, водно-электролитного баланса, артериального давления. Это относится к назначению кандесартана или валсартана в качестве дополнительной терапии к ингибиторам АПФ у пациентов с хронической сердечной недостаточностью. Проведение двойной блокады РААС под тщательным наблюдением специалиста и обязательным мониторингом функции почек, водно-электролитного баланса и артериального давления, возможно у пациентов с хронической сердечной недостаточностью при непереносимости антагонистов альдостерона (спиронолактона), у которых наблюдается персистирование симптомов хронической сердечной недостаточности, несмотря на проведение иной адекватной терапии.
Сообщалось о возникновении кашля при лечении ингибиторами АПФ. Кашель непродуктивный, постоянный и происходит после прекращения терапии. При проведении дифференциального диагноза кашля у пациента должна приниматься во внимание возможность его связи с приемом ингибиторов АПФ.
Симптомы: выраженное снижение АД, шок, выраженная брадикардия, нарушения водно-электролитного равновесия, острая почечная недостаточность, ступор.
Лечение: промывание желудка, прием адсорбентов, натрия сульфата (при возможности в течение первых 30 минут). В случае развития артериальной гипотензии к терапии по восполнению объема циркулирующей крови и восстановлению солевого баланса может быть добавлено введение альфа-1-адренергических агонистов (норэпинефрин, допамин) и ангиотензина-II (ангиотензинамид).
Не рекомендуемые комбинации:
— соли калия, калийсберегающие диуретики (например, амилорид, триамтерен, спиронолактон): одновременное применение приводит к гиперкалиемии (необходим контроль калия в сыворотке крови);
— антигипертензивные средства (в частности, диуретики) и другие препараты, снижающие АД: одновременный прием приводит к усилению действия рамиприла;
— снотворные, наркотические и обезболивающие средства: могут вызвать резкое снижение ад;
— вазопрессорные симпатомиметические препараты (эпинефрин) и эстрогены могут вызвать ослабление действия рамиприла;
— аллопуринол, прокаинамид, цитостатические средства, иммунодепрессанты, системные кортикостероиды и другие препараты, которые могут изменить картину крови, в частности, снизить число лейкоцитов в крови;
— литий: повышение концентрации сывороточного лития и в результате усиление кардио- и невротического действия лития;
— пероральные гипогликемические средства (производные сульфонилмочевины, бигуаниды), инсулин: усиление гипогликемии;
— нестероидные противовоспалительные препараты (индометацин, ацетилсалициловая кислота): возможно ослабление действия рамиприла;
— гепарин: возможное повышение концентрации калия в сыворотке крови;
— поваренная соль: ослабление действия рамиприла;
— алкоголь: усиление гипотензивного эффекта рамиприла.
— двойная блокада РААС с применением ингибиторов АПФ, блокаторов рецепторов AT II (БРА II) или Алискирена не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией. У пациентов с сахарным диабетом или умеренной / тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2) одновременное применение Алискирена с ингибиторами АПФ или БРА II противопоказано. В отдельных случаях, когда совместное применение ингибиторов АПФ и БРА II абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции почек, водно-электролитного баланса, артериального давления.
Некоторые побочные реакции (такие симптомы понижения кровяного давления, как тяжесть, головокружение) могут снижать реакцию и концентрацию внимания пациента, что может повлиять на его способность управлять автомобилем и механизмами. Это наиболее вероятно в начале лечения, во время увеличения дозы, смены лекарственного средства и при взаимодействии с алкоголем.
Не рекомендуется управлять автомобилем или работать с механизмами в течение нескольких часов после приема первой дозы или увеличения дозы.
В защищенном от влаги и света месте при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
2 года.
Не использовать по истечении срока годности, указанного на упаковке.
Дозировка 2,5 мг: 10 или 15 таблеток в контурной ячейковой упаковке из пленки полимерной и фольги алюминиевой. По три контурные ячейковые упаковки по 10 таблеток или по две контурные ячейковые упаковки по 15 таблеток вместе с инструкцией по медицинскому применению в пачке из картона.
Дозировка 5 мг: по 10 или 15 таблеток в контурной ячейковой упаковке из пленки поливинилхлоридной и фольги алюминиевой. По три или шесть контурных ячейковых упаковок по 10 таблеток; по две или четыре контурные ячейковые упаковки по 15 таблеток с инструкцией по медицинскому применению в пачке из картона.
Дозировка 10 мг: по 10 таблеток в контурной ячейковой упаковке из пленки поливинилхлоридной и фольги алюминиевой. По три или шесть контурных ячейковых упаковок по 10 таблеток с инструкцией по медицинскому применению в пачке из картона.
Информация о производителе
СООО «Лекфарм», Республика Беларусь, 223141, г. Логойск, ул. Минская, д. 2а/4 тел./факс: (01774)-53801, сайт lekpharm.by
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-004496
Торговое наименование препарата
Амброксол
Международное непатентованное наименование
Амброксол
Лекарственная форма
сироп
Состав
5 мл сиропа содержат:
действующее вещество: амброксола гидрохлорид — 15,0 мг;
вспомогательные вещества: сорбитол жидкий (некристаллизующийся) — 1750,0 мг; глицерол (глицерин) — 637,5 мг; ароматизатор «Лесные ягоды R3712-1» — 11,0 мг; гиэтеллоза (гидроксиэтилцеллюлоза) — 10,0 мг; бензойная кислота — 8,5 мг; ацесульфам калия — 5,0 мг; ароматизатор «Ваниль с натуральным экстрактом RX15460» — 3,0 мг; вода очищенная — до 5,0 мл.
Описание
Прозрачная бесцветная или с желтовато-коричневым оттенком слегка вязкая жидкость с характерным запахом.
Фармакотерапевтическая группа
Отхаркивающее муколитическое средство
Код АТХ
R05CB06
Фармакодинамика:
Амброксол обладает секретомоторным, секретолитическим и отхаркивающим действием: стимулирует серозные клетки желез слизистой оболочки бронхов, увеличивает содержание слизистого секрета и выделение сурфактанта в альвеолах и бронхах; нормализует нарушенное соотношение серозного и слизистого компонентов мокроты. Активирует гидролизирующие ферменты и усиливает высвобождение лизосом из клеток Клара, снижая вязкость мокроты. Повышает двигательную активность ресничек мерцательного эпителия. Усиливает ток и транспорт слизи (мукоцилиарный клиренс). Усиление мукоцилиарного клиренса улучшает отхождение мокроты и облегчает кашель.
Фармакокинетика:
Всасывание
Для амброксола характерна быстрая и почти полная абсорбция из желудочно-кишечного тракта с линейной зависимостью от дозы в терапевтическом интервале концентраций. Максимальная концентрация в плазме крови (Сmах) при приеме внутрь достигается через 1-2,5 часа.
Распределение
Объем распределения составляет 552 л. В терапевтическом интервале концентраций связывание с белками плазмы крови составляет около 90 %. Биодоступность составляет 70-80 %. Проникает через гематоэнцефалический барьер, плацентарный барьер, выделяется с грудным молоком. Переход амброксола из крови в ткани при приеме внутрь происходит быстро. Самые высокие концентрации активного компонента препарата наблюдаются в легких.
Метаболизм
Примерно 30 % от принятой дозы подвергается эффекту «первичного прохождения» через печень. Исследования на микросомах печени человека показали, что изофермент CYP3A4 является преобладающим изоферментом, ответственным за метаболизм амброксола до дибромантраниловой кислоты. Оставшаяся часть амброксола метаболизируется в печени, главным образом с образованием глюкуроновых конъюгатов и путем частичного расщепления до дибромантраниловой кислоты (приблизительно 10 % от введенной дозы), а также небольшого количества дополнительных метаболитов.
Выведение
Терминальный период полувыведения амброксола составляет 10 часов. Общий период полувыведения амброксола и его метаболитов составляет около 22 часов. Общий клиренс находится в пределах 660 мл/мин. Выводится почками: 90 % в виде метаболитов, около 10 % — в неизменном виде.
Фармакокинетика у особых групп пациентов
Пациенты с нарушениями функции почек
При нарушениях функции почек тяжелой степени (клиренс креатинина менее 30 мл/мин) возможно накопление метаболитов амброксола.
Ввиду высокой степени связывания с белками плазмы крови и значительного объема распределения, а также медленного перераспределения из тканей в кровь, эффективная элиминация амброксола посредством диализа или форсированного диуреза маловероятна.
Пациенты с нарушениями функции печени
При печеночной недостаточности тяжелой степени клиренс амброксола снижается на 20-40 %.
Возраст, пол
Не обнаружено клинически значимого влияния возраста и пола на фармакокинетику амброксола, поэтому нет оснований для подбора дозы по этим признакам.
Показания:
Острые и хронические заболевания дыхательных путей с выделением вязкой мокроты:
— острый и хронический бронхит;
— пневмония;
— хроническая обструктивная болезнь легких;
— бронхиальная астма с затруднением отхождения мокроты;
— бронхоэктатическая болезнь.
Противопоказания:
— Повышенная чувствительность к амброксолу или другим компонентам препарата;
— беременность (I триместр);
— период грудного вскармливания;
— непереносимость фруктозы (препарат содержит сорбитол).
С осторожностью:
— Нарушение моторной функции бронхов и повышенное образование мокроты (при синдроме неподвижных ресничек);
— снижение кашлевого рефлекса или задержка мокроты;
— язвенная болезнь желудка и 12-перстной кишки в период обострения;
— беременность (II и III триместры);
— почечная недостаточность;
— печеночная недостаточность тяжелой степени.
Пациенты с нарушениями функции почек или тяжелыми заболеваниями печени должны принимать препарат Амброксол с особой осторожностью, соблюдая большие интервалы между приемами препарата или принимая препарат в меньшей дозе (половина рекомендованной дозы для взрослых).
Беременность и лактация:
Беременность
Амброксол проникает через плацентарный барьер.
Доклинические исследования не выявили прямого или косвенного неблагоприятного влияния на беременность, эмбриональное/фетальное, постнатальное развитие и на родовую деятельность.
Обширный клинический опыт применения амброксола после 28 недель беременности не обнаружил свидетельств отрицательного влияния на плод.
Тем не менее, необходимо соблюдать обычные меры предосторожности при использовании лекарственных препаратов во время беременности. Применение препарата Амброксол в I триместре беременности противопоказано. Во II и III триместрах беременности применение препарата возможно только в том случае, если потенциальная польза для матери превышает потенциальный риск для плода.
Период грудного вскармливания
Амброксол может экскретироваться с грудным молоком. Несмотря на то, что нежелательные эффекты у детей, получающих кормление грудью, не наблюдались, при необходимости применения препарата грудное вскармливание необходимо прекратить. Фертильность
Доклинические исследования амброксола не выявили отрицательного воздействия на фертильность.
Способ применения и дозы:
Внутрь. Препарат Амброксол можно применять независимо от приема пищи. Муколитический эффект препарата проявляется при приеме большого количества жидкости, поэтому во время лечения рекомендуется обильное питье. Препарат не следует принимать непосредственно перед сном.
В 5 мл сиропа содержится 15 мг амброксола.
Взрослые и дети старше 12 лет: в течение первых 2-3 дней принимать по 10 мл сиропа 3 раза в день, затем дозу следует уменьшить до 10 мл сиропа 2 раза в день.
Дети от 6 до 12 лет: по 5 мл сиропа 2-3 раза в день.
Дети от 2 до 6 лет: по 2,5 мл сиропа 3 раза в день.
Дети в возрасте до 2 лет: по 2,5 мл сиропа 2 раза в день.
Максимальная суточная доза для взрослых — 120 мг амброксола; максимальная суточная доза для детей от 6 до 12 лет — 45 мг амброксола, для детей от 2 до 6 лет — 22,5 мг амброксола, для детей в возрасте до 2 лет — 15 мг амброксола.
Длительность лечения подбирается индивидуально, в зависимости от течения заболевания. В случае сохранения симптомов заболевания в течение 4-5 дней от начала приема препарата рекомендуется обратиться к врачу.
Побочные эффекты:
Классификация частоты развития побочных эффектов согласно
Всемирной организации здравоохранения (ВОЗ):
очень часто ≥ 1/10;
часто от ≥ 1/100 до < 1/10;
нечасто от ≥ 1/1000 до < 1/100;
редко от ≥ 1/10000 до < 1/1000;
очень редко < 1/10000, включая отдельные сообщения;
частота неизвестна — по имеющимся данным установить частоту возникновения не представляется возможным.
Желудочно-кишечные нарушения: часто — тошнота; нечасто — диспепсия, боль в верхней части живота, рвота, диарея, изжога; частота неизвестна — снижение чувствительности в полости рта и глотке, сухость слизистой оболочки полости рта и глотки.
Нарушения со стороны иммунной системы: редко — кожная сыпь, крапивница; частота неизвестна — анафилактические реакции (включая анафилактический шок), синдром Стивенса-Джонсона, синдром Лайелла, реакции гиперчувствительности, кожный зуд, ангионевротический отек, острый генерализованный экзантематозный пустулез.
Нарушения со стороны нервной системы: частота неизвестна — дисгевзия (нарушение вкусовых ощущений).
Прочие: редко — адинамия, лихорадка.
Передозировка:
Симптомы
Специфических симптомов передозировки амброксола у человека не описано.
Имеются сообщения о случайной передозировке и/или медицинской ошибке, в результате которых наблюдались симптомы известных побочных эффектов амброксола: тошнота, диспепсия, рвота, диарея, абдоминальная боль. При этом возможна необходимость в симптоматической терапии.
Меры по оказанию помощи при передозировке
Искусственная рвота, промывание желудка в первые 1-2 часа после приема препарата, симптоматическая терапия.
Взаимодействие:
При применении с противокашлевыми препаратами возможно затруднение отхождения мокроты в результате подавления кашлевого рефлекса.
При одновременном применении с амоксициллином, цефуроксимом, эритромицином, доксициклином амброксол увеличивает их всасывание в бронхиальный секрет.
О клинически значимых нежелательных взаимодействиях с другими лекарственными средствами не сообщалось.
Особые указания:
Препарат Амброксол не следует применять совместно с противокашлевыми препаратами, которые могут тормозить кашлевой рефлекс.
Препарат Амброксол следует с осторожностью применять у пациентов с ослабленным кашлевым рефлексом или нарушенным мукоциллиарным транспортом из-за возможности скопления мокроты.
Пациентам, принимающим препарат Амброксол, не следует рекомендовать выполнение дыхательной гимнастики; у тяжелобольных пациентов следует выполнять аспирацию разжиженной мокроты.
У пациентов с бронхиальной астмой амброксол может усиливать кашель.
Не следует принимать препарат непосредственно перед сном.
Имеются единичные сообщения о тяжелых поражениях кожи, таких как синдром Стивенса-Джонсона и токсический эпидермальный некролиз, совпавшие по времени с назначением отхаркивающих препаратов, таких как амброксол. В большинстве случаев они могут быть объяснены тяжестью основного заболевания и/или сопутствующей терапией. У пациентов с синдромом Стивенса-Джонсона или токсическим эпидермальным некролизом в ранней фазе могут появиться температура, боль в теле, ринит, кашель и боль в горле. При симптоматическом лечении возможно ошибочное назначение муколитических средств, таких как амброксол. При появлении новых поражений кожи и слизистых рекомендуется прекратить лечение препаратом Амброксол и немедленно обратиться за медицинской помощью.
При нарушениях функции почек препарат Амброксол необходимо применять только по рекомендации врача.
В 5 мл препарата Амброксол содержится 1750,0 мг сорбитола. Пациенты с редкой наследственной непереносимостью фруктозы не должны принимать препарат.
Влияние на способность управлять транспортными средствами и механизмами:
Нет сведений о неблагоприятном воздействии на способность управлять транспортными средствами и обслуживать механизмы, требующие повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска/дозировка:
Сироп 15 мг/5 мл.
Упаковка:
100 мл или 200 мл во флаконах из полиэтилентерефталата или темного стекла с навинчивающейся крышкой с контролем первого вскрытия из полиэтилена высокой плотности или из полипропилена.
Каждый флакон вместе с мерным стаканчиком из полипропилена и инструкцией по применению в пачке из картона.
Условия хранения:
Хранить при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Срок годности:
3 года.
Не применять по истечении срока годности.
Условия отпуска
Без рецепта
Производитель
Акционерное общество «ВЕРТЕКС» (АО «ВЕРТЕКС»), г. Санкт-Петербург, Дорога в Каменку, д.62, лит. А, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
АО «ВЕРТЕКС»
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Ревлимид (15 мг)
МНН: Леналидомид
Производитель: Селджен Интернешнл Сарл.
Анатомо-терапевтическо-химическая классификация: Lenalidomide
Номер регистрации в РК:
№ РК-ЛС-5№020648
Информация о регистрации в РК:
10.06.2019 — бессрочно
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
85 756.91 KZT
- Скачать инструкцию медикамента
Торговое название
Ревлимид
Международное непатентованное название
Леналидомид
Лекарственная форма
Капсулы, 5 мг, 10 мг, 15 мг и 25 мг
Состав
Ревлимид 5 мг, капсулы
Одна капсула содержит
активное вещество – леналидомид 5 мг
вспомогательные вещества: лактоза безводная, целлюлоза микрокристаллическая, натрия кроскармеллоза, магния стеарат,
корпус капсулы: титана диоксид (E171), желатин,
крышка капсулы: титана диоксид (E171), желатин,
чернила черные: шеллак, этанол, 2-пропанол, бутанол, пропиленгликоль, вода очищенная, раствор аммиака, калия гидроксид, железа оксид черный (E172).
Ревлимид 10 мг, капсулы
Одна капсула содержит
активное вещество – леналидомид 10 мг
вспомогательные вещества: лактоза безводная, целлюлоза микрокристаллическая, натрия кроскармеллоза, магния стеарат,
корпус капсулы: железа оксид желтый (E172), титана диоксид (E171), желатин,
крышка капсулы: индигокармин FD&C синий 2, железа оксид желтый (E172), титана диоксид (E171), желатин,
чернила черные: шеллак, этанол, 2-пропанол, бутанол, пропиленгликоль, вода очищенная, раствор аммиака, калия гидроксид, железа оксид черный (E172).
Ревлимид 15 мг, капсулы
Одна капсула содержит
активное вещество – леналидомид 15 мг
вспомогательные вещества: лактоза безводная, целлюлоза микрокристаллическая, натрия кроскармеллоза, магния стеарат,
корпус капсулы: титана диоксид (E171), желатин,
крышка капсулы: индигокармин FD&C синий 2, титана диоксид (E171), желатин,
чернила черные: шеллак, этанол, 2-пропанол, бутанол, пропиленгликоль, вода очищенная, раствор аммиака, калия гидроксид, железа оксид черный (E172).
Ревлимид 25 мг, капсулы
Одна капсула содержит
активное вещество – леналидомид 25 мг
вспомогательные вещества: лактоза безводная, целлюлоза микрокристаллическая, натрия кроскармеллоза, магния стеарат,
корпус капсулы: титана диоксид (E171), желатин,
крышка капсулы: титана диоксид (E171), желатин,
чернила черные: шеллак, этанол, 2-пропанол, бутанол, пропиленгликоль, вода очищенная, раствор аммиака, калия гидроксид, железа оксид черный (E172).
Описание
Твердые желатиновые непрозрачные капсулы размером «2», от белого до почти белого цвета, с черной надписью «REV» и «5mg» (для дозировки 5 мг).
Твердые желатиновые капсулы размером «0», с непрозрачным корпусом бледно-желтого цвета и непрозрачной крышкой сине-зеленого цвета, с черной надписью «REV» и «10mg» (для дозировки 10 мг).
Твердые желатиновые капсулы размером «0», с непрозрачным корпусом от белого до почти белого цвета и непрозрачной крышкой зеленовато-голубого цвета, с черной надписью «REV» и «15mg» (для дозировки 15 мг).
Твердые желатиновые непрозрачные капсулы размером «0», от белого до почти белого цвета, с черной надписью «REV» и «25mg» (для дозировки 25 мг).
Содержимое капсул – порошок от белого до почти белого цвета или от почти белого до бледно-желтого цвета.
Фармакотерапевтическая группа
Иммунодепрессанты. Иммунодепрессанты другие. Леналидомид.
Код ATX L04AX04
Фармакологические свойства
Фармакокинетика
В структуру леналидомида входит асимметричный атом углерода и, следовательно, он может существовать в оптически активных формах S(‑) и R(+). Леналидомид представляет собой рацемическую смесь этих изомеров. Леналидомид обычно хорошо растворим в органических растворителях, достигает максимальной растворимости в буферном растворе 0.1N HCl.
Всасывание
Леналидомид быстро всасывается из желудочно-кишечного тракта после приема внутрь натощак здоровыми добровольцами, максимальная концентрация в плазме достигается между 0,5 и 2 часами после приема. У пациентов с множественной миеломой, так же как и у здоровых добровольцев, максимальные концентрации (Cmax) и площадь под кривой концентрация-время (AUC) увеличиваются пропорционально увеличению дозы. Прием многократных доз не приводит к накоплению лекарственного препарата. В плазме относительная экспозиция S- и R- энантиомеров леналидомида составляет приблизительно 56% и 44%, соответственно.
Сопутствующий прием жирной и высококалорийной пищи снижает степень всасывания препарата у здоровых добровольцев, что приводит, приблизительно, к 20% снижению значения площади под кривой концентрация-время (AUC) и 50% снижению концентрации Cmax в плазме. Однако, в основных регистрационных испытаниях с пациентами с множественной миеломой, где была установлена эффективность и безопасность леналидомида, лекарственный препарат принимали вне зависимости от приема пищи. Следовательно, леналидомид можно принимать как с едой, так и натощак.
Распределение
In vitro связывание (14C)-леналидомида с белками плазмы крови больных множественной миеломой и здоровых добровольцев составляет 23% и 29%, соответственно.
Леналидомид обнаруживается в семенной жидкости (< 0,01% принятой дозы) после приема дозы 25 мг/сутки, и не обнаруживается спустя 3 дня после прекращения приема препарата у здоровых добровольцев (см. «Особые указания»).
Биотрансформация и выведение
Результаты исследований метаболизма in vitro указывают, что изоферменты системы цитохрома Р450 не принимают участия в метаболизме леналидомида у человека, поэтому при совместном применении леналидомида и препаратов, ингибирующих изоферменты системы цитохрома Р450, метаболические лекарственные взаимодействия маловероятны. Результаты исследований in vitro демонстрируют отсутствие ингибирующего действия леналидомида на изоферменты CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A или UGT1A1. Таким образом, маловероятно, что леналидомид будет способствовать развитию любых клинически значимых лекарственных взаимодействий при одновременном назначении с субстратами этих изоферментов.
По данным исследований in vitro леналидомид не является субстратом белка резистентности рака молочной железы человека (BCRP), переносчиков белка множественной лекарственной устойчивости MRP1, MRP2 или MRP3, переносчиков органических анионов (ОАТ) ОАТ1 и ОАТ3, полипептида-переносчика органических анионов 1В1 (ОАТР1В1), переносчика органических катионов (ОСТ) ОСТ1 и ОСТ2, белка-переносчика семейства МАТЕ (multidrug and toxin extrusion protein), МАТЕ1, и оригинальных переносчиков органических катионов (OCTN), OCTN1 и OCTN2.
Неизвестно, проявляет ли леналидомид in vivo ингибиторные свойства в отношении энергозависимых переносчиков BSEP (Bile Salt Export Pump — насос экспорта желчных кислот), BCRP, MRP2, OAT1, OAT3, OATP1B1, OATP1B3 или OCT2, при том, что in vitro, в концентрациях до 20 мкмоль, ингибиторного действия у него не отмечалось.
Основная часть леналидомида выводится с мочой. Доля почечной экскреции в общем клиренсе у пациентов с нормальной почечной функцией составляет 90%; 4% леналидомида выводится с калом.
Леналидомид практически не метаболизируется в организме, 82% принятой дозы выводится с мочой в неизмененном виде. Гидрокси-леналидомид и N-ацетил-леналидомид составляют 4,59% и 1,83% от выводимой дозы, соответственно. Почечный клиренс леналидомида превышает скорость клубочковой фильтрации, и поэтому процесс носит как пассивный, так и активный характер.
При приеме в дозах от 5 до 25 мг/сутки период полувыведения из плазмы составляет приблизительно 3 часа у здоровых добровольцев и от 3 до 5 часов у пациентов с множественной миеломой.
Пожилые пациенты
Специальных клинических исследований для оценки фармакокинетики леналидомида у пожилых пациентов не проводилось. Популяционный анализ, в который были включены фармакокинетические данные пациентов в возрасте от 39 до 85 лет, не выявил влияния возраста на клиренс леналидомида (экспозиция в плазме). Учитывая повышенную вероятность нарушения функций почек в пожилом возрасте, следует соблюдать осторожность при подборе дозы препарата и осуществлять тщательный контроль функции почек на фоне терапии.
Почечная недостаточность
Фармакокинетика леналидомида была изучена у пациентов с нарушением функции почек неопухолевой природы. В данном исследовании для классификации функции почек были использованы два метода: измерение клиренса креатинина в суточной моче и расчет клиренса креатинина по формуле Кокрофта-Голта. Исследование показало, что при снижении функции почек (< 50 мл/мин), общий клиренс препарата снижается пропорционально, приводя к увеличению значения AUC. Значения AUC повышались примерно в 2,5, 4 и 5 раз у пациентов с умеренной почечной недостаточностью, тяжелой почечной недостаточностью и терминальной стадией почечной недостаточности соответственно, по сравнению с группой, объединяющей больных с нормальной функцией почек и больных с легкой почечной недостаточностью. Период полувыведения леналидомида увеличивается с примерно 3,5 часов у пациентов с клиренсом креатинина > 50 мл/мин до свыше 9 часов у пациентов с пониженной функцией почек, КК < 50 мл/мин. Однако нарушение почечной функции не влияет на всасывание леналидомида из желудочно-кишечного тракта. Не наблюдается различий по значению Cmax между здоровыми добровольцами и больными множественной миеломой. Примерно 30% препарата выводилось из организма в ходе 4-часового сеанса диализа. Рекомендуемая корректировка дозы для больных с нарушением функции почек описана в разделе «Способ применения и дозы».
Печеночная недостаточность
Популяционный анализ фармакокинетических данных пациентов с печеночной недостаточностью легкой степени тяжести (N=16, общий билирубин >1 и ≤1,5 x ВГН, верхняя граница нормы, или АСТ > ВГН) показал отсутствие влияния печеночной недостаточности легкой степени тяжести на клиренс леналидомида (экспозиция в плазме). Данных в отношении пациентов с печеночной недостаточностью средней и тяжелой степени не получено.
Другие внутренние факторы
Популяционный анализ фармакокинетических данных показал отсутствие клинически значимого влияния массы тела (33-135 кг), пола, расы и типа онкогематологического заболевания на клиренс леналидомида у взрослых пациентов.
Фармакодинамика
Механизм действия леналидомида основан на противоопухолевых, антиангиогенных, проэритропоэтических и иммуномодулирующих свойствах. Леналидомид ингибирует пролиферацию клеток некоторых линий гемопоэтических опухолей, включая плазматические опухолевые клетки множественной миеломы (ММ) и клетки, которые имеют цитогенетические дефекты хромосомы 5. Леналидомид повышает клеточный иммунитет, опосредованный T-клетками и собственными клетками-киллерами (КК), а также индуцирует пролиферацию КК Т-клеток. Леналидомид ингибирует ангиогенез, блокируя миграцию и адгезию эндотелиальных клеток и образование микрососудов, а также индуцирует экспрессию фетального гемоглобина CD34+ стволовыми гемопоэтическими клетками и ингибирует секрецию провоспалительных цитокинов (например, фактора некроза опухоли-α (ФНО-α) и интерлейкина ИЛ‑6) моноцитами.
Клиническая эффективность и безопасность
Эффективность и безопасность Ревлимида была подтверждена результатами двух многоцентровых рандомизированных двойных слепых плацебо-контролируемых параллельно-групповых исследований III фазы (MM-009 и MM-010), в которых больные множественной миеломой получали леналидомид совместно с дексаметазоном или только дексаметазон в качестве 2-й линии терапии. Из 353 пациентов в исследованиях MM-009 и MM-010, получавших лечение леналидомидом/дексаметазоном, 45,6% составляли пациенты в возрасте 65 лет или старше. Из 704 пациентов, принявших участие в исследованиях MM‑009 и MM-010, 44,6% составляли пациенты в возрасте 65 лет или старше.
Первичной конечной точкой эффективности в обоих исследованиях являлось время до прогрессирования (TTP). В общей сложности, 353 пациента были оценены в исследовании ММ-009, 177 — в группе, получавшей леналидомид/дексаметазон, и 176 пациентов — в группе, получавшей плацебо/дексаметазон, и, в общей сложности, 351 пациент был оценен в исследовании ММ-010: 176 пациентов в группе, получавшей леналидомид/дексаметазон, и 175 пациентов в группе, получавшей плацебо/дексаметазон.
Плановый промежуточный анализ обоих исследований показал, что комбинированное лечение леналидомидом/дексаметазоном статистически значимо (p < 0.00001) превосходило линию лечения только дексаметазоном по первичным конечным точкам эффективности и TTP (средняя продолжительность периода наблюдения — 98,0 недель). В обоих исследованиях показатели полного и общего ответа в группе леналидомид/дексаметазон были значительно выше, чем в группе, получавшей дексаметазон/плацебо. Результаты этого анализа последовательно привели к необходимости раскрытия кодов лечения в обоих исследованиях, чтобы позволить пациентам группы, получавшей плацебо/дексаметазон, получить комбинированное лечение леналидомидом / дексаметазоном.
Длительный анализ эффективности проведен за период наблюдения, составлявший, в среднем, 130,7 недель. В таблице 1 представлены результаты анализа эффективности за период наблюдения по исследованиям MM‑009 и MM‑010.
Таблица 1: Обобщение результатов анализа эффективности на дату завершения периода длительного наблюдения по исследованиям MM-009 и MM‑010 (даты завершения наблюдения — 23 июля 2008 года и 2 марта 2008 года, соответственно)
|
Конечная точка |
ЛЕН/ДЕКС (N=353) |
Плацебо/ДЕКС (N=351) |
|
|
Время до события |
Соотношение риска [95% ДИ], p-значениеa |
||
|
Время до прогрессирования, медиана [95% ДИ], недели |
60,1 [44,3, 73,1] |
20,1 [17,7, 20,3] |
0,350 [0,287, 0,426], p < 0,001 |
|
Выживаемость без прогрессирования, медиана [95% ДИ], недели |
48,1 [36,4, 62,1] |
20,0 [16,1, 20,1] |
0,393 [0,326, 0,473] p < 0,001 |
|
Общая выживаемость, медиана [95% ДИ], недели Однолетняя общая выживаемость |
164,3 [145,1, 192,6] 82% |
136,4 [113,1, 161,7] 75% |
0,833 [0,687, 1,009] p = 0,045 |
|
Ответ на лечение |
Отношение вероятностей [95% ДИ], p-значениеb |
||
|
Общий ответ [n, %] Полный ответ [n, %] |
212 (60,1) 58 (16,4) |
75 (21,4) 11 (3,1) |
5,53 [3,97, 7,71], p < 0.001 6,08 [3,13, 11,80], p < 0,001 |
a: двусторонний ранговый критерий сравнения кривых выживаемости между группами лечения.
b: двусторонний непрерывно-корректируемый критерий хи-квадрат.
Эксплоративное исследование
Открытое рандомизированное многоцентровое исследование 3 фазы было проведено с участием 445 пациентов с впервые диагностированной множественной миеломой; 222 пациента были рандомизированы в группу, получавшую леналидомид и низкодозированный дексаметазон, а 223 пациента были рандомизированы в группу, получавшую леналидомид и дексаметазон в стандартной дозировке. Пациенты, рандомизированные в группу, получавшую леналидомид/дексаметазон в стандартной дозировке, принимали леналидомид по 25 мг/сутки в 1 по 21 дни каждые 28 дней плюс дексаметазон 40 мг/сутки с 1 по 4, с 9 по 12 и с 17 по 20 дни каждые 28 дней в течение первых четырех циклов лечения. Пациенты, рандомизированные в группу, получающую леналидомид и низкодозированный дексаметазон, принимали леналидомид по 25 мг/сутки с 1 по 21 дни каждые 28 дней плюс дексаметазон в низкой дозировке – 40 мг/сутки в 1, 8, 15 и 22 день каждые 28 дней. В группе, получавшей леналидомид и низкодозированный дексаметазон, 20 пациентам (9,1%) потребовалось, по меньшей мере, одно прерывание лечения, в сравнении с 65 пациентами (29,3%) в группе, получавшей леналидомид/дексаметазон в стандартной дозировке.
При последующем анализе более низкая смертность наблюдалась в группе, получавшей леналидомид и низкодозированный дексаметазон – 6.8% (15/220), в сравнении с группой, получающей леналидомид/дексаметазон в стандартной дозировке 19,3% (43/223) среди пациентов с впервые диагностированной множественной миеломой и периодом наблюдения в среднем 72,3 недели.
Однако при более длительном наблюдении наблюдалась тенденция к сокращению различия в пользу низкодозированного дексаметазона по показателю выживаемости.
Учитывая индивидуальные различия между пациентами в популяции, эти результаты следует интерпретировать с осторожностью.
Европейское Медицинское агентство освободило производителя от обязательства предоставить результаты исследований Ревлимида в популяции детей с множественной миеломой (см. «Способ применения и дозы» для получения информации по применению препарата в педиатрии).
Показания к применению
-
в комбинации с дексаметазоном для лечения взрослых больных с множественной миеломой, которые получили, по меньшей мере, одну линию терапии
Способ применения и дозы
Лечение следует начинать и проводить строго под контролем врача, имеющего опыт лечения пациентов с множественной миеломой (MM).
Рекомендуемая дозировка
Рекомендуемая начальная доза Ревлимида составляет 25 мг внутрь 1 раз в сутки в 1‑21 дни повторных 28‑дневных циклов. Рекомендуемая доза дексаметазона составляет 40 мг внутрь 1 раз в сутки в 1‑4, 9‑12 и 17‑20 дни каждого 28-дневного цикла первых 4 циклов терапии, а затем по 40 мг 1 раз в день в 1–4-й дни каждого последующего 28-дневного цикла.
Продолжение лечения или модификация дозы производятся на основании клинических и лабораторных показателей (см. «Особые указания»). Врачу следует тщательно подбирать дозу дексаметазона, принимая во внимание состояние больного и стадию заболевания.
Лечение леналидомидом не следует начинать, если абсолютное число нейтрофилов (AЧН) составляет < 1,0 x 109/л, и/или количество тромбоцитов < 75 x 109/л, или, в зависимости от инфильтрации костного мозга плазматическими клетками, количество тромбоцитов < 30 x 109/л.
Рекомендуемые корректировки дозы в ходе лечения или его возобновления
Корректировки дозы, приведенные ниже, рекомендованы для контроля нейтропении, тромбоцитопении или других видов токсичности 3 или 4 степени тяжести, связь которых с применением Ревлимида нельзя исключить.
Пошаговое снижение дозы
|
Начальная доза |
25 мг |
|
Доза 1 уровня |
15 мг |
|
Доза 2 уровня |
10 мг |
|
Доза 3 уровня |
5 мг |
Тромбоцитопения
|
Количество тромбоцитов |
Рекомендации |
|
Снизилось впервые до <30х109/л |
Прервать лечение леналидомидом |
|
Восстановилось до ≥30х109/л |
Возобновить лечение леналидомидом в дозе 1 уровня 1 раз в день |
|
Каждое последующее снижение ниже 30х109/л |
Прервать лечение леналидомидом |
|
Восстановилось до ≥30х109/л |
Возобновить лечение леналидомидом в меньшей дозе (доза 2 или 3 уровня) 1 раз в день. Не использовать дозы препарата ниже 5 мг в день |
Нейтропения
|
Количество нейтрофилов |
Рекомендации |
|
Снизилось впервые до <0,5х109/л |
Прервать лечение леналидомидом |
|
Восстановилось до ≥0,5х109/л, если нейтропения – единственное проявление токсичности |
Возобновить лечение леналидомидом в начальной дозе 1 раз в день |
|
Восстановилось до ≥0,5х109/л и есть другие проявления дозозависимой гематологической токсичности, помимо нейтропении |
Возобновить лечение леналидомидом в дозе 1 уровня один раз в день |
|
Для каждого последующего снижения <0,5х109/л |
Прервать лечение леналидомидом |
|
Восстановилось до ≥0,5х109/л |
Возобновить лечение леналидомидом в меньшей дозе (доза 1, 2 или 3 уровня) 1 раз в день. Не использовать дозы препарата ниже 5 мг в день |
В случае нейтропении врач должен рассмотреть возможность назначения пациенту препаратов фактора роста.
Особые группы пациентов
Дети и подростки
Безопасность и эффективность Ревлимида у детей в возрасте от 0 до 17 лет не установлена. Данных по применению в данной группе пациентов не имеется.
Пожилые пациенты (старше 65 лет)
Результаты исследования фармакокинетики леналидомида у пожилых пациентов представлены в разделе «Фармакокинетика». В ходе клинических исследований леналидомид назначался больным в возрасте до 86 лет (см. Фармакодинамика). Процент пациентов в возрасте 65 лет или старше в группах, получавших леналидомид/дексаметазон или плацебо/дексаметазон, значительно не различался. В целом, не отмечено различий в эффективности и безопасности леналидомида у более молодых пациентов и пациентов пожилого возраста, хотя нельзя исключить возможность большей чувствительности к препарату у больных старшей возрастной группы. Поскольку у пожилых больных вероятность нарушения функции почек больше, дозу препарата нужно подбирать осторожно, во время лечения рекомендуется мониторировать функцию почек.
Пациенты с почечной недостаточностью
Леналидомид выводится преимущественно почками, поэтому следует проявлять осторожность при подборе дозы; рекомендуется контроль функции почек.
Для пациентов с легкой формой почечной недостаточности корректировка дозы не требуется. В таблице представлены начальные дозы препарата, рекомендуемые для пациентов с умеренной или тяжелой формой почечной недостаточности, а также в терминальной стадии почечной недостаточности.
|
Функция почек (клиренс креатинина (КК)) |
Рекомендуемая доза Ревлимида (с 1 по 21 день каждого 28‑дневного цикла) |
|
Умеренная почечная недостаточность (30 мл/мин ≤ КК <50 мл/мин) |
10 мг 1 раз в сутки1 |
|
Тяжелая почечная недостаточность (КК <30 мл/мин, диализ не требуется) |
15 мг через день2 |
|
Терминальная стадия почечной недостаточности (ТСПН) (КК <30 мл / мин, требуется диализ) |
5 мг 1 раз в сутки. В день диализа дозу следует принять после проведения диализа. |
1 После 2 циклов терапии доза препарата может быть повышена до 15 мг 1 раз в сутки при отсутствии ответа на терапию, но хорошей ее переносимости.
2 Доза может быть повышена до 10 мг 1 раз в сутки при хорошей переносимости лечения.
После начала лечения леналидомидом последующая модификация дозы леналидомида у пациентов с почечной недостаточностью должна быть основана на индивидуальной переносимости лечения пациентом, как описано выше.
Пациенты с печеночной недостаточностью
Поскольку специальных исследований леналидомида у пациентов с нарушенной функцией печени не проводилось, специальных рекомендаций по дозировке препарата для данной категории лиц не имеется.
Способ применения
Капсулы Ревлимида рекомендуется принимать ежедневно в одно и то же время. Капсулы нельзя вскрывать, разламывать или разжевывать; их следует проглатывать целиком и запивать водой независимо от приема пищи. Если с момента пропуска приёма дозы прошло менее 12 часов, пациент может принять пропущенную дозу. Если же с момента пропуска приема дозы прошло более 12 часов, пропущенную дозу принимать не следует. Очередную дозу следует принять на следующий день в обычное время.
Побочные действия
Сводные данные по профилю безопасности
В двух плацебо-контролируемых исследованиях III фазы 353 пациента с множественной миеломой получали комбинированное лечение леналидомидом/дексаметазоном, а 351 получали комбинированное лечение плацебо/дексаметазоном.
К наиболее тяжелым побочным реакциям относились:
-
Венозная тромбоэмболия (тромбоз глубоких вен, тромбоэмболия легочной артерии) (см. «Особые указания»);
-
Нейтропения 4-й степени (см. «Особые указания»).
У больных множественной миеломой, получавших леналидомид в объединенных исследованиях (MM-009 и MM-010), наиболее часто наблюдались следующие побочные реакции: слабость (43,9%), нейтропения (42,2%), запор (40,5%), диарея (38,5%), мышечные судороги (33,4%), анемия (31,4%), тромбоцитопения (21,5%) и сыпь (21,2%).
Побочные реакции, представленные в виде таблицы
Побочные реакции, наблюдаемые у пациентов, получающих лечение леналидомидом/дексаметазоном, представлены ниже в таблице и систематизированы по системно-органным классам и частоте возникновения. Частота побочных реакций, приведенных ниже, определялась соответственно следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000) и очень редко (<1/10000, включая единичные случаи), частота неизвестна (не может быть оценена по имеющимся данным).
Таблица ниже составлена по данным, полученным в ходе проведения основных клинических исследований. Данные не корректировались для отражения большей продолжительности лечения в группе леналидомид/дексаметазон в сравнении с группой плацебо/дексаметазон в основных клинических исследованиях (см. «Фармакодинамика»).
Таблица 2: Побочные реакции, отмечавшиеся в клинических исследованиях и полученные из постмаркетинговых данных у пациентов с множественной миеломой, получавших леналидомид
|
Системно-органный класс/Рекомендуемые термины |
Побочные реакции (суммарно)/частота |
Побочные реакции 3−4 степени тяжести/частота |
|
Инфекционные и паразитарные заболевания |
Очень часто Пневмония, инфекции верхних дыхательных путей Часто Сепсис, бактериальные, вирусные и грибковые инфекции (включая оппортунистические), синусит |
Часто Пневмония, бактериальные, вирусные и грибковые инфекции (включая оппортунистические) |
|
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы) |
Нечасто Базалиома Плоскоклеточный рак кожи ^ * |
Редко Синдром лизиса опухоли † |
|
Нарушения со стороны крови и лимфатической системы |
Очень часто Тромбоцитопения^, нейтропения^, анемия, геморрагические нарушения ^, лейкопения Часто Панцитопения Нечасто Гемолиз, аутоиммунная гемолитическая анемия, гемолитическая анемия |
Очень часто Тромбоцитопения^, нейтропения^, лейкопения Часто Фебрильная нейтропения, анемия Нечасто Гиперкоагуляция, коагулопатия |
|
Нарушения со стороны иммунной системы |
Нечасто Реакции гиперчувствительности^ |
|
|
Нарушения со стороны эндокринной системы |
Часто Гипотиреоз, Гипертиреоз |
|
|
Нарушения со стороны обмена веществ и питания |
Очень часто Гипокалиемия, снижение аппетита Часто Гипомагниемия, гипокальциемия, обезвоживание |
Часто Гипокалиемия, гипокальциемия, гипофосфатемия |
|
Нарушения психики |
Нечасто Потеря либидо |
Часто Депрессия |
|
Нарушения со стороны нервной системы |
Очень часто Периферическая нейропатия (за исключением двигательной нейропатии), головокружение, тремор, извращение вкусовых ощущений, головная боль Часто Атаксия, нарушение равновесия |
Часто Инсульт, головокружение, обморок Нечасто Внутричерепное кровоизлияние^, транзиторная ишемическая атака, ишемия головного мозга |
|
Нарушения со стороны органов зрения |
Очень часто Нечёткость зрения Общий Снижение остроты зрения, катаракта |
Часто Катаракта Нечасто Слепота |
|
Нарушения со стороны органов слуха и лабиринтные нарушения |
Часто Глухота (в том числе тугоухость), звон в ушах |
|
|
Нарушения со стороны сердца |
Часто Мерцательная аритмия, брадикардия Нечасто Аритмия, удлинение интервала QT, трепетание предсердий, желудочковая экстрасистолия |
Часто Инфаркт миокарда^, мерцательная аритмия, застойная сердечная недостаточность, тахикардия |
|
Нарушения со стороны сосудов |
Очень часто тромбоэмболические нарушения (преимущественно тромбоз глубоких вен и тромбоэмболия легочной артерии)^ Часто артериальная гипотензия, артериальная гипертензия, экхимозы ^ |
Очень часто тромбоэмболические нарушения (преимущественно тромбоз глубоких вен и тромбоэмболия легочной артерии)^ Нечасто Ишемия, периферическая ишемия, тромбоз внутричерепного венозного синуса |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Очень часто Одышка, назофарингит, фарингит, бронхит, носовое кровотечение ^ |
Часто Респираторный дистресс-синдром Неизвестно Интерстициальный пневмонит † |
|
Нарушения со стороны желудочно-кишечного тракта |
Очень часто Запор, диарея, тошнота, рвота Часто Желудочно-кишечные кровотечения (включая ректальное, геморроидальное, кровотечение при пептической язве и гингивальное кровотечение)^, боль в животе, сухость во рту, стоматит, дисфагия Нечасто Колит, тифлит |
Общий Диарея, запоры, тошнота Неизвестно Панкреатит †, перфорация желудочно-кишечного тракта (включая перфорацию дивертикула, тонкой и толстой кишки). |
|
Нарушения со стороны печени и желчевыводящих путей |
Часто Отклонение значений функциональных проб печени от нормы Нечасто Печеночная недостаточность ^ Неизвестно Острая печеночная недостаточность^ †, токсический гепатит^ ^ цитолитический гепатит† , холестатический гепатит^ † , смешанный цитолитический/ холестатический гепатит^ † |
Часто Отклонение значений функциональных проб печени от нормы Нечасто Печеночная недостаточность ^ Неизвестно Острая печеночная недостаточность^ †, токсический гепатит^ † |
|
Нарушения со стороны кожи и подкожных тканей |
Очень часто Сыпь Часто Крапивница, гипергидроз, сухость кожи, кожный зуд, гиперпигментация кожи, экзема Нечасто Нарушение цвета кожи, реакции фотосенсибилизации |
Часто Сыпь Нечасто Отек Квинке † Редко Синдром Стивенса-Джонсона^ †, токсический эпидермальный некролиз^† Неизвестно Лейкоцитокластический васкулит^ † |
|
Нарушения со стороны опорно-двигательного аппарата |
Очень часто Мышечные судороги, боль в костях, боль и дискомфорт со стороны скелетно-мышечной и соединительной ткани Часто Припухание суставов |
Часто Мышечная слабость, боль в костях Нечасто Припухание суставов |
|
Нарушения со стороны почек и мочевыводящих путей |
Часто Гематурия ^, задержка мочи, недержание мочи Нечасто Приобретенный синдром Фанкони |
Часто Почечная недостаточность Нечасто Тубулярный почечный некроз |
|
Нарушения со стороны репродуктивной системы и молочных желез |
Часто Эректильная дисфункция |
|
|
Общие расстройства и реакции в месте введения |
Очень часто Утомляемость, отеки (включая периферические), лихорадка, гриппоподобный синдром (включающий лихорадку, миалгию, скелетно-мышечную боль, головную боль и озноб) Часто Боль в груди, летаргия |
Часто Утомляемость |
|
Травмы, интоксикации и осложнения манипуляций |
Часто Ушиб ^ |
Побочные действия
† согласно постмаркетинговым данным
Описание отдельных побочных реакций
Тератогенность
Леналидомид представляет собой структурный аналог талидомида — вещества, обладающего выраженным тератогенным действием, приводящим к развитию тяжелых жизнеугрожающих врождённых дефектов. Экспериментальные исследования на обезьянах показали результаты, схожие с результатами, описанными для талидомида (см. «Фертильность, беременность и грудное вскармливание; Генотоксичность и канцерогенез»). Если леналидомид принимается во время беременности, велик риск развития врожденных дефектов.
Нейтропения и тромбоцитопения
Применение комбинации леналидомида с дексаметазоном у пациентов с множественной миеломой сопровождалось повышением частоты развития нейтропении 4 степени тяжести (5,1% у пациентов, принимавших леналидомид с дексаметазоном по сравнению с 0,6% у пациентов, принимавших комбинацию дексаметазона и плацебо). Фебрильная нейтропения 4 степени тяжести у пациентов, принимавших комбинацию леналидомида с дексаметазоном, отмечалась нечасто — 0,6% (у пациентов, принимавших комбинацию дексаметазона и плацебо — 0,0%).
Применение комбинации леналидомида с дексаметазоном при множественной миеломе сопровождалось повышением вероятности развития тромбоцитопении 3 и 4 степени тяжести (соответственно 9,9% и 1,4% у пациентов, принимавших леналидомид с дексаметазоном, в сравнении с 2,3% и 0,0% — у пациентов, принимавших комбинацию дексаметазона и плацебо).
Венозная тромбоэмболия
Применение леналидомида с дексаметазоном у пациентов с множественной миеломой сопровождается повышенным риском развития тромбоза глубоких вен и тромбоэмболии легочной артерии (см. «Лекарственные взаимодействия»). Одновременное назначение эритропоэтических средств или наличие в анамнезе тромбоза глубоких вен также могут увеличить риск тромботических осложнений у данной группы пациентов.
Инфаркт миокарда
У пациентов, принимавших леналидомид, отмечались случаи инфаркта миокарда, особенно при наличии известных факторов риска.
Геморрагические нарушения
Геморрагические осложнения приведены в соответствии c системно-органным классoм: нарушения со стороны крови и лимфатической системы; нарушения со стороны нервной системы (внутричерепное кровоизлияние); со стороны дыхательной системы, органов грудной клетки и средостения (носовое кровотечение); со стороны желудочно-кишечного тракта (гингивальное, геморроидальное, ректальное кровотечения); со стороны почек и мочевыводящих путей (гематурия); травмы, интоксикации и осложнения манипуляций (ушибы) и сосудистые нарушения (экхимозы).
Аллергические реакции
Сообщалось о развитии аллергических реакций/реакций гиперчувствительности. Имеются публикации о возможности перекрестной реакции между леналидомидом и талидомидом.
Тяжелые кожные реакции
Имеются сообщения о развитии синдрома Стивенса-Джонсона (ССД) и токсического эпидермального некролиза (ТЭН). Леналидомид не следует назначать пациентам, в анамнезе которых отмечались тяжелые формы сыпи при приеме талидомида.
Первичные злокачественные опухоли другой локализации
*Новые злокачественные новообразования, отмечавшиеся в клинических исследованиях у пациентов с миеломой после применения комбинации леналидомида с дексаметазоном по сравнению с контролем, представлены, главным образом, базальноклеточным или плоскоклеточным раком кожи.
Острый миелолейкоз
Особые указания
Печеночная недостаточность
Сообщается (частота неизвестна) о таких нарушениях печеночной функции, как острая печеночная недостаточность и холестаз (потенциально фатальные), токсический гепатит, цитолитический гепатит, смешанный цитолитический/холестатический гепатит.
Рабдомиолиз
Редко наблюдались случаи рабдомиолиза, некоторые из них — при приеме леналидомида с препаратами из группы статинов.
Заболевания щитовидной железы
Сообщалось о случаях гипотиреоза и гипертиреоза (см. раздел «Особые указания: Заболевания щитовидной железы»).
Заболевания желудочно-кишечного тракта
На фоне применения леналидомида была зарегистрирована перфорация желудочно-кишечного тракта. Перфорация желудочно-кишечного тракта может приводить к септическим осложнениям и фатальному исходу.
Противопоказания
-
беременность и период лактации
-
женщины с сохраненным детородным потенциалом, за исключением случаев, когда возможно соблюдение всех необходимых условий Программы предохранения от беременности
-
повышенная чувствительность к леналидомиду или вспомогательным компонентам препарата (см. «Состав»)
Лекарственные взаимодействия
Эритропоэтические лекарственные средства, а также другие средства, которые могут повышать риск тромбоза, например, препараты гормонозаместительной терапии, следует применять с осторожностью у пациентов с множественной миеломой, принимающих леналидомид в комбинации с дексаметазоном (см. «Особые указания» и «Побочные действия»).
Пероральные контрацептивы
Изучение лекарственного взаимодействия с пероральными контрацептивами не проводилось. Леналидомид не является индуктором ферментов. В исследовании in vitro на гепатоцитах человека леналидомид в различных концентрациях не вызвал индукции CYP1A2, CYP2B6, CYP2C9, CYP2C19 и CYP3A4/5. Следовательно, индукция, приводящая к снижению эффективности препарата, включая гормональные контрацептивы, маловероятна, если леналидомид принимается в качестве монотерапии. Однако, дексаметазон, как известно, является слабо-умеренным индуктором цитохрома CYP3A4 и, возможно, влияет и на другие ферменты и транспортеры. Дексаметазон может снижать эффективность пероральных контрацептивов. Для эффективного предупреждения беременности необходимо использовать средства, указанные в Программе предохранения от беременности (см. «Фертильность, беременность и грудное вскармливание; Генотоксичность и канцерогенез»).
Варфарин
Одновременный прием нескольких доз леналидомида по 10 мг не влияет на фармакокинетику однократной дозы R- и S-варфарина. Одновременный прием однократной дозы 25 мг варфарина не влияет на фармакокинетику леналидомида. Однако остается неизвестным, существует ли взаимодействие во время клинического применения (комбинированное лечение с дексаметазоном). Дексаметазон является слабо-умеренным индуктором ферментов, и его влияние на варфарин неизвестно. Рекомендуется тщательный контроль концентрации варфарина во время лечения.
Дигоксин
Одновременное назначение леналидомида в дозе 10 мг/сутки с дигоксином сопровождается увеличением концентрации дигоксина (0.5 мг, однократная доза) в плазме крови на 14 % с 90% ДИ (доверительным интервалом) [0.52%-28.2%]. Неизвестно, будет ли меняться эффект при изменении терапевтической ситуации (более высокие дозы леналидомида и сопутствующий прием дексаметазона). Таким образом, на фоне лечения леналидомидом рекомендуется контролировать концентрацию дигоксина.
Статины
При комбинированном приеме леналидомида с препаратами группы статинов существует повышенный риск рабдомиолиза, который может быть обусловлен суммацией действия этих препаратов. В связи с этим в первые недели лечения рекомендуется проводить тщательный клинический и мониторинг и лабораторное наблюдение.
Дексаметазон
Одновременный однократный или многократный прием дексаметазона (40 мг/день) не оказывает клинически значимого эффекта на фармакокинетику леналидомида при многократном его приеме в дозе 25 мг/день.
Взаимодействие с ингибиторами Р-гликопротеина (P-gp)
Леналидомид in vitro является субстратом P-gp, но не ингибиторов P-gp. Одновременное многократное применение сильного ингибитора P-gp хинидина (600 мг 2 раза в день) или умеренного ингибитора P-gp/субстрата темсиролимуса (25 мг) не оказывало клинически значимого эффекта на фармакокинетику леналидомида (25 мг/день). Фармакокинетика темсиролимуса не изменялась при совместном применении с леналидомидом.
Особые указания
Предупреждения относительно беременности
Леналидомид – структурный аналог талидомида. Известно, что прием беременными женщинами талидомида, обладающего выраженным тератогенным действием, вызывает тяжелые и жизнеугрожающие нарушения внутренних органов плода. Экспериментальные исследования леналидомида на обезьянах показали результаты, сходные с описанными ранее результатами для талидомида (см. разделы «Фертильность, Беременность и грудное вскармливание; Генотоксичность и канцерогенез»). При приеме леналидомида во время беременности риск развития врожденных дефектов очень велик.
Неукоснительное соблюдение всех требований Программы предохранения от беременности распространяется на всех пациентов детородного возраста с сохранённым детородным потенциалом, если только достоверно не подтверждено его отсутствие.
Женщины, не способные к деторождению
Пациентка или женщина-сексуальный партнер мужчины-пациента, НЕ считаются способными к деторождению при наличии хотя бы одного из перечисленных факторов:
-
возраст ≥50 лет и длительность естественной аменореи ≥1 года*;
-
преждевременное угасание функции яичников, подтвержденное гинекологом;
-
двусторонняя сальпингоофорэктомия или гистерэктомия в анамнезе;
-
генотип XY, синдром Тернера, анатомический дефект матки.
* Аменорея вследствие противораковой терапии или в период грудного вскармливания не исключает наличия детородного потенциала.
Рекомендации
Женщинам с сохранённым детородным потенциалом прием леналидомида противопоказан, если не соблюдается хотя бы одно из указанных ниже условий, в соответствии с которыми женщина должна:
-
знать о возможном тератогенном действии леналидомида на плод;
-
понимать необходимость непрерывного использования эффективных методов контрацепции в течение 4 недель до начала лечения, в течение всего курса лечения и 4 недель после лечения леналидомидом;
-
даже в случае аменореи соблюдать все правила эффективной контрацепции;
-
быть способной к соблюдению всех правил эффективной контрацепции;
-
знать и понимать возможные последствия беременности, а также необходимость быстрого обращения за консультацией при подозрении на наступившую беременность;
-
понимать необходимость незамедлительного начала соблюдения эффективных мер контрацепции после назначения леналидомида и получения отрицательных результатов теста на беременность;
-
осознавать необходимость и проводить тест на беременность каждые 4 недели, за исключением случаев подтвержденной трубной стерилизации;
-
подтвердить понимание всех возможных нежелательных последствий и мер предосторожности на фоне лечения леналидомидом.
Для мужчин, принимающих леналидомид, фармакокинетические данные показали, что в ходе лечения леналидомид обнаруживается в семенной жидкости в очень низкой концентрации, и не обнаруживается спустя 3 дня после прекращения приема препарата здоровыми добровольцами (см. «Фармакокинетика»). В качестве меры предосторожности все мужчины, принимающие леналидомид, должны:
-
понимать возможный риск тератогенного действия леналидомида при сексуальном контакте с беременной женщиной или женщиной детородного возраста;
-
понимать необходимость использования презервативов (даже после перенесенной вазэктомии) при сексуальном контакте с беременными женщинами или женщинами детородного возраста, не использующими надежные методы контрацепции, в период лечения и в течение 1 недели после приостановки лечения и/или завершения лечения;
-
должен понимать, что если его женщина-партнер забеременела во время его лечения Ревлимидом или сразу же после прекращения терапии Ревлимидом, то он должен незамедлительно проинформировать об этом своего лечащего врача, и что его женщине-партнеру рекомендуется обратиться за консультацией к врачу-тератологу.
Врач, назначающий лечение леналидомидом женщине с сохранённым детородным потенциалом, должен:
-
быть уверен в том, что пациентка удовлетворяет всем условиям Программы предохранения от беременности, а также адекватно понимает условия Программы;
-
получить согласие пациентки на соблюдение всех вышеперечисленных условий.
Правила контрацепции
Женщины с сохраненным детородным потенциалом должны использовать один из высокоэффективных методов контрацепции в течение 4 недель до начала лечения, в течение всего периода лечения леналидомидом и в течение 4 недель после окончания лечения, а также в случае перерывов в лечении. Исключение составляют лишь пациентки, которые полностью воздерживаются от сексуальных отношений на протяжении всего указанного срока, что ежемесячно подтверждается документально. При необходимости пациентка должна быть направлена к специалисту для подбора эффективного метода контрацепции.
К подходящим методам контрацепции относятся:
-
подкожные гормональные импланты;
-
внутриматочные системы, выделяющие левоноргестрел;
-
депо-препараты медроксипрогестерон ацетата;
-
перевязка маточных труб;
-
вазэктомия партнера (подтверждается двумя отрицательными анализами семенной жидкости);
-
прогестерон-содержащие таблетки, ингибирующие овуляцию (например, дезогестрел).
Прием комбинированных пероральных контрацептивов не показан больным множественной миеломой в связи с повышенным риском тромбоэмболических осложнений на фоне лечения леналидомидом и дексаметазоном (см. также раздел “Лекарственные взаимодействия»). Если пациентка в настоящее время принимает оральные контрацептивы, для эффективной контрацепции ей следует использовать один из методов, перечисленных выше. Повышенный риск развития венозной тромбоэмболии сохраняется в течение 4–6 недель после прекращения приема комбинированных пероральных противозачаточных средств. Эффективность стероидных противозачаточных препаратов может снизиться при одновременном назначении дексаметазона (см. «Лекарственные взаимодействия»).
Подкожные гормональные импланты или внутриматочные системы, выделяющие левоноргестрел, связаны с повышенным риском инфекционных осложнений в момент установки и спонтанными вагинальными кровотечениями. В связи с этим, необходимо профилактически назначать антибиотики, в особенности пациенткам с нейтропенией.
Использование внутриматочных систем, выделяющих медь, как правило, не рекомендуется в связи с высоким риском развития инфекционных осложнений в момент имплантации и повышенной кровопотери во время менструации, которая может усилить выраженность нейтропении или тромбоцитопении у больной.
Тесты на беременность
Тесты на беременность чувствительностью не менее 25 мМЕ/мл, должны выполняться в соответствии с методикой, приведённой ниже, под контролем лечащего врача всеми женщинами с сохраненным детородным потенциалом, включая и тех, кто постоянно полностью воздерживается от сексуальных отношений. Тесты выполняются в день назначения лечения. Прием первой дозы леналидомида женщиной с сохраненным детородным потенциалом должен быть осуществлен не позже 7 дней с момента назначения лечения.
Перед началом лечения
Тесты на беременность выполняются в день назначения лечения под контролем лечащего врача или за 3 дня до визита к лечащему врачу, даже если пациентка использовала эффективные методы контрацепции в течение 4 последних недель до начала лечения. Результаты теста должны подтвердить факт отсутствия беременности у пациентки на момент начала лечения леналидомидом.
Период наблюдения и завершение лечения
Тесты на беременность под контролем лечащего врача выполняются каждые 4 недели, в том числе и через 4 недели после окончания приема леналидомида, кроме пациенток с перевязкой маточных труб. Такие тесты на беременность выполняются в день очередного назначения лечения или за 3 дня до визита к лечащему врачу.
Мужчины
Леналидомид в очень низких концентрациях обнаруживается в семенной жидкости во время приема препарата, и не обнаруживается спустя 3 дня после прекращения приема препарата здоровыми добровольцами (см. раздел Фармакокинетика). В качестве меры предосторожности, и принимая во внимание тех пациентов, у которых время выведения препарата увеличено, например, вследствие почечной недостаточности, все пациенты-мужчины должны пользоваться презервативом в течение всего курса лечения леналидомидом, во время перерывов в лечении и в течение 1 недели после завершения лечения в том случае, если сексуальный партнер – беременная женщина или женщина детородного возраста, не использующая высокоэффективные методы контрацепции (даже если мужчина перенес вазэктомию).
Дополнительные меры предосторожности
Пациенты не должны передавать Ревлимид другим лицам. Неиспользованный препарат необходимо возвратить в медицинское учреждение по окончании лечения.
Пациентам не разрешается сдавать донорскую кровь или сперму на протяжении всего лечения леналидомидом и в течение 1 недели после окончания курса лечения.
Обучающие материалы, ограничения в назначении и выдаче препарата
Для повышения безопасности терапии леналидомидом и снижения риска тератогенного эффекта держатель регистрационного удостоверения обеспечивает врачей необходимыми для их пациентов обучающими материалами, которые включают в себя всю необходимую информацию о возможном тератогенном эффекте леналидомида, рекомендации по контрацепции во время, до и после терапии и руководство по использованию тестов на беременность. Врач должен информировать пациентов мужского и женского пола о тератогенном риске леналидомида и строгих мерах по предохранению от беременности, как указано в Программе предохранения от беременности, и обеспечить пациентов обучающей брошюрой, картой пациента и/или эквивалентным инструментом в соответствии с национальной системой карт пациентов. Контролируемая система распределения включает использование карт пациентов и/или эквивалентного инструмента для контролирования назначения и/или выдачи препарата и сбора подробных данных, относящихся к показанию, с целью тщательного мониторирования случаев применения по неодобренным показаниям на национальной территории. В идеале, тест на беременность, назначение лечения и выдача препарата должны происходить в один и тот же день. Выдача леналидомида женщинам репродуктивного возраста должна происходить в течение 7 дней после назначения терапии и получения отрицательного результата теста на беременность, выполненного под наблюдением врача.
Выдача препарата женщинам с сохраненным детородным потенциалом должна производиться не более чем на 4 недели лечения, всем остальным категориям пациентов – не более чем на 12 недель.
Другие особые указания и меры предосторожности
Сердечно-сосудистые нарушения
Инфаркт миокарда
Имеются сообщения о случаях инфаркта миокарда у пациентов, принимающих леналидомид, в частности, у лиц, имеющих факторы риска сердечно-сосудистых заболеваний. В случае наличия факторов риска, включая, в первую очередь, наличие тромбозов в анамнезе, необходимо контролировать состояние больных, а также предпринимать действия, направленные на возможное уменьшение влияния всех управляемых факторов риска (курение, артериальная гипертензия, гиперлипидемия).
Венозная и артериальная тромбоэмболия
У пациентов с множественной миеломой, комбинированное лечение леналидомидом с дексаметазоном сопровождается повышенным риском развития венозных тромбоэмболий (преимущественно тромбозов глубоких вен и тромбоэмболии легочной артерии) и артериальных тромбоэмболий (преимущественно инфаркта миокарда и нарушений мозгового кровообращения) — см. “Лекарственные взаимодействия» и «Побочные действия». Следовательно, необходимо контролировать состояние пациентов, имеющих факторы риска тромбоэмболий, в том числе тромбозы в анамнезе. Следует принимать меры по возможному устранению таких управляемых факторов риска как курение, артериальная гипертензия, гиперлипидемия. Наибольшее прогностическое значение имеют тромбоэмболические осложнения в анамнезе, сопутствующая терапия эритропоэтином, заместительная гормональная терапия. Таким образом, препараты, обладающие эритропоэтической активностью, а также препараты, которые могут повышать риск развития тромбозов (например, гормонозаместительная терапия) должны назначаться с осторожностью больным множественной миеломой, принимающим леналидомид вместе с дексаметазоном. Концентрация гемоглобина выше 120 г/л предполагает прекращение терапии эритропоэтином.
Врачи и пациенты должны внимательно оценивать клинические симптомы, свидетельствующие о возможности развития тромбоэмболии. Пациентов следует предупреждать о необходимости немедленного обращения к врачу в случае появления таких симптомов, как одышка, боль в грудной клетке, отек верхней или нижней конечности. Рекомендуется использовать антитромботические препараты для профилактики венозных тромбоэмболий, особенно у пациентов, имеющих дополнительные факторы риска. Решение о назначении антитромботической терапии в профилактических целях следует принимать после тщательной оценки индивидуальных факторов риска.
В случае появления симптомов тромбоэмболии лечение леналидомидом должно быть прервано, и начато стандартное лечение антикоагулянтами. После того, как состояние больного стабилизируется на фоне лечения антикоагулянтами и будут устранены любые тромбоэмболические осложнения, лечение леналидомидом может быть возобновлено в первоначальной дозе при благоприятной оценке риска/пользы. Пациенту следует продолжить прием антикоагулянтов в течение всего дальнейшего периода лечения леналидомидом.
Нейтропения и тромбоцитопения
Способ применения и дозы
Риск развития нейтропении 4-й степени тяжести у больных множественной миеломой при одновременном назначении леналидомида и дексаметазона очень высок (5,1% — в группе больных, получавших леналидомид/дексаметазон, и 0,6% — в группе больных, получавших плацебо/дексаметазон; см. “Побочные действия»). Эпизоды фебрильной нейтропении 4-й степени тяжести регистрируются нечасто (0,6% — в группе больных, получавших леналидомид/дексаметазон, и 0,0% — в группе больных, получавших плацебо/дексаметазон; см. «Побочные действия»).
Высокая частота развития тромбоцитопении 3-й и 4-й степени тяжести отмечается у больных множественной миеломой при одновременном назначении леналидомида и дексаметазона (9,9 и 1,4% соответственно у больных на фоне лечения леналидомидом/дексаметазоном, и 2,3 и 0,0% на фоне лечения плацебо/дексаметазоном; см. «Побочные действия»). Рекомендуется тщательный контроль со стороны и врача и пациента за признаками и симптомами повышенной кровоточивости, включая петехии и носовое кровотечение, особенно в случаях, когда одновременно применяемые лекарственные препараты способны повышать склонность к кровотечениям (см. «Побочные действия»).
Почечная недостаточность
Учитывая преимущественное выделение леналидомида почками, у больных почечной недостаточностью необходимо тщательно контролировать состояние функции почек и дозу леналидомида (см. «Способ применения и дозы»).
Заболевания щитовидной железы
Имеются сообщения о случаях гипотиреоза и гипертиреоза. Перед началом лечения следует оценить сопутствующие заболевания, способные оказывать влияние на функцию щитовидной железы.
Рекомендуется проводить оценку функции щитовидной железы перед началом лечения и ее регулярный контроль на фоне применения Ревлимида.
Периферическая нейропатия
В настоящее время нельзя исключить возможность нейротоксического действия леналидомида при его длительном приеме, учитывая структурное подобие молекул леналидомида и талидомида, который известен своей способностью вызывать выраженную периферическую нейропатию.
Синдром лизиса опухоли
В связи с выраженной антинеопластической активностью леналидомида возможно развитие синдрома лизиса опухоли, особенно у больных, имеющих большую опухолевую массу. За этими больными должно быть организовано соответствующее наблюдение с применением общепринятых профилактических мер.
Аллергические реакции
Имеются сообщения о случаях аллергических реакций/реакций повышенной чувствительности (см. «Побочные действия»). В связи с тем, что имеются научные публикации о возможных перекрестных реакциях между леналидомидом и талидомидом, следует с особой тщательностью контролировать состояние пациентов, у которых в анамнезе есть указания на аллергические реакции в период лечения талидомидом.
Тяжелые кожные реакции
Имеются сообщения о случаях развития синдрома Стивенса-Джонсона (ССД) и токсического эпидермального некролиза (ТЭН). При появлении эксфолиативных или буллезных высыпаний на коже или подозрении на развитие ССД или TЭН прием леналидомида следует немедленно прекратить и не возобновлять после исчезновения этих реакций. Необходимость перерыва или отмены леналидомида следует рассмотреть в случае появления других видов кожных реакций в зависимости от их выраженности. Леналидомид нельзя назначать пациентам, в анамнезе которых имеются указания на тяжелые кожные реакции на фоне применения талидомида.
Непереносимость лактозы
В состав капсул Ревлимида входит лактоза. Пациентам с редкими заболеваниями – непереносимостью галактозы, дефицитом лактазы Лаппа или синдромом глюкозо-галактозной мальабсоробции не рекомендуется применение препарата.
Неиспользованные капсулы
Пациенты никогда не должны передавать данный лекарственный препарат другим лицам. Неиспользованный препарат необходимо возвратить лечащему врачу по окончании лечения.
Первичные злокачественные опухоли другой локализации
В клинических исследованиях отмечена более высокая частота возникновения злокачественных первичных опухолей другой локализации (ПОДЛ) у пациентов, ранее получавших лечение леналидомидом и дексаметазоном (3,98 на 100 пациенто-лет) по сравнению с контрольной группой (1,38 на 100 пациенто-лет). Неинвазивные ПОДЛ включали в себя базалиому или плоскоклеточный рак кожи. Большинство инвазивных ПОДЛ относилось к солидным опухолям.
В клинических исследованиях у больных с вновь диагностированной множественной миеломой у пациентов, получавших Ревлимид, наблюдалось 4-кратное увеличение случаев ПОДЛ (7,0%) по сравнению с контрольной группой (1,8%). Из инвазивных ПОДЛ у пациентов, получающих комбинированное лечение Ревлимидом и мелфаланом, или сразу после применения высоких доз мелфалана и аутологичной трансплантации стволовых клеток, отмечены случаи острого миелоидного лейкоза, МДС (миелодиспластического синдрома) и солидных опухолей. Случаи развития В-клеточных опухолей (включая лимфому Ходжкина) были отмечены в клинических исследованиях, когда Ревлимид применяли после аутологичной ТСК.
Следует принимать во внимание риск развития ПОДЛ перед назначением Ревлимида. Врачи должны тщательно обследовать больных с использованием стандартных диагностических методов для выявления онкологических заболеваний, как перед принятием решения о назначении Ревлимида, так и в течение всего периода лечения Ревлимидом. Лечение следует проводить согласно общепринятым рекомендациям.
Печеночная недостаточность
Имеются сообщения о печеночной недостаточности, в том числе с летальным исходом, у пациентов, получавших леналидомид в комбинации с дексаметазоном: также были зарегистрированы острая печеночная недостаточность, токсический гепатит, цитолитический гепатит, холестатический гепатит и смешанный цитолитический/холестатический гепатит. Механизмы серьезной гепатотоксичности, вызванной лекарственными препаратами, остаются неизвестными, хотя, в ряде случаев, факторами риска могут являться сопутствующие вирусные заболевания печени, повышенный уровень печеночных ферментов и, возможно, лечение антибиотиками.
Часто сообщается об отклонениях по печеночным пробам, которые носят бессимптомный характер и обратимы после прерывания лечения. После восстановления параметров печеночной пробы до исходных значений, лечение может быть продолжено на сниженной дозе препарата.
Леналидомид выводится почками. Следует принять во внимание важность корректировки дозы у пациентов с почечной недостаточностью, чтобы избежать достижения в плазме крови уровня препарата, способного повысить риск возникновения гематологических побочных эффектов или гепатотоксичности. Рекомендуется контролировать функцию печени у пациентов с перенесенными или существующими вирусными заболеваниями печени, а также при сочетании леналидомида с препаратами, в отношении которых известно, что они могут вызвать нарушения функции печени.
Фертильность, беременность и грудное вскармливание; генотоксичность и канцерогенез
Женщины с сохраненным детородным потенциалом / Контрацепция для мужчин и женщин
Женщины с сохраненным детородным потенциалом должны использовать эффективные методы контрацепции. Если во время лечения леналидомидом у пациентки наступает беременность, лечение следует немедленно прекратить, а пациентка должна быть направлена к гинекологу или специалисту по тератологии для обследования и получения дальнейших рекомендаций. Если беременность наступает у женщины-полового партнера пациента, получающего лечение леналидомидом, ей также рекомендуется обратиться к гинекологу или специалисту по тератологии для обследования и получения рекомендаций.
Во время приема препарата леналидомид в очень низких концентрациях обнаруживается в семенной жидкости, и не обнаруживается спустя 3 дня после прекращения приема препарата здоровыми добровольцами (см. Фармакокинетика). В качестве меры предосторожности, и принимая во внимание увеличение времени выведения препарата при почечной недостаточности, мужчины-пациенты должны пользоваться презервативом в течение всего курса лечения леналидомидом, в перерывах в лечении и в течение 1 недели после прекращения лечения в том случае, если их половой партнер – беременная женщина или женщина с сохраненным детородным потенциалом, не использующая высокоэффективные методы контрацепции.
Беременность
Леналидомид является структурным аналогом талидомида, который обладает выраженным тератогенным действием. Известно, что прием талидомида беременными женщинами вызывает тяжелые и жизнеугрожающие нарушения внутренних органов плода.
Нарушения, вызванные приёмом леналидомида в исследовании на обезьянах были сходны с описанными ранее результатами приема талидомида. Поскольку риск развития врожденных дефектов очень велик, прием леналидомида противопоказан во время беременности (см. «Противопоказания»).
Грудное вскармливание
Неизвестно, проникает ли леналидомид в грудное молоко. В связи с этим, в период лечения леналидомидом грудное вскармливание должно быть прекращено.
Фертильность
Исследование фертильности на крысах показало, что леналидомид в дозах до 500 мг/кг (что приблизительно в 200-500 раз превышает терапевтические дозы для человека, 25 мг и 10 мг, в пересчёте на площадь поверхности тела), не вызывал нарушения фертильности и не оказывал токсических эффектов на организм родителей.
Генотоксичность и канцерогенез
В исследованиях мутагенности in vitro (бактериальная мутация, лимфоциты человека, лимфома мыши, трансформация эмбриональных клеток сирийского хомячка) и in vivo (микроядра крыс) не обнаружено влияния препарата на генетическом или хромосомном уровне. Исследований канцерогенной активности леналидомида не проводилось.
Особенности влияния лекарственного средства на способность управлять транспортным средством и потенциально опасными механизмами
Некоторые побочные действия леналидомида, такие как головокружение, слабость, сонливость и нечёткость зрения, могут отрицательно влиять на способность управления автомобилем и выполнения потенциально опасных видов деятельности. В связи с этим, при управлении транспортными средствами и работе с механизмами следует проявлять особую осторожность.
Передозировка
Случаев передозировки леналидомида у пациентов с множественной миеломой не зарегистрировано, хотя в рамках изучения дозирования некоторые пациенты принимали до 150 мг препарата, а в исследовании однократного дозирования некоторые пациенты принимали до 400 мг препарата. Дозолимитирующая токсичность в этих исследованиях является, преимущественно, гематологической. В случае передозировки рекомендуется поддерживающее лечение.
Форма выпуска и упаковка
Капсулы 5 мг, 10 мг, 15 мг и 25 мг.
По 7 капсул помещают в контурную ячейковую упаковку из ПВХ/ ПХТФЭ и алюминиевой фольги.
По 3 контурных ячейковых упаковки вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона.
Условия хранения
В сухом месте при температуре не выше 25 С.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не использовать после истечения срока годности, указанного на картонной коробке.
Условия отпуска из аптек
По рецепту
Производитель
Селджен Интернешнл Сарл,
Рут де Перро, 1
2017 Бодри,
Швейцария
Наименование и страна владельца регистрационного удостоверения
Селджен Интернешнл Сарл,
Рут де Перро, 1
2017 Бодри,
Швейцария
Наименование и страна упаковщика
ОАО «Фармстандарт-Лексредства»
305022, Россия, Курск, ул. 2-я Агрегатная, 1a/18
Тел. / Факс: +7 (4712) 34-03-13
www.pharmstd.ru
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции
ТОО «Карагандинский фармацевтический комплекс»
Республика Казахстан, 100009,
г. Караганда, ул. Ботаническая, д. 12
тел./ факс +7 (7212) 437002
тел. +7 (7212) 908042
e-mail: kphk@kphk.kz
АДРЕС ПРЕДСТАВИТЕЛЬСТВА В РОCСИИ
Селджен Интернэшнл Холдингз Корпорэйшн (США)
125047, г. Москва, ул.1-ая Тверская — Ямская, 21
Бизнес центр «Four Winds Plaza»
Телефон: +7 (495) 777 65 55
Факс: +7 (495) 213 09 39
| 256663631477976692_ru.doc | 224 кб |
| 083087811477977825_kz.doc | 354 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Выбор описания
| Лек. форма | Дозировка |
|---|---|
|
таблетки |
8 мг |
|
капли для приема внутрь |
8 мг/мл |
|
раствор для приема внутрь |
4 мг/5 мл |
|
сироп |
4 мг/5 мл 8 мг/5 мл |
|
таблетки для детей |
4 мг |
раствор для приема внутрь
Бромгексин (раствор для приема внутрь, 4 мг/5 мл), инструкция по медицинскому применению РУ № ЛП-003103
Дата последнего изменения: 20.08.2020
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Нозологическая классификация (МКБ-10)
- Фармакологическая группа
- Лекарственная форма
- Состав
- Описание лекарственной формы
- Фармакокинетика
- Фармакодинамика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Лекарственная форма
Раствор для
приема внутрь.
Состав
5 мл
содержат:
Действующее
вещество:
Бромгексина
гидрохлорид — 4,000 мг.
Вспомогательные
вещества:
Этанол 95% —
150,000 мг, левоментол — 0,340 мг, сорбитол некристаллизующийся 70% —
2142,855 мг, метилпарагидроксибензоат — 8,200 мг, хлористоводородная
кислота — 1,420 мг, вода очищенная — до 5 мл.
Описание лекарственной формы
Бесцветная,
прозрачная или слабо опалесцирующая жидкость с характерным запахом.
Фармакокинетика
При приеме
внутрь бромгексин практически полностью (99%) всасывается в желудочно-кишечном
тракте в течение 30 минут. Биодоступность зависит от индивидуальных
особенностей организма, активности почечных ферментов при первичном прохождении
активного вещества через печень и составляет приблизительно 20%. Бромгексин в
плазме связывается с белками, проникает через гематоэнцефалический и
плацентарный барьеры, а также в грудное молоко. В печени бромгексин
подвергается деметилированию и окислению, часть образующихся метаболитов
сохраняет активность. Предельный период полураспада составляет 15 часов
вследствие медленной обратной диффузии из тканей. Максимальная концентрация в
крови достигается примерно через 1 час после приема.
Экскретируется
почками. При хронической почечной недостаточности нарушается выделение
метаболитов бромгексина. При многократном применении бромгексин может
кумулировать.
Фармакодинамика
Бромгексин
оказывает муколитическое (секретолитическое), отхаркивающее и слабое
противокашлевое действие. Муколитический эффект связан с деполимеризацией
мукопротеиновых и мукополисахаридных волокон и увеличением серозного компонента
бронхиального секрета.
Показания
Острые и
хронические бронхолегочные заболевания, сопровождающиеся образованием мокроты
повышенной вязкости (бронхиальная астма, пневмония, трахеобронхит,
обструктивный бронхит, бронхоэктазы, эмфизема легких, муковисцидоз, туберкулез,
пневмокониоз).
Санация
бронхиального дерева в предоперационном периоде и при проведении лечебных и
диагностических внутрибронхиальных манипуляций, профилактика скопления в
бронхах густой вязкой мокроты после операции.
Противопоказания
–
Повышенная
чувствительность к компонентам препарата;
–
Беременность
и период грудного вскармливания;
–
Язвенная
болезнь (в стадии обострения);
–
Детский
возраст до 3‑х лет;
–
Наследственная
непереносимость фруктозы (т.к. препарат содержит сорбитол).
С осторожностью
Применять у
пациентов с желудочным кровотечением в анамнезе, при заболеваниях бронхов,
сопровождающихся чрезмерным скоплением секрета, при наличии в анамнезе эпизодов
кровохарканья, почечной и/или печеночной недостаточности.
Наличие спирта в
препарате (этанол 95%) может оказывать неблагоприятное влияние на детей,
беременных женщин, на людей с заболеваниями головного мозга, эпилепсией,
при черепно-мозговой травме, алкоголизме.
Детский возраст
от 3 до 6 лет.
Раствор
бромгексина содержит сорбитол. Сорбитол может оказывать также легкое
слабительное действие.
Применение при беременности и кормлении грудью
Бромгексин
проникает через плацентарный барьер, а также в грудное молоко. Препарат
противопоказан к применению в период беременности и в период грудного
вскармливания. При необходимости применения препарата в период лактации на
время лечения следует прекратить грудное вскармливание.
Способ применения и дозы
Внутрь.
Взрослым и детям
старше 10 лет:
по 10–20 мл 3 раза в сутки (суточная доза — 24–48 мг
бромгексина).
Детям от 6 до
10 лет, а также пациентам с массой тела менее 50 кг — по
5–10 мл 3 раза в сутки (суточная доза — 12–24 мг бромгексина).
Детям от 3 до
6 лет
— по 2,5–5 мл 3 раза в сутки (суточная доза — 12 мг
бромгексина).
При почечной
и/или печеночной недостаточности следует увеличить интервалы между приемами,
либо уменьшить дозу. По данному вопросу необходимо проконсультироваться с
лечащим врачом.
Для удобства
дозирования препарата используют прилагаемый мерный стаканчик (мерную ложку).
В процессе
лечения рекомендуется употреблять достаточное количество жидкости, что поддерживает
секретолитическое действие бромгексина.
Без консультации
врача не рекомендуется принимать бромгексин более 4–5 дней. Следует применять
препарат только согласно тем показаниям, тому способу применения и в тех
дозах, которые указаны в инструкции.
Побочные действия
Нежелательные
реакции перечислены ниже в зависимости от анатомо-физиологической классификации
и частоты встречаемости.
Частота
определена следующим образом: очень часто (≥1/10); часто
(≥1/100 и <1/10); нечасто (≥1/1000 и <1/100); редко
(≥1/10000 и <1/1000); очень редко, включая отдельные сообщения
(<1/10000), частота неизвестна (частота не может быть оценена по
имеющимся данным).
Нарушения со
стороны иммунной системы:
Редко — реакции
гиперчувствительности; частота неизвестна — анафилактические реакции,
включая анафилактический шок, ангионевротический отек, кожный зуд, ринит.
Нарушения со
стороны нервной системы:
Нечасто —
головокружение, головная боль.
Нарушения со
стороны дыхательной системы, органов грудной клетки и средостения:
Редко — бронхоспазм.
Нарушения со
стороны желудочно-кишечного тракта:
Часто — тошнота, боль
в животе, рвота, диарея; частота неизвестна — обострение язвенной
болезни желудка и 12‑перстной кишки, повышение активности «печеночных»
трансаминаз в сыворотке крови.
Нарушения со
стороны кожи и подкожных тканей:
Редко — кожная сыпь,
крапивница; частота неизвестна — тяжелые кожные реакции, включая
мультиформную эритему, синдром Стивенса-Джонсона, токсический эпидермальный
некролиз (синдром Лайелла), острый генерализованный экзантематозный пустулез.
Общие
расстройства:
Нечасто — лихорадка.
У пациентов с
непереносимостью сорбитола/фруктозы под действием сорбитола, содержащегося
в препарате, также могут наблюдаться: тошнота, рвота и понос, снижение
уровня сахара в крови (сопровождающееся дрожью, холодным потом, сердцебиением,
чувством страха), повышение активности «печеночных» трансаминаз.
Если у Вас
отмечаются побочные эффекты, указанные в инструкции, или они усугубляются, или
Вы заметши любые другие побочные эффекты, не указанные в инструкции,
сообщите об этом врачу.
Взаимодействие
Бромгексин не
назначают одновременно с противокашлевыми средствами (в том числе
содержащими кодеин), так как они могут затруднять откашливание разжиженной
бромгексином мокроты.
Бромгексин способствует
проникновению антибиотиков (эритромицин, цефалексин, окситетрациклин,
ампициллин, амоксициллин), сульфаниламидных препаратов в бронхиальный
секрет. При одновременном применении препаратов, вызывающих симптомы
раздражения желудочно-кишечного тракта, возможно усиление раздражающего
действия на слизистые оболочки желудочно-кишечного тракта.
Препарат
несовместим с щелочными растворами.
Передозировка
Опасные для
жизни симптомы передозировки, при применении бромгексина неизвестны.
Симптомы
Опубликовано
исследование случаев передозировки, согласно которому в 4 из 25 случаев
передозировки наблюдалась рвота. У трех детей были отмечены такие явления, как
рвота, а также оглушение сознания, атаксия, диплопия, метаболический ацидоз
легкой степени тяжести и тахипноэ. У детей симптомы не возникали при приеме
бромгексина в дозе до 40 мг, даже при отсутствии лечения.
Доказательства
хронической токсичности бромгексина у человека отсутствуют.
Лечение
При выраженной
передозировке показаны мониторинг кровообращения и, в случае необходимости,
симптоматическое лечение. В связи с низкой токсичностью бромгексина, как
правило, нет необходимости в проведении инвазивных мероприятий, направленных на
снижение его всасывания (принудительная рвота, промывание желудка) или на
ускорение выведения. Кроме того, из‑за особенностей фармакокинетики
(высокий объем распределения, медленные процессы перераспределения и высокая
степень связывания с белками), эффективного удаления бромгексина
из организма путем диализа или форсированного диуреза не следует
ожидать. Поскольку у детей с 2‑х лет даже после приема больших
доз бромгексина ожидаются только легкие симптомы, при дозе бромгексина до
80 мг (например, 100 мл препарата Бромгексин) детоксикацию можно
не проводить. У детей более младшего возраста соответствующий предел
дозы составляет 60 мг бромгексина (6 мг/кг массы тела).
При
передозировке возможно также развитие побочных эффектов, вызванных
вспомогательными веществами.
Особые указания
При лечении
необходимо принимать достаточное количество жидкости, что повышает
отхаркивающий эффект.
В случаях
нарушения моторики бронхов или при значительном объеме выделяемой мокроты
(например, при редком злокачественном синдроме ресничек) применение бромгексина
требует осторожности в связи с риском задержки отделяемого в дыхательных путях.
При нарушении
функции почек и при тяжелых заболеваниях печени бромгексин следует применять
с особой осторожностью (например, рекомендуется уменьшить дозу или
увеличить интервал между приемами). При тяжелой почечной недостаточности
необходимо учитывать возможность кумуляции образующихся в печени метаболитов.
Рекомендуется мониторинг печени, особенно при длительном лечении. Имеются
данные о возникновении в очень редких случаях тяжелых кожных реакций (таких как
мультиформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный
некролиз, острый генерализованный экзантематозный пустулез) на фоне приема
бромгексина. При появлении аллергических реакций и/или признаков
прогрессирующей кожной сыпи (иногда в сочетании с возникновением пузырей и
поражением слизистых оболочек) следует немедленно прекратить применение
препарата и обратиться к врачу.
Указание для
пациентов с сахарным диабетом: в 5 мл раствора (1 мерная ложка)
содержится 1,5 г сорбитола, что соответствует 0,12 хлебным единицам.
В состав
препарата входит спирт в количестве 0,15 г на 5 мл, что составляет на
одну дозу препарата для взрослых (20 мл) — 0,6 г, соответственно для
детей (2,5 мл) — 0,075 г. В связи с этим следует соблюдать
осторожность пациентам проходящим лечение антабусом и метронидазолом.
Влияние на
способность управлять транспортными средствами, механизмами
Прием
рекомендуемых терапевтических доз (20 мл 3 раза в день) не оказывает
влияние на скорость психомоторных реакций пациента.
Значительное
превышение рекомендуемых доз препарата, содержащего спирт, может влиять
на скорость психомоторных реакций и представлять опасность при вождении
машины или работе с оборудованием.
Форма выпуска
Раствор для
приема внутрь 4 мг/5 мл.
По 60 мл
или 100 мл раствора во флакон стеклянный из коричневого стекла или флакон
из полиэтилентерефталата для лекарственных средств, укупоренные крышкой
винтовой полипропиленовой с контролем первого вскрытия или колпачком
пластиковым.
Один флакон
вместе с инструкцией по применению, а также мерным стаканчиком или мерной
ложкой, или без мерного стаканчика, мерной ложки помещают в картонную упаковку
(пачку).
Условия отпуска из аптек
Условия хранения
При температуре
не выше 25 °С во вторичной упаковке (пачке).
Хранить
недоступном для детей месте.
Срок годности
3 года.
Не применять по
истечении срока годности.
Заказ в аптеках
Выбор региона:
| Название препарата | Цена за упак., руб. | Аптеки |
|---|---|---|
|
Бромгексин, сироп, |
||
|
130.00 |
|
|
|
139.00 |
|
|
|
Бромгексин, таблетки, |
||
|
47.00 |
|
|
|
57.00 |
|
|
|
Бромгексин, таблетки, |
||
|
55.50 |
|
|
|
148.00 |
|
|
|
Бромгексин, таблетки, |
||
|
36.00 |
|
|
|
54.00 |
|
|
|
Бромгексин, раствор для приема внутрь, |
||
|
103.00 |
|
|
|
214.00 |
|
|
|
Бромгексин, таблетки, |
||
|
103.00 |
|
|
|
103.00 |
|
|
|
Бромгексин, сироп, |
||
|
156.00 |
|
|
|
Бромгексин, таблетки, |
||
|
88.00 |
|
|
|
Бромгексин, таблетки, |
||
|
47.00 |
|
|
|
Бромгексин, таблетки, |
||
|
33.50 |
|
|
|
Бромгексин, таблетки, |
||
|
118.00 |
|
|
|
Бромгексин, таблетки для детей, |
||
|
72.00 |
|
|
|
Бромгексин, сироп, |
||
|
68.00 |
|
|
|
Бромгексин, сироп, |
||
|
83.00 |
|
|
|
Бромгексин, сироп, |
||
|
66.00 |
|
|
|
Бромгексин, капли для приема внутрь, |
||
|
65.00 |
|
|
|
Бромгексин, таблетки, |
||
|
126.00 |
|
|
|
Бромгексин, таблетки для детей, |
||
|
113.00 |
|
|
|
Бромгексин, таблетки, |
||
|
204.00 |
|
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Отзывы