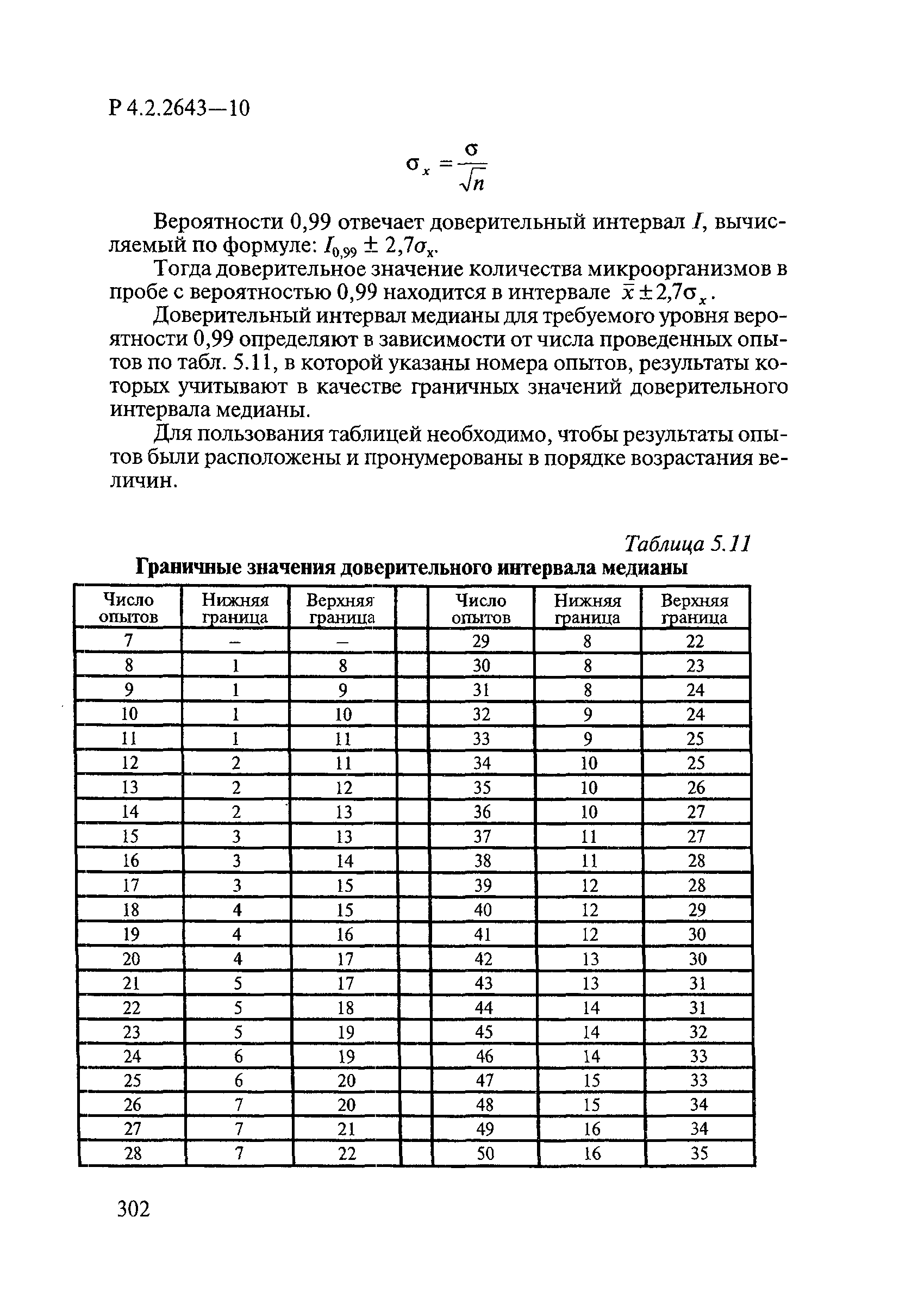
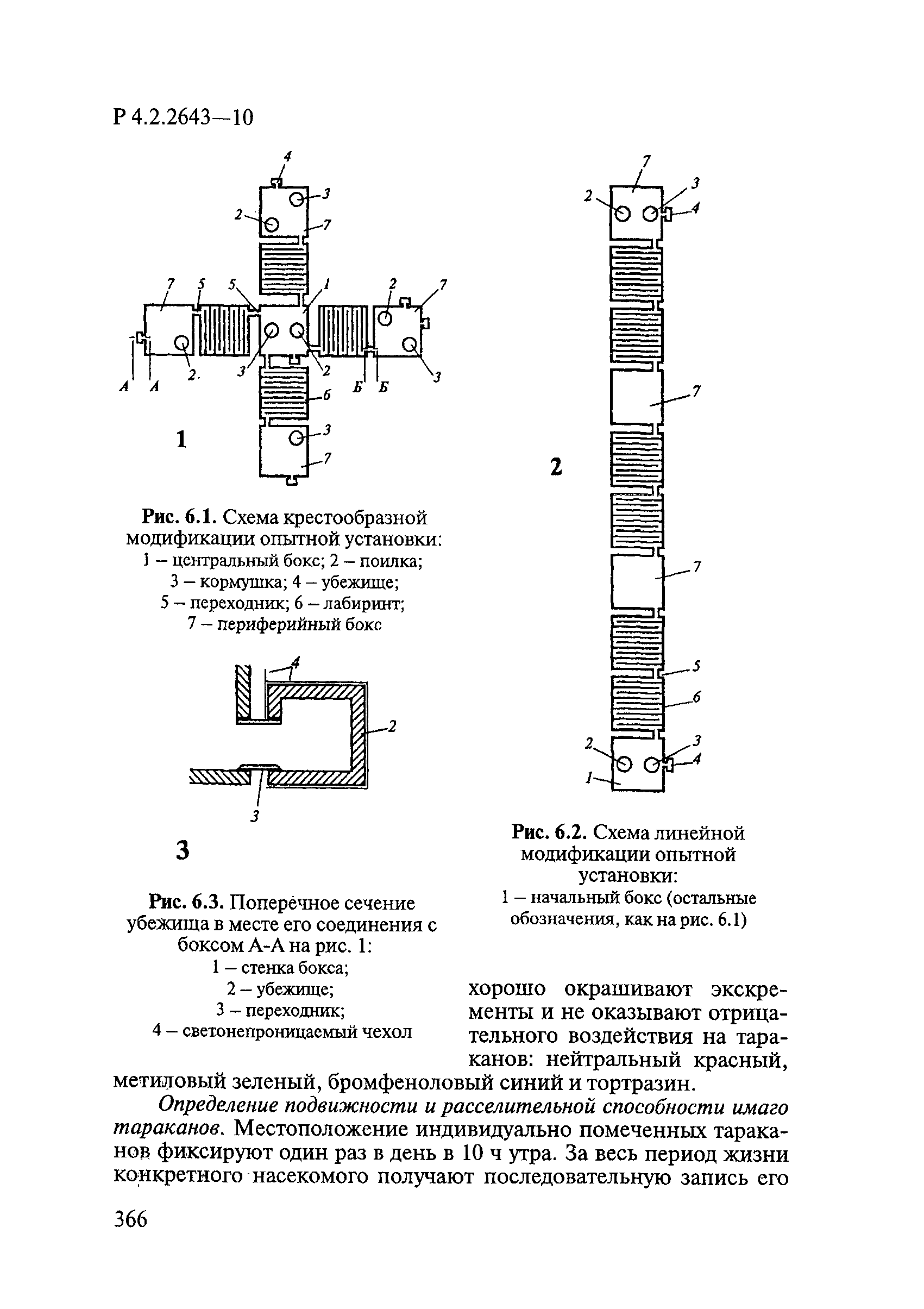
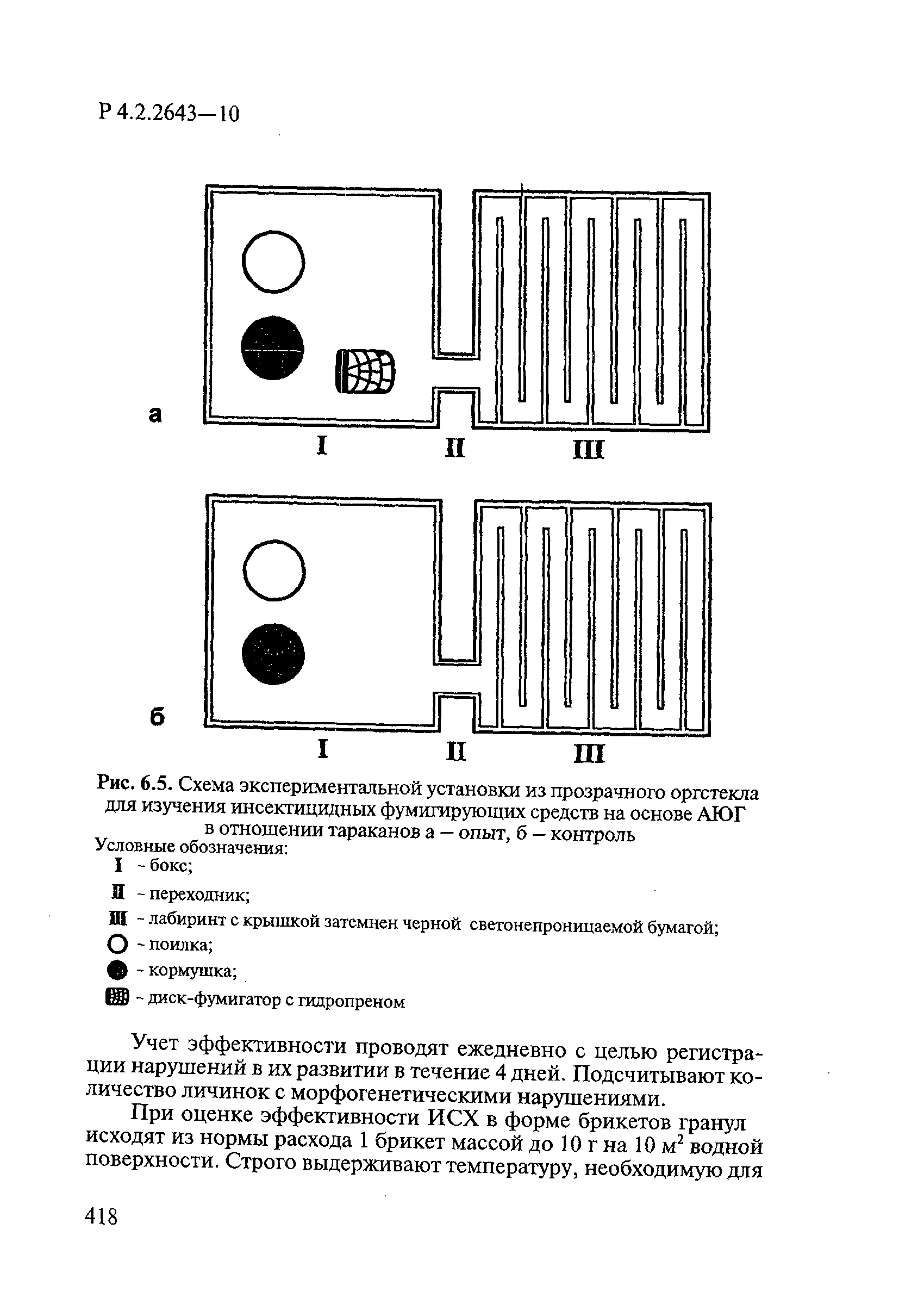
Утверждаю
Руководитель Федеральной
службы по надзору в сфере
защиты прав потребителей
и благополучия человека,
Главный государственный
санитарный врач
Российской Федерации
Г.Г.ОНИЩЕНКО
1 июня 2010 года
3.5. ДЕЗИНФЕКТОЛОГИЯ
МЕТОДЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ И ИСПЫТАНИЙ
ДЕЗИНФЕКЦИОННЫХ СРЕДСТВ ДЛЯ ОЦЕНКИ
ИХ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ
РУКОВОДСТВО
Р 4.2.2643-10
Дата введения
2 июня 2010 года
1. Разработаны Федеральным государственным учреждением науки «НИИ дезинфектологии» Роспотребнадзора и кафедрой дезинфектологии ММА им. И.М. Сеченова; Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека; ФГУН 48 НИИМ МО РФ — Центром военно-технических проблем биологической защиты; Научно-исследовательским центром бытовой химии; ООО «Суперсан-МК»; Институтом медицинской паразитологии тропической медицины им. Е.И. Марциновского ММА им. И.М. Сеченова; кафедрой тропической медицины и паразитарных болезней МПФ ППО ММА им. И.М. Сеченова; ГУ НИИ вирусологии им. Д.И. Ивановского РАМН; ГУ институтом полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН.
2. Рекомендованы к утверждению Комиссией по санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 24 декабря 2009 г. N 4).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 1 июня 2010 г.
4. Введены в действие со 2 июня 2010 г.
5. Введены взамен «Методических рекомендаций по определению вирулицидной активности препаратов» (от 06.09.1973 N 1119-73), «Инструкции по определению бактерицидных свойств новых дезинфицирующих средств» (от 6 мая 1968 г. N 739-68), Методических указаний «Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности», 1998 г.
1. Область применения
1.1. Настоящее руководство (далее — руководство) устанавливает единые методы лабораторных исследований и испытаний дезинфекционных средств для оценки их антимикробной, инсектицидной, акарицидной, репеллентной и родентицидной активности, эффективности и безопасности при применении в быту, в лечебно-профилактических организациях и на других объектах для обеспечения безопасности жизни и здоровья людей, животных и неповреждения объектов внешней среды.
1.2. Настоящее руководство предназначено для организаций, учреждений, предприятий, аккредитованных испытательных центров лабораторий, органов по сертификации дезинфекционных средств, аккредитованных в системе аккредитации ГОСТ Р, специалистов, осуществляющих исследования дезинфицирующих, стерилизующих, дезинсекционных, дератизационных средств, а также их субстанций (действующих веществ) в процессе их разработки, производства, применения, регистрационных и сертификационных испытаний, производственного контроля и надзора [4, 5].
1.3. Руководство разработано на основе Федерального закона от 31.03.1999 N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» [1], Федерального закона от 10.01.2002 N 23001 «Об охране окружающей среды» [2], Федерального закона «Основы законодательства Российской Федерации об охране здоровья граждан» от 22.06.1993 N 5487-1 [3], Постановления Правительства от 04.04.2001 N 262 «О государственной регистрации отдельных видов продукции, представляющих потенциальную опасность для человека, а также отдельных видов продукции, впервые ввозимых на территорию Российской Федерации» [7], а также «Положения о государственном санитарно-эпидемиологическом нормировании», утвержденного Постановлением Правительства Российской Федерации от 24 июля 2000 г. N 554 [6], и других нормативных и методических показателей, приведенных в разделе 2 «Нормативные ссылки».
2. Нормативные ссылки
1. Федеральный закон от 31.03.1999 N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» (Собрание законодательства Российской Федерации, 1999, N 14, ст. 1650; 2002, N 1 (ч. 1), ст. 2; 2003, N 2, ст. 167; N 27 (ч. 1), ст. 2007; 2004, N 35, ст. 3607; 2005, N 19, ст. 1752; 2006, N 1, ст. 10; 2007, N 1, ст. 29; N 27, ст. 3213; N 46, ст. 5554; N 49, ст. 6070).
2. Федеральный закон от 10.01.2002 N 23001 «Об охране окружающей среды».
3. «Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июня 1993 г. N 5487-1 (с изменениями от 2 марта 1998 г., 20 декабря 1999 г., 2 декабря 2000 г., 10 января, 27 февраля, 30 июня 2003 г., 29 июня, 22 августа, 1, 29 декабря 2004 г., 7 марта, 21, 31 декабря 2005 г., 2 февраля 2006 г.).
4. Федеральный закон от 16.09.1998 N 158-ФЗ «О лицензировании отдельных видов деятельности».
5. Федеральный закон от 10.06.1993 N 5151-1 «О сертификации продукции и услуг».
6. «Положение о государственном санитарно-эпидемиологическом нормировании», утвержденное Постановлением Правительства Российской Федерации от 24 июля 2000 г. N 554 (Собрание законодательства Российской Федерации, 2000, N 31, ст. 3295).
7. Постановление Правительства от 04.04.2001 N 262 «О государственной регистрации отдельных видов продукции, представляющих потенциальную опасность для человека, а также отдельных видов продукции, впервые ввозимых на территорию Российской Федерации».
8. Приказ Минздрава СССР от 30.12.1983 N 1509 «О дальнейших мерах по совершенствованию порядка оформления разрешения к медицинскому применению и передачи для промышленного производства новых лекарственных средств».
9. Приказ Минздрава России от 20.07.1998 N 217 «О гигиенической оценке производства, поставки и реализации продукции и товаров».
10. Приказ Минздрава России от 10.11.2002 N 344 «О государственной регистрации дезинфицирующих, дезинсекционных и дератизационных средств для применения в быту, в лечебно-профилактических учреждениях и на других объектах для обеспечения безопасности и здоровья людей».
11. Постановление Госстандарта России от 30.07.2002 N 64 «Номенклатура продукции, в отношении которой законодательными актами Российской Федерации предусмотрена обязательная сертификация».
12. СП 3.1/3.2.558-96 «Общие требования по профилактике инфекционных и паразитарных заболеваний».
13. СП 3.5.3.1129-02 «Санитарно-эпидемиологические требования к проведению дератизации».
14. СП 3.5.1378-03 «Санитарно-эпидемиологические требования к организации и осуществлению дезинфекционной деятельности».
15. СП 1.3.1285-03 «Безопасность работы с микроорганизмами I — II групп патогенности (опасности)».
16. СП 3.1.1275-03 «Профилактика инфекционных заболеваний при эндоскопических манипуляциях».
17. СП 1.3.2322-08 «Безопасность работы с микроорганизмами III — IV групп патогенности (опасности) и возбудителями паразитарных болезней» с дополнениями и изменениями (СП 1.3.2518-09).
18. СанПиН 1.2.681-97 «Гигиенические требования к производству и безопасности парфюмерно-косметической продукции».
19. СанПиН 2.1.7.728-99 «Правила сбора, хранения и удаления отходов лечебно-профилактических учреждений».
20. СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
21. Нормативные показатели безопасности и эффективности дезинфекционных средств, подлежащих контролю при проведении обязательной сертификации. 1998 г., N 01-12/75-97.
22. СанПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества».
23. Нормативные показатели эффективности и безопасности дезинфекционных средств, утвержденные 08.03.2004.
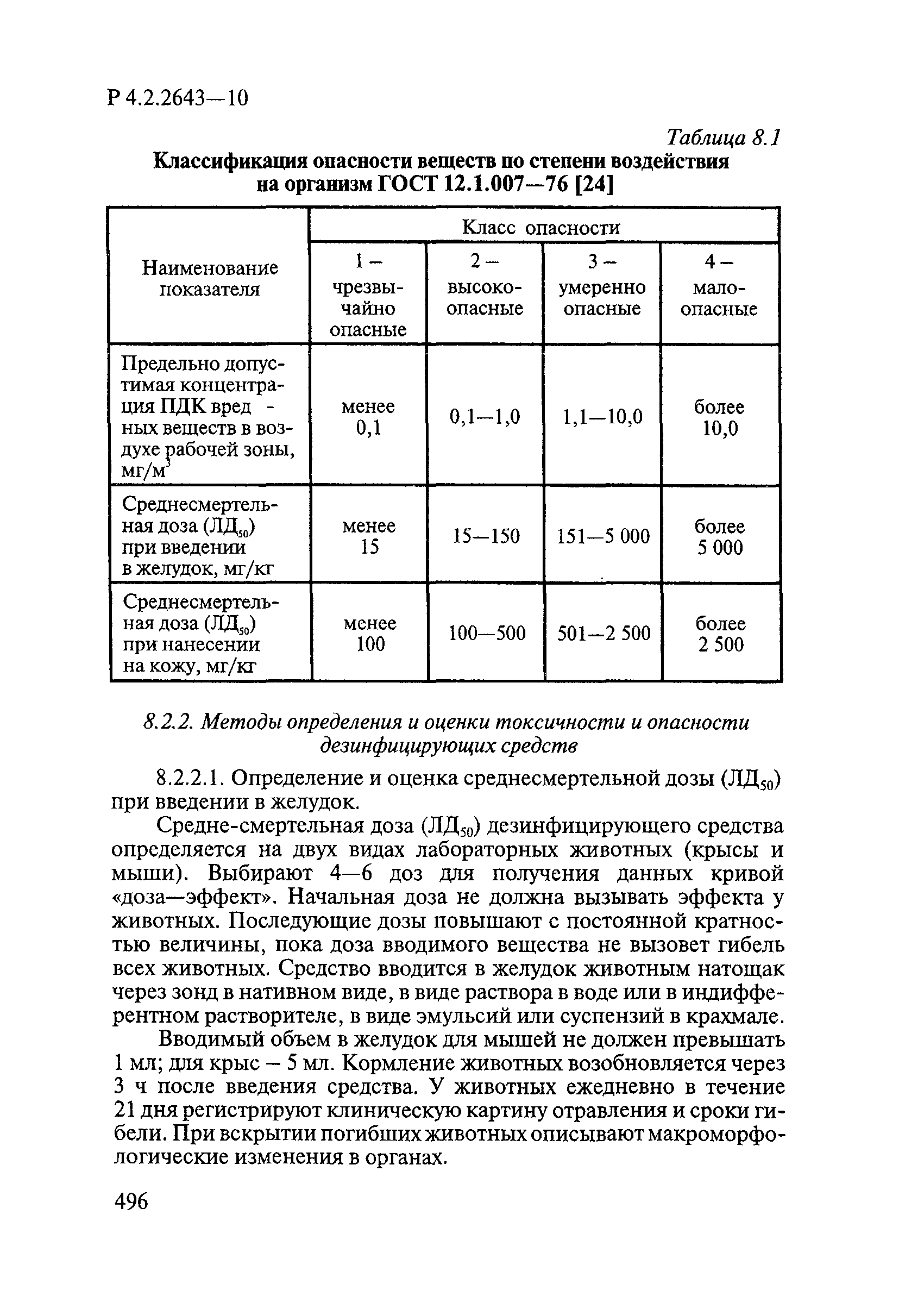
24. ГОСТ 12.1.007-76 «ССБТ. Вредные вещества. Классификация и общие требования безопасности».
25. ГОСТ 22567.8-77 «Средства моющие синтетические. Методы определения силиката натрия».
26. ГОСТ 8728-77 «Диметилфталат. Технические условия».
27. ГОСТ 13081-77 «Фосфид цинка. Технические условия».
28. ГОСТ 27283-87 «Средства индивидуальные химические для обеззараживания воды от бактериологических средств».
29. ГОСТ 177-88 «Водорода перекись. Технические условия».
30. ГОСТ 12.1.005-88 «ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны».
31. ГОСТ 29188.0-91 «Изделия парфюмерно-косметические. Правила приемки, отбор проб, методы органолептических исследований».
32. ГОСТ 29188.6-91 «Изделия парфюмерно-косметические. Газохроматографический метод определения этилового спирта».
33. ГОСТ Р 50550-93 «Товары бытовой химии. Метод определения показателя активности водородных ионов pH».
34. ГОСТ 22567.5-93 «Средства моющие синтетические и вещества поверхностно-активные. Методы определения концентрации водородных ионов pH».
35. ГОСТ Р 50551-93 «Товары бытовой химии. Метод определения активного хлора».
36. ГОСТ 18995.1-73 «Продукты химические жидкие. Методы определения плотности».
37. ГОСТ 18995.2-73 «Продукты химические жидкие. Методы определения показателя преломления».
38. ГОСТ 18995.4-73 «Продукты химические органические. Методы определения интервала температуры плавления».
39. ГОСТ Р 51022-97 «Методы определения анионного поверхностно-активного вещества».
40. ГОСТ Р 51018-97 «Методы определения неионогенного поверхностно-активного вещества».
41. Ратиндан. Фармакопейная статья ФС 42-330-79.
42. Определение температуры плавления. Государственная фармакопея СССР. XI изд., вып. 1. С. 16.
43. Определение плотности. Государственная фармакопея СССР. XI изд., вып. 1. С. 24.
44. Определение показателя преломления (рефрактометрия). Государственная фармакопея СССР. XI изд., вып. 1. С. 29.
45. Определение вязкости жидкостей. Государственная фармакопея СССР. XI изд., вып. 1. С. 87.
46. Определение pH. Государственная фармакопея СССР. XI изд., вып. 1. С. 113.
47. ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства, режимы». М., 1985 г.
48. Стандарт Европейского Комитета по стандартизации NEN-EN 14476.
49. Государственная фармакопея СССР. XI изд., вып. 1. С. 183 — 186.
50. ГОСТ Р 51021-97 «Методы определения смываемости с посуды».
51. Инструкция по определению бактерицидных свойств новых дезинфицирующих средств. Утв. МЗ СССР 6 мая 1968 г. N 739-68.
52. Методические указания по оценке дезинфицирующих средств, предназначенных для обеззараживания различных объектов и санитарной обработки людей. Утв. МЗ СССР 20 августа 1970 г. N 859-70.
53. Методические указания по определению эффективности препаратов для борьбы с молью. Утв. МЗ СССР 12.06.1977.
54. Методические указания по гигиенической оценке одежды и обуви из полимерных материалов. М., 1977, 47 с.
55. Методические указания по изучению токсичности препаратов санитарно-гигиенического и бытового назначения в аэрозольных баллонах. М., 1980 г.
56. МУ 2163-80 «Методические указания к постановке исследований для обоснования санитарных стандартов вредных веществ в воздухе рабочей зоны». М., 1980.
57. Методические указания по первичному отбору новых акарицидов и сравнительному изучению их активности против саркоподобных клещей от 23.07.1982. Утв. ВАСХНИЛ.
58. Методические указания по определению устойчивости культур микроорганизмов, контаминирующих изделий медицинского назначения в условиях производства и эксплуатации, к стерилизующим агентам. Утв. МЗ СССР 29 марта 1985 г. N 28-6/7.
59. Методические указания «Токсикологическая оценка педикулицидов» от 20.06.1985 N 26-6/6.
60. Временные методические указания по обоснованию предельно допустимых концентраций ПДК загрязняющих веществ в атмосферном воздухе населенных мест от 15.06.1988 N 4681-88.
61. Методические указания по использованию культуры диплоидных клеток человека, рекомендуемых для токсиколого-гигиенических исследований. Утв. МЗ СССР 18.09.1991. 20 с.
62. Методические указания по оценке активности хемостерилянтов и регуляторов развития насекомых. МУ 01-19/06-11 от 03.02.1995.
63. Гигиеническая оценка условий труда при применении пестицидов. Методические указания от 20.11.1995 N 01-19/140-17.
64. Методические указания по лабораторной оценке воздействия соединений на синантропных тараканов. Утв. ГКСЭН РФ от 09.02.1995 N 01-19/17-11.
65. МУ 1.1.578-96 «Требования к постановке экспериментальных исследований по обоснованию предельно допустимых концентраций промышленных химических аллергенов в воздухе рабочей зоны и атмосферы». М., 1997.
66. Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности. Утв. МЗ РФ, 1998.
67. МУ 3.1.1027-01 «Сбор, учет и подготовка к лабораторному исследованию кровососущих членистоногих — переносчиков возбудителей природно-очаговых инфекций».
68. Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения. МУ 287-113 от 30.12.1998.
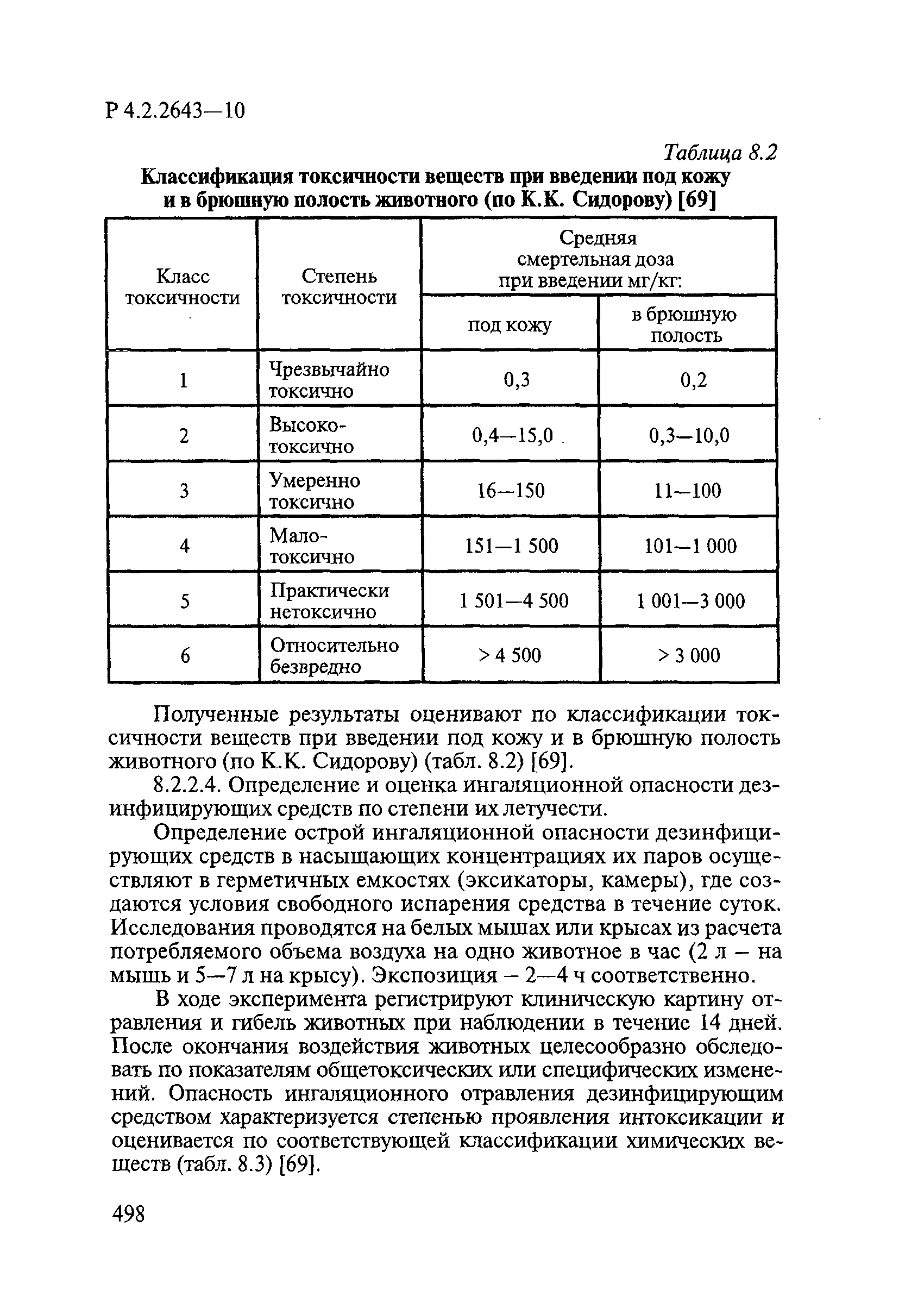
69. МУ 1.2.1105-02 «Оценка токсичности и опасности дезинфицирующих средств». Утв. МЗ России, 10.02.2002.
70. Методические указания по лабораторной оценке антимикробной активности текстильных материалов, содержащих антимикробные препараты. МУ от 18.11.1983 N 28-6/32.
71. МУ 3.1.1029-01 «Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекций». М., 2002.
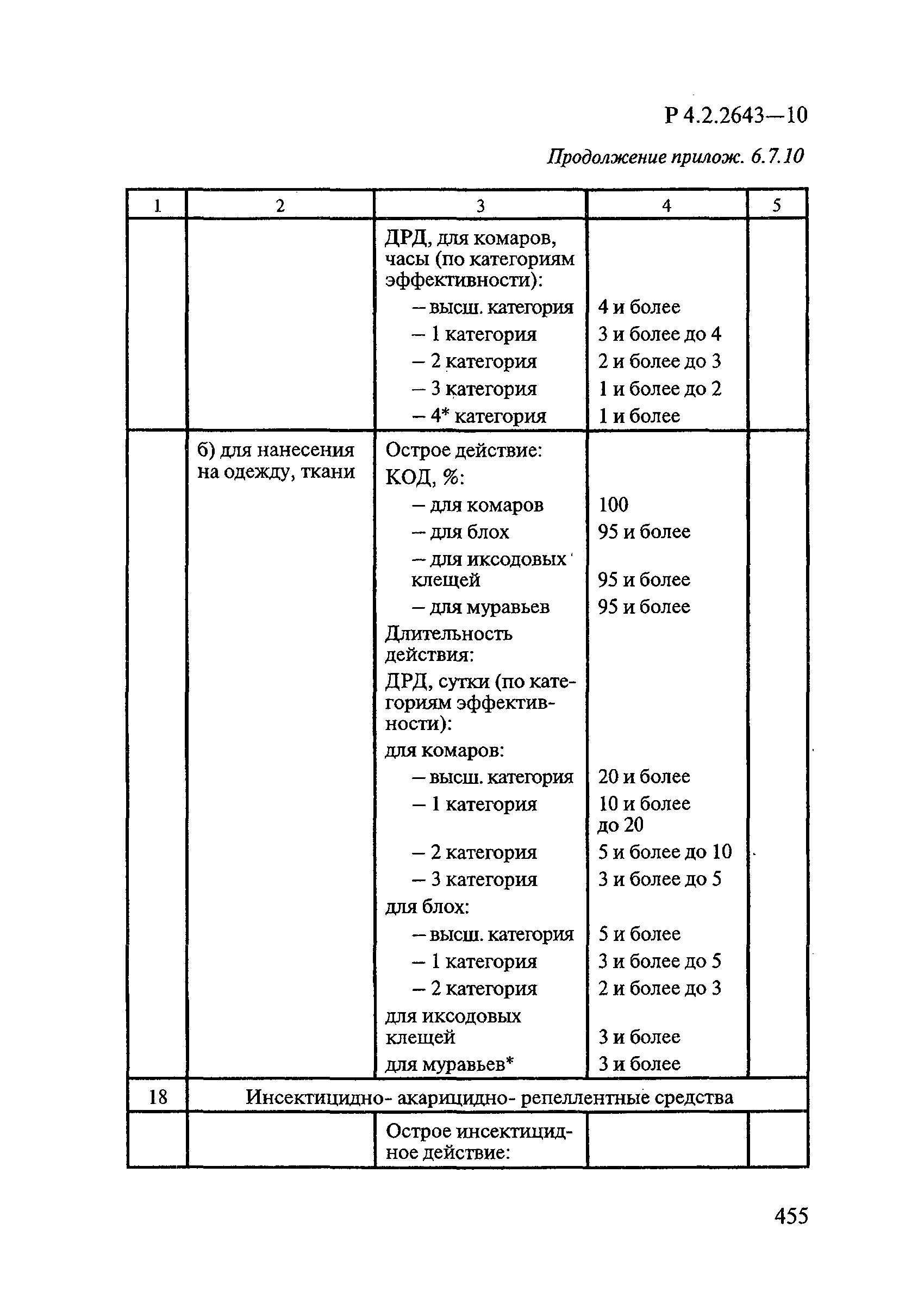
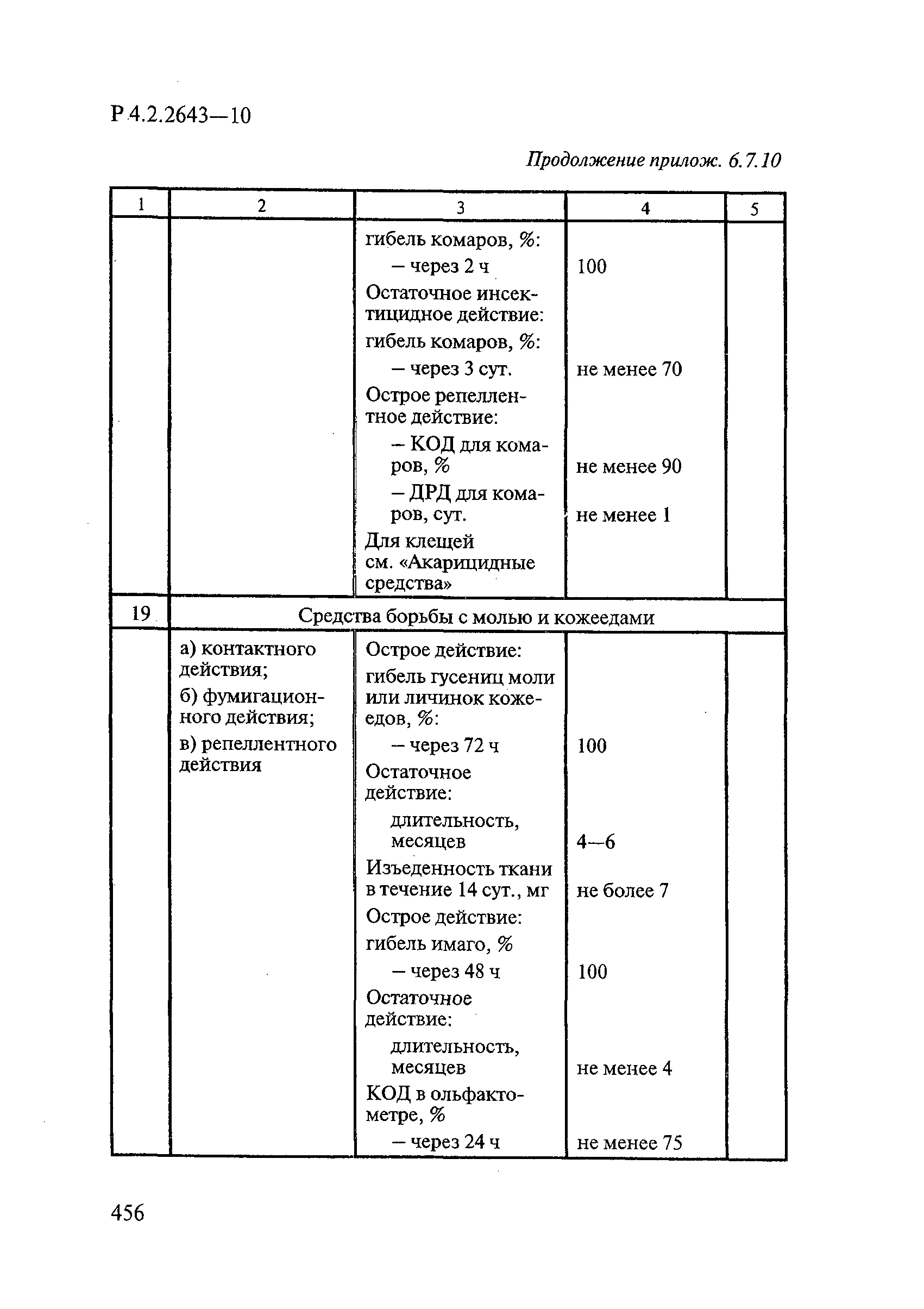
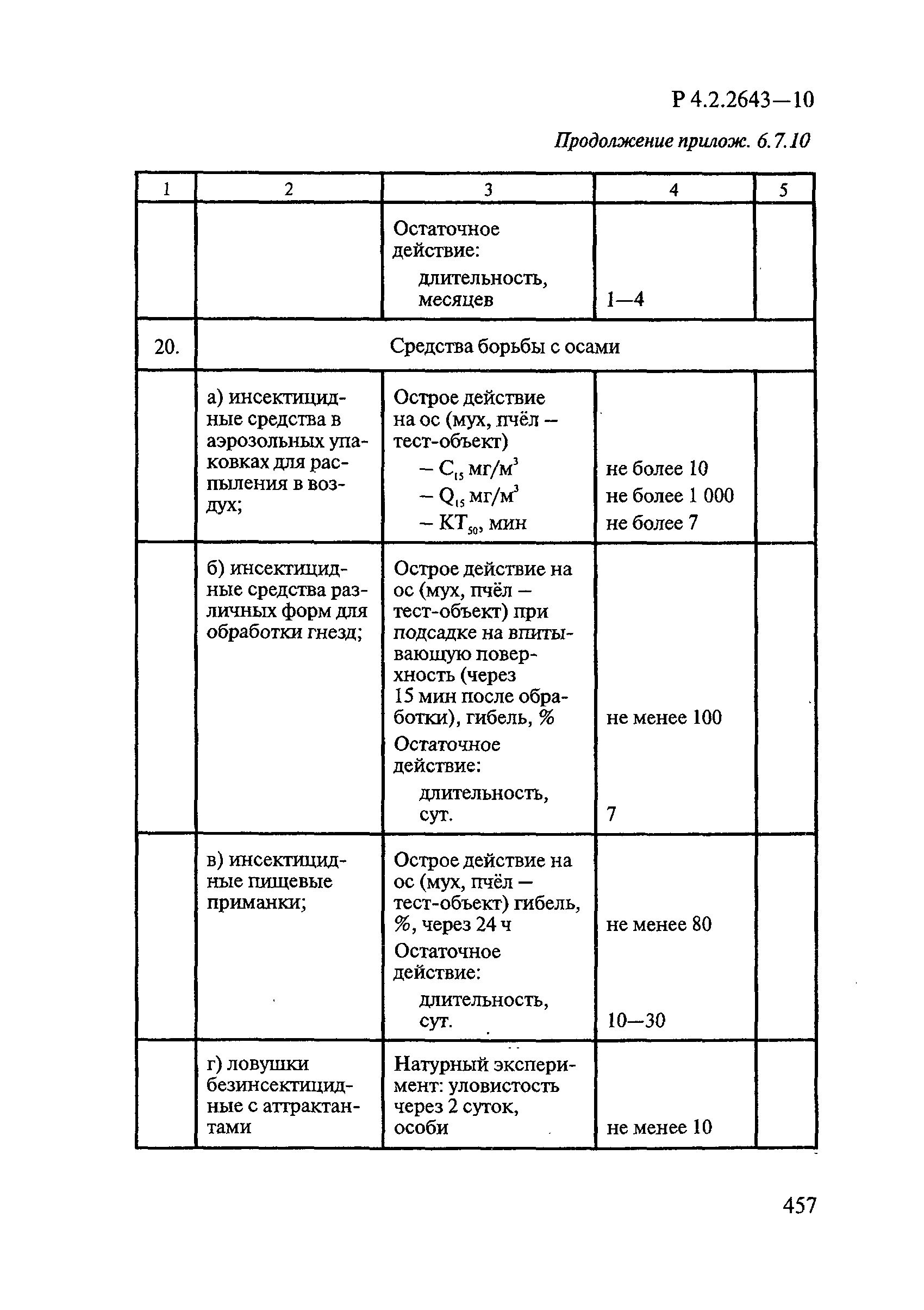
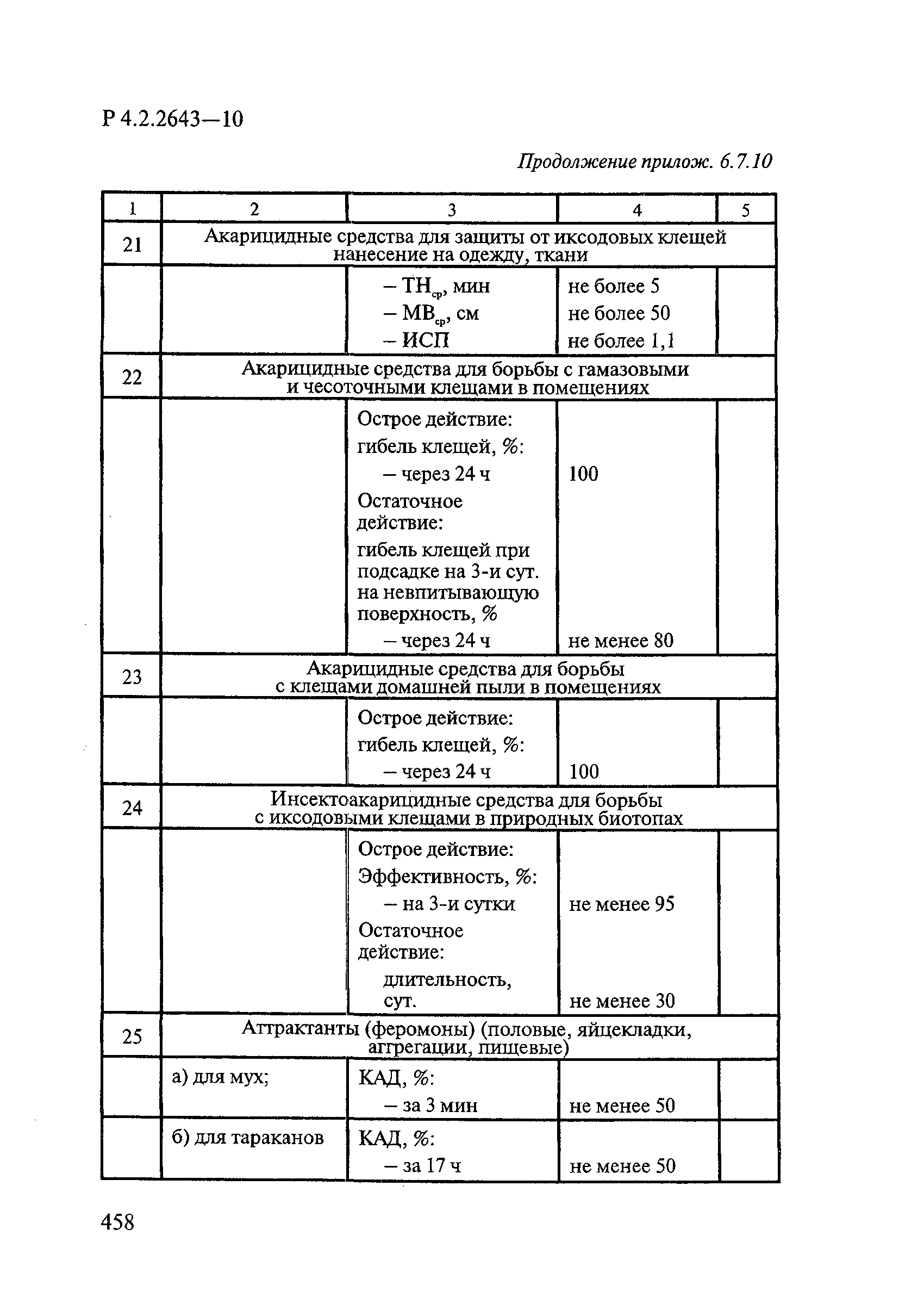
72. МУ 3.5.2.1759-03 «Методы определения эффективности инсектицидов, акарицидов, регуляторов развития и репеллентов, используемых в медицинской дезинсекции».
73. МУ 3.5.1937-04 «Очистка, дезинфекция и стерилизация эндоскопов и инструментов к ним».
74. МУ 3.5.2435-09 «Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств».
75. МУ 3.5.2431-08 «Методические указания по изучению и оценке вирулицидной активности дезинфицирующих средств».
76. Сборник руководящих методических материалов по токсиколого-гигиеническим исследованиям полимерных материалов и изделий на их основе медицинского назначения. Утв. МЗ СССР, 1987 г. С. 85.
77. Методические указания «Оценка воздействия вредных химических соединений на кожные покровы и обоснование предельно допустимых уровней загрязнения кожи» от 01.11.1979 N 2102-79.
78. ГОСТ 9.055-75 «Ткани шерстяные. Методы лабораторных испытаний на устойчивость к повреждению молью». М., 1975.
79. Приказ Минздрава СССР от 06.04.1973 «Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)».
80. Приказ Минздрава СССР от 10.10.1983 «Об утверждении нормативов затрат кормов для лабораторных животных в учреждениях здравоохранения СССР».
81. МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды». М.: Минздрав России, 2001.
82. СП 3.1.3.2.52-08 «Профилактика клещевого вирусного энцефалита».
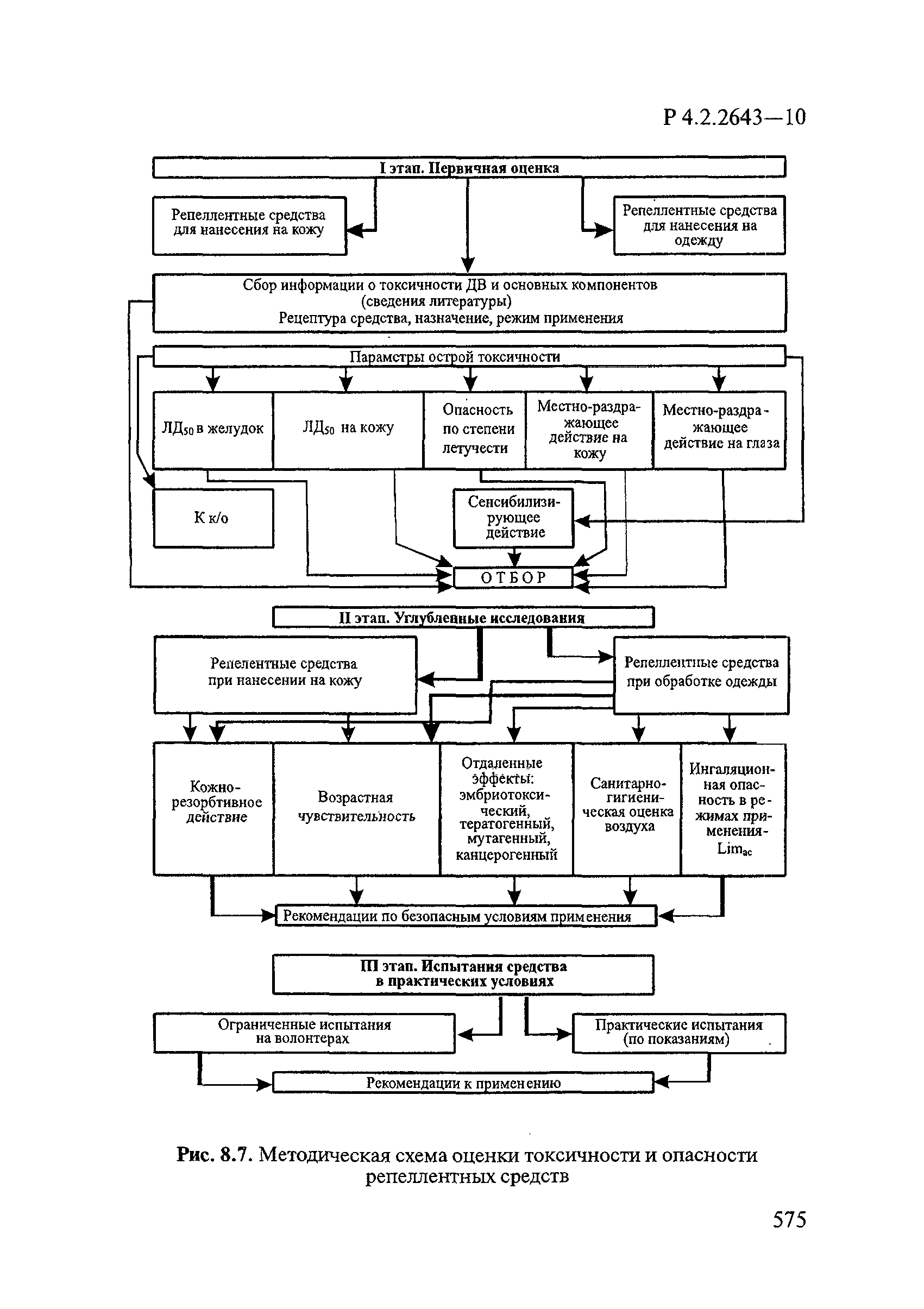
83. Методические рекомендации по отбору и изучению биологической активности и токсичности репеллентов. М., 1987.
84. Р 1.1.003-96 «Общие требования к построению, изложению и оформлению нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования».
85. Методические указания по определению зоокумарина в тканях и крови животных, в приманках и препарате пенокумарин хроматографическими и спектрофотометрическими методами N 1550-76.
3. Общие положения
Одними из важнейших элементов санитарно-эпидемиологического благополучия населения страны, составляющими ее национальную безопасность, являются организация и неуклонное проведение комплексных мер по неспецифической профилактике и борьбе с возникновением и распространением случаев инфекционных, в т.ч. внутрибольничных, инфекций, а также паразитарных болезней с помощью дезинфектологических средств прерывания путей передачи возбудителей инфекций через объекты внешней среды.
В комплексы профилактических и противоэпидемических мер по борьбе с упомянутыми инфекциями входят дезинфектологические технологии, включающие дезинфицирующие, стерилизующие, дезинсекционные и дератизационные средства.
Дезинфектологические средства обеспечивают гибель, устранение или инактивацию на/в объектах внешней среды возбудителей болезней и их переносчиков (членистоногих и грызунов), т.е. являются биоцидными агентами и поэтому могут являться потенциально опасными также для людей, животных, обрабатываемых объектов и окружающей среды.
Безопасность для людей в связи с проведением дезинфекционных мероприятий требует, прежде всего, обеспечения высокой эффективности соответствующей целевой технологии. Именно этим может и должно быть гарантировано предупреждение возможного неблагоприятного побочного эффекта — токсического воздействия самих дезинфекционных средств на людей и животных, повреждения обрабатываемых объектов и загрязнения окружающей среды.
В настоящее время при разработке, производстве, проведении регистрационных и сертификационных испытаний разрешается применение, хранение дезинфекционных средств, использование максимально безопасных химико-аналитических, микробиологических, энтомологических, родентологических методов, регламентированных официальными обязательными нормативно-методическими документами.
Унификация методов исследований и критериев оценки эффективности и безопасности дезинфицирующих, стерилизующих, инсектицидных, акарицидных, родентицидных, репеллентных средств необходима для обеспечения единства требований и сравнимости результатов оценки дезинфекционных средств различного состава, данных экспертизы при их государственной регистрации, сертификации средств разных производителей, а также при контроле качества дезинфекционных средств в системе Роспотребнадзора Российской Федерации.
На основе анализа, обобщения и унификации отечественных методов исследований и критериев оценки эффективности и безопасности дезинфекционных и стерилизационных средств, а также гармонизации их с зарубежными стандартами подготовлено руководство «Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности».
Данное руководство оформлено в соответствии с требованиями руководства «Общие требования к построению, изложению и оформлению нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования» Р.1.1.1001 — Р.1.1.1005. 1996 г. [84] и на основе принятого в нашей стране порядка изучения дезинфекционных средств в целях государственной регистрации и сертификации. Оно состоит из восьми разделов:
1. Область применения.
2. Нормативные ссылки.
3. Общие положения.
4. Химико-аналитические методы исследований дезинфекционных средств.
5. Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих и стерилизующих средств.
6. Энтомологические методы исследований и критерии оценки эффективности дезинсекционных средств.
7. Родентологические методы исследований и критерии оценки эффективности дератизационных средств.
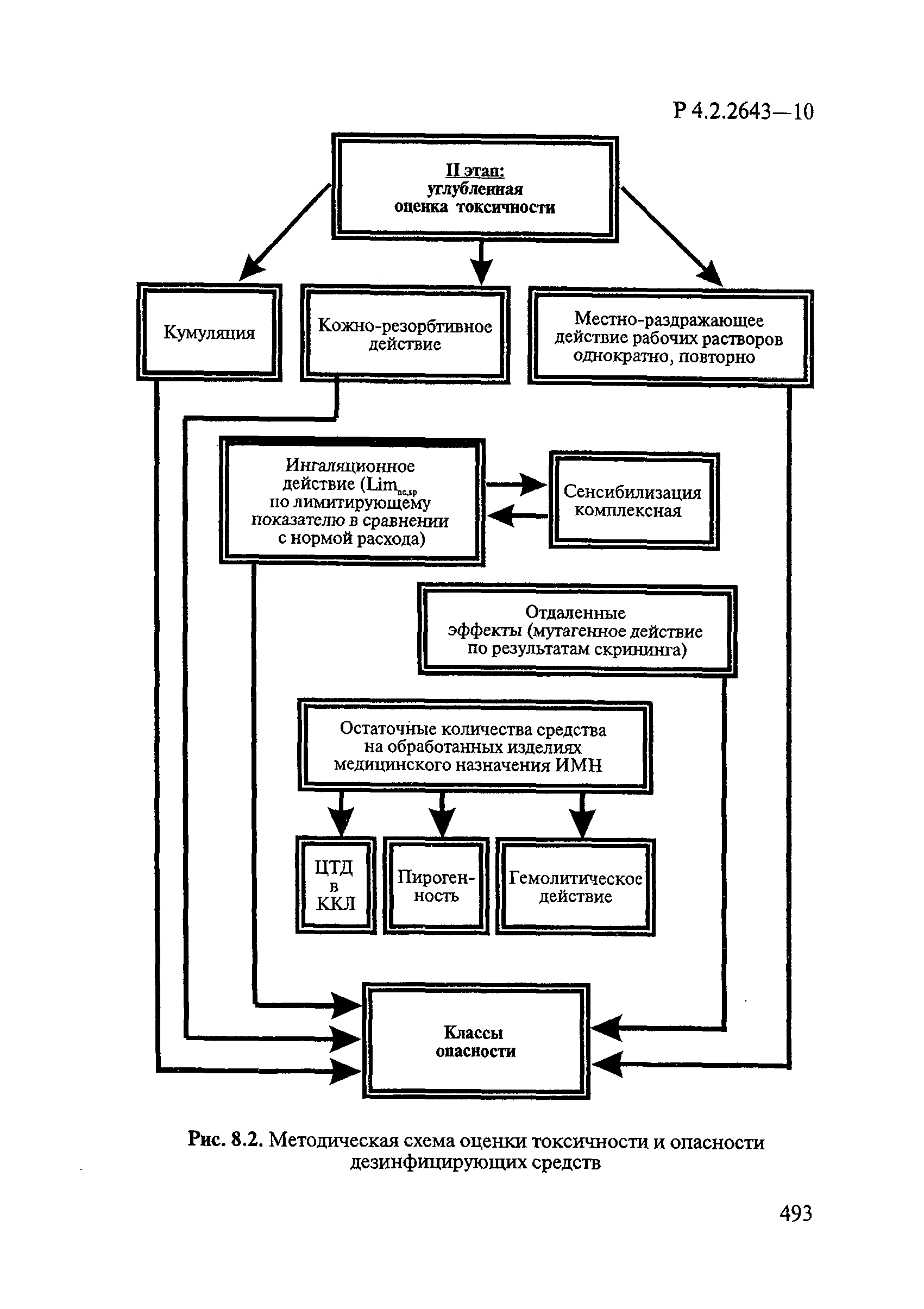
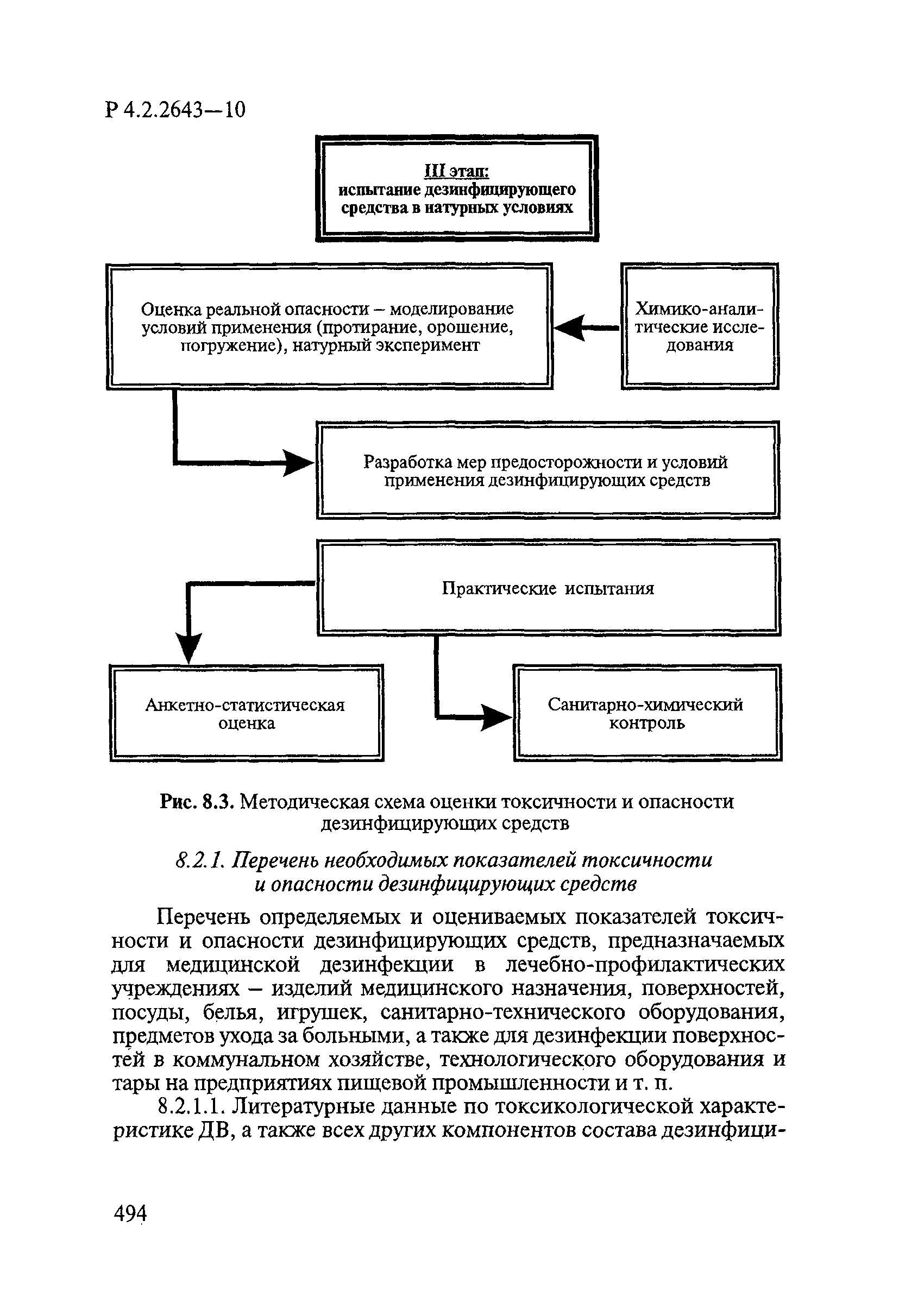
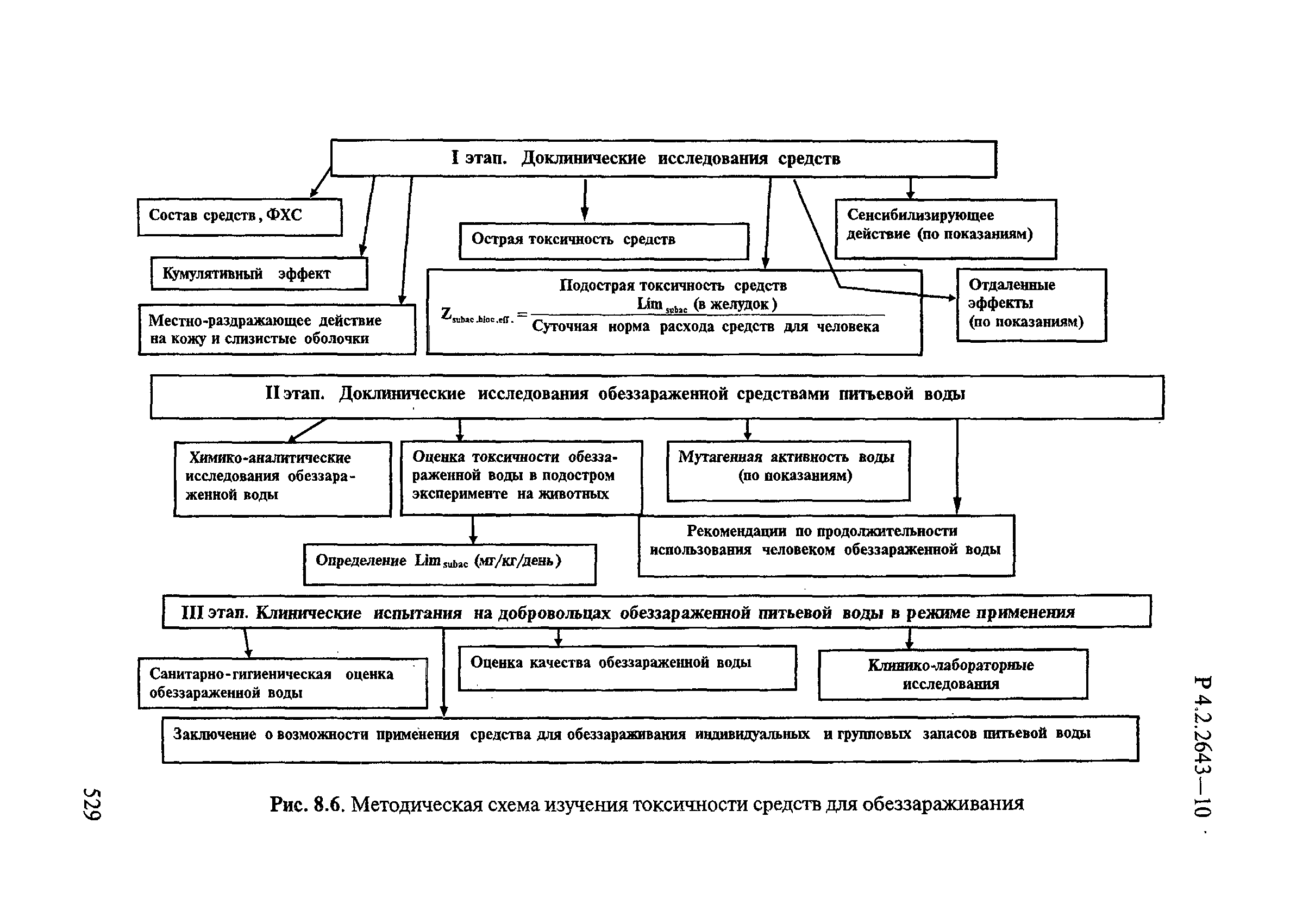
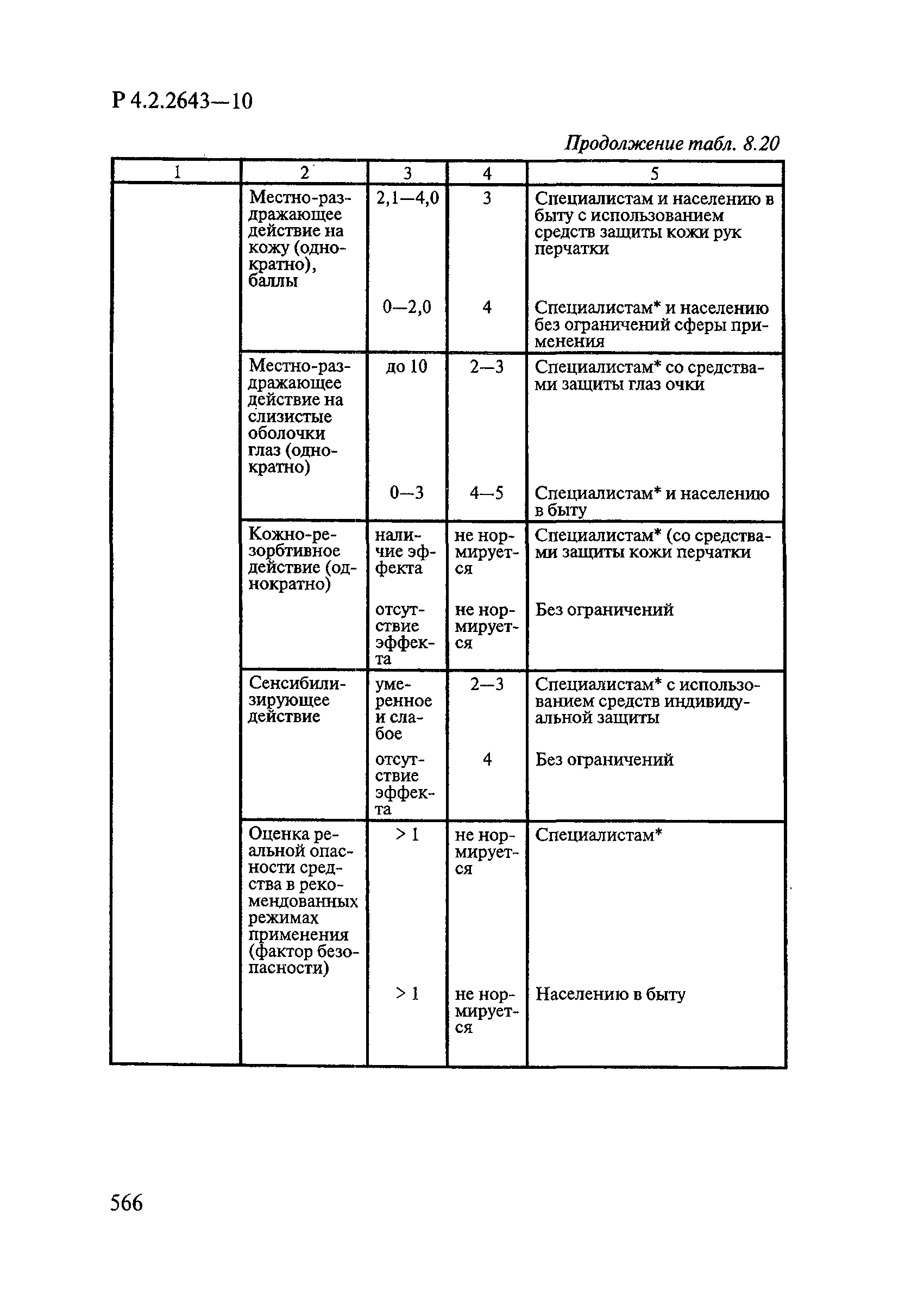
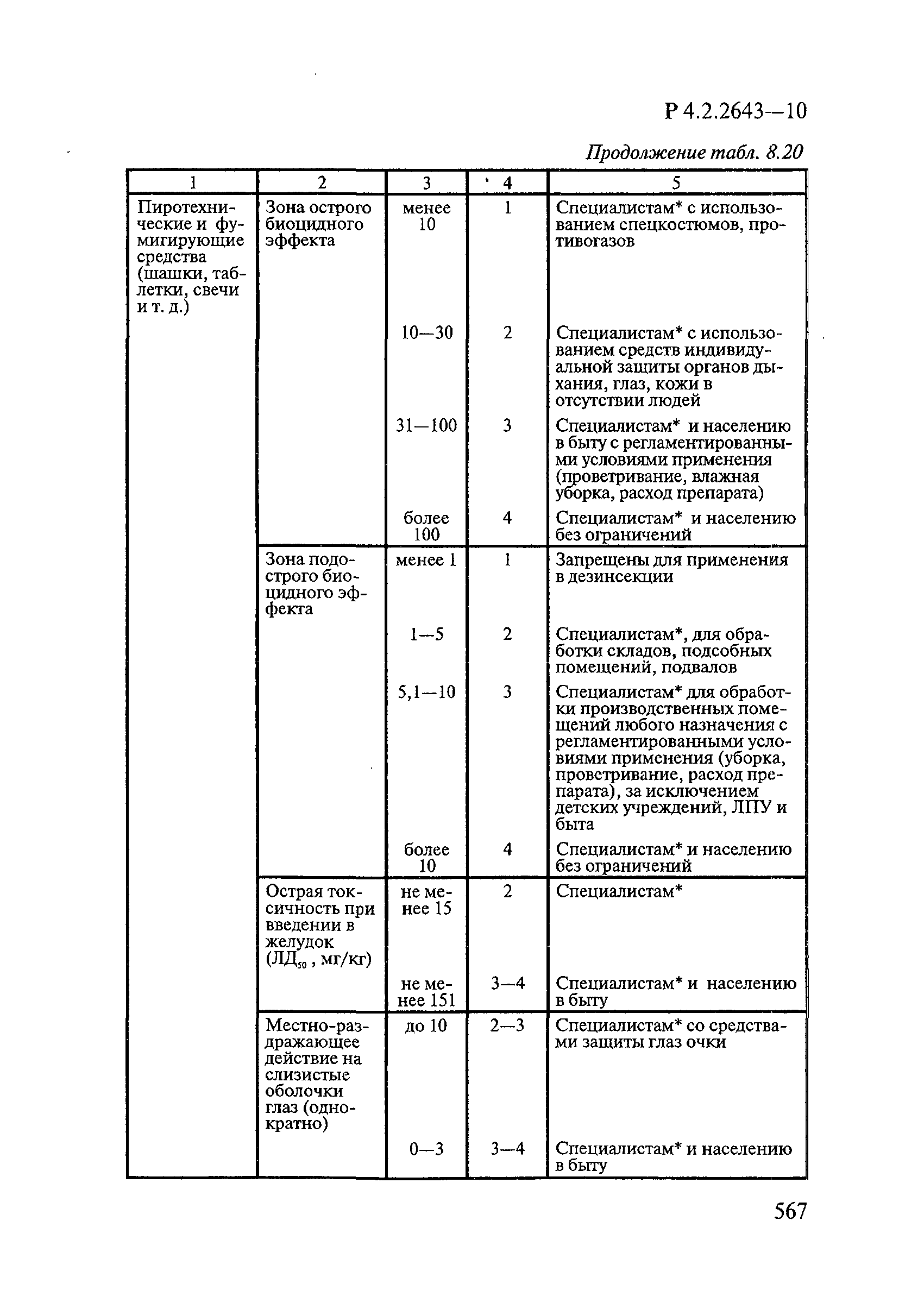
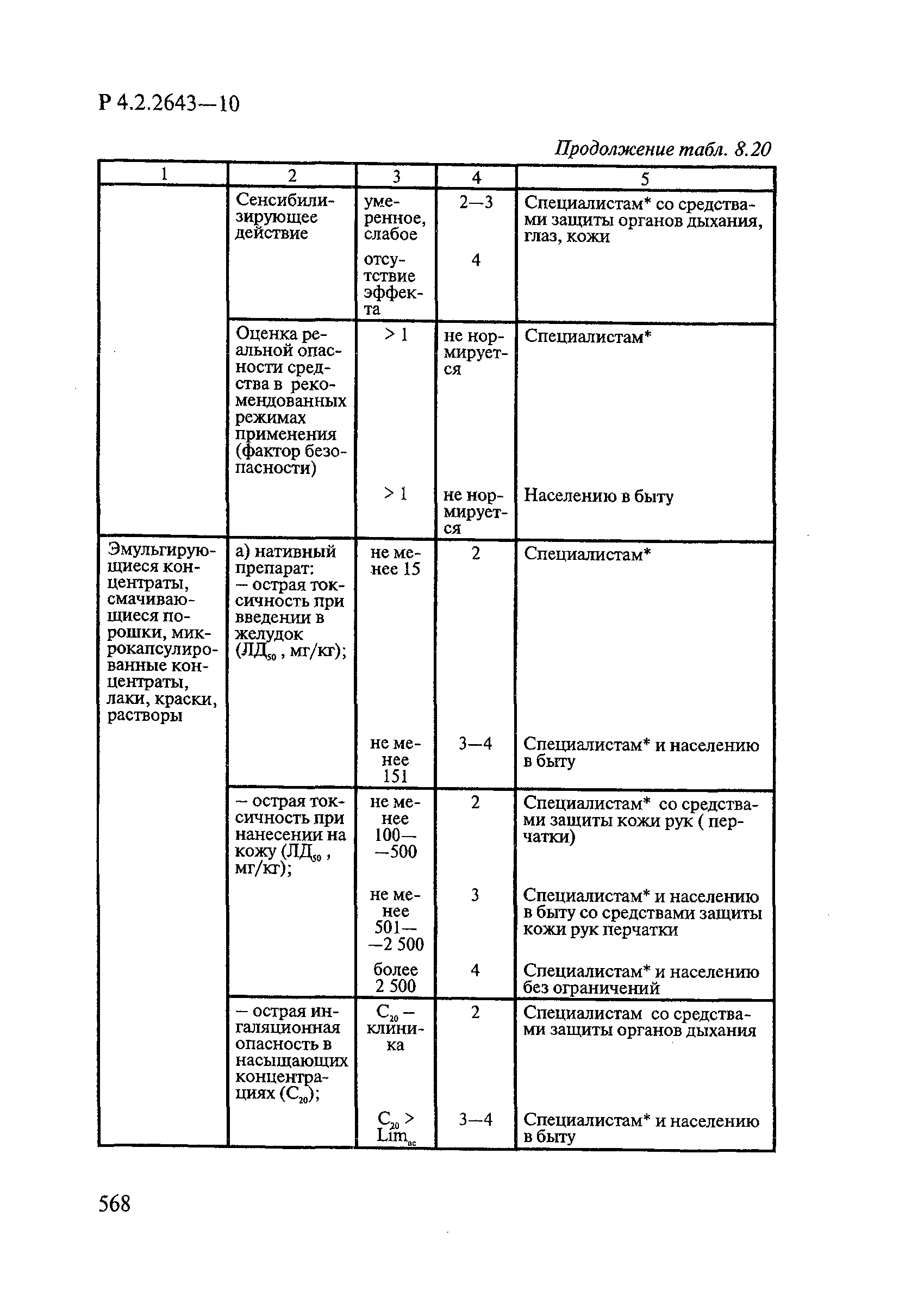
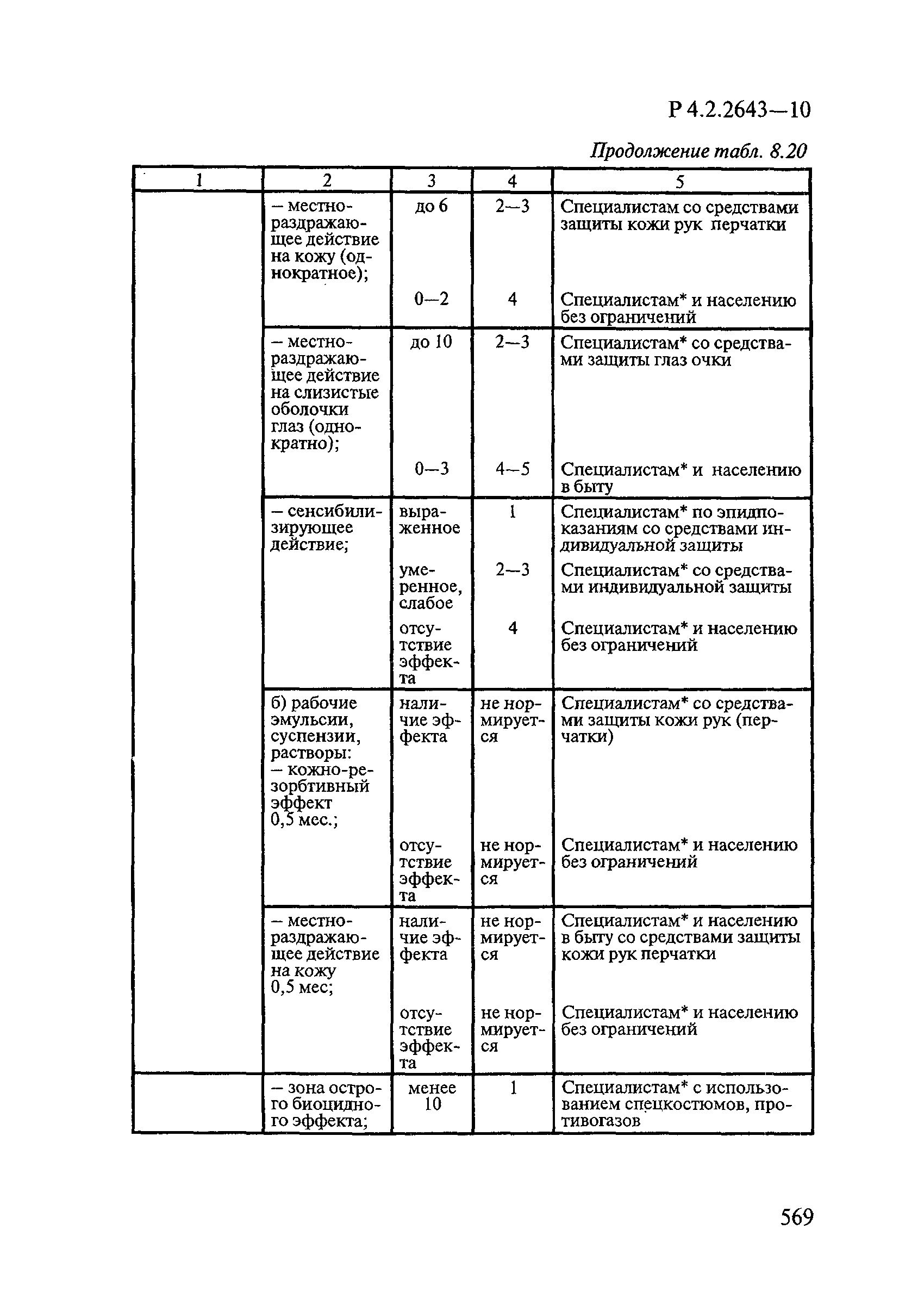
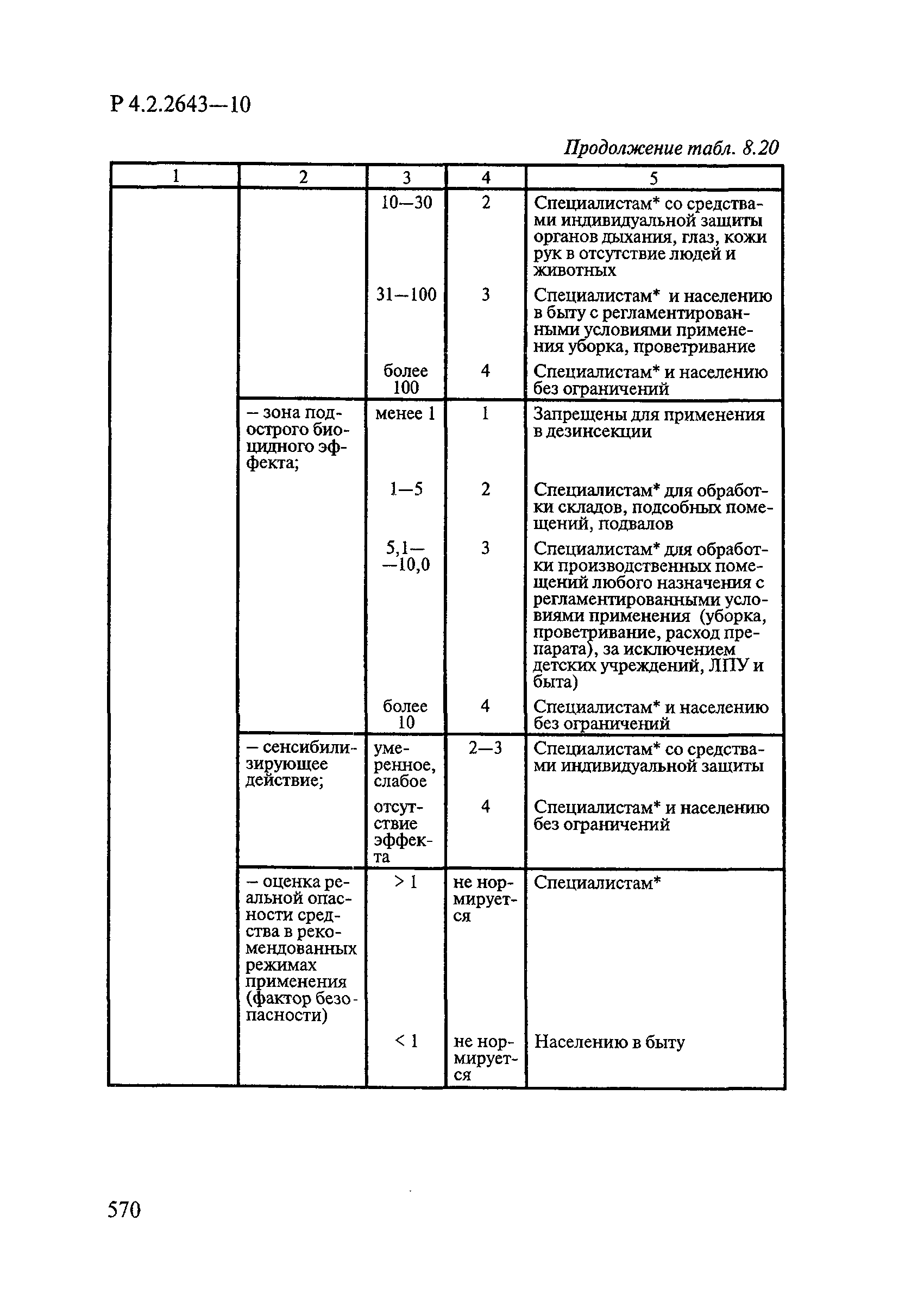
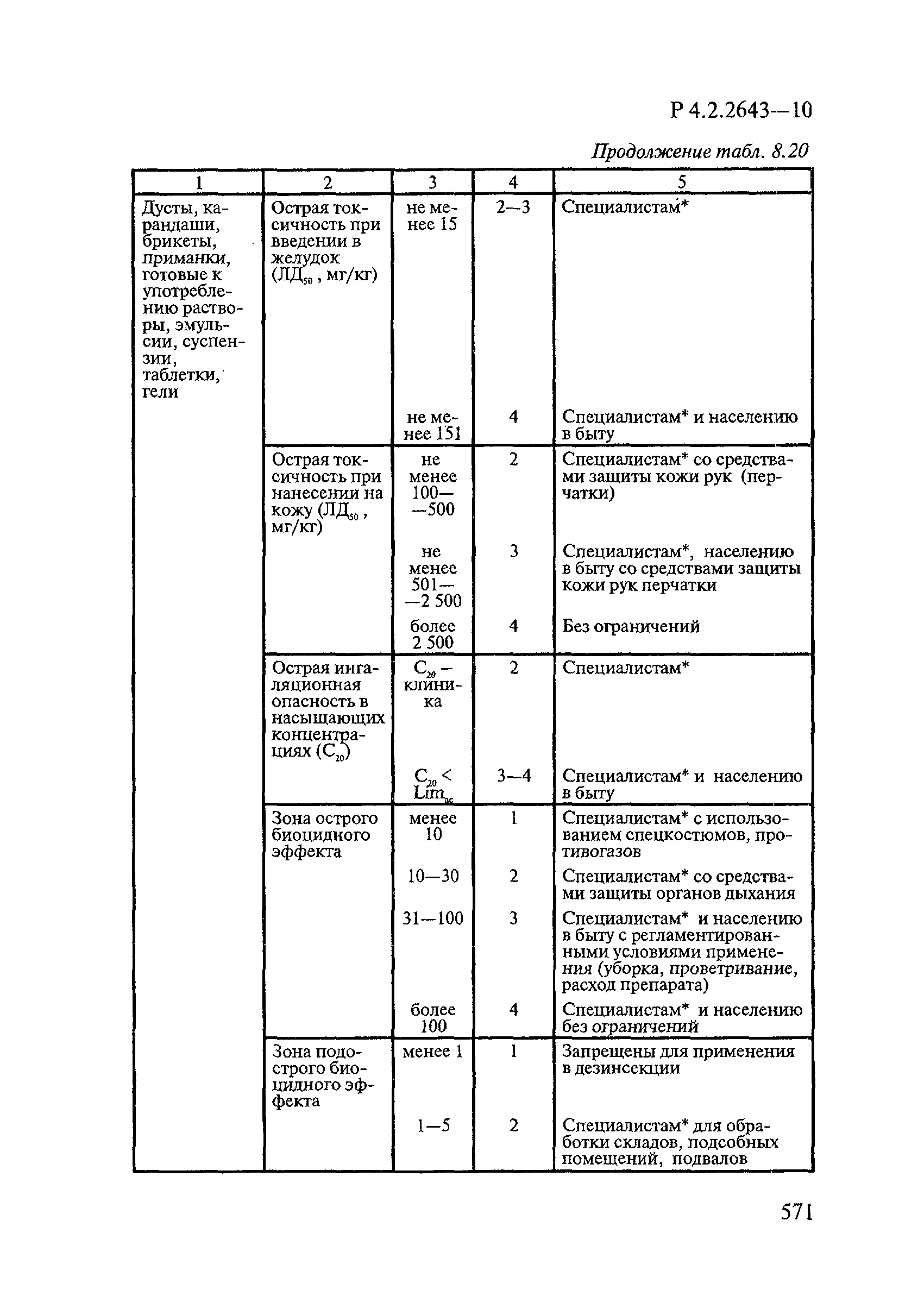
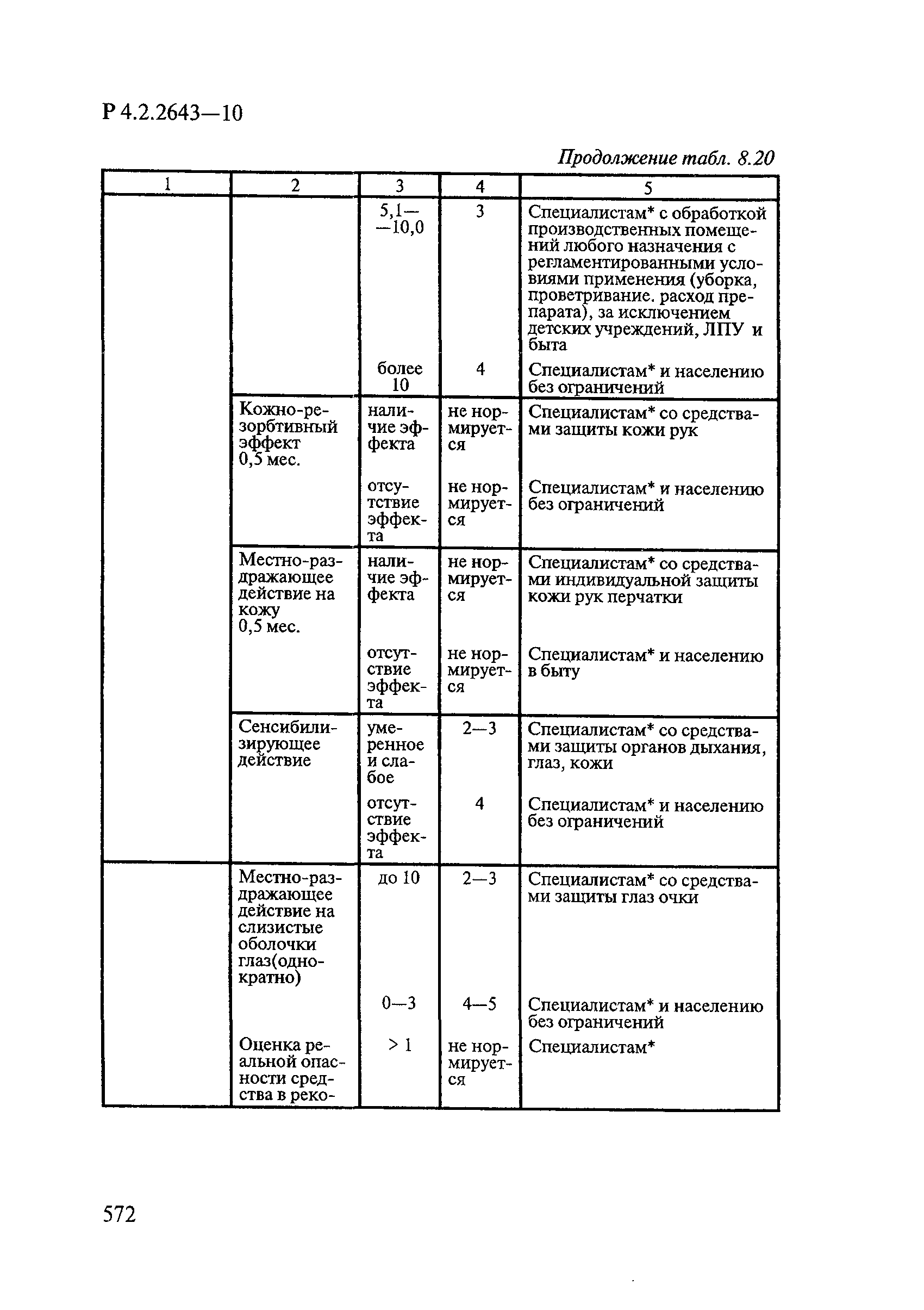
8. Методы исследований и критерии оценки токсичности и безопасности дезинфекционных средств.
4. Химико-аналитические методы исследований
дезинфекционных средств
4.1. Общие положения
Химические исследования являются важнейшей составляющей исследований и испытаний при создании, государственной регистрации, производстве, применении и сертификации дезинфекционных средств.
При создании дезинфекционных средств химические исследования включают:
— синтез действующего вещества;
— разработку рецептуры средства;
— разработку методов анализа действующих веществ и средств;
— установление срока годности действующих веществ и средств.
При государственной регистрации дезинфекционных средств проводят химико-аналитические исследования с целью:
— установления соответствия представляемых на регистрацию образцов дезинфекционных средств требованиям нормативной документации;
— определения количеств средства в воздухе и на обрабатываемых изделиях (санитарно-химические исследования) в случае использования в средствах летучих и плохо смываемых компонентов, представляющих потенциальную опасность при их использовании.
При производстве и применении дезинфекционных средств осуществляют контроль их качества согласно требованиям нормативной документации с использованием методов химико-аналитических исследований. При использовании дезинфицирующих средств в пищевой промышленности для обработки оборудования, кроме контроля качества самих дезинфицирующих средств, химическими методами контролируют также рабочие растворы средств и смывные воды с обрабатываемого оборудования.
При сертификационных испытаниях дезинфекционных средств химико-аналитические испытания являются основным способом подтверждения соответствия выпускаемого средства требованиям нормативной документации, т.е. соответствия выпускаемого средства зарегистрированному.
Дезинфекционные средства представляют собой составы в различных агрегатных состояниях: жидком, твердом и газообразном, а также в виде разных форм применения.
В состав дезинфекционных средств входят действующие вещества из разных классов химических соединений. Часто эти средства наряду с действующими веществами содержат функциональные добавки (моющие компоненты, синергисты, антикоррозионные добавки, растворители, регуляторы pH, красители, отдушки и пр.), придающие им дополнительные полезные свойства.
Поэтому для оценки качества дезинфекционных средств, помимо обязательного количественного определения действующих веществ, необходимо оценивать также косвенные интегральные физико-химические показатели качества, характеризующие многокомпонентные дезинфекционные средства в целом. Особенно характерно и обоснованно определение физико-химических показателей для дезинфицирующих средств. Эти показатели в совокупности в определенном приближении могут служить для дополнительной идентификации каждого конкретного дезинфицирующего средства.
Порядок определения показателей качества дезинфекционных средств следующий: сначала оценивают физико-химические показатели и только после полного соответствия этих показателей требованиям нормативной документации переходят к количественному анализу действующих веществ.
Такой порядок проведения химико-аналитических исследований дезинфекционных средств обусловлен тем, что при нем осуществляется переход от менее сложных и трудоемких в исполнении измерений, каковыми является определение физико-химических параметров, к более сложным процедурам количественного определения действующих веществ. Это позволяет обнаружить несоответствие средства требованиям нормативной документации уже на этапе измерений физико-химических параметров без проведения длительных исследований по количественному определению действующих веществ.
Контроль качества дезинфекционных средств химическими методами проводится с целью оценки соответствия средства требованиям нормативной документации и, следовательно, рецептуре средства. Вследствие этого, учитывая важную контролирующую функцию химических испытаний дезинфекционных средств, необходимо иметь методическую базу, позволяющую получать достоверные результаты при их аналитических исследованиях.
4.1.1. Методы определения физико-химических
показателей дезинфекционных средств
К числу определяемых общих для всех средств показателей относятся внешний вид, включающий агрегатное состояние и цвет, а также запах. Эти показатели определяют органолептически.
Кроме того, для характеристики жидких дезинфекционных средств используют такие физико-химические показатели, как водородный показатель, называемый также показателем активности или показателем концентрации водородных ионов pH самого средства или его водных растворов; плотность при 20 °C; показатель преломления при 20 °C; относительную или удельную вязкость. Для порошкообразных индивидуальных веществ (субстанций) определяют температуру плавления и pH их водных растворов. Таблетированные формы дезинфицирующих средств испытывают на распадаемость и/или растворимость.
При этом, если указанные выше показатели качества (кроме водородного показателя) являются всего лишь интегральными характеристиками многокомпонентных рецептур, величина водородного показателя pH очень существенна для характеристики дезинфекционных средств, т.к. активность некоторых действующих веществ в значительной мере зависит от величины этого показателя. В то же самое время следует иметь в виду, что величиной pH не следует характеризовать средства с высоким содержанием органических растворителей, в частности, для рецептур с высоким содержанием спиртов величина pH является условной и ее не измеряют.
В связи с вышеизложенным перечень тестируемых физико-химических параметров определяется конкретно для каждого средства с учетом его агрегатного состояния и состава.
Органолептическую оценку, включающую визуальное определение внешнего вида и определение запаха обонянием, можно проводить в соответствии с ГОСТ 27025-86 [31]. В случае избрания других условий оценки внешнего вида и запаха, эти условия (посуда и освещение — при определении внешнего вида и особые условия определения запаха) должны быть указаны в нормативной документации.
Распадаемость и растворимость таблетированных форм дезинфицирующих средств определяют по времени распадения и растворения их в определенном объеме воды. Условия определения указанных показателей обычно устанавливают разработчики средств, при этом желательно, чтобы они были приближены к условиям применения этих средств.
Измерение физико-химических параметров — водородного показателя, плотности, показателя преломления, относительной или удельной вязкости, температуры плавления — проводят в соответствии с действующими ГОСТами на методы определений и Государственной фармакопеей СССР XI издания. В частности, водородный показатель определяют потенциометрически [33, 34, 46], плотность при 20 °C измеряют с помощью ареометра или пикнометра [36, 43], показатель преломления при 20 °C — рефрактометрически [37, 42], температуру плавления — термометрически [42, 44], вязкость — вискозиметрически [45].
4.1.2. Методы количественного определения
действующих веществ в дезинфекционных средствах
Без контроля качества выпускаемой продукции — приемосдаточных и сертификационных испытаний на соответствие нормативной документации — не может быть использовано ни одно дезинфекционное средство. При этом обязательным условием оценки качества дезинфекционных средств является количественное определение действующих веществ, обусловливающих их активность и токсичность.
Вследствие этого нормативная документация на дезинфекционные средства (технические условия на отечественную и спецификации на зарубежную продукцию) должна в обязательном порядке включать нормы на содержание действующих веществ. Кроме того, представляемые зарубежными фирмами спецификации должны сопровождаться описаниями методик анализа действующих веществ.
Поскольку в качестве действующих веществ в дезинфекционных средствах применяются вещества из разных классов химических соединений, для количественного определения действующих веществ используются разнообразные методы химического анализа: гравиметрические, титриметрические, фотоколориметрические, спектрофотометрические, методы газовой — газоадсорбционной и газожидкостной хроматографии и высокоэффективной жидкостной хроматографии и др.
Методы и конкретные методики, которые могут быть использованы для количественного определения действующих веществ в средствах указанного назначения, многочисленны. Все они разные и потому не всегда поддаются унификации. В связи с этим ниже приводим систематизированный и обобщенный материал по методам анализа действующих веществ из различных классов химических соединений с описанием некоторых методик, наиболее применяемых для анализа дезинфекционных средств. Приведенные методики могут оказаться неприменимыми для многокомпонентных рецептур, содержащих неиндифферентные к конкретным методам ингредиенты. В таких случаях следует путем химических исследований выяснить причины искажающего действия компонентов на результаты анализов и устранить их в рамках существующих методик или разработать новые методы анализа.
Для анализа действующих веществ в дезинфекционных средствах могут быть использованы также другие, не приведенные ниже методики анализа, обеспечивающие достаточную точность, воспроизводимость и сходимость результатов.
В нижеследующих главах приведено описание методов анализа действующих веществ в дезинфицирующих, стерилизующих средствах, средствах для предстерилизационной очистки, дезинсекционных (инсектицидных, акарицидных, инсектоакарицидных и репеллентных) и дератизационных средствах.
Приводимые ниже методы — это наиболее часто применяемые для контроля качества дезинфекционных средств методы анализа, описанные в химико-аналитических разделах инструкций по их применению.
4.2. Методы количественного определения действующих
веществ в дезинфицирующих, стерилизующих средствах
и средствах для предстерилизационной очистки
В дезинфицирующих и стерилизующих средствах действующими веществами в основном являются:
— галоидактивные (хлор-, бром- и йодактивные соединения);
— кислородактивные соединения (перекись водорода, ее комплексы с солями, надуксусная кислота, озон);
— альдегиды (глутаровый альдегид, глиоксаль, формальдегид, янтарный альдегид, ортофталевый альдегид);
— четвертичные аммониевые соли (алкилдиметилбензиламмоний хлорид, дидецилдиметиламмоний хлорид и т.п. из ряда катионных ПАВ);
— производные гуанидина (соли полигексаметиленгуанидина, полигексаметиленбигуанидина и хлоргексидин биглюконат);
— третичный алкиламин — N,N-бис3-аминопропилдодециламин;
— низшие жирные спирты (этиловый, изопропиловый и н-пропиловый);
— фенольные соединения [2-бифенилол, 2-бензил-4-хлорфенол, 5-хлор-2-гидроксидифенилметан, 5-хлор-2-(2,4-дихлорфенокси)-фенол] и др.;
— кислоты органические и неорганические;
— щелочи;
— метасиликат натрия и др.
В состав средств для предстерилизационной очистки входят моющие компоненты, содержание которых в ряде случаев также контролируется. Это вещества из класса анионных, неионогенных и катионных ПАВ, щелочи, соли щелочных металлов (в частности, метасиликат натрия), ферменты и др.
Для количественного определения действующих веществ, входящих в состав дезинфицирующих, стерилизующих средств и средств для предстерилизационной очистки, в настоящее время наиболее часто применяют описанные ниже методы анализа.
4.2.1. Методы определения галоидактивных соединений
(хлорактивных, бромактивных и йодактивных)
Анализ галоидактивных соединений (хлорактивных, бромактивных и йодактивных) основан на определении активных галоидов (активного хлора, активного брома и активного йода соответственно).
Из этого класса в качестве действующих веществ дезинфицирующих средств в основном используют хлорактивные и йодактивные соединения.
Определение хлорактивных соединений. Анализ хлорактивных соединений проводят с количественным определением активного хлора методом йодометрического титрования.
Сущность метода заключается в титровании серноватистокислым натрием (тиосульфатом натрия) свободного йода, выделяющегося при взаимодействии содержащих активный хлор соединений с йодистоводородной кислотой, образующейся из йодистого калия в кислой среде [35].
Выполнение анализа. К навеске средства или аликвоте раствора навески средства, содержащим около 35 мг активного хлора, прибавляют 10 куб. см 10%-ного раствора йодистого калия, 10 куб. см 10%-ного раствора серной кислоты, перемешивая после добавления каждого реактива, закрывают колбу пробкой и выдерживают в темном месте 3 мин.
Выделившийся йод титруют 0,1 н раствором тиосульфата натрия до светло-желтой окраски, прибавляют 1 — 2 куб. см 0,5%-ного раствора крахмала и продолжают титровать до исчезновения синей окраски раствора.
Обработка результатов. Массовую долю активного хлора X в процентах вычисляют по формуле:
V x 0,003545
X = ———— x 100,
m
где:
V — объем раствора тиосульфата натрия концентрации точно с
(Na S O x 5H O) = 0,1 моль/куб. дм (0,1 н), израсходованный на титрование,
2 2 3 2
куб. см;
0,003545 — масса активного хлора, соответствующая 1 куб. см раствора
тиосульфата натрия концентрации точно с (Na S O x 5H O) = 0,1 моль/куб. дм
2 2 3 2
0,1 н, г/куб. см;
m — масса анализируемой пробы, г.
Определение бромактивных соединений. Анализ бромактивных соединений
проводят с количественным определением активного брома методом
йодометрического титрования.
Выполнение анализа. По описанной для хлорактивных соединений методике
анализируют навеску или аликвоту раствора навески, содержащие около 80 мг
активного брома.
Обработка результатов. Массовую долю активного брома X в процентах
вычисляют по формуле:
V x 0,00799
X = ———— x 100,
m
где:
V — объем раствора тиосульфата натрия концентрации точно с
(Na S O x 5H O) = 0,1 моль/куб. дм (0,1 н), израсходованный на титрование,
2 2 3 2
куб. см;
0,00799 — масса активного брома, соответствующая 1 куб. см раствора
тиосульфата натрия концентрации точно с (Na S O x 5H O) = 0,1 моль/куб. дм
2 2 3 2
0,1 н, г/куб. см;
m — масса анализируемой пробы, г.
Определение йодактивных соединений. Для анализа йодактивных соединений также используют метод йодометрического титрования. Сущность метода заключается в титровании активного йода раствором тиосульфата натрия.
Выполнение анализа. Навеску средства, содержащую около 130 мг активного йода, вносят в титровальную колбу и доводят объем дистиллированной водой до 30 куб. см. Полученный раствор йодофора титруют 0,1 н раствором тиосульфата натрия в присутствии индикатора — 2 куб. см (0,5%-ного раствора крахмала), добавляемого при переходе окраски в светло-желтый цвет. Иногда титрование йодактивных соединений ведут в отсутствии крахмала до обесцвечивания раствора.
Обработка результатов. Массовую долю активного йода X в процентах вычисляют по формуле:
V x 0,01269
X = ———— x 100,
m
где:
V — объем раствора тиосульфата натрия концентрации точно с
(Na S O x 5H O) = 0,1 моль/куб. дм (0,1 н), израсходованный на титрование,
2 2 3 2
куб. см;
0,01269 — масса активного йода, соответствующая 1 куб. см раствора
тиосульфата натрия концентрации точно с (Na S O x 5H O) = 0,1 моль/куб. дм
2 2 3 2
0,1 н, г/куб. см;
m — масса анализируемой пробы, г.
4.2.2. Методы определения перекисных соединений
(перекиси водорода, ее комплексов с солями,
надуксусной кислоты и озона)
Определение активного кислорода. Часто перекисные соединения анализируются на содержание активного кислорода.
Для количественного определения активного кислорода используют метод йодометрического титрования [35].
Сущность метода заключается в титровании раствором тиосульфата натрия свободного йода, выделяющегося при взаимодействии содержащих активный кислород соединений с йодистоводородной кислотой, образующейся из йодистого калия в кислой среде.
Выполнение анализа. Навеску средства, содержащую около 8 мг активного кислорода, титруют в условиях, описанных в п. 2.1, для йодометрического титрования хлорактивных соединений [35].
Обработка результатов. Массовую долю активного кислорода X в процентах вычисляют по формуле:
V x 0,0008
X = ———- x 100,
m
где:
V — объем раствора тиосульфата натрия концентрации точно с
(Na S O x 5H O) = 0,1 моль/куб. дм (0,1 н), израсходованный на титрование,
2 2 3 2
куб. см;
0,0008 — масса активного кислорода, соответствующая 1 куб. см раствора
тиосульфата натрия концентрации точно с (Na S O x 5H O) = 0,1 моль/куб. дм
2 2 3 2
0,1 н, г/куб. см;
m — масса анализируемой пробы, г.
Методы определения перекиси водорода. Для анализа перекиси водорода могут быть использованы следующие объемные методы — перманганатометрическое, йодометрическое или периметрическое титрование. В литературе описан целый ряд других методов анализа перекиси водорода (фотоколориметрический, спектрофотометрический, полярографический и пр.).
Наиболее применяемым из указанных выше методов является метод перманганатометрического титрования, описанный в ГОСТе на перекись водорода [29].
Выполнение анализа. Навеску средства, содержащую около 25 мг перекиси водорода, помещают в коническую колбу вместимостью 250 куб. см, содержащую 25 куб. см дистиллированной воды и 20 куб. см раствора серной кислоты (разбавление 1:4 по объему), перемешивают и титруют 0,1 н раствором марганцовокислого калия до розовой окраски, не исчезающей в течение минуты.
Параллельно проводят контрольный опыт в тех же условиях и с тем же количеством реактивов, но без добавления перекиси водорода.
Обработка результатов. Массовую долю перекиси водорода X в процентах вычисляют по формуле:
V — V x 0,0017 x K
1
X = ——————- x 100,
m
где:
V — объем раствора марганцовокислого калия концентрации с (1/5 KMnO ) =
4
0,1 моль/куб. дм (0,1 н), израсходованный на титрование анализируемой
пробы, куб. см;
V — объем раствора марганцовокислого калия концентрации точно с
1
(1/5 KMnO ) = 0,1 моль/куб. дм (0,1 н), израсходованный на контрольное
4
титрование, куб. см;
0,0017 — масса перекиси водорода, соответствующая 1 куб. см раствора
тиосульфата натрия концентрации точно с (1/5 KMnO ) = 0,1 моль/куб. дм
4
0,1 н, г/куб. см;
K — поправочный коэффициент раствора марганцовокислого калия
концентрации с (1/5 KMnO ) = 0,1 моль/куб. дм 0,1 н;
4
m — масса анализируемой пробы, г.
Методы определения надуксусной кислоты. Надуксусная (пероксоуксусная) кислота образуется при взаимодействии уксусной кислоты с перекисью водорода. Средства на ее основе получаются смешиванием этих компонентов, поэтому они практически всегда содержат перекись водорода.
Основными методами анализа систем перекись водорода — надуксусная кислота являются методы последовательного перманганатометрически-йодометрического и цериметрически-йодометрического титрования компонентов в одной и той же анализируемой пробе. Сначала перманганатометрическим или цериметрическим титрованием определяют перекись водорода, после чего проводят йодометрическое определение надуксусной кислоты. Для удаления кислорода, выделяющегося при перманганатометрическом и цериметрическом титровании перекиси водорода, к кислому титруемому раствору прибавляют карбонаты натрия. Выделяющийся при этом углекислый газ уносит с собой растворенный кислород.
Выполнение анализа. К навеске средства, содержащей перекись водорода и около 15 мг надуксусной кислоты, прибавляют 90 куб. см 10%-ного раствора серной кислоты и проводят титрование перекиси водорода 0,1 н раствором марганцовокислого калия до светло-розового окрашивания, не исчезающего в течение минуты. К оттитрованной пробе прибавляют 1 г карбоната или бикарбоната натрия, колбу взбалтывают в течение 2 мин., после чего прибавляют 10 куб. см 10%-ного раствора йодида калия и выдерживают 10 мин. в темном месте.
Выделившийся йод титруют 0,1 н водным раствором тиосульфата натрия до светло-желтой окраски, прибавляют 1 куб. см 1%-ного водного раствора крахмала и продолжают титровать до обесцвечивания раствора.
Обработка результатов. Массовую долю перекиси водорода в смеси ее с надуксусной кислотой вычисляют по формуле, приведенной выше в подразделе «Методы определения перекиси водорода».
Массовую долю надуксусной кислоты X в процентах вычисляют по формуле:
V x 0,0038 x K
X = ————— x 100,
m
где:
V — объем раствора тиосульфата натрия концентрации с (Na S O x 5H O) =
2 2 3 2
0,1 моль/куб. дм (0,1 н), израсходованный на титрование, куб. см;
0,0038 — масса надуксусной кислоты, соответствующая 1 куб. см раствора
тиосульфата натрия концентрации точно с (Na S O x 5H O) = 0,1 моль/куб. дм
2 2 3 2
0,1 н, г/куб. см;
K — поправочный коэффициент раствора тиосульфата натрия концентрации с
(Na S O x 5H O) = 0,1 моль/куб. дм (0,1 н);
2 2 3 2
m — масса анализируемой пробы, г.
Методы определения озона. Наиболее доступны и применяемы в настоящее время методы количественного определения озона с помощью газоанализаторов.
Для анализа озона в жидких средах используют измеритель концентрации озона ИКО-3.
Принцип действия измерителя заключается в фотоколориметрическом определении озона по собственной полосе поглощения при длине волны 253,7 нм.
Диапазон измеряемой концентрации растворенного озона от 0,1 до 30 мг/л.
Выполнение измерений проводят согласно инструкции по применению прибора.
Для анализа озона в воздухе могут быть использованы газоанализаторы озона — измеритель концентрации озона в газе ИКО-1, оптический газоанализатор озона «Циклон-5.51» и хемилюминесцентный газоанализатор озона модели «3.02П-Р».
Принцип действия ИКО-1 и оптического газоанализатора заключается в фотоколориметрическом определении озона по собственной полосе поглощения при длине волны 253,7 нм.
Диапазон измеряемых концентраций озона прибором ИКО-1 — от 1 до 150 мг/л, газоанализатором «Циклон-5.51» — от 0 до 100 мг/куб. м.
Принцип действия газоанализатора озона модели «3.02П-Р» — в эффекте гетерогенной хемилюминесценции, возникающей в результате экзотермической реакции озона с окисляемыми химическими веществами композиции. Интенсивность свечения композиции пропорциональна концентрации озона в газовой смеси, измеряется и преобразуется в цифровой сигнал, отображаемый на мониторе анализатора.
Диапазон измеряемых концентраций — 0 — 500 мкг/куб. м.
Выполнение измерений указанными газоанализаторами озона проводят согласно руководствам по их эксплуатации.
4.2.3. Методы определения альдегидов (глутарового альдегида,
глиоксаля, формальдегида, орто-фталевого альдегида и др.)
Альдегиды, входящие в состав дезинфицирующих средств, анализируют в основном следующими методами: объемными (титриметрическими) — бисульфитным (2 варианта), сульфитным и с использованием гидроксиламина и гидроксиламина солянокислого. В последние годы для их анализа стали использовать методы ГЖХ и ВЭЖХ, которые приводятся в инструкциях по применению дезинфицирующих средств.
Сущность бисульфитного метода заключается в образовании бисульфитного производного при взаимодействии альдегидов с бисульфитом натрия с последующим определением альдегидов методом йодометрического титрования. В первом классическом варианте метода используется обратное титрование прибавляемого избытка йода раствором тиосульфата натрия. Второй вариант предусматривает прямое титрование раствором йода.
В основе сульфитного метода — образование при взаимодействии альдегидов с сульфитом натрия гидроокиси натрия, титруемой растворами серной или соляной кислот.
При применении в анализе свободного гидроксиламина в спиртовой среде происходит оксимирование, и содержание альдегида определяется разностью объемов соляной кислоты, израсходованных на титрование в контрольном опыте и при титровании анализируемой пробы.
Сущность метода с использованием гидроксиламина солянокислого заключается в том, что при взаимодействии альдегидов с ним образуются альдоксимы с выделением эквивалентного количества соляной кислоты, которая титруется раствором гидроокиси натрия, либо потенциометрически до pH в интервале от 3 до 4, либо с индикатором бромфеноловым синим.
Ниже приводится в обобщенном виде наиболее часто применяемый метод количественного определения альдегидов с использованием гидроксиламина солянокислого на примере глутарового альдегида.
Выполнение анализа. Навеску или аликвоту навески средства, содержащие около 250 мг глутарового альдегида, вносят в коническую колбу с притертой пробкой, прибавляют 10 куб. см дистиллированной воды и 0,1 куб. см 0,1%-ного водного раствора бромфенолового синего.
В случае кислой реакции полученного раствора (раствор в присутствии индикатора окрашивается в желтый цвет) прибавляют 0,5 н раствор гидроокиси натрия до появления синего окрашивания. В случае щелочной реакции раствора (раствор окрашивается в синий цвет) прибавляют 0,5 н раствор соляной кислоты до светло-желтого окрашивания и затем 0,5 н раствор гидроокиси натрия до появления синего окрашивания. Затем вносят 25 куб. см 7%-ного водного раствора гидроксиламина солянокислого, закрывают колбу пробкой, оставляют на 20 — 30 мин. при комнатной температуре, после чего образовавшийся раствор желтого цвета титруют 0,5 н раствором гидроокиси натрия до появления синего окрашивания.
Обработка результатов. Массовую долю глутарового альдегида X в процентах вычисляют по формуле:
V x 0,0025 x K
X = ————— x 100,
m
где:
V — объем раствора гидроокиси натрия концентрации с NaOH =
0,5 моль/куб. дм (0,5 н), израсходованный на титрование, куб. см;
0,0025 — масса глутарового альдегида, соответствующая 1 куб. см
раствора тиосульфата натрия концентрации точно с NaOH = 0,5 моль/куб. дм
(0,5 н), г/куб. см;
K — поправочный коэффициент раствора гидроокиси натрия концентрации с
NaOH = 0,5 моль/куб. дм (0,5 н);
m — масса анализируемой пробы, г.
4.2.4. Методы определения четвертичных аммониевых солей
Анализ четвертичных аммониевых солей (ЧАС) из ряда катионных ПАВ в дезинфицирующих средствах проводят с использованием методов двухфазного и аргентометрического титрования, фотоколориметрического, спектрофотометрического и других методов.
В большинстве случаев для анализа ЧАС применяют методики анализа, основанные на методе двухфазного титрования.
Существует много вариантов метода двухфазного титрования ЧАС, отличающихся по величине pH титруемого раствора и по используемым индикаторам. Для анализа дезинфицирующих средств применяют щелочное и кислотное титрования с использованием индикаторов бромфенолового синего, метиленового голубого, смешанных индикаторов метиленового голубого и эозина Н, а также димидиум бромида и дисульфина голубого.
В основе метода количественного определения ЧАС двухфазным титрованием лежит взаимодействие катионоактивных ЧАС с анионоактивным додецилсульфатом натрия.
Указанные варианты двухфазного титрования позволяют количественно определять ЧАС с большой степенью точности. Они описаны в технических условиях и инструкциях по применению дезинфицирующих средств, содержащих ЧАС.
Ниже приведена методика анализа алкилдиметилбензиламмоний хлорида методом двухфазного титрования в щелочной среде с использованием индикатора бромфенолового синего.
Приготовление щелочного буферного раствора с pH 11. 50 г сульфата натрия и 3,5 г карбоната натрия растворяют в 500 куб. см дистиллированной воды.
Выполнение анализа. В цилиндр или коническую колбу вносят навеску или аликвоту раствора навески средства, содержащие около 15 мг алкилдиметилбензиламмоний хлорида, 30 куб. см буферного раствора с pH 11, 20 куб. см хлороформа и 8 — 12 капель 0,1%-ного водного раствора индикатора бромфенолового синего. Титруют 0,004 н раствором додецилсульфата натрия с интенсивным встряхиванием в закрытой емкости до появления отчетливого фиолетового окрашивания в верхней водной фазе.
Обработка результатов. Массовую долю алкилдиметилбензиламмоний хлорида X в процентах вычисляют по формуле:
V x 0,00143 x K
X = ————— x 100,
m
где:
V — объем раствора додецилсульфата натрия концентрации с
(C H OSO Na) = 0,004 моль/куб. дм (0,004 н), израсходованный на
12 25 3
титрование, куб. см;
0,0038 — масса алкилдиметилбензиламмоний хлорида, соответствующая
1 куб. см раствора додецилсульфата натрия концентрации точно с
(C H OSO Na) = 0,004 моль/куб. дм (0,004 н), г/куб. см, при средней
12 25 3
молекулярной массе ЧАС 357, г/куб. см;
K — поправочный коэффициент раствора додецилсульфата натрия
концентрации с (Na S O x 5H O) = 0,1 моль/куб. дм (0,1 н);
2 2 3 2
m — масса анализируемой пробы, г.
Данный метод не избирателен в присутствии ПГМГ.
4.2.5. Методы определения производных гуанидина
(солей полигексаметиленгуанидина гидрохлорида
и хлоргексидина биглюконата)
Методы определения полигексаметиленгуанидин гидрохлорида и полигексаметиленгуанидин фосфата. В настоящее время для анализа солей полигексаметиленгуанидина в дезинфицирующих средствах часто используют фотоколориметрический метод с использованием красителя эозина Н. Для анализа солей полигексаметиленгуанидина в составе дезинфицирующих средств разработан также метод двухфазного титрования.
Разные модификации этих методов описаны в инструкциях по применению средств, содержащих соли полигексаметиленгуанидина.
Ниже приведен один из вариантов фотоколориметрической методики анализа полигексаметиленгуанидин гидрохлорида ПГМГ.
Данная методика может быть использована только при отсутствии в составе средства других азотсодержащих органических соединений (ЧАС, аминов и др.).
Сущность метода заключается в фотометрическом определении оптической плотности ионных ассоциатов, образуемых в растворах при взаимодействии ПГМГ с эозином Н.
Приготовление буферного раствора. Готовят два раствора:
Раствор 1 — 0,1 н водный раствор соляной кислоты с использованием фиксанала.
Раствор 2 — 0,75 г глицина и 0,59 г хлористого натрия растворяют в мерной колбе вместимостью 100 куб. см с доведением объема дистиллированной водой до метки.
Для приготовления буферного раствора в мерную колбу вместимостью 100 куб. см вносят 92,5 куб. см раствора 2 и объем жидкости доводят до метки раствором 1. Значение pH буферного раствора должно быть 3,5 +/- 0,1, что необходимо контролировать с помощью pH-метра.
Построение градуировочного графика. График строят в интервале концентраций от 0,4 до 1,6 мкг/куб. см. Для этого в мерные колбы вместимостью 25 куб. см вносят 1, 2, 3 и 4 куб. см раствора, содержащего 10 мкг/куб. см стандартного образца ПГМГ, и доводят объемы во всех колбах до 10 куб. см прибавлением соответственно 9, 8, 7 и 6 куб. см дистиллированной воды. Затем прибавляют 1 куб. см 0,05%-ного водного раствора эозина Н, 10 куб. см глицинового буферного раствора с pH 3,5 и доводят объем дистиллированной водой до метки. После перемешивания растворы фотометрируют относительно образца сравнения при длине волны 540 нм в кюветах с толщиной поглощающего слоя 50 мм.
Образец сравнения готовят внесением в мерную колбу вместимостью 25 куб. см 10 куб. см дистиллированной воды, 1 куб. см 0,05%-ного раствора эозина Н, 10 куб. см буферного раствора с доведением объема дистиллированной водой до метки.
Выполнение анализа. Навеску средства, содержащую 20 — 30 мг ПГМГ, разводят или растворяют в мерной колбе вместимостью 100 куб. см с доведением объема дистиллированной водой до метки.
1 куб. см приготовленного раствора разводят дистиллированной водой в мерной колбе вместимостью 100 куб. см до метки. Берут 10 куб. см раствора второго разведения, вносят в мерную колбу вместимостью 25 куб. см и далее прибавляют раствор эозина Н, буферный раствор и проводят определение оптической плотности в указанных выше для построения градуировочного графика условиях.
Обработка результатов. Массовую долю ПГМГ X в процентах вычисляют по формуле:
C x V x P x 100 C x 2,5
X = ————— = ——-,
-6
m x 10 m
где:
-6
C / 10 — концентрация ПГМГ, обнаруженная по градуировочному графику в
анализируемой пробе, г/куб. см;
V — объем раствора анализируемой пробы, равный 100 куб. см;
P — кратность разведения раствора анализируемой пробы, равная 250 куб. см;
m — масса анализируемой пробы, г.
Методы определения полигексаметиленбигуанидина гидрохлорида. Полигексаметиленбигуанидин гидрохлорид, называемый бигуанидом, олигомером бигуанида или полигексаметиленбигуанидом, может быть количественно определен фотоколориметрически по методике, описанной выше для солей полигексаметиленгуанидина.
Кроме того, для его анализа может быть использован спектрофотометрический метод с проведением измерений при длине волны 233 — 237 нм.
Методы определения хлоргексидина биглюконата. Количественное определение хлоргексидина биглюконата в дезинфицирующих средствах проводят с использованием следующих методов: метода безводного титрования хлорной кислотой, фотоколориметрического метода, основанного на окрашивании хлоргексидина биглюконата гипобромитом натрия, спектрофотометрического метода и метода ВЭЖХ. Описание последних двух методов дается в ряде инструкций по применению дезинфицирующих средств.
Приводим описание спектрофотометрического метода анализа хлоргексидина биглюконата.
Выполнение анализа. Навеску средства, содержащую около 1 мг хлоргексидина биглюконата, помещают в мерную колбу вместимостью 100 куб. см, объем доводят дистиллированной водой до метки и перемешивают.
Измеряют оптическую плотность полученного раствора на спектрофотометре при длине волны 253 нм в кювете с толщиной поглощающего слоя 1 см.
В качестве раствора сравнения используют дистиллированную воду.
Обработка результатов. Массовую долю хлоргексидина биглюконата X в процентах вычисляют по формуле:
D x 100
X = ——-,
330 x m
где:
D — оптическая плотность испытуемого раствора;
330 — удельный показатель поглощения хлоргексидин биглюконата;
m — масса анализируемой пробы, г.
4.2.6. Методы определения третичного алкиламина —
N,N-бис(3-аминопропил)-додециламина
Для количественного определения указанного третичного алкиламина в дезинфицирующих средствах используют метод кислотно-основного титрования, в т.ч. потенциометрическое титрование в спиртовой среде. Кроме того, могут быть использованы метод неводного титрования хлорной кислотой в присутствии индикатора кристаллического фиолетового и метод ГЖХ.
В случае отсутствия в средствах кислых и щелочных компонентов анализ третичного амина проводят описанным ниже методом кислотно-основного титрования в водной среде.
Сущность метода заключается в титровании амина раствором соляной кислоты, с которой амин реагирует с образованием соответствующей соли.
Выполнение анализа. В титровальную колбу вносят навеску средства, содержащую около 100 мг третичного амина, доводят объем дистиллированной водой до 30 куб. см, вносят 1,0 куб. см 0,1%-ного водного раствора индикатора бромтимолового синего и титруют 0,1 н раствором соляной кислоты до перехода синей окраски в желтую.
Обработка результатов. Массовую долю N,N-бис(3-аминопропил)-додециламина (X) в процентах вычисляют по формуле:
V x 0,00998 x K
X = ————— x 100,
m
где:
V — объем раствора соляной кислоты концентрации с HCl = 0,1 моль/куб. дм (0,1 н), израсходованный на титрование, куб. см;
0,00998 — масса N,N-бис3-аминопропилдодециламина, соответствующая 1 куб. см раствора соляной кислоты концентрации точно с HCl = 0,1 моль/куб. дм (0,1 н), г/куб. см;
K — поправочный коэффициент раствора соляной кислоты с HCl = 0,1 моль/куб. дм (0,1 н);
m — масса анализируемой пробы, г.
4.2.7. Методы определения низших жирных спиртов
этилового, изопропилового и н-пропилового
Для анализа низших жирных спиртов каждого в отдельности и их смесей используют газохроматографические методы, в основе которых лежит метод, описанный для парфюмерно-косметических изделий [32].
Количественная оценка спиртов — методом «внутреннего эталона», в качестве которого для этилового и изопропилового спиртов может быть использован н-пропиловый спирт, для н-пропилового спирта — изопропиловый или этиловый спирт.
Средства измерений. Хроматограф лабораторный газовый с пламенно-ионизационным детектором; колонка из нержавеющей стали длиной 200 см и внутренним диаметром 0,3 см, насадка — полисорб-1 с частицами размером 0,1 — 0,3 мм.
Условия хроматографирования
Газ-носитель азот
Температура термостата 30 °C
Температура испарителя 200 °C
Температура детектора 200 °C
-8
Предел измерения по току, А 5 x 10
Объемный расход газа-носителя, куб. см/мин. 40
Объемный расход водорода, куб. см/мин. 60
Объемный расход воздуха, куб. см/мин. 300
Скорость движения ленты самописца, мм/ч 240
-3
Объем пробы (0,6 — 1,0) см .
Определение калибровочного коэффициента. Готовят две искусственные смеси взвешиванием равных количеств анализируемого спирта и внутреннего эталона. Каждую из них хроматографируют 10 раз.
Относительный калибровочный коэффициент рассчитывают по формуле:
m x S
эт
K = ——-,
m x S
эт
где:
m и m — массы определяемого спирта и внутреннего эталона с учетом
эт
чистоты, г;
S и S — площади пиков определяемого спирта и внутреннего эталона,
эт
кв. мм.
Выполнение анализа. К анализируемому образцу прибавляют внутренний
эталон в количестве, примерно равном определяемому компоненту. Готовят две
пробы анализируемого образца и каждую из них хроматографируют 3 раза.
Обработка результатов. Массовую долю спирта X в процентах вычисляют по
формуле:
m x S x K
эт
X = ———— x 100,
m x S
эт
где:
m — масса анализируемого образца, г;
m — масса внутреннего эталона с учетом чистоты, г;
эт
S — площадь пика определяемого спирта, кв. мм;
S — площадь пика внутреннего эталона, кв. мм;
эт
K — относительный калибровочный коэффициент.
Для количественной оценки спиртов применяют также метод абсолютной градуировки.
4.2.8. Метод определения соединений фенольного ряда
[2-бифенилола, 2-бензил-4-хлорфенола,
5-хлор-2-гидроксидифенил-метана,
5-хлор-2-2,4-дихлорфеноксифенола] и др.
Для определения о-фенилфенола, о-бензил-р-хлорфенола, 2-феноксиэтанола, 2-феноксипропанола, 5-хлор-2(2,4-дихлорфенокси)фенола триклозана в дезинфицирующих средствах могут быть применены спектрофотометрические и хроматографические методы в зависимости от состава и концентраций ДВ, а также вспомогательных веществ рецептурного состава средства.
Спектрофотометрические методы определения фенольных соединений проводят с прямым определением вещества по собственному поглощению или в виде окрашенных комплексов.
Спектрофотометрический метод определения фенольных соединений по собственному поглощению основан на измерении оптической плотности раствора средства при длине волны 260 — 290 нм относительно растворителя с применением градуировочного графика или молярных и удельных коэффициентов погашения.
Метод может быть применен для серийного анализа в условиях производства.
Метод не избирателен в присутствии компонентов рецептурного состава средства, поглощающих в указанной области длин волн, несколько фенольных соединений при совместном присутствии определяются суммарно.
Подготовка пробы к анализу зависит от рецептурного состава средства.
Так при определении о-фенилфенола по собственному поглощению в дезинфицирующем средстве на основе водного раствора пропилового и этилового спиртов пробу готовят разбавлением средства в этиловом спирте [21] и измеряют оптическую плотность при длине волны 286 нм, раствор сравнения — этиловый спирт.
При определении триклозана по собственному поглощению в антибактериальном туалетном мыле подготовка пробы включает экстракционное извлечение триклозана гексаном [22] для устранения мешающего влияния компонентов рецептурного состава, измерение оптической плотности проводят при длине волны 286 нм, раствор сравнения — гексан.
В случае совместного присутствия в дезинфицирующем средстве наряду с фенольными соединениями другого ДВ, характеризующегося значительно меньшими, чем у фенольных ДВ коэффициентами погашения, например 2-феноксипропанола и катионных ПАВ с ароматическими циклами, применяют большое разбавление исследуемого раствора (от 1:100 до 1:5000) [1].
Спектрофотометрическое определение триклозана в антибактериальном мыле может быть проведено по поглощению окрашенных продуктов его взаимодействия с 4-аминоантипирином в присутствии гексацианоферрата калия при лямбда = 490 нм [21]. При этом градуировочные смеси для построения градуировочного графика необходимо готовить путем добавления известных количеств триклозана в водный раствор такого мыла, не содержащего триклозан. При использовании градуировочного графика в координатах «оптическая плотность — содержание вещества в аликвотной части раствора, мкг» массовую долю определяемого ДВ (X, %) вычисляют по формуле общего вида:
-3
a x 10 x V
1
X = ————- x 100,
m
где:
a — содержание ДВ в аликвотной части раствора, найденное по
градуировочному графику, мг;
-3
10 — фактор пересчета из мг в г;
V — объем раствора средства или экстракта, мл;
1
m — масса средства, взятая на анализ, г.
При использовании значений молярных (эпсилон ) или удельных
лямбда
лямбда %
(эпсилон ) коэффициентов погашения массовую долю определяемого ДВ X,
лямбда
% вычисляют по формуле общего вида:
D x M x V x V
лямбда 1 3
X = ——————— x 100,
эпсилон x V x m x l
2
где:
D — оптическая плотность анализируемого раствора при длине волны
лямбда
лямбда, нм;
M — молярная масса определяемого вещества ДВ, г/моль;
V — объем раствора или экстракта, мл;
1
V — объем фотометрируемого раствора, л;
3
эпсилон — молярный коэффициент (эпсилон ), г/моль x см, или
лямбда
лямбда %
удельный коэффициент (эпсилон ) погашения для определяемого вещества
лямбда
ДВ при длине волны лямбда;
m — масса средства, взятая для анализа, г;
V — объем отобранной аликвотной части раствора или экстракта, л;
2
l — толщина поглощающего слоя кюветы, см.
В [19, 21] приведены оценочные значения молярных коэффициентов
погашения некоторых фенольных соединений при длине волны измерения лямбда,
эпсилон , л/моль x см: о-фенилфенол эпсилон = 11000;
лямбда 289
о-бензил-р-хлорфенол эпсилон = 5300; 5-хлор-2(2,4-дихлорфенокси)-фенол
285
эпсилон = 4500; 2-феноксипропанол эпсилон = 2000.
280 270
Приборы, реактивы и растворы. Для выполнения анализа применяют спектрофотометр СФ-26, СФ-46; электрофотоколориметр типа КФК-2, стандартную стеклянную мерную посуду, весы аналитические; примененный растворитель, реактивы для получения окрашенных соединений.
Хроматографические методы определения фенольных соединений. Проблемы анализа фенольных соединений, в т.ч. раздельного определения нескольких фенольных соединений при совместном присутствии, успешно решаются методами ГЖХ с применением пламенно-ионизационного детектирования и ВЭЖХ с применением спектрофотометрического детектирования. Современные хроматографы, снабженные программой управления, сбора и обработки хроматографических данных на базе персонального компьютера, позволяют достаточно быстро подбирать оптимальные условия анализа, гибко изменять программу температурных условий хроматографирования или создавать градиентный режим элюирования, проводить обработку хроматограмм в расширенном диапазоне концентраций определяемых веществ.
При анализе фенольных соединений методом ВЭЖХ применяют хроматографические колонки для обращенно-фазной ВЭЖХ типа Zorbax ODS, Zorbax Eclipse — XDB C8 3,5 мкм, Nucleosil 100 10 C18, LiChrospher 100 RP 18 5 мкм, Intersil ODS-2 и др. В качестве подвижной фазы наиболее часто используют: для изократического хроматографирования — растворы в соотношении по объему метанол:вода (90:10), ацетонитрил:вода (35:65), ацетонитрил:0,2%-ный водный раствор ортофосфорной кислоты (68:32); для градиентного хроматографирования элюенты — метанол и 0,2%-ный водный раствор хлорной кислоты, ацетонитрил и 1%-ный водный раствор уксусной кислоты, ацетонитрил и 0,2%-ный водный раствор ортофосфорной кислоты и др.
Для разделения фенольных соединений в ГЖХ применяют насадочные стандартные колонки длиной 1 м, внутренним диаметром 0,2 — 0,4 мм, в качестве неподвижной фазы используют СКТФ и силиконы SE-30 и XE-60, при содержании 3 — 5% к весу твердого носителя — силанизированного хроматона N-AW-DMCS и инертона AW-DMCS, зернением 0,20 — 0,25 мм, для анализа 2-феноксипропанола и 2-феноксиэтанола известно использование в качестве сорбента также карбосфера, пропитанного 0,1%-м AT-100 и др.
Разделение смеси действующих веществ 4-хлор-3-метилфенола и о-фенилфенола и глутарового альдегида получено на капиллярной колонке (50 м x 0,32 мм) с неподвижной фазой CP Sil 5 CB, толщиной слоя 1,2 мкм в режиме программирования температуры от 100 до 250 °C при скорости нагрева 10 °C/мин.; время удерживания глутарового альдегида составило 6,4 мин., 4-хлор-3-метилфенола 13,4 мин. и о-фенилфенола 16,8 мин.
Выбор режима хроматографирования — изотермического или программирования температуры — зависит от содержания, состава ДВ, а также вспомогательных компонентов рецептурного состава дезинфицирующего средства.
Количественную оценку определяемого вещества проводят с использованием абсолютной градуировки, которая целесообразна для выборочного единичного анализа, или с применением внутреннего эталона, рекомендуемого при выполнении массовых рутинных анализов, например в условиях производственного контроля.
Газохроматографическое определение 2-феноксиэтанола в кожном антисептике в виде геля [23] проводят с применением пламенно-ионизационного детектирования, изотермического хроматографирования раствора пробы после разрушения структуры геля и использованием абсолютной градуировки или внутреннего эталона, в качестве которого применяют 1-тетрадеканол (спирт тетрадециловый).
Приборы, реактивы и растворы. Газовый хроматограф, снабженный пламенно-ионизационным детектором, стандартной колонкой (1 м x 3 мм), заполненной силанизированным хроматоном N-AW-DMCS с 5% неподвижной фазы XE-60; стандартная стеклянная мерная посуда; микрошприц типа МШ вместимостью 1 мкл; спирт этиловый ректификованный с объемной долей не менее 96%; аналитический стандарт 2-феноксиэтанола; 1-тетрадеканол; газ-носитель — азот, водород из баллона, воздух от компрессора.
Выполнение анализа. К 50 г анализируемого средства добавляют около 0,25 г хлористого натрия, смесь перемешивают и образовавшийся раствор отфильтровывают через бумажный фильтр. Около 20 г фильтрата взвешивают с точностью до четвертого десятичного знака, добавляют 5 мл раствора тетрадецилового спирта и после перемешивания вводят в хроматограф.
Градуировочные смеси и анализируемую пробу хроматографируют при следующих условиях: расход газов — азот 45 мл/мин., водород 30 мл/мин., воздух 300 мл/мин.; температура колонки (140 +/- 3) °C, испарителя 250 °C; объем вводимой дозы 1 мкл.
Приготовление градуированных смесей с внутренним эталоном. Для определения градуировочного коэффициента 2-феноксиэтанола по веществу — внутреннему эталону готовят три градуировочные смеси и раствор вещества-эталона: 0,14, 0,17 и 0,20 г 2-феноксиэтанола растворяют в 20 г этилового спирта; 4 г тетрадецилового спирта растворяют в 100 мл этилового спирта в мерной колбе. Результаты взвешиваний записывают с точностью до четвертого десятичного знака. К каждой градуировочной смеси 2-феноксиэтанола добавляют по 5 мл раствора тетрадецилового спирта, тщательно перемешивают и вводят в хроматограф не менее трех раз. Из каждой хроматограммы определяют площадь хроматографических пиков 2-феноксиэтанола, тетрадецилового спирта в градуировочной смеси и вычисляют градуировочный коэффициент K по формуле:
m x S
эт
K = ——-,
m x S
эт
где:
m — масса 2-феноксиэтанола в градуировочной смеси, г;
m — масса вещества-эталона в 5 мл раствора тетрадецилового спирта, г;
эт
S и S — площади пиков 2-феноксиэтанола и вещества-эталона.
эт
За градуировочный коэффициент (K) принимают среднее арифметическое
результатов всех определений, расхождения которых от средней величины не
превышают 20%.
Обработка результатов. Массовую долю 2-феноксиэтанола в средстве X, %
вычисляют по формуле:
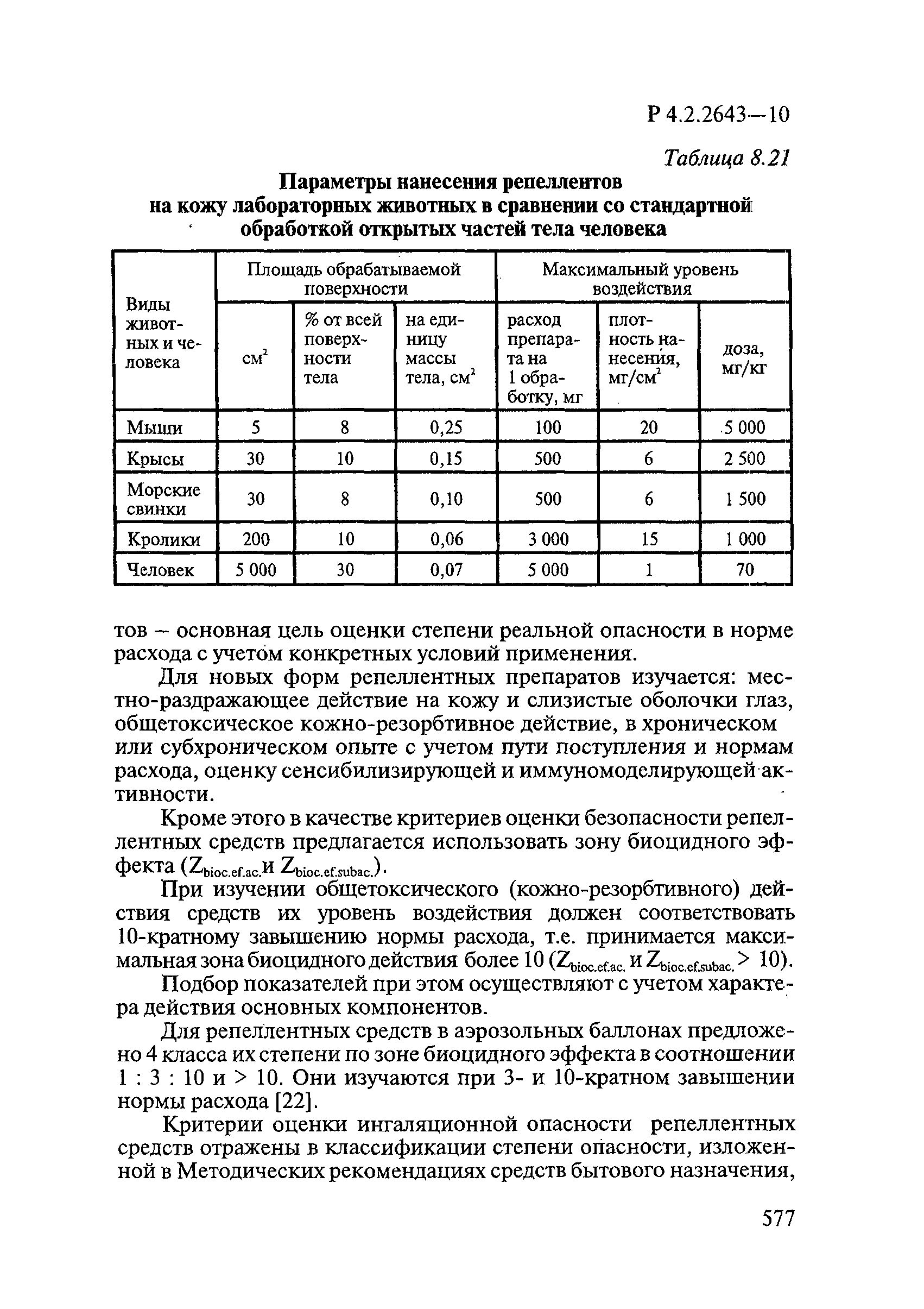
m x S x K
эт
X = ———— x 100,
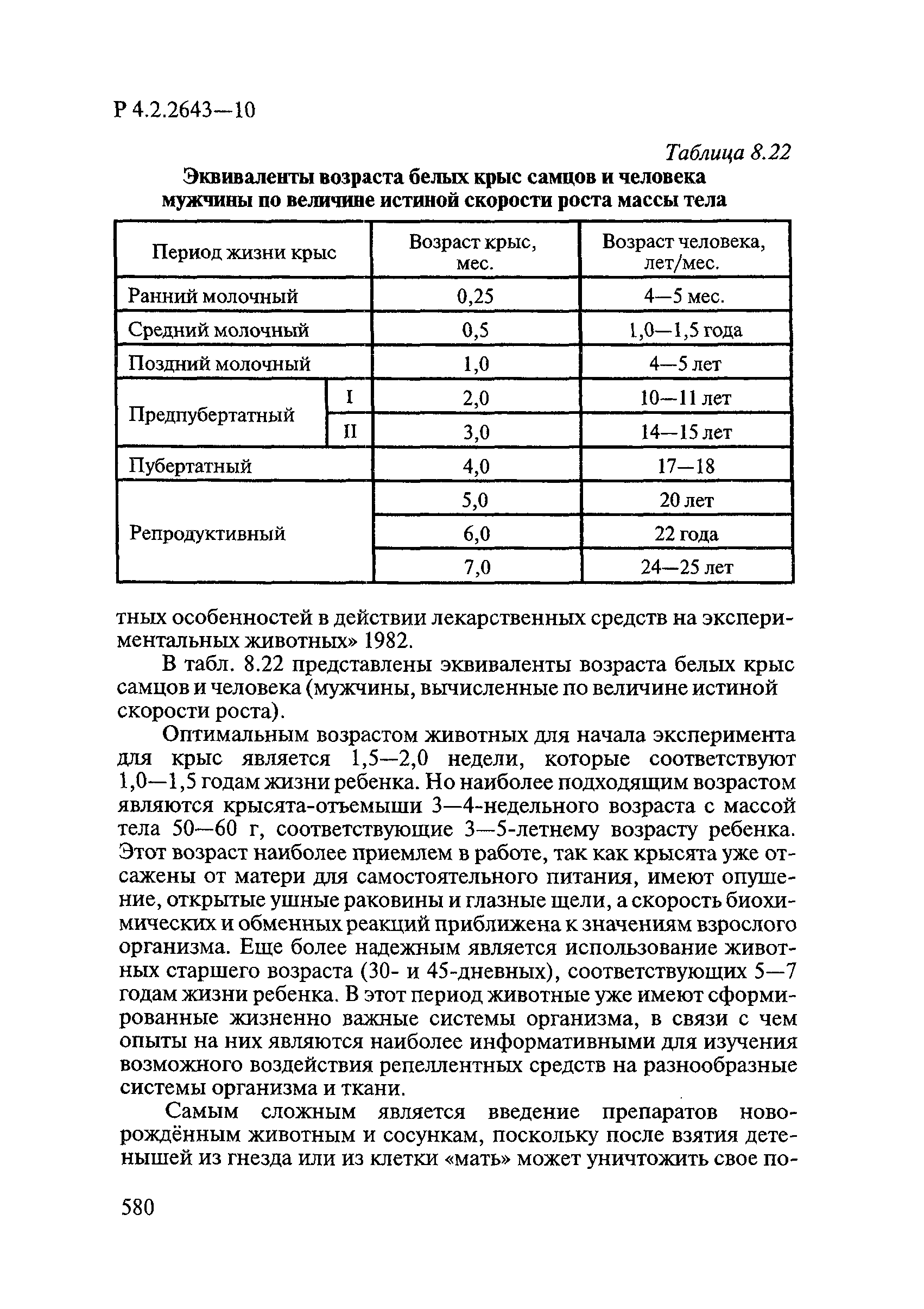
m x S
эт
где:
K — градуировочный коэффициент 2-феноксиэтанола;
S и S — площади пиков 2-феноксиэтанола и вещества-эталона в
эт
анализируемой пробе;
m и m — масса средства, взятая на анализ, и масса вещества-эталона в
эт
5 мл раствора тетрадецилового спирта, г.
Газохроматографическое определение о-фенилфенола и о-бензил-р-хлорфенола, 3-метил-4-хлорфенола с применением пламенно-ионизационного детектирования, хроматографирования в режиме программирования температуры и использованием абсолютной градуировки.
Приборы, реактивы и растворы. Газовый хроматограф снабженный пламенно-ионизационным детектором, стандартной колонкой (1 м x 3 мм), заполненной силанизированным хроматоном N-AW-DMCS с 5% неподвижной фазы XE-60; стандартная стеклянная мерная посуда; микрошприц типа МШ вместимостью 1 мкл; ацетон; аналитические стандарты о-фенилфенола и о-бензил-р-хлорфенола; азот из баллона, водород из баллона, воздух от компрессора.
Выполнение анализа [24]. Около 3,3 г средства, взвешенного с точностью до четвертого десятичного знака, растворяют в ацетоне в мерной колбе вместимостью 25 мл и после перемешивания вводят в хроматограф.
Градуировочные смеси и анализируемую пробу хроматографируют при следующих условиях. Расход газов: азот 30 — 40 мл/мин., водород 25 — 30 мл/мин., воздух 250 — 300 мл/мин.; температура испарителя и детектора 250 °C; температура колонки начальная 70 °C, нагрев со скоростью 15 °C/мин. до 190 °C; объем вводимой дозы 1 мкл. Порядок выхода определяемых веществ: о-бензил-р-хлорфенол, о-фенилфенол.
Градуировочные смеси готовят с массовой концентрацией по 4 — 4,5 мг/мл о-фенилфенола и о-бензил-р-хлорфенола в ацетоне.
Обработка результатов. Массовую долю определяемого вещества в средстве X, % вычисляют по формуле:
S x C x a x V
гс
X = —————,
S x m
гс
где:
S и S — площади хроматографических пиков определяемого вещества в
гс
анализируемой пробе и градуировочной смеси;
C — массовая концентрация аналитического стандарта определяемого
гс
вещества в градуировочной смеси, мг/мл;
a — массовая доля основного вещества в аналитическом стандарте, %;
V — объем раствора пробы, мл;
m — масса средства, взятая на анализ, мг.
4.2.9. Метод определения кислот и щелочей
Количественное определение кислот и щелочей проводят методом кислотно-основного титрования с использованием индикаторов кислотно-основного титрования, из которых наиболее часто применяются метиловый оранжевый, фенолфталеин, метиловый красный, бромфеноловый синий и др.
Приводится обобщенный метод количественного определения кислот на примере серной кислоты.
Сущность метода — в проведении реакции нейтрализации серной кислоты щелочью путем титрования раствором гидроокиси натрия в присутствии индикаторов кислотно-основного титрования.
Выполнение анализа. Навеску средства, содержащую около 50 мг серной кислоты, помещают в коническую колбу, прибавляют дистиллированную воду до 30 куб. см, необходимый объем раствора индикатора и титруют 0,1 н раствором гидроокиси натрия до соответствующего перехода окраски индикатора.
Обработка результатов. Массовую долю серной кислоты X в процентах вычисляют по формуле:
V x 0,0049 x K
X = ————— x 100,
m
где:
V — объем раствора гидроксида натрия концентрации с NaOH = 0,1 моль/куб. дм (0,1 н), израсходованный на титрование, куб. см;
0,0049 — масса серной кислоты, соответствующая 1 куб. см раствора гидроокиси натрия концентрации точно с NaOH = 0,1 моль/куб. дм 0,1 н, г/куб. см;
K — поправочный коэффициент раствора гидроокиси натрия концентрации с NaOH = 0,1 моль/куб. дм (0,1 н);
m — масса анализируемой пробы, г.
Приводится обобщенный метод количественного определения щелочей на примере гидроокиси натрия.
Сущность метода в проведении реакции нейтрализации гидроокиси натрия кислотой путем титрования 0,1 н водным раствором соляной кислоты в присутствии индикаторов кислотно-основного титрования.
Выполнение анализа. Навеску средства, содержащую около 40 мг щелочи, помещают в коническую колбу, прибавляют дистиллированную воду до 30 куб. см, необходимый объем раствора индикатора и титруют 0,1 н раствором соляной кислоты до соответствующего перехода окраски индикатора.
Обработка результатов. Массовую долю гидроокиси натрия X в процентах вычисляют по формуле:
V x 0,0040 x K
X = ————— x 100,
m
где:
V — объем раствора соляной кислоты концентрации с HCl = 0,1 моль/куб. дм (0,1 н), израсходованный на титрование, куб. см;
0,0040 — масса гидроокиси натрия, соответствующая 1 куб. см раствора соляной кислоты концентрации точно с HCl = 0,1 моль/куб. дм 0,1 н, г/куб. см;
K — поправочный коэффициент раствора соляной кислоты концентрации с HCl = 0,1 моль/куб. дм 0,1 н;
m — масса анализируемой пробы, г.
4.2.10. Методы анализа анионных и неионогенных ПАВ
Количественное определение анионных ПАВ проводят с использованием метода двухфазного титрования в присутствии смешанного индикатора метиленового голубого и эозина БА или эозина Н, а также фотоколориметрическим методом, основанным на образовании окрашенного комплекса с азуром 1 с фотоколориметрическим измерением оптической плотности его хлороформного экстракта, согласно ГОСТам на указанные методы [39].
Для анализа неионогенных ПАВ (оксиэтилированных высших спиртов и алкилфенолов) может быть использован метод, сущность которого в осаждении неионогенного ПАВ избытком фосфорномолибденовой кислоты и последующим потенциометрическим титрованием ее избытка раствором диантипирилметана с катодно-поляризованным платиновым электродом [40].
4.2.11. Методы анализа метасиликата натрия
Анализ метасиликата натрия проводят фотоколориметрическим методом, основанным на образовании окрашенного комплекса с молибденовокислым аммонием и гравиметрическим методом, сущность которого в осаждении кремниевой кислоты с определением ее массы. Описание этих методов приводится в ГОСТах на методы анализа силиката натрия [25].
4.3. Методы исследования дезинсекционных средств
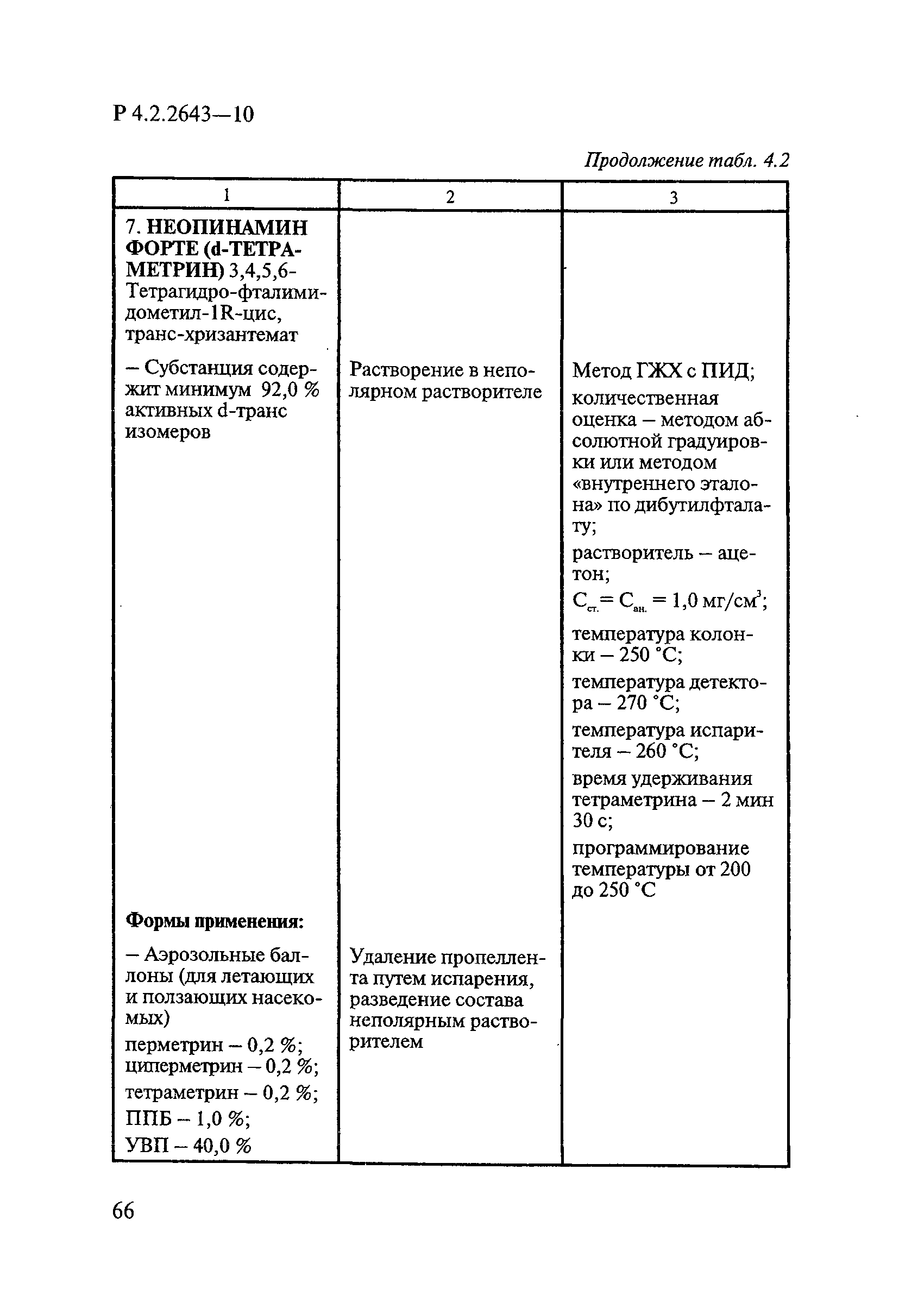
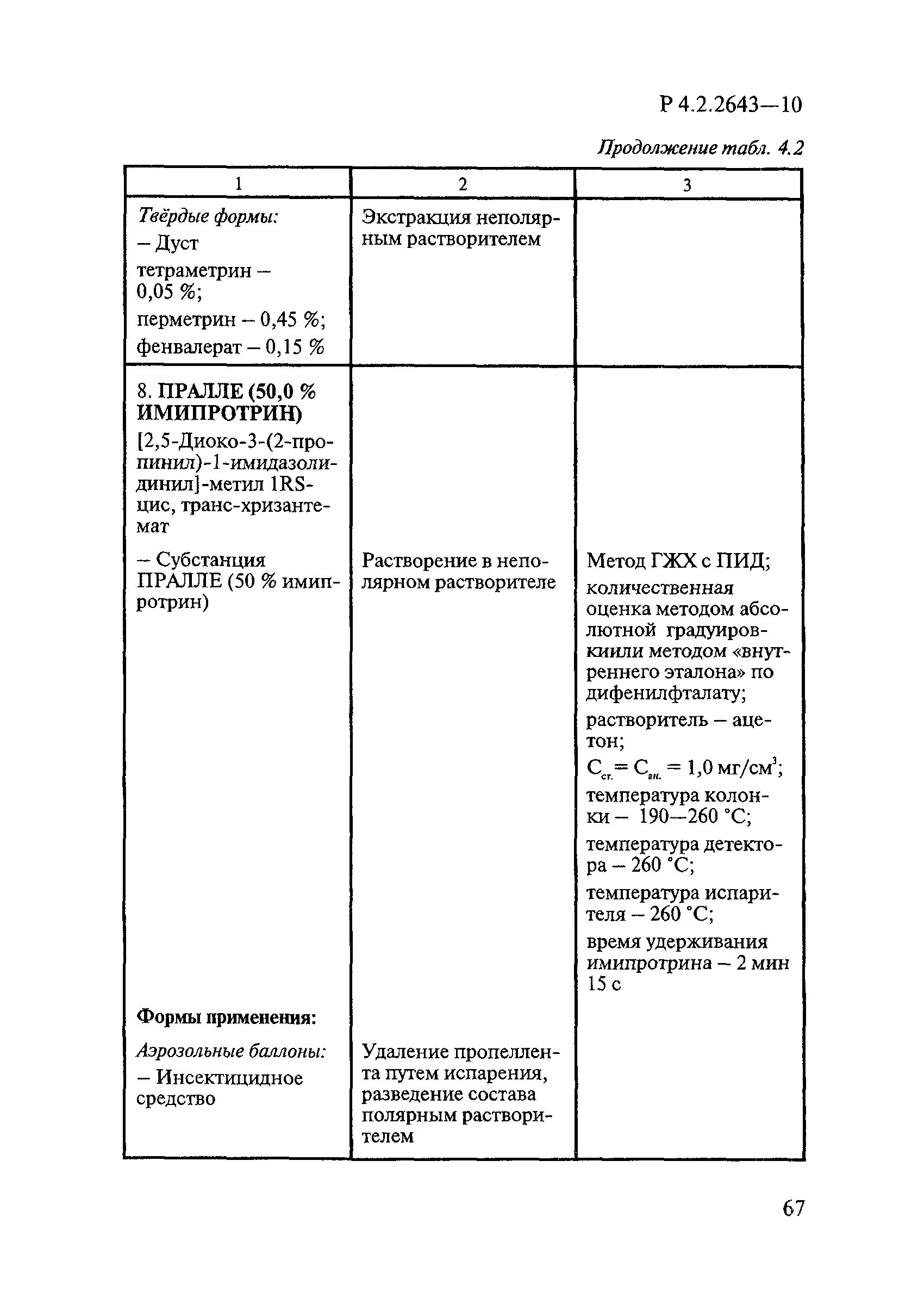
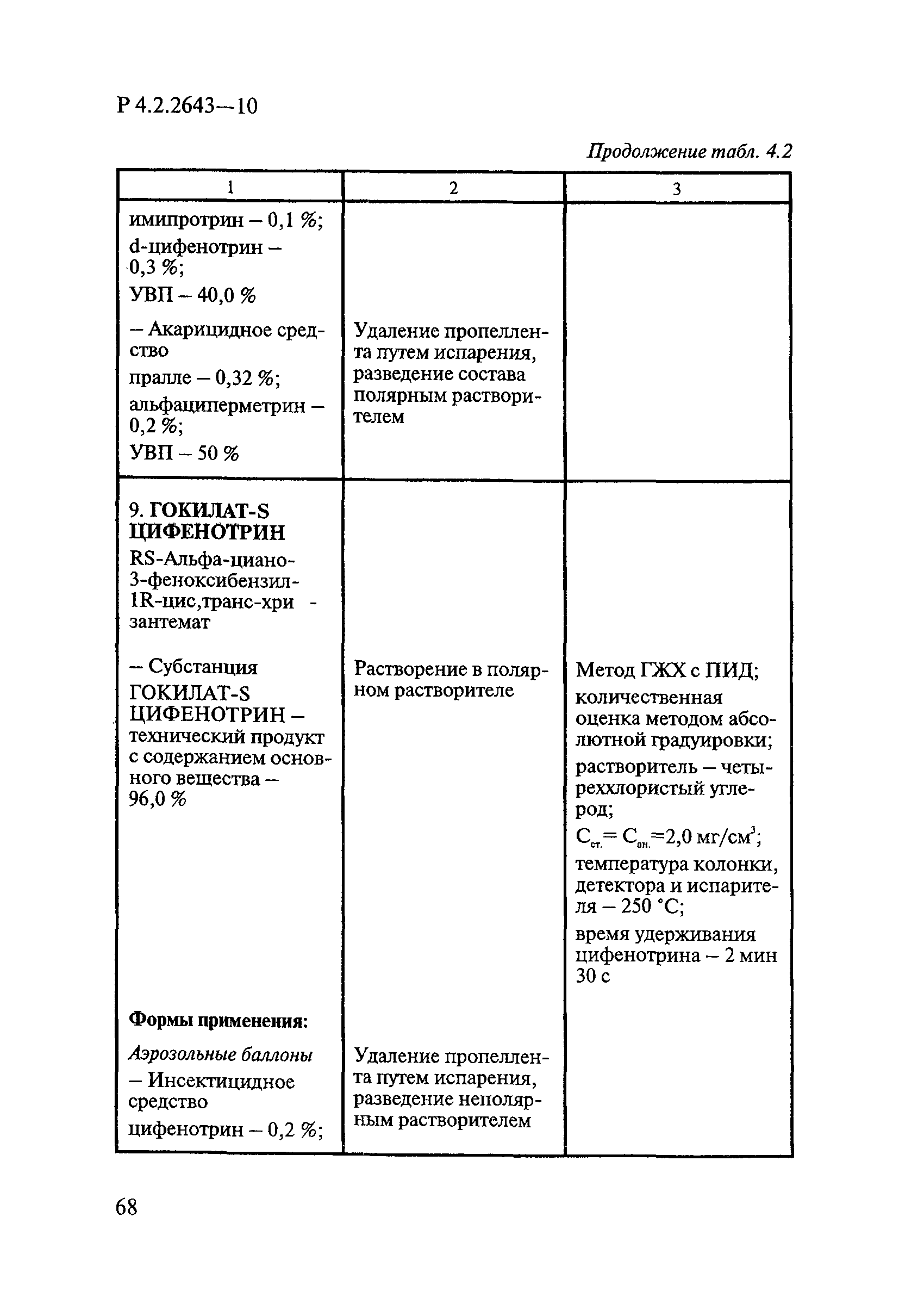
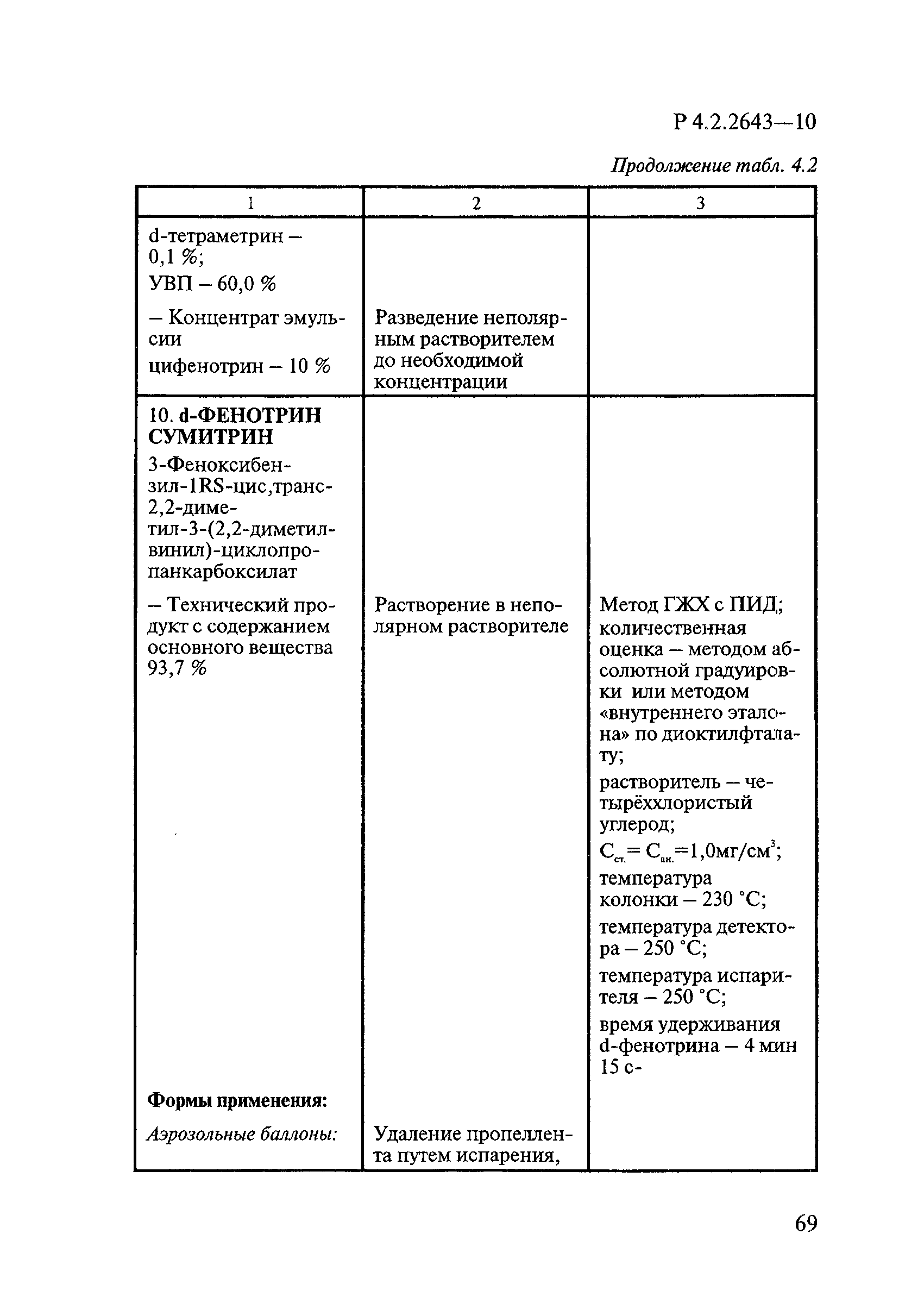
Дезинсекционные средства включают инсектицидные, акарицидные, инсектоакарицидные и репеллентные средства.
В инсектицидных средствах в качестве действующих веществ ДВ используют пиретроиды, фосфорорганические соединения ФОС, карбаматы, регуляторы развития насекомых и некоторые вещества из других классов химических соединений в основном сложного химического строения, например фипронил, тиаметоксам, имидаклоприд, гидраметилнон.
В акарицидных и инсектоакарицидных средствах в качестве ДВ применяют пиретроиды и фосфорорганические соединения.
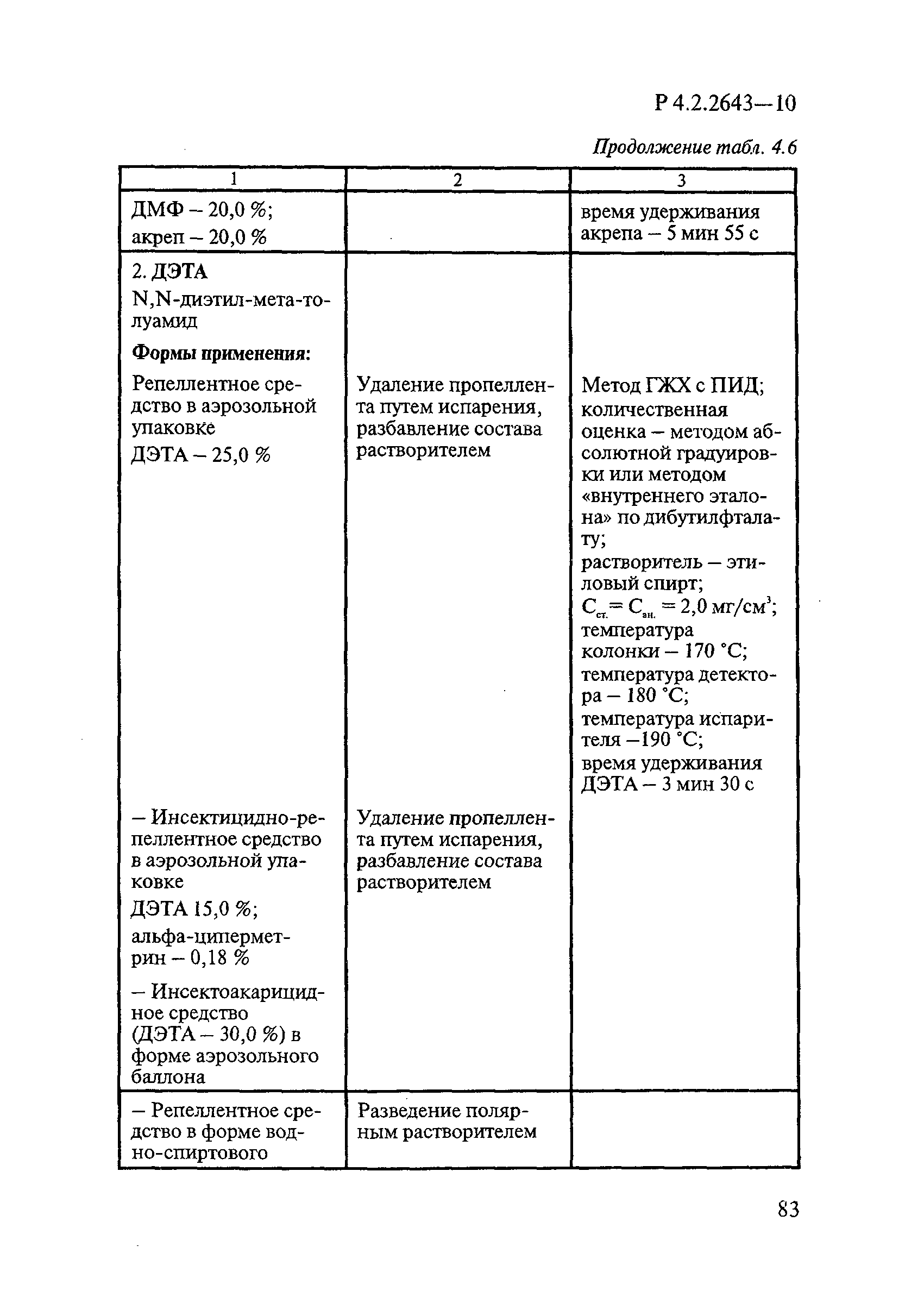
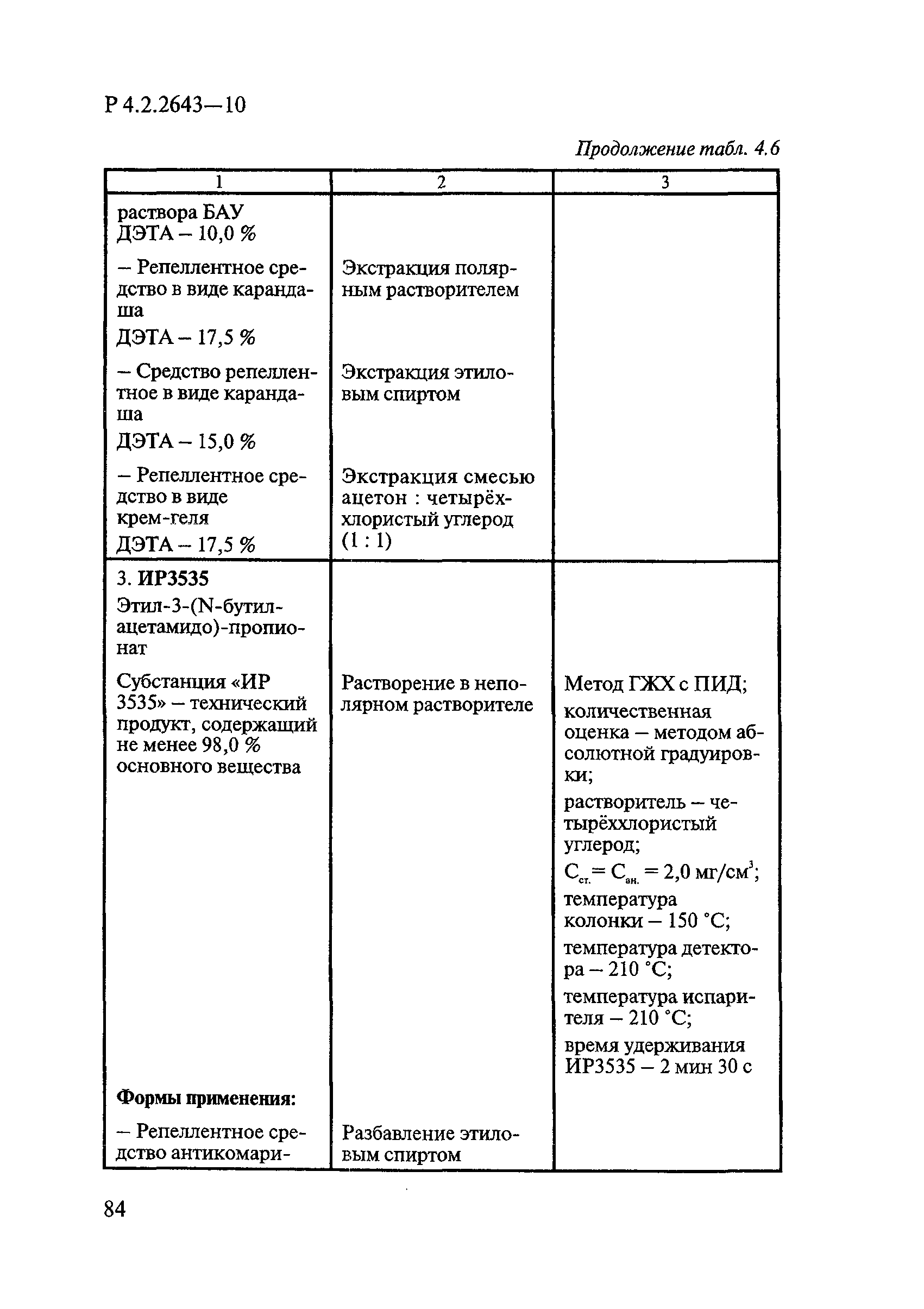
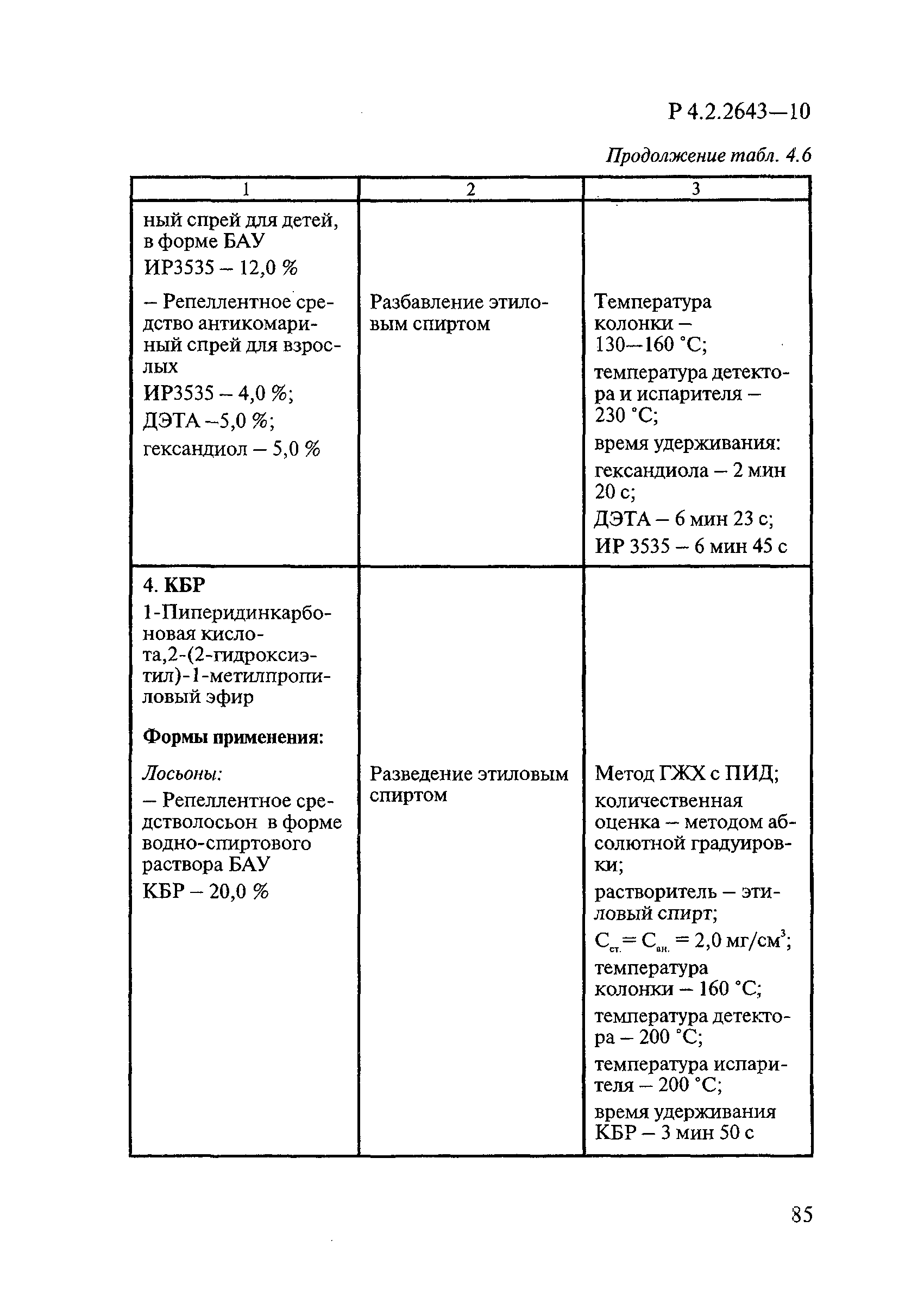
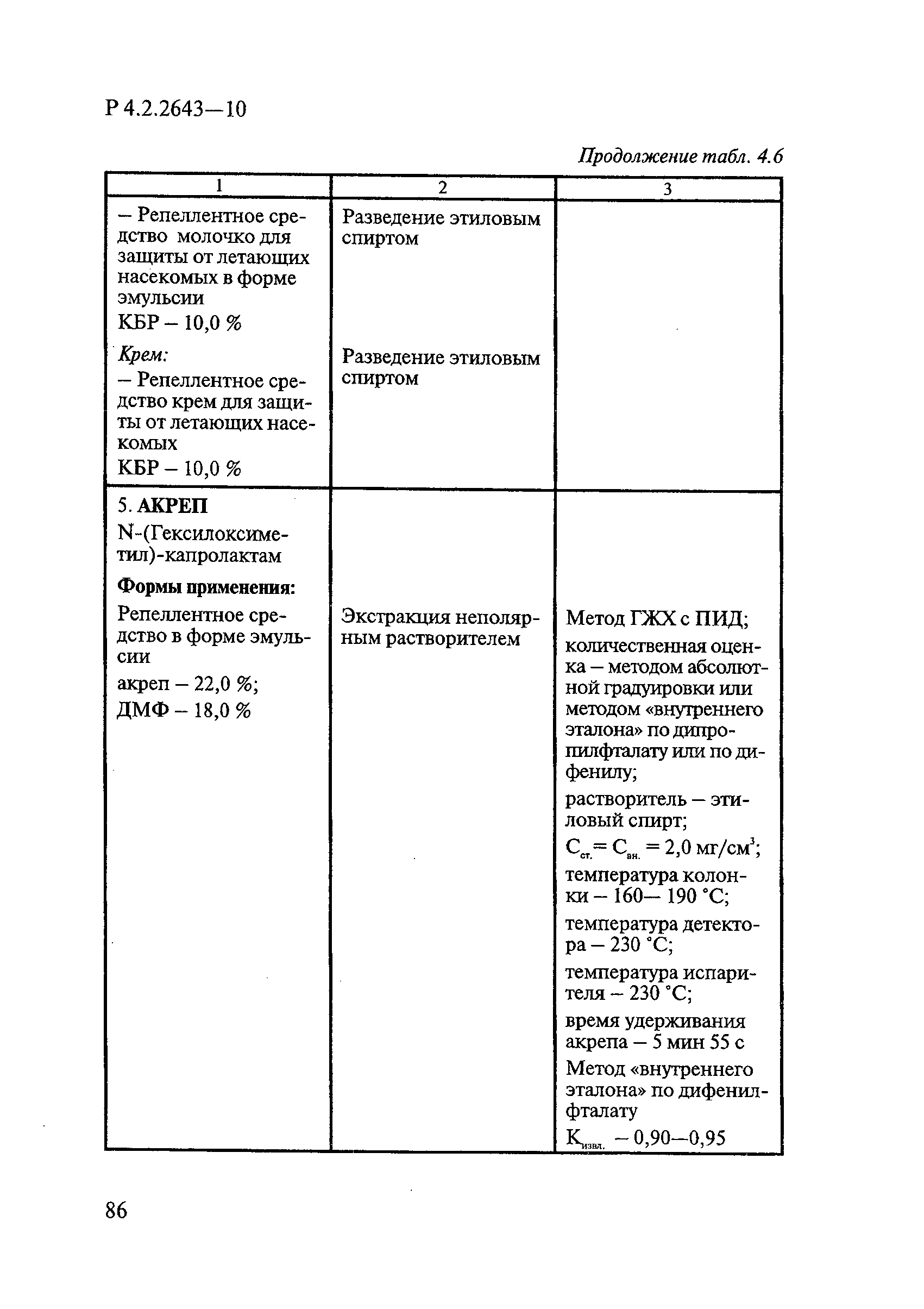
В репеллентных средствах действующими веществами в основном являются диметилфталат, N,N-диэтил-м-толуамид ДЭТА и этил-3-N-бутил-ацетамино-пропионат ИР3535.
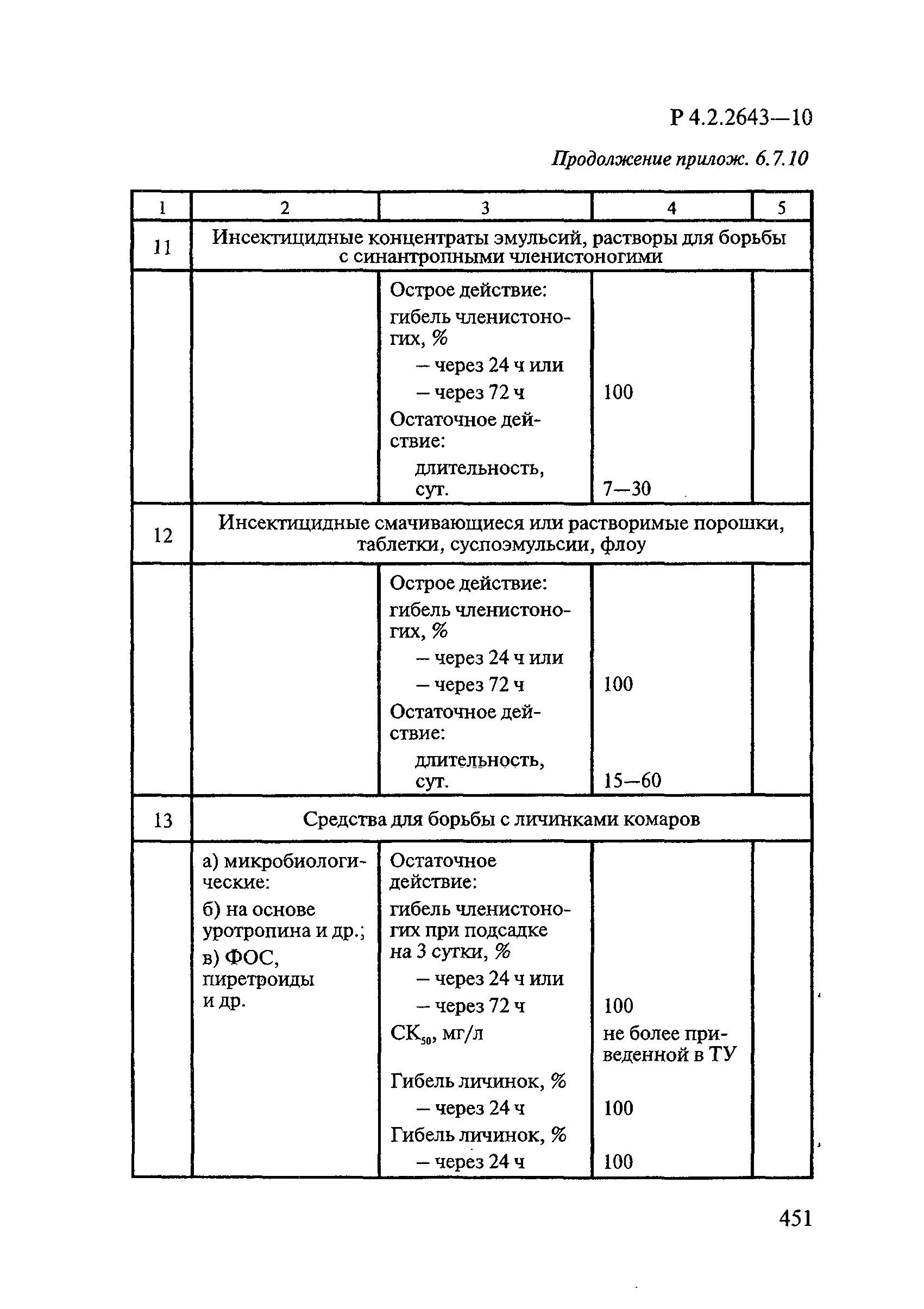
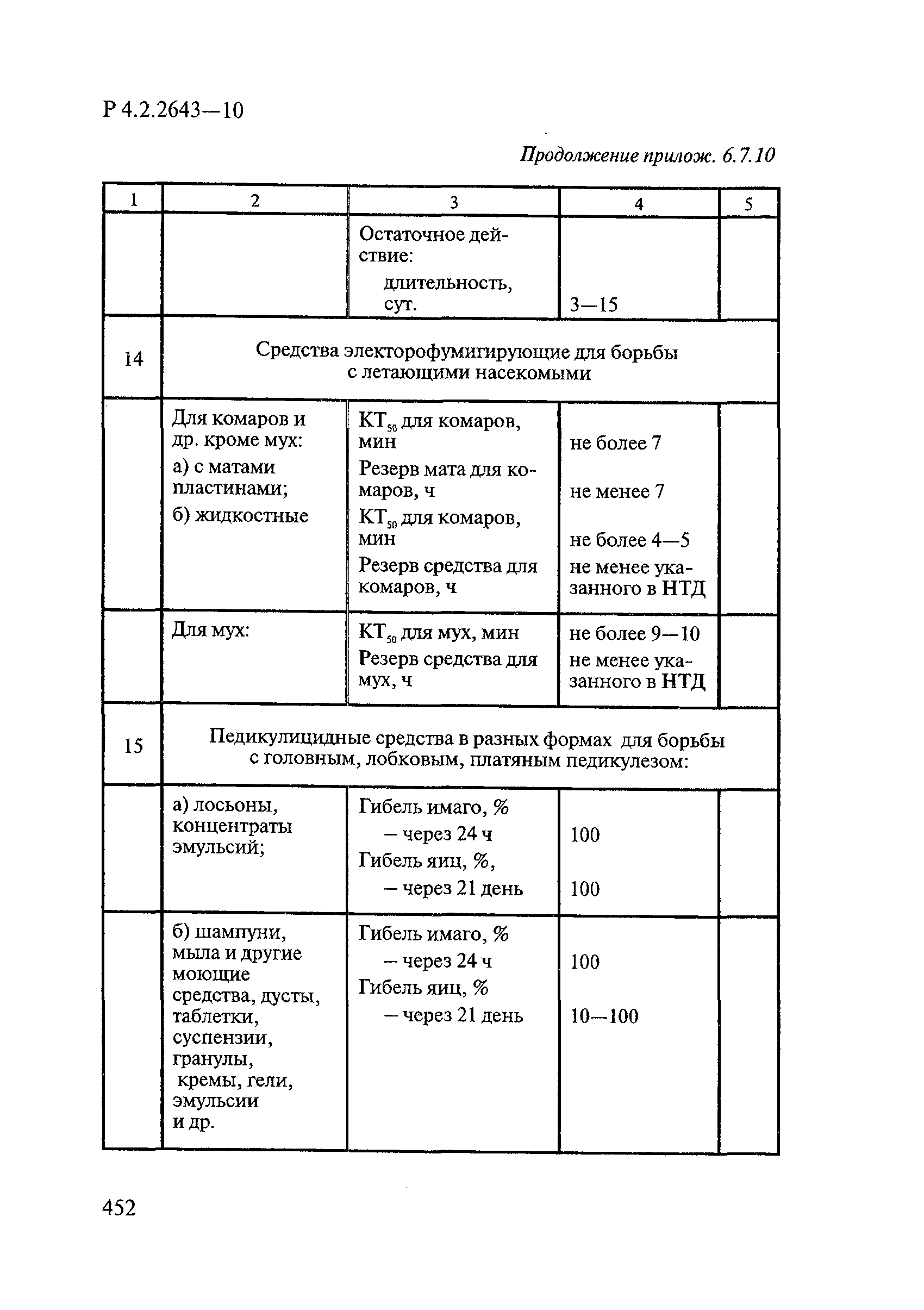
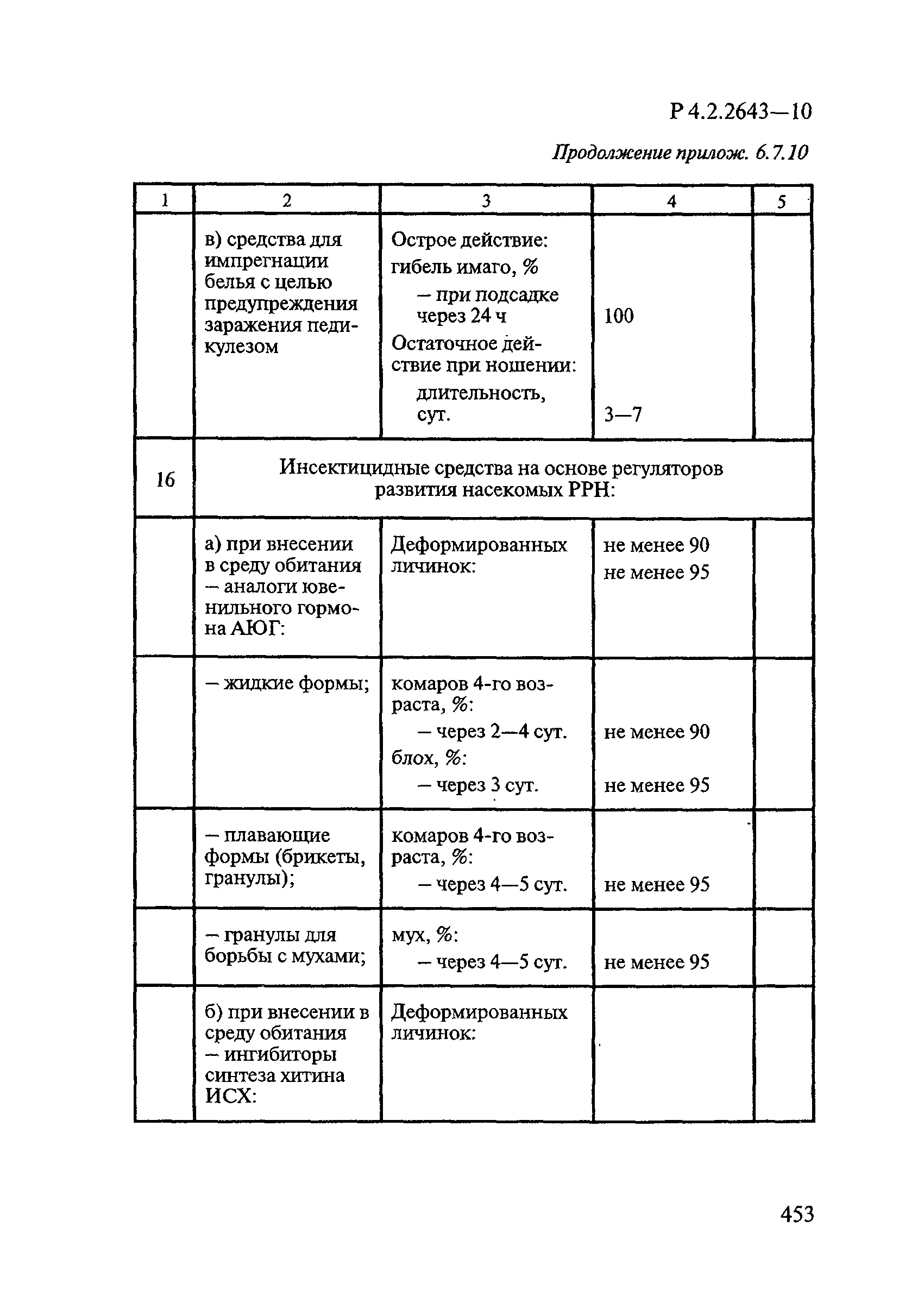
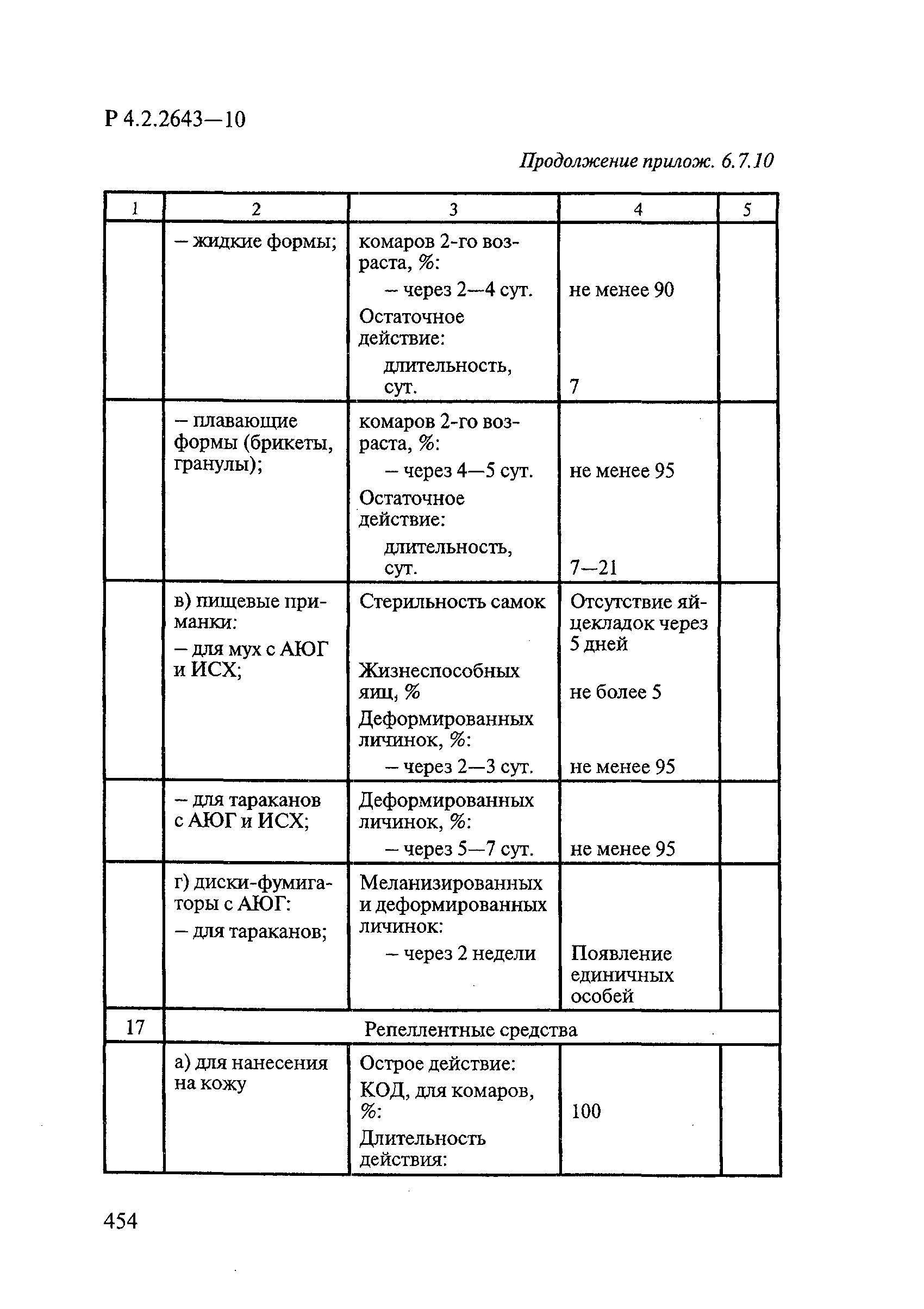
Формами применения дезинсекционных средств являются: жидкие (лосьоны, эмульсии, шампуни, концентраты эмульсий, растворы в беспропеллентных аэрозольных упаковках БАУ); твердые (смачивающиеся порошки, дусты, карандаши, таблетки, шашки); гели; кремы; аэрозольные баллоны, электрофумигирующие средства (пластины, спирали, жидкости); свечи; а также бумага, ткани, салфетки, пропитанные инсектицидными составами, и др.
К основным показателям качества дезинсекционных средств, контролируемым при регистрации и сертификации, относятся: внешний вид, определяемый визуально, запах, оцениваемый органолептически, и массовая доля ДВ; к дополнительным при характеристике водно-спиртовых лосьонов и шампуней — показатель активности водородных ионов pH, определяемый потенциометрически по ГОСТ Р 50550-93 [33].
Для идентификации и количественного определения ДВ в дезинсекционных средствах используются методы газожидкостной хроматографии ГЖХ, высокоэффективной жидкостной хроматографии ВЭЖХ и спектрофотометрический.
Универсальным и наиболее доступным методом анализа ДВ в дезинсекционных средствах является метод ГЖХ, поскольку его можно использовать для количественного определения практически всех применяемых ДВ (за исключением имидаклоприда, гидраметилнона, определяемых методом ВЭЖХ, и азаметифоса, тиаметоксама, определяемых спектрофотометрическим методом).
Преимуществом метода ГЖХ является возможность эффективно разделять смеси ДВ в одном средстве, что затруднено при анализе спектрофотометрическим методом. Метод ГЖХ обладает высокой чувствительностью (0,01 — 0,05 мг/куб. см), что позволяет определять самые низкие концентрации ДВ в различных формах применения.
Погрешность метода определения ДВ методом ГЖХ не превышает 5% относительных.
4.3.1. Метод газожидкостной хроматографии ГЖХ
для идентификации и количественного определения
действующих веществ в дезинсекционных средствах
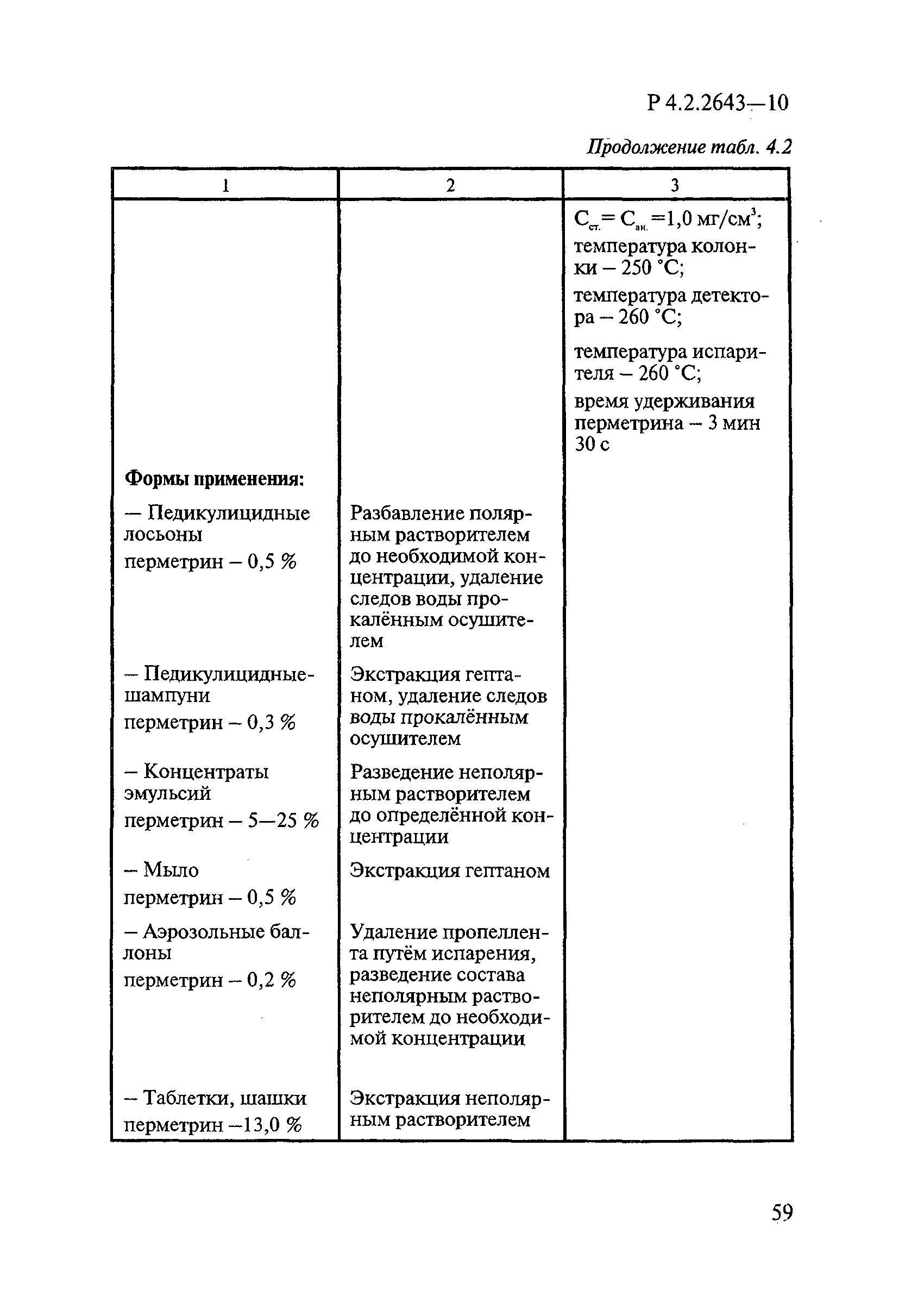
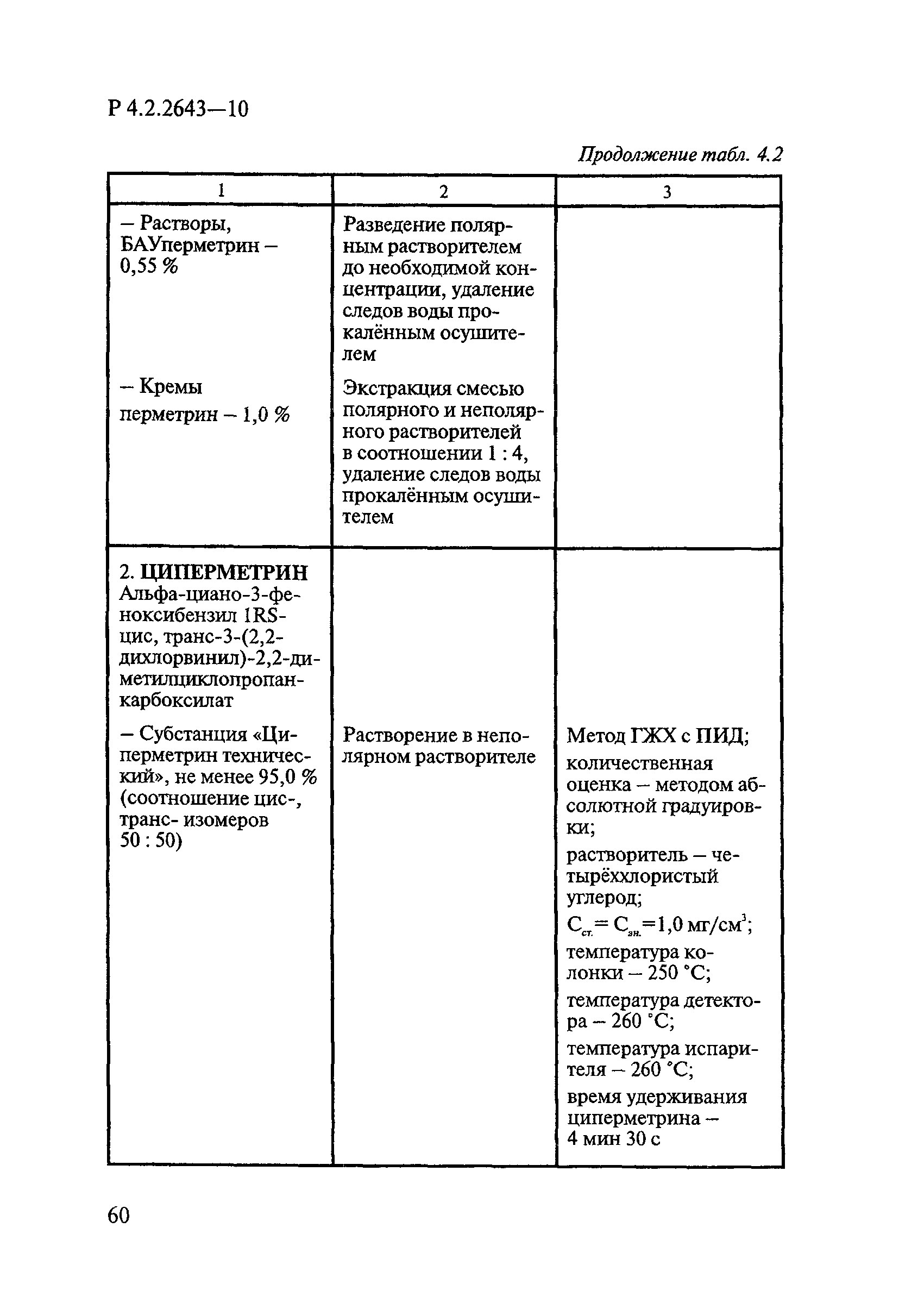
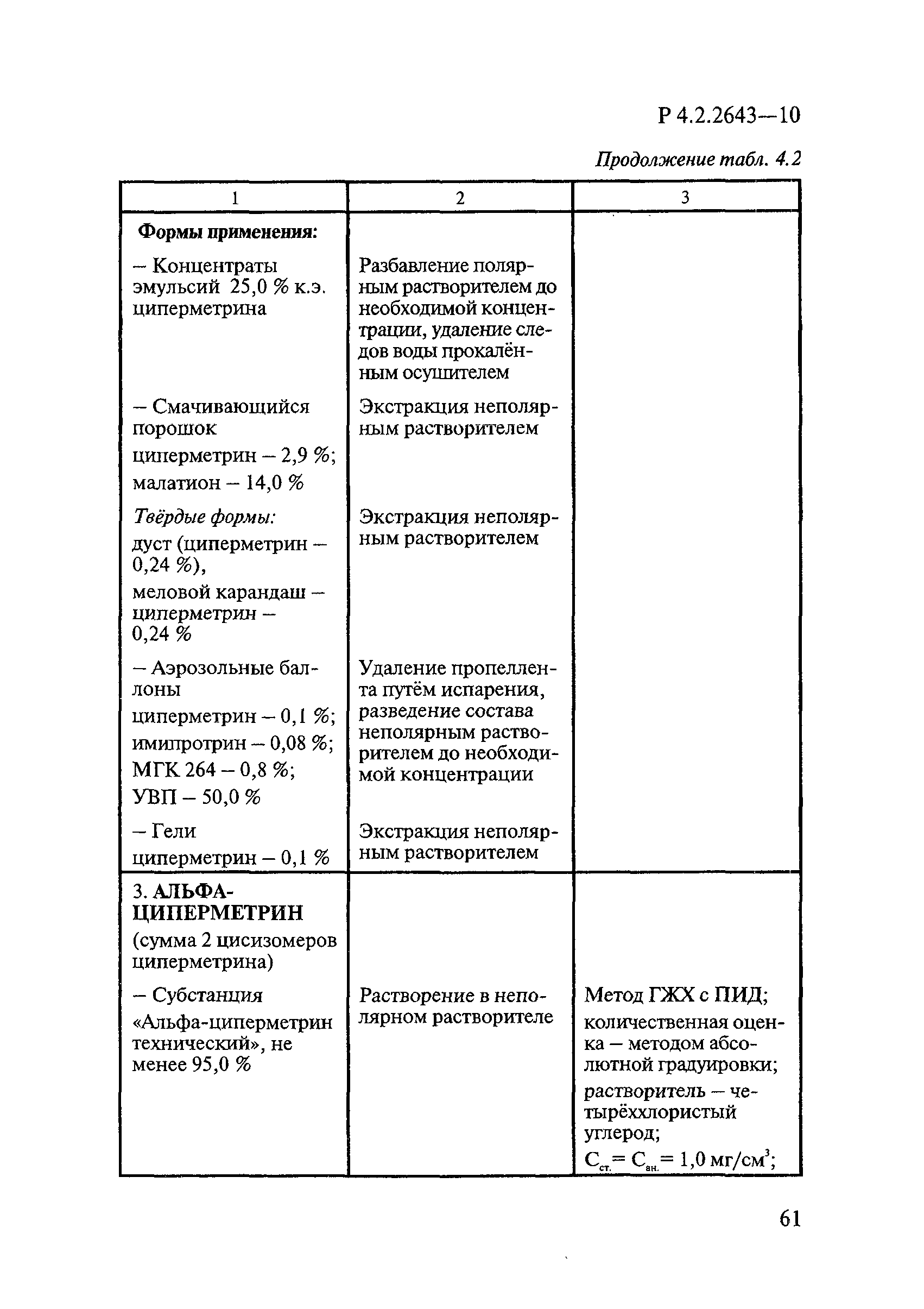
Определение массовой доли ДВ включает следующие операции: подготовку анализируемой пробы (часто приходится выделять ДВ из некоторых форм применения методом экстракции); идентификацию и количественное определение ДВ методом ГЖХ.
Способы подготовки пробы при анализе различных форм применения. Способы подготовки пробы при анализе ДВ зависят от вида форм применения дезинсекционных средств. В случае безводных жидких форм, в которых растворителями являются органические растворители, или концентрированных водных растворов пробу готовят простым разведением средства. В случае же разбавленных жидких водных растворов, эмульсий, порошков и других твердых форм применения обязательной начальной стадией анализа является выделение ДВ путем экстракции его из анализируемых средств органическими растворителями. При этом степень извлечения ДВ зависит от состава средства — массовой доли ДВ и сопутствующих компонентов. Чем сложнее состав средства и чем ниже концентрация в нем ДВ, тем коэффициент извлечения их ниже.
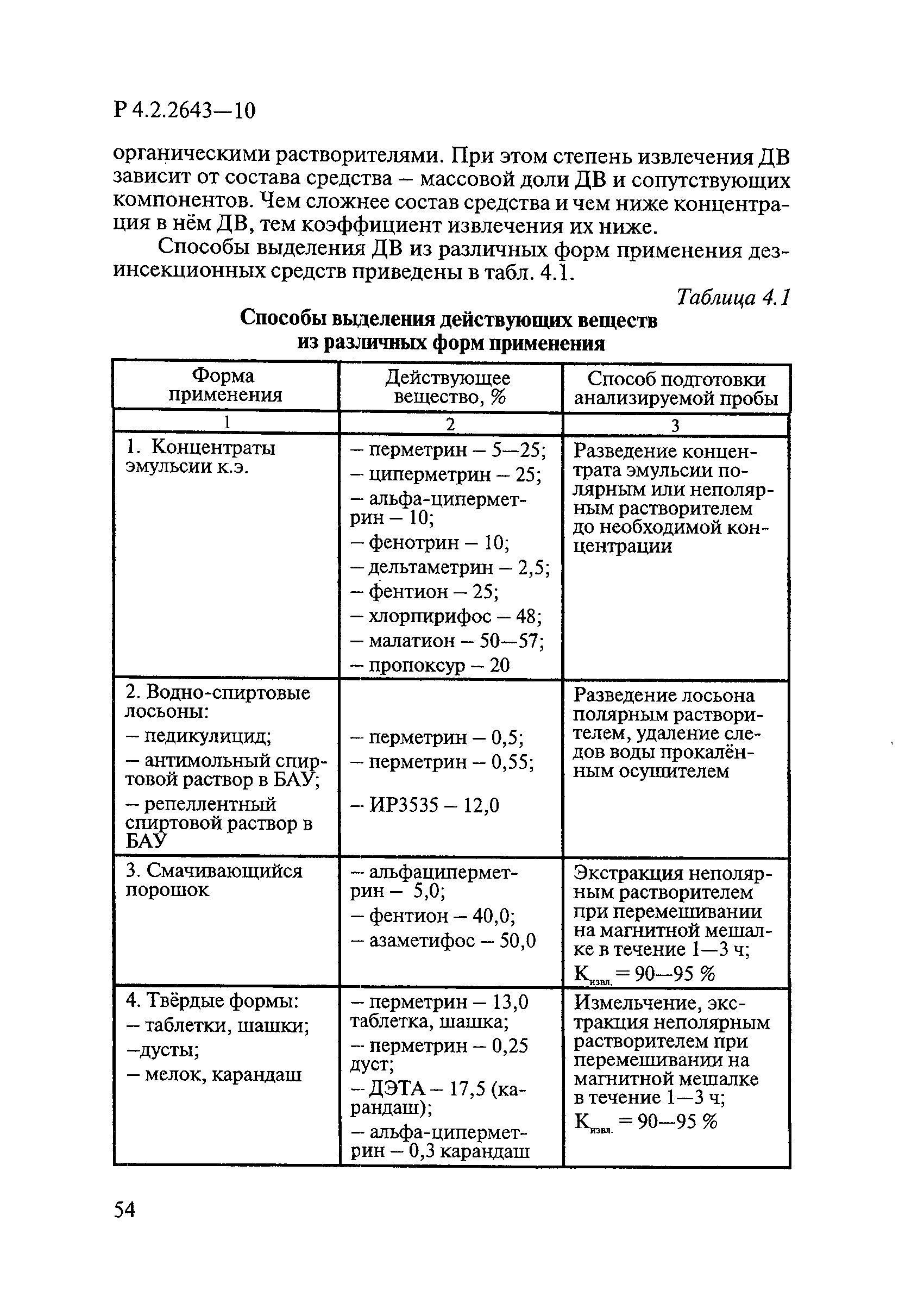
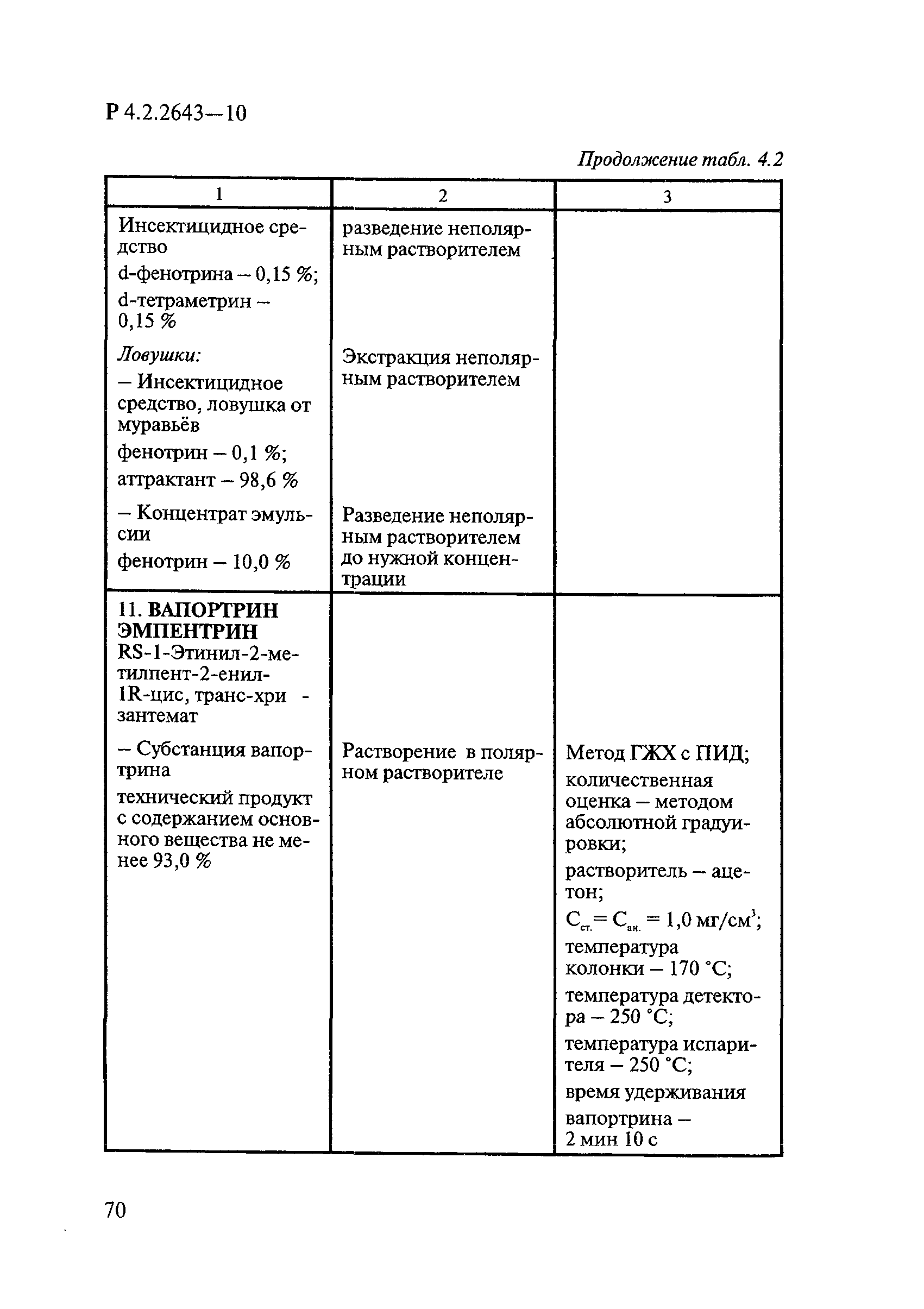
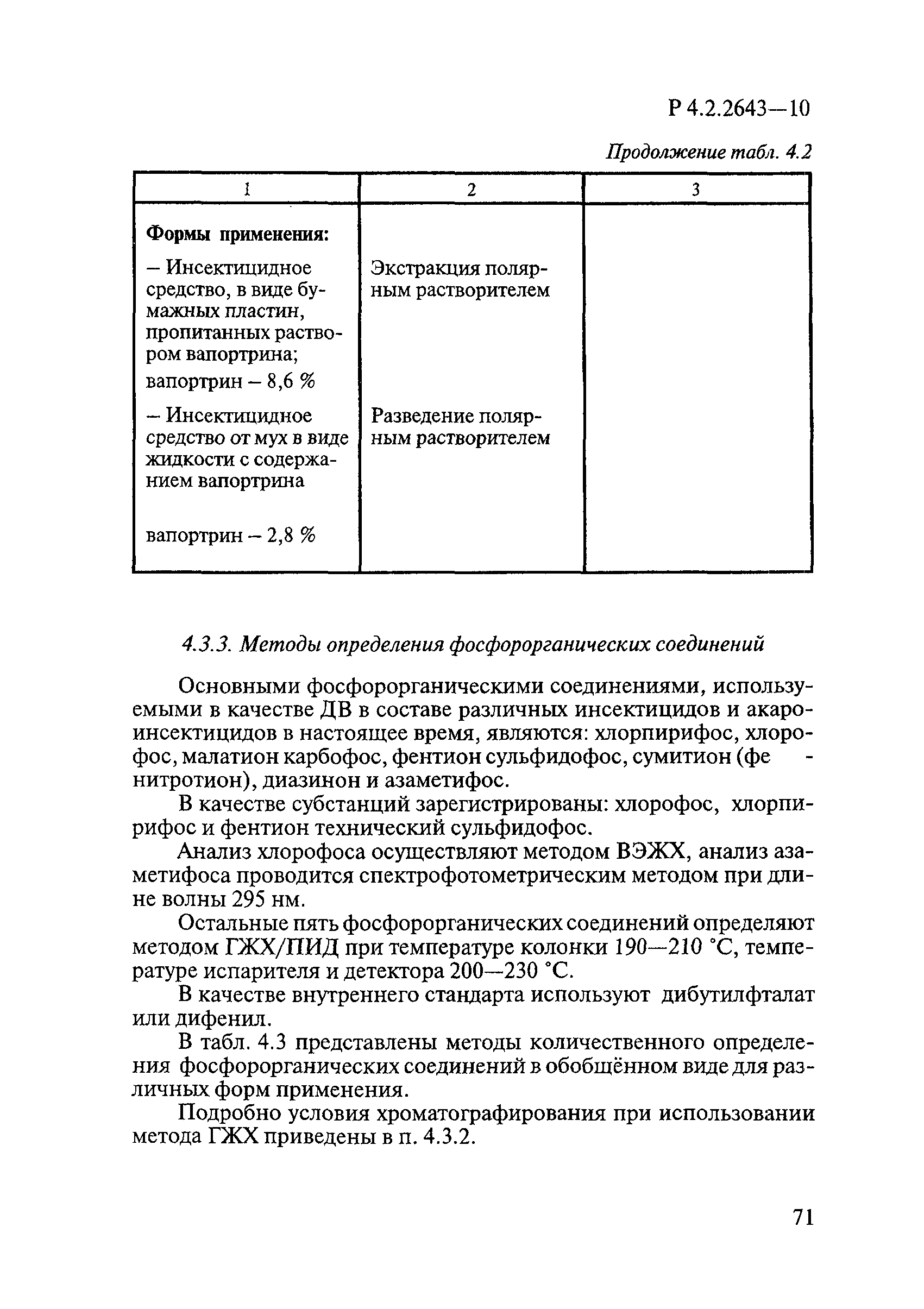
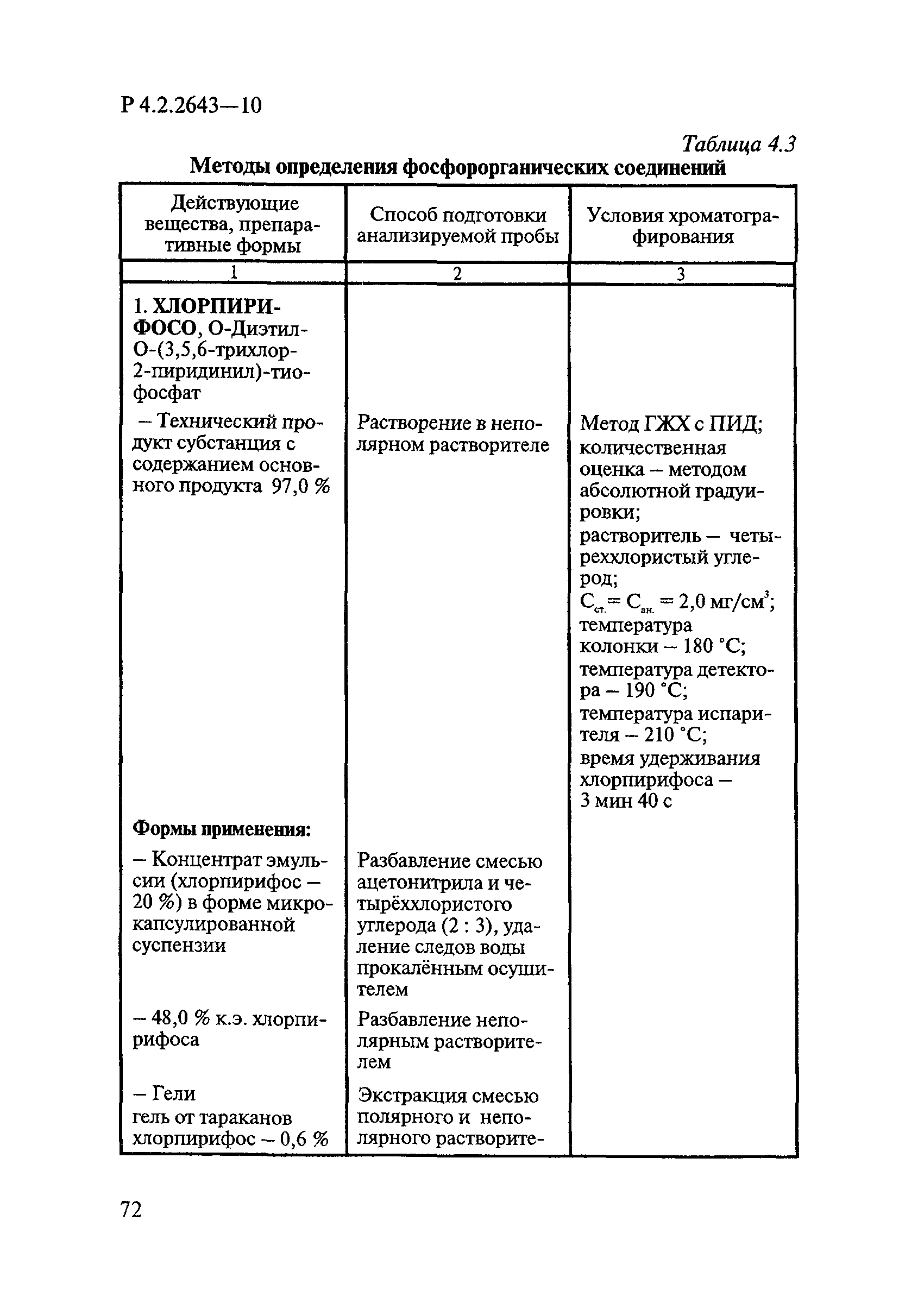
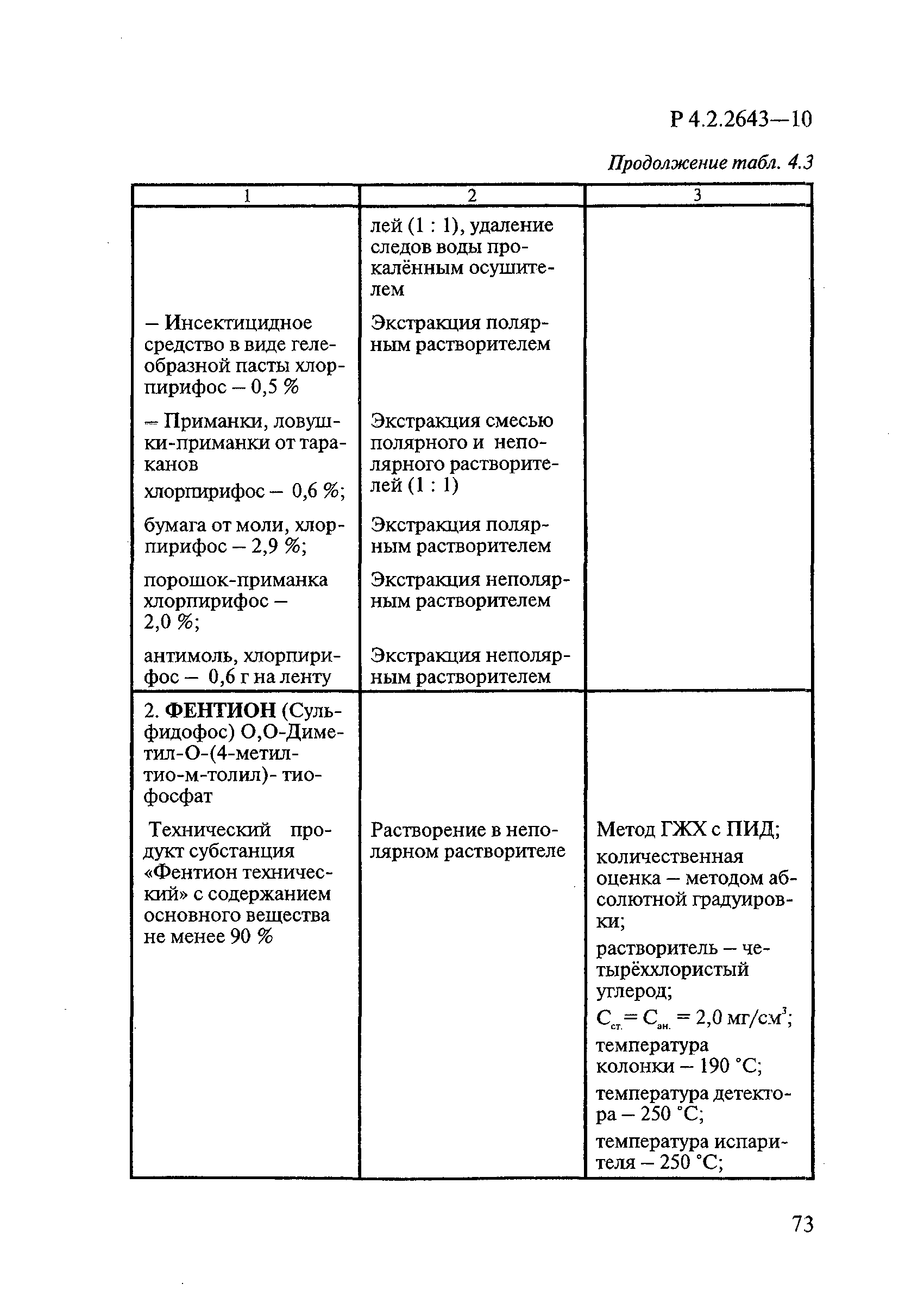
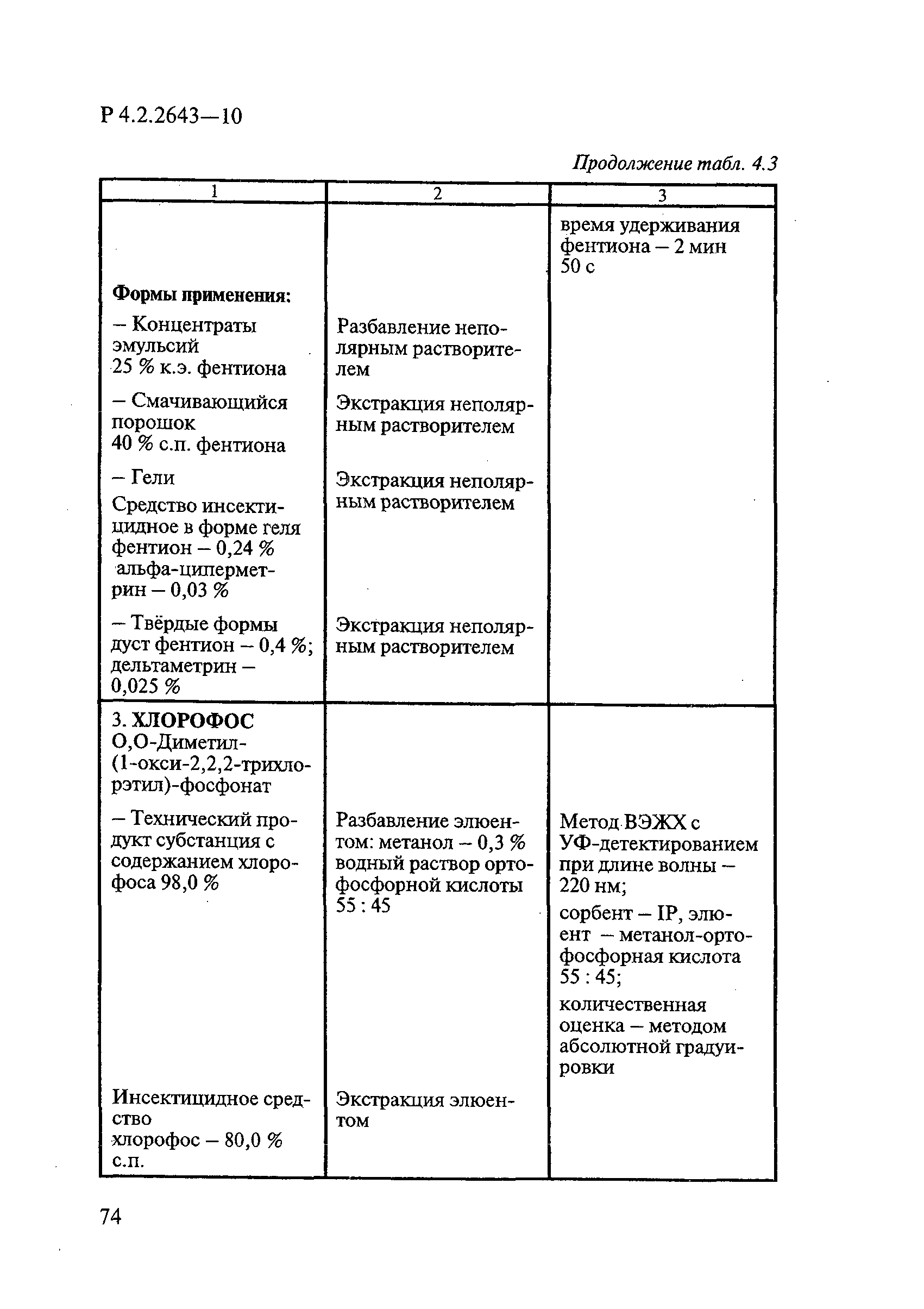
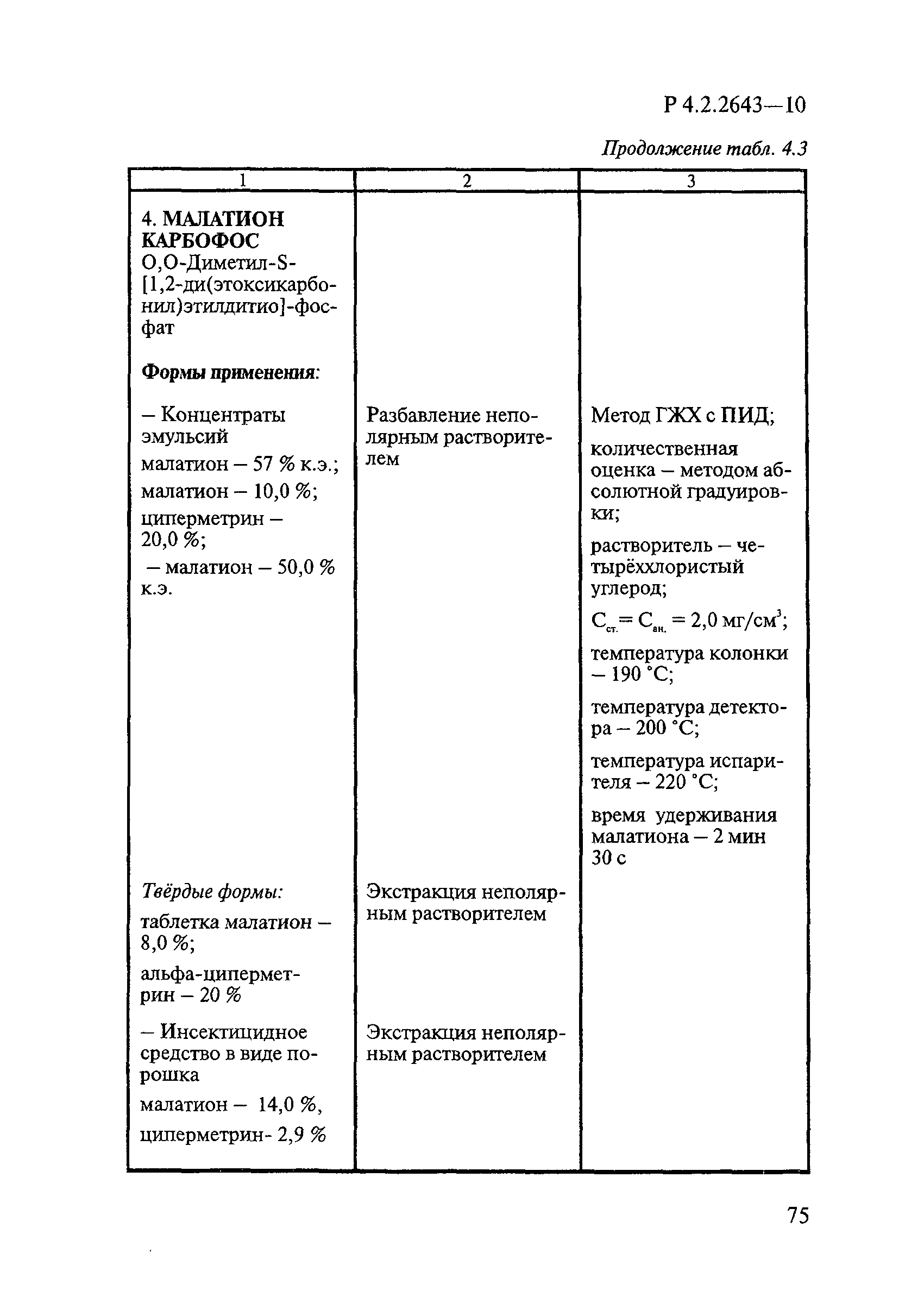
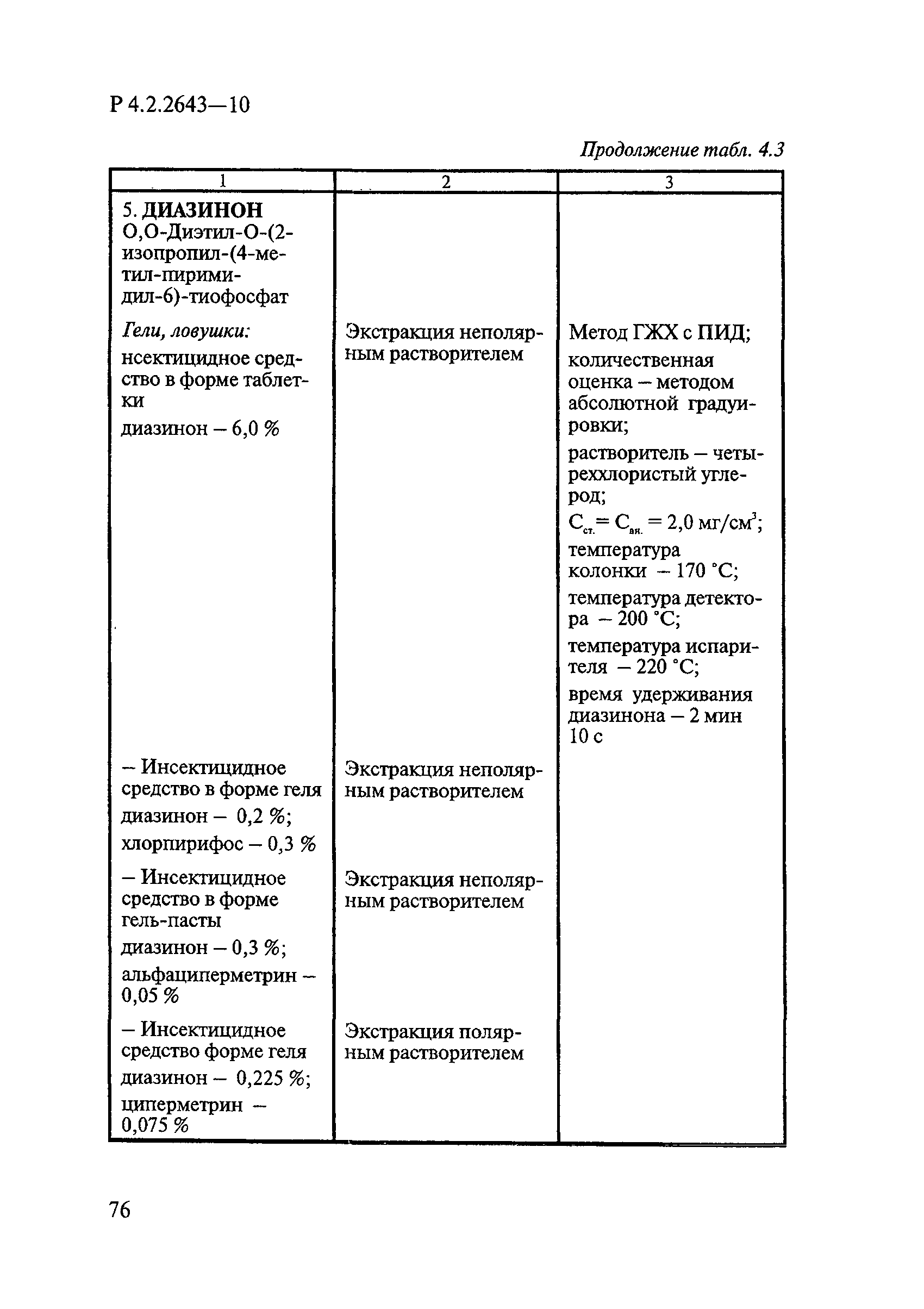
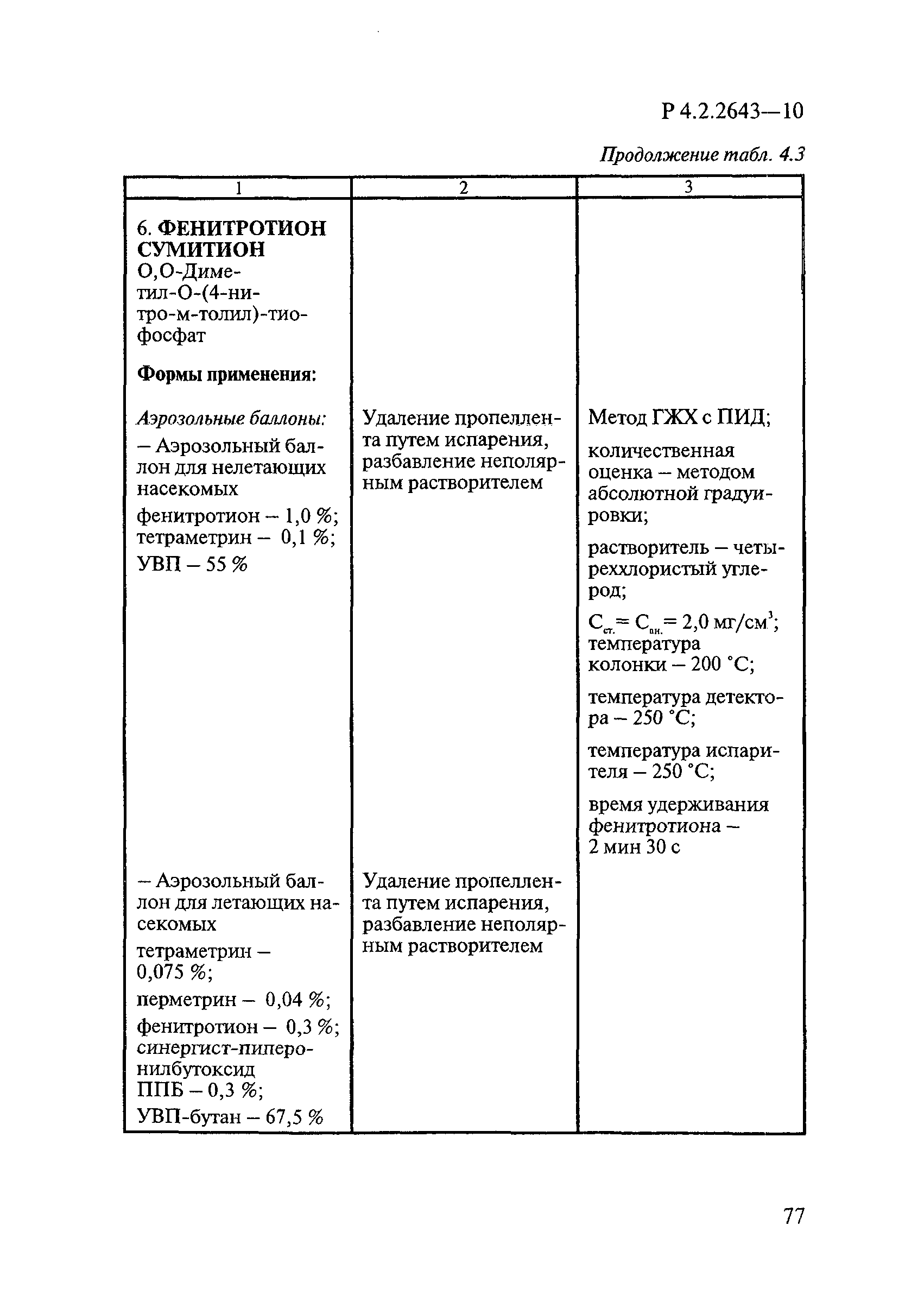
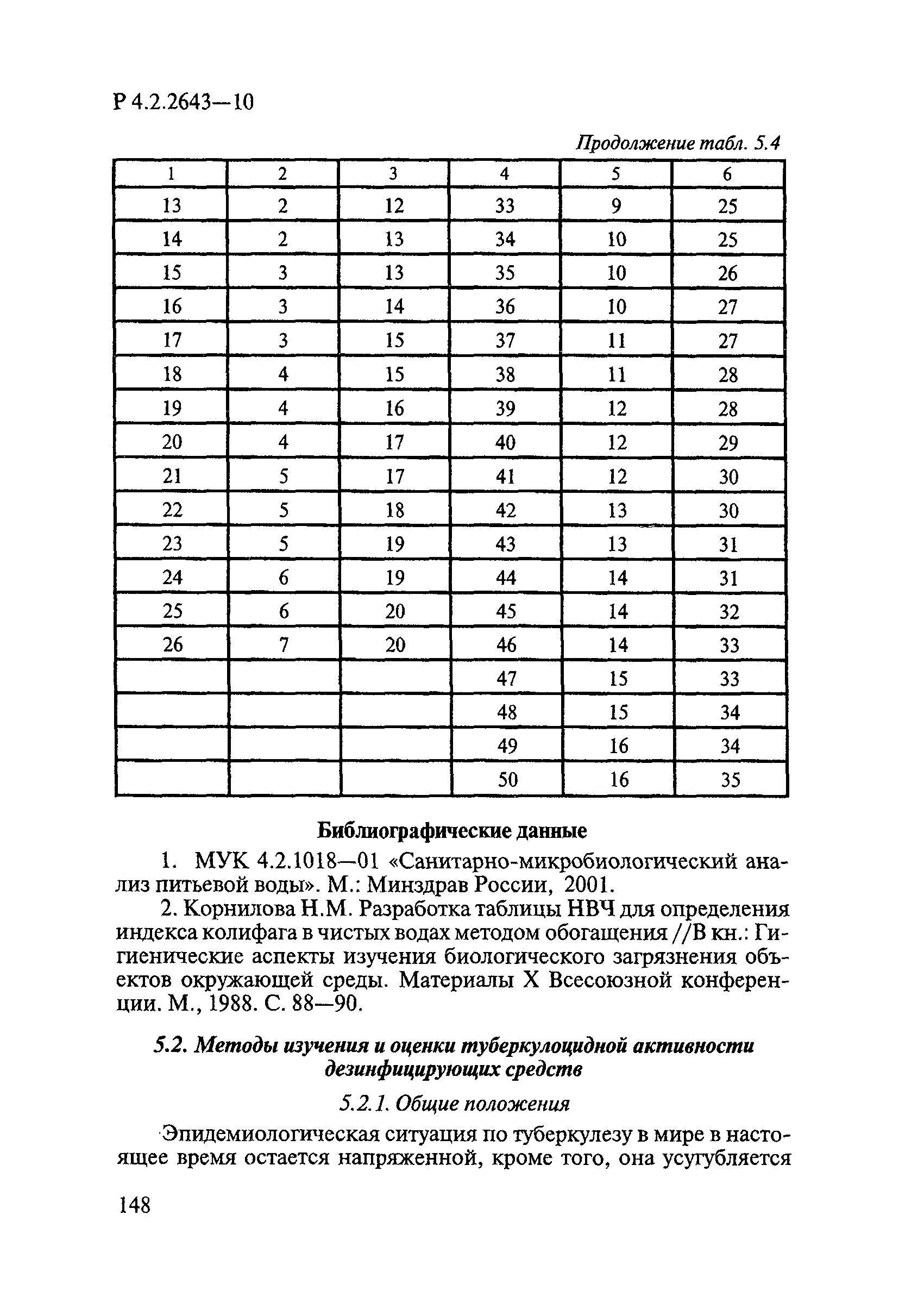
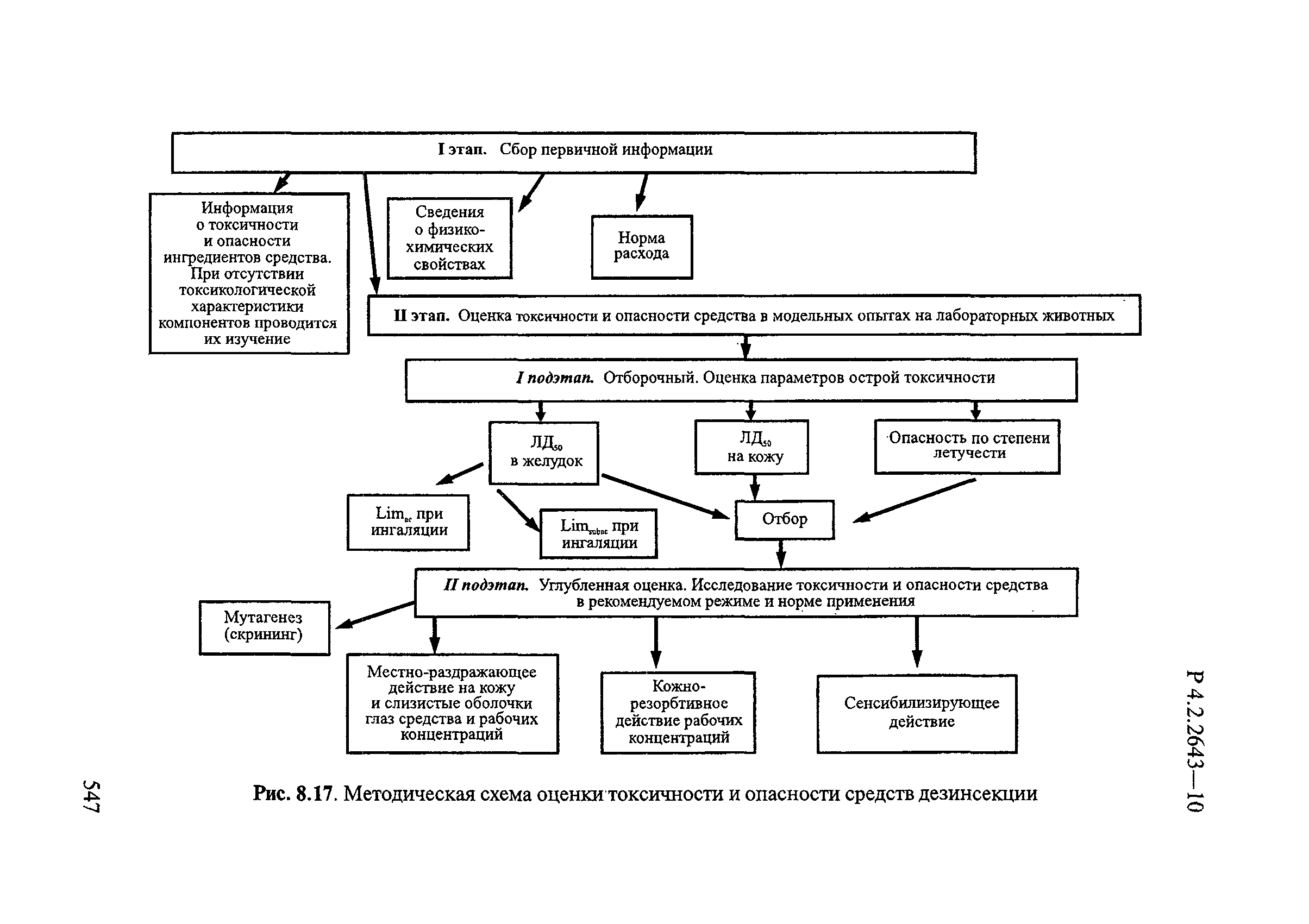
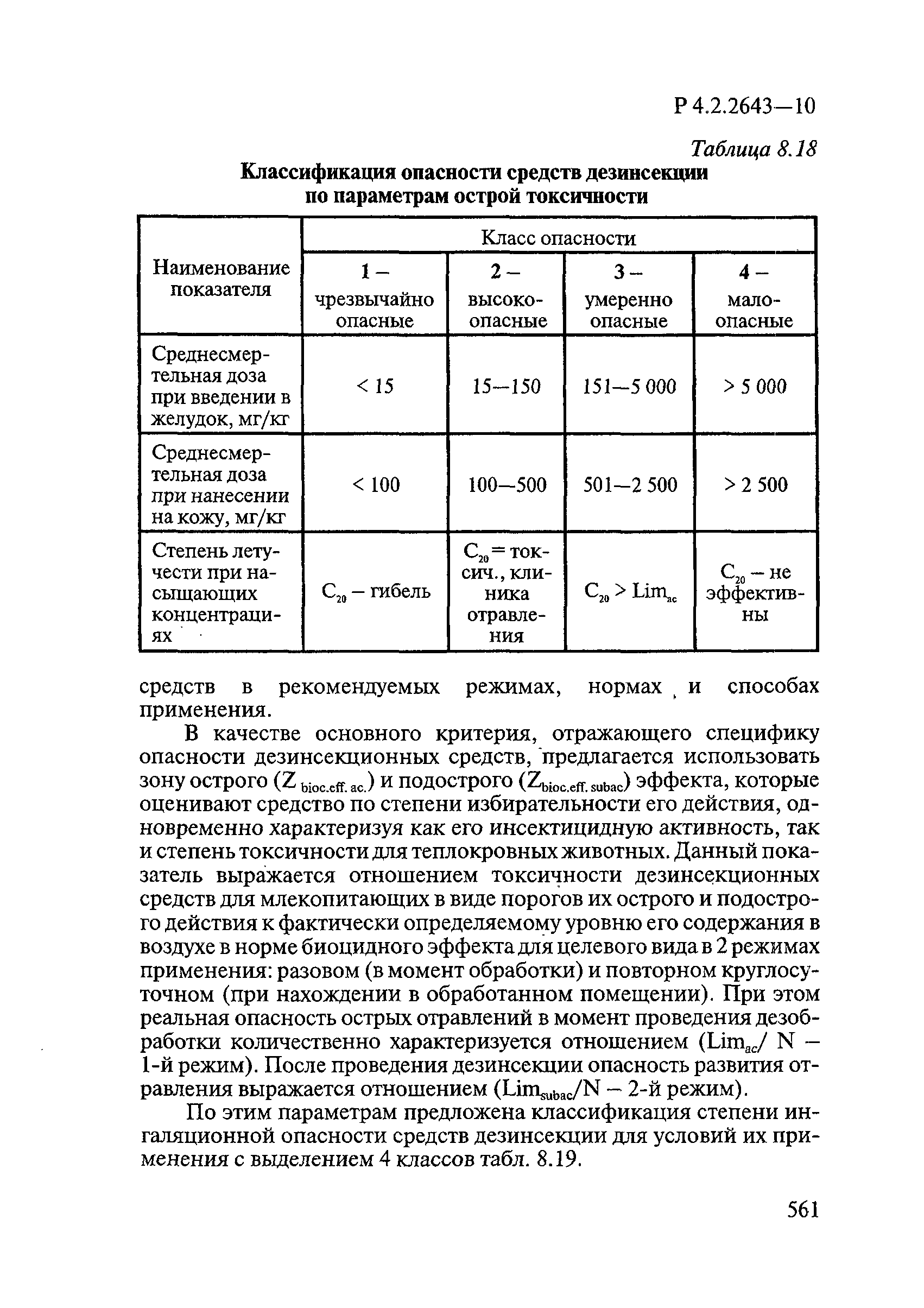
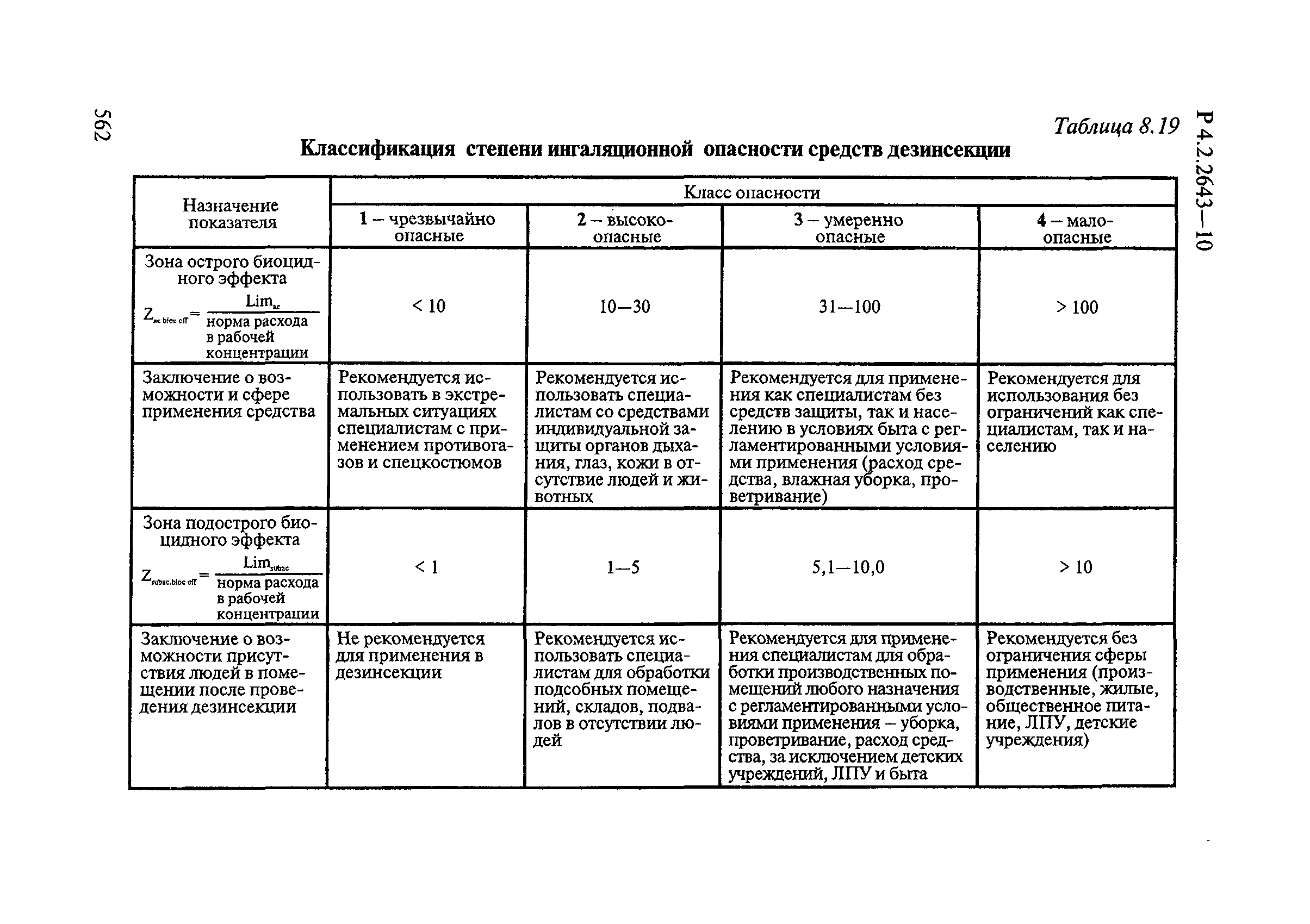
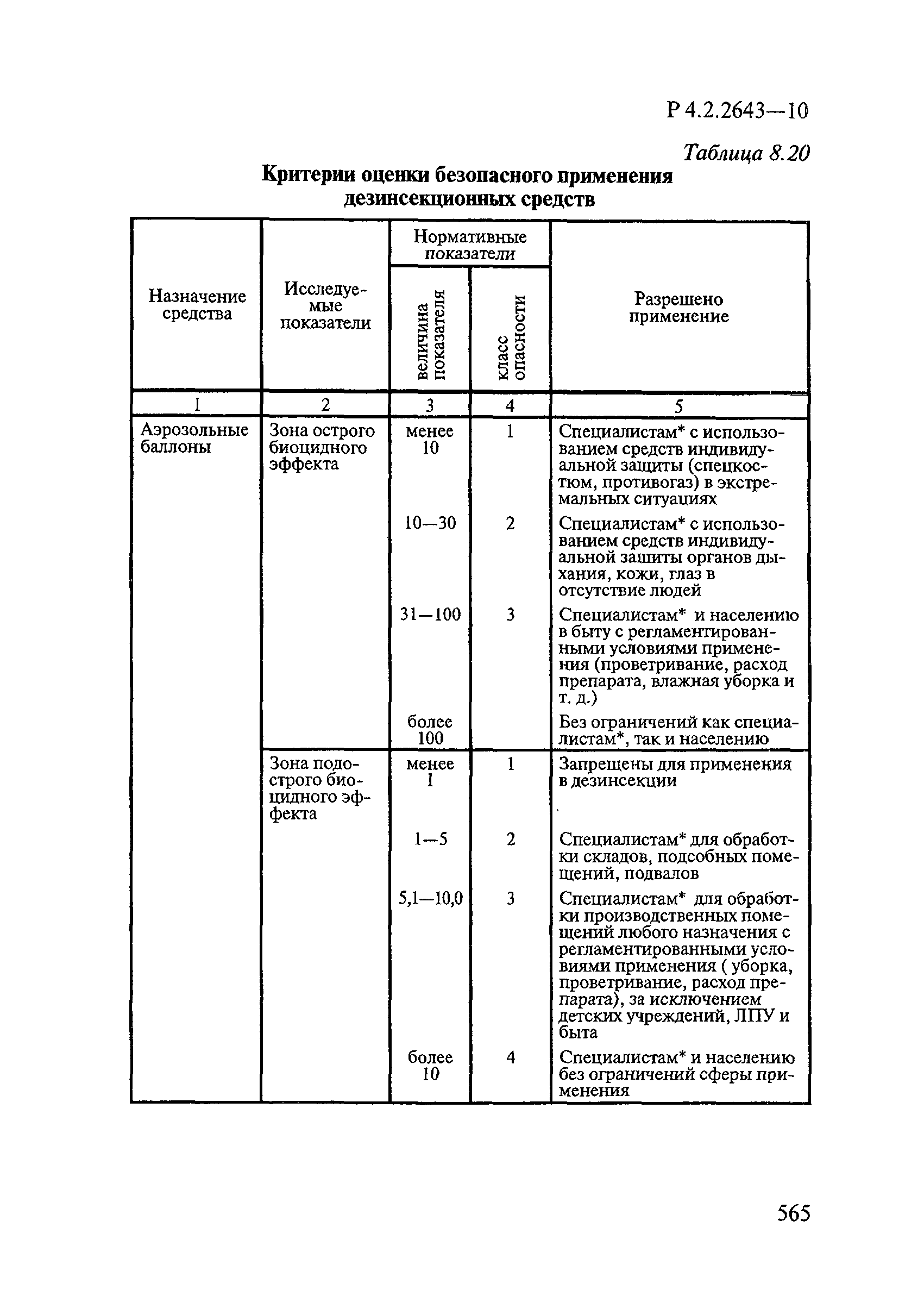
Способы выделения ДВ из различных форм применения дезинсекционных средств приведены в табл. 4.1.
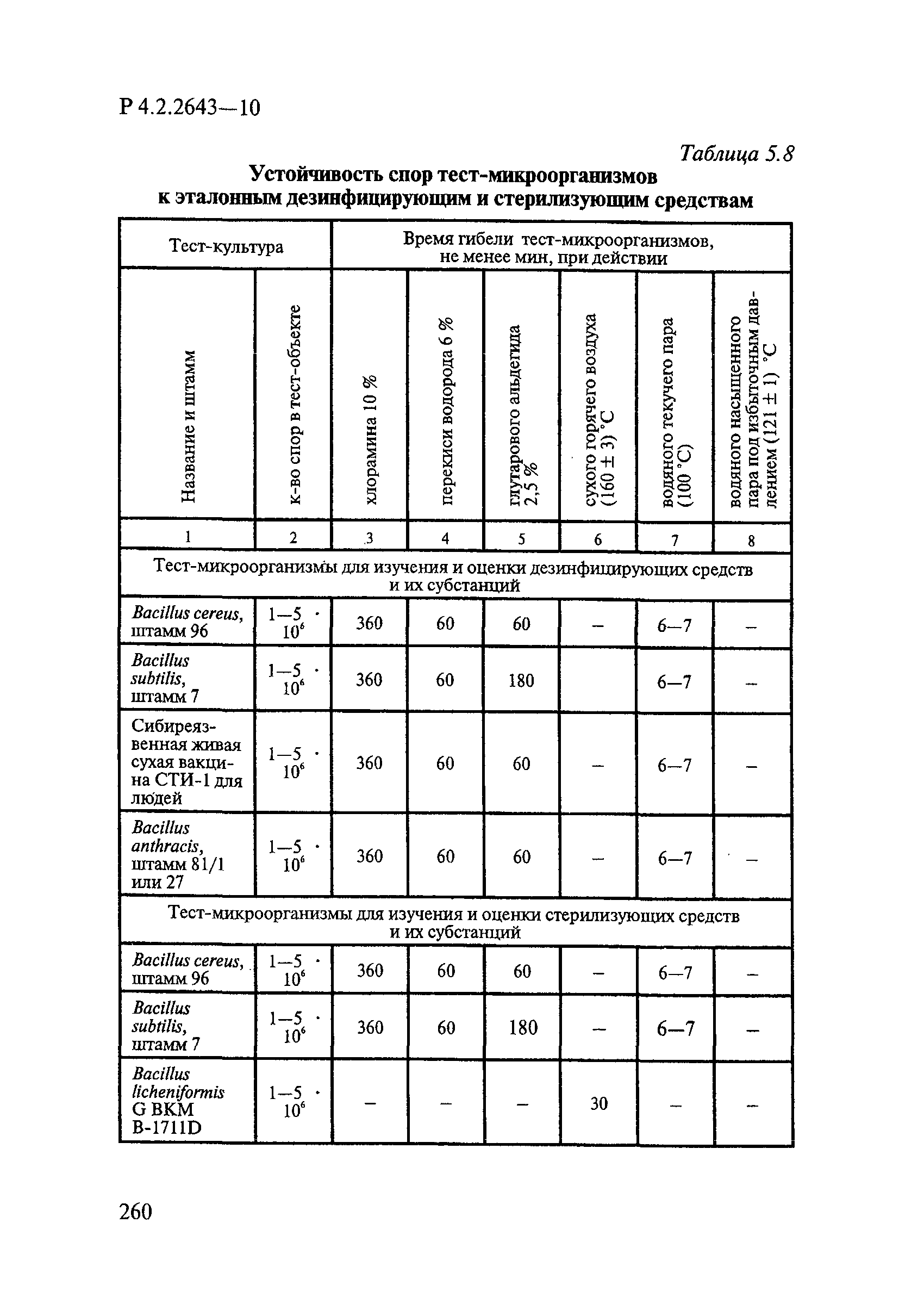
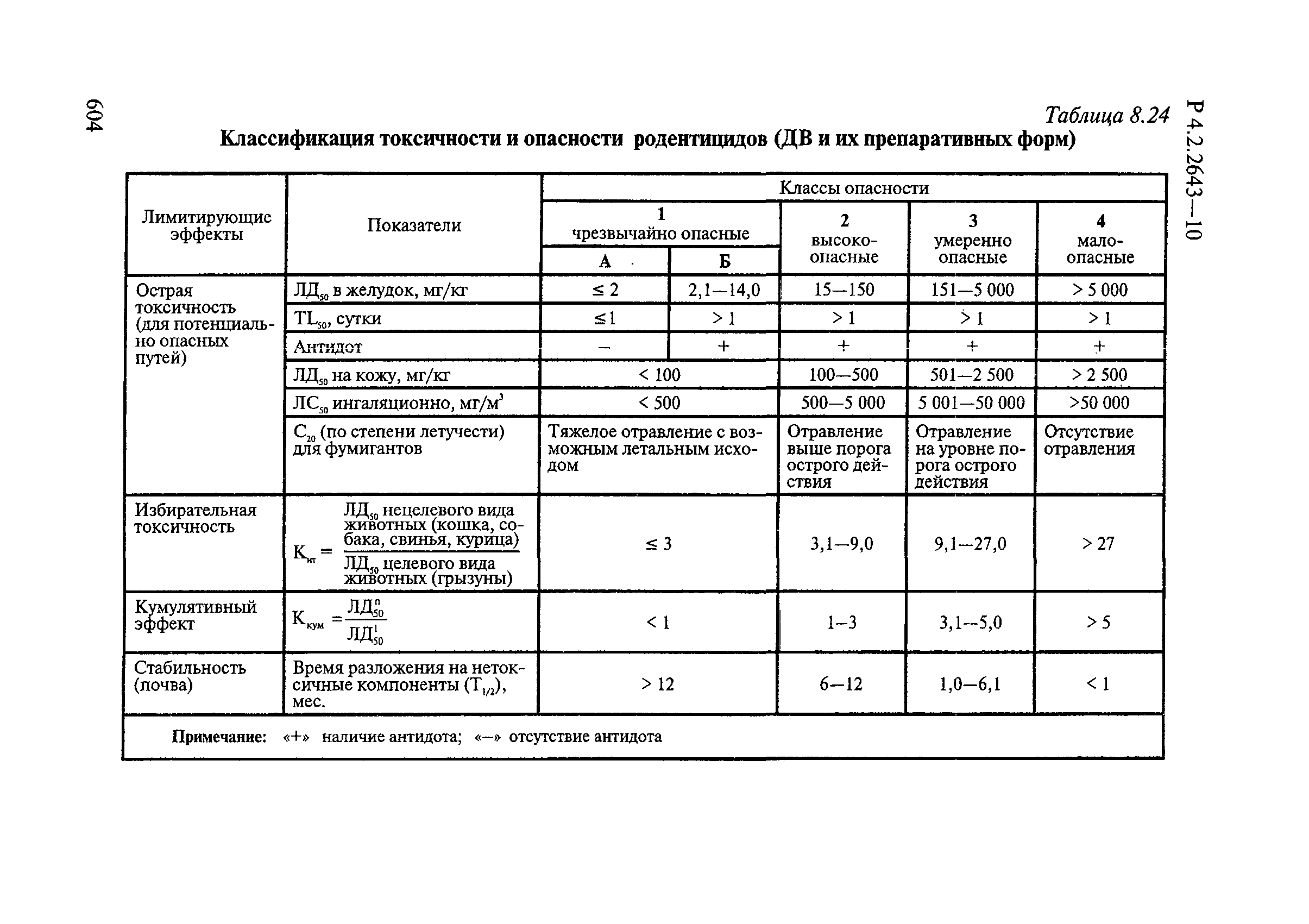
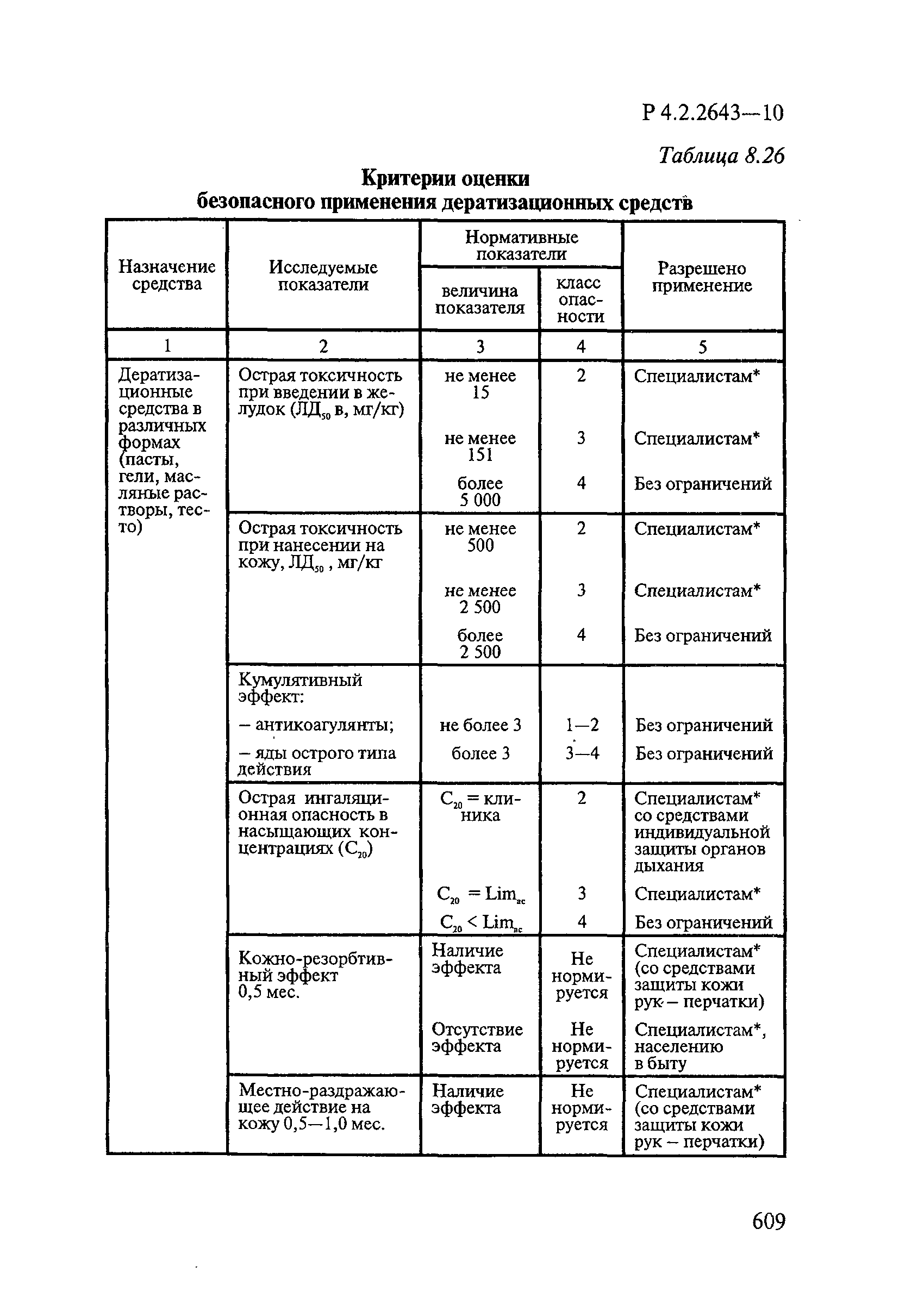
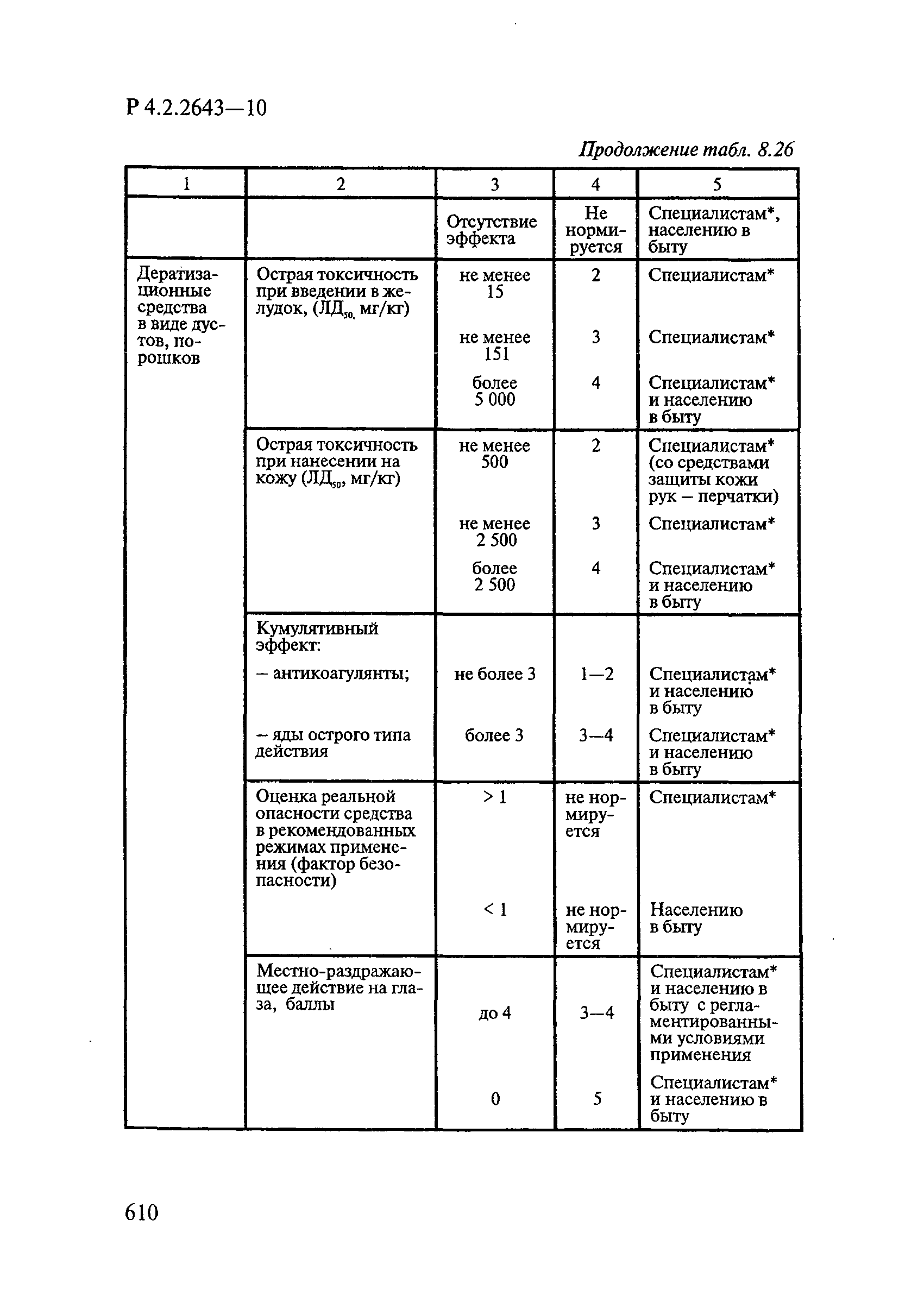
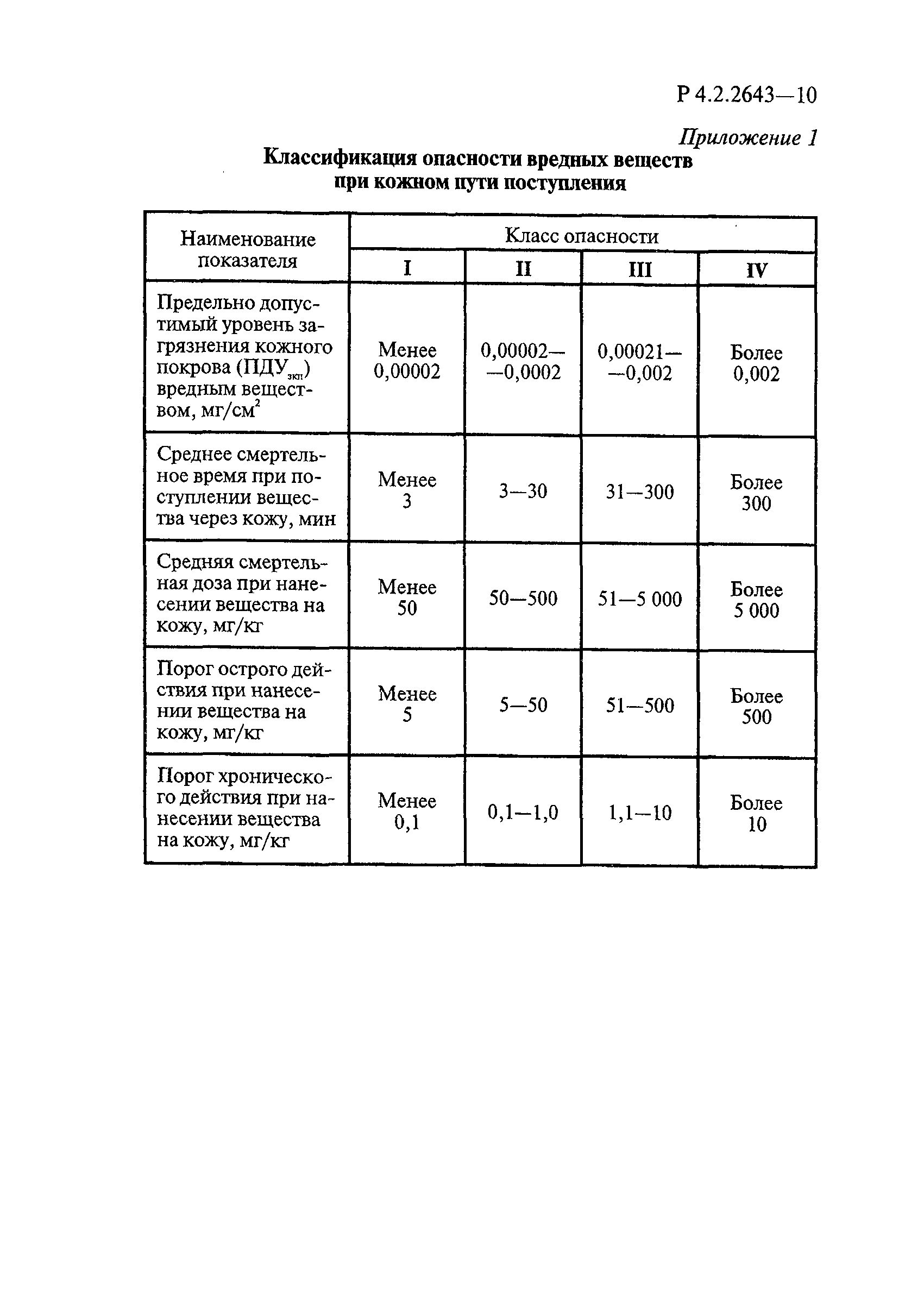
Таблица 4.1
СПОСОБЫ ВЫДЕЛЕНИЯ ДЕЙСТВУЮЩИХ ВЕЩЕСТВ
ИЗ РАЗЛИЧНЫХ ФОРМ ПРИМЕНЕНИЯ
┌────────────────────────┬──────────────────────────┬─────────────────────┐
│ Форма применения │ Действующее вещество, % │ Способ подготовки │
│ │ │ анализируемой пробы │
├────────────────────────┼──────────────────────────┼─────────────────────┤
│ 1 │ 2 │ 3 │
├────────────────────────┼──────────────────────────┼─────────────────────┤
│1. Концентраты эмульсии │- перметрин — 5 — 25; │Разведение │
│к.э. │- циперметрин — 25; │концентрата эмульсии │
│ │- альфа-циперметрин — 10; │полярным или │
│ │- фенотрин — 10; │неполярным │
│ │- дельтаметрин — 2,5; │растворителем до │
│ │- фентион — 25; │необходимой │
│ │- хлорпирифос — 48; │концентрации │
│ │- малатион — 50 — 57; │ │
│ │- пропоксур — 20 │ │
├────────────────────────┼──────────────────────────┼─────────────────────┤
│2. Водно-спиртовые │ │Разведение лосьона │
│лосьоны: │ │полярным │
│- педикулицид; │- перметрин — 0,5; │растворителем, │
│- антимольный спиртовой │- перметрин — 0,55; │удаление следов воды │
│раствор в БАУ; │ │прокаленным │
│- репеллентный спиртовой│- ИР3535 — 12,0 │осушителем │
│раствор в БАУ │ │ │
├────────────────────────┼──────────────────────────┼─────────────────────┤
│3. Смачивающийся порошок│- альфа-циперметрин — 5,0;│Экстракция неполярным│
│ │- фентион — 40,0; │растворителем при │
│ │- азаметифос — 50,0 │перемешивании на │
│ │ │магнитной мешалке в │
│ │ │течение 1 — 3 ч; │
│ │ │K = 90 — 95% │
│ │ │ извл │
├────────────────────────┼──────────────────────────┼─────────────────────┤
│4. Твердые формы: │- перметрин — 13,0, │Измельчение, │
│- таблетки, шашки; │таблетка, шашка; │экстракция неполярным│
│- дусты; │- перметрин — 0,25,дуст; │растворителем при │
│- мелок, карандаш │- ДЭТА — 17,5 (карандаш); │перемешивании на │
│ │- альфа-циперметрин — 0,3,│магнитной мешалке в │
│ │карандаш │течение 1 — 3 ч; │
│ │ │K = 90 — 95% │
│ │ │ извл │
├────────────────────────┼──────────────────────────┼─────────────────────┤
│5. Аэрозольные баллоны │- пралле — 0,32; │Удаление углеводород-│
│ │- альфа-циперметрин — │ного пропеллента УВП │
│ │0,20; │методом испарения, │
│ │- пропеллент УВП — 50; │разведение состава │
│ │- цифенотрин — 0,2; │соответствующим раст-│
│ │- тетраметрин — 0,1; │ворителем до необхо- │
│ │- УВП — 60,0 [40] │димой концентрации; │
│ │ │K = 85 — 90% │
│ │ │ извл │
├────────────────────────┼──────────────────────────┼─────────────────────┤
│6. Гели, пасты │- хлорпирифос — 0,6, │Экстракция неполярным│
│ │гель; │растворителем; │
│ │- ДЭТА — 17,5, крем-гель; │удаление следов воды │
│ │- пропоксур — 2,0, │прокаленным │
│ │приманка │осушителем; │
│ │ │K = 80 — 85% │
│ │ │ извл │
├────────────────────────┼──────────────────────────┼─────────────────────┤
│7. Ткани, импрегнирован-│- перметрин — 0,5; │Экстракция неполярным│
│ные составом перметрина │- хлорпирифос — 0,6 │растворителем; │
│- бумага, пропитанная │ │экстракция неполярным│
│хлорпирифосом │ │растворителем │
└────────────────────────┴──────────────────────────┴─────────────────────┘
Идентификация и количественное определение действующих веществ методом газожидкостной хроматографии. Сущность метода заключается в разделении смеси веществ на хроматографической колонке. Входным сигналом хроматографа является концентрация или масса определяемого компонента на входе в хроматограф.
Выходным сигналом хроматографа являются: амплитуда в максимуме хроматографического пика (высота пика) или площадь хроматографического пика и время удерживания определяемого компонента. По времени удерживания ДВ осуществляется его идентификация; по высоте хроматографического пика или площади рассчитываются концентрация и массовая доля ДВ.
Средства измерения:
— хроматографы лабораторные разных марок (ЛХМ-80, «Цвет», «Кристалл» или другой аналогичный) с пламенно-ионизационным детектором ПИД;
— аналитическая колонка (металлическая или стеклянная) длиной 100 или 200 см и внутренним диаметром 0,3 см;
— наполнитель — хроматон N-AW-HMDS с 5% SE-30 или хромосорб W-HP с 3% OV-210.
Выполнение анализа. Анализ дезинсекционного средства включает следующие операции:
— приготовление градуировочных растворов точной концентрации (0,5 — 2,0 мг/куб. см) для градуировки хроматографа (построение графика зависимости высоты площади хроматографического пика от концентрации ДВ;
— приготовление раствора анализируемой пробы (разведением или экстракцией средства);
— хроматографирование анализируемого раствора параллельно с градуировочным раствором определенной концентрации в аналогичных условиях.
Условия хроматографирования
Скорость газа-носителя азота, куб. см/мин. 30 — 35
Скорость водорода, куб. см/мин. 30 — 35
Скорость воздуха, куб. см/мин. 300
-10 -10
Чувствительность шкалы электрометра 5 x 10 А
Концентрация анализируемого и стандартного
растворов, мг/куб. см 0,5 — 2,0
Температура колонки, °C <*> 170 — 260
Температура детектора, °C 190 — 270
Температура испарителя, °C 190 — 280
———————————
<*> Температурные интервалы заданы для всех инсектицидов.
На хроматограммах измеряются высоты или площади хроматографических пиков.
Обработка результатов анализа раздел 4.3.2.
4.3.2. Метод ГЖХ для определения пиретроидов
В настоящее время известны около 18 пиретроидов, используемых в качестве ДВ в составе различных дезинсекционных средств. Распределение пиретроидов по назначению: в качестве педикулицидов используют фенотрин и перметрин (0,3 — 0,5%); инсектоакарицидов — циперметрин и альфа-циперметрин (0,20 — 0,25%); инсектицидов с высоким «нокдаун-эффектом» в составе аэрозольных баллонов — тетраметрин (0,1 — 1,0%) и имипротрин (0,1 — 0,2%) в сочетании с другими пиретроидами (перметрин, циперметрин, фенотрин, цифенотрин) или ФОС сумитрин; электрофумигирующих средств — изомеры аллетрина (биоаллетрин, эсбиотрин) и праллетрин (10 — 20 мг/куб. см); в противомольных средствах — вапортрин, перметрин.
Из пиретроидов отобраны 11 (табл. 4.2.) наиболее востребованных, для 10 из которых зарегистрированы субстанции (технические продукты).
В качестве примера использования метода ГЖХ для количественного определения пиретроидов приведен анализ технического продукта перметрина.
Массовую долю перметрина определяют методом ГЖХ с использованием пламенно-ионизационного детектирования и количественной оценки перметрина методом абсолютной градуировки по стандартному образцу ГСО 7715-99.
Для анализа используют аналитический газовый хроматограф, снабженный ПИД, металлической колонкой длиной 100 см и диаметром 0,3 см, заполненной силанизированным хроматоном N-AW-DMCS 0,20 — 0,25, пропитанным 5% неподвижной фазы SE-30.
С целью определения зависимости высоты (площади) хроматографических пиков от концентрации анализируемых растворов разово готовят и хроматографируют рабочие градуировочные растворы с концентрацией ДВ 0,5; 1,0; 1,5 и 2,0 мг/куб. см в четыреххлористом углероде.
После установления линейной зависимости в изучаемой области концентраций анализ перметрина технического проводят следующим образом.
Выполнение анализа. Анализируемый раствор готовят растворением 0,25 г технического продукта в четыреххлористом углероде в мерной колбе вместимостью 50 куб. см с последующим разведением аликвоты полученного раствора в 5 раз тем же растворителем.
Приготовленный анализируемый раствор вводят в хроматограф не менее 3 раз параллельно с рабочим градуировочным концентрации 1,0 мг/куб. см.
Условия хроматографирования
Температура колонки, °C 250
Температура детектора, °C 260
Температура испарителя, °C 260
-10
Чувствительность шкалы электрометра 10 x 10 А
Объем вводимой пробы, мкл 1
Время удерживания перметрина 3 мин. 30 с
Обработка результатов. Массовую долю перметрина X в процентах рассчитывают по формуле:
H x C x V
х ст
X = ———— x 100,
H x m
ст
где:
H и H — высоты хроматографических пиков перметрина в анализируемом и
х ст
рабочем градуировочном растворах, мм;
C — концентрация перметрина в градуировочном растворе, мг/куб. см;
ст
V — объем анализируемого раствора, куб. см;
m — масса навески субстанции (перметрина технического), мг.
За результат анализа принимают среднее арифметическое значение из 3 определений, абсолютное расхождение между которыми не превышает 0,5%.
Ниже в табл. 4.2 представлен метод анализа различных форм применения пиретроидов в обобщенном виде. При этом для каждого пиретроида приведены наиболее распространенные формы применения, условия их хроматографирования, метод количественной оценки (абсолютная градуировка с использованием стандартного образца определяемого вещества или метод «внутреннего эталона»), растворитель для разведения или экстракции ДВ из дезинсекционного средства и коэффициент извлечения ДВ.
Таблица 4.2
ГАЗОХРОМАТОГРАФИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ПИРЕТРОИДОВ
В РАЗЛИЧНЫХ ФОРМАХ ПРИМЕНЕНИЯ
┌────────────────────────────┬───────────────────┬────────────────────────┐
│ Название ДВ, │ Способ │ Условия │
│ формы применения │ приготовления │ хроматографирования │
│ │анализируемой пробы│ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│ 1 │ 2 │ 3 │
├────────────────────────────┼───────────────────┼────────────────────────┤
│1. ПЕРМЕТРИН │ │ │
│3-Феноксибензил(1RS)-цис, │ │ │
│транс-3-(2,2-дихлорвинил)- │ │ │
│2,2-диметил-циклопропан-кар-│ │ │
│боксилат │ │ │
│- Субстанция «Перметрин │Растворение в непо-│Метод ГЖХ с ПИД; │
│технический» │лярном растворителе│ │
│не менее 92,0% (соотношение │ │количественная оценка — │
│цис-транс-изомеров 25:75) │ │методом абсолютной │
│ │ │градуировки; │
│ │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │250 °C; │
│ │ │температура детектора — │
│ │ │260 °C; │
│ │ │температура испарителя -│
│ │ │260 °C; │
│ │ │время удерживания │
│ │ │перметрина — 3 мин. 30 с│
│Формы применения: │ │ │
│- Педикулицидные лосьоны │Разбавление поляр- │ │
│перметрин — 0,5% │ным растворителем │ │
│ │до необходимой кон-│ │
│ │центрации, удаление│ │
│ │следов воды прока- │ │
│ │ленным осушителем │ │
│- Педикулицидные шампуни │Экстракция │ │
│перметрин — 0,3% │гептаном, удаление │ │
│ │следов воды прока- │ │
│ │ленным осушителем │ │
│- Концентраты эмульсий │Разведение неполяр-│ │
│перметрин — 5 — 25% │ным растворителем │ │
│ │до определенной │ │
│ │концентрации │ │
│- Мыло │Экстракция гептаном│ │
│перметрин — 0,5% │ │ │
│- Аэрозольные баллоны │Удаление пропеллен-│ │
│перметрин — 0,2% │та путем испарения,│ │
│ │разведение состава │ │
│ │неполярным раство- │ │
│ │рителем до необхо- │ │
│ │димой концентрации │ │
│- Таблетки, шашки │Экстракция неполяр-│ │
│перметрин — 13,0% │ным растворителем │ │
│- Растворы, │Разведение полярным│ │
│БАУ перметрин — 0,55% │растворителем до │ │
│ │необходимой кон- │ │
│ │центрации, удаление│ │
│ │следов воды прока- │ │
│ │ленным осушителем │ │
│- Кремы │Экстракция смесью │ │
│перметрин — 1,0% │полярного и непо- │ │
│ │лярного раствори- │ │
│ │телей в соотношении│ │
│ │1:4, удаление сле- │ │
│ │дов воды прокален- │ │
│ │ным осушителем │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│2. ЦИПЕРМЕТРИН │ │ │
│Альфа-циано-3-феноксибензил │ │ │
│1RS-цис,транс- │ │ │
│3-(2,2-дихлорвинил)-2,2- │ │ │
│диметил-циклопропан- │ │ │
│карбоксилат │ │ │
│- Субстанция «Циперметрин │Растворение в │Метод ГЖХ с ПИД; │
│технический», не менее 95,0%│неполярном │количественная оценка — │
│(соотношение цис-, │растворителе │методом абсолютной │
│транс-изомеров 50:50) │ │градуировки; │
│ │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │250 °C; │
│ │ │температура детектора — │
│ │ │260 °C; │
│ │ │температура испарителя -│
│ │ │260 °C; │
│ │ │время удерживания ципер-│
│ │ │метрина — 4 мин. 30 с │
│Формы применения: │ │ │
│- Концентраты эмульсий 25,0%│Разбавление поляр- │ │
│к.э. циперметрина │ным растворителем │ │
│ │до необходимой │ │
│ │концентрации, │ │
│ │удаление следов │ │
│ │воды прокаленным │ │
│ │осушителем │ │
│- Смачивающийся порошок │Экстракция неполяр-│ │
│циперметрин — 2,9%; │ным растворителем │ │
│малатион — 14,0% │ │ │
│Твердые формы: │Экстракция неполяр-│ │
│дуст (циперметрин — 0,24%), │ным растворителем │ │
│меловой карандаш — │ │ │
│циперметрин — 0,24% │ │ │
│- Аэрозольные баллоны │Удаление пропеллен-│ │
│циперметрин — 0,1%; │та путем испарения,│ │
│имипротрин — 0,08%; │разведение состава │ │
│МГК 264 — 0,8%; │неполярным раство- │ │
│УВП — 50,0% │рителем до необхо- │ │
│ │димой концентрации │ │
│- Гели │Экстракция неполяр-│ │
│циперметрин — 0,1% │ным растворителем │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│3. АЛЬФА-ЦИПЕРМЕТРИН │ │ │
│(сумма 2 цис-изомеров │ │ │
│циперметрина) │ │ │
│- Субстанция │Растворение в │Метод ГЖХ с ПИД; │
│»Альфа-циперметрин │неполярном │количественная оценка — │
│технический», не менее 95,0%│растворителе │методом абсолютной │
│ │ │градуировки; │
│ │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │250 °C; │
│ │ │температура детектора — │
│ │ │260 °C; │
│ │ │температура испарителя -│
│ │ │260 °C; │
│ │ │время удерживания │
│ │ │альфа-циперметрина — │
│ │ │4 мин. 30 с │
│Формы применения: │ │ │
│- Аэрозольные баллоны │Удаление пропеллен-│ │
│альфа-циперметрин — 0,15%; │та путем испарения,│ │
│перметрин — 0,2% │разведение состава │ │
│ │неполярным │ │
│ │растворителем │ │
│- Растворы, БАУ │Разбавление поляр- │ │
│альфа-циперметрин — 0,22% │ным растворителем │ │
│ │до необходимой кон-│ │
│ │центрации, удаление│ │
│ │следов воды прока- │ │
│ │ленным осушителем │ │
│Гели │Экстракция неполяр-│ │
│альфа-циперметрин — 0,2% │ным растворителем │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│4. ДЕЛЬТАМЕТРИН │ │ │
│S-альфа-циано-3-фенокси- │ │ │
│бензил │ │ │
│(1R, 3R)-3-(2,2-дибром- │ │ │
│винил)-2,2-(диметил)- │ │ │
│циклопропан-карбоксилат │ │ │
│- Субстанция, содержащая не │Растворение в │Метод ГЖХ с ПИД; │
│менее 98,0% основного │неполярном │количественная оценка — │
│вещества │растворителе │методом абсолютной │
│ │ │градуировки; │
│ │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │250 °C; │
│ │ │температура детектора — │
│ │ │260 °C; │
│ │ │температура испарителя -│
│ │ │260 °C; │
│ │ │время удерживания │
│ │ │дельтаметрина — 6 мин. │
│ │ │30 с │
│Формы применения: │ │ │
│- Концентраты эмульсий │Экстракция неполяр-│ │
│дельтаметрин — 2,5% │ным растворителем │ │
│Твердые формы: │Экстракция неполяр-│ │
│- Дуст │ным растворителем │ │
│дельтаметрин — 0,025%; │ │ │
│фентион — 0,40%; │ │ │
│мелокдельтаметрин — 0,1%; │ │ │
│зетациперметрин — 0,05% │ │ │
│- Аэрозольные баллоны │Удаление пропеллен-│ │
│дельтаметрин — 0,02% │та путем испарения,│ │
│ │экстракция из │ │
│ │состава неполярным │ │
│ │растворителем, │ │
│ │удаление следов │ │
│ │воды прокаленным │ │
│ │осушителем │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│5. ЭСБИОТРИН │ │ │
│1RS-Аллил-2-метил-4-оксо- │ │ │
│циклопент-2-енил-(1R, 3R)- │ │ │
│2,2-диметил-3-(2-метил-проп-│ │ │
│1-енил)-циклопропан- │ │ │
│карбоксилат │ │ │
│- Субстанция │Растворение в │Метод ГЖХ с ПИД; │
│»Эсбиотрин», суммарное │полярном │количественная оценка — │
│содержание ДВ в техническом │растворителе │методом абсолютной │
│продукте не менее 93,0% │ │градуировки или методом │
│ │ │»внутреннего эталона» по│
│ │ │дибутилфталату; │
│ │ │растворитель — ацетон; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │200 °C; │
│ │ │температура детектора — │
│ │ │250 °C; │
│ │ │температура испарителя -│
│ │ │250 °C; │
│ │ │время удержания │
│ │ │эсбиотрина — 2 мин. 20 с│
│Формы применения: │ │ │
│Электрофумигирующие │ │ │
│средства: │ │ │
│- Электрофумигатор │Разведение полярным│ │
│жидкостной │растворителем │ │
│эсбиотрин — 3,0% │ │ │
│- Электрофумигатор с │Измельчение, │ │
│пластинами от комаров │экстракция полярным│ │
│эсбиотрин — 20,0 мг/на │растворителем │ │
│пластину │ │ │
│- Свеча │Экстракция полярным│ │
│эсбиотрин — 0,16% │растворителем │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│6. ПРАЛЛЕТРИН ЭТОК │ │ │
│S-2-метил-4-оксо-3-проп-2- │ │ │
│инил-циклопент-2-енил-1R- │ │ │
│2,2-диме-диметил-3- │ │ │
│(2-метил-проп-1-енил)- │ │ │
│циклопропанкарбоксилат │ │ │
│- Субстанция ЭТОК с │Растворение в │Метод ГЖХ с ПИД; │
│содержанием действующего │полярном │количественная оценка — │
│вещества в техническом │растворителе │методом абсолютной │
│продукте не менее 93,0% │ │градуировки или методом │
│ │ │»внутреннего эталона» по│
│ │ │дибутилфталату; │
│ │ │растворитель — ацетон; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │200 °C; │
│ │ │температура детектора — │
│ │ │250 °C; │
│ │ │температура испарителя -│
│ │ │250 °C; │
│ │ │время удерживания прал- │
│ │ │летрина — 2 мин. 20 с │
│Формы применения: │ │ │
│- Электрофумигирующее │Измельчение │ │
│средство в форме пластины │пластины, │ │
│содержание праллетрина — │экстракция полярным│ │
│10 мг на пластину │растворителем │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│7. НЕОПИНАМИН ФОРТЕ │ │ │
│(d-ТЕТРАМЕТРИН) │ │ │
│3,4,5,6-Тетрагидро- │ │ │
│фталимидометил-1R-цис,транс-│ │ │
│хризантемат │ │ │
│- Субстанция содержит │Растворение в │Метод ГЖХ с ПИД; │
│минимум 92,0% активных │неполярном │количественная оценка — │
│d-транс-изомеров │растворителе │методом абсолютной │
│ │ │градуировки или методом │
│ │ │»внутреннего эталона» по│
│ │ │дибутилфталату; │
│ │ │растворитель — ацетон; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │250 °C; │
│ │ │температура детектора — │
│ │ │270 °C; │
│ │ │температура испарителя -│
│ │ │260 °C; │
│ │ │время удерживания тетра-│
│ │ │метрина — 2 мин. 30 с; │
│ │ │программирование │
│ │ │температуры от 200 до │
│ │ │250 °C │
│Формы применения: │ │ │
│- Аэрозольные баллоны │Удаление │ │
│(для летающих и ползающих │пропеллента путем │ │
│насекомых) │испарения, │ │
│перметрин — 0,2%; │разведение состава │ │
│циперметрин — 0,2%; │неполярным │ │
│тетраметрин — 0,2%; │растворителем │ │
│ППБ — 1,0%; │ │ │
│УВП — 40,0% │ │ │
│Твердые формы: │Экстракция │ │
│- Дуст │неполярным │ │
│тетраметрин — 0,05%; │растворителем │ │
│перметрин — 0,45%; │ │ │
│фенвалерат — 0,15% │ │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│8. ПРАЛЛЕ (50,0% ИМИПРОТРИН)│ │ │
│[2,5-Диоко-3-(2-пропинил)-1-│ │ │
│имидазолидинил]-метил │ │ │
│1RS-цис,транс-хризантемат │ │ │
│- Субстанция │Растворение в │Метод ГЖХ с ПИД; │
│ПРАЛЛЕ (50% имипротрин) │неполярном │количественная оценка │
│ │растворителе │методом абсолютной │
│ │ │градуировки или методом │
│ │ │»внутреннего эталона» по│
│ │ │дифенилфталату; │
│ │ │растворитель — ацетон; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │190 — 260 °C; │
│ │ │температура детектора — │
│ │ │260 °C; │
│ │ │температура испарителя -│
│ │ │260 °C; │
│ │ │время удерживания ими- │
│ │ │протрина — 2 мин. 15 с │
│Формы применения: │ │ │
│Аэрозольные баллоны: │Удаление пропеллен-│ │
│- Инсектицидное средство │та путем испарения,│ │
│имипротрин — 0,1%; │разведение состава │ │
│d-цифенотрин — 0,3%; │полярным │ │
│УВП — 40,0% │растворителем │ │
│- Акарицидное средство │Удаление пропеллен-│ │
│пралле — 0,32%; │та путем испарения,│ │
│альфа-циперметрин — 0,2%; │разведение состава │ │
│УВП — 50% │полярным │ │
│ │растворителем │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│9. ГОКИЛАТ-S ЦИФЕНОТРИН │ │ │
│RS-Альфа-циано-3-феноксибен-│ │ │
│зил-1R-цис,транс- │ │ │
│хризантемат │ │ │
│- Субстанция ГОКИЛАТ-S │Растворение в │Метод ГЖХ с ПИД; │
│ЦИФЕНОТРИН — технический │полярном │количественная оценка │
│продукт с содержанием │растворителе │методом абсолютной │
│основного вещества — 96,0% │ │градуировки; │
│ │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │2,0 мг/куб. см; │
│ │ │температура колонки, │
│ │ │детектора и испарителя -│
│ │ │250 °C; │
│ │ │время удерживания ци- │
│ │ │фенотрина — 2 мин. 30 с │
│Формы применения: │ │ │
│Аэрозольные баллоны │Удаление пропеллен-│ │
│- Инсектицидное средство │та путем испарения,│ │
│цифенотрин — 0,2%; │разведение неполяр-│ │
│d-тетраметрин — 0,1%; │ным растворителем │ │
│УВП — 60,0% │ │ │
│- Концентрат эмульсии │Разведение неполяр-│ │
│цифенотрин — 10% │ным растворителем │ │
│ │до необходимой │ │
│ │концентрации │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│10. d-ФЕНОТРИН СУМИТРИН │ │ │
│3-Феноксибензил-1RS-цис, │ │ │
│транс-2,2-диметил-3-(2,2- │ │ │
│диметилвинил)-циклопро- │ │ │
│панкарбоксилат │ │ │
│- Технический продукт с │Растворение в │Метод ГЖХ с ПИД; │
│содержанием основного │неполярном │количественная оценка — │
│вещества 93,7% │растворителе │методом абсолютной │
│ │ │градуировки или методом │
│ │ │»внутреннего эталона» по│
│ │ │диоктилфталату; │
│ │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │230 °C; │
│ │ │температура детектора — │
│ │ │250 °C; │
│ │ │температура испарителя -│
│ │ │250 °C; │
│ │ │время удерживания │
│ │ │d-фенотрина — 4 мин. │
│ │ │15 с │
│Формы применения: │ │ │
│Аэрозольные баллоны: │Удаление пропел- │ │
│Инсектицидное средство │лента путем испа- │ │
│d-фенотрина — 0,15%; │рения, разведение │ │
│d-тетраметрин — 0,15% │неполярным │ │
│ │растворителем │ │
│Ловушки: │Экстракция неполяр-│ │
│- Инсектицидное средство, │ным растворителем │ │
│ловушка от муравьев │ │ │
│фенотрин — 0,1%; │ │ │
│аттрактант — 98,6% │ │ │
│- Концентрат эмульсии │Разведение неполяр-│ │
│фенотрин — 10,0% │ным растворителем │ │
│ │до нужной │ │
│ │концентрации │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│11. ВАПОРТРИН ЭМПЕНТРИН │ │ │
│RS-1-3-Этинил-2-метилпент-2-│ │ │
│енил-1R-цис,транс- │ │ │
│хризантемат │ │ │
│- Субстанция вапортрина │Растворение в │Метод ГЖХ с ПИД; │
│технический продукт с │полярном │количественная оценка — │
│содержанием основного │растворителе │методом абсолютной │
│вещества не менее 93,0% │ │градуировки; │
│ │ │растворитель — ацетон; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │1,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │170 °C; │
│ │ │температура детектора — │
│ │ │250 °C; │
│ │ │температура испарителя -│
│ │ │250 °C; │
│ │ │время удерживания │
│ │ │вапортрина — 2 мин. 10 с│
│Формы применения: │ │ │
│- Инсектицидное средство │Экстракция полярным│ │
│в виде бумажных пластин, │растворителем │ │
│пропитанных раствором │ │ │
│вапортрина; │ │ │
│вапортрин — 8,6% │ │ │
│- Инсектицидное средство от │Разведение полярным│ │
│мух в виде жидкости с │растворителем │ │
│содержанием вапортрина │ │ │
│вапортрин — 2,8% │ │ │
└────────────────────────────┴───────────────────┴────────────────────────┘
4.3.3. Методы определения фосфорорганических соединений
Основными фосфорорганическими соединениями, используемыми в качестве ДВ в составе различных инсектицидов и акароинсектицидов в настоящее время, являются: хлорпирифос, хлорофос, малатион карбофос, фентион сульфидофос, сумитион (фенитротион), диазинон и азаметифос.
В качестве субстанций зарегистрированы: хлорофос, хлорпирифос и фентион технический сульфидофос.
Анализ хлорофоса осуществляют методом ВЭЖХ, анализ азаметифоса проводится спектрофотометрическим методом при длине волны 295 нм.
Остальные пять фосфорорганических соединений определяют методом ГЖХ/ПИД при температуре колонки 190 — 210 °C, температуре испарителя и детектора 200 — 230 °C.
В качестве внутреннего стандарта используют дибутилфталат или дифенил.
В табл. 4.3 представлены методы количественного определения фосфорорганических соединений в обобщенном виде для различных форм применения.
Подробно условия хроматографирования при использовании метода ГЖХ приведены в п. 4.3.2.
Таблица 4.3
МЕТОДЫ ОПРЕДЕЛЕНИЯ ФОСФОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
┌────────────────────────────┬───────────────────┬────────────────────────┐
│ Действующие вещества, │ Способ подготовки │ Условия │
│ препаративные формы │анализируемой пробы│ хроматографирования │
├────────────────────────────┼───────────────────┼────────────────────────┤
│ 1 │ 2 │ 3 │
├────────────────────────────┼───────────────────┼────────────────────────┤
│1. ХЛОРПИРИФОС, │ │ │
│O-Диэтил-O-(3,5,6-трихлор-2-│ │ │
│пиридинил)-тиофосфат │ │ │
│- Технический продукт │Растворение в │Метод ГЖХ с ПИД; │
│субстанция с содержанием │неполярном │количественная оценка — │
│основного продукта 97,0% │растворителе │методом абсолютной │
│ │ │градуировки; │
│ │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │2,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │180 °C; │
│ │ │температура детектора — │
│ │ │190 °C; │
│ │ │температура испарителя -│
│ │ │210 °C; │
│ │ │время удерживания хлор- │
│ │ │пирифоса — 3 мин. 40 с │
│Формы применения: │ │ │
│- Концентрат эмульсии │Разбавление смесью │ │
│(хлорпирифос — 20%) в форме │ацетонитрила и │ │
│микрокапсулированной │четыреххлористого │ │
│суспензии │углерода (2:3), │ │
│ │удаление следов │ │
│ │воды прокаленным │ │
│ │осушителем │ │
│- 48,0% к.э. хлорпирифоса │Разбавление │ │
│ │неполярным │ │
│ │растворителем │ │
│- Гели │Экстракция смесью │ │
│гель от тараканов │полярного и непо- │ │
│хлорпирифос — 0,6% │лярного растворите-│ │
│ │лей (1:1), удаление│ │
│ │следов воды прока- │ │
│ │ленным осушителем │ │
│- Инсектицидное средство в │Экстракция полярным│ │
│виде гелеобразной пасты │растворителем │ │
│хлорпирифос — 0,5% │ │ │
│- Приманки, ловушки-приманки│Экстракция смесью │ │
│от тараканов │полярного и непо- │ │
│ │лярного раствори- │ │
│ │телей (1:1) │ │
│хлорпирифос — 0,6%; │ │ │
│бумага от моли, │Экстракция полярным│ │
│хлорпирифос — 2,9%; │растворителем │ │
│порошок-приманка │Экстракция неполяр-│ │
│хлорпирифос — 2,0%; │ным растворителем │ │
│антимоль, хлорпирифос — │Экстракция неполяр-│ │
│0,6 г на ленту │ным растворителем │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│2. ФЕНТИОН (Сульфидофос) │ │ │
│O,O-Диметил-O-(4-метил- │ │ │
│тио-м-толил)-тиофосфат │ │ │
│Технический продукт │Растворение в │Метод ГЖХ с ПИД; │
│субстанция «Фентион │неполярном │количественная оценка — │
│технический» с содержанием │растворителе │методом абсолютной │
│основного вещества не менее │ │градуировки; │
│90% │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │2,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │190 °C; │
│ │ │температура детектора — │
│ │ │250 °C; │
│ │ │температура испарителя -│
│ │ │250 °C; │
│ │ │время удерживания │
│ │ │фентиона — 2 мин. 50 с │
│Формы применения: │ │ │
│- Концентраты эмульсий │Разбавление │ │
│25% к.э. фентиона │неполярным │ │
│ │растворителем │ │
│- Смачивающийся порошок │Экстракция неполяр-│ │
│40% с.п. фентиона │ным растворителем │ │
│- Гели │Экстракция неполяр-│ │
│Средство инсектицидное в │ным растворителем │ │
│форме геля фентион — 0,24% │ │ │
│альфа-циперметрин — 0,03% │ │ │
│- Твердые формы │Экстракция │ │
│дуст фентион — 0,4%; │неполярным │ │
│дельтаметрин — 0,025% │растворителем │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│3. ХЛОРОФОС │ │ │
│O,O-Диметил-(1-окси-2,2,2- │ │ │
│трихлорэтил)-фосфонат │ │ │
│- Технический продукт │Разбавление элюен- │Метод ВЭЖХ с │
│субстанция с содержанием │том: метанол — 0,3%│УФ-детектированием при │
│хлорофоса 98,0% │водный раствор │длине волны — 220 нм; │
│ │ортофосфорной │сорбент — IP, элюент — │
│ │кислоты 55:45 │метанол-ортофосфорная │
│ │ │кислота 55:45; │
│ │ │количественная оценка — │
│ │ │методом абсолютной │
│ │ │градуировки │
│Инсектицидное средство │Экстракция элюентом│ │
│хлорофос — 80,0% с.п. │ │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│4. МАЛАТИОН КАРБОФОС │ │ │
│O,O-Диметил-S-[1,2- │ │ │
│ди(этоксикарбонил)этил- │ │ │
│дитио]-фосфат │ │ │
│Формы применения: │ │ │
│- Концентраты эмульсий │Разбавление │Метод ГЖХ с ПИД; │
│малатион — 57% к.э.; │неполярным │количественная оценка — │
│малатион — 10,0%; │растворителем │методом абсолютной │
│циперметрин — 20,0%; │ │градуировки; │
│- малатион — 50,0% к.э. │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │2,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │190 °C; │
│ │ │температура детектора — │
│ │ │200 °C; │
│ │ │температура испарителя -│
│ │ │220 °C; │
│ │ │время удерживания │
│ │ │малатиона — 2 мин. 30 с │
│Твердые формы: │Экстракция неполяр-│ │
│таблетка малатион — 8,0%; │ным растворителем │ │
│альфа-циперметрин — 20% │ │ │
│- Инсектицидное средство в │Экстракция неполяр-│ │
│виде порошка │ным растворителем │ │
│малатион — 14,0%, │ │ │
│циперметрин — 2,9% │ │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│5. ДИАЗИНОН │ │ │
│O,O-Диэтил-O-(2-изопропил- │ │ │
│(4-метил-пиримидил-6)- │ │ │
│тиофосфат │ │ │
│Гели, ловушки: │Экстракция │Метод ГЖХ с ПИД; │
│инсектицидное средство в │неполярным │количественная оценка — │
│форме таблетки │растворителем │методом абсолютной │
│диазинон — 6,0% │ │градуировки; │
│ │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │2,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │170 °C; │
│ │ │температура детектора — │
│ │ │200 °C; │
│ │ │температура испарителя -│
│ │ │220 °C; │
│ │ │время удерживания │
│ │ │диазинона — 2 мин. 10 с │
│- Инсектицидное средство в │Экстракция │ │
│форме геля │неполярным │ │
│диазинон — 0,2%; │растворителем │ │
│хлорпирифос — 0,3% │ │ │
│- Инсектицидное средство в │Экстракция │ │
│форме гель-пасты │неполярным │ │
│диазинон — 0,3%; │растворителем │ │
│альфа-циперметрин — 0,05% │ │ │
│- Инсектицидное средство в │Экстракция полярным│ │
│форме геля │растворителем │ │
│диазинон — 0,225%; │ │ │
│циперметрин — 0,075% │ │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│6. ФЕНИТРОТИОН СУМИТИОН │ │ │
│O,O-Диметил-O-(4-нитро-м- │ │ │
│толил)-тиофосфат │ │ │
│Формы применения: │ │ │
│Аэрозольные баллоны: │Удаление │Метод ГЖХ с ПИД; │
│- Аэрозольный баллон для │пропеллента путем │количественная оценка — │
│нелетающих насекомых │испарения, │методом абсолютной │
│фенитротион — 1,0%; │разбавление │градуировки; │
│тетраметрин — 0,1%; │неполярным │растворитель — четырех- │
│УВП — 55% │растворителем │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │2,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │200 °C; │
│ │ │температура детектора — │
│ │ │250 °C; │
│ │ │температура испарителя -│
│ │ │250 °C; │
│ │ │время удерживания фени- │
│ │ │тротиона — 2 мин. 3 с │
│- Аэрозольный баллон для │Удаление пропеллен-│ │
│летающих насекомых │та путем испарения,│ │
│тетраметрин — 0,075%; │разбавление │ │
│перметрин — 0,04%; │неполярным │ │
│фенитротион — 0,3%; │растворителем │ │
│синергист — пиперонил- │ │ │
│бутоксид ППБ — 0,3%; │ │ │
│УВП-бутан — 67,5% │ │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│7. АЗАМЕТИФОС │ │ │
│O,O-диметил-S-(2-оксо-6- │ │ │
│хлор-пиридо-оксазолил-3- │ │ │
│метил)-тиофосфат │ │ │
│- Инсектицидное средство │Экстракция неполяр-│ │
│»Альфакрон 50% с.п.» │ным растворителем │ │
│- Инсектицидное средство в │Экстракция │ │
│форме порошка │неполярным │ │
│альфакрон — 0,4% │растворителем │ │
│или азаметифос — 0,2% │ │ │
│Приманка для мух в виде │Экстракция │Спектрофотометрический │
│пластины │неполярным │метод (длина волны — │
│азаметифос — 1,0 мг на │растворителем │295 нм) │
│пластину │ │ │
└────────────────────────────┴───────────────────┴────────────────────────┘
4.3.4. Метод ТЖХ для определения карбаматов
За последние 5 лет нашли применение средства с двумя ДВ из класса карбаматов — метомилом и пропоксуром.
В нижеследующей табл. 4.4 приведены методики количественного определения указанных ДВ в средствах на основе карбаматов.
Таблица 4.4
МЕТОДИКИ ОПРЕДЕЛЕНИЯ КАРБАМАТОВ
┌────────────────────────────┬───────────────────┬────────────────────────┐
│ Действующие вещества, │ Способ подготовки │ Условия │
│ формы применения │анализируемой пробы│ хроматографирования │
├────────────────────────────┼───────────────────┼────────────────────────┤
│ 1 │ 2 │ 3 │
├────────────────────────────┼───────────────────┼────────────────────────┤
│1. МЕТОМИЛ │ │ │
│1-Метилтиоацетальдегида- │ │ │
│O-(N-метил-карбамоил)оксим │ │ │
│- Технический продукт │Растворение в непо-│Метод ГЖХ с ПИД; │
│ │лярном растворителе│количественная оценка │
│ │ │методом абсолютной │
│Субстанция «Метомил» с │ │градуировки; │
│содержанием основного │ │растворитель — четырех- │
│вещества не менее 98,0% │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │2,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │100 °C; │
│ │ │температура детектора — │
│ │ │200 °C; │
│ │ │температура испарителя -│
│ │ │200 °C; │
│ │ │время удерживания │
│ │ │метомила — 2 мин. 20 с │
│- Приманка от мух │Экстракция │ │
│Инсектицидное средство в │неполярным │ │
│виде гранулированной │растворителем │ │
│приманки для мух │ │ │
│метомил — 1,0% │ │ │
├────────────────────────────┼───────────────────┼────────────────────────┤
│2. ПРОПОКСУР │ │ │
│O-(2-Изопропокси-карбонил- │ │ │
│пропен-1-ил-2)-O-метил-N- │ │ │
│этиламидотиофосфат │ │ │
│- Концентрат эмульсии │Разведение полярным│Метод ГЖХ с ПИД; │
│(пропоксур, 20% к.э.) │растворителем │количественная оценка │
│ │ │методом абсолютной │
│ │ │градуировки; │
│ │ │растворитель — четырех- │
│ │ │хлористый углерод; │
│ │ │C = C = │
│ │ │ ст ан │
│ │ │2,0 мг/куб. см; │
│ │ │температура колонки — │
│ │ │180 °C; │
│ │ │температура детектора — │
│ │ │230 °C; │
│ │ │температура испарителя -│
│ │ │230 °C; │
│ │ │время удерживания │
│ │ │пропоксура — 2 мин. 20 с│
│- Приманка для уничтожения │Экстракция полярным│ │
│тараканов (пропоксур — 2,0%)│растворителем │ │
└────────────────────────────┴───────────────────┴────────────────────────┘
Подробно условия хроматографирования приведены в п. 4.3.2.
4.3.5. Метод ГЖХ для определения регулятора
размножения тараканов — S-гидропрена
Метод ГЖХ для определения регулятора размножения тараканов — S-гидропрена представлен в табл. 4.5.
Таблица 4.5
МЕТОД ГЖХ ДЛЯ ОПРЕДЕЛЕНИЯ РЕГУЛЯТОРА РАЗМНОЖЕНИЯ
ТАРАКАНОВ S-ГИДРОПРЕНА
┌─────────────────────┬─────────────────┬─────────────────────────────────┐
│Действующие вещества,│Способ подготовки│ Условия хроматографирования │
│ формы применения │ анализируемой │ │
│ │ пробы │ │
├─────────────────────┼─────────────────┼─────────────────────────────────┤
│S-Гидропрен │ │ │
│- Средство │Растворение в │Метод ГЖХ с ПИД; │
│инсектицидное │неполярном │количественная оценка — методом │
│регулятор размножения│растворителе │абсолютной градуировки; │
│тараканов │ │растворитель — гексан; │
│»S-Гидропрен» с │ │C = C = 2,0 мг/куб. см; │
│содержанием основного│ │ ст ан │
│вещества не менее │ │температура колонки — 200 °C; │
│99,1% │ │температура детектора — 250 °C; │
│ │ │температура испарителя — 250 °C; │
│ │ │время удерживания S-гидропрена — │
│ │ │3 мин. 5 с │
└─────────────────────┴─────────────────┴─────────────────────────────────┘
Подробно условия хроматографирования приведены в п. 4.3.2.
4.3.6. Методы идентификации и количественного определения
действующих веществ в репеллентных средствах
Основными репеллентами, широко применяемыми в сфере медицинской дезинсекции, являются диметилфталат ДМФ, N,N-диэтил-мета-толуамид ДЭТА, N-гексилоксиметилкапролактам акреп, этил-3-N-бутилацетамино-пропионат (репеллент ИР3535), 1-(1-метилпропокси-карбонил)-2-(2-гидроксиэтилен)-пиперидин (КБР).
Основные формы применения — аэрозольные баллоны, растворы в беспропеллентной упаковке БАУ, лосьоны, эмульсии, кремы, карандаши, салфетки.
Наиболее востребованным репеллентом является ДЭТА. В составе аэрозольных баллонов, предназначенных для уничтожения кровососущих насекомых, его содержание — 10,0 — 20,0%, в составе аэрозольных баллонов, предназначенных для защиты от клещей — 30 — 32%. Часто ДЭТА комбинируют с другими репеллентами, например в составе лосьонов с ДМФ, в сочетании с репеллентом ИР3535 в спреях или в сочетании с альфа-циперметрином в акароинсектицидных средствах в форме аэрозольных баллонов.
Акреп — репеллент отечественного производства — используется для изготовления эмульсий, как правило, в сочетании с ДМФ.
В качестве субстанций в настоящее время зарегистрированы репеллент ИР3535 производства фирмы «Мерк» Германия и ДЭТА производства фирмы «МакЛафлин Гормли Кинг» США.
Анализ всех репеллентов осуществляют методом ГЖХ на хроматографе с ПИД и количественной оценкой ДВ методом абсолютной градуировки или методом «внутреннего эталона» по дипропилфталату или по дифенилу.
Основная задача при анализе различных репеллентных средств заключается в количественном выделении ДВ из препаративной формы путем подбора оптимальных условий выделения: растворителя для экстракции ДВ, времени экстракции, температурного режима. Наименьший коэффициент извлечения (85 — 90%) достигается при анализе кремов, что обусловлено их сложным составом.
В табл. 4.6 представлен анализ репеллентов в обобщенном виде для различных препаративных форм. Для каждого репеллента приведены наиболее распространенные формы применения, ДВ в препаративной форме, условия хроматографирования, растворитель для экстракции и коэффициент извлечения ДВ.
Таблица 4.6
ГАЗОХРОМАТОГРАФИЧЕСКИЙ МЕТОД АНАЛИЗА РЕПЕЛЛЕНТОВ
В РАЗЛИЧНЫХ ФОРМАХ ПРИМЕНЕНИЯ
┌─────────────────────┬──────────────────┬────────────────────────────────┐
│ Название ДВ, │Способ подготовки │ Условия хроматографирования │
│ формы применения │ анализируемой │ │
│ │ пробы │ │
├─────────────────────┼──────────────────┼────────────────────────────────┤
│ 1 │ 2 │ 3 │
├─────────────────────┼──────────────────┼────────────────────────────────┤
│1. ДМФ │ │ │
│Диметилфталат │ │ │
│Формы применения: │ │ │
│- Репеллентное │Разведение │Метод ГЖХ с ПИД; │
│средство │этиловым спиртом │количественная оценка — методом │
│лосьон (ДМФ — 30%) │ │абсолютной градуировки [18] или │
│ │ │методом «внутреннего эталона» по│
│ │ │дециловому спирту; │
│ │ │растворитель — этиловый спирт; │
│ │ │C = C = 2,0 мг/куб. см; │
│ │ │ ст ан │
│ │ │температура колонки — 160 °C; │
│ │ │температура детектора — 170 °C; │
│ │ │температура испарителя — 160 °C;│
│ │ │время удерживания ДМФ — │
│ │ │2 мин. 30 с │
│- Репеллентное │Разведение │ │
│средство в виде │этиловым спиртом │ │
│водно-спиртового │ │ │
│раствора в БАУ │ │ │
│ДЭТА — 14,0%; │ │ │
│ДМФ — 9,0% │ │ │
│- Репеллентное │Разведение │Количественная оценка методом │
│средство в форме │этиловым │»внутреннего эталона» по │
│эмульсии │спиртом │дипропилфталату; │
│ДМФ — 20,0%; │ │время удерживания ДМФ — │
│акреп — 20,0% │ │3 мин. 30 с; │
│ │ │время удержания акрепа — │
│ │ │5 мин. 55 с │
├─────────────────────┼──────────────────┼────────────────────────────────┤
│2. ДЭТА │ │ │
│N,N-диэтил-мета- │ │ │
│толуамид │ │ │
│Формы применения: │ │ │
│Репеллентное средство│Удаление пропел- │Метод ГЖХ с ПИД; │
│в аэрозольной │лента путем испа- │количественная оценка — методом │
│упаковке │рения, разбавление│абсолютной градуировки или │
│ДЭТА — 25,0% │состава │методом «внутреннего эталона» по│
│ │растворителем │дибутилфталату; │
│ │ │растворитель — этиловый спирт; │
│ │ │C = C = 2,0 мг/куб. см; │
│ │ │ ст ан │
│ │ │температура колонки — 170 °C; │
│ │ │температура детектора — 180 °C; │
│ │ │температура испарителя — 190 °C;│
│ │ │время удерживания ДЭТА — │
│ │ │3 мин. 30 с │
│- Инсектицидно-репел-│Удаление │ │
│лентное средство в │пропеллента путем │ │
│аэрозольной упаковке │испарения, │ │
│ДЭТА — 15,0%; │разбавление │ │
│альфа-циперметрин — │состава │ │
│0,18% │растворителем │ │
│- Инсектоакарицидное │ │ │
│средство │ │ │
│(ДЭТА — 30,0%) в │ │ │
│форме аэрозольного │ │ │
│баллона │ │ │
│- Репеллентное │Разведение │ │
│средство в форме │полярным │ │
│водно-спиртового │растворителем │ │
│раствора БАУ │ │ │
│ДЭТА — 10,0% │ │ │
│- Репеллентное сред- │Экстракция │ │
│ство в виде карандаша│полярным │ │
│ДЭТА — 17,5% │растворителем │ │
│- Средство репеллент-│Экстракция │ │
│ное в виде карандаша │этиловым спиртом │ │
│ДЭТА — 15,0% │ │ │
│- Репеллентное │Экстракция смесью │ │
│средство в виде │ацетон:четырех- │ │
│крем-геля │хлористый углерод │ │
│ДЭТА — 17,5% │(1:1) │ │
├─────────────────────┼──────────────────┼────────────────────────────────┤
│3. ИР3535 │ │ │
│Этил-3-(N-бутил- │ │ │
│ацетамидо)-пропионат │ │ │
│Субстанция │Растворение в │Метод ГЖХ с ПИД; │
│»ИР 3535″ — │неполярном │количественная оценка — методом │
│технический продукт, │растворителе │абсолютной градуировки; │
│содержащий не менее │ │растворитель — четыреххлористый │
│98,0% основного │ │углерод; │
│вещества │ │C = C = 2,0 мг/куб. см; │
│ │ │ ст ан │
│ │ │температура колонки — 150 °C; │
│ │ │температура детектора — 210 °C; │
│ │ │температура испарителя — 210 °C;│
│ │ │время удерживания ИР3535 — │
│ │ │2 мин. 30 с │
│Формы применения: │ │ │
│- Репеллентное сред- │Разбавление │ │
│ство антикомариный │этиловым спиртом │ │
│спрей для детей, в │ │ │
│форме БАУ │ │ │
│ИР3535 — 12,0% │ │ │
│- Репеллентное сред- │Разбавление │Температура колонки — │
│ство антикомариный │этиловым спиртом │130 — 160 °C; │
│спрей для взрослых │ │температура детектора и │
│ИР3535 — 4,0%; │ │испарителя — 230 °C; │
│ДЭТА — 5,0%; │ │время удерживания: │
│гександиол — 5,0% │ │гександиола — 2 мин. 20 с; │
│ │ │ДЭТА — 6 мин. 23 с; │
│ │ │ИР3535 — 6 мин. 45 с │
├─────────────────────┼──────────────────┼────────────────────────────────┤
│4. КБР │ │ │
│1-Пиперидинкарбоновая│ │ │
│кислота, 2-(2-гидрок-│ │ │
│сиэтил)-1-метилпропи-│ │ │
│ловый эфир │ │ │
│Формы применения: │ │ │
│Лосьоны: │ │ │
│- Репеллентное сред- │Разведение │Метод ГЖХ с ПИД; │
│ство лосьон в форме │этиловым спиртом │количественная оценка — методом │
│водно-спиртового │ │абсолютной градуировки; │
│раствора БАУ │ │растворитель — этиловый спирт; │
│КБР — 20,0% │ │C = C = 2,0 мг/куб. см; │
│ │ │ ст ан │
│ │ │температура колонки — 160 °C; │
│ │ │температура детектора — 200 °C; │
│ │ │температура испарителя — 200 °C;│
│ │ │время удерживания КБР — 3 мин. │
│ │ │50 с │
│- Репеллентное │Разведение │ │
│средство молочко для │этиловым спиртом │ │
│защиты от летающих │ │ │
│насекомых в форме │ │ │
│эмульсии │ │ │
│КБР — 10,0% │ │ │
│Крем: │ │ │
│- Репеллентное │Разведение │ │
│средство крем для │этиловым спиртом │ │
│защиты от летающих │ │ │
│насекомых │ │ │
│КБР — 10,0% │ │ │
├─────────────────────┼──────────────────┼────────────────────────────────┤
│5. АКРЕП │ │ │
│N-(Гексилоксиметил)- │ │ │
│капролактам │ │ │
│Формы применения: │ │ │
│Репеллентное средство│Экстракция │Метод ГЖХ с ПИД; │
│в форме эмульсии │неполярным │количественная оценка — методом │
│акреп — 22,0%; │растворителем │абсолютной градуировки или │
│ДМФ — 18,0% │ │методом «внутреннего эталона» по│
│ │ │дипропилфталату или по дифенилу;│
│ │ │растворитель — этиловый спирт; │
│ │ │C = C = 2,0 мг/куб. см; │
│ │ │ ст ан │
│ │ │температура колонки — │
│ │ │160 — 190 °C; │
│ │ │температура детектора — 230 °C; │
│ │ │температура испарителя — 230 °C;│
│ │ │время удерживания акрепа — │
│ │ │5 мин. 55 с │
│ │ │Метод «внутреннего эталона» по │
│ │ │дифенилфталату │
│ │ │K = 0,90 — 0,95 │
│ │ │ извл │
└─────────────────────┴──────────────────┴────────────────────────────────┘
Подробно условия хроматографирования приведены в п. 4.3.2.
4.4. Методы исследований дератизационных средств
В средствах для медицинской дератизации применяют действующие вещества ДВ различной химической природы и различного механизма действия. В настоящее время в России зарегистрированы родентицидные ДВ, представляющие собой яды острого типа действия и яды пролонгированного действия — антикоагулянты индандионового и кумаринового ряда.
Острые яды, такие как фосфид цинка, глифтор и нафтилтиомочевина, имеют ограниченное применение. Наибольшее применение получили ДВ пролонгированного действия — антикоагулянты индандионового (дифенацин, этилфенацин, изопропилфенацин, хлорфасинон) и кумаринового ряда (зоокумарин и его натриевая соль, бромадиолон, бродифакум, дифетиалон, дифенакум, куматетралил).
Дератизационные средства выпускают в различных препаративных формах: в виде ДВ (индивидуальных и смесевых) с содержанием основного вещества от 30 до 99,8%, жидких и диспергированных твердых порошки концентратов с содержанием ДВ от 0,25 до 2,5%, а также в виде отравленных приманок на пищевой основе с содержанием ДВ от 0,0025 до 3%.
Специфическими требованиями к выпускаемым препаративным формам дератизационных средств являются обязательное добавление интенсивных красителей и горечи (бензоат натрия, битрекс), которые обеспечивают отличие отравленных приманок от пищевых продуктов и предохраняют от случайного отравления на этапах производства и применения дератизационных средств. Исключение составляют фосфид цинка и 1-нафтилтиомочевина, собственная окраска которых не требует дополнительного предупредительного окрашивания.
Основными показателями, которые позволяют идентифицировать средство, являются внешний вид, цвет и содержание ДВ. Внешний вид и цвет определяют визуально. Выбор метода определения ДВ зависит от его физико-химических свойств и уровня содержания, а также состава инертных компонентов в рецептуре средства.
Разнообразие физико-химических свойств ДВ, применяемых в дератизационных средствах, обусловливает возможность применения различных методов их определения: химических — титрование и физико-химических инструментальных методов — спектрофотометрия, газовая хроматография, высокоэффективная жидкостная хроматография.
4.4.1. Методы определения фосфида цинка
в дератизационных субстанциях и средствах
Фосфид цинка Zn P представляет собой порошок темно-серого цвета.
3 2
Действующим веществом является фосфин (фосфористый водород) — PH ,
3
выделяющийся при гидролизном расщеплении фосфида цинка. В качестве примесей
технический фосфид цинка может содержать металлический цинк, оксиды цинка и
оксиды железа.
Анализ ДВ в техническом продукте фосфида цинка проводят объемным волюмометрическим методом [27] или титриметрическим методом. Указанные методы применимы для анализа фосфида цинка и в препаративных формах дератизационных средств.
Поскольку ратицидная активность фосфида цинка определяется именно токсичностью фосфина, образующегося при кислотном гидролизе фосфида цинка, его определение является предпочтительным для оценки качества дератизационного средства.
Объемный волюмометрический метод определения фосфида цинка основан на кислотном гидролизе фосфида цинка и измерении объема выделившегося фосфина с применением водного раствора сернокислой меди.
Содержание ДВ может быть охарактеризовано по фосфидному фосфору или по фосфидному цинку, которые вычисляют по результатам измерения объема фосфина.
Метод избирателен, примеси в техническом продукте и другие компоненты рецептурного состава в дератизационных средствах не мешают определению.
Приборы, реактивы и растворы. Специальный прибор для измерения объема выделившегося фосфина, в котором последовательно соединены капельная воронка вместимостью 50 мл, круглодонная колба вместимостью 25 — 30 мл, измерительная ячейка вместимостью 100 мл, снабженная водяной рубашкой и уравнительным сосудом с затворной жидкостью — раствором хлористого натрия; поглотительный сосуд с раствором сернокислой меди; весы аналитические; 20%-ный раствор соляной кислоты; 5%-ный раствор сернокислой меди — поглотительная жидкость; насыщенный раствор хлористого натрия — затворная жидкость; азот газообразный; вода дистиллированная.
Выполнение анализа. Масса средства для анализа берется из расчета 20 — 80 мг фосфидного фосфора или 80 — 400 мг фосфидного цинка в пробе. Анализируемую пробу средства, взвешенную в граммах с точностью до четвертого десятичного знака (около 0,15 г фосфида цинка или около 4 г зерновой приманки), помещают в круглодонную колбу, присоединяют к коммуникациям прибора и, заполнив измерительную бюретку затворной жидкостью, продувают слабым потоком азота в течение двух минут, после чего в капельницу при закрытом кране наливают около 20 мл раствора соляной кислоты. Затем по каплям подают раствор в круглодонную колбу, содержащую анализируемое средство, для разложения фосфида цинка. Постепенно нагревают содержимое колбы до кипения. По окончании реакции газ, оставшийся в колбе, вытесняют в измерительную бюретку насыщенным раствором хлористого натрия. После охлаждения газа в бюретке замеряют его объем. Затем с помощью прибора проводят поглощение фосфина раствором сернокислой меди. Объем выделившегося фосфина определяют по разности объема газа до и после его поглощения.
Обработка результатов. Измеренный объем фосфина приводят к нормальным
условиям (V , мл) по формуле:
0
V x 273 x P — p
V = —————,
0 P x 273 — t
0
где:
V — объем фосфина, измеренный в опыте, мл;
P — атмосферное давление, Па (мм рт. ст.);
p — упругость водяных паров над насыщенным раствором хлористого натрия,
Па (мм рт. ст.);
P — нормальное атмосферное давление, равное 10325 Па (760 мм рт. ст.);
0
t — температура газа, °C.
Массовую долю фосфина в средстве (X) в процентах вычисляют по формуле:
0,001518 x V x 100
0
X = ——————-,
m
где:
0,001518 — масса фосфина, содержащаяся в 1 мл газообразного фосфина, г;
m — масса средства, взятая для анализа, г.
Для того, чтобы вычислить массовую долю фосфидного фосфора в
техническом продукте, измеренный объем фосфина пересчитывают на фосфидный
фосфор (X ) в процентах по формуле:
фф
0,001318 x V x 100
0
X = ——————-,
фф m
где 0,001318 — масса фосфидного фосфора, содержащаяся в 1 мл
газообразного фосфина, г.
Массовую долю фосфидного цинка (X ) в процентах вычисляют из
фц
соотношения:
X = 4,16 x X ,
фц фф
где 4,16 — масса фосфида цинка, соответствующая 1 г фосфидного фосфора, определяемая из отношения молекулярной массы фосфида цинка к массе двух атомов фосфора 258,06 г / 2 x 31 г.
Титриметрический метод определения фосфидного цинка в техническом продукте субстанции [27] основан на раздельном титровании общего и свободного металлического цинка. Содержание фосфидного цинка определяют по разности полученных результатов.
Приборы, реактивы и растворы. Весы аналитические; бюретка и стеклянная мерная посуда; точно 0,1 н раствор тиосульфата натрия; 10%-ный раствор йодистого калия; 1 М раствор гидроокиси натрия; аммиачно-хлоридный буфер с pH 10,0 — 10,5; 0,1 М раствор уксусной кислоты; 2 М раствор серной кислоты; 0,1 М раствор сернокислой меди; точно 0,1 н раствор трилона Б; 1%-ный раствор крахмала индикатор; эриохром черный Т индикатор.
Выполнение анализа.
Определение металлического цинка.
В мерную колбу вместимостью 25 куб. см вносят навеску фосфида цинка массой 0,1 г, взвешенную с точностью до 0,0002 г, или эквивалентное количество отравленной приманки. Приливают 5 куб. см 0,1 М раствора сульфата меди. Смесь оставляют на 30 мин., периодически встряхивая. Затем раствор отфильтровывают через бумажный фильтр, осадок промывают на фильтре дважды по 5 куб. см дистиллированной воды, приливают к фильтрату 1 куб. см 0,1 М уксусной кислоты, 5 куб. см 10%-ного раствора йодистого калия. Выделившийся йод титруют 0,1 н раствором тиосульфата натрия до слабо-желтой окраски. Аналогично титруют 5 куб. см 0,1 М раствора сульфата меди после прибавления 1 куб. см 0,1 М уксусной кислоты и 5 куб. см 10%-ного раствора йодистого калия — холостую пробу.
Обработка результатов. Массовую долю металлического цинка в средстве Zn, % вычисляют по формуле:
V — V x 0,00327 x 100
0
Zn = ———————-,
m
где:
0,00327 — масса цинка, соответствующая 1 мл точно 0,1 н раствора
тиосульфата натрия, г;
V — объем 0,1 н раствора тиосульфата натрия, израсходованный на
0
титрование холостой пробы, куб. см;
V — объем 0,1 н раствора тиосульфата натрия, израсходованный на
титрование холостой пробы, куб. см;
m — масса средства, взятая на анализ, г.
Определение массовой доли основного вещества. К навеске технического образца фосфида цинка массой 0,1 г, взвешенной с точностью до 0,0002 г, или к эквивалентному количеству отравленной приманки прибавляют 5 — 10 куб. см 5 М серной кислоты, 25 куб. см дистиллированной воды и кипятят в течение 15 мин. Смесь охлаждают и нейтрализуют 1 М раствором гидроксида натрия до pH 3 — 5, приливают 5 куб. см аммиачно-хлоридного буфера с pH 10 — 10,5 и титруют раствором трилона Б с применением индикатора эриохрома черного Т до перехода окраски от красно-фиолетовой до синей.
Обработка результатов. Содержание фосфидного цинка в средстве (Zn P ) в
3 2
процентах определяют по формуле:
V x 0,00863 x 100
Zn P = —————— — Zn,
3 2 m
где:
0,00863 — масса Zn P , соответствующая 1 куб. см точно 0,1 н раствора
3 2
трилона Б, г;
Zn — массовая доля металлического цинка в пробе, определенная при титровании тиосульфатом натрия, %;
V — объем 0,1 н раствора трилона Б, израсходованный на титрование, куб. см;
m — масса средства, взятая на анализ, г;
(V x 0,00863 x 100 / m) — суммарное содержание фосфидного и металлического цинка, найденное при титровании тиосульфатом натрия, %.
4.4.2. Методы определения 1-1-нафтил-2-тиомочевины
в дератизационных субстанциях и средствах
4.4.2.1. Спектрофотометрические методы определения
1-1-нафтил-2-тиомочевины
Определение 1-1-нафтил-2-тиомочевины НТМ спектрофотометрическим методом по собственному поглощению в ультрафиолетовой области спектра основано на измерении оптической плотности растворов НТМ при длине волны в диапазоне 280 — 300 нм.
Определению могут мешать вещества, поглощающие в указанном волновом диапазоне. Метод может использоваться при серийном анализе в условиях производства.
Приборы и реактивы. Для выполнения анализа применяется спектрофотометр СФ-26, СФ-46 или другой марки; стандартная стеклянная мерная посуда; весы аналитические; этиловый спирт 96%-ный.
Выполнение анализа. Подготовка пробы к спектрофотометрическому измерению включает растворение технического продукта в этиловом спирте для последующего фотометрирования. Из препаративной формы средства в виде приманки проводят извлечение ДВ 96%-м этиловым спиртом при повышенной температуре (60 °C) в течение 15 мин. Оптическую плотность приготовленного раствора измеряют при длине волны 285 нм в кювете с толщиной поглощающего слоя 1 см. В качестве раствора сравнения используют экстракт, полученный в таких же условиях из «холостой» пробы (не содержащей НТМ).
Обработка результатов. Массовую долю ДВ в средстве X в процентах вычисляют по формуле:
D x 202,3 x K x V x 100
X = ————————,
эпсилон x m x l
где:
D — оптическая плотность раствора;
202,3 — молекулярная масса НТМ;
K — кратность разведения экстракта;
V — объем экстракта, л;
эпсилон = 8400 — значение молекулярного коэффициента поглощения НТМ при 285 нм, л/моль x см;
m — масса анализируемой пробы, г;
l — толщина поглощающего слоя, см.
Применение справочного значения молярного коэффициента поглощения НТМ при длине волны 285 нм позволяет исключить построение калибровочного графика.
Для определения НТМ в дератизационных средствах применяют также спектрофотометрический метод, основанный на измерении оптической плотности раствора азосоединения, образующегося при взаимодействии НТМ и сульфанилата диазония, при длине волны 490 нм.
Метод избирателен.
Приборы, реактивы и растворы. Для выполнения анализа применяется спектрофотометр СФ-26, СФ-46 или электрофотоколориметр КФК-2; стандартная стеклянная мерная посуда, весы аналитические; этиловый спирт 96%-ный, аналитический стандарт НТМ; раствор сульфанилата диазония с массовой концентрацией 5 мг/мл; 0,1 М раствор соляной кислоты; 0,1 М раствор натрия гидроокиси.
Выполнение анализа. При анализе дератизационного средства в виде приманки ДВ извлекают 96%-м этиловым спиртом при повышенной температуре (60 °C) и вносят в аликвоту экстракта реактивы, необходимые для получения азосоединения: раствор НТМ с концентрацией 0,1 мг/мл; раствор сульфанилата диазония с концентрацией 5 мг/мл и 0,1 М раствор соляной кислоты. Смесь выдерживают в течение 5 мин., затем добавляют 0,1 М раствор гидроокиси натрия и фотометрируют при длине волны 490 нм относительно «холостого» раствора калибровочного графика. Для построения калибровочного графика готовят калибровочные растворы азосоединения, эквивалентные содержанию в пробе 20, 40 и 60 мкг НТМ.
Обработка результатов. Массовую долю действующего вещества X в процентах вычисляют по формуле, используя калибровочный график:
-6
a x 10 x K x V x 100
X = ———————-,
m x l
где:
a — содержание НТМ в аликвоте, найденное по калибровочному графику,
мкг;
-6
10 — коэффициент пересчета из мкг в г;
K — кратность разведения пробы;
m — масса средства, взятая на анализ, г;
l — толщина поглощающего слоя, см.
4.4.2.2. Хроматографический метод определения
1-1-нафтил-2-тиомочевины
Анализ НТМ в зерновой приманке проводят методом высокоэффективной жидкостной хроматографии с применением спектрофотометрического детектирования, градиентного режима хроматографирования и использованием абсолютной градуировки.
Метод избирателен, компоненты рецептурного состава средства не мешают определению.
Приборы, реактивы и растворы. Аналитический жидкостный хроматограф, снабженный спектрофотометрическим детектором, градиентной системой, инжектором с дозирующей петлей 5 — 10 мкл, программой обработки хроматографических данных на базе персонального компьютера; весы аналитические; магнитная мешалка; ротационный испаритель; стандартная стеклянная мерная посуда, НТМ — аналитический стандарт; рабочая градуировочная смесь НТМ в ацетонитриле с массовой концентрацией 0,1 мг/мл; ацетонитрил градации для жидкостной хроматографии; хлористый метилен ч.д.а.; вода бидистиллированная.
Выполнение анализа. Подготовка пробы к анализу предусматривает извлечение ДВ из средства хлористым метиленом в течение 4 ч с помощью магнитной мешалки. Из отфильтрованного экстракта под разрежением отгоняют растворитель, сухой остаток растворяют в ацетонитриле и хроматографируют. Предварительно хроматографируют рабочую градуировочную смесь. Из полученных хроматограмм определяют удерживаемый объем и площади хроматографических пиков НТМ в градуировочной смеси и в анализируемом растворе.
Хроматографирование проводят на колонке для обращенно-фазной хроматографии типа ACCUBOND ODS 5 мкм. В качестве элюентов используют ацетонитрил и воду. Градиент по ацетонитрилу от 40 до 100%. Длина волны измерений 290 нм.
Обработка результатов. Массовую долю НТМ в средстве X в процентах вычисляют по формуле:
S x C x a x V
ргс
X = —————-,
S x m
ргс
где:
S и S — площади хроматографических пиков определяемого вещества в
ргс
анализируемой пробе и рабочей градуировочной смеси;
C — массовая концентрация аналитического стандарта определяемого
ргс
вещества в рабочей градуировочной смеси;
a — массовая доля основного вещества в аналитическом стандарте, %;
V — объем анализируемого раствора, мл;
m — масса средства, взятая на анализ, мг.
4.4.3. Методы определения индандионов в дератизационных
субстанциях и средствах
Особенности химико-аналитических исследований дератизационных ДВ субстанций для производства препаративных форм определяются их составом: содержанием основного вещества, уровнем примесей и содержанием технологических добавок. Для анализа применяют титрование раствором гидроокиси натрия, спектрофотометрические методы с прямым фотометрированием определяемого вещества и в виде окрашенных комплексов, высокоэффективную жидкостную хроматографию со спектрофотометрическим детектированием в ультрафиолетовой области спектра.
4.4.3.1. Титриметрический метод определения дифенацина,
этилфенацина и изопропилфенацина
Определение содержания ДВ в субстанциях дифенацина, этилфенацина и изопропилфенацина и концентратах титриметрическим методом [41] основано на титровании индандиона раствором гидроокиси натрия в среде органического растворителя (диоксан; этанол, ацетон) с добавлением индикатора (бромтимоловый синий, феноловый красный) или с применением потенциометрических измерений.
Метод не избирателен, определению могут мешать вещества, титруемые гидроокисью натрия, в связи с этим метод не применим для определения действующего вещества в таких технических продуктах, как трифенацин, тетрафенацин.
Метод может быть рекомендован для рутинных анализов в условиях производства.
Приборы, реактивы и растворы. Весы аналитические; бюретка вместимостью 25 мл; стандартная стеклянная мерная посуда; диоксан; 0,1 М раствор гидроокиси натрия; спиртовой раствор бромтимолового синего индикатор; иономер универсальный ЭВ-74 со стеклянным и каломельным электродами.
Выполнение анализа. Анализируемую пробу растворяют в диоксане и титруют с помощью раствора гидроокиси натрия в присутствии индикатора бромтимолового синего с визуальным или потенциометрическим определением конца титрования.
Обработка результатов. Массовую долю определяемого вещества X в процентах вычисляют по известной формуле:
V x T x 100
X = ————,
m
где:
V — объем точно 0,1 М раствора гидроокиси натрия, израсходованный на титрование пробы, мл;
T — масса определяемого вещества, соответствующая 1 мл точно 0,1 М раствора гидроокиси натрия, г/мл;
m — масса анализируемой пробы, г.
4.4.3.2. Спектрофотометрические методы определения
дифенацина, этилфенацина и изопропилфенацина
Определение дифенацина, этилфенацина, изопропилфенацина, хлорфасинона в дератизационных субстанциях (технический продукт, жидкие и диспергированные твердые концентраты) и в препаративных формах проводят спектрофотометрическим методом с прямым определением вещества или в виде окрашенных комплексов.
Спектрофотометрический метод прямого определения изопропилфенацина основан на измерении оптической плотности индан-1,3-диона, в растворе органического растворителя при длине волны 325 и 340 нм относительно растворителя с применением градуировочного графика или молярных коэффициентов поглощения.
Метод избирателен в отсутствии компонентов рецептурного состава средства, поглощающих в указанной области длин волн. Не избирателен в присутствии нескольких веществ индандионового ряда, которые определяются суммарно.
Метод может быть применен для серийного анализа в условиях производства.
Приборы, реактивы и растворы. Для проведения анализа используют спектрофотометр типа СФ-46; стеклянную мерную посуду; этиловый спирт.
Выполнение анализа. Подготовка пробы к анализу заключается в выделении ДВ в раствор. Способ выделения определяемого вещества зависит от рецептурного состава средства. Технический продукт растворяют; из концентратов и приманок ДВ извлекают жидкостной экстракцией с применением этилового спирта и фотометрируют на спектрофотометре при двух длинах волн.
Обработка результатов. Содержание индан-1,3-диона определяют, используя калибровочный график в координатах: оптическая плотность — содержание вещества, мг.
При использовании значений молярных коэффициентов поглощения определяемого индан-1,3-диона содержание ДВ X в процентах вычисляют по формуле:
D — D x V x M x 100
325 340
X = ————————-,
-4
1,10 x m x l
где:
(D — D ) — разница оптической плотности анализируемого раствора
325 340
при разных длинах волн;
M — молекулярная масса определяемого индан-1,3-диона, г/моль;
V — объем раствора или экстракта, л;
-4
1,10 — разность молярных коэффициентов поглощения индан-1,3-диона при
325 и 340 нм, л/моль x см.
m — масса анализируемой пробы, г;
l — толщина поглощающего слоя, см.
Спектрофотометрический метод определения дифенацина, этилфенацина и изопропилфенацина в виде окрашенных комплексов основан на образовании водорастворимых окрашенных комплексов ионов железа III с индандионами и измерении их оптической плотности при длине волны 490 нм с применением калибровочного графика или молярных коэффициентов поглощения.
Метод избирателен в отношении традиционно применяемых красителей и других экстрагируемых компонентов рецептурного состава средства. Не избирателен в присутствии нескольких веществ индандионового ряда, которые определяются суммарно.
Метод может быть применен для серийного анализа в условиях производства.
Приборы, реактивы и растворы. Для проведения анализа используют электрофотоколориметр типа КФК или спектрофотометр типа СФ-46; стеклянную мерную посуду; диоксан; 6%-ный раствор железа треххлористого.
Выполнение анализа. Подготовка пробы к анализу заключается в выделении ДВ в раствор. Способ выделения определяемого вещества зависит от рецептурного состава средства. Технический продукт растворяют; из концентратов и приманок действующие вещества извлекают жидкостной экстракцией с применением диоксана.
Навеску технического продукта из расчета получения молярной
-4
концентрации раствора 2 — 4 x 10 М растворяют в смешивающемся с водой
растворителе (диоксан, ацетон) с добавлением небольшого количества воды (до
5%) и 6%-ного водного раствора Fe Cl x 6H O. Оптимальная концентрация FeIII
3 2
-3
2 x 10 М. Раствор фотометрируют при 490 нм. Содержание определяемого
индан-1,3-диона вычисляют, используя калибровочный график или молярный
коэффициент поглощения комплекса определяемого индан-1,3-диона с железом.
Обработка результатов. Содержание индан-1,3-диона определяют, используя калибровочный график в координатах: оптическая плотность — содержание вещества, мг.
При использовании значений молярных коэффициентов поглощения комплекса определяемого индан-1,3-диона с железом содержание действующего вещества X в процентах вычисляют по формуле:
D — D x M x V x 100
0
X = ———————,
эпсилон x m x K x l
где:
(D — D ) — разница оптической плотности анализируемого и контрольных
0
растворов;
M — молекулярная масса определяемого индандиона, г/моль;
V — объем раствора или экстракта, л;
эпсилон — молярный коэффициент поглощения комплекса железа III с индандионом, л/моль x см;
m — масса пробы, взятой на анализ, г;
K — коэффициент, учитывающий разбавление фотометрируемого раствора водой и солью железа;
l — толщина поглощающего слоя, см.
Экспериментально установлены значения молярных коэффициентов поглощения комплекса железа III для некоторых веществ: дифенацин 1300 +/- 60; хлорфасинон 1260 +/- 80; изопропилфенацин 1100 +/- 80; этилфенацин 960 +/- 80.
4.4.3.3. Хроматографические методы определения
антикоагулянтов индандионового ряда
Определение антикоагулянтов индан-1,3-дионового ряда (дифенацин, изопропилфенацин, хлорфасинон, этилфенацин) в субстанциях (технические продукты, жидкие и порошковые концентраты) и различных препаративных формах дератизационных средств проводят методом прямой или обращенно-фазной высокоэффективной хроматографии с применением спектрофотометрического детектирования. Для идентификации и хроматографических измерений антикоагулянтов индан-1,3-дионового ряда применяют спектрофотометрические детекторы на диодной матрице для измерений в области 190 — 400 нм и детекторы для измерений при одной длине волны. Надежность идентификации ДВ, характеризующихся близкими спектрами поглощения в ультрафиолетовой области, достигается использованием двух критериев: 1) спектр поглощения в области 190 — 400 нм; 2) время удерживания в заданных условиях хроматографических измерений.
При анализе технических продуктов (трифенацин, тетрафенацин), представляющих собой малоочищенную технологическую смесь, в которой содержится несколько индандионов с разным содержанием, применение диодно-матричного детектора позволяет записать спектры поглощения каждого пика хроматограммы в диапазоне 190 — 400 нм и идентифицировать индандионы по спектрам поглощения в рабочей градуировочной смеси и испытуемой пробе.
Специфические условия подготовки пробы для анализа обуславливаются содержанием действующего вещества и свойствами ингредиентов рецептуры средства (технологические и функциональные добавки, в т.ч. натуральные пищевые аттрактанты).
Технические продукты и жидкие концентраты растворяют в растворителе, совместимом с хроматографической подвижной фазой. Из порошковых концентратов и пищевых приманок требуется выделение действующего вещества в органическую фазу с помощью экстракции. При этом из-за низкого уровня содержания ДВ в пищевых приманках на фоне сложного рецептурного состава и пищевой основы повышаются требования к селективному выделению действующего вещества и условиям эффективного хроматографического разделения компонентов пробы.
Хроматографический метод определения индандионов с применением прямофазной высокоэффективной хроматографии основан на применении УФ-детектирования, хроматографировании пробы на аминной колонке в изократическом режиме с использованием абсолютной градуировки. В качестве элюента (подвижной фазы) применяют смесь ацетонитрил:вода в соотношении 80:20 по объему.
Избирательность метода. Метод избирателен в присутствии нескольких ДВ индан-1,3-дионового ряда. Определению не мешают технологические примеси в техническом продукте.
Приборы. Аналитический жидкостный хроматограф «Стайер» или другого типа, снабженный спектрофотометрическим детектором на диодной матрице или детектором для измерений при одной длине волны в ультрафиолетовой области спектра, термостатируемой колонкой, изократической системой микронасосов, инжектором типа «Реодайн» (или другого типа) с дозирующей петлей объемом от 5 до 20 мкл, программой управления оборудованием и обработки хроматографических данных на базе персонального компьютера; хроматографическая колонка, как правило, заводского заполнения сорбентом, с соответствующей предколонкой; микрошприц вместимостью 100 — 250 мкл для ручного ввода пробы в инжектор и промывки инжектора; фильтрующее устройство с фильтром 0,45 мкм; ультразвуковая ванна для дегазации элюентов и подготовки пробы; общелабораторное оборудование (аналитические весы с точностью взвешивания до 0,1 мг; мерная стеклянная посуда).
Реактивы и растворы. Ацетонитрил градации для жидкостной хроматографии
(210 — 230 нм), вода бидистиллированная или очистки супер-q на оборудовании
«Миллипор». Подвижная фаза (элюент) — ацетонитрил:вода (80:20 по объему),
дегазированная перед использованием с помощью ультразвуковой ванны или
потока гелия. Сорбенты для прямофазной хроматографии типа сепарон SGX NH ,
2
лихросорб NH .
2
Выполнение анализа. Точную навеску технического продукта около
0,05 — 0,1 г (0,5 — 0,7 г жидкого концентрата) или аналитического стандарта
определяемого вещества помещают в мерную колбу вместимостью 25 мл и
растворяют в 5 — 7 мл хлороформа, затем проводят разбавление
приготовленного раствора элюентом (из расчета получения концентрации в
рабочей градуировочной смеси и испытуемом растворе 0,010 — 0,005 мг/мл) и
4 мкл приготовленного раствора вводят в хроматограф. Условия
хроматографирования: колонка типа сепарон SGX NH 5 мкм (150 x 3,3 мм);
2
скорость элюента — 0,4 мл/мин.; температура колонки 60 °C.
Спектрофотометрические измерения проводят при длине волны 288 нм.
Из полученных хроматограмм рабочей градуировочной смеси определяют время удерживания и площадь хроматографического пика определяемого вещества в рабочей градуировочной смеси. По совладению времени удерживания на хроматограммах градуировочной смеси и хроматограммах анализируемой пробы проводят идентификацию веществ и вычисляют площади их хроматографических пиков в пробе.
Обработка результатов. Вычисление массовой доли ДВ в средстве X в процентах с применением абсолютной градуировки проводится по формуле:
S x C x a x V x k
гс
X = ——————-,
S x m
гс
где:
S и S — площади хроматографических пиков определяемого вещества в
гс
испытуемой пробе и рабочей градуировочной смеси;
C — массовая концентрация аналитического стандарта определяемого
гс
вещества в рабочей градуировочной смеси, мг/мл;
a — массовая доля основного вещества в аналитическом стандарте, %;
V — объем раствора пробы, мл;
k — кратность разведения раствора пробы;
m — масса анализируемой пробы, мг.
В отсутствие стандартных образцов определяемых веществ при анализе дератизационных субстанций в виде малоочищенной технологической смеси (трифенацин, тетрафенацин) в качестве аналитического стандарта может быть принят стандарт дифенацина, имеющий квалификацию государственного стандартного образца. Массовую долю ДВ вычисляют по сумме площадей всех хроматографических пиков, характеризующихся спектрами индан-1,3-дионов.
При вычислении содержания примесей в техническом продукте может быть применен метод нормализации площадей.
Хроматографический метод определения индандионов с применением обращенно-фазной высокоэффективной хроматографии основан на применении УФ-детектирования, хроматографировании пробы в градиентном режиме и использовании абсолютной градуировки.
Хроматографирование проводят на колонках, заполненных сорбентом типа сепарон C18, ультрасфер ODS, партисил ODS 2; в качестве элюента используют смеси растворителей, приготавливаемые по объему: метанол:изопропанол:0,1%-ный раствор фосфорной кислоты в соотношении 65:15:20, ацетонитрил:0,2%-ный раствор фосфорной кислоты в соотношении 75:25, а также применяют другие хроматографические системы сорбент-элюент для обращенно-фазной хроматографии.
Метод избирателен. Спектрофотометрическому измерению дифенацина, этилфенацина, изопропилфенацина и хлорфасинона не мешают технологические и функциональные добавки, типичные для рецептурного состава приманок: битрекс, бензоат натрия, красители. В зависимости от состава пищевой основы экспериментально подбирают условия экстракционного выделения ДВ и очистки экстракта с помощью тест-пробы.
Выполнение анализа.
Подготовка пробы. В навеску зерновой приманки массой 10 — 20 г добавляют 100 мл органического растворителя и проводят экстрагирование с помощью ультразвуковой ванны в течение 30 — 50 мин. В качестве экстрагента может быть применен ацетонитрил; ацетонитрил, подкисленный уксусной кислотой (1% об.); ацетонитрил:метанол в соотношении 1:1 и др. После отстаивания отбирают аликвоту экстракта, фильтруют через фильтр 0,45 мкм и хроматографируют в градиентном режиме обращенно-фазной хроматографии.
При анализе зерновой приманки в виде парафинированного брикета может быть использована последовательная экстракция растворителями разной полярности. Сначала проводят экстракцию небольшими порциями гексана при интенсивном перемешивании на магнитной мешалке. Экстракцию повторяют несколько раз, проэкстрагированный гексаном образец подсушивают до воздушно-сухого состояния, после чего проводят экстракцию ацетонитрилом с помощью ультразвуковой ванны в течение 30 мин. В гексановый экстракт добавляют сорбент — оксид алюминия и после выдерживания в течение 20 — 30 мин. фильтруют. Осадок на фильтре промывают ацетонитрилом, полученный фильтрат вносят в подсушенный образец и проводят экстракцию ацетонитрилом с помощью ультразвуковой ванны в течение 30 мин. После отстаивания отбирают аликвоту экстракта, фильтруют через фильтр 0,45 мкм и хроматографируют в градиентном режиме обращенно-фазной хроматографии.
Условия хроматографирования: колонка типа LUNA C18 3 мкм (150 x 3,3 мм); элюент А — ацетонитрил; элюент Б — 0,16%-ный раствор фосфорной кислоты. Градиент по ацетонитрилу от 60 до 85% за 10 мин.; скорость подвижной фазы 0,4 мл/мин; температура колонки комнатная; объем хроматографируемой дозы 10 мкл. Примерное время удерживания хлорфасинона 8,9 мин., дифенацина 10,2 мин.
Идентификацию определяемого вещества проводят сравнением времени удерживания в градуировочной смеси и анализируемой пробе при одной длине волны в интервале 250 — 280 нм, дополнительно могут быть использованы спектры поглощения в области 190 — 400 нм в исследуемой пробе и градуировочной смеси.
Обработка результатов. Массовую долю ДВ в приманке X в процентах с применением абсолютной градуировки вычисляют с учетом фактора извлечения тета по формуле:
S x C x a x V x k
гс
X = ——————-,
S x m x тета
гс
где:
S и S — площади хроматографических пиков определяемого вещества в
гс
испытуемой пробе и рабочей градуировочной смеси;
C — массовая концентрация аналитического стандарта определяемого
гс
вещества в рабочей градуировочной смеси, мг/мл;
a — массовая доля основного вещества в аналитическом стандарте, %;
V — объем раствора пробы, мл;
k — кратность разведения раствора пробы;
m — масса анализируемой пробы, мг;
тета — фактор извлечения устанавливают по контрольному образцу с
известным содержанием определяемого вещества, тета = m / m .
контр
4.4.4. Методы определения антикоагулянтов кумаринового ряда
4.4.4.1. Спектрофотометрические методы определения
зоокумарина и бромадиолона
Определение зоокумарина и бромадиолона в дератизационных средствах спектрофотометрическим методом может быть проведено по собственному поглощению в ультрафиолетовой части спектра и по измерению оптической плотности растворов натриевой соли.
Спектрофотометрический метод определения зоокумарина и бромадиолона по собственному поглощению в ультрафиолетовой части спектра основан на измерении оптической плотности раствора пробы в органическом растворителе с использованием молярного коэффициента поглощения определяемого вещества.
Приборы, реактивы и растворы. Спектрофотометр СФ-26 или другого типа; весы аналитические; ротационный испаритель; стеклянная мерная посуда; 2%-ный раствор натрия гидроокиси; хлороформ; диоксан; этанол; оксид алюминия для хроматографии.
Выполнение анализа. Зоокумарин (3%) из навески порошкового средства массой около 0,1 г экстрагируют 25 мл диоксана с помощью магнитной мешалки и разбавляют диоксаном в 10 раз, после фильтрования проводят измерение оптической плотности раствора при длине волны 310 нм.
Обработка результатов. Содержание зоокумарина в средстве X в процентах вычисляют по формуле:
D — D x 308,2 x V x 10 x 100
0
X = ——————————,
эпсилон x m x l
где:
D и D — оптические плотности анализируемого раствора и раствора
0
«холостой» пробы средства, не содержащей зоокумарина;
308,2 — молекулярная масса зоокумарина, г/моль;
V — объем фотометрируемого раствора, мл;
10 — кратность разведения экстракта;
тета — молярный коэффициент поглощения зоокумарина в диоксане, равный 14500 л/моль x см;
m — масса средства, г;
l — толщина поглощающего слоя, см.
При определении бромадиолона (0,25%) в концентрате навеску средства массой около 0,04 г растворяют в 5 мл этанола. Измерения проводят при длинах волн 320 и 340 км. При вычислении содержания бромадиолона применяют разность молярных коэффициентов поглощения бромадиолона при 320 и 340 нм, равную 7800 л/моль x см.
Метод не избирателен в присутствии растворимых веществ рецептурного состава средства, поглощающих в указанных областях спектра. Метод может быть применен для серийных анализов в условиях производства.
Спектрофотометрический метод определения зоокумарина по поглощению его натриевой соли основан на измерении при 306 — 308 нм оптической плотности раствора натриевой соли зоокумарина, получаемой с помощью 2%-ного раствора гидроокиси натрия.
Метод не избирателен в присутствии веществ в пробе, поглощающих при длине волны измерения 306 — 308 нм. Метод может быть применен для серийных анализов в условиях производства.
Выполнение анализа. При анализе технического продукта пробу растворяют в 2%-м растворе гидроокиси натрия и измеряют оптическую плотность при 306 — 308 нм.
При анализе препаративных форм проводят извлечение хлороформом, при необходимости — сорбционную очистку экстракта на колонке с окисью алюминия. Растворитель отгоняют и растворяют сухой остаток в 2%-м растворе гидроокиси натрия. После фильтрования измеряют оптическую плотность при 308 нм, используя в качестве раствора сравнения «холостую пробу». Количество ДВ измеряют по калибровочному графику в интервале 25, 50, 100 и 200 мкг, для построения которого применяют стандартный раствор натриевой соли зоокумарина 0,1 мг/мл.
Обработка результатов. Массовую долю зоокумарина в средстве X в процентах вычисляют по формуле:
C x V
X = ———— x 100,
6
V x m x 10
1
где:
C — содержание зоокумарина, найденное по калибровочному графику, мкг;
V — объем раствора средства, мл;
V — объем раствора, взятый для анализа, мл;
1
m — масса средства, взятая для анализа, г;
6
10 — коэффициент пересчета мкг в г.
4.4.4.2. Хроматографические методы определения
антикоагулянтов оксикумаринового ряда
Определение антикоагулянтов кумаринового ряда (бродифакума, бромадиолона, дифетиалона, зоокумарина, куматетралила, флокумафена) в субстанциях (технических продуктах, жидких и порошковых концентратах) и различных препаративных формах дератизационных средств проводят методом прямой или обращенно-фазной высокоэффективной хроматографии с применением спектрофотометрического детектирования. Для идентификации и хроматографических измерений антикоагулянтов оксикумаринового ряда применяют спектрофотометрические детекторы для измерений при одной длине волны, а также детекторы на диодной матрице для измерений в области 190 — 400 нм, которые позволяют повысить надежность идентификации веществ за счет использования двух критериев: 1) спектр поглощения в области 190 — 400 нм; 2) время удерживания в заданных условиях хроматографических измерений.
Специфические условия подготовки пробы и спектрофотометрического детектирования обуславливаются содержанием ДВ и составом ингредиентов рецептуры средства (технологические и функциональные добавки, в т.ч. натуральные пищевые аттрактанты).
Субстанции (технические продукты и жидкие концентраты) растворяют в растворителе, совместимом с хроматографической подвижной фазой. Определение ДВ проводят в условиях прямой или обращенно-фазной высокоэффективной хроматографии. При анализе технического продукта определяют содержание основного вещества с использованием абсолютной градуировки или «внутреннего эталона», для количественной оценки примесей применяют метод нормализации площадей.
Из порошковых концентратов требуется выделение ДВ в органическую фазу жидкостной экстракцией.
Из пищевых приманок также извлекают ДВ с помощью жидкостной экстракции. При этом из-за низкого уровня содержания ДВ (3 — 10%) в пищевых приманках на фоне сложного рецептурного состава и пищевой основы повышаются требования к селективному выделению ДВ и условиям эффективного хроматографического разделения компонентов пробы.
Метод избирателен. Определению бродифакума, бромадиолона, дифетиалона, зоокумарина, куматетралила, флокумафена не мешают технологические примеси в техническом продукте.
Приборы. Аналитический жидкостный хроматограф «Стайер» или другого типа, снабженный спектрофотометрическим детектором на диодной матрице или детектором для измерений при одной длине волны в ультрафиолетовой области спектра, термостатируемой колонкой, изократической системой микронасосов, инжектором типа «Реодайн» (или другого типа) с дозирующей петлей объемом от 5 до 20 мкл, программой управления оборудованием и обработки хроматографических данных на базе персонального компьютера.
Хроматографическая колонка, как правило, заводского заполнения сорбентом, с соответствующей предколонкой. Микрошприц вместимостью 100 — 250 мкл для ручного ввода пробы в инжектор и промывки инжектора. Фильтрующее устройство с фильтром 0,45 мкм. Ультразвуковая ванна для дегазации элюентов и подготовки пробы. Общелабораторное оборудование (аналитические весы с точностью взвешивания до 0,1 мг, мерная стеклянная посуда).
Реактивы и растворы. Ацетонитрил градации для жидкостной хроматографии
(210 — 230 нм); уксусная кислота х.ч.; вода бидистиллированная или очистки
супер-q на оборудовании «Миллипор». Сорбенты для прямофазной и
обращенно-фазной хроматографии типа сепарон SGX NH , лихросорб NH , MAX RP
2 2
C12, зорбакс ODS, лихросорб RP 18 и др.
Элюент (подвижная фаза) — ацетонитрил:вода в соотношении 80:20 (по объему); ацетонитрил:вода:уксусная кислота в соотношении 80:20:1 (по объему), дегазированные перед использованием с помощью ультразвуковой ванны или потока гелия.
Выполнение анализа. Точную навеску технического продукта 0,05 г или аналитического стандарта определяемого вещества растворяют в мерной колбе вместимостью 50 — 100 мл в соответствующем органическом растворителе (ацетонитрил, этиловый спирт и др.) с помощью ультразвуковой ванны, затем проводят последовательное разбавление исходного раствора ацетонитрилом или элюентом (из расчета получения концентрации в рабочей градуировочной смеси и испытуемом растворе 0,010 — 0,005 мг/мл) и хроматографируют в условиях прямофазной или обращенно-фазной высокоэффективной хроматографии. Из полученных хроматограмм рабочей градуировочной смеси определяют время удерживания и площадь хроматографического пика определяемого вещества в рабочей градуировочной смеси. Из хроматограмм испытуемой пробы проводят идентификацию определяемого вещества по совпадению времени удерживания и вычисляют площадь хроматографического пика в испытуемой пробе. Применение диодно-матричного детектора позволяет записать и сравнить спектры поглощения хроматографического пика определяемого вещества в диапазоне 190 — 400 нм в рабочей градуировочной смеси и испытуемой пробе. Близким характером спектров поглощения характеризуются зоокумарин и куматетралил, бродифакум и бромадиолон.
Условия хроматографирования при прямофазной и обращенно-фазной высокоэффективной хроматографии приведены в табл. 4.7.
Таблица 4.7
┌───────────────────────┬───────────────────────┬─────────────────────────┐
│ Параметры │ Прямофазная │ Обращенно-фазная │
│ │ высокоэффективная │ высокоэффективная │
│ │ хроматография │ хроматография │
├───────────────────────┼───────────────────────┼─────────────────────────┤
│Подвижная фаза │Ацетонитрил:вода │Ацетонитрил:вода:уксусная│
│ │80:20 │кислота 80:20:1 │
├───────────────────────┼───────────────────────┼─────────────────────────┤
│Скорость подвижной фазы│0,5 мл/мин. │0,5 мл/мин. │
├───────────────────────┼───────────────────────┼─────────────────────────┤
│Колонка │Сепарон NH 5 мкм │Max RP (C ) 4 мкм │
│ │ 2 │ 12 │
│ │(150 x 3,3 мм) │(250 x 4 мм) │
├───────────────────────┼───────────────────────┼─────────────────────────┤
│Температура колонки │37 °C │37 °C │
├───────────────────────┼───────────────────────┼─────────────────────────┤
│Хроматографируемая доза│20 мкл │20 мкл │
└───────────────────────┴───────────────────────┴─────────────────────────┘
В указанных условиях бродифакум и бромадиолон детектируются двумя пиками стереоизомеров. Примерное относительное время удерживания действующих веществ по основному пику бромадиолона приведено в табл. 4.8.
Таблица 4.8
|
Действующее вещество |
Прямофазная высокоэффективная хроматография |
Обращенно-фазная высокоэффективная хроматография |
|
Дифетиалон |
1,5 |
0,7 |
|
Бродифакум |
1,4 |
0,8 |
|
Бромадиолон |
1,0 |
1,0 |
|
Куматетралил |
0,9 |
1,8 |
|
Зоокумарин |
0,8 |
2,9 |
Обработка результатов. Вычисление массовой доли основного вещества X в процентах в техническом продукте с применением абсолютной градуировки проводится по формуле:
S x C x a x V x k
X = ——————,
S x m
где:
S и S — площадь хроматографического пика определяемого вещества в
ргс
анализируемой пробе и рабочей градуировочной смеси;
C — массовая концентрация анализируемого стандарта определяемого вещества в рабочей градуировочной смеси, мг/мл;.
a — массовая доля действующего вещества в аналитическом стандарте, %;
V — объем раствора пробы, мл;
k — кратность разведения пробы;
m — масса средства, мг.
Определение ДВ в порошковых и жидких концентратах основано на разбавлении или экстракционном извлечении ДВ, разделении компонентов пробы в хроматографической системе сорбент — подвижная жидкая фаза (элюент) в изократическом режиме и последующем спектрофотометрическом измерении в элюате определяемого вещества с применением абсолютной градуировки.
Метод избирателен. Спектрофотометрическому измерению бродифакума, бромадиолона, дифетиалона, зоокумарина, куматетралила, флокумафена не мешают технологические и функциональные добавки, типичные для рецептурного состава концентратов: битрекс, бензоат натрия, красители (например, метиленовый голубой, красный темный) и растворители (например, этиловый и пропиловый спирт, триэтиленгликоль, пропиленгликоль).
Выполнение анализа.
Подготовка пробы. Масляный концентрат (около 0,1 г) растворяют в ацетонитриле в мерной колбе вместимостью 25 мл, затем 20 мл полученного раствора вносят в мерную колбу вместимостью 25 мл и добавляют до метки элюент (смесь ацетонитрил:вода в соотношении 80:20), после перемешивания хроматографируют.
Гелеобразный жидкий концентрат (около 0,5 г) помещают в мерную колбу вместимостью 25 мл и растворяют в 2,5 мл диметилформамида при периодическом перемешивании или с помощью ультразвуковой ванны, затем добавляют ацетонитрил. После отстаивания 2 мл прозрачного раствора вносят в мерную колбу вместимостью 25 мл и добавляют до метки элюент (смесь ацетонитрил:вода в соотношении 80:20), после перемешивания хроматографируют.
Порошковый концентрат (0,05 — 0,15 г) экстрагируют 50 мл ацетонитрила с помощью ультразвуковой ванны в течение 20 — 25 мин., затем центрифугируют и полученный раствор хроматографируют. В качестве экстрагента может быть применен также водный ацетонитрил (1:1), хлористый метилен, насыщенный муравьиной кислотой — в этом случае отгоняют экстрагент с помощью ротационного испарителя, сухой остаток растворяют в элюенте (метанол:вода:уксусная кислота в соотношении 94,2:5:0,8) и хроматографируют. При необходимости проводят сорбционную очистку экстракта от красителя на слое целита 545.
Условия хроматографирования при прямофазной и обращенно-фазной
высокоэффективной жидкостной хроматографии. Для прямофазной
высокоэффективной жидкостной хроматографии может быть использована
хроматографическая система: аминная колонка с сорбентом типа сепарон SGX
NH 5 мкм, лихросорб NH 5 мкм — элюент (ацетонитрил:вода в соотношении
2 2
80:20). Для обращенно-фазной высокоэффективной жидкостной хроматографии —
хроматографическая система: колонка с сорбентом типа MAX RP C12, зорбакс
ODS, нуклеосил C18, лихросорб RP 18 — (элюент ацетонитрил:вода:уксусная
кислота в соотношении 80:20:1; метанол:вода:уксусная кислота в соотношении
94,2:5:0,8 и др).
Длина волны измерений может быть применена в диапазоне от 254 до 288 нм. Скорость элюента применяется в интервале от 0,4 до 2 мл/мин., температура колонки в диапазоне 25 — 60 °C, объем хроматографируемой пробы 5 — 20 мкл.
Рабочие градуировочные смеси готовят с массовой концентрацией определяемых ДВ 0,005 — 0,010 мг/мл. Из полученных хроматограмм рабочей градуировочной смеси определяют время удерживания и площадь хроматографического пика вещества в рабочей градуировочной смеси. Из хроматограмм испытуемой пробы проводят идентификацию определяемого вещества по совпадению времени удерживания и вычисляют площадь хроматографического пика в анализируемой пробе. Для идентификации определяемого вещества дополнительно могут быть использованы спектры поглощения в области 190 — 400 нм в исследуемой пробе и градуировочной смеси.
Обработка результатов. Массовую долю ДВ в концентрате определяют по известной формуле при применении абсолютной градуировки.
Определение ДВ в дератизационных приманках основано на его экстракционном извлечении, хроматографическом разделении компонентов пробы в градиентном режиме и последующем спектрофотометрическом измерении определяемого вещества в элюате с применением абсолютной градуировки.
Метод избирателен. Спектрофотометрическому измерению бродифакума, бромадиолона, дифетиалона, зоокумарина, куматетралила, флокумафена не мешают технологические и функциональные добавки, типичные для рецептурного состава приманок: красители (например, метиленовый голубой, красный темный), битрекс, бензоат натрия и растворители (например, этиловый и пропиловый спирт, триэтиленгликоль, пропиленгликоль). Идентификацию определяемого вещества проводят сравнением времени удерживания при одной длине волны в интервале 250 — 280 нм, дополнительно могут быть использованы спектры поглощения в области 190 — 400 нм в исследуемой пробе и градуировочной смеси.
Выполнение анализа. Зерновые приманки. Навеску зерновой приманки массой 10 — 20 г экстрагируют ацетонитрилом и обрабатывают в ультразвуковой ванне в течение 30 мин. В качестве экстрагента может быть применен ацетонитрил, подкисленный уксусной кислотой (1% об.). После отстаивания отбирают аликвоту экстракта, фильтруют через фильтр 0,45 мкм и хроматографируют в градиентном режиме обращенно-фазной хроматографии. Условия хроматографирования: колонка с сорбентом нуклеосил С18 (125 x 3 мм); элюент А — ацетонитрил, элюент Б (0,16% об.) — раствор ортофосфорной кислоты. Градиент по ацетонитрилу от 40 до 75% за 10 мин.; 75% изократика 5 мин.; скорость подвижной фазы 0,4 мл/мин.; длина волны 284 нм; объем хроматографируемой дозы 10 мкл.
Гранулированные приманки. Навеску 20 — 40 г измельченной гранулированной приманки помещают в коническую колбу вместимостью 500 мл, добавляют 250 мл экстрагента и интенсивно перемешивают на магнитной мешалке в течение 20 мин. В качестве экстрагента применяют хлористый метилен, насыщенный муравьиной кислотой. Затем содержимое колбы количественно переносят на фильтр с целитом и трижды промывают экстрагентом порциями по 50 мл. Фильтрат упаривают с помощью ротационного испарителя. К сухому остатку добавляют 10 мл смеси метанол:хлористый метилен (3:2) (по объему), центрифугируют и раствор вводят в хроматограф. Условия хроматографирования: колонка с сорбентом для обращенно-фазной хроматографии зорбакс ODS 5 мкн (250 x 4,6 мм); подвижная фаза метанол:вода:уксусная кислота (94,2:5:0,8); скорость 1 мл/мин.; длина волны 254 нм; объем хроматографируемой дозы 10 мкл. Рабочая градуировочная смесь в растворителе — метанол:хлористый метилен (3:2) с концентрацией определяемого вещества 0,2 мг/мл.
Обработка результатов. Массовую долю ДВ в приманке X в процентах с применением абсолютной градуировки вычисляют по следующей формуле с учетом фактора извлечения тета:
S x C x a x V x k
гс
X = ——————-,
S x m x тета
гс
где:
S и S — площади хроматографических пиков определяемого вещества в
гс
испытуемой пробе и рабочей градуировочной смеси;
C — массовая концентрация анализируемого стандарта определяемого
гс
вещества в рабочей градуировочной смеси, мг/мл;
a — массовая доля основного вещества в аналитическом стандарте, %;
V — объем раствора пробы, мл;
k — кратность разведения раствора пробы;
m — масса пробы, взятая на анализ, мг;
тета — фактор извлечения устанавливают по контрольному образцу с
известным содержанием определяемого вещества, тета = X / X .
исп контр
4.5. Библиографические данные
1. Крейнгольд С.У. Практическое руководство по химическому анализу дезинфекционных препаратов. М., 2002. 156 с.
2. Шамб У., Сеттерфилд Ч., Вентворс Р. Перекись водорода. М., 1958. С. 460 — 468.
3. Губен-Вейль. Методы органической химии. Методы анализа. М.: Химия, 1967. С. 452 — 462.
4. Сукиасян А.Н., Копылова А.И. Количественное определение глутарового альдегида в разбавленных водных растворах//Теория и практика дезинфекции и стерилизации: Сборник научных трудов. М., 1983. С. 116 — 119.
5. Сукиасян А.Н., Свитова И.Р. Количественное определение надкислот в растворах, содержащих перекись водорода//Хим.-фарм. журнал. 1983. N 3. С. 366 — 368.
6. Сукиасян А.Н., Свитова И.Р. Модификация цериметрически-йодометрического метода анализа перекисных компонентов в растворах, содержащих надкислоту и перекись водорода//Проблемы дезинфекции и стерилизации: Сб. научн. тр. М., 1980. С. 115 — 119.
7. Газоанализатор 3.02П-Р. Руководство по эксплуатации ИРМБ. 4 133 12.005-02 РЭ. СПб, 2001.
8. Оптический анализатор озона «Циклон-5.51». Руководство по эксплуатации ИРМБ. 4 133 13.009 РЭ. СПб, 2001.
9. Мельников Н.Н., Новожилов К.Б., Белан С.Р. Пестициды и регуляторы роста растений: Справочник. М., 1995.
10. Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде. М.: Колос, 1992. Т. 1, 2. N 94.
11. Гигиенические критерии состояния окружающей среды, N 94, Перметрин, ВОЗ, Женева, 1992.
12. Гигиенические критерии состояния окружающей среды, N 82, Циперметрин, ВОЗ, Женева, 1991.
13. Гигиенические критерии состояния окружающей среды, N 97, Дельтаметрин, ВОЗ, Женева, 1992.
14. Гигиенические критерии состояния окружающей среды, N 87, Аллетрины, ВОЗ, Женева, 1992.
15. Гигиенические критерии состояния окружающей среды, N 96, d-Фенотрин, ВОЗ, Женева, 1993.
16. Крейнгольд С.У. и Шестаков К.А. Методика определения фосфида цинка в техническом препарате//Дезинфекционное дело, N 2. 2003. С. 23 — 24.
17. Хубер Л. Применение диодно-матричного детектирования в ВЭЖХ. М.: Мир, 1993. 95 с.
18. Методические указания по определению зоокумарина в тканях и крови животных, в приманках и препарате пенокумарин хроматографическими и спектрофотометрическими методами от 20.12.1976 N 1550-76//Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде. Справочное. Мин. сельхоз. СССР. Гос. Комиссия по химическим средствам борьбы с вредителями, болезнями растений и сорняками/Под ред. М.А. Клисенко. М.: Колос, 1983. С. 227 — 331.
19. Крейнгольд С.У. Простые и экспрессные методы химического контроля качества дезинфекционных препаратов//Дез. дело. N 4. 2002. С. 37 — 39.
20. Крейнгольд С.У. Спектрофотометрическое определение фенолов в дезинфицирующих средствах после разделения их методом тонкослойной хроматографии//Дез. дело, N 4. 2003. С 45 — 47.
21. Крейнгольд С.У. и Шестаков К.А. Определение триклозана в жидком туалетном антибактериальном мыле//Дез. дело, N 3. 2003. С. 46 — 47.
22. Мыло жидкое с дезинфицирующим эффектом «НИКА-СВЕЖЕСТЬ антибактериальное». ТУ 9392-023-12910434-2005. ООО НПФ «ГЕНИКС».
23. Средство дезинфицирующее «ДЕЛАСЕПТ-ГЕЛЬ» (кожный антисептик). Технические условия ТУ 9392-051-00479095-2005. ЗАО «Петроспирт».
24. Средство дезинфицирующее КЕМИ-САЙД. Технические условия ТУ 9392-001-5671Б5159-2004. ООО «КЕМИТРЕЙД».
5. Микробиологические методы исследований и критерии оценки
эффективности дезинфицирующих и стерилизующих средств
Общие положения
Современные дезинфицирующие средства ДС представляют собой индивидуальные химические соединения или композиционные составы, включающие одно или несколько действующих веществ ДВ. Кроме того, в их состав могут входить вспомогательные компоненты: стабилизаторы, ингибиторы коррозии, моющие вещества, красители, отдушки и др.
В качестве действующих веществ в ДС используют хлорактивные, кислородактивные соединения, альдегиды, четвертичные аммониевые соединения, амины, гуанидины; спирты и др.
ДС производятся в форме жидких концентратов, готовых к применению жидкостей, порошков, таблеток, гелей, спреев, салфеток, биоцидных лакокрасочных материалов и др.
ДС должны отвечать следующим требованиям [14, 21, 23, 51, 66]:
— обладать достаточной антимикробной активностью в отношении патогенных и условно патогенных видов микроорганизмов: бактерий, грибов, вирусов, а также споровых форм микроорганизмов;
— относительно низкой токсичностью для человека;
— быть экологически безопасными;
— быть стабильными при хранении;
— не иметь резкого неприятного запаха;
— хорошо растворяться в воде;
— не повреждать обрабатываемые объекты;
— иметь оптимальное соотношение стоимость-качество.
К некоторым средствам узкоцелевого назначения дополнительно предъявляют индивидуальные требования, изложенные в соответствующих главах.
ДС могут быть универсального назначения, которые рекомендуется применять для дезинфекции многих объектов при разных инфекциях, или узко целевого назначения, предназначенные для дезинфекции одного конкретного объекта, например для дезинфекции стоматологических оттисков, или воздуха, или поверхностей и т.д.
Предполагаемая сфера применения ДС определяет объем микробиологических исследований, необходимых для разработки режимов обеззараживания соответствующих объектов.
Микробиологические исследования начинают только после получения результатов химико-аналитических исследований, подтверждающих соответствие средства требованиям нормативно-технической документации НТД: технических условий — на отечественные средства, спецификации — на зарубежные.
Этапы исследований дезинфицирующих веществ и дезинфицирующих средств. Микробиологические исследования включают изучение активности ДВ и изучение эффективности ДС [51, 52, 66].
При исследовании субстанций, предназначенных для производства ДС, определяют спектр антимикробного действия в экспериментах in vitro.
Исследование свойств ДС проводят в 3 этапа:
1) определение in vitro спектра антимикробной активности ДС и влияния на нее различных факторов: pH, органических веществ, температуры;
2) эффективность обеззараживания искусственно контаминированных тест-микроорганизмами объектов в лабораторных условиях с целью разработки режимов применения ДС в зависимости от концентрации ДВ, времени воздействия, характера объекта, способа обработки и других факторов;
3) испытание ДС в практических условиях для подтверждения эффективности разработанных режимов в реальных условиях применения в случаях: исследования средства, содержащего новое ДВ; нового способа применения, значительного снижения концентрации и времени воздействия по сравнению с ранее разрешенными режимами и пр.
5.1. Методы изучения и оценки бактерицидной активности
дезинфицирующих средств и их субстанций
5.1.1. Тест-микроорганизмы для изучения
бактерицидной активности ДС и их субстанций.
Требования к тест-микроорганизмам
При изучении бактерицидной активности дезинфицирующих субстанций и ДС в качестве тест-микроорганизмов используют [66]: Escherichia coli (штамм 1257), Pseudomonas aeruginosa (штамм АТСС 27853), Salmonella typhimurium — для оценки бактерицидной активности в отношении грамотрицательных бактерий; Staphylococcus aureus (штамм 906) — для оценки бактерицидной активности в отношении грамположительных бактерий.
При сертификационных испытаниях и экспертной оценке ранее зарегистрированных ДС набор тест-микроорганизмов может быть ограничен наиболее устойчивыми представителями каждой группы.
Перечень тест-микроорганизмов, если он шире стандартного, указан в соответствующих разделах по изучению эффективности ДС при обеззараживании отдельных объектов.
Условия культивирования тест-микроорганизмов. Тест-микроорганизмы — E. coli, S. typhimurium, P. aeruginosa и S. aureus — культивируют на следующих питательных средах: казеиновом бульоне, мясо-пептонном бульоне, агаре Эндо, казеиновом агаре, мясо-пептонном агаре и т.п. при температуре 37 °C в течение 18 — 24 ч.
Музейные культуры указанных выше микроорганизмов хранят при температуре плюс (3 +/- 1) °C в ампулах (после лиофильной сушки) или на плотных питательных средах (посев уколом) под слоем стерильного вазелинового масла (толщина слоя 1,5 — 3 мм), а рабочие культуры — на скошенном агаре или в бульоне.
Тест-микроорганизмы должны иметь типичные биохимические, морфологические, тинкториальные, культуральные и ферментативные свойства, присущие данному виду [66], и обладать стандартной устойчивостью к эталонным дезинфицирующим средствам: растворам хлорамина, перекиси водорода, катамина АБ — алкилдиметилбензиламмония хлорида АДБАXg, глутарового альдегида (табл. 5.1).
Таблица 5.1
УСТОЙЧИВОСТЬ ТЕСТ-МИКРООРГАНИЗМОВ К ДЕЗИНФИЦИРУЮЩИМ АГЕНТАМ
|
Дезинфицирующее вещество |
Концентрация раствора по ДВ, % |
Время гибели тест-микроорганизмов, мин., не менее |
|
|
Е. coli, шт. 1257 |
S. aureus, шт. 906 |
||
|
Хлорамин |
0,020 <*> |
5 |
— |
|
0,200 <*> |
— |
15 |
|
|
АДБАХ |
0,025 |
20 |
10 |
|
Глутаровый альдегид |
0,030 |
10 |
— |
|
0,060 |
— |
10 |
|
|
Перекись водорода |
2,000 |
10 |
— |
|
3,000 |
— |
25 |
|
|
<*> Концентрация раствора указана по препарату. |
Устойчивость тест-микроорганизмов к эталонным дезинфицирующим средствам определяют методом батистовых тест-объектов (п. 5.1.2.2).
Проверку устойчивости тест-микроорганизмов проводят не реже 1 раза в месяц. При снижении резистентности культур делают их пересевы на обогащенные питательные среды до восстановления устойчивости.
5.1.1.1. Методы приготовления суспензии
тест-микроорганизмов. Определение биологической
концентрации тест-микроорганизмов в бактериальной суспензии
Культуры тест-микроорганизмов подвергают контролю их качества. В частности, непосредственно перед использованием тест-культур для исследовательских целей необходимо убедиться в том, что тест-штаммы, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста культур тест-штаммов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды. Проводят микроскопию мазка выросших культур, окрашенных по Грамму.
Рабочую суспензию тест-культур готовят из культуры данного тест-штамма,
выращенного на плотной питательной среде (МПА или казеиновый агар) при
температуре 37 °C в течение 18 — 24 ч. Для приготовления бактериальной
взвеси культуру смывают с агара стерильной питьевой водой. Полученную
взвесь микробов фильтруют через ватно-марлевый фильтр и разводят стерильной
питьевой водой до концентрации, соответствующей по мутности оптическому
стандарту мутности (ФГУН «Государственный научно-исследовательский институт
стандартизации и контроля медицинских биологических препаратов им.
9
Л.А. Тарасевича» Роспотребнадзора) N 20 (он соответствует 2 x 10 микробных
тел в 1 мл).
В связи с тем, что суспензия может содержать наряду с живыми мертвые микроорганизмы, необходимо определять бактериологическую концентрацию фактического количества живых клеток в приготовленной суспензии, чтобы при необходимости внести коррективы и обеспечить требуемые уровни контаминации батистовых тест-объектов жизнеспособными микроорганизмами.
Определение биологической концентрации тест-микроорганизмов выполняют методом последовательных десятикратных разведений суспензии тест-микроорганизма в стерильной питьевой воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (казеиновый агар, агар Эндо, МПА). После определенного времени инкубации при соответствующей температуре проводят подсчет выросших колониеобразующих единиц КОЕ и определяют количество жизнеспособных бактерий в одном мл суспензии.
Из практики известно, что суспензия, содержащая такое количество живых
микробов, при контаминации ею батистовых тест-объектов обеспечивает
5 6
требуемые (порядка 1 x 10 — 1 x 10 КОЕ/кв. см) уровни их обсеменения
живыми клетками тест-микроба.
5.1.1.2. Приготовление рабочих растворов ДС и их субстанций
Рабочие растворы ДС и их субстанций готовят непосредственно перед проведением исследований (кроме тех случаев, когда изучают стабильность рабочих растворов в процессе хранения).
При изучении средств, производимых в форме гранул, порошков, таблеток и т.п., рабочие растворы используют только после полного растворения ДВ дезинфицирующего средства (если не указано на возможность выпадения осадка).
Для оценки антимикробного действия субстанций и ДС в лабораторных условиях и исследования эффективности ДС, предназначенных для обеззараживания различных объектов, растворы готовят на стерильной питьевой воде. Для этого необходимое количество сухого ДС или жидкого концентрата вносят в пробирку, колбу и добавляют расчетное количество воды, тщательно размешивают и закрывают пробкой. Отмечают время полного растворения и внешний вид приготовленного рабочего раствора.
Температура растворов ДС должна быть в пределах плюс (20 +/- 2) °C (если по условиям эксперимента не рекомендована другая температура) независимо от температуры окружающей среды. Для поддержания требуемой температуры используют водяную баню.
При испытании ДС в практических условиях рабочие растворы готовят на нестерильной питьевой воде комнатной температуры (20 +/- 2) °C или при необходимости — умеренно повышенной температуры 45 — 50 °C. Навеску средства или отмеренное количество жидкого концентрата вносят в соответствующую емкость, добавляют воду, размешивают и закрывают крышкой. Работу с раствором начинают после полного растворения ДВ. Рабочие растворы из ДС в форме таблеток готовят путем добавления в отмеренный объем воды определенного числа таблеток.
Рабочие растворы субстанций и ДС готовят с соблюдением мер предосторожности. Если ДВ относится к летучим веществам и представляет опасность при ингаляционном воздействии, растворы готовят в вытяжном шкафу или в отдельном помещении, оборудованном приточно-вытяжной вентиляцией, в респираторе РУ 60М или РПГ-67, кожу рук защищают резиновыми перчатками, глаза — защитными очками.
Исследуемые ДС (перед, во время и после исследований) следует хранить в соответствии с требованиями технических условий или спецификации; при отсутствии таковых — в соответствии с СП 3.5.1378-03 [14].
5.1.2. Методы исследований и оценки результатов
бактерицидной активности ДС и их субстанций in vitro
Целью исследований является определение уровня и спектра антимикробной активности ДС и их субстанций.
Субстанции, предназначенные для производства ДС, должны соответствовать следующим требованиям:
— хорошо растворяться в воде или других растворителях;
— обладать бактерицидной активностью, т.е. убивать бактерии, а не задерживать их рост;
— иметь удовлетворительные органолептические (по цвету, запаху) и физико-химические (по растворимости, биоразлагаемости и стабильности при хранении и др.) свойства.
Антимикробную активность ДС и их субстанций изучают суспензионным методом или методом батистовых тест-объектов.
5.1.2.1. Суспензионный метод
Для приготовления растворов ДС в различных концентрациях ДВ разводят
или растворяют в стерильной питьевой воде, далее по 4,5 мл разливают в
стерильные пробирки, в которые добавляют 0,5 мл взвеси тест-микроорганизма
9
или бульонной культуры, содержащей 1 x 10 к/мл, и тщательно перемешивают.
Через определенные интервалы времени (5 мин.) по 0,5 мл взвеси
«тест-микроорганизм + ДВ» добавляют к 4,5 мл соответствующего
нейтрализатора, снова тщательно перемешивают и оставляют на 5 мин. Затем по
0,5 мл вносят в пробирку с 4,5 мл стерильной питьевой воды, после чего
0,1 мл из этой пробы вносят в пробирки с 5 мл жидкой и на поверхность
твердой питательной среды. В контрольных опытах вместо растворов ДС
используют стерильную питьевую воду, а посевы делают в среду без
нейтрализации или с нейтрализацией.
Температура инкубирования посевов в термостате — 37 °C, сроки учета результатов опыта — 24 — 48 ч. Для подтверждения снятия биоцидного действия ДВ из пробирок, в которых отсутствовал рост тест-культуры, ежедневно делают пересев по 0,5 мл в 4,5 мл новой питательной среды.
Результаты опыта оценивают по наличию или отсутствию роста микроорганизмов в жидкой и на твердой питательной среде. Сравнение проводят с контролем опыта, которым является посев тест-микроорганизмов в питательную среду без добавления ДС или субстанции.
Эффективной считают концентрацию средства, при которой трижды повторенный опыт при определенном времени воздействия дает отрицательный результат (отсутствие роста микроорганизмов) при наличии типичного роста тест-культуры в контроле.
5.1.2.2. Метод батистовых тест-объектов
Подготовка батистовых тест-объектов.
Перед приготовлением батистовых тест-объектов кусок батиста погружают на 24 ч в холодную воду для удаления аплитуры, крахмала. Затем его тщательно стирают с мылом, кипятят, сушат и гладят утюгом. С помощью иглы в приготовленном куске ткани выдергивают нитки в продольном направлении на расстоянии 11 мм друг от друга, а в поперечном — на расстоянии 6 мм. По этим линиям батист разрезают ножницами на тест-объекты и по 50 штук раскладывают в чашки Петри, последние заворачивают в бумагу и стерилизуют паровым методом при 132 °C (2,0 кГс/кв. см) 20 мин.
Контаминация батистовых тест-объектов.
Приготовление суспензии тест-микроорганизмов (E. coli, S. aureus, P. aeruginosa, S. typhimurium) проводят в соответствии с п. 5.1.1.1. Для контаминации стерильные батистовые тест-объекты в чашке Петри заливают суспензией тест-микроорганизма из расчета 0,5 мл на 1 тест-объект, равномерно смачивая все тест-объекты. Чашку Петри закрывают крышкой и оставляют на 20 мин. Затем в асептических условиях батистовые тест-объекты, пропитанные суспензией тест-микроорганизмов, переносят на поверхность стерильной фильтровальной бумаги (2 — 4 слоя на дне чашки Петри), прикрывают их сверху стерильной фильтровальной бумагой и закрывают чашку Петри крышкой. Через 10 мин. после удаления избытка жидкости тест-объекты переносят на поверхность сухой стерильной фильтровальной бумаги в чашке Петри и сверху прикрывают стерильным листом фильтровальной бумаги, подсушивают в термостате при 37 °C в течение 20 мин. с приоткрытой крышкой.
Хранят контаминированные батистовые тест-объекты в чашках Петри в холодильнике при температуре 4 °C.
Срок хранения тест-объектов: контаминированных E. coli, S. typhimurium, P. aeruginosa — 1 сутки, S. aureus — 4 суток.
Постановка опыта. При постановке опытов в стерильную пробирку пипеткой наливают требуемый объем приготовленного дезинфицирующего раствора (из расчета 0,5 мл на каждый тест-объект) и, не касаясь краев колбы, опускают в него с помощью стерильного пинцета все тест-объекты, используемые в эксперименте (по 2 на каждую экспозицию). Легким покачиванием колбы достигают смачивания тест-объектов исследуемым раствором. Колбу помещают в водяную баню с температурой 18 — 20 °C и поддерживают данную температуру в течение всего эксперимента. При постоянной температуре в помещении 18 — 20 °C эксперименты можно проводить без использования водяной бани.
Отсчет времени воздействия эталонного раствора начинают с момента смачивания всех тест-объектов раствором. Через определенные интервалы времени (5 мин.) стерильным пинцетом или платиновой петлей извлекают по 2 тест-объекта из раствора и погружают в пробирки с 5 мл стерильного раствора соответствующего нейтрализатора. Через 5 мин. тест-объекты переносят в пробирку со стерильной питьевой водой, а еще через 5 мин. каждый из двух тест-объектов в отдельности переносят в пробирки с жидкой питательной средой, необходимой для культивирования изучаемого тест-микроорганизма.
Контролем являются 2 тест-объекта, погруженные на весь период эксперимента в раствор нейтрализатора, и 2 тест-объекта, погруженные на этот же срок в питьевую воду, которые по окончании эксперимента переносят в питательную среду. Посевы инкубируют в термостате при температуре 37 °C. Результаты оценивают качественно по отсутствию/наличию роста тест-микроорганизма в питательном бульоне.
Критерием активности ДС и субстанций является 100% гибель тест-микроорганизмов (отсутствие роста в опытных пробах) при времени дезинфекционной выдержки S. aureus, E. coli, S. typhimurium, P. aeruginosa — не более 30 мин.
5.1.2.3. Методы исключения бактериостатического
действия действующих веществ
Для определения микробоцидного и исключения бактериостатического действия ДВ по истечении экспозиции необходимо прекратить воздействие ДВ на тест-культуру. Это достигается путем использования следующих методов:
— применения химического нейтрализатора;
— посева в большой объем питательной среды;
— ежедневного пересева на новые питательные среды;
— биологической пробы на животных.
Применение химического нейтрализатора действующего вещества.
Для нейтрализации действующего вещества, которое может быть перенесено с материалом тест-объекта при его посеве в питательную среду, используют нейтрализатор — вещество, которое устраняет, нейтрализует действие химического агента на микробную клетку, но не убивает и не задерживает рост тест-микроорганизма. Тест-объекты после воздействия химического агента промывают в нейтрализаторе или добавляют его непосредственно в питательную среду (если установлено, что вносимая концентрация нейтрализатора не убивает и не задерживает рост тест-бактерий).
В качестве нейтрализаторов ДВ из различных химических групп применяют для:
— галоидактивных (хлор-, бром- и йодактивные) и кислородактивных (перекись водорода, ее комплексы с солями, надуксусная кислота, озон) — 0,1 — 1,0%-ные растворы тиосульфата натрия;
— четвертичных аммониевых солей (алкилдиметилбензиламмоний хлорид, дидецилдиметиламмоний хлорид и др.), производных гуанидина (полигексаметиленгуанидин гидрохлорид, хлоргексидин биглюконат и др.) — 0,1 — 1,0%-ные растворы лаурилсульфата натрия (сульфонол) или растворы лаурилсульфата натрия с 10% обезжиренного молока или универсальный нейтрализатор (см. ниже);
— альдегидов (глутаровый альдегид, глиоксаль, формальдегид, ортофталевый альдегид) — 1,0%-ный раствор пиросульфита (метабисульфита) натрия или универсальный нейтрализатор (см. ниже);
— кислот — щелочи в эквивалентном количестве;
— щелочей — кислоты в эквивалентном количестве;
— спиртов — разведение в воде до недействующей концентрации;
— композиционных средств — универсальный нейтрализатор, содержащий Твин-80 (3%), сапонин (0,3 — 3,0%), гистидин (0,1%), цистеин (0,1%). Если в состав композиции входят окислители, в нейтрализатор дополнительно вводят тиосульфат натрия.
Методика контроля полноты нейтрализации действующего вещества с использованием культуры бактерий. В целях сокращения времени на подбор оптимального нейтрализатора, а также объективного подтверждения того, что ДВ, входящие в состав субстанции или ДС, полностью нейтрализованы, используют культуру бактерий, чувствительную к исследуемому ДВ, например тест-штамм E. coli (штамм 1257) или S. aureus (штамм 906), выращенные, как описано в п. 5.1.1.
Поэтому каждый случай проведения испытания ДС должен предварительно сопровождаться экспериментальным контролем эффективности нейтрализации остаточного действия ДС на микробную клетку, а также на бактерицидное и бактериостатическое действие используемой концентрации нейтрализатора.
Для контроля эффективности нейтрализатора и полноты нейтрализации ДС используют суспензионный метод, предусматривающий проведение исследования, основные операции которого и их назначение приведены на схеме 5.1 (не приводится) и в табл. 5.2.
Таблица 5.2
НАЗНАЧЕНИЕ ОПЕРАЦИЙ ЭКСПЕРИМЕНТА ПО ОЦЕНКЕ ЭФФЕКТИВНОСТИ
НЕЙТРАЛИЗАЦИИ ОСТАТОЧНОГО ДЕЙСТВИЯ ДС
┌─────┬─────────────────┬─────────────────────────────────┬───────────────┐
│ N │ Назначение │ Процедура выполнения операции │ Ожидаемый │
│пробы│ операции │ исследования │ результат │
│ │ исследования │ │ │
├─────┼─────────────────┼─────────────────────────────────┼───────────────┤
│1 │Контроль │К 9 мл суспензии тест-культуры │Рост │
│ │губительного │ 3 │микроорганизмов│
│ │действия ДС │(10 КОЕ/мл) на дист. воде + 1 мл│должен │
│ │ │раствора ДС │отсутствовать │
├─────┼─────────────────┼─────────────────────────────────┼───────────────┤
│2 │Контроль полноты │К 9 мл суспензии тест-культуры │Примерно │
│ │нейтрализации ДС │ 3 │одинаковое │
│ │ │(10 КОЕ/мл) на нейтрализаторе + │количество │
│ │ │1 мл раствора ДС │колоний в │
├─────┼─────────────────┼─────────────────────────────────┤посевах проб по│
│3 │Контроль отсут- │К 9 мл суспензии тест-культуры │0,1 мл на │
│ │ствия антимикроб-│ 3 │плотной │
│ │ного эффекта у │(10 КОЕ/мл) на нейтрализаторе + │питательной │
│ │нейтрализатора │1 мл раствора нейтрализатора │среде │
├─────┼─────────────────┼─────────────────────────────────┤ │
│4 │Референс-контроль│К 9 мл суспензии тест-культуры │ │
│ │количества бак- │ 3 │ │
│ │терий (E. coli) │(10 КОЕ/мл) на д.в.+ 1 мл дист. │ │
│ │ │воды │ │
├─────┴─────────────────┴─────────────────────────────────┴───────────────┤
│ Примечание: спустя 5 мин. после постановки опыта из каждой из четырех│
│проб производят посев смеси по 0,1 мл как минимум на 3 пробирки со│
│скошенной питательной средой, которые инкубируют в термостате при 37 °C,│
│по истечении 2 — 3 суток учитывают результаты исследований. │
└─────────────────────────────────────────────────────────────────────────┘
Критерии отбора действующих веществ (субстанций). Критерием отбора действующего вещества в качестве субстанции для создания ДС является наличие у него бактерицидной активности.
Гибель тест-микроорганизмов должна составлять 100% при времени действия мин. ДС в минимальной концентрации в отношении бактерий (S. aureus, E. coli, S. typhimurium, P. aeruginosa) не более 30 мин.
5.1.2.4. Методы изучения факторов, влияющих
на бактерицидную активность ДС и их субстанций
Исследования включают определение спектра антимикробного действия ДС, а при проведении углубленного изучения — дополнительно влияние различных факторов (pH, температура, органические вещества) на антимикробную активность растворов ДС. Такая необходимость возникает при изучении ДС, созданных на основе нового, ранее не изученного ДВ.
Изучение спектра антимикробной активности и влияние на активность различных факторов проводят методом батистовых тест-объектов (п. 5.1.2.2), контаминированных тест-микроорганизмами.
Изучение зависимости активности ДС от присутствия органических веществ проводят при добавлении к суспензии микроорганизмов 20% инактивированной лошадиной сыворотки или сыворотки крупного рогатого скота при контаминации батистовых тест-объектов.
Для инактивации нормальной сыворотки ее прогревают на водяной бане при температуре плюс 56 °C в течение 30 мин.
Испытание бактерицидной активности ДС в присутствии органических веществ проводят с теми концентрациями, которые оказались эффективными при обеззараживании тест-объектов, контаминированных тест-микроорганизмами без добавления сыворотки.
Если активность средства при таких условиях эксперимента не снижается, концентрацию сыворотки увеличивают до 40%. При отсутствии снижения активности ДС и при добавлении 40% белка считают, что в присутствии белка активность средства не снижается.
Влияние температуры на активность исследуемого ДС изучают при обеззараживании контаминированных батистовых тест-объектов растворами средств при различных температурах растворов (от -30 до 50 °C). Для этого колбу с исследуемым раствором ДС помещают в водяную баню или холодильную камеру и устанавливают необходимую температуру. Температуру раствора доводят до желаемого уровня и опускают в него контаминированные тест-микроорганизмами батистовые тест-объекты. Далее порядок проведения опыта такой, как при изучении спектра антимикробного действия субстанций (п. 5.1.2.2). Температуру поддерживают в течение заданной экспозиции. Если эффективная концентрация одинаковая при температуре растворов 18 — 20 °C и других значениях, то считают, что температура не влияет на активность ДС и, соответственно, если эффективная концентрация увеличивается или уменьшается, то считают, что с повышением или понижением температуры эффективность ДС снижается или повышается.
Влияние pH среды на активность исследуемого ДС изучают при обеззараживании контаминированных тест-микроорганизмами батистовых тест-объектов в растворах ДС, имеющих различное значение pH (5,6 — 6,0; 7,0; 8,5 — 9,0). Готовят ряд разведений исследуемого вещества, искусственно подкисляя или подщелачивая растворы. Для подкисления используют децинормальный раствор соляной или другой кислоты, а для подщелачивания — децинормальный раствор щелочи. Порядок проведения опыта такой же, как при оценке спектра антимикробного действия субстанций, п. 5.1.2.2.
Влияние факторов среды на активность ДС учитывается при разработке оптимальных режимов и применении ДС в практике.
5.1.3. Методы исследования бактерицидной эффективности ДС,
предназначенных для обеззараживания объектов внешней среды,
контаминированных тест-микроорганизмами
Цель исследования — разработка режимов применения ДС с учетом условий их дальнейшего применения на практике для обеззараживания изделий медицинского назначения ИМН, предметов ухода за больными, игрушек, белья, поверхностей, посуды, выделений и т.п. в зависимости от вида контаминации, концентрации действующего вещества, времени воздействия, нормы расхода, характера объекта, наличия на нем органического загрязнения и его специфики, температуры, способа и кратности обработки.
5.1.3.1. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания ИМН
При выборе ДС для исследований с указанной целью следует учитывать:
— назначение и кратность применения ИМН (многократного или однократного применения);
— наличие у ДС негативных свойств, например корродирующего или фиксирующего действия и т.п., ограничивающих возможности его использования или требующих индивидуального методического подхода при исследовании;
— материал (материалы), из которого изготовлено ИМН;
— функциональные особенности изделия и условия его эксплуатации, обусловливающие особенности методики проведения эксперимента и последующих рекомендаций по технологии их обеззараживания.
Исследование эффективности ДС, предназначенных для обеззараживания ИМН из различных материалов (кроме эндоскопов). В качестве тест-изделий используют стерильные инструменты и ИМН (катетеры, микропипетки, пластмассовые шпатели и др.) из различных материалов (металлов, резин, стекла, пластмасс) или имитирующие их тест-объекты. Перечень инструментов, взятых в эксперимент, должен включать не менее трех инструментов, имеющих замковые части (щипцы, ножницы, корнцанг), и не менее двух, не имеющих замковых частей (пинцеты, шпатели), а также стоматологические, в т.ч. вращающиеся, инструменты (не менее 4) — бор, бурав корневой, зеркало, диск шлифовальный. В качестве тест-изделий из резин, стекла, пластмасс используют фрагменты изделий катетеров, микропипеток, шпателей и пр.
В качестве тест-микроорганизмов используют S. aureus, P. aeruginosa. На поверхность тест-изделия (у замковых ИМН — в область замка, а при наличии каналов и полостей — также в канал изделия) с помощью пипетки наносят по 0,1 мл 1-млрд. суспензии того или иного вида тест-микроорганизмов, содержащей 40% инактивированной лошадиной сыворотки. Тест-изделия подсушивают до полного высыхания. Мелкие тест-изделия погружают в указанную взвесь тест-микроорганизмов на 15 мин., затем их извлекают и подсушивают (до полного высыхания). При испытании ДС, обладающих фиксирующими свойствами, количество добавляемой сыворотки уменьшают до 5%.
Дезинфицирующие растворы готовят на стерильной питьевой воде. После подсушивания контаминированные изделия полностью погружают в раствор испытываемого ДС, заполняя им все каналы и полости изделий, избегая образования воздушных пробок. Инструменты, имеющие замковые части, погружают раскрытыми, предварительно сделав ими в растворе ДС несколько рабочих движений для лучшего проникновения раствора в труднодоступные участки изделий в области замка. Толщина слоя раствора ДС над изделиями должна быть не менее 1 см. Параллельно для контроля изделия погружают в воду.
Через определенное время (от 5 до 120 мин.) изделия извлекают из дезинфицирующего раствора и марлевой салфеткой размером 5 x 5 кв. см, пропитанной нейтрализатором, с поверхности изделия делают смывы, затем салфетку помещают в пробирку с 10 мл того же нейтрализатора и встряхивают с бусами в течение 5 — 10 мин. Канал изделия промывают раствором нейтрализатора. Мелкие изделия погружают в раствор нейтрализатора на 5 мин., а затем переносят в пробирки с жидкой питательной средой. Для контроля эффективности обеззараживания смывную жидкость с поверхности изделия и из канала засевают на соответствующие питательные среды. Посевы выдерживают в термостате при температуре и времени, оптимальных для роста использованного тест-микроорганизма.
Кратность постановки эксперимента должна быть достаточной для получения статистически достоверных результатов.
Эффективным считают режим (концентрация — время — температура), обеспечивающий гибель тест-микроорганизма на всех изделиях. При наличии положительных проб эксперимент повторяют, увеличивая концентрацию или время воздействия.
Критерий эффективности обеззараживания — 100%-ная гибель тест-микроорганизма.
Время обеззараживания ИМН, контаминированных S. aureus, P. aeruginosa, — не более 60 мин.
Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания эндоскопов, включая дезинфекцию высокого уровня ДВУ.
В качестве тест-объектов используют стерильные фрагменты эндоскопа или эндоскоп (гибкий — гастроскоп, жесткий — цистоскоп), а в качестве тест-микроорганизма — S. aureus.
На наружную поверхность тест-объекта наносят по 0,1 мл 1-млрд. суспензии тест-микроорганизма, содержащей 5% сыворотки; через канал эндоскопа с помощью пипетки пропускают не менее 5 мл такой же суспензии. После этого эндоскоп подсушивают в течение 20 мин. Затем контаминированное изделие погружают в раствор ДС, заполняя полости и каналы эндоскопа. Через определенные интервалы времени в течение 5 — 60 мин. изделие извлекают из раствора и делают смыв с наружной поверхности марлевой салфеткой, смоченной в растворе нейтрализатора. Канал изделия промывают нейтрализатором. Смывную жидкость засевают на соответствующие питательные среды.
Критерий эффективности обеззараживания эндоскопов — 100%-ная гибель тест-микроорганизма. Время обеззараживания эндоскопов, контаминированных S. aureus, — не более 60 мин.
5.1.3.2. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания
стоматологических оттисков
ДС, предназначенное для обеззараживания стоматологических оттисков, должно иметь широкий спектр антимикробной активности, не вызывать изменений свойств и размеров оттисков, иметь короткое время дезинфекционной выдержки (не более 30 мин.).
При разработке режимов обеззараживания стоматологических оттисков в качестве тест-микроорганизмов используют S. aureus, P. aeruginosa, в качестве тест-объектов — оттиски из альгинатных, силиконовых или других материалов. Для изготовления оттисков слепочную массу, полученную в соответствии с рекомендациями изготовителя, помещают в пластмассовую или металлическую ложку и делают оттиск с пластмассовых зубных протезов с моделированной десной. На оттиски наносят по 0,1 мл 1-млрд. суспензии тест-микроорганизма (с добавлением 40% инактивированной сыворотки), подсушивают их в течение 2 — 3 мин., затем полностью погружают в раствор ДС. При установленном фиксирующем действии ДС оттиски перед погружением в дезинфицирующий раствор промывают проточной питьевой водой. Параллельно для контроля контаминированные оттиски погружают в воду. Через определенное время (5 — 30 мин.) оттиски извлекают из раствора и марлевой салфеткой, пропитанной нейтрализатором, делают смывы. Салфетки помещают в стерильные пробирки с бусами, содержащие 10 мл нейтрализатора, и встряхивают в течение 10 мин. Затем делают посев смывной жидкости на питательные среды для контроля эффективности обеззараживания. Критерий эффективности обеззараживания — 100%.
5.1.3.3. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания предметов
ухода за больными, игрушек
В качестве тест-объектов используют предметы ухода за больными (подкладные клеенки, резиновые грелки, судна, термометры, пластмассовые наконечники для клизм и др.), игрушки (пластмассовые, металлические, деревянные, резиновые, кроме мягких) или тест-объекты, их имитирующие. В качестве тест-культур используют S. aureus и E. coli.
Перед контаминацией тест-микроорганизмами тест-объекты подвергают механической очистке — моют водой с мылом и щеткой. Для имитации загрязнения используется 40% инактивированной лошадиной сыворотки или сыворотки крупного рогатого скота. Для этого перед контаминацией объектов к суспензии тест-микроорганизмов добавляют необходимое количество сыворотки.
После подсушивания контаминированные тест-объекты располагают горизонтально и на них пипеткой наносят взвесь тест-микроорганизмов из расчета 0,5 мл 2-млрд. микробной взвеси на площадь в 100 кв. см. Суспензию равномерно распределяют по поверхности тест-объектов стеклянным шпателем, подсушивают (до полного высыхания) при комнатной температуре 18 — 20 °C и относительной влажности воздуха 50 — 60%, затем обрабатывают дезинфицирующим раствором.
Обработку предметов ухода за больными и игрушек проводят способами протирания, погружения, а для крупных игрушек — способом орошения (капельное).
Норму расхода дезинфицирующего раствора при обеззараживании способами протирания или орошения определяют в зависимости от способа обработки аналогично опытам по обеззараживанию поверхностей (п. 5.1.3.5). Двукратное протирание или орошение проводят через 5 — 15 мин. после первого.
При обработке способом погружения в дезинфицирующий раствор предметов ухода за больными и мелких игрушек последний должен полностью и с избытком покрывать все объекты. При погружении мелких игрушек необходимо препятствовать их всплытию.
Время обеззараживания объектов определяют в интервале от 15 до 120 мин. в зависимости от вида тест-микроорганизма и наличия органического загрязнения.
Контрольные тест-объекты обрабатывают стерильной питьевой водой из того же расчета, что и опытные.
Контроль эффективности обеззараживания контаминированных тест-объектов проводят следующим образом: марлевой салфеткой (размером 5 x 5 кв. см), смоченной в растворе нейтрализатора, соответствующего для данного ДС, тщательно протирают тест-объект и погружают ее в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин. при постоянном встряхивании. Отмывную жидкость сеют на 2 — 3 чашки по 0,2 — 0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температуре 37 °C и учитывают результаты через 2 суток.
Критерий эффективности обеззараживания — не менее 100%.
Время обеззараживания объектов, контаминированных S. aureus, — не более 60 мин.
5.1.3.4. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания белья
Эффективность обеззараживания белья ДС определяют с помощью тест-объектов, представляющих собой кусочки ткани из бязи размером 2 x 2 см. В качестве тест-культур используют S. aureus и E. coli.
При разработке режима обеззараживания загрязненного белья к суспензии микроорганизмов перед контаминацией тест-объектов добавляют 40% инактивированной сыворотки (6 мл 2-млрд. взвеси тест-культуры смешивают с 4 мл инактивированной сыворотки) или 40% фекальной эмульсии (6 мл 2-млрд. взвеси тест-культуры смешивают с 4 мл фекальной эмульсии). Для приготовления фекальной эмульсии 8 г фекалий растирают в ступке с 20 мл воды. Контаминированные тест-объекты подсушивают в термостате при 37 °C в течение 20 — 25 мин. или 1,5 — 2 ч при комнатной температуре до полного высыхания.
Стерильные тест-объекты пропитывают 2-млрд. взвесью тест-микроорганизмов из расчета 20 мл на 10 тест-объектов и подсушивают в термостате. Далее контаминированные тест-объекты помещают в стерильные бязевые мешочки размером 5 x 8 см по 2 штуки в каждый.
При разработке режимов обеззараживания белья, не загрязненного выделениями, белье погружают в емкость с дезинфицирующим раствором из расчета 4 л раствора на 1 кг сухого белья. При разработке режимов обеззараживания белья, загрязненного выделениями, его погружают в емкость с дезинфицирующим раствором из расчета 5 л раствора на 1 кг сухого белья. Белье погружают в раствор последовательно, одну вещь за другой, следя за тем, чтобы между вещами не образовывалось воздушных полостей, препятствующих процессу дезинфекции. Мешочки с контаминированными тест-объектами распределяют между слоями белья (сверху, в середине, внизу). Через заданное время воздействия ДС (например, 15, 30, 60 мин.) извлекают по 1 мешочку с каждого уровня, стерильным пинцетом вынимают тест-объекты, переносят их в раствор нейтрализатора на 5 мин., затем промывают 5 мин. в стерильной питьевой воде, затем помещают в жидкие питательные среды. В контрольных опытах вместо дезинфицирующего раствора используют стерильную питьевую воду.
Критерий эффективности — 100%-ная гибель тест-культуры.
Время обеззараживания белья без видимых загрязнений, контаминированного S. aureus, E. coli, — не более 120 мин.
Время обеззараживания белья, загрязненного выделениями и контаминированного S. aureus, E. coli, — не более 240 мин.
5.1.3.5. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания поверхностей
Исследования проводят в зависимости от вида поверхностей, их положения (горизонтальное, вертикальное), способа и кратности обработки.
В качестве тест-поверхностей используют поверхности размером 10 x 10 см из различных материалов: гладкие, шероховатые, впитывающие и невпитывающие (деревянные, оштукатуренные, поверхности, окрашенные масляной, силикатной, водоэмульсионной или клеевой краской; оклеенные обоями, поверхности из линолеумных покрытий, поверхности из окрашенного или неокрашенного металла — нержавеющая хром-никелевая кислотостойкая сталь, пластика, стекла, искусственной или натуральной кожи, поверхности из облицовочной плитки — кафельной и метлахской, фаянса и др.), но не менее 5 видов поверхностей. Набор тест-поверхностей для исследований определяется назначением средства.
В качестве тест-микроорганизмов используют S. aureus, E. coli, S. typhimurium, P. aeruginosa.
При разработке режима обеззараживания технологического оборудования и поверхностей в помещениях в различных отраслях пищевой промышленности в качестве тест-поверхностей используют неокрашенный металл, пластик, облицовочную плитку (кафельная, метлахская, фаянсовая), контаминированные санитарно-показательными и специфическими для предприятий данного вида промышленности микроорганизмами.
Перед контаминацией тест-культурой поверхности подвергают механической очистке — моют водой с мылом и щеткой (за исключением поверхностей, оклеенных обоями и окрашенных клеевой краской). Последние протирают несколько раз стерильной салфеткой, увлажненной стерильной питьевой водой.
Высушенные поверхности располагают горизонтально, и на них пипеткой наносят взвесь тест-микроорганизмов из расчета 0,5 мл 2-млрд. микробной взвеси на площадь в 100 кв. см и равномерно распределяют ее по поверхности стеклянным шпателем. Поверхности подсушивают (до полного высыхания) при температуре 18 — 20 °C и относительной влажности воздуха 50 — 60%, затем обрабатывают дезинфицирующим раствором.
При изучении эффективности обеззараживания линолеум, плитку метлахскую, искусственную или натуральную кожу, стекло располагают горизонтально, а дерево, окрашенное масляной, силикатной, водоэмульсионной или клеевой красками, поверхности, оклеенные обоями, пластик, кафельную и фаянсовую плитки — вертикально.
Для имитации загрязнения поверхностей используют белковое или фекальное загрязнение: 40% инактивированной сыворотки, 40% фекальная эмульсия (при разработке режимов обеззараживания унитазов).
Обработку поверхностей проводят способами протирания или орошения крупнокапельное и аэрозольное.
Для определения нормы расхода при однократной обработке дезинфицирующий раствор наносят с помощью пипетки на поверхность размером 10 x 10 см при применении способа протирания в количестве 1,0, 1,5 или 2,0 мл, а при крупнокапельном орошении наносят с помощью дозатора 1,5 — 3,0 мл. При аэрозольном методе обработки изучают эффективность обеззараживания при норме расхода 30 — 50 — 100 мл/кв. м (в зависимости от вида аэрозольного генератора и применяемой аэрозольной насадки). Многократное протирание или орошение проводят с интервалом между обработками 5 — 15 — 30 мин.
Время обеззараживания поверхностей определяют в интервале от 5 до 120 мин. Выбор экспозиции зависит от назначения и рекомендуемых условий применения ДС.
Контрольные поверхности обрабатывают стерильной питьевой водой также и из того же расчета, что и опытные.
Исследования проводят при температуре 18 — 20 °C. При необходимости оценивают эффективность обеззараживания поверхностей при повышенной до 50 °C или пониженной до -30 °C температуре (исследования проводят в термо- или холодильной камере).
Контроль эффективности обеззараживания тест-поверхностей проводят следующим образом: марлевой салфеткой (размером 5 x 5 см), смоченной в растворе соответствующего для данного дезинфицирующего средства нейтрализатора, тщательно протирают тест-поверхность, затем ее погружают в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин. при постоянном встряхивании. Отмывную жидкость сеют (на 2 — 3 чашки по 0,1 — 0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды.
В зависимости от вида тест-микроорганизма посевы выращивают в термостате при температуре 37 °C. Учет результатов проводят в течение 1 — 2 суток путем подсчета количества выросших колоний, затем рассчитывают плотность контаминации 100 кв. см поверхности и % обеззараживания, принимая количество колоний, снятых с контрольных поверхностей, за 100%.
Критерий эффективности обеззараживания поверхностей — не менее 99,99% гибели тест-микроорганизмов; время обеззараживания при контаминации S. aureus, E. coli, S. typhimurium, P. aeruginosa — не более 120 мин.
5.1.3.6. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания посуды
В зависимости от назначения ДС исследования проводят при обеззараживании посуды столовой и кухонной, лабораторной и из-под выделений.
В качестве тест-объектов при разработке режимов обеззараживания столовой и кухонной посуды используют тарелки, стаканы, кружки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью) и столовые приборы — ножи, вилки, ложки из различных материалов (нержавеющая сталь, алюминий, пластик); лабораторной посуды — предметные и покровные стекла, пипетки, чашки Петри, планшеты для иммунологического анализа и др.; посуды из-под выделений — подкладные судна, мочеприемники, горшки, плевательницы и т.п. или тест-объекты их имитирующие. В качестве тест-микроорганизмов при контаминации столовой посуды используют S. aureus, E. coli.
Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя
добавляют 1 мл 2-млрд. микробной взвеси), лабораторной посуды — 40%
инактивированной сыворотки, а посуды из-под выделений — 40% фекальную
эмульсию или мокроту, контаминированные тест-микроорганизмами (на 10 мл —
9
1 мл 2 x 10 млрд. взвеси).
Перед контаминацией микроорганизмами посуду и столовые приборы подвергают механической очистке — моют водой с мылом и щеткой. Посуду располагают горизонтально и на нее пипеткой наносят взвесь тест-микроорганизмов из расчета 0,5 мл 2-млрд. взвеси на площадь в 100 кв. см и равномерно распределяют ее по поверхности посуды стеклянным шпателем. Столовые приборы для контаминации погружают в бактериальную суспензию на 1 — 2 мин., оставляя незараженными их ручки.
Посуду подсушивают (до полного высыхания) при комнатной температуре 18 — 20 °C и относительной влажности воздуха 50 — 60%, затем обрабатывают дезинфицирующим раствором.
Для разработки режимов обеззараживания посуды с остатками пищи до ее контаминации микробную взвесь смешивают с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-млрд. микробной взвеси).
Обработку столовой, чайной, лабораторной посуды и столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18 — 20 °C. При необходимости изучают эффективность растворов, имеющих температуру 50 °C.
Контролем служит аналогично контаминированная посуда, которую погружают в такой же объем стерильной питьевой воды.
Дезинфицирующий раствор должен полностью и с избытком покрыть всю посуду и приборы (из расчета не менее 2 л на 1 комплект).
Через определенные интервалы времени (например, 15, 30, 60 мин. и т.д.) извлекают из дезинфицирующего раствора по одному предмету (например, тарелка, стакан, предметное стекло, нож и т.д.) и стерильной марлевой салфеткой (размер 5 x 5 кв. см), смоченной в растворе нейтрализатора, соответствующего данному ДС, тщательно протирают зараженную часть каждого предмета, погружают салфетку в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин. при постоянном встряхивании. После отмыва марлевую салфетку погружают в соответствующую жидкую питательную среду. Отмывную жидкость сеют на 2 — 3 чашки по 0,2 — 0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температуре 37 °C и учитывают через 2 суток.
Время обеззараживания посуды определяют в интервале от 15 до 240 мин. в зависимости от вида тест-микроорганизма и наличия загрязнения.
Критерий эффективности обеззараживания — не менее 100%.
Время обеззараживания столовой посуды без остатков пищи, контаминированной S. aureus, E. coli, — не более 60 мин.
Время обеззараживания посуды с остатками пищи, контаминированной S. aureus, E. coli, S. typhimurium, — не более 120 мин.
Время обеззараживания лабораторной посуды, контаминированной S. aureus, E. coli, — не более 120 мин.
Время обеззараживания посуды из-под выделений, контаминированной E. coli, S. typhimurium, — не более 120 мин.
5.1.3.7. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания выделений
Дезинфицирующие средства, предназначенные для обеззараживания выделений, должны обладать способностью гомогенизировать органический субстрат (фекалии, мокрота). Препараты, не обладающие этим свойством, для обеззараживания выделений не пригодны.
Изучение активности ДС при обработке выделений проводят с учетом их консистенции и соотношения с дезинфицирующим раствором или сухим препаратом.
В качестве тест-микроорганизмов при разработке режимов обеззараживания выделений используют S. aureus, E. coli, S. typhimurium.
Определение эффективности ДС при обработке мочи проводят следующим
образом: берут несколько пробирок, наливают в них по 9 мл мочи, прибавляют
9
по 1 мл взвеси тест-микроорганизма, содержащей 1 x 10 КОЕ/мл.
Неразведенное ДС или его растворы добавляют к моче в различных соотношениях
(равном, двойном и т.д.). По истечении времени воздействия (15, 30, 60, 90,
120 мин.) пипеткой берут 1 мл опытной смеси и переносят в нейтрализатор
объемом 9 мл, а затем из нее 1 мл смеси в пробирку с 5 мл бульона. После
тщательного перемешивания 1 мл переносят во вторую пробирку с бульоном, а
затем делают посевы по 0,1 мл на твердые питательные среды как из первой,
так и из второй пробирок. Чашки Петри с посевами ставят в термостат.
Контролем служат аналогично поставленные опыты с добавлением к моче не дезинфицирующего раствора, а стерильной водопроводной питьевой воды.
Эффективным считают ДС, обеспечивающее 100%-ную гибель тест-микроорганизмов в 6 — 8 опытах с совпадающими результатами.
Определение эффективности ДС при обработке фекалий: 20 г фекалий
растирают в ступке и добавляют 80 мл стерильной питьевой воды. Полученную
эмульсию фильтруют через двойной слой марли, разливают в пробирки по 9 мл и
9
добавляют по 1 мл взвеси тест-микроорганизмов, содержащей 1 x 10 КОЕ/мл.
Приготовленную эмульсию фекалий заливают равным или двойным количеством дезинфицирующего раствора или вносят различное количество сухого препарата. После контакта с ДС производят высевы так же, как и при обеззараживании мочи. Результаты учитывают через двое суток.
При положительных результатах проводят опыты с большим количеством оформленных фекалий (200 — 250 г). Для этого помещают их в сосуд и заливают дезинфицирующим раствором в равном или двойном количестве по отношению к весу фекалий или засыпают сухим препаратом. Затем небольшую часть фекальных масс стеклянной палочкой перемешивают с жидкостью, а остальную массу оставляют в виде небольших комочков. Через определенные промежутки времени (30, 60, 90 и 120 мин.) проводят раздельные высевы жидкой части и комочков.
Жидкую часть фекальных масс набирают пипеткой и производят посев так же, как мочи. Плотные части фекалий забирают петлей и опускают в 5 мл питательной среды, растерев их о край пробирки и тщательно перемешав с бульоном; затем переносят из этой пробирки 1 мл смеси во вторую пробирку, также содержащую 5 мл бульона. Как из первой, так и из второй пробирки производят посев по 0,1 мл на чашки Петри с плотной питательной средой.
Контролем служат аналогично поставленные опыты с добавлением к фекальной эмульсии стерильной воды вместо ДС.
Об эффективности исследуемого ДС судят на основании 6 — 8 опытов с совпадающими результатами. Эффективным считают ДС, обеспечивающее 100%-ную гибель тест-микроорганизмов в обеззараживаемом материале.
При определении эффективности ДС при обработке фекально-мочевой взвеси
с целью снижения микробной обсемененности консервации в качестве
тест-микроорганизма используют культуру E. coli (штамм 1257).
Фекально-мочевую взвесь готовят из расчета: 1 часть фекалий и 4 части мочи.
В пробирки разливают по 4,5 мл фекально-мочевой взвеси и добавляют в каждую
9
пробирку по 0,5 мл взвеси тест-культуры, содержащей 1 x 10 КОЕ/мл.
Неразведенное ДС или его растворы добавляют к фекально-мочевой взвеси в
различных соотношениях. По истечении времени воздействия из каждой пробы
отбирают по 0,5 мл жидкости и переносят в пробирки с 4,5 мл казеинового
бульона. Это обеспечивает нейтрализацию ДС. После ряда серийных разведений
из каждой пробирки производят высев на чашки Петри с питательным агаром
(мясо-пептонный, Эндо). Результаты эксперимента учитывают через 48 ч
инкубации при 37 °C. В контрольных пробах вместо препарата применяют
стерильную питьевую воду.
Эффективным считают ДС, обеспечивающее снижение микробной обсемененности фекально-мочевой взвеси не менее чем на 99,9% и не более чем через 120 мин.
Критерий эффективности обеззараживания выделений — 100%-ная гибель тест-микроорганизмов. Время обеззараживания выделений, контаминированных тест-микроорганизмами (S. aureus, E. coli, S. typhimurium), — не более 6 ч.
5.1.3.8. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания воздуха
Целью исследования является определение эффективности химических ДС и разработка режимов их применения для обеззараживания воздуха в помещениях.
Химические ДС применяют для обеззараживания воздуха в помещениях в виде аэрозолей или паров растворов ДС, а также газов.
При исследовании эффективности обеззараживания воздуха химическими ДС в качестве тест-микроорганизмов используют S. aureus.
Исследования проводят в испытательных камерах объемом 1 — 2 куб. м. Предварительно внутреннюю поверхность камеры моют раствором моющего средства, остатки которого затем смывают водопроводной водой, и включают бактерицидный УФ-облучатель. В центре камеры располагают продезинфицированный вентилятор, производительностью 15 — 25 куб. м/ч, назначение которого — предотвращение быстрого оседания микроорганизмов.
Помещение, в котором находится испытательная камера, должно быть оборудовано УФ-облучателем рециркуляторного типа, который функционирует в течение всего эксперимента. Перед началом работы исследователь надевает халат, резиновые перчатки и маску.
При определении эффективности ДС, предназначенных для обеззараживания воздуха, используют 2 метода: седиментационный и аспирационный методы.
Седиментационный метод. Для проведения исследований седиментационным методом камера должна иметь окошко с дверцей размером 20 x 20 см для внесения в камеру чашек Петри.
Растопленный агар с добавленным нейтрализатором разливают по чашкам Петри, питательную среду не подсушивают.
До начала распыления суспензии тест-микроорганизма отбирают пробу на контроль обсемененности воздуха в камере, для чего открытую чашку Петри с питательной средой помещают на 30 мин. в камеру.
Затем в камере распыляют суспензию тест-микроорганизма в количестве,
достаточном для создания в воздухе камеры концентрации микроорганизмов
4
2,1 x 10 КОЕ/куб. м.
Аэрозоль создают с помощью распыливающей аппаратуры, которая обеспечивает образование в воздухе не менее 80% частиц с дисперсностью 10 +/- 5 мкм, и включают вентилятор. Для контроля степени контаминации воздуха открытую чашку Петри с питательной средой помещают в камеру на 10 мин.
Затем в камере распыляют раствор исследуемого средства и через определенные промежутки времени проверяют обсемененность воздуха.
Аспирационный метод. Этот метод основан на аспирировании воздуха через жидкость. При использовании аспирационного метода для оценки эффективности ДС, предназначенных для обеззараживания воздуха, необходимо следующее оборудование:
— воздуходувка с производительностью 15 — 25 л/мин.;
— стерильные склянки Дрекселя с 50 мл стерильной водопроводной воды из расчета 2 шт. на 1 пробу. Предварительно в стерильную воду вносят соответствующий нейтрализатор;
— трубка диаметром 8 — 10 мм, длиной 50 — 60 см, которая вводится в камеру для забора проб воздуха в центре камеры;
— стерильные резиновые шланги, соединяющие склянки Дрекселя (последовательно одну за другой) и далее с воздуходувкой.
Подготовка камеры к эксперименту осуществляется, как указано выше. Для исследования отбирается 50 л воздуха (объем пробы).
Очередность отбора проб следующая:
— контроль обсемененности воздуха до начала распыления суспензии тест-микроорганизмов;
— контроль обсемененности воздуха после распыления суспензии тест-микроорганизма;
— контроль эффективности обеззараживания — отбор проб через каждые 5 — 10 мин. в зависимости от предполагаемой эффективности ДС.
После отбора проб жидкость из 2 склянок Дрекселя смешивают и по 1 — 2 мл вносят в стерильную чашку Петри; затем заливают растопленным агаром. Посевы помещают в термостат. После инкубации подсчитывают количество выросших колоний и рассчитывают обсемененность 1 куб. м воздуха.
Пример:
10 x 0,015 x 1000
X = —————— = 10,
50
где:
X — КОЕ/куб. м;
10 — количество колоний, выросших на чашке Петри;
0,015 — объем стерильной питьевой воды, л;
1000 — 1 куб. м воздуха камеры, л;
50 — объем пробы воздуха, л.
Критерий эффективности обеззараживания воздуха в соответствии с категорией помещения, % (не менее): I — 99,9; II — 99,0; III — 95,0; IV — 90,0; V — 85,0.
5.1.3.9. Исследование эффективности ДС,
предназначенных для обеззараживания питьевой воды
и воды плавательных бассейнов
Методы распространяются на испытания химических ДС для обеззараживания индивидуальных и групповых запасов питьевой воды и воды плавательных бассейнов. Обеззараженная питьевая вода должна соответствовать требованиям СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников» [20], ГОСТ 27283-87 [28], а вода плавательных бассейнов — требованиям СанПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества» [22].
ДС для обеззараживания питьевой воды должны обеспечивать гибель в воде тест-микроорганизмов при их исходной концентрации:
5 6
— бактерий, не образующих споры, — 10 — 10 КОЕ/л;
5 6
— вирусов — 10 — 10 УЕ/л;
5 6
— бактерий в споровой форме не менее 10 — 10 спор/л (при
необходимости — в зависимости от назначения средства, п. 5.8).
ДС для обеззараживания воды плавательных бассейнов должны обеспечивать
гибель в воде тест-микроорганизмов при исходной концентрации:
при разработке режимов для постоянного обеззараживания воды в
присутствии посетителей:
2 3
— бактерий, не образующих споры, — 10 — 10 КОЕ/л;
2 3
— вирусов — 10 — 10 УЕ/л;
при разработке режимов для обеззараживания воды во время
продолжительного перерыва в работе бассейна более 2 ч:
5 6
— бактерий, не образующих споры, — 10 — 10 КОЕ/л;
5 6
— вирусов — 10 — 10 УЕ/л.
Тест-микроорганизмы. В качестве тест-микроорганизмов при изучении средств обеззараживания питьевой воды используют культуры E. coli (штамм 1257), S. typhimurium, РНК-содержащего колифага MS2.
В качестве тест-микроорганизмов при изучении средств обеззараживания воды плавательных бассейнов используют культуры E. coli (штамм 1257), S. aureus (штамм 906) и РНК-содержащего колифага MS2.
Питательные среды, методы культивирования и приготовления для экспериментов тест-культур бактерий, не образующих споры, приведены в п. п. 5.1, 5.3, 5.7.
Колифаг MS2 (штамм ВКПМ-3254) и штамм культуры клеток-хозяина E. coli K12
+ R
F Str получают во Всероссийской коллекции промышленных микроорганизмов ВКПМ
ГНИИ «Генетика», адрес: 113545, г. Москва, 1-й Дорожный проезд, д. 1.
Исследования проводят в соответствии с методическими указаниями
МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды», Минздрав
России, М., 2001 [81].
+ R
Питательные среды и реактивы для колифага MS2 и E. coli K12 F Str :
Сухой питательный бульон
Агар питательный сухой ТУ 42-14-33-75
Стрептомицин стерильный
Хлороформ технический ГОСТ 20015-76
+ R
Приготовление питательных сред для колифага MS2 и E. coli K12 F Str .
Питательный бульон готовят из сухого препарата промышленного производства
по способу, указанному на этикетке; питательный бульон десятикратный для
колифагов — путем увеличения в 10 раз навески сухого препарата, указанной
на этикетке; питательный агар — из сухого препарата промышленного
производства по способу, указанному на этикетке; питательный агар двойной
концентрации для определения колифагов прямым методом — путем увеличения
навески сухого препарата в 2 раза от прописи.
Питательный агар запрещается выдерживать в расплавленном состоянии более 8 ч. Оставшийся неиспользованным агар повторному расплавлению не подлежит.
Полужидкий питательный агар готовят следующим образом: сухой питательный бульон (15 г) и агар микробиологический (3 г) растворить при нагревании в 1000 мл дистиллированной воды. Довести pH до 7,0 — 7,2, разлить в пробирки и стерилизовать автоклавированием при температуре 121 °C в течение 15 мин.
Питательный агар со стрептомицином готовят из расчета содержания 100 мкг стрептомицина на 1 мл питательного агара, приготовленного по стандартной прописи. Стерильно на стерильной дистиллированной воде готовят раствор стрептомицина в концентрации 10 мг на 1 мл. В готовый питательный агар, отмеренный по объему и остуженный до температуры 45 — 49 °C, вносят приготовленный стерильный раствор стрептомицина из расчета 0,1 мл на 10 мл питательного агара. Разливают в пробирки для приготовления скошенного агара. Повторное расплавление питательной среды со стрептомицином запрещается.
+
Ведение культур колифага MS2 и культуры клеток-хозяина E. coli K12 F
R + R
Str . Процесс ведения культур колифага MS2 и E. coli K12 F Str включает:
— восстановление лиофилизированных культур колифага MS2 и E. coli K12
+ R
F Str ;
+ R
— создание запасов культур колифага MS2 и E. coli K12 F Str для
целевого использования.
+ R
Для восстановления лиофилизированной культуры E. coli K12 F Str
оттянутый конец ампулы с лиофилизированной культурой нагревают над пламенем
горелки. Влажным концом стерильного ватного тампона прикасаются к нагретой
части, в результате чего появляются трещины. Конец ампулы накрывают
трехслойной марлевой салфеткой, смоченной 70%-м этиловым спиртом и хорошо
отжатой, и обламывают пинцетом. После вскрытия ампула остается накрытой той
же салфеткой в течение 1 — 2 мин. Затем салфетку осторожно снимают и вместе
с остатками стекла погружают в дезраствор. В ампулу вносят ~ 0,5 мл
питательного бульона для регидратации. Содержимое ампулы перемешивают,
переносят стерильной пастеровской пипеткой или шприцем в пробирку с
питательным бульоном и инкубируют при температуре (37 +/- 1) °C в течение
18 — 24 ч.
После инкубации из питательного бульона делают высев петлей на
скошенный питательный агар по ТУ 42-14-33-75, содержащий стрептомицин.
Посевы инкубируют при температуре (37 +/- 1) °C в течение 18 — 24 ч.
Культуру на скошенном питательном агаре проверяют на способность
лизироваться специфическим колифагом MS2, а также на загрязненность фагом.
При удовлетворительных результатах указанных проверок культура считается
пригодной для проведения исследований с колифагом MS2.
+ R
Для создания запасов рабочей культуры E. coli K12 F Str культуру со
скошенного питательного агара со стрептомицином засевают уколом в столбик с
полужидким питательным агаром. Посевы инкубируют при температуре (37 +/- 1)
°C в течение 18 — 24 ч. При наличии роста пробирки закрывают резиновыми
(силиконовыми) пробками и закладывают на хранение при температуре 4 — 8 °C.
Восполнение запасов рабочей культуры проводят через 3 месяца [81].
На всех этапах исследования используют бактериальную взвесь культуры
+ R
E. coli K12 F Str , приготовленную следующим образом. Культуру,
выращенную в пробирке со скошенным питательным агаром со стрептомицином,
смывают с косяка 5 мл стерильного физиологического раствора и по стандарту
9
мутности готовят взвесь в концентрации 10 бактериальных клеток в 1 мл.
Допускается использование 4-часовой бульонной культуры E. coli, полученной
путем подращивания в термостате при температуре (37 +/- 1) °C. Концентрация
9
10 бактериальных клеток E. coli содержится в 2 мл.
Для восстановления лиофилизированной культуры колифага MS2 оттянутый
конец ампулы с лиофилизированной культурой нагревают над пламенем горелки.
Влажным концом стерильного ватного тампона прикасаются к нагретой части, в
результате чего появляются трещины. Конец ампулы накрывают трехслойной
марлевой салфеткой, смоченной 70%-м этиловым спиртом и хорошо отжатой, и
обламывают пинцетом. После вскрытия ампула остается накрытой той же
салфеткой в течение 1 — 2 мин. Затем салфетку осторожно снимают и вместе с
остатками стекла погружают в дезраствор. В ампулу вносят ~ 0,5 мл
питательного бульона для регидратации.
Для создания запасов культуры колифага MS2 используют рабочую культуру
+ R
клеток-хозяина E. coli K12 F Str , хранящуюся на полужидком агаре, которую
засевают в пробирку с 10 мл питательного бульона. Посевы инкубируют при
температуре (37 +/- 1) °C в течение 18 — 24 ч.
+
После инкубации 0,1 мл полученной бульонной культуры E. coli K12 F
R
Str повторно засевают в 3 — 4 пробирки с 10 мл питательного бульона и
помещают в термостат при температуре (37 +/- 1) °C. Через 2 ч инкубации в
каждую пробирку вносят регидрированную культуру фага MS2, инкубацию
продолжают до 18 — 24 ч. После инкубации в пробирку добавляют по 1 мл
хлороформа, герметично укупоривают, интенсивно встряхивают и помещают в
холодильник.
Титр полученной культуры колифага MS2 определяют следующим образом.
Готовят 7 — 8 десятикратных разведений культуры колифага MS2. По 1 мл из
каждого разведения вносят в чашки Петри и заливают смесью питательного
+ R
агара и взвеси культуры E. coli K12 F Str из расчета 1 мл взвеси на
100 мл агара. Посевы инкубируют при температуре (37 +/- 1) °C. Пробирки с
разведениями закупоривают резиновыми силиконовыми пробками и хранят до
получения результатов при температуре (4 +/- 2) °C для получения рабочих
суспензий фага.
Через 18 — 24 ч инкубации подсчитывают число бляшек на чашках. Учету
подлежат чашки, на которых отмечается рост 30 — 100 негативных колоний
7
фага. Для использования допускается культура с титром не менее 10 .
7
При получении титра менее 10 фаг можно размножить. Для этого
необходимо повторить описанную процедуру.
Методика постановки экспериментов. В качестве исходной воды используют водопроводную или природную воду (колодезную, речную), показатели качества которой соответствуют назначению испытываемого дезинфицирующего средства. Водопроводную воду перед использованием дехлорируют нагреванием при температуре 50 — 60 °C с последующим выдерживанием в течение одних суток. В образцах природной воды определяют общее микробное число и общие колиформные бактерии.
Исходную воду наливают в емкости с нижним тубусом объемом 5 — 10 л и контаминируют культурами тест-микроорганизмов.
После внесения расчетной дозы микроорганизмов воду тщательно перемешивают и отбирают пробы для определения концентрации исходного заражения воды микроорганизмами.
Концентрацию исходного заражения воды бактериями определяют следующим образом. Из емкости отбирают 1 — 3 пробы воды (в зависимости от объема емкости) по 3 — 5 мл. Из каждой пробы делают по 3 — 4 последовательных десятикратных разведения в стерильном физиологическом растворе или стерильной водопроводной воде, в которых затем определяют число бактерий в 1 мл пробы воды методом мембранной фильтрации.
Сущность метода заключается в концентрировании микроорганизмов из определенного объема анализируемой воды путем фильтрования через мембранные фильтры, выращивании посевов при температуре (37 +/- 1) °C на плотной питательной среде и в подсчете количества бактерий в единице объема воды. Используют мембранные фильтры для микробиологических целей с диаметром пор не более 0,45 мкм и размером диска 35 или 47 мм или другие фильтрующие мембраны с аналогичной способностью фильтрации, имеющие сертификат качества. Мембранные фильтры готовят к анализу в соответствии с указаниями производителя.
Фильтрование воды проводят с помощью прибора для мембранной фильтрации под вакуумом с диаметром фильтрующей поверхности 35 или 47 мм с устройством для создания разрежения 0,5 — 1,0 атм. Воронку и столик прибора перед анализом воды стерилизуют в паровом или воздушном стерилизаторе. На нижнюю часть прибора (столик) кладут фламбированным пинцетом стерильный мембранный фильтр; прижимают его верхней частью прибора (стаканом, воронкой); закрепляют устройством, предусмотренным конструкцией прибора, наливают при соблюдении правил стерильности необходимый объем воды и создают вакуум в приемном сосуде. Фильтруют сначала меньшие, затем большие объемы воды через один фильтровальный прибор, сменяя каждый раз фильтры. После окончания фильтрования стакан, воронку снимают, фильтр осторожно приподнимают за край фламбированным пинцетом при сохранении вакуума для удаления излишней влаги на нижней стороне фильтра, а затем переносят его, не переворачивая, на плотную питательную среду в чашку Петри так, чтобы между средой и фильтром не было пузырьков воздуха.
При определении числа бактерий E. coli используют питательный агар Эндо, S. aureus, S. typhimurium — казеиновый или мясо-пептонный агар. Под каждым фильтром на обратной стороне дна чашки Петри делают надпись с указанием объема профильтрованной воды, даты посева и номера пробы. Посевы с E. coli, S. aureus, S. typhimurium инкубируют при температуре (37 +/- 2) °C в течение 24 — 48 ч. По окончании инкубации учитывают количество выросших на фильтрах колоний и определяют концентрацию тест-микроорганизмов в 1 л воды по формуле:
K
C = — N x 1000,
V
где:
C — количество тест-микроорганизмов, содержащихся в 1 л воды;
K — кратность разведения;
V — посеянный объем в мл;
N — среднее арифметическое числа колоний, выросших на мембранных фильтрах при высевах одинаковых разведений.
Результат анализа при определении числа бактерий выражают числом колониеобразующих единиц КОЕ в 1 л воды.
Концентрацию исходного заражения воды колифагом MS2 определяют
следующим образом. При исходной концентрации колифага на уровне
5 6
10 — 10 БОЕ/л из емкости отбирают пробу воды объемом 5 — 10 мл. Готовят
3 — 4 последовательных десятикратных разведения в стерильном
физиологическом растворе или стерильной водопроводной воде. По 1 мл из
каждого разведения вносят в чашки Петри и заливают смесью питательного
+ R
агара и взвеси культуры E. coli K12 F Str из расчета 1 мл взвеси на
100 мл агара. Посевы инкубируют при температуре (37 +/- 1) °C. Через
18 — 24 ч инкубации подсчитывают количество бляшек на чашках. Учету
подлежат чашки, на которых отмечается рост 30 — 100 негативных колоний
фага. Подсчитывают число негативных колоний на 2 — 3 чашках с наиболее
характерным и четким ростом. По этим данным определяют среднее число
колоний, которое умножают на величину наибольшего разведения.
2 3
При исходной концентрации колифага на уровне 10 — 10 БОЕ/л из
емкости отбирают пробу воды объемом 150 — 200 мл. Готовят десятикратное
разведение в стерильном физиологическом растворе или стерильной
водопроводной воде. Колифаг определяют в 1 мл из десятикратного разведения,
а также в 1, 10 и 100 мл исходной зараженной воды.
Посев 1 мл из десятикратного разведения, а также 1 мл исходной воды
5 6
осуществляют как при исходном заражении воды на уровне 10 — 10 БОЕ/л.
Посев 10 мл исходной воды осуществляют следующим образом. 10 мл
исходной воды вносят в питательный агар двойной концентрации, расплавленный
+ R
и остуженный до 45 — 49 °C, добавляют смыв E. coli K12 F Str из расчета
2 мл смыва (или 4 мл 4-часовой бульонной культуры) на каждые 100 мл агара,
перемешивают. Чашки с посевами оставляют при комнатной температуре до
застывания. Чашки с застывшим агаром помещают дном вверх в термостат и
инкубируют при температуре (37 +/- 1) °C в течение (18 +/- 2) ч.
Посев 100 мл исходной воды осуществляют следующим образом. В
питательный агар двойной концентрации, расплавленный и остуженный до
+ R
45 — 49 °C, добавляют смыв E. coli K12 F Str из расчета 2 мл смыва (или
4 мл 4-часовой бульонной культуры) на каждые 100 мл агара, перемешивают.
Исследуемые 100 мл воды разливают по 20 мл в большие пробирки, нагревают до
35 — 44 °C и немедленно (не более чем через 5 мин. по достижении требуемой
температуры) разливают в 5 чашек Петри и сразу же вносят в каждую чашку по
+ R
20 мл смеси агара с культурой E. coli K12 F Str , осторожно перемешивают.
+ R
Для контроля культуры E. coli K12 F Str в одну чашку Петри вносят
20 мл стерильной водопроводной воды, предварительно прогретой до 35 — 44
+ R
°C, заливают 20 мл приготовленного агара с E. coli K12 F Str и осторожно
перемешивают.
Чашки с посевами оставляют при комнатной температуре до застывания. Затем чашки с застывшим агаром помещают дном вверх в термостат и инкубируют при температуре (37 +/- 1) °C в течение (18 +/- 2) ч. Учет результатов проводят путем подсчета и суммирования бляшек, выросших на 5 чашках Петри. Результаты выражают в бляшкообразующих единицах БОЕ на 100 мл пробы воды. В контрольной чашке бляшки должны отсутствовать.
По результатам определения числа частиц колифага в 1, 10 и 100 мл исходной воды рассчитывают исходное заражение воды колифагом и выражают его в БОЕ/л.
Для обеззараживания воды ДС вносят в емкость с зараженной водой в необходимых концентрациях и тщательно перемешивают. Через заданные промежутки времени при соблюдении условий стерильности отбирают пробы воды объемом 1 л в стерильные флаконы с внесенным в них нейтрализатором, подобранным в соответствии с рецептурой дезинфицирующего средства, и определяют микробиологические показатели обеззараженной воды. Пробы воды должны быть исследованы не позднее чем через 1 ч после их отбора. При условии хранения проб в холодильнике при температуре 1 — 5 °C допускается проводить анализ не позже чем через 6 ч после отбора проб.
Число бактерий культур S. aureus, E. coli, S. typhimurium в обеззараженной воде определяют методом мембранной фильтрации.
На начальных этапах обеззараживания воды анализируют не менее двух проб воды, отличающихся по объему в 10 раз и выбранных таким образом, чтобы на одном из фильтров выросло не более 300 колоний. На одну чашку можно поместить 3 — 4 фильтра с условием, чтобы фильтры не касались друг друга.
При анализе воды на конечных этапах обеззараживания исследуют объем не менее 1 л, профильтровывая это количество не менее чем через 3 — 4 фильтра.
Посевы инкубируют как указано в п. 5.2. Учитывают количество выросших колоний на фильтрах, результат анализа выражают числом бактерий в 1 л воды.
Идентификация общих и термотолерантных колиформных бактерий. К общим колиформным бактериям ОКБ относятся грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре (37 +/- 1) °C в течение 24 — 48 ч.
Термотолерантные колиформные бактерии ТКБ входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре (44,0 +/- 0,5) °C в течение 24 ч.
При отсутствии роста на фильтрах или при наличии только пленчатых, губчатых, плесневых, прозрачных и расплывчатых колоний через 18 — 24 ч дают отрицательный ответ.
При росте на фильтрах колоний, характерных для кишечных палочек (темно-красных с металлическим блеском и без него, красных, розовых слизистых, розовых с темным центром, бесцветных, с отпечатком на обратной стороне фильтра), выполняют оксидазный тест, для чего мембранный фильтр колониями вверх переносят на кружок фильтровальной бумаги, смоченный реактивом для определения оксидазной активности.
Учитывая бактерицидность реактивов для определения оксидазной активности, мембранный фильтр сразу после проявления реакции следует перенести обратно на среду Эндо.
Наличие активной оксидазы (изменение цвета колоний на сине-фиолетовый) у всех колоний, за исключением нехарактерных для ОКБ и ТКБ, позволяет дать отрицательный ответ и закончить анализ через 18 — 24 ч.
Если выросли колонии, не обладающие оксидазной активностью, то из нескольких колоний каждого типа готовят мазки, окрашивают по Грамму и микроскопируют.
Отсутствие в мазках грамотрицательных, не образующих спор палочек, позволяет дать отрицательный ответ и закончить анализ через 18 — 24 ч.
Красные и темно-красные колонии с металлическим блеском и без него лактозоположительные, образованные грамотрицательными палочками, не обладающими оксидазной активностью, подсчитывают и относят к общим и термотолерантным колиформным бактериям.
Результат анализа выражают числом бактерий в 1 л воды.
Определение числа частиц колифага MS2 в обработанной воде в пробах
объемом 1 л проводят методом обогащения (Корнилова Н.М., 1988 г.). Для
этого пробу обеззараженной воды объемом 1 л разливают в стерильные флаконы
по 500, 200, 100, 50 и 20 мл, добавляют 10% десятикратного питательного
+ R
бульона для колифагов и суспензию суточной культуры E. coli K12 F Str .
После инкубирования при температуре (37 +/- 1) °C в течение 18 — 24 ч
жидкость разливают в пробирки, встряхивают с хлороформом для устранения
бактериальной флоры и определяют число частиц колифага MS2. Для этого по
1 мл из каждой пробирки вносят в чашки Петри и заливают смесью питательного
+ R
агара и взвеси культуры E. coli K12 F Str из расчета 1 мл взвеси на
100 мл агара. Посевы инкубируют при температуре (37 +/- 1) °C. Через 18 —
24 ч инкубации подсчитывают число бляшек на чашках. В зависимости от того,
в каком из объемов выявлен рост колифага, вычисляют наиболее вероятное
число фаговых частиц в 1 л воды, пользуясь табл. 5.3.
Таблица 5.3
РАСЧЕТ ЧИСЛА ФАГОВЫХ ЧАСТИЦ ПРИ ОПРЕДЕЛЕНИИ ТИТРА ФАГА
В 1 Л ВОДЫ МЕТОДОМ ОБОГАЩЕНИЯ
|
Присутствие фага после инкубации в пробах воды объемом, мл |
Число БОЕ в 1 л воды |
||||
|
500 |
200 |
100 |
50 |
20 |
|
|
— |
— |
— |
— |
— |
0 |
|
+ |
— |
— |
— |
— |
2 |
|
+ |
+ |
— |
— |
— |
5 |
|
+ |
+ |
+ |
— |
— |
10 |
|
+ |
+ |
+ |
+ |
— |
20 |
|
+ |
+ |
+ |
+ |
+ |
>= 50 |
Обработка и оценка результатов микробиологических исследований. Статистическая обработка результатов микробиологических анализов по оценке эффективности способов и средств обеззараживания воды имеет целью исключить случайные ошибки, оценить отклонение результатов анализов от действительной величины и дать искомые результаты с заданной вероятностью.
Случайные ошибки бактериологических анализов, как правило, распределены по нормальному закону, поэтому в процессе статистической обработки результатов экспериментальных исследований рекомендуется использовать при определении концентрации заражения исходной воды и на промежуточных этапах обработки — среднюю арифметическую x, а при оценке эффективности обеззараживания воды на завершающем этапе — медианное значение Me.
Количество проб n, необходимых для действительной оценки результатов микробиологических исследований, определяют по формуле:
сигма x t
p 2
n = (———-) ,
I
p
где:
сигма — квадратичное отклонение;
I — максимальное допустимое отклонение от средней, оцениваемое с
p
вероятностью p = 0,99;
t — коэффициент, зависящий от числа опытов (не менее 10), по которым
p
определялась величина сигма.
Если сигма определяется по данным 16 опытов, то t = 2,7.
0,99
Число проб для оценки содержания микроорганизмов в обеззараженной воде
должно быть не менее 16.
Оценку результатов бактериологических анализов проводят для заданной
вероятности 0,99, соответственно для того же значения определяют
доверительный интервал средней арифметической и медианы.
Доверительный интервал средней арифметической определяют по данным
величины квадратичного отклонения сигма и средней ошибки сигма .
x
Величину квадратичного отклонения вычисляют по формуле:
_________
/ 2
/SUM x — x
сигма = /————,
n — 1
где:
2
SUM x — x — сумма квадратов отклонений результатов отдельных измерений
от средней арифметической;
n — число отдельных измерений.
Среднюю ошибку вычисляют по формуле:
сигма
сигма = ——.
x _
/n
Вероятности 0,99 отвечает доверительный интервал I, вычисляемый по
формуле:
I = +/- 2,7 x сигма .
0,99 x
Доверительный интервал медианы (медианного значения) для требуемого уровня вероятности 0,99 определяют в зависимости от числа проведенных опытов по табл. 5.4, в которой указаны номера опытов, результаты которых учитывают в качестве граничных значений доверительного результата медианы.
Таблица 5.4
ГРАНИЧНЫЕ ЗНАЧЕНИЯ ДОВЕРИТЕЛЬНОГО ИНТЕРВАЛА МЕДИАНЫ
|
Число опытов |
Нижняя граница |
Верхняя граница |
|
1 |
2 |
3 |
|
7 |
— |
— |
|
8 |
1 |
8 |
|
9 |
1 |
9 |
|
10 |
1 |
10 |
|
11 |
1 |
11 |
|
12 |
2 |
11 |
|
13 |
2 |
12 |
|
14 |
2 |
13 |
|
15 |
3 |
13 |
|
16 |
3 |
14 |
|
17 |
3 |
15 |
|
18 |
4 |
15 |
|
19 |
4 |
16 |
|
20 |
4 |
17 |
|
21 |
5 |
17 |
|
22 |
5 |
18 |
|
23 |
5 |
19 |
|
24 |
6 |
19 |
|
25 |
6 |
20 |
|
26 |
7 |
20 |
|
27 |
7 |
21 |
|
28 |
7 |
22 |
|
29 |
8 |
22 |
|
30 |
8 |
23 |
|
31 |
8 |
24 |
|
32 |
9 |
24 |
|
33 |
9 |
25 |
|
34 |
10 |
25 |
|
35 |
10 |
26 |
|
36 |
10 |
27 |
|
37 |
11 |
27 |
|
38 |
11 |
28 |
|
39 |
12 |
28 |
|
40 |
12 |
29 |
|
41 |
12 |
30 |
|
42 |
13 |
30 |
|
43 |
13 |
31 |
|
44 |
14 |
31 |
|
45 |
14 |
32 |
|
46 |
14 |
33 |
|
47 |
15 |
33 |
|
48 |
15 |
34 |
|
49 |
16 |
34 |
|
50 |
16 |
35 |
Для пользования табл. 5.4 необходимо, чтобы результаты опытов были расположены и пронумерованы в порядке возрастания их величин.
Показателем эффективности ДС, предназначенных для обеззараживания воды, является 100%-ное снижение обсемененности воды, контаминированной тест-микроорганизмами, т.е. отсутствие тест-микроорганизмов в 1 л обеззараженной воды.
Библиографические данные
1. МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды». М.: Минздрав России, 2001.
2. Корнилова Н.М. Разработка таблицы НВЧ для определения индекса колифага в чистых водах методом обогащения//В кн.: Гигиенические аспекты изучения биологического загрязнения объектов окружающей среды. Материалы X Всесоюзной конференции. М., 1988. С. 88 — 90.
5.2. Методы изучения и оценки туберкулоцидной активности
дезинфицирующих средств
5.2.1. Общие положения
Эпидемиологическая ситуация по туберкулезу в мире в настоящее время остается напряженной, кроме того, она усугубляется появлением и распространением суперустойчивых к химическим противотуберкулезным веществам форм возбудителя. Такие микобактерии зачастую характеризуются более высокой сохраняемостью во внешней среде, что приводит к возникновению внутрибольничных вспышек нозокомиального туберкулеза. Кроме того, все чаще стали регистрироваться случаи заболеваний, вызванных нетуберкулезными видами микобактерий НТМБ, которые обладают естественной резистентностью к воздействию негативных факторов окружающей среды. НТМБ являются возбудителями микобактериозов человека и наиболее опасны для больных с иммунодефицитными состояниями, т.к. существенно сокращают сроки их жизни.
В такой неблагоприятной эпидемической ситуации по туберкулезу и микобактериозам возрастает роль неспецифических противоэпидемических мероприятий, среди которых ведущую роль занимает химическая дезинфекция, направленная на уничтожение возбудителей на объектах внешней среды, имеющих значение в передаче инфекции.
Как известно, успех проведения химической дезинфекции напрямую зависит от соблюдения рекомендаций, инструкций по применению дезинфицирующих средств, правильного выбора эффективного режима (концентрация, экспозиция, способ обработки). Помимо этого, дезинфекционные мероприятия будут эффективны лишь в том случае, когда режимы дезинфекции отработаны на адекватном по устойчивости реальным возбудителям тест-микроорганизме.
В нашей стране для разработки туберкулоцидных режимов применения ДС
используют сапрофитный штамм Mycobacterium B [23, 66], который изначально
5
был предложен как тест-микроорганизм для оценки качества проведения
камерной дезинфекции в очагах туберкулеза, поскольку обладал естественной
резистентностью к температурному фактору. Более того, результаты
исследований по сравнительной оценке устойчивости микобактерий к химическим
веществам, проведенные в 50 — 60-е гг. прошлого столетия, свидетельствуют о
меньшей устойчивости Mycobacterium B по сравнению с вирулентными штаммами
5
микобактерий. Обоснованных экспериментальных данных по выбору Mycobacterium
B для оценки туберкулоцидной активности химических средств дезинфекции в
5
открытой литературе не найдено.
За рубежом для разработки туберкулоцидных режимов применения ДС
используют такие штаммы, как M. Terrae и M. avium [3]. Насколько
чувствительность к ДС всех перечисленных тест-микобактерий адекватна
реальным возбудителям туберкулеза и микобактериозов сказать трудно,
поскольку такие сведения в литературе отсутствуют.
В связи с вышесказанным представлялось актуальной задачей для
дезинфектологии и фтизиатрической практики проведение экспериментов по
сравнительной оценке чувствительности тест-микобактерий к воздействию ДС
разных химических групп.
Исследования, проведенные в НИИД и на базе лаборатории микробиологии и
ПЦР диагностики Уральского НИИ фтизиопульмонологии, г. Екатеринбург,
показали, что Mycobacterium B является самым чувствительным видом
5
микобактерий к воздействию большинства ДС. Наиболее устойчивыми оказались
M. Terrae, M. Avium-intracellulara и M. tuberculosis с множественной
лекарственной устойчивостью.
Тест-микроорганизм M. Terrae является наиболее подходящей моделью для
изучения и оценки туберкулоцидной активности ДС, поскольку в наибольшей
степени соответствует устойчивости патогенных микобактерий.
На основании этих данных, а также учитывая, что сапрофитные
микроорганизмы более удобны и безопасны в работе, чем патогенные виды
микобактерий, наиболее адекватной моделью для тестирования химических ДС
является M. Terrae. При оценке туберкулоцидной эффективности физических
температурных методов дезинфекции в качестве тест-микроорганизмов
рекомендуется использовать Mycobacterium B .
5
Данные методические указания регламентируют методы и технологию изучения, а также оценки туберкулоцидной активности субстанций для производства ДС, туберкулоцидной активности и эффективности химических, физических и комбинированных ДС при обеззараживании различных объектов, контаминированных наиболее устойчивым видом микобактерий с учетом максимально возможного уровня контаминации объектов возбудителем туберкулеза в практических условиях.
Исследования туберкулоцидной активности субстанций, ДС и эффективности режимов применения ДС включают:
— выбор и подготовку культур тест-микроорганизмов для изучения туберкулоцидной активности ДС и субстанций;
— обеспечение стандартности условий проведения исследований туберкулоцидной активности ДС и субстанций;
— методы исследований и оценки результатов туберкулоцидной активности ДС и субстанций in vitro (суспензионный метод, метод батистовых (бязевых) тест-объектов);
— методы исследований туберкулоцидной эффективности ДС с использованием искусственно контаминированных тест-микобактериями различных тест-объектов с целью разработки режимов обеззараживания тех или иных объектов в отношении возбудителя туберкулеза (поверхностей в помещениях, транспорта, санитарно-технического оборудования, мебели, посуды, белья, одежды, предметов ухода за больными, медицинских приборов, инструментов и других изделий медицинского назначения и т.д.);
— методы исследований туберкулоцидной эффективности ДС в практических условиях.
5.2.1.1. Тест-микроорганизмы для изучения туберкулоцидной
активности дезинфицирующих средств и их субстанций.
Требования к тест-микроорганизмам
К применению в отечественной медицинской практике для дезинфекции при туберкулезе предлагаются различные ДС как отечественного, так и зарубежного производства, имеющие туберкулоцидные режимы, разработанные с использованием наиболее устойчивых тест-микроорганизмов, что должно гарантировать их эффективность в отношении возбудителя.
Исследование и оценку туберкулоцидной и микобактерицидной (в отношении непатогенных микобактерий) активности ДС, предлагаемых для применения на территории России, проводят, используя в качестве тест-микроорганизмов:
— агаровую культуру Mycobacterium B для оценки эффективности и
5
разработки туберкулоцидных режимов камерного обеззараживания различных
объектов;
— агаровую культуру Mycobacterium terrae (DSM 43227) для оценки активности ДС и разработки режимов их применения при обеззараживании объектов в отношении возбудителя туберкулеза и микобактериозов;
— агаровую культуру Mycobacterium tuberculosis для подтверждения эффективности разработанных режимов применения ДС в отношении возбудителей туберкулеза и микобактериозов в практических условиях.
Требования к тест-микроорганизмам.
Тест-микобактерии должны иметь типичные морфологические, культуральные,
биохимические, тинкториальные и ферментативные свойства, присущие данному
штамму (Прилож. 1), и обладать стандартной устойчивостью к эталонным ДС и
температуре. Культура Mycobacterium B должна быть устойчива к температуре
5
60 °C в течение 60 мин. Показатели устойчивости, которым должна
соответствовать культура Mycobacterium terrae, приведены в табл. 5.5.
Таблица 5.5
УСТОЙЧИВОСТЬ MYCOBACTERIUM TERRAE К ЭТАЛОННЫМ ДС
|
ДС |
Концентрация раствора, % |
Время гибели Mycobacterium terrae, мин. |
|
Хлорамин Б (28,0% по активному хлору) |
5,0 <*> |
120 |
|
Глутаровый альдегид |
0,5 |
60 |
|
Перекись водорода |
4,0 |
60 |
|
<*> Указана концентрация по препарату. |
Тест-микобактерии M. terrae могут быть приобретены в виде сухой
культуры в ампулах (после лиофильной сушки) в Немецком музее
микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen
und Zellkulturen GmbH) под N DSM 43227. Тест-микобактерии штамма B могут
5
быть приобретены в коллекции музея микроорганизмов ФГУН
Научно-исследовательского института дезинфектологии ФГУН НИИД
Роспотребнадзора.
Получение и хранение исходной рабочей культуры тест-микобактерий. Для выращивания культур тест-микобактерий используют плотные питательные среды. Перечень и методика приготовления питательных сред для культивирования тест-микобактерий, предназначенных для изучения и оценки туберкулоцидной активности ДС и их субстанций, приведены в Прилож. 2. В отличие от питательных сред, рекомендуемых в стандарте NEN-EN 14476 [48], использование приведенных в Приложении питательных сред позволяет получать результат оценки туберкулоцидной активности ДС не на 21 сутки, а на 10 — 14 сутки.
Для получения культуры штамма тест-микобактерий ампулу с лиофилизированной музейной культурой этого штамма вскрывают в асептических условиях следующим образом: ватным тампоном, смоченным 70%-м этиловым спиртом, обрабатывают поверхность ампулы, затем нагревают ее запаянный конец в пламени горелки до образования на ампуле трещины. К накаленному концу ампулы прикладывают ватную пробку, смоченную стерильной водой. После этого ударом металлического инструмента (скальпель, пинцет) по трещине откалывают конец ампулы. Стерильной пастеровской пипеткой в ампулу вливают 1,0 мл стерильной дистиллированной воды и оставляют в течение 30 мин. при комнатной температуре для растворения лиофилизата и получения суспензии. Суспензию, приготовленную из музейной тест-культуры, рассевают по 0,1 мл в пробирки со скошенной питательной средой Левенштейна-Йенсена или «Новая» (всего 10 пробирок). Посевы инкубируют в термостате при 37 °C в течение 14 — 21 суток.
С выросшими культурами M. terrae на питательных средах далее работают следующим образом:
— полученную биомассу снимают платиновой лопаточкой или стеклянной палочкой с поверхности питательной среды Левенштейна-Йенсена или «Новая» со всех пробирок;
— помещают в пробирку с 10 мл бульона Миддлбрука 7Н9 с 10% ADC ростовой добавкой и гомогенизируют;
— доводят объем полученной суспензии до 100 мл бульоном Миддлбрука 7Н9 и по 0,5 мл суспензии вносят в микропробирки;
— подписывают на каждой пробирке наименование штамма и дату;
— замораживают при -70 °C и оставляют в таком состоянии для длительного хранения.
Это самый эффективный способ длительного (десятилетиями) хранения культур с обеспечением сохранения биологических свойств тест-микобактерий. При отсутствии такой возможности, суспензию в микропробирках замораживают в бытовом холодильнике при -20 °C. Срок хранения культуры в таких условиях — не более 5 лет.
Данная методика получения и хранения исходной рабочей культуры тест-микобактерий позволяет длительный период времени проводить испытания ДС с максимальным обеспечением стандартности свойств тест-микобактерий, в т.ч. по устойчивости к различным факторам, поскольку исключает необходимость многократного пересева, приводящего, как известно, к изменению биологических свойств микроорганизмов.
Полученная и хранящаяся таким образом культура тест-микобактерий используется для получения агаровой культуры тест-микобактерий (первый пассаж) и приготовления из нее рабочей суспензии тест-микобактерий, используемой для проведения испытаний ДС.
5.2.1.2. Методика приготовления суспензии
тест-микроорганизмов
Определение биологической концентрации тест-микроорганизмов в суспензии. Для получения первого пассажа культуры тест-штамма микобактерий, используемой при оценке ДС, необходимое для исследования количество хранящихся при температуре -70 °C или -20 °C микропробирок (2 штуки на 1 исследование) с данным штаммом микобактерий размораживают при комнатной температуре, переносят по 0,1 мл содержимого в пробирки со скошенной питательной средой Левенштейна-Йенсена или «Новая» и инкубируют в термостате при 37 °C в течение 14 — 21 суток. Выросшую на плотной питательной среде в пробирках культуру используют для приготовления рабочей суспензии тест-микобактерий данного штамма.
Одна или несколько пробирок может быть использована для получения второго пассажа культуры тест-микобактерий этого штамма. Для этого культуру первого пассажа в пробирке снимают платиновой лопаточкой или стеклянной палочкой с плотной питательной среды, помещают в толстостенную стеклянную пробирку и тщательно растирают, постепенно добавляя по каплям стерильную дистиллированную воду. Полученную суспензию рассевают на плотную питательную среду тем же способом, который использовался для получения первого пассажа.
Культуры тест-микроорганизмов подвергают контролю их качества. В частности, непосредственно перед использованием культур для исследовательских целей необходимо убедиться в том, что тест-штаммы, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста культур микобактерий тест-штаммов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды. Проводят микроскопию мазка выросших культур методом окраски по Циль-Нильсену (M. terrae представляют собой короткие прямые палочки малиново-красного цвета, располагающиеся в мазке параллельно друг другу, наподобие частокола. Размер клеток микобактерий 0,2 — 0,6 x 1 — 10 мкм).
Рабочую суспензию культуры тест-микобактерий готовят из тест-штамма первого и/или второго пассажей, выросших на плотной питательной среде. Дальнейшее субкультивирование недопустимо!
Для приготовления рабочей суспензии культуру микобактерий снимают
платиновой лопаточкой или стеклянной палочкой с плотной питательной среды и
помещают в толстостенную стеклянную пробирку. Микробную биомассу тщательно
гомогенизируют, постепенно добавляя по каплям стерильную дистиллированную
воду. Густую исходную бактериальную суспензию оставляют на 15 мин. для
осаждения негомогенизированных конгломератов и частиц. Полученную
надосадочную жидкость отбирают пастеровской пипеткой, переносят в
стерильную пробирку, диаметр которой соответствует диаметру пробирки с
оптическим стандартом мутности (ФГУН Государственного
научно-исследовательского института стандартизации и контроля медицинских
биологических препаратов им. Л.А. Тарасевича Роспотребнадзора), и
стандартизуют по оптическому стандарту мутности N 10 (он соответствует 1 x
9
10 микробных тел в 1 мл), добавляя стерильную дистиллированную воду.
Суспензия, содержащая такое количество живых микробов, при контаминации
ею бязевых батистовых тест-объектов, тест-поверхностей и т.п. обеспечивает
5 6 -2
требуемые (порядка 1 x 10 — 1 x 10 КОЕ/см ) уровни их обсеменения живыми
клетками тест-микроба.
Однако в связи с тем, что микобактерии могут отмирать в результате
хранения или по иным причинам, а мертвые микроорганизмы, присутствующие в
суспензии, будут, как и живые, давать помутнение суспензии, необходимо
осуществлять бактериологический контроль фактического количества живых
клеток в приготовленной суспензии, чтобы при необходимости внести
коррективы и обеспечить требуемые уровни контаминации тест-объектов
жизнеспособными микобактериями.
Определение биологической концентрации тест-микроба в рабочей
суспензии. Из суспензии, приготовленной по оптическому стандарту мутности
9
N 10 (10 КОЕ/мл), делают, как показано на схеме 5.2 (не приводится),
3
разведения с 10-кратным шагом до 10 микробных клеток в 1 мл (посев
0,1 мл суспензии из этого разведения на плотную питательную среду
позволяет произвести достаточно точный подсчет выросших на среде колоний
микобактерий, количество которых будет находиться в пределах 100 ед.).
8 3
Первое разведение соответствует 10 КОЕ/мл, а шестое — 10 КОЕ/мл. Из
этого разведения производят посев по 0,1 мл на 5 пробирок со средой
Левенштейна-Йенсена или «Новая», инкубируют в термостате при 37 °C в
течение 14 — 21 суток. Подсчитывают количество выросших колоний на среде в
пробирке, рассчитывают среднее значение из 5 и делают пересчет количества
жизнеспособных клеток в исходной суспензии, учитывая коэффициент
разведения. Количество жизнеспособных клеток в рабочей суспензии должно
9
быть 10 КОЕ/мл.
Посев суспензии в пробирки со скошенной плотной питательной средой
позволяет существенно экономить расход среды и избежать пересыхания и
растрескивания среды, наблюдаемого при использовании чашек Петри с плотной
питательной средой.
Расчет количества жизнеспособных бактериальных клеток в приготовленной
исходной суспензии осуществляют по следующей формуле:
7
X = A x 10 ,
где:
X — количество жизнеспособных бактериальных клеток в 1 мл
приготовленной суспензии;
A — среднее количество колониеобразующих единиц КОЕ, выросших на 5
чашках Петри;
7
10 — коэффициент пересчета, учитывающий степень разведения суспензии
6
(10 ), и объем, использованный для посева 0,1 мл.
Например: получен рост микобактерий в 1-й пробе — 70 КОЕ, во 2-й — 130
КОЕ, в 3-й — 99 КОЕ, в 4-й — 115 КОЕ, в 5-й — 97 КОЕ, тогда среднее
количество колониеобразующих единиц КОЕ, выросших на 5 пробирках, будет
равно:
A = 70 + 130 + 99 + 115 + 97 : 5 = 102,
7 9
X = 102 x 10 = 10
микробных тел в 1 мл, что соответствует оптическому стандарту мутности
9
N 10 (1 млрд. микробных тел (10 ) в 1 мл).
5.2.1.3. Определение устойчивости тест-микроорганизмов
к эталонным ДС
Определение устойчивости тест-микобактерий к воздействию температуры.
В стерильный стеклянный стакан объемом 100 мл наливают 50 мл стерильной дистиллированной воды и помещают в водяную баню. Рядом с ним в водяной бане размещают стеклянный стакан объемом 100 мл с 50 мл дистиллированной воды и с погруженным в нее термометром, позволяющим измерять температуру до 100 °C. Включают водяную баню, доводят температуру воды в стакане до 60 °C и поддерживают эту температуру на протяжении всего эксперимента.
В стерильные пробирки разливают по 5 мл стерильной дистиллированной воды комнатной температуры (количество пробирок соответствует количеству отбираемых в опыте проб). Исходя из количества проб, готовят пробирки со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая». Готовят и контаминируют тест-микроорганизмами батистовые тест-объекты (п. 5.1.2.2). Если в опытах используют ранее приготовленные и хранящиеся в холодильнике контаминированные микобактериями тест-объекты, то их заранее извлекают из холодильника, чтобы они приобрели комнатную температуру 18 — 20 °C.
Отсчитывают в чашке Петри необходимое для опыта количество батистовых тест-объектов (по 2 на каждую экспозицию), контаминированных тест-микобактериями, захватывают тест-объекты стерильным пинцетом все сразу и опускают их в стакан со стерильной дистиллированной водой, нагретой в водяной бане до 60 °C. Легким покачиванием емкости добиваются полного смачивания тест-объектов. В момент смачивания всех тест-объектов отмечают время.
Через каждые 15 мин. стерильным пинцетом извлекают по 2 тест-объекта и опускают их в пробирку с 5 мл стерильной дистиллированной воды при температуре (20 +/- 2) °C для нейтрализации действия температурного фактора. Через 5 мин. каждый тест-объект помещают на поверхность скошенной в пробирке плотной питательной среды.
Для контроля два контаминированных тест-микобактерией тест-объекта погружают в стерильную дистиллированную воду при температуре (20 +/- 2) °C на максимальный срок экспозиции, затем (как и опытные тест-объекты) их помещают на поверхность скошенной в пробирке плотной питательной среды.
Посевы опытные и контрольные ставят в термостат при температуре 37 °C; наличие роста тест-культур проверяют через 10 — 14 суток.
Опыт повторяют не менее 3 раз. Тест-микобактерии должны быть устойчивы к нагреванию при 60 °C не менее 1 ч.
Определение устойчивости тест-микобактерий к эталонным ДС.
Для определения устойчивости микобактерий в качестве эталонных ДС используют монохлорамин Б, глутаровый альдегид и перекись водорода медицинскую.
Методом йодометрического титрования определяют процент активного хлора в монохлорамине Б. В опытах используют препарат, содержащий 26,0 — 28,0% активного хлора, растворяя который в дистиллированной воде в соотношении 1:20 готовят рабочий раствор (5,0% по препарату).
Глутаровый альдегид (зарегистрированный в России как субстанция) разводят дистиллированной водой до концентрации рабочего раствора 0,5% по глутаровому альдегиду.
Массовую долю перекиси водорода медицинской определяют методом перманганатометрического титрования в соответствии с ГОСТ 177-88. Готовят 4,0%-ный раствор по перекиси водорода.
Предварительно готовят и разливают в пробирки по 5 мл стерильный раствор нейтрализатора (п. 5.2.1.4); стерильную питьевую воду; пробирки со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая». Готовят и контаминируют тест-микобактериями батистовые тест-объекты (п. 5.2.2.2). Если в опытах используют ранее приготовленные и хранящиеся в холодильнике контаминированные тест-микробом тест-объекты, то их заранее извлекают из холодильника, чтобы они приобрели комнатную температуру (18 — 20 °C).
Перед постановкой опыта контролируют содержание ДВ в рабочем растворе ДС.
При проведении экспериментов в стеклянную емкость объемом 50 — 100 мл пипеткой наливают требуемый объем раствора эталонного ДС из расчета 0,5 мл на каждый тест-объект и помещают в водяную баню с температурой 20 °C на весь период опыта. Отсчитывают в чашке Петри необходимое для опыта количество бязевых батистовых тест-объектов (по 2 на каждую экспозицию), контаминированных тест-микобактериями, захватывают стерильным пинцетом тест-объекты все сразу и опускают их в емкость с раствором ДС; легким покачиванием емкости добиваются полного смачивания тест-объектов. В момент смачивания всех тест-объектов отмечают время.
Через каждые 30 мин. стерильным пинцетом извлекают по 2 тест-объекта из раствора ДС и опускают их в пробирку с 5 мл 1,0%-ного стерильного раствора тиосульфата натрия для нейтрализации остаточного действия ДС. Пробирку с нейтрализатором и тестами не подвергают встряхиванию. Через 5 — 10 мин. тест-объекты переносят в пробирку с 5 мл стерильной питьевой воды. Еще через 10 — 15 мин. каждый тест-объект помещают на поверхность скошенной в пробирке плотной питательной среды.
Для контроля два контаминированных тест-микобактериями тест-объекта погружают в стерильную дистиллированную воду (вместо раствора ДС) на максимальный срок экспозиции, затем (как и опытные тест-объекты) их переносят в раствор нейтрализатора (тиосульфат натрия) и помещают на поверхность скошенной в пробирке плотной питательной среды.
Посевы опытные и контрольные ставят в термостат при температуре 37 °C; наличие роста тест-культур проверяют через 14 — 21 сутки.
Опыт повторяют не менее 3 раз. Тест-микобактерии должны быть устойчивы к 5,0%-ному раствору монохлорамина не менее 2 ч; к 0,5%-ному раствору глутарового альдегида — не менее 60 мин.; к 4,0%-ному раствору перекиси водорода — не менее 60 мин.
В процессе испытаний контролируют температуру раствора ДС в опыте, исходный и остаточный уровень контаминации тест-микобактериями тест-объекта (КОЕ на кв. см), время выдержки тест-объектов в испытуемом дезинфицирующем растворе.
5.2.1.4. Обеспечение стандартности условий проведения
исследований активности ДС и их субстанций
Для обеспечения стандартности условий постановки экспериментов необходимо провести химико-аналитический контроль исследуемых ДС и их субстанций. До проведения исследования туберкулоцидной активности ДС и их субстанций необходимо ознакомиться с рецептурой средства и техническими условиями на отечественные или спецификацией на зарубежные средства, провести химико-аналитические исследования по определению концентрации действующих веществ в средствах и определить соответствие рецептуры и других показателей, регламентированных вышеуказанными документами. При этом используют химико-аналитические методы контроля и применяют условия хранения средства и меры безопасности при работе с ним, предложенные производителем средства.
Так как для дезинфекции при туберкулезе применяют средства, обладающие действием, убивающим микобактерии, а не задерживающие их рост, при определении туберкулоцидной активности и эффективности ДС необходимо разграничить туберкулоцидное действие препарата от туберкулостатического. Для этого применяют нейтрализаторы, исключающие остаточное бактерицидное действие.
Для нейтрализации антимикробного действия дезинфицирующих средств из различных химических групп применяют следующие нейтрализаторы:
— для галоидактивных (хлор-, бром- и йодактивные) и кислородактивных (перекись водорода, ее комплексы с солями, надуксусная кислота, озон) — 0,1 — 1,0%-ные растворы тиосульфата натрия;
— для четвертичных аммониевых солей (алкилдиметилбензиламмоний хлорид, дидецилдиметиламмоний хлорид и др.), производных гуанидина (полигексаметиленгуанидин гидрохлорид, хлоргексидин биглюконат и др.) — 0,1 — 1,0%-ные растворы лаурилсульфата натрия, сульфонол, растворы лаурилсульфата натрия с 10% обезжиренного молока или универсальный нейтрализатор, см. ниже;
— для альдегидов (глутаровый альдегид, глиоксаль, формальдегид, ортофталевый альдегид) — 1,0%-ный раствор гидросульфита метабисульфита натрия или универсальный нейтрализатор (см. ниже);
— для кислот — щелочи в эквивалентном количестве;
— для щелочей — кислоты в эквивалентном количестве;
— для спиртов — разведение в воде до недействующей концентрации;
— для композиционных средств — универсальный нейтрализатор, содержащий Твин-80 (0,3%), сапонин (0,3 — 3%), гистидин 0,1%, цистеин 0,1%. Если в состав композиции входят окислители, в нейтрализатор дополнительно вводят тиосульфат натрия. Универсальным нейтрализатором является также нейтрализующий бульон по Ди-Ингли (фирма-производитель «HIMEDIA»). В его состав входят такие ингредиенты, как гидролизат казеина, дрожжевой экстракт, глюкоза, натрия тиосульфат, натрия тиогликолят, натрия бисульфит, лецитин, Твин-80 и др.
Растворы нейтрализаторов готовят в асептических условиях, применяя для этого только стерильную дистиллированную воду.
При невозможности соблюдения асептических условий приготовления нейтрализаторов допускается стерилизация готовых растворов автоклавированием при 1,1 атм. (121 °C) в течение 15 мин.
Температура растворов нейтрализаторов должна быть 20 °C, независимо от температуры окружающей среды.
Готовые растворы должны использоваться в день приготовления. Допускается хранение готовых растворов при температуре 4 °C в течение 48 ч.
Контроль полноты нейтрализации остаточного действия испытываемого ДС. Несмотря на существующие рекомендации по применению нейтрализаторов для различных действующих веществ ДВ, многие современные ДС содержат несколько ДВ и другие вспомогательные вещества, обладающие бактериостатическим действием, и существующие рекомендуемые нейтрализаторы могут не обеспечивать эффективной нейтрализации остаточного действия ДС в пробе. В этой связи результаты оценки эффективности ДС могут быть необъективными.
Поэтому каждый случай проведения испытания ДС должен предварительно сопровождаться экспериментальным контролем эффективности нейтрализации остаточного действия ДС на микробную клетку.
Для контроля эффективности нейтрализатора и полноты нейтрализации ДС используют суспензионный метод, предусматривающий проведение исследования, основные операции которого и их назначение приведены на схеме 5.3 (не приводится) и в табл. 5.6.
Таблица 5.6
НАЗНАЧЕНИЕ ОПЕРАЦИЙ ЭКСПЕРИМЕНТА ПО ОЦЕНКЕ ЭФФЕКТИВНОСТИ
НЕЙТРАЛИЗАЦИИ ОСТАТОЧНОГО ДЕЙСТВИЯ ДС
┌─────┬─────────────────┬─────────────────────────────────┬───────────────┐
│ N │ Назначение │ Процедура выполнения операции │ Ожидаемый │
│пробы│ операции │ исследования │ результат │
│ │ исследования │ │ │
├─────┼─────────────────┼─────────────────────────────────┼───────────────┤
│1 │Контроль │К 9 мл суспензии тест-штамма │Рост │
│ │губительного │ 3 │микроорганизмов│
│ │действия ДС │(10 КОЕ/мл) на дист. воде + 1 мл│должен │
│ │ │раствора ДС │отсутствовать │
├─────┼─────────────────┼─────────────────────────────────┼───────────────┤
│2 │Контроль полноты │К 9 мл суспензии тест-штамма │Примерно │
│ │нейтрализации ДС │ 3 │одинаковое │
│ │ │(10 КОЕ/мл) на нейтрализаторе + │количество │
│ │ │1 мл раствора дезсредства │колоний в │
├─────┼─────────────────┼─────────────────────────────────┤посевах проб │
│3 │Контроль отсут- │К 9 мл суспензии тест-штамма │по 0,1 мл на │
│ │ствия антимик- │ 3 │плотной │
│ │робного эффекта у│(10 КОЕ/мл) на нейтрализаторе + │питательной │
│ │нейтрализатора │1 мл раствора нейтрализатора │среде │
├─────┼─────────────────┼─────────────────────────────────┤ │
│4 │Референс-контроль│К 9 мл суспензии тест-штамма │ │
│ │количества │ 3 │ │
│ │микобактерий │(10 КОЕ/мл) на дист. воде + 1 мл│ │
│ │ │дист. воды │ │
├─────┴─────────────────┴─────────────────────────────────┴───────────────┤
│ Примечание. Спустя 5 мин. после постановки опыта из каждой из четырех│
│проб производят посев смеси по 0,1 мл как минимум на 3 пробирки со│
│скошенной питательной средой, которые инкубируют в термостате при 37 °C,│
│по истечении 14 — 21 суток учитывают результаты исследований. │
└─────────────────────────────────────────────────────────────────────────┘
5.2.2. Методы исследований и оценки результатов
активности ДС и их субстанций in vitro
5.2.2.1. Суспензионный метод
Суспензионный метод оценки туберкулоцидной активности ДС и их субстанций используют для получения первичной информации о концентрационных и временных параметрах эффективного (отсутствие жизнеспособных микобактерий) туберкулоцидного действия ДС. Методология выполнения эксперимента по оценке туберкулоцидной активности ДС суспензионным методом приведена на схеме 5.4.
┌───────────────────┐ ┌─────────────────┐ ┌────────────┐ ┌─────────────┐
│Приготовление сус- │ │Приготовление │ │Отбор из │ │Встряхивание │
│пензии тест-мико- │ │рабочего раствора│ │смеси 3 проб│ │проб на шей- │
│бактерий и контроль│ │ДС. Смешивание │ │(по 1 мл) │ │кере. Посев │
│биологической кон- │ │суспензии тест- │ │после каждой│ │из каждой │
│центрации их в ней ├─>│микобактерий и ├─>│экспозиции и├─>│пробы по │
│путем последова- │ │дезинфицирующего │ │перенос их в│ │0,1 мл на │
│тельного 10-крат- │ │раствора в соот- │ │пробирки с │ │чашки с пита-│
│ного разведения и │ │ношении 1:9. │ │9 мл нейтра-│ │тельной сре- │
│посева на плотную │ │Отсчет экспозиции│ │лизатора │ │дой. Термо- │
│питательную среду │ │воздействия ДС на│ │остаточного │ │статирование │
│ │ │микобактерии │ │действия ДС │ │посевов │
└───────────────────┘ └─────────────────┘ └────────────┘ └─────────────┘
┌──┐
│ │
├──┤
┌─────────────────────────────────────>│ │
│ │ ┼─┐
│ ┌────────┐ └──┘ │
┌──┐ │ ┌>└────────┘ / │ ┌──┐ ┌────────┐
├──┤ │┌──┐┌──┐┌──┐┌──┐┌──┐┌──┐│ ┌────────┐ │ │ │ │┌>└────────┘
│ ┼─┘│ ││ ││ ││ ││ ││ │├>└────────┘ │ │ ├──┤│ ┌────────┐
│ │ ├──┤├──┤├──┤├──┤├──┤├──┤│ ┌────────┐ │ └──>│ ┼┤>└────────┘
│ ┼┐ │ ┼┼> ││ ┼┼> ││ ┼┼> ┼┼>└────────┘ │ │ ││ ┌────────┐
└──┘└─┼> ││ ┼┼> ││ ┼┼> ││ ││ ┌────────┐ │ └──┘└>└────────┘
/ └──┘└──┘└──┘└──┘└──┘└──┘├>└────────┘ │ / /
│ / └>┌────────┐ │ │ │
│ │ └────────┘ │ │ │
│ │ / │ │ │
│ │ │ │ │ │
│ ┌───────┴───┐ │ │ │ │
│ │Пробирки со│ │ │ │ │
┌──┴──────┐ │стерильной │ │ │ │ ┌──┴─────┐
│Пробирка │ │водопровод-│ │ │ ┌──┴─────┐ │Чашки │
│с рабочей│ │ной водой │ ┌───────┴─┐ │ │Пробирки│ │Петри с │
│суспензи-│ │(по 9 мл) в│ │Чашки │ │ │с 9 мл │ │плотной │
│ей тест- │ │количестве,│ │Петри с │ ┌─────┴──┐ │нейтра- │ │пита- │
│микроба в│ │необходимом│ │плотной │ │Пробирка│ │лизатора│ │тельной │
│концент- │ │для опреде-│ │пита- │ │или │ │(не ме- │ │средой │
│рации │ │ления БК │ │тельной │ │флакон с│ │нее 3 на│ │(не ме- │
│ 9 │ │тест- │ │средой │ │рабочим │ │каждую │ │нее 3 на│
│(2 x 10 │ │микроба в │ │(5 чашек │ │раство- │ │экспо- │ │каждую │
│КОЕ/мл) │ │суспензии │ │на пробу)│ │ром ДС │ │зицию) │ │пробу) │
└─────────┘ └───────────┘ └─────────┘ └────────┘ └────────┘ └────────┘
Схема 5.4. Проведение эксперимента по оценке
туберкулоцидной активности ДС суспензионным методом
Как видно из схемы 5.4, для проведения опыта по оценке туберкулоцидных свойств дезинфицирующего средства суспензионным методом необходимо приготовить:
— рабочую суспензию штамма тест-микобактерий с концентрацией не менее
9
1 x 10 КОЕ/мл (это обеспечивает возможность создания в смеси дезинфектанта
с суспензией (обоснованной и применяемой для этого метода оценки ДС)
8
концентрации микроорганизмов порядка 1 x 10 КОЕ/мл);
— пробирки со стерильной дистиллированной водой для проведения контроля реальной биологической концентрации БК тест-микроорганизма в суспензии, используемой в опыте;
— пробирки или флакон с раствором ДС в испытываемой концентрации в количестве, необходимом для обеспечения отбора всех проб;
— необходимое количество пробирок (в зависимости от количества проб, отбираемых для определения времени, обеспечивающего полную гибель тест-микроба), содержащих по 9 мл нейтрализатора, проверенного предварительно на эффективность нейтрализации остаточного действия испытываемого ДС п. 5.1.2.3;
— пробирки со скошенной стерильной плотной питательной средой в количестве, необходимом для посева пробы контроля исходной суспензии и проб контроля эффективности действия ДС на тест-микроб.
Методика проведения самого опыта включает, как видно из схемы, последовательное выполнение следующих операций:
— тщательное перемешивание хранимой в пробирке или во флаконе рабочей суспензии тест-микроорганизма путем встряхивания ее в течение 2 — 3 мин.;
— помещение испытываемого рабочего раствора ДС в водяную баню с заданной температурой; если задачей эксперимента не предусмотрено изучение влияния воздействия температуры на эффективность средства, то оценка эффективности раствора испытываемого средства осуществляется при температуре 18 — 20 °C;
— проведение контроля реальной на момент проведения опыта биологической концентрации БК тест-микроорганизма в суспензии;
— внесение в испытываемый дезинфицирующий раствор рабочей суспензии тест-микроорганизма с обеспечением соотношения ДС и суспензии тест-микроорганизма 9:1;
— перемешивание смеси и отсчет по секундомеру времени начала воздействия ДС на тест-микроорганизм;
— по окончании каждой заданной экспозиции проведение отбора пробы в количестве 3 мл, которую по 1 мл вносят в 3 пробирки, содержащих по 9 мл стерильного раствора нейтрализатора остаточного действия дезинфекционного средства на тест-микроорганизм;
— перемешивание пробы путем встряхивания вручную в течение 1 — 2 мин. (или в течение 5 мин. на шейкере) и посев из них стерильно на поверхность плотной питательной среды в чашках Петри или в пробирках (по 0,1 мл на каждую чашку или пробирку, но не менее чем на три из каждой пробы);
— инкубирование посевов проб при температуре (37 +/- 1) °C в течение 14 — 21 суток и учет результатов.
Эффективной экспозицией для рабочего раствора испытанной концентрации считается вторая экспозиция из показавших отсутствие жизнеспособных клеток в посевах соответствующих им проб.
Количество и интервал (шаг) экспозиций, при которых осуществляется отбор проб на эффективность ДС, выбирают на основе учета данных о составе и эффективности входящих в средство действующих веществ.
Средство, растворы которого обеспечивают при комнатной температуре в течение 60 мин. полную гибель микобактерий, рассматривают как перспективное туберкулоцидное средство для дальнейшего изучения: оценки факторов, влияющих на туберкулоцидную активность ДС, отработки режимов эффективного применения и др.
5.2.2.2. Метод батистовых тест-объектов
Как суспензионный метод оценки туберкулоцидной активности ДС и их субстанций, так и метод батистовых тест-объектов используют для получения информации о концентрационных и временных параметрах эффективного туберкулоцидного действия ДС. В принципиальном плане методология выполнения эксперимента по оценке (тестированию) туберкулоцидной эффективности ДС методом батистовых тест-объектов приведена на схеме 5.5 (не приводится).
Как видно из схемы 5.5, методика эксперимента предусматривает проведение контаминации микобактериями батистовых тест-объектов, контроля исходного уровня обсеменения тест-объектов, обработки (замачивания) тест-объектов в испытываемом дезинфицирующем растворе, нейтрализации ДС после заданной экспозиции воздействия, инкубирование нейтрализованных тест-объектов на плотной питательной среде.
Приготовление и контаминация батистовых тест-объектов. Батистовую ткань погружают на 24 ч в холодную питьевую воду для удаления аппрета. Затем ткань тщательно стирают с мылом, прополаскивают в холодной воде, кипятят, сушат и гладят горячим утюгом. С помощью иглы в приготовленном куске батистовой ткани выдергивают нитки в продольном направлении на расстоянии 10 мм друг от друга и в поперечном — на расстоянии 0,5 см. По этим линиям ткань разрезают ножницами на отдельные тест-объекты; раскладывают по 50 штук в чашки Петри, которые завертывают в бумагу и автоклавируют в паровом стерилизаторе 20 мин. при 132 °C (1,1 кгс/кв. см).
Приготавливают рабочую суспензию тест-микобактерий (п. 5.2.1.2) в количестве, достаточном для контаминации используемых в опыте тест-объектов (из расчета 0,2 мл на тест).
Стерильные батистовые тест-объекты (в количестве 50 — 100 штук) в чашке
Петри заливают 10 — 20 мл рабочей суспензии тест-микобактерий, содержащей
9
10 КОЕ/мл, и равномерно смачивая, оставляют тест-объекты в суспензии в
закрытой чашке Петри. Через 30 мин. тест-объекты, контаминированные
бактериальной суспензией, стерильным пинцетом с соблюдением асептики
переносят в стерильную чашку Петри на поверхность двухслойной стерильной
фильтровальной бумаги, покрывают их сверху стерильной фильтровальной
бумагой и закрывают чашку. Оставляют на 10 мин. с целью удаления избытка
жидкости. Для фиксации микроорганизмов на батистовых тест-объектах
последние переносят на поверхность сухой стерильной фильтровальной бумаги в
чашке Петри и сверху прикрывают стерильным листом фильтровальной бумаги,
подсушивают в термостате при 37 °C в течение 20 мин. с приоткрытыми
крышками.
Хранение контаминированных тест-объектов возможно в холодильнике при температуре (4 +/- 2) °C в течение суток.
Контроль исходного количества живых тест-микобактерий на тест-объекте. Для контроля количества жизнеспособных микобактериальных клеток на тест-объектах тест-объект погружают в колбу со 100 мл стерильной дистиллированной воды. Колбу устанавливают на шейкер и встряхивают в течение 30 мин. для отмывания бактериальных клеток с бязевого батистового тест-объекта. Из полученной суспензии производят посев по 0,1 мл на 5 пробирок (5 повторностей) со средой Левенштейна-Йенсена или «Новая», инкубируют в термостате при 37 °C в течение 14 — 21 суток. Выросшие колонии на поверхности питательной среды подсчитывают, определяют среднее значение, производят пересчет с учетом разведения. Количество жизнеспособных бактериальных клеток в приготовленной суспензии на тест-объекте должно составлять 105 — 106 микробных тел (если рост микобактерий отсутствует, при посеве суспензии объемом 0,1 мл, можно увеличить объем до 0,2 — 0,3 мл и соответственно учесть его при расчете бактериальной концентрации на тест-объекте).
Расчет концентрации живых микобактерий на тест-объекте осуществляют по следующей формуле:
X = A x 1000,
где:
X — концентрация живых микобактерий на тест-объекте;
A — среднее количество колониеобразующих единиц КОЕ, выросших на 5 пробирках;
1000 — коэффициент, полученный от соотношения 100 мл (общий объем пробы в колбе) к 0,1 мл (объем пробы, использованный для посева).
Например: получен рост микобактерий в 1-й пробе — 50 КОЕ, во 2-й — 110 КОЕ, в 3-й — 98 КОЕ, в 4-й — 150 КОЕ, в 5-й — 100 КОЕ, тогда среднее количество колониеобразующих единиц КОЕ, выросших на 5 пробирках, будет равно:
A = (50 + 110 + 98 + 150 + 100) : 5 = 102
X = 102 x 1000 = 102000,
что соответствует 1 млн. живых микробных клеток на тест-объекте.
Проведение обработки тест-объектов раствором испытуемого ДС и контроль эффективности обеззараживания. Стерильным пинцетом погружают необходимое для проведения эксперимента количество контаминированных тест-штаммом микобактерий тест-объектов в пробирку или чашку Петри с раствором ДС (объем ДС должен рассчитываться с учетом соотношения 1,0 мл раствора на 1 тест-объект), обеспечивая полное смачивание (погружение тест-объектов), фиксируют время начала экспозиции и следят за соблюдением температурного режима (20 +/- 2) °C.
По истечении заданного времени экспозиции стерильным пинцетом извлекают тест-объект из раствора ДС и погружают его на 1 — 2 мин. в пробирку со стерильным раствором нейтрализатора при температуре (20 +/- 2) °C (пробирку с раствором нейтрализатора и погруженным в него тестом не встряхивают).
Затем при помощи пинцета размещают тест-объект на скошенную поверхность питательной среды Левенштейна-Йенсена или «Новая» (на скошенную площадку питательной среды в пробирке можно разместить 3 тест-объекта, что позволяет увеличить без дополнительных затрат количество проб на каждую экспозицию, а значит и достоверность результатов оценки эффективности средства). Пробирки закрывают ватно-марлевыми пробками, помещают в термостат в наклонном положении под углом 30° таким образом, чтобы стекающий с теста посевной материал тоже равномерно распределился по поверхности питательной среды, и инкубируют при 37 °C в течение 10 — 21 дня с ежедневным просмотром.
Учет и анализ результатов эксперимента. Учет результатов посевов проводят визуально путем подсчета выросших колоний на самом тест-объекте и на поверхности питательной среды. Колонии M. terrae на среде Левенштейна-Йенсена представляют собой шероховатые и матовые выпуклые округлые образования, на среде «Новая» — гладкие и блестящие или с молочным или желтоватым оттенком.
Наличие роста колоний тест-микобактерий на тест-объекте и на поверхности питательной среды показывает, что тестируемое ДС в данном режиме применения (концентрация раствора и экспозиция воздействия) не обеспечивает надежного туберкулоцидного эффекта.
Отсутствие роста колоний тест-микобактерий на тест-объекте и на
поверхности питательной среды свидетельствует о наличии у средства в данном
режиме (концентрация раствора и экспозиция воздействия) туберкулоцидной
эффективности, отвечающей предъявляемым требованиям к ДС для практического
их использования (обеспечение снижения уровня обсемененности объекта на
5
10 КОЕ кв. см).
Эффективной экспозицией для рабочего раствора испытанной концентрации считается вторая экспозиция из показавших отсутствие в посевах соответствующих им проб жизнеспособных микобактерий.
Количество и интервал (шаг) экспозиций, при которых осуществляется отбор проб на эффективность ДС, выбирают на основе данных о составе и эффективности входящих в средство действующих веществ.
Средство, растворы которого обеспечивают при температуре (20 +/- 2) °C в течение 60 мин. полную гибель микобактерий тест-микроорганизма, может рассматриваться как перспективное туберкулоцидное ДС для дальнейшего изучения: оценки факторов, влияющих на туберкулоцидную активность ДС, отработки режимов эффективного применения и др.
5.2.2.3. Методы изучения факторов, влияющих
на туберкулоцидную активность ДС и их субстанций
Для определения условий применения и направлений дальнейших исследований необходимо изучить зависимость туберкулоцидного действия ДС от температуры раствора ДС, величины pH и присутствия белковых загрязнений.
Исследования проводят методом батистовых тест-объектов (п. 5.2.2.2).
На основании полученных данных определяют целесообразность и направления дальнейших исследований препарата для применения в качестве ДС.
Определение влияния температуры на туберкулоцидную активность ДС и их субстанций проводят с целью выявления возможности использования подогретых растворов ДС для сокращения времени обеззараживания объектов в отношении микобактерий туберкулеза, а также для оценки эффективности туберкулоцидных свойств при пониженных температурах окружающей среды, обеззараживаемого объекта и самого раствора ДС.
Для изучения влияния температуры рабочие растворы испытуемых ДС готовят в день опыта, наливают в стеклянные колбы (пробирки) из расчета по 0,5 мл на каждый тест-объект.
Исследование влияния положительных температур раствора ДС на его туберкулоцидную активность проводят с использованием водяной бани, в которой нагревают емкость с дезинфицирующим раствором до (18 +/- 1), (37 +/- 1), (55 +/- 1) °C, после чего погружают в него зараженные тест-объекты и поддерживают эти температуры в процессе всего опыта.
Опыты по оценке влияния пониженной температуры на активность ДС проводят с использованием криостата или солевых низкозамерзающих растворов, в которых охлаждают емкость с дезинфицирующим раствором до (10 +/- 1), (5 +/- 1), -(2 +/- 1) °C и поддерживают их в процессе опыта. После достижения указанной температуры в раствор ДС погружают батистовые тест-объекты, контаминированные культурой тест-микроорганизма, из расчета 2 тест-объекта на каждую экспозицию.
Через определенные промежутки времени из каждой колбы извлекают по 2 тест-объекта и помещают их при температуре (20 +/- 1) °C в пробирки с соответствующим нейтрализатором на 5 мин., затем во вторую пробирку со стерильной водой на 5 мин. и только после этого каждый тест-объект переносят в пробирку со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая» и укладывают его на поверхность среды. Посевы инкубируют в течение 14 — 21 суток при (37 +/- 1) °C. Контролем служат по 2 тест-объекта при каждой исследованной температуре, не подвергавшиеся действию испытуемого ДС, но погруженные в пробирки со стерильной питьевой водой на срок, равный действию испытуемого ДС.
Определение влияния величины pH на туберкулоцидную активность ДС и их субстанций начинают с приготовления рабочих растворов ДС, имеющих различную величину pH (5,6 — 6,0; 7,0; 8,5 — 9,0). Для подкисления раствора используют децинормальный раствор соляной или другой кислоты, а для подщелачивания — децинормальный раствор щелочи. В подготовленные растворы погружают контаминированные микобактериями батистовые тест-объекты. Исследование зависимости туберкулоцидной активности ДС и их субстанций от величины pH проводят по методике, описанной выше, только при нейтрализации действия действующих веществ одновременно понижают или повышают и величину pH, добавляя соответственно кислоту или щелочь.
Определение влияния белковых загрязнений на туберкулоцидную активность ДС проводят с целью выявления возможности влияния (или установления его отсутствия) белковых загрязнений на обеззараживаемом объекте на туберкулоцидную активность ДС.
Исследование проводят методом батистовых тест-объектов (п. 5.2.2.2), только для контаминации тест-объектов используют суспензию тест-микобактерий, содержащую 20,0% инактивированной сыворотки крупного рогатого скота или дефибринированной крови, которые добавляют в суспензию при ее приготовлении. Инактивацию нормальной сыворотки крупного рогатого скота проводят дробным трехкратным прогреванием на водяной бане при температуре (60 +/- 1) °C в течение 30 мин. Если активность препарата не снижается в присутствии 20,0% белка, концентрацию инактивированной сыворотки крупного рогатого скота или дефибринированной крови в суспензии тест-микроорганизма увеличивают до 40,0%. Отсутствие снижения туберкулоцидной активности ДС при добавлении 40,0% сыворотки позволяет считать ДС не реагирующим на присутствие белковых загрязнений.
5.2.3. Методы исследований туберкулоцидной эффективности ДС,
предназначенных для обеззараживания объектов внешней среды,
контаминированных тест-микроорганизмами
Многообразие факторов передачи туберкулеза и длительная выживаемость возбудителей туберкулеза и микобактериозов во внешней среде обосновывает необходимость обеззараживания большого перечня объектов, которые могут быть контаминированы возбудителями в инфекционном очаге на дому, в лечебно-профилактических учреждениях, в специализированных бактериологических лабораториях, работающих с этими возбудителями.
Учитывая вышесказанное, перечень тест-объектов, моделирующих объекты, подлежащие дезинфекции, включает: поверхности помещений, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и др.; изделия медицинского назначения, в т.ч. эндоскопы; предметы ухода за больными, игрушки; посуду, включая лабораторную и из-под выделений; белье, одежду, спецодежду и другие объекты из тканей; изделия из резины, в т.ч. перчатки, сапоги, фартуки и др.; обувь; руки в резиновых перчатках; остатки пищи; выделения: фекалии, мочу, кровь, мокроту; воду; воздух; медицинские отходы.
5.2.3.1. Исследование туберкулоцидной эффективности ДС,
предназначенных для обеззараживания поверхностей помещений,
мебели, аппаратов, приборов, санитарно-технического
оборудования, транспортных средств и других объектов
В исследованиях используют тест-поверхности (10 x 10 см) из различных материалов: дерева (неокрашенного, окрашенного масляной, клеевой или другими красками, оклеенного обоями), линолеума, пластика, кафеля, фаянса, плитки, металлов, стекла.
Тест-поверхности из различных материалов (за исключением деревянных
тест-поверхностей, окрашенных клеевой краской и оклеенных обоями) тщательно
моют водой с мылом и щеткой, стерилизуют в паровом стерилизаторе (при
температуре (121 +/- 1) °C в течение 30 мин.). Тест-поверхности, окрашенные
клеевой краской и оклеенные обоями, протирают несколько раз стерильной
марлевой салфеткой, увлажненной стерильной питьевой водой. Готовят
9
суспензию тест-микобактерий, содержащую 2,0 x 10 КОЕ/мл. При разработке
режимов обеззараживания раковин, ванн и других загрязненных объектов для
имитации органического загрязнения к суспензии добавляют 40,0% лошадиной
сыворотки, инактивированной при 56 °C в течение 30 мин. (к 6 мл
2-миллиардной суспензии прибавляют 4 мл сыворотки).
После подсыхания тест-поверхности располагают горизонтально и на них с помощью одноканального механического дозатора или стеклянной пипетки наносят 0,5 мл суспензии тест-микроорганизма. Суспензию равномерно распределяют по тест-поверхности (100 кв. см) стерильным стеклянным шпателем. Если суспензия тест-микроорганизма не распределяется равномерно, а собирается в каплю, растирание шпателем по тест-поверхности осуществляют неоднократно (3 — 5 раз). Контаминированные тест-поверхности подсушивают при комнатной температуре до полного высыхания (30 — 120 мин.). Обеззараживание тест-поверхностей осуществляют способами протирания, орошения дезинфицирующим раствором.
При обеззараживании тест-поверхности из дерева (окрашенные клеевой и другими красками, оклеенные обоями), из стекла, кафеля и т.п. располагают вертикально; поверхности из линолеума, метлахской плитки и других покрытий для пола располагают горизонтально. Тест-поверхности обеззараживают путем их орошения, протирания (однократного или двукратного) дезинфицирующим раствором.
В зависимости от вида обрабатываемой поверхности и наличия загрязнений на ней норма расхода ДС на одну обработку способом протирания составляет 100 — 150 мл на кв. м (1,0 — 1,5 мл на 100 кв. см); способом орошения — 150 мл на кв. м (1,5 мл на 100 кв. см) при обработке распылителем типа «Квазар» и 300 мл на кв. м (3 мл на 100 кв. см) — при обработке распылителем типа «Автомакс» или гидропультом.
При необходимости обработку способом протирания или орошения повторяют через 5 — 15 мин.
Для контроля эффективности обеззараживания через определенные промежутки времени (15 — 30 — 60 и т.д. до 120 мин.) с тест-поверхностей делают смывы путем тщательного протирания поверхности стерильной марлевой салфеткой (5 кв. см), увлажненной нейтрализатором. После протирания на тест-поверхности не должно оставаться излишней влаги. Салфетки погружают на 5 мин. в пробирки (емкости) с соответствующим нейтрализатором (10 мл), а затем в стерильную питьевую воду с бусами и встряхивают на шейкере в течение 10 мин. Полученную смывную жидкость вносят по 0,1 мл в 3 — 5 пробирок со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая», тщательно распределяя ее по всей поверхности. Посевы инкубируют в термостате при температуре (37 +/- 1) °C в течение 10 — 21 суток.
В контрольных опытах для обработки аналогично контаминированных тест-поверхностей вместо раствора ДС используют стерильную питьевую воду объемом из того же расчета, что и опытный. Жидкость, в которую помещают стерильную марлевую салфетку после взятия смыва с контрольных поверхностей, перед посевом разводят в 100 раз и вносят по 0,1 мл на скошенную поверхность плотной питательной среды Левенштейна-Йенсена или «Новая» в 3 — 5 пробирок. Посевы инкубируют в термостате при температуре (37 +/- 1) °C. Учитывают результаты через 10 — 21 суток.
Оценку результатов проводят по посеву того разведения, в котором число колоний на чашке Петри или в пробирке составляет от 30 до 300.
После выдерживания посевов в термостате подсчитывают число колоний на чашках или пробирках с плотной питательной средой, рассчитывают остаточную плотность контаминации на 100 кв. см тест-поверхности и высчитывают эффективность обеззараживания, принимая количество тест-микроорганизмов, снятых с контрольных тест-объектов тест-поверхностей, за 100%.
Например: на 100 кв. см контрольной тест-поверхности по результатам бактериологического контроля обнаружено 148000 микробных клеток, а на аналогичного вида опытной тест-поверхности — 20 микробных клеток.
148000 — 100%
x = 20 x 100 : 148000 = 2 : 148 = 0,013%.
20 — x
Эффективность обеззараживания опытной тест-поверхности составляет:
100 — 0,013 = 99,987%.
Критерий эффективности ДС при обеззараживании тест-поверхностей из различных материалов, контаминированных тест-микроорганизмом, равен не менее 99,99%.
5.2.3.2. Исследование туберкулоцидной эффективности ДС,
предназначенных для обеззараживания предметов ухода
за больными и игрушек из различных материалов кроме мягких
В исследованиях используют тест-объекты (100 кв. см) и предметы ухода за больными из различных материалов: резин на основе натурального и силиконового каучука (медицинская клеенка, грелка, груша); стекла (поильник; плевательница; градусник); пластмасс (грелка, лоток; наконечник для клизм); металлов (таз, стакан для термометра); игрушки (кроме мягких) из резин и пластмасс.
Тест-объекты, предметы ухода за больными и игрушки из различных материалов тщательно моют водой с мылом и щеткой. Тест-объекты стерилизуют паровым или воздушным методом.
9 -1
Готовят суспензию тест-микобактерий, содержащую 2,0 x 10 КОЕ мл . К
суспензии добавляют 40,0% лошадиной сыворотки, инактивированной при 56 °C в
течение 30 мин. (к 6 мл 2-миллиардной суспензии прибавляют 4 мл сыворотки).
С помощью одноканального механического дозатора или стеклянной пипетки на поверхность тест-объекта наносят 0,5 мл суспензии тест-микроорганизма. Суспензию равномерно распределяют по поверхности (100 кв. см) стерильным стеклянным шпателем. Каналы и полости предмета ухода за больными, игрушек заполняют с помощью шприца. Мелкие игрушки полностью погружают в суспензию. Контаминированные тест-объекты, предметы ухода за больными и игрушки подсушивают при комнатной температуре до полного высыхания 30 — 120 мин.
Растворы ДС готовят на водопроводной воде при температуре (20 +/- 2) °C. Обеззараживание осуществляют способом погружения, протирания, орошения. После подсушивания контаминированные тест-объекты, предметы ухода за больными, игрушки, в т.ч. имеющие каналы и полости, погружают в раствор испытуемого дезинфицирующего средства или протирают салфеткой, смоченной им. Мелкие игрушки полностью погружают в емкость с раствором ДС, препятствуя их всплытию; крупные игрушки обеззараживают способом орошения. Норма расхода ДС способом протирания из расчета 100 — 150 мл/кв. м при однократной обработке и 200 — 300 мл/кв. м при двукратной; способом орошения — 150 мл/кв. м при обработке распылителем типа «Квазар» и 300 мл/кв. м — при обработке распылителем типа «Автомакс» или гидропультом. При необходимости обработку способом протирания или орошения повторяют через 5 — 15 мин.
Для контроля эффективности обеззараживания через определенные промежутки времени после обработки (30 — 60 — 120 мин.) тест-объекты, предметы ухода за больными и игрушки извлекают из раствора, делают смывы стерильной марлевой салфеткой (5 кв. см), увлажненной нейтрализатором. Салфетки погружают в стерильный раствор нейтрализатора на 5 мин., затем переносят в пробирки (емкости) с бусами и стерильной питьевой водой (10 мл) и встряхивают на шейкере в течение 10 мин. Каналы и полости промывают нейтрализатором (10 мл), который собирают в стерильные пробирки (емкости) и оставляют на 5 мин. для нейтрализации.
Полученную смывную жидкость и смывную жидкость из каналов вносят по 0,1 мл на скошенную поверхность плотной питательной среды Левенштейна-Йенсена или «Новая» в 3 — 5 пробирок. В контрольных опытах вместо раствора ДС используют стерильную питьевую воду.
Посевы инкубируют в термостате при температуре (37 +/- 1) °C.
Результаты учитывают через 10 — 21 сутки инкубирования.
Эффективность ДС при обеззараживании тест-объектов, предметов ухода за больными и игрушек из различных материалов (кроме мягких), контаминированных тест-микроорганизмом, должна быть не менее 100%.
5.2.3.3. Исследование туберкулоцидной эффективности ДС,
предназначенных для обеззараживания посуды столовой,
лабораторной и из-под выделений
Для определения туберкулоцидной активности ДС, предназначенных для обеззараживания посуды, используют в качестве тест-объектов набор столовой и чайной посуды: тарелки, стаканы, кружки из различного материала (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью); столовые приборы: ножи, вилки, ложки из различного материала (нержавеющая сталь, алюминий, пластик); посуду одноразового использования и набор лабораторной посуды, представляющий тест-объекты из стекла и пластмасс: предметные и покровные стекла, пипетки, чашки Петри, планшеты для иммунологического анализа и др.; посуду из-под выделений (мочеприемники, подкладные судна). Перед экспериментом посуду и столовые приборы моют водой с мылом и щеткой и высушивают.
На посуду (площадь в 100 кв. см) пипеткой наносят суспензию
9
тест-микроорганизма из расчета 0,5 мл суспензии, содержащей 2 x 10 КОЕ в
1 мл. Суспензию тест-микроорганизма равномерно распределяют по поверхности
посуды стеклянным шпателем. Столовые приборы для контаминации погружают в
бактериальную суспензию на 1 — 2 мин., оставляя незараженными их ручки.
Контаминированную посуду подсушивают (до полного высыхания) при комнатной
температуре (30 — 120 мин.) и относительной влажности воздуха 50 — 60%.
Для разработки режимов обеззараживания посуды с остатками пищи при контаминации используют суспензию тест-микроорганизма, смешанную с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-миллиардной микробной взвеси). Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя добавляют 1 мл 2-миллиардной микробной взвеси), лабораторной посуды — 40,0% инактивированной сыворотки, посуды из-под выделений — 20,0%-ную эмульсию фекалий, предварительно растертую в ступке.
Обработку столовой, чайной, лабораторной посуды, столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18 — 20 °C. При необходимости изучают эффективность растворов ДС при температуре 50 °C.
Дезинфицирующий раствор должен полностью заполнить и с избытком покрыть всю посуду и приборы (из расчета не менее 2 л на 1 комплект).
Время обеззараживания посуды — от 15 до 240 мин., в зависимости от вида ДС и наличия загрязнения.
Через определенные интервалы времени (например, 15, 30, 60 мин. и т.д.) извлекают по одному предмету разных наименований (например, тарелка, стакан, предметное стекло, нож и т.д.) из дезинфицирующего раствора и стерильной марлевой салфеткой (5 кв. см), смоченной в растворе нейтрализатора, соответствующего данному ДС, тщательно протирают зараженную часть каждого предмета и погружают в 10 мл этого же нейтрализатора на 5 мин., затем салфетку переносят в пробирку со стерильной питьевой водой и бусами. Время отмыва марлевой салфетки — 10 мин. при постоянном встряхивании на шейкере. После отмыва смывную жидкость по 0,1 мл высевают в 3 — 5 пробирок со скошенной поверхностью плотной питательной среды Левенштейна-Йенсена или «Новая» (по 0,1 мл в каждую). Посевы помещают в термостат при температуре 37 °C. Предварительный учет результатов проводят через 10 — 14 суток, окончательный — через 21 сутки.
Контролем служит аналогично контаминированная посуда, которая погружается не в дезинфицирующий раствор, а в такой же объем стерильной питьевой воды.
Критерий эффективности обеззараживания посуды: гибель тест-микроорганизма не менее 100%.
5.2.3.4. Исследование туберкулоцидной эффективности ДС,
предназначенных для обеззараживания изделий медицинского
назначения ИМН, включая эндоскопы
5.2.3.4.1. Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания ИМН (кроме эндоскопов)
В качестве тест-изделий используют стерильные инструменты и другие ИМН, в т.ч. однократного применения, из различных материалов (металлов, резин, стекла, пластмасс) или имитирующие их тест-объекты. Перечень инструментов должен включать разнообразные по форме, характеру поверхности и используемому материалу изделия (гладкие изделия простой конфигурации; изделия, имеющие замковые части, каналы и полости, насечки и напыления, изделия извитой формы; изделия, изготовленные из нескольких видов материалов, и т.д.).
На рабочую поверхность тест-изделия (у замковых изделий — также в
область замка, а при наличии каналов и полостей — также в канал изделия)
9
наносят 0,1 мл суспензии, содержащей 2 x 10 КОЕ/мл тест-микроорганизма и
40% инактивированной лошадиной сыворотки. Мелкие тест-изделия для
контаминации погружают в эту суспензию на 15 мин. Контаминированные
тест-изделия подсушивают в термостате в течение 20 — 25 мин.
Дезинфицирующие растворы готовят на питьевой воде комнатной температуры или
подогретой до (50 +/- 1) °C.
После подсушивания контаминированные изделия погружают в раствор испытываемого средства, заполняя им все каналы и полости изделий, избегая образования воздушных пробок. Инструменты, имеющие замковые части, погружают раскрытыми, предварительно сделав ими в растворе ДС несколько рабочих движений для лучшего проникновения раствора в труднодоступные участки изделия в области замка. Толщина слоя раствора средства над изделиями должна быть не менее 1 см. Параллельно контаминированные контрольные изделия погружают в воду.
Через определенное время (от 15 до 120 мин.) изделия извлекают из раствора и марлевой салфеткой размером 5 x 5 см, пропитанной нейтрализатором, с поверхности изделия делают смывы, салфетку помещают в пробирку с 10 мл того же нейтрализатора на 5 мин., затем переносят ее в пробирку со стерильной питьевой водой и встряхивают с бусами в течение 5 — 10 мин. Для контроля эффективности обеззараживания делают посев смывной жидкости по 0,1 мл на поверхность агаровой питательной среды, а салфетку помещают в бульон. Канал изделия промывают нейтрализатором, и смывную жидкость засевают по 0,1 мл на скошенную плотную питательную среду в 3 — 5 пробирок. Посевы выдерживают в термостате при температуре (37 +/- 1) °C в течение 21 суток. Учет предварительных результатов проводят через 10 — 14 суток и окончательных — через 21 сутки.
Кратность постановки эксперимента должна быть достаточной для получения статистически достоверных результатов.
Эффективным считают режим (концентрация — время — температура), обеспечивающий 100%-ную гибель тест-микроорганизмов на всех изделиях. При наличии положительных проб эксперимент повторяют, увеличивая концентрацию или время воздействия.
5.2.3.4.2. Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания эндоскопов [16, 68]
В качестве тест-объектов используют фрагменты эндоскопа или эндоскоп
(гибкий — гастроскоп, жесткий — цистоскоп). По 0,1 мл суспензии, содержащей
9
1 x 10 КОЕ/мл тест-микроорганизмов, наносят с помощью пипетки на наружную
поверхность и в канал эндоскопа, подсушивают в течение 20 мин. Затем
контаминированное изделие погружают в раствор ДС, заполняя полости и каналы
эндоскопа. Через определенное время (от 15 до 60 мин.) изделие извлекают из
раствора и делают смыв с наружной поверхности марлевой салфеткой
(5 x 5 см), смоченной в растворе нейтрализатора; салфетку помещают в
пробирку с 10 мл того же стерильного раствора нейтрализатора на 5 мин., а
затем переносят ее в пробирку со стерильной питьевой водой и встряхивают с
бусами в течение 5 — 10 мин. Канал изделия промывают раствором
нейтрализатора и смывную жидкость засевают на питательный агар. Проводят
также контроль микробной обсемененности использованных для отмыва проб
раствора нейтрализатора и питьевой воды. Кратность постановки эксперимента
должна быть достаточной для получения статистически достоверных
результатов.
Эффективным считают режим (концентрация — время — температура), обеспечивающий гибель тест-микроорганизма на всех тест-изделиях и отсутствие тест-микроорганизмов в растворе нейтрализатора. При наличии положительных проб эксперимент повторяют, увеличивая время воздействия, но не более чем до 60 мин. Положительной считается проба, показывающая характерный рост тест-микроорганизма на плотных питательных средах, или обнаружение тест-микроорганизма в растворе применявшегося нейтрализатора.
Режим обеззараживания, разработанный на имитаторах канала эндоскопа, проверяют при обеззараживании эндоскопа, контаминированного тест-микроорганизмом. При необходимости эффективность разработанного режима проверяют в практических условиях.
Критерием эффективности ДС (режим применения ДС) при обеззараживании ИМН (включая эндоскопы) является 100%-ная гибель тест-микроорганизма.
Исследование туберкулоцидной эффективности ДС при дезинфекции высокого уровня ДВУ эндоскопов. Данная методика предназначена для разработки режимов ДВУ эндоскопов при проведении «нестерильных» диагностических и лечебных манипуляций [16, 73].
Для исследования выбирают ДС, обладающее спороцидным действием, и испытания его проводят при тех же условиях (концентрация, температура), которые обеспечивают гибель спор бацилл, определяя необходимое время дезинфекционной выдержки для достижения гибели наиболее устойчивого к изучаемому ДС микроорганизма.
При определении эффективности средств для ДВУ эндоскопов в качестве тест-объектов используют фрагменты канала гибкого эндоскопа или его имитаторы в виде трубок из пластика длиной 2 см, диаметром 2 мм.
Стерильные тест-объекты искусственно контаминируют, нанося с помощью
дозатора/микропипетки в центральную часть канала и на поверхность каждой
6
трубки суспензию тест-микроорганизма из расчета 10 микробных клеток
тест-микобактерий на каждое изделие. Для имитации органического загрязнения
к суспензии микроорганизмов перед контаминацией объекта добавляют 2%
инактивированной лошадиной сыворотки.
Контаминированные тест-объекты подсушивают при комнатной температуре 18 — 22 °C в течение 20 мин.
Дезинфицирующий раствор готовят на стерильной водопроводной питьевой воде. Обработку исследуемым ДС осуществляют способом погружения в испытуемый дезинфицирующий раствор. Через определенные интервалы времени, зависящие от химического состава средства, в промежутке от 5 до 60 мин., тест-изделия извлекают из дезинфицирующего раствора, помещают на 5 — 10 мин. в раствор соответствующего нейтрализатора. После отмыва смывную жидкость по 0,1 мл высевают в 3 — 5 пробирок со скошенной питательной средой для проверки эффективности обеззараживания.
Посевы выдерживают в термостате при температуре и времени, оптимальных для роста использованного тест-микроорганизма: для тест-микобактерий — 37 °C 21 сутки, после чего проводят учет результатов эксперимента.
В качестве контроля используют тест-объекты, контаминированные, как указано выше, и помещенные в воду на время дезинфекционной выдержки.
Кратность постановки эксперимента должна быть достаточной для получения статистически достоверных результатов.
Эффективным считают режим (концентрация — время — температура), обеспечивающий гибель тест-микроорганизма на всех тест-изделиях при отсутствии его роста в питательной среде. Положительной считается проба с характерным ростом микроорганизма на плотной питательной среде или обнаружение микроорганизмов в растворе применявшегося нейтрализатора. При наличии положительных проб эксперимент повторяют, увеличивая время воздействия, но не более чем до 60 мин.
При необходимости эффективность разработанного режима проверяется в практических условиях.
Критерий эффективности обеззараживания — 100%-ная гибель тест-микроорганизма.
Время обеззараживания — не более 60 мин.
5.2.3.5. Исследование туберкулоцидной эффективности ДС,
предназначенных для обеззараживания белья, одежды,
спецодежды и других объектов из ткани
Исследования с ДС проводят в целях оценки эффективности его для обеззараживания белья и других объектов из ткани, чистых и загрязненных кровью или выделениями (фекалии, моча, мокрота).
Оценку эффективности ДС для обеззараживания белья, одежды, спецодежды и
других объектов из ткани осуществляют с помощью стерильных тест-объектов,
представляющих собой кусочки бязи размером 2 x 2 см. Бязь предварительно
готовят и обеззараживают так же, как батист. Контаминируют стерильные
9
тест-объекты суспензией тест-микроорганизмов, содержащей 1 x 10 КОЕ/мл, из
расчета 20 мл на 10 тест-объектов и подсушивают в течение 30 мин. Затем
тест-объекты закладывают в бязевые мешочки размером 5 x 8 см (по 2 шт. в
каждый), которые закрывают в виде конверта.
Раствор испытываемого ДС на питьевой воде комнатной температуры или подогретой до (50 +/- 1) °C готовят из расчета 5 л на 1 кг белья. Ветошь, имитирующую белье, поштучно погружают в емкость с раствором испытываемого ДС так, чтобы между слоями ткани не образовывалось воздушных прослоек, препятствующих процессу обеззараживания. Одновременно между слоями белья распределяют (сверху, в середине и внизу) мешочки с контаминированными тест-объектами. Через заданное время мешочки извлекают одновременно из трех слоев. Тест-объекты вынимают из мешочка стерильным пинцетом, помещают на 5 мин. в емкость с раствором соответствующего нейтрализатора, затем переносят в стерильную питьевую воду и высевают на питательный агар. Посевы инкубируют при (37 +/- 1) °C. Предварительный учет результатов проводят через 10 — 14 суток, а окончательный — через 21 сутки. В контрольных опытах белье погружают в стерильную питьевую воду. Мешочки с тестами закладывают так же, как и в опыте. При получении 100%-ной гибели тест-микроорганизма в опытах по обеззараживанию белья без белковых загрязнений переходят к опытам по обеззараживанию белья, загрязненного выделениями.
Для определения эффективности ДС при обеззараживании белья, одежды,
спецодежды и других объектов из ткани, загрязненных кровью, выделениями
(фекалии, мокрота, моча и др.), в лабораторных условиях используют бязевые
тест-объекты, которые контаминируют суспензией тест-микобактерий с
добавлением 40% инактивированной сыворотки (6 мл суспензии, содержащей
9
1 x 10 КОЕ/мл тест-микроорганизма смешивают с 4 мл инактивированной
сыворотки) или 40% фекальной эмульсии (6 мл суспензии тест-микроорганизма
смешивают с 4 мл 40% фекальной эмульсии), исходя из расчета 30 мл суспензии
на 10 тест-объектов. Для приготовления фекальной эмульсии 8 г фекалий
растирают в ступке с 20 мл воды. Количество суспензии тест-микроорганизма,
содержащей сыворотку или фекалии, готовят из расчета 30 мл на 10
тест-объектов. Контаминированные тест-объекты подсушивают в термостате при
(37 +/- 1) °C в течение 20 — 25 мин. или 1,5 — 2,0 ч при комнатной
температуре до полного высыхания. Методика проведения эксперимента
аналогична опытам с чистым бельем.
Критерием эффективности ДС при обеззараживании белья, одежды, спецодежды и других объектов из тканей является 100%-ная гибель тест-микроорганизмов на тест-объектах. При изучении эффективности обеззараживания изделий из синтетических тканей (капрон, ацетат, лавсан и др.) используют тест-объекты из этих тканей размером 5 x 5 см, т.к. микроорганизмы не проникают в структуру этих тканей и смываемость их в 2 раза больше, чем с бязевых тест-объектов.
5.2.3.6. Исследование туберкулоцидной эффективности
камерного метода обеззараживания
Камерный метод используют для обеззараживания одежды, обуви, постельных принадлежностей, мягких игрушек и др.
В качестве тест-микроорганизма используют Mycobacterium B в виде
5
9
суспензии, содержащей 1 x 10 КОЕ в 1 мл, которой контаминируют
тест-объекты из батиста, бязи и других материалов, соответствующих
обеззараживаемым объектам. Тест-объекты закладывают в стерильные конверты
из хлопчатобумажной ткани (по 2 тест-объекта в конверт). Пронумерованные
тест-объекты помещают в хлопчатобумажные мешочки с максимальными
термометрами и размещают в толще объектов в контрольные точки камеры на
трех уровнях.
После обеззараживания мешочки извлекают из камеры и записывают показания максимальных термометров. Тест-объекты помещают в пробирки с 5 мл картофельно-глицеринового бульона.
Инкубирование посевов с тест-объектами проводят при температуре (37 +/- 1) °C в течение 5 — 7 суток. Отсутствие помутнения питательной среды указывает на гибель микобактерий в тест-объектах. При наличии роста проводят сравнение выделенной культуры с тест-микобактерией.
В качестве контроля используют тест-объекты, которые не помещали в камеру, и питательную среду, которую применяли для культивирования тест-микроорганизма после обработки. Контрольные тест-объекты и среду проверяют аналогично тест-объектам, которые обрабатывали в камере. Для установления эффективности обработки проводят не менее трех экспериментов на каждое время обработки.
Эффективность обеззараживания вещей в дезинфекционных камерах должна
быть равна 100%-ной гибели Mycobacterium B на использованных
5
тест-объектах.
5.2.3.7. Исследование туберкулоцидной эффективности ДС
при обеззараживании рук в резиновых перчатках
В качестве тест-микроорганизма используют суспензию M. terrae,
8 7 5
содержащую 1,0 — 5,0 x 10 КОЕ/мл, которую разводят до содержания 10 , 10
3
и 10 КОЕ/мл.
Для устранения посторонней микрофлоры руки, включая запястья и предплечья, испытатели тщательно моют с мылом в теплой проточной воде, затем протирают стерильной марлевой салфеткой и надевают резиновые перчатки.
Поверхность резиновых перчаток, надетых на руки испытателей-добровольцев, контаминируют путем тщательного растирания 1 мл суспензии тремя вышеуказанными разведениями (каждое разведение на одного испытателя). После подсыхания микробной взвеси для контроля исходной обсемененности с поверхности резиновой перчатки тыльной стороны кисти делают смыв стерильной марлевой салфеткой размером 5 x 5 см, смоченной стерильной питьевой водой. Затем салфетку помещают в пробирку с 10 мл стерильной питьевой воды с бусами и встряхивают 10 мин. Полученный смыв высевают по 0,5 мл на скошенную поверхность питательной среды в пробирке.
Для обеззараживания поверхности перчаток в сжатую ладонь руки в перчатке испытателю-добровольцу наносят 2,5 мл исследуемого ДС. Затем он в течение 10 — 15 с протирает этой порцией дезинфицирующего раствора поверхность перчаток обеих рук, совершая движения рук, которые выполняют при обработке кожи рук антисептиком. После этого такую же операцию проводят, нанося 2,5 мл дезинфицирующего раствора на ладонь второй руки, и засекают по секундомеру начало экспозиции.
Через 5 мин. экспозиции делают смыв марлевой салфеткой (5 x 5 см), смоченной соответствующим нейтрализатором, предварительно проверенным на эффективность нейтрализации и статического действия. Салфетку помещают в пробирку с 10 мл стерильного нейтрализатора на 10 мин. Затем салфетку переносят стерильным пинцетом в пробирку с 10 мл стерильной питьевой воды с бусами, встряхивают пробирку 10 мин. в шейкере. Из полученного смыва делают посев по 0,5 мл на твердые питательные среды в пробирках не менее 3 пробирок на пробу.
Эффективным считают режим применения ДС, обеспечивающий 100%-ную гибель тест-микроорганизма на резиновых перчатках, защищающих кожу рук.
5.2.3.8. Исследование туберкулоцидной эффективности ДС,
предназначенных для обеззараживания выделений
(моча, кал, мокрота) и крови
Обеззараживание мочи. Мочу разливают в колбы или пробирки по 8 мл,
9
добавляют 1 мл суспензии, содержащей 2 x 10 КОЕ/мл M. terrae и 1 мл
инактивированной лошадиной сыворотки.
Растворы испытываемого ДС готовят в концентрациях, обеспечивающих туберкулоцидный эффект при испытании его на батистовых тест-объектах с белковой защитой.
Испытуемые растворы ДС добавляют к моче в равном или двойном объеме. Отмечают время контакта и через интервалы 15, 30, 60 мин. смесь в количестве 1 мл пипеткой переносят в пробирки с 5 мл соответствующего нейтрализатора. После тщательного смешивания 1 мл жидкости из первой пробирки переносят во вторую пробирку с 5 мл нейтрализатора и затем засевают по 0,1 мл в пробирки на скошенную поверхность питательной среды как из первой, так и из второй пробирки. Посевы инкубируют в термостате при (37 +/- 1) °C.
Контролем служат аналогично поставленные опыты, только с добавлением к моче не дезинфицирующего раствора, а воды.
Ориентировочный учет результатов проводят через 10 — 14 суток, окончательный — через 21 сутки. Результаты опытов учитывают по отношению к контролю, который принимают за 100%. Окончательное заключение об эффективности ДС делают на основании не менее трех опытов с совпадающими результатами.
Эффективными считают средство и режим его применения, обеспечивающие 100%-ную гибель тест-микроорганизмов.
Обеззараживание кала. При разработке режимов обеззараживания кала учитывают соотношение ДС к обеззараживаемой массе, время обработки, температуру, консистенцию обеззараживаемых выделений, степень гомогенизации в процессе обеззараживания.
Исследования проводят в два этапа. На первом этапе в качестве тест-объекта используют 20%-ную эмульсию фекалий, на втором — оформленные фекалии.
Для приготовления 20% эмульсии 20 г кала растирают в ступке и добавляют
80 мл воды; полученную эмульсию фильтруют через двойной слой марли,
стерилизуют в автоклаве, разливают пипеткой в пробирки по 9 мл и добавляют
9
по 1 мл 2 x 10 КОЕ/мл суспензии M. terrae. Опыты начинают ставить с
концентрации, вызывающей гибель тест-микроорганизма в моче с белком через
30 мин. Приготовленную эмульсию фекалий заливают равным или двойным объемом
дезинфицирующего раствора и дальше производят высевы так же, как и при
обеззараживании мочи. Результаты учитывают через 21 сутки.
При положительных результатах проводят опыты с большим количеством оформленных фекалий (200 — 250 г). Для этого помещают их в сосуд, заливают дезинфицирующим раствором или засыпают сухими ДС в равном или двойном количестве по отношению к весу фекалий, определяют, происходит ли гомогенизация фекалий. Затем небольшую часть каловых масс размешивают стеклянной палочкой с жидкостью, а остальную массу оставляют в виде небольших комочков. Через определенные промежутки времени, например 30, 60 мин., проводят посев.
Посев жидкой части фекалий производят так же, как в опытах с мочой. Плотные же части комочки забирают бактериологической петлей и помещают в 5 мл соответствующего нейтрализатора, растерев их о края пробирки и тщательно перемешав. Затем стерильной пипеткой переносят из этой пробирки 1 мл смеси во вторую пробирку, тоже содержащую нейтрализатор. Как из первой, так и из второй пробирки производят посев по 0,1 мл на скошенную поверхность питательной среды в пробирках (не менее чем в три пробирки). Предварительный результат учитывают через 10 — 14 суток, а окончательный — через 21 сутки.
Контролем служат аналогично поставленные опыты с добавлением вместо дезинфицирующего раствора воды. Результаты опытов учитывают по отношению к контролю, который принимают за 100%. Судят об эффективности исследуемого средства на основании не менее трех опытов с совпадающими результатами. Эффективными считают средство и режим его применения, обеспечивающие 100%-ную гибель тест-микроорганизмов в обеззараживаемом материале.
Обеззараживание крови и мокроты. В качестве тест-объектов при оценке
туберкулоцидной эффективности ДС, предназначенных для обеззараживания
крови, используют кровь, а мокроты — куриный белок. Для контаминации
тест-объектов тест-микроорганизмом к 9 мл 40% крови или 50% куриного белка
9
добавляют по 1 мл суспензии тест-микроорганизма, содержащей 2 x 10 КОЕ/мл,
перемешивают и разливают по 1 мл в стерильные флаконы. Затем во флаконы
засыпают или наливают исследуемое ДС в объемных (5, 10% и т.д.)
соотношениях к исследуемому материалу. Через определенные промежутки
времени (1, 2 ч и т.д.) с помощью стерильной бактериологической петли
производят отбор пробы смеси и переносят ее в 5 мл нейтрализатора для
нейтрализации остаточного действия ДС на тест-микроорганизм. По истечении 5
мин. из этой пробирки с помощью пипетки производят высев по 0,2 мл
исследуемой пробы на скошенную поверхность питательной среды в пробирках.
Пробирки с посевами инкубируют при (37 +/- 1) °C.
Предварительный результат роста тест-микроорганизмов на чашках учитывают через 10 — 14 суток, а окончательный — через 21 сутки.
Эффективным считают средство, обеспечивающее 100%-ную гибель тест-микроорганизма в обеззараживаемом материале.
5.2.3.9. Исследование туберкулоцидной эффективности ДС,
предназначенных для обеззараживания медицинских отходов
При изучении туберкулоцидной активности ДС с целью разработки режимов
обеззараживания медицинских отходов используют тест-объекты из резин,
пластмасс, текстильных материалов, стекла, металлов [19]. Для приготовления
тест-объектов стерильные одноразовые изделия медицинского назначения
(бинты, ватные тампоны, фрагменты систем для переливания крови и
лекарственных препаратов, катетеры, шпатели, шприцы, иглы, перчатки,
одноразовое белье, салфетки, пипетки, трубки и пр.) измельчают и погружают
9
в суспензию тест-микроорганизма, содержащую 2 x 10 КОЕ/мл с добавлением
80% инактивированной лошадиной сыворотки или сыворотки крупного рогатого
скота. После достаточного пропитывания объекты извлекают в сухую стерильную
емкость и подсушивают в термостате при 37 °C в течение 20 мин. или при
комнатной температуре 18 — 20 °C и относительной влажности воздуха 50 — 60%
в течение 1 ч.
Контаминированные тест-объекты погружают в емкость с испытуемым дезинфицирующим раствором так, чтобы он полностью закрывал их. Контроль эффективности обеззараживания объектов проводят через каждые 15 — 30 мин. в течение времени до 360 мин. Для этого тесты из различных материалов (по два каждого наименования) извлекают из дезинфицирующего раствора, промывают в растворе соответствующего нейтрализатора, из полученных смывов производят посев по 0,1 мл на поверхность твердой питательной среды. Контрольные тест-объекты погружают в стерильную водопроводную воду на срок максимальной экспозиции, а затем высевают на скошенную поверхность питательной среды. Пробирки с посевами помещают в термостат при температуре (37 +/- 1) °C. Окончательный учет результатов проводят на 21 сутки.
Критерий эффективности обеззараживания медицинских отходов — 100%-ная гибель M. terrae на тест-объектах, обработанных ДС.
5.2.3.10. Методы определения туберкулоцидной
активности ДС при обеззараживании воздуха
Химические ДС применяют для обеззараживания воздуха в помещениях в виде аэрозолей или паров растворов ДС, а также газов.
При исследовании эффективности обеззараживания воздуха химическими ДС с целью разработки режима его применения при туберкулезе в качестве тест-микроорганизмов используют M. terrae.
Исследования проводят в испытательных камерах объемом 1 или 2 куб. м. Предварительно внутреннюю поверхность камеры моют раствором моющего средства, остатки которого затем смывают водопроводной водой, и включают бактерицидный УФ-облучатель. В центре камеры располагают продезинфицированный вентилятор, производительностью 15 — 25 куб. м/ч, назначение которого — предотвращение быстрого оседания микроорганизмов.
Для определения эффективности обеззараживания воздуха используют аспирационный метод.
В камере распыляют суспензию тест-микроорганизма в количестве,
достаточном для создания в воздухе камеры концентрации микроорганизмов
4
2,1 x 10 КОЕ/куб. м (определяется опытным путем).
Аэрозоль дезинфицирующего средства создают с помощью распыливающей аппаратуры, которая обеспечивает образование в воздухе не менее 80% частиц с дисперсностью 10 — 15 мкм, и включают вентилятор. Затем в камере распыляют раствор исследуемого средства и через определенные промежутки времени проверяют обсемененность воздуха.
Аспирационный метод основан на аспирации воздуха через жидкость. При использовании аспирационного метода для оценки эффективности обеззараживания воздуха необходимо следующее оборудование:
— воздуходувка с производительностью 15 — 25 л/мин.;
— стерильные склянки Дрекселя с 50 мл стерильной водопроводной воды из расчета 2 шт. на 1 пробу. Предварительно в стерильную воду вносят нейтрализатор, соответствующий испытуемому ДС;
— трубка диаметром 8 — 10 мм, длиной 50 — 60 см, которая вводится в камеру для забора проб воздуха в центре камеры;
— стерильные резиновые шланги, соединяющие склянки Дрекселя (последовательно одну за другой) и далее с воздуходувкой.
Подготовка камеры к эксперименту осуществляется, как указано выше. На исследование отбирается 50 л воздуха (объем пробы).
Последовательность отбора проб следующая:
1) проведение контроля обсемененности воздуха до начала распыления суспензии тест-микроорганизмов;
2) проведение контроля обсемененности воздуха после распыления суспензии тест-культуры;
3) проведение контроля эффективности обеззараживания воздуха — отбор проб через каждые 5 — 10 мин. в зависимости от предполагаемой эффективности ДС.
После отбора проб жидкость из 2 склянок Дрекселя смешивают и по 1 мл вносят в пробирки со скошенной питательной средой. Посевы помещают в термостат. Предварительный учет результатов проводят через 10 — 14 суток, окончательный — через 21 сутки. Критерий эффективности обеззараживания воздуха — 100%.
5.2.4. Методы исследования и оценки туберкулоцидной
активности ДС в практических условиях
Практические испытания проводят в тех случаях, когда ДС содержит новое действующее вещество и требуется подтверждение эффективности разработанных в лабораторных условиях режимов в отношении возбудителей туберкулеза и микобактериозов.
Испытания проводят в соответствии с инструкцией по испытанию ДС, оценивая туберкулоцидную эффективность, безопасность применения и надежность рекомендованных мер предосторожности, физико-химические качества ДС: растворимость, запах, наличие моющего действия и пр.
При оценке эффективности ДС предварительно оценивают обсемененность объектов окружающей среды, имеющих эпидемиологическое значение при туберкулезе, до проведения дезинфекции (фон) и сравнивают ее с обсемененностью этих объектов после обработки рабочим раствором ДС.
Эффективным считают средство, после обработки которым в соответствии с режимом, указанным в инструкции, на объектах не обнаруживают возбудителей туберкулеза, микобактериозов и S. aureus.
По завершении испытаний оформляется акт испытаний, в котором отражаются указанные выше параметры и другие отмеченные свойства.
5.2.5. Приложения
Приложение 1
справочное
Характеристика тест-микобактерий по морфологическим, культуральным и биохимическим свойствам.
Mycobacterium B представляют собой полиморфные, неподвижные,
5
неспорообразующие палочки, размером (0,2 — 0,6 x 1,0 — 10,0) мкм (как и
другие виды микобактерий). Mycobacterium B — грамположительные, аэробы,
5
растут на элективных питательных средах на яичной основе (реакция среды
почти нейтральная (pH 6,8 — 7,2)): Петраньяни, Левенштейна-Йенсена, «Новая»
и др. при оптимальной температуре 37 °C, хотя могут расти при температуре
25 — 38 °C. Колонии Mycobacterium B на плотных питательных средах
5
представляют собой шероховатые, матовые, выпуклые образования ярко
оранжево-желтого цвета. Оранжево-желтая окраска колоний обусловлена
пигментом, который образуется при культивировании Mycobacterium B в
5
темноте. Длительность роста Mycobacterium B на питательных средах
5
составляет от 5 до 7 суток. На элективных синтетических питательных средах
(например, Миддлбрука 7H9 с 10% ростовой добавки ADC, 7H10 с 10%-ми
ростовой добавки OADC) Mycobacterium B растет плохо или вообще не растет.
5
В мазках из молодых культур Mycobacterium B имеют вид коротких,
5
толстых палочек, расположенных поодиночке. В старых культурах имеют
овоидную, колбовидную или веретенообразную форму. Окрашиваются по
Циль-Нильсену в малиново-красный цвет.
Mycobacterium B проявляют более выраженную каталазную активность, чем
5
вирулентные виды микобактерий, и в большей степени, чем последние,
разлагают перекись водорода. Пероксидаза Mycobacterium B более устойчива к
5
температурным воздействиям, чем таковая вирулентных микобактерий.
Mycobacterium B не свертывают молоко, не разжижают желатины.
5
По классификации патогенных для человека микроорганизмов
Mycobacterium B , как и все микобактерии, относятся к IV группе опасности,
5
являются непатогенными микроорганизмами.
Mycobacterium B используют для оценки эффективности камерного
5
обеззараживания вещей, одежды и других объектов, как наиболее адекватную
модель возбудителя туберкулеза к температурному воздействию.
Тест-микроорганизм Mycobacterium B хранится в музее ФГУН
5
«Научно-исследовательский институт дезинфектологии» Роспотребнадзора:
117246, Москва, Научный проезд, д. 18.
Mycobacterium terrae (ATCC 15755, DSM 43227) представляют собой короткие прямые палочки малиново-красного цвета, располагающиеся в мазке параллельно друг другу, наподобие частокола. Микобактерий M. terrae неподвижные, грамположительные, не образующие спор и капсул. В связи с высоким содержанием миколовых кислот плохо окрашиваются обычными методами, но хорошо окрашиваются по Циль-Нильсену в малиново-красный цвет.
Микобактерии M. terrae — аэробы, температурные границы роста — от 25 до 37 °C, оптимальная температура — 37 °C.
M. terrae требовательны к питательным средам, растут на элективных средах (реакция среды почти нейтральная (pH 6,4 — 7,0): Левенштейна-Йенсена, «Новая», Миддлбрука 7H9 с 10%-ми ростовой добавки ADC, 7H10 с 10%-ми ростовой добавки OADC и др. Колонии M. terrae на среде Левенштейна-Йенсена — шероховатые и матовые выпуклые округлые образования, на среде «Новая» — гладкие и блестящие или с молочным или желтоватым оттенком. Длительность роста M. terrae на питательных средах зависит от состава среды. При оптимальной температуре инкубирования на «богатых» питательных средах Левенштейна-Йенсена и «Новая» рост M. terrae может появиться на 5 — 7 сутки. На «голодных» питательных средах инкубация M. terrae составляет до 8 недель.
M. terrae гидролизуют Твин-80 (т.к. продуцируют липазы), имеют высокоактивную каталазу и проявляют бета-галактазную активность. Восстанавливают теллурит калия до металлического теллура в течение 9 дней.
По классификации патогенных для человека микроорганизмов относится к IV группе опасности, является непатогенным микроорганизмом.
Приложение 2
рекомендуемое
Методики приготовления питательных сред для культивирования тест-микобактерий, предназначенных для изучения и оценки туберкулоцидной активности ДС и их субстанций.
Методика приготовления среды Петраньяни.
1. В рецептуру питательной среды входят следующие компоненты:
Пептон 2 г
Крахмал 12 г
Молоко 300 мл
Яйца 10 шт.
Картофель 2 шт.
Малахитовый зеленый 2 г
Глицерин 24 мл
Вода 100 мл
2. В стерильную колбу (1 л) помещают 12 г крахмала и 2 г пептона. Затем добавляют 2 шт. мелко нарезанного картофеля (картофель предварительно моют с мылом и щеткой, чистят). Доливают в колбу 300 мл свежего цельного молока и подогревают на водяной бане в течение часа (с момента начала свертывания молока) при постоянном помешивании. В другую стерильную колбу разбивают 8 диетических яиц и 2 желтка. Свежие диетические куриные яйца со сроком хранения не более 7 суток без трещин и дефектов скорлупы тщательно отмывают в теплой проточной воде с помощью ручных щеток и щелочного мыла, затем оставляют на 30 мин. в мыльном растворе. Тщательно промывают в проточной воде и погружают в 70%-ный этиловый спирт на 30 мин. Перед тем, как начать работу с чистыми и сухими яйцами, рекомендуется тщательно вымыть руки с мылом и щеткой. Яйца тщательно взбивают до однородной массы и переливают в колбу со смесью крахмала, пептона, картофеля и молока. Сюда же добавляют 24 мл глицерина и 16 мл 2%-ного раствора малахитовой зелени. Полученную смесь тщательно перемешивают, фильтруют через стерильный марлевый фильтр в стерильную колбу. Для свертывания среды используют специальные аппараты-свертыватели типа «АСПС». Пробирки с разлитой в них средой помещают в специальные штативы с подобранным углом наклона для формирования скошенной поверхности среды высотой 8 — 10 см. Штативы устанавливают в свертыватель и проводят коагуляцию при 85 °C в течение 45 мин.
3. Приготовление раствора малахитового зеленого:
Малахитовый зеленый 2 г
Стерильная дистиллированная вода 100 мл
Взвешенный порошок малахитового зеленого растворяют в стерильной теплой дистиллированной воде и помещают раствор в термостат на 1 — 2 — 2,5 ч для большего растворения. Затем фильтруют раствор через бумажный фильтр, разливают по флаконам или небольшим колбам и стерилизуют в паровом стерилизаторе при 1 атм. (121 °C) в течение 30 мин. Приготовленный раствор не подлежит длительному хранению, и при появлении осадка или изменении окраски его заменяют свежим раствором.
Методика приготовления картофельно-глицеринового бульона.
Готовят картофельный отвар. На 1 л питьевой воды берут 200 г очищенного (картофель предварительно моют с мылом и щеткой, чистят) картофеля, отваривают в течение 30 мин. с момента закипания, остужают и отстаивают. Затем фильтруют через ватно-марлевый фильтр и доводят водой до первоначального объема, добавляют 10 мл глицерина. pH картофельного бульона 7,0 — 7,2. Бульон стерилизуют в паровом стерилизаторе при 1 атм. (121 °C) в течение 30 мин.
Методика приготовления картофельно-глицеринового агара.
В рецептуру питательной среды входят следующие компоненты:
Картофельно-глицериновый бульон:
Пептон 5 г
Мел 1 г
Агар-агар 20 г
Вода 1 л
К картофельно-глицериновому бульону добавляют 5 г пептона, 20 г агар-агара, 1 г мела, устанавливают pH 7,0 — 7,2. Агар расплавляют и разливают в пробирки или колбы. Стерилизуют в паровом стерилизаторе при 1 атм. (121 °C) в течение 30 мин.
Методика приготовления среды Миддлбрука 7H9 бульон с 10%-ми ростовой добавки ADC (MADC-бульон для хранения замороженных культур при минус 70 °C).
Миддлбрук 7H9 порошок бульона 4,7 г
Глицерин (C H O ) 100,0 мл
3 8 3
Вода стерильная, дистиллированная 750,0 мл
Ингредиенты соединить, перемешать, стерилизовать в паровом стерилизаторе при 1,1 атм. (121 °C) в течение 10 мин., охладить до 45 °C. Добавить в асептических условиях 100 мл ростовой добавки ADC и стерильной дистиллированной воды до 1000,0 мл.
pH среды будет эквивалентен 6,6 +/- 0,2 в бульоне, остывшем до 25 °C.
Методика приготовления среды Левенштейна-Йенсена.
Среда Левенштейна-Йенсена — международная среда, широко используемая в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности.
Это плотная яичная среда, на которой видимый рост M. terrae получают приблизительно на 7 — 10-й день после посева. Для чистоты эксперимента желательно использовать готовую питательную среду в стандартных пробирках с завинчивающимися крышками. При невозможности приобретения готовой среды ее можно приготовить самостоятельно.
В состав среды Левенштейна-Йенсена входят следующие компоненты:
1. Раствор минеральных солей:
Калий однозамещенный фосфорнокислый 2,4 г
Магний лимонно-кислый 0,6 г
Магний сернокислый 0,24 г
L-аспарагин 3,6 г
Глицерин 12,0 мл
Вода дистиллированная 600 мл
Вышеперечисленные ингредиенты растворяют в теплой дистиллированной воде в указанной последовательности при слабом подогревании (не доводя до кипения) на водяной бане. L-аспарагин рекомендуется растворять отдельно и вносить последним. Затем солевой раствор стерилизуют в паровом стерилизаторе при 1 атм. (121 °C) в течение 20 — 30 мин. Срок хранения раствора составляет 3 — 4 недели при комнатной температуре.
2. Раствор малахитового зеленого:
Малахитовый зеленый 2 г
Стерильная дистиллированная вода 100 мл
Взвешенный порошок малахитового зеленого растворяют в стерильной теплой дистиллированной воде и помещают раствор в термостат на 1 — 2 — 2,5 ч для большего растворения. Затем фильтруют раствор через бумажный фильтр, разливают по флаконам или небольшим колбам и стерилизуют при 1 атм. (121 °C) в течение 30 мин. Приготовленный раствор не подлежит длительному хранению, и при появлении осадка или изменении окраски его заменяют свежим раствором.
3. Яичная масса.
Свежие диетические куриные яйца со сроком хранения не более 7 суток без трещин и дефектов скорлупы тщательно отмывают в теплой проточной воде с помощью ручных щеток и щелочного мыла, затем оставляют на 30 мин. в мыльном растворе. Тщательно промывают в проточной воде и погружают в 70%-ный этиловый спирт на 30 мин. Перед тем, как начать работу с чистыми и сухими яйцами, рекомендуется тщательно вымыть руки с мылом и щеткой. Затем в стерильном боксе разбивают яйца стерильным ножом в стерильную посуду, доводя общий объем яичной массы до 1 л (для этого требуется в среднем 20 — 25 яиц, в зависимости от их величины). Тщательно взбивают яичную массу стерильным венчиком или в стерильном миксере при минимальной скорости.
Приготовление среды.
В большую стерильную емкость, соблюдая правила асептики, помещают следующие растворы:
Раствор минеральных солей 600 мл
Гомогенизированная яичная масса 1000 мл
Смесь тщательно перемешивают и фильтруют через 4-слойный стерильный марлевый фильтр. Добавляют 20 мл раствора малахитового зеленого, тщательно перемешивают, избегая образования пены, и в течение не более 15 минут разливают в пробирки приблизительно по 5 мл, следя за тем, чтобы в растворе не сформировался осадок.
Коагуляция (свертывание среды).
Для свертывания среды используют специальные аппараты-свертыватели типа «АСПС». Пробирки с разлитой в них средой помещают в специальные штативы с подобранным углом наклона для формирования скошенной поверхности среды высотой 8 — 10 см. Штативы устанавливают в свертыватель и проводят коагуляцию при 85 °C в течение 45 мин.
Хранение среды.
Готовую питательную среду проверяют на стерильность, помещая 10 пробирок из вновь приготовленной партии в термостат при 37 °C на 3 суток. По истечении времени инкубации в пробирках на питательной среде должен отсутствовать микробный рост. В случае наличия роста приготовленная партия среды подлежит уничтожению. Приготовленная партия среды должна иметь этикетку с датой изготовления и сохраняться в холодильнике при 4 °C с тщательно закрытыми пробками для предотвращения высыхания. Срок хранения среды не должен превышать 4 недели.
Методика приготовления среды «Новая».
Среда «Новая» — это плотная яичная среда, на которой хороший рост колоний M. terrae получают приблизительно на 5 — 7-й день после посева материала проб.
В рецептуру питательной среды «Новая» входят следующие компоненты в весовых %:
Калий фосфорнокислый одноосновной 0,05
Натрий лимонно-кислый 0,05
Магний сернокислый 0,05
Натрий пировинограднокислый гликокол 0,2
Глицерин 3,6
Малахитовая зелень 0,036
Желтки яиц 50,0
Дистиллированная вода до 100,0
Способ получения концентрированной питательной среды заключается в смешивании сухих навесок ингредиентов солей (кроме бактерицидного красителя) с желточной массой, стерилизации ингредиентов 70%-м этиловым спиртом, растворении бактерицидного красителя в глицерине и соединении всех компонентов среды.
Для получения 1 литра концентрированной питательной среды необходимо:
— сделать навески: однозамещенного фосфорно-кислого калия — 1 г, лимоннокислого натрия — 1 г, серно-кислого магния — 1 г, натрия пировиноградно-кислого гликокола — 4 г и каждую навеску поместить в стерильную фарфоровую ступку;
— обеззаразить навески путем смачивания каждой навески 1 мл 70%-ного этилового спирта. Затем поместить ступки с навесками в термостат при температуре 37 °C и высушить при периодическом помешивании в течение 45 мин.;
— приготовить 1 л желточной массы, 50 штук куриных яиц обработать снаружи с целью обеззараживания 70%-м спиртом. Затем отделить белок от желтка. Перенести желточную массу в мерную колбу и тщательно гомогенизировать.
Приготовить желточно-солевую смесь. К 1 литру желточной массы добавить обеззараженные навески и перемешать.
Приготовить раствор бактерицидного красителя. Навеску 700 мг малахитовой зелени смочить 1 мл 70%-ного спирта и соединить с 70 мл глицерина (это соответствует 1%-ному раствору малахитового зеленого в глицерине).
Получение концентрированной питательной смеси. Производят соединение 1 л желточно-солевой смеси с 70 мл 1%-ного раствора малахитового зеленого в глицерине и тщательно гомогенизируют. Полученную концентрированную питательную смесь (среду) выдерживают в течение суток при комнатной температуре и разливают среду во флаконы емкостью 250 мл, которые герметично упаковывают и маркируют. Укупоренные флаконы с концентрированной питательной средой хранят в холодильнике при 3 — 5 °C в течение 3 — 4 недель.
Приготовление рабочей (используемой при тестировании ДС) плотной питательной среды в пробирках. К концентрированной питательной среде добавляют равный объем стерильной дистиллированной воды (1:1), гомогенизируют, разливают по 5 мл в пробирки. Для образования скоса питательной среды пробирки укладывают в наклонном положении в свертыватель, предварительно нагретый до 90 °C. Среду коагулируют 20 мин. при температуре 82 — 83 °C. Контроль приготовленной партии среды на стерильность осуществляют также, как описано для среды Левенштейна-Йенсена.
Пробирки с питательной средой могут храниться в холодильнике при температуре 5 °C в течение 4 недель. При длительном хранении необходимо пробирки герметично укупорить и поместить в полиэтиленовые пакеты, чтобы предотвратить высыхание среды.
Приложение 3
рекомендуемое
Материалы и оборудование, необходимые для изучения туберкулоцидной активности ДС
Химические вещества
Магний сернокислый MgSO x 7H O ГОСТ 4523-77
4 2
Натрий лимонно-кислый C H O Na x 5,5H O ГОСТ 22280-86
6 5 7 3 2
Калий фосфорнокислый однозамещенный KH PO ТУ-6-09-5324-87
2 4
Натрий пировинограднокислый ТУ 6-09-08-990-83
Глицерин C H O ГОСТ 6259-75
3 8 3
Малахитовый зеленый C H O N ТУ-6-09-1557-77
52 54 12 4
Вода дистиллированная ГОСТ 6709-77
Желтки куриных яиц
Магний лимонно-кислый Mg (C H O ) x 14H O ТУ-6-09-1770-77
3 6 5 7 2 2
L-аспарагин C H N O x H O импортный реактив
4 8 2 3 2
Миддлбрук 7H9 порошок бульона импортная среда
10% ADC ростовая добавка импортный реактив
нейтрализующий бульон Ди-Ингли фирма HIMEDIA
спирт этиловый, ректификационный технический ГОСТ 18300-72
стерильная дистиллированная вода
Оборудование
Весы лабораторные (например, весы для химических
реактивов с точностью до 0,01 г, рекомендованные
к применению Приказом МЗ РФ N 109) ГОСТ 24104-80
Аппарат для свертывания питательных сред, например
АСПС — «Торгмаш» рег. N 29/07020401/
3573-02
Термостат на 37 °C, например термостат суховоздушный
ТВ-80-«ПК-К» рег. N 98/219-151
Низкотемпературная морозильная камера для хранения
тест-культур микроорганизмов, например морозильник
сверхнизких температур MDF-4086S рег. N 60202380
Камера на 1 или 2 куб. м с необходимыми
приспособлениями для изучения обеззараживания воздуха
Микроскоп
Аэрозольный генератор
Гидропульт, автомакс, «Квазар»
Шейкер, например шейкер лабораторный S-3.02 рег. N 14413
ГОСТ 12.2.05
Бытовой холодильник (например,
холодильник-морозильник STINOL 256Q) сер. N 103410881041
Плита электрическая бытовая ГОСТ 14919-83
Штативы лабораторные химические ТУ 48-0534-8-87
Тест-объекты: ткань бязевая и батистовая; поверхности размером 10 x 10 см из различных материалов; предметы ухода за больными; игрушки мелкие и крупные из различных материалов; медицинские инструменты, разнообразные по форме, характеру поверхности и материалу; жесткий и гибкий эндоскопы; набор резиновых и пластиковых трубок; столовая посуда и приборы; лабораторная посуда и посуда из-под выделений; бинты, вата.
Секундомер механический ГОСТ 8.423-81
Термометры ГОСТ 215-73
Карандаш по стеклу ТУ 46-22-904-78
Лабораторная посуда
Пипетки вместимостью 1,0 и 10,0 куб. см 2 класса точности ГОСТ 20292-74
Пробирки химические ГОСТ 10515-6
Чашки Петри ГОСТ 25336-82
Спиртовка лабораторная или газовая горелка ГОСТ 25336-82
Цилиндры вместимостью 100,0 и 250,0 куб. см ГОСТ 1770-74
Колбы вместимостью 100,0; 250,0 и 1000,0 куб. см ГОСТ 25336-82
Склянки Дрекселя
5.3. Методы изучения и оценки фунгицидной
активности дезинфицирующих средств
5.3.1. Общие положения
5.3.1.1. Тест-микроорганизмы для изучения фунгицидной
активности ДС и их субстанций. Требования к тест-грибам
При изучении фунгицидной активности ДС и их субстанций в качестве тест-микроорганизмов используют культуры грибов: Candida albicans (штамм 15) — для оценки фунгицидной активности в отношении возбудителей кандидозов, Trichophyton gypseum (муз. штамм НИИД) — для оценки фунгицидной активности в отношении возбудителей дерматофитий, Aspergillus niger (муз. штамм НИИД) для оценки фунгицидной активности в отношении плесневых грибов рода Aspergillus.
При сертификационных испытаниях [66] и экспертной оценке ранее зарегистрированных ДС набор тест-микроорганизмов может быть ограничен наиболее устойчивыми представителями каждой группы.
Условия культивирования тест-грибов. Тест-микроорганизмы культивируют на следующих питательных средах:
C. albicans — на бульоне Сабуро, агаре Сабуро при температуре плюс 27 °C в течение 2 — 10 суток;
T. gypseum — на бульоне Сабуро, агаре Сабуро при температуре плюс 27 °C в течение 28 суток;
A. niger — на бульоне Сабуро, агаре Сабуро при температуре 37 °C в течение 2 суток, а затем выдерживают 3 — 5 суток при температуре (20 +/- 2) °C в темном месте.
Музейные культуры указанных выше микроорганизмов хранят при температуре (3 +/- 1) °C в ампулах (после лиофильной сушки) или на плотных питательных средах (посев уколом) под слоем стерильного вазелинового масла (толщина слоя 1,5 — 3 мм), а рабочие культуры — на скошенном агаре или в бульоне.
Тест-микроорганизмы должны иметь типичные биохимические, морфологические, тинкториальные, культуральные и ферментативные свойства, присущие данному виду, и обладать стандартной устойчивостью к эталонным ДС: растворам хлорамина, перекиси водорода, Катамина АБ — алкилдиметилбензиламмония хлорида АДБАХ, глутарового альдегида, табл. 5.7.
Таблица 5.7
УСТОЙЧИВОСТЬ ТЕСТ-МИКРООРГАНИЗМОВ
К ДЕЗИНФИЦИРУЮЩИМ СРЕДСТВАМ
┌───────────────────┬────────────┬────────────────────────────────────────┐
│ Дезинфицирующее │Концентрация│Время гибели тест-грибов, мин., не менее│
│ средство │ раствора ├─────────────┬────────────┬─────────────┤
│ │ по ДВ, % │ C. albicans │ T. gypseum │ A. niger │
├───────────────────┼────────────┼─────────────┼────────────┼─────────────┤
│Хлорамин │1,0 <*> │35 │50 │- │
├───────────────────┼────────────┼─────────────┼────────────┼─────────────┤
│АДБАХ │0,5 │5 │25 │- │
├───────────────────┼────────────┼─────────────┼────────────┼─────────────┤
│Глутаровый альдегид│1,0 │15 │- │- │
│ │2,0 │- │30 │- │
│ │2,5 │- │- │60 │
├───────────────────┼────────────┼─────────────┼────────────┼─────────────┤
│Перекись водорода │4,0 │- │50 │- │
│ │6,0 │> 60 │- │60 │
├───────────────────┴────────────┴─────────────┴────────────┴─────────────┤
│ <*> Концентрация раствора указана по препарату. │
└─────────────────────────────────────────────────────────────────────────┘
Методы приготовления суспензии тест-микроорганизмов. Определение биологической концентрации тест-грибов в суспензии. Культуры тест-грибов подвергают контролю их качества. В частности, непосредственно перед использованием культур для исследовательских целей необходимо убедиться в том, что тест-штаммы, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста культур тест-грибов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды.
Рабочие суспензии тест-грибов готовят из культуры данного тест-штамма, выращенного на питательной среде.
Культуру T. gypseum, выращенную на бульоне Сабуро при температуре 27 °C
в течение 28 суток, извлекают петлей из пробирки, помещают в фарфоровую
ступку и растирают с небольшим количеством стерильного физиологического
раствора до гомогенной взвеси с минимальным размером частиц. Полученную
суспензию фильтруют через стерильный ватно-марлевый фильтр и доводят с
помощью физиологического раствора по оптическому стандарту мутности (ФГУН
Государственного научно-исследовательского института стандартизации и
контроля медицинских биологических препаратов им. Л.А. Тарасевича
9
Роспотребнадзора) N 20 до концентрации 2 x 10 КОЕ/мл.
Культуру C. albicans выращивают на агаре Сабуро в течение 2 суток при температуре 27 °C. Затем ее смывают с питательной среды небольшим количеством стерильного физиологического раствора и тщательно перемешивают. Полученную суспензию фильтруют и разводят так же, как и культуру T. gypseum.
Культуру A. niger, выращенную на бульоне Сабуро в течение 2 суток и
выдержанную в течение 3 — 5 суток в темном месте, извлекают петлей из
пробирки, помещают в фарфоровую ступку и растирают с небольшим количеством
стерильного физиологического раствора до гомогенной суспензии с минимальным
размером частиц. Полученную взвесь фильтруют через стерильный
9
ватно-марлевый фильтр и доводят до концентрации 2 x 10 КОЕ/мл по
оптическому стандарту мутности.
В связи с тем, что суспензия может содержать наряду с живыми мертвые микроорганизмы, необходимо определять биологическую концентрацию тест-грибов. Для этого проводят десятикратные разведения суспензии тест-гриба в стерильной дистиллированной воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (агар Сабуро). После определенного времени инкубации при соответствующей температуре подсчитывают количество выросших колониеобразующих единиц КОЕ и определяют количество жизнеспособных клеток в одном мл суспензии.
Устойчивость тест-грибов к растворам эталонных ДС определяют методом батистовых тест-объектов (п. 5.3.2.2). Проверку устойчивости проводят не реже 1 раза в месяц. При снижении резистентности культур делают их пересевы на обогащенные питательные среды до восстановления устойчивости.
Приготовление рабочих растворов ДС и их субстанций проводят в соответствии с п. 5.1.1.2.
5.3.2. Методы исследований и оценки результатов
фунгицидной активности ДС и их субстанций in vitro
Целью исследований является определение уровня и спектра фунгицидной активности ДС и их субстанций.
Субстанции (действующие вещества), предназначенные для производства ДС должны соответствовать следующим требованиям:
— хорошо растворяться в воде или других растворителях;
— обладать фунгицидным действием, т.е. убивать грибы, а не задерживать их рост;
— иметь удовлетворительные органолептические (по цвету, запаху) и физико-химические (по растворимости, биоразлагаемости и стабильности при хранении и др.) свойства.
Фунгицидную активность ДС и их субстанций определяют суспензионным методом или методом батистовых тест-объектов.
5.3.2.1. Суспензионный метод
Для приготовления растворов ДС в различных концентрациях ДВ средства
разводят или растворяют в стерильной питьевой воде и по 4,5 мл разливают в
стерильные пробирки. Добавляют по 0,5 мл суспензии тест-гриба
9
(п. 5.3.1.1), содержащей 1 x 10 КОЕ/мл, и тщательно перемешивают. Через
определенные интервалы времени (15 мин.) по 0,5 мл взвеси «тест-
микроорганизм + ДВ» добавляют к 4,5 мл соответствующего нейтрализатора.
Тщательно перемешивают и оставляют на 5 мин. Затем по 0,5 мл вносят в
пробирку с 4,5 мл стерильной питьевой воды, после чего по 0,1 мл из этой
пробы вносят в пробирки с 5 мл жидкой и на поверхность твердой питательных
сред. В контрольных опытах вместо ДВ используют стерильную питьевую воду, а
посевы делают в среду без нейтрализатора и с нейтрализатором.
Температура инкубирования посевов в термостате и сроки учета результатов опыта зависят от вида микроорганизма (п. 5.3.1.1). Для подтверждения снятия биоцидного действия ДВ из пробирок, в которых отсутствовал рост тест-грибов, ежедневно делают пересев по 0,5 мл в 4,5 мл новой питательной среды.
Результаты опыта оценивают по наличию или отсутствию роста грибов в жидкой и на твердой питательной среде. Сравнение проводят с контролем опыта, которым является посев тест-грибов в питательную среду без добавления действующего вещества.
Эффективной считают концентрацию средства, при которой трижды повторенный опыт при определенном времени воздействия дает отрицательный результат (отсутствие роста грибов) при наличии типичного роста тест-гриба в контроле.
5.3.2.2. Метод батистовых тест-объектов
Приготовление суспензии грибов проводят в соответствии с п. 5.3.1.1. Подготовку батистовых тест-объектов, их контаминацию и постановку эксперимента осуществляют так, как указано в п. 5.1.2.2.
Хранят контаминированные тест-объекты в чашках Петри в холодильнике при температуре 4 °C.
Срок хранения тест-объектов: контаминированных C. albicans — 4 суток, T. gypseum и A. niger — 30 суток.
Критерием активности ДВ субстанции является 100%-ная гибель тест-грибов (отсутствие роста в опытных пробах) при времени дезинфекционной выдержки: C. albicans, T. gypseum, A. niger — не более 60 мин.
5.3.2.3. Методы исключения фунгистатического
действия действующих веществ
Для определения фунгицидного и исключения фунгистатического действия ДВ по истечении экспозиции необходимо прекратить воздействие ДВ на тест-культуру. Это достигается путем использования следующих методов:
— применения химического нейтрализатора;
— посева в большой объем питательной среды;
— ежедневного пересева на новые питательные среды.
Применение химического нейтрализатора ДВ, контроль его эффективности и полноты нейтрализации ДВ при воздействии на культуры грибов проводят в соответствии с п. 5.1.2.3.
Критерии отбора действующих веществ субстанций. Критерием отбора действующего вещества в качестве субстанции для создания ДС, предназначенных для обеззараживания объектов, контаминированных тест-грибами, является наличие у него фунгицидной активности.
Гибель тест-микроорганизмов должна составлять 100% при времени действия мин. ДС в минимальной концентрации в отношении:
— грибов C. albicans, T. gypseum — не более 60 мин.;
— A. niger — не более 120 мин.
5.3.2.4. Методы изучения факторов, влияющих
на фунгицидную активность ДС и их субстанции
Исследования включают определение спектра фунгицидного действия ДС, а при проведении углубленного изучения дополнительно определяют влияние различных факторов (pH, температура, органические вещества) на фунгицидную активность растворов ДС.
Изучение спектра фунгицидной активности и влияние на активность различных факторов проводят методом батистовых тест-объектов, контаминированных тест-культурами C. albicans, T. gypseum, A. niger.
Изучение зависимости активности ДС от присутствия органических веществ и pH, а также изучение влияния температуры на активность исследуемого ДС проводят в соответствии с п. 5.1.2.4.
Критерии оценки фунгицидной активности ДС. Для ДС, предназначенных для обеззараживания различных объектов, гибель тест-грибов должна составлять 100% при времени действия мин. дезинфицирующего раствора в минимальной концентрации ДВ в отношении:
— грибов C. albicans, T. gypseum — не более 60 мин.;
— A. niger — не более 120 мин.
Влияние факторов среды на активность ДС учитывается при разработке оптимальных режимов и применении ДС в практике.
5.3.3. Методы исследования фунгицидной эффективности ДС,
предназначенных для обеззараживания различных объектов
внешней среды, контаминированных тест-грибами
Цель исследования — разработка режимов применения ДС с учетом условий их дальнейшего применения в практике для обеззараживания ИМН, предметов ухода за больными, игрушек, белья, поверхностей, посуды, выделений и пр., в зависимости от вида контаминации, концентрации действующего вещества, времени воздействия, нормы расхода, характера объекта, наличия на нем органического загрязнения и его специфики, температуры, способа и кратности обработки.
5.3.3.1. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания ИМН
При выборе ДС для изучения с целью последующей рекомендации для обеззараживания изделий медицинского назначения (ИМН) следует учитывать:
— назначение и кратность применения изделия (многократного или однократного применения);
— наличие у средства негативных свойств, например корродирующего или фиксирующего действия и др., ограничивающих возможности его использования или требующих индивидуального методического подхода при исследовании;
— материал (материалы), из которого изготовлено изделие;
— функциональные особенности изделия и условия его эксплуатации, обусловливающие особенности методики проведения эксперимента и последующих рекомендаций по технологии их обеззараживания.
Определения эффективности ДС при обработке ИМН из различных материалов (кроме эндоскопов). В качестве тест-изделий используют стерильные инструменты и изделия медицинского назначения (катетеры, микропипетки, пластмассовые шпатели и др.) из различных материалов (металлов, резин, стекла, пластмасс) или имитирующие их тест-объекты. Перечень инструментов, взятых в эксперимент, должен включать не менее трех инструментов, имеющих замковые части (щипцы, ножницы, корнцанг) и не менее двух, не имеющих замковые части (пинцеты, шпатели), а также стоматологические, в т.ч. вращающиеся, инструменты (не менее 4): — бор, бурав корневой, зеркало, диск шлифовальный. В качестве тест-изделий из резин, стекла, пластмасс используют фрагменты изделий: катетеров, микропипеток, шпателей и пр.
В качестве тест-грибов используют суспензии культур C. albicans, T. gypseum. На поверхность тест-изделия (у замковых изделий — в область замка, а при наличии каналов и полостей — также в канал изделия) с помощью пипетки наносят по 0,1 мл 1-млрд. суспензии того или иного вида тест-микроорганизмов, содержащей 40% инактивированной лошадиной сыворотки. Тест-изделия подсушивают до полного высыхания. Мелкие тест-изделия погружают в указанную суспензию грибов на 15 мин., затем их извлекают и подсушивают (до полного высыхания). Дезинфицирующие растворы готовят на стерильной питьевой воде.
После подсушивания контаминированные изделия полностью погружают в раствор испытываемого ДС, заполняя им все каналы и полости изделий, избегая образования воздушных пробок. Инструменты, имеющие замковые части, погружают раскрытыми, предварительно сделав ими в растворе ДС несколько рабочих движений для лучшего проникновения раствора в труднодоступные участки изделий в области замка. Толщина слоя раствора ДС над изделиями должна быть не менее 1 см. Параллельно для контроля изделия погружают в воду.
Через определенное время (от 5 до 120 мин.) изделия извлекают из раствора и марлевой салфеткой размером 5 x 5 кв. см, пропитанной нейтрализатором, с поверхности изделия делают смывы, затем салфетку помещают в пробирку с 10 мл того же нейтрализатора и встряхивают с бусами в течение 5 — 10 мин. Канал изделия промывают раствором нейтрализатора. Мелкие изделия погружают в раствор нейтрализатора на 5 мин., а затем переносят в пробирки с жидкой питательной средой. Для контроля эффективности обеззараживания смывную жидкость с поверхности изделия и из канала засевают на соответствующие питательные среды (п. 5.3.1.1). Посевы выдерживают в термостате при температуре и времени, оптимальных для роста использованного тест-микроорганизма.
Кратность постановки эксперимента должна быть достаточной для получения статистически достоверных результатов.
Эффективным считают режим (концентрация-время-температура), обеспечивающий гибель тест-грибов на всех изделиях. При наличии положительных проб эксперимент повторяют, увеличивая концентрацию или время воздействия.
Критерий эффективности обеззараживания — 100%-ная гибель C. albicans, T. gypseum.
Время обеззараживания изделий, контаминированных C. albicans, T. gypseum, — не более 120 мин.
5.3.3.2. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания эндоскопов, включая
дезинфекцию высокого уровня ДВУ
Для определения эффективности ДС при обеззараживании эндоскопов в качестве тест-объектов используют стерильные фрагменты эндоскопа или эндоскоп (гибкий — гастроскоп, жесткий — цистоскоп), а в качестве тест-гриба — C. albicans.
На наружную поверхность тест-объекта наносят по 0,1 мл 1-млрд. суспензии C. albicans, содержащей 5% сыворотки; через канал эндоскопа с помощью пипетки пропускают не менее 5 мл такой же суспензии. После этого эндоскоп подсушивают в течение 20 мин. Затем контаминированное изделие погружают в раствор ДС, заполняя полости и каналы эндоскопа. Через определенные интервалы времени в течение 5 — 60 мин. изделие извлекают и делают смыв с наружной поверхности марлевой салфеткой, смоченной в растворе нейтрализатора. Канал изделия промывают нейтрализатором. Смывную жидкость засевают на соответствующие питательные среды.
Критерий эффективности обеззараживания эндоскопов — 100%-ная гибель C. albicans не более чем через 60 мин.
Определение эффективности ДС при дезинфекции высокого уровня ДВУ эндоскопов. Данная методика предназначена для разработки режимов дезинфекции высокого уровня ДВУ эндоскопов при проведении «нестерильных» диагностических и лечебных манипуляций.
ДС, предназначенное для ДВУ эндоскопов, должно обеспечивать гибель на эндоскопах C. albicans.
Для исследования выбирают ДС, эффективное для стерилизации эндоскопов, и испытания его проводят при тех же условиях (концентрация, температура), что и при стерилизации эндоскопов, определяя необходимое время дезинфекционной выдержки для достижения гибели тест-микроорганизма. При определении эффективности средств для ДВУ эндоскопов в качестве тест-объектов используют фрагменты канала гибкого эндоскопа или его имитаторы в виде трубок из пластика длиной 2 см, диаметром 2 мм.
Стерильные тест-объекты искусственно контаминируют, нанося с помощью
дозатора/микропипетки в центральную часть канала и на поверхность каждой
6
трубки суспензию C. albicans из расчета 10 клеток C. albicans на каждое
изделие. Для имитации органического загрязнения к суспензии микроорганизмов
перед контаминацией объекта добавляют 2% инактивированной лошадиной
сыворотки.
Контаминированные тест-объекты подсушивают при комнатной температуре (18 — 22 °C) в течение 20 мин.
Дезинфицирующий раствор готовят на стерильной питьевой воде согласно п. 1.2. Обработку исследуемым ДС осуществляют способом погружения в испытуемый дезинфицирующий раствор. Через определенные интервалы времени, зависящие от химического состава средства, в промежутке от 5 до 60 мин., тест-изделия извлекают из дезинфицирующего раствора, помещают на 5 — 10 мин. в раствор соответствующего нейтрализатора.
Затем тест-изделия помещают в пробирки с питательной средой для проверки эффективности обеззараживания: для C. albicans — бульон Сабуро.
Посевы выдерживают в термостате при температуре и времени, оптимальных для роста использованного тест-микроорганизма: для C. albicans — 27 °C 7 суток, после чего проводят учет результатов эксперимента.
В качестве контроля используют тест-объекты, контаминированные, как указано выше, и помещенные в воду на время дезинфекционной выдержки.
Кратность постановки эксперимента должна быть достаточной для получения статистически достоверных результатов.
Эффективным считают режим (концентрация-время-температура), обеспечивающий гибель тест-микроорганизма на всех тест-изделиях при отсутствии его роста в питательной среде. Положительной считается проба с характерным ростом микроорганизма, дающая изменение питательной среды (помутнение, осадок, хлопья и т.д.) или положительный результат (характерный рост микроорганизма) при пересеве на плотную питательную среду, или обнаружение микроорганизмов в растворе применявшегося нейтрализатора. При наличии положительных проб эксперимент повторяют, увеличивая время воздействия, но не более чем до 60 мин.
При необходимости эффективность разработанного режима проверяется в практических условиях.
Критерий эффективности обеззараживания — 100%-ная гибель C. albicans.
Время обеззараживания — не более 60 мин.
Примечание: средство должно обладать стерилизующим действием [16, 73].
5.3.3.3. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания
стоматологических оттисков
При разработке режимов обеззараживания стоматологических оттисков в качестве тест-микроорганизма используют C. albicans. В качестве тест-объектов используют оттиски из альгинатных, силиконовых или других материалов. Для изготовления оттисков слепочную массу, полученную в соответствии с рекомендациями изготовителя, помещают в пластмассовую или металлическую ложку и делают оттиск с пластмассовых зубных протезов с моделированной десной. На оттиски наносят по 0,1 мл 1-млрд. суспензии C. albicans (с добавлением 40% инактивированной сыворотки), подсушивают их в течение 2 — 3 мин., затем полностью погружают в раствор ДС. При установленном фиксирующем действии ДС оттиски перед погружением в дезинфицирующий раствор промывают проточной питьевой водой. Параллельно для контроля контаминированные оттиски погружают в воду. Через определенное время (5 — 30 мин.) оттиски извлекают из раствора и марлевой салфеткой, пропитанной нейтрализатором, делают смывы. Салфетки помещают в стерильные пробирки с бусами, содержащие 10 мл нейтрализатора, и встряхивают в течение 10 мин. Затем делают посев смывной жидкости на питательные среды для контроля эффективности обеззараживания.
Критерий эффективности обеззараживания — 100%-ная гибель C. albicans при времени обеззараживания не более 60 мин.
5.3.3.4. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания предметов
ухода за больными, игрушек
При изучении эффективности ДС используют тест-объекты, имитирующие предметы ухода за больными, или непосредственно предметы ухода (подкладные клеенки, резиновые грелки, судна, объекты из стекла и пластмасс: термометры, пластмассовые наконечники для клизм и др.), игрушки (пластмассовые, металлические, деревянные, резиновые, кроме мягких).
В качестве тест-микроорганизмов используют C. albicans и T. gypseum. Для имитации загрязнения используется 40% инактивированной лошадиной сыворотки или сыворотки крупного рогатого скота. Для этого перед контаминацией объектов к суспензии тест-грибов добавляют необходимое количество сыворотки.
Перед контаминацией тест-грибами тест-объекты подвергают механической очистке: моют водой с мылом и щеткой.
После подсушивания контаминированные тест-объекты располагают горизонтально и на них пипеткой наносят суспензию тест-грибов из расчета 0,5 мл 2-миллиардной взвеси на площадь в 100 кв. см. Суспензию равномерно распределяют по поверхности тест-объектов стеклянным шпателем, подсушивают (до полного высыхания) при комнатной температуре 18 — 20 °C и относительной влажности воздуха 50 — 60%, затем обрабатывают дезинфицирующим раствором.
Обработку предметов ухода за больными и игрушек проводят способами протирания, погружения и для крупных игрушек — орошения капельного.
Норму расхода дезинфицирующего раствора при обеззараживании способами протирания или орошения определяют в зависимости от способа обработки аналогично опытам по обеззараживанию поверхностей (п. 5.3.3.6). Двукратное протирание или орошение проводят через 5 — 15 мин. после первого.
При обработке способом погружения в дезинфицирующий раствор предметов ухода за больными и мелких игрушек последний должен полностью и с избытком покрывать все объекты. При погружении мелких игрушек необходимо препятствовать их всплытию.
Время обеззараживания объектов определяют в интервале от 15 до 120 мин. в зависимости от вида тест-гриба и наличия органического загрязнения.
Контрольные тест-объекты обрабатывают стерильной питьевой водой из того же расчета, что и опытные.
Контроль эффективности обеззараживания тест-объектов проводят следующим образом: марлевой салфеткой (размером 5 x 5 кв. см), смоченной в растворе нейтрализатора, соответствующего для данного ДС, тщательно протирают тест-объект и погружают ее в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин. при постоянном встряхивании. Отмывную жидкость сеют на 2 — 3 чашки по 0,2 — 0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температурах 28 или 37 °C и учитывают результаты через 2 — 28 суток, в зависимости от вида тест-микроорганизма.
Критерий эффективности обеззараживания — не менее 100% гибели тест-грибов.
Время обеззараживания объектов, контаминированных C. albicans, T. gypseum, — не более 120 мин.
5.3.3.5. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания белья
Эффективность обеззараживания белья ДС определяют с помощью тест-объектов, представляющих собой кусочки ткани из бязи размером 2 x 2 см. В качестве тест-культур используют грибы C. albicans и T. gypseum. Стерильные тест-объекты пропитывают 2-млрд. суспензией тест-грибов из расчета 20 мл на 10 тест-объектов и подсушивают в термостате. Далее контаминированные тест-объекты помещают в стерильные бязевые мешочки размером 5 x 8 см по 2 штуки в каждый.
При разработке режима обеззараживания загрязненного белья к суспензии грибов перед контаминацией тест-объектов добавляют 40% инактивированной сыворотки (6 мл 2-млрд. взвеси C. albicans или T. gypseum смешивают с 4 мл инактивированной сыворотки) или 40% фекальной эмульсии (6 мл 2-млрд. взвеси C. albicans смешивают с 4 мл фекальной эмульсии). Для приготовления фекальной эмульсии 8 г фекалий растирают в ступке с 20 мл воды. Контаминированные тест-объекты подсушивают в термостате при 37 °C в течение 20 — 25 мин. или 1,5 — 2,0 ч при комнатной температуре до полного высыхания.
При разработке режимов обеззараживания белья, не загрязненного выделениями, белье погружают в емкость с дезинфицирующим раствором из расчета 4 л раствора на 1 кг сухого белья. При разработке режимов обеззараживания белья, загрязненного выделениями, его погружают в емкость с дезинфицирующим раствором из расчета 5 л раствора на 1 кг сухого белья. Белье погружают в раствор последовательно, одну вещь за другой, следя за тем, чтобы между вещами не образовывались воздушные полости, препятствующие процессу дезинфекции. Мешочки с контаминированными тест-объектами распределяют между слоями белья (сверху, в середине, внизу). Через заданное время воздействия дезинфектанта (например, 15, 30, 60 мин.) извлекают по 1 мешочку с каждого уровня, стерильным пинцетом вынимают тест-объекты, переносят их в раствор нейтрализатора на 5 мин., затем промывают 5 мин. в стерильной питьевой воде, затем помещают в жидкие питательные среды. В контрольных опытах вместо дезинфицирующего раствора используют стерильную питьевую воду.
Критерий эффективности — 100%-ная гибель тест-грибов.
Время обеззараживания белья без видимых загрязнений, контаминированного C. albicans, T. gypseum, — не более 240 мин.
Время обеззараживания белья, загрязненного выделениями и контаминированного C. albicans, T. gypseum, — не более 240 мин.
5.3.3.6. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания поверхностей
Исследования проводят в зависимости от вида поверхностей, их положения (горизонтальное, вертикальное), способа и кратности обработки.
При разработке режимов обеззараживания поверхностей используют поверхности размером 10 x 10 кв. см из различных материалов: гладкие, шероховатые, впитывающие и невпитывающие (деревянные, оштукатуренные, поверхности, окрашенные масляной, силикатной, водоэмульсионной или клеевой краской; оклеенные обоями, поверхности из линолеумных покрытий, поверхности из окрашенного или неокрашенного металла — нержавеющая хром-никелевая кислотостойкая сталь, пластика, стекла, искусственной или натуральной кожи, поверхности из облицовочной плитки — кафельной и метлахской, фаянса и др.), но не менее 5 видов поверхностей. В качестве тест-культур используют C. albicans, T. gypseum.; A. niger используют для разработки режимов обеззараживания поверхностей с целью профилактики и борьбы с плесенью. Для имитации загрязнения поверхностей санитарно-технического оборудования при контаминации C. albicans, T. gypseum используют белковое загрязнение в виде 40% инактивированной лошадиной сыворотки. Для имитации загрязнения поверхностей унитазов при контаминации C. albicans используют загрязнение в виде 40% фекальной эмульсии. Для этого перед контаминацией объектов к суспензии грибов C. albicans, T. gypseum добавляют необходимое количество сыворотки и к суспензии C. albicans — необходимое количество фекальной эмульсии.
Перед контаминацией культурой грибов поверхности подвергают механической очистке: моют водой с мылом и щеткой (за исключением поверхностей, оклеенных обоями и окрашенных клеевой краской). Последние протирают несколько раз стерильной салфеткой, увлажненной стерильной водопроводной водой.
Высушенные поверхности располагают горизонтально и на них пипеткой наносят взвесь тест-грибов из расчета 0,5 мл 2-миллиардной микробной взвеси на площадь в 100 кв. см. Культуру равномерно распределяют по поверхности стеклянным шпателем. Поверхности подсушивают (до полного высыхания) при комнатной температуре 18 — 20 °C и относительной влажности воздуха 50 — 60%, затем обрабатывают дезинфицирующим раствором.
При изучении эффективности обеззараживания линолеум, плитку метлахскую, искусственную или натуральную кожу, стекло располагают горизонтально, а дерево, окрашенное масляной, силикатной, водоэмульсионной или клеевой красками, поверхности, оклеенные обоями, пластик, кафельную и фаянсовую плитки — вертикально.
Обработку поверхностей проводят способами протирания или орошения крупнокапельное и аэрозольное.
Для определения нормы расхода при однократной обработке дезинфицирующий раствор наносят с помощью пипетки на поверхность размером 10 x 10 см при применении способа протирания в количестве 1,0, 1,5 или 2,0 мл, а при крупнокапельном орошении наносят с помощью дозатора 1,5 — 3,0 мл. При аэрозольном методе обработки изучают эффективность обеззараживания при норме расхода 30 — 50 — 100 мл/кв. м (в зависимости от вида аэрозольного генератора и применяемой аэрозольной насадки). Многократное протирание или орошение проводят с интервалом между обработками 5 — 15 — 30 мин.
Время обеззараживания поверхностей определяют в интервале от 5 до 120 мин. Выбор экспозиции зависит от назначения и рекомендуемых условий применения средства.
Контрольные поверхности обрабатывают стерильной питьевой водой так же и из того же расчета, что и опытные.
Исследования проводят при комнатной температуре. При необходимости оценивают эффективность обеззараживания поверхностей при повышенной до 50 °C или пониженной до -30 °C температуре (исследования проводят в термо- или холодильной камере).
Для контроля эффективности обеззараживания тест-поверхностей марлевой салфеткой (размером 5 x 5 кв. см), смоченной в растворе соответствующего для данного дезинфицирующего средства нейтрализатора, тщательно протирают тест-поверхность, затем ее погружают в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин. при постоянном встряхивании. Отмывную жидкость сеют (на 2 — 3 чашки по 0,1 — 0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды.
Посевы выращивают в термостате при температуре 28 °C. Учет результатов проводят в течение 2 — 7 суток (C. albicans, A. niger) и 21 — 28 суток (T. gypseum) путем подсчета количества выросших колоний, затем рассчитывают плотность контаминации 100 кв. см поверхности и процент обеззараживания, принимая количество колоний, снятых с контрольных поверхностей, за 100%.
Критерий эффективности обеззараживания поверхностей — не менее 99,99% гибели тест-грибов; время обеззараживания при контаминации C. albicans, T. gypseum — не более 240, A. niger — не более 360 мин.
5.3.3.7. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания посуды
В зависимости от назначения ДС исследования проводят при обеззараживании посуды столовой и кухонной, лабораторной и из-под выделений.
В качестве тест-объектов при разработке режимов обеззараживания столовой и кухонной посуды используют тарелки, стаканы, кружки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью); столовые приборы: ножи, вилки, ложки из различных материалов (нержавеющая сталь, алюминий, пластик); лабораторной посуды: предметные и покровные стекла, пипетки, чашки Петри, планшеты для иммунологического анализа и другие; посуды из-под выделений: подкладные судна, мочеприемники, горшки, плевательницы и другие или тест-объекты, их имитирующие. В качестве тест-микроорганизмов при контаминации столовой посуды используют C. albicans, лабораторной — C. albicans, T. gypseum.
При разработке режимов обеззараживания посуды с остатками пищи суспензию C. albicans смешивают с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-миллиардной микробной взвеси).
Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя
добавляют 1 мл 2-млрд. суспензии C. albicans), лабораторной посуды — 40%
инактивированной сыворотки (6 мл 2-х млрд. суспензии C. albicans или
T. gypseum смешивают с 4 мл инактивированной сыворотки), а посуды из-под
выделений — 40%-ную фекальную эмульсию, контаминированную C. albicans (на
9
10 мл — 1 мл 2 x 10 суспензии).
Перед контаминацией тест-грибами посуду (столовую и лабораторную) и столовые приборы подвергают механической очистке: моют водой с мылом и щеткой. Посуду располагают горизонтально и на нее пипеткой наносят взвесь тест-грибов из расчета 0,5 мл 2-млрд. суспензии на площадь в 100 кв. см. Культуру равномерно распределяют по поверхности посуды стеклянным шпателем. Столовые приборы для контаминации погружают в бактериальную суспензию на 1 — 2 мин., оставляя незараженными их ручки.
Посуду подсушивают (до полного высыхания) при комнатной температуре 18 — 20 °C и относительной влажности воздуха 50 — 60%, затем обрабатывают дезинфицирующим раствором.
Обработку столовой, чайной, лабораторной посуды и столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18 — 20 °C. При необходимости изучают эффективность растворов, имеющих температуру 50 °C.
Контролем служит аналогично контаминированная посуда, которая погружается в такой же объем стерильной питьевой воды.
Дезинфицирующий раствор должен полностью и с избытком покрыть всю посуду (столовую и лабораторную) и столовые приборы (из расчета не менее 2 л на 1 комплект).
Через определенные интервалы времени (например, 15, 30, 60 мин. и т.д.) извлекают из дезинфицирующего раствора по одному предмету (например, тарелка, стакан, предметное стекло, нож и т.д.) и стерильной марлевой салфеткой (размер 5 x 5 кв. см), смоченной в растворе нейтрализатора, соответствующего данному ДС, тщательно протирают контаминированную часть каждого предмета, погружают салфетку в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин. при постоянном встряхивании. После отмыва марлевую салфетку погружают в соответствующую жидкую питательную среду. Отмывную жидкость сеют на 2 — 3 чашки по 0,2 — 0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температуре 28 °C и учитывают результат через 2 — 7 суток (C. albicans) и 21 — 28 суток (T. gypseum).
Время обеззараживания посуды определяют в интервале от 15 до 240 мин. в зависимости от вида тест-микроорганизма и наличия загрязнения.
Критерий эффективности обеззараживания — не менее 100%-ная гибель тест-грибов.
Время обеззараживания столовой посуды без остатков пищи, контаминированной C. albicans, — не более 60 мин.
Время обеззараживания посуды с остатками пищи, контаминированной C. albicans, — не более 120 мин.
Время обеззараживания лабораторной посуды, контаминированной C. albicans, T. gypseum, — не более 120 мин.
Время обеззараживания посуды из-под выделений, контаминированной C. albicans, — не более 120 мин.
5.3.3.8. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания выделений
ДС, предназначенные для обеззараживания выделений, должны обладать способностью гомогенизировать органический субстрат (фекалии, мокрота). Препараты, не обладающие этим свойством, для обеззараживания выделений не пригодны.
Изучение активности дезинфицирующих средств при обработке выделений проводят с учетом их консистенции и соотношения с дезинфицирующим раствором или сухим препаратом.
В качестве тест-микроорганизмов при разработке режимов обеззараживания выделений используют C. albicans.
Определение эффективности обеззараживания мочи проводят следующим
образом: берут несколько пробирок, наливают в них по 9 мл мочи, прибавляют
9
по 1 мл суспензии C. albicans, содержащей 1 x 10 мк/мл. Неразведенное ДС
или его растворы добавляют к моче в различных соотношениях (равном, двойном
и т.д.). По истечении времени воздействия (15, 30, 60, 90, 120 мин.)
пипеткой берут 1 мл опытной смеси и переносят в нейтрализатор объемом 9 мл,
а затем из нее 1 мл смеси — в пробирку с 5 мл бульона. После тщательного
перемешивания 1 мл переносят во вторую пробирку с бульоном, а затем делают
посевы по 0,1 мл на твердые питательные среды как из первой, так и из
второй пробирок. Чашки Петри с посевами ставят в термостат.
Контролем служат аналогично поставленные опыты с добавлением к моче не дезинфицирующего раствора, а стерильной питьевой воды.
Эффективным считают ДС, обеспечивающее 100%-ную гибель C. albicans в 6 — 8 опытах с совпадающими результатами.
Определение эффективности обеззараживания фекалий: 20 г фекалий
растирают в ступке и добавляют 80 мл стерильной воды. Полученную эмульсию
фильтруют через двойной слой марли, разливают в пробирки по 9 мл и
9
добавляют по 1 мл суспензии культуры C. albicans, содержащей 1 x 10 мк/мл.
Приготовленную эмульсию фекалий заливают равным или двойным количеством дезинфицирующего раствора или вносят различное количество сухого препарата. После контакта с ДС производят высевы так же, как и при обеззараживании мочи. Результаты учитывают через двое суток.
При положительных результатах проводят опыты с большим количеством оформленных фекалий (200 — 250 г). Для этого помещают их в сосуд и заливают дезинфицирующим раствором в равном или двойном количестве по отношению к весу фекалий или засыпают сухим препаратом. Затем небольшую часть фекальных масс стеклянной палочкой перемешивают с жидкостью, а остальную массу оставляют в виде небольших комочков. Через определенные промежутки времени (30, 60, 90 и 120 мин.) проводят раздельные высевы жидкой части и комочков.
Жидкую часть фекальных масс набирают пипеткой и проводят посев так же, как мочи. Плотные части фекалий забирают петлей и опускают в 5 мл питательной среды, растерев их о край пробирки и тщательно перемешав с бульоном; затем переносят из этой пробирки 1 мл смеси во вторую пробирку, также содержащую 5 мл бульона. Как из первой, так и из второй пробирки проводят посев по 0,1 мл на чашки Петри с плотной питательной средой.
Контролем служат аналогично поставленные опыты с добавлением к фекальной эмульсии стерильной воды вместо ДС.
Об эффективности исследуемого ДС судят на основании 6 — 8 опытов с совпадающими результатами. Эффективным считают средство, обеспечивающее 100%-ную гибель C. albicans в обеззараживаемом материале.
Критерий эффективности обеззараживания выделений — 100%-ная гибель тест-гриба. Время обеззараживания выделений, контаминированных C. albicans, — не более 6 ч.
5.4. Методы определения активности антимикробных
материалов тканей, лакокрасочных покрытий
Определение активности антимикробных материалов проводят комплексно с использованием методов: «агаровых пластин» и капельного нанесения тест-микроорганизмов на тест-образцы из антимикробных материалов [21].
Оценка активности антимикробных тканей. Определение антимикробной активности текстильных материалов проводят с использованием метода «агаровых пластин». При оценке активности тканей контролем служат образцы тканей тех же артикулов, не содержащие антимикробные вещества.
Для определения антимикробной активности тканей в зависимости от
целевого назначения используют следующие тест-микроорганизмы: S. aureus,
E. coli, Mycobacterium B , T. gypseum.
5
Метод «агаровых пластин» дает качественную оценку антимикробной
активности исследуемых образцов, т.к. он позволяет определить наличие или
отсутствие антимикробного эффекта. Методически он может быть выполнен двумя
способами.
Способ N 1. Растопленный на водяной бане и охлажденный до 45 °C
питательный агар (100 мл) смешивают с 1 мл взвеси тест-микроорганизма,
8
содержащей 10 КОЕ/мл, и разливают в чашки Петри по 20 мл. На поверхность
застывшего агара накладывают тест-образцы испытываемой ткани размером
2 x 2 см. Чашки помещают в термостат при 28 °C или 37 °C, в зависимости от
тест-микроорганизма. Учет результатов антимикробной активности в отношении
S. aureus и E. coli проводят через 24 — 48 ч, в отношении Mycobacterium
B — через 5 суток, в отношении T. gypseum — через 21 — 28 суток, определяя
5
величину зон задержки роста микроорганизмов путем измерения расстояния от
края тест-образца до границы роста микроорганизмов вокруг теста.
Способ N 2. К 16-часовой бульонной культуре E. coli или S. aureus добавляют 0,9%-ный раствор поваренной соли в соотношении 1:2. В стерильные чашки Петри наливают 12 мл питательного агара; после застывания на его поверхности равномерно распределяют шпателем 0,1 мл приготовленной взвеси тест-культур; затем сверху помещают тест-образцы ткани размером 2 x 2. Выращивание тест-культур и учет результатов проводят, как в первом способе.
Критерии лабораторной оценки эффективности антимикробных тканей.
Антимикробные ткани, исследованные методом «агаровых пластин», считают эффективными, если зона задержки роста тест-микроорганизмов не менее 4 мм.
Антимикробная активность тканей не должна снижаться при многократных, не менее 10, стирках более чем на 15%.
Оценка антимикробной активности лакокрасочных покрытий. Определение
антимикробной активности лакокрасочных покрытий проводят с использованием
капельного нанесения тест-микроорганизмов. В качестве тест-микроорганизмов
используют E. coli и S. aureus. В зависимости от предполагаемой области
применения антимикробных покрытий перечень тест-микроорганизмов может быть
расширен (Mycobacterium B , C. albicans, A. niger).
5
На тест-поверхность размером 10 x 10 кв. см, окрашенную антимикробной
краской или покрытую антимикробным лаком, стерильной пипеткой наносят
8
0,5 мл суспензии тест-микроорганизма, содержащей 2 x 10 КОЕ/мл. После
необходимой дезинфекционной выдержки в течение определенного промежутка
времени в период от 30 мин. до 24 ч с поверхности берут смыв стерильной
марлевой салфеткой, смоченной стерильным раствором нейтрализатора. Салфетки
помещают в пробирки с бусами, содержащие 10 мл нейтрализатора, и в течение
5 — 10 мин. встряхивают. Затем проводят посевы смывной жидкости на плотные
питательные среды. Посевы выдерживают в термостате при температуре и
времени, оптимальных для роста использованного тест-микроорганизма. В
качестве контроля используют поверхности, окрашенные краской или покрытые
лаком, не содержащие антимикробные вещества. Активность лакокрасочных
материалов оценивают путем расчета процента снижения микробной
обсемененности опытного образца по сравнению с контрольным.
Критерий антимикробной активности лакокрасочных покрытий — снижение обсемененности не менее чем на 90% через 24 ч после нанесения тест-микроорганизмов, указанных выше.
Изучение пролонгированного действия лакокрасочных материалов. Изучение пролонгированного действия лакокрасочных покрытий проводят на тест-поверхностях с дополнительной искусственной контаминацией тест-микроорганизмами.
На тест-поверхности регулярно, 1 раз в неделю, в течение 6 месяцев
6
наносят по 0,5 мл суспензии тест-микроорганизмов, содержащей 10 КОЕ/мл.
Эффективность обеззараживания оценивают 1 — 2 раза в месяц.
Критерий антимикробной активности ЛКМ — снижение обсемененности не менее чем на 90% через 24 часа после нанесения тест-микроорганизмов и пролонгированное антимикробное действие не менее 6 месяцев.
5.5. Методы определения эффективности кожных антисептиков
5.5.1. Общие положения
По назначению кожные антисептики подразделяются на 5 групп для:
1) гигиенической обработки рук [52, 66];
2) обработки рук хирургов (и других лиц, участвующих в оперативных вмешательствах и приеме родов);
3) обработки кожи операционного поля и локтевых сгибов, доноров;
4) обработки кожи инъекционного поля;
5) санитарной (общей или частичной) обработки кожных покровов.
Кожные антисептики должны [23]:
— обладать широким спектром антимикробного действия за короткое время;
— убивать транзиторную микрофлору и снижать количество резидентной микрофлоры;
— обеспечивать обеззараживание кожных покровов в течение от 30 с до 5 мин., в зависимости от назначения;
— обладать пролонгированным антимикробным остаточным действием в пределах от 1 до 3 ч;
— быть безопасными в рекомендованных режимах применения при многократном использовании;
— выпускаться в виде готовых к применению растворов, концентратов, дезинфицирующих салфеток, пропитанных кожным антисептиком, аэрозолей (беспропеллентных аэрозольных упаковок), гелей, кремов антисептических, мыл (жидких и твердых).
Целью изучения кожных антисептиков является разработка эффективных режимов обеззараживания кожных покровов в зависимости от концентрации активно-действующих веществ, времени воздействия, а также способа и кратности обработки.
До изучения эффективности антисептиков при обработке кожных покровов
определяют спектр антимикробного действия их, используя батистовые
тест-объекты, контаминированные следующими тест-микроорганизмами: для
оценки бактерицидной активности — E. coli (шт. 1257), S. aureus (шт. 906),
P. aeruginosa (шт. АТСС 27853); туберкулоцидной активности — Mycobacterium
B ; фунгицидной активности — C. albicans (шт. 15); вирулицидной
5
активности — вирус полиомиелита 1 типа (вакцинный штамм LSc-2ab) [23].
5.5.2. Определение эффективности кожных антисептиков,
предназначенных для гигиенической обработки рук
Методы изучения эффективности кожных антисептиков для гигиенической обработки рук включают определение эффективности кожного антисептика в отношении естественной микрофлоры кожи рук и при искусственной контаминации их тест-микроорганизмом [52, 66].
Изучение эффективности кожных антисептиков в отношении общей микрофлоры кожи рук. С контрольной руки до обработки кожным антисептиком делают смыв стерильной марлевой салфеткой, смоченной стерильным раствором нейтрализатора.
Затем обе руки обрабатывают кожным антисептиком, после чего с опытной руки делают смыв стерильной марлевой салфеткой размером 5 x 5 см, смоченной в стерильном растворе нейтрализатора (п. 2.3). Марлевые салфетки помещают в отдельные широкогорлые пробирки со стеклянными бусами и 10 мл стерильного физиологического раствора и отмывают в течение 10 мин. Затем смывную жидкость вносят по 0,5 мл в чашку Петри и заливают казеиновым агаром, по 0,2 мл на среду Эндо и желточно-солевой агар. Посевы инкубируют в термостате при 37 °C в течение 48 ч, после чего считают выросшие колонии.
Критерий эффективности антисептика [23] — снижение общей микробной обсемененности кожи не менее чем на 95%.
Изучение эффективности кожных антисептиков в отношении искусственно контаминированной кожи рук тест-микроорганизмом. Для искусственной контаминации кожи рук испытателей используют суспензию 18 — 20-часовой бульонной культуры E. coli (штамм 1257), выращенной в термостате при температуре 37 °C.
На ладонь наносят 1 мл суспензии, содержащей 107 КОЕ/мл, и равномерно распределяют ее по поверхности кисти рук. После подсыхания микробной взвеси в течение 2 — 3 мин. с контрольной руки делают смыв стерильной марлевой салфеткой, смоченной стерильным раствором нейтрализатора. После смыва руку осушают стерильным ватным тампоном для удаления остатков жидкости.
Затем обе руки обрабатывают кожным антисептиком, после чего с опытной руки так же делают смыв, как с контрольной.
Смывы с кожи рук и посев их на питательную среду Эндо делают так, как указано выше.
Критерий эффективности антисептика — снижение обсемененности кожи тест-микроорганизмом E. coli не менее чем на 99,99% [23].
Пролонгированное антимикробное действие кожных антисептиков оценивают на руках испытателей в отношении общей микрофлоры кожи.
Руки испытателей обрабатывают кожным антисептиком в течение 30 с — 1 мин. Затем с одной контрольной руки у каждого испытателя делают смыв стерильной марлевой салфеткой, смоченной стерильным раствором нейтрализатора, после чего испытатели выполняют работу на своем рабочем месте, но в течение всего эксперимента (от 30 мин. до 3 ч) не моют руки водой и туалетным мылом. Смывы с другой опытной руки делают стерильной марлевой салфеткой, смоченной в стерильном растворе нейтрализатора, через каждый час от начала эксперимента (от 30 мин. до 3 ч). Каждый час смывы делают у разных испытателей. Марлевые салфетки после взятия смывов помещают в отдельные широкогорлые пробирки со стерильным физиологическим раствором (по 10 мл в каждой) и стеклянными бусами, встряхивают в течение 10 мин. Затем производят посев смывной жидкости из опытных и контрольных пробирок на казеиновый агар, как указано выше. Посевы инкубируют в термостате при 37 °C в течение 48 ч, после чего подсчитывают выросшие колонии.
Если кожный антисептик обладает пролонгированным антимикробным действием, то на протяжении нескольких часов после обработки рук антисептиком количество микроорганизмов, обнаруживаемое в смывах, остается минимальным (по сравнению с тем количеством, которое обнаруживается сразу после обработки рук антисептиком).
5.5.3. Определение эффективности кожных антисептиков,
предназначенных для обработки рук хирургов
Изучение эффективности кожных антисептиков для обработки рук хирургов проводят в два этапа [66].
1 этап обработки рук проводится с целью удаления загрязнений и снижения количества общей микрофлоры. При этом руки испытателей, включая запястья и предплечья, обрабатывают следующим способом.
Перед применением антисептика кисти рук и предплечий (до локтевого сгиба) моют теплой проточной водой и туалетным (но не с антимикробными добавками) мылом в течение двух минут. После этого под водой смывают мыло с каждой руки и предплечья (поочередно). При этом кисти рук должны быть выше положения локтей, а не наоборот. Затем кисти рук и предплечья высушивают стерильной марлевой салфеткой.
До обработки кожным антисептиком (далее — антисептик), с одной руки, контрольной, делают смыв стерильной марлевой салфеткой, смоченной физиологическим раствором.
2 этап обработки рук. На сухие кисти обеих рук испытателей наносят от 3 до 5 мл изучаемого антисептика и равномерно распределяют его по тыльной и ладонной поверхности кожи обеих рук, постепенно переходя на предплечья. При этом втирают антисептик путем последовательных движений рук вверх-вниз (не доходя до локтевого сгиба). При обработке кожным антисептиком необходимо поддерживать руки во влажном состоянии в течение подбираемого времени обеззараживания для конкретного кожного антисептика (не более 5 мин.) и следить за тем, чтобы кисти рук были выше положения локтей. Последнюю порцию антисептика втирают до его высыхания.
По истечении времени обработки (не более 5 мин.) марлевой салфеткой, смоченной нейтрализатором, делают смыв с кожи рук испытателей и его посев.
Критерий эффективности антисептика [23] — снижение общей микробной обсемененности кожи рук испытателей на 100%.
Определение остаточного антимикробного действия кожного антисептика — средства на коже после обработки рук испытателей в режиме применения, рекомендованном для обработки рук хирургов, проводят на естественно обсемененной коже рук испытателей.
После предварительного мытья кистей рук и предплечий испытателей (до локтевого сгиба) теплой проточной водой и туалетным (но не с антимикробными добавками) мылом в течение двух минут, с каждой руки и предплечья поочередно смывают мыло водой. При этом кисти рук должны быть выше положения локтей, а не наоборот. Затем кисти рук и предплечья высушивают стерильной марлевой салфеткой.
На руки наносят испытуемое средство и проводят им обработку — обеззараживание рук.
Испытатели надевают на руки стерильные хирургически перчатки и выполняют в них обычную работу на протяжении трех часов.
Через каждый час испытатели снимают перчатки, не выворачивая их. В каждую перчатку наливают по 10 мл стерильного раствора нейтрализатора или физиологического раствора, омывая внутренние поверхности перчаток этим раствором в течение 5 минут. После этого делают посев смывной жидкости в количестве 0,5 мл на чашки Петри и заливают растопленным и остуженным до 40 — 45 °C питательным агаром.
Учет результатов проводят через 48 ч инкубирования посевов в термостате при 37 °C, определяя наличие или отсутствие роста микроорганизмов.
О наличии остаточного действия у изучаемого средства судят по количеству стерильных проб (отсутствие роста микроорганизмов), которое должно составлять более 50% от числа проб, отобранных у испытателей, обработавших руки средством.
5.5.4. Определение эффективности кожных антисептиков,
предназначенных для обработки кожи операционного
и инъекционного полей и локтевых сгибов доноров
Изучение эффективности кожных антисептиков для обработки кожи операционного поля и локтевых сгибов доноров проводят в отношении естественной микрофлоры кожи и при искусственном обсеменении кожи тест-микроорганизмом — Escherichia coli (шт. 1257), а инъекционного поля — только естественной микрофлоры кожи [66].
До обработки кожным антисептиком с кожи внутренней поверхности предплечья делают смыв.
Для оценки эффективности антисептика для обработки кожи операционного поля и локтевых сгибов доноров в отношении естественной микрофлоры участок кожи внутренней поверхности предплечья размером 5 x 13 см последовательно протирают в одном направлении двумя раздельными стерильными марлевыми тампонами, смоченными антисептиком, для обработки инъекционного поля — одним. Через определенное время марлевой салфеткой, смоченной нейтрализатором, с этого же участка кожи предплечья делают смыв, салфетку встряхивают в течение 10 мин. в пробирке со стеклянными бусами в нейтрализаторе. Затем смывную жидкость засевают в чашки Петри в толщу казеинового агара по 0,5 мл, в чашки Петри со средой Эндо и желточно-солевым агаром по 0,2 мл. Чашки Петри с посевами инкубируют в термостате при 37 °C в течение 48 ч, после чего подсчитывают колонии, выросшие на поверхности среды.
Критерий эффективности антисептика, предназначенного для обработки кожи операционного поля и локтевых сгибов доноров, — снижение общей микробной обсемененности кожи предплечья рук испытателей на 100%.
Критерий эффективности антисептика, предназначенного для обработки кожи инъекционного поля, — снижение общей микробной обсемененности кожи предплечья рук испытателей не менее чем на 95%.
Для оценки эффективности антисептика при искусственной контаминации на участок кожи внутренней поверхности предплечья размером 5 x 13 см наносят 0,2 мл бульонной суточной культуры E. coli (шт. 1257), содержащей 105 КОЕ/мл. Затем, после ее подсыхания, наносят 0,2 мл антисептика и растирают стерильным шпателем. Через определенное время (2 — 3 мин.) марлевой салфеткой, смоченной нейтрализатором, делают смыв с кожи предплечья, встряхивают салфетку в течение 10 мин. в пробирке с бусами в нейтрализаторе. Затем делают посевы на поверхность среды Эндо. Посевы помещают в термостат, учитывают результаты через 48 ч.
Критерий эффективности антисептика — отсутствие роста тест-культуры в смывах с контаминированной кожи предплечья рук испытателей [23].
5.5.5. Определение эффективности кожных антисептиков,
предназначенных для санитарной обработки кожных покровов
Оценка эффективности «кожных антисептиков — дезинфицирующих средств» для санитарной обработки кожных покровов проводится на коже предплечий рук испытателей при искусственной контаминации культурой тест-микроорганизма — E. coli (штамм 1257) [52].
На внутреннюю поверхность кожи предплечий рук наносят и равномерно
распределяют по 1 мл суспензии суточной бульонной культуры E. coli (штамм
5
1257), выращенной в термостате при 37 °C и содержащей 2 x 10 КОЕ/мл.
После подсыхания тест-культуры (2 — 3 мин.) с кожи контаминированного участка предплечья берут контрольный смыв стерильной марлевой салфеткой. Затем этот участок предплечья обрабатывают кожным антисептиком и через определенное время снова делают смыв марлевой салфеткой, смоченной в нейтрализаторе. Далее делают посев смывной жидкости и учет результатов.
Критерий эффективности антисептика [23] — снижение обсемененности кожи не менее чем на 99,99%.
5.5.6. Определение эффективности
«кожных антисептиков — моющих средств», предназначенных
для гигиенической обработки рук, санитарной
обработки кожных покровов
Оценка эффективности «кожных антисептиков — моющих средств» в различных формах применения, предназначенных для гигиенической обработки рук и санитарной обработки кожных покровов проводится на руках испытателей по снижению общей микробной обсемененности кожи.
До обработки кожным антисептиком с контрольной руки делают смыв. Затем руки обрабатывают антисептиком в течение 1 — 2 мин., после чего с опытной руки делают смыв марлевой салфеткой, смоченной в нейтрализаторе. Далее делают посев смывной жидкости и учет результатов.
Критерий эффективности антисептика — снижение общей микробной обсемененности кожи не менее чем на 60%.
5.6. Методы определения эффективности ДС и кожных
антисептиков в практических условиях
5.6.1. Общие положения
Изучение эффективности ДС в практических условиях является заключительным этапом исследования, по результатам которого даются рекомендации для его промышленного производства и применения в практике медицинской дезинфекции [52]. Практические испытания проводятся в тех случаях, когда ДС содержит новое действующее вещество и требуется подтверждение эффективности разработанных режимов.
Целью практических испытаний является уточнение целевого назначения, условий применения, дается оценка эффективности и безопасности разработанных режимов обеззараживания, надежности рекомендованных мер предосторожности, влияния на фактуру и функциональные свойства обрабатываемых объектов, выявления преимуществ и недостатков по сравнению с используемыми аналогами.
Испытания проводят в ЛПУ и/или инфекционных очагах в соответствии с программой и методическими указаниями по испытанию ДС, которые составляются на основании результатов ранее проведенных исследований по физико-химическим свойствам, антимикробной и дезинфицирующей активности, а также токсичности в лабораторных условиях.
В программе должны быть указаны сроки, длительность, место проведения и цель испытаний, перечень объектов обработки, контроль параметров, объем, количество смывов.
Методические указания по проведению испытаний должны содержать конкретные сведения о назначении ДС, его характеристику (описание, физико-химические и антимикробные свойства, токсичность), способы приготовления рабочих растворов, условия и режимы применения, правила по технике безопасности и оказанию первой помощи при отравлениях.
Испытания ДС в практических условиях проводят сотрудники ЛПУ или государственного учреждения дезинфекционного профиля, или центров гигиены и эпидемиологии, или государственных унитарных предприятий, или дезинфекционной станции. Текущую дезинфекцию проводят в одном или двух многопрофильных ЛПУ, а заключительную — не менее чем в 10 инфекционных очагах.
Перед проведением испытаний проводят входной химический контроль на соответствие опытной партии ДС требованиям технических условий и инструктаж медицинского персонала, проводящего испытания.
5.6.2. Определение эффективности ДС при обеззараживании
различных объектов поверхностей, белья, посуды и др.
Оценку эффективности ДС проводят на основании обнаружения санитарно-показательных и патогенных микроорганизмов в смывах, взятых с объектов до и после проведения обеззараживания.
При испытании ДС в очагах бактериальных инфекций контроль эффективности осуществляют по обнаружению E. coli — при кишечных инфекциях; S. aureus — при инфекциях дыхательных путей; S. aureus и M. tuberculosis — при туберкулезе (M. tuberculosis определяют только в очагах с обильным бацилловыделением у пациентов или при оценке эффективности обеззараживания мокроты). При вирусных и грибковых инфекциях контроль качества дезинфекции проводят на основании обнаружения санитарно-показательных микроорганизмов — E. coli и S. aureus.
В ЛПУ об эффективности дезинфицирующего средства судят по обнаружению санитарно-показательной микрофлоры (E. coli и S. aureus), а также возбудителей внутрибольничных инфекций (P. aeruginosa, P. vulgaris, C. albicans, A. niger и других), в зависимости от профиля стационара и наличия внутрибольничной инфекции.
Для оценки эффективности ДС в практических условиях берут не менее 50 смывов (по 25 до и после дезинфекции). Пробы после дезинфекции отбирают сразу после окончания экспозиции и доставляют для анализа в лабораторию не позднее 2 ч с момента их отбора. Пробы отбирают с объектов, имеющих эпидемиологическое значение, возможность повторной контаминации которых исключается спецификой их использования.
При ограниченных практических испытаниях, проводимых с участием
исследователей ДС, из-за сложности выделения и культивирования некоторых
возбудителей допускается использование тест-объектов, искусственно
контаминированных микроорганизмами в лаборатории (например, при
обеззараживании белья при туберкулезе используют тесты, обсемененные
Mycobacterium B , а при грибковых заболеваниях — T. gypseum).
5
Учет эффективности обеззараживания проводят качественным и количественным методами.
При качественном методе оценки эффективности обеззараживания пробы, взятые с объектов до и после дезинфекции, засевают на дифференциально-диагностические среды и проводят учет по наличию специфического роста микроорганизмов, определяя процент обнаружения микроорганизмов до и после дезинфекции. При количественном методе отобранные пробы засевают на твердые питательные среды, подсчитывают число КОЕ и определяют не только процент положительных проб, но и плотность контаминации единицы поверхности.
После обеззараживания поверхностей в помещениях, мебели, санитарно-технического оборудования, посуды, игрушек пробы отбирают путем протирания поверхностей перечисленных объектов площадью 100 кв. см увлажненными в растворе нейтрализатора стерильными марлевыми салфетками размером 5 x 5 см или ватными тампонами.
При качественном методе оценки эффективности обеззараживания пробы, взятые с объектов до и после дезинфекции, засевают на дифференциально-диагностические среды и проводят учет по наличию специфического роста микроорганизмов, определяя процент обнаружения микроорганизмов до и после дезинфекции. При количественном методе отобранные пробы засевают на твердые питательные среды, подсчитывают число КОЕ и определяют не только процент положительных проб, но и плотность контаминации единицы поверхности.
При контроле эффективности обеззараживания мелких предметов смыв берут со всей поверхности (или полностью объект погружают в питательную среду), а объектов большой площади — с 2 — 3 участков, общей площадью 100 кв. см.
Эффективность средства при обеззараживании объектов в практических условиях оценивают, сравнивая контаминацию объектов до и после обработки.
Критерий эффективности при проведении заключительной дезинфекции — высев микроорганизмов не более 0,5%, при текущей дезинфекции на дому — не более 3%, при текущей дезинфекции в лечебно-профилактических учреждениях — высев непатогенной микрофлоры не более 2% отобранных смывов.
5.6.3. Определение эффективности ДС при обеззараживании ИМН
Изделия медицинского назначения после использования у пациента делят на 2 группы. С изделий 1-й группы берут смыв для определения микробного фона при испытаниях. Изделия медицинского назначения (включая эндоскопы) из 2-й группы обеззараживают в соответствии с режимами и при условиях, рекомендованных в методических указаниях, инструкциях по испытанию конкретного средства.
Контроль качества дезинфекции изделий медицинского назначения осуществляют методом смывов. Взятие смывов проводят стерильными марлевыми салфетками размером 5 x 5 см, простерилизованными в бумажных пакетах или чашках Петри.
Контролю подлежит 1% одновременно обработанных изделий одного наименования, но не менее 3 — 5 единиц.
Перед взятием смывов с объектов в широкогорлые пробирки со стеклянными бусами стерильной пипеткой разливают по 10 мл стерильного нейтрализатора, соответствующего применяемому дезинфицирующему средству. Увлажненной стерильной салфеткой протирают поверхность изделия, после чего салфетку помещают в пробирку с раствором нейтрализатора и 5 мин. встряхивают.
У изделий, имеющих каналы, рабочий конец изделия опускают в пробирку со стерильным нейтрализатором и с помощью стерильного шприца или пипетки 1 — 2 раза промывают канал этим раствором. После этого из смывной жидкости проводят высев на дифференциально-диагностические среды.
Контроль обеззараживания эндоскопов осуществляют методом взятия смывов с участков эндоскопа, труднодоступных для очистки и дезинфекции, например дистальный конец эндоскопа, а также путем микробиологического контроля смывной жидкости, в первую очередь, из инструментального канала эндоскопа, а также других каналов, полостей и поверхностей.
О качестве дезинфекции после ее проведения судят по отсутствию на изделиях медицинского назначения золотистого стафилококка, синегнойной палочки и бактерий группы кишечной палочки.
Для обнаружения микроорганизмов в смывной жидкости ее пропускают через мембранный фильтр, который затем помещают на поверхность плотной дифференциально-диагностической среды. При отсутствии фильтрующего устройства смывную жидкость по 0,1 мл засевают на поверхность желточно-солевого, кровяного агара и среду Эндо. Посевы выдерживают в термостате при 37 °C в течение 48 ч.
При наличии роста микроорганизмов на агаре их идентификацию проводят в соответствии с действующими методическими документами.
5.6.4. Определение активности изделий
из антимикробных тканей
Оценку эффективности изделий из антимикробных тканей проводят в лечебно-профилактических учреждениях и на промышленных предприятиях, где условия труда способствуют развитию заболеваний кожных покровов микробной этиологии или на которых требуется обеспечение незначительного количества микроорганизмов в воздухе и на поверхностях.
Набор изделий из антимикробной ткани, подлежащих испытанию, определяют конкретно для каждого учреждения. Обычно в ЛПУ и на предприятиях это нательное и постельное белье, спецодежда персонала.
Во всех учреждениях, наряду с изделиями из испытываемой ткани (опытная группа), исследуется группа аналогичных изделий из обычной ткани (контрольная группа), желательно того же артикула, что и опытная группа.
Микробную обсемененность изделий из антимикробных тканей изучают методом отпечатков. Предметные стекла, разрезанные пополам, раскладывают стерильным пинцетом в стерильные чашки Петри (три половинки предметного стекла). Питательную среду (в зависимости от тест-микроорганизма — казеиновый или мясо-пептонный агар, агар Сабуро, картофельно-глицериновый агар) растапливают на водяной бане и при помощи пипетки, соблюдая правила асептики, наливают на поверхность каждого стекла до его полного покрытия (1,5 — 2,0 мл). Чашки с пластинками после застывания среды можно сохранять до 3 суток в холодильнике.
Взятие посевов-отпечатков проводят следующим образом: приоткрыв чашку с пластинками, берут пальцами пластинку за края, не касаясь питательной среды. Извлекают пластинку из чашки и плотно прикладывают питательной средой к испытываемой поверхности на 2 — 3 с. После соприкосновения с поверхностью пластинки с питательной средой отпечатком кверху помещают в чашку Петри. Чашку закрывают крышкой и ставят в термостат при 37 °C на 48 ч, после чего проводят подсчет выросших колоний. В посеве-отпечатке сохраняется естественное расположение микробных клеток.
При определении обсемененности белья пробы отбирают методом отпечатков с внутренней поверхности нательного белья в области спины (верхний край лопатки), средней линии живота между пупком и грудиной, груди (область грудных желез, над грудными сосками). Пробы отбирают симметрично с левой и правой стороны. С наружной поверхности нательного белья пробы берут в подмышечной области и области плечевого шва.
С наволочек, полотенец отбирают пробы в трех точках. С пододеяльников, простыней, мягкого инвентаря (шторы, ширмы, мешки для белья) отбирают по 3 — 5 проб по углам и в середине.
Антимикробная активность тканей не должна снижаться при многократных, не менее 30, стирках более чем на 15%.
Критерий эффективности — отсутствие роста микроорганизмов в отобранных пробах.
5.6.5. Определение антимикробной активности
лакокрасочных покрытий
Определение антимикробной активности лакокрасочных материалов в практических условиях является заключительным этапом исследования, по результатам которого даются рекомендации для применения в практике медицинской дезинфекции.
В соответствии с назначением ЛКМ поверхности в помещении окрашивают краской или покрывают лаком. Контролем служат поверхности других аналогичных помещений, обработанных ЛКМ, не содержащими биодобавок.
Оценку антимикробной активности лакокрасочных покрытий проводят на основании обнаружения санитарно-показательных и патогенных микроорганизмов в смывах, взятых с поверхностей, окрашенных испытуемой краской или покрытых лаком. В качестве контроля используют поверхности, окрашенные краской или покрытые лаком, не содержащими биодобавок.
Оценку антимикробной активности ЛКМ проводят количественным методом: отобранные пробы засевают на твердые питательные среды, подсчитывают число КОЕ и определяют процент снижения микробной обсемененности по сравнению с контролем.
Антимикробное покрытие считают эффективным при обеспечении снижения обсемененности по сравнению с контрольными поверхностями через 24 ч не менее чем на 90% и длительности антимикробного действия не менее 6 мес.
5.6.6. Определение эффективности кожных антисептиков
Методика определения эффективности обеззараживающего действия антисептиков, предназначенных для гигиенической обработки рук. Оценку эффективности обеззараживающего действия антисептиков для гигиенической обработки рук осуществляют методом смыва. Для оценки эффективности антисептиков в практических условиях берут не менее 100 смывов (по 50 до и после обработки рук антисептиком). Смывы после обработки отбирают сразу после окончания необходимой экспозиции и доставляют для анализа в лабораторию не позднее 2 ч с момента их отбора.
С одной руки, контрольной, до обработки рук антисептиком берут смыв стерильной марлевой салфеткой размером 5 x 5 см, смоченной в 1%-м растворе пептонной воды. Затем руки обрабатывают антисептиком и по истечении времени обработки с другой руки, опытной, берут смыв стерильной марлевой салфеткой размером 5 x 5 см, смоченной в нейтрализаторе. Марлевые салфетки после взятия смывов помещают в пробирки с 1%-м раствором пептонной воды. Пробирки инкубируют в термостате при 37 °C в течение 18 — 20 ч, после чего из них делают посевы на среду Эндо для выявления энтеробактерий и синегнойной палочки. Для выявления золотистого стафилококка делают посев на желточно-солевой агар.
Показатель эффективности обеззараживающего действия антисептика — отсутствие роста золотистого стафилококка, энтеробактерий и синегнойной палочки в отобранных смывах.
Определение эффективности обеззараживающего действия кожных антисептиков, предназначенных для обработки рук хирургов, осуществляют методом смыва. Для оценки эффективности обработки рук хирургов кожными антисептиками в практических условиях берут не менее 100 смывов (по 50 смывов до и после обработки рук антисептиком).
Смывы берут стерильной марлевой салфеткой сразу после окончания времени, необходимого для обработки рук хирургов кожным антисептиком.
До обработки рук антисептиком с одной руки, контрольной, берут смыв стерильной марлевой салфеткой (5 x 5 см), смоченной физиологическим раствором. После этого проводят обработку рук, для чего на кисти обеих рук наносят определенное количество антисептика и проводят обработку рук путем втирания антисептика в кожу кистей рук, между пальцами, а также запястий и предплечий рук в режиме обработки, рекомендованном для конкретного кожного антисептика. После окончания обработки рук хирургов стерильной марлевой салфеткой, увлажненной стерильным раствором нейтрализатора, берут смыв с кожи рук, тщательно протирая ладони, околоногтевые пространства обеих рук. Салфетки помещают в пробирки с жидкой питательной средой. Посевы помещают в термостат и выдерживают при температуре 37 °C в течение 48 ч, после чего производят учет результатов.
Критерий эффективности обработки рук кожным антисептиком — снижение общей микробной обсемененности кожи рук на 100% (отсутствие роста микроорганизмов на жидкой питательной среде).
Определение эффективности обеззараживающего действия кожных антисептиков, предназначенных для обработки кожи операционного поля (локтевых сгибов доноров), осуществляют методом смыва. Для оценки эффективности обработки кожи операционного поля кожными антисептиками в практических условиях берут не менее 100 смывов (по 50 смывов до и после обработки рук антисептиком).
Смывы берут стерильной марлевой салфеткой сразу после окончания времени, необходимого для обработки кожи операционного поля кожным антисептиком.
До обработки кожи операционного поля антисептиком берут смыв стерильной марлевой салфеткой (5 x 5 см), смоченной физиологическим раствором. После этого проводят обработку кожи операционного поля в режиме применения, рекомендованном для конкретного кожного антисептика. После окончания обработки кожи операционного поля стерильной марлевой салфеткой, увлажненной стерильным раствором нейтрализатора, берут смыв с обработанной кожи. Салфетки помещают в пробирки с жидкой питательной средой. Посевы помещают в термостат и выдерживают при температуре 37 °C в течение 48 ч, после чего производят учет результатов.
Критерий эффективности обработки операционного поля (локтевых сгибов доноров) кожным антисептиком — снижение общей микробной обсемененности кожи на 100% (отсутствие роста микроорганизмов на жидкой питательной среде).
5.7. Методы изучения и оценки вирулицидной
активности дезинфицирующих средств
5.7.1. Общие положения
Методы изучения и оценки вирулицидной активности ДС гармонизированы с Европейским стандартом 14476 «Химические дезинфектанты и антисептики. — Вируцидный количественный суспензионный тест для химических дезинфектантов и антисептиков, используемых в медицине. — Тест-методы и требования (фаза 2/ступень 1)», 2005 г.; «Протоколом тестирования эффективности дезинфектантов, используемых для инактивации вируса гепатита B уток и поддержания соответствующего уровня требований», EPA 2000 г., США; «Комиссии по антивирусной дезинфекции Немецкого Объединения по борьбе с вирусными заболеваниями (DVV)», 2004.
Вирусы обладают разной устойчивостью к действию физических и химических факторов, в т.ч. ДС и субстанций. Устойчивость вирусов к ДС определяется их структурой и химическим составом. Более устойчивы к действию ДС вирусы без липидсодержащей оболочки, например пикорнавирусы, парвовирусы. Вирусы с липидсодержащей оболочкой, например вирусы гриппа, герпеса, ВИЧ, относительно легко инактивируются. Механизм действия ДС на вирусы различен и зависит от химического состава. Они могут избирательно повреждать нуклеиновую кислоту вируса, белки нуклеокапсида или липопротеины суперкапсидной оболочки. Возможно синхронное воздействие на эти структурные элементы, дезинтеграция вирусной частицы или блокировка рецепторов на ее поверхности за счет накопления амфотерных веществ дезинфектанта. Для оценки вирулицидной активности следует использовать несколько тест-вирусов с различной устойчивостью, что позволяет оценить активность ДС в отношении широкого спектра вирусов [60].
Результаты исследований вирулицидной активности ДС зависят также от характера используемого вируссодержащего материала, метода индикации вируса, метода определения вирулицидных свойств ДС, состава испытываемого ДС (действующие вещества — ДВ и другие компоненты) [75].
При изучении вирулицидной активности ДС необходимо иметь его подробную характеристику с указанием рецептуры, физико-химических свойств (включая растворимость и стабильность), подтвержденных результатами входного химического контроля.
ДС, принимаемые для исследований, должны отвечать следующим требованиям: обладать хорошей растворимостью в воде, сохранять свою активность в присутствии органических веществ (кровь и др. биологические субстраты), быть нетоксичными или малотоксичными для людей (и животных), не должны иметь неприятный запах, портить обеззараживаемые предметы [75].
Непременным условием при исследованиях вирулицидной активности ДС является использование нейтрализатора.
5.7.2. Тест-вирусы, модельные системы,
критерии оценки и основные условия, которые необходимо
соблюдать при исследованиях вирулицидной активности
ДС и их субстанций. Применение нейтрализатора
Тест-вирусы. Модельные системы для исследований ДС и субстанций. При исследованиях вирулицидной активности ДС необходимо использовать как РНК-, так и ДНК-содержащие тест-вирусы (Прилож. 1). При этом следует учитывать наличие лабораторной модели, безопасность для лиц, работающих с вирусом.
Обязательным для всех ДС является испытание на двух тест-вирусах: вирусе полиомиелита 1 типа (вакцинном штамме Sabin LSc-2ab) [далее — «полиовирус»] и аденовирусе 5 типа (штамм Аденоид 75) [далее — «аденовирус»] [75].
Средство, показавшее способность инактивировать полио- и аденовирус, включают в группу ДС с вирулицидной активностью. ДС с вирулицидной активностью могут быть использованы для дезинфекции при любой вирусной (включая особо опасные) инфекции, имеющей значение в инфекционной патологии человека.
Для ДС, применяемых при повышенной (до 60 °C) температуре растворов (например, для обеззараживания белья), в качестве тест-вируса используют бычий парвовирус, штамм Хаден [75].
В связи с эпидемиологической и социальной значимостью гепатита A для дезинфекции в инфекционных очагах проводят также исследования с вирусом гепатита A. Для изучения и оценки активности ДС в отношении вируса гепатита A используют вирус гепатита A человека (штамм HAS-15). ДС, инактивирующие вирус гепатита A, входят в группу средств с вирулицидной активностью [75].
Для изучения вирулицидной активности ДС в отношении вируса гепатита B применяют суррогатный вирус — вирус гепатита B уток ВГВУ, в отношении вируса гепатита C — суррогатный вирус — вирус диареи — болезни слизистых оболочек крупного рогатого скота ВД-БС (штамм ВК — 1В1 — N 28) или вирус гепатита C человека штамм Д1 [75].
Спектр тест-вирусов может быть расширен, в таком случае дают дополнительную информацию о результатах исследований на конкретном вирусе.
Модельные системы для исследований ДС и субстанций. Исследования in vitro в культуре клеток. В экспериментах используют культуры клеток, чувствительные к тест-вирусу.
Исследования in vivo. В экспериментах используют чувствительных лабораторных животных (белые мыши), уток и др. (Прилож. 1).
Критерии оценки вирулицидной активности ДС и субстанций. Вирулицидное
ДС и субстанции должны подавлять инфекционность обязательных для испытаний
тест-вирусов — полиовируса и аденовируса на исследуемых объектах не менее
чем на 4 log ТЦИД (т.е. степень инактивации должна быть не менее
10 50
99,99%) [7, 75].
Критерием вирулицидной активности ДС и субстанций для других тест-вирусов (включая вирусы — возбудители особо опасных инфекций) является отсутствие инфекционности, определяемое современными методами индикации.
Степень инактивации тест-вируса определяют в чувствительных модельных системах по подавлению инфекционной, цитопатической или бляшкообразующей активности вируса в культуре клеток, или по отсутствию маркеров инфицирования, или по специфической гибели лабораторных животных (белые мыши) и др. Для получения более точных результатов тест-вирус следует использовать с максимальным титром.
Показателем вирулицидной активности ДС и субстанций является скорость инактивации, которая представляет собой соотношение концентрации тест-вируса, выраженное в десятичных логарифмах, до и после воздействия ДС за определенный промежуток времени экспозиции. Степень снижения вирусной инфекционности вычисляется в десятичных логарифмах по разнице титров вируса до и после обработки ДС [75].
Основные условия, которые следует соблюдать при исследованиях вирулицидной активности ДС и субстанций [66, 75]:
— исследуемые ДС до, во время и после исследований (испытаний) должны храниться в соответствии с требованиями технических условий ТУ. При отсутствии ТУ необходимо соблюдать общие требования: избегать попадания прямых солнечных лучей и влаги, воздействия высоких температур и замораживания;
— при проведении сертификационных испытаний ДС хранят в соответствии с правилами сертификации;
— растворы ДС готовить на стерильной водопроводной дехлорированной воде;
— поддерживать температуру растворов исследуемых ДС в течение всего эксперимента в пределах 20 +/ 2 °C (если по условиям эксперимента не рекомендована другая температура), независимо от температуры окружающей среды;
— использовать рабочие растворы ДС, производимых в форме гранул, порошков, таблеток и др., только после полного их растворения;
— кратность постановки экспериментов должна быть не менее трех при условии получения одинаковых результатов;
— при отсутствии цитопатического эффекта пробы подвергают необходимой обработке с целью проведения второго, а при необходимости и третьего слепого пассажа для определения полноты ингибирования тест-вируса;
— эксперименты должны сопровождаться всеми необходимыми контролями, в т.ч. контролем полноты нейтрализации дезинфектанта, жизнеспособности тест-вируса, контаминации тест-объекта тест-вирусом, культуры клеток или лабораторных животных, мыши, уток и др.;
— использовать нейтрализатор, подобранный к конкретному ДС (или дезинфицирующей субстанции, далее в этом разделе — «ДС»);
— при исследованиях ДС следует строго соблюдать рекомендуемые меры индивидуальной защиты (перчатки, очки, респираторы и др.).
Применение нейтрализатора ДС и субстанции. Для нейтрализации ДС и субстанции используют вещество — нейтрализатор (или комплекс из нескольких веществ), останавливающее действие ДС. Нейтрализатор либо добавляют непосредственно в питательную среду, либо промывают им тест-объекты после воздействия ДС (субстанции, исследуемого вещества) для того, чтобы остановить его действие на тест-вирус через заданное время экспозиции.
Для нейтрализации ДС применяют следующие вещества:
— для ДС в виде монопрепарата на основе окислителей (хлор-, йод-, кислородсодержащие средства) — 0,1 — 1,0%-ные растворы тиосульфата натрия;
— для галоидактивных (хлор-, бром- и йодактивные) и кислородактивных (перекись водорода, ее комплексы с солями, надуксусная кислота, озон) — 0,1 — 1,0%-ные растворы тиосульфата натрия;
— для четвертичных аммониевых солей (алкилдиметилбензиламмоний хлорид, дидецилдиметиламмоний хлорид и др.), производных гуанидина (полигексаметиленгуанидин гидрохлорид, хлоргексидин биглюконат и др.) — 0,1 — 1,0%-ные растворы лаурилсульфата натрия сульфонол или растворы лаурилсульфата натрия с 10% обезжиренного молока, или комплексный нейтрализатор (см. ниже);
— для альдегидов (глутаровый альдегид, глиоксаль, формальдегид, ортофталевый альдегид) — 1,0%-ный раствор пиросульфита метабисульфита натрия или комплексный нейтрализатор (см. ниже);
— для кислот — щелочи в эквивалентном количестве;
— для щелочей — кислоты в эквивалентном количестве;
— для спиртов — разведение в воде до недействующей концентрации;
— для композиционных средств — «комплексный» нейтрализатор, например содержащий Твин 80 (3%), сапонин (0,3 — 3%), гистидин (0,1%), цистеин (0,1%). Если в состав ДС входят окислители, в нейтрализатор дополнительно вводят тиосульфат натрия. Следует иметь в виду, что комплексный нейтрализатор обладает выраженным цитотоксическим действием на клеточные культуры.
Если не удается подобрать какой-либо из перечисленных нейтрализаторов, что проявляется в неспецифической дегенерации культуры клеток (или гибели мышей, уток), то используют 60 — 80% сыворотки (без консерванта) крупного рогатого скота (СКРС), инактивированной при 56 °C в течение 30 мин. СКРС нейтрализует большой перечень ДВ и наиболее близка к комплексному нейтрализатору.
При невозможности нейтрализовать токсическое действие ДС следует применять дополнительные методы удаления ДС — диализ смеси вирус-дезинфектант, например с использованием сефадекса LH-20, G-75; осаждения вируса методом высокоскоростного центрифугирования или фильтрацией через мембранные фильтры.
5.7.3. Основные этапы и методы изучения вирулицидной
активности ДС и субстанций [75]
Исследование вирулицидной активности ДС осуществляется в два этапа:
1) первый этап исследований — определение наличия вирулицидной активности. Проводится in vitro суспензионным методом или методом батистовых тест-объектов;
2) второй этап исследований — изучение вирулицидной эффективности ДС при обработке ими различных тест-объектов, воздуха, контаминированных тест-вирусом.
В качестве тест-объектов следует использовать различные изделия медицинского назначения; предметы ухода за больными и игрушки; белье, спецодежду и другие изделия из тканей; посуду, в т.ч. лабораторную; различные поверхности в помещениях (жесткой мебели, разных предметов, оборудования, в т.ч. санитарно-технического и др.); кровь; выделения (моча, фекалии, мокрота).
Объем исследований и перечень объектов обеззараживания зависит от назначения ДС, их состава, токсикологической характеристики, формы выпуска средства и др.
Проводятся также исследования вирулицидной активности кожных антисептиков, антимикробных тканей и лакокрасочных материалов.
5.7.3.1. Суспензионный метод [66, 75]
К вирусной суспензии ВС, в качестве которой может быть использована культуральная жидкость после удаления клеточных остатков, или ВС органов или тканей, или сыворотка крови, добавляют испытуемое средство в объеме 1:9 (1 объем вируса и 9 объемов средства) в различных концентрациях.
Суспензионный тест проводят в двух вариантах: без белковой нагрузки и с белковой нагрузкой. В последнем случае к вирусной суспензии добавляется инактивированная сыворотка КРС из расчета 40% ее концентрации в смеси вирус-дезинфектант.
Полученную смесь (как с сывороткой, так и без нее) выдерживают при комнатной температуре (20 +/ 2 °C) в течение 15 — 30 — 60 мин., нейтрализуют (в соотношении 1:1, т.е. 1 объем смеси и 1 объем нейтрализатора), встряхивая в течение 5 — 10 мин., и используют для определения тест-вируса в чувствительной культуре клеток или на мышах, или на утках.
Методика определения инфекционного вируса после воздействия ДС и субстанции: исследуемый материал (смесь вируса, ДС и нейтрализатора) вносят (или исследуемым материалом заражают мышей или уток) в лунки планшета, пробирки с выращенным монослоем клеток или в суспензию клеток (в случае применения суспензионной культуры клеток), через 30 — 60 мин. удаляют смесь, заменяют ее культуральной средой. Культуру клеток инкубируют в термостате при температуре, необходимой для репродукции вируса в течение срока наблюдения.
О вирулицидной активности средства судят по наличию или отсутствию цитопатогенного действия, вызываемого вирусом, или по другим проявлениям, указывающим на репродукцию вируса.
Все эксперименты сопровождаются контролями культуры клеток, вируса, полноты нейтрализации.
Эффективным считают средство (субстанцию), обеспечивающее инактивацию вируса при времени воздействия не более 60 мин.
5.7.3.2. Метод батистовых тест-объектов [66, 75]
Исследования вирулицидной активности ДС и субстанций этим методом
проводят на тест-вирусах, фиксированных на батистовых тест-объектах. При
использовании данного метода происходит некоторая потеря (1 — 2 log ТЦИД /
50
мл) вирусных частиц во время погружения контаминированных тест-объектов в
раствор ДС, нейтрализатор и при последующем отмывании от остатков ДС.
Однако этот метод более приемлем для изучения ДС, продукты нейтрализации
которых токсичны для культуры клеток и вызывают в них неспецифические
дегенеративные изменения.
Подготовка эксперимента. Вирусной суспензией контаминируют батистовые тест-объекты, далее — «тесты».
В качестве тестов используют кусочки батиста размером 1 x 0,5 см, предварительно простиранного (т.е. освобожденного от крахмала) и проглаженного. Тесты помещают в стерильную чашку Петри и заливают ВС из расчета 0,05 — 0,1 мл жидкости на один тест (без сыворотки или с добавлением 40 процентов СКРС). Тесты подсушивают при комнатной температуре не менее 60 мин. Контаминированные ВС тесты используют в опытах. Тесты не следует заготавливать впрок, их контаминируют ВС ex tempore.
При исследовании вирулицидной активности готовят 3 — 5 концентраций раствора ДС на стерильной дехлорированной водопроводной воде из расчета 1,0 мл раствора на каждый тест.
Постановка эксперимента. В исследуемые растворы погружают контаминированные ВС тесты по 5 штук на каждую экспозицию.
Момент смачивания тестов раствором ДС является началом опыта и с этого момента отсчитывают экспозицию. Через 5 — 15 — 30 — 45 — 60 мин. стерильным охлажденным пинцетом или петлей извлекают по 5 тестов, помещают их в пробирку с бусами (из стекла, пластика) и 5 мл стерильного раствора нейтрализатора, помещают в шуттель-аппарат на 10 мин.
По истечении каждой экспозиции смывной жидкостью заражают культуру клеток (мышей, уток). Культуру клеток, отмытую от ростовой среды, оставляют на контакт на 30 — 60 мин. для адсорбции вируса. Затем клетки промывают раствором Хенкса и заливают поддерживающей средой с сывороткой. Клетки инкубируют в термостате при оптимальной для конкретного вируса температуре.
Критерием вирулицидной активности ДС является снижение количества
вируса не менее чем на 4 log при времени дезинфекционной выдержки не
10
более чем 60 мин.
Контроль культуры клеток. С этой целью оставляют незараженными пробирки с культурой клеток и наблюдают в течение максимального срока опыта. При работе с культурой клеток в контрольных пробирках так же, как и в опытных, при необходимости меняют поддерживающую среду в зависимости от изменения pH.
Контроль вируса. С этой целью 5 штук тестов, контаминированных вирусом, помещают в пробирку с 5 мл раствора Хенкса, выдерживают максимальную экспозицию, используемую в эксперименте; переносят в пробирки с 5 мл нейтрализатора и бусами, встряхивают в шуттель-аппарате в течение 10 мин. и заражают культуру клеток (или другой чувствительный биологический объект) соответствующей дозой (0,2 мл или менее) жидкости, отмытой с тестов. Для выяснения количества жизнеспособного вируса проводят титрование.
Неспецифический цитопатический эффект (ЦПЭ) может быть при неполной нейтрализации дезинфектанта или цитотоксическом эффекте смеси «дезинфектант + нейтрализатор». Исключить неспецифический цитотоксический эффект в некоторых случаях удается путем дополнительного отмыва монослоя раствором Хенкса после контакта клеток с внесенной пробой с нейтрализатором в течение 60 мин. для адсорбции вируса на поверхности клеток. По истечении этого времени добавляют поддерживающую среду. Избежать неполной нейтрализации можно путем тщательной отработки условий нейтрализации или поиска другого нейтрализатора.
Контроль контаминации вирусом тестов. С этой целью 5 штук тестов, контаминированных вирусом, помещают в пробирку с бусами и 5 мл физиологического раствора, отмывают в шуттель-аппарате в течение 10 мин. и соответствующей дозой (0,2 мл или менее, как в опыте) жидкости, отмытой с тестов, заражают культуру клеток (или другой биологический объект). Для определения степени контаминации тестов вирусом проводят титрование.
Контроль полноты нейтрализации ДС. С этой целью 5 штук тестов (без вируса) помещают на максимальную экспозицию, используемую в эксперименте, в 5 мл раствора максимальной концентрации ДС. После этого тесты переносят на 5 мин. в 5 мл раствора нейтрализатора, отмывают с бусами в течение 10 мин. и вносят (по 0,2 мл или менее) смыв с тестов в культуру клеток (или другой биологический объект).
Исследования вирулицидной активности субстанции завершаются первым этапом.
Исследования вирулицидной активности ДС, предназначенных для дезинфекции при особо опасных вирусных инфекциях, завершаются первым этапом, если возбудитель по устойчивости к конкретному ДС не превышает полиовирус и аденовирус.
После получения данных о наличии у ДС вирулицидной активности исследования продолжаются на втором этапе — изучение эффективности при обеззараживании различных объектов.
Эффективным считают средство (субстанцию), обеспечивающее инактивацию вируса при времени воздействия не более 60 мин.
5.7.4. Методы изучения и оценки вирулицидной эффективности
ДС, предназначенных для обеззараживания различных объектов,
контаминированных тест-вирусами [15, 66, 75]
Исследования эффективности ДС при обеззараживании различных объектов (изделия медицинского назначения, включая эндоскопы, посуда, белье, поверхности, выделения и др.), имеющих эпидемиологическое значение в распространении инфекционных заболеваний вирусной этиологии, проводят с целью разработки эффективных режимов дезинфекции. Полученные положительные результаты в опытах на тест-вирусах уточняют (при необходимости) на вирусах-возбудителях той инфекции, при которой они будут использованы, учитывая их специфику и механизм передачи инфекции. Объем исследований ДС зависит от их предполагаемого назначения и может включать все или некоторые из приведенных ниже объектов.
5.7.4.1. Определение вирулицидной активности ДС,
предназначенных для обеззараживания ИМН [16, 68, 73]
5.7.4.1.1. Определение вирулицидной активности ДС, предназначенных для обеззараживания ИМН (кроме эндоскопов) из различных материалов.
В качестве тест-изделий используют стерильные инструменты и другие ИМН (в т.ч. однократного применения): имеющие замковые части (щипцы, ножницы, корнцанг), не имеющие замковых частей (пинцеты, шпатели); стоматологические, в т.ч. вращающиеся, инструменты (боры, буравы корневые, зеркала, диски шлифовальные) из различных материалов (металлов, резин, стекла, пластмасс) или имитирующие их тест-объекты.
Контаминация изделий тест-вирусом. Простерилизованные или продезинфицированные (способом кипячения) тест-изделия контаминируют ВС с добавлением 40% инактивированной (без консерванта) СКРС в качестве органической нагрузки (например, к 6 мл ВС добавляют 4 мл неразведенной сыворотки), перемешивают. Если средство обладает фиксирующими свойствами, то сыворотку в качестве белковой нагрузки добавляют в количестве 5%.
Приготовленной смесью контаминируют изделия, полностью погружая в нее мелкие, а на крупные наносят пипеткой, следя за равномерным смачиванием всей поверхности. Каналы изделий заполняют с помощью шприца или другого приспособления, избегая образования пузырьков воздуха.
Разъемные изделия погружают в смесь и, опуская в нее, делают несколько рабочих движений. Инструменты, имеющие замковые части, погружают раскрытыми, предварительно сделав ими несколько рабочих движений для лучшего проникновения вируса в труднодоступные участки изделия в области замка. Избыток смеси удаляют любым способом (промокают с помощью стерильной фильтровальной бумаги, марлевой салфетки), но не протирают! изделия. Тест-изделия подсушивают при температуре (20 +/- 2) °C в течение 60 — 90 мин.
Определение активной концентрации средства и времени вирулицидного действия. Контаминированные вирусом изделия погружают в дезинфектант на время дезинфекционной выдержки (5, 10, 15, 20, 30, 45, 60, 90, 120 мин.) или при необходимости на более длительное время, например 240 мин. — для изделий однократного применения перед утилизацией.
По истечении времени дезинфекционной выдержки изделия извлекают из дезинфектанта. Каналы промывают нейтрализатором, с поверхностей берут смывы салфетками размером 5 x 5 см, смоченными нейтрализатором. Салфетки, мелкие изделия погружают в пробирки с бусами и нейтрализатором (объем — 5 мл), которые помещают в шуттель-аппарат на 10 мин.
Полученную смывную жидкость вносят в пробирки или лунки планшета с культурой клеток или вводят в организм лабораторного животного или уток.
Оптимальное время обеззараживания — не более 60 мин., для изделий однократного применения — не более 240 мин.
5.7.4.1.2. Определение вирулицидной активности ДС, предназначенных для обеззараживания эндоскопов, включая ДВУ [16, 66, 73, 75].
В качестве исследуемых объектов используют гибкий гастроскоп, жесткий цистоскоп, эндоскопы или фрагменты гибкого эндоскопа (гастроскопа) — его каналов и наружной поверхности.
С помощью пипетки ВС контаминируют поверхность и каналы эндоскопа (или его фрагменты), затем их погружают в раствор ДС, заполняя им каналы изделия. Для имитации минимального органического загрязнения к ВС перед контаминацией тест-изделия добавляют 5% инактивированной сыворотки. Через 5 — 60 мин. тест-изделие извлекают из раствора и берут смыв с его поверхности стерильной марлевой салфеткой, смоченной нейтрализатором. Канал изделия промывают раствором нейтрализатора и оставляют на 10 мин. Салфетки помещают в пробирки с нейтрализатором и стеклянными бусами, отмывают в шуттель-аппарате в течение 10 мин. Промывную — из каналов и смывную — с салфеток жидкости вносят в культуру клеток (или заражают другой биологический объект), отмытую от ростовой среды, оставляют на контакт на 30 — 60 мин. для адсорбции вируса и добавляют поддерживающую среду. При необходимости для снятия цитотоксического действия ДС клетки промывают раствором Хенкса и заливают поддерживающей средой с сывороткой. Клетки инкубируют в термостате при необходимой для конкретного вируса температуре.
Оптимальное время обеззараживания — не более 60 мин.
При разработке режима ДВУ в качестве органической нагрузки используют 5% инактивированной СКРС. ДС используют в концентрации, обеспечивающей стерилизацию, и исследуют только время ДВУ.
Оптимальное время ДВУ — не более 30 мин.
5.7.4.1.3. Определение вирулицидной активности ДС, предназначенных для обеззараживания стоматологических оттисков [75].
В качестве тест-объектов используют оттиски из альгинатных, силиконовых или других материалов. Для изготовления оттисков слепочную массу, полученную в соответствии с рекомендациями изготовителя, помещают в пластмассовую или металлическую ложку и делают оттиск с пластмассовых зубных протезов с моделированной десной.
На оттиски наносят ВС, подсушивают в течение 2 — 3 мин., промывают стерильной водой и погружают полностью в раствор ДС. Контрольные контаминированные ВС оттиски погружают в стерильную водопроводную воду (вместо раствора ДС) на максимальное время, взятое в эксперименте.
Через 5 — 30 мин. оттиски извлекают из раствора ДС (контрольные — из воды) и делают смывы марлевой салфеткой, смоченной в 5 мл нейтрализатора, приготовленного на поддерживающей среде.
Салфетки помещают в пробирки с нейтрализатором и стеклянными бусами, отмывают в шуттель-аппарате в течение 10 мин. Смывной жидкостью заражают культуру клеток (или другой биологический объект). Культуру клеток, отмытую от ростовой среды, оставляют на контакт на 30 — 60 мин. для адсорбции вируса. Затем клетки промывают раствором Хенкса и заливают поддерживающей средой с сывороткой. Клетки инкубируют в термостате при оптимальной для конкретного вируса температуре.
Оптимальное время обеззараживания — не более 30 мин.
5.7.4.1.4. Особенности постановки экспериментов по изучению вирулицидной активности ДС, предназначенных для обеззараживания ИМН в установках: моюще-дезинфицирующие машины и др. [75].
Одним из самых значимых условий постановки экспериментов по разработке (для отечественных) или экспертной оценке (для зарубежных) режимов обеззараживания ИМН в установках, например ультразвуковых, моюще-дезинфицирующих машинах, является создание условий эксперимента, максимально приближенных к условиям практического применения (в соответствии с техническим паспортом и инструкцией по эксплуатации).
Принципиальными являются следующие характеристики: скорость движения циркуляции дезинфицирующего раствора, температура раствора, количество (объем) раствора, диаметр канала (каналов) по которым циркулирует раствор. Повышенная температура растворов ДС и принудительная циркуляция повышают их активность, в несколько раз сокращая время обеззараживания ИМН.
5.7.4.2. Определение вирулицидной активности ДС,
предназначенных для обеззараживания предметов
ухода за больными и игрушек [66, 75]
Определение вирулицидной активности ДС при обеззараживании предметов ухода за больными. Предметы ухода за больными можно поделить на 2 группы, в зависимости от возможного загрязнения биосубстратами и степени контаминации вирусами:
— наконечники к клизмам соприкасаются при их использовании со слизистой оболочкой прямой кишки, поэтому требования к их обработке и критерии эффективности ДС такие же, как к ИМН. Органическая нагрузка в экспериментах должна составлять 40% сыворотки, а способ обеззараживания — путем погружения в раствор ДС;
— подкладные клеенки могут быть загрязнены любыми выделениями, поэтому органическая нагрузка должна быть такая же, как и в экспериментах с ИМН — 40%, а способ обеззараживания — путем погружения в раствор или одно-, при необходимости — двукратного протирания;
— пузыри для льда и грелки соприкасаются только с кожей, они, как правило, не загрязнены выделениями, однако могут быть контаминированы вирусами. При разработке режимов их обеззараживания органическая нагрузка на тест-объектах не обязательна, а способ обработки — одно- или двукратное протирание.
В качестве тест-объектов, имитирующих предметы ухода за больными, используют тест-поверхности размером 10 x 10 кв. см, изготовленные из резиновых грелок, пузырей для льда, медицинской клеенки, а также наконечники к клизмам и др. из разных материалов. Их контаминируют смесью ВС с 40% инактивированной сыворотки. Наконечники к клизмам контаминируют вирусом по такой же методике, что и ИМН, имеющие каналы, затем подсушивают до полного высыхания при температуре 20 +/- 2 °C.
Подготовленные тест-объекты протирают однократно или двукратно с интервалом 15 мин. салфеткой, смоченной раствором ДС. Кроме того, тест-объекты, изготовленные из медицинской клеенки, погружают в дезинфицирующий раствор.
Мелкие предметы (наконечники к клизмам и др.) погружают в раствор ДС, заполняя им полости и каналы, избегая образования пузырьков воздуха.
Через 30, 60, 90, 120 мин. смывы берут марлевыми салфетками размером 5 x 5 см, смоченными в нейтрализаторе. Предметы ухода, имеющие каналы, промывают нейтрализатором (не более 5 мл), который собирают в стерильные пробирки и оставляют на 10 мин. для нейтрализации. Марлевые салфетки погружают в широкогорлые пробирки с бусами (с 5 мл нейтрализатора, приготовленного на поддерживающей среде), которые отмывают в шуттель-аппарате в течение 10 мин. Далее — как в п. 5.7.4.1.1.
Оптимальное время обеззараживания предметов ухода за больными — не более 120 мин.
Определение вирулицидной активности ДС при обеззараживании игрушек. При обеззараживании игрушек (мелких и средних) определение вирулицидной активности ДС проводят при обработке способами протирания, погружения в раствор ДС или орошения для крупных игрушек.
С этой целью игрушки (без отверстий) контаминируют ВС из расчета 0,5 мл на 100 кв. см, но так, чтобы вся их поверхность была ею покрыта. Мелкие игрушки погружают полностью в ВС. Затем их подсушивают при температуре 18 — 20 °C до полного высыхания.
Поверхность игрушек протирают салфеткой, смоченной раствором ДС (в контроле — стерильной водой), мелкие игрушки погружают в раствор ДС, препятствуя их всплытию; крупные игрушки орошают раствором ДС. Норма расхода раствора ДС способом протирания 100 — 150 мл/кв. м при однократной обработке, способом орошения — 150 мл/кв. м при обработке распылителем типа «Квазар» и 300 мл/кв. м при обработке распылителем типа «Автомакс» или гидропультом. При необходимости обработку способом протирания или орошения повторяют через 5 — 15 мин.
Через определенные интервалы времени (от 15 до 120 мин.) с помощью марлевой салфетки (5 x 5 см), смоченной нейтрализатором, приготовленным на поддерживающей среде или физрастворе, с игрушек берут смывы. Салфетки погружают в пробирки со стеклянными бусами и нейтрализатором. Далее — как в п. 5.7.4.1.1.
Оптимальное время обеззараживания — не более 120 мин.
5.7.4.3. Определение вирулицидной активности ДС,
предназначенных для обеззараживания белья, спецодежды
и других изделий из тканей [66, 75]
При определении вирулицидной активности ДС при обеззараживании белья учитывают соотношение раствора ДС и белья: при особо опасных инфекциях расход раствора составляет 5 л на 1 кг сухого белья, при прочих — 4 л раствора на 1 кг сухого белья; температуру раствора, степень и характер загрязнения белья.
Определение эффективности ДС при обеззараживании белья без видимых загрязнений. Исследования проводят с помощью батистовых тестов. Контаминированные вирусом тесты подсушивают при комнатной температуре, затем их закладывают (по 5 штук в каждый) в бязевые стерильные мешочки размером 5 x 8 см с пришитой к углу каждого из них прочной ниткой длиной около 0,5 м. Мешочки закрывают в виде конверта.
Белье (старые бязевые халаты, полотенца и др.) погружают в емкость с раствором ДС, последовательно замачивая одну вещь за другой, следя за тем, чтобы между вещами не образовывалось воздушных прослоек, препятствующих процессу дезинфекции. Одновременно между слоями белья распределяют (сверху, в середине и внизу) мешочки с контаминированными вирусом тестами.
Через определенные промежутки времени (15 — 30 — 60 и более минут) мешочки с тестами извлекают одновременно из трех слоев.
Тесты вынимают из мешочка стерильным пинцетом, погружают в широкогорлые пробирки с нейтрализатором и бусами, далее — как в п. 5.7.4.1.1.
Определение вирулицидной активности ДС при обеззараживании белья, загрязненного кровью, фекалиями. С целью изучения эффективности средства при обеззараживании белья, загрязненного кровью (имитация в виде 40% сыворотки), медицинских отходов из тканей, марли, ваты (одноразовое хирургическое белье и акушерские комплекты, перевязочный материал, марлевые салфетки, ватные тампоны и др.) к 6 мл вируссодержащей жидкости прибавляют 4 мл инактивированной СКРС, смешивают и заливают тесты, подсушивают их и используют в опыте (п. 5.7.4.1.3).
Оптимальное время обеззараживания белья — не более 120 мин., медицинских отходов — не более 240 мин.
Для имитации загрязнения белья и медицинских отходов из тканей и других фекалиями в экспериментах с тест-вирусом используют фекальную эмульсию. Фекальную эмульсию готовят следующим образом: к 6 мл 10%-ной ВС добавляют 4 мл 40%-ной эмульсии фекалий. Для этого 8 г простерилизованных фекалий (1,5 атм. в течение 30 мин.) растирают в ступке с 20 мл стерильной воды. В качестве органической нагрузки можно использовать также 80% инактивированной СКРС из расчета: 8 мл сыворотки и 2 мл ВС тщательно перемешивают и этой смесью заливают тесты. Избыток жидкости через 15 мин. удаляют с помощью пипетки, тесты подсушивают при комнатной температуре. Далее эксперимент проводят по схеме для незагрязненного белья (п. 5.7.4.1.3).
Оптимальное время обеззараживания белья и медицинских отходов, загрязненных фекалиями, — не более 240 мин.
5.7.4.4. Определение вирулицидной активности ДС,
предназначенных для обеззараживания посуды,
в том числе лабораторной [66, 75]
Методика обеззараживания посуды без остатков пищи, а также без других видимых загрязнений. При обеззараживании посуды без остатков пищи, лабораторной посуды без видимых загрязнений в качестве тест-объектов используют тарелки, стаканы, эмалированные кружки; столовые приборы — ножи, вилки, ложки; лабораторную посуду — пипетки, в т.ч. микропипетки, наконечники к ним, предметные стекла, пробирки.
Чистую посуду контаминируют ВС, которую наносят пипеткой из расчета 0,5 мл на 100 кв. см и равномерно распределяют по поверхности стерильным стеклянным шпателем. Вилки, ложки и ножи погружают в ВС на 10 — 15 мин. (за исключением ручек), каналы пипеток контаминируют вирусом.
Посуду, столовые приборы подсушивают при комнатной температуре. После полного высыхания погружают в раствор ДС, полностью их покрывая (расход раствора составляет примерно 2 л на комплект посуды: чашка, блюдце, 2 тарелки, ложка, вилка, нож) раствором.
Через определенные интервалы времени (15, 30, 60, 90, 120 мин.) посуду извлекают из раствора ДС. Для оценки эффективности обеззараживания стерильными марлевыми салфетками размером 5 x 5 см (вначале увлажненной нейтрализатором, затем сухой) тщательно протирают контаминированные вирусом части каждого предмета. Салфетки помещают в стерильную широкую пробирку с бусами и 5 мл стерильного нейтрализатора (п. 5.7.4.1.1).
Оптимальное время обеззараживания — не более 60 мин.
Контролем служит аналогичным способом контаминированная вирусом посуда, погруженная на максимальную экспозицию в стерильную или прокипяченную водопроводную воду.
Методика обеззараживания посуды с остатками пищи, а также загрязненной лабораторной посуды. Для изучения эффективности ДС при обеззараживании посуды с остатками пищи, загрязненной лабораторной посуды многократного использования и однократного применения (перед утилизацией) к ВС добавляют 80% инактивированной СКРС из расчета: 20% ВС и 80% сыворотки, смесь наносят равномерно на посуду, подсушивают. Далее — как в п. 5.7.4.4 для посуды без остатков пищи.
Оптимальное время обеззараживания — не более 120 мин. для посуды многократного использования и не более 240 мин. — для посуды однократного применения перед утилизацией.
5.7.4.5. Определение вирулицидной активности ДС,
предназначенных для обеззараживания поверхностей [66, 75]
Определение вирулицидной активности ДС при обеззараживании тест-поверхностей изучают двумя способами: способом протирания одно- или двукратного или способом орошения.
В экспериментах используют тест-поверхности размером 10 x 10 см, гладкие, шероховатые, впитывающие и невпитывающие ДС из различных материалов: деревянные, оштукатуренные, окрашенные масляной или клеевой и другими красками, оклеенные обоями, а также из линолеума, пластика, стекла, кафеля, метлахской плитки, фаянса, искусственной или натуральной кожи и др. Набор тест-поверхностей (далее — «поверхностей») определяется назначением средства.
Перед экспериментом поверхности подвергают механической очистке: моют водой с мылом и щеткой, за исключением поверхностей, оклеенных обоями и окрашенных клеевой краской. Последние протирают несколько раз стерильной салфеткой, увлажненной стерильной водопроводной водой. После подсыхания поверхности располагают горизонтально и пипеткой наносят ВС из расчета 0,5 мл с добавлением 5% инактивированной СКРС на площадь в 100 кв. см, равномерно распределяют по поверхности стеклянным шпателем. Контаминированные вирусом поверхности подсушивают до полного высыхания при температуре 20 +/- 2 °C и относительной влажности воздуха 50 — 60%, затем обрабатывают раствором ДС.
Обеззараживание контаминированных ВС поверхностей некоторых видов: оштукатуренные, окрашенные клеевой и другими красками, оклеенные обоями, из стекла, фаянса, дерева, окрашенного масляной краской, из кафеля, проводят в вертикальном положении (способ орошения). Остальные поверхности обрабатывают как в горизонтальном (способ однократного или двукратного протирания), так и в вертикальном положениях. Раствор ДС наносят на поверхность путем орошения из пульверизатора, точно следя за количеством израсходованной жидкости. Норма расхода — от 80 до 500 мл раствора на 1 кв. м обрабатываемой площади.
Для имитации органического загрязнения используют 40% инактивированной сыворотки при разработке режимов обеззараживания раковин, ванн или 80% при разработке режимов обеззараживания унитазов. Возможно также использование вируссодержащей фекальной эмульсии, которую наносят на поверхности из кафеля или фаянса в экспериментах с вирусами, выделяющимися из организма с фекалиями.
Контроль эффективности обеззараживания осуществляют через 15 — 30 — 60 мин. Пробы отбирают путем тщательного протирания орошенных раствором ДС поверхностей стерильной марлевой салфеткой (5 x 5 см), слегка увлажненной нейтрализатором в физиологическом растворе или растворе Хенкса с антибиотиками, а затем сухой. Салфетки помещают в широкогорлые пробирки с бусами и 5 мл нейтрализатора (п. 5.7.4.1.1).
Оптимальное время обеззараживания поверхностей — не более 60 мин.
В контроле вируса контаминированные ВС поверхности протирают или орошают стерильной или прокипяченной водопроводной водой при той же норме расхода воды, что и ДС в опыте. Забор проб и их обработку проводят аналогично опытным. Для определения плотности контаминации проводят титрование смывов с поверхностей.
При работе с вирусом гепатита A опыт моделируется с меньшим количеством белья, ДС и ВС.
5.7.4.6. Определение вирулицидной активности ДС,
предназначенных для обеззараживания выделений:
моча, фекалии, мокрота и кровь [66, 75]
При определении вирулицидной активности ДС для обеззараживания мочи подбирают концентрацию ДС и время обработки. Растворы ДС добавляют к продезинфицированной способом кипячения моче в равном или двойном объеме. Через 15, 30, 60 мин. указанную смесь в количестве 1 мл переносят в пробирки с 5 мл нейтрализатора, перемешивают, оставляют на 10 мин. для нейтрализации, затем заражают культуру клеток (или другой биологический объект). Культуру клеток, отмытую от ростовой среды, оставляют на контакт на 30 — 60 мин. для адсорбции вируса. Затем клетки промывают раствором Хенкса и заливают поддерживающей средой с сывороткой. Клетки инкубируют в термостате при оптимальной для конкретного вируса температуре.
В контроле к моче добавляют не дезинфицирующий раствор, а стерильную воду. Результаты опытов учитывают в сравнении с контролем. Количество вируса в моче в контроле определяют титрованием.
Оптимальное время обеззараживания — не более 120 мин.
При разработке режимов обеззараживания фекалий учитывают соотношение ДС и обеззараживаемой массы фекалий, время обработки, консистенцию обеззараживаемых выделений, степень гомогенизации в процессе обеззараживания.
С этой целью 20 г простерилизованных фекалий растирают в ступке с добавлением 80 мл воды до получения гомогенной эмульсии. Эмульсию разливают по 9 мл в пробирки и добавляют по 1 мл вируссодержащей жидкости.
Приготовленную эмульсию фекалий заливают равным или двойным количеством раствора ДС и в дальнейшем берут пробы так же, как и при обеззараживании мочи. Взятые пробы центрифугируют при 2500 — 3000 об./мин. в течение 20 мин., после чего надосадочной жидкостью заражают культуру клеток, внося ее в пробирки/лунки с клетками или в организм чувствительного животного, уток.
В контроле вместо раствора ДС используют стерильную воду. Результаты учитывают в сравнении с контролем.
Оптимальное время обеззараживания — не более 240 мин.
При разработке режимов обеззараживания крови (без сгустков) используют цитратную (или дефибринированную) кровь, контаминированную тест-вирусом (соотношение объема крови и вирусной суспензии 1:1). Можно также использовать эритроцитарную массу (бараньи эритроциты), которая готовится путем добавления к 3 мл отмытой эритроцитарной массы 97 мл 3,0%-ного раствора альбумина на фосфатном буфере. Аликвоты этой смеси контаминируют тест-вирусом. Подбирают оптимальное соотношение ДС и обеззараживаемой крови, концентрацию ДС, время обработки, нейтрализуют (1:1, т.е. 1 объем смеси крови и ДС и 1 объем нейтрализатора), выдерживают 5 — 10 мин. (перемешивая или встряхивая) и используют для определения инфекционности тест-вируса. Для обеззараживания крови со сгустками эффективным является только термический метод обработки (в паровом стерилизаторе).
Оптимальное время обеззараживания — не более 240 мин.
При разработке режимов обеззараживания мокроты используют мокроту волонтеров, подбирают оптимальное соотношение ДС и обеззараживаемой мокроты, время обработки, концентрацию ДС, нейтрализатор.
Оптимальное время обеззараживания — не более 240 мин.
5.7.4.7. Определение вирулицидной активности аэрозолей ДС,
предназначенных для обеззараживания воздуха
в помещениях [75]
Для определения вирулицидной активности аэрозолей ДС при обеззараживании воздуха в помещениях (инфекционные очаги, ЛПУ и др.) применяют аспирационный метод.
В качестве тест-вирусов используют полиовирус и/или аденовирус. ВС
распыляют в камере в количестве, достаточном для получения в воздухе камеры
5
концентрации вируса 1 x 10 ТЦИД /куб. м. Аэрозоль создают с помощью
50
распыливающей аппаратуры, которая обеспечивает образование в воздухе не
менее 80% частиц с дисперсностью 20 +/- 5 мкм, затем включают вентилятор
для предотвращения оседания аэрозоля ДС.
В склянки Дрекселя вместо 50 мл стерильной водопроводной воды наливают 5 мл раствора Хенкса или поддерживающей питательной среды с нейтрализатором и антибиотиками.
Для контроля исходной контаминации воздуха вирусом перед началом эксперимента через склянки Дрекселя, соединенные последовательно одна с другой, а также в процессе эксперимента пропускают по 50 л воздуха (объем пробы для исследования). После отбора проб через каждые 5, 10 или 15 мин., в зависимости от предполагаемой эффективности ДС и с учетом чувствительности вируса к ДВ, жидкость из двух склянок Дрекселя соединяют, перемешивают и по 2 мл вносят в пробирки/лунки с культурой клеток (или в организм лабораторного животного, уток). Клетки оставляют на 1 ч для контакта, затем сливают. После этого во все пробирки вносят поддерживающую среду в количестве 2 мл и помещают в термостат.
При определении эффективности аэрозоля ДС исследования проводят при трех показателях относительной влажности воздуха: 20 — 25, 50 — 55 и 80 — 85% и температуре воздуха (20 +/- 2) °C. Во время эксперимента в камере должен постоянно работать вентилятор для перемешивания компонентов исследуемой системы: вируса, воздуха, аэрозоля ДС.
Об инактивации вируса судят по утрате им инфекционной активности.
Вирулицидная активность ДС в форме аэрозоля зависит от концентрации вируса в воздухе, расхода смеси аэрозоля на единицу объема, концентрации раствора ДС в аэрозольной смеси, экспозиции, относительной влажности воздуха и температуры в камере.
В контроле используют аэрозольные смеси, содержащие вместо раствора ДС стерильную воду, которые распыляют в камере в тех же количествах, при этом размер аэрозольных частиц должен быть одинаковым с размером частиц аэрозоля средства.
5.7.4.8. Определение вирулицидной активности ДС,
предназначенных для обеззараживания медицинских отходов [75]
Методики определения вирулицидной активности ДС при обеззараживании медицинских отходов разного происхождения приведены в соответствующих разделах: изделий медицинского назначения однократного применения — п. 5.7.4.1.1; отходов из тканей (медицинская защитная одежда и белье, перевязочный материал, марлевые салфетки, ватные тампоны и др.) — п. 5.7.4.3; посуды, в том числе лабораторной однократного использования, — п. 5.7.4.4; крови и др. — п. 5.7.4.6.
5.7.5. Определение вирулицидной
активности кожных антисептиков
Для изучения вирулицидной активности кожных антисептиков используют
суспензионный метод (п. 5.7.3.1) или метод батистовых тест-объектов
(п. 5.7.3.2). С этой целью используют полиовирус, аденовирус, а также ВГВУ
5
в количестве 10 ТЦИД /мл (ИД /мл), или вирус диареи крупного рогатого
50 50
скота ВД-БС. Время дезинфекционной выдержки не должно превышать 4 мин.
Эффективность — снижение титра вируса не менее чем на 4 log .
10
5.7.6. Определение вирулицидной активности антимикробных
тканей, лакокрасочных материалов [75]
При определении вирулицидной активности антимикробных тканей выбор тест-вируса и тест-объекта зависит от назначения и сферы применения, например марлевые повязки для защиты верхних дыхательных путей профессионального контингента (медицинские работники, продавцы в супермаркетах и др.) или изготовление спецодежды и пр.
С этой целью на тест-объекты (по два на каждое разведение) из исследуемой ткани размером 2 x 2 см капельно наносят по 0,05 мл ВС.
Через 30 сек., 1, 3, 5, 10, 15, 30, 60 мин. тест-объекты переносят в широкогорлые пробирки с бусами и 5 мл нейтрализатора, отмывают в шуттель-аппарате в течение 10 мин. Смывной жидкостью заражают культуру клеток (или другой биологический объект). Культуру клеток, отмытую от ростовой среды, оставляют на контакт на 30 — 60 мин. для адсорбции вируса. Затем клетки промывают раствором Хенкса и заливают поддерживающей средой с сывороткой. Клетки инкубируют в термостате при оптимальной для конкретного вируса температуре. В контроле используют тест-объекты из ткани того же артикула, но не содержащей противовирусные вещества.
Критерии вирулицидной активности — снижение титра вируса не менее чем
на 4 log .
10
Определение вирулицидной активности лакокрасочных материалов. При
определении вирулицидной активности лакокрасочных материалов (антимикробные
5
лаки, краски) ВС в дозе 10 ТЦИД /мл наносят в количестве 0,5 мл на
50
исследуемую тест-поверхность (размер 10 x 10 кв. см). После необходимой
экспозиции (от 30 мин. до 24 ч) с поверхности берут смыв стерильной
марлевой салфеткой, смоченной нейтрализатором. Салфетки погружают в
широкогорлые пробирки с 5 мл нейтрализатора и бусами, отмывают в течение
10 мин. в шуттель-аппарате (п. 5.7.4.1.1).
В качестве контроля используют тест-поверхности, окрашенные краской или покрытые лаком, не содержащими вирулицидные вещества.
Определение пролонгированного вирулицидного действия лакокрасочных материалов проводят на тест-поверхностях без дополнительной и с дополнительной искусственной контаминацией испытуемым тест-вирусом.
Критерии вирулицидной активности лакокрасочного покрытия — снижение
количества вируса не менее чем на 4 log через 24 ч после нанесения его
10
на поверхность; наблюдение может продолжаться в течение 6 месяцев и более.
5.7.7. Библиографические данные
1. Disinfection, sterilization, and preservation. Seymour S. Block. Fifth Edition, by Lippincott Williams S Wilkins, Philadelphia, PA 19106 USA. 2001. 1481 с.
2. Handbuch der viruswirksamen Desinfektionen. F. v. Rheinbaben, M.H. Wolf. Springer-Verlad, Berlin. 2002. 509 с.
3. EN 14476. Chemical disinfectants and antiseptics — Virucidal quantitative suspension test for chemical disinfectants and antiseptics used in human medicine — Test methods and requirements (phase 2/step 1) ICS 11.080.20, april 2005 + A1:2006.
4. Prufung und Deklaration der Wirksamkeit von Desinfections-mitteln gegen Viren. Stellungnahme des Arbeitskreises Virazidie beim Robert Koch-Institut RKI sowie des Fachausschusses «Virusdesinfektion» der Deutschen Gesellschaft zur Bekampfung der Viruskrankheiten DVV und der Desinfektionsmittel-kommission der Deutschen Gesellschaft fur Hygiene und Mikrobiologie DGHM. Bundesgesundheitsbl-Gesundheitsforsch-Gesundheitsschutz. 2004. N 47. С. 62 — 66.
5. Методические рекомендации по определению вирулицидной активности препаратов. N 1119-73 от 06.09.73, М., 1974. 16 с.
6. Руководство по вирусологическим исследованиям полиомиелита. ВОЗ, Женева. — М., 1998. 114 с.
7. Комплексная оценка вирулицидной активности дезинфектантов на вирус гепатита A. Н.А. Замятина, Р.М. Элбакян, В.Ф. Полещук, М.И. Михайлов/Тр. Ин-та полиомиелита и вирусных энцефалитов им. М.П. Чумакова. Медицинская вирусология. М., 2006. Т. XXIII. С. 137 — 141.
8. Вирус гепатита B уток как суррогатная модель для изучения вируса гепатита B человека. /Т.А. Тетерина, К.К. Кюрегян, О.В. Исаева, О.Е. Попова, В.П. Князев, К.Н. Груздев, М.И. Михайлов/ Тр. Ин-та полиомиелита и вирусных энцефалитов им. М.П. Чумакова. Медицинская вирусология. М., 2006. Т. XXIII. С. 152 — 160.
9. Protocol for testing the efficacy of disinfectants used to inactivate duck hepatitis B virus and to support corresponding label claims. Developed by MicroBioTest, Inc. and Submitted to the Environmental Protection Agency. 2000. P. 1 — 12.
10. Дерябин П.Г., Львов Д.К. Высокопродуктивный вариант вируса гепатита C. Выделение, характеристика, идентификация//Доклады Академии наук РФ. 1998. Т. 358. 5. С. 688 — 691.
11. Дерябин П.Г., Исаева Е.И., Гренкова Е.П., Сухно А.С. и др. Цитопатогенные варианты вируса гепатита C ВГС, пригодные для разработки вакцины//Аллергия, астма и клиническая иммунология. 2001. Т. 1. С. 28 — 30.
5.7.8. Приложения
Приложение 1
рекомендуемое
1. Тест-вирусы и методы их культивирования
1.1. Тест-вирусы
Тест-вирусы получают из национальных или из международных коллекций вирусов:
1.1.1. Вирус полиомиелита 1-го типа, вакцинный штамм Sabin LSc-2ab, РНК-содержащий вирус, не имеющий оболочки, из семейства пикорнавирусов.
1.1.2. Аденовирус, тип 5, штамм Аденоид 75 (ATCC VR-5), ДНК-содержащий вирус, не имеющий оболочки, из семейства аденовирусов.
1.1.3. Бычий парвовирус, штамм Хаден ATCC VR-767.
1.1.4. Вирус гепатита A, штамм HAS-15, РНК-содержащий вирус, не имеющий оболочки, из семейства пикорнавирусов.
1.1.5. Вирус гепатита B уток ВГВУ, штамм «УФА-04», ДНК-содержащий, из семейства гепаднавирусов.
1.1.6. Вирус гепатита C человека, штамм Д1.
1.1.7. Вирус бычьей диареи ВД-БС, РНК-содержащий вирус диареи — болезни слизистых оболочек крупного рогатого скота, из семейства пестивирусов, штамм BK-1B1-N 28.
1.2. Культивирование вирусов
1.2.1. Исходный вирус — это вирус, полученный из референс-центров (из национальных или международных коллекций вирусов), размноженный в объемах, достаточных для длительной работы с данным пассажем, при минимальных количествах пассажей. Хранится в малых объемах при -70 °C или в жидком азоте (Руководство по вирусологическим исследованиям полиомиелита, ВОЗ. Женева, М., 1998).
1.2.2. Тест-вирусная суспензия — вирусная суспензия, полученная из исходного вируса и используемая для определения вирулицидных свойств дезинфектанта.
1.2.3. Исходный вирус размножают в чувствительных клетках (лабораторных животных, утках и др.), продуцирующих вирус в высоких титрах. Клеточный детрит удаляют центрифугированием при низких оборотах (1000 об./5 мин.). Этот материал называют «тест-вирусной суспензией». Ее используют не разведенной.
Предполагается, что минимальный титр вирусной суспензии по крайней мере
6,5
10 ТЦИД /мл. В любом случае он должен быть достаточно высоким, чтобы
50
можно было получить снижение титра на 4,0 log .
10
Полиовирус размножают в перевиваемой культуре клеток RD и HEp-2 или в других чувствительных клеточных культурах (4647, Vero и т.д.). Для получения ВС культуру клеток, инфицированную вирусом полиомиелита на стадии 100%-ного поражения монослоя, вызванного цитопатическим действием вируса, трехкратно замораживают и оттаивают. После удаления разрушенных клеток центрифугированием, полученную суспензию используют в экспериментах.
Аденовирус размножают в перевиваемой клеточной культуре HEp-2, 4647 и в других чувствительных клеточных культурах. Методика получения ВС аналогична вышеописанной, за исключением того, что перед процедурой разрушения клеток методом замораживания-оттаивания проводят замену культуральной среды на не содержащую сыворотки и добавляют ее в меньшем объеме.
Вирус гепатита A размножают в перевиваемой культуре клеток 4647. Для получения ВС флаконы инкубируют при 37 °C в течение 21 — 28 дней с еженедельной сменой среды. По окончании инкубации из флаконов удаляют среду поддержания, монослой промывают раствором Хенкса, добавляют подогретый до 37 °C раствор Версена, монослой обмывают диспергентом, раствор Версена сливают и добавляют 0,1 М фосфатно-солевой буфер, pH 7,6.
Зараженные клетки ресуспендируют в фосфатно-солевом буфере, суспензию
клеток пятикратно замораживают (-70 °C) и оттаивают при комнатной
температуре. Полученный клеточный лизат, содержащий 6,5 — 7,0 log ВГА,
10
гомогенизируют и осветляют центрифугированием (3000 об./5 мин.), затем
используют в качестве тест-вируса.
Супернатант аттестовывают на содержание антигена вирусного гепатита A
методом ИФА. Оптическая плотность (ОП ) испытуемых образцов, обработанных
450
ДС, должна соответствовать ОП контрольных образцов, не содержащих ВГА.
450
Методика определения инфекционного титра основана на выявлении антигена
ВГА при титровании методом конечного разведения. Готовят 10-кратные
разведения анализируемого материала на среде Игла MEM x 2. Каждым
3
разведением вируса, начиная с 10 , заражают не менее 4 одинаковых емкостей
с плотным монослоем культуры клеток 4647. После инкубации в течение
21 — 28 дней супернатант аттестуют на содержание вирусного антигена методом
ИФА. Инфекционные титры вычисляют по методу Рида и Менча или по методу
Спермана-Кербера (Прилож. 2).
Вирус гепатита B уток. Метод моделирования инфекции ВГВУ in vivo. Источником вируса при моделировании инфекции является сыворотка крови домашней утки, инфицированной ВГВУ in vivo при экспериментальном заражении вирусом с известными инфекционными свойствами. Для тест-вируса ВГВУ, используемого в каждом опыте по оценке ДС, должен быть определен инфекционный титр.
Важным моментом при подготовке опыта по испытанию ДС с помощью моделирования ВГВУ-инфекции домашних уток является определение численности опытных групп. По причине довольно широкой распространенности естественной ВГВУ-инфекции и отсутствия скрининга на ВГВУ в хозяйствах — поставщиках эмбрионов и утят на территории Российской Федерации — перед закладкой опыта необходимо предварительное тестирование на ДНК ВГВУ для отвода от участия в опыте уток с естественной инфекцией. Ввиду максимальной восприимчивости к инфицированию ВГВУ утят в возрасте 1 — 3 дней целесообразно работать с утятами именно этого возраста, однако предварительный скрининг может привести к задержке эксперимента и, как следствие, к снижению числа восприимчивых к инфицированию особей. Поэтому рекомендуется увеличение опытных групп до 10 — 15 голов каждая с учетом потенциального числа утят с естественной ВГВУ-инфекцией, взятие крови у всех утят непосредственно перед введением опытного материала, определение ДНК ВГВУ в течение ближайшего времени и выведение из опыта утят с выявленной естественной ВГВУ-инфекцией.
После определения числа опытных групп проводят непосредственно обработку вируса ДС. Обработка ДС должна проводиться непосредственно перед введением материала уткам, при необходимости обработанный ДС вирусный препарат может храниться не более суток при 4 °C без снижения потенциальных инфекционных свойств.
Обработка вируса ДС проводится по стандартной методике, с использованием суспензионного метода или метода батистовых тест-объектов.
Затем проводят нейтрализацию ДС по стандартной методике. Трехдневных утят размещают по 10 голов в изолированных клетках по числу групп эксперимента. Затем у всех утят берут кровь и используют для последующего ПЦР-анализа. После взятия крови уткам внутрибрюшинно вводят материал, полученный в результате обработки ВГВУ ДС. Показано, что внутрибрюшинное инфицирование ВГВУ так же эффективно, как и внутривенное, но при этом менее травматично для животных. Каждой утке вводят 200 мкл материала, в каждой опытной группе используют соответствующий материал, обработанный выбранной концентрацией ДС. В позитивной и негативной группах таким же образом вводят соответствующий контрольный материал.
После получения данных по выявлению естественной ВГВУ-инфекции среди задействованных в эксперименте уток позитивных по ВГВУ особей удаляют. У всех участвующих в эксперименте уток проводят взятие крови через 3 недели после инфицирования. Взятие крови и отделение сыворотки крови проводят таким же образом, как и при предварительном тестировании на естественную ВГВУ-инфекцию. В отобранных образцах проводят определение ВГВУ-инфекции в ПЦР. Оценка результатов эксперимента проводится по системе «да/нет», т.е. появление даже одного случая ВГВУ-инфекции в опытной группе рассматривается как инфицирование ВГВУ, и, как следствие, указывает на недостаточные вирулицидные свойства анализируемой концентрации ДС.
Вирус диареи — болезни слизистых оболочек крупного рогатого скота размножают в клетках КСТ — перевиваемой культуре клеток коронарных сосудов сердца плода коровы. Вирус имеется в музее ГУ «Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. Я.Р. Коваленко».
Вирус гепатита C человека размножают в культуре клеток по методике, разработанной в ГУ НИИ вирусологии им. Д.И. Ивановского РАМН.
Приложение 2
справочное
СТАТИСТИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ
А. Определение 50%-ной дозы по методу Рида и Менча
и по методу Спермана-Кербера
Титрование вируса в пробирочных культурах и на животных предусматривает
определение дозы, при которой действие вируса (цитопатогенный эффект или
гибель животных) проявляется в 50% тест-объектов (пробирочных культур или
животных), так называемых ТЦИД или LD . Поскольку в большинстве случаев
50 50
по данным титрования сразу не удается определить 50%-ную дозу, возникает
необходимость в статистической обработке результатов. Результаты могут
считаться статистически достоверными при соблюдении следующих условий:
1. Количество тест-объектов, зараженных одним разведением вируса,
должно быть не менее 4;
2. В титрование должны быть включены два разведения вируса ниже 50%-ной
дозы и два разведения вируса выше этой дозы.
Среди различных методов подсчета ТЦИД или LD наибольшее
50 50
распространение получили метод полных кумулятивов Рида и Менча и метод
определения «центральной величины» Кербера.
1. Метод Рида и Менча
(Reed L.J., Muench H.A. A simple method of estimating 50% endpoints. Am. J. Hyd., 1938, 27, 493 — 497. Упрощенный вариант по книге Ворошиловой М.К., Жевандеровой В.И., Балаяна М.С. Методы лабораторной диагностики энтеровирусных инфекций. М., Медицина, 1964. С. 127 — 129. Статистическая обработка результатов).
Метод основан на логической предпосылке, что тканевая культура или животное, погибшие при заражении их каким-либо разведением вируса, погибнут и при заражении любым более низким разведением.
Пример подсчета показан в табл. 1.
Таблица 1
ПОДСЧЕТ 50%-НОЙ ДОЗЫ (ТЦИД ) ПО МЕТОДУ РИДА И МЕНЧА
50
┌──────────┬─────────────┬──────────────────┬───────────────────┬─────────┐
│Разведение│ Количество │ Исходные данные │Кумулятивные данные│ Процент │
│ вируса │тест-объектов├─────────┬────────┼─────────┬─────────┤ гибели │
│ │ │ погибло │ выжило │ погибло │ выжило │ │
├──────────┼─────────────┼─────────┼────────┼─────────┼─────────┼─────────┤
│ -5 │ │ │ │ │ │ │
│10 │4 │4 │0 │7 │0 │100 │
├──────────┼─────────────┼─────────┼────────┼─────────┼─────────┼─────────┤
│ -6 │ │ │ │ │ │ │
│10 │4 │2 │2 │3 │2 │60 │
├──────────┼─────────────┼─────────┼────────┼─────────┼─────────┼─────────┤
│ -7 │ │ │ │ │ │ │
│10 │4 │1 │3 │1 │5 │17 │
├──────────┼─────────────┼─────────┼────────┼─────────┼─────────┼─────────┤
│ -8 │ │ │ │ │ │ │
│10 │4 │0 │4 │0 │9 │0 │
└──────────┴─────────────┴─────────┴────────┴─────────┴─────────┴─────────┘
Из табл. 1 видно, что 50%-ная доза находится между разведениями вируса
-6 -7
10 и 10 .
Далее расчет величины X, которую необходимо прибавить к разведению
непосредственно ниже 50%-ной дозы (в log ), производится по следующей
10
формуле:
A — 50
X = ——, (1)
A — B
где:
A — процент гибели при разведении непосредственно ниже искомой 50%-ной дозы (в данном случае 60%);
B — процент гибели при разведении непосредственно выше искомой 50%-ной дозы (в данном случае 17%).
Подставляя полученные значения в формулу 1, находим:
60 — 50
X = ——- = 0,23,
60 — 17
откуда — титр вируса (в обратных log ) равен 6 + 0,23 = 6,23; другими
10
-6,23
словами, одна ТЦИД или LD соответствует разведению вируса 10 .
50 50
Если в титрование были взяты разведения вируса с интервалом 0,5 log ,
10
то величину X в формуле 1 следует умножить на 0,5.
Поскольку при титровании вируса в пробирочных культурах обычно получаются четкие результаты и культуры со 100%-ной дегенерацией отделены от культур с полным отсутствием дегенерации всего одним разведением вируса, удобно пользоваться при подсчете титров по Риду и Менчу упрощенной схемой:
┌───────────────────────────────┬─────────────┬─────────────┬─────────────┐
│Количество пробирочных культур,│ Количество │ Процент │ Титр вируса │
│ -n │культур с ЦПЭ│культур с ЦПЭ│ в log 10 │
│ зараженных разведением 10 │ │ │ │
├───────────────────────────────┼─────────────┼─────────────┼─────────────┤
│4 │1 │25 │n-1, 66 │
│4 │2 │50 │n, 0 │
│4 │3 │75 │n, 33 │
│4 │4 │100 │n, 50 │
└───────────────────────────────┴─────────────┴─────────────┴─────────────┘
Для вычисления ТЦИД (количества цитопатогенных доз) вируса в 1 мл
50
исследуемой жидкости к показателю величины титра вируса в log прибавляют
10
в зависимости от количества вируссодержащего материала, взятого для
заражения одной культуры, соответствующие величины поправок:
|
Объем материала в миллилитрах, взятого для заражения одной культуры |
Величина поправки в единицах логарифма |
|
0,2 |
0,7 |
|
0,25 |
0,6 |
|
0,3 |
0,52 |
|
0,4 |
0,4 |
|
0,5 |
0,3 |
|
0,6 |
0,22 |
|
0,7 |
0,16 |
|
0,8 |
0,1 |
Например, если во всех пробирочных культурах, зараженных по 0,2 мл
-4
материалом в разведении 10 , наблюдается цитопатогенный эффект, а в
-6
культурах, инокулированных разведением 10 , цитопатогенного эффекта не
-5
наблюдается (при инокуляции же разведением 10 цитопатогенный эффект
отмечен в одной из четырех пробирок), то титр вируса в log будет равен
10
4,66 5,36
10 . Содержание же его в 1 мл будет равно 10 ТЦИД .
50
2. Определение ТЦИД вируса по методу Спермана-Кербера
50
ТЦИД представляет собой отрицательный десятичный логарифм наибольшей
50
использованной концентрации вируса, умноженной на логарифм разведения, то
есть (сумма % пораженных клеток в каждом разведении / 100 — 0,5) x log
10
разведения.
Таблица 2
ПРИМЕР РЕЗУЛЬТАТА ТИТРОВАНИЯ
┌──────────────────┬─────────────────────┬────────────────────────────────┐
│Разведения, -log │Результаты по ЦПД <*>│ Процент, %, культур │
│ 10│ │ с наличием ЦПД │
├──────────────────┼─────────────────────┼────────────────────────────────┤
│-4 │4, 4, 4, 4, 4, 4 │100 │
│-5 │4, 4, 3, 4, 4, 4 │100 │
│-6 │4, 4, 3, 3, 0, 0 │66,7 │
│-7 │4, 2, 0, 0, 0, 0 │33,3 │
│-8 │0, 0, 0, 0, 0, 0 │0 │
├──────────────────┴─────────────────────┼────────────────────────────────┤
│Сумма % с ЦПД │300 │
├────────────────────────────────────────┴────────────────────────────────┤
│ <*> от 1 до 4 — плюсовая система %-ного выражения гибели клеточных│
│культур 1+ = 25%, 2+ = 50%, 3+ = 75% и 4+ = 100%, 0 = отсутствие ЦПД. │
└─────────────────────────────────────────────────────────────────────────┘
Формула расчета ТЦИД по этим данным:
50
-4 — [{(100 + 100 + 66,7 + 33,3 + 0) / 100} — 0,5] x 1 =
= -4 — [300 / 100 — 0,5] x 1 = -4 — 2,5 = 6,5
-6,5
Таким образом, ТЦИД будет равно 10 или 6,5 log ТЦИД .
50 10 50
3. Метод бляшек
Для расчета среднего значения количества бляшек используется следующая
формула:
SUM c + c + … + c
1 2 n
БОЕ / t = ———————————,
n + n x v + … + n x v x d
1 2 2 n n
где:
t — объем, добавляемый в лунку при каждом шаге разведения;
c — число БОЕ во всех лунках наименьшего разведения, при котором
1
возможен учет (уже несливные бляшки);
c — число БОЕ во всех лунках следующего разведения;
2
c — число БОЕ во всех лунках последнего разведения;
n
n — количество всех лунок наименьшего разведения с несливными
1
бляшками (соответствует c );
1
n — число всех лунок второго разведения с несливными бляшками (c );
2 2
-3 -4
v — фактор разведения между n / n (например, n = 10 и n = 10 ,
2 1 2 1 2
то v = 0,1);
2
n — количество всех лунок последнего разведения, при котором имеются
n
бляшки (c );
n
-3 -6
v — фактор разведения между n и n (например, n = 10 и n = 10 ,
n 1 n 1 n
то v = 0,0001);
n
d — шаг разведения c .
1
Вычисления проводятся с целыми числами. Если последнее число меньше 5,
то оно остается неизменным; если оно больше 5, то округляется до следующего
целого числа.
Пример.
52 + 48 + 49 + 25 + 27 + 31 + 5 + 6 + 7 250
БОЕ / t = ————————————— = ———— =
-3 -3
[3 + 3 x 0,1 + 3 x 0,1] x 10 3,33 x 10
= 75075,075 = lg 4,875 = lg 4,9
Если объем, добавляемый при разведении равен 0,2 мл, то
БОЕ/мл = log 5,6.
10
5.8. Методы изучения и оценки спороцидной активности
дезинфицирующих и стерилизующих средств
5.8.1. Общие положения
Федеральный закон «О санитарно-эпидемиологическом благополучии населения» [1] и Федеральный закон «Об охране окружающей среды» [2] регламентируют проведение специфической и неспецифической профилактики инфекционных заболеваний. В комплекс неспецифических профилактических мероприятий входят дезинфекция и стерилизация [12] с использованием ДС и СС, обладающих спороцидной активностью, т.е. убивающих споры микроорганизмов при регламентированных параметрах технологии (режимах обработки) [10, 47, 68].
ДС, обладающие спороцидной активностью, необходимы для обеззараживания различных объектов при сибирской язве, газовой гангрене, столбняке, дезинфекции высокого уровня ДВУ эндоскопов; стерилизующие средства — для стерилизации изделий медицинского назначения ИМН, включая эндоскопы, и для ДВУ эндоскопов [7 — 11].
Данное руководство регламентирует методологию и технологию изучения и оценки спороцидной активности субстанций для производства ДС и СС, спороцидной активности и эффективности химических и физических ДС для обеззараживания различных объектов, а также СС для стерилизации ИМН, обсемененных наиболее устойчивыми микроорганизмами в споровой форме с учетом максимально возможного уровня контаминации ими объектов [10, 74].
Исследования спороцидной активности субстанций, ДС, СС и эффективности режимов их применения включают [74]:
— выбор и подготовку тест-микроорганизмов в споровой форме для изучения спороцидной активности ДС, СС и их субстанций;
— обеспечение стандартности условий проведения исследований спороцидной активности ДС, СС и их субстанций;
— методы исследований и оценку результатов спороцидной активности ДС, СС и их субстанций in vitro (суспензионный метод, метод батистовых тест-объектов) и спектра спороцидной активности;
— методы исследований и оценку спороцидной эффективности ДС при разработке режимов обеззараживания объектов внешней среды, контаминированных тест-микроорганизмами в споровой форме;
— методы исследований спороцидной эффективности СС при разработке режимов стерилизации ИМН, включая эндоскопы;
— методы исследований спороцидной активности СС, предназначенных для ДВУ эндоскопов.
Для применения спороцидных ДС в очагах искусственного происхождения (биотерроризм) разработанные режимы (дезин — фектологические технологии) должны корректироваться в специальных лабораториях, изучающих возможные споровые биологические рецептуры и связанные с этим специфические особенности дезинфекции в очагах заражения.
Организации, проводящие исследования спороцидной активности и эффективности химических ДС, СС и их субстанций, в отчетной документации, представляемой для регистрации и сертификации средств, должны представлять конкретные результаты оценки стандартности использованных в исследованиях спор тест-микроорганизмов, а также эффективности нейтрализации ДВ использованного нейтрализатора [7, 8, 9, 10, 11].
5.8.1.1. Тест-микроорганизмы для изучения и оценки
спороцидной активности ДС, СС и их субстанций.
Требования к тест-микроорганизмам
При изучении спороцидной активности ДС и их субстанций в качестве тест-микроорганизмов используют [74]:
— Bacillus cereus, штамм 96;
— Bacillus subtilis, штамм 7;
— сибиреязвенная живая сухая вакцина СТИ-1 для людей;
+ + +
— Bacillus anthracis, штамм 81/1 (pX01 , pX02 ) или штамм 27 (pX01 ,
+
pX02 ).
При изучении спороцидной активности СС и их субстанций в качестве тест-микроорганизмов используют:
— Bacillus cereus, штамм 96;
— Bacillus subtilis, штамм 7;
— Bacillus licheniformis, штамм G BKM B-1711D;
— Geobacillis stearothermophilius, штамм BKM B-718.
Тест-микроорганизмы выбирают в зависимости от действующего вещества ДВ и от назначения спороцидного ДС, СС и его субстанции.
Требования к тест-микроорганизмам. Тест-микроорганизмы должны иметь типичные морфологические, культуральные, биохимические свойства, присущие данному виду (Прилож. 1), и обладать стандартной устойчивостью к эталонным ДС и СС [10]: хлорамину 10%, перекиси водорода 6%, глутаровому альдегиду 2,5% (pH 7,2), сухому горячему воздуху при (160 +/- 3) °C, водяному текучему пару при 100 °C, водяному насыщенному пару под избыточным давлением при (121 +/- 1) °C.
Показатели устойчивости тест-микроорганизмов к вышеперечисленным средствам приведены в табл. 5.8.
Таблица 5.8
УСТОЙЧИВОСТЬ СПОР ТЕСТ-МИКРООРГАНИЗМОВ К ЭТАЛОННЫМ
ДЕЗИНФИЦИРУЮЩИМ И СТЕРИЛИЗУЮЩИМ СРЕДСТВАМ
┌──────────────────────────┬──────────────────────────────────────────────┐
│ Тест-культура │ Время гибели тест-микроорганизмов, │
│ │ не менее мин., при действии │
├──────────────┬───────────┼─────┬─────┬──────┬────────┬────────┬─────────┤
│ Название │Кол-во спор│хлор-│пере-│глута-│ сухого │водяного│водяного │
│ и штамм │ в тест- │амина│киси │рового│горячего│текучего│насыщен- │
│ │ объекте │10% │водо-│альде-│воздуха │ пара │ного пара│
│ │ │ │рода │гида │(160 +/-│(100 °C)│под избы-│
│ │ │ │6% │2,5% │ 3) °C │ │точным │
│ │ │ │ │ │ │ │давлением│
│ │ │ │ │ │ │ │(121 +/- │
│ │ │ │ │ │ │ │1) °C │
├──────────────┼───────────┼─────┼─────┼──────┼────────┼────────┼─────────┤
│ 1 │ 2 │ 3 │ 4 │ 5 │ 6 │ 7 │ 8 │
├──────────────┴───────────┴─────┴─────┴──────┴────────┴────────┴─────────┤
│ Тест-микроорганизмы для изучения и оценки дезинфицирующих │
│ средств и их субстанций │
├──────────────┬───────────┬─────┬─────┬──────┬────────┬────────┬─────────┤
│ │ 6│ │ │ │ │ │ │
│Bacillus │1 — 5 x 10 │360 │60 │60 │- │6 — 7 │- │
│cereus, │ │ │ │ │ │ │ │
│штамм 96 │ │ │ │ │ │ │ │
├──────────────┼───────────┼─────┼─────┼──────┼────────┼────────┼─────────┤
│ │ 6│ │ │ │ │ │ │
│Bacillus │1 — 5 x 10 │360 │60 │180 │- │6 — 7 │- │
│subtilis, │ │ │ │ │ │ │ │
│штамм 7 │ │ │ │ │ │ │ │
├──────────────┼───────────┼─────┼─────┼──────┼────────┼────────┼─────────┤
│ │ 6│ │ │ │ │ │ │
│Сибиреязвенная│1 — 5 x 10 │360 │60 │60 │- │6 — 7 │- │
│живая сухая │ │ │ │ │ │ │ │
│вакцина СТИ-1 │ │ │ │ │ │ │ │
│для людей │ │ │ │ │ │ │ │
├──────────────┼───────────┼─────┼─────┼──────┼────────┼────────┼─────────┤
│ │ 6│ │ │ │ │ │ │
│Bacillus │1 — 5 x 10 │360 │60 │60 │- │6 — 7 │- │
│anthracis, │ │ │ │ │ │ │ │
│штамм 81/1 │ │ │ │ │ │ │ │
│или 27 │ │ │ │ │ │ │ │
├──────────────┴───────────┴─────┴─────┴──────┴────────┴────────┴─────────┤
│ Тест-микроорганизмы для изучения и оценки стерилизующих │
│ средств и их субстанций │
├──────────────┬───────────┬─────┬─────┬──────┬────────┬────────┬─────────┤
│ │ 6│ │ │ │ │ │ │
│Bacillus │1 — 5 x 10 │360 │60 │60 │- │6 — 7 │- │
│cereus, │ │ │ │ │ │ │ │
│штамм 96 │ │ │ │ │ │ │ │
├──────────────┼───────────┼─────┼─────┼──────┼────────┼────────┼─────────┤
│ │ 6│ │ │ │ │ │ │
│Bacillus │1 — 5 x 10 │360 │60 │180 │- │6 — 7 │- │
│subtilis, │ │ │ │ │ │ │ │
│штамм 7 │ │ │ │ │ │ │ │
├──────────────┼───────────┼─────┼─────┼──────┼────────┼────────┼─────────┤
│ │ 6│ │ │ │ │ │ │
│Bacillus │1 — 5 x 10 │- │- │- │30 │- │- │
│licheniformis │ │ │ │ │ │ │ │
│G BKM B-1711D │ │ │ │ │ │ │ │
├──────────────┼───────────┼─────┼─────┼──────┼────────┼────────┼─────────┤
│ │ 6│ │ │ │ │ │ │
│Geobacillis │1 — 5 x 10 │- │- │- │- │- │15 │
│stearothermoph│ │ │ │ │ │ │ │
│ilius, штамм │ │ │ │ │ │ │ │
│BKM B-718 │ │ │ │ │ │ │ │
├──────────────┴───────────┴─────┴─────┴──────┴────────┴────────┴─────────┤
│Использование B. cereus и B. subtilis в качестве тест-микроорганизмов при│
│изучении спороцидной активности дезинфицирующих и стерилизующих средств│
│гармонизировано с Европейским стандартом. Руководствуясь данными│
│табл. 5.8, дальнейшие исследования проводят с использованием наиболее│
│устойчивого тест-микроорганизма к проверяемому средству. │
└─────────────────────────────────────────────────────────────────────────┘
Музейные штаммы тест-микроорганизмов хранят в холодильнике при температуре (6 +/- 2) °C в виде сухой культуры в ампулах после лиофильной сушки не более 2 лет [66, 74].
Тест-микроорганизмы, не обладающие указанной устойчивостью, подлежат замене.
Спороцидную активность ДС, СС и их субстанций определяют, используя тест-микроорганизмы в споровой форме [74].
5.8.1.2. Методика приготовления суспензии
спор тест-микроорганизмов
Для получения тест-микроорганизмов в споровой форме их выращивают на питательных средах, приведенных в табл. 5.9.
Таблица 5.9
ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ ВЫРАЩИВАНИЯ
ТЕСТ-МИКРООРГАНИЗМОВ В СПОРОВОЙ ФОРМЕ
|
N п/п |
Тест-культуры |
Питательные среды |
|
1 |
Bacillus cereus, штамм 96 |
Пшеничный агар |
|
2 |
Bacillus subtilis, штамм 7 |
|
|
3 |
Bacillus anthracis, штамм 81/1, 27 |
Пшеничный агар или агар Хоттингера с аминным азотом 120 мг% |
|
4 |
Bacillus licheniformis, G BKM B-1711D |
Пшеничный агар или картофельно-пептонный агар |
|
5 |
Geobacillis stearothermophilius, штамм BKM B-718 |
Перечень компонентов и методика приготовления питательных сред для культивирования тест-микроорганизмов, предназначенных для изучения и оценки спороцидной активности ДС, СС и их субстанций, приведены в Прилож. 2.
Процесс приготовления суспензии спор тест-микроорганизма, используемого при исследовании и оценке спороцидной активности ДС, СС и их субстанций, включает три последовательных этапа [74]:
— получение бульонной культуры из музейной лиофилизированной или агаровой культуры тест-микроорганизма;
— получение споровой агаровой культуры тест-микроорганизма;
— приготовление суспензии спор тест-микроорганизма и оценка соответствия ее требованиям.
При использовании лиофилизированной споровой культуры B. cereus и B. subtilis ампулы с этими тест-микроорганизмами вскрывают в асептических условиях следующим образом: тампоном ваты, смоченным этиловым спиртом, обрабатывают поверхность ампулы, затем нагревают ее запаянный конец над пламенем. К накаленному концу ампулы прикладывают ватную пробку, смоченную стерильной водой, чтобы на ампуле образовалась трещина. Металлическим инструментом (скальпель, пинцет) откалывают по трещине конец ампулы. После этого стерильной пастеровской пипеткой в ампулу вливают 0,2 мл стерильной питьевой воды, накрывают стерильной марлевой салфеткой и оставляют на 30 мин. при комнатной температуре. Для получения суспензии спор содержимое ампулы перемешивают с помощью стерильной бактериологической петли.
Полученную таким образом в ампуле суспензию спор тест-микроорганизма отсасывают стерильной пастеровской пипеткой и переносят по 1 — 2 капли в две пробирки с 5 мл питательного бульона (бульон Хоттингера, сухой питательный бульон — СПБ, мясо-пептонный бульон МПБ), содержащего 0,5% глюкозы.
При работе с возбудителем сибирской язвы для приготовления суспензии спор ампулы с высушенными культурами вскрывают в помещении музея коллекции живых культур. Манипуляции проводят в боксе биологической безопасности. При этом оттянутый конец ампулы нагревают над пламенем газовой горелки; затем влажным концом стерильного ватного тампона прикасаются к нагретой части, в результате чего появляются трещины. Конец ампулы накрывают трехслойной марлевой салфеткой, смоченной дезинфицирующим раствором и хорошо отжатой, и обламывают пинцетом.
После вскрытия ампула остается накрытой той же салфеткой в течение 1 — 2 мин. Затем салфетку осторожно снимают и вместе с остатками стекла погружают в дезинфицирующий раствор. Вскрытую ампулу накрывают стерильным марлевым тампоном на 1 — 2 мин. Затем в ампулу вносят 0,2 мл стерильной питьевой воды для приготовления суспензии спор, которую далее высевают в жидкие питательные среды, как указано выше.
Посевы G. stearothermophilius инкубируют при температуре (55 +/- 1) °C, а B. cereus, B. subtilis, B. anthracis и B. licheniformis — при температуре (37 +/- 1) °C в течение 24 — 48 ч.
Бульонные культуры тест-микроорганизмов бактериологической петлей или пастеровской пипеткой (по 1 — 2 капли) пересевают в пробирки на скошенную питательную среду (сухой питательный агар — СПА, мясо-пептонный агар — МПА). Посевы инкубируют в течение 24 — 48 ч, как указано выше.
Для получения спор культур B. licheniformis, G. stearothermophilius в пробирки с посевом необходимого для проведения исследования тест-микроорганизма добавляют 5 мл стерильной дистиллированной воды и смывают культуру, выросшую на твердой питательной среде. Полученную взвесь переносят во флаконы или емкости до 250/500 мл, содержащие соответственно 100/200 мл соответствующего для данного тест-микроорганизма скошенной твердой агаровой питательной среды табл. 5.9.
На поверхность питательной среды в каждый флакон (матрац), в зависимости от их вместимости (250/500 мл), вносят суспензию, смытую с 1 — 2 пробирок с посевами. Взвесь покачиванием флакона (матраца) равномерно распределяют по поверхности среды, закрывают ватно-марлевыми пробками и бумажными колпачками и инкубируют при температуре (55 +/- 1) °C (G. stearothermophilius) или (37 +/- 1) °C (B. licheniformis) в течение 10 — 12 суток в наклонном положении (под углом 45°) агаром вверх. Для создания достаточной влажности в термостат, работающий при температуре (55 +/- 1) °C, помещают открытые емкости с водой (до 2 л на термостат вместимостью 80 л).
Тест-микроорганизмы B. cereus, B. subtilis и B. anthracis для получения споровой формы засевают на скошенный пшеничный агар или агар Хоттингера с аминным азотом 120 мг% и выращивают при температуре 37 +/- 1 °C двое суток в термостате, а затем еще 7 — 12 суток при температуре (20 +/- 1) °C в темном месте. На 7-е и 9-е сутки культуры проверяют на интенсивность спорообразования. Для этого выборочно с 2 — 3 флаконов (матрацев) культуру забирают петлей с верхнего, среднего и нижнего участков агара; все три пробы растирают вместе на одном предметном стекле, распределяя тонким слоем. Мазок фиксируют над пламенем горелки, окрашивают по Грамму или генцианвиолетом (по Синеву). Окрашенные препараты промывают питьевой водой, подсушивают и микроскопируют с иммерсионной системой — споры имеют вид неокрашенных пустот, находящихся внутри клеток.
При работе с B. anthracis для фиксации мазков используют 90°-й этиловый спирт или смесь Никифорова (равное количество спирта и эфира), время фиксации 30 мин. Затем мазок окрашивают при нагревании 1 — 2 мин. карболовым фуксином Циля, промывают водой и обесцвечивают, погружая в 2%-ный раствор азотной кислоты в спирте или в 1%-ный раствор серной кислоты, так, чтобы на препарате не было видно следов красителя.
Исследуют 10 полей зрения, подсчитывают количество спор, выражая в процентах. Достаточным количеством считают не менее 90% спор в поле зрения от общего числа клеток.
После завершения спорообразования тест-микроорганизмы осторожно при помощи шпателя (из проволоки) или стерильных стеклянных бус смывают с поверхности агара 5 — 10 мл стерильной дистиллированной воды (в зависимости от вместимости флакона) и сливают в емкости (пробирки, флаконы), которые закрывают стерильными резиновыми пробками.
Для оценки качества полученной споровой суспензии тест-микроорганизма и принятия решения о возможности использования ее по назначению из флакона (после тщательного перемешивания путем встряхивания) стерильно отбирают в пробирку 10 мл суспензии и определяют соответствие требованиям по биологической концентрации БК спор тест-микроорганизма в суспензии и их устойчивости к эталонным физическим и химическим дезинфицирующим и стерилизующим средствам, представленным в табл. 5.8.
В случае загрязнения исходного штамма тест-микроорганизма посторонней микрофлорой выделяют его чистую культуру принятыми методами (прогревания, промывания, центрифугирования и др.). Выделенную культуру тест-микроорганизма идентифицируют и проверяют его устойчивость к эталонным дезинфицирующим и стерилизующим средствам.
5.8.1.3. Определение биологической концентрации
тест-микроорганизма в споровой суспензии [74]
Определение выполняют методом последовательных десятикратных разведений суспензии тест-микроорганизма в стерильной дистиллированной воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (агар Хоттингера, СПА, МПА). После определенного времени инкубации при соответствующей температуре проводят подсчет выросших колониеобразующих единиц КОЕ и определяют количество жизнеспособных спор в одном мл суспензии БК.
Для проведения испытания необходимы материалы и оборудование, приведенные в Прилож. 3.
При выполнении испытания соблюдают следующие условия:
— используют дозаторы переменного объема не менее 2-го класса точности;
— в процессе выполнения опыта соблюдают асептические условия;
— контролируют температуру термостата и срок инкубации посевов.
До проведения испытания выполняют следующие подготовительные операции:
— расплавляют на кипящей водной бане плотную питательную среду (агар) и охлаждают ее до температуры (45 +/- 5) °C;
— охлажденную питательную среду разливают по (25 +/- 5) куб. см в стерильные чашки Петри в пламени спиртовки (газовой горелки) и оставляют чашки на горизонтальной поверхности пока не застынет агар;
— при необходимости подсушивают чашки с плотной питательной средой в термостате крышками вниз;
— разливают в стерильные пробирки с ватно-марлевыми пробками по 4,5 куб. см стерильной дистиллированной воды.
В работе используют только кондиционные партии питательных сред, для чего предварительно проверяют их качество путем высева эталонной культуры соответствующего штамма. Для кондиционной среды число выросших тест-микроорганизмов от их общего количества должно составлять не менее 50%.
При определении БК тест-микроорганизма в исходной суспензии спор
агаровой культуры последнюю разводят стерильной дистиллированной водой до
концентрации, соответствующей по бактериальному стандарту мутности 1-млрд.
микробных тел в 1 мл. Затем стерильной пипеткой отбирают 0,5 мл суспензии
спор и переносят в пробирку, содержащую 4,5 мл стерильной дистиллированной
-1
воды. Полученное разведение (10 ) тщательно встряхивают. Аналогично, меняя
-6
пипетку, делают все последующие разведения до необходимого (10 ),
3
теоретически соответствующего концентрации 1 x 10 спор в 1 мл. Из двух
последовательных десятикратных разведений исходной суспензии производят
высев по 0,1 мл на поверхность трех чашек Петри с агаром (агар Хоттингера,
СПА, МПА). Чашки Петри инкубируют при температуре (55 +/- 1) °C или
(37 +/- 1) °C в зависимости от вида культуры в течение 24 — 48 ч, после
чего определяют число КОЕ. Количество жизнеспособных спор в исходной
суспензии определяют как среднее арифметическое число КОЕ с учетом
разведения исходной суспензии и объема пробы для посева.
Пример расчетов. Предположим, что при посеве на три чашки Петри с агаром суспензии в разведении 1:100000 подсчитано 140, 110 и 134 КОЕ. Аналогичные высевы из разведений 1:1000000 привели к образованию 12, 14 и 16 КОЕ.
Вычисляем общее число КОЕ, найденных во всех трех чашках Петри соответствующих разведений:
1:100000 140 + 110 + 134 = 384
1:1000000 12 + 14 + 16 = 42
Среднее число КОЕ на чашках составит для разведения:
1:100000 384 : 3 = 128
1:1000000 42 : 3 = 14
Из расчета посевной дозы (0,1 мл на каждую чашку) вычисляем число
жизнеспособных спор в 1 мл исходной суспензии с учетом разведений, далее
находим среднее арифметическое числа КОЕ:
5 7
128 x 10 x 10 = 12,8 x 10
6 7
14 x 10 x 10 = 14,0 x 10
Таким образом, число жизнеспособных спор в исходной суспензии составит:
7 7 8
(12,8 + 14,0) x 10 : 2 = 13,4 x 10 = 1,32 x 10 спор/мл.
Или при посеве из одного последнего разведения по 0,1 мл на 5 чашек Петри расчет концентрации жизнеспособных микроорганизмов в 1 мл суспензии препарата осуществляют по формуле:
БК = х x р x 2,
где:
БК — концентрация жизнеспособных спор тест-микроорганизма, КОЕ x мл;
х — суммарное количество колоний, выросших на пяти чашках, КОЕ;
р — разведения;
2 — коэффициент, приводящий измерение объема посеянной суспензии к 1 мл.
Например: общее количество колоний на 5 чашках Петри составило 540 КОЕ, тогда количество жизнеспособных спор в исходной суспензии равно:
6 6 9
БК = 540 x 2 x 10 = 1080 x 10 = 1,08 x 10 спор/мл.
Герметично закрытые стерильной пробкой флаконы (пробирки) с исходной суспензией спор хранят в холодильнике при температуре (6 +/- 2) °C до 6 месяцев, если споры тест-микроорганизма соответствуют вышеуказанным требованиям (табл. 1). Для снижения негативного влияния на суспензию спор перепада температуры, неизбежного при извлечении флакона из холодильника для отбора части суспензии, необходимой для проведения исследования ДС, СС и их субстанций, суспензию спор тест-микроорганизма из флакона целесообразно расфасовывать в пробирки и использовать их по мере необходимости.
Чистоту культуры тест-микроорганизма на всех этапах культивирования контролируют путем посева ее на чашки Петри с агаром Хоттингера, СПА, МПА.
Сибиреязвенную живую сухую вакцину СТИ-1 при изучении спороцидной
активности и эффективности используют в виде суспензии, содержащей
8 9
10 — 10 спор/мл, приготовленной разбавлением содержимого одной ампулы в
10 мл стерильной питьевой воды.
5.8.1.4. Методики определения устойчивости спор
тест-микроорганизмов к эталонным ДС
5.8.1.4.1. Определение устойчивости спор к текучему пару, водяному насыщенному пару под избыточным давлением, сухому горячему воздуху [51, 52, 74]
Устойчивость к действию текучего пара спор B. cereus, B. subtilis, B. anthracis, сибиреязвенной вакцины СТИ-1 определяют в аппарате Ойль-Мюллера, используя батистовые тест-объекты, контаминированные вышеуказанными тест-микроорганизмами, с последующим посевом тест-объектов в жидкую питательную среду.
Аппарат Ойль-Мюллера может быть заменен устройством, доступным для изготовления практически в любой лаборатории, где необходимо провести такое исследование. Для этого берется стеклянная колба объемом 1 — 2 л с широким удлиненным горлом. Корковую пробку под него срезают на 1/3 по длине для обеспечения выхода пара. Это отверстие используется и для проведения измерения термометром температуры пара в месте размещения батистовых тест-объектов. Через трубку пропускают проволоку, имеющую на конце припаянную (или укрепленную другим способом) перпендикулярно к ней металлическую сеточку диаметром 3 — 3,5 см из нержавеющей стали, предназначенную для размещения батистовых тест-объектов, контаминированных спорами тест-микроорганизма.
Проволоку в пробке устанавливают так, чтобы сеточка находилась в месте перехода конуса колбы в горло. Это обеспечивает прохождение через сеточку практически всего объема выделяемого кипящей в колбе водой пара. Уровень воды должен находиться от сеточки на расстоянии 5 — 6 см.
В процессе испытаний контролируют следующие показатели:
— температуру текучего пара;
— исходную и остаточную контаминацию тест-микроорганизмами батистовых тест-объектов;
— время действия пара на контаминированные тест-объекты в аппарате Ойль-Мюллера колбе.
Исследования проводят следующим образом: в колбу наливают дистиллированную воду и нагревают ее до кипения. При достижении температуры 100 °C на термометре, находящемся под воздействием текучего пара, на предварительно простерилизованную автоклавированием вместе с пробкой или обожженную в пламени сеточку помещают 2 батистовых тест-объекта (1 x 0,5 см), контаминированных спорами тест-микроорганизма (методику приготовления тест-объектов см. в п. 5.1.2.2). Тест-объекты размещают так, чтобы исключался контакт их со стенкой горла колбы при введении сеточки в колбу. Держась за пробку, сеточку с тест-объектами вносят в зону действия текучего пара и включают секундомер. По истечении 2 мин. воздействия пара, держась за пробку, сеточку с тест-объектами извлекают из колбы, а тест-объекты сразу помещают (засевают) в две пробирки со стерильным питательным бульоном. Обжигают сеточку и кладут на нее 2 новых тест-объекта. Аналогично вышеописанному вносят их в зону действия пара на 2 мин., затем также извлекают и помещают в пробирки со стерильным питательным бульоном. Так операцию повторяют, увеличивая экспозицию на 1 мин., до 10 мин. Посевы инкубируют при (37 +/- 1) °C в течение 7 суток. Предварительный учет результатов проводят через 48 ч инкубирования, окончательный — на 7-е сутки. Из пробирок с проросшим бульоном делают посев петлей на твердую среду для идентификации выросших тест-микроорганизмов.
При использовании аппарата Ойль-Мюллера необходимо не допускать случайного прикосновения к горлышку колбы сначала до обеззараживания тест-объектов, затем — после обеззараживания. Этих погрешностей, искажающих результаты опыта, можно избежать при использовании аппарата Ойль-Мюллера в модификации Л.А. Блиновой (рис. 5.1 — не приводится). В емкости для текучего пара имеется четыре отверстия. Первое отверстие (1) размещается вверху и предназначено для термометра, второе (2) — справа в торце — для внесения зараженных тест-объектов, третье (3) — на лицевой стороне — для изъятия обеззараженных тест-объектов и четвертое (4) — слева в торце — для выхода пара. При пользовании таким аппаратом тест-объекты накалывают на иглу, закрепленную в пробке, которую вставляют в отверстие 2. Отверстие 3 во время экспозиции закрыто стерильной пробкой. По окончании экспозиции его открывают и через него извлекают обожженным пинцетом снятые с иглы тест-объекты, которые сразу засевают в бульон.
Применяемый в аппарате термометр должен иметь шкалу с делениями на десятые доли градуса. Определение устойчивости спор (бацилл) к текучему пару проводят при атмосферном давлении близком к 760 мм рт. ст. Учет этого фактора важен, поскольку существенно может влиять на результаты оценки. Так, при атмосферном давлении 745 мм рт. ст. температура текучего пара составляет 99,4 °C и резистентность при этой температуре B. cereus равна 6 — 7 мин., а при давлении 765 мм рт. ст. температура пара — 100,8 °C резистентность не превышает 3 — 4 мин.
Споры тест-микроорганизмов должны иметь устойчивость к текучему пару температурой 100 °C не менее 7 — 9 мин.
Устойчивость тест-микроорганизма G. stearothermophilius к водяному насыщенному пару под избыточным давлением. В качестве тест-носителя применяют флаконы из нейтрального стекла, контаминированные суспензией спор тест-микроорганизма G. stearothermophilius.
Предварительно флаконы тщательно моют и стерилизуют паровым или воздушным методом. Из исходной суспензии спор готовят рабочую суспензию для контаминации тест-носителей.
6
Стерильные тест-носители контаминируют из расчета 1 — 5 x 10
тест-микроорганизма G. stearothermophilius, что достигается внесением в
каждый носитель с помощью дозатора переменного объема 0,02 мл суспензии
7 8
спор с содержанием от 5 x 10 до 2,5 x 10 спор/мл.
Контаминированные тест-носители высушивают в термостате при температуре (37 +/- 1) °C в течение 24 ч и закладывают в бумажные пакеты, разрешенные к применению в качестве стерилизационных упаковочных материалов в Российской Федерации.
Устойчивость спор тест-микроорганизма G. stearothermophilius к водяному насыщенному пару под избыточным давлением определяют в паровом стерилизаторе объемом 75 куб. дм с гравитационным способом предварительного удаления воздуха из стерилизационной камеры.
Упакованные тест-носители помещают в стерилизационной коробке в незагруженную камеру парового стерилизатора. После набора давления в водопаровой камере (1,1 +/- 0,1) кгс/кв. см проводят вытеснение воздуха паром из камеры парового стерилизатора (продувка парового стерилизатора) в течение 10 мин. (при открытом спускном кране и давлении в стерилизационной камере от 0,1 до 0,2 кгс/кв. см). После продувки доводят давление пара в стерилизационной камере до (1,1 +/- 0,1) кгс/кв. см (121 +/- 1) °C и через 5 мин. (время выживания спор тест-микроорганизма) с момента установления давления спускают пар. Для уменьшения времени воздействия пара до и после периода испытуемого воздействия (время воздействия при температуре (121 +/- 1) °C) подъем давления проводят максимум в течение 8 мин., спуск — в течение 3 мин. Контроль температуры осуществляют максимальными термометрами СП-82.
Аналогичное исследование проводят с 15-минутным временем воздействия (время гибели спор тест-микроорганизма). При каждом из указанных периодов воздействия экспонируют не менее 10 тест-носителей. По окончании времени выдержки тест-носители вынимают из стерилизатора. Во флаконы вносят 1 мл питательной среды (бульон Хоттингера, МПБ, СПБ, цветная питательная среда с индикатором бромкрезоловым пурпуровым), закрывают стерильными резиновыми пробками N 7,5 и инкубируют при температуре (55 +/- 1) °C в течение 7 суток при использовании питательного бульона (бульон Хоттингера, СПБ, МПБ) или в течение 48 ч при использовании цветной питательной среды с индикатором бромкрезоловым пурпуровым.
Учет результатов проводят путем визуального осмотра. Отсутствие помутнения/изменения цвета питательной среды с индикатором указывает на гибель спор. При наличии роста микроорганизмов проводят сравнение последних с тест-микроорганизмом.
В качестве контроля используют тест-носители, которые не подвергали действию стерилизующего средства. Посевы контрольных тест-носителей и питательную среду, а также инкубирование посевов осуществляют аналогично опытным тест-носителям, которые подвергали действию стерилизующего средства.
Время гибели спор G. stearothermophilius при действии водяного насыщенного пара под избыточным давлением (1,1 +/- 0,1) кгс/кв. см, температуре (121 +/- 1) °C должно быть не менее 15 мин.
Устойчивость спор B. licheniformis к сухому горячему воздуху определяют в воздушном стерилизаторе объемом 80 куб. дм с принудительной циркуляцией и скоростью движения воздуха более 1 м/с, которые обеспечивают допустимые предельные отклонения от номинального значения температуры.
В качестве тест-носителя применяют флаконы из нейтрального стекла,
контаминированные спорами тест-микроорганизма B. licheniformis.
Предварительно флаконы тщательно моют и стерилизуют паровым или воздушным
методом. Из исходной суспензии спор готовят рабочую суспензию для
6
контаминации тест-носителей из расчета 1 — 5 x 10 спор в носителе.
Стерильные тест-носители контаминируют рабочей суспензией спор
тест-микроорганизма B. licheniformis, что достигается внесением в каждый
тест-носитель с помощью дозатора с переменным объемом 0,02 мл суспензии
7
спор в дистиллированной воде с содержанием от 5,0 x 10 до
8
2,5 x 10 спор/мл.
Контаминированные тест-носители высушивают в термостате при температуре (37 +/- 1) °C в течение 24 ч и закладывают в бумажные или полимерные пакеты, разрешенные к применению в качестве стерилизационных упаковочных материалов в Российской Федерации.
Упакованные тест-носители помещают на полку воздушного стерилизатора, предварительно прогретого до 140 °C. Стерилизатор закрывают и после достижения температуры (160 +/- 3) °C начинают отсчет времени выдержки. Через 4 мин. (время выживания спор тест-микроорганизма) аппарат отключают. Контроль температуры осуществляют по наружному термометру.
Аналогичное исследование проводят с 30-минутным временем испытуемого воздействия (время гибели спор тест-микроорганизма). При каждом из указанных периодов испытуемого воздействия экспонируют не менее 10 тест-носителей.
По окончании времени выдержки тест-носители вынимают из стерилизатора. Во флаконы вносят 1 мл питательной среды (бульон Хоттингера, МПБ, СПБ, цветная питательная среда с индикатором бромтимоловым синим) и закрывают стерильными резиновыми пробками N 7,5 и инкубируют при температуре (37 +/- 1) °C в течение 7 суток при использовании питательного бульона (бульон Хоттингера, СПБ, МПБ) или в течение 48 ч при использовании цветной питательной среды с индикатором бромтимоловым синим.
Учет результатов опытов и контроля проводят аналогично, как при определении устойчивости спор к водяному насыщенному пару под давлением.
Время гибели спор тест-микроорганизма B. licheniformis при действии сухого горячего воздуха при температуре (160 +/- 3) °C должно быть не менее 30 мин.
5.8.1.4.2. Определение устойчивости спор к хлорамину, перекиси водорода, глутаровому альдегиду
Устойчивость к хлорамину, перекиси водорода, глутаровому альдегиду у спор B. cereus, B. subtilis, B. anthracis, живой сухой сибиреязвенной вакцины СТИ-1 определяют методом погружения батистовых тест-объектов, контаминированных споровой суспензией указанных культур (п. 5.1.2.2), в 10%-ный раствор хлорамина, 6%-ный раствор перекиси водорода, 2,5%-ный раствор глутарового альдегида с последующей нейтрализацией действующих веществ и посевом в жидкую питательную среду [74].
В процессе испытаний контролируют концентрацию действующего вещества в рабочем растворе ДС, температуру его в опыте, исходный и остаточный уровень контаминации спорами тест-микроорганизма тест-объекта, время выдержки тест-объектов в испытуемом дезинфицирующем растворе.
Определение устойчивости спор к хлорамину. Йодометрическим методом определяют процент активного хлора в хлорамине. В опытах используют препарат, содержащий 26 — 28% активного хлора, растворяя который в воде готовят 10%-ный (по препарату) рабочий раствор. Готовят и разливают в пробирки по 5 мл стерильный раствор нейтрализатора (2%-ный раствор тиосульфата натрия), стерильную питьевую воду, питательный бульон МПБ. Готовят и контаминируют тест-микроорганизмом батистовые тест-объекты (п. 5.1.2.2). Если в опытах используют ранее приготовленные и хранящиеся в холодильнике контаминированные спорами тест-микроорганизма тест-объекты, то их заранее извлекают из холодильника, чтобы они приобрели комнатную температуру (18 — 20 °C).
При проведении экспериментов в стеклянную емкость объемом 50 — 100 мл пипеткой наливают требуемый объем 10%-ного раствора хлорамина из расчета 0,5 мл на каждый тест-объект и помещают в водяную баню с температурой 20 °C на весь период опыта. Отсчитывают в чашке Петри необходимое для опыта количество контаминированных спорами тест-микроорганизмов батистовых тест-объектов (по 2 на каждую экспозицию), захватывают их стерильным пинцетом все сразу и опускают в емкость с раствором хлорамина; легким покачиванием емкости добиваются полного их смачивания. В момент смачивания всех тест-объектов отмечают время.
Через каждый час стерильной петлей извлекают по 2 тест-объекта из раствора хлорамина и опускают их в пробирку с 5 мл 2%-ного стерильного раствора тиосульфата натрия для нейтрализации остаточного действия хлорамина. Через 5 — 10 мин. тест-объекты переносят во вторую пробирку с 5 мл стерильной питьевой воды, а через 10 — 15 мин. каждый тест-объект помещают в 5 мл питательного бульона.
Для контроля два контаминированных спорами тест-микроорганизма тест-объекта погружают в стерильную воду (вместо раствора хлорамина) на максимальный срок экспозиции, затем (как и опытные тест-объекты) их переносят последовательно в раствор нейтрализатора (тиосульфат натрия), стерильную питьевую воду и сеют в жидкий питательный бульон в пробирках. Полноту нейтрализации активного хлора контролируют путем погружения неконтаминированных тест-объектов в раствор 10%-ного хлорамина на максимальную экспозицию, затем в раствор тиосульфата натрия, промывают в воде и помещают в бульон, куда вносят 0,1 мл суспензии, содержащей 20 — 30 жизнеспособных спор тест-микроорганизма. Рост культуры в бульоне свидетельствует об эффективной нейтрализации действия хлорамина.
Посевы опытные и контрольные ставят в термостат при температуре (37 +/- 1) °C; наличие роста тест-микроорганизма проверяют через 48 ч. Из пробирок с ростом делают посев петлей на твердую питательную среду для идентификации тест-микроорганизмов. Окончательный учет результатов проводят через 7 суток.
Опыт повторяют не менее 3 раз. Споры тест-микроорганизмов: B. cereus (штамм 96), B. subtilis (штамм 7), B. anthracis (штамм 81/1 и 27), живой сибиреязвенной вакцины СТИ-1 должны быть устойчивы к 10%-ному раствору хлорамина не менее 360 мин.
Определение устойчивости спор к перекиси водорода. Йодометрическим методом определяют концентрацию перекиси водорода в средстве «Перекись водорода медицинская». В опытах используют средство, содержащее не менее 30% перекиси водорода, из которого путем разведения стерильной питьевой водой готовят раствор для исследований, содержащий 6% перекиси водорода. Для нейтрализации перекиси водорода используют стерильный 2,5%-ный раствор тиосульфата натрия. Подготовку и определение устойчивости спор тест-микроорганизмов к 6%-ному раствору перекиси водорода проводят по такой же методике, как и к хлорамину, только в качестве нейтрализатора используют 2,5%-ный раствор тиосульфата натрия. Учитывая, что споры тест-микроорганизмов должны быть устойчивы к воздействию 6%-ного раствора перекиси водорода в течении не менее 60 мин., испытание осуществляют в течение 90 мин. с отбором проб (по 2 теста) через каждые 15 мин. (обычно берут по 2 тест-объекта на 6 экспозиций). Аналогично, как и при определении устойчивости спор к хлорамину, проводят посевы, учет результатов и контроль.
Споры тест-микроорганизмов: B. cereus (штамм 96), B. subtilis (штамм 7), B. anthracis (штамм 81/1 и 27), живой сибиреязвенной вакцины СТИ-1 должны быть устойчивы к 6%-ному раствору перекиси водорода не менее 60 мин.
Определение устойчивости спор B. subtilis (штамм 7) к 2,5%-ному раствору глутарового альдегида. Определяют концентрацию глутарового альдегида в исходном концентрированном растворе глутарового альдегида. В экспериментах используют средство, содержащее не менее 20% глутарового альдегида. Раствор для исследований, содержащий 2,5% глутарового альдегида, готовят путем разведения исходного раствора стерильной питьевой водой с последующим доведением pH приготовленного раствора до значений 7,5. Подготовку и определение устойчивости спор B. subtilis (штамм 7) к 2,5%-му раствору глутарового альдегида проводят по такой же методике, как и к хлорамину, используя батистовые тест-объекты, контаминированные этим тест-микроорганизмом, только в качестве нейтрализатора используют или стерильный 1%-ный раствор бисульфита натрия или стерильный универсальный нейтрализатор, содержащий Твин-80 (3%), сапонин (0,1%), гистидин (0,1%), цистеин (0,1%). Учитывая, что споры некоторых тест-микроорганизмов должны быть устойчивы к воздействию 2,5%-ного раствора глутарового альдегида не менее чем в течение 3 ч, испытание осуществляют в течение 6 ч с отбором проб (по 2 тест-объекта) через каждые 30 мин. Посевы, учет результатов и постановку контроля осуществляют аналогично определению устойчивости спор к хлорамину.
Споры тест-микроорганизма B. subtilis (штамм 7) должны быть устойчивы к 2,5%-ному раствору глутарового альдегида не менее 3 ч.
5.8.2. Обеспечение стандартности условий
проведения исследований спороцидной активности
ДС, СС и их субстанций
Химико-аналитический контроль ДС, СС и их субстанций [74].
До проведения исследования спороцидной активности ДС, СС и их субстанций необходимо проанализировать представленные производителем утвержденные рецептуры средства и технические условия на отечественные или спецификацию на зарубежные средства, провести химико-аналитические исследования по определению концентрации действующих веществ и определить соответствие ее и других показателей, регламентированных вышеуказанными документами. При этом используют химико-аналитические методы контроля и применяют условия хранения средства и меры безопасности при работе с ним, предложенные производителем средства.
Выбор, приготовление и контроль эффективности нейтрализаторов ДС с целью исключения остаточного спороцидного или споростатического действия ДС, СС и их субстанций на тест-микроорганизмы [74]. Для дезинфекции и стерилизации применяют средства, обладающие спороцидным действием, т.е. убивающие споры, но не задерживающие только их рост. Поэтому при определении спороцидного действия необходимо разграничить спороцидное действие средства от споростатического.
На основании накопленного опыта для нейтрализации антимикробного действия ДВ из различных химических групп (в зависимости от концентрации ДВ в растворе) применяют следующие нейтрализаторы:
— для средств из группы окислителей (хлор-, йод-, перекисьсодержащие средства; средства, содержащие надуксусную кислоту, озон) — 0,5 — 2,5%-ные растворы тиосульфата натрия;
— для альдегид- и фенолсодержащих средств — универсальный нейтрализатор, содержащий 3% полисорбита 80% Твин-80, 3% сапонина, 0,1% гистидина и 0,1% цистеина; или 3% полисорбита 80%, 2% гистидина, 0,3% лецитина, 3% сапонина;
— для композиционных ДС — универсальный нейтрализатор, например содержащий 3% полисорбита 80%, 3% сапонина, 0,1% гистидина и 0,1% цистеина или 3% полисорбита 80%, 3% сапонина, 0,3% лецитина и 0,15% цистеина, 0,15% тиосульфата натрия, или другие нейтрализаторы, рекомендуемые производителями.
Растворы нейтрализаторов готовят в асептических условиях, применяя только стерильную дистиллированную воду. При невозможности соблюдения асептических условий приготовления нейтрализаторов допускается стерилизация готовых растворов автоклавированием при 1,1 кГс/кв. см (121 °C) в течение 15 мин. Температура растворов нейтрализаторов должна быть 20 °C независимо от температуры окружающей среды. Готовые растворы необходимо использовать в день приготовления. Допускается хранение готовых растворов при температуре 4 °C в течение 48 ч.
Контроль полноты нейтрализации остаточного действия испытываемого средства [74]. Существующие рекомендации по применению нейтрализаторов рассчитаны для различных монодействующих веществ ДВ. Однако многие современные ДС содержат несколько ДВ и другие вспомогательные вещества, которые могут обладать споростатическим действием. Поэтому существующие (рекомендуемые) нейтрализаторы могут не обеспечивать эффективную нейтрализацию остаточного действия таких ДС. В этой связи результаты оценки эффективности ДС могут быть необъективными. Поэтому каждый случай проведения испытаний, даже известного ДС, должен предварительно сопровождаться экспериментальным контролем эффективности нейтрализации остаточного действия ДС на тест-микроорганизм.
Для контроля эффективности нейтрализатора и полноты нейтрализации остаточного действия ДС используют суспензионный метод, как обеспечивающий наиболее жесткие условия действия нейтрализатора при проведении испытаний ДС. Последовательность и методология выполнения основных операций при проведении такого эксперимента и их назначение приведены на рис. 5.2 и в табл. 5.10.
Стерильный Стерильная
Рабочий раствор ДС нейтрализатор дистиллированная вода
┌──┐ ┌──┐ ┌──┐
│ │ │ │ │ │
├──┤ ├──┤ ├──┤
│ │ │ │ │ │
┌────┬────┤ │ │ │ │ │
│ │ └──┘ └─┬┘ по 1 мл └┬─┘
│ │ по 1 мл └───────────┐ ┌──────────┘
/ / / /
Пробирка N 1 ┌──┐ ┌──┐ Пробирка N 2 Пробирка N 3 ┌──┐ ┌──┐ Пробирка N 4
9 мл суспензии │ │ │ │ 9 мл суспензии 9 мл суспензии │ │ │ │ 9 мл суспензии спор
спор на дистил- ├──┤ ├──┤ спор на спор на ├──┤ ├──┤ на стерильной дис-
лированной воде │ │ │ │ нейтрализаторе нейтрализаторе │ │ │ │ тиллированной воде
3 │ │ │ │ 3 3 │ │ │ │ 3
(1 x 10 спор/мл) └─┬┘ └┬─┘ (1 x 10 спор/мл) (1 x 10 спор/мл) └─┬┘ └┬─┘ (1 x 10 спор/мл)
│ │ │ │
┌─────────┐<─────┤ ├─────>┌─────────┐ ┌─────────┐<─────┤ ├─────>┌─────────┐
└─────────┘ │ │ └─────────┘ └─────────┘ │ │ └─────────┘
┌─────────┐<───┤ ├───>┌─────────┐ ┌─────────┐<───┤ ├───>┌─────────┐
└─────────┘ │ │ └─────────┘ └─────────┘ │ │ └─────────┘
┌─────────┐<─┘ └─>┌─────────┐ ┌─────────┐<─┘ └─>┌─────────┐
└─────────┘ └─────────┘ └─────────┘ └─────────┘
Высев из каждой пробирки по 0,1 мл на чашки Петри с соответствующей
для тест-микроорганизма плотной питательной средой (не менее 3 на пробу)
Рис. 5.2. Принципиальная схема проведения эксперимента
по контролю эффективности нейтрализации действия ДС на споры
тест-микроорганизма используемым нейтрализатором
Таблица 5.10
НАЗНАЧЕНИЕ ОПЕРАЦИЙ ЭКСПЕРИМЕНТА ПО ОЦЕНКЕ
ЭФФЕКТИВНОСТИ НЕЙТРАЛИЗАЦИИ ОСТАТОЧНОГО ДЕЙСТВИЯ ДС
┌─────┬───────────────────┬─────────────────────────────────┬─────────────┐
│ N │Назначение операции│ Процедура выполнения операции │ Ожидаемый │
│пробы│ исследования │ исследования │ результат │
├─────┼───────────────────┼─────────────────────────────────┼─────────────┤
│1 │Контроль │к 9 мл суспензии спор │Рост тест- │
│ │губительного │ 3 │микроорганиз-│
│ │действия ДС │(10 спор/мл) на дистиллированной│мов должен │
│ │ │воде + 1 мл раствора ДС (переме- │отсутствовать│
│ │ │шать встряхиванием пробирки) │ │
├─────┼───────────────────┼─────────────────────────────────┼─────────────┤
│2 │Контроль полноты │к 9 мл суспензии спор │Примерно │
│ │нейтрализации ДС │ 3 │одинаковое │
│ │ │(10 спор/мл) с нейтрализатором +│(или в преде-│
│ │ │1 мл раствора ДС (сразу интенсив-│лах ошибки в │
│ │ │но перемешать встряхиванием │25%) КОЕ в │
│ │ │пробирки) │посевах проб │
├─────┼───────────────────┼─────────────────────────────────┤(по 0,1 мл) │
│3 │Контроль отсутствия│к 9 мл суспензии спор │на плотной │
│ │антимикробного │ 3 │питательной │
│ │действия у │(10 спор/мл) с нейтрализатором +│среде │
│ │нейтрализатора │1 мл раствора нейтрализатора (пе-│ │
│ │ │ремешать встряхиванием пробирки) │ │
├─────┼───────────────────┼─────────────────────────────────┼─────────────┤
│4 │Референс-контроль │к 9 мл суспензии спор │ │
│ │количества спор │ 3 │ │
│ │тест-микроорганизма│(10 спор/мл) на дистиллированной│ │
│ │ │воде + 1 мл дистиллированной воды│ │
│ │ │(перемешать встряхиванием │ │
│ │ │пробирки) │ │
├─────┴───────────────────┴─────────────────────────────────┴─────────────┤
│ Примечание: спустя 5 мин. после постановки опыта из каждой из четырех│
│проб производят посев смеси по 0,1 мл как минимум на 3 чашки Петри с│
│питательной средой, которые инкубируют в термостате при (37 +/- 1) °C и│
│через 2 — 4 суток учитывают результаты исследований. │
└─────────────────────────────────────────────────────────────────────────┘
Обеспечение техники безопасности при исследовании спороцидной активности ДС, СС и их субстанций. Споры тест-микроорганизмов обладают высокой устойчивостью, поэтому их гибель обеспечивают в большинстве случаев высокие концентрации ДС, СС и их субстанций и по препарату, и по ДВ. Поэтому при хранении, взвешивании, приготовлении рабочих растворов, их химико-аналитических исследованиях и проведении экспериментов необходимо применять меры защиты, предусмотренные в технических условиях на отечественные средства или спецификации — на зарубежные с учетом класса их опасности [74].
Все тест-микроорганизмы, кроме патогенных штаммов возбудителя сибирской язвы, относятся к III и IV группам патогенности (опасности), поэтому микробиологические исследования с ними следует проводить в асептических условиях при соблюдении правил техники безопасности, предусмотренных СП 1.3.2322-08 «Безопасность работы с микроорганизмами III — IV групп патогенности и возбудителями паразитарных болезней» [74].
Лабораторные исследования с использованием патогенных штаммов возбудителя сибирской язвы должны проводить специалисты, прошедшие подготовку на курсах по особо опасным инфекциям, в лицензированных лабораториях, имеющих допуск на работу с микроорганизмами I — II групп патогенности (опасности), при строгом соблюдении всех правил техники безопасности, предусмотренных СП 1.3.1285-03 «Безопасность работы с микроорганизмами I — II групп патогенности (опасности)» [15].
5.8.3. Методы исследований и оценки результатов спороцидной
активности ДС, СС и их субстанций in vitro
5.8.3.1. Суспензионный метод
Суспензионный метод оценки спороцидной активности ДС и их субстанций используют для получения первичной информации о концентрации и времени эффективного (отсутствие жизнеспособных спор) спороцидного действия ДС [51, 52, 74]. Методология выполнения эксперимента по оценке спороцидной активности ДС суспензионным методом приведена на схеме рис. 5.3.
┌─────────────────┐ ┌───────────────────────────┐ ┌─────────────────┐ ┌───────────────┐
│Приготовление │ │Приготовление рабочего │ │Отбор из смеси │ │Шюттелирование │
│суспензии спор ├>│раствора ДС. ├>│3 проб (по 1 мл) ├>│проб. Посев из │
│тест-микроорга- │ │Смешивание суспензии спор и│ │после каждой экс-│ │каждой пробы по│
│низма и контроль │ │дезинфицирующего раствора │ │позиции и перенос│ │0,1 мл на чашки│
│БК спор в ней │ │в соотношении 1:9. │ │их в пробирки с │ │с питательной │
│путем последова- │ │Отсчет экспозиции │ │9 мл нейтрализа- │ │средой. │
│тельного 10-крат-│ │воздействия ДС на споры │ │тора остаточного │ │Термостатирова-│
│ного разведения │ └───────────────────────────┘ │действия ДС │ │ние посевов │
│и посева на плот-│ └─────────────────┘ └───────────────┘
│ную питательную │
│среду │ ┌──┐
└─────────────────┘ │ │
┌────────────────────────────────────────────>├──┤
│ │ │
│ ┌───────┐ │ ─┼─┐
┌─┼┐ ┌─>└───────┘ └──┘ │ ┌──┐
│ ││ ┌──┐ ┌──┐ ┌──┐ ┌──┐ ┌──┐ ┌──┐│ ┌───────┐ / │ │ │ ┌───────┐
├─┼┤ │ │ │ │ │ │ │ │ │ │ │ │├─>└───────┘ │ │ ├──┤┌─>└───────┘
│ ││ ├──┤ ├──┤ ├──┤ ├──┤ ├──┤ ├──┤├─>┌───────┐ │ │ │ ─┼┤ ┌───────┐
│ └┼─┼> │ │ │ │ │ │ │ │ │ │ ├┤ └───────┘ │ └─────┼> │├─>└───────┘
└──┘ │ ┼─┼> ┼─┼> ┼─┼> ┼─┼> ┼─┼> │├─>┌───────┐ │ └──┘│ ┌───────┐
/ └──┘ └──┘ └──┘ └──┘ └──┘ └──┘│ └───────┘ │ / └─>└───────┘
│ / └─>┌───────┐ │ │ /
│ │ └───────┘ │ │ │
┌─┴──────────┐┌──────┴─────────────┐ / │ │ │
│Пробирка с ││Пробирки со стериль-│ │ │ │ │
│рабочей сус-││ной водопроводной │ │ │ │ │
│пензией спор││водой (по 9 мл) │┌────┴──────┐┌┴───────┐┌─┴─────────┐┌┴────────────┐
│тест-микро- ││в количестве, ││Чашки Петри││Пробирка││Пробирки с ││Чашки Петри │
│организма в ││необходимом для ││с плотной ││или ││9 мл ней- ││с плотной │
│концентрации││определения БК ││питательной││флакон с││трализатора││питательной │
│ 9 ││тест-микроорганизма ││средой ││рабочим ││(не менее 3││средой (не │
│(2 x 10 ││в суспензии ││(5 чашек ││раство- ││на каждую ││менее 3 на │
│спор/мл) ││ ││на пробу) ││ром ДС ││экспозицию)││каждую пробу)│
└────────────┘└────────────────────┘└───────────┘└────────┘└───────────┘└─────────────┘
Рис. 5.3. Схема алгоритма проведения эксперимента
по оценке спороцидной активности ДС
Как видно из схемы рис. 5.3, для проведения опыта по оценке спороцидной активности ДС суспензионным методом необходимо приготовить:
— рабочую суспензию тест-микроорганизма с концентрацией спор не менее
9
1 x 10 спор/мл (это обеспечивает возможность создания в смеси ДС с
суспензией (обоснованной и применяемой для этого метода оценки ДС)
8
концентрации спор порядка 1 x 10 спор/мл);
— пробирки со стерильной питьевой водой для проведения контроля реальной биологической концентрации БК тест-микроорганизма в суспензии, используемой в опыте;
— пробирки или флакон с раствором ДС в испытываемой концентрации в количестве, необходимом для обеспечения отбора всех проб;
— необходимое количество пробирок (в зависимости от количества проб, отбираемых для определения времени, обеспечивающего полную гибель спор тест-микроорганизма), содержащих по 9 мл нейтрализатора, проверенного предварительно на эффективность нейтрализации остаточного действия испытываемого ДС на тест-микроорганизм, п. 5.8.2;
— чашки Петри со стерильной плотной питательной средой в количестве, необходимом для посева пробы контроля исходной суспензии и проб контроля эффективности действия ДС на тест-микроорганизм.
Методика проведения самого опыта включает, как видно из схемы, последовательное выполнение следующих операций:
— тщательное перемешивание хранимой в пробирке или во флаконе рабочей суспензии тест-микроорганизма путем встряхивания в течение 2 — 3 мин.;
— помещение испытываемого рабочего раствора ДС в водяную баню с заданной температурой; если задачей эксперимента не предусмотрено изучение влияния воздействия температуры на эффективность средства, то оценка эффективности раствора испытываемого средства осуществляется при температуре 18 — 20 °C;
— проведение контроля реальной на момент проведения опыта биологической концентрации БК тест-микроорганизма в суспензии, п. 5.8.1.3;
— внесение в испытываемый дезинфицирующий раствор рабочей суспензии тест-микроорганизма с обеспечением соотношения ДС и суспензии тест-микроорганизма 9:1;
— перемешивание смеси и отсчет по секундомеру времени начала действия ДС на тест-микроорганизм;
— по окончании каждой заданной экспозиции проводят отбор пробы в количестве 3 мл, которую по 1 мл вносят в 3 пробирки, содержащие по 9 мл стерильного раствора нейтрализатора;
— перемешивание пробы путем встряхивания в течение 1 — 2 мин. (или в течение 5 мин. на шейкере) и посев из них стерильно на поверхность плотной питательной среды в чашках Петри (по 0,1 мл на каждую чашку и не менее чем на 3 чашки из каждой пробы).
В опытах с вирулентным тест-микроорганизмом возбудителя сибирской язвы, кроме посева на твердую питательную среду, пробу по 0,2 мл вводят внутрибрюшинно белым мышам весом по 10 — 12 г. Параллельно проводят контрольное заражение животных питательной средой с нейтрализатором и суспензией спор исходного тест-микроорганизма. Количество животных в контрольных группах — не менее 3. Наблюдают за животными в течение 48 — 96 ч. Как павших, так и усыпленных эфиром мышей вскрывают, делают посев органов на элективные среды для выявления роста возбудителя сибирской язвы и его идентификации;
— инкубирование чашек Петри с посевами проб при температуре (37 +/- 1) °C или (55 +/- 1) °C в зависимости от тест-микроорганизма в течение 2 — 7 суток и учет результатов.
Эффективной экспозицией для рабочего раствора испытанной концентрации считается вторая экспозиция из показавших отсутствие жизнеспособных спор в посевах соответствующих им проб.
Количество и интервал (шаг) экспозиций, при которых осуществляют отбор проб на эффективность ДС, выбирают на основе учета данных о составе и эффективности входящих в средство действующих веществ.
Средство, растворы которого обеспечивают при комнатной температуре в течение 60 мин. полную гибель спор одного из рекомендуемых споровых тест-микроорганизмов, рассматривают как перспективное спороцидное средство для дальнейшего изучения: определения спектра спороцидного действия, факторов, влияющих на спороцидную активность ДС и др.
5.8.3.2. Метод батистовых тест-объектов
Как и суспензионный метод оценки спороцидной активности ДС и их субстанций, так и метод батистовых тест-объектов используют для получения информации о концентрации и времени эффективной спороцидной активности ДС [51, 52, 74]. В принципиальном плане методология выполнения эксперимента по оценке спороцидной активности ДС методом батистовых тест-объектов приведена на схеме рис. 5.4 (не приводится).
Как видно из схемы рис. 5.4, для проведения опыта по оценке спороцидной активности ДС методом батистовых тест-объектов необходимо приготовить:
— стерильные батистовые тест-объекты размером 1 x 0,5 см путем погружения куска батиста на 24 ч в холодную питьевую воду для удаления апплитуры. Затем ткань тщательно стирают с мылом, прополаскивают в холодной воде, кипятят, сушат и гладят горячим утюгом. С помощью иглы в приготовленном куске ткани выдергивают нитки в продольном направлении на расстоянии 11 мм друг от друга, а в поперечном направлении — 6 мм. По этим линиям батист разрезают ножницами на отдельные тест-объекты; раскладывают по 50 штук в чашки Петри, упаковывают в бумагу и стерилизуют в паровом стерилизаторе;
— рабочую суспензию тест-микроорганизма с концентрацией не менее
9
1 x 10 спор/мл для контаминации батистовых тест-объектов;
— пробирки со стерильной питьевой водой (10 мл) для контроля реальной биологической концентрации БК тест-микроорганизма на контаминированных тест-объектах;
— испытываемый раствор ДС в емкости (пробирка, колба или стакан) в количестве, достаточном для замачивания всех взятых в опыт тест-объектов, исходя из расчета 0,5 мл раствора на 1 тест-объект;
— необходимое количество пробирок (в зависимости от количества проб, отбираемых для определения времени полной гибели спор тест-микроорганизма под действием ДС), содержащих по 9 мл нейтрализатора, проверенного предварительно на эффективность нейтрализации остаточного действия испытываемого ДС на тест-микроорганизм, п. 5.8.2;
— чашки Петри со стерильной плотной питательной средой для посева проб контроля БК тест-микроорганизма на тест-объекте и проб контроля эффективности действия ДС на тест-микроорганизм.
Методика проведения самого опыта по оценке спороцидной активности ДС предусматривает, как видно из схемы, последовательное выполнение следующих этапов, рис. 5.4:
— тщательное перемешивание хранимой в пробирке или во флаконе при
температуре (6 +/- 2) °C исходной суспензии агаровой культуры
тест-микроорганизма путем встряхивания пробирки (флакона) в течение 2 —
3 мин.; приготовление из нее рабочей суспензии тест-микроорганизма в
9
концентрации не менее 1 x 10 спор/мл и в количестве, достаточном для
контаминации используемых в опыте тест-объектов (из расчета 0,2 мл на
тест-объект);
— контаминация батистовых тест-объектов тест-микроорганизмом. Для этого помещают в чашку Петри необходимое для опыта количество стерильных батистовых тест-объектов; заливают их приготовленной рабочей суспензией спор тест-микроорганизма, обеспечивая их равномерное смачивание, и оставляют их в суспензии в закрытой чашке Петри на 20 мин. С соблюдением асептики контаминированные тест-объекты переносят на стерильную фильтровальную бумагу, уложенную в два слоя в стерильной чашке Петри, покрывают их листом такой же бумаги и закрывают чашку крышкой; через 10 мин. перекладывают тест-объекты на сухую стерильную фильтровальную бумагу в стерильной чашке Петри и подсушивают в термостате при (37 +/- 1) °C в течение 60 мин. с приоткрытыми крышками. Высушенные тест-объекты, контаминированные спорами тест-микроорганизма, помещают в чашки Петри в холодильник и хранят при температуре (6 +/- 2) °C, используя для проведения опытов в течение не более 3 — 4 суток;
— с целью контроля микробной контаминации тест-объектов определяют БК
спор на них. Для этого контаминированные спорами батистовые тесты погружают
в пробирки с 10 мл стерильной питьевой воды и встряхивают в течение 10 —
15 мин. на шейкере для отмывания спор с тест-объекта. Затем делают
3 последовательных 10-кратных разведения, чтобы получить суспензию с
3
концентрацией порядка 1 x 10 спор/мл, из которой производят посев по
0,1 мл на 5 чашек с плотной питательной средой. Посевы инкубируют в
термостате при (37 +/- 1) °C или (55 +/- 1) °C в течение 2 — 4 суток и
подсчитывают общее количество выросших на чашках КОЕ. Используя формулу
определения БК, приведенную в п. 5.8.1.3, рассчитывают количество
жизнеспособных спор тест-микроорганизма на тест-объекте;
— приготовление испытываемого рабочего раствора ДС в соответствующей емкости из расчета 0,5 — 1,0 мл на тест-объект;
— помещение испытываемого рабочего раствора ДС на водяную баню с заданной температурой. Если задачей эксперимента не предусмотрено изучение влияния воздействия температуры на эффективность средства, то оценка эффективности раствора испытываемого средства осуществляется при температуре 18 — 20 °C;
— замачивание необходимого для обеспечения отбора проб количества контаминированных тест-объектов в дезинфицирующем растворе с заданной температурой и отсчет по секундомеру времени начала воздействия ДС на тест-микроорганизм;
— отбор (по окончании каждой заданной экспозиции) стерильным пинцетом (петлей) тест-объектов (не менее 3 на экспозицию), которые помещают в пробирку с 10 мл заранее проверенного на эффективность нейтрализатора остаточного действия ДС на тест-микроорганизм.
Определение наличия жизнеспособных спор на тест-объекте. Если предусматривается только установление наличия на данную экспозицию оставшихся на тест-объекте жизнеспособных спор тест-микроорганизма, то проба не подвергается встряхиванию, а тесты стерильным пинцетом извлекают из нейтрализатора и помещают в пробирку со стерильным питательным бульоном. Если предусматривается количественное определение оставшихся на тест-объекте жизнеспособных спор тест-микроорганизма, то на стерильную плотную питательную среду в чашках Петри сеют по 0,1 мл стерильной пипеткой из нейтрализованной пробы (или из ее соответствующего разведения), полученной после интенсивного встряхивания тест-объектов вручную в течение 5 — 10 мин. или на шейкере;
— инкубирование посевов в чашках Петри или пробирках проводят при температуре (37 +/- 1) °C или (55 +/- 1) °C в зависимости от вида тест-микроорганизма в течение 2 — 4 суток;
— учет и анализ результатов эксперимента испытания.
Эффективной экспозицией для рабочего раствора испытанной концентрации считается вторая экспозиция из показавших отсутствие жизнеспособных спор в посевах соответствующих им проб.
Количество и интервал (шаг) экспозиций, при которых осуществляется отбор проб на эффективность ДС, выбирают на основе данных о составе и эффективности входящих в средство действующих веществ.
Средство, растворы которого обеспечивают при комнатной температуре в течение 60 мин. полную гибель спор одного из рекомендуемых споровых тест-микроорганизмов, может рассматриваться как перспективное спороцидное ДС для дальнейшего изучения.
Исследование спектра спороцидной активности химических ДС, СС и их субстанций проводят с использованием следующих тест-микроорганизмов: B. cereus, B. subtilis, B. anthracis, сибиреязвенной сухой живой вакцины СТИ-1. Дальнейшие исследования проводят, используя наиболее устойчивый тест-микроорганизм.
5.8.3.3. Методы изучения факторов, влияющих
на спороцидную активность ДС, СС и их субстанций
Для определения сферы применения и направлений дальнейших исследований необходимо изучить спектр спороцидной активности ДС, СС и их субстанций и зависимости от температуры, величины pH и присутствия белковых загрязнений [51, 74].
Исследования проводят методом батистовых тест-объектов, п. 5.8.3.2.
Для определения спектра спороцидного действия ДС, СС и их субстанций используют споровые тест-микроорганизмы, рекомендуемые для изучения и оценки спороцидной активности, п. 5.8.1.1, табл. 5.8.
На основании полученных данных определяют целесообразность дальнейших исследований для применения в качестве ДС, СС и их субстанций.
Определение влияния температуры на спороцидную активность ДС, СС и их субстанций проводят с целью выявления возможности использования подогретых растворов ДС для сокращения времени обеззараживания объектов в отношении спор тест-микроорганизмов, а также для оценки эффективности спороцидного действия при пониженных температурах окружающей среды, обеззараживаемого объекта и самого раствора ДС.
Для изучения влияния температуры рабочие растворы испытуемых ДС готовят в день опыта, наливают в стеклянные колбы (пробирки) из расчета по 0,5 мл на каждый тест-объект.
Исследование влияния положительных температур раствора ДС на его спороцидную активность проводят с использованием водяной бани, в которой нагревают емкость с дезинфицирующим раствором до (18 +/- 1), (37 +/- 1), (55 +/- 1) °C, после чего погружают в него контаминированные тест-объекты и поддерживают эти температуры в процессе всего опыта.
Опыты по оценке влияния пониженной температуры на активность ДС проводят с использованием криостата или солевых низкозамерзающих растворов, в которых охлаждают емкость с дезинфицирующим раствором до температур (10 +/- 1), (5 +/- 1), (-20 +/- 1) °C и поддерживают их в процессе опыта. После достижения указанной температуры в раствор ДС погружают батистовые тест-объекты, контаминированные тест-микроорганизмом из расчета 2 тест-объекта на каждую экспозицию.
Через определенные промежутки времени из каждой колбы извлекают по 2 тест-объекта и помещают их в пробирки с соответствующим нейтрализатором на 5 мин., затем во вторую пробирку со стерильной водопроводной водой на 5 мин. и только после этого каждый тест-объект переносят в пробирку, заполненную 5 мл бульона Хоттингера (pH 7,2). Посевы инкубируют в течение 48 — 72 ч при (37 +/- 1) °C. Контролем служат по 2 тест-объекта при каждой исследованной температуре, не подвергавшиеся действию испытуемого ДС, но погруженные в пробирки со стерильной питьевой водой на срок, равный действию испытуемого ДС.
Определение влияния величины pH на спороцидную активность ДС, СС и их субстанций начинают с приготовления рабочих растворов ДС, имеющих различную величину pH (5,6 — 6,0; 7,0; 8,5 — 9,0). Для подкисления раствора используют децинормальный раствор соляной или другой кислоты, а для подщелачивания — децинормальный раствор щелочи. В подготовленные растворы погружают контаминированные спорами батистовые тест-объекты. Исследование зависимости спороцидной активности ДС, СС и их субстанций от величины pH проводят по методике, описанной выше, только при нейтрализации действия действующих веществ одновременно понижают и величину pH, добавляя соответственно кислоту или щелочь.
Определение влияния белковых загрязнений на спороцидную активность ДС проводят с целью выявления возможности влияния (или установления его отсутствия) белковых загрязнений на обеззараживаемом объекте на спороцидную активность ДС.
Исследование проводят методом батистовых тест-объектов (п. 5.8.3.2), только для контаминации тест-объектов используют суспензию спор тест-микроорганизма, содержащую 20% инактивированной сыворотки крупного рогатого скота или дефибринированной крови, которые добавляют в суспензию при ее приготовлении. Инактивацию нормальной сыворотки крупного рогатого скота проводят дробным трехкратным прогреванием на водяной бане при температуре (60 +/- 1) °C в течение 30 мин. Если активность препарата не снижается в присутствии 20% белка, концентрацию инактивированной сыворотки крупного рогатого скота или дефибринированной крови в суспензии тест-микроорганизма увеличивают до 40%. Отсутствие снижения спороцидной активности ДС при добавлении и 40% сыворотки позволяет считать ДС не реагирующим на присутствие белковых загрязнений.
5.8.4. Методы исследований спороцидной эффективности ДС,
предназначенных для обеззараживания объектов внешней среды,
контаминированных тест-микроорганизмами в споровой форме
Длительная выживаемость спор возбудителей сибирской язвы во внешней среде обосновывает необходимость обеззараживания большого перечня объектов, которые могут быть контаминированы возбудителем сибирской язвы при уходе за больными животными, захоронении их трупов, транспортировании, реализации, переработке и уничтожении продуктов и сырья, полученных от больных животных, в очаге на дому при выявлении лиц, больных сибирской язвой, в лечебно-профилактических учреждениях при оказании медицинской помощи больным сибирской язвой, в специализированных бактериологических лабораториях, работающих с этими возбудителями, на предприятиях по производству биопрепаратов на их основе, а также при биотеррористическом использовании возбудителя сибирской язвы [12, 14, 15].
Учитывая вышесказанное, перечень тест-объектов, моделирующих объекты, подлежащие дезинфекции, включает:
— поверхности помещений, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и др.;
— изделия медицинского назначения, в т.ч. эндоскопы;
— предметы ухода за больными, игрушки;
— посуду столовую, лабораторную и из-под выделений;
— белье, одежду, спецодежду и другие объекты из тканей;
— изделия из резины, в т.ч. перчатки, сапоги, фартуки и др.;
— обувь;
— руки в резиновых перчатках;
— остатки пищи;
— выделения: фекалии, мочу, кровь, мокроту;
— воду;
— воздух;
— медицинские отходы.
5.8.4.1. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания поверхностей помещений,
мебели, аппаратов, приборов, санитарно-технического
оборудования, транспортных средств и других объектов
В исследованиях используют тест-поверхности (10 x 10 см) из различных материалов: дерева (окрашенные масляной или клеевой и другими красками, оклеенные обоями и неокрашенные), линолеума, пластика, кафеля, фаянса, плитки, металлов, стекла [51, 52, 66, 74].
Тест-поверхности из различных материалов (за исключением поверхностей,
окрашенных клеевой краской и оклеенных обоями) тщательно моют водой с мылом
и щеткой, стерилизуют в паровом стерилизаторе. Тест-поверхности, окрашенные
клеевой краской и оклеенные обоями, протирают несколько раз стерильной
марлевой салфеткой, увлажненной стерильной питьевой водой. Готовят споровую
суспензию тест-микроорганизма (B. cereus, сибиреязвенная живая сухая
9
вакцина СТИ-1 для людей, B. anthracis), содержащую 2,0 x 10 спор/мл,
добавляют 40% лошадиной сыворотки, инактивированной при 56 °C в течение
9
30 мин. (к 6 мл суспензии, содержащей 2,0 x 10 спор/мл, прибавляют 4 мл
сыворотки).
После подсыхания тест-поверхности располагают горизонтально и на них с помощью одноканального механического дозатора или стеклянной пипетки наносят 0,5 мл суспензии спор тест-микроорганизма. Суспензию равномерно распределяют по всей тест-поверхности (100 кв. см) стерильным стеклянным шпателем. Если суспензия тест-микроорганизма не распределяется равномерно, а собирается в каплю, растирание шпателем по тест-поверхности осуществляют неоднократно (3 — 5 раз). Контаминированные тест-поверхности подсушивают при комнатной температуре до полного высыхания (30 — 120 мин.). Обеззараживание тест-поверхностей осуществляют способами протирания или орошения дезинфицирующим раствором (при работе с B. anthracis применяют только орошение в боксе биологической защиты при предварительном подсушивании не более 20 мин.).
При поведении экспериментов тест-поверхности, окрашенные клеевой и другими красками или оклеенные обоями, располагают вертикально и обеззараживают путем орошения дезинфицирующим раствором. Остальные тест-поверхности обеззараживают как в горизонтальном, так и в вертикальном положениях путем орошения, однократного или двукратного протирания или мытья дезинфицирующим раствором.
В зависимости от вида обрабатываемой поверхности и наличия загрязнений на ней норма расхода ДС способом протирания равна 100 — 150 мл/кв. м (1,0 — 1,5 мл на 100 кв. см); способом орошения — 150 мл/кв. м (1,5 мл на 100 кв. см) при обработке распылителем типа «Квазар» или его аналогами и 300 — 500 мл/кв. м (3 — 5 мл на 100 кв. см) — при обработке распылителем типа «Автомакс» или гидропультом.
При необходимости обработку способом протирания или орошения повторяют через 15 мин.
Для контроля эффективности обеззараживания через определенные промежутки времени (15 — 30 — 60 мин.) с тест-поверхностей делают смывы путем тщательного протирания тест-поверхности сначала в одном, а затем в перпендикулярном направлении стерильной марлевой салфеткой (5 x 5 см), увлажненной нейтрализатором. После протирания на тест-поверхности не должно оставаться излишней влаги. Салфетки погружают на 5 мин. в пробирки (емкости) с соответствующим для испытуемого ДС нейтрализатором (10 мл), а затем в стерильную питьевую воду с бусами и встряхивают на шейкере в течение 10 мин. Полученную смывную жидкость вносят по 0,1 мл на поверхность питательного агара двух чашек Петри, тщательно распределяя по всей поверхности. Посевы инкубируют в термостате при температуре (37 +/- 1) °C в течение 48 — 72 ч.
В контрольных опытах для обработки аналогично контаминированных тест-поверхностей вместо раствора ДС используют стерильную питьевую воду из того же расчета, что и опытные. Жидкость, в которую помещают стерильную марлевую салфетку после взятия смыва с контрольных поверхностей, перед посевом разводят в 100 раз и вносят по 0,1 мл на поверхность питательного агара двух чашек Петри. Посевы инкубируют в термостате при температуре (37 +/- 1) °C. Учитывают результаты через 48 ч (предварительные), а окончательные — через 21 сутки.
Оценку результатов контрольных опытов проводят по посеву того разведения, в котором число КОЕ на поверхности питательного агара в чашке Петри составляет от 30 до 300.
После выдерживания посевов в термостате подсчитывают число КОЕ на чашках с агаром, рассчитывают плотность контаминации на 100 кв. см и высчитывают эффективность обеззараживания, принимая количество тест-микроорганизмов, снятых с контрольных тест-объектов, за 100%.
Например: на посевах со 100 кв. см контрольной тест-поверхности обнаружено 148000 КОЕ, а с аналогичного вида опытной тест-поверхности — 20 КОЕ.
148000 — 100%
х = 20 x 100 : 148000 = 2 : 148 = 0,013%
20 — х
Эффективность обеззараживания опытной тест-поверхности составляет: 100,000 — 0,013 = 99,987%.
Критерий эффективности ДС при обеззараживании тест-поверхностей объектов, контаминированных тест-микроорганизмом в споровой форме, равен 100%. При необходимости отработанные в лабораторных условиях режимы обеззараживания подлежат апробации на натурных объектах.
5.8.4.2. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания предметов ухода
за больными и игрушек из различных материалов (кроме мягких)
В исследованиях используют тест-объекты (100 кв. см) и предметы ухода за больными из различных материалов:
— резин на основе натурального и силиконового каучука (медицинская клеенка, грелка, груша);
— стекла (поильник, плевательница, градусник);
— пластмасс (грелка, лоток, наконечник для клизм);
— металлов (таз, стакан для термометра);
— игрушки (кроме мягких) из резин и пластмасс [66].
Тест-объекты, предметы ухода за больными и игрушки из различных материалов тщательно моют водой с мылом и щеткой. Тест-объекты стерилизуют паровым или воздушным методом.
9
Готовят суспензию тест-микроорганизма, содержащую 2,0 x 10 спор/мл, к
которой добавляют 40% лошадиной сыворотки, инактивированной при 56 °C в
течение 30 мин. (к 6 мл суспензии прибавляют 4 мл сыворотки).
С помощью одноканального механического дозатора или стеклянной пипетки на поверхность тест-объекта, предмета ухода за больными, игрушки наносят 0,5 мл суспензии спор тест-микроорганизма. Равномерно ее распределяют по поверхности (100 кв. см) стерильным стеклянным шпателем. Каналы и полости предмета ухода за больными, игрушек заполняют споровой суспензией с помощью шприца; мелкие игрушки полностью погружают в суспензию. Контаминированные тест-объекты, предметы ухода за больными и игрушки подсушивают при комнатной температуре до полного высыхания 60 — 120 мин.
Растворы ДС готовят на питьевой воде при комнатной температуре. Обеззараживание осуществляют способом погружения, протирания, орошения. После подсушивания контаминированные тест-объекты, предметы ухода за больными, игрушки, в т.ч. имеющие каналы и полости, погружают в раствор испытуемого ДС или протирают салфеткой, смоченной им. Мелкие игрушки полностью погружают в емкость с раствором ДС, препятствуя их всплытию; крупные игрушки дезинфицируют способом орошения. Норма расхода ДС способом протирания из расчета 100 — 150 мл/кв. м при однократной обработке и 200 — 300 мл/кв. м при двукратной; способом орошения — 150 мл/кв. м при обработке распылителем типа «Квазар» и 300 мл/кв. м — при обработке распылителем типа «Автомакс» или гидропультом. При необходимости обработку способом протирания или орошения повторяют через 5 — 15 мин.
Для контроля эффективности обеззараживания через определенные промежутки времени после дезинфекции (30 — 60 — 120 мин.) тест-объекты, предметы ухода за больными и игрушки извлекают из раствора, делают смывы стерильной марлевой салфеткой (5 x 5 см), увлажненной нейтрализатором. Салфетки погружают в стерильный раствор нейтрализатора на 5 мин., затем переносят в пробирки (емкости) с бусами и стерильной питьевой водой (10 мл) и встряхивают на шейкере в течение 10 мин. Каналы и полости промывают нейтрализатором (10 мл), который собирают в стерильные пробирки (емкости) и оставляют на 10 мин. для нейтрализации.
Полученную смывную жидкость и смывную жидкость из каналов вносят по 0,1 мл на поверхность питательного агара двух чашек Петри и равномерно распределяют стерильным шпателем по поверхности среды. В контрольных опытах вместо раствора ДС используют стерильную питьевую воду.
Посевы инкубируют в термостате при температуре (37 +/- 1) °C. Предварительные результаты учитывают через 48 ч, а окончательные — через 21 сутки.
Критерием эффективности ДС при обеззараживании тест-объектов, предметов ухода за больными и игрушек из различных материалов (кроме мягких), контаминированных тест-микроорганизмом в споровой форме, является 100%-ная гибель тест-микроорганизмов [23, 74].
5.8.4.3. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания посуды столовой,
лабораторной и из-под выделений
Для определения спороцидной эффективности ДС, предназначенных для обеззараживания посуды, в качестве тест-объектов используют набор столовой и чайной посуды: тарелки, стаканы, кружки из различного материала (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью); столовые приборы: ножи, вилки, ложки из различного материала (нержавеющая сталь, алюминий, пластик); посуду одноразового использования и набор лабораторной посуды, представляющий тест-объекты из стекла и пластмасс: предметные и покровные стекла, пипетки, чашки Петри, планшеты для иммунологического анализа и др.; посуду из-под выделений (мочеприемники, подкладные судна). Перед экспериментом посуду и столовые приборы моют водой с мылом и щеткой, затем высушивают.
В качестве тест-микроорганизмов для контаминации посуды используют наиболее устойчивый к данному ДС вид спор.
На посуду (площадь 100 кв. см) пипеткой наносят 0,5 мл споровой
9
суспензии тест-микроорганизмов, содержащей 2 x 10 спор/мл. Культуру
равномерно распределяют по поверхности посуды стеклянным шпателем. Столовые
приборы погружают в споровую суспензию на 1 — 2 мин., оставляя
неконтаминированными их ручки. Контаминированную посуду подсушивают (до
полного высыхания) при комнатной температуре (60 — 120 мин.) и
относительной влажности воздуха 50 — 60% (при работе с B. anthracis
подсушивают посуду не более 20 мин.).
Для разработки режимов обеззараживания посуды с остатками пищи при контаминации используют суспензию тест-микроорганизмов, смешанную с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-миллиардной взвеси спор). Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя добавляют 1 мл 2-миллиардной взвеси спор), лабораторной посуды — 40% инактивированной сыворотки; посуды из-под выделений — 20%-ную эмульсию кала, предварительно растертого в ступке.
Обработку столовой, чайной, лабораторной посуды, столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18 — 20 °C. При необходимости изучают эффективность растворов ДС при температуре (50 +/- 1) °C.
Дезинфицирующий раствор должен полностью заполнить и с избытком покрыть всю посуду и приборы (из расчета не менее 2 л на 1 комплект). Время обеззараживания посуды от 15 до 240 мин. в зависимости от вида тест-микроорганизма и наличия загрязнения. Через определенные интервалы времени (например, 15, 30, 60 мин. и т.д.) извлекают по одному предмету разных наименований (например, тарелка, стакан, предметное стекло, нож и т.д.) из дезинфицирующего раствора и стерильной марлевой салфеткой (5 x 5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС, тщательно протирают контаминированную часть каждого объекта и погружают в 10 мл этого же нейтрализатора на 5 мин., затем салфетку переносят в пробирку со стерильной питьевой водой и бусами. Время отмыва марлевой салфетки — 10 мин. при постоянном встряхивании. После отмыва марлевую салфетку погружают в питательный бульон. Смывную жидкость по 0,1 мл вносят на поверхность питательного агара в 2 — 3 чашки Петри (по 0,1 мл в каждую и распределяют стерильным шпателем по всей поверхности среды). Посевы помещают в термостат при температуре (37 +/- 1) °C. Учет результатов проводят через 48 ч в течение 21 суток.
Контролем служит аналогично контаминированная посуда, которую погружают не в дезинфицирующий раствор, а в такой же объем стерильной питьевой воды.
Критерием эффективности обеззараживания контаминированной посуды является гибель спор тест-микроорганизмов на посуде не менее 100% [23, 74].
5.8.4.4. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания изделий медицинского
назначения ИМН, включая эндоскопы
5.8.4.4.1. Исследование спороцидной эффективности ДС, предназначенных для обеззараживания ИМН из различных материалов (кроме эндоскопов)
В качестве тест-изделий используют стерильные инструменты и ИМН, в т.ч. однократного применения, из различных материалов (металлов, резин, стекла, пластмасс) или имитирующие их тест-объекты. Перечень инструментов должен включать разнообразные по форме, характеру поверхности и используемому материалу изделия (гладкие изделия простой конфигурации; изделия, имеющие замковые части, каналы и полости, насечки и напыления; изделия извитой формы; изделия, изготовленные из нескольких видов материалов и т.д.) [74].
На рабочую поверхность тест-изделия (у замковых изделий — также в
область замка, а при наличии каналов и полостей — также в канал изделия)
9
наносят 0,1 мл суспензии, содержащей 2 x 10 спор/мл тест-микроорганизма,
содержащей 40% инактивированной лошадиной сыворотки. Мелкие тест-изделия
для контаминации погружают в эту суспензию на 15 мин. Контаминированные
тест-изделия подсушивают в термостате в течение 20 — 25 мин. При испытании
средств, обладающих фиксирующими свойствам, например альдегиды, сыворотку
добавляют в количестве 5%.
Дезинфицирующие растворы готовят на питьевой воде комнатной температуры или подогретой до (50 +/- 1) °C.
После подсушивания контаминированные изделия погружают в раствор испытываемого средства, заполняя им все каналы и полости изделий, избегая образования воздушных пробок. Инструменты, имеющие замковые части, погружают раскрытыми, предварительно сделав ими в растворе ДС несколько рабочих движений для лучшего проникновения раствора в труднодоступные участки изделия в области замка. Толщина слоя раствора средства над изделиями должна быть не менее 1 см. Параллельно контаминированные изделия погружают в воду.
Через определенное время (от 15 до 120 мин.) изделия извлекают из раствора и марлевой салфеткой размером 5 x 5 см, пропитанной нейтрализатором, с поверхности изделия делают смывы, салфетку помещают в пробирку с 10 мл того же нейтрализатора на 5 мин., затем переносят ее в пробирку со стерильной питьевой водой и встряхивают с бусами в течение 5 — 10 мин. Для контроля эффективности обеззараживания делают посев смывной жидкости по 0,1 мл на поверхность соответствующего для тест-микроорганизма агаровой питательной среды, а салфетку помещают в бульон. Канал изделия промывают нейтрализатором, и смывную жидкость засевают по 0,1 мл на плотную питательную среду в чашках Петри. Посевы выдерживают в термостате при температуре (37 +/- 1) °C в течение 21 суток. Учет предварительных результатов проводят через 48 ч и окончательных — через 21 сутки.
Кратность постановки эксперимента должна быть достаточной для получения статистически достоверных результатов.
Эффективным считают режим (концентрация — время — температура); обеспечивающий 100%-ную гибель спор тест-микроорганизмов на всех изделиях. При наличии положительных проб эксперимент повторяют, увеличивая концентрацию или время воздействия [23, 74].
5.8.4.4.2. Исследование спороцидной эффективности ДС, предназначенных для обеззараживания эндоскопов
В качестве тест-объектов используют фрагменты эндоскопа или эндоскоп
(гибкий — гастроскоп, жесткий — цистоскоп). По 0,1 мл суспензии, содержащей
9
1 x 10 спор тест-микроорганизмов, наносят с помощью пипетки на наружную
поверхность и в канал эндоскопа, подсушивают в течение 20 мин. Затем
контаминированное изделие погружают в раствор ДС, заполняя им полости и
каналы эндоскопа. Через определенное время (от 15 до 60 мин.) изделие
извлекают из раствора и делают смыв с наружной поверхности марлевой
салфеткой (5 x 5 см), смоченной в растворе нейтрализатора; салфетку
помещают в пробирку с 10 мл того же стерильного раствора нейтрализатора на
5 мин., а затем переносят ее в пробирку со стерильной питьевой водой и
встряхивают с бусами в течение 5 — 10 мин. Канал изделия промывают
раствором нейтрализатора и смывную жидкость засевают на питательный агар.
Проводят также контроль микробной обсемененности использованных для отмыва
проб раствора нейтрализатора и питьевой воды. Кратность постановки
эксперимента должна быть достаточной для получения статистически
достоверных результатов.
Эффективным считают режим (концентрация — время — температура), обеспечивающий гибель тест-микроорганизма на всех тест-изделиях и отсутствие тест-микроорганизмов в растворе нейтрализатора. При наличии положительных проб эксперимент повторяют, увеличивая время воздействия, но не более чем до 60 мин.
Положительной считается проба, показывающая характерный рост тест-микроорганизма на питательных средах; изменение жидкой питательной среды (помутнение, осадок, хлопья и т.д.) и характерный рост при посеве и пересеве на плотную питательную среду или обнаружение тест-микроорганизма в растворе применявшегося нейтрализатора.
Режим дезинфекции, разработанный на имитаторах канала эндоскопа, проверяют при обеззараживании эндоскопа, контаминированного тест-микроорганизмом. При необходимости эффективность разработанного режима проверяют в практических условиях.
Критерием эффективности ДС (режим применения ДС) при обеззараживании ИМН (включая эндоскопы) является 100%-ная гибель спор тест-микроорганизма [16, 23, 66, 68].
5.8.4.5. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания белья, одежды,
спецодежды и других объектов из ткани
Исследования с ДС проводят в целях оценки эффективности его для обеззараживания белья и других объектов из ткани, чистых и загрязненных кровью или выделениями (фекалии, моча, мокрота) [51, 52].
Оценку эффективности ДС для обеззараживания белья, одежды, спецодежды и
других объектов из ткани осуществляют с помощью стерильных тест-объектов,
представляющих собой кусочки бязи размером 2 x 2 см. Бязь предварительно
готовят и обеззараживают так же, как батист. Контаминируют стерильные
9
тест-объекты суспензией тест-микроорганизмов, содержащей 2 x 10 спор/мл,
из расчета 20 мл на 10 тест-объектов. Через 30 мин. тест-объекты
закладывают в бязевые мешочки размером 5 x 8 см по 2 штамма в каждый,
которые закрывают в виде конверта.
Раствор испытываемого ДС на питьевой воде комнатной температуры или подогретой до (50 +/- 1) °C готовят из расчета 5 л на 1 кг белья. Ветошь, имитирующую белье, поштучно погружают в емкость с раствором испытываемого ДС так, чтобы между слоями ткани не образовывалось воздушных прослоек, препятствующих процессу дезинфекции. Одновременно между слоями белья распределяют (сверху, в середине и внизу) мешочки с контаминированными тест-объектами. Через заданное время мешочки извлекают одновременно из трех слоев. Тест-объекты вынимают из мешочка стерильным пинцетом, помещают на 5 мин. в емкость с раствором соответствующего нейтрализатора, затем переносят в стерильную питьевую воду и высевают в бульон Хоттингера (pH 7,2). Посевы инкубируют при (37 +/- 1) °C в течение 48 ч. Предварительный учет результатов проводят через 48 ч, а окончательный — через 21 сутки. В контрольных опытах белье погружают в стерильную питьевую воду. Мешочки с тестами закладывают так же, как и в опыте. При получении 100%-ной гибели тест-микроорганизма в опытах по обеззараживанию белья без белковых загрязнений переходят к опытам по обеззараживанию белья, загрязненного выделениями.
Для определения эффективности ДС при обеззараживании белья, одежды,
спецодежды и других объектов из ткани, загрязненных кровью, выделениями
(фекалии, мокрота, моча и др.), в лабораторных условиях используют бязевые
тест-объекты, которые контаминируют из расчета 30 мл суспензии на
10 тест-объектов тестовой суспензией спор тест-микроорганизма с добавлением
9
40% инактивированной сыворотки (6 мл суспензии, содержащей 2 x 10 спор
тест-микроорганизма, смешивают с 4 мл инактивированной сыворотки) или 40%
фекальной эмульсии (6 мл суспензии спор тест-микроорганизма смешивают с 4
мл 40% фекальной эмульсии). Для приготовления фекальной эмульсии 8 г
фекалий растирают в ступке с 20 мл воды. Количество суспензии спор
тест-микроорганизма, содержащей сыворотку или фекалии, готовят из расчета
30 мл на 10 тест-объектов. Контаминированные тест-объекты подсушивают в
термостате при (37 +/- 1) °C в течение 20 — 25 мин. или 1,5 — 2,0 ч при
комнатной температуре до полного высыхания. Методика проведения
эксперимента аналогична опытам с чистым бельем.
Критерием эффективности ДС при обеззараживании белья, одежды, спецодежды и других объектов из тканей является 100%-ная гибель спор тест-микроорганизмов на тест-объектах.
При изучении эффективности обеззараживания изделий из синтетических тканей (капрон, ацетат, периацетат, лавсан и др.) используют тест-объекты из этих тканей размером 5 x 5 см, т.к. микроорганизмы не проникают в структуру этих тканей и смываемость их в 2 раза больше, чем с батистовых тест-объектов [23, 74].
5.8.4.5.1. Исследование спороцидной эффективности камерного метода обеззараживания
Камерный метод используют для обеззараживания одежды, обуви, постельных принадлежностей, мягких игрушек и др. [74].
В качестве тест-микроорганизма используют B. cereus в виде суспензии,
9
содержащей 2 x 10 спор/мл, которой контаминируют тест-объекты из батиста,
бязи и других материалов, соответствующих обеззараживаемым объектам.
Контаминированные тест-объекты закладывают в стерильные конверты из
хлопчатобумажной ткани (по 2 тест-объекта в конверт). Пронумерованные
тест-объекты помещают в хлопчатобумажные мешочки с максимальными
термометрами и размещают в толще объектов в контрольные точки камеры на
трех уровнях.
После дезинфекции мешочки извлекают из камеры и записывают показания максимальных термометров, а тест-объекты помещают в пробирки с 5 мл питательного бульона.
Инкубирование посевов с тест-объектами проводят при температуре (37 +/- 1) °C в течение 21 суток при использовании питательного бульона (бульон Хоттингера, СПБ, МПБ). Предварительный учет результатов проводят через 24 — 72 ч, окончательный — через 21 сутки. Для установления эффективности обработки проводят не менее трех экспериментов на каждое время обработки. При наличии роста микроорганизмов проводят сравнение выросшей культуры с тест-микроорганизмом.
В качестве контроля используют контаминированные тест-объекты, которые не помещали в камеру. Контрольные посевы выращивают с использованием тех же питательных сред, что и для опытных тест-образцов. Контрольные посевы и среду контролируют аналогично тест-объектам, которые обрабатывали в камере. Для установления эффективности обработки проводят не менее трех экспериментов на каждое время обработки.
Контролем эффективности режима обеззараживания вещей в испытуемых дезинфекционных камерах является 100%-ная гибель спор тест-микроорганизмов [74].
5.8.4.6. Исследование спороцидной эффективности ДС
при обеззараживании рук в резиновых перчатках
В качестве тест-микроорганизма используют лиофильно-высушенную
сибиреязвенную сухую вакцину СТИ-1. Готовят споровую суспензию путем
внесения в ампулу с сухой вакциной 2 мл стерильной дистиллированной воды.
После растворения сухой вакцины получают суспензию, содержащую 1,0 — 5,0 x
8 3 5 7
10 спор/мл, которую разводят до содержания 10 , 10 и 10 спор/мл [74].
Для устранения посторонней микрофлоры руки, включая запястья и предплечья, испытатели тщательно моют с мылом в теплой проточной воде, затем протирают стерильной марлевой салфеткой и одевают резиновые перчатки.
Поверхность резиновых перчаток, надетых на руки испытателей-добровольцев, контаминируют путем тщательного растирания 1 мл споровой суспензии тремя вышеуказанными разведениями (каждое разведение на одного испытателя). После подсыхания микробной взвеси для контроля исходной обсемененности с поверхности резиновой перчатки тыльной стороны кисти делают смыв стерильной марлевой салфеткой размером 5 x 5 см, смоченной стерильной питьевой водой. Затем салфетку помещают в пробирку с 10 мл стерильной питьевой воды с бусами и встряхивают 10 мин. Полученный смыв высевают по 0,5 мл в селективную жидкую питательную среду 9,5 мл в пробирке.
Для обеззараживания поверхности перчаток в сжатую ладонь руки в печатке испытателю-добровольцу наносят 2,5 мл исследуемого спороцидного ДС.
Затем он в течение 10 — 15 с протирает этой порцией дезинфицирующего раствора поверхность перчаток обеих рук, совершая движения, которые выполняют при обработке кожи рук антисептиком. После этого такую же операцию проводят, нанося 2,5 мл дезинфицирующего раствора на ладонь второй руки и засекают по секундомеру начало экспозиции.
После 5-минутной экспозиции делают смыв марлевой салфеткой (5 x 5 см), смоченной соответствующим ДС нейтрализатором, предварительно проверенным на эффективность нейтрализации и статического действия на споры. Салфетку помещают в пробирку с 10 мл стерильного нейтрализатора на 10 мин. Затем салфетку переносят стерильным пинцетом в пробирку с 10 мл стерильной питьевой воды с бусами, встряхивают пробирку 10 мин. в шейкере. Из полученного смыва делают посев по 0,5 мл на селективные жидкие питательные среды в пробирках не менее 3 пробирок на пробу.
Эффективным считают режим применения ДС, обеспечивающий 100%-ную гибель исследованных спор вакцины СТИ-1 на резиновых перчатках, защищающих кожу рук [74].
5.8.4.7. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания воды
Методы распространяются на изучение спороцидной эффективности химических ДС при обеззараживании питьевой и природной воды, содержащей или подозрительной на содержание возбудителя сибирской язвы [74].
При определении спороцидной эффективности ДС в качестве тест-объектов используют водопроводную дехлорированную, колодезную, речную и другие воды. Водопроводную воду дехлорируют нагреванием до температуры (50 — 60 °C) с последующим выдерживанием в течение одних суток при комнатной температуре. Определяют физико-химические свойства питьевой дехлорированной воды и образцов природных вод. Кроме того, в последних определяют микробиологические показатели (общее микробное число и общее количество колиформных бактерий).
В качестве тест-микроорганизмов для контаминации исследуемых проб воды используют споровую культуру B. cereus (штамм 96) или сибиреязвенную живую сухую вакцину СТИ-1 для людей. Вирулентную культуру возбудителя сибирской язвы в этих целях использовать не разрешается из-за сложности соблюдения противоэпидемических мероприятий.
Контаминацию изучаемых образцов воды проводят путем внесения споровой
8
культуры B. cereus (штамм 96) в виде суспензии, содержащей 10 спор/мл, а
сибиреязвенную живую сухую вакцину СТИ-1 — в виде суспензии, приготовленной
разбавлением содержимого одной ампулы вакцины в 10 мл стерильного
физиологического раствора или стерильной водопроводной воды до содержания
8 9
10 — 10 спор/мл.
При постановке экспериментов исходную воду наливают в емкости с нижним
тубусом объемом 5 — 10 л и вносят в воду вышеуказанные тест-микроорганизмы
5 6
из расчета 10 — 10 спор/л. После тщательного перемешивания определяют
концентрацию исходной контаминации воды. Для этого из емкостей отбирают 1 —
3 пробы воды объемом 3 — 5 мл. Из каждой пробы делают по 3 — 4
последовательных десятикратных разведения стерильным физиологическим
раствором или стерильной питьевой водой, в которых затем определяют
количество тест-микроорганизма в 1 мл пробы воды методом мембранной
фильтрации.
Метод основан на концентрировании микроорганизмов из определенного объема анализируемой воды путем фильтрования через мембранные фильтры, выращивании посевов при температуре (37 +/- 1) °C на плотной питательной среде и подсчете количества тест-микроорганизмов в единице объема воды.
Используют мембранные фильтры для микробиологических целей с диаметром пор не более 0,45 мкм и размером диска 35 или 47 мм или другие фильтрующие мембраны с аналогичной способностью фильтрации, имеющие сертификат качества. Мембранные фильтры готовят к анализу в соответствии с указаниями производителя.
Фильтрование воды проводят с помощью прибора для мембранной фильтрации. Стакан (воронку) и столик прибора перед анализом воды завертывают в бумагу и стерилизуют в паровом или воздушном стерилизаторе. На нижнюю часть прибора (столик) кладут фламбированным пинцетом стерильный мембранный фильтр; прижимают его верхней частью прибора (стаканом, воронкой); закрепляют устройством, предусмотренным конструкцией прибора; при соблюдении правил стерильности наливают необходимый объем исследуемой воды и создают вакуум в приемном сосуде.
Фильтруют вначале меньшие, а затем большие количества воды через один фильтровальный прибор, каждый раз сменяя мембранный фильтр.
После окончания фильтрования определенного количества воды стакан воронку снимают, а фильтр осторожно приподнимают за край фламбированным пинцетом при сохранении вакуума для удаления излишней влаги на нижней стороне фильтра, а затем переносят его, не переворачивая, на поверхность казеинового или мясо-пептонного агара в чашках Петри, так чтобы между средой и фильтром не было пузырьков воздуха. Под каждым фильтром на обратной стороне дна чашки Петри делают надпись с указанием объема профильтрованной воды, даты посева и номера пробы. Посевы инкубируют при температуре (37 +/- 1) °C в течение 24 — 48 ч.
По окончании инкубации учитывают количество колоний тест-микроорганизма, выросших на фильтрах, и определяют их концентрацию в 1 л воды по формуле:
k
C = — x N x 100,
v
где:
C — количество спор, содержавшихся в 1 л воды;
k — кратность разведения;
v — посеянный объем воды в мл;
N — среднее арифметическое числа колоний, выросших на мембранных фильтрах при посеве одинаковых разведений.
Результат анализа при определении числа спор в исходной воде выражается числом КОЕ в 1 л воды.
Для определения эффективности обеззараживания спороцидным ДС в емкость с водой, контаминированной спорами тест-микроорганизмов, вносят ДС в изучаемых концентрациях, воду тщательно перемешивают. Через заданные промежутки времени при соблюдении условий стерильности отбирают пробы воды объемом 1 л в стерильные флаконы с внесенным в них стерильным нейтрализатором, подобранным в концентрации, обеспечивающей нейтрализацию действующего агента изучаемого ДС.
В обеззараженной воде определяют число непогибших спор B. cereus или сибиреязвенной живой вакцины СТИ-1 для людей методом мембранной фильтрации. Пробы обеззараженной воды с нейтрализатором должны быть исследованы не позднее чем через 1 ч после их отбора.
На начальных этапах изучения эффективности обеззараживания воды анализируют не менее двух проб, отличающихся по объему в 10 раз, и выбранных так, чтобы на одном фильтре выросло не более 300 колоний. На одну чашку Петри можно поместить 3 — 4 фильтра с условием, чтобы они не соприкасались друг с другом. При анализе обеззараженной воды на конечных этапах обеззараживания необходимо исследовать объем не менее 1 л, профильтровывая это количество не менее чем через 3 — 4 мембранных фильтра.
Посевы инкубируют, как указано выше. Учитывают общее количество выросших колоний на фильтрах после фильтрования 1 л воды. Результат анализа выражают числом спор в 1 л обеззараженной воды.
Статистическая обработка результатов микробиологических анализов по оценке эффективности средств обеззараживания воды имеет целью исключить случайные ошибки, оценить отклонения результатов анализа от действительной величины и дать искомые результаты с заданной вероятностью.
В процессе статистической обработки результатов экспериментальных
исследований рекомендуется использовать при определении концентрации
контаминации исходной воды тест-микроорганизмами и на промежуточных этапах
_
обработки среднюю арифметическую (x), а при оценке эффективности
обеззараживания на завершающем этапе — медианное значение Me.
Количество проб n, необходимое для действительной оценки результатов
микробиологических исследований, определяют по формуле:
сигма x t
p 2
n = (———-) ,
I
p
где:
сигма — квадратичное отклонение;
I — максимально допустимое отклонение от средней, оцениваемое с
p
вероятностью p = 0,99;
t — коэффициент, зависящий от числа опытов (не менее 10), по которым
p
определяется величина сигма.
Если сигма определяется по данным 16 опытов, то t = 2,7. Число проб
0,99
для оценки содержания микроорганизмов в обеззараженной воде должно быть не
менее 16.
Оценку результатов микробиологических анализов проводят для заданной
вероятности 0,99, соответственно, для того же значения определяют и
доверительный интервал средней арифметической и медианы.
Доверительный интервал средней арифметической определяют по данным
величины квадратичного отклонения сигма и средней ошибки сигма .
x
Величину квадратичного отклонения вычисляют по формуле:
_2
SUM x — x
сигма = ———-,
n — 1
где:
_2
SUM x — x — сумма квадратов отклонений измерений от средней
арифметической;
n — число отдельных измерений.
Среднюю ошибку вычисляет по формуле:
сигма
сигма = ——.
x _
/n
Вероятности 0,99 отвечает доверительный интервал I, вычисляемый по
формуле: I +/- 2,7 сигма .
0,99 x
Тогда доверительное значение количества микроорганизмов в пробе с
_
вероятностью 0,99 находится в интервале х +/- 2,7 сигма .
x
Доверительный интервал медианы для требуемого уровня вероятности 0,99 определяют в зависимости от числа проведенных опытов по табл. 5.11, в которой указаны номера опытов, результаты которых учитывают в качестве граничных значений доверительного интервала медианы.
Таблица 5.11
ГРАНИЧНЫЕ ЗНАЧЕНИЯ ДОВЕРИТЕЛЬНОГО ИНТЕРВАЛА МЕДИАНЫ
|
Число опытов |
Нижняя граница |
Верхняя граница |
|
7 |
— |
— |
|
8 |
1 |
8 |
|
9 |
1 |
9 |
|
10 |
1 |
10 |
|
11 |
1 |
11 |
|
12 |
2 |
11 |
|
13 |
2 |
12 |
|
14 |
2 |
13 |
|
15 |
3 |
13 |
|
16 |
3 |
14 |
|
17 |
3 |
15 |
|
18 |
4 |
15 |
|
19 |
4 |
16 |
|
20 |
4 |
17 |
|
21 |
5 |
17 |
|
22 |
5 |
18 |
|
23 |
5 |
19 |
|
24 |
6 |
19 |
|
25 |
6 |
20 |
|
26 |
7 |
20 |
|
27 |
7 |
21 |
|
28 |
7 |
22 |
|
29 |
8 |
22 |
|
30 |
8 |
23 |
|
31 |
8 |
24 |
|
32 |
9 |
24 |
|
33 |
9 |
25 |
|
34 |
10 |
25 |
|
35 |
10 |
26 |
|
36 |
10 |
27 |
|
37 |
11 |
27 |
|
38 |
11 |
28 |
|
39 |
12 |
28 |
|
40 |
12 |
29 |
|
41 |
12 |
30 |
|
42 |
13 |
30 |
|
43 |
13 |
31 |
|
44 |
14 |
31 |
|
45 |
14 |
32 |
|
46 |
14 |
33 |
|
47 |
15 |
33 |
|
48 |
15 |
34 |
|
49 |
16 |
34 |
|
50 |
16 |
35 |
Для пользования таблицей необходимо, чтобы результаты опытов были расположены и пронумерованы в порядке возрастания величин.
Критерием оценки эффективности ДС при обеззараживании воды является отсутствие тест-микроорганизмов в 1 л воды [23, 74].
5.8.4.8. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания выделений
(моча, фекалии, мокрота, кровь)
Обеззараживание мочи. В качестве тест-объекта используют мочу, которую
разливают в колбы или пробирки по 8 мл, добавляют по 1 мл споровой
9
суспензии, содержащей 2 x 10 спор/мл тест-микроорганизма и
инактивированной лошадиной сыворотки [74].
Растворы испытываемого ДС готовят в концентрациях, обеспечивающих спороцидную активность при испытании его на батистовых тест-объектах с белковой защитой.
Испытуемые концентрации растворов ДС добавляют к моче в равном или двойном объеме. Отмечают время контакта и через интервалы 15, 30, 60 мин. пипеткой берут указанную смесь в количестве 1 мл и переносят в пробирки с 5 мл питательной среды (бульон Хоттингера, pH 7,2) и соответствующего нейтрализатора. После тщательного смешивания 1 мл жидкости из первой пробирки с бульоном переносят во вторую пробирку с бульоном (5 мл) и затем засевают по 0,1 мл на агар Хоттингера (pH 7,2) в чашках Петри как из первой, так и из второй пробирки. Чашки Петри инкубируют в термостате при (37 +/- 1) °C.
Контролем служат аналогично поставленные опыты, только с добавлением к моче не дезинфицирующего раствора, а воды.
Ориентировочный учет результатов проводят через 1 сутки, предварительный — через 5 — 7 суток, окончательный — 21 сутки. Результаты опытов учитывают по отношению к контролю, который принимают за 100%. Окончательное заключение об эффективности ДС делают на основании не менее трех опытов с совпадающими результатами.
Эффективным считают средство и режим его применения, обеспечивающие 100%-ную гибель спор тест-микроорганизмов.
Обеззараживание фекалий. При разработке режимов обеззараживания фекалий учитывают соотношение дезинфицирующего средства к обеззараживаемой массе, время обработки, температуру, консистенцию обеззараживаемых выделений, степень гомогенизации в процессе обеззараживания.
Исследования проводят в два этапа. На первом этапе в качестве тест-объекта используют 20%-ную эмульсию фекалий, на втором — оформленные фекалии.
Для приготовления 20% эмульсии 20 г фекалий растирают в ступке и
добавляют 80 мл воды; полученную эмульсию фильтруют через двойной слой
марли, стерилизуют в автоклаве, разливают пипеткой в пробирки по 9 мл
и добавляют по 1 мл суспензии тест-микроорганизма, содержащей
9
2 x 10 спор/мл. Опыты начинают с концентрации, вызывающей гибель
тест-микроорганизма в моче с белком через 30 мин. Приготовленную эмульсию
фекалий заливают равным или двойным объемом дезинфицирующего раствора,
через 30, 60, 120 мин. отбирают пробы и производят высевы так же, как и при
обеззараживании мочи. Результаты учитывают через 48 ч.
При положительных результатах проводят опыты с большим количеством оформленных фекалий (200 — 250 г). Для этого помещают их в сосуд, заливают дезинфицирующим раствором или засыпают сухими дезинфектантами в равном или двойном количестве по отношению к весу фекалий, определяют визуально, происходит ли гомогенизация фекалий. Затем небольшую часть каловых масс размешивают стеклянной палочкой с жидкостью, а остальную массу оставляют в виде небольших комочков. Через определенные промежутки времени (например, 30, 60 мин.) проводят посев.
Посев жидкой части фекалий высевают так же, как и мочу. Плотные же части (комочки) забирают бактериологической петлей и помещают в 5 мл питательной среды с соответствующим нейтрализатором, растерев их о края пробирки и тщательно перемешав. Затем стерильной пипеткой переносят из этой пробирки 1 мл смеси во вторую пробирку, тоже содержащую бульон Хоттингера (pH 7,2). Как из первой, так и из второй пробирки производят посев на агар Хоттингера в чашках Петри (не менее чем в три чашки по 0,1 мл). Окончательный результат учитывают через 7 суток, а предварительный — через 24 ч.
Контролем служат аналогично поставленные опыты с добавлением вместо дезинфицирующего раствора воды. Результаты опытов учитывают по отношению к контролю, который принимают за 100%. Судят об эффективности исследуемого вещества на основании не менее трех опытов с совпадающими результатами. Эффективным считают средство и режим его применения, обеспечивающие 100%-ную гибель спор тест-микроорганизмов в обеззараживаемом материале.
Обеззараживание крови и мокроты. В качестве тест-объектов при оценке
спороцидной эффективности ДС, предназначенных для обеззараживания крови,
используют кровь, а мокроты — куриный белок. В качестве тест-микроорганизма
используют споры B. cereus (штамм 96). Для контаминации тест-объектов
тест-микроорганизмом к 9 мл 40% крови или 50% куриного белка добавляют по
9
1 мл суспензии тест-микроорганизма, содержащей 2 x 10 спор/мл,
перемешивают и разливают по 1 мл в стерильные флаконы. Затем во флаконы
засыпают или наливают исследуемое ДС в объемных (5%, 10% и т.д.)
соотношениях к объему исследуемого материала. Через определенные промежутки
времени (1, 3 ч и т.д.) с помощью стерильной бактериологической петли
производят отбор пробы смеси и переносят ее в 5 мл селективной жидкой
питательной среды с соответствующим (заранее проверенным по эффективности
нейтрализации ДС) нейтрализатором для нейтрализации остаточного действия ДС
на споры тест-микроорганизма. По истечении 5 мин. экспозиции из этой
пробирки с помощью пипетки производят высев по 0,2 мл исследуемой пробы на
агар Хоттингера (pH 7,2) в чашках Петри. Пробирки и чашки с посевами
инкубируют при (37 +/- 1) °C.
Окончательный результат роста тест-микроорганизмов на чашках учитывают на 3 — 7 суток, а предварительный — через 24 ч, а в пробирках соответственно через 21 сутки и 24 — 48 ч.
Эффективным считают средство, обеспечивающее 100%-ную гибель спор тест-микроорганизма в обеззараживаемом материале [23, 74].
5.8.4.9. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания
медицинских отходов [74]
При изучении спороцидной активности ДС с целью разработки режимов
обеззараживания медицинских отходов используют тест-объекты из резин,
пластмасс, текстильных материалов, стекла, металлов. Для приготовления
тест-объектов стерильные одноразовые изделия медицинского назначения
(бинты, ватные тампоны, фрагменты систем для переливания крови и
лекарственных препаратов, катетеры, шпатели, шприцы, иглы, перчатки,
одноразовое белье, салфетки, гашетки, трубки и пр.) измельчают и погружают
9
в суспензию, содержащую 2 x 10 спор/мл B. cereus с 40% инактивированной
лошадиной сывороткой или сывороткой крупного рогатого скота. После
достаточного пропитывания тест-объекты извлекают в сухую стерильную емкость
и подсушивают в термостате в течение 20 мин. или при комнатной температуре
при 18 — 20 °C и относительной влажности воздуха 50 — 60% в течение 1 ч.
Контаминированные тест-объекты погружают в емкость с испытуемым дезинфицирующим раствором, так чтобы он полностью закрывал их. Контроль эффективности обеззараживания тест-объектов проводят через каждые 15 — 30 мин. в течение времени от 30 до 360 мин. Для этого тест-объекты из различных материалов (по два каждого наименования) извлекают из дезинфицирующего раствора, промывают в растворе соответствующего нейтрализатора и помещают в пробирки с жидкой питательной средой. Контрольные тест-объекты погружают на срок максимальной экспозиции в стерильную водопроводную воду, а затем в жидкую питательную среду. Пробирки с посевами помещают в термостат при температуре (37 +/- 1) °C. Учет результатов проводят в течение 21 суток.
Критерий эффективности обеззараживания медицинских отходов — 100% гибель спор тест-микроорганизма на тест-объектах, обработанных ДС.
5.8.5. Методы исследования и оценки спороцидной активности
ДС при использовании в качестве тест-микроорганизмов
вирулентных штаммов B. anthracis [74]
При использовании в качестве тест-микроорганизмов спор непатогенных штаммов (B. cereus, B. subtilis, сибиреязвенная живая сухая вакцина СТИ-1 и др.) спороцидную активность ДС определяют только культуральным методом, а при использовании вирулентных тест-микроорганизмов B. anthracis — одновременно культуральным и биологическим. При культуральном методе результаты исследований оценивают по росту тест-микроорганизмов на питательных средах до и после действия ДС, а при биологическом — по гибели белых мышей от возбудителя сибирской язвы.
Трудность соблюдения противоэпидемических мероприятий при использовании вирулентных штаммов B. anthracis не позволяет использовать его для определения эффективности обеззараживания многих объектов (воды, воздуха, камерного метода обеззараживания вещей и др.), поэтому для изучения спороцидной активности и эффективности ДС при обеззараживании всех объектов, являющихся факторами передачи возбудителя сибирской язвы, рекомендуется использовать непатогенные тест-микроорганизмы.
После установления спороцидной активности ДС культуральным методом, применяя вышеуказанные непатогенные тест-микроорганизмы, целесообразно проводить исследования культуральным и биологическим методами, используя B. anthracis, т.к. биологический метод позволяет отличить спороцидное действие ДС от споростатического при отсутствии полной нейтрализации действующего вещества ДС химическими нейтрализаторами.
Спороцидная эффективность ДС с использованием спор вирулентных штаммов B. anthracis может быть изучена на следующих контаминированных тест-объектах: поверхности помещений, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств; изделия медицинского назначения; предметы ухода за больными; посуда, включая столовую, лабораторную и из-под выделений; белье, спецодежда и другие объекты из тканей; изделия из резины, в т.ч. перчатки, сапоги, фартуки и др.; выделения (фекалии, моча), медицинские отходы. Эти исследования проводят при строгом соблюдении всех правил безопасности, предусмотренных СП 1.3.1285-03 «Безопасность работы с микроорганизмами I и II группы патогенности опасности» в специализированных лабораториях, имеющих разрешения на работу с вирулентными штаммами возбудителя сибирской язвы, соответствующее оборудование и подготовленный персонал.
Методика изучения спороцидной активности ДС при работе с B. anthracis.
В качестве тест-микроорганизмов используют вирулентные штаммы B. anthracis
+ +
(штаммы 81/1 и 27, имеющие плазмиды pX01 и pX02 ), единичные клетки
которых при внутрибрюшинном введении вызывают гибель биопробных животных.
Характеристика этих штаммов, требования по устойчивости, питательные среды
для культивирования приведены в п. 5.8.1 и Прилож. 1 и 2.
Методы получения суспензии спор вирулентных штаммов B. anthracis, обеспечение стандартных условий проведения исследований спороцидной активности ДС и их субстанций, исследования спороцидной активности и эффективности при разработке режимов применения ДС для обеззараживания объектов внешней среды, контаминированных тест-микроорганизмами в споровой форме, изложены в п. 5.8.1.
При контроле спороцидного действия ДС на споры вирулентных штаммов B. anthracis действующее вещество необходимо сразу после окончания экспозиции нейтрализовать соответствующим нейтрализатором с последующим высевом на твердые и/или жидкие питательные среды как изложено в предыдущих разделах.
Одновременно часть пробы исследуют при постановке биопробы, используя белых мышей весом 10 — 12 г в количестве 6 штук на постановку одной биопробы. Подготовленную и использованную пробу вводят внутрибрюшинно белым мышам в объеме 0,2 мл каждой. Параллельно проводят контрольные заражения животных раствором нейтрализатора (контроль отсутствия губительного действия нейтрализатора на белых мышей) и суспензией интактных (не подвергшихся воздействию ДС) спор вирулентных штаммов B. anthracis в заражающих дозах (контроль вирулентного действия использованной суспензии спор возбудителя). Количество животных в контрольных группах должно быть не менее 3.
Наблюдения за животными проводят в течение 48 — 96 ч; павших и выживших мышей вскрывают, делают посев из органов животных на агар Хоттингера (pH 7,0) для выделения возбудителя сибирской язвы.
Посевы подготовленных проб из органов животных инкубируют при температуре (37 +/- 1) °C в течение 48 — 96 ч. Идентифицируют и подсчитывают выросшие колонии B. anthracis.
Эффективным считается ДС, после воздействия которого в установленных режимах не обнаружены жизнеспособные клетки вирулентных тест-микроорганизмов B. anthracis при исследовании культуральным методом и нет павших животных в опытной группе, а в контрольных пробах — высев из органов животных патогенного тест-микроорганизма (B. anthracis).
5.8.6. Методы исследования и оценки
спороцидной эффективности СС, предназначенных
для стерилизации ИМН, включая эндоскопы
5.8.6.1. Исследование спороцидной эффективности
водяного насыщенного пара под избыточным давлением,
предназначенного для стерилизации ИМН [74]
Метод предназначен для исследования эффективности стерилизации ИМН водяным насыщенным паром под избыточным давлением, в т.ч. при испытаниях новых паровых стерилизаторов. Исследование проводят в паровых стерилизаторах при загруженной стерилизационной камере.
Для контроля эффективности стерилизации ИМН водяным насыщенным паром под избыточным давлением используют тест-объекты и тест-изделия, контаминированные суспензией спор тест-микроорганизма G. stearothermophilius, а также биологические индикаторы, разрешенные к применению в установленном порядке при паровом методе стерилизации в Российской Федерации.
В качестве тест-объектов применяют тест-образцы (0,5 x 1,0 см), нарезанные из резин, латекса, бязи, перевязочных материалов и др. Подготовленные тест-объекты стерилизуют паровым или воздушным методом (тест-объекты из резин, латекса, бязи, перевязочных материалов раскладывают в чашки Петри).
Из исходной суспензии спор G. stearothermophilius готовят суспензию,
7 8
содержащую от 5,0 x 10 до 2,5 x 10 спор в 1 мл для контаминации
тест-объектов. Стерильные тест-объекты контаминируют этой суспензией из
6
расчета (1,0 — 5,0) x 10 спор в объект путем нанесения на каждый
тест-объект с помощью дозатора переменного объема 0,02 мл подготовленной
суспензии. Контаминированные тест-объекты высушивают в термостате при
температуре (37 +/- 1) °C в течение 24 ч и закладывают в бумажные и
комбинированные (полимерная пленка + бумага) пакеты, разрешенные к
применению в качестве стерилизационных упаковочных материалов для парового
метода стерилизации в Российской Федерации.
В качестве тест-изделий используют ИМН из коррозионностойких металлов
(хирургические, стоматологические, гинекологические инструменты —
корнцанги, зажимы, щипцы, пинцеты), стекла (пробирки, микропипетки), резин
(катетеры, зонды, трубки), пластмасс (наконечники, лотки), которые
предварительно стерилизуют паровым методом, а затем контаминируют исходной
суспензией спор тест-микроорганизма G. stearothermophilius (плотность
6
контаминации 10 спор на тест-изделие) и упаковывают в бумажные пакеты или
листовые материалы, или бязь — при размещении изделий в коробках
стерилизационных; в комбинированные пакеты — при размещении изделий в
корзинах загрузочных.
Упаковки с контаминированными тест-объектами/тест-изделиями, а также биологическими индикаторами нумеруют и размещают вместе с максимальными термометрами в контрольные точки стерилизационной камеры вне коробок стерилизационных/корзин загрузочных у двери и задней стенки и в коробки стерилизационные/корзины загрузочные между изделиями.
Тест-объекты размещают между изделиями, применяемыми в качестве имитаторов загрузки, а также в изделиях — перчатках, халатах; тест-изделия — между изделиями, использующимися в качестве имитаторов загрузки.
Плотность загрузки коробок стерилизационных изделиями из резин и текстиля должна соответствовать нормам, приведенным в «Методических указаниях по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения» (МУ N 287-113 от 30.12.1998). Указанные изделия, а также изделия из металлов и стекла в коробках стерилизационных и корзинах загрузочных распределяют равномерно; пакеты заполняют изделиями не более чем на 3/4 объема.
Стерилизатор включают и после его выхода на режим (достижение номинального значения давления/температуры стерилизации) начинают отсчет времени выдержки. По окончании времени выдержки тест-объекты и тест-изделия вынимают из стерилизатора.
Тест-объекты из резин, латекса, бязи, перевязочных материалов пинцетом, который обжигают в пламени, помещают в бактериологические пробирки с 5 мл питательного бульона (бульон Хоттингера, МПБ, СПБ).
Для контроля стерильности крупных тест-изделий, подвергнутых обработке в стерилизаторе, осуществляют посев в питательный бульон марлевых салфеток (размер 5 x 5 см), с помощью которых производят отбор проб с изделий методом смыва. Салфетки предварительно увлажняют стерильным физиологическим раствором (0,9%-ный раствор натрия хлорида). У изделий, имеющих каналы, через последние пропускают физиологический раствор, после чего его засевают в питательный бульон.
Инкубирование посевов проводят при температуре (55 +/- 1) °C в течение 7 суток при использовании питательного бульона (бульон Хоттингера, СПБ, МПБ).
При наличии роста микроорганизмов производят сравнение выделенной культуры с тест-микроорганизмом.
В качестве средств контроля используют тест-объекты и тест-изделия, которые не подвергают обработке в стерилизаторе. Посевы контрольных тест-объектов и тест-изделий или смывы с них в питательную среду, а также инкубирование посевов осуществляют аналогично тест-объектам/тест-изделиям, которые подвергали обработке в стерилизаторе.
Аналогичную методологию исследования применяют и при отработке эффективных режимов стерилизации ИМН во вновь разрабатываемых паровых стерилизаторах. Для этого эксперименты проводят при различном времени выдержки и размещении тест-объектов/тест-изделий и максимальных термометров в различных точках стерилизационной камеры. Для установления эффективности обработки проводят не менее трех экспериментов на каждый режим, каждое время обработки.
Критерием эффективности водяного насыщенного пара под избыточным давлением для стерилизации ИМН является 100%-ная гибель спор G. stearothermophilius на тест-объектах и тест-изделиях из различных материалов, обработанных в исследуемом аппарате [23, 74].
5.8.6.2. Исследование спороцидной эффективности сухого
горячего воздуха, предназначенного для стерилизации ИМН
Метод предназначен для исследования эффективности стерилизации ИМН сухим горячим воздухом, в т.ч. при испытаниях новых воздушных стерилизаторов.
Исследование проводят в воздушных стерилизаторах при загруженной стерилизационной камере.
Для контроля эффективности стерилизации ИМН сухим горячим воздухом в качестве тест-изделий используют пробирки типа П2-21-200, ГОСТ 25336-82 (для стерилизаторов объемом стерилизационной камеры до 20 куб. дм включительно), и чашки биологические Петри с крышками низкие ЧБН-1-100 по ГОСТ 25336-82 (для стерилизаторов объемом стерилизационной камеры 40 куб. дм и более). Предварительно их стерилизуют паровым или воздушным методом и контаминируют суспензией спор тест-микроорганизма B. licheniformis. Кроме этого, используют биологические индикаторы, разрешенные к применению в установленном порядке, при воздушном методе стерилизации в Российской Федерации.
Из исходной суспензии спор B. licheniformis готовят суспензию,
8 9
содержащую от 10 до 10 спор в 1 мл для контаминации тест-изделий из
6
расчета 10 спор в/на тест-изделие, что достигается нанесением в/на каждое
тест-изделие с помощью дозатора переменного объема 0,02 мл подготовленной
суспензии.
Контаминированные тест-изделия высушивают в термостате при температуре (37 +/- 1) °C в течение 24 ч, затем их и имитаторы загрузки (пробирки и чашки Петри) упаковывают в листовую бумагу, в бумажные или полимерные пакеты, разрешенные к применению в качестве стерилизационных упаковочных материалов для воздушного метода стерилизации в Российской Федерации (пробирки по 1 штамму, чашки Петри по 2 штамма в упаковке).
Упаковки с тест-изделиями, а также биологические индикаторы нумеруют и размещают на загрузочные полки в места размещения датчиков температуры (не менее 5 точек). Имитаторы загрузки равномерно размещают на загрузочные полки стерилизатора. Количество имитаторов загрузки, в т.ч. тест-изделий, в зависимости от объема стерилизационной камеры составляет: 20 куб. дм — 40 пробирок; 40 куб. дм — 40 чашек Петри; 80 куб. дм — 80 чашек Петри; 160 куб. дм — 160 чашек Петри; 320 куб. дм — 320 чашек Петри; 640 куб. дм — 640 чашек Петри.
Стерилизатор включают и после достижения номинального значения температуры стерилизации начинают отсчет времени стерилизационной выдержки. По окончании времени стерилизационной выдержки тест-изделия и биологические индикаторы вынимают из стерилизатора. Пробирки заливают питательным бульоном (бульон Хоттингера, МПБ, СПБ); чашки Петри — питательным агаром (агар Хоттингера, МПА, СПА).
Инкубирование тест-изделий проводят при температуре (37 +/- 1) °C в течение 21 суток при использовании питательного бульона (бульон Хоттингера, МПБ, СПБ); чашки Петри инкубируют в течение 7 суток. Учет результатов проводят путем визуального осмотра.
Отсутствие помутнения питательного бульона, роста микроорганизмов на чашке Петри указывает на гибель спор в/на тест-изделиях. При наличии роста микроорганизмов проводят сравнение выделенной культуры с тест-микроорганизмом.
В качестве средств контроля используют тест-изделия, которые не подвергают обработке в стерилизаторе. Посевы контрольных тест-изделий или смывы с них в питательную среду, а также инкубирование посевов осуществляют аналогично тест-изделиям, которые подвергали обработке в стерилизаторе.
Аналогичную методологию исследования применяют при отработке эффективных режимов стерилизации ИМН в стерилизаторах разных марок, в т.ч. во вновь разрабатываемых стерилизаторах. Для этого эксперименты проводят при различном времени выдержки и размещении тест-объектов и тест-изделий, датчиков температуры в различных точках стерилизационной камеры. Для установления эффективности обработки проводят не менее трех экспериментов на каждое время обработки.
Критерием эффективности сухого горячего воздуха для стерилизации ИМН, является 100%-ная гибель спор B. licheniformis на обработанных в исследуемом аппарате тест-объектах и тест-изделиях из различных материалов.
5.8.6.3. Исследования спороцидной эффективности растворов
химических СС, предназначенных для стерилизации ИМН
При исследовании и оценке спороцидной эффективности растворов стерилизующих средств, предназначенных для стерилизации ИМН, используют B. cereus штамм 96 и B. subtilis штамм 7 с определенной устойчивостью, табл. 5.8.
Культивирование спорообразующих тест-микроорганизмов, устойчивых к действующему веществу, входящему в состав изучаемого СС, приготовление суспензии спор (п. 5.8.1). В качестве тест-носителей используют простерилизованные тест-образцы из различных материалов (пластмасс, резин на основе натурального и силиконового каучука, стекла, металлов), имитирующие ИМН, а также сами ИМН (катетеры, боры и зеркала стоматологические, зажимы, эндоскопы). Для контаминации тест-носителей используют споры тест-микроорганизма, обладающего наибольшей устойчивостью к раствору данного химического агента [66, 74].
При испытании раствора средства на основе ранее не изучавшегося для этой цели действующего вещества подбирают устойчивый спорообразующий микроорганизм, споры которого могут быть использованы в качестве тест-микроорганизма п. 5.8.3.
С целью контаминации тест-изделий на них капельным способом наносят
6
суспензию спор тест-микроорганизма (из расчета 10 спор на тест-изделие).
Тест-микроорганизмы должны быть нанесены на наиболее сложные по конструкции
и труднодоступные участки тест-изделий: в каналы, рабочие и замковые части.
После этого тест-изделия подсушивают в течение 60 мин. при температуре
(37 +/- 1) °C.
При проведении экспериментов изделия погружают в рабочие растворы таким образом, чтобы раствор полностью покрыл изделия (толщина слоя раствора над поверхностью изделий должна быть не менее 1 см) и заполнил все полости и каналы без воздушных пробок. Инструментами, имеющими замковые части, необходимо сделать несколько рабочих движений для лучшего проникновения раствора средства в области замка. При исследованиях используют растворы, имеющие комнатную температуру 18 — 20 °C. При испытании растворов альдегидсодержащих средств температура раствора должна составлять 20 — 22 °C. В случае необходимости (для повышения активности растворов) готовят рабочие растворы умеренно-повышенной температуры (50 +/- 1) °C. Одновременно не менее чем по два тест-объекта помещают в воду, а также в раствор нейтрализатора на время, соответствующее максимальному исследуемому времени выдержки в изучаемом растворе средства.
Изучение эффективности средства и его рабочих растворов в зависимости от сроков хранения, а также (при необходимости) изучение эффективности рабочих растворов при многократном их использовании осуществляют аналогично указанному выше, применяя растворы средства с различными сроками хранения и кратностью использования для стерилизации.
При работе с тест-объектами и изделиями небольшого размера боры через определенные интервалы времени (в зависимости от состава средства) изделия извлекают из раствора исследуемого средства и последовательно осуществляют отмыв в растворе нейтрализатора и стерилизованной питьевой воде (по 5 мин.) с последующим прямым посевом на жидкие питательные среды с 0,5% глюкозы.
При работе с крупными изделиями для контроля стерильности подвергнутых обработке средством изделий осуществляют посев марлевых салфеток (размер 5 x 5 см), с помощью которых производят отбор проб с изделий методом смыва. Салфетки предварительно увлажняют раствором соответствующего нейтрализатора. При отмыве изделий, имеющих каналы, через последние пропускают раствор нейтрализатора. Если нейтрализатор для изучаемого средства неизвестен, целесообразно использовать универсальный нейтрализатор, проверенный на эффективность. Посевы выдерживают в термостате при температуре (37 +/- 1) °C в течение 14 суток.
Критерием эффективности является достижение 100%-ной гибели спор тест-микроорганизма на всех тест-изделиях. При этом время действия раствора должно составлять не более 16 ч при температуре 18 — 20 °C и не более 3 ч при умеренно повышенной температуре (50 °C) [23, 74].
5.8.7. Исследование и оценка спороцидной
эффективности СС, предназначенных для исследования
эффективности ДВУ эндоскопов
Средства, предназначенные для ДВУ эндоскопов, должны обеспечивать гибель на эндоскопах споровых форм микроорганизмов.
При изучении в качестве тест-объектов используют простерилизованные фрагменты канала гибкого эндоскопа в виде пластмассовых трубок длиной 20 мм и внутренним диаметром 2 мм. Перед проведением эксперимента тест-объекты подвергают очистке одним из средств, разрешенных для предстерилизационной очистки эндоскопов, а затем стерилизуют физическим паровым или химическим методом, рекомендованным для стерилизации гибких эндоскопов [16, 23, 66, 74].
Простерилизованные тест-объекты искусственно контаминируют, нанося с
помощью дозатора/микропипетки в центральную часть канала и на поверхности
каждой трубки суспензию спор тест-микроорганизма (п. 5.8.4.4.2) из расчета
6
10 спор на каждый тест-объект. Контаминированные тест-объекты подсушивают
при температуре (37 +/- 1) °C в течение 120 мин.
Обработку исследуемым средством осуществляют способом погружения в исследуемый раствор, имеющий температуру 18 — 20 °C (для альдегидсодержащих средств — 20 — 22 °C). При проведении экспериментов тест-изделия погружают в рабочие растворы таким образом, чтобы раствор полностью покрыл изделия (толщина слоя раствора над поверхностью изделий должна быть не менее 1 см) и заполнил все полости и каналы без воздушных пробок. Через определенные интервалы времени, зависящие от химического состава средства (от 5 до 30 мин.), тест-изделия извлекают из раствора и помещают на 5 мин. в раствор соответствующего нейтрализатора, проверенного на эффективность. После этого тест-изделия переносят в пробирки с жидкой питательной средой СПБ с 0,5% глюкозы, Посевы выдерживают в термостате при температуре (37 +/- 1) °C в течение 21 суток. Предварительный учет результатов осуществляют через 48 — 72 ч, а окончательный — на 21-е сутки. В качестве контроля используют тест-объекты, контаминированные, как указано выше, и помещенные в нейтрализатор и в водопроводную воду на время максимальной стерилизационной выдержки.
Эффективным считают режим (концентрация — время — температура), обеспечивающий 100%-ную гибель спор тест-микроорганизма на всех тест-объектах при отсутствии его в нейтрализаторе. При наличии положительных проб эксперимент повторяют, увеличивая время воздействия, но не более чем до 16 ч. Режим стерилизации, разработанный на имитаторах канала эндоскопа, проверяют при обработке эндоскопа, контаминированного тест-микроорганизмом.
Критерием эффективности является достижение 100% гибели спор тест-микроорганизма на всех тест-изделиях. При этом время действия раствора должно составлять не более 16 ч при температуре 18 — 20 °C и не более 3 ч при умеренно повышенной температуре (50 +/- 1) °C [23, 74].
5.8.8. Библиографические данные
1. Абрамова И.М., Готье Т.М. Изучение устойчивости спорообразующих культур к растворам перекиси водорода//Сб. науч. трудов. 1980. С. 37.
2. Абрамова И.М. Изучение спороцидной активности глутарового альдегида в зависимости от pH и температуры растворов//Основные направления развития науки и практики дезинфекционного дела: Сб. научн. трудов. М., 1981. С. 46 — 48.
3. Абрамова И.М., Готье Т.М. Изучение устойчивости спорообразующих культур к растворам перекиси водорода и дезоксона//Теория и практика дезинфекции и стерилизации: Сб. трудов. М., 1983, С. 40.
4. Абрамова И.М., Сукиасян А.Н., Копылова А.И. Спороцидная активность глутарового альдегида в зависимости от pH и температуры//Вопросы дезинфекции и стерилизации: Сб. научн. трудов. М., 1986. С. 58.
5. Алексеева М.И., Масленников М.И., Меграбян Е.А. Стерилизация и дезинфекция эндоскопической аппаратуры в лечебно-профилактических учреждениях//Основные направления развития науки и практики дезинфекционного дела: Сб. научн. трудов. М., 1986. С. 58 — 61.
6. Барсунова Э.М., Рубинов Г.Е., Соколова Н.Ф. Эффективность хлорицина, ДП-2, дезоксона при обеззараживании объектов, зараженных возбудителем сибирской язвы//Актуальные вопросы дезинфекции и стерилизации. М., 1984. С. 14 — 18.
7. Барсунова Э.М., Мартынова В.Ю., Перепелкина Н.В. Нейтральный гипохлорит кальция и натриевая соль ДХУК — новые средства для дезинфекции при сибирской язве//Современные методы и средства дезинфекции и стерилизации. М., 1979. С. 16.
8. Гутерман Р.Л. Выбор и использование штамма B. licheniformis G для контроля воздушного метода стерилизации изделий медицинского назначения: Материалы научной конференции, посвященной 90-летию проф. В.И. Вашкова, 15 — 17 декабря 1992 г.//Актуальные вопросы дезинфекции и стерилизации. С. 134.
9. Гутерман Р.Л. Средства контроля работы паровых и воздушных стерилизаторов//Дезинфекционное дело. 1992. N 1. С. 18 — 22.
10. Журавлева В.И. Подбор и сравнительная оценка терморезистентности культур, используемых для контроля качества стерилизации: Материалы всесоюзной научной конференции. Волгоград, 1983. С. 41.
11. Кареев Н.В. Подбор бактериальной культуры для контроля эффективности газовой стерилизации//Проблемы дезинфекции и стерилизации: Сб. науч. трудов. М., 1974. N 23. С. 134.
12. Лебедева Н.С. Бактерицидные и спороцидные свойства калиевой соли дихлоризоциануровой кислоты//Труды ЦНИДИ. М., 1970. N 19. С. 135 — 139.
13. Леви М.И., Гутерман Р.Л., Пирятинский Л.Б. и др. Апробация биотестов для контроля стерилизации//Гигиена и санитария. 1990. N 3. С. 68 — 69.
14. Мамоненко Л.Л., Гумерова Р.Н. Анализ международного сотрудничества, осуществляемого во ВНИИДиС в 1981 — 1985 гг. по тематике СЭВ//Основные направления дезинфекционного дела: Сб. научных трудов. М., 1987. С. 169 — 173.
15. Мельникова Г.Н., Нехорошева А.Г., Панин О.Г. Сравнительная устойчивость бактериальных спор к действию стерилизующих агентов: Проблемы дезинфекции и стерилизации//Сб. научных трудов. М., 1976. N 25. С. 141 — 145.
16. Мельникова Г.Н., Нехорошева А.Г. Изменение устойчивости у тест-культур при длительном хранении к действию химических агентов//Современные методы и средства дезинфекции и стерилизации. М., 1977. N 26. С. 113 — 116.
17. Мельникова Г.Н., Панин О.Г. Сравнительная устойчивость музейных комплексов спор бацилл к действию некоторых дезинфицирующих и стерилизующих агентов//Проблемы дезинфекции и стерилизации: Сб. научных трудов. М., 1980. С. 46 — 50.
18. Овнанян Г.В. Устойчивость возбудителей раневых инфекций к физическим и химическим обеззараживающим агентам//Современные методы и средства дезинфекции и стерилизации: Сб. научных трудов. М., 1989. С. 50 — 51.
19. Рамкова Н.В., Мельникова Г.Н., Нехорошева А.Г. и др. Сравнительная устойчивость спорообразующих культур к стерилизующим агентам//Современные методы и средства дезинфекции и стерилизации: Сб. научных трудов. М., 1978. С. 119 — 123.
20. Рамкова Н.В., Абрамова И.М., Рысина Э.М. Антимикробные и моющие свойства электрохимически активированных растворов, получаемых в установках «Редококс»//Современные методы и средства дезинфекции и стерилизации: Сб. научных трудов. М., 1991. С. 42 — 46.
21. Соколова Н.Ф., Шумаева Ю.Г. Сравнительная устойчивость спор сибирской язвы, вакцинных штаммов, псевдоантракса и антракоида к различным дезинфицирующим средствам//Современные методы и средства дезинфекции и стерилизации: Труды ЦНИДИ. М., 1962. N 15. С. 58 — 66.
22. Соколова Н.Ф., Павловская Л.Г. Сравнительное изучение устойчивости спор некоторых штаммов микроорганизмов к дезинфицирующим средствам и пару//Проблемы дезинфекции и стерилизации: Труды ВНИИДиС. М., 1971. Вып. 21. Т. 1. С. 58 — 66.
23. Соколова Н.Ф., Грачева М.Н., Барсунова Э.М. К вопросу о выборе тест-микробов для изучения спороцидной активности дезинфектантов//Проблемы дезинфекции и стерилизации: Сб. научных трудов. М., 1974. N 23. С. 26 — 29.
24. Соколова Н.Ф., Канищев В.В., Левчук Н.Н., Федорова Л.С. К вопросу об устойчивости споровых культур к дезинфицирующим средствам: VIII Межгосударственная научно-практическая конференция государств — участников СНГ «Международные медико-санитарные правила и реализация глобальной стратегии борьбы с инфекционными заболеваниями в государствах — участниках СНГ», 25 — 26 сентября 2007 г.
25. Сукиасян А.Н., Абрамова И.М. Синтез и изучение спороцидной активности препарата на основе надмалеиновой кислоты//Проблемы дезинфекции и стерилизации: Сб. научных трудов. М., 1985. С. 63 — 69.
26. Сучков Ю.Г., Леви М.И., Бессонова В.Я. Новый термофильный штамм для бактериологического контроля паровой стерилизации. Сообщение 1//Дезинфекционное дело. 1996. N 3. С. 28 — 32.
27. Федорова Л.С. Сравнительное изучение бактерицидной и спороцидной активности калиевой соли дихлоризоциануровой кислоты в чистом виде и в комплексе с хлористыми солями щелочных металлов//Современные методы и средства дезинфекции и стерилизации: Сб. научных трудов. М., 1978. N 27. С. 79 — 83.
28. Федорова Л.С. Бактерицидные и спороцидные свойства гипохлорита кальция нейтрального//Проблемы дезинфекции и стерилизации: Сб. научных трудов. М., 1976. N 25. С. 114 — 19.
29. Методы исследования дезинфекционных, дезинсекционных и дератизационных препаратов//Под ред. В.И. Вашкова. М.: Медгиз, 1961. 236 с.
30. Draft European Standard. CEN/TC 216//Norme Europeenne WI 216042, 8 September 2003. English version. Chemical desinfectants and antiseptics: Application of European standards for chemical desinfectants and antiseptics.
31. Europaische Norm. EN 14347. Marz 2005. Deutsche Fassung. Chemische Desinfectionmittel und Antiseptika — Sporozide Wirkung Basistest — Prufverfahren und Anforderungen Phase 1.
5.8.9. Приложения
Приложение 1
справочное
ХАРАКТЕРИСТИКА ТЕСТ-МИКРООРГАНИЗМОВ
ПО МОРФОЛОГИЧЕСКИМ, КУЛЬТУРАЛЬНЫМ, БИОХИМИЧЕСКИМ
СВОЙСТВАМ, ПРИСУЩИМ ДАННОМУ ВИДУ
1. Bacillus cereus (штамм 96). Подвижная грамположительная палочка; размер, мкм: длина — 3 — 5, ширина — 1,2. Температура роста °C: минимальная — 10 — 20; оптимальная — (37 +/- 1), максимальная — 35 — 45. Споры размером 0,8 x 1,2 мкм эллиптической или цилиндрической формы, расположенные центрально. Аэроб. На МПБ (pH 7,3 +/- 0,1) через 24 ч инкубирования образует крошковидный осадок и пристеночное кольцо, образует R-формы; на МПА (pH 7,3 +/- 0,1) — круглые, сухие, белые, выпуклые колонии с неровным краем, размером 3 — 5 мм; продукты расщепления глюкозы: кислота, ацетон, газ — не образуются. Окрашиваемость вегетативных клеток по Грамму, спор — по Цилю-Нильсону. По классификации патогенных для человека микроорганизмов относится к IV группе патогенности.
Bacillus cereus (штамм 96) используют для изучения и оценки спороцидной активности ДС, СС и их субстанций на основе кислородактивных и хлорактивных ДВ.
Тест-микроорганизм B. cereus (штамм 96) хранится в музее Федерального государственного учреждения науки «Научно-исследовательский институт дезинфектологии» Роспотребнадзора (117246, г. Москва, Научный проезд, д. 18).
2. Geobacillus stearothermophilius (штамм BKM B-718), подвижная грамположительная термофильная палочка. Оптимальная температура роста (55 +/- 1) °C, исключающая развитие других широко распространенных микроорганизмов. Споры эллиптические, расположенные центрально. Аэроб. На МПБ (pH 7,3 +/- 0,1) через 24 ч инкубирования образует помутнение среды, на МПА (pH 7,3 +/- 0,1) — слабо выпуклые колонии диаметром 2 — 4 мм, с ровным краем. Реакция Фогес-Проскауэра отрицательная. Ферментирует глюкозу с образованием кислоты; не ферментирует арабинозу, ксилозу и маннин. Гидролизует казеин. Не расщепляет фенилаланин и тирозин. Непатогенен для человека и животных.
G. stearothermophilius используют для исследования и оценки действия водяного насыщенного пара под избыточным давлением при стерилизации ИМН.
Тест-микроорганизм G. stearothermophilius (штамм BKM B-718) хранится:
— в музее культур Федерального государственного учреждения науки «Научно-исследовательский институт дезинфектологии» Роспотребнадзора (117246, г. Москва, Научный проезд, д. 18);
— в музее культур Испытательного лабораторного центра ГУП «Московский городской центр дезинфекции» (129337, г. Москва, Ярославское шоссе, д. 9).
3. Bacillus licheniformis (штамм G BKM B-1711D): подвижная грамположительная палочка. Оптимальная температура роста (37 +/- 1) °C. Споры эллиптические, расположенные центрально. Факультативный анаэроб. На МПБ (pH 7,3 +/- 0,1) через 24 ч инкубирования образует помутнение среды, на поверхности — сухую пленку; на МПА (7,3 +/- 0,1) — слабо выпуклые сухие колонии вытянутой звездчатой формы с неровными краями диаметром 4 — 6 мм, врастающие в питательную среду. Реакция Фогес-Проскауэра положительная. Ферментирует глюкозу с образованием кислоты и газа. Редуцирует нитраты, образует газ в среде для нитрификации в анаэробных условиях. Утилизирует пропинат. Гидролизует крахмал. Расщепляет аргинин. Не образует индол, лецитиназу, кислоту в лакмусовом молоке. Непатогенен для человека и животных.
Bacillus licheniformis (штамм G BKM B-1711D) используют для исследования и оценки спороцидной активности сухого горячего воздуха при стерилизации ИМН.
Тест-микроорганизм B. licheniformis (штамм G BKM B-1711D) хранится:
— в музее культур Федерального государственного учреждения науки «Научно-исследовательский институт дезинфектологии» Роспотребнадзора (117246, г. Москва, Научный проезд, д. 18);
— в музее культур Испытательного лабораторного центра ГУП «Московский городской центр дезинфекции» (129337, г. Москва, Ярославское шоссе, д. 9).
4. Bacillus subtilis (штамм 7): подвижная грамположительная палочка размером 2 — 3 x 0,7 — 0,8 мкм. Температура роста (°C): минимальная — 5 — 20, оптимальная — 37 +/- 1; максимальная — 45 — 55. Споры размером 0,8 x 1,2 мкм, эллиптической или цилиндрической формы, расположены центрально. Аэроб. На жидких питательных средах образует пленку серовато-белого цвета; на плотной питательной среде образует R-форму, складчатые колонии телесного цвета с изрезанными краями размером 3 x 5 мм, легко снимающиеся петлей. Разлагает глюкозу на кислоту, ацетон; газ не образует. Окрашиваемость вегетативных клеток по Грамму, спор — по Цилю-Нильсону.
Bacillus subtilis (штамм 7) используют для изучения и оценки спороцидной активности ДС, СС и их субстанций на основе альдегидактивных ДВ. Тест-микроорганизм Bacillus subtilis (штамм 7) хранится в музее культур Федерального государственного учреждения науки «Научно-исследовательский институт дезинфектологии» Роспотребнадзора (117246, г. Москва, Научный проезд, д. 18).
+ —
5. Вакцинный штамм B. anthracis СТИ-1 (pX01 , pX01 ). Штамм СТИ-1 — это
подвижная грамположительная палочка размером 3 — 5 x 1,0 — 1,2 мкм.
Температура роста °C: минимальная — 15 — 20, оптимальная — 37 +/- 1,
максимальная — 40. Споры размером 0,8 x 1,2 мкм, эллиптической или
цилиндрической формы, расположены центрально. Анаэроб, на жидких
питательных средах растет в виде ватных хлопьев, взвешенных комков, не
вызывает помутнения; на плотной питательной среде образует R-формы,
серовато-белые с ворсистым краем («львиная грива»), колонии размером 3 —
5 мм. Разлагает глюкозу на кислоту, ацетон; газ не образует; не разлагает
арабинозу, рамнозу, маннозу, галактозу, рафинозу, лактозу, гекулин,
маннит, дульцид, сорбит, инозит; не обладает гемолитической, фосфатазной,
лицитиназной активностью; лизируется специфическим сибиреязвенным фагом;
дает положительную реакцию с люминесцирующей адсорбированной сибиреязвенной
сывороткой, чувствителен к воздействию сибиреязвенного фага и пенициллина,
не вызывает гемолиза эритроцитов при посеве на 5%-ный кровяной агар, не
коагулирует яичный желток.
Используют при изучении и оценке спороцидной активности ДС и их
субстанций в виде сибиреязвенной живой вакцины СТИ-1 для людей (МТРУ-42
N 10), представляет собой живую споровую культуру сибиреязвенных вакцинных
штаммов.
+ + + +
6. Bacillus anthracis, штамм 81/1 (pX01 , pX02 ) или 27 (pX01, pX02 ) —
это подвижные грамположительные палочки размером 3 — 5 x 1,0 — 1,2 мкм.
Температура роста °C: минимальная — 15 — 20, оптимальная — 37 +/- 1,
максимальная — 40. Споры размером 0,8 x 1,2 мкм, эллиптической или
цилиндрической формы, расположены центрально. Анаэроб, на жидкой
питательной среде растет в виде ватных хлопьев, взвешенных комков, не
вызывает помутнения; на плотной питательной среде образует R-формы,
серовато-белые с ворсистым краем («львиная грива»), колонии размером 3 —
5 мм. Разлагает глюкозу на кислоту, ацетон; газ не образует; не разлагает
арабинозу, рамнозу, маннозу, галактозу, рафинозу, лактозу, гекулин, маннит,
дульцид, сорбит, инозит; не обладает гемолитической, фосфатазной,
лицитиназной активностью; лизируется специфическим сибиреязвенным фагом;
дает положительную реакцию с люминесцирующей адсорбированной сибиреязвенной
сывороткой.
Используют при изучении спороцидной эффективности ДС при обеззараживании различных объектов с применением биологического метода контроля.
Приложение 2
рекомендуемое
МЕТОДИКА
ПРИГОТОВЛЕНИЯ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ КУЛЬТИВИРОВАНИЯ
ТЕСТ-МИКРООРГАНИЗМОВ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ИЗУЧЕНИЯ И ОЦЕНКИ
СПОРОЦИДНОЙ АКТИВНОСТИ ДС, СС И ИХ СУБСТАНЦИЙ
1. Агар Хоттингера.
Мясной перевар по Хоттингеру (аминный азот от 140 до
160 мг%) 1000 мл
Натрий хлористый 5,0 г
Агар 20,0 г
pH 7,3 +/- 0,1
Мясной перевар по Хоттингеру разводят дистиллированной водой до содержания аминного азота от 140 до 160 мг%, добавляют хлористый натрий и агар, кипятят на слабом огне при постоянном помешивании до полного расплавления агара. Фильтруют и стерилизуют при температуре 120 °C в течение 30 мин.
2. Пшеничный агар.
Пшеничная крупа «Артек» или «Полтавская» 500,0 г
Агар 25,0 г
Дистиллированная вода 1000 мл
pH 7,3 +/- 0,1
Пшеничную крупу «Артек» (или «Полтавская») заливают дистиллированной водой. Через 18 — 24 ч настой аккуратно сливают не выжимая, доводят до первоначального объема, добавляют агар и растапливают на водяной бане или в автоклаве (текучим паром 1 ч). Оставляют в теплом месте до осаждения осадка на 12 ч. Остывший агар выкладывают на противень и срезают осадок. Агар растапливают на водяной бане, постоянно помешивая. Устанавливают pH 7,3 +/- 0,1. Разливают в бутылки, пробирки, матрацы (в зависимости от решаемых задач и целей). Стерилизуют текучим паром в аппарате Коха по 1 ч в течение 3 суток.
3. Картофельно-пептонный агар.
Пептон 5,0 г
Мел 1,0 г
Агар 25,0 г
Картофельная вода 1000 мл
pH 7,1 +/- 0,1
Сырой картофель (из расчета 200 г очищенного картофеля на 1 л водопроводной воды) тщательно моют, очищают от кожуры и глазков, нарезают мелкими ломтиками, заливают водопроводной водой и кипятят 30 мин. после закипания (молодой картофель употреблять нельзя). Отвар отстаивают и фильтруют в холодном состоянии через ватно-марлевый фильтр. Доводят объем фильтрата до первоначального. Устанавливают pH 7,1 +/- 0,1. Добавляют пептон и агар. Нагревают, помешивая, до полного расплавления агара, фильтруют через ватно-марлевый фильтр, после чего добавляют мел. Разливают по флаконам, стерилизуют при 120 °C в течение 30 мин. После стерилизации среду во флаконах скашивают.
4. Мясо-пептонный агар.
Методика приготовления изложена в «Справочнике по микробиологическим и вирусологическим методам исследования» (под ред. М.О. Биргера. М.: Медицина, 1982).
5. Питательный агар для культивирования микроорганизмов сухой, НПО «Питательные среды», г. Махачкала СПБ.
Питательный агар для культивирования микроорганизмов готовят согласно прописи на этикетке.
6. Бульон Хоттингера.
Мясной перевар по Хоттингеру (аминный азот 140 до 160 мг%) 1000 мл
Натрий хлористый 5,0 г
Глюкоза 5,0 г
pH 7,3 +/- 0,1
Мясной перевар по Хоттингеру разводят дистиллированной водой до содержания аминного азота от 140 до 160 мг%, добавляют хлористый натрий. Кипятят на слабом огне с закрытой крышкой 10 мин. до полного растворения соли. Если есть выкипание, доводят объем до первоначального дистиллированной водой. Устанавливают pH 7,3 +/- 0,1, кипятят повторно. Фильтруют, прибавляют глюкозу. Разливают в стерильную посуду. Стерилизуют при 110 °C в течение 30 мин.
7. Мясо-пептонный бульон.
Методика приготовления изложена в «Справочнике по микробиологическим и вирусологическим методам исследования» (под ред. М.О. Биргера. М.: Медицина, 1982). Для приготовления бульона с глюкозой добавить 0,5% глюкозы.
8. Питательный бульон для культивирования микроорганизмов сухой, НПО «Питательные среды», г. Махачкала СПА.
Питательный бульон для культивирования микроорганизмов готовят согласно прописи на этикетке. Для приготовления бульона добавить глюкозу 0,5%.
9. Цветная питательная среда с индикатором бромкрезоловым пурпуровым.
Питательный бульон для культивирования микроорганизмов сухой: готовят согласно прописи на этикетке.
Глюкоза 5 г
Бромкрезоловый пурпуровый спиртовый 1% 2 мл
Дистиллированная вода до 1000 мл
pH 7,3 +/- 0,1
В питательный бульон для культивирования микроорганизмов сухой, приготовленный согласно прописи на этикетке, добавляют 5 г глюкозы, перемешивают до полного растворения последней, фильтруют через ватно-марлевый фильтр и добавляют 2 мл 1%-ного спиртового раствора индикатора бромкрезолового пурпурового.
Устанавливают pH (7,3 +/- 0,1) и разливают в стерильную посуду. Стерилизуют при температуре 110 °C в течение 30 мин.
10. Цветная питательная среда с индикатором бромтимоловым синим.
Питательный бульон для культивирования микроорганизмов сухой: готовят согласно прописи на этикетке.
Глюкоза 5 г
Бромтимоловый синий спиртовой 1% 2 мг
Дистиллированная вода до 1000 мл
pH 7,3 +/- 0,1
В питательный бульон для культивирования микроорганизмов сухой, приготовленный согласно прописи на этикетке, добавляют 5 г глюкозы, перемешивают до полного растворения последней, фильтруют через ватно-марлевый фильтр и добавляют 2 мл 1%-ного спиртового раствора индикатора бромтимолового синего. Устанавливают pH (7,3 +/- 0,1) и разливают в стерильную посуду. Стерилизуют при температуре 110 °C в течение 30 мин.
Приложение 3
справочное
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ,
НЕОБХОДИМЫЕ ДЛЯ ПРОВЕДЕНИЯ ИССЛЕДОВАНИЙ СУСПЕНЗИИ
СПОР ТЕСТ-МИКРООРГАНИЗМОВ
1. При определении концентрации спор в суспензии:
термостат суховоздушный ТС-80М ТУ 64-1-2622-75
баня водяная
пипетки вместимостью 1,0 и 10,0 куб. см 2-го класса
точности ГОСТ 20292-74
дозаторы пипеточные (фирмы «Bcoheat», Финляндия)
пробирки химические ГОСТ 10515-63
чашки Петри ГОСТ 25336-82
спиртовка лабораторная ГОСТ 25336-82
или газовая горелка
спирт этиловый, ректификационный технический ГОСТ 18300-72
электроплитка бытовая ГОСТ 14919-83
трубка медицинская резиновая ГОСТ 3399-76
зажимы пружинные для резиновых трубок ТУ 64-1-964-79
спринцовка резиновая ТУ 38.106-141-80
штативы лабораторные химические ТУ 48-0534-8-87
вата медицинская гигроскопическая ГОСТ 5556-81
карандаш по стеклу ТУ 46-22-904-78
секундомер механический ГОСТ 8.423-81
термометры ГОСТ 215-73
стерильная питьевая вода
питательные среды, приведенные в Прилож. 2
2. При определении устойчивости спор к текучему пару:
аппарат Ойль-Мюллера
термостат суховоздушный ТС-80М ТУ 64-1-2622-75
пипетки вместимостью 1,0 и 10,0 куб. см 2-го класса
точности ГОСТ 20292-74
пробирки химические ГОСТ 10515-63
чашки Петри ГОСТ 25336-82
спиртовка лабораторная ГОСТ 25336-82
батист или отбельная бязь
спирт этиловый, ректификационный технический ГОСТ 18300-72
электроплитка бытовая ГОСТ 14919-83
трубка медицинская резиновая ГОСТ 3399-76
зажимы пружинные для резиновых трубок ТУ 64-1-964-79
спринцовка резиновая ТУ 38.106-141-80
штативы лабораторные химические ТУ 48-0534-8-87
вата медицинская гигроскопическая ГОСТ 5556-81
карандаш по стеклу ТУ 46-22-904-78
секундомер механический ГОСТ 8.423-81
термометры ГОСТ 215-73
дистиллированная вода ГОСТ 6709-72
мясо-пептонный бульон МПБ, ВФС 42-366 ВС-92
3. При определении устойчивости спор к хлорамину, перекиси водорода, глутаровому альдегиду:
баня лабораторная
термостат суховоздушный ТС-80М ТУ 64-1-2622-75
пипетки вместимостью 1,0 и 10,0 куб. см 2-го класса
точности ГОСТ 20292-74
пробирки химические ГОСТ 10515-63
стаканы химические 50 — 100 мл ГОСТ 10515-63
чашки Петри ГОСТ 25336-82
спиртовка лабораторная ГОСТ 25336-82
батист или отбельная бязь
спирт этиловый, ректификационный технический ГОСТ 18300-72
электроплитка бытовая ГОСТ 14919-83
трубка медицинская резиновая ГОСТ 3399-76
зажимы пружинные для резиновых трубок ТУ 64-1-964-79
спринцовка резиновая ТУ 38.106-141-80
штативы лабораторные химические ТУ 48-0534-8-87
вата медицинская гигроскопическая ГОСТ 5556-81
карандаш по стеклу ТУ 46-22-904-78
секундомер механический ГОСТ 8.423-81
термометры ГОСТ 215-73
дистиллированная вода ГОСТ 6709-72
мясо-пептонный бульон МПБ, ВФС 42-366 ВС-92
хлорамин или перекись водорода
тиосульфат натрия
5.9. Методы исследований и критерии оценки эффективности
средств для предстерилизационной очистки ИМН
5.9.1. Общие положения
Требования к средствам предстерилизационной очистки
Химические средства, рекомендуемые для предстерилизационной очистки изделий медицинского назначения, должны отвечать следующим требованиям [23, 66]:
— обладать высокой моющей способностью, т.е. за короткое время при температуре не выше 50 °C обеспечивать удаление органических (белковых, в т.ч. кровяных, жировых и др.) и неорганических загрязнений, включая остатки лекарственных препаратов;
— не оказывать фиксирующего действия на загрязнения при контакте с ними; средства для совмещения предстерилизационной очистки и дезинфекции изделий не должны приводить к фиксирующему эффекту в рекомендуемых для такой обработки режимах;
— хорошо растворяться в воде;
— не приводить к обильному пенообразованию;
— не приводить к повреждению обрабатываемых изделий;
— иметь срок годности не менее 1 года; средства, относящиеся к электрохимически активированным растворам (анолиты, католиты), вырабатываемым установками, должны иметь срок годности не менее 3 суток.
Правила изучения средств предстерилизационной очистки
При изучении эффективности химических средств для предстерилизационной очистки изделий медицинского назначения необходимо иметь характеристику средства с указанием физико-химических свойств и условий хранения.
К исследованиям приступают только после получения результатов химико-аналитических исследований, подтвердивших соответствие образца средства данным, приведенным в технических условиях или спецификации.
Средства, предназначенные для предстерилизационной очистки изделий медицинского назначения, а также действующие вещества для производства этих средств до начала исследований моющих свойств подлежат проверке на фиксирующее действие в следующих случаях:
— если в состав средства входят спиртовые и/или альдегидные компоненты, и/или амины, надкислоты или их производные;
— если на исследования представлено новое действующее вещество или в состав средства входит новый компонент, относительно которого нет данных о фиксирующем действии.
Исследования порошкообразных средств, их рабочих растворов проводят только в случае их полного растворения в питьевой воде (если разработчиком специально не оговорена возможность присутствия остатков нерастворенных компонентов, которые не должны/не могут оказывать отрицательных воздействий на моющие свойства средства).
Для оценки эффективности действующих веществ (субстанций), предназначенных для производства средств предстерилизационной очистки, а также самих средств предстерилизационной очистки в лабораторных условиях, в качестве тест-загрязнения применяют донорскую кровь [66, 68].
5.9.2. Исследование эффективности действующих веществ,
субстанций, предназначенных для производства средств
предстерилизационной очистки ИМН
Исследование фиксирующих свойств действующих веществ
Для определения фиксирующего действия используют тест-изделия из следующих материалов [66, 68]:
— металлов (скальпель хирургический остроконечный или брюшистый, стоматологический диск алмазный);
— резин из натурального и синтетического каучука (фрагменты дренажных трубок длиной 10 мм);
— стекла (предметное стекло) или крышка чашки Петри.
В день постановки эксперимента на поверхность каждого тест-изделия (обязательно на поверхность канала фрагмента дренажной трубки) с помощью глазной или стеклянной (объем 1 — 2 мл) пипетки наносят по две капли (диаметр не менее 3 мм) консервированной донорской крови и подсушивают до полного высыхания в течение 45 — 90 мин. (в зависимости от влажности воздуха в помещении).
Готовят рабочие растворы действующего вещества с различными, подлежащими изучению концентрациями.
Эксперименты проводят при температуре воздуха в помещении и температуре растворов средства (действующего вещества) (20 +/- 2) °C.
Тест-изделия, загрязненные кровью, после подсушивания погружают (избегая соприкосновения с краями емкости) в приготовленный рабочий раствор на различное время (максимальное время воздействия раствора не должно превышать 20 мин.).
По истечении времени выдержки каждое тест-изделие ополаскивают под струей проточной (120 л/час <*>) питьевой воды в течение 30 с, не допуская прямого попадания струи воды на места, первоначально загрязненные кровью.
———————————
<*> Объем воды измеряют с помощью мерного сосуда и секундомера. С помощью водопроводного крана регулируют поток воды таким образом, чтобы за 30 с в мерный сосуд поступал 1 л воды.
При работе с действующими веществами, предназначенными одновременно для производства средств дезинфекции изделий медицинского назначения, для оценки фиксирующих свойств используют рабочие растворы тех концентраций и при том времени воздействия, которые оказались эффективными при оценке антимикробных свойств. Все манипуляции проводят аналогично указанному выше.
О наличии фиксирующих свойств у действующих веществ судят, визуально оценивая наличие остатков крови на поверхности тест-изделия в местах нанесения крови после его выдержки в рабочем растворе средства и ополаскивания под проточной питьевой водой.
Критерии фиксирующего действия
Группа А. Отсутствие визуально наблюдаемого ореола на поверхности тест-изделия в местах первоначального нанесения капель крови свидетельствует о том, что раствор не оказывает фиксирующего действия (условное обозначение «-«).
Группа В. Наличие визуально наблюдаемого ореола на поверхности тест-изделия в местах первоначального нанесения капель крови свидетельствует о том, что раствор оказывает слабое фиксирующее действие (условное обозначение «+»).
Группа Г. Наличие визуально наблюдаемых следов крови на поверхности тест-изделия в местах первоначального нанесения капель крови свидетельствует о том, что раствор оказывает умеренное фиксирующее действие (условное обозначение «++»).
Группа Д. Наличие визуально наблюдаемых явно выраженных остатков крови на поверхности тест-изделия в местах первоначального нанесения капель крови свидетельствует о том, что раствор оказывает сильное фиксирующее действие (условное обозначение «+++»).
Исходя из критериев по фиксирующему действию, дезинфицирующие средства целесообразно использовать для предстерилизационной очистки, в т.ч. совмещенной с дезинфекцией, изделий медицинского назначения (с подсушенными загрязнениями), если они относятся к группе А.
Если дезинфицирующие средства относятся к группе В, то их можно использовать для предстерилизационной очистки, в т.ч. совмещенной с дезинфекцией, изделий медицинского назначения, не допуская подсушивания загрязнений.
Если дезинфицирующие средства относятся к группе Г, то их можно использовать для предстерилизационной очистки, в т.ч. совмещенной с дезинфекцией, изделий медицинского назначения (не допуская подсушивания загрязнений) с предварительным удалением видимых загрязнений с поверхностей и из каналов изделий.
Дезинфицирующие средства, относящиеся к группе Д, нецелесообразно использовать для предстерилизационной очистки, в т.ч. совмещенной с дезинфекцией, изделий медицинского назначения.
Определение эффективности действующих веществ
Для определения эффективности (моющих свойств) действующих веществ используют тест-изделия (в количестве не менее 10, относящихся к конкретной группе <*>) из различных материалов: металлов (хирургические инструменты — пинцеты, скальпели, ножницы, зажимы; стоматологические инструменты — боры твердосплавные и алмазные, зеркала цельнометаллические и с амальгамой, щипцы, гладилки), стекла, пластмасс, резин на основе натурального и силиконового каучука (фрагменты трубок длиной 10 мм и внутренним диаметром 2 — 7 мм). При необходимости определения эффективности средств для предстерилизационной очистки изделий медицинского назначения иной конструкции (эндоскопы, инструменты к ним и др.) используют изделия, относящие к конкретной группе (эндоскопы и инструменты к ним в количестве не менее 3) [23, 66, 68].
———————————
<*> Конкретные группы однородных изделий: изделия, имеющие замковые части; изделия, имеющие каналы; изделия, не имеющие замковых частей или каналов (кроме стоматологических инструментов, имеющих алмазные рабочие части); вращающиеся стоматологические инструменты, имеющие алмазные рабочие части.
Новые тест-изделия предварительно очищают от масел, механических загрязнений, моют и стерилизуют паровым методом. Тест-изделия из металлов и стекла могут быть простерилизованы воздушным методом.
В качестве тест-загрязнения применяют донорскую кровь. Эксперименты проводят при температуре воздуха в помещении (20 +/- 2) °C.
В день постановки эксперимента тест-изделия загрязняют донорской кровью с помощью глазной или стеклянной (объем 1 — 2 мл) пипетки:
— на поверхность рабочей части тест-изделия из металлов наносят одну каплю и в замковую часть две капли крови (диаметр каждой капли не менее 3 мм) и делают несколько рабочих движений для проникновения крови в труднодоступные участки замковой части инструмента;
— во внутреннюю часть тест-изделий из резин, пластмасс и стекла наносят две капли крови, которые должны быть распределены по всей внутренней поверхности тест-изделия.
Загрязненные тест-изделия подсушивают до полного высыхания в течение 45 — 90 мин. (в зависимости от температуры и влажности воздуха в помещении).
Готовят рабочие растворы действующего вещества с различными, подлежащими изучению концентрациями. Температура рабочего раствора должна быть в пределах 18 — 22 °C.
Тест-изделия, загрязненные кровью, погружают в приготовленный рабочий раствор на различное время (максимальное время воздействия раствора не должно превышать 20 мин.), каждый раз по окончании которого осуществляют механическую очистку с помощью различных приспособлений (щетки, ерши, марлевые салфетки, ватные тампоны, шприцы — в зависимости от конструкционных особенностей изделий) в той же порции раствора, в которой проводили замачивание, а затем ополаскивают под проточной питьевой водой в течение 1 мин.
При работе с действующими веществами, предназначенными одновременно для производства средств дезинфекции изделий медицинского назначения, для оценки моющих свойств используют рабочие растворы тех концентраций и при том времени воздействия, которые оказались эффективными при оценке антимикробных свойств. Все манипуляции проводят аналогично указанному выше, за исключением этапа промывания под проточной питьевой водой.
При определении эффективности действующих веществ, предназначенных для производства средств предстерилизационной очистки, помимо изучения зависимости моющего действия от концентрации действующего вещества и времени воздействия раствора, при необходимости исследуют зависимость эффективности от температуры и pH раствора.
Оценку моющих свойств действующего вещества проводят визуально, оценивая наличие или отсутствие остатков крови на поверхности тест-изделия в местах нанесения крови после его выдержки в рабочем растворе и ополаскивания под проточной питьевой водой, исходя из критериев фиксирующего действия.
Если действующее вещество, субстанция, относится к группе А — Г, то его можно использовать в производстве средств предстерилизационной очистки.
Если действующее вещество, субстанция, относится к группе Д, то это свидетельствует о том, что действующее вещество не обладает достаточными моющими свойствами для использования в производстве средств предстерилизационной очистки.
5.9.3. Исследование эффективности средств
для предстерилизационной очистки ИМН
5.9.3.1. Определение эффективности
средств в лабораторных условиях
Исследование фиксирующих свойств средств для предстерилизационной очистки изделий медицинского назначения проводят аналогично исследованию фиксирующих свойств действующих веществ (п. 5.9.2). При необходимости испытывают растворы с начальной повышенной (но не выше плюс 50 °C) температурой; конкретную температуру подбирают применительно к конкретному средству.
Определение эффективности средств для предстерилизационной очистки ручным способом.
Для определения эффективности (моющих свойств) средств для предстерилизационной очистки используют тест-изделия, аналогичные указанным в п. 5.9.2.
В качестве тест-загрязнения применяют донорскую кровь. Эксперименты проводят при температуре воздуха в помещении (20 +/- 2) °C.
В день постановки эксперимента тест-изделия загрязняют донорской кровью аналогично указанному в п. 5.9.2.
Готовые к применению средства (не требующие разбавления), используют в экспериментах в исходном виде. Из средств в виде порошка или жидкого концентрата готовят рабочие (растворы) с различными, подлежащими изучению концентрациями действующего вещества (действующих веществ). Температура готового средства или рабочего раствора средства должна быть в пределах 18 — 22 °C. При необходимости испытывают растворы с начальной повышенной (но не выше плюс 50 °C) температурой; конкретную температуру подбирают применительно к конкретному средству.
Тест-изделия, загрязненные кровью, промывают под проточной питьевой водой в течение 30 с и погружают (избегая соприкосновения с краями емкости) в приготовленный рабочий раствор (растворы) на различное время (максимальное время воздействия раствора не должно превышать 30 мин.), каждый раз по окончании которого осуществляют механическую очистку с помощью различных приспособлений (щетки, ерши, марлевые салфетки, ватные тампоны, шприцы — в зависимости от конструкционных особенностей тест-изделий) в той же порции раствора, в которой проводили замачивание.
При работе со средствами, предназначенными одновременно для дезинфекции изделий медицинского назначения, для оценки моющих свойств используют рабочие растворы тех концентраций и при том времени воздействия, которые оказались эффективными при оценке антимикробных свойств. Все манипуляции проводят аналогично указанному в п. 5.9.2, за исключением этапа промывания под проточной питьевой водой.
При определении эффективности средств, предназначенных для предстерилизационной очистки, помимо изучения зависимости моющего действия от концентрации действующего вещества и времени воздействия раствора, при необходимости исследуют зависимость эффективности от температуры.
Оценку моющих свойств средства проводят путем постановки азопирамовой пробы, оценивая наличие или отсутствие крови на тест-изделиях (после их выдержки и механической очистки в рабочем растворе и ополаскивания под проточной питьевой водой).
Методика постановки азопирамовой пробы. Определение скрытой крови с помощью комплекта реактива N 1 (амидопирин в порошке, медицинский) и реактива N 2 (солянокислый анилин, ч.д.а.) «Азопирам».
Приготовление спиртового раствора реактива «Азопирам»
10 г реактива N 1 и 0,15 г реактива N 2 смешивают в сухой мерной колбе (150 мл), добавляют 50 мл 95%-ного этилового спирта (ГОСТ 18300-87), тщательно перемешивают до полного растворения и доводят объем 95%-ным этиловым спиртом до 100 мл.
Примечание. Спиртовой раствор «Азопирам» следует хранить в закрытой стеклянной колбе с притертой пробкой в холодильнике при температуре 4 — 8 °C не более 2 месяцев или в темном месте при комнатной температуре (не выше 25 °C) не более 1 месяца. Небольшое пожелтение спиртового раствора «Азопирам» в процессе хранения не снижает его рабочих качеств.
Приготовление рабочего раствора реактива «Азопирам»
Непосредственно перед проверкой качества предстерилизационной очистки изделий готовят рабочий раствор, смешивая равные объемные количества раствора реактива «Азопирам» и 3%-ного раствора перекиси водорода.
Пригодность рабочего раствора реактива «Азопирам» проверяется в случае необходимости: 2 — 3 капли этого раствора наносят на кровяное пятно. Если не позже чем через 1 мин. появляется фиолетовое окрашивание, переходящее затем в сиреневый цвет, реактив пригоден к употреблению; если окрашивание в течение 1 мин. не появляется, реактивом пользоваться нельзя.
Исследование качества предстерилизационной очистки изделий
Рабочим раствором реактива «Азопирам» обрабатывают исследуемые изделия: протирают тампонами, смоченными рабочим раствором, или наносят несколько капель рабочего раствора на рабочие части исследуемых изделий с помощью пипетки.
Внимание! У изделий, имеющих замковые части, обрабатывают помимо рабочих частей и замковые части.
В шприцы наливают 3 — 4 капли рабочего раствора реактива и несколько раз продвигают поршнем для того, чтобы смочить рабочим раствором внутреннюю поверхность шприца, особенно места соединения стекла с металлом, где чаще всего остается кровь, рабочий раствор в шприце оставляют на 0,5 — 1,0 мин., после чего его вытесняют на марлевую салфетку.
При проверке качества очистки игл рабочий раствор набирают в чистый, не имеющий следов коррозии шприц, и, последовательно меняя иглы, пропускают рабочий раствор через них, выдавливая 3 — 4 капли на марлевую салфетку.
Качество очистки катетеров или других полых изделий оценивают путем введения рабочего раствора внутрь изделий с помощью чистого шприца или пипетки. Рабочий раствор оставляют внутри изделия в течение 0,5 — 1,0 мин., после чего его сливают на марлевую салфетку. Количество рабочего раствора, вносимого внутрь изделия, зависит от величины изделия.
Контролю подвергают 1% от одновременно обработанных изделий одного наименования, но не менее 3 — 5 ед.
Индикация загрязнений
В присутствии следов крови немедленно или не позднее чем через 1 мин. после контакта реактива с загрязненным участком появляется окрашивание, вначале фиолетовое, затем быстро, в течение нескольких секунд, переходящее в розово-сиреневое или буроватое.
Окрашивание, наступившее позже, чем через 1 мин. после обработки исследуемых изделий, не учитывается.
Рабочий раствор реактива «Азопирам» выявляет наличие гемоглобина, пероксидаз растительного происхождения (растительных остатков), окислителей (хлорамина, хлорной извести, стирального порошка с отбеливателем, хромовой смеси для обработки посуды и др.), а также ржавчины (окислов и солей железа) и кислот.
Буроватое окрашивание наблюдается при наличии на исследуемых предметах ржавчины и хлорсодержащих окислителей. В остальных случаях окрашивание розово-сиреневое.
Особенности реакции
Исследуемые изделия должны иметь комнатную температуру (желательно не выше 25 °C). Нельзя подвергать проверке горячие изделия, а также держать рабочий раствор на ярком свету или при повышенной температуре (вблизи нагревательных приборов и т.п.).
Рабочий раствор реактива «Азопирам» должен быть использован в течение 1 — 2 ч. При более длительном стоянии может появиться спонтанное розовое окрашивание. При температуре выше 25 °C рабочий раствор реактива розовеет быстрее, поэтому его рекомендуют использовать в течение 30 — 40 мин.
После проверки, независимо от ее результатов, следует удалить остатки рабочего раствора реактива «Азопирам» с исследованных изделий, обмыв их водой или протерев тампоном, смоченным водой или спиртом.
При получении «положительной азопирамовой пробы» (наличие скрытой крови на изделиях) следует повторить предстерилизационную очистку этих изделий.
Меры предосторожности
Реактив N 1 и реактив N 2 и их растворы должны храниться в плотно закрывающихся емкостях отдельно от пищевых продуктов, лекарственных препаратов, дезинфицирующих средств, крепких кислот и щелочей.
Приготовление спиртового и рабочего растворов реактива «Азопирам» проводится на лабораторном столе в хорошо вентилируемом помещении, желательно в вытяжном шкафу, следует избегать пыления реактивов. При приготовлении 3%-ной перекиси водорода из пергидроля следует пользоваться резиновыми перчатками.
При попадании на кожу реактивов N 1 и N 2, спиртового и рабочего растворов реактива «Азопирам», 3%-ного раствора перекиси водорода или пергидроля их следует удалить чистой ватой или марлей-ветошью и место контакта обмыть водой. При попадании реактивов на слизистые место контакта следует обильно промыть большим количеством холодной воды.
Рассыпанные или пролитые реактивы удаляют, а место, где они находились, промывают или протирают тампонами, смоченными водой или спиртом.
Спиртовый и рабочий растворы реактива «Азопирам» относятся к горючим растворам, т.к. в их состав входит спирт. Поэтому нельзя допускать контакта с открытым огнем и раскаленными поверхностями нагревательных приборов.
При приготовлении и использовании реактива «Азопирам» следует руководствоваться правилами техники безопасности, изложенными в руководствах по охране труда работников здравоохранения.
Регистрация результатов проверки качества
предстерилизационной очистки
Регистрация результатов проверки качества предстерилизационной очистки изделий медицинского назначения проводится в журнале формы N 366/у.
Код формы по ОКУД
Код учреждения по ОКПО
|
Министерство здравоохранения РФ |
Медицинская документация. Форма N 366/у Утверждена Минздравом СССР 04.10.1980, N 1030 |
|
|
Наименование учреждения |
Журнал
учета качества предстерилизационной обработки
Начат «____» __________ 201__ г. Окончен «____» __________ 201__ г.
|
Дата |
Способ обра- ботки |
Применяемое средство |
Результаты выборочного химического контроля обработанных изделий |
Фамилия лица, производивше- го контроль |
|||
|
наимено- вание изделий |
коли- чество штук |
из них загрязненных |
|||||
|
кровью |
моющими средствами |
||||||
Определение эффективности средств для предстерилизационной
очистки механизированным способом
Экспериментальные исследования по оценке эффективности средств для предстерилизационной очистки механизированным способом проводят в ультразвуковых установках, зарегистрированных в Российской Федерации и разрешенных к применению в лечебно-профилактических учреждениях для очистки изделий медицинского назначения из металлов [66, 68].
Для определения эффективности средств для предстерилизационной очистки (моющих свойств) используют тест-изделия, имеющие замковые части, из металлов (ножницы хирургические, зажимы кровоостанавливающие, корнцанги, стоматологические щипцы).
В качестве тест-загрязнения применяют донорскую кровь. Эксперименты проводят при температуре воздуха в помещении (20 +/- 2) °C.
В день постановки эксперимента тест-изделия загрязняют донорской кровью с помощью глазной или стеклянной (объем 1 — 2 мл) пипетки: на поверхность рабочей части тест-изделия наносят одну каплю и в замковую часть две капли крови (диаметр каждой капли не менее 3 мм) и делают несколько рабочих движений для проникновения крови в труднодоступные участки замковой части инструмента.
Загрязненные тест-изделия подсушивают до полного высыхания в течение 45 — 90 мин. (в зависимости от температуры и влажности воздуха в помещении).
Тест-изделия, загрязненные кровью, ополаскивают под проточной питьевой водой в течение 30 с (при изучении средства, предназначенного для совмещения процесса очистки и дезинфекции, ополаскивание тест-изделий не проводят) и размещают их в загрузочной корзине ультразвуковой установки, раскладывая их раскрытыми, обеспечивая свободный доступ рабочего раствора средства. Тест-изделия размещают не более чем в 3 слоя, при этом каждый последующий слой располагают со сдвигом по отношению к тест-изделиям предыдущего слоя.
Загрузочную корзину с тест-изделиями погружают в рабочую ванну ультразвуковой установки с приготовленным рабочим раствором изучаемого средства и подвергают ультразвуковому воздействию различное время (максимальное время ультразвукового воздействия не должно превышать 15 мин.; для стоматологических щипцов — 20 мин.).
По окончании ультразвуковой обработки извлекают загрузочную корзину, вынимают тест-изделия и помещают их в пластмассовую емкость для ополаскивания проточной питьевой водой 1 мин.
Качество очистки изделий от кровяных загрязнений после обработки раствором средства механизированным способом оценивают с помощью азопирамовой пробы в соответствии с методикой, изложенной в п. 5.9.3.1.
5.9.3.2. Определение эффективности средств
в практических условиях
Определение эффективности средств
для предстерилизационной очистки ручным способом
Эффективность средства в практических условиях оценивают в соответствии с программой и методикой проведения медицинских испытаний конкретного моющего или моюще-дезинфицирующего средства в ЛПУ по режимам, указанным в данной программе [68].
Целью медицинских испытаний является оценка режимов, разработанных при проведении исследований эффективности средства для цели предстерилизационной очистки, в т.ч. совмещенной с процессом дезинфекции, изделий медицинского назначения.
Определение эффективности средства в практических условиях проводит персонал, осуществляющий в ЛПУ подготовку изделий медицинского назначения к стерилизации.
Медицинские испытания проводят не менее чем в течение 1 месяца при ежедневном использовании средства для обработки изделий.
Для определения эффективности средств для предстерилизационной очистки (моющих свойств) ручным способом используют изделия, которые должны быть подвергнуты стерилизации перед их использованием у пациентов, из различных материалов (металла, резины на основе натурального и синтетического каучука, пластмассы, стекла).
Готовые к применению средства (не требующие разбавления) используют в экспериментах в исходном виде. Из средств в виде порошка или жидкого концентрата готовят рабочие растворы с различными, подлежащими изучению концентрациями действующего вещества (действующих веществ). Эксперименты проводят при температуре рабочих растворов, указанной в программе.
Изделия, подлежащие очистке, промывают под проточной питьевой водой в течение 30 с и погружают (замачивают) на различное время (указано в программе испытаний) в средство (рабочий раствор), каждый раз по окончании которого осуществляют механическую очистку с помощью различных приспособлений (щетки, ерши, марлевые салфетки, ватные тампоны, шприцы — в зависимости от конструкционных особенностей тест-изделий) в той же порции средства (рабочего раствора), в которой проводили замачивание. После окончания механической очистки изделия ополаскивают проточной питьевой водой (время указано в программе) и дистиллированной водой.
При работе со средствами, предназначенными одновременно для дезинфекции изделий медицинского назначения, для оценки моющих свойств используют рабочие растворы тех концентраций и при том времени воздействия, которые оказались эффективными при оценке антимикробных свойств. Все манипуляции проводят аналогично указанному в п. 5.9.2, за исключением этапа промывания под проточной питьевой водой.
Оценку эффективности средства (моющих свойств) проводят путем постановки азопирамовой пробы, оценивая наличие или отсутствие крови на изделиях, подвергнутых очистке, в соответствии с методикой, изложенной в п. 5.9.3.1.
Результаты медицинских испытаний оформляют в форме протокола.
В протоколе должны быть отражены:
— наименование лечебно-профилактического учреждения;
— наименование отделений, где испытывалось средство;
— дата начала и окончания испытаний;
— порядок проведения испытаний;
— характеристика испытывавшегося средства;
— использованные режимы очистки (совмещенной и/или не совмещенной с процессом дезинфекции);
— перечень изделий, подвергнутых обработке;
— результаты, полученные в ходе испытаний, их анализ;
— замечания и предложения (при их наличии) по использованию средства в ЛПУ;
— вывод о возможности применения средства для обработки различных изделий медицинского назначения в ЛПУ.
Определение эффективности средств
для предстерилизационной очистки механизированным способом
Эффективность средства в практических условиях оценивают в соответствии с программой и методикой проведения медицинских испытаний конкретного моющего или моюще-дезинфицирующего средства в ЛПУ по режимам, указанным в данной программе [68].
Целью медицинских испытаний является оценка режимов, разработанных при проведении исследований эффективности средства для цели предстерилизационной очистки, в т.ч. совмещенной с процессом дезинфекции, изделий медицинского назначения.
Определение эффективности средства в практических условиях проводит персонал, осуществляющий в ЛПУ подготовку изделий медицинского назначения к стерилизации.
Медицинские испытания проводят не менее чем в течение 1 месяца при ежедневном использовании средства для обработки изделий.
Экспериментальные исследования по оценке эффективности средств для предстерилизационной очистки механизированным способом проводят в ультразвуковых установках, зарегистрированных в Российской Федерации и разрешенных к применению в лечебно-профилактических учреждениях для очистки изделий медицинского назначения из металлов.
Для определения эффективности средств (моющих свойств) для предстерилизационной очистки механизированным способом используют изделия из металлов, которые должны быть подвергнуты стерилизации перед их использованием у пациентов.
Готовые к применению средства (не требующие разбавления) используют в экспериментах в исходном виде. Из средств в виде порошка или жидкого концентрата готовят рабочие растворы с различными, подлежащими изучению концентрациями действующего вещества (действующих веществ). Эксперименты проводят при температуре рабочих растворов, указанной в программе.
Изделия, подлежащие очистке, промывают под проточной питьевой водой в течение 30 с (при испытании средства, предназначенного для совмещения процесса очистки и дезинфекции, ополаскивание изделий не проводят) и размещают их в загрузочной корзине ультразвуковой установки, раскладывая их раскрытыми, обеспечивая свободный доступ рабочего раствора средства. Изделия размещают не более чем в 2 — 3 слоя (определяется программой испытаний), при этом каждый последующий слой располагают со сдвигом по отношению к изделиям предыдущего слоя.
Загрузочную корзину с изделиями погружают в рабочую ванну ультразвуковой установки с приготовленным рабочим раствором изучаемого средства и подвергают ультразвуковому воздействию различное время (указано в программе испытаний).
По окончании ультразвуковой обработки извлекают загрузочную корзину, вынимают изделия и помещают их в пластмассовую емкость для ополаскивания проточной питьевой водой (определяется программой испытаний).
Оценку эффективности средства (моющих свойств) проводят путем постановки азопирамовой пробы, оценивая наличие или отсутствие крови на изделиях, подвергнутых очистке механизированным способом, в соответствии с методикой, изложенной в п. 5.9.3.1.
Результаты медицинских испытаний оформляют в форме протокола.
В протоколе должны быть отражены:
— наименование лечебно-профилактического учреждения;
— наименование отделений, где испытывалось средство;
— дата начала и окончания испытаний;
— порядок проведения испытаний;
— характеристика использованных ультразвуковых установок;
— характеристика испытанного средства;
— использованные режимы очистки (совмещенной и/или не совмещенной с процессом дезинфекции);
— перечень изделий, подвергнутых обработке;
— результаты, полученные в ходе испытаний, их анализ;
— замечания и предложения (при их наличии) по использованию средства в ЛПУ;
— вывод о возможности применения средства для обработки в ЛПУ изделий из металлов механизированным способом.
6. Энтомологические методы исследований и критерии
оценки эффективности дезинсекционных средств
6.1. Общие положения. Организация экспериментов
6.1.1. Общие положения
При разработке и изучении средств медицинской дезинсекции необходимо учитывать то, что членистоногие, имеющие эпидемиологическое и санитарно-гигиеническое значение, являются представителями двух классов (насекомых и клещей), относятся к разным отрядам и семействам, обитающим в разных (в различных) экосистемах.
Более того, насекомые делятся на две большие группы: с неполным превращением и полным превращением. У насекомых с неполным превращением личинки и нимфы внешне похожи на имагинальную стадию, отсутствует стадия куколки и они обитают в тех же условиях, что и взрослые. У насекомых с полным превращением кроме стадии яйца и личинки имеется стадия куколки и личинки совершенно не похожи на взрослое насекомое, обитают и развиваются в иной среде. Типичным примером насекомого с полным типом превращения являются комары, у которых личинки развиваются в водной среде, комары-имаго — на суше. Кроме того, насекомым и клещам присуща как видовая чувствительность к различным химическим веществам и физическим факторам, так и разная чувствительность стадий развития. Разные виды насекомых и клещей по-разному реагируют на химические стимулы, отпугивающие или привлекающие их.
В связи со сказанным выше, разнообразны как вещества (физические, биологические факторы), убивающие членистоногих или воздействующие на процессы их роста и развития, отпугивающие или привлекающие их, так и препаративные формы, которые наиболее приемлемы для применения в различных биотопах с целью подавления представителей типа членистоногих, и разнообразны методы изучения действующих веществ субстанций и препаративных форм на их основе (препараты, средства) [72].
Ниже излагаются методы, применяемые для выявления и изучения инсектицидных, акарицидных, репеллентных и рострегулирующих свойств химических веществ, физических и биологических агентов и средств на их основе.
6.1.2. Организация экспериментов
В зависимости от необходимости установления инсектицидных, акарицидных или других типов действий у веществ, которые не имеют такой характеристики, проводят исследования на ограниченном количестве лабораторных культур насекомых и клещей в выбранной в зависимости от класса химических веществ концентрации или дозе.
При выявлении той или иной активности проводят углубленные исследования, увеличивая количество биообъектов, используя серии концентраций или доз.
При оценке активности описанных веществ ее выявляют в экспериментах параллельно с эталонным образцом такого же вещества, биообъекты и методы испытаний выбирают в зависимости от целевой активности.
Оценку активности препаративных форм средств проводят на лабораторных культурах членистоногих, а также на природных популяциях членистоногих в лабораторных или натурных экспериментах в различных режимах применения.
6.1.2.1. Тест-членистоногие, используемые в экспериментах
Членистоногие, используемые в экспериментах, могут разводиться в лабораторных условиях или отлавливаться в природе. Кроме того, могут быть использованы модельные объекты, которые легко культивировать в лаборатории, но данные, полученные на этих объектах, могут быть перенесены на другие целевые виды [67]. Такое перенесение возможно только после проведения многократных экспериментов и получения достоверно сходных данных.
В лабораторных условиях культивируют:
Класс насекомые Insecta:
— отряд таракановых: рыжие тараканы Blattella germanica L., американские тараканы Periplaneta americana L. (международные тест-объекты) и черные тараканы Blatta orientalis L. В экспериментах используют самок до выдвижения оотеки, самцов 3 — 21-дневного возрастов и личинок разных возрастов. При изучении кишечного действия инсектицидов в опытах используют голодных тараканов, которым за 12 ч до опыта дают только воду, но не дают пищи;
— отряд полужесткокрылых: постельный клоп Cimex lectularius L. В экспериментах используют самцов и самок 5-дневного возраста, накормленных за 3 ч до опыта на морских свинках, кроликах или белых мышах, яйца 3 — 5-дневные;
— отряд вшей: платяные вши Pediculus humanus corporis De Geer. В эксперименте используют имаго (самки, самцы 15-дневного возраста, накормленные не ранее чем за 1 ч до опыта), личинок 3-го возраста, яйца любых возрастов в зависимости от целей эксперимента. Платяные вши легче культивируются в лабораторных условиях, они более устойчивы к инсектицидам, чем головные и лобковые, поэтому данные, получаемые на этом объекте, можно переносить на два других вида вшей;
— отряд перепончатокрылых: рыжий домовый муравей Monomorium pharaonis L. В эксперименте используют рабочих особей и самок;
— отряд блох: крысиная блоха Xenopsylla cheopis Roth. В экспериментах используют самцов и самок 5-дневного возраста, накормленных на белых мышах за 3 ч до опыта, личинок 2-го и последнего возрастов. Этот вид наиболее значим, поскольку является переносчиком возбудителя чумы, кроме того, по видовой чувствительности близок другим видам блох. При изучении репеллентной активности веществ используют голодных имаго блох 2 — 3-недельного возраста [82];
— отряд двукрылых: комнатные мухи Musca domestica L. В экспериментах используют самок и самцов 3 — 5-дневного возраста, питавшихся молоком и сахарным сиропом, свежеотложенные яйца, личинок разных возрастов и куколок. Комнатные мухи являются международным тест-объектом, на котором можно тестировать различные вещества и средства, данные, полученные на мухах, можно ориентировочно переносить на другие виды мух и ос. При изучении кишечного действия инсектицидов в опытах используют голодных мух, которым за 12 ч до опыта дают только воду, но не дают пищи.
Комары. Желтолихорадочный комар Aedes aegypti L. — международный биообъект. Подвальные комары Culex pipiens molestus Forsk. Малярийные комары Anopheles maculipennis Meigen, An. stephensi, An. atroparous. В экспериментах используют самок 5-дневного возраста, накормленных раствором сахара в воде за 3 ч до опыта, личинок 2, 3-го и начала 4-го возрастов и куколок, развивающихся в водопроводной дехлорированной воде. При изучении репеллентной активности веществ используют голодных имаго комаров 8 — 10-дневного возраста;
— отряд жесткокрылых: кожееды Attagenus smirnovi Zhant. В экспериментах используют имаго и личинок 11 — 12-дневного возраста. Является тестовым объектом для всех видов кожеедов;
— отряд чешуекрылых: платяная моль Tineola bisselliella Humm. В экспериментах используют бабочек и гусениц 28 — 30-дневного возраста. Является тестовым объектом для всех видов молей (шубной, ковровой, мебельной).
Класс клещи Acarina:
— чесоточные — ушной кроличий клещ Psoroptes cuniculi Hering; модельный объект для чесоточного клеща человека. В эксперименте используют самок;
— гамазовые — крысиный клещ Ornythonissus bacoti Hirst. В эксперименте используют взрослых клещей;
— клещи домашней пыли Dermatophagoides pteronyssinus Trouessart и D. farinae Huges. В экспериментах используют имаго, личинок;
— иксодовые: таежный Ixodes persulcatus P. Sch. и лесной I. ricinus L., клещи родов Dermacentor, Hyalomma и др. В экспериментах используют активных голодных имаго и нимф;
— аргасовые Ornithodorus papillipes Bir. нимфы 3-го и 4-го возрастов, голодавшие не более 5 — 7 месяцев; самки, самцы, голодавшие не более 1 года.
Природные популяции членистоногих, которые можно использовать в лабораторных экспериментах:
— муравьи: рыжий домовый муравей Monomorium pharaonis L., черный садовый муравей Lasius niger L. и муравей Myrmica rubra L. рабочие особи;
— вши: платяные Pediculus humanus corporis De Geer. и головные Pediculus humanus capitus вши имаго, личинки и яйца;
— комары: различные виды родов Aedes, Culex, Anopheles (личинки, имаго);
— клещи: иксодовые таежный Ixodes persulcatus P. Sch. и лесной I. ricinus L. — активные голодные имаго; родов Dermacentor, Hyalomma и др. активные голодные имаго [57, 67].
При проведении натурных экспериментов перечень видов членистоногих увеличивается. Так, в природных условиях эффективность устанавливается для следующих видов: тараканы, постельные клопы, разные виды блох, муравьи, комнатные и другие виды мух, комары, слепни, мошки, москиты, мокрецы, вши, иксодовые, аргасовые и гамазовые клещи. Приведенный список может быть расширен.
6.1.2.2. Принципы приготовления рабочих растворов
для проведения экспериментов и расчеты активности
субстанций и препаративных форм
Для проведения экспериментов необходимо в зависимости от биообъектов и характера опытов подобрать концентрации рабочих растворов. Вначале готовят серию из 4 — 5 концентраций с шагом разведения 10. В качестве растворителей следует использовать ацетон, этиловый спирт или воду.
На аналитических весах берут навеску субстанции или средства и готовят
исходный рабочий раствор определенной концентрации (C ), которую можно
исх
рассчитать по нижеприведенным формулам:
а) для субстанций по формуле 1:
A x B
C = ——, (1)
исх C
где:
A — необходимая концентрация ДВ, % (мг/л, мг/мл);
B — необходимое количество раствора, мл;
C — концентрация ДВ в веществе, % (мг/л, мг/мл).
Пример 1: из вещества, содержащего 90% ДВ, необходимо приготовить 100 мл раствора с концентрацией ДВ 0,3%.
C = 0,3 x 100 : 90 = 0,33 мл (г), т.е. к 99,67 мл растворителя
исх
необходимо добавить 0,33 мл испытуемого вещества.
Пример 2: из 50%-ного концентрата эмульсии необходимо приготовить
0,7%-ную водную эмульсию. C = 0,7 x 100 : 50 = 1,4 мл;
исх
б) для препаративной формы:
В том случае, если необходимо приготовить раствор заданной концентрации
для обработки определенной площади так, чтобы получить заданную дозировку,
производится расчет по формуле 2:
D x S
C = ——— x 100%, (2)
исх C x V
преп
где:
C — концентрация ДВ в средстве, % (мг/л, мг/мл);
преп
C — концентрация ДВ в исходном растворе, % (мг/л, мг/мл);
исх
D — заданная доза, мг/кв. м (г/кв. м);
S — площадь обрабатываемой поверхности, кв. м (кв. см, га);
V — объем препарата для обработки этой поверхности, куб. см, мл, л.
Пример: нужно получить дозу (D) величиной 0,1 г/кв. м при обработке
диска из фильтровальной бумаги площадью (S) 78 кв. см (0,0078 кв. м)
раствором в объеме (V) 1 мл. Концентрация ДВ в препарате (C ) — 5%,
преп
0,05. Все показатели используются в одной размерности — граммы и квадратные
метры или килограммы, литры и гектары. Проценты даются десятичной дробью
5% = 0,05.
Расчет: C = (0,1 x 0,0078) : (0,05 x 1) x 100% = 1,56%.
исх
То есть для получения исходного (рабочего) раствора нужно приготовить 1,56%-ный раствор препарата (развести в соотношении 1:63).
Из исходного раствора готовят серию 10-кратных разведений. Для этого к 1 мл исходного раствора добавляют 9 мл растворителя и в результате получают второе разведение; к 1 мл второго разведения добавляют 9 мл растворителя и получают третье разведение и т.д. В нашем примере получаем серию растворов, один мл которых на фильтрах стандартного размера обеспечивает дозировки 0,1 г/кв. м, 0,01 г/кв. м, 0,001 г/кв. м и т.д.
Для более точного нахождения среднесмертельных концентраций доз готовят серии концентраций (не менее 4 — 5) с шагом разведения 2 или менее в зависимости от вида членистоногого, типа субстанции или средства.
Инсектоакарицидную активность оценивают по проценту гибели членистоногих в опытных вариантах по сравнению с контрольным. В качестве контрольного варианта следует использовать или необработанных членистоногих, или обработанных растворителем, используемым для приготовления рабочих растворов, или контакт членистоногих с поверхностью, обработанной растворителем.
В зависимости от организации эксперимента возможны 3 варианта оценки инсектоакарицидной активности.
Опыт, при котором членистоногое контактирует с испытуемым веществом, нанесенным на поверхность (или при топикальном нанесении вещества на тело), и в контроле — с растворителем или необработанной поверхностью. В этом случае инсектоакарицидную активность вещества Y в каждой повторности оценивают по формуле 3:
B B
0 k
Y = — x (1 — —) x 100%, (3)
A A
0 k
где:
A и A — исходное количество особей в опыте и контроле;
0 k
B и B — количество погибших особей в опыте и контроле.
0 k
Заключительная оценка представляет среднюю величину из всех
повторностей опыта. Формула 4 учитывает уровень гибели насекомых в контроле
и опыте. В случае гибели в контроле 5 — 20% особей, а яиц вшей свыше 20%, к
данным опытов вводят поправку по формуле Аббота:
A — B
C = ——- x 100, (4)
100 — B
где:
A — гибель насекомых в опыте, %;
B — гибель насекомых в контроле, %.
Если гибель особей в контроле превышает 20%, то опыт бракуют. Для получения более надежных оценок препарата исследование следует повторить с более жизнеспособной культурой членистоногих или изменить условия опыта в сторону большей их комфортности для объекта как в контроле, так и в опыте.
Если по каким-то причинам постановка контроля невозможна и об инсектицидной активности приходится судить только по числу (численности) особей до и после применения вещества, формулу упрощают (формула 5):
1 — B
0
Y = —— x 100%. (5)
A
0
Для определения СД , СК используют графический способ
5095,99 5095,99
вычисления этих показателей, применяя пробит-логарифмическую бумагу. На оси
абсцисс откладывают дозы ДВ (г/кв. м, мкг/г массы насекомого, мг/особь) или
концентрации (%) в последовательных разведениях. На оси ординат — % гибели
насекомых при этих дозах (концентрациях). Между полученными точками
проводят линию регрессии. Для определения СД (СК ) проводят
50 50
горизонтальную линию на уровне 50% до пересечения с линией графика.
Опущенный из точки пересечения перпендикуляр на ось абсцисс покажет
по шкале на этой оси искомое значение. Проводя горизонтальную прямую на
других уровнях и опуская перпендикуляр, можно определить соответствующие
другие значения СД, СК, например, для определения СД горизонтальную
95
прямую до пересечения с линией графика проводят на уровне 95% и т.д.
Для определения массы одного членистоногого до опыта взвешивают не
менее 10 анестезированных особей (обычно от 10 до 100 особей).
Пересчет концентрации (%) в дозу (мкг/г массы членистоногого) при
использовании топикального метода нанесения проводят по формуле 6:
A x 10 x Y x 1000
СД , мкг/г = ——————, (6)
50 B
где:
A — концентрация СК ,%;
50
Y — нанесенный объем, мкл;
B — масса членистоногого, мг.
Таким образом, возможен перевод любой концентрации в дозу.
Пересчет величин СД (ЛД ) мкг на 1 г массы проводят по
5095,99 5095,99
формуле 7:
x
ЛД = — x 1000, (7)
5095,99 y
где:
x — ЛД на 1 членистоногое в мкг;
5095,99
y — средняя масса 1 членистоногого в мг.
Средняя арифметическая величина вычисляется по формуле 8:
SUM V
X = ——, (8)
n
где:
V — гибель членистоногих в каждом опыте, %;
SUM — знак суммы;
n — число повторностей.
Ошибку среднего значения инсектицидной активности средства (и других
средних величин) рассчитывают по известной формуле ошибки средней:
____________
/ 2
/ 2 SUM V
/ ——
дельта /SUM V — n
m = ——; дельта = /—————-, (9)
_ / n — 1
/n
где:
V — значение инсектицидной активности в каждой из повторностей опыта, %;
n — число повторностей;
SUM — знак суммы.
Из-за малого числа повторностей ошибка средней в энтомо-токсикологических исследованиях может быть очень велика, особенно в диапазоне около 50%, но при приближении средней эффективности к 100% она снижается. Так, при эффективности препарата в трех повторностях 70, 80 и 90% ошибка составит 7,1%, а при значениях эффективности 85, 90 и 95% — 3,5%.
Для оценки степени достоверности средней величины X при данном числе наблюдений используют формулу 10 для подсчета ошибки средней:
P x 100 — P
x = +/- ————, (10)
n
где:
P — среднее квадратичное отклонение;
n — число наблюдений.
Значение среднего квадратичного отклонения получают по формуле:
2
SUM x
X = ——, (11)
n — 1
где:
2
x — сумма квадратов отклонения от среднего (дисперсия);
n — число наблюдений.
Коэффициент отпугивающего действия для насекомых рассчитывают по
формуле 12:
A — B
КОД = —— x 100, (12)
A
где:
A — количество насекомых на необработанной поверхности за определенный промежуток времени;
B — количество насекомых на обработанной репеллентом поверхности за такой же промежуток времени.
Коэффициент отпугивающего действия для клещей рассчитывают по той же формуле 12, где: A — количество клещей, взятых в опыт; B — количество клещей, прошедших обработанную репеллентом зону.
При испытании веществ в природе, когда об их эффективности судят по уменьшению численности объектов на опытном и контрольном участках, расчет проводят по формуле:
A x B
t 0
Y = 100 — ——- x 100, (13)
A x B
0 t
где:
A — количество объектов на опытном участке до обработки;
0
B — количество объектов на контрольном участке до обработки;
0
A — количество объектов через t суток (часов) на опытном участке после
t
обработки;
B — количество объектов через t суток (часов) в контроле после
t
обработки.
6.2. Методы определения активности действующих
веществ (субстанций) дезинсекционных средств
6.2.1. Общие методы определения инсектоакарицидных
свойств действующих веществ (субстанций)
6.2.1.1. Метод топикального нанесения
инсектоакарицидов на членистоногих
Растворы инсектоакарицидов (спиртовые или ацетоновые) определенного объема с помощью микродозатора наносят на среднеспинку мух, среднегрудь клопов и тараканов или на спинной щиток иксодовых или аргасовых клещей [72]. В качестве микродозатора можно использовать микрошприцы, специальные аппликаторы или петли из некорродирующей проволоки. Размер капли должен быть сопоставим с размером членистоногого, но не должен его превышать. Рекомендуются следующие размеры капель: для мух, тараканов и клопов — 1 мкл, для постельных клопов — 0,5 мкл, для иксодоидных клещей — 0,3 мкл. В опыте используют не менее 5 — 7 концентраций инсектицидов. Параллельно ставят 2 контрольных варианта, в первом — на членистоногих наносят растворитель без инсектоакарицида, во втором — членистоногих оставляют без обработки. Все опыты ставят в 3 повторностях, в каждой по 10 — 20 особей. В период проведения опытов температура воздуха в помещении должна составлять 21 — 23 °C, относительная влажность — 55 — 60%.
Членистоногих после нанесения инсектоакарицида (растворителя) и его высыхания помещают в чистые сосуды: клопов и аргасовых клещей — в пробирки с фильтровальной бумагой, сложенной «гармошкой»; иксодовых клещей в — пробирки с дифференцированной влажностью; мух и тараканов — в стаканы. Тараканам дают пищу. Сосуды с членистоногими размещают в условиях постоянной температуры (22 +/- 2) °C и освещенности или при комнатной температуре и естественной освещенности. Учет результатов опытов для комнатных мух проводят через 24 ч; клопов, тараканов, клещей — ежедневно в течение 1 — 5 суток в зависимости от химической принадлежности инсектоакарицида. К живым относят особей, способных к направленному передвижению, а особей неподвижных или с резкими нарушениями координации — к мертвым. Если смертность членистоногих в контрольном варианте составляет более 5%, то в расчеты гибели необходимо вводить поправку по формуле Аббота (формула 4).
При проведении экспериментов используют не менее 5 концентраций,
которые должны вызывать гибель в интервале 0,1 — 99,9%. Полученные
результаты обрабатывают с помощью пробит-анализа, строя кривую регрессии
«концентрация-гибель» или «доза-гибель». По кривой регрессии рассчитывают
показатели СК , % (ЛД , мкг/г), СК , % (ЛД , мкг/г), СК , % (ЛД ,
50 50 95 95 99 99
мкг/г).
При указании данных по летальным концентрациям или дозам необходимо указывать вид членистоногого, при необходимости пол, стадию развития, происхождение расы или популяции, температуру при проведении экспериментов. Наличие таких сведений позволяет сравнивать данные разных экспериментаторов.
Если перед началом исследований неизвестен диапазон концентраций, вызывающих такую гибель, то целесообразно поставить ориентировочный опыт с интервалом разведений концентраций в 10 раз.
Точно дозированное количество растворов инсектоакарицидов, как указывалось выше, также может быть нанесено на членистоногих с помощью петли из проволоки.
Подготовка петли. Петля должна быть изготовлена из некорродирующего материала (платина, родий, держатель спирали в электролампе) путем наматывания на иглу одного завитка. Форма петли должна быть круглой. Затем в месте соединения петли и стержня делают изгиб под прямым углом и стержень петли прикрепляют к держателю (микробиологический держатель, цанговый карандаш и др.).
Калибровка петли. Петлю калибруют путем перенесения 0,5 мл спирта из маленького стаканчика объемом 1 мл на фильтровальную бумагу с подсчетом количества перенесенных капель. Опыт повторяют не менее 3 раз. Оптимальным является объем петли 1 мкл, 0,5 мл = 500 капель.
6.2.1.2. Методы опрыскивания насекомых
и тест-поверхностей
Метод опрыскивания с помощью опрыскивателей различного типа (пульверизаторы, беспропеллентные упаковки, квазары). Членистоногих и тест-поверхности помещают на фильтровальную бумагу и опрыскивают рабочими растворами, подбирая необходимый объем жидкости в зависимости от объекта и тест-поверхности. При необходимости членистоногих предварительно анестезируют. После высыхания жидкости членистоногих переносят в чистые пластиковые или стеклянные стаканы.
Метод опрыскивания насекомых и тест-поверхностей с помощью опрыскивателя с вращающимся столиком (опрыскиватель Поттера). Опрыскиватель состоит из следующих основных частей: распылитель жидкости, вращающийся столик для размещения биологических объектов, колпак, воздуходувка с мотором для подачи сжатого воздуха. Собственно распылитель изготавливают из латуни, нержавеющей стали или бронзы. Распылитель вставляют в отверстие колпака, воздушный шланг, идущий от воздуходувки, соединяют с распылителем. Колпак обычно делают из стекла или нержавеющей стали с окошком для наблюдения за ходом опрыскивания, высота его 40 — 45 см. Столик опрыскивателя делают вращающимся со скоростью 30 — 40 об./мин. для обеспечения равномерного покрытия поверхности каплями инсектицида. Столик снабжают тарелкой с отверстием посередине и бортиками. На столик опрыскивателя помещают чашки с обездвиженными диэтиловым эфиром насекомыми (или раскладывают их на круг фильтровальной бумаги), ставят колпак. Устанавливают на колпак распылитель, в патрубок распылителя заливают отмеренное количество рабочего раствора определенной концентрации инсектицида (например, 2,5 мл), включают мотор столика и воздуходувку. Жидкость вытекает через центральную трубку и разбивается конической струей воздуха, проходящей через щели между центральной трубкой и наконечником. Мелкие капли оседают на столик, стенки колпака и опрыскиваемые предметы. Растворы могут быть водными, спиртово-водными или приготовленными на 60%-м ацетоне, поскольку растворы на чистом спирте или ацетоне слишком сильно испаряются. Количество жидкости, заливаемой в опрыскиватель, подбирается экспериментально, путем сравнения результатов, полученных методом опрыскивания, с результатами, полученными методом топикального нанесения инсектицида откалиброванной петлей или микрошприцем (микродозатором) [72].
6.2.1.3. Методы принудительного контакта членистоногих
с поверхностями, обработанными инсектоакарицидами
Остаточное действие инсектоакарицидов определяют, используя метод принудительного контакта членистоногих с обработанными поверхностями. Членистоногих подсаживают на поверхности, используя два типа экспозиметров или без их применения.
В первом случае используют: стеклянные экспозиметры Набокова-Ларюхина высотой 13 — 15 см, диаметром 3,5 — 4,0 см; стеклянные экспозиметры высотой 8 — 10 см, диаметром 8 — 9 см по методу CSMA (Chemical Specialities Manufacturers Association), который применяется в международной практике для тестирования инсектицидных средств. Время контакта в экспозиметрах Набокова-Ларюхина — 5 — 15 мин., в больших экспозиметрах CSMA — 1 ч и более.
Экспозиметры приспосабливают для работы с разными насекомыми. Так, для экспериментов с тараканами экспозиметры смазывают вазелином; для мух используют специальный стеклянный поршень, прижимающий насекомых к поверхности; для блох экспозиметр накрывают влажной многослойной марлевой салфеткой. Время контакта тараканов и постельных клопов — 15 мин, крысиных блох и комнатных мух — 5 мин. Насекомых после контакта с обработанными пластинами переносят в чистые пластиковые или стеклянные стаканы и регистрируют их состояние (без внешних признаков паралича, парализованные, мертвые) в течение 24 — 48 ч.
Контактирование имаго комаров можно проводить также в пластмассовых экспозиметрах — конусах, рекомендованных ВОЗ для биотестов с обработанными инсектицидами поверхностями. Внутренний диаметр конуса — 85 мм у основания, высота — 55 мм. Конусы сделаны из прозрачного гладкого пластика. В отверстие в центре конуса запускают самок комаров с помощью стандартного аспиратора с загнутым концом (диаметром 10 мм). Комары остаются в экспозиметре (т.е. принудительно контактируют с обработанной поверхностью) в течение 30 мин. После этого комаров переносят в чистые садки.
Поверхности разных типов — пластины размером 10 x 20 см из стекла, фанеры, фанеры, окрашенной масляной краской, линолеума и т.п. — обрабатывают раствором вещества или рабочими жидкостями, изготовленными из препаративных форм (концентраты эмульсии, суспензий, смачивающиеся порошки, флоу, гели и др.).
Для обработки поверхностей пластин, не впитывающих жидкость (стекло), используют 50 мл/кв. м рабочей жидкости; для обработки поверхностей, впитывающих жидкость (фанера), — 100 мл/кв. м. При обработке порошками их равномерно распределяют по поверхности кисточкой при норме расхода 3 — 10 г/кв. м. При испытании инсектицидных карандашей (брусков и т.п.) ими обрабатывают только фанерные пластинки. Количество препаративной формы, находящейся на пластине, вычисляют путем взвешивания пластинки до обработки и после нее. Расчет ДВ проводят на 1 кв. м.
Без использования экспозиметров эксперимент можно проводить с комнатными мухами, блохами и иксодовыми клещами.
Комнатные мухи. Принудительный контакт комнатных мух с действующими веществами инсектицидов осуществляют в биологических пробирках. Пробирки обрабатывают ацетоновыми растворами ДВ инсектицидов в логарифмически снижающихся концентрациях (не менее 5 концентраций) из расчета 1 мл/кв. дм, высушивают в потоке теплого воздуха при непрерывном вращении в горизонтальном положении. Время контакта мух составляет 15, 30, 60 мин., после чего их высаживают в пластиковые контейнеры объемом около 250 мл (пластиковые бутылки со срезанным и затянутым марлей дном). Насекомым дают ватные тампоны, смоченные водой. Поражение мух учитывают каждый час после экспозиции до 6 ч и через 24 и 48 ч подсчитывают число погибших насекомых. Повторность опыта 3 — 5-кратная, по 10 особей в каждом варианте.
Блохи. Определение токсичности ДВ инсектицидов для крысиных блох Xenopsylla cheopis (Roths) проводят с использованием непитавшихся блох 1 — 3-недельного возраста без разделения по полу путем подсадки на импрегнированную инсектицидом фильтровальную бумагу.
Приготовление импрегнированной бумаги ведут непосредственно перед проведением опытов путем пропитки стандартных обеззоленных фильтров (синяя лента) ацетоновыми растворами инсектицидов в логарифмически снижающихся концентрациях. Расход жидкости составляет 1 мл/100 кв. см. После высыхания бумагу разрезают ножницами на прямоугольники размером 5 x 1 см. Импрегнированную бумагу используют в течение 3 суток, но не ранее чем через 1 ч после высыхания растворителя.
Взрослых блох лабораторной культуры помещают в пробирки по 20 шт.,
затем опускают в них кусочки импрегнированной бумаги. Через 1 ч бумагу
аккуратно извлекают, а пробирки с блохами помещают в темный термостат при
температуре 26 °C и относительной влажности > 50%. Учет смертности проводят
через 24 ч после окончания экспозиции. Блох, лежащих на спине, неспособных
самостоятельно перевернуться, относят к погибшим и определяют показатели
СК , % (СК , %). С каждой концентрацией инсектицида проводят 3 опыта не
50 95
менее чем в 3 повторностях, используя не менее 20 насекомых на одну
повторность. Для каждого опыта ставят три контрольных варианта (1 —
необработанная бумага, 2 — обработанная ацетоном бумага, 3 — блохи в
пробирках без бумаги), в каждом из которых используют не менее
20 насекомых. Из контрольных вариантов, так же как из опытных, бумагу
извлекают через 1 ч.
Иксодовые клещи. Контактирование иксодовых клещей с обработанными поверхностями проводят, используя фильтровальную бумагу. Бумагу в виде круга диаметром 10 см (площадь — 78 кв. см) размещают горизонтально на невпитывающей поверхности (стекло, глазурованная керамическая плитка и т.д.) и с помощью пипетки равномерно наносят на нее раствор изучаемого вещества в ацетоне (серия концентраций не менее 5) из расчета 1 мл раствора на 100 кв. см или 0,78 мл на круг. В контрольном варианте на круги такой же бумаги наносят тем же способом растворитель. После испарения растворителя круги помещают на дно чашек Петри так, чтобы края круга поднимались на стенки чашки. Продолжительность контакта клещей с бумагой 1 мин. Клещей, выползающих за пределы круга, кисточкой возвращают на бумагу. Поскольку клещи достаточно подвижны, одновременно в чашку Петри целесообразно помещать не более 2 — 3 клещей. В опыте с каждой концентрацией вещества используют по 30 клещей. Опыты с самками и самцами клещей ставят и учитывают раздельно, поскольку есть данные о разной чувствительности к акарицидам особей разного пола. Сразу после контакта клещей кисточкой переносят в пробирки дифференцированной влажности (по 10 особей в пробирке), которые размещают горизонтально в условиях постоянной температуры (около 25 °C) и освещенности или при комнатной температуре и естественной освещенности. Все работы с контрольными клещами должны быть проведены на отдельном столе с использованием незагрязненных инструментов (ножниц, кисточек и т.д.). Работы с разными концентрациями необходимо начинать с меньших. Учет гибели иксодовых клещей проводят через сутки после опыта. К живым относят особей, способных к передвижению, а неподвижных, почти неподвижных и клещей с резкими нарушениями координации относят к категории мертвых. Если смертность клещей в контроле составляет более 5%, то в дальнейшие расчеты необходимо вводить поправку по формуле Аббота (формула 4). Полученные данные обрабатывают с помощью метода пробит-анализа.
6.2.1.4. Метод свободного контакта членистоногих
с поверхностями, обработанными инсектоакарицидами
Этот метод позволяет более полно оценить инсектоакарицидное средство с учетом степени его репеллентности.
Тараканы. Опыты с тараканами проводят в специальных полигонах площадью не менее 0,2 кв. м (40 x 50 см) и высотой бортов 12 — 20 см, края которых смазаны вазелином. В центре полигона помещают пластинку (стекло, фанера) размером 10 x 10 см, верхняя сторона которой обработана инсектицидом в определенной выбранной дозе, обеспечивающей 50, 95 или 99% гибели тараканов в опыте с принудительным контактом. По углам этой пластинки располагают прокладки высотой 15 мм и сверху накрывают чистыми фанерными пластинками того же размера. Таким образом получается укрытие для тараканов.
В каждый полигон помещают 120 тараканов при соотношении самок, самцов и личинок 2 — 4-го возраста — 1:1:4. В полигоне расставляют сосуды с водой и кормом (белый хлеб). Опыты ставят не менее чем в 3 повторностях. Учет погибших насекомых проводят каждые 24 ч в течение 3 — 5 суток или более в зависимости от целей эксперимента и изучаемого средства.
Муравьи. Опыты с рабочими особями муравьев проводят в полигонах площадью не менее 0,2 кв. м с высотой бортов 12 — 20 см, края которых смазаны слоем вазелина шириной не менее 2 см. В центре полигона помещают пластину (стекло, фанера) размером 10 x 10 см, верхняя сторона которой обработана инсектицидом.
В каждый полигон помещают лист бумаги в виде неплотно свернутой трубочки (убежище для муравьев), ставят поилку с ватой, пропитанной водой, и корм (в т.ч. белый хлеб, вареное яйцо, вареное мясо, рыбу). Затем в каждый полигон запускают 50 — 100 рабочих особей муравьев. Опыты ставят не менее чем в 3 повторностях. Учет погибших насекомых проводят каждые 24 ч в течение 2 суток.
Мухи. Опыты на мухах проводят в стеклянных камерах объемом 1 куб. м, имеющих затянутые марлей «окна» для проветривания. В каждую камеру помещают по 300 особей мух обоего пола в соотношении 1:1 и сосуд с 10%-ным сахарным сиропом. Камеру снаружи освещают электролампой (60 Вт). Ленты или пластинки, пропитанные инсектицидом в разных дозах, обеспечивающих 50, 95 и 99% гибели мух в опытах с принудительным контактированием, подвешивают в верхней части камеры. Жидкие препараты в чашке Петри помещают на дно камеры. Каждый вариант опыта и контроль ставят не менее чем в 3 повторностях. Учет погибших насекомых проводят через 24 ч. Эффективность препарата в каждом варианте опыта оценивается по формуле 3.
6.2.1.5. Методы изучения овицидного действия инсектицидов
Метод изучения действия инсектицидов на яйца мух. При определении овицидности веществ или средств для яиц мух можно использовать разные методы [72].
При первом методе кладки яиц мух по 14 — 15 мг заворачивают в батистовую салфетку и погружают в раствор инсектицида, затем тщательно прополаскивают в проточной воде. Часть оставляют на влажной фильтровальной бумаге для наблюдения, а часть переносят в питательный субстрат. В контрольном варианте яйца погружают в воду. Учет проводят через 48 ч.
При втором методе 20 мг яиц комнатных мух помещают на влажные отруби в 0,5-литровые сосуды. Для приготовления влажных отрубей берут на 100 г прокаленных отрубей 200 г воды и тщательно перемешивают. В каждый сосуд помещают 200 г влажных отрубей, поверхность субстрата с яйцекладками равномерно орошают 10 мл раствора (эмульсии, суспензии) инсектицида, что соответствует норме расхода рабочей жидкости 1 л/кв. м. Дозу препарата рассчитывают по ДВ на 1 кг субстрата. Опыты ставят одновременно не менее чем в 5 дозах, каждая в 3 повторностях. В контрольном варианте яйцекладки орошают водой или растворителем. После орошения яйцекладки засыпают тонким слоем (1,0 — 1,5 см) влажных отрубей, чтобы предотвратить их высыхание. Сосуды завязывают салфетками из бязи. Учет результатов проводят через 48 ч, подсчитывая число личинок, выплодившихся из контрольных и обработанных яйцекладок. Эффективность препарата устанавливают по соотношению числа личинок в обработанном и контрольном субстрате. Определяют дозу, обеспечивающую 50 и 99% гибели яиц.
При третьем методе на пластинки черной бумаги 1 x 1 см, слегка
смоченные молоком или белком куриных яиц, кисточкой или препаровальной
иглой наносят по 20 жизнеспособных яиц. Пластинки с яйцами погружают на 3 с
в спиртовые или водные рабочие растворы средств или действующих веществ;
контрольные — в чистый спирт или воду, подсушивают на фильтровальной бумаге
и переносят в чашки Конвея, в которых круговые емкости заполнены водой для
поддержания 100%-ной влажности. Для нахождения величин СК и СК
50 95
используют не менее 5 — 6 концентраций в 5 — 7-кратной повторности.
Метод изучения действия инсектицидов на яйца клопов. Яйцекладки 3 — 5-дневного возраста, помещенные на листы фильтровальной бумаги размером 30 кв. см, орошают 0,3 мл раствора (эмульсии, суспензии) инсектицида. Каждый инсектицид испытывают не менее чем в 5 концентрациях, в трех повторностях каждая. Дозу инсектицида по ДВ рассчитывают в граммах на 1 кв. м обработанной поверхности. В контроле яйцекладки обрабатывают водой или растворителем. После обработки яйцекладки переносят в стеклянные стаканы и сверху покрывают нарезанной фильтровальной бумагой. Учет результатов проводят через 5 — 7 суток. Эффективность препарата определяют по соотношению числа личинок, вылупившихся из обработанных и контрольных яйцекладок. Определяют дозу, обеспечивающую 50, 95 и 99% гибели яиц.
Метод изучения действия инсектицидов на яйца блох. На дно трехлитрового сосуда кладут листы черной бумаги так, чтобы она полностью покрывала дно сосуда, и помещают туда белую мышь в сетчатой клетке. На зверька выпускают 100 самок и 25 самцов блох. Листы бумаги меняют ежедневно и подсчитывают количество отложенных на них яиц. Из листа, на котором отложены яйца блох, вырезают листки размером 4 x 5 см и обрабатывают каждый 0,2 мл раствора эмульсии инсектицида. Опыты ставят в 5 концентрациях, в трех повторностях каждая. В контрольном варианте лист бумаги обрабатывают растворителем. Опыты с яйцекладками насекомых проводят при температуре воздуха в помещении — 23 — 27 °C. Учет результатов проводят через 4 — 6 суток. Эффективность обработки определяют по соотношению числа личинок, выплодившихся на обработанном и контрольном листах. Определяют концентрацию, обеспечивающую 50, 95 и 99% гибели яиц.
6.2.1.6. Методы изучения активности инсектицидов
для преимагинальных стадий мух
Метод обработки инсектицидами субстрата с личинками. В сосуд объемом 0,5 л с 200 г влажных отрубей помещают на поверхность субстрата 30 личинок 3-го возраста. Когда все личинки проникнут в субстрат (через 10 — 15 мин.), из распылителя равномерно орошают поверхность 10 мл раствора (эмульсии, суспензии) инсектицида, что соответствует 2 л/кв. м рабочей жидкости. Сосуды закрывают бязевыми салфетками, которые закрепляют резинками. В каждом опыте используют 5 концентраций инсектицида в 3 повторностях [72]. Учет результатов проводят через 48 ч, подсчитывая число личинок, погибших в 3 сосудах, а в 3 сосудах личинок оставляют в субстрате до окончания метаморфоза. Эффективность обработки определяют по процентному соотношению числа погибших личинок и выплодившихся имаго в контроле и опыте. Определяют концентрацию, обеспечивающую 50, 95 и 99% гибели личинок (формула 3).
Метод обработки субстрата инсектицидами до подсадки личинок. Влажные отруби обрабатывают раствором (эмульсией, суспензией) инсектицида из расчета 50 мл на 1 кг субстрата и тщательно перемешивают. В каждые 200 г обработанного субстрата подсаживают 30 личинок 3-го возраста. В каждом опыте используют 4 концентрации инсектицида в 3 повторностях. Учет результатов проводят через 24 и 48 ч после постановки опыта. Оставшихся в живых личинок пересаживают через 2 суток в необработанные отруби и наблюдают за циклом метаморфоза — подсчитывают число куколок и выплодившихся имаго. Эффективность обработки определяют по соотношению числа личинок и выплодившихся имаго в контроле и опыте (формула 3). При подсчете результатов опытов рассчитывают дозу по ДВ на 1 кг субстрата [72].
Метод изучения действия инсектицидов на куколок мух. По 10 — 20 куколок комнатных мух помещают на дно стеклянных сосудов и засыпают слоем песка высотой 6 — 7 см, затем с помощью распылителя обрабатывают песок водными эмульсиями (растворами, суспензиями) препарата из расчета 1 л раствора на 1 кв. м. Обработку проводят 5 — 7-ю концентрациями препарата, каждый опыт ставят в 3 повторностях. Сосуды с куколками обвязывают марлевыми салфетками либо ставят открытыми в марлевый (сетчатый) садок. Подсчет выплодившихся мух проводят через 2 — 3 — 5 суток после обработки. Одновременно ставят контроль-сосуды с куколками, обработанными растворителем (водой). Эффективность препарата определяют по процентному соотношению числа мух, выплодившихся в контроле и опыте (формула 3). Определяют концентрации, обеспечивающие 50, 95 или 99% гибели мух [72].
6.2.1.7. Метод изучения фумигационного
действия инсектицидов
Опыты проводят в сосудах емкостью 1 л. На стенках сосудов внутри помещают фильтровальную бумагу 10 x 20 см, предварительно пропитанную 2 мл ацетонового спиртового раствора препарата и просушенную при комнатной температуре не менее 20 мин. При использовании сосудов большего объема размер бумаги соответственно увеличивают. Расчет препарата проводят в г/куб. м по ДВ. К крышке сосудов подвешивают садок из металлической сетки на расстоянии 10 см от дна. В садок помещают комнатных мух, тараканов или постельных клопов (не менее 10 насекомых). В опытах используют серии концентраций в 3 повторностях. Подсчет погибших насекомых осуществляют через 3 — 6 — 24 ч. Расчет эффективности проводят по формуле 5. Определяют концентрации, которые обеспечивает 50, 95 и 99% гибели насекомых [72].
6.2.1.8. Методы изучения кишечного действия инсектицидов
Метод группового кормления мух жидкими приманками. Раствором инсектицида в 10%-ном сахарном сиропе (50 мл) пропитывают кусочки ваты массой 1 г, которые размещают тонким слоем на дне чашек Петри. При изучении веществ, нерастворимых в воде, готовят 10%-ный спиртовой раствор, а затем разбавляют его сахарным сиропом до нужной концентрации. Испытания инсектицидов проводят в концентрациях 0,001; 0,01; 0,1; 1,0%, в каждой не менее 3 повторностей. В марлевый садок размером 20 x 20 x 20 см помещают чашку Петри с испытуемым веществом (отравленной приманкой), в качестве альтернативной пищи ставят сосуд с молоком.
Метод группового кормления мух сухими приманками. В опытах используют голодных комнатных мух без разделения по полу 3 — 4-дневного возраста чувствительной лабораторной культуры. В течение первых 3 суток после начала вылета мухам в качестве корма дают только сахар и воду. За 16 ч до начала эксперимента у мух отнимают корм, оставляя в садках только воду. Приготавливают ацетоновые растворы ДВ инсектицида, которыми обрабатывают сахарный песок из расчета 1 часть ацетонового раствора на 2 части сахарного песка. Сахарный песок развешивают по 2 г на часовые стекла или стеклянные чашки Петри, затем наливают пипеткой 1 мл ацетонового раствора инсектицида и оставляют под тягой до полного испарения растворителя. Для получения необходимой дозы инсектицида в сахаре готовят исходный ацетоновый раствор инсектицида, учитывая, что при нанесении 1 мл 1%-ного раствора, т.е. 10 мг ДВ инсектицида в 1 мл ацетона на 2 г сахара, доза инсектицида в приманке составляет 5 мг/г сахара.
В качестве емкостей для содержания мух можно использовать либо марлевые садки размером 30 x 30 x 30 см, либо прозрачные пластиковые емкости (бутылки) объемом 2 л. В последнем случае у бутылок срезают дно и закрывают его марлевыми салфетками. Салфетки закрепляют резиновыми колечками. Бутылку кладут горизонтально, в горлышко помещают ватный тампон, смоченный водой, в середину бутылки помещают сахарную приманку на подложке, маленькие чашки Петри и т.п.
Для вычленения кишечного действия инсектицида опыты следует проводить в
двух вариантах: первый — открытая приманка в чашке Петри, второй — приманка
в мелкоячеистой сетке для предотвращения контакта лапок мух с отравленным
сахаром. В этой модификации группового кормления удобно использовать
быстрорастворимый рафинад, который пропитывают ацетоновыми растворами ДВ
инсектицидов, учитывая массу каждого кубика. Кубики помещают в чашки Петри
диаметром 4 см и вкладывают в сетчатый конверт из фатина (мелкоячеистая
сетка), который плотно натягивают и закрепляют. Данные, полученные в
результате экспериментов с открытыми и засетченными кубиками, сравнивают по
показателям СД и СД .
50 95
В опыте используют предварительно анестезированных эфиром или охлажденных в холодильнике мух. В контрольном варианте используют сахарный песок, обработанный ацетоном без инсектицида, в том же объеме, что и в опытном варианте. Проводят 3 опыта не менее чем в 3 повторностях, используя не менее 120 насекомых на одну концентрацию (40 мух на одну пластиковую бутылку), в контрольном варианте используют не менее 40 насекомых.
Опыты проводят при постоянной температуре воздуха (оптимальной является (23 +/- 2) °C) и относительной влажности более 50%. Учет гибели насекомых проводят через 24 и 48 ч. Мух, лежащих на спине, неспособных самостоятельно перевернуться и ползать, относят к погибшим.
При изучении активности готовой сухой сахарной приманки (40 — 60% сахара) ее наносят на пластинки из стекла или фанеры, которые помещают в садок. В опытах используют 30 мух обоего пола 3 — 5-дневного возраста. За 12 ч до опыта в садках, в которых выращивают мух, оставляют только воду. Контролем служат мухи, питавшиеся молоком. Подсчет погибших мух проводят через 3, 24 и 48 ч. Эффективность инсектицида определяют по числу мух, погибших в опытных и контрольных садках (формула 3). Определяют концентрации, которые обеспечивают 50, 95 или 99% гибели мух [72].
Метод группового кормления тараканов. Приготавливают растворы (эмульсии, суспензии) инсектицида в подсолнечном масле или воде (в 4 — 5 концентрациях) и наносят по 1,5 мл на кусочки пшеничного хлеба размером 2 x 1 x 1 см. Опыты ставят одновременно со всеми концентрациями в 3 повторностях. В контроле используют хлеб, смоченный растворителем (масло, вода). Хлеб, смоченный инсектицидом, помещают на подложке из полиэтилена (целлофана) в сосуд диаметром около 30 см и высотой около 10 см. Края сосуда смазывают изнутри вазелином, чтобы предотвратить выползание тараканов. В сосуд помещают по 30 насекомых (самки, самцы, личинки 2 — 4-го возрастов в соотношении 1:1:4). В качестве альтернативной пищи кладут необработанный инсектицидом кусочек пшеничного хлеба и тампон, смоченный водой. Учет гибели тараканов проводят ежедневно в течение 5 суток. Критерием оценки кишечного действия инсектицида является число выживших насекомых через 5 суток от начала опыта в сравнении с контролем (формула 3). Рассчитывают концентрации, вызывающие 50, 95 или 99% гибели насекомых [72].
Опыты в жестяных полигонах. Опыты с групповым кормлением тараканов можно проводить в жестяных полигонах площадью 0,2 кв. м (40 x 50 см) и высотой бортов 15 см. По периметру борт смазывают вазелином для предотвращения ухода насекомых. В полигон помещают укрытие из картона, поилку с водой, приманку и при необходимости альтернативный корм. В качестве основы для приготовления приманки можно использовать сухой собачий корм. В этом случае гранулы корма размалывают на кофемолке, развешивают полученный порошок в стеклянные бюксы по 2 г, добавляют сырой желток куриного яйца по 1 г, ацетоновые растворы инсектицидов в логарифмически снижающихся концентрациях по 0,5 мл. Полученную массу тщательно перемешивают и развешивают на маленькие чашки Петри диаметром 4 см по 1 г. Массу каждой приманки записывают и чашки ставят сушить при комнатной температуре до полного высыхания (приобретения постоянной массы) (около 7 суток). Альтернативный корм готовят аналогично контрольному варианту, добавляя вместо инсектицида такой же объем растворителя (ацетон).
В каждый полигон помещают не менее 20 экземпляров самок (без оотек) или самцов рыжих тараканов, предварительно голодавших не менее 2 суток. Учет пораженных и погибших насекомых и поедаемость приманок путем взвешивания их на аналитических весах определяют ежедневно в течение 7 — 15 суток. Для выявления аверсии (индекса питания) в вариантах с альтернативным кормом проводят расчет величины индекса питания по формуле:
Поглощение приманки, мг — Поглощение альтерн. корма, мг
Индекс питания = ——————————————————-
Поглощение приманки, мг + Поглощение альтерн. корма, мг
Метод дозированного кормления насекомых. Метод предусматривает
кормление насекомых из микропипетки с оттянутым концом водными растворами
(эмульсиями), приготовленными на 10%-ном сахарном сиропе. Метод позволяет
точно регулировать количество раствора, выпиваемого насекомыми, путем
прерывания кормления в нужный момент. При постоянном объеме раствора (для
комнатных мух — 0,01 мл, рыжих тараканов — 0,05 мл) дозу инсектицида
варьируют путем изменения концентрации ДВ. Перед кормлением мух выдерживают
без питания 12 ч, тараканов — 2 суток. В контрольных опытах насекомых
кормят сахарным сиропом или растворителем. Опыты ставят в 3 повторностях
для каждой концентрации, в каждой повторности используют не менее 10
насекомых. За процессом отмирания комнатных мух наблюдают в течение
1 суток, тараканов — в течение 3 — 5 суток. Критерием оценки эффективности
инсектицида служит величина ЛД , выраженная в мкг на одно насекомое или
5099
в мкг на 1 г массы насекомого (формулы 6, 7).
Метод изучения ларвицидного действия инсектицидов на личинок комаров. В сосуды объемом 0,5 л (стеклянные сосуды, полистироловые или парафинированные стаканы и т.п.) наливают по 249 мл водопроводной воды, отстоянной в течение 24 ч. В каждый сосуд (за 2 ч до опыта) помещают по 25 личинок 2-го, 3-го или начала 4-го возрастов. Через 2 ч погибших или ослабленных личинок удаляют и заменяют на жизнеспособных. В сосуды добавляют 1 мл раствора (эмульсии, суспензии) инсектицида определенной концентрации. Одновременно испытывают 4 — 5 концентраций, каждая в 3 повторностях. Контролем служат личинки, находившиеся в воде без добавления инсектицида. Параллельно ставят контроль с эталонным препаратом. В период эксперимента температура воды должна находиться в пределах 21 — 23 °C. Подсчет погибших личинок проводят через 24 ч. Если более 10% личинок в контроле окуклилось, опыт не учитывают и повторяют [72].
6.2.1.9. Метод изучения раздражимости комаров
под действием инсектицидов
Раздражимость комаров может быть вызвана не только самим инсектицидом, но и другими компонентами, входящими в состав испытываемой формы. Раздражимость крайне важна при работе с эпидемиологически опасными малярийными комарами, поскольку способствует перелету комаров из обработанных помещений (хлева, надворные постройки) в необработанные (жилые помещения). Риск заражения малярией при этом многократно увеличивается.
Для определения раздражимости рекомендуется предложенный ВОЗ метод с усовершенствованиями, внесенными ИМПиТМ. Фильтровальную бумагу обрабатывают из пульверизатора рабочим раствором инсектицида в концентрации, отобранной в первичном опыте. Исследования проводят через 1 — 2 суток после обработки.
Аппарат для определения раздражимости представляет собой светонепроницаемую камеру из легкого дерева размером 135 x 135 x 90 мм. Свет проникает в нее сквозь круглое отверстие в задней стенке диаметром 90 мм, по бокам которого имеются пазы для матового стекла, пропитанной инсектицидом бумаги (или контрольной) и конического экспозиметра (те же конуса, что и для определения продолжительности действия инсектицида). Опыты проводят в темной комнате с единственной электрической лампочкой, помещаемой перед задней стенкой прибора, на расстоянии, зависящем от мощности лампы: 40 вт — 41 см, 60 Вт — 55 см, 100 Вт — 92 см. Комаров в садке перед опытом содержат в той же комнате при том же освещении (т.е. расстоянии от лампы) в течение 0,5 — 1,0 ч. Каждого комара (сытых самок) сначала сажают в контрольный экспозиметр (та же бумага, но без инсектицида), где выдерживают 3 мин., а затем в течение 10 мин. подсчитывают число взлетов. Комары, взлетевшие в контроле 2 и более раз, выбраковываются, как спонтанно раздражимые. Обычно таких мало. Причиной спонтанной раздражимости могут быть травмы комаров при пересадке или неблагоприятные условия (при массовой раздражимости). Спокойных комаров (не было взлетов или 1 случайный взлет без ползания по бумаге) по одному пересаживают в опытный экспозиметр с бумагой, обработанной инсектицидом, и после 3 мин. начинают подсчет взлетов, продолжающийся 10 мин. Отмечают также «хождение» комара по бумаге, что тоже говорит о раздражимости. В опыте должно быть использовано не менее 50 особей. По окончании опыта подсчитывают распределение особей по степени раздражимости. Для подвальных комаров Cx. pipiens опыты по раздражимости также важны, поскольку при некачественной обработке (с огрехами) комары, обладающие раздражимостью, выбирают для посадок необработанные инсектицидом места [67, 72].
6.2.1.10. Метод изучения проявления нокдаун-эффекта
у насекомых под действием инсектицидов
Сравнительную оценку проявления нокдауна проводят экспресс-методом.
Метод основан на измерении времени, проходящего от обработки насекомых до
наступления состояния нокдауна (ТН , мин., — среднее по повторностям для
100
100% особей, ТН — среднее по повторностям для первых 50% особей). На
50
необездвиженных тараканов или 5 — 6-дневных имаго комнатных мух наносят по
1 мкл ацетоновых растворов инсектицидов. Затем насекомых помещают в чистые
стеклянные емкости (с вертикальными стенками стаканы или пробирки).
Нокдаун считают зафиксированным, когда насекомое не может удержаться на вертикальной стенке сосуда. В опыте применяют 3 — 5 концентраций инсектицидов, различающихся в 2 — 10 раз. Повторность опыта — 3 — 5-кратная, на каждую повторность используют 10 насекомых. Учет времени наступления состояния нокдауна ведут индивидуально, рассаживая насекомых по одной особи в пробирку. При работе с тараканами время наступления состояния нокдауна определяют отдельно у самцов и самок. Показателем наступления состояния нокдауна у насекомых служит неспособность их ползти вверх по поверхности стекла, переворачивание на спину и нарушение координации движений. Отмечают время в минутах от нанесения инсектицида до проявления первых признаков отравления (гиперактивность, нарушение координации движений) и наступления состояния нокдауна (глубокий паралич). Учитывают динамику отравления обработанных насекомых (% пораженных насекомых) в течение 24 — 96 ч в зависимости от вида. Для характеристики состояния нокдауна (обратимый, необратимый) строят график. Построение графика ведут в полулогарифмических координатах, на оси абсцисс откладывают время наступления нокдауна (логарифмическая шкала), по оси ординат % пораженных насекомых. В том случае, если состояние нокдауна является обратимым, % пораженных насекомых уменьшается во времени. Если состояние нокдауна является необратимым, насекомые полностью погибают.
6.2.2. Метод изучения двигательной активности и расселения
популяционных группировок синантропных тараканов
Для исследования воздействия биологически активных веществ (инсектицидов, репеллентов, аттрактантов, феромонов), а также абиотических (температура, влажность, освещенность, магнитное поле) и биотических (плотность популяции, межвидовая конкуренция) факторов применяется метод изучения двигательной активности и расселения насекомых, который позволяет наблюдать поведенческие реакции тараканов как на индивидуальном уровне, так и на уровне сформированных популяционных группировок в течение длительного времени, соизмеримого со сроком жизни нескольких поколений наблюдаемого объекта. В ходе опыта возможно наблюдение за перемещением и направлением расселения насекомых, динамикой пространственной и возрастной структуры популяционных группировок тараканов, влиянием на все эти процессы различных биологически активных веществ [64].
Устройство для наблюдения за поведением насекомых. Устройство представляет собой сборную конструкцию из унифицированных модулей трех типов: боксов, лабиринтов и убежищ. Размеры, материал и число используемых в работе модулей зависят от конкретного объекта исследований. Все модули и соединяющие их переходники изготовляют из прозрачного оргстекла по следующим размерам: боксы — 200 x 200 x 200 мм, лабиринты — 200 x 200 x 40 мм, убежища — 20 x 20 x 40 мм. Боксы снабжают донными кормушками и поилками, лабиринты — крышками, а убежища — съемными светонепроницаемыми чехлами. Боксы и лабиринты устанавливают на ножках. Боксы и лабиринты должны иметь квадратные боковые отверстия для подсоединения друг к другу при помощи переходников двух размеров: 20 x 20 x 20 мм и 20 x 20 x 60 мм. Разные части установки моделируют соответствующие участки естественных биотопов синантропных тараканов: боксы — относительно большие открытые участки; лабиринты — пути перемещения между открытыми участками, имитирующие щели и трещины в стенах помещений и коммуникаций, по которым эти насекомые мигрируют как с этажа на этаж, так и между помещениями в пределах одного этажа в здании; убежища — замкнутые участки скопления насекомых. Благодаря использованию унифицированных модулей можно собирать опытные лабораторные установки разных типов в зависимости от конкретных задач. На рис. 6.1 (не приводится) показана схема крестообразной модификации опытной установки, позволяющей одновременно изучать влияние на жизнь подопытной популяционной группировки нескольких факторов (биологически активные вещества, освещенность, температура, влажность, магнитное поле, наличие корма и воды и т.д.). В то же время, при изучении двигательной активности, закономерностей расселения и образования дочерних популяционных группировок, а также влияния друг на друга популяционных группировок разных видов при совместном обитании в локальном биотопе, может быть использована с большей эффективностью линейная модификация установки (рис. 6.2 — не приводится), состоящая из чередующихся боксов и лабиринтов и позволяющая создать значительную длину суммарного пробега между ее концами на небольшой площади. С этой целью используют лабиринты, разделенные перегородками на определенное число участков. Один лабиринт обеспечивает длину пробега 2 м, а при включении в конструкцию четырех боксов и шести лабиринтов общая длина пробега составляет 13 м при собственной длине установки чуть более 2 м.
Работа с устройством. В центральном или начальном (в линейной модификации) боксе (рис. 6.1-1; 6.2-1) закрывают отверстия в боковых стенках и помещают воду в поилку (рис. 6.1-2; 6.2-2), а пищу — в кормушку (рис. 6.1-3; 6.2-3). К боксу подсоединяют убежище (рис. 6.1-4; 6.2-4), затемненное чехлом (рис. 6.3-4 — не приводится), который во время наблюдения за насекомыми снимают. На внутреннюю поверхность боковых стенок бокса вверху наносят полосу вазелинового масла шириной около 2 см, препятствующую выползанию насекомых. В боксе формируют опытную популяционную группировку с требуемой численностью насекомых, которых при необходимости метят. Затем к боксу подсоединяют лабиринты (рис. 6.1-6; 6.2-6; 6.4 — не приводится) с крышками (рис. 6.4-2) и остальные боксы. Перед началом опыта проходы открывают, освободив отверстия в боковых стенках. Насекомым предоставляют возможность свободного перемещения, расселения, выбора предпочитаемых условий в пределах всего устройства. В запланированные сроки отмечают положение насекомых в тех или иных участках устройства, которые предварительно нумеруют.
Мечение насекомых. Индивидуальное мечение тараканов проводят следующим образом: а) отлавливают имаго из бокса, в котором была сформирована опытная популяционная группировка, в отдельные пробирки; б) охлаждают насекомых при температуре -11,5 — -15,0 °C в течение 1 — 2 мин.; в) тонкой кисточкой наносят метку белой эмалью на переднеспинку или переднюю пару крыльев насекомого; г) возвращают тараканов в бокс, где проходила адаптация насекомых, когда подсыхает метка. Для того, чтобы можно было следить за перемещениями и скоплениями не только имаго, но и личинок, в пищу и воду добавляют красители, которые хорошо окрашивают экскременты и не оказывают отрицательного воздействия на тараканов: нейтральный красный, метиловый зеленый, бромфеноловый синий и тортразин.
Определение подвижности и расселительной способности имаго тараканов. Местоположение индивидуально помеченных тараканов фиксируют один раз в день в 10 ч утра. За весь период жизни конкретного насекомого получают последовательную запись его местоположений в тех или иных участках устройства. Затем просчитывают суммарное количество перемещений, совершенных тараканом, от одной точки регистрации до другой. Разделив эту величину на число дней наблюдения, получают значение индивидуальной подвижности особи, измеряемое в перемещениях в день. Для получения величины индивидуальной расселительной способности выделяют активный период жизни каждой особи, который определяют по морфологическим изменениям, связанным со старением организма (укорочение и скручивание антенн, скручивание «лодочкой» крыльев, высокая «стойка» на конечностях) и отсутствием перемещений (или единичными перемещениями) от одного дня наблюдений к другому в течение длительного периода. Разделив число перемещений за активный период на число дней наблюдений, получают значение индивидуальной расселительной способности особи, также измеряемое в перемещениях в день [64, 72].
6.2.3. Методы изучения акарицидной
активности действующих веществ
Оценка биологической активности акарицидов может быть проведена на активных нетравмированных самках различных видов иксодовых клещей. Предпочтительнее использовать для опытов виды, имеющие наибольшее распространение и эпидемиологическое значение. Например, для Российской Федерации самыми эпидемиологически значимыми видами являются таежный (I. persulcatus) и лесной (I. ricinus) клещи, являющиеся основными переносчиками возбудителей клещевого энцефалита и иксодового клещевого боррелиоза. Желательны, но не обязательны, дополнительные испытания в отношении самцов клещей и видов, являющихся второстепенными переносчиками. При необходимости исследования проводятся на нескольких видах клещей, отличающихся биологией, географическим распространением и чувствительностью к акарицидам. Предпочтительнее испытания проводить в период высокой активности клещей в природе и использовать самок природной популяции. Собирать самок с растительности следует не более чем за сутки до проведения опытов и хранить их в пробирках дифференцированной влажности или во влажных бинтах при температуре (12 +/- 2) °C. Возможно использование самок лабораторного разведения после проверки их двигательной активности и агрессивности.
Методы оценки общетоксического действия акарицидов описаны в п. 6.2.1.1 и 6.2.1.3. Ниже приведены методы, разработанные специально для оценки действия акарицидов на иксодовых клещей [57].
Метод определения скорости наступления состояния нокдауна и высоты подъема клещей по обработанной ткани. Данный метод целесообразно использовать для оценки активности акарицидов, проявляющейся в первые 15 мин. воздействия. Такие данные необходимы для решения вопроса о перспективности вещества как активной субстанции в средствах индивидуальной защиты людей от нападения иксодовых клещей.
В опытах используют тест из хлопчатобумажной бязи, представляющий собой ленту 10 x 70 см, на которую на расстоянии 10 см от края (далее — отметка 0) наносятся карандашом отметки длины вплоть до 60 см. Тесты размещают горизонтально на невпитывающей поверхности (стекло, керамическая плитка и т.д.). На опытный тест из пипетки равномерно на участок ленты, начиная от отметки 0 до 10 (площадь обрабатываемого участка 100 кв. см), наносят 1 мл 1%-ного ацетонового раствора изучаемого вещества. Контрольный тест обрабатывают аналогично, используя ацетон. После испарения растворителя все тесты развешивают в лаборатории в одинаковых контролируемых условиях температуры, влажности, освещенности.
Опыты проводят в день обработки. Рабочий стол должен быть освобожден от
лишних предметов и застелен белой бумагой, что уменьшит вероятность потери
клеща. Тесты закрепляют под углом 70° к горизонту. Клещей по одному
помещают на 5 см ниже нулевой отметки и наблюдают за их передвижением вверх
по ткани, дополнительно стимулируя их пальцем наблюдателя, который держат
на расстоянии 0,5 см от гипостома. Время регистрируют с помощью
секундомера. На контрольном тесте самки таежного клеща при температуре
(22 +/- 2) °C должны за две минуты проходить путь не менее 25 — 30 см. На
опытном тесте регистрируют время от момента пересечения клещом нижней черты
обработанного участка до отпадения клеща с теста, что соответствует времени
наступления состояния нокдауна (КТ, мин.). Часто полезным является
выполнение рисунков, отражающих перемещение клещей по тестам. Отпавших
клещей помещают в 70%-ный раствор этилового спирта с целью их консервации
или продолжают дальнейшее наблюдение за ними. Опыт проводят не менее чем с
30 самками. Рассчитывают среднее значение времени наступления состояния
нокдауна КТ в минутах и статистическую ошибку. Одновременно с
ср
определением КТ регистрируют максимальную высоту подъема клеща по тесту.
ср
Рассчитывают среднее значение этого показателя в сантиметрах МВ , и
ср
статистическую ошибку. Целесообразно сопоставить полученные данные по
акарицидной активности веществ с приведенными в выполненных ранее
аналогичных работах.
Метод определения скорости присасывания клещей. Данный метод позволяет оценить изменение агрессивности иксодовых клещей по отношению к теплокровному животному, обусловленное воздействием акарицида. Известно, что многие акарициды обладают свойством ускорять присасывание клещей к теплокровным организмам.
На тщательно выстриженную спину лабораторного кролика коллодием или другим нетоксичным для кожи клеем приклеивают рядом 4 стеклянных цилиндра (диаметр 3, высота 4 см). Один цилиндр является контрольным, а три — опытными. Сначала в контрольный цилиндр запускают 5 самок, ползавших до этого в течение 2 мин. на необработанном контрольном тесте. Верхнее отверстие цилиндра затягивают мелкосетчатым материалом, закрепляя его резиновым кольцом. Время от запуска до присасывания каждой самки к кролику регистрируют с помощью секундомера.
В каждый из опытных цилиндров запускают по 5 самок сразу после их
контакта с обработанной поверхностью теста. Время контакта должно равняться
1/2 КТ . Контроль и опыт повторяют трижды. Рассчитывают среднее значение
ср
времени присасывания самок в контроле, опыте и отношение этих показателей,
которое называется индексом скорости присасывания ИСП:
V
к
ИСП = —, (14)
V
о
где:
V — средняя скорость присасывания клещей в контроле, мин.;
к
V — средняя скорость присасывания клещей в опыте, мин.
о
Целесообразно сопоставить полученные данные с приведенными в выполненных ранее работах.
6.2.4. Методы изучения репеллентной активности веществ
по отношению к кровососущим насекомым и клещам
Изучение веществ, обладающих репеллентной активностью в отношении членистоногих, проводят в два этапа. На первом этапе определяют уровень репеллентной активности 5, 10 и 20%-х растворов вещества в этиловом спирте в отношении стандартных лабораторных культур комаров Ae. aegypti и блох X. cheopis. Исследования проводят в сравнении с эталоном, в качестве которого рекомендуется широкоизвестный репеллент диэтилтолуамид ДЭТА в аналогичных концентрациях. На втором этапе изучают спектр репеллентного действия отобранных веществ в разных концентрациях по отношению к природным популяциям различных видов насекомых и клещей. Поскольку токсичность отбираемых веществ, как правило, не изучена в полном объеме, для опытов используют специальные ольфактометры. Преимущество рекомендуемых ольфактометров состоит в том, что можно одновременно испытывать несколько веществ с неизвестной токсичностью, эталон и контроль. Репеллентную активность токсикологически изученных репеллентных веществ после соответствующего заключения о безопасности нанесения на кожу человека целесообразно изучать в виде растворов в этиловом спирте при нанесении на кожу добровольцев.
Метод определения репеллентной активности веществ по отношению к лабораторной культуре комаров в ольфактометре. Метод основан на реакции бегства комаров при возбуждении и их стремлении лететь к свету. Изучается дистантное репеллентное действие веществ на комаров.
На полоски фильтровальной бумаги или ткани бязь размером 2 x 6 см наносят 0,12 мл 5 — 20%-ных растворов испытуемых соединений или 0,5%-ных растворов синтетических и натуральных душистых веществ. После полного высыхания тесты помещают в ольфактометр. Каждую концентрацию испытывают в трех повторностях. Контрольные полоски пропитывают 0,12 мл растворителя. Для опытов используют ольфактометр, основная часть которого состоит из цилиндрической камеры высотой 12 см и диаметром 30 см. Камера имеет по окружности 24 отверстия, в которые впаяны трубки диаметром 2,5 см, длиной 6 — 8 см. Трубки имеют боковые отводки, а на конце Т-образные стеклянные приемники, в которые через трубки вылетают насекомые. Один конец приемников закрывают мельничным газом, другой — пробкой. Внутрь боковых отводов трубок вкладывают полоски тестов, пропитанные раствором изучаемого вещества. Внутри камеры имеется подвижная цилиндрическая шторка высотой 6 см, плотно прилегающая к стенкам ольфактометра. При движении шторки вверх-вниз одновременно закрываются или открываются боковые отверстия приемников с изучаемыми веществами, позволяя или препятствуя комарам, находящимся в камере, залететь в трубки и реагировать на пары репеллентов. Ольфактометр помещают в специально оборудованный бокс, где поддерживают оптимальные для комаров условия: температуру воздуха (26 +/- 1) °C и относительную влажность 60 — 70% и в котором имеется постоянный источник света — лампа в 150 Вт. 500 голодных комаров помещают в камеру ольфактометра, открывают, опуская шторку, боковые отверстия, включают электромотор и лампу, расположенную над камерой. Камера медленно вращается вокруг оси для выравнивания освещения. Экспозиция — 15 мин. За это время основная часть насекомых покидает камеру и распределяется по трубкам. Для подсчета насекомых, находящихся в трубках, шторку закрывают, а насекомых усыпляют эфиром. Степень отпугивающего действия вещества определяют по числу комаров, залетевших в трубки с обработанными и контрольными полосками, и вычисляют КОД по формуле 12.
При определении длительности отпугивающего действия обработанные полоски испытывают каждые 3 — 5 суток вплоть до утраты ими репеллентных свойств, когда КОД становится ниже 70%. При изучении быстро испаряющихся веществ (душистые вещества и др.) опыты следует проводить ежедневно.
Метод определения репеллентной активности веществ по отношению к лабораторной культуре блох в ольфактометре. Метод основан на способности голодных блох вспрыгивать и оставаться длительное время на колеблющихся полосках бумаги или ткани. Изучается контактное репеллентное действие веществ.
На полоски фильтровальной бумаги или ткани бязь размером 1,5 x 14,5 см наносят 0,2 мл 5 — 20%-ных растворов испытуемых веществ или 0,5 — 1,0%-ных растворов синтетических и натуральных душистых веществ. Через сутки тесты помещают в специальный ольфактометр. Каждую концентрацию испытывают в трех повторностях. Контрольные полоски пропитывают 0,2 мл растворителя.
Опыты проводят в ольфактометре, который представляет собой цилиндрическую камеру с внутренним цилиндром. На оси под верхней крышкой расположен вращающийся диск. На диске по окружности имеются 24 отверстия, куда вставляют стеклянные трубки с развернутым верхним краем, внутренним диаметром не менее 15 мм. Высота внешнего цилиндра — 15 см, диаметр — 25 см, внутреннего — 15 см и 17 см соответственно. Трубки висят между стенками наружного и внутреннего цилиндров.
При проведении опыта обработанные и контрольные полоски помещают в трубки ольфактометра, чередуя 1 контрольный с 4 — 5 обработанными, и закрывают сверху пробками. На дно камеры между внешним и внутренним цилиндрами помещают 500 голодных блох. Экспозиция — 20 мин. Для равномерного распределения насекомых диск с трубками вращают с помощью мотора со скоростью 10 об./мин. Насекомые покидают камеру прибора и распределяются по полоскам в трубках. По окончании экспозиции мотор выключают, трубки быстро извлекают из прибора, помещают в пробирки, расположенные в штативе, блох усыпляют и подсчитывают.
Степень отпугивающего действия веществ определяют по соотношению числа блох, оставшихся на обработанных и контрольных полосках. Коэффициент отпугивающего действия КОД вычисляют по формуле 12. При определении длительности отпугивающего действия обработанные полоски испытывают каждые 3 — 5 суток вплоть до утраты ими репеллентных свойств, когда КОД становится ниже 70%. При изучении быстро испаряющихся веществ (душистые вещества и др.) опыты следует проводить ежедневно.
Метод определения репеллентной активности веществ по отношению к иксодовым клещам на тестах ткани. Метод основан на отрицательном геотаксисе (стремлении ползти вверх), свойственном многим видам иксодовых клещей и, в частности, представителям рода Ixodes. В опытах используют тесты из хлопчатобумажной ткани бязи, которые представляют собой ленты 10 x 70 см, на которых на расстоянии 10 см от края (далее — отметка 0) отмечают карандашом участки, подлежащие обработке репеллентом. Тесты размещают горизонтально на невпитывающей поверхности (стекло, керамическая плитка и т.д.). На опытный тест из пипетки равномерно на определенные участки ленты наносят растворы изучаемого вещества в этиловом спирте. Эталонный тест обрабатывают аналогично опытному, используя раствор ДЭТА. Контрольный тест обрабатывают растворителем. Через 15 мин. после обработки тесты развешивают вертикально для просушки в лаборатории в одинаковых контролируемых условиях температуры, влажности, освещенности. Опыты начинают после полного высыхания тестов через 1 — 2 ч после обработки.
Подготовленные к испытанию тесты закрепляют под углом 70° к горизонту. Клещей по одному помещают на 5 см ниже нулевой отметки и наблюдают за их передвижением вверх по ткани, дополнительно стимулируя их пальцем наблюдателя, который держат на расстоянии 0,5 см от гипостома. Контрольный тест все клещи должны проползать без остановки. При испытаниях опытного и эталонного тестов регистрируют число клещей, проползших обработанную зону (или зоны). После испытаний клещей помещают в 70%-ный раствор этилового спирта с целью их консервации или продолжают дальнейшее наблюдение за ними. Каждый опыт проводят не менее чем с 30 самками. Результаты опытов сопоставляют с результатами испытаний эталонного теста. КОД, рассчитанный на основании данных испытаний в день обработки, характеризует острое действие репеллентного вещества. Для определения длительности репеллентного действия (ДРД) испытания повторяют ежедневно до тех пор, пока КОД сохраняется равным или выше 90%.
Возможно два варианта обработки тестов: по отсекающей концентрации и по градиенту концентраций. В первом случае используется тест, на котором на расстоянии 10 см от края (отметка 0) отмечают карандашом полоску длиной 10 см (площадь 100 кв. см). На опытный тест из пипетки равномерно на отмеченный участок ленты наносят 1 мл 20%-ного раствора изучаемого вещества в этиловом спирте. Эталонный тест обрабатывают аналогично опытному, используя раствор ДЭТА. Рассчитывают КОД, который в данном случае равен % клещей, не проползших обработанную зону, от числа клещей в опытном варианте. Это наиболее простой вариант проведения опытов, удобный при необходимости за короткий отрезок времени испытать много веществ.
Градиент концентраций создают, обрабатывая зоны по 5 см (площадь 50 кв. см) одним миллилитром 5 — 10 — 20 — 40%-х растворов репеллента в этиловом спирте. Первая обработанная зона начинается от отметки 0. Обработанные зоны чередуют с контрольными необработанными полосами по 10 см.
Контрольный тест обрабатывают, используя только растворитель. После испарения растворителя все тесты развешивают в лаборатории в одинаковых контролируемых условиях температуры, влажности, освещенности. Опыты проводят в день обработки. Тесты закрепляют под углом 70° к горизонту. Клещей по одному помещают на 5 см ниже первой обработанной полосы и наблюдают за их передвижением вверх по ткани, дополнительно стимулируя их пальцем наблюдателя, который держат на расстоянии 0,5 см от гипостома. На контрольном тесте, как правило, все клещи проползают отмеченную зону. При испытаниях опытного и эталонного тестов регистрируют число клещей, проползших каждую обработанную зону. Отмечают поведение клещей при пересечении обработанных полос. Определяют наименьшую концентрацию, отпугивающую клещей. Удовлетворительными репеллентными свойствами обладает та концентрация, при которой обработанное пространство пересекают не более 10% клещей от числа взятых в опыт.
После испытаний клещей помещают в 70%-ный раствор этилового спирта с целью их консервации или продолжают дальнейшее наблюдение за ними. Опыт проводят не менее чем с 30 самками [72].
Определение репеллентной активности веществ по отношению к природным популяциям кровососущих двукрылых методом ольфактометрии. В опытах используют природные популяции кровососущих двукрылых, доминирующих в данной климатической зоне. Конструкция ольфактометра аналогична описанной выше, но его размер и число трубок зависят от того, сколько веществ одновременно исследуется и по отношению к каким видам насекомых. При проведении опытов на комарах и слепнях используют ольфактометр, состоящий из 12-канальной камеры емкостью 1 л и Т-образных трубок диаметром 2,5 — 3,0 см, длиной 8 — 10 см. При проведении опытов на мошках и мокрецах используют ольфактометр с камерой объемом 0,5 л и трубками диаметром 1,5 см и длиной 8 см.
Принцип работы ольфактометра такой же, как и в лабораторных опытах. Полоски фильтровальной бумаги или бязи пропитывают изучаемым препаратом или раствором вещества. Поскольку отпугивающие свойства веществ и реакция на них насекомых изменяются под влиянием различных факторов, в каждый опыт обязательно включают эталон ДЭТА и контроль. Каждое вещество изучают в 3 повторностях. Контрольными служат полоски фильтровальной бумаги или бязи, пропитанные растворителем.
Насекомых для опытов собирают в ловушки или сачками. Чтобы насекомых меньше травмировать при сборах, сачки снабжают приемником — трубкой, вставленной в узкий конец сачка. В ольфактометр помещают 500 мошек или мокрецов, 100 комаров или 50 — 100 слепней. В период постановки опытов регистрируют температуру, влажность воздуха, освещенность.
Коэффициент отпугивающего действия КОД определяют по соотношению числа насекомых, залетевших в контрольные трубки и трубки с обработанными тестами (формула 12). Соединения и препараты, у которых установлен широкий спектр отпугивающего действия при КОД не менее 90%, отбирают для проведения испытаний на обработанной ткани [72].
Метод определения репеллентной активности веществ по отношению к природным популяциям кровососущих двукрылых при обработке ткани. Полоски марли размером 20 x 50 см площадью 1000 кв. см пропитывают 10 — 20%-ными спиртовыми растворами репеллентов из расчета 20 г на 1 кв. м ткани.
Первое определение отпугивающего действия тестов проводят через сутки после обработки, последующие — один раз в 3 — 5 — 7 дней. В промежутках между опытами тесты хранят в вертикальном положении на открытом воздухе под навесом в условиях, обеспечивающих свободное испарение вещества.
Испытания проводят в местах массового нападения кровососущих насекомых. До начала исследований и в период проведения опытов проводят учеты численности насекомых и их сбор (сачком или эксгаустером) для определения доминирующих видов, регистрируют метеорологические факторы (температура и влажность воздуха, сила ветра, освещенность, давление). Интенсивность нападения кровососов на человека определяют путем подсчета числа насекомых, севших на обнаженное предплечье, голень испытателя в течение 20 мин. (4 раза по 5 мин.) через каждый час в период суточной активности кровососущих насекомых.
Эффективность репеллента определяют в часы максимальной активности доминирующих видов при интенсивности их нападения на обнаженное предплечье, голень испытателя не менее 25 — 30 особей за 5 мин. Испытания проводят не менее 3 человек (один испытывает опытный образец, второй — эталон, третий — контроль). Испытатели с опытной и эталонной полосками ткани располагаются с подветренной стороны от контрольного на расстоянии не менее 5 м от него и друг от друга в условиях равномерного освещения. Полоски ткани размещают на обнаженном предплечье, голени и подсчитывают число кровососов, садящихся на них в течение 15 мин. три раза по 5 мин.
Величину репеллентного действия препарата определяют по показателю КОД. Острое репеллентное действие характеризует КОД, установленный в 1-е сутки после обработки тестов. В качестве эталона используют ДЭТА в аналогичной концентрации.
Определение длительности репеллентного действия обработанной ткани проводят периодически в течение 1 — 3 месяцев. Вещество считают неэффективным, когда его КОД опускается ниже 70%.
6.3. Методы определения активности инсектицидных средств
6.3.1. Методы оценки эффективности инсектицидных средств,
предназначенных для борьбы с нелетающими
синантропными насекомыми
Метод оценки активности липкой ловушки без инсектицидов в виде домиков для борьбы с тараканами. Оценка эффективности липких ловушек проводится на рыжих тараканах инсектарной культуры.
Для этого используется бокс из оргстекла 20 x 20 x 30 см или жестяные полигоны 60 x 40 x 15 см, на верхнюю часть внутренней поверхности которых нанесена полоска вазелина шириною 2 см, препятствующая выползанию насекомых. В бокс (полигон) помещают по 20 самок, 20 самцов и 80 личинок 2 — 4-го возрастов. Снимают бумагу и освобождают липкую поверхность ловушки. Вскрывают пакетик с пищевой приманкой и помещают ее в центре ловушки (если приманка не находится в ловушке под защитной бумагой). Ловушку помещают в центре бокса (полигона), в боксе (полигоне) располагают поилку с водой и альтернативное укрытие. Учеты эффективности проводят через 1 — 5 ч, далее через 1, 2, 7 и 14 дней и далее при необходимости. Повторность опыта трехкратная. Параллельно ставят контрольный вариант: в бокс (полигон) помещают альтернативный корм на подложке (кусочек белого хлеба с подсолнечным маслом), поилку с водой и альтернативное укрытие.
Показатели эффективности: средняя уловистость на 7-е сутки — не менее 92%; на 14-е сутки — не менее 97%; ресурс ловушки — 1 рыжий таракан/кв. см; срок действия не менее 15 суток.
Метод оценки активности инсектицидных пищевых приманок, применяемых в борьбе с тараканами (в виде контейнеров — приманочных станций, таблеток, шариков, брикетов, гранул, порошка, пасты, гелей и др.). Оценка эффективности пищевых приманок проводится на рыжих тараканах. Для этого используются боксы из оргстекла 20 x 20 x 30 см или стеклянные кристаллизаторы (D = 30 см) или жестяные полигоны 60 x 40 x 15 см, на верхнюю часть внутренней поверхности которых нанесена полоска вазелина шириною 2 см, препятствующая выползанию насекомых. Жестяные полигоны изнутри оклеивают бумагой. В бокс (кристаллизатор или полигон) помещают по 20 самок, 20 самцов и 80 личинок 2 — 4-го возрастов тараканов; после этого там же располагают контейнер или на подложке инсектицидную пищевую приманку массой 0,5 — 3,0 г, поилку с водой и альтернативное убежище. Параллельно ставят контрольный вариант: в бокс (контейнер, полигон) помещают альтернативную приманку (кусочек белого хлеба с подсолнечным маслом), поилку и альтернативное убежище. Повторность опытов трехкратная, при температуре 20 — 22 °C и относительной влажности воздуха 50 — 70%. Учет гибели ведут ежедневно. Для изучения остаточного действия проводят подсадку новой экспериментальной группы насекомых через 7, 14, 21, 28 и более суток. При испытании гелей опыты могут быть заложены в двух модификациях: а) нанесение геля в виде пунктирной линии по периметру сосуда (1,5 см геля с 4 — 10 см интервалом); б) помещение геля массой 0,5 — 1,5 г на подложку.
Учет поедаемости геля приманки ведут путем ежедневного взвешивания подложки с гелем (приманки в контейнере) с точностью до 0,001 г. Поскольку гель в первые несколько суток теряет влагу, входящую в рецептуру, учитывают потерю массы средства в сравнении с массой контрольного варианта (гель в отсутствие тараканов) путем ежедневного взвешивания подложки с полоской геля.
Показатели эффективности: а) ДВ — ФОС, карбаматы, пиретроиды, фенилпиразолы (фипронил): острое действие — гибель насекомых на 2-е сутки не менее 70%; длительность остаточного действия — не менее 30 суток; б) ДВ — имидаклоприд (гель): острое действие — гибель на 3-е сутки не менее 70%; длительность остаточного действия — не менее 90 суток; в) ДВ — гидраметилнон или другой гидразон, борная кислота, сульфофторамид, перфтороктансульфонат лития, тиаметоксам, авермектины: острое действие — гибель на 5-е сутки не менее 70%, длительность остаточного действия — не менее 90 суток; г) ДВ — борная кислота, бура гель: острое действие — гибель на 5-е сутки не менее 70%, длительность остаточного действия — не менее 90 суток; д) ДВ — борная кислота, бура (жидкие приманки): острое действие — гибель на 5-е сутки не менее 70%, длительность остаточного действия — не менее 10 суток.
Метод оценки активности средств в аэрозольных или беспропеллентных упаковках по отношению к нелетающим членистоногим. Эксперименты проводят в камерах объемом 1 куб. м, снабженных вентиляционной системой. Дно камеры выстилается фильтровальной бумагой. Температура в камере при проведении экспериментов составляет 22 — 25 °C при относительной влажности не менее 50% и не более 70%. Для характеристики эффективности средств в аэрозольных и беспропеллентных аэрозольных упаковках с механическим распылителем определяется острое действие и период остаточного действия.
Определение острого действия. Для определения острого действия используют имаго рыжих, черных и американских тараканов, которых помещают в 0,5-литровые емкости по 10 экземпляров (5 самок и 5 самцов), постельных клопов и их яйца 1 — 4-дневного эмбрионального развития помещают в стеклянные экспозиметры (H = 5 см, D = 4,5 см), которые располагают на стеклах 10 x 10 см, покрытых фильтровальной бумагой.
Насекомых и поверхности орошают препаратом из баллона с высоты 20 см, направляя струю аэрозоля под углом 45° ко дну камеры. Насекомых и поверхности удаляют из камеры через 10 мин. после орошения. Насекомых переносят в чистую посуду. За их состоянием наблюдают, отмечая через 5, 10, 30 мин., 1, 2, 4 ч и далее ежедневно в течение 2 — 5 суток число насекомых без внешних признаков паралича, парализованных и погибших. Энтомологическую оценку каждой рецептуры наполнителя аэрозольных баллонов или беспропеллентных упаковок проводят в 3 повторностях. Норма расхода препарата составляет 10 — 20 г на 1 кв. м обрабатываемой поверхности в зависимости от состава рецептуры средства. Отклонение от средней величины расхода препарата не должно превышать 5%. Расход препарата определяют путем взвешивания баллона упаковки до и после опыта.
Определение остаточного действия. Для определения остаточного действия отложений аэрозоля в пяти точках дна камеры располагают тест-поверхности (стеклянные или из фанеры, или из других типов материалов размером 10 x 20 см). Эти обработанные поверхности после обработки и подсушки хранят в вертикальном положении при комнатной температуре и периодически на них проводят подсадку имаго рыжих тараканов и постельных клопов и т.п. для выявления длительности инсектицидного действия. Остаточное действие отложений аэрозолей определяют через 1, 2, 3 суток и далее при наличии длительного остаточного действия через каждые 7 дней в течение 28 суток и более после контакта тараканов с обработанными поверхностями в течение 15 мин. с помощью экспозиметров Набокова-Ларюхиной или в течение 1 ч и более в экспозиметрах с D = 85 мм согласно рекомендациям CSMA. Насекомых после контакта с обработанными пластинками переносят в чистые сосуды и регистрируют их состояние в течение 24, 48 и 72 ч в зависимости от химической структуры действующих веществ. Остаточное действие считают законченным, когда смертность насекомых составляет менее 50% [72].
Показатели эффективности: острое действие — гибель тараканов через 10 мин. не менее 30%, через 24 ч не менее 100%, длительность остаточного действия — 5 — 60 суток.
Метод оценки активности пиротехнических средств, предназначенных для борьбы с нелетающими насекомыми. Оценка эффективности пиротехнических средств проводится на рыжих тараканах, крысиных блохах и постельных клопах инсектарной культуры.
На дно камеры объемом 2 куб. м раскладывают по 5 тест-поверхностей из стекла и фанеры или других материалов в зависимости от цели эксперимента; в 5 точках поверхности дна камеры расставляют емкости на 0,5 л, в которых помещено по 10 имаго тараканов (5 самок и 5 самцов), клопы в стеклянных экспозиметрах (H — 5 см, D — 4,5 см). Во время испытаний температуру воздуха поддерживают в режиме (22 +/- 2) °C, чтобы избежать излишне возбуждающего или угнетающего влияния температуры, относительную влажность — в пределах 50 — 70%.
На подложку из негорючих материалов помещают в камеру пиротехническое средство. Требуемое количество пиротехнического средства для опыта рассчитывают на камеру объемом 2 куб. м. Средство поджигают, камеру закрывают, выдерживают в течение 2 ч, подсчет погибших насекомых проводят через 2 ч.
Остаточное действие определяют путем подсадки рыжих тараканов, постельных клопов и крысиных блох в экспозиметрах на тест-поверхности через 2 и 24 ч после их обработки на 15 мин. В дальнейшем подсадки ведут через 3, 5, 7 суток и более в зависимости от длительности защитного действия средства. Учет гибели ведут через 24 ч.
В том случае, если пиротехническое средство рассчитано на помещения больших объемов, испытания следует проводить не в камере, а в модельных помещениях, поскольку нельзя нарушать строение средства. При нарушении меняется термодинамика и получаются искаженные результаты [72].
Показатели эффективности: острое действие — гибель тараканов не менее 90%, гибель блох не менее 100%; остаточное действие — при подсадке на 3 сутки гибель тараканов, клопов, блох при учете через 24 ч не менее 90%, длительность действия не менее 3 суток.
Метод оценки активности инсектицидных дустов для нелетающих насекомых и имаго комнатных мух. Оценка эффективности инсектицидных дустов проводится на рыжих тараканах и других нелетающих насекомых и комнатных мухах инсектарной культуры.
Различные навески дуста для выбора нормы расхода данного средства из расчета не на 1 кв. м, а на площадь тест-поверхности наносят на пластинки из фанеры размером 10 x 20 см (площадь 200 кв. см). Навеску дуста равномерно распределяют по площади пластинки. Насекомых подсаживают в экспозиметрах на обработанную поверхность на 30 сек., затем их переносят в чистые стаканы. Кратковременность выбранного контакта связана с тем, что дуст быстро налипает на насекомых, поэтому не следует увеличивать экспозицию, поскольку дуст, находящийся на теле насекомого, продолжает действовать после пересадки их в чистый стакан. При определении острого действия подсадку насекомых проводят сразу после нанесения дуста. Учет гибели ведут через 24 — 48 ч. При определении остаточного действия насекомых подсаживают через 1, 3 и более суток после обработки поверхности до окончания инсектицидного действия. Учет гибели насекомых после подсадки также ведут через 24 — 48 ч [72].
Показатели эффективности: острое действие — гибель тараканов, мух через 24 ч 100%; длительность остаточного действия — 7 — 90 суток.
Метод оценки активности инсектицидных карандашей, мелков, брусков. Используется в качестве тест-поверхности пластинка из фанеры размером 10 x 20 см (площадь 200 кв. см), которую взвешивают и результаты записывают. Предварительно рассчитывают норму расхода для тестируемого средства не на 1 кв. м, а на площадь тест-поверхности, как указано выше. Инсектицидным карандашом или бруском закрашивается тест-поверхность. Для контроля нормы расхода обработанную пластинку взвешивают. При необходимости средство удаляют или же добавляют. При определении острого действия подсадку насекомых в экспозиметрах проводят сразу после нанесения средства на 30 с, затем их переносят в чистые стаканы. Учет гибели ведут через 24 ч. При определении остаточного действия насекомых подсаживают на 30 с через 1, 3 и более суток после обработки поверхности до окончания инсектицидного действия. Учет гибели насекомых также ведут через 24 — 48 ч [72].
Показатели эффективности: острое действие — гибель тараканов через 24 ч 100%; длительность остаточного действия — 7 — 60 суток.
Экспресс-метод определения активности инсектицидных карандашей, мелков, брусков для тараканов. Берется емкость (таз или кристаллизатор) диаметром не менее 30 см. Из оберточной бумаги вырезаются круги, диаметр которых соответствует диаметру таза. На кругах производится предварительная разметка канцелярским карандашом: наносится 6 окружностей. Диаметр первой составляет 4 см, диаметр каждой последующей увеличивается на 2 см. Эти бумажные круги взвешиваются, и результаты записывают. Предварительно рассчитывают площадь 3 концентрических полос на каждом круге по формуле:
2
3,14 x R
S = ——— кв. см. (15)
2
Для нашего примера упрощенный расчет выглядит так:
3,14 2 2 2 2 2 2
S = —- 14 + 12 + 10 — 8 + 6 — 4 = 169,56 кв. см.
2
В соответствии с рекомендуемыми нормами расхода инсектицидного средства на 1 кв. м обрабатываемой поверхности рассчитывается количество средства, наносимого на концентрические полосы. Так, при норме расхода 5 г/кв. м в рассматриваемом случае должно быть нанесено 85 мг средства. Далее инсектицидным карандашом или мелком закрашиваются 3 концентрических полосы. Для контроля нанесенной нормы бумажные круги с нанесенным средством вновь взвешиваются. При необходимости средство удаляют или добавляют.
При определении острого действия в центр бумажного круга, помещенного в емкость, края которой смазаны вазелином, из пробирки выпускают 10 имаго рыжих тараканов (5 самцов и 5 самок). Тараканы разбегаются и прячутся под бумажный круг. При этом время контакта насекомых с обработанной поверхностью составляет 3 — 5 с. Затем круг аккуратно вынимают и собирают тараканов в чистые стаканы. Учет гибели ведут через 24 ч. Опыты ставят в 3 — 5-кратной повторности.
При определении остаточного действия бумажные круги с нанесенным средством хранят 3 и более суток в горизонтальном положении вдали от солнечных лучей. Для определения продолжительности остаточного действия описанный выше процесс повторяют через 3 и более суток в зависимости от продолжительности остаточного действия или выбранных экспериментатором экспозиций [72].
Показатели эффективности: острое действие — гибель тараканов через 24 ч не менее 50%; длительность остаточного действия — 7 — 60 суток.
Метод оценки активности микрокапсулированных инсектицидных средств для борьбы с нелетающими насекомыми. Оценка эффективности микрокапсулированных инсектицидных средств проводится на разных видах насекомых инсектарных культур.
Образец средства интенсивно взбалтывается и на весах берется навеска для приготовления различных концентраций. Путем разбавления водой готовятся необходимые концентрации. Опыты проводят на рыжих тараканах в камере объемом 1 куб. м, снабженной вентиляционной системой [64]. На дне камеры на площади 0,5 куб. м по постоянной схеме равномерно размещают в 5 точках по 10 экземпляров рыжих тараканов (соотношение самок и самцов 1:1), помещенных в сосуды объемом 0,5 л.
Для установления остаточного действия отложений средства образцы поверхностей (пластинки стекла и фанеры размером 10 x 20 см помещают в камеры в количестве не менее 10 штук каждой, поскольку остаточное действие может быть весьма продолжительным (более 6 месяцев). Насекомых и поверхности орошают препаратом из пульверизатора или опрыскивателя типа «Росинка» или «Квазар» с высоты 20 см, направляя струю средства под углом 45° ко дну камеры. Температура в камере во время опытов должна быть постоянной (22 +/- 2) °C, относительная влажность — более 50%. Насекомых и поверхности удаляют из камеры через 10 мин. после орошения. Норма расхода рабочей жидкости 50 мл/кв. м.
Насекомых переносят в чистую посуду. За их состоянием наблюдают в течение 5 ч, отмечая через 10, 30 мин., 1 ч и далее ежедневно в течение 5 суток число насекомых без внешних признаков паралича, парализованных и погибших. Расход препарата определяют или предварительно беря 50 мл рабочей жидкости, или путем взвешивания опрыскивателя до и после проведения опрыскивания. Остаточное действие отложений средства определяют на 1-е, 7-е сутки и далее с интервалом в 1 — 2 недели после обработки методом контакта тараканов с обработанными поверхностями в течение 15 мин. в экспозиметрах до окончания инсектицидного действия. Насекомых после контакта с обработанными пластинками переносят в чистые сосуды и регистрируют их состояние через 24 — 48 ч [72].
Показатели эффективности: острое действие — гибель тараканов через 24 ч 100%; длительность остаточного действия — 30 — 90 суток.
Метод оценки активности средств, применяемых методами опрыскивания (концентраты эмульсий, микро- и макроэмульсии, смачивающиеся и растворимые порошки, гели, формы флоу, суспоэмульсии, водные растворы и др.), для борьбы с насекомыми. Оценка эффективности концентратов эмульсий, микро- и макроэмульсий, суспоэмульсий, смачивающихся и растворимых порошков, гелей, из которых готовят рабочие жидкости, флоу, водных растворов и т.п. для борьбы с насекомыми проводится на тараканах и других насекомых инсектарных культур. В том случае, если средство предназначено для уничтожения определенного вида членистоногого, испытания проводят именно на этом объекте.
Образец средства, представленный для определения его активности, интенсивно взбалтывается и на весах берется навеска для приготовления серии концентраций. Путем разбавления водой готовятся необходимые концентрации. Опыты проводят на насекомых в камере объемом 1 куб. м, снабженной вентиляционной системой. На дне камеры на площади 0,5 кв. м по постоянной схеме равномерно размещают в 5 точках по 10 экземпляров тараканов (соотношение самок и самцов 1:1), которых помещают в сосуды объемом 0,5 л, постельных клопов и их яйца в экспозиметры, описанные выше.
Для установления остаточного действия отложений средства образцы поверхностей — пластинки стекла и фанеры размером 10 x 20 см — помещают в камеры в количестве не менее 5 штук каждой. Насекомых и поверхности орошают препаратом из пульверизатора или опрыскивателя типа «Росинка» или «Квазар» с высоты 20 см, направляя струю средства под углом 45° ко дну камеры. Температура в камере во время опытов должна быть постоянной (22 +/- 2) °C, относительная влажность — не менее 50% и не более 70%.
Насекомых и поверхности удаляют из камеры через 10 минут после орошения. Норма расхода рабочей жидкости из расчета 50 мл/кв. м. Насекомых переносят в чистую посуду. За их состоянием наблюдают, отмечая через 10, 30 мин., 1 ч и далее ежедневно в течение 3 суток количество насекомых без внешних признаков паралича, парализованных и погибших. Расход препарата определяют или предварительно, беря 50 мл рабочей жидкости при обработке стекла и 100 мл при обработке фанеры, или путем взвешивания опрыскивателя до и после проведения опрыскивания.
Остаточное действие отложений средства определяют на 1-е, 3-и, 5-е, 7-е сутки и более после обработки методом контакта тараканов с обработанными поверхностями в течение 15 мин. (мух, блох — 5 мин.) в экспозиметрах. Насекомых после контакта с обработанными пластинками переносят в чистые сосуды и регистрируют их состояние через 24 — 48 ч [72].
Показатели эффективности: а) инсектицидные концентраты эмульсий, растворы: острое действие — гибель членистоногих через 24 или 72 ч — 100%, длительность остаточного действия — 7 — 30 суток; б) инсектицидные смачивающиеся или растворимые порошки, таблетки, суспоэмульсии, флоу: острое действие — гибель членистоногих через 24 или 72 ч 100%; длительность остаточного действия — 15 — 60 суток.
6.3.2. Методы оценки активности средств, применяемых
для борьбы с муравьями
Особенность оценки средств для борьбы с муравьями заключается в том, что они подразделяются на неспецифические, которые уничтожают только рабочих особей, и специфические, которые уничтожают всю колонию.
Неспецифические средства для уничтожения муравьев. К неспецифическим средствам относятся все препаративные формы инсектицидов контактного типа действия, предназначенные для уничтожения комплекса нелетающих насекомых, оценку их активности в отношении рабочих особей муравьев проводят методом опрыскивания по п. 6.2.1.2 или свободного контакта с обработанной поверхностью по п. 6.2.1.4.
Специфические средства для уничтожения муравьев. Специфическими средствами для борьбы с муравьями являются инсектицидные пищевые приманки (жидкие, в виде приманочных станций-контейнеров, порошка, гранул, пасты, геля и т.д.).
Метод определения инсектицидной активности приманок для рабочих особей муравьев. Прежде всего проводят оценку активности приманки в отношении рабочих особей муравьев (лабораторной культуры или природной популяции рыжих домовых муравьев или природной популяции другого синантропного вида муравьев).
Опыты проводят методом группового кормления в условиях альтернативного корма. Для этого в зависимости от типа приманки используют открытые чашки Петри, лабораторные стаканы, любые другие стеклянные или пластмассовые емкости, площадь дна которых превышает 50 — 60 кв. см. Края тщательно смазывают вазелином. В емкость помещают поилку с водой (можно смоченную водой вату), альтернативный корм на подложке, лист бумаги в виде неплотно свернутой трубочки (убежище для муравьев), инсектицидную приманку (либо жидкость, которой смачивают вату, либо порошок, гранулы, пасту, гель и т.д. на подложке, либо контейнер с приманкой). После этого запускают по 100 рабочих особей муравьев. Параллельно ставят полностью аналогичный контрольный вариант, но без инсектицидной приманки.
Наблюдение за состоянием насекомых с учетом парализованных погибших особей начинают через несколько минут после их внесения в емкость и продолжают в течение первых 1 — 3 ч, для того, чтобы выявить неспецифические инсектицидные приманки, которые из-за своего очень быстрого действия на рабочих особей либо не достигают колонии, либо не распространяются в ней посредством трофаллаксиса. Далее учет гибели проводят каждые 24 ч в течение 2 — 5 суток в зависимости от типа применяемого действующего вещества [72].
Показатели эффективности: а) ДВ — ФОС, карбаматы, пиретроиды, фенилпиразолы (фипронил): острое действие — гибель на 2-е сутки не менее 70%; длительность остаточного действия — не менее 30 суток; б) ДВ — имидаклоприд гель: острое действие — гибель на 3-и сутки не менее 70%; длительность остаточного действия — не менее 90 суток; в) ДВ — гидраметилнон или другой гидразон, борная кислота, сульфофторамид, перфтороктансульфонат лития, тиаметоксам, авермектины: острое действие — гибель на 5-е сутки не менее 70%; длительность остаточного действия — не менее 90 суток; г) ДВ — борная кислота, бура гель: острое действие — гибель на 5-е сутки не менее 70%; длительность остаточного действия — не менее 90 суток; д) ДВ — борная кислота, бура (жидкие приманки): острое действие — гибель на 5-е сутки не менее 70%; длительность остаточного действия — не менее 10 суток.
Метод определения инсектицидной активности приманочных станций в лабораторных условиях при отсутствии инсектарной культуры муравьев. Для определения инсектицидной активности приманочных станций при отсутствии инсектарной культуры муравьев отлов рабочих особей проводят в натурных условиях с помощью эксгаустера. В качестве модельных объектов могут быть использованы рыжие домовые муравьи Monomorium pharaonis L., а при невозможности их отлова в достаточном количестве — черные садовые муравьи Lasius niger L. и/или муравьи Myrmica rubra L.
Рабочих особей муравьев (по 100 экземпляров на повторность) помещают в стеклянную емкость (объемом 3 л), на верхнюю часть внутренней поверхности которой нанесена полоса вазелина шириной 2 — 3 см. В емкость устанавливают приманочную станцию. Опыты проводят при естественном световом режиме и комнатной температуре в 3 повторностях. В контрольных экспериментах используют либо аналогичную приманочную станцию с приманкой без ДВ (если таковая имеется), либо приманочную станцию с произвольной пищевой приманкой (мед, варенье, фарш). Учет погибших насекомых (острое действие) проводят на 1 — 5-е сутки (в зависимости от ДВ).
Метод определения инсектицидной активности гелей и паст в лабораторных условиях при отсутствии инсектарной культуры муравьев. Для определения инсектицидной активности гелей и паст рабочих особей муравьев (при отсутствии лабораторной культуры) отлавливают с помощью эксгаустера в помещениях или в условиях, приближенных к антропогенным. Насекомых помещают в пластиковые стаканчики (диаметром 80 мм), которые сверху по внутренней поверхности смазывают вазелиновым маслом. На дно стаканчиков по окружности наносят тестируемый гель или пасту пунктирными линиями (в виде штрихов или капель с выбранным интервалом в зависимости от ДВ). Опыты проводят при естественном световом режиме и комнатной температуре в 3 повторностях. Для предотвращения выползания муравьев, кроме нанесения вазелинового масла, стаканчики дополнительно прикрывают стеклом. Учет гибели насекомых проводят на 1 — 5-е сутки (в зависимости от ДВ). Остаточное действие проверяют при подсадке муравьев в емкости, в которых был нанесен гель, как для острого действия.
Метод изучения активности инсектицидных средств на колониях рыжих домовых муравьев. Для оценки эффективности средства в отношении всей колонии отбирают только те средства, которые вызывают гибель не менее 70% рабочих особей, но не ранее чем через 1 — 3 ч. Изучение эффективности средства в отношении всей колонии проводят с использованием колоний, взятых из лабораторной культуры рыжих домовых муравьев, которые состоят из нескольких сотен (до 1000) рабочих особей и нескольких самок с расплодом.
Колонию помещают в сосуд типа аквариума объемом 0,03 — 0,05 куб. м, края стенок которого тщательно смазывают вазелином. В аквариум помещают поилку с ватой, смоченной водой, и корм для насекомых (вареный желток, яйца мух, вареное мясо, рыба), лист бумаги в виде неплотно свернутой трубочки (убежище для муравьев). Контролем служат аналогичные помещенные в аквариум колонии. Жидкую инсектицидную приманку наливают в чашку объемом 10 мл с ватным тампоном. Периодически тампон увлажняют, подливая питьевую воду. Другие типы приманок помещают либо на подложке по 0,5 — 1,5 г (можно несколько подложек в разных частях экспериментальной емкости), либо в контейнере. По мере продолжения эксперимента приманку следует периодически заменять, прежде всего, если визуально отмечено резкое снижение количества подходов к ней рабочих особей или в случае заметного снижения количества приманки. Учет гибели насекомых (отдельно рабочих особей и отдельно самок) и визуальную оценку уменьшения расплода проводят через определенные промежутки времени вплоть до полной гибели колонии (как правило, от нескольких недель до 1,5 — 2,0 месяцев) [72].
6.3.3. Методы определения активности инсектицидных
средств, предназначенных для борьбы с летающими
синантропными насекомыми
Метод оценки эффективности клейких липких ловушек в виде листов, лент и палочек для борьбы с летающими насекомыми (мухи, моль). Оценка эффективности липких листов и палочек проводится на комнатных мухах инсектарной культуры. Для этого используются большие садки (50 x 50 x 50 см), представляющие собой каркасы с натянутыми на них марлевыми садками или садками из мельничного газа или камеры объемом 1 куб. м. Липкие листы, предварительно разъединив или сняв с них защитный бумажный слой, помещают по одному в садок или камеру. Липкие палочки или липкие ленты освобождают от защитного слоя бумаги или гильзы и также подвешивают в садке или камере. В садок выпускают 100 комнатных мух (50 самок и 50 самцов), в камеру — 300 насекомых (150 самок и 150 самцов). Повторность опыта трехкратная. Количество прилипших мух подсчитывают в динамике: через 3 — 5 ч, 1 и 2 суток и далее в зависимости от необходимости [72, 53].
Показатели эффективности: средняя уловистость на 2-е сутки — не менее 96%, ресурс ловушки — 1 комнатная муха/кв. см, срок действия — не менее 15 суток.
Метод оценки активности пищевых инсектицидных приманок (жидких, сухих сахарных, гранулированных) для борьбы с мухами. Оценка эффективности пищевых приманок проводится на комнатных мухах инсектарной культуры. Для этого используются большие садки (50 x 50 x 50 см), представляющие собой каркасы с натянутыми на них марлевыми садками или садками из мельничного газа или специальные боксы объемом 1,0 куб. м. В центре садка/бокса размещают емкость с жидкой приманкой или на подложку помещают 2 — 3 г сухой формы приманок (порошок, пена, паста, гранулы). Сахарную приманку наносят на стеклянную, фанерную или другие типы поверхностей и дают им подсохнуть, затем помещают в бокс или садок. Параллельно ставят контрольный вариант: в садки/боксы помещают сосуд с 5%-ным сахарным сиропом и выпускают 100 мух. Учитывают гибель мух через 1, 2, 4, 24 ч, а далее — в зависимости от цели эксперимента.
Первичную оценку приманок можно проводить экспресс-методом определения эффективности приманок в отношении комнатных мух: сухую приманку помещают на кусочек картона площадью 1 кв. см и кладут его на дно стакана. В стакан запускают одну муху, затягивают сверху марлей и фиксируют время посадки на приманку и время наступления поражения и гибели особи. Повторность опыта 5 — 10-кратная [72].
Показатели эффективности: а) ДВ — ФОС (кроме хлорофоса), пиретроиды, неоникотиноиды: острое действие — 100%-ная гибель мух через 24 ч; длительность остаточного действия — 15 — 60 суток; б) ДВ — хлорофос: острое действие — гибель не менее 80% мух через 24 ч; длительность остаточного действия — не менее 14 суток.
Метод оценки инсектицидной активности средств в аэрозольной упаковке по отношению к летающим насекомым (мухи, комары). Оценка эффективности средств в аэрозольной упаковке проводится на комнатных мухах или комарах A. aegypti или C. pipiens molestus инсектарной культуры.
В камеру объемом 2 куб. м выпускают 300 насекомых, во время испытаний температуру воздуха поддерживают в режиме (22 +/- 2) °C, чтобы избежать излишне возбуждающего или угнетающего влияния температуры, относительную влажность — не менее 50% и не более 70%. При изучении каждой рецептуры ставят не менее 5 опытов. Струю аэрозоля из баллона направляют в камеру, расход смеси не должен превышать 1 г/куб. м. При помощи секундомера определяют время T поражения 99% насекомых. Определяют концентрацию C инсектицида в воздухе по уравнению:
Q x Z
C = ——, (16)
V
где:
Q — количество смеси, выпущенной из аэрозольного баллона в камеру, определяемое по разности веса упаковки до и после опыта, г;
Z — доля инсектицида в смеси, % действующего вещества, пересчитанного в мг/г, определяемая составом наполнителя;
V — объем камеры, куб. м.
Эффект определяют по импульсу концентрации (C x T), где T — время поражения 99% насекомых, для которого устанавливают среднеарифметическую величину и ее доверительные границы при P = 0,05.
Критерием оценки эффективности аэрозолей служит условно принятая
величина концентрации инсектицида в воздухе C , мг/куб. м, которая
15
вызывает поражение 99% мух или комаров в течение условно принятого
времени — 15 мин. и Q , мг/куб. м, — количество смеси, выпущенное из
15
баллона, вызывающее поражение 99% насекомых за 15 мин., а также величина
КТ , время поражения 50% особей. Величина КТ вычисляется графически
50 50
[72].
C x T
C = —— (17)
15 15
C x 100
15
Q = ——— (18)
15 масс% ДВ
Показатели эффективности: острое действие на мух C — не более 15
15
мг/куб. м; Q — не более 1000 мг/куб. м; КТ — не более 10 мин.
15 50
Метод оценки инсектицидной активности пиротехнических средств, предназначенных для борьбы с летающими насекомыми (шашки, таблетки, спирали). Оценка инсектицидной активности пиротехнических средств проводится на комнатных мухах или комарах инсектарной культуры.
На дно камеры объемом 2 куб. м раскладывают по 5 тест-поверхностей из стекла и фанеры или других типов поверхностей в зависимости от задач экспериментов и выпускают 300 насекомых, во время испытаний температуру воздуха поддерживают в режиме (22 +/- 2) °C, чтобы избежать излишне возбуждающего или угнетающего влияния температуры, относительную влажность — в пределах не менее 50 и не более 70%. В камеру на подложку из негорючих материалов помещают пиротехническое средство. Требуемое количество пиротехнического средства для опыта рассчитывают на камеру объемом 2 куб. м. Средство поджигают, камеру закрывают, выдерживают в течение 2 ч, подсчет погибших насекомых проводят через 2 ч. Остаточное действие определяют путем подсадки имаго комнатных мух или комаров на 5 мин. в экспозиметрах на тест-поверхности через 2 ч после их обработки и далее через 1 и более суток. Учет гибели ведут через 24 ч [72].
Показатели эффективности: а) шашки, таблетки, шнуры: острое действие — 100%-ная гибель через 2 ч после полного задымления; остаточное действие — 100%-ная гибель через 24 ч; б) инсектицидные спирали: острое действие — 100%-ная гибель имаго комаров через 15 мин.
Метод оценки инсектицидной активности антикомариных средств в форме свечей. Эксперименты проводятся в лабораторных условиях при температуре 20 — 25 °C в экспериментальных пластмассовых камерах объемом 1 куб. м, поверхности которых должны быть без стыков, чтобы комары не могли в них спрятаться. Объектом исследований являются имаго комаров A. aegypti и C. pipiens инсектарных культур.
В камеру впускают 100 имаго комаров, в центре нижней поверхности
камеры помещают опытную свечу, которую поджигают. Свеча должна гореть не
более 6 мин., после чего ее гасят. При проведении эксперимента фиксируют
температуру воздуха в камере до начала эксперимента и после того, как свечу
загасили. Перед зажиганием и после гашения свечу взвешивают. Повторность
эксперимента трехкратная. В качестве контрольного варианта используют
стандартную свечу без инсектицида. Динамику гибели комаров отслеживают с
интервалом 5, 10 и 15 мин. Затем рассчитывают величины Т и Т , мин.
50 90
(время горения свечи, обеспечивающее гибель 50% и 90% комаров в течение 15
мин. после ее гашения), а также величину КТ , мин. [72].
50
Показатели эффективности: гибель комаров через 15 мин. после гашения свечи — не менее 90%.
Методы определения активности электрофумигаторов для борьбы с летающими насекомыми. Оценку активности инсектицидов для комаров проводят на имаго желтолихорадочного комара A. aegypti или подвальных комаров C. pipiens molestus инсектарных культур в возрасте 14 — 20 дней, выведенных на углеводном питании; для мух — на 3-дневных имаго комнатных мух M. domestica [72].
Электрофумигаторы с матами (пластинами)
Метод определения КТ . В чистую камеру объемом 1 куб. м (для мух — 2
50
куб. м) запускают 100 +/- 5 самок комаров (200 +/- 10 имаго мух без
разделения по полу). Температура в камере (25 +/- 2) °C. Электрофумигатор
(нагревательное устройство) включают в электрическую сеть согласно
инструкции за 15 мин. до начала опыта. Инсектицидный мат (пластину)
помещают на нагревательную поверхность и сразу размещают электрофумигатор с
пластиной в камере с комарами. С помощью секундомера регистрируют время
начала нокдауна у первого комара/мухи в камере и время нокдауна у 99%
комаров/мух. По этим показателям графическим методом определяют время
наступления нокдауна у 50% особей (КТ , мин.). Опыт повторяют три раза.
50
Рассчитывают среднее значение КТ и статистическую ошибку.
Метод оценки резерва мата. Для определения резерва мата (максимального
времени использования мата) определяют КТ для комаров и мух (по
50
приведенному выше методу), используя маты, которые уже нагревались до опыта
1, 2, 3, 4, 5 и более часов. Опыт повторяют три раза. Рассчитывают среднее
значение КТ и статистическую ошибку. За резерв мата принимается
50
максимальное время нагрева мата в часах, при котором КТ составляет не
50
более 7 мин. для комаров и 9 — 20 мин. для мух в зависимости от изучаемого
действующего вещества.
Жидкостные электрофумигаторы
Метод определения КТ . Электрофумигатор включают в электрическую сеть
50
согласно инструкции и через 60 мин. помещают его в камеру с комарами/мухами
так же, как описано выше для электрофумигаторов с матами. С помощью
секундомера регистрируют время начала нокдауна у первого комара/мухи в
камере и время нокдауна у 99% комаров/мух. По этим показателям графическим
методом определяют время наступления нокдауна у 50% особей (КТ , мин.).
50
Опыт повторяют три раза. Рассчитывают среднее значение КТ и
50
статистическую ошибку.
Метод оценки резерва жидкости во флаконе. Для определения резерва жидкости во флаконе (максимального времени использования жидкости во флаконе) определяют количество испарившейся жидкости после непрерывной работы электрофумигатора в течение не менее 8 ч. Этот процесс должен быть повторен не менее 3 — 5 раз. Каждый раз флакон взвешивают до и после эксплуатации, фиксируется время работы, ДЕЛЬТА массы флакона. На основании этих данных рассчитывают количество вышедшего в воздух содержимого флакона, мг/ч, и далее резерв флакона в часах путем деления массы нетто флакона в мг на количество вышедшего в воздух в мг/ч.
Электрофумигаторы с таблеткой
В качестве носителя ДВ используется таблетка из технопеска в пластиковой оправе, которая применяется с электронагревательным устройством определенного типа. В пластиковую оправу вмонтирован индикатор (с подкрашенной жидкостью). Когда жидкость в индикаторе полностью испаряется, это сигнал к тому, что все ДВ вышло в воздух и средство свою работу завершило.
Метод определения КТ . В чистую камеру объемом 1 куб. м (для мух — 2
50
куб. м) запускают 100 +/- 5 самок комаров (200 +/- 10 имаго мух без
разделения по полу). Температура в камере (25 +/- 2) °C. Нагревательное
устройство включают в электрическую сеть согласно инструкции за 15 мин. до
начала опыта без таблетки. Таблетку вставляют в нагревательное устройство и
сразу размещают в камере с комарами. С помощью секундомера регистрируют
время начала нокдауна у первого комара/мухи в камере и время нокдауна у 99%
комаров/мух. По этим показателям графическим методом определяют время
наступления нокдауна у 50% особей (КТ , мин.). Опыт повторяют три раза.
50
Рассчитывают среднее значение КТ и статистическую ошибку.
50
Метод оценки резерва таблетки. Для определения резерва таблетки
(максимального времени использования таблетки) определяют КТ для комаров
50
и мух (по приведенному выше методу), используя таблетки, которые уже
нагревались до опыта в течение определенного времени. Опыт повторяют три
раза. Рассчитывают среднее значение КТ и статистическую ошибку. За резерв
50
таблетки принимается максимальное время нагрева таблетки в часах, при
котором КТ составляет не более 15 мин. для комаров и не более 45 мин. для
50
мух. ДВ — трансфлутрин.
Показатели эффективности электрофумигаторов: а) с матами (пластинами):
КТ для комаров — не более 7 мин.; резерв мата для комаров — не менее 7 ч;
50
б) жидкостные: КТ для комаров — не более 4 — 5 мин.; резерв средства для
50
комаров — не менее указанного в НТД; КТ для мух — не более 9 — 12 мин.
50
(при использовании вапортрина) и 20 мин. (при использовании других летучих
пиретроидов); резерв средства для мух не менее указанного в НТД; в) с
таблеткой: КТ для комаров — не более 15 мин.; КТ для мух — не более 45
50 50
мин. (при использовании трансфлутрина); резерв средства для комаров/мух —
не менее указанного в НТД.
6.3.4. Метод оценки активности средств борьбы
с личинками комаров
Оценку активности инсектицидов для личинок комаров проводят на личинках 2 — 4-го возрастов желтолихорадочного комара A. aegypti или подвального комара C. pipiens molestus инсектарных культур.
Образец средства, представленный для определения его активности, если он представляет собой жидкую форму, интенсивно взбалтывается и на весах берется навеска для приготовления серий концентраций. Путем разбавления водой готовятся необходимые концентрации. Из образцов других форм берутся навески. Далее поступают описанным выше образом. В сосуды объемом 0,5 л (стеклянные сосуды, химические или парафинированные стаканы и т.п.) наливают по 250 мл водопроводной воды, отстоянной в течение 24 ч. В каждый сосуд (за 2 ч до опыта) помещают по 25 личинок 2 — 4-го возрастов. В сосуды добавляют 1 мл рабочего раствора (эмульсии, суспензии) инсектицида определенной концентрации. Повторность опыта 3-кратная. Контролем являются личинки, находившиеся в воде без добавления инсектицида. Каждый опыт повторяют не менее трех раз. В период эксперимента температура воды должна находиться в пределах (22 +/- 1) °C. Подсчет погибших личинок проводят через 24 ч. Если более 10% личинок в контроле окуклилось, опыт не учитывают и повторяют [72].
Показатели эффективности: остаточное действие — гибель личинок при
подсадке на 3 сутки через 24 или 72 ч 100%; а) микробиологические CK ,
50
мг/л, не более приведенной в ТУ; б) на основе уротропина и др.: гибель
личинок через 24 ч 100%; в) ФОС, пиретроиды и др.: гибель личинок через
24 ч 100%; длительность остаточного действия 3 — 15 суток.
6.3.5. Методы оценки активности педикулицидных средств
Оценку эффективности педикулицидных свойств средств проводят несколькими методами на платяных вшах лабораторной культуры P. humanus corporis имаго, личинки, яйца [72].
В опытах используют сытых вшей. Подопытных вшей содержат в термостате при температуре (28 +/- 2) °C и относительной влажности 70 — 76%. При изучении эффективности инсектицидов используют методы погружения насекомых и яиц или контактирования их с обработанными поверхностями. Опыт проводят не менее трех раз, в каждом опыте не менее трех повторностей. Контролем являются насекомые и яйца, подвергающиеся воздействию растворителя, и насекомые и яйца, не подвергающиеся воздействию средства и растворителя (биоконтроль). Если в контроле погибло более 10% насекомых или яиц вшей, опыт не учитывают и повторяют.
Метод погружения имаго, личинок и яиц вшей для оценки инсектицидной, ларвицидной и овицидной активностей педикулицидных средств. Приготавливают рабочие жидкости (водные эмульсии, суспензии, мыла и др.) или же используют дусты педикулицидов. Насекомых (личинок 3-го возраста, как наиболее устойчивых к инсектицидам, имаго) в количестве 20 штук и яйца помещают в марлевые салфетки 5 x 5 см и погружают в рабочие жидкости средства или в дуст на разные сроки: от 15 с до 60 мин. в зависимости от рекомендованной экспозиции. Опыты проводят в трех повторностях и сопровождают контролем. По окончании экспозиции насекомых промывают мыльной теплой водой и повторно — теплой водой, просушивают на фильтровальной бумаге, и переносят в чашки Петри на чистые образцы бязи 5 x 5 см и помещают в термостат при температуре (28 +/- 2) °C.
Метод импрегнации (пропитки) тканей для оценки инсектицидной, ларвицидной и овицидной активности педикулицидных средств. При оценке средств, предназначенных для профилактики платяного и лобкового педикулеза, образцы разных тканей (бязь, сатин, шерсть и пр.) размером 10 x 10 см погружают в рабочие жидкости (водные эмульсии, суспензии, растворы) или дусты. Время погружения ткани и концентрации средств зависят от химической группы действующего вещества и от формы применения средства. Обработанные образцы просушивают, часть образцов используют для определения острого инсектицидного действия. На просушенные образцы ткани подсаживают не менее 20 особей вшей (10 имаго и 10 личинок 3-го возраста). Срок контакта насекомых со средством составляет от 1 до 60 мин. в зависимости от назначения эксперимента. После контакта насекомых промывают сначала в мыльном растворе, затем теплой водой и переносят на фильтровальную бумагу для просушивания. Затем насекомых переносят в чашки Петри на чистые образцы бязи размером 5 x 5 см, которые помещают в термостат при температуре (28 +/- 2) °C. Учет гибели насекомых ведут через 10, 30 мин. и через 24 ч после контакта с обработанными образцами. В контрольном варианте насекомых подсаживают на чистые (необработанные) образцы тканей.
Для установления сроков носки импрегнированного белья и одежды образцы разделяют на две части. Одну часть образцов подшивают к белью и одежде добровольцев. Через 1, 3, 7 сутки ношения образцы отпарывают и на них подсаживают насекомых, устанавливая сроки эффективности обработанных тканей при ношении. Другую часть обработанных образцов содержат в полиэтиленовых или крафт-пакетах при комнатной температуре для установления сроков эффективности образцов при хранении. Если после контакта с обработанными тканями регистрируются живые насекомые (хотя бы 1 особь), защитное действие обработанных тканей считается завершенным.
Метод контактирования вшей с обработанными поверхностями для изучения инсектицидной и ларвицидной активностей педикулицидных средств. При оценке средств, предназначенных для борьбы с платяным педикулезом, образцы бязи размером 10 x 10 см обрабатывают средством (эмульсией, раствором, суспензией, дустом). Жидкие формы используют из расчета 100 мл/кв. м, дуст равномерно распределяют по поверхности ткани в норме расхода 10 г/кв. м. Образцы бязи, обработанные жидким средством, после высыхания помещают в чашки Петри и на них подсаживают не менее 20 особей вшей (10 имаго и 10 личинок 3-го возраста). Срок контакта насекомых со средством составляет от 5 до 60 мин. в зависимости от назначения эксперимента.
При оценке средств, предназначенных для борьбы с головным педикулезом, пряди волос (или полиамидные волокна) обрабатывают средством из расчета 1 мл/10 кв. см волос или волокон. Насекомых подсаживают на обработанные волосы или волокна на срок от 1 до 60 мин. После контактирования волосы с насекомыми промывают теплой водой с мылом или шампунем и переносят на фильтровальную бумагу для подсушивания. После этого насекомых переносят в чашки Петри на чистые образцы бязи 5 x 5 см, которые помещают в термостат при температуре (28 +/- 2) °C.
При установлении эффективности педикулицидных мазей или гелей их с помощью кисточки наносят на поверхность ткани размером 10 x 10 см и яйца вшей из расчета 1 г/10 кв. см на период от 1 до 60 мин. После воздействия мази на вазелиновой основе или геля насекомых или их яйца промывают теплой водой с добавлением мыльного крема для бритья или шампуня для мытья волос. После окончания контактирования насекомых переносят на чистые образцы бязи 5 x 5 см в чашки Петри, которые помещают в термостат для дальнейших наблюдений при температуре (28 +/- 2) °C. Опыты ставят в трех повторностях и сопровождают контролем.
Метод оценки активности педикулицидных средств в аэрозольных или беспропеллентных упаковках. Оценку эффективности педикулицидных средств в виде аэрозольных или беспропеллентных упаковок проводят в камере объемом 1 куб. м. Ткани с подсаженными на них насекомыми (имаго и личинки 3-го возраста), а также яйцекладками орошают струей аэрозоля, направляя ее с высоты 50 см под углом 45°. Норма расхода средства составляет 10 или 20 г/кв. м. Количество нанесенного средства определяют по разности веса баллона до и после выпуска смеси и далее рассчитывают расход действующего вещества, исходя из состава содержимого упаковки. После орошения тканей через 10 мин. подопытных насекомых пересаживают в чистые чашки Петри на чистые кусочки бязи размером 5 x 5 см и помещают в термостат для наблюдения. Каждый опыт проводят не менее трех раз, каждый в 3 повторностях, и сопровождают контролем. Учеты гибели насекомых ведут через 5, 10, 15, 30 мин. и 1 — 5 и 24 ч. Если в контроле погибло более 10% насекомых или яиц вшей, опыт не учитывают и повторяют.
Показатели эффективности [23]: а) лосьоны, концентраты эмульсий: гибель имаго через 24 ч 100%, гибель яиц через 21 день 100%; б) шампуни, мыла и другие моющие средства, дусты, таблетки, суспензии, гранулы, кремы, гели, эмульсии и др.: гибель имаго через 24 ч 100%; гибель яиц через 21 день 10 — 100%; в) средства для импрегнации белья с целью предупреждения заражения педикулезом: острое действие — гибель имаго при подсадке через 24 ч 100%; длительность остаточного действия при ношении — 3 — 7 суток.
6.3.6. Методы оценки активности средств борьбы
с насекомыми-кератофагами
Оценку эффективности проводят на лабораторных культурах имаго и гусеницах платяной моли T. bisselliella и имаго и личинках кожееда A. smirnovi [51, 52, 53, 72, 78]. Средства для борьбы с насекомыми-кератофагами подразделяются на неспецифические и специфические.
К неспецифическим средствам для борьбы с бабочками моли относятся средства в аэрозольной и беспропеллентной аэрозольной упаковке. Для опытов используют 1 — 2-дневных бабочек моли. Опыты проводят в стеклянных камерах объемом 2 куб. м (п. 6.3.2) или используют модификацию метода, согласно которой испытания проводят в платяных шкафах, объемом примерно 1 куб. м, в которые запускают по 50 бабочек моли и распыляют средство из расчета 1 г/куб. м. Учет гибели проводят через 15 мин. и через 24 ч, учитывая количество живых, мертвых и парализованных бабочек.
К неспецифическим средствам борьбы с личинками кожеедов относятся средства контактного типа действия, предназначенные для уничтожения комплекса нелетающих насекомых. Оценку эффективности указанных средств проводят в отношении личинок кожееда 11 — 12-недельного возраста методом 15-минутного принудительного контакта с обработанной соответствующим средством поверхностью п. 6.2.1.3.
Метод изучения инсектицидной и овицидной активности специфических средств контактного типа действия. Острое действие определяют при непосредственном орошении средством 28 — 30-дневных гусениц моли или 11 — 12-недельных личинок кожееда на пищевом субстрате — неаппретированном сукне (артикул 3907), а также методом свободного контакта насекомых с поверхностью указанной ткани размером 10 x 10 см, обработанной средством, исходя из нормы расхода 10 — 20 г/кв. см (до легкого увлажнения). В качестве контроля используют аналогичные образцы, обработанные только основным растворителем, присутствующим в средстве. Обработанные образцы высушивают в течение 24 ч при комнатной температуре, помещают на них по 10 гусениц моли или личинок кожееда и накрывают крышкой от чашки Петри. Учет опытов проводят ежедневно в течение 72 ч. Опыты проводят в 3 повторностях при температуре (23 +/- 1) °C.
Аналогично оценивают продолжительность действия средства, подсаживая насекомых ежемесячно (или при необходимости через более короткие промежутки времени) на эти же обработанные образцы сукна.
Для средств, которые не содержат традиционных инсектицидов, обладают невысоким или непродолжительным действием, в т.ч. при снижении инсектицидной активности после хранения в течение нескольких месяцев, аналогичным методом оценивают молезащитное антифидантное действие средства. При этом высушенные образцы ткани размером 4 x 4 см взвешивают с точностью до четвертого знака, помещают на них по 10 гусениц моли строго указанного выше возраста, затем образцы ткани вместе с насекомыми переносят в стеклянные стаканчики диаметром 3,5 см, высотой 6 см, которые сверху закрывают бязью.
Продолжительность опыта составляет 14 суток, после чего визуально проводят определение количества погрызов и оценивают повреждение ткани в баллах и взвешивают ткань с точностью до четвертого знака, определяя количество ткани, съеденной 10 гусеницами моли.
Аналогично проводят оценку антифидантного действия в отношении личинок кожееда, но при этом с поверхности субстрата и со дна стаканчика кисточкой собирают все экскременты и также взвешивают с точностью до четвертого знака.
Метод изучения инсектицидной и овицидной активности специфических средств фумигационного типа действия. Оценку острого действия средств в отношении гусениц моли проводят в экспериментальных емкостях объемом 0,01 — 0,50 куб. м или платяных шкафах объемом 0,6 — 1,0 куб. м. В емкости помещают сукно (артикул 3907), размещают средство требуемым образом, вносят по 20 бабочек моли (в садках размером 10 x 10 см либо, в случае небольших емкостей, предназначенных для оценки средств в виде небольших пластин, в садках меньшего размера), по 30 гусениц на пищевом субстрате (сукне размером 10 x 10 см), вложенном в полотняный мешочек объемом 300 куб. см, и по 100 яиц на таком же субстрате. Опыты проводят в 3 повторностях при температуре (23 +/- 1) °C. Определение эффективности средств в отношении имаго и личинок кожееда проводят в аналогичных емкостях, помещая насекомых на пищевой субстрат и затем в полотняный мешочек.
Учет гибели бабочек моли в зависимости от применяемого действующего вещества проводят через 24 — 72 ч, имаго и личинок кожеедов — через 72 ч, яиц — через 10 суток.
Гибель гусениц оценивают ежедневно в течение 3 суток, при отсутствии гибели или невысоком уровне смертности через 14 суток оценивают молезащитное действие, п. 6.3.4.1.
Аналогично проводят изучение продолжительности действия средства, при этом не заменяют средство и развешенное сукно и через определенные промежутки времени в экспериментальные емкости вносят насекомых.
Метод оценки активности средств репеллентного типа действия. Предварительную оценку репеллентного действия проводят в ольфактометре, который представляет собой ящик из оргстекла объемом 0,04 куб. м, разделенный перегородкой на отсеки-ловушки. В опытную ловушку помещают в качестве привлекательного пищевого субстрата сукно артикула 3907, на которое наносят средство (исходя из нормы расхода, составляющей 1/25 от нормы, необходимой для внесения в емкость объемом 1 куб. м), а в контрольную ловушку помещают только указанный пищевой субстрат. Опыты проводят в 3 повторностях при температуре (23 +/- 1) °C. В ольфактометр запускают по 50 бабочек моли (1 — 2-дневного возраста) и через 24 ч проводят оценку репеллентного действия, критерием которого является количество бабочек моли и количество отложенных на субстрат яиц в опытном и контрольном отсеке. Коэффициент отпугивающего действия КОД отдельно для бабочек и яиц моли рассчитывают по формуле 12.
Для проведения испытаний в условиях, приближенных к натурным, используют платяные шкафы или другие замкнутые емкости объемом 0,5 — 1,0 куб. м, в которых размещают требуемое количество средства. Опытные и контрольные шкафы заполняют в качестве имитации одежды 1,5 — 2,0 кв. м неаппретированного сукна артикула 3907. Во все экспериментальные объемы запускают по 50 бабочек моли 1 — 2-дневного возраста. Через 24 ч проводят осмотр шкафов и коробов и развешенного в них сукна. При осмотре учитывают количество живых бабочек на сукне и количество отложенных ими яиц. Рассчитывают величину КОД. Для определения продолжительности действия средства бабочек запускают в экспериментальные емкости через фиксированные промежутки времени, не заменяя в них средство и сукно.
Показатели эффективности: а) средства контактного действия: острое действие — гибель гусениц моли или личинок кожеедов через 72 ч 100%; длительность остаточного действия 4 — 6 месяцев, изъеденность ткани в течение 14 суток не более 7 мг; б) средства фумигационного действия: острое действие — гибель имаго через 48 ч 100%; длительность остаточного действия не менее 4 месяцев; в) средства репеллентного действия: КОД в ольфактометре через 24 ч — не менее 75%; длительность остаточного действия — 1 — 4 месяца.
6.3.7. Методы оценки инсектицидной активности
средств для уничтожения ос
Метод оценки активности инсектицидных средств в аэрозольной упаковке
для борьбы с осами в помещении (при распылении в воздух). Оценка активности
инсектицидных средств в аэрозольной упаковке проводится в лабораторных
условиях на модельном объекте — имаго комнатных мух инсектарной культуры. В
камеру объемом 2 куб. м выпускают 300 мух. Во время проведения эксперимента
температуру воздуха поддерживают в интервале (22 +/- 2) °C, чтобы избежать
излишне возбуждающего или угнетающего влияния температуры на насекомых;
относительную влажность поддерживают в пределах 50 — 70%. При изучении
каждого варианта рецептуры средства эксперимент повторяют пятикратно. Струю
аэрозоля направляют в камеру, при этом расход средства не должен превышать
1 г/куб. м. Расход средства контролируется взвешиванием аэрозольной
упаковки до и после выпуска содержимого. При помощи секундомера определяют
время T поражения 99% насекомых в минутах и рассчитывают величины C
15
(мг/куб. м) — величина концентрации инсектицида в воздухе, которая вызывает
поражение 99% насекомых за 15 мин., Q (мг/куб. м) — количество
15
содержимого аэрозольной упаковки, выпущенное из баллона, вызывающее
поражение 99% насекомых за 15 мин., и величину КТ (в мин.) (формулы 16,
50
17, 18) [72].
Метод оценки активности инсектицидных средств, применяемых способом орошения, для борьбы с осами в гнездах. Оценку активности инсектицидных средств для обработки гнезд ос проводят на имитациях моделей гнезд ос и на впитывающих поверхностях различного типа в лабораторных условиях, используя в качестве модельных объектов мух и рыжих тараканов. В летний период эксперимент можно провести в натурных условиях непосредственно на осах в гнездах, глава 7.
А. Оценка активности инсектицидных средств в специальной аэрозольной упаковке на моделях гнезд.
В летний период собирают опустевшие осиные гнезда или же изготавливают имитации гнезд из пяти слоев папиросной бумаги или фильтровальной бумаги в 2 слоя, напоминающие по форме осиные гнезда, диаметром примерно 10 см. Внутрь гнезда помещают по 100 имаго комнатных мух лабораторной культуры без разделения по полу, входное отверстие закрывают марлей. Модели гнезд прикрепляют клейкой лентой скотчем к стене на высоте 1,5 м от уровня пола в помещении объемом 10 — 15 куб. м. Обработку гнезд проводят с расстояния 1,5 — 2,0 м при нормах расхода 20 — 40 г/кв. м, что соответствует распылению в течение 1 — 3 с в зависимости от типа распылительного устройства и скорости эвакуации жидкости из упаковки. Струю жидкости стараются направить в отверстие модели гнезда. Сразу после обработки испытатель должен покинуть помещение на 30 мин. Затем помещение проветривают, обработанные гнезда помещают в марлевые садки и проводят учет гибели мух через 1 и 24 ч [72].
Б. Оценка продолжительности остаточного действия на поверхностях различного типа инсектицидных средств, применяемых способом орошения, для борьбы с осами.
В том случае, если гнездо расположено в полости стен, крыши и т.д., его не видно снаружи и до него трудно добраться, рекомендуется обработать инсектицидом поверхность вокруг щелей (трещин), через которые осы проникают внутрь строения и вылетают обратно.
В камеру для опрыскиваний помещают различные тест-поверхности: натуральный материал осиных гнезд размером 10 x 10 см, который раскладывают в чашки Петри; фанеру, шифер размером 10 x 20 см, картон или бумагу — 10 x 10 см. Тест-поверхности орошают средством из аэрозольной упаковки с расстояния 20 см под углом 45° при норме расхода 20 г/кв. м (либо рабочей водной эмульсией средства при норме расхода 100 — 150 г/кв. м). Через 15 мин. тест-поверхности удаляют из камеры и на них подсаживают имаго мух (на 5 мин.) или рыжих тараканов (на 15 мин.), используя стандартные экспозиметры Набокова-Ларюхина (D = 4 см). Затем насекомых переносят в сухие чистые пластиковые стаканы, которые закрывают марлей (мухи) или пластиковыми крышками с отверстиями для аэрации (тараканы). Учеты гибели ведут через 15 мин. и 24 ч.
Для оценки продолжительности остаточного действия тест-поверхности следует хранить при комнатной температуре и периодически (через 2, 3, 5 суток) подсаживать на них мух и тараканов описанным выше способом. Учеты гибели следует вести через 24 ч. Если количество погибших насекомых через 24 ч не превышает 50%, исследование остаточного действия считают законченным [72].
Метод оценки активности неспецифических инсектицидных приманок для борьбы с осами в помещении. В лабораторных условиях при оценке неспецифических инсектицидных приманок для уничтожения ос (например, сухих приманок типа «Адамант — приманка от мух», «Агита 10% в.г.», которые эффективны как в отношении мух, так и в отношении ос) в качестве тест-объекта используют имаго комнатных мух. Эксперименты проводят согласно п. 6.2.2. При необходимости исследования специфических приманок для ос эксперименты проводят в натурных условиях согласно п. 6.7.2.6 [72].
Показатели эффективности: а) инсектицидные средства в аэрозольной
упаковке для борьбы с осами в помещениях (при распылении в воздух): острое
действие на ос (мух — тест-объект) C — не более 10 мг/куб. м, Q — не
15 15
более 1000 мг/куб. м, КТ — не более 7 мин.; б) инсектицидные средства в
50
специальной аэрозольной упаковке для обработки гнезд: острое действие на ос
(мух — тест-объект) через 30 мин. после обработки моделей гнезд — не менее
90%, при подсадке мух (рыжих тараканов) на впитывающую тест-поверхность
(через 15 мин. после обработки), гибель не менее 100%; гибель через 24 ч —
не менее 100%; длительность остаточного действия — не менее 3 суток; б)
инсектицидные средства, наносимые на поверхности в районе гнезда способом
орошения: острое действие на ос (мух — тест-объект) при подсадке мух (рыжих
тараканов) на впитывающую поверхность (через 15 мин. после обработки),
гибель не менее 100%; гибель через 24 ч — не менее 100%; длительность
остаточного действия — не менее 3 суток; в) неспецифические инсектицидные
приманки: острое действие на ос (мух — тест-объект) — гибель через 24 ч не
менее 80%, длительность остаточного действия — 10 — 30 суток [23].
6.4. Методы изучения активности акарицидных
и инсектоакарицидных средств
6.4.1. Методы изучения активности средств, предназначенных
для борьбы с иксодовыми клещами и защиты
людей от их нападения
Оценка эффективности должна быть проведена на активных нетравмированных самках вида клещей, в отношении которого будут даваться рекомендации по применению. Как правило, это виды, имеющие наибольшее эпидемиологическое значение. При необходимости исследования проводятся на нескольких видах клещей, отличающихся биологией, географическим распространением и чувствительностью к акарицидам. Дополнительно можно провести опыты на самцах. При наличии достаточного обоснования схожести в чувствительности к акарицидам разных видов клещей возможно распространение данных, полученных для одного вида, на несколько. Поскольку есть данные о схожести биологии и экологии таежного и лесного клещей и близкой чувствительности их к акарицидам, допустимо выводы, сделанные на основе исследований на I. persulcatus распространять на I. ricinus. Однако для рекомендаций применения против клещей других родов (Dermacentor, Haemaphysalis, Hyalomma) необходимы дополнительные исследования. Предпочтительнее испытания проводить в период максимальной активности клещей в природе и использовать самок природной популяции (п. 6.2.3). Поскольку лабораторные условия очень существенно отличаются от природных биотопов, где будет применяться средство, то на основании лабораторных опытов можно делать только предварительные выводы, а далее изучить эффективность средства в реальных условиях применения (природных очагах клещевых инфекций) и проводить практические испытания.
Метод оценки активности средств, предназначенных для борьбы с популяциями иксодовых клещей в природе (жидкие и порошкообразные). На первом этапе оценки средств такого назначения целесообразно использовать методику принудительного контакта п. 6.2.1.3.
Метод оценки активности средств, предназначенных для обработки одежды
с целью защиты людей от нападения иксодовых клещей (аэрозольные и
беспропеллентные упаковки, бруски). Используется тест из хлопчатобумажной
бязи — лента 10 — 70 см, которую закрепляют на впитывающей поверхности
(ткань, фильтровальная бумага и т.п.) размером 0,5 кв. м, прикрыв
полиэтиленом нижние 10 см. Затем эту поверхность с тестом закрепляют
вертикально и обрабатывают аэрозолем в соответствии с рекомендуемой нормой
расхода, обычно 12 с на 0,5 кв. м ткани. При оценке эффективности
акарицидных брусков полосы средства наносят в соответствии с рекомендациями
по применению на расстоянии 10 см от нижнего края теста. После обработки
тесты открепляют, просушивают и развешивают в лаборатории в одинаковых
контролируемых условиях температуры, влажности, освещенности. Опыты
проводят в день обработки. Тесты закрепляют под углом 70° к горизонту.
Клещей по одному помещают на 5 см ниже нулевой отметки и наблюдают за их
передвижением вверх по ткани, дополнительно стимулируя их пальцем
наблюдателя, который держат на расстоянии 0,5 см от гипостома. С помощью
секундомера регистрируют время от момента пересечения клещом нижней черты
обработанного участка до отпадения клеща с теста, что соответствует
наступлению состояния нокдауна. Отпавших клещей помещают в 70%-й раствор
этилового спирта с целью их консервации или продолжают дальнейшее
наблюдение за ними. Опыт проводят не менее чем с 30 самками. Рассчитывают
среднее значение времени наступления состояния нокдауна в минутах КТ
ср
(п. 6.2.3) и статистическую ошибку. Одновременно с определением КТ ,
ср
регистрируют максимальную высоту подъема клеща по тесту. Рассчитывают
среднее значение этого показателя в сантиметрах — МВ (п. 2.3.1).
ср
Метод определения индекса скорости присасывания ИСП определяют по
п. 6.2.3. Время контакта клещей с обработанной аэрозолем частью теста
должно равняться 1/2 КТ .
ср
Нормативными показателями достаточной эффективности акарицидных средств такого назначения являются: среднее время наступления состояния нокдауна — не более 5 мин., средняя максимальная высота подъема по ткани — не более 50 см, индекс скорости присасывания не более 1,1 [72].
Показатели эффективности: акарицидные средства для защиты от иксодовых
клещей (нанесение на одежду, ткани) ТН — не более 5 мин., МВ — не более
ср ср
50 см, ИСП — не более 1,1; инсектоакарицидные средства для борьбы с
иксодовыми клещами в природных биотопах: острое действие — эффективность на
3 сутки, не менее 95%; длительность остаточного действия — не менее 30
суток.
6.4.2. Методы оценки активности акарицидных средств,
предназначенных для уничтожения кровососущих гамазовых
клещей в помещениях, обработка поверхностей
В качестве биологического материала в лабораторных экспериментах используют голодных половозрелых особей гамазового крысиного клеща O. bacoti. При отборе клещей в эксперимент используют метод случайной выборки. Подопытные и контрольные клещи должны быть одного возраста. Клещей содержат при стабильных оптимальных для них условиях в термостатах при температуре воздуха 25 — 26 °C и относительной влажности воздуха 80%. Каждый опыт сопровождается контролем.
Метод подсадки на обработанную тест-поверхность (для исследований активности жидких и порошкообразных форм). Оценку эффективности средств, предназначенных для обработки поверхностей в помещениях с целью уничтожения кровососущих гамазовых клещей, проводят в зависимости от формы средства.
Акарицидное действие средства оценивают в лабораторных условиях на поверхностях двух типов: впитывающей влагу поверхности — фанера и невпитывающей — стекло. Для предотвращения расползания клещей в эксперименте края стеклянных пластин и кусков фанеры стандартного размера 20 x 10 см обрабатывают репеллентами, эффективными в отношении O. bacoti (20%-ными растворами диметилфталата или акрепа), или в течение времени контактирования клещей не дают им покидать тест-поверхности и возвращают назад при помощи тонкой кисточки.
Острое акарицидное действие определяют методом принудительного контактирования клещей со свежеобработанной поверхностью (после высыхания тест-поверхностей). Время контакта составляет 5 мин. После этого клещей переносят в чистую посуду и помещают в термостат. Учет пораженных особей проводят через 24, 48, 72 ч.
Остаточное акарицидное действие средства определяют аналогичным методом, подсаживая клещей на 5 мин. на обработанные тест-поверхности, на 3, 7, 14 сутки и более до окончания акарицидного действия. После экспозиции клещей переносят в чистые емкости и помещают в термостат. Учет погибших клещей проводят через 24, 48, 72 ч после контакта с обработанной поверхностью. Стеклянные пластины и фанеру, используемые в опыте, хранят в вертикальном положении при комнатной температуре.
Метод оценки активности средств в аэрозольных и беспропеллентных упаковках. Оценку эффективности средств в аэрозольных и беспропеллентных упаковках в отношении крысиных клещей проводят в соответствии со стандартной методикой, изложенной в п. 3.1.3, по испытанию средств в аэрозольных упаковках для уничтожения нелетающих насекомых. При этом крысиных клещей помещают в чашки Петри (не менее 30 особей в каждой), края которых смазывают вазелином или 20%-м раствором репеллента (диметилфталата, акрепа), чтобы избежать расползания клещей. Чашки Петри размещают в 5 точках в камере и затем обрабатывают средствами в аэрозольной или беспропеллентной упаковке.
Через 10 мин. после нанесения препарата чашки Петри вынимают из камеры и пересаживают клещей в чистые пробирки, которые помещают на 24 ч в термостат. Учет смертности клещей проводят через 24, 48, 72 ч [72].
Показатели эффективности: а) акарицидные средства для борьбы с гамазовыми клещами в помещениях: острое действие — гибель клещей через 24 ч, 100%; б) остаточное действие — гибель клещей через 24 ч при подсадке на 3 сутки на невпитывающую поверхность не менее 80%.
6.4.3. Методы оценки активности средств,
предназначенных для борьбы с акариформными клещами;
чесоточные клещи и клещи домашней пыли
6.4.3.1. Методы оценки активности средств
скабицидов, предназначенных для обработки поверхностей
в помещениях, одежды, белья и т.д. с целью
уничтожения чесоточных клещей
Оценку эффективности средств, предназначенных для обработки поверхностей в помещениях, одежды, белья и т.д. с целью уничтожения чесоточных клещей, проводят in vitro на модельном объекте — ушном кроличьем клеще P. cuniculi инсектарной культуры.
В зависимости от препаративной формы средства оценку скабицидной активности проводят тремя методами, описанными ниже. Для концентрированного средства — образец интенсивно взбалтывают и на весах отбирают навеску для приготовления серии рабочих концентраций. Путем разбавления водой готовят необходимые концентрации. Готовые препаративные формы испытывают без разведения [72].
Метод погружения для исследования жидких препаративных форм скабицидов (эмульсии, суспензии, растворы и т.п.). Самок клещей по 10 особей помещают на кружок фильтровальной бумаги, свернутой углом в виде «фунтика», погружают в исследуемую рабочую жидкость на 1 мин. Затем клещей переносят в чистую пробирку со вложенной в нее фильтровальной бумагой. Через 24 ч определяют количество пораженных клещей и подсчитывают процент поражения. Опыты ставят при комнатной температуре в трех повторностях. В качестве контрольного варианта используют необработанных клещей, помещенных в пробирки аналогичным образом [72].
Метод орошения (опрыскивания) для оценки скабицидной активности средств. Самок клещей в количестве 10 особей подсаживают в чашки Петри на впитывающую (фильтровальная бумага, бязь) поверхность, после чего чашки Петри с клещами размещают случайным образом в камере в пяти точках и обрабатывают средствами в аэрозольной или беспропеллентной упаковке или водными рабочими растворами различных препаративных форм при помощи аппаратуры типа «Квазар» или «Росинка» с высоты 20 см, направляя струю средства под углом 45° ко дну камеры. Температура в камере во время опытов должна быть постоянной (22 +/- 2) °C, относительная влажность — не менее 60%. На края чашек необходимо нанести полоску вазелина для предотвращения расползания клещей. Через 10 мин. чашки Петри вынимают из камеры, клещей пересаживают в чистые пробирки и проводят учет гибели через 24 ч, подсчитывая процент пораженных особей. Опыты проводят при комнатной температуре в трех повторностях. В качестве контроля используют необработанных клещей, помещенных в пробирки аналогичным образом [72].
Метод подсадки на обработанную скабицидом поверхность. Метод применяется для исследований эффективности дустов и других порошкообразных форм, а также для изучения длительности остаточного действия. Самок клещей в количестве 10 особей подсаживают на обработанную средством невпитывающую (стекло) и впитывающую (фильтровальную бумагу, бязь) поверхность на 15 мин.
Для установления остаточного действия средства образцы поверхностей — пластинки стекла и фильтровальной бумаги или бязи размером 10 x 20 см — помещают в камеры в количестве не менее 5 штук каждой и обрабатывают описанным выше способом. Тест-поверхности оставляют для последующего исследования остаточного действия средства.
После экспозиции клещей пересаживают в чистые пробирки и проводят учет гибели через 24 ч, подсчитывая процент пораженных особей. Опыты проводят при комнатной температуре в трех повторностях. В качестве контроля используют необработанных клещей, помещенных в пробирки аналогичным образом. Определяют эффективные концентрации и норму расхода средства, обеспечивающие достаточное качество, равномерность нанесения на разные типы поверхностей с обеспечением скабицидной эффективности.
Остаточное действие отложений средства определяют после обработки на 1, 3, 5, 7 сутки и более методом контакта клещей с обработанными поверхностями в течение 15 мин. в экспозиметрах. После контакта с обработанными тестами особей переносят в чистые пробирки и регистрируют их состояние через 24 ч [72].
Показатели эффективности: острое действие — гибель клещей через 24 ч 100%; остаточное действие — гибель клещей при подсадке на 3 сутки на невпитывающую поверхность при учете через 24 ч — не менее 80% [23].
6.4.3.2. Методы оценки активности средств акарицидов,
предназначенных для уничтожения клещей домашней пыли
В качестве биологического материала в лабораторных экспериментах используют культуры клещей домашней пыли сем. Pyroglyphidae: D. pteronyssinus и/или D. farinae. Подопытные и контрольные клещи должны быть одного вида, возраста. Клещей содержат при стабильных, оптимальных для их развития условиях, в термостатах при температуре 25 — 26 °C в стеклянных плотно закрытых эксикаторах с относительной влажностью воздуха 70%. Пищевой рацион клещей должен содержать все необходимые компоненты для их нормальной жизнедеятельности.
В лабораторных условиях оценку акарицидной активности средств, предназначенных для борьбы с клещами домашней пыли, проводят на впитывающей тканевой поверхности (бязь). Размеры и форма кусочков бязи, используемой в качестве тест-поверхности, соответствует форме и размеру дна сосуда (бюксы, небольшие стеклянные стаканчики и т.п.), в которых содержат клещей во время экспериментов. Края каждого сосуда с клещами домашней пыли предварительно обклеивают липкой лентой во избежание расползания клещей («ловчий пояс»). Каждый опыт включает не менее 3 повторностей, в каждой из которых используют не менее 20 клещей, и сопровождается контролем [72, 57].
Метод, используемый для оценки эффективности средств, предназначенных для уничтожения клещей домашней пыли, выбирают в зависимости от препаративной формы средства.
Метод оценки активности средств в аэрозольных и беспропеллентных упаковках. Для оценки эффективности средств в аэрозольной и беспропеллентной упаковках используют стандартный метод опрыскивания членистоногих в камере объемом 1 куб. м. В пяти точках размещают чашки Петри с клещами, помещенными непосредственно на бязь. Одновременно в камеру также помещают тест-поверхности — кусочки ткани бязь — в пяти различных точках для изучения длительности остаточного действия отложений средства. Клещей и бязь орошают средством с расстояния 20 — 30 см под углом 45°. Через 10 мин. после орошения клещей переносят в чистую посуду и помещают в эксикаторы. Гибель клещей учитывают через определенные промежутки времени (10 мин., 24, 48 ч после обработки). Пораженными считают мертвых и необратимо парализованных клещей.
Обработанные тест-поверхности (бязь) хранят в подвешенном положении при комнатной температуре. На 1-е и 3-и сутки после обработки для определения длительности остаточного действия отложений аэрозоля на них подсаживают клещей с добавлением кормового субстрата и оставляют для дальнейшего наблюдения. Учеты гибели клещей проводят в течение 5 — 14 суток [72, 57].
Метод подсадки клещей на обработанную тест-поверхность (для исследований активности жидких форм). Обработанные образцы ткани бязь помещают в стеклянный небольшой сосуд. После полного высыхания на бязь подсаживают клещей и добавляют кормовой субстрат. Учет пораженных клещей проводят через 24, 48, 72 ч [72, 57].
Показатели эффективности: острое действие — гибель клещей через 24 ч — не менее 100%.
Метод обработки среды культивирования клещей (для изучения действующих веществ, жидких препаративных форм). Среду культивирования клещей обрабатывают средством с акарицидной активностью. После полного испарения растворителя в субстрат помещают 30 — 50 клещей. Учет живых особей проводят через 24, 72 ч, далее — один раз в 7 дней в течение 3 недель [72].
Показатели эффективности: гибель клещей — не менее 100%.
6.5. Методы определения активности
инсекто- и акарорепеллентных средств
6.5.1. Методы оценки эффективности репеллентных
средств в отношении насекомых
Метод оценки активности репеллентных средств, предназначенных для нанесения на кожу (кремы, лосьоны, эмульсии, салфетки, карандаши, аэрозоли). К испытаниям допускаются только средства, имеющие подтверждение безопасности их применения на кожу людей. В опытах используют голодных самок A. aegypti инсектарной культуры в возрасте 8 — 10 дней, получавших углеводное питание. В марлевый садок размером 30 x 30 x 30 см выпускают (50 +/- 5) самок. Испытания репеллентных средств начинают через 30 мин. после запуска комаров. В период проведения опыта температура в помещении должна составлять 23 — 25 °C, относительная влажность 60 — 70%. Опыты проводят при рассеянном освещении, избегая прямого солнечного света.
Чтобы подтвердить активность комаров, в садок помещают оголенное предплечье испытателя, защитив кисть руки резиновой перчаткой. Проводят учет посадок и укусов комаров в течение 30 с. Активность комаров признается удовлетворительной, если за этот период зарегистрировано не менее 10 посадок и 3 укусов. После этого изучаемое средство наносят на обнаженное предплечье испытателя в норме расхода 0,1 мл (г) на 100 кв. см поверхности кожи. Обработанную руку помещают в садок с комарами на 3 мин. и регистрируют число посадок и укусов комаров. Сразу после нанесения репеллентные средства, как правило, обеспечивают отпугивание всех насекомых, т.е. КОД равен 100%. С целью определения длительности репеллентного действия ДРД проводят повторение опыта через каждые 30 мин. до тех пор, пока не будет зарегистрировано 3 или более укусов за 3 мин. испытания. В каждом садке повторное испытание можно проводить не ранее чем через час после предыдущего. Испытания должны быть проведены с 9 до 14 ч. Каждое средство испытывают не менее чем три испытателя не менее чем в трех повторностях (всего 9 повторностей). Рассчитывают среднее значение ДРД и статистическую ошибку. Изученные средства распределяют по категориям эффективности репеллентных средств. К высшей категории эффективности относят средства, у которых ДРД составляет 4 и более часа, к 1-й категории — 3 и более, до 4, ко 2 категории — 2-й и более, до 3, к 3-й категории — 1 и более, до 2. Если репеллентное средство по своим показателям эффективности не соответствует даже 3-й категории эффективности, то его следует испытать на соответствие 4-й категории эффективности. Испытания средств этой категории проводятся при определенных изменениях в методике проведения опытов, приводящих к снижению агрессивности комаров. В марлевый садок размером 50 x 50 x 50 см выпускают 20 +/- 2 самки. Испытания должны быть проведены с 12 до 14 ч. Все остальные условия опыта остаются прежними.
Показатели эффективности. Нормативными показателями достаточной эффективности репеллентных средств такого назначения являются: коэффициент отпугивающего действия КОД — 100%, а длительность репеллентного действия в часах в соответствии с категориями эффективности: высшая категория — 4 и более (в этикетке указывается защитное действие от насекомых более 4 ч), 1 категория — 3 и более, до 4 (в этикетке указывается защитное действие от насекомых до 4 ч), 2 категория — 2 и более, до 3 (в этикетке указывается защитное действие от насекомых до 3 ч), 3 категория — 1 и более, до 2 (в этикетке указывается защитное действие от насекомых до 2 ч), 4 категория — 1 и более (в этикетке указывается защитное действие от насекомых до 2 ч при низкой численности комаров).
Полный спектр репеллентного действия средства определяется на основании изучения эффективности средства в натурных условиях или на основании литературных данных.
Метод оценки активности репеллентных средств в виде аэрозолей, предназначенных для защиты от двукрылых, при нанесении на одежду. Возможно применение 2 методов: метод ольфактометрии и метод обработанных рукавов. Рукава подготавливают из хлопчатобумажной бязи (ткань рукава должна довольно плотно прилегать к предплечью испытателя) и обрабатывают аэрозолем из расчета 20 г/кв. м. Испытание репеллентной эффективности проводят первый раз после полного высыхания ткани (примерно через 1 ч) и затем через 1 — 2 — 3 — 5 и далее суток. В промежутках между испытаниями рукава развешивают в комнатных условиях. При испытаниях обработанный рукав надевают на предплечье испытателя (кисть руки в резиновой перчатке) и руку помещают в садок с комарами аналогично методике, описанной выше.
Показатели эффективности. Нормативными показателями достаточной эффективности репеллентных средств такого назначения являются: коэффициент отпугивающего действия КОД — 100%, а длительность репеллентного действия в часах в соответствии с категориями эффективности: высшая категория — 20 и более суток (в этикетке указывается защитное действие от насекомых более 20 суток), 1 категория — 10 и более, до 20 суток (в этикетке указывается защитное действие от насекомых до 20 суток), 2 категория — 5 и более, до 10 (в этикетке указывается защитное действие от насекомых до 10 суток), 3 категория — 3 и более, до 5 (в этикетке указывается защитное действие от насекомых до 5 суток) [72].
Методы оценки активности репеллентных средств, предназначенных для защиты от муравьев. Оценку репеллентной активности проводят на муравьях рода Formica в натурных условиях в период их активности весна-осень. Каждое средство испытывают не менее трех испытателей не менее чем в трех повторностях (всего 9 повторностей) [72].
Метод оценки активности репеллентных средств, предназначенных для защиты от муравьев, при нанесении на одежду. Штанины подготавливают из хлопчатобумажной бязи и обрабатывают средством из расчета 20 г/кв. м. При испытаниях обработанную штанину надевают на ногу испытателя, заправляя в носок, чтобы избежать попадания муравьев под одежду, и ногу в обуви ставят на то место около муравейника, где наблюдается скопление насекомых. Муравьи заходят на обувь, после чего поднимаются на носок к обработанной штанине и ползут по ней вверх. Регистрируют число муравьев, проползших отрезок, обработанный репеллентным средством, длиной 50 см.
Рассчитывают КОД, который равен доле муравьев (в процентах), не проползших обработанную зону, от числа муравьев в опыте. Испытание репеллентной активности проводят первый раз после полного высыхания ткани (примерно через 1 ч после обработки) и затем через 1 — 2 — 3 — 5 суток и далее. Для определения длительности репеллентного действия испытания повторяют до тех пор, пока КОД сохраняется не менее 70%. В промежутках между испытаниями штанины развешивают в комнатных условиях.
Показатели эффективности. Нормативными показателями достаточной эффективности репеллентных средств такого назначения являются: коэффициент отпугивающего действия КОД — 95 и более %, а длительность репеллентного действия — 3 и более суток.
Метод оценки активности репеллентных средств, предназначенных для защиты от муравьев, при нанесении на кожу. К испытаниям допускаются только средства, имеющие подтверждение безопасности их применения на коже людей. Изучаемое средство наносят на обнаженную голень испытателя в норме расхода 0,1 мл (г) на 100 кв. см поверхности кожи. Испытатели должны избежать попадания муравьев под одежду: надеть носки с плотной резинкой, закатать брюки так, чтобы они плотно прилегали к ноге выше колена. Ногу в обуви ставят на то место около муравейника, где наблюдается скопление насекомых. Муравьи заходят на обувь, после чего поднимаются на носок к обработанной голени и ползут по ней вверх. Регистрируют число муравьев, проползших отрезок, обработанный репеллентным средством (от носка до колена). Испытания начинают сразу после нанесения средства. С целью определения длительности репеллентного действия ДРД проводят повторение опыта через каждые 30 мин. Рассчитывают КОД, который равен доле муравьев (в процентах), не проползших обработанную зону, от числа муравьев в опыте. Для определения длительности репеллентного действия испытания повторяют до тех пор, пока КОД сохраняется не менее 70%.
6.5.2. Методы оценки активности репеллентных средств
для защиты от иксодовых клещей
Метод оценки активности репеллентных средств в виде аэрозолей, предназначенных для защиты от иксодовых клещей, при нанесении на одежду. Используется тест из хлопчатобумажной бязи — лента 10 — 70 см, которую закрепляют на впитывающей поверхности (ткань, фильтровальная бумага и т.п.) размером 0,5 кв. м, прикрыв полиэтиленом нижние 10 см (п. п. 2.3 и 4.1). Затем эту поверхность с тестом закрепляют вертикально и обрабатывают аэрозолем в соответствии с рекомендуемой нормой расхода, обычно 12 с на 0,5 кв. м ткани. После обработки тесты открепляют, просушивают и развешивают в лаборатории в одинаковых контролируемых условиях температуры, влажности, освещенности. Опыты проводят в день обработки. Тесты закрепляют под углом 70° к горизонту. Клещей по одному помещают на 5 см ниже нулевой отметки и наблюдают за их передвижением вверх по ткани, дополнительно стимулируя их пальцем наблюдателя, который держат на расстоянии 0,5 см от гипостома. Регистрируют число клещей, проползших отрезок, обработанный репеллентным средством, длиной 50 см. На контрольном тесте, как правило, все клещи проползают отмеченную зону. После испытаний клещей помещают в 70%-ный раствор этилового спирта с целью их консервации или продолжают дальнейшее наблюдение за ними. Опыт проводят не менее чем с 30 самками. Рассчитывают КОД, который в данном случае равен доле клещей (в процентах), не проползших обработанную зону, от числа клещей в опыте. Результаты опытов трактуют в сравнении с результатами испытаний эталонного теста. Для определения длительности репеллентного действия испытания повторяют ежедневно до тех пор, пока КОД сохраняется равным или выше 90% [72].
Показатели эффективности. Нормативными показателями достаточной эффективности репеллентных средств такого назначения являются: коэффициент отпугивающего действия КОД — 95 и более %, а длительность репеллентного действия — 3 и более суток.
Метод оценки акарицидно-репеллентных средств в виде аэрозолей,
предназначенных для защиты от иксодовых клещей, при нанесении на одежду.
Оценка акарицидно-репеллентных средств проводится по двум направлениям: как
акарицидного средства и как репеллентного. Тест подготавливается по
п. 6.4.1. Изучение эффективности проводится по п. 6.4.1, 6.4.2.
Определяются показатели КТ , МВ , ИСП, КОД и ДРД.
ср ср
6.5.3. Метод оценки активности акарорепеллентных
средств в отношении гамазовых клещей
Оценку эффективности репеллентных средств в отношении O. bacoti проводят при помощи методики, разработанной для иксодовых клещей, при этом оценивается отрицательная локомоторная реакция клеща на границе химического барьера, представляющего собой репеллент, нанесенный на субстрат, на пути следования клещей. Путь следования определяется отрицательным геотропизмом голодных клещей O. bacoti, подкрепленным привлекающим фактором добычи (рука экспериментатора). Отпугивающее действие исследуют на 1, 3 и 5 сутки после обработки. Опыт с каждым соединением проводят не менее чем в 3 повторностях, используя не менее 30 клещей в каждой. В опыте используют голодных самок крысиного клеща.
Для оценки репеллентной активности веществ вычисляют коэффициент отпугивающего действия КОД по формуле 12. Длительность репеллентного действия ДРД оценивают как время (в сутках), в течение которого зону, обработанную репеллентом, проходят не более 30% клещей [72].
Показатели эффективности. Репеллентные средства: а) для нанесения на кожу (острое действие) КОД для комаров — 100%; длительность действия — ДРД для комаров (по категориям эффективности): высшая категория — 4 ч и более, 1 категория — 3 ч и более, до 4 ч, 2 категория — 2 ч и более, до 3 ч, 3 категория — 1 ч и более, до 2 ч, 4 категория — 1 ч и более; б) для нанесения на одежду, ткани (острое действие) КОД для комаров — 100%, для блох — 95% и более, для иксодовых клещей — 95% и более, для муравьев — 95% и более; длительность действия — ДРД для комаров (по категориям эффективности): высшая категория — 20 суток и более, 1 категория — 10 суток и более, до 20 суток, 2 категория — 5 суток и более, до 10 суток, 3 категория — 3 суток и более, до 5 суток; для блох: высшая категория — 5 суток и более, 1 категория — 3 суток и более, до 5 суток, 2 категория — 2 суток и более, до 3 суток; для иксодовых клещей — 3 суток и более; для муравьев — 3 суток и более.
Инсектицидно-, акарицидно-репеллентные средства: острое инсектицидное
действие — гибель комаров через 2 ч 100%; остаточное инсектицидное действие
— гибель комаров через 3 суток — не менее 70%; острое репеллентное действие
КОД для комаров не менее 90%, ДРД для комаров — не менее 1 суток, для
клещей ТН — не более 5 мин., МВ — не более 50 см, ИСП — не более 1,1.
ср ср
6.6. Методы определения активности средств на основе
регуляторов развития насекомых и аттрактантов феромонов
6.6.1. Методы оценки активности средств на основе
регуляторов развития насекомых
Группа регуляторов развития насекомых РРН объединяет соединения, являющиеся по механизму действия аналогами природных гормонов насекомых: ювенильного (АЮГ или ювеноиды), линочного (ЛГ или экдизоиды), нейрогормонов и др. В эту группу входят также химические соединения, не являющиеся по структуре аналогами природных гормонов, но вызывающие у насекомых гормоноподобные эффекты. К ним относятся ингибиторы синтеза хитина ИСХ: хлор- и фторпроизводные мочевины (дифлубензурон, тримфлумурон, гексафлумурон и др.). Из группы аналогов ювенильного гормона в РФ наиболее известен метопрен, гидропрен и пирипроксифен. Для характеристики активности АЮГ и ИСХ используются величины эффективных концентраций и доз, вызывающие морфогенетические или прочие изменения у 50, 95 или 99% биообъектов.
Механизм действия АЮГ заключается в том, что введение экзогенного аналога в тот период, когда титр истинного гормона в организме насекомого минимален («критический период»), вызывает эффекты, отсутствующие при нормальном прохождении метаморфоза. Поскольку эти соединения являются аналогами природного гормона, то организм реагирует на их появление (присутствие) образованием промежуточных особей, гигантских, сильно меланизированных личинок, недоразвитых куколок с развитой головой имаго и т.п.
Ингибиторы синтеза хитина — это соединения, которые ингибируют процесс образования глюкозы, необходимой для синтеза хитина. Из-за ее отсутствия ослабляется связь между эндо- и экзокутикулой: она расслаивается и насекомое не может завершить процесс окукливания. При воздействии ИСХ — отсутствие куколок и различные нарушения линьки на протяжении всего цикла развития, от яйца до начала окукливания. Появление куколок — свидетельство окончания срока действия ИСХ.
При воздействии АЮГ: нарушения морфогенеза на протяжении всего цикла развития, отсутствие вылета выплода имаго, появление неполноценных имаго или особей с признаками предшествующей фазы развития: «адультоидов».
Фаза имаго. АЮГ не рекомендуется для использования в отношении имаго мух: вместо ожидаемого эффекта подавления численности они повышают яйцепродуктивность самок в 1,5 — 2 раза в сравнении с контролем. У имаго тараканов они вызывают эффект стерилизации и резко выраженные морфогенетические эффекты: деформированные или укороченные крылья, смазанный рисунок жилкования, промежуточные формы сильно меланизированные, редукция члеников конечностей, недоразвитые оотеки. У блох наблюдается эффект стерилизации у самок при воздействии ИСХ и нарушения при формировании кокона при воздействии АЮГ.
ИСХ обладают стерилизующим действием на имаго мух при скармливании им приманок. Эффект выражается в частичной или полной нежизнеспособности отложенных яиц или в полном отсутствии кладок.
Фаза яйца. Воздействие АЮГ на процессы эмбриогенеза заключается в ингибировании дифференциации клеток и тканей и может проявляться или в гибели эмбрионов на разных стадиях развития внутри яйца, или в отрождении уродливых нежизнеспособных личинок. Видимые нарушения эмбриогенеза могут быть вызваны как путем нанесения АЮГ непосредственно на яйцо, так и путем обработки самок в период, предшествующий яйцекладке. Воздействие препаратов на свежеотложенное яйцо — 20 — 30 ч после откладки — препятствует нормальному развитию, приводя его к гибели. Но в более поздние сроки после откладки, когда процесс эмбриогенеза уже завершен и в яйце происходят процессы личиночной дифференциации, обработка уже не препятствует отрождению личинок. Однако личинки могут иметь нарушения линьки, образовывать промежуточные формы и погибать при линьке на имаго.
ИСХ в отличие от АЮГ не блокируют эмбриогенез: из яйца развивается личинка, которая погибает на стадии очередной линьки или при формировании куколки.
Фаза личинки. В процессе онтогенеза насекомых периоды очень высокой чувствительности к ЮГ чередуются периодами полной нечувствительности к его действию. Поэтому получить видимые эффекты от применения АЮГ возможно лишь в отдельные моменты развития, когда титр природного гормона в гемолимфе снижается до критического уровня или гормон отсутствует вообще. В это время организм наиболее чувствителен к ЮГ — это и есть «критический период», во время которого и следует проводить испытания АЮГ. Учитывая, что «критический период» у АЮГ — это личинка последнего зрелого возраста, для получения достоверных результатов необходим строго выравненный по возрасту биологический материал, отличающийся по возрасту в пределах от нескольких часов до 1 суток.
Фаза куколки. ИСХ и АЮГ слабо проникают через пупарий, поэтому этот метод испытания не рекомендуется, поскольку для получения очень слабого эффекта концентрации приходится увеличивать в 3 — 5 раз по сравнению с теми, которые использовали для обработки личинок.
В целом отличие испытаний РРН от инсектицидов касается работы с личинками мух и комаров (блох — в меньшей степени), где необходимо учитывать «критический период», ибо воздействие вещества можно просто «не поймать». При работе с тараканами и в меньшей степени с блохами, имеющими сухопутную воздушную среду для развития и имаго, и личинок, методы испытаний почти не отличаются по сути, различны лишь методы оценки эффективности и сами получаемые эффекты.
Комары. При испытании АЮГ в отношении личинок комаров их следует вносить в сосуды с водой, где содержатся личинки комаров зрелого 4-го возраста. Наблюдения за их развитием проводят постоянно, ежедневно регистрируя особи с признаками начала окукливания, затем — формирующие куколку. Показателями эффективности являются: 1) отсутствие нормально сформированной куколки; 2) особи, которые не смогли освободиться от экзувия; 3) особи, которые не смогли подняться с поверхности воды.
ИСХ вносят в воду с личинками комаров, находящимися на 1-й — 2-й стадиях развития, и наблюдают за процессом линьки, отмечая ежедневно ее нарушения. Появление куколок свидетельствует о прекращении действия препарата.
Мухи. АЮГ вносят в субстрат, где происходит развитие преимагинальных стадий, в период, когда преобладают личинки последнего зрелого возраста. Показатель эффективности — отсутствие вылета нормально сформированного имаго.
ИСХ вносят в субстрат для развития преимагинальных стадий при наличии любых личиночных возрастов. Показатель эффективности — отсутствие нормально сформированной куколки.
Блохи. Испытания проводят методом обработки субстрата (песок + альбумин), где развиваются личинки блох. Соединения можно вносить в виде растворов в ацетоне, который быстро испаряется, а вещество остается в субстрате. Показатели эффективности: 1) нарушения в развитии личинок; 2) отсутствие нормально сформированного кокона; 3) отсутствие выплода жизнеспособных имаго.
Тараканы. Испытания АЮГ и ИСХ проводят на имаго и личинках методом скармливания отравленных пищевых приманок в течение 1 — 3 суток, особи с явными нарушениями в развитии появляются не ранее чем через 5 — 7 дней. Учет эффективности АЮГ и ИСХ аналогичен: 1) количество особей с нарушениями; 2) отсутствие жизнеспособных оотек; 3) выплод нормального поколения.
Муравьи. Испытания АЮГ и ИСХ проводят на имаго рабочих особей рыжих домовых муравьев методом скармливания отравленных пищевых приманок в течение 1 — 3 суток. Особи с явными нарушениями морфогенеза появляются в течение 4 — 7 суток. Показателем активности АЮГ и ИСХ является появление особей с нарушениями развития, что свидетельствует о наличии у соединения гормоноподобного действия. Рабочими особями муравьев приманка, содержащая АЮГ или ИСХ, доставляется в гнездо матки и приводит к ее стерилизации/бесплодию. Далее матка не дает потомства, а рабочие особи гибнут естественной смертью, что приводит к ликвидации колонии.
При оценке активности регуляторов развития РРН основным условием является использование в экспериментах строго выравненного по возрасту (не менее 5 — 6 ч со времени последней линьки) биологического материала: при оценке аналогов ювенильного гормона АЮГ используют личинок последнего возраста; при оценке активности ингибиторов синтеза хитина ИСХ — личинок 2-го возраста для всех биологических объектов.
На весах берется навеска вещества или средства, представленного для определения его активности, и готовятся серии концентраций. В том случае, если средство представляет собой жидкую форму, оно интенсивно взбалтывается и после этого берется навеска, если это гранулы или порошкообразные формы, то берется навеска без предварительных манипуляций [72, 62].
6.6.1.1. Методы оценки активности аналогов
ювенильного гормона АЮГ
Оценку активности АЮГ для личинок комаров проводят на личинках желтолихорадочного комара A. aegypti 4-го возраста; личинках крысиных блох X. cheopis, комнатных мух M. domestica, рыжих тараканов B. germanica последних возрастов инсектарных культур [72].
Метод оценки активности АЮГ в отношении комаров. При испытании АЮГ в отношении личинок комаров их вносят в сосуды с водой, где содержатся личинки комаров 4-го возраста. Наблюдения за их развитием проводят постоянно, ежедневно регистрируя особей с признаками начала окукливания, затем — формирующих куколку. Показателями эффективности являются: 1) отсутствие нормально сформированной куколки; 2) особей, которые не смогли освободиться от экзувия; 3) особей, которые не смогли подняться с поверхности воды. Учет эффективности проводят ежедневно с целью регистрации нарушений в их развитии в течение 4 дней. Подсчитывают количество личинок с морфогенетическими нарушениями.
При оценке эффективности АЮГ в форме брикетов гранул исходят из нормы расхода: 1 брикет массой до 10 г на 10 кв. м водной поверхности. Строго выдерживают температуру, необходимую для развития личинок (27 +/- 2) °C, поскольку в зависимости от температуры меняются сроки развития. Учет эффективности проводят ежедневно, регистрируя количество деформированных личинок. Из-за медленной диффузии ДВ в воду из этой формы, в отличие от жидких и порошкообразных форм, при использовании которых ДВ сразу попадает в воду, эффект проявляется медленнее.
Метод оценки активности АЮГ в отношении комнатных мух. Препаративные формы на основе АЮГ вносят в субстрат, где происходит развитие преимагинальных стадий, в период, когда преобладают личинки последнего возраста. Показатель эффективности — отсутствие вылета нормально сформированного имаго.
При оценке эффективности АЮГ в форме гранул их вносят, исходя из рекомендованной нормы расхода, в субстрат для развития личинок, в который помещают личинок последнего возраста. Строго выдерживают температуру, необходимую для развития личинок (20 +/- 2) °C, поскольку в зависимости от температуры меняются сроки развития: при 20 °C — 4 дня, при 16 °C — 6 — 8 дней. Учет проводят ежедневно.
Метод оценки активности АЮГ в отношении крысиных блох. В субстрат для развития личинок (тонкий слой песка, предварительно, во избежание заплесневения, прокаленный в течение 2 ч и смешанный с сухим стандартным альбумином и пивными дрожжами: 3 г альбумина на 10 г песка) вносят раствор АЮГ в ацетоне. После испарения растворителя по 30 личинок блох последнего возраста помещают в субстрат. Эффективность оценивают, подсчитывая ежедневно личинок с нарушением метаморфоза. Показатели эффективности: 1) нарушения в развитии личинок; 2) отсутствие нормально сформированного кокона; 3) отсутствие выплода жизнеспособных имаго [72].
Метод оценки активности АЮГ в отношении муравьев. Активность приманок, содержащих АЮГ и т.д., в отношении колоний муравьев оценивается по п. 6.3.2 [72].
Метод оценки активности пищевой приманки с АЮГ в отношении тараканов. Пищевую приманку с РРН ставят в пластиковые боксы размером 20 x 20 x 30 см, в который вносят имаго и личинок тараканов (самцы:самки:личинки в соотношении 1:1:4). В этот же садок ставят поилки с водой. Наблюдения ведут ежедневно в течение 7 суток, подсчитывая количество личинок с морфологическими изменениями. Особи с явными нарушениями в развитии появляются не ранее чем через 5 — 7 дней. Учет эффективности АЮГ и ИСХ аналогичен: 1) количество особей с нарушениями; 2) отсутствие жизнеспособных оотек; 3) выплод нормального поколения.
Метод изучения инсектицидных фумигирующих средств на основе АЮГ гидропрена в отношении тараканов. Для определения биологической активности инсектицидных фумигирующих устройств средств, выполненных в форме диска-фумигатора, в которых в качестве ДВ используют АЮГ гидропрен, необходима специальная установка. Это связано с тем, что пары гидропрена, испаряясь с поверхности диска-фумигатора (или другого устройства), обладают способностью проникать в щели и трещины, где укрываются тараканы, и губительно воздействовать на них. Эксперименты проводят в системе из сообщающихся между собой с помощью переходника (15 x 15 x 30 мм) бокса из прозрачного оргстекла (200 x 200 x 200 мм) и лабиринта с крышкой (200 x 200 x 40 мм), рис. 6.5 (не приводится).
Такая конструкция позволяет создать длину пробега насекомых в одном лабиринте, равную двум метрам, сохраняя компактность установки, и проводить наблюдения за влиянием гидропрена на уровне модельной группы тараканов в условиях, максимально приближенных к естественным, в течение продолжительного периода жизни насекомых. Лабиринты выполняют функцию убежища (имитация щелей и трещин) и поэтому они должны быть затемнены черной светонепроницаемой бумагой. В опытном варианте в боксы устанавливают диски-фумигаторы (или другие аналогичные устройства), кормушки и поилки с водой. В контрольном варианте в боксах создают те же условия, но без дисков-фумигаторов. Эксперименты ставят при комнатной температуре воздуха (20 — 24 °C) и естественном световом режиме.
Эксперименты ставят в 3 повторностях. В каждой повторности используют по 60 тараканов (10 самок, 10 самцов и 40 личинок) с учетом естественного соотношения особей в популяции рыжих тараканов 1:1:4. Учеты погибших тараканов, а также наблюдения за появлением меланизированных особей и тараканов с морфологическими отклонениями проводят на 1, 2, 3, 6 — 10, 13 — 14, 21, 28-е сутки и далее через 5, 6, 7, 8, 9, 10 недель. Кроме того, отслеживают появление оотек у самок и процесс отрождения из них личинок первого возраста (в течение 10 недель) и вносят в таблицу. Для определения целевой эффективности исследуемого средства с АЮГ оценивают отсутствие имаго и появление меланизированных и уродливых особей, а также отсутствие роста популяции. Статистическую обработку результатов (величину ошибки выборочной средней) проводят согласно математико-статистическим методам, применяемым в биологических исследованиях [72, 64].
Показатели эффективности. При внесении в среду обитания — аналоги ювенильного гормона АЮГ — жидкие формы: деформированных личинок — комаров 4-го возраста — через 2 — 4 суток не менее 90%, блох — через 3 суток — не менее 95%; плавающие формы (брикеты, гранулы): деформированных личинок — комаров 4 возраста — через 4 — 5 суток не менее 95%; гранулы для борьбы с мухами: деформированных личинок мух — через 4 — 5 суток — не менее 95%.
Пищевые приманки с АЮГ: а) для мух: стерильность самок, отсутствие яйцекладок через 5 дней, жизнеспособных яиц — не более 5%, деформированных личинок через 2 — 3 суток — не менее 95%; б) для тараканов: деформированных личинок через 5 — 7 суток — не менее 95%.
Диски-фумигаторы с АЮГ — для тараканов: через 2 недели появление единичных меланизированных и деформированных личинок.
6.6.1.2. Методы оценки активности средств на основе
ингибиторов синтеза хитина ИСХ
Оценку активности ИСХ проводят на личинках 2-го возраста желтолихорадочного комара A. aegypti, крысиных блох X. cheopis, комнатных мух M. domestica, рыжих тараканов B. germanica инсектарных культур [72].
Метод оценки активности ИСХ в отношении комаров. ИСХ вносят в воду с личинками комаров 1 — 2-го возрастов и наблюдают за процессом линьки, отмечая ежедневно ее нарушения. Появление куколок свидетельствует о прекращении действия средства.
Учет эффективности проводят ежедневно с целью регистрации нарушений в их развитии в течение 4 дней. Подсчитывают количество личинок с морфогенетическими нарушениями.
При оценке эффективности ИСХ в форме брикетов гранул исходят из нормы расхода 1 брикет массой до 10 г на 10 кв. м водной поверхности. Строго выдерживают температуру, необходимую для развития личинок (27 +/- 2) °C, поскольку в зависимости от температуры меняются сроки развития. Учет эффективности проводят ежедневно, регистрируя количество деформированных личинок. Из-за медленной диффузии ДВ в воду из этой формы, в отличие от жидких и порошкообразных форм, при использовании которых ДВ сразу попадает в воду, эффект проявляется медленнее [72].
Метод оценки активности ИСХ в отношении комнатных мух. При оценке эффективности ИСХ в любой препаративной форме вносят средство, исходя из нормы расхода, в субстрат для развития личинок, в который помещают личинок 2-го возраста. Строго выдерживают температуру, необходимую для развития личинок (20 +/- 2) °C, поскольку в зависимости от температуры меняются сроки развития: при 20 °C — 4 дня, при 16 °C — 6 — 8 дней. Учет проводят ежедневно, подсчитывая количество деформированных личинок. Показатель эффективности — отсутствие нормально сформированной куколки.
Пищевую приманку с регулятором развития насекомых ставят в садок размером 30 x 30 x 30 см, в который запускают 50 — 100 имаго 3 — 4-дневных комнатных мух. В этот же садок ставят субстрат для откладки яиц (смесь отрубей с водой и молоком) и поилки с водой. Наблюдения ведут ежедневно в течение 5 суток до получения яйцекладок [72].
Метод оценки активности ИСХ в отношении крысиных блох. В субстрат для развития личинок (тонкий слой песка, предварительно, во избежание заплесневения, прокаленный в течение 2 ч и смешанный с сухим стандартным альбумином и пивными дрожжами: 3 г альбумина на 10 г песка) вносят раствор ИСХ в ацетоне. После испарения растворителя по 30 личинок блох 2-го возраста помещают в субстрат. Эффективность оценивают, подсчитывая ежедневно личинок с нарушением метаморфоза [72].
Метод оценки активности пищевой приманки с ИСХ в отношении тараканов. Активность пищевых приманок, содержащих ИСХ, оценивают по п. 6.1.1 [72].
Показатели эффективности. При внесении в среду обитания — ингибиторы синтеза хитина ИСХ — жидкие формы: деформированных личинок комаров 2-го возраста через 2 — 4 суток не менее 90%; длительность остаточного действия 7 суток; плавающие формы (брикеты, гранулы): деформированных личинок комаров 2-го возраста через 4 — 5 суток не менее 95%; длительность остаточного действия — 7 — 21 сутки.
Пищевые приманки с ИСХ: а) для мух: стерильность самок, отсутствие яйцекладок через 5 дней, жизнеспособных яиц не более 5%, деформированных личинок через 2 — 3 суток не менее 95%; б) для тараканов: деформированных личинок через 5 — 7 суток не менее 95%.
6.6.2. Методы оценки активности аттрактантов феромонов
Аттрактанты феромоны подразделяются на половые, агрегационные, следовые, тревоги и яйцекладки.
Половые феромоны являются основным средством коммуникации особей членистоногих разного пола, обеспечивая процесс спаривания. Запахи, которые выделяют самки членистоногих, служат, главным образом, для привлечения самцов. Феромоны могут выделяться и самцами для привлечения и полового возбуждения самок.
Агрегационные феромоны обуславливают существование группировок насекомых в определенном месте. Так например, очень активен агрегационный феромон у таракановых. Основное количество этого феромона обнаружено в экскрементах тараканов.
Следовые феромоны — этим химическим стимулом насекомые метят пути своего передвижения; феромонами яйцекладки насекомые отмечают места, оптимальные для яйцекладок; феромоны тревоги являются химическими стимулами, с помощью которых насекомые информируют друг друга о возможной опасности.
В составе различных препаративных форм, применяемых в практике медицинской дезинсекции, используются как половые феромоны, так и агрегационные феромоны для привлечения особей к инсектицидной приманке или клейкой поверхности.
Оценку эффективности аттрактантов и феромонов проводят на имаго комнатных мух M. domestica и рыжих тараканов B. germanica.
Метод оценки активности аттрактантов феромонов для рыжих тараканов. Оценку эффективности аттрактантов феромонов проводят на рыжих тараканах инсектарной культуры. Для этого используют бокс из оргстекла 20 x 20 x 30 см, на верхнюю часть внутренней поверхности которого нанесена полоска вазелина шириною 2 см, препятствующая выползанию насекомых. В бокс помещают по 20 самок, 20 самцов и 80 личинок 2 — 4-го возрастов. Далее помещают аттрактант феромон на клейкую поверхность в центре бокса по п. 6.1.1. Параллельно ставят контрольный вариант: в бокс помещают стеклянную емкость объемом 0,5 л, в которую кладут приманку (кусочек белого хлеба с подсолнечным маслом). Край емкости также смазывают вазелином. Учеты эффективности проводят через 17 — 24 ч. Повторность опыта трехкратная.
Метод оценки активности аттрактантов феромонов для комнатных мух. В опытном варианте в садок размером 30 x 30 x 30 см помещают лист бумаги с нанесенным на него энтомологическим клеем, тестируемое средство и выпускают 50 имаго мух; в контрольном варианте — лист бумаги с нанесенным клеем. Наблюдения ведут в течение 3 мин., подсчитывают количество прилипших мух в опытном и контрольном вариантах.
Далее рассчитывают коэффициент аттрактивного действия КАД по формуле 19:
О — К
КАД = —— x 100, (19)
50
где:
О — количество прилипших мух в опыте, %;
К — количество прилипших мух в контрольном варианте, %.
Метод оценки активности пищевых приманок, содержащих феромон, для комнатных мух. Оценка активности пищевых приманок, содержащих в качестве действующего вещества различные инсектициды в композиции с феромоном цис-трикозеном, осуществляется по методу, изложенному в п. 6.2.2, с модификациями. В садок размером 30 x 30 x 30 см помещают приманку с феромоном, во второй садок — приманку без феромона. Наблюдения ведут в течение нескольких часов, проводя учеты через 15, 30 мин., 1, 2, 3, 6 и 24 ч. Рассчитывают коэффициент аттрактивного действия по формуле 19, п. 6.2, и смертность, % [72]
Показатели эффективности. Аттрактанты феромоны (половые, агрегации, пищевые): а) для мух за 3 мин. КАД — — не менее 50%, б) для тараканов за 17 ч КАД — не менее 50%.
6.7. Методы определения эффективности инсектицидных,
акарицидных и репеллентных средств в натурных условиях
6.7.1. Общие требования к проведению испытаний
в натурных условиях
На основании изучения в лабораторных условиях инсектицидной, акарицидной, рострегулирующей, репеллентной активности субстанций и их препаративных форм определяют эффективные концентрации и нормы расхода по отношению к разным видам членистоногих, имеющим эпидемиологическое и санитарно-гигиеническое значение (спектр действия) и ориентировочную кратность обработок.
Поскольку реальные условия применения средств значительно отличаются от лабораторных, часто бывает важно, а иногда обязательно проводить испытания в натурных условиях. Под натурными условиями понимаются реальные условия применения дезинфекционных средств. Объектами в данном случае являются жилые помещения, заселенные синантропными насекомыми, природные биотопы, транспортные средства и т.д.
На первом этапе определяют оптимальные режимы обработок в зависимости от типа объектов и используемой аппаратуры, возможные побочные явления, которые могут возникнуть у людей, контактировавших с препаратом (проводящих обработку, находящихся в обработанных помещениях или использующих репеллентные средства). Эти испытания проводят на ограниченном количестве объектов.
6.7.2. Испытания инсектицидных средств
6.7.2.1. Изучение эффективности инсектицидных средств
по отношению к тараканам, постельным клопам и блохам
При обследовании объекта на наличие постельных клопов и тараканов используют визуальный контроль, отмечая места нахождения насекомых и их количество. Степень заселенности помещения насекомыми оценивают следующими показателями (см. таблицу). Визуальную оценку количества тараканов в объекте целесообразно проводить в часы их активности — вечером. Учет количества тараканов можно проводить, расставляя ловушки разных типов: картонные укрытия с липкой массой, а также ловушки, содержащие в качестве приманки аттрактанты или феромоны тараканов в сочетании с клеем. В качестве ловушек могут быть использованы стеклянные банки емкостью 200 — 250 мл, в которых в качестве приманки используют куски хлеба, смоченные пивом, пивные дрожжи, кусочки яблока. Ловушки расставляют из расчета 1 экз. на 10 кв. м пола и не менее 2 экз. в помещениях до 20 кв. м.
|
Насекомые |
Степень заселенности помещения площадью 20 кв. м |
||
|
Малая |
Средняя |
Высокая |
|
|
Постельные клопы |
Единичные |
До 10 мест скопления насекомых |
Свыше 10 мест скопления насекомых |
|
Синантропные тараканы |
Единичные |
3 — 5 экземпляров |
Свыше 5 экземпляров |
Инсектициды контактного действия наносят на поверхности стен и предметов обстановки в местах обитания насекомых. Расход жидкости составляет 50 — 100 мл на 1 кв. м, дуста — 2 — 5 г на 1 кв. м в зависимости от типа обрабатываемой поверхности и действующего вещества в дусте. Учет эффективности обработок проводят первый раз через 24 ч после обработки, затем каждые 5 — 7 дней в течение месяца. При обследовании объекта после обработки подсчитывают количество погибших насекомых (по полу и возрасту). При учете эффективности обработки необходимо использовать средства, активизирующие выход клопов и тараканов из укрытий (средства в аэрозольных упаковках). Если в течение 2 недель не обнаружены живые насекомые, последующие обследования проводят раз в 2 недели в течение 2 месяцев.
При оценке эффективности обработок по отношению к блохам используют липкие листы 20 x 30 см, которые раскладывают на полу под предметами обстановки из расчета 2 листа на 10 кв. м площади. Если на 1 лист в течение первых суток попало в среднем не более 2 блох, считают, что в помещении «блохи единичные», от 3 до 10 — «блох много», более 10 — «блох очень много».
Показатели эффективности. Эффективными считают средства, которые обеспечивают 100%-ную гибель насекомых в объектах в течение 1 — 2 суток и обладают остаточным инсектицидным действием не менее 3 недель. Для одномоментного уничтожения насекомых могут быть отобраны средства острого действия, у которых остаточная инсектицидная активность не превышает 3 суток [72].
6.7.2.2. Изучение эффективности инсектицидных
средств по отношению к мухам
При изучении ларвицидной активности средств органические отходы в сборниках разного типа, в которых происходит развитие преимагинальных фаз мух, обрабатывают водными растворами (эмульсиями, суспензиями) и дустами инсектицидов. Норма расхода рабочих растворов (эмульсий, суспензий) составляет 0,5 — 5 л на 1 кв. м для твердых отходов при толщине слоя до 30 — 50 см, при толщине слоя субстрата свыше 50 см — 2 — 12 л на 1 кв. м. Норма расхода дуста — порошка — 150 — 300 г на 1 кв. м. Одновременно обрабатывают не менее 3 объектов одного типа.
Перед началом обработки проводят учет численности преимагинальных фаз развития мух (личинок и куколок) в каждом отдельном биотопе. При учете численности личинок и куколок мух в скоплениях твердых отходов в мусоросборниках, штабелях мусора, компостах не менее чем в 5 — 6 точках отбрасывают верхний слой мусора или навоза на площадках размером примерно 20 x 25 см и отмечают наличие личинок по шкале: личинок нет — 0, личинки единичные — до 5 на площадке — +, личинки встречаются десятками — ++, личинки встречаются сотнями — +++. В скоплениях жидких отходов наличие личинок отмечают по той же шкале при осмотре поверхности субстрата.
Проверку эффективности инсектицидов проводят 1 раз в 3 дня в течение 2 недель после обработки. При учетах отмечают наличие погибших личинок в обработанном субстрате, а также появление новых кладок и развитие личинок в обработанном и новом субстрате. Эффективным считают средство, которое обеспечивает гибель 98 — 100% личинок куколок в течение 5 суток.
При изучении эффективности регуляторов развития через 24 ч после обработки субстрата отбирают не менее 3 проб, каждую с участка размером 20 x 40 см содержащих куколок. Пробы переносят в лабораторию и содержат при температуре 23 — 25 °C в течение 10 суток, подсчитывая количество вылетевших мух. Контролем служат пробы, взятые из необработанного субстрата. Средство считают эффективным, если оно обеспечивает гибель 98% куколок.
Контактную активность инсектицидов для окрыленных мух определяют при обработке нежилых помещений различного типа, куда происходит постоянный залет мух: мусорокамер, подсобных комнат пищевых объектов, помещений туалетов и т.п. В помещениях выборочно орошают поверхности суспензиями (эмульсиями, растворами) средств в концентрациях, отобранных при лабораторных экспериментах и обеспечивающих полную гибель мух. В одном населенном пункте обрабатывают не менее трех объектов.
Обработку поверхностей проводят из распыливающей аппаратуры, орошая места концентрации мух (стены около оконных рам, дверей, оконные стекла, плафоны и др.), но не более 10% поверхностей стен помещения. Норма расхода жидкости для не впитывающих жидкость поверхностей составляет 50 мл на 1 кв. м, для впитывающих — 100 мл на 1 кв. м. Расчет проводят по количеству ДВ на 1 кв. м.
За сутки до обработки в помещениях проводят учет численности мух с помощью листов (лент) липкой бумаги или сахарных приманок с сильно действующим кишечным инсектицидом. Непосредственно перед обработкой проводят визуально учет численности мух, подсчитывая среднее (из трех подсчетов) число насекомых на 1 кв. м поверхности стены. Липкие листы размером 25 x 30 см раскладывают из расчета 1 лист на 10 кв. м пола.
Результаты обработки учитывают по числу погибших и живых мух в помещениях в утренние часы 2 раза в неделю в течение 3 — 4 недель. После каждого учета погибших мух удаляют из помещения.
Эффективным считают инсектицид, который обеспечивает гибель более 95% мух в течение 3 ч и сохраняет остаточное инсектицидное действие на обработанных поверхностях в течение 10 дней.
С целью установления кишечной активности инсектициды изучают в виде жидких и сухих приманок. Для приготовления жидких приманок используют 10%-ный сахарный сироп, в котором растворяют необходимое количество инсектицидного средства. Емкости, содержащие по 50 — 100 мл приманки (которой пропитывают вату, фильтровальную бумагу), расставляют на подоконниках, в закрытых витринах магазинов и т.п. из расчета 1 емкость на 10 кв. м площади пола. По мере высыхания в них добавляют воду до ранее отмеченного уровня, чтобы сохранить необходимую концентрацию инсектицида.
Для приготовления сухих приманок используют 40 — 60%-ные растворы сахара и необходимое количество инсектицида. Раствор наносят кистью полосами шириной 3 — 4 см по границе оконного стекла и на другие невпитывающие поверхности из расчета 100 мл раствора на помещение площадью 50 кв. м. Гранулированные формы пищевых приманок раскладывают на подложки, которые расставляют в местах наибольшего скопления мух согласно Инструкции по практическим испытаниям средства.
Учет эффективности приманок проводят через сутки и далее 1 раз в 5 — 7 суток в течение месяца. Если приманки сохраняют эффективность и далее, учеты проводят 1 раз в 2 недели в течение 3 месяцев. При учете подсчитывают число погибших мух в сосуде с приманкой и в радиусе 50 см от него и отмечают наличие летающих мух в помещении в утренние часы до начала залета новых насекомых. Дополнительно 1 раз в 5 дней проводят учет эффективности приманочного метода с помощью лент (листов) липкой бумаги, размещаемых из расчета 1 лента (лист) на помещение площадью 20 кв. м.
Показатели эффективности. Эффективными считают жидкие приманки, которые обеспечивают гибель 95% мух в помещениях в течение 3 недель, сухие — гибель 95% мух в помещениях в течение 2 месяцев. Эффективность рассчитывают по формулам 5, 13.
6.7.2.3. Изучение эффективности средств в
аэрозольных и беспропеллентных упаковках
Изучение эффективности средств в аэрозольных и беспропеллентных упаковках, предназначенных для уничтожения летающих насекомых. Изучение инсектицидной активности средств в аэрозольных и беспропеллентных упаковках по отношению к комнатным мухам проводят в квартирах, а также в объектах общественного назначения, не менее чем в 10 помещениях. За сутки до проведения обработки в помещениях учитывают численность мух с помощью листов лент липкой бумаги или сахарных приманок. Визуальный учет численности мух проводят непосредственно перед обработкой.
Средство из упаковки распыляют в воздух при закрытых дверях и окнах. Обработку помещения начинают с противоположного от входа конца, постепенно отступая к входной двери. Сняв с упаковки колпачок и нажимая на распылительную головку, направляют струю аэрозоля в воздух и места скопления насекомых, передвигая упаковку вдоль обрабатываемого участка на расстоянии 50 см от поверхности. Время распыления средства из упаковки зависит от содержания пропеллента, типа распылительной головки и указано в Инструкции по проведению испытаний средства. Через 15 мин. после обработки помещение проветривают сквозным потоком воздуха. В зависимости от состава средства время обработки помещения и его проветривания может меняться.
Контроль эффективности действия средства проводят визуально через 15 мин. после его применения, затем через 6 и 24 ч. При проверке отмечают острое действие препарата и возможное остаточное действие — время, в течение которого происходит гибель мух, залетающих в обработанное помещение. Контроль проводят путем осмотра помещения, отмечая погибших и парализованных мух, а также путем опроса населения.
Показатели эффективности. Средство считают эффективным, если в течение 15 мин. зарегистрирована полная гибель насекомых в обработанном помещении.
Изучение эффективности средств в аэрозольных и беспропеллентных упаковках, предназначенных для уничтожения нелетающих насекомых. Изучение инсектицидной активности средств в аэрозольных или беспропеллентных упаковках для нелетающих насекомых проводят в квартирах и в объектах общественного назначения, не менее чем в 10 помещениях для каждого вида насекомых. За сутки до проведения опытных работ объект обследуют с целью установления степени его заселенности насекомыми, используя методы и средства, изложенные выше.
Средство распыляют при открытых окнах и форточках. Сняв с упаковки колпачок, слегка нажимают на распылительную головку и наносят средство на места, где обнаружены скопления насекомых или места их возможного обитания. При этом упаковку (баллон) держат на расстоянии 20 см от поверхности, продвигая его вдоль обрабатываемых участков. Норма расхода инсектицида составляет 10 — 20 г на кв. м обрабатываемой поверхности.
При обработке против постельных клопов орошают места обнаружения клопов: кровати, диваны, плинтусы, места отхождения обоев, щели в стенах, тыльные стороны картин, ковров. Не допускают попадания инсектицида на полированные поверхности. После окончания обработки помещение проветривают сквозным потоком воздуха в течение не менее 30 мин.
Контроль эффективности средства проводят сразу после обработки объекта, далее через сутки, одну или две недели, а при необходимости и в более поздние сроки после дезинсекции. При этом устанавливают заселенность объекта насекомыми, используя те же градации, что и при предварительном учете заселенности, реакцию насекомых на средство (быстро ли активизируют аэрозоли выход насекомых из укрытий), сроки наступления паралича и гибели насекомых.
Показатели эффективности. Инсектицид считают эффективным, если в течение 1 недели после обработки активные насекомые в помещении не обнаружены.
6.7.2.4. Изучение эффективности инсектицидных
средств по отношению к муравьям
Изучение эффективности приманочных станций в натурных условиях. В городских условиях натурные эксперименты проводят в помещениях, в которых визуально отмечали муравьев. Приманочные станции устанавливают в местах наибольшего скопления (рядом с муравьиным гнездом) или на путях регулярного интенсивного передвижения насекомых — муравьиные «дорожки». Учеты передвигающихся муравьев-фуражиров проводят ежедневно, отмечая снижение и полное прекращение передвижений насекомых. Исчезновение передвигающихся муравьев-фуражиров служит косвенным свидетельством подавления колонии и гибели самки и расплода.
В условиях, приближенных к антропогенным (парники, теплицы, оранжереи, бетонные и каменные дорожки в саду, фундаменты строений), а также в загородных домах (особенно на верандах, террасах, в банях) часто можно отметить черных садовых муравьев и муравьев M. rubra, перемещающихся из открытой природы. Приманочные станции устанавливают аналогичным образом — в местах наибольшего скопления и перемещения насекомых с учетом конкретного места (между цветочными вазонами и контейнерами, между кирпичами в фундаменте, в щелях между бревнами, под бетонными плитами и т.д.), отмечая ежедневно снижение численности муравьев-фуражиров и в конечном счете — гибель колонии.
Изучение эффективности гелей и паст в натурных условиях. Натурные эксперименты проводят в помещениях, в которых были обнаружены муравьи. Гель наносят в виде пунктирных линий (штрихи, капли) вдоль плинтусов, в щели, трещины и другие места возможного обитания и перемещения муравьев. Возможно использовать пасту, гель в виде приманок на пластиковой подложке, которые устанавливают в местах скопления (рядом с муравьиным гнездом) или интенсивного передвижения муравьев («дорожки» рабочих особей).
Гели, содержащие инсектициды острого действия (предназначенные для ряда ползающих насекомых), оказывают губительное воздействие на самих муравьев-фуражиров. Гели, предназначенные для уничтожения только муравьев, позволяют рабочим особям муравьев выполнить функцию фуражиров и перенести отравленную приманку в гнездо с самкой и расплодом. В результате обмена кормом между муравьями погибают самки, откладывающие яйца, и в конечном счете вся семья. Учеты интенсивности перемещения муравьев отмечают ежедневно до полного его прекращения [72].
6.7.2.5. Изучение эффективности инсектицидных
средств по отношению к имаго комаров
В населенном пункте выбирают помещения, в которых концентрируются малярийные комары p. Anopheles (хлева, сараи, жилые комнаты и др.). До обработки проводят учет численности комаров.
Участки помещения, являющиеся дневками комаров, обрабатывают рабочими растворами средства в норме расхода 100 мл на 1 кв. м. В одном населенном пункте каждым препаратом обрабатывают не менее 3 помещений в концентрациях, отобранных при лабораторных испытаниях.
Эффективность инсектицида определяют либо визуально, подсчитывая на следующий день после обработки и затем каждые 3 — 5 дней количество погибших комаров в помещениях, либо с помощью прозрачных пластмассовых конусов, прикрепленных к обработанным поверхностям липкими лентами. В каждый конус с помощью эксгаустера помещают 10 — 20 комаров на 30 мин. После этого комаров из конусов переносят в чистый садок и оставляют на сутки. В садки помещают вату, смоченную водой. Такие испытания проводят первый раз через сутки после обработки и затем раз в 7 — 10 суток вплоть до того, как гибель комаров снизится до 70%.
Контрольными являются помещения, не обработанные инсектицидом. В этих помещениях также ставят конуса, потому что необходимо учитывать травмы комаров при посадке их в конуса и пересадке в садки эксгаустером (сравнение гибели в опыте и контроле).
Показатели эффективности. Эффективными считают средства (их концентрации), обеспечивающие гибель 100% комаров в течение первых 3 — 4 недель после обработки и не менее 95% в течение последующих сроков наблюдения.
Для обработки отдельных очагов (по показаниям) могут быть использованы средства, не имеющие длительного остаточного действия, обеспечивающие 100%-ную гибель комаров в течение 5 — 7 суток после обработки.
При изучении степени раздражимости комаров к изучаемому средству в обработанное помещение выпускают 100 — 200 комаров и в течение часа наблюдают за их поведением. Если комары садятся на обработанные поверхности и гибнут, не обнаруживая признаков возбуждения, то раздражимости нет, и инсектицид может быть рекомендован для применения. Если комары беспокойны и пытаются вылететь из обработанного помещения, то раздражимость имеется, и изучаемый инсектицид в практику противомалярийных обработок можно рекомендовать только после повторного испытания и подтверждения отсутствия раздражимости комаров.
При изучении эффективности инсектицидов по отношению к имаго комаров p. Culex обрабатывают 2 — 3 подвала с высокой численностью комаров (более 100 экз./кв. м) концентрациями, отобранными при лабораторных испытаниях и норме расхода 100 мл/кв. м. Через сутки проводят учет численности комаров, а также определяют действие инсектицида на стенах подвала с помощью конусов по описанной выше методике. Комаров из конусов помещают в садки, учет их гибели проводят через 24 ч. Следующие учеты численности комаров и опыты с конусами проводят раз в 7 — 10 суток вплоть до того, когда препарат будет обеспечивать гибель менее 70% комаров. Эффективными считают инсектициды, обеспечивающие 100%-ную гибель комаров в течение первых двух недель после обработки и не менее 90% гибели в последующий месяц. В отдельных объектах (по показаниям) могут быть использованы инсектициды с коротким остаточным действием на обработанных поверхностях 5 — 7 суток [72].
6.7.2.6. Изучение эффективности специальных
средств для уничтожения ос
Изучение эффективности инсектицидных средств в специальной аэрозольной упаковке, предназначенных для обработки осиных гнезд, в натурных условиях. Специальная аэрозольная упаковка снабжена головкой, которая обеспечивает струю аэрозоля длиной до 5 м.
Необходимо соблюдать следующие условия и меры предосторожности при обработке осиных гнезд. Не рекомендуется проводить обработку одному испытателю. Для обработки гнезд благоприятны прохладные дни, т.к. осы активнее и агрессивнее в теплую погоду. Наиболее подходящее время для обработки гнезд — раннее утро (перед восходом солнца), когда активность ос наименьшая, или после захода солнца в сумерки, когда почти все рабочие особи ос находятся в гнезде. Это требование также согласуется с экологическим регламентом — проводить обработки инсектицидами ранним утром и поздним вечером во избежание возможного контакта пчел с ядами. Указанное время суток также является фактором, лимитирующим возможный нежелательный контакт ос с людьми и животными.
При обработке не следует использовать карманный фонарик или другой источник света, т.к. это может спровоцировать активность ос. Проводящий обработку должен надеть защитную одежду, хорошо закрывающую голову и шею, кисти рук (плащ или куртку из водоотталкивающей ткани с капюшоном, плотные перчатки). Не следует перед обработкой пользоваться парфюмерией и употреблять спиртные напитки, т.к. осы агрессивно реагируют на резкие запахи.
Испытатели находят осиное гнездо, которое расположено в пределах их досягаемости. Один из испытателей обрабатывает гнездо, не снимая его с места прикрепления, с расстояния не менее 1,5 м в течение 2 — 4 с, что соответствует норме расхода 40 г/кв. м. Затем второй испытатель быстро надевает на гнездо герметичный прозрачный полиэтиленовый мешок и плотно завязывает его. Учет эффективности обработки проводят через 1 ч и 12 ч по появлению живых или погибших ос в мешке [72].
Изучение эффективности специальных аттрактивных и аттрактивно-инсектицидных приманок, предназначенных для отлова и уничтожения ос, в натурных условиях. Приманки, предназначенные для отлова и уничтожения ос, подразделяются на два типа:
а) аттрактивные приманки на основе углеводов без инсектицида. Такие приманки помещаются в ловушки (например, бутылки с водой), из которых насекомые, привлеченные аттрактантом, не могут выбраться наружу. Несколько ловушек с приманкой размещают в помещении или снаружи строения и учитывают попавших в ловушку ос;
б) приманки на основе белкового корма, содержащие инсектицид замедленного действия (например, авермектины) или регулятор развития насекомых. Отравленный белковый корм насекомые относят в гнездо и скармливают личинкам. Распространение отравленного корма происходит внутри гнезда посредством трофаллаксиса.
Показатели эффективности: а) инсектицидные средства в специальной аэрозольной упаковке, предназначенные для обработки осиных гнезд: гибель насекомых через 1 и 12 ч составляет не менее 100%; б) приманки на основе углеводородов с аттрактантом, помещенные в ловушку: уловистость через 2 суток не менее 10 особей; в) приманки на основе белкового корма, содержащие инсектицид: гибель колонии через 3 — 4 недели.
6.7.3. Изучение эффективности инсектицидов и регуляторов
развития по отношению к личинкам комаров
6.7.3.1. Изучение эффективности инсектицидных средств
Средства испытывают не менее чем в трех концентрациях в водоемах площадью не менее 1 — 5 кв. м. Для определения эффективности одной концентрации подбирают не менее трех водоемов одного типа. Рабочими растворами или порошками из опрыскивающей или распыливающей аппаратуры обрабатывают поверхность водоема из расчета 100 мл (г) на 1 кв. м. Гранулы равномерно разбрасывают вручную из расчета 20 — 30 г на 1 кв. м. Нормы расхода инсектицида рассчитывают в граммах ДВ на 1 кв. м, если глубина водоема не превышает 20 см; если же глубина водоема больше, то расчет проводят на объем воды в граммах ДВ на 1 куб. м.
Эффективность обработки оценивают путем сравнения численности личинок комаров до и после обработки через 1, 2, 5, 7 и 14 суток в обработанном и контрольном водоемах. Оценку полученных результатов проводят по формуле 3.
Учет численности личинок разных возрастов проводят стандартным сачком (диаметр — 20 см, глубина — 25 см) или кюветой с пересчетом числа личинок каждого возраста на 1 кв. м. Пробы берут не менее чем в 10 местах равномерно по всей площади водоема. В период испытаний в водоемах регистрируют температуру, pH воды, степень зарастания водоема растительностью, степень проточности, загрязненность воды органическими веществами.
Остаточное действие средств определяют на личинках комаров инсектарной культуры. Для этого из обработанного водоема набирают в 0,5 л емкости по 250 мл воды, в которую помещают по 25 личинок 2 — 3-го возрастов. Учет погибших личинок проводят через 1 и 2 суток. Каждые 5 — 7 суток опыт повторяют вплоть до того, как число личинок, погибших в воде, взятой из обработанного водоема, будет ниже 70%. Одновременно ставят контроль. Средство считают эффективным, если в течение 1 — 2 суток он обеспечивает 100%-ную гибель личинок в водоеме.
6.7.3.2. Изучение эффективности регуляторов
развития насекомых
Средства испытывают не менее чем в трех концентрациях на водоемах площадью водной поверхности от 1 до 5 кв. м. Для определения эффективности одной концентрации подбирают не менее трех водоемов одного типа. Рабочими растворами или порошками из опрыскивающей или распыливающей аппаратуры обрабатывают поверхность водоема из расчета 100 мл (г) на 1 кв. м. Гранулы равномерно разбрасывают вручную из расчета 20 — 30 г на 1 кв. м. Нормы расхода РРН рассчитывают в граммах ДВ на 1 кв. м, если глубина водоема не превышает 20 см; если же глубина водоема больше, то расчет проводят на объем воды в граммах ДВ на 1 куб. м.
Эффективность обработки оценивают ежедневно путем сравнения численности и внешнего вида личинок комаров до и после обработки до получения явных эффектов нарушения линьки в обработанных водоемах.
Учет численности личинок разных возрастов проводят стандартным сачком (диаметр — 20 см, глубина — 25 см) или кюветой с пересчетом числа личинок каждого возраста на 1 кв. м. Пробы берут не менее чем в 10 местах равномерно по всей площади водоема. В период испытаний в водоемах регистрируют температуру, pH воды, степень зарастания водоема растительностью, степень проточности, загрязненность воды органическими веществами.
Остаточное действие РРН определяют на личинках комаров инсектарной культуры. Для этого из обработанного водоема набирают в 0,5 л емкости по 250 мл воды, в которую помещают по 25 личинок 2-го возраста в случае с ИСХ и 4-го возраста при испытании АЮГ. Учет погибших личинок проводят ежедневно. Каждые 5 — 7 суток опыт повторяют вплоть до того, как число личинок, погибших в воде, взятой из обработанного водоема, будет ниже 70%. Одновременно ставят контроль.
Показатели эффективности. Средства считают эффективными, если в течение 25 — 30 суток они обеспечивают нарушения линьки или гибель куколок при окрылении в воде, взятой из обработанного водоема [72].
6.7.4. Изучение эффективности акарицидных,
инсектоакарицидных средств для обработки природных
биотопов с целью уничтожения иксодовых клещей
Изучение акарицидной активности средств проводят на территории, где отмечена высокая численность клещей (не менее 20 экз. на 1 км маршрута при стандартном учете численности клещей флагом) в период подъема или пика численности. Для таежных клещей этот период приходится на середину апреля — первую половину июня. В период падения численности клещей испытания акарицидов не проводят.
Изучение эффективности концентратов эмульсий и смачивающихся порошков. Для испытания препаратов на выбранной территории размечают квадратные делянки размером 50 x 50 м, площадью 0,25 га. По периметру каждой делянки намечают нейтральную полосу шириной 1 м. Вместе с нейтральной полосой размер каждой делянки равняется 52 x 52 м, площадь около 0,27 га. С целью увеличения количества клещей на делянке в центр каждой из них подсаживают по 30 клещей (15 самок и 15 самцов), собранных на флаг на территории, не подвергавшейся обработке акарицидами. Опыт начинают на следующие сутки после разметки площадок и подсадки клещей.
Обрабатывают акарицидом каждую делянку, включая нейтральную полосу. В случае испытания нескольких концентраций опытные делянки можно располагать вплотную одна к другой. Контрольную делянку располагают так, чтобы исключить попадание на нее инсектицидов (занос ветром во время обработок, стоком воды при дождях). Обработку делянок проводят испытуемым инсектицидом в концентрациях, рекомендованных в проекте Инструкции по проведению испытаний средства. Для обработки используют любые опрыскиватели, обеспечивающие мелкокапельное распыление. Обработку проводят так, чтобы обеспечить равномерное покрытие испытуемым препаратом всей площади делянки.
Учеты клещей проводят одновременно на делянках и в контроле перед обработкой на 3-и сутки после обработки и затем еженедельно в течение 1 — 2 месяцев до полного исчезновения клещей на контрольной делянке. Учеты проводят в утренние часы после схода росы. Если погода пасмурная, без заметного повышения полуденных температур, учеты можно проводить и днем. Для учета на опытных делянках и в контроле используют разные флаги, которые должны быть соответственно маркированы. На каждой контрольной делянке при первом учете должно быть зарегистрировано не менее 10 клещей. Отсутствие на ней клещей или их меньшее количество свидетельствует о плохом качестве выполнения опытов и должен быть рассмотрен вопрос о повторении опыта на другой территории. На каждой делянке учет проводят челночным ходом так, чтобы суммарная длина маршрута составляла не менее 0,5 км, желательно — 1 км (10 — 20 параллельных ходов на площадке со стороной 50 м). Оценку полученных результатов проводят по формуле 8. Расчет эффективности действия акарицида проводят для каждого срока контрольного обследования. Изменение показателей эффективности по сезону служит критерием длительности эффекта обработок [72].
Показатели эффективности. Нормативными показателем достаточной эффективности акарицидных средств такого назначения являются: эффективность средства на 3 сутки — не менее 95%, длительность такого действия должна быть не менее 30 суток.
Изучение эффективности аттрактивно-акарицидных гранул. Аттрактивно-акарицидные гранулы содержат нейтральный наполнитель, аттрактант — вещество, привлекающее клещей к грануле, и акарицид — убивающий клещей после контакта их с гранулой.
Проверку акарицидной активности гранул проводят на площадках размером 2 и более га на участках с высокой численностью клещей. Разметку площадок желательно закончить до начала активации клещей или в начале периода активности. В последнем случае в процессе разметки площадки следует постоянно осматриваться, снимать и выбрасывать в месте поимки напавших на работника клещей.
Разметка и обработка площадки. Перед началом работы проводят учет численности клещей на территории, намеченной под обработку и в контроле. Если выбранный для обработки участок не имеет естественных границ (тропы, дороги, просеки, опушка леса), то перед обработкой необходимо обозначить его границы заметными метками (матерчатые ленточки, бумажные флажки, несмываемая краска и др.).
Обработку проводит бригада дезинфекторов (желательно 5 человек) и инструктор. Инструктор выстраивает дезинфекторов в шеренгу с промежутками между людьми в 4 м. По команде инструктора шеренга начинает движение с остановками через каждые 2 м. Крайний дезинфектор движется по границе площадки, остальные — параллельными ходами, стараясь сохранять расстояние между людьми в 4 м. Инструктор, замыкающий шеренгу, отмечает границу обработанной полосы метками, меряет шагами расстояние и каждые 2 м дает команду дезинфекторам бросить 2 гранулы — одну сразу позади себя, а другую — на 2 м в сторону (в сторону дезинфектора) под прямым углом к направлению движения шеренги.
Дойдя до третьей границы обрабатываемого участка, шеренга смещается по этой границе вглубь площадки так, что первый дезинфектор (шедший по границе участка) становится на трассу, пройденную и размеченную дезинструктором, а остальные — дальше от него с интервалами в 4 м. Замыкает шеренгу дезинструктор. Операция повторяется, но уже в обратном направлении. Так челночными ходами обрабатывается вся площадка. Производительность труда пяти дезинфекторов в зависимости от их опыта и расторопности 1,5 — 2 га/ч. Если препарат использован не весь, то оставшееся количество уничтожают, т.к. за год препарат существенно снижает аттрактивность и, следовательно, эффективность.
Действие препарата основано на привлечении клещей к грануле, содержащей акарицид. Эффект, приближающийся к 100%, достигается к концу второй недели после обработки, если послезимовочная активация клещей закончилась. Если обработка проведена в начале активации, то появление все новых, активирующихся клещей будет отсрочивать достижение 100% эффекта. Оптимальное время для обработки — первая половина мая.
Через неделю после размещения на площадке гранул проводят учет численности клещей на флаг. Учетчик, двигаясь параллельно визирам челночным ходом, проходит по площадке не менее 1,5 — 2,0 км, подсчитывая прикрепившихся к флагу и одежде клещей, и выпуская их по возможности в месте поимки. Одновременно проводится учет флагом на контрольной территории на маршруте протяженностью также не менее 1,5 — 2 км (если на контрольном маршруте собрано менее 50 клещей, его длину следует увеличить). Последующие учеты на площадке проводятся также с недельными интервалами в течение периода высокой численности клещей. Если два последних учета дали нулевые результаты, учеты прекращают. Если нулевые результаты не получены, учеты продолжают до конца сезона активности клещей, но с интервалами до 2 недель.
Расчет эффективности действия инсектицида проводят по формулам 5 — 7 для каждого срока контрольного обследования. Изменение показателей эффективности по сезону служит критерием длительности эффекта обработок.
Если есть возможность, то для разметки площадок желательно применять простейшую геодезическую аппаратуру, отмечая на местности параллельные трассы на расстоянии 4 м друг от друга. Это поможет избежать огрехов при размещении гранул и снизит ошибки при оценке их эффективности [72].
6.7.5. Изучение защитного действия репеллентных средств
Изучение защитного действия репеллентных средств, в отношении кровососущих насекомых, предназначенных для нанесения на кожу (кремы, лосьоны, эмульсии, салфетки, карандаши, аэрозоли). Репеллентное средство наносят на открытые участки кожи специалистов-испытателей в соответствии с рекомендуемым режимом. Как правило, тонким слоем не втирая. Опыт показывает, что на обнаженное предплечье расходуется 0,4 г крема, 0,5 г лосьона или эмульсии, 0,2 г пены. Учет эффективности защиты от летающих кровососущих насекомых проводят в природных биотопах с разнообразным спектром нападающих на человека кровососов. Регистрируют КОД через 15 мин. после нанесения средства. Как правило, он равен 100%. Критерием окончания защитного действия служит регистрация 3 укусов насекомых в предплечье одного испытателя за 10 мин. Контрольный испытатель во время испытаний учитывает и отлавливает кровососущих насекомых, производит все записи, измеряет температуру и влажность воздуха, направление и силу ветра, отмечает состояние погоды и пр.
Испытание каждого средства проводят не менее 10 раз при различных условиях (разные биотопы, погодные условия, время суток). На основании полученных данных высчитывают КОД и показатель ДРД по отношению к различным группам кровососущих насекомых (комары, мошки, мокрецы, слепни), который выражают в часах. В качестве эталона используют ДЭТА в аналогичных концентрациях. В качестве дополнительных возможно проведение испытаний защитных свойств репеллентных средств при разной физической нагрузке испытателей.
Изучение защитного действия в отношении кровососущих насекомых и клещей репеллентных средств в виде концентратов эмульсий, аэрозольных и беспропеллентных упаковок, предназначенных для нанесения на одежду. Обработку одежды (костюмы, наголовные сетки и т.д.) проводят в соответствии с рекомендованным способом применения (замачивание в эмульсии, распыление эмульсии, распыление из аэрозольной упаковки). Испытания проводят специалисты, одетые в обработанную одежду, в местах с высокой численностью гнуса и клещей. Необработанная одежда не должна защищать от укусов насекомых. Эффективность защитного действия пропитанной репеллентами одежды определяют по соотношению числа кровососов, нападающих за единицу учетного времени (20 мин.) на испытателя в обработанной и контрольной необработанной одежде. Острое отпугивающее действие определяют через сутки после обработки. В дальнейшем испытания проводят один раз в 3 — 5 дней вплоть до утраты одеждой защитных свойств. Длительностью защитного действия репеллентного средства является период времени в сутках, пока защитные свойства сохраняются не менее чем на 90%. Другими словам, пока число укусов через обработанную одежду и число клещей, находящихся на обработанной одежде более 10 мин., составляет менее 10% от контроля.
6.7.6. Изучение защитного действия в отношении иксодовых
клещей акарицидных, инсектоакарицидных средств в виде
брусков, концентратов эмульсий, аэрозольных
и беспропеллентных упаковок
Акарицидные средства, предназначенные для индивидуальной защиты людей от нападения иксодовых клещей, наносят на одежду. Испытуемым образцом средства обрабатывают хлопчатобумажные костюмы в соответствии с рекомендуемым способом применения. Испытания костюмов проводят в природных биотопах, где численность иксодовых клещей составляет не менее 20 экз. на 1 км маршрута при стандартном методе учета. Биотопы и время испытаний определяют специалисты-энтомологи. Две пары испытателей идут по лесу параллельными курсами в 5 — 10 м друг от друга. Испытатели в одежде, обработанной инсектоакарицидным средством, регистрируют число клещей, прицепившихся к одежде и двигающихся по ней более 5 мин. Если клещ находится на одежде более 10 мин., но он при этом не двигается, то его не учитывают. Пара контрольных испытателей учитывает и собирает всех клещей, прицепившихся к необработанной одежде. Оценку защитного действия проводят по соотношению количества клещей, собранных за 2 ч с необработанной одежды и с обработанной. Защитное действие оценивается в процентах клещей, снятых с обработанной одежды, от числа клещей, снятых с необработанной одежды. Костюмы, обеспечивавшие защиту от клещей в первые сутки после обработки более чем на 95%, оставляют для определения длительности защитного действия. Обработанные костюмы в промежутках между испытаниями хранят в полиэтиленовых клеенчатых пакетах или развешивают под навесом в тени. Защитные свойства обработанных костюмов проверяют через день. Утратившими защитные свойства признают костюмы, на которых собирают более 5% клещей от числа собранных на контрольных костюмах.
Показатели эффективности. Инсектоакарицидные средства для борьбы с иксодовыми клещами в природных биотопах — острое действие — эффективность на 3-и сутки не менее 95%; длительность остаточного действия — не менее 30 суток.
6.7.7. Методы изучения эффективности репеллентных
средств, предназначенных для защиты от муравьев
Оценку репеллентной активности проводят на муравьях рода Formica в натурных условиях в период их активности (весна — осень). Каждое средство испытывают не менее трех испытателей не менее чем в трех повторностях, всего 9 повторностей.
Метод изучения эффективности репеллентных средств, предназначенных для защиты от муравьев, при нанесении на одежду. Штанины подготавливают из хлопчатобумажной бязи и обрабатывают средством из расчета 20 г/кв. м. При испытаниях обработанную штанину надевают на ногу испытателя, заправляя в носок, чтобы избежать попадания муравьев под одежду, и ногу в обуви ставят на то место около муравейника, где наблюдается скопление насекомых. Муравьи заходят на обувь, после чего поднимаются на носок к обработанной штанине и ползут по ней вверх. Регистрируют число муравьев, проползших отрезок, обработанный репеллентным средством, длиной 50 см.
Рассчитывают КОД по формуле 12, который равен доле муравьев (в процентах), не проползших обработанную зону от числа муравьев в опыте. Испытание репеллентной активности проводят первый раз после полного высыхания ткани (примерно через 1 ч после обработки) и затем через 1 — 2 — 3 — 5 суток и далее. Для определения длительности репеллентного действия испытания повторяют до тех пор, пока КОД сохраняется не менее 70%. В промежутках между испытаниями штанины развешивают в комнатных условиях [72].
Метод изучения эффективности репеллентных средств, предназначенных для защиты от муравьев, при нанесении на кожу. К испытаниям допускаются только средства, имеющие подтверждение безопасности их применения на кожу людей. Изучаемое средство наносят на обнаженную голень испытателя в норме расхода 0,1 мл (г) на 100 кв. см поверхности кожи. Испытатели должны избежать попадания муравьев под одежду: надеть носки с плотной резинкой, закатать брюки так, чтобы они плотно прилегали к ноге выше колена. Ногу в обуви ставят на то место около муравейника, где наблюдается скопление насекомых. Муравьи заходят на обувь, после чего поднимаются на носок к обработанной голени и ползут по ней вверх. Регистрируют число муравьев, проползших отрезок, обработанный репеллентным средством (от носка до колена). Испытания начинают сразу после нанесения средства. С целью определения длительности репеллентного действия ДРД проводят повторение опыта через каждые 30 мин.
Рассчитывают КОД по формуле 12, который равен доле муравьев (в процентах), не проползших обработанную зону от числа муравьев в опыте. Для определения длительности репеллентного действия испытания повторяют до тех пор, пока КОД сохраняется не менее 70% [72].
6.7.8. Практические испытания инсектицидных,
акарицидных и репеллентных средств
Практические испытания — испытания дезинфекционных средств, проводимые силами санитарно-эпидемиологической и дезинфекционной служб на обычных объектах дезинфекционных мероприятий с использованием имеющегося в распоряжении служб оборудования.
На проведение практических испытаний требуется разрешение органа здравоохранения, отвечающего за эпидемиологическую обстановку в стране. В настоящее время такое разрешение дает Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека.
Практические испытания проводят силами практических организаций в разных регионах, отличающихся климатическими, географическими условиями, видовым составом и сезонной динамикой численности членистоногих и др. При проведении этих испытаний определяют эффективность средства по отношению к доминирующим видам членистоногих в зависимости от климатических условий региона и уровня чувствительности природных популяций членистоногих к инсектицидам, определяют длительность остаточного действия средства при использовании его в разных климатических зонах, пригодность для обработки серийной стандартной аппаратурой, возможность рекомендовать его для использования населением.
Практические испытания проводят в соответствии с утвержденными Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека Программой проведения практических испытаний и инструкцией по их проведению, разработанными для каждого испытуемого средства специалистами (энтомологами, биологами, паразитологами, врачами, гигиенистами). В инструкцию должны быть включены общие сведения о средстве (состав полностью, класс опасности, для каких целей предназначено); методика обработки; рабочие концентрации и нормы расхода препарата по отношению к каждой группе членистоногих, для которых средство предназначено; методика учета эффективности обработок; меры предосторожности при работе со средством и меры первой помощи при случайном отравлении.
К инструкции прилагают формы необходимой документации (акты, анкеты, опросные листы и др.), которые заполняют специалисты практических организаций, непосредственно руководившие испытаниями препарата. В анкетах, кроме эффективности средства, отмечают наличие или отсутствие побочных явлений у людей, проводивших обработки, пользовавшихся средством или находившихся в обработанных объектах.
Обобщение и анализ материалов практических испытаний проводит организация, ответственная за подготовку и проведение таких испытаний.
Подготовленные отчеты по результатам практических испытаний с приложением подлинников актов организаций, проводивших испытания, представляются в Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека.
Меры предосторожности при работе с природными популяциями членистоногих. Многие членистоногие являются переносчиками возбудителей природноочаговых трансмиссивных болезней (малярия и чума, вирусные энцефалиты и желтая лихорадка, трипаносомозы и риккетсиозы, туляремия и др.). В связи с этим, при сборе и последующей работе с природными популяциями членистоногих необходимо соблюдать меры предосторожности!
При работе в природных биотопах, расположенных в природных очагах трансмиссивных инфекций, персонал должен быть проинструктирован о необходимых мерах предосторожности в отношении членистоногих. Обязательно проведение соответствующих прививок и наличие необходимых средств экстренной профилактики. При работе с членистоногими необходимо работать в резиновых перчатках и халатах, эксгаустеры должны быть снабжены грушами или ватными фильтрами.
При работе с иксодовыми клещами рабочий стол должен быть застелен белой бумагой и на нем не должно быть лишних предметов. Исследователю не следует одновременно осуществлять наблюдение за несколькими клещами или допускать исчезновение клеща из вида. Люди, работающие с клещами, являющимися переносчиками вируса клещевого энцефалита, должны быть привиты от этой инфекции.
Насекомые, оставшиеся в живых после проведения эксперимента уничтожаются (завариваются кипятком или помещаются в 70%-ный этиловый спирт).
6.7.9. Библиографические данные
1. Рославцева С.А., Седых А.С., Перегуда Т.А. и др. Выявление инсектицидного, рострегулирующего и других типов воздействия химических соединений на членистоногих: Методические рекомендации/Ред. С.С. Кукаленко, Е.И. Андреева. Черкассы, 1982. 62 с.
2. Рославцева С.А. Методы определения инсектоакарицидной активности и методы разведения биотестов в лабораторных условиях/НИИТЭХИМ, ВНИИХСЗР. 1978. 31 с.
3. Вашков В.И. Методика исследования дезинфекционных, дезинсекционных и дератизационных препаратов. М.: Медгиз, 1961.
4. Гар К.А. Методы испытания токсичности и эффективности инсектицидов. М., 1963. 290 с.
5. Дремова В.П., Алешо Н.А. Синантропные тараканы. Биология, экология, контроль численности. М.: ЗАО «НКФ «РЭТ», 2003. 272 с.
6. Методические рекомендации по лабораторному разведению и изучению блох/Сост. И.Ф. Жовтый, Л.К. Нечаева. Утв. Иркутским гос. Науч.-иссл. противочумным инст. Сибири и Дальнего Востока 21.11.1983. Иркутск, 1983. 27 с.
7. Хрусталева Н.А. Культивирование синантропных тараканов в сообщающихся емкостях с учетом миграционного поведения насекомых/Тез. докл. Первого Всесоюзного совещания по проблемам зоокультуры. Москва, 2 — 4 декабря 1986 г. Ч. III. М., 1986. С. 268 — 270.
8. Нельзина Е.Н. Крысиный клещ. М.: АМН СССР, 1950. 100 с.
9. Шашина Н.И., Маркина В.В. Культивирование иксодовых клещей для изучения репеллентов/Тез. докл. конфер. «Лабораторные животные для медико-биологических исследований». М., 1990. С. 129.
10. Тарасевич И.В., Земская А.А., Дремова В.П., Фролова А.И. и др. Вши человека (диагностика, медицинское значение, меры борьбы): Методические рекомендации: МР N 15-6/28. Утв. МЗ СССР 05.07.1990. М., 1990. 24 с.
11. Соколова Т.В., Лопатина Ю.В. Паразитарные дерматозы: Чесотка и крысиный клещевой дерматит. М.: Бином, 2003. 120 с.
12. Олифер В.В. Новые подходы к разработке скабицидных средств и совершенствование профилактических мероприятий в очагах чесотки/Дисс. на соиск. уч. ст. канд. биол. наук. М., 2006. 168 с.
13. Таежный клещ Ixodes persulcatus Schulze (Acari: Ixodidae). Морфология, систематика, экология, медицинское значение. Л.: Наука, 1985. 416 с.
14. Руководство по медицинской энтомологии/Под. ред. В.П. Дербеневой-Уховой. М.: Медицина, 1974. 360 с.
15. Вашков В.И., Сухова М.Н., Кербабаев Э.Б., Шнайдер Е.В. Инсектициды и их применение в медицинской практике. М.: Медицина, 1965. 524 с.
16. Сухова М.Н., Гвоздева И.В., Ерофеева Т.В. О методах определения чувствительности комнатных мух к инсектицидам путем местного нанесения микродоз препаратов на насекомых/Труды ЦНИДИ. В. 13. М., 1960. С. 207 — 212.
17. Успенский И.В. О чувствительности клещей Ixodes persulcatus Schulze (Parasitiformes: Ixodidae) к акарицидам//Паразитология. 1974. Т. 8. В. 4. С. 312 — 321.
18. Набоков В.А., Ларюхина М.А.//Гигиена и санитария. 1952. N 4. С. 50 — 51.
19. Успенский И.В., Левиков В.Б. Развитие поражения у иксодовых клещей (Ixodes persulcatus, Dermacentor silvarum, Haemaphysalis concinna) после воздействия ДДТ//Мед. паразитол. и паразитарн. болезни. 1974. Т. 43. N 4. с. 411 — 417.
20. Резистентность к инсектицидам и борьба с переносчиками. 17-й Доклад Комитета экспертов ВОЗ. 1972. Сер. Техн. Докладов N 443. С. 111 — 117.
21. Резистентность переносчиков и резервуаров инфекций. 22-й Доклад Комитета экспертов ВОЗ. 1978. Сер. техн. докладов N 585. С. 45.
22. Попов П.В. Статистический анализ опытных данных с помощью линии регрессии «доза пестицида — эффект»//Химия в с-х. 1965. N 10. С. 72 — 79.
23. Рославцева С.А., Еремина О.Ю., Перегуда Т.А. Инсектицидная активность пиретроидов для комнатных мух и рыжих тараканов//Мед. паразитол. и паразитарн. бол. 1989. N 1. С. 48 — 50.
24. Рославцева С.А., Еремина О.Ю., Перегуда Т.А. Особенности действия пиретроидов на комнатных мух Diptera и синантропных тараканов Blattoptera//Энтомологическое обозрение, 1991. Т. 70. Вып. 1. С. 3 — 13.
25. Еремина О.Ю., Рославцева С.А., Перегуда Т.А. Экспресс-метод выявления Kdr-фактора у комнатных мух//Химия в с-х. 1985. Т. 23. N 5. С. 37 — 40.
26. Хрусталева Н.А. Устройство для наблюдения за живыми организмами. А.С. N 1436960, СССР. Заявл. 29.12.85, N 4003256/30-15, опубл. в Б. И., 15.11.1988, N 42 МКИ 4 А 01 К 67/00.
27. Хрусталева Н.А. Методика изучения двигательной активности и расселения популяционных группировок синантропных тараканов//Изв. Академии наук. Серия биологическая. 1994. N 3. С. 487 — 491.
28. Хрусталева Н.А. Методические рекомендации по изучению двигательной активности и расселения популяционных группировок синантропных тараканов: МР N 01-19/51-17. Утв. ГКСЭН РФ 01.04.1996. М., 1996.7 с.
29. Maupin G.O., Piesman J. Acaricide susceptibility of immature Ixodes scapularis (Acari: Ixodidae) as determined by the disposable pipet method//J. Med. Entomol. 1994. V. 31. N 2. P. 319 — 321.
30. Instruction for determining the susceptibility or resistance of adult tick to insecticides//WHO/VBC. 1981. P. 814 — 817.
31. Дремова В.П. Репелленты и их применение в медицинской акароэнтомологии /Дисс. на соиск. уч. степени докт. биол. наук. М., 1973. 400 с.
32. Жукова Л.И. Методика лабораторного испытания репеллентов против клещей Ixodes persulcatus//Мед. паразитол. и паразитарн. бол. 1959. В. 5. С. 45 — 49.
33. Жукова Л.И. Об усовершенствовании методики лабораторного испытания репеллентов против клещей Ixodes persulcatus//Мед. паразитол. и паразитарн. бол. 1962. N 4. С. 436 — 438.
34. Жукова Л.И. Об усовершенствовании методики лабораторного испытания репеллентов против клещей Ixodes persulcatus//Мед. паразитол. и паразитарн. бол. 1972. N 5. С. 26 — 28.
35. Методические рекомендации по отбору и изучению биологической активности и токсичности репеллентов. Утв. МЗ СССР N 24-6/24 от 14.07.1987 М. МЗ СССР. 1987. 60 с.
36. Потапов А.А. Ольфактометр 0-21 для сравнительных испытаний репеллентов//Мед. паразитол. и паразитарн. болезни. 1966. Т. 35. N 1. С. 69 — 73.
37. Потапов А.А. Ольфактометр 0-33 для испытаний репеллентов на блохах// Мед. паразитол. и паразитарн. болезни. 1968. Т. 37. N 1. С. 97 — 99.
38. Report of the WHO informal consultation 3 — 6 February 1998. Mosquito coils. Vaporising mats. Liquid vaporisers. Aerosols. WHO. Geneva. 1998. 53 p.
39. Хрусталева Н.А. Методические рекомендации по изучению эффективности в лабораторных и натурных условиях липких ловушек, не содержащих инсектициды, для борьбы с синантропными тараканами и другими насекомыми: МР N 01-19/136-12. Утв. ГКСЭН РФ 02.10.1996. М., 1996. 11 с.
40. Костина М.Н., Хрусталева Н.А., Мальцева М.М., Тимофеевская Л.А., Рысина Т.З., Родионова Р.П. Новые инсектицидные средства серии Глоболь//РЭТ-инфо. 1998. N 226. С. 31 — 33.
41. Цетлин В.М. Аэрозольные баллоны. Л.: Химия, 1970. 160 с.
42. Лярский П.П., Цетлин В.М. Дезинфекция аэрозолями. М.: Медицина, 1981. 176 с.
43. Еремина О.Ю. Сравнительная эффективность китайских меловых карандашей против синантропных насекомых//РЭТ-инфо. 1992. N 4. С. 7 — 8.
44. Хрусталева НА. Подавление численности популяции рыжего домового муравья Monomorium pharaonis L. и черного садового муравья Lasius niger L. с помощью «Глоболь-бокс-приманки»//Дез. дело. 1998. N 4. С. 40 — 42.
45. Гвоздева И.В., Татаринова С.Г. Исследование кишечного действия инсектицидов в отношении комнатных мух/Сб. трудов по бытовой химии. М., 1984. С. 56 — 59.
46. Стецуренко Н.Н., Ларионова В.Д. Методика определения педикулицидной активности инсектицидов в лабораторных условиях/Вопросы дезинфекции и стерилизации. Сб. науч. тр. М., 1986. С. 97 — 100.
47. Методические рекомендации по применению современных педикулицидных средств. Авторы: Фролова А.И., Олифер В.В., Лубошникова В.М., Родионова Р.П., Заева Г.Н. МЗ РФ МР N 11-7/15-09 от 11.12.2003. М., 2003. 20 с.
48. Методические указания по борьбе с кожеедами в жилых и служебных помещениях/Сост. Л.А. Дегтярева. Утв. 4 ГУ МЗ СССР. М., 1974. 12 с.
49. Баканова Е.И., Алексеев М.А. Использование средств в аэрозольной упаковке для борьбы с осами/Задачи современной дезинфектологии и пути их решения. Матер. Всерос. науч. конфер. 22 — 24 октября 2003. М.: ИТАР-ТАСС, 2003. С. 6 — 8.
50. Маркина В.В., Грязнов А.И., Мимонов Е.В. Методика определения фумигирующего действия веществ и инсектицидно-репеллентных таблеток на их основе/Вопросы дезинфекции и стерилизации. Сб. науч. тр. М., 1986. С. 93 — 97.
51. Методические указания по испытанию пестицидов, предназначенных для борьбы с эктопаразитами животных. Утв. ГУ ветеринарии МСХ СССР 07.06.1973. М., 1973. 13 с.
52. Маркина В.В., Шашина Н.И. Оценка эффективности репеллентных препаратов//РЭТ-инфо. 1996. N 1. С. 6 — 7.
53. Лопатина Ю.В., Шашина Н.И. Чувствительность крысиного клеща к репеллентам/5-я Всероссийская научная конференция «Актуальные вопросы медицинской паразитологии». Санкт-Петербург, 1998. С. 109.
54. Костина М.Н. Регуляторы развития насекомых в медицинской дезинсекции/Задачи современной дезинфектологии и пути их решения. Матер. Всерос. науч. конфер. 22 — 24 октября 2003. М.: ИТАР-ТАСС, 2003. С. 32 — 39.
55. Кирюханцева В.Н., Лопатина Ю.В. Влияние гидропрена на метаморфоз крысиной блохи Xenopsylla cheopis L. и рыжего таракана Blattella germanica L./Сб. Актуальные вопросы совершенствования дезинфекционных и стерилизационных мероприятий. Ч. III. Москва, 1990. С. 136 — 142.
56. Хрусталева Н.А. Влияние метопрена на структуру популяционной группировки рыжих тараканов Blattella germanica L. в лабораторных условиях//Дез. дело. М., 1993. N 1. С. 40 — 44.
57. Методические указания по применению Лафарекса для борьбы с рыжим домовым муравьем/Сост. М.Н. Костина, М.М. Мальцева. Утв. МЗ СССР 26.10.1989. N 15-6/26.
58. Костина М.Н. Биологическое обоснование комбинированного применения регуляторов развития, инсектицидов и хемостерилянтов для борьбы с членистоногими, имеющими медицинское значение. Диссертация на соиск. учен. степени докт. биол. наук. М., 1993. 520 с.
59. Костина М.Н. Перспективы применения регуляторов развития насекомых РРН в медицинской дезинсекции/Сб. Поиск и использ. БАВ в защите растений: состояние и перспективы. С.-Пб., 1998. С. 8 — 10.
60. Morgan P.B., Labrecque G.C., Weiddhaas D.E., Benton A. The effect of methoprene, an insect growth regulator on Musca domestica Diptera: Muscidae//Canad. Entomol. 1975. V. 107. P. 413 — 417.
61. Chamberlain W.F. Methoprene and the flea//Pest Contr. 1979. V. 47. N 6. P. 22 — 26.
62. Meola R.W., Pullen S., Meola S. Toxicity and histopathology of the growth regulator pyriproxyfen to adults and eggs of the cat flea Siphonaptera, Pulicidae//J. Med. Entomol. 1996. V. 33. P. 670 — 679.
63. Хрусталева Н.А. Изучение биологической активности нового инсектицидного средства «Рейд макс — регулятор размножения тараканов» на основе аналога ювенильного гормона гидропрена. Сообщение 1 и 2//РЭТ-ИНФО. 2003. N 246. С. 23 — 27, N 347. С. 26 — 28.
64. Костина М.Н., Мальцева М.М., Олифер В.В., Лопатина Ю.В. Новое инсектицидное средство из группы ингибиторов синтеза хитина ИСХ — «Димилин 25% с.п.»//Дез. дело. 2001. N 3. С. 28 — 32.
65. Imai C. A new method to control houseflies, Musca domestica, at waste disposal sites //Res. Pop. Ecol. 1985. V. 27. P. 111 — 123.
66. Костина М.Н. Регуляторы развития насекомых в медицинской дезинсекции//РЭТ-инфо. 1993. N 1. С. 18 — 22.
67. Chamberlain W.F., Becker J.D. Inhibition of cocoon formation and adult emergence of oriental rat fleas X. cheopis by insect grow regulators//Southwestern Entomologist. 1977. V. 2. N 14. P. 179 — 182.
68. Джекобсон М. Половые феромоны насекомых. М., 1976. 391 с.
69. Adams T.S., Holt G.G. Effect of pheromone components when applied to different models on male sexual behaviour in the housefly Musca domestica//J. Insect. Physiol. 1987. V. 33. N 1. P. 9 — 18.
70. Хрусталева Н.А. Лабораторное изучение сравнительной аттрактивной активности двух образцов полового феромона комнатных мух Musca domestica L. — Z-9-трикозена. Сообщение 1 и 2//РЭТ-инфо. 2002. N 2. С. 22 — 24, N 3. С. 20 — 22.
71. Методические указания по борьбе с тараканами, блохами, постельными клопами, рыжими домовыми муравьями. Утв. МЗ N 945-71 от 28.12.1971.
72. Методические указания по борьбе с тараканами, блохами, постельными клопами, рыжими домовыми муравьями. Утв. МЗ N 28-6/9 от 12.11.1981.
73. Методические рекомендации по борьбе с синантропными тараканами. Утв. МЗ N 28-6/3 от 31.12.1986.
74. Хрусталева Н.А. Методические рекомендации по изучению эффективности в лабораторных и натурных условиях липких ловушек, не содержащих инсектициды, для борьбы с синантропными тараканами и другими насекомыми. Утв. ГКСЭН РФ N 01-19/136-12 от 2.10.1996. М., 1996. С. 1 — 11.
75. Одинец А.А., Батршина А.А., Дегтярева Л.А. и др. Особенности организации работ по снижению численности тараканов и рыжих домовых муравьев в большом городе/Матер. междунар. колл. по общественным насекомым. Росс. Секция IUSSI, Socium. С.-Пб., 1997. Т. 3 — 4. С. 305 — 306.
76. Жукова Л.И. Производственные испытания новых репеллентов против гнуса и клещей Ixodes persulcatus. Сообщение 1 и 2//Мед. паразитол. и паразитарн. бол. 1964. N 5. С. 537 — 540, 1965. N 5. С. 540 — 543.
77. МУ 3.2.974-00 «Малярийные комары и борьба с ними на территории Российской Федерации». М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2000. 56 с.
78. МУ 3.5.2.705-98 «Борьба с комарами, выплаживающимися в подвальных помещениях». М.: «ИНТЕРСЭН», 1998. 23 с.
79. Наумов Р.Л. Аттрактивно-акарицидные гранулы — акарицид нового поколения//Дез. дело. 1997. N 2. С. 18 — 21.
6.7.10. Приложение
Приложение
рекомендуемое
ПОКАЗАТЕЛИ ЭФФЕКТИВНОСТИ СРЕДСТВ ДЕЗИНСЕКЦИИ [2]
┌───┬───────────────────────┬──────────────────────────┬───────────────┬──┐
│ N │ Вид продукции │Исследуемые характерис- │ Нормативы │НД│
│п/п│ │тики, показатели │ │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ 1 │ 2 │ 3 │ 4 │5 │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│1 │ Клейкие ловушки без инсектицидов в виде домиков │
│ │ для борьбы с тараканами │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Средняя уловистость, % │ │64│
│ │ │ — на 7-е сутки │не менее 92 │ │
│ │ │ — на 14-е сутки │не менее 97 │ │
│ │ │Ресурс ловушки │1 рыжий │ │
│ │ │ │таракан/кв. см │ │
│ │ │Срок действия, сут. │не менее 15 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│2 │ Клейкие ловушки в виде лент, листов, палочек для борьбы │
│ │ с летающими насекомыми: мухи, моль │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Средняя уловистость, % │ │72│
│ │ │ — на 2-е сутки │не менее 96 │ │
│ │ │Ресурс ловушки │1 комнатная │ │
│ │ │ │муха/кв. см │ │
│ │ │Срок действия, сут. │не менее 15 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│3 │ Инсектицидные пищевые приманки для борьбы с тараканами │
│ │ и муравьями (в виде контейнеров, таблеток, шариков, │
│ │ брикетов, гранул, порошка, пасты, гелей, пены и др.) │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) ДВ — ФОС, карбаматы,│Острое действие: │ │ │
│ │пиретроиды, │гибель, % │ │ │
│ │фенилпиразолы │ — на 2-е сутки │не менее 70 │ │
│ │(фипронил) │Остаточное действие: │ │ │
│ │ │ длительность, сут. │не менее 30 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │б) ДВ — имидаклоприд │Острое действие: │ │ │
│ │гель │гибель, % │ │ │
│ │ │ — на 3-е сутки │не менее 70 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │не менее 90 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │в) ДВ — гидраметилнон │Острое действие: │ │ │
│ │или другой гидразон, │гибель, % │ │ │
│ │борная кислота, сульфо-│ — на 5-е сутки │не менее 70 │ │
│ │фторамид, перфтороктан-│Остаточное действие: │ │ │
│ │сульфонат лития, тиаме-│ длительность, сут. │не менее 90 │ │
│ │токсам, авермектины │ │ │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │г) ДВ — борная кислота,│Острое действие: │ │ │
│ │бура гель │гибель, % │ │ │
│ │ │ — на 5-е сутки │не менее 70 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │не менее 90 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │д) ДВ — борная кислота,│Острое действие: │ │ │
│ │бура (жидкие приманки) │гибель, % │ │ │
│ │ │ — на 5-е сутки │не менее 70 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │не менее 10 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│4 │ Инсектицидные пищевые приманки для борьбы │
│ │ с синантропными мухами (жидкие, сухие сахарные, │
│ │ гранулированные, пластины, гели и др.) │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) ДВ — ФОС │Острое действие: │ │ │
│ │(кроме хлорофоса), │гибель мух, % │ │ │
│ │пиретроиды, │ — через 24 ч │100 │ │
│ │неоникотиноиды │Остаточное действие: │ │ │
│ │ │ длительность, сут. │15 — 60 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │б) ДВ — хлорофос │Острое действие: │ │ │
│ │ │гибель мух, % │ │ │
│ │ │ — через 24 ч │не менее 80 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │не менее 14 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│5 │ Инсектицидные средства в аэрозольных │
│ │ или беспропеллентных упаковках │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) для борьбы с │Острое действие на мух: │ │72│
│ │летающими насекомыми │ — C , мг/куб. м │не более 15 │ │
│ │(мухи, комары и др.) │ 15 │ │ │
│ │ │ — Q , мг/куб. м │не более 1000 │ │
│ │ │ 15 │ │ │
│ │ │ — КТ , мин. │не более 10 │ │
│ │ │ 50 │ │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │б) для борьбы с │Острое действие для │ │ │
│ │нелетающими насекомыми │тараканов: гибель │ │ │
│ │(тараканы, клопы, │тараканов, % │ │ │
│ │муравьи, блохи) │ — через 10 мин. │не менее 30 │ │
│ │ │ — через 24 ч │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │5 — 60 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│6 │ Инсектицидные пиротехнические средства: шашки, таблетки, шнуры │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) для борьбы с │Острое действие: │ │72│
│ │летающими насекомыми │гибель, %, │ │ │
│ │ │ — после полного │100 │ │
│ │ │задымления через 2 ч │ │ │
│ │ │Остаточное действие: │ │ │
│ │ │гибель, % │ │ │
│ │ │ — через 24 ч │100 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │б) для борьбы с │Острое действие: гибель, %│ │ │
│ │нелетающим насекомыми │ — тараканов │не менее 90 │ │
│ │ │ — блох │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │гибель тараканов, клопов, │ │ │
│ │ │блох при подсадке на │ │ │
│ │ │3 сутки, % │ │ │
│ │ │ — через 24 ч │не менее 90 │ │
│ │ │ длительность, сут. │не менее 3 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│7 │ Инсектицидные спирали для борьбы с летающими насекомыми │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое действие: │ │72│
│ │ │гибель имаго комаров, % │ │ │
│ │ │ — через 15 мин. │100 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│8 │ Инсектицидные дусты для борьбы с нелетающими членистоногими │
│ │ и обработки мест посадки и выплода мух │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое действие: │ │72│
│ │ │гибель тараканов, мух, % │ │ │
│ │ │ — через 24 ч │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │7 — 90 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│9 │ Инсектицидные карандаши, мелки, бруски для борьбы │
│ │ с нелетающими членистоногими │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое действие: │ │72│
│ │ │гибель тараканов, % │ │ │
│ │ │ — через 24 ч │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │7 — 60 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│10 │ Микрокапсулированные инсектицидные препараты │
│ │ для борьбы с синантропными насекомыми │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое действие: │ │72│
│ │ │гибель тараканов, % │ │ │
│ │ │ — через 24 ч │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │30 — 90 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│11 │ Инсектицидные концентраты эмульсий, растворы │
│ │ для борьбы с синантропными членистоногими │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое действие: │ │ │
│ │ │гибель членистоногих, % │ │ │
│ │ │ — через 24 ч или │ │ │
│ │ │ — через 72 ч │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │7 — 30 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│12 │ Инсектицидные смачивающиеся или растворимые порошки, │
│ │ таблетки, суспоэмульсии, флоу │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое действие: │ │ │
│ │ │гибель членистоногих, % │ │ │
│ │ │ — через 24 ч или │ │ │
│ │ │ — через 72 ч │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │15 — 60 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┼──┤
│13 │ Средства для борьбы с личинками комаров │ │
├───┼───────────────────────┬──────────────────────────┬───────────────┼──┤
│ │а) микробиологические; │Остаточное действие: │ │ │
│ │б) на основе уротропина│гибель членистоногих при │ │ │
│ │и др.; │подсадке на 3 сутки, % │ │ │
│ │в) ФОС, пиретроиды и │ — через 24 ч или │ │ │
│ │др. │ — через 72 ч │100 │ │
│ │ │СК , мг/л │не более при- │ │
│ │ │ 50 │веденной в ТУ │ │
│ │ │Гибель личинок, % │ │ │
│ │ │ — через 24 ч │100 │ │
│ │ │Гибель личинок, % │ │ │
│ │ │ — через 24 ч │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │3 — 15 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│14 │ Средства электрофумигирующие для борьбы │
│ │ с летающими насекомыми │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │Для комаров и др. кроме│КТ для комаров, мин. │не более 7 │ │
│ │мух: │ 50 │ │ │
│ │а) с матами │Резерв мата для │не менее 7 │ │
│ │(пластинами); │комаров, ч │ │ │
│ │б) жидкостные │КТ для комаров, мин. │не более 4 — 5 │ │
│ │ │ 50 │ │ │
│ │ │Резерв средства для │не менее ука- │ │
│ │ │комаров, ч │занного в НТД │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │Для мух: │КТ для мух, мин. │не более 9 — 10│ │
│ │ │ 50 │ │ │
│ │ │Резерв средства для │не менее ука- │ │
│ │ │мух, ч │занного в НТД │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│15 │ Педикулицидные средства в разных формах для борьбы │
│ │ с головным, лобковым, платяным педикулезом: │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) лосьоны, концентраты│Гибель имаго, % │ │ │
│ │эмульсий │ — через 24 ч │100 │ │
│ │ │Гибель яиц, %, │ │ │
│ │ │ — через 21 день │100 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │б) шампуни, мыла и │Гибель имаго, % │ │ │
│ │другие моющие средства,│ — через 24 ч │100 │ │
│ │дусты, таблетки, сус- │Гибель яиц, % │ │ │
│ │пензии, гранулы, кремы,│ — через 21 день │10 — 100 │ │
│ │гели, эмульсии и др. │ │ │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │в) средства для │Острое действие: │ │ │
│ │импрегнации белья с │гибель имаго, % │ │ │
│ │целью предупреждения │ — при подсадке через 24 ч│100 │ │
│ │заражения педикулезом │Остаточное действие при │ │ │
│ │ │ношении: │ │ │
│ │ │ длительность, сут. │3 — 7 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│16 │ Инсектицидные средства на основе регуляторов │
│ │ развития насекомых РРН: │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) при внесении в среду│Деформированных личинок: │не менее 90 │ │
│ │обитания — аналоги юве-│ │не менее 95 │ │
│ │нильного гормона АЮГ: │ │ │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │- жидкие формы │комаров 4-го возраста, %: │ │ │
│ │ │ — через 2 — 4 сут. │не менее 90 │ │
│ │ │блох, %: │ │ │
│ │ │ — через 3 сут. │не менее 95 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │- плавающие формы │комаров 4-го возраста, %: │ │ │
│ │(брикеты, гранулы) │ — через 4 — 5 сут. │не менее 95 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │- гранулы для борьбы с │мух, %: │ │ │
│ │мухами │ — через 4 — 5 сут. │не менее 95 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │б) при внесении в среду│Деформированных личинок: │ │ │
│ │обитания — ингибиторы │ │ │ │
│ │синтеза хитина ИСХ: │ │ │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │- жидкие формы; │комаров 2-го возраста, %: │ │ │
│ │ │ — через 2 — 4 сут. │не менее 90 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │7 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │- плавающие формы │комаров 2-го возраста, %: │ │ │
│ │(брикеты, гранулы) │ — через 4 — 5 сут. │не менее 95 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │7 — 21 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │в) пищевые приманки: │Стерильность самок │Отсутствие │ │
│ │- для мух с АЮГ и ИСХ │ │яйцекладок │ │
│ │ │ │через 5 дней │ │
│ │ │Жизнеспособных яиц, % │не более 5 │ │
│ │ │Деформированных личинок, │ │ │
│ │ │%: │ │ │
│ │ │ — через 2 — 3 сут. │не менее 95 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │- для тараканов с АЮГ и│Деформированных личинок, │ │ │
│ │ИСХ │%: │ │ │
│ │ │ — через 5 — 7 сут. │не менее 95 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │г) диски-фумигаторы с │Меланизированных и │ │ │
│ │АЮГ: │деформированных личинок: │ │ │
│ │- для тараканов │ — через 2 недели │Появление │ │
│ │ │ │единичных │ │
│ │ │ │особей │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│17 │ Репеллентные средства │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) для нанесения на │Острое действие: │ │ │
│ │кожу │КОД, для комаров, %: │100 │ │
│ │ │Длительность действия: │ │ │
│ │ │ДРД, для комаров, часы (по│ │ │
│ │ │категориям эффективности):│ │ │
│ │ │ — высш. категория │4 и более │ │
│ │ │ — 1 категория │3 и более до 4 │ │
│ │ │ — 2 категория │2 и более до 3 │ │
│ │ │ — 3 категория │1 и более до 2 │ │
│ │ │ — 4* категория │1 и более │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │б) для нанесения на │Острое действие: │ │ │
│ │одежду, ткани │КОД, %: │ │ │
│ │ │ — для комаров │100 │ │
│ │ │ — для блох │95 и более │ │
│ │ │ — для иксодовых клещей │95 и более │ │
│ │ │ — для муравьев │95 и более │ │
│ │ │Длительность действия: │ │ │
│ │ │ДРД, сутки (по категориям │ │ │
│ │ │эффективности): │ │ │
│ │ │для комаров: │ │ │
│ │ │ — высш. категория │20 и более │ │
│ │ │ — 1 категория │10 и более до │ │
│ │ │ │20 │ │
│ │ │ — 2 категория │5 и более до 10│ │
│ │ │ — 3 категория │3 и более до 5 │ │
│ │ │для блох: │ │ │
│ │ │ — высш. категория │5 и более │ │
│ │ │ — 1 категория │3 и более до 5 │ │
│ │ │ — 2 категория │2 и более до 3 │ │
│ │ │для иксодовых клещей │3 и более │ │
│ │ │для муравьев* │3 и более │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│18 │ Инсектицидно-акарицидно-репеллентные средства │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое инсектицидное │ │ │
│ │ │действие: │ │ │
│ │ │гибель комаров, %: │ │ │
│ │ │ — через 2 ч │100 │ │
│ │ │Остаточное инсектицидное │ │ │
│ │ │действие: │ │ │
│ │ │гибель комаров, %: │ │ │
│ │ │ — через 3 сут. │не менее 70 │ │
│ │ │Острое репеллентное │ │ │
│ │ │действие: │ │ │
│ │ │ — КОД для комаров, % │не менее 90 │ │
│ │ │ — ДРД для комаров, сут. │не менее 1 │ │
│ │ │Для клещей │ │ │
│ │ │см. «Акарицидные средства»│ │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│19 │ Средства борьбы с молью и кожеедами │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) контактного │Острое действие: │ │ │
│ │действия; │гибель гусениц моли или │ │ │
│ │б) фумигационного │личинок кожеедов, %: │ │ │
│ │действия; │ — через 72 ч │100 │ │
│ │в) репеллентного │Остаточное действие: │ │ │
│ │действия │ длительность, месяцев │4 — 6 │ │
│ │ │Изъеденность ткани в │не более 7 │ │
│ │ │течение 14 сут., мг │ │ │
│ │ │Острое действие: │ │ │
│ │ │гибель имаго, % │ │ │
│ │ │ — через 48 ч │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, месяцев │не менее 4 │ │
│ │ │КОД в ольфактометре, % │ │ │
│ │ │ — через 24 ч │не менее 75 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, месяцев │1 — 4 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│20.│ Средства борьбы с осами │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) инсектицидные │Острое действие на ос │ │ │
│ │средства в аэрозольных │(мух, пчел — тест-объект) │ │ │
│ │упаковках для │ — C , мг/куб. м │не более 10 │ │
│ │распыления в воздух │ 15 │ │ │
│ │ │ — Q , мг/куб. м │не более 1000 │ │
│ │ │ 15 │ │ │
│ │ │ — КТ , мин. │не более 7 │ │
│ │ │ 50 │ │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │б) инсектицидные │Острое действие на ос │не менее 100 │ │
│ │средства различных форм│(мух, пчел — тест-объект) │ │ │
│ │для обработки гнезд │при подсадке на │ │ │
│ │ │впитывающую поверхность │ │ │
│ │ │(через 15 мин. после │ │ │
│ │ │обработки), гибель, % │ │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │7 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │в) инсектицидные │Острое действие на ос │не менее 80 │ │
│ │пищевые приманки │(мух, пчел — тест-объект) │ │ │
│ │ │гибель, %, через 24 ч │ │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │10 — 30 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │г) ловушки │Натурный эксперимент: │не менее 10 │ │
│ │безинсектицидные с │уловистость через 2 суток,│ │ │
│ │аттрактантами │особи │ │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│21 │ Акарицидные средства для защиты от иксодовых клещей, │
│ │ нанесение на одежду, ткани │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │ — ТН , мин. │не более 5 │ │
│ │ │ ср │ │ │
│ │ │ — МВ , см │не более 50 │ │
│ │ │ ср │ │ │
│ │ │ — ИСП │не более 1,1 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│22 │ Акарицидные средства для борьбы с гамазовыми │
│ │ и чесоточными клещами в помещениях │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое действие: │ │ │
│ │ │гибель клещей, %: │ │ │
│ │ │ — через 24 ч │100 │ │
│ │ │Остаточное действие: │ │ │
│ │ │гибель клещей при подсадке│ │ │
│ │ │на 3-и сут. на невпитыва- │ │ │
│ │ │ющую поверхность, % │ │ │
│ │ │ — через 24 ч │не менее 80 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│23 │ Акарицидные средства для борьбы с клещами │
│ │ домашней пыли в помещениях │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое действие: │ │ │
│ │ │гибель клещей, %: │ │ │
│ │ │ — через 24 ч │100 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│24 │ Инсектоакарицидные средства для борьбы с иксодовыми │
│ │ клещами в природных биотопах │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │ │Острое действие: │ │ │
│ │ │Эффективность, %: │ │ │
│ │ │- на 3-и сутки │не менее 95 │ │
│ │ │Остаточное действие: │ │ │
│ │ │ длительность, сут. │не менее 30 │ │
├───┼───────────────────────┴──────────────────────────┴───────────────┴──┤
│25 │ Аттрактанты (феромоны) │
│ │ (половые, яйцекладки, агрегации, пищевые) │
├───┼───────────────────────┬──────────────────────────┬───────────────┬──┤
│ │а) для мух │КАД, %: │ │ │
│ │ │ — за 3 мин. │не менее 50 │ │
├───┼───────────────────────┼──────────────────────────┼───────────────┼──┤
│ │б) для тараканов │КАД, %: │ │ │
│ │ │ — за 17 ч │не менее 50 │ │
└───┴───────────────────────┴──────────────────────────┴───────────────┴──┘
7. Родентологические методы исследований и критерии оценки
эффективности дератизационных средств
7.1. Общие положения. Требования к экспериментальным
животным и условиям их содержания
Под дератизационными средствами понимают химические и физические средства, используемые для умерщвления и отпугивания грызунов с целью снижения их численности.
К химическим дератизационным средствам относятся родентициды и их формы, синергисты и репелленты. К физическим дератизационным средствам относятся механические устройства, умерщвляющие грызунов (давилки, капканы, клеевые ловушки), или средства отлова однократного и многократного действия, ограничивающие передвижение грызунов живоловки, а также отпугивающие устройства (ультразвуковые и электромагнитные излучатели, электрические устройства).
Дератизационные средства и рекомендуемые способы их применения должны удовлетворять следующим требованиям:
— быть эффективными в отношении целевых видов;
— не обладать репеллентными свойствами (за исключением репеллентов);
— быть безопасными для человека и нецелевых видов животных, что предполагает наличие антидотов или соответствующих мер применения.
Дератизационные средства испытывают в лабораторных условиях и в естественных местообитаниях грызунов (в натурных условиях). В лабораторных условиях эффективность дератизационных средств оценивают при одиночном или групповом содержании животных. В естественных местах обитания грызунов уточняют режимы применения и эффективность дератизационных средств.
Все работы проводят в соответствии с действующими требованиями, инструкциями, утвержденными нормами и правилами, методиками содержания лабораторных животных и испытания дератизационных средств.
Требования к экспериментальным животным и условиям их содержания. Эффективность дератизационных средств определяют на лабораторных формах грызунов целевых видов — серых и черных крысах, домовых мышах, серых полевках — видах, которые являются главными объектами дератизации в населенных пунктах [66]. В экспериментах используют только потомков диких грызунов, выращенных в условиях вивария. Диких грызунов для опытов не используют, т.к. они подвержены стрессам, могут содержать в организме антикоагулянт, могут быть заражены эктопаразитами, больны инфекционными болезнями или инвазиями, что окажет влияние на результаты экспериментов. Помимо этого, дикие грызуны плохо поедают предлагаемые корма и очень агрессивны. Лабораторную культуру грызунов получают от диких особей, отловленных в естественных местообитаниях. В течение месяца грызунов содержат поодиночке в карантине. В течение этого периода за ними наблюдают и отбирают внешне здоровых особей с блестящей шерстью, без повреждения конечностей или кожи, подвижных, с хорошим аппетитом. Для уничтожения эктопаразитов грызунов обрабатывают инсектицидами. После карантина из оставшихся грызунов формируют пары для размножения. При этом подсаживают самца к самке или помещают пару в новую клетку.
Большое значение для получения здоровых животных имеет своевременная отсадка молодняка от родителей. Полевок отсаживают в возрасте 18 — 20 дней, домовых мышей — через 20 — 25 дней после рождения, крысят — через 25 — 28 дней.
При содержании и разведении целевых видов грызунов соблюдают все зоогигиенические и зоотехнические требования [79, 80]. Помещения, в которых содержатся грызуны, должны иметь естественный световой режим, комнатную температуру (20 — 22 °C) и стабильную относительную влажность воздуха (50 — 60%). При групповом содержании и разведении животных используют просторные вольеры размером не менее 120 x 50 x 30 см. При одиночном или парном содержании грызунов, а также самок с приплодом используют металлические сетчатые клетки размером 40 x 30 x 25 см или пластмассовые лотки размером 40 x 30 x 15 см и 25 x 17 x 12 см с решетчатыми металлическими крышками. Внутрь вольеров, клеток и пластмассовых лотков помещают специальные домики-укрытия, кормушки, автоматические поилки или баночки с водой. В качестве подстилки применяют опилки или стружку, смешанные с гранулированным поглотителем влаги и запаха (например, адсорбент для кошачьих туалетов). Вольеры, клетки и пластмассовые лотки чистят один раз в два дня, при этом удаляют загрязненный подстилочный материал и добавляют свежий. Подстилку полностью меняют один раз в неделю. Воду в поилках меняют ежедневно. Кормушки моют при смене корма, каждый день. Вольеры, клетки и пластмассовые лотки моют и дезинфицируют не менее одного раза в две недели. В комнатах, где содержат животных, ежедневно проводят влажную уборку. Раз в неделю проводят дезинфекцию 2 — 5%-ным раствором хлорамина или другими, разрешенными для этих целей, дезинфицирующими средствами. По показаниям осуществляют дезинсекцию против блох и гамазовых клещей. Борьбу с мухами ведут постоянно с помощью современных инсектицидных приманок.
Кормление животных должно быть полноценным и разнообразным. Основной рацион серых крыс составляет гранулированный животный корм. Используют также зерновую смесь и овощи. Домовых мышей кормят зерновыми смесями и гранулированным животным кормом. Мышей подкармливают зеленым кормом и корнеплодами. Полевок, адаптированных к условиям лабораторного содержания, кормят гранулированными растительными и животными кормами, но обязательно добавляют к рациону зеленые корма, корнеплоды, фрукты, зерно.
7.2. Методы исследований эффективности химических
родентицидных средств
7.2.1. Требования к условиям эксперимента по оценке
эффективности родентицидных средств. Контролируемые
показатели и обработка результатов
Чистота эксперимента по оценке эффективности родентицидных средств зависит от поддержания постоянных условий содержания животных на протяжении всего опыта. Лабораторное помещение, где проводят эксперименты, должно быть изолировано от других помещений вивария, иметь естественный световой режим, комнатную температуру (20 — 22 °C) и стабильную относительную влажность воздуха (50 — 60%).
Состав и качество корма остаются постоянными на протяжении опыта. При изучении эффективности отравленных приманок в качестве контроля используют альтернативный корм, не содержащий родентицидного средства. Для этих целей используют овсяную крупу.
Определение эффективности субстанций и концентратов действующих веществ ДВ изучают на приготовленной стандартной отравленной приманке, используемой в качестве модели, с известной концентрацией действующего вещества. Для стандартной отравленной приманки в качестве пищевой основы применяют овсяную крупу. Стандартную приманку с определенной концентрацией ДВ готовят, смешивая зерновую основу с концентратом действующего вещества.
Необходимое количество концентрата К в приманке рассчитывают по формуле:
П x ДВ
2
K = ——-,
ДВ
1
где:
K — количество концентрата, г;
П — количество приманки, г;
ДВ — содержание ДВ в концентрате, %;
1
ДВ — заданное содержание ДВ в приманке, %.
2
Во время эксперимента животным обеспечивают свободный доступ к воде и корму. Используют водопроводную воду без постороннего запаха и привкуса с pH 6,8 — 7,0. Конструкция автоматических поилок исключает загрязнение воды. Кормушки с кормами подвешивают на противоположные стенки клетки — это уменьшает его загрязнение и растаскивание. Альтернативный корм и приманку раскладывают в разные кормушки по 100 г для крыс и по 50 г для мышей. Полного съедания кормов не допускают; при съедании 2/3 корма в кормушку добавляют новый, до первоначальной массы.
Кормушки ежедневно меняют местами для того, чтобы исключить привыкание грызунов к одному месту кормления.
В опыт отбирают здоровых грызунов, примерно одного возраста (2 — 6 месяцев) и массы тела (серые крысы 150 — 280 г; домовые мыши 20 — 30 г; серые полевки 18 — 28 г). Если не ставится задача специальных исследований, то в опытах не используют беременных или лактирующих самок.
Грызунов, отобранных для опытов, не обрабатывают инсектицидами, антигельминтными препаратами, места их содержания не обрабатывают дезинфектантами.
Для экспериментов используют 6 особей одного вида. При получении нечетких результатов опыты повторяют на 10 грызунах.
Перед началом эксперимента грызунов в течение 3 дней выдерживают для
адаптации к новым условиям содержания и кормления. Для изучения
эффективности родентицидных средств в эксперименте наблюдения проводят до
момента гибели животного, но не более 3 суток для родентицидов острого
действия, 10 суток — для антикоагулянтов второго поколения и ядов
смешанного действия (витаминов D и D ) и 14 суток — для антикоагулянтов
2 3
первого поколения.
Действие отравленной приманки на грызунов определяют по трем основным параметрам:
— поедаемость приманки;
— количество погибших;
— время гибели.
В качестве дополнительных параметров используют количество поглощенного грызуном ДВ в миллиграммах и количество ДВ в пересчете на единицу массы тела мг/кг. Вес грызуна и его изменение определяют в начале опыта и по его окончании.
Первичные результаты опытов фиксируют в «Рабочем журнале», а затем рассчитывают необходимые параметры. Примеры расчетов и их оформление представлены на рис. 7.1, в табл. 7.1 и 7.2.
|
N п/п |
Дата начала опыта |
Вид |
Пол |
Вес (г) |
Продолжительность эксперимента (сут.) |
||||||||||||||
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|||||
|
1 |
03.03.05 |
Крыса серая |
Самец |
грызуна (г) |
265 |
— |
— |
— |
— |
— |
245 |
||||||||
|
остаток приманки в кормушке (г) |
100 |
85 |
75 |
70 |
65 |
60 |
60 |
||||||||||||
|
съедено приманки (г) |
0 |
15 |
10 |
5 |
5 |
5 |
0 |
||||||||||||
|
остаток альтерна- тивного корма в кормушке (г) |
100 |
90 |
85 |
80 |
75 |
75 |
75 |
||||||||||||
|
съедено альтернатив- ного корма (г) |
0 |
10 |
5 |
5 |
5 |
0 |
0 |
||||||||||||
|
7 |
03.03.05 |
Домовая мышь |
Самка |
грызуна (г) |
27 |
— |
— |
— |
— |
22 |
|||||||||
|
остаток приманки в кормушке (г) |
50 |
43 |
37 |
32 |
29 |
29 |
|||||||||||||
|
съедено приманки (г) |
0 |
7 |
6 |
5 |
3 |
0 |
|||||||||||||
|
остаток альтернатив- ного корма в кормушке (г) |
50 |
45 |
43 |
40 |
38 |
38 |
|||||||||||||
|
съедено альтернатив- ного корма (г) |
0 |
5 |
2 |
3 |
2 |
0 |
Рис. 7.1. Рабочий журнал (образец)
Таблица 7.1
ДИНАМИКА ПОЕДАЕМОСТИ ИССЛЕДУЕМОЙ ПРИМАНКИ
И АЛЬТЕРНАТИВНОГО КОРМА СЕРЫМИ КРЫСАМИ
┌───┬─────┬────────────────────────────────┬───────────────────────────────────────────────┐
│ N │ Пол │ Вес грызуна │ Количество съеденного корма по дням, г │
│п/п│ ├──────┬──────┬──────────────────┼───────┬───────┬───────┬───────┬───────┬───────┤
│ │ │ в │в день│ средний │ 1 │ 2 │ 3 │ 4 │ 5 │ 6 │
│ │ │начале│гибели│ ├───┬───┼───┬───┼───┬───┼───┬───┼───┬───┼───┬───┤
│ │ │опыта │ │ │ О │ К │ О │ К │ О │ К │ О │ К │ О │ К │ О │ К │
│ x │ │ V │ v │ V │P │p │P │p │P │p │P │p │P │p │P │p │
│ │ │ x │ x │ ср │ x │ x │ x │ x │ x │ x │ x │ x │ x │ x │ x │ x │
├───┼─────┼──────┼──────┼──────────────────┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┤
│1 │самец│265 │245 │255 │15 │10 │10 │5 │5 │5 │5 │5 │5 │0 │+ │+ │
├───┼─────┼──────┼──────┼──────────────────┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┤
│…│… │… │… │… │…│…│…│…│…│…│…│…│…│…│…│…│
├───┼─────┼──────┼──────┼──────────────────┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┤
│n │самка│200 │196 │198 │15 │15 │15 │5 │10 │5 │5 │0 │+ │+ │ │ │
├───┴─────┼──────┼──────┼──────────────────┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┼───┤
│Среднее m│m │m │ SUM V │ │ │ │ │ │ │ │ │ │ │ │ │
│ │ V │ v │ ср 1…n│ │ │ │ │ │ │ │ │ │ │ │ │
│ │ x │ x │m = ————│ │ │ │ │ │ │ │ │ │ │ │ │
│ │ │ │ ср n │ │ │ │ │ │ │ │ │ │ │ │ │
└─────────┴──────┴──────┴──────────────────┴───┴───┴───┴───┴───┴───┴───┴───┴───┴───┴───┴───┘
Примечание: + — гибель крысы; О — опыт (исследуемая приманка); К —
контроль (альтернативный корм); P — съедено корма в опыте (x = 1, 2…n);
x
p — съедено корма в контроле; n — количество крыс в эксперименте;
x
остальные обозначения в тексте.
Таблица 7.2
ПОЕДАЕМОСТЬ ПРИМАНКИ И КОЛИЧЕСТВО ДВ В ОРГАНИЗМЕ СЕРЫХ КРЫС
┌───────┬────────────────────────────────────┬─────────────────────┬──────┐
│ N │Съедено корма в течение эксперимента│ Количество │Время │
│ пп │ │ действующего │гибели│
│ │ │ вещества, │крыс, │
│ │ │ поглощенного крысой │ сут. │
│ ├──────────────────────┬─────────────┼──────────┬──────────┤ │
│ │ в граммах │ в % │ мг │ мг/кг │ │
│ ├───────┬────────┬─────┼────┬────────┤ │ │ │
│ │ Опыт │Контроль│Итого│Опыт│Контроль│ │ │ │
│ x │SUM P │ SUM p │ P │ G │ R │ DВ │ Dв │ t │
│ │ x │ x │ │ x │ x │ x │ x │ x │
├───────┼───────┼────────┼─────┼────┼────────┼──────────┼──────────┼──────┤
│1 │40 │25 │65 │62 │38 │2,0 │7,8 │6 │
├───────┼───────┼────────┼─────┼────┼────────┼──────────┼──────────┼──────┤
│. │. │. │. │. │. │. │. │. │
├───────┼───────┼────────┼─────┼────┼────────┼──────────┼──────────┼──────┤
│п │45 │25 │70 │64 │36 │2,3 │11,6 │5 │
├───────┼───────┼────────┼─────┼────┼────────┼──────────┼──────────┼──────┤
│среднее│ │ │ │ │ │ │ │ │
└───────┴───────┴────────┴─────┴────┴────────┴──────────┴──────────┴──────┘
Примечание: концентрация ДВ в приманке 0,005%; обозначения в тексте.
Поедаемость определяют по количеству корма, съеденного грызуном в течение одних суток. С этой целью ежедневно взвешивают остаток корма в кормушке и определяют разницу между первоначальным весом корма и весом остатка.
Средний вес грызуна рассчитывают по формуле:
V + v
x x
V = ——-,
ср 2
где:
V — средний вес грызуна;
ср
x — порядковый номер грызуна;
V — вес грызуна в начале опыта;
x
v — вес грызуна в день гибели (табл. 1).
x
Среднее арифметическое m веса крыс в начале эксперимента (m ) и веса
V
x
погибших крыс (m ) рассчитывают по следующим формулам:
v
x
SUM V SUM v
1…n 1…n
m = ———- +/- ДЕЛЬТА или m = ———- +/- ДЕЛЬТА,
V n v n
x x
где:
n — количество крыс в опыте, объем выборки;
SUM V — сумма веса крыс в начале эксперимента (V + V +…+ V );
1…n 1 2 n
SUM v — сумма веса погибших крыс (v + v +…+ v );
1…n 1 2 n
ДЕЛЬТА — средняя ошибка.
сигма
ДЕЛЬТА = ——,
—
/n
где сигма — среднее квадратичное отклонение.
Определение относительной поедаемости исследуемой приманки G и
x
альтернативного корма R для крысы в %, табл. 7.2:
x
SUM P SUM p
x x
G = —— x 100%, R = —— x 100%,
x P x P
где:
G — поедаемость приманки, %;
x
R — поедаемость альтернативного корма, %;
x
SUM P — количество приманки, съеденной крысой в опыте, мг;
x
SUM p — количество альтернативного корма, съеденного крысой в
x
опыте, мг;
P — общее количество корма мг, съеденного крысой в опыте (SUM P +
x
SUM p );
x
Определение количества действующего вещества, поглощенного крысой в
мг, табл. 7.2:
DВ = SUM P x 10 x C,
x x
где:
DВ — количество действующего вещества, поглощенного крысой в мг;
x
C — концентрация действующего вещества в приманке, %.
Определение количества действующего вещества, поглощенного крысой в
пересчете на килограмм веса (табл. 2):
1000 x DВ
x
Dв = ———-,
x V
ср
где:
Dв — количество действующего вещества, поглощенного крысой в мг/кг;
x
V — среднее значение веса крысы (табл. 7.1).
ср
7.2.2. Методы исследований эффективности
различных форм родентицидов
Исследование эффективности готовых форм родентицидов острого и кумулятивного действия. Готовые формы родентицидов могут быть представлены на испытание в виде зерновой приманки, гранул, мягких и парафиновых брикетов, капсул, галет, таблеток, паст и т.д. с известным действующим веществом и его концентрацией.
Эффективность готовых форм родентицидов изучают на целевых видах грызунов: серых крысах, домовых мышах, серых полевках. В процессе эксперимента проводят сравнительный анализ поедаемости отравленной приманки и альтернативного корма, определяют срок наступления гибели грызунов и их количество в процентах от общего числа используемых в опыте грызунов (п. 7.1).
Продолжительность эксперимента по испытанию готовой формы с родентицидами различного типа действия дается в п. 7.1.
При низкой эффективности готовой родентицидной формы грызуны в течение указанных сроков не погибают.
Критериями оценки эффективности готовых форм служат следующие параметры [23]:
— для родентицидов острого действия
Гибель в присутствии альтернативного корма мышей и крыс, % не менее 80
Время гибели, сутки не более 3
Поедаемость готовой формы родентицидов или приготовленной
стандартной отравленной приманки в присутствии альтернативного
корма мышами и крысами, % от суточного рациона не менее 10
— для антикоагулянтов I поколения
Гибель в присутствии альтернативного корма мышей и крыс, % не менее 80
Время гибели, сутки не более 14
Поедаемость готовой формы родентицидов или приготовленной
стандартной отравленной приманки в присутствии
альтернативного корма (кроме приманок для мышей на основе
этилфенацина, зоокумарина, куматетралила) мышами
и крысами, % от суточного рациона не менее 15
Поедаемость готовой формы родентицидов или приготовленной
стандартной отравленной приманки на основе этилфенацина,
зоокумарина, куматетралила в присутствии альтернативного
корма мышами, % от суточного рациона не менее 20
— для антикоагулянтов II поколения
Гибель в присутствии альтернативного корма мышей и крыс, % не менее 90
Время гибели, сутки не более 10
Поедаемость готовой формы родентицидов или приготовленной
стандартной отравленной приманки в присутствии
альтернативного корма мышами и крысами, % от суточного рациона не менее 15
— для готовых форм с витаминами D и D
2 3
Гибель
мышей, % не менее 80
крыс, % —
Время гибели, сутки не более 7
Поедаемость готовой формы в присутствии альтернативного
корма мышами (% от суточного рациона) не менее 10
крысами, % от суточного рациона —
Исследование эффективности субстанций (техническое ДВ) и концентратов ДВ. Субстанции и концентраты ДВ изучают в виде стандартной отравленной приманки, п. 7.1.
На основе субстанции сначала готовят концентрат с нужным содержанием ДВ в форме масляного или иного раствора, эмульсии, суспензии или порошка с красителем, достаточным для индикации равномерности распределения действующего вещества в приманке. В качестве красителя используют вещества, не влияющие на поедаемость приманки грызунами. Количество действующего вещества в концентрате рассчитывают по формуле:
к x ДВ
2
ДВ = ——-,
ДВ
1
где:
ДВ — количество действующего вещества, г;
к — количество концентрата, г;
ДВ — содержание ДВ в субстанции, %;
1
ДВ — заданное содержание ДВ в концентрате, %.
2
Для приготовления стандартной приманки, используемой в качестве модели, концентрат перемешивают с пищевой основой (овсяной крупой). Качество перемешивания контролируют по равномерности окрашивания приманки красителем.
Оценку эффективности субстанций и концентратов проводят на стандартной приманке по методике и критериям, изложенным в п. 7.1.
Исследование эффективности липких родентицидных покрытий. Эффективность липкого родентицидного покрытия при заданной концентрации ДВ изучают на грызунах целевых видов: серых крысах, домовых мышах, серых полевках. Оценивают сроки и процент гибели грызунов, их отношение к липкому родентицидному покрытию, в т.ч. наличие и характер реакции избегания (неофобия, репеллентность).
Липкие родентицидные покрытия изучают на грызунах, содержащихся поодиночке в вольерах, где оборудованы две одинаковых дорожки или туннеля для их передвижения от гнездового домика к кормушке. После адаптации грызуна к условиям содержания на одну дорожку или туннель длиной 0,25 м по всей длине наносят липкое родентицидное покрытие слоем в 1 — 2 мм. Другая дорожка или туннель остаются чистыми.
Отмечают количество проходов грызуна к корму по каждой дорожке за сутки. Наблюдения проводят визуально в период максимальной активности грызуна или при помощи автоматических датчиков, установленных перед кормушками. Время гибели зависит от количества проходов грызуна по ядовитому липкому покрытию.
Грызуну позволяют контактировать с липким родентицидным покрытием не более 10 суток. Если он в течение этого времени не погиб, его отсаживают в клетку для определения времени гибели.
Покрытие считается эффективным, если не менее 80% подопытных животных погибает в течение 10 суток.
Если в течение первых двух дней животные используют только дорожки или туннель без покрытия, то имеет место реакция неофобии на покрытие. Если эта реакция сохраняется до конца экспозиции липкого родентицидного покрытия, то имеет место репеллентность.
Возможна оценка эффективности липких родентицидных покрытий при отсутствии альтернативного пути перемещения в условиях принудительного пропускания грызуна по туннелю, обработанному липким родентицидным покрытием, что позволяет определить количество проходов, необходимых для его гибели.
Критериями оценки эффективности липких родентицидных покрытий служат следующие параметры:
гибель мышей и крыс, % не менее 80;
экспозиция, сутки не более 10.
7.3. Методы исследования эффективности репеллентов
Исследование эффективности отпугивающих химических соединений по поедаемости корма, содержащего репеллент. Эффективность репеллентов изучают на грызунах целевых видов: серых крысах, домовых мышах, серых полевках.
Исследуемый репеллент вводят в корм. При различных концентрациях репеллента в корме определяют наличие или отсутствие у химического вещества свойств, отпугивающих грызунов и степень его репеллентной активности. С этой целью одинаковое количество корма с репеллентом и без него предлагают грызунам, содержащимся поодиночке. В качестве пищевой основы используют как в опыте, так и в контроле овсяную крупу (п. 7.1). В течение 3 дней учитывают поедаемость корма с репеллентом и без него.
На основании полученных результатов определяют коэффициент отпугивающего действия корма с репеллентом по формуле:
100 x Т
с
КОД = 100 — ———,
Т + Е
с
где:
КОД — коэффициент отпугивающего действия, %;
Т — съедено корма с содержанием репеллента С, г;
с
Е — съедено корма без репеллента, г.
Эффективность репеллента оценивают по КОД.
КОД = 100 ~ 90 — сильно отпугивающие вещества;
КОД = 89 ~ 80 — вещества с удовлетворительными результатами отпугивания;
КОД = 79 и ниже — малоэффективные вещества.
Длительность репеллентной активности химического вещества определяют по КОД корма с добавкой репеллента.
Исследование эффективности отпугивающих химических соединений по
выбору пути перемещения к пище. Эксперимент проводят в клетке, разделенной
на две половины перегородкой с двумя отверстиями. Грызун из гнездовой
половины клетки стремится через то или иное отверстие проникнуть в
половину, где находится корм и вода. В эксперименте одно из отверстий
закрывают экраном из фильтровальной бумаги, обработанной раствором
репеллента, другое — закрывают необработанным экраном из фильтровальной
бумаги. Экран заменяют новым при каждом повреждении. Наблюдения за
поведением грызуна проводят ежедневно по два часа в течение трех дней в
светлое время суток. Отмечают количество повреждений экрана каждого
отверстия и переходов грызуна в кормовую половину. Эффективность репеллента
оценивают по «коэффициенту повреждения» КП. Коэффициент определяют по
отношению числа повреждений грызуном преграды, обработанной репеллентом
(П ), к числу повреждений грызуном преграды, не обработанной репеллентом
р
(П ):
с
П
р
КП = —-.
П
с
Если КП меньше единицы, то испытываемое вещество обладает репеллентными свойствами. Наибольшей репеллентной активностью обладают химические соединения, «коэффициент повреждения» которых приближается или равен нулю. Испытываемое вещество не обладает репеллентными свойствами, если КП равен или больше единицы.
Исследование эффективности ультразвуковых родентицидных средств по их влиянию на поедаемость корма. Определение эффективности ультразвукового излучателя УЗИ проводят в специально оборудованном полигоне, размером 5 x 10 м, разделенном на опытную и контрольную половины металлическим барьером-экраном. В каждой половине выставляют равное количество домиков-укрытий и кормушек таким образом, чтобы одна половина полигона являлась зеркальным отражением другой. Корм в кормушках всегда должен быть в избытке.
В опытной половине помещают устройство УЗИ так, чтобы кормушки попадали под действие ультразвукового излучения. Затем в опытную и контрольную половины полигона запускают равные группы грызунов по 3 — 5 особей в каждой группе. В течение трех суток грызуны адаптируются к новым условиям. В регистрационном журнале ежедневно отмечают количество съеденного ими корма в каждой половине полигона. По окончании периода адаптации в опытной половине полигона включают устройство УЗИ. Устройство остается включенным 5 суток. В течение этого времени в опытной и контрольной половинах полигона определяют ежедневную поедаемость корма грызунами.
Результаты заносят в «Рабочий журнал», а затем рассчитывают коэффициент отпугивающего действия УЗИ. Примеры расчетов и их оформление представлены в табл. 7.3.
Таблица 7.3
ПОЕДАЕМОСТЬ КОРМА СЕРЫМИ КРЫСАМИ ПРИ ВОЗДЕЙСТВИИ НА НИХ УЗИ
|
Полигон, размером 5 x 10 м |
Вид |
Коли- чество грызу- нов |
N кормушки |
Количество съеденного корма (г) |
|||||||||||||||
|
контроль (вне зоны УЗИ) |
опыт (в зоне действия УЗИ) |
в период адаптации (сут.) |
в эксперименте (сут.) |
всего |
в % |
||||||||||||||
|
1 |
2 |
3 |
всего |
среднее |
1 |
2 |
3 |
4 |
5 |
всего |
среднее |
опыт |
конт- роль |
||||||
|
Опытная половина |
Крыса серая |
5 |
1 |
28 |
25 |
15 |
68 |
23,7 |
4 |
1 |
2 |
2 |
5 |
14 |
|||||
|
2 |
25 |
23 |
30 |
78 |
26,0 |
3 |
1 |
1 |
6 |
4 |
15 |
||||||||
|
3 |
20 |
20 |
27 |
67 |
22,3 |
2 |
3 |
1 |
3 |
6 |
15 |
||||||||
|
4 |
12 |
16 |
13 |
41 |
13,7 |
1 |
1 |
1 |
9 |
7 |
19 |
||||||||
|
5 |
30 |
21 |
20 |
71 |
23,7 |
2 |
1 |
2 |
6 |
5 |
16 |
||||||||
|
6 |
27 |
20 |
17 |
64 |
21,3 |
1 |
2 |
1 |
9 |
8 |
21 |
||||||||
|
Всего |
142 |
125 |
122 |
389 |
129,7 |
13 |
9 |
8 |
35 |
35 |
100 |
20 |
149,7 |
13 |
87 |
||||
|
Среднее |
64,8 |
||||||||||||||||||
|
Контрольная половина |
Крыса серая |
5 |
1 |
19 |
23 |
24 |
66 |
24 |
30 |
22 |
25 |
29 |
130 |
||||||
|
2 |
21 |
22 |
21 |
64 |
23 |
26 |
31 |
29 |
23 |
132 |
|||||||||
|
3 |
19 |
21 |
23 |
63 |
26 |
24 |
23 |
33 |
23 |
129 |
|||||||||
|
4 |
17 |
20 |
22 |
59 |
20 |
27 |
27 |
30 |
21 |
125 |
|||||||||
|
5 |
20 |
25 |
21 |
66 |
27 |
21 |
21 |
31 |
20 |
120 |
|||||||||
|
6 |
16 |
24 |
23 |
63 |
22 |
22 |
20 |
24 |
14 |
102 |
|||||||||
|
Итого |
112 |
135 |
134 |
381 |
127 |
142 |
180 |
144 |
172 |
130 |
738 |
147,6 |
274,6 |
54 |
46 |
||||
|
Среднее |
63,5 |
123 |
Эффективность действия УЗИ на грызунов оценивают по поедаемости корма. Сравнивают количество съеденного корма в контрольной и опытной группах. Устройство УЗИ оценивают как эффективное, если во время его действия поедаемость корма зверьками опытной группы составила не более 10% среднесуточного рациона, а разница в поедаемости корма с контрольной группой составляет не менее 40%.
Радиус действия УЗИ определяют опытным путем, устанавливая кормушки на различном расстоянии от источника излучения.
7.4. Методы исследований эффективности механических
дератизационных средств
Исследование эффективности умерщвляющих устройств — давилок и капканов. Пружинные дуговые капканы (N 0 и N 1) и давилки «Геро» относятся к механическим средствам отлова и умерщвления грызунов. Давилки «Геро» представляют собой деревянные плашки или металлические пластины, к которым прикреплена на пружине стальная дужка. Срабатывание механизма заряженной давилки «Геро» и придавливание грызуна дужкой к деревянному или металлическому основанию происходит при одергивании грызуном приманки с крючка или при надавливании на трапик, соединенный со сторожком ловушки. Срабатывание дугового капкана происходит под тяжестью грызуна при надавливании на диск устройства.
Оценку эффективности механических средств дератизации проводят в вольерах на группах грызунов тех видов, для которых они предназначены. В начале эксперимента незаряженные устройства помещают в вольеры для привыкания грызунов к ним. Затем устройства приводят в рабочее состояние и оценивают их эффективность по количеству срабатываний запорного или убивающего механизма при контакте с ним грызуна и количеству грызунов, попавших в устройство.
Критерием оценки механического устройства при контактах с ним грызунов является эффективное срабатывание его не менее чем в 80% случаев.
Исследование эффективности клейких масс и готовых клеевых ловушек. Испытание проводят в вольерах при одиночном или групповом содержании грызунов. Определение эффективности клейких масс осуществляют с помощью клеевых пластин, выполненных из материала, не впитывающего клей. При контакте грызуна с клеевой поверхностью пластины клеевая масса должна удерживать зверька. Для домовых мышей и полевок используют пластины размером 12 x 20 см. Для опытов с крысами применяют пластины размером 20 x 25 см. Клеевую массу на поверхность пластины наносят сплошным слоем не более 1 мм. Пластины с клеевой массой помещают перед кормушкой либо в другом месте, и тогда в центр клеевой поверхности приклеивают в качестве приманки небольшой кусочек хлеба с растительным маслом.
Показателем эффективности клейкой массы является удерживание не менее 80% зверьков весом не более 100 г.
Исследование эффективности живоловок. Живоловки для крыс и мышей бывают целиком из металлической сетки, оцинкованного железа с отверстиями, из металлической сетки, закрепленной на деревянной доске или пластмассовые. Одноразовые устройства имеют дверцу, которая захлопывается при одергивании грызуном приманки с крючка или надавливании на трапик. Балансирующая одноразовая живоловка состоит из пластмассовой трубки квадратного сечения, изогнутой под определенным углом, и дверцы, захлопывающейся при нарушении баланса. Грызун входит внутрь ловушки по горизонтально расположенной части трубки и при переходе в другую ее половину нарушает баланс ловушки, от чего дверца приподнимается и захлопывается.
Многоразовые живоловки (типа верш) изготовлены из металлической сетки. Грызуны попадают внутрь по сужающемуся проходу или через отверстие с трапиком. Трапик срабатывает под тяжестью грызуна, который попадает в вершу, а трапик под действием пружины принимает первоначальное положение и закрывает выход грызуну. Оценку эффективности живоловок проводят по методике, используемой для испытания одноразовых механических устройств с учетом специфики многоразового попадания.
7.5. Методы исследований эффективности химических
родентицидных средств в условиях группового
содержания грызунов
Эксперименты на семье или искусственно созданной группировке грызунов позволяют имитировать их поведенческие реакции по отношению к родентицидным средствам, характерные для естественных условий, и более точно оценить эффективность испытываемых средств.
Исследование эффективности готовых форм родентицидов острого и кумулятивного действия. Реакция грызунов на родентицидные средства в условиях группового содержания в вольере приближенно отражает их поведение в естественных условиях. Отношения животных в группировке определяют иную степень контакта грызунов с родентицидными средствами, чем при одиночном содержании, связанную с их социальным поведением.
Эксперименты по оценке эффективности родентицидных средств на семейных или искусственно созданных группах грызунов осуществляют в вольерах, оборудованных одним или двумя домиками, поилкой и двумя кормушками, которые подвешивают на одной из боковых стенок вольера или укрепляют симметрично на противоположных стенках. Группировку формируют из 5 грызунов (трех самцов и двух самок, причем увеличение количества самок возможно, а самцов — не рекомендуется) и выдерживают их совместно в течение 3 дней — для установления иерархической структуры в группировке (минимально необходимое время), а также для определения количества корма, съедаемого за сутки. После образования в группировке устойчивых взаимоотношений одну из кормушек заполняют отравленной приманкой, другую — альтернативным контрольным кормом. Вес его в кормушках должен превышать суточную норму, необходимую для питания группы, в 1,5 раза. По мере необходимости добавляют корм в кормушки. Для определения поедаемости ежедневно взвешивают остаток корма (п. 7.1). Кормушки ежедневно меняют местами.
Критериями оценки эффективности готовых форм служат параметры, указанные в п. 7.2.2.
Исследование эффективности липких родентицидных покрытий. Эксперимент осуществляют в вольере, имеющем 1 — 2 гнездовых домика и поилку. Группировку грызунов формируют, как описано выше.
Липкое родентицидное покрытие наносят слоем 1 — 2 мм на пластину размером 25 x 25 см. В середину пластины прикрепляют небольшую кормушку (не более 6 x 6 см) с весом корма, превышающим суточную норму питания грызунов. Пластину с кормушкой помещают в вольер. Корм используют в качестве приманки, а поедаемость его как индикатор контакта грызунов с липким родентицидным покрытием. Ежедневно взвешивают остаток корма в кормушке и определяют поедаемость корма. Существует прямая зависимость между количеством контактов грызунов с липким родентицидным покрытием и количеством съеденного корма.
Время гибели грызунов зависит от количества контактов их с липким родентицидным покрытием. Эксперимент в вольере проводят не более 10 дней. Затем оставшихся в живых грызунов пересаживают по одному в клетки для определения сроков их гибели.
Для определения репеллентности липкого родентицидного покрытия в вольеры помещают две кормушки с одинаковым кормом. Одна кормушка закреплена на площадке, обработанной ядовитым покрытием, другая — на площадке без покрытия. По количеству съеденного корма в каждой кормушке определяют наличие у покрытия репеллентных свойств.
7.6. Методы оценки эффективности дератизационных средств
в естественных местообитаниях грызунов
в натурных условиях
7.6.1. Требования к проведению испытаний дератизационных
средств в натурных условиях
Биологическую активность и целевую эффективность дератизационных средств изучают на объектах, заселенных грызунами. Для проведения экспериментов выбирают объекты с высокой или средней численностью грызунов [71].
Наличие и количество грызунов, а также их видовой состав первоначально устанавливают на основании опроса работников объекта и визуального его обследования по следам жизнедеятельности грызунов. Уточнение видового состава грызунов и степени заселенности объекта проводят с помощью контрольно-пылевых следовых площадок или пищевых приманок без токсиканта, т.е. методами, которые не изменяют состав и количество грызунов на объекте.
Изучение эффективности дератизационных средств на объекте осуществляют
не более 10 суток для родентицидов острого действия, механических средств
(ловушек, живоловок, клеевых устройств) и ультразвуковых излучателей УЗИ,
28 суток для антикоагулянтов второго поколения и родентицидов смешанного
действия (витаминов D и D ) и 40 суток для антикоагулянтов первого
2 3
поколения.
Эффективность действия отравленной приманки на грызунов определяют по следующим основным параметрам:
— поедаемость приманки;
— время появления трупов;
— изменение относительной численности грызунов;
— скорость освобождения объекта от грызунов.
На объекте отравленную приманку помещают в кормушки в зависимости от численности грызунов в количестве от 20 до 100 г. На объекте менее 100 кв. м расставляют не более пяти кормушек. Одновременно оборудуют не более 10 контрольно-пылевых (следовых) площадок.
На объектах более 100 кв. м кормушки расставляют в соответствии с СанПин 3.5.3.1129-02 [13], то есть 8 г приманки на 1 кв. м. При этом на одну кормушку должно приходиться 50 г отравленной приманки.
Дополнительными параметрами, с помощью которых оценивают эффективность дератизационных средств в естественных местах обитания грызунов, являются: снижение их численности и динамика видового состава, а для механических или клеевых дератизационных средств — их уловистость.
Поедаемость определяют по количеству корма, съеденного зверьками на объекте в течение одних или двух суток. С этой целью взвешивают остаток корма в кормушках и определяют разницу между первоначальным весом корма и весом остатка. Частота контрольных взвешиваний зависит от численности грызунов на объекте. При высокой численности взвешивание корма следует проводить один раз в сутки. Кормушками могут служить пластиковые одноразовые тарелки, ящички размером 10 x 10 см, специальные стандартные контейнеры для приманки.
Одновременно методом контрольно-пылевых следовых площадок определяют относительную численность грызунов на объекте. Контроль численности грызунов до и после эксперимента проводят по одной и той же методике с соблюдением стандартных требований к расстановке средств учета и сроков их экспозиции (т.е. периоду между расстановкой и контролем средств учета).
Скорость освобождения объекта определяют по увеличению количества не заслеженных контрольно-пылевых следовых площадок по дням.
Первичные результаты опытов заносят в «Рабочий журнал», рис. 7.2.
|
N п/пло- щадки |
N кор- мушки |
Дата начала опыта |
Вид |
Наименование контрольного учета |
Время контрольного учета, сут. |
|||||||||
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
… |
|||||
|
— |
2 |
03.03.05 |
— |
Остаток приманки в кормушке, г |
||||||||||
|
Съедено приманки, г |
||||||||||||||
|
3 |
— |
03.03.05 |
Крыса серая |
Кол-во пылевых площадок |
||||||||||
|
П/площадка со следами |
||||||||||||||
|
П/площадка без следов |
||||||||||||||
|
7 |
— |
03.03.05 |
Домо- вая мышь |
Кол-во пылевых площадок |
||||||||||
|
П/площадка со следами |
||||||||||||||
|
П/площадка без следов |
Рис. 7.2. Рабочий журнал
На объекте, выбранном для проведения испытаний, не должны проводиться другие дератизационные мероприятия, а также не должно быть других родентицидных средств.
В процессе испытаний дератизационных средств оценивают также безопасность и удобство их применения в естественных местах обитания грызунов и определяют соответствие правилам охраны труда и техники безопасности [13, 14].
7.6.2. Методы исследований эффективности
дератизационных средств
Методика контрольно-пылевых следовых площадок. Данная методика позволяет обнаружить грызунов на объекте и оценить заселенность его грызунами, определить их видовую принадлежность и пути передвижения. При изучении дератизационных средств и оценки их эффективности, методику контрольно-пылевых следовых площадок применяют для определения тенденции изменения количества грызунов на объекте. Динамика заслеженных грызунами площадок в сторону уменьшения происходит вследствие применения средства и отражает его эффективность.
Контрольно-пылевые (следовые) площадки размером 10 x 20 см, покрытые слоем муки, талька или другого пылевидного материала, размещают в местах вероятного передвижения грызунов по объекту и, прежде всего, в углах, вдоль стен, перегородок, вблизи дверей и окон. Количество площадок на объекте зависит от его площади. На объектах или в помещениях менее 100 кв. м оборудуют не более 10 площадок. При этом площадки располагают вдоль плинтусов по бокам дверного проема (две), в углах комнаты (четыре), под окном (одна) и по середине основания боковых стен (две). На объектах площадью более 100 кв. м контрольно-пылевые (следовые) площадки оборудуют из расчета: одна площадка на 5 — 10 кв. м.
По следам, оставленным грызунами на контрольно-пылевых следовых площадках, вычисляют относительное их количество на объекте. Для этого определяют количество площадок со следами пребывания грызунов и рассчитывают процент заслеженных площадок по формуле:
А x 100
К = ——-,
Б
где:
К — число заслеженных площадок в %;
Б — всего площадок на объекте, штук;
А — количество заслеженных площадок, штук.
При обнаружении на площадках следов крыс, мышей или полевок, чтобы определить относительное их количество, рассчитывают % заслеженных площадок по каждому виду.
Исследование биологической активности и целевой эффективности дератизационных средств в естественных местах обитания. Биологически активное средство должно вызывать гибель грызунов (отравленные приманки, липкие покрытия, механические и клеевые умерщвляющие устройства) либо ограничивать их передвижение (живоловки) или проникновение (репелленты и УЗИ) на объект. Чем быстрее исчезают грызуны в помещениях объекта, тем эффективнее испытываемое средство и тем меньшее количество площадок заслежено грызунами. Эффективность дератизационного средства оценивают по скорости освобождения объекта от грызунов. Для этого до начала эксперимента учитывают количество заслеженных и незаслеженных площадок и рассчитывают относительную численность грызунов. Затем на объекте размещают испытываемое дератизационное средство в соответствии с нормами, указанными в п. 7.1. После этого ежедневно проверяют контрольно-пылевые (следовые) площадки, учитывая количество заслеженных и незаслеженных площадок.
Поедаемость приманок определяют по количеству корма, съеденного грызунами на объекте в течение одних или двух суток. Процент съеденной приманки определяют от общего количества разложенного корма за каждые сутки или в среднем за выбранный период. Для определения количества поедаемого корма в кормушки раскладывают взвешенные его порции. В каждую кормушку раскладывают от 50 до 100 г приманки и расставляют, как указанно в п. 7.1. Чтобы при осмотре не пропустить кормушки, их следует пронумеровать.
Через одни или двое суток корм в кормушках взвешивают. После этого весь оставшийся корм собирают, а в кормушки раскладывают другой из предварительно подготовленной и взвешенной новой порции. Вычитая из исходного веса корма последующий, определяют массу корма, съеденного грызунами за день в каждой кормушке. Корм раскладывают 2 — 3 раза и рассчитывают среднее потребление приманки за определенный период наблюдения.
Количество контрольно-пылевых следовых площадок рассчитывают исходя из норм указанных выше.
Эффективность давилок, живоловок, клейких масс или готовых клеевых ловушек, липких ядовитых покрытий, ультразвуковых родентицидных средств, отпугивающих химических соединений оценивают по скорости освобождения объекта от грызунов, используя для контроля метод контрольно-пылевых следовых площадок.
Эффективность дератизационного средства рассчитывают по формуле:
К — К x 100
1 2
Э = ————-,
К
1
где:
Э — эффективность дератизационного средства, %;
К — число заслеженных площадок на объекте до начала эксперимента, %;
1
К — число заслеженных площадок в конце эксперимента, %.
2
К и К определяют по формуле процента заслеженных площадок — К,
1 2
п. 7.2.
7.6.3. Критерии оценки биологической активности
и целевой эффективности дератизационных средств
в естественных местах обитания [23]
— для родентицидов острого действия
Поедаемость готовой формы родентицидов или
приготовленной стандартной отравленной приманки
мышами и крысами, % от общего к-ва приманки не менее 5
Появление трупов грызунов, сутки на 3
Снижение кол-ва заслеженных площадок или
относительной численности грызунов на 98%, сутки в течение 10
— для антикоагулянтов I поколения
Поедаемость готовой формы родентицидов или
приготовленной стандартной отравленной приманки
(кроме приманок для мышей на основе этилфенацина,
зоокумарина, куматетралила) мышами и крысами,
% от общего к-ва приманки не менее 15
Появление трупов грызунов, сутки на 10
Снижение кол-ва заслеженных площадок или
относительной численности грызунов на 98%, сутки в течение 40
Поедаемость готовой формы родентицидов или
приготовленной стандартной отравленной приманки
на основе этилфенацина, зоокумарина, куматетралила
мышами, % от общего к-ва приманки не менее 10
Появление трупов грызунов, сутки на 15
Снижение кол-ва заслеженных площадок или
относительной численности грызунов на 98%, сутки в течение 40
— для антикоагулянтов II поколения
Поедаемость готовой формы родентицидов или
приготовленной стандартной отравленной приманки
мышами и крысами, % от общего к-ва приманки не менее 10
Появление трупов грызунов, сутки на 10
Снижение кол-ва заслеженных площадок или
относительной численности грызунов на 98%, сутки в течение 28
— для готовых форм с витаминами D и D
2 3
Поедаемость готовой формы мышами
(% от общего к-ва приманки) не менее 10
крысами, % от общего к-ва приманки —
Появление трупов мышей, сутки на 5
Снижение кол-ва заслеженных площадок или
относительной численности грызунов на 98%, сутки в течение 28
— для липких родентицидных покрытий
Появление трупов грызунов, сутки на 15
Снижение кол-ва заслеженных площадок или
относительной численности грызунов на 98%, сутки в течение 40
— для давилок, живоловок, клейких масс и готовых клеевых ловушек
Снижение кол-ва заслеженных площадок или
относительной численности грызунов на 98%, сутки в течение 10
— для ультразвуковых отпугивающих излучателей
Снижение кол-ва заслеженных площадок или
относительной численности грызунов на 98%, сутки в течение
1 — 2 дней работы
излучателя
— для химических отпугивающих средств
Снижение кол-ва заслеженных площадок или
относительной численности грызунов на 98%, сутки в течение
1 — 2 суток
продолжительностью
не менее 5
7.7. Библиографические данные
1. Вашков В.И., Вишняков С.В., Полежаев В.Г. и др. Борьба с грызунами в городах и населенных пунктах сельской местности. М.: Медицина, 1974. 256 с.
2. Мешкова Н.Н., Шутова М.И. Особенности психической деятельности серой крысы. АН СССР, М., 1990. С. 11 — 87.
3. Башенина Н.В. Руководство по содержанию и разведению в лабораторной практике мелких видов грызунов. М.: Изд. МГУ, 1975. 161 с.
4. Покровский А.В., Большаков В.Н. Экспериментальная экология полевок. М.: Наука, 1979. 148 с.
5. Западнюк И.П., Западнюк В.И., Захария Е.А. Лабораторные животные. Разведение, содержание, использование в эксперименте. 2-е изд. Киев: Вища школа, 1974. 304 с.
6. Петрухин И.В., Петрухин Н.И. Кормление домашних и декоративных животных. М.: Нива России, 1992. 336 с.
7. Шутова М.И. Питание//В сб.: Серая крыса. Систематика, экология, регуляция численности. М.: Наука, 1990. С. 144 — 161.
8. Методические рекомендации по оценке эффективности, токсичности и опасности родентицидов N 01-19/127-17 М., 1995.
9. Полежаев В.Г. Фосфид цинка как препарат, отпугивающий грызунов. Тр. центр, я.-и. дезинф. ин-та, Вып. 14. 1961. С. 275 — 278.
10. Прозоровский В.Б. Использование метода наименьших квадратов для пробит-анализа кривых летальности//Фармакология и токсикология. N 1. 1962. С. 115 — 118.
11. Рокицкий П.Ф. Основы вариационной статистики для биологов. Минск: Изд-во Белгосуниверситета, 1961. 224 с.
12. Урбах В.Ю. Биометрические методы. М.: Наука, 1964. 415 с.
13. Guidelines for the biological evaluation of rodenticides. Laboratory and field tests for the evaluation of rodenticidal dusts. Bull. OEPP, 1986, vol. 16, N 1. С. 97 — 209.
14. Misslin R., Ropart P. Responses in mice to a novel objects. Benaviour, vol. 78, N 314. 1981. С. 169 — 177.
15. Сизова Г.И., Леви М.И.//Дезинфекционное дело. 1994. N 2. С. 16.
16. Калинин А.А., Шутова М.И. Разработка оптимальных концентраций ратицидов и пищевой приманки для борьбы с черными крысами//В сб.: Основные направления дезинфекционного дела. М., 1987. С. 99 — 102.
17. Мешкова Н.Н., Котенкова Е.В., Лялюхина С.И. Поведение домовой (Mus museums) и курганчиковой (Mus bortulanus) мышей при освоении нового пространства//Зоол. ж., Т. 65. N 1. 1986. С. 123 — 133.
18. Шутова М.И., Калинин А.А., Жабина Е.В. 1986. Влияние концентрации дифенацина на поедаемость пищевой приманки крысами/В сб.: Вопросы дезинфекции и стерилизации М., С. 157 — 161.
19. Бочаров Е.В., Крючков Т.П. Репеллентные методы защиты материалов от крыс//В сб.: Серая крыса. М.: Наука, 1990. С. 390 — 395.
20. Инструкция по борьбе с мышевидными грызунами. Утв. МЗ СССР. Саратов, 1973.
21. Хляп Л.А., Маликова А.Ш. Оценка численности и распределения домовой мыши в помещениях методом следовых площадок//В сб.: Синантропия грызунов и ограничение их численности. М.: РАН, 1992, С. 256 — 264 с.
22. СП 3.5.3.1129-02 «Санитарно-эпидемиологические требования к проведению дератизации». М.: МЗ России, 2002.
23. Методические рекомендации по полевой дератизации и дезинсекции в очагах чумы сусликового типа Российской Федерации. Утв. Зам. Предс. Госсанэпиднадзора РФ Г.Г. Онищенко 24 декабря 1995 г. Саратов, 1995.
24. Правила по охране труда работников дезинфекционного дела и по содержанию дезинфекционных станций, дезинфекционных отделов, отделов профилактической дезинфекции санитарно-эпидемиологических станций, отдельных дезинфекционных установок. Утв. Приказом МЗ СССР N 1963-79 от 09.02.1979. М., 1979.
25. Камуз Ю.П. Пособие по охране труда и технике безопасности при проведении дезинфекционных мероприятий. М.: Изд. АО «Росагросервис», 1993. 128 с.
8. Методы исследования и критерии оценки токсичности
и опасности дезинфекционных средств
8.1. Общие требования к организации и проведению
токсикологических исследований
дезинфекционных средств
Токсикологическое изучение дезинфекционных средств имеет целью научные обоснования мер по обеспечению безопасности людей при осуществлении дезинфекционной деятельности, включая условия производства и реализации ДС, технологию проведения дезмероприятий, средства индивидуальной и коллективной защиты и др.
В связи с планом токсикологических исследований должно быть предусмотрено решение следующих вопросов:
1) принципиальная возможность (или недопустимость по соображениям безопасности) применения данного препарата в дезинфекционной практике;
2) возможные сферы его безопасного применения (объекты обработки), контингенты контактирующего населения;
3) безопасные для людей режимы эффективного в целевом отношении применения препарата (концентрации рабочих растворов, нормы расхода препарата, экспозиции, средства защиты персонала, меры охраны окружающей среды и населения т.п.).
Для оценки безопасности дезинфекционных средств и разработки гигиенических рекомендаций по их применению необходимы, прежде всего, следующие сведения:
— состав средства, структурная формула действующего вещества (субстанции) и его физико-химические свойства; молекулярная масса; плотность, летучесть, температура кипения или плавления, стойкость в естественных условиях, растворимость в воде и жирах и др.;
— степень чистоты: при наличии примесей в сырье необходимо знать их состав и количественное содержание;
— характеристика вспомогательных компонентов рецептуры;
— назначение средства;
— нормы расхода и рабочие концентрации, способы и кратность обработки соответствующих объектов.
Исходными данными для организации токсикологического изучения дезинфекционных средств должны служить литературные материалы о токсичности и опасности входящих в их состав активно действующих веществ.
Токсикологическая характеристика действующих веществ (далее — ДВ или субстанций) должна включать сведения по следующим параметрам токсикометрии при потенциально опасных путях поступления в организм и по оценке общетоксических, специфических и отдаленных эффектов:
— острая токсичность (ЛД ) при введении в желудок;
50
— острая токсичность (ЛД ) при нанесении на кожу;
50
— острая токсичность (ЛС и порог острого действия) при ингаляционном
50
воздействии в насыщающих концентрациях паров;
— клиническая картина отравления;
— подострая токсичность (кумулятивные свойства);
— хроническая токсичность;
— сенсибилизирующее действие;
— местно-раздражающее действие на кожу и слизистые оболочки глаз;
— мутагенный эффект;
— эмбриотропное действие;
— тератогенное действие;
— гонадотропное действие и репродуктивная функция;
— онкогенность;
— метаболизм в организме млекопитающих.
Кроме того, необходимы сведения о гигиеническом нормировании соответствующих веществ:
— гигиенические нормативы — ПДК или ОБУВ в воздухе рабочей зоны, обеспечивающие безопасность работающих при производстве дезинфекционных субстанций или соответствующих ДС в России [56];
— гигиенические нормативы — ПДК (максимально разовые и среднесуточные) или ОБУВ (максимально разовые) в атмосферном воздухе для субстанций ДС, производимых в России, обеспечивающие безопасность в окружающей среде [60].
Программа изучения токсичности и опасности дезинфекционного средства составляется с учетом его назначения, состава (вида и свойств действующих и вспомогательных веществ), а также особенностей режимов применения, видов обрабатываемых объектов.
Изучение проводится по трехэтапной схеме.
I этап — сбор информации о действующих веществах и вспомогательных компонентах в составе дезинфекционного средства, первичная оценка его токсичности и опасности с определением лимитирующих параметров токсичности при потенциально опасных путях поступления в организм (в желудок, на кожу, на слизистые оболочки, через органы дыхания, парентерально).
II этап — экспериментальные исследования токсичности дезинфекционного средства в острых и подострых опытах при разных путях поступления в организм, исходя из назначения препарата, характера обрабатываемых объектов и режимов применения (нормы расхода, рабочие концентрации и экспозиции, способы обработки — протирание, орошение, погружение, замачивание, их кратности).
III этап — оценка степени опасности ДС на основе моделирования условий его применения с проведением санитарно-химического анализа воздуха в помещении.
После этого проводится анализ и обобщение всех полученных материалов, составляется токсикологическая характеристика дезинфицирующего средства, разрабатываются необходимые меры предосторожности, определяются безопасные условия его применения и меры первой помощи, которые включаются в соответствующие инструкции по применению.
При необходимости (новое, ранее не применявшееся действующее вещество, сложная многокомпонентная рецептура), помимо лабораторно-экспериментальных исследований, следует проводить практические испытания дезинфекционного средства.
В токсикологических экспериментах на III этапе проводят также санитарно-химические исследования:
— воздуха на содержание ДВ дезинфектантов в затравочных камерах при моделировании условий и способов обработки (протирание, погружение, орошение), при проведении натурного эксперимента, при практических испытаниях, соблюдая рекомендуемые условия, способы и нормы расхода;
— смывов с посуды, с изделий медицинского назначения ИМН и других обработанных объектов.
Применяемые при этом химико-аналитические методы определения содержания ДВ в воздухе или в смывах должны отвечать требованиям ГОСТ 12.1.007-76 в части обеспечения точности определения химических веществ на уровне 0,5 гигиенического норматива в воздухе рабочей зоны, 0,8 норматива для атмосферы населенных мест и 0,5 гигиенического норматива воды (водных объектов) хозяйственно-питьевого и культурно-бытового водопользования [47].
В полном объеме экспериментальные исследования токсичности должны проводиться в отношении новых ДВ субстанций. Для известных ранее и уже применяемых ДВ сбор информации по вышеуказанным параметрам проводится по данным литературы.
При изучении ДС разного назначения, наряду с изучением их токсичности на животных, должны проводиться биомедицинские исследования на людях-добровольцах. Цель этих исследований сводится к подтверждению или уточнению данных по безопасности ДС, выявлении видовых и индивидуальных особенностей реакций организма человека к действию ДС, проверке рекомендованных мер предосторожности для человека. Главным образом, это касается ДС непосредственно связанных с воздействием на организм человека (наносимых на кожу, одежду, волосы, в желудочно-кишечный тракт).
Исследования ДС на добровольцах должно проводиться в строгом соответствии с этическими принципами, сформулированными в Хельсинской декларации Всемирной медицинской ассоциации по проведению биомедицинских исследований на людях 1964 — 1996 гг.
Основные принципы Хельсинской декларации едины для врачей всего мира.
Основной этический принцип биомедицинских исследований состоит в уважении личности участника и соблюдении принципа «не навреди».
Для проведения конкретных биомедицинских исследований ДС с привлечением испытателей-добровольцев ответственный исполнитель должен составить «Протокол исследования», который должен быть передан в Комиссию по этике для его рассмотрения и вынесения решения. «Протокол исследования» должен учитывать этические принципы, сформулированные в Хельсинской декларации и в Директивах при проведении научных исследований на испытателях-добровольцах [8].
В «Протоколе исследования» излагается цель и программа изучения ДС на испытателях-добровольцах, используемые методы и ожидаемые результаты. Указанная информация доводится до сведения испытуемых.
Проводить испытания ДС на добровольцах должны квалифицированные специалисты с врачебным образованием или с участием врача.
Риск отрицательного воздействия ДС на испытуемых должен отсутствовать.
В связи с этим безопасность ДС для добровольцев, привлеченных в эксперимент, должна быть оценена заранее.
Заключение по безопасности испытаний ДС добровольцами должны давать токсикологи аккредитованных в этих целях лабораторий. Для новых и мало изученных ДС гарантии по безопасности испытываемых ДС должны быть получены с предварительным проведением экспериментов на животных.
Заключение может быть дано и по результатам уже зарегистрированных в нашей стране (или в других странах) аналогов с опытом их безопасного практического применения.
Основным требованием при проведении исследований на испытателях-добровольцах является отбор практически здоровых людей разного пола и возраста. Не допускается привлечение лиц моложе 18 лет и старше 65 лет, а также беременных и кормящих женщин.
В ходе проводимых исследований ДС испытатель-доброволец обязан сообщать ответственному исполнителю о своем самочувствии. И в случае нарушения здоровья — прекратить испытание средства.
От испытателя-добровольца в случае его согласия получают информированное согласие на участие в испытаниях — договор. Договор с испытателем-добровольцем заключается только с разрешения Комиссии по этике на проведение испытаний ДС на добровольцах при гарантии их безопасности, о чем сообщается испытателю. Согласие на испытания должно быть добровольным, причем за испытателем сохраняется право в любой момент отозвать свое согласие на испытания и их прервать.
При заключении с добровольцами договора их знакомят с «Протоколом испытаний» по апробации ДС.
С учетом вышеизложенного в составы дезинфекционных средств не должны входить субстанции, относящиеся к 1-му классу опасности при потенциально опасных путях поступления в организм [24], а также к 1-му и 2-му классу опасности — по отдаленным эффектам (мутагенный, эмбриотоксический, гонадотоксический и тератогенный, канцерогенный).
Для токсикологической оценки дезинфекционных средств разного назначения используются показатели опасности, в основу которых положены лимитирующие критерии вредности при потенциально опасных путях поступления в организм. При этом в связи с разным назначением дезинфекционных средств, различными видами их препаративных форм и разными условиями применения установлены дифференцированные лимитирующие критерии для дезинфицирующих средств, кожных антисептиков, для средств стерилизации и предстерилизационной очистки изделий медицинского назначения, средств для обеззараживания воды, дезинсекционных средств, педикулицидов, репеллентов и дератизационных средств.
Установление лимитирующих критериев для ДС предполагает использование принятых методов по определению основных параметров токсичности и опасности, а также проявлений общетоксических, специфических и отдаленных эффектов в соответствии с назначением и режимом применения.
Целью токсикологических исследований является определение характера воздействия ДС как химических веществ на биологические системы организма и получение количественных данных о зависимости «эффект — норма расхода» для данного средства. Такие данные свидетельствуют о степени потенциальной опасности ДС для человека при использовании конкретного средства. Они кладутся в основу классификации их опасности. Выбор наиболее информативных методов оценки токсичности ДС должен осуществляться при строгом соблюдении описываемой ниже трехэтапной схемы проведения эксперимента.
Условия токсикологического эксперимента при изучении ДС определяются их назначением, составом, формой и сферой применения. Эксперимент требует проведения исследований ДС при основных путях их поступления в организм (ингаляционном, в желудок, на кожу).
Методы оценки токсичности разных по назначению ДС при определении сходных параметров токсикометрии должны быть одинаковыми. Каждый из них требует использования группы животных, содержащихся в соответствующих условиях под воздействием градированных доз концентраций исследуемого средства в условиях острого, подострого или хронического эксперимента. Для этих целей используются основные виды половозрелых лабораторных животных: белые крысы, мыши, морские свинки и кролики, которые должны быть здоровыми, генетически устойчивыми, получены из одного питомника.
Исследования выполняются на равноценных по численности опытных и контрольных группах животных обоего пола.
В ходе испытаний необходимо тщательно следить за проявлением у животных симптомов интоксикации. По завершении исследований подопытные животные, в т.ч. и контрольные, подлежат патоморфологическим исследованиям. Выбор животных для токсикологических экспериментов предполагает максимальное сходство моделируемого на них процесса с наблюдаемым у человека. Чтобы с большей степенью достоверности экстраполировать на человека данные, получаемые в эксперименте на животных, исследования желательно проводить на нескольких видах животных (обязательным видом являются крысы) в статистически достаточных группах (но не менее 8 — 10 особей для мелких лабораторных животных и не менее 3 — 6 — для крупных: кролики, морские свинки). Срок наблюдения за животными после острого воздействия — 2 недели, после подострого и хронического — месяц.
При отборе животных в эксперимент должен соблюдаться метод случайной выборки. Подопытные животные должны быть одной линии, вида, возраста, пола, весовых характеристик (масса мышей — 16 — 30 г; крыс — 180 — 350 г; морских свинок — 200 — 400 г; кроликов — 2 — 3 кг). Максимальная разница в весе тела животных не должна составлять более 10%. Животные должны быть здоровыми, что подтверждается предварительными наблюдениями за ними в условиях карантина. Перед экспериментом необходимо снять фоновые характеристики по основным показателям (масса тела, состояние нервной системы, общий анализ крови) и отбраковать нестандартных животных. Пищевой рацион животных должен содержать все необходимые компоненты для их нормальной жизнедеятельности. Животные при их содержании в виварии должны иметь свободный доступ к воде и пище.
В виварии необходимо контролировать содержание аммиака в воздухе (не более 0,2 мг/куб. м), температуру и влажность воздуха.
Изучение ингаляционного влияния ДС проводится в затравочных камерах (0,5 — 1,0 — 2,0 куб. м) специальной конструкции с созданием в них статического режима воздействия средств в виде паров или аэрозоля. Экспозиция и уровни воздействия должны согласовываться условиями применения ДС.
Затравки через рот проводятся общепринятым способом с регламентированным количеством вводимого средства в зависимости от вида животных.
Изучение влияния ДС на кожу проводится на двух видах экспериментальных животных (кролики и морские свинки). Используются кролики-альбиносы или породы «шиншилла», а также морские свинки светлой масти. Размер участка аппликации для кроликов — 7 x 8 см, для морских свинок — 5 x 5 см.
Для опыта пригодны животные с чистой здоровой кожей. За 1 — 2 дня до эксперимента тщательно выстригается шерсть на симметричных участках спины (применение депилятора недопустимо!), по обе стороны от позвоночника, с оставлением шерстного покрова между ними в 2 см. Один бок служит для аппликации изучаемого вещества, другой — для контроля.
На время экспозиции животных фиксируют для исключения слизывания продукта с кожи. С этой целью для кроликов применяют специальные станки или полужесткие «воротники». Морских свинок помещают в индивидуальные домики. Исследуемое средство наносится на кожу в нативном виде из расчета 20 мг/кв. см. Экспозиция должна составлять 4 ч. Время наблюдения после однократной аппликации средства — 2 недели.
В случае невозможности нанесения вещества в чистом виде или при наличии выраженного раздражающего действия его применяют в разведенном виде. В качестве растворителя или разбавителя средства следует использовать дистиллированную воду или модельную среду, имитирующую пот. Средство наносят на поверхность кожи при температуре окружающей среды 18 — 24 °C. Для летучих веществ (температура кипения до 160 °C) следует использовать закрытый способ: компресс, наклейка капсул или часовых стекол и др. На контрольный участок кожи животного наносят чистый растворитель или разбавитель.
Выбор оцениваемых показателей интоксикации должен осуществляться с учетом данных литературы о механизме действия и токсикокинетике изучаемого средства субстанции и результатов предшествующего острого и подострого экспериментов.
Следует использовать комплекс физиологических, биохимических и морфологических, а также токсико-кинетических и других показателей, связанных с типом действия яда. В выборе физиологических, биохимических и морфологических показателей следует исходить из направленности действия средств. Необходимо применение интегральных тестов, отражающих общее состояние организма (динамику массы и температуры тела, потребления пищи и воды, работоспособности, потребления кислорода, поведенческих реакций, иммунобиологической реактивности и др.). Если механизм действия яда известен заранее, целесообразно контролировать и специфические показатели на уровне систем, тканей и субклеточных структур.
С учетом вышесказанного при оценке токсичности и опасности дезинфицирующих субстанций и средств в качестве обязательных показателей необходимо определять динамику:
— изменений массы тела;
— работоспособности;
— функционального состояния нервной, сердечно-сосудистой и дыхательной системы;
— состава периферической крови;
— функций печени и почек.
В качестве дополнительных показателей целесообразно использовать данные исследований состояния эндокринной системы, иммунологической реактивности организма подопытных животных и др.
В завершение исследований на животных должны проводиться морфологические исследования с оценкой коэффициентов массы внутренних органов.
Исследование ряда показателей может проводиться на одной и той же группе животных, учитывая при этом возможность влияния одного теста на результаты другого. В случае экстремальных нагрузок использованные группы животных выводятся из опыта.
Оценка состояния подопытных животных в течение подострого и хронического экспериментов проводится также в динамике. До начала опыта проводится обследование животных по выбранным показателям.
По окончании эксперимента часть подопытных и контрольных животных забивается, а на оставшихся в живых прослеживается восстановительный период в течение месяца. Этот срок достаточен для обычных исследований, но в случае подозрений на возможность отдаленных эффектов он пролонгируется.
Так как преобладающая часть ДС представляет собой композиционные составы, оценка их комбинированного действия проводится по ведущему компоненту.
Наряду с изучением токсичности ДС в условиях эксперимента на животных иногда необходимо подтверждение их безопасности в реальных условиях применения, т.е. оценка степени риска.
Результаты всех токсикологических экспериментов должны подвергаться статистической обработке принятыми методами (t-критерий Стьюдента, критерий 2, непараметрические критерии). Оценка результатов основывается, в первую очередь, на данных, полученных на группе наиболее чувствительных животных. Для признания неблагоприятными выявленных изменений принимается их выход за пределы 1,5 — 2,0 физиологических колебаний с учетом характера показателя.
8.2. Методы изучения токсичности и опасности микробоцидных
дезинфицирующих средств
Различные дезинфицирующие средства по своему назначению могут иметь широкую сферу применения: в лечебно-профилактических, детских учреждениях, на объектах коммунального хозяйства, на предприятиях общественного питания, в очагах инфекционных заболеваний, населением в быту, на предприятиях пищевой промышленности (пивобезалкогольной и винодельческой, мясо-молочной, рыбоперерабатывающей, хлебопекарной и кондитерской), для обеззараживания транспортных средств (санитарного транспорта, перевозки пищевых продуктов), воды в плавательных бассейнах, а также питьевой воды при нецентрализованном водоснабжении.
Программа изучения токсичности и опасности дезинфицирующих средств определяется конкретным его назначением, составом, видом и свойствами действующих веществ, режимами применения (нормой расхода, рабочими концентрациями, способами обработки), видами обрабатываемых объектов и проводится по следующей трехэтапной методической схеме, рис. 8.1 — 8.3.
┌─────────────────┐
│ I этап: │
┌───────────────┤ первичная ├────────────────────┐
│ │токсикологическая│ │
│ │ оценка │ │
│ └────────┬────────┘ │
/ / /
┌─────────────────────┐ ┌───────────┐ ┌─────────────┐
│Сбор информации о ДВ │ │ Параметры │ │Специфические│
│ и вспомогательных │ │ острой │ │и отдаленные │
│ веществах │ │токсичности│ │ эффекты │
│(сведения литературы)│ └─────┬─────┘ └──────┬──────┘
└────┬────────────────┘ │ │
/ / /
┌────────┐ ┌─────────────────────────┐ ┌──────────────┐
│ Состав │ │ЛД в желудок, на кожу, │ │Сенсибилизация│
│средства│ │ 50 │ │ (скрининг) │
└────┬───┘ │парентерально (в/бр, в/в)│ └───────┬──────┘
│ └───────────┬─────────────┘ │
/ / /
┌───────────────────┐ ┌──────────────────────┐ ┌──────────┐
│ Физико-химические │ │Ингаляция в насыщающей│ │Мутагенное│
│свойства соединений│ │ концентрации (C ) │ │ действие │
└────┬──────────────┘ │ 20 │ │(скрининг)│
│ └──────────┬───────────┘ └───┬──────┘
│ / │
│ ┌────────────────────────────┐ │
│ │Местно-раздражающее действие│ │
│ │ (кожа, глаза) │ │
│ └──────────────┬─────────────┘ │
│ / │
│ ┌─────┐ │
└───────────────────────────>│Отбор│<─────────────────────────┘
└─────┘
Рис. 8.1. Методическая схема оценки токсичности и опасности
дезинфицирующих средств
┌──────────────────┐
│ II этап: │
┌─────────────────────┤ углубленная ├──────────────┐
│ │оценка токсичности│ │
│ └─────────┬────────┘ │
/ / /
┌─────────┐ ┌───────────────────────────┐ ┌─────────────────────────────┐
│Кумуляция│ │Кожно-резорбтивное действие│ │Местно-раздражающее действие │
└┬────────┘ └────────┬──────────────────┘ │ рабочих растворов │
│ │ │ (однократно, повторно) │
│ │ └───────────────────────────┬─┘
│ ┌──────┘ │
│ │ ┌──────────────────────┐ ┌──────────────┐ │
│ │ │ Ингаляционное ├────>│Сенсибилизация│ │
│ │ │ действие (Lim │<────┤(комплексная) │ │
│ │ │ ac.sp │ └──────────────┘ │
│ │ │ по лимитирующему │ │
│ │ │показателю в сравнении│ │
│ │ │ с нормой расхода) │ │
│ │ └┬─────────────────────┘ │
│ │ │ ┌─────────────────────────┐ │
│ │ │ │ Отдаленные эффекты │ │
│ │ │ │ (мутагенное действие │ │
│ │ │ │по результатам скрининга)│ │
│ │ │ └───────────────────────┬─┘ │
│ │ │ ┌───────────────────────────────┐ │ │
│ │ │ │Остаточные количества средства │ │ │
│ │ │ │ на обработанных изделиях │ │ │
│ │ │ │ медицинского назначения (ИМН)│ │ │
│ │ │ └──┬───────┬─────────────┬──────┘ │ │
│ │ │ / / / │ │
│ │ │ ┌─────┐┌────────┐┌──────────────┐ │ │
│ │ │ │ ЦТД ││Пироген-││Гемолитическое│ │ │
│ │ │ │в ККЛ││ность ││ действие │ │ │
│ │ │ └─────┘└────────┘└──────────────┘ │ │
│ │ │ │ │
│ │ │ ┌─────────┐ │ │
│ │ └────────────>│ Классы │<──────────────────┘ │
│ └───────────────>│опасности│<────────────────────────────┘
└─────────────────────────────>└─────────┘
Рис. 8.2. Методическая схема оценки токсичности и опасности
дезинфицирующих средств
┌────────────────────────────┐
│ III этап: │
│ испытание дезинфицирующего │
│средства в натурных условиях│
└────────────────────────────┘
┌─────────────────────────────────────────┐ ┌────────────────────┐
│Оценка реальной опасности — моделирование│ │Химико-аналитические│
│условий применения (протирание, орошение,│<─────────┤ исследования │
│ погружение), натурный эксперимент │ └────────────────────┘
└─────────────────┬───────────────────────┘
│ ┌─────────────────────────────────────────┐
│ │Разработка мер предосторожности и условий│
└────────────>│ применения дезинфицирующих средств │
└─────────────────────────────────────────┘
┌────────────────────────────────────────┐
┌──────────────┤ Практические испытания │
/ └────┬───────────────────────────────────┘
┌─────────────────────────────┐ │ ┌─────────────────────────────┐
│Анкетно-статистическая оценка│ └────>│Санитарно-химический контроль│
└─────────────────────────────┘ └─────────────────────────────┘
Рис. 8.3. Методическая схема оценки токсичности и опасности
дезинфицирующих средств
8.2.1. Перечень необходимых показателей токсичности
и опасности дезинфицирующих средств
Перечень определяемых и оцениваемых показателей токсичности и опасности дезинфицирующих средств, предназначаемых для медицинской дезинфекции в лечебно-профилактических учреждениях: изделий медицинского назначения, поверхностей, посуды, белья, игрушек, санитарно-технического оборудования, предметов ухода за больными, а также для дезинфекции поверхностей в коммунальном хозяйстве, технологического оборудования и тары на предприятиях пищевой промышленности и т.п.
8.2.1.1. Литературные данные по токсикологической характеристике ДВ, а также всех других компонентов состава дезинфицирующего средства, включая вспомогательные: наполнители, стабилизаторы, антикоррозионные добавки, отдушки, красители и т.д.
8.2.1.2. Экспериментальные данные:
— Параметры острой токсичности дезинфицирующего средства (ЛД ):
50
при введении в желудок;
при нанесении на кожу;
при внутрибрюшинном введении.
— Оценка острой ингаляционной опасности дезинфицирующего средства и его рабочих растворов в насыщающих концентрациях паров.
— Оценка местно-раздражающего действия на кожу самого дезинфицирующего средства и его рабочих растворов при однократном, а рабочих растворов дезинфицирующего средства также и при многократном нанесении на кожу.
— Оценка местно-раздражающего действия на глаза самого дезинфицирующего средства и его рабочих растворов при однократном нанесении.
— Оценка кожно-резорбтивного действия рабочих растворов дезинфицирующего средства.
— Кумулятивный эффект дезинфицирующего средства экспресс-методом (метод Лима).
— Оценка сенсибилизирующего действия ДС (комплексом методов).
— Экспериментальные данные ингаляционной опасности рабочих растворов ДС в режимах применения: орошение, протирание. Определение порогов острого и подострого токсического действия при разных способах обработки поверхностей с расчетом зоны биоцидного действия. Оценка безопасности применения по классификации степени ингаляционной опасности дезинфицирующих средств.
— Обоснование безопасности остаточных количеств дезинфицирующего средства на обработанных поверхностях: посуде, изделиях медицинского назначения из разных материалов, отработка режимов их отмыва чистой водой.
8.2.1.3. Исследование реальной опасности при моделировании условий применения (орошение, протирание, погружение) с учетом ингаляционного воздействия и при возможности кожного пути поступления.
8.2.1.4. Комплексная токсикологическая характеристика дезинфицирующего средства, разработка мер предосторожности при работе и хранении, первая помощь при отравлении для включения соответствующих требований в инструкцию по применению и в текст этикетки.
8.2.2. Методы определения и оценки токсичности и опасности
дезинфицирующих средств
8.2.2.1. Определение и оценка среднесмертельной дозы (ЛД ) при
50
введении в желудок.
Среднесмертельная доза (ЛД ) дезинфицирующего средства определяется
50
на двух видах лабораторных животных (крысы и мыши). Выбирают 4 — 6 доз для
получения данных кривой «доза — эффект». Начальная доза не должна вызывать
эффекта у животных. Последующие дозы повышают с постоянной кратностью
величины, пока доза вводимого вещества не вызовет гибель всех животных.
Средство вводится в желудок животным натощак через зонд в нативном виде, в
виде раствора в воде или в индифферентном растворителе, в виде эмульсий или
суспензий в крахмале.
Вводимый объем в желудок для мышей не должен превышать 1 мл; для крыс — 5 мл. Кормление животных возобновляется через 3 ч после введения средства. У животных ежедневно в течение 21 дня регистрируют клиническую картину отравления и сроки гибели. При вскрытии погибших животных описывают макроморфологические изменения в органах.
При необходимости проводится гистопатологическое исследование органов.
При условии экспертной оценки известных соединений или композиций
допускается определение ЛД ускоренным методом «одной точки» по Ван Дер
50
Вардену.
Расчет определяемого параметра проводится статистическими методами, принятыми для обработки экспериментально-токсикологических исследований (например, методы Кербера или пробит-анализа) [69]. Класс опасности определяется по классификации (ГОСТ 12.1.007-76) (табл. 8.1) [24].
Таблица 8.1
КЛАССИФИКАЦИЯ ОПАСНОСТИ ВЕЩЕСТВ ПО СТЕПЕНИ ВОЗДЕЙСТВИЯ
НА ОРГАНИЗМ (ГОСТ 12.1.007-76) [24]
┌───────────────────────────────┬─────────────────────────────────────────┐
│ Наименование показателя │ Класс опасности │
│ ├─────────┬─────────┬──────────┬──────────┤
│ │1 — │2 — │3- │4 — │
│ │чрезвы- │высоко- │умеренно │мало- │
│ │чайно │опасные │опасные │опасные │
│ │опасные │ │ │ │
├───────────────────────────────┼─────────┼─────────┼──────────┼──────────┤
│Предельно допустимая концент- │Менее 0,1│0,1 — 1,0│1,1 — 10,0│Более 10,0│
│рация ПДК вредных веществ в │ │ │ │ │
│воздухе рабочей зоны, мг/куб. м│ │ │ │ │
├───────────────────────────────┼─────────┼─────────┼──────────┼──────────┤
│Среднесмертельная доза (ЛД ) │Менее 15 │15 — 150 │151 — 5000│Более 5000│
│ 50 │ │ │ │ │
│при введении в желудок, мг/кг │ │ │ │ │
├───────────────────────────────┼─────────┼─────────┼──────────┼──────────┤
│Среднесмертельная доза (ЛД ) │Менее 100│100 — 500│501 — 2500│Более 2500│
│ 50 │ │ │ │ │
│при нанесении на кожу, мг/кг │ │ │ │ │
└───────────────────────────────┴─────────┴─────────┴──────────┴──────────┘
8.2.2.2. Определение и оценка среднесмертельной дозы (ЛД ) при
50
нанесении на неповрежденную кожу.
Среднесмертельная доза изучаемого средства при нанесении на неповрежденные кожные покровы определяется на белых крысах или белых мышах путем однократного нанесения на кожу спины после предварительного (за 1 сутки до опыта) удаления волосяного покрова (без использования депиляторных средств). Средство наносят в чистом виде или в разведении в 4 — 5 дозах. Площадь кожи на спине крыс 4 x 4 см, а мышей — 2 x 2 см. Экспозиция — 4 ч. У животных регистрируют клинические проявления интоксикации и сроки гибели, при вскрытии описывают макроморфологические изменения во внутренних органах.
Наблюдение за состоянием животных и регистрация гибели животных проводится ежедневно в течение 21 дня.
Расчет ЛД проводится статистическими методами, принятыми для обработки данных экспериментально-токсикологических исследований. Класс опасности определяют по классификации ГОСТ 12.1.007-76, табл. 8.1.
8.2.2.3. Определение и оценка среднесмертельной дозы при введении в брюшную полость.
Определение среднесмертельной дозы (ЛД ) при однократном введении в
50
брюшную полость проводят для средств дезинфекции, стерилизации и
предстерилизационной очистки изделий медицинского назначения,
контактирующих с внутренней средой организма. Исследования выполняются на
мышах или крысах с использованием 4 — 6 доз с постоянной кратностью
величин, определяя недействующую дозу и дозу со 100%-ной гибелью животных.
Максимальный вводимый объем раствора для мышей составляет 0,5 мл, для крыс
— 1 — 1,5 мл. После введения у животных описывают клиническую картину
интоксикации и регистрируют гибель при наблюдении в течение 14 дней.
Погибших животных вскрывают и проводят макроскопические исследования
внутренних органов.
Расчеты определяемого параметра проводятся статистическими методами: методы Кербера или пробит-анализа [69].
Полученные результаты оценивают по классификации токсичности веществ при введении под кожу и в брюшную полость животного (по К.К. Сидорову) (табл. 8.2) [69].
Таблица 8.2
КЛАССИФИКАЦИЯ ТОКСИЧНОСТИ ВЕЩЕСТВ ПРИ ВВЕДЕНИИ ПОД КОЖУ
И В БРЮШНУЮ ПОЛОСТЬ ЖИВОТНОГО (ПО К.К. СИДОРОВУ) [69]
|
Класс токсичности |
Степень токсичности |
Средняя смертельная доза при введении, мг/кг: |
|
|
под кожу |
в брюшную полость |
||
|
1 |
Чрезвычайно токсично |
0,3 |
0,2 |
|
2 |
Высокотоксично |
0,4 — 15,0 |
0,3 — 10,0 |
|
3 |
Умеренно токсично |
16 — 150 |
11 — 100 |
|
4 |
Малотоксично |
151 — 1500 |
101 — 1000 |
|
5 |
Практически нетоксично |
1501 — 4500 |
1001 — 3000 |
|
6 |
Относительно безвредно |
> 4500 |
> 3000 |
8.2.2.4. Определение и оценка ингаляционной опасности дезинфицирующих средств по степени их летучести.
Определение острой ингаляционной опасности дезинфицирующих средств в насыщающих концентрациях их паров осуществляют в герметичных емкостях (эксикаторы, камеры), где создаются условия свободного испарения средства в течение суток. Исследования проводятся на белых мышах или крысах из расчета потребляемого объема воздуха на одно животное в час (2 л на мышь и 5 — 7 л на крысу). Экспозиция — 2 — 4 ч соответственно.
В ходе эксперимента регистрируют клиническую картину отравления и гибель животных при наблюдении в течение 14 дней. После окончания воздействия животных целесообразно обследовать по показателям общетоксических или специфических изменений. Опасность ингаляционного отравления дезинфицирующим средством характеризуется степенью проявления интоксикации и оценивается по соответствующей классификации химических веществ (табл. 8.3) [69].
Таблица 8.3
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ВЕЩЕСТВ ПО СТЕПЕНИ ЛЕТУЧЕСТИ (C ) [69]
20
|
Класс опасности |
Степень опасности и выраженность действия |
|
1 Чрезвычайно опасное вещество |
Насыщающая концентрация вызывает гибель |
|
2 Высокоопасное |
Насыщающая концентрация вызывает отчетливые проявления интоксикации, гибель отсутствует |
|
3 Умеренно опасное |
Насыщающая концентрация вызывает минимальные изменения интегральных показателей при обследовании животных (пороговый уровень) |
|
4 Малоопасное |
Насыщающая концентрация не оказывает токсического действия |
8.2.2.5. Определение и оценка кумулятивных свойств.
Под кумуляцией понимается усиление проявления действия яда при его повторном воздействии.
Выраженность кумулятивных свойств дезинфицирующих средств оценивается по величине коэффициента кумуляции — отношение величины суммарной дозы яда, вызывающей определенный эффект (чаще — смертельный) у 50% подопытных животных при многократном дробном введении, к величине дозы, вызывающей эффект при однократном воздействии.
Изучение кумулятивных свойств дезинфицирующих средств проводится
методом Лима [69] в течение 24 +/- 4 дней при введении в желудок крыс или
мышей. Начальная доза составляет 0,1 ЛД и вводится 4 дня, затем дозу
50
каждый раз увеличивают в 1,5 раза до окончания опыта. В течение всего
эксперимента регистрируется гибель животных. В конце рассчитывается
среднелетальная доза для повторного воздействия (ЛД ):
n
50
ЛД
n
50
K = ——.
кум ЛД
1
50
Расчет ЛД и ЛД проводится вышеупомянутым методом Кербера или
1 n
50 50
пробит-анализа [24; 69].
Если для изучаемого дезинфицирующего средства не удается получить смертельного эффекта, оценку кумулятивных свойств проводят с введением максимально возможной дозы в течение 10 дней. Показателем кумулятивного эффекта препарата (кроме смертельного) являются клиническая картина отравления и изменения различных показателей состояния организма (функциональная кумуляция).
Кроме указанных методов оценки кумулятивного эффекта можно рекомендовать другие методы: метод Ю.С. Кагана, метод Т.Н. Паньшиной и др.
Согласно классификации пестицидов различают 4 класса кумулятивного эффекта:
1 класс — сверхкумуляция — K менее 1;
кум
2 класс — выраженная кумуляция — K от 1 до 3;
кум
3 класс — умеренная кумуляция — K от 3,1 до 5;
кум
4 класс — слабая кумуляция — K более 5.
кум
8.2.2.6. Определение и оценка местно-раздражающего действия на кожу.
Исследования проводят не менее чем на двух видах животных. В качестве подопытных животных используются кролики породы шиншилла (обязательно), а также морские свинки светлой масти или белые крысы (по выбору). Правый бок служит для аппликации изучаемого средства, левый — для контроля.
При однократных аппликациях проводят изучение местного раздражающего действия средства в нативном виде и в виде рабочих концентраций.
Время экспозиции — 2 ч, после опыта средство смывают водой. Состояние кожи регистрируется визуально ежедневно в течение 14 дней. Отмечают функционально-морфологические нарушения кожи (эритема, отек, трещины, некроз, шелушение, сухость, изъязвления) (табл. 8.4) [69].
Таблица 8.4
ОЦЕНКА ИНТЕНСИВНОСТИ МЕСТНО-РАЗДРАЖАЮЩЕГО ДЕЙСТВИЯ
ХИМИЧЕСКИХ ВЕЩЕСТВ НА КОЖУ
Оценка степени эритемы
|
Интенсивность эритемы визуально |
Оценка эритемы по линейке С.В. Суворова, баллы |
|
Отсутствие эритемы |
0 |
|
Слабая, розовый тон |
1 |
|
Умеренно выраженная, розово-красный тон |
2 |
|
Выраженная, красный тон |
3 |
|
Резко выраженная, ярко-красный тон |
4 |
Оценка интенсивности отека кожи
|
Степень интенсивности отека |
Увеличение толщины кожной складки, мм |
Оценка отека, баллы |
|
|
кролики |
морские свинки |
||
|
Отсутствие |
0 |
0 |
0 |
|
Слабая |
До 0,5 |
До 0,3 |
1 |
|
Умеренная |
0,6 — 1,0 |
0,4 — 0,6 |
2 |
|
Выраженная |
1,1 — 2,0 |
0,7 — 1,0 |
3 |
|
Резко выраженная |
Более 2,0 |
Более 1,0 |
4 |
Выраженность эритемы оценивается в баллах по классификации С.В. Суворова, табл. 8.4.
Объективным методом оценки отека кожи служит измерение толщины кожной складки (в мм) при помощи инженерного микрометра и переводится в баллы, табл. 8.4.
Баллы по эритеме и отеку суммируются для каждого подопытного животного, после чего вычисляется средний суммарный балл для данной группы экспериментальных животных.
Выраженность местно-раздражающего действия испытуемого дезинфицирующего средства при однократной аппликации на кожу оценивается в соответствии с классификацией (табл. 8.5) [69].
Таблица 8.5
КЛАССИФИКАЦИЯ ОПАСНОСТИ ПО ВЫРАЖЕННОСТИ МЕСТНО-РАЗДРАЖАЮЩИХ
СВОЙСТВ ДЕЗИНФИЦИРУЮЩИХ СРЕДСТВ НА КОЖЕ
|
Выраженность раздражающего действия |
Средний суммарный балл выраженности эритемы и величины отека |
Классы опасности |
|
Резко выраженное |
Более 6 |
1 |
|
Выраженное |
4,1 — 6,0 |
2 |
|
Умеренное |
2,1 — 4,0 |
3 |
|
Слабое или отсутствие |
0 — 2,0 |
4 |
При многократном нанесении (10 — 12 аппликаций) в зависимости от назначения средства качественно оценивают степень кожной реакции (эритема, отек, трещины, шелушение, сухость и т.д.) и регистрируют время ее возникновения.
8.2.2.7. Определение и оценка местно-раздражающего действия на глаза.
Местно-раздражающее действие средства на глаза проводят на кроликах и морских свинках при однократном воздействии. Один глаз служит для нанесения средства, другой — в качестве контроля. Твердые средства вносят в конъюнктивальный мешок в количестве 50 мг (дисперсность частиц до 10 мкм), жидкие — в нативном виде и рабочих концентрациях в количестве 1 — 2 капли. Изучение влияния аэрозольного состава на слизистую оболочку глаза проводят однократно. С расстояния 20 см глаз кролика орошают из аэрозольного баллона в течение 1 с. Другой глаз является контролем.
Отмечают выраженность гиперемии и отека конъюнктивы, инъекцию сосудов склеры, состояние роговицы и радужной оболочки, количество и качество выделений из глаза, которые оценивают в баллах, табл. 8.6 [69].
Таблица 8.6
ОЦЕНКА ИНТЕНСИВНОСТИ МЕСТНО-РАЗДРАЖАЮЩЕГО ДЕЙСТВИЯ
СРЕДСТВА НА ГЛАЗА
|
Признаки местно-раздражающего действия |
Оценка, баллы |
|
|
А Покраснение века и бульбарная конъюнктива, не затрагивающая роговицу и радужную оболочку |
||
|
Состояние сосудов нормальное |
0 |
|
|
Сосуды явно расширены больше нормы |
1 |
|
|
Разлитая гиперемия, отдельные сосуды трудноразличимы |
2 |
|
|
Диффузная, ярко-красного цвета гиперемия |
3 |
|
|
Б Отек век |
||
|
Отека нет |
0 |
|
|
Слабый отек, включая мигательную перепонку |
1 |
|
|
Явный отек и частичное выворачивание века |
2 |
|
|
Отек, веки наполовину закрылись |
3 |
|
|
Отек, веки закрыты более чем наполовину или полностью закрылись |
4 |
|
|
В Выделения |
||
|
Выделений нет |
0 |
|
|
Минимальное количество в углу глазной щели |
1 |
|
|
Количество выделений с увлажнением век и шерсти, прилегающей к векам |
2 |
|
|
Количество выделений с увлажнением век и шерсти и значительной площади вокруг глаз |
3 |
|
|
Сумма баллов А + Б + В |
||
|
А Помутнение роговицы — степень плотности, участок наибольшей плотности |
||
|
Помутнения нет |
0 |
|
|
Рассеянное или диффузное, детали радужной оболочки хорошо видны |
1 |
|
|
Хорошо различимые полупрозрачные участки, детали радужной оболочки слегка замутнены |
2 |
|
|
Участок с замутнением, детали радужной оболочки не видны, размер зрачка едва различим |
3 |
|
|
Непрозрачная, радужная оболочка не видна |
4 |
|
|
Б Площадь поражения роговицы |
||
|
Одна четверть или менее, но более нуля |
1 |
|
|
Более одной четверти, но менее половины |
2 |
|
|
Более половины, но менее трех четвертей |
3 |
|
|
Более трех четвертей, но менее всей площади |
4 |
|
|
Сумма баллов А + Б |
Результаты обследования каждого животного суммируются и выносится заключение о степени и характере поражения глаз при действии на него изучаемого соединения или средства, указывается характер конъюнктивита (поверхностный, глубокий), наличие кератита. Класс по раздражающему действию дезинфицирующего средства оценивается по классификации выраженности раздражающих свойств на глаза, табл. 8.7 [69].
8.2.2.8. Определение и оценка кожно-резорбтивного действия.
Кожно-резорбтивное действие дезинфицирующих средств (за исключением аэрозольных форм и кожных антисептиков) оценивают в остром (нативное средство — однократное воздействие) и в подостром эксперименте (рабочие концентрации) в течение 10 — 30 дней в зависимости от назначения средства. В эксперименте используют «пробирочный метод» или нанесение на выстриженный участок кожи спины. Опыты проводят на крысах или мышах, или морских свинках. При «пробирочном методе» животных (крысы или мыши) помещают в специальные домики, хвосты опускают в пробирку с изучаемым средством на 2/3 длины. Экспозиция опыта — 2 — 4 ч соответственно. Затем средство смывают. В случае подострого опыта каждый раз используют новую порцию средства. В течение эксперимента регистрируют местное состояние кожи, клинические проявления интоксикации, гибель животных.
Показателями кожной резорбции, кроме смертельного исхода и клинической картины интоксикации, служат функциональные изменения различных органов и систем организма: интегральные и специфические — по выбору в зависимости от механизма действия средства. Обследование животных проводят в конце опыта при воздействии в течение 10 — 12 дней и дважды при воздействии в течение 30 дней.
Исследования кожно-резорбтивного действия средства в аэрозольных баллонах проводят при однократном воздействии. Животных фиксируют в станке спиной кверху, закрывают их листом из оргстекла или картона с вырезанным в центре окном соответствующей площади по размеру и форме аналогичного подопытному участку кожи. Затем смесь из баллонов равномерно распыляют по всей поверхности картона (в т.ч. и коже животного). За животными наблюдают в течение 14 суток. При необходимости проводится обследование животных по интегральным и специфическим показателям, в зависимости от механизма действия средства.
8.2.2.9. Определение и оценка острой ингаляционной опасности (зона острого биоцидного действия).
Оценку острой ингаляционной опасности рабочих растворов или готового к употреблению дезинфицирующего средства проводят в затравочных камерах, моделируя в статических условиях способы применения (орошение, протирание, замачивание или погружение) с учетом режимов применения (нормы расхода, рабочих концентраций, экспозиции) [69].
При моделировании способа протирания или орошения в затравочной камере обрабатывают все боковые поверхности и пол в рекомендуемой рабочей концентрации с учетом нормы расхода. В острых опытах обработки проводятся однократно. Время воздействия зависит от разработанного режима применения.
При моделировании способа погружения или замачивания в затравочную камеру объемом 1 куб. м помещают открытую емкость с площадью открытой поверхности 0,1 кв. м (что составляет 10% от площади пола затравочной камеры) с налитым в нее рабочим раствором дезинфицирующего средства.
В затравочных камерах контролируют температуру и влажность воздуха, определяют содержание летучих действующих веществ средства.
Животных обследуют сразу после окончания воздействия по лимитирующим
эффектам для дезинфицирующих средств — это в основном раздражающий эффект и
состояние центральной нервной системы. На основании проведенных
исследований определяют порог острого действия (Lim ), рассчитывают зону
ac
биоцидного действия по отношению порога острого действия к норме расхода
(Lim / норма расхода).
ac
По классификации ингаляционной опасности дезинфицирующих средств определяют класс опасности и оценивают сферу их безопасного применения, табл. 8.8 [69].
Таблица 8.8
КЛАССИФИКАЦИЯ СТЕПЕНИ ИНГАЛЯЦИОННОЙ ОПАСНОСТИ
ДЕЗИНФИЦИРУЮЩИХ СРЕДСТВ ПО ЗОНЕ ОСТРОГО БИОЦИДНОГО ДЕЙСТВИЯ
[МУ 1.2.1105-02]
┌────────────┬──────────────────────┬─────────────────────────────────────┐
│ Класс │ Зона острого │ Рекомендуемые условия применения │
│ опасности │биоцидного действия: │ │
│ │ Lim │ │
│ │ ac │ │
│ │Z = ————- │ │
│ │ ac норма расхода │ │
├────────────┼──────────────────────┼─────────────────────────────────────┤
│I │Менее 1 │Использовать в экстремальных │
│высокоопасно│ │ситуациях (по эпидемиологическим │
│ │ │показаниям) в специальных костюмах │
│ │ │и противогазах │
├────────────┼──────────────────────┼─────────────────────────────────────┤
│II │1 — 3 │Использовать в ЛПУ со средствами │
│опасно │ │защиты органов дыхания, глаз, кожи, │
│ │ │в отсутствие больных и пациентов │
├────────────┼──────────────────────┼─────────────────────────────────────┤
│III │3,1 — 10,0 │Использовать в ЛПУ без средств защиты│
│умеренно │ │органов дыхания и глаз, но в │
│опасно │ │отсутствие больных и пациентов │
├────────────┼──────────────────────┼─────────────────────────────────────┤
│IV │Более 10 │Использовать в присутствии больных, │
│малоопасно │ │пациентов и в быту (перспективно для │
│ │ │текущей и профилактической │
│ │ │дезинфекции) │
└────────────┴──────────────────────┴─────────────────────────────────────┘
8.2.2.10. Определение и оценка подострой ингаляционной опасности (зона подострого биоцидного действия).
Исследования ингаляционной опасности при повторных воздействиях проводят в затравочных камерах, моделируя в статических условиях способы обработки (орошение, протирание, погружение) с учетом режимов применения (нормы расхода, экспозиции).
Обработки проводят ежедневно, 5 раз в неделю, в течение всего эксперимента (от 2 до 4 недель). Обработки проводят так же, как при однократном воздействии.
В затравочных камерах контролируют температуру и влажность воздуха.
Определение содержания летучих действующих веществ — при необходимости.
Обследование животных проводят перед экспериментом (фоновые данные по массе тела, показателям периферической крови) и в конце по показателям состояния разных органов и систем в зависимости от механизма действия дезинфицирующего средства (обязательно исследование в динамике массы тела, оценка состояния центральной нервной системы и состояние периферической крови).
Определяют порог подострого действия по лимитирующему показателю и
рассчитывают зону подострого биоцидного действия по отношению порога
подострого действия к норме расхода (Lim / норма расхода).
subac
Ингаляционную опасность при повторном воздействии дезинфицирующего
средства (аэрозоли + пары или только пары) оценивают по зоне подострого
биоцидного действия: при зоне (Z ) менее 10 — средство рекомендуется
subac
использовать в ЛПУ со средствами защиты органов дыхания, глаз, кожи, в
отсутствие больных и пациентов, при зоне (Z ) более 10 — его можно
subac
использовать в присутствии пациентов, табл. 8.9 [69].
Таблица 8.9
КЛАССИФИКАЦИЯ СТЕПЕНИ ИНГАЛЯЦИОННОЙ ОПАСНОСТИ
ДЕЗИНФИЦИРУЮЩИХ СРЕДСТВ ПО ЗОНЕ ПОДОСТРОГО
БИОЦИДНОГО ДЕЙСТВИЯ
┌──────────┬────────────────────────────┬─────────────────────────────────┐
│ Класс │ Зона подострого биоцидного │Рекомендуемые условия применения │
│опасности │ действия: │ │
│ │ Lim │ │
│ │ subac │ │
│ │ Z = ————- │ │
│ │ subac норма расхода │ │
├──────────┼────────────────────────────┼─────────────────────────────────┤
│Опасно │Менее 10 │Использовать в ЛПУ со средствами │
│ │ │защиты органов дыхания, глаз, │
│ │ │кожи, в отсутствие больных и │
│ │ │пациентов │
├──────────┼────────────────────────────┼─────────────────────────────────┤
│Малоопасно│Более 10 │Использовать в присутствии │
│ │ │больных, пациентов или в быту │
│ │ │(для текущей и профилактической │
│ │ │дезинфекции) │
└──────────┴────────────────────────────┴─────────────────────────────────┘
8.2.2.11. Определение и оценка сенсибилизирующих свойств.
Сенсибилизирующие свойства дезинфицирующих средств определяют комплексом методов (при необходимости используют ряд методов или ограничиваются одним):
а) методом Алексеевой-Петкевич на морских свинках при внутрикожном введении 50 — 200 мкг с последующими (через 10 дней) накожными аппликациями и постановкой проб — кожной и конъюнктивальной и аллергологических тестов с клетками крови [65];
б) по реакции гиперчувствительности «замедленного» типа ГЗТ на мышах массой 20 +/- 0,5 г или морских свинках при внутрикожной сенсибилизации средством в ПАФ (полном адъюванте Фрейнда) проводят согласно методическим указаниям [65].
Индекс реакции ИР вычисляют по формуле:
h — h
0 k
ИР = ——- x 100%,
h
k
где h и h — объем (масса) стопы в опыте и контроле соответственно,
0 k
в мм (мг).
Достоверным считают значения ИР более 5%.
Силу аллергенной активности оценивают по классификации для химических веществ, табл. 8.10 [65];
в) при положительных результатах на первом этапе оценку аллергенного
действия дезинфицирующих средств проводят при комплексном поступлении
аллергена в организм (через органы дыхания и кожу). Для этого используются
эксперименты, описанные выше при определении порогов подострого
ингаляционного действия (п. 8.2.2.10). В опытах обязательно используют
морских свинок. Тестирование проводят на 14-е и 28-е сутки от начала
воздействия, используя конъюнктивальную пробу как более чувствительную при
ингаляционном пути поступления средства в организм и 2 — 3
иммунологических теста. Определяют порог подострого специфического действия
(Lim ), который учитывают при определении зоны подострого биоцидного
sp
действия для средств с аллергенной активностью [65];
г) при кожном пути поступления дезинфицирующего средства в организм его исследования проводят на морских свинках при повторных 4-недельных кожных аппликациях в концентрации, не вызывающей местно-раздражающего действия. Тестирование проводят по конъюнктивальной и кожной пробам и по 2 — 3 специфическим иммунологическим показателям. При оценке результатов учитывают развитие сенсибилизации даже у единичных животных в группе [65].
Таблица 8.10
ГИГИЕНИЧЕСКАЯ КЛАССИФИКАЦИЯ ПО АЛЛЕРГЕННОСТИ ПЕСТИЦИДОВ
(МР N 01-19/126-17) [МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОЦЕНКЕ
СТЕПЕНИ ОПАСНОСТИ ПЕСТИЦИДОВ
(ГИГИЕНИЧЕСКАЯ КЛАССИФИКАЦИЯ)]
|
Классы опасности |
|||
|
I |
II |
III |
IV |
|
Чрезвычайно опасные |
Опасные |
Умеренно опасные |
Малоопасные |
|
Достаточные доказательства аллергенности для человека в эпидемиологических и/или клинико- аллергологических исследованиях, подтвержденные специфическими аллерготестами, в сочетании или при отсутствии доказательств сенсибилизирующего действия на животных |
Ограниченные доказательства аллерген- ности для человека в эпидемиологических и/или клинико-аллергологических иссле- дованиях (при ограниченных возможностях специфического аллерготестирования) в сочетании с достаточными доказательст- вами сенсибилизирующего действия на животных |
Достаточные доказательства сенсиби- лизирующего действия на животных |
Отсутствие сенсибилизирующего эффекта в рамках стандартного протокола исследований |
|
Подкласс A Достаточные доказа- тельства чрезвычайно сильного сенсибили- зирующего действия на животных: развитие сенсибили- зации при всех способах ее воспроизведения у 100% животных при высокой достовер- ности (Р < 0,001 — 0,01) отличий среднегруп- повых показателей специфических аллерготестов in vivo и in vitro |
Подкласс B Достаточные доказательства сильного сенсиби- лизирующего действия на животных: развитие сенсибилизации при всех способах ее воспроизведения у 50% животных при достоверном (Р < 0,01 — 0,05) отличии средне- групповых показа- телей специфиче- ских аллерготестов in vivo и in vitro |
Подкласс A Умеренный аллер- ген: развитие сенсибилизации при более чем у 30% животных при достоверном (Р < 0,05) отличии среднегрупповых показателей специфических аллерготестов in vivo и in vitro |
Подкласс B Слабый аллерген: развитие сенсиби- лизации у единич- ных (менее 30%) животных при отсутствии досто- верного отличия среднегрупповых показателей специфических аллерготестов in vivo и in vitro |
8.2.2.12. Оценка безопасности остаточных количеств дезинфицирующих средств на обработанных изделиях (ИМН, посуде, игрушках из полимерных и резиновых материалов и пр.).
Безопасность остаточных количеств дезинфицирующих средств на изделиях медицинского назначения ИМН, на столовой посуде, игрушках и т.п. оценивают комплексом методов (или по выбору): пирогенность, цитотоксическое действие в культуре клеток ККЛ, гемолитическое действие. Оценку смываемости дезинфицирующих средств проводят с изделий из разных материалов (металлов, стекла, резин натуральных и силиконовых, пластмасс) [50; 69]. Отмыв изделий осуществляют двумя способами (при необходимости можно ограничиться одним):
— под проточной питьевой водой;
— при многократном погружении в дистиллированную воду.
Остаточные количества (вытяжку или смывы) дезинфицирующих средств с изделий получают с помощью дистиллированной воды. Комплект изделий из разных материалов погружают (каждый комплект в отдельную емкость) в дезинфицирующий раствор и выдерживают в течение рекомендованного времени воздействия. Затем изделия вынимают, дают стечь остаткам раствора и помещают в новую емкость для отработки режима отмыва. После первого отмыва изделия погружают в другую емкость и делают смывы или вытяжки дистиллированной водой при соотношении объема изделий к объему воды 1:1. Вытяжки и смывы готовят при температуре 37 °C (в термостате): в течение 24 ч (вытяжки) и в течение 2 ч (смывы с изделий из металлов и стекла). На каждый момент времени отмыва используется самостоятельный комплект изделий. В полученные вытяжки или смывы добавляют хлористый натрий для получения изотонического раствора, который используют:
1) для оценки пирогенности [49];
2) для оценки гемолитического действия — согласно методике оценки полимерных материалов и изделий на их основе медицинского назначения [76];
3) для оценки цитотоксического действия ЦТД в культуре клеток (диплоидные клетки человека или клетки почек зеленых мартышек — ПЗМ-4647) [61].
8.2.2.13. Оценка реальной опасности — моделирование условий применения: протирание, орошение, погружение.
Оценка реальной опасности ДС проводится в условиях натурного эксперимента. В специально выделенном помещении должны быть обрабатываемые поверхности из разных материалов: масляная краска, стекло, кафельная плитка, линолеум. Эксперименты проводят с учетом способов обработки (протирание или орошение) с заданной нормой расхода и с разными рекомендуемыми рабочими растворами. Помещение должно хорошо проветриваться, т.к. после обработки и времени воздействия следует отработать режим проветривания. После окончания экспериментов в помещении проводится влажная уборка.
В течение эксперимента проводится санитарно-химический контроль воздуха помещений на содержание ДВ ДС. Интервалы между заборами проб устанавливаются в каждом конкретном случае. Обязательно берется фоновая проба: в момент обработки, в конце воздействия и после проветривания. Далее — по необходимости в зависимости от конкретного средства и степени летучести. В данном эксперименте проверяется безопасность рекомендованных мер предосторожности.
8.2.3. Критерии оценки токсичности и опасности
дезинфицирующих средств на первом этапе
1. Безусловно бракуются и поэтому снимаются с дальнейшего изучения
дезинфицирующие средства, которые по параметрам острой токсичности
относятся к 1 — 2-му классам опасности по ГОСТ 12.1.007-76 (при введении в
желудок и нанесении на кожу), или к 1 — 2-му классам токсичности по
классификации К.К. Сидорова (при введении в брюшную полость), или к 1-му
классу опасности по классификации химических веществ по степени летучести
(C ) (при ингаляции в насыщающих концентрациях паров).
20
2. Бракуются дезинфицирующие средства, обладающие выраженным кожно-резорбтивным действием и аллергенным эффектом, 1 класс — чрезвычайно опасные.
3. Отбирают менее опасные дезинфицирующие средства, которые должны оцениваться дифференцированно с учетом условий использования в разных областях и сферах применения (в лечебно-профилактических учреждениях, на объектах коммунального хозяйства, социального обеспечения, общественного питания, в детских учреждениях, на объектах торговли, в пенитенциальных учреждениях, на транспорте (санитарном, железнодорожном, воздушном), на объектах пищевой промышленности, населением в быту) и углубленного изучения с учетом рабочих концентраций, условий и режимов применения.
8.2.4. Критерии оценки токсичности и опасности
дезинфицирующих средств на втором этапе
8.2.4.1. Острое ингаляционное действие дезинфицирующего средства (пары или аэрозоли + пары) оценивают по зоне острого биоцидного действия, которую рассчитывают по отношению величины полученного порога острого действия к норме расхода. На этой основе устанавливают класс опасности по классификации степени ингаляционной опасности дезинфицирующих средств и определяют возможные условия применения:
а) при зоне острого биоцидного действия менее 1 дезинфицирующее средство следует отнести к 1-му классу высокоопасных препаратов и допускать для использования только в экстремальных эпидемиологических ситуациях специально обученным персоналом с применением противогаза и противочумного костюма;
б) при зоне острого биоцидного действия в диапазоне от 1 до 3 следует отнести дезинфицирующее средство ко 2-му классу опасных средств и разрешать для использования в ЛПУ в отсутствие пациентов при заключительной дезинфекции с обязательным применением индивидуальных средства защиты органов дыхания, кожных покровов и глаз;
в) при зоне острого биоцидного действия в диапазоне от 3,1 до 10,0 дезинфицирующее средство следует отнести к 3-му классу умеренно опасных и использовать в ЛПУ в отсутствие больных или пациентов. Проводящему обработку персоналу допускается работать без средств защиты органов дыхания и глаз, но рекомендуется избегать попадания средства в глаза и на кожные покровы;
г) при зоне острого биоцидного действия более 10 дезинфицирующее средство относится к 4-му классу малоопасных средств и может рекомендоваться для использования и в присутствии пациентов (перспективно для профилактической и текущей дезинфекции).
8.2.4.2. Ингаляционная опасность при многократном повторном
воздействии дезинфицирующего средства (пары или аэрозоли + пары)
оценивается по зоне подострого биоцидного действия: при Z менее 10 —
subac
средство рекомендуется использовать в ЛПУ со средствами защиты органов
дыхания, глаз, кожи, в отсутствие больных и пациентов; при Z более 10
subac
— можно рекомендовать для использования в присутствии пациентов и
населением в быту (перспективно для текущей и профилактической
дезинфекции). Пороги подострого действия определяются по лимитирующему
специфическому показателю (для дезинфицирующих средств — это аллергенный
эффект и раздражающее действие) [69].
8.2.4.3. Выраженность местно-раздражающего действия дезинфицирующих средств в нативном виде и в рабочих концентрациях на кожу и глаза оценивается по соответствующим классификациям п. п. 8.2.2.6 и 8.2.2.7:
а) дезинфицирующие средства в нативном виде, относящиеся к 1 — 2-му классам опасности (резко выраженное и выраженное раздражающее действие) при аппликациях на кожу и глаза, должны использоваться только специалистами дезслужбы с защитой кожи рук и глаз;
б) дезинфицирующие средства, относящиеся к 3 — 4-му классам опасности (умеренное, слабое или отсутствие раздражающего действия), могут быть рекомендованы для использования не только специалистами, но и населением в быту;
в) дезинфицирующие средства, относящиеся даже в рабочих растворах к 1 — 2-му классам опасности уже при однократных аппликациях на кожу и глаза, не рекомендуются для использования в практике;
г) дезинфицирующие средства, относящиеся в рабочих растворах к 3-му классу опасности при однократных аппликациях на кожу и глаза, рекомендуются для использования только специалистами дезслужбы;
д) дезинфицирующие средства, относящиеся в рабочих растворах к 4-му классу опасности при однократных аппликациях на кожу и глаза, рекомендуются для использования не только специалистами, но и населением в быту.
8.2.4.4. Дезинфицирующие средства с резко выраженными кумулятивными свойствами должны контролироваться химико-аналитическим методом при отработке режима отмыва его с посуды и игрушек и оцениваются с учетом величины ПДК действующего вещества в питьевой воде.
8.2.4.5. Дезинфицирующие средства, относящиеся по аллергенной активности ко 2-му классу опасности (табл. 8.10), разрешаются для использования в лечебно-профилактических учреждениях только обученным персоналом с применением средств индивидуальной защиты в отсутствие пациентов в очагах инфекционных заболеваний при заключительной и генеральной дезинфекции с последующей уборкой и проветриванием помещений.
Дезинфицирующие средства, относящиеся по аллергенной активности к 3-му классу опасности, для дезинфекции в лечебно-профилактических учреждениях разрешаются с ограничениями:
— к работе с такими средствами не допускаются лица с аллергическими заболеваниями и с повышенной чувствительностью к химическим веществам.
Дезинфицирующие средства, относящиеся по аллергенной активности к 4-му классу опасности (не обладающие сенсибилизирующим действием), могут без ограничений использоваться как в ЛПУ, так и на объектах коммунального хозяйства, они перспективны для использования в детских учреждениях и населением в быту.
8.2.4.6. Режим отмыва изделий медицинского назначения от дезинфицирующих средств удовлетворяет требованиям безопасного использования, если вытяжки или смывы:
а) не оказывают цитотоксического действия ЦТД в ККЛ и ни одна из опытных клеточных культур не имеет степень более 1;
б) не вызывают эффекта по пирогенности;
в) если их гемолитическое действие не превышает 2%.
8.2.5. Критерии оценки токсичности и опасности
дезинфицирующих средств на третьем этапе
Для оценки реальной опасности ДС при моделировании условий их
применения (орошение, протирание, погружение) с учетом ингаляционного
воздействия и при необходимости кожного пути поступления рассчитывается
фактор безопасности (S ) по формуле:
F
K
фак
S = ————-,
F персонал ПДК (ОБУВ)
р.з
где:
S — фактор безопасности;
F
K — фактическая концентрация средства в воздухе рабочей зоны;
фак
ПДК (ОБУВ) — гигиенический норматив в воздухе рабочей зоны.
р.з
В случае когда S > 1, реальная опасность ДС высокая (как для
F
персонала, проводящего обработки, так и для пациентов) и при работе с ним
необходимо соблюдение условий безопасного применения и мер предосторожности
с использованием средств индивидуальной защиты.
В случае когда S < 1, реальная опасность ДС низкая и его можно
F
рекомендовать для использования в широкой сфере применения: для текущей и
профилактической дезинфекции не только специалистами, но и населением в
быту.
На заключительном — третьем этапе — проводится анализ и обобщение полученных данных, составляется научный отчет, разрабатываются разделы по безопасности в инструкцию по применению дезинфицирующего средства в лечебно-профилактических учреждениях, на объектах коммунального хозяйства и т.д. с характеристикой его токсичности и опасности, рекомендациями необходимых мер предосторожности, средств индивидуальной защиты, а также мер первой помощи при случайном отравлении. Формулируются меры предосторожности при хранении средств, а также режимы отмыва посуды, ИМН (в т.ч. эндоскопов) после дезинфекционной обработки.
Решается вопрос о допуске дезинфицирующего средства, содержащего в своем составе новое, ранее не применявшееся действующее вещество, к практическим испытаниям в ЛПУ, в очагах инфекционных заболеваний или на предприятиях пищевой промышленности.
Проводится санитарно-химический контроль воздуха в помещениях на содержание летучих действующих веществ дезинфицирующего средства для проверки безопасности рекомендованных мер предосторожности.
Анкетным способом (см. форму анкеты) собирается информация о побочных действиях дезинфицирующего средства в процессе его испытаний в практике.
Результаты практических испытаний оформляются в виде актов-заключений с приложением анкет по учету побочного действия дезинфицирующего средства. Составляется отчет о проведении практических испытаний.
При положительных результатах испытаний в практических условиях дезинфицирующие средства рекомендуются к государственной регистрации в России и применению в медицинской практике.
8.2.6. Перечень необходимых токсикологических показателей
при оценке токсичности и опасности дезинфицирующих средств,
предназначенных для дезинфекции на предприятиях пищевой
промышленности (пивобезалкогольная и винодельческая,
мясо-молочная, хлебопекарная, кондитерская, сыроварения,
рыбоперерабатывающая промышленность)
Сбор данных литературы о токсичности изучаемого средства по общей токсичности, метаболизму в организме, отдаленным проявлениям, экологической безопасности.
— ЛД при введении:
50
— в желудок, мг/кг;
— на кожу, мг/кг.
Ингаляционное воздействие:
— в насыщающих концентрациях (пары) по степени летучести;
— в форме аэрозоля.
Кумуляция.
Местно-раздражающее действие на кожу:
— нативный препарат;
— рабочие растворы.
Местно-раздражающее действие на глаза:
— нативный препарат;
— рабочие растворы.
Кожно-резорбтивное действие рабочих растворов.
Сенсибилизация:
— ГЗТ;
— кожные аппликации.
Безопасность остаточных количеств ДС на оборудовании.
Обоснование мер предосторожности и средств индивидуальной защиты с учетом условий применения, меры первой помощи при случайном отравлении средством, условия хранения.
8.2.6.1. Методы определения и оценка токсичности и опасности ДС, предназначенных для дезинфекции на предприятиях пищевой промышленности.
Исследования следует проводить по схеме изучения дезинфицирующих средств п. п. 8.2.2.1 — 8.2.2.13.
8.2.6.2. Критерии отбора дезинфицирующих средств, предназначенных для предприятий пищевой промышленности. Оценка безопасного применения проводится по критериям для дезинфицирующих средств п. п. 8.2.3 — 8.2.5.
1. Не допускаются ДС:
— относящиеся к 1-му классу опасности при потенциально опасных путях поступления в организм (через рот, кожные покровы, ингаляционно);
— с выраженными отдаленными проявлениями действия;
— с выраженным кожно-резорбтивным действием;
— с выраженным сенсибилизирующим действием;
— обладающие выраженной кумуляцией в организме.
2. Для отобранных ДС отрабатывается режим отмыва до безопасных остаточных количеств средства. Разрабатывается метод контроля средства в смывах с оборудования.
3. Разрабатывается инструкция по применению ДС в практике предприятий пищевой промышленности с характеристикой токсичности и опасности средства, с разработкой необходимых мер предосторожности и рекомендациями по применению средств индивидуальной защиты, а также мер первой помощи при случайном отравлении.
8.3. Методы изучения токсичности и опасности средств
для стерилизации и предстерилизационной очистки изделий
медицинского назначения ИМН
Перед стерилизацией изделий медицинского назначения ИМН, включая эндоскопы, проводят их предстерилизационную очистку для удаления крови и других органических загрязнений.
8.3.1. Оценка токсичности и опасности средств,
предназначенных для предстерилизационной
очистки ИМН
8.3.1.1. Перечень необходимых токсикологических показателей при оценке токсичности и опасности дезинфицирующих средств, предназначенных для предстерилизационной очистки изделий медицинского назначения ИМН, включая эндоскопы:
— токсикологическая характеристика по литературным данным всех компонентов состава средства (вспомогательные компоненты: наполнители, стабилизаторы, антикоррозионные, отдушки, красители и т.д.);
— острая токсичность ДС при введении в желудок — ЛД , мг/кг;
50
— острая токсичность ДС при нанесении на кожу — ЛД , мг/кг;
50
— острая ингаляционная опасность ДС и рабочих концентраций в насыщающих концентрациях паров;
— местно-раздражающее действие на кожу нативного ДС и рабочих концентраций (однократно);
— местно-раздражающее действие рабочих концентраций на кожу (многократное нанесение в течение 2 недель);
— местно-раздражающее действие на глаза нативного ДС и рабочих концентраций (однократно);
— кожно-резорбтивное действие рабочих концентраций (при повторных аппликациях в течение 2 — 4 недель);
— сенсибилизирующее действие;
— ингаляционная опасность рабочих концентраций в режиме применения — погружение. Оценка реальной опасности при моделировании условий применения;
— оценка остаточных количеств ДС на ИМН из разных материалов, отработка режима их отмыва.
8.3.1.2. Средства, предназначенные для предстерилизационной очистки изделий медицинского назначения, следует изучать по схеме изучения дезинфицирующих средств, предназначенных для дезинфекции изделий медицинского назначения (п. п. 8.2.2.1 — 8.2.2.13).
8.3.1.3. Критерии отбора и оценки безопасного применения проводят по критериям для дезинфицирующих средств п. п. 8.2.3 — 8.2.5.
8.3.2. Изучение оценки токсичности и опасности
стерилизующих средств СС, предназначенных для стерилизации
ИМН, включая эндоскопы
Средства, предназначенные для стерилизации изделий медицинского назначения, начинают изучать по схеме исследований дезинфицирующих средств на первом этапе, рис. 8.1.
Особенностью изучения токсичности СС является обоснование их допустимых остаточных количеств (ДОК) на обрабатываемых объектах на основе установления допустимой суточной дозы (ДСД) для человека в соответствии с условиями и режимами применения СС, что представлено в методической схеме (рис. 8.4). Исследование стерилизующих средств проводится с учетом потенциально опасных путей их поступления в организм и продолжительности контакта изделий с организмом. Изучаемые средства парентерально вводятся животным в водном или физиологическом растворах с соблюдением правил асептики. Учитывая назначение и характер контакта простерилизованных изделий с организмом пациента, возможны следующие пути поступления остаточных количеств СС в организм: ингаляция, в желудок, парентерально (под кожу, в кровяное русло, внутрибрюшинно, в мышцу, через слизистые оболочки как поврежденные, так и неповрежденные). В качестве модельного пути для оценки с кровью или поврежденными слизистыми оболочками принимается введение СС в брюшинную полость.
┌───────────────────┐ ┌─────────────────────┐ ┌──────────────────────┐
│Медико-техническая │ │ Токсичность средств │ │ Физико-химические │
│характеристика ИМН │ │(парентеральные пути)│ │исследования в системе│
└────┬───────────┬──┘ └───┬─────────────┬───┘ │ «материал-средство» │
│ │ │ │ └─────┬───────────┬────┘
/ / / / / /
┌─────────┐┌────────────┐ ┌──────┐ ┌─────────┐ ┌───────────┐ ┌────────┐
│Материал,││ Путь, │ │Острая│ │Подострая│ │Сорбционно-│ │Химико- │
│ масса, ││длительность│ └┬─────┤ └─────────┘ │диффузион- │ │аналити-│
│ форма ││ контакта │ / / / │ные │ │ческие │
└─────────┘└┬─┬──────┬──┘ ЛД Lim Lim │свойства │ │методы │
│ │ │ 50 ac ──┐ subac └───────────┘ │контроля│
│ │ │ │ │ └────────┘
│ │ │ / /
│ │ │ ┌──────────┐ ┌───────────┐ ┌───────┐
│ │ │ │Масса тела│ │ДСД │ │K │
┌───────┘ │ │ │ человека ├─>│ ac;subac│<─>│ запаса│
│ │ │ │ (70 кг) │ │ │ │ │
│ │ │ └──────────┘ └────┬──────┘ └───────┘
/ / / /
┌───────┐┌──────┐┌──────┐ ┌───┐
│Одно- ││Дли- ││По- │ │ДОК│
│кратно ││тельно││вторно│ └─┬─┘
└───────┘└──────┘└──────┘ /
┌───────┐ ┌──────────────────┐
│Оценка │<───>│ Режим удаления │
│изделий│ │средств из изделий│
└─┬──┬──┘ │ (до ДОК) │
│ │ └──────────────────┘
│ │
┌───────────────────────┐ │ │ ┌────────────────────┐
│Биотестирование вытяжек│<──────────┘ └──>│Санитарно-химические│
└───────────────────────┘ │исследования вытяжек│
└────────────────────┘
Рис. 8.4. Методическая схема токсиколого-гигиенического
изучения и оценка средств стерилизации в целях
их регламентации в изделиях медицинского
назначения (ИМН)
8.3.2.1. Перечень необходимых показателей токсичности и опасности стерилизующих средств.
С учетом особенностей назначения и условий применения стерилизующих средств СС в перечень определяемых и оцениваемых показателей токсичности и опасности входят следующие показатели:
— острая токсичность СС при введении в желудок — ЛД , мг/кг;
50
— острая токсичность СС при нанесении на кожу — ЛД , мг/кг;
50
— острая токсичность при парентеральном введении СС (под кожу,
внутривенно, в брюшную полость) — ЛД , мг/кг;
50
— острая ингаляционная опасность СС и рабочих концентраций в насыщающих концентрациях паров;
— местно-раздражающее действие на кожу нативного СС и рабочих концентраций (однократно);
— местно-раздражающее действие рабочих концентраций СС на кожу (многократное нанесение в течение 2 недель);
— местно-раздражающее действие на глаза нативного СС и рабочих концентраций (однократно);
— кожно-резорбтивное действие рабочих концентраций СС (при повторных аппликациях в течение 2 — 4 недель);
— кумулятивный эффект;
— сенсибилизирующее действие;
— мутагенное действие экспресс-методами;
— определение порогов острого действия СС (при потенциально опасных парентеральных путях поступления в организм);
— определение порогов подострого действия СС (при потенциально опасных парентерально путях поступления в организм 0,5 — 1,5 месяца);
— обоснование допустимых суточных доз ДСД СС для человека, исходя из условий применения;
— обоснование ДОК СС в простерилизованных ИМН;
— отработка режима отмыва ИМН до ДОК.
На основе анализа полученных экспериментальных данных разрабатываются меры предосторожности и средства индивидуальной защиты при работе со стерилизующими препаратами с учетом условий применения и хранения, а также меры по оказанию первой помощи при случайном отравлении СС.
8.3.2.2. Методы определения и оценка токсичности и опасности средств стерилизации.
8.3.2.2.1. Все методы до определения пороговых уровней при парентеральном введении следует изучать по схеме изучения дезинфицирующих средств, предназначенных для дезинфекции изделий медицинского назначения п. п. 8.2.2.1 — 8.2.2.13.
8.3.2.2.2. Определение порогов острого (Lim ) и подострого (Lim )
ac subac
действия СС при введении в брюшную полость. Определение Lim начинают с
ac
5-кратным шагом в интервале доз 1/1000 — 1/1500 ЛД при введении в брюшную
50
полость. При определении Lim средство вводят в долях от Lim в
subac ac
течение 2 — 3 недель. При обследовании животных выбираются как интегральные
показатели, характеризующие общее состояние организма (внешний вид, масса
тела, ректальная температура и т.д.), так и показатели по оценке
функционального состояния отдельных органов и систем с учетом политропной
направленности действия большинства СС (нервная система, морфологический
состав крови, состояние неспецифического иммунитета, функции печени
(белковообразующая, ферментативная, антитоксическая), почек (выделительная,
концентрационная)). При необходимости оценивают состояние
сердечно-сосудистой системы, функцию внешнего дыхания, применяют адекватные
функциональные нагрузки. При повторных воздействиях определяют Lim и
subac
недействующий уровень. Исходя из полученных данных, рассчитывают зону
повторного действия: Z = Lim / Lim .
subac ac subac
Кроме порога Lim по общетоксическим показателям определяют пороги
ac
острого специфического действия (Lim ): гемолитическое действие и
spec
состояние свертывающей и противосвертывающей систем крови.
С целью выбора лимитирующего эффекта сравнивают пороги острого действия
— Lim и Lim . За лимитирующий эффект принимается общетоксический, если
ac spec
порог острого действия меньше порога по специфическим показателям (Lim <
ac
Lim ). Если порог острого действия больше порога по специфическим
spec
показателям Lim > Lim , то регламентацию следует проводить по
ac spec
специфическому действию.
8.3.2.2.3. Расчет допустимой суточной дозы ДСД стерилизующего средства для человека и ДОК на изделиях.
Исходя из порогов действия, установленных по лимитирующим эффектам, обосновываются допустимые суточные дозы СС для человека (ДСД) из расчета его среднего веса (70 кг) с введением дифференцированного коэффициента запаса в зависимости от токсичности препарата и условий применения обрабатываемых изделий. Этот коэффициент составляет 10 — для однократного и 100 — для повторяющегося применения препарата у данного пациента:
Lim x 70 кг
ac,subac
ДСД (мг/сутки) = ——————-.
K
запаса
Установленные величины ДСД препаратов для человека принимаются в
качестве их ДОК на изделиях. На основе порогов острого действия (Lim )
ac
устанавливаются ДСД и ДОК средств для изделий однократного применения,
ac ac
а на основе порогов подострого действия (Lim ) устанавливаются ДСД
subac subac
и ДОК средств для изделий многократного применения.
subac
8.3.2.3. Критерии оценки и отбора стерилизующих средств.
Не рекомендуются для использования стерилизующие средства:
— обладающие специфическими отдаленными эффектами (мутагенным, эмбриотропным, гонадотоксическим, тератогенным, канцерогенным) 1 — 2-го классов опасности;
— обладающие аллергенным действием 1 — 2-го классов опасности.
Остальные показатели оценивают по критериям, указанным в п. п. 8.2.3 — 8.2.5.
8.4. Методы изучения токсичности и опасности
кожных антисептиков
Основополагающие токсиколого-гигиенические требования по безопасности кожных антисептиков сводятся к недопущению прежде всего лимитирующих эффектов их воздействия — местно-раздражающего, кожно-резорбтивного и контактного сенсибилизирующего действия в рекомендованных режимах применения. Кожные антисептики не должны также обладать специфическими отдаленными эффектами (эмбриотоксическим, гонадотропным, тератогенным, мутагенным, бластомогенным).
В целом схема оценки кожных антисептиков совпадает со схемой изучения
дезинфицирующих средств (п. 8.2). К особенностям оценки относится изучение
их токсичности при реальном пути поступления в организм — накожном.
Учитывая это, в эксперименте основное внимание уделяется оценке таких
лимитирующих эффектов, как местно-раздражающий, кожно-резорбтивный и
сенсибилизирующий при остром, подостром и хроническом воздействии, а также
определение ингаляционной опасности кожных антисептиков в насыщающей
концентрации паров (C ). Следует также учитывать, что подавляющее
20
большинство антисептиков выпускается в готовой к применению форме, а не в
концентратах, и наносится на небольшие по площади участки кожи (5% от общей
поверхности кожи). Схема исследований кожных антисептиков представлена на
рис. 8.5.
┌────────────────────────┐
│ I этап │
┌───────────┤ Первичная ├───────────────┐
│ │токсикологическая оценка│ │
│ └─────────────┬──────────┘ │
/ / /
┌──────────────────────┐ ┌───────────────────────┐ ┌─────────────────────┐
│ Сбор информации │ │ Параметры острой │ │Лимитирующие эффекты │
│ о токсичности ДВ │ │ токсичности │ └────────────┬────────┘
│и основных компонентов│ └────────────┬──────────┘ │
│(по данным литературы)│ │ │
└───────────┬──────────┘ │ │
/ / /
┌──────────────────────┐ ┌────────────────────────┐ ┌─────────────────────┐
│ Рецептура средства, │ │ЛД на кожу, в желудок,│ │ Местно-раздражающее │
│ назначение, режим │ │ 50 │ │действие на интактную│
│ применения │ │ ингаляция в насыщающей │ │ и поврежденную кожу │
└───────────┬──────────┘ │ концентрации (C ) │ └────────────┬────────┘
│ │ 20 │ │
│ └────────────┬───────────┘ │
│ / /
│ ┌────────────────────────┐ ┌─────────────────────┐
│ │ Местно-раздражающее │ │ Сенсибилизирующее │
│ │ действие (кожа, глаза) │ │ действие │
│ └────────────┬───────────┘ └────────────┬────────┘
│ / │
│ ┌─────┐ │
└────────────────────>│Отбор│<───────────────────────┘
└─────┘
┌──────────────────┐
│ II этап │
┌──────────────┤ Углубленная ├──────────────────┐
│ │оценка токсичности│ │
│ └──────────┬───────┘ │
/ / /
┌──────────────────────┐ ┌────────────────────────┐ ┌─────────────────────┐
│ Кожно-резорбтивное │ │ Местно-раздражающее │ │ Отдаленные эффекты: │
│ действие │ │ действие на интактную │ │ эмбриотоксический, │
└───────────┬──────────┘ │ кожу (субхроническое │ │ тератогенный, │
│ │ воздействие) │ │ мутагенный │
│ └────────────┬───────────┘ │ (по показаниям) │
│ │ └────────────┬────────┘
│ │ │
│ / │
│ ┌──────────────────────────────────┐ │
└─────>│ Разработка мер предосторожности │<─────────┘
│при применении и хранении средства│
└──────────────────────────────────┘
┌───────────────────────┐
│ III этап │
┌────────────┤ Испытания ├───────────────┐
│ │в практических условиях│ │
/ └───────────────────────┘ /
┌───────────────────────┐ ┌─────────────────────┐
│Ограниченные испытания │ │Расширенные испытания│
│ на волонтерах │ │ на волонтерах │
└───────────────────────┘ │ (по показаниям) │
└─────────────────────┘
Рис. 8.5. Методическая схема изучения токсичности
и опасности кожных антисептиков
На 1-м отборочном этапе до постановки экспериментов на животных необходимо собрать литературные сведения об изучаемом средстве и его основных компонентах: состав рецептуры и физико-химические свойства компонентов (растворимость в воде, жирах, величина pH), токсикологическая характеристика всех компонентов средства, включая отдаленные эффекты: мутагенный, эмбриотропный, тератогенный, бластомогенный.
На 2-м этапе углубленных исследований основное внимание уделяется изучению лимитирующих эффектов антисептических средств в субхроническом эксперименте (1 — 3 месяца): местно-раздражающего и кожно-резорбтивного с учетом разработанных режимов и условий применения средства. В целях гарантии безопасности продолжительного применения средства в эксперименте необходимо оценить его не только в норме расхода, но и с 3 — 10-кратным ее превышением (т.е. с определением зоны опасности), что достигается увеличением дозы, экспозиции и площади аппликации средства.
Исследования средства в условиях практического применения включают два подэтапа: ограниченные испытания на волонтерах-добровольцах и расширенные клинические испытания средства (в случае нового ДВ) на базе 2 — 3 специализированных учреждений (аккредитованных в этой области). На этом этапе исследований изучаются барьерно-защитные функции кожи, возможные аллергические реакции, проводится анкетный опрос лиц, применявших кожные антисептики на практике.
8.4.1. Перечень необходимых показателей токсичности
и опасности кожных антисептиков
Перечень определяемых и оцениваемых показателей токсичности и опасности кожных антисептиков в целом совпадает с перечнем, предусмотренным для дезинфицирующих средств (п. 8.2.1) [69]:
— острая токсичность при введении в желудок ЛД ;
50
— острая токсичность при нанесении на кожу ЛД ;
50
— острая ингаляционная опасность в насыщающих концентрациях паров C ;
20
— местно-раздражающее действие на интактную кожу;
— местно-раздражающее действие на поврежденную кожу;
— раздражающее действие на слизистые оболочки глаза;
— кожно-резорбтивное действие;
— сенсибилизирующее действие;
— эмбриотропное, тератогенное и мутагенное действия (по показаниям);
— испытания средства в практических условиях;
— разработка рекомендаций по мерам предосторожности при работе и хранении средства (для включения в текст этикетки, инструкцию по применению и технические условия на производство).
Одной из особенностей изучения кожных антисептиков, предназначенных для обработки операционных и инъекционных полей, является изучение их местного действия на «скарифицированную» поврежденную кожу.
8.4.2. Методы определения и оценка токсичности
и опасности кожных антисептиков
8.4.2.1. Показатели острой токсичности.
Определение среднесмертельной дозы средства при однократном введении в
желудок и нанесении на кожу (ЛД ) проводится описанными выше методами
50
(п. п. 8.2.2.1 — 8.2.2.2). Для сравнительной оценки разных кожных
антисептиков и их последующего отбора целесообразно определение ЛД при
50
парентеральном пути введения средства: под кожу или в брюшную полость
(п. 8.2.2.3). Ингаляционная опасность средства по степени летучести
определяется согласно п. 8.2.2.4 и соответствующей классификации,
табл. 8.3.
8.4.2.2. Кожно-резорбтивное действие.
Исследования проводят на крысах (не менее 3 групп) путем открытых накожных аппликаций средства на кожу спины в норме расхода, а также в 3- и 10-кратно завышенных нормах расхода (или режимах применения). Подготовка животных к эксперименту описана в п. 8.2.2.8. Длительность эксперимента составляет 1 — 3 месяца, в зависимости от степени изученности ДВ и широты сферы применения средства.
Кроме того, у специальной группы животных обрабатывают такие же участки кожи равными дозами соответствующего растворителя (особенно это важно для спиртовых растворов) или другой основы состава средства. Для интактного контроля берется отдельная группа животных.
Норма расхода средства устанавливается исходя из рекомендуемого режима его применения по результатам микробиологических исследований (т.е. по эффективности). Обычно для гигиенической обработки рук рекомендуется 2 — 3 мл средства на одну обработку, а для обработки рук хирургов, как правило, от 3 до 5 мл средства при двукратной обработке. Условно принимается, что гигиеническая обработка рук проводится 10 раз в день, при этом расходуется 30 мл средства. Хирурги используют средство 2 — 3 раза в день, расходуя 18 — 30 мл средства. Исходя из этого, ведется пересчет нормы расхода средства на массу тела человека и животного.
В опытах на животных для гарантированной оценки безопасности применения рекомендуемых средств необходимо использовать широкий набор общетоксических и специфических тестов (физиологических, биохимических, морфологических и др.), в зависимости от механизма действия ДВ или компонентов средства. Оценивается общее состояние животных, поведение, аппетит, состояние волосяного и кожного покровов. Еженедельно наблюдают за динамикой массы тела. Раз в месяц исследуют функциональное состояние ведущих систем: нервной, сердечно-сосудистой, функции печени, почек, морфологический состав периферической крови. Обязательным является по окончании эксперимента гистологическое исследование кожи и внутренних органов.
8.4.2.3. Местное раздражающее действие на кожу.
Общие рекомендации по проведению эксперимента даны в п. 8.2.2.6. Длительность экспериментального воздействия на лабораторных животных устанавливается исходя из рекомендуемых режимов применения данного кожного антисептика на практике. Для средств разового и эпизодического применения (обеззараживание кожи операционного и инъекционного полей у пациентов, а также локтевых сгибов доноров) изучение на животных может ограничиваться 2-недельным опытом. Средства для использования профессиональным контингентом (например, для гигиенической обработки и обеззараживания кожи рук хирургов и медицинского персонала) подлежат изучению в субхроническом (от 1 до 3 месяцев) эксперименте, в зависимости от степени изученности ДВ и широты рекомендуемой сферы применения.
Изучение проводится как в рекомендуемых, так и аггравированных режимах — с 10-кратным превышением нормы расхода — доз, концентраций, экспозиций, площадей.
Оценка местного раздражающего действия кожных антисептиков проводится визуально и количественными методами: определяется цвет, тургор, эластичность кожи, наличие шелушения, геморрагических корочек, трещин и т.п. Выраженность эритемы оценивают визуально по балльной шкале по классификации ДС (табл. 8.4 в п. 8.2.2.6). Величину отека кожи определяют, измеряя толщину кожной складки с помощью инженерного микрометра, и переводят в баллы, табл. 8.5 в п. 8.2.2.6.
Целесообразно также использовать лабораторные методы оценки состояния кожи: температура, pH, содержание липидов и др.
Для кожных антисептиков, предназначаемых для обработки операционных и инъекционных полей, дополнительно изучается местно-раздражающее действие средства на скарифицированную поврежденную кожу. Кожа повреждается путем нанесения глубоких царапин иглой в виде сетки # до появления крови. На опытный участок кожи средство наносится ежедневно в течение 10 дней, на контрольный участок также с поврежденной кожей наносится эталонный антисептик (70%-ный этиловый спирт). Ведется наблюдение за процессом заживления нанесенных повреждений в течение 1 — 2 недель.
8.4.2.4. Определение и оценка сенсибилизирующего действия кожных антисептиков.
Для выявления контактной сенсибилизации кожных покровов наиболее адекватным является комбинированный метод Алексеевой-Петкевич с адъювантом Фрейнда с первоначальной внутрикожной сенсибилизацией животных (п. 8.2.2.11) и дальнейших повторных накожных аппликаций по методу Е.А. Иевлевой [65]. Предпочтительным видом животных являются морские свинки. Изучаемый препарат наносится на кожу в течение 20 — 30 дней в рабочей концентрации (или в готовой форме). После этого проводится повторное нанесение средства (от 5 до 10 аппликаций) на кожу противоположного симметричного участка тела. В случае отсутствия у средства раздражающего действия при однократном воздействии, используют конъюнктивальные разрешающие пробы. Критериями оценки эффекта сенсибилизации служат: развитие воспалительной реакции на симметричном участке кожи и появление «воспламенения» на первичном участке. Возможно использование и других тестов выявления кожной сенсибилизации (например, специфического лизиса или агломерации лейкоцитов и др.) [65]. Допустимо применение и других методов оценки сенсибилизирующего эффекта с учетом потенциально опасного пути воздействия средства накожно.
8.4.3. Испытания кожных антисептиков в практических условиях
Кожные антисептические средства, получившие положительную оценку безопасности в экспериментальных исследованиях на животных, подлежат апробации на людях в специализированных аккредитованных учреждениях с соблюдением этических принципов проведения исследований.
До этапа широких клинических испытаний предполагается проведение ограниченных испытаний на волонтерах (10 — 25 человек) с оценкой у них барьерно-защитных функций кожи. На этом этапе проводятся некоторые предварительные специальные исследования: pH кожи, количество липидов, электросопротивляемость и, возможно, другие физиологические и гигиенические показатели [18, 77]. Обязательной является проверка на добровольцах аллергенных свойств изучаемого средства (кожные пробы, «лоскутная проба», пробы in vitro и др.).
При появлении у испытуемых каких-либо побочных явлений дальнейшие испытания на них необходимо прекратить.
Положительные результаты этого этапа позволяют перейти к широким практическим испытаниям на базе 2 — 3 клиник (с участием в общей сложности не менее 50 человек) под наблюдением врачей основных специальностей: терапевта, дерматолога, аллерголога и др.
Результаты клинической апробации средства оформляются в виде актов испытаний на основе анкет учета субъективных и объективных признаков их воздействия. За период наблюдения у 95% испытуемых не должно возникать побочных эффектов. Образец анкеты учета побочного действия средства представлен в табл. 8.11.
Таблица 8.11
АНКЕТА
учета побочных явлений при проведении практических испытаний
кожного антисептика _________________
|
N п/п |
Ф.И.О. |
Долж- ность |
Стаж работы |
Вид работы |
Побочное действие |
Подпись |
||||
|
су- хость кожи |
шелу- шение кожи |
сыпь, зуд |
покрас- нение |
общее со- стоя- ние |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
1 |
||||||||||
|
2 |
||||||||||
|
3 |
||||||||||
|
4 |
||||||||||
|
5 |
||||||||||
|
… |
||||||||||
|
и т.д. |
Подпись и должность лица, ответственного за проведение испытаний:
Печать учреждения:
8.4.4. Критерии оценки токсичности, опасности и отбор
кожных антисептиков
1. Бракуются и снимаются с дальнейшего изучения кожные антисептики, у которых обнаруживают острую токсичность на уровне:
— ЛД при нанесении на кожу 2500 мг/кг и менее (1 — 3-й классы
50
опасности по ГОСТ 12.1.007-76) [24];
— ЛД при введении в желудок менее 151 мг/кг (1 — 2-й классы опасности
50
по ГОСТ 12.1.007-76) [24];
— ЛД при введении под кожу 150 мг/кг и менее (1 — 3-й классы
50
токсичности по классификации К.К. Сидорова (табл. 8.2 в п. 8.2.2.3).
2. Бракуются также кожные антисептики, обладающие местным раздражающим действием при 2-недельном воздействии на кожу в 10 нормах расхода; обладающие сенсибилизирующим действием.
3. Ограничивается сфера применения кожных антисептиков, обладающих кожно-резорбтивным эффектом в 10-кратно завышенной норме расхода при 2-недельном воздействии на кожу: такие средства разрешаются только для обработки инъекционных и операционных полей и локтевых сгибов доноров.
4. Дезинфицирующие средства, оказывающие раздражающее, кожно-резорбтивное и сенсибилизирующее действия, не могут использоваться в качестве кожных антисептиков.
5. Активно действующие вещества субстанции, обладающие выраженными кожно-резорбтивными, контактными аллергенными свойствами, а также (по данным литературы) отдаленными специфическими проявлениями интоксикации (мутагенное, канцерогенное, эмбриотропное, тератогенное и гонадотоксическое действие), не подлежат включению в разрабатываемые рецептуры.
Сфера безопасного применения кожного антисептика устанавливается по степени выраженности кожно-резорбтивного и местно-раздражающего действия, в зависимости от величины коэффициента запаса по отношению к норме расхода.
Средства, имеющие коэффициент запаса более 10 от нормы расхода (4-й класс), допускаются для широкого применения: обработки рук хирургов, гигиенической обработки рук, кожных покровов инъекционного и операционного полей, гигиенической обработки рук работников коммунальной сферы и населения.
Кожные антисептики, характеризующиеся 10-кратным коэффициентом запаса (3-й класс), допускаются в основном для использования профессиональным контингентом (обработка рук медперсонала и хирургов).
При 3-кратном коэффициенте запаса (2-й класс) средства допускаются для эпизодического применения (обработки кожи операционного и инъекционного полей).
При обнаружении токсикологических проявлений уже в норме расхода 1-й класс применение средств не разрешается.
8.5. Методы изучения токсичности и опасности средств
для обеззараживания питьевой воды при
нецентрализованном водоснабжении
Используемые нами подходы для оценки безопасности средств обеззараживания индивидуальных и групповых запасов питьевой воды имеют свои особенности. Эти особенности прежде всего связаны с тем, что применение средств такого назначения рассчитано на особый период и, как правило, на период непродолжительный по времени, связанный с использованием средств, главным образом, по эпидпоказаниям, в зонах чрезвычайных ситуаций, т.е. когда необходимо использовать воду для питьевых целей из поверхностных источников водоснабжения.
Для таких средств приоритетным прежде всего является обеспечение эпидемической безопасности обработанной ими воды перед их химической безопасностью.
В связи с этим используемые для этих целей средства рассчитаны на высокое микробное и органическое загрязнения природной воды и содержат заведомо высокие концентрации дезинфектантов.
По этой причине и в сложившихся у нас подходах к изучению таких средств был принят опыт изучения лекарственной токсикологии.
Используемая программа изучения средств сначала включает их доклинические исследования в эксперименте на животных, а затем клинические испытания обеззараженной природной воды на добровольцах с учетом возможных проявлений ее побочного действия.
Методическая схема изучения токсичности средств для обеззараживания индивидуальных и групповых запасов питьевой воды представлена на рис. 8.17.
┌──────────────────────────────────────────┐
┌──────┤I этап. Доклинические исследования средств├───────┐
/ └─┬┬──────────────────┬──────────────┬──┬──┘ /
┌───────────────┐││ │ │ │┌─────────────────┐
│Состав средств,│││ │ │ ││Сенсибилизирующее│
│ ФХС │││ / │ ││ действие │
└───────────────┘││ ┌──────────────────────────┐│ ││ (по показаниям) │
┌────────┘│ │Острая токсичность средств││ │└─────────────────┘
/ ┌─┘ └──────────────────────────┘│ └──────────┐
┌────────────┐ │ / │
│Кумулятивный│ │ ┌─────────────────────────────────────┐ │
│ эффект │ │ │ Подострая │ │
└────────────┘ │ │ токсичность средств │ /
┌────────────┐ │ │ Lim │ ┌───────────────┐
│Местно- │ │ │ subac │ │ Отдаленные │
│раздражающее│ │ │ (в желудок) │ │ эффекты │
│действие │ │ │Z = ——————-│ │(по показаниям)│
│на кожу │<─┘ │ subac.bioc.eff Суточная норма │ └───────────────┘
│и слизистые │ │ расхода средств │
│оболочки │ │ для человека │
└────────────┘ └─────────────────────────────────────┘
┌──────────────────────────────────────────────────┐
│II этап. Доклинические исследования обеззараженной├───────────┐
│ средствами питьевой воды │ │
└───┬──────────────────┬────────────────────┬──────┘ │
/ / / │
┌────────────────────┐┌──────────────────────┐┌─────────────────────┐ │
│Химико-аналитические││ Оценка токсичности ││Мутагенная активность│ │
│ исследования ││обеззараженной воды в ││воды (по показаниям) │ │
│обеззараженной воды ││подостром эксперименте│└─────────────────────┘ │
└────────────────────┘│ на животных │ │
└───────────┬──────────┼───────────────────────┐ │
│ │ Рекомендации │ │
/ │ по продолжительности │<───┘
┌────────────────────┐ │использования человеком│
│Определение Lim │ │ обеззараженной воды │
│ subac│ └───────────────────────┘
│ (мг/кг/день) │
└────────────────────┘
┌──────────────────────────────────────────────────────────────┐
│III этап. Клинические испытания на добровольцах обеззараженной│
│ питьевой воды в режиме применения │
└─────────┬─────────────┬───────────┬─────────────────────┬────┘
/ │ / /
┌──────────────────────────┐ │┌───────────────────┐ ┌────────────────────┐
│ Санитарно-гигиеническая │ ││ Оценка качества │ │Клинико-лабораторные│
│оценка обеззараженной воды│ ││обеззараженной воды│ │ исследования │
└──────────────────────────┘ │└───────────────────┘ └────────────────────┘
/
┌────────────────────────────────────────────────────────────────┐
│Заключение о возможности применения средства для обеззараживания│
│ индивидуальных и групповых запасов питьевой воды │
└────────────────────────────────────────────────────────────────┘
Рис. 8.6. Методическая схема изучения токсичности средств
для обеззараживания
Она включает 3 этапа: на 1-м этапе проводятся доклинические исследования средств в эксперименте на лабораторных животных в целях их отбора на применение, на 2-м этапе проводятся доклинические исследования обеззараженной средствами питьевой воды в целях регламентации продолжительности ее применения, на 3-м этапе проводятся клинические испытания на добровольцах обеззараженной воды в режиме применения для подтверждения безопасности ее применения человеком и для выявления возможных проявлений ее побочного действия.
8.5.1. Перечень определяемых показателей для оценки
токсичности и опасности дезинфицирующих средств
на первом этапе их доклинических исследований
Перечень определяемых и оцениваемых на 1-м этапе показателей включает:
— определение состава средств и физико-химических свойств;
— определение острой токсичности средств при введении в желудок (ЛД );
50
— определение острой токсичности средств при нанесении на кожу (ЛД );
50
— определение острой ингаляционной опасности средств в насыщающих
концентрациях паров по степени летучести;
— определение пороговой дозы средств при введении в желудок в подостром
эксперименте (Lim , мг/кг);
subac
— определение зоны подострого биоцидного эффекта средств:
Lim (в желудок)
subac
Z = ——————————————-;
subac.bioc.eff Суточная норма расхода средств для человека
— оценку кумулятивного эффекта (K );
кум
— оценку местно-раздражающего действия средств на кожу повторно, 10 аппликаций;
— оценку местно-раздражающего действия средств на слизистые оболочки глаз;
— определение сенсибилизирующих свойств (по показаниям);
— определение отдаленных эффектов: эмбриотропного, гонадотропного, мутагенного, канцерогенного по показаниям.
8.5.2. Критерии отбора дезинфицирующих средств
для обеззараживания воды на первом этапе
Основным видом исследований является оценка опасности средств в рекомендуемом режиме применения, т.е. исходя из их суточной нормы N расхода человеком. С этой целью в подостром эксперименте на животных с пероральной затравкой в серии доз 1/2N; N; 3N и выше определяется пороговый уровень.
При сравнении токсичности средств (на пороговых уровнях) с их суточной
нормой расхода определяется такой специфический критерий, как зона
опасности биоцидного эффекта (Z ). По ее величине
subac.bioc.eff
устанавливается класс опасности средств в эффективном режиме применения и
определяются подходы к условиям их применения.
Так, при величине Z > 1 допустимо применение средств для
subac.bioc.eff
обеззараживания воды, а при Z < 1 применение средств
subac.bioc.eff
недопустимо. При Z = 1 (1-й класс опасности) применение
subac.bioc.eff
средств допустимо только по эпидпоказаниям.
Помимо этого, у средств на этом этапе проводится изучение острой токсичности, кумулятивного эффекта, раздражающих свойств на кожу и слизистые оболочки, а по показаниям — сенсибилизирующих и отдаленных эффектов. Дается также характеристика токсичности основным компонентам состава средства.
В состав дезинфицирующих средств не должны входить субстанции, относящиеся к 1-му классу опасности, с выраженными аллергенными и раздражающими свойствами, а также обладающие специфическими отдаленными эффектами (эмбриотропным, гонадотропным, мутагенным, канцерогенным).
8.5.3. Изучение токсичности обеззараженной средствами
питьевой воды на втором этапе
доклинических исследований
Обеззараживание дезинфектантами воды из природных источников (особенно сильно загрязненных и сомнительных по микробиологическому составу) не всегда позволяет полностью обеспечить соответствие предъявляемым к ней СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников» [20] требований по нормативным показателям качества воды. И в зависимости от местных природных и санитарных условий, а также эпидемической обстановки перечень контролируемых показателей качества воды может быть расширен по постановлению органов Госсанэпиднадзора РФ.
В случае несоответствия обеззараженной воды требованиям указанного СанПиН, для решения вопроса о возможности ее применения для питьевых целей требуется проведение подострого (до 3 мес.) токсикологического эксперимента, моделирующего на животных натурные условия потребления ими природной воды, обеззараженной в эффективных бактерицидных режимах [20].
8.5.3.1. Указанные исследования должны начинаться с проведения химико-аналитического определения обеззараженной воды на содержание дезинфектантов и возможных продуктов их трансформации. Так, при дезинфекции воды хлорсодержащими соединениями должно обязательно проводиться определение содержания свободного и связанного хлора и суммы галогеносодержащих соединений ГСС, особенно при хлорировании воды, содержащей органические соединения (в частности, гуминовые производные). Содержание и уровень в обеззараженной воде ГСС прогнозируют опасность развития таких отдаленных эффектов, как мутагенного, канцерогенного, что делает необходимой оценку такой воды на указанные проявления действия. Для этого используется природная вода в соответствии с заданными по ТЗ свойствами.
8.5.3.2. Целью подострого токсикологического эксперимента является установление «времени», гарантирующего безопасность использования человеком воды, обеззараженной в заданном эффективном режиме ее обработки. В этом случае безопасность может быть обеспечена ограничением времени использования такой воды людьми.
В подостром токсикологическом эксперименте на крысах моделируются условия водопотребления животными воды из природных водоемов, обеззараженной дезинфектантом в эффективных бактерицидных режимах.
Постановкой этого эксперимента прежде всего предусматривается оценка комбинированного воздействия на организм обеззараженной воды с учетом ее многокомпонентного состава, продуктов трансформации в воде и возможных примесей.
Основной целью исследований на этом этапе является выявление у животных
начальных пороговых изменений (Lim ) по лимитирующим эффектам. В
subac
эксперименте, во-первых, проводится оценка животными потребительских
вкусовых свойств воды с ежедневным контролем ее суточного потребления, а
также токсического действия: влияния на репродуктивную функцию,
желудочно-кишечный тракт, печень, проявления дисбактериоза. На этом уровне
обязателен контроль обратимости выявленных изменений в восстановительном
периоде.
8.5.3.3. Критерии безопасности применения обеззараженной питьевой воды.
В рекомендациях по продолжительности применения человеком обеззараженной воды исходим из времени выявления у животных пороговых изменений в подостром эксперименте.
И в соответствии с требованиями Фармкомитета МЗ СССР (Приказ N 1509 от 30.12.1983) [8] предлагаем следующие критерии: при выявлении у животных пороговых изменений через 3 месяца — продолжительность использования воды разрешается на месяц, при выявлении этих изменений через месяц — продолжительность использования воды разрешается на 10 — 15 дней, а при выявлении изменений в первые 3 дня — применение воды или вообще не разрешается, или разрешается только эпизодически.
Результатами собственных исследований ДС указанного назначения (Аквасепт, Неоаквасепт, Акватабс, Аквасан, Аквасан-Д и др.) на основе натриевой соли дихлоризоциануровой кислоты было установлено, что сроки выявления пороговых изменений у животных при использовании ими обеззараженной воды зависели в основном от концентрации в воде активного хлора.
8.5.3.4. Методы определения порога подострого действия у животных в подостром эксперименте.
Эксперимент проводится на крысах обоего пола. Подопытным животным спаивается обеззараженная вода из природных источников с ежедневной регистрацией ее суточного потребления, а контролю — водопроводная вода.
Для определения Lim используется комплекс лимитирующих
subac
показателей, отражающих в первую очередь органолептические свойства воды, а
также проявления ее общетоксического и специфического действия на основные
органы и системы организма (желудочно-кишечный тракт, микрофлору кишечника,
функции печени и почек и на другие органы). По показаниям может
планироваться и проводиться изучение репродуктивной функции, развитие
потомства первого поколения мутагенного эффекта.
Для обнаружения у животных пороговых изменений в ранние сроки их обследование следует начинать на стадии «первичной декомпенсации» патологического процесса, т.е. в первые две недели (на 2 — 4 — 8 — 15 день), применяя нагрузочные тесты для выявления первичных реакций.
8.5.4. Клинические испытания обеззараженной питьевой воды
в режиме применения
Окончательная проверка безопасности для человека рекомендованных в эксперименте на животных режимов применения обеззараженной воды дается на 3-м этапе с ее испытаниями на добровольцах.
Клинические испытания обязательно должны проводиться при проверке новых рецептур дезинфицирующих средств на основе новых дезинфицирующих субстанций.
Сначала проводится санитарно-гигиеническая оценка обеззараженной воды, включающая определение ее физико-химических и органолептических свойств.
Испытания обеззараженной воды на добровольцах включают анкетный опрос по оценке качества обеззараженной воды и клинико-лабораторное обследование.
При проведении биомедицинских исследований на людях в настоящее время необходимо соблюдение этических принципов Хельсинской декларации Всемирной медицинской ассоциации.
Учет побочных явлений у добровольцев проводится по разработанной анкете, табл. 8.12.
Таблица 8.12
АНКЕТА
учета побочных явлений у добровольца при потреблении
обеззараженной дезинфектантом питьевой воды
в рекомендованном режиме обработки
|
N п/п |
Ф.И.О. |
Пол |
Воз- раст |
Стаж работы |
Вид работы |
Побочное действие |
Роспись |
||||
|
диспеп- тиче- ские явления со сто- роны желу- дочно- кишеч- ного тракта |
нару- шения стула |
боли в пра- вом подре- берье |
желтая окраска склер |
отсут- ствие аппе- тита |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
1 |
|||||||||||
|
2 |
|||||||||||
|
3 |
|||||||||||
|
4 |
|||||||||||
|
… |
|||||||||||
|
и т.д. |
Подпись и должность лица, ответственного за проведение испытаний:
Печать учреждения:
При клинических испытаниях у добровольцев обязательно должна оцениваться функция желудочно-кишечного тракта и печени.
Подтверждением безопасности использования обеззараженной воды является отсутствие у 95% добровольцев проявлений побочного действия.
По результатам проведенных исследований дается окончательное заключение о возможности и безопасных сроках применения человеком обеззараженной дезинфектантами питьевой воды.
8.5.5. Методы определения других показателей качества
обеззараженной воды
При обеззараживании воды хлорсодержащими дезинфектантами должно проводиться определение свободного остаточного хлора методом йодометрического титрования (ГОСТ 18190, МУ 4.1.165-99) и суммы галогенсодержащих соединений, включая 10 высокоприоритетных веществ: хлороформа, четыреххлористого углерода, дибромметана, трихлорэтилена, перхлорэтилена, бромоформа, дихлорметана, 1,2-дихлорэтана и 1,2-дихлорэтилена.
Оценка органолептических свойств обеззараженной воды проводится по ее запаху и привкусу. На предварительном этапе эти показатели оцениваются полуколичественно (в баллах). Полученные величины сопоставляются с их допустимыми нормативами в питьевой воде (не более 4 баллов). К оценке запаха и привкуса привлекаются дегустаторы (не менее 5 — 7 человек). Характер запаха воды определяется при температуре 20 и 60 °C, а привкуса — при температуре 20 и 40 °C. Интенсивность запаха (и привкуса) оценивается по соответствующей 5-балльной шкале, табл. 8.13.
Таблица 8.13
ШКАЛА ИНТЕНСИВНОСТИ ЗАПАХА, ПРИВКУСА
|
Характер проявления |
Оценка интенсив- ности баллов |
|
Не ощущается |
0 |
|
Не ощущается населением, но обнаруживается опытным дегустатором |
1 |
|
Замечается населением, если обратить на это его внимание |
2 |
|
Легко обнаруживается и вызывает неодобрительный отзыв о воде |
3 |
|
Обращает на себя внимание и заставляет воздерживаться от питья |
4 |
|
Настолько сильный, что делает воду непригодной для употребления |
5 |
8.5.6. Оценка реальной опасности риска обеззараженной воды
При хлорировании обеззараженной воды ее опасность связана с присутствием в ней хлора. Для постоянного потребления питьевой воды концентрация хлора не должна быть выше 0,5 мг/л. Однако при непродолжительном использовании воды эта концентрация может быть превышена. Так, по ГОСТ 27283-87 на особый период допускается непрерывное потребление обеззараженной воды в течение 7 — 10 суток при содержании в ней остаточного хлора до 10 мг/л [28].
Что касается показателей качества обеззараженной воды в режиме применения по органолептическим свойствам (запаху, привкусу), то они не должны превышать 4 баллов.
Критериями безопасности средств для обеззараживания или обеззараживания и очистки индивидуальных и групповых запасов питьевой воды разработаны Г.Н. Заевой и соавторами и представлены в табл. 8.14.
Таблица 8.14
КРИТЕРИИ БЕЗОПАСНОСТИ СРЕДСТВ ДЛЯ ОБЕЗЗАРАЖИВАНИЯ
ИНДИВИДУАЛЬНЫХ И ГРУППОВЫХ ЗАПАСОВ
ПИТЬЕВОЙ ВОДЫ [34]
┌─────────────────┬──────────────────────────────┬──────────────────────┬──────────────┐
│ Назначение │ Исследуемые показатели │Нормативные показатели│ Разрешено │
│ средства │ ├──────────┬───────────┤ применение │
│ │ │ величина │ класс │ │
│ │ │показателя│ опасности │ │
├─────────────────┼──────────────────────────────┼──────────┼───────────┼──────────────┤
│ 1 │ 2 │ 3 │ 4 │ 5 │
├─────────────────┴──────────────────────────────┴──────────┴───────────┴──────────────┤
│ Доклинические испытания средств │
├─────────────────┬──────────────────────────────┬──────────┬───────────┬──────────────┤
│Средства для │Острая токсичность при │не │3 — 4 │ │
│обеззараживания │введении в желудок (ЛД , │менее 151 │ │ │
│или обеззаражи- │ 50 │ │ │ │
│вания и очистки │мг/кг) │ │ │ │
│индивидуальных и ├──────────────────────────────┼──────────┼───────────┤ │
│групповых запасов│Острая токсичность при │не │3 — 4 │ │
│питьевой воды │нанесении на кожу (ЛД , │менее 501 │ │ │
│(таблетки, │ 50 │ │ │ │
│порошки, │мг/кг) │ │ │ │
│растворы, ├──────────────────────────────┼──────────┼───────────┤ │
│гранулы) │Острая ингаляционная опасность│<= Lim │3 — 4 │ │
│ │в насыщающих концентрациях │ ac │ │ │
│ │(C ) │ │ │ │
│ │ 20 │ │ │ │
│ ├──────────────────────────────┼──────────┼───────────┤ │
│ │Местно-раздражающее действие │не более 4│3 — 4 │ │
│ │средства на кожу (повторно, │ │ │ │
│ │10 аппликаций), баллы │ │ │ │
│ ├──────────────────────────────┼──────────┼───────────┤ │
│ │Местно-раздражающее действие │не более 3│4 — 5 │ │
│ │средства на слизистые оболочки│ │ │ │
│ │глаз однократно, баллы │ │ │ │
│ ├──────────────────────────────┼──────────┼───────────┤ │
│ │Сенсибилизирующее действие │Отсутствие│Не норми- │ │
│ │(по показаниям) │эффекта │руется │ │
│ ├──────────────────────────────┼──────────┼───────────┤ │
│ │Отдаленные эффекты: │ │3 — 4 │ │
│ │гонадотропный, мутагенный, │ │ │ │
│ │канцерогенный (по показаниям) │ │ │ │
│ ├──────────────────────────────┼──────────┼───────────┤ │
│ │Определение пороговой дозы │ │ │ │
│ │средств при введении в желудок│ │ │ │
│ │в подостром эксперименте │ │ │ │
│ │(Lim , мг/кг) │ │ │ │
│ │ subac │ │ │ │
│ ├──────────────────────────────┼──────────┼───────────┼──────────────┤
│ │Определение зоны подострого │>= 1 │ │Разрешено │
│ │биоцидного эффекта средств │ │ │производство и│
│ │ Lim │ │ │применение │
│ │ subac │ │ │средств для │
│ │ (по лимити- │ │ │обеззаражива- │
│ │ рующему │ │ │ния индивиду- │
│ │ эффекту) │ │ │альных и груп-│
│ │Z = ———— │ │ │повых запасов │
│ │ subac.bioc.eff Суточная │ │ │питьевой воды │
│ │ норма │< 1 │ │Недопустимо │
│ │ расхода │ │ │применение │
│ │ │ │ │средства в │
│ │ │ │ │указанных │
│ │ │ │ │целях │
├─────────────────┴──────────────────────────────┴──────────┴───────────┴──────────────┤
│ Доклинические испытания обеззараженной природной воды в режиме применения │
├─────────────────┬──────────────────────────────┬──────────┬───────────┬──────────────┤
│Питьевая вода, │Местно-раздражающее действие │0 — 2 │5 │ │
│обработанная │на кожу обеззараженной воды в │ │ │ │
│дезинфицирующим │режиме применения │ │ │ │
│средством в │10 аппликаций, баллы │ │ │ │
│режиме применения├──────────────────────────────┼──────────┼───────────┼──────────────┤
│по действующему │Местно-раздражающее действие │0 │5 │ │
│веществу │на слизистые оболочки глаза │ │ │ │
│ │обеззараженной воды в режиме │ │ │ │
│ │применения однократно, баллы │ │ │ │
│ ├──────────────────────────────┼──────────┼───────────┼──────────────┤
│ │Мутагенная активность │Не │ │Допустимо │
│ │обеззараженной воды по │выявлена │ │применение │
│ │показаниям │ │ │воды │
│ │ │Выявлена │ │Недопустимо │
│ │ │ │ │применение │
│ │ │ │ │воды │
│ ├──────────────────────────────┼──────────┼───────────┼──────────────┤
│ │Определение порога действия │1 — 3 │ │Эпизодическое │
│ │обеззараженной природной воды │ │ │применение │
│ │в подостром эксперименте │ │ │воды или │
│ │(Lim ) │ │ │запрет │
│ │ subac │30 │ │Применение │
│ │ │ │ │воды в течение│
│ │ │ │ │10 — 15 дней │
│ │ │90 │ │Применение │
│ │ │ │ │воды в течение│
│ │ │ │ │месяца │
├─────────────────┴──────────────────────────────┴──────────┴───────────┴──────────────┤
│ Клинические испытания на добровольцах обеззараженной │
│ воды в режиме применения │
├─────────────────┬──────────────────────────────┬──────────┬───────────┬──────────────┤
│ │Показатели качества воды, │Не более 4│ │ │
│ │органолептические свойства │ │ │ │
│ │обеззараженной воды в режиме │ │ │ │
│ │применения (запах, привкус), │ │ │ │
│ │баллы │ │ │ │
│ ├──────────────────────────────┼──────────┼───────────┼──────────────┤
│ │Клинико-лабораторные │Отсутствие│ │Подтверждается│
│ │исследования на добровольцах │проявлений│ │безопасность │
│ │обеззараженной воды в │побочного │ │и эффектив- │
│ │рекомендуемом режиме │действия у│ │ность обезза- │
│ │применения │95% добро-│ │раживания │
│ │ │вольцев │ │индивидуальных│
│ │ │ │ │и групповых │
│ │ │ │ │запасов питье-│
│ │ │ │ │вой воды в │
│ │ │ │ │рекомендуемом │
│ │ │ │ │режиме приме- │
│ │ │ │ │нения. Разре- │
│ │ │ │ │шается произ- │
│ │ │ │ │водство и │
│ │ │ │ │применение │
│ │ │ │ │средств │
│ │ │ │ │указанного │
│ │ │ │ │назначения │
└─────────────────┴──────────────────────────────┴──────────┴───────────┴──────────────┘
8.6. Методы изучения токсичности и опасности средств
для обеззараживания воды плавательных бассейнов
Обработанная дезинфицирующими средствами вода плавательных бассейнов может оказывать на человека комплексное воздействие в связи с поступлением дезинфектанта через органы дыхания, кожные покровы и желудочно-кишечный тракт при ее случайном заглатывании.
По своему составу и качеству обеззараженная вода плавательных бассейнов должна соответствовать нормативам, приведенным в СаНПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества» [22].
В качестве основных методов обеззараживания воды используется хлорирование, бромирование, озонирование, а также ультрафиолетовое облучение и их комбинации.
8.6.1. Методическая схема изучения и критерии оценки
дезинфицирующих средств для обеззараживания воды
плавательных бассейнов
Изучение дезинфицирующих средств, предназначенных для обработки воды плавательных бассейнов, следует проводить по 3-этапной схеме:
— на 1-м этапе изучается токсичность и опасность самих дезинфицирующих средств;
— на 2-м этапе в подостром токсикологическом эксперименте на животных проводится изучение обеззараженной воды с оценкой ее комплексного воздействия на организм;
— при необходимости осуществляется проведение 3-го этапа — практических испытаний на добровольцах с проверкой рекомендуемых режимов обеззараживания воды в бассейнах разного типа, схема аналогична представленной в п. 8.5.1.
Перечень определяемых показателей на 1-м этапе существенно не
отличается от таковых при изучении других дезинфицирующих средств,
изложенных в п. 8.2.3. Исключаются лишь п. 8.2.3.3 (внутрибрюшинное
введение) и п. 8.2.3.12 (на ИМН), но вводится дополнительно определение
орально-кожного коэффициента (K ), выражаемого в виде отношения: K =
о/к о/к
ЛД в желудок
50
—————, характеризующего кожно-резорбтивное действие испытываемого
ЛД на кожу
50
дезинфектанта, п. 8.2.3.8.
Критерии отбора ДС на 1-м этапе. В составы дезинфицирующих средств не должны входить субстанции, относящиеся к 1-му классу опасности, а также обладающие отдаленными специфическими эффектами с выраженными аллергенными, раздражающими, кожно-резорбтивными и кумулятивными свойствами [69].
По критериям отбора на 1-м этапе дезинфицирующие средства указанного
назначения должны в основном соответствовать требованиям, предъявляемым к
средствам бытового назначения, относиться к 3 — 4-му классам умеренно и
малоопасных веществ. Однако для специалистов, имеющих право заниматься
водоподготовкой воды для плавательных бассейнов, разрешается использование
средств, относящихся по острой токсичности при введении в желудок, по
коэффициенту K , по опасности при ингаляции в насыщающих концентрациях
о/к
паров и по степени выраженности местно-раздражающего действия на кожу ко
2-му классу опасности.
Однако при этом использоваться такие средства могут только при водоподготовке, со средствами индивидуальной защиты органов дыхания и кожных покровов и только специалистами, имеющими право заниматься такой водоподготовкой.
8.6.2. Токсикологическое изучение и оценка качества
обеззараженной дезинфектантами воды плавательных бассейнов,
2-й этап
8.6.2.1. Исследования должны начинаться с проведения химико-аналитического определения в воде содержания дезинфектантов и возможных продуктов их трансформации.
Контроль остаточного содержания дезинфектантов проводится химическими методами (в соответствии с видом дезинфектанта).
При хлорировании, бромировании или озонировании воды проводится определение остаточных количеств соответственно свободного хлора, брома или озона в сопоставлении с нормативами их допустимого содержания. При обеззараживании воды гипохлоритом натрия, получаемым электролизом поваренной соли, определяется содержание хлора и концентрация хлоридов.
При контроле хлорирования воды в ней должен также определяться индикаторный компонент галогеносодержащих соединений — хлороформ, содержание которого сопоставляется с допустимым нормативом (не более 0,1 мг/л). Повышенное содержание в обеззараженной воде хлороформа создает опасность развития таких отдаленных эффектов, как мутагенный и канцерогенный. В этой связи необходимой является оценка такой воды на мутагенную активность.
Помимо этого проводится определение органолептических и физико-химических показателей обеззараженной воды — запаха, привкуса, цветности и мутности.
При соответствии регистрируемых показателей качества обеззараженной воды в процессе ее эксплуатации в ванне бассейна требованиям СанПиН 2.1.2.1188-03 [22] она может использоваться в плавательных бассейнах без ограничений.
8.6.2.2. При обеззараживании воды плавательных бассейнов новыми дезинфектантами для решения вопроса о возможности их использования следует проводить подострый (1,0 — 1,5 месяца) токсикологический эксперимент, моделирующий на животных условия воздействия на них воды, обеззараженной дезинфектантом в эффективных бактерицидных режимах.
В эксперименте используются крысы обоего пола, которые плавают в закрытом бассейне с обеззараженной водой по 15 мин. в день. Вода в бассейне должна быть подогрета до 25 — 27 °C. Закрытый бассейн используется для создания в воздухе концентраций летучих компонентов дезинфектанта.
При такой постановке в эксперименте оценивается комплексное воздействие на организм животных обеззараженной дезинфектантом воды в режиме применения — через кожные покровы и при ингаляционном воздействии. Кроме того, поскольку при плавании человек может заглатывать до 200 мл воды (3 г/кг), животным предварительно вводится в желудок эквивалентное их весу количество обеззараженной воды.
Целью эксперимента является определение одного показателя — порогового
уровня подострого токсического действия дезинфектанта на животных
(Lim ).
subac
Для этого проводится серия экспериментов с разными концентрациями дезинфектанта в обеззараженной воде. Их уровни выбираются с ориентиром на реальную концентрацию рабочего раствора средства (норму расхода), обеспечивающую требуемый эффект обеззараживания воды.
Для установления Lim средства используется комплекс лимитирующих
subac
показателей, отражающих как органолептические свойства обработанной воды,
так и проявления общетоксического и специфического действия средства на
основные органы и системы организма (органы дыхания, желудочно-кишечный
тракт, состояние кожных покровов и слизистых). Обследование животных
следует проводить в динамике, через каждые 2 недели. По показаниям может
проводиться также изучение отдаленных эффектов воздействия (мутагенный в
системе тестов, состояние репродуктивной функции, развитие потомства
первого поколения).
8.6.2.3. Критерии оценки.
В качестве критерия оценки степени опасности средств, предназначенных
для обеззараживания воды плавательных бассейнов в режиме применения,
рекомендуется показатель, аналогичный критерию опасности других
дезинфекционных средств, — зона биоцидного действия — Z (п.
bioc.eff
8.2.3.9). В данном случае этот показатель определяется как отношение
пороговой концентрации средства в подостром эксперименте (Lim ) к его
subac
рабочей концентрации (норма расхода) и выражается величиной
Z .
subac.bioc.eff
Эта величина характеризует степень опасности средства при
обеззараживании воды плавательных бассейнов. Чем больше величина
Z , тем меньше опасность средства, и наоборот. В зависимости
subac.bioc.eff
от этой величины предлагаются рекомендации по условиям использования
средств для обеззараживания воды в плавательных бассейнах:
— при Z < 1 — средства не разрешаются для обеззараживания
subac.bioc.eff
воды плавательных бассейнов;
— при Z > 10 — средства рекомендуются без ограничения для
subac.bioc.eff
обеззараживания воды всех видов плавательных бассейнов с использованием как
населением, так и обученным персоналом;
— при Z , лежащей в интервале от 1 до 10, — средства в
subac.bioc.eff
основном могут применяться в бассейнах, в которых обеззараживанием воды
занимается обученный персонал, при ограничении их использования широкими
кругами населения. Не следует рекомендовать указанные средства для
обеззараживания воды плавательных бассейнов для детей, особенно младшего
возраста.
Средства, обнаруживающие в эксперименте величину Z в
subac.bioc.eff
интервале от 1 до 10, следует направлять на практические испытания.
8.6.3. Практические испытания обеззараженной воды
плавательных бассейнов в рекомендуемом режиме применения
дезинфицирующих средств, 3-й этап
Третий этап включает практические испытания обеззараженной воды плавательных бассейнов на добровольцах с проведением анкетно-статистического анализа и клинико-лабораторных исследований. При этом проводится проверка рекомендованных на основании эксперимента безопасных режимов использования обеззараженной воды. Испытания должны проводиться в 2 — 3 бассейнах разного вида продолжительностью 0,5 — 1,0 месяц.
В опыте должно быть не менее 25 — 50 человек разного возраста, пола, включая детей с 5 лет.
В практических испытаниях у добровольцев обязательно должно оцениваться состояние верхних дыхательных путей, желудочно-кишечного тракта, кожных покровов и слизистых. В состав специалистов должны входить: отоларинголог, дерматолог, аллерголог и гастроэнтеролог.
Учет побочных явлений у добровольцев проводится по разработанной анкете, табл. 8.15.
Таблица 8.15
АНКЕТА
учета побочных явлений добровольца при проведении
практических испытаний обеззараженной дезинфицирующим
средством воды плавательных бассейнов
|
N п/п |
Ф.И.О. |
Пол |
Воз- раст |
Продол- житель- ность плава- ния |
Побочное действие |
Рос- пись |
|||||
|
слезо- тече- ние |
кашель, насморк |
перше- ние в горле и в носу |
зуд, покрас- нение кожи, сли- зистых |
диспеп- тические явления со сто- роны же- лудочно- кишеч- ного тракта |
голов- ная боль, голо- вокру- жение |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
1 |
|||||||||||
|
2 |
|||||||||||
|
3 |
|||||||||||
|
… |
|||||||||||
|
и т.д. |
Примечание: использование средств защиты глаз обозначить «+», отсутствие — знаком «-«.
Подпись и должность лица, ответственного за проведение испытаний:
Печать учреждения:
Практические испытания обязательно должны проводиться при проверке новых рецептур дезинфицирующих средств на основе новых дезинфицирующих субстанций.
После проведения практических испытаний уточняются рекомендации о сфере и условиях применения средства для обеззараживания воды плавательных бассейнов, табл. 8.16.
Таблица 8.16
КРИТЕРИИ БЕЗОПАСНОСТИ СРЕДСТВ ДЛЯ ОБЕЗЗАРАЖИВАНИЯ ВОДЫ
ПЛАВАТЕЛЬНЫХ БАССЕЙНОВ
┌────────────┬────────────────────┬─────────────────────────┬─────────────┐
│Оцениваемый │ Исследуемые │ Нормативные величины │ Разрешено │
│ объект │ показатели ├────────────┬────────────┤ применение │
│ │ │оцениваемого│ класса │ │
│ │ │ показателя │ опасности │ │
├────────────┼────────────────────┼────────────┼────────────┼─────────────┤
│ 1 │ 2 │ 3 │ 4 │ 5 │
├────────────┼────────────────────┼────────────┼────────────┼─────────────┤
│1. Средства │Острая токсичность │Не менее 15 │3 │Специалистам │
│для │при введении в │ │ │<*> │
│обработки │желудок (ЛД , │Не менее 151│4 │Без ограни- │
│воды │ 50 │ │ │чений │
│плавательных│мг/кг) │ │ │ │
│бассейнов ├────────────────────┼────────────┼────────────┼─────────────┤
│(таблетки, │Острая токсичность │Не менее 501│Высокоопасно│ │
│порошки, │при нанесении на │ │ │ │
│жидкости, │кожу (ЛД , │ │ │ │
│гранулы) │ 50 │ │ │ │
│ │мг/кг) │ │ │ │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Орально-кожный │> 1 │Относительно│ │
│ │коэффициент (K ) │<= 1 │или мало- │ │
│ │ о/к │ │опасно │ │
│ │ │ │ │ │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Острая ингаляционная│> Lim │3 │Специалистам │
│ │опасность в насыщаю-│ ac │ │<*> │
│ │щих концентрациях │<= Lim │4 │Без ограни- │
│ │паров (C ) │ ac │ │чений │
│ │ 20 │ │ │ │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Кумулятивный эффект │Более 5 │4 │Без ограни- │
│ │ │ │ │чений │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Сенсибилизирующее │Слабое или │4 │Без ограни- │
│ │действие │отсутствие │ │чений │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Кожно-резорбтивное │Отсутствие │4 │Без ограни- │
│ │действие │ │ │чений │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Местно-раздражающее │2,1 — 4,0 │3 │Специалистам │
│ │действие на кожу │ │ │<*> │
│ │однократно, баллы │0 — 2 │4 │Без ограни- │
│ │ │ │ │чений │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Местно-раздражающее │0 — 3 │4 — 5 │Без ограни- │
│ │действие на слизис- │ │ │чений │
│ │тые оболочки глаз │ │ │ │
│ │однократно, баллы │ │ │ │
├────────────┼────────────────────┼────────────┼────────────┼─────────────┤
│2. Вода │Оценка токсичности │ │ │ │
│плавательных│обеззараженной воды │ │ │ │
│бассейнов, │(комплексное воздей-│ │ │ │
│обеззаражен-│ствие) в подостром │ │ │ │
│ная дезинфи-│эксперименте на │ │ │ │
│цирующим │животных │ │ │ │
│средством в │1,0 — 1,5 мес. │ │ │ │
│режиме при- ├────────────────────┼────────────┼────────────┼─────────────┤
│менения │Определение │ │ │ │
│ │порогового уровня │ │ │ │
│ │(Lim ) по лими- │ │ │ │
│ │ subac │ │ │ │
│ │тирующим эффектам │ │ │ │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Определение зоны │< 1 │ │Не рекомен- │
│ │подострого │ │ │дуются для │
│ │биоцидного эффекта │ │ │обеззаражива-│
│ │(Z ) │ │ │ния воды │
│ │ subac.bioc.eff │ │ │бассейнов │
│ │ │1 — 10 │ │С регламента-│
│ │ │ │ │цией условий │
│ │ │ │ │применения │
│ │ │ │ │или запреще- │
│ │ │ │ │нием примене-│
│ │ │ │ │ния в бассей-│
│ │ │ │ │нах │
│ │ │> 10 │ │Рекомендуется│
│ │ │ │ │без ограниче-│
│ │ │ │ │ний примене- │
│ │ │ │ │ния в │
│ │ │ │ │бассейнах │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Оценка реальной │> 1 │Не норми- │Специалистам │
│ │опасности средства в│ │руется │<*> │
│ │рекомендованных │< 1 │ │Без ограни- │
│ │режимах применения, │ │ │чений │
│ │фактор безопасности │ │ │ │
│ ├────────────────────┼────────────┼────────────┼─────────────┤
│ │Практические │ │Отсутствие │В соответст- │
│ │испытания на │ │изменений у │вии с заклю- │
│ │добровольцах │ │95% обследо-│чением о │
│ │ │ │ванных │возможности │
│ │ │ │ │применения │
│ │ │ │ │средства │
├────────────┼────────────────────┼────────────┼────────────┼─────────────┤
│3. Средства │Требования те же, │ │ │ │
│для обезза- │что изложены в п. 1 │ │ │ │
│раживания │(средства для │ │ │ │
│чаши │обработки воды │ │ │ │
│бассейнов │плавательных │ │ │ │
│(порошки, │бассейнов) │ │ │ │
│таблетки, │ │ │ │ │
│гранулы, │ │ │ │ │
│жидкости) │ │ │ │ │
├────────────┴────────────────────┴────────────┴────────────┴─────────────┤
│ <*> Специалисты: обученный персонал организаций, имеющих право│
│заниматься подготовкой воды. │
└─────────────────────────────────────────────────────────────────────────┘
8.7. Методы изучения токсичности и опасности
дезинсекционных средств
Настоящие рекомендации разработаны в развитие действующих методических указаний и составлены на основе анализа отечественных и зарубежных достижений в этой области за последние годы с учетом современных требований к оценке опасности дезинсекционных средств.
Использование дезинсекционных средств имеет свои специфические особенности: средства применяются в замкнутых, небольшого объема помещениях с ограниченным воздухообменом. При этом для достижения биоцидного эффекта в воздухе помещения могут создаваться сложные парогазоаэрозольные комплексы инсектицидов, нередко превышающие их предельно допустимые уровни.
В этих условиях с препаратами возможен контакт двух категорий лиц: профессионального контингента в процессе проведения дезобработок, а после их проведения — практически всего населения разных возрастных групп и состояния здоровья.
Дезинсекционные средства представляют собой сложные комбинации, состоящие из действующего начала и вспомогательных ингредиентов (растворителей, сорастворителей, наполнителей, отдушек, пропеллентов). Наличие в их рецептурах действующих веществ (с биоцидным эффектом для целевых видов) разной токсичности и особенности действия может представлять опасность и для здоровья человека.
С гигиенических позиций средства для дезинсекции должны соответствовать следующим требованиям:
— не накапливаться в объектах внешней среды;
— не образовывать более стойкие продукты превращения;
— не вызывать острых и хронических отравлений у людей в рекомендуемой концентрации и норме расхода;
— не вызывать отдаленных проявлений у ныне живущих и последующих поколений людей;
— должны быть менее токсичными и менее опасными для здоровья населения по сравнению с применяемыми средствами того же назначения;
— не оказывать влияния на полезную флору и фауну.
Токсиколого-гигиенические исследования вновь внедряемых дезинсекционных средств осуществляется по 3-этапной программе с учетом их назначения, условий и сферы применения.
Схема исследования представлена на рис. 8.17.
┌─────────────────────────────────┐
┌──────────┤I этап. Сбор первичной информации├───────┐
/ └─┬─────────────────────────┬─────┘ │
┌─────────────────┐ │ ┌───────────────────┐ │ ┌───────┐ │
│ Информация │ │ │ Сведения │ │ │ Норма │ │
│ о токсичности │ │ │о физико-химических│<──┘ │расхода│<──┘
│ и опасности │ │ │ свойствах │ └───────┘
│ ингредиентов │ │ └───────────────────┘
│ средства. │ │
│ При отсутствии │ │ ┌────────────────────────────────────────────────┐
│токсикологической│ └─>│II этап. Оценка токсичности и опасности средства│
│ характеристики │ │ в модельных опытах на лабораторных животных │
│ компонентов │ └──────────────────────────┬─────────────────────┘
│ проводится │ /
│ их изучение │ ┌───────────────────────────────────────────────┐
└─────────────────┘ │ I подэтап. Отборочный. Оценка параметров │
│ острой токсичности │
└┬─────────────────┬──────────────────┬─────────┘
/ / /
┌─────────┐ ┌───────┐ ┌────────────────────┐
│ ЛД │ │ ЛД │ │Опасность по степени│
┌─────┤ 50 ├──────┐ │ 50 │ │ летучести │
│ │в желудок│ │ │на кожу│ └──────────┬─────────┘
/ └─┬───────┘ │ └───┬───┘ │
┌─────────┐ │ │ │ │
│Lim при│ │ ┌─────────┐ │ / │
│ ac │ │ │ Lim │ │ ┌─────┐ │
│ингаляции│ └─>│ subac│ └───>│Отбор│<──────────────┘
└─────────┘ │ при │ └──┬──┘
│ингаляции│ │
└─────────┘ /
┌────────────────────────────────────────────────────────┐
│II подэтап. Углубленная оценка. Исследование токсичности│
┌──────────┤ и опасности средства в рекомендуемом режиме │
│ │ и норме применения │
/ └───────┬────────────────────┬───────────────────┬───────┘
┌──────────┐ / / /
│Мутагенез │┌───────────────────────┐┌────────────────┐ ┌─────────────────┐
│(скрининг)││ Местно-раздражающее ││ Кожно- │ │Сенсибилизирующее│
└──────────┘│ действие на кожу ││ резорбтивное │ │ действие │
│ и слизистые оболочки ││действие рабочих│ └─────────────────┘
│глаз средства и рабочих││ концентраций │
│ концентраций │└────────────────┘
└───────────────────────┘
Рис. 8.17. Методическая схема оценки токсичности
и опасности средств дезинсекции
I этап — сбор первичной информации.
Первый этап включает анализ и обобщение данных литературы по токсичности ведущих и вспомогательных компонентов средства с регламентацией их содержания в рецептуре.
Прогнозирование токсичности и опасности средства согласно сведениям о его энтомологической эффективности и токсичности ингредиентов композиции, их физико-химических свойствах. В случае отсутствия токсикологических характеристик одного из компонентов композиции (действующее вещество, растворитель, пропеллент) проводится его исследование по общепринятым в токсикологии методам с установлением основных параметров токсикометрии и оценкой опасности, гигиенических нормативов в объектах окружающей среды.
II этап — оценка токсичности и опасности средства в модельных опытах на лабораторных животных.
Второй этап подразделяется на два подэтапа.
I подэтап — отборочный. Оценка параметров острой токсичности средства.
В отборочный подэтап исследований входит определение параметров острой токсичности и характера действия средства при потенциально опасных путях поступления в организм (ингаляционно, введении в желудок, нанесении на кожу).
На основании полученных результатов исследования проводится отбор дезинсекционных средств на дальнейшее углубление изучения с учетом его назначения, способа и формы применения. В этих целях разработаны критерии отбора, которые служат целям внедрения в практику наименее токсичных и опасных средств.
II подэтап — углубленная оценка. Исследование токсичности и опасности средства в рекомендуемом режиме и норме применения. Основной целью II подэтапа исследований является оценка степени реальной опасности дезинсекционных средств в рабочих концентрациях и норме расхода с учетом конкретных условий применения. Оценку токсичности и опасности средств проводят в модельных опытах на лабораторных животных согласно рекомендуемому режиму применения и возможных путей поступления в организм человека.
В задачу указанных исследований входит:
— установление порогов вредного действия при ингаляционном воздействии средства с учетом интегральных и специфических показателей в условиях острого и подострого эксперимента с расчетом зоны острого и подострого биоцидного эффекта;
— изучение кожно-резорбтивного и местно-раздражающего действия средств в нативном виде и в рабочих концентрациях на неповрежденные кожные покровы;
— исследование сенсибилизирующего действия состава;
— исследование мутагенных свойств средства (по показаниям).
На основании комплекса проведенных исследований дезинсекционных средств составляется инструкция (или текст этикетки) по применению средства для III этапа с проверкой надежности рекомендованного режима его безопасного применения.
III этап — оценка реальной опасности средств в рекомендуемом режиме применения в натурных условиях.
III этап включает: определение фактора безопасности в реальных условиях применения средства и проведение практических испытаний (при необходимости). С целью оценки потенциальной и реальной опасности риска для здоровья людей, использующих ДС, рассматривается модель, предложенная отечественными учеными А.И. Потаповым, В.Н. Ракитским, А.В. Ильницкой и другими для гигиенической оценки условий труда при применении пестицидов [63], адаптированная по условиям использования к дезинсекционным средствам.
Предлагаемая модель оценки реальной опасности моделирует два основных потенциально опасных пути поступления средств в организм — через органы дыхания и кожные покровы.
Указанная модель позволяет оценить предполагаемую опасность как
суммацию определяемых факторов безопасности (S ), которые характеризуются
F
отношением между наблюдаемыми фактическими уровнями воздействия средств в
воздухе помещения и на кожу к их гигиеническим нормативам (ПДК ,
в.р.з
ОБУВ (для специалистов); ПДК ; ОБУВ (для населения);
в.р.з ат.н.м ат.н.м
ОДУ на кожу).
Практические испытания в натурных условиях проводят согласно инструкции, разработанной для каждого конкретного ДС. На основе результатов этого этапа проводится проверка надежности и безопасности рекомендованных режимов применения и средств индивидуальной защиты.
В объем III этапа входит наблюдение за лицами, проводящими обработку помещений, путем анкетного опроса с регистрацией субъективных признаков возможного неблагоприятного действия средств. При разработке анкет учитывается назначение средства, его препаративная форма, способ применения, потенциально опасный путь поступления в организм, клинические симптомы проявления интоксикации, установленные в эксперименте на животных, длительность контакта, средства индивидуальной защиты при работе со средством. По результатам проведенных исследований разрабатывается окончательный вариант мер предосторожности для специалистов, имеющих право заниматься дезинфекционной практикой, и населения.
8.7.1. Перечень необходимых токсикологических показателей
токсичности и опасности дезинсекционных средств
8.7.1.1. Перечень необходимых токсикологических показателей дезинфекционных средств в форме эмульгирующихся концентратов, смачивающихся порошков, микрокапсул, красок, растворов, таблеток:
— острая токсичности средства при введении в желудок (ЛД );
50
— острая токсичность дезинсекционного средства при нанесении на кожу
(ЛД );
50
— опасность по степени летучести средства;
— местно-раздражающее действие на кожу дезинсекционного средства при однократном воздействии;
— опасность по степени летучести рабочих концентраций средства;
— местно-раздражающее действие на кожу рабочих концентраций средства в подостром эксперименте;
— местно-раздражающее действие нативного средства на слизистые оболочки глаз при однократном воздействии;
— сенсибилизирующее действие;
— ингаляционная опасность рабочих концентраций средства в режиме применения (в момент обработки) при однократном воздействии. Определение порога острого ингаляционного действия с расчетом зоны острого биоцидного эффекта;
— ингаляционная опасность остаточных количеств средства после проведения дезинсекционных мероприятий в помещении. Определение порога подострого ингаляционного действия паров средства при круглосуточном воздействии с расчетом зоны подострого биоцидного эффекта;
— мутагенное действие по показаниям;
— кожно-резорбтивное действие рабочих концентраций средства в подостром эксперименте;
— исследование опасности средства в натурных условиях. Определение
фактора безопасности (S );
F
— проведение практических испытаний (при необходимости).
8.7.1.2. Перечень необходимых токсикологических показателей для дезинсекционных средств в форме аэрозольных баллонов:
— ингаляционная опасность средства в виде аэрозолей и паров при однократном воздействии в рекомендуемом режиме применения. Определение порога однократного действия с расчетом зоны острого биоцидного эффекта;
— ингаляционная опасность средства (остаточных количеств) после проведения дезинсекции помещения. Определение порога подострого действия с расчетом зоны подострого биоцидного эффекта;
— местно-раздражающее действие на кожу однократно;
— местно-раздражающее действие на слизистые оболочки глаз однократно;
— кожно-резорбтивное действие однократно;
— сенсибилизирующее действие;
— оценка реальной опасности средства в рекомендованных режимах применения.
8.7.1.3. Перечень необходимых токсикологических показателей пиротехнических и фумигирующих дезинсекционных средств: шашки, спирали, таблетки:
— острая токсичность средства при введении в желудок (ЛД );
50
— местно-раздражающее действие на слизистые оболочки глаз однократно;
— сенсибилизирующее действие;
— ингаляционная опасность средства при однократном воздействии (в момент обработки помещения). Определение порога острого действия с расчетом зоны острого биоцидного эффекта;
— определение порога подострого ингаляционного действия паров средства при круглосуточном воздействии с расчетом зоны подострого биоцидного эффекта;
— мутагенное действие по показаниям;
— оценка реальной опасности средства в натурных условиях. Определение фактора безопасности;
— проведение практических испытаний по необходимости.
8.7.1.4. Перечень токсикологических показателей для дустов, брикетов, приманок, карандашей, гелей, готовых к употреблению растворов, суспензий:
— острая токсичность средства при введении в желудок (ЛД );
50
— острая токсичность средства при нанесении на кожу (ЛД );
50
— опасность по степени летучести средства;
— ингаляционная опасность средства в режиме применения при однократном воздействии. Определение порога острого действия с расчетом зоны острого биоцидного эффекта;
— ингаляционная опасность остаточных количеств средства после проведения дезинсекции. Определение порога подострого действия с расчетом зоны подострого биоцидного эффекта;
— кожно-резорбтивное действие средства в подостром эксперименте;
— местно-раздражающее действие средства на кожу в подостром эксперименте;
— местно-раздражающее действие на слизистые оболочки глаз однократно;
— сенсибилизирующее действие;
— мутагенное действие по показаниям;
— оценка реальной опасности средства в рекомендуемом режиме применения. Фактор безопасности;
— практические испытания при необходимости.
8.7.2. Методы определения и оценки токсичности и опасности
дезинсекционных средств
8.7.2.1. Определение среднесмертельной дозы средства при однократном
введении в желудок (ЛД ) (п. 8.2.2.1).
50
Оценку результатов проводят в соответствии с Классификацией опасности средств дезинсекции по параметрам острой токсичности, табл. 8.18.
Таблица 8.18
КЛАССИФИКАЦИЯ ОПАСНОСТИ СРЕДСТВ ДЕЗИНСЕКЦИИ ПО ПАРАМЕТРАМ
ОСТРОЙ ТОКСИЧНОСТИ
┌──────────────────┬──────────────────────────────────────────────────────┐
│ Наименование │ Класс опасности │
│ показателя ├─────────────┬──────────────┬────────────┬────────────┤
│ │ 1 — │ 2 — │ 3 — │ 4 — │
│ │ чрезвычайно │высокоопасные │ умеренно │малоопасные │
│ │ опасные │ │ опасные │ │
├──────────────────┼─────────────┼──────────────┼────────────┼────────────┤
│Среднесмертельная │< 15 │15 — 150 │151 — 5000 │> 5000 │
│доза при введении │ │ │ │ │
│в желудок, мг/кг │ │ │ │ │
│ │ │ │ │ │
├──────────────────┼─────────────┼──────────────┼────────────┼────────────┤
│Среднесмертельная │< 100 │100 — 500 │501 — 2500 │> 2500 │
│доза при нанесении│ │ │ │ │
│на кожу, мг/кг │ │ │ │ │
│ │ │ │ │ │
├──────────────────┼─────────────┼──────────────┼────────────┼────────────┤
│Степень летучести │C — гибель │C = токсич.,│C > Lim │C — не │
│при насыщающих │ 20 │ 20 │ 20 ac │ 20 │
│концентрациях │ │клиника │ │эффективны │
│ │ │отравления │ │ │
└──────────────────┴─────────────┴──────────────┴────────────┴────────────┘
8.7.2.2. Определение среднесмертельной дозы средства при нанесении на неповрежденные кожные покровы, п. 8.2.2.2.
Оценку результатов проводят в соответствии с Классификацией опасности средств дезинсекции по параметрам острой токсичности, п. 8.2.2.2, табл. 8.18.
8.7.2.3. Определение ингаляционной опасности средства по степени летучести, п. 8.2.2.4.
Оценку результатов проводят в соответствии с Классификацией опасности средств дезинсекции по параметрам острой токсичности, табл. 8.18.
8.7.2.4. Определение ингаляционной опасности средства в рекомендуемом режиме и способе применения.
Оценку ингаляционной опасности средств проводят в 2 направлениях: оценивают его опасность в рабочих концентрациях и норме расхода в момент проведения дезинсекции и в условиях круглосуточного пребывания в обработанном средством помещении, исходя из сроков биоцидного действия.
Исследование ингаляционной опасности дезинсекционных средств
предусматривает определение порога острого (Lim ) и подострого (Lim )
ac subac
воздействия в рекомендуемом режиме и способе его применения.
С целью установления порогов вредного действия при остром и подостром ингаляционном воздействии средства рекомендуется ориентироваться на набор интегральных и специфических показателей, отражающих основной характер индикаторного компонента. Следует использовать показатели, характеризующие, главным образом, состояние наиболее поражаемых органов и систем.
Уровни воздействия в указанных опытах выбирают в интервале от нормы
расхода препарата, необходимого для получения биоцидного эффекта, до явного
действующего с целью последующего определения порога вредного действия
(Lim ; Lim ).
ac subac
Учитывая, что средства дезинсекции представляют собой многокомпонентные расшифрованные составы, гигиеническую регламентацию указанных средств в условиях их применения осуществляют по индикаторному компоненту, к которому, как правило, относится действующее вещество состава — инсектицид.
8.7.2.4.1. Определение зоны острого биоцидного эффекта.
При определении Lim эксперименты проводят при однократном внесении
ac
средства в камеру. Экспозиция опыта при исследовании дустов, гелей,
приманок, карандашей, эмульсий, растворов, микрокапсул, суспензий
составляет 1 ч, для составов наполнителей аэрозольных баллонов — 90 мин.
Опыты проводят не менее чем на 2 видах лабораторных животных: белых
крысах, мышах. Устанавливают Lim по специфическим и интегральным
ac
показателям, которые регистрируют сразу после воздействия и на следующие
сутки. Контроль воздуха осуществляют по индикаторному компоненту. Отбор
проб воздуха проводят сразу после внесения средства в камеру — через 30
мин. и в конце опыта. Рассчитывают средневзвешенную концентрацию.
Полученные величины позволяют рассчитать зону острого биоцидного эффекта. Оценку проводят в соответствии с Классификацией степени ингаляционной опасности средств дезинсекции, табл. 8.19.
Таблица 8.19
КЛАССИФИКАЦИЯ СТЕПЕНИ ИНГАЛЯЦИОННОЙ ОПАСНОСТИ
СРЕДСТВ ДЕЗИНСЕКЦИИ
┌──────────────────────────────┬───────────────────────────────────────────────────────┐
│ Назначение показателя │ Класс опасности │
│ ├─────────────┬─────────────┬─────────────┬─────────────┤
│ │ 1 — │ 2 — │ 3 — │ 4 — │
│ │ чрезвычайно │высокоопасные│ умеренно │ малоопасные │
│ │ опасные │ │ опасные │ │
├──────────────────────────────┼─────────────┼─────────────┼─────────────┼─────────────┤
│ Зона острого биоцидного │ │ │ │ │
│ эффекта │ │ │ │ │
│ │ │ │ │ │
│ Lim │ │ │ │ │
│ ac │ │ │ │ │
│Z = ———— │< 10 │10 — 30 │31 — 100 │> 100 │
│ ac.bioc.eff норма │ │ │ │ │
│ расхода в │ │ │ │ │
│ рабочей │ │ │ │ │
│ концентрации │ │ │ │ │
├──────────────────────────────┼─────────────┼─────────────┼─────────────┼─────────────┤
│Заключение о возможности и │Рекомендуется│Рекомендуется│Рекомендуется│Рекомендуется│
│сфере применения средства │использовать │использовать │для примене- │для использо-│
│ │в экстремаль-│специалистам │ния как │вания без │
│ │ных ситуациях│со средствами│специалистам │ограничений │
│ │специалистам │индивидуаль- │без средств │как специа- │
│ │с применением│ной защиты │защиты, так и│листам, так │
│ │противогазов │органов дыха-│населению в │и населению │
│ │и спец- │ния, глаз, │условиях быта│ │
│ │костюмов │кожи в отсут-│с регламенти-│ │
│ │ │ствие людей │рованными │ │
│ │ │и животных │условиями │ │
│ │ │ │применения │ │
│ │ │ │(расход │ │
│ │ │ │средства, │ │
│ │ │ │влажная │ │
│ │ │ │уборка, про- │ │
│ │ │ │ветривание) │ │
├──────────────────────────────┼─────────────┼─────────────┼─────────────┼─────────────┤
│ Зона подострого биоцидного │ │ │ │ │
│ эффекта │ │ │ │ │
│ │ │ │ │ │
│ Lim │ │ │ │ │
│ subac │ │ │ │ │
│Z = ————│< 1 │1 — 5 │5,1 — 10,0 │> 10 │
│ subac.bioc.eff норма │ │ │ │ │
│ расхода в │ │ │ │ │
│ рабочей │ │ │ │ │
│ концентрации│ │ │ │ │
├──────────────────────────────┼─────────────┼─────────────┼─────────────┼─────────────┤
│Заключение о возможности │Не рекомен- │Рекомендуется│Рекомендуется│Рекомендуется│
│присутствия людей в помещении │дуется для │использовать │для примене- │без ограни- │
│после проведения дезинсекции │применения в │специалистам │ния специа- │чения сферы │
│ │дезинсекции │для обработки│листам для │применения │
│ │ │подсобных │обработки │(производст- │
│ │ │помещений, │производст- │венные, │
│ │ │складов, │венных поме- │жилые, │
│ │ │подвалов в │щений любого │общественное │
│ │ │отсутствие │назначения с │питание, ЛПУ,│
│ │ │людей │регламентиро-│детские │
│ │ │ │ванными │учреждения) │
│ │ │ │условиями │ │
│ │ │ │применения — │ │
│ │ │ │уборка, про- │ │
│ │ │ │ветривание, │ │
│ │ │ │расход │ │
│ │ │ │средства, за │ │
│ │ │ │исключением │ │
│ │ │ │детских │ │
│ │ │ │учреждений, │ │
│ │ │ │ЛПУ и быта │ │
└──────────────────────────────┴─────────────┴─────────────┴─────────────┴─────────────┘
8.7.2.4.2. Определение зоны подострого биоцидного эффекта.
Для оценки условий, имитирующих проживание людей в обработанном ДС помещении, проводят подострые эксперименты при круглосуточном воздействии с определением порога подострого действия.
Длительность эксперимента с круглосуточным ингаляционным воздействием лимитируется временем инсектицидного действия препарата и составляет:
1) для средств эпизодического применения — 10 дней с ежедневным внесением вещества в камеру (растворы, эмульсии, суспензии, порошки, дусты, гели, карандаши, ленты, микрокапсулы, составы наполнителей аэрозольных баллонов, пиротехнические и фумигирующие средства) для уничтожения нелетающих насекомых;
2) 35 дней — для антимольных средств с внесением их в камеру 1 раз в 5 дней, при этом вещество наносят на поверхность тканей: шерсть, хлопок, ворсовые ткани;
3) для средств, предназначенных для уничтожения летающих насекомых (аэрозольные баллоны, приманки), длительность опыта — 30 суток.
Обследование экспериментальных животных проводят по специфическим и интегральным показателям на следующие сутки после затравки и к моменту окончания опыта.
Выбор концентрации основывается на норме расхода средства и ее превышении в диапазоне от 3 — 10 и более раз до выявления явного действия с целью последующего определения порогового уровня. Испытывается не менее 3 уровней воздействия.
Концентрация препарата в камере определяется по индикаторному компоненту. В процессе ингаляционных затравок в камере регистрируют температуру воздуха и относительную влажность.
Отбор проб воздуха для всех форм препаратов в первые сутки проводят после внесения вещества в камеру через 4 и 24 ч, затем на протяжении опыта — ежедневно.
В качестве критерия степени опасности средства после проведения дезинсекции предлагается использовать зону подострого биоцидного эффекта.
Критерии оценки результатов по эксперименту отражены в Классификации по степени ингаляционной опасности средств дезинсекции, табл. 8.19.
8.7.2.5. Определение и оценка местно-раздражающего действия средства на кожу.
Изучение местного раздражающего действия дезинсекционных средств в форме растворов, суспензий, эмульсий, порошков, аэрозольных баллонов проводят при однократном воздействии; их рабочих концентраций и готовых к применению форм — при многократном нанесении (10 аппликаций) (п. 8.2.2.6).
При однократном воздействии время экспозиции — 2 ч, после опыта средство смывают водой. В качестве растворителей или сорастворителей используют дистиллированную воду, модельную воду, имитирующую потовую жидкость, растительное или вазелиновое масло; возможно использование ланолина или свиного жира, особенно в случае испытания порошкообразных форм.
Состояние кожи регистрируется визуально. Отмечают функционально-морфологические нарушения кожи (эритема, отек, трещины, некроз, шелушение, сухость, изъязвления).
Выраженность местно-раздражающего действия средства при однократной аппликации оценивается по классификации (п. 8.2.2.6). При многократном воздействии дается альтернативный ответ.
8.7.2.6. Определение кожно-резорбтивного действия средства на кожные покровы.
Кожно-резорбтивное действие средств в различных формах, за исключением аэрозольных составов, оценивают в подостром эксперименте (рабочие концентрации и готовые формы) в течение 10 суток, п. 8.2.2.8.
8.7.2.7. Определение и оценка местно-раздражающего действия на слизистые оболочки глаз, п. 8.2.2.7.
8.7.2.8. Определение и оценка сенсибилизирующих свойств дезинсекционных средств.
Сенсибилизирующие свойства дезинсекционных средств определяют комплексом методов (п. 8.2.2.11). Силу аллергенной активности оценивают по классификации пестицидов по степени опасности.
8.7.2.9. Определение мутагенных свойств дезинсекционных средств.
Для выявления мутагенной активности дезинсекционных средств могут быть использованы методы цитогенетического анализа клеток костного мозга, микроядерный тест на ретикулоцитах костного мозга и доминантных летальных мутаций, а также метод хромосомного анализа.
8.7.3. Определение реальной опасности средства
в рекомендуемом режиме применения
в натурных условиях
В соответствии с рассматриваемой моделью общий уровень вдыхания и кожного пути воздействия средства определяется в соответствии с формулой совокупной токсичности:
I
о.а Д
S = ————- + ———— для специалистов;
F ПДК ОБУВ ПДК ОДУ
в.р.з в.р.з
I
о.а Д
S = ————— + ———— для населения,
F ПДК ОБУВ ПДК ОДУ
ат.н.м в.р.з
где:
S — фактор безопасности;
F
I — фактическая концентрация в воздухе помещений;
о.а
Д — фактическое загрязнение кожных покровов.
Фактическую кожную экспозицию (Д ) рассчитывают по формуле:
ф
Д x F
ср
Д = ——-,
ф F
1
где:
F — дневная норма площади обработки: для дезинсекционных средств —
2000 — 2050 кв. м (для специалистов), 50 — 100 кв. м (для населения);
F — фактическая площадь обработки.
1
При значении фактора безопасности (S ) < 1 — отсутствие риска; > 1 —
F
наличие риска.
Гигиенические исследования по применению дезинсекционных средств проводятся при максимальных нормах расхода средства.
Условия проведения исследований регистрируются заключением, которое включает назначение средства, характеристику обрабатываемого объекта, вид и способ обработки, норму расхода, площадь обработки.
Отбор проб воздуха в рабочей зоне, смывы с кожи производятся при приготовлении определенных препаративных форм рабочих растворов и их применении при обработке объектов.
Лица, проводящие исследования в модельных помещениях, должны соблюдать все меры предосторожности, рекомендуемые при применении дезинсекционных средств.
8.7.3.1. Определение содержания остаточных количеств дезинсекционных средств в воздухе помещений.
Отбор проб воздуха в рабочей зоне осуществляется в соответствии с требованиями ГОСТ 12.1.005-88 [30] и в соответствии с конкретными методическими указаниями на определение вредного вещества в воздухе.
При отсутствии описания методов определения действующих веществ (средств) в воздухе разрабатываются оригинальные методы, которые должны удовлетворять следующим основным требованиям:
— степень поглощения из воздуха должна быть не менее 95%;
— погрешность в измерении объема отобранной пробы не должна превышать 10%;
— погрешность при определении количества средства в отобранной пробе должна быть не более 10%;
— максимальная суммарная погрешность не должна превышать 25%;
— предел обнаружения (мг/куб. м) для средств, используемых специалистами, должен обеспечить определение средства на уровне не выше 0,5 ПДК при продолжительности отбора пробы не более 30 мин.;
— для средств, рекомендованных для применения населением, не выше 0,5
ПДК не более 30 мин.
ат.н.м
Контроль содержания вредных веществ в воздухе включает в себя выбор точек отбора пробы, периодичность отбора проб, продолжительность отбора проб, переведения пробы в состояние, пригодное для анализа, идентификацию и количественное определение.
Исследования проводят в экспериментах при моделировании реальных условий применения дезинсекционных средств разного назначения, при этом учитывая, что дезинсекционные средства представляют собой многокомпонентные расшифрованные композиции, гигиеническую регламентацию указанных средств в условиях их применения осуществляют по индикаторному компоненту (или индикаторным компонентам), к которому, как правило, относится действующее вещество или вещества состава.
В процессе отбора проб регистрируют температуру и влажность.
При гигиенических исследованиях эксперименты проводят в условиях, моделирующих жилище помещения: площадь — 10 — 25 кв. м; высота — 2,5 — 3,5 м. Обследование проводят при максимальных концентрациях и нормах средства. Контроль содержания в воздухе дезинсекционных средств проводят в момент обработки, сразу после обработки, после необходимой экспозиции и проветривания, а также через 24 ч после проветривания.
Перед проведением испытаний проводят контрольный отбор проб воздуха в
целях определения «фона» по анализирующему веществу. Помещение можно
использовать для проведения опыта, если фоновая концентрация анализируемого
вещества будет меньше его ПДК в 10 и более раз.
ат.н.м
Отбор проб воздуха проводят на высоте 1,5 м:
а) в помещении площадью 10 кв. м — в двух точках, равностоящих от углов, на расстоянии 0,8 — 1,2 м на диагонали пола;
б) в помещении 10 — 25 кв. м — в трех точках, равноотстоящих от углов, на расстоянии 0,8 — 1,2 м по диагонали пола.
Отбор проб в течение всего опыта проводят в одних и тех же точках помещения.
Разовый отбор пробы воздуха проводится в течение стандартного времени, не превышающего 30 мин., со скоростью 0,5 — 5,0 л/мин.
Для получения достоверных результатов при контроле содержания вредных веществ в любой намеченной точке должны быть отобраны не менее 3 проб воздуха. После этого по результатам анализа вычисляется среднее арифметическое значение X и доверительный интервал C.
Выбор сорбентов определяется агрегатным состоянием веществ, поступающих в воздух и подлежащих определению. Пары и газы отбираются из воздуха через поглотительный прибор с соответствующим растворителем или водой (для пестицидов, растворимых в воде) либо трубку с твердым сорбентом; гидроаэрозоль или аэрозоль пестицидов, обладающих низкой летучестью, — путем протягивания воздуха через патрон с фильтром типа АФА, «синяя лента» и т.д. При одновременном присутствии в воздухе паров и аэрозоля (гидроаэрозоля) пробы отбирают через последовательно соединенные патрон с фильтром и поглотитель (или трубка с сорбентом).
8.7.3.2. Определение и содержание остаточных количеств ДС на коже.
Остаточные количества ДС на коже определяются способом смыва с участков поверхности тела, площадь которых должна четко фиксироваться и составлять 100 кв. см.
При исследовании дезинсекционных средств смывы проводят в конце смены с открытых участков тела (лицо, шея, кисти рук). Фоновые смывы следует проводить до работы с кистей рук.
Для смыва средства с кожи используют хлопчатобумажные салфетки (например, из бязи) белого цвета размером 5 x 5 см, прошедшие специальную обработку в зависимости от вида смывающей жидкости.
Подбор смывающей жидкости осуществляют с учетом данных о физико-химических свойствах вещества (растворимость в воде и органических средах, стабильность в растворах).
В качестве растворителей применяют холодную и нагретую воду или сравнительно безопасный для здоровья человека этиловый спирт.
Растворитель объемом 20 — 25 мл наливают в стеклянную емкость с притертой пробкой. Пинцетом захватывают салфетку, смачивают растворителем, слегка отжимают и тщательно протирают (без усилий) контролируемые участки кожи. После смыва обработанный участок протирают сухой салфеткой. Процедуру повторяют 2 раза. Использованные салфетки и смывы хранят в емкости с притертой пробкой.
Для каждого участка смыва используют 2 влажные и 2 сухие салфетки, 2 емкости.
Предел измерения дезинсекционного средства в смывах с кожи в мг/кв. дм устанавливают по уровню, достигнутому в условиях лабораторного определения, погрешность не более +/- 25%.
Допускается применение методов суммарного определения соединений с близким определяемым минимумом, принадлежащих к одному классу веществ и содержащих одинаковые функциональные группы.
Результаты измерения содержания активного вещества в смывах с кожи представляются в виде:
Д +/- m,
ср
где:
Д — средняя дермальная экспозиция, мг/кв. см, из числа n-смывов на
ср
разных участках тела;
m — ошибка средней арифметической величины;
n — количество смывов, подлежащих усреднению, должно быть не менее 5.
Фактическую кожную экспозицию (Д ) рассчитывают по формуле:
ф
Д x F
ср
Д = ——-,
ф F
1
где:
F — дневная норма площади обработки для дезинсекционных средств — 2000
кв. м;
F — фактическая площадь отработки.
1
Оценку фактической экспозиционной дозы рекомендуется проводить путем
сравнения с ориентировочно допустимым уровнем загрязнения кожных покровов
пестицидами — ОДУ , мг/кв. см.
эксп
8.7.3.3. Обоснование ОДУ и расчет риска.
эксп
Расчет ОДУ , мг/кв. см, проводится с применением расчетной
эксп
c
ориентировочной величины Lim , мг/кг, по показателю острой кожной
ch
k
токсичности ЛД , мг/кг.
50
c
Формула для расчета ОДУ , мг/кв. см, по Lim , мг/кг, на основе
эксп ch
k
ЛД , мг/кг:
50
c
Lim , мг/кг x M x K x K
ch ост отн.прон
ОДУ , мг/кв. см = ————————————,
эксп S x K
S
где:
c
Lim , мг/кг, — пороговая доза, установленная экспериментально в
ch
хроническом опыте (нанесение на кожу 5 раз в неделю не менее 4 месяцев) или
k
рассчитанная на основании ЛД , мг/кг;
50
M — масса тела человека в среднем принята за 70 кг;
K — коэффициент остаточный, выражающий экспозиционное соотношение
ост
количества вещества, попавшего и оставшегося на коже, в среднем равен 0,25;
S — площадь кожного покрова человека в среднем 16120 кв. см;
K — коэффициент относительной проницаемости, установленный
отн.прон
экспериментально или ориентировочный, равный 2;
K — коэффициент запаса.
S
При расчетах ОДУ коэффициент запаса должен составлять для веществ
эксп
1 — 2-го классов опасности от 20 до 10; 3 — 4-го классов опасности от 10 до
3.
Для веществ, обладающих отдаленными и сенсибилизирующими эффектами
действия, K принимается более 20.
S
c
Расчет Lim , мг/кг, производится для веществ 1 — 2-го классов
ch
опасности по формуле:
c k
Lim , мг/кг = 0,0002 ЛД , мг/кг,
ch 50
для веществ 3 — 4-го классов опасности по формуле:
c k
Lim , мг/кг = 0,001 ЛД , мг/кг.
ch 50
Класс опасности вещества при кожном поступлении определяется согласно
Прилож. 1.
Реакция опасности определяется соотношением (Д ) и ОДУ .
ф эксп
Практические испытания средства проводить в соответствии с разработанной инструкцией по применению средства.
Учет возможных признаков воздействия средства на здоровье профессионального контингента и населения после дезмероприятий проводят путем анкетного опроса. Отсутствие объективных и субъективных признаков воздействия препарата на лиц, проводящих обработку помещений, свидетельствует об эффективности применяемых средств индивидуальной защиты или безопасности средств.
Результаты апробации средства в практических условиях оформляются в виде актов-заключений и представляются в регламентирующие органы для решения вопроса о возможности внедрения средства в практику.
8.7.4. Критерии оценки токсичности и опасности
средств дезинсекции
8.7.4.1. Критерии оценки токсичности и опасности средств дезинсекции на отборочном этапе I подэтапа II этапа.
На отборочном I подэтапе II этапа проводится первичная оценка токсичности средств дезинсекции и ранжирование их с целью запрета применения наиболее токсичных и опасных из них.
Оценка результатов острых опытов проводится в соответствии с классификацией опасности средств дезинсекции по параметрам острой токсичности, табл. 8.24.
Дезинсекционные средства, относящиеся к 1-му классу опасности (чрезвычайно опасные) при введении в желудок, нанесении на кожу, по степени летучести, не рекомендуются для дальнейшего изучения.
Дезинсекционные средства, относящиеся ко 2-му классу высокоопасных по параметрам острой токсичности, планируются для дальнейшего изучения на II подэтапе только в случае использования их специалистами с применением средств индивидуальной защиты.
Средства 3-го (умеренно опасные) и 4-го классов (малоопасные) переходят на следующий углубленный этап исследований.
8.7.4.2. Критерии оценки опасности средства дезинсекции на этапе углубленной оценки. Исследования, которые проводятся на II подэтапе II этапа, ставят своей основной целью в модельных опытах на лабораторных животных оценить степень опасности средств в рекомендуемых режимах, нормах и способах применения.
В качестве основного критерия, отражающего специфику опасности
дезинсекционных средств, предлагается использовать зону острого
(Z ) и подострого (Z ) эффекта, которые оценивают
bioc.eff.ac bioc.eff.subac
средство по степени избирательности его действия, одновременно характеризуя
как его инсектицидную активность, так и степень токсичности для
теплокровных животных. Данный показатель выражается отношением токсичности
дезинсекционных средств для млекопитающих в виде порогов их острого и
подострого действия к фактически определяемому уровню его содержания в
воздухе в норме биоцидного эффекта для целевого вида в 2 режимах
применения: разовом (в момент обработки) и повторном круглосуточном (при
нахождении в обработанном помещении). При этом реальная опасность острых
отравлений в момент проведения дезобработки количественно характеризуется
отношением (Lim / N — 1-й режим). После проведения дезинсекции опасность
ac
развития отравления выражается отношением (Lim / N — 2-й режим).
subac
По этим параметрам предложена классификация степени ингаляционной опасности средств дезинсекции для условий их применения с выделением 4 классов, табл. 8.19.
Средства с зоной острого биоцидного эффекта менее 10 (1-й класс опасности) рекомендуются для применения в экстремальных ситуациях в специальных костюмах и противогазах. Средства, относящиеся ко 2-му классу опасности (по величине зоны острого биоцидного эффекта), рекомендуется использовать только специалистам с применением средств индивидуальной защиты органов дыхания, глаз, кожи в отсутствие людей и животных. Средства 3-го класса опасности рекомендуются для использования как специалистам (без средств защиты), так и населению в быту с регламентированными условиями применения (расход препарата, режим проветривания, влажная уборка).
Средства 4-го класса рекомендованы для использования в дезинсекции как специалистам, так и населению без ограничения.
Средства 1-го класса опасности по зоне подострого биоцидного эффекта меньше 1 не рекомендуются для использования в дезинсекции.
Средства 2-го класса (Z — 1 — 5) рекомендуются для
subac.bioc.eff
обработки только подсобных помещений, подвалов и складов в отсутствие
людей. Средства 3-го класса (Z — 5,1 — 10) рекомендуются для
subac.bioc.eff
применения специалистами для обработки производственных помещений любого
назначения с регламентированными условиями применения: расход средства,
влажная уборка, проветривание, за исключением детских учреждений, ЛПУ,
быта. Средства 4-го класса (Z > 10) рекомендуются для
subac.bioc.eff
использования без ограничений сферы применения (производственные, жилые
помещения, ЛПУ, детские учреждения, предприятия общественного питания).
Способность дезинсекционных средств проникать через неповрежденные кожные покровы оценивают в субхроническом опыте. Полученные результаты дают альтернативный ответ о необходимости защиты кожных покровов — использование перчаток.
Выраженность местно-раздражающего действия средства в нативном виде и в рабочих концентрациях при однократном нанесении на кожу и слизистые глаза оценивают по соответствующим классификациям (п. п. 8.2.2.6 — 8.2.2.7). Дезинсекционные средства, относящиеся к 1-му классу опасности (резко выражено) при контакте с кожей и со слизистыми глаза, не рекомендуются для использования в дезинсекции.
Средства, относящиеся ко 2 — 3-му классам опасности (выраженное, умеренно выраженное), должны использоваться только специалистами с защитой кожи и глаз. Средства 4-го класса опасности (эффект слабый или отсутствует) могут использоваться как специалистами, так и населением в быту.
Результаты оценки местно-раздражающего действия средства при многократном контакте с неповрежденными кожными покровами дают альтернативный ответ. Наличие эффекта свидетельствует о необходимости использования защиты кожных покровов (перчатки).
Дезинсекционные средства по аллергенной активности, относящиеся к 1-му классу опасности, запрещаются для использования в области дезинсекции. Дезинсекционные средства 2 — 3-го классов (опасные, умеренно опасные) рекомендуются для использования специалистам со средствами индивидуальной защиты в производственных помещениях, за исключением детских учреждений, ЛПУ. Средства 4-го класса, малоопасные, могут быть использованы без ограничений (быт, ЛПУ, производственные помещения, детские учреждения).
Мутагенная активность дезинсекционных средств оценивается по 4 классам соответствующей классификации.
Дезинсекционные средства, относящиеся к 1 — 2-му классам опасности, не рекомендуются для использования в области дезинсекции. Средства 3-го класса опасности могут быть применены специалистами с использованием средств индивидуальной защиты в производственных помещениях, подвалах, складах, за исключением детских учреждений, ЛПУ, быта, учреждений общественного питания. Средства, относящиеся к 4-му классу малоопасных по мутагенной активности, могут быть использованы в широкой сфере (ЛПУ, детские учреждения, производственные и жилые помещения).
8.7.4.3. Критерии оценки опасности дезинсекционных средств на III этапе.
Реальная опасность дезинсекционных средств в рекомендуемом режиме и
способе использования оценивается на III этапе в натурных условиях с
расчетом фактора безопасности. Полученные данные должны подтвердить
результаты оценки средства, полученные в модельных опытах на животных. В
случае, когда S > 1, реальная опасность средства высока (как для
F
специалистов, так и для населения) и для его применения необходимо
использовать комплекс средств индивидуальной защиты.
В случае, когда S < 1, реальная опасность средства низка и его можно
F
рекомендовать для использования населением и специалистами без средств
индивидуальной защиты.
При необходимости полученные результаты исследований подтверждают материалами практических испытаний.
Таблица 8.20
КРИТЕРИИ ОЦЕНКИ БЕЗОПАСНОГО ПРИМЕНЕНИЯ
ДЕЗИНСЕКЦИОННЫХ СРЕДСТВ
┌─────────────┬─────────────┬────────────────────┬────────────────────────┐
│ Назначение │ Исследуемые │ Нормативные │ Разрешено применение │
│ средства │ показатели │ показатели │ │
│ │ ├─────────────┬──────┤ │
│ │ │ величина │класс │ │
│ │ │ показателя │опас- │ │
│ │ │ │ности │ │
├─────────────┼─────────────┼─────────────┼──────┼────────────────────────┤
│ 1 │ 2 │ 3 │ 4 │ 5 │
├─────────────┼─────────────┼─────────────┼──────┼────────────────────────┤
│Аэрозольные │Зона острого │Менее 10 │1 │Специалистам <*> с │
│баллоны │биоцидного │ │ │использованием средств │
│ │эффекта │ │ │индивидуальной защиты │
│ │ │ │ │(спецкостюм, противогаз)│
│ │ │ │ │в экстремальных │
│ │ │ │ │ситуациях │
│ │ │10 — 30 │2 │Специалистам <*> с │
│ │ │ │ │использованием средств │
│ │ │ │ │индивидуальной защиты │
│ │ │ │ │органов дыхания, кожи, │
│ │ │ │ │глаз в отсутствие людей │
│ │ │31 — 100 │3 │Специалистам <*> и │
│ │ │ │ │населению в быту с │
│ │ │ │ │регламентированными │
│ │ │ │ │условиями применения │
│ │ │ │ │(проветривание, расход │
│ │ │ │ │препарата, влажная │
│ │ │ │ │уборка и т.д.) │
│ │ │Более 100 │ │Без ограничений как │
│ │ │ │ │специалистам <*>, так │
│ │ │ │ │и населению │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Зона │Менее 1 │1 │Запрещены для применения│
│ │подострого │ │ │в дезинсекции │
│ │биоцидного │1 — 5 │2 │Специалистам <*> для │
│ │эффекта │ │ │обработки складов, │
│ │ │ │ │подсобных помещений, │
│ │ │ │ │подвалов │
│ │ │5,1 — 10,0 │3 │Специалистам <*> для │
│ │ │ │ │обработки производствен-│
│ │ │ │ │ных помещений любого │
│ │ │ │ │назначения с регламенти-│
│ │ │ │ │рованными условиями │
│ │ │ │ │применения (уборка, │
│ │ │ │ │проветривание, расход │
│ │ │ │ │препарата), за │
│ │ │ │ │исключением детских │
│ │ │ │ │учреждений, ЛПУ и быта │
│ │ │Более 10 │4 │Специалистам <*> и │
│ │ │ │ │населению без │
│ │ │ │ │ограничений сферы │
│ │ │ │ │применения │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Местно- │2,1 — 4,0 │3 │Специалистам и населению│
│ │раздражающее │ │ │в быту с использованием │
│ │действие на │ │ │средств защиты кожи рук │
│ │кожу (одно- │ │ │(перчатки) │
│ │кратно), │0 — 2,0 │4 │Специалистам <*> и │
│ │баллы │ │ │населению без ограниче- │
│ │ │ │ │ний сферы применения │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Местно- │до 10 │2 — 3 │Специалистам <*> со │
│ │раздражающее │ │ │средствами защиты глаз │
│ │действие на │ │ │(очки) │
│ │слизистые │0 — 3 │4 — 5 │Специалистам <*> и │
│ │оболочки глаз│ │ │населению в быту │
│ │(однократно) │ │ │ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Кожно- │Наличие │Не │Специалистам <*> со │
│ │резорбтивное │эффекта │норми-│средствами защиты кожи │
│ │действие │ │руется│(перчатки) │
│ │(однократно) │Отсутствие │Не │Без ограничений │
│ │ │эффекта │норми-│ │
│ │ │ │руется│ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Сенсибилизи- │Умеренное │2 — 3 │Специалистам <*> с │
│ │рующее │и слабое │ │использованием средств │
│ │действие │ │ │индивидуальной защиты │
│ │ │Отсутствие │4 │Без ограничений │
│ │ │эффекта │ │ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Оценка │> 1 │Не │Специалистам <*> │
│ │реальной │ │норми-│ │
│ │опасности │ │руется│ │
│ │средства в │> 1 │Не │Населению в быту │
│ │рекомендован-│ │норми-│ │
│ │ных режимах │ │руется│ │
│ │применения │ │ │ │
│ │(фактор безо-│ │ │ │
│ │пасности) │ │ │ │
├─────────────┼─────────────┼─────────────┼──────┼────────────────────────┤
│Пиротехни- │Зона острого │Менее 10 │1 │Специалистам <*> с │
│ческие и │биоцидного │ │ │использованием спец- │
│фумигирующие │эффекта │ │ │костюмов, противогазов │
│средства │ │10 — 30 │2 │Специалистам <*> с │
│(шашки, │ │ │ │использованием средств │
│таблетки, │ │ │ │индивидуальной защиты │
│свечи и т.д.)│ │ │ │органов дыхания, глаз, │
│ │ │ │ │кожи в отсутствие людей │
│ │ │31 — 100 │3 │Специалистам <*> и │
│ │ │ │ │населению в быту с │
│ │ │ │ │регламентированными │
│ │ │ │ │условиями применения │
│ │ │ │ │(проветривание, влажная │
│ │ │ │ │уборка, расход │
│ │ │ │ │препарата) │
│ │ │Более 100 │4 │Специалистам <*> и │
│ │ │ │ │населению без │
│ │ │ │ │ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Зона │Менее 1 │1 │Запрещены для применения│
│ │подострого │ │ │в дезинсекции │
│ │биоцидного │1 — 5 │2 │Специалистам <*> для │
│ │эффекта │ │ │обработки складов, │
│ │ │ │ │подсобных помещений, │
│ │ │ │ │подвалов │
│ │ │5,1 — 10 │3 │Специалистам <*> для │
│ │ │ │ │обработки производст- │
│ │ │ │ │венных помещений любого │
│ │ │ │ │назначения с регламенти-│
│ │ │ │ │рованными условиями │
│ │ │ │ │применения (уборка, │
│ │ │ │ │проветривание, расход │
│ │ │ │ │препарата), за │
│ │ │ │ │исключением детских │
│ │ │ │ │учреждений, ЛПУ и быта │
│ │ │Более 10 │4 │Специалистам <*> и │
│ │ │ │ │населению без │
│ │ │ │ │ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Острая │Не менее 15 │2 │Специалистам <*> │
│ │токсичность │Не менее 151 │3 — 4 │Специалистам <*> и │
│ │при введении │ │ │населению в быту │
│ │в желудок │ │ │ │
│ │(ЛД , мг/кг)│ │ │ │
│ │ 50 │ │ │ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Местно- │До 10 │2 — 3 │Специалистам <*> со │
│ │раздражающее │ │ │средствами защиты глаз │
│ │действие на │ │ │(очки) │
│ │слизистые │0 — 3 │3 — 4 │Специалистам <*> и │
│ │оболочки глаз│ │ │населению в быту │
│ │(однократно) │ │ │ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Сенсибилизи- │Умеренное, │2 — 3 │Специалистам <*> со │
│ │рующее │слабое │ │средствами защиты │
│ │действие │Отсутствие │4 │органов дыхания, глаз, │
│ │ │эффекта │ │кожи │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Оценка │> 1 │Не │Специалистам <*> │
│ │реальной │ │норми-│ │
│ │опасности │ │руется│ │
│ │средства в │> 1 │Не │Населению в быту │
│ │рекомендован-│ │норми-│ │
│ │ных режимах │ │руется│ │
│ │применения │ │ │ │
│ │(фактор │ │ │ │
│ │безопасности)│ │ │ │
├─────────────┼─────────────┼─────────────┼──────┼────────────────────────┤
│Эмульгирую- │а) Нативный │Не менее 15 │2 │Специалистам <*> │
│щиеся │препарат: │не менее 151 │3 — 4 │Специалистам <*> и │
│концентраты, │- острая │ │ │населению в быту │
│смачивающиеся│токсичность │ │ │ │
│порошки, │при введении │ │ │ │
│микрокапсули-│в желудок │ │ │ │
│рованные │(ЛД , │ │ │ │
│концентраты, │ 50 │ │ │ │
│лаки, краски,│мг/кг) │ │ │ │
│растворы ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- острая │Не менее │2 │Специалистам <*> со │
│ │токсичность │100 — 500 │ │средствами защиты кожи │
│ │при нанесении│ │ │рук (перчатки) │
│ │на кожу │Не менее │3 │Специалистам <*> и │
│ │(ЛД , │501 — 2500 │ │населению в быту со │
│ │ 50 │ │ │средствами защиты кожи │
│ │мг/кг) │ │ │рук (перчатки) │
│ │ │Более 2500 │4 │Специалистам <*> и │
│ │ │ │ │населению без │
│ │ │ │ │ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- острая │C — клиника│2 │Специалистам со │
│ │ингаляционная│ 20 │ │средствами защиты │
│ │опасность в │ │ │органов дыхания │
│ │насыщающих │C > Lim │3 — 4 │Специалистам <*> и │
│ │концентрациях│ 20 ac │ │населению в быту │
│ │(C ) │ │ │ │
│ │ 20 │ │ │ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- местно- │До 6 │2 — 3 │Специалистам со │
│ │раздражающее │ │ │средствами защиты кожи │
│ │действие на │ │ │рук (перчатки) │
│ │кожу (одно- │0 — 2 │4 │Специалистам <*> и │
│ │кратное) │ │ │населению без │
│ │ │ │ │ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- местно- │До 10 │2 — 3 │Специалистам <*> со │
│ │раздражающее │ │ │средствами защиты глаз │
│ │действие на │ │ │(очки) │
│ │слизистые │0 — 3 │4 — 5 │Специалистам <*> и │
│ │оболочки глаз│ │ │населению в быту │
│ │(однократно) │ │ │ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- сенсибили- │Выраженное │1 │Специалистам <*> по │
│ │зирующее │ │ │эпидпоказаниям со │
│ │действие │ │ │средствами индивидуаль- │
│ │ │ │ │ной защиты │
│ │ │Умеренное, │2 — 3 │Специалистам <*> со │
│ │ │слабое │ │средствами индивидуаль- │
│ │ │ │ │ной защиты │
│ │ │Отсутствие │4 │Специалистам <*> и насе-│
│ │ │эффекта │ │лению без ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │б) Рабочие │Наличие │Не │Специалистам <*> со │
│ │эмульсии, │эффекта │норми-│средствами защиты кожи │
│ │суспензии, │ │руется│рук (перчатки) │
│ │растворы: │Отсутствие │Не │Специалистам <*> и │
│ │- кожно- │эффекта │норми-│населению без │
│ │резорбтивный │ │руется│ограничений │
│ │эффект │ │ │ │
│ │0,5 мес. │ │ │ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- местно- │Наличие │Не │Специалистам <*> и │
│ │раздражающее │эффекта │норми-│населению в быту со │
│ │действие на │ │руется│средствами защиты кожи │
│ │кожу │ │ │рук (перчатки) │
│ │0,5 мес. │Отсутствие │Не │Специалистам <*> и │
│ │ │эффекта │норми-│населению без │
│ │ │ │руется│ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- зона │Менее 10 │1 │Специалистам <*> с │
│ │острого │ │ │использованием спец- │
│ │биоцидного │ │ │костюмов, противогазов │
│ │эффекта │10 — 30 │2 │Специалистам <*> со │
│ │ │ │ │средствами индивидуаль- │
│ │ │ │ │ной защиты органов │
│ │ │ │ │дыхания, глаз, кожи рук │
│ │ │ │ │в отсутствие людей и │
│ │ │ │ │животных │
│ │ │31 — 100 │3 │Специалистам <*> и │
│ │ │ │ │населению в быту с │
│ │ │ │ │регламентированными │
│ │ │ │ │условиями применения │
│ │ │ │ │(уборка, проветривание) │
│ │ │Более 100 │4 │Специалистам <*> и │
│ │ │ │ │населению без │
│ │ │ │ │ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- зона │Менее 1 │1 │Запрещены для применения│
│ │подострого │ │ │в дезинсекции │
│ │биоцидного │1 — 5 │2 │Специалистам <*> для │
│ │эффекта │ │ │обработки складов, │
│ │ │ │ │подсобных помещений, │
│ │ │ │ │подвалов │
│ │ │5,1 — 10,0 │3 │Специалистам <*> для │
│ │ │ │ │обработки производствен-│
│ │ │ │ │ных помещений любого │
│ │ │ │ │назначения с регламенти-│
│ │ │ │ │рованными условиями │
│ │ │ │ │применения (уборка, │
│ │ │ │ │проветривание, расход │
│ │ │ │ │препарата), за исключе- │
│ │ │ │ │нием детских учреждений,│
│ │ │ │ │ЛПУ и быта │
│ │ │Более 10 │4 │Специалистам <*> и насе-│
│ │ │ │ │лению без ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- сенсибили- │Умеренное, │2 — 3 │Специалистам <*> со │
│ │зирующее │слабое │ │средствами индивидуаль- │
│ │действие │ │ │ной защиты │
│ │ │Отсутствие │4 │Специалистам <*> и насе-│
│ │ │эффекта │ │лению без ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │- оценка │> 1 │Не │Специалистам <*> │
│ │реальной │ │норми-│ │
│ │опасности │ │руется│ │
│ │средства в │< 1 │Не │Населению в быту │
│ │рекомендован-│ │норми-│ │
│ │ных режимах │ │руется│ │
│ │применения │ │ │ │
│ │(фактор безо-│ │ │ │
│ │пасности) │ │ │ │
├─────────────┼─────────────┼─────────────┼──────┼────────────────────────┤
│Дусты, │Острая │Не менее 15 │2 — 3 │Специалистам <*> │
│карандаши, │токсичность │Не менее 151 │4 │Специалистам <*> и │
│брикеты, │при введении │ │ │населению в быту │
│приманки, │в желудок │ │ │ │
│готовые к │(ЛД , мг/кг)│ │ │ │
│употреблению │ 50 │ │ │ │
│растворы, ├─────────────┼─────────────┼──────┼────────────────────────┤
│эмульсии, │Острая │Не менее │2 │Специалистам <*> со │
│суспензии, │токсичность │100 — 500 │ │средствами защиты кожи │
│таблетки, │при нанесении│ │ │рук (перчатки) │
│гели │на кожу │Не менее │3 │Специалистам <*>, │
│ │(ЛД , мг/кг)│501 — 2500 │ │населению в быту со │
│ │ 50 │ │ │средствами защиты кожи │
│ │ │ │ │рук (перчатки) │
│ │ │Более 2500 │4 │Без ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Острая инга- │C — клиника│2 │Специалистам <*> │
│ │ляционная │ 20 │ │ │
│ │опасность в │C < Lim │3 — 4 │Специалистам <*> и │
│ │насыщающих │ 20 ac │ │населению в быту │
│ │концентрациях│ │ │ │
│ │(C ) │ │ │ │
│ │ 20 │ │ │ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Зона острого │Менее 10 │1 │Специалистам <*> с │
│ │биоцидного │ │ │использованием спец- │
│ │эффекта │ │ │костюмов, противогазов │
│ │ │10 — 30 │2 │Специалистам <*> со │
│ │ │ │ │средствами защиты │
│ │ │ │ │органов дыхания │
│ │ │31 — 100 │3 │Специалистам <*> и │
│ │ │ │ │населению в быту с │
│ │ │ │ │регламентированными │
│ │ │ │ │условиями применения │
│ │ │ │ │(уборка, проветривание, │
│ │ │ │ │расход препарата) │
│ │ │Более 100 │4 │Специалистам <*> и │
│ │ │ │ │населению без │
│ │ │ │ │ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Зона │Менее 1 │1 │Запрещены для применения│
│ │подострого │ │ │в дезинсекции │
│ │биоцидного │1 — 5 │2 │Специалистам <*> для │
│ │эффекта │ │ │обработки складов, │
│ │ │ │ │подсобных помещений, │
│ │ │ │ │подвалов │
│ │ │5,1 — 10,0 │3 │Специалистам <*> с │
│ │ │ │ │обработкой производст- │
│ │ │ │ │венных помещений любого │
│ │ │ │ │назначения с регламенти-│
│ │ │ │ │рованными условиями │
│ │ │ │ │применения (уборка, │
│ │ │ │ │проветривание, расход │
│ │ │ │ │препарата), за │
│ │ │ │ │исключением детских │
│ │ │ │ │учреждений, ЛПУ и быта │
│ │ │Более 10 │4 │Специалистам <*> и насе-│
│ │ │ │ │лению без ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Кожно- │Наличие │Не │Специалистам <*> со │
│ │резорбтивный │эффекта │норми-│средствами защиты кожи │
│ │эффект │ │руется│рук │
│ │0,5 мес. │Отсутствие │Не │Специалистам <*> и │
│ │ │эффекта │норми-│населению без │
│ │ │ │руется│ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Местно- │Наличие │Не │Специалистам <*> со │
│ │раздражающее │эффекта │норми-│средствами индивидуаль- │
│ │действие на │ │руется│ной защиты кожи рук │
│ │кожу 0,5 мес.│ │ │(перчатки) │
│ │ │Отсутствие │Не │Специалистам <*> и │
│ │ │эффекта │норми-│населению в быту │
│ │ │ │руется│ │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Сенсибили- │Умеренное │2 — 3 │Специалистам <*> со │
│ │зирующее │и слабое │ │средствами защиты │
│ │действие │ │ │органов дыхания, глаз, │
│ │ │ │ │кожи │
│ │ │Отсутствие │4 │Специалистам <*> и насе-│
│ │ │эффекта │ │лению без ограничений │
│ ├─────────────┼─────────────┼──────┼────────────────────────┤
│ │Местно- │до 10 │2 — 3 │Специалистам <*> со │
│ │раздражающее │ │ │средствами защиты глаз │
│ │действие на │ │ │(очки) │
│ │слизистые │0 — 3 │4 — 5 │Специалистам <*> и │
│ │оболочки глаз│ │ │населению без │
│ │(однократно) │ │ │ограничений │
│ │Оценка │> 1 │Не │Специалистам <*> │
│ │реальной │ │норми-│ │
│ │опасности │ │руется│ │
│ │средства в │< 1 │Не │Населению в быту │
│ │рекомендован-│ │норми-│ │
│ │ных режимах │ │руется│ │
│ │применения │ │ │ │
│ │(фактор │ │ │ │
│ │безопасности)│ │ │ │
├─────────────┴─────────────┴─────────────┴──────┴────────────────────────┤
│ <*> Специалисты: обученный персонал организаций, имеющих право│
│заниматься дезинфекционной деятельностью. │
└─────────────────────────────────────────────────────────────────────────┘
8.8. Методы изучения токсичности и опасности
репеллентных средств
8.8.1. Методическая схема, критерии оценки и методы
изучения токсичности и опасности репеллентов
Разработка рекомендаций по методической схеме, критериям оценки и методам изучения токсичности и опасности репеллентных средств изложена в развитие методических рекомендаций по отбору и изучению биологической активности и токсичности репеллентов (М., 1987) с добавлением подходов к изучению токсичности репеллентных средств для детей.
8.8.1.1. Общие положения
В области медицинской дезинсекции репелленты используются в составах препаратов от нападения летающих кровососущих членистоногих (комаров, мошек, мокрецов, москитов, слепней, мух, блох, а также клещей) в целях профилактики трансмиссивных заболеваний, а также для обеспечения комфортных условий работы и отдыха населения.
Репеллентные средства представляют собой сложные композиционные составы, состоящие из активно действующего начала (репеллента или смеси репеллентов) и вспомогательных ингредиентов (растворителей, наполнителей, структурообразователей, эмульгаторов, душистых веществ, отдушек, фармацевтических добавок и др.).
Они занимают своеобразное положение между фармакологическими профилактическими средствами, средствами дезинфекции и бытовой химии, имея особенности в отношении продолжительности применения, способов и форм использования. К репеллентным средствам предъявляются повышенные требования, т.к. они могут наноситься непосредственно на кожу и особенно детского контингента.
Для индивидуальной защиты репеллентные препараты наносят на открытые участки кожи и (или) на различные предметы одежды, сетки, накомарники; для коллективной защиты обрабатывают полога, наружные стенки палаток, занавеси, портьеры, наличники окон и дверей, плинтуса в помещениях.
Для обработки кожи применяются препараты в форме линиментов (кремы, аэрозольные пены), эмульсий, жидкостей (лосьоны, аэрозольные упаковки, беспропеллентные аэрозольные упаковки (БАУ)), карандашей, брусков, бумажных салфеток и др. Для обработки одежды используются спиртово-водно-ацетоновые растворы репеллентов или 20%-ные водные эмульсии, а также аэрозольные упаковки и БАУ.
В зависимости от вида обрабатываемого объекта и препаративной формы средства зависят и условия его воздействия (через кожу или через органы дыхания и в комбинации).
Репеллентные средства использует как профессиональный контингент (лесорубы, геологи, мелиораторы), так и наиболее широкое население — взрослое и дети разного возраста.
Перед началом изучения токсичности новых репеллентных активно действующих веществ РАДВ необходимо иметь паспорт на соединение, в котором указывается химическое название, структурная формула, физико-химические свойства, а также степень чистоты и процентное содержание примесей. Кроме этого указываются условия безопасного хранения соединения и способы обезвреживания, дезактивации.
8.8.1.2. Оценка токсичности и опасности репеллентных средств
Схема отбора и изучения репеллентов и репеллентных средств представлена на рис. 8.7.
┌────────────────────────┐
│I этап. Первичная оценка│
└────────┬────┬───┬──────┘
┌─────────────────────┐ │ │ │ ┌───────────────────────┐
│Репеллентные средства│<─────────┘ │ └──────>│ Репеллентные средства │
│для нанесения на кожу│ │ │для нанесения на одежду│
└─────────────────────┘ / └───────────────────────┘
┌─────────────────────────────────────────────────────────────────────┐
│ Сбор информации о токсичности ДВ и основных компонентов │
┌──┤ (сведения литературы) │
│ │ Рецептура средства, назначение, режим применения │
│ └─────────────────────────────────────────────────────────────────────┘
│ ┌─────────────────────────────────────────────────────────────────────┐
│┌─┤ Параметры острой токсичности ├┐
││ └───┬───────┬──────────┬────────────────┬───────────────────┬─────────┘│
││ / / / / / │
││ ┌────────┬───────┬────────────┬───────────────────┬───────────────────┐│
││ │ ЛД в │ЛД на│ Опасность │Местно-раздражающее│Местно-раздражающее││
││ │ 50 │ 50 │ по степени │ действие │ действие ││
││ │желудок │ кожу │ летучести │ на кожу │ на глаза ││
││ └───┬────┴─────┬─┴─────┬──────┴─────────────────┬─┴─────────┬─────────┘│
││ └──────┐ │ └────────────────────┐ │ │ │
││ ┌───────┐ │ │ ┌─────────────────┐ │ │ │ │
│└>│ К к/о │ │ │ │Сенсибилизирующее│ │ │ │ │
│ └───────┘ │ │ │ действие │<┼───┼───────────┼──────────┘
│ │ │ └────────┬────────┘ │ │ │
│ │ │ / │ │ │
│ │ └───────>┌─────────────────┐<┘ │ │
│ └───────────>│ ОТБОР │<────┘ │
└─────────────────────────>└─────────────────┘<────────────────┘
┌─────────────────────────────────┐
│II этап. Углубленные исследования│
└───────────┬─────────┬───────────┘
┌─────────────────────┐ │ └─────────>┌─────────────────────┐
│Репеллентные средства│<────────┘ ┌──────────────────┤Репеллентные средства│
│при нанесении на кожу│┌──────────┼──────────────────┤при обработке одежды │
└─┬───────────────┬───┘│ │ ┌────────────────┴──┬──────────┬───────┘
│ ┌───────┼────┼──────────┘ │ │ │
/ / / / / / /
┌────────────┬──────────┬───────────────────┬──────────────┬──────────────┐
│ Кожно- │Возрастная│Отдаленные эффекты:│ Санитарно- │ Ингаляционная│
│резорбтивное│чувстви- │эмбриотоксический, │гигиеническая │ опасность в │
│ действие │тельность │ тератогенный, │ оценка │ в режимах │
│ │ │ мутагенный, │ воздуха │ применения — │
│ │ │ канцерогенный │ │ Lim │
│ │ │ │ │ ac │
└─────┬──────┴────┬─────┴────────┬──────────┴──────┬───────┴────────┬─────┘
│ / / / │
│ ┌────────────────────────────────────────────────┐ │
└────>│ Рекомендации по безопасным условиям применения │<─────┘
└────────────────────────────────────────────────┘
┌───────────────────────────────────────────────────┐
│III этап. Испытания средства в технических условиях│
└─────────────────────┬───────┬─────────────────────┘
┌──────────────────────┐ │ │ ┌───────────────────────┐
│Ограниченные испытания│<────────┘ └───────>│ Практические испытания│
│ на волонтерах │ │ по показаниям │
└───────┬──────────────┘ └─────────────────┬─────┘
│ ┌───────────────────────────────┐ │
└───────────>│ Рекомендации к применению │<─────────────┘
└───────────────────────────────┘
Рис. 8.7. Методическая схема оценки токсичности
и опасности репеллентных средств
Токсикологические и клинико-гигиенические исследования в соответствии с Методическими рекомендациями включают:
— первичную оценку токсичности репеллента на лабораторных животных с целью рекомендации о возможном способе и сфере применения (первый этап);
— углубленное изучение токсичности репеллента на лабораторных животных в целях регламентации его содержания в предполагаемом препарате (второй этап):
характеристика токсичности ингредиентов препарата (по данным литературы) — в целях рекомендаций по использованию наиболее безвредных компонентов рецептуры и их регламентации;
изучение токсичности отобранной композиции на лабораторных животных;
— клинико-гигиеническую оценку безопасности применения препарата на добровольцах с получением актов от учреждений, проводивших испытания препарата (третий этап).
Исследование нового, ранее не изученного компонента композиции (действующее вещество, растворитель, пропеллент) проводится по общепринятым в токсикологии методам с установлением основных параметров токсикометрии и оценкой опасности.
Изучение общего токсического действия репеллентов и препаратов на их основе осуществляется в субхроническом или хроническом эксперименте. В условиях эксперимента моделируют основные пути поступления в организм человека, исходя из способов и органов применения.
При нанесении препарата на открытые участки тела лимитирующим является изучение кожно-раздражающего и кожно-резорбтивного действия.
Условия эксперимента по применению репеллентов на кожу человека представлены в табл. 8.21.
Таблица 8.21
ПАРАМЕТРЫ НАНЕСЕНИЯ РЕПЕЛЛЕНТОВ НА КОЖУ ЛАБОРАТОРНЫХ
ЖИВОТНЫХ В СРАВНЕНИИ СО СТАНДАРТНОЙ ОБРАБОТКОЙ
ОТКРЫТЫХ ЧАСТЕЙ ТЕЛА ЧЕЛОВЕКА
|
Виды животных и человек |
Площадь обрабатываемой поверхности |
Максимальный уровень воздействия |
||||
|
кв. см |
% от всей поверх- ности тела |
на единицу массы тела, кв. см |
расход препарата на 1 обра- ботку, мг |
плотность нанесения, мг/кв. см |
доза, мг/кг |
|
|
Мыши |
5 |
8 |
0,25 |
100 |
20 |
5000 |
|
Крысы |
30 |
10 |
0,15 |
500 |
6 |
2500 |
|
Морские свинки |
30 |
8 |
0,10 |
500 |
6 |
1500 |
|
Кролики |
200 |
10 |
0,06 |
3000 |
15 |
1000 |
|
Человек |
5000 |
30 |
0,07 |
5000 |
1 |
70 |
Для оценки кожно-раздражающего действия моделируют плотность нанесения, при изучении кожно-резорбтивного действия — дозу.
Набор конкретных показателей для исследования функции отдельных органов и систем зависит от характера действия изучаемых соединений.
Условия постановки экспериментов с нанесением средства на кожу, с обработкой одежды, помещений, защитных сеток также изложены в Методических рекомендациях.
8.8.1.2.1. Первичная оценка токсичности репеллентов. Первичная оценка токсичности репеллентов имеет целью отбор веществ, перспективных для дальнейшего изучения и определения возможности их применения (нанесение на кожу или одежду, использование в помещении).
Первичная оценка включает изучение острой токсичности при потенциально опасных путях поступления в организм и изучение местно-раздражающих свойств на кожу и слизистые оболочки глаз (см. методические рекомендации).
Для дальнейших исследований отбирают вещества со среднесмертельной
per.os
дозой (ЛД ) не ниже 2500 мг/кг (3-й класс опасности) и кожно-оральным
50
коэффициентом не менее 3, по кожно-раздражающему действию — на уровне или
ниже порога хронического действия (Lim ) для наиболее чувствительного
subac
вида животных (кроликов).
При выявлении у веществ отчетливого раздражающего эффекта на кожу — эти
вещества возможно использовать для обработки одежды или предметов помещения
(C < Lim ).
20 ac
8.8.1.2.2. Углубленная оценка токсичности репеллентных препаратов. Углубленная оценка токсичности репеллентных препаратов — основная цель оценки степени реальной опасности в норме расхода с учетом конкретных условий применения.
Для новых форм репеллентных препаратов изучается: местно-раздражающее действие на кожу и слизистые оболочки глаз, общетоксическое кожно-резорбтивное действие, в хроническом или субхроническом опыте с учетом пути поступления и нормам расхода, оценку сенсибилизирующей и иммуномодулирующей активности.
Кроме этого в качестве критериев оценки безопасности репеллентных
средств предлагается использовать зону биоцидного эффекта (Z
bioc.ef.ac
и Z ).
bioc.ef.subac
При изучении общетоксического (кожно-резорбтивного) действия средств их
уровень воздействия должен соответствовать 10-кратному завышению нормы
расхода, т.е. принимается максимальная зона биоцидного действия более
10 (Z и Z > 10).
bioc.ef.ac bioc.ef.subac
Подбор показателей при этом осуществляют с учетом характера действия основных компонентов.
Для репеллентных средств в аэрозольных баллонах предложено 4 класса их степени по зоне биоцидного эффекта в соотношении 1:3:10 и > 10. Они изучаются при 3- и 10-кратном завышении нормы расхода [22].
Критерии оценки ингаляционной опасности репеллентных средств отражены в классификации степени опасности, изложенной в Методических рекомендациях средств бытового назначения, в которой в соответствии с классом опасности, предлагаются рекомендации для их использования в практике [30].
Для следующего этапа клинических испытаний в практических условиях
рекомендуются препараты при отсутствии общетоксического,
местно-раздражающего, сенсибилизирующего и иммуномоделурующего действия и
при 10-кратном превышении нормы расхода в условиях хронического или
субхронического эксперимента (Z и Z > 10).
bioc.ef.ac bioc.ef.subac
Препараты, токсичные при 10-кратном превышении нормы расхода, но безопасные при 3-кратном превышении нормы расхода, могут быть рекомендованы к использованию только специалистами, имеющими право заниматься дезинфекционной деятельностью, с применением СИЗ [22, 30].
8.8.1.3. Клинические испытания репеллентных средств
в практических условиях
Клинические испытания включают оценку эффективности препарата и испытания безопасности его применения широкими слоями населения, используемых средств для нанесения на кожу, одежду и другие предметы, а также в процессе их обработки.
Испытания безопасности рекомендуется проводить на рандомизированных по полу, возрасту, образу жизни и привычкам, а также степени физической нагрузки группах здоровых добровольцев. Численность групп, использующих препарат, и контрольной группы людей должна быть не менее 30 человек на основе известных ДВ и 50 человек при испытании новых репеллентов. Продолжительность применения не менее месяца.
Врачи-специалисты проводят общий осмотр и отбирают лиц «практически здоровых». В процессе испытаний проводят не менее 4 раз в течение месяца анкетный опрос добровольцев с целью выявления субъективных ощущений, жалоб, возникших в период применения препарата в режиме применения.
Врачи-специалисты (терапевт, невропатолог, дерматолог, отоларинголог, иммунолог) определяют следующие показатели:
— частоту пульса и АД;
— анализ морфологического состава периферической крови;
— общий клинический анализ мочи;
— регистрацию функционального состояния кожи;
— изучение сенсибилизирующего действия (капельный и компрессионный тест);
— общее количество липидов кожи;
— аутофлору поверхностных и глубоких слоев кожи;
— активность лизоцима в слюне.
При выборе показателей для исследования необходимо учитывать различные способы применения препаратов, пути поступления в организм человека, патогенетическую направленность действия их на организм.
Обследование добровольцев проводят перед началом испытаний препарата (фон), через 5, 15 и 30 дней после начала его применения.
В процессе испытания необходимо осуществлять контроль за содержанием наиболее токсичного компонента в биосредах: кровь, моча.
Для промышленного производства и широкого применения рекомендуются препараты, испытанные на проявление местного, общетоксического и сенсибилизирующего действия на добровольцах в режиме применения.
8.8.2. Методическая схема, критерии оценки и методы
определения репеллентных средств для детей
8.8.2.1. Общие требования
Кроме разработки репеллентных средств для взрослых очень важна разработка репеллентных средств для детского контингента.
Начиная с начала 90-х годов прошлого столетия нами совместно с сотрудниками АО НИЦБЫТХИМ (в т.ч. с Л.А. Тимофиевской, Н.Н. Ивановой и др.) были начаты исследования по накоплению материала, позволяющие подойти к обоснованию возрастных критериев для оценки токсичности и опасности репеллентных средств, предназначенных для применения детским контингентом населения [55].
В настоящее время отечественная практика использования репеллентных средств для детей регламентирована в основном их 3 возрастными группами — 7, 5 и 3 годами их жизни. В то же время в международной практике имеет место использование репеллентных средств с еще более раннего возраста 1,0 — 1,5 года.
Обоснование возрастных критериев отбора и оценки репеллентных средств для детей является в настоящее время достаточно актуальной проблемой.
8.8.2.2. Критерии отбора животных по возрастным группам,
соответствующим возрасту ребенка
При оценке токсичности и опасности репеллентных средств для детей разного возраста в опыте используются экспериментальные животные (чаще потомство крыс) с их отбором по возрасту, соответствующему требуемому возрасту ребенка, руководствуясь при этом методическим письмом Фармкомитета «Изучение возрастных особенностей в действии лекарственных средств на экспериментальных животных», 1982.
В табл. 8.22 представлены эквиваленты возраста белых крыс самцов и человека (мужчины, вычисленные по величине истиной скорости роста).
Таблица 8.22
ЭКВИВАЛЕНТЫ ВОЗРАСТА БЕЛЫХ КРЫС САМЦОВ И ЧЕЛОВЕКА МУЖЧИНЫ
ПО ВЕЛИЧИНЕ ИСТИНОЙ СКОРОСТИ РОСТА МАССЫ ТЕЛА
|
Период жизни крыс |
Возраст крыс, мес. |
Возраст человека, лет/мес. |
|
|
Ранний молочный |
0,25 |
4 — 5 мес. |
|
|
Средний молочный |
0,5 |
1,0 — 1,5 года |
|
|
Поздний молочный |
1,0 |
4 — 5 лет |
|
|
Предпубертатный |
I |
2,0 |
10 — 11 лет |
|
II |
3,0 |
14 — 15 лет |
|
|
Пубертатный |
4,0 |
17 — 18 |
|
|
Репродуктивный |
5,0 |
20 лет |
|
|
6,0 |
22 года |
||
|
7,0 |
24 — 25 лет |
Оптимальным возрастом животных для начала эксперимента для крыс является 1,5 — 2,0 недели, которые соответствуют 1,0 — 1,5 годам жизни ребенка. Но наиболее подходящим возрастом являются крысята-отъемыши 3 — 4-недельного возраста с массой тела 50 — 60 г, соответствующие 3 — 5-летнему возрасту ребенка. Этот возраст наиболее приемлем в работе, так как крысята уже отсажены от матери для самостоятельного питания, имеют опушение, открытые ушные раковины и глазные щели, а скорость биохимических и обменных реакций приближена к значениям взрослого организма. Еще более надежным является использование животных старшего возраста (30- и 45-дневных), соответствующих 5 — 7 годам жизни ребенка. В этот период животные уже имеют сформированные жизненно важные системы организма, в связи с чем опыты на них являются наиболее информативными для изучения возможного воздействия репеллентных средств на разнообразные системы организма и ткани.
Самым сложным является введение препаратов новорожденным животным и сосункам, поскольку после взятия детенышей из гнезда или из клетки «мать» может уничтожить свое потомство или просто не принять его обратно. Поэтому большинство токсикологических исследований проводится на животных 2 возрастных периодов: молочного кормления и полового созревания.
8.8.2.3. Основные требования по безопасности
для репеллентных средств для детей
В рецептурах репеллентных средств должны использовать РАДВ с детальной и всесторонней характеристикой их токсичности: возрастной и видовой чувствительности, местно-раздражающих, сенсибилизирующих и резорбтивных свойств при лимитирующем кожном пути поступления в организм, отдаленным специфическим видам действия.
Длительным и положительным опытом применения на основе АДВ репеллентных средств взрослым контингентом.
Положительным опытом клинических испытаний и практического применения репеллентных средств на основе изученных АДВ детским контингентом.
Создание улучшенной рецептуры и вида препаративной формы репеллентного средства в сравнении с ранее применяемой (например, в виде кремов и гелей с уменьшением содержания ДВ, использованием в качестве АДВ веществ природного происхождения, введением вспомогательных компонентов, обладающих фотозащитным, противоаллергическим, ранозаживляющим и дезинфицирующим действием) и т.д.
Наблюдение за постнатальным развитием и состоянием здоровья по достижении половозрелого возраста (2,5 — 3,0 месяца) с оценкой основных органов, тканей и функций организма, включая репродуктивную, и получение потомства с изучением его развития <*>.
———————————
<*> Репеллентные средства для детей должны иметь надежный коэффициент
запаса (К ) от величины их ПДУ на кожу (не менее 10) <**>.
зап
———————————
<**> В связи с этим для репеллентов, предназначенных для разработки средств для детей, необходимо обосновать ПДУ на кожу, соответствующий 4-му классу опасности.
Как и по требованиям к лекарственным средствам, перед применением средства детьми оно должно быть испытано на взрослых, а перед применением детьми младшего возраста получить проверку на детях более старшего возраста.
Для обоснования ПДУ ОДУ ДВ на кожу возможен другой подход, который нами используется в лаборатории, — подход по ускоренному обоснованию предельно допустимых уровней загрязнения кожного покрова вредными веществами [29].
Lim x 70 x K x K
ch ост от.пр
ОДУ , мг/кв. см = —————————,
средства S x K
где:
Lim — порог хронического действия препарата, рассчитанный по формуле:
ch
Lim = 0,001 x DL = 0,001 x 19000 мг/кг = 19 мг/кг;
ch 50
70 — масса тела человека;
K — коэффициент остаточный — 0,25;
ост
K — коэффициент относительной проницаемости — 2;
от.пр
S — площадь кожных покровов человека (средняя площадь 16120 кв. см);
K — коэффициент запаса.
Таким образом, репеллентные средства для детей с 3 лет и моложе должны отвечать вышеперечисленным требованиям и включать в состав рецептуры хорошо изученные репеллентные ДВ.
Репеллент должен относиться к малотоксичным веществам 4-го класса по лимитирующим критериям, без отдаленных эффектов, не проявляющий возрастных различий, а также отчетливых раздражающих, резорбтивных, сенсибилизирующих и иммуномодулирующих эффектов.
8.9. Методы изучения токсичности и опасности
педикулицидных средств
В основу предлагаемого методического руководства положены методические указания по токсиколого-гигиенической оценке педикулицидов [59].
Основное требование, которому должны отвечать все педикулицидные средства, — отсутствие вредного влияния при непосредственном (борьба с головным и лобковым педикулезом) и опосредованном (борьба с платяным педикулезом) контакте с кожей человека, а также при возможном дополнительном их воздействии через органы дыхания.
Педикулициды выпускаются в виде разных препаративных форм: шампунь, мыло, эмульсия, лосьон, дуст, аэрозоль, импрегнированная ткань и т.д. По назначению педикулицидные средства подразделяются на головные, лобковые и платяные.
Сроки токсикологического эксперимента определяются продолжительностью применения педикулицидных средств в практике. Для средств с эпизодическим применением в течение 1 — 3 дней при головном и лобковом педикулезе (с учетом возможной повторной обработки) — 10 дней, для применения в течение 10 — 15 дней (при дезинсекции вещей, ношении импрегнированного белья) — 30 дней.
При токсикологической оценке педикулицидов, предназначенных для борьбы с головным педикулезом у детей, особое внимание уделяется изучению возрастной чувствительности неполовозрелых животных к средству.
Длительность и объем токсикологических исследований при борьбе с платяным педикулезом зависит от содержания средства в ткани по результатам санитарно-гигиенического анализа на разных видах материалов (хлопчатобумажных, шерстяных, синтетических), что обуславливает степень опасности педикулицида при контакте с кожей. При оценке импрегнированной ткани основной задачей токсикологического эксперимента является изучение ее опасности при контакте с кожей в сочетании с гигиенической характеристикой тканей (воздухопроницаемость, гигроскопичность, электризуемость и др.).
Токсиколого-гигиеническое изучение проводится для всех вновь внедряемых педикулицидных средств и осуществляется по 3-этапной схеме:
I этап — первичная оценка токсичности;
II этап — углубленные исследования;
III этап — испытания средства в практических условиях.
Схема исследований педикулицидных средств представлена на рис. 8.8.
┌──────────────────────────────────┐
┌────────┤ I этап. Первичная оценка │──────────┐
│ └───────────────────┬──────────────┘ │
/ / /
┌─────────────────────┐ ┌─────────────────────────────┐ ┌─────────────────┐
│ Сбор информации │ │Параметры острой токсичности:│ │ Специфическое │
│ о токсичности ДВ и │ │ЛД на кожу, ЛД в желудок.│ │ действие │
│основных компонентов │ │ 50 50 │ └────────┬────────┘
│(сведения литературы)│ │ Опасность по степени │ │
└─────────┬───────────┘ │ летучести (C ) │ │
│ │ 20 │ │
│ └──────────────┬──────────────┘ │
/ / /
┌───────────────────┐ ┌────────────┐ ┌───────────────────┐
│Рецептура средства,│ │ K % │ │Местно-раздражающее│
│ назначение, режим │ └───────┬────┘ │ действие на │
│ применения │ │ │ интактную кожу │
└───────────────────┘ │ └───────────┬───────┘
/ /
┌────────────────────────┐ ┌────────────────────┐
│ Местно-раздражающее │ │ Сенсибилизирующее │
┌──────────────┤действие на поврежденную│ │ действие │
│ │ кожу (для головных ПС) │ └───────────┬────────┘
│ └───────────────┬────────┘ │
/ / /
┌──────────────────┐ ┌────────────────────────┐ ┌─────────────────────┐
│Действие на волосы│ │ Местно-раздражающее │ │ Оценка остаточных │
│(для головных ПС) │ │ действие на глаза │ │количеств средств на │
└───────┬──────────┘ └───────────────┬────────┘ │ образцах материи │
│ / │ (для платяных ПС) │
│ ┌────────────────────────┐ └────────────┬────────┘
└─────────────>│ ОТБОР │<───────────────┘
└────────────────────────┘
┌───────────────────────────────────────┐
┌──────────┤ II этап. Углубленные исследования ├─────────┐
│ └──┬─────────────┬────────────────┬─────┘ │
/ / / / /
┌──────────┬────────────┬───────────────────┬─────────────┬───────────────┐
│Кожно- │Возрастная │Отдаленные эффекты:│Ингаляционная│ Санитарно- │
│резорбтив-│чувствитель-│эмбриотоксический, │ опасность │ гигиеническая │
│ное │ность (для │ тератогенный, │ в режимах │оценка образцов│
│действие │головных ПС)│ мутагенный │ применения │ материи (для │
│ │ │ (по показаниям) │ │ (платяных ПС) │
└──────────┴────────────┴───────────────────┴─────────────┴───────────────┘
┌────────────────────────────────────────────────────┐
│ Рекомендации по безопасным условиям применения │
├────────────────────────────────────────────────────┤
┌──────┤III этап. Испытания средства в практических условиях├───────┐
/ └────────────────────────────────────────────────────┘ /
┌──────────────────────┐ ┌───────────────────────┐
│Ограниченные испытания│ │ Практические испытания│
│ на волонтерах │ │ (по показаниям) │
└──────────────────────┘ └───────────────────────┘
Рис. 8.8. Методическая схема оценки токсичности
и опасности педикулицидных средств ПС
I этап. Первичная оценка токсичности ДВ и препаративных форм включает сбор сведений литературы о токсичности ДВ и всех компонентов рецептуры, включая отдаленные эффекты: эмбриотоксический, тератогенный, мутагенный, бластомогенный. Необходимо также иметь сведения о составе рецептуры средства, его назначении и режиме применения.
Исследование нового ДВ, растворителя проводится по общепринятым в токсикологии методам с оценкой общей и специфической токсичности и установлением гигиенических нормативов в объектах окружающей среды, гл. 8.1.
Для средства определяют острую токсичность при введении в желудок
разным возрастным группам животных и нанесении на кожу, опасность по
степени летучести (C ), вычисляется кожно-оральный коэффициент (K ).
20 к/о
Наряду с общей токсичностью изучают токсичность при потенциально опасном
пути поступления в организм: местно-раздражающее действие на кожу и глаза,
сенсибилизирующее действие (при наличии в составе аллергено-опасного
компонента). Оценивают действие на волосы.
По окончании исследований первого этапа проводится отбор перспективных средств с целью их последующего углубленного изучения.
На II этапе углубленного токсикологического исследования продолжается изучение кожно-резорбтивного действия средства, изучается также возрастная чувствительность педикулицидных средств против головного и лобкового педикулеза (для безопасности переноса экспериментальных данных на детское население).
Опасность педикулицидов, предназначенных против платяного педикулеза, оценивают комплексно: по резорбции через кожу и возможном поступлении их паров и аэрозоля через органы дыхания. Проведение токсикологического эксперимента со средствами, предназначенными для борьбы с платяным педикулезом, в основном зависит от наличия остаточных количеств ДВ на различных видах материи, которые обусловливают степень их опасности при контакте с кожей человека или при ингаляции. При отсутствии остаточных количеств ДВ педикулицида на образцах материи после рекомендованного режима дезинсекции, исследования кожно-резорбтивного действия не проводятся, ограничиваются только физико-гигиенической характеристикой различных образцов
Для изучения отдаленных проявлений интоксикации средством проводят оценку эмбриотоксического, тератогенного и мутагенного эффектов (по показаниям) согласно соответствующим методическим рекомендациям.
После II этапа исследований на основании полученных данных составляют разделы в этикетки (бытовая и тарная) и инструкцию по применению педикулицида с характеристикой его токсичности и опасности, необходимых мер предосторожности с рекомендациями мер индивидуальной защиты, а также мер первой помощи при случайном отравлении.
На заключительном III этапе испытаний педикулицидных средств проводят испытания средства в практических условиях.
Практическим испытаниям обязательно подлежат средства на новых ДВ. Для средств на основе хорошо известных компонентов этап испытаний ограничивается апробацией его на ограниченной группе волонтеров (добровольцев), которые проводятся в соответствии с этическими принципами, сформулированными в Хельсинкской Декларации Всемирной Медицинской Ассоциации по проведению биомедицинских исследований на людях (1964 — 1996 гг.) (п. 8.2).
Испытания и оценку безопасности применения педикулицидов для борьбы с лобковым педикулезом следует проводить в кожно-венерологических диспансерах.
8.9.1. Перечень определяемых показателей для оценки
токсичности и опасности педикулицидных средств против
головного и лобкового педикулеза
Острая токсичность при введении в желудок (ЛД ).
50
cut
Острая токсичность при нанесении на кожу (ЛД ).
50
cut
Кожно-оральный коэффициент (K = ЛД / ЛД в желудок).
к/о 50 50
Острая ингаляционная опасность в насыщающих концентрациях паров (C ).
20
Ингаляционная опасность в режимах применения.
Местно-раздражающее действие на кожу.
Местно-раздражающее действие на глаза.
Кожно-резорбтивное действие.
Определение коэффициента возрастной чувствительности КВЧ по лимитирующим параметрам для животных разного возраста: половозрелого и неполовозрелого.
Сенсибилизирующее действие.
Эмбриотропное, тератогенное и мутагенное действия (по показаниям).
Испытания средства в практических условиях.
8.9.2. Методы определения и оценки токсичности и опасности
педикулицидных средств против головного
и лобкового педикулеза
8.9.2.1. Показатели острой токсичности
Определение среднесмертельной дозы при однократном введении в желудок
и нанесении на кожу (ЛД ), а также ингаляционной опасности в насыщающих
50
концентрациях паров (C ) рассмотрены в п. п. 8.2.2.1, 8.2.2.2 и 8.2.2.4.
20
8.9.2.2. Ингаляционная опасность в режимах применения
На втором этапе исследований препаративных форм, применяемых в виде аэрозолей, изучают токсичность при ингаляционном пути поступления педикулицида в организм с учетом режима применения: в норме расхода и 3 — 10-кратном ее завышении. Норма расхода состава устанавливается исходя из рекомендуемого режима применения. Это позволяет определить широту зоны токсического действия, класс опасности и условия применения средства на практике. Длительность эксперимента — 10 — 14 дней для средств эпизодического применения при ежедневной экспозиции — 4 ч. Животных обследуют в середине и по окончании эксперимента, регистрируя интегральные и специфические показатели состояния организма.
8.9.2.3. Определение и оценка местного раздражающего
действия на кожу
Местное раздражающее действие на кожу педикулицидов изучают при однократном и многократном нанесении на кожные покровы не менее двух видов животных. Общие рекомендации по проведению эксперимента даны в п. 8.9.2.6. Участок аппликации должен составлять 3% поверхности кожи человека, что при переносе на кожу лабораторных животных составляет: для крыс — 6 кв. см (2 x 3), для морских свинок — 9 кв. см (3 x 3), для кроликов — 25 кв. см (5 x 5). Правый бок служит для аппликации изучаемого средства, левый — для контроля. Сроки токсикологического эксперимента определяются продолжительностью применения педикулицидных средств в практике: для борьбы с головным и лобковым педикулезом (1 — 2-разовая обработка) — 2 недели (10 аппликаций). Однократная экспозиция средства составляет 30 — 60 мин. с учетом нормы расхода. В норме расхода исходят из расчета 30 — 50 мл (г) средства на кожу головы. Однократное нанесение соответствует одной норме расхода, трехкратное — трем нормам расхода, десятикратное — десяти нормам расхода.
Целесообразно проведение дробного нанесения средства с двумя перерывами по 4 дня по схеме: 3 аппликации, перерыв 4 дня, 3 аппликации, перерыв 4 дня и еще 4 аппликации.
В эксперименте на морских свинках или кроликах изучается также местно-раздражающее действие средства на скарифицированную кожу, имитируя поврежденную расчесами кожу. Для этого на предварительно выстриженные участки кожи иглой наносят царапины в виде решетки # до появления крови. Однократно наносят средство на один из поврежденных участков кожи, другой — служит контрольным. Ведется наблюдение за процессом полного заживления искусственных царапин в течение 1 — 2 недель.
Признаки раздражения кожи выявляются визуально, а также с помощью инструментов, фиксируя покраснение кожи, отек, сухость, шелушение и т.д. Выраженность эритемы оценивается визуально в баллах по классификации С.В. Суворова (п. 8.2.2.6, табл. 8.4, 8.5).
Изучение местного действия средств проводят как на освобожденном от шерсти участке кожи, так и непосредственно на шерстный покров с целью оценки действия на волосы. Для шерсти оценивают изменения цвета, блеска, ломкости, неравномерности роста, в т.ч. облысения.
Местный раздражающий эффект в условиях повторного опыта оценивают по той же классификации выраженности раздражающих свойств (табл. 8.4, 8.5) и показателям с дополнительной регистрацией сухости, шелушения, трещин, уплотнения кожи и т.д.
8.9.2.4. Определение и оценка местно-раздражающего
действия на глаза
Местно-раздражающее действие на глаза изучают в эксперименте на кроликах при однократном воздействии (без промывания и с промыванием глаз водой). После внесения средства в конъюнктивальный мешок глаз промывают из шприца (или резиновой груши) теплой питьевой водой в течение 1 — 2 мин.
Регистрацию изменений слизистой оболочки глаза, склеры и роговицы проводят визуально или с помощью офтальмоскопа сразу после воздействия, через час и ежедневно до исчезновения клинических признаков. Отмечают выраженность гиперемии и отека слизистой оболочки, инъекцию сосудов склеры, состояние роговицы, количество и качество выделений из глаза (классификации раздражающих свойств на глаза, п. 8.2.2.7, табл. 8.6, 8.7).
8.9.2.5. Определение и оценка кожно-резорбтивного действия
Общие подходы, см. п. 8.2.2.8. В качестве подопытных животных используются крысы. Для контроля берется отдельная группа животных. Участок аппликации должен составлять 3% поверхности кожи человека, что при переносе на кожу лабораторных животных составляет: для крыс — 6 кв. см (2 x 3). Изучаемое средство наносят на кожу животных в готовой форме или в рабочей концентрации (рекомендуемой для применения). Однократная экспозиция средства составляет 30 — 60 мин. с учетом нормы расхода. В норме расхода исходят из расчета 30 — 50 мл (г) средства на кожу головы. Однократное нанесение соответствует одной норме расхода, трехкратное — трем нормам расхода, десятикратное — десяти нормам расхода.
Кожно-резорбтивное действие оценивают при повторном (в течение
2 недель) воздействии на кожные покровы крыс с установлением по возможности
порога подострого действия (Lim ). Обследование подопытных животных
subac
проводят после 3 и 10 аппликаций средства. Показатели биологического
действия препарата выбирают с учетом направленности действия ДВ и активно
действующих ингредиентов.
8.9.2.6. Определение коэффициента возрастной
чувствительности КВЧ
Токсикологический эксперимент педикулицидных средств, предназначенных для использования детским контингентом, начиная с 3-летнего возраста, проводят на молодых животных (чаще потомство крыс), соответствующих возрасту ребенка, руководствуясь документом Фармкомитета. Эквиваленты возраста белых крыс и человека представлены в гл. 8, табл. 8.22. Наиболее оптимальным возрастом являются крысята-отъемыши 3-недельного возраста с массой тела 40 — 50 г, соответствующие 3-летнему возрасту ребенка. Обследование молодых животных осуществляют по окончании воздействия средства, используя комплекс тестов, характеризующих состояние основных органов и функций, включающих как интегральные, так и специфические показатели физиологического, биохимического и морфологического характера.
8.9.2.7. Определение и оценка сенсибилизирующих свойств
Оценку сенсибилизирующего действия педикулицидов проводят путем комплексной сенсибилизации с адъювантом Фрейнда по методу Алексеевой-Петкевич, сочетающей внутрикожную сенсибилизацию организма с накожными аппликациями (п. 8.2.2.11), или метод Е.П. Иевлевой (п. 8.4.2.4).
8.9.3. Перечень показателей и методы определения токсичности
и опасности педикулицидных средств против
платяного педикулеза
Острая токсичность при введении в желудок (ЛД ).
50
cut
Острая токсичность при нанесении на кожу (ЛД ).
50
cut
Кожно-оральный коэффициент (K = ЛД / ЛД в желудок).
к/о 50 50
Острая ингаляционная опасность в насыщающих концентрациях паров (C ).
20
Ингаляционная опасность в режимах применения.
Местное раздражающее действие на кожу.
Местно-раздражающее действие на глаза.
Кожно-резорбтивное действие.
Определение коэффициента возрастной чувствительности КВЧ по лимитирующим параметрам для животных разного возраста: половозрелого и молодого.
Сенсибилизирующее действие.
Оценка остаточных количеств средства на образцах материи.
Санитарно-гигиеническая оценка материалов, обработанных или импрегнированных средством.
Эмбриотропное, тератогенное и мутагенное действия (по показаниям).
Испытания средства в практических условиях.
Перечень показателей токсичности педикулицидных средств против платяного педикулеза включает те же параметры и показатели, что и для головного и лобкового педикулеза. Ниже приведены некоторые особенности изучения средств, предназначенных для борьбы с платяным педикулезом.
На первом этапе токсиколого-гигиенических исследований определяют ДВ в смывах с различных образцов материи или путем экстракции. Целью аналитических исследований является: обнаружение остаточных количеств ДВ; изучение интенсивности и динамики миграции из различных образцов материи. Исследования проводятся специалистом химиком-аналитиком.
8.9.3.1. Определение и оценка кожно-резорбтивного
действия средства
Кожно-резорбтивное действие средства в остром опыте оценивают по кожно-
оральному коэффициенту (K ), представляющему собой соотношение
к/о
среднесмертельной дозы при воздействии на кожу и введении в желудок.
Длительные токсикологические эксперименты на животных проводят в случае обнаружения потенциально опасных количеств ДВ (при дезинсекции вещей средством) и независимо от этого с импрегнантами белья.
Изучение кожно-резорбтивного действия средств проводят в субхроническом эксперименте в норме расхода средства и с 10-кратным ее завышением в течение 1 месяца при ежедневной 4-часовой экспозиции.
Длительность и объем токсикологических исследований указанных средств зависит от содержания средства в ткани по результатам санитарно-гигиенического анализа на разных видах материалов (хлопчатобумажных, шерстяных, синтетических), что обусловливает степень опасности педикулицида при контакте с кожей. Оценке подвергаются количества препарата, реально присутствующие на ткани, исходя из результатов санитарно-гигиенического анализа. В случае отсутствия остаточных количеств препарата на тканях токсикологический эксперимент не проводится.
Изучение токсического действия импрегнантов проводят с помощью пропитанных препаратом матерчатых попон, которые контактируют с кожей животных в течение 7 — 10 суток (с учетом носки белья до стирки). Затем попоны стирают, вновь импрегнируют и одевают на аналогичный срок.
8.9.3.2. Санитарно-гигиеническая оценка материалов,
обработанных или импрегнированных педикулицидами
Для средств, предназначенных для борьбы с платяным педикулезом (в т.ч. импрегнирования белья), необходимо проведение санитарно-гигиенического исследования различных образцов материалов: хлопчатобумажных, шерстяных, синтетических.
К гигиеническим свойствам материи, в основном, относят: воздухопроницаемость, электризуемость, гигроскопичность, испаряемость и др. Перечисленные показатели имеют важное значение в формировании пододежного микроклимата и определения условий терморегуляции организма.
На первом этапе токсиколого-гигиенических исследований педикулицидов вначале проводят экспертную оценку различных образцов материи, подвергнутых дезинсекции или импрегнированных препаратами, в сопоставлении с ее контрольными образцами (визуальную, органолептическую по балльной системе). Регистрируют наличие стойкого специфического запаха, изменение окраски и нарушение прочности материалов. При отсутствии перечисленных признаков, делают заключение о возможности применения педикулицидного препарата и ограничивают исследования первым этапом. В противоположном случае переходят ко второму этапу гигиенических исследований.
На втором этапе углубленного исследования проводят изучение физико-химических свойств материалов, подвергнутых дезинсекции или импрегнации препаратом, в соответствии с «Методическими указаниями по гигиенической оценке одежды и обуви из полимерных материалов» [54]. Физико-гигиенические исследования тканей должны проводиться с учетом их сорбционных свойств сохранения дезинсектанта материей с целью рекомендаций по преимуществу обработки того или иного текстильного материала конкретным препаратом.
Критериями гигиенической оценки материалов, подвергнутых дезинсекции или импрегнации педикулицидами, являются:
— стойкость специфического запаха, придаваемая материалам;
— изменение физико-гигиенических свойств тканей (воздухопроницаемость, испаряемость, гигроскопичность), которые нарушают нормальные физиологические реакции организма;
— отсутствие роста патогенной микрофлоры;
— отсутствие повреждающего действия на внешний вид материи.
Санитарно-гигиенические показатели учитываются при обосновании безопасных условий применения педикулицидов.
8.9.4. Испытания средства в практических условиях
До этапа широких практических испытаний целесообразно проведение ограниченных испытаний на волонтерах с оценкой состояния кожных покровов: pH, температура кожи, электросопротивляемость и другие физиологические и гигиенические показатели. При необходимости проверяются на добровольцах аллергенные свойства изучаемого средства (кожные пробы, «лоскутная проба», пробы in vitro и др.).
Положительные результаты этого этапа позволяют перейти к широким практическим испытаниям педикулицидов против головного и лобкового педикулеза, а также для средств, предназначенных для дезинсекции вещей и импрегнантов, для которых проводятся клинико-гигиенические исследования на волонтерах под наблюдением врачей основных специальностей: терапевта, дерматолога, аллерголога, невропатолога и др. Испытания проводятся в соответствии с этическими принципами, сформулированными в Хельсинской декларации Всемирной медицинской ассоциации по проведению биомедицинских исследований на людях 1964 — 1996 гг. (п. 8.2).
При положительных результатах практических испытаний средство рекомендуют для регистрации и внедрения в практику.
Наличие острых субъективных и объективных реакций на воздействие средства более чем у 5% испытуемых, а также сдвиги в физиологических и биохимических показателях у волонтеров (опытной группы) в сравнении с контрольной, с учетом противопоказаний, является основанием к пересмотру рекомендованных режимов применения средства или его рецептуры.
На основании проведенных исследований разрабатываются рекомендации по мерам предосторожности при работе и хранении средства, которые включают в текст этикетки и инструкцию по применению средства.
Практические испытания педикулицидов проводят на заключительном этапе с целью оценки их безопасного применения. Практическим испытаниям обязательно подлежат средства на новых ДВ. Для средств на основе хорошо известных компонентов этап испытаний ограничивается апробацией его на ограниченной группе волонтеров, добровольцев-испытателей.
Оценка безопасности средства проводится в соответствии с разработанным режимом применения в двух сериях:
— предварительная апробация средства на ограниченной группе волонтеров, добровольцев-испытателей — 6 — 10 человек;
— окончательная апробация средства проводится на 2 — 3 базах с участием не менее 30 человек согласно разработанной инструкции по испытанию эффективности и опасности как для профессионального контингента, так и для пациентов.
Перед началом исследований проводят общий медицинский осмотр и оценивают состояние здоровья добровольцев с учетом анамнестических данных о кожных и аллергических заболеваниях. Всех испытуемых инструктируют о режиме применения изучаемого препарата, возможных субъективных ощущениях и при появлении побочных реакций о необходимости немедленного обращения к медицинскому персоналу, обслуживающему испытания. По ходу испытаний проводят анкетный опрос испытуемых для учета субъективных ощущений и возможных жалоб. К проведению осмотров привлекается дерматолог, а в случае необходимости — врачи других специальностей.
При положительных результатах испытаний в практических условиях или на ограниченном контингенте испытателей изучаемое педикулицидное средство рекомендуется для применения в практике или на промышленный выпуск с последующим использованием по назначению.
В результате проведенных исследований разрабатывают рекомендации по мерам предосторожности при работе и хранении средства для включения в текст этикеток (бытовая или тарная) и инструкцию по применению.
8.9.5. Критерии оценки токсичности, опасности и отбор
педикулицидных средств
По полученной в эксперименте токсикологической характеристике средства
обосновывают величину коэффициента запаса (K ) и возможный допустимый
зап
уровень его на кожных покровах. Коэффициент запаса выбирается с учетом:
острой токсичности; времени контакта педикулицида с кожей и
продолжительности его применения; величин зоны острого и субхронического
действия, препаративной формы и др. Для большинства препаративных форм
предложено устанавливать K равный 3.
зап
В результате исследований I этапа проводят отбор средства для
последующего углубленного изучения. Не подлежат дальнейшему изучению
средства, имеющие:
— ЛД при нанесении на кожу менее 2500 мг/кг (по классификации
50
ГОСТ 12.1.007-76);
— ЛД при введении в желудок менее 151 мг/кг (та же классификация);
50
— местное раздражающее действие на кожу более 2 баллов;
— выраженное местное раздражающее действие на слизистые оболочки глаза
(2 класс опасности по классификации ДС, более 6 баллов);
— выраженное кожно-резорбтивное действие (K менее 3);
к/о
— сенсибилизирующий эффект;
— отрицательное влияние на волосы.
По местному раздражающему действию на кожные покровы допускается слабая (розовый тон) эритема (1 балл по классификации ДС), наблюдаемая после 3 — 10 аппликаций. Средства, рекомендованные для детей, не должны обладать местным раздражающим действием на кожу.
Допускается слабое раздражающее действие средства на слизистые оболочки глаза (1 балл), проходящее в короткие сроки через 1 — 2 ч.
Ингаляционную опасность средства и возможность применения его на практике определяют согласно классификации табл. 8.23.
Таблица 8.23
КЛАССИФИКАЦИЯ ПО СТЕПЕНИ ОПАСНОСТИ ПЕДИКУЛИЦИДНЫХ
СРЕДСТВ В АЭРОЗОЛЬНОЙ ФОРМЕ
|
Класс опасности |
Характеристика ингаляционной токсичности аэрозолей при повторном воздействии |
Заключение о возможности применения средства в практике |
|
1 Высокоопасные |
Токсичны в рекомендуемой норме расхода |
Непригодны |
|
2 Умеренно опасные |
Токсичны при 3-кратном завышении нормы расхода |
Пригодны в отсутствии людей с защитой органов дыхания для дезслужбы |
|
3 Малоопасные |
Токсичны при 10-кратном завышении нормы расхода |
1. Пригодны для дезслужбы (при регламентации режима работы). 2. Пригодны для населения |
|
4 Практически не опасные |
Не токсичны при 10-кратном завышении нормы расхода |
Пригодны в условиях дезслужбы и быта |
В составы педикулицидных средств не разрешается вводить инсектициды ДВ, относящиеся к 1-му классу чрезвычайно опасных соединений согласно ГОСТ 12.1.007-76, обладающих специфическими отдаленными эффектами (эмбриотропным, мутагенным и бластомогенным).
Количественная степень опасности педикулицидов распределена по 4 классам в зависимости от величины зоны биоцидного эффекта по кожно-резорбтивному эффекту (от 1 до 10) и в зависимости от наличия и степени выраженности раздражающих и сенсибилизирующих свойств. Чем уже зона биоцидного эффекта, тем опаснее средство и наоборот.
Не рекомендуются к применению чрезвычайно опасные средства, повреждающие волосяной покров, проявляющие одновременно большинство 2 — 3 эффектов — кожно-резорбтивный эффект в ранние сроки, сильное раздражающее действие в нативном виде и рабочих растворах, а также вызывающие выраженный (у 50% животных) сенсибилизирующий эффект.
К применению по эпидемиологическим показаниям с жесткой регламентацией режимов применения рекомендуются высокоопасные средства, проявляющие какой-либо один лимитирующий эффект. Средства 3-го класса (умеренно опасные) при зоне биоцидного эффекта 3,1 — 10,0 с умеренным раздражением от препарата при его повторном нанесении, а также проявлении сенсибилизирующего эффекта у отдельных лиц могут применяться только для взрослого населения обученным персоналом. И без ограничения сфер и контингента рекомендуются средства малоопасные 4-го класса.
Сфера применения педикулицидных средств в виде аэрозольной формы регламентируется прежде всего с учетом реального ингаляционного пути воздействия на организм. Средства, токсичные в норме расхода, не пригодны для применения. Умеренно опасные средства 2-го класса (табл. 8.23), токсичные при 3-кратном завышении нормы расхода, рекомендованы для применения специалистами дезслужбы с защитой органов дыхания. Средства 3-го и 4-го классов могут использоваться как специалистами дезслужбы, так и населением в быту.
Критерии отбора по ДВ. Запрещению подлежат средства, содержащие ДВ 1-го
класса опасности при введении в желудок (ЛД < 15 мг/кг) и ингаляционном
50
воздействии по степени летучести (C — гибель), 1 — 2-го классов при
20
воздействии на кожу (ЛД < 500 мг/кг), с резко выраженными местно-
50
раздражающими (1-й класс опасности по классификации ДС, суммарный балл
отека и эритемы более 6 баллов) (табл. 8.25), кожно-резорбтивными
(K < 1), а также аллергенными свойствами, оказывающие депиляторный и
к/о
депигментационный эффекты на волосы и кожу.
8.10. Методы изучения токсичности и опасности
дератизационных средств
8.10.1. Этапы изучения токсичности и опасности
дератизационных средств
Среди большой группы дезинфекционных средств проблема безопасности наиболее остро стоит для дератизационных средств, в связи с чрезвычайно высокой их токсичностью, обусловленной их назначением для уничтожения грызунов и, в свою очередь, представляющих не меньшую опасность для человека.
Как правило, родентициды в своей основной массе относятся к группе чрезвычайно опасных веществ 1-го класса по ГОСТ 12.1.007-76 [24]. И если при отборе ДС другого назначения такие вещества запрещается включать в составы рецептур, то в качестве дератизационных средств их необходимо использовать для обеспечения целевого эффекта.
Дератизационные средства в основном подразделяются на яды острого и кумулятивного типа действия, среди последних преобладают яды, обладающие антикоагулянтным механизмом действия.
Наиболее опасными среди дератизационных средств являются яды острого типа действия по сравнению с дератизационными средствами с антикоагулянтным механизмом действия, так как для них отсутствует специфический антидот.
В связи с этим яды острого типа действия должны применяться только по эпидпоказаниям специалистами организаций, имеющих право заниматься дезинфекционной деятельностью.
Мероприятия по борьбе с грызунами осуществляют как специалисты организаций, имеющих право заниматься дезинфекционной деятельностью, так и население, приобретающее средства через торговую сеть. Специалисты организаций, имеющих право заниматься дезинфекционной деятельностью, в процессе работы с родентицидами должны руководствоваться правилами по охране труда работников дезинфекционного дела и СП 3.5.3.1129-02 «Санитарно-эпидемиологические требования к проведению дератизации» [13], в которых описан основной режим работы, правила по технике безопасности и необходимые средства индивидуальной защиты при проведении дератизационных мероприятий. Наиболее ответственная задача по разработке режимов безопасного применения и хранения дератизационных средств относится к их использованию населением в быту.
Для истребления грызунов используют дератизационные средства острого и кумулятивного типа действия. Пути их поступления в организм грызунов различны и определяются препаративной формой. Дератизационные средства, входящие в состав пищевых отравленных приманок, поступают в организм преимущественно через желудочно-кишечный тракт. Для липких композиций и дустов, используемых при приготовлении ядовитых покрытий, имеет место комплексное поступление в организм — через желудочно-кишечный тракт и кожу. Для фумигантов основным путем воздействия (а для дустов дополнительным) являются органы дыхания. В практике дератизации ведущее место занимают дератизационные средства, содержащие яды кишечного действия. Поэтому основное внимание уделяется методам изучения дератизационных средств, поступающих в организм грызунов преимущественно через желудочно-кишечный тракт. При изучении и оценке дустов и фумигантов следует ориентироваться на разработанные ранее для этих целей методические подходы. Наиболее опасно применение фумигантов, но сфера их использования достаточно узка (норы грызунов в природных биотопах или на незастроенной территории, отдельные сооружения: зернохранилища, мукомольные комбинаты, морские и речные суда, а также стога, скирды и некоторые другие объекты). Применение дератизационных средств в виде дустов оправдано по эпидпоказаниям, но не менее опасно и требует жесткой регламентации.
Дератизационные средства поступают в торговую сеть в виде разных препаративных форм: полностью готовых к употреблению (гранулы, таблетки, галеты, брикеты, тесто, пищевые приманки, клей) или в виде менее опасных концентратов (растворы, гели, пасты и др.), из которых готовят отравленные пищевые приманки или ядовитые покрытия.
Вновь разрабатываемые препаративные формы дератизационных средств и рекомендуемые способы применения должны:
— быть эффективны в отношении грызунов;
— не обладать репеллентными свойствами (резким запахом или вкусом, отпугивающим грызунов);
— гарантировать безопасность для здоровья человека;
— не вызывать отравлений и гибели нецелевых видов животных, в т.ч. диких животных и домашних птиц;
— иметь антидоты;
— не приводить к загрязнению окружающей среды;
— быть безопасными в пожарном отношении;
— не повреждать материалы, с которыми соприкасаются.
По внешнему виду и упаковке дератизационные средства для предотвращения ошибок при их использовании должны отличаться от пищевых продуктов, лекарственных препаратов, фуража, предметов домашнего обихода, детских игрушек, содержать в своем составе горечь битрекс. Цветовая маркировка приманок обязательна (Постановление N 7 Госкомсанэпиднадзора России от 21.09.1994).
При проведении токсикологического эксперимента с дератизационными средствами учитывают его назначение, сферу применения, вид препаративной формы, норму расхода и способ применения.
Методическая схема изучения токсичности и опасности дератизационных средств представлена на рис. 8.9. Она включает 3 этапа: сбор информации (1-й этап), оценку токсичности и опасности средства в эксперименте на лабораторных животных с учетом рекомендованного режима применения (2-й этап) и натурные испытания в практических условиях (3-й этап).
┌─────────────────────────┐
┌───────────┤1 этап — Сбор информации├──────────┐
/ └─────────────────────────┘ /
┌───────────────────────────┐ ┌─────────────────────────┐
│ Итоговые сведения о ДВ и │ │ Разработка рецептуры, │
│ сопутствующих компонентах │<─────────────────>│оценка ее эффективности в│
│ рецептуры, гигиенические │ │ лабораторных условиях, │
│ рекомендации к составу и ├───┐ ┌───┤ рекомендации по нормам │
│ виду препаративной формы, │ │ │ │ расхода │
│сфере и условиям применения│ │ │ └─────────────────────────┘
└───────────────────────────┘ / /
┌───────────────────────────────────────┐
│2 этап — Оценка токсичности и опасности│
│ средства в эксперименте на │
│ лабораторных животных │
└────────────────────┬──────────────────┘
┌──────────────┴─────────────┐
┌──────────┤1 подэтап — Первичная оценка├───────┐
/ └──────┬───────┬───┬───┬─────┘ │
┌──────────────────┐ │ │ │ │ │
│Острая токсичность│ │ │ │ │ /
└┬───────┬───────┬─┘ │ │ │ │ ┌─────────────┐
/ / / │ │ │ │ │Избирательная│
┌───────┐ ┌────┐ ┌───────┐ │ │ │ │ │ токсичность │
│ В │ │ На │ │Органы │ │ │ │ │ └──────┬──────┘
│желудок│ │кожу│ │дыхания│ │ │ │ │ /
└───┬───┘ └──┬─┘ └───┬───┘ │ │ │ │ ┌────┐
/ / / │ │ │ │ │ K │
┌────┐ ┌────┐ ┌────┐ │ │ │ │ │ ит│
│ЛД │ │ЛД │ │ЛС │ │ │ │ │ └────┘
│ 50│ │ 50│ │ 50│ │ │ │ │ ┌─────────────────────┐
└──┬─┘ └──┬─┘ └──┬─┘ │ │ │ └─>│Раздражающие свойства│
/ / / │ │ │ └┬────────────┬───────┘
┌────┐ ┌────┐ ┌────┐ │ │ │ │ │
│ЛД │ │ Z │ │ Z │ │ │ │ │ │
│ 50│ │ 1 │ │ 1 │ │ │ │ / /
└──┬─┘ └──┬─┘ └──┬─┘ │ │ │ ┌────┐ ┌──────────────────┐
/ / / │ │ │ │Кожа│ │Слизистые оболочки│
┌────┐ ┌────┐ ┌────┐ │ │ │ └────┘ └──────────────────┘
│ Z │ │TL │ │ C │ │ │ │
│ 1 │ │ 50│ │ 20│ │ │ │ ┌──────────────────┐
└──┬─┘ └────┘ └──┬─┘ │ │ └─────────>│Сенсибилизирующий │
/ / │ │ │ эффект │
┌────┐ ┌────┐ │ │ │ (по показаниям) │
│TL │ │TL │ │ │ └──────────────────┘
│ 50│ │ 50│ │ │
└────┘ └────┘ │ │
┌─────────────────────────┐ │ │
│Кожно-резорбтивный эффект│ │ │
│ (K ) , однократно и │<───┘ │
│ к/о э │ │
│ повторно (2 недели) │ │
└─────────────────────────┘ │
┌─────────────┴────────────────┐
┌───────────────┤2 подэтап — Углубленная оценка├──────────┐
│ └─────────────┬────┬───────────┘ │
/ │ / /
┌───────────────────┐ ┌────────────┴───────────┐ ┌───────────────┐
│Кумулятивный эффект│ │Стабильность в объектах │ │Риск вторичных │
│ для потенциально │ │окружающей среды (почве)│ │отравлений для │
│ опасных путей │ └─────┬──────┬───────────┘ │нецелевых видов│
└──┬──────────┬─────┘ │ │ └─────┬─────────┘
/ │ │ │ │
┌──────┐ │ │ │ │
│ K │ │ │ │ │
│ кум │ │ │ │ │
└──────┘ / / │ /
┌────────────────────────────────┴───────────────────────────────┐
│ Оценка результатов исследования с регламентацией безопасности │
│ применения средств в зависимости от его степени опасности, │
│характера действия и санитарно-гигиенической ситуации на объекте│
└──┬──────────────────────┬──────┬───────────────────────┬───────┘
/ / │ /
┌──────────────┐ ┌─────────────────────┴────────────┐ ┌───────────────────┐
│ Дозировка, │ │Выбор сферы применения (дезслужба,│ │Условия хранения, │
│ фасовка, │ │быт), вида препаративной формы │ │утилизация остаточ-│
│ упаковка, │ │(безопасной для человека и нецеле-│ │ных количеств │
│ маркировка, │ │вых видов животных), условий │ │средства и погибших│
│этикетирование│ │обработки в зависимости от │ │животных │
└───────────┬──┘ │категории объекта │ └─────┬─────────────┘
│ └──────────────┬──────┬────────────┘ │
/ / │ /
┌─────────────────────────────┴────────────────────────┐
│ Составление проекта НТД для производства (ТУ) │
│и применения средств (методические указания, этикетка)│
└─────────────────────────────┬────────────────────────┘
/
┌───────────────────────────────────────────────────┐
│3 этап — Натурные испытания в практических условиях│
└──────┬──────────────────────────────────────┬─────┘
/ /
┌─────────────────────────────────┐ ┌──────────────────────────────────┐
│Учет эффективности и безопасности│ │Рекомендации к применению средства│
│ применения по результатам │ │ с учетом натурных испытаний, │
│анкетного опроса, учет вторичных │ │ составление НТД │
│ отравлений нецелевых видов │ └──────────────────────────────────┘
└─────────────────────────────────┘
Рис. 8.9. Методическая схема оценки токсичности и опасности
препаративных форм дератизационных средств
На первом этапе изучения препаративных форм дератизационных средств собираются итоговые сведения о ДВ и компонентах рецептуры по литературным или собственным данным; даются рекомендации по допустимому содержанию ДВ в препарате, составу и виду препаративной формы, сфере и условиям применения.
Этот этап завершается оценкой рецептуры средства, оценкой эффективности в лабораторных условиях и рекомендациями по нормам расхода и способам применения.
Второй этап подразделяется на два подэтапа: 1-й — с проведением первичной оценки токсичности средства и 2-й — с его углубленной оценкой.
Первичная оценка родентицидных средств включает подробную
характеристику их острой токсичности для потенциально опасных путей
поступления в организм по тем же параметрам, что и ДВ. Устанавливаются
такие параметры, как ЛД , TL , Z и K при введении в желудок, на кожу,
50 50 1 ит
ингаляционная опасность — для фумигантов и дустов по ЛС и степени
50
летучести (C ). При этом важным является определение среднесмертельной
20
дозы (ЛД ) на наиболее чувствительном виде животных. На основании этого
50
параметра проводится регламентация норм расхода средства на объекте во
избежание смертельного отравления (в основном для родентицидов острого
типа действия).
По показаниям изучают местно-раздражающие, кожно-резорбтивные и сенсибилизирующие свойства для препаративных форм в виде концентратов гелей, паст, масляных растворов.
Основной целью подэтапа углубленных исследований родентицидных средств является оценка степени их реальной опасности с учетом назначения, условий применения, нормы расхода и вида препаративной формы. На этом подэтапе проводится определение кумулятивных свойств с учетом потенциально опасных путей поступления в организм (изолированного или комплексного). Этот эксперимент обязателен для всех препаративных форм родентицидов. На этом этапе дается характеристика стабильности препарата в объектах окружающей среды (прежде всего в почве) и возможности вторичных отравлений нецелевых видов.
На третьем, завершающем, этапе проводятся практические испытания родентицидных средств с учетом их эффективного применения и оценки безопасности. По результатам такой апробации в проект инструкции по применению конкретной препаративной формы вносятся изменения и дополнения.
При опасности вторичных отравлений дератизационными средствами необходимо соблюдать строгий режим их применения (или запрещения) на пищевых объектах (особенно мясокомбинатах, птице- и животноводческих фермах).
Во избежание отравления птиц особой осторожности в использовании заслуживают зерновые и гранулированные препаративные формы родентицидов.
Анализ полученных от испытателей заключений о побочных эффектах должен быть основанием (при необходимости) для внесения соответствующих изменений и дополнений в разделы по мерам предосторожности и оказанию первой помощи инструкции по применению и этикетку готового средства.
В инструкции по применению родентицидного средства особое внимание уделяется мерам предосторожности:
— хранению, перевозке и раскладке средства;
— медицинским противопоказаниям для лиц, работающих со средством;
— использованию средств индивидуальной защиты;
— методам и способам безопасного применения раскладки, включая требования для разных категорий объектов (детские, лечебные, пищевые и др.);
— способам сбора и утилизации остатков средства, тары и трупов павших грызунов;
— способам оказания первой помощи при случайном отравлении, включая применение антидота и другие меры по детоксикации яда.
Кроме этого проводится определение фактора безопасности (S ) в реальных
F
условиях применения для дератизационных средств в форме дустов и порошков.
8.10.2. Перечень определяемых показателей для оценки
токсичности и опасности дератизационных средств
8.10.2.1. Дератизационные средства в различных формах:
пасты, гели, масляные растворы, тесто
Острая токсичность при введении в желудок (ЛД ).
50
Острая токсичность при нанесении на кожу (ЛД ).
50
Кумулятивный эффект.
Острая ингаляционная опасность в насыщающих концентрациях по степени
летучести (C ).
20
Кожно-резорбтивное действие 0,5 мес.
Местно-раздражающее действие на кожу 0,5 — 1,0 мес.
8.10.2.2. Дератизационные средства в виде дустов и порошков
Острая токсичность при введении в желудок (ЛД ).
50
Острая токсичность при нанесении на кожу (ЛД ).
50
Кумулятивный эффект.
Оценка реальной опасности средства в рекомендованных режимах применения фактор безопасности.
Местно-раздражающее действие на слизистые оболочки глаз.
Кожно-резорбтивное действие 0,5 мес.
8.10.2.3. Дератизационные приманки зерновые,
гранулированные, блоки восковые, парафинированные
Острая токсичность при введении в желудок (ЛД ).
50
Кумулятивный эффект.
8.10.3. Методы изучения токсичности и опасности
дератизационных средств
8.10.3.1. Определение среднесмертельной дозы
при однократном введении в желудок (ЛД )
50
Определение среднесмертельной дозы дератизационных средств при однократном введении в желудок проводится путем насильственного введения исследуемого родентицида в желудок зондом (это относится к препаративным формам в виде масляных концентратов, гелей, паст, дустов) (п. 8.2.2.1) или путем дозированного скармливания (это относится в основном к препаративным формам в виде брикетов, гранул, зерновых приманок).
На основании установления тесной корреляционной связи параметров острой
токсичности (ЛД ) ДВ и дератизационных средств на их основе, в составы
50
которых входят в основном индифферентные компоненты, как правило, пищевые
добавки, предлагается осуществлять прогноз величины ЛД дератизационных
50
средств, исходя из величины ЛД ДВ и процента содержания ДВ в
50
дератизационных средствах по формуле ВОЗ:
ЛД ДВ x 100
50
ЛД средства = —————.
50 % ДВ в средстве
Оценку результатов проводят в соответствии с критериями отбора
дератизационных средств.
8.10.3.2. Определение среднесмертельной дозы при однократном
нанесении на неповрежденные кожные покровы (ЛД ) (п. 8.2.2.2)
50
Оценку результатов проводят в соответствии с критериями отбора дератизационных средств.
8.10.3.3. Определение кумулятивных свойств
Кумулятивный эффект является основным показателем действия
дератизационных средств кумулятивного действия. Кумулятивное действие
дератизационных средств определяется при их повторном введении в желудок
методом Ю.С. Кагана. Этот метод позволяет определять коэффициент кумуляции
(K ) по летальному исходу и среднюю продолжительность летального исхода
кум
(в сутках) у 50% животных (TL ). Для выявления кумулятивного эффекта
50
грызунам (мыши, крысы) средство вводят перорально в течение 2 — 4
месяцев ежедневно в дробностях от ЛД (1/2 и ниже). Число доз и их уровень
50
определяется свойствами дератизационных средств. В целях сравнительной
оценки кумулятивности различных дератизационных средств сопоставляют
значения их K , найденных при введении 0,05 ЛД .
кум 50
Исследования кумулятивности эффекта дератизационных средств можно
проводить другими методами, которые, в основном, пригодны для целей
ускоренной оценки, п. 8.2.2.11.
В случае если ЛД родентицида более 10 г/кг, что имеет место у многих
50
дератизационных средств, оценка их кумулятивных свойств проводится с
затравкой животных в максимальных режимах с оценкой степени интоксикации.
На основании установления тесной корреляционной связи кумулятивных
свойств (K ) ДВ и дератизационных средств на их основе предлагается
кум
осуществлять прогноз кумулятивного эффекта дератизационных средств по
кумулятивному эффекту их ДВ и наоборот.
Оценку результатов проводят в соответствии с критериями отбора
дератизационных средств.
8.10.3.4. Определение ингаляционной опасности в насыщающих
концентрациях по степени летучести (C ) (п. 8.2.2.4)
20
Оценку результатов проводят в соответствии с критериями отбора дератизационных средств.
8.10.3.5. Определение местно-раздражающего действия на кожу
См. п. 8.2.2.6.
8.10.3.6. Определение кожно-резорбтивного действия средства
на кожные покровы
Кожно-резорбтивное действие дератизационных средств проводится как для ДВ, так и препаративных форм соответствующего вида (пасты, гели, масляные концентраты и др.) в экспериментах на мышах, крысах или животных других видов с повторным (10 аппликаций) воздействием.
Указанные исследования проводятся в случае отсутствия смертельного
cut
эффекта при однократном воздействии, показателями которого служит ЛД ,
50
K и TL , п. 8.2.2.8.
к/о 50
Показателями кожной резорбции, кроме смертельного исхода и клинической картины интоксикации, служат функциональные изменения (интегральные и специфические), регистрируемые к моменту окончания опыта.
8.10.3.7. Определение местно-раздражающего действия
на слизистые оболочки глаз
См. п. 8.2.2.7.
8.10.3.8. Определение сенсибилизирующего действия
дератизационных средств
См. п. 8.2.2.11.
8.10.3.9. Определение фактора безопасности (S )
f
См. п. 8.7.3.
8.10.4. Критерии оценки токсичности и опасности
дератизационных средств
8.10.4.1. Критерии отбора
Критерии оценки опасности дератизационных средств отражены в разработанной классификации токсичности и опасности родентицидов (ДВ и препаративных форм) (табл. 8.24). Она включает 4 класса (1 класс опасности — чрезвычайно опасные; 2 класс опасности — высокоопасные; 3 класс опасности — умеренно опасные и 4 класс опасности — малоопасные).
Таблица 8.24
КЛАССИФИКАЦИЯ ТОКСИЧНОСТИ И ОПАСНОСТИ РОДЕНТИЦИДОВ
(ДВ И ИХ ПРЕПАРАТИВНЫХ ФОРМ)
┌─────────────┬──────────────────────┬──────────────────────────────────────────────────┐
│Лимитирующие │ Показатели │ Классы опасности │
│ эффекты │ ├───────────────┬──────────┬────────────┬──────────┤
│ │ │ 1 │2 │ 3 │4 │
│ │ │ чрезвычайно │высоко- │ умеренно │мало- │
│ │ │ опасные │опасные │ опасные │опасные │
│ │ ├────┬──────────┤ │ │ │
│ │ │ А │ Б │ │ │ │
├─────────────┼──────────────────────┼────┼──────────┼──────────┼────────────┼──────────┤
│Острая │ЛД в желудок, │<= 2│2,1 — 14,0│15 — 150 │151 — 5000 │> 5000 │
│токсичность │ 50 │ │ │ │ │ │
│(для │мг/кг │ │ │ │ │ │
│потенциально ├──────────────────────┼────┼──────────┼──────────┼────────────┼──────────┤
│опасных │TL , сутки │<= 1│> 1 │> 1 │> 1 │> 1 │
│путей) │ 50 │ │ │ │ │ │
│ ├──────────────────────┼────┼──────────┼──────────┼────────────┼──────────┤
│ │Антидот │- │+ │+ │+ │+ │
│ ├──────────────────────┼────┴──────────┼──────────┼────────────┼──────────┤
│ │ЛД на кожу, мг/кг │< 100 │100 — 500 │501 — 2500 │> 2500 │
│ │ 50 │ │ │ │ │
│ ├──────────────────────┼───────────────┼──────────┼────────────┼──────────┤
│ │ЛС ингаляционно, │< 500 │500 — 5000│5001 — 50000│> 50000 │
│ │ 50 │ │ │ │ │
│ │мг/куб. м │ │ │ │ │
│ ├──────────────────────┼───────────────┼──────────┼────────────┼──────────┤
│ │C (по степени │Тяжелое │Отравление│Отравление │Отсутствие│
│ │ 20 │отравление с │выше │на уровне │отравления│
│ │летучести) для │возможным │порога │порога │ │
│ │фумигантов │летальным │острого │острого │ │
│ │ │исходом │действия │действия │ │
├─────────────┼──────────────────────┼───────────────┼──────────┼────────────┼──────────┤
│ │ ЛД нецелевого │ │ │ │ │
│ │ 50 │ │ │ │ │
│ │ вида животных │ │ │ │ │
│ │ (кошка, собака, │ │ │ │ │
│ │ свинья, курица) │ │ │ │ │
│Избирательная│K = —————-│<= 3 │3,1 — 9,0 │9,1 — 27,0 │> 27 │
│токсичность │ ит ЛД целевого │ │ │ │ │
│ │ 50 │ │ │ │ │
│ │ вида животных │ │ │ │ │
│ │ (грызуны) │ │ │ │ │
├─────────────┼──────────────────────┼───────────────┼──────────┼────────────┼──────────┤
│ │ n │ │ │ │ │
│ │ ЛД │ │ │ │ │
│ │ 50 │ │ │ │ │
│Кумулятивный │K = —— │< 1 │1 — 3 │3,1 — 5,0 │> 5 │
│эффект │ кум 1 │ │ │ │ │
│ │ ЛД │ │ │ │ │
│ │ 50 │ │ │ │ │
├─────────────┼──────────────────────┼───────────────┼──────────┼────────────┼──────────┤
│Стабильность │Время разложения на │> 12 │6 — 12 │1,0 — 6,1 │< 1 │
│(почва) │нетоксичные компоненты│ │ │ │ │
│ │(T ), мес. │ │ │ │ │
│ │ 1/2 │ │ │ │ │
├─────────────┴──────────────────────┴───────────────┴──────────┴────────────┴──────────┤
│ Примечание: «+» наличие антидота; «-» отсутствие антидота. │
└───────────────────────────────────────────────────────────────────────────────────────┘
Предлагаемая классификация охватывает наиболее широкий диапазон
параметров острой токсичности от наименьших величин для ДВ до наибольших
величин для их препаративных форм при трех основных потенциально опасных
путях поступления в организм (в желудок и на кожу по ЛД , а ингаляционно —
50
по ЛС и степени летучести). Из других показателей опасности введено
50
среднесмертельное время (TL ). Этот параметр позволяет разделить яды
50
острого и кумулятивного типа действия с быстрой гибелью животных и во
времени.
Введен показатель избирательной токсичности в виде коэффициента
избирательной токсичности (K ) при сравнении величин ЛД нецелевых видов
ит 50
(кошка, собака, свинья, курица) и целевых видов (грызуны), а также
выраженности кумулятивного эффекта в виде коэффициента кумуляции (K ) —
кум
n
отношения величины ЛД при повторном воздействии (ЛД ) к ЛД при
50 50 50
1
однократном воздействии (ЛД ). При этом различают 4 степени кумуляции
50
(чрезвычайная — K < 1; высокая — K 1 — 3; умеренная — K 3,1 — 5,0
кум кум кум
и малая — K > 5). По величине коэффициента кумуляции ДВ прогнозируется
кум
степень опасности препаративных форм дератизационных средств. Высокая
кумулятивная активность прогнозирует опасность хронической интоксикации.
Не менее важным является определение функциональной кумуляции
дератизационных средств с введением в желудок низких доз (1/100 ЛД и
50
ниже) на протяжении 1 — 2 месяцев по методике Г.Н. Красовского и
расчетом кумулятивного эффекта по зоне кумулятивного действия. По
окончании подострого опыта устанавливается минимально действующая пороговая
доза родентицида (ПД ), используемая для определения зоны кумулятивного
пэк
действия (ЛД / ПД ) и ускоренного прогноза МНД.
50 пэк
Величина зоны кумулятивного действия прямо пропорциональна степени выраженности кумулятивных свойств вещества. Этот показатель опасности имеет большое значение в гигиене окружающей среды, т.к. позволяет оценить кумулятивность веществ по функциональным изменениям организма на пороговых уровнях воздействия. Классы опасности родентицидов по значениям зоны кумулятивного действия представлены в табл. 8.25.
Таблица 8.25
КЛАССЫ ОПАСНОСТИ ВЕЩЕСТВ ПО ЗНАЧЕНИЯМ ЗОН
КУМУЛЯТИВНОГО ДЕЙСТВИЯ
┌──────────────────────────────────────────┬──────────────────────────────────┐
│ Показатель │ Класс опасности │
│ ├─────────┬───────┬───────┬────────┤
│ │ 1 │ 2 │ 3 │ 4 │
├──────────────────────────────────────────┼─────────┼───────┼───────┼────────┤
│ │ 4│ 3│ 2│ │
│Зона кумулятивного действия (ЛД / ПД )│> 1 х 10 │1 х 10 │1 х 10 │< 1 х 10│
│ 50 пэк │ │ │ │ │
└──────────────────────────────────────────┴─────────┴───────┴───────┴────────┘
Последний показатель — экологический в виде стабильности ДВ в почве и
времени разложения (T ) ДВ на нетоксичные компоненты.
1/2
Принято также во внимание наличие или отсутствие антидота к средствам.
В предлагаемой классификации 1 класс подразделяется на два класса — 1-й класс А и 1-й класс Б.
Подклассы 1А и 1Б разграничены между собой не только по величине ЛД в
50
желудок, но и по TL и антидоту (наличию или отсутствию). Так, в 1-й
50
класс А включены яды с величиной ЛД в желудок < 2 мг/кг,
50
TL <= 1 суток, с отсутствием антидота; в 1-й класс Б включены яды с
50
величиной ЛД в желудок 2,1 — 14,0 мг/кг, TL > 1 суток (как и для
50 50
последующих классов) и с наличием антидота, включая и последующие классы.
По 1-му и 2-му классам будет в основном осуществляться классификация опасности ДВ, а по 2 — 3-му и 4-му классам — классификация самих родентицидных средств.
Причем при оценке опасности ДВ и дератизационных средств по классификации следует исходить из приоритетных лимитирующих критериев и их совокупности, которые характеризуют их реальную опасность.
Так, например, для условий применения средств следует ориентироваться на параметры их острой токсичности, а в случае их систематического воздействия, имеющего место в производственной сфере, — на силу их кумулятивных свойств.
В связи с этим одно и то же средство для условий применения и производства может характеризоваться разными классами опасности. В первом случае оцениваться по 3-му или 4-му классу, а во втором — по 1-му классу опасности.
Причем и по показателям острой токсичности выбор лимитирующего критерия
в оценке опасности средства должен определяться потенциально опасным путем
его поступления в организм. Так, для приманок, например, величиной ЛД
50
при введении в желудок, для дустов, фумигантов и порошков — величиной ЛС
50
и степенью летучести (C ) при ингаляции, для гелей, мазей, паст, масляных
20
растворов — ЛД на кожу.
50
Естественно, что опасность средств будет выше, если по всем лимитирующим параметрам они будут относиться к 1 классу.
Указанная классификация позволяет оценивать степень опасности родентицидов, осуществлять их отбор и регламентацию в составах препаративных форм.
Наиболее жесткие требования относятся к родентицидам 1-го класса А. Они
должны запрещаться или ограничиваться по содержанию в составах
родентицидных средств. Особенно это относится к родентицидам, приводящим к
тяжелым и необратимым изменениям при отсутствии антидотов (например,
фторацетамиду, фторацетату натрия), к остродействующим ядам с быстрой
гибелью животных, например крысиду, к антикоагулянтам 2-го поколения
(бродифакуму, бромадиолону, флокумафену и др.) с низкими величинами ЛД
50
в желудок.
С ограничением следует также использовать дератизационные средства, не
обладающие избирательной токсичностью в отношении целевых видов (K < 3).
ит
Родентицидные средства на их основе должны запрещаться и лишь при
необходимости использоваться специалистами организаций, имеющих право
заниматься дезинфекционной деятельностью, по эпидпоказаниям с ограничением
сферы применения, причем только в безопасных препаративных формах
(парафинированные приманки, брикеты, гранулы, микрокапсулы) и с соблюдением
всех мер предосторожности, включая раскладку только в приманочных ящиках с
запорами или под надзором.
Родентициды, относящиеся к 1-му классу Б, должны использоваться дифференцированно: с остронаправленным типом действия, рекомендуются для использования, главным образом, специалистами организаций, имеющих право заниматься дезинфекционной деятельностью, а кумулятивного — населением в условиях быта. Родентициды этого класса должны строго регламентироваться в составах препаративных форм, в зависимости от их вида, формы и условий применения, особенно в условиях быта. Родентицидные средства на основе ДВ этого класса должны применяться со средствами индивидуальной защиты, а в быту только специалистами организаций, имеющих право заниматься дезинфекционной деятельностью в безопасных, готовых к применению препаративных формах (зерновых, гранулированных в виде парафинированных блоков и брикетов, микрокапсул).
Для высокоопасных родентицидов 2-го класса конкретная тактика в применении должна определяться свойствами готовой препаративной формы — ее изолированным или комплексным воздействием на организм. При комплексном воздействии на организм средства должны использоваться преимущественно специалистами организаций, имеющих право заниматься дезинфекционной деятельностью с соблюдением мер предосторожности и регламентацией норм расхода на объекте, а при изолированном — населением в быту. Для широкого использования в практике без ограничения сфер применения рекомендуются умеренно и малоопасные средства 3 и 4 классов.
Так, если для условий применения следует в основном ориентироваться на острую токсичность средств, то для условий производства — на силу их кумулятивных свойств. И как показали наши исследования: в то время как опасность острого отравления у препаратов снижается, опасность их хронического отравления (по выраженности кумулятивных свойств) остается по-прежнему высокой, требуя строгих мер предосторожности для специалистов организаций, имеющих право заниматься дезинфекционной деятельностью в сфере производства.
8.10.4.2. Критерии оценки
Дератизационные средства, относящиеся ко 2 — 3-му классам высоко и
умеренно опасных веществ в форме паст, гелей, масляных растворов, дустов и
порошков, при введении в желудок, нанесении на кожу и острой ингаляционной
опасности в насыщающих концентрациях (C ) должны применяться только
20
специалистами, а 4-го класса — без ограничений.
По кумулятивному эффекту ограничения в применении дератизационных средств отсутствуют. Учитывается только вид дератизационного средства (яды острого или кумулятивного типа действия).
Дератизационные средства в форме паст, гелей, масляных растворов, обладающие местно-раздражающим и кожно-резорбтивным действием, при нанесении на кожу должны применяться только специалистами со средствами индивидуальной защиты кожи рук — резиновые перчатки, а при отсутствии указанных эффектов — без ограничений сферы применения.
Дератизационные средства в форме дустов и порошков, относящиеся к 3 — 4-му классам опасности по местно-раздражающему действию на слизистые оболочки глаз, должны применяться специалистами и населением в быту с регламентированными условиями применения, а к 5-му классу опасности — без ограничений сферы применения.
Дератизационные средства, относящиеся ко 2 — 3-му классам высоко- и умеренно опасных веществ, в форме приманок при введении в желудок должны применяться только специалистами, а 4 класса — без ограничений.
Оценка реальной опасности дератизационных средств должна проводиться только для препаративных форм в виде дустов и порошков.
Критерии оценки безопасного применения дератизационных средств представлены в табл. 8.26.
Таблица 8.26
КРИТЕРИИ ОЦЕНКИ БЕЗОПАСНОГО ПРИМЕНЕНИЯ
ДЕРАТИЗАЦИОННЫХ СРЕДСТВ
┌──────────────┬──────────────────┬─────────────────────┬─────────────────┐
│ Назначение │ Исследуемые │ Нормативные │ Разрешено │
│ средства │ показатели │ показатели │ применение │
│ │ ├──────────────┬──────┤ │
│ │ │ величина │класс │ │
│ │ │ показателя │опас- │ │
│ │ │ │ности │ │
├──────────────┼──────────────────┼──────────────┼──────┼─────────────────┤
│ 1 │ 2 │ 3 │ 4 │ 5 │
├──────────────┼──────────────────┼──────────────┼──────┼─────────────────┤
│Дератизацион- │Острая токсичность│Не менее 15 │2 │Специалистам <*> │
│ные средства в│при введении в │Не менее 151 │3 │Специалистам <*> │
│различных │желудок (ЛД , │Более 5000 │4 │Без ограничений │
│формах (пасты,│ 50 │ │ │ │
│гели, масляные│мг/кг) │ │ │ │
│растворы, ├──────────────────┼──────────────┼──────┼─────────────────┤
│тесто) │Острая токсичность│Не менее 500 │2 │Специалистам <*> │
│ │при нанесении на │Не менее 2500 │3 │Специалистам <*> │
│ │кожу, ЛД , мг/кг │более 2500 │4 │Без ограничений │
│ │ 50 │ │ │ │
│ ├──────────────────┼──────────────┼──────┼─────────────────┤
│ │Кумулятивный │ │ │ │
│ │эффект: │ │ │ │
│ │- антикоагулянты; │Не более 3 │1 — 2 │Без ограничений │
│ │- яды острого типа│Более 3 │3 — 4 │Без ограничений │
│ │действия │ │ │ │
│ ├──────────────────┼──────────────┼──────┼─────────────────┤
│ │Острая ингаляцион-│C = клиника │2 │Специалистам <*> │
│ │ная опасность в │ 20 │ │со средствами │
│ │насыщающих │ │ │индивидуальной │
│ │концентрациях │ │ │защиты органов │
│ │(C ) │ │ │дыхания │
│ │ 20 │C = Lim │3 │Специалистам <*> │
│ │ │ 20 ac │ │ │
│ │ │C < Lim │4 │Без ограничений │
│ │ │ 20 ac │ │ │
│ ├──────────────────┼──────────────┼──────┼─────────────────┤
│ │Кожно-резорбтивный│Наличие │Не │Специалистам <*> │
│ │эффект 0,5 мес. │эффекта │норми-│(со средствами │
│ │ │ │руется│защиты кожи │
│ │ │ │ │рук — перчатки) │
│ │ │Отсутствие │Не │Специалистам <*>,│
│ │ │эффекта │норми-│населению в быту │
│ │ │ │руется│ │
│ ├──────────────────┼──────────────┼──────┼─────────────────┤
│ │Местно-раздражаю- │Наличие │Не │Специалистам <*> │
│ │щее действие на │эффекта │норми-│(со средствами │
│ │кожу │ │руется│защиты кожи рук -│
│ │0,5 — 1,0 мес. │ │ │перчатки) │
│ │ │Отсутствие │Не │Специалистам <*>,│
│ │ │эффекта │норми-│населению в быту │
│ │ │ │руется│ │
├──────────────┼──────────────────┼──────────────┼──────┼─────────────────┤
│Дератизацион- │Острая токсичность│Не менее 15 │2 │Специалистам <*> │
│ные средства в│при введении в │Не менее 151 │3 │Специалистам <*> │
│виде дустов, │желудок, (ЛД , │Более 5000 │4 │Специалистам <*> │
│порошков │ 50 │ │ │и населению в │
│ │мг/кг) │ │ │быту │
│ ├──────────────────┼──────────────┼──────┼─────────────────┤
│ │Острая токсичность│Не менее 500 │2 │Специалистам <*> │
│ │при нанесении на │ │ │(со средствами │
│ │кожу (ЛД , мг/кг)│ │ │защиты кожи рук -│
│ │ 50 │ │ │перчатки) │
│ │ │Не менее 2500 │3 │Специалистам <*> │
│ │ │Более 2500 │4 │Специалистам <*> │
│ │ │ │ │и населению в │
│ │ │ │ │быту │
│ ├──────────────────┼──────────────┼──────┼─────────────────┤
│ │Кумулятивный │ │ │ │
│ │эффект: │ │ │ │
│ │- антикоагулянты; │Не более 3 │1 — 2 │Специалистам <*> │
│ │ │ │ │и населению в │
│ │ │ │ │быту │
│ │- яды острого типа│Более 3 │3 — 4 │Специалистам <*> │
│ │действия │ │ │и населению в │
│ │ │ │ │быту │
│ ├──────────────────┼──────────────┼──────┼─────────────────┤
│ │Оценка реальной │> 1 │Не │Специалистам <*> │
│ │опасности средства│ │норми-│ │
│ │в рекомендованных │ │руется│ │
│ │режимах применения│< 1 │Не │Населению в быту │
│ │(фактор │ │норми-│ │
│ │безопасности) │ │руется│ │
│ ├──────────────────┼──────────────┼──────┼─────────────────┤
│ │Местно-раздражаю- │До 4 │3 — 4 │Специалистам <*> │
│ │щее действие на │ │ │и населению в │
│ │глаза, баллы │ │ │быту с регламен- │
│ │ │ │ │тированными │
│ │ │ │ │условиями │
│ │ │ │ │применения │
│ │ │0 │5 │Специалистам <*> │
│ │ │ │ │и населению в │
│ │ │ │ │быту │
├──────────────┼──────────────────┼──────────────┼──────┼─────────────────┤
│Дератизацион- │Острая токсичность│Не менее 151 │3 │Специалистам <*> │
│ные приманки │при введении в │Более 5000 │4 │Специалистам <*> │
│(зерновые, │желудок (ЛД , │ │ │и населению в │
│гранулирован- │ 50 │ │ │быту │
│ные, блоки │мг/кг) │ │ │ │
│восковые, ├──────────────────┼──────────────┼──────┼─────────────────┤
│парафинирован-│Кумулятивный │ │ │ │
│ные и др.) │эффект: │ │ │ │
│ │- антикоагулянты; │Не более 3 │1 — 2 │Специалистам <*> │
│ │ │ │ │и населению в │
│ │ │ │ │быту │
│ │- яды острого типа│Более 3 │3 — 4 │Специалистам <*> │
│ │действия │ │ │и населению в │
│ │ │ │ │быту │
├──────────────┴──────────────────┴──────────────┴──────┴─────────────────┤
│ <*> Специалисты: обученный персонал организаций, имеющих право│
│заниматься дезинфекционной деятельностью. │
└─────────────────────────────────────────────────────────────────────────┘
В случае, когда S > 1, реальная опасность средства высока (как для
F
специалистов, так и для населения) и для применения его необходимо
использовать комплекс средств индивидуальной защиты.
В случае, когда S < 1, реальная опасность средства низка и его можно
F
рекомендовать для использования населением и специалистам без средств
индивидуальной защиты.
8.11. Библиографические данные
1. Методические рекомендации по токсикометрии. СЭВ, ЮНЕП, М., 1987.
2. Саноцкий И.В. Методы определения токсичности и опасности химических веществ. М., 1970. 343 с.
3. Саноцкий И.В., Уланова И.П. Критерии вредности в гигиене и токсикологии при оценке опасности химических соединений. М.: Медицина, 1975. 328 с.
4. Токсикометрия химических веществ, загрязняющих окружающую среду /Под ред. А.А. Каспарова и И.В. Саноцкого. М.: МРПТХВ, ГКНТ, 1986. 417 с.
5. Всемирная Хельсинская декларация. Этические принципы проведения медицинских исследований с участием людей в качестве субъектов исследования. Финляндия, 1964 — 1996 гг.
6. Гигиеническая классификация пестицидов по степени опасности. Методические рекомендации N 2001/26. М., 2001.
7. Токсикологическая оценка и гигиеническая регламентация паро-газо-аэрозольных комплексов в воздухе рабочей зоны: Информационное письмо. М., 1988.
8. Рекомендации по статистической обработке результатов экспериментально-токсикологических исследований. М.: Изд. Инс-т гигиены труда и профессиональных заболеваний АМН СССР, 1965. 80 с.
9. Лакин Г.Ф. Биометрия, М., 1973. 343 с.
10. Методические рекомендации по оценке иммунотоксических свойств фармакологических средств. М., 1992.
11. Алексеева О.Г., Дуева Л.А. Аллергия к новым химическим соединениям. М., 1978. 270 с.
12. Сборник руководящих методических материалов по токсиколого-гигиеническим исследованиям полимерных материалов и изделий на их основе медицинского назначения. Утверждены МЗ СССР. М., 1987. 85 с.
13. Оценка биологического действия медицинских изделий. Ч. 5: Исследования на цитотоксичность: методы in vitro. М.: Госстандарт России, 1999.
14. Альтернативные методы исследований, экспресс-методы для токсиколого-гигиенической оценки материалов, изделий и объектов окружающей среды: Методическое пособие. М., 1999. С. 79 — 89.
15. Панкратова Г.П., Мальцева М.М., Новикова Э.А. Новое в оценке дезинфицирующих средств. В кн. «Задачи современной дезинфектологии и пути их решения». Материалы Всероссийской научной конференции, посвящ. 70-летию НРШД МЗ РФ. М., 2003. С. 178 — 180.
16. Панкратова Г.П., Мальцева М.М., Новикова Э.А. Токсикологические аспекты изучения дезинфицирующих средств. В кн. «Современные проблемы медицины окружающей среды». Материалы пленума Научного совета по экологии человека и гигиене окружающей среды РАМН и МЗ РФ. М., 2004. С. 35 — 37.
17. Методические рекомендации по изучению газообразных стерилизующих агентов в целях гигиенической регламентации и контроля их содержания в изделиях медицинского назначения: МР 28-6/4. М., 1988.
18. Верклова З.С., Цветкова А.М., Петрашевская Е.В., Рапина Т.Н., Журавлева Л.И., Мурзич А.В., Гладкова Т.Н. Методические подходы к комплексной гигиенической оценке педикулицидов, репеллентов и кожных антисептиков. Сборник научных трудов. Вопросы дезинфекции и стерилизации. М., 1986. С. 144 — 147.
19. Оценка воздействия вредных химических соединений на кожные покровы и обоснование предельно допустимых уровней загрязнений кожи: Методические указания, утв. МЗ СССР, N 2102-79 от 01.11.1979. М., 1980.
20. Методические рекомендации по ускоренному обоснованию предельно допустимых уровней загрязнения кожных покровов человека вредным веществом, N 10-92 от 17.07.1992. М., 1992.
21. Мальцева М.М., Заева Г.Н., Рысина Т.З., Березовский О.И. Актуальные проблемы дезинфектантов питьевой воды нецентрализованного водоснабжения. В сб. «Материалы конференции «Актуальные проблемы дезинфектологии в профилактике инфекционных и паразитарных заболеваний, посвященной 100-летию со дня рождения В.И. Вашкова», М., ИТАР-ТАСС, 2002 г., С. 146 — 147.
22. Шандала М.Г., Заева Г.Н., Мальцева М.М., Рысина Т.З., Соколова Н.Ф., Березовский О.И., Климашина Н.В. Особенности оценки безопасности средств при обеззараживании индивидуальных и групповых запасов питьевой воды. В сб. Материалов научно-практической конференции по гигиене, эпидемиологии и дезинфектологии. Тезисы докладов. М., 2006. С. 58 — 60.
23. Заева Г.Н., Мальцева М.М., Рысина Т.З., Березовский О.И., Соколова Н.Ф., Колычева Л.И. Критерии безопасности применения обеззараженной дезинфектантами питьевой воды при нецентрализованном водоснабжении //Дезинфекционное дело N 4. 2004. С. 46 — 51.
24. Жолдакова З.И., Одинцов Е.Е. Методические подходы к гигиенической оценке условий применения реагентов для обеззараживания воды. В материалах Всероссийской Научной конференции, посвященной 70-летию НИИ дезинфектологии МЗ РФ, 22 — 24 октября 2003 г., Т. 1. «Задачи современной дезинфектологии и пути их решения» М.: ИТАР-ТАСС, 2003. С. 133 — 135.
25. Оценка токсичности и опасности препаратов дезинсекции: Методические рекомендации N 15-6/7 от 22.01.1990, М., 1990 г.
26. Методические рекомендации по оценке новых пестицидов. Киев, 1988. 37 с.
27. Методические рекомендации по отбору и изучению биологической активности и токсичности репеллентов М., 1987. N 24-7/24 от 14.07.1987.
28. Заева Г.Н., Мальцева М.М., Рысина Т.З., Юрченко В.В., Березовский О.И., Тимофиевская Л.А. Совершенствование методических подходов к изучению токсичности и опасности репеллентов и препаратов на их основе //РЭТ-инфо. 1996. N 117. С. 12 — 15.
29. Маркина В.В., Заева Г.Н., Рысина Т.З., Юрченко В.В., Германт О.М., Березовский О.И. Репеллентные препараты для защиты детей //Тезисы докл. V Российского национального конгресса «Человек и лекарство». М., 1998. С. 296.
30. Маркина В.В. и соавт. Методические походы к разработке и изучению репеллентных препаратов для защиты детей от укусов кровососущих насекомых//РЭТ-инфо. N 25. 1998. С. 6 — 7.
31. Изучение возрастных особенностей в действии лекарственных средств на экспериментальных животных: Методическое письмо Фармкомитета. 1982.
32. Заева Г.Н., Тимофиевская Л.А., Иванова Н.И., Рысина Т.З. Репеллентные средства, предназначенные для детей //Тезисы докл. VI Всероссийского национального конгресса «Человек и лекарство» М., 1999. С. 310.
33. Маркова И.В. Современные проблемы возрастной фармакологии//Фармакология и токсикология. 1981. N 4. С. 434.
34. Гуськова Т.А. Особенности изучения токсичности лекарственных препаратов для педиатрии. В кн.: «Токсикология лекарственных средств». М., 2003. С. 51 — 87.
35. Красовский Г.Н., Авилов Г.Г. Видовая, половая и возрастная чувствительность к ядам //Всесоюзного химического общества им. Д.И. Менделеева. М., 1974. Вып. 2. С. 159 — 164.
36. Рысина Т.З., Заева Г.Н., Мальцева М.М. Обоснование возрастных критериев при разработке репеллентных средств для детей (Задачи современной дезинфектологии и пути их решения. Материалы Всерос. науч. конф., посв. 70-летию НИИД МЗ РФ). М.: ИТАР-ТАСС, 2003. С. 84 — 86).
37. Тимофиевская Л.А., Перегуда Т.А., Иванова Н.И., Шалатилова А.Г. Репеллентные средства для детей: основные подходы к оценке их безопасности и эффективности. В кн.: «Задачи современной дезинфектологии и пути их решения». М., 2003. С. 95 — 97.
38. Цветкова А.М. Значимость показателя проницаемости рогового слоя эпидермиса для гигиенической оценки дезинфекционных средств кожного пути поступления в организм человека //Сборник научных трудов. Основные новые направления дезинфекционного дела. М., 1987. С. 125 — 128.
39. Методические рекомендации по оценке эффективности, токсичности и опасности родентицидов. Утв. Госкомсанэпиднадзором России N 01-19/127-17 от 20.12.1995.
Приложение 1
КЛАССИФИКАЦИЯ ОПАСНОСТИ ВРЕДНЫХ ВЕЩЕСТВ
ПРИ КОЖНОМ ПУТИ ПОСТУПЛЕНИЯ
┌───────────────────────────┬─────────────────────────────────────────────┐
│ Наименование показателя │ Класс опасности │
│ ├─────────────┬─────────┬─────────┬───────────┤
│ │ I │ II │ III │ IV │
├───────────────────────────┼─────────────┼─────────┼─────────┼───────────┤
│Предельно допустимый │Менее 0,00002│0,00002 -│0,00021 -│Более 0,002│
│уровень загрязнения кожного│ │0,0002 │ │ │
│покрова (ЦДУ ) вредным │ │ │0,002 │ │
│ зкп │ │ │ │ │
│веществом, мг/кв. см │ │ │ │ │
├───────────────────────────┼─────────────┼─────────┼─────────┼───────────┤
│Среднее смертельное время │Менее 3 │3 — 30 │31 — 300 │Более 300 │
│при поступлении вещества │ │ │ │ │
│через кожу, мин. │ │ │ │ │
├───────────────────────────┼─────────────┼─────────┼─────────┼───────────┤
│Средняя смертельная доза │Менее 50 │50 — 500 │51 — 5000│Более 5000 │
│при нанесении вещества на │ │ │ │ │
│кожу, мг/кг │ │ │ │ │
├───────────────────────────┼─────────────┼─────────┼─────────┼───────────┤
│Порог острого действия при │Менее 5 │5 — 50 │51 — 500 │Более 500 │
│нанесении вещества на кожу,│ │ │ │ │
│мг/кг │ │ │ │ │
├───────────────────────────┼─────────────┼─────────┼─────────┼───────────┤
│Порог хронического действия│Менее 0,1 │0,1 — 1,0│1,1 — 10 │Более 10 │
│при нанесении вещества на │ │ │ │ │
│кожу, мг/кг │ │ │ │ │
└───────────────────────────┴─────────────┴─────────┴─────────┴───────────┘
Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности
| Обозначение: |  Р 4.2.2643-10 Р 4.2.2643-10 |
| Обозначение англ: |  R 4.2.2643-10 R 4.2.2643-10 |
| Статус: | действует |
| Название рус.: | Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности |
| Дата добавления в базу: | 01.09.2013 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 02.06.2010 |
| Область применения: | Руководство устанавливает единые методы лабораторных исследований и испытаний дезинфекционных средств для оценки их антимикробной, инсектицидной, акарицидной, репеллентной и родентицидной активности, эффективности и безопасности при применении в быту, в лечебно-профилактических организациях и на других объектах для обеспечения безопасности жизни и здоровья людей, животных и неповреждения объектов внешней среды. Руководство предназначено для организаций, учреждений, предприятий, аккредитованных испытательных центров лабораторий, органов по сертификации дезинфекционных средств, аккредитованных в системе аккредитации ГОСТ Р, специалистов, осуществляющих исследования дезинфицирующих, стерилизующих, дезинсекционных, дератизационных средств, а также их субстанций (действующих веществ) в процессе их разработки, производства, применения, регистрационных и сертификационных испытаний, производственного контроля и надзора. |
| Оглавление: | 1. Область применения 2. Нормативные ссылки 3. Общие положения 4. Химико-аналитические методы исследований дезинфекционных средств 4.1. Общие положения 4.2. Методы количественного определения действующих веществ в дезинфицирующих, стерилизующих средствах и средствах для предстерилизационной очистки 4.3. Методы исследования дезинсекционных средств 4.4. Методы исследований дератизационных средств 4.5. Библиографические данные 5. Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих и стерилизующих средств 5.1. Методы изучения и оценки бактерицидной активности дезинфицирующих средств и их субстанций 5.2. Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств 5.3. Методы изучения и оценки фунгицидной активности дезинфицирующих средств 5.4. Методы определения активности антимикробных материалов тканей, лакокрасочных покрытий 5.5. Методы определения эффективности кожных антисептиков 5.6. Методы определения эффективности ДС и кожных антисептиков в практических условиях 5.7. Методы изучения и оценки вирулицидной активности дезинфицирующих средств 5.8. Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств 5.9. Методы исследований и критерии оценки эффективности средств для предстерилизационной очистки ИМН 6. Энтомологические методы исследований и критерии оценки эффективности дезинсекционных средств 6.1. Общие положения. Организация экспериментов 6.2. Методы определения активности действующих веществ субстанций дезинсекционных средств 6.3. Методы определения активности инсектицидных средств 6.4. Методы изучения активности акарицидных и инсекто-акарицидных средств 6.5. Методы определения активности инсекто- и акарорепеллентных средств 6.6. Методы определения активности средств на основе регуляторов развития насекомых и аттрактантов феромонов 6.7. Методы определения эффективности инсектицидных, акарицидных и репеллентных средств в натурных условиях 7. Родентологические методы исследований и критерии оценки эффективности дератизационных средств 7.1. Общие положения. Требования к экспериментальным животным и условиям их содержания 7.2. Методы исследований эффективности химических родентицидных средств 7.3. Методы исследования эффективности репеллентов 7.4. Методы исследований эффективности механических дератизационных средств 7.5. Методы исследований эффективности химических родентицидных средств в условиях группового содержания грызунов 7.6. Методы оценки эффективности дератизационных средств в естественных местообитаниях грызунов в натурных условиях 7.7. Библиографические данные 8. Методы исследования и критерии оценки токсичности и опасности дезинфекционных средств 8.1. Общие требования к организации и проведению токсикологических исследований дезинфекционных средств 8.2. Методы изучения токсичности и опасности микробоцидных дезинфицирующих средств 8.3. Методы изучения токсичности и опасности средств для стерилизации и предстерилизационной очистки изделий медицинского назначения ИМН 8.4. Методы изучения токсичности и опасности кожных антисептиков 8.5. Методы изучения токсичности и опасности средств для обеззараживания питьевой воды при нецентрализованном водоснабжении 8.6. Методы изучения токсичности и опасности средств для обеззараживания воды плавательных бассейнов 8.7. Методы изучения токсичности и опасности дезинсекционных средств 8.8. Методы изучения токсичности и опасности репеллентных средств 8.9. Методы изучения токсичности и опасности педикулицидных средств 8.10. Методы изучения токсичности и опасности дератизационных средств 8.11. Библиографические данные |
| Разработан: | НИИ дезинфектологии Институт медицинской паразитологии и тропической медицины им. Е.И. Марциновского МЗ РФ ГУ Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова ФГУН 48 НИИМ МО РФ |
| Утверждён: | 01.06.2010 Главный государственный санитарный врач Российской Федерации |
| Издан: | Федеральный центр гигиены и эпидемиологии Роспотребнадзора (2011 г. ) |
| Расположен в: | Техническая документация Экология ЗДРАВООХРАНЕНИЕ Стерилизация и дезинфекция Стерилизация и дезинфекция, прочие аспекты |
| Заменяет собой: |
|
| Нормативные ссылки: |
|
Утверждаю
Руководитель Федеральной
службы по надзору в сфере
защиты прав потребителей
и благополучия человека,
Главный государственный
санитарный врач
Российской Федерации
Г.Г.ОНИЩЕНКО
1 июня 2010 года
Дата введения:
2 июня 2010 года
3.5. ДЕЗИНФЕКТОЛОГИЯ
МЕТОДЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ И ИСПЫТАНИЙ
ДЕЗИНФЕКЦИОННЫХ СРЕДСТВ ДЛЯ ОЦЕНКИ
ИХ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ
РУКОВОДСТВО
Р 4.2.2643-10
1. Разработаны Федеральным государственным учреждением науки «НИИ дезинфектологии» Роспотребнадзора и кафедрой дезинфектологии ММА им. И.М. Сеченова; Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека; ФГУН 48 НИИМ МО РФ — Центром военно-технических проблем биологической защиты; Научно-исследовательским центром бытовой химии; ООО «Суперсан-МК»; Институтом медицинской паразитологии тропической медицины им. Е.И. Марциновского ММА им. И.М. Сеченова; кафедрой тропической медицины и паразитарных болезней МПФ ППО ММА им. И.М. Сеченова; ГУ НИИ вирусологии им. Д.И. Ивановского РАМН; ГУ институтом полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН.
2. Рекомендованы к утверждению Комиссией по санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 24 декабря 2009 г. N 4).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 1 июня 2010 г.
4. Введены в действие со 2 июня 2010 г.
5. Введены взамен «Методических рекомендаций по определению вирулицидной активности препаратов» (от 06.09.1973 N 1119-73), «Инструкции по определению бактерицидных свойств новых дезинфицирующих средств» (от 6 мая 1968 г. N 739-68), Методических указаний «Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности», 1998 г.
1. Область применения
1.1. Настоящее руководство (далее — руководство) устанавливает единые методы лабораторных исследований и испытаний дезинфекционных средств для оценки их антимикробной, инсектицидной, акарицидной, репеллентной и родентицидной активности, эффективности и безопасности при применении в быту, в лечебно-профилактических организациях и на других объектах для обеспечения безопасности жизни и здоровья людей, животных и неповреждения объектов внешней среды.
1.2. Настоящее руководство предназначено для организаций, учреждений, предприятий, аккредитованных испытательных центров лабораторий, органов по сертификации дезинфекционных средств, аккредитованных в системе аккредитации ГОСТ Р, специалистов, осуществляющих исследования дезинфицирующих, стерилизующих, дезинсекционных, дератизационных средств, а также их субстанций (действующих веществ) в процессе их разработки, производства, применения, регистрационных и сертификационных испытаний, производственного контроля и надзора [4, 5].
КонсультантПлюс: примечание.
В официальном тексте документа, видимо, допущены опечатки, имеются в виду:
1. Федеральный закон N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» от 30.03.1999, а не от 31.03.1999;
2. Федеральный закон от 10.01.2002 «Об охране окружающей среды» N 7-ФЗ, а не N 23001;
3. «Основы законодательства Российской Федерации об охране здоровья граждан» N 5487-1 от 22.07.1993, а не от 22.06.1993.
1.3. Руководство разработано на основе Федерального закона от 31.03.1999 N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» [1], Федерального закона от 10.01.2002 N 23001 «Об охране окружающей среды» [2], Федерального закона «Основы законодательства Российской Федерации об охране здоровья граждан» от 22.06.1993 N 5487-1 [3], Постановления Правительства от 04.04.2001 N 262 «О государственной регистрации отдельных видов продукции, представляющих потенциальную опасность для человека, а также отдельных видов продукции, впервые ввозимых на территорию Российской Федерации» [7], а также «Положения о государственном санитарно-эпидемиологическом нормировании», утвержденного Постановлением Правительства Российской Федерации от 24 июля 2000 г. N 554 [6], и других нормативных и методических показателей, приведенных в разделе 2 «Нормативные ссылки».
2. Нормативные ссылки
1. Федеральный закон от 31.03.1999 N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» (Собрание законодательства Российской Федерации, 1999, N 14, ст. 1650; 2002, N 1 (ч. 1), ст. 2; 2003, N 2, ст. 167; N 27 (ч. 1), ст. 2007; 2004, N 35, ст. 3607; 2005, N 19, ст. 1752; 2006, N 1, ст. 10; 2007, N 1, ст. 29; N 27, ст. 3213; N 46, ст. 5554; N 49, ст. 6070).
2. Федеральный закон от 10.01.2002 N 23001 «Об охране окружающей среды».
3. «Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июня 1993 г. N 5487-1 (с изменениями от 2 марта 1998 г., 20 декабря 1999 г., 2 декабря 2000 г., 10 января, 27 февраля, 30 июня 2003 г., 29 июня, 22 августа, 1, 29 декабря 2004 г., 7 марта, 21, 31 декабря 2005 г., 2 февраля 2006 г.).
4. Федеральный закон от 16.09.1998 N 158-ФЗ «О лицензировании отдельных видов деятельности».
5. Федеральный закон от 10.06.1993 N 5151-1 «О сертификации продукции и услуг».
6. «Положение о государственном санитарно-эпидемиологическом нормировании», утвержденное Постановлением Правительства Российской Федерации от 24 июля 2000 г. N 554 (Собрание законодательства Российской Федерации, 2000, N 31, ст. 3295).
7. Постановление Правительства от 04.04.2001 N 262 «О государственной регистрации отдельных видов продукции, представляющих потенциальную опасность для человека, а также отдельных видов продукции, впервые ввозимых на территорию Российской Федерации».
8. Приказ Минздрава СССР от 30.12.1983 N 1509 «О дальнейших мерах по совершенствованию порядка оформления разрешения к медицинскому применению и передачи для промышленного производства новых лекарственных средств».
9. Приказ Минздрава России от 20.07.1998 N 217 «О гигиенической оценке производства, поставки и реализации продукции и товаров».
10. Приказ Минздрава России от 10.11.2002 N 344 «О государственной регистрации дезинфицирующих, дезинсекционных и дератизационных средств для применения в быту, в лечебно-профилактических учреждениях и на других объектах для обеспечения безопасности и здоровья людей».
11. Постановление Госстандарта России от 30.07.2002 N 64 «Номенклатура продукции, в отношении которой законодательными актами Российской Федерации предусмотрена обязательная сертификация».
12. СП 3.1/3.2.558-96 «Общие требования по профилактике инфекционных и паразитарных заболеваний».
13. СП 3.5.3.1129-02 «Санитарно-эпидемиологические требования к проведению дератизации».
14. СП 3.5.1378-03 «Санитарно-эпидемиологические требования к организации и осуществлению дезинфекционной деятельности».
15. СП 1.3.1285-03 «Безопасность работы с микроорганизмами I — II групп патогенности (опасности)».
16. СП 3.1.1275-03 «Профилактика инфекционных заболеваний при эндоскопических манипуляциях».
17. СП 1.3.2322-08 «Безопасность работы с микроорганизмами III — IV групп патогенности (опасности) и возбудителями паразитарных болезней» с дополнениями и изменениями (СП 1.3.2518-09).
18. СанПиН 1.2.681-97 «Гигиенические требования к производству и безопасности парфюмерно-косметической продукции».
19. СанПиН 2.1.7.728-99 «Правила сбора, хранения и удаления отходов лечебно-профилактических учреждений».
20. СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
21. Нормативные показатели безопасности и эффективности дезинфекционных средств, подлежащих контролю при проведении обязательной сертификации. 1998 г., N 01-12/75-97.
22. СанПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества».
23. Нормативные показатели эффективности и безопасности дезинфекционных средств, утвержденные 08.03.2004.
24. ГОСТ 12.1.007-76 «ССБТ. Вредные вещества. Классификация и общие требования безопасности».
25. ГОСТ 22567.8-77 «Средства моющие синтетические. Методы определения силиката натрия».
26. ГОСТ 8728-77 «Диметилфталат. Технические условия».
27. ГОСТ 13081-77 «Фосфид цинка. Технические условия».
28. ГОСТ 27283-87 «Средства индивидуальные химические для обеззараживания воды от бактериологических средств».
29. ГОСТ 177-88 «Водорода перекись. Технические условия».
30. ГОСТ 12.1.005-88 «ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны».
31. ГОСТ 29188.0-91 «Изделия парфюмерно-косметические. Правила приемки, отбор проб, методы органолептических исследований».
32. ГОСТ 29188.6-91 «Изделия парфюмерно-косметические. Газохроматографический метод определения этилового спирта».
33. ГОСТ Р 50550-93 «Товары бытовой химии. Метод определения показателя активности водородных ионов pH».
34. ГОСТ 22567.5-93 «Средства моющие синтетические и вещества поверхностно-активные. Методы определения концентрации водородных ионов pH».
35. ГОСТ Р 50551-93 «Товары бытовой химии. Метод определения активного хлора».
36. ГОСТ 18995.1-73 «Продукты химические жидкие. Методы определения плотности».
37. ГОСТ 18995.2-73 «Продукты химические жидкие. Методы определения показателя преломления».
38. ГОСТ 18995.4-73 «Продукты химические органические. Методы определения интервала температуры плавления».
39. ГОСТ Р 51022-97 «Методы определения анионного поверхностно-активного вещества».
40. ГОСТ Р 51018-97 «Методы определения неионогенного поверхностно-активного вещества».
41. Ратиндан. Фармакопейная статья ФС 42-330-79.
42. Определение температуры плавления. Государственная фармакопея СССР. XI изд., вып. 1. С. 16.
43. Определение плотности. Государственная фармакопея СССР. XI изд., вып. 1. С. 24.
44. Определение показателя преломления (рефрактометрия). Государственная фармакопея СССР. XI изд., вып. 1. С. 29.
45. Определение вязкости жидкостей. Государственная фармакопея СССР. XI изд., вып. 1. С. 87.
46. Определение pH. Государственная фармакопея СССР. XI изд., вып. 1. С. 113.
47. ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства, режимы». М., 1985 г.
48. Стандарт Европейского Комитета по стандартизации NEN-EN 14476.
49. Государственная фармакопея СССР. XI изд., вып. 1. С. 183 — 186.
50. ГОСТ Р 51021-97 «Методы определения смываемости с посуды».
51. Инструкция по определению бактерицидных свойств новых дезинфицирующих средств. Утв. МЗ СССР 6 мая 1968 г. N 739-68.
52. Методические указания по оценке дезинфицирующих средств, предназначенных для обеззараживания различных объектов и санитарной обработки людей. Утв. МЗ СССР 20 августа 1970 г. N 859-70.
53. Методические указания по определению эффективности препаратов для борьбы с молью. Утв. МЗ СССР 12.06.1977.
54. Методические указания по гигиенической оценке одежды и обуви из полимерных материалов. М., 1977, 47 с.
55. Методические указания по изучению токсичности препаратов санитарно-гигиенического и бытового назначения в аэрозольных баллонах. М., 1980 г.
56. МУ 2163-80 «Методические указания к постановке исследований для обоснования санитарных стандартов вредных веществ в воздухе рабочей зоны». М., 1980.
57. Методические указания по первичному отбору новых акарицидов и сравнительному изучению их активности против саркоподобных клещей от 23.07.1982. Утв. ВАСХНИЛ.
58. Методические указания по определению устойчивости культур микроорганизмов, контаминирующих изделий медицинского назначения в условиях производства и эксплуатации, к стерилизующим агентам. Утв. МЗ СССР 29 марта 1985 г. N 28-6/7.
59. Методические указания «Токсикологическая оценка педикулицидов» от 20.06.1985 N 26-6/6.
60. Временные методические указания по обоснованию предельно допустимых концентраций ПДК загрязняющих веществ в атмосферном воздухе населенных мест от 15.06.1988 N 4681-88.
61. Методические указания по использованию культуры диплоидных клеток человека, рекомендуемых для токсиколого-гигиенических исследований. Утв. МЗ СССР 18.09.1991. 20 с.
62. Методические указания по оценке активности хемостерилянтов и регуляторов развития насекомых. МУ 01-19/06-11 от 03.02.1995.
63. Гигиеническая оценка условий труда при применении пестицидов. Методические указания от 20.11.1995 N 01-19/140-17.
64. Методические указания по лабораторной оценке воздействия соединений на синантропных тараканов. Утв. ГКСЭН РФ от 09.02.1995 N 01-19/17-11.
65. МУ 1.1.578-96 «Требования к постановке экспериментальных исследований по обоснованию предельно допустимых концентраций промышленных химических аллергенов в воздухе рабочей зоны и атмосферы». М., 1997.
66. Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности. Утв. МЗ РФ, 1998.
67. МУ 3.1.1027-01 «Сбор, учет и подготовка к лабораторному исследованию кровососущих членистоногих — переносчиков возбудителей природно-очаговых инфекций».
68. Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения. МУ 287-113 от 30.12.1998.
69. МУ 1.2.1105-02 «Оценка токсичности и опасности дезинфицирующих средств». Утв. МЗ России, 10.02.2002.
70. Методические указания по лабораторной оценке антимикробной активности текстильных материалов, содержащих антимикробные препараты. МУ от 18.11.1983 N 28-6/32.
71. МУ 3.1.1029-01 «Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекций». М., 2002.
72. МУ 3.5.2.1759-03 «Методы определения эффективности инсектицидов, акарицидов, регуляторов развития и репеллентов, используемых в медицинской дезинсекции».
73. МУ 3.5.1937-04 «Очистка, дезинфекция и стерилизация эндоскопов и инструментов к ним».
74. МУ 3.5.2435-09 «Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств».
Описание
Р 4.2.2643-10 Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности
Область применения: Руководство устанавливает единые методы лабораторных исследований и испытаний дезинфекционных средств для оценки их антимикробной, инсектицидной, акарицидной, репеллентной и родентицидной активности, эффективности и безопасности при применении в быту, в лечебно-профилактических организациях и на других объектах для обеспечения безопасности жизни и здоровья людей, животных и неповреждения объектов внешней среды. Руководство предназначено для организаций, учреждений, предприятий, аккредитованных испытательных центров лабораторий, органов по сертификации дезинфекционных средств, аккредитованных в системе аккредитации ГОСТ Р, специалистов, осуществляющих исследования дезинфицирующих, стерилизующих, дезинсекционных, дератизационных средств, а также их субстанций (действующих веществ) в процессе их разработки, производства, применения, регистрационных и сертификационных испытаний, производственного контроля и надзора.
Заменяет собой:
- МР 1119-73 «Методические рекомендации по определению вирулицидной активности препаратов»
- Методические указания «Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности»
- 739-68 «Инструкция по определению бактерицидных свойств новых дезинфицирующих средств»
Ответы экспертов
Руководящие документы, определяющие методы лабораторных исследований и испытаний дезинфекционных средств
26 апреля 2021 в 10:00
В предыдущем НД Р 4.2.2643-10 есть разделы «3.5. Дезинфектология. Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности» и «5. Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих и стерилизующих средств».
В новом Руководстве 4.2.3676-20 нет этого раздела по исследованию дезинфекционных средств на содержание хлора и т. д.
Чем пользоваться в данной области?

 МР 1119-73 «Методические рекомендации по определению вирулицидной активности препаратов»
МР 1119-73 «Методические рекомендации по определению вирулицидной активности препаратов»