Атопический дерматит
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Атопический дерматит (L20)
Разделы медицины:
Дерматовенерология
Общая информация
Краткое описание
Разработчик клинической рекомендации:
- Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов»
- Общероссийская общественная организация «Российская ассоциация аллергологов и клинических иммунологов»
- Общероссийская общественная организация «Союз педиатров России»
При участии Союза «Национальный альянс дерматовенерологов и косметологов»
Клинические рекомендации Атопический дерматит
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: L20
Возрастная группа: Дети/взрослые
Год утверждения:
1. Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Атопический дерматит – мультифакторное генетически детерминированное воспалительное заболевание кожи, характеризующееся зудом, хроническим рецидивирующим течением, возрастными особенностями локализации и морфологии очагов поражения.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
L20 Атопический дерматит
L20.0 Почесуха Бенье
L20.8 Другие атопические дерматиты: экзема: сгибательная, детская (острая), (хроническая), эндогенная (аллергическая), нейродерматит: атопический (локализованный), (диффузный)
L20.9 Атопический дерматит неуточненный
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Общепринятой клинической классификации не существует.
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
К генетическим факторам развития атопического дерматита относят наличие мутации гена филаггрина в нарушении функции эпидермального барьера при атопическом дерматите, а также семейный анамнез аллергических заболеваний [1].
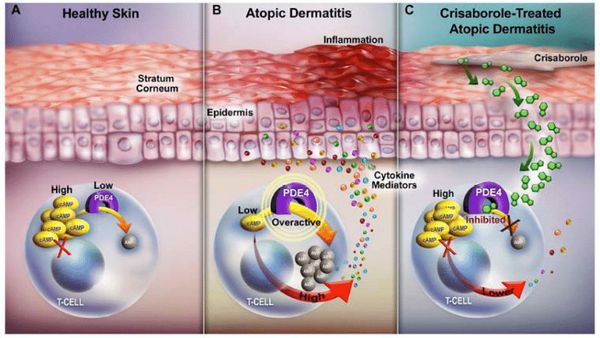
С дефектами иммунной системы связано развитие воспалительной реакции в коже с участием Т-лимфоцитов. В острую фазу заболевания преобладает Th2-ответ, когда происходит стимуляция Th2-клеток с последующей гиперпродукцией IgE; в хроническую – происходит переключение с Th2- на Th1-иммунный ответ[2]. Ключевыми цитокинами, вовлеченными в патофизиологические механизмы атопического дерматита, являются ИЛ- 4,ИЛ-5, ИЛ-13, ИЛ-31 и ИФН-γ, которым для передачи сигнала требуется участие сигнальной системы JAK/STAT, в том числе Янус-киназы 1 (JAK-1) [3]. Во многих исследованиях описана патогенетическая роль ИЛ-4 в развитии аллерген-специфических IgE-опосредованных реакций при атопическом дерматите, которая заключается в переключении синтеза антител на IgE.ИЛ-4 связывается не только с рецептором ИЛ-4, но и с рецептором ИЛ-13, данные цитокины имеют схожие биологические функции. ИЛ-13 также играет важную роль в развитии Th2-типа иммунного ответа при атопическом дерматите [4] .
Доказана роль аллергии к клещам домашней пыли, энтеротоксинам золотистого стафилококка, плесневым грибам, а такжеIgE-аутореактивности в механизмах развития заболевания [5].
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или
состояний)
Атопический дерматит – одно из наиболее распространенных заболеваний (от 20% до 40% в структуре кожных заболеваний), встречающееся во всех странах, у лиц обоего пола и в разных возрастных группах. Распространенность атопического дерматита среди детского населения составляет до 20%, среди взрослого населения – 2–8% [6]. Согласно данным Федерального статистического наблюдения в 2018 году в Российской Федерации заболеваемость атопическим дерматитом составила 188,2случаев на 100000 населения, а распространенность – 426,3 случая на 100000 всего населения. Среди детей в возрасте от 0 до 14 лет заболеваемость атопическим дерматитом составила 774,4 случаев на 100000 соответствующего населения, а распространенность – 1589,4 случаев на 100000 всего населения. Заболеваемость атопическим дерматитом среди детей в возрасте от 15 до 17 лет в Российской Федерации составила 374,1 случаев на 100000 соответствующего населения, распространенность – 1134,0 случаев на 100000 соответствующего населения [7].
Атопический дерматитможет быть ассоциирован с респираторной аллергией – с аллергическим ринитом и бронхиальной астмой. Риск развития респираторной аллергии у пациентов, страдающих атопическим дерматитом, по разным данным, составляет 30–80%; 60% пациентов с атопическим дерматитом имеют латентную склонность к развитию бронхиальной астмы, а 30–40% пациентов заболевают бронхиальной астмой[8,9].По данным систематического обзора у 29,5% детей с атопическим дерматитом в возрасте 6 лет или старше диагностирована бронхиальная астма [10]. Поллиноз был выявлен у 48,4% пациентов с атопическим дерматитом по сравнению с 24,4% человек, не страдающих атопическим дерматитом, бронхиальная астма была диагностирована у 24,1% пациентов с атопическим дерматитом по сравнению с 8,9% человек, не страдающих атопическим дерматитом [11].
Риск развития аллергической реакции и бронхиальной астмы существенно выше у детей с пищевой аллергией и атопическим дерматитом пищевая сенсибилизация, развившаяся в возрасте до 2 лет независимо от наличия сопутствующей сенсибилизации к ингаляционным аллергенам, была ассоциирована с развитием бронхиальной астмы к школьному возрасту, хотя сенсибилизация только к ингаляционным аллергенам в возрасте до 2 лет не влияла на риск развития бронхиальной астмы [12].
Согласно концепции «атопического марша», у пациентов сатопическим дерматитом и пищевой аллергией может произойти последовательное развитие других атопических заболеваний – аллергического ринита и бронхиальной астмы на протяжении жизни [13, 14]. Взаимосвязь между этими заболеваниями тогда зависит от степени тяжести атопического дерматита: у 20% детей со средне-тяжелым течением и у 60% с тяжелым течением могут присоединяться симптомы бронхиальной астмы и аллергического ринита [15]. Предполагается, что существует группа пациентов сатопическим дерматитом, у которых бронхиальная обструкция развивается также рано, как и поражение кожи, или даже предшествует ему, в связи с чем в данном случае нельзя говорить о развитии бронхиальной астмы как итога «атопического марша» [16, 17].
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина
заболевания или состояния (группы заболеваний или состояний)
В большинстве случаев атопический дерматит начинается в раннем детском возрасте (до 2 лет). Для заболевания характерны возрастные особенности клинических проявлений и хроническое рецидивирующее течение с периодическими обострениями и ремиссиями, которые могут продолжаться на протяжении нескольких лет. В анамнезе у пациента могут быть другие атопические заболевания (аллергический ринит, бронхиальная астма). Характерен семейный анамнез аллергических заболеваний (бронхиальная астма, аллергический ринит, атопический дерматит). Для заболевания характерна сезонность обострений с ухудшением состояния в холодное время года и улучшением летом. Обострение процесса может развиться также под влиянием ряда провоцирующих факторов (аллергены, раздражающие вещества, пищевые продукты, эмоциональный стресс и т.д.). При повышенном потоотделении может увеличиться интенсивность зуда.
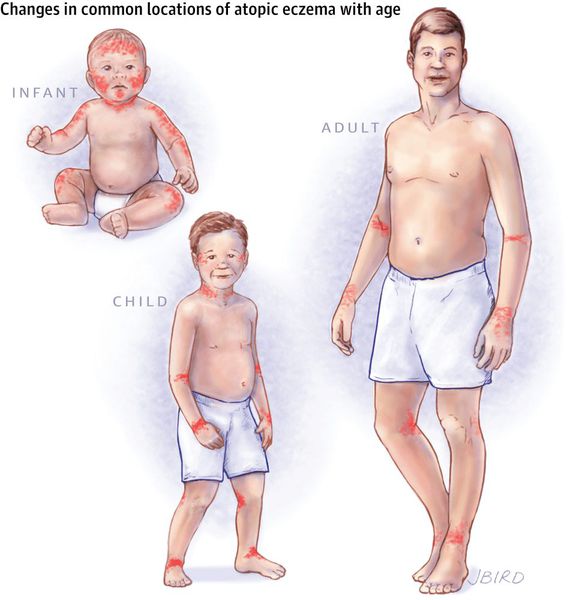
Клинические проявления атопического дерматита отличаются в разные возрастные периоды. Основные различия заключаются в локализации очагов поражения и соотношении экссудативных и лихеноидных компонентов высыпаний.
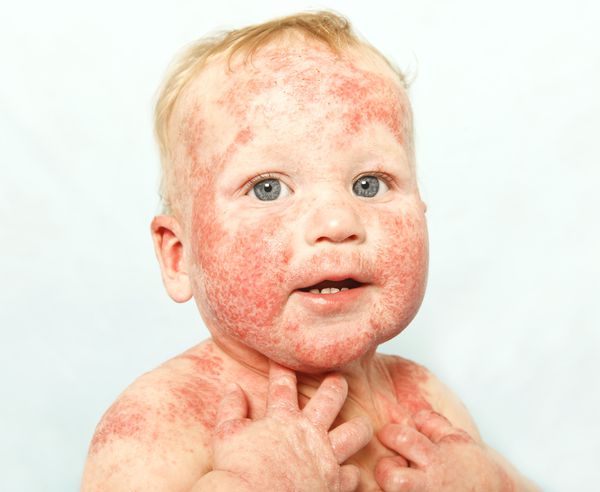
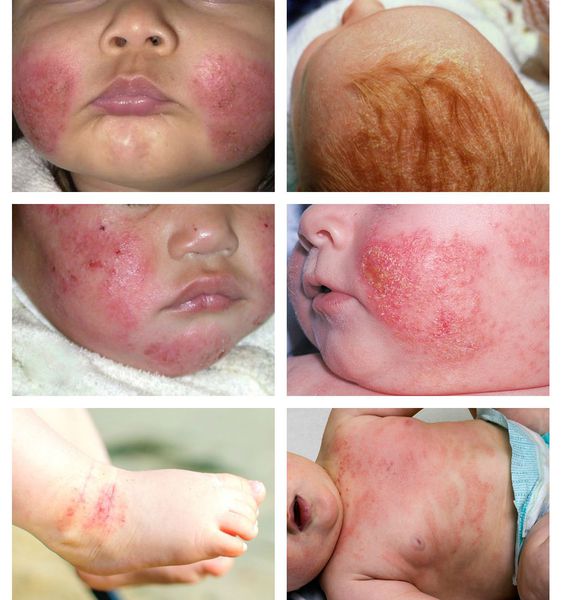
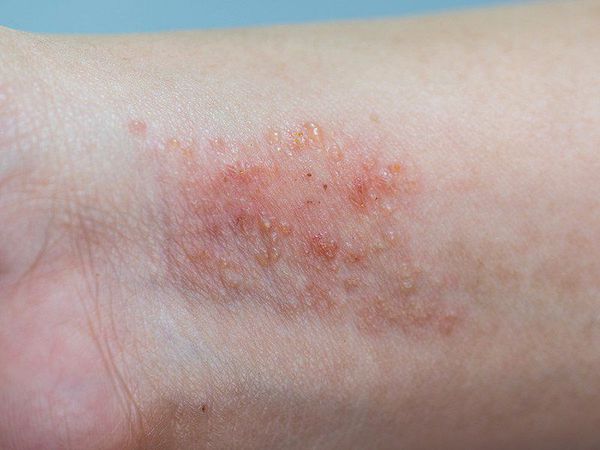
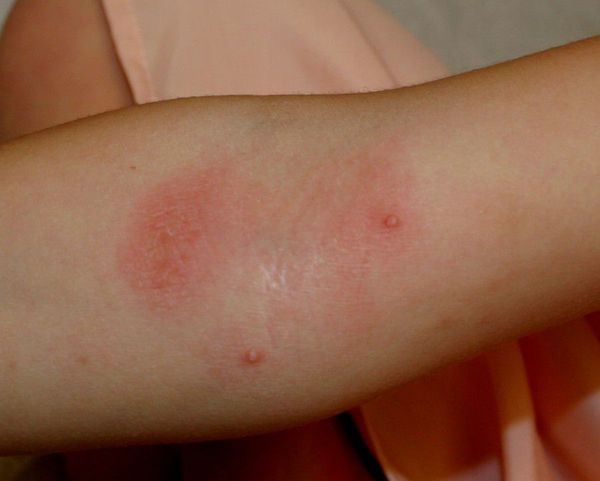
Младенческий период атопического дерматита обычно начинается с 2–3 месяцев жизни ребёнка. В этот период преобладает экссудативная форма заболевания, при которой воспаление носит острый или подострый характер. Отмечаются симметричные эритематозные, папуло-везикулезные высыпания на коже лица и волосистой части головы, экссудация с образованием чешуйко-корок. В дальнейшем высыпания распространяются на кожу наружной поверхности голеней, предплечий, туловища и ягодиц, а также могут появляться в естественных складках кожи. Дермографизм обычно красный или смешанный. Субъективно отмечается зуд кожных покровов различной интенсивности. К концу этого периода очаги сохраняются преимущественно в локтевых и подколенных сгибах, а также в области запястий и шеи. Обострения заболевания в значительной степени связаны с алиментарными факторами. Младенческий период атопического дерматита обычно заканчивается ко второму году жизни ребенка клиническим выздоровлением (у 60% пациентов) или переходит в следующий период (детский).
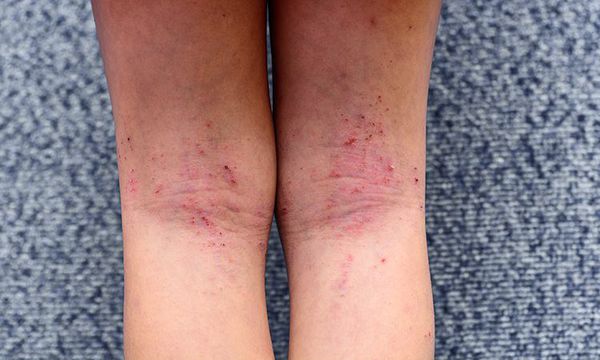
Детский период атопического дерматитахарактеризуется высыпаниями, которые носят менее экссудативный характер, чем в младенческом периоде, и представлены воспалительными милиарными и/или лентикулярными папулами, папуло-везикулами и эритематозно-сквамозными элементами, локализующимися на коже верхних и нижних конечностей, в области запястий, предплечий, локтевых и подколенных сгибов, голеностопных суставов и стоп. Характерно наличие зудящих узелков, эрозий и экскориаций, а также незначительная эритема и инфильтрация в области высыпаний на коже туловища, верхних и нижних конечностей, реже – на коже лица. Дермографизм становится розовым, белым или смешанным. Появляются пигментация век, дисхромии, нередко – ангулярный хейлит.
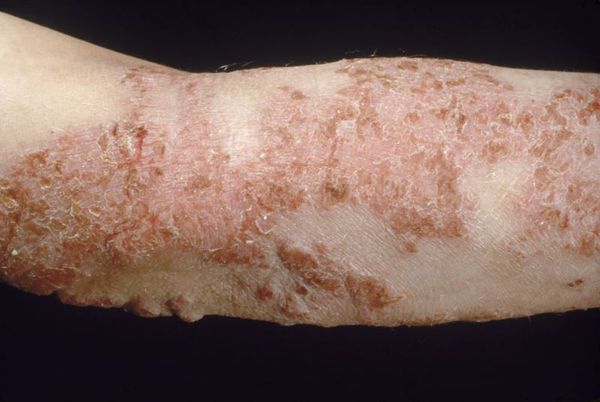
Подростковый и взрослый период атопического дерматита характеризуется высыпаниями преимущественно на сгибательной поверхности конечностей (в области локтевых и коленных сгибов, сгибательных поверхностей голеностопных и лучезапястных суставов), на задней поверхности шеи, в заушных областях. Высыпания представлены эритемой, папулами, шелушением, инфильтрацией, лихенификацией, множественными экскориациями и трещинами. В местах разрешения высыпаний в очагах поражения остаются участки гипо- или гиперпигментации. Со временем у большинства пациентов кожа очищается от высыпаний, поражёнными остаются лишь подколенные и локтевые сгибы.
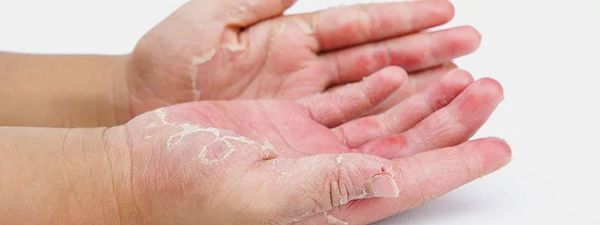
Возможны гиперлинеарность ладоней и подошв, фолликулярный гиперкератоз («роговые» папулы на боковых поверхностях плеч, предплечий, локтей), хейлит, экзема сосков, складки на передней поверхности шеи. Наблюдается гиперпигментация кожи периорбитальной области, появление складки под нижним веком (линии Денни-Моргана). Отмечается повышенная сухость кожи. Дермографизм белый стойкий или смешанный. Зуд выраженный, постоянный, реже – приступообразный. Нередко у подростков и взрослых преобладает лихеноидная форма заболевания, которая характеризуется сухостью, выраженным рисунком, отечностью и инфильтрацией кожных покровов, крупными, сливающимися очагами лихенизации кожи и упорным стойким зудом. Относительно редко наблюдается пруригинозная форма заболевания, для которой характерны высыпания в виде множественных изолированных плотных отечных папул, на вершине которых могут появляться мелкие пузырьки. Очаги поражения могут иметь распространенный характер с преимущественной локализацией на коже конечностей.
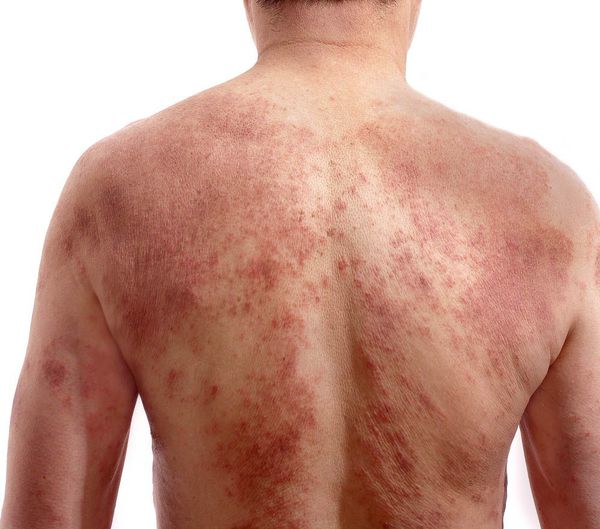
Наиболее тяжелым проявлением атопического дерматита является эритродермия, которая характеризуется универсальным поражением кожных покровов в виде эритемы, инфильтрации, лихенификации, шелушения и сопровождается симптомами интоксикации и нарушением терморегуляции (гипертермия, озноб, лимфоаденопатия).
При лабораторном обследовании пациентов с атопическим дерматитом могут быть выявлены эозинофилия периферической крови, повышение содержания общего и аллерген-специфических IgE в сыворотке крови.
Стадии болезни
Стадия обострения или выраженных клинических проявлений характеризуется наличием эритемы, папул, микровезикул, мокнутия, множественных экскориаций, корок, шелушения; зуда разной степени интенсивности.
Стадии ремиссии:
- при неполной ремиссии отмечается значительное уменьшение симптомов заболевания с сохранением инфильтрации, лихенификации, сухости и шелушения кожи, гипер- или гипопигментации в очагах поражения;
- полная ремиссия характеризуется отсутствием всех клинических симптомов заболевания [18].
Распространённость кожного процесса
При ограниченно-локализованном процессе площадь поражения не превышает 10% кожного покрова.
При распространённом процессе площадь поражения составляет от 10% до 50% кожного покрова.
При диффузном процессе площадь поражения составляет более 50% кожного покрова.
Степень тяжести атопического дерматита
Лёгкое течение заболевания характеризуется преимущественно ограниченно- локализованными проявлениями кожного процесса, незначительным кожным зудом, редкими обострениями (реже 1–2 раз в год), продолжительностью рецидива до 1 месяца преимущественно в холодное время года. Длительность ремиссии составляет 8–10 месяцев и более. Отмечается хороший эффект от проводимой терапии.
При среднетяжёлом течении отмечается распространённый характер поражения. Частота обострений – 3–4 раза в год с увеличением их продолжительности. Длительность ремиссий составляет 2–3 месяца. Процесс приобретает упорное течение с незначительным эффектом от проводимой терапии.
При тяжёлом течении заболевания кожный процесс носит распространённый или диффузный характер с длительными обострениями, редкими и непродолжительными ремиссиями (частота обострений – 5 раз в год и более, длительность ремиссии 1–1,5 месяца). Лечение приносит кратковременное и незначительное улучшение. Отмечается выраженный зуд, приводящий к нарушению сна [18].
Осложненные формы атопического дерматита
Течение атопического дерматита часто осложняется присоединением вторичной инфекции (бактериальной, микотической или вирусной). Эта особенность, свойственнаяпациентам с атопическим дерматитом, отражает нарушение противоинфекционной защиты, обусловленное нарушением синтеза антимикробных пептидов и эпидермального барьера.
- Наиболее частое инфекционное осложнение атопического дерматита – присоединение вторичной бактериальной инфекции. Оно протекает в виде стрепто- и/или стафилодермии с характерными кожными проявлениями на фоне обострения атопического дерматита. Пиококковые осложнения проявляются в виде различных форм пиодермии: остиофолликулитов, фолликулитов, вульгарного, реже стрептококкового импетиго, иногда – фурункулов.
- Разнообразная микотическая инфекция (дерматофиты, дрожжеподобные, плесневые и другие виды грибов) также часто осложняет течение атопического дерматита, приводит к более продолжительным обострениям, отсутствию улучшения или к ухудшению состояния. Заболевание приобретает персистирующий характер. Наличие микотической инфекции может изменить клиническую картину атопического дерматита: появляются очаги с четкими фестончатыми,несколько приподнятыми краями, часто рецидивируют заеды (хейлит), отмечаются поражения заушных, паховых складок, ногтевого ложа, гениталий.
- Пациенты с атопическим дерматитом, независимо от остроты процесса, склонны к поражению вирусной инфекцией (чаще вирусом простого герпеса, вирусом папилломы человека, вирусом контагиозного моллюска). Герпетическая суперинфекция может привести к редкому, но тяжелому осложнению – герпетической экземе Капоши. Заболевание характеризуется распространенными пузырьковыми высыпаниями, сильным зудом, повышением температуры, быстрым присоединением пиококковой инфекции. Возможно поражение центральной нервной системы, глаз, развитие сепсиса.
- Доброкачественная лимфоаденопатия, как правило, связана с обострениями атопического дерматита и проявляется в виде увеличения лимфатических узлов в шейной, подмышечной, паховой и бедренной областях. Величина узлов может варьировать, они подвижны, эластичной консистенции, безболезненны. Доброкачественная лимфоаденопатия проходит самостоятельно при улучшении состояния, либо на фоне проводимого лечения. Сохраняющееся, несмотря на уменьшение активности заболевания, выраженное увеличение лимфатических узлов требует проведения диагностической биопсии для исключения лимфопролиферативного заболевания.
- Осложненияатопического дерматита со стороны глаз проявляются в виде рецидивирующих кератоконъюнктивитов, сопровождающихся зудом. В тяжелых случаях хронический конъюнктивит может прогрессировать в эктропион и вызывать постоянное слезотечение. Возможно формирование ранней катаракты, как правило, связанное с частым использованием топических стероидов в периорбитальной зоне.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
- Рекомендуется для диагностики атопического дерматита пациентам всем возрастных групп использовать диагностические критерии J.M. Hanifin и G. Rajka [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Для постановки диагноза атопического дерматита необходимо сочетание трёх основных и не менее трёх дополнительных критериев.
Выделяют основные и дополнительные диагностические критерии J.M. Hanifin и G.Rajka:
Основные диагностические критерии (3 или более):
- кожный зуд;
- типичная морфология и локализация поражения кожи: у детей первых лет жизни – покраснение и высыпания на лице и разгибательных поверхностях конечностей, у детей более старшего возраста и взрослых лиц – лихенификация и расчёсы в области сгибов конечностей;
- хроническое рецидивирующее течение;
- наличие атопических заболеваний у пациента или его родственников;
Дополнительные диагностические критерии (3 или более):
- сухость кожи (ксероз);
- гиперлинеарность ладоней («складчатые») и подошв или фолликулярный гиперкератоз;
- повышение содержания общего и специфических IgE в сыворотке крови;
- начало заболевания в раннем детском возрасте (до 2 лет);
- склонность к кожным инфекциям (S. aureus, H. simplex);
- локализация кожного процесса на кистях и стопах;
- экзема сосков;
- хейлит;
- рецидивирующие конъюнктивиты;
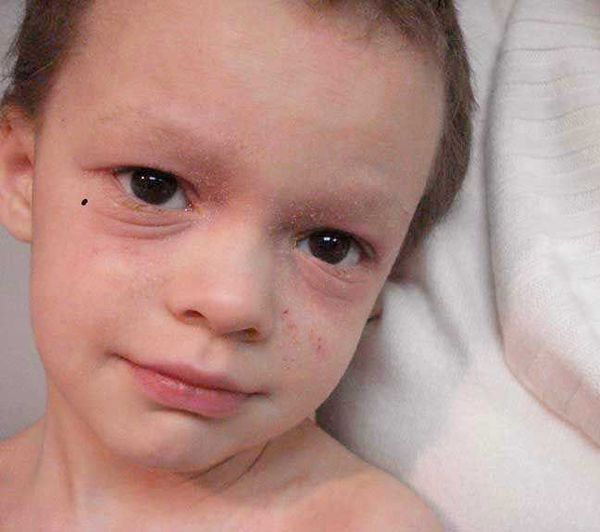
- симптом Денни-Моргана (дополнительная складка нижнего века);
- кератоконус;
- передняя субкапсулярная катаракта;
- гиперпигментация кожи периорбитальной области;
- бледность/эритема лица;
- себорейная экзема;
- складки на передней поверхности шеи;
- зуд при повышенном потоотделении;
- обострение процесса и усиление зуда под влиянием провоцирующих факторов (шерстяная одежда, мыло, аллергены, ирританты, пищевые продукты, эмоциональный стресс и т.д.);
- перифолликулярнаяакцентуация;
- непереносимость пищи;
- сезонность обострений (ухудшение в холодное время года и улучшение летом);
- белый дермографизм.
Дифференциальный диагноз атопического дерматита проводят с Т-клеточной лимфомой кожи, хронической экземой, аллергическим и ирритантным контактным дерматитом, себорейным дерматитом, нуммулярной экземой, чесоткой, псориазом, ихтиозом, питириазом красным волосяным отрубевидным, дерматофитией, иммунодефицитными состояниями (Х-сцепленный синдром Вискотта-Олдрича, синдром гипериммуноглобулинемии Е) и др.
У детей атопический дерматит следует дифференцировать со всеми вышеперечисленными заболеваниями, а также с пеленочным дерматитом.
2.1 Жалобы и анамнез
Зуд является постоянным симптомом заболевания во всех возрастных периодах [20]. Зуд относится к основным диагностическим критериями атопического дерматита по J.M. Hanifin и G. Rajka.
- Рекомендуется оценивать характер течения заболевания, сроки начала заболевания, наличие атопических заболеваний как у пациента, так и его родственников, сезонность обострений, факторы, провоцирующие обострения дерматита, а также обращать внимание на склонность пациента к развитию бактериальных, вирусных и грибковых инфекций кожи [20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Оценивается соответствие данных анамнеза основным и дополнительным диагностическим критериям атопического дерматита поJ.M. Hanifin и G. Rajka.
2.2 Физикальное обследование
Для постановки диагноза основным является проведение визуального осмотра кожных покровов пациента. Проявления заболевания подробно описаны в разделе «Клиническая картина».
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам общий (клинический) анализ крови развернутый для диагностики заболеваний и состояний, являющихся противопоказаниями к проведению системной терапии атопического дерматита и для контроля безопасности проводимой системной терапии циклоспорином** [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Контроль показателей общего (клинического) анализа кровинеобходим во время терапии циклоспорином**, так как циклоспорин** может вызвать развитие нежелательных явлений – лейкопении, анемии, тромбоцитопении [21].
- Рекомендуется анализ крови биохимический общетерапевтический пациентамдля диагностики заболеваний и состояний, являющихся противопоказаниями к проведению системной терапии атопического дерматита и для контроля безопасности проводимой системной терапиициклоспорином** [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Контроль показателей анализа крови биохимического общетерапевтического необходим во время терапии циклоспорином**, так как циклоспорин** может вызвать развитие нежелательных явлений – увеличение концентрации креатинина и мочевины в плазме крови, гиперлипидемию, гиперурикемию, гиперкалиемию, гипомагниемию, гипергликемию, Циклоспорин** может также вызывать дозозависимое обратимое увеличение концентрации билирубина в плазме крови и активности ферментов печени. Возможно гепатотоксическое действие циклоспорина** с развитием холестаза, желтухи, гепатита и печеночной недостаточности [21].
- Рекомендуется общий (клинический) анализ мочи пациентам для диагностики заболеваний и состояний, являющихся противопоказаниями к проведению системной терапии атопического дерматита и для контроля безопасности проводимой системной терапиициклоспорином** [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии:Контроль показателей общего (клинического) анализа мочи необходим во время терапии циклоспорином**, так как циклоспорин** может вызвать токсическое поражение почек и, кроме того, обладая иммуносупрессивным действием, он может способствовать развитию инфекционных поражений почек и мочевыводящих путей [21].
- Рекомендуется в случае отсутствия достаточного для установления диагноза атопического дерматита числа диагностических критериев пациентам исследование уровня общего иммуноглобулина E в крови [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии:Повышение содержания общего IgE в сыворотке крови является дополнительным диагностическим критерием атопического дерматита [20] и коррелирует с тяжестью заболевания.
2.4 Инструментальные диагностические исследования
Не применяются.
2.5 Иные диагностические исследования
- Рекомендуется патолого-анатомическое исследование биопсийного (операционного) материала кожи для дифференциальной диагностики в случае наличия у пациента клинических признаков общих с другими заболеваниями кожи [23].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
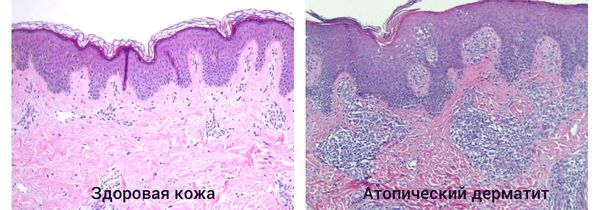
Комментарии:В случае диагностики атопического дерматита у взрослых пациентов проводится дифференциальная диагностика с Т-клеточными лимфомами кожи или другими дерматозами.При атопическом дерматите наблюдается различной степени выраженности акантоз с удлинением эпидермальных выростов и их разветвлением. Могут обнаруживаться участки паракератоза, экзоцитоз. В дерме обнаруживаетсяпериваскулярный или сливающийся лимфогистиоцитарный инфильтрат; при хроническом течении инфильтрация незначительная, преобладает фиброз.
- Рекомендуется проведение аллергологического обследования пациентам с атопическим дерматитом с семейным и/или личным анамнезом аллергических заболеваний – пищевой аллергии, аллергического ринита, бронхиальной астмы, а также с указанием на обострение заболевания при контакте с аллергенами [245– 250]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Проведение аллергологического обследования необходимо для подтверждения аллергической природы атопического дерматита, выявления причинно-значимых аллергенов с целью выработки рекомендаций по образу жизни, питанию и определения целесообразности проведения аллерген-специфической иммунотерапии. Аллергологическое обследование может проводиться методом кожного тестирования с небактериальными аллергенами (накожные исследования реакции на аллергены), определения уровня аллерген-специфических IgE антител в сыворотке крови, проведения провокационных тестов. Выбор метода аллергологического обследования определяется доступностью и оснащенностью аллергологического кабинета и наличием/отсутствием противопоказаний к проведению кожного тестирования (обострение заболевания, необходимость приема антигистаминных препаратов).
- Рекомендуется проведение накожных исследований реакции на аллергены с бытовыми, пыльцевыми, эпидермальными, грибковыми и пищевыми аллергенами для диагностики [22, 255-257].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарий: Объем обследования определяет врач-аллерголог-иммунолог. Кожные пробы проводят в условиях аллергологического кабинета специально обученная медицинская сестра и врач-аллерголог-иммунолог. Наиболее часто применяют prick-тесты (тесты уколом) или скарификационные тесты. Результаты тестирования с аллергенами соотносят с результатами отрицательного и положительного тест-контроля.
- Рекомендуется пациентам с атопическим дерматитом при наличии противопоказаний или иных причин, препятствующих проведению кожного тестирования, сомнительных результатах кожного тестирования, расхождении данных, полученных при сборе анамнеза, с результатами кожного тестирования исследование уровня аллерген-специфических IgE антител к пыльцевым, бытовым, эпидермальным, грибковым и пищевым аллергенам [245–250].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Определение уровня аллерген-специфических IgЕ антител в сыворотке особенно важно при неубедительных результатах кожных проб либо при невозможности их постановки (например, в период обострения аллергического заболевания или наличии иных противопоказаний). На достоверность результата влияет используемая тест-система, которая может иметь невысокую чувствительность и специфичность, что в свою очередь отражается как в ложноположительном, так и в ложноотрицательном результате. Компонентная (молекулярная) диагностика используется для картирования аллергенной сенсибилизации пациента на молекулярном уровне с применением очищенных натуральных или рекомбинантных аллергенных молекул вместо экстрактов аллергенов.Этот метод может быть использован при расхождении данных анамнеза, результатов накожных исследований реакций на аллергены и результатов определения специфических IgE антител к экстрактам аллергенов, а также при наличии указаний на пищевую анафилаксию, перекрестную пищевую аллергию ипри неэффективности АСИТ.
- Рекомендуется при необходимости дополнительной количественной оценки степени тяжести атопического дерматита определять общую оценку заболевания исследователем IGA (Приложение Г1) [24].
Уровень убедительности рекомендаций А(уровень достоверности доказательств – 2)
- Рекомендуется при необходимости дополнительной количественной оценки степени тяжести атопического дерматита использовать индекс SCORAD (Приложение Г2) [6, 25, 26].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
Комментарии: SCORAD является интегральным показателем, включающим балльную оценку шести объективных симптомов: эритема, отек/папулезные элементы, корки/мокнутие, экскориации, лихенификация/шелушение, сухость кожи и двух субъективных показателей (интенсивность зуда и выраженность нарушений сна).
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
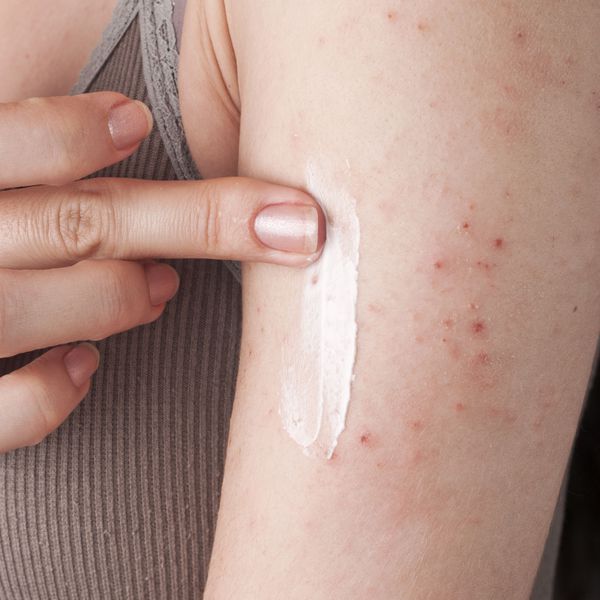
- Рекомендуется всем пациентам сатопическим дерматитом независимо от степени тяжести: увлажняющие и смягчающие средства (эмоленты) наружно [27–37].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Эмоленты могут использоваться в форме лосьонов, кремов, мазей, моющих средств, средств для ванн. Выбор препарата и его формы осуществляется индивидуально с учетом предпочтений пациента, индивидуальных особенностей кожи, сезона, климатических условий.
Пациентам с атопическим дерматитом необходимо постоянно, часто и в больших количествах использовать увлажняющие и смягчающие средства (не менее 3–4 раз в день) как самостоятельно, так и после водных процедур [38–40]. Однако есть указания, что нанесение эмолентов без принятия ванны имеет более продолжительное действие [40].
Наиболее выраженный эффект увлажняющих и смягчающих препаратов наблюдается при их постоянном использовании в виде крема, мази, масла для ванны и заменителей мыла. Выбор препарата и его формы осуществляется индивидуально с учетом предпочтений пациента, индивидуальных особенностей кожи, сезона, времени года, климата. Они не должны иметь запаха, цвета и содержать консерванты. Средства на мазевой основе (более жирные) можно использовать в холодное время года, а летом следует применять кремы и гели с высоким содержанием воды. Лосьоны отличаются более высоким содержанием воды, которая может испаряться, поэтому их не следует применять у пациентов со выраженным ксерозом.
Для достижения клинического эффекта необходимо использовать достаточный объем смягчающих препаратов (у взрослого с распространенным поражением кожи расходуется до 600 граммов в неделю, у ребенка – до 250 граммов в неделю) [28].
Наружная терапия
- Пациентам при атопическом дерматите легкой, средней и тяжелой степени тяжести рекомендуется наружная терапия: глюкокортикоидами, применяемыми в дерматологии, препаратами для лечения дерматита, кроме глюкокортикоидов [41, 42].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: При легком течении атопического дерматита предпочтительно применение низко- и умеренно-активных глюкокортикоидов, применяемых в дерматологии, а при средне-тяжелом и тяжелом течении атопического дерматита целесообразно применение активных и высокоактивных глюкокортикоидов, применяемых в дерматологии,в минимальных эффективных дозах (Приложение Г3). Для быстрого лечения обострения атопического дерматита возможно использование средств для наружной терапии и эмолентов с применением влажных повязок. Сначала на пораженные участки кожи наносят наружные средства (глюкокортикоиды, применяемые в дерматологии и/или эмоленты), затем накладывают влажную хлопчатобумажную или марлевую салфетку, а затем сухую наружную повязку [43–45]. Следует соблюдать осторожность при использовании глюкокортикоидов, применяемых в дерматологии, средней и высокой силы действия с применением влажных повязок в связи с риском угнетения функции надпочечников [45, 46].
- Рекомендуются для наружной терапии пациентов с атопическим дерматитомглюкокортикоиды, применяемые в дерматологии:
клобетазол 0,05% крем для наружного применения, 0,05% мазь для наружного применения наносится тонким слоем на пораженные участки кожи 1–2 раза в сутки в течение 3–4 недель [47–51].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Противопоказанием к назначению препарата клобетазол является детский возраст до 12 лет.
или
бетаметазон** 0,05% мазь для наружного применения 1 раз в сутки наносить на пораженный участок кожи тонким слоем 1–2 раза в сутки, слегка втирая, в течение 2– 4 недель [52, 53].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Противопоказанием к назначению препарата бетаметазон** 0,05% мазь для наружного применения является детский возраст до 1 года.
или
бетаметазон** 0,05%крем для наружного применения 1 раз в сутки наносить взрослым пациентам с атопическим дерматитом на пораженный участок кожи тонким слоем 1–2 раза в сутки, слегка втирая, в течение 2–4 недель [54, 55].
Уровень убедительности рекомендаций B(уровень достоверности доказательств – 3)
Комментарии: Противопоказанием к назначению препарата бетаметазон** 0,05% крем для наружного применения является детский возраст до 1 года.
или
триамцинолон 0,1% мазь для наружного применения наносят тонким слоем на пораженные участки кожи 2–3 раза в сутки в течение 2–4 недель. Возможно использование окклюзионной повязки [56–58].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Противопоказанием к назначению препарата триамцинолон 0,1% мазь для наружного применения является детский возраст до 2 лет.
или
флутиказон 0,05% крем для наружного применения, 0,005% мазь для наружного применения наносить 1 или 2 раза в сутки тонким слоем в количестве, не большем, чем необходимо для покрытия всего пораженного участка, и осторожно втирать, в течение 2–4 недель [59–61].
Уровень убедительности рекомендаций С(уровень достоверности доказательств – 5)
Комментарии: Противопоказанием к назначению мази флутиказон является детский возраст до 6 месяцев, крема флутиказон – детский возраст до 1 года.
или
мометазон** крем 0,1% , мазь 0,1% тонким слоем наносят на пораженные участки кожи 1 раз в сутки в течение 2–4 недель [51, 62–69].
Уровень убедительности рекомендаций С(уровень достоверности доказательств – 5)
Комментарии: Противопоказанием к назначению препарата мометазон** является детский возраст до 2 лет.
или
метилпреднизолона ацепонат 0,1% крем, мазь, эмульсия для наружного применения наносить 1 раз в сутки тонким слоем на пораженные участки кожи в течение 2–4 недель [70–74].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Противопоказанием к назначению крема, мази, эмульсии для наружного примененияметилпреднизолонаацепонатаявляется детский возраст до 4 месяцев.
или
алклометазон крем 0,05%, мазь 0,05% наносить пациентам с атопическим дерматитом детского возраста на пораженные участки кожи равномерным слоем 2–3 раза в сутки в течение 2–4 недель. У детей и в период долечивания возможно использовать препарат 1 раз в сутки [75–79].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Противопоказанием к назначению алклометазона0,05%крема, 0,05% мази для наружного примененияявляется детский возраст до 6 месяцев.
или
гидрокортизон** 0,1% крем для наружного применения, 0,1% мазь для наружного применения, 0,1% эмульсия для наружного применения наносить на пораженные участки кожи тонким слоем не чаще 2 раз в сутки в течение 2–4 недель [80–87].
Уровень убедительности рекомендаций B(уровень достоверности доказательств – 2)
Комментарии: Возможно применение 0,1% крема, мази и эмульсии гидрокортизона с 6-месячного возраста.
или
гидрокортизон** 1% мазь для наружного применения пациентам с атопическим дерматитом детского возрастананосить на пораженные участки кожи тонким слоем 1–3 раза в сутки в течение 2–4 недель [88–90].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Противопоказанием к назначению мази 1% является детский возраст до 2 лет.
или
преднизолон** 0,5% мазь для наружного применения наносят тонким слоем на пораженные участки кожи 1–3 раза в сутки [91].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Противопоказанием к назначению преднизолона** 0,5% мази для наружного применения является детский возраст до 1 года. Длительность применения не должна превышать 14 дней.
- Рекомендуются пациентам со средней тяжестью течения и тяжелой формой атопического дерматита препараты для лечения дерматита, кроме глюкокортикоидов:
такролимус** взрослым 0,03% мазь для наружного применения или 0,1% мазь для наружного применения, детям старше 2 лет – 0,03% мазь для наружного применения наносить 2 раза в сутки тонким слоем на пораженные участки кожи [85, 92–110].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Продолжительность лечения по данной схеме не должна превышать трех недель. В дальнейшем частота применения уменьшается до одного раза в сутки, лечение продолжается до полного регресса очагов поражения.При отсутствии положительной динамики в течение 14 дней необходима повторная консультация врача для уточнения дальнейшей тактики терапии.Через 12 месяцев поддерживающей терапии (при использовании такролимуса** 2 раза в неделю) следует временно отменить препарат и затем рассмотреть вопрос о необходимости продолжения поддерживающей терапии.
Такролимус** применяется для лечения атопического дерматита (средней степени тяжести и тяжелых форм) в случае его резистентности к иным средствам наружной терапии или наличия противопоказаний к таковым. Применение 0,1% мази такролимус** противопоказано детям до 16 лет. Противопоказанием к назначению 0,03% мази такролимус** является детский возраст до 2 лет.
Во время применения такролимуса** следует избегать попадания на кожу солнечных лучей, посещения солярия, ультрафиолетового облучения кожи УФ- лучами B или А, ПУВА-терапии.
или
пимекролимус** 1% крем для наружного применения 2 раза в сутки взрослым и детям старше 3 месяцев наносить на пораженную поверхность тонким слоем [92, 111–119].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Пимекролимус** крем для наружного применения показан как для кратковременного, так и длительного лечения атопического дерматиталегкой и средней степени тяжести у взрослых, подростков и детей (от 3-х месяцев). Возможно длительное применение по интермиттирующей схеме (1 раз в неделю или реже). Противопоказанием к назначению пимекролимуса** является детский возраст до 3 месяцев.
Препарат назначают 2 раза в сутки на пораженные участки кожи любых частей тела, включая голову, лицо, шею, области опрелостей. Особенно показан для чувствительных участков кожи [119]. При первых признаках рецидива атопического дерматита терапию следует возобновить. Если симптомы заболевания сохраняются в течение 6 недель, следует провести повторную оценку состояния пациента. Не запрещен беременным и кормящим.
Во время применения пимекролимуса** следует избегать попадания на кожу солнечных лучей, посещения солярия, ультрафиолетового облучения кожи УФ-лучами B или А, ПУВА-терапии.
- Рекомендуется пиритион цинк для местного применения пациентам с атопическим дерматитом детского возраста: крем 0,2% наносится тонким слоем на пораженные участки кожи 2 раза в сутки детям с 1 года, возможно применение под окклюзионную повязку; аэрозоль 0,2% детям с 1 года в случаях выраженного мокнутия распыляют с расстояния 15 см 2–3 раза в сутки [120–122].
Комментарии: Курс лечения при атопическом дерматите – 3–4 недели.
Уровень убедительности рекомендаций C (уровень достоверности доказательств –4)
- Рекомендуется в случае наличия у пациентов выраженной инфильтрации высыпания: нафталанская нефть линимент 10% наносят тонким слоем, не втирая, на пораженные участки кожи 2 раза в сутки [123].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Обладает противовоспалительным, противозудным, дезинфицирующим и заживляющим эффектом.
Системная терапия для уменьшения интенсивности зуда
- Рекомендуются пациентам для уменьшения интенсивности зуда: клемастин1 мг, перорально взрослым и детям старше 12 лет – по 1 таблетке (1 мг) утром и вечеромв течение 7–10 дней. В случаях трудно поддающихся лечению суточная доза может составлять до 6 таблеток (6 мг); детям в возрасте 6–12 лет – по ½–1таблетке перед завтраком и на ночь [91, 124, 125].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Клемастин в форме таблеток противопоказан в возрасте до 6 лет.
или
хлоропирамин** 25 мг перорально детям в возрасте от 1 месяца до 12 месяцев– по 6,25 мг (¼ таблетки) 2–3 раза в сутки в растертом до порошка состоянии вместе с детским питанием; детям в возрасте от 1 года до 6 лет – по 8,3 мг (1/3 таблетки) 2–3 раза в сутки; детям в возрасте от 7 до 14 лет – по 12,5 мг (½таблетки) 2–3 раза в сутки; детям в возрасте старше 14 лет и взрослым – по 1 таблетке 3–4 раза в сутки (75–100 мг в сутки) [126–130].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Хлоропирамин** в форме таблеток противопоказан в зависимости от производителя лекарственного препарата в возрасте до 6 месяцев или до 14 лет.
или
хифенадин10 мг, 25 мг, 50 мг, взрослым по 25–50 мг 2–4 раза в сутки; детям в возрасте от 3 до 7 лет – по 10 мг перорально 2 раза в сутки, детям в возрасте от 7 до 12 лет – по 10–15 мг перорально 2–3 раза в сутки, детям в возрасте старше 12 лет и взрослым – по 1 таблетке 25 мг перорально 2–3 раза в сутки в течение 10–15 дней [91].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Противопоказанием к назначению хифенадина в форме таблеток является детский возраст до 3 лет (для дозировки 10 мг), детский возраст до 18 лет (для дозировки 50 мг).
или
лоратадин** сироп, таблетки 10 мг,детям в возрасте от 2 до 12 лет с массой тела менее 30 кг – 5 мг (5 мл) 1 раз в сутки перорально, при массе тела более 30 кг – 10 мг (10 мл) 1 раз в сутки; детям в возрасте старше 12 лет и взрослым – 10 мг (10 мл) 1 раз в сутки перорально в течение 14–28 дней в возрасте от 2 до 12 лет – 5 мг (5 мл) 1 раз в сутки перорально; детям в возрасте старше 12 лет и взрослым – 10 мг (10 мл) 1 раз в сутки перорально 1 раз в сутки в течение 14–18 дней [131–133].
Уровень убедительности рекомендаций B(уровень достоверности доказательств – 2)
или
цетиризин** капли для приема внутрь 10 мг/мл, таблетки 10 мг – детям в возрасте от 6 до 12 месяцев (только по назначению врача и под строгим медицинским контролем) – 2,5 мг (5 капель) перорально 1 раз в сутки, детям в возрасте от 1 года до 2 лет – 2,5 мг (5 капель) перорально 1–2 раза в сутки, детям в возрасте от 2 до 6 лет – 2,5 мг (5 капель) перорально 2 раза в сутки или 5 мг (10 капель) перорально 1 раз в сутки, детям в возрасте старше 6 лет и взрослым – 5 мг перорально 1 раз в сутки в течение 14–28 дней [134–138].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Цетиризин** в форме таблеток противопоказан в возрасте до 6 лет, цетиризин** в форме капель для приема внутрь противопоказан в возрасте до 6 месяцев или до 1 года в зависимости от производителя.
или
левоцетиризин 5 мг – детям в возрасте старше 6 лет и взрослым – 5 мг перорально 1 раз в сутки в течение 14–28 дней [139–143].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Противопоказанием к назначению левоцетиризина является детский возраст до 6 лет
- Рекомендуется пациентам с выраженным зудом [123]:
клемастин раствор для инъекций внутримышечно взрослым 2 мг (2 мл) 2 раза в сутки (утром и вечером); детям – 0,025 мг на кг массы тела в сутки внутримышечно, разделяя на 2 инъекции; в течение 5–7 дней
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Противопоказанием к назначению клемастина в форме раствора для инъекций является детский возраст до 1 года.
или
хлоропирамин** раствор для инъекций детям в возрасте от 1 месяца до 1 года по 5 мг (0,25 мл раствора) внутримышечно 1 раз в сутки; детям в возрасте от 1 года до 6 лет – по 10 мг (0,5 мл раствора) внутримышечно 1 раз в сутки; детям в возрасте от 6 до 14 лет – по 10–20 мг (0,5–1 мл раствора) внутримышечно 1 раз в сутки; детям в возрасте старше 14 лет и взрослым – по 20–40 мг (1–2 мл раствора) внутримышечно 1 раз в сутки в течение 5–7 дней [123].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Хлоропирамин** в форме раствора для инъекций противопоказан новорожденным.
Терапия пациентов с атопическим дерматитом средней и тяжелой степени тяжести
Физиотерапевтическое лечение
- Рекомендуется пациентам с атопическим дерматитом средней и тяжелой степени тяжести ультрафиолетовое облучение кожи (фототерапия) [144–158]:
Уровень убедительности рекомендаций B(уровень достоверности доказательств – 2)
Комментарии: Перед назначением фототерапии пациентам с атопическим дерматитом для выявления противопоказаний рекомендуется комплекс лабораторных исследований, включающий общий (клинический) анализ крови, общий анализ мочи, анализ крови биохимический общетерапевтический, консультация врача- терапевта или врача-педиатра, врача-эндокринолога, врача-акушера-гинеколога (для женщин). По показаниям рекомендуют обследование у других специалистов [159– 164].
- Рекомендуются пациентам с атопическим дерматитом средней и тяжелой степени тяжести:
узкополосная средневолновая ультрафиолетовая терапия УФВ-311 терапия, с длиной волны 311 нм взрослым пациентам с атопическим дерматитом [144–146].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
или
узкополосная средневолновая ультрафиолетовая терапия УФВ-311 терапия, с длиной волны 311 нм детям с атопическим дерматитом [147, 148].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Данные о применении фототерапии в детском возрасте ограничены, ввиду чего необходимо соблюдать осторожность при использовании. Узкополосная средневолновая ультрафиолетовая терапия назначается детям 5 лет и старше. При назначении узкополосной средневолновой ультрафиолетовой терапии необходимо учитывать психоэмоциональные особенности ребенка, общее состояние, способность самостоятельного нахождения в кабине и выполнения требований медицинского персонала.
или
ультрафиолетовая терапия дальнего длинноволнового диапазона (УФА-1 терапия, длина волны 340–400 нм) взрослым [149–153].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Ультрафиолетовая терапия дальнего длинноволнового диапазона противопоказана детям до 18 лет.
или
селективная фототерапия (широкополосная средневолновая ультрафиолетовая терапия (УФВ терапия, с длиной волны 280–320 нм) взрослым пациентам с атопическим дерматитом [154].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Данные о применении фототерапии в детском возрасте ограничены.
- Рекомендуется при отсутствии эффекта от лечения другими методами фототерапии, а также наличии очагов поражения с выраженной инфильтрацией кожи взрослым: Фотохимиотерапия с внутренним применением фотосенсибилизаторов (ПУВА) [155–158].
Комментарии: Для выявления противопоказаний к ПУВА-терапии следует провести комплекс лабораторных исследований, включающий общий (клинический) анализ крови, общий (клинический) анализ мочи, анализ крови биохимический общетерапевтический, консультация врача-терапевта, врача-эндокринолога, врача-офтальмолога, врача-акушера-гинеколога (для женщин).
Многокурсовое применение метода ПУВА-терапии может повышать риск злокачественных новообразований кожи. ПУВА-терапия противопоказана лицам до 18 лет.
Системная терапия
- Рекомендуется пациентам детского возраста в возрасте от 6 лет и старше при атопическом дерматите средней и тяжелой степени тяжести и при отсутствии противопоказаний:
дупилумаб** 200 или 300 мг раствор для подкожного введения. Для пациентов с массой тела от 15 до < 30 кг: начальная доза – 600 мг (2 инъекции по 300 мг), далее по 300 мг каждые 4 недели; для пациентов с массой тела от 30 до < 60 кг: начальная доза – 400 мг (2 инъекции по 200 мг), далее по 200 мг каждые 2 недели; для пациентов с массой тела 60 кг и более начальная доза – 600 мг (2 инъекции по 300 мг), далее по 300 мг каждые 2 недели [165–168]:
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Противопоказанием к назначению дупилумаба** больным атопическим дерматитом является детский возраст до 6 лет.
- Рекомендуется взрослым пациентам при атопическом дерматите средней и тяжелой степени тяжести и при отсутствии противопоказаний:
дупилумаб** 300 мг раствор для подкожного введения в начальной дозе – 600 мг (2 инъекции по 300 мг в разные места для инъекций), далее – по 300 мг каждые 2 недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг еженедельно [169–175]:
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Дупилумаб** может применяться в монотерапии или одновременно с топическими лекарственными препаратами. Инъекцию препарата может делать себе либо сам пациент, либо лицо, ухаживающее за ним. Необходимо до начала применения дупилумаба** обучить пациентов и/или ухаживающих за ними лиц подготовке и проведению инъекции препарата, согласно указаниям в инструкции по медицинскому применению. Дупилумаб** также может применяться у пациентов с сочетанием средне-тяжелого и тяжелого атопического дерматита с тяжелой бронхиальной астмой.
Эффективность дупилумаба** в лечении пациентов с атопическим дерматитом подтверждена результатами клинических исследований SOLO 1, SOLO 2, CHRONOS иCAFÉ [169–171]. Тяжесть атопического дерматита, оценивавшаяся по индексу EASI (Eczema Area and Severity Index), на фоне терапии дупилумабом** в режиме 1 инъекция каждые 2 недели на 16-ой неделе уменьшилась на 75% и более (EASI75) у 44–51% пациентов, не получавших наружную терапию. В случае, если терапия дупилумабом** в режиме 1 инъекция каждые 2 недели сопровождалась наружной терапией глюкокортикоидами, применяемыми в дерматологии, то эффективность лечения была еще на 10–20% выше, чем монотерапиядупилумабом**, и на 16-ой неделе лечения тяжесть атопического дерматита по EASI уменьшилась на 75% и более (EASI75) у 69% пациентов с атопическим дерматитом, получавших лечение дупилумабом** и глюкокортикоидами, применяемыми в дерматологии. Уменьшение зуда у пациентов отмечалось уже на 2-ой неделе терапии, и на 16-ой неделе терапии отмечено уменьшение зуда в среднем на 53,9%. К 52-ой неделе терапии эффект сохранялся, и уменьшение тяжести атопического дерматита на 75% и более по сравнению с исходным уровнем (EASI75) отмечено у 65% пациентов с атопическим дерматитом, получавших дупилумаб** 1 инъекцию каждые 2 недели и наружную терапию глюкокортикоидами, применяемыми в дерматологии [169–171].
- Рекомендуется при тяжелом течении атопического дерматита у взрослых и при отсутствии противопоказаний: циклоспорин** в начальной дозе 2,5–3 мг на кг массы тела в сутки в 2 приема с 12- часовым интервалом. При необходимости доза препарата может быть увеличена до максимальной – 5 мг на кг массы тела в сутки – в зависимости от индивидуального состояния пациента. При достижении положительного результата дозу необходимо постепенно снижать до полной отмены [176–181].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: В число противопоказаний для назначения циклоспорина** входит детский возраст до 18 лет для всех показаний, не связанных с трансплантацией за исключением нефротического синдрома.
Степень тяжести атопического дерматита уменьшается на 50% через 6–8 недель непрерывного лечения циклоспорином**. У пациентов, которые получают более высокую начальную дозу препарата (4–5 мг/кг/сут), наступает более быстрое улучшение – через 2 недели (снижение тяжести на 40%), чем у пациентов, получавших более низкую начальную дозу (2,5–3 мг/кг/сут; снижение тяжести на 22%). Однако через 6–8 недель терапии циклоспорином** не было разницы в ответе между пациентами, получавшими препарат в более высоких и в более низких дозах, однако те пациенты, кто получал более высокую дозу препарата, сообщали о большем количестве побочных эффектов, связанных с циклоспорином**[181, 182].Длительность непрерывной терапии циклоспорином** предлагается ограничить 2 годами [183].
- Пациентам с тяжелым течением атопического дерматита рекомендуются кортикостероиды системного действия перорально по схеме – в течение первых 2–3 дней [6, 184]:
метилпреднизолон** 16–20 мг 1 раз в сутки после завтрака или
преднизолон** 20–25 мг после завтрака и 5 мг после обеда.
далее 1 раз в сутки после завтрака в течение последующих 2–3 дней: метилпреднизолон** 12 мг
или
преднизолон** 15 мг.
далее 1 раз в сутки после завтрака в течение последующих 2–3 дней: метилпреднизолон** 8 мг
или
преднизолон** 10 мг 1 раз в сутки,
далее 1 раз в сутки после завтрака с последующей отменой препарата: метилпреднизолон** 4 мг
или
преднизолон** 5 мг [91].
Уровень убедительности рекомендаций C(уровень достоверности доказательств –5)
Комментарии: При необходимости прием кортикостероидов системного действия можно продолжить еще в течение 2–3 дней 1 раз в день после завтрака: метилпреднизолон** 2 мг или преднизолон** 2,5 мг
Лечение осложненного атопического дерматита
- Рекомендуются для лечения атопического дерматита, осложненного вторичной инфекцией антибиотики и противомикробные средства, применяемые в дерматологии:
фузидовая кислота, 2% крем для наружного применения или 2% мазь для наружного применения наносить на инфицированные очаги поражения 3 раза в сутки в течение 7–14 дней [185–188].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
или
бацитрацин + неомицин 250 МЕ/г + 5000 МЕ/мг наружно наносить на инфицированные очаги поражения 2–3 раза в сутки в течение 7–14 дней [189, 190].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5)
или
мупироцин 2% мазь для наружного применения наносить на инфицированные очаги поражения 2–3 раза в сутки не более10 дней [191, 192].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
или
эритромицин мазь для наружного применения (10000 ЕД/г) наружно наносить на инфицированные очаги поражения 2–3 раза в сутки 7–14 дней [193].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
или
сульфатиазол серебра крем для наружного применения 2% наносить на инфицированные очаги поражения 2–3 раза в сутки 7–14 дней [193, 194]
Уровень убедительности рекомендаций C(уровень достоверности доказательств –5)
Комментарии: Антибактериальные препараты используются для наружного применения при локализованных формах вторичной инфекции [195, 196]
- Рекомендуются при наличии признаков вторичного инфицирования использовать короткими курсами (обычно в течение 1 недели) глюкокортикоиды в комбинации с антибиотиками или глюкокортикоиды в комбинации с другими препаратами:
гидрокортизон + окситетрациклин мазь, аэрозоль наружно на инфицированные очаги поражения 1–3 раза в сутки в течение 7 дней [91].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
или
тетрациклин + триамцинолон аэрозоль для наружного применения – орошать струей аэрозоля инфицированные очаги поражения 1–3 раза в сутки, держа баллон в вертикальном положении, на расстоянии 15–20 см от кожи, в течение 7–10 дней [197, 198].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
или
гидрокортизон + фузидовая кислота крем для наружного применения наружно на инфицированные очаги поражения 3 раза в сутки взрослым и детям в возрасте 2 лет и старше в течение 14 дней [199].
Уровень убедительности рекомендаций B (уровень достоверности доказательств –2)
или
бетаметазон + фузидовая кислота крем для наружного применения взрослым пациентам с атопическим дерматитом наружно на инфицированные очаги поражения 2 раза в сутки в течение 7 дней [200].
Уровень убедительности рекомендаций B (уровень достоверности доказательств –2)
или
бетаметазон+ гентамицин + клотримазол крем для наружного применения, мазь для наружного применения наружно на инфицированные очаги поражения 2 раза в сутки взрослым и детям в возрасте 2 лет и старше в течение 7–14 дней [91, 201–204].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –4)
Комментарии: Для наружного лечения детей предпочтительными являются лекарственные формы в виде крема и монокомпонентные наружные средства: глюкокортикоиды, применяемые в дерматологии, препараты для лечения дерматита, кроме глюкокортикоидов (такролимус** и пимекролимус**). Многокомпонентные наружные лекарственные препараты – глюкокортикоиды в комбинации с антибиотиками или глюкокортикоиды в комбинации с другими препаратами показаны только при клиническом и/или лабораторном подтверждении бактериальной и/или грибковой инфекции. Необоснованное применение многокомпонентных наружных препаратов может способствовать развитию у детей дополнительной сенсибилизации к компонентам топического лекарственного средства.
- Рекомендуется пациентам с дефектами кожи (трещины, экскориации) с целью устранения вторичного инфицирования на местах экскориаций и трещин, особенно у детей, антисептики и дезинфицирующие средстваили другие лечебные средства (метилтиониния хлорид) 1–2 раза в сутки в течение 5–10 дней [123, 193].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5)
борная кислота+резорцин+фенол+фуксин раствор для наружного применения наносят с помощью тампона или стеклянной палочки на пораженные участки кожи 2–4 раза в сутки. После высыхания жидкости на обработанный участок можно наносить мази и пасты [123, 193]
Комментарии: Не рекомендуется применять препарат борная кислота+резорцин+фенол+фуксин женщинам во время беременности и в период грудного вскармливания
или
метилтиониния хлорид 1% раствор для местного и наружного применения, [водный] взрослым и детям с момента рождения раствор наносят с помощью тампона или стеклянной палочки на пораженные участки 2–3 раза в сутки [123, 193]
Комментарии: Возможно применение водного раствора метилтиониния хлоридаво время беременности и грудного вскармливания.
- Рекомендуется пациентам с дефектами кожи (трещины, экскориации) с целью устранения вторичного инфицирования на местах экскориаций и трещин, особенно у детей, антисептики и дезинфицирующие средстваили другие лечебные средства (метилтиониния хлорид) 1–2 раза в сутки в течение 5–10 дней [123, 193].
Уровень убедительности рекомендаций C(уровень достоверности доказательств –5)
борная кислота+резорцин+фенол+фуксин раствор для наружного применения наносят с помощью тампона или стеклянной палочки на пораженные участки кожи 2–4 раза в сутки. После высыхания жидкости на обработанный участок можно наносить мази и пасты [123, 193]
Комментарии: После высыхания жидкости на обработанный участок можно наносить мази и пасты. Не следует применять препарат борная кислота+резорцин+фенол+фуксин женщинам во время беременности и в период грудного вскармливания
или
метилтиониния хлорид 1% раствор для местного и наружного применения, [водный] взрослым и детям с момента рождения раствор наносят с помощью тампона или стеклянной палочки на пораженные участки 2–3 раза в сутки [121, 190]
Комментарии: Возможно применение водного раствора метилтиониния хлорида во время беременности и грудного вскармливания
- Рекомендуются антибактериальные препаратысистемного действия для лечения рецидивирующей или распространенной бактериальной инфекции:
амоксициллин +клавулановая кислота** взрослым и детям старше 12 лет (массой 40 кг и более) таблетки, покрытые пленочной оболочкой, 250 мг + 125 мг по 1 таблетке 3 раза в сутки или 875 мг + 125 мг – по 1 таблетке 2 раза в сутки в течение 5–14 дней или таблетки диспергируемые взрослым и детям старше 12 лет (массой 40 кг и более) – по 500/125 мг 3 раза в сутки в течение 5–14 дней, детям от 2 до 12 лет или с массой тела менее 40 кг – по 125/31,25 мг или по 250/62,5 мг в дозах, не превышающих 2400/600 мг в сутки, в 3 приемав течение 5–14 дней [205].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Противопоказанием для назначения таблеток, покрытых пленочной оболочкой,амоксициллин + клавулановая кислота** является детский возраст до 12 лет. Противопоказанием для назначения диспергируемых таблеток амоксициллин + клавулановая кислота** является детский возраст до 1 года.
или
цефуроксим**– по 250 мг перорально 2 раза в сутки взрослым и детям в возрасте 3 лет и старше в течение 5–10 дней [206–208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 2)
Комментарии: Противопоказанием для назначения таблеток, покрытых пленочной оболочкой, цефуроксим** является детский возраст до 3 лет.
или
цефтриаксон** – по 1–2 г в сутки внутримышечно или внутривенно детям старше 12 лет (желательно в 2 введения через 12 часов), новорожденным до 2 нед – 20–50 мг/кг/сут, детям от 3 нед до 12 лет – 20–80 мг/кг/сут в 2 введения [207].
Уровень убедительности рекомендаций C(уровень достоверности доказательств –4)
Комментарии: Цефтриаксон** противопоказан недоношенным детям в возрасте до 41 недели включительно. Цефтриаксон** следует назначать с осторожностью в период грудного вскармливания.
Комментарии: Атопический дерматит часто осложняется развитием бактериальных инфекционных поражений кожи, требующих проведения антибактериальной терапии [209, 210]. До назначения антибактериальных препаратов системного действия следует провестимикробиологическое (культуральное) исследование гнойного отделяемого на аэробные и факультативно- анаэробные микроорганизмы и с целью идентификации возбудителя и микробиологическое (культуральное) исследование отделяемого высыпных элементов кожи на чувствительность к антибактериальным и противогрибковым препаратам. До получения результатов микробиологического исследования в большинстве случаев начинают лечение антибактериальными препаратами широкого спектра действия, активными в отношении наиболее часто встречающихся возбудителей, в первую очередь, S. aureus. С высокой эффективностью применяются комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз, цефалоспорины первого или второго поколения, макролиды, у взрослых лиц – фторхинолоны.
Продолжительность терапии антибактериальными препаратами системного действия обычно составляет 7–10 дней.
- Рекомендуются в случае развития у пациентов с атопическим дерматитом герпетической экземы Капоши противовирусные препараты прямого действия [211, 212]:
Ацикловир** таблетки 200 мг взрослым и детям от 3 лет внутрь 5 раз в сутки. Курс лечения составляет 5 дней, но может быть продлен при тяжелых инфекциях.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: В случае диссеминированного процесса, сопровождающегося повышением температуры тела, явлениями тяжелой интоксикации, необходима госпитализация в стационар с наличием боксированного отделения. В условиях стационара следует проводитьвнутривенное введение ацикловира. Наружная терапия заключается в использовании антисептиков и дезинфицирующих средств (борная кислота+резорцин+фенол+фуксин, метилтиониния хлорид 1% раствор для местного и наружного применения, [водный] и др.).
В случае поражения глаз следует применять мазь глазную 3% ацикловир**, которая закладывается в нижний конъюнктивальный мешок 5 раз в сутки. Лечение продолжают на протяжении не менее 3 дней после купирования симптомов.
Противопоказанием к назначению ацикловира** в таблетках является детский возраст до 3 лет.
3.2 Иное лечение
- Пациентам с наличием сенсибилизации к аллергенам клещей домашней пыли и пыльцевым аллергенам, контакт с которыми вызывает обострение атопического дерматита и/или респираторные проявления – аллергический ринит, бронхиальная астма, рекомендуется аллерген-специфическая иммунотерапия аллергенами клещей домашней пыли [6, 213–223]:
аллергены бытовые раствор для накожного скарификационного нанесения, прик- теста и подкожного введения [215–220]
или
аллергены бытовые суспензия для подкожного введения [216], или
аллергены бытовые капли подъязычные [221–223].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии: Показания выбор метода и противопоказания к аллерген- специфической иммунотерапии определяет врач-аллерголог-иммунолог. Аллерген- специфическую иммунотерапию назначают только после купирования обострения атопического дерматита с помощью адекватной наружной терапии, а также санации очагов хронической инфекции и лечения сопутствующих заболеваний. Проводится врачом-аллергологом-иммунологом в условиях аллергологического кабинета или стационара. Продолжительность и схемааллерген-специфической иммунотерапии определяется индивидуально.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Отсутствует.
Медицинская реабилитация
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов реабилитации, в том числе основанных на использовании природных лечебных факторов
Госпитализация
6. Организация оказания медицинской помощи
— В рамках оказания первичной врачебной медико-санитарной помощи врачи- терапевты участковые, врачи-педиатры участковые, врачи общей практики (семейные врачи) при выявлении у больных высыпаний на коже, кожного зуда, симптомов или признаков атопического дерматита направляют больного в медицинскую организациюдерматовенерологического профиля или кабинет врача аллерголога-иммунолога для оказания ему первичной специализированной медико- санитарной помощи, а также осуществляют оказание медицинской помощи в соответствии с рекомендациями медицинской организации дерматовенерологического профиля и/или врача аллерголога-иммунолога при отсутствии медицинских показаний для направления в нее.
— При невозможности оказания медицинской помощи в рамках первичной специализированной медико-санитарной помощи и наличии медицинских показаний больной направляется в медицинскую организацию, оказывающую специализированную медицинскую помощь.
— Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-дерматовенерологами и/или врачами-аллергологами- иммунологами в стационарных условиях.
Показания для плановой госпитализации в медицинскую организацию:
1. Показания для оказания медицинской помощи в дневном стационаре:
- недостаточная эффективность лечения, проводимого в амбулаторных условиях, у пациентов с ограниченными высыпаниями;
2. Показания для оказания медицинской помощи в стационарных условиях:
- отсутствие эффекта от проводимого лечения в амбулаторных условиях;
- тяжелое течение атопического дерматита, требующее системной терапии или фототерапии;
- присоединение вторичной инфекции, не купируемое в амбулаторных условиях;
- развитие вирусной инфекции (герпетической экземы Капоши).
Показания к выписке пациента из медицинской организации:
- частичный или полный регресс высыпаний.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Первичная профилактика атопического дерматита направлена на предупреждение возникновения и воздействия факторов риска развития заболевания и включает в себя комплекс гипоаллергенных мероприятий:
- Рекомендуетсяв качестве мероприятий первичной профилактики атопического дерматита беременным женщинам с пищевой аллергиейэлиминация аллергенного продукта из диеты [224, 254, 255].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
- Рекомендуется в качестве мероприятий первичной профилактики атопического дерматита всем детям на протяжении первых 4–6 месяцев жизни грудное вскармливание [225, 226].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
- Рекомендуетсяв качестве мероприятий первичной профилактики атопического дерматита введение прикормов с 4-го месяца жизни ребенка вне зависимости от наследственной отягощенности [226].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуютсяв качестве мероприятий первичной профилактики атопического дерматитапри необходимости для прикорма детям из группы высокого риска профилактические или лечебные (высокогидролизные) смеси [227, 257].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- Рекомендуются для прикорма здоровым детям без наследственной отягощенности по аллергическим заболеваниям адаптированные смеси на основе коровьего молока [227].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуются беременным и новорожденным из групп риска пробиотики, содержащие лактобактерии [227–230].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1)
- Не рекомендуются ограничительные гипоаллергенные диеты в общей популяции [231].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Убедительных данных об эффективности гипоаллергенных или элиминационных диет в процессе беременности в отношении развития атопического дерматита в общей популяции в настоящее время не получено [225].
- Не рекомендуются элиминационные диеты здоровым женщинам во время лактации [224, 254].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
- Рекомендуется беременным, детям и взрослым в качестве мероприятий первичной профилактики атопического дерматита с целью контроляза факторами внешней среды исключение воздействия табачного дыма [232].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Курение недопустимо во время беременности и лактации; пассивное курение исключают с первых дней жизни ребенка.
- Рекомендуется в качестве мероприятий первичной профилактики атопического дерматита у детей с целью контроляза факторами внешней среды поддержание низкой влажности и адекватной вентиляции в помещениях, где находится ребенок (исключение сырости) [233].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
- Рекомендуется беременным, детям и взрослым в качестве мероприятий первичной профилактики атопического дерматита с целью контроляза факторами внешней среды уменьшение воздействия загрязняющих веществ окружающей среды (поллютантов) [234, 235].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
- Рекомендуется элиминация или удаление причинно-значимых аллергенов. При установленной сенсибилизации к бытовым, эпидермальным, грибковым аллергенам рекомендованы элиминационные мероприятия с целью уменьшения выраженности симптомов атопического дерматита, снижения фармакологической нагрузки и профилактики обострений. При развитии симптомов пищевой аллергии, включая анафилаксию, что нередко наблюдается у детей и взрослых с сенсибилизацией к белкам пищевых аллергенов, установленной с помощью определения аллерген-специфических IgE антител в сыворотке крови, рекомендованы элиминационные диеты с исключением причинно-значимых аллергенов [255, 256]
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Вторичная профилактика атопического дерматита– комплекс мероприятий, направленных на устранение выраженных факторов риска, которые при определенных условиях (стресс, ослабление иммунитета, чрезмерные нагрузки на любые другие функциональные системы организма) могут привести к возникновению, обострению и рецидиву заболевания.
- Рекомендуется в качестве мероприятий вторичной профилактики атопического дерматита обучение пациентов с атопическим дерматитом и/или членов их семьи [236–240].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
- Рекомендуются в качестве мероприятий вторичной профилактики атопического дерматита профилактическое консультирование по коррекции факторов риска развития неинфекционных заболеваний [236–240].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Любые профилактические элиминационные мероприятия, назначаемые на длительное время, могут оказывать негативное влияние на членов семьи, ухудшая качество их жизни.
Третичная профилактика
– это комплекс мероприятий, направленных на предотвращение обострений или развития осложнений атопического дерматита.
- Рекомендуется в качестве мероприятий третичной профилактики атопического дерматитауменьшение влияния провоцирующих факторов: ограничение использования мыла, одежды из грубых тканей; минимализация факторов влияющих на потливость [241, 242].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
- Рекомендуется в качестве мероприятий третичной профилактики атопического дерматита рациональный уход за кожей [243, 244].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
- Рекомендуется при проведении плановой вакцинации детей с атопическим дерматитом придерживаться национального календаря профилактических прививок [245–247].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Вакцинация не влияет на течение каких-либо аллергических заболеваний, в том числе атопического дерматита. Вакцинация не проводится в период обострения заболевания. При персистирующем течении атопического дерматита следует провести курс терапии глюкокортикоидами, применяемыми в дерматологии в течение 2 недель до вакцинации. Пациенты, получающие лечениеиммунодепрессантами, должны быть консультированы врачом перед вакцинацией живыми вакцинами, так как противопоказанием к терапии иммунодепрессантами может быть вакцинация живыми вакцинами. При аллергии на белок куриного яйца перед вакцинацией необходима консультация врача- аллерголога-иммунолога.
Информация
Источники и литература
-
Клинические рекомендации Российского общества дерматовенерологов и косметологов
- 1. Palmer C.N., IrvineA.D., Terron-KwiatkowskiA. etal. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis. Nat. Genet. 2006; 38: 441–446.
2. McGirtL.Y., BeckL.A. Innate immune defects in atopic dermatitis. J Allergy Clin Immunol. 2006;118:202–208
3. Bao L., Zhang H., Chan L.S. The involvement of the JAK-STAT signaling pathway in chronic inflammatory skin disease atopic dermatitis. JAKSTAT. 2013; 2(3) e24137
4. Gandhi N.A., Pirozzi G., Graham N.M. Commonality of the IL-4/IL-13 pathway in atopic diseases. Expert Rev Clin Immunol. 2017;13(5):425–437.
5. Werfel T., Allam J.P., Biedermann T. et al. Cellular and molecular immunologic mechanisms in patients with atopic dermatitis. J Allergy Clin Immunol 2016; 138: 336–349.
6. Wollenberg A., Barbarot S., Bieber T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I.J Eur Acad Dermatol Venereol. 2018;32(5): 657–682.
7. Кубанов А.А., Богданова Е.В.Организация и результаты оказания медицинской помощи по профилю дерматовенерология в Российской Федерации. Итоги 2018 года. Вестникдерматологииивенерологии. 2019; 95 (4): 8–23.
8. Schneider L., Hanifin J., Boguniewicz M. et al. Study of the atopic march: development of atopic comorbidities. Pediatr Dermatol. 2016;33(4):388–398.
9. Bieber T.Atopic dermatitis 2.0: from the clinical phenotype to the molecular taxonomy and stratified medicine. Allergy. 2012; 67 (12); 1475–1482.
10. van der Hulst A.E., Klip H., Brand P.L. Risk of developing asthma in young children with atopic eczema: a systematic review. J Allergy Clin Immunol 2007; 120: 565–569.
11. Eckert L., Gupta S., Amand C. et al. The burden of atopic dermatitis in US adults: Health care resource utilization data from the 2013 National Health and Wellness Survey. J AmAcadDermatol 2018; 78: 54–61.
12. Illi S., von Mutius E., Lau S. et al. The pattern of atopic sensitization is associated with the development of asthma in childhood. J Allergy Clin Immunol. 2001;108: 709–714.
13. Aw M., Penn J., Gauvreau G.M. et al. Atopic March: Collegium InternationaleAllergologicum Update 2020.Int Arch Allergy Immunol. 2020;181(1):1–10.
14. Spergel J.M. Epidemiology of atopic dermatitis and atopic march in children. Immunol Allergy Clin N Am. 2010; 30: 269–280.15. Hill D.A., Spergel J.M. The atopic march: Critical evidence and clinical relevance. Ann Allergy Asthma Immunol. 2018;120(2):131–137.
16. Williams H., Flohr C. How epidemiology has challenged 3 prevailing concepts about atopic dermatitis. J Allergy Clin Immunol. 2006; 118:209–213.
17. Illi S., von Mutius E., Lau S. et al. The natural course of atopic dermatitis from birth to age 7 years and the association with asthma. JAllergyClinImmunol. 2004; 113:925–931.
18. Атопический дерматит: рекомендации для практических врачей. Российский согласительный национальный документ по атопическому дерматиту. Под ред. P.M. Хаитова, А.А. Кубановой. М.: Фармакус Принт, 2002. 192 с.
19. Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta DermVenereol. 1980;92(Suppl):44–47.
20. Eichenfield L.F., Tom W.L., Chamlin S.L. et al. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol. 2014;70(2):338–351.
21. Ryan C., Amor K.T., Menter A. The use of cyclosporine in dermatology: part II.J Am Acad Dermatol. 2010;63(6):949–972.
22. Arbes S.J. Jr. Gergen P.J., Elliott L., Zeldin D.C. Prevalences of positive skin test responses to 10 common allergens in the US population: results from the third National Health and Nutrition Examination Survey. J Allergy Clin Immunol. 2005; 116:377–383.
23. Клиническая дерматовенерология: в 2 т. / под ред. Ю.К. Скрипкина, Ю.С. Бутова. – М.: ГЭОТАР-Медиа, 2009. – т.II. – 928 с.
24. Futamura M., Leshem Y.A., Thomas K.S. et al. A systematic review of Investigator Global Assessment (IGA) in atopic dermatitis (AD) trials: Many options, no standards. J Am Acad Dermatol. 2016;74(2):288–294.
25. Oranje A.P., Stalder J.F., Taieb A.et al. Scoring of atopic dermatitis by SCORAD using a training atlas by investigators from different disciplines. ETAC Study Group. Early Treatment of the Atopic Child. Pediatr Allergy Immunol. 1997; 8:28–34.
26. Schram M.E., Spuls P.I., Leeflang M.M. et al. EASI, (objective) SCORAD and POEM for atopic eczema: responsiveness and minimal clinically important difference. Allergy. 2012; 67:99–106.
27. Giam Y.C., Hebert A.A., Dizon M.V. A review on the role of moisturizers for atopic dermatitis. Asia Pac Allergy. 2016;6 (2):120–128.28. Breternitz M., Kowatzki D., Langenauer M. et al. Placebo-controlled, double-blind, randomized, prospective study of a glycerol-based emollient on eczematous skin in atopic dermatitis: biophysical and clinical evaluation. Skin Pharmacol Physiol. 2008; 21: 39–45.
29. Verallo-Rowell V.M., Dillague K.M., Syah-Tjundawan B.S. Novel antibacterial and emollient effects of coconut and virgin olive oils in adult atopic dermatitis. Dermatitis. 2008;19 (6): 308–315.
30. Simpson E., Dutronc Y. A new body moisturizer increases skin hydration and improves atopic dermatitis symptoms among children and adults. J Drugs Dermatol. 2011;10: 744– 749.
31. Lindh J.D., Bradley M. Clinical effectiveness of moisturizers in atopic dermatitis and related disorders: a systematic review. Am J Clin Dermatol. 2015; 16: 341–359.
32. Miller D.W., Koch S.B., Yentzer B.A. et al. An over-the-counter moisturizer is as clinically effective as, and more cost-effective than, prescription barrier creams in the treatment of children with mild-to-moderate atopic dermatitis: a randomized, controlled trial. J DrugsDermatol. 2011; 10: 531–537.
33. Grimalt R., Mengeaud V., Cambazard F. The steroid-sparing effect of an emollient therapy in infants with atopic dermatitis: a randomized controlled study. Dermatology. 2007; 214 (1): 61–67.
34. Msika P., De Belilovsky C., Piccardi N. et al. New emollient with topical corticosteroid- sparing effect in treatment of childhood atopic dermatitis: SCORAD and quality of life improvement. Pediatr Dermatol. 2008; 25 (6): 606–612.
35. Lucky A.W., Leach A.D., Laskarzewski P., Wenck H. Use of an emollient as a steroid- sparing agent in the treatment of mild to moderate atopic dermatitis in children. Pediatr Dermatol. 1997; 14 (4): 321–324.
36. Eberlein B., Eicke C., Reinhardt H.W., Ring J. Adjuvant treatment of atopic eczema: assessment of an emollient containing N-palmitoylethanolamine (ATOPA study). J Eur Acad Dermatol Venereol. 2008; 22 (1): 73–82.
37. Sugarman J.L., Parish L.C. Efficacy of a lipid-based barrier repair formulation in moderate- to-severe pediatric atopic dermatitis. J Drugs Dermatol. 2009; 8 (12): 1106–1111.
38. Leung T.N., Chow C.M., Chow M.P. et al. Clinical guidelines on management of atopic dermatitis in children. Hong Kong J Paediatr (new series). 2013; 18: 96–104.
39. Darsow U., Wollenberg A., Simon D. et al. ETFAD/EADV Eczema Task Force 2009 position paper on diagnosis and treatment of atopic dermatitis. J Eur Acad Dermatol Venereol. 2010; 24 (3): 317–328.40. Chiang C., Eichenfield L.F. Quantitative assessment of combination bathing and moisturizing regimens on skin hydration in atopic dermatitis. PediatrDermatol. 2009; 26 (3): 273–278.
41. Guidance on Prescribing. In: British National Formulary No.60. London: British Medical Association and Royal Pharmaceutical Society of Great Britain; 2010.
42. Dabade T.S., Davis D.M., Wetter D.A. et al. Wet dressing therapy in conjunction with topical corticosteroids is effective for rapid control of severe pediatric atopic dermatitis: experience with 218 patients over 30 years at Mayo Clinic. J Am Acad Dermatol. 2012; 67 (1):100–106.
43. Devillers A.C., Oranje A.P. Efficacy and safety of ‘wet-wrap’ dressings as an intervention treatment in children with severe and/or refractory atopic dermatitis: a critical review of the literature. Br J Dermatol. 2006; 154 (4):579–585.
44. Devillers A.C., de Waard-van der Spek F.B., Mulder P.G., Oranje A.P. Treatment of refractory atopic dermatitis using ‘wet-wrap’ dressings and diluted corticosteroids: results of standardized treatment in both children and adults. Dermatology. 2002; 204:50–55.
45. Goodyear H.M., Spowart K., Harper J.I. ‘Wet-wrap’ dressings for the treatment of atopic eczema in children. Br J Dermatol. 1991; 125 (6):604.
46. Brenninkmeijer E.E., Spuls P.I., Lindeboom R. et al. Excimer laser vs. clobetasol propionate 0•05% ointment in prurigo form of atopic dermatitis: a randomized controlled trial, a pilot. Br J Dermatol. 2010; 163 (4): 823–831.
47. Pels R., Sterry W., Lademann J. Clobetasol propionate – where, when, why? Drugs Today (Barc). 2008; 44 (7): 547–557.
48. Breneman D., Fleischer A.B. Jr, Kaplan D. et al. Clobetasol propionate 0.05% lotion in the treatment of moderate to severe atopic dermatitis: a randomized evaluation versus clobetasol propionate emollient cream. J Drugs Dermatol. 2005; 4 (3): 330–336.
49. Feldman S.R. Relative efficacy and interchangeability of various clobetasol propionate vehicles in the management of steroid-responsive dermatoses. CurrTher Res ClinExp. 2005; 66 (3): 154–171.
50. Datz B., Yawalkar S. A double-blind, multicenter trial of 0.05% halobetasol propionate ointment and 0.05% clobetasol 17-propionate ointment in the treatment of patients with chronic, localized atopic dermatitis or lichen simplex chronicus. J AmAcadDermatol. 1991; 25 (6 Pt 2): 1157–1160.51. Viglioglia P., Jones M.L., Peets E.A. Once-daily 0.1% mometasone furoate cream versus twice-daily 0.1% betamethasone valerate cream in the treatment of a variety of dermatoses. J Int Med Res. 1990; 18 (6): 460–467.
52. Vanderploeg D.E. Betamethasone dipropionate ointment in the treatment of psoriasis and atopic dermatitis: a double-blind study. South Med J. 1976; 69 (7): 862–863.
53. Queille C., Pommarede R., Saurat J.H. Efficacy versus systemic effects of six topical steroids in the treatment of atopic dermatitis of childhood. Pediatr Dermatol. 1984; 1 (3): 246–253.
54. Cabrera M.E. Treatment of severe or resistant corticosteroid-responsive dermatoses with Diprolene cream. J Int Med Res. 1984; 12 (3) :163–169.
55. Lodolo J.C.Diprolene cream in the treatment of severe or resistant corticosteroid-responsive dermatoses. J Int Med Res. 1984; 12 (2): 114–120.
56. Peterkin G.A., Morley W.N., Chalmers D. Triamcinolone and fluocinolone acetonide ointments in atopic eczema. BrMed J. 1962; 1 (5289): 1392.
57. Hanifin J.M. Atopic dermatitis. Special clinical complications. Postgrad Med. 1983;74(3):188–193, 196–199.
58. Cadmus S.D., Sebastian K.R., Warren D. et al. Efficacy and patient opinion of wet‐ wrap dressings using 0.1% triamcinolone acetonide ointment vs cream in the treatment of pediatric atopic dermatitis: A randomized split‐ body control study. PediatrDermatol. 2019; 36 (4): 437–441.
59. Wolkerstorfer A., Strobos M.A., Glazenburg E.J. et al. Fluticasone propionate 0.05% cream once daily versus clobetasone butyrate 0.05% cream twice daily in children with atopic dermatitis. J Am Acad Dermatol. 1998; 39 (2 Pt 1): 226–231.
60. Bleehen S.S., Chu A.C., Hamann I. et al. Fluticasone propionate 0.05% cream in the treatment of atopic eczema: a multicentre study comparing once-daily treatment and once- daily vehicle cream application versus twice-daily treatment. Br J Dermatol. 1995; 133 (4): 592–597.
61. Белоусова Т.А., Горячкина М.В. Опыт применения флутиказона пропионата (Кутивейт) в терапии псориаза, экземы и атопического дерматита. Эффективная фармакотерапия. 2010; 9: 24–29.
62. Prakash A., Benfield P.Topical mometasone. A review of its pharmacological properties and therapeutic use in the treatment of dermatological disorders.Drugs. 1998;55(1):145–163.
63. Vernon H.J., Lane A.T., Weston W. Comparison of mometasone furoate 0.1% cream and hydrocortisone 1.0% cream in the treatment of childhood atopic dermatitis. J Am Acad Dermatol. 1991; 24 (4): 603–607.64. Lebwohl M. A comparison of once-daily application of mometasone furoate 0.1% cream compared with twice-daily hydrocortisone valerate 0.2% cream in pediatric atopic dermatitis patients who failed to respond to hydrocortisone: mometasone furoate study group. Int J Dermatol. 1999; 38 (8): 604–606.
65. Томилова А.Ю., Торшхоева Р.М., Геворкян А.К., Вознесенская Н.И. Эффективность и безопасность применения мометазонафуроата при атопическом дерматите у детей. Педиатрическая фармакология 2009; 6 (4): 123–127.
66. Шаипов Т.С., Мазитова Л.П. Применение мометазонафуроата при лечении атопического дерматита у детей. Педиатрическая фармакология. 2007; 4 (5): 41–44.
67. Ненашева Н.М. Особенности атопического дерматита у взрослых пациентов Эффективная фармакотерапия. Дерматовенерология и дерматокосметология. 2012; (3): 6–15.
68. Lane A.T. Efficacy and safety of topical steroids in paediatric atopic dermatitis. J Eur Acad Dermatol Venereol. 1997; 8: S24–S27.
69. Faergemann J., Christensen O., Sjövall P. et al. An open study of efficacy and safety of long‐ term treatment with mometasone furoate fatty cream in the treatment of adult patients with atopic dermatitis. J Eur Acad Dermatol Venereol. 2000; 14 (5): 393–396.
70. Haneke E. The treatment of atopic dermatitis with methylprednisolone aceponate (MPA), a new topical corticosteroid. J DermatolTreatm. 1992; 3 (Suppl.2): 13–15.
71. Luger T.A. Balancing efficacy and safety in the management of atopic dermatitis: the role of methylprednisolone aceponate. J EurAcadDermatolVenereol. 2011; 25 (3): 251–258.
72. Bieber T., Vick K., Fölster-Holst R. et al. Efficacy and safety of methylprednisolone aceponate ointment 0.1% compared to tacrolimus 0.03% in children and adolescents with an acute flare of severe atopic dermatitis. Allergy. 2007; 62 (2): 184–189.
73. Кондратьева Ю.С., Кархова В.В. Опыт применения 0,1% метилпреднизолонаацепоната в комплексной терапии стероидчувствительных дерматозов. Вестник дерматологии и венерологии 2016; 1: 93–98.
74. Чикин В.В. Метилпреднизолонаацепонат и декспантенол в топической терапии больных атопическим дерматитом. Вестникдерматологииивенерологии 2014; 5: 112– 116.
75. Lassus A. Alclometasone dipropionate cream 0.05% versus clobetasone butyrate cream 0.05%. A controlled clinical comparison in the treatment of atopic dermatitis in children. Int J Dermatol. 1984; 23 (8): 565–566.
- 1. Palmer C.N., IrvineA.D., Terron-KwiatkowskiA. etal. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis. Nat. Genet. 2006; 38: 441–446.
Информация
Список сокращений
ИЛ – интерлейкин
ИФН – интерферон
МКБ – Международная классификация болезней
УФА-1 – ультрафиолетовая терапия дальнего длинноволнового диапазона
УФВ – узкополосная средневолновая ультрафиолетовая терапия
EASI – Eczema Area and Severity Index (Индекс распространенности и тяжести экземы)
IgE – иммуноглобулин Е
IGA – Investigator Global Assessment (Общаяоценкаисследователем)
SCORAD – Scoring of Atopic Dermatitis
Термины и определения
Атопический дерматит – мультифакторное генетически детерминированное воспалительное заболевание кожи, характеризующееся зудом, хроническим рецидивирующим течением, возрастными особенностями локализации и морфологии очагов поражения.
Критерии оценки качества медицинской помощи
ПриложениеА1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- КубановАлексейАлексеевич – член-корреспондент РАН, доктор медицинских наук, профессор, президент Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Намазова-Баранова Лейла Сеймуровна – академик РАН, доктор медицинских наук, профессор, председатель исполкома Союза педиатров России. Конфликт интересов отсутствует.
- Хаитов Рахим Мусаевич – академик РАН, доктор медицинских наук, профессор, президент Российской ассоциации аллергологов и клинических иммунологов.
- Ильина Наталия Ивановна – доктор медицинских наук, профессор, вице-президент Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Алексеева Елена Александровна – кандидат медицинских наук, заместитель руководителя КДЦ для детей НИИ педиатрии и охраны здоровья детей ФГБУЗ ЦКБ РАН, член Союза педиатров России.Конфликт интересов отсутствует.
- Амбарчян Эдуард Тигранович – кандидат медицинских наук, член Союза педиатров России.Конфликт интересов отсутствует.
- Артемьева Софья Иосифовна – врач-дерматовенеролог, младший научный сотрудник МНПЦДК Департамента здравоохранения г. Москвы, член Национального Альянса дерматовенерологов и косметологов.
- Аршинский Марк Иванович – член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Астафьева Наталия Григорьевна – доктор медицинских наук, профессор, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Вишнева Елена Александровна – доктор медицинских наук, член Российской ассоциации аллергологов и клинических иммунологов, член Союза педиатров России. Конфликт интересов отсутствует.
- Волнухин Владимир Анатольевич – доктор медицинских наук, профессор. Главный научный сотрудник лаборатории фундаментальных методов исследования МНПЦДК ДЗМ. Член Национального Альянса дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Данилычева Инна Владимировна – кандидат медицинских наук, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Елисютина Ольга Гурьевна – доктор медицинских наук, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Епишев Роман Владимирович – кандидат медицинских наук, врач- дерматовенеролог.Конфликт интересов отсутствует.
- Жестков Александр Викторович – доктор медицинских наук, профессор, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Жилова Марьяна Борисовна – доктор медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Жукова Ольга Валентиновна-доктор медицинских наук, профессор. Главный врач МНПЦДК ДЗМ. Исполнительный директор Национального Альянса дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Заславский Денис Владимирович – доктор медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует
- Знаменская Людмила Федоровна – доктор медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует
- КарамоваАрфеня Эдуардовна – кандидат медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Короткий Николай Гаврилович – доктор медицинских наук, профессор. Заведующий кафедрой дерматовенерологии педиатрического факультета РНИМУ им. Н.И. Пирогова, Вице-президент Национального Альянса дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Кохан Муза Михайловна — доктор медицинских наук, профессор, зав. научным клиническим отделом дерматологии ГБУ СО «Уральский научно- исследовательский институт дерматовенерологии и иммунопатологии».Конфликт интересов отсутствует.
- Круглова Лариса Сергеевна – доктор медицинских наук, профессор. Проректор по учебной работе, заведующая кафедрой дерматовенерологии и косметологии ЦГМА УДП РФ. Конфликт интересов отсутствует.
- Кунгуров Николай Васильевич – доктор медицинских наук, профессор. Директор государственного бюджетного учреждения Свердловской области «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии» (ГБУ СО «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии»). Член Национального альянса дерматовенерологов и косметологов. Конфликт интересов отсутствует
- Левина Юлия Григорьевна – кандидат медицинских наук, заведующий отделом клинической иммунологии и аллергологии ФГБУ «ЦКБ» РАН. Член Союза педиатров России. Конфликт интересов отсутствует.
- Львов Андрей Николаевич – доктор медицинских наук, профессор. Руководитель отдела клинической дерматовенерологии и косметологии Московского научно- практического центра дерматовенерологии и косметологии ДЗМ. Член Национального Альянса дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Материкин Александр Игоревич – кандидат медицинских наук, врач — дерматовенеролог, член Союза педиатров России. Конфликт интересов отсутствует.
- Мишина Олеся Сергеевна – кандидат медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Монахов Константин Николаевич – доктор медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Мурашкин Николай Николаевич – доктор медицинских наук, член Российского общества дерматовенерологов и косметологов, член Союза педиатров России. Конфликт интересов отсутствует.
- Ненашева Наталья Михайловна – доктор медицинских наук, профессор, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Пампура Александр Николаевич – доктор медицинских наук, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Плахова Ксения Ильинична– доктор медицинских наук, ученый секретарь, и.о. заведующего отделом ИППП ФГБУ «ГНЦДК» Минздрава России, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует
- Потекаев Николай Николаевич — доктор медицинских наук, профессор, главный внештатный специалист по дерматовенерологии и косметологии Минздрава России и Департамента здравоохранения Москвы, заведующий кафедрой кожных болезней и косметологии ФДПО ФГАОУ ВО РНИМУ им. Н.И.Пирогова Минздрава России, президент Национального Альянса дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Притуло Ольга Александровна – доктор медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует
- Разнатовский Константин Игоревич – доктор медицинских наук, профессор. Главный дерматовенеролог и косметолог Комитета здравоохранения Санкт- Петербурга, зав. кафедрой дерматовенерологии федерального государственного бюджетного образовательного учреждения высшего образования «Северо- Западного государственного медицинского университета им. И.И. Мечникова» Министерства здравоохранения Российской Федерации (ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России). Член Национального Альянса дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Сапунцова Светлана Геннадьевна – кандидат медицинских наук, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует
- Селимзянова Лилия Робертовна – кандидат медицинских наук, член Союза педиатров России. Конфликт интересов отсутствует.
- Скороходкина Олеся Валерьевна – доктор медицинских наук, профессор, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Феденко Елена Сергеевна – доктор медицинских наук, профессор, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Фомина Дарья Сергеевна – кандидат медицинских наук, главный внештатный специалист аллерголог-иммунолог, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Фриго Наталья Владиславовна – доктор медицинских наук, заместитель директора по наукеГБУЗ «МНПЦДК» Департамента здравоохранения г. Москвы,членСоюза «Национальный альянс дерматовенерологов и косметологов».
- Фролова Зоя Владимировна – член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
- Хаитов Муса Рахимович — член-корреспондент РАН, доктор медицинских наук, профессор, член Российской ассоциации аллергологов и клинических иммунологов. Конфликт интересов отсутствует.
- Чикин Вадим Викторович – доктор медицинских наук, старший научный сотрудник отдела дерматологии ФГБУ «ГНЦДК» Минздрава России, член Российского общества дерматовенерологов и косметологов. Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи-специалисты: врачи-дерматовенерологи, врачи-аллергологи- иммунологи,врачи-педиатры, врачи общей практики (семейные врачи), врачи-терапевты.
- Ординаторы и слушатели циклов повышения квалификации по указанным специальностям.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Таблица 3.Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года,а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учётом следующих нормативно- правовых документов:
- Порядок оказания медицинской помощи по профилю «дерматовенерология», утвержденный Приказом Министерства здравоохранения Российской Федерации № 924н от 15 ноября 2012 г.
- Порядок оказания медицинской помощи населению по профилю «аллергология и иммунология», утвержденный Приказом Министерства здравоохранения Российской Федерации № 606н от 7 ноября 2012 г.
Приложение Б. Алгоритмы действий врача
Приложение В. Информация для пациента
1. Учитывая, что атопический дерматит является хроническим заболеванием, для предотвращения рецидивов необходимо проведение регулярной базисной терапии увлажняющими и смягчающими наружными средствами.
2. При наличии в семье отягощенного наследственного аллергологического анамнеза рекомендуется соблюдать профилактические мероприятия в отношении соблюдения диеты кормящей матери и введения прикорма ребенку первого года жизни.
3. Во избежание развития побочных эффектов следует избегать самостоятельного бесконтрольного применения топических глюкокортикостероидных и антибактериальных препаратов.
Приложение Г. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Общая оценка заболевания исследователем IGA
Оригинальное название:
Investigator’s global assessment (IGA).
Источник (официальный сайт разработчиков, публикация с валидацией):
https://
www.eczemacouncil.org/research/investigator-global-assessment-scale/
Тип (подчеркнуть):
—
шкала оценки
— индекс
— вопросник
— другое (уточнить): —
Назначение:
оценка общей степени тяжести атопического дерматита
Содержание (шаблон):
Показатель IGA используется для оценки степени тяжести атопического дерматита.
Оценивается тяжесть атопического дерматита на момент проведения оценки.
Поражение кожи оценивается визуально и пальпаторно. IGA представляет собой оценку по 5-бальной шкале от 0 балловдо 4 баллов и отражает выраженность эритемы, утолщения (уплотнения) кожи и шелушения. Оценка 0 баллов соответствует чистой коже,максимальная оценка 4 балла соответствует атопическому дерматиту тяжелой степени тяжести.
Приложение Г2. Индекс SCORAD
Индекс SCORAD предназначен для оценки степени тяжести атопического дерматита.
Оригинальное название:
Scoring of Atopic Dermatitis (SCORAD).
Источник (официальный сайт разработчиков, публикация с валидацией):
Consensus report of the European Task Force on Atopic Dermatitis. Severity of scoring of atopic dermatitis: the SCORAD index. Dermatology.1993; 186: 23–31.
Тип (подчеркнуть):
— шкала оценки
—
индекс
— вопросник
— другое (уточнить): —
Назначение:
оценка степени тяжести атопического дерматита.
Содержание (шаблон):
А площадь поражения
(оценивается врачом)
В интенсивность клинических проявлений (оценивается врачом)
Оценка клинических проявлений атопического дерматита:
Ключ (интерпретация):
SCORAD предусматривает балльную оценку шести объективных симптомов: эритема, отек/папулезные элементы, корки/мокнутие, экскориации, лихенификация/шелушение, сухость кожи. Интенсивность каждого признака оценивается по 4-уровневой шкале: 0 – отсутствие, 1 – слабая, 2 – умеренная, 3 – сильная. При оценке площади поражения кожного покрова следует использовать правило «девятки», в котором за единицу измерения принята площадь поверхности ладони больного, эквивалентная одному проценту всей поверхности кожи. Цифрами указано значение площади для больных в возрасте старше 2 лет, а в скобках – для детей в возрасте до 2 лет (Рис.1). Оценку субъективных симптомов (ощущение зуда, нарушение сна) проводят у детей в возрасте старше 7 лет и взрослых; у детей младшего возраста оценку субъективных симптомов проводят с помощью родителей, которым предварительно объясняют принцип оценки.
Расчет индекса SCORAD производится по формуле: SCORAD = А/5+7В/2+С, где:А – распространенность поражения кожи,
В – сумма уровней интенсивности клинических симптомов атопического дерматита, С – сумма оценок субъективных нарушений по визуальной аналоговой шкале.
На линейке внизу рисунка указывается точка, соответствующая степени выраженности оцениваемого субъективного признака, усредненное за последние 3 суток.
Значения индекса могут варьировать в пределах от 0 (нет заболевания) до 103 (максимально тяжелое течение атопического дерматита).
Атопический дерматит легкой степени тяжести соответствует значению SCORAD<25 Атопический дерматит средней степени тяжести соответствует значению SCORADот 25 до 50.
Тяжелый атопический дерматит соответствует значению SCORAD> 50.
Приложение Г3. Классификация глюкокортикоидов, применяемых в дерматологии

Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Эйхенфилд Л., Том В., детская больница Калифорния; Чамлин С., детская больница Чикаго; Фельдман С., Университет Северной Каролины; Ханифин Д., Университет Орегона, США
Руководство по атопическому дерматиту
Раздел 1. Диагностика и оценка атопического дерматита
Клинические рекомендации были разработаны на основе наилучших имеющихся фактических данных. Они ранжированы следующим образом:
А. Рекомендация основана на последовательных и качественных ориентированных на пациента доказательств.
B. Рекомендация основана на противоречивых или ограниченного качества ориентированных на пациента доказательств.
C. Рекомендация основана на консенсусе, мнениях, тематических исследованиях или заболеваниях, ориентированных на доказательства.
В ситуациях, когда документированные данные на основе фактических данных не доступны, мы использовали экспертное заключение для генерации наших клинических рекомендаций.
Это руководство было разработано в соответствии с Американской академией дерматологии (AAD) / AAD ассоциация Административные регламенты на основании данных клинических руководств (версия утвержден мая 2010 года), которая включает в себя возможность для рассмотрения и замечаний со стороны всех членов AAD и итоговое рассмотрение и утверждение в AAD Советом директоров. Это руководство будет считать основным в течение 5 лет с даты публикации.
Определение
AD является хроническим, зудящим воспалительным заболеванием кожи, которое наиболее часто встречается у детей, но и влияет на многих взрослых. Заболевание имеет рецидивирующее течение. AD часто ассоциируется с повышенным уровнем сывороточного иммуноглобулина (IgE) и наличием в личном или семейном анамнезе I типа аллергии, аллергического ринита и астмы. Атопическая экзема является синонимом AD.
Введение
Наиболее распространенным началом AD является возраст между 3 и 6 месяцами. Примерно у 60% пациентов заболевание дебютирует на первом году жизни и у 90% — в возрасте до 5 лет. В то время как у большинства больных AD наблюдается разрешение болезни в зрелом возрасте, у 10% — 30% заболевание продолжается всю жизнь. AD имеет сложный патогенез с участием генетических, иммунологических и экологических факторов, которые приводят к нарушению барьерной функции кожи и нарушениям в регуляции иммунной системы. Известные клинические данные включают эритему, отек, ксероз, эрозии / ссадины, мокнутие и корки, и лихенификацию, которые различаются в зависимости от возраста пациента и хронического поражения. Отличительной чертой является зуд.
Диагностика
Диагноз AD устанавливается клинически и базируется на анамнестических особенностях, морфологии и распределении кожных поражений и связанных с ними клинических признаках. Чтобы помочь в классификации, различными группами были разработаны формальные наборы критериев. Одним из самых ранних и самых известных наборов диагностических критериев являются критерии Hanifin и Rajka 1980г., которые требуют для диагностики AD наличия 3 из 4 основных критериев и 3 из 23 мелких критериев. Такое большое количество критериев является громоздким для использования в клинической практике. Некоторые из малых критериев были отмечены как нечеткие или неспецифические, такие как белый лишай (Pityriasis alba-белесоватые пятна на коже лица, плечевого пояса), в то время как другие, такие как верхний хейлит губ и экзема сосков, довольно специфичны для AD, но встречаются редко. Несколько международных групп предложили внести изменения в эти критерии (например, критерии Kang и Tian; критерии Международного исследования астмы и аллергии в детстве [ISAAC] Великобритания). Измененные и адаптированные критерии состоят из 1 обязательного и 5 основных критериев и не требуют каких-либо лабораторных анализов. Диагностические критерии были подтверждены в исследованиях и испытаны в различных популяциях.
|
Таблица II Сила рекомендаций по диагностике и оценке атопического дерматита |
||
|
Рекомендация |
Сила рекомендации |
Уровень доказательности |
|
Диагностика производится с помощью критериев в приложении1 |
C |
III |
|
Никаких конкретных биомаркеров для диагностики или тяжести оценки не существует |
В |
II |
|
Не рекомендуется регулярное определение уровней иммуноглобулина Е |
A |
I |
|
Оценка индекса тяжести заболевания не для рутинного клинического использования |
C |
II |
|
Оценка индекса качества тяжести жизни не для рутинного клинического использования |
C |
II |
|
Расспрос о зуде, сне, влиянии их на повседневную деятельность и течении болезни |
C |
III |
|
Осведомленность и обсуждение общих ассоциаций |
C |
I и II |
|
Комплексный, междисциплинарный подход к уходу |
C |
III |
В 2003году согласительная Конференция, возглавляемая Американской академией дерматологии, предложила пересмотренные критерии Hanifin и Rajka, которые являются более обтекаемыми и дополнительно распространяются на весь спектр возрастов пострадавших. Пересмотренные критерии являются адаптацией к прагматическому подходу для диагностики AD у младенцев, детей и взрослых и хорошо подходит для использования в клинических условиях ( Вставка 1 ).
Приложение 1
Особенности, которые должны быть рассмотрены
в диагностике пациентов с атопическим дерматитом
Основные особенности — должны присутствовать:
Зуд
Экзема (острая, подострая, хроническая)
Типичная морфология и возрастные закономерности *
Хроническое или рецидивирующее течение в анамнезе
* Шаблоны включают в себя:
1. На лице, шее и разгибателях у младенцев и детей
2. Поражения сгибов в настоящем и прошлом в любой возрастной группе
3. Редкое поражение паховых и подмышечных областей
Важные особенности — в большинстве случаев, добавляются для поддержки диагностики:
Начало заболевания в раннемй возрасте
Атопия
Личный и / или семейный анамнез
Иммуноглобулин E реактивность
Ксероз
Ассоциированные особенности -Эти клинические ассоциации помогают преположить диагноз AD, но слишком неспецифические для определения или обнаружения AD в исследовательских и эпидемиологических целях:
Нетипичные сосудистые реакции (например, бледность лица, белый дермографизм)
Фолликулярный кератоз / Pityriasis alba / Усиление кожного рисунка на ладонях / ихтиоз
Глазные / периорбитальные изменения
Другие региональные данные (например, изменения вокруг рта / периаурикулярные поражения)
Перифолликулярный кератоз / лихенизация / поражения по типу почесухи
Исключающие условия — Следует отметить, что диагноз AD зависит от условий, которые должны быть исключены первоначально, такие как:
Чесотка
Себорейный дерматит
Контактный дерматит (раздраженный или аллергический)
Ихтиоз
Кожная Т-клеточная лимфома
Псориаз
Фоточувствительные дерматозы
Иммунодефицитные заболевания
Эритродермия от других причин
Оригинальные критерии Великобритании не могут быть применены к очень маленьким детям.
Приложение 1 .
Особенности, которые будут рассмотрены в диагностике пациентов с атопическим дерматитом
Рекомендации для диагностики AD показаны на таблице II , и сила рекомендации отображается в таблице III. AD следует дифференцировать от других заболеваний кожи, сопровождающихся эритемой и шелушением. Его часто трудно отличить от себорейного дерматита в младенчестве. AD обычно щадит пах и подмышечные области, в то время как себорейный дерматит затрагивает эти области и имеет тенденцию к отсутствию зуда. Диагноз АД следует пересмотреть в случаях отсутствия эффекта от терапии с учетом возможности других расстройств, в том числе более серьезных метаболических и иммунологических состояний у детей и кожной Т-клеточной лимфомы у взрослых.
|
Таблица II Рекомендация для диагностики атопического дерматита |
|
Пациенты с предполагаемый диагноз AD должен устанавливаться на основе критериев, обобщенных в приложении 1. Иногда, чтобы исключить другие или связанные состояния кожи могут быть полезными биопсияв кожи или другие тесты (такие как определение уровня сывороточного иммуноглобулина Е, КОН-тест на грибы, кожные пробы и / или генетическое тестирование). |
Биомаркеры
Диагноз AD остается клиническим, потому что в настоящее время нет надежных биомаркеров, которые позволяют отличать данное заболевание от других. Наиболее частым лабораторным признаком является повышенный уровень общего и / или аллерген-специфического IgE в сыворотке, который не обнаруживается примерно у 20% пациентов с AD. Некоторые обозначения «внешней» и «внутренние» группы заболеваний на основе наличия или отсутствия из IgE высоте, но являются ли они истинными варианты остается спорным. У некоторых людей повышенные уровни IgE могут развиваться позже, и на основании недавних исследований барьерных дефектов кожи и исследований по кожной сенсибилизации выдвинуто предположение, что повышенный уровень IgE может быть вторичным явлением. Повышенные уровни аллерген-специфического IgE также неспецифические, потому что они обнаруживаются у 55% население США. Хотя общий уровень IgE имеет тенденцию меняться с тяжестью заболевания, это не является надежным показателем, потому что некоторые люди с тяжелыми заболеваниями имеют нормальные значения, и IgE также может быть повышенным при некоторых неатопических состояниях (например, паразитарные инфекции, некоторых видах рака и аутоиммунных заболеваниях). Увеличение тучных клеток тканей и числа периферических эозинофилов также было оценено, но с аналогичными несовместимыми ассоциациями.
Открытие новых подмножеств T-лимфоцитов и новых цитокинов и хемокинов породило множество дополнительных потенциальных биомаркеров. К ним относятся сывороточные уровни CD30, макрофаги, полученные хемоаттрактанты (MDC), интерлейкины (IL) -12, -16, -18, и -31, и TARC. Некоторые показали корреляцию с тяжестью AD с использованием индекс SCORAD и других шкал. Но на сегодняшний день ни один не показал надежную чувствительность или специфичность для AD и не пригоден для клинического применения с цеью диагностики или мониторинга. Большинство исследований страдают от небольшого размера когорты и набора пациентов из центров высокоспециализированной медицинской помощи с более тяжелой формой болезни, а не из общего населения. Мало исследований, сравнивающих AD с другими экзематозными и атопическими заболеваниями, которые бы позволили оценить специфичность биомаркеров для AD.
Маркеры для прогноза также отсутствуют, хотя высокие уровни общего сывороточного IgE и генные мутации филаггрина ( FLG ), как правило, свидетельствуют о более серьезном и затяжном течении болезни (обсуждается ниже в разделе «Факторы риска для развития болезни»). Рекомендации по использованию биомаркеров в оценке AD показаны в таблице IV .
Таблица IV Рекомендации по использованию биомаркеров в оценке атопического дерматита |
|
Для пациентов с предполагаемым AD, нет конкретных биомаркеров, которые могут быть рекомендованы для диагностики и / или оценки тяжести заболевания. |
|
Мониторинг уровня иммуноглобулина Е не рекомендуется для рутинной оценки тяжести заболевания. |
Тяжесть заболевания и оценка клинических результатов
Оценка тяжести заболевания
Для измерения степени тяжести заболевания были предложены 28 различных шкал, ни одна из которых не является единным золотым стандартом. Они используют различные методы. Наиболее часто используются индекс тяжести AD – индекс SCORAD, индекс EASI, Глобальная оценка исследователя (IGA), и SASSAD. Эти системы оценок используются в первую очередь при клинических испытаниях и редко в клинической практике, поскольку они, как правило, не предназначены для этой цели.
Разработка шкалы во многих случаях включала тщательное тестирование и оценку следующих статистических свойств: надежность, обоснованность, надежность внутренней согласованности, оперативность, чтобы изменить, и минимальное клинически важное различие. Этим требованиям максимально отвечали индекс SCORAD, оценка EASI, и пациент-ориентированная экземы мера (POEM). Поэтому, их использование можно рассматривать и для практических целей. Следует отметить, что EASI использует объективные оценки степени заболевания и тяжести, устанавливаемые врачом, в то время как SCORAD включает в себя как объективные оценки врача о степени и тяжести, так и субъективные оценки пациента в отношении зуда и степени потери сна. Тест POEM специально разработан для измерения тяжести с точки зрения пациента и использует 7 вопросов, касающихся симптомов и их частоты. Три пункта шкалы тяжести (TISS) являются еще одним упрощением шкалы, которая показывает перспективы для будущего использования в клинической практике, но для этого нужно дополнительное тестирование.
Признавая отсутствие единого подхода к оценке степени тяжести AD для массового использования, предпринимаются международные усилия по стандартизации измеряемых результатов. Это включает в себя разработку базового набора допустимых мер признаков и симптомов, которые могут быть реально зарегистрированы в контролируемых исследованиях, направленных на улучшение сравнения между испытаниями и облегчающих метаанализ.
Оценка уровня качества жизни и воздействия болезни
22 разные шкалы предложены для оценки уровня качества жизни и других психологических результатов у пациентов с AD. Эти методики были использованы для оценки влияния заболевания на человека и результатов воздействия лечебных мероприятий, а также для сравнения с воздействием других расстройств. В клинических испытаниях, наиболее часто используют дерматологический индекс качества жизни детей (CDLQI), с последующим Dermatitis Family Impact (DFI), дерматологический индекс качества жизни (DLQI), и дерматологический индекс качества жизни младенца (IDLQI), но эти индексы не предназначены для использования в повседневной клинической практике.
Необходима дополнительная разработка практической клинической оценки качества жизни. Это может быть сделано путем преобразования существующих шкал в укороченные клинические варианты или путем тестирования существующих шкал в клинической популяции. Следует отметить, что показатель оценки зуда у пациента является критическим, учитывая его центральное значение при AD. Оценка интенсивности зуда, сделанная родителями за маленького ребенка или пожилыми людьми для себя не всегда коррелирует с качеством их жизни.
|
Таблица V |
|
Рекомендации по оценке тяжести заболевания и клинических исходов |
|
При лечении пациентов с атопическим дерматитом оценка индекса тяжести заболевания в повседневной клинической практике не рекомендуется, так как он не предназначен для этой цели. |
|
При лечении пациентов с атопическим дерматитом оценка индекса качества жизни пациента в повседневной клинической практике не рекомендуется, так как он не предназначен для этой цели. |
|
Врачам рекомендуется уточнять у пациента характер зуда, сна, влияние их на повседневную деятельность, течение болезни и динамику имеющихся в настоящее время высыпаний. |
Клинические ассоциации
Сопутствующие AD заболевания включают в себя другие атопические состояния, а именно пищевую аллергию, астму и аллергический ринит / риноконъюнктивит. Некоторые считают AD началом «атопического марша,» учитывая последующее развитие одного или нескольких других атопических заболеваний. Тем не менее, объединение AD с другими атопическими заболеваниями является достаточно сложной и многофакторной задачей, потому что эта прогрессия наблюдается не у всех индивидов.
Нарушение сна является частым симптомом, связанным в значительной степени с интенсивным зудом. Сон нарушается у 60% детей с экземой, а при обострениях он нарушается у 83% пациентов. Наряду с самим больным страдают и другие члены семьи от частых пробуждений. Даже при клинической ремиссии люди с экземой больше страдают от нарушений сна, чем здоровые люди. Высокая тяжесть заболевания кожи также, кажется, влияет на настроение.
При AD не обнаружено повышенного риска кожи или внутренних злокачественных новообразований, хотя некоторые данные наводят на размышления о высоких темпах лимфомы и более низкие — глиомы. На связь AD с ожирением указывают несколько эпидемиологических исследований. Однако был зарегистрирован слабый рост, особенно у детей, страдающих тяжелыми дерматозами.
Рекомендации, касающиеся оценки для клинических ассоциаций с AD ( Таблица VI ) основаны на консенсусе, потому что нет высококачественных, убедительных доказательств того, что скрининг для них приводит к улучшению результатов лечения пациентов. Преимущество использования комплексного, междисциплинарного клинического подхода к уходу за пациентами с AD с общими ассоциациями, в основном, ограничивается несколькими клиническими случаями.
Таблица VI. Рекомендации по оценке клинических ассоциаций атопического дерматита |
|
Врачи должны знать и оценивать состояния, связанные с атопическим дерматитом, такие как ринит / риноконъюнктивит, астма, пищевая аллергия, нарушение сна, депрессия и другие нервно-психические состояниия, и при необходимости врачам рекомендуется обсудить их с пациентом в рамках плана лечения. |
|
Комплексный, междисциплинарный подход к уходу может быть ценным и предлагается для пациентов с атопическим дерматитом, обращающихся с общими ассоциированными заболеваниями. |
Факторы риска для развития болезни
Два фактора риска по всей видимости, последовательно и прочно ассоциируются с развитием AD: 1) атопия в семейном анамнезе и 2) нарушение функции гена FLG.
Около 70% пациентов с AD имеют положительный семейный анамнез атопических заболеваний. Вероятность развития AD выше в 2 — 3 раза выше у детей с 1 атопическим родителем и в 3- 5 раз выше, если оба родителя страдают атопией. Ген FLG кодирует профиллагрин, который распадается на мономеры филаггрина, и эти белки играют ключевую роль в терминальной дифференцировке эпидермиса и формировании кожного барьера, в том числе рогового слоя. Продукты филаггрина являются частью естественного увлажняющего фактора, который способствует гидратации эпидермиса и барьерной функции. Мутации FLG создают риск для более тяжелой, упорной болезни. Они также приводят к повышенной склонностью к герпетиформной экземе. Различные дефекты FLG были отмечены в различных этнических популяциях при AD, показывая свою важность в патогенезе. Тем не менее, значительное число пациентов с AD не имеют никаких известных мутаций FLG , и, наоборот, около 40% людей с мутациями гена FLG не заболевают AD.
Тип родоразрешения (то есть, кесарево сечение или вагинальные роды), кажется, не изменяет риск AD. Повышенный вес при рождении может быть фактором риска для развития болезни, однако величина эффекта, скорее всего, небольшая, потому что исследования были противоречивыми, с отрицательной связью в отдельных исследованиях.
В то время как пациенты с АД часто осведомлены о некоторых продуктах, сроки введения пищи или диета с ограничением потенциально аллергенных продуктов, кажется, не изменяют риск AD. Большинство исследований материнской или младенческой диеты не показывают защитного действия, хотя недавно опубликованные исследования гидролизованной формулы и пробиотика позволили предположить, что эти подходы могут иметь положительный эффект в предотвращении развития заболевания у некоторых детей с высоким риском, которых кормят не только грудью. В настоящее время, однако, существует достаточно доказательств, чтобы рекомендовать какие-либо определенные диетические или другие меры, эффективные для первичной профилактики AD. Грудное вскармливание в течение первых 6 месяцев жизни рекомендуется из-за ряда своих преимуществ для ребенка и матери (например, пассивный иммунитет).
Нет проверенных данных, но имеются исследования, указывающие на более высокий риск AD у черной расы, у родителей с более высоким уровнем образования, но последний эффект от социально-экономического статуса неясен. Предыдущие исследования обнаружили более высокий риск AD среди высших социально-экономических групп, но более поздние исследования не подтвердили эти выводы. Проживающие в городских районах имеют более высокий риск AD, но исследования при попытке определить причинные агенты окружающей среды не были убедительными.
Эффект воздействия домашних животных не ясен, с противоречивыми данными. Два недавних исследования показали, что у пациентов с AD , контактирующих с кошками, но не с собаками, потенцируется эффект мутаций филаггрина. В то время как пациенты с АД являются часто осведомлены о клещах домашней пыли, нет убедительных доказательств, демонстрирующих, что стратегия избегания пылевого клеща предотвращает AD. Самый недавний систематический обзор показал, что воздействие эндотоксинов микроорганизмов сельскохозяйственных животных и собак может защитить от AD. Потребление непастеризованного молока и приобретение гельминтозов могут быть защитными, но не рекомендуемыми мерами из-за их потенциального риска для здоровья.
Нет окончательных выводов в отношении раннего применения антибиотиков и риска их для AD. Хотя исследования противоречивы, личное и пассивное курение кажется, не существенно влияют на развитие AD. Однако, курение вредно для больных астмой и имеет много других негативных рисков для здоровья.
Пробелы в исследованиях
В то время, как многое известно о диагностике и оценке AD, многое еще должно быть изучено. Хочется надеяться, что новые знания о патогенезе AD скоро позволят идентифицировать проверенные биомаркеры для диагностики и / или мониторинга заболевания.
Дата публикации 18 июня 2019Обновлено 24 мая 2022
Определение болезни. Причины заболевания
Атопический дерматит (эндогенная экзема) — это хронически рецидивирующее воспалительное заболевание кожи, которое сопровождается мучительным зудом и появлением экзематозных и лихеноидных высыпаний.
Такая форма дерматоза часто протекает одновременно с другими аллергическими болезнями, например, бронхиальной астмой, аллергическим ринитом и конъюнктивитом, пищевой аллергией, а также с ихтиозом. Это сочетание усугубляет течение атопического дерматита.
Краткое содержание статьи — в видео:
Распространённость атопического дерматита
Заболеваемость детей составляет 10-12 % случаев, а заболеваемость взрослых — 0,9 %, из которых 30 % параллельно болеют бронхиальной астмой, а 35 % — аллергическим ринитом[17].
Причины и факторы риска атопического дерматита
Атопический дерматит является иммунозависимой болезнью. Мощным фактором его развития являются мутации в генах, кодирующих филаггрин — структурный белок кожи, который участвует в образовании кожного барьера, препятствует потере воды и попаданию большого количества аллергенов и микроорганизмов. Поэтому в основном атопический дерматит наследуется от родителей, причём чаще всего от матери, чем от отца[1][18][19].
Сама по себе такая генетическая мутация не приводит к атопическому дерматиту, но предрасполагает к его развитию. Такую «запрограммированную» склонность сейчас принято называть диатезом. Он не является самостоятельным заболеванием и может привести к развитию атопического дерматита только под влиянием провоцирующих факторов. К ним относятся:
- атопены — экологические аллергены, вызывающие образование аллергических антител, повышая чувствительность тучных клеток и базофилов:
- пищевые атопены (коровье молоко, пшеница, раки, крабы, соя, шоколад, цитрусовые);
- пыльцевые атопены (амброзия, полынь, берёза, ольха);
- пылевые атопены (шерсть животных, постельные клещи, плесневые грибы, бумажная пыль, лаки, краски);
- продукты питания (сладости, копчёности, острые блюда, спиртные напитки);
- медикаменты (антибиотики, витамины, сульфаниламиды, производные пиразолона);
- переохлаждение;
- эмоциональный стресс.
Значительную роль в обострении атопического дерматита играют:
- Внешние факторы:
- климатические условия (болезнь чаще возникает в скандинавских странах в весенне-осенний период);
- загрязняющие вещества бытовой среды (дым, духи);
- испарения растворителей (ацетон, скипидар);
- вредные условия труда (загрязнение кожи твёрдыми масляными частицами, частое трение и давление, агрессивные растворители и моющие средства).
- Внутренние факторы:
- вирусные инфекции (ВЭБ-мононуклеоз, СПИД, инфекционные гепатиты);
- болезни ЖКТ (панкреатиты, инфекционные гастриты);
- заболевания эндокринной системы (тиреотоксикоз, дисменорея, менопауза).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы атопического дерматита
Клиническая картина заболевания зависит от возраста пациента, в котором впервые возникли его симптомы. Начинается болезнь, как правило, в раннем детстве и к школьным годам затихает, но во время полового созревания и позже она может возникнуть снова.
Выделяют три фазы заболевания:
- младенческая — от 7-8 недель до 1,5-2 лет;
- детская — от 2 до 12-13 лет;
- взрослая — от начала полового созревания и старше.
По мере смены этих фаз локализации атопического дерматита постепенно меняются.
В младенческой фазе атопический дерматит протекает остро в форме младенческой экземы. При этом возникают красные отёчные папулы (узелки) и бляшки, которые мокнут и покрываются коркой. В основном они покрывают кожу щёк и лба, боковой поверхности шеи, верхней части груди, сгибательной поверхности конечностей и тыльной стороны кистей рук. На волосистой части головы образуется скопление чешуек-корок — гнейс.
В детской фазе заболевание протекает в форме детской экземы. Первыми признаками в этот период являются зуд кожи и лёгкий отёк, сглаживающий мелкие складки. При этом складка нижнего века, наоборот, становится более выраженной (симптом Денни).
Первичным элементом кожной сыпи становятся везикулёзные (пузырьковые) высыпания. Затем образуются экзематозные бляшки величиной с монету, покрытые мелкими кровянистыми корками. По-другому эту сыпь называют экземой сгибов, т. к. в основном она располагается на сгибательной поверхности рук и ног.
Единственный постоянный симптом болезни, который появляется независимо от возраста, — это сильный, иногда мучительный зуд. При различных повреждениях в коже накапливаются медиаторы воспаления, снижающие порог её чувствительности к различным раздражителям. Из-за этого при расчёсывании возникает экзематозное воспаление[22].
Течение атопического дерматита зависит от времени года: зимой заболевание обостряется и возникают рецидивы, а летом наблюдается частичная или полная ремиссия[3].
При обострении заболевания на месте регрессирующих высыпаний появляется шелушение, папулы, похожие на красный плоский лишай, и очаги лихенификации — утолщение кожи с увеличением складок. Процесс становится распространённым. Сыпь поражает в основном кожу сгибов локтевых и коленных суставов, лица, шеи и кистей рук. Нередко она стойко держится в области тыльной поверхности кистей рук, приобретая картину «хронической экземы кистей у атопика».
При продолжительном обострении общее состояние ухудшается. У некоторых возникают признаки астено-депрессивного синдрома — повышенная утомляемость, раздражительность, тревожность.
В период ремиссии кожа отличается сухостью (атопический ксероз), бледностью и раздражимостью.
Помимо основных проявлений болезни, т. е. экзем и зуда, становятся более выраженными симптомы сопутствующих заболеваний, таких как:
- фолликулярный кератоз («гусиная» кожа);
- вульгарный ихтиоз (шелушение кожи, складчатость ладоней) — встречается в 1,6-6 % случаев.
У людей с врождённым ихтиозом нередко развивается субкапсулярная катаракта.
При нерациональном лечении и повторном воздействии раздражающих средств помимо свежих высыпаний появляются парадоксальные вегетативные реакции кожи:
- усиленное потоотделение на сухих и здоровых с виду участков кожи (возникает мое мере стихания обострения);
- в ответ на механическое раздражение кожа становится резко белой.
Кроме того, появляются такие симптомы, как:
- периорбитальные изменения (складки под нижними веками, тени);
- полиаденит (воспаление множества лимфоузлов) — возникает при тяжёлом течении заболевания[2].
Патогенез атопического дерматита
В основе патогенеза атопического дерматита лежит патологическая реакция организма. Она возникает из-за сложного взаимодействия трёх факторов[4]:
- дисфункции кожного барьера — основополагающий фактор;
- воздействия окружающей среды;
- нарушения иммунной системы.
Изменение проницаемости кожи связано с дефицитом филаггрина, который возникает из-за дефекта генов, регулирующих строение рогового слоя эпидермиса. Другими причинами нарушения кожного барьера являются:
- снижение уровня керамидов — липидов (жиров), которые защищают кожу от агрессивного влияния окружающей среды и предупреждают потерю влаги;
- увеличение протеолитических ферментов — веществ, отвечающих за скорость реакции клетки на раздражители;
- повышение электрокинетической активности клеток эпителия[5];
- усиление потери влаги через эпидермис.[6][7].
Также защитный барьер кожи повреждается из-за внешнего воздействия протеаз клещей домашней пыли и золотистого стафилококка[7].
Когда защитный барьер кожи нарушен, она становится более проницаемой для аллергенов, токсинов и раздражающих веществ, при проникновении которых возникает патологический иммунный ответ. Как правило, он протекает с участием Т-хелперов второго типа (Th2) — клеток, усиливающих адаптивную иммунную реакцию. Они приводят к продукции интерлейкинов (ИЛ-4, ИЛ-5, ИЛ-13), которые активируют В-лимфоциты, производящие иммуноглобулин Е (IgE), запускающий аллергическую реакцию. В результате в периферической крови происходит увеличение эозинофилов — лейкоцитов, которые участвуют в развитии аллергической реакции и защищают организм от аллергенов.
Расчёсывание при возникшем иммунном ответе травмирует кожу и стимулирует кератиноциты к выработке провоспалительных цитокинов, приводящих к хроническому воспалению.
Все эти изменения в эпидермисе становятся причиной усиленного поглощения аллергенов, микробной колонизации кожи, а также снижения порога чувствительности к холодовым и тактильным раздражителям[8].
Классификация и стадии развития атопического дерматита
Классификация атопического дерматита основывается на оценке степени распространённости процесса, характера поражения и выраженности зуда[4]. В связи с этим выделяются два варианта течения заболевания:
- Лёгкое — характерно для людей с высоким уровнем антител IgE к пищевым и пылевым атопенам. Такое течение отличается сыпью в виде очагов экземы и участков лихенизации, располагающейся на коже шеи, лица и сгибов крупных суставов. В ответ на раздражители кожа белеет или приобретает смешанный оттенок. Обострение возникает в основном в весеннее и осеннее время до 4 раз в год. Поддаётся лечению топическими кортикостероидами и ингибиторами кальциневрина. Для предотвращения рецидива проводится санаторно-курортного лечение.
- Тяжёлое — свойственно пациентам с сопутствующими заболеваниями и склонностью к контактной чувствительности к металлам при нормальном уровне антител IgE. Течение отличается лихеноидными и экзематозными высыпаниями, которые затрагивают все конечности, туловище, лицо и шею. Подмышечные и бедренные лимфоузлы увеличиваются до размера лесного ореха и становятся плотными и малоболезненными. Щетинковые волосы бровей обламываются. При обследовании выявляется контактная чувствительность к никелю и хрому. Чаще болеют женщины. Регрессирует только под влиянием системной терапии иммуносупресссантами, кортикостероидами и селективной УФА. Пациенты с этим течением госпитализируются более 4 раз в год.
В зависимости от степени вовлечения кожного покрова различают три формы болезни:
- ограниченная;
- распространённая;
- универсальная (эритродермия).
При ограниченной форме высыпания возникают на коже шеи, локтевых и подколенных сгибов, тыльной стороне кистей и стоп, в области лучезапястных и голеностопных суставов. За пределами этих очагов кожа с виду здорова. Зуд приступообразный.
При распространенной форме сыпь появляется на коже предплечий, плеч, голеней, бёдер и туловище. На красновато-отёчном фоне возникают обширные участки лихеноидных папул с расчёсами и корками. Границы очагов поражения нечёткие. Кожные покровы сухие с отрубевидным шелушением. Зуд приводит к бессоннице.
При универсальной форме сыпь покрывает более 50 % поверхности кожи кроме ладоней и носогубного треугольника. Кожа ярко красного цвета, напряженная, уплотнённая, покрыта многочисленными трещинами, особенно в складках. Пациентов беспокоят нестерпимый зуд, приводящий к расчёсам, глубоко травмирующим кожу. Щетинковые волосы обломаны в области бровей и усов. Возникает лихорадка до 38,2 °C и озноб.
По характеру преобладающих высыпаний выделяют три типа атопического дерматита:
- эритематозно-сквамозный с лихенизацией (чаще возникает в детстве);
- экссудативный;
- лихеноидный (чаще поражает взрослых)[23].
Осложнения атопического дерматита
При развитии болезни часто возникают различные инфекционные осложнения, связанные со стадией обострения. В период стабилизации кожа в участках поражения подвержена появлению импетиго[9].
Осложнения младенческой фазы:
- Кандидоз — начинается с появления в глубине складок белесоватой полоски размокшего рогового слоя. Затем возникают мелкие пузырьки и обширные эрозии, по краям которых появляются отсевы вялых пустул.
- Герпетиформная экзема Капоши — на коже появляются пузырьки и пустулы с пупкообразным западением в центре и размером с булавочную головку или горошину. Серозное содержимое пузырьков быстро становится геморрагическим (наполняется кровью). Сыпь чаще появляется на коже лица, шеи и волосистой части головы, реже — в местах расчёсов на туловище и конечностях.
Осложнения детской фазы:
- Стафилококковое импетиго — проявляется сыпью в виде вялых пузырьков размером с горошину или лесной орех. Если их вскрыть, то на коже остаются повреждения, окружённые обрывками эпидермиса.
- Контагиозный моллюск — появляются полусферические телесные или розоватые папулы величиной с булавочную головку или больше с пупкообразным вдавлением в центре. Элементы могут быть единичными и множественными. При надавливании пинцетом на моллюск выделяется беловатая крошковатая масса — «моллюсковые тельца».
- Хроническая папилломавирусная инфекция — на тыле кистей и лице возникают плоские узелки. Их размер достигает 3-5 мм в диаметре. Они слегка возвышаются над поверхностью кожи, имеют округлую или многогранную форму, по цвету могут быть жёлтыми или не отличаться от здоровой кожи.
Осложнения взрослой фазы:
- Дерматофитии — на любых участках тела появляются грибковые поражения. Чаще они поражают паховые складки, ягодицы, бёдра и голени. На вид очаги грибка бледного цвета, покрыты отрубевидными чешуйками. Его границы розово-красного цвета, они чётко отграничивают очаг от здорового эпидермиса. По краям располагается выпуклый прерывистый валик, который состоит из папул, мелких пузырьков и корочек.
- Кератомикозы — отрубевидный лишай, который появляется в виде высыпаний светло-коричневого цвета, пятен неправильной формы с неровными «ажурными» краями. У людей с тёмной кожей эти пятна тёмно-коричневого цвета, покрыты еле заметными отрубевидными чешуйками, которые при поскабливании становятся хорошо заметными. Когда заболевание проходит, пятна остаются депигментированными и не поддаются загару.
Атопический дерматит значительно нарушает качество жизни пациента и членов его семьи. Внешний вид человека с зудящим дерматитом вызывает у окружающих беспокойство из-за инстинктивной осторожности заразиться паразитарным дерматозом. Сладострастное выражение лица больного, которое появляется от «оргазма» при расчёсывания очагов, ассоциируется у окружающих с психическим расстройством. Поэтому судьбе человека с атопическим дерматитом не позавидуешь: она мало отличается от судьбы прокажённого. Если добавить к этому невежество медицинских работников, которые не знают дерматологии и дают случайные рекомендации по лечению, то картина трудностей в общении со сверстниками становится полной[20].
Длительные обострения атопического дерматита осложняются неврастеническим, депрессивным синдромами и истерией. По сути, это проявление чрезмерно выраженных черт характера, которое уходит сразу после выздоровления.
Диагностика атопического дерматита
У данного заболевания нет специфического лабораторного анализа, поэтому диагноз основывается на выявлении симптомов с учётом критериев Rajka[2] и оценки степени тяжести по шкале SCORAD.
Согласно критериям Rajka, речь об атопическом дерматите идёт, если у пациента есть три основных или дополнительных критерия и более[21].
- Основные критерии:
- зуд;
- экземы;
- хроническое течение;
- наличие атопического дерматита у родственников.
- Дополнительные критерии:
- начало заболевания в детском возрасте;
- повышение IgE в сыворотке крови;
- сухость кожи и т.д.
Чтобы определить степень тяжести по шкале SCORAD, нужно оценить объективные и субъективные критерии. К объективным относят интенсивность и распространённость поражений, к субъективным — интенсивность зуда днём и нарушение сна. Общая оценка высчитывается по определённой формуле. Максимальный возможный балл — 103, он указывает на крайне тяжёлое течение болезни.
О стадии заболевания можно судить по двум вегетативным изменениям:
- сосудистые реакции на механическое раздражение (дермографизм);
- влажность кожи в очагах поражения и её здоровой или нездоровый вид (перспирация).
| Стадии атопического дерматита |
Дермографизм | Перспирация |
|---|---|---|
| Обострение | белый | выраженная сухость вне очагов и повышенная в очагах |
| Ремиссия | смешанный | выраженная влажность вне очагов и трещины, шелушение в очагах |
| Разрешение болезни | розовый | умеренная влажность кожи |
Также для установления диагноза необходимо выявить специфические антитела класса IgE к экологическим аллергенам. С этой целью проводятся накожные аппликационные тесты, но только если у пациента выявлена гиперчувствительность замедленного типа.
При гистологическом исследовании участка поражённой кожи возникает следующая картина:
- в поверхностных слоях кожи вокруг кровеносных сосудов скапливаются клеточные элементы с примесью лимфы и единичными эозиновилами;
- в эпидермисе нарушен процесс ороговения клеток — отсутствует зернистый слой;
- в участках хронического воспаления эпидермиса наблюдается его утолщение, утолщение рогового слоя, межклеточный отёк и иногда спонгиозные пузырьки[4].
Часто атопический дерматит можно спутать с другими заболеваниями. Чтобы избежать ошибки, проводится дифференциальная диагностика с простым и аллергическим контактным дерматитом, монетовидной экземой, простым лишаем Видаля, псориазом, чесоткой, себорейной экземой, микозом гладкой кожи, СПИДом, энтеропатическим дерматитом и гистиоцитозом.
Для этого прибегают к лабораторным исследованиям:
- выявление патологии тромбоцитов для исключения синдрома Вискотта — Олдрича;
- оценка иммунного статуса для исключения синдрома Джоба;
- микроскопия чешуек при подозрении на дерматомикоз.
Иногда, чтобы отличить болезнь от другой патологии, достаточно посмотреть на локализацию сыпи. Например, при вульгарном псориазе поражаются разгибательные поверхности, а при атопическом дерматите — сгибательные[17].
Лечение атопического дерматита
Тактика лечения зависит от тяжести и длительности заболевания:
- при лёгком течении болезни без чувствительности к аллергенам и осложнений возможно амбулаторное лечение;
- при тяжёлом течении и реакции организма на атопены требуется госпитализация.
Базисная терапия включает приём противовоспалительных, противозудных и гипосенсибилизирующих средств, угнетающих аллергическую реакцию[10][12].
В первую очередь необходимо избавиться от зуда. Так как он связан с воспалением, для его устранения могут использоваться антигистаминные и седативные препараты, топические кортикостероиды или ингибиторы кальциневрина (Такролимус и Пимекролимус) [13].
При развитии среднетяжёлой и тяжёлой формы болезни, если топические препараты не помогают, больному вводят Дупилумаб (противопоказан пациентам младше 18 лет).
Второй задачей лечения является коррекция сухости кожи (ксероза), сосудистых и обменных нарушений. Для этого нужно устранить провоцирующие факторы, избегать запоров и диареи, принимать антигистаминные, седативные и иммунокорригирующие средства. Также показана рефлексотерапия, облучение кожи ультрафиолетом, селективная фототерапия и фотохимиотерапия. На кожу накладывают антисептические влажно-высыхающие повязки, горячие припарки и аппликации из парафина и наносят мази с кортикостероидами.
Диетотерапия проводится в три этапа:
- I этап — диагностическая диета. Она направлена на исключение из рациона продукта, который предположительно стал аллергеном. Если на протяжении этой диеты состояние пациента улучшилось, то аллергия к продукту подтверждается.
- II этап — лечебная диета. Нацелена на исключение не только всех пищевых аллергенов, но и провоцирующих факторов;
- III этап — расширение рациона во время ремиссии[14].
При младенческой форме заболевания следует уделять особое внимание прикорму: он должен быть гипоаллергенным. Для этого нужно исключить такие продукты и вещества, как молоко, глютен, сахар, соль, бульон, консерванты, искусственные красители и ароматизаторы. Если у ребёнка есть желудочно-кишечные нарушения, то первым прикормом должны стать безмолочные каши промышленного производства, в составе которых нет сахара и глютена (например, гречневая, рисовая и кукурузная). В случае запоров или избыточной массы тела малыша прикорм начинают с пюре из кабачков, патиссонов, капусты и других овощей. Белковая часть рациона включает пюре из мяса кролика, индейки, конины и ягнёнка. Фруктовый прикорм состоит из зелёных и белых яблок. Соки рекомендуется давать только к концу первого года жизни.
При общем лечении рекомендуется использовать «Дезлоратадин»: в форме сиропа его можно давать детям от года, в форме таблеток — начиная с 12-13 лет. Короткий курс глюкокортикостероидов в форме таблеток показан только в случае тяжёлого обострения. Мази, гели и кремы с глюкокортикостероидами также рекомендованы при обострении и тяжёлой форме болезни[15]. К ним относятся гидрокортизон, флутиказон и другие. Активированный пиритион цинка в виде 0,2 % аэрозоля, крема и 1 % шампуня применяют с учётом его способности провоцировать обострение вирусных заболеваний и усиливать действие солнца[14].
При госпитализации проводится инфузионная терапия — внутривенное введение раствора «Циклоспорин» с начальной дозой 2,5 мг/кг в сутки. В тяжёлых случаях доза может быть увеличена до 5 мг/кг в сутки. При достижении положительного результата дозировку постепенно снижают до полной отмены. Комплексно рекомендуется применять увлажняющие и смягчающие кремы «Локобейз Рипеа», «Ликоид Липокрем», «Липикар» и молочко «Дардиа».
Стойкой ремиссии способствует проживание в течение 2-3 лет на территории с тёплым климатом (Средиземноморье, климат пустыни, высокогорье)[10].
Прогноз. Профилактика
При достижении школьного возраста обычно наступает стойкая ремиссия. Обострения возникают крайне редко. У пациентов с сопутствующим ихтиозом, бронхиальной астмой и аллергическим риносинуситом заболевание затягивается до взрослого возраста.
Спрогнозировать течение атопического дерматита можно с помощью оценки электрокинетической подвижности клеток буккального эпителия: чем ниже показатель, тем тяжелее будет протекать болезнь[10][11].
К профилактике заболевания относят:
- обучение пациента и членов его семьи правилам ухода за кожей, грамотному использованию лекарств и пр.;
- консультирование по поводу коррекции факторов риска развития неинфекционных заболеваний;
- проведение мероприятий по сохранению беременности у пациенток с атопическим дерматитом, начиная с первой половины срока беременности;
- соблюдение диеты кормящей матерью и новорождённым;
- лечение сопутствующих заболеваний;
- длительный приём «Дезлоратадина».
В качестве профилактики также применяется препарат «Рузам», который длительно подавляет аллергические реакции и модулирует иммунную реакцию организма.[16]. Перед его применением проводится проба с препаратом.
В случае начала обострения заболевания рекомендуется следующая формула профилактики: сон 8-10 часов в день + гипоаллергенная диета + ежедневные четырёхчасовые прогулки.
Атопический дерматит (АтД) — широко распространенное хроническое воспалительное заболевание кожи, в развитии которого участвуют сложные генетические и иммунные механизмы [1–3]. Заболевание возникает в раннем детском возрасте, особенно у детей с наследственной предрасположенностью к атопии, характеризуется рецидивирующим течением, возрастными особенностями локализации и морфологии очагов воспаления. Многочисленные исследования и клинические наблюдения свидетельствуют о различных фенотипах АтД, обуславливающих неодинаковый ответ и эффективность на проводимую стандартную терапию, что связано с многообразием триггерных факторов и разнообразием факторов окружающей среды в разных странах мира, влияющих на течение заболевания [4, 5]. В настоящее время большинство исследователей выделяют группу больных с ранним дебютом заболевания и высоким риском развития респираторных проявлений аллергии, таких как бронхиальная астма и аллергический ринит. Отмечено, что сопутствующие заболевания достоверно чаще развиваются у детей раннего возраста с тяжелым течением АтД [6].
В последние годы наблюдается существенный прогресс в изучении генетических и патофизиологических механизмов АтД. Все это дает мощный импульс для разработки новых терапевтических подходов с позиций стратегической и персонифицированной медицины. Однако, несмотря на многочисленные исследования, механизмы, вызывающие воспаление в коже при АтД, остаются до конца не раскрытыми. Предполагают, что, помимо иммунных факторов, воспаление в коже обусловлено нейропептидами, вызывающими мучительный зуд и механическое повреждение кожи вследствие расчесывания, которое, в свою очередь, приводит к высвобождению провоспалительных цитокинов кератиноцитами [7, 8]. C другой стороны, в условиях нарушения функций эпидермального барьера развивается иммунное воспаление в коже в ответ на внешнее воздействие аллергенов/антигенов [9]. Многие исследования доказали роль IgE-сенсибилизации при АтД [7, 10]. Возможность формирования сенсибилизации организма в ответ на чрескожное введение аллергена показана у пациентов с аллергией к пыльцевым и пищевым аллергенам [11, 12]. Однако не всегда IgE-опосредованные реакции лежат в основе развития клинической симптоматики заболевания. Это дало повод для выделения «IgE-независимого атопического дерматита».
Прогресс в понимании патогенеза АтД связан с открытием мутаций в гене, кодирующем филаггрин — белок, вырабатываемый кератиноцитами. Это показало, что в основе развития заболевания лежит генетически детерминированное нарушение функций эпидермального барьера [13–16]. В этой связи выделены две основные гипотезы патогенеза АтД. Первая гипотеза, «outside-to-inside» (снаружи — внутрь), согласно которой нарушение проницаемости и функции эпидермального барьера кожи является первичным в развитии иммунного ответа при АтД. Вторая гипотеза, «inside-to-outside» (изнутри — наружу), предполагает нарушения функции эпидермального барьера при АтД вторичными вследствие первичных изменений иммунного ответа. Данные гипотезы не противоречат друг другу. Все это еще раз подтверждает многофакторность АтД, а сочетание различных причинных факторов определяет полиморфизм клинических проявлений заболевания. Диагностические критерии заболевания, предложенные J. Hanifin и G. Rajka в 1980 г., усовершенствованы и модифицированы. В 2003 г. группой экспертов Американской академии дерматологии (American Academy of Dermatology, AAD) предложены модифицированные критерии диагностики АтД для детей и взрослых (табл. 1).
Разработаны диагностические шкалы для оценки степени тяжести АтД на основании субъективных и объективных показателей. Наиболее широко используются индексы SCORAD, EASI и IGA [18–21]. В клинической практике диагноз АтД устанавливают на основании клинических симптомов. Необходимо учитывать, что заболевание имеет определенные особенности клинического течения, которые зависят от возраста, тяжести течения, гендерных и расовых различий, воздействия инфекционных, неинфекционных аллергенов, ирритантов и психоэмоциональных факторов, а также ответа на терапию. В этой связи D. Y. M. Leung и соавт. [22] предлагают выделять следующие основные клинические фенотипы АтД (табл. 2).
В зависимости от механизмов развития выделят следующие фенотипы АтД (табл. 3).
Следует заметить, что различные фенотипы АтД нередко имеют общие черты и симптомы и в большинстве случаев доминирующая клиническая картина определяет соответствующий клинический фенотип заболевания. Очень важно, что выделение клинических фенотипов, установление провоцирующих факторов, определение генетических и биологических маркеров помогают в выборе адекватного лечения и профилактике развития респираторных проявлений аллергии (бронхиальной астмы и аллергического ринита) [23–25].
Согласно современным представлениям патогенез АтД обусловлен следующими механизмами:
1) нарушение эпидермального барьера на разных уровнях: физическом (pH кожи, роговой слой, десмосомы, плотные межклеточные контакты), биохимическом (липиды, органические кислоты, лизосомы, антимикробные пептиды) и иммунном (лимфоциты, нейтрофилы, моноциты, клетки Лангерганса) [26, 27];
2) нарушение иммунного ответа;
3) особенности микробиома кожи;
4) развитие IgE-зависимой специфической сенсибилизации к аллергенам;
5) аутоиммунные механизмы развития заболевания.
Нарушение функций эпидермального барьера приводит к избыточной трансэпидермальной потере воды. Уменьшение гидратация кожи за счет увеличения трансэпидермальной потери влаги создает благоприятные условия для хронического воспаления в коже, которое, в свою очередь, усиливает зуд, экскориации, образуя дополнительные входные ворота для S. aureus и других патогенов [28, 29]. В настоящее время доказано, что нарушения эпидермального барьера при АтД обусловлены генетическими мутациями гена филаггрина, белка, принимающего важнейшее участие в формировании эпителия. Филаггрин образуется из белка профилаггрина, который содержится в кератогиалиновых гранулах кератиноцитов. Ген филаггрина находится на 1q21.3 хромосоме, его мутации при АтД могут приводить к снижению способности корнеоцитов удерживать влагу, а также снижению эластичности и прочности кожи. Наряду с геном филаггрина в развитии заболевания могут участвовать и другие гены. Известны мутации генов белка псориазина, гены так называемого эпидермального дифференциального комплекса, белка клаудина [30, 31].
Иммунопатогенез АтД связан с участием различных популяций иммунокомпетентных клеток. Основными участниками иммунного ответа являются Т-лимфоциты, дендритные клетки, кератиноциты, моноциты и эозинофилы. В настоящее время существует концепция двухфазного иммунного ответа при АтД. Так, в первую фазу иммунного ответа при остром воспалении при АтД происходит активация Th2-иммунного ответа различными антигенами, проникающими через кожу, и выработка специфических IgE антител В-клетками. Активация синтеза IgE-антител — это ведущее патогенетическое звено в развитии АтД. При хроническом течении АтД происходит переключение Тh2-типа иммунного ответа на Th1-тип в то время, когда продукция цитокинов Th2-профиля резко уменьшается. Для этой фазы характерно повышение уровней ИЛ-12, ИЛ-5, ИЛ-8 и ИФН-γ, ИЛ-3 и GM-CSF. Иммунный ответ характеризуется не количеством Т-лимфоцитов, а изменением дифференцировки Т-лимфоцитов (Th0) и профиля их цитокинов. Роль ИЛ-4, ИЛ-5, ИЛ-12, ИФН-γ, ИЛ-31, ИЛ-10 в патогенезе АтД изучена достаточно хорошо. В то же время участие ИЛ-17, ИЛ-22 пока не раскрыто. Появляются сведения об участии ИЛ-25 в патогенезе этого заболевания. Исследование роли цитокинов в механизмах развития АтД крайне перспективно, поскольку именно нарушения в этой системе служат мишенью для разработки новых методов терапии. Большинство современных методов лечения АтД относятся к иммунотерапии, поскольку они направлены на коррекцию дисбаланса иммунного ответа и подавление патологических иммунных реакций. Активно развиваются новые иммунологически обоснованные методы терапии, к которым относятся не только традиционные фармакологические препараты, но и биологические агенты (цитокины, антитела и гибридные белки).
Успех терапии АтД во многом определяется комплексным подходом с использованием терапевтических мероприятий, среди которых следует выделить: элиминацию триггерных факторов, диетотерапию, системную и наружную терапию, а также психокоррекцию. В первую очередь следует исключить причинно-значимые в развитии заболевания факторы, необходимо удаление источников различных аллергенов из окружения ребенка.
Основной и неотъемлемой частью комплексного лечения детей с АтД является диетотерапия, основными принципами которой являются:
а) исключение из рациона питания доказанных непереносимых пищевых продуктов с соблюдением длительности элиминации;
б) элиминируемый продукт должен быть заменен на переносимый, сопоставимый по пищевой ценности, содержанию макро- и микронутриентов;
в) полноценное обеспечение физиологических потребностей организма в энергии, основных пищевых веществах, витаминах и минералах;
г) соблюдение квоты белка;
д) обеспечение в диете количества жира, составляющего не более 30% от суточной калорийности рациона;
е) дробный режим питания: 4–6-разовый прием пищи в зависимости от возраста.
Точное установление пищевого продукта, вызывающего развитие аллергических реакций, правильное определение длительности элиминации в значительной мере определяют эффективность диетотерапии.
В клинической практике нередко встречаются ситуации, когда элиминационные диеты назначаются без доказательства причинно-значимой связи с употреблением непереносимого пищевого продукта и развитием симптомов болезни. Все это приводит к необоснованному исключению многих продуктов питания из рациона ребенка и является причиной развития дефицитных состояний и/или недостаточности макро- и микроэлементов с соответствующими функциональными нарушениями. Несбалансированное питание и недостаточное поступление витаминов и микроэлементов существенно отражаются на общем состоянии ребенка, могут приводить к нарушению минерального и костного метаболизма и утяжелению кожного процесса.
Бесспорное преимущество в достижении положительных результатов лечения принадлежит персонализированной диетотерапии, которая дает возможность подбора индивидуального лечебного питания. Для диетотерапии молочной аллергии у детей первого года жизни, находящихся на искусственном вскармливании, используют следующие виды специализированных продуктов:
- гидролизаты белка коровьего молока, состоящие из смеси пептидов, лишенных антигенных детерминант;
- смеси синтетических аминокислот;
- лечебные соевые смеси с учетом возраста ребенка (старше 6 месяцев жизни при отсутствии аллергических реакций на белки сои);
- гипоаллергенные продукты и блюда прикорма — гипоаллергенные каши, плодоовощные и мясные пюре.
К лечебным смесям на основе глубокого гидролиза белков коровьего молока относятся: «Альфаре», «Альфаре Аллерджи», «Нутрилак Пептиди СЦТ», «Нутрилон Пепти Аллергия», «Нутрилон Пепти Гастро», «Пептикейт», «Симилак Алиментум», «Фрисопеп АС», «Фрисопеп». При неэффективности высокогидролизованных смесей используются смеси, содержащие свободные аминокислоты, которые назначаются как на короткий, так и длительный периоды.
Из других методов лечения АтД следует указать фототерапию и системную терапию, которые постоянно совершенствуются. Среди методов фототерапии наиболее эффективными считаются узкополосная средневолновая терапия с длиной волны 311 нм и ультрафиолетовая длинноволновая терапия с длиной волны 340–400 нм.
Препараты для системной терапии АтД, рекомендуемые при тяжелом течении болезни, представлены в табл. 4. Данные препараты обладают выраженным иммуносупрессивным или цитостатическим действием. Они способны подавлять пролиферацию Т-лимфоцитов и высвобождение провоспалительных цитокинов.
Данные литературы свидетельствуют, что каждый из представленных препаратов для системной терапии АтД может быть эффективным для конкретного больного. Однако они имеют ряд побочных реакций, для предупреждения которых следует строго придерживаться выполнения инструкций к данным препаратам. Очень важно оценивать риск и пользу при назначении этих препаратов.
В период обострения АтД, протекающего с выраженным зудом кожных покровов, нарушением сна, имеющих другие аллергические появления, назначаются антигистаминные препараты.
Характерные особенности АтД, отличающие его от других заболеваний кожи, требуют постоянного применения средств наружной терапии. В клиническую практику предложен и внедрен новый подход к проведению наружной терапии АтД. Смысл этого подхода заключается в использовании активных наружных средств не только в период обострений, но и в период ремиссий, когда сохраняются патологические изменения в коже даже без видимых признаков воспаления [31–33]. В соответствии с клиническими проявлениями заболевания и локализацией очагов поражения используются различные лекарственные средства и различные их формы. Для купирования острых проявлений АтД применяются нестероидные и стероидные противовоспалительные наружные средства (табл. 5).
Эффективность топических кортикостероидов при АтД хорошо изучена в многочисленных исследованиях. Они по-прежнему остаются «золотым стандартом» для лечения обострений АтД. Они обладают противовоспалительным, противоаллергическим, иммуносупрессивным и антипролиферативным эффектами, которые реализуются через достаточно хорошо изученные механизмы. Они тормозят синтез цитокинов ИЛ-1, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, GM-CSF. Противовоспалительный эффект осуществляется за счет связывания с глюкокортикостероидными (ГКС) рецепторами, расположенными внутри клеток-мишеней. На клеточном уровне выраженное противовоспалительное и антипролиферативное действие топических ГКС связано с ингибированием маркеров воспаления в эндотелиальных клетках и молекул адгезии эндотелия сосудов. Универсальный механизм действия топических ГКС позволяет эффективно контролировать АтД на любой стадии болезни. В настоящее время выделяют несколько классов топических ГКС в зависимости от степени их активности (в Европе I–IV, в США — I–VII).
Топические ГКС применяют строго в соответствии с инструкциями. Они наносятся на пораженные участки кожи 1–2 раза в сутки, длительность до 5–10 дней. Побочные эффекты возникают в случаях неконтролируемого длительного применения без учета локализации очагов поражения.
Для восстановления функций эпидермального барьера в настоящее время используют целый ряд увлажняющих средств, или эмолентов. Регулярное использование этих средств составляет основу базовой терапии АтД. Средства по уходу за кожей в зависимости от цели их применения подразделяют на очищающие, увлажняющие, питательные и противовоспалительные. Их подразделяют также на традиционные (индифферентные) и современные средства лечебной дерматологической косметики [34]. Вещества (вазелин, силикон, парафин) создают на поверхности кожи водонепроницаемую пленку и предотвращают потерю влаги и устраняют сухость кожи. Гигроскопические вещества (глицерин, гиалуроновая кислота, компоненты естественного увлажняющего фактора: мочевина, аминокислоты и др.) способны удерживать влагу. Репаративные вещества (декспантенол, витамины) способствуют регенерации кожи. Комплексы микроэлементов (медь, цинк, марганец) обладают заживляющими свойствами. Клиническая эффективность эмолентов при АтД была продемонстрирована в нескольких мультицентровых исследованиях [35–38]. Особенно важно сочетать эмоленты с топическими ГКС, что позволяет достичь «стероидсберегающего эффекта» и уменьшить потребность применения активных противовоспалительных средств [39].
В настоящее время активно изучаются топические препараты из группы ингибиторов фосфодиэстеразы-4, фермента, который регулирует метаболизм циклического аденозинмонофосфата (цАМФ) в иммунных клетках [40]. Они подавляют все фазы воспаления (синтез и продукция провоспалительных цитокинов, выделение свободных радикалов, пролиферация фибробластов, выделение протеолитических ферментов). Для терапии АтД предложены топические формы (крем ципамфиллина и крем крисоборола), эффективность которых в настоящее время исследуется.
В последние годы большой интерес вызывают препараты таргетной терапии, действие которых направлено на определенные иммунопатогенетические механизмы АтД (табл. 6), а именно повышение устойчивости к воздействию специфических антигенов, подавление Th2-иммунного ответа, а также воздействие на определенные белки, которые участвуют в развитии воспаления.
Некоторые препараты, такие как омализумаб, ингибиторы ФНО-α, ИФН-γ, пока не зарегистрированы для лечения АтД. Они применяются при других аллергических и воспалительных заболеваниях.
Активно изучается эффективность и безопасность целого ряда биологических препаратов (рекомбинантных и человеческих), воздействующих на определенные мишени: антагонисты ИЛ-1R, ИЛ-2, ИЛ-4, ИЛ-5, ФНО-α и его рецепторов, ИЛ-8, ИЛ-31. Интересны исследования, посвященные изучению применения препаратов ИФН-γ при АтД [41].
Наиболее перспективным и обнадеживающим препаратом является дупилумаб, который обладает направленным действием на α-субъединицу рецептора ИЛ-4 (ИЛ4-Rα], которая является общей для рецепторов ИЛ-4 и ИЛ-13. Данный препарат уже зарегистрирован в ряде стран Европы, Азии и Америки.
Таким образом, очевидно, что системная иммунотерапия не может быть одинаково эффективна для всех больных АтД. Для них нужна индивидуальная схема лечения в зависимости от участия конкретных иммунных механизмов в каждом конкретном случае. Системная иммунотерапия показана при отсутствии контроля заболевания с помощью стандартных схем терапии. Они показаны в тех случаях, когда тяжесть течения АтД существенно влияет на повседневную активность, психоэмоциональное состояние пациента и оказывает негативное влияние на качество жизни больного.
Еще одним методом, широко применяемым при АтД, является энтеросорбция, смысл которой заключается в выведении из организма аллергенов и токсинов. Для этого используются энтеросорбенты — препараты медицинского назначения, обладающие высокой сорбционной емкостью, не разрушающиеся в желудочно-кишечном тракте (ЖКТ) и способные связывать экзо- и эндогенные вещества путем адсорбции, ионообмена или комплексообразования.
Особый интерес представляет «Комплекс с пектином Жидкий уголь для детей», в состав которого входит пектин, инулин и экстракт семян фенхеля. Пектин — пищевое волокно, которое обладает адсорбирующим действием и поэтому связывает и выводит из организма тяжелые металлы, радионуклиды, аллергены, токсические вещества, а также защищает слизистые от раздражения за счет обволакивающего действия. Пектин обладает более высокой сорбционной емкостью по сравнению с другими сорбентами на основе пищевых волокон, лигнина и активированного угля, не травмирует слизистую оболочку желудочно-кишечного тракта и способствует ее репарации. Второй компонент данного комплекса — инулин, который является эффективным пребиотиком. Инулин утилизируется бифидо- и лактобактериями, способствует их росту. При приеме инулина происходит улучшение нарушенного баланса микроорганизмов в кишечнике. Инулин обладает «обволакивающим действием», защищая слизистые оболочки желудка и частично кишечника от механического раздражения пищей. Инулин способен уменьшить действие токсических веществ при попадании в желудок. Третий компонент комплекса — экстракт плодов (семен) фенхеля. Основной составляющей экстракта фенхеля является эфирное масло, которое содержит трансанетол, фенхон, эстрагол, лимонен и другие компоненты. Кроме того, в состав входят флавоноиды, жирные кислоты и сахара.Препараты плодов фенхеля стимулируют пищеварение, усиливают секрецию и перистальтику ЖКТ, обладают спазмолитическим, ветрогонным, антимикробным и слабым противовоспалительным действием.
По данным клинического исследования применение «Комплекса с пектином Жидкий уголь для детей» в комплексной терапии АтД у детей по сравнению со стандартной терапией позволило уменьшить тяжесть основных симптомов заболевания, сократить сроки купирования гиперемии кожи на 27,7%, зуда кожи на 41,2%, сухости кожи на 20,3%, а также сократить сроки купирования запора на 24,6% [42].
Актуальным на сегодняшний день является поиск значимых специфических иммунологических и воспалительных маркеров АтД. Это поможет для разработки новых лекарственных средств направленного действия, а также даст возможность заранее проводить отбор пациентов, которым необходимо лечение определенными препаратами, что существенно повысит эффективность терапии.
Литература
- Аллергология и иммунология: национальное руководство / Под ред. Р. М. Хаитова, Н. И. Ильиной. М.: ГЭОТАР-Медиа, 2009.
- Астафьева Н. Г., Еремина М. Г., Еремин А. В. Индивидуальное бремя атопического дерматита // Саратовский науч.-мед. журнал. 2013. Т. 9, № 3. С. 543–548.
- Ревякина В. А. Этапная терапия атопического дерматита у детей // Consilium Medicum. Педиатрия. 2015, № 1. С. 50–53.
- Mortz C. G. Atopic dermatitis from adolescence to adulthood in the TOACS cohort: prevalence, persistence and comorbidities // Allergy. 2015, vol. 70, № 7, p. 836–845.
- Gustaffson D., Sjoberg O., Foucard T. Development of allergies and asthma in infants and young children with atopic dermatitis — a prospective follow-up to 7 years of age // Allergy. 2000, vol. 55, № 3, p. 240–245.
- Schneider L. Study of the Atopic March: Development of Atopic Comorbidities // Pediatr Dermatol. 2016, vol. 33, № 4, p. 388–398.
- Buddenkotte J., Steinhoff M. Pathophysiology and therapy of pruritus in allergic and atopic diseases // Allergy. 2010, vol. 65, № 7, p. 805–821.
- Schulte-Herbruggen O. Clinical relevance of nerve growth factor serum levels in patients with atopic dermatitis and psoriasis // Int. Arch. Allergy Immunol. 2007, vol. 144, № 3, p. 211–216.
- Heratizadeh A. Atopic dermatitis: new evidence on the role of allergic inflammation // Curr Opin. Allergy Clin. Immunol. 2016, vol. 16, p. 458–464.
- Yohe S., Thyagarajan B. Review of Clinical Next-Generation Sequencing // Arch. Pathol. Lab. Med. 2017, vol. 141, № 11, p. 1544–1557.
- Li W. Prevention of oral food allergy sensitization via skin application of food allergen in a mouse model // Allergy. 2012, vol. 67, № 5, p. 622–629.
- Ring J., Mohrenschlager M., Weidinger S. Molecular genetics of atopic eczema // Chem. Immunol. Allergy. 2012, vol. 96, p. 24–29.
- Фрейдин М. Б. Генетика атопии: современное состояние // Вестник ВОГиС. 2006, t. 10, № 3, с. 153–159.
- Ruether A. Filaggrin loss-of-function variant contributes to atopic dermatitis risk in the population of Northern Germany // Br. J. Dermatol. 2006, vol. 155, № 5, p. 1093–1094.
- Irvine A. D., McLean W. H., Leung D. Y. Filaggrin mutations associated with skin and allergic diseases // N. Engl. J. Med. 2011, vol. 365, № 14, p. 1315–1327.
- Levin J. S., Friedlander F., del Rosso J. Q. Atopic dermatitis and the stratum corneum: part 1: the role of filaggrin in the stratum corneum barrier and atopic skin // J. Clin. Aesthet. Dermatol. 2013, vol. 6, № 10, p. 16–22.
- European Dermatology Forum (EDF), the European Academy of Dermatology and Venereology (EADV), the European Academy of Allergy and Clinical Immunology (EAACI), the European Task Force on Atopic Dermatitis (ETFAD), European Federation of Allergy and Airways Diseases Patients’ Associations (EFA), the European Society for Dermatology and Psychiatry (ESDaP), the European Society of Pediatric Dermatology (ESPD), Global Allergy and Asthma European Network (GA2LEN) and the European Union of Medical Specialists (UEMS). Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II // J. Eur. Acad. Dermatol. Venereol. 2018, vol. 32, № 6, p. 850–878.
- Guidelines for treatment of atopic eczema (atopic dermatitis) part I // J. Eur. Acad. Dermatol. Venereol. 2012, vol. 26, № 8, p. 1045–1060.
- Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis // J. Am. Acad. Dermatol. 2014, vol. 70, № 2, p. 338–351.
- Brenninkmeijer E. E. Diagnostic criteria for atopic dermatitis: a systematic review // Br. J. Dermatol. 2008, vol. 158, № 4, p. 754–765.
- Oranje A. P. Practical issues on interpretation of scoring atopic dermatitis: SCORAD Index, objective SCORAD, patient-oriented SCORAD and Three-Item Severity score // Curr. Probl. Dermatol. 2011, vol. 41, p. 149–155.
- Pucci N. Scoring atopic dermatitis in infants and young children: distinctive features of SCORAD index // Allergy. 2005, vol. 60, № 1, p. 113–116.
- Schmitt J. The Harmonising Outcome Measures for Eczema (HOME) statement to assess clinical signs of atopic eczema in trials // J. Allergy Clin. Immunol. 2014, vol. 134, № 4, p. 800–807.
- Leung D. Y., Guttman Yassky E. Deciphering the Complexities of Atopic Dermatitis: Shifting Paradigms in Treatment Approaches // J. Allergy Clin. Immunol. 2014, 134, № 4 (Oct.), p. 769–779.
- Marenholz I. Meta-analysis identifies seven susceptibility loci involved in the atopic march // Nat.Commun. 2015, vol. 6; № 6, p. 8804–8810.
- Shaker M. New insights into the allergic march // Curr Opin. Pediatr. 2014, vol. 26, № 4, p. 516–520.
- Antúnez C. Cytokine production, activation marker, and skin homing receptor in children with atopic dermatitis and bronchial asthma // Pediatr Allergy Immunol. 2006, vol. 17, № 3, p. 166–174.
- Hae-Jin L., Seung-Hun L. Epidermal permeability barrier defects and barrier repair therapy in atopicdermatitis // Allergy Asthma Immunology Res. 2014, vol. 6, № 4, p. 276–287.
- Lee S. H., Jeong S. K. An update of the defensive barrier function of skin // Med. J. 2006, vol. 47, № 3, p. 293–306.
- Bouwstra J. A., Pilgrim K., Ponec M., Elias M. K., Feingold R. Structure of the skin barrier, in Skin barrier. New York: Naylor and Francis, 2006. 65 p.
- Cork M. J. Epidermal barrier dysfunction in atopic dermatitis // J. Invest. Dermatol. 2009, vol. 129, № 8, p. 1892–1908.
- Baek H. Acute modulations in stratum corneum permeability barrier function affect claudin expression and epidermal tight junction function via changes of epidermal calcium gradient // Yonsey Med. J. 2013, vol. 54, № 2, p. 523–528
- Sugavara T. Tight junction dysfunction in the stratum granulosum leads to aberrant stratum corneum barrier function in claudin-1-deficient mice // J. Dermatol. Sci, 2013, vol. 70, № 1, p. 2–18.
- Миченко А. В., Жукова О. В., Львов А. Н. Атопический дерматит: новые горизонты наружной терапии // Фарматека. 2017, № S4, с. 50–53.
- Callen A. Systematic review of the safety of topical therapies for atopic dermatitis // Br. J. Dermatol. 2007, vol. 156, № 2, p. 203–221.
- Maneechotesuwan K. Suppression of GATA-3 nuclear import and phosphorylation: A novel mechanism of corticosteroid action in allergic disease // PLoS Med, 2009, vol. 6, e1000076.
- Дерматовенерология. Национальное руководство. Краткое издание. М., 2013.
- Korting H. C. Efficacy and tolerability of pale sulfonated shale oil cream 4% in the treatment of mild to moderate atopic eczema in children: a multicentre, randomized vehicle-controlled trial // J. Eur. Acad. Dermatol. Venereol. 2010, vol. 24, № 10, p. 1176–1182.
- Grimalt R., Mengeaud V., Cambazard F. The steroid-sparing effect of an emollient therapy in infants with atopic dermatitis: a randomized controlled study // Dermatology. 2007, vol. 214, № 1, p. 61–67.
- Ohba F. Efficacy of a novel phosphodiesterase inhibitor, E6005, in patients with atopic dermatitis: An investigatorblinded, vehicle-controlled study // J. Dermatolog. Treat. 2016, vol. 27, № 5, p. 467–472.
- Noh G., Jang H. Dual specific oral tolerance induction using interferon gamma for IgE-mediated anaphylactic food allergy and the dissociation of local skin allergy and systemic oral allergy: tolerance or desensitization? // J. Investig. Allergol. Clin. Immunol. 2014, vol. 24, № 2, p. 87–97.
- Данилова Е. И., Трусова О. Ю., Рощупкин А. Н., Ветеркова З. А. и др. Эффективность энтеросорбента на основе пектина, инулина и экстракта фенхеля в комплексной терапии детей с атопическим дерматитом: ретроспективное сравнительное (по типу «случай-контроль») исследование. // Вопросы современной педиатрии. 2016. № 15 (3). С. 268–272.
В. А. Ревякина*, 1, доктор медицинских наук, профессор
А. В. Таганов**
Е. Д. Кувшинова*
И. А. Ларькова*, кандидат медицинских наук
В. А. Мухортых*
* ФГБУН ФИЦ ПБ, Москва
** ФГАОУ ВО РУДН, Москва
1 Контактная информация: 5356797@mail.ru
Атопический дерматит, современная стратегия в терапии/ В. А. Ревякина, А. В. Таганов, Е. Д. Кувшинова, И. А. Ларькова, В. А. Мухортых
Для цитирования: Лечащий врач № 5/2019; Номера страниц в выпуске: 32-37
Теги: заболевания кожи, высыпания, зуд, аллергия