Целиакия у детей
Версия: Клинические рекомендации РФ 2013-2017 (Россия)
Категории МКБ:
Целиакия (K90.0)
Разделы медицины:
Гастроэнтерология детская, Педиатрия
Общая информация
Краткое описание
Союз педиатров России
Клинические рекомендации
Целиакия у детей
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
Целиакия (глютеновая энтеропатия) — хроническая генетически детерминированная аутоиммунная Т-клеточно-опосредованная энтеропатия, характеризующаяся стойкой непереносимостью специфических белков эндосперма зерна некоторых злаковых культур с развитием атрофической энтеропатии и связанного с нею синдрома мальабсорбции.
Существует и другое определение (ESPGHAN 2012).
Целиакия – иммуноопосредованное системное заболевание, которое возникает в ответ на употребление глютена или соответствующих проламинов генетически предрасположенными индивидуумами и характеризуется наличием широкой комбинации глютен-зависимых клинических проявлений, специфических антител (антител к тканевой трансглутаминазе TG2, антител к эндомизию (EMA), антител к деамидированым пептидам глиадина (DGP), наличием HLA-DQ2 или HLA-DQ8 гаплотипов и энтеропатии.
Эти определения не противоречат друг другу, однако в последнем подчеркивается системный (полиорганный) характер аутоиммунного процесса при целиакии и необходимость комплексного подхода к ее диагностике.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Кодирование по МКБ-10
K90.0 — Целиакия
Классификация
В соответствии с клинической картиной и результатами лабораторных исследований ранее было принято выделять следующие формы заболевания:
• типичную целиакию, характеризующуюся наличием в клинической картине симптомов мальабсорбции: хронической диареи, истощения, «дефицитных» симптомов как следствие нарушения всасывания минеральных веществ и витаминов;
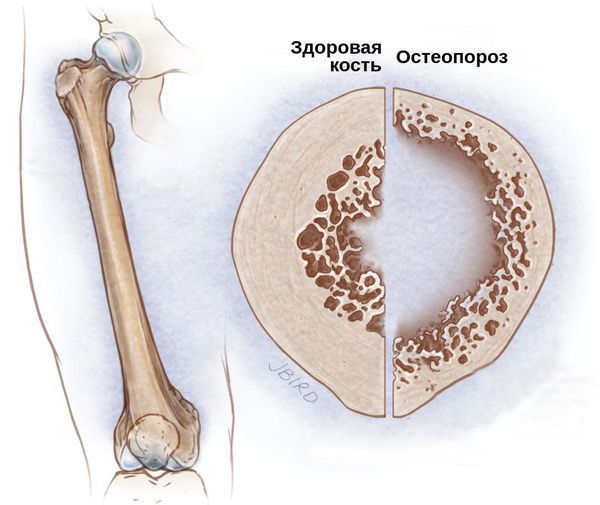
• атипичную целиакию, при которой гастроинтестинальные симптомы отсутствуют или слабо выражены, в то время как в клинической картине на первое место выходят внекишечные проявления, такие как остеопороз, анемия, бесплодие, неврологические симптомы и др.
При типичной и атипичной форме заболевания гистологическая картина характеризуется наличием атрофической энтеропатии, а в сыворотке крови определяется повышенный уровень специфических антител.
В настоящее время разделение целиакии на «типичную» и «атипичную» не может считаться целесообразным, так как «атипичные» формы заболевания встречаются значительно чаще «типичных».
Говоря о клинической картине целиакии, в настоящее время выделяют симптомные (с гастроэнтерологическими симптомами и внекишечными проявлениями) и бессимптомные формы заболевания.
У пациентов с бессимптомной (скрытой) формой целиакии отсутствуют какие-либо проявления заболевания. Диагноз в этом случае устанавливается в ходе скрининговых обследований или при обследовании родственников.
Вопрос о выделении потенциальной целиакии (наличие повышенного уровня специфических антител и характерных генетических маркеров при нормальной структуре СОТК) на настоящий момент остается дискуссионным.
Рефрактерная целиакия характеризуется отсутствием ответа (клинического, серологического, морфологического) на безглютеновую диету. Рефрактерная форма целиакии (при безусловном исключении нарушений безглютеновой диеты) совершенно не характерна для детей и требует продолжения диагностического поиска.
Выделяют периоды заболевания: латентный, клинической манифестации (активный), ремиссии, декоменсации.
Латентный период продолжается от момента введения глютена до начала клинических проявлений заболевания и может продолжаться от нескольких дней до многих лет. Чаще не диагностируется, может быть выявлен при целенаправленном диагностическом поиске в группах риска.
Активный период (период клинической манифестации).
Период неполной ремиссии (начальная ремиссия) наступает, как правило, спустя 3 – 6 месяцев после назначения строгой безглютеновой диеты; отмечается уменьшение выраженности основных симптомов, снижение титров специфических антител, при наличии определенных признаков атрофической энтеропатии в СОТК;
Период полной ремиссии (клинико-серологическая, морфологическая ремиссия) возможен не ранее, чем через 1 – 1,5 года от начала строгой безглютеновой диеты и характеризуется отсутствием специфических антител и нормализацией морфологической структуры слизистой оболочки тонкой кишки.
При несоблюдении безглютеновой диеты заболевание вновь переходит в активный период (декомпенсации).
Примеры формулировки диагнозов.
• Целиакия, симптомная (типичная) форма, период манифестации; белково-энергетическая недостаточность питания (кахексия); синдром экссудативной энтеропатии;
• Целиакия, симптомная, период манифестации, железодефицитная анемия;
• Целиакия, симптомная, остеопения;
• Инсулин-зависимый сахарный диабет. Целиакия;
• Аутоиммунный тиреоидит. Целиакия.
Этиология и патогенез
Основным этиологическим фактором развития целиакии является белковый компонент клейковины некоторых злаковых культур. Токсичными для больных являются растворимые в этаноле белки эндосперма зерна пшеницы (глиадины), ржи (секалины) и ячменя (хордеины), которые объединены в медицинской литературе общим названием «глютен».
Из рекомбинантного α2-глиадина выделен 33-мерный пептид LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPH, идентифицированный как инициатор иммуновоспалительного ответа. Благодаря высокому содержанию пролина, данный полипептид устойчив к воздействию всех желудочных, панкреатических и интестинальных протеиназ; его гомологи присутствуют во всех зерновых, токсичных при целиакии, и отсутствуют в нетоксичных злаках. В настоящее время накоплено достаточно данных, позволяющих расценивать целиакию как генетически детерминированное заболевание.
Среди ближайших родственников больных частота целиакии составляет 20%, а конкордантность среди монозиготных близнецов достигает 86%.
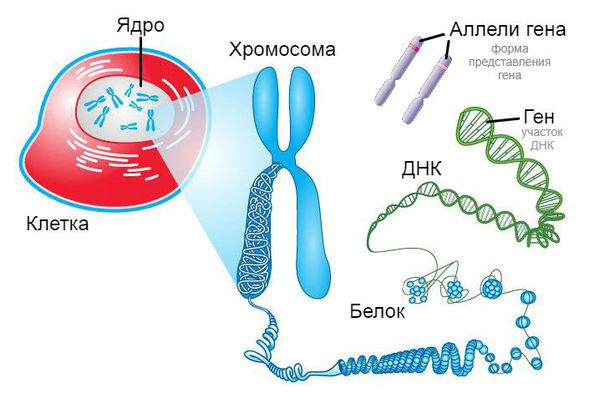
Доказана ассоциация целиакии с антигенами главного комплекса гистосовместимости человека (MCH II) HLA-DQ2.5 (DQA1*05, DQB1*02) и HLA-DQ8 (DQA1*03, DQB1*0302), расположенными на 6р21 хромосоме. Гаплотип HLA-DQ2.5 выявляется у 90-95% пациентов, HLA-DQ8 — у остальных 5-10%. Отсутствие в генотипе типичных для целиакии аллелей делает развитие заболевание невозможным.
Центральным событием патогенеза целиакии является связывание пептидов глиадина с HLA-DQ2/DQ8 молекулами для презентации их глютен-специфическим CD4+ Т лимфоцитам с последующим развитием иммуновоспалительного процесса в слизистой оболочке тонкой кишки (СОТК). Важную роль в модификации пептидов глиадина играет тканевая трансглутаминаза-2 (ТТГ), фермент, катализирующий реакцию деамидирования аминокислот с заменой глутамина на глутаминовую кислоту. Под действием тканевой трансглутаминазы в молекуле глиадина формируются отрицательно заряженные эпитопы, что повышает сродство (аффинность) пептидов к соответствующим связывающим участкам молекул DQ2 и DQ8 и способствует прочному соединению HLA молекулы с рецепторами Т лимфоцитов (рис. 1).
Рис. 1 — Презентация пептидов глиадина Т лимфоцитам в составе молекул HLA
Активированные CD4 клетки продуцируют провоспалительные цитокины (IFNγ, TNFα, TNFβ, IL10, IL1β, TGFβ), повреждающие эпителиоциты слизистой оболочки кишечника, а также стимулируют В лимфоциты к продукции антител к глиадину, тканевой трансглутаминазе и структурам СОТК (эндомизию), которые попадают в системную циркуляцию и могут быть выявлены при проведении серологического исследования (рис. 2).
Рис. 2 — Патогенез целиакии.
Образующиеся иммунные комплексы могут быть выявлены как в слизистой оболочке тонкой кишки, так и в других органах и тканях, включая печень, головной мозг и периферические нервы, лимфатические узлы, почки, кожу, что обуславливает многообразие (системность) клинических проявлений целиакии.
Целиакию можно считать мультифакториальным заболеванием, где наряду с генетической предрасположенностью и токсическим действием глютена, определенное значение имеют средовые факторы, роль которых в развитии заболевания требует дальнейшего изучения.
Эпидемиология
Скрининговые сплошные эпидемиологические исследования, проведенные за последние 25 лет с использованием высокочувствительных серологических методов, свидетельствуют о том, что частота встречаемости целиакии в странах Европы и Северной Америки достигает 1% (1:100), при этом соотношение между диагностированными и недиагностированными случаями составляет 1:5 – 1:13. В клинической картине в настоящее время преобладают малосимптомные и скрытые формы заболевания, что существенно затрудняет процесс постановки диагноза. Поздняя диагностика значительно увеличивает риск развития серьезных осложнений, таких как бесплодие, остеопороз, неврологические нарушения и онкологические заболевания (в частности, Т-клеточная лимфома тонкой кишки). Об увеличении частоты заболевания свидетельствуют исследования, проведенные в cтранах Ближнего Востока, Северной Африки, Южной Америке, Индии, Австралии и Новой Зеландии. В нашей стране крупных эпидемиологических исследований до настоящего времени не проводилось. Отдельные данные из регионов свидетельствуют о частоте заболевания от 1:85 в группах риска в Рязани (Стройкова М.В., 2006) до 1,2:1000 в Томске (Кондратьева Е.И., 2007). Предполагаемая частота заболевания в России может составлять 1:100 — 1:250.
Клиническая картина
Cимптомы, течение
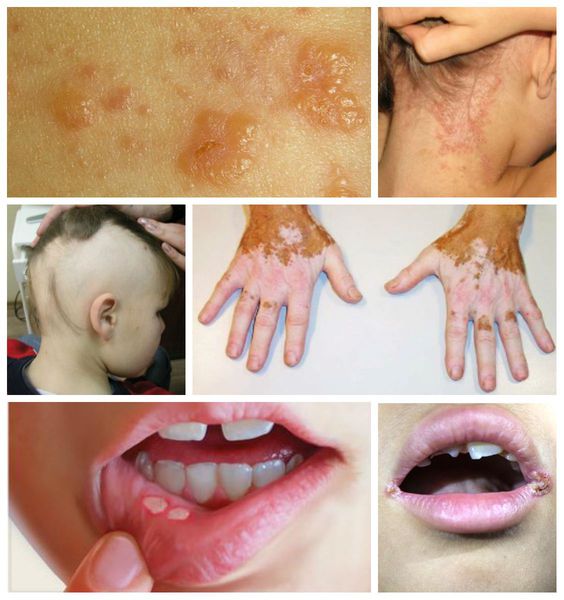
Наиболее яркие симптомы заболевания, как правило, отмечаются у детей первых лет жизни, при этом в клинической картине доминируют гастроинтестинальные проявления (табл. 1).
Таблица 1 — Клинические проявления целиакии у детей раннего возраста
| Гастроинтестинальные симптомы |
• боли в животе • диарея, обильный зловонный стул • стеаторея • метеоризм, увеличение живота • рвота • стойкие запоры • нарушение аппетита |
| Неспецифические симптомы |
• задержка физического развития • потеря в весе • мышечная гипотония • апатия, негативизм |
У подростков и взрослых пациентов в клинической картине часто доминируют внекишечные проявления (табл. 2).
Таблица 2 — Клинические проявления целиакии у детей старшего возраста
| Неспецифические симптомы |
• хроническая усталость • слабость, утомляемость • раздражительность |
|
Гастроинтестинальные симптомы |
• рецидивирующие боли в животе • вздутие живота • тошнота • запоры • повышение печеночных трансаминаз |
|
Изменения со стороны кожи и слизистых |
• герпетиформный дерматит • алопеция • витилиго • атопический дерматит • афтозный стоматит, хейлиты |
|
Изменения со стороны костной системы |
• боли в костях • остеопороз, остеомаляция, повторные переломы • артриты, боли в суставах • множественный кариес, дефект зубной эмали • низкий рост |
| Гематологические проявления |
• рефрактерная к терапии железодефицитная или В12 дефицитная анемия • кровотечения |
| Неврологические проявления |
• головные боли • нарушения сна • депрессия • полинейропатия • атаксия |
|
Нарушения репродуктивной функции |
• задержка полового развития • женское и мужское бесплодие • привычное невынашивание беременности, спонтанные аборты, мертворождения |
При диагностике целиакии необходимо помнить о высокой частоте ее ассоциации с рядом аутоиммунных и генетических заболеваний (табл. 3).
Таблица 3 — Ассоциированные с целиакией заболевания
|
Заболевания эндокринной системы |
Сахарный диабет I типа Аутоиммунные заболевания щитовидной железы Болезнь Аддисона Нарушения репродуктивной функции |
| Неврологические заболевания |
Мозжечковая атаксия Нейропатия |
|
Заболевания сердечно-сосудистой системы |
Идиопатическая дилатационная кардиомиопатия Аутоиммунный миокардит |
|
Заболевания гепатобилиарной системы |
Первичный билиарный цирроз Аутоиммунный гепатит Аутоиммунный холангит Синдром Шегрена |
| Хромосомные аномалии |
Синдром Дауна Синдром Шерешевского-Тернера Синдром Вильямса |
| Другие заболевания |
Ревматоидный артрит Болезнь Крона Язвенный колит Селективный дефицит IgA |
Диагностика
Жалобы и анамнез
В типичном случае целиакия манифестирует через 1,5 – 2 месяца после введения в рацион питания ребенка глютенсодержащих продуктов (сухарики, хлеб, сушки, баранки, манная (пшеничная) каша, мультизлаковая каша). Иногда манифестация целиакии у детей происходит после перенесенных инфекционных заболеваний (кишечных или респираторных инфекций), однако часто заболевание начинается без видимой причины.
Клинические симптомы целиакии появляются, в большинстве случаев, постепенно. Появляется свойственный для целиакии обильный пенистый, жирный, зловонный стул, нарушение аппетита, беспричинная рвота, потеря массы тела. Родители обращают внимание на нарушения поведения – появляется раздражительность, негативизм, апатия, нарушается сон, исчезает интерес к окружающему.
Старшие дети жалуются на боли в животе, которые чаще имеют непостоянный, «тупой» характер и локализуются преимущественно в околопупочной области.
Физикальное обследование: эмоциональный тонус, аппетит ребенка, наличие тошноты/рвоты, болей в животе, характер стула (диарея, запор, полифекалия), показатели нутритивного статуса (масса тела, рост), тургор тканей, наличие отеков, псевдоатрофии проксимальных групп мышц, увеличение, вздутие живота, симптомы рахита, гиповитаминозов.
Лабораторная диагностика
• Рекомендуется определение антител к тканевой трансглутаминазе [1-4].
(Сила рекомендаций – 1; достоверность доказательств – А)
Комментарии: диагностически значимым является выявление антител класса IgА, образующихся в слизистой оболочке. Учитывая, что с целиакией в 5-10% случаев ассоциирован селективный дефицит иммуноглобулина A, общий уровень IgA должен обязательно определяться при первичном серологическом обследовании. В случае выявлении низкого уровня общего IgA, дальнейшее серологическое обследование должно строиться на определении специфических антител класса IgG. Антитела к тканевой трансглутаминазе (anti-tTG) определяют иммуноферментными методом (ELISA). Метод характеризуется высокой чувствительностью (98%).
Специфичность метода ниже, что связано с возможностью повышения антител к тканевой трансглутаминазе у пациентов с аутоиммунными и онкологическими заболеваниями, патологией печени и сердечно-сосудистой системы, у детей с персистирующей герпетической инфекцией, распространенным атопическим дерматитом. Определение антител к тканевой трансглутаминазе является в настоящее время методом выбора при проведении скрининговых исследований с целью отбора пациентов для дальнейшего эндоскопического обследования). Для экспресс-диагностики целиакии в настоящее время разработаны быстрые тесты (POC tests), позволяющие в течение 10 минут оценить уровень антител к тканевой трансглутаминазе в капиллярной крови пациентов. В качестве субстрата для определения антител данный метод использует собственную трансглутаминазу, находящуюся в эритроцитах крови.
• Рекомендуется определение антител к эндомизию [1-4]
(Сила рекомендаций – 1; достоверность доказательств – А)
Комментарии: Антитела к эндомизию (EMA) в качестве своего субстрата также имеют тканевую трансглутаминазу, расположенную в межклеточном веществе, окружающем гладкомышечные элементы собственной пластинки слизистой оболочки тонкой кишки. EMA определяются методом непрямой иммунофлуоресценции с использованием в качестве субстрата тканей пищевода обезьян или пуповины человека. Метод полуколичественный, имеет высокую чувствительность и специфичность, однако требует специального оборудования, а оценка результатов исследования является субъективной и зависит от квалификации специалистов. Ранее в диагностике целиакии широко использовались антиглиадиновые антитела (AGA). В настоящее время показано, что антитела к глиадину могут появляться у пациентов с воспалительными заболеваниями кишечника, различными вариантами пищевой аллергии и др. Ввиду недостаточной специфичности метода, а также низкой прогностической ценности положительных и отрицательных результатов, определение уровня АGА в настоящее время не рекомендуется в комплексе диагностических мероприятий при подозрении на целиакию.
• Рекомендуется определение антител к деамидированным пептидам глиадина [1,2,5,6]
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: более специфичным маркером целиакии, по сравнению с АGА, могут быть антитела к деамидированным пептидам глиадина (aDPG). Антитела к деамидированным пептидам глиадина по чувствительности и специфичности не превосходят anti-tTG и EMA (1В). Для детей младше 2 лет определение антител к тканевой к тканевой трансглутаминазе должно сочетаться с определением антител к деамидированным пептидам глиадина.
• Рекомендуется проведение скрининговых серологических исследований пациентам с аутоиммунными и эндокринологическими заболеваниями, так как они входят в группу риска по развитию целиакии [1,2].
(Сила рекомендации 1; уровень доказательств А).
Комментарий: Своевременное выявление целиакии и назначение безглютеновой диеты может предотвратить как прогрессирование основного заболевания, так и развитие тяжелых необратимых осложнений целиакии, включая Т-клеточную лимфому и другие виды злокачественных новообразований (аденокарцинома желудка и кишечника, сквамозный рак пищевода).
• Рекомендовано проведение серологической диагностики всем пациентам проводить до назначения лечебной диеты на фоне употребления обычного количества глютенсодержащих продуктов. Ограничение или исключение глютена в рационе может привести к быстрому снижению титра специфических антител, что сделает дальнейший диагностический поиск затруднительным, а иногда и невозможным [1].
(Сила рекомендации 1; уровень доказательств А).
• Рекомендовано проведение генетического исследования [1-4,9].
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: Генетическое исследование предполагает определение наличия у пациента характерных аллелей HLA-DQ2/DQ8. HLA-DQ2 гетеродимер кодируется в цис-конфигурации HLA-DR3-DQA1*0501 DQB1*0201, в транс-конфигурации HLADR11-DQA1*505 DQB1*0301; DR7 – DQA1*0201 DQB1*0202; DQ8 – гетеродимер кодируется DQA1*0301 DQB1*0302. Отрицательные результаты генетического типирования имеют высокую прогностическую ценность, позволяя исключить целиакию. Наличие данных гаплотипов у 30% здорового населения не позволяет использовать данное исследование в качестве скринингового метода и не является основанием для постановки диагноза целиакии. HLA-DQ2/DQ8 генотипирование должно использоваться для исключения целиакии, перед принятием решения о необходимости проведения глютеновой нагрузки. Генетическое типирование может быть использовано для исключения диагноза целиакии в сложных диагностических случаях. Ценность генетических маркеров при этом определяется тем, что они не зависят от того, находится ли пациент в момент исследования на безглютеновой диете или нет.
Инструментальная диагностика
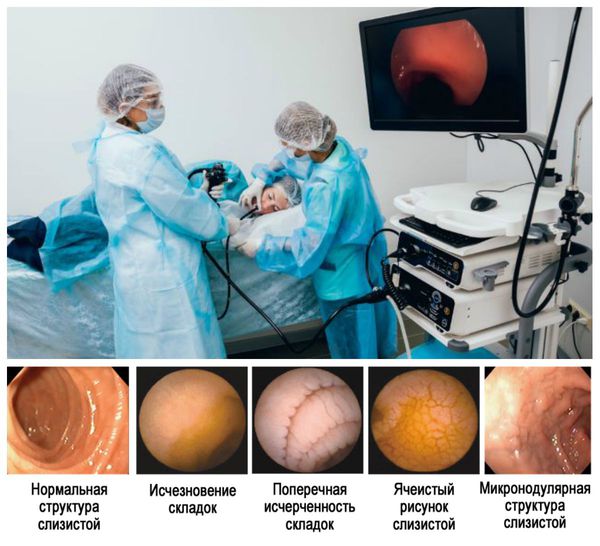
• Рекомендовано проведение эзофагогастродуоденоскопии (ЭГДС) [1-4, 7,8].
(Сила рекомендаций – 1; достоверность доказательств – А)
Комментарии: заподозрить целиакию при проведении эндоскопического исследования можно на основании таких макроскопических признаков, как уплощение или исчезновение циркулярных складок слизистой двенадцатиперстной кишки, появление поперечной исчерченности складок, ячеистого рисунка или микронодулярной структуры слизистой (рис. 3).
Рис. 3 — Эндоскопические признаки целиакии
Однако, макроскопическая картина слизистой может оставаться нормальной, что не позволяет использовать эндоскопическое исследование в качестве основного диагностического метода. Повысить диагностическую ценность эндоскопии у пациентов с целиакией стало возможным с использованием современных эндоскопов, имеющих высокую разрешающую способность, а также путем применения иммерсионной техники визуализации ворсинок слизистой – конфокальной эндоскопии.
• Рекомендовано проведение морфологической диагностики [1-4, 7,8].
(Сила рекомендаций – 1; достоверность доказательств – А)
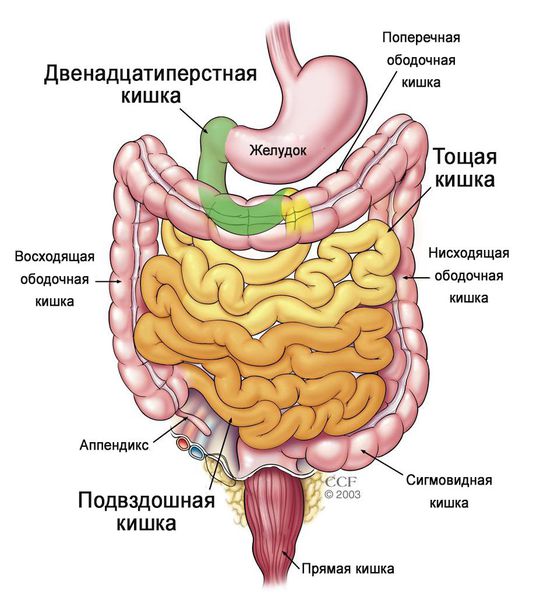
Комментарии: для постановки диагноза целиакии положительные результаты серологического исследования должны подкрепляться результатами гистологического исследования биоптатов слизистой оболочки тонкой кишки. Для выполнения качественного морфологического исследования в ходе эзофагогастродуоденоскопии (ЭГДС) необходимо произвести забор, как минимум, 4 биоптатов из луковицы и нисходящего отдела двенадцатиперстной кишки, учитывая, что повреждение слизистой при целиакии может носить неоднородный характер, а в ряде случаев атрофические изменения наблюдаются только в луковице двенадцатиперстной кишки.
Проведение морфологического исследования должно происходить на фоне употребления обычного количества глютенсодержащих продуктов. Исключение глютена из рациона может привести к быстрому восстановлению нормальной структуры слизистой оболочки, что сделает морфологическое подтверждение целиакии затруднительным, а иногда и невозможным).
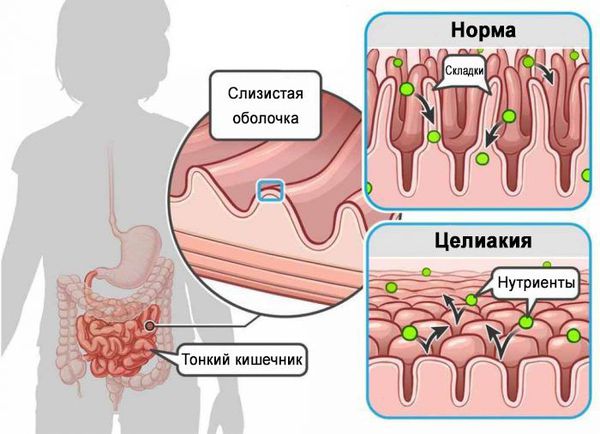
Комплекс морфологических изменений слизистой тонкой кишки, свойственных целиакии, включает: увеличение количества межэпителиальных лимфоцитов (МЭЛ), различную степень атрофии ворсинок и гиперплазию крипт.
В настоящее время для патоморфологической диагностики используется классификация степеней энтеропатии по M.N. Marsh (1992), в соответствии с которой выделяют 3 типа повреждений СОТК: 1 тип (Marsh 1) — «инфильтративный», 2 тип (Marsh 2) — «гиперпластический» и 3 тип (Marsh 3) — «деструктивный» (рис. 4).
Рис. 4 — Типы повреждения слизистой по классификации Marsh M. (1992)
В 1999 году Oberhuber G. предложил модификацию классификации Marsh, указав на необходимость определения количества межэпителиальных лимфоцитов (в пересчете на 100 эпителиальных клеток), а также выделения 3 степеней атрофических изменений. Гистологическая классификация Marsh-Oberhuber используется в диагностике целиакии до настоящего времени и включает в себя 5 типов повреждений СОТК (табл. 4, рис. 5).
Таблица 4 — Гистологическая классификация целиакии Marsh-Оberhuber (1999)
| Тип 0 | Тип 1 | Тип 2 | Тип 3а | Тип 3в | Тип 3с | |
| МЭЛ | <40 | >40 | >40 | >40 | >40 | >40 |
| Крипты | норма | норма | гипертрофия | гипертрофия | гипертрофия | гипертрофия |
| Ворсинки | норма | норма | норма |
умеренная атрофия |
выраженная атрофия |
отсутствуют |
Рис. 5 — Гистологическая классификация целиакии Marsh-Оberhuber
Выявление при микроскопическом исследовании 2, 3A-C типов повреждения, является достаточным основанием для диагностики целиакии у серопозитивных пациентов, даже при отсутствии у них клинических проявлений заболевания.
Выявление при световой микроскопии повышенного количества межэпителиальных лимфоцитов (тип 1 по Marsh-Oberhuber) не может служить основанием для диагностики целиакии и требует проведения дополнительных исследований (иммуногистохимии), результаты которых должны расцениваться в совокупности с клинической картиной заболевания, данными серологических тестов и HLA-типирования.
Сложности интерпретации Marsh 1 типа повреждений связаны с тем, что повышение количества МЭЛ может отмечаться при различных патологических состояниях, в частности: при пищевой аллергии, вирусных кишечных инфекциях, лямблиозе, аутоиммунных заболеваниях, воспалительных заболеваниях кишечника и др. Отличительной особенностью лимфоцитоза при целиакии является то, что большинство клеток несут на своей поверхности специфический Т-клеточный рецептор (TCR γδ). Эта особенность используется при проведении иммуногистохимического исследования, позволяющего определить преобладающий тип лимфоцитов в СОТК.
В 2012 г Европейское общество педиатрической гастроэнтерологии, гепатологии и нутрициологии (ESPGHAN) предложило новый алгоритм диагностики целиакии у детей, который позволяет в ряде случаев установить диагноз целиакии без проведения биопсии. У детей с симптомами, характерными для целиакии, при обнаружении титров антител к тканевой трансглутаминазе более 10 норм, положительных антител к эндомизию и наличии гаплотипов HLA DQ2 и/или DQ8 диагноз может быть подтвержден без проведения гастроскопии и биопсии (Приложение Г2). Для бессимптомных пациентов из групп риска предлагается другой алгоритм диагностики, включающий обязательную биопсию (Приложение Г3) [2].
Иная диагностика
• Рекомендуется проведение провокационного теста (нагрузка глютеном) детям,
которым была начата безглютеновая диета при отсутствии серологического и
морфологического подтверждения или в сомнительных случаях [1].
(Сила рекомендаций – 2 достоверность доказательств – С)
Комментарии: на практике приходится сталкиваться с пациентами, которым безглютеновая диета была начата при отсутствии серологического и морфологического подтверждения, или результаты первичного обследования позволяют усомниться в правильности диагноза. В таких случаях выполнение нагрузки глютеном является единственным способом верифицировать диагноз.
Перед проведением нагрузки целесообразно проведение генетического исследования – отрицательные результаты теста делают невозможным развитие целиакии и исключают необходимость проведения провокации. Выполнение провокационного теста требует обязательного проведения двух эндоскопических исследований с забором биопсий: первое – на фоне безглютеновой диеты, второе – при появлении клинических симптомов заболевания на фоне употребления в пищу глютенсодержащих продуктов или через 6 месяцев при отсутствии признаков рецидива заболевания. Нагрузку глютеном рекомендуют проводить, подсыпая глютеновый порошок в пищу и не давать пациенту пшеничного хлеба (печенья, выпечки), так как, в случае подтверждения диагноза целиакии, повторно запретить употребление этих продуктов ребенку будет очень трудно. Ежедневная доза при проведении провокации должна быть не менее 10 г глютена, что соответствует 150 г муки или 200 г пшеничного хлеба. Порошок глютена в российских условиях недоступен, поэтому в наших условиях мы рекомендуем давать пациенту ежедневно 1 порцию (примерно 250 г) манной каши или вермишели. Если биопсия, проведенная через 6 месяцев употребления глютена не выявляет никаких изменений, морфологическое исследование необходимо повторить спустя 2 года от начала нагрузки глютеном. Если структурные изменения слизистой и к этому времени отсутствуют, рекомендовано динамическое наблюдение за пациентами с проведением эндоскопического исследования при появлении симптомов или повышении уровня антител в сыворотке крови.
Дифференциальный диагноз
Дифференциальная диагностика
1. Заболевания, проявляющиеся синдромом мальабсорбции: муковисцидоз, синдром Швахмана-Даймонда, недостаточность панкреатической липазы, аутоиммунная энтеропатия, врожденная лимфангиоэктазия кишечника (синдром Вальдмана), а-бета-липопротеинемия, недостаточность трипсин-энтерокиназы.
2. Задержка роста и развития ребенка: гипофизарный нанизм, синдромальные формы низкорослости.
3. Гастроинтестинальная форма пищевой аллергии к пшенице.
Лечение
Консервативное лечение
Единственным методом лечения целиакии и профилактики ее осложнений в настоящее время является строгая пожизненная безглютеновая диета.
• Строгая безглютеновая диета рекомендуется как симптомным (Сила рекомендации 1; уровень доказательств А), так и бессимптомным пациентам [1-4,10].
(Сила рекомендации 2; уровень доказательств С).
• Включение очищенного овса в диету больному целиакией рекомендуется проводить под строгим контролем[1].
(Сила рекомендации 1; уровень доказательств В).
• Больным целиакией рекомендуется наблюдение и лечение диетолога, имеющего опыт ведения данного заболевания [1].
(Сила рекомендации 1; уровень доказательств В).
Комментарии: в основе элиминационной диетотерапии лежит полное исключение из рациона питания продуктов, содержащих глютен или его следы. Принципиально важным является отказ от употребления не только тех продуктов, которые содержат «явный» глютен (хлеб, хлебобулочные и кондитерские изделия, макаронные изделия, пшеничная/манная, ячневая/перловая крупы, булгур, кус-кус, полба, спельта, тритикале, камут), но и тех, которые содержат «скрытый» глютен, который используется в качестве пищевой добавки в процессе производства (Приложение Г1).
Ряд непищевых продуктов, которые могут попадать в организм человека, могут также содержать глютен, что следует учитывать в повседневной жизни. К таким продуктам относятся клей на почтовых марках и конвертах, некоторые сорта косметики, в т.ч. губной помады, некоторые сорта зубной пасты и др.
Лекарственные препараты также могут содержать глютен, в т.ч. таблетки, покрытые оболочкой.
Состав рациона больного целиакией зависит от возраста, тяжести состояния и периода заболевания и строится на основании общих принципов: углеводный компонент составляют за счет переносимых круп, картофеля, бобовых, овощей, фруктов, ягод; белковый и жировой – за счет мяса, яиц, рыбы, молочных продуктов, растительного и сливочного масел.
• Пациентам с «потенциальной целиакией» (наличие повышенного уровня специфических антител и характерных генетических маркеров при нормальной структуре СОТК) при отсутствии клинических симптомов рекомендуется не назначать безглютеновую диету, но продолжить наблюдение, с проведением повторной биопсии в случае появления симптоматики [1-4].
(Сила рекомедации 2; уровень доказательств С).
• В российских условиях рекомендуется исключение овса из диеты больных целиакией.
(Сила рекомендации 2; уровень доказательств С).
Комментарий: Вопрос о токсичности овса для больных целиакией остается открытым. Наиболее распространено мнение, что авенины овса не токсичны, однако овсяная крупа часто контаминирована примесями других злаков, особенно пшеницы[1].
• Для питания больных с целиакией рекомендуются специализированные безглютеновые продукты-заменители хлебобулочных, макаронных и кондитерских изделий. Рекомендованные приемлемые уровни глютена составляют <20 ppm* (20 мг/кг готового продукта) [1,10,11].
(Сила рекомендации 1; уровень доказательств В).
• Рекомендована коррекция дефицитных состояний [1,10,12].
(Сила рекомендации 1; уровень доказательств А).
Комментарии: необходимо учитывать наличие вторичных нарушений со стороны органов и систем и дефицитных состояний, которые могут потребовать специализированного питания.
Для течения активного периода целиакии в раннем детском возрасте характерны выраженные диспептические расстройства и нарушения в состоянии питания, вплоть до дистрофии.
При тяжелой гипотрофии необходимо учитывать такие факторы, как резкая анорексия, сниженная толерантность к пищевым нагрузкам. Ребенку первого года жизни назначается диета, содержащая 3–4 г белка и 130–150 ккал на 1 кг фактической массы тела. Питание в активную стадию заболевания проводится согласно принципам диетотерапии детей с гипотрофией.
• Приблизительно у 2/3 детей раннего возраста с целиакией рекомендуется в активном периоде наряду с глютеном рассмотреть вопрос об исключении молочных продуктов и смесей [1,10,12].
(Сила рекомендации 1; уровень доказательств С.).
Комментарии: состояние и проведение диетотерапии у больных целиакией в активном периоде осложняет также частое развитие множественной пищевой непереносимости. Наиболее часто это – вторичная лактазная недостаточность (75%), сенсибилизация к белкам коровьего молока (72%), нередко – сенсибилизация к другим пищевым протеинам – рису, банану, белкам куриного яйца и пр.
Заменой молочным продуктам могут служить специализированные смеси на основе высоко гидролизованных белков с включением в жировой компонент среднецепочечных триглицеридов: Нутрилак Пептиди СЦТ (Инфаприм); Алфаре (Нестле); Нутрило Пепти Гастро (Нутриция); у детей старше 1 года –Пептамен Юниор (Нестле). Однако использование указанных продуктов может быть ограниченно у больных со сниженным аппетитом, вследствие специфических органолептических свойств таких смесей.
• Рекомендована медикаментозная терапия высокоактивными микрокапсулированными панкреатическими ферментами (панкреатинж,вк) [1].
(Сила рекомендации 2; уровень доказательств С).
Комментарии: медикаментозная терапия при целиакии носит вспомогательный характер, но в ряде случаев может быть жизненно необходимой. В основном она направлена на коррекцию метаболических нарушений, развившихся на фоне синдрома мальабсорбции. Коррекция процессов переваривания проводится назначением препаратов высокоактивных микрокапсулированных панкреатических ферментов (панкреатинж,вк). Доза препарата определяется возрастом ребенка, характером питания и выраженностью стеатореи. Начальная доза может составлять 1000 МЕ по липазе на 1 кг массы в сутки. На фоне выраженной диареи могут назначаться адсорбенты-мукоцитопротекторы.
• Не рекомендовано применение лоперамидаж,вк [1].
(Сила рекомендации 1; уровень доказательств С).
• При необходимости рекомендуется проведение коррекции нарушений кишечной микрофлоры[1].
(Сила рекомендации 2; уровень доказательств С).
• Больных с впервые установленным диагнозом целиакии рекомендуется обследовать и назначить лечение в отношении дефицитов микронутриентов (железа, кальция, фолиевой кислоты, витамина D, витамина В12) [1,10,12].
(Сила рекомендации 2; уровень доказательств C).
Комментарии: При железодефицитной анемии назначают препараты железа и фолиевой кислоты. При нарушениях обмена кальция (рахитоподобный синдром, гипокальциемические судороги, остеопения) назначают препараты кальция и витамина D.
• При нарушениях белкового и водно-электролитного обмена рекомендована посиндромная парентеральная коррекции. В тяжелых случаях требуется кратковременное проведение парентерального питания [1,10].
(Сила рекомендации 2; уровень доказательств С).
• Применение глюкокортикоидных препаратов при целиакии рекомендуется в случае тяжелого течения заболевания с выраженной белково-энергетической недостаточностью и в качестве заместительной терапии для коррекции надпочечниковой недостаточности [1,10].
(Сила рекомендации 2; уровень доказательств С).
Хирургическое лечение
Не требуется
Не требуется
Прогноз
Исходы и прогноз
Поздняя диагностика значительно увеличивает риск развития серьезных осложнений, таких как бесплодие, остеопороз, неврологические нарушения и онкологические заболевания (в частности, Т-клеточной лимфомы тонкой кишки). При строгом пожизненном соблюдении безглютеновой диеты прогноз благоприятный. При строгом соблюдении безглютеновой диеты более 5 лет риск онкологических заболеваний приближается к популяционному. Риск возникновения аутоиммунных заболеваний (в особенности аутоиммунного тиреоидита и сахарного диабета 1 типа) и остеопороза остается повышенным, что необходимо учитывать при диспансерном наблюдении.
Профилактика
Профилактика и диспансерное наблюдение
Не разработана.
• Существовавшие до последнего времени представления, что продолжительное грудное вскармливание, введение глютен-содержащего прикорма в малых дозах на фоне грудного вскармливания в возрасте «окна толерантности» (4-6 месяцев) или отсроченное введение глютена снижают частоту возникновения целиакии, опровергнуто в ходе ряда многоцентровых рандомизированных плацебо-контролируемых исследований, в частности, проекта PreventCD [13] и поэтому не рекомендовано использовать данные методики.
(Сила рекомендации 2; уровень доказательств A).
Мониторинг состояния пациентов с целиакией
Пациентам с тяжелыми проявлениями синдрома мальабсорбции (выраженные степени белково-энергетической недостаточности, нарушения водно-электролитного обмена) нуждаются в госпитализации в стационар гастроэнтерологического профиля для проведения полной диагностической программы, коррекции метаболических нарушений, проведения энтерального/парентерального питания, подбора индивидуального варианта безглютеновой диеты, реабилитационных мероприятий. Длительность первичной госпитализации может составлять 14-21 день и более.
Пациентам с малосимптомным течением целиакии диагностическая программа с комплексом терапии и оценкой эффективности безглютеновой диеты может проводиться в гастроэнтерологическом стационаре / дневном стационаре (длительность госпитализации 7 – 14 дней).
Пациентам с моносимптомным/бессимптомным течением целиакии комплекс первичной диагностики, при наличии диагностических возможностей (проведение ЭГДС, серологическая диагностика, HLA-типирование) может быть осуществлен в амбулаторных условиях. Тактика динамического наблюдения определяется тяжестью течения заболевания.
Диспансерное наблюдение при установленном диагнозе целиакии
Срок наблюдения: пожизненно. Ведение больного осуществляет детский гастроэнтеролог и сертифицированный диетолог.
Кратность наблюдения: после установки диагноза в течение первых двух лет – 1 раз в 6 месяцев, с 3-го года наблюдения при условии установления стойкой ремиссии и регулярных достаточных весоростовых прибавок – 1 раз в год.
Обследование в ходе диспансерного наблюдения: опрос, осмотр, измерение роста и массы, копрограмма, клиническое исследование крови, биохимическое исследование крови (общий белок, печеночные пробы, глюкоза, кальций, фосфор, железо, холестерин, триглицериды); УЗИ органов пищеварения и щитовидной железы, у девочек старше 12 лет — УЗИ органов малого таза, денситометрия поясничного отдела позвоночника; серологическое обследование. По показаниям проводится ЭГДС с биопсией СОТК, консультации специалистов (эндокринолога, стоматолога, остеолога, психолога и пр.).
Серологическое исследование (IgG, IgA, анти-ТТГ, AGA) рекомендуется повторять ежегодно с целью объективного контроля за соблюдением БГД.
Эндоскопическое/гистологическое обследование проводится при первом поступлении, в активном периоде заболевания и через 12-18 месяцев после первого обследования в случае клинической ремиссии, а также при ухудшении состояния больного. В случае стойкой ремиссии при установленном диагнозе целиакии, подтвержденном морфологически/гистологически, проведение повторных ЭГДС/биопсий является необоснованным.
• Родственникам пациента рекомендуется провести серологическое исследование, а в случае выявления повышенных уровней специфических антител – провести полный комплекс обследования, включая эндоскопическое и гистологическое исследования.
• В качестве противорецидивного лечения рекомендована пожизненная строгая безглютеновая диета, являющаяся залогом нормализации строения и функций тонкой кишки, устранения обменных нарушений, обеспечения нормальных темпов физического, психического и полового развития ребенка. Дополнительное медикаментозное лечение проводится по индивидуальным показаниям.
• Рекомендовано проведение профилактических прививок в период ремиссии.
• Рекомендуется проведение противопневмококковой вакцинации в связи с повышенным риском пневмококковых инфекций[11].
(Сила рекомендации 2; уровень доказательств С).
Дополнительное медикаментозное лечение проводится по индивидуальным показаниям.
Информация
Информация
Ключевые слова
• Аутоиммунное заболевание
• Глютен
• Мальабсорбция
• Пептиды глиадина
• Тканевая трансглутаминаза
• Целиакия
• Энтеропатия
Список сокращений
aDPG, anti-DPG – антитела к деамидированным пептидам глиадина
AGA (АГА) – антитела к глиадину
Anti-tTG, анти-ТТГ – антитела к тканевой трансглутаминазе
EMA – антитела к эндомизию
ESPGHAN – European Society for Paediatric Gastroenterology, Hepatology and Nutrition, Европейское общество педиатрической гастроэнтерологии, гепатологии и питания.
HLA – (Human Leukocyte Antigens)— группа антигенов гистосовместимости, главный комплекс гистосовместимости (MHC) у людей.
IgA – иммуноглобулины класса А
IgG – иммуноглобулины класса G
POC-test (Point of Care Test) – «быстрый тест» — тест- полоска для определения антител к тканевой трансглутаминазе в капиллярной крови
БГД – безглютеновая диета
МЭЛ, IEL’s – межэпителиальные (интраэпителиальные) лимфоциты
СОТК – слизистая оболочка тонкой кишки
Термины и определения
Строгая пожизненная безглютеновая диета — полное пожизненное исключение из рациона питания продуктов, содержащих глютен или его следы
Критерии качества оказания медицинской помощи детям с целиакией
Таблица 1 — Организационно-технические условия оказания медицинской помощи.
| Вид медицинской помощи |
специализированная, в том числе высокотехнологичная, медицинская помощь |
| Возрастная группа | Дети |
|
Условия оказания медицинской помощи |
стационарно, в дневном стационаре |
|
Форма оказания медицинской помощи |
Плановая |
Таблица 2 — Критерии качества оценки медицинской помощи
| № | Критерии качества |
Уровень достоверности доказательств |
Уровень убедительности рекомендаций |
| 1 |
Выполнено определение антител к тканевой трансглутаминазе при диагностике заболевания |
А | 1 |
| 2 |
Выполнена морфологическая диагностика — гистологическое исследование биоптатов слизистой оболочки тонкой кишки с определением степени энтеропатии по Marsh-Oberhuber при отсутствии противопоказаний |
А | 1 |
| 3 |
Назначена пожизненная безглютеновая диета — полное исключение из рациона питания продуктов, содержащих глютен или его следы |
А | 1 |
Приложение А1. Состав рабочей группы
Баранов А.А., акад. РАН, профессор, д.м.н., Председатель Исполкома Союза педиатров России.
Намазова-Баранова Л.С., акад. РАН, профессор, д.м.н., заместитель Председателя Исполкома Союза педиатров России.
Боровик Т.Э. — д.м.н., проф., член Исполкома Союза педиатров России
Захарова И.Н. — д.м.н., проф., член Исполкома Союза педиатров России
Рославцева Е.А. — к.м.н., член Союза педиатров России
Потапов А.С. — д.м.н., проф., член Союза педиатров России
Бушуева Т.В. – д.м.н., член Союза педиатров России
Звонкова Н.Г. – к.м.н., член Союза педиатров России
Дмитриева Ю.А. — к.м.н., член Союза педиатров России
Бельмер С.В. — д.м.н., проф.
Хавкин А.И. — д.м.н., проф.
Ревнова М.О. — д.м.н., проф.
Корниенко Е.А. — д.м.н., проф.
Мухина Ю.Г. — д.м.н., проф., член Союза педиатров России
Мачнева Е.Б. — к.м.н., член Союза педиатров России
Вишнева Е.А. — к.м.н., член Союза педиатров России
Селимзянова Л.Р. — к.м.н., член Союза педиатров России
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. Врачи-педиатры;
2. Врачи-гастроэнтерологи;
3. Врачи общей практики (семейные врачи);
4. Диетологи;
5. Врачи аллергологи-иммунологи;
6. Врачи детские гематологи;
7. Студенты медицинских ВУЗов;
8. Обучающиеся в ординатуре и интернатуре.
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств:
доказательной базой для рекомендаций являются публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска — 8 лет.
Методы, использованные для оценки качества и силы доказательств:
• консенсус экспертов;
• оценка значимости в соответствии с рейтинговой схемой.
Методы, использованные для анализа доказательств:
• обзоры опубликованных мета-анализов;
• систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь, влияет на силу рекомендаций. Для минимизации потенциальных ошибок каждое исследование оценивалось независимо. Любые различия в оценках обсуждались всей группой авторов в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств: заполнялись авторами клинических рекомендаций.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Индикаторы доброкачественной практики (Good Practice Points – GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте авторов разработанных рекомендаций.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидации рекомендаций
• Внешняя экспертная оценка.
• Внутренняя экспертная оценка.
Описание метода валидации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых, прежде всего, попросили прокомментировать, насколько доступна для понимания интерпретация доказательств, лежащая в основе рекомендаций. От врачей первичного звена получены комментарии в отношении доходчивости изложения данных рекомендаций, а также их оценка важности предлагаемых рекомендаций, как инструмента повседневной практики. Все комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы (авторами рекомендаций). Каждый пункт обсуждался в отдельности.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован независимыми экспертами, которых, прежде всего, попросили прокомментировать доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Сила рекомендаций (1-2) на основании соответствующих уровней доказательств (А-С) и индикаторы доброкачественной практики (табл. 7) – good practice points (GPPs) приводятся при изложении текста рекомендаций.
Таблица П1 — Схема для оценки уровня рекомендаций
| Степень достоверности рекомендаций | Соотношение риска и преимуществ | Методологическое качество имеющихся доказательств | Пояснения по применению рекомендаций |
|
1А Сильная рекомендация, основанная на доказательствах высокого качества |
Польза отчетливо превалирует над рисками и затратами, либо наоборот |
Надежные непротиворечивые доказательства, основанные на хорошо выполненных РКИ или неопровержимые доказательства, представленные в какой-либо другой форме. Дальнейшие исследования вряд ли изменят нашу уверенность в оценке соотношения пользы и риска. |
Сильная рекомендация, которая может использоваться в большинстве случаев у преимущественного количества пациентов без каких-либо изменений и исключений |
|
1В Сильная рекомендация, основанная на доказательствах умеренного качества |
Польза отчетливо превалирует над рисками и затратами, либо наоборот | Доказательства, основанные на результатах РКИ, выполненных с некоторыми ограничениями (противоречивые результаты, методологические ошибки, косвенные или случайные и т.п.), либо других веских основаниях. Дальнейшие исследования (если они проводятся), вероятно, окажут влияние на нашу уверенность в оценке соотношения пользы и риска и могут изменить ее. | Сильная рекомендация, применение которой возможно в большинстве случаев |
|
1С Сильная рекомендация, основанная на доказательствах низкого качества |
Польза, вероятно, будет превалировать над возможными рисками и затратами, либо наоборот | Доказательства, основанные на обсервационных исследованиях, бессистемном клиническом опыте, результатах РКИ, выполненных с существенными недостатками. Любая оценка эффекта расценивается как неопределенная. | Относительно сильная рекомендация, которая может быть изменена при получении доказательств более высокого качества |
|
2А Слабая рекомендация, основанная на доказательствах высокого качества |
Польза сопоставима с возможными рисками и затратами |
Надежные доказательства, основанные на хорошо выполненных РКИ или подтвержденные другими неопровержимыми данными. Дальнейшие исследования вряд ли изменят нашу уверенность в оценке соотношения пользы и риска. |
Слабая рекомендация. Выбор наилучшей тактики будет зависеть от клинической ситуации (обстоятельств), пациента или социальных предпочтений. |
|
2В Слабая рекомендация, основанная на доказательствах умеренного качества |
Польза сопоставима с рисками и осложнениями, однако в этой оценке есть неопределенность. |
Доказательства, основанные на результатах РКИ, выполненных с существенными ограничениями (противоречивые результаты, методологические дефекты, косвенные или случайные), или сильные доказательства, представленные в какой-либо другой форме. Дальнейшие исследования (если они проводятся), скорее всего, окажут влияние на нашу уверенность в оценке соотношения пользы и риска и могут изменить ее. |
Слабая рекомендация. Альтернативная тактика в определенных ситуациях может явиться для некоторых пациентов лучшим выбором. |
|
2С Слабая рекомендация, основанная на доказательствах низкого качества |
Неоднозначность в оценке соотношения пользы, рисков и осложнений; польза может быть сопоставима с возможными рисками и осложнениями. | Доказательства, основанные на обсервационных исследованиях, бессистемного клинического опыта или РКИ с существенными недостатками. Любая оценка эффекта расценивается как неопределенная. |
Очень слабая рекомендация; альтернативные подходы могут быть использованы в равной степени. |
Актуализация данных клинических рекомендаций будет проводиться не реже, чем один раз в три года. Принятие решения об обновлении будет принято на основании предложений, представленных медицинскими профессиональными некоммерческими организациями с учётом результатов комплексной оценки лекарственных препаратов, медицинских изделий, а также результатов клинической апробации.
Приложение А3. Связанные документы
Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н «Об утверждении Порядка оказания педиатрической помощи»
Приложение Б. Алгоритм диагностики и лечения целиакии у детей и подростков
Приложение В. Информация для пациентов
Целиакия – это генетически обусловленное заболевание. Для людей с целиакией характерна непереносимость глютена – белка, содержащегося в ряде злаковых культур (пшеница, рожь и т.д.). Под действием глютена у больных поражается слизистая оболочка кишечника и появляются разнообразные симптомы нарушения деятельности органов пищеварения – частый жидкий стул, вздутие живота, а также признаки нарушения всасывания питательных веществ – потеря массы тела, замедление роста, авитаминозы, недостаток микроэлементов.
Целиакия встречается у лиц как мужского, так и женского пола.
Прогноз целиакии зависит от своевременности постановки диагноза и начала терапии.
Строгая пожизненная безглютеновая диета является единственным эффективным методом лечения целиакии.
Назначение безглютеновой диеты как можно раньше определяет благоприятный прогноз и улучшает качество жизни детей с целиакией, предотвращая развитие осложнений.
Приложение Г1. Глютен-содержащие продукты и блюда, которые следует исключить из рациона питания при целиакии
| Продукты | Пшеница | Рожь | Ячмень | Овес |
| Крупы, каши |
Манная, пшеничная, «Артек», «Полтавская», кускус, спельта, тритикале, дурум, булгур, полба, а также крупы из нескольких злаков, включающие в свой состав пшеницу («5 злаков», «7 злаков» и др.) |
Ржаная, а также крупы из нескольких злаков, включающие в свой состав рожь («5 злаков», «7 злаков» и др.) |
Ячневая, перловая, ячменная, а также крупы из нескольких злаков, включающие в свой состав ячмень («5 злаков», «7 злаков» и др.) |
Овсяная, «Геркулес», толокно, а также крупы из нескольких злаков, включающие в свой состав овес («5 злаков», «7 злаков» и др.) |
| Мука и отруби |
Пшеничная мука и отруби, мучные смеси с пшеничной мукой в составе |
Ржаная мука и отруби, мучные смеси с ржаной мукой в составе |
Ячменная мука и отруби, мучные смеси с ячменной мукой в составе |
Овсяная мука, мучные смеси с овсяной мукой в составе |
| Детские каши |
Детские инстантные (быстрорастворимые) каши с пшеничными, манными хлопьями, «смешанные злаки», «4 злака»,«7 злаков» и т.п. |
«4 злака», «7 злаков», «смешанные злаки» |
Ячневая, ячменная каша, «4 злака», «7 злаков», «смешанные злаки» |
Все готовые каши с овсяной мукой и хлопьями, «4 злака», «7 злаков», «смешанные злаки» |
|
Готовое баночное питание |
Консервы для детского питания с мясом, рыбой и овощами и др. с добавками пшеничной муки или манной крупы (см. состав на упаковке) |
Детские мясные, мясо-овощные, рыбные, фруктовые консервы с овсяной мукой |
||
|
Хлеб и хлебобулочные изделия; кондитерские изделия |
Хлеб, сушки, сухари, печенье, вафли, сдоба, пироги, торты, блины, выпечка и др. из пшеничной муки. |
Хлеб, лепешки, хлебцы, сухари и др. из ржаной муки |
Ячменные лепешки, кукурузные палочки, кукурузные хлопья и др. изделия, содержащие ячменный солод и ячменную патоку |
Хлеб, печенье, лепешки, галеты, хлебцы, блины и др. из овсяной муки |
|
Макаронные изделия |
Макароны, вермишель, рожки, спагетти, лапша, а также любые макаронные изделия, содержащие другие виды пшеницы (например, спельту, полбу, тритикале, дурум) |
|||
| Мясные, рыбные и молочные полуфабрикаты | Вареная колбаса, сосиски, полуфабрикаты котлет и др., изделия из рубленого мяса и рыбы, крабовые палочки, пельмени, вареники, сырники, творожные пасты и сырки, подливы к мясным и рыбным блюдам на пшеничной муке, мука и сухари для панировки | |||
| Напитки | Пиво |
Хлебный квас, пиво |
Кофейные напитки, растворимый кофе, концентрат чая, порошковые витаминные напитки, кисель ячменный |
Овсяный кисель |
|
Молочные продукты промышленного производства |
Молочные продукты с добавлением отрубей и хлопьев из пшеницы, ячменя, овса, ржи Сырники, сырки глазированные, мягкие сыры, некоторые сыры твердых сортов, в которых по традиционным рецептам используется пшеница Заменители молочных продуктов (творожный продукт, сметанный продукт, спред, сырный продукт) |
«Скрытый» глютен могут содержать (зависит от рецептуры производителя):
• вареные колбасы, сосиски, полуфабрикаты из измельченного мяса и рыбы;
• многие мясные, рыбные консервы;
• многие овощные и фруктовые консервы, в т.ч. томатные пасты, кетчупы;
• некоторые сорта мороженого, йогуртов, творожные сырки и пасты, мягкие и плавленые сыры
• маргарины с глютен содержащими стабилизаторами;
• некоторые виды уксусов и салатных соусов, майонезов;
• соевые соусы;
• многокомпонентные сухие приправы и пряности;
• концентрированные сухие супы, бульонные кубики, картофельное пюре быстрого приготовления;
• картофельные и кукурузные чипсы;
• замороженный картофель – «фри»;
• некоторые виды чая, кофе- и какао-смеси для быстрого приготовления (быстрорастворимые);
• кукурузные хлопья при использовании ячменной патоки;
• имитации морепродуктов — «крабовые палочки», «крабовое мясо»;
• карамель, соевые и шоколадные конфеты с начинкой, восточные сладости, повидло промышленного производства;
• модифицированный крахмал, некоторые пищевые добавки (краситель аннато Е-160b, карамельные красители Е-150а — Е-150d, мальтол Е-636, изомальтол Е-953, мальтит и мальтитный сироп Е-965), эмульгаторы, стабилизаторы
• квас, пиво.
• нетоксичными злаками при целиакии являются рис, гречиха, кукуруза, пшено, амарант, киноа, монтина, чумиза, саго, сорго, тэфф. Безопасными являются мука и крахмалы, приготовленные из корнеплодов: картофеля, маниоки, тапиоки, батата, бобовых: бобов, фасоли, гороха, сои, различных орехов.
Приложение Г2. Алгоритм диагностики целиакии у детей и подростков с характерными симптомами заболевания
анти-ТТГ – антитела к тканевой трансглутаминазе, EMA – антитела к эндомизию, БГД – безглютеновая диета
Приложение Г3. Алгоритм диагностики целиакии у бессимптомных пациентов из группы риска
анти-ТТГ – антитела к тканевой трансглутаминазе, EMA – антитела к эндомизию, БГД – безглютеновая диета
Приложение Г4. Расшифровка примечаний
…ж – лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2016 год (Распоряжение Правительства РФ от 26.12.2015 N 2724-р)
…вк – лекарственный препарат, входящий в Перечень лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций (Распоряжение Правительства РФ от 26.12.2015 N 2724-р)
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы
Быкова С.В.
Московский клинический научно-практический центр. ЦНИИ гастроэнтерологии Департамента здравоохранения Москвы
Сабельникова Е.А.
Московский клинический научно-практический центр
Маев И.В.
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Баранов А.А.
ФГБУ «Научный центр здоровья детей» Минздрава России, Москва
Бакулин И.Г.
Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия
Крумс Л.М.
Московский клинический научно-практический центр
Бельмер С.В.
Российская детская клиническая больница, Москва
Боровик Т.Э.
ФГБУ «Научный центр здоровья детей» Минздрава России, Москва
Захарова И.Н.
кафедра педиатрии ФГБОУ ДПО «Российская медицинская академия последипломного образования Минздрава России, Москва
Дмитриева Ю.А.
кафедра педиатрии ФГБОУ ДПО «Российская медицинская академия последипломного образования Минздрава России, Москва
Рославцева Е.А.
ФГБУ «Научный центр здоровья детей» Минздрава России, Москва
Корниенко Е.А.
ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, Санкт-Петербург
Хавкин А.И.
Научно-исследовательский клинический институт педиатрии им. акад. Ю.Е. Вельтищева ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, Москва, Россия
Потапов А.С.
ФГБУ «Научный центр здоровья детей» Минздрава России, Москва
Ревнова М.О.
ГБОУ ВПО «Санкт-Петербургский государственный педиатрический медицинский университет, Санкт-Петербург, Россия
Мухина Ю.Г.
Российская детская клиническая больница, Москва;
Кафедра детских болезней №2 ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва
Щербаков П.Л.
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы
Федоров Е.Д.
Кафедра госпитальной хирургии №2 и научно-исследовательская лаборатория хирургической гастроэнтерологии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова
- SPIN РИНЦ: 6785-9959
- Scopus AuthorID:
7004381289 - ORCID:
0000-0002-6036-7061
Белоусова Е.А.
ФГБУ «Научно-исследовательский институт детской травматологии и ортопедии им. Г.И. Турнера» Минздрава России, Санкт-Петербург, Россия
Халиф И.Л.
ФГБУ «Государственный научный центр колопроктологии» Минздрава России, Москва
Хомерики С.Г.
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Центральный НИИ гастроэнтерологии, Москва
Ротин Д.Л.
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Москва, Россия
Воробьева Н.Г.
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы, Москва
Пивник А.В.
ФГБУ «Гематологический научный центр» Минздрава России, Москва
Гудкова Р.Б.
ГБУЗ «Центральный научно-исследовательский институт гастроэнтерологии» Департамента здравоохранения Москвы
Чернин В.В.
Тверская государственная медицинская академия Минздрава РФ
Вохмянина Н.В.
Санкт-Петербургское государственное казенное учреждение здравоохранения «Диагностический центр», Санкт-Петербург, Россия
Пухликова Т.В.
Медико-генетическая лаборатория Санкт-Петербургское ГКУЗ «Диагностический центр», Санкт-Петербург
Дегтярев Д.А.
лаборатория HLA-типирования ГБУЗ «Станция переливания крови Департамента здравоохранения города Москвы», Москва
Дамулин И.В.
кафедра нервных болезней Московской медицинской академии им. И.М. Сеченова
Мкртумян А.М.
Московский государственный медико-стоматологический университет им. А.И. Евдокимова, Москва
Джулай Г.С.
Тверская государственная медицинская академия Минздрава РФ
Тетруашвили Н.К.
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Барановский А.Ю.
Северо-западный государственный медицинский университет им. И.И. Мечникова Минздрава РФ, Санкт-Петербург
Назаренко Л.И.
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Харитонов А.Г.
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Лоранская И.Д.
ФГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва
Сайфутдинов Р.Г.
ГБОУ ДПО «Казанская государственная медицинская академия» Минздрава России, Казань, Россия
Ливзан М.А.
Омская государственная медицинская академия
Абрамов Д.А.
ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России, Москва
Осипенко М.Ф.
ГБОУ ВПО «Новосибирский государственный медицинский университет»
Орешко Л.В.
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Ткаченко Е.И.
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Ситкин С.И.
ФГБОУ ВО «Тверской государственный медицинский университет» Минздрава России, 170100, Тверь, Россия
Ефремов Л.И.
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы, Москва
Всероссийский консенсус по диагностике и лечению целиакии у детей и взрослых
Авторы:
Парфенов А.И., Быкова С.В., Сабельникова Е.А., Маев И.В., Баранов А.А., Бакулин И.Г., Крумс Л.М., Бельмер С.В., Боровик Т.Э., Захарова И.Н., Дмитриева Ю.А., Рославцева Е.А., Корниенко Е.А., Хавкин А.И., Потапов А.С., Ревнова М.О., Мухина Ю.Г., Щербаков П.Л., Федоров Е.Д., Белоусова Е.А., Халиф И.Л., Хомерики С.Г., Ротин Д.Л., Воробьева Н.Г., Пивник А.В., Гудкова Р.Б., Чернин В.В., Вохмянина Н.В., Пухликова Т.В., Дегтярев Д.А., Дамулин И.В., Мкртумян А.М., Джулай Г.С., Тетруашвили Н.К., Барановский А.Ю., Назаренко Л.И., Харитонов А.Г., Лоранская И.Д., Сайфутдинов Р.Г., Ливзан М.А., Абрамов Д.А., Осипенко М.Ф., Орешко Л.В., Ткаченко Е.И., Ситкин С.И., Ефремов Л.И.
Как цитировать:
Парфенов А.И., Быкова С.В., Сабельникова Е.А., Маев И.В., Баранов А.А., Бакулин И.Г., Крумс Л.М., Бельмер С.В., Боровик Т.Э., Захарова И.Н., Дмитриева Ю.А., Рославцева Е.А., Корниенко Е.А., Хавкин А.И., Потапов А.С., Ревнова М.О., Мухина Ю.Г., Щербаков П.Л., Федоров Е.Д., Белоусова Е.А., Халиф И.Л., Хомерики С.Г., Ротин Д.Л., Воробьева Н.Г., Пивник А.В., Гудкова Р.Б., Чернин В.В., Вохмянина Н.В., Пухликова Т.В., Дегтярев Д.А., Дамулин И.В., Мкртумян А.М., Джулай Г.С., Тетруашвили Н.К., Барановский А.Ю., Назаренко Л.И., Харитонов А.Г., Лоранская И.Д., Сайфутдинов Р.Г., Ливзан М.А., Абрамов Д.А., Осипенко М.Ф., Орешко Л.В., Ткаченко Е.И., Ситкин С.И., Ефремов Л.И. Всероссийский консенсус по диагностике и лечению целиакии у детей и взрослых. Терапевтический архив.
2017;89(3):94‑107.
Parfenov AI, Bykova SV, Sabel’nikova EA, Maev IV, Baranov AA, Bakulin IG, Krums LM, Belmer SV, Borovik TE, Zakharova IN, Dmitrieva YuA, Roslavtseva EA, Kornienko EA, Khavkin AI, Potapov AS, Revnova MO, Mukhina YuG, Shcherbakov PL, Fedorov ED, Belousova EA, Khalif IL, Khomeriki SG, Rotin DL, Vorobyeva NG, Pivnik AV, Gudkova RB, Chernin VV, Vokhmyanina NV, Pukhlikova TV, Degtyarev DA, Damulin IV, Mkrtumayn AM, Dzhulaĭ GS, Tetruashvili NK, Baranovskiĭ AIu, Nazarenko LI, Kharitonov AG, Loranskaya ID, Saifutdinov RG, Livzan MA, Abramov DA, Osipenko MF, Oreshko LV, Tkachenko EI, Sitkin SI, Efremov LI. All-Russian Consensus on Diagnosis and Treatment of Celiac Disease in Children and Adults. Terapevticheskii Arkhiv. 2017;89(3):94‑107. (In Russ.)
https://doi.org/10.17116/terarkh201789394-107

Читать метаданные
Аннотация В статье изложен Всероссийский консенсус по диагностике и лечению целиакии у детей и взрослых, разработанный ведущими экспертами — гастроэнтерологами и педиатрами России на основе существующих отечественных и зарубежных рекомендаций. Консенсус утвержден на 42-й ежегодной Научной сессии ЦНИИГ «Принципы доказательной медицины в клиническую практику» (2—3 марта 2016 г.). Консенсус предназначен для практикующих врачей, осуществляющих ведение и лечение больных целиакией. Поиск доказательств основных положений консенсуса проводился в электронных базах данных. При составлении рекомендаций основным источником являлись публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска — 10 лет. Рекомендации в предварительной версии рецензированы независимыми экспертами. Голосование проводилось по Дельфийской системе.
Авторы:
Парфенов А.И.
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы
Быкова С.В.
Московский клинический научно-практический центр. ЦНИИ гастроэнтерологии Департамента здравоохранения Москвы
Сабельникова Е.А.
Московский клинический научно-практический центр
Маев И.В.
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Баранов А.А.
ФГБУ «Научный центр здоровья детей» Минздрава России, Москва
Бакулин И.Г.
Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия
Крумс Л.М.
Московский клинический научно-практический центр
Бельмер С.В.
Российская детская клиническая больница, Москва
Боровик Т.Э.
ФГБУ «Научный центр здоровья детей» Минздрава России, Москва
Захарова И.Н.
кафедра педиатрии ФГБОУ ДПО «Российская медицинская академия последипломного образования Минздрава России, Москва
Дмитриева Ю.А.
кафедра педиатрии ФГБОУ ДПО «Российская медицинская академия последипломного образования Минздрава России, Москва
Рославцева Е.А.
ФГБУ «Научный центр здоровья детей» Минздрава России, Москва
Корниенко Е.А.
ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, Санкт-Петербург
Хавкин А.И.
Научно-исследовательский клинический институт педиатрии им. акад. Ю.Е. Вельтищева ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, Москва, Россия
Потапов А.С.
ФГБУ «Научный центр здоровья детей» Минздрава России, Москва
Ревнова М.О.
ГБОУ ВПО «Санкт-Петербургский государственный педиатрический медицинский университет, Санкт-Петербург, Россия
Мухина Ю.Г.
Российская детская клиническая больница, Москва;
Кафедра детских болезней №2 ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва
Щербаков П.Л.
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы
Федоров Е.Д.
Кафедра госпитальной хирургии №2 и научно-исследовательская лаборатория хирургической гастроэнтерологии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова
- SPIN РИНЦ: 6785-9959
- Scopus AuthorID:
7004381289 - ORCID:
0000-0002-6036-7061
Белоусова Е.А.
ФГБУ «Научно-исследовательский институт детской травматологии и ортопедии им. Г.И. Турнера» Минздрава России, Санкт-Петербург, Россия
Халиф И.Л.
ФГБУ «Государственный научный центр колопроктологии» Минздрава России, Москва
Хомерики С.Г.
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Центральный НИИ гастроэнтерологии, Москва
Ротин Д.Л.
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Москва, Россия
Воробьева Н.Г.
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы, Москва
Пивник А.В.
ФГБУ «Гематологический научный центр» Минздрава России, Москва
Гудкова Р.Б.
ГБУЗ «Центральный научно-исследовательский институт гастроэнтерологии» Департамента здравоохранения Москвы
Чернин В.В.
Тверская государственная медицинская академия Минздрава РФ
Вохмянина Н.В.
Санкт-Петербургское государственное казенное учреждение здравоохранения «Диагностический центр», Санкт-Петербург, Россия
Пухликова Т.В.
Медико-генетическая лаборатория Санкт-Петербургское ГКУЗ «Диагностический центр», Санкт-Петербург
Дегтярев Д.А.
лаборатория HLA-типирования ГБУЗ «Станция переливания крови Департамента здравоохранения города Москвы», Москва
Дамулин И.В.
кафедра нервных болезней Московской медицинской академии им. И.М. Сеченова
Мкртумян А.М.
Московский государственный медико-стоматологический университет им. А.И. Евдокимова, Москва
Джулай Г.С.
Тверская государственная медицинская академия Минздрава РФ
Тетруашвили Н.К.
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Барановский А.Ю.
Северо-западный государственный медицинский университет им. И.И. Мечникова Минздрава РФ, Санкт-Петербург
Назаренко Л.И.
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Харитонов А.Г.
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Лоранская И.Д.
ФГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва
Сайфутдинов Р.Г.
ГБОУ ДПО «Казанская государственная медицинская академия» Минздрава России, Казань, Россия
Ливзан М.А.
Омская государственная медицинская академия
Абрамов Д.А.
ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России, Москва
Осипенко М.Ф.
ГБОУ ВПО «Новосибирский государственный медицинский университет»
Орешко Л.В.
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Ткаченко Е.И.
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Ситкин С.И.
ФГБОУ ВО «Тверской государственный медицинский университет» Минздрава России, 170100, Тверь, Россия
Ефремов Л.И.
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы, Москва
a:2:{s:4:»TEXT»;s:65535:»a:2:{s:4:»TEXT»;s:65535:»a:2:{s:4:»TEXT»;s:65535:»a:2:{s:4:»TEXT»;s:111214:»
АГА — антитела к глиадину
АГД — аглютеновая диета
АЭM — антитела к эндомизию
АДПГ — антитела к деамидированным пептидам глиадина
АТТГ — антитела к тканевой трансглутаминазе
ГКС — глюкокортикостероиды
ЖДА — железодефицитная анемия
КТ — компьютерная томография
МЭЛ — межэпителиальные (интраэпителиальные) лимфоциты
РЦ — рефрактерная целиакия
СД — сахарный диабет
СНВ — синдром нарушенного всасывания
СОТК — слизистая оболочка тонкой кишки
ТТГ — тканевая трансглутаминаза
ЭГДС — эзофагогастродуоденоскопия
ESPGHAN — European Society for Paediatric Gastroenterology, Hepatology and Nutrition — Европейское общество педиатрической гастроэнтерологии, гепатологии и питания
HLA — Human Leucocyte Antigens — группа антигенов гистосовместимости, главный комплекс гистосовместимости (MHC) человека
IgA — иммуноглобулины класса А
IgG — иммуноглобулины класса G
POC-test (Point of Care Test) — «быстрый тест» — тест- полоска для определения антител к тканевой трансглутаминазе в капиллярной крови
MMPs — матриксные металлопротеиназы
Методология
Поиск доказательств основных положений консенсуса проводился в электронных базах данных.
При составлении рекомендаций основным источником служили публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска 10 лет.
Для оценки качества и силы доказательств использовались: а) консенсус экспертов; б) оценка значимости в соответствии с рейтинговой схемой.
Для анализа доказательств использовались обзоры опубликованных метаанализов и систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств. При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что влияет на силу рекомендаций. Таблицы доказательств заполнялись авторами клинических рекомендаций.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Индикаторы доброкачественной практики (Good Practice Points — GPPs): рекомендуемая доброкачественная практика базируется на клиническом опыте авторов разработанных рекомендаций.
Экономический анализ. Публикации по фармакоэкономике не анализировались. Анализ стоимости не проводился.
Описание метода валидации рекомендаций. Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами. Голосование проведено по Дельфийской системе.
Итоговое голосование в один тур проведено по 6-балльной шкале Лайкерта: 1 — полностью согласен (А+), 2 — согласен с небольшими замечаниями (А), 3 — согласен со значительными замечаниями (А–), 4 — не согласен, но при этом со значительными замечаниями (D–), 5 — не согласен, но при этом с небольшими замечаниями (D), 6 — категорически не согласен (D+).
При согласии с положением (A+, А, A–) более 2/3 экспертов (≥67%), соглашение считалось достигнутым. В итоговой статье приведены результаты итогового голосования по каждому из положений (указан процент проголосовавших по каждому из пунктов шкалы Лайкерта).
Основные рекомендации. Сила рекомендаций (1—2) базируется на соответствующих уровнях доказательств (А—С) и индикаторах доброкачественной практики — GPPs.
Введение
Консенсус разработан ведущими экспертами — гастроэнтерологами и педиатрами России, основан на методических рекомендациях: «Глютеновая энтеропатия — междисциплинарная патология», 2006; «Диагностика и лечение целиакии у детей», 2010; Рекомендациях общества детских гастроэнтерологов России «Диагностика и лечение целиакии у детей», 2010; федеральных клинических рекомендациях по оказанию медицинской помощи детям с целиакией Союза педиатров России-2015, пересмотренных критериях ESPGHAN; Американских рекомендациях по диагностике и лечению целиакии-2013 (Аmerican college of gastroenterology clinical guideline: diagnosis and management of celiac disease), Британских рекомендациях по лечению целиакии взрослых — 2014 (Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology и утвержден на 42-й ежегодной Научной сессии ЦНИИГ «Принципы доказательной медицины в клиническую практику» (2—3 марта 2016 г.).
В России отсутствуют единые рекомендации (для детей и взрослых), определяющие тактику ведения больных целиакией. Настоящий Всероссийский консенсус по диагностике и лечению детей и взрослых с целиакией является руководством для практикующих врачей, осуществляющих ведение и лечение таких пациентов. Рекомендации подлежат регулярному пересмотру в соответствии с новыми данными научных исследований в этой области.
Определение. Целиакия — иммуноопосредованное, генетически детерминированное системное заболевание, возникающее в ответ на употребление глютена или соответствующих проламинов и характеризующееся развитием атрофической энтеропатии, появлением в сыворотке крови специфических антител и широким спектром глютензависимых клинических проявлений.
По результатам голосования 47 экспертов получено:89,4% положительных ответов (А+), 10,6% (А).
Эпидемиология. Распространенность целиакии во взрослой популяции большинства стран мира составляет приблизительно 1:100 — 1:250, или 0,5—1%. Соотношение между диагностированными и не диагностированными случаями может достигать 1:5—1:13. Об увеличении частоты заболевания свидетельствуют исследования, проведенные в cтранах Ближнего Востока, Северной Африки, Южной Америке, Индии, Австралии и Новой Зеландии [1—3].
В Российской Федерации (РФ) крупных эпидемиологических исследований до настоящего времени не проводилось. Отдельные данные из регионов свидетельствуют о частоте заболевания от 1:85 в группах риска в Рязани до 1,2:1000 в Томске. Предполагаемая частота заболевания в РФ может составлять 1:100—1:250.
Этиология и патогенез. Ведущая роль в этиологии заболевания принадлежит глиадину, все четыре фракции которого: α, β, γ и ω — токсичны для больных целиакией, однако, α-глиадин, содержащий 33-мерный пептид, идентифицирован как инициатор иммунного ответа при болезни. Это связано с устойчивостью данного полипептида к воздействию всех желудочных, панкреатических и кишечных протеиназ [1].
Употребление продуктов, содержащих глютен, является необходимым, но не единственным фактором патогенеза целиакии. Доказана связь целиакии с антигенами главного комплекса гистосовместимости человека (HLA) [4]. Гетеродимеры HLA-DQ2 и HLA-DQ8 встречаются в популяции с частотой 30—3%, а частота заболевания целиакией составляет 1%. Поэтому продолжается поиск других генетических факторов, ответственных за развитие заболевания. Генетические исследования последних лет выявили полиморфизм генов, играющих роль в патогенезе целиакии. В развитие данного заболевания вовлечены гены, расположенные на 5, 2, 19 и 4-й хромосомах и регулирующие выработку цитокинов (α-фактор некроза опухоли — α-ФНО), интерферон, интерлейкин — ИЛ-15, ИЛ-21), активацию естественных киллеров, Т-клеток и В-лимфоцитов. Мутации в различных регуляторных участках часто выявляются при воспалительных заболеваниях кишечника, ревматоидном артрите, инсулинзависимом сахарном диабете (СД), что лежит в основе частой ассоциации целиакии с аутоиммунной патологией.
Роль молекул главного комплекса гистосовместимости в патогенезе целиакии обусловлена их участием в процессе представления антигенов клеткам, распознающим антиген, который находится в слизистой оболочке тонкой кишки — СОТК (дендритные клетки, макрофаги, Т-лим-фоциты). Они начинают вырабатывать множество биологически активных веществ, включая ИЛ-15, повреждающих кишечный эпителий и попадающих в системную циркуляцию. Кроме того, ИЛ-15 способствует соединению пептидов глиадина с деамидирующим ферментом — тканевой трансглутаминазой (ТТГ). В результате создаются мощные иммуностимулирующие антигенные детерминанты. Эти комплексы становятся перекрестно — реагирующими и деамидируемыми, презентируются Т-клеткам через HLA-DQ2 или HLA-DQ8 на дендритных и эпителиальных клетках. Активированные антиген-представляющие клетки впоследствии активируют Т-лимфоциты (Th1-клетки CD4–) и продуцируют главным образом цитокины типа интерферона-γ и α-ФНО. Эти провоспалительные цитокины вызывают активацию фибробластов и выделение матриксных металлопротеиназ (MMPs 1, 3, 12), которые приводят к деградации и ремоделированию СОТК и атрофии ворсинок.
При целиакии нарушена регуляция врожденного и адаптивного иммунного ответа. В СОТК в ответ на прямое токсическое воздействие глютена происходит преобладание трансформации межэпителиальных Т-лимфо-цитов (МЭЛ) в естественные киллеры, изменяется фенотип энтероцитов и активируются дендритные клетки, усиливается продукция ИЛ-15, который повышает распознавание белковых молекул. Развитие адаптивного ответа связано с антигенспецифической активацией Т-лим-фоцитов, с провоспалительными цитокинами, повреждающими эпителиоциты СОТК, стимулируются В-лим-фоциты к выработке специфических антител: к глиадину (АГА), к ТТГ (АТТГ), к деамидированным пептидам глиадина (АДПГ) к структурам СОТК (кальретикулину, эндомизию). Антитела различной специфичности из ткани и локальных иммунных органов попадают в системную циркуляцию и выявляются в сыворотке крови при иммунологических исследованиях.
Согласно современным представлениям целиакию можно считать мультифакторным заболеванием, при котором наряду с генетической предрасположенностью и токсическим действием глютена определенное значение имеют средовые факторы, роль которых в развитии заболевания нуждается в дальнейшем изучении [1, 5].
Классификация. В соответствии с клинической картиной и результатами лабораторных исследований принято выделять следующие формы заболевания.
Типичную (классическую) целиакию, характеризующуюся хронической диареей и симптомами мальабсорбции: истощение, «дефицитные» симптомы вследствие нарушения всасывания минеральных веществ и витаминов.
Атипичную целиакию, при которой гастроинтестинальные симптомы отсутствуют или слабовыражены, в то время как в клинической картине на первое место выходят внекишечные проявления, такие как остеопороз, анемия, бесплодие, неврологические симптомы и др.
В настоящее время разделение целиакии на «типичную» и «атипичную» считается нецелесообразным, так как «атипичные» формы заболевания встречаются значительно чаще «типичных».
Поэтому принято логичным выделять симптомные, или манифестные (с гастроэнтерологическими симптомами и внекишечными проявлениями) и бессимптомные формы заболевания.
У пациентов с бессимптомной (скрытой) формой целиакии отсутствуют проявления заболевания и диагноз устанавливают в ходе скрининговых обследований.
Вопрос о выделении потенциальной целиакии (наличие повышенного уровня специфических антител и характерных генетических маркеров при нормальной структуре СОТК) остается дискуссионным. В отсутствие клинических симптомов предлагается не назначать таким пациентам аглютеновую диету (АГД), но продолжить наблюдение с динамическим контролем за уровнем АТТГ и других антител и проведением повторной биопсии в случае появления симптоматики (степень достоверности рекомендаций 2С) [3, 6, 7].
Рефрактерная целиакия (РЦ) характеризуется отсутствием ответа (клинического, серологического, морфологического) на АГД. РЦ не характерна для детей.
Целесообразно выделять периоды заболевания: латентный, клинической манифестации (активный), ремиссии и декомпенсации.
Латентный период продолжается от момента введения глютена до начала клинических проявлений заболевания и может продолжаться от нескольких дней до многих лет. Чаще не диагностируется, может быть выявлен при целенаправленном диагностическом поиске в группах риска.
Активный период — период клинической манифестации заболевания.
Период неполной ремиссии (начальная ремиссия) наступает, как правило, спустя 3—6 мес после назначения строгой АГД; отмечается уменьшение выраженности основных симптомов, снижение титров специфических антител, при наличии патогистологических признаков атрофической энтеропатии.
Период полной ремиссии (клинико-серологическая, морфологическая ремиссия) возможен не ранее чем через 1—1,5 года от начала следования АГД и характеризуется отсутствием специфических антител и полным восстановлением морфологической структуры СОТК.
При несоблюдении АГД заболевание вновь переходит в активный период (декомпенсации).
По результатам голосования 47 экспертов получено 72,3% положительных ответов (А+), 27,7% (А).
Клиническая картина. В клинической картине (табл. 1) могут доминировать желудочно-кишечные симптомы, такие как диарея, обильный зловонный стул, стеаторея, боли в животе, метеоризм, увеличение живота, рвота, нарушение аппетита, запоры [1, 3, 8]. К неспецифическим симптомам относятся задержка физического развития, потеря массы тела, мышечная гипотония, апатия.
Клинические симптомы целиакии появляются в большинстве случаев постепенно. Отмечается нарушение аппетита, беспричинная рвота, потеря массы тела. Родители обращают внимание на нарушения поведения — появляется раздражительность, негативизм, апатия, нарушается сон, исчезает интерес к окружающему.
Клиническими проявлениями СНВ у взрослых служат общая слабость, снижение работоспособности, прогрессирующая потеря массы тела от 5 до 30 кг, симптомы гиповитаминоза, нарушения минерального обмена, ЖДА.
Заболевание может начинаться в детстве, на фоне введения прикормов, но нередко может длительно протекать субклинически и проявляться впервые у взрослых или даже в пожилом возрасте. Факторами, провоцирующими появление первых клинических симптомов, могут быть беременность и роды (у женщин), кишечные инфекции, стрессовые ситуации и антибиотикотерапия [3].
Заключение. Больные с диареей и клинико-лабораторными проявлениями синдрома мальабсорбции, такими как снижение массы тела, стеаторея, боли и вздутие в животе, синдром избыточного роста бактерий, должны обследоваться для выявления целиакии (степень достоверности рекомендаций 1А).
По результатам голосования 47 экспертов получено 93,6% положительных ответов (А+), 4,2% (А), 2,1% (А–).
Целиакия в группах риска
Неврологические проявления. Среди неврологических нарушений наиболее часто упоминается глютеновая атаксия (по некоторым данным, отмечается уменьшение количества клеток Пуркинье в мозжечке в сочетании с атрофией и глиозом мозжечка) и сенсомоторная аксональная полиневропатия. Признаки аксональной полиневропатии отмечаются почти у 40—50% больных целиакией, иногда сопровождаясь изменениями ликвора (появление олигоклональных антител).
Имеются наблюдения, свидетельствующие о связи целиакии с лимфомой центральной нервной системы, миопатией, миастенией, миелопатией, деменцией, синдромом ригидного человека, рассеянным склерозом, а также с эпилепсией (в последнем случае нередко визуализируются внутрикраниальные кальцификаты, а заболевание все же в большей мере присуще детям) и некоторыми психическими расстройствами (аутизм, депрессия, шизофрения) [3].
Высказывается мнение, что АГД помогает 90% больных [1, 3].
Заключение. Больные с мозжечковой атаксией и дистальной симметричной сенсомоторной полиневропатией неясной этиологии должны быть обследованы для исключения целиакии (степень достоверности рекомендаций 2В).
По результатам голосования 47 экспертов получено 89,4% положительных ответов (А+), 4,2% (А), 2,1% (А–), 6,4% (D–).
Гематологические проявления. Анемия является одним из наиболее частых симптомов целиакии и может быть ее единственным клиническим проявлением [1, 3, 8, 9]. У большинства больных отмечается ЖДА, которая обусловлена снижением содержания железа и ферритина в сыворотке крови. Причиной служит нарушение всасывания железа, которое происходит в двенадцатиперстной и проксимальных отделах тонще кишки, в наибольшей степени повреждаемых при целиакии. У нелеченых больных целиакией возможны осложнения в виде эрозивно-язвенных поражений тощей кишки, которые могут привести к оккультным, а в некоторых случаях, массивным кровотечениям, что также приводит к ЖДА. В исследованиях, проведенных в ЦНИИГ, у 47,5% больных с ЖДА выявлена целиакия [1]. У 16,6% обследованных больных анемия была единственным проявлением целиакии. В некоторых случаях при нормальном уровне гемоглобина наблюдается значительное снижение содержания железа в сыворотке крови. Л.Б. Филатов и В.Г. Берман отметили, что у 23,7% детей анемия служит единственным проявлением болезни. Применение препаратов железа оказывается неэффективным у больных с неустановленным диагнозом целиакии.
Фолиевая кислота является одним из необходимых компонентов для нормального гемопоэза. Всасывание фолиевой кислоты также осуществляется в проксимальных отделах тонкой кишки. У многих больных отмечается дефицит фолатов. Отсутствие фолиевой кислоты приводит к мегалобластной анемии. Витамин В12 в двенадцатиперстной кишке связывается с внутренним фактором и в дальнейшем всасывается в дистальном отделе подвздошной кишки. Точная причина дефицита витамина В12 при целиакии неизвестна. Предполагают, что В12-дефицитная анемия может развиваться при снижении желудочной секреции или тотальном поражении всей тонкой кишки при тяжелой целиакии. Таким образом, можно считать, что у больных целиакией в большинстве случаев развивается ЖДА. При строгом соблюдении АГД уровень гемоглобина и железа в сыворотке крови приходят к норме.
Заключение. Больные ЖДА неустановленной этиологии должны быть обследованы для выявления целиакии (степень достоверности рекомендаций 2А).
По результатам голосования 47 экспертов получено 95,7% положительных ответов (А+), 2,1% (А–), 2,1% (D–).
Гипертрансаминаземия. Имеются сообщения о повышении активности трансаминаз у отдельных больных целиакией [1]. У большинства больных в результате соблюдения АГД их уровень снижается до нормы. Реже целиакия может быть связана с тяжелыми поражениями печени — первичным билиарным циррозом (3—7%), аутоиммунным гепатитом (3—6%) и первичным склерозирующим холангитом (2—3%).
Заключение. Повышение активности печеночных трансаминаз служит показанием к обследованию для выявления целиакии, если нет других причин, вызывающих повышение активности цитолитических ферментов, связанных с заболеванием печени (степень достоверности рекомендаций 1А).
По результатам голосования 47 экспертов получено 91,5% положительных ответов (А+), 4,2% (А), 4,25% (А–).
Нарушение репродуктивной функции у женщин. Репродуктивные нарушения у больных целиакией проявляются в виде задержки полового развития, нерегулярного менструального цикла, невынашивания беременности, бесплодия, ранней менопаузы. Некоторые исследователи считают, что связывание АТТГ с трофобластом может представлять ключевой механизм в нарушении имплантации эмбриона и развитии плаценты, от которого зависит исход беременности у женщин с целиакией. Дефицит витаминов и микронутриентов, развивающийся вследствие нарушенного всасывания, также может иметь значение в развитии нарушений репродуктивной функции у больных целиакией. Репродуктивные нарушения могут быть последствием эндокринных расстройств, обусловленных селективной мальабсорбцией нутриентов. Накопленные в последние годы данные свидетельствуют, что строгое следование АГД способствуют постепенному восстановлению детородной функции.
Заключение. Женщинам с репродуктивными нарушениями (задержка полового развития, аменорея, бесплодие, невынашивание беременности), особенно при наличии гастроэнтерологических жалоб, в план обследования необходимо включать диагностику целиакии (степень достоверности рекомендаций 2В).
По результатам голосования 47 экспертов получено 97,9% положительных ответов (А+), 2,1% (D+).
Аутоиммунные заболевания. В табл. 2 представлены основные аутоиммунные и генетические заболевания, при которых отмечена связь с целиакией.
СД 1-го типа.По мнению некоторых ученых [1, 3, 10], целиакия существенно чаще встречается у больных СД 1-го типа, чем в общей популяции. Частота развития целиакии варьирует до 3 до 10%. Больным С.Д. 1-го типа с гастроэнтерологическими симптомами при направлении на эндоскопическое исследование необходимо проводить биопсию СОТК для исключения целиакии. Необходимость скрининга больных бессимптомным СД 1-го типа является спорной. Исследователи из Швеции показали повышенный риск развития диабетической ретинопатии у больных целиакией и СД 1-го типа. Пациенты с СД 1-го типа и недиагностированной целиакией имели более высокую распространенность ретинопатии (58% против 25%) и нефропатии (42% против 4%). В этих случаях больным назначается АГД.
Заключение. Пациенты с СД 1-го типа должны обследоваться для выявления целиакии, особенно при наличии гастроэнтерологических жалоб или лабораторных изменений, позволяющих предположить наличие целиакии (степень достоверности рекомендаций 1А).
По результатам голосования 47 экспертов получено 85% положительных ответов (А+), 10,6% (А), 2,1% (D–) 2,1% (D+).
Болезни щитовидной железы. Связь болезней щитовидной железы с целиакией в среднем выявляется у 10—15% больных. Четкая связь целиакии с аутоиммунным тиреоидитом подтверждена D. Larizza и соавт., которые нашли целиакию у 7,8% детей с аутоиммунным тиреоидитом и гипертиреозом. При целиакии очень часто развивается субклиническая форма гипотиреоидизма. C. Ching и соавт. (2007) обнаружили у 3,4% больных с аутоиммунными заболеваниями щитовидной железы целиакию, что существенно чаще, чем в контрольных группах (0,6 и 0,25% соответственно). Органные аутоантитела (например, антитела к ткани щитовидной железы) при аутоиммунном тиреоидите, ассоциированном с целиакией, исчезают при соблюдении АГД уже через 3—6 мес. При этом исчезают не только симптомы, но и ограничивается риск развития других аутоиммунных заболеваний.
Заключение. Больных с аутоиммунными заболеваниями щитовидной железы, особенно при наличии гастроэнтерологических жалоб или лабораторных отклонений, позволяющих предположить целиакию, необходимо обследовать для выявления целиакии (степень достоверности рекомендаций 2В).
По результатам голосования 47 экспертов получено 95,7% положительных ответов (А+), 4,2% (А).
Дерматологические проявления (дерматит Дюринга). Дерматит Дюринга часто отождествляют с кожной целиакией [11]. Такое тождество весьма оправданно, поскольку, как и целиакия, дерматит Дюринга характеризуется четко определенной генетической предрасположенностью: оба заболевания более чем у 90% пациентов имеют ассоциацию с HLA-класса II-антигенами DR3/DQ2; более чем у 70% пациентов имеется гаплотип HLA-AI, B8, DR3. Частота сочетания целиакии и герпетиформного дерматита составляет 7,8% [11].
Заключение. Больные герпетиформным дерматитом должны быть обследованы для выявления целиакии (степень достоверности рекомендаций 2В).
По результатам голосования 47 экспертов получено 91,5% положительных ответов (А+), 8,5% (А–).
Целиакия у родственников первой линии родства
Частота развития целиакии существенно увеличивается у родственников первой линии родства [1, 11].Самый высокий риск развития заболевания отмечается у одноклеточных близнецов, ниже — у родителей и детей пациентов с целиакией.
В некоторых странах Европы рекомендуется проводить генетическое обследование и динамическое наблюдение родственников первой линии родства, не имеющих гастроэнтерологических симптомов. Отмечено, что при тщательном расспросе удается выявить некоторые неспецифические жалобы, на которые обследуемые не обращали внимания. Однако при диагностике и соблюдении АГД больные отмечали существенное улучшение качества жизни.
Заключение. Родственники первой линии родства больных целиакией должны обследоваться для выявления целиакии, особенно, если они имеют гастроэнтерологические жалобы или лабораторные отклонения, позволяющие предполагать целиакию (степень достоверности рекомендаций 1А).
По результатам голосования 47 экспертов получено 93,6% положительных ответов (А+), 4,2% (А), 2,1% (А–).
Диагностика целиакии
Диагностика заболевания должна быть комплексной и основываться на совокупной оценке клинических данных, результатов серологического и морфологического исследований и наличия в генотипе типичных аллелей.
Серологическая диагностика. Наиболее информативными неинвазивными методами в диагностике целиакииявляются исследования специфических серологических маркеров. В сыворотке крови пациентов, употребляющих глютен, выявляются 4 вида специфических антител: АТТГ, антитела к деамидированным пептидам глиадина (АДПГ) [4, 12], антитела к эндомизию (АЭМ) и глиадину (АГА). Наиболее диагностически значимыми являются антитела класса IgA, так как образуются В-лимфоцитами собственной пластинки СОТК. При низком содержании общего IgA диагностическое значение имеют антитела класса IgG.
АТТГ (IgA или IgG) образуются к кальцийзависимому ферменту, катализирующему реакцию деамидирования глиадина, формируются отрицательные эпитопы, образуются иммунные комплексы, активируются Т-лимфоциты и формируется иммуновоспалительный процесс в СОТК. Когортные исследования с использованием тестирования АTTГ IgA, направленные на диагностику целиакии, позволили определить чувствительность АTTГ IgA для нелеченой целиакии, которая составляет 89—95%, специфичность — ниже 85%. Меньшая специфичность метода связана с выявлением этих антител (класса IgG) при аутоиммунных, генетических и эндокринных заболеваниях. Аутоиммунный ответ за пределами кишечника осуществляется при взаимодействии тканевой трансглутаминазы с деамидированными пептидами глиадина, которые имеются в структурах различных органов и тканей. В результате неоантигены и тканевые аутоантигены распознаются естественными киллерами и Т-лимфоцитами, а также стимулируют В-лимфоциты и провоцируют выработку специфических антител.
АДПГобразуются к эпитопам (фрагментам) глиадина, деамидированного тканевой трансглутаминазой, и могут быть дополнительными специфическими маркерами АТТГ. Высокие титры в тесте указывают на большую вероятность истинноположительного результата. Исследования АДПГ многочисленны, метаанализ показал, что АДПГ не отличаются по чувствительности и специфичностиот АТТГ и АЭМ. При сравнении лабораторных характеристик АДПГ в разных возрастных категориях показано, что у детей чувствительность метода АДПГ (IgG) составляет 80—98,6%, АДПГ (IgA) — более 80,7—95,1%, специфичность АДПГ (IgG) 86—96,9%, АДПГ (IgA) — 86,3—93,1%. У взрослых чувствительность АДПГ (IgG) составляет 56—94%, АДПГ (IgA) — 84,3%, а специфичность — АДПГ (IgG) — 90—99,3%, а АДПГ (IgA) — 79,8%.
АЭМ в качестве антигена имеют тканевую трансглутаминазу межклеточного матрикса окружающую гладкие мышечные клетки собственной пластинки СОТК. В тест-системах используется субстрат тканей пищевода зеленых мартышек или пуповины человека. Метод непрямой иммунофлюоресценции позволяет выявлять специфические антитела в 100% случаев целиакии, но АЭМ реже используются в диагностике, так как применение биологических субстратов в настоящее время резко ограничено. В недавних исследованиях Сервисный центр оценки Национального внешнего качества Британии заявил, что не все тесты для целиакии, включая АТТГ IgA, надежны, и предлагают сохранять руководящие принципы ESPGHAN. У взрослых эта стратегия проводится, однако установлены очень веские доводы для того, чтобы сохранить биопсию как «золотой стандарт» для диагноза целиакии [12].
AГА в настоящеевремя для диагностики целиакии не используются, так как выявляются не только при целиакии, но и у пациентов с воспалительными заболеваниями кишечника и при пищевой аллергии. Однако содержание АГА IgA значительно снижается при соблюдении АГД в течение 4—6 нед, что позволяет их рекомендовать для оценки эффективности лечения.
В связи с тем что все известные в настоящее время сывороточные маркеры имеют недостатки, трудно выделить из них наиболее информативные. Зависимость чувствительности сывороточных маркеров АТТГ от степени поражения СОТК отражена в табл. 3.
Отсутствие или незначительность воспалительных (иммунных) процессов в СОТК, которые могут наблюдаться при латентных формах целиакии, протекающих с незначительным поражением СОТК, снижают выработку антител за счет низкой активности АTТГ2, что является причиной ложноотрицательных результатов при обследовании пациента для определения сывороточных маркеров. При этом количество ложноотрицательных результатов может варьировать от 6 до 22%.
Cерологические маркеры целиакии у детей. У детей часто возможен дефицит IgA, поэтому в данной ситуации необходимо определение общего IgA. Альтернативный подход при основном тестировании пациентов с низким IgA или селективным дефицитом IgA должен включать и IgA и IgG АТТГ. В обследование детей младше 2 лет для диагностики целиакии должны быть использованы тесты: АТТГ IgA и АДПГ IgA и IgG [10, 13, 14].
Официальный протокол диагностики целиакии у детей, предложенный в 2012 г. Европейским обществом детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN), включил новые руководящие принципы. У детей в отсутствие симптоматики, у которых уровень антител к тканевой трансглутаминазе IgA превышает в 10 раз верхнюю границу нормы, а также при повышенном титре антител к эндомизию и положительных маркерах HLA-DQ2 или HLA-DQ8, предлагается диагностировать заболевание без проведения биопсии. Данный протокол до настоящего времени проходит клиническое тестирование в ходе крупного многоцентрового исследования в Европе.
Серологические маркеры в группах риска. Для группы риска в отсутствие клинических проявлений экспертами ESPGHAN разработан отдельный протокол диагностики, включающий генетическое исследование с определением маркеров HLA-DQ2/DQ8. Пациенты, имеющие типичные аллели, обследуются для выявления АТТГ с одновременной оценкой уровня общего IgA. При нормальном уровне IgA и в отсутствие антител целиакии нет, но заболевание может проявиться позднее, поэтому серологическое исследование целесообразно повторять каждые 2—3 года. В случае превышения титров АТТГ IgA верхней границы нормы более чем в 3 раза необходимо эндоскопическое и морфологичеcкое исследование биоптатов СОТК, полученных из нисходящей части двенадцатиперстной кишки. В случае умеренного превышения верхней границы нормы титра АТТГ IgA (менее чем в 3 раза) и отрицательных АЭМ пациент подлежит наблюдению и контролю уровня АТТГ IgA каждые 3—6 мес [14].
Для первичного скрининга целиакии в группах риска большинство экспертов предлагают использовать АТТГ IgA в качестве первого шага диагностики целиакии ввиду относительной простоты метода и невысокой стоимости.
Диагностическая ценность «быстрых тестов» для первичного скрининга. Использование нового субстрата — эндогенной ТТГ, полученной при лизисе собственных энтероцитов пациента, определяло конкурентное преимущество экспресс-метода, связанное с использованием доступного, удобного и специфичного субстрата, который впервые позволил решить проблему быстрой постановки диагноза и мог бы использоваться как скрининговый тест. Однако проведенные клинические испытания иммунохроматографического экспресс-метода выявили субъективность в оценке результатов, неизбежную при их качественной характеристике, особенно при пограничных или незначительных превышениях уровня ТТГ, а также недостаточную чувствительность теста, приводящую к пропуску положительных результатов. В настоящее время этот тест может использоваться после предварительного обучения персонала для правильной интерпретации полученных результатов. Тест не исключает дополнительного обследования при неопределенном результате и возможность получения ложноположительных результатов, что создает необходимость расширения диагностической панели с целью их исключения.
Селективный дефицит IgA при первичной диагностике. Данное нарушение иммунной системы встречается с частотой 1 на 400—800 человек в общей популяции и у 2—3% пациентов, страдающих целиакией (AGA Institute, 2006). При выявлении селективного дефицита IgA рекомендуется использовать антитела класса IgG. Так, в рекомендациях Американского общества гастроэнтерологов предлагается определять уровень АЭМ IgG и/или АТТТ IgG. В то же время отмечается более низкая чувствительность этих тестов по сравнению с IgA-тестами (AGA Institute, 2006) [9]. Британское общество гастроэнтерологов рекомендует использование только АТТГ IgG. В своем отчете авторы ссылаются на публикации, в которых чувствительность этих антител в диагностике целиакии не превышала 30% [12]. Американская коллегия гастроэнтерологов, напротив, рассматривает выявление АТТГ IgG как метод, чувствительность которого достигает 75—95%, и рекомендует использовать эти антитела вместе с АДПГ IgG (чувствительность 80—88%) [4]. Вместе с тем эксперты американской коллегии отмечают ограниченную доступность тестов для определения АЭМ IgG, несмотря на удовлетворительную чувствительность метода (75%).
Серонегативная целиакия. Механизмы возникновения ложноположительных и ложноотрицательных иммунологических тестов. Диагноз серонегативной целиакии может быть установлен по результатам тщательного дополнительного обследования. Так, при гипогаммаглобулинемии АТТГ могут не образовываться даже при наличии клинических и морфологических изменений, характерных для целиакии. Серонегативная целиакия встречается у 6—22% больных. В случаях серонегативных тестов АТТГ могут быть не выявлены также АЭM и АДПГ, но при наличии явных клинических симптомов и подозрении на целиакию рекомендуется выполнять биопсию СОТК и генетический тест на HLA-DQ.
До 2% больных целикией имеют дефицит IgA (0,2% от общей популяции) и при определении АТТГ IgA и АЭM IgA можно получить ложноотрицательные результаты. Если известно, что у данного пациента имеется дефицит IgA, нужно определять IgG (АТТГ IgG или АДПГ IgG) или проводить биопсию СОТК, так как определение только АТТГ IgA может дать ложноотрицательный результат [9]. У серонегативных пациентов при наличии симптомов мальабсорбции (анемия, диарея) и семейной предрасположенности необходимо выполнять биопсию СОТК.
Следует отметить, что АТТГ могут содержаться в ткани тонкой кишки или других тканях у серонегативных пациентов. Отрицательные результаты определения антител в крови могут наблюдаться у лиц с герпетиформным дерматитом, после уменьшения количества глютена в рационе, в течение и после приема иммуносупрессивных препаратов.
Если АТТГ IgA отрицательные при нормальном уровне общего IgA (или АДПГ IgG отрицательные), то целиакия как причина симптомов маловероятна. Ряд состояний могут давать ложноотрицательные результаты определения анти-ТТГ: низкое содержание глютена в рационе, экссудативная энтеропатия с ?+), 4,2% (А), 4,25% (А–).
Нарушение репродуктивной функции у женщин. Репродуктивные нарушения у больных целиакией проявляются в виде задержки полового развития, нерегулярного менструального цикла, невынашивания беременности, бесплодия, ранней менопаузы. Некоторые исследователи считают, что связывание АТТГ с трофобластом может представлять ключевой механизм в нарушении имплантации эмбриона и развитии плаценты, от которого зависит исход беременности у женщин с целиакией. Дефицит витаминов и микронутриентов, развивающийся вследствие нарушенного всасывания, также может иметь значение в развитии нарушений репродуктивной функции у больных целиакией. Репродуктивные нарушения могут быть последствием эндокринных расстройств, обусловленных селективной мальабсорбцией нутриентов. Накопленные в последние годы данные свидетельствуют, что строгое следование АГД способствуют постепенному восстановлению детородной функции.
Заключение. Женщинам с репродуктивными нарушениями (задержка полового развития, аменорея, бесплодие, невынашивание беременности), особенно при наличии гастроэнтерологических жалоб, в план обследования необходимо включать диагностику целиакии (степень достоверности рекомендаций 2В).
По результатам голосования 47 экспертов получено 97,9% положительных ответов (А+), 2,1% (D+).
Аутоиммунные заболевания. В табл. 2 представлены основные аутоиммунные и генетические заболевания, при которых отмечена связь с целиакией.
СД 1-го типа.По мнению некоторых ученых [1, 3, 10], целиакия существенно чаще встречается у больных СД 1-го типа, чем в общей популяции. Частота развития целиакии варьирует до 3 до 10%. Больным С.Д. 1-го типа с гастроэнтерологическими симптомами при направлении на эндоскопическое исследование необходимо проводить биопсию СОТК для исключения целиакии. Необходимость скрининга больных бессимптомным СД 1-го типа является спорной. Исследователи из Швеции показали повышенный риск развития диабетической ретинопатии у больных целиакией и СД 1-го типа. Пациенты с СД 1-го типа и недиагностированной целиакией имели более высокую распространенность ретинопатии (58% против 25%) и нефропатии (42% против 4%). В этих случаях больным назначается АГД.
Заключение. Пациенты с СД 1-го типа должны обследоваться для выявления целиакии, особенно при наличии гастроэнтерологических жалоб или лабораторных изменений, позволяющих предположить наличие целиакии (степень достоверности рекомендаций 1А).
По результатам голосования 47 экспертов получено 85% положительных ответов (А+), 10,6% (А), 2,1% (D–) 2,1% (D+).
Болезни щитовидной железы. Связь болезней щитовидной железы с целиакией в среднем выявляется у 10—15% больных. Четкая связь целиакии с аутоиммунным тиреоидитом подтверждена D. Larizza и соавт., которые нашли целиакию у 7,8% детей с аутоиммунным тиреоидитом и гипертиреозом. При целиакии очень часто развивается субклиническая форма гипотиреоидизма. C. Ching и соавт. (2007) обнаружили у 3,4% больных с аутоиммунными заболеваниями щитовидной железы целиакию, что существенно чаще, чем в контрольных группах (0,6 и 0,25% соответственно). Органные аутоантитела (например, антитела к ткани щитовидной железы) при аутоиммунном тиреоидите, ассоциированном с целиакией, исчезают при соблюдении АГД уже через 3—6 мес. При этом исчезают не только симптомы, но и ограничивается риск развития других аутоиммунных заболеваний.
Заключение. Больных с аутоиммунными заболеваниями щитовидной железы, особенно при наличии гастроэнтерологических жалоб или лабораторных отклонений, позволяющих предположить целиакию, необходимо обследовать для выявления целиакии (степень достоверности рекомендаций 2В).
По результатам голосования 47 экспертов получено 95,7% положительных ответов (А+), 4,2% (А).
Дерматологические проявления (дерматит Дюринга). Дерматит Дюринга часто отождествляют с кожной целиакией [11]. Такое тождество весьма оправданно, поскольку, как и целиакия, дерматит Дюринга характеризуется четко определенной генетической предрасположенностью: оба заболевания более чем у 90% пациентов имеют ассоциацию с HLA-класса II-антигенами DR3/DQ2; более чем у 70% пациентов имеется гаплотип HLA-AI, B8, DR3. Частота сочетания целиакии и герпетиформного дерматита составляет 7,8% [11].
Заключение. Больные герпетиформным дерматитом должны быть обследованы для выявления целиакии (степень достоверности рекомендаций 2В).
По результатам голосования 47 экспертов получено 91,5% положительных ответов (А+), 8,5% (А–).
Целиакия у родственников первой линии родства
Частота развития целиакии существенно увеличивается у родственников первой линии родства [1, 11].Самый высокий риск развития заболевания отмечается у одноклеточных близнецов, ниже — у родителей и детей пациентов с целиакией.
В некоторых странах Европы рекомендуется проводить генетическое обследование и динамическое наблюдение родственников первой линии родства, не имеющих гастроэнтерологических симптомов. Отмечено, что при тщательном расспросе удается выявить некоторые неспецифические жалобы, на которые обследуемые не обращали внимания. Однако при диагностике и соблюдении АГД больные отмечали существенное улучшение качества жизни.
Заключение. Родственники первой линии родства больных целиакией должны обследоваться для выявления целиакии, особенно, если они имеют гастроэнтерологические жалобы или лабораторные отклонения, позволяющие предполагать целиакию (степень достоверности рекомендаций 1А).
По результатам голосования 47 экспертов получено 93,6% положительных ответов (А+), 4,2% (А), 2,1% (А–).
Диагностика целиакии
Диагностика заболевания должна быть комплексной и основываться на совокупной оценке клинических данных, результатов серологического и морфологического исследований и наличия в генотипе типичных аллелей.
Серологическая диагностика. Наиболее информативными неинвазивными методами в диагностике целиакииявляются исследования специфических серологических маркеров. В сыворотке крови пациентов, употребляющих глютен, выявляются 4 вида специфических антител: АТТГ, антитела к деамидированным пептидам глиадина (АДПГ) [4, 12], антитела к эндомизию (АЭМ) и глиадину (АГА). Наиболее диагностически значимыми являются антитела класса IgA, так как образуются В-лимфоцитами собственной пластинки СОТК. При низком содержании общего IgA диагностическое значение имеют антитела класса IgG.
АТТГ (IgA или IgG) образуются к кальцийзависимому ферменту, катализирующему реакцию деамидирования глиадина, формируются отрицательные эпитопы, образуются иммунные комплексы, активируются Т-лимфоциты и формируется иммуновоспалительный процесс в СОТК. Когортные исследования с использованием тестирования АTTГ IgA, направленные на диагностику целиакии, позволили определить чувствительность АTTГ IgA для нелеченой целиакии, которая составляет 89—95%, специфичность — ниже 85%. Меньшая специфичность метода связана с выявлением этих антител (класса IgG) при аутоиммунных, генетических и эндокринных заболеваниях. Аутоиммунный ответ за пределами кишечника осуществляется при взаимодействии тканевой трансглутаминазы с деамидированными пептидами глиадина, которые имеются в структурах различных органов и тканей. В результате неоантигены и тканевые аутоантигены распознаются естественными киллерами и Т-лимфоцитами, а также стимулируют В-лимфоциты и провоцируют выработку специфических антител.
АДПГобразуются к эпитопам (фрагментам) глиадина, деамидированного тканевой трансглутаминазой, и могут быть дополнительными специфическими маркерами АТТГ. Высокие титры в тесте указывают на большую вероятность истинноположительного результата. Исследования АДПГ многочисленны, метаанализ показал, что АДПГ не отличаются по чувствительности и специфичностиот АТТГ и АЭМ. При сравнении лабораторных характеристик АДПГ в разных возрастных категориях показано, что у детей чувствительность метода АДПГ (IgG) составляет 80—98,6%, АДПГ (IgA) — более 80,7—95,1%, специфичность АДПГ (IgG) 86—96,9%, АДПГ (IgA) — 86,3—93,1%. У взрослых чувствительность АДПГ (IgG) составляет 56—94%, АДПГ (IgA) — 84,3%, а специфичность — АДПГ (IgG) — 90—99,3%, а АДПГ (IgA) — 79,8%.
АЭМ в качестве антигена имеют тканевую трансглутаминазу межклеточного матрикса окружающую гладкие мышечные клетки собственной пластинки СОТК. В тест-системах используется субстрат тканей пищевода зеленых мартышек или пуповины человека. Метод непрямой иммунофлюоресценции позволяет выявлять специфические антитела в 100% случаев целиакии, но АЭМ реже используются в диагностике, так как применение биологических субстратов в настоящее время резко ограничено. В недавних исследованиях Сервисный центр оценки Национального внешнего качества Британии заявил, что не все тесты для целиакии, включая АТТГ IgA, надежны, и предлагают сохранять руководящие принципы ESPGHAN. У взрослых эта стратегия проводится, однако установлены очень веские доводы для того, чтобы сохранить биопсию как «золотой стандарт» для диагноза целиакии [12].
AГА в настоящеевремя для диагностики целиакии не используются, так как выявляются не только при целиакии, но и у пациентов с воспалительными заболеваниями кишечника и при пищевой аллергии. Однако содержание АГА IgA значительно снижается при соблюдении АГД в течение 4—6 нед, что позволяет их рекомендовать для оценки эффективности лечения.
В связи с тем что все известные в настоящее время сывороточные маркеры имеют недостатки, трудно выделить из них наиболее информативные. Зависимость чувствительности сывороточных маркеров АТТГ от степени поражения СОТК отражена в табл. 3.
Отсутствие или незначительность воспалительных (иммунных) процессов в СОТК, которые могут наблюдаться при латентных формах целиакии, протекающих с незначительным поражением СОТК, снижают выработку антител за счет низкой активности АTТГ2, что является причиной ложноотрицательных результатов при обследовании пациента для определения сывороточных маркеров. При этом количество ложноотрицательных результатов может варьировать от 6 до 22%.
Cерологические маркеры целиакии у детей. У детей часто возможен дефицит IgA, поэтому в данной ситуации необходимо определение общего IgA. Альтернативный подход при основном тестировании пациентов с низким IgA или селективным дефицитом IgA должен включать и IgA и IgG АТТГ. В обследование детей младше 2 лет для диагностики целиакии должны быть использованы тесты: АТТГ IgA и АДПГ IgA и IgG [10, 13, 14].
Официальный протокол диагностики целиакии у детей, предложенный в 2012 г. Европейским обществом детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN), включил новые руководящие принципы. У детей в отсутствие симптоматики, у которых уровень антител к тканевой трансглутаминазе IgA превышает в 10 раз верхнюю границу нормы, а также при повышенном титре антител к эндомизию и положительных маркерах HLA-DQ2 или HLA-DQ8, предлагается диагностировать заболевание без проведения биопсии. Данный протокол до настоящего времени проходит клиническое тестирование в ходе крупного многоцентрового исследования в Европе.
Серологические маркеры в группах риска. Для группы риска в отсутствие клинических проявлений экспертами ESPGHAN разработан отдельный протокол диагностики, включающий генетическое исследование с определением маркеров HLA-DQ2/DQ8. Пациенты, имеющие типичные аллели, обследуются для выявления АТТГ с одновременной оценкой уровня общего IgA. При нормальном уровне IgA и в отсутствие антител целиакии нет, но заболевание может проявиться позднее, поэтому серологическое исследование целесообразно повторять каждые 2—3 года. В случае превышения титров АТТГ IgA верхней границы нормы более чем в 3 раза необходимо эндоскопическое и морфологичеcкое исследование биоптатов СОТК, полученных из нисходящей части двенадцатиперстной кишки. В случае умеренного превышения верхней границы нормы титра АТТГ IgA (менее чем в 3 раза) и отрицательных АЭМ пациент подлежит наблюдению и контролю уровня АТТГ IgA каждые 3—6 мес [14].
Для первичного скрининга целиакии в группах риска большинство экспертов предлагают использовать АТТГ IgA в качестве первого шага диагностики целиакии ввиду относительной простоты метода и невысокой стоимости.
Диагностическая ценность «быстрых тестов» для первичного скрининга. Использование нового субстрата — эндогенной ТТГ, полученной при лизисе собственных энтероцитов пациента, определяло конкурентное преимущество экспресс-метода, связанное с использованием доступного, удобного и специфичного субстрата, который впервые позволил решить проблему быстрой постановки диагноза и мог бы использоваться как скрининговый тест. Однако проведенные клинические испытания иммунохроматографического экспресс-метода выявили субъективность в оценке результатов, неизбежную при их качественной характеристике, особенно при пограничных или незначительных превышениях уровня ТТГ, а также недостаточную чувствительность теста, приводящую к пропуску положительных результатов. В настоящее время этот тест может использоваться после предварительного обучения персонала для правильной интерпретации полученных результатов. Тест не исключает дополнительного обследования при неопределенном результате и возможность получения ложноположительных результатов, что создает необходимость расширения диагностической панели с целью их исключения.
Селективный дефицит IgA при первичной диагностике. Данное нарушение иммунной системы встречается с частотой 1 на 400—800 человек в общей популяции и у 2—3% пациентов, страдающих целиакией (AGA Institute, 2006). При выявлении селективного дефицита IgA рекомендуется использовать антитела класса IgG. Так, в рекомендациях Американского общества гастроэнтерологов предлагается определять уровень АЭМ IgG и/или АТТТ IgG. В то же время отмечается более низкая чувствительность этих тестов по сравнению с IgA-тестами (AGA Institute, 2006) [9]. Британское общество гастроэнтерологов рекомендует использование только АТТГ IgG. В своем отчете авторы ссылаются на публикации, в которых чувствительность этих антител в диагностике целиакии не превышала 30% [12]. Американская коллегия гастроэнтерологов, напротив, рассматривает выявление АТТГ IgG как метод, чувствительность которого достигает 75—95%, и рекомендует использовать эти антитела вместе с АДПГ IgG (чувствительность 80—88%) [4]. Вместе с тем эксперты американской коллегии отмечают ограниченную доступность тестов для определения АЭМ IgG, несмотря на удовлетворительную чувствительность метода (75%).
Серонегативная целиакия. Механизмы возникновения ложноположительных и ложноотрицательных иммунологических тестов. Диагноз серонегативной целиакии может быть установлен по результатам тщательного дополнительного обследования. Так, при гипогаммаглобулинемии АТТГ могут не образовываться даже при наличии клинических и морфологических изменений, характерных для целиакии. Серонегативная целиакия встречается у 6—22% больных. В случаях серонегативных тестов АТТГ могут быть не выявлены также АЭM и АДПГ, но при наличии явных клинических симптомов и подозрении на целиакию рекомендуется выполнять биопсию СОТК и генетический тест на HLA-DQ.
До 2% больных целикией имеют дефицит IgA (0,2% от общей популяции) и при определении АТТГ IgA и АЭM IgA можно получить ложноотрицательные результаты. Если известно, что у данного пациента имеется дефицит IgA, нужно определять IgG (АТТГ IgG или АДПГ IgG) или проводить биопсию СОТК, так как определение только АТТГ IgA может дать ложноотрицательный результат [9]. У серонегативных пациентов при наличии симптомов мальабсорбции (анемия, диарея) и семейной предрасположенности необходимо выполнять биопсию СОТК.
Следует отметить, что АТТГ могут содержаться в ткани тонкой кишки или других тканях у серонегативных пациентов. Отрицательные результаты определения антител в крови могут наблюдаться у лиц с герпетиформным дерматитом, после уменьшения количества глютена в рационе, в течение и после приема иммуносупрессивных препаратов.
Если АТТГ IgA отрицательные при нормальном уровне общего IgA (или АДПГ IgG отрицательные), то целиакия как причина симптомов маловероятна. Ряд состояний могут давать ложноотрицательные результаты определения анти-ТТГ: низкое содержание глютена в рационе, экссудативная энтеропатия с потерей белка, прием иммуносупрессивных препаратов.
Заключение. Ввиду относительной простоты метода и невысокой стоимости в качестве первого шага при проведении скрининговых исследований в группах риска рекомендуется использовать определение АТТГ с целью отбора пациентов для дальнейшего эндоскопического обследования (степень достоверности рекомендаций 1А).
Результаты голосования 47 экспертов: 89,4% (А+), 2,1% (А), 8,5% (А–).
У детей младше 2 лет определение АТТГ IgA должно сочетаться с определением АДПГ IgA и IgG (степень достоверности рекомендаций 1В).
Результаты голосования 47 экспертов: 89,4% (А+), 2,1% (А), 8,5% (А–).
Ввиду недостаточной специфичности метода, а также низкой прогностической ценности положительных и отрицательных результатов определение уровня антиглиадиновых антител в настоящее время не рекомендуется в комплексе диагностических мероприятий при подозрении на целиакию (степень достоверности рекомендаций 1А).
При выявлении селективного дефицита IgA рекомендуется определение АТТГ IgG в сочетании с АДПГ IgG (степень достоверности рекомендаций 1B).
Экспресс-тесты могут быть использованы для первичной диагностики целиакии в случае недоступности остальных серологических методов и обязательно подтверждены гистологическим исследованием (степень достоверности рекомендаций 1B).
Обязательным требованием является проведение серологической диагностики до назначения АГД на фоне употребления обычного количества глютенсодержащих продуктов. Ограничение или исключение глютена в рационе может привести к быстрому снижению титра специфических антител, что сделает дальнейший диагностический поиск затруднительным, а иногда и невозможным (степень достоверности рекомендаций 1А).
При сильном подозрении на целиакию должна быть выполнена биопсия СОТК даже при отрицательных серологических тестах (степень достоверности рекомендаций 1B).
Эндоскопическая диагностика. Стандартная эзофагогастродуоденоскопия (ЭГДС) является оптимальным методом эндоскопии. Для выполнения качественного морфологического исследования в ходе ЭГДС необходимо произвести забор не менее 5 биоптатов СОТК: 1 — из луковицы, 2 из средней, 2 из дистальной части двенадцатиперстной кишки.
Эндоскопические признаки целиакии весьма неспе-цифичны. Предположить целиакию при эндоскопическом исследовании можно на основании таких макроскопических признаков, как уплощение или исчезновение циркулярных складок СОТК, появление поперечной и??черченности складок, ячеистого рисунка или микронодулярной структуры СОТК. Однако макроскопическая картина может оставаться нормальной, что не позволяет использовать эндоскопическое исследование в качестве основного диагностического метода. Повысить диагностическую ценность эндоскопии у пациентов с целиакией стало возможным с использованием современных эндоскопов, имеющих высокую разрешающую способность, а также путем применения иммерсионной техники визуализации ворсинок — конфокальной эндоскопии.
В соответствии с официальным протоколом диагностики целиакии у детей, предложенным в 2012 г. Европейским обществом детских гастроэнтерологов, гепатологов и нутрициолов (ESPGHAN), у пациентов с симптомами и уровнем АТТГ IgA, превышающем в 10 раз верхнюю границу нормы, при повышенном титре АЭМ и положительных HLA DQ2 DQ8 маркерах, диагностировать заболевание возможно без проведения биопсии [6, 9].
Глубокая энтероскопия или видеокапсульная эндоскопия проводятся только с целью дифференциальной диагностики целиакии с другими заболеваниями, характеризующимися сходной клинической симптоматикой в отсутствие эндоскопических и гистологических изменений в двенадцатиперстной кишке (например, при подозрении на болезнь Крона тонкой кишки, локальную лимфангиэктазию, опухоль и т. д.)
Заключение. Взятие не менее 5 биоптатов, в том числе из луковицы двенадцатиперстной кишки, повышает точность морфологической диагностики целиакии (степень достоверности рекомендаций 1А).
Морфологическая диагностика. Комплекс морфологических изменений СОТК, свойственных целиакии, включает увеличение количества МЭЛ, различную степень атрофии ворсинок и гиперплазию крипт.
В настоящее время для патоморфологической диагностики используется классификация степеней энтеропатии по M. Marsh (1992), в соответствии с которой выделяют 3 типа повреждений СОТК: 1-й тип (Marsh 1) — «инфильтративный», 2-й тип (Marsh 2) — «гиперпластический» и 3-й тип (Marsh 3) — «деструктивный».
В 1999 г. G. Oberhuber предложил модификацию классификации Marsh, указав на необходимость определения количества МЭЛ в пересчете на 100 эпителиальных клеток, а также выделения 3 степеней атрофических изменений. Последние рекомендации и накопленный опыт свидетельствует о необходимости использовать критерии, приведенные в современных руководствах, исходя из границ нормы МЭЛ 1:25.
Гистологическая классификация целиакии. Выявление при микроскопическом исследовании типов повреждения 2, 3A—C является достаточным основанием для диагностики целиакии у серопозитивных пациентов даже в отсутствие у них клинических проявлений заболевания.
При первичной диагностике уменьшение высоты ворсин, углубление крипт и увеличение содержания МЭЛ представляют собой равные по значимости критерии. В условиях соблюдения АГД соотношение ворсина/крипта характеризуется более выраженной положительной динамикой, тогда как количество МЭЛ долго остается повышенным. Точный учет количества МЭЛ с выведением среднего значения повышает эффективность диагностики, тогда как точные измерения глубины крипт и высоты ворсин не имеют клинической значимости (достаточно указать примерное соотношение размеров этих структур). Выявление при световой микроскопии только повышенного количества МЭЛ (тип 1 по Marsh—Oberhuber) не может служить основанием для диагностики целиакии. Это связано с тем, что увеличение количества МЭЛ может отмечаться при пищевой аллергии, вирусных кишечных инфекциях, лямблиозе, аутоиммунных заболеваниях, воспалительных заболеваниях кишечника и др. [5].
Отличительной особенностью лимфоцитоза при целиакии является то, что большинство клеток несут на своей поверхности специфический Т-клеточный рецептор (TCR γ/δ). Эта особенность используется при проведении иммуногистохимического исследования, позволяющего определить преобладающий тип лимфоцитов в СОТК. Кроме того, атрофия ворсин также может наблюдаться при целом ряде заболеваний: пищевой аллергии (к белкам мяса, молока, яиц, рыбы, риса, сои), аутоиммунной энтеропатии, коллагеновой спру, общем вариабельном иммунодефиците, гипогаммаглобулинемической спру, ишемической энтеропатии, лучевой терапии, энтеропатии, ассоциированной с Т-клеточной лимфомой, и синдроме Золлингера—Эллисона.
Заключение. Для постановки диагноза целиакии положительные результаты серологического исследования должны подкрепляться результатами гистологического исследования биоптатов СОТК с подсчетом количества МЭЛ (25 на 100) (степень достоверности рекомендаций 1А).
Выявление при микроскопическом исследовании типов повреждения 2, 3A—C служит достаточным основанием для диагностики целиакии у серопозитивных пациентов даже в отсутствие у них клинических проявлений заболевания.
Изменения гистологической структуры СОТК, соответствующие типу 1 по Marsh—Oberhuber, не могут служить основанием для установления диагноза целиакии без проведения иммуногистохимического анализа и должны оцениваться только в совокупности с серологическими, генетическими и клиническими данными (степень достоверности рекомендаций 1А).
Морфологическое исследование должно проводиться на фоне употребления обычного количества продуктов, содержащих глютен. Исключение глютена из рациона может привести к быстрому восстановлению нормальной структуры СОТК, что сделает морфологическое подтверждение целиакии затруднительным, а иногда и невозможным (степень достоверности рекомендаций 1А).
Генетическая диагностика. Генетическое исследование предполагает определение наличия у пациента характерных аллелей HLA-DQ2/DQ8. Гетеродимер HLA-DQ2 кодируется в цис-конфигурации HLA-DR3-DQA1*0501 DQB1*0201, в транс-конфигурации HLA-DR11-DQA1*505 DQB1*0301; DR7 — DQA1*0201 DQB1*0202; DQ8 — гетеродимер кодируется DQA1*0301 DQB1*0302 [6, 9, 4, 12].
Распространенность DQ2 в популяции колеблется от 0 до 40%, DQ8 — от 0 до 20%, в то время как распространенность целиакии колеблется в пределах 1%. В отчете Европейской ассоциации гастроэнтерологов отмечается, что сочетание генотипов HLA-DQ2 и HLA-DQ8 повышает риск развития целиакии до 94,6—99,8% [12]. Частота выявления целиакии существенно увеличивается у родственников первой линии родства с этими больными.
При обследовании взрослых пациентов с клиническими проявлениями целиакии не выявлено ни одного случая заболевания среди лиц, не имеющих HLA-DQ2 и HLA-DQ8. Особенно важно генетическое типирование генов HLA в случаях выявления заболевания у лиц, принадлежащих к группам риска или имеющих признаки атипичной формы целиакии.
В исследованиях Американской коллегии гастроэнтерологов гетеродимеры DQ2 (95%) и DQ8 (5%) выявлены практически у всех пациентов с целиакией, что позволило сделать вывод о малой вероятности ее развития у людей без аллелей, кодирующих данные гетеродимеры. Несмотря на это, типирование HLA является дополнительным методом диагностики и не должно использоваться регулярно при начальном обследовании. Для подтверждения или опровержения диагноза необходимы выполнение биопсии и исследования крови на антитела. Типирование генов HLA предлагается использовать в дополнение к гистологическому исследованию для исключения или подтверждения диагноза целиакии у пациентов с отрицательными серологическими тестами или с сомнительными результатами гистологического исследования. Помимо этого, генетическое типирование следует выполнять при рефрактерной форме целиакии.
Заключение. Отрицательные результаты генетического типирования позволяют исключить целиакию. Наличие данных гаплотипов у 30% здорового населения не позволяет использовать данное исследование в качестве скринингового метода и не является основанием для постановки диагноза целиакии (степень достоверности рекомендаций 1А).
Генетическое типирование может быть использовано для исключения диагноза целиакии в сложных диагностических случаях. Ценность генетических маркеров при этом определяется тем, что они не зависят от того, находится ли пациент в момент исследования на АГД (степень достоверности рекомендаций 1А).
Провокационный тест (нагрузка глютеном). Современные протоколы диагностики целиакии не включают проведение повторных морфологических исследований, а также выполнение нагрузки глютеном. Российские Федеральные клинические рекомендации по оказанию медицинской помощи детям с целиакией (2015 г.) рекомендуют выполнять нагрузочную пробу в случае, если АГД использовалась в отсутствие серологического и морфологического подтверждения, или результаты первичного обследования позволяют усомниться в правильности диагноза. В таких случаях выполнение нагрузки глютеном предлагается в качестве единственного способа верифицировать диагноз. Перед проведением нагрузки рекомендуется провести генетическое исследование, которое в случае получения отрицательных результатов позволит избежать проведения провокации.
При проведении провокационного теста рекомендуется выполнить два эндоскопических исследования с забором биопсий: первое — на фоне АГД, второе — при появлении клинических симптомов заболевания на фоне употребления в пищу глютенсодержащих продуктов или через 6 мес в отсутствие признаков рецидива заболевания.
Ежедневная доза глютена при проведении провокации должна быть не менее 10 г, что соответствует 150 г муки или 200 г пшеничного хлеба. Рекомендовано давать пациенту ежедневно 1 порцию (примерно 250 г) манной каши или вермишели.
Если биопсия, проведенная через 6 мес употребления глютена, не выявляет изменений, морфологическое исследование необходимо повторить спустя 2 года от начала нагрузки глютеном. Если структурные изменения СОТК и к этому времени отсутствуют, рекомендовано динамическое наблюдение за пациентами с проведением эндоскопического исследования при появлении симптомов или повышении уровня антител в сыворотке крови.
Рефрактерная целиакия
Рефрактерная целиакия (РЦ) диагностируется на основании сохранения или повторного появления клинических симптомов целиакии при строгом соблюдении АГД в течение 6—12 мес, в отсутствие других причин возникновения клинических симптомов в том числе онкологического заболевания [1, 3].
В первую очередь необходимо убедиться в точном соблюдении АГД. Необходимо исключить другие причины манифестации симптомов, такие как не строгое соблюдение АГД, синдром избыточного роста бактерий, микроскопический колит и т. д.
Клинические проявления. Характеризуются сохранением или появлением клинических симптомов целиакии. Как правило, это диарея и тяжелый синдром нарушенного всасывания (СНВ). Среди клинических симптомов наиболее часто встречаются диарея, боль в животе, снижение массы тела, повышенная утомляемость, слабость.
Лабораторные показатели. Включают низкий уровень гемоглобина, общего белка и альбумина, а также повышение уровня печеночных ферментов. Отрицательные прогностические факторы: альбумин ≤3,2 г/дл, гемоглобин ≤11 г/дл, возраст ≥65 лет, тотальная атрофия ворсин, МЭЛ с измененным иммунофенотипом.
Несмотря на тщательное соблюдение АГД, 19—30% пациентов с РЦ имеют положительные специфические серологические пробы (АЭМ, АТТГ).
Методы визуализирующей диагностики. При стандартной и видеокапсульной эндоскопии часто обнаруживаются макроскопические признаки атрофии ворсинок («мозаичность» слизистой оболочки, зазубренность складок) или язвы. Язвенный еюнит или язвы >1 см чаще встречаются у пациентов с РЦ II типа.
Для диагностики язвенных еюнитов и их дифференциальной диагностики с Т-клеточной лимфомой может применяться глубокая энтероскопия или компьютерная томография (КТ) брюшной полости с энтерографией.
Малый объем селезенки (<122 см3), непроходимость кишечника, утолщение стенки кишки и увеличение лимфатических узлов чаще обнаруживаются при КТ брюшной полости у больных РЦ II типа или Т-клеточной лимфоме, ассоциированной с целиакией. Однако более чувствительным и специфичным, чем традиционная КТ, методом исследования является позитронно-эмиссионная томография.
Дифференциально-диагностические критерии РЦ I и II типа.Обнаружение аномального фенотипа МЭЛ служит основой для деления РЦ на 2 типа, а также может иметь прогностическое значение. При Р.Ц. I типа инфильтрация лимфоцитами СОТК подобна таковой при нелеченой целиакии. При Р.Ц. II типа CD3-положительные МЭЛ демонстрируют аномальный иммунофенотип лимфоцитов с потерей экспрессии маркеров дифференциации нормальной клеточной поверхности таких, как CD8. CD3/CD8 и аберрантный Т-клеточный рецептор обнаруживают с помощью иммуногистохимического исследования на фиксированных срезах или в свежезамороженных срезах ткани посредством проточной цитометрии. Определение CD3/CD8 методом иммуногистохимии важно для первичной оценки потенциального развития Р.Ц. Кроме того, анализ рецепторов T-клеток может выявить олигоклональную экспансию Т-клеток в пределах СОТК.
Основные дифференциально-диагностические критерии РЦ I и II типа представлены в табл. 4.
Медикаментозная терапия.Необходимо продолжать строгое соблюдение АГД. Полное парентеральное питание необходимо 28—60% пациентов с РЦ из-за потери массы тела и тяжелого СНВ [8].
Преднизолон (0,5—1 мг/кг/сут), будесонид (9 мг/сут) или сочетание преднизолона и азатиоприна (2 мг/кг/сут) являются клинически эффективными для индукции ремиссии и клинического восстановление СОТК у РЦ I типа. Однако у большинства пациентов развивается гормональная зависимость.
Клинический ответ на ГКС наблюдается почти у 75% пациентов с Р.Ц. При типе II, однако, СОТК не восстанавливается и не происходит предотвращения прогрессирования в Т-клеточную лимфому. Клиническое и гистологическое улучшение наблюдалось у 61% пациентов с РЦ после лечения циклоспорином (5 мг/кг/сут) [8].
Применение препаратов биологической терапии. Может применяться биологическая терапия инфликсимабом (5 мг/кг/сут) и алемтузумабом (анти-CD52-монокло-нальное антитело) (30 мг 2 раза в неделю в течение 12 нед). Алемтузумаб или сочетание его с пентостатином (4 мг/м2 каждые 2 нед в течение 24 нед) и будесонидом вызывает клиническое и гистологическое улучшение, но не исчезновение клональных МЭЛ. Кроме того, проблемой применения алемтузумаба является развитие лимфомы у отдельных больных.
Таким образом, при РЦ I типа эффективными средствами являются ГКС в комбинации с цитостатиками и парентеральным питанием, при РЦ II типа нет достаточно эффективного способа лечения [1, 8].
Заключение. Каждый пациент с подозрением на РЦ должен быть тщательно обследован для исключения других причин манифестации симптомов (степень достоверности рекомендаций 1А).
На первом этапе диагностики РЦ необходимо определить серологические маркеры и проанализировать тщательность соблюдения АГД (степень достоверности рекомендаций 1А).
Для дальнейшего ведения пациентов и оценки прогноза важно провести дифференциальную диагностику между РЦ I и II типа (степень достоверности рекомендаций 1В).
Применение медикаментозного лечения является необходимым условием лечения больных РЦ в дополнение к АГД (степень достоверности рекомендаций 1В).
Пациенты с РЦ должны находиться под тщательным диспансерным наблюдением и получать необходимую нутритивную поддержку, включая парентеральное питание (степень достоверности рекомендаций 1А).
Диета и медикаментозное лечение
Диета. Основным методом лечения целиакии и профилактики ее осложнений является строгая пожизненная АГД.
Cоблюдение диеты предполагает полное исключение из рациона продуктов, содержащих глютен или его следы. Принципиально важным является отказ от употребления не только продуктов, которые содержат «явный» глютен (хлеб, хлебобулочные и кондитерские изделия, макаронные изделия, пшеничная/манная, ячневая/перловая крупы, булгур, кус-кус, полба, спельта, тритикале, камут), но и тех, которые содержат «скрытый» глютен, который используется в качестве пищевой добавки в процессе производства.
Нетоксичными злаками при целиакии являются рис, гречиха, кукуруза, пшено, амарант, киноа, монтина, чумиза, саго, сорго, тэфф. Безопасными являются мука и крахмалы, приготовленные из корнеплодов: картофеля, маниоки, тапиоки, батата, бобовых: бобов, фасоли, гороха, сои, различных орехов.
Для питания больных целиакией рекомендуются специализированные безглютеновые продукты — заменители хлебобулочных, макаронных и кондитерских изделий. Рекомендуемые приемлемые уровни глютена составляют <20 ppm (20 мг/кг готового продукта).
Большинство исследователей считают, что авенины овса не токсичны, однако овсяная крупа часто контаминирована примесями других злаков, особенно пшеницы, в связи с этим в России не рекомендуется употребление овса при целиакии.
Необходимо учитывать наличие вторичных нарушений органов, которые могут обусловить необходимость специализированного питания.
Для активного периода целиакии в раннем детском возрасте характерны выраженные диспепсические явления и нарушения питания, вплоть до кахексии. Проведение диетотерапии у таких больных осложняет также частое развитие множественной пищевой непереносимости. Наиболее часто это вторичная лактазная недостаточность (75%), сенсибилизация к белкам коровьего молока (72%), нередко сенсибилизация к другим пищевым протеинам: рису, банану, белкам куриного яйца и пр.
Лекарственные препараты также могут содержать глютен, в том числе таблетки, покрытые оболочкой [1, 7, 8, 10, 15].
Медикаментозная терапия. Данная терапия играет вспомогательную роль, но в ряде случаев может быть жизненно необходимой. В основном она направлена на коррекцию метаболических нарушений, развившихся на фоне СНВ.
Коррекция переваривания проводится с помощью препаратов высокоактивных микрокапсулированных панкреатических ферментов. Больным целиакией ферментные препараты необходимо назначать длительными повторными курсами и обязательно в периоды обострения диареи.
При обострении диареи назначают адсорбенты, нейтрализующие органические кислоты, вяжущие и обволакивающие препараты: белая глина, карбонат кальция, дерматол, смекта до еды в виде болтушки. Применение лоперамида противопоказано.
С целью восстановления эубиоза кишечника рекомендуются последовательные курсы антибактериальных препаратов и пробиотиков.
Коррекция нарушений белкового обмена. При тяжелой белковой недостаточности с целью восстановления коллоидно-осмотического давления и ликвидации гемодинамических нарушений применяют препараты цельного белка — плазму, альбумин. При снижении уровня белка и фракции альбуминов проводится внутривенное переливание смесей чистых аминокислот. Широко используются препараты для энтерального питания. С целью лучшего усвоения белка применяются анаболические гормоны [7, 8].
Коррекция водно-электролитных нарушений. Лечение должно быть дифференцир??ванным в зависимости от степени тяжести клинических и лабораторных признаков водно-электролитных расстройств, состояния кислотно-основного баланса. При нарушениях обмена кальция назначают препараты кальция и витамина D.
Для лечения гиповитаминозов назначают комплекс витаминов группы В, витамин С, никотиновую кислоту и витамины из группы жирорастворимых витаминов — А, D, К и Е.
При выраженной ЖДА применяют препараты железа парентерально. В дальнейшем рекомендуются препараты железа пролонгированного действия — внутрь до полной нормализации гемоглобина и содержания ферритина сыворотки крови.
Применение ГКС при целиакии показано в случае тяжелого течения заболевания с выраженной белково-энергетической недостаточностью и в качестве заместительной терапии для коррекции надпочечниковой недостаточности.
Заключение. Строгая АГД рекомендуется как при симптомной (степень достоверности рекомендаций 1А), так и бессимптомной целиакии (степень достоверности рекомендаций 2С).
Овес не рекомендуется включать в диету больным целиакией (степень достоверности рекомендаций 2С).
В случае тяжелого течения заболевания с выраженной белково-энергетической недостаточностью и в качестве заместительной терапии рекомендовано назначение ГКС (степень достоверности рекомендаций 1В).
Больные с впервые установленным диагнозом целиакии должны быть обследованы и получать симптоматическое лечение, направленное на устранение дефицита микронутриентов (железа, кальция, фолиевой кислоты, витамина D и витамина В12) (степень достоверности рекомендаций 2С).
Профилактика
Первичная профилактика не разработана. Существовавшие до последнего времени представления, что продолжительное грудное вскармливание, введение глютенсодержащего прикорма в малых дозах на фоне грудного вскармливания в возрасте «окна толерантности» (4—6 мес) или отсроченное введение глютена снижают частоту возникновения целиакии, опровергнуто в ходе ряда многоцентровых рандомизированных плацебо-контролируемых исследований, в частности проекта Prevent CD (степень достоверности рекомендаций 2A).
Критерии динамического наблюдения
Диспансерное наблюдение при установленном диагнозе целиакии
Срок наблюдения: пожизненно.
Ведение больного ребенкаосуществляет детский гастроэнтеролог и сертифицированный диетолог.
Кратность наблюдения: после установки диагноза в течение первых 2 лет — 1 раз в 6 мес, с 3-го года наблюдения при условии установления стойкой ремиссии и регулярных достаточных массоростовых прибавок — 1 раз в год.
Обследование в ходе диспансерного наблюдения: опрос, осмотр, измерение роста и массы тела, копрограмма, клиническое исследование крови, биохимическое исследование крови (общий белок, печеночные пробы, глюкоза, кальций, фосфор, железо, холестерин, триглицериды); УЗИ органов брюшной полости и щитовидной железы, у девочек старше 12 лет — УЗИ органов малого таза, денситометрия поясничного отдела позвоночника; серологическое обследование [7, 14, 15].
Наблюдение за взрослыми больными с целиакией осуществляет гастроэнтеролог. Кратность наблюдения: 1 раз в 6 мес в первый год наблюдения. В последующем 1 раз в год. При диспансерном осмотре необходимо проводить анализ тщательности соблюдения АГД, осмотр, клиническое исследование крови, биохимическое исследование крови (общий белок и фракции, печеночные пробы, глюкоза, кальций, калий, железо, холестерин); УЗИ органов брюшной полости и щитовидной железы, органов малого таза, колоноскопию и рентгенологическое исследование тонкой кишки (особенно у лиц с сохраняющимися симптомами заболевания), денситометрию поясничного отдела позвоночника; серологическое обследование.
Серологическая диагностика в динамическом наблюдении проводится как метод контроля за соблюдением АГД. Мониторируются следующие серологические показатели: АТТГ IgA или, при дефиците IgA, АДПГ IgG и АТТГ IgG. Мониторируются также все измененные клинические, лабораторные и инструментальные показатели, обнаруженные при первичном обследовании больного.
Частота контрольных исследований на 1-м году наблюдения и в последующем не регламентируется, но должна быть не реже одного раза в год [1, 8].
Повторные эндоскопические и гистологические исследования. Повторное эндоскопическое исследование с морфологическим исследованием биопсийного материала СОТК рекомендуется проводить в случае недостаточного клинического ответа или возврата симптомов болезни, несмотря на утверждения больного о соблюдении АГД, спустя 6—12 мес. Считается, что полугодовые исследования неоптимальны (главным образом из экономических соображений), чаще рекомендуются ежегодные осмотры с биопсией [1]. У взрослых пациентов повторные биопсии необходимы для снижения риска развития лимфомы. Вместе с тем, если на фоне АГД симптомов нет, то от ежегодной биопсии можно воздержаться.
Повторная биопсия для оценки восстановления СОТК на фоне лечения и положительного клинического ответа на терапию (нет клинических проявлений на фоне АГД) считается оптимальной по прошествии 2 лет, однако четко сроки проведения не регламентируются и варьируют от 2 до 5 лет.
Если уровни антител не снижаются в пределах 12 мес, следует убедиться в тщательности соблюдения АГД. В частности, надо исключить возможность неосознанного ее нарушения за счет употребления продуктов, которые могут содержать глютен. В этом случае надо убедить больного в необходимости повторной биопсии спустя несколько месяцев после коррекции АГД.
Противорецидивное лечение. Пожизненная строгая АГД является залогом нормализации строения и функций тонкой кишки, устранения обменных нарушений. Дополнительное медикаментозное лечение проводится по индивидуальным показаниям.
Профилактические прививки у детей выполняются в период ремиссии. Подчеркивается необходимость противопневмококковой вакцинации в связи с повышенным риском развития пневмококковых инфекций (степень достоверности рекомендаций 2С).
Заключение. Контрольное серологическое обследование в 1-й год наблюдения за больным рекомендуется проводить через 6 мес соблюдения АГД, в дальнейшем с периодичностью 1 раз в год (степень достоверности рекомендаций 1B).
Повторное эндоскопическое исследование с биопсией СОТК рекомендуется проводить у больных с сохраняющимися клиническими симптомами 1 раз в год (степень достоверности рекомендаций 1C).
В отсутствие клинических симптомов от проведения ежегодной ЭГДС с биопсией можно воздержаться (степень достоверности рекомендаций 1C).
Повторную биопсию СОТК на фоне лечения рекомендуется проводить в сроки от 2 до 5 лет (степень достоверности рекомендаций 1B).
Исходы и прогноз
Поздняя диагностика значительно увеличивает риск развития онкологических заболеваний (особенно Т-клеточной лимфомы тонкой кишки), бесплодия, остеопороза, неврологических нарушений.
При строгом пожизненном соблюдении АГД прогноз благоприятный.
При строгом соблюдении АГД более 5 лет риск развития онкологических заболеваний приближается к популяционному. Риск возникновения аутоиммунных заболеваний (особенно аутоиммунного тиреоидита и СД 1-го типа) и остеопороза остается повышенным, что необходимо учитывать при диспансерном наблюдении.
Эффект от проводимой диетотерапии зависит от тщательности ее соблюдения, поэтому крайне важно правильно информировать пациентов о категории безглютеновых продуктов. Важна социальная адаптация больных детей в садах, школах, в местах общественного питания. Только совместная работа врача, диетолога и общества больных целиакией позволяет получить хорошие результаты лечения и улучшить качество жизни больных.
Конфликт интересов отсутствует.
Актуальность
Американский колледж гастроэнтерологов (ACG) опубликовал рекомендации по диагностике, лечению и наблюдению за педиатрическими и взрослыми пациентами с целиакией. Рекомендации основаны на результатах систематических обзоров, мета-анализов и отдельных клинических исследований.
Рекомендации
- Эксперты рекомендуют проведение ЭГДС со взятием множественных дуоденальных биопсий для подтверждения диагноза у детей и взрослых с подозрением на целиакию (строгая рекомендация)
Эксперты считают, что высокий уровень IgA к тканевой трансглутаминазе (ТТГ) (>10× верхней границы нормы) в сочетании с положительными антителами к эндомизию является надежным методом диагностики целиакии у детей. У взрослых с симптомами целиакии при отказе от проведения ЭГДС или при невозможности ее выполнения лабораторная диагностика возможна для установления вероятного диагноза целиакии (условная рекомендация).
Множественные биопсии из двенадцатиперстной кишки (1 или 2 из бульбарного отдела, 4 из дистального отдела) необходимы для диагностики целиакии.
Проведение ЭГДС с биопсией также необходимо для дифференциальной диагностики с заболеваниями, протекающими с мальабсорбцией и энтеропатиями.
Лимфоцитоз двенаднацитиперстной кишки (≥25 интраэпителиальных лимфоцитов на 100 эпителиальных клеток в отсутствии атрофии ворсинок не специфичен для диагноза целиакии и другие причины должны быть найдены.
- Эксперты полагают, что эндоскопическая ремиссия является конечной целью безглютенового режима. Эксперты также предлагают принимать индивидуальное решение в отношении достижения цели клинической или серологической ремиссии (условная рекомендация)
Проведение ЭГДС со взятием биопсии полезно для мониторинга в отсутствии клинического ответа или рецидива симптомов несмотря на соблюдение безглютенового рациона.
Гистологическое исследование позволяет судить о ремиссии (заживлении слизистой) в отсутствии симптомов после 2 лет от начала безглютеновой диеты.
- Эксперты выступают против рутинного использования устройств, для обнаружения глютена в продуктах питания и биопробах у пациентов с целиакией (условная рекомендация)
Рацион питания для пациента с целиакией целесообразно подбирать с диетологом, имеющим опытом в безглютеновой диете
Технологии качественного обнаружения глютена в пищевых продуктах или биообразцах не всегда позволяют различить клинически значимое и незначимое воздействие глютена.
К настоящему моменту получено мало доказательств того, что применение технологии обнаружения глютена улучшает соблюдение диеты или положительно сказывается на качестве жизни.
Необходимо проведение исследований, оценивающих пользу устройств для обнаружения глютена для улучшения соблюдения безглютеновой диеты и клинических исходов целиакии.
- В настоящее время получено недостаточно доказательств против или за применение пробиотиков в терапии целиакии
Дисбиоз является одной из черт целиакии, однако его роль в патогенезе заболевания и развитии симптомов полностью не доказана.
Польза от приема пробиотиков у пациентов с целиакией не установлена.
- Эксперты рекомендуют употребление безглютенового овса у пациентов с целиакией. Загрязнение овса глютеном, различная токсичность разных сортов овса и небольшой риск иммунной реакции на белок овса авенин требуют мониторинга переносимости овса (строгая рекомендация)
Потребление овса кажется безопасным у большинства пациентов с целиакией, но может быть иммуногенным у части пациентов.
Гетерогенность в переносимости овса может быть связана с различиями в происхождении/урожае и количестве потребляемого овса.
Период мониторинга симптомов и серологии после введения в рацион безглютенового овса неизвестны.
- Эксперты рекомендуют вакцинацию для профилактики пневмококковой болезни пациентам с целиакией (условная рекомендация)
Вакцинация против пневмококковой инфекции безопасна и эффективна.
Вацинация против пневмококковой инфекции широко рекомендована у взрослых пациентов старше 65 лет и курящих лиц в возрасте 19-64 лет и у ряда других пациентов.
- Эксперты рекомендуют повышение выявления целиакии (строгая рекомендация)
- Эксперты выступают против массового скрининга в популяции (строгая рекомендация)
Пациентам с симптомами, признаками и типичными лабораторными изменениями, свидетельствующими о мальабсорбции (хроническая диарея с потерей веса, стеаторея, боль в животе и вздутие живота) слудет провести скрининг на целиакию.
Пациенты, у которых есть родственники первой линии с целиакией, и которые имеют возможные симптомы, признаки и типичные лабораторные изменения, должны пройти скрининг на целиакию.
Следует рассмотреть возможность тестирования бессимптомных родственников первой линии пациентов с целиакией
- Эксперты рекомендуют определение антител IgA анти-ТТГ для выявления целиакии у детей младше 2 лет в отсутствии дефицита IgA (строгая рекомендация)
- Эксперты рекомендуют проведение скрининга на целиакию у детей с дефицитом IgA при помощи IgG-антител (антитела к деамидированным пептидам глиадина IgG (DGP-IgG) или ТТГ-IgG) (строгая рекомендация)
Результаты исследований показывают, что ТТГ-IgA или антитела к эндомизию (EMA-IgA) имеют меньшую точность у детей младше 2 лет.
Тестирование на целиакию у детей младше 2 лет должно включать оба теста ТТГ-IgA и DGP-IgG.
Источник: Rubio-Tapia Alberto, Hill Ivor D, Semrad Carol, et al. American College of Gastroenterology Guidelines Update: Diagnosis and Management of Celiac Disease. The American Journal of Gastroenterology 118(1):p 59-76, January 2023. | DOI: 10.14309/ajg.0000000000002075.
Дата публикации 5 апреля 2020Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
Целиакия (глютеновая непереносимость) — это хроническое генетическое заболевание, при котором пища, содержащая глютен (выпечка, макароны, сухие завтраки, йогурты), повреждает слизистую оболочку тонкого кишечника, в которой происходит основное всасывание питательных веществ. При целиакии организм не получает белки, жиры, углеводы и витамины в полном объёме, что приводит к снижению веса [1].
По статистическим данным Европы и Северной Америки, распространённость целиакии достигает 1 %, т. е. она встречается у одного человека из ста [1]. Чаще всего с этим заболеванием сталкиваются педиатры, так как обычно заболевание впервые даёт о себе знать в детском возрасте [12].
Основной причиной возникновения целиакии является глютен — белковый компонент злаковых культур: пшеницы, ржи, ячменя. Он, как клейковина, связывает между собой белки этих злаковых культур.
Непереносимость глютена развивается только у людей с генетической поломкой в иммунной системе. В таких случаях продукты с этим компонентом воспринимаются организмом как аллерген, «чужеродный» агент. Он приводит к активации иммунного ответа, который способствует повреждению ворсинок кишечника. Это приводит к уменьшению всасывания питательных веществ, из-за чего у человека с глютеновой непереносимостью не только снижается вес, но и появляется множество других заболеваний, маскирующих основную проблему.
Если человек болен целиакией, то с вероятностью 20 % эта болезнь может быть диагностирована у его родственников. Гораздо чаще целиакию выявляют среди близнецов — в 86 % случаев [1].
В каких изделиях может содержаться глютен:
- в изделиях из пшеничной муки: хлебе, макаронах, выпечке;
- в изделиях, содержащих рожь, овёс, ячмень.
Учитывая его широкое применение в качестве «загустителя», глютен также содержат:
- сладости;
- йогурты;
- мороженое;
- консервы;
- пиво;
- густые соусы;
- сухие завтраки, исключая настоящие кукурузные хлопья.
Так как глютен входит во множество продуктов, он неизбежно попадает в организм во время еды. От какого именно количества разовьётся целиакия у предрасположенных людей, пока не установлено — каждый случай индивидуален. То, насколько серьёзными будут проявления заболевания, зависит в первую очередь от активности аутоиммунного процесса.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы целиакии
Клиническая картина целиакии настолько разнообразна, что единого симптома, который бы встречался у 100 % пациентов, не существует.
Чаще всего первые признаки заболевания возникают у детей через 1,5-2 месяца после введения прикорма (мучных изделий и мультизлаковых каш). У ребёнка снижается аппетит вплоть до отказа от еды. Могут появиться приступы рвоты и проблемы со стулом — он становится обильным, пенистым, жирным и зловонным. Ребёнок отстаёт от своих сверстников по весу, плохо растёт, что говорит о задержке физического развития [2]. Родители отмечают у ребёнка повышенную раздражительность, нарушение сна, иногда апатию и снижение настроения. В случае апатии ребёнок практически не интересуется внешним миром, в отличии от остальных здоровых детей. Иногда может наблюдаться гипотония — слабость мышц. При этом ребёнок утрачивает приобретённые навыки: если раньше он умел вставать и ходить самостоятельно, то спустя время перестаёт это делать. Помимо этого может появиться пищевая аллергия на белки коровьего молока и лактозная недостаточность [11].
Иногда все эти симптомы вновь возникают после перенесённых инфекций: кишечного гриппа (ротавирусной инфекции) или респираторных заболеваний. Любая инфекция активирует иммунную систему для борьбы с вирусами и микробами. При целиакии эта иммунная реакция будет неправильной: она будет направлена не только на уничтожение вирусов, но и на поражение слизистой оболочки тонкого кишечника.
Дети постарше жалуются на боли в животе, которые имеют непостоянный, но локализованный характер — они возникают в околопупочной области. У подростков и взрослых пациентов преобладают внекишечные проявления. Клиническая картина целиакии становится стёртой, что значительно усложняет постановку правильного диагноза. Поэтому пациент может годами наблюдаться по поводу других заболеваний, которые на самом деле являются следствием глютеновой непереносимости [1]:
- у эндокринолога наблюдаются пациенты с задержкой физического развития;
- у гинеколога — пациенты с бесплодием;
- у невролога — пациенты с апатией, мышечной гипотонией;
- у онколога — пациенты с Т-клеточной лимфомой тонкой кишки (может возникнуть в совсем запущенном случае целиакии);
В целом существует несколько специфических симптомов, по которым педиатр может заподозрить наличие непереносимости глютена:
- боли в животе (при исключении хирургической патологии);
- обильный, зловонный, пенистый, жирный стул;
- рвота (от редкой до ежедневной);
- увеличение окружности живота.
Патогенез целиакии
Целиакия развивается только у лиц с генетической поломкой — наличием таких вариантов лейкоцитарных антигенов человека (HLA), как HLA-DQ2 и HLA-DQ8. Они располагаются на шестой хромосоме, большинство генов которой программируют иммунный ответ организма. Если эти аллели отсутствуют, то развитие целиакии невозможно [1].
Патогенез заболевания связан с механизмом поражения тонкого кишечника — самого длинного отдела пищеварительного тракта, который включает в себя три отдела: двенадцатиперстную, тощую и подвздошную кишку.
Основной функцией тонкого кишечника является всасывание питательных веществ. Этот процесс в первую очередь происходит на уровне слизистой оболочки. Она состоит из множества складок, которые увеличивают всасываемую поверхность кишечника.
У здоровых людей слизистая оболочка тонкого кишечника полностью расщепляет глютен и всасывает его составляющие. При наличии генетической поломки глютен воспринимается организмом как чужеродный компонент. При контакте со слизистой он активирует иммунный ответ, направленный против слизистой оболочки тонкого кишечника: в организме образуются иммунные комплексы, которые вызывают иммуновоспалительную реакцию [4].
В результате токсического воздействия нарушается структура слизистой оболочки тонкого кишечника, площадь всасываемой поверхности уменьшается. Таким образом, поражается основное место всасывания полезных веществ, из-за чего снижается количество питательных веществ, попадающих в организм. Это в свою очередь нарушает обменные процессы, приводя к дефициту макро- и микронутриентов (биологически значимых элементов), которое сопровождается снижением веса, диареей, рвотой, появлением болей в животе.
Образующиеся иммунные комплексы могут поражать не только слизистую оболочку тонкой кишки, но и другие органы и системы. Циркулируя в крови, иммунные комплексы попадают в печень, почки, периферическую нервную систему, головной мозг, лимфоток и кожу. В связи с этим клиническая картина целиакии настолько многообразна, что её проявления ошибочно воспринимаются как самостоятельные заболевания, не связанные с глютеновой непереносимостью [1].
Классификация и стадии развития целиакии
В соответствии с клинической картиной и преобладанием в ней кишечных симптомов, типичных для глютеновой непереносимости, выделяют две основные формы заболевания:
- Типичная целиакия. Классическая картина характерна для пациентов детского возраста. У них наблюдается диарея, рвота, боли в животе, увеличение его объёма, отставание в росте и весе.
- Атипичная целиакия. Данная форма заболевания встречается чаще всего. Её сложнее диагностировать, потому что кишечных симптомов в этом случае либо нет, либо они очень слабо выражены. К проявлениям атипичной целиакии относятся: анемия, остеопороз, задержка физического развития, неврологические симптомы. У взрослых возможно бесплодие.
Так же, как у любой болезни, у целиакии выделяют периоды заболевания в зависимости от активности процесса:
- Латентный — скрытый период, когда у больного ещё нет клинических проявлений. У каждого человека этот период длится по-разному: от нескольких месяцев до нескольких лет. Его продолжительность зависит от особенностей организма, а не от количества попадающей в организм глютеносодержащей еды.
- Активный — период клинических проявлений заболевания.
- Период неполной ремиссии — период начала ремиссии. Наступает тогда, когда выставлен диагноз, определена причина заболевания и соблюдается строгая диета, полностью исключающая из рациона продукты с содержанием глютена. Обычно этот процесс может занимать от 3 до 6 месяцев. При этом снижается проявление кишечных симптомов, отмечается улучшение самочувствия (полностью симптомы не исчезают).
- Период полной ремиссии — период значительного ослабления или полного исчезновения признаков целиакии. Он может наступить только через 1-1,5 года строгой диеты, полностью исключающей глютеносодержащие продукты. Так как глютен больше не попадает в организм, иммунная система не вырабатывает новые специфические антитела и комплексы. Со временем структура слизистой оболочки тонкого кишечника восстанавливается, улучшается всасываемость питательных веществ. Ребёнок начинает прибавлять в росте и весе.
- Декомпенсация — период возобновления симптомов целиакии. Может наступить как из-за не выявления причины заболевания, так и по халатности пациента или его родителей, которые не хотят прислушиваться к рекомендации исключить из рациона продукты, содержащие глютен. Это может стать причиной преждевременной гибели больного [2].
Осложнения целиакии
Осложнения целиакии чаще всего развиваются у взрослых с атипичной формой целиакии через много лет после начала заболевания. К ним относятся:
- Изменения со стороны кожи: герпитеформный и атопический дерматит, витилиго, алопеция, афтозный стоматит, хейлит [2].
- Риск онкологии органов желудочно-кишечного тракта — основная причина смертности у 10-50 % пациентов с целиакией. Причём к развитию рака тонкого кишечника предрасположены не только люди с глютеновой непереносимостью, но и их ближайшие родственники: мамы, папы, братья и сестры.
- Множественные хронические язвы в тонком кишечнике — сопровождаются повышением температуры тела, быстрой потерей веса, диареей, болями в области живота. Язвы могут быть осложнёнными, с проявлениями кровотечения и формированием рубцов, что в итоге способно привести к кишечной непроходимости — острой хирургической патологии, требующей неотложной помощи.
- Динамическая кишечная непроходимость — заболевание, при котором нормальные сократительные движения кишечной стенки временно прекращаются. Оно, в отличие от острой формы, может обойтись без хирургического вмешательства. Пациентов с этим осложнением беспокоят тошнота, рвота, запоры и боли в животе.
- Рефрактерная целиакия — постоянное повреждение тонкого кишечника с характерными симптомами, несмотря на соблюдение строгой безглютеновой диеты. Эта форма заболевания не поддаётся лечению. Её механизм развития до конца не изучен.
- Вторичный остеопороз — это хроническое поражение костей. Чаще всего оно развивается у женщин в постменопаузальный период спустя 10 лет, иногда возникает у детей дошкольного возраста и молодых людей. При целиакии вместе с остальными питательными веществами в организм не попадают и не усваиваются важные элементы для роста костей: кальций и витамин Д. Из-за их хронической нехватки костная ткань не может восполнять свои запасы, что приводит к снижению её плотности, т.е. к хрупкости костей [8].
- Бесплодие чаще возникает у взрослых пациентов без явной кишечной клинической картины, т. е. при атипичной форме целиакии. Оно также связано с нарушением всасывания жизненно необходимых питательных веществ для наступления нормальной беременности: фолиевой кислоты, железа, витамина Д и кальция. При соблюдении диеты слизистая оболочка восстанавливается и необходимые компоненты усваиваются. Без подтверждения целиакии соблюдать безглютеновую диету не нужно [13].
- Эпилепсия часто встречается у пациентов с целиакией, как и наоборот. Их также связывает недостаточное поступление питательных веществ, а точнее дефицит фолиевой кислоты, из-за чего в веществе головного мозга появляются отложения кальция. Если у детей с выявленной эпилепсией есть неяркие проявления целиакии, то лечение эпилепсии без лечения целиакии будет неэффективным [14].
Так как генетическая поломка в организме часто поражает не один ген, а сразу несколько, целиакия может сочетаться с другими аутоиммунными и генетическими заболеваниями. К таким патологиям относятся:
- сахарный диабет 1-го типа;
- аутоиммунные патологии щитовидной железы — чаще всего хронический аутоиммунный тиреоидит (наблюдается в 5-7 % случаев целиакии);
- болезнь Аддисона — разрушение коры надпочечников, сопровождается рвотой, диареей, ухудшением аппетита, потерей веса, резким снижением глюкозы в крови, увеличивается потребность в солёной пище;
- дисфункция репродуктивной системы — развитие бесплодия, нарушение менструального цикла, отсутствие менструаций на фоне низкого веса;
- сердечно-сосудистые патологии — аутоиммунный миокардит и др.;
- заболевания пищеварительного тракта — аутоиммунный гепатит, цирроз печени;
- другие аутоиммунные патологии — ревматоидный артрит, язвенный колит, болезнь Крона [5].
Диагностика целиакии
Диагностика проводится при подозрении на целиакию и ассоциированные с ней заболевания, например задержку физического развития, сахарный диабет 1-го типа и др. Очень важно сдавать анализы перед началом безглютеновой диеты, т. е. на фоне обычного питания, при котором появились симптомы. При соблюдении диеты снижается количество специфических антител, что может привести к ложноотрицательным результатам. Это затруднит постановку правильного диагноза.
При первичном обследовании определяется общий уровень иммуноглобулина А. При сдаче биохимического анализа стоит обратить внимание на анемию, снижение уровня альбумина, кальция, калия, натрия, повышение уровня щелочной фосфатазы и увеличение времени свёртывания крови. Помимо этого обязательно должны проводиться общий анализ мочи и исследование кала [1][11].
Также существует анализ на специфические антитела, которые формируются иммунитетом при глютеновой непереносимости:
- к тканевой трансглутаминазе;
- к деамидированным пептидам глиадина;
- к эндомизию.
Чаще всего при подозрении на глютеновую непереносимость берут кровь из вены на определение антител к тканевой трансглутаминазе, и только потом решается вопрос о проведении ЭФГДС (эзофагогастродуоденофиброскопии) с биопсией ворсин тонкого кишечника. Биопсия нужна для того, чтобы рассмотреть клетки кишечника под микроскопом и определить уровень повреждения ворсин. Если биопсия кишечника не дала результата и ворсины остаются нормальными, но при этом есть положительный результат анализа крови на специфические антитела, то исключать наличие целиакии нельзя [11].
Лечение целиакии
Так как причина данного заболевания — это глютеносодержащие продукты, нужно не просто ограничить их потребление, а полностью исключить. Заболевание нельзя устранить окончательно, можно только поддерживать организм, поэтому диету необходимо соблюдать постоянно.
Рацион питания составляется диетологом, который занимается лечением глютеновой непереносимости. Если специфические антитела выявляются, но клинические проявления отсутствуют, то диета при целиакии не назначается — показано только наблюдение в динамике [7].
Что же можно есть пациентам с целиакией? Из распространённых продуктов в пищу используются гречка, рис, пшено, кукуруза. Безопасно употребление амаранта, тэффа, чумизы, саго, монтина, киноа. Разрешена мука, приготовленная из картофеля, тапиоки, батата и мониоки. Из бобовых можно есть фасоль, сою и горох. Допустимо употреблять в пищу различные орехи, яйца, мясо, рыбу, молочные продукты, фрукты и овощи [1].
Вопрос о безопасности употребления овса пока остаётся открытым. Он достаточно редко встречается в чистом виде: в нём содержатся примеси пшеницы. Это делает продукт небезопасным при глютеновой непереносимости [9].
Покупая продукты в магазине, пациент с целиакией может ориентироваться на специальный логотип перечёркнутого колоса, размещённый на упаковке товара. Он является зарегистрированной товарной маркой Ассоциации европейских обществ целиакии AOECS. Его могут получить только проверенные продукты, безопасные для людей с глютеновой непереносимостью.
Также на упаковках продуктов можно встретить надпись «без глютена» или похожий по смыслу символ. Иногда они используются как рекламный ход и не гарантируют отсутствие аллергена. В товарах с такой маркировкой может присутствовать «скрытый глютен». Согласно своей рецептуре, его могут содержать следующие продукты:
- различные колбасные изделия, полуфабрикаты из мяса и рыбы;
- любые консервы;
- томатная паста, кетчуп;
- творожные сырки, мягкие и плавленые сыры;
- мороженное, йогурты;
- некоторые сорта маргарина;
- сухие приправы и пряности;
- майонез и соусы;
- бульонные кубики, картофельное пюре и супы быстрого приготовления;
- чипсы;
- квас и пиво;
- крабовые палочки и крабовое мясо;
- некоторые виды чая, кофе и какао;
- отдельные виды сладостей — соевые шоколадные конфеты с начинкой, восточные сладости и повидло промышленного производства;
- все продукты с некоторыми пищевыми добавками — Е160b, Е150а – Е150d, Е636, Е953, Е965.
Лечение лекарственными препаратами при целиакии может быть жизненно необходимой мерой. Оно направлено на восполнение дефицита витаминов и минералов. При необходимости проводится восстановление кишечной микрофлоры — назначение пробиотиков без лактозы (примадофилуса или линекса) [11]. При дефиците железа и развитии железодефицитной анемии показаны препараты с содержанием железа и фолиевой кислоты, которая нужна организму для улучшения усвоения железа. При дефиците кальция, остеопорозе и появлении судорог назначают кальций и витамин Д.
В тяжёлых запущенных случаях, когда пациент не может питаться или его организм не может усваивать пищу естественным путём, допустимо внутривенное вливание питательных веществ [6].
Прогноз. Профилактика
Специфических мероприятий по профилактике целиакии, направленных на предупреждение появления её причины, в настоящее время нет [2].
При строгом соблюдении диеты, полном отказе от глютеносодержащих продуктов прогноз благоприятный. Соблюдение рекомендаций по питанию снижает риск развития рака желудочно-кишечного тракта. Если же у пациента, несмотря на длительную диету, возникают кишечные расстройства, то ему необходимо повторно выполнить биопсию тонкого кишечника для исключения онкологии [12].
Пациентов с рефрактерным течением целиакии, которые не поддаются диетотерапии, необходимо более тщательно обследовать на наличие онкологических заболеваний [10].