Руководство по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов
(в ред. Решения Коллегии Евразийской экономической комиссии
от 11.10.2022 N 143)
В соответствии со статьей 30 Договора о Евразийском экономическом союзе от 29 мая 2014 года, статьeй 6 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года и пунктом 15 перечня актов Евразийской экономической комиссии по вопросам регулирования общих рынков лекарственных средств и медицинских изделий в рамках Евразийского экономического союза на 2017 – 2019 годы (приложение к распоряжению Совета Евразийской экономической комиссии «Об актах Евразийской экономической комиссии по вопросам регулирования общих рынков лекарственных средств и медицинских изделий в рамках Евразийского экономического союза» от 17 мая 2017 г. N 15) Коллегия Евразийской экономической комиссии РЕШИЛА:
Утвердить прилагаемое Руководство по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов.
Настоящее Решение вступает в силу по истечении 6 месяцев с даты его официального опубликования.
При этом исходить из того, что в случае, если реализация положений указанного Руководства осуществляется в соответствии с актами Евразийской экономической комиссии, применение таких положений осуществляется с даты вступления в силу (с даты начала применения) соответствующих актов. соответствующих актов.
Председатель Коллегии
Евразийской экономической комиссии
Т.Саркисян
УТВЕРЖДЕНО
Решением Коллегии
Евразийской экономической комиссии
от 26 ноября 2019 г. N 202
РУКОВОДСТВО
ПО ДОКЛИНИЧЕСКИМ ИССЛЕДОВАНИЯМ БЕЗОПАСНОСТИ В ЦЕЛЯХ
ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ И РЕГИСТРАЦИИ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
(в ред. Решения Коллегии Евразийской экономической комиссии
от 11.10.2022 N 143)
I. Общие положения
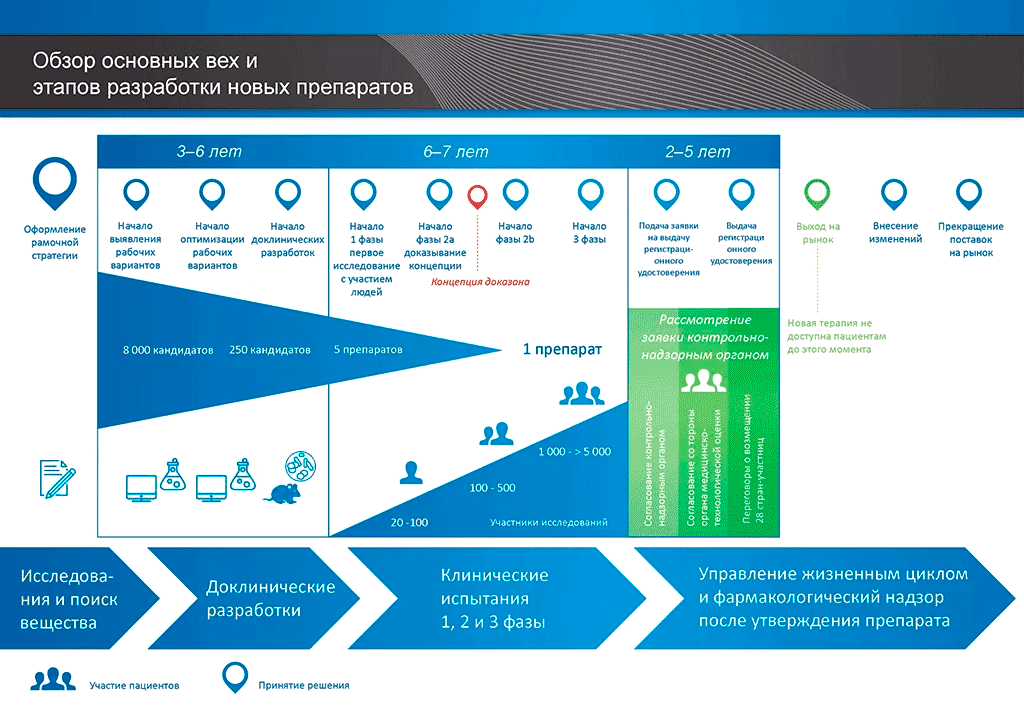
1. Целью настоящего Руководства является установление единого порядка проведения доклинических исследований безопасности лекарственных препаратов (далее — доклинические исследования) для их последующей регистрации в рамках Евразийского экономического союза. В настоящем Руководстве отражена взаимосвязь между необходимостью проведения доклинических исследований и проведением клинических исследований с участием человека.
2. Настоящее Руководство направлено на обеспечение:
безопасной, этичной разработки и внедрения новых лекарственных препаратов;
своевременного проведения клинических исследований;
сокращения использования в исследованиях лабораторных животных в соответствии с принципами 3R (замена, улучшение, сокращение) (replacement, refinement, reduction);
сокращения использования других ресурсов при разработке лекарственных препаратов.
Необходимо учитывать возможность использования новых альтернативных in vitro методов оценки безопасности, которые при их надлежащей валидации и одобрении уполномоченными органами (экспертными организациями) государств — членов Евразийского экономического союза (далее соответственно — государства-члены, Союз) могут заменить существующие стандартные методы.
3. Настоящее Руководство составлено в целях гармонизации доклинических исследований, направленных на обоснование проведения клинической разработки лекарственных препаратов на различных ее этапах.
4. Настоящее Руководство содержит указания относительно вида, продолжительности и сроков проведения доклинических исследований в качестве обоснования проведения клинических исследований и регистрации лекарственных препаратов.
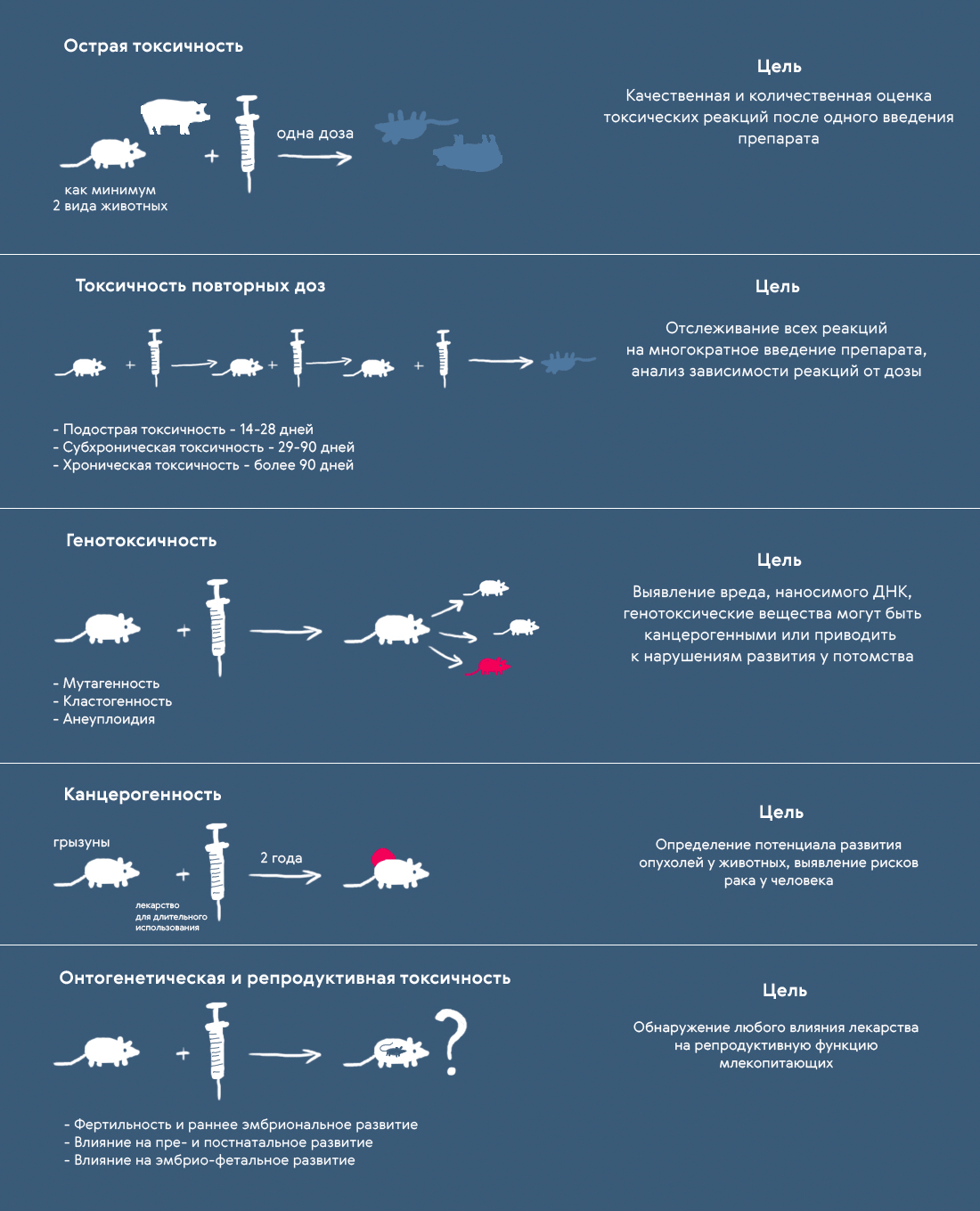
5. Доклиническая оценка безопасности лекарственных препаратов в целях их регистрации предусматривает проведение:
а) фармакологических исследований;
б) исследований общетоксических свойств;
в) токсикокинетических и доклинических фармакокинетических исследований;
г) исследований репродуктивной токсичности;
д) исследований генотоксичности;
е) оценки канцерогенного потенциала в отношении лекарственных препаратов, вызывающих особые опасения или предназначенных для длительного применения.
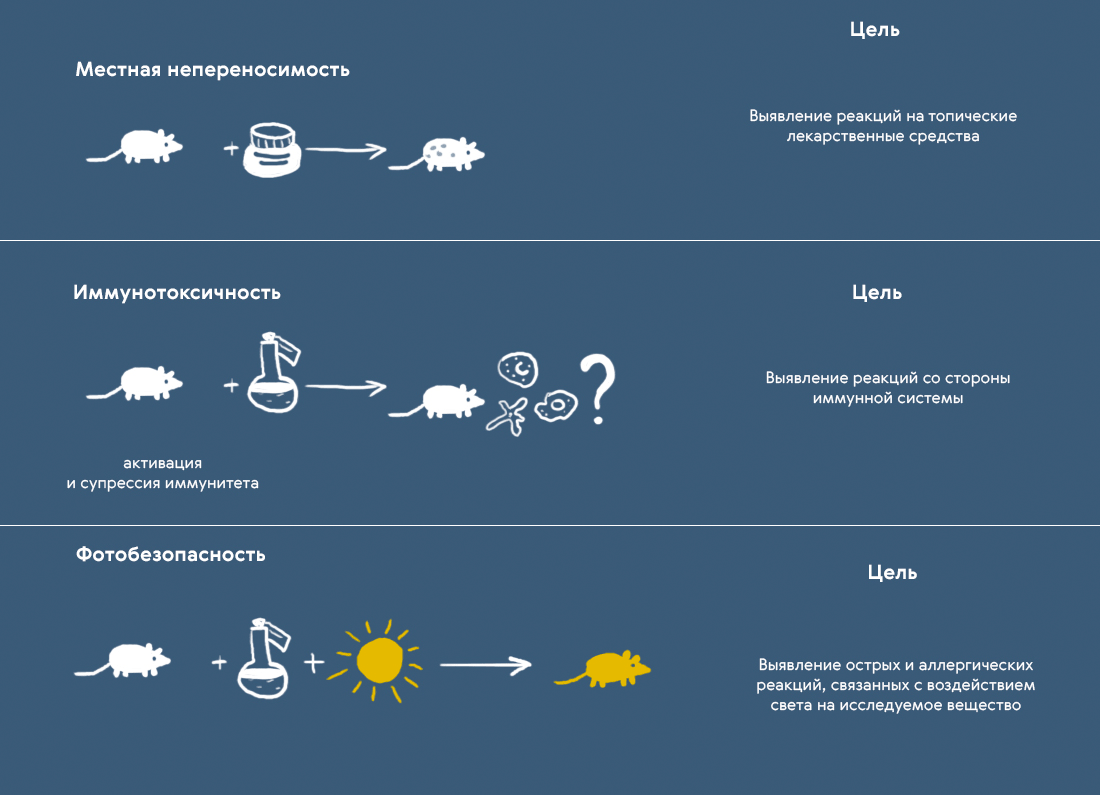
6. Необходимость проведения доклинических исследований в целях оценки фототоксичности, иммунотоксичности, токсичности на неполовозрелых животных и склонности к возникновению лекарственной зависимости определяется в индивидуальном порядке.
7. Настоящее Руководство применяется на этапе разработки лекарственных препаратов и содержит общие требования к процессу доклинической разработки лекарственных препаратов. Планирование и дизайн доклинических исследований и клинических исследований с участием человека основываются на подходе, удовлетворительном с научной и этической точек зрения.
8. Исследования безопасности биотехнологических лекарственных препаратов необходимо проводить в соответствии с требованиями глав 5.3 и 5.4 Правил проведения исследований биологических лекарственных средств Евразийского экономического союза, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 89. При проведении исследования безопасности биотехнологических лекарственных препаратов настоящее Руководство применяется только в отношении сроков проведения доклинических исследований в зависимости от фазы клинической разработки биотехнологических лекарственных препаратов.
Результаты исследований безопасности лекарственных препаратов, длительно применяемых в медицинской практике и содержащих действующие вещества, данные о доклиническом исследовании которых ограничены или отсутствуют, допускается представлять в составе смешанных регистрационных досье лекарственных препаратов. Составление документов о доклинических исследованиях для смешанных регистрационных досье лекарственных препаратов осуществляется в соответствии с требованиями, согласно приложению N 1.
9. В целях оптимизации и ускорения разработки лекарственных препаратов для лечения жизнеугрожающих и тяжелых заболеваний (например, распространенного рака, резистентной ВИЧ-инфекции, состояния, обусловленного врожденной ферментативной недостаточностью), не имеющих эффективной терапии, допустим индивидуальный подход к токсикологической оценке и клинической разработке. В этих случаях, а также в отношении лекарственных препаратов, созданных на основе инновационных терапевтических методов (например, малой интерферирующей РНК (siRNA) и адъювантных вакцин), в программе доклинического исследования допустимо сокращение, отказ от проведения или добавление определенных исследований. Для решения вопроса об объеме изменений программы доклинического исследования необходимо руководствоваться положениями актов органов Союза в сфере обращения лекарственных средств или законодательством государств-членов.
10. Доклинические исследования необходимо проводить с учетом требований пунктов 34 и 35 Правил регистрации и экспертизы лекарственных средств для медицинского применения, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78 (далее — Правила регистрации и экспертизы).
11. Доклинические исследования, проведенные за пределами таможенной территории Союза, должны быть выполнены с учетом указаний пункта 35 Правил регистрации и экспертизы, а также соответствовать настоящему Руководству и другим актам органов Союза в сфере обращения лекарственных средств.
12. По вопросам, не урегулированным в настоящем Руководстве, заявители вправе обратиться за научной консультацией в уполномоченные органы (экспертные организации) государств-членов в соответствии с пунктом 26 Правил регистрации и экспертизы.
13. Разработка лекарственного препарата — поэтапный процесс, предусматривающий оценку данных о его эффективности и безопасности для животных и человека. К целям доклинической оценки безопасности относится установление:
характеристик токсического действия в отношении органов-мишеней;
зависимости токсического действия от дозы;
зависимости токсического действия от экспозиции;
потенциальной обратимости токсического действия (в соответствующих случаях).
Полученные сведения используют для оценки начальной безопасной дозы и диапазона доз в исследованиях с участием человека, а также для определения соотношения «польза — риск» и параметров клинического мониторинга потенциальных нежелательных эффектов.
14. Доклинические исследования, несмотря на ограниченный характер на начальном этапе клинической разработки, должны быть достаточными для описания потенциальных нежелательных реакций, которые могут возникнуть в условиях обоснованного клинического исследования.
15. Клинические исследования проводятся в целях изучения эффективности и безопасности лекарственного препарата, начиная с относительно низкой системной экспозиции у небольшого числа субъектов. За ними следуют клинические исследования, в которых экспозиция лекарственного препарата увеличивается, как правило, за счет продолжительности применения и (или) размера популяции пациентов.
16. Клинические исследования необходимо расширять, если получены результаты, подтверждающие достаточную безопасность лекарственного препарата в ранее проведенном клиническом исследовании (исследованиях), а также при наличии дополнительных данных доклинических исследований безопасности, которые становятся доступными по мере выполнения клинической разработки.
17. Серьезные нежелательные эффекты, выявленные на клиническом и (или) доклиническом этапах разработки лекарственного препарата, могут повлиять на продолжение клинической разработки. В целях определения целесообразности разработки дизайна и проведения дополнительных доклинических и (или) клинических исследований эти данные необходимо рассматривать в рамках общего плана клинической разработки.
18. Клинические исследования проводятся с разделением по фазам клинической разработки, каждая из которых имеет различные цели. Поскольку допускается объединение фаз клинической разработки, в настоящем Руководстве требования к доклиническим исследованиям соотнесены не только с фазами клинической разработки, но и с характером клинических исследований и целевой популяцией.
19. Понятия, используемые в настоящем Руководстве, применяются в значениях, определенных в Правилах надлежащей клинической практики Евразийского экономического союза, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 79.
II. Выбор максимальных доз в исследованиях
общей токсичности
20. В случае если в токсикологических исследованиях удается охарактеризовать все потенциальные клинически значимые эффекты при введении диапазона доз лекарственного препарата ниже, чем его максимальная переносимая доза (MTD), то устанавливать максимальную переносимую дозу в каждом таком исследовании не требуется.
21. К другим подходящим предельным дозам относятся дозы, создающие в организме высокие кратные экспозиции или насыщение экспозиции, либо максимальная достижимая доза (MFD). Такие предельные дозы позволяют не использовать в отношении животных дозы, которые не дают дополнительных сведений для прогнозирования клинической безопасности. Подход к выбору максимальных доз в исследованиях общей токсичности приведен на рисунке. Этот подход согласуется с указаниями в отношении дизайна исследований репродуктивной токсичности и канцерогенности, в которых уже определены предельные дозы и (или) экспозиции.
Рисунок. Подход к выбору максимальных доз в исследованиях
общей токсичности
22. Предельные дозы для исследований токсичности при однократном и повторном (многократном) введении, равные 1 000 мг/кг/сут. для грызунов и негрызунов, признаны приемлемыми во всех случаях, за исключением случаев, если:
доза 1 000 мг/кг/сут. не обеспечивает 10-кратного превышения клинической экспозиции, а клиническая доза превышает 1 г/сут. В этом случае дозы в токсикологических исследованиях необходимо ограничить 10-кратным превышением экспозиции, либо дозой, равной 2 000 мг/кг/сут., либо максимальной достижимой дозой в зависимости от того, какая из этих доз меньше;
доза 2 000 мг/кг/сут. меньше клинической экспозиции. В этом случае может потребоваться увеличение дозы вплоть до максимальной достижимой дозы.
23. Дозы, обеспечивающие 50-кратное превышение средней экспозицией клинической экспозиции, как правило, также приемлемы в качестве максимальной дозы в исследованиях токсичности при однократном введении и токсичности с повторным (многократным) введением всем видам животных при условии, что установлена линейная зависимость «доза — концентрация» исходного соединения или фармакологически активной молекулы пролекарства в биологическом материале.
Экспозицию необходимо определять для исходного соединения или фармакологически активной молекулы пролекарства по групповому среднему значению площади под кривой «плазменная концентрация — время» (AUC) с момента приема лекарственного препарата. В некоторых случаях превышение экспозиции допускается определять по групповым средним значениям максимальной плазменной концентрации (Cmax) (например, если соединение или класс соединений способны вызывать острые сердечно-сосудистые изменения или клинические симптомы, связанные с воздействием на центральную нервную систему).
24. Для обоснования проведения клинических исследований III фазы необходимо, как правило, определить дозолимитирующую токсичность не менее чем на 1 виде животных с предельной дозой, обеспечивающей 50-кратное превышение экспозиции. В противном случае рекомендуется провести исследование продолжительностью 1 месяц (или более), на одном виде животных с предельной дозой, равной 1 000 мг/кг, максимальной достижимой дозе или максимальной переносимой дозе, с использованием меньшей из этих доз. Такое исследование может не потребоваться, если в исследовании меньшей продолжительности установлена дозолимитирующая токсичность при дозах, превышающих дозы, обеспечивающие 50-кратное превышение экспозиции.
25. Если в исследование общей токсичности включаются конечные точки генотоксичности, то подходящую максимальную дозу необходимо выбирать на основе максимальной достижимой дозы, максимальной переносимой дозы или предельной дозы, равной 1 000 мг/кг/сут.
III. Исследования фармакологической безопасности
26. Исследования фармакологической безопасности и фармакодинамические исследования проводятся в соответствии с руководством по исследованию фармакологической безопасности лекарственных препаратов для медицинского применения, принимаемым Евразийской экономической комиссией.
27. Основной набор (батарея) исследований фармакологической безопасности включает в себя оценку воздействия на сердечно-сосудистую, центральную нервную и дыхательную системы, которая должна проводиться до начала клинической разработки в соответствии с руководством по исследованию фармакологической безопасности лекарственных препаратов для медицинского применения.
28. Вспомогательные и последующие исследования фармакологической безопасности при необходимости допускается проводить на более поздних этапах клинической разработки.
29. В целях уменьшения использования животных в исследованиях фармакологической безопасности необходимо предусмотреть возможность замены этих исследований оценкой определенных конечных точек в рамках исследований общей токсичности in vivo.
30. Исследования первичной фармакодинамики (in vivo и (или) in vitro) направлены на изучение механизма действия и (или) эффектов действующего вещества по отношению к его целевой терапевтической мишени. Такие исследования проводятся в начальной фазе фармацевтической разработки лекарственного препарата, их проведение допускается без учета требований Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 81 (далее — Правила лабораторной практики). Результаты этих исследований учитываются при обосновании выбора дозы (режима дозирования) в доклинических и клинических исследованиях.
IV. Токсикокинетические и фармакокинетические исследования
31. До начала клинических исследований необходимо оценить метаболический профиль и степень связывания с белками плазмы у животных и человека in vitro, а также проанализировать данные о системной экспозиции, полученные в исследованиях на видах животных, использованных для изучения токсичности при повторном (многократном) введении действующего вещества лекарственного препарата, в соответствии с руководством по изучению токсикокинетики и оценки системного воздействия в токсикологических исследованиях, принимаемом Евразийской экономической комиссией.
32. До назначения лекарственного препарата большому числу субъектов или в течение длительного времени (как правило, до начала III фазы клинических исследований лекарственных препаратов) необходимо располагать более подробными данными о фармакокинетике (включая сведения об абсорбции, распределении, метаболизме и выведении) у испытуемых видов животных и in vitro биохимическими данными, значимыми для выявления потенциальных лекарственных взаимодействий. Эти данные используются для сравнения метаболитов человека и животных, а также для определения необходимости проведения дополнительных исследований.
33. Доклиническое установление характеристик метаболита (метаболитов) человека необходимо осуществлять только в том случае, если его экспозиция превышает 10% от суммарной экспозиции лекарственного препарата и величина экспозиции у человека значимо превышает экспозицию, наблюдавшуюся в токсикологических исследованиях. Такие исследования проводятся для обоснования проведения клинических исследований III фазы. В отношении лекарственных препаратов, суточная доза которых менее 10 мг, допускается обосновывать более высокий предел экспозиции для проведения доклинического исследования метаболита с уровнем, превышающим 10% от суммарной экспозиции лекарственного препарата. Некоторые метаболиты (например, большинство глутатион-конъюгатов) не представляют токсикологической опасности и не требуют проведения исследований. Доклиническое установление характеристик метаболитов с выявленной причиной для опасений (например, метаболита, свойственного только человеку) рассматривается в индивидуальном порядке.
V. Исследования токсичности при однократном введении
лекарственного препарата
34. Данные по токсичности при однократном введении лекарственного препарата традиционно получают в исследованиях токсичности с введением млекопитающим двух видов с использованием парентерального пути введения и пути введения, указанного в проекте общей характеристики лекарственного препарата. Вместе с тем эти данные также можно получить в надлежащим образом проводимых исследованиях эскалации дозы или краткосрочных исследованиях по подбору диапазона доз, которые позволяют определить максимальную переносимую дозу у животных, используемых в исследованиях общей токсичности.
35. При наличии данных токсичности при однократном введении лекарственного препарата, полученных при проведении других исследований, отдельные исследования с однократным введением лекарственного препарата проводить не требуется. Если введение лекарственного препарата в клинических условиях обосновано соответствующими исследованиями токсичности при повторном (многократном) введении лекарственного препарата в соответствии с Правилами лабораторной практики, то исследования токсичности при однократном введении лекарственного препарата допустимо ограничить только исследованиями токсичности при данном клиническом способе введения лекарственного препарата и исследованиями токсичности при однократном введении лекарственного препарата, проведенными без учета требований Правил лабораторной практики. Летальность не должна являться целевой конечной точкой в исследованиях токсичности при однократном введении лекарственного препарата.
36. В некоторых случаях (например, при исследовании микродоз) исследования токсичности при однократном введении лекарственного препарата или исследования однократного введения лекарственного препарата могут быть главным обоснованием проведения исследований с участием человека. В этих случаях выбор максимальной дозы может отличаться от описанного в разделе II настоящего Руководства, но он должен соответствовать планируемой клинической дозе и пути введения лекарственного препарата. Эти исследования необходимо проводить в соответствии с Правилами лабораторной практики.
37. Данные токсичности при однократном введении лекарственного препарата могут использоваться в целях прогнозирования последствий передозировки у человека и должны быть доступны для обоснования проведения III фазы клинических исследований. При изучении показаний к применению лекарственного препарата у популяций пациентов, имеющих высокий риск передозировки (например, при депрессии, боли, деменции), в клинических исследованиях, проводимых в амбулаторных условиях, может потребоваться более ранняя оценка токсичности при однократном введении лекарственного препарата.
VI. Исследования токсичности при повторном (многократном)
введении лекарственного препарата
38. Рекомендуемая продолжительность исследования токсичности при повторном (многократном) введении лекарственного препарата, как правило, зависит от продолжительности, показаний к применению и направленности планируемого клинического исследования. Продолжительность токсикологических исследований на животных, проводимых на млекопитающих 2 видов (один из которых относится к негрызунам), должна быть равной или превышать продолжительность клинических исследований с участием человека вплоть до максимальной рекомендованной продолжительности исследований токсичности при повторном (многократном) введении лекарственного препарата (в соответствии с требованиями согласно приложению N 2). Предельные дозы (экспозиции), подходящие для исследований токсичности при повторном (многократном) введении лекарственного препарата, описаны в разделе II настоящего Руководства.
1. Исследования клинической разработки
39. Исследования токсичности при повторном (многократном) введении лекарственного препарата животным двух видов (один из которых относится к негрызунам) с минимальной продолжительностью 2 недели, предусмотренной приложением N 2 к настоящему Руководству, как правило, достаточны для обоснования проведения каждого исследования клинической разработки продолжительностью менее 2 недель.
40. Проведение исследований клинической разработки большей продолжительности необходимо обосновать результатами исследований токсичности при повторном (многократном) введении лекарственного препарата, по меньшей мере эквивалентной продолжительности. Исследования на негрызунах в течение 6 и 9 месяцев применения лекарственного препарата также используются для обоснования дозирования в клинических исследованиях, превышающих 6 месяцев, за исключением случаев, указанных в приложении N 2 к настоящему Руководству.
2. Исследования для обоснования регистрации
лекарственного препарата
41. Для регистрации лекарственного препарата необходима бльшая продолжительность доклинических исследований в связи с увеличением целевой популяции пациентов, которые будут подвергаться риску, связанному с приемом лекарственного препарата, а также менее контролируемыми условиями применения препарата по сравнению с клиническими исследованиями. Продолжительность исследований токсичности при повторном (многократном) введении лекарственного препарата, необходимых для обоснования терапии различной продолжительности, определяется в соответствии с приложением N 3. Вместе с тем при небольшом числе состояний с рекомендуемой продолжительностью применения лекарственного препарата от 2 недель до 3 месяцев, но при наличии большого клинического опыта, подтверждающего более широкое и длительное применение лекарственного препарата сверх рекомендуемой продолжительности применения (например, при тревоге, сезонном аллергическом рините, боли), продолжительность исследований больше соответствует случаям, когда рекомендуемая продолжительность применения лекарственного препарата превышает 3 месяца.
VII. Доклинические исследования, проводимые в целях
определения величины первой дозы у человека
42. Определение величины начальной дозы для человека — важный элемент обеспечения безопасности субъектов, участвующих в исследованиях, впервые проводимых с участием человека.
43. При определении рекомендованной начальной дозы лекарственного препарата для человека необходимо учитывать все актуальные данные доклинических исследований, включающие фармакологическую зависимость «доза — эффект», фармакологический (токсикологический) профиль и фармакокинетику.
44. При определении рекомендованной начальной дозы наиболее значимой является величина дозы, не оказывающей явного нежелательного эффекта (NOAEL), установленная в доклинических исследованиях безопасности на подходящих видах животных. Планируемая клиническая начальная доза также может зависеть от разных факторов, включая фармакодинамику, определенные свойства молекулы и дизайн клинических исследований.
45. Поисковые клинические исследования с участием человека могут быть начаты при меньшем объеме данных доклинических исследований, чем объем, который необходим для проведения исследований клинической разработки, в связи с чем величина клинической начальной (и максимальной) дозы может отличаться от величины дозы, определенной на основании полного объема данных доклинических исследований. Критерии выбора начальных доз в различных поисковых клинических исследованиях определяются в соответствии с требованиями согласно приложению N 4.
VIII. Доклинические исследования, проводимые в целях
обоснования проведения поисковых клинических исследований
46. Оптимизированные поисковые клинические исследования и ранний доступ к данным, полученным в исследованиях с участием человека, могут способствовать:
а) правильной оценке изменений физиологических функций в организме человека под влиянием лекарственного препарата (фармакологических свойств лекарственного препарата);
б) установлению характеристик исследуемого лекарственного препарата;
в) оценке соответствия терапевтических мишеней лекарственного препарата заболеванию, для лечения которого он предназначен.
47. Для целей настоящего Руководства под поисковыми клиническими исследованиями понимаются исследования, проводимые на раннем этапе I фазы клинических исследований, предусматривающие ограниченную экспозицию у человека и не предполагающие проведение оценки терапевтической эффективности и клинической переносимости. Эти исследования проводят для изучения таких параметров, как:
фармакодинамические;
фармакокинетические;
биомаркеры, которые могут включать в себя рецепторное связывание и вытеснение лекарственного препарата, изучены по результатам позитронно-эмиссионной томографии (далее — ПЭТ);
другие диагностические параметры.
Субъектами этих исследований могут являться как пациенты из целевой популяции, так и здоровые добровольцы.
48. Объем и вид обосновывающих данных доклинических исследований, необходимых для планирования поисковых клинических исследований, будут зависеть от величины экспозиции у человека с точки зрения используемой максимальной клинической дозы, продолжительности курса лечения и кратности введения. В настоящем разделе и приложении N 4 к настоящему Руководству представлены 5 видов клинических поисковых подходов с программами доклинических исследований, которые разрешены для этих подходов, а также рекомендуемыми начальными дозами и максимальными дозами для этих 5 подходов.
49. Допустимо использование альтернативных подходов, не описанных в настоящем Руководстве (в том числе стратегии разработки биотехнологических препаратов). Такие альтернативные подходы должны быть согласованы с уполномоченным органом (экспертной организацией) государства-члена. Применение альтернативных подходов может уменьшить использование животных при разработке лекарственных препаратов.
50. Во всех случаях для обоснования выбора доз в исследованиях с участием человека необходимо устанавливать характеристики фармакодинамики и фармакологических свойств действующего вещества лекарственного препарата с использованием моделей in vivo и (или) in vitro, приведенных в разделе III и приложении N 4 к настоящему Руководству.
1. Исследования микродоз
51. При исследовании микродоз используются 2 основных поисковых клинических подхода.
Первый подход предполагает применение суммарной дозы, не превышающей 100 мкг, которая может быть введена субъекту в виде однократной дозы или разделенной на несколько доз. Это может способствовать изучению связывания с рецептором-мишенью или распределения в тканях с помощью ПЭТ. Другой целью может служить изучение фармакокинетики с помощью использования меченного изотопом действующего вещества лекарственного препарата или без него.
Второй подход предусматривает не более 5 введений доз с максимальной величиной 100 мкг на введение (суммарно до 500 мкг) субъекту. Этот подход можно использовать для решения задач, аналогичных задачам в первом подходе, но для лигандов, менее активных при ПЭТ. Разрешается проводить клиническое исследование микродоз с внутривенным введением лекарственного препарата, предназначенного для приема внутрь, в отношении которого уже проведен ряд токсикологических исследований с пероральным введением. В этом случае вводимая внутривенно микродоза обосновывается имеющимися данными исследований пероральной токсичности, описанными в приложениях N 2 и N 4 (подход 3-й) к настоящему Руководству, если достигнуто достаточное превышение экспозиции. В таком случае местная переносимость лекарственного препарата при внутривенном введении не изучается, поскольку вводимая доза слишком мала (до 100 мкг). При использовании нового внутривенного носителя необходимо оценить его местную переносимость.
2. Клинические исследования с однократным
введением субтерапевтических доз или доз предполагаемого
терапевтического диапазона
52. Третий поисковый клинический подход предусматривает проведение клинического исследования обычно начинающегося с однократного введения субтерапевтических доз с возможным повышением до фармакологического или предполагаемого терапевтического диапазона доз предусмотренного приложением N 4 к настоящему Руководству. Введение максимальной допустимой дозы лекарственного препарата должно основываться на данных доклинических исследований. В дальнейшем на основании клинических данных, полученных в ходе данного исследования, она может быть уменьшена. Такой подход позволяет:
определить фармакокинетические параметры радиоактивно не меченного лекарственного препарата при условии его введения в прогнозируемой фармакодинамически активной дозе или в близком к ней диапазоне доз;
дать оценку участия мишени или фармакологических свойств лекарственного препарата после введения однократной дозы.
Этот подход не предназначен для обоснования определения максимальной переносимой клинической дозы.
53. В рамках расширенного исследования токсичности при однократном введении лекарственного препарата необходимо, как правило, оценить данные по гематологии, биохимии, некропсии и гистопатологии (только для контроля и максимальной дозы, если при максимальной дозе не обнаруживается патология, обусловленная применением препарата) после однократного введения лекарственного препарата с последующим изучением спустя 2 недели для оценки отсроченной токсичности и (или) восстановления. Стандартный дизайн исследования на грызунах предусматривает использование 10 особей каждого пола на группу, оцениваемых на следующий день после введения, и 5 особей каждого пола для дозы (доз), оцениваемой на 14-й день после введения лекарственного препарата. Стандартный дизайн исследований на негрызунах предусматривает использование 3 особей каждого пола во всех группах для оценки (изучения) данных по фармакологической безопасности на 2-й день и 2 особей каждого пола для дозы (доз), оцениваемой на 14-й день. Проведение клинических исследований продолжительностью менее 14 дней разрешается обосновывать исследованиями токсичности с той же продолжительностью.
3. Клинические исследования с повторным (многократным)
введением лекарственного препарата
54. Для клинических исследований с повторным (многократным) введением лекарственного препарата четвертый и пятый поисковые клинические подходы совместно с программами доклинических исследований приведены в приложении N 4 к настоящему Руководству. Указанные подходы позволяют обосновать продолжительность дозирования до 14 дней в целях изучения фармакокинетики и фармакодинамики у человека в терапевтическом диапазоне, но не предназначены для обоснования максимальной переносимой клинической дозы.
55. Четвертый подход предусматривает проведение 2-недельных исследований токсичности при повторном (многократном) введении лекарственного препарата грызунам и негрызунам, в которых выбор доз основан на экспозиции, кратной ожидаемому групповому среднему значению площади под кривой «плазменная концентрация — время» при максимальной клинической дозе.
56. Пятый подход предусматривает проведение 2-недельных исследований токсичности при повторном (многократном) введении лекарственного препарата грызунам и подтверждающих исследований на негрызунах, направленных на подтверждение того, что доза, не оказывающая явного нежелательного эффекта (NOAEL), установленная для грызунов, также не является токсичной дозой для негрызунов. Если при применении дозы, создающей экспозицию, равную дозе, не оказывающей явного нежелательного эффекта (NOAEL-экспозиция) для грызунов, токсическое воздействие наблюдается у негрызунов, то клиническое применение лекарственного препарата необходимо отложить до проведения дополнительных доклинических исследований на данном виде негрызунов (как правило, стандартного токсикологического исследования).
IX. Исследования местной переносимости
лекарственного препарата
57. Если местная переносимость лекарственного препарата при его планируемом пути введения изучена во время исследований общей токсичности, выполнение отдельного исследования местной переносимости лекарственного препарата не требуется.
58. Для обоснования ограниченного введения лекарственного препарата с помощью нетерапевтических путей (например, однократного внутривенного введения в целях определения относительной биодоступности лекарственного препарата для приема внутрь) необходимо выполнить исследование местной переносимости при однократном введении одному виду животных. Если ожидаемая системная экспозиция (AUC и Cmax) при нетерапевтическом пути введения перекрывается имеющимися токсикологическими данными, конечными точками исследования местной переносимости являются клинические признаки, макроскопические и микроскопические изменения при гистологическом исследовании места введения лекарственного препарата. Состав лекарственного препарата, предназначенный для изучения местной переносимости, может полностью не совпадать с клиническим составом лекарственного препарата, но должен быть сходным с ним.
59. В случае проведения исследования микродоз с применением внутривенного введения лекарственного препарата, обоснованного токсикологическими данными при пероральном введении, оценка местной переносимости действующего вещества не требуется. При использовании лекарственного препарата с новым составом вспомогательных веществ для внутривенного введения действующего вещества необходимо оценить местную переносимость такого лекарственного препарата.
60. Для парентерального лекарственного препарата до того, как экспозиции данного лекарственного препарата подвергнется большое количество пациентов в клинических исследованиях (например, в клинических исследованиях III фазы), необходимо оценить местную переносимость этого лекарственного препарата в доклинических исследованиях с использованием для его введения мест инъекций, которые не предусмотрены предполагаемым клиническим применением лекарственного препарата. Необходимо проводить однократное паравенозное введение в отношении лекарственных препаратов с внутривенным способом введения. Иные парентеральные пути введения лекарственного препарата необходимо оценивать в индивидуальном порядке.
X. Клинические исследования генотоксичности
лекарственного препарата
61. Проведение доклинических исследований на генные мутации достаточно для обоснования проведения всех клинических исследований с однократным введением лекарственного препарата. В целях обоснования проведения клинических исследований с повторным (многократным) введением лекарственного препарата необходимо провести дополнительную оценку, позволяющую выявить хромосомные повреждения у млекопитающих. Полный набор (батарею) исследований на генотоксичность необходимо завершить до начала II фазы клинических исследований.
62. Если результаты исследований генотоксичности положительны, в целях установления возможности продолжения введения лекарственного препарата человеку, необходимо провести оценку этих результатов, а также при необходимости дополнительные исследования.
63. Доклинические исследования генотоксичности, необходимые для обоснования подходов к проведению поисковых клинических исследований, указаны в разделе VIII настоящего Руководства.
XI. Исследования канцерогенности лекарственного препарата
64. Условия, требующие исследования канцерогенного потенциала лекарственного препарата, установлены в Руководстве по оценке и контролю ДНК-реактивных (мутагенных) примесей в лекарственных средствах и установлению границ потенциального канцерогенного риска (приложение к Рекомендации Коллегии Евразийской экономической комиссии от 6 августа 2019 г. N 23).
65. Если проведение исследований канцерогенности лекарственного препарата требуется для клинического показания, такие исследования канцерогенности следует провести для обоснования регистрации лекарственного препарата с применением по данному показанию. При наличии опасений относительно возможного канцерогенного риска лекарственного препарата результаты исследований канцерогенности необходимо представить до проведения клинических исследований такого лекарственного препарата. Большая продолжительность клинического исследования не рассматривается в качестве существенной причины возможного канцерогенного риска.
66. Исследования канцерогенности лекарственных препаратов, разрабатываемых для лечения тяжелых заболеваний у взрослых или детей, при необходимости разрешается проводить после регистрации лекарственного препарата.
XII. Исследования репродуктивной и онтогенетической
токсичности лекарственного препарата
67. Исследования репродуктивной и онтогенетической токсичности лекарственного препарата необходимо проводить с учетом особенностей популяции, которая будет подвергаться экспозиции этого лекарственного препарата.
1. Мужчины
68. Поскольку оценка репродуктивной системы самцов проводится в рамках проведения исследований токсичности с повторным (многократным) введением лекарственного препарата, разрешается включать мужчин в клинические исследования I и II фаз до проведения специальных исследований фертильности у самцов. Оценка репродуктивной системы у самцов и самок по результатам стандартного гистопатологического исследования яичек и яичников в исследованиях токсичности с повторным (многократным) введением лекарственного препарата (как правило, у грызунов) не менее 2-недельной продолжительности считается сопоставимой по чувствительности к выявлению токсического действия на репродуктивные органы животных со специальными исследованиями фертильности.
69. Исследования фертильности у самцов необходимо провести до начала крупных или длительных клинических исследований (например, клинические исследования III фазы).
2. Женщины без детородного потенциала
70. Если проведены исследования токсичности при повторном (многократном) введении лекарственного препарата, предусматривающие оценку репродуктивных органов у самок, разрешается включать в клинические исследования женщин без детородного потенциала (то есть стерилизованных или находящихся в постменопаузе) без проведения исследований репродуктивной токсичности. При этом постменопауза определяется как отсутствие менструаций в течение 12 месяцев, не обусловленное иными медицинскими причинами.
3. Женщины с детородным потенциалом
71. В отношении женщин с детородным потенциалом существует высокая степень опасности подвергнуть эмбрион или плод непреднамеренной экспозиции лекарственного препарата до получения сведений о потенциальной пользе и потенциальных рисках этого лекарственного препарата.
72. При включении в клинические исследования женщин с детородным потенциалом необходимо описать и минимизировать риск непреднамеренной экспозиции лекарственного препарата у эмбриона или плода. Первый подход к достижению этой цели заключается в проведении исследований репродуктивной токсичности для оценки риска, связанного с самим лекарственным препаратом, и принятия соответствующих мер предосторожности у женщин с детородным потенциалом в клинических исследованиях. Второй подход заключается в ограничении риска за счет принятия мер в целях предотвращения наступления беременности в ходе проведения клинических исследований. К таким мерам относятся:
тесты на беременность (например, по определению свободной -субъединицы хорионического гонадотропина человека);
использование высоконадежных методов контрацепции, которыми считаются как изолированные, так и комбинированные методы, обеспечивающие низкую частоту неудач (то есть менее 1% в год) при их постоянном и правильном применении. При применении метода гормональной контрацепции необходимо учитывать информацию об исследуемом лекарственном препарате и его потенциальном влиянии на контрацепцию;
включение в исследование только после подтверждения наличия менструаций.
Тесты на беременность, выполняемые в ходе проведения исследования, и обучение пациентов мерам предотвращения наступления беременности и контроля наступления беременности должны быть достаточными, чтобы обеспечить приверженность пациентов таким мерам в период экспозиции лекарственного препарата (который может превышать продолжительность исследования).
73. Для дополнительной минимизации риска непреднамеренной экспозиции лекарственного препарата в рамках подходов, описанных в пункте 72 настоящего Руководства, информированное согласие должно основываться на всей имеющейся информации о репродуктивной токсичности лекарственного препарата (например, общей оценке потенциальной токсичности лекарственных препаратов, имеющих родственные структуры и фармакологические эффекты). В случае отсутствия актуальных сведений о репродуктивной токсичности лекарственного препарата в информированном согласии необходимо указать сведения о потенциальных невыявленных рисках для эмбриона или плода.
74. Допускается включать женщин с детородным потенциалом в ранние фазы клинических исследований без доклинического изучения онтогенетической токсичности (исследования эмбриофетального развития) в следующих случаях:
а) интенсивный контроль риска в краткосрочных (например, 2-недельных) клинических исследованиях;
б) преобладание заболевания среди женщин и невозможность достижения цели исследования без включения в клинические исследования женщин с детородным потенциалом, а также принятие достаточных мер для предотвращения наступления беременности.
75. Дополнительными факторами проведения исследований у женщин с детородным потенциалом без проведения доклинических исследований онтогенетической токсичности являются сведения о механизме действия лекарственного препарата (его метаболита), его свойствах, степени экспозиции лекарственного препарата у эмбриона или плода и затруднениях при проведении исследований онтогенетической токсичности на подходящей модели животных (например, исследования онтогенетической токсичности моноклональных антител, для которых по имеющимся научным данным установлена низкая эмбриофетальная экспозиция в период органогенеза, разрешается проводить во время III фазы клинических исследований). При этом исследования онтогенетической токсичности должны быть проведены к моменту подачи регистрационного досье лекарственного препарата на регистрацию и в регистрационное досье должен быть включен полный отчет о данном виде токсичности лекарственного препарата.
76. До проведения основных исследований репродуктивной токсичности разрешается включение в клинические исследования женщин с детородным потенциалом (до 150 человек), которые будут получать исследуемый лекарственный препарат в течение относительно короткого периода (до 3 месяцев), при условии наличия предварительных данных о репродуктивной токсичности лекарственного препарата, полученных на 2 видах животных, и при принятии мер для предотвращения наступления беременности у субъектов исследования. Для достижения этой цели проводится предварительное исследование эмбриофетального развития при введении лекарственного препарата в достаточных дозах. Исследование должно быть проведено с участием не менее 6 самок на группу животных и самок, получавших препарат в период органогенеза. Исследование должно включать в себя оценку выживаемости плода, массы тела, внешнее изучение плода, а также изучение внутренних органов плода. Предварительное доклиническое исследование проводится в соответствии с Правилами лабораторной практики и научными стандартами в области биомедицинских исследований при условии обеспечения прямого доступа заинтересованных лиц к собранным данным.
77. Разрешение на проведение клинических исследований с участием женщин с детородным потенциалом связано с:
а) очень низкой частотой наступления беременности во время контролируемых клинических исследований с участием небольших когорт (до 150 человек);
б) короткой продолжительностью таких исследований. Частота наступления беременности у женщин, впервые предпринимающих попытку забеременеть, составляет примерно 17% на менструальный цикл. Частота наступления беременности в III фазе клинических исследований, проведенных у женщин с детородным потенциалом, составляла менее 0,1% на менструальный цикл, если в ходе этих исследований субъектам рекомендовали не допускать наступления беременности и были предприняты меры для предотвращения наступления беременности. Частота наступления беременности во II фазе клинических исследований ниже, чем в III фазе исследований, но ввиду ограниченного числа включенных в данную фазу исследований женщин величину снижения частоты таких случаев установить невозможно. Основываясь на указанных данных, частота наступления беременности во II фазе исследований, включающих в себя до 150 женщин с детородным потенциалом и продолжительностью до 3 месяцев, должна составлять менее чем 0,5 случая беременности на каждый исследуемый лекарственный препарат;
в) способностью надлежащим образом спланированных предварительных исследований выявлять большинство онтогенетических токсических эффектов, которые могли бы повлиять на включение в клинические исследования женщин с детородным потенциалом.
78. На допустимое к включению в клинические исследование число женщин с детородным потенциалом и продолжительность исследования влияют характеристики популяции, связанные с вероятностью наступления беременности (например, возраст, заболевание и т.д.). Необходимо завершить основные доклинические исследования онтогенетической токсичности до включения в клиническое исследование женщин с детородным потенциалом, за исключением ситуаций, указанных в пунктах 72 — 76 настоящего Руководства.
79. Поскольку оценка репродуктивных органов самок проводится в рамках проведения исследований токсичности при повторном (многократном) введении лекарственного препарата, разрешается включать женщин с детородным потенциалом в клинические исследования I и II фаз с повторным (многократным) введением до проведения исследования фертильности у самок с учетом пункта 68 настоящего Руководства. Для обоснования включения женщин с детородным потенциалом в крупные или продолжительные клинические исследования (например, исследования III фазы) необходимо провести доклинические исследования, направленные на оценку фертильности у самок.
80. В регистрационное досье лекарственного препарата необходимо включить результаты исследований пренатального и постнатального онтогенетического развития потомства животных, подвергшихся экспозиции лекарственного препарата.
81. До включения женщин с детородным потенциалом в клинические исследования, в которых не используются высокоэффективные методы контрацепции, или при неизвестном гестационном статусе необходимо провести полное исследование репродуктивной токсичности у самок и стандартный (полный) набор (батарею) исследований генотоксичности. Высоконадежными методами контрацепции считаются как изолированные, так и комбинированные методы, обеспечивающие низкую частоту неудач (то есть менее 1% в год), при их постоянном и правильном применении. При применении метода гормональной контрацепции необходимо учитывать информацию об исследуемом лекарственном препарате и его потенциальном влиянии на эффективность этого метода гормональной контрацепции.
4. Беременные женщины
82. До включения беременных женщин в клинические исследования необходимо провести исследования репродуктивной токсичности у самок и стандартный (полный) набор (батарею) исследований генотоксичности, а также необходимо оценить имеющиеся данные о безопасности экспозиции изучаемого лекарственного препарата у человека.
XIII. Клинические исследования с участием детей
83. При включении в клинические исследования детей наиболее значимыми сведениями являются данные по безопасности, которые получены с участием взрослых субъектов, которые, как правило, должны быть доступны до начала клинических исследований с участием детей.
84. Достаточность и объем данных о безопасности исследуемого лекарственного препарата, полученных в клинических исследованиях с участием взрослых определяются в индивидуальном порядке. До начала применения лекарственного препарата у детей достаточные данные об опыте применения этого лекарственного препарата у взрослых могут отсутствовать (например, при исключительно детских показаниях).
85. До начала проведения исследований с участием детей необходимо располагать результатами:
а) исследований токсичности при повторном (многократном) введении лекарственного препарата взрослым животным в течение определенного периода;
б) основного набора (батареи) исследований фармакологической безопасности;
в) стандартного набора исследований генотоксичности.
86. Может потребоваться проведение исследования репродуктивной токсичности, соответствующего возрасту и полу исследуемых детей, для получения сведений о прямых токсических или онтогенетических рисках (например, исследования фертильности и пренатального (постнатального) развития).
87. Проведение клинических исследований эмбриофетального развития необязательно для обоснования проведения таких исследований с участием мужчин и препубертатных женщин.
88. Токсикологические исследования на неполовозрелых животных проводят, если имеющиеся данные о безопасности исследуемого лекарственного препарата, полученные в результате исследований на животных и с участием человека, включая данные об эффектах других лекарственных препаратов этого фармакологического класса, считаются недостаточными для обоснования проведения исследований с участием детей. Если требуется проведение токсикологического исследования, достаточно использование 1 вида неполовозрелых животных, в основном грызунов. При достаточном научном обосновании разрешается проведение доклинических исследований на негрызунах. При краткосрочных фармакокинетических исследованиях с участием детей (например, 1 — 3 дозы лекарственного препарата) проведение предварительных токсикологических исследований на неполовозрелых животных не требуется.
89. В зависимости от показаний к применению, возраста детей и данных о безопасности применения лекарственного препарата, полученных в результате исследований на взрослых животных и с участием человека, до начала краткосрочных клинических исследований эффективности и безопасности с повторным (многократным) введением необходимо рассмотреть вопрос о целесообразности предварительного получения результатов исследований на неполовозрелых животных.
90. Одним из наиболее важных факторов является возраст участников исследования по отношению к продолжительности проведения клинического исследования (то есть период развития, в течение которого участники клинического исследования подвергаются экспозиции лекарственного препарата). Эта оценка позволяет определить необходимость проведения исследований на неполовозрелых животных, установить сроки их проведения по отношению к клиническим исследованиям.
91. При проведении долгосрочных клинических исследований с участием детей, если требуется оценка токсичности в отношении неполовозрелых животных, доклинические исследования необходимо завершить до начала исследований.
92. Проведение долгосрочных исследований токсичности в отношении неполовозрелых животных необходимо в случаях, если детская популяция является основной популяцией, которая получает лекарственный препарат, а в проведенных доклинических исследованиях на животных обнаружены потенциальные онтогенетические риски (токсикологические или фармакологические) для органов-мишеней. Это может быть долгосрочное доклиническое исследование, начатое на животных соответствующего возраста и вида, с соответствующими конечными точками для анализа такого онтогенетического риска (например, 12-месячное исследование на собаках (которое при этом может включать в себя весь период развития собак) или 6-месячное исследование на крысах). У любого из видов животных допускается адаптация данного дизайна доклинического исследования в целях замены им соответствующего стандартного долгосрочного доклинического исследования и отдельного доклинического исследования на неполовозрелых животных.
93. До начала долгосрочных клинических исследований с участием детей необходимо определить целесообразность проведения исследования канцерогенного потенциала. Вместе с тем при отсутствии существенной причины для опасений (например, признаки генотоксичности по результатам разных исследований, наличие проканцерогенного риска, обусловленного механизмом действия действующего вещества, или наличие данных, выявленных при проведении исследований общей токсичности) не требуется проведение исследований канцерогенного потенциала для обоснования проведения клинических исследований с участием детей.
XIV. Исследование иммунотоксичности
лекарственного препарата
94. Новые лекарственные препараты для медицинского применения подлежат оценке в целях подтверждения наличия иммунотоксического потенциала с проведением стандартных токсикологических исследований и дополнительных исследований иммунотоксичности на основе анализа значимости доказательств потенциальной иммунотоксичности лекарственного препарата, включая иммуноопосредованные сигналы, полученные при проведении стандартных токсикологических исследований.
95. Если показано проведение дополнительных исследований иммунотоксичности, их необходимо завершить до экспозиции лекарственного препарата у большой популяции пациентов (например, III фазы клинических исследований).
XV. Исследование фотобезопасности лекарственного препарата
96. Целесообразность и сроки проведения исследования фотобезопасности по отношению к экспозиции лекарственного препарата у человека определяются:
а) фотохимическими свойствами молекулы (например, фотоабсорбция и фотостабильность);
б) сведениями о фототоксическом потенциале химически родственных соединений;
в) распределением в тканях;
г) клиническими или доклиническими проявлениями, свидетельствующими о фототоксичности.
97. Необходимо провести первоначальную оценку фототоксического потенциала исходя из фотохимических свойств и фармакологического (химического) класса. Если оценка всех доступных данных и предлагаемого плана клинических исследований свидетельствует о потенциальном существенном риске фототоксичности для человека, в амбулаторных клинических исследованиях необходимо предусмотреть соответствующие меры защиты.
98. В целях получения сведений о потенциальном фототоксическом риске лекарственного препарата для человека и определения необходимости дальнейшего изучения выполняется доклиническая оценка распределения лекарственного препарата в коже и глазах. При необходимости проводится экспериментальная оценка (доклиническая оценка in vitro или in vivo либо клиническая оценка) фототоксического потенциала до экспозиции лекарственного препарата у большого числа пациентов (III фаза клинических исследований).
99. В качестве альтернативы пошаговому подходу, предусмотренному пунктами 97 и 98 настоящего Руководства, в ходе доклинических или клинических исследований можно провести прямую оценку фототоксического потенциала. Если результаты такого исследования отрицательны, проведение ранней оценки распределения лекарственного препарата в коже и глазах и защитных клинических мер не требуется.
100. Если результаты проведения оценки фототоксичности свидетельствуют о потенциальном фотоканцерогенном риске, у пациентов этот риск обычно в достаточной степени контролируется с применением защитных мер, включающих в себя предостережение в информированном согласии и в информации о зарегистрированном лекарственном препарате. Проведение исследований фотоканцерогенности на грызунах с использованием доступных моделей (например, исследование с участием бесшерстных грызунов) для обоснования разработки лекарственных препаратов считается нецелесообразным и, как правило, не требуется. Если исследования фототоксичности указывают на наличие фотоканцерогенного риска и существует соответствующая методика изучения фотоканцерогенного действия лекарственного препарата, такое исследование необходимо, как правило, завершить до регистрации этого лекарственного препарата, а его результаты необходимо учитывать при оценке риска для человека.
XVI. Доклиническая оценка развития
лекарственной зависимости
101. В отношении действующих на центральную нервную систему лекарственных препаратов независимо от их показания к применению необходимо оценить риск развития лекарственной зависимости. Доклинические исследования должны обосновывать:
а) дизайн клинической оценки потенциала возникновения лекарственной зависимости;
б) определение условий отпуска лекарственного препарата населению;
в) составление информации о лекарственном препарате.
102. При планировании исследований, включающих в себя оценку возникновения лекарственной зависимости разрешается использовать руководства по проведению доклинической оценки риска развития лекарственной зависимости государств-членов.
103. Доклинические данные, полученные на ранних этапах проведения доклинических исследований лекарственного препарата до его первого введения человеку, необходимо учитывать при выявлении ранних индикаторов потенциальной способности лекарственного препарата вызывать развитие лекарственной зависимости. Такие ранние индикаторы включают в себя:
а) фармакокинетический (фармакодинамический) профиль лекарственного препарата, определяющий продолжительность его действия;
б) сходство химической структуры лекарственного препарата с известными лекарственными препаратами, вызывающими лекарственную зависимость;
в) профиль связывания действующего вещества лекарственного препарата с рецепторами;
г) поведенческие (клинические) признаки, установленные при применении лекарственного препарата в доклинических исследованиях in vivo.
104. Если по результатам ранних этапов проведения доклинических исследований потенциал лекарственного препарата в части развития лекарственной зависимости не установлен, расширенные доклинические исследования этого лекарственного препарата на моделях оценки зависимости могут не потребоваться.
105. Если действующее вещество лекарственного препарата проявляет признаки, сходные с известным профилем проявления лекарственной зависимости, или имеет новый механизм действия на центральную нервную систему, для обоснования крупных клинических исследований (например, III фазы), как правило, необходимо провести дополнительные доклинические исследования.
106. Если профиль метаболитов и мишени действия лекарственного препарата у грызунов совпадают с профилем метаболитов и мишенями действия лекарственного препарата у человека, доклиническую оценку риска развития зависимости необходимо провести на грызунах. Разрешается проводить исследования на нечеловекообразных приматах, если выполняются оба следующих условия:
а) есть неоспоримые признаки того, что их участие в доклинических исследованиях поможет спрогнозировать подверженность человека развитию лекарственной зависимости;
б) неприменимы модели изучения на грызунах способности лекарственного препарата вызывать лекарственную зависимость.
107. В целях доклинической оценки риска развития лекарственной зависимости наиболее часто проводятся 3 вида исследований:
а) предпочтение лекарственного препарата;
б) самовведение лекарственного препарата;
в) оценка отмены приема лекарственного препарата.
108. Исследования предпочтения и самовведения лекарственного препарата проводятся как самостоятельные эксперименты. Проведение оценки отмены приема лекарственного препарата разрешается включить в дизайн исследования токсичности с повторным (многократным) введением лекарственного препарата для группы животных с оценкой обратимости восстановления. Максимальная доза, при которой концентрация в плазме в несколько раз превышает концентрацию, полученную при приеме терапевтической клинической дозы у человека, рассматривается как подходящая для такой доклинической оценки риска развития лекарственной зависимости.
XVII. Другие исследования токсичности
лекарственного препарата
109. Если полученные ранее доклинические или клинические данные о лекарственном препарате или родственных лекарственных препаратах указывают на возможные проблемы в отношении безопасности этого лекарственного препарата, целесообразно проведение дополнительных исследований (например, в целях определения потенциальных биомаркеров для изучения механизма действия лекарственного препарата). Проведение дополнительных доклинических исследований (например, для выявления потенциальных биомаркеров изучения механизма действия лекарственного препарата) целесообразно, если предыдущие доклинические или клинические исследования лекарственного препарата или родственных лекарственных препаратов указывали на особые проблемы, связанные с безопасностью лекарственного препарата.
110. Подходы к квалификации примесей и продуктов деградации должны соответствовать правилам по изучению примесей в лекарственных средствах и установлению требований к ним в спецификациях, утверждаемых Евразийской экономической комиссией. Если для квалификации примеси и продукта деградации необходимо проведение отдельных исследований, их допускается не проводить до начала III фазы клинических исследований. Однако если в рамках разработки и изучения лекарственного препарата происходят изменения, приводящие к образованию нового профиля примесей (например, новый путь синтеза, новый продукт деградации, образовавшийся в результате взаимодействия между компонентами производственной рецептуры), требуется проведение соответствующих исследований квалификации примеси и продукта деградации для обоснования проведения доклинических исследований II фазы или более поздних этапов разработки лекарственного препарата.
XVIII. Исследование токсичности комбинированных
лекарственных препаратов
111. В настоящем разделе описаны исследования токсичности комбинированных лекарственных препаратов, которые упаковываются совместно или вводятся в 1 лекарственной форме (фиксированная комбинация доз). Указанные в настоящем разделе принципы также могут применяться при разработке лекарственных препаратов, которые согласно информации о них будут одновременно применяться с определенным лекарственным препаратом в составе комбинированной терапии (даже если он не будет входить в фиксированную комбинацию доз) и о безопасности комбинирования которых получены минимальные клинические сведения.
112. Положения настоящего раздела применяются при проведении изучения токсичности комбинированных лекарственных препаратов, содержащих в своем составе следующие комбинации действующих веществ:
а) лекарственный препарат представляет собой комбинацию 2 действующих веществ или более, находящихся на позднем этапе разработки (то есть эти действующие вещества являются соединениями со значительным опытом клинического применения, для которых имеются данные по III фазе клинических исследований, и (или) эти комбинации содержатся в зарегистрированных лекарственных препаратах);
б) лекарственный препарат представляет собой комбинацию, в которой 1 действующее вещество или более находятся на позднем этапе разработки и 1 действующее вещество или более находятся на раннем этапе разработки (то есть вторая часть комбинации представляет собой соединения с ограниченным опытом клинического применения, для которых имеются только данные по II фазе клинических исследований или данные по более ранним фазам клинических исследований);
в) лекарственный препарат представляет собой комбинацию, в которой все действующие вещества находятся на раннем этапе разработки.
113. В отношении большинства комбинаций действующих веществ, содержащих 2 действующих вещества, находящихся на позднем этапе разработки и имеющих достаточный опыт совместного клинического применения, в отсутствие существенных опасений относительно токсического действия (например, аналогичная токсичность в отношении органа-мишени) проведение доклинических исследований комбинации для обоснования проведения клинических исследований и регистрации лекарственного препарата не требуется. Опасения относительно токсического действия устанавливаются исходя из границ безопасности лекарственного препарата и возможности мониторинга нежелательных реакций у человека. Если исследование проводится в целях поиска причины возникших при разработке комбинированного лекарственного препарата опасений относительно его токсического действия, такое исследование, как правило, необходимо завершить до начала клинических исследований комбинированного лекарственного препарата.
114. Проведение доклинических исследований для обоснования проведения небольших, относительно краткосрочных клинических исследований (например, исследований II фазы исследования продолжительностью до 3 месяцев) не требуется в случае, если в отношении лекарственных препаратов, содержащих 2 действующих вещества и более, находящихся на позднем этапе разработки, не имеется достаточного опыта совместного клинического применения, но на основании имеющихся данных нет причин для существенных опасений относительно токсического действия. Вместе с тем для проведения продолжительных или крупномасштабных клинических исследований, а также для регистрации лекарственного препарата проведение доклинических исследований указанных комбинаций обязательно.
115. Проведение токсикологических исследований комбинированных лекарственных препаратов для обоснования проведения их клинических исследований продолжительностью до 1 месяца с проверкой безопасности таких комбинированных лекарственных препаратов не требуется в случае, если лекарственный препарат является комбинацией веществ, находящихся на раннем этапе разработки и имеющих опыт клинического применения, с веществами, находящимися на позднем этапе разработки и не имеющими установленного токсического воздействия. При этом клиническое исследование таких комбинаций не должно по продолжительности превышать клинический опыт применения отдельных компонентов. Если клинические исследования проводятся на более позднем этапе разработки комбинированного лекарственного препарата или имеют большую продолжительность, их необходимо обосновать доклиническими токсикологическими исследованиями комбинации.
116. В отношении лекарственных препаратов, содержащих комбинацию 2 действующих веществ и более, находящихся на раннем этапе разработки, для обоснования проведения клинических исследований необходимо провести доклинические токсикологические исследования такой комбинации.
117. Если в отношении отдельных компонентов лекарственного препарата из комбинации 2 действующих веществ и более проведена полная программа доклинической разработки, для обоснования проведения клинических исследований такого комбинированного лекарственного препарата требуется проведение доклинического токсикологического исследования продолжительностью эквивалентной продолжительности клинического исследования, но не более 90 дней введения лекарственного препарата.
Для одобрения регистрации комбинированного лекарственного препарата необходимо представление результатов указанного 90-дневного токсикологического исследования. Однако в случае кратковременной продолжительности планируемого клинического применения лекарственного препарата в целях его регистрации разрешается представление результатов проведения токсикологического исследования комбинации действующих веществ меньшей продолжительности.
117. Если в отношении отдельных компонентов лекарственного препарата из комбинации 2 действующих веществ и более, находящихся на раннем этапе разработки, проведена полная программа доклинической разработки, для обоснования проведения клинических исследований такого комбинированного лекарственного препарата требуется проведение доклинического токсикологического исследования продолжительностью эквивалентной продолжительности клинического исследования, но не более 90 дней введения лекарственного препарата.
Для одобрения регистрации комбинированного лекарственного препарата необходимо представление результатов указанного 90-дневного токсикологического исследования. Однако в случае кратковременной продолжительности планируемого клинического применения лекарственного препарата в целях его регистрации разрешается представление результатов проведения токсикологического исследования комбинации действующих веществ меньшей продолжительности.
118. Дизайн доклинических исследований, рекомендуемых для определения характеристик комбинации действующих веществ, зависит от фармакологического, токсикологического и фармакокинетического профилей отдельных компонентов, показаний к применению, целевой популяции пациентов и имеющихся клинических данных.
119. Доклинические исследования комбинации действующих веществ в составе лекарственного препарата необходимо, как правило, проводить с участием 1 релевантного вида животных. При выявлении непредвиденной токсичности разрешается проведение дополнительных исследований.
120. Если в отношении отдельных компонентов комбинированного лекарственного препарата полная программа доклинической разработки не выполнена, разрешается провести полную программу доклинических токсикологических исследований исключительно в отношении всей комбинации действующих веществ в составе лекарственного препарата при условии, что отдельные компоненты этой комбинации предназначены исключительно для применения в составе комбинированного лекарственного препарата.
121. Если отдельные компоненты комбинации действующих веществ были изучены в соответствии с актами органов Союза в сфере обращения лекарственных средств, для обоснования проведения клинических исследований и регистрации лекарственного препарата проведение исследований генотоксичности, фармакологической безопасности и канцерогенности комбинации, как правило, не требуется.
122. Если популяция пациентов включает в себя женщин с детородным потенциалом, а результаты исследований отдельных компонентов свидетельствуют об эмбриофетальном риске, проводить исследования комбинации не требуется, поскольку уже выявлена потенциальная опасность для эмбриофетального развития человека.
123. Если результаты проведения доклинических исследований эмбриофетального развития свидетельствуют о том, что ни один из компонентов комбинации действующих веществ не несет онтогенетического риска для человека, при отсутствии опасений (основанных на свойствах отдельных компонентов), что их комбинация может представлять опасность для человека, проведение исследований комбинации действующих веществ не требуется.
124. Если отдельные компоненты комбинации действующих веществ изучены при проведении доклинических исследований эмбриофетального развития, но требуется проведение эмбриофетальных исследований комбинации действующих веществ, результаты таких исследований необходимо представить для обоснования регистрации лекарственного препарата.
Приложение N 1
к Руководству по доклиническим
исследованиям безопасности
в целях проведения клинических
исследований и регистрации
лекарственных препаратов
ТРЕБОВАНИЯ
К СОСТАВЛЕНИЮ ДОКУМЕНТОВ О ДОКЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ
ДЛЯ СМЕШАННЫХ РЕГИСТРАЦИОННЫХ ДОСЬЕ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
I. Область применения
1. Ряд лекарственных препаратов, применяемых в медицинской практике в течение длительного времени, содержит действующие вещества, данные о доклиническом исследовании которых ограничены или отсутствуют. Для оценки рисков, связанных с применением таких лекарственных препаратов, и во избежание проведения повторных экспериментов на животных в настоящем документе определяется минимальный объем доклинических исследований таких лекарственных препаратов.
2. Положения настоящего документа распространяются на лекарственные препараты, действующее вещество которых, относится к группе химических действующих веществ с известным химическим строением.
3. Положения настоящего документа не распространяются на биологические, биотехнологические и лекарственные растительные препараты.
4. Под смешанным регистрационным досье лекарственного препарата понимается вид регистрационного досье лекарственного препарата, в котором модули 4 и 5 представляют собой комбинацию результатов собственных доклинических и (или) клинических исследований и обзора фармако-токсикологических свойств лекарственного препарата на основе опубликованных в научной медицинской литературе сведений с указанием библиографических ссылок (включая научные работы, клинические исследования, данные пострегистрационного опыта, полученного по результатам широкого клинического применения лекарственного препарата человеком). Данные, содержащиеся в смешанном регистрационном досье лекарственного препарата позволяют оценить безопасность применения такого лекарственного препарата.
II. Документы о доклинических исследованиях
1. Общие положения
5. Проведение доклинических исследований, как правило, не требуется в случае, если имеется достаточный надлежащим образом документированный опыт клинического применения для установления всех аспектов клинической эффективности и безопасности лекарственного препарата.
6. Доклинические исследования необходимо проводить в случае, если фармакологический класс веществ, к которому относится лекарственный препарат, или опыт клинического применения лекарственного препарата вызывают обоснованные опасения о небезопасности применения такого лекарственного препарата или в случае, если возникает подозрение в отношении небезопасности его применения.
7. Отсутствие отдельных доклинических исследований (в частности, исследований репродуктивной токсичности, генотоксичности и канцерогенности) является основанием для наличия у уполномоченного органа (экспертной организации) государства — члена Евразийского экономического союза опасений о небезопасности лекарственного препарата. Если лекарственный препарат способен вызывать токсические эффекты, которые трудно или невозможно обнаружить в рамках клинического изучения этого лекарственного препарата, требуется проведение доклинических исследований.
2. Отдельные виды доклинических исследований
Токсичность при однократном и повторном (многократном)
введении лекарственного препарата
8. Допускается не проводить исследование токсичности при однократном и повторном (многократном) введении лекарственного препарата, а также исследование его фармакологических свойств (включая исследование фармакологической безопасности и фармакокинетики) в случае, если планируется проведение регистрации данного лекарственного препарата с представлением смешанного регистрационного досье.
Репродуктивная и онтогенетическая токсичность
9. Проведение доклинических исследований влияния лекарственного препарата на фертильность и общую репродуктивную функцию не требуется при отсутствии опасений о небезопасности лекарственного препарата.
10. Необходимо оценить потенциал влияния репродуктивной токсичности лекарственного препарата на эмбриофетальное и перинатальное (постнатальное) развитие человека. Необходимо принимать во внимание, что данные о репродуктивной токсичности большинства действующих веществ могут быть доступны в виде фармакотоксикологических сведений и могут содержаться в научных публикациях, но при этом таких данных недостаточно для надлежащей оценки безопасности лекарственного препарата.
11. Проведение исследований эмбриофетальной токсичности лекарственного препарата и его влияния на перинатальное (постнатальное) развитие не требуется для каждого следующего случая:
а) получены достаточные данные об экспозиции лекарственного препарата у беременных и новорожденных;
б) лекарственный препарат не предназначен для применения женщинами с детородным потенциалом;
в) лекарственный препарат не предназначен для применения во время беременности и в период грудного вскармливания.
Генотоксичность
12. Необходимо оценить генотоксический потенциал действующего вещества лекарственного препарата.
13. Необходимо принимать во внимание, что данные о генотоксичности большинства действующих веществ могут быть доступны в виде фармакотоксикологических сведений и могут содержаться в научных публикациях, но при этом таких данных недостаточно для надлежащей оценки безопасности лекарственного препарата. В случае если невозможно провести полноценную оценку мутагенности и (или) хромосомных повреждений у человека при применении данного лекарственного препарата, требуется проведение дополнительных исследований на генотоксичность.
14. В ряде случаев разрешается экстраполировать генотоксические свойства других веществ (например, цитостатических средств), принадлежащих к определенному классу анатомо-терапевтическо-химической классификации, на действующее вещество лекарственного препарата, принадлежащего к этому же фармакологическому классу. В таких случаях проведение исследований генотоксичности лекарственного препарата не требуется.
Канцерогенность
15. Проведение экспериментальных исследований канцерогенности не требуется в случае, если отсутствуют подозрения в отношении наличия у действующего вещества канцерогенного потенциала.
16. В случае возникновения подозрения в отношении наличия у действующего вещества канцерогенного потенциала при принятии разработчиком лекарственного препарата решения о необходимости проведения собственных экспериментальных исследований канцерогенности необходимо учитывать следующие обстоятельства:
а) влияние положительного результата таких исследований на оценку соотношения «польза — риск»;
б) прогнозируемость индукции опухолей на основании результатов предыдущих исследований действующих веществ с аналогичной молекулярной структурой и (или) механизмом действия;
в) обоснованность подозрения в отношении канцерогенного действия лекарственного препарата (наличие положительных результатов исследований его генотоксичности) и возможность устранения этого подозрения посредством проведения дополнительных исследований его генотоксичности (главным образом in vivo);
г) обоснованность подозрения в отношении канцерогенного действия лекарственного препарата, подтвержденного положительными результатами эпидемиологических наблюдений у человека (например, эстроген-индуцированные опухоли молочной железы);
д) наличие в регистрационном досье лекарственного препарата научных данных необходимых для устранения подозрения в отношении канцерогенного потенциала действующего вещества лекарственного препарата.
Токсикокинетические данные требуются для представления в составе регистрационного досье лекарственного препарата только при проведении новых исследований канцерогенности на животных.
III. Доклинический обзор
17. Специалист производителя лекарственных средств, ответственный за подготовку модуля 2 регистрационного досье лекарственного препарата, обязан проанализировать совокупность доступных сведений, подтверждающих допустимый уровень безопасности действующего вещества. В случае наличия действующих веществ с недостающими токсикологическими данными этот специалист обязан проанализировать результаты соответствующих фармакологических и токсикологических исследований лекарственного препарата, указав ссылки на научную литературу, и (или) представить в регистрационном досье лекарственного препарата научное обоснование, подтверждающее допустимый уровень безопасности действующего вещества (с учетом сведений о широком клиническом применении этого действующего вещества). При выполнении такого анализа и интерпретации результатов исследований специалист должен учитывать степень значимости возможных отклонений ранее выполненных исследований от требований к выполнению доклинических исследований (предусмотренных Правилами надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств, утвержденными Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 81).
18. В разделы 4.6 и 5.3 общей характеристики лекарственного препарата, представляемой в составе модуля 1 регистрационного досье лекарственного препарата, необходимо включить формулировки об отсутствии собственных экспериментальных данных о безопасности таких лекарственных препаратов.
Приложение N 2
к Руководству по доклиническим
исследованиям безопасности
в целях проведения клинических
исследований и регистрации
лекарственных препаратов
ТРЕБОВАНИЯ
К МИНИМАЛЬНОЙ ПРОДОЛЖИТЕЛЬНОСТИ ДОКЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
ПРИ ПОВТОРНОМ (МНОГОКРАТНОМ) ВВЕДЕНИИ ЛЕКАРСТВЕННОГО
ПРЕПАРАТА, НЕОБХОДИМЫХ ДЛЯ ОБОСНОВАНИЯ ПРОВЕДЕНИЯ
КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ РАЗЛИЧНОЙ ПРОДОЛЖИТЕЛЬНОСТИ
|
Максимальная продолжительность клинического исследования |
Минимальная продолжительность исследований токсичности при повторном (многократном) введении лекарственного препарата для обоснования продолжительности проведения клинических исследований |
|
|
грызуны |
негрызуны |
|
| До 2 недель |
2 недели <1> |
2 недели <1> |
|
От 2 недель До 6 месяцев |
такая же, как в клинических исследованиях <2> |
такая же, как в клинических исследованиях <2> |
| Свыше 6 месяцев |
6 месяцев <2>, <3> |
9 месяцев <2>, <3>, <4> |
<1> Возможной альтернативой 2-недельным исследованиям для обоснования проведения клинических исследований при однократном введении лекарственного препарата является расширенное исследование токсичности при однократном введении лекарственного препарата. В рамках расширенного исследования токсичности при однократном введении лекарственного препарата необходимо, как правило, оценить данные по гематологии, биохимии, некропсии и гистопатологии (только для контроля и максимальной дозы, если при максимальной дозе не обнаруживается патология, обусловленная применением препарата) после однократного введения лекарственного препарата с последующим изучением спустя 2 недели для оценки отсроченной токсичности и (или) восстановления. Стандартный дизайн исследования на грызунах предусматривает использование 10 особей каждого пола на группу, оцениваемых на следующий день после введения, и 5 особей каждого пола для дозы (доз), оцениваемой на 14-й день после введения. Стандартный дизайн исследований на негрызунах предусматривает использование 3 особей каждого пола во всех группах для оценки на 2-й день и 2 особей каждого пола при дозе (дозах), оцениваемых на 14-й день. Клинические исследования продолжительностью менее 14 дней разрешается обосновывать исследованиями токсичности с той же продолжительностью.
<2> Клинические исследования продолжительностью более 3 месяцев разрешается начинать при наличии результатов 3-месячного исследования на грызунах и 3-месячного исследования на негрызунах при выполнении следующих условий:
уполномоченному органу (экспертной организации) государства — члена Евразийского экономического союза представлено обоснование такой программы доклинической и клинической разработки;
представлены полные результаты исследований токсичности при повторном (многократном) введении грызунам и негрызунам прежде, чем продолжительность дозирования лекарственного препарата в клиническом исследовании превысит 3 месяца.
При серьезных или угрожающих жизни показаниях или в индивидуальном порядке такое продление возможно при наличии результатов полностью завершенных исследований токсичности при повторном (многократном) введении грызунам и результатов прижизненных исследований и данных некропсии в исследовании на негрызунах. Полные патогистологические данные исследований на негрызунах необходимо получить в течение последующих 3 месяцев.
<3> В некоторых случаях основной популяцией являются дети, а имеющиеся доклинические исследования на животных (токсикологические или фармакологические) указывают на потенциальные онтогенетические опасения в отношении органов-мишеней. В этих случаях при определенных обстоятельствах могут потребоваться долгосрочные исследования токсичности, начатые на неполовозрелых животных.
<4> Исследования 6-месячной продолжительности на негрызунах считаются достаточными. Вместе с тем в случае, если проведены исследования большей продолжительности, проведение дополнительных 6-месячных исследований не требуется. Исследования на негрызунах 6-месячной продолжительности также достаточны в следующих случаях:
иммуногенность или непереносимость лекарственного препарата может исказить результаты более длительных исследований;
пациенты подвергаются многократной краткосрочной экспозиции даже в условиях клинического исследования продолжительностью свыше 6 месяцев (например, при нерегулярном лечении мигрени, эректильной дисфункции или простого герпеса);
лекарственный препарат предназначен для длительного применения для снижения риска рецидива онкологических заболеваний;
лекарственный препарат предназначен для применения по показаниям пациентами с короткой ожидаемой продолжительностью жизни.
Приложение N 3
к Руководству по доклиническим
исследованиям безопасности
в целях проведения клинических
исследований и регистрации
лекарственных препаратов
ТРЕБОВАНИЯ
К МИНИМАЛЬНОЙ ПРОДОЛЖИТЕЛЬНОСТИ ДОКЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
ПРИ ПОВТОРНОМ (МНОГОКРАТНОМ) ВВЕДЕНИИ ЛЕКАРСТВЕННОГО
ПРЕПАРАТА, НЕОБХОДИМЫХ ДЛЯ ОБОСНОВАНИЯ ПРОДОЛЖИТЕЛЬНОСТИ
ЕГО ПРИМЕНЕНИЯ ЧЕЛОВЕКОМ (ПРИ РЕГИСТРАЦИИ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА)
|
Продолжительность применения по показанию |
Грызуны |
Негрызуны |
| До 2 недель |
1 месяц |
1 месяц |
| Свыше 2 недель до 1 месяца |
3 месяца |
3 месяца |
| Свыше 1 месяца до 3 месяцев |
6 месяцев |
6 месяцев |
| Свыше 3 месяцев |
6 месяцев <1> |
9 месяцев <1>, <2> |
<1> В некоторых случаях основной популяцией являются дети, а имеющиеся доклинические исследования на животных (токсикологические или фармакологические) указывают на потенциальные онтогенетические опасения в отношении органов-мишеней. В этих случаях при определенных обстоятельствах могут потребоваться долгосрочные исследования токсичности, начатые на неполовозрелых животных.
<2> Исследования 6-месячной продолжительности на негрызунах считаются достаточными. Вместе с тем в случае, если проведены исследования большей продолжительности, проведение дополнительных 6-месячных исследований не требуется. Исследования на негрызунах 6-месячной продолжительности также достаточны в следующих случаях:
иммуногенность или непереносимость лекарственного препарата может исказить результаты более длительных исследований;
пациенты подвергаются многократной краткосрочной экспозиции даже в условиях клинического исследования продолжительностью свыше 6 месяцев (например, при нерегулярном лечении мигрени, эректильной дисфункции или простого герпеса);
лекарственный препарат предназначен для длительного применения для снижения риска рецидива онкологических заболеваний;
лекарственный препарат предназначен для применения по показаниям пациентами с короткой ожидаемой продолжительностью жизни.
Приложение N 4
к Руководству по доклиническим
исследованиям безопасности
в целях проведения клинических
исследований и регистрации
лекарственных препаратов
ТРЕБОВАНИЯ
К ПРОВЕДЕНИЮ ДОКЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ, НЕОБХОДИМЫХ
ДЛЯ ОБОСНОВАНИЯ ОБЪЕМА ПРОВЕДЕНИЯ ПОИСКОВЫХ
КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
|
Поисковые клинические исследования |
Доклинические исследования |
|||
|
вводимая доза |
начальная и максимальная дозы |
исследование фармакологических свойств |
исследования общетоксических свойств <1> |
исследование генотоксичности <2> (прочие исследования) |
|
Подход 1-й. Суммарная доза удовлетворяет всем следующим критериям: фармакологически активной дозы (выраженной в мг/кг для внутривенного введения и в мг/м2 для перорального введения) |
максимальная и начальная дозы могут быть одинаковыми, но не должны превышать суммарную кумулятивную дозу в 100 мкг | необходимо провести профилирование связывания с мишенями (рецепторами) in vitro. Для обоснования выбора дозы для человека необходимо располагать результатами установления соответствующих характеристик первичной фармакологии (механизма действия и (или) эффектов) на фармакологически значимой модели | расширенное исследование токсичности при однократном введении <3>, <4> на одном виде животных (обычно грызунах) при планируемом пути введения с данными по токсикокинетике или при внутривенном введении. Разрешается использовать максимальную дозу, в 1 000 раз превышающую клиническую дозу, выраженную в мг/кг для внутривенного введения и в мг/м2 поверхности тела для перорального введения | проведение исследований генотоксичности не требуется, однако в досье клинического исследования необходимо включить все проведенные исследования и оценку структурно-функциональной зависимости. Необходимо представить соответствующие фармакокинетические данные и дозиметрические показатели высокорадиоактивных веществ (например, веществ для ПЭТ-визуализации) |
|
Подход 2-й. Выполнение всех следующих критериев: суммарная кумулятивная доза каждая доза каждая доза фармакологически активной дозы |
максимальная суточная и начальная дозы могут быть одинаковыми, но не должны превышать суммарную кумулятивную дозу в 100 мкг | необходимо провести профилирование связывания с мишенями (рецепторами) in vitro. Для обоснования выбора дозы для человека необходимо располагать результатами установления соответствующих характеристик первичной фармакологии (механизма действия и (или) эффектов) на фармакологически значимой модели | 7-дневное исследование токсичности при повторном (многократном) введении на одном виде животных (обычно грызунах) при планируемом пути введения с данными по токсикокинетике или при внутривенном введении. Необходимо включить данные о гематологии, биохимических исследованиях материала, некропсии и гистопатологии. Разрешается использовать максимальную дозу, в 1 000 раз превышающую клиническую дозу, выраженную в мг/кг для внутривенного введения и в мг/м2 для перорального введения | проведение исследований генотоксичности не требуется, однако в досье клинического исследования необходимо включить все проведенные исследования и оценку структурно-функциональной зависимости. Необходимо представить соответствующие фармакокинетические данные и дозиметрические показатели высокорадиоактивных веществ (например, веществ для ПЭТ-визуализации) |
|
Подход 3-й. Исследования с однократным введением субтерапевтических доз или доз предполагаемого терапевтического диапазона |
начальную дозу необходимо определить исходя из характера токсических данных, выявленных у наиболее чувствительного вида животных, и предполагаемой фармакологически активной дозы. Необходимо учесть вопросы выбора начальной дозы для человека исходя из требований соответствующих руководств, применяемых в государствах — членах Евразийского экономического союза (далее — государства-члены). Максимальной дозой может быть доза, обеспечивающая достижение |
необходимо провести профилирование связывания с мишенями (рецепторами) in vitro. Для обоснования выбора дозы у человека необходимо располагать результатами установления соответствующих характеристик первичной фармакологии (механизма действия и (или) эффектов) на фармакологически значимой модели. Основной набор (батарея) исследований фармакологической безопасности | расширенное исследование токсичности при однократном введении грызунам и негрызунам <3> при клиническом пути введения с данными по токсикокинетике, гематологии, клинической биохимии, некропсии и гистопатологии. В этом случае максимальной дозой должна быть максимальная переносимая доза, максимальная достижимая доза или предельная доза | тест Эймса (или альтернативный метод, если проведение теста Эймса невозможно (например, в отношении антибактериального лекарственного препарата)) |
|
Подход 4-й. Дозирование до 14 дней в терапевтическом диапазоне, но не с целью оценки клинической максимальной переносимой дозы |
При выявлении токсичности у 2 видов животных необходимо учесть вопросы выбора начальной дозы для человека исходя из требований соответствующих руководств, применяемых в государствах-членах. Если ни у одного вида животных токсичность не выявлена (то есть NOAEL являлись максимальными исследованными дозами, которые не были ограничены другим образом (например, не являлись максимальной достижимой дозой)) или выявлена только у одного вида животных, клинической начальной дозой должна стать доза, обеспечивающая прогнозируемое клиническое значение AUC (основанное или на межвидовом фармакокинетическом моделировании, или на преобразовании по мг/м2), что примерно равно 1/50 AUC при NOAEL у вида животных с меньшей экспозицией. Другие вопросы выбора начальной дозы для человека (например, исходя из прогнозируемой фармакодинамической активности) необходимо учитывать исходя из требований соответствующих руководств, применяемых в государствах-членах. В отсутствие токсичности у 2 видов животных максимальная клиническая доза не должна превышать 1/10 меньшей экспозиции (AUC), достигнутой у любого из видов животных при максимальной испытанной дозе. Если токсичность проявляется только у одного вида животных, максимальная клиническая доза не должна превышать NOAEL у того вида животных, у которого отмечалась токсичность, или |
необходимо провести профилирование связывания с мишенями (рецепторами) in vitro. Для обоснования выбора дозы для человека необходимо располагать результатами установления соответствующих характеристик первичной фармакологии (механизма действия и (или) эффектов) на фармакологически значимой модели. Основной набор (батарея) исследований фармакологической безопасности в дозах, совпадающих с дозами, использованными в токсикологических исследованиях | 2-недельные исследования токсичности с повторным (многократным) введением грызунам и негрызунам с оценкой стандартных параметров и выбором дозы для животных на основе кратности экспозиции от ожидаемой клинической AUC при максимальной дозе | тест Эймса (или альтернативный метод, если проведение теста Эймса невозможно (например, в отношении антибактериального лекарственного препарата)) и тест (in vitro или in vivo), способный обнаружить повреждение хромосом у млекопитающих |
|
Подход 5-й: дозирование до 14 дней, не превышающее продолжительность дозирования у негрызунов в терапевтическом диапазоне, но не с целью оценки клинической максимальной переносимой дозы |
прогнозируемая величина экспозиции при начальной дозе не должна превышать 1/50 NOAEL у более чувствительного вида животных в мг/м2. Вопросы выбора начальной дозы для человека необходимо учитывать исходя из требований соответствующих руководств, применяемых в государствах-членах. Максимальная экспозиция у человека не должна превышать AUC при NOAEL у негрызунов или |
необходимо провести профилирование связывания с мишенями (рецепторами) in vitro. Для обоснования выбора дозы для человека необходимо располагать результатами установления соответствующих характеристик первичной фармакологии (механизма действия и (или) эффектов) на фармакологически значимой модели. Основной набор (батарея) исследований фармакологической безопасности в дозах, совпадающих с дозами, использованными в токсикологических исследованиях | стандартное 2-недельное исследование токсичности при повторном (многократном) введении грызунам (при обосновании того, что грызуны являются релевантным видом). Максимальная доза должна быть максимальной переносимой дозой, максимальной достижимой дозой или предельной дозой. Подтверждающее исследование на негрызунах (n = 3) в дозе, равной ожидаемой NOAEL-экспозиции у грызунов, продолжительностью не менее 3 дней и по меньшей мере с планируемой продолжительностью клинического исследования или исследование с эскалацией дозы у негрызунов продолжительностью не менее 3 дней и по меньшей мере планируемой продолжительностью клинического исследования при ожидаемой NOAEL-экспозиции у грызунов | тест Эймса (или альтернативный метод, если проведение теста Эймса невозможно (например, в отношении антибактериального лекарственного препарата)) и тест (in vitro или in vivo), способный обнаруживать повреждение хромосом у млекопитающих. В случае оценки in vivo ее разрешается провести в рамках токсикологического исследования на грызунах |
<1> Исследования общетоксических свойств необходимо проводить в соответствии с требованиями Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 81.
<2> Дизайн и выбор дозы для исследований генотоксичности.
<3> В рамках расширенного исследования токсичности при однократном введении лекарственного препарата необходимо, как правило, оценить данные по гематологии, биохимии, некропсии и гистопатологии (только для контроля и максимальной дозы, если при максимальной дозе не обнаруживается патология, обусловленная применением препарата) лекарственного препарата после однократного введения с последующим изучением спустя 2 недели для оценки отсроченной токсичности и (или) восстановления. Стандартный дизайн исследований на грызунах предусматривает использование 10 особей каждого пола на группу, оцениваемых на следующий день после введения, и 5 особей каждого пола для дозы (доз), оцениваемой на 14-й день после введения лекарственного препарата. Стандартный дизайн исследований на негрызунах предусматривает использование 3 особей каждого пола во всех группах для оценки на 2 день и 2 особей каждого пола при дозе (дозах), оцениваемых на 14-й день.
<4> При подходе с исследованием микродоз разрешается проведение оценки обратимости (отсроченной токсичности) на 14-й день после однократного введения. Используемая доза необязательно должна быть максимальной, но она должна превышать клиническую дозу в 100 раз.
<5> При отсутствии нежелательных реакций в клинических исследованиях разрешается эскалация дозы выше AUC, если реакции, выявленные в токсикологических исследованиях, поддаются мониторингу, являются обратимыми и имеют низкую степень тяжести у человека.
Руководство по доклиническим испытаниям лекарственных препаратов на местную переносимость
Non-clinical local tolerance testing of medicinal products
Сводное резюме
Настоящий документ содержит рекомендации по разработке и оценке лекарственных препаратов, которые вступают или могут вступить в контакт с различными участками организма человека в ходе стандартного клинического применения, а также при непреднамеренном введении.
В целях как можно большего сокращения числа животных испытания на местную переносимость, по возможности, следует проводить в составе исследований других видов токсичности, поэтому в последние необходимо включать соответствующие конечные точки. Проведение «самостоятельных» исследований местной переносимости, в целом, не рекомендуется. Проводить отдельные исследования вспомогательных веществ при имеющихся данных клинической безопасности, в целом, не требуется.
1. Введение (справочные сведения)
Доклинические испытания на местную переносимость направлены на обоснование экспозиции лекарственного препарата у человека (как действующего вещества, так и вспомогательных веществ) при его вступлении в контакт с организмом после клинического применения. Дизайн доклинического исследования должен быть направлен на нахождение различий в физических последствиях введения, например, местная травма после инъекции или чисто физико-химическое действие препарата вследствие местных токсикологических или фармакодинамических эффектов. Проводить отдельные исследования вспомогательных веществ с ранее полученными данными клинической безопасности, в целом, не требуется.
В соответствие с Директивой 2010/63/EU о защите животных, используемых в научных целях, по возможности, следует использовать научно приемлемый метод или стратегию испытаний, не предполагающую использования живых животных. Если законодательством Союза альтернативные методы не предусмотрены, то число животных можно сократить путем использования других методов и стратегии испытаний, предполагающей замену, сокращение и совершенствование использования животных. Перед проведением доклинических исследований следует обратиться к руководству по регуляторной приемлемости 3R-подходов к испытаниям.
Если в целях оценки местной переносимости при предполагаемом клиническом пути введения требуется проведение исследований на животных, рекомендуется, по возможности, включать такую оценку в состав исследований общетоксических свойств, а не проводить ее в качестве «самостоятельного» исследования.
2. Сфера применения
Настоящий документ содержит рекомендации по доклиническим испытаниям на местную переносимость для обоснования клинической разработки и регистрации лекарственных препаратов для медицинского применения. Исследования примесей, опосредованных действующими веществами и вспомогательными веществами, содержащимися в лекарственном препарате, или экстрагированными или выделенными из системы контейнер/укупорка, напрямую в настоящем руководстве не рассматриваются.
Принципы, изложенные в настоящем руководстве, применимы ко всем видам лекарственных препаратов, включая биотехнологические лекарственными препараты и растительные препараты. Вместе с тем, в отношении биотехнологических лекарственных препаратов следует также обратиться к руководству ICH S6(R1).
3. Правовая основа
Настоящее руководство неразрывно связано с Директивой 2001/83/EC в действующей редакции, а также всеми применимыми руководствами ICH и КМЛП. Руководство также применимо к досье на клинические исследования в соответствии с регламентами ЕС.
В части содержания животных, помимо Директивы 2010/63/EU, необходимо учитывать Решение Совета о Европейской конвенции по защите позвоночных животных (1999/575/EC).
Все доклинические исследования необходимо проводить в соответствии с правилами надлежащей лабораторной практики (GLP), предусмотренными Директивами 2004/9/EC и 2004/10/EC.
Полный текст документа доступен после покупки в личном кабинете.
Библиотека PharmAdvisor даёт вам доступ к действующим нормативно-правовым актам, а также научным и административным руководствам ICH, EC, EMA, FDA. Они хорошо и точно переведены на русский язык, их современная реализация позволяет работать с ними когда вам удобно.
Где можно посмотреть примеры переводов?
В открытом доступе много полноценных документов.
Существуют ли скидки для учебных заведений?
Да, мы предоставляем скидки студентам и учебным заведениям. Пожалуйста, напишите нам по электронной почте с запросом.
Какие существуют способы оплаты кроме кредитной карты?
Мы принимаем различные способы оплаты, включая безналичный перевод, PayPal и наличными курьеру.
В каком формате предоставляются руководства?
При заказе вы получаете моментальный и неограниченный доступ к купленным документам в личном кабинете через специальный интерфейс. Обратите внимание, что для покупки целого пакета документов PharmAdvisor необходимо связаться с нами.
Другие вопросы?
Пишите на pharmadvisor@csa.expert
Ранее «Биомолекула» уже рассказывала о том, как проходят масштабные клинические исследования. Теперь пришло время узнать о не менее важной стадии разработки лекарственных препаратов. Из этой статьи, открывающей спецпроект о доклинических исследованиях, вы узнаете, как именно сегодня происходит изучение свойств потенциальных лекарств еще до начала испытаний с участием добровольцев.
Будущее доклинических исследований
Ни для кого не секрет, что биологические исследования и разработка лекарств — сложный и ответственный процесс. При этом в ходе отбора лучших молекул-кандидатов ученые должны заботиться не только о действенности, но и о безопасности новых препаратов. Так до того, как созданное лекарство получит человек, его изучают в других моделях: от компьютерных программ и клеточных культур до разных видов животных.
Спецпроект о доклинических исследованиях (доКИ) стал своеобразным приквелом к циклу статей о клинических испытаниях (КИ): что нужно сделать и изучить перед тем, как проводить клинические исследования с участием людей? Можно ли обойтись без экспериментов на животных? Почему правильные доКИ не менее значимы для разработки лекарства, чем КИ? Мы постараемся в доступной форме осветить сложные вопросы планирования и регулирования доклинических исследований; принципы этичности работы с лабораторными животными; узнаем, когда и чем можно их заменить; и заглянем в ближайшее будущее биомедицинской отрасли.
Независимый рецензент статьи — Равиль Ниязов, кандидат медицинских наук, специалист по разработке и регулированию лекарств в Центре научного консультирования, автор образовательного YouTube-канала PhED, а также ресурса по переводу на русский язык зарубежных документов по разработке и регулированию лекарств PharmAdvisor.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл», ФМИ (PMI Affiliates in Russia), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Начать рассказ о доклинических исследованиях придется с принятой в отрасли терминологии, которая не лишена особенностей. С первой мы сталкиваемся сразу же, когда видим определение самих доклинических исследований (доКИ).
- Доклиническое исследование
- лекарственного препарата для медицинского применения — это исследование, субъектом которого является любой объект живого или неживого мира, за исключением целостного организма живого человека, и которое направлено на установление безопасности и эффективности такого лекарственного препарата у человека.
Говоря более простыми словами, цель доКИ — получение данных, которые позволят сделать выводы о возможном воздействии нового препарата на организм человека и обоснованно перейти к клиническим исследованиям с участием людей .
О том, как проводят клинические исследования лекарств (которые следуют за доКИ), подробно можно почитать в одноименном спецпроекте «Биомолекулы», например: «С миру по нитке: как соединились компоненты клинического исследования» [1].
Иногда можно встретить термин неклинические (non-clinical) исследования в контексте разговора о тех же доклинических (pre-clinical) испытаниях. И он даже лучше отражает суть: ведь некоторые такие исследования могут идти параллельно с клиническими, а не предшествовать им. Для упрощения и без того сложного материала в рамках этого спецпроекта мы будем обсуждать в основном доклинические исследования новых лекарственных средств (ЛС) , полученных методами химического синтеза и впервые выходящих на фармацевтический рынок. Тонкости доКИ биотехнологических продуктов, включая генные и клеточные терапии, заслуживают отдельной публикации.
На самом деле в доКИ участвуют еще не сами лекарства, а действующие вещества, их метаболиты, примеси и вспомогательные вещества, которые войдут в состав ЛС. Говоря «лекарство», «препарат» или «вещество», будем иметь в виду сразу все возможные объекты исследований.
Взглянем теперь на место доКИ в разработке новых препаратов (рис. 1). Здесь важно понять, что программа доклинической разработки может длиться от нескольких месяцев до нескольких лет, не уступая в сложности КИ, и очень дорого стоить. Однако по сравнению с клиническими исследованиями, стадия доКИ всё же примерно в 3 раза быстрее и в 8–10 раз дешевле.
Рисунок 1. Основные этапы разработки новых лекарственных препаратов
Каковы же субъекты доКИ, если в них нельзя прибегать к помощи людей? В качестве моделей в доклинических разработках могут быть использованы компьютерные программы и базы данных, изолированные рецепторы и органеллы клеток, сами клетки (обычно в виде стандартизированных клеточных линий), ткани, органы и цельные живые лабораторные животные. Первая статья спецпроекта в основном будет посвящена работе с лабораторными животными как с наиболее «традиционной» моделью, от которой, тем не менее, хочется «уйти» в сторону более этичных способов получения необходимых данных. Пусть исследования in silico и in vitro имеют свои ограничения и пока не могут полностью заменить животные модели, развитие этих технологий в последние десятилетия позволило начать сокращать количество животных в доКИ, о чем мы расскажем в следующих статьях.
Напомним основные обозначения, пришедшие к нам из латыни: in silico означает компьютерное моделирование; in vitro — исследования на живых клетках, тканях и органах, но не на целостном организме; in vivo — исследования на живом животном. См. также: In vivo — in vitro — in silico [2].
Цели доклинических исследований
Основная идея доКИ — в обосновании целесообразности проведения последующих КИ, после которых новые вещества смогут войти в состав готовых продуктов. Пренебрежение доКИ чревато массой проблем. В лучшем случае будет потрачено очень много денег и времени на дальнейшие исследования неэффективного препарата. В худшем — участники КИ получат опасный для их здоровья препарат, что может привести к серьезным побочным эффектам и даже смерти.
У доклинических исследований существуют вполне определенные цели. Этичность доКИ с участием животных обеспечивается в том числе правильным планированием экспериментов — они должны быть направлены на получение необходимых данных. К целям доКИ относятся:
- проверка биологического действия (как полезного, так и токсического) различных веществ;
- определение биологически активных доз действующих веществ;
- выбор потенциальной стартовой дозы в будущих клинических исследованиях с участием добровольцев, определение диапазона безопасных доз и других параметров, необходимых для планирования КИ первой фазы;
- установление клинического пути введения и его безопасности;
- обоснование критериев отбора добровольцев/пациентов для включения в клинические исследования;
- определение физиологических параметров, подлежащих контролю в ходе клинического наблюдения с участием людей;
- выявление потенциальных рисков для здоровья не только пациентов, но и других людей (например, для населения в целом, ухаживающих лиц, членов семьи, близких и интимных контактов).
Виды доклинических исследований
ДоКИ можно разделить на разные типы в зависимости от целей, субъектов исследований и исследуемых параметров (табл. 1).
| По предназначению результатов: | ||
| поисковые (фундаментальные, трансляционные) | регуляторные (пилотные, опорные) | |
| По изучаемым параметрам: | ||
| фармакологические (фармакодинамические и фармакокинетические) | токсикологические (общие и специфические виды токсичности, токсикокинетика, исследования экологической безопасности) | |
| По используемой модели: | ||
| in silico (компьютерная модель) | in vitro (клеточная культура) | in vivo (исследования на животных) |
Поисковые и регуляторные исследования
По использованию получаемых результатов можно выделить поисковые (фундаментальные, трансляционные) и регуляторные (пилотные и опорные) исследования.
К поисковым, или нерегуляторным, исследованиям можно отнести всё, что помогает сформировать правильные гипотезы и цели для последующей разработки нового лекарства. Фундаментальные исследования во всём их многообразии изучают мишень для будущего лекарства. Они проводятся для изучения механизмов развития заболеваний, деталей биохимических взаимодействий в живых организмах и так далее. Такие исследования в основном проводят на клетках, а животных «подключают» для проверки гипотез, предварительно полученных in vitro. Трансляционные исследования изучают возможность какого-либо влияния на выбранную мишень с точки зрения лечения заболеваний, то есть являются первым «мостиком» для переноса научного знания в плоскость реального применения в медицине.
Важно отметить, что проведение поисковых исследований не урегулировано законодательно, т.е. нет строгих юридических требований в отношении используемых моделей, дизайна, размера выборки, оформления отчетов и т.д. Параметры исследований и модели определяются исключительно научными соображениями. Результаты этих исследований обычно не включаются в регистрационное досье, поскольку большинство из них касаются молекул-кандидатов, так и не доходящих до последующих этапов разработки. Задача поисковых исследований — найти несколько многообещающих кандидатов, которые можно было бы начать изучать в КИ.
После того, как разработчик по результатам поисковых клинических исследований приходит к выводу, что можно начать испытания с участием добровольцев, ему необходимо подготовить почву для проведения будущих экспериментов. Для этого инициируются регуляторные доКИ. Данное понятие предполагает, что существуют определенные юридически обязывающие критерии, которые должны быть выполнены при планировании, проведении, анализе, интерпретации и документальном оформлении таких исследований, поскольку на их основании впоследствии будет разрешаться изучение лекарства с участием людей.
Регуляторные исследования (пилотные и опорные) уже относятся к конкретному кандидату и изучению его действия, а их результаты влияют на получение последующих разрешений на КИ. Пилотные исследования проводятся для четкого определения параметров (например, дозы, режима дозирования, частоты введения, времени взятия образцов и др.) опорных исследований. Пилотными являются, например, работы с целью определения подходящих видов животных для последующих доКИ или же изучение диапазона токсических доз для выбранных животных.
Опорные исследования проводят, чтобы получить разрешение на КИ. Они уже отвечают на вопросы, заявленные в целях исследования, а их результаты включаются в регистрационное досье будущего препарата с целью обоснования проведения испытаний с участием добровольцев и регистрации средства.
Итак, строго регламентируются и контролируются только опорные доКИ, так как это, главным образом, исследования безопасности, необходимые для максимального снижения рисков для людей в КИ — об этом мы расскажем в соответствующем разделе ниже.
Фармакологические и токсикологические исследования
По изучаемым параметрам традиционно выделяют фармакологические и токсикологические исследования. Они могут проводиться в рамках как пилотных, так и опорных доКИ. Однако большой объем фармакологических исследований выполняется еще до начала регуляторной разработки, т.е. на поисковом этапе.
Фармакологические испытания нужны, чтобы изучить, как именно вещество будет воздействовать на человека или патогенные микроорганизмы и что происходит с целевым веществом после того, как оно попадет в организм. С другой стороны, токсикологические исследования подразумевают намеренное использование высоких доз исследуемого кандидата, заведомо превышающих предполагаемую терапевтическую дозу, для определения диапазонов его токсичности и ее конкретных проявлений (табл. 2).
| Классификация доклинических исследований по изучаемым параметрам | |
| Фармакологические | Токсикологические |
Фармакодинамические:
|
Общие виды токсичности:
|
Фармакокинетические:
|
Специфические виды токсичности:
|
| Токсикокинетика | |
| Исследования экологической безопасности |
В группе фармакологических исследований выделяют фармакодинамические и фармакокинетические исследования.
- Фармакодинамика
- раздел фармакологии, изучающий локализацию, механизм действия и фармакологические эффекты лекарственных средств, силу и длительность их действия. Иными словами, фармакодинамика отвечает на вопрос: «Как лекарство влияет на организм?»
- Фармакокинетика
- раздел фармакологии, изучающий кинетические закономерности химических и биологических процессов, происходящих с ЛС в организме (абсорбция, биораспределение, метаболизм, выведение). Таким образом, фармакокинетика отвечает на вопрос: «Как организм влияет на лекарство?»
Токсикологию, в свою очередь, делят на исследования общих, специфических видов токсичности, токсикокинетику, а также исследования экологической безопасности.
Фармакологические исследования: фармакодинамика и фармакокинетика
Разберемся чуть подробнее, из чего состоят фармакологические исследования.
Первая задача фармакодинамики — определить, является ли новое вещество эффективным. Для этого ученые в рамках тестов для оценки первичной фармакодинамики изучают, как препарат влияет на системы организма, на лечение которых он направлен.
Изучение вторичной, или второстепенной, фармакодинамики, напротив, дает информацию о том, как препарат действует на системы организма, в работу которых создатели средства изначально вмешиваться не стремились. И чаще всего, что ожидаемо, такое непредвиденное воздействие оказывается неблагоприятным. Здесь мы вплотную подходим ко второй цели фармакологических тестов — исследованию фармакологической безопасности, где оценивают негативные эффекты желательного фармакологического действия, если терапевтические дозы превышены. Это очень важное исследование, необходимое для последующей регистрации любого препарата, прошедшего доКИ. Более того, исследования фармакологической безопасности так же, как токсикологические исследования, строго регламентируются правилами надлежащей лабораторной практики GLP, о которых мы поговорим в следующем разделе .
Фармакологическая безопасность и токсикология — самая важная часть регуляторных доКИ: все эти испытания входят в так называемые доклинические исследования безопасности и нужны для того, чтобы снизить риски побочных эффектов от лекарств для будущих пациентов (в таблице 2 они выделены синим цветом). Если вещество впоследствии окажется просто неэффективным, это полбеды: тогда компания-разработчик просто не получит прибыль. А вот если оно окажется вредным для здоровья, расплачиваться будут люди — участники будущих исследований. Стремясь исключить возможность таких неприятных сюрпризов, ученые еще на стадии доКИ тщательно ищут и выявляют все нежелательные фармакодинамические свойства испытуемых веществ, анализируют эффекты, выявленные в токсикологических исследованиях (о них мы говорим ниже), и изучают, как и почему они проявляются. Если препарат подозревают в воздействии на какой-то определенный орган (сердце, мочеполовую или нервную системы), его работу изучают более подробно, проводя дополнительные тесты, если это требуется.
Во время исследования фармакодинамических взаимодействий определяют, как разные вещества влияют на работу друг друга: например, лекарство для лечения диабета может существенно изменять свойства противоопухолевого препарата.
А что насчет фармакокинетических исследований? Здесь ученые отслеживают судьбу действующего вещества с момента попадания его в организм и до полного выведения вещества и его метаболитов из организма. Для этого требуется определить биодоступность и способность препарата усваиваться (т.е. попадать в организм, например, после приема внутрь или нанесения на кожу); изучить его распределение в организме (в том числе узнать, достигает ли вещество молекулы-мишени или органов, на которые оно может оказывать токсический эффект); увидеть, как оно трансформируется и выводится. Фармакокинетические тесты делятся на исследования абсорбции, распределения, метаболизма, выведения и фармакокинетических лекарственных взаимодействий (табл. 2). Первые четыре параметра часто сокращают до аббревиатуры ADME (absorption, distribution, metabolism, and excretion). Роль фармакокинетики крайне велика, поскольку большинство испытуемых веществ обычно плохо всасываются или плохо распределяются по организму. Если планировать и проводить такие исследования грамотно, то можно отсечь значительное количество молекул-кандидатов уже на этом этапе, что позволит расходовать больше ресурсов на работу с действительно перспективными веществами.
Во время фармакологических испытаний животным вводят разные дозы препарата, а затем с определенными интервалами берут кровь, мочу и другие биологические жидкости, чтобы определить концентрацию в них лекарства и его метаболитов. Кроме того, нередко проводят исследования с лекарствами, мечеными радиоактивным изотопом. Для этого к исследуемому веществу добавляют радиоактивную метку и далее отслеживают его накопление в тех или иных органах и системах организма. Это позволяет — с помощью радиографического анализа — наглядно отследить, как быстро и сколько вещества попадает в организм, а также как оно распределяется по организму, в том числе количественно охарактеризовать преимущественное накопление в определенных органах и последующее выведение из них. Полученные данные дают возможность, среди прочего, спрогнозировать, каким способом стоит вводить препарат людям в КИ и через сколько времени он будет выводиться из организма.
Общая и специфическая токсичности, токсикокинетика
Классификация токсикологических исследований также представлена в таблице 2. Они делятся на исследования общих видов токсичности (то есть исследования, проводимые в отношении всех лекарственных препаратов) и исследования специфических видов токсичности. К общим видам токсичности относятся исследования общетоксических свойств, генотоксичности, канцерогенности, а также онтогенетической и репродуктивной токсичности (т.н. DART studies) (рис. 2).
Рисунок 2. Исследования общих видов токсичности
В качестве примера доКИ, которое можно делать параллельно с КИ на добровольцах вплоть до второй фазы, можно привести исследования генотоксичности, но и тут есть нюансы. Изучение способности вещества вызывать изменения в генетическом материале in vitro с использованием бактерий в качестве субъекта исследования (тест Эймса) должно быть завершено только до начала I фазы КИ. Генотоксичность in vivo, в свою очередь, изучают параллельно с исследованиями на здоровых добровольцах до начала II фазы. Некоторые исключения могут быть сделаны, если в разработке находится препарат для детей, исследования которого на взрослых не проводятся — тогда весь комплекс исследований генотоксичности на животных придется завершить до начала исследований с участием детей.
Любая специфическая токсичность исследуется только в том случае, когда это необходимо. Например, если результаты изучения общей токсичности показали, что препарат может вызывать нежелательные реакции со стороны кожи (или же предполагается его наружное нанесение), нужно дополнительно исследовать фототоксичность — способность вещества снижать устойчивость клеток кожи к неблагоприятному воздействию солнечных лучей (рис. 3).
Рисунок 3. Исследования некоторых специфических видов токсичности
Отдельно стоит упомянуть токсикокинетические тесты, в ходе которых ученые определяют системную концентрацию ЛС у животных, участвующих в доКИ безопасности, или, иными словами, проводят оценку фармакокинетики вещества во время токсикологического исследования. Токсикокинетика призвана бороться с риском перепутать отсутствие токсичности с банальным недостижением у животных токсической концентрации исследуемого вещества. Недостижение токсической концентрации может быть связано с использованием животных разного пола, с путем введения вещества, его недостаточной абсорбцией, выраженным метаболизмом, высокой иммуногенностью (в случае биопрепарата) и другими факторами. Кроме того, токсикокинетика помогает удостовериться в биодоступности вещества и дает возможность увидеть зависимость выраженности токсических эффектов от содержания вещества-кандидата в организме. Этот анализ необходим практически во всех случаях опорных токсикологических исследований in vivo, и только после его завершения исследователи могут говорить о дозах вещества, которые станут стартовыми в КИ.
Экологическая безопасность
Требования многих зарубежных стран предусматривают проведение испытаний с целью подтвердить безопасность не только для человека, но и для окружающей среды в целом. Это необходимо для оценки последствий попадания нового препарата в биосферу. В некоторых случаях вред может быть значительным и требовать особых мер по утилизации.
Регламент и контроль доклинических исследований
В соответствии с общемировыми требованиями опорные токсикологические исследования и опорные исследования фармакологической безопасности (они входят в доКИ безопасности и являются стандартным комплексом исследований для всех новых молекул, которые войдут в состав лекарств) должны проводиться в соответствии с GLP. Все остальные фармакологические исследования, а также пилотные токсикологические исследования, могут проводиться без соответствия GLP, однако также должны быть хорошо стандартизированы, чтобы давать валидные результаты. Но что такое GLP? Почему исследования безопасности подвергаются дополнительному контролю? Какие еще есть ограничения и регламенты?
GLP расшифровывается как Good Laboratory Practice, или, по-русски, «Правила надлежащей лабораторной практики». GLP определяют методологию, уровень организации и проведения доклинических исследований и применимы не только в доклинических исследованиях потенциальных лекарственных препаратов, но и в разработке агрохимических, косметических средств, пищевых добавок, а также медицинских изделий, контактирующих с тканями человеческого организма. Международный стандарт, описывающий GLP, называется OECD Principles on Good Laboratory Practice и призван обеспечить взаимное признание результатов доКИ во всех странах-участницах OECD .
Некоторые компании, заинтересованные в проведении эффективных биомедицинских исследований, на основе международных стандартов разрабатывают собственные методологии, которые, как правило, содержат более широкие перечни требований. Примером может служить подход OECD+, который для своих экспериментов in vitro и in vivo сформировала команда PMI Science. В его основе лежит совместное применение стандартных методов токсикологической оценки и методов системной токсикологии, созданных в компании.
Кроме того, каждая страна имеет национальные документы, так или иначе соответствующие международным принципам проведения доКИ. В России это, например, ГОСТ 33044-2014, ГОСТ 33647-2015 и ряд других (перечислены в вышеобозначенных государственных стандартах), соответствующие приказы Минздрава РФ и Федеральный закон «Об обращении лекарственных средств» от 12.04.2010 №61-ФЗ, а также Правила надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств. Однако многие российские и евразийские ГОСТы и правила являются переводом документов OECD различной степени полноты и качества.
К сожалению, система обеспечения соблюдения норм GLP в России/ЕАЭС не полностью соответствует международной, что означает необходимость иностранных GLP-инспекций или повторения соответствующих исследований за рубежом (в том числе с этим столкнулись разработчики вакцины «Спутник V»), либо дополнительные сложности в процессе признания результатов испытаний новых препаратов.
Требования GLP в основном касаются качества и целостности данных с фокусом на воспроизводимость и стандартизацию протоколов, но не связаны напрямую с научными аспектами или вопросами гуманности и этичности. Научные аспекты, т.е. дизайн, объем и сроки исследований, материалы и методы, способы анализа и интерпретации регламентируются принимающими ведомствами — организациями, использующими результаты доКИ, которые должны проводиться в соответствии с GLP, для принятия собственных решений, например о выдаче разрешения на клиническое исследование или регистрацию. Наиболее известными организациями, вырабатывающими научные требования к проведению доКИ, являются:
- Международный совет по гармонизации технических требований к регистрации лекарственных препаратов для медицинского применения (ICH);
- Организация экономического сотрудничества и развития (OECD);
- Управление по санитарному надзору за качеством продуктов и медикаментов США (FDA);
- Национальная токсикологическая программа США — подразделение в составе FDA (NTP);
- Европейское агентство лекарственных средств (EMA).
Эти организации составили множество руководств по доклиническим исследованиям, доступных на русском языке на портале PharmAdvisor. А об этичности исследований на животных мы поговорим чуть позже.
Как выбирают животных для доклинических исследований?
Итак, мы уже обмолвились, что наиболее значимую роль в доклинических исследованиях играет работа с лабораторными животными. Теперь пришло время обсудить, на какие факторы ученые опираются при выборе животных моделей для исследования новых лекарств.
Для понимания, что данные, полученные в ходе исследований на животных, далеко не всегда отражают, как вещество будет работать в человеческом организме, не нужно получать специального образования. Достаточно взглянуть на такие распространенные животные модели, как крыса и кролик. Между нами и этими пушистыми созданиями много сходств, но много и различий. И тем не менее эти виды млекопитающих помогают науке год за годом, «беря на себя» все риски, связанные с воздействием неизученных молекул, создаваемых людьми. Как же решить, какое животное лучше подойдет для конкретного исследования? Здесь нужно учитывать множество факторов, начиная с природы тестируемого вещества и предполагаемого механизма его действия и заканчивая поиском баланса между этичностью работы и нуждами исследователей.
Идеальная модель — это крыса?
Среди главных факторов, на которые приходится оглядываться, выбирая субъект исследования для доКИ, можно выделить его биологическое соответствие (релевантность), этичность работы с ним и возможность создавать модели для изучения определенных видов заболеваний.
В процессе доКИ важно как можно больше узнать о том, как новое вещество будет взаимодействовать с телом человека, и оценить потенциальные риски, связанные с приемом препарата людьми. Иными словами, выбранная животная модель должна давать возможность предсказать, как препарат поведет себя в КИ. Это значит, что ее фармакодинамические и фармакокинетические профили должны быть максимально приближены к человеческим. Вот почему исследования фармакологии и токсикологии лекарств проводятся исключительно на млекопитающих, а вот исследования экологической безопасности, если они требуются, могут включать работу с другими представителями хордовых и даже беспозвоночных.
Второй фактор — этичность — подразумевает, что ученые всегда должны думать о том, как обеспечить достойное содержание животных и снизить их количество без ущерба для качества процесса. Традиционно используемые в доКИ виды животных были когда-то выбраны не только из-за того, что они прекрасно подходили для поставленных задач, но и потому, что они способны переносить лабораторные условия. Не зря большинство исследований in vivo проводятся на мышах и крысах (рис. 4) .
В статье «Модельные организмы: грызуны» [3] мы рассказали о множестве заслуг наших маленьких собратьев перед человечеством. Читатель также благоволит ознакомиться с материалом «Грызун особого назначения» [4].
Рисунок 4. Памятник лабораторной мыши в новосибирском Академгородке. Памятник установлен в сквере около Института цитологии и генетики Сибирского отделения РАН в 2013 году.
Грызуны удобны с точки зрения размножения и обращения с ними в процессе экспериментов. Эти животные достаточно мелкие, что позволяет использовать больше особей на единицу затрат: например, им не нужно вводить очень много препарата. Кроме того, их легко транспортировать.
Еще один плюс грызунов — относительная простота выведения специальных линий животных с определенным генетическим статусом, например мышей с «поломанными» генами, на которых удобно изучать какую-то конкретную болезнь. Существует множество линий трансгенных мышей для имитации разных болезней человека: гемофилий, болезни Гентингтона, ожирения, артериальной гипертензии. Так, мыши ApoE−/−, склонные к атеросклерозу из-за дефицита у них аполипопротеина E, активно используются учеными в ходе исследования сердечно-сосудистых и респираторных заболеваний (в том числе в ходе изучения влияния на организм сигаретного дыма), а FUS-TG F19-трансгенные мыши служат для изучения нейродегенеративных расстройств.
Несомненно, мыши и крысы хороши. Но современные требования к разработке лекарств требуют проводить исследования как на грызунах, так и на других млекопитающих. Почему? Давайте разбираться.
Два вида млекопитающих вместо одного для оценки токсичности
Несмотря на то, что в научном сообществе существует тренд сокращения количества используемых в экспериментах животных, официальные нормы часто требуют от исследователей тестирования новых веществ с привлечением двух видов млекопитающих, один из которых — негрызуны. Например, так обстоят дела при изучении общетоксических свойств новых молекул.
Дело в том, что грызуны не всегда позволяют получить полноценную картину того, как препарат будет действовать на человека. Работая с ними, ученые сталкиваются с выявлением как ложноположительной, так и ложноотрицательной токсичности. Конечно, привлечение дополнительных моделей не гарантирует 100% попадания, тем не менее комбинация из двух моделей (грызун + негрызун) лучше, чем одна. Она всё еще позволяет экономно расходовать ресурс и при этом статистически имеет больше шансов выявить потенциально негативное воздействие препарата на людей.
В качестве «негрызунов» часто используют собак. Однако иногда для работы могут не подойти ни крысы, ни собаки. Это может быть связано, например, с отсутствием у них в организме мишеней, на которые должно воздействовать исследуемое вещество, чтобы проявить свою терапевтическую активность. Такое нередко случается с изучением крупных молекул.
Исследования молекул больших и маленьких
Малые молекулы относятся к первому поколению лекарств и составляют порядка 90% всех лекарственных препаратов на рынке, включая многие безрецептурные препараты. Это низкомолекулярные вещества, которые быстро всасываются в кровоток и оказывают широкий спектр воздействий на организм, как положительных (запланированных), так и отрицательных. В ходе доКИ таких препаратов важно отслеживать зависимость доза—ответ для запланированных и незапланированных, нежелательных эффектов. Здесь прекрасно подходит двухвидовая модель, которая повышает вероятность выявления потенциальной токсичности вещества для человека.
Подробнее о том, как развивалась фармацевтическая отрасль, и какими бывают лекарства, читайте в статье «Три поколения лекарств» [7] на нашем сайте.
Иначе дела обстоят с биомолекулами, которых мы коснемся лишь очень кратко. Так называемые «биологические молекулы» (иначе biologicals — моноклональные антитела, факторы роста, ферменты, цитокины и др.), лежащие в основе биотерапевтических или биологических препаратов, имеют большой размер, а их воздействие часто очень специфичное — они прикрепляются и активируют только определенные рецепторы в организме. Из-за этого выбор животных моделей для них значительно затруднен и бывает ограничен, например, только нечеловекообразными приматами . Тогда двойная модель не используется. Для поиска подходящих видов животных для изучения больших молекул часто проводят предварительные испытания in vitro.
О том, какое место макаки и другие обезьяны занимают в современной науке, читайте в статье «Модельные организмы: приматы» [8].
Важное условие для исследования биотерапевтических лекарств заключается в том, что биологическая мишень молекулы должна быть одинаковой у человека и животной модели. Широко известный пример, когда игнорирование этого правила привело к провалу в разработке, связан с препаратом TGN1412 [9]. Это моноклональное антитело , связывающееся с рецепторами Т-клеток, которое предназначалось для лечения лейкоза и рассеянного склероза. До того, как ввести средство добровольцам, его испытывали на кроликах и макаках, причем вводимые макакам дозы в 500 раз превышали терапевтические для людей, но серьезных побочных эффектов выявлено не было. Проблемы начались в ходе клинических испытаний в 2006 году: уже после первого введения в первой фазе исследования у шести добровольцев развилась системная воспалительная реакция — «цитокиновый шторм». В одном из случаев это привело к развитию сепсиса и сухой гангрены. К счастью, все добровольцы выжили, но некоторым из них пришлось провести в больнице продолжительное время. Отличия рецепторов Т-клеток макак от человеческих оказались серьезной проблемой: разработку препарата прекратили.
Подробности о данном классе биофармацевтических средств мы сообщили ранее в материале «Терапевтические моноклональные антитела» [10].
Сколько животных нужно для предварительных и опорных доКИ
Предварительные исследования могут включать в себя определение различных параметров, но выборка и количество экспериментов на этом этапе обычно маленькие, потому что цель этих исследований — определить, стоит ли включать вещество в регуляторные доКИ, достаточно ли оно перспективно, и если да, то на каких видах животных целесообразно проводить эксперименты. Вследствие этого опорные тесты могут повторять уже проведенные предварительные исследования, но на большем количестве животных и более подробно. Для проведения одного исследования общетоксических свойств может понадобиться минимум 30 крыс (по пять грызунов каждого пола для каждой дозировки и контрольная группа) и несколько более крупных животных, например, собак [11]. Тогда как для выполнения полной батареи тестов исследований репродуктивной и онтогенетической токсичности на крысах в трех поколениях, в соответствии с действующими стандартами, потребуется участие около 3000 особей.
Имеет ли значение, насколько разными будут животные внутри группы? Спойлер: да!
Как получают и разводят лабораторных животных для исследований
Перед тем как решить, использовать ли однородных или разнородных животных, ученые взвешивают все плюсы и минусы каждого подхода. Если животные внутри группы похожи друг на друга, результаты экспериментов будут более согласованными, их вариабельность будет меньше. Но в то же время эти результаты нельзя будет распространять на другие группы. В целом для регуляторных исследований выбирают более разнородные группы животных — иногда это даже обязательное требование [12].
По степени однородности линии лабораторных животных делят на [13]:
- инбредные, или линейные (максимальная однородность, такие животные получены скрещиванием близкородственных особей — минимум 20 скрещиваний между братьями и сестрами);
- гибридные (получены скрещиванием инбредных линий, что позволяет выводить более здоровых животных);
- аутбредные (максимальная генетическая разнородность, как минимум четыре поколения животных разводят в закрытых популяциях).
Ранее мы также упоминали создание специальных трансгенных и нокаутных линий животных с измененным геномом. В ДНК первых ученые встраивают чужеродные гены, а у вторых искусственно выключают нужные участки ДНК-цепи.
«Качество» животных внутри линий тщательно контролируется, при этом ученые смотрят на определенные генетические маркеры, по которым можно понять, к какой линии относится та или иная особь [14]. Все животные, которые оказываются «испорченными» в результате случайных скрещиваний, уничтожаются. Чтобы отличить животных разных групп, можно использовать также тесты тканевой совместимости [15].
Выбор животного: каждый раз сначала
Выбрать животных для доКИ не так просто, как кажется на первый взгляд. Нередко исследователи новых лекарств раз за разом оказываются в сложной ситуации, когда имеющихся данных не хватает для того, чтобы качественно спланировать эксперимент. Всё же часто ученым помогает опыт их коллег (табл. 3) — чем больше экспериментов проводится, тем больше знаний накапливается, а это значит, что с каждым годом совершается всё меньше ошибок.
| Животные | Заболевания, на лечение которых чаще всего направлены исследуемые в этой модели препараты |
|---|---|
| Рыбки данио рерио | Врожденные дефекты, генетические заболевания |
| Крысы | Острый панкреатит, геморрагический шок, регенерация печени, диабет, артериальный тромбоз, болезни Паркинсона и Альцгеймера |
| Кролики | Переломы костей, геморрагический шок, синдром раздраженного кишечника, остеопороз, гипертиреоз |
| Минипиги | Гиперхолестеринемия |
| Кошки | Кардиомиопатия, дистрофия роговицы, ВИЧ-1 |
| Собаки | Острый панкреатит, сепсис, сосудистое протезирование, стеноз аорты |
| Свиньи | Сепсис, сосудистое протезирование, геморрагический шок, регенерация печени |
| Бабуины | Инфаркт миокарда, гипертиреоз, ишемическая болезнь почек |
| Овцы | Сосудистое протезирование, переломы костей, эпилепсия, повреждения хрящей |
Этичность исследований на животных
Использование животных в доклинических исследованиях и научных разработках — сложный этический вопрос. Польза для человека имеет свою цену: страдания и гибель сотен тысяч животных.
Попыткой найти баланс между этикой и научным знанием при работе с животными является стратегия 3Rs — reduction, refinement and replacement of laboratory use of animals: уменьшение, усовершенствование и замена использования животных в лабораториях. Существует несколько подходов, которые в равной мере соответствуют принципам 3Rs.
- Во-первых, чрезвычайно важно правильно спланировать исследование. Хорошо сформулированные гипотеза и эксперименты, минимально достаточная с точки зрения статистики выборка, следование нормам GLP и документирование всех результатов позволяют существенно сократить количество животных, вовлеченных в доКИ. Исследование, выполненное с учетом всех необходимых требований (таких как ослепление, рандомизация, корректные первичные и вторичные точки для последующего анализа, адекватный выбор вида животных и их количества), скорее всего, даст исследователям необходимые данные и будет принято регулятором (если оно опорное). Плохо проведенное исследование придется переделывать — а значит, использовать лишних животных. Это же касается несоответствия требованиям GLP: непризнание результатов уже проведенных доКИ в другой стране при выводе препарата на международный рынок может означать необходимость их повторения. Старая поговорка «семь раз отмерь, один отрежь» не теряет актуальности.
- Во-вторых, ключевым вопросом является релевантность животной модели. Организм животных, как мы уже упоминали выше, отличается от человеческого, и многие системы работают иначе: кожа может иметь бóльшую или меньшую всасывающую способность, почти всегда отличается работа нервной и репродуктивной систем. Ряд ограничений объясняется изначально разными сроками жизни. Эксперименты, проведенные на нерелевантных моделях, приводят к результатам, которые нельзя экстраполировать на человека. В таком случае гибель животных в ходе доКИ может оказаться просто бесполезной — что может быть обиднее?
- В-третьих, немаловажную роль играет содержание животных, обезболивание и гуманные методы эвтаназии. Жизнь подопытного кролика может стать лучше: в ряде стран локальные регуляторы и комиссии по биоэтике следят за размером клеток, наличием укрытия и игрушек, соблюдением правильной температуры и влажности. Улучшение условий содержания животных уменьшает их стресс, боль и дискомфорт в течение жизни. Делается это не только из заботы о подопытных. Плохие условия и стресс могут привести к неадекватным результатам из-за гормонального дисбаланса. Особые требования предъявляются к более социальным животным, таким как собаки или нечеловекообразные обезьяны — их нельзя содержать в клетках, только в вольерах, причем достаточно большого размера. Немаловажную роль играет квалификация специалистов, непосредственно контактирующих с животными.
Какие организации отвечают за этичность исследований с животными? Единого международного регулятора, к сожалению, пока нет. Но как правило в каждой научно-исследовательской организации, работающей с животными, присутствует биоэтическая комиссия. Также каждая страна имеет свое законодательство в области биоэтики и организации, следящие за его выполнением. В США это Institutional Animal Care and Use Committees (IACUCs). В странах ЕС существуют аналогичные локальные организации, но на уровне всего Евросоюза часть вопросов регламентируется EMA и входящими в ее состав комиссиями, а основные принципы соответствия подходу 3Rs при работе с животными прописаны в Европейской Фармакопее и Директиве 2010/63/EU. В 2014 году в России была основана Ассоциация специалистов по работе с лабораторными животными Rus-LASA, которая стала членом Федерации европейских ассоциаций по науке о лабораторных животных (FELASA) и Международного совета по науке о лабораторных животных (ICLAS).
Задача этих организаций — обеспечение правовых и этических норм по содержанию лабораторных животных, контроль за экспериментами, процедурами и состоянием помещений (в соответствии с требованиями санитарно-эпидемиологического и ветеринарного законодательства), а также рассмотрение предложений, жалоб и заявлений, касающихся содержания и использования лабораторных животных в научных и учебных целях.
К сожалению, наличие комитетов и ассоциаций не гарантирует стопроцентную этичность доКИ. Например, конвенция Совета Европы и Директива Евросоюза 210/63/EU устанавливают определенные этические принципы в отношении вреда, причиняемого охраняемым животным в исследованиях. Они затрагивают шаги, которые следует предпринимать для уменьшения боли, стресса и других страданий животных, включая применение принципа 3Rs; профессиональную подготовку персонала и качество вивариев; качество дизайна эксперимента. Но эти документы только в общих словах ограничивают цели, для которых могут быть использованы животные, и не содержат специфичных требований к биоэтической экспертизе. Этическую экспертизу, как было отмечено выше, обычно проводят локальные комиссии по биоэтике, и их требования разнятся в зависимости от страны и института или компании. Самым сложным вопросом является оценка соотношения «риск—польза»: точно ли такое исследование нужно проводить на животных?
Биоэтические комиссии оценивают не только планируемые доКИ, но и фундаментальные исследования на животных в научных центрах. Ученые в норме не могут и не должны претендовать на финансовую поддержку или начинать работу без одобрения комиссией по биоэтике специальной заявки на исследования с животными. К сожалению, несмотря на некоторые успехи, говорить о существовании развитого правового поля в сфере доКИ на животных в России пока рано. Основная роль отечественных комитетов по биоэтике остается формальной и сводится к почти автоматической выдаче научным коллективам документов, необходимых для продолжения исследований, без реального анализа планируемых экспериментов, их целесообразности и организации.
Будущее отрасли: кто, если не мышь?
Перед тем, как проводить доКИ на животных, вещества исследуют in vitro, то есть вне организма — как правило, сначала на изолированных рецепторах, а потом на клеточных культурах, которые могут быть как человеческими, так и животными. Это позволяет оценить связывание веществ с молекулами-мишенями на клетках и токсичность в простых условиях. Более того, на начальных этапах новые молекулы-кандидаты можно исследовать вообще вне живого, используя физические и химические тесты (например, для определения растворимости и липофильности) или специальные компьютерные программы. Последний подход называется in silico и служит для оценки потенциальной эффективности и токсичности веществ.
Для многих парадоксальной может показаться идея, что свойства реальных молекул реально исследовать в электронных «мозгах» компьютеров. Как это делается, предлагаем прочесть в статье «Биомолекулы»: «12 методов в картинках: “сухая” биология» [17].
Но можно ли совсем отказаться от животных, перейдя к исследованиям in vitro и in silico? К сожалению, пока нет. В случае оригинальных разработок получить разрешения регуляторов [18] и перейти к исследованиям с участием добровольцев без испытаний на лабораторных животных (in vivo) пока что практически невозможно. Животные не потребуются только в ряде случаев и лишь для некоторых тестов, например, если препарат был получен из плазмы крови или на основе клеток человека [19], а также если речь идет о дженериках или биоаналогах уже существующих средств, поскольку их действующие вещества уже были изучены ранее.
Большинство людей согласятся, что существующее положение вещей оправданно. Мы уже обсуждали, как важно выбрать правильную модель в доКИ, чтобы КИ были безопасными. Тем не менее тренд, предполагающий переход к более этичным методам исследования, продолжает набирать обороты, и альтернативные подходы к изучению свойств новых препаратов становятся всё более эффективными и просто реализуемыми. В следующих статьях спецпроекта мы еще коснемся новейших методик подробно, здесь же остановимся на них кратко.
In vitro: клетки в пробирке
In vitro-скрининг, где в качестве субъекта исследования выступает клеточная культура, выращенная в лаборатории, дает первичную информацию о возможных эффектах препарата на биологическую систему. Самый главный плюс такого испытания — возможность избежать трудностей, неразрывно связанных с использованием такой сложной системы, как живой организм.
Наиболее часто используемая модель in vitro — это монослой иммортализованной, или бессмертной, клеточной культуры (2D-культура). На нем удается получать воспроизводимые результаты, так как клетки в культуре унифицированы и способны делиться без ограничения и изменения своих свойств. Благодаря этому данные, полученные таким способом в разное время и даже в разных лабораториях, можно довольно легко сравнивать между собой. Однако они могут мало говорить о том, как препарат поведет себя в реальных клетках и тем более в организме животного или человека. Для получения более точной информации можно пользоваться первичными культурами клеток человека, т.е. взятых у здорового донора или пациента, однако с такими клетками сложнее работать.
- Во-первых, они не унифицированные: между клетками от разных доноров различий может быть столько же, сколько между самими донорами, и реагировать на одно и то же вещество они могут по-разному.
- Во-вторых, они имеют ограниченный срок жизни и пассажей, то есть количество экспериментов, которые можно провести с клетками одного донора, ограничено.
- В-третьих, культивировать их сложнее — для этого, как правило, требуются более дорогие питательные среды и высококвалифицированные специалисты.
- В-четвертых, для того чтобы использовать первичные клетки как модель, необходимо провести обширную работу по их характеристике [20].
Примером 2D-культуры могут служить иммортализованные клетки колоректального рака человека Caco-2 . Они используются для изучения абсорбции в кишечнике с конца 70-х годов прошлого века, моделируя кишечный барьер. В культуре они способны самопроизвольно дифференцироваться в энтероциты с плотными контактами и микроворсинками и синтезировать ферменты, переносящие лекарственные вещества (рис. 7) [21].
В статье «Модельные организмы: бонус — раковые клетки» [22] можно подробнее узнать, для чего и как они используются в научных целях. А в публикации «12 методов в картинках: клеточные технологии» [23] рассказывается, как именно исследователи работают с клетками.
Рисунок 7. Иммортализованная клеточная культура Caco-2, образующая микроворсинки и плотные контакты. Клетки выделены из аденокарциномы толстой кишки человека.
Еще более приближенную к реальности картину дают трехмерные, или 3D-клеточные модели (рис. 8). Они лучше воспроизводят условия жизни клеток в организме — у них есть микроокружение из клеток-соседей и межклеточного матрикса. Это позволяет моделировать взаимодействие клеток разных типов, что важно, так как клетки в естественной среде обитания постоянно «переговариваются» между собой с помощью специальных сигнальных веществ, что невозможно в 2D-культуре.
Рисунок 8а. In vitro 3D-клеточная модель, позволяющая оценить воздействие аэрозолей, содержащих никотин, на эпителиальные клетки человека. Подробнее об устройстве модели можно узнать из видео. Экспериментальный дизайн экспонирования человеческих органотипических культур клеток в системе воздействия аэрозолей in vitro (Vitrocell® 24/48).
Рисунок 8б. In vitro 3D-клеточная модель, позволяющая оценить воздействие аэрозолей, содержащих никотин, на эпителиальные клетки человека. Бронхиальные (а) и назальные (б) культуры клеток на границе воздух—жидкость в индивидуальных ячейках, к которым подводится тестируемый аэрозоль. Модели in vitro, содержащие ресничные клетки, показаны в апикальном слое окрашенных гематоксилином и эозином клеток. Модели претерпели совместное культивирование с фибробластами, необходимыми для роста и дифференциации эпителиальных клеток (показаны стрелочками).
Также 3D-модель обеспечивает наличие градиента концентрации вводимого вещества, то есть клетки снаружи получают больше лекарства, чем внутри культуры, как это и происходит внутри живого организма, особенно в твердых опухолях (рис. 9). Здесь виден эффект барьерных клеток, ведь в организме есть эпителиальная ткань, которая может значительно влиять на взаимодействие исследуемого вещества с клетками-мишенями. Благодаря всем этим факторам 3D-модель гораздо более информативна, чем 2D.
Рисунок 9. Распределение исследуемого вещества в 2D- и 3D-клеточных культурах. 3D-культура позволяет получить градиент распределения.
Конечно, у 3D-версии есть и минусы. Она более дорога, сложна и объемна, чем стандартный монослой клеток. Чтобы поддерживать такую культуру, нужно отдельно следить за распределением в ней питательных веществ и кислорода. Из-за сложности ее непросто адаптировать к высокопроизводительному скринингу, то есть процесс тестирования становится дороже, хотя компании активно работают над решением этого вопроса. Наконец, монослой — привычная для многих модель, которая хорошо описана в литературе, поэтому многие используют его по привычке.
Еще более продвинутой моделью являются «органы на чипе» (organs-on-a-chip), им будет посвящена отдельная статья спецпроекта. Здесь скажем лишь, что это устройство для выращивания клеточных культур, которое воспроизводит механические и физиологические условия в органах (рис. 10) или даже системах органов.
Рисунок 10. Трехмерная система «Кишечник на чипе», созданная совместно учеными Mimetas и PMI Science и предназначенная для исследования воспалительных заболеваний кишечника. Система состоит из эпителиальных и иммунокомпетентных клеток. Уже на четвёртый день культивирования команде удалось получить трубчатую структуру, состоящую из клеток Caco-2 и HT29-MTX-E12.
По своей сути это искусственные органы, ведь такая модель учитывает взаимодействие разных тканей, химический градиент веществ и механическую реакцию клеток на них (например, сужение сосудов). Предполагается, что в будущем этот подход позволит обойти тестирование на животных, и прецеденты уже есть: недавно ученым из Израиля удалось разработать новое лекарство от рака и провести доКИ без участия животных. При разработке ученые использовали чип, симулирующий человеческое тело. Этот чип содержит ткани человека и микроскопические сенсоры, чтобы отслеживать ответ человеческого организма — почек, печени и сердца — на препарат. Сейчас потенциальное лекарственное средство находится на стадии получения одобрения для КИ. Хотя этой идее уже 30 лет, израильская команда — первая, кто успешно заменил тестирование на животных исследованиями в искусственном органе. А сейчас настало время поговорить о «сухих» исследованиях — in silico.
In silico: организм внутри компьютера
В исследованиях in silico, чтобы оценить действие нового вещества на живые системы, используют компьютерные модели. Это позволяет сократить объем исследований in vitro и in vivo и удешевить весь процесс разработки.
С помощью подхода in silico можно подобрать молекулу под интересующий ученых сайт связывания (фрагмент биомолекулы-мишени, с которым должно связываться вводимое в организм вещество) и тестировать на животных только отобранных таким образом кандидатов. Этот подход называют драг-дизайном de novo [24].
«Биомолекула» не раз писала о применении подхода in silico к драг-дизайну. Для примера предлагаем обратиться к статьям «Драг-дизайн: как в современном мире создаются новые лекарства» [25], «Виртуальные тропы реальных лекарств» [26] и «12 методов в картинках: “сухая” биология» [17].
Существуют также методы, с помощью которых можно предсказать активность вещества и его механизм действия на основании химической структуры. Примером здесь выступает QSAR — Quantitative structure–activity relationship, количественная оценка зависимости «структура—активность». Этот метод представляет собой работу с математическими соотношениями, связывающими химические структуры и биологическую активность с использованием физико-химических свойств веществ. При этом во время расчетов свойство рассматривается как независимая, а биологическое действие — как зависимая переменная. Метод, к примеру, рекомендован для скрининговой оценки генотоксичности реактивных примесей, которые могут содержаться в лекарственных препаратах.
Компьютерное моделирование, сочетающее в себе методы классической токсикологии и системной биологии, — Quantitative Systems Pharmacology (QSP) — может, в свою очередь, предсказать механизм действия вещества, используя имеющиеся данные по препаратам, вышедшим на рынок и не прошедшим отбор. Также оно может предоставить полезные данные о дозах и режиме дозирования схожих средств, таким образом сужая диапазон исследований и уменьшая размер эксперимента, экономя деньги и время на дорогостоящих I и II фазах КИ. Подход системной токсикологии, используемый специалистами PMI Science для исследования воздействия аэрозолей на организм человека, включает в том числе компьютерное моделирование и методы вычислительной биологии, что позволяет получать релевантные результаты, работая с моделями биологических систем, имитирующих множество процессов, происходящих в живых тканях.
Математические модели фармакокинетики, основанной на физиологии (Physiologically based pharmacokinetic modeling, PBPK), широко используют для предсказания фармакокинетических свойств различных веществ. В этих моделях сотни дифференциальных уравнений описывают физиологические процессы, участвующие в распределении веществ по тканям и органам. Около 70% компаний в фармацевтической отрасли используют этот подход в рамках доКИ. Такое распространение стало возможным благодаря коммерчески доступным платформам PBPK и рекомендациям к их использованию от регуляторных агентств.
Следует сказать, что почти все описанные здесь модели in silico используют уже накопленные данные о веществах и их токсичности, поэтому инициативы, связанные с выкладыванием данных в общий доступ, поощряются, и существует множество подобных баз данных [27]. Например, проект Etox агрегирует данные по токсикологии, чтобы более точно предсказывать токсичность молекул in vivo. Исследователи могут свободно пользоваться этими данными для своих моделей. Компанией PMI, в свою очередь, была запущена инициатива INTERVALS — открытая онлайн-платформа для совместной работы с большими данными, которая призвана облегчать планирование новых экспериментов, например, используя уже полученные ранее результаты для проверки формулируемых вновь гипотез.
«Филип Моррис Интернэшнл» (PMI, или ФМИ) входит в число тех компаний, которые применяют инновационные методы исследований, альтернативные тестам на животных. В своих испытаниях ученые ФМИ основываются на практиках, уже много лет применяющихся в фармацевтической отрасли, а также используют все перечисленные выше методы — компьютерные модели, клеточные культуры и «органы на чипе».
Не конец, а начало пути
Перед тем, как вещество преодолеет путь от создания в лаборатории до применения (bench-to-bedside), его тщательно исследуют. В частности, на этапе доКИ ученым предстоит выяснить, стоит ли препарату вообще попадать в живой организм и какие побочные эффекты он может вызвать. Долгое время практически единственным способом получить такую информацию были животные — в наше время за год для исследований может быть использовано 9,39 млн лабораторных животных в одном лишь Евросоюзе. При этом большинство молекул-кандидатов вовсе не доходят до выпуска на рынок, ведь на любом этапе возможен провал и сворачивание проекта.
В ответ на существующие вызовы ученые изобретают всё больше новых способов подтвердить безопасность и эффективность новых веществ — in silico с помощью компьютерных моделей и in vitro на 3D-клеточных культурах и «органах на чипах». Возможно, мы еще застанем то время, когда для поиска лекарственного вещества не нужно будет причинять страдания ни одному животному, а все исследования будут проводиться на более близких к людям моделях.
- С миру по нитке: как соединились компоненты клинического исследования;
- In vivo — in vitro — in silico;
- Модельные организмы: грызуны;
- Грызун особого назначения;
- Botting J.H. 18. The history of thalidomide. In: Animals and medicine. Cambridge, UK: Open Book Publishers, 2015. P. 183–198;
- No role for thalidomide in leprosy. (2003). WHO;
- Три поколения лекарств;
- Модельные организмы: приматы;
- Кинякина Е. (2019). Токсичная молекула: как сколковский стартап потратил полмиллиарда на лекарство с плохой историей. Forbes;
- Терапевтические моноклональные антитела;
- Nuria Tubau-Juni, Raquel Hontecillas, Marion Ehrich, Andrew Leber, Victoria Zoccoli-Rodriguez, Josep Bassaganya-Riera. (2018). Preclinical Studies: Efficacy and Safety. Accelerated Path to Cures. 25-40;
- D.L. McCormick. (2017). Preclinical Evaluation of Carcinogenicity Using Standard-Bred and Genetically Engineered Rodent Models. A Comprehensive Guide to Toxicology in Nonclinical Drug Development. 273-292;
- Katoh H. International harmonization of laboratory animals. In: Microbial Status and Genetic Evaluation of Mice and Rats: Proceedings of the 1999 US/Japan Conference. Washington (DC): National Academies Press (US), 2000;
- Marjorie C. Strobel, Laura G. Reinholdt, Rachel D. Malcolm, Kathleen Pritchett-Corning. (2015). Genetic Monitoring of Laboratory Mice and Rats. Laboratory Animal Medicine. 1403-1416;
- Е.А. Gajdaj, D.S. Gajdaj. (2019). Genetic variety of laboratory mice and rats: history of occurrence, methods of obtaining and control. Lab Anim Sci Rus. 2;
- Miri Lee, Jee-Hyun Hwang, Kyung-Min Lim. (2017). Alternatives toIn VivoDraize Rabbit Eye and Skin Irritation Tests with a Focus on 3D Reconstructed Human Cornea-Like Epithelium and Epidermis Models. ToxicolRes. 33, 191-203;
- 12 методов в картинках: «сухая» биология;
- Gail A. Van Norman. (2020). Limitations of Animal Studies for Predicting Toxicity in Clinical Trials. JACC: Basic to Translational Science. 5, 387-397;
- Expedited programs for regenerative medicine therapies for serious conditions. (2019). FDA;
- Feiling Feng, Chuncui Huang, Mingjia Xiao, Huizhen Wang, Qingxiang Gao, et. al.. (2020). Establishment and characterization of patient-derived primary cell lines as preclinical models for gallbladder carcinoma. Transl Cancer Res TCR. 9, 1698-1710;
- Tor Lea. (2015). Caco-2 Cell Line. The Impact of Food Bioactives on Health. 103-111;
- Модельные организмы: бонус — раковые клетки;
- 12 методов в картинках: клеточные технологии;
- Thomas Fischer, Silvia Gazzola, Rainer Riedl. (2019). Approaching Target Selectivity by De Novo Drug Design. Expert Opinion on Drug Discovery. 14, 791-803;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Виртуальные тропы реальных лекарств;
- Gopal Pawar, Judith C. Madden, David Ebbrell, James W. Firman, Mark T. D. Cronin. (2019). In Silico Toxicology Data Resources to Support Read-Across and (Q)SAR. Front. Pharmacol.. 10;
- Justyna Szostak, Ee Tsin Wong, Bjoern Titz, Tom Lee, Sin Kei Wong, et. al.. (2020). A 6-month systems toxicology inhalation study in ApoE−/− mice demonstrates reduced cardiovascular effects of E-vapor aerosols compared with cigarette smoke. American Journal of Physiology-Heart and Circulatory Physiology. 318, H604-H631;
- Pablo Meyer, Leonidas G Alexopoulos, Thomas Bonk, Andrea Califano, Carolyn R Cho, et. al.. (2011). Verification of systems biology research in the age of collaborative competition. Nat Biotechnol. 29, 811-815;
- Ruth Dempsey, Christopher R.E. Coggins, Ewald Roemer. (2011). Toxicological assessment of cigarette ingredients. Regulatory Toxicology and Pharmacology. 61, 119-128;
- Diana Kuehn, Shoaib Majeed, Emmanuel Guedj, Remi Dulize, Karine Baumer, et. al.. (2015). Impact Assessment of Repeated Exposure of Organotypic 3D Bronchial and Nasal Tissue Culture Models to Whole Cigarette Smoke. JoVE;
- Linda Gijzen, Diego Marescotti, Elisa Raineri, Arnaud Nicolas, Henriette L. Lanz, et. al.. (2020). An Intestine-on-a-Chip Model of Plug-and-Play Modularity to Study Inflammatory Processes. SLAS TECHNOLOGY: Translating Life Sciences Innovation. 247263032092499.
Выпуск на рынок нового фармацевтического препарата — процесс долгий, сложный и многоэтапный. Один из наиболее продолжительных этапов в создании лекарственного средства — это исследования его безопасности. Исследования могут длиться до 10 лет и требовать больших бюджетов на их проведение. Одной из первых стадий изучения безопасности являются доклинические исследования, которые позволяют определить общую токсичность полученного в результате научного поиска вещества.
Что это такое?
Это, прежде всего, меры безопасности, принимаемые при разработке медицинского препарата. Также во время проведения доклинического исследования изучается токсичность и фармакокинетика (механизм движения, распределения и выведения лекарства из организма) потенциального медицинского средства.
Часто определение доклинических исследований заменяют на тождественное «предклинические». Однако следует пояснить, что предклинические этапы разработки включают в себя не только начальные исследования, но и сам процесс поиска формулы действующего вещества и создания для него правильной лекарственной формы. То есть доклинические исследования являются исключительно важным, но все же не единственным аспектом предклинической работы.
Виды доклинических исследований
Процесс исследования общей токсичности проходит сразу по нескольким путям:
- Моделирование на компьютере. Это позволяет строить прогнозы на основании информации о химическом строении вещества и его свойствах, полученных в процессе поиска.
- Лабораторные исследования. Они включают в себя тестирование безопасности будущего препарата на клеточных культурах. Большинство людей представляют себе доклинические исследования лекарственных средств именно как тесты вне организма. С целью централизованного проведения различных проверок на токсичность фармацевтические компании и государство организуют специализированные производственные объекты. Именно центры доклинических исследований являются основными исследовательскими структурами, проводящими такого рода тесты. Но наиболее долгий путь — это, разумеется, тестирование на животных.
- Исследования токсичности на живых организмах, то есть на животных. Также используются растения, и в редких случаях препараты тестируются на людях.
Для создания сложных препаратов для лечения тяжелых заболеваний человека используются все возможности для доклинических и клинических исследований. Поэтому проверка безопасности вещества на начальной стадии делается по всем трем составляющим процесса исследований.
Какие аспекты безопасности исследуются
Производитель как нового препарата, так и дженерика стремится сделать свой продукт максимально успешным на рынке. Для этого необходимо, чтобы препарат оказывал лечебное воздействие, не нанося при этом ущерба здоровым организмам. Для получения более подробной информации о свойствах действующего вещества доклинические исследования проводятся по таким характеристикам, как:
- Общая токсичность. Эта характеристика определяет, насколько вреден препарат и какова его токсическая и летальная доза.
- Репродуктивная токсичность. Эта характеристика касается репродуктивной функции организма.
- Тератогенность. Это понятие означает уровень негативного влияния на плод во время беременности.
- Аллергенность. Способность вещества вызывать аллергию.
- Иммунотоксичность. Это свойство весьма важно, так как иммунитет трудно поддается восстановлению в случае появления нарушений.
- Фармакокинетика. Означает сам механизм движения вещества в организме.
- Фармакодинамика. Если предыдущий пункт определяет влияние организма на изменение вещества, то фармакодинамика говорит о том, как исследуемое вещество влияет на организм.
- Мутагенность — способность препарата вызывать мутации.
- Канцерогенность. Это достаточно сложный для изучения на этапе доклинических исследований аспект, так как образование злокачественных опухолей в организме до сих пор слабо изучено. Но вещества, введение которых в организм дало явно связанную с этим реакцию образования опухолей, не проходят этот этап и бракуются.
Проведение исследований
Сам процесс проведения доклинических исследований лекарственных средств в значительной мере зависит от того, что именно изучается. Так, например, разработка нового препарата является крайне долгим и дорогим процессом, так как новое лекарственное средство должно пройти все этапы проверки. Тогда как при разработке дженериков должны учитываться общая токсичность и фармакокинетика препарата. Разумеется, в особых случаях и для дженерика может потребоваться дополнительное исследование, однако, даже несмотря на это, производство аналоговых лекарств является намного менее затратным делом как по времени, так и финансово.
На доклинических исследованиях лаборатория также определяет дозировки препарата, которые являются терапевтическими (оказывают лечебный эффект), зависимость уровня эффекта от размера дозы, а также летальную и токсическую дозы исследуемого вещества. Все эти данные должны вноситься в подробный отчет, описывающий все стадии, данные и задачи проводимых тестов.
Кроме результатов в отчете должен быть отображен план, руководство и резюме о допуске или недопуске препарата к следующим стадиям разработки.
Задачи
Изучаемое вещество попадает на стадию доклинических исследований с уже определенным составом и приблизительной информацией о его возможных свойствах, полученной на основании химических свойств близких ему по строению веществ. Доклиника должна определить его свойства более подробно, для чего перед ней ставятся следующие задачи:
- Оценка действенности и эффективности вещества в предполагаемых для применения условиях.
- Процесс введения и доставки лекарственного средства к нужной мишени в организме. С этой целью изучают фармакокинетику.
- Безопасность препарата: токсичность, летальность, негативное воздействие на физиологические свойства организма.
- Насколько целесообразно выпускать препарат на рынок, является он лучше аналогов, уже имеющихся в медицинской практике, и насколько дорогим будет производство.
Последняя задача также важна, так как процесс создания даже дженерика является крайне затратным как по финансовым и временным вложениям, так и по человеческим усилиям.
Доклинические исследования лекарственных препаратов не требуют большого количества вещества для их проведения, однако в процессе изучения необходимо учитывать также будущую необходимость в масштабном массовом производстве. Также так как большинство крупных фармацевтических компаний работают по стандарту GMP (надлежащая производственная практика), то некоторая партия будущего лекарственного средства должна быть произведена с учетом требований этого стандарта.
Руководство по доклиническим исследованиям и управление их проведением
Так как процесс проведения подобных проектов очень сложен, то у руководителей должен быть объемный багаж опыта как в управленческой и медицинской сфере, так и в сфере организации работы команд высококлассных специалистов, занятых работой над разными направлениями общего проекта. Кроме того, доклинические исследования лекарственных средств требуют особой внимательности в работе, так как результаты напрямую влияют на здоровье потребителей.
С этой целью организации, осуществляющие ведение доклинических тестов, создают свои собственные инструкции и правила. Так, производитель лекарственных средств руководствуется, прежде всего, собственными документами под названием СОП (стандартные операционные процедуры), которые в деталях описывают процесс выполнения конкретного действия в рамках разработки.
Кроме того, существуют и общие стандарты, которые регламентируют весь процесс появления нового препарата, от поиска и разработки его формулы до производства и клинических исследований. Это стандарты GMP, инструкции Европейского агентства по лекарственным средствам и законы страны-производителя. Подобными стандартами пользуются все, кто проводит тесты безопасности: крупные фармгиганты, центры доклинических исследований и лаборатории, предоставляющие независимые экспертизы токсичности.
Также среди передовых по разработке новых лекарств стран был утвержден и единый документ, призванный объединить и стандартизировать форматы производства препаратов: «Общий технический документ». Он был разработан и утвержден специальной Международной конференцией по гармонизации технических требований к регистрации фармацевтических продуктов, предназначенных для применения человеком. В состав списка стран, подписавших документ, вошли Япония, США и страны Европы. Благодаря ему фармацевтическим компаниям больше не требуется подавать данные о результатах своих поисков в сфере разработки новых препаратов, в разные органы по контролю и надзору.
Таким образом, единого руководства по проведению доклинических исследований на данный момент не существует, однако идет работа в направлении объединения множества разрозненной нормативной документации в несколько общих документов.
Процесс
Сам процесс исследования токсичности проходит по схожему алгоритму, выработанному за годы проведения такого рода контроля. Доклинические исследования препарата всегда начинаются с составления подробного плана и дизайна, после чего лаборатория приступает к началу самих исследований. Специалисты создают компьютерные модели, на которых тестируют влияние исследуемого вещества на организм. Используя клеточные культуры, вещество проверяют на общую токсичность для клеток организма. При помощи исследований на животных определяют терапевтические дозировки, а также специфические виды токсичности, аллергенность и канцерогенность вещества.
Во время проведения контроля получаемые в процессе статистические данные собираются и внимательно изучаются, после чего лаборатория формирует итоговый отчет и передает его заказчику исследований.
Результаты
Результаты доклинических исследований предоставляются в виде отчета, который указывает, возможно ли допустить исследуемое вещество до следующего этапа тестирования — клинических исследований. Сразу после доклиники вещество должно пройти тестирование на организмах здоровых добровольцев, поэтому убедиться в том, что оно нетоксично, до того как его станут исследовать на людях, крайне важно.
Также результаты этих исследований попадают в статистическую базу данных компании, и информацией, полученной в результате исследований конкретного вещества, может быть дополнена библиотека данных сходных по химическому составу препаратов. Это поспособствует более точному поиску следующего кандидата в новые лекарственные вещества.
Допуск препарата до клинических испытаний
Переход препарата на стадию клинических испытаний (в частности, к испытаниям на здоровых людях — первому этапу клинических исследований) возможен только после доказанного отсутствия токсичности, канцерогенности и других негативных эффектов, проявляющихся в и вне организмов других видов.
Для перехода лекарственного средства на заключительную стадию исследований — исследования на пациентах с соответствующими терапевтической группе лекарства заболеваниями — должно пройти достаточно длительное время. Это время нужно, чтобы выяснить отложенные эффекты от приема вещества, которые не проявились сразу в доклинических испытаниях и на первом этапе клинических.
В среднем между появлением конкретного действующего вещества в результате разработки и выходом уже готового препарата под торговым названием на рынок может проходить до 10 лет. Однако и это еще не все: в течение следующих 10 лет компания активно собирает данные об эффективности и безопасности с обычных потребителей своего продукта. Это позволяет совершенствовать и развивать его, но в некоторых случаях наличие большого количества побочных эффектов может заставить компанию отказаться от выпуска препарата.
Стоимость проведения
Цена полного цикла исследований нового лекарственного препарата может исчисляться миллионами и миллиардами долларов. Поэтому большинство инновационных лекарственных препаратов разрабатывается крупными фармацевтическими холдингами, оборот которых крайне высок и позволяет вкладываться в исследование и производство новых препаратов.
Более мелкие производители фармацевтических товаров предпочитают выпускать на рынок более простые и дешевые в разработке и исследовании лекарства — дженерики. Это аналоги оригинальных лекарственных средств, в которых находится то же действующее вещество. Согласно законодательству большинства стран, такие препараты имеют право проходить сокращенную процедуру как клинических, так и доклинических исследований. Это намного удешевляет их производство.
Однако непосредственно после доклинических исследований дженерик должен пройти дополнительные тесты — тесты на биоэквивалентность. Такие тесты входят в число тех, которые проводят на заключительной стадии доклинических испытаний, а также во все этапы клинических. Большинство дженериков, производимых крупными фармацевтическими гигантами, имеют высокую биоэквивалентность, и ими можно заменять оригинальные препараты.