Туффаха С..А. Муин, Гичка Сергей, Гуски Ганс, Кристиансен Глен. Иммуногистохимия в диагностике опухолей. — Киев.: Книга-плюс, 2018. — 336 с.
Медицинская наука постоянно развивается, появляется новая информация и совершенствуются методы и подходы в диагностике и лечении заболеваний. Авторы и издатель гарантируют, что информация, представленная в этой книге, является точной и актуальной. Однако, авторы и издатель не несут ответственности за возможные ошибки или любые последствия, возникшие в результате применения информации, содержащейся в книге. Ни издатель, ни авторы не несут никакой ответственности за любые неблагоприятные последствия и/или убытки, причиненные людям или имуществу, вытекающие из данной публикации. Все протоколы и методы, изложенные в книге, предназначены только для исследовательских целей. Каждая лаборатория должна получить официальное разрешение на использование этих методов и протоколов с целью диагностики в соответствии с национальным законодательством и регионарными правилами.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Стяжкина С.Н.
1
Порываева Е.Л.
1
Климентов М.Н.
1
Леднева А.В.
1
1 ФГБОУ ВО «Ижевская государственная медицинская академия»
Иммуногистохимическое исследование используется для выявления локализации антигена в клетках и тканях. Albert Coons в 1941 г. впервые получил меченные флюоресцеином антитела и применил их в диагностических целях. В 1970 г. Ludwig Sternberger изобрёл пероксидаза-антипероксидазный метод [25], а в 1975 г. Georges Kцhler и Cйsar Milstein впервые добились слияния короткоживущих лимфоцитов, продуцирующих антитела, и постоянно растущих клеток плазмоцитомы, и полученные, теоретически «бессмертные», культивируемые клоны гибридных клеток позволили получать разнообразные моноклональные антитела в больших количествах. В 1990-х было обнаружено, что возможен поиск нереактивных антигенов в тканях, фиксированных формалином и заключённых в парафин, путём их нагрева в буферных растворах. Это расширило возможности метода и повысило его чувствительность. Целью данного исследования являлась оценка пролиферативной активности ткани щитовидной железы с помощью иммуногистохимических исследований. Определение степени пролиферации позволяет выбирать наиболее оптимальный объем оперативного лечения.
оперативное лечение
иммуногистохимия
щитовидная железа
1. Павлова Т.В. Ультраструктурные и иммуногистохимические особенности рака щитовидной железы / Т.В. Павлова, Е.А. Смирнова // Архив патологии. — 2008. — № 3. – С. 49-52.
2. Петров С.В. Руководство по иммуногистохимической диагностике опухолей человека / Петров С.В., Райхлин Н.Т. – Казань, 2000. – С. 456.
3. Петров С.В. Иммуногистохимическая диагностика опухолей щитовидной и паращитовидных желез, вилочковой железы // Руководство по иммуногистохимической диагностике опухолей человека / под ред. С.В. Петрова, Н.Т. Райхлина. – Казань : Татул, 2004. – С. 150–159.
4. Стяжкина С.Н., Грачева В.А., Ситников В.А. Клинико-морфологические параллели при узловых образованиях щитовидной железы // Морфологические ведомости : международный морфологический журнал. – М. – Берлин, 2009. — С. 217–217.
5. Стяжкина С.Н., Елгашина Л.Н., Габибова С.Ф., Максимова Т.А. Выявление рака щитовидной железы у больной с узловым зобом // Сборник трудных ситуаций в хирургии. – Ижевск, 2015. – С. 10.
Иммуногистохимия (ИГХ) — это метод выявления точной локализации того или иного клеточного или тканевого компонента (антигена) благодаря связыванию его с мечеными антителами. Albert Coons в 1941 г. впервые получил меченные флюоресцеином антитела и применил их в диагностических целях. В 1970 г. Ludwig Sternberger изобрёл пероксидаза-антипероксидазный метод, а в 1975 г. Georges Kцhler и Cйsar Milstein впервые добились слияния короткоживущих лимфоцитов, продуцирующих антитела, и постоянно растущих клеток плазмоцитомы, и полученные, теоретически «бессмертные», культивируемые клоны гибридных клеток позволили получать разнообразные моноклональные антитела в больших количествах. В 1990-х было обнаружено, что возможен поиск нереактивных антигенов в тканях, фиксированных формалином и заключённых в парафин, путём их нагрева в буферных растворах. Это расширило возможности метода и повысило его чувствительность [1].
В последнее десятилетие ИГХ-анализ обрёл широкое применение в каждодневной диагностической практике, перестал быть методом сугубо научных исследований.
На сегодняшний день существуют различные иммуногистохимические методы, однако в практической деятельности наиболее широко распространено непрямое иммуноокрашивание с использованием биотинавидинового комплекса. Непрямой метод предполагает использование двух различных антител.
Первичные антитела реагируют с антигенами ткани. Связанные с меткой вторичные антитела специфически взаимодействуют с первичными, которые для вторичных антител являются антигеном. Метод значительно чувствительнее прямого, т.к. с каждой молекулой первичных антител связывается несколько молекул вторичных антител, содержащих метку. Биотин (витамин H) — соединение, стойкое к действию высоких температур, к кислой и щелочной среде, хорошо растворяется в воде и спирте. Он является коферментом во многих реакциях присоединения (карбоксилирования). Биотин легко может вступать в стойкое соединение с различными белками, в том числе с ферментами и иммуноглобулинами. Авидин образует с биотином чрезвычайно стойкий комплекс. Разрушить такой комплекс можно только при температурной обработке, т.к. авидин разрушается при нагревании. Авидин имеет 4 места связывания, к которым можно присоединить биотин или белки. Таким образом, комплекс биотинавидин используется связующим мостиком между антителами и ферментами. Для этого готовится комплекс, состоящий из фермента, связанного с биотином, и авидина [2].
В настоящее время все большее распространение иммуногистохимическое исследование приобретает в исследовании щитовидной железы. Данное исследование позволяет оценить степень пролиферативной активности клеток щитовидной железы.
Цель исследования
Целью работы явилось исследование пролиферативной активности ткани щитовидной железы на основе экспрессии белков Ki67 (клон MIB-1), p53 (клон DO-7), Тиреоидного фактора транскрипции TTF-1 (клон 8G7G3/1), тиреоглобулина (клон DAK-Tg6) и их взаимосвязи с возможностью рецидива зоба после оперативного лечения. Это позволяет прогнозировать возможность либо отсутствие рецидива, помогает в выборе более щадящей операции.
Материалы и методы исследования
Иммуногистохимические реакции проводились на фиксированных 10%-ным фосфатным забуференным формалином, залитых в парафин срезах. Использовались моноклональные антитела к белкам Ki67 (клон MIB-1), p53 (клон DO-7), Тиреоидному фактору транскрипции TTF-1 (клон 8G7G3/1), тиреоглобулину (клон DAK-Tg6). Для восстановления антигенных детерминант применялся метод нагревания в цитратном буфере при 95 градусах Цельсия в течение 20 минут на водяной бане. Использовалась высокочувствительная полимерная система детекции, меченная пероксидазой хрена. В качестве хромогена использовался диаминобензидин (продукт реакции имеет различные оттенки коричневого цвета, от желтоватого до почти чёрного, в зависимости от концентрации антигена в исследуемой ткани). В целях визуализации морфологии ткани срезы докрашивались гематоксилином Майера в течение 30 секунд до слабой сине-фиолетовой окраски ядер клеток. В дальнейшем готовые препараты изучались при помощи микроскопа в проходящем свете. Диапазон увеличений от 50 до 1000.
В исследовании было проведено 30 иммуногистохимических исследований препаратов щитовидной железы, удаленных у пациентов хирургического отделения БУЗ МЗ «Первая республиканская клиническая больница МЗ УР» г. Ижевска с диффузными токсическими и диффузно-узловыми формами зоба в период с 01.02. 2015 г. по 01.02.2016 г.
Результаты исследования
При исследовании операционного материала производили его распределение по морфологическим признакам: диффузный зоб, узловой зоб, смешанный зоб (включая кистозный и кистозно-узловой).
Таблица 1
Распределение зоба по морфологическому строению
|
Диффузный зоб |
Узловой зоб |
Смешанный зоб |
Всего |
|
|
количество |
6 |
21 |
3 |
40 |
|
20% |
70% |
10% |
100% |
Таблица 2
Распределение факторов пролиферативной активности у пациентов при иммуногистохимическом исследовании
|
До 20% |
20-55% |
Более 55% |
|
|
Ki67 |
18 |
10 |
2 |
|
60% |
33% |
7% |
|
|
До 30% |
30-50% |
Более 50% |
|
|
p53 |
23 |
6 |
1 |
|
77% |
20% |
3% |
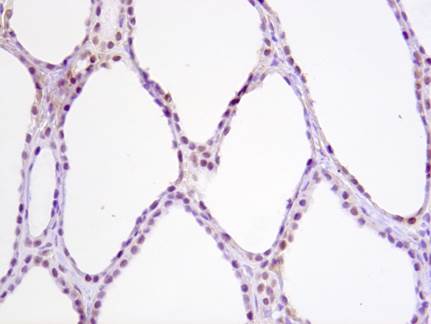
У пациентов с макрофолликулярными формами зоба отмечается низкий индекс пролиферации фолликулярного эпителия (до 1% позитивных клеток) — экспрессия Ki67. При микрофолликулярных формах зоба отмечается более высокий индекс пролиферации фолликулярного эпителия (до 5% позитивных клеток). Белок p53 является проапоптотическим белком, участвует в одном из основных сигнальных путей, регулирующих запрограммированную гибель клетки (апоптоз) – ядерный путь апоптоза. Он экспрессируется в ядрах большинства нормальных клеток, при этом определяемая степень экспрессии слабая (желтоватое или бледно-коричневое окрашивание ядер) – так называемый дикий тип гена. При мутации гена, кодирующего белок р53, функция белка нарушается, ядерный путь апоптоза блокируется, клетки становятся «бессмертными», что может впоследствии служить основой для развития опухоли. Мутантный ген также обладает свойством гиперэкспрессии – производится большое количество белка р53, не обладающего функциональной активностью. Продукт мутантного гена накапливается в ядрах клеток, что иммуногистохимически выявляется в виде тёмно-коричневого окрашивания ядер, более яркого, чем окраска ядер соседних клеток, несущих ген «дикого» типа (рисунок).
Экспрессия белка р53 в нормальной ткани щитовидной железы. Слабое желтовато-коричневое окрашивание ядер на сине-фиолетовом фоне. «Дикий тип» экспрессии гена р53
У пациентов с пролиферативными формами зоба наблюдалось более интенсивное коричневое окрашивание ядер, что указывает на гиперэкспрессию гена р53 в участках микрофолликулярной пролиферации и косвенно свидетельствует о возможной мутации гена р53. У 2 пациентов наблюдалась гиперэкспрессия мутантного гена р53 в участке микрофолликулярной пролиферации эпителия с морфологическими (ядерными) признаками тяжёлой дисплазии, что говорит о высоком потенциале опухолевой трансформации этой клеточной популяции [3].
Тиреоглобулин – белковый продукт фолликулярного эпителия щитовидной железы, выявляемый в цитоплазме фолликулярных клеток, в коллоиде фолликулов щитовидной железы. Позитивная реакция определяется по различным оттенкам коричневого окрашивания вышеназванных структур. У пациентов с макрофолликуляным зобом наблюдается умеренная интенсивность реакции в коллоиде фолликулов. У пациентов с тиреотоксическими формами зоба наблюдалась интенсивная реакция в коллоиде фолликулов и в цитоплазме фолликулярного эпителия, что свидетельствует о высокой функциональной активности ткани железы. У пациентов с микрофолликулярными формами зоба структуры в цитоплазме практически не содержат коллоида, что говорит о функциональной незрелости данного участка железистой ткани. Тиреоидный фактор транскрипции TTF-1 – белковый продукт, локализующийся в ядрах клеток фолликулярного эпителия щитовидной железы, С-клеток щитовидной железы, альвеолярного эпителия и нейроэндокринных клеток лёгкого. Этот белок является индуктором транскрипции (экспрессии) групп генов, ответственных за дифференцировку вышеназванных клеточных типов, имеющих общее происхождение в эмбриогенезе. Позитивная реакция определяется по коричневому окрашиванию ядер клеток.
При всех вариантах зоба наблюдалась интенсивная экспрессия TTF-1 в фолликулярном эпителии.
После проведенных иммуногистохимических исследований все случаи были распределены в 3 группы в соответствии со степенью выявленной пролиферации ткани щитовидной железы [4].
I степень пролиферации:
- индекс пролиферации Ki-67 составляет 15-20%;
- экспрессия протеина Р53 составляет 25-30%;
- пролиферация фолликулярного и парафолликулярного эпителия, занимающих 30-35% фолликулов.
II степень пролиферации:
- индекс пролиферации Ki-67 составил 50-55%;
- экспрессия протеина Р53 составляет 55-60%;
- пролиферация фолликулярного и парафолликулярного эпителия, занимающих 50% фолликулов.
III степень пролиферации:
- пролиферация фолликулярного и парафолликулярного эпителия, занимающих 70-75% фолликулов;
- индекс пролиферации Ki-67 составил 70%;
- экспрессия протеина Р53 75-80%.
Результаты исследования
После проведенных иммуногистохимических исследований все случаи были распределены в 3 группы в соответствии со степенью выявленной пролиферации ткани щитовидной железы. В 60% случаев была выявлена I степень пролиферации, что позволяет в данных случаях выполнять органосохраняющие операции. В 33% случаях была выявлена II степень пролиферации ткани щитовидной железы, что может говорить о высоком риске рецидивирования, в данном случае будут оправданы радикальные операции. В 7% случаев была выявлена III степень пролиферации, что подразумевает риск малигнизации, данные пациенты должны быть оперированы в условиях онкологического диспансера [5].
Выводы
Первая степень зобной пролиферации не является фактором риска рецидива зоба после оперативного удаления одной доли (гемиструмэктомии) или резекции щитовидной железы. Вторая степень зобной пролиферации служит фактором риска рецидива зоба. Третья степень пролиферации служит достоверным признаком рецидива зоба и возможной малигнизации узлов-регенератов. Эта стадия должна рассматриваться как предраковая и оцениваться как дисплазия III степени.
Заключение
При выявлении первой степени пролиферации зоба оправданными были органосохраняющие операции, гемитиреоидэктомия или резекция щитовидной железы, поскольку риск рецидивирования отсутствует. При выявлении второй степени пролиферации целесообразнее выполнять субтотальную тиреоидэктомию, так как существует риск рецидивирования. При выявлении третьей степени пролиферации должно проводиться радикальное оперативное лечение в условиях онкологического диспансера.
Библиографическая ссылка
Стяжкина С.Н., Порываева Е.Л., Климентов М.Н., Леднева А.В. ВОЗМОЖНОСТИ ИММУНОГИСТОХИМИЧЕСКОГО ИССЛЕДОВАНИЯ ДЛЯ ОЦЕНКИ ПРОЛИФЕРАТИВНОЙ АКТИВНОСТИ ТКАНИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. – 2017. – № 2.
;
URL: https://science-education.ru/ru/article/view?id=26185 (дата обращения: 21.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Опухоль под микроскопом: зачем нужны иммуногистохимические исследования?
Иммуногистохимические исследования сегодня стали рутиной любой диагностической службы. Более половины всех биоптатов и более 80% онкологических биоптатов подвергаются дополнительному иммуногистохимическому исследованию.
Что оно позволяет понять? Почему данные иммуногистохимии, проведенной в разных лабораториях, порой сильно отличаются? На эти и другие вопросы отвечает руководитель Центра патоморфологической диагностики и молекулярной генетики Первой онкологической больницы города Москвы Анна Борисова Семенова.
Иммуногистохимические исследования вошли в нашу жизнь в конце прошлого века, и сегодня мы уже не представляем медицину без них. Можно долго говорить о том, насколько важны иммуногистохимические исследования для онкологии, но пациентов больше всего интересуют практические вопросы: в каких случаях их назначают, как проводят, для чего они нужны и можно ли доверять их результатам? Разберемся по порядку.
Зачем нужна такая диагностика?
Есть различные направления, при которых проводятся иммуногистохимические исследования. Но, прежде всего, они необходимы для определения биологических свойств опухоли и чувствительности опухолевых клеток к таргетным препаратам.
Сегодня каждого онкологического пациента лечат индивидуально. Понимание биологических свойств опухоли и того, насколько она будет чувствительна к тому или иному виду лечения позволяют клиницистам, лечащим врачам наиболее точно подобрать каждому пациенту тип терапии. Поэтому после биопсии и получения гистологического заключения иногда требуется провести углубленное иммуногистохимическое исследование.
Как его проводят?
В образце ткани опухоли происходит реакция связывания антигена и антитела. Затем образец подкрашивается специальным красителем, позволяющим увидеть биологические особенности в световом микроскопе. Это очень сложный и очень чувствительный процесс. Для проведения иммуногистохимических исследований требуется специализированное оборудование, чувствительное к различным факторам окружающей среды, например, температуре помещения, которую всегда нужно поддерживать на определенном уровне. За каждым стеклом стоит целая армия сотрудников (лаборантов, медицинских лабораторных техников, врачей), которые трудятся в ежедневном режиме с утра до ночи и семь дней в неделю.
Почему так долго?
Иммуногистохимическое исследование – сложный и длительный процесс, требующий усилия и внимания лабораторных специалистов. В среднем выполнение такого анализа занимает до 10 рабочих дней, а иногда даже дольше. Мы получаем окрашенные препараты, которые рассматриваем в световом микроскопе, но периодически возникает необходимость провести дополнительные исследования, поскольку не всегда биологические свойства опухоли можно определить сразу же. От того, насколько точно будет выполнено такое исследование, зависит, насколько точно затем можно подобрать эффективные лекарства. Этот анализ становится мечом в руках врача-химиотерапевта, который назначит персонализированное лечение. Медицина должна быть доказательной, поэтому специалисты выполняют свою работу добросовестно и добиваются максимально достоверных и точных результатов.
При каких онкологических заболеваниях требуется проведение иммуногистохимического исследования?
Иммуногистохимическое исследование проводится при различных опухолевых процессах, практически при всех видах злокачественных новообразований. Чаще всего такое исследование выполняют при такой распространенной патологии, как рак молочной железы, который стоит на первом месте в структуре женских онкозаболеваний. Кроме того, иммногистохимический анализ делают почти всем пациентам с лимфопролиферативными заболеваниями, с саркомами, раком легкого и тд. После иммуногистохимического исследования материал может направляться на молекулярно-генетическое исследование.
Иммуногистохимическое исследование во многих случаях является золотым стандартом в диагностике тех или иных опухолей и занесено практически во все клинические рекомендации, которые опубликованы на сайте Министерства здравоохранения РФ. Можно самостоятельно ознакомиться с информацией, какие виды иммуногистохимических исследований положены при тех или иных нозологических формах и какие требования предъявляются к такой диагностике.
Как мы обходились раньше?
Пациенты часто спрашивают: а как же мы жили раньше, ведь раньше не было подобных исследований? И не нужно было ждать, и все вроде бы было нормально. Но нужно учитывать, что раньше и таких методов лечения, какие есть в арсенале врачей сегодня, не было. Таргетная терапия появилась в мире лишь в конце прошлого века, а иммунотерапия и вовсе всего несколько лет назад. Раньше не было таких подходов, какие предполагает сегодня персонализированная медицина. Главный из них – пациенту должно быть назначено не просто подходящее именно ему лекарство, но и подходящая именно ему дозировка этого лекарства. И именно та схема, которая бы не осложнила течение заболевания, а позволила бы справиться с ним максимально быстро, максимально эффективно и с минимальным количеством побочных действий.
Почему в разных клиниках – разные результаты исследования?
Иногда пациенты не доверяют результатам полученного исследования, сомневаются в своем диагнозе и хотят перепроверить анализ в другом месте. В этом нет ничего плохого, но тут нужно учитывать очень важный момент. Сравнивать имуногистохимические заключения можно лишь в том случае, если исследования проводились с одного образца биологической ткани, взятого во время биопсии! То есть, взятого в одной конкретной точки в один момент времени.
Например, у пациента взято две биопсии с разницей в два месяца. И по каждому проведено иммуногистохимическое исследование. Нередки ситуации, когда пациенты частично отдают материал на пересмотр в разные лаборатории. Это в корне неправильно! В процессе лечения могут меняться биологические свойства опухоли. И если вы хотите корректно сравнить исследования, проведенные в разных клиниках для устранения спорных моментов, необходимо приносить полностью весь материал, который у вас забирали, все результаты биопсий, которые у вас брали все блоки и все стекла, которые у вас на руках. Сравнивать результаты можно лишь с одного фрагмента ткани и с одного биоптата. В одной биопсии может быть до нескольких биоптатов (например, при раке предстательной железы – до 12, а при раке молочной железы – до 6). И если в одной больнице провели исследования с одного биоптата, а в другой – с другого, сравнивать такие биоптаты некорректно: опухоли поликлональны и гетерогенны. Например, в одной опухоли рака молочной железы может встречаться более 60 клонов разных видов клеток, и в одну биопсию может попасть один клон, а в другую – совершенно другой клон клеток, который имеет совершенно другие биологические свойства. В результате вы получите разные результаты. Но это не значит, что кто-то ошибся и исследование проведено неправильно – причина лишь в биологических свойствах опухоли, которые нужно учитывать. И врач-химиотерапевт, и хирург обязательно должны знать обо всех результатах исследований, которые проводились.
Иммуногистохимические исследования – интересный и перспективный вид исследований, поэтому молодые доктора с удовольствием выбирают различные направления в этой области для углубленной специализации. Например, у нас есть молодые доктора, которые специализируются в области рака молочной железы или доктора, которые наиболее интенсивно и усиленно исследуют рак легкого.
Важно понимать, что над каждым анализом трудятся ни один день и иногда ни одну неделю. Но мы всегда стоим на страже ваших интересов и всегда работаем с вашим материалом до тех пор, пока не получим адекватный, достоверный и доказательный результат. И очень надеемся, что наши труды помогут вам в борьбе с онкологическим заболеванием!
Иммуногистохимические исследования – важный этап современной морфологической диагностики, основанный на проведении реакции между антигенами опухоли и вводимыми антителами, видимой при окрашивании хромогеном. Эти исследования требуют осуществления нескольких подготовительных этапов перед непосредственно аналитическим. Качество их проведения существенно влияет на результат анализа.
Биопсия
Морфологические исследования требуют для своего осуществления образцы опухоли. Поэтому исследование начинается с проведения биопсии – забора кусочков опухоли у пациента. Эта процедура может проводиться как амбулаторно, так и в виде операции (возможно с удалением опухоли целиком). Образцы ткани сразу помещают в раствор забуференного 10%-ного формалина, каждый кусочек в свой отдельный контейнер с маркировкой. Контейнеры с образцами доставляют в патоморфологическую лабораторию, где начинается этап подготовки к анализу – фиксация и проводка материала.
Фиксация
Фиксация проводится для изменения структуры белков с целью предохранить их от вымывания, деградации или других 
Существует много различных типов фиксирующих растворов, однако наиболее часто используемый для фиксации реагент – 10% раствор нейтрального забуференного формалина. Он быстро проникает в ткань, а затем медленно ее фиксирует. Формалин особенно хорошо фиксирует маленькие молекулы, такие например как гормоны. Очень важно соблюдать оптимальное время фиксации, которое может варьировать от одной комбинации антиген-антитело к другой. В среднем, она занимает около 6-12 часов.
Проводка
На этапе проводки фиксированные образцы обрабатывают последовательно серией растворов спирта, ксилола, а затем 
Окрашивание и исследование
Полученные стекла окрашиваются сначала гематоксилином-эозином, а затем проводится окрашивание антителами выбранной врачом панели и проявление реакции хромогеном. Эти этапы могут проводиться вручную, либо быть автоматизированными, что повышает качество окрашивания.
Затем готовые стекла попадают к врачу-патоморфологу, который изучает их под микроскопом и ставит диагноз. При наличии сомнений в постановке диагноза могут проводиться дополнительные консультации готовых стекол с другим специалистом, называемые пересмотром гистологических стекол.