Почти на каждой коробке с БАДами производители пишут: «Сделано по стандартам GMP». Возьмем БАД «Сорбипол» — заменитель лекарства «Полисорб» — и прочтем на упаковке круглую плашку: GMP.
Но подождите, БАД — это не лекарство. Какое же отношение добавка имеет к GMP? Если даже предположим, что «Сорбипол» произведен по надлежащей практике, то как мы это проверим?
Стандарты GMP первоначально разрабатывали именно для производства лекарств, а производители добавок соблюдать их не обязаны. Однако компания, которая выпускает БАДы, имеет право добровольно пройти аудит и получить сертификат GMP.
Хотя это дорого и сложно, в конце концов вложения обычно окупаются, ведь покупатели больше доверяют добавкам, которые создавали под таким же строгим контролем, что и лекарства. Проверить подлинность сертификата GMP просто — достаточно заглянуть на сайт Минпромторга.
Как лечиться эффективно и недорого
Лучшие материалы о том, как проверять назначение, выбирать качественное лекарство из дюжины аналогов и возвращать деньги за лечение, — в вашей почте дважды в месяц по четвергам. Бесплатно
Что такое стандарты GMP и зачем они нужны
GMP — это аббревиатура, которая расшифровывается как Good Manufacturing Practice, или «надлежащая производственная практика». Фактически это набор правил, в соответствии с которыми фармкомпании обязаны производить лекарственные препараты.
Стандарты GMP охватывают все аспекты производства — от требований к сырью и чистоте помещений до обучения сотрудников и упаковки товара. Все это позволяет делать высококачественные лекарства, в которых будет ровно столько действующего вещества, сколько заявлено на упаковке, и не будет вредных примесей и загрязнителей.
Какие стандарты GMP существуют в мире. Впервые стандарт GMP ввели в США — это произошло в 1963 году. Эксперимент оказался таким удачным, что в 1968 году сотрудники ВОЗ взяли американские правила производства лекарств за основу собственных фармацевтических стандартов. В 1969 году ВОЗ рекомендовала стандарт GMP всем государствам мира.
Сегодня в большинстве стран производство лекарств контролируется на государственном уровне. Там действуют национальные правила надлежащей производственной практики, которых обязаны придерживаться все фармкомпании.
При этом существуют стандарты GMP, регулирующие производство лекарств на уровне межгосударственных союзов. Например, собственные правила производства лекарств есть в Евросоюзе, Ассоциации государств Юго-Восточной Азии и Евразийском экономическом союзе ЕАЭС, в который входит и Россия.
Если какая-то фармкомпания планирует продавать свои препараты на территории межгосударственного союза, ей нужно подтвердить, что она работает в соответствии с его требованиями.
Какие стандарты GMP есть в России. Национальные российские стандарты GMP описаны в ГОСТ Р 52249-2009. Это адаптированный для России перевод Руководства по GMP Евросоюза версии 2011—2012 года.
Но с 2022 года все российские фармкомпании должны работать по стандартам GMP ЕАЭС. Правила GMP Евразийского экономического союза очень похожи на национальный российский стандарт, поэтому перестраивать работу компаниям не придется.
Как фармкомпании подтверждают, что они работают по GMP
Все российские фармкомпании обязаны получить сертификат GMP — документ, который подтверждает, что они работают в соответствии с правилами надлежащей производственной практики. В России сертификацию контролирует Министерство промышленности и торговли, или Минпромторг.
Чтобы получить сертификат, представители фармкомпании подают в Минпромторг заявление и документы, в которых описано устройство завода и то, какие препараты на нем производят.
Затем специалисты Минпромторга направляют документы в Государственный институт лекарственных средств и надлежащих практик — ФГБУ «ГИЛС и НП». Сотрудники этого института назначают дату проверки и создают комиссию для инспекции.
В назначенный срок инспекторы приезжают на производство, проверяют документы, осматривают завод и отбирают образцы лекарств, которые затем передают на анализ.
Если инспекторы не обнаружат проблем с документами и недочетов на производстве, а лабораторные исследования покажут, что состав лекарства не отличается от заявленного в инструкции, фармкомпания получит сертификат GMP. Но если инспекция обнаружит проблемы, компания может сертификат и не получить.
И в том и в другом случае информация об этом попадет в базу данных Минпромторга. Там находятся сведения обо всех выданных и отозванных сертификатах, а также о тех, действие которых было приостановлено или прекращено.
Как на упаковке добавки может появиться упоминание стандарта GMP
Согласно российскому закону «О качестве и безопасности пищевых продуктов» биологически активные добавки, или БАДы, относятся к продуктам питания — наряду с минеральной водой, алкогольными напитками и жевательной резинкой. Это значит, что производители продуктов питания и добавок не обязаны сертифицировать производство по стандартам GMP.
Если компания производит исключительно добавки, она обязана получить только свидетельство о государственной регистрации. Этот документ подтверждает, что продукт безопасен с гигиенической и санитарной точки зрения.
Чтобы его получить, производитель должен обратиться в Федеральное управление Роспотребнадзора. Его сотрудники проверят образцы добавки и составят экспертное заключение о возможности ее применения. Если все в порядке, добавка получит свидетельство, которое попадет в Реестр свидетельств о государственной регистрации Роспотребнадзора.
Однако некоторые фармкомпании, которые уже прошли сертификацию GMP, производят на своих заводах не только лекарства, но и добавки. В этом случае они имеют право написать на упаковке добавки, что она сделана по стандартам GMP.
Но право работать по стандартам GMP и пройти добровольную сертификацию производства есть даже у тех компаний, которые делают только добавки. Им придется проделать большую работу: провести предварительный аудит, разработать программу внедрения стандарта и внутреннюю документацию предприятия, изменить практику и обучить персонал работать по новым правилам. После этого они могут подать заявление на сертификацию в Минпромторг и пройти эту процедуру на тех же условиях, что и фармкомпании. Если все получится, сведения об этом сертификате тоже попадут в базу данных Минпромторга.
Как проверить, что добавку действительно произвели в соответствии со стандартом GMP
У всех компаний, которые работают по стандарту GMP, должен быть соответствующий сертификат. Как правило, фармкомпании размещают скриншоты этих документов на своих сайтах. Например, компания «Фармакор-продакшн», которая производит БАД «Сорбипол», разместила сертификат GMP в разделе «О компании».
Проверить подлинность сертификата можно на сайте Минпромторга. Для этого нужно зайти на страницу «Перечни и реестры» и найти там раздел «Сведения из базы данных о сертификатах GMP».
Откроется окно, в котором будет закреплена эксель-таблица. Скачайте таблицу, зайдите на вкладку «Выдача сертификата» и найдите в ней номер интересующего вас сертификата. Если в колонке «Статус выданного сертификата» стоит пометка «Действующий», все в порядке.
Сертификат GMP компании «Фармакор-продакшн» действующий, поэтому добавку «Сорбипол» действительно произвели по надлежащей практике.
Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
- К каким производствам применима эта процедура?
- Стандарт GMP в международной практике
- Правила GMP в России
- Процедура получения сертификата в России
- Стоимость получения сертификата
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
- лекарственные препараты;
- медицинские изделия различного назначения, включая те из них, которые применяются в диагностических целях;
- продукты питания и ингредиенты для их производства;
- биологически активные добавки.
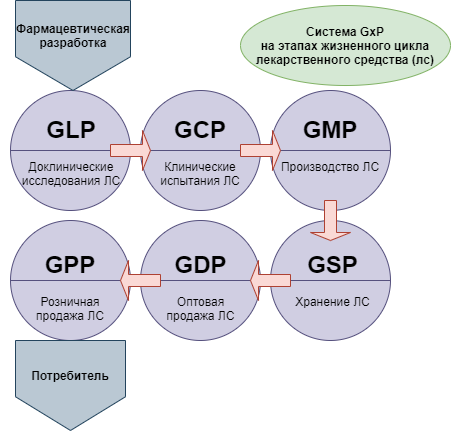
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
- GLP — Good Laboratory Practice (надлежащая лабораторная практика);
- GCP — Good Clinical Practice (надлежащая клиническая практика);
- GDP — Good Distributon Practice (надлежащая дистрибьюторская практика);
- GACP — Good Agricultural and Collection Practice (надлежащая практика культивирования и сбора лекарственных растений).
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
- национальный стандарт РФ ГОСТ Р 52249-2009, устанавливающий правила изготовления и контроля качества лекарственных препаратов;
- постановление Правительства от 5 июня 2008 года N 438 с рядом изменений, внесенных за последние годы, которое утверждает полномочия Министерства промышленности и торговли в этой области;
- постановление Правительства от 3 декабря 2015 года N 1314, устанавливающее порядок оценки соответствия производителей требованиям стандарта надлежащей практики;
- приказ Минпромторга от 14 июня 2013 года N 916, утверждающий правила применения надлежащей производственной практики в соответствии с актуальным стандартом;
- приказ Минпромторга от 26 мая 2016 года N 1714, определяющий административный регламент предоставления государственной услуги по выдаче документации, подтверждающей соответствие изготовителя установленным нормам надлежащей производственной практики;
- приказ Минпромторга России от 17.12.2015 N 4119, утверждающий правила ведения реестра сведений о том, какие лекарства имеют сертификат качества GMP в России.
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
- Решение Совета ЕЭК от 3 ноября 2016 года N 77, утверждающее правила надлежащей производственной практики в границах ЕАЭС;
- Приказ Минпромторга от 4 сентября 2020 года N 2945, которым введен административный регламент предоставления госуслуги по выдаче документации, подтверждающей соответствие производств установленным правилам.
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
- стабильное качество продукции, не зависящее от внешних факторов;
- повышение доверия потребителей, включая крупных оптовых покупателей, которые всегда отслеживают, какие производители имеют сертификат соответствия GMP на их продукцию;
- возможность вывода продукции на международные рынки, где ее может купить гораздо больше потребителей;
- возможность привлечения инвесторов для реализации проектов по расширению производства;
- получение преимуществ при участии в конкурсном отборе поставщиков, в том числе для государственных закупок.
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
- оценка производства на соответствие критериям безопасности, включая проведение его проверки в отношении вероятности попадания в продукт посторонних примесей и веществ;
- оценка производства на соблюдение технических требований к выпуску продукции, включая выполнение условий относительно влажности, температуры и других параметров в производственных помещениях;
- оценка качества, безопасности и действенности лекарственных средств, производимых на конкретном предприятии;
- оценка соответствия параметров производства и характеристик лекарственного средства нормативной документации, принятой в рамках процедуры GMP.
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
- копию документа, подтверждающего наличие у заявителя полномочий по взаимодействию с контролирующей организацией;
- копия основного досье используемого производственного объекта;
- информация о фактах несоответствия препарата действующим требованиям к качеству и безопасности и о фактах отзыва медикамента из оборота за период не менее 2 лет;
- полный список лекарств, который изготавливаются на данном производственном объекте;
- копия лицензии на производство лекарств;
- письмо о согласии на проведение инспекции производства.
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
|
Этап сертификационной процедуры |
Максимальная допустимая продолжительность |
|
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции |
10 рабочих дней |
|
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку |
3 рабочих дня |
|
Инспектирование и анализ лекарственного средства |
160 рабочих дней |
|
Принятие решения о выдаче заключения по результатам инспекционного отчета |
10 рабочих дней |
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
Лекарственные средства — продукция особой важности, поэтому к их безопасности требуется особый подход. Препараты низкого качества представляют собой не только опасность для здоровья, но и напрасную трату денег как для системы здравоохранения, так и для отдельных пациентов. Безопасность, эффективность и качество лекарственных препаратов обеспечивают стандарты GMP.
Что такое GMP
Надлежащая производственная практика (GMP — сокр. от англ. good manufacturing practice) — это система, которая обспечивает постоянный контроль фармацевтической продукции в соответствии со стандартами качества. Она предназначен для того, чтобы свести к минимуму риски, связанные с любым фармацевтическим производством, которые невозможно устранить, тестируя конечный продукт: неожиданное загрязнение готовых лекарств, неправильные этикетки на упаковках, недостаточное или слишком большое количество активного вещества, которые могут привести к неэффективному лечению или побочным эффектам.
GMP охватывает все аспекты производства: от исходных материалов, помещений и оборудования до обучения и личной гигиены персонала. Для каждого процесса, который может повлиять на качество лекарств, должны существовать прописанные инструкции и системы, обеспечивающие документальное подтверждение того, что правильные процедуры последовательно выполняются на каждом этапе производственного процесса — каждый раз, когда производится продукт.
Почему GMP — это важно
Как правило, покупатели не могут самостоятельно определить, безопасны ли лекарства и произведены ли они с надлежащим качеством. По умолчанию мы доверяем производителям в том, что лекарства соответствуют своим заявленным свойствам и не содержат вредных примесей. Лучшим подтверждением того, что компания выпускает качественные лекарства служит получение ей сертификата GMP.
Введение надлежащей производственной практики выгодно и самим производителям. Изготовление некачественной продукции приводит к значительным затратам. Вдобавок, в долгосрочной перспективе найти ошибки после того, как они были совершены, обходится дороже, чем предотвратить их изначально. Надлежащая производственная практика предназначена для предотвращения ошибок.
Кроме этого, речь идет о репутации производителей. Некачественные лекарства не только вредят пациентам, но и создают негативный имидж фармацевтических компаний. Производителям приходится отзывать серии проблемных лекарств с рынка, выделять команды для анализа ситуаций и потенциальных возмещений пациентам. Следование стандартам GMP позволяет значительно снизить риск таких ситуаций.
Основные требования GMP
- Производство и распространение лекарств должны минимизировать любой риск для их качества;
- Производственные помещения должны содержаться в чистоте, включая лаборатории и складские помещения;
- Производственные помещения, принципы работы и ее условия должны контролироваться, чтобы предотвратить загрязнение лекарственных препаратов;
- Все процессы должны быть четко определены и контролироваться для обеспечения согласованности. Любые изменения в производстве оцениваются с точки зрения безопасности пациента и качества продукта, а любые утвержденные изменения, которые могут повлиять на качество лекарственного средства, при необходимости аттестуются;
- Инструкции должны быть написаны четким и недвусмысленным языком;
- Во время производства и контроля качества должны быть сделаны записи, демонстрирующие, что все необходимые шаги были выполнены в соответствии с определением и что указанные характеристики качества продукции были соблюдены;
- Любые отклонения исследуются и документируются;
- Записи о производстве хранятся в понятном и доступном формате, позволяющем проследить всю историю партии лекарств;
- Есть рабочая система для отзыва любой партии из продажи или поставки;
- Жалобы на продаваемые продукты должны быть рассмотрены, причины дефектов качества расследованы, и должны быть приняты соответствующие меры в отношении дефектных лекарств и для предотвращения повторных нарушений.
Как регулируется GMP в мире
Стандарты GMP применяются к фармацевтическим производителям во всем мире, при этом они существуют сразу на нескольких уровнях регулирования: национальном и наднациональном, например, АТЭС (Азиатско-Тихоокеанском экономическом сотрудничестве), и других. У каждой страны, которая занимается производством лекарств, есть свои требования к фармацевтическим компаниям, но обычно они весьма похожи.
Большинство стран входит в Международный совет по гармонизации технических требований к лекарственным средствам для человека, основная задача которого состоит в выработке общих правил в производстве лекарств и унификации регуляторных актов. Поэтому нельзя сказать, что одни лекарства, если мы говорим о развитых странах, качественнее других. Практически все препараты в мире создаются и распространяются в идентичных условиях.
Как регулируется GMP в России
В России с 2014 года производство лекарственных средств на законодательном уровне обязано соответствовать стандартам GMP. Российский стандарт GMP был утвержден Приказом Министерства промышленности и торговли РФ от 14 июня 2013 г. № 916 “Об утверждении правил надлежащей производственной практики”. На сайте Минпромторга также можно проверить, какие производители имеют сертификаты GMP.
Поскольку GMP — обязательные правила, а не добровольные инструкции, то они подлежат проверке государством. В России проводить инспектирование иностранных производителей лекарственных средств для медицинского применения на соответствие стандартам уполномочено Федеральное бюджетное учреждение “Государственный институт лекарственных средств и надлежащих практик”.
При этом соответствовать российским стандартам должны компании, которые не имеют производства внутри страны, но поставляют в нее лекарства. Иными словами, отечественные эксперты проверяют любую площадку, включая иностранную, лекарства с которой доходят до полок аптек в России. Поэтому у большинства производителей есть сразу несколько сертификатов GMP от стран, где они продают лекарства.
Технически, производить лекарства в России без сертификата возможно, но только в двух случаях. В первом варианте речь идет о производстве без реализации, то есть готовые препараты никогда не дойдут до покупателя. Второй вариант предполагает выпуск лекарств на экспорт, что запрещает продавать их в России. В таком случае компании нужно иметь сертификат GMP той страны, куда планируется вести поставки. Но, учитывая схожесть регулирования надлежащей производственной практики во всем мире, в этом случае стандарты производства все равно придется поддерживать на должном уровне.
Нужно не забывать, что большинство производителей в России имеют еще и сертификат GMP ЕАЭС. С 2022 года регистрация по правилам Евразийского экономического союза стала обязательной для производителей, которые находятся на его территории. Правда, для производителей это не составляет проблем, так как требования в новом регулировании идентичны требованиям, предъявляемым Минпромторгом России, но формулировки дополнительно гармонизированы с требованиями GMP ЕАЭС.
Как получить сертификат GMP в России
Любой производитель, который хочет подтвердить свое соответствие надлежащей производственной практике в России, должен пройти ряд процедур. Начинается все с подачи заявления в Минпромторг России, специалисты которого проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
После этого информация передается в “Государственный институт лекарственных средств и надлежащих практик”, который, в случае отсутствия проблем с документацией, определяет дату инспекции. Согласно законодательству, она должна пройти в течение 160 дней после подачи заявления. В целом, вся процедура занимает в среднем 8 месяцев, а проходить ее требуется раз в 3 года.
Текст: Владимир Пучнин
.
Post Views:
3 075
В 2006 году утверждены национальные стандарты ГОСТ Р 52537 «Производство лекарственных средств. Система обеспечения качества. Общие требования» и ГОСТ Р 52550 «Производство лекарственных средств. Организационно-технологическая документация», в которых более полно раскрыты подходы к реализации требований GMP для подтверждения соответствия требованиям ГОСТ Р 52249-2004 «Правила производства и контроля качества лекарственных средств».
Значение этих документов состоит в том, что они существенно облегчили жизнь практикам, указав вектор движения. Не являясь догматичными, они дают возможность учесть специфику каждого предприятия.
Не буду останавливаться на теоретических аспектах внедрения систем качества, они изложены в соответствующей литературе.
Поговорим о практике. Возможно, теоретики GMP найдут здесь крамольные мысли. Но поскольку именно возможность применения на практике является критерием истины, позволю себе поделиться некоторым опытом.
И так, с чего начать, если Вы решили создать неформальную систему качества?
Анализ управляемости организации (схемы принятия решений и информационные потоки)
Как правило, решение той или иной задачи требует:
- во-первых, обсуждения и выработки оптимального для всех заинтересованных сторон алгоритма действий (или плана);
- во-вторых, координации действий подразделений различной подчиненности;
- в-третьих, контроля исполнения принятых решений.
Обычно организационной структуры и должностных инструкций бывает не достаточно, чтобы отразить способ принятия коллективных решений. Поэтому следует определить орган управления по каждому из основных направлений деятельности, ответственный за разработку и принятие тех или иных коллективных решений. Полномочия органов управления, режим работы, персональный состав, формы документов, в которых будут зафиксированы решения, и ответственные лица должны быть записаны в соответствующих инструкциях или положениях.
На нашем предприятии существует четыре основных органа управления:
- Экспертный совет. В его компетенции – инновации и стратегия развития.
- Технический совет. Отвечает за модернизации, техническое перевооружение, оборудование и инженерные сети.
- Совещание по качеству. Осуществляет надзор за качеством продукции, управляет изменениями, проводит анализ рисков.
- Совещание директората. Проводит всесторонний анализ и принимает решения о финансировании проектов предложенных первыми тремя органами управления.
Все обсуждаемые вопросы и принятые решения записываются в соответствующих протоколах. Решения являются обязательными для исполнения. Копии протоколов получают все исполнители. Каждое следующее совещание начинается с анализа выполнения решений предыдущего.
Определение исходного уровня
На мой взгляд, единственно возможный и эффективный путь – проведение «честной» самоинспекции, выявление всех существующих проблем. Официальное информирование руководства предприятия о реальном положении дел, с целью выработки стратегии действий исходя из реальных финансовых возможностей предприятия.
Создание неформальной команды
Внедрение системы качества, к сожалению, невозможно без рутинной, планомерной работы с документами и персоналом. Такая работа никогда не воспринимается «на ура!» и чаще всего вызывает скрытое и/или явное сопротивление.
Если руководство предприятия хочет преодолеть это сопротивление, оно должно возглавить создание команды единомышленников.
Если в Вашем коллективе подразделения кивают друг на друга в поисках виноватых, а не ищут совместно оптимальных путей решения проблемы – значит, у Вас нет такой команды.
Хорошо, если среди управленцев Вашего предприятия есть несколько неформальных лидеров, способных консолидировать персонал.
Если нет – ищите…, иначе все будет медленно и трудно.
Получение одобрения и финансовой поддержки со стороны руководства
Поскольку «люди бизнеса» редко имеют возможность глубоко вникнуть в суть «Правил GMP», для того чтобы получить «добро» от руководства на проведение тех или иных мероприятий, связанных с материальными затратами, необходимо иметь четкие и убедительные аргументы:
- почему это необходимо сделать, какова конечная цель;
- какие трудности могут возникнуть у предприятия, если этого не сделать;
- какие преимущества появятся у предприятия, если это сделать;
- сколько это будет стоить;
- почему это будет стоить именно столько, а не меньше;
- в какой период времени нужно осуществить эти изменения.
И если Вам удалось убедить руководство, обязательно внесите это решение в протокол и получите соответствующие подписи.
Избегайте ущемления интересов бизнеса
С некоторых пор мы живем при капитализме, поэтому понятно, что основной целью создания предприятия является получение прибыли. Внедрение системы качества не должно противоречить общей концепции развития предприятия и его финансовым возможностям на данном этапе. Запросив слишком много, можно не получить и малого. Если финансы, как обычно, «поют романсы», начинайте с тех изменений, которые требуют минимальных финансовых и максимальных организационных затрат: разработка документации, внутреннее обучение персонала, аттестация, анализ рисков, контроль изменений. В дальнейшем (при необходимости реализации высоко затратных изменений) выбор будет за руководством предприятия: уходить из бизнеса либо искать инвестиции для технического переоснащения. При этом Ваша совесть будет чиста: вы сделали все, что могли.
Как преодолевать сопротивление изменениям?
Внедрение любого элемента системы качества, как правило, предполагает изменение существующего порядка. Любое изменение существующего порядка в сторону его ужесточения встречает огромное сопротивление персонала. По этому поводу могу порекомендовать следующее:
Четко определить требования
Требования, обозначенные в документах должны быть однозначными, не рекомендую употреблять выражения: «при необходимости» – кто и как ее определит; «или….. или» – кто будет выбирать; «в процессе работы» – когда точно?
Организуйте и опишите процедуры так, чтобы их выполнение было реальным, даже если на настоящем этапе это не на 100% соответствует требованиям GMP. Выбирайте самый доступный для персонала способ достижения необходимого результата, не усложняйте задачу искусственно, руководствуйтесь принципом разумной целесообразности.
Обеспечить все условия для выполнения требований
Вы написали замечательную с Вашей точки зрения процедуру, она так здорово выглядит на бумаге, но для того чтобы ее выполнить не хватает необходимых материалов – дорого, необходимого количества персонала – кризис, и т.д. Так «истина» становиться «ложью». Вы думаете, в следующий раз персонал Вам поверит?
Начинать с себя
Руководство предприятия и подразделений должно быть примером для подражания. Если вы сами нарушаете правила, не ждите от подчиненных, что они будут поступать иначе.
Использовать приемы воспитания детей: «нет – это всегда нет», «кнут и пряник»; «обещал – сделай, не можешь – не обещай» и т.д.
Практически каждый взрослый ведет себя как ребенок, если дело касается освоения чего-то нового. Сначала нами движет любопытство – что это они еще придумали? Затем, если это новое требует от нас:
- приобретения дополнительных навыков,
- увеличения временных затрат,
- усилий для организации определенного порядка,
- системности и тщательности
мы начинаем оказывать сопротивление переменам, возмущаться и протестовать. Вспомните, не так ли ведут себя Ваши дети? Вы их ругаете? Вы их наказываете? Вы требуете исполнения Ваших указаний? Конечно, ведь вы их воспитываете, добиваетесь послушания.
Не злиться и не спешить
Необходимо понимать, что новый порядок должен «накопиться».
Поскольку процесс воспитания является длительным, непрерывным и не всегда сразу приводит к требуемому результату, следует проявлять терпение и обязательно быть последовательным, ведь вода камень точит.
Быть честным и принципиальным: предупреждать о карательных мерах и не бояться их применять
Как правило, бывает достаточно одного раза. Наказание (выговор) должны применяться всегда, когда Вы видите нарушение, и не зависеть от Вашего настроения или личности нарушителя.
По началу приходится трудно, но постепенно персонал привыкает к тому, что происходит постоянное движение, и становится более мобильным в реализации изменений.
Как говорит на семинарах АСИНКОМ Александр Евгеньевич Федотов: «Персонал – это 80 % успеха». Преодолению сопротивления персонала я бы отдала – 50% из этих 80%.
Еще один важный аспект при внедрении системы качества это – организация контроля исполнения. Без системного периодического контроля не возможно добиться исполнительной дисциплины. Так уж устроен человек. Чудес не бывает, и как бы ни хотелось, чтобы порядок воцарился раз и навсегда – увы, это невозможно. Здесь нам на помощь опять приходит самоинспекция, в программу которой, помимо всего прочего, мы всегда включаем детальную проверку выполнения 4-5 стандартных процедур, действующих в подразделении.
Регулярные проверки исполнения требований GMP на производстве отделом обеспечения качества и директором по качеству также помогают поддерживать необходимую дисциплину. Все замечания, выявленные при проверках, заносятся в журнал установленной формы, анализируются на производственных планерках и устраняются. Следующая проверка начинается с анализа устранения предыдущих замечаний.
Исполнительная дисциплина должна быть присуща не только рабочим и служащим, но и руководителям предприятия и его подразделений.
Известное правило «Что не записано, то не сделано» помогает организовывать этот процесс. Все принимаемые решения должны быть записаны (протоколы совещаний, заседаний), выполнение должно быть проконтролировано (каждое следующее совещание начинается с анализа выполнения решений предыдущего).
Контролироваться, также, должно исполнение утвержденных планов или других документов, определяющих порядок действий. Кто и когда производит контроль должно быть описано в соответствующих инструкциях или положениях. Информация о результатах контроля (выполнении или невыполнении решений) должна быть доступна для руководства предприятия с целью применения наказаний к нерадивым и поощрений к старательным.
Контроль изменений и анализ рисков – эти процедуры также помогают поддерживать систему качества в работоспособном состоянии и координировать деятельность подразделений предприятия.
На предприятии разработаны соответствующие стандарты по этим процедурам.
В стандарте все изменения классифицированы, исходя из вызывающих их причин. Стандарт также определяет порядок взаимодействия подразделений и документы, необходимые для реализации того или иного изменения.
Анализ рисков мы обычно проводим, если имеется какое-либо системно повторяющееся несоответствие, причины которого сразу установить не удается и требуются дополнительные исследования процесса. Определяем возможные риски (причины, по которым может возникать данное несоответствие), оцениваем в соответствии с методикой приведенной в стандарте, являются ли риски приемлемыми, существенными или неприемлемыми. Если риск приемлемый, исследования влияния данного риска на процесс не производится. Если риск существенный или неприемлемый, для исследования его влияния на процесс определяются контрольные точки, необходимый объем испытаний и критерии приемлемости. Далее, после проведения всех необходимых испытаний, на совещании по качеству вырабатываются меры, которые необходимо принять для предотвращения отрицательных результатов (снижение критичности риска), и проводится контроль их эффективности – достигнут желаемый результат или нет. Результаты всей проведенной работы отражаются в отчете по анализу рисков.
В заключение, хочу пожелать Вам успехов на нелегком пути создания действующей системы качества.