- Журналы
- Естественные науки и математика
- Здравоохранение и физическая культура
- Информатика и вычислительная техника
- История и исторические дисциплины
- Отечественная история
- Культура и искусство
- Образование и педагогика
- Политология и юриспруденция
- Психология
- Религиоведение
- Сельское, лесное и рыбное хозяйство
- Социология
- Технические науки
- Филология
- Философия
- Экономика и управление
- Языкознание
- Учебная литература
- Автоматика и управление
- Архитектура и строительство
- Безопасность жизнедеятельности, природообустройство и защита окружающей среды
- Библиотечно-информационные ресурсы
- Воспроизводство и переработка лесных ресурсов
- Геодезия и землеустройство
- Геология, разведка полезных ископаемых
- Гуманитарные науки
- Документоведение и архивоведение
- Журналистика
- Искусствоведение
- История
- Книжное дело
- Культурология
- Лингвистика
- Международные отношения
- Политология
- Психология
- Регионоведение
- Реклама
- Религиоведение
- Физическая культура и спорт
- Филология
- Философия
- Юриспруденция
- Естественные науки
- Биология
- Ботаника
- География и картография
- Геология
- Гидрометеорология
- Зоология
- Почвоведение
- Физико-математические науки
- Химия
- Экология и природопользование
- Здравоохранение
- Информатика и вычислительная техника
- Культура и искусство
- Библиотечно-информационные ресурсы
- Декоративно-прикладное искусство и народные промыслы
- Дизайн
- Изобразительное искусство (графика, живопись, скульптура)
- Искусствознание
- Киноискусство
- Музыкальное искусство
- Театральное искусство
- Металлургия, машиностроение и материалообработка
- Морская техника
- Образование и педагогика
- Естественно-научное образование
- Педагогика
- Русский язык и литература
- Социально-экономическое образование
- Технологическое образование
- Физико-математическое образование
- Филологическое образование
- Художественное образование
- Приборостроение и оптотехника
- Сельское, лесное и рыбное хозяйство
- Социальные науки
- Социальная работа
- Социология
- Сфера обслуживания
- Технология производства продовольственных продуктов и потребительских товаров
- Транспортные средства
- Физико-математические науки
- Математика
- Механика
- Физика
- Химия
- Химия и биотехнологии
- Экономика и управление
- Менеджмент
- Статистика
- Экономика
- Электронная техника, радиотехника и связь
- Энергетика, энергетическое машиностроение и электротехника
- Художественная литература
- Драматургия
- Литературные обзоры. Критика
- Мемуары, биографии, дневники
- Очерки, эссе
- Поэзия
- Прочие литературные жанры
- Романы, повести, рассказы, новеллы
- Сборники различных произведений
- Художественная литература для детей
- Эпистолярные произведения
- Юмор, сатира, пародия
- Ноты
- Авиационная и ракетно-космическая техника
- Архитектура
- Биологические науки
- Ветеринария и зоотехника
- Здравоохранение и медицинские науки
- Здравоохранение
- Лечебное дело
- Организация здравоохранения
- Сестринское дело
- Фармакология
- Фундаментальная медицина
- Информатика и вычислительная техника
- Информационная безопасность
- Искусствознание
- Изобразительное и прикладные виды искусства
- История и археология
- Археология
- Всеобщая история
- История Древнего мира
- История Нового времени
- История Средних веков
- Современная история
- Вспомогательные исторические дисциплины
- Геральдика
- Историческая география
- Источниковедение
- Палеография
- Хронология
- Отечественная история
- История России в древности (до середины XII в.)
- История России в средние века (середина XII — XVI вв.)
- История России новейшего времени (XX в.)
- История России нового времени (XVII — XIX вв.)
- Теория и методология истории
- Этнография
- Культурология и социокультурные проекты
- Математика и механика
- Машиностроение
- Международные отношения
- Музыкальное искусство
- Нанотехнологии и материалы
- Научно-популярная литература
- Науки о Земле
- Образование и педагогические науки
- История образования и педагогики
- Общая педагогика
- Педагогика и методика высшего образования
- Педагогика и методика дошкольного образования
- Педагогика и методика начального и среднего образования
- Педагогика и психология
- Социальная педагогика
- Специальная педагогика
- Школьная литература
- Оружие и системы вооружения
- Политические науки и регионоведение
- Прикладная геология, горное дело, нефтегазовое дело и геодезия
- Промышленная экология и биотехнологии
- Продукты питания
- Экология
- Психологические науки
- История и теория психологии
- Отдельные направления в психологии
- Прикладная психология
- Сельское, лесное и рыбное хозяйство
- Сервис и туризм
- Социология и социальная работа
- Общая социология
- Региональная социология
- Социальная антропология
- Социальная работа
- Средства массовой информации и информационно-библиотечное дело
- Сценические искусства и литературное творчество
- Техника и технологии кораблестроения и водного транспорта
- Техника и технологии наземного транспорта
- Техника и технологии строительства
- Технологии легкой промышленности
- Технологии материалов
- Техносферная безопасность и природообустройство
- Управление в технических системах
- Физика и астрономия
- Физико-технические науки и технологии
- Физическая культура и спорт
- Философия, этика и религиоведение
- Зарубежная философия
- История философии
- Современная философия
- Философия Древнего Мира
- Отдельные направления и философские школы
- Отечественная философия
- Политическая философия
- Религиоведение
- Религиозная философия
- Философия науки
- Эстетика
- Этика
- Фотоника, приборостроение, оптические и биотехнические системы и технологии
- Химия
- Химические технологии. Химические производства
- Экономика и управление
- Банковское дело
- Коммерция
- Менеджмент
- Антикризисное управление
- Государственное и муниципальное управление
- Менеджмент организации
- Управление персоналом
- Экономика и управление на предприятии
- Регионоведение
- Статистика
- Товароведение и экспертиза товаров
- Экономика
- Банковское дело
- Бухгалтерский учет, анализ и аудит
- Маркетинг
- Математические методы в экономике
- Мировая экономика
- Налоги и налогообложение
- Национальная экономика
- Страховое дело
- Таможенное дело
- Теория экономики
- Финансы и кредит
- Экономика труда
- Экономическая теория
- Электро и теплоэнергетика
- Электроника, радиотехника и системы связи
- Юриспруденция
- Ядерная энергетика и технологии
- Языкознание и литературоведение
- Издательское дело и редактирование
- История всемирной литературы
- История филологии
- Общее языкознание
- Перевод и межкультурная коммуникация
- Теория литературы
- Фольклор и культурная антропология
- Языки мира
- Азербайджанский язык
- Английский язык
- Арабский язык
- Армянский язык
- Белорусский язык
- Болгарский язык
- Венгерский язык
- Восточные языки
- Вьетнамский язык
- Греческий язык
- Грузинский язык
- Датский язык
- Древние и мертвые языки
- Иврит
- Испанский язык
- Итальянский язык
- Казахский язык
- Киргизский язык
- Китайский язык
- Корейский язык
- Латинский язык
- Латышский язык
- Литовский язык
- Молдавский язык
- Немецкий язык
- Нидерландский язык
- Норвежский язык
- Персидский язык
- Польский язык
- Португальский язык
- Румынский язык
- Русский язык
- Сербский и хорватский языки
- Таджикский язык
- Татарский язык
- Турецкий язык
- Туркменский язык
- Узбекский язык
- Украинский язык
- Финский язык
- Французский язык
- Хинди
- Чешский и словацкий языки
- Шведский язык
- Эстонский язык
- Японский язык
Страница недоступна для просмотра
РУКОВОДСТВО ПО КЛИНИЧЕСКОЙ ИММУНОЛОГИИ В РЕСПИРАТОРНОЙ МЕДИЦИНЕ Под редакцией М.П. Костинова, А.Г. Чучалина 1-е издание АТМО Москва 2016 УДК 616-097(072) ББК Р252.3 Р851 РЕЦЕНЗЕНТЫ Е. А. Курбатова – д.м.н., профессор, заведующая лабораторией терапевтических вакцин ФГБНУ «НИИВС им. И.И. Мечникова» Г.Л. Осипова – д.м.н., ведущий научный сотрудник отдела клинической физиологии и клинических исследований ФГБУ «НИИ пульмонологии» ФМБА России Р851 Руководство по клинической иммунологии в респираторной медицине / Под ред. М.П. Костинова, А.Г. Чучалина. 1-е изд. — М.: ООО «АТМО», 2016. — 128 с. ISBN 978-5-902123-70-5 В руководстве представлены современные аспекты вакцинопрофилактики респираторных инфекций при основных хронических заболеваниях легких у взрослых. Приведены обоснование значимости профилактики инфекционных заболеваний и тактические подходы при осуществлении иммунизации у пациентов с патологией дыхательной системы. Рассмотрены особенности течения основного заболевания, клинический и иммунологический эффекты вакцинации, а также схемы и сроки последующей иммунизации. Даны характеристика современных вакцинных препаратов, используемых для указанной категории пациентов, позиции Всемирной организации здравоохранения и Министерства здравоохранения РФ в отношении профилактики вакциноуправляемых инфекций у взрослых с хроническими заболеваниями. Предназначено для терапевтов, пульмонологов, фтизиатров, иммунологов-аллергологов, инфекционистов и врачей других специальностей. © Коллектив авторов, 2016 г. ISBN 978-5-902123-70-5 © ООО «АТМО», 2016 г. Ответственный редактор Г.В. Ходасевич Корректор Л.С. Бражникова ООО «АТМО», 127018 Москва, Печать офсетная ул. Сущевский Вал, 5, стр. 15, Печ. л. 8,0 тел./факс: (495) 730 63 51 Тираж 5500 экз. http://atm-press.ru Заказ 16-401 Отпечатано в ООО «Группа Подписано к печати 04.10.2016 г. Компаний Море» × 1 Формат 60 90 / http://группаморе.рф/ 16 КОЛЛЕКТИВ АВТОРОВ ФГБНУ «НИИВС им. И.И. Мечникова» М.П. Костинов – д.м.н., профессор, заведующий лабораторией вакцинопрофилактики и иммунотерапии аллергических заболеваний Н.К. Ахматова – д.м.н., заведующая лабораторией механизмов регуляции иммунитета Сотрудники лаборатории вакцинопрофилактики и иммунотерапии аллергических заболеваний: О.О. Магаршак – к.м.н., старший научный сотрудник В.Б. Полищук – к.м.н., старший научный сотрудник А.А. Рыжов – к.м.н., старший научный сотрудник Е.С. Коровкина – к.м.н., старший научный сотрудник Д.В. Пахомов – к.м.н., старший научный сотрудник И.В. Лукачев – к.м.н., старший научный сотрудник А.Д. Шмитько – к.м.н., научный сотрудник А.М. Поддубикова – младший научный сотрудник Д.А. Благовидов – аспирант Е.А. Хромова – аспирант С.В. Кажарова – аспирант ФГБУ «НИИ пульмонологии» ФМБА России А.Г. Чучалин – д.м.н., академик РАН, профессор, директор ФГБУ «НИИ пульмонологии» ФМБА России, заведующий кафедрой госпитальной терапии педиатрического факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Министерства здравоохранения РФ, главный внештатный терапевт-пульмонолог Министерства здравоохранения РФ Сотрудники: С.Н. Авдеев – д.м.н., профессор, руководитель клинического отдела А.С. Белевский – д.м.н., профессор, заведующий лабораторией легочной реабилитации и изучения состояния здоровья легочных больных, заведующий кафедрой пульмонологии ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Министерства здравоохранения РФ, главный пульмонолог Департамента здравоохранения города Москвы Т.Н. Биличенко – д.м.н., заведующая лабораторией клинической эпидемиологии Амелина – к.м.н., заведующая лабораторией муковисцидоза Н.А. Царева – к.м.н., заведующая лабораторией интенсивной терапии и дыхательной недостаточности И.В. Шубин – к.м.н., заведующий лабораторией клинической вакцинологии Чикина – к.м.н., старший научный сотрудник лаборатории функциональных и ультразвуковых методов исследования Н.А. Карчевская – научный сотрудник ФГБОУ ВО «Самарский государственный медицинский университет» Министерства здравоохранения РФ А.В. Жестков – д.м.н., профессор, заведующий кафедрой общей и клинической микробиологии, иммунологии и аллергологии, главный терапевт-пульмонолог Приволжского федерального округа, главный внештатный специалист Министерства здравоохранения Самарской области по аллергологии и иммунологии А.Д. Протасов – к.м.н., доцент кафедры общей и клинической микробиологии, иммунологии и аллергологии Ю.В. Тезиков – д.м.н., доцент, заведующий кафедрой акушерства и гинекологии № 1 ФГБОУ ВО «Казанский государственный медицинский университет» Министерства здравоохранения РФ А.А. Визель – д.м.н., профессор, заведующий кафедрой фтизиопульмонологии, главный пульмонолог Министерства здравоохранения Республики Татарстан И.Ю. Визель – к.м.н., ассистент кафедры фтизиопульмонологии ФГБОУ ВО «Южно-Уральский медицинский университет» Министерства здравоохранения РФ Г.Л. Игнатова – д.м.н., профессор, заведующая кафедрой терапии факультета послевузовского и дополнительного профессионального образования, главный пульмонолог города Челябинска В.Н. Антонов – к.м.н., доцент кафедры терапии факультета послевузовского и дополнительного профессионального образования Сотрудники других учреждений О.И. Симонова – д.м.н., профессор, заведующая отделением пульмонологии и аллергологии ФГАУ «Научный центр здоровья детей» Министерства здравоохранения РФ А.П. Черданцев – д.м.н., профессор кафедры педиатрии ФГБОУ ВО «Ульяновский государственный университет» М.В. Райчева – к.м.н., старший врач-терапевт, начальник бронхолегочного кабинета пульмонологического отделения ФКУ «Главный военный клинический госпиталь внутренних войск МВД России» Т.А. Костинова – врач функциональной диагностики ГКДЦ ГБУЗ «Московский городской научно-практический центр борьбы с туберкулезом» Департамента здравоохранения города Москвы А.М. Костинова – ординатор ФГБУ «ГНЦ Институт иммунологии» ФМБА России А.М. Костинов – студент 3-го курса ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова» А.В. Чебыкина – к.м.н., КОГБУЗ «Кировская областная клиническая больница» Т.Н. Елагина – аспирант Института профессионального образования ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения РФ М.А. Игнатьева – аспирант ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» СОДЕРЖАНИЕ Предисловие ……………………………………………………………………………………………… 8 (Чучалин А.Г.) I. Положение Всемирной организации здравоохранения, рекомендации Министерства здравоохранения и Экспертного совета Российской Федерации по вакцинации против пневмококковой инфекции и гриппа ……………………………………….. 9 (Чучалин А.Г.) II. Вакцины для профилактики респираторных инфекций ………………………14 (Магаршак О.О., Шмитько А. Д., Благовидов Д.А.) Вакцины против пневмококковой инфекции ……………………………………..14 Вакцины против вируса гриппа ………………………………………………………….17 Вакцины против гемофильной типа b инфекции …………………………………30 Вакцина против синегнойной инфекции ……………………………………………33 III. Вакцинация взрослых против пневмококковой инфекции и гриппа ……36 Вакцинация взрослых против пневмококковой инфекции – реальные возможности в улучшении индекса здоровья населения ………..36 (Костинов М.П., Чучалин А.Г., Елагина Т.Н., Поддубикова А.М.) Вакцинация пациентов, перенесших внебольничную пневмонию ………..42 (Коровкина Е.С., Костинов М.П., Кажарова С.В., Шубин И.В., Биличенко Т.Н., Райчева М.В.) …………………………………..44 Вакцинация против пневмококковой инфекции …………………………………………………….46 Вакцинация против вируса гриппа Вакцинация контактных лиц в окружении иммунокомпрометированных пациентов ……………………………………………48 (Костинова А.М., Костинов А.М.) IV. Подходы к вакцинации больных с бронхолегочной патологией ……………55 Вакцинация больных ХОБЛ ………………………………………………………………55 (Протасов А.Д., Жестков А.В., Костинов М.П., Игнатова Г.Л.) …………………………………..56 Вакцинация против пневмококковой инфекции …………………………………………………….59 Вакцинация против вируса гриппа Сочетанная вакцинация против вируса гриппа, ………………………………..61 пневмококковой и гемофильной типа b инфекций Вакцинация больных ХОБЛ с ишемической болезнью сердца ……………..67 (Игнатова Г.Л., Антонов В.Н.) …………………………………..68 Вакцинация против пневмококковой инфекции …………………………………………………….70 Вакцинация против вируса гриппа Вакцинация больных бронхиальной астмой ………………………………………..71 (Протасов А.Д., Жестков А.В., Костинов М.П., Чебыкина А.В., Костинова Т.А.) …………………………………..71 Вакцинация против пневмококковой инфекции …………………………………………………….73 Вакцинация против вируса гриппа Вакцинация кандидатов на трансплантацию и лиц после трансплантации легких ……………………………………………………75 (Полищук В.Б., Рыжов А.А., Костинов М.П., Карчевская Н.А., Лукачев И.В., Магаршак О.О.) …………………………………..76 Вакцинация против пневмококковой инфекции …………………………………………………….79 Вакцинация против вируса гриппа ………………………………81 Вакцинация против гемофильной типа b инфекции Вакцинация больных муковисцидозом ………………………………………………83 (Благовидов Д.А., Костинов М.П., Симонова О.И., Амелина Е.Л.) …………………………………..86 Вакцинация против пневмококковой инфекции …………………………………………………….88 Вакцинация против вируса гриппа ………………………………89 Вакцинация против гемофильной типа b инфекции …………………………………………91 Вакцинация против синегнойной инфекции Вакцинация больных саркоидозом …………………………………………………….94 (Визель А.А., Визель И.Ю.) …………………………………..95 Вакцинация против пневмококковой инфекции …………………………………………………….95 Вакцинация против вируса гриппа ………………………………………………………..96 Вакцинация против туберкулеза ………………………………………………..97 Вакцинация против других инфекций Вакцинация больных раком легкого …………………………………………………..99 (Коровкина Е.С., Костинов М.П., Чикина С.Ю.) …………………………………100 Вакцинация против пневмококковой инфекции …………………………………………………..100 Вакцинация против вируса гриппа Вакцинация больных интерстициальными заболеваниями легких ………102 (Авдеев С.Н.) …………………………………103 Вакцинация против пневмококковой инфекции …………………………………………………..104 Вакцинация против вируса гриппа Вакцинация больных идиопатической легочной артериальной гипертензией ……………………………………………….105 (Царева Н.А.) …………………………………106 Вакцинация против пневмококковой инфекции …………………………………………………..107 Вакцинация против вируса гриппа Вакцинация больных туберкулезом …………………………………………………..109 (Пахомов Д.В., Костинов М.П.) …………………………………110 Вакцинация против пневмококковой инфекции …………………………………………………..111 Вакцинация против вируса гриппа Вакцинация ВИЧ-инфицированных пациентов с бронхолегочной патологией …………………………………………………………..113 (Костинов М.П., Пахомов Д.В., Белевский А.С.) …………………………………114 Вакцинация против пневмококковой инфекции …………………………………………………..117 Вакцинация против вируса гриппа Вакцинация беременных с хроническими заболеваниями бронхолегочной системы …………………………………………………………………120 (Хромова Е.А., Костинов М.П., Черданцев А.П., Ахматова Н.К., Шмитько А.Д., Тезиков Ю.В., Игнатьева М.А.) …………………………………………………..124 Вакцинация против вируса гриппа …………………………………126 Вакцинация против пневмококковой инфекции ПРЕДИСЛОВИЕ В «Руководстве по клинической иммунологии в респираторной медицине» под редакцией профессора М.П. Костинова и академика РАН А.Г. Чучалина освещена предельно актуальная проблема респираторных заболеваний, таких как пневмония, обострение хронической обструктивной болезни легких, бронхиальной астмы и ряда других заболеваний, включая онкологические. В России накоплен большой опыт вакцинопрофилактики, направленной на снижение распространенности инфекционных респираторных заболеваний. Так, например, уникальный проект был реализован в Хабаровском крае и Амурской области в период наводнения в 2014 г. По научным прогнозам там предполагалось значительное повышение респираторной заболеваемости в осенне-зимний период, что было обосновано данными мониторинга эпидемиологической ситуации Роспотребнадзора РФ. Ситуацию удалось кардинально изменить, объединив усилия санитарно-эпидемиологической службы и учреждений здравоохранения регионов. В результате проведенных мероприятий по антигриппозной и антипневмококковой вакцинации в этих регионах была достигнута самая низкая заболеваемость респираторными инфекциями. Опыт, приобретенный в период неблагоприятной экологической обстановки, был использован в ряде регионов России – Красноярском крае, Республике Саха (Якутия) и др. «Руководство по клинической иммунологии в респираторной медицине» предназначено для широкой аудитории и представляет собой следующий этап в развитии первичной профилактики острых и обострения хронических легочных заболеваний. Авторы надеются, что расширение профессиональных знаний врачей в области клинической вакцинологии найдет свое отражение в повышении качества профилактики болезней органов дыхания. Будем признательны за ваш опыт и суждения по вакцинопрофилактике. ФГБУ «НИИ пульмонологии» ФМБА России, доктор медицинских наук, профессор, академик РАН А.Г. Чучалин 8 I ПОЛОЖЕНИЕ ВСЕМИРНОЙ ОРГАНИЗАЦИИ ЗДРАВООХРАНЕНИЯ, РЕКОМЕНДАЦИИ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И ЭКСПЕРТНОГО СОВЕТА РОССИЙСКОЙ ФЕДЕРАЦИИ ПО ВАКЦИНАЦИИ ПРОТИВ ПНЕВМОКОККОВОЙ ИНФЕКЦИИ И ГРИППА Позиция и рекомендации Всемирной организации здравоохранения (ВОЗ) по вакцинации против пневмококковой инфекции (ПИ): • вакцинация – единственный способ существенно повлиять на заболеваемость и смертность от ПИ; • вакцинацию против ПИ оптимально начинать с пневмококковой конъюгированной вакцины (ПКВ); • конъюгированная вакцина вызывает выраженный вторичный иммунный ответ, что подтверждает наличие иммунной памяти и возможность долгосрочной защиты; • вакцинации подлежат все взрослые с 65 лет; • полисахаридная вакцина (пневмококковая полисахаридная 23-валентная вакцина, ППВ23) используется в качестве бустеризации после проведенной первичной иммунизации ПКВ и для расширения охвата серотипов. Во избежание формирования гипореспонсивности вакцинацию оптимально начинать с ПКВ, а ППВ23 может быть введена в качестве бустерной дозы с интервалом не менее 2 мес; 9 I. Положение ВОЗ, отечественные рекомендации по вакцинации против ПИ и гриппа • необходимо включить ПКВ для детей во все национальные программы иммунизации. Взрослые также могут выиграть от противопневмококковой вакцинации; • NB: максимальный защитный эффект достигается при рутинной вакцинации всех детей первых лет жизни, а не только пациентов групп риска; • вакцинация против ПИ с использованием конъюгированных вакцин влияет на снижение распространенности антибиотикорезистентных штаммов пневмококка. Рекомендации по вакцинации против ПИ в России согласно национальному календарю профилактических прививок [1]: • вакцинация против ПИ проводится с 2014 г. детям по схеме 2 + 1 (две дозы первичной серии в 2 и 4,5 мес жизни и ревакцинация в 15 мес; • в рамках календаря профилактических прививок по эпидемическим показаниям вакцинация рекомендована детям 2–5 лет и взрослым из групп риска, включая лиц, подлежащих призыву на военную службу, а также лиц старше 60 лет, страдающих хроническими заболеваниями легких [2]. Федеральные клинические рекомендации «Вакцинопрофилактика пневмококковой инфекции» (утверждены на заседании профильной комиссии Министерства здравоохранения РФ по эпидемиологии 14.04.2015 г., протокол № 5) [3]: • вакцинацию взрослых против ПИ необходимо начинать с 13-валентной ПКВ (ПКВ13); • вакцинации против ПИ вакцинами ПКВ13 и ППВ23 подлежат все взрослые в возрасте старше 65 лет; • даже в случае, если пациент ранее был вакцинирован ППВ23, ему необходима одна доза ПКВ13; • временные интервалы между вакцинацией ПКВ13 и ППВ23 в зависимости от стартовой вакцины составляют 6–12 мес, а между дозами ППВ23 – не менее 5 лет; • взрослым, включая пациентов, ранее вакцинированных ППВ23, ПКВ13 вводят однократно. Необходимость ревакцинации не установлена; • взрослым 18–50 лет из групп риска (хронические болезни органов дыхания, хронические болезни сердца, сахарный диабет, курильщики сигарет и т.д.) после вакцинации ПКВ13 рекомендуется введение одной дозы ППВ23, но не ранее чем через 1 год после введения ПКВ13. Группы риска по развитию тяжелой ПИ: • лица с иммунодефицитными состояниями, в том числе ВИЧ, онкологическими заболеваниями; • лица, получающие иммуносупрессивную терапию; • пациенты с анатомической/функциональной аспленией; 10 II ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ РЕСПИРАТОРНЫХ ИНФЕКЦИЙ Вакцины против пневмококковой инфекции Существует два типа вакцин для профилактики ПИ – пневмококковая полисахаридная вакцина (ППВ) и ПКВ. В настоящее время в России зарегистрированы ППВ – Пневмо 23 и Пневмовакс и ПКВ – 10-валентная Синфлорикс и 13-валентная ПКВ (ПКВ13) Превенар 13 [1–3]. 23-валентную ППВ (ППВ23) можно применять начиная с возраста 2 лет. 10-валентная ПКВ (Синфлорикс) применяется только у детей с 2 мес жизни до 5 лет; ПКВ13 (Превенар 13) показана к применению с 2 мес жиз- ни во всех возрастах. С 2 лет жизни могут применяться следующие пневмококковые вакцины: – Пневмо 23 («Санофи Пастер С.А.», Франция); • ППВ23 – Пневмовакс (MSD, США); • ПКВ13 – Превенар 13 (ООО «НПО Петровакс Фарм», Россия, по лицензии «Пфайзер»). Противопоказано применение пневмококковых вакцин (и ППВ, и ПКВ) для проведения иммунизации пациентов, у которых в анамнезе есть указания на развитие реакций гиперчувствительности при введении пневмококковой вакцины. Иммунизацию не проводят пациентам с гипертермией, острыми заболеваниями инфекционной и неинфекционной этиологии, а также в период рецидива хронических заболеваний (допускается проведение вакцинации только после наступления стойкой ремиссии или полного выздоровления). Перенесенная ПИ (независимо от верности диагноза) не является противопоказанием к вакцинации против ПИ как ППВ, так и ПКВ. ППВ23 – вакцины, предназначенные для профилактики бактериемической (инвазивной) пневмококковой пневмонии и генерализованных 14 Вакцины против пневмококковой инфекции (инвазивных) ПИ, вызванных представленными в вакцине серотипами Streptococcus pneumoniae, у лиц групп риска с 2-летнего возраста. Одна доза (0,5 мл) вакцины Пневмо 23 или Пневмовакс содержит очищенные капсульные полисахариды Streptococcus pneumoniae 23 серотипов: 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 19А, 19F, 20, 22F, 23F и 33F – по 25 мкг. Дополнительные ингредиенты – фенольный буферный раствор. Допускается сочетанное применение ППВ23 с вакцинами, предназначенными для профилактики гриппа. Раствор ППВ23 вводят сразу из шприца, в который расфасован препарат, внутримышечно или подкожно. Схему применения ППВ23 определяет врач. При первичной иммунизации вводят 1 дозу (0,5 мл) ППВ23. Ревакцинацию следует проводить с интервалом не менее 3–5 лет. Не рекомендуется проведение иммунизации вакцинами Пневмо 23 и Пневмовакс во время беременности. Допускается проведение вакцинации препаратом Пневмо 23 или Пневмовакс в период грудного вскармливания. Введение вакцины не требует прерывания кормления грудью. При введении Пневмо 23 или Пневмовакса возможно развитие местных нежелательных эффектов, включая гиперемию, уплотнение, отек и болезненность тканей в месте инъекции. Как правило, эти эффекты умеренно выражены и быстро проходят без проведения специфической терапии. В единичных случаях при применении вакцины Пневмо 23 или Пневмовакс возможно развитие тяжелых местных эффектов, включая феномен Артюса. Эти эффекты также проходят самостоятельно и без каких-либо последствий, специфической терапии не требуется. Преимущественно у пациентов с высоким уровнем противопневмококковых антител возможно развитие гипертермии (в редких случаях температура тела может превышать 39°С). Гипертермия может развиваться в день прививки и сохраняться не более 24 ч. Сообщалось об отдельных случаях развития аденопатии, артралгии, кожной сыпи и анафилактоидных реакций (включая ангионевротический отек и анафилактический шок) при введении препарата Пневмо 23 или Пневмовакс. Пневмококковые полисахаридные вакцины Пневмо 23 и Пневмовакс выпускаются в индивидуальной упаковке, в шприцах по 1 дозе. ПКВ13 (Превенар 13) представляет собой капсулярные полисахариды 13 серотипов пневмококка: 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, индивидуально конъюгированные с дифтерийным белком CRM197 и адсорбированные на алюминия фосфате. ПКВ13 показана для профилактики пневмококковых заболеваний, включая инвазивные инфекции (в том числе менингит, бактериемию, 15 Вакцины против вируса гриппа аппетита и нарушение режима сна. У детей старшего возраста при первичной вакцинации препаратом Превенар 13 наблюдалась более высокая частота местных реакций, чем у детей 1-го года жизни. В целом частота побочных эффектов была одинаковой у пациентов в возрасте 18–49 лет и у пациентов старше 50 лет, за исключением рвоты, которая чаще встречалась в возрастной группе 18–49 лет. У лиц в возрасте 65 лет и старше отмечалось меньшее количество побочных эффектов вне зависимости от предшествующих вакцинаций, однако частота развития реакций была такой же, как и в более молодой популяции. Число местных побочных реакций не увеличивалось при вакцинации одновременно с инактивированной гриппозной вакциной. Вакцина Превенар 13 выпускается в индивидуальной упаковке, в шприцах по 1 дозе по 0,5 мл. Вакцины против вируса гриппа Все гриппозные вакцины готовят из актуальных штаммов вирусов гриппа А и В, рекомендуемых ежегодно ВОЗ. Это связано с высокой изменчивостью вируса гриппа. В настоящее время используют вакцины, нацеленные на три (3-валентные) самых характерных из циркулирующих типов вируса (два подтипа А и один подтип В вирусов гриппа) (табл. 2). В последние годы планируется применение 4-валентных вакцин, в которые добавлен второй вирус гриппа В. Ожидается, что 4-валентные вакцины против гриппа обеспечат более широкую защиту от инфекций, вызываемых вирусами гриппа подтипа В. Вакцины против гриппа подразделяются на «живые» (из аттенуированных штаммов вируса) и инактивированные (из убитых или обезвреженных вирусов гриппа). Инактивированные вакцины, в свою очередь, подразделяются на цельновирионные, основу которых составляют неразрушенные цельные вирусы гриппа; предварительно убитые и очищенные, расщепленные, или сплит-вакцины, которые включают в себя частички разрушенных вирионов, т.е. полный антигенный состав (наружные и внутренние белки). Так- же существуют субъединичные вакцины, которые состоят из смеси двух белков вируса – гемагглютинина и нейраминидазы, поэтому эти вакцины имеют минимальное количество побочных реакций. Новая технология в изготовлении вакцин – виросомальные вакцины. Они содержат инактивированный виросомальный комплекс с поверхностными антигенами ви17 II. Вакцины для профилактики респираторных инфекций руса гриппа. Виросомы усиливают иммунный ответ на вакцинацию. Виросомальные вакцины не содержат консервантов (тиомерсал) и отличаются хорошей переносимостью. Таблица 2. Классификация 3-валентных противогриппозных вакцин, зарегистрированных в России Поколение Состав Основные характеристики Примеры и тип Живые вакцины • • Цельно- Живой Высокая реактогенность Ультравак (ФГУП • вирионные ослабленный Область применения «НПО «Микроген») неочищенный ограничена (с 3 лет; вирус не рекомендованы к применению у иммунокомпрометированных пациентов) Инактивированные вакцины • • I – цельно- Цельный вирус, Хорошие показатели Ультрикс вирионные прошедший иммуногенности (ООО «Форт») • • инактивацию Высокая реактогенность Микрофлю (ФГУП и незначительную «СПбНИИВС») • очистку Флюваксин («Чанчунь Чаншэн Лайф Сайенсиз Лтд») • • II – Частицы Содержат по 15 мкг Ваксигрип («Санофи расщеп- разрушенного антигенов каждого Пастер С.А.») • ленные вируса, штамма вируса гриппа Флюарикс (GSK) • (сплит- поверхностные и реактогенные Бегривак (Novartis) вакцины) и внутренние липопротеиды белки и липиды клеточной стенки вируса • Эффективны, но относительно реактогенны • • III – субъ- Высокоочищенные Содержат по 15 мкг Инфлювак (Abbott) • единичные поверхностные антигенов каждого Агриппал (Novartis) антигены вируса штамма вируса гриппа • гриппа Эффективны, наименее (гемагглютинин реактогенны и нейраминидаза) 18 II. Вакцины для профилактики респираторных инфекций Вакцины против гемофильной b типа инфекции Современные вакцины для профилактики инфекций, вызываемых Haemophilus influenzae типа b (ХИБ-инфекции), представляют собой химически связанные антиген капсулы гемофильной палочки и столбнячный анатоксин, который нужен для того, чтобы основной антиген вырабатывал иммунитет у детей в возрасте до 18 мес. На сегодняшний день в России зарегистрированы три моновакцины против ХИБ-инфекции – Акт-ХИБ (Франция), Хиберикс (Бельгия) и вакцина гемофильная типа В конъюгированная (Россия). Также они входят в состав комбинированных вакцин Пентаксим и Инфанрикс Гекса. Вакциной, в отношении которой имеется опыт наиболее массового применения в нашей стране, является Акт-ХИБ. Акт-ХИБ (Act-HIB) – конъюгированная вакцина для профилактики гнойно-септических заболеваний, вызываемых Haemophilus influenzae типа b (менингит, сепсис, артриты, эпиглоттиты, пневмонии), применяется с 3 мес жизни [10]. Вакцину вводят внутримышечно или глубоко подкожно в разовой дозе 0,5 мл. Детям в возрасте до 2 лет вакцину вводят в среднюю треть переднелатеральной области бедра, лицам старше 2 лет – в область дельтовидной мышцы. Схема вакцинации следующая. При начале вакцинации в возрасте до 6 мес: 3 инъекции с интервалом в 1–2 мес; ревакцинацию проводят однократно через 1 год после 3-й вакцинации. При начале вакцинации в возрасте от 6 до 12 мес: 2 инъекции с интервалом в 1 мес; ревакцинация однократно в 18 мес. При начале вакцинации в возрасте старше 1 года – однократная инъекция. Противопоказано введение Акт-ХИБ в случаях повышенной чувствительности на предшествующее введение вакцины для профилактики ХИБ-инфекции, аллергии к ингредиентам вакцины, особенно к столбнячному анатоксину; острых инфекционных или неинфекционных заболеваний, обострения хронических заболеваний. При нетяжелых формах респираторной и кишечной инфекции вакцинацию возможно проводить сразу же после нормализации температуры тела. У большинства привитых никаких побочных явлений после вакцинации нет. Могут быть небольшое повышение температуры тела (не более чем в 10% случаев), покраснение, отек и болезненность в месте введения. Реакции в месте введения препарата (покраснение, уплотнение) отмечаются не более чем у 5–7% привитых. Выраженные температурные реакции (повы30 Вакцины против гемофильной типа b инфекции шение температуры тела выше 39°С) редки и встречаются не более чем у 1% привитых. Указанные реакции не влияют на привычный образ жизни, не требуют лечения и самопроизвольно проходят в течение 1–2 дней. В ходе практического применения на основании данных пассивного фармаконаблюдения очень редко (менее чем в 0,01% случаев) отмечались периферический отек нижних конечностей, реакции гиперчувствительности, фебрильные или афебрильные судороги, крапивница, сыпь и зуд. Акт-ХИБ может применяться одновременно с другими вакцинами национального календаря прививок и календаря профилактических прививок по эпидемическим показаниям при условии использования разных шприцев и введения в разные части тела. Вакцина выпускается во флаконе с 1 дозой лиофилизата и по 0,5 мл растворителя в шприце. Лиофилизат: 1 доза вакцины содержит активHaemophilus influenzae b ные (полисахарид типа – 10 мкг; конъюгированный столбнячный белок – 18–30 мкг) и вспомогательные (трометамол – 0,6 мг, сахароза – 42,5 мг) вещества. Растворитель (натрия хлорида раствор 0,4%) – 0,5 мл. Хиберикс (Hiberix) – конъюгированная вакцина для профилактики заHaemophilus influenzae b, болеваний, вызванных типа у детей в возрасте от 6 нед до 5 лет [11]. ≥0,15 Антитела в защитном титре мкг/мл появляются через 1 мес после окончания курса вакцинации препаратом Хиберикс у 95–100% детей, а через 1 мес после ревакцинации – у 100% детей, из которых у 94,7% титр ≥10 антител составил мкг/мл. Хиберикс не предохраняет от заболеваний, вызванных другими типами Haemophilus influenzae, и бактериальных менингитов другой этиологии. Вакцину вводят внутримышечно. Пациентам с тромбоцитопенией и другими нарушениями свертывающей системы крови вакцину вводят подкожно. Схема вакцинации следующая. Дети в возрасте 6 нед–6 мес: при начале вакцинации до 6-месячного возраста курс состоит из трех прививок с интервалами между дозами 1 мес (2, 3, 4 или 3, 4, 5 мес жизни), или 1,5 мес (3; 4,5; 6 мес жизни), или 2 мес (2, 4 и 6 мес жизни). Схема вакцинации в разных странах может варьировать; в Российской Федерации начало вакцинации против ХИБ-инфекции предусмотрено с 3-месячного возраста. Ревакцинацию проводят однократно на 2-м году жизни. Прививку рекомендуется проводить одновременно с вакцинацией против полиомиелита, коклюша, дифтерии и столбняка. В связи с этим в соответствии с национальным календарем профилактических прививок Российской Федерации предпочтительна схема 3; 4,5; 6 мес с ревакцинацией в возрасте 18 мес. 31 Вакцина против синегнойной инфекции Вакцина против синегнойной инфекции Псевдовак (Pseudovac) – поливалентная вакцина для профилактики синегнойной инфекции, которая содержит антигены Pseudomonas aeruginosa семи иммунотипов (по классификации Фишера–Девлина–Гнабасика) [12]. Псевдовак представляет собой комбинированную вакцину из семи иммунотипов, содержащую структурные и внеклеточные антигены инактивированных нагреванием штаммов Pseudomonas aeruginosa. Штаммы культивируются на искусственной питательной среде Дэвиса. При использовании вакцины Псевдовак в профилактических или лечебных целях препарат стимулирует активный иммунитет, что проявляется повышением уровня антител к синегнойным бактериям в плазме крови. Введение вакцины непосредственно после получения травмы способствует снижению риска бактериемии и сепсиса, вызванных Pseudomonas aeruginosa. Вакцина Псевдовак применяется с целью формирования активного иммунитета к синегнойным инфекциям и может использоваться при любых состояниях, сопровождающихся повышенным риском синегнойных инфекций или сепсиса, особенно у больных с обширными ожогами. В профилактических целях – с целью формирования активного иммунитета к синегнойным инфекциям при длительной госпитализации, интубации, искусственной вентиляции легких (ИВЛ), катетеризации, рецидивирующих инфекциях, различных видах ран, в том числе послеоперационных. лечебных целях – у пациентов с лабораторно доказанными синегнойными инфекциями, такими как пневмония, инфекции нижних дыхательных путей, инфекции мочевыводящих путей и др., для усиления специфического иммунитета и уменьшения риска бактериемии и сепсиса. Поскольку вакцина применяется как с лечебной, так и с профилактической целью у особых категорий больных по медицинским показаниям, длительность поствакцинального иммунитета специально не изучалась. Однако, согласно данным проведенных клинических исследований, нарастание титра антител к Pseudomonas aeruginosa у пациентов, вакцинированных препаратом Псевдовак по рекомендуемой схеме, сохраняется даже на 25-й день после введения последней дозы. Вакцину вводят внутримышечно. Схема вакцинации следующая. У детей с 1 мес и у взрослых вакцину Псевдовак в лечебных и профилактических 33 II. Вакцины для профилактики респираторных инфекций целях следует использовать согласно приведенному протоколу: в 1-й день – 0,2 мл вакцины, на 4-й день – 0,4 мл, на 6-й – 0,6 мл, на 8-й – 0,8 мл и на 10-й день – 1 мл. При иммунизации ожоговых больных введение вакцины начинают как можно раньше (через 1–3 дня после получения травмы), строго соблюдая изложенную схему. При развитии побочных реакций локального или системного характера допускается увеличение интервала между введениями препарата или повторное введение вакцины в той же дозе при очередной инъекции, конечная доза препарата, однако, должна составлять 1,0 мл. Превышение конечной дозы (1,0 мл) не допускается. Противопоказано введение вакцины Псевдовак в случаях повышенной чувствительности на предшествующее введение вакцины, аллергии к компонентам вакцины; острых инфекций с лихорадкой, не вызванных бактериями Pseudomonas aeruginosa (легкие формы инфекций не являются противопоказанием для использования вакцины), обострения хронических заболеваний (вакцинация проводится после наступления ремиссии), беременности и лактации. Общие (головная боль, повышение температуры тела, утомляемость) и местные (покраснение, болезненная припухлость) реакции встречаются редко. Симптомы обычно проходят через 24–48 ч. При развитии более сильных локальных или системных реакций необходимо увеличить интервал между введениями вакцины либо при очередной инъекции использовать препарат в прежней дозе, однако впоследствии доза должна быть доведена до 1,0 мл. Специальных исследований с целью изучения лекарственного взаимодействия не проводилось. Согласно данным литературы, неспецифические вакцины нельзя применять одновременно со специфическими вакцинами, а также с иммуносупрессорами. Однако их можно применять одновременно с антибактериальным лечением (т.е. с антибиотикотерапией). Вакцина выпускается в ампулах по 1 мл. Один миллилитр раствора Pseudomonas aeruginosa содержит активные (антигены семи иммунотипов (по классификации Фишера–Девлина–Гнабасика): иммунотипа 1 – 0,125 мл, иммунотипа 2 – 0,125 мл, иммунотипа 3 – 0,125 мл, иммунотипа 4 – 0,125 мл, иммунотипа 5 – 0,125 мл, иммунотипа 6 – 0,125 мл, иммунотипа 7 – 0,125 мл, иммунотипа 3,7 – 0,125 мл) и вспомогательные (фенол) вещества. Список литературы 1. Инструкция по применению лекарственного препарата для медицинского применения Пневмо 23. Доступно по: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid= b276b716-921a-41bb-a348-4bacfe373d56&t= (ссылка активна на 20.09.2016). 34 III ВАКЦИНАЦИЯ ВЗРОСЛЫХ ПРОТИВ ПНЕВМОКОККОВОЙ ИНФЕКЦИИ И ГРИППА Вакцинация взрослых против пневмококковой инфекции – реальные возможности в улучшении индекса здоровья населения Во всем мире пневмококковые заболевания лидируют по числу смертельных исходов среди инфекций, предотвращаемых вакцинацией [1, 2]. Эпидемиологическая ситуация по ПИ в России аналогична международной – пневмококк занимает одно из лидирующих мест в этиологической структуре пневмоний у взрослых и детей [3]. От пневмококкового менингита в РФ умирает 60% заболевших взрослых в возрасте старше 65 лет [4, 5]. Пневмонии представляют особую актуальность для здравоохранения Российской Федерации, учитывая распространенность, тяжесть течения и высокую угрозу летального исхода. В РФ пневмонии занимают 1-е место среди причин летальности от инфекционных болезней и 6-е – среди всех причин летальности [6]. Смертность от пневмонии в РФ особенно высока среди детей 1-го года жизни (37 на 100 000), а также среди лиц старше 55 лет (48,2 на 100 000) и пожилых людей (до 78,5 на 100 000) [7, 8]. У пожилых больных пневмонией имеет место в 3–5 раз более высокий риск развития летального исхода от пневмонии и ее осложнений, чем у пациентов молодого возраста (5–7% у молодых) [9]. Также пневмонии являются лидирующей причиной смерти у лиц пожилого и старческого возраста, находящихся в домах престарелых и геронтологических центрах [10]. Уровень летальности от пневмоний среди лиц, проживающих в домах престарелых, достигает 20–50% [11]. Риск развития бактериальной пневмонии повышается у лиц с иммунодефицитными состояниями (ИДС). Так, при ВИЧ-инфекции частота пневмоний в 25 раз выше, чем в ее отсутствие [12]. 36 Вакцинация взрослых против пневмококковой инфекции – реальные возможности Как показывают данные исследований, у пациентов с хроническими заболеваниями риск развития пневмоний и летальных исходов намного выше, чем у пациентов без сопутствующей патологии. Пациенты с хронической обструктивной болезнью легких (ХОБЛ) составляют 20,5–25,7% госпитализированных больных внебольничной пневмонией (ВП). Причем смерть в 30-дневный срок наступает примерно у 9,6% пациентов [13]. Среди пациентов, поступающих в стационары по поводу пневмоний, до 15,8% имеют ишемическую болезнь сердца, 14,3% – хроническую сердечно-сосудистую недостаточность, 9,6% – сахарный диабет [14]. Доказан патогенез развития кардиальных осложнений при пневмококковой пневмонии, что усугубляет течение хронических сердечно-сосудистых заболеваний, а также может приводить к летальному исходу [15]. В исследованиях выявлено, что у 7,1% пациентов с пневмонией может развиться инфаркт миокарда, у 5,8% – первый эпизод аритмии, у 14% – ухудшение течения хронической сердечно-сосудистой недостаточности. Смертность среди больных с пневмококковой пневмонией и острой сердечной недостаточностью значительно выше (27,3% (р < 0,008)), чем среди пациентов, не имеющих в анамнезе сердечно-сосудистых заболеваний (8,8%) [16]. Следует отметить, что повышенный риск смертельного исхода у пациентов, перенесших ВП, сохраняется длительно и после выздоровления. V. Kaplan et al. установили, что смертность после перенесенной ВП в течение 1 года в 2,69 раза выше, чем в популяции в целом, и в 1,93 раза выше, чем у пациентов, госпитализированных по другим причинам [17]. Ведение (лечение и реабилитация) больных с пневмонией высокозатратно с экономической и социальной точек зрения. Доказано, что первичная профилактика пневмонии и ПИ с помощью вакцинации экономически целесообразна [18]. По мнению ВОЗ, вакцинация – единственный способ существенно повлиять на заболеваемость ПИ. Повышение уровня антибиотикорезистентности особо подчеркивает значимость иммунопрофилактики [19]. Вакцинопрофилактика ПИ у пациентов групп риска рекомендована ведущими научными мировыми сообществами [20–24]. Согласно новой стратегии вакцинации взрослых против ПИ, EMA (European Medicines Agency – Европейское медицинское агентство), ВОЗ, CDC (U.S. Centers for Disease Control and Prevention – Центры по контролю и профилактике заболеваний США), ACIP (Advisory Committee on Immunization Practices, U.S. – Консультативный комитет по практике иммунизации США), Российское респираторное общество рекомендуют начинать вакцинацию против ПИ с ПКВ13 (Превенар 13). Даже в случае, 37 III. Вакцинация взрослых против пневмококковой инфекции и гриппа 33. Жукова А. В десятке смертельных болезней. Медицинская газета 24.12.2014. Доступно по: http://www.mgzt.ru/content/в-десятке-смертельных-болезней (ссылка активна на 21.09.2016). 34. Игнатова Г.Л., Родионова О.В. Клиническая эффективность вакцинации конъюгированной пневмококковой вакциной пациентов с хронической бронхолегочной патологией в Городском пульмонологическом центре Челябинска. Пульмонология 2013; 6: 38–42. 35. Костинов М.П., Протасов А.Д., Жестков А.В., Полищук В.Б. Перспективные данные применения пневмококковой 13-валентной конъюгированной вакцины у взрослых пациентов с хронической бронхолегочной патологией. Пульмонология 2014; 4: 57–63. 36. Protasov A., Kostinov M., Zhestkov A. Microbiological effect of anti-pneumococcal vaccination in COPD patients. 10th International Symposium On Pneumococci and Pneumococcal Diseases. June 26–30, 2016. Glasgow, UK, 2016: 494. 37. Костинов М.П., Жестков А.В., Протасов А.Д. и др. Сравнительный анализ динамики показателей качества жизни у больных хронической обструктивной болезнью легких на фоне вакцинации против пневмококковой инфекции с использованием 13-валентной конъюгированной и 23-валентной полисахаридной вакцин. Пульмонология 2015; 25(2): 163–166. 38. Крысанов И.С. Анализ стоимости хронической обструктивной болезни легких в Российской Федерации. Качественная клиническая практика 2014; 2: 51–56. 39. Игнатова Г.Л., Антонов В.Н. Нарушения функции внешнего дыхания при сочетанном течении ХОБЛ и ИБС. Consilium Medicum 2014; 16(11): 32–36. 40. О реализации мероприятий региональных государственных программ повышения качества жизни пожилых людей. Информация от 28 мая 2014 г. Доступно по: http://www.rosmintrud.ru/ docs/mintrud/protection/94 (ссылка активна на 21.09.2016). Вакцинация пациентов, перенесших внебольничную пневмонию Внебольничная пневмония – острый воспалительный процесс нижних отделов дыхательных путей бактериальной этиологии, характеризующийся образованием перибронхиальных инфильтратов или развитием интерстициальных очагов воспаления. Почему необходима вакцинация против ПИ и вируса гриппа у больных ВП? К числу наиболее актуальных типичных бактериальных возбудителей пневмоний относятся S. pneumoniae, H. influenzae, S. aureus, M. catarrhalis, Kl. pneumoniae (у некоторых категорий пациентов существенно возросла актуальность P. aeruginosa). В последние годы, с появлением и распространением в популяции пандемического вируса гриппа H1N1, участилось возникновение случаев тяжелых вторичных бактериальных пневмоний, возбудителями которых являются S. aureus, S. pneumoniae. Кроме того, при ВП возможно выявление коинфекции более чем двумя возбудителями, которая может быть вызвана как ассоциацией различных бактери42 Вакцинация пациентов, перенесших внебольничную пневмонию альных возбудителей, так и их сочетанием с респираторными вирусами, что приводит к более тяжелому течению и худшему прогнозу заболевания [1]. Возрастание числа антибиотикополирезистентных штаммов микроорганизмов диктует необходимость поиска новых подходов к терапии и реабилитации пациентов с различными воспалительными заболеваниями системы органов дыхания. Внебольничная пневмония – широко распространенное заболевание взрослых, занимающее ведущее место в структуре заболеваемости и смертности от инфекционных заболеваний в развитых странах. Распространенность ВП определяет значительные экономические потери, которые несет государство. Подсчитано, что ежегодно ВП переносит 1,5% населения развитых стран. Так, в США ВП ежегодно заболевает 5–6 млн. человек, из которых более 1 млн. нуждаются в госпитализации. В Европе заболеваемость ВП составляет 2–15 случаев, в России – 3,9 случая на 1000 человек в год среди лиц старше 18 лет, что приводит к значительным прямым и непрямым затратам [1, 2]. Однако эти цифры не отражают истинной заболеваемости ВП в России, которая, согласно расчетам, достигает 14–15%, а общее число заболевших ежегодно превышает 1,5 млн. человек. Смертность от пневмонии в РФ особенно высока среди детей 1-го года жизни (37 случаев на 100 000), а также среди лиц старше 55 лет (48,2 случая на 100 000) и у пожилых людей (до 78,5 случая на 100 000) [1]. Основными группами риска по заболеваемости ВП являются дети до 2 лет и лица в возрасте 50 лет и старше, при этом с возрастом риск летального исхода при ВП увеличивается в несколько раз [3]. Тяжелая ВП – особая форма заболевания, характеризующаяся высокой летальностью и значительными затратами на медицинскую помощь. До 40% пациентов с тяжелой ВП, госпитализированных в отделения реанимации и интенсивной терапии, не отвечают на проводимую терапию, что может проявляться прогрессированием острой дыхательной недостаточности, развитием септического шока, необходимостью проведения ИВЛ, усугублением проявлений полиорганной недостаточности [4]. Современные принципы терапии ВП предполагают комплексный подход. В соответствии с научными рекомендациями основным методом лечения ВП является антибактериальная терапия, которая улучшает прогноз, уменьшает длительность стационарного лечения, снижает летальность [5, 6]. Несмотря на это наблюдаются значительные трудности в лечении затяжных форм ВП, которые в большой части случаев развиваются на фоне сниженной иммунологической реактивности организма, а при отсутствии адекватного лечения имеют тенденцию к утяжелению и хронизации заболевания. 43 III. Вакцинация взрослых против пневмококковой инфекции и гриппа По данным исследований, риск развития пневмоний и летальных исходов намного выше у пациентов с хроническими заболеваниями, чем у лиц без сопутствующей патологии. У многих пациентов, госпитализированных по поводу ВП, имеется ряд сопутствующих заболеваний: у 15,8% – ишемическая болезнь сердца, у 14,3% – хроническая сердечно-сосудистая недостаточность, у 9,6% – сахарный диабет [4]. Одним из ведущих факторов риска развития пневмоний тяжелого течения является ХОБЛ. Пациенты с ХОБЛ составляют 20,5–25,7% госпитализированных с ВП, причем летальный исход в 30-дневный срок насту≈9,6% у из них [7]. По мнению ВОЗ, вакцинация – единственный способ существенно повлиять на заболеваемость ПИ. Повышение уровня антибиотикорезистентности особенно подчеркивает значимость иммунопрофилактики [8]. Вакцинация против пневмококковой инфекции Когда и как проводить вакцинацию? • При проведении вакцинопрофилактики ПИ у пациентов, имеющих в анамнезе ВП, необходимо руководствоваться действующими нормативными и методическими документами по организации иммунизации, прежде всего национальным календарем профилактических прививок и календарем профилактических прививок по эпидемическим показаниям (приказ Министерства здравоохранения РФ от 21 марта 2014 г. № 125н с внесенными изменениями в приказ Министерства здравоохранения РФ от 16.06.2016 № 370н), Федеральными клиническими рекомендациями «Вакцинопрофилактика пневмококковой инфекции» (утверждены на заседании профильной комиссии Министерства здравоохранения РФ по эпидемиологии 14.04.2015, протокол № 5), а также инструкциями по применению иммунобиологических препаратов. • Решение о проведении вакцинации против ПИ взрослых пациентов, перенесших ВП, принимает лечащий врач, хотя рекомендации по вакцинации против ПИ пациентам с ВП должны давать врачи-терапевты, врачи общей практики, пульмонологи, аллергологи-иммунологи, врачи стационаров перед выпиской пациента с ВП. • Вакцинация проводится в срок 2–4 нед после клинического выздоровления в условиях кабинета вакцинопрофилактики. В случае обострения сопутствующей хронической патологии вакцинацию против ПИ проводят через 2–4 нед после купирования обострения на фоне базисной терапии основного заболевания. 44 Вакцинация пациентов, перенесших внебольничную пневмонию • Осмотр пациента с ВП в анамнезе перед вакцинацией против ПИ проводит врач-терапевт или врач другой специальности. • Вакцинацию против ПИ пациентов с ВП проводят амбулаторно: в кабинете вакцинопрофилактики поликлиник либо в частных медицинских центрах, занимающихся вакцинацией. В редких случаях при удовлетворительном состоянии пациентов, проживающих в местах, отдаленных от медицинских учреждений, или при других обстоятельствах допускается вакцинация при выписке из стационара. Информация для пациента. При использовании вакцин возможны местные реакции в месте введения (боль, покраснение, отек мягких тканей, уплотнение), а также общие (системные) реакции (головная боль, головокружение, дискомфорт, повышение температуры тела). Указанные реакции возникают в первые 1–2 дня после введения вакцины, как правило, носят слабовыраженный или умеренный характер и проходят самостоятельно в первые 2–3 дня. В случае повышения температуры тела выше 38,5°С следует принять внутрь парацетамол 500 мг. Возникновение кашля, насморка, боли в горле, суставах и мышцах чаще всего связаны с присоединением респираторной инфекции и не должны рассматриваться как реакция на введение вакцины. В редких случаях может возникнуть аллергическая реакция на введение вакцины в виде сыпи, зуда, что является показанием для назначения одного из антигистаминных препаратов до исчезновения указанных симптомов. • После вакцинации необходимо наблюдение за пациентом в течение 30–45 мин с целью выявления возможных реакций гиперчувствительности немедленного типа. В случае возникновения реакций гиперчувствительности немедленного типа (которые развиваются крайне редко) необходимо принять соответствующие меры: назначают антигистаминный препарат, системный глюкокортикостероид, по показаниям адреналин и т.д. Ожидаемый эффект вакцинации Имеются данные по эффективности применения пневмококковых вакцин у взрослых пациентов, перенесших ВП. По результатам наблюдательных исследований ППВ23, в течение 1 года после вакцинации не отмечались повторные ВП, острый бронхит. В единичных случаях выявлены острые респираторные инфекции и острый синусит, протекавшие в легкой форме [9]. Более длительные наблюдения показывают, что эффект от вакцинации ППВ23 через 1,5–2 года угасает [10]. Накоплено достаточно данных по эффективности ПКВ13 (Превенар 13) у пациентов, перенесших ВП, в первую очередь имеющих в анам45 III. Вакцинация взрослых против пневмококковой инфекции и гриппа незе ХОБЛ, ишемическую болезнь сердца. При этом в течение периода наблюдения (3–4 года после введения вакцины) эффект от вакцинации (снижение частоты возникновения повторных пневмоний, госпитализаций) не снижался [10]. Применение ПКВ имеет преимущества по сравнению с использованием ППВ (см. в разделе «Вакцинация больных ХОБЛ» (с. 57)). Сроки вакцинации или ревакцинации конкретными вакцинами в последующие годы Не привитым ранее против ПИ пациентам с ВП сначала вводится ПКВ13 (Превенар 13). Пациентам с хроническими заболеваниями (заболеваниями бронхолегочной системы, сердечно-сосудистыми заболеваниями, заболеваниями почек, эндокринной патологией, аутоиммунными заболеваниями и др.) через 1 год вводится ППВ23 (Пневмо 23), затем каждые 5 лет Пневмо 23. Пациентам с ВП, получавшим ранее вакцинацию против ПИ с использованием ППВ23 (Пневмо 23), в последующем не ранее чем через 1 год вводится однократно препарат Превенар 13. Пациентам с хроническими заболеваниями (заболеваниями бронхолегочной системы, сердечно-сосудистыми заболеваниями, заболеваниями почек, эндокринной патологией, аутоиммунными заболеваниями и др.) в последующем через каждые 5 лет после предыдущего введения Пневмо 23 вводится ППВ. Вакцинация против вируса гриппа Почему необходима вакцинация против вируса гриппа пациентам, перенесшим ВП? См. подраздел «Почему необходима вакцинация против ПИ и вируса гриппа у больных ВП?» настоящего раздела (с. 42). Когда и как проводить вакцинацию? См. подраздел «Когда и как проводить вакцинацию?» раздела «Вакцинация против пневмококковой инфекции» (с. 44). Необходимо дополнительно учитывать следующее: • при возникновении неблагополучной эпидемической ситуации по гриппу допускается вакцинация в стационаре на фоне базисной терапии, за исключением больных, находящихся в палате интенсивной терапии; • следует отметить, что частота возникновения общих системных и местных реакций после введения вакцин против гриппа существенно ниже, чем при использовании пневмококковых вакцин. 46 Вакцинация пациентов, перенесших внебольничную пневмонию Ожидаемый эффект вакцинации У пациентов без сопутствующей хронической патологии, перенесших ВП, клинический и иммунологический эффекты вакцинации против гриппа не отличаются от таковых в когорте здоровых. У вакцинированных с ВП, имеющих хронические патологии, могут отмечаться улучшение в клиническом течении основного заболевания, снижение частоты респираторных инфекций и увеличение синтеза специфических антител к штаммам вируса гриппа, сравнимые с таковыми у пациентов с ХОБЛ, БА и другими патологиями (см. подразделы «Вакцинация против вируса гриппа»). Сроки вакцинации в последующие годы Вакцинацию проводят ежегодно в осенний период с применением инактивированных субъединичных и сплит-вакцин, а также живых атенуированных вакцин против гриппа. При угрозе возникновения пандемии или ожидании циркуляции новых штаммов вируса гриппа, ранее не входивших в состав вакцины, пациентам, перенесшим ВП с сопутствующей хронической патологией, целесообразно вводить две дозы вакцины с интервалом 21–28 дней. Список литературы 1. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. М., 2014; 82с. 2. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике. М., 2010; 108c. Доступно по: http://webmed.irkutsk.ru/doc/pdf/cap.pdf (ссылка активна на 21.09.2016). 3. WHO 2009. Acute respiratory infections. Update September 2009. Available at: http://apps.who.int/ vaccine_research/diseases/ari/en/index5.html (accessed 21.09.2016). 4. Коровкина Е.С. Последствия внебольничных пневмоний и возможности их профилактики. Пульмонология 2015; 25(1): 101–105. 5. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др.; Российское респираторное общество (РРО); Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ). Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. Пульмонология 2014; 4: 13–48. 6. Lim W.S., Smith D.L., Wise M.P., Welham S.A.; British Thoracic Society. British Thoracic Society community acquired pneumonia guideline and the NICE pneumonia guideline: how they fit together. Thorax 2015; 70(7): 698–700. 7. WHO Weekly Epidemiological Record. 2007: 82(12): 93–104. Available at: http://www.who.int/ wer/2007/wer8212.pdf (accessed 21.09.2016). 8. Harrison L.H. Prospects for vaccine prevention of meningococcal infection. Clin Microbiol Rev 2006; 19(1): 142–164. 9. От профилактического к терапевтическому эффекту вакцин против пневмококковой и гемофильной типа b инфекций у пациентов с бронхолегочной патологией. Под ред. М.П. Костинова. М., 2007; 182с. 10. Игнатова Г.Л., Антонов В.Н., Родионова О.В. Эффективность вакцинопрофилактики конъюгированной пневмококковой вакциной у больных хронической обструктивной болезнью легких за 3 года. Consilium Medicum 2016; 18(3): 42–46. 47 III. Вакцинация взрослых против пневмококковой инфекции и гриппа Вакцинация контактных лиц в окружении иммунокомпрометированных пациентов Понятие «иммунокомпрометированные пациенты» Иммунная недостаточность подразумевает дефицит способности организма распознавать, элиминировать из внутренней среды и запоминать агенты чужеродной генетической природы, прежде всего микробные. Иммунной недостаточности придается важное значение в объяснении повышенной восприимчивости к инфекциям и некоторым другим иммунопатологическим проявлениям (аллергия, аутоиммунитет, неоплазия). Различают первичные и вторичные ИДС, а также примыкающие к последним состояния иммунокомпрометированности [1]. Первичные ИДС – врожденные нарушения системы иммунитета, связанные с генетическими дефектами одного или нескольких компонентов системы иммунитета, а именно клеточного и гуморального иммунитета, фагоцитоза, комплемента. Вторичные ИДС характеризуются нарушениями функционирования иммунной системы, не связанными с генетическими дефектами и развивающимися в постнатальном периоде или у взрослых лиц [2]. Снижение иммунного ответа вызывает нарушение важнейшей функции иммунной системы – защиты организма от внешней и внутренней агрессии, прежде всего от инфекционных агентов или измененных клеток организма, включая злокачественные клетки [3, 4]. В последнее десятилетие наблюдается постоянное увеличение распространенности вторичной иммунодефицитной недостаточности (ВИН), способной осложнять течение любой патологии человека, ухудшать прогноз и резко снижать качество жизни. «Иммунокомпрометированный пациент» – определение, которое часто используется наряду с термином «ВИН», – в чем различие? Нередко это название одного и того же состояния, характеризующегося повышенной инфекционной заболеваемостью. Однако диагноз ВИН предусматривает наличие симптомокомплекса, свидетельствующего об ослаблении иммунной системы, имеющего клинические и лабораторные признаки и требующего включения в комплексную терапию иммуномодуляторов, в то время как определение «иммунокомпрометированный пациент» требует дифференцированного подхода к тактике ведения [2]. Термин «иммунокомпрометированный пациент» применим к различным контингентам населения: 48 Вакцинация контактных лиц в окружении иммунокомпрометированных пациентов • лицам, проживающим или работающим в экологически неблагоприятных условиях и подвергающихся воздействию радиационного, химического и других факторов; • лицам определенных возрастных групп (в частности, пожилого и старческого возраста); • лицам определенных профессий (например, подвергающихся постоянному стрессу (летчики, подводники и др.), сверхвысоким физическим нагрузкам, высоким и низким температурам и т.д.); • больным, перенесшим тяжелые инфекции или травмы и др. Однако к каждой из указанных групп населения в одних случаях могут относиться лица с ВИН, а в других – здоровые, но в ряде случаев и они могут считаться «иммунокомпрометированными». Человек из группы «иммунокомпрометированные пациенты» при определенных неблагоприятных условиях может стать больным с признаками ВИН, для которого всегда характерно наличие клинических проявлений – повышенная инфекционная заболеваемость и необходимость включения в комплексную терапию иммуномодулирующих средств. При этом изменения в иммунной системе обнаруживаются примерно в 30% случаев. Иммунокомпрометированный пациент может иметь изменения в иммунном статусе, но при этом оставаться «здоровым» человеком, с высокой трудоспособностью и которому, конечно, не требуется назначение иммуностимуляторов [2]. Следовательно, иммунокомпрометированный пациент заведомо наиболее восприимчив к инфекционным агентам, поэтому всегда сохраняется вероятность обострения основного заболевания и осложнений. Угрожающие инфекции у иммунокомпрометированных пациентов Существует множество вирусов и бактерий, которые могут быть причинно-значимыми в развитии инфекционного заболевания. Из них к вакциноуправляемым относятся вирус гриппа, пневмококк и ХИБ-инфекция. Ведущая роль отводится пневмококку и вирусу гриппа. Так, среди пациентов, госпитализированных с инвазивной ПИ, более чем у 80% имелись хронические сопутствующие заболевания, наиболее частыми из которых были ХОБЛ (25,2% случаев), онкологические заболевания (22,3%), хроническая сердечно-сосудистая недостаточность (18,7%), хроническая почечная недостаточность (13,4%) [5]. В связи с этим с начала практического применения вакцин против ПИ и гриппа иммунокомпрометированным пациентам рекомендовалось с профилактической целью проводить вакцинацию. Так, ACIP были определены основные группы иммунокомпрометированных пациентов в возрасте 18–49 лет, нуждаю49 IV ПОДХОДЫ К ВАКЦИНАЦИИ БОЛЬНЫХ С БРОНХОЛЕГОЧНОЙ ПАТОЛОГИЕЙ Вакцинация больных ХОБЛ Хроническая обструктивная болезнь легких – хроническая патология с прогрессирующей обструкцией дыхательных путей и развитием легочной гипертензии. Термин объединяет хронический обструктивный бронхит и эмфизему. Хронический бронхит проявляется увеличенной секрецией слизи и рецидивирующим продуктивным кашлем на протяжении 3 мес в течение последних 2 лет. Эмфизема проявляется деструкцией стенок альвеол. Почему необходима вакцинация против ПИ, ХИБ-инфекции и вируса гриппа у больных ХОБЛ? Обострения ХОБЛ являются основной причиной обращения больных за медицинской помощью. До 75–80% обострений ХОБЛ имеют инфекционную природу. Каждое последующее обострение ХОБЛ, особенно сопровождающееся госпитализацией пациента, связано с худшим прогнозом в плане выживаемости. Поэтому предупреждение инфекционных обострений ХОБЛ представляется критически важным [1]. Пневмококки часто выступают в качестве этиологического фактора обострений ХОБЛ. В настоящее время выделено 96 серотипов S. pneumoniae. Приблизительно 80% наиболее тяжелых случаев ПИ обусловлено 20 серотипами пневмококка, большинство из которых входят в состав современных вакцин для профилактики ПИ [2, 3]. В качестве частого возбудителя инфекционного обострения ХОБЛ также выступает H. influenzae, в том числе типа b, которая оказывает следующие эффекты у больных ХОБЛ: угнетение мукоцилиарного клиренса, фагоцитарной активности нейтрофилов и альвеолярных макрофагов, повреждение трахеобронхиального эпителия. В конечном счете персис55 IV. Подходы к вакцинации больных с бронхолегочной патологией тирование H. influenzae у больных ХОБЛ приводит к прогрессированию заболевания [4]. Вирус гриппа может вызывать обострения ХОБЛ как самостоятельно, так и с присоединением бактериальной флоры [5]. Вакцинация против пневмококковой инфекции Когда и как проводить вакцинацию? • Вакцинацию больных ХОБЛ против ПИ проводят в период ремиссии основного заболевания на фоне базисной терапии ХОБЛ. В случае обострения ХОБЛ вакцинацию против ПИ проводят через 2–4 нед после купирования обострения, на фоне базисной терапии ХОБЛ. • Рекомендации по вакцинации против ПИ больным ХОБЛ дают врачи-терапевты, врачи общей практики, пульмонологи, кардиологи, аллергологи-иммунологи, врачи стационаров перед выпиской пациента с ХОБЛ. • Осмотр пациента с ХОБЛ перед вакцинацией против ПИ проводит врач-терапевт или врач другой специальности. • Вакцинацию против ПИ у пациентов с ХОБЛ проводят амбулаторно: в кабинете вакцинопрофилактики поликлиники либо в частных медицинских центрах, занимающихся вакцинацией. В редких случаях, при удовлетворительном состоянии пациентов, проживающих в местах, отдаленных от медицинских учреждений, а также при других обстоятельствах, допускается вакцинация при выписке из стационара. Информация для пациента. При вакцинации возможны местные реакции в месте введения (боль, покраснение, отек мягких тканей, уплотнение), а также общие (системные) реакции (головная боль, головокружение, дискомфорт, повышение температуры тела). Указанные реакции возникают в первые 1–2 дня после введения вакцины, как правило, носят слабовыраженный или умеренный характер и проходят самостоятельно в первые 2–3 дня. При возникновении выраженной местной реакции следует назначить один из антигистаминных препаратов (например, цетиризин, дезлоратадин и др.) в стандартной дозировке в течение 1–2 дней. В случае повышения температуры тела более 38,5°С следует принять внутрь парацетамол 500 мг. Возникновение кашля, насморка, боли в горле, суставах и мышцах чаще всего связаны с присоединением респираторной инфекции и не должны рассматриваться как реакция на введение вакцины. В редких случаях может возникнуть аллергическая реакция на введение вакцины в виде сыпи, зуда, что является показанием для назначения одного из антигистаминных препаратов до исчезновения указанных симптомов. 56 Вакцинация больных ХОБЛ • После вакцинации необходимо наблюдение за пациентом в течение 30–45 мин с целью выявления возможных реакций гиперчувствительности немедленного типа. В случае возникновения реакций гиперчувствительности немедленного типа (которые развиваются крайне редко) необходимо принять соответствующие меры: назначить антигистаминный препарат, системный глюкокортикостероид, по показаниям адреналин и т.д. [6]. Ожидаемый эффект вакцинации Вакцинация больных ХОБЛ против ПИ на фоне проводимой базисной терапии оказывает ряд положительных эффектов. Так, уже в краткосрочной перспективе (через 1 год после вакцинации) отмечается статистически значимое уменьшение числа обострений ХОБЛ – с 2 [1; 3] до 0 [0; 1] (р < 0,001), количества курсов антимикробных химиопрепаратов, принимаемых по любым причинам, – с 2 [1; 3] до 0 [0; 0] (р < 0,001), а также числа госпитализаций по поводу обострения ХОБЛ – с 1 [0; 1] до 0 [0; 0] (р < 0,001) по сравнению с периодом до вакцинации [7]. В отечественном исследовании у больных ХОБЛ в сочетании с пневмокониозом в результате вакцинации ППВ23 (Пневмо 23) на фоне базисной терапии в течение 12 мес наблюдалось снижение количества обострений ХОБЛ в 1,8 раза, пневмоний – в 3 раза. Число пациентов, не перенесших за отчетный год инфекций дыхательных путей, увеличилось в 9,3 раза, а также у пациентов достоверно снизилась заболеваемость ОРВИ и гриппом. В группе контроля, наоборот, количество обострений ХОБЛ увеличилось в 1,6 раза, пневмоний – в 13 раз, количество пациентов, не болевших инфекциями дыхательных путей, уменьшилось в 1,6 раза. Однако уже к 3-му году наблюдения у пациентов наблюдалось «ускользание» эффекта вакцинации [8]. Результаты 3-летнего наблюдения за пациентами, вакцинированными ПКВ13 (Превенар 13), свидетельствовали о явном ее преимуществе перед вакцинацией ППВ23 – число госпитализаций и эпизодов пневмоний снизилось в 8,3 и 7,7 раза соответственно в течение 3 лет. Отмечались снижение индекса степени одышки по шкале MRC (Medical Research Council) с 3,03 до 1,51, стабилизация бронхиальной обструкции – 56,31% к 1-му году и 56,11% к 3-му году наблюдения, улучшение качества жизни по шкале SGRQ (St. George’s Respiratory Questionnaire – респираторный вопросник клиники святого Георгия) более чем на 4 балла [8]. Снижение числа обострений ХОБЛ на фоне вакцинации ПКВ13 против ПИ закономерно приводит к улучшению показателей качества жиз- ни, связанного со здоровьем. В проведенном нами исследовании оцени57 Вакцинация больных ХОБЛ ПКВ13 (Превенар 13), а затем использовалась ППВ23 (Пневмо 23). Применение ППВ23 не сопровождалось формированием иммунологической памяти [11, 12]. У пациентов с ХОБЛ большую важность представляет защита от вирусных респираторных инфекций (грипп, парагрипп, респираторно-синцитиальный вирус, герпес-вирусы (цитомегаловирус, вирус Эпштейна–Барр, вирусы простого герпеса), вирус Коксаки и др.). Для значительной части больных ХОБЛ характерна длительная персистенция указанных вирусов в организме, которая может приводить к иммуносупрессии и развитию на ее фоне бактериального обострения ХОБЛ. В связи с этим для больных ХОБЛ наряду с защитой против бактериальных патогенов (в первую очередь против пневмококка) чрезвычайно важными являются противовирусная защита и способы ее усиления. Было установлено, что вакцинация больных ХОБЛ препаратом Превенар 13 приводит к активации факторов неспецифической антибактериальной защиты (усиление фагоцитоза) и + + + + + факторов противовирусной защиты (CD3 CD8 , CD3 CD16 CD56 ), чего не наблюдается при использовании вакцины Пневмо 23 [13–15]. Сроки вакцинации или ревакцинации конкретными вакцинами в последующие годы • Не привитым ранее против ПИ пациентам с ХОБЛ (в любом возрасте) сначала вводится ПКВ13 (Превенар 13), через 1 год – ППВ23 (Пневмо 23), затем каждые 5 лет Пневмо 23. • Пациентам с ХОБЛ, получавшим ранее вакцинацию против ПИ с использованием ППВ23 (Пневмо 23), не ранее чем через 1 год после этого вводится однократно Превенар 13. В последующем через каждые 5 лет после предыдущего введения Пневмо 23 вводится ППВ. Вакцинация против вируса гриппа Почему необходима вакцинация против гриппа у больных ХОБЛ? См. подраздел «Почему необходима вакцинация против ПИ, ХИБ-инфекции и вируса гриппа у больных ХОБЛ?» настоящего раздела (с. 55). Когда и как проводить вакцинацию? • Вакцинацию больных ХОБЛ против вируса гриппа проводят в период ремиссии основного заболевания на фоне базисной терапии ХОБЛ. В случае обострения ХОБЛ вакцинацию проводят через 2–4 нед после купирования обострения, на фоне базисной терапии ХОБЛ. Вакцинацию против гриппа можно проводить круглогодично, хотя наилучший 59 IV. Подходы к вакцинации больных с бронхолегочной патологией эффект достигается при ее осуществлении перед началом эпидемического сезона. • Рекомендации по вакцинации против вируса гриппа больным ХОБЛ дают врачи-терапевты, врачи общей практики, пульмонологи, кардиологи, аллергологи-иммунологи, врачи стационаров перед выпиской пациента с ХОБЛ. • Осмотр пациента с ХОБЛ перед вакцинацией проводит врач-терапевт или врач другой специальности. • Вакцинацию против вируса гриппа у пациентов с ХОБЛ проводят амбулаторно: в кабинете вакцинопрофилактики поликлиники либо в частных медицинских центрах, занимающихся вакцинацией. При возникновении неблагополучной эпидемической ситуации по гриппу допускается вакцинация в стационаре на фоне базисной терапии, за исключением больных, находящихся в палате интенсивной терапии. Информация для пациента. См. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 56). • Следует отметить, что частота возникновения общих системных и местных реакций после введения вакцин против гриппа существенно ниже, чем при использовании пневмококковых вакцин. • Наблюдение за пациентом после вакцинации см. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 57). Ожидаемый эффект вакцинации Проведенное нами исследование свидетельствует о том, что моновакцинация против гриппа приводит к статистически значимому снижению числа обострений ХОБЛ – с 2 [2; 3] до 1 [0; 2] (p < 0,05) и количества курсов антимикробных химиопрепаратов – с 2 [2; 3] до 0 [0; 1] (p < 0,05). По сравнению с отсутствием вакцинации моновакцинация против вируса гриппа уменьшает риск необходимости приема антимикробных химиопрепаратов у больных ХОБЛ на 35%. Моновакцинация против вируса гриппа сопровождается положительной тенденцией в отношении увеличения ОФВ – c 1130 (130) до 1 1170 (80) мл (с 33,7% (3,4%) до 35,8% (2,2%), р > 0,05), кроме того, отмечается прирост показателей теста с 6-минутной ходьбой – с 351 (14,5) до 364 (16,2) м (р > 0,05). Также было установлено, что моновакцинация против вируса гриппа у пациентов с ХОБЛ сопровождается адекватным иммунным ответом – формированием антител к вакцинным антигенам. Среди больных ХОБЛ группой риска с тенденцией к слабовыраженному ответу на вакцинацию против вируса гриппа являются пациенты, имеющие длительный стаж 60 Вакцинация больных ХОБЛ ХОБЛ, частые респираторные инфекции, обострения ХОБЛ, требующие госпитализации, применения системных глюкокортикостероидов и антимикробных химиопрепаратов [16]. Сроки вакцинации в последующие годы Вакцинацию проводят ежегодно в осенний период с применением инактивированных субъединичных и сплит-вакцин. При угрозе возникновения пандемии или ожидания циркуляции новых штаммов вируса гриппа, ранее не входивших в состав вакцины, больным ХОБЛ целесообразно вводить две дозы вакцины с интервалом 21–28 дней. Сочетанная вакцинация против вируса гриппа, пневмококковой и гемофильной типа b инфекций Почему необходима сочетанная вакцинация против вируса гриппа, ПИ и ХИБ-инфекции? См. подраздел «Почему необходима вакцинация против ПИ, ХИБ-инфекции и вируса гриппа у больных ХОБЛ?» настоящего раздела (с. 55). Сочетанная вакцинация имеет преимущества перед моновакцинацией, поскольку дает возможность одномоментно защитить пациентов (ранее не привитых) от вакциноуправляемых респираторных инфекций. Вакцинация против ХИБ-инфекции у больных ХОБЛ на практике очень редко проводится, поскольку в инструкции по применению вакцины не указана эта категория пациентов. Тем не менее результаты проведенных исследований демонстрируют эффект вакцинации у больных ХОБЛ [5, 17]. Когда и как проводить вакцинацию? • Сочетанную вакцинацию пациентов с ХОБЛ против вируса гриппа, ПИ и ХИБ-инфекции проводят в период ремиссии основного заболевания, на фоне базисной терапии ХОБЛ. В случае обострения ХОБЛ вакцинацию проводят через 2–4 нед после купирования обострения, на фоне базисной терапии ХОБЛ. • Рекомендации по сочетанной вакцинации против вируса гриппа, ПИ и ХИБ-инфекции пациентам с ХОБЛ дают врачи-терапевты, врачи общей практики, пульмонологи, кардиологи, аллергологи-иммунологи, врачи стационаров перед выпиской пациента с ХОБЛ. • Осмотр пациента с ХОБЛ перед сочетанной вакцинацией проводит врач-терапевт или врач другой специальности. • Сочетанную вакцинацию пациентов с ХОБЛ проводят амбулаторно: в кабинете вакцинопрофилактики поликлиники либо в частных меди61 IV. Подходы к вакцинации больных с бронхолегочной патологией цинских центрах, занимающихся вакцинацией. Допускается сочетанная вакцинация больных ХОБЛ при выписке из стационара при удовлетворительном состоянии пациента. Сочетанную вакцинацию против вируса гриппа, ПИ и ХИБ-инфекции проводят одномоментно (в разные участки тела), в случае обращения пациента в осенний период (когда проводится вакцинация против вируса гриппа) либо в любое время года. Информация для пациента. См. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 56). Поскольку при сочетанной вакцинации вводится несколько вакцинных препаратов, существует вероятность некоторого увеличения частоты местных и общих реакций, и об этом необходимо информировать пациента. • Наблюдение за пациентом после вакцинации см. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 57). Ожидаемый эффект вакцинации Было проведено пилотное исследование по сочетанной вакцинации против вируса гриппа, ПИ и ХИБ-инфекции больных ХОБЛ. Отмечена безопасность такой сочетанной вакцинации. После сочетанной вакцинации у больных ХОБЛ количество обострений заболевания через 1 год снизилось в 3,7 раза, а число проведенных курсов антимикробной химиотерапии уменьшилось в 4,3 раза. Через 6 и 12 мес после вакцинации выявлены более высокие значения относительных показателей ОФВ (57,9 ± 3,02 против 51,1 ± 1,13% и 1 57,4 ± 2,0 против 50,4 ± 2,8% соответственно; р < 0,05) и теста с 6-минутной ходьбой (73,9 ± 2,83 против 62,2 ± 1,28% и 75,2 ± 2,8 против 60,4 ± 2,3% соответственно; р < 0,001) в группе вакцинированных больных по сравнению с непривитыми пациентами с ХОБЛ. Интересен микробиологический эффект сочетанной вакцинации больных ХОБЛ. В группе вакцинированных больных через 12 мес от начала наблюдения у меньшего числа пациентов выделялись с мокротой S. pneumoniae по сравнению с исходными данными, в 88,0% случаев отмечена элиминация пневмококка из мокроты. Аналогично, через 12 мес от начала исследования у вакцинированных пациентов с ХОБЛ гемофильная палочка выделялась с мокротой статистически значимо реже, чем у непривитых (6,5 и 24,5% случаев соответственно; р < 0,05). Ни в одном случае у вакцинированных больных ХОБЛ через 12 мес не отмечалась контаминация мокроты гемофильной палочкой в случае ее исходного отсутствия. У 16,3% невакцинированных пациентов с ХОБЛ через 12 мес от начала наблюдения отмечалась контаминация мокроты H. influenzaе при изначальном ее отсутствии. 62 Вакцинация больных ХОБЛ с ишемической болезнью сердца 28. Приказ Министерства здравоохранения Российской Федерации (Минздрав России) от 21 марта 2014 г. № 125н г. Москва «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям». Доступно по: http://www.rg.ru/2014/05/16/kalendar-dok.html (ссылка активна на 21.09.2016). Вакцинация больных ХОБЛ с ишемической болезнью сердца Хроническая патология дыхательных путей часто сочетается с ишемической болезнью сердца (ИБС). Ишемическая болезнь сердца – группа заболеваний, обусловленных несоответствием между потребностью миокарда в кислороде и его доставкой. Общепризнанной морфологической основой ИБС является атеросклероз коронарных артерий (95–98% всех случаев заболевания). Почему необходима вакцинация против ПИ и вируса гриппа у больных ХОБЛ с ИБС? Чаще всего приходится задумываться о вакцинации пациентов с заболеваниями респираторного тракта в связи с устоявшимися представлениями о роли инфекционных агентов в генезе воспаления в бронхолегочной системе. Однако не меньшую актуальность вакцинопрофилактика ПИ имеет и при большинстве сердечно-сосудистых заболеваний. Эту проблему можно рассматривать с нескольких позиций. Во-первых, респираторные и сердечно-сосудистые заболевания, в частности ХОБЛ и ИБС, имеют общие факторы риска, такие как курение, урбанизация, низкая физическая активность, старение популяции, генетическая предрасположенность [1]. Крайне опасным фактором риска признано курение. Так, среди пациентов, госпитализированных с ПИ, у курильщиков отмечалось 5-кратное увеличение риска смерти от пневмококковой внебольничной пневмонии в течение 30 дней по сравнению с некурящими и отказавшимися от употребления табака больными [2]. Во-вторых, ИБС и ХОБЛ имеют общий механизм в виде формирования системного воспаления. Предполагается, что усиление локального воспаления в бронхах, легочной паренхиме и сосудах оказывает системное воздействие и способствует прогрессированию ХОБЛ, развитию атеросклероза и сердечной патологии у таких больных. Существует ряд предположений о взаимосвязи кардиоваскулярной патологии и ХОБЛ, в основе которой лежат гипоксемия, эндотелиальная дисфункция, оксидативный стресс, цитокиновый дисбаланс, избыточная 67 IV. Подходы к вакцинации больных с бронхолегочной патологией сосудистая жесткость. Известно, что снижение ОФВ на 10% увеличивает 1 риск сердечно-сосудистой смерти на 28%, а риск нефатальных коронарных событий – на 20% [1]. В-третьих, воспаление поддерживается инфекционными агентами. Среди основных причин обострений ХОБЛ удельный вес инфекций достигает 80%, из них 50% – бактериальной этиологии. Полученные в последнее время данные не только позволяют верифицировать бронхолегочную инфекцию, подтверждая ее роль при обострениях ХОБЛ, но и свидетельствуют о взаимосвязи тяжести обострения заболевания и характера выделенной микробной флоры [3]. Так, у больных с обострением ХОБЛ с показателями ОФВ более 50% от должных основным этиологи1 фактором инфекционного обострения (почти 50% случаев) оказались S. pneumoniae и S. aureus [3]. И главное – и ХОБЛ, и ИБС являются социально значимыми заболеваниями, вносящими колоссальный вклад в структуру заболеваемости и смертности [4]. С наибольшим риском в отношении развития ПИ ассоциируются такие сердечно-сосудистые заболевания, как ИБС и хроническая сердечная недостаточность. Последняя является мощным фактором, повышающим риск летального исхода ПИ в течение 30 дней, причем этот риск прямо коррелирует со степенью тяжести хронической сердечной недостаточности [2]. Вакцинация против пневмококковой инфекции Когда и как проводить вакцинацию? • У пациентов с ХОБЛ и ИБС вакцинацию против ПИ проводят в период ремиссии основного заболевания, на фоне базисной терапии ХОБЛ и ИБС. В случае обострения заболевания вакцинацию против ПИ проводят через 2–4 нед после купирования обострения, по достижении минимальной степени гемодинамических нарушений, на фоне базисной терапии ХОБЛ и ИБС [5, 6]. • Рекомендации по поводу вакцинации против ПИ пациентам с ХОБЛ и ИБС дают врачи-терапевты, врачи общей практики, пульмонологи, кардиологи, аллергологи-иммунологи, врачи стационаров перед выпиской пациента с ХОБЛ и ИБС. • Осмотр пациента с ХОБЛ и ИБС перед вакцинацией против ПИ проводит врач-терапевт или врач другой специальности. • Вакцинацию против ПИ у пациентов с ХОБЛ и ИБС проводят амбулаторно: в кабинете вакцинопрофилактики поликлиники либо в частных медицинских центрах, занимающихся вакцинацией. В редких случа68 Вакцинация больных ХОБЛ с ишемической болезнью сердца ях, при удовлетворительном состоянии пациентов, проживающих в местах, отдаленных от медицинских учреждений, а также при других обстоятельствах, допускается вакцинация при выписке из стационара. Информация для пациента. См. в подразделе «Вакцинация против пневмококковой инфекции» раздела «Вакцинация больных ХОБЛ» (с. 56). • Наблюдение за пациентом после вакцинации см. в подразделе «Вакцинация против пневмококковой инфекции» раздела «Вакцинация больных ХОБЛ» (с. 57). Ожидаемый эффект вакцинации Эффективность вакцинопрофилактики у пациентов с сочетанием ХОБЛ и ИБС была проанализирована в когорте из 306 больных, наблюдавшихся в городском пульмонологическом центре Челябинска. Для вакцинации использовались ПКВ13 (Превенар 13) и ППВ23 (Пневмо 23) [5–7]. По результатам исследования были сделаны следующие выводы: • сочетанное течение ХОБЛ и ИБС характеризуется увеличением тяжести заболевания, ухудшением респираторных симптомов и бронхиальной проходимости, утяжелением функционального класса стенокардии; • при вакцинации ПКВ13 уменьшались субъективные проявления одышки (снижение индекса по шкале MRC в 2 раза) у пациентов как с сочетанным течением ХОБЛ и ИБС, так и при изолированных их формах; • в 3-летней перспективе после вакцинации ПКВ13 сохранялось достоверное увеличение функциональных показателей респираторной и сердечно-сосудистой систем – ОФВ (с 46,11 до 52,26%) и фракции 1 выброса левого желудочка (с 51,52 до 62,86%); • у вакцинированных ПКВ13 больных с сочетанной патологией достоверно снижались частота обострений ХОБЛ (в 8 раз) и число госпитализаций (в 4 раза); • у пациентов с ИБС после вакцинации ПКВ13 в 2 раза уменьшалось количество эпизодов нестабильной стенокардии, госпитализаций и пневмоний. Экономическая составляющая вакцинопрофилактики Ведение больных ХОБЛ с ИБС связано с высокими затратами – как прямыми (стоимость ресурсов здравоохранения, необходимых для диагностики и лечения), так и непрямыми (выраженные в денежном эквиваленте последствия инвалидизации, пропусков работы, преждевременной смерти, а также связанные с заболеванием затраты семей или лиц, ухаживающих за больным). В развитых странах общие экономические расходы, связанные с ХОБЛ и ИБС, занимают 1-е место по прямым затратам [7]. 69 IV. Подходы к вакцинации больных с бронхолегочной патологией В связи с изложенными фактами особую актуальность приобретают различные меры профилактики, в частности вакцинопрофилактика. Вакцинация против гриппа и ПИ является эффективным средством профилактики бронхообструктивных заболеваний и их обострений, снижает риск летальных исходов (класс рекомендаций I, уровень доказательности А) [8]. По результатам проведенного в Челябинске исследования, при использовании ПКВ13 минимизировались издержки системы здравоохранения на лечение больных ХОБЛ. При этом экономия бюджета через 1 год после вакцинации достигала 64%, через 1,5 года – 70%, а в группе пациентов с ХОБЛ + ИБС – 82,1% в течение 3 лет. Применение ППВ23 было связано со снижением клинической эффективности со временем, а возможная экономия бюджетных средств составила 55 и 47% через 1 и 1,5 года соответственно. Сроки вакцинации или ревакцинации конкретными вакцинами в последующие годы Не привитым ранее против ПИ пациентам с ХОБЛ и ИБС сначала вводится ПКВ13 (Превенар 13), через 1 год – ППВ23 (Пневмо 23), затем каждые 5 лет Пневмо 23. Пациентам с ХОБЛ и ИБС, получавшим ранее вакцинацию против ПИ с использованием ППВ23 (Пневмо 23), в последующем не ранее чем через 1 год вводится однократно Превенар 13. Затем через каждые 5 лет после предыдущего введения Пневмо 23 вводится ППВ [9, 10]. Вакцинация против вируса гриппа См. в подразделе «Вакцинация против вируса гриппа» раздела «Вакцинация больных ХОБЛ» (с. 59). Нам не удалось найти работы по вакцинации пациентов с ХОБЛ в сочетании с ИБС, но можно предположить, что клинический эффект вакцинации против вируса гриппа может быть выше, поскольку будет отражаться на статусе бронхолегочной и сердечно-сосудистой систем. Список литературы 1. Куценко М.А., Чучалин А.Г. Парадигма коморбидности: синтропия ХОБЛ и ИБС. Русский медицинский журнал 2014; 5: 389–392. 2. Torres A., Blasi F., Dartois N., Akova M. Which individuals are at increased risk of pneumococcal disease and why? Impact of COPD, asthma, smoking, diabetes, and/or chronic heart disease on community-acquired pneumonia and invasive pneumococcal disease. Thorax 2015; 70(10): 984–989. 3. Дворецкий Л.И. Инфекционное обострение ХОБЛ. Лечащий врач 2007; 3: 80–84. 70 Вакцинация больных бронхиальной астмой 4. Диспансерное наблюдение больных хроническими неинфекционными заболеваниями и пациентов с высоким риском их развития. Методические рекомендации. Под ред. С.А. Бойцова, А.Г. Чучалина. М., 2014; 112с. 5. Чучалин А.Г., Биличенко Т.Н., Зверев В.В. и др. Иммунизация полисахаридной поливалентной вакциной для профилактики пневмококковой инфекции. Методические рекомендации (утв. Главным санитарным врачом РФ 8 февраля 2008 г. № 01/816-8-34). М., 2008; 12c. 6. Инструкция по применению лекарственного препарата для медицинского применения Превенар 13. Доступно по: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid= c46b7ab8-2e68-430f-af83-854e152703f4&t= (ссылка активна на 20.09.2016). 7. Игнатова Г.Л., Антонов В.Н., Родионова О.В. Экономическая оценка вакцинопрофилактики больных хронической обструктивной болезнью легких и ишемической болезнью сердца. Пульмонология 2015; 3: 312–319. 8. Крысанов И.С. Анализ стоимости хронической обструктивной болезни легких в Российской Федерации. Качественная клиническая практика 2014; 2: 51–56. 9. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management and prevention of COPD. Revised 2016. Bethesda: GOLD 2016. Available at: http://goldcopd.org/ (accessed 21.09.2016). 10. 23-валентная пневмококковая полисахаридная вакцина. Документ с изложением позиции ВОЗ. Еженедельный эпидемиологический бюллетень 2008; 83(42): 373–384. Доступно по: http://www.who.int/immunization/documents/Russian_PPV23_translation_15_Dec_08.pdf?ua=1 (ссылка активна на 21.09.2016). Вакцинация больных бронхиальной астмой Вакцинация против пневмококковой инфекции Почему необходима вакцинация против ПИ у больных БА? Бронхиальная астма является хроническим воспалительным заболеванием дыхательных путей, при котором воспаление индуцируется контактом с аллергенами, поллютантами, промышленными факторами или респираторной инфекцией. S. pneumoniae является одним из наиболее частых бактериальных аллергенов при БА (42,3% случаев). Микроорганизмы у больных БА оказывают двоякое действие: с одной стороны, сенсибилизирующее, с другой – бактериальная инфекция (в том числе S. pneumoniae) вызывает хроническое неспецифическое воспаление в бронхах, усиливая их гиперреактивность [1]. Когда и как проводить вакцинацию? • У пациентов с БА вакцинацию против ПИ проводят в период контролируемого течения заболевания, на фоне базисной терапии. В случае обострения вакцинацию против ПИ проводят через 2–4 нед после купирования обострения, на фоне базисной терапии БА. 71 IV. Подходы к вакцинации больных с бронхолегочной патологией • Рекомендации по поводу вакцинации против ПИ пациентам с БА дают врачи-терапевты, врачи общей практики, пульмонологи, аллергологи-иммунологи, врачи стационаров перед выпиской пациента с БА. • Осмотр пациента с БА перед вакцинацией против ПИ проводит врач-терапевт или врач другой специальности. • Вакцинацию против ПИ у пациентов с БА проводят амбулаторно: в кабинете вакцинопрофилактики поликлиники, в частных медицинских центрах, занимающихся вакцинацией. Допускается вакцинация больных БА при выписке из стационара при удовлетворительном состоянии пациента. Информация для пациента. См. в подразделе «Вакцинация против пневмококковой инфекции» раздела «Вакцинация больных ХОБЛ» (с. 56). Ожидаемый эффект вакцинации У пациентов с БА вакцинация против ПИ на фоне проводимой базисной терапии оказывает ряд положительных эффектов, таких как статистически значимое уменьшение числа обострений БА – с 2 [1; 2,5] до 0 [0; 0,5] (р < 0,001), сокращение количества курсов антимикробных химиопрепаратов, принимаемых по любым причинам, – с 1 [0,5; 2] до 0 [0; 1] (р < 0,05), а также числа госпитализаций по поводу обострения БА – с 0 [0; 1] до 0 [0; 0] (р < 0,01) по сравнению с периодом до вакцинации. Снижение числа обострений БА на фоне вакцинации против ПИ приводит к улучшению показателей качества жизни, связанных со здоровьем. Было проведено исследование по оценке показателей качества жизни, связанных со здоровьем, с использованием специального вопросника по контролю БА – АСQ-5 (Asthma Control Questionnaire). Полученные результаты свидетельствовали об улучшении показателей качества жизни у больных БА на фоне вакцинации против ПИ (снижение показателя по ACQ-5 с 2 [1,5; 1,8; 3] баллов (отсутствие контроля БА) до 0,6 [0; 1] балла (контроль БА), р < 0,001). Вакцинация против ПИ у больных БА приводит к элиминации возбудителя из мокроты. Так, у детей с БА однократное введение пневмококковой вакцины способствует элиминации S. pneumoniae из мокроты в 88% случаев, а в остальных случаях приводит к переходу ассоциации микробов в монокультуру. Вакцинация против ПИ сопровождается у пациентов с БА увеличением содержания IgG-антител к смеси полисахаридов, входящих в состав вакцины, что приводит к снижению уровня IgE-антител к S. pneumoniae, свидетельствуя о гипосенсибилизирующем действии вакцинации [2]. 72 Вакцинация больных бронхиальной астмой Вакцинация против ПИ не только способствует достижению клинического эффекта у больных БА, но и оказывает иммунокорригирующее действие, что, собственно, и лежит в основе улучшения клинического статуса вакцинированного пациента с БА. Так, было выявлено формирование иммунологической памяти к антигенам пневмококка, отвечающей за длительность поствакцинального иммунитета у пациентов с БА, привитых ПКВ13 (Превенар 13). При этом наиболее выраженная иммунологиче+ память (CD45RO ) формировалась в случае, когда сначала вводилась ПКВ13 (Превенар 13), а затем ППВ23 (Пневмо 23). Применение только ППВ не сопровождалось формированием иммунологической памяти. Сроки вакцинации и ревакцинации конкретными вакцинами в последующие годы Не привитым ранее против ПИ пациентам с БА сначала вводится ПКВ13 (Превенар 13), через 1 год – ППВ23 (Пневмо 23), затем через каждые 5 лет – Пневмо 23. Пациентам с БА, получавшим ранее вакцинацию против ПИ с использованием ППВ (Пневмо 23), в последующем не ранее чем через 1 год вводится однократно Превенар 13, затем через каждые 5 лет после предыдущего введения Пневмо 23 вводится ППВ. Вакцинация против вируса гриппа Почему необходима вакцинация против вируса гриппа больных БА? Бронхиальная астма является хроническим воспалительным заболеванием дыхательных путей, при котором воспаление индуцируется контактом с аллергенами, поллютантами, промышленными факторами или респираторной инфекцией. Респираторные вирусы, в том числе вирус гриппа, вызывают обструкцию преимущественно малых дыхательных путей и бронхиальную гиперреактивность, которые служат одной из основных причин обострения БА. Когда и как проводить вакцинацию? • Вакцинацию против вируса гриппа у пациентов с БА проводят в период контролируемого течения заболевания, на фоне базисной терапии БА. В случае обострения вакцинацию проводят через 2–4 нед после купирования обострения, на фоне базисной терапии БА. Наилучший эффект вакцинации достигается при ее проведении перед началом эпидемического сезона гриппа, хотя ее можно проводить круглогодично. IV. Подходы к вакцинации больных с бронхолегочной патологией • Рекомендации по поводу вакцинации против вируса гриппа пациентам с БА дают врачи-терапевты, врачи общей практики, пульмонологи, аллергологи-иммунологи, врачи стационаров перед выпиской пациента с БА. • Осмотр пациента с БА перед вакцинацией против вируса гриппа проводит врач-терапевт или врач другой специальности. • Вакцинацию у пациентов с БА проводят амбулаторно: в кабинете вакцинопрофилактики поликлиники либо в частных медицинских центрах, занимающихся вакцинацией. При возникновении неблагополучной эпидемической ситуации по гриппу допускается вакцинация в стационаре на фоне базисной терапии, за исключением больных, находящихся в палате интенсивной терапии. Информация для пациента. См. в подразделе «Вакцинация против пневмококковой инфекции» раздела «Вакцинация больных ХОБЛ» (с. 56). • Следует отметить, что частота развития общих системных и местных реакций после введения вакцин против гриппа у пациентов с БА существенно ниже, чем при использовании пневмококковых вакцин. Ожидаемый эффект вакцинации Вакцинация против вируса гриппа у пациентов с БА приводит к снижению частоты и длительности обострений и госпитализаций в 2 раза. Также отмечается синтез антител в защитных титрах к вакцинным штаммам вируса гриппа. Кроме того, наблюдается снижение уровня маркеров системного воспаления [3]. Сроки вакцинации в последующие годы Рекомендуется проведение вакцинации ежегодно в осенний период с применением инактивированных субъединичных и сплит-вакцин. При угрозе возникновения пандемии или ожидании циркуляции новых типов вируса гриппа, ранее не входивших в состав вакцины, больным БА целесообразно вводить две дозы вакцины с интервалом 21–28 дней. Список литературы 1. Лукачев И.В. Специфический IgG-, IgE-ответ и течение бронхиальной астмы у детей в процессе вакцинации препаратами «Pneumo-23» и «Act-Hib»: Автореф. дис. … канд. мед. наук. М., 2004. 2. Рыжов А.А. Вакцины «Pneumo-23» и «Act-HIB» в профилактике и лечении хронических заболеваний легких у детей: Автореф. дис. … канд. мед. наук. М., 2004. 3. Чебыкина А.В., Костинов М.П. Поствакцинальный иммунитет против гриппа у пациентов с хронической бронхолегочной патологией. Журнал микробиологии, эпидемиологии и иммунобиологии 2011; 4: 76–80. 74 Вакцинация кандидатов на трансплантацию и лиц после трансплантации легких Вакцинация кандидатов на трансплантацию и лиц после трансплантации легких Трансплантация легких является признанным методом лечения терминальных стадий болезней легких у ряда пациентов с исчерпанным медикаментозным ресурсом лечения. По данным разных авторов, летальность пациентов из листа ожидания трансплантации легких составляет 20–30% ввиду того, что ряд больных не дожидаются трансплантации, так как обращаются за помощью слишком поздно. Показаниями к трансплантации легких являются такие наиболее распространенные нозологии, как ХОБЛ, идиопатический фиброзирующий альвеолит, муковисцидоз, α эмфизема легких, обусловленная недостаточностью -антитрипсина, 1 первичная легочная гипертензия, а также более редкие болезни легких и состояния: саркоидоз, лимфангиолейомиоматоз, гистиоцитоз, болезни соединительной ткани, интерстициальный пневмонит, ретрансплантация легких [1]. Почему необходима вакцинация против ПИ, ХИБ-инфекции и вируса гриппа у кандидатов на трансплантацию и лиц после трансплантации легких? Согласно международным протоколам, пациенты, относящиеся к категории лиц до и после трансплантации легких, должны быть вакцинированы против всех вакциноуправляемых инфекций. В данном разделе будут рассмотрены только вакциноуправляемые инфекции. Во время нахождения пациента в листе ожидания, так же как и в послеоперационном периоде, профилактика и лечение инфекционных заболеваний играют одну из ведущих ролей, поскольку респираторные инфекции представляют собой серьезную проблему из-за массивной иммуносупрессивной терапии. Респираторные инфекции вирусной и бактериальной природы у этой категории больных протекают в более тяжелой форме, ухудшают течение основного заболевания, чаще вызывают развитие осложнений и могут представлять угрозу жизни. В посттрансплантационном периоде риск возникновения инфекционных осложнений у пациентов с пересаженными легкими резко возрастает в связи c индуцированной иммуносупрессией, которая осуществляется с целью предотвращения отторжения трансплантата. Проводимая пожизненно иммуносупрессивная терапия нарушает ключевые механизмы как 75 IV. Подходы к вакцинации больных с бронхолегочной патологией врожденного, так и приобретенного иммунитета и снижает способность организма к реализации клеточного и гуморального ответов на введение вакцинного антигена [2, 3]. Реципиентам легких проводится более жесткая иммуносупрессивная терапия по сравнению с реципиентами других солидных органов, что делает их более уязвимыми к воздействию различных инфекционных агентов [4]. Кроме того, предрасполагающими факторами к развитию инфекционных процессов у этой категории больных являются постоянное воздействие на аллографт факторов окружающей среды, нарушение мукоцилиарного клиренса, денервация аллографта, угнетение кашлевого рефлекса, проблемы с анастомозом, эпизоды острого отторжения трансплантата, требующие усиления иммуносупрессивной терапии [5]. Как следствие, инфекционные осложнения после трансплантации легких встречаются в 2 раза чаще, чем после трансплантации сердца. Наиболее частым местом инфекции является само пересаженное легкое [6–8]. Одновременно с этим имеются данные о способности инфекционных агентов вызывать отторжение трансплантата. Грипп, ПИ и ХИБ-инфекция являются доминирующими при обострениях хронических заболеваний бронхолегочной системы [9–11], а после трансплантации легких часто возникают герпетическая (цитомегаловирус, вирус простого герпеса и др.) и грибковая инфекции, а также появляются P. aeruginosa, S. aureus [1]. Вакцинопрофилактика представляет собой эффективный способ предотвращения респираторных инфекций и рекомендована пациентам групп риска [12, 13]. Так, ежегодная профилактика гриппа на 50% снижает частоту осложнений и смертность среди пациентов группы риска [14]. Также установлена эффективность вакцинации против ПИ в профилактике осложнений гриппа [15] и в снижении частоты инвазивных форм инфекции, которые у реципиентов солидных органов встречаются в 12,7 раза чаще, чем у здоровых лиц [16, 17]. Однако охват вакцинацией пациентов группы риска остается низким. Так, против ПИ вакцинируется 23,8–62,4% кандидатов на трансплантацию легких [16, 18]. Вакцинация против пневмококковой инфекции Когда и как проводить вакцинацию? • Вакцинация кандидатов на трансплантацию солидного органа, в том числе легких, должна проводиться как можно раньше после решения о постановке в лист ожидания. Имеющиеся данные свидетельствуют о том, что у пациентов, находящихся на поздних стадиях заболеваний, 76 Вакцинация кандидатов на трансплантацию и лиц после трансплантации легких ниже уровни протективных антител к вакциноуправляемым инфекциям, а также меньше длительность поствакцинального иммунитета в сравнении со здоровыми лицами. В посттрансплантационном периоде эффективность вакцинации может быть еще более низкой из-за проводимой иммуносупрессивной терапии [19–21]. • Вакцинация проводится в отсутствие обострения основного заболевания и инфекционных процессов, а в посттрансплантационном периоде – при отсутствии данных, свидетельствующих об отторжении трансплантата, на фоне базисной терапии. Реакция отторжения трансплантата наряду с инфекционными процессами является одним из частых осложнений посттрансплантационного периода. При этом указанное состояние может быть выявлено как при проведении плановой биопсии, так и при внеплановом обращении пациента в связи с ухудшением состояния (появлении респираторных жалоб, таких как одышка). В последнем случае необходимо выполнение биопсии трансплантата легкого для подтверждения диагноза и проведения дифференциальной диагностики с инфекционным процессом, так как принципиальные подходы к лечению этих состояний различные. В случае подтверждения реакции отторжения трансплантата проводится пульс-терапия глюкокортикостероидами. • Рекомендации по поводу вакцинации против ПИ пациентам-кандидатам на трансплантацию и лицам после трансплантации органов дают пульмонологи, врачи-терапевты, врачи общей практики, аллергологи-иммунологи. пациентов перед вакцинацией против ПИ проводит врач-терапевт или врач другой специальности. • Вакцинация проводится врачом-специалистом в стационарных или амбулаторных условиях. Учитывая тяжесть состояния пациентов по основному заболеванию, сложности транспортировки в лечебное учреждение, возможно проведение вакцинации на дому. При этом необходимо соблюдение всех условий, включая температурный режим транспортировки вакцины, наличие препаратов неотложной терапии и наблюдение за состоянием пациента в течение 30–45 мин после введения вакцины. • Введение вакцинного препарата проводится согласно инструкции, при этом возможно одномоментное введение вакцин против гриппа, ПИ и ХИБ-инфекции в разные участки тела. Информация для пациента. Введение инактивированных вакцин против ПИ, ХИБ-инфекции и гриппа хорошо переносится пациентами как перед операцией, так и в посттрансплантационном периоде. В течение 77 Вакцинация кандидатов на трансплантацию и лиц после трансплантации легких максимальна, если она проводится в предтрансплантационном периоде [29]. В настоящее время в таких случаях применяются как ППВ, так и ПКВ. Рекомендуется вакцинация против ПИ с использованием ПКВ13, с последующим введением через 8 нед ППВ23. Если пациент ранее был привит против ПИ с использованием ППВ23, введение ПКВ рекомендуется не ранее чем через 1 год, а ревакцинация ППВ – через 5 лет [13, 30]. В посттрансплантационном периоде вакцинация против ПИ, если она не была проведена до операции, может быть выполнена через 3–6 мес после оперативного вмешательства с использованием ПКВ13, через 8 нед – введение ППВ23, ревакцинация – через 5 лет ППВ23 [31]. Вакцинация против вируса гриппа Когда и как проводить вакцинацию? • См. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 76). Ожидаемый эффект вакцинации Клиническая эффективность вакцинации против гриппа выражается в сокращении длительности обострений основного заболевания, уменьшении числа острых респираторных инфекций, снижении потребности в базисной и симптоматической терапии [24, 32]. Вакцинация против гриппа у пациентов с хронической бронхолегочной патологией обеспечивает специфическую защиту против гриппа в течение 1 года после введения вакцины, о чем свидетельствуют показатели иммуногенности гриппозных вакцин у этих пациентов [24, 32]. При вакцинации против гриппа полимер-субъединичной вакциной у 19 пациентов листа ожидания трансплантации легких была выявлена высокая иммунологическая эффективность препарата. Через 1 мес после введения вакцины наблюдалось статистически значимое нарастание титров антител ко всем подтипам вируса гриппа. Среднегеометрический титр (СГТ) антител к штаммам вируса гриппа А/H1N1, А/H3N2 и типа В составил 1 : 115, 1 : 110 и 1 : 92 соответственно. Титр антител 1 : 40 и более ко всем трем подтипам вируса гриппа, входящим в состав вакцины, был зарегистрирован у 13 пациентов (68,4%). Показатели серопротекции были следующими: для штаммов А/H1N1 и типа В – 89,5 ± 7%, для штамма А/H3N2 – 84,2 ± 8,4%. В то же время показатели сероконверсии для указанных штаммов гриппа через 1 мес после вакцинации составили 57,9 ± 11,3; 52,6 ± 11,5 и 47,4 ± 11,5% соответственно. Одновременно с 79 IV. Подходы к вакцинации больных с бронхолегочной патологией этим кратность нарастания титров антител через 1 мес после вакцинации была выше 2,5 для подтипов вируса гриппа А/H1N1 и А/H3N2 – 5,5 и 3,7 соответственно, и только для типа В этот показатель составил 2,3. При анализе полученных результатов были выявлены различия исследуемых показателей у исходно серонегативных и исходно серопозитивных пациентов. В группах исходно серонегативных пациентов в поствакцинальном периоде зарегистрировано достоверное увеличение СГТ антител ко всем трем подтипам вируса гриппа, тогда как в группах пациентов с исходными СГТ антител, превышающими условно-защитный титр, нарастание уровня антител не достигало статистически значимых различий по сравнению с довакцинальными показателями. Однако следует отметить, что уровни антител к штаммам вируса гриппа у этих пациентов через 1 мес после вакцинации имели тенденцию к повышению по сравнению с показателями исходно серонегативных пациентов. Через 12 мес после вакцинации у пациентов отмечалось снижение СГТ антител для всех подтипов вируса гриппа, однако показатели были выше исходных и превышали условно-защитный титр. Одновременно с этим было выявлено снижение показателей серопротекции, но они оставались выше 70% для подтипа вируса гриппа А/H3N2 и типа В. Иммунологическую эффективность вакцинации против гриппа полимер-субъединичной вакциной изучали у 8 пациентов, которым была проведена трансплантация легких. Через 1 мес после введения вакцины была отмечена тенденция к нарастанию титров антител ко всем штаммам вируса гриппа. Показатели серопротекции были следующими: для штамма А/H1N1 – 87,5 ± 11,7%, для штамма А/H3N2 – 75 ± 15,3% и для штамма В – 50 ± 17,7%. В то же время показатели сероконверсии для этих штаммов гриппа через 1 мес после вакцинации были низкими и составили 0–12,5%. Показатели кратности нарастания титров антител через 1 мес после вакцинации также были низкими для всех подтипов вируса гриппа – 1,3–1,5. Через 12 мес после вакцинации показатели серопротекции составили для штамма А/H1N1 100%, для штамма А/H3N2 – 75% и для штамма типа В – 62,5%. Сроки вакцинации конкретными вакцинами в последующие годы Ежегодная вакцинация против гриппа инактивированными вакцинами рекомендована всем пациентам из листа ожидания трансплантации легких [13]. Проводить ее нужно как можно раньше в предсезонный период, в отсутствие обострения основного заболевания и симптомов респираторной инфекции. 80 Вакцинация кандидатов на трансплантацию и лиц после трансплантации легких В посттрансплантационном периоде также рекомендуется ежегодная вакцинация реципиентов, при этом необходимо учитывать, что вакцинация более эффективна, если проводится не ранее чем через 3–6 мес после трансплантации. Однако имеются рекомендации о возможности вакцинации через 1 мес после трансплантации в случае вспышки гриппа [31]. При этом у пациентов после трансплантации легких отмечаются более низкие показатели иммуногенности вакцин против гриппа в сравнении с группами контроля и реципиентами других солидных органов [33–35]. b Вакцинация против гемофильной типа инфекции Когда и как проводить вакцинацию? • См. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 76). Ожидаемый эффект вакцинации Имеются отдельные рекомендации о двукратном введении вакцины с интервалом в 1 мес, однако результаты об иммунологической эффективности разных схем введения не представлены [12]. Вакцинация против ХИБ-инфекции у детей, больных хроническими воспалительными заболеваниями легких, приводит к достоверному увеличению уровня IgG-антител через 1 мес после вакцинации и сохранению их на уровне значений, превышающих исходные, в течение 1 года наблюдения [22, 24]. У взрослых, страдающих хроническими заболеваниями легких, вакцинация против ХИБ-инфекции проводилась сочетанно с вакцинацией против ПИ и вируса гриппа. Результаты исследования свидетельствовали о значительном клиническом эффекте, выражавшемся как в снижении частоты респираторных инфекций, так и в уменьшении вероятности обострения основного заболевания. Однако не представляется возможным оценить эффективность моновакцинации против ХИБ-инфекции. При исследовании уровня IgG-антител было выявлено его нарастание в течение 1 года после вакцинации (срока наблюдения). См. в разделе «Вакцинация больных ХОБЛ» (с. 63). Сроки вакцинации и ревакцинации конкретными вакцинами в последующие годы Вакцинация против ХИБ-инфекции проводится после постановки в лист ожидания. В случае, если пациент не был привит до трансплантации, вакцинация против ХИБ-инфекции возможна не ранее чем через 2–6 мес после оперативного вмешательства. Данных по ревакцинации против ХИБ-инфекции нет. 81 IV. Подходы к вакцинации больных с бронхолегочной патологией Список литературы 1. Трансплантация легких. Национальные клинические рекомендации. 2013. Доступно по: http://transpl.ru/images/cms/data/pdf/nacional_nye_klinicheskie_rekomendacii_po_transplantacii_ legkih_doc.pdf (ссылка активна на 22.09.2016). 2. Gangappa S., Kokko K.E., Carlson L.M. et al. Immune responsiveness and protective immunity after transplantation. Transpl Int 2008; 21(4): 293–303. 3. Mazzone P.J., Mossad S.B., Mawhorteret S.D. et al. Cell-mediated immune response to influenza vaccination in lung transplant recipients. J Heart Lung Transplant 2004; 23(10): 1175–1181. 4. Burguete S.R., Maselli D.J., Fernandez J.F., Levine S.M. Lung transplant infection. Respirology 2013; 18(1): 22–38. 5. Speich R., van der Bij W. Epidemiology and management of infections after lung transplantation. Clin Infect Dis 2001; 33(Suppl. 1): 58–65. 6. Remund K.F., Best M., Egan J.J. Infections relevant to lung transplantation. Proc Am Thorac Soc 2009; 6(1): 94–100. 7. Arcasoy S.M., Kotloff R.M. Lung transplantation. N Engl J Med 1999; 340(14): 1081–1091. 8. Kotloff R.M., Ahya V.N., Crawford S.W. Pulmonary complications of solid organ and hematopoietic stem cell transplantation. Am J Respir Crit Care Med 2004; 170(1): 22–48. 9. Синопальников А.И., Романовских А.Г. Инфекционное обострение хронической обструктивной болезни легких. Атмосфера. Пульмонология и аллергология 2006; 3: 15–22. 10. Bogaert D., van der Valk P., Ramdin R. et al. Host-pathogen interaction during pneumococcal infection in patients with chronic obstructive pulmonary disease. Infect Immun 2004; 72(2): 818–823. 11. От профилактического к терапевтическому эффекту вакцин против пневмококковой и гемофильной типа b инфекций у пациентов с бронхолегочной патологией. Под ред. М.П. Костинова. М., 2007; 182с. 12. Serrano B., Bayas J.M., Bruni L., Díez C. Solid organ transplantation and response to vaccination. Vaccine 2007; 25(42): 7331–7338. 13. Recommended adult immunization schedule – United States-2016. Available at: http://www.cdc.gov/ vaccines/schedules/downloads/adult/adult (accessed 22.09.2016). 14. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management and prevention of COPD. Revised 2016. Bethesda: GOLD 2016. Available at: http://goldcopd.org/ (accessed 22.09.2016). 15. Костинов М.П., Пахомов Д.В., Магаршак О.О., Сухинин М.В. Вакцинопрофилактика пневмококковой инфекции как одной из причин осложнений и летальности при гриппе. Вопросы современной педиатрии 2009; 8(6): 131–134. 16. Kumar D., Humar A., Plevneshiet A. et al. Invasive pneumococcal disease in solid organ transplant recipients – 10-year prospective population surveillance. Am J Transplant 2007; 7(5): 1209–1214. 17. de Bruyn G., Whelan T.P., Mulliganet M.S. et al. Invasive pneumococcal infections in adult lung transplant recipients. Am J Transplant 2004; 4(8): 1366–1371. 18. Gasink L.B., Wurcell A.G., Kotloffet R.M. et al. Low prevalence of prior streptococcus pneumoniae vaccination among potential lung transplant candidates. Chest 2006; 130(1): 218–221. 19. Chow J., Golan Y. Vaccination of solid-organ transplantation candidates. Clin Infect Dis 2009; 49(10): 1550–1556. 20. Danzinger-Isakov L., Kumar D.; AST Infectious Diseases Community of Practice. Guidelines for vaccination of solid organ transplant candidates and recipients. Am J Transplant 2009; 9(Suppl. 4): S258–S262. 21. Duchini A., Goss J.A., Karpenet S., Pockros P.J. Vaccinations for adult solid-organ transplant recipients: current recommendations and protocols. Clin Microbiol Rev 2003; 16(3): 357–364. 22. Применение вакцин «Пневмо 23» и «Акт-ХИБ» в комплексе лечебно-профилактических мероприятий при хронических воспалительных заболеваниях легких у детей. Пособие для врачей. Под ред. М.П. Костинова. М.: Медицина для всех 2004; 48c. 82 Вакцинация больных муковисцидозом 23. Костинов М.П., Протасов А.Д., Жестков А.В., Полищук В.Б. Перспективные данные применения пневмококковой 13-валентной конъюгированной вакцины у взрослых пациентов с хронической бронхолегочной патологией. Пульмонология 2014; 4: 57–62. 24. Kostinov M.P., Zhestkov A.V., Pakhomov D.V. et al. Post-vaccination immunity to pneumococcal, Haemophilus influenzae type b infection and influenza in patients with chronic obstructive pulmonary disease (COPD). J Vaccines Vaccin 2014; 5: 2. 25. Kumar D., Rotstein C., Miyata G. et al. Randomized, double-blind, controlled trial of pneumococcal vaccination in renal transplant recipients. J Infect Dis 2003; 187(10): 1639–1645. 26. Linnemann C.C. Jr., First M.R., Schiffman G. Revaccination of renal transplant and hemodialysis recipients with pneumococcal vaccine. Arch Intern Med 1986; 146(8): 1554–1556. 27. Dransfield M.T., Nahm M.H., Han M.K. et al.; COPD Clinical Research Network. Superior immune response to protein-conjugate versus free pneumococcal polysaccharide vaccine in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 180(6): 499–505. 28. Advisory Committee on Immunization Practices. Recommended adult immunization schedule: United States, October 2007–September 2008. Ann Intern Med 2007; 147(10): 725–729. 29. Sarmiento E., Rodríguez-Hernández C., Rodríguez-Molina J. et al. Impaired anti-pneumococcal polysaccharide antibody production and invasive pneumococcal infection following heart transplantation. Int Immunopharmacol 2006; 6(13–14): 2027–2030. 30. Вакцинация взрослых с бронхолегочной патологией. Руководство для врачей. Под ред. М.П. Костинова. М.: Арт Студия «Созвездие» 2013; 112c. 31. Rubin L.G., Levin M.J., Ljungmanet P. et al.; Infectious Diseases Society of America. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis 2014; 58(3): e44–e100. 32. Костинов М.П., Чучалин А.Г., Чебыкина А.В. Особенности формирования поствакцинального иммунитета к гриппу у пациентов с хронической бронхолегочной патологией. Инфекционные болезни 2011; 9(3): 35–40. 33. Mazzone P.J., Mossad S.B., Mawhorter S.D. et al. The humoral immune response to influenza vaccination in lung transplant patients. Eur Respir J 2001; 18(6): 971–976. 34. Hayney M.S., Welter D.L., Francois M. et al. Influenza vaccine antibody responses in lung transplant recipients. Prog Transplant 2004; 14(4): 346–351. 35. Blumberg E.A., Albano C., Pruettet T. et al. The immunogenicity of influenza virus vaccine in solid organ transplant recipients. Clin Infect Dis 1996; 22(2): 295–302. Вакцинация больных муковисцидозом Почему необходима вакцинация против ПИ, вируса гриппа, ХИБ-инфекции и синегнойной инфекции? Муковисцидоз – частое наследственное аутосомно-рецессивное полиорганное заболевание, связанное с мутацией в гене, кодирующем синтез белка CTFR (cystic fibrosis transmembrane conductance regulator – муковисцидозный трансмембранный регулятор проводимости), формирующего хлорный канал в мембранах клеток. Нарушение транспорта иона хлора между клеткой и межклеточным веществом существенно увеличивает вязкость секрета экзокринных желез, обусловливая их кистозное перерождение. У 95% больных доминируют бронхолегочные изменения, определяющие течение и прогноз болезни. 83 IV. Подходы к вакцинации больных с бронхолегочной патологией Сочетание гиперсекреции чрезмерно вязкой мокроты с нарушением клиренса бронхов приводит к мукоцилиарной недостаточности и накоплению большого количества патогенных микроорганизмов, которым принадлежит ключевая роль в развитии обострения хронического бронхолегочного процесса [1, 2]. В результате изучения микрофлоры нижних дыхательных путей у больных муковисцидозом детей разных возрастных групп было установлено, что основными возбудителями инфекции легких Р. aeruginosa, S. aureus H. influenzae при этом заболевании являются и [3, 4]. В возрасте 8–18 лет нижние дыхательные пути обсеменены у 100% больных. Как правило, в первую очередь респираторные пути инфицируются S. aureus; у пациентов в возрасте до 9 лет могут выявляться S. pneumoniae, нетипируемые штаммы H. influenzae, реже – представители семейства Enterobacteriaceae. По мнению многих авторов, в дальнейшем происходит присоединение P. aeruginosa, как в монокультуре, так и в ассоциациях с другими патогенами. При анализе данных микробиологических исследований установлено, что микроорганизмы выделяются у 61,9% детей в возрасте до 1 года, у 92,9% – в возрасте 1–4 года, у 93,8% – в возрасте 5–7 лет, а в возрасте 8–14 и 15–18 лет – у 100% детей. В возрасте 5–7 лет S. aureus P. aeruginosa выявляется у 87,5% детей, а – у 31,2%. Хроническая стафилококковая, синегнойная или смешанная инфекция начинает диагностироваться уже в возрасте 1–4 лет у 25% детей, больных муковисцидозом, в возрасте 5–7 лет – у 50%, в возрасте 8–14 лет – у 65% и к 18 годам – у 80%, причем более чем в половине случаев хроническая инфекция легких вызывается ассоциацией микроорганизмов. Наиболее часто встречающимися ассоциациями являются P. aeruginosa + S. aureus (18,2%) и P. aeruginosa + + B. cepacia (9,1%) [5–8] (рисунок). В настоящее время установлено, что продолжительность жизни у больных муковисцидозом зависит от этиологии хронической легочной инфекции [9]. Так, хроническая синегнойная инфекция является одной из самых частых причин наиболее тяжелого клинического течения заболевания и его негативных исходов [10–14]. Особенностью бактерий P. aeruginosa, S. aureus является устойчивость ко многим антибиотикам, кроме того, отH. influenzae мечается возрастание антибиотикорезистентности штаммов [9, 14, 15]. По данным анализа антибиотикограмм штаммов установлено, что в процессе лечения штаммы приобретают устойчивость к антимикробным препаратам, это делает возможным длительную персистенцию микроорганизма и препятствует эрадикации возбудителя [9]. Ряд авторов отмечают важную роль вирусов в формировании хронического воспалительного процесса, в частности респираторно-синцитиального вируса, вируса парагриппа и гриппа А и В, аденовируса. Установлена 84 IV. Подходы к вакцинации больных с бронхолегочной патологией Вакцинация против пневмококковой инфекции Почему необходима вакцинация против ПИ? Колонизация респираторного тракта S. pneumoniae у больных муковисцидозом встречается, по оценкам разных авторов, в 5–10% случаев [22–24]. Обострения заболевания, связанные с ПИ, манифестировавшей после вирусной инфекции, отмечались у 35% пациентов [25]. В ходе исследования S. pneumoniae уровня антител к у невакцинированных против ПИ больных муковисцидозом было выявлено отсутствие у них адекватной защиты [26], в связи с чем представляется необходимым вакцинировать эту категорию S. pneumoniae. пациентов против инфекций, вызванных В методических рекомендациях «Эпидемиология и вакцинопрофилактика инфекции, вызываемой Streptococcus pneumoniae» лица с хроническими заболеваниями легких, хроническими заболеваниями печени (включая цирроз), длительно и часто болеющие дети составляют группы, которым в первую очередь показана вакцинация против ПИ [27]. В национальных рекомендациях по вакцинации против ПИ в США, Великобритании, Франции указанная категория пациентов входит в группу риска и подлежит вакцинации вне зависимости от возраста [28–30]. Когда и как проводить вакцинацию? • Вакцинацию против ПИ у пациентов с муковисцидозом проводят в период ремиссии основного заболевания на фоне базисной терапии. В случае обострения муковисцидоза вакцинацию против ПИ проводят через 2–4 нед после купирования обострения, на фоне его базисной терапии. • Рекомендации по поводу вакцинации против ПИ пациентам с муковисцидозом дают пульмонологи, гастроэнтерологи, врачи-терапевты, врачи общей практики, аллергологи-иммунологи, врачи стационаров перед выпиской пациента. • Осмотр пациента с муковисцидозом перед вакцинацией против ПИ проводит врач-терапевт или врач другой специальности. • Вакцинацию против ПИ у пациентов с муковисцидозом проводят амбулаторно: в кабинете вакцинопрофилактики поликлиники либо в частных медицинских центрах, занимающихся вакцинацией. В редких случаях, при удовлетворительном состоянии пациентов, проживающих в местах, отдаленных от медицинских учреждений, а также при других обстоятельствах, допускается вакцинация при выписке из стационара. Информация для пациента. При использовании вакцин возможны местные реакции в месте введения (боль, покраснение, отек мягких тканей, уплотнение), а также общие (системные) реакции (головная боль, го86 Вакцинация больных муковисцидозом ловокружение, дискомфорт, повышение температуры тела). Эти реакции возникают в первые 1–2 дня после введения вакцины, как правило, носят слабовыраженный или умеренный характер и проходят самостоятельно в первые 2–3 дня. При возникновении выраженной местной реакции следует назначить один из антигистаминных препаратов (например, цетиризин, дезлоратадин и др.) в стандартной дозировке в течение 1–2 дней. В случае повышения температуры тела более 38,5°С следует принять внутрь парацетамол 500 мг. Возникновение кашля, насморка, боли в горле, суставах и мышцах чаще всего связаны с присоединением респираторной инфекции и не должны рассматриваться как реакция на введение вакцины. В редких случаях может возникнуть аллергическая реакция на введение вакцины в виде сыпи, зуда, что является показанием для назначения одного из антигистаминных препаратов до исчезновения указанных симптомов. • После вакцинации необходимо наблюдение за пациентом в течение 30–45 мин с целью выявления возможных реакций гиперчувствительности немедленного типа. В случае возникновения реакций гиперчувствительности немедленного типа (которые развиваются крайне редко) следует принять соответствующие меры: назначить антигистаминный препарат, системный глюкокортикостероид, по показаниям адреналин и т.д. Ожидаемый эффект вакцинации При анализе литературы за последние 10 лет не было выявлено опубликованных данных по эффективности и безопасности применения вакцин против ПИ у взрослых больных муковисцидозом, хотя с появлением ППВ она могла быть применена на практике у этой категории пациентов [31]. Однако в исследованиях у детей с хроническими заболеваниями легких, в том числе с муковисцидозом, была доказана безопасность и клиническая эффективность вакцинации, что выражалось в снижении частоты присоединения респираторных инфекций и уменьшении числа обострений основного заболевания в 2 раза, а элиминация S. pneumoniae из мокроты через 1 год отмечалась в 88% случаев [32, 33]. Сроки вакцинации или ревакцинации конкретными вакцинами в последующие годы Не привитым ранее против ПИ пациентам с муковисцидозом сначала вводится ПКВ13 (Превенар 13), через 1 год – ППВ23 (Пневмо 23), затем каждые 5 лет Пневмо 23. Пациентам с муковисцидозом, получавшим ранее вакцинацию против ПИ с использованием ППВ (Пневмо 23), в последующем не ранее чем че87 IV. Подходы к вакцинации больных с бронхолегочной патологией рез 1 год вводится однократно Превенар 13. Затем через каждые 5 лет после предыдущего введения Пневмо 23 вводится ППВ. Вакцинация против вируса гриппа Почему необходима вакцинация против вируса гриппа у больных муковисцидозом? См. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 86). Когда и как проводить вакцинацию? • Вакцинацию против вируса гриппа у пациентов с муковисцидозом проводят в период ремиссии основного заболевания, на фоне базисной терапии. В случае обострения муковисцидоза вакцинацию проводят через 2–4 нед после купирования обострения, на фоне базисной терапии. Вакцинацию против гриппа можно проводить круглогодично, хотя наилучший эффект достигается при ее осуществлении перед началом эпидемического сезона. • Рекомендации по поводу вакцинации против вируса гриппа пациентам с муковисцидозом дают пульмонологи, гастроэнтерологи, врачи-терапевты, врачи общей практики, аллергологи-иммунологи, врачи стационаров перед выпиской пациента. • Осмотр пациента с муковисцидозом перед вакцинацией проводит врач-терапевт или врач другой специальности. • Вакцинацию против вируса гриппа у пациентов с муковисцидозом проводят амбулаторно: в кабинете вакцинопрофилактики поликлиники либо в частных медицинских центрах, занимающихся вакцинацией. При возникновении неблагополучной эпидемической ситуации по гриппу допускается вакцинация в стационаре, на фоне базисной терапии, за исключением больных, находящихся в палате интенсивной терапии. Информация для пациента. См. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 86). Следует отметить, что частота возникновения общих системных реакций после введения вакцин против гриппа существенно ниже, чем при использовании пневмококковых вакцин. • Наблюдение за пациентом после вакцинации см. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 86). Ожидаемый эффект вакцинации Согласно международным клиническим рекомендациям по лечению муковисцидоза, рекомендуется ежегодное проведение вакцинации против 88 Вакцинация больных муковисцидозом гриппа. Иммуногенность вакцин против гриппа у больных муковисцидозом сравнима с таковой у здоровых лиц. Различий в иммуногенности и переносимости вакцин разных типов не выявлено [34–36]. При проведении ежегодной регулярной вакцинации против гриппа детей с муковисцидозом различных возрастных групп было выявлено снижение заболеваемости гриппом и острыми респираторными инфекциями. Также отмечались стабилизация клинической картины со стороны бронхолегочной системы, улучшение показателей нутритивного статуса, снижение количества обострений хронического бронхолегочного процесса [37]. В проведенных исследованиях по вакцинации против гриппа субъединичными вакцинами была выявлена меньшая их реактогенность в сравнении с другими типами вакцинных препаратов [37]. Положительный опыт применения субъединичных вакцин у детей с муковисцидозом позволяет рекомендовать этот тип вакцин и для профилактики гриппа у взрослых пациентов [36]. Сроки вакцинации в последующие годы Вакцинацию проводят ежегодно в осенний период с применением При угрозе возникноинактивированных субъединичных и сплит-вакцин. вения пандемии или ожидании циркуляции новых типов вируса гриппа, ранее не входивших в состав вакцины, для больных муковисцидозом целесообразно вводить две дозы вакцины с интервалом 21–28 дней. b Вакцинация против гемофильной типа инфекции Почему необходима вакцинация против ХИБ-инфекции? См. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 86). Вакцинация больных муковисцидозом против ХИБ-инфекции на практике проводится очень редко, поскольку в инструкции по ее применению не указана данная категория пациентов. Следует отметить, что в странах, где проводится массовая вакцинация против ХИБ-инфекции детей первых 2 лет жизни, отмечается значительный непрямой популяционный эффект – снижение носительства и заболеваемости (инвазивной и неинвазивной ХИБ-инфекции) среди взрослого населения. Поскольку в Российской Федерации вакцинация против ХИБ-инфекции проводится только детям из групп риска, непрямой популяционный эффект является незначительным или вообще отсутствует, в связи с чем актуальна вакцинация взрослых иммунокомпрометированных пациентов. Результаты исследования по применению вакцины против ХИБ-инфекции у больных ХОБЛ свидетельствуют о ее эффективности [38]. 89 IV. Подходы к вакцинации больных с бронхолегочной патологией Когда и как проводить вакцинацию? См. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 86). Имеются различия в переносимости вакцинации в сторону уменьшения частоты возникновения системных и местных реакций на введение вакцины против ХИБ-инфекции по сравнению с вакциной против ПИ. Ожидаемый эффект вакцинации На данный момент не удалось найти исследований, посвященных эффективности вакцинации против ХИБ-инфекции у взрослых пациентов с муковисцидозом. Опыт сотрудников ФГБНУ «НИИВС им. И.И. Мечникова» по применению вакцины изложен в разделе по вакцинации кандидатов на трансплантацию и лиц после трансплантации легких. У этой группы пациентов всё большую актуальность приобретает проблема лечения инфекций, вызванных нетипируемыми штаммами H. influenzае. В настоящее время вакцины против данных типов возбудителей лишь разрабатываются [32]. Сроки вакцинации или ревакцинации конкретными вакцинами в последующие годы Вакцинация против ХИБ-инфекции проводится однократно. Данные о необходимости проведения ревакцинации на сегодняшний день отсутствуют. Врач, принимающий решение о вакцинации против ХИБ-инфекции, должен руководствоваться международными протоколами по ведению больных-кандидатов на трансплантацию легких, в которых вакцинация против ХИБ-инфекции является обязательной. В настоящий момент назначение ХИБ-вакцин взрослым не предусмотрено в российских инструкциях по применению этих вакцин, однако в методических рекомендациях 2010 г. указано, что дети и взрослые с иммунодефицитными состояниями или анатомическими дефектами, приводящими к резко повышенной опасности заболевания ХИБ-инфекцией, подлежат вакцинации против возбудителя этой инфекции. Следует учитывать, что протективная эффективность вакцинации лиц с серьезными иммунологическими и анатомическими дефектами не абсолютна: первичные или повторные заболевания ХИБ-инфекцией возможны и после проведения вакцинации, что не отменяет целесообразность вакцинации данной группы лиц, поскольку в среднем вероятность заболевания ХИБ-инфекцией снижается [39]. В «Заявлении ВОЗ о политике по конъюгированной вакцине против ХИБ-инфекции» указано: «…дети и взрослые должны быть вакциниро90 Вакцинация больных муковисцидозом ваны в случае повышенного риска заболевания инвазивной формой инфекции при наличии соответствующих ресурсов. В группу повышенного риска входят лица с ВИЧ-инфекцией и иммуноглобулиновым дефицитом, лица с имплантированными стволовыми клетками, пациенты, получающие химиотерапию по поводу злокачественных новообразований, и лица с аспленией (например, в результате серповидно-клеточной анемии или спленэктомии)» [40]. Вакцинация против синегнойной инфекции Почему необходима вакцинация против синегнойной инфекции? См. в подразделе «Вакцинация против пневмококковой инфекции» настоящего раздела (с. 86). В доступных источниках литературы данные о клинической эффективности и иммуногенности вакцин против синегнойной инфекции у больных муковисцидозом отсутствуют. В настоящее время в ФГБНУ «НИИВС им. И.И. Мечникова» завершается научно-исследовательская работа по применению вакцины против синегнойной инфекции у детей с муковисцидозом и врожденными пороками развития легких, в которой будет дана оценка клинического эффекта и иммуногенности вакцины. Однако, опираясь на результаты исследований эффективности используемой вакцины у пациентов других категорий, следует ожидать положительного эффекта и у данной категории пациентов [41–45]. Вакцинация проводилась зарегистрированным в РФ препаратом против синегнойной инфекции, содерP. aeruginosa жащим антигены 8 иммунотипов (по классификации Фишера), согласно инструкции. Данных о проведении ревакцинации в настоящий момент нет. Список литературы 1. Муковисцидоз. Под ред. Н.И. Капранова, Н.Ю. Каширской. М.: Медпрактика 2014; 672c. 2. Симонова О.И., Лазарева А.В., Мотузова О.В. и др. Новые возможности антибиотикотерапии при острой и хронической респираторной патологии у детей. Вопросы современной педиатрии 2013; 12(1): 123–130. 3. Шагинян И.А., Капранов Н.И., Чернуха М.Ю. и др. Микробный пейзаж нижних дыхательных путей у различных возрастных групп детей, больных муковисцидозом. Журнал микробиологии, эпидемиологии и иммунобиологии 2010; 1: 15–20. 4. Hauser A.R., Jain M., Bar-Meir M., McColley S.A. Microbes and outcomes in cystic fibrosis. Clin Microbiol Rev 2011; 24: 1–70. 5. Шагинян И.А., Капранов Н.И., Чернуха М.Ю. и др. Особенности микрофлоры нижних дыхательных путей у различных возрастных групп детей, больных муковисцидозом. В кн.: Муковисцидоз в России (20 лет Российскому центру муковисцидоза). По материалам Х На91 IV. Подходы к вакцинации больных с бронхолегочной патологией ционального конгресса «Муковисцидоз у детей и взрослых». 1–2 июня 2011 г., г. Ярославль. Ярославль, 2011: 64–71. 6. Guss A.M., Roeselers G., Newton I.L. et al. Phylogenetic and metabolic diversity of bacteria associated with cystic fibrosis. ISME J 2011; 5(1): 20–29. 7. Hoiby N. Microbiology of lung infections in cystic fibrosis patients. Acta Paediat Scand 1982; 301(Suppl.): 33–54. 8. Cystic Fibrosis Foundation Patient Registry: Annual Data Report 2007. Bethesda, 2008; 24p. Available at: http://www.cysticfibrosisdata.org/LiteratureRetrieve.aspx?ID=132649 (accessed 22.09.2016). 9. Шагинян И.А., Чернуха М.Ю., Капранов Н.И. и др. Консенсус «Муковисцидоз: определение, диагностические критерии, терапия», раздел «Микробиология и эпидемиология хронической респираторной инфекции при муковисцидозе». Педиатр 2016; 7(1): 80–96. 10. Høiby N., Frederiksen B. Microbiology of cystic fibrosis. In: Hodson M.E., Geddes D., editors. Cystic fibrosis. London: Arnold; 2000: 83–108. 11. Koch C. Early infection and progression of cystic fibrosis lung disease. Pediatr Pulmonol 2002; 34: 232–236. 12. Kosorok M.R., Zeng L., West S.E. et al. Acceleration of lung disease in children with cystic fibrosis Pseudomonas aeruginosa after acquisition. Pediatr Pulmonol 2001; 32: 277–287. 13. Каширская Н.Ю., Капранов Н.И. Место ингаляционных форм антибактериальных препаратов в терапии бактериальной инфекции легких у больных муковисцидозом. Атмосфера. Пульмонология и аллергология 2012; 3: 5–12. 14. Ebbing R., Robertson C.F., Robinson P.J. Haemophilus influenzae and Haemophilus parainfluenza in cystic fibrosis: 15 years experience. J Med Microbiol Diagn 2015; S5:004. doi: 10.4172/2161-0703. S5-004. 15. Cardines R., Giufrè M., Pompilio A. et al. Haemophilus influenzae in children with cystic fibrosis: antimicrobial susceptibility, molecular epidemiology, distribution of adhesins and biofilm formation. Int J Med Microbiol 2012; 302(1): 45–52. 16. Нисевич Л.Л., Середа Е.В., Селютина Н.С. и. др. Вирусные инфекции у детей с муковисцидозом. Педиатрическая фармакология 2011; 8(2): 43–48. 17. Wang E.E., Prober C.G., Manson B. et al. Association of respiratory viral infections with pulmonary deterioration in patients with cystic fibrosis. N Engl J Med 1984; 311(26): 1653–1658. 18. Hiatt P.W., Grace S.C., Kozinetz C.A. et al. Effects of viral lower respiratory tract infection on lung function in infants with cystic fibrosis. Pediatrics 1999; 103(3): 619–626. 19. Goffard A., Lambert V., Salleron J. et al. Virus and cystic fibrosis: rhinoviruses are associated with exacerbations in adult patients. J Clin Virol 2014; 60(2): 147–153. 20. Bucher J., Boelle P.Y., Hubert D. et al. Lessons from a French collaborative case–control study in cystic fibrosis patients during the 2009 A/H1N1 influenza pandemy // BMC Infect Dis 2016; 16: 55. 21. От профилактического к терапевтическому эффекту вакцин против пневмококковой и гемофильной типа b инфекций у пациентов с бронхолегочной патологией. Под ред. М.П. Костинова. М., 2007; 182c. 22. Thornton C.S., Brown E.L., Alcantara J. et al. Prevalence and impact of Streptococcus pneumoniae in adult cystic fibrosis patients: a retrospective chart review and capsular serotyping study. BMC Pulm Med 2015; 15: 49. 23. Esposito S., Colombo C., Tosco A. et al. Streptococcus pneumoniae oropharyngeal colonization in children and adolescents with cystic fibrosis. J Cyst Fibros 2016; 15(3): 366–371. 24. Maeda Y., Elborn J.S., Parkins M.D. et al. Population structure and characterization of viridans group Streptococcus pneumoniae streptococci (VGS) including isolated from adult patients with cystic fibrosis (CF). J Cyst Fibros 2011; 10(2): 133–139. 25. del Campo R., Morosini M.I., de la Pedrosa E.G. et al. Population structure, antimicrobial resistance, and mutation frequencies of Streptococcus pneumoniae isolates from cystic fibrosis patients. J Clin Microbiol 2005; 43(5): 2207–2214. 26. Lahiri T., Waltz D.A. Preimmunization anti-pneumococcal antibody levels are protective in a majority of patients with cystic fibrosis. Pediatrics 2001; 108(4): 62. 92
Руководство по клинической иммунологии в респираторной медицине
500 ₽
Под ред. М.П. Костинова, А.Г. Чучалина
128 с.
2016
-
Описание
Описание
В руководстве представлены современные аспекты вакцинопрофилактики респираторных инфекций при основных хронических заболеваниях легких у взрослых. Приведены обоснование значимости профилактики инфекционных заболеваний и тактические подходы при осуществлении иммунизации у пациентов с патологией дыхательной системы. Рассмотрены особенности течения основного заболевания, клинический и иммунологический эффекты вакцинации, а также схемы и сроки последующей иммунизации. Даны характеристика современных вакцинных препаратов, используемых для указанной категории пациентов, позиции Всемирной организации здравоохранения и Министерства здравоохранения РФ в отношении профилактики вакциноуправляемых инфекций у взрослых с хроническими заболеваниями.
Предназначено для терапевтов, пульмонологов, фтизиатров, иммунологов-аллергологов, инфекционистов и врачей других специальностей.
1. Ferkol T., Schraufnagel D. The global burden of respiratory disease // Ann. Am. Thorac. Soc. 2014, 11, 404-406. DOI: 10.1513/AnnalsATS.201311-405PS.
2. World Health Organization. Influenza (Seasonal). Available online at: https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal) (accessed January 25, 2019).
3. Behzadi M. A., Leyva-Grado V. H. Overview of Current Therapeutics and Novel Candidates Against Influenza, Respiratory Syncytial Virus, and Middle East Respiratory Syndrome Coronavirus Infections // Front Microbiol. 2019; 10: 1327. DOI: 10.3389/fmicb.2019.01327.
4. Никифоров В. В. и соавт. Грипп и острые респираторные вирусные инфекции: современная этиотропная и патогенетическая терапия. Алгоритмы оказания медицинской помощи больным. Методические рекомендации. М.: Спецкнига; 2019. 32 с.
5. Kotey E., Lukosaityte D., Quaye O., Ampofo W., Awandare G., Iqbal M. Current and novel approaches in influenza management // Vaccines (Basel). 2019; Jun 18; 7 (2). DOI: 10.3390/vaccines7020053.
6. Jin Y., Lei C., Hu D., Dimitrov D. S., Ying T. Human monoclonal antibodies as candidate therapeutics against emerging viruses // Front. Med. 2017, 11, 462-470. DOI: 10.1007/s11684-017-0596-6.
7. Nicholson E. G., Munoz F. M. A review of therapeutics in clinical development for respiratory syncytial virus and influenza in children // Clin Ther. 2018, Aug; 40 (8): 1268-1281. DOI: 10.1016/j.clinthera.2018.06.014. Epub 2018 Aug 2.
8. Shaw M. L. The Next Wave of Influenza Drugs // ACS Infect. Dis. 2017, 3, 691-694.
9. Ashraf U., Tengo L., Le Corre L. et al. Destabilization of the human RED-SMU1 splicing complex as a basis for host-directed antiinfluenza strategy // Proc Natl Acad Sci USA. 2019, May 28; 116 (22): 10968-10977. DOI: 10.1073/pnas.1901214116.
10. Global influenza strategy 2019-2030. Geneva: World Health Organization; 2019. Available at: https://apps.who.int/iris/handle/10665/311184.
11. Dunning J., Blankley S., Hoang L. T. et. Al. Progression of whole blood transcriptional signatures from interferon-induced to neutrophil-associated patterns in patients with severe influenza // Nat Immunol. 2018, June; 19 (6): 625-635. DOI: 10.1038/s41590-018-0111-5.
12. Epstein O. The spatial homeostasis hypothesis // Symmetry. 2018. Vol. 10 (4). 103. DOI: 10.3390/sym10040103.
13. Инструкция по медицинскому применению препарата Эргоферон.
14. Rafalskiy V. V., Averyanov A. V., Bart B. Ya. et al. Efficacy and safety of Ergoferon compared to oseltamivir in the outpatient treatment of seasonal influenza virus infection in adult patients: a multicenter open-label randomized clinical study // Spravochnik poliklinicheskogo vracha. 2016; (6): 24-36.
15. Веревщиков В. К., Борзунов В. М., Шемякина Е. К. Оптимизация этиопатогенетической терапии гриппа и ОРВИ у взрослых при применении эргоферона // Антибиотики и химиотерапия. 2011; 56 (9-10): 23-26.
16. Селькова Е. П., Костинов М. П., Барт Б. Я., Аверьянов А. В., Петров Д. В. Лечение острых респираторных вирусных инфекций у взрослых: результаты рандомизированного двойного слепого плацебо-контролируемого клинического исследования // Пульмонология. 2019; 29 (3): 302-310. https://doi.org/10.18093/0869-0189-2019-29-3-302-310.
17. Геппе Н. А., Кондюрина Е. Г., Мельникова И. М. и др. Релиз-активный противовирусный препарат Эргоферон в лечении острых респираторных инфекций у детей. Эффективность жидкой лекарственной формы Эргоферона: результаты рандомизированного двойного слепого плацебо-контролируемого клинического исследования // Педиатрия. 2019; 98 (1): 87-94.
18. Аверьянов А. В., Бабкин А. П., Барт Б. Я. и др. Эргоферон и осельтамивир в лечении гриппа — результаты многоцентрового сравнительного рандомизированного клинического исследования // Антибиотики и химиотерапия. 2012; 57 (7-8): 23-30.
19. Спасский А. А., Попова Е. Н., Плоскирева А. А. Применение препарата Эргоферон в лечении ОРВИ и гриппа у взрослых пациентов с различными сопутствующими заболеваниями // Терапия. 2018; 6 (24): 157-161.
20. Шестакова Н. В., Загоскина Н. В., Самойленко Е. В. и др. Эффективность и безопасность применения Эргоферона в комплексной терапии внебольничных пневмоний // Доктор.ру. 2012; 8 (76): 44-47.
21. Радциг Е. Ю., Ермилова Н. В., Малыгина Л. В. и др. Этиотропная терапия воспалительных заболеваний ЛОР-органов — осложнений острой респираторной инфекции // Вопросы современной педиатрии. 2014; 13 (6): 113-116.
22. Powell H., Smart J., Wood L. G. et al. Validity of the Common Cold Questionnaire (CCQ) in Asthma Exacerbations // PLOS ONE. 2008, 3 (3): e1802. https://doi.org/10.1371/journal.pone.0001802.
23. Chue A. L., Moore R. L. et al. Comparability of tympanic and oral mercury thermometers at high ambient temperatures // BMC Research Notes. 2012, 5: 356-361.
24. Gasim G. I., Musa I. R., Abdien M. T., Adam I. Accuracy of tympanic temperature measurement using an infrared tympanic membrane thermometer // BMC Research Notes 2013, 6: 194-198.
25. Barrett B., Brown R. L., Mundt M. P., Safdar N., Dye L., Maberry R., Alt J. The Wisconsin Upper Respiratory Symptom Survey is responsive, reliable, and valid // Journal of Clinical Epidemiology. 2005; 58 (6): 609-617.
26. Шерстобоев Е. Ю., Масная Н. В., Дугина Ю. Л. и др. Сверхмалые дозы антител к интерферону гамма влияют на Th1/Тh2 баланс. М.: 5-й конгресс «Современные проблемы аллергологии, иммунологии и иммунофармакологии», 2002. 281 с.
27. Эпштейн О. И., Бельский Ю. П., Шерстобоев Е. Ю., Агафонов В. И., Мартюшев А. В. Механизмы иммунотропных свойств потенцированных антител к человеческому интерферону-? // Бюл. экспер. биол. 2001; 1: 34-36.
28. Эпштейн О. И., Дугина Ю. Л., Качанова М. В., Тарасов С. А., Хейфец И. А., Белопольская М. В. Противовирусная активность сверхмалых доз антител к гамма-интерферону // Вестник Международной Академии наук (Русская Секция). 2008; 2: 20-23.
29. Емельянова А. Г., Греченко В. В., Петрова Н. В., Шиловский И. П., Горбунов Е. А., Тарасов С. А., Хаитов М. Р., Морозов С. Г., Эпштейн О. И. Влияние релиз-активных антител к рецептору CD4 на уровень lck-киназы в культуре мононуклеарных клеток периферической крови человека // Бюллетень экспериментальной биологии и медицины. 2016; 162 (9): 304-307.
30. Жавберт Е. С., Дугина Ю. Л., Эпштейн О. И. Противовоспалительные и противоаллергические свойства антител к гистамину в релиз-активной форме: обзор экспериментальных и клинических исследований // Детские инфекции. 2014, 1: 40-43.
31. Kostinov M. P. http://orcid.org/0000-0002-1382-9403
32. Костинов М. П. Новый препарат для лечения гриппа и острых респираторных вирусных инфекций // Инфекционные болезни. 2011. 9 (4): 29-34.
33. Костинов М. П. Иммунокоррекция в педиатрии / Практическое руководство для врачей. М.: «Медицина для всех», 1997. 111 с.
34. Афиногенова В. П., Лукачев И. В., Костинов М. П. Иммунотерапия: механизм действия и клиническое применение иммунокорригирующих препаратов // Лечащий врач. 2010. 4:9.
35. Федеральное руководство по использованию лекарственных средств (формулярная система, справочное издание). Выпуск XVI. Под ред. А. Г. Чучалина (главный редактор), В. В. Яснецова. М.: «Эхо», 2015. 1016 с.
36. Руководство по клинической иммунологии в респираторной медицине / Под ред. М. П. Костинова, А. Г. Чучалина. 1-е изд. М.: АТМО, 2016. 128 с.
37. Респираторная медицина. Руководство. / Под ред. А. Г. Чучалина, (2-е изд, переработ. и допол.). М.: Литтерра, 2017; Т. 2. 544 с.
8.5.Хроническая обструктивная болезнь легких
И.В. Лещенко, С.И. Овчаренко
Эпидемиология и определение хронической обструктивной болезни легких
ХОБЛ — заболевание, которое ложится тяжелым бременем на общество и приобретает все большую социальную значимость.
В настоящее время ХОБЛ относится к наиболее распространенным заболеваниям человека, что обусловлено непрекращающимся загрязнением окружающей среды, усиливающимся табакокурением и повторяющимися респираторными инфекционными заболеваниями. По данным ВОЗ, в мире более 210 млн человек страдают ХОБЛ. В РФ в 2012 г. было зарегистрировано 2,7 млн больных с ХОБЛ, но, согласно оценке экспертов, реальное количество может быть в несколько раз больше и достигать 16 млн человек.
Одно из глобальных исследований, посвященных ХОБЛ (проект BOLD), обеспечило уникальную возможность оценить распространенность ХОБЛ с помощью стандартизированных вопросников и легочных функциональных тестов в популяциях взрослых людей старше 40 лет как в развитых, так и в развивающихся странах [1]. Распространенность ХОБЛ II стадии и выше (GOLD 2008), по данным исследования BOLD, среди лиц старше 40 лет составила 10,1±4,8%; в том числе среди мужчин — 11,8±7,9% и женщин — 8,5±5,8% [1]. Распространенность ХОБЛ увеличивалась с возрастом: в возрастной группе от 50 до 69 лет заболеванием страдали 10,1% мужчин в городе и 22,6% — в сельской местности. Причинами такой вариабельности служат различия в образе жизни людей, их поведении и контакте с разнообразными повреждающими агентами.
В большом двухгодичном исследовании (2010–2011), охватившем 12 регионов России и включавшим 7164 жителя старше 18 лет (3067 мужчин и 4093 женщины), изучалась распространенность хронических респираторных заболеваний и факторов риска их возникновения [2]. Курение установлено у 45,7% жителей (69,5% мужчин и 28,1% женщин). В 34% (30,3% мужчин и 36,1% женщин) случаев причина заболевания связана с воздействием биоорганического топлива. Распространенность ХОБЛ в этом исследовании у пациентов с факторами риска, респираторными жалобами составляла 21,8%. При экстраполяции на всю исследуемую популяцию распространенность ХОБЛ составила 15,3%.
В России, по официальным данным докладов МЗ РФ, ХОБЛ занимает 4-е место среди всех причин смертности от хронических неинфекционных заболеваний после ССЗ, сахарного диабета (СД) и травм.
Для российской популяции больных с ХОБЛ характерен высокий процент выхода на инвалидность, достигающий в некоторых регионах половины всех заболевших. Согласно прогнозам, ХОБЛ станет 5-й причиной потерь по показателю DALY в 2020 г. повсеместно, пропуская вперед ИБС, большие депрессии, несчастные случаи на дороге и цереброваскулярные заболевания. Одновременно к 2020 г. ХОБЛ войдет в первую тройку заболеваний по показателям смертности, достигнув 4,7 млн смертей в год [3, 4].
Бремя экономических затрат, связанных с ХОБЛ, которые несут государства, огромны. Так, например, только в США в 2002 г. затраты, обусловленные этим заболеванием, составили 32,1 млрд долларов [5]. В развитых странах общие экономические расходы, связанные с ХОБЛ, в структуре легочных заболеваний занимают 2-е место после рака легких и 1-е место по прямым затратам, превышая прямые расходы на БА в 1,9 раза. Экономические расходы на одного больного, связанные с ХОБЛ, в 3 раза выше, чем на больного БА. Немногочисленные сообщения о прямых медицинских расходах при ХОБЛ свидетельствуют о том, что более 80% материальных средств приходится на стационарную помощь больным и менее 20% на амбулаторную. Установлено, что 73% средств расходуются на 10% больных с тяжелым течением заболевания. Наибольший экономический ущерб приносит лечение обострений ХОБЛ. В России экономическое бремя ХОБЛ с учетом непрямых затрат, в том числе абсентеизма (невыхода на работу) и презентеизма (менее эффективной работы в связи с плохим самочувствием), составляет 24,1 млрд руб.
Подсчитано, что в странах Европейского сообщества только прямые расходы на респираторные заболевания составляют около 6% всего бюджета здравоохранения, при этом на долю затрат, связанных с ХОБЛ, приходится 56%, а в денежном выражении 38,6 млрд евро [6]. Имеется выраженная прямая взаимосвязь степени тяжести ХОБЛ с затратами на ее лечение, и по мере прогрессирования заболевания происходит перераспределение затрат. Так, увеличение степени тяжести ХОБЛ приводит к многократному росту затрат, связанных с госпитализациями и амбулаторной кислородотерапией.
Другая важная проблема ХОБЛ — ее поздняя диагностика. Даже в экономически развитых странах ранняя диагностика заболевания осуществляется не более чем в 25% случаев [7]. С этими же трудностями сталкивается и российская медицина. Гиподиагностика не исчерпывается только клиническими аспектами проблемы. Неполная медицинская статистика чревата сильной недооценкой социально-экономического ущерба, наносимого заболеванием обществу. Знание достоверных показателей распространенности, заболеваемости и смертности служит необходимой предпосылкой для оценки социального бремени ХОБЛ, без чего невозможно планирование и внедрение экономически эффективных стратегий профилактики и лечения данного заболевания [8].
Отвечая на вопрос, почему так широко распространена ХОБЛ в современном человеческом обществе, следует обратить внимание на то, что она относится к группе экологически опосредованных болезней органов дыхания. Тем самым подчеркивается роль поллютантов окружающей среды, как в развитии самой болезни, так и ее обострений.
Признавая возрастающую значимость ХОБЛ как проблемы национального здоровья во всех странах мира, Национальный институт «Сердце, легкие и кровь» США и ВОЗ совместно работали над созданием программы GOLD. Программа была создана и вышла в свет в 2001 г. и до сих пор представляет собой методику управления ХОБЛ — глобальную стратегию диагностики, лечения и профилактики ХОБЛ. Этот документ с учетом появления новых данных, накапливающихся от года к году, пересматривался в 2006, 2008, 2011 гг. (с небольшими изменениями выходил в 2013–2015 гг.).
Определение ХОБЛ: заболевание, которое можно предупредить и лечить, характеризуемое персистирующей обструкцией дыхательных путей, которая прогрессирует и ассоциируется с усиленной воспалительной реакцией дыхательных путей и легких на вредные частицы или газы. У ряда пациентов обострения и сопутствующие заболевания могут влиять на общую тяжесть ХОБЛ (GOLD, 2015).
Этиология и механизмы развития (патогенез) хронической обструктивной болезни легких
Факторы риска ХОБЛ представлены в табл. 8.17. Механизм развития ХОБЛ представлен на рис. 8.23, см. .
| Вероятность значимости факторов | Внешние факторы | Внутренние факторы |
|---|---|---|
|
Установленная |
Курение. |
Дефицит ААТ |
|
Высокая |
Загрязнение окружающего воздуха (SO2, NO2, O3). |
Недоношенность. |
|
Возможная |
Аденовирусная инфекция. |
Генетическая предрасположенность. |
Основными механизмами развития ХОБЛ служат: хронический воспалительный процесс, окислительный (оксидативный) стресс, дисбаланс в системе протеиназ–антипротеиназ.
Ведущая роль в становлении и развитии ХОБЛ, начиная с ранних стадий, принадлежит воспалению, которое усиливается по мере прогрессирования заболевания.
Хронический воспалительный процесс в дыхательных путях затрагивает все отделы дыхательных путей, паренхиму и сосуды легких и характеризуется увеличением числа нейтрофилов, макрофагов и Т-лимфоцитов, преимущественно CD8+, выделением большого числа медиаторов воспаления (рис. 8.24, см. ).
Окислительный (оксидативный) стресс выражается в нарушении баланса между оксидантами и антиоксидантами в пользу первых, что проявляется ослаблением антиоксидантной защиты, избыточной продукцией активных форм кислорода и азота с закономерным повреждением структуры белков, нуклеиновых кислот, ферментов, биомембран, повреждением фибробластов, снижением активности сурфактанта, повышением проницаемости эпителия и эндотелия, усилением секреции слизи и др. [9].
Дисбаланс в системе протеиназ и антипротеиназ проявляется в первую очередь дефицитом ААТ, активацией сывороточных протеиназ (нейтрофильный катепсин G, нейтрофильная протеиназа-3, катепсины макрофагов, матриксные металлопротеиназы), приводящих к разрушению альвеолярных стенок, поддержанию местного воспаления и развитию эмфиземы легких.
Взаимодействие основных параметров становления ХОБЛ представлено на рис. 8.25.
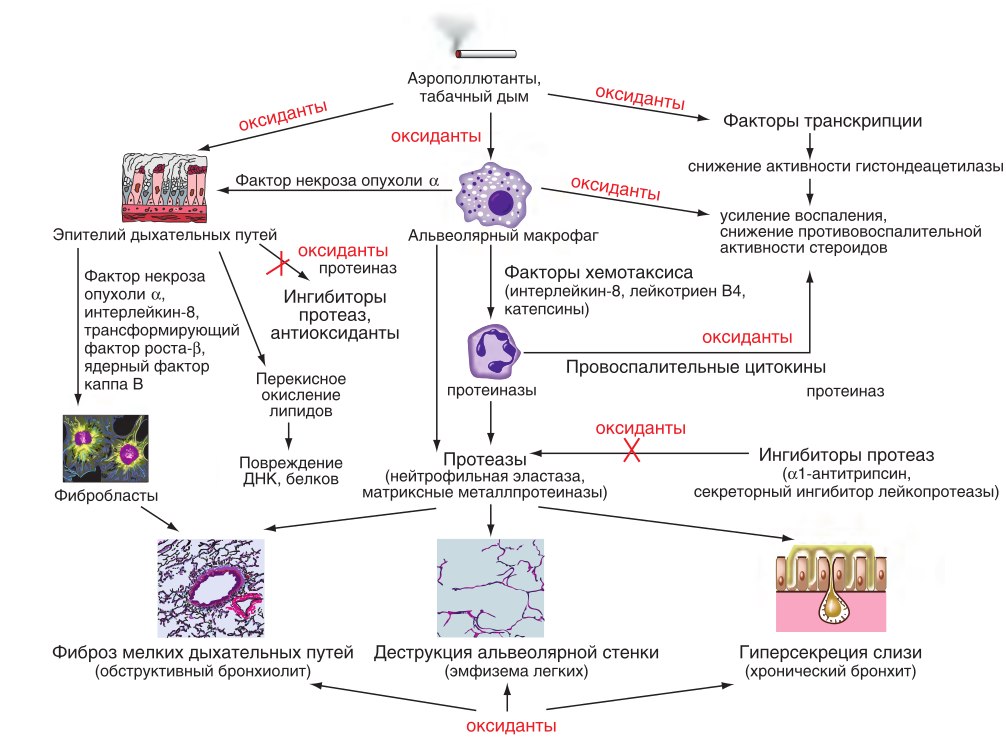
Рис. 8.25. Оксиданты и протеиназы в патогенезе хронической обструктивной болезни легких [10]
Патофизиологические изменения при ХОБЛ, начинаясь, как правило, с гиперсекреции слизи, изменений ее состава, дисфункции ресничек мерцательного эпителия и нарушения мукоцилиарного клиренса, сопровождаются в дальнейшем потерей эластической тяги легких в результате разрушения альвеол, исчезновения альвеолярной поддержки мелких дыхательных путей, что приводит к ограничению воздушного потока и как результат — к формированию бронхиальной обструкции в дебюте болезни, частично обратимой, а по мере прогрессирования заболевания — необратимой. Все перечисленное выше приводит к нарушению газообмена (вначале гипоксемия, при прогрессировании — гиперкапния), легочной гипертензии, в дальнейшем с формированием легочного сердца и развитием правожелудочковой недостаточности. С увеличением тяжести болезни воспалительный процесс приобретает системный характер с вовлечением эндотелия сосудов и развитием системных эффектов [11]. Точные механизмы системного воспаления при ХОБЛ изучены недостаточно. Предполагается, что взаимосвязь местного (т.е. бронхолегочного) с системным воспалением осуществляется несколькими путями:
-
Выходом стресс-индуцированных цитокинов и свободных радикалов из бронхолегочной системы в системную циркуляцию.
-
Активацией лейкоцитов периферической крови или клеток-предшественников в костном мозге.
-
Стимуляцией костного мозга и печени провоспалительными медиаторами, высвобождаемыми воспалительными и структурными клетками [12]. Стимуляция этих органов приводит к еще большей продукции лейкоцитов, тромбоцитов, СРБ и фибриногена.
Параллельно формируются системные эффекты: со стороны скелетных мышц — дисфункция и слабость, костной ткани — остеопороз, органов кроветворения — анемия или эритроцитоз, сердечно-сосудистой системы — АГ, поражение сосудов сердца, нижних конечностей; изменения психоэмоциональной сферы и др.
Клиническая картина хронической обструктивной болезни легких (стабильное течение)
В условиях воздействия факторов риска (курение, как активное, так и пассивное, экзогенные поллютанты, биоорганическое топливо и т.п.) ХОБЛ развивается обычно медленно и прогрессирует постепенно. Особенность клинической картины ХОБЛ состоит в том, что долгое время болезнь протекает без выраженных клинических проявлений. Возникновению первых клинических симптомов у больных с ХОБЛ, как правило, предшествует курение, по крайней мере 20 сигарет в день на протяжении более 20 лет [13].
При описании клинической картины ХОБЛ необходимо учитывать черты, характерные именно для этой болезни: субклиническое ее начало, отсутствие специфических симптомов, неуклонное прогрессирование заболевания.
Первыми признаками, с которыми пациенты обращаются к врачу, является кашель, часто с выделением мокроты и/или одышка. Эти симптомы бывают наиболее выражены по утрам. В холодные сезоны возникают «частые простуды». Такова клиническая картина дебюта заболевания, которая врачом расценивается как проявление бронхита курильщика, и диагноз «ХОБЛ» на этой стадии практически не ставится.
Хронический кашель — обычно первый симптом ХОБЛ, часто недооценивается и пациентами, так как считается ожидаемым следствием курения и/или воздействия неблагоприятных факторов окружающей среды. Обычно у больных выделяется небольшое количество вязкой мокроты. Нарастание кашля и продукции мокроты происходит чаще всего в зимние месяцы, во время инфекционных обострений.
Одышка — наиболее важный симптом ХОБЛ, нередко служит причиной обращения за медицинской помощью и основной причиной, ограничивающей трудовую деятельность больного. Вначале одышка отмечается при относительно высоком уровне физической нагрузки, например при беге по ровной местности или ходьбе по ступенькам. По мере прогрессирования заболевания одышка усиливается и может ограничивать даже ежедневную активность, а в дальнейшем возникает и в покое, заставляя больного оставаться дома.
Очень важным показателем оценки состояния здоровья является объективизация тяжести одышки. Существует несколько специальных шкал для оценки одышки. Чаще всего в практической деятельности используется 4-балльная шкала MRC — модификация шкалы Флетчера, которая используется для градации одышки соразмерно уровню нагрузки, необходимой для ее возникновения [14].
Имеется также визуальная шкала BORG [15], которая позволяет качественному признаку одышки дать количественную характеристику в баллах (рис. 8.26). Шкала BORG в основном используется при проведении 6-МТ.
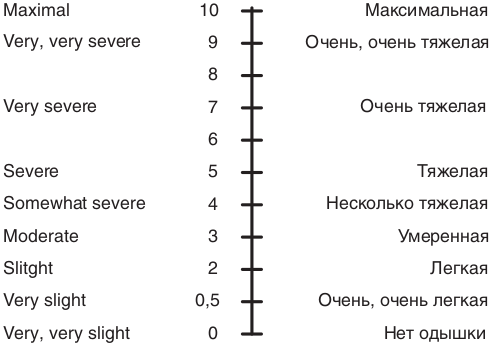
Рис. 8.26. Оценка выраженности одышки по шкале Borg
Основным механизмом появления на ранних стадиях заболевания одышки при физической нагрузке можно считать гиперинфляцию [16]. Легочная гиперинфляция (или повышение воздушности легких) развивается из-за неполного опорожнения альвеол во время выдоха вследствие потери эластической тяги легких и недостаточного времени выдоха. Уже в начале болезни при физической нагрузке и учащении дыхания происходит сокращение времени выдоха, задержка воздуха в альвеолах, что и способствует развитию легочной гиперинфляции, характерной для ХОБЛ, и ее клиническому проявлению — одышке. В дальнейшем происходит нарушение газообмена, что приводит к гипоксии и гиперкапнии, а со временем на поздних стадиях ХОБЛ — к развитию легочной гипертензии [17].
Прогрессирующая легочная гипертензия может приводить к гипертрофии ПЖ и в итоге — к легочному сердцу и правожелудочковой недостаточности. Подъем давления в яремных венах и наличие небольших отеков на голеностопных суставах являются наиболее частыми признаками, по которым судят в клинической практике о наличии легочного сердца. Однако у больных с ХОБЛ давление в яремных венах трудно измерить из-за значительных перепадов внутригрудного давления, а отеки могут быть результатом сопутствующей сердечно-сосудистой патологии. Отсюда следует, что для диагностики легочного сердца необходимо выполнение ряда диагностических процедур, включая рентгенографию органов грудной клетки, ЭКГ, ЭхоКГ, а иногда требуется проведение радионуклидной сцинтиграфии и МРТ [18].
Когда выраженность одышки не соответствует значениям ОФВ1, необходимо провести пробу с физической нагрузкой. Предпочтение отдается выполнению 6-МТ. Этот метод является наиболее простым средством для индивидуального наблюдения и мониторирования течения заболевания и может быть выполнен в условиях амбулаторной практики.
Тест проводится в соответствии со стандартным протоколом [19]. Пациентов инструктируют о целях теста. Им предлагают ходить по измеренному коридору в собственном темпе и стараться пройти максимальное расстояние в течение 6 мин. При этом пациентам разрешено останавливаться и отдыхать во время теста, но они должны возобновлять ходьбу, когда сочтут это возможным. Во время ходьбы разрешается подбадривать пациента. Перед началом и в конце теста оцениваются одышка по шкале Борга (0–10 баллов), наличие и тяжесть ДН по величине SpO2, определяемая по пульсоксиметрии [11–20]. Расстояние, пройденное в течение 6 мин в метрах (6-МТ), сравнивается с должным показателем. Пациентам следует прекратить ходьбу при возникновении следующих симптомов: боль в грудной клетке, головокружение, боль в ногах, резкое нарастание одышки и снижение SpO2 до 88%.
Скорость прогрессирования и выраженность симптомов ХОБЛ зависят от интенсивности воздействия этиологических факторов и их суммации. Помимо этого, выраженность симптомов характеризуется фазой течения заболевания. Выделяют стабильное течение заболевания и обострение. Стабильным следует считать то состояние, при котором выраженность симптомов существенно не меняется в течение недель или даже месяцев, а прогрессирование заболевания можно обнаружить лишь при длительном (6–12 мес) динамическом наблюдении за больным [12–21].
Клиническая картина хронической обструктивной болезни легких (обострение)
Обострения ХОБЛ — периодически возникающие ухудшения состояния (длительностью не менее 2–3 дней), сопровождаемые нарастанием интенсивности симптоматики и функциональными расстройствами. Во время обострения отмечается усиление выраженности гиперинфляции и так называемых воздушных ловушек в сочетании со сниженным экспираторным потоком, что приводит к усилению одышки [22], которая обычно сопровождается появлением или усилением дистанционных хрипов, чувством сдавления в груди, снижением толерантности к физической нагрузке. Помимо этого, происходит нарастание интенсивности кашля, изменяются (увеличиваются или резко уменьшаются) количество мокроты, характер ее отделения, цвет и вязкость. Одновременно ухудшаются показатели ФВД и газов крови: снижаются скоростные показатели (ОФВ1 и др.), может возникнуть гипоксемия и даже гиперкапния.
Обострения могут начинаться постепенно, исподволь, а могут характеризоваться и стремительным ухудшением состояния больного с развитием острой дыхательной и правожелудочковой недостаточности.
Выделяют два типа обострения [18]: I тип обострения характеризуется нарастанием проявлений воспалительного синдрома и сопровождается повышением температуры тела, увеличением количества, вязкости и «гнойности» мокроты, ростом острофазовых показателей крови (лейкоцитоз, повышение скорости оседания эритроцитов, α2-глобулинов, СРБ) — инфекционный фенотип обострения; II тип обострения проявляется нарастанием одышки, усилением внелегочных проявлений ХОБЛ (слабость, усталость, головная боль, плохой сон, депрессия), может появиться удушье — неинфекционный фенотип обострения.
Классическими (кардинальными) признаками, характеризующими обострение заболевания, являются критерии, предложенные N. Anthonisen и соавт. [23]:
-
появление или усиление одышки;
-
увеличение объема отделяемой мокроты;
-
усиление гнойности мокроты.
Наличие двух и более из трех указанных выше критериев описывается как I тип обострения заболевания.
Помимо кардинальных признаков обострения ХОБЛ, рекомендуется учитывать дополнительные признаки:
-
симптомы инфекции верхних дыхательных путей, сохраняющиеся в течение последних 5 дней;
-
лихорадка без других видимых причин;
-
нарастание свистящих хрипов над легочными полями;
-
усиление кашля, повышение ЧД или ЧСС.
Чем более выражена тяжесть ХОБЛ, тем более тяжело протекает обострение. Обострения ХОБЛ разделяются по тяжести проявлений на легкое, среднетяжелое или умеренное и тяжелое. В свою очередь, легкое и среднетяжелое обострение характеризуется как неосложненные, а тяжелое — как осложненное. Однако и среднетяжелое обострение ХОБЛ может протекать с осложнениями, если развивается у лиц с тяжелыми сопутствующими заболеваниями.
Для оценки тяжести обострения особое внимание уделяется установлению таких клинических, функциональных и лабораторных признаков, как участие в акте дыхания вспомогательной мускулатуры, парадоксальное движение грудной клетки, появление или усугубление центрального цианоза, появление периферических отеков, гемодинамическая нестабильность. Большое значение придается оценке внелегочной симптоматики — вегетативным расстройствам, слабости, апатии. Классификация тяжести обострения ХОБЛ представлена в табл. 8.18.
| Тяжесть обострения | Клинические симптомы обострения ХОБЛ и уровень оказания медицинской помощи | Характеристика обострения |
|---|---|---|
|
Легкое |
Усиление симптомов, возможно, с потребностью в увеличении дозы принимаемых «скоропомощных» препаратов |
Неосложненное |
|
Среднетяжелое |
Стойкое усиление симптомов (2–3 дня), например:
Требуется назначение антибиотиков и/или глюкокортикоидов |
Неосложненное/осложненное |
|
Тяжелое |
Пациент/врач отмечают явное и/или быстрое ухудшение состояния больного, требуется госпитализация |
Осложненное |
Неосложненное обострение ХОБЛ — относительно редкое обострение, проявляется с частотой менее 2 раз в год, не требует госпитализации, возникает у больных в возрасте до 65 лет с нетяжелым течением заболевания (при постбронходилатационном значении ОФВ1 ≥50% должной величины) без тяжелых сопутствующих заболеваний.
Отличительными чертами тяжелого обострения ХОБЛ являются цианоз, тахипноэ, тахикардия, тремор, повышение работы дыхательной мускулатуры (втяжение нади подключичных промежутков, втяжение межреберных промежутков), сопровождаемые падением PaO2 до 35–60 мм рт.ст., десатурацией (снижение SpO2) до 75–90% с признаками декомпенсированного респираторного ацидоза.
Тяжелое, как правило, осложненное обострение ХОБЛ характеризуется частыми обострениями в течение года (2 и более обострений в течение года и/или госпитализация по поводу обострения в предшествующие 12 мес), возникающее у больных в возрасте 65 лет и старше с тяжелым течением заболевания (при постбронходилатационном значении ОФВ1 <50% должной величины) или на фоне тяжелых сопутствующих заболеваний (СД, хронические заболевания печени, почек с функциональными нарушениями, СН).
Обострения могут осложняться развитием ОДН, ТЭЛА, пневмотораксом, СН. В течение обострения может развиваться пневмония, происходить декомпенсация ССЗ (АГ, ИБС и др.) Развившиеся осложнения могут существенно ухудшать течение ХОБЛ и требуют изменения тактики лечения.
В процессе обследования больного необходимо уточнить длительность текущего обострения, частоту предшествовавших обострений (в том числе потребовавших госпитализации), а также характер лечения в период стабильного течения ХОБЛ.
Клинические особенности хронической обструктивной болезни легких
Течение ХОБЛ представляет собой чередование стабильной фазы и обострения заболевания, но у разных людей оно протекает неодинаково. Вместе с тем общим является прогрессирование ХОБЛ, особенно если продолжается воздействие на пациента ингалируемых патогенных частиц или газов. Поскольку прогрессирование ХОБЛ, проявляемое неуклонным нарастанием бронхиальной обструкции, служит основополагающей чертой, которая усугубляет ДН, оно в целом определяет тяжесть течения заболевания и его прогноз.
В зависимости от индивидуальных особенностей больных уже давно выделяют
2 основные клинические формы заболевания — эмфизематозную и бронхитическую, имеющие четкие разграничительные признаки, определяемые как фенотипы.
Эмфизематозный фенотип ХОБЛ связывают преимущественно с панацинарной эмфиземой. Таких больных образно называют «розовыми пыхтельщиками» (рис. 8.27, см. ), поскольку для преодоления преждевременно наступающего экспираторного коллапса бронхов выдох производится через сложенные в трубочку губы и сопровождается своеобразным пыхтением. В клинической картине превалирует одышка в покое вследствие уменьшения диффузионной поверхности легких. Такие больные обычно худые, кашель у них чаще сухой или с небольшим количеством густой и вязкой мокроты. Цвет лица розовый, так как достаточная оксигенация крови поддерживается максимально возможным увеличением вентиляции. Предел вентиляции достигается в состоянии покоя, и больные очень плохо переносят физическую нагрузку. Легочная гипертензия умеренно выражена, так как редукция артериального русла, вызванная атрофией межальвеолярных перегородок, не достигает значительных величин. Легочное сердце длительное время компенсировано. Таким образом, эмфизематозный тип ХОБЛ характеризуется преимущественным развитием ДН, и такие больные «пыхтят» очень долго и уходят из жизни в пожилом возрасте.
Бронхитический фенотип (рис. 8.28, см. ) наблюдается, как правило, при центриацинарной эмфиземе и в основе своей имеет картину хронического бронхита. Постоянная гиперсекреция вызывает увеличение сопротивления на вдохе и выдохе, что способствует существенному нарушению вентиляции. В свою очередь, резкое уменьшение вентиляции приводит к значительному уменьшению содержания кислорода в альвеолах, последующему нарушению перфузионно-диффузионных соотношений и шунтированию крови. Это и обусловливает характерный синий оттенок диффузного цианоза у больных данной категории. Такие больные тучные («синие одутловатики»), в клинической картине преобладает кашель с обильным выделением мокроты. Прогрессирующие фиброзные изменения легочной ткани и облитерация просвета кровеносных сосудов ведут к развитию легочного сердца и его декомпенсации. Этому способствуют стойкая легочная гипертензия, значительная гипоксемия, эритроцитоз и постоянная интоксикация вследствие выраженного воспалительного процесса в бронхах.
Более подробно особенности фенотипов представлены в табл. 8.19.
| Признаки | Преимущественно эмфизематозный тип («розовый пыхтельщик») | Преимущественно бронхитический тип («синий одутловатик») |
|---|---|---|
|
Возраст (лет) на момент диагностики ХОБЛ |
Около 60 |
Около 50 |
|
Особенности внешнего вида |
|
|
|
Преобладающий симптом |
Одышка |
Кашель |
|
Мокрота |
Скудная — чаще слизистая |
Обильная — чаще слизисто-гнойная |
|
Бронхиальная инфекция |
Нечасто |
Часто |
|
Легочное сердце |
Редко, лишь в терминальной стадии |
Часто |
|
Рентгенография органов грудной клетки |
Гиперинфляция, буллезные изменения, «вертикальное» сердце |
Усиление легочного рисунка, увеличение размеров сердца |
|
Гематокрит, % |
35–45 |
50–55 |
|
PaO2 |
65–75 |
45–60 |
|
PaCO2 |
35–40 |
50–60 |
|
Диффузионная способность |
Снижена |
Норма, небольшое снижение |
Однако в клинической практике очень редко можно выделить эмфизематозный или бронхитический фенотип ХОБЛ в так называемом чистом виде (правильнее было бы говорить о преимущественно бронхитическом или о преимущественно эмфизематозном фенотипе заболевания). Наряду с этим может быть сочетание этих двух фенотипов у одного больного. Можно сказать, что в клинических условиях чаще встречаются больные со смешанным (сочетанным) фенотипом заболевания.
Кроме перечисленных выше, в настоящее время выделяют и иные фенотипы заболевания.
В первую очередь это относится к так называемому фенотипу «ХОБЛ + БА». Несмотря на то что необходимо тщательно дифференцировать больных с ХОБЛ и БА (см. Дифференциальная диагностика ХОБЛ) и значительным различием хронического воспаления при этих заболеваниях, у некоторых пациентов ХОБЛ и астма могут присутствовать одновременно. Частота сочетания ХОБЛ и БА у одного пациента составляет от 13 до 22% с нарастанием частоты встречаемости в пожилом возрасте — около 50% в возрасте ≥70 годам. В первую очередь этот фенотип может развиться у курящих больных, страдающих БА.
Наряду с этим в результате широкомасштабных исследований было показано, что около 20–30% больных с ХОБЛ могут иметь обратимую бронхиальную обструкцию, а в клеточном составе при воспалении появляются эозинофилы. Часть из этих больных также можно отнести к фенотипу «ХОБЛ + БА». Такие пациенты хорошо отвечают на терапию глюкокортикоидами. Они описываются с помощью ряда диагностических терминов, большинство из которых включают в себя термин «перекрестный синдром» (overlap syndrome) [24].
Научными комитетами GINA и GOLD был разработан и опубликован в 2014 г. документ, в котором дается обоснование для диагностики этого «перекрестного синдрома» и тактики ведения таких больных [25].
Перекрестный синдром БА–ХОБЛ характеризуется персистирующим ограничением воздушного потока и рядом симптомов, которые обычно связаны с БА, а также рядом симптомов, которые обычно свойственны ХОБЛ. В соответствии с этим перекрестный синдром БА–ХОБЛ определяется симптомами, которые характерны как для БА, так и для ХОБЛ.
Чаще всего ХОБЛ развивается на фоне БА, чем наоборот. У таких больных прослеживается длительное воздействие факторов риска ХОБЛ (курение, профессиональные или бытовые вредности).
Клинические особенности смешанного фенотипа ХОБЛ–БА (overlap phenotype) представлены ниже [26]:
-
обычно это больные старше 40 лет с клинико-функциональными параметрами ХОБЛ, у которых ранее (чаще до 40 лет) диагностировалась БА;
-
ХОБЛ при смешанном фенотипе развивается в более молодом возрасте, при меньшей продолжительности и интенсивности курения;
-
смешанный фенотип протекает более тяжело и с большей частотой обострений, чем изолированные БА и ХОБЛ;
-
выделяется 2 смешанных фенотипа — эозинофильный и нейтрофильный, различаемые ответом на терапию ИГК.
Убедительно говорить о таких ситуациях можно тогда, когда больной находится в стабильном состоянии по БА, т.е. имеет:
-
контролируемые симптомы;
-
малую вариабельность значений ПСВ, при сохраняющейся сниженной величине ОФВ1, даже если есть прирост в пробе с короткодействующими бронходилататорами (КДБД).
При этом:
-
уменьшается эффективность глюкокортикоидов, ранее обеспечивающих хороший эффект;
-
снижаются переносимость физической нагрузки и качество жизни;
-
при длительном наблюдении за больными отмечается прогрессирование ДН, носящее неуклонный характер.
Присоединение БА к ХОБЛ встречается значительно реже. В этом случае появляется ранее отсутствовавшая волнообразность клинических симптомов, связанных с бронхиальной обструкцией, возникают эпизоды приступов малопродуктивного кашля в ночные и/или в ранние утренние часы, удушья, сопровождаемые ощущением «свистящего» дыхания и потребностью применения КДБД.
Диагностические критерии смешанного фенотипа БА + ХОБЛ
А. Большие критерии.
-
Бронходилатационный ответ >400 мл и >15% ОФВ1.
-
Эозинофилия мокроты (>3%, специфичность и чувствительность 82 и 85%).
-
Верифицированный ранее диагноз БА.
Б. Малые критерии.
-
Повышенный уровень общего IgE.
-
Предсуществующий анамнез атопии.
-
Бронходилатационный ответ >200 мл и >12% ОФВ1.
Диагноз сочетания БА и ХОБЛ ставится:
-
при наличии двух больших или
-
одного большого и двух малых критериев.
Дополнительные методы обследования, используемые при диагностике сочетания БА и ХОБЛ, см. в табл. 8.20 [27].
| Показатель | Астма | ХОБЛ |
|---|---|---|
|
Диффузия газов |
Нормальная или незначительно снижена |
Часто снижена |
|
Газы артериальной крови |
Между обострениями в норме |
При тяжелой ХОБЛ между обострениями могут быть нарушены |
|
Тест на гиперреактивность |
Не имеет значительной пользы для дифференциальной диагностики. Высокая гиперреактивность характерна больше для БА |
|
|
КТ высокого разрешения |
Обычно в норме, может выявить воздушные ловушки и увеличение толщины стенок дыхательных путей |
Воздушные ловушки или эмфизема, возможно выявление увеличения толщины стенок дыхательных путей и признаки легочной гипертензии |
|
Определение IgE и/или кожные пробы |
Необязательные для верификации диагноза, (+) более характерны для БА |
Соответствуют фоновой распространенности аллергии, не исключают ХОБЛ |
|
NO в выдыхаемом воздухе |
Если высокий (>50 ppb), характерно для эозинофильного воспаления |
Обычно нормальный, низкий у активных курильщиков |
|
Эозинофилия крови |
Встречается при БА |
Может быть во время обострений |
|
Воспалительные элементы в мокроте |
Их роль в дифференциальной диагностике не установлена на большой популяции пациентов |
У пациентов с признаками как БА, так и ХОБЛ симптомы со стороны органов дыхания, включая одышку при физической нагрузке, персистируют, но их вариабельность может быть выраженной. Ограничение воздушного потока не является полностью обратимым, но часто отмечается его вариабельность. В мокроте — эозинофилы и нейтрофилы. Отмечаются более частые обострения. Такие пациенты характеризуются более низким качеством жизни, более быстрым ухудшением ФВД и более высокой смертностью. Кроме того, эти пациенты нуждаются в более интенсивном использовании ресурсов здравоохранения, чем пациенты только с БА или с ХОБЛ [27].
Еще один фенотип, о котором говорят в последнее время, это пациенты с частыми обострениями (2 или более обострений в год или 1 и более обострений, приведших к госпитализации) и определяют его как устойчивый во времени фенотип «пациент с частыми обострениями» [28].
Вместе с тем следует помнить и о том, что встречается и рецидив обострения. Рецидивом обострения ХОБЛ считается сохранение или усугубление ее симптомов в течение 14 дней после возникновения, несмотря на проводимую терапию или сохранение симптомов обострения ХОБЛ на фоне антибактериальной терапии, продолжающейся более 7 дней. Рецидивы обострения ХОБЛ возникают в 21–40% случаев. Весьма важным является оценка факторов риска рецидивирующих обострений ХОБЛ, к которым относятся [29]:
-
низкие показатели ОФВ1;
-
увеличение потребности в бронхолитиках и системных ГК;
-
предыдущие обострения ХОБЛ (более 3 в течение последних 2 лет);
-
ранее проводимая антибактериальная терапия (преимущественно ампициллином);
-
наличие сопутствующих заболеваний (СН, коронарная, почечная или/и печеночная недостаточность).
Важность этого фенотипа определяется тем, что из обострения пациент выходит с уменьшенными функциональными показателями легких, а частота обострений напрямую влияет на продолжительность жизни больных и требует индивидуального подхода к лечению.
Выделение других многочисленных фенотипов требует дальнейшего уточнения. В нескольких недавних исследованиях привлекло внимание различие в клинических проявлениях ХОБЛ между мужчинами и женщинами. Как оказалось, женщины характеризуются более выраженной ГДП, отмечают более выраженную одышку при тех же самых, что у мужчин, значениях бронхиальной обструкции и т.д. При одних и тех же функциональных показателях у женщин оксигенация происходит лучше, чем у мужчин. Однако у женщин чаще отмечают развитие обострений, они демонстрируют меньший эффект физических тренировок в реабилитационных программах, более низко оценивают качество жизни по данным стандартных вопросников (SF-36, Респираторный вопросник госпиталя Святого Георгия — SGRQ). Вероятнее всего, все описанные выше особенности течения ХОБЛ у женщин укладываются в гендерные особенности и не могут соответствовать понятию фенотипа ХОБЛ.
В целом качественная оценка состояния больных дается, используя показатели, изучающие качество жизни, которые, с одной стороны, объективно оценивают основные аспекты жизнедеятельности человека, а с другой — отражают субъективный уровень его благополучия.
Для того чтобы помочь пациентам самим охарактеризовать состояние здоровья, можно использовать ВАШ (рис. 8.29), где наилучшее состояние оценивается как 100, а наихудшее как 0, и пациент сам выбирает показатель шкалы, оценивающий его состояние на день визита к врачу.

Рис. 8.29. Визуально-аналоговая шкала
Являясь основой ХОБЛ, воспаление проявляется не только в дыхательной системе, но оно носит и системный характер. Это подтверждается повышением уровня СРБ, ФНО-α и других провоспалительных цитокинов (IL-6, -8 и др.).
Циркулирующие в крови воспалительные медиаторы могут способствовать потере мышечной массы и кахексии, а также способны провоцировать развитие или усугублять течение сопутствующих заболеваний, таких как ИБС, СН, остеопороз, нормоцитарная анемия, СД, метаболический синдром и депрессия.
Основные системные эффекты при ХОБЛ могут иметь следующие клинические и лабораторные проявления (рис. 8.30, см. ):
-
потеря массы тела;
-
нарушение питания;
-
дисфункция скелетной мускулатуры (снижение мышечной силы, атрофия верхнего плечевого пояса, атрофия мышц);
-
остеопороз;
-
анемия;
-
сердечно-сосудистые эффекты.
Они оказывают существенное влияние на клиническую картину заболевания и нередко определяют выживаемость пациентов.
Установлено, что системное воспаление усиливается по мере прогрессирования ХОБЛ и его проявления становятся очевидными у тяжелых больных. Механизмы, лежащие в основе системных проявлений ХОБЛ, представлены в табл. 8.21.
| Основные механизмы | Характеристика |
|---|---|
|
Системное воспаление |
Основная локализация воспаления при ХОБЛ — малые дыхательные пути, но активное воспаление присутствует также и в крупных бронхах, и в легочной паренхиме, и в легочных сосудах [30]. Взаимосвязь местного (т.е. бронхолегочного) с системным воспалением осуществляют:
|
|
Снижение питательного статуса (кахексия) |
Увеличение базального метаболического уровня, причиной которого может быть увеличение потребления кислорода дыхательными мышцами вследствие одышки [32] |
|
Дисфункция скелетных мышц |
2 феномена: атрофия мышц (митохондриальные нарушения, потеря сократительных белков); нарушение функции «оставшейся» мускулатуры [33] |
|
Остеопороз |
Причинами развития, кроме приема стероидов, могут быть: низкая физическая активность, курение, снижение уровня половых гормонов, гиперкапния, снижение массы тела [34] |
|
Анемия |
Сывороточные цитокины и хемокины могут нарушать основные этапы гемопоэза, возможными механизмами анемии при ХОБЛ являются укорочение времени жизни эритроцитов, нарушение мобилизации и утилизации железа, нарушение ответа костного мозга на эритропоэтин [35] |
|
Сердечно-сосудистые эффекты |
ССЗ обнаруживают не менее чем у 50% больных с ХОБЛ [36]. Наличие ХОБЛ у больного повышает риск развития ССЗ в 2–3 раза [37] |
Хроническое персистирующее системное воспаление играет важную роль в патогенезе сердечно-сосудистых расстройств у больных с ХОБЛ. Отмечается увеличение риска ССЗ, коррелирующее с повышением уровня СРБ [38], который является мощным независимым фактором — предиктором роста ССЗ и летальности пациентов с ХОБЛ [39]. Основу сердечно-сосудистой патологии следует трактовать как результат дисфункции эндотелия и ее патологических последствий, проявляющихся в усилении вазоконстрикции в ответ на стимулы, усилении сосудистого тонуса, пролиферации и миграции гладкомышечных клеток, экспрессии адгезивных молекул, увеличении агрегации тромбоцитов, адгезией моноцитов и т.п. Все изложенное выше и приводит к прогрессированию АГ, ускоренному развитию атеросклероза, склонности к тромбообразованию и т.д.
Исследования, проведенные в Великобритании, объединяющие более 5 млн историй болезни, показали, что [40]:
-
пациенты с ХОБЛ в 5 раз чаще страдают ССЗ;
-
в группе от 35 до 45 лет в 7,6 раза у пациентов с ХОБЛ выше шансы развития сопутствующей сердечно-сосудистой патологии;
-
у молодых пациентов с ХОБЛ риск ИМ возрастает в 12 раз.
Системное воспаление вносит свой вклад и в развитие остеопороза [41, 42]. У больных с ХОБЛ остеопороз встречается чаще, чем в здоровой популяции (30%), и достигает 69%. Так, известно, что ФНО-α является ингибитором синтеза коллагена и стимулятором остеокластической резорбции кости. Вместе с тем следует подчеркнуть, что важную роль в развитии остеопороза играют другие факторы, включая курение, недостаток витамина D, низкий ИМТ, малоподвижный образ жизни, гипогонадизм, применение глюкокортикоидных гормонов, а также генетический фактор. Пациенты с ХОБЛ имеют более высокий риск снижения плотности костной ткани и развития переломов, причем этот риск в большей степени обусловлен хроническим системным воспалением, чем применением ГК, включая ИГК. Степень выраженности остеопороза можно определить по данным денситометрии и/или сканирования опорно-двигательного аппарата.
Наряду со свойственной больным с ХОБЛ полицитемией, у них отмечается высокая распространенность анемии: по данным М. John и соавт. (2005), у 13% больных выявляется анемия, как правило, нормохромная и нормоцитарная, в то время как полицитемия отмечена у 8,4% больных [43]. Основной причиной развития анемии у больных с ХОБЛ является персистенция системного воспаления, проявляющаяся повышением концентрации воспалительных медиаторов, в том числе ФНО-α, ИЛ-6 и свободных кислородных радикалов. Все это приводит к уменьшению срока жизни эритроцитов (ускоренный их распад), недостаточной выработке эритропоэтина в ответ на физиологические стимулы, нарушению регуляции обмена железа (снижение мобилизации железа из депо, повышение связывания с ферритином), нарушению эритропоэза в костном мозге (резистентность клеток-предшественников к эритропоэтину, апоптоз клеток-предшественников) [44].
Одни из отягчающих проявлений системных эффектов, оказывающих существенное влияние на клиническую картину и прогноз у больных с ХОБЛ, — нервно-психические нарушения, проявляющиеся снижением памяти, депрессией, «страхами» и нарушением сна [45]. Все начинается с развития у больных так называемых страхов, связанных с ограничением повседневной активности из-за одышки, невозможностью справиться с ней, нарастанием тяжести симптомов и частыми простудами.
Увеличение частоты депрессий ассоциируется с высокой частотой обострений и повторными госпитализациями, а также с более высокой ценой медицинского обслуживания.
Помимо таких расстройств, могут встречаться и другие нарушения, которые существенно влияют на поведение в болезни, в том числе встречаемая нередко у больных с ХОБЛ и малоизученная гипонозогнозическая реакция на заболевание, характеризуемая отрицанием воздействия на жизнь даже такого тяжелого заболевания, как ХОБЛ [46].
У ряда больных с ХОБЛ отмечается снижение питательного статуса (кахексия), основной причиной которого служит потеря мышечной массы [47]. Причиной этой потери и слабости мышц, возможно, является активация апоптоза и/или бездействие мышц в связи с практически обездвиженным образом жизни, который вынуждены вести больные с ХОБЛ тяжелого течения [48].
В последние годы все большее внимание обращается на сопутствующие заболевания со стороны органов пищеварения. Отмечается рост эзофагита, гастрита или язвы желудка, а особенно ГЭРБ [49].
Сопутствующие заболевания могут изменять клиническую картину ХОБЛ и оказывать существенное влияние на лечение таких больных. Помимо изложенного выше, клиническую картину ХОБЛ следует рассматривать в рамках комплекса болезней, свойственных людям пожилого возраста. Известно, что пожилые больные часто страдают несколькими хроническими заболеваниями. По данным исследования, проведенного С. van Well (1996) в Нидерландах, во всем мире 25% людей в возрасте старше 65 лет страдают двумя из пяти наиболее распространенных заболеваний (к которым относится и ХОБЛ), а 10% страдают тремя и более из этих заболеваний. В возрасте 75 лет и старше показатели достигают 40 и 25% соответственно [50].
Для ХОБЛ характерно частое развитие сопутствующих заболеваний. Некоторые (например, ИБС, бронхиальная карцинома, остеопороз), как правило, являются косвенным следствием ХОБЛ, возникая у пожилых больных независимо, но при наличии ХОБЛ — с большей вероятностью. Другие сопутствующие патологии (СД, гастроэзофагеальный рефлюкс, артрит, аденома простаты) могут существовать одновременно с ХОБЛ, поскольку они являются частью процесса старения. В целом следует подчеркнуть, поскольку ХОБЛ обычно развивается у длительно курящих, такие люди очень часто страдают другими различными заболеваниями, связанными или с курением, или с возрастом (старше 40–45 лет), которые отягчают клиническую картину ХОБЛ, могут существенно модифицировать ее течение. Это положение постоянно подчеркивается и в программах GOLD (2006, 2011, 2013–2015 гг.). Недоучет влияния сопутствующих болезней на основные симптомы ХОБЛ нередко может стать причиной диагностических и лечебных ошибок у этой категории больных.
Подводя итог описанию клинической картины, следует подчеркнуть, что выраженность клинических проявлений у больных с ХОБЛ зависит от многочисленных факторов, включающих:
-
фазу процесса (стабильное течение или обострение);
-
тяжесть течения;
-
фенотип болезни (бронхитический, эмфизематозный, смешанный, ХОБЛ + астма и др.);
-
выраженность внелегочных проявлений или/и сопутствующих заболеваний;
-
наличие осложнений и их характер.
Все описанное выше наряду с интенсивностью воздействия факторов риска, скоростью прогрессирования болезни и создает облик больного с ХОБЛ в разные периоды его жизни.
Диагностика хронической обструктивной болезни легких
Диагноз «хроническая обструктивная болезнь легких» должен предполагаться у всех пациентов при наличии кашля, выделении мокроты или одышке и выявлении факторов риска развития ХОБЛ.
Особенность клинической картины ХОБЛ состоит в том, что болезнь долгое время протекает без выраженных клинических проявлений и это может затруднять своевременную постановку диагноза. Проблема гиподиагностики связана также с тем, что многие люди, страдающие ХОБЛ, не ощущают себя больными. В реальной жизни на ранних стадиях заболевания курильщик не считает себя больным ХОБЛ, так как оценивает кашель как нормальное состояние, если трудовая деятельность его еще не нарушена. Из-за отсутствия одышки на определенном этапе развития заболевания больные не попадают в поле зрения врача. Отсюда следует, что в подавляющем большинстве случаев диагностика ХОБЛ осуществляется на инвалидизирующих стадиях болезни, а наличие кашля с мокротой курильщики не считают проявлением заболевания, объясняя это тем, что все курильщики кашляют. Даже появление одышки, возникающей при физической нагрузке, расценивается ими как результат пожилого возраста или детренированности.
Будучи уже больным ХОБЛ, курильщик на ранних стадиях болезни и вне обострения обращается к врачам-специалистам по поводу других заболеваний, также являющихся результатом курения. Так, например, если у курильщика «стынут» или «зябнут» ноги — он обращается к хирургу, а если беспокоит одышка и появляется чувство нехватки воздуха — пациент направляется к кардиологу. Из этого нужно сделать вывод, что и специалисты должны знать и помнить о развитии ХОБЛ у курящего и направлять его на исследование ФВД или на консультацию к пульмонологу.
Диагноз ХОБЛ всегда необходимо подтверждать результатами исследования ФВД. Спирометрия должна проводиться всем пациентам, имеющим в анамнезе:
-
курение или контакт с поллютантами окружающей среды либо профессиональными вредностями;
-
респираторные болезни у родственников;
-
наличие длительного кашля, продукции мокроты и/или одышки.
Основные направления диагностики ХОБЛ включают:
-
выявление факторов риска (установление ингаляционного воздействия патогенных агентов, в первую очередь табачного дыма);
-
сведения, полученные из беседы с больным (анализ словесного портрета больного) — кашель, его характер, одышка, ее выраженность, определяемая у больных с ХОБЛ, на основании вопросника mMRC [51] (табл. 8.22);
-
для оценки клинической картины применение оценочного теста COPD Assessment Test (CAT) [18, 25] (табл. 8.23);
-
объективизацию симптомов обструкции (данные объективного обследования);
-
исследование респираторной функции легких (диагноз ХОБЛ должен быть подтвержден данными спирометрии: постбронходилатационные значения ОФВ1/ФЖЕЛ <70% на всех стадиях заболевания). Показатель ОФВ1 отражает степень нарушения бронхиальной проходимости [52].
Рентгенография органов грудной клетки должна быть проведена всем больным с предполагаемым диагнозом ХОБЛ. Этот метод не является чувствительным инструментом для постановки диагноза, но позволяет исключить другие заболевания, сопровождаемые аналогичными с ХОБЛ клиническими симптомами (опухоль, туберкулез, ЗСН и т.п.), а в период обострения — выявить пневмонию, плевральный выпот, спонтанный пневмоторакс и т.д. В типичных случаях обструктивные изменения рентгенографически характеризуются увеличением объема легких за счет гипервоздушности респираторных отделов (на ранних стадиях заболевания эти проявления, как правило, отсутствуют). И.Е. Тюрин [53] приводит следующие рентгенологические признаки бронхиальной обструкции (рис. 8.31, см. ):
-
уплощение купола диафрагмы;
-
ограничение подвижности диафрагмы при дыхательных движениях;
-
изменение переднезаднего размера грудной полости;
-
расширение ретростернального пространства;
-
«саблевидная трахея»;
-
вертикальное расположение сердца.
| Степень | Тяжесть | Описание |
|---|---|---|
|
0 |
Нет |
Я чувствую одышку только при сильной физической нагрузке |
|
1 |
Легкая |
Я задыхаюсь, когда быстро иду по ровной местности или поднимаюсь по пологому холму |
|
2 |
Средняя |
Из-за одышки я хожу по ровной местности медленнее, чем люди того же возраста, или у меня останавливается дыхание, когда я иду по ровной местности в привычном для меня темпе |
|
3 |
Тяжелая |
Я задыхаюсь после того, как пройду примерно 100 м или после нескольких минут ходьбы по ровной местности |
|
4 |
Очень тяжелая |
У меня слишком сильная одышка, чтобы выходить из дому, или я задыхаюсь, когда одеваюсь или раздеваюсь |
|
Я никогда не кашляю |
0 |
1 |
2 |
3 |
4 |
5 |
Я постоянно кашляю |
|
У меня в легких совсем нет мокроты (слизи) |
0 |
1 |
2 |
3 |
4 |
5 |
Мои легкие наполнены мокротой (слизью) |
|
У меня совсем нет ощущения сдавления в грудной клетке |
0 |
1 |
2 |
3 |
4 |
5 |
У меня очень сильное ощущение сдавления в грудной клетке |
|
Когда я иду в гору или поднимаюсь вверх на один лестничный пролет, у меня нет |
0 |
1 |
2 |
3 |
4 |
5 |
Когда я иду в гору или поднимаюсь вверх на один лестничный пролет, возникает сильная одышка |
|
Моя повседневная деятельность в пределах дома не ограничена |
0 |
1 |
2 |
3 |
4 |
5 |
Моя повседневная деятельность в пределах дома очень ограничена |
|
Несмотря на мое заболевание легких, я чувствую себя уверенно, когда выхожу из дома |
0 |
1 |
2 |
3 |
4 |
5 |
Из-за моего заболевания легких я совсем не чувствую себя уверенно, когда выхожу из дома |
|
Я сплю очень хорошо |
0 |
1 |
2 |
3 |
4 |
5 |
Из-за моего заболевания легких я сплю очень плохо |
|
У меня много энергии |
0 |
1 |
2 |
3 |
4 |
5 |
У меня совсем нет энергии |
Примечание: 0–10 баллов — незначительное влияние ХОБЛ на жизнь пациента; 11–20 баллов — умеренное влияние ХОБЛ на жизнь пациента; 21–30 баллов — сильное влияние ХОБЛ на жизнь пациента; 31–40 баллов — чрезвычайно сильное влияние ХОБЛ на жизнь пациента.
Обширные участки легочных полей, лишенные легочного рисунка, обычно в сочетании с оттеснением или обрывом легочных сосудов — так рентгенологически могут выглядеть проявления эмфиземы.
Рентгенография может выявить тонкостенные воздушные полости — результат развития буллезной эмфиземы, однако внутридольковая, парасептальная и другие формы эмфиземы могут быть выявлены с помощью КТ высоких разрешений. КТ помогает не только уточнить природу эмфиземы, но и обнаружить БЭ.
ЭКГ относится к обязательным методам обследования и позволяет у ряда больных обнаружить признаки гипертрофии и/или перегрузки правых отделов сердца, однако эти признаки могут изменяться при развитии эмфиземы и не соответствовать общепринятым критериям. Данные ЭКГ в большинстве случаев помогают исключить (или уточнить) кардиальный генез респираторной симптоматики.
Из числа лабораторных методов диагностики к обязательно выполняемым относятся исследования клинического анализа крови и цитологии мокроты.
При обострении заболевания наиболее часто встречаются нейтрофильный лейкоцитоз с палочкоядерным сдвигом и увеличение скорости оседания эритроцитов. Наличие лейкоцитоза служит дополнительным аргументом в пользу инфекционного фактора как причины обострения ХОБЛ.
При стабильном течении ХОБЛ существенных изменений содержания лейкоцитов в периферической крови не происходит.
При исследовании клинического анализа крови может быть выявлена как анемия (результат общего воспалительного синдрома), так и полицитемия. Полицитемический синдром (повышение числа эритроцитов, высокий уровень гемоглобина — более 16 г/дл у женщин и более 18 г/дл у мужчин, и повышение гематокрита >47% у женщин и >52% у мужчин) может указывать на существование выраженной и длительной гипоксемии. Существование этого синдрома свойственно, как правило, тяжелому течению ХОБЛ, и если болезнь диагностируется на таком этапе, это свидетельствует об очень поздней постановке диагноза.
Цитологическое исследование мокроты дает информацию о характере воспалительного процесса и степени его выраженности. Определение атипичных клеток усиливает онкологическую настороженность и требует проведения дополнительных методов обследования.
Культуральное микробиологическое исследование мокроты целесообразно проводить при неконтролируемом прогрессировании инфекционного процесса и использовать для подбора рациональной антибиотикотерапии [54]. С этой же целью проводится бактериологическое исследование бронхиального содержимого, полученного при бронхоскопии.
Бронхоскопическое исследование служит дополнительным при диагностике ХОБЛ. Оно проводится для оценки состояния слизистой оболочки бронхов и дифференциальной диагностики с другими заболеваниями органов дыхания, которые могут быть причиной хронической бронхиальной обструкции.
Исследование может включать:
-
осмотр слизистой оболочки бронхов;
-
культуральное исследование бронхиального содержимого;
-
бронхиальный лаваж с определением клеточного состава;
-
биопсию стенки бронхов.
α-1-Антитрипсин
У относительно молодых больных (моложе 40 лет) или у больных с явным семейным анамнезом ХОБЛ имеет смысл исследовать уровень ААТ. Если его сывороточная концентрация составляет менее 15–20% нормального уровня, то очень высока вероятность, что у больного гомозиготный тип дефицита ААТ, который может быть причиной развития ХОБЛ.
Газовый состав артериальной крови. У больных при диагностике ХОБЛ на поздних стадиях развития заболевания (ОФВ1 <50% должного или при наличии признаков тяжелой ДН либо правожелудочковой СН) следует провести исследование газового состава артериальной крови. Наиболее важными показателями являются PaO2, PaCO2, рH и уровень бикарбонатов НСО3 артериальной крови (рекомендуется серийное исследование этих показателей).
При отсутствии возможности определить PaO2 артериальной крови ориентировочную информацию о степени гипоксемии позволяет получить исследование SpO2 с помощью пульсоксиметра.
Диффузионная способность. Для дифференциальной диагностики БА и эмфиземы дополнительно изучается DLCO. Так, при эмфиземе этот параметр значительно снижен вследствие редукции капиллярного русла.
ЭхоКГ. Врач дополнительно может направить пациента на УЗИ сердца для выявления и оценки дисфункции правых (а при наличии изменений — и левых) отделов сердца и определения легочной гипертензии и степени ее выраженности.
Проба с физической нагрузкой. Для объективизации степени ограничения физических возможностей рекомендуется провести пробу с физической нагрузкой [55]. Предпочтение отдается тесту 6-МТ, который выполняется по стандартному протоколу. Тест 6-МТ используется в тех случаях, когда выраженность одышки не соответствует снижению ОФВ1, а также применяется для отбора больных на реабилитационные программы.
С учетом того, что постановка диагноза «хроническая обструктивная болезню легких» — прерогатива врача первичного звена, для улучшения диагностики ХОБЛ предлагается следующий алгоритм действий врача-терапевта, который включает следующее.
-
Выявление факторов риска и определение индекса курящего человека (ИКЧ).
-
Анкетирование каждого курящего и/или имеющего контакт с пылью, используя опросник CAT.
-
Определение наличия и степени выраженности одышки по вопроснику mMRС.
-
Выявление объективных признаков бронхиальной обструкции и/или эмфиземы (необходимо знать, что клинические признаки ограничения воздушного потока обычно не выражены до развития существенного нарушения функции легких и имеют относительно невысокую чувствительность).
-
Проведение пикфлоуметрии и теста с бронхолитиками.
-
Постановка вероятного диагноза ХОБЛ и назначение лекарственных препаратов для регулярной терапии.
-
Проведение лабораторно-инструментального обследования (согласно принятым стандартам: клинический анализ крови, мокроты, рентгенологическое исследование органов грудной клетки и ЭКГ).
-
Спирометрия.
-
Направление к специалисту-пульмонологу.
Таким образом, диагностика ХОБЛ базируется на суммировании следующих данных:
-
наличие факторов риска, в том числе табакокурения;
-
клинических признаков, главными из которых являются кашель и экспираторная одышка, сухие свистящие хрипы;
-
по данным ФВД — неуклонно прогрессирующие нарушения бронхиальной проходимости и наличие частично (слабо) обратимой или необратимой обструкции;
-
исключение других заболеваний, которые могут привести к появлению указанных выше симптомов.
Классификация хронической обструктивной болезни легких
Классификация ХОБЛ с учетом рекомендаций программы GOLD (2016) основана на интегральной оценке тяжести больных с ХОБЛ и включает постбронходилатационные значения показателей ОФВ1 и ФЖЕЛ (табл. 8.24).
| Стадия ХОБЛ | Степень тяжести | ОФВ1/ФЖЕЛ | ОФВ1, % должного |
|---|---|---|---|
|
I |
Легкая |
<0,7 (70%) |
ОФВ1 ≥80 |
|
II |
Среднетяжелая |
<0,7 (70%) |
50% ≤ОФВ1 <80 |
|
III |
Тяжелая |
<0,7 (70%) |
30% ≤ОФВ1 <50 |
|
IV |
Крайне тяжелая |
<0,7 (70%) |
ОФВ1 <30 |
Классификация ХОБЛ включает клинические данные о пациенте: количество обострений ХОБЛ за год и выраженность клинических симптомов, используя тест CAT (см. табл. 8.23). Оценку одышки по результатам вопросника mMRC (см. табл. 8.22) следует использовать только у больных с установленным диагнозом ХОБЛ. В табл. 8.25 представлена классификация ХОБЛ.
| Группа больных | Характеристика | Спирометрическая классификация | Число обострений за год | mMRC-шкала одышки | CAT-тест оценки симптомов ХОБЛ |
|---|---|---|---|---|---|
|
A |
Низкий риск обострений. |
GOLD 1–2 |
≤1 |
0–1 |
<10 |
|
B |
Низкий риск обострений. |
GOLD 1–2 |
≤1 |
≥2 |
≥10 |
|
C |
Высокий риск обострений. |
GOLD 3–4 |
≥2 |
0–1 |
<10 |
|
D |
Высокий риск обострений. |
GOLD 3–4 |
≥2 |
≥2 |
≥10 |
При оценке степени риска рекомендуется выбирать наивысшую степень в соответствии с ограничением скорости воздушного потока по классификации GOLD или с частотой обострений в анамнезе.
Дифференциальная диагностика хронической обструктивной болезни легких
Основная задача дифференциальной диагностики ХОБЛ — исключение заболеваний со сходной симптоматикой. Несмотря на вполне определенные различия между БА и ХОБЛ по механизмам развития, в клинических проявлениях и принципах профилактики и лечения эти два заболевания имеют некоторые общие черты.
Дифференциальная диагностика БА и ХОБЛ основана на интеграции основных данных клинической картины, результатов функциональных и лабораторных тестов.
Особенности воспаления при ХОБЛ и БА представлены на рис. 8.32.
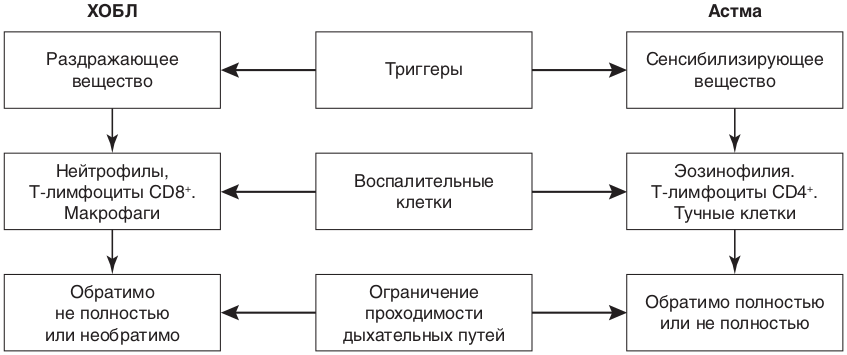
Рис. 8.32. Характеристика воспаления при хронической обструктивной болезни легких и при астме
Ведущие отправные пункты для дифференциальной диагностики этих болезней даны в табл. 8.26.
| Признаки | ХОБЛ | БА |
|---|---|---|
|
Возраст начала болезни |
Как правило, старше 40 лет |
Чаще детский и молодой |
|
Курение в анамнезе |
Характерно |
Нехарактерно |
|
Факторы риска |
Курение (до 90%), продукты сгорания некоторых видов бытового топлива, промышленного загрязнения и некоторые производственные факторы (кремний, кадмий) |
Бытовые аллергены, пыльца растений, некоторые производственные факторы |
|
Отягощенная наследственность по астме |
Нехарактерна |
Характерна |
|
Внелегочные проявления аллергии |
Нехарактерны |
Характерны |
|
Характер воспаления |
Локализуется преимущественно в периферических дыхательных путях, распространяется на интерстициальную ткань и паренхиму легких, приводя к деструкции эластического каркаса стенок альвеол и формированию эмфиземы легких |
Локализуется преимущественно в периферических дыхательных путях без распространения на интерстициальную ткань и паренхиму легких |
|
Тип воспаления |
Преобладают нейтрофилы |
Преобладают эозинофилы |
|
Характер течения заболевания |
Позднее появление и медленное неуклонное нарастание респираторных симптомов. Поздняя диагностика. |
Волнообразность и яркость клинических проявлений, их обратимость (либо спонтанно, либо под влиянием терапии), отсутствие прогрессирования при неосложненных формах БА |
|
Симптомы (кашель и одышка) |
Постоянны, прогрессируют медленно |
Изменчивы, появляются приступообразно, сезонность |
|
Наличие легочного сердца |
Характерно при тяжелом течении |
Нехарактерно |
|
Бронхиальная обструкция |
Малообратима или необратима |
Обратима |
|
Показатели ФВД |
Снижение ОФВ1/ФЖЕЛ <70%. |
Прирост ОФВ1 ≥12% исходной величины и ≥200 мл в ингаляционной пробе с короткодействующими бронходилататорами |
|
Суточная вариабельность ПСВ |
<10% |
>20% |
|
Эффективность глюкокортикоидной терапии |
Низкая |
Высокая |
* Положительный результат теста не исключает ХОБЛ.
Вместе с тем следует помнить о том, что ХОБЛ может сочетаться с БА, создавая так называемый синдром перекреста (overlap syndrome), о чем подробно изложено в разделе «Клиническая картина ХОБЛ».
Помимо бронхиальной астмы, на определенных стадиях развития ХОБЛ (особенно при первой встрече с больным) возникает необходимость дифференцировать ХОБЛ от ряда других заболеваний со сходной симптоматикой. Их основные отличительные признаки приведены в табл. 8.27.
| Диагноз | Основные диагностические критерии |
|---|---|
|
Хроническая обструктивная болезнь легких |
Начало в зрелом возрасте. Симптомы медленно прогрессируют. Длительный анамнез курильщика. Одышка при нагрузке. В основном малообратимое или необратимое ограничение воздушного потока |
|
Сердечная недостаточность |
Хрипы в нижних отделах легких при аускультации. Значительное снижение фракции выброса ЛЖ. Дилатация отделов сердца. На рентгенограмме расширение контуров сердца, застойные явления, вплоть до отека легких. При исследовании функции легких определяются нарушения по рестриктивному типу, без ограничения воздушного потока |
|
Бронхоэктазы |
Большие объемы гнойной мокроты. Частая связь с бактериальной инфекцией. Грубые влажные разнокалиберные хрипы при аускультации. Симптом «барабанных палочек». На рентгенограмме или КТ расширение бронхов, утолщение их стенок |
|
Туберкулез |
Начинается в любом возрасте. Рентгенография демонстрирует инфильтрат в легких или очаговые поражения. Микробиологическое подтверждение. Высокая заболеваемость в данном регионе. При подозрении на туберкулез легких: томография и/или КТ легких, исследования мокроты на МБТ, в том числе методом флотации, посев мокроты на МБТ, исследования плеврального экссудата, диагностическая бронхоскопия с биопсией при подозрении на туберкулез бронха, реакция Манту |
|
Облитерирующий бронхиолит |
Развитие в молодом возрасте. Связи с курением не установлено. Ревматоидный артрит. Контакт с парами, дымом. На КТ определяются очаги пониженной плотности при выдохе |
|
Диффузный панбронхиолит |
Большинство пациентов — некурящие мужчины, почти все больны хроническим пансинуситом. На рентгенограмме или КТ высокого разрешения — диффузные малые центрилобулярные узловые затемнения и гиперинфляция |
Дифференциальная диагностика на разных стадиях развития ХОБЛ имеет свои особенности. При легком течении ХОБЛ главное — выявить отличия от других заболеваний, связанных с факторами экологической агрессии, протекающих субклинически или с малой симптоматикой, в первую очередь — различных вариантов хронических бронхитов. Сложность возникает при проведении дифференциальной диагностики у больных с тяжелым течением ХОБЛ. Она определяется не только тяжестью больных, выраженностью необратимых изменений, а также большим набором сопутствующих заболеваний (ИБС, гипертоническая болезнь, болезни обмена и т.д.).
Сопутствующие заболевания
Наиболее частые сопутствующие заболевания при ХОБЛ показаны в табл. 8.28.
| Нозологическая форма | Частота встречаемости, % |
|---|---|
|
Сердечно-сосудистые заболевания |
42,0 |
|
Остеопороз |
28–34 |
|
Депрессия |
35–42 |
|
Инфекция нижних дыхательных путей |
67–72 |
|
Синдром апноэ сна |
17–26 |
|
Катаракта |
31–32 |
|
ТЭЛА* |
10–20 |
|
Импотенция |
37–43 |
* ТЭЛА — тромбоэмболия легочной артерии.
Прогноз наиболее неблагоприятен при сочетании ХОБЛ с группой ССЗ. Среди лидирующих, но нераспознанных причин смерти у больных с ХОБЛ — ИБС и СН. По данным крупных популяционных исследований, риск смерти от сердечно-сосудистых патологий у больных с ХОБЛ повышен в 2–3 раза и составляет приблизительно 50% общего количества смертельных случаев. Причины смерти пациентов с ХОБЛ отражены в табл. 8.29.
| Причина смерти | % |
|---|---|
|
Легочная |
35 |
|
Сердечно-сосудистая |
27 |
|
Рак |
21 |
|
Другая |
10 |
|
Причина неизвестна |
7 |
Доказано, что ОФВ1 может быть маркером будущего кардиоваскулярного риска, т.е. прогрессирующее снижение ОФВ1 опосредует манифестацию внелегочных заболеваний, негативно отражаясь на величине общей и кардиоваскулярной смертности.
Взаимосвязь сопутствующей патологии при ХОБЛ и риска смерти показана на рис. 8.33.
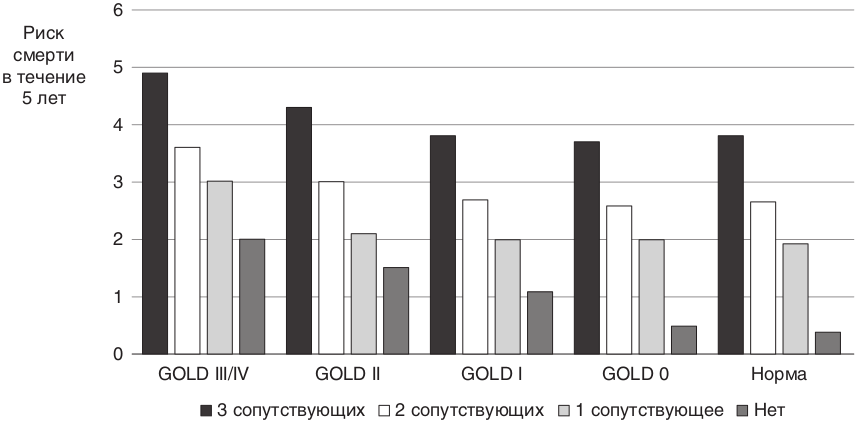
Рис. 8.33. Сопутствующие заболевания и риск смерти [57]
Хроническая обструктивная болезнь легких и сердечно-сосудистые заболевания
На рис. 8.34 показан риск развития ССЗ у пациентов с ХОБЛ.
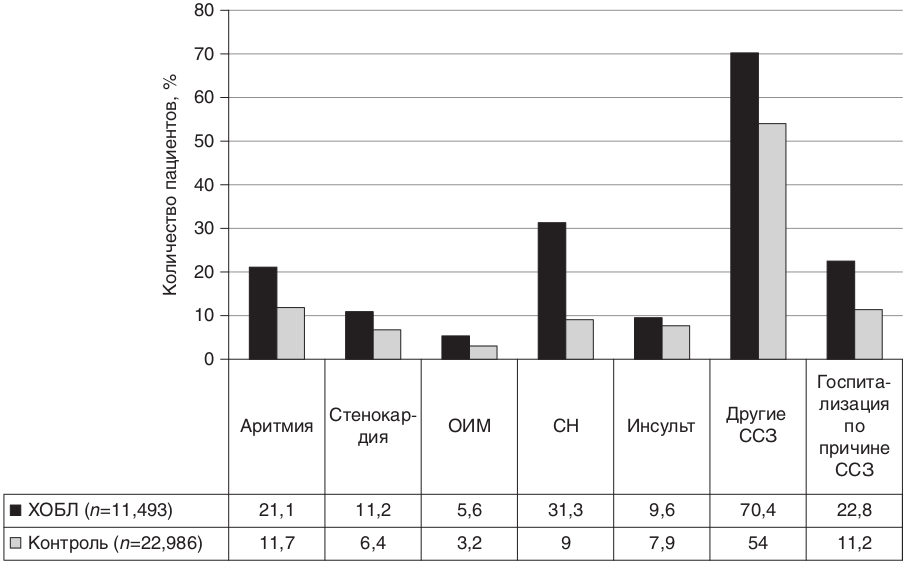
Рис. 8.34. Риск развития сердечно-сосудистых заболеваний у пациентов с хронической обструктивной болезнью легких [58]
Больные, страдающие тяжелыми формами ХОБЛ, относятся к группе высокого риска внезапной смерти. Одной из причин, которая может лежать в основе развития внезапной смерти, является нарушение ритма сердечных сокращений. Суправентрикулярные и вентрикулярные формы нарушения ритма сердца являются достаточно частой клинической проблемой у больных.
Несомненно, большую роль в прогнозе для жизни пациента с ХОБЛ играет сопутствующая ИБС и СН. В случаях ХОБЛ другую важную причину возникновения эпизодов аритмии связывают с приемом определенных лекарственных средств: теофиллина, дигоксина, агонистов β2-рецепторов. Весь спектр перечисленных условий возникновения аритмий у больных с ХОБЛ затрудняет получение полной картины данной клинической проблемы. Особое место в изучении аритмий сердца у больных с ХОБЛ занимает мультифокальная предсердная тахикардия. Основными морфологическими признаками этой формы нарушения ритма сердечных сокращений является вариабельность зубца Р, зубцы Р различаются по форме, полярности, амплитуде, что лучше регистрируется в отведениях I, II, III; ЧСС более 100 в минуту, интервалы Р–Р и Р–R, R–R разные. Мультифокальная предсердная тахикардия ассоциируется в значительной степени с ДН, причем с ее возникновением связывают функциональные изменения в работе сердечной мышцы. Прогноз течения ХОБЛ при появлении этого типа сердечной аритмии принято считать неблагоприятным.
Сочетание АГ и ХОБЛ достаточно часто встречается в клинической практике. Нередко пациенты с этими формами сочетанных болезней представляют одну и ту же возрастную группу. Трудности в ведении этой категории больных связаны в первую очередь с тем, что некоторые антигипертензивные лекарственные средства могут оказывать эффект бронхоконстрикции, тем самым усугубляя течение БА и ХОБЛ. Общие рекомендации построены на предельно осторожном назначении β-адреноблокаторов; в меньшей степени эти рекомендации распространяются на группу иАПФ. Необходимо подчеркнуть патогенетическую роль гипоксемии в развитии артериальной гипертензии.
ИБС и ХОБЛ достаточно часто бывают сопутствующими заболеваниями. В клинической практике порой бывает трудно определить, какая из болезней у данного конкретного больного в данной клинической ситуации является ведущей. Большую роль отводят развитию гипоксемии, которая существенно ухудшает течение ИБС. Особенно пагубно сказываются снижение SpO2 до 80% и продолжительность гипоксии более 5 мин. Наиболее опасную группу больных составляют те, у которых гипоксия сочетается с гиперкапнией. В лечебные программы этой категории больных обязательно включается назначение кислорода. Неоднократно было показано, что длительная терапия кислородом (время ингаляции превышает
15 ч/сут) значительно повышает выживаемость больных.
Хроническая обструктивная болезнь легких и сердечная недостаточность
Отдельного внимания заслуживают больные с ХОБЛ и СН. Селективные β-адреноблокаторы, имеющие большое значение при лечении СН, не влияют значимо на краткосрочную функцию легких и не ослабляют β2-индуцированную бронходилатацию. Селективные β1-адреноблокаторы могут безопасно применяться у всех пациентов с СН и заболеваниями легких.
Доказаны положительные эффекты статинов, иАПФ, антагонистов рецепторов ангиотензина на кардиоваскулярную и респираторную заболеваемость и смертность у пациентов с ХОБЛ.
Хроническая обструктивная болезнь легких, метаболический синдром и сахарный диабет
К экстрапульмональным эффектам относят и сахарный диабет, который манифестирует у пациентов старше 40 лет. Среди госпитализированных больных с ХОБЛ у 14% выявлялся сахарный диабет. Среди пациентов с СД 2-го типа и сопутствующей ХОБЛ наблюдаются более высокие концентрации СРБ, фибриногена, ИЛ-6 и TNF-α по сравнению с пациентами без обструктивных заболеваний легких, независимо от их пола и возраста.
Особенности течения ХОБЛ при СД 2-го типа:
-
более выражена ДН;
-
частые обострения ХОБЛ;
-
гиперреактивность бронхов;
-
преобладание смешанного фенотипа ХОБЛ;
-
увеличение частоты развития и более тяжелое течение коронарной болезни сердца, ХСН и АГ (рефрактерность к терапии);
-
гипоксемия, нарастание легочной гипертензии и легочного сосудистого сопротивления;
-
меньшая выраженность гиперинфляция легких.
Хроническая обструктивная болезнь легких и остеопороз
Основными причинами и механизмами развития остеопороза при ХОБЛ могут быть следующие: курение, низкая масса тела, дефицит витамина D, гипогонадизм, гипомобильность, глюкокортикоидная терапия.
Основные клинические проявления остеопороза:
-
болевой синдром;
-
переломы (позвоночник, проксимальная часть бедра);
-
снижение мышечной массы тела.
Диагностика остеопороза: двуэнергетическая рентгеновская абсорбциометрия.
Основные направления терапии больных остеопорозом в сочетании с ХОБЛ:
-
контроль ХОБЛ в фазе обострений и ремиссий (бронхолитики, муколитики, антибиотики, глюкокортикоиды, вакцины, реабилитация, кинезотерапия, образовательные программы и др.);
-
контроль сопутствующей патологии;
-
физическая активность;
-
борьба с алиментарной недостаточностью;
-
антиостеопоротические препараты.
Исследования по применению антиостеопоротических препаратов у больных с ХОБЛ касаются главным образом больных, получающих глюкокортикоиды, являющиеся доказанным фактором риска остеопороза.
Хроническая обструктивная болезнь легких и психические расстройства
Депрессия отмечается как наиболее часто встречаемое эмоциональное расстройство, связанное с ХОБЛ. Такие симптомы, как пессимизм, безнадежность и безысходность, указываются практически всеми исследователями психологических аспектов ХОБЛ.
Причины депрессии у больных с ХОБЛ:
-
социальные проблемы, вызванные заболеванием, — потеря интереса к различным видам деятельности, снижение возможности выполнять привычную для себя работу, адаптационные сложности в коллективе и в семье;
-
материальные проблемы, связанные с частой нетрудоспособностью;
-
физиологические факторы, в частности хроническая гипоксия головного мозга.
Дифференциально-диагностические критерии ХОБЛ и БА изложены в разделе «Клинические особенности ХОБЛ».
Список литературы
См.
Лечение хронической обструктивной болезни легких стабильного течения
Основные направления терапии при стабильном течении ХОБЛ включают:
-
Немедикаментозное лечение.
-
Медикаментозную терапию.
-
Другие методы лечения.
Немедикаментозное лечение
Задачи немедикаментозной терапии:
-
снижение влияния факторов риска развития и прогрессирования ХОБЛ (антиникотиновые программы, снижение и предупреждение влияния производственных вредностей, атмосферных и домашних поллютантов);
-
распространение среди населения профильных образовательных программ;
-
вакцинопрофилактика;
-
поддержание физической активности больного с ХОБЛ;
-
легочная реабилитация.
Медикаментозная терапия
Задачи медикаментозной терапии:
-
контроль симптомов заболевания;
-
улучшение функции легких;
-
сокращение частоты и тяжести обострений;
-
улучшение общего состояния и повышение толерантности к физической нагрузке;
-
предотвращение смертельного исхода от основного заболевания и сопутствующей патологии.
В сравнительном исследовании по оценке выживаемости больных с ХОБЛ между подгруппами 1–4 (по GOLD, 2007) и A–D (по GOLD, 2011) показано, что выживаемость при ХОБЛ хуже в группе B, чем в группе C, т.е. у больных с выраженными симптомами, несмотря на удовлетворительные показатели ОФВ1 (≥50% должной величины) по сравнению с пациентами с невыраженными симптомами, но с низкими показателями ОФВ1 (<50% должной величины) (рис. 8.35) [1]. Следовательно, основная задача, стоящая перед лечащим врачом, — влияние на симптомы заболевания и, следовательно, предотвращение обострений ХОБЛ и снижение риска смертельного исхода.
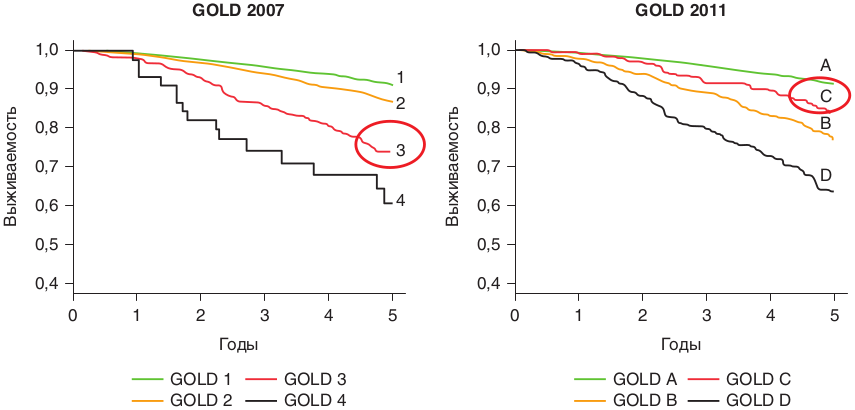
Рис. 8.35. Выживаемость больных в соответствии с подгруппами хронической обструктивной болезни легких 1–4 и A–D [1]
Ни одно из имеющихся средств для лечения ХОБЛ на данный момент не влияет на долгосрочное снижение легочной функции, что служит отличительной чертой этой болезни [2, 3]. В результате лечения возможно снижение темпов прогрессирования ХОБЛ. Выбор лекарственных средств для регулярной терапии и объем препаратов для больных с ХОБЛ зависят от выраженности симптомов, степени ограничения воздушного потока (оценка ФВД), риска обострений, сопутствующих заболеваний [2].
Перечень основных лекарственных препаратов, зарегистрированных в России и применяемых для базисной терапии больных с ХОБЛ, представлен в табл. 8.30 [2, 3].
|
Препараты, международное непатентованное наименование (торговое название) |
Разовые дозы |
Длительность действия, ч |
||
|
ингалятор, мкг |
раствор для небулайзера, мг/мл |
для приема внутрь, мг |
||
|
β2-Агонисты |
||||
|
Короткодействующие |
||||
|
Фенотерол (Беротек Н♠) |
100–200 (ДАИ1) |
1/1 |
– |
4–6 |
|
Сальбутамол (Вентолин♠, Саламол♠, Саламол Эко Легкое дыхание♠, Сальбутамол♠, Сальбувент♠⊗, Сальбутамол-натив♠) |
200 (ДАИ) |
2,5–5,0/2,5–5,0 |
4 |
4–6 |
|
Длительнодействующие |
||||
|
Формотерол (Оксис Турбухалер♠, Атимос♠, Формотерол Изихейлер♠, Форадил♠) |
4,5; 9 (ДПИ2); 12 (ДАИ, ПИ3) |
– |
– |
12 |
|
Индакатерол (Онбрез Бризхалер♠) |
150(ПИ) |
– |
– |
24 |
|
Олодатерол (Стриверди Респимат♠) |
5 (Респимат6) |
– |
– |
24 |
|
Антихолинергические препараты |
||||
|
Кoроткодействующие |
||||
|
Ипратропия бромид (Атровент Н♠) |
20–40 (ДАИ) |
0,5/2,0 |
– |
6–8 |
|
Длительнодействующие |
||||
|
Тиотропия бромид (Спирива Ханди Халер℘, Спирива Респимат♠) |
18 (ПИ); |
– |
– |
24 |
|
Гликопиррония бромид (Сибри Бризхалер♠) |
50 (ПИ) |
– |
– |
24 |
|
Аклидиния бромид (Бретарис Дженуэйр♠) |
322 (ПИ) |
– |
– |
12 |
|
Комбинация короткодействующих β2-агонистов с антихолинергическими препаратами |
||||
|
Ипратропия бромид + фенотерол (Беродуал Н♠, Ипратерол-натив♠) |
100+40; |
1,0+0,5/2,0 |
– |
6–8 |
|
Ипратропия бромид + сальбутамол (Ипрамол Стери-Неб♠) |
– |
2,5+0,5/2,5 |
– |
6–8 |
|
Комбинация ДДБА с антихолинергическими препаратами в одном ингаляторе |
||||
|
Вилантерол + умеклидиния бромид (Аноро Эллипта♠) |
25 + 62,5 (ДПИ) |
– |
– |
24 |
|
Гликопиррония бромид + индакатерол (Ультибро Бризхалер♠) |
110+50 (ПИ) |
– |
– |
24 |
|
Олодатерол + тиотропия бромид (Спиолто Респимат♠)* |
5+5 (Респимат®) |
24 |
||
|
Метилксантины |
||||
|
Теофиллин медленного высвобождения (Теопэк♠, Теотард♠, Ретафил♠⊗ и др.) |
– |
– |
100–600 таблетки |
Различная, до 24 |
|
Комбинация ДДБА + ГК в одном ингаляторе |
||||
|
Будесонид + формотерол (Симбикорт Турбухалер♠) |
4,5+160; |
– |
– |
12 |
|
Мометазон + формотерол (Зенхейл♠) |
10+200; |
– |
– |
12 |
|
Салметерол + флутиказон (Серетид♠, Тевакомб♠) |
50+250;50+500 |
– |
– |
12 |
|
Беклометазон + формотерол (Фостер♠) |
12+200 |
– |
– |
12 |
|
Вилантерол + флутиказона фуроат (Релвар Эллипта♠) |
25+100 |
24 |
||
|
Ингибиторы ФДЭ-4 |
||||
|
Рофлумиласт (Даксас♠) |
– |
– |
500 мкг |
24 |
Примечание:
1 ДАИ — дозированный аэрозольный ингалятор.
2 ДПИ — дозированный порошковый ингалятор.
3 ПИ — порошковый ингалятор.
4 ЭМД ДАИ — экстрамелкодисперсный ДАИ.
Общая характеристика лекарственных препаратов, применяемых для лечения больных с ХОБЛ стабильного течения в соответствии с уровнями доказательств и силой рекомендаций, представлена в табл. 8.31 [3].
| Класс препаратов | Наименование препаратов | Уровень доказательности | Степень рекомендаций |
|---|---|---|---|
|
Бронходилататоры |
Бронхолитические препараты являются основными средствами в лечении больных с ХОБЛ. |
1+ |
А |
|
Ингаляционная терапия предпочтительнее таблетированных форм. |
1+ |
А |
|
|
Бронходилататоры назначаются либо «по потребности», либо систематически. |
1++ |
А |
|
|
Преимущество отдается длительно действующим бронходилататорам (ДДБД). |
1+ |
А |
|
|
Тиотропия бромид — ДДАХ, обладая 24-часовым действием, уменьшает частоту обострений и госпитализаций, улучшает симптомы и качество жизни (группы В, С, D). |
1++ |
А |
|
|
Тиотропия бромид улучшает эффективность легочной реабилитации. |
2++ |
В |
|
|
Аклидиния бромид — ДДАХ 12-часового действия, оказывает выраженное действие на симптомы ХОБЛ, значительно повышает переносимость физической нагрузки, улучшает качество жизни, а также обладает профилем безопасности, сопоставимым с плацебо. |
2++ |
В |
|
|
Гликопиррония бромид — ДДАХ 24-часового действия, оказывает выраженное действие на симптомы ХОБЛ, повышает переносимость физической нагрузки. улучшает качество жизни и обладает профилем безопасности. |
2++ |
В |
|
|
Формотерол достоверно улучшает ОФВ1 и другие легочные объемы, качество жизни, снижает выраженность симптомов и частоту обострений, не влияя на смертность и падение легочной функции (группа В). |
2++ |
В |
|
|
Индакатерол — ультра-ДДБА позволяет значительно увеличить ОФВ1, уменьшить выраженность одышки, частоту обострений и повысить качество жизни (группа В) |
1+ |
А |
|
|
Комбинации бронходилататоров |
Комбинации ДДБД повышают эффективность лечения, снижают риск побочных эффектов и оказывают большее влияние на ОФВ1, чем каждый из препаратов в отдельности (больные группы В, С, D) |
2++ |
В |
|
ИГК |
Положительно влияют на симптоматику заболевания, функцию легких, качество жизни, уменьшают частоту обострений, не оказывая влияния на постепенное снижение ОФВ1, не снижают общую смертность. |
1+ |
А |
|
ИГК назначаются только в сочетании с ДДБА (больные группы C, D) или |
2++ |
B |
|
|
в составе трехкомпонентной терапии с ДДАХ или инг. ФДЭ-47 (больные группы D) |
2++ |
В |
|
|
Комбинации ИГК с ДДБД |
Комбинированная терапия ИГК и ДДБА может снижать смертность у больных с ХОБЛ (больные группы C, D). |
2++ |
В |
|
Комбинированная терапия ИГК и ДДБА повышает риск развития пневмонии, но не имеет других побочных явлений. |
1+ |
А |
|
|
Добавление к комбинации ДДБА с ИГК тиотропия бромида (ДДАХ) улучшает функцию легких, качество жизни и способно предотвратить повторные обострения у больных с высоким риском обострений (больные группы D) |
2++ |
В |
|
|
инг. ФДЭ-4 |
Рофлумиласт применяется в сочетании с ДДБД (группа С) или в составе трехкомпонентной терапии с ИГК и ДДБА (группа D). |
1+ |
A |
|
Рофлумиласт снижает частоту среднетяжелых и тяжелых обострений у пациентов с бронхитическим вариантом ХОБЛ тяжелого и крайне тяжелого течения и обострениями в анамнезе |
2++ |
В |
|
|
Метилксантины |
При ХОБЛ теофиллин оказывает умеренный бронхолитический эффект по сравнению с плацебо. |
1+ |
А |
|
Теофиллин в низких дозах уменьшает количество обострений у больных с ХОБЛ, но не увеличивает пост- бронходилатационную функцию легких |
2++ |
В |
|
|
Антиоксиданты |
Препараты, такие как ацетилцистеин (N-ацетилцистеин♠), способны проявлять антиоксидантные свойства и могут играть роль в лечении больных с повторяющимися обострениями ХОБЛ. |
2++ |
В |
|
У пациентов с ХОБЛ, не получающих ИГК, лечение карбоцистеином и ацетилцистеином (N-ацетилцистеином♠) может уменьшить число обострений |
2++ |
В |
Здесь и в последующих таблицах:
1 ХОБЛ — хроническая обструктивная болезнь легких.
2 ДДБД — длительно действующие бронходилататоры.
3 ДДАХ — длительно действующие антихолинергетики.
4 ДДБА — длительно действующие β2-агонисты.
5 ИГК — ингаляционные глюкокортикоиды.
6 ОФВ1 — объем форсированного выдоха в 1-ю секунду.
7 инг.ФДЭ-4 — ингибитор фосфодиэстеразы-4.
Характеристика лекарственных препаратов для регулярной терапии хронической обструктивной болезни легких
Бронхолитические препараты представляют основной и единственный класс лекарственных средств, рекомендуемый больным с ХОБЛ в качестве монотерапии или в комбинации с ИГК и/или инг.ФДЭ-4 независимо от принадлежности пациента к каким-либо группам больных с ХОБЛ стабильного течения (A-D) (табл. 8.32) [2, 3].
| Показания и режим дозирования | ДДБД1 | КДБД2 |
|---|---|---|
|
Больные ХОБЛ, группы, степень тяжести |
Любая степень тяжести (GOLD II, III, IV; группы В, С, D) |
ХОБЛ легкого течения (GOLD I; группа А) |
|
Режим дозирования |
Постоянная терапия |
Режим по требованию |
Примечание: 1 ДДБД — длительно действующие бронходилататоры; 2 КДБД — короткодействующие бронходилататоры.
Бронхолитические средства оказывают положительное влияние на симптомы, более выраженные в сравнении с минимальной динамикой или отсутствием изменений показателя ОФВ1, особенно у пациентов со среднетяжелым и тяжелым течением ХОБЛ. Расслабление гладких мышц, снижение динамической гиперинфляции, сопровождаемое уменьшением ОО и ОЕЛ, улучшение функции дыхательных мышц, усиление мукоцилиарного клиренса объясняют редукцию симптомов у больных с ХОБЛ. Основные механизмы ДДБД у больных с ХОБЛ отражены на рис. 8.36.
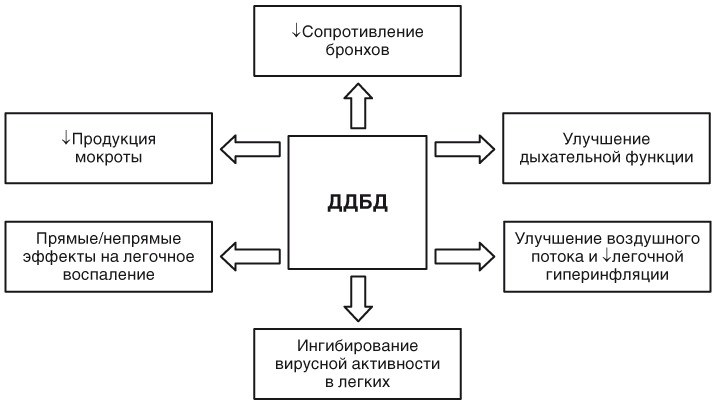
Рис. 8.36. Основные механизмы длительно действующих бронходилататоров [4]
Длительно действующие антихолинергические препараты. Среди ДДБД ведущая роль в лечении больных с ХОБЛ принадлежит ДДАХ. Наиболее важным эффектом ДДАХ у больных с ХОБЛ является блокирование действия ацетилхолина на уровне М3-рецепторов, расположенных на гладких мышцах дыхательных путей, что приводит к их расслаблению.
В терапии больных с ХОБЛ стабильного течения, согласно рекомендациям GOLD, 2015 [2] и Федеральным клиническим рекомендациям по диагностике и лечению ХОБЛ [3], ДДАХ рекомендуются в качестве препаратов 1-го ряда для монотерапии при любой тяжести ХОБЛ и входят в состав практически всех схем лекарственной комбинированной терапии (группы больных А–D по классификации GOLD, 2011).
Длительно действующие β2-агонисты. Принципом действия β2-агонистов является расслабление гладкой мускулатуры бронхов благодаря стимуляции β2-адренергических рецепторов, которые повышают уровень цАМФ и вызывают функциональный антагонизм к бронхоконстрикции. Не рекомендуется применять высокие дозы β2-агонистов короткого действия по потребности у пациентов, использующих ДДБД, так как подобная тактика не поддерживается результатами клинических исследований и может вызывать развитие побочных эффектов.
Показаниями к назначению ДДБА при стабильном течении ХОБЛ в качестве монотерапии являются только пациенты с нетяжелым течением и низким риском обострений (группы больных А, В).
Применение ДДБА для лечения больных ХОБЛ значительно расширяется в следующих случаях:
-
сочетания с ДДАХ и инг.ФДЭ-4 (группы больных В, C, D);
-
в фиксированной комбинации с ИГК (группы больных C, D);
-
в составе трехкомпонентной комбинации с ИГК и ДДАХ (больные группы D).
Комбинированная терапия длительно действующими бронходилататорами
Одновременное назначение ДДБА и ДДАХ повышает эффективность лечения, снижает риск побочных эффектов, оказывает большее влияние на ОФВ1, чем каждый из препаратов в отдельности, и расширяет возможности бронхолитической терапии у больных с ХОБЛ [5]. Доказано преимущество в виде более выраженного влияния на ОФВ1 при одновременном применении двух препаратов с различными механизмами действия и точками приложения, в частности: ДДАХ — тиотропия бромида и ДДБА — формотерола [5]. В соответствии с Федеральными клиническими рекомендациями по диагностике и лечению ХОБЛ комбинация ДДБД повышает эффективность лечения, снижает риск побочных эффектов и оказывает большее влияние на ОФВ1, чем каждый из препаратов в отдельности [3]. Применение ДДБД с различным механизмом действия существенно расширяет возможности лечения больных с ХОБЛ. Принципы выбора ДДБД при ХОБЛ изложены в табл. 8.33.
|
ДДБА |
ДДАХ |
|
|
|
|
|
+ |
|
Двойная терапия ДДАХ + ДДБА показана следующим категориям больных с ХОБЛ:
-
при впервые выявленном заболевании, с выраженными симптомами независимо от тяжести течения (с учетом показаний к назначению ИГК).
Ингаляционные глюкокортикоиды
Роль ИГК в лечении стабильной ХОБЛ ограничена специфическими показаниями, и их роль менее заметна, чем при БА. Назначение ИГК больным с ХОБЛ не приводит к такому значимому быстрому положительному клиническому эффекту, как при БА. При назначении ИГК необходимо учесть, что высокие и средние дозы ИГК у больных с ХОБЛ одинаково эффективны.
Принципиальным является положение о том, что ни один из ИГК не лицензирован для монотерапии ХОБЛ. Результаты большинства рандомизированных клинических исследований, посвященных фармакотерапии ХОБЛ и проведенных в течение последних 10 лет, свидетельствуют об уменьшении выраженности симптомов и числа обострений заболеваний, улучшении качества жизни больных с ХОБЛ при длительном применении фиксированной комбинации ИГК и ДДБА [6]. С высокой степенью доказательности установлено, что включение в схему лечения больным с тяжелым и крайне тяжелым течением и/или высоким риском обострений ХОБЛ ИГК позволяет уменьшить частоту обострений заболевания, увеличить время до развития первого обострения, повышает уровень качества жизни. Заслуживает внимания, что применение ИГК у больных со среднетяжелым и тяжелым течением (GOLD II–III) оказывает позитивное влияние на уровень ОФВ1 только в первые 6 мес, особенно у бывших курильщиков по сравнению с теми, кто продолжает курить, однако после 6 мес терапии ИГК не влияют на падение ОФВ1 [7].
Применение ИГК при тяжелом течении ХОБЛ и ДН, требующей ДКТ, приводит к снижению риска смерти от всех причин в течение 1 года на 54%. В то же время ИГК не оказывают значительного влияния на кардиоваскулярную смертность [8].
Комбинированная терапия ИГК и ДДБА может повышать риск развития пневмонии, но не имеет других побочных явлений [9–12].
Показания к назначению ИГК в сочетании с ДДБА при стабильном течении ХОБЛ зависят от ряда факторов. Так, в отличие от больных БА, когда ИГК являются основным лекарственным средством для базисной терапии, показания к применению ИГК определяются фенотипом ХОБЛ. Анализ литературных данных позволил выделить следующие показания к применению ИГК с ДДБА при ХОБЛ.
Ингаляционные ГК в качестве комбинированной терапии показаны больным с ХОБЛ тяжелого/ крайне тяжелого течения (ХОБЛ III–IV / группы С и D) с учетом следующих клинико-лабораторных и анамнестических показателей:
-
при 2 и более неинфекционных обострений в году, не требующих госпитализации, или при 1-й и более госпитализаций по поводу неинфекционного обострения;
-
больным с эозинофилией мокроты (более 3%) и/или крови (более 300 кл/мл) [13];
-
больным с ХОБЛ в сочетании с БА [2].
При назначении ИГК необходимо учитывать риск побочных эффектов, высокие суточные дозы ИГК не имеют преимуществ по сравнению со средними суточными дозами. Не следует назначать ИГК больным с ХОБЛ с ОФВ1 постдилатационным ≥50% должной величины или низким риском обострений (при I–II степени тяжести — группы А и В по GOLD, 2015).
Показания к отмене ИГК у пациентов с ХОБЛ:
-
ИГК могут быть отменены, если они были назначены не по показаниям;
-
нет общепринятых клинических рекомендаций по режиму отмены;
-
при отмене ИГК пациент должен находиться под активным наблюдением в течение года, регулярно принимая ДДБД (контроль легочной функции и клиническая оценка 1 раз в 3 мес).
Системные глюкокортикоиды
Постоянное применение системных ГК больным с ХОБЛ не показано, в первую очередь в связи с неблагоприятным отношением польза/риск, и количество исследований по оценке долговременного эффекта этого вида лечения невелико [14, 15].
Ингибитор фосфодиэстеразы-4
Основным действием ингибиторов ФДЭ-4 является подавление воспаления путем блокирования распада внутриклеточной цАМФ [16–18].
Инг.ФДЭ-4 используются только в качестве комбинированной терапии при лечении ХОБЛ. Добавление инг.ФДЭ-4 к регулярной терапии ДДБД применяется у больных с ХОБЛ с высоким риском обострений и редкими симптомами (группа больных С) и в составе трехкомпонентной лекарственной терапии с ИГК и ДДБА у больных с высоким риском обострений и частыми симптомами (группа больных D).
Схема начальной терапии ХОБЛ с учетом выраженности симптомов и риска обострений пред- ставлена в табл. 8.34 [1]*.
| Группа больного с ХОБЛ и характеристика | Рекомендуемый выбор препаратов 1-го ряда | Альтернативные препараты | Другие возможные группы препараты** |
|---|---|---|---|
|
Группа А |
1-я схема: |
1-я схема: |
|
|
Группа В |
1-я схема: |
1-я схема: |
|
|
Группа С |
1-я схема: |
1-я схема: |
|
|
Группа D |
1-я схема: |
1-я схема: |
|
* Выбор препаратов 1-го и 2-го столбца основывается на фенотипе ХОБЛ, право выбора принадлежит лечащему врачу.
** Данные препараты могут быть использованы самостоятельно или в комбинации с другими препаратами из первого или второго столбца.
В табл. 8.35 представлены схемы регулярной стартовой медикаментозной терапии в зависимости от фенотипа ХОБЛ, которая послужит ориентиром в выборе лекарственных средств в качестве регулярной терапии ХОБЛ.
| Фенотипы ХОБЛ и их характеристика | Лекарственные препараты, группы | |
|---|---|---|
|
I |
Фенотип ХОБЛ, нетяжелое течение (GOLD 1, 2 или GOLD А, В) с невыраженными симптомами |
ДДАХ; |
|
II |
Фенотип ХОБЛ, нетяжелое течение (GOLD 1, 2 или GOLD А, В) с выраженными симптомами |
ДДАХ и ДДБА; |
|
III |
Фенотип ХОБЛ, эмфизематозный, тяжелое/крайне тяжелое течение (GOLD 3, 4 или GOLD C, D) |
ДДАХ; |
|
IV |
Фенотип ХОБЛ, бронхитический, тяжелое/крайне тяжелое течение (GOLD 3, 4 или GOLD C, D) без эозинофилии мокроты (≤3%) и/или крови (≤300 кл/мл) |
ДДАХ; |
|
V |
Фенотип ХОБЛ, бронхитический, тяжелое/крайне тяжелое течение (GOLD 3, 4 или GOLD C, D) с эозинофилией мокроты (>3%) и/или крови (>300 кл/мл) |
ИГК + ДДБА; |
|
VI |
Фенотип ХОБЛ, бронхитический, тяжелое/крайне тяжелое течение (GOLD 3, 4 или GOLD C, D) с инфицированной бронхоэктазией и/или инфекционными обострениями |
ДДАХ и инг.ФДЭ-4; |
|
VII |
Фенотип сочетания БА и ХОБЛ (нетяжелое течение) |
ИГК и ДДАХ; |
|
VIII |
Фенотип сочетания БА и ХОБЛ (тяжелое/крайне тяжелое течение) |
ИГК + ДДБА и ДДАХ |
В помощь практическому врачу в табл. 8.36 представлены схемы регулярной фармакологической терапии при стабильном течении ХОБЛ.
| Группа больного с ХОБЛ | Препараты 1-го ряда* | Альтернативные препараты* | Другие возможные препараты** |
|---|---|---|---|
|
Группа А |
1-я схема |
1-я схема |
Теофиллин 300 мг 2 раза в сутки внутрь |
|
Группа В |
1-я схема |
1-я схема |
1-я схема |
|
Группа С |
1-я схема |
1-я схема |
1-я схема |
|
Группа D |
1-я схема |
1-я схема |
1-я схема |
* Каждая схема лечения имеет равнозначное значение; ** медикаменты из этой колонки могут применяться в качестве монотерапии либо в сочетании с препаратами 1-го ряда или альтернативными препаратами; # в настоящее время препараты в РФ не зарегистрированы.
Подавляющее большинство лекарственных средств, назначаемых больным с ХОБЛ независимо от тяжести течения и риска обострения болезни, — ингаляционные препараты. Считается доказанным, что ингаляционная терапия — наиболее предпочтительный метод лекарственной терапии для больных с ХОБЛ. Существенное значение для достижения эффекта имеют форма доставки и техника ингаляций у каждого индивидуума.
Ингаляционные устройства, применяемые больными с ХОБЛ в качестве способа доставки лекарственных средств, представлены ДАИ, ПИ, небулайзерами и инновационной формой доставки Респимат®.
Среди ДАИ наиболее эффективным является обеспечивающий создание экстрамелкодисперсных форм аэрозолей. Доля частиц оптимального диаметра в процентах отмеренной дозы, создаваемая экстрамелкодисперсным ДАИ, составляет 37–55%, а ингаляция обычным ДАИ — до 27% [19].
Ингаляторы, содержащие препарат в виде сухой пудры, — ПИ, активируются вдохом больного: Тубухалер®, Дискхалер®, Аэролайзер®, Мультидиск®, Хандихалер®, Изихейлер® и более современные Бризхалер®, Эллипта®, Дженуэйр®. Эффективность ПИ зависит от скорости инспираторного потока, при которой они используются. Чем меньше разница между минимальной и оптимальной пиковой скоростью вдоха, тем меньше вариабельность доставленной дозы. Минимальные скорости инспираторного воздушного потока для различных ПИ представлены в табл. 8.37 [20].
| Наименование ПИ (представлены в алфавитном порядке) | Минимальные скорости инспираторного воздушного потока, л/мин |
|---|---|
|
Аэролайзер |
Минимальная — более 60 |
|
Дженуэйр |
Минимальная — 30 |
|
Дискус |
Минимальная — 30 |
|
Изихейлер |
Минимальная — 28 |
|
Турбухалер |
Минимальная — 30 |
|
Хандихалер |
Минимальная — 30 |
Кроме того, эффективность ингаляционных препаратов, помимо скорости инспираторного потока, зависит от внутреннего сопротивления ингалятора. Современные ПИ имеют низкое внутреннее сопротивление, что позволяет при пользовании ими выполнить ингаляцию даже пациентам со значительно сниженной функцией легких.
Многие препараты доступны в виде растворов для небулайзера, и у пациентов со значительной гиперинфляцией и соответственно с очень низкой скоростью потока на вдохе небулайзерная терапия теоретически может иметь преимущества. Если отдается предпочтение небулайзеру, то больной должен быть обеспечен необходимыми инструкциями по его использованию. Небулайзерная терапия лекарственными средствами проводится больным с тяжелым и крайне тяжелым течением заболевания. В 2012 г. в России зарегистрировано ингаляционное устройство Респимат®, представляющее инновационную форму доставки лекарственных средств. Особенностью ингалятора Респимат является способность образовывать медленное скоростное облако аэрозоля, что обеспечивает высокую респирабельную фракцию тиотропиума в нижние дыхательные пути (до 55%) и минимальную ротоглоточную депозицию [21].
Другие методы лечения
Так называемые другие, но не менее важные, а в ряде случаев жизнеспасающие методы лечения включают:
-
длительную кислородотерапию;
-
вентиляционную поддержку;
-
хирургическое лечение.
ДКТ. Одним из наиболее тяжелых осложнений ХОБЛ является ХДН. Главным признаком ХДН служит развитие гипоксемии, т.е. снижение содержания кислорода в артериальной крови. Коррекция гипоксемии с помощью кислорода — наиболее патофизиологически обоснованный метод терапии тяжелой ДН. Использование кислорода у больных с хронической гипоксемией должно быть постоянным, длительным и, как правило, проводиться в домашних условиях, поэтому такая форма терапии называется «длительная кислородотерапия». ДКТ — единственный метод лечения, способный снизить летальность больных с ХОБЛ и предотвратить развитие ОДН, являющейся основной причиной смерти больных с ХОБЛ.
Показания к ДКТ при ХОБЛ представлены в табл. 8.38.
| Показания | PaO2, мм рт.ст. | SpO2, % | Показания |
|---|---|---|---|
|
Абсолютные |
≤55 |
≤88 |
Нет |
|
Относительные (при наличии особых условий) |
55–59 |
89 |
Легочное сердце, отеки, полицитемия (гематокрит >55%) |
|
Нет показаний (за исключением особых условий) |
≥60 |
≥90 |
Десатурация при нагрузке. |
Целью оксигенотерапии является повышение PaO2 не менее чем до 60 мм рт.ст. в покое и SpO2 выше 90%. У больных с ХОБЛ с ХДН рекомендуется поддержание PaO2 в пределах 60–65 мм рт.ст. и SpO2 в пределах 90–92%. ДКТ не показана больным с умеренной гипоксемией (PaO2 >60 мм рт.ст. и/или SpO2 выше 90%) [22].
Параметры газообмена, на которых основываются показания к ДКТ, должны оцениваться только во время стабильного состояния больных, т.е. через 3–4 нед после обострения ХОБЛ, так как именно такое время требуется для восстановления газообмена и кислородного транспорта после периода ОДН. При проведении ДКТ необходимо проведение пульсоксиметрии, а также двукратное исследование КОС в течение 3 нед [23].
Что касается режимов назначения кислородотерапии, то большинству больных с ХОБЛ достаточно потока O2 1–2 л/мин, хотя, конечно, у наиболее тяжелых больных поток может быть увеличен и до 4–5 л/мин. Оптимальным режимом считается ДКТ от 15 до 20 ч/сут. ДКТ увеличивает выживаемость больных с ХДН. Максимальные перерывы между сеансами O2-терапии не должны превышать 2 ч подряд.
Благоприятные эффекты ДКТ не были получены у больных, продолжающих курить и имеющих повышенный уровень карбоксигемоглобина. В ночное время, при физической нагрузке и при воздушных перелетах пациенты должны увеличивать поток кислорода в среднем на 1 л/мин по сравнению с оптимальным дневным потоком. Алгоритм ДКТ у больных с ХОБЛ представлен на рис. 8.37.
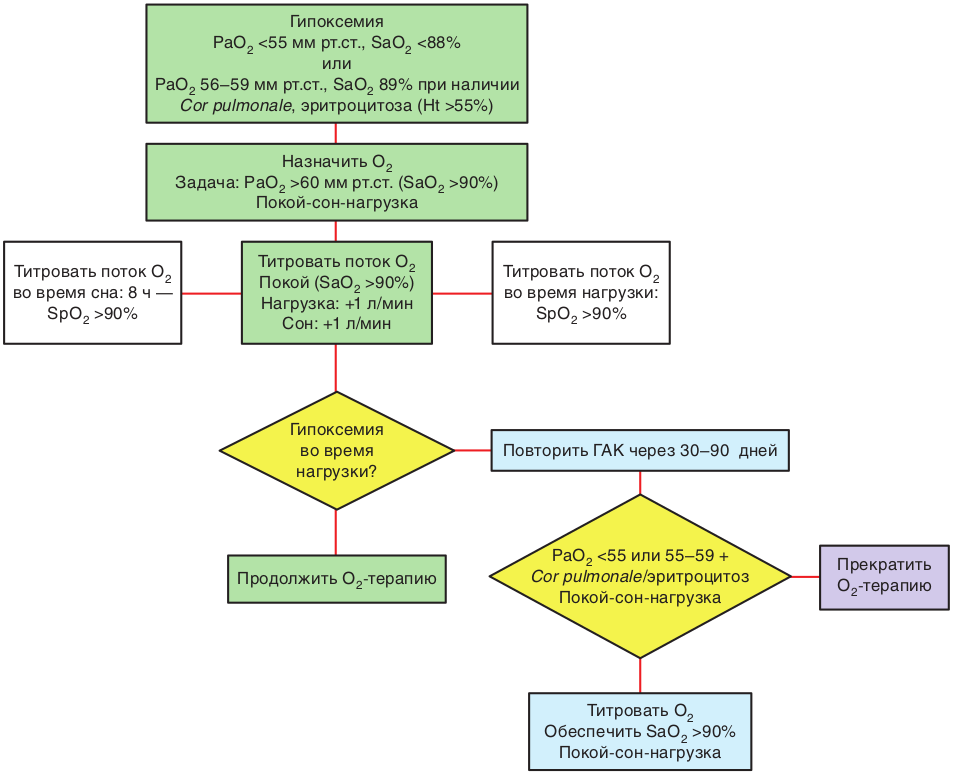
Рис. 8.37. Алгоритм длительной кислородотерапии
Длительная вентиляционная поддержка — метод долговременной респираторной поддержки больных со стабильным течением ХДН и не нуждающихся в интенсивной терапии.
Клиническими показаниями к длительной домашней вентиляции легких являются [24]:
-
инвалидизирующая одышка, слабость, утренние головные боли;
-
расстройства сна и изменения личности;
-
легочная гипертензия и легочное сердце, не поддающееся консервативной терапии.
Функциональные показания к длительной домашней вентиляции легких:
-
PaCO2 >55 мм рт.ст.,
или -
PaCO2 в пределах 50–54 мм рт.ст. в сочетании с ночной десатурацией (SpO2 <88% продолжительностью более 5 мин во время проведения кислородотерапии с потоком более 2 л/мин),
или -
PaCO2 50–54 мм рт.ст. в сочетании с частыми эпизодами госпитализации больного по поводу гиперкапнической ДН (более 2 эпизодов в течение 12 мес).
Параметры вентиляции подбираются в условиях стационара. Масочная НВЛ является основным методом длительной домашней вентиляции легких и обеспечивает снижение числа инфекционных и механических осложнений респираторной поддержки.
Применение масочной НВЛ у больных с ХОБЛ и тяжелой ДН снижает пребывание больных в стационаре, приводит к повышению толерантности к физическим нагрузкам, улучшает качество сна, субъективное улучшение самочувствия больных, снижение PaCO2. Длительная домашняя вентиляция легких считается более предпочтительной для лечения больных с ХОБЛ с гиперкапнической ДН.
Хирургическое лечение. Буллэктомия приводит к снижению одышки и улучшению легочной функции легких у больных с ХОБЛ. Оперативная коррекция легочного объема остается паллиативной хирургической процедурой с неподтвержденной эффективностью. Трансплантация легкого улучшает качество жизни и функциональные показатели у тщательно отобранных больных с очень тяжелым течением ХОБЛ. Критериями отбора к хирургическому лечению считаются ОФВ1 <25% должной величины, PaO2 <55 мм рт.ст., PaCO2 >50 мм рт.ст. при дыхании комнатным воздухом и легочная гипертензия (Рра >40 мм рт.ст).
Прогноз ХОБЛ во многом зависит от отношения пациента к своей болезни. Для облегчения состояния многие больные вынуждены до конца жизни пользоваться кислородным концентратором и принимать лекарственные средства в постепенно возрастающих дозах, а также использовать дополнительные средства в период обострений.
Терапия обострения хронической обструктивной болезни легких
Терапия обострения ХОБЛ во многом определяется его тяжестью. Обычно тяжесть обострения соответствует выраженности клинических проявлений заболевания. Так, у пациентов с легким или среднетяжелым течением ХОБЛ (GOLD I–II стадии) обострение, как правило, характеризуется усилением одышки, кашля и увеличением объема мокроты, что позволяет вести больных в амбулаторных условиях. Напротив, у пациентов с тяжелым течением ХОБЛ (GOLD III–IV стадии) обострение сопровождается прогрессированием ХДН, вплоть до развития ОДН.
Факторами риска развития обострений являются возраст пациента старше 65 лет, сопутствующие ССЗ, а также частота и тяжесть обострений в предшествующий год.
Наиболее частыми причинами обострения оказываются респираторные инфекции верхних и нижних дыхательных путей (вирусные или бактериальные). В возникновении обострений ХОБЛ играет роль и воздействие неинфекционных факторов. В первую очередь — вредные факторы окружающей среды (NO2, SO2, озон), ДКТ, неэффективная легочная реанимация, ТЭЛА, развитие пневмоторакса, а также дисфункция ЛЖ (СН). Примерно в 1/3 случаев причина тяжелых обострений ХОБЛ может быть не установлена. Повышение числа обострений ХОБЛ в холодное время года часто связано с повышением распространенности респираторных вирусных инфекций в зимние месяцы и чувствительности к ним эпителия верхних дыхательных путей.
Исходя из положения, что все обострения с клинической точки зрения следует рассматривать как фактор прогрессирования ХОБЛ, основной целью лечения ХОБЛ является предупреждение обострений заболевания. Лечебные мероприятия, которые могут уменьшить количество обострений и госпитализаций:
-
отказ от курения;
-
вакцинация против гриппа и пневмококковой инфекции;
-
осведомленность пациента о проводимой терапии, в том числе о технике выполнения ингаляций;
-
терапия адекватная тяжести течения ХОБЛ с учетом риска последующих обострений.
Цель лечения обострений ХОБЛ — минимизация воздействия текущего обострения и предотвращение развития обострений в будущем.
Медикаментозное и немедикаментозное лечение обострений ХОБЛ
Принципы медикаментозной терапии обострения ХОБЛ
-
КДБД:
-
увеличение дозы и/или частоты приема применяемого бронходилататора (КДБА, фиксированная комбинация КДБА и КДАХ);
-
при монотерапии КДБА добавляются КДАХ до улучшения симптомов;
-
предпочтение отдается комбинированным КДБД.
-
-
ГК:
-
30–40 мг/сут преднизолона внутрь или другого системного ГК в дозе, эквивалентной преднизолону, или небулизированный будесонид 2–4 мг/сут в течение 5 дней.
-
-
Антибиотики (при I и II типе обострения по N. Anthonisen) в течение
5–7 сут: β-лактамы, макролиды, β-лактам/ингибитор β-лактамаз, респираторные фторхинолоны.
Перечень групп лекарственных препаратов и немедикаментозных средств, применяемых у больных с различной тяжестью обострения ХОБЛ, в соответствии с уровнями доказательности представлены в табл. 8.39.
| Степень рекомендаций | Уровень доказательности | Лекарственные препараты и немедикаментозные средства |
|---|---|---|
|
А В В |
1+++ 2++ 2++ |
Бронходилататоры [2, 5]:
|
|
В С В |
2++ 2+ 2++ |
ГК:
|
|
В |
2++ |
Антибиотики (показания и схемы применения представлены в табл. 8.40 и на рис. 8.38) [29–31] |
|
С |
2+ |
Мукоактивные препараты [ацетилцистеин (N-ацетилцистеин♠), карбоцистеин, эрдостеин и другие препараты] [32] |
|
В |
2++ |
Кислородотерапия [33] |
|
А |
1++ |
НВЛ [34, 35] |
|
В |
2++ |
ИВЛ [3] |
КДБД относятся к лекарственным средствам, которые применяются независимо от характеристики обострения, имеющие наивысшую степень доказательности их эффективности. Перечень КДБД и их характеристика представлена в табл. 8.40.
|
Препарат, международное непатентованное наименование |
Разовая лечебная доза, мг |
Пик действия, мин |
Продолжительность действия, ч |
|
|
дозированный ингалятор |
небулайзер |
|||
|
Сальбутамол |
0,1–0,2 |
2,5–5,0 |
30–60 |
4–6 |
|
Фенотерол |
0,1–0,2 |
0,5–1,0 |
30 |
4–6 |
|
Ипратропия бромид |
0,02–0,08 |
0,50 |
45 |
6–8 |
|
Ипратропия бромид + фенотерол |
0,2/0,50–0,4/1,0 |
1,0/0,5 |
30 |
6 |
|
Ипратропия бромид + сальбутамол |
– |
2,5/ 0,5 |
30 |
6 |
Интенсификация бронходилатирующей терапии не всегда дает ощутимый лечебный эффект и улучшает бронхиальную проходимость при обострении ХОБЛ. Синдром фиксированной бронхиальной обструкции и гиперинфляция, характерные для больных с ХОБЛ, являются причиной менее выраженной эффективности бронхолитической терапии при обострении ХОБЛ по сравнению с эффективностью бронходилататоров у больных БА [37]. Во всех случаях обострения ХОБЛ, независимо от тяжести обострения и причин, его вызвавших, назначаются, если не применялись ранее, ингаляционные бронхолитические лекарственные средства или увеличивается их доза и/или кратность приема [3].
В отличие от КДБД, которые применяются всегда при обострении ХОБЛ, антибиотики и ГК назначаются в соответствии с конкретными показаниями [2, 3].
ИГК, в отличие от системных ГК, оказывают более быстрый клинический эффект за счет «прямого» действия на слизистую оболочку бронхов, а именно:
-
сосудосуживающий эффект и снижение бронхиального кровотока;
-
уменьшение экссудации плазмы и продукции мокроты в дыхательных путях.
У некоторых пациентов с ХОБЛ частота обострений очень высока, и эти пациенты нуждаются в высоких и повторных дозах глюкокортикоидов [38]. Установлено, что короткие, но частые курсы терапии системных ГК приводят к развитию тяжелых нежелательных реакций. В отличие от системных ГК, небулизированные ГК проявляют высокую эффективность за счет выраженного местного действия в сочетании с минимальными системными эффектами.
Одной из наиболее частых причин обострений ХОБЛ является бактериальная инфекция. Продолжительность АБТ больных, переносящих обострение ХОБЛ, составляет, как правило, 5–7 дней.
Определенным ориентиром в выборе антибиотиков является тяжесть бронхиальной обструкции, что в значительной мере связано с характером микробной колонизации. Так, при ОФВ1 ≥50% чаще причиной обострения являются: H. influenzae, M. сatarrhalis и S. рneumoniae с возможной резистентностью к β-лактамам. При ОФВ1 <50% к указанным выше микроорганизмам присоединяется грамотрицательная флора (Klebsiella pneumoniae и др.), часто развивается резистентность к β-лактамам. При постоянной продукции гнойной мокроты возрастает вероятность, помимо вышеуказанных агентов, участия в воспалении Enterobacteriaceae и P. аerogenosa.
Показания к АБТ при обострении ХОБЛ в зависимости от типа обострения по N. Anthonisen (табл. 8.41) [34].
| Показание | Степень рекомендаций | Уровень доказательности |
|---|---|---|
|
Обострение 1-го типа: гнойная мокрота, увеличение объема мокроты, нарастание одышки |
В |
2++ |
|
Обострение 2-го типа: гнойная мокрота в сочетании с одним из основных признаков — увеличение объема мокроты или нарастание одышки |
В |
2++ |
|
Тяжелое обострение с потребностью ИВЛ или НВЛ |
D |
3 |
|
Уровень С-реактивного белка ≥10–15 мг/л [20] |
С |
2+ |
|
Антибактериальная терапия (АБТ), как правило, не рекомендуются при обострении 2-го типа при отсутствии гнойной мокроты |
А |
2++ |
Большое влияние на эффективность АБТ оказывает резистентность микроорганизмов к назначаемым антибиотикам. Выделяют так называемые модифицирующие факторы, т.е. факторы риска формирования резистентности микроорганизмов:
-
для пневмококков — возраст старше 65 лет, терапия β-лактамами в течение последних 3 мес, алкоголизм, иммуносупрессия (включая терапию системными ГК), наличие сердечно-сосудистых или нескольких других сопутствующих заболеваний, частые обострения (≥2 в год);
-
для грамотрицательных энтеробактерий — проживание в доме престарелых, сопутствующие сердечно-сосудистые и легочные заболевания, наличие нескольких сопутствующих заболеваний, недавняя антибактериальная терапия;
-
для P. aeruginosa — структурные заболевания легких (бронхоэктазия), терапия ГК (более 10 мг преднизолона в течение последних 2 нед), частые курсы антибиотиков (4 и более в течение последнего года), выделение P. aeruginosa в предыдущие обострения, колонизация P. aeruginosa.
Схемы антибиотикотерапии у больных с инфекционным обострением ХОБЛ представлены в табл. 8.42.
| Вид обострений | Показатель ОФВ1, % должного значения | Наиболее частые патогенные микроорганизмы | Наименование антибиотиков (МНН) |
|---|---|---|---|
|
ХОБЛ легкого, среднетяжелого течения, без факторов риска обострений |
>50 |
H. influenzae, |
Амоксициллин, |
|
ХОБЛ легкого, среднетяжелого течения, с факторами риска обострения |
>50 |
H. influenzae, PRSP |
Амоксициллин + клавулановая кислота; левофлоксацин, моксифлоксацин |
|
ХОБЛ тяжелого течения |
30–50 |
H. nfluenzae, |
|
|
ХОБЛ крайне тяжелого течения |
<30 |
H. influenzae, |
Ципрофлоксацин и другие антибиотики с антисинегнойной активностью |
PRSP — пенициллин-резистентные Streptococcus pneumoniae.
* Предикторы инфекции P. aeruginosa:
-
частые курсы антибиотиков (>4 за последний год);
-
ОФВ1 <30%;
-
выделение P. aeruginosa в предыдущие обострения, колонизация P. aeruginosa;
-
частые курсы системных ГК (>10 мг преднизолона в последние 2 нед);
-
наличие БЭ.
Представляем алгоритм лечебно-диагностических мероприятий, в зависимости от тяжести обострения ХОБЛ (рис. 8.38).
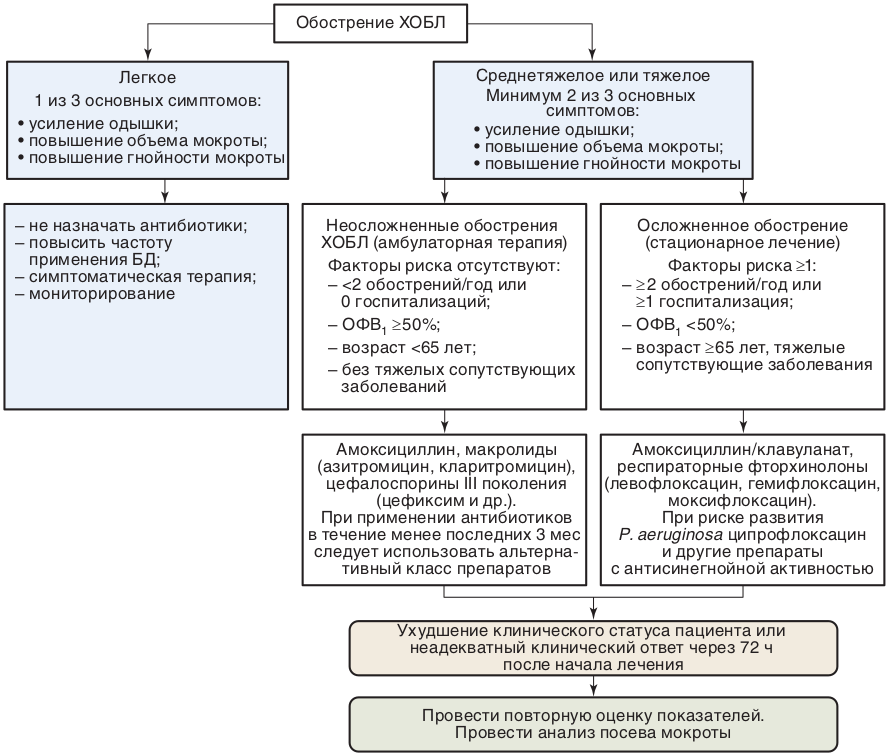
Рис. 8.38. Алгоритм лечебно-диагностических мероприятий в зависимости от тяжести обострения хронической обструктивной болезни легких
Кислородотерапия
Целью кислородотерапии является достижение PaO2 в пределах 60–65 мм рт.ст. и/или SpO2 >90– 93% (в норме PaO2 80–100 мм рт.ст., SpO2 ≥95%) [39]. При ОДН у больных с ХОБЛ для доставки O2 используются носовые канюли или маска Вентури. При назначении O2 через канюли большинству больных достаточно потока O2 1–2 л/мин, причем в ночные часы поток кислорода увеличивается на 1 л/мин. После назначения кислородотерапии в течение ближайших 30–60 мин рекомендовано проведение газового анализа артериальной крови для контроля показателей PaCO2 и рН или, по крайней мере, определение SpO2.
Показания проведения респираторной поддержки (НВЛ и ИВЛ) по поводу ОДН при обострении ХОБЛ осуществляются врачом-реаниматологом в отделении реанимации и интенсивной терапии или специализированной палате интенсивного наблюдения, желательно совместно с пульмонологом.
Неинвазивная вентиляция легких
Показания и противопоказания для проведения НВЛ представлены в табл. 8.43 [40, 41].
| Показатели | Характеристика |
|---|---|
|
Симптомы и признаки ОДН |
|
|
Признаки нарушения газообмена |
|
|
Критерии исключения для НВЛ при ОДН |
|
НВЛ является единственно доказанным методом терапии, способным снизить летальность у больных с ХОБЛ с ОДН.
Инвазивная респираторная поддержка
ИВЛ показана пациентам ХОБЛ с ОДН, у которых медикаментозная или другая консервативная терапия, в том числе НВЛ, не приводит к дальнейшему улучшению состояния. Показания к проведению вентиляции должны учитывать не только отсутствие эффекта от консервативных методов терапии, степень тяжести функциональных показателей, но и быстроту их развития и потенциальную обратимость процесса, вызвавшего ОДН (табл. 8.44) [42].
| Показатели | Характеристика |
|---|---|
|
Абсолютные показания |
|
|
Относительные показания |
|
Как правило, при назначении респираторной поддержки проводится комплексная клиническая и функциональная оценка статуса больного. Отлучение от ИВЛ должно начинаться как можно раньше у больных с ХОБЛ, так как каждый дополнительный день инвазивной респираторной поддержки значительно повышает риск развития осложнений ИВЛ, особенно таких как вентилятор-ассоциированная пневмония.
В помощь практическому врачу ниже приводим схемы лечения и показания к госпитализации больных с обострением ХОБЛ.
Лечение больных с обострением ХОБЛ в амбулаторных условиях
-
Образование больных. Проверить технику применения ингаляторов.
-
Применение КДБА и/или КДАХ или их комбинации с помощью спейсера 2–4 дозы либо небулайзера 2 мл «по требованию» 3–4 раза в сутки в течение 5–7 дней.
-
Глюкокортикоиды:
-
преднизолон 30–40 мг/сут внутрь или небулизированный будесонид 2–4 мг/сут в течение 5 дней.
-
-
Антибиотики в соответствии с критериями обострения ХОБЛ по N. Anthonisen для больных с легким или среднетяжелым неосложненным обострением и ОФВ1 ≥50% назначаются внутрь (один из ниже перечисленных):
-
амоксициллин 500 мг 3 раза в сутки — до 7 дней;
-
азитромицин 500 мг 1 раз в сутки 3 дня, кларитромицин 500 мг 2 раза в сутки или кларитромицин СР 1000 мг 1 раз в сутки — 7–10 дней;
-
цефиксим 400 мг 1 раз в сутки — до 7 дней.
-
При отсутствии эффекта от первоначально назначенной АБТ (гнойная мокрота, одышка, фебрильная температура тела) в течение 3 сут:
-
амоксициллин/клавулановая кислота 1000 мг 2 раза в сутки — 7 дней
или -
левофлоксацин 500 мг 1 раз в день — 7 дней;
-
моксифлоксацин 400 мг 1 раз в день — 5 дней.
Показания для госпитализации больных с обострением ХОБЛ:
-
с высоким риском и тяжелыми сопутствующими заболеваниями (пневмония, аритмия, СН, СД, почечная и/или печеночная недостаточность);
-
резистентность к ранее проводимой амбулаторной терапии:
-
усиление одышки;
-
нарушение сна из-за усиления симптомов;
-
гипоксемия (SpO2 <90%);
-
гиперкапния (PaCO2 >45 мм рт.ст.);
-
нарушение сознания;
-
невозможность пациентом обслуживать себя;
-
неуточненный диагноз.
Лечение госпитализированных больных с обострением ХОБЛ
-
Применение КДБА и/или КДАХ либо их комбинации с помощью спейсера 2–4 дозы либо небулайзера 2 мл «по требованию» 3–4 раза в сутки в течение 7–10 дней.
-
Малопоточная кислородотерапия 1–2 л/мин, если SpO2 <90%, и/или PaO2 <60 мм рт.ст., и/или PaCO2 >45 мм рт.ст.
-
Глюкокортикоиды:
-
преднизолон 30–40 мг/сут внутрь или небулизированный будесонид 2–4 мг/сут в течение 5 дней;
-
при невозможности приема ГК внутрь назначается эквивалентная доза ГК внутривенно.
-
-
Антибиотики в соответствии с рекомендациями по N. Anthonisen для больных с осложненным обострением ХОБЛ и ОФВ1 <50%, назначаемые по принципу ступенчатой терапии, один из перечисленных ниже:
-
амоксициллин/клавуланат 1,2 г 3 раза в сутки внутривенно и 1000 мг 2 раза в сутки внутрь;
-
левофлоксацин 500 мг 1 раз в сутки или моксифлоксацин 400 мг 1 раз в сутки.
-
При подозрении на Pseudomonas spp. и/или другие Enterobactereaces spp. рассматривается вопрос о назначении комбинированной АБТ с активностью против Pseudomonas spp.:
-
ципрофлоксацин 400 мг 2 раза в сутки внутривенно и 500–750 мг 2 раза в сутки внутрь
или -
цефтазидим 2,0 г 3 раза в сутки внутривенно и другие антибиотики с активностью против Pseudomonas spp.
Показания для лечения больных в отделении реанимации и интенсивной терапии:
-
угроза развития ОДН или ее наличие;
-
полиорганная дисфункция (шок, почечная, печеночная недостаточность, нарушение сознания);
-
гемодинамические нарушения;
-
прогрессирующее снижение PaO2 <55 мм рт.ст., SpO2 <88% и/или повышение PaCO2 >45 мм рт. ст., несмотря на оксигенотерапию.
Критерии возможной выписки из стационара при обострении ХОБЛ:
-
потребность в КДБА не более чем через 4–6 ч;
-
стабильное состояние больного в течение последних 24 ч;
-
стабильные показатели газов крови или SpO2 в последние 24 ч;
-
пациент способен передвигаться в пределах палаты, самостоятельно принимать пищу и спать без частых приступов одышки;
-
пациент и члены семьи полностью понимают необходимые режимы терапии;
-
наличие кислородного концентратора;
-
при выписке больного из отделения реанимации и интенсивной терапии домой больному обеспечены необходимые условия домашнего наблюдения и ухода.
Список литературы
См.
Аннотация
Федеральные клинические рекомендации по вакцинопрофилактике (ВП) пневмококковой инфекции у взрослых составлены специалистами Российского респираторного общества и Некоммерческого партнерства «Национальная ассоциация специалистов по контролю инфекций, связанных с оказанием медицинской помощи» на основании анализа исследований, опубликованных за последние 5 лет и вошедших в базы данных EMBASE, MEDLINE, PubMedи библиотеки Cochrane. Результаты анализа рецензированы независимыми экспертами с учетом мнения практических врачей первичного звена. Качество, уровень выработанных доказательств, а также сила созданных на их основе рекомендаций оценены в соответствии с международными критериями. В настоящих клинических рекомендациях рассмотрены эпидемиология, социальная значимость, патогенез, клинические формы, характеристика вакцин для профилактики пневмококковой инфекции (ПИ), а также специфическая ВП ПИ у лиц, причисленных к различным группам риска, и с различными коморбидными заболеваниями. Проведена оценка эффективности ВП при ПИ, описаны поствакцинальные реакции. Настоящие клинические рекомендации соответствуют требованиям Министерства здравоохранения Российской Федерации к разработке федеральных клинических рекомендаций по основным нозологическим формам и методам терапии.
Ключевые слова
Об авторах
А. Г. Чучалин
Российский национальный исследовательский медицинский университет имени Н.И.Пирогова
Россия
Чучалин Александр Григорьевич – доктор медицинских наук, профессор, академик Российской академии наук, заведующий кафедрой госпитальной терапии педиатрического факультета РНИМУ имени Н.И.Пирогова МЗ РФ; председатель правления Российского респираторного общества.
117997, Москва, ул. Островитянова, 1; тел.: (499) 780-08-50.
Н. И. Брико
Первый Московский государственный медицинский университет имени И.М.Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); Национальная ассоциация специалистов по контролю инфекций, связанных с оказанием медицинской помощи
Россия
Брико Николай Иванович – доктор медицинских наук, профессор, академик Российской академии наук, заведующий кафедрой эпидемиологии и доказательной медицины Первого МГМУ (Сеченовский Университет); председатель НАСКИ, главный внештатный специалист-эпидемиолог Министерства здравоохранения Российской Федерации.
119991, Москва, ул. Трубецкая, 8, стр. 2; 603022, Нижний Новгород, ул. Пушкина, 20, стр. 4; тел.: (499) 248-94-13.
С. Н. Авдеев
Первый Московский государственный медицинский университет имени И.М.Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства
Россия
Авдеев Сергей Николаевич – доктор медицинских наук, профессор, член-корреспондент РАН, заведующий кафедрой пульмонологии Первого МГМУ им. И.М. Сеченова (Сеченовский Университет), руководитель клинического отдела НИИ пульмонологии Федерального медико-биологического агентства.
119991, Москва, ул. Трубецкая, 8, стр. 2; 115682, Москва, Ореховый бульвар, 28; тел.: (495) 395-63-93.
А. С. Белевский
Российский национальный исследовательский медицинский университет имени Н.И.Пирогова Министерства здравоохранения Российской Федерации
Россия
Белевский Андрей Станиславович – доктор медицинских наук, профессор, заведующий кафедрой пульмонологии РНИМУ имени Н.И.Пирогова МЗ РФ, президент Российского респираторного общества, главный внештатный специалист-пульмонолог Департамента здравоохранения Правительства Москвы.
117997, Москва, ул. Островитянова, 1; тел.: (495) 963-24-67.
Т. Н. Биличенко
Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства
Россия
Биличенко Татьяна Николаевна – доктор медицинских наук, профессор, заведующая лабораторией клинической эпидемиологии НИИ пульмонологии Федерального медико-биологического агентства России.
115682, Москва, Ореховый бульвар, 28; тел.: (495) 965-11-15.
И. B. Демко
Красноярский государственный медицинский университет имени профессора В.Ф.Войно-Ясенецкого Министерства здравоохранения Российской Федерации
Россия
Демко Ирина Владимировна – доктор медицинских наук, профессор, заведующая кафедрой внутренних болезней № 2 с курсом постдипломного образования КрасГМУ имени профессора В.Ф.Войно-Ясенецкого МЗ РФ, главный внештатный специалист-пульмонолог Сибирского федерального округа.
660022, Красноярск, ул. Партизана Железняка, 1; тел.: (913) 507-84-08.
О. М. Драпкина
Национальный медицинский исследовательский центр профилактической медицины Министерства здравоохранения Российской Федерации
Россия
Драпкина Оксана Михайловна – доктор медицинских наук, профессор, член-корр. Российской академии наук, директор НМИЦ профилактической медицины МЗ РФ.
101000, Москва, Петроверигский переулок, 10, стр. 3; тел.: (495) 623-86-36.
A. В. Жестков
Самарский государственный медицинский университет Министерства здравоохранения Российской Федерации
Россия
Жестков Александр Викторович – доктор медицинских наук, профессор, заведующий кафедрой общей и клинической микробиологии, иммунологии и аллергологии СамГМУ МЗ РФ, главный внештатный специалист-пульмонолог Приволжского федерального округа.
443099, Самара, ул. Чапаевская, 89; тел.: (846) 260-33-61.
А. А. Зайцев
Главный военный клинический госпиталь имени академика Н.Н.Бурденко Министерства обороны Российской Федерации
Россия
Зайцев Андрей Алексеевич – доктор медицинских наук, профессор, главный пульмонолог ГВКГ имени академика Н.Н.Бурденко Министерства обороны РФ, главный пульмонолог Министерства обороны РФ.
105094, Москва, Госпитальная пл., 3; тел.: (499) 263-10-47.
Г. Л. Игнатова
Южно-Уральский государственный медицинский университет Министерства здравоохранения Российской Федерации
Россия
Игнатова Галина Львовна – доктор медицинских наук, профессор, заведующая кафедрой терапии Института дополнительного профессионального образования ЮУГМУ МЗ РФ, главный внештатный специалист-пульмонолог Уральского федерального округа.
454092, Челябинск, Воровского, 64; тел.: (351) 742–66-40.
О. В. Ковалишена
Приволжский исследовательский медицинский университет Министерства здравоохранения Российской Федерации
Россия
Ковалишена Ольга Васильевна – доктор медицинских наук, профессор, заведующая кафедрой эпидемиологии ПИМУ МЗ РФ.
603005, Нижний Новгород, пл. Минина и Пожарского, 10 / 1; тел.: (903) 608-39-08.
В. А. Коршунов
Первый Московский государственный медицинский университет имени И.М.Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Россия
Коршунов Владимир Андреевич – кандидат медицинских наук, старший преподаватель кафедры эпидемиологии и доказательной медицины Первого МГМУ имени И.М.Сеченова МЗ РФ (Сеченовский Университет).
119991, Москва, ул. Трубецкая, 8, стр. 2; тел.: (499) 248-04-13.
М. П. Костинов
Первый Московский государственный медицинский университет имени И.М.Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); Научно-исследовательский институт вакцин и сывороток им. И.И.Мечникова
Россия
Костинов Михаил Петрович – доктор медицинских наук, профессор, заведующий лабораторией вакцинопрофилактики и иммунотерапии НИИ вакцин и сывороток им. И.И.Мечникова, профессор кафедры эпидемиологии Института профессионального образования Первого МГМУ имени И.М.Сеченова МЗ РФ (Сеченовский Университет).
119991, Москва, ул. Трубецкая, 8, стр. 2; 105064, Москва, Малый Казенный переулок, 5а; тел.: (495) 917-41-49.
В. Ю. Мишланов
Пермский государственный медицинский университет имени академика Е.А.Вагнера Министерства здравоохранения Российской Федерации
Россия
Мишланов Виталий Юрьевич – доктор медицинских наук, профессор, член-корреспондент Российской академии наук, заведующий кафедрой пропедевтики внутренних болезней ПГМУ имени академика Е.А.Вагнера МЗ РФ, главный внештатный пульмонолог Минздрава Пермского края.
614990, Пермский край, Пермь, ул. Петропавловская, 26; тел.: (342) 265-97-25.
С. В. Сидоренко
Детский научно-клинический центр инфекционных болезней Федерального медико-биологического агентства
Россия
Сидоренко Сергей Владимирович – доктор медицинских наук, профессор, руководитель отдела молекулярной микробиологии и эпидемиологии ДНКЦИБ Федерального медико-биологического агентства.
197022, Санкт-Петербург, ул. Профессора Попова, 9; тел.: (812) 234-60-04.
Н. В. Трушенко
Первый Московский государственный медицинский университет имени И.М.Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства
Россия
Трушенко Наталья Владимировна – кандидат медицинских наук, научный сотрудник научно-методического центра мониторинга и контроля болезней органов дыхания НИИ пульмонологии Федерального медико-биологического агентства, ассистент кафедры пульмонологии Первого МГМУ имени И.М.Сеченова МЗ РФ (Сеченовский Университет).
119991, Москва, ул. Трубецкая, 8, стр. 2; 115682, Москва, Ореховый бульвар, 28; тел.: (495) 395-63-93.
И. В. Шубин
Центральная клиническая больница Российской академии наук
Россия
Шубин Игорь Владимирович – кандидат медицинских наук, заместитель главного врача по медицинской части ЦКБ РАН, заслуженный врач Российской Федерации.
117593, Москва, Литовский бульвар, 1А; тел.: (495) 427-62-46.
И. В. Фельдблюм
Пермский государственный медицинский университет имени академика Е.А.Вагнера Министерства здравоохранения Российской Федерации
Россия
Фельдблюм Ирина Викторовна – доктор медицинских наук, профессор, заведующая кафедрой эпидемиологии с курсом гигиены и эпидемиологии факультета дополнительного профессионального образования ПГМУ имени академика Е.А.Вагнера МЗ РФ.
614990, Пермский край, Пермь, ул. Петропавловская, 26; тел.: (8342) 218-16-68.
Список литературы
1. Брико Н.И., ред. Эпидемиология, клиника и профилактика пневмококовой инфекции: Учебное пособие для врачей. Нижний Новгород: Ремедиум Приволжье; 2017.
2. Таточенко В.К., Озерецковский Н.А. Иммунопрофилактика-2018. Справочник. 13-е изд., расшир. Москва: Боргес; 2018.
3. Pollard A.J., Perrett K.P., Beverley P.C. Maintaining protection against invasive bacteria with protein-polysaccharide conjugate vaccines. Nat. Rev. Immunol. 2009; 9 (3): 213–220. DOI: 10.1038/nri2494.
4. Caplan A., Fett N., Rosenbach M. et al. Prevention and management of glucocorticoid-induced side effects: A comprehensive review: Infectious complications and vaccination recommendations. J. Am. Acad. Dermatol. 2017; 76 (2): 191–198. DOI: 10.1016/j.jaad.2016.02.1240.
5. Siegrist C.A., Aspinall R. B-cell responses to vaccination at the extremes of age. Nat. Rev. Immunol. 2009; 9 (3): 185–194. DOI: 10.1038/nri2508.
6. Huijts S.M., van Werkhoven C.H., Bolkenbaas M. et al. Post-hoc analysis of a randomized controlled trial: Diabetes mellitus modifies the efficacy of the 13-valent pneumococcal conjugate vaccine in elderly. Vaccine. 2017; 35 (34): 4444–4449. DOI: 10.1016/j.vaccine.2017.01.071.
7. Shea K.M., Edelsberg J., Weycker D. et al. Rates of pneumococcal disease in adults with chronic medical conditions. Open Forum Infect. Dis. 2014; 1 (1): ofu024. DOI: 10.1093/ofid/ofu024.
8. Luján M., Burgos J., Gallego M. et al. Effects of immunocompromise and comorbidities on pneumococcal serotypes causing invasive respiratory infection in adults: implications for vaccine strategies. Clin. Infect. Dis. 2013; 57 (12): 1722–1730. DOI: 10.1093/cid/cit640.
9. Костинов М.П., Чучалин А.Г., ред. Руководство по клинической иммунологии в респираторной медицине. 2-е изд., доп. Москва: МДВ; 2018.
10. Koch D.H., Moon K.T., Kim J.Y. et al. The risk of hospitalization for infectious pneumonia in mineral dust exposed industries. Occup. Environ. Med. 2011; 68 (2): 116–119. DOI: 10.1136/oem.2009.051334.
11. Coggon D., Harris E.C., Cox V., Palmer K.T. Pneumococcal vaccination for welders. Thorax. 2015; 70 (2): 198–199. DOI: 10.1136/thoraxjnl-2014-206129.
12. Лобзин Ю.В., Сидоренко С.В., Харит С.М. и др. Серотипы Streptococcus pneumoniae, вызывающие ведущие клинические формы пневмококковых инфекций. Журнал инфектологии. 2013; 5 (4): 35–41.
13. Белошицкий Г.В., Королева И.С., Миронов К.О. Фенотипическая и генотипическая характеристика штаммов пневмококков, выделенных от больных пневмококковым менингитом. Клинитческая микробиология и антимикробная химиотерапия. 2011; 13 (3): 261–266.
14. Siegrist C.A. Vaccine immunology. In: Plotkin S.A., Orenstein W.A., Offit P.A., eds. Vaccines. The 6th Edition. Philadelphia: Elsevier-Saunders; 2013.
15. Bonten M.J.M., Huijts S.M., Bolkenbaas M. et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N. Eng. J. Med. 2015; 372: 1114–1125. DOI: 10.1056/NEJMoa1408544.
16. Falkenhorst G., Remschmidt C., Harder T. et al. [Background paper to the updated pneumococcal vaccination recommendation for older adults in Germany]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2016; 59 (12): 1623–1657. DOI: 10.1007/s00103-016-2466-9 (in German).
17. Gonzalez-Romo F., Picazo J.J. Rojas A.G. et al. [Consensus document on pneumococcal vaccination in adults at risk by age and underlying clinical conditions. 2017 Update]. Rev. Esp. Quimioter. 2017; 30 (2): 142–168. Available at:http://www.seq.es/seq/0214-3429/30/2/gonzalez15feb2017.pdf (in Spanish).
18. Australian Government Department of Health. Australian Immunisation Handbook. The National Immunisation Program. Available at: http://www.health.gov.au/internet/immunise/publishing.nsf/Content/national-immunisation-program-schedule
19. Center for Disease Control and Prevention. Pneumococcal Diseases. Pneumococcal Vaccination. Available at: https://www.cdc.gov/pneumococcal/vaccination.html
20. Tin Tin Htar M., Stuurman A.L., Ferreira G. et al. Effectiveness of pneumococcal vaccines in preventing pneumonia in adults, a systematic review and meta-analyses of observational studies. PLoS One. 2017; 12 (5): e0177985. DOI: 10.1371/journal.pone.0177985.
21. Center for Disease Control and Prevention. Vaccine Recommendations and Guidelines of the ACIP. Available at: https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/immunocompetence.html
22. van Cuyck H., Pichon B., Leroy P. et al. Multiple-locus variable-number tandem-repeat analysis of Streptococcus pneumoniae and comparison with multiple loci sequence typing. BMC Microbiology. 2012; 12: 241. DOI: 10.1186/1471-2180-12-241.
23. Мартынова А.В., Балабанова Л.А., Чулакова О.А., Шепарев А.А. Молекулярно-эпидемиологический мониторинг штаммов Streptococcus Pneumoniae, выделенных у пациентов пожилого возраста с внебольничными пневмониями. СТМ. 2014; 6 (3): 91–96. Доступно на: https://cyberleninka.ru/article/v/molekulyarno-epidemiologicheskiy-monitoring-shtammov-streptococcus-pneumoniae-vydelennyh-u-patsientov-pozhilogo-vozrasta-s
24. Демко И.В., Корчагин Е.Е., Гордеева Е.В. и др. Опыт вакцинопрофилактики пневмококковой инфекции у взрослых на примере Красноярского края. Пульмонология. 2017; 27 (1): 21–28. DOI: 10.18093/0869-0189-2017-27-1-21-28.
25. Захарова И.А. Возможности профилактики обострений хронического бронхита у лиц молодого возраста. Современные проблемы науки и образования. 2016; 5. Available at: http://www.science-education.ru/article/view?id=25124
26. Игнатова Г.Л., Антонов В.Н. Эпидемиологические особенности хронической респираторной патологии при вакцинации против пневмококковой инфекции. Пульмонология. 2017; 27 (3): 376–383. DOI: 10.18093/0869-0189-2017-27-3-376-383.
27. Игнатова Г.Л., Антонов В.Н. Эффективность вакцинопрофилактики пневмококковой инфекции у пациентов с ХОБЛ с различными индексами коморбидности. Эпидемиология и вакцинопрофилактика. 2017; 16 (5): 22–27. DOI: 10.31631/2073-3046-2017-16-5-22-27.
28. Клинические рекомендации. Хроническая сердечная недостаточность (ХСН) Код МКБ – 150.0/150.1/150.9. Общество специалистов по сердечной недостаточности. Российское кардиологическое общество; 2016. Доступно на: http://www.ossn.ru/upload/medialibrary/003/RekomendatsiiOSSN_MZ_30012017.pdf
29. Протасов А.Д., Жестков А.В., Костинов М.П. и др. Анализ отдаленных результатов эффективности и формирования адаптивного иммунитета при применении разных препаратов и схем вакцинации против пневмококковой инфекции у больных с хронической обструктивной болезнью легких. Терапевтический архив. 2017; 89 (12-2): 165–174.
30. Голоднова С.О., Фельдблюм И.В., Семериков В.В. и др. Распространенность носительства Streptococcus pneumoniae среди медицинских работников и оценка эффективности вакцинопрофилактики. Эпидемиология и вакцинопрофилактика. 2014; 1 (74): 50–54.
31. Фельдблюм И.В., Николенко В.В., Воробьева Н.Н. и др. Реактогенность, безопасность, иммуногенность и профилактическая эффективность полисахаридной пневмококковой вакцины при иммунизации ВИЧ-инфицированных пациентов. Журнал микробиологии, эпидемиологии, иммунобиологии. 2013; (3): 52–60.
32. Николенко В.В., Фельдблюм И.В., Голоднова С.О., Воробьева Н.Н. Медицинские работники как группа риска по пневмококковой инфекции. Медицинский альманах. 2014; 4 (34): 30–34.
33. Чучалин А.Г., Онищенко Г.Г., Колосов В.П. и др. Реализация противоэпидемических мероприятий по профилактике пневмококковых инфекций в зонах паводкового наводнения в Приамурье. Пульмонология. 2015; 25 (3): 303–311. DOI: 10.18093/0869-0189-2015-25-3-303-311.
34. Rubin L.G., Levin M.J., Ljungman P. et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin. Infect. Dis. 2014; 58 (3): 309–318. DOI: 10.1093/cid/cit816.
35. U.S. National Library of Medicine. Pneumococcal Vaccine in Untreated CLL (Chronic Lymphocytic Leukemia) Patients. ClinicalTrials . gov NCT01892618. Available at: https://clinicaltrials.gov/ct2/show/NCT01892618?term=NCT01892618&rank=1
36. U.S. National Library of Medicine. VACcination In Methotrexate Treated Rheumatoid Arthritis Patients (VACIMRA). ClinicalTrials . gov NCT01942174. Available at: https://clinicaltrials.gov/ct2/show/NCT01942174?term=NCT01942174&rank=1
37. McLaughlin J.M., Jiang Q., Isturiz R.E. et al. Effectiveness of 13-valent pneumococcal conjugate vaccine against hospitalization for community-acquired pneumonia in older US adults: A test-negative design. Clin. Infect. Dis. 2018; 67 (10): 1498–1506. DOI: 10.1093/cid/ciy312.
38. Greenberg R.N., Gurtman A., Frenck R.W. et al. Sequential administration of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naïve adults 60–64 years of age. Vaccine. 2014; 32 (20): 2364–2374. DOI: 10.1016/j.vaccine.2014.02.002.
39. Paradiso P.R. Pneumococcal conjugate vaccine for adults: a new paradigm. Clin. Infect. Dis. 2012; 55 (2): 259–264. DOI: 10.1093/cid/cis359.
40. U.S. National Library of Medicine. Evaluation of the Safety and Immunogenicity of Sequential Administration of Prevnar 13™ and Pneumovax™ 23 in Healthy Participants 50 Years of Age and Older (V110-029). ClinicalTrials . gov NCT02225587. August 26, 2014. Available at: https://clinicaltrials.gov/ct2/results?cond=&term=NCT02225587&cntry=&state=&city=&dist=

