Меланома кожи
Версия: Клинические протоколы МЗ РК — 2020 (Казахстан)
Категории МКБ:
Злокачественная меланома кожи (C43)
Разделы медицины:
Онкология
Общая информация
Краткое описание
Одобрен Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «12» ноября 2020 года
Протокол №121
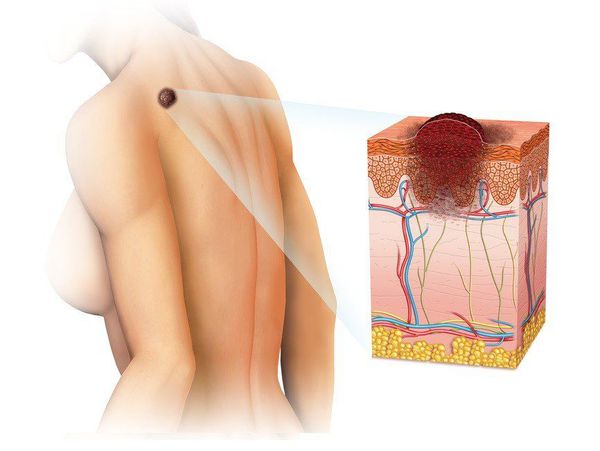
Меланома кожи – злокачественная опухоль, развивающаяся из меланоцитов – пигментных клеток, продуцирующих специфический полипептид меланин. Для меланомы характерно скопление меланина в клетках опухоли, однако встречаются и беспигментные меланомы [18] (УД – А).
ВВОДНАЯ ЧАСТЬ
Название протокола: МЕЛАНОМА КОЖИ
Код(ы) МКБ – 10:
| С43 | Злокачественная меланома кожи |
| С43.1 | Кожа век |
| С43.2 | Кожа ушных раковин |
| С43.3 | Кожа иных отделов лица |
| С43.4 | Кожа волосистой части головы и шеи |
| С43.5 | Кожа туловища |
| С43.6 | Кожа верхних конечностей |
| С43.7 | Кожа нижних конечностей |
| С43.8 | Комбинированное поражение кожи |
| С43.9 | Кожа, БДУ |
Дата разработки/пересмотра протокола: 2018 год (пересмотр 2020 г.).
Сокращения, используемые в протоколе:
| БДУ | – | без дополнительных уточнений |
| ОАК | – | общий анализ крови |
| ОАМ | – | общий анализ мочи |
| АЛТ | – | аланинтрансаминаза |
| АСТ | – | аспартаттрансминаза |
| ЛДГ | – | лактатдегидрогиназа |
| КТ | – | компьютерно-томографическое исследование |
| МРТ | – | магнитно-резонансная томография |
| УЗИ | – | ультразвуковое исследование |
| ПЭТ | – | позитронно-эмиссионная томография |
| РОД | – | разовая очаговая доза |
| ГР | – | грей |
| УЗИ | – | ультразвуковое исследование |
| RW | – | реакция Вассермана |
| ВИЧ | – | вирус иммунодефицита человека |
| ИГХ | – | иммуногистохимия |
| ОГК | – | органов грудной клетки |
| ЗП | – | забрюшинное пространство |
| ЦНС | – | центральная нервная система |
| СРХ | – | стереотаксическая радиохирургия |
| СРТ | – | стереотаксическая радиотерапия |
Пользователи протокола: онкологи, хирурги, нейрохирурги, лучевые терапевты (радиологи), химиотерапевты, врачи лучевой диагностики, врач общей практики, терапевты, врач скорой и неотложной помощи.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результатов. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Клиническая классификация
Классификация по системе TNM (8 издание 2017г) Рекомендации Американской объединенной комиссии по злокачественным новообразованиям [19] (УД – А).
Т – первичная опухоль.
Степень распространения первичной опухоли классифицируется после ее удаления (см. рТ).
N – регионарные лимфатические узлы.
NХ – региональные лимфатические узлы не могут быть оценены.
N0 – нет метастазов в региональных лимфатических узлах.
N1 – метастаз в 1 региональном лимфатическом узле.
N1а – только микроскопический метастаз (клинически скрытый).
N1b – макроскопический метастаз (клинически выявляемый).
N1с – сателлитный или транзитный метастаз без метастазов в региональный лимфоузел
N2 – метастазы в 2 либо в 3 регионарных лимфатических узлах илиинтралимфатический региональный метастаз с поражением лимфоузла.
N2а— только микроскопические метастазы в региональных лимфатических узлах.
N2b – макроскопические метастазы в региональных лимфатических узлах.
N2с – сателлитный или транзитный метастаз с метастазом в 1 региональный лимфоузел
N3 – метастазы в 4 и более регионарных узлах, или связанное (единое) метастатическое поражение регионарных лимфатических узлов, или сателлитные, или транзитные метастазы с метастазами в регионарном лимфатическом узле (узлах).
N3a – микроскопический метастаз в лимфоузле
N3b – макроскопический метастаз в лимфузле.
N3с – сателлитные и/или транзитные метастазы в 2 или более региональных лимфоузлах
Примечание. Сателлитами являются скопления опухолевых клеток или узелки (макро-или микроскопические) в пределах 2 см от первичной опухоли. Транзитные метастазы поражают кожу и подкожные ткани на расстоянии более 2 см от первичной опухоли, но не дальше месторасположения регионарных лимфатических узлов.
М – отдаленные метастазы.
М0 – нет отдаленных метастазов.
М1 – есть отдаленные метастазы
М1а – кожа, подкожные ткани или лимфатические узлы (узел) дальше региональных лимфатических узлов.
М1b –легкие.
М1с – другие метастазы без вовлечения ЦНС
М1d – метастазы в ЦНС (поражение головного мозга)
Примечание для категории М (метастазы):
- – уровень ЛДГ в норме
- – уровень ЛДГ выше нормы
Необходимо указать значение ЛДГ при наличии категории М: например, М1а (1).
pTNM патогистологическая классификация
рT – первичная опухоль;
pТХ – первичная опухоль не может быть оценена.
pТ0 – отсутствие данных о первичной опухоли.
pТis – меланома insitu (I уровень инвазии по Clark) (атипичная меланоцитарная гиперплазия, тяжелая меланоцитарная дисплазия, неинвазивное злокачественное поражение).
Примечание. pTX включает результаты shave-биопсии (с помощью дерматома) и регресс- меланомы.
pТ1 – меланома толщиной 1 мм или менее.
pТ1а –меланома толщиной 0,8 мм или менее без изъязвления
pТ1b –меланома толщиной 0,8 мм с изъязвлением или более 0,8мм но не более 1мм.
pТ2 – меланома толщиной более 1 мм, но не более2 мм.
pТ2а – без изъязвления.
pТ2b– с изъязвлением.
pТ3 – меланома толщиной более 2 мм, но не превышающая 4 мм.
pТ3а – без изъязвления.
pТ3b – с изъязвлением.
pТ4 – меланома толщиной более 4 мм.
pТ4а – без изъязвления.
pТ4b– с изъязвлением.
рN – регионарные лимфатические узлы
рN-категории соответствуют N-категориям.
РN0 – при региональной лимфаденэктомии гистологическое исследование должно включать не менее 6 лимфатических узлов.
Если в лимфатических узлах метастазы не выявлены, но исследовано меньшее количество узлов, то классифицируют как pN0. Если N-категория устанавливается на основании данных биопсии сторожевого лимфатического узла без подмышечной лимфодиссекции, это классифицируется как pN0(sn). При одиночном метастазе, который был установлен путем биопсии сторожевого узла, указывается pN1(sn).
рM– отдалённые метастазы
рM- соответствуют M-категориям.
Клинические стадии
| Стадия | Т | N | M |
| Стадия 0 | рТis | N0 | M0 |
| Стадия IА | p Т1а | N0 | M0 |
| Стадия IВ | p Т1b | N0 | M0 |
| p Т2a | N0 | M0 | |
| Стадия IIА | p Т2b | N0 | M0 |
| p Т3a | N0 | M0 | |
| Стадия IIВ | p Т3b | N0 | M0 |
| p Т4a | N0 | M0 | |
| Стадия IIC | p Т4b | N0 | M0 |
| Стадия III | любая pТ | N1-3 | M0 |
| Стадия IV | любая pТ | любая N | M1 |
Патоморфологические стадии
| Стадия | Т | N | M |
| Стадия 0 | рТis | N0 | M0 |
| СтадияI | pТ1 | N0 | M0 |
| Стадия IА | p Т1а | N0 | M0 |
| Стадия IВ | p Т1b | N0 | M0 |
| p Т2a | N0 | M0 | |
| Стадия IIА | p Т2b | N0 | M0 |
| p Т3a | N0 | M0 | |
| Стадия IIВ | p Т3b | N0 | M0 |
| p Т4a | N0 | M0 | |
| Стадия IIC | p Т4b | N0 | M0 |
| Стадия III | любая pТ | N1,2,3 | M0 |
| Стадия IIIА | p Т1а, T1b, T2a | N1а, 2а | M0 |
| Стадия IIIВ | p Т1а, T1b, T2a, | N1b,N1c,N2b | M0 |
| p Т2b–3a | N1, N2a,N2b | M0 | |
| Стадия IIIC | p T1a, Т1b–4b | N1b, 2b | M0 |
| любая pТ | N3 | M0 | |
| Стадия IIID | T4b | N3a, N3b, N3c | M0 |
| Стадия IV | любая pТ | любая N | M1 |
Меланома кожи
| pT1а | £1 мм, уровень инвазии II или III, без изъязвления |
| pT1b | £1 мм, уровень инвазии IV или V, или изъязвление |
| pТ2a | >1-2 мм, без изъязвления |
| pТ2b | >1-2 мм, с изъязвлением |
| pТ3a | >2-4 мм, без изъязвления |
| pТ3b | >2-4 мм, c изъязвлением |
| pТ4a | >4 мм, без изъязвления |
| pТ4b | >4 мм, c изъязвлением |
| N1 | 1 лимфатический узел |
| N1a | микроскопический метастаз |
| N1b | макроскопический метастаз |
| N2 | 2–3 лимфатических узла или сателлиты/транзитные метастазы, без поражения лимфатических узлов |
| N2a | микроскопические метастазы |
| N2b | макроскопические метастазы |
| N2c | сателлиты или транзитные метастазы без поражения лимфатических узлов |
| N3 | ³ 4 лимфатических узлов; конгломерат; сателлиты или транзитные метастазы с поражением лимфатических узлов |
Гистологическая классификация (приведены наиболее часто встречающиеся гистологические типы)
- Меланома insitu.
- Злокачественная меланома без дополнительных уточнений (БДУ).
- Поверхностно-распространяющаяся меланома.
- Узловая меланома.
- Лентиго-меланома, злокачественная.
- Краевая лентигинозная меланома.
- Десмопластическая меланома.
- Эпителиоидно-клеточная меланома.
- Веретеноклеточная меланома.
- Баллоноклеточная меланома.
- Голубой невус, злокачественный.
- Злокачественная меланома в гигантском пигментном невусе.
- Беспигментная меланома.
- Злокачественная меланома регрессирующая.
- Злокачественная меланома в пограничном невусе.
- Лентигинозная меланома слизистой оболочки.
- Смешанная эпителиоидная и веретеноклеточная меланома.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии:
Жалобы и анамнез [17] (УД – B):
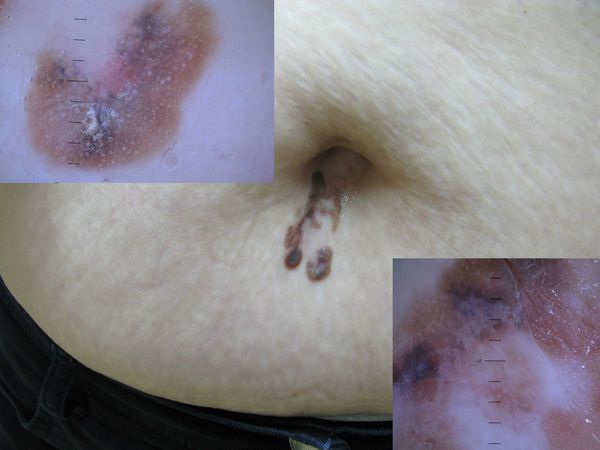
наличие опухолевого образования кожи, изменение цвета и рост пигментного образования кожи, изменение размера, формы или цвета родинки или другого кожного нароста, увеличение периферических лимфатических узлов.
Физикальное обследование [17] (УД – B):
- Пальпация всех доступных групп лимфатических узлов (шейных, подмышечных, пахово-бедренных и др.);
- Диагностика меланомы в ранних стадиях предусматривает прежде всего внимательное исследование образования на коже, выявленного пациентом, родственниками или медицинскими работниками при профилактическом осмотре, и всей кожи рутинным физикальным методом при хорошем освещении и использовании увеличительного стекла
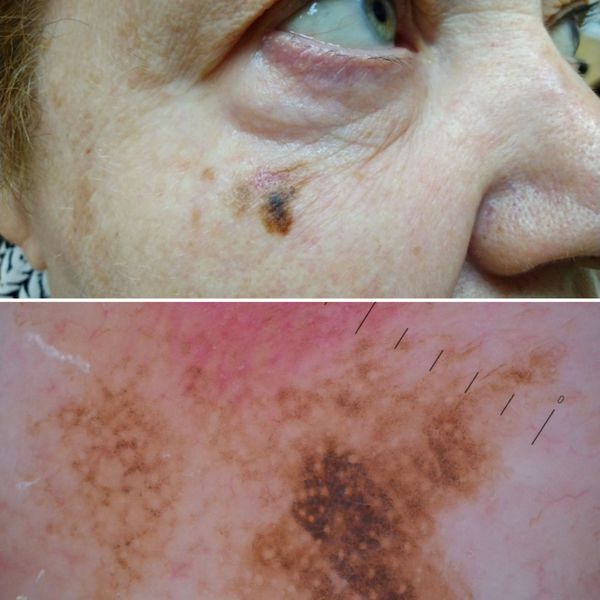
Необходимо использовать специальные таблицы «правил злокачественности», в частности таблицу «ABCDE», содержащую перечень наиболее показательных оценочных диагностических признаков [18] (УД – А);
- A (asymmetry) — асимметрия, одна сторона не похожа на другую;
- В (boundary, border irregularity) –неровный край;
- С (color) — включение участков красного, коричневого, синего или белого цвета;
- D (diameter) — диаметр более 6 мм;
- Е (elevation) — приподнятость опухоли над окружающей кожей.
Лабораторные исследования:
- ОАК;
- ОАМ;
- биохимический анализ (билирубин, общий белок, АЛТ, АСТ, мочевина, креатинин, глюкоза, ЛДГ);
- Определение группы крови по системе ABO стандартными сывороткам;
- Коагулограмма;
- Бактериологическое исследование на микрофлору: мазок из раны, зева, с поверхности распадающейся опухоли;
- Цитологическое исследование;
- Гистологическое исследование;
- Определение типа BRAF-мутации в опухоли.
Инструментальные исследования:
- определение функциональной активности: общего состояния больного с оценкой качества жизни по Карновскому (см. приложение 1).
- определение уровня сознания по шкале Глазго (GCS) (см. приложение 2);
- дерматоскопия с использованием специальной, с наличием градуировки или обычной лупы с подсветкой с увеличением до 10 раз (см. Приложение 3)
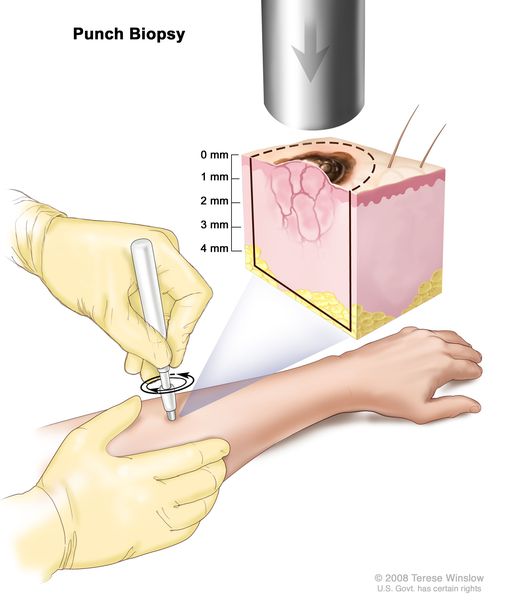
- тонкоигольная пункционная (аспирационная) биопсия (при наличии увеличенных или измененных лимфатических узлов с целью подтверждения метастатического характера их поражения выполняется);
- МРТ головного мозга с контрастированием;
- ЭКГ;
- ПЭТ-КТ;
- КТ органов грудной клетки;
- КТ органов брюшной полости и забрюшинного пространства с контрастированием;
- КТ органов малого таза;
- Ультразвуковая диагностика комплексная (печень, желчный пузырь, поджелудочная железа, селезенка, почек);
- Сцинтиграфия костей скелета;
- УЗИ регионарных лимфоузлов;
- Биопсия сторожевого (сигнального лимфоузла) [36; А] (при регистрации оборудования и радиоизотопа в Республике Казахстан).
Показания для консультации узких специалистов:
- консультация кардиолога (пациентам 50 лет и старше, так же пациенты моложе 50 лет при наличии сопутствующей патологии сердечно-сосудистой системы);
- консультация невропатолога (при сосудистых мозговых нарушениях, в том числе инсультах, травмах головного и спинного мозга, эпилепсии, миастении, нейроинфекционных заболеваниях, а также во всех случаях потери сознания);
- консультация гастроэнтеролога (при наличии сопутствующей патологии органов ЖКТ в анамнезе);
- консультация нейрохирурга (при наличии метастазов в головной мозг, позвоночник);
- консультация торакального хирурга (при наличии метастазов в легких);
- консультация эндокринолога (при наличии сопутствующей патологии эндокринных органов).
Диагностический алгоритм:
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Эпителиоидный и (или) веретеноклеточный невус — юношеская „меланома”. Очень часто фигурирует в литературе под названием невуса Спитц. | юношеская (ювенильная) меланома чаще встречается у детей в возрасте от 5 до 10 лет, однако очень редко наблюдается у взрослых. Чаще она локализуется на коже лица, причем цвет образования варьирует от красноватого до темно-коричневого, а размеры — от 0.3 до 4.0 см. Возможность рецидивирования (после иссечения), малигнизации и метастазирования юношеской меланомы крайне мала. Гораздо чаще это образование либо подтвергается спонтанной инволюции, либо трансформируется в обычный невус | Локальный осмотр дерматоскопия | Встречается в детском и юношеском возрасте |
| Голубой или синий невус |
Голубой или синий невус является врожденным или появляется в детском возрасте. Диагностируется у детей и молодых людей. Чаще встречается у лиц женского пола. Развитие начинается с образованием пятна или уплотнения в дерме, которые трансформируется в узел или бляшку с гладкой или неровной поверхностью размерами до 2-2,5см синего цвета. |
Дерматоскопия Локальный осмотр |
В отличие от голубого невуса, размеры «злокачественного голубого невуса» более 2см в диаметре. |
| Галоневус — болезнь Сеттона. |
Галоневусы имеют округлую форму диаметром 3-8 мм и возвышаются над уровнем окружающей кожи на 1-1.5 мм. Вокруг них присутствует депигментированный венчик, превышающий в 3-4 раза диаметр невусов. возможно, как спонтанное исчезновение этих образований, так и появление новых. депигментация кожи вокруг невусов (так называемый синдром Сеттона) может иметь место при злокачественных опухолях внутренних органов, а также при меланоме кожи, что позволяет предположительно рассматривать его как паранеопластический процесс. Локализация любая, но чаще на спине (40-50%) |
Локальный осмотр. Чаще встречается в возрастном промежутке от 3 до 42 лет. |
Гипопигментированный ободок также может встречаться при злокачественной опухоли кожи: базалиоме, меланоме (первичной или ее метастазов). |
| Пигментная форма базалиомы | Характеризуется диффузной или неравномерной пигментацией очага поражения. Пигментная форма базалиомы в виде узла или бляшки встречается в пожилом возрасте. |
Дерматоскопия Локальный осмотр При наличие изъявления -соскоб с поверхности опухоли |
Длительный анамнез, В случае быстрого роста отмечается отсутствие региональных метастазов В отличие от узловой меланомы, базалиома имеет более плотную консистенцию, чаще встречается на лице, меланома – на любых участках кожного покрова. |
| Дерматофибромы | плотные красно-коричневого цвета папулы или узелки, состоящие из соединительной ткани. Они, как правило, возникают на бедрах или ногах, но могут возникнуть и в любом другом месте. | Локальный осмотр | 1% атипичной формы меланомы может протекать под «маской» дерматофибромы, поэтому рекомендуется оперативное лечение обязательно с гистологическим исследованием |
| Ограниченный предраковый меланоз Дюбрейля | Возникает данная патология чаще у женщин пожилого возраста. Наиболее типичная локализация – открытые участки тела (лицо, грудь, конечности). Внешне меланоз Дюбрейля выглядит как пигментное пятно размерами до 3 см различного цвета (от светлокоричневого до черного) с нечеткими контурами, кожный рисунок на этом участке сохранен. Пятно может существовать в течение нескольких десятилетий, описаны случаи внезапного исчезновения пятна. Под действием травматизации и (или) гиперинсоляции происходит трансформация пятна (меланоза Дюбрейля) в меланому. |
Дерматоскопия Локальный осмотр |
Учитывая высокую вероятность перерождения в меленному кожи, рекомендовано оперативное лечение с гистологическим исследованием |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
Немедикаментозное лечение
Режим больного при проведении консервативного лечения – общий. В ранний послеоперационный период –полупостельный или общий. В послеоперационном периоде – свободный.
Диета стол – №15, после хирургического лечения – №1.
Режим общий, стол 15
Медикаментозное лечение
Первичным и обязательным этапом лечения локальной меланомы кожи является радикальное иссечение первичной опухоли в пределах здоровых тканей. Подбор и проведение дальнейшей терапии зависит от установленной стадии.
Пациентам с установленной IA, IB или IIA стадией заболевания не рекомендуется проведение адъювантной терапии при наличии благоприятного прогноза, в связи с низким риском прогрессирования заболевания, а также в том случае, если риски, связанные с развитием нежелательных явлений на фоне применения ИФН, превышают ожидаемую пользу. Назначение ИФН-α в адъювантном режиме оправдано только для изъязвленных форм IIB и IIC стадии в низких дозах ИФН-α 3–5 млн. Ед. п / к × 3 раза в нед. × 12 мес. [32]
Рекомендуемые режимы адъювантной терапии меланомы кожи в зависимости от стадии заболевания и мутационного статуса:
| Стадия | Мутация BRAF | Оптимальный объем лечения |
| IIB, IIC стадии (изъязвленные формы) | — | Низкие дозы ИФН-α 3–5 млн. Ед. п / к × 3 раза в нед. × 12 мес. |
| IIIA | BRAF V600 есть |
Ингибиторы BRAF / MEK: дабрафениб 150 мг внутрь × 2 раза в сут. + траметиниб 2 мг внутрь × 1 раз в сут. × 12 мес.
|
| IIIA | BRAF V600 нет |
Анти-PD1 терапия: пембролизумаб 200 мг в / в в / в каждые 3 нед. |
| IIIB, IIIC, IIID | BRAF V600 есть |
Ингибиторы BRAF / MEK: дабрафениб 150 мг внутрь × 2 раза в сут. + траметиниб 2 мг внутрь × 1 раз в сут. × 12 мес.
|
|
IIIB, IIIC, IIID |
BRAF V600 нет |
Анти-PD1 терапия: пембролизумаб 200 мг в / в каждые 3 нед. × 12 мес.; или ниволумаб*3 мг / кг (но не более 240 мг) в / в каждые 2 нед. (или ниволумаб* 480 мг в / в каждые 4 нед.) × 12 мес. |
Примечание: назначение адъювантной терапии блокаторами PD1 или ингибиторами BRAF / MEK должно проводиться по решению врачебной комиссии.
*Незарегистрированные лекарственные средства используются в соответствии со статьей 251 Кодекса Республики Казахстан «О здоровье народа и системе здравоохранения».
Таргетная терапия: необходимо определение наличия мутации BRAFV600, при ее наличии назначение ингибиторов BRAF – вемурафениб, дабрафениб [9; С] в монорежиме, и/или комбинации с МЕК-ингибиторами – кобиметиниб и траметиниб [21; С]. Назначение ингибиторов BRAF показано при метастатической меланоме, а также в адъювантном режиме больным с III стадией и наличием мутации гена BRAF (V600E и V600K) [22; С].
Таргетная терапия в адъювантном режиме: рекомендуемая доза дабрафениба составляет 150 мг (2 капсулы по 75 мг) 2 раза в сутки, что соответствует суммарной суточной дозе 300 мг при назначении препарата в качестве монотерапии, так и в комбинации с траметинибом. Рекомендованная доза траметиниба при применении в комбинации с дабрафенибом составляет 2 мг один раз в сутки.
Перечень основных лекарственных средств (имеющих 100% вероятность применения);
| Фармакотерапевтическая группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Ингибитор BRAF | Вемурафениб | 960 мг 2 раза в сут., перорально, ежеденевно, длительно до прогрессирования | С |
| Ингибитор BRAF | Дабрафениб | 150 мг 2 раза в сут., перорально, ежеденевно, длительно до прогрессирования | С |
| Ингибитор MEK | Траметиниб | 2 мг перорально, ежедневно, длительно до прогрессирования | С |
| Ингибитор MEK | Кобиметиниб | 60 мг перорально, с 1 по 21 день, далее 7 дней перерыв, длительно до прогрессирования | С |
|
Моноклональные антитела |
Пембролизумаб | 200 мг в виде в/в инфузии, один раз каждые 3 недели | С |
|
Моноклональные антитела |
Ниволумаб* |
Монотерапия: 240мг в/в кап, каждые 2 недели или 480мг в/в кап каждые 4 недели Комбинированная: 1мг/кг в/в кап в сочетании с ипилимумабом, каждые 3 недели, максимум 4 введения |
С |
|
Моноклональные антитела |
Ипилимумаб* |
Метастатическая меланома: 3мг/кг, в/в кап, каждые 3 недели, максимум 4 введения. Адъювантная терапия: 10мг/кг, в/в кап каждые 3 недели – 4 введения, далее 10м/кг в/в кап каждые 12 недель – 3 года. |
B |
(*Незарегистрированные лекарственные средства используются в соответствии со статьей 251 Кодекса Республики Казахстан «О здоровье народа и системе здравоохранения»)
Рекомендуемые режимы применения ингибиторов BRAF и МЕК при метастатической меланоме кожи (только при положительной мутации BRAF):
1. Монотерапия:
- Вемурафениб 960 мг внутрь × 2 раза в сут. ежедневно, длительно, до прогрессирования или развития неприемлемой токсичности. Оценка эффекта от проводимого лечения делается через 12 недель, далее каждые 8-12 недель.
- Дабрафениб 150 мг внутрь × 2 раза в сут. ежедневно, длительно, до прогрессирования или развития неприемлемой токсичности. Оценка эффекта от проводимого лечения делается через 12 недель, далее каждые 8-12 недель.
2. Комбинированная терапия:
- Вемурафениб 960 мг внутрь × 2 раза в сут. ежедневно + кобиметиниб 60 мг в сутки внутрь в 1–21й дни, перерыв 7 дней, длительно, до прогрессирования или развития неприемлемой токсичности. Оценка эффекта от проводимого лечения делается через 12 недель, далее каждые 8-12 недель.
- Дабрафениб 150 мг внутрь × 2 раза в сут. ежедневно + траметиниб 2 мг внутрь × 1 раз в сут. ежедневно, длительно, до прогрессирования или развития неприемлемой токсичности. Оценка эффекта от проводимого лечения делается через 12 недель, далее каждые 8-12 недель.
Хирургическое вмешательство:
- широкое иссечение опухоли кожи при возможности выполнения радикальной операции.
Дальнейшее ведение:
Диспансерное наблюдение за излеченными больными:
в течение первого года после завершения лечения – 1 раз каждые 3 месяца;
в течение второго года после завершения лечения – 1 раз каждые 6 месяцев;
с третьего года после завершения лечения – 1 раз в год в течение 3 лет.
Методы обследования:
- локальный контроль- при каждом обследовании;
- пальпация регионарных лимфатических узлов — при каждом обследовании;
- рентгенографическое исследование органов грудной клетки — один раз в год;
- ультразвуковое исследование органов брюшной полости – один раз в 6 месяцев (при первично-распространенных и метастатических опухолях).
- Наблюдение онколога по месту жительства (осмотр зоны удаленной опухоли, пальпация периферических лимфоузлов).
- КТ органов грудной клетки (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев со второго по пятый годы наблюдения).
- УЗИ зон регинарного лимфооттока (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев во 2-й год наблюдения и однократно в 3-й год).
- МРТ головного мозга с контрастированием (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев во 2-й год наблюдения и однократно в 3-й год).
- УЗИ ОБП и ЗП (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев во 2-й год наблюдения и однократно в 3-й год).
- Определение уровня ЛДГ крови (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев во 2-й год наблюдения и однократно в 3-й год).
- ПЭТ-КТ (1 раз в 6 месяцев или в иные сроки при наличии строгих показаний)
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
- УЗИ данные об отстутствии МТС и рецидива;
- КТ данные об отсутствии отдаленных МТС;
- МРТ данные об отсутствии отдаленных МТС;
- Удовлетворительные показатели крови, мочи, биохимических показателей крови.
- Заживление послеоперационной раны
- Относительно удовлетворительное состояние больного (-ой).
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Карта наблюдения пациента и маршрутизация пациента – данная категория пациентов находится на динамическом наблюдении у районного онколога.
Общие принципы лечения
Основные методы лечения меланомы кожи – хирургический и лекарственный. При метастатических формах заболевания используются хирургические, лекарственные методы в самостоятельном виде или в форме комбинированного и комплексного лечения. Лучевая терапия применяется при метастатических поражениях головного мозга.
Лечение по стадиям
0 стадия меланомы:
Иссечение опухоли с захватом 0,5-1,0 см здоровой ткани в амбулаторных условиях.
I стадия:
Органосохраняющее повторное иссечение опухоли после биопсии в амбулаторных условиях.
Широкое удаление опухоли в условиях стационара (отступя от края на 1-2 см: рТ1 – 1см, рТ2 – 2см). При формировании обширного дефекта кожи применяют лоскуты и трансплантаты. Иногда иссекают прилежащие к опухоли лимфатические узлы.
II стадия:
- Широкое иссечение первичного опухолевого очага, в сочетании с исследованием регионарных лимфатических узлов на наличие метастазов.
- Широкое удаление меланомы и регионарных лимфатических узлов, как в один, так и в два этапа.
- Сочетание широкого удаления опухоли с поддерживающей терапией (химио- или иммунотерапия).
III стадия:
- Широкое хирургическое удаление опухоли (отступя от края на 2.0 см). Пластическое закрытие дефекта. Регионарная лимфодиссекция. Химио- иммунотерапия.
IV стадия (любая рT любая N M1):
- при компенсированном общем состоянии пациентов и отсутствии выраженного синдрома опухолевой интоксикации проводится комплексное лечение по индивидуальным схемам с применением таргетной терапии, химиотерапии, паллиативная лучевая терапия;
- паллиативные хирургические вмешательства выполняются по санитарным показаниям или в связи с осложненным течением болезни.
- Паллиативная лучевая терапия по индивидуальным показаниям в зависимости от тяжести состояния пациента и симптомов заболевания.
Немедикаментозное лечение
Режим больного при проведении консервативного лечения – общий. В ранний послеоперационный период – постельный или полупостельный (в зависимости от объема операции и сопутствующей патологии). В послеоперационном периоде – палатный.
Диета стол — №15, после хирургического лечения – №1.
Лучевая терапия.
Показания к лучевой терапии:
Проведение лучевой терапии при метастатических поражениях головного мозга с паллиативной целью. Паллиативная ЛТ может быть назначена также при множественном поражении головного мозга или при «симптомном» поражении костей, мягких тканей и лимфоузлов.
Виды лучевой терапии:
- дистанционная лучевая терапия;
- 3D-конформное облучение;
- модулированная по интенсивности лучевая терапия (IMRT).
- томотерапия на томоаппаратах; упор при томотерапии делается на гипофракционирование при РОД<2,5 Гр.
- проведение СРТ при единичном метастазе в головной мозг размером до 3 cм. Открытая хирургическая операция имеет преимущества перед СРТ у пациентов с очагами >3 см, расположенными в функционально не значимых отделах мозга, при ожидаемой продолжительности жизни (без учета влияния метастатического поражения головного мозга) >3 мес. После хирургического лечения дополнительно возможно проведение сеанса стереотаксической ЛТ на операционную полость для улучшения локального контроля. При поражении функционально значимых отделов головного мозга предпочтение может быть отдано СРТ. При олигометастатическом поражении головного мозга (3–10 очагов размерами до 3 см каждый) стереотаксическая ЛТ может иметь преимущества в сравнении с лекарственным лечением или с облучением всего головного мозга. Сообщения о роли ЛТ при множественном поражении головного мозга или его оболочек противоречивы. Эта процедура может быть предложена пациенту для облегчения неврологических симптомов при множественных метастазах в головном мозге.
Паллиативная ЛТ для региональных метастазов. Показанием может быть: нерезектабельные узлы, сателлиты, остаточная опухоль.
Дозовые режимы. Оптимальная доза не установлена, но имеются потенциально правильные дозы:
— 24-27 Гр в 3 фракции в течение 1-1,5недель
— 32 Гр в 4 фракции в течение 4 недель
— 40 Гр в 8 фракции в течение 4 недель
— 50 Гр в 20 фракции в течение 4 недель
— 30 Гр в 10 фракции в течение 2 недель
— 30 Гр в 5 фракции в течение 2 недель
— 20 Гр в 5 фракции в течение 1 недели
— 8 Гр в 1 фракции в течение 1 дня.
Паллиативная ЛТ для «симптомных» экстракраниальных метастазов. Выбор режима зависит от локализации или клинических симптомов. Высокие дозы и/или гипофракционированные режимы могут быть использованы для облегчения симптоматики. Дозовые режимы:
— 24-27 Гр фракции в течение 1-1,5 недель
— 32 Гр 4 фракции в течение 4 недель
— 40 Гр в 8 фракции в течение 4 недель
— 50 Гр в 20 фракции в течение 4 недель
— 30 Гр в 10 фракции в течение 2 недель
— 30 Гр в 5 фракции в течение 2 недель
— 8 Гр в 1 фракции в течение 1 дня.
ЛТ метастазов головного мозга
СРХ и СРТ используется для подведения высоких доз радиации к мишени с минимальной нагрузкой на окружающие ткани для метастазов в головном и спинном мозге:
— очаг с максимальным диаметром до 20мм до 24 Гр
— очаг с максимальным диаметром 21-30мм до 18 Гр
— очаг с максимальным диаметром 31-40мм до 15 Гр.
Крупные очаги могут быть лечены фракционированной СРТ:
24-27 Гр в 3 фракции
— 25-26 Гр в 5 фракции.
Медикаментозное лечение
Полихимиотерапия
Схемы лекарственной терапии генерализованных форм меланом:
1. CVD:
цисплатин 20 мг/м2 в/в 2-5 дни
винбластин 1,6 мг/м2 инфузия 1-5 день
дакарабазин 800 мг/м2 в/в 2-х часовая инфузия 1 день (при диссеминированном процессе паллиативная химиотерапия может быть рекомендована). Интервалом 3-4 недели.
2. Дакарбазин 1000 мг/м², интервал 3-4 нед
3. Темозоломид 150-200мг/м² 1-5 дни каждые 28 дней
4. Паклитаксел 175-225мг/м2 в/в 1й день каждые 3 недели после 4 курсов дозу уменьшить до 175мг/м2. КарбоплатинAUC 6 в/в 1й день каждые 3 недели, после 4х курсов дозу уменьшить до AUC 4.
Перечень основных лекарственных средств (имеющих 100% вероятность применения);
| Фармакотерапевтическая группа | Международное непатентованное наименование ЛС | Способ применения |
Уровень доказательности |
|
Моноклональные антитела |
Пембролизумаб | 200 мг в виде в/в инфузии, один раз каждые 3 недели | С |
|
Моноклональные антитела |
Ниволумаб* |
Монотерапия: 240мг в/в кап, каждые 2 недели или 480мг в/в кап каждые 4 недели Комбинированная: 1мг/кг в/в кап в сочетании с ипилимумабом, каждые 3 недели, максимум 4 введения |
С |
|
Моноклональные антитела |
Ипилимумаб* |
Метастатическая меланома: 3мг/кг, в/в кап, каждые 3 недели, максимум 4 введения. Адъювантная терапия: 10мг/кг, в/в кап каждые 3 недели – 4 введения, далее 10м/кг в/в кап каждые 12 недель – 3 года. |
В |
Перечень дополнительных лекарственных средств (менее 100% вероятности применения);
| Фармакотерапевтическая группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Препараты платины | Цисплатин | 20 мг/м2 в/в 2-5 дни, каждые 3 нед | С |
|
Алкилирующие препараты |
Дакарбазин | 1000мг/м2, в/в каждые 3-4 нед | В |
|
Алкилирующие препараты |
Темозоломид | 150-200мг/м² 1-5 дни, перорально, каждые 28 дней | С |
|
Противоопухо Левые средства растительного происхождения |
Паклитаксел | 175-225м/м2, в/в кап, каждые 3 нед | С |
|
Препараты платины |
Карбоплатин | AUC4-6 в/в кап, каждые 3 недели | С |
|
Алкалоид растительного происхождения |
Винкристин |
2мг в/в кап, каждые 3 нед |
С |
Иммунотерапия метастатической или неоперабельной меланомы
Для лечения метастатической неоперабельной меланомы назначаются препараты пембролизумаб, ниволумаб*, ипилимумаб* (*Незарегистрированные лекарственные средства используются в соответствии со статьей 251 Кодекса Республики Казахстан «О здоровье народа и системе здравоохранения») [1-7; С]
Для назначения пембролизумаба нет необходимости определения экспрессии PD-L1 опухолевыми клетками. [8; С]
Рекомендуемые режимы иммунотерапии метастатической меланомы кожи:
1.Комбинированная иммунотерапия (анти-PD1 + анти-CTLА-4):
- Ниволумаб* 1 мг / кг в / в капельно + ипилимумаб* 3 мг / кг в / в капельно 1 раз в 3 нед. (максимум 4 введения, или менее при развитии неприемлемой токсичности), затем ниволумаб* 3 мг / кг (или 240 мг, но не более) в / в капельно 1 раз в 2 нед. (или в дозе 480мг каждые 4 недели), длительно, до прогрессирования или развития неприемлемой токсичности. Оценка эффекта от проводимого лечения делается через 12 недель, далее каждые 8-12 недель.
Примечание:* Незарегистрированные лекарственные средства используются в соответствии со статьей 251 Кодекса Республики Казахстан «О здоровье народа и системе здравоохранения».
2. Анти-PD1 терапия:
- Ниволумаб* 3 мг / кг (или 240 мг, но не более) в / в капельно 1 раз в 2 нед., длительно (или ниволумаб 480 мг в / в каждые 4 нед.) до прогрессирования или развития неприемлемой токсичности. Оценка эффекта от проводимого лечения делается через 12 недель, далее каждые 8-12 недель.
- Пембролизумаб 200 мг в / в капельно 1 раз в 3 нед., длительно, до прогрессирования или развития неприемлемой токсичности. Оценка эффекта от проводимого лечения делается через 12 недель, далее каждые 8-12 недель.
3. Анти-CTLА-4:
- Ипилимумаб* 3 мг / кг в / в капельно 1 раз в 3 нед., 4 введения в составе комбинированной терапии метастатической меланомы, или 10мг/кг, в/в кап каждые 3 недели – 4 введения, далее 10м/кг в/в кап каждые 12 недель – 3 года, в качестве адъювантной терапии
Примечание: *Незарегистрированные лекарственные средства используются в соответствии со статьей 251 Кодекса Республики Казахстан «О здоровье народа и системе здравоохранения».
Другие виды лечения:
Электрохимиотерапия.
Показания. Возможно применение данного метода лечения при локальном поражении кожи и мягких тканей и поверхностном залегании метастатических узлов (внутрикожных и подкожных) [20; B]
Хирургическое вмешательство:
Стандартные хирургические вмешательства при лечении меланомы кожи
- При экономном иссечении опухоль иссекают эллипсовидным разрезом, отстоящим на 0,5-1,0см от краев образования под наркозом.
- При меланоме insitu, лентиго-меланоме с толщиной до 1,5 мм и I–II уровне инвазии, при поверхностно распространяющейся меланоме толщиной до 0,76 мм и I уровне инвазии кожу рассекают на расстоянии 1–2 см от края опухоли. Опухоль удаляют единым блоком с окружающей кожей и подкожной клетчаткой.
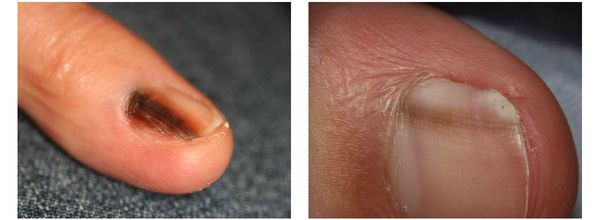
- При локализации меланомы на пальцах кисти и стопы выполняется ампутация, экзартикуляция пальцев.
- При расположении опухоли на коже ушной раковины в верхней или центральной части удаляется вся ушная раковина.
Лимфодиссекция выполняется при наличии метастазов в лимфатических узлах и производится одновременно с удалением первичного опухолевого очага.
Профилактическая лимфодиссекция не выполняется.
Стандартные хирургические вмешательства на регионарном лимфатическом аппарате при меланоме кожи:
Стандартными хирургическими вмешательствами на лимфатическом аппарате являются: подключично-подмышечно-подлопаточная, подвздошно-пахово-бедренная, классическая радикальная шейная (операция Крайла), модифицированная радикальная шейная лимфодиссекция III типа (футлярно-фасциальная шейная). Пахово-бедренная лимфодиссекция, при подвздошно-пахово-бедренной лимфодиссекции лимфатические узлы удаляются до уровня бифуркации аорты.
Дальнейшее ведение:
Динамическое наблюдение за излеченными больными:
в течение первого года после завершения лечения – 1 раз каждые 3 месяца;
в течение второго года после завершения лечения – 1 раз каждые 6 месяцев;
с третьего года после завершения лечения – 1 раз в год в течение 3 лет.
Методы обследования:
- локальный контроль- при каждом обследовании;
- пальпация регионарных лимфатических узлов — при каждом обследовании;
- рентгенографическое исследование органов грудной клетки — один раз в год;
- ультразвуковое исследование органов брюшной полости – один раз в 6 месяцев (при первично-распространенных и метастатических опухолях).
- Наблюдение онколога по месту жительства (осмотр зоны удаленной опухоли, пальпация периферических лимфоузлов).
- КТ органов грудной клетки (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев со второго по пятый годы наблюдения).
- УЗИ зон регинарного лимфооттока (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев во 2-й год наблюдения и однократно в 3-й год).
- МРТ головного мозга с контрастированием (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев во 2-й год наблюдения и однократно в 3-й год).
- УЗИ ОБП и ЗП (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев во 2-й год наблюдения и однократно в 3-й год).
- Определение уровня ЛДГ крови (1 раз в 3 месяца в течение первых 2-х лет наблюдения; 1 раз в 6 месяцев во 2-й год наблюдения и однократно в 3-й год).
- ПЭТ-КТ (1 раз в 6 месяцев или в иные сроки при наличии строгих показаний)
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
- Объективные признаки регрессии опухоли, МТС;
- УЗИ данные об отсутствии МТС и рецидива;
- КТ данные об отсутствии отдаленных МТС;
- МРТ данные об отсутствии отдаленных МТС;
- Удовлетворительные показатели крови, мочи, биохимических показателей крови.
- Заживление послеоперационной раны
- Относительно удовлетворительное состояние больного (-ой).
Критерии эффективности лечения по шкале ВОЗ при солидных опухолях
Традиционно в течение долгого времени для оценки объективного эффекта химиотерапии использовались критерии комитета экспертов ВОЗ. При этом применялась оценка размеров опухоли и метастазов как производное двух наибольших перпендикулярных диаметров.
| Эффект | Признаки |
| Полный эффект | Исчезновение всех очагов поражений на срок не менее 4 недель |
| Частичный эффект | Уменьшение всех или отдельных опухолей на ≥50% при отсутствии прогрессирования других очагов |
| Стабилизация (без изменений) | Уменьшение <50% или увеличение <25% при отсутствии новых очагов поражения |
| Прогрессирование | Увеличение >25% одной или более опухолей либо появление новых очагов поражения |
Критерии эффективности лечения по шкале RECIST
С 2000 года в международных клинических исследованиях используется новая методика оценки эффективности терапии солидных опухолей по шкале RECIST (ResponseEvaluationCriteriaInSolidTumors) 2000, которая была пересмотрена в 2009 году (RECIST 1.1).
По этой шкале опухоли оцениваются как измеряемые (20 мм в диаметре или более при стандартном исследовании, 10 мм — при использовании спиральной компьютерной томографии) или неизмеряемые (меньше размеров, указанных выше). Определяют наибольший диаметр 5 очагов поражения (до 2-х в одном органе или до 5-ти в различных органах). Сумма диаметров до лечения рассматривается как базовый показатель и сравнивается с таковой после лечения.
| Эффект | Признаки |
| Полный эффект | Исчезновение всех очагов поражений на срок не менее 4 недель |
| Частичный эффект | Уменьшение измеряемых очагов на 30% или более |
| Стабилизация | Нет уменьшения, достаточного для оценки как частичный эффект, или увеличения, которое можно оценить как прогрессирование |
| Прогрессирование | Увеличение на 20% наименьшей суммы очагов поражения, зарегистрированной за время наблюдения, или появление новых очагов |
Критерии эффективности лечения метастазов в костях по шкале RECIST
Для оценки эффективности при лечении метастазов в костях существуют отдельные критерии эффективности.
| Эффект | Признаки |
| Полный эффект | Полное исчезновение всех поражений на рентгенограммах или сканограммах |
| Частичный эффект | Частичное уменьшение остеолитических метастазов, их рекальцификация или уменьшение плотности остеобластных поражений |
| Стабилизация | Отсутствие изменений в течение 8 недель от начала лечения |
| Прогрессирование | Увеличение существующих или появление новых очагов поражения |
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для экстренной госпитализации: нет
Показания для плановой госпитализации:
- пациенты с выявленной меланомой или с подозрительными на меланому образованиями для гистологической верификации диагноза, определения стадии заболевания и выработки дальнейшей тактики лечения; если нет противопоказаний к проведению операции со стороны соматического статуса, для проведения самостоятельной и/или послеоперационной (адъювантной) химиотерапии, иммунотерапии с морфологически верифицированным диагнозом (после операции).
Цель лечения:
удаление опухоли кожи, удаление метастазов при их резектабельности, проведение адьювантной иммунотерапии и самостоятельной химиотерапии.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2020
- 1. Злокачественные опухоли мягких тканей и меланома кожи: И. А. Гилязутдинов, Р. Ш. Хасанов, И. Р. Сафин, В. Н. Моисеев — Москва, Практическая Медицина, 2010 г.- 204 с.
2. Меланома: — Санкт-Петербург, Гранат, 2015 г.- 252 с.
3. Фрадкин С.З. Залуцкий И.В. Меланома кожи: Практическое руководство для врачей. – Минск, Беларусь, 2000. – 221с.
4. Переводчикова Н.И. Справочник химиотерапевта
5. Клинические рекомендации ESMO 2010
6. Клинические рекомендации ASKO 2006
7. Онкология. Клинические рекомендации. 2-е исправленное издание. Под редакцией В.И. Чиссова, проф. С.Л. Дарьялова. Москва. 2009.
8. TNM классификация злокачественных опухолей, 8-ой пересмотр.
9. Hauschild A, Grob JJ, Demidov LV, et al. Dabrafenib in BRA
10. F-mutated metastatic melanoma: a multicentre, open-label, phase 3
11. Randomised controlled trial. Lancet 2012;380:358-365.
12. Flaherty KT, Puzanov I, Kim KB, et al. Inhibition of mutated,
13. Аctivated BRAF in metastatic melanoma. N Engl J Med 2010;363:809-819.
14. Payne MJ, Argyropoulou K, Lorigan P, et al. Phase II Pilot Study ofIntravenous High-Dose Interferon With or Without MaintenanceTreatment in Melanoma at High Risk of Recurrence. J ClinOncol2014;32:185-190.
15. «Медицинский справочник» (AlexanderD.Belyaev) 2008г.
16. В.И.Чиссов, С.Л.Дарьялова «Онкология. 2-е издание, исправленное и дополненное»
17. B. O’SullivanMDM. MasonMDH. AsamuraMDA. LeeMDE. VanEyckenMDL. DennyMB, ChBM.B. AminMDS. GuptaMD.8й пересмотр TNM, 2017. Справочник по классификации злокачественных опухолей, официальные рекомендации международной объединенной комиссии по злокачественным новообразованиям.
18. SersaG1, MiklavcicD, CemazarM, RudolfZ, PuciharG, SnojM. Electrochemotherapy in treatment of tumours. Eur J SurgOncol. 2008 Feb;34(2):232-40.
19. Robert, C., Karaszewska, B., Schachter, J., Rutkowski, P., Mackiewicz, A., Stroiakovski, D., … &Chiarion-Sileni, V. (2015). Improved overall survival in melanoma with combined dabrafenib and trametinib. New England Journal of Medicine, 372(1), 30-39.
20. LongGV, HauschildA, Santinami, etal. AdjuvantdabrafenibplustrametinibinstageIIIBRAF-mutatedmelanoma. NEJM, published online September 10, 2017
21. Navari RM, Reinhardt RR, Gralla RJ, et al. Reduction of cisplatin-induced emesis by a selective neurokinin-1-receptor antagonist. New Engl J Med. 1999;340(3):190-195.
22. Griffin AM, Butow PN, Coates AS, et al. On the receiving end V: patient perceptions of the side effects of cancer chemotherapy in 1993. Ann Oncol. 1996;7(2):189-195.
23. Osaba D, Zee B, Warr D, Kaizer L, Latreille J, Pater J. Quality of life studies in chemotherapy-induced emesis. Oncology. 1996;53(suppl 1):92-95.
24. Morrow GR, Roscoe JA, Kirshner JJ, Hynes HE, Rosenbluth RJ. Anticipatory nausea and vomiting in the era of 5-HT3 antiemetics. Support Care Cancer. 1998;6:244-247.
25. Bilgrami S, Fallon BG. Chemotherapy-induced nausea and vomiting. Postgrad Med. 1993;94(5):55-58, 62-64.
26. Адаптированоиз 1 — Berger AM, Clark-Snow RA. In Cancer: Principles and Practice of Oncology. 7th ed. Philadelphia: Lippincott Williams & Wilkins, 2004:2515–2523; Antiemetic Subcommittee Ann Oncol 1998;9:811–819.
27. J.D. Hainsworth “Nausea and vomiting”, Abeloff’s Clinical Oncology (Fifth Edition), 2014, 626-634
https://www.sciencedirect.com/science/article/pii/B9781455728657000424
28. Roila F et al. 2016 MASCC and ESMO guideline update for the prevention of chemotherapy and radiotherapy induced nausea and vomiting and of nausea and vomiting in advanced cancer patients. Clinical practice guidelines. Annals of Oncology 27: v 119-133, 2016.
29. Antiemetic guidelines: MASCC/ESMO 2016 http://www.mascc.org/assets/Guidelines-Tools/mascc_antiemetic_guidelines_english_2016_v.1.2.pdf
30. NCCN Clinical Practice Guidelines in Oncology. Antiemesis. Version 2.2017 – March 2018, 2017
https://www.nccn.org/professionals/physician_gls/pdf/antiemesis.pdf
31. P. Hesketh, M. G. Kris, et al. “Antiemetics: American Society of Clinical Oncology Clinical Practice Guideline Update”. Journal of Clinical Oncology. Volume 35 (28), October 1, 2017 http://ascopubs.org/doi/pdfdirect/10.1200/JCO.2017.74.4789
32. Российское общество клинической онкологии RUSSCO, «Практические рекомендации по лекарственному лечению меланомы кожи», 2019 год
33. Лучевая терапия в онкологии: Эрик К. Хансен, МэкРоачIII — США, 2014г.- 34-44 с.
34. Ang K.K., Byers R.M., Peters L.J. Postoperative radiotherapy for cutaneus melanoma of the head and neck region. 1994. Vol 30. – P.169-172
35. Ang K.K., Peters L.J., Weber R.S. Regional radiotherapy as adjuvant treatment for head and neck malignant melanoma. 1990. Vol116. – P.795-798
36. Atkins M.B., Hsu J., Lee S., et Phase III trial comparing concurrent biochemotherapy with cisplatin, vinblastine, dacarbazine,interleukin-2, and interferon alfa-2b with cisplatin, vinblastine, and dacarbazine alone in patients with metastatic malignant melanoma (E3695): A trial coordinated by the Eastern Cooperative Oncology Group //J. Clin. Oncol. — 2008. — Vol. 26. -P. 5748-5754.
37. Chang D.T., Amdur R.J., Morris C.G. et al. Adjuvant radiotherapy for cutaneous melanoma: comparing hypofractionation to conventional fractionation // Int. J. Radiat. Oncol. Biol. Phys. 2006. — Vol. 66. — Suppl. 4. — P. 1051-1055.
38. Burmeister B.H., Mark Smithers B., Burmeister E. et al. A prospective phase II study of adjuvant postoperative radiation therapy following nodal surgery in malignant melanoma -Trans Tasman Radiation Oncology Group (TROG) Study 96,06 // Radiether Oncol. — 2006. — Vol. 81. — P. 136-42.
- 1. Злокачественные опухоли мягких тканей и меланома кожи: И. А. Гилязутдинов, Р. Ш. Хасанов, И. Р. Сафин, В. Н. Моисеев — Москва, Практическая Медицина, 2010 г.- 204 с.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
- Курманалиев Аль-Фараби Канатович – АО «Казахский научно-исследовательский институт онкологии и радиологии», врач онколог/химиотерапевт Центра опухолей костей, мягких тканей и меланом.
- Тулеуова Дина Абдурасуловна – кандидат медицинских наук, АО «Казахский научно – исследовательский институт онкологии и радиологии», врач Центра опухолей костей, мягких тканей и меланом.
- Савхатова Акмарал Доспуловна – кандидат медицинских наук, АО «Казахский научно – исследовательский институт онкологии и радиологии», заведующая отделением дневного стационара лучевой терапии.
- Абдрахманов Рамиль Зуфарович – кандидат медицинских наук, АО «Казахский научно – исследовательский институт онкологии и радиологии», заведующий отделением химиотерапии опухолей.
- Каримбаева Еркеш Мухтаровна – руководитель отдела клинической фармации ГКП на ПХВ «Многопрофильный медицинский центр акимата города Нур-Султан»
Указание конфликта интересов: нет.
Рецензенты:
Чингисова Жанна Казбековна — доктор медицинских наук, заведующая кафедрой «Онкология с курсом гематологии» Казахский медицинский университет непрерывного образования
Указание условий пересмотра клинического протокола:
Пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
Оценка общего состояния больного с использованием индекса Карновского
| Нормальная физическая активность, больной не нуждается в специальном уходе | 100 баллов | Состояние нормальное, нет жалоб и симптомов заболевания |
| 90 баллов | Нормальная активность сохранена, но имеются незначительные симптомы заболевания. | |
| 80 баллов | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания. | |
|
Ограничение нормальной активности при сохранении полной независимости больного |
70 баллов | Больной обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60 баллов | Больной иногда нуждается в помощи, но в основном обслуживает себя сам. | |
| 50 баллов | Больному часто требуется помощь и медицинское обслуживание. | |
| Больной не может обслуживать себя самостоятельно, необходим уход или госпитализация | 40 баллов | Большую часть времени больной проводит в постели, необходим специальный уход и посторонняя помощь. |
| 30 баллов | Больной прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно. | |
| 20 баллов | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия. | |
| 10 баллов | Умирающий больной, быстрое прогрессирование заболевания. | |
| 0 баллов | Смерть. |
Приложение 2
Шкала Глазго(Glasgow coma scale или GCS).
| Признак | Баллы |
| Открывание глаз: | |
|
4 |
|
3 |
|
2 |
|
1 |
| Речевая реакция: | |
|
5 |
|
4 |
|
3 |
|
2 |
|
1 |
| Двигательная реакция: | |
|
6 |
|
5 |
|
4 |
|
3 |
|
2 |
|
1 |
|
Состояние больного, согласно шкале комы Глазго, оценивается по трем признакам, каждый из которых оценивается в баллах. Баллы суммируются. Интерпретация полученных результатов по шкале комы Глазго:
|
Приложение 3
Цель дерматоскопии — постановка предварительного диагноза, согласно правилу «АВСДЕ».
Показания для дерматоскопии:
Наличие большого количества пигментных образований на коже, т.е меланоме на фоне диспластическогоневусного синдрома(ДНС), для исключения метахромного, одномоментного множественного поражения.( Рекомендации Сиднейского Центра по диагностике Меланомы кожи; MelanomaAvstralianInstitut, Anderson.P, Австралия ,г.Сидней 2013 г. Уровень доказательности «В».)
Трудности в дифференциальной диагностике, при не больших по размеру пигментных образованиях. (Рекомендации Международной конференции ЕАФО по диагностике и лечению меланомы, 22 июня 2011года, г.Москва. УД «А»)
Приложение 4
Рекомендуется проведение генетических исследований удаленной опухоли на наличие мутаций, позволяющих определить прогноз, персонализировать лечение, и показания к иммунотерапии, химио-и таргетной терапии включая V600E, с- КIТ.(J. Longetal. JClinOncol 29:1239-1246, Проценко С.А., Современные возможности персонализированной терапии метастатической меланомы// Материалы международной конференции «Персонализированная онкология» С-Пб, Алматы 14.01.2015, УД «В»)
Терапия при диссеминированной меланоме – перечень основных лекарственных средств
| Название препарата/комбинации | Показания |
| Дабрафениб | 1я линия терапии при нерезактабельной меланоме при наличии мутации BRAFV600 |
| Вемурафениб | 1я линия терапии при нерезактабельной меланоме при наличии мутации BRAFV600 |
| Дабрафениб + траметиниб | 1я линия терапии при нерезактабельной меланоме при наличии мутации BRAFV600 |
| Вемурафениб+кобиметиниб | 1я линия терапии при нерезактабельной меланоме при наличии мутации BRAFV600 |
| Пембролизумаб | 1я линия терапии при нерезектабельной меланоме или при мутации BRAFV600 WT, и при прогрессировании после лечения BRAF/BRAF+МЕК ингибиторами |
| Дакарбазин 800мг/м2 в/в в 1й день | 2я линия терапии при прогрессировании на фоне лечения BRAF/BRAF+МЕК / PD-1/ PD – L1 ингибиторами |
| Цисплатин 25 мг/м2 в/в в 1-5 дни, интервал 3-4 недели | 2я линия терапии при прогрессировании на фоне лечения BRAF/BRAF+МЕК / PD-1/ PD – L1 ингибиторами |
| Паклитаксел 225мг/м2 в/в в 1й день каждые 3 недели, после 4х курсов дозу уменьшить до 175 мг/м2 + КарбоплатинAUC 6 в/в 1й день каждые 3 недели, после 4х курсов дозу уменьшить до AUC | 2я линия терапии при прогрессировании на фоне лечения BRAF/BRAF+МЕК / PD-1/ PD – L1 ингибиторами |
| Темозоламид 200-250мг/м2 – 1-5й дни. | 2я линия терапии при прогрессировании на фоне лечения BRAF/BRAF+МЕК / PD-1/ PD – L1 ингибиторами. Предпочтительнее при мтс в головном мозге. |
| Ниволумаб* | 1я линия терапии при нерезектабельной меланоме или при мутации BRAFV600 WT, и при прогрессировании после лечения BRAF/BRAF+МЕК ингибиторами (*Незарегистрированные лекарственные средства используются в соответствии со статьей 251 Кодекса Республики Казахстан «О здоровье народа и системе здравоохранения».) |
| Ипилимумаб* | 1я линия терапии при нерезектабельной меланоме или при мутации BRAFV600 WT, и при прогрессировании после лечения BRAF/BRAF+МЕК ингибиторами (*Незарегистрированные лекарственные средства используются в соответствии со статьей 251 Кодекса Республики Казахстан «О здоровье народа и системе здравоохранения») |
Тактика и лечение меланомы у беременных.
Рекомендовано широкое иссечение первичной опухоли для гистологической верификации заболевания. При подтверждении диагноза меланомы, рекомендовано прерывание беременности вне зависимости от стадии заболевания. Возможно сохранение беременности при меланоме 0, I, Ia стадиях при отказе пациентки от прерывания беременности, однако в данных ситуациях также необходимо предупредить пациентку и ближайших родственников о высоком риске прогрессирования и возможном летальном исходе как для матери, так и для ребенка.
При II-IV стадиях меланомы рекомендовано прерывание беременности при сроках беременности до 28 недель. При сроке более 28 недель рекомендовано решение вопроса о досрочном родоразрешении пациентки.
Причинами для прерывания являются:
— невозможность полного тщательного дообследования пациентки ввиду тератогенного воздействия на плод методов инструментальных исследований, необходимых для установки правильной стадии (ПЭТ-КТ, КТ, рентгенография, сцинтиграфия).
— невозможность проведения лекарственной терапии ввиду тератогенного воздействия на плод и риск развития осложнений от лечения на фоне беременности (кровотечения из половых путей, самопроизвольный выкидыш, антенальная гибель плода, ДВС-синдром у беременной).
— невозможность проведения или высокий риск проведения объемных операции под наркозом у беременных: лимфодиссекции, удаление множественных метастазов кожи и мягких тканей, резекции костей, удаление метастазов головного мозга.
— невозможность проведения лучевой терапии ввиду тератогенного воздействия на плод.
— высокий риск прогрессирования заболевания на фоне продолжающейся беременности в связи с резким изменением гормонального статуса пациентки.
При отказе от прерывания беременности необходимо проведение разъяснительной беседы пациентке и ближайшим родственникам о причинах прерывания беременности и высоком риске прогрессирования, и возможном летальном исходе как для матери, так и для ребенка.
Каждый случай меланомы у беременных необходимо обсуждать на расширенном консилиуме с участием специалистов профильного центра по лечению меланомы, акушер-гинекологов, специалистов лучевой диагностики, для решения вопроса о дальнейшей тактике ведения, диагностики и лечения пациентки.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Дата публикации 24 декабря 2018Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
Меланома (от греч. melanos – «чёрный», «тёмный») — это злокачественная опухоль, развивающаяся из меланоцитов (клеток, синтезирующих меланин). Чаще всего она образуется из кожных меланоцитов, то есть располагается на коже. В 7% случаев меланома локализуется на сетчатке глаза и в 1-3% случаев — на слизистых оболочках прямой кишки, полости рта, оболочках головного и спинного мозга.[1][2]
Эта болезнь — одна из наиболее злокачественных опухолей, которая часто метастазирует в разные органы.
Заболеваемость меланомой продолжает увеличиваться. По росту смертности эта патология занимает второе место после рака лёгкого.[3]
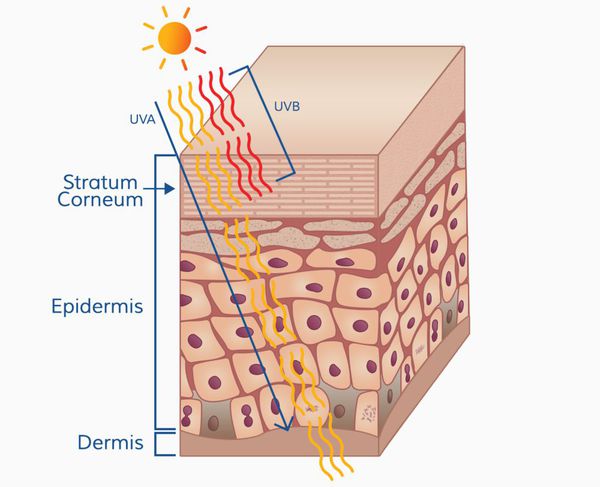
В настоящее время известно значительное количество факторов, которые повышают вероятность заболевания меланомой. Ни один из них не может быть признан главным или обязательным для возникновения заболевания. Однако современные исследования чётко установили, что основная причина меланомы — воздействие ультрафиолетовых лучей естественного солнечного света (а также излучения солярия) на кожу человека.[1][4]
Другие факторы риска развития меланомы:
- светлая кожа (склонность к солнечным ожогам, светлые или рыжие волосы, голубой цвет глаз);
- большое количество невусов (родинок), в том числе наличие атипичных;
- меланома в личном анамензе, а также наличие меланомы у кровных родственников;
- солнечные ожоги с образованием пузырей, наличие солнечных ожогов в детстве;
- существование врождённого невуса (риск возрастает пропорционально увеличению его размера).
Особенности меланомы у детей
У детей меланома бывает редко. Однако беспигментная меланома у детей может выглядеть как обычная бородавка. Также часто встречается разновидность невусов — невус Шпитц (резко очерченная куполообразная розовато-красная папулу или бляшку), который также не всегда можно отличить от меланомы. Для уточнения необходимо наблюдение и цифровая дерматоскопия.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы меланомы
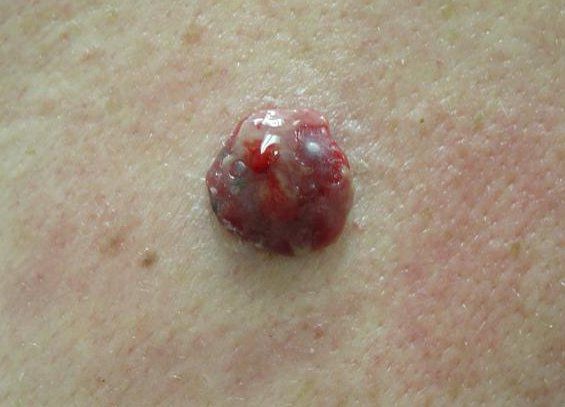
Первые признаки меланомы — появление на коже образования, непохожего на остальные по размеру, цвету и форме.
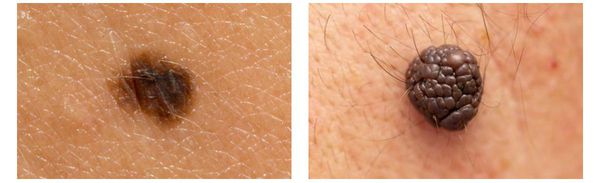
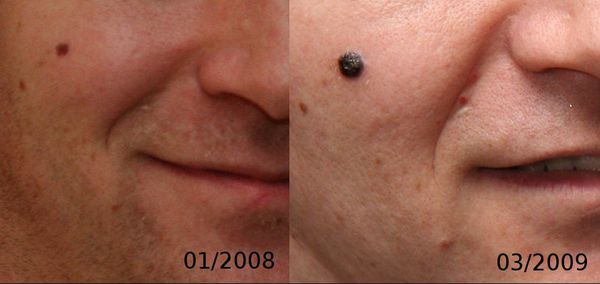
Меланома отличается от родинки следующими признаками: образование асимметричное по цвету и структуре, его края неправильные и зубчатые, оттенки в пределах одного образования отличаются, размер образования более 4 мм. С течением времени меланома изменяется по одному или нескольким ранее перечисленным критериям.
При обследовании важно учитывать, насколько пигментное образование отличается от остальных. Выявление «гадкого утёнка» среди родинок является причиной его более детального осмотра.
Клиническая картина меланомы достаточна разнообразна. Внешне она может представлять собой как незначительное пигментное пятно, так и узловое образование с изъязвлением. Цвет варьируется от светло-коричневого до чёрного.
Зачастую меланома возникает у взрослых, но иногда встречаются случаи врождённой формы заболевания. В детском возрасте меланома развивается редко.
Меланома локализуется на любых участках кожи, в том числе и на ногтевой ложе.
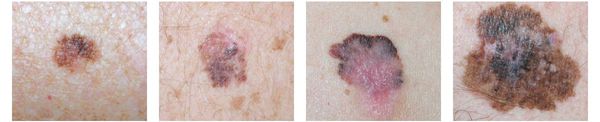
Различают четыре основных типа меланомы в зависимости от клинической картины, течения заболевания, анатомического расположения и гистологических параметров.
1. Поверхностно-распространяющаяся меланома встречается в 65-75% случаев. Для неё характерно длительное течение. Сначала это пятно коричневого цвета, которое постепенно растёт и становится асимметричным по структуре и цвету (появляются вкрапления тёмно-коричневого, чёрного и розового цвета). При переходе в вертикальную фазу роста на пятне появляется утолщение — бляшка. Наиболее часто встречаемая локализация у мужчин — на спине, а у женщин — преимущественно на нижних конечностях.
2. Лентиго-меланома представлена в виде пятна неправильной формы и окраски. Она развивается у лиц пожилого возраста. Чаще всего локализуется на лице, шее и тыле конечностей. Лентиго-меланома растёт на фоне длительно существующего злокачественного лентиго (предракового меланоза Дюбрейля). При инвазии клеток меланомы за пределы эпидермиса на пятне появляются возвышающиеся участки.
3. Узловая меланома представлена выступающим над поверхностью кожи образованием тёмно-коричневого или чёрного цвета. Часто эти образования симметричны и не вызывают подозрений. Однако, как правило, такая меланома характеризуется быстрым ростом и плотные на ощупь. С ростом опухоли она может изъязвляться. Чаще всего располагается на спине, голове и шее.
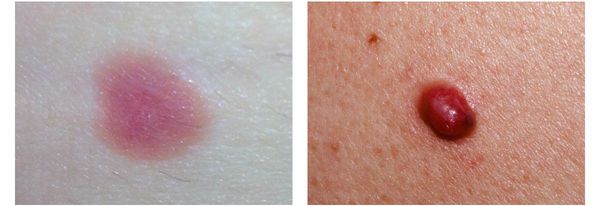
4. Во всех формах возможны беспигментные варианты (около 2%). Беспигментная (амеланотическая) меланома достаточно сложна для диагностики, так как сначала выглядит как безвредная розово-красная папула.
Поздние симптомы меланомы. Появление метастазов
Признаки метастазов зависят от того, в каком органе они появились:
- головной мозг — головные боли, неврологические симптомы (нарушение чувствительности к теплу, боли, расстройства памяти, координации и подвижности и т. п.);
- кости — боли в спине;
- лимфатические узлы — их увеличение и болезненность;
- на коже вблизи первичного очага — одновременное появление множества чёрных образований.
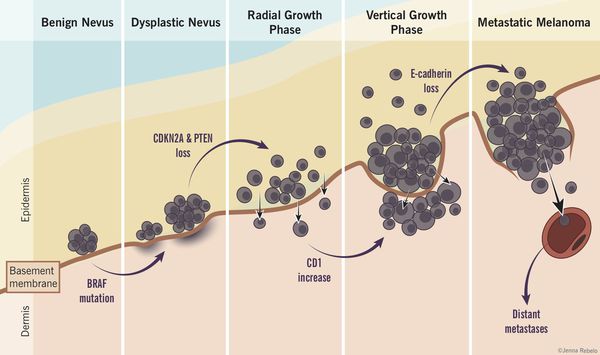
Патогенез меланомы
Патогенез меланомы, как и всех злокачественных опухолей, весьма сложный. Результат воздействия ультрафиолета на кожу человека (лучей А и В, длиной 280-340 нм) зависит от многих факторов, включающих дозу облучения и индивидуальный ответ организма (особенности иммунного ответа и генетическую предрасположенность).
Ультрафиолетовое облучение вызывает:
- фотохимические реакции;
- повреждение молекулы ДНК (иногда повреждение восстанавливается);
- мутации (когда повреждение ДНК «не лечится» организмом);
- иммунные нарушения.
Образование пиримидиновых димеров (т. е. дефектов ДНК) под действием УФО — основная причина мутаций.[5]
Роль диспластических невусов в развитии меланомы недостаточно ясна. Проводимые исследования пока не ответили на вопрос, являются ли эти образования предраковым состояниям, или развитие меланомы в их зоне является статистически случайным событием.
По данным многочисленных гистологических исследований, около 30% меланом развиваются в области меланоцитарных невусов, остальные 70% развиваются на неизменённой коже.[6][7][8]
Таким образом, по имеющимся данным, на фоне невусов развивается небольшой процент всех случаев злокачественной меланомы.[4]
Атипичные невусы в первую очередь являются важными маркерами повышенного риска меланомы. При этом профилактическое удаление таких невусов нецелесообразно (они не являются 100% предшественником меланомы)
Пациенты с диспластическими невусами представляют собой группу повышенного риска и должны находиться под постоянным врачебным наблюдением.
В 7-15% всех случаев меланома является наследственной патологией. При этом обнаруживаются мутации в генах-супрессорах опухолевого роста.
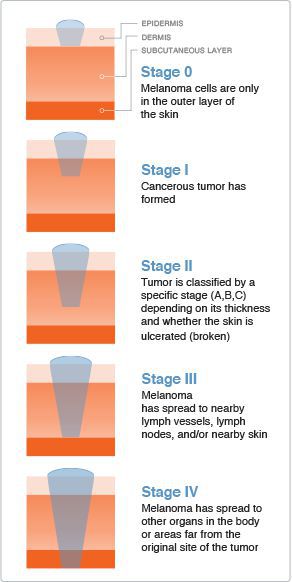
Классификация и стадии развития меланомы
Стадию опухолевого процесса меланомы определяют в соответствии с классификацией TNM. Она зависит от толщины первичной опухоли, а также наличия или отсутствия регионарных и/или отдалённых метастазов.
Для определения стадии меланомы необходимо гистологическое исследование. Оценку состояния лимфоузлов для установления стадии выполняют при помощи клинического осмотра и ультразвукового исследования.
Критерий Т говорит о распространённости первичной опухоли (для классификации по этому критерию необходимо удалить первичную опухоль и провести её гистологическое исследование):
- pТis — первичная (неинвазивная) меланома (I уровень инвазии);
- pТ1 — толщина опухоли ≤ 1 мм:
○ pТ1а — II уровень прорастания опухоли в соседние ткани или III уровень без изъязвления опухоли;
○ pТ1b — IV или V уровень прорастания опухоли в соседние ткани или присутствие её изъязвления;
- pТ2 — опухоль толщиной > 1 мм и ≤ 2 мм:
○ pТ2а — без изъязвления опухоли;
○ pТ2b — с изъязвлением;
- pТ3 — опухоль толщиной > 2 мм и ≤ 4 мм:
○ pТ3а — без изъязвления;
○ pТ3b — с изъязвлением;
- pТ4 — опухоль толщиной > 4 мм:
○ pТ4а — без изъязвления;
○ pТ4b — с изъязвлением.
Критерий N говорит о существовании или отсутствии метастазов в регионарных лимфоузлах:
- N0 — поражения регионарных лимфоузлов нет;
- N1 — метастаз в одном регионарном лимфоузле;
- N2 — метастазы в 2-3 регионарных лимфоузлах или только сателлитные или транзитные метастазы;
- N3 — метастазы более чем в трёх регионарных лимфоузлах, или конгломераты лимфоузлов, или сателлитные/транзитные метастазы при метастазировании в регионарных лимфоузлах.
Критерий М указывает на метастазы:
- М0 — отдалённых метастазов нет.
- М1 — наличие отдалённых метастазов.
| Клинические стадии меланомы |
Первичная опухоль |
Регионарные лимфоузлы |
Отдалённые метастазы |
|---|---|---|---|
| I стадия | pT1 pT2 |
N0 | M0 |
| II стадия | pT3 pT4 |
N0 | M0 |
| III стадия | любая pT | N1 N2 |
M0 |
| IV стадия | любая pT | любая N | M1 |
Осложнения меланомы
Если меланому кожи не лечить, то размеры опухоли будут увеличиваться, а само злокачественное образование станет изъязвляться и кровоточить.
Кроме того, прогрессирование болезни осложняется возникновением метастазов в лимфоузлах, органах (печени, лёгких, головном мозгу, костях, почках и надпочечниках), а также в кожу.
Тенденция распространения меланомы зависит от биологических особенностей опухоли. Такие гистологические признаки меланомы, как толщина, митотическая активность (скорость деления клеток), изъязвление, выраженный регресс опухоли в той или иной степени влияют на потенциальную возможность распространения. Так, при толщине опухоли более 1 мм внутрикожные метастазы выявляются в 12,4% случаев.
Пациенты с меланомой кожи вне зависимости от стадии наблюдаются у онколога. При появлении определённых симптомов показано то или иное обследование:
- при болях в спине у пациента, пролеченного по поводу меланомы кожи, показано рентгенологическое исследование указанного отдела позвоночника (в случае необходимости дополнительно проводят КТ);
- при появлении неврологической симптоматики также показано обследование головного мозга.
К сожалению, при наличии отдалённых метастазов (IV стадия) 5-летняя выживаемость составляет не более 7-10%.
Диагностика меланомы
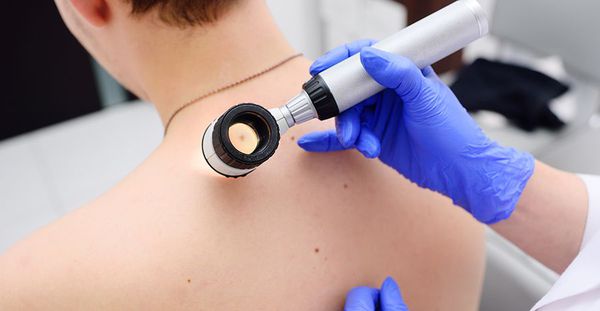
При подозрении на меланому следует обратиться к врачу-онкологу или дерматологу, владеющему методом дерматоскопии. Желательно, чтобы осмотр проводился врачом, который уже имеет опыт ранней диагностики злокачественных новообразований кожи.
Как выявить меланому на ранней стадии
Для выявления меланомы на ранней стадии проводится дерматоскопия. Также осуществляется наблюдение за пациентами в зоне риска с составлением у них карты родинок у них (цифровая дерматоскопия).
Если пациент впервые обратился к доктору по поводу пигментного новообразования кожи, врач осматривает и оценивает состояние всех кожных покровов (в том числе и волосистой части головы, а также стопы). При осмотре также необходимо оценить состояние регионарных лимфоузлов. Для этого проводится пальпация.
Во время осмотра пациента врач пользуется правилом ABCDE, которое также можно применять и при самообследовании:
- A (asymmetry) — асимметричное образование по цвету и структуре;
- B (border) — неправильные, зубчатые края образования;
- С (colour) — различные цвета или оттенки в пределах одного образования;
- D (diameter) — размер образования более 6 мм (в настоящее время проведены исследования, которые показывают наличие ранних меланом с диаметром 3-4 мм);[8]
- E (evolving) — изменение образования с течением времени по одному или нескольким ранее перечисленным критериям.
При обследовании важно учитывать, насколько пигментное образование отличается от остальных. Выявление «гадкого утёнка» среди остальных родинок является причиной его более детального осмотра.
Использование эпилюминисцентной микроскопии (дерматоскопии), оптической когерентной томографии может существенно повышать точность неинвазивной диагностики и уменьшать потребность в выполнении биопсии, но может быть рекомендовано к применению только специалистами, обученными этому методу диагностики.
Применение дерматоскопии позволяет на начальном этапе выявлять пигментные новообразования, требующие хирургического иссечения с дальнейшим гистологическим исследованием. В опытных руках дермоскопия является очень важным методом обследования больных, хотя и требует приобретения соответствующих навыков и квалификации.
Дерматоскопия — лучший способ обнаружения и раннего выявления меланомы:[9]
- первые дерматоскопические признаки меланомы появляются раньше, чем клинические, доступные невооруженному глазу;
- имея в руках дерматоскоп, клиницисты более внимательно относятся к банально выглядящим невусам;
- дерматоскопия позволяет более тщательно планировать и проводить мониторинг пациентов.
По результатам анализа жалоб, анамнеза и данных физикального обследования на приёме рекомендуется принять решение о целесообразности инвазивной диагностики (биопсии) новообразования.
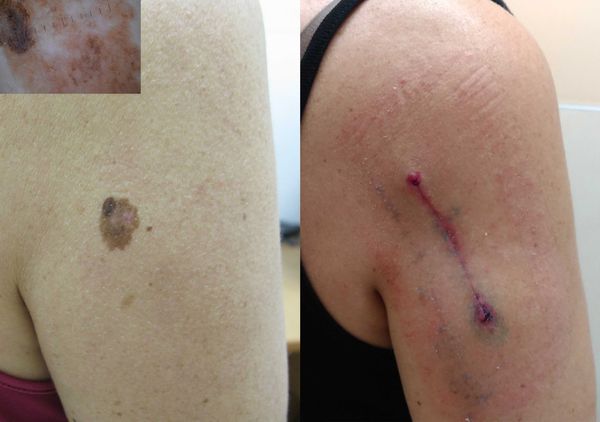
Биопсия — это хирургическая манипуляция с иссечением подозрительного пигментного новообразования на всю толщу кожи (отступ от края опухоли не более 5 мм) и последующим наложением швов. После неё проводится патоморфологическое (гистологическое) исследование, при котором диагноз меланомы подтверждается или не подтверждается.
До морфологического подтверждения диагноза лабораторная и инструментальная диагностика не рекомендуется, если только общее состояние пациента не требует этих исследований для безопасного проведения биопсии.
План обследования пациента формируется в зависимости от результатов биопсии пигментного новообразования кожи и клинического осмотра:
- в случае 0, I и IIA стадий рекомендовано проведение УЗИ регионарных лимфоузлов;
- лучевая диагностика нежелательна при отсутствии симптомов (боли, головокружения и других);
- биопсия сторожевого лимфоузла проводится при толщине опухоли 1мм и более;
- при стадиях IIB, IIC, III проводится УЗИ регионарных лимфоузлов, КТ головного мозга, грудной и брюшнойполостей, ЛДГ, анализ на S100-2, а также общий и биохимический анализы крови; (10)
- при IV стадии показано УЗИ регионарных лимфоузлов, лучевая диагностика в полном объёме, ЛДГ, S100, общий и биохимический анализы крови, а биопсия сторожевого лимфоузла не проводится.
- при меланоме кожи обязательно проводится тест на мутацию BRAF, при отсутствии мутации в гене BRAF — тест на мутацию в гене CKIT (11,12).
Необходимо отметить, что серологическое исследование (определение маркеров S-100 и прочих) не используется для первичной диагностики. Уровень ЛДГ, S-100 используют для оценки прогрессирования заболевания и прогноза (после постановки гистологического диагноза).
Лечение меланомы
Основным методом лечения злокачественной меланомы кожи является хирургическое лечение — её иссечение с захватом здоровых тканей вокруг опухоли. Размер отступа зависит от толщины меланомы.
| Толщина меланомы | Отступ при иссечении новообразования |
|---|---|
| до 1 мм | 1 см |
| 1-2 мм | 1-2 см |
| 2-4 мм | 2 см |
| более 4 мм | 3 см |
В зависимости от клинико-морфологической картины опухоли производят биопсию сторожевого лимфоузла и/или лимфаденэктомию (удаление регионарных лмфоузлов).
Иммунотерапия при меланоме кожи
Адъювантная (дополнительная) терапия после выполнения радикальной хирургической резекции показана для стадий IIВ, IIС, III, IV. В настоящее время доказала свою эффективность иммунотерапия меланомы кожи при помощи препаратов рекомбинантного интерферона альфа 2 a,b (ИФН альфа) для стадий IIB и IIC. Для стадий III и IV рекомендована терапия ингибиторами BRAF (вемурафениб, дабрафениб), блокаторами рецептора CTLA4 (ипилимумаб), анти-PD1 терапия (ниволумаб – «Опдиво»).[13][14]
В каждом отдельном случае распространённой меланомы проводится консилиум в составе нескольких специалистов для формирования оптимального плана лечения, который может корректироваться в зависимости от эффективности терапии.
На выбор терапии первой линии у пациентов с метастатической или неоперабельной меланомой кожи влияет множество факторов:
- биологические особенности болезни;
- общее состояние пациента и его сопутствующие заболевания;
- доступность методов лечения.
Составляя оптимальный план лечения, всегда нужно учитывать каждый из этих факторов.
Также следует проводить молекулярно-генетическое исследование меланомы на наличие мутаций в 15 экзоне гена BRAF. Для данного исследования можно воспользоваться как архивным опухолевым материалом, так и свежим, полученным с помощью биопсии. Если мутация в указанном гене не подтверждена, желательно исследовать биоптат опухоли на мутацию в гене CKIT.[11][15]
При обнаружении мутации в гене BRAF V600 в первую очередь следует прибегнуть либо к монотерапии анти-PD1, либо к комбинации ингибиторов BRAF и МЕК. Если комбинированное лечения этими ингибиторами или анти-PD1 недоступно, возможно осуществление монотерапии ингибиторами BRAF.[16][17] Лечение проводится до прогрессирования меланомы или до развития выраженных токсических явлений, которые не купируются.
Лучевое лечение, химиотерапия и общая гипертермия (ОГТ) для лечения меланомы не применяются.
Диета при онкологических заболеваниях
Правильное питание рекомендовано всем, в том числе пациентам с меланомой. Неправильное питание, например избыток жиров и алкоголя, а также курение и ультрафиолетовое облучение, негативно влияют на организм человека и могут стать причиной онкологии.
Прогноз. Профилактика
Сколько проживет больной после установления диагноза зависит от уровня инвазии слоёв кожи, её толщины (уровень по Бреслоу) в миллиметрах (до 0,75 мм, 0,76-1,5 мм, 1,51-4 мм, 4 мм и более), митотического индекса, наличия/отсутствия признаков регресса и инвазии сосудов, степени лимфоцитарной инфильтрации опухоли. Также нужно учитывать расположение меланомы, а также возраст и пол пациента.
Толщина опухоли и наличие изъязвления является одним из наиболее важных прогностических факторов (15,18,19).
Так, 5-летняя выживаемость при стадии IA (толщина опухоли до 1 мм включительно, без изъязвления и метастазов, T1aN0M0) составляет 95%. А при IV стадии (опухоль с метастазами во внутренние органы) 5-летняя выживаемость — 7-10%.
Необходимо отметить, что по данным многочисленных исследований тип удаления опухоли (тип биопсии) не влияет ни на общую, ни на безрецидивную выживаемость.[18][19]
Основной фактор риска развития меланомы и иных опухолей кожи — ультрафиолетовое облучение, которое происходит по ряду естественных (солнечные ожоги) и искусственных причин (посещение солярия). Поэтому защита от ультрафиолета лежит в основе первичной профилактики. Риск образования меланомы повышают солнечные ожоги, полученные в детском и подростковом возрасте.
Пациенты с множественными и/или диспластическими родинками, а также с I и II фототипом кожи также относятся к группе риска, поэтому им следует регулярно наблюдаться у онкодерматолога. Наличие меланомы в анамнезе, в том числе среди ближайших родственников, также является показанием к регулярным профилактическим осмотрам.
Рекомендации после лечения меланомы
- проводить регулярный осмотр кожи;
- ограничивать пребывание на солнце, не посещать солярии;
- регулярно использовать солнцезащитные средства.
В некоторых исследованиях показано, что при соблюдении рекомендаций по ограничению инсоляции и регулярном применении средств, защищающих от УФ излучений, у лиц с диспластическими невусами появляется меньше новых пигментных новообразований, а дети, которых защищают от инсоляции в семьях высокого риска, также имеют меньше невусов.
Проблема ограничения инсоляции в качестве профилактики меланомы кожи существует во всём мире. Загар считается показателем красоты, молодости и здоровья (особенно у женщин). Но на самом деле УФ излучения вызывают повреждение ДНК, преждевременное старение кожи, а также способствуют иммуносупрессии. В связи с этим Всемирная организация здравоохранения относит УФ установки , используемые в соляриях, к канцерогенам. Но не смотря на это женщины активно пользуются соляриями. Так, по данным Европейского онкологического института, только в 2008 году в европейских странах было зарегистрировано 3438 новых случаев меланомы, которые возникли у женщин после посещения соляриев.[20]
Наибольшее повреждение коже наносят ультрафиолетовые лучи с длиной волны 320-400 нм (УФО-А) и 290-320 нм (УФО-В). Применение солнцезащитных средств с фильтрами широкого спектра при правильном использовании эффективно защищают кожу от солнечных лучей.
Также для профилактики необходимо:
- избегать нахождения под открытым солнцем с 11:00 до 16:00 (периода наиболее интенсивного излучения УФ);
- носить одежду. Защищающую от прямых солнечных лучей (рубашки с длинными рукавами, шляпы с широкими полями, солнцезащитные очки).
Первичная профилактика меланомы кожи — непростая задача, которая требует не только наблюдения у специалиста, но и соблюдения его рекомендаций пациентами.
Основной фактор увеличения продолжительности жизни людей с меланомой кожи — ранняя диагностика опухоли. Этот способ профилактики является вторичным. Поэтому знание факторов риска, симптомов заболевания, а также дерматоскопия и патогистология очень важны в клинической практике дерматолога и онколога. Необходимо активно выявлять людей с повышенным риском развития меланомы и проводить динамическое наблюдение.
Результаты лечения пациентов с меланомой IV стадии неудовлетворительны: медиана выживаемости составляет 6-10 месяцев, 5-летняя выживаемость – менее 10% пациентов.
Факторы, имеющие существенное прогностическое значение у пациентов с меланомой IV стадии – физическая форма и расположение метастатических очагов. Если пациент подходит для хирургического лечения или системного лечения IV стадии, заболевание следует оценивать с помощью визуализации или ПЭТ-КТ (только отдельные метастатические очаги, пригодные для резекции).
В случае вторичных изменений кожи, мягких тканей, лимфатических узлов (лучший прогноз) всегда следует учитывать возможность удаления, то же самое следует делать для изолированных метастазов в паренхиматозные органы.
В случае изменений, которые невозможно удалить, выбор лечения зависит от наличия метастазов в центральной нервной системе, для выявления которых необходимо сначала рассмотреть (решение зависит от места и количества изменений) использование хирургического лечения или облучения центральной нервной системы для отсрочки начала кровотечения или неврологических расстройств.
В паллиативном лечении у пациентов с метастазами в мягких тканях (язва и боль) и костях (боль) также используется лучевая терапия.
Прогресс в развитии генерализованной меланомы с низкой эффективностью классических цитотоксических лекарственных средств связан с неспецифической иммунотерапией с использованием моноклональных антител против CTLA4, которые ингибируют системные механизмы иммуносупрессии, чтобы индуцировать противоопухолевый ответ (активация Т-клеток) и молекулярно направленное лечение ингибиторами серин-трин-киназы.
Дакарбазин
Дакарбазин является единственным цитотоксическим препаратом с ограниченной эффективностью (объективный ответ – 15% пациентов, средняя продолжительность ответа – 4 месяца), зарегистрированным для применения при генерализованной меланоме. Режим применения дакарбазина, основанный на регистрационных показаниях, заключается в приеме препарата в течение 5 дней подряд в суточной дозе 200 мг / м 2.
В исследовании III фазы аналогичные результаты были получены с темозоломидом. Паклитаксел отдельно или в комбинации с карбоплатином существенно не увеличивает продолжительность реакции второй линии, и этот препарат еще не одобрен для лечения прогрессирующей меланомы.
В рандомизированных исследованиях не было подтверждено большей эффективности схем лечения несколькими лекарственными средствами, включающими дакарбазин в сочетании с цисплатином, алкалоидами барвинка (например, винбластином) и производными нитрозомочевины (например, кармустином) и тамоксифеном.
Использование биохимиотерапии (химиотерапия вместе с интерлейкином-2 и интерфероном α-2b) не улучшает выживаемость пациентов по отношению к химиотерапии.
Ипилимумаб
Ипилимумаб был одобрен в Европе для лечения пациентов с метастатической меланомой после неудачной предыдущей терапии и показал – по сравнению с пептидной вакциной gp100 – значительное продление общей выживаемости (разница – около 3,5 месяцев) без значительного влияния на выживаемость без прогрессирования заболевания.
Кинетика и продолжительность реакции на ипилимумаб отличаются от классической химиотерапии – пациенты получают пользу от лечения только через 3-4 месяца, что ограничивает его применение больным с прогрессирующей меланомой.
Из-за позднего появления объективных ответов, через 12 недель после начала лечения должна проводиться обязательная оценка эффективности ипилимумаба, особенно с учетом возможности раннего парадоксального прогрессирования, связанного с инфильтрацией иммунологически активных клеток. Для оценки ответа на ипилимумаб целесообразно использовать критерии иммунного ответа.
Процент объективных ответов на лечение ипилимумабом невелик (около 10% пациентов), ограниченное число пациентов имеет долгосрочные преимущества (20-25%), но они характеризуются значительным продлением выживаемости.
Проблема с терапией ипилимумабом – побочные эффекты, связанные с аутоиммунитетом, которые наблюдались гораздо чаще в регистрационном исследовании, чем у пациентов, получавших вакцину (общие и побочные реакции 3-4 степени – в два и пять раз чаще, соответственно). В настоящее время мы не знаем предикторов ответа на лечение ипилимумабом.
Вемурафениб
Мутации RAS / RAF / MEK / ERK MAP киназы (MAPK) обнаруживаются примерно в 75% случаев меланомы кожи. Доминирующим механизмом, приводящим к гиперактивности пути RAS / RAF / MAPK при меланоме кожи, является мутация гена, кодирующего киназу BRAF, при этом соматические мутации в гене BRAF наблюдаются в 50-70% меланом кожи, возникающих в местах, не подверженных длительному воздействию солнечного света.
Опубликованные в 2011 году результаты III фазы регистрационного исследования с вемурафенибом 1-й линии у пациентов с мутацией BRAFV600 показал ответы на лечение у 48% пациентов, получавших BRAF против 5% пациентов, получавших дакарбазин, а также значительное улучшение выживаемости без прогрессирования заболевания (разница – около 5 месяцев) и общей выживаемости (разница – около 3 месяцев).
Для лечения пациентов с прогрессирующей меланомой BRAF был одобрен препарат Вемурафениб. Хотя у большинства пациентов развивается резистентность к лечению (медиана выживаемости без прогрессирования составляет 6-7 месяцев), результаты исследования фазы II-III показали, что медиана общей выживаемости у пациентов с метастатической меланомой составляет 13-16 месяцев, что важно превышает наблюдаемую ранее выживаемость в этой группе пациентов.
Вемурафениб характеризуется значительной кожной токсичностью (повышенной чувствительностью к ультрафиолетовому излучению), а также приводит к образованию вторичных раков (плоскоклеточный рак или кератома почти у 20% пациентов). Нежелательные реакции нередко требуют снижения дозы вемурафениба.
Дабрафениб, траметиниб
В 2012 году была подтверждена терапевтическая эффективность другого ингибитора BRAF – дабрафениба (подтверждено, что он сопоставим с вемурафенибом, но с другим профилем токсичности – включая значительно более низкий риск развития плоскоклеточного рака).
Исследование III фазы также подтвердило эффективность ингибитора MEK траметиниба при лечении пациентов с метастатической меланомой с наличием мутации BRAF. Эффективность ингибиторов MEK также наблюдалась у пациентов с мутациями NRAS.
Перечисленные препараты также оказывают благоприятное действие на пациентов со стабильными и / или бессимптомными метастазами в мозг, что до сих пор было недоступным местом для системной терапии метастатической меланомы.
Поскольку ингибиторы BRAF у пациентов с прогрессирующей меланомой BRAF приводят к быстрому ответу и контролю опухоли у большинства пациентов, с ограниченным временем ответа, связанным с активацией механизмов устойчивости (средняя продолжительность ответа составляет около 6-7 месяцев), эти препараты следует рассматривать для выбора у пациентов с симптомами заболевания и / или большой опухолевой массой.
Точных данных относительно последовательности лечения ипилимумабом и вемурафенибом у пациентов с меланомой с мутацией BRAF нет, хотя активность ингибитора BRAF также сохраняется после лечения ипилимумабом.
У пациентов с меланомой без мутации BRAF ипилимумаб является основным вариантом во второй линии терапии. Ингибиторы тирозинкиназы являются предметом интенсивных исследований в комбинированной терапии (с применением ипилимумаба, ингибиторов MEK, ангиогенеза или пути mTOR). В настоящее время ведутся исследования в отношении других лекарственных средств с неспецифической иммуностимулирующей активностью (например, анти-PD1, анти-PDL1-антитела).
Схемы иммунного лечения у пациентов с неоперабельной меланомой, отдаленными метастазами
Иммунное лечение – первое лечение
- Ниволумаб: 3 мг / кг, внутривенно, каждые 2 недели;
- Ниволумаб + ипилимумаб: ниволумаб 1 мг / кг и ипилимумаб 3 мг / кг, в / в, каждые 3 недели, 4 цикла. Затем ниволумаб 3 мг / кг каждые 2 недели;
- Пембролизумаб: 2 мг / кг, в / в , каждые 3 недели.
Иммунологическое лечение – Первое лечение у пациентов с мутацией BRAF
- Дабрафениб + траметиниб: дабрафениб 150 мг перорально 2 раза в день и траметиниб 2 мг / кг перорально, ежедневно;
- Вемурафениб + кобиметиниб: вемурафениб 960 мг, перорально, 2 раза в день в дни 1-28 и кобиметиниб 60 мг ежедневно, перорально 1-21. Циклы повторяются каждые 28 дней.
Иммунологическое лечение – вторая линия лечения
- Пембролизумаб: 2 мг / кг, IV, каждые 3 недели. Nivolumab: 3 мг / кг, IV, каждые 2 недели;
- Ниволумаб + Ипилимумаб: Ниволумаб 1 мг / кг и Ипилимумаб 3 мг / кг, IV, каждые 3 недели, 4 цикла. Затем ниволумаб 3 мг / кг каждые 2 недели;
- Ипилимумаб: ипилимумаб 3 мг / кг внутривенно. Лечение повторяют каждые 3 недели;
- Интерлейкин: 2 (ИЛ-2): ИЛ-2 22 мкг / кг (360 000 МЕ / кг) в увеличивающихся дозах. Порог толерантности к дозе;
- Иматиниба: иматиниб 400 мг перорально, 2 раза в день.
Иммунное лечение – второй курс лечения у пациентов с мутацией BRAF
- Дабрафениб + траметиниб: дабрафениб 150 мг перорально 2 раза в день с траметинибом 2 мг / день, перорально;
- Вемурафениб + кобиметиниб: вемурафин: 960 мг, перорально, 2 раза в день в дни 1-28 и кобиметиниб 60 мг в день, перорально 1-21. Циклы повторяются каждые 28 дней;
- Вемурафениб: Вемурафениб 960 мг, перорально, 2 раза в день;
- Дабрафениб: Дабрафениб 150 мг перорально 2 раза в день.
Местное лечение меланомы III стадии в случае нерезектабельных поражений, частично резецированных или неоперабельных рецидивов после иссечения – в виде инъекции
- Alimogen laherarepvec (TVEC) – вакцины на основе генетически модифицированных вирусов простого герпеса;
- Вакцина Bacillus Calmette-Guerin (BCG);
- Интерферон альфа-2b;
- Интерлейкин 2 (IL-2).
Лечение транзитных метастазов на конечностях
Изолированная перфузия конечностей и инфузионная химиотерапия (ILP – изолированная перфузия конечностей, ILI – изолированная инфузия конечностей).