Кистозный фиброз (муковисцидоз)
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Кистозный фиброз (E84)
Разделы медицины:
Аллергология, Аллергология детская, Педиатрия, Пульмонология, Пульмонология детская
Общая информация
Краткое описание
Разработчик клинической рекомендации:
Союз педиатров России
Ассоциация медицинских генетиков
Российское респираторное общество
Российское трансплантологическое общество
Ассоциация детских врачей Московской области
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации
Кистозный фиброз (муковисцидоз)
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: Е84
Год утверждения: 2021
Возрастная группа: Дети/ взрослые
1. Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
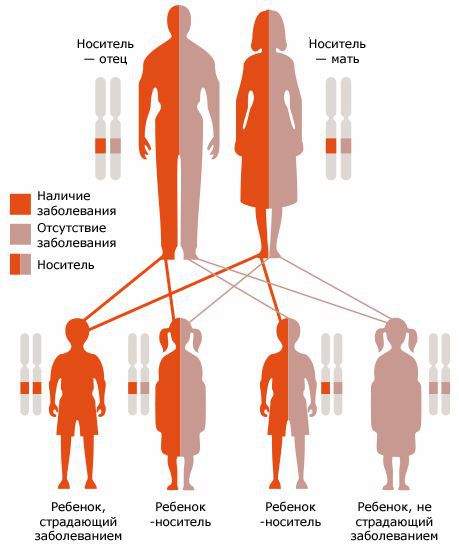
Кистозный фиброз (муковисцидоз, МВ) — аутосомно-рецессивное моногенное наследственное заболевание, характеризующееся поражением всех экзокринных желёз, а также жизненно важных органов и систем [1,2].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем (МКБ 10)
Кистозный фиброз (E84):
E84.0 – Кистозный фиброз с лёгочными проявлениями;
E84.1 – Кистозный фиброз с кишечными проявлениями1;
E84.8 – Кистозный фиброз с другими проявлениями;
E84.9 – Кистозный фиброз неуточнённый2.
1 –Код E84.1 Изолированной кишечной формы нет в современной классификации ВОЗ и Европейской Ассоциации Муковисцидоза. Код E84.1 — кистозный фиброз с кишечными проявлениями не рекомендуется использовать [19,20].
2 -В настоящее время –
1) неопределенный диагноз при положительном неонатальном скрининге на муковисцидоз
2) у пациентов любого возраста из группы риска по муковисцидозу, которым на основании результатов обследования не удается окончательно исключить или подтвердить диагноз.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Классификация, принятая ВОЗ, Международной Ассоциацией Муковисцидоза, Европейской Ассоциацией Муковисцидоза [1, 2, 3, 4, 5, 7, 8, 9]:
- Классический муковисцидоз с панкреатической недостаточностью (смешанная или легочно-кишечная форма заболевания1), PI. E84.8.
- Классический муковисцидоз с ненарушенной функцией поджелудочной железы (преимущественно легочная форма заболевания1), PS. E84.0.
- Неопределенный диагноз при положительном неонатальном скрининге на муковисцидоз. E84.9.
- Заболевания, ассоциированные с геном CFTR(МВТР)
- изолированная обструктивная азооспермия;
- хронический панкреатит;
- диссеминированные бронхоэктазы.
В клинической практике используется классификация, представленная в таблице 2 [2].
Таблица 2. Клиническая классификация муковисцидоза (предложена на основе Рабочей классификации муковисцидоза (Рачинский С.В., Капранов Н.И., 2000), рекомендаций ВОЗ и Европейской ассоциации муковисцидоза), опубликовано — https://mukoviscidoz.org/doc/konsensus/CF_consensus_2017.pdf
Примечания:
1 Форма из классификации МВ Рачинского С.В., Капранова Н.И. (2000).
2 Степень дыхательной недостаточности устанавливается согласно «Классификации дыхательной недостаточности» (Национальное руководство по болезням органов дыхания, 2010). Степень тяжести заболевания рекомендуется не указывать исходя из первично-хронического течения, полиорганного поражения и прогредиентного течения.
3 Положительный неонатальный скрининг или неонатальная гипертрипсиногенемия не являются диагнозом и в классификацию не включены, пациентам с неонатальной гипертрипсиногенемией рекомендуется в 1 год провести повторно потовую пробу. Используется новый диагноз – «неопределенный диагноз при положительном неонатальном скрининге на муковисцидоз»
4 Код МКБ рекомендуется использовать из соответствующих разделов.
Тяжестьсостоянияустанавливается согласно Приложению к приказу Министерства труда и социальной защиты Российской Федерации «О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы» (с 01 января 2019, см. раздел «Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата»)
В будущем, по мере углубления знаний, эта классификация также потребует пересмотра.
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Ген CFTR (МВТР — трансмембранный регулятор проводимости муковисцидоза) был идентифицирован в 1989 г. Ген расположен в середине длинного плеча 7 аутосомы, содержит 27 экзонов и охватывает 250 000 пар нуклеотидов. Он контролирует структуру и функцию одноимённого белка. Последние исследования показали, что МВТР является собственно хлоридным каналом.
Белок МВТР локализуется в апикальной части мембраны эпителиальных клеток, выстилающих выводные протоки желез внешней секреции (потовых, слюнных, желез в бронхах, поджелудочной железе, кишечнике, урогенитальном тракте), он регулирует транспорт электролитов (главным образом хлора) между этими клетками и межклеточной жидкостью. В базе HGMD (The Human Gene Mutation Database; https://my.qiagendigitalinsights.com/bbp/view/hgmd/pro/all.php) описано около 2 000 мутаций гена — CFTR), ответственных за развитие симптомов МВ. По состоянию на 31 июля 2020 года на веб- сайте международного проекта CFTR2 (https://cftr2.org) представлено 360 патогенных вариантов нуклеотидной последовательности гена CFTR. Они препятствуют синтезу белка CFTR, его транспорту к апикальной мембране клетки или нарушают его функцию в качестве канала анионов хлора. В зависимости от влияния на функцию белка CFTR все варианты нуклеотидной последовательности гена CFTR подразделяют на 7 основных классов [3,4]
Известно, что один и тот же вариант может вызвать несколько видов нарушения структуры или функции белка, и не для всех вариантов нуклеотидной последовательности гена CFTR определен класс Согласно данным национального регистра наиболее часто встречаются следующие мутации: F508del (53,14%),СFTRdele2,3 (6,18%), E92K (3,11%), 3849+10kbC>T (2,29%), 2143delT (2,05%), 2184insA (1,88%), 1677delTA (1,76%), N1303K (1,69%), W1282X (1,63%), L138ins (1,46%), G542X (1,43%) [5].
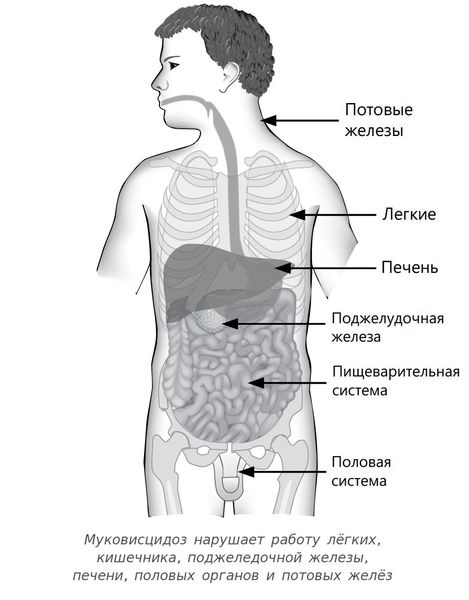
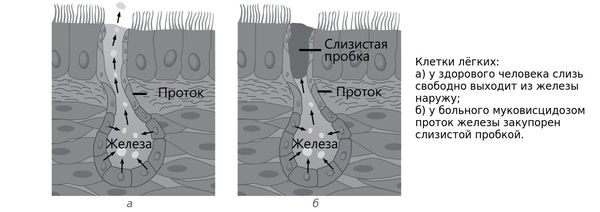
Мутации гена CFTR нарушают не только транспорт, но и секрецию ионов хлора. При затруднении их прохождения через клеточную мембрану увеличивается реабсорбция натрия железистыми клетками, нарушается электрический потенциал просвета, что вызывает изменение электролитного состава и дегидратацию секрета желез внешней секреции. В результате выделяемый секрет становится чрезмерно густым и вязким. При этом страдают легкие, желудочно-кишечный тракт, печень, поджелудочная железа, мочеполовая система (табл.1) [1, 6].
Таблица 1. Патогенез МВ
Прогрессирование легочной и сердечной недостаточности является наиболее частой причиной смерти пациентов (95%).
Спектр микроорганизмов, связанных с инфекциями дыхательных путей у пациентов с МВ продолжает расширяться и исследования микробиома легких у данной категории пациентов демонстрируют сложный синергизм между культивируемыми и некультивируемыми микроорганизмами. Микробиологическая диагностика у пациентов МВ имеет ряд особенностей, которые необходимо учитывать при организации работы с данной категорией пациентов.
Чаще всего в отделяемом нижних дыхательных путей у пациентов с МВ выявляются S. aureus, P. aeruginosa, B. cepacia complex, S. maltophilia, Achromobacter spp. Более типичные респираторные патогены, такие как H. influenzae, S. pneumoniae, M. catarrhalis также могут играть важную роль в развитии бронхолегочного процесса. У пациентов с МВ может встречается хроническая колонизация микроорганизмами семейства Enterobacterialеs.
Имеются наблюдения выделения из нижних дыхательных путей пациентов с МВ неферментирующих грамотрицательных бактерий (НГОБ Burkholderia gladioli, Inquilinus spp, Ralstonia spp., Cupriavidus spp., Pandoraea spp.) Данные виды являются близкородственными, имеют генетическое сходство с бактериями рода Burkholderia. Они редко выделяются у пациентов с МВ, однако описаны случаи выделения их при хронической инфекции. Нет достаточного количества исследований, указывающих на возможность передачи штаммов от пациента к пациенту.
Другие микроорганизмы, имеющие этиологическое значение при МВ: нетуберкулезные микобактерии (НТМБ) — Mycobacterium abscessus complex, Mycobacterium avium complex и другие микобактерии, грибы — Aspergillus spp., Scedosporium spp., Trichosporon spp., вирусы — Respiratory syncytial virus, Influenza virus, Adenovirus, Rhinovirus, Coronavirus, Parainfluenza virus, Human metapneumovirus. Возрастает выявляемость нетуберкулезных микобактерий у пациентов старшего возраста. Mycobacterium abscessus complex и Mycobacterium avium complex являются наиболее часто встречающимися [2].
Особенностями хронической инфекции легких у больных муковисцидозом является то, что данная инфекция в 2/3 случаев вызывается не монокультурой, а ассоциацией микроорганизмов. За рубежом эти показатели в два раз ниже — в 35% исследуемых образцов бронхоальвеолярного лаважа (БАЛ) выявляют рост двух микроорганизмов и в 10% случаев ассоциации представлены тремя и более видами микроорганизмов. Наиболее часто встречающейся ассоциацией является сочетание P. aeruginosa и S. aureus [7,8]. В составе микробных ассоциаций выделяли одновременно P.aeruginosa мукоидный и немукоидный фенотипы. Кроме P.aeruginosa, часто выделяли других представителей неферментирующих грамотрицательных микроорганизмов – Burkholderia cepacia complex, Achromobacter spp., S.maltophilia, A.baumanii и др. [9].
При анализе данных микробиологических исследований установлено, что микроорганизмы были выделены у 61,9% детей в возрасте до 1 года, у 92,9% — в возрасте 1-4 года, у 93.8% — в возрасте 5-7 лет и в возрасте 8-14 и 15-18 у 100% детей. Это свидетельствует о том, что колонизация легких микроорганизмами больных муковисцидозом начинается, фактически, с первых дней после рождения и достигает максимума уже к 5 годам жизни. В возрасте до 1 года более чем у 1/3 больных муковисцидозом нижние дыхательные пути еще не обсеменены микроорганизмами, в возрасте 1-4 лет нижние дыхательные пути обсеменены почти у всех больных (92,9%), а к 8-18 годам – у 100% больных. Хроническую стафилококковую, синегнойную или смешанную инфекцию диагностируют у 25% детей уже в возрасте 1-4 года, в возрасте 5-7 лет – у 50% больных, в возрасте 8-14 лет – у 65% и к 18 годам – у 80% больных муковисцидозом [7]
При оценке микробиологического профиля респираторного тракта выявлен рост частоты высева грамотрицательной флоры с увеличением возраста больных.
Наибольшая частота инфицирования S.aureus отмечена в возрастной группе 12-16 лет, где она составила 64,5%, P. aeruginosa в 24-28 лет с частотой 55,0%, в этой же возрастной группе максимальное инфицирование Вurkholderia cepacia complex, которое составило– 22,6%, S. maltophilia в 16-20 лет – 5,6%. Achromobacter spp. достигает своего пика у пациентов старше 36 лет, где ее частота составила 14,3%. MRSA имеет два пика максимальной частоты, в 20-24 года и 32-36 лет, где его частота составила 11,4% и 10,5%, соответственно.
Частота хронического инфицирования дыхательных путей S. aureus составляет 56,0 %, P. aeruginosa – 32,1 %, Bcc – 6,6 %, MRSA- 6,4%, Achromobacter spp.-3,9%, S. maltophilia– 3,4 %. В 7,5% случаев дыхательные пути больных хронически инфицированы другой грамоотрицательной флорой, среди которых наиболее часто встречающиеся представители семейства Enterobacteriales (Klebsiella spp.: Klebsiella pneumonia, Klebsiella oxytoca, Raoultella (Klebsiella) ornithinolytica; Escherichia coli, Serratia spp., Proteus spp. и др.), а также представители неферментирующих грамотрицательных бактерий (НГОБ) (Pseudomonas spp.: P. stutzeri, P. oryzihabitans, P. montelii, P. putida, P. koreensis, P. fluorescens, P. fragi, P. luteola; Аcinetobacter spp.: A. baumanii, A. lwoffii, A. haemolyticus, A. calcoaceticus, A. junii, A. pittii, A. anitratus.). У ряда пациентов встречается микст-инфицирование респираторного тракта различной непсевдомонадной грамотрицательной флорой. Доля пациентов, инфицированных НТМБ составяет 0,9 %.
Другой особенностью микрофлоры при хронической инфекции легких у больных муковисцидозом является различная резистентность к антибиотикам представителей одного и того же вида возбудителя, персистирующего у больного в легких. Это обусловлено как фенотипической гетерогенностью, которая является результатом адаптации микроорганизма при персистенции под воздействием антибиотикотерапии и/или иммунной системы, так и с изменчивостью, связаной с генетическими изменениями, происходящими в бактериях при персистенции — приобретением или потерей мобильных генетических элементов, имеющих в своем составе гены резистентности к антибиотикам. Данная особенность имеет как клиническое, так и эпидемиологическое значение и должна рассматриваться как фактор, ограничивающий эффективность антибиотикотерапии, способствующий выживанию бактерий и формированию хронической инфекции. Этот факт является важным для клиницистов и еще раз подтверждает необходимость исследования антибиотикочувствительности выделенных изолятов при назначении антибиотикотерапии и указывает на необходимость применения комбинированной антибиотикотерапии при лечении хронической инфекции у больных МВ. [10,11]
Развитию аспергиллеза легких у пациентов с МВ способствуют нарушение мукоцилиарного клиренса и иммунного ответа, а также продолжительная антибактериальная и глюкокортикостероидная терапия.
Колонизация дыхательных путей у пациентов с МВ Aspergillus spp.- выявление грибов рода Aspergillus в ≥50% образцов мокроты или в течение ≥6 месяцев в год, отсутствие инструментальных признаков ухудшения легочной функции, а также отсутствие клинических признаков обострения МВ [12,13].
В настоящее время нет убедительных данных о негативном влиянии колонизации Aspergillus spp. дыхательных путей на функцию дыхания пациентов с МВ [12,13,14]. Колонизация дыхательных путей пациентов с МВ грибами Aspergillus spp. не является показанием для назначения противогрибковых ЛС.
Наиболее распространенным осложнением, обусловленным Aspergillus spp., у пациентов с МВ является аллергический бронхолегочный аспергиллез (АБЛА). АБЛА характеризуется развитием реакции гиперчувствительности I типа при колонизации дыхательных путей Aspergillus spp., которая без лечения приводит к развитию фиброза легких и необратимой дыхательной недостаточности. У пациентов с МВ инвазивный аспергиллез встречается редко, чаще как осложенение после трансплантации легких на фоне иммуносупрессивной терапии.
Инвазивного поражения тканей легких при АБЛА обычно не происходит, хотя сочетание с ХАЛ выявляют у 10% пациентов. Основные возбудители АБЛА – A. fumigatus и A. niger [15,16].
Хронический аспергиллез легких (ХАЛ) представляет собой медленно прогрессирующий деструктивный процесс в легких, обусловленный грибами Aspergillus spp., в ранее существовавших бронхоэктазах, полостях и пр. Описана генетическая предрасположенность к этому заболеванию, связанная с дефицитом или дисфункцией Th-17 лимфоцитов [17,18].
Многие пациенты с МВ до развития ХАЛ получали ингаляционные или низкие дозы кортикостероидов для системного применения. Кроме того, развитию ХАЛ способствует повышенное содержание конидий Aspergillus spp. в окружающей среде, в том числе в жилых и производственных помещениях. Основные возбудители ХАЛ – A. fumigatus, A.flavus и A.niger. Без лечения ХАЛ приводит к ухудшению качества жизни пациентов с МВ и увеличению летальности.
Эпидемиология
1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Частота МВ колеблется среди представителей европеоидов от 1:600 до 1:17000 новорожденных. В РФ частота муковисцидоза составляет по данным ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова» 1:9000 новорожденных [1,5].
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Муковисцидоз может быть заподозрен по следующим признакам (табл. 3,4).
Наличие внутриутробно по данным УЗИ — гиперэхогенного кишечника, мекониевый илеус
— при рождении.
В периоде новорожденности затяжная неонатальная желтуха, витамин К-зависимые геморрагические состояния, мекониевый илеус.
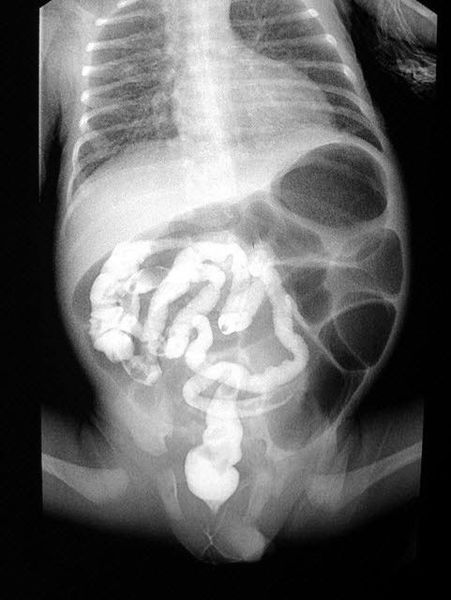
Мекониевый илеус – это синдром, характеризующихся проявлением низкой обтурационной кишечной непроходимости, без перерыва просвета кишечной трубки. Данное заболевание при муковисцидозе обусловлено механическими причинами — облитерацией просвета плотной мекониальной пробкой.
В мировой общепринятой практике считается, что в 90-95% случаев этиологией мекониевого илеуса является муковисцидоз [21]. Мекониевый илеус диагностируется у 15–20% новорожденных с муковисцидозом. В европейских странах пациенты с мекониевым илеусом подлежат обязательному обследованию на муковисцидоз [1,22]. По данным регистра пациентов с муковисцидозом РФ, доля пациентов с муковисцидозом, перенесших мекониевый илеус при рождении, в группе детей первого года жизни составила 22,1% пациентов, что отражает его реальную распространенность [23].
Задержка прибавки веса, частый, обильный, с примесью жира и зловонным запахом стул, повышенный аппетит, в возрасте после года эпизоды выпадения прямой кишки, эпизоды задержки стула с клиническими проявлениями частичной или полной кишечной непроходимости (синдром дистальной интестинальной обструкции – СДИО).
С раннего возраста возможны навязчивый коклюшеподобный кашель, часто рецидивирующие респираторные инфекции с явлениями бронхитов, пневмоний, может отмечаться свистящее дыхание и/или «оральная крепитация», одышка, кашель с выделением гнойной мокроты, в том числе вне периодов обострения, влажные разнокалиберные хрипы разной степени локализации в зависимости от распространенности процесса.
В раннем возрасте отмечаются эпизоды проявлений синдрома потери солей (гипокалиемия, гипонатриемия, гипохлоремия) – потеря веса, срыгивания, рвота, вялось, отказ от еды. Вследствие потери электролитов с потовой жидкостью, особенно в условиях усиленного потоотделения (лихорадка, жаркая погода, пребывание в сауне, физические нагрузки), через желудочно-кишечный тракт, недостаточное поступление солей с пищей и водой (особенно у детей первого года жизни при отсутствии дотации соли) может развиваться Псевдо-Барттер синдром (ПБС).
Синдром манифестирует преимущественно на первом году жизни у пациентов с муковисцидозом и является жизнеугрожающим состоянием, поэтому рассматривается с точки зрения тяжелого и опасного осложнения МВ, требующего в определенных случаях экстренного вмешательства. ПБС может быть первым симптомом МВ. Клинические проявления: от задержки физического развития до острого состояния, протекающего с отказом от еды и питья, вялостью, срыгиваниями и рвотой, признаками дегидратации. Часто ошибочно принимается за острую кишечную инфекцию, патологию почек, адреногенитальный синдром [2].
«Соленый» привкус» кожных покровов.
Деформации грудной клетки.
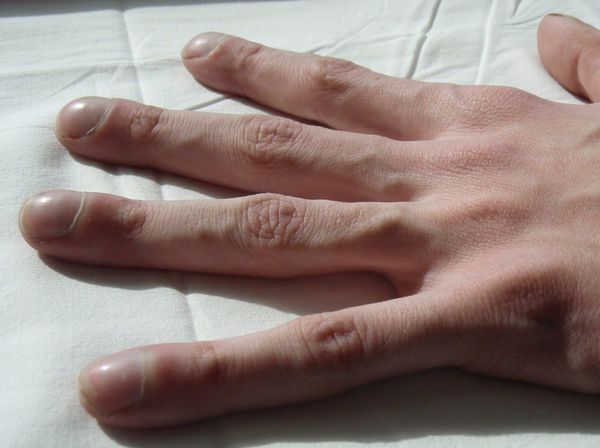
Формирование признаков хронической гипоксии в виде деформации концевых фаланг и ногтей по типу «барабанных палочек» и «часовых стекол».
Признаки хронического гайморита, полипозного синусита.
Муковисцидоз-ассоциированные заболевания печени (cysticfibrosis-associatedliverdisease (CFLD) включают в себя такое многообразие нозологий как: билиарный цирроз печени с и без синдрома внутрипеченочной портальной гипертензии, персистирующее повышение уровня печеночных ферментов, фиброз, стеатоз, желчнокаменная болезнь и изолированно лишь ультразвуковые изменения паренхимы печени [24,25].
Встречаемость муковисцидоз-ассоциированной гепатобилиарной патологии во всем мире примерно 37,9%, причем 2,5% летальных исходов отмечается именно по причине декомпенсации заболеваний печени [26]. По Европейскому Регистру пациентов с муковисцидозом за 2017 г. процент пациентов с циррозом печени и портальной гипертензией в Великобритании составляет – 1,51% (149 пациентов от 8344), в России же – 4,42% (136 пациентов от 2291) [5]. Цирроз печени с портальной гипертензией зафиксирован у 4,5% пациентов РФ в 2017 г, без портальной гипертензии – у 2,3%, цирроз печени (гипертензия не известна) у 0,7% больных и поражение печени без цирроза – у 15,9% пациентов.
У 1,5% пациентов поражение печени является первым клиническим симптомом МВ; именно поэтому в диагностический алгоритм при циррозе печени неясной этиологии рекомендуется включать потовый тест для исключения МВ [24,25].
Поражение печени, как и многие другие фенотипические проявления МВ, зависит не только и не столько от генетического дефекта и типа мутации CFTR, но от действия генов- модификаторов, находящихся вне локуса CFTR, например, Z аллель гена SERPINA1 (α1- antitrypsin или α1-antiprotease) [2,5] и аллель A VNTR в гене eNOS4 [19], и от факторов окружающей среды, включая ятрогенные.
Клинически при формировании цирроза печени диагностируется увеличение живота за счет гепатоспленомегалии, расширение поверхностных вен на передней брюшной стенке.
Рецидивирующие панкреатиты (как правило, у пациентов с сохранной функцией поджелудочной железы – PS).
С возрастом у пациентов с МВ нередко развивается и эндокринная недостаточность поджелудочной железы (муковисцидоз-зависимый сахарный диабет (МЗСД), который, как правило, протекает бессимптомно, и может долгое время оставаться не диагностированным. При этом известно, что уже за 2–4 года до манифестации диабета ухудшаются показатели нутритивного статуса и дыхательной функции. Комбинация МВ и диабета оказывает негативное влияние на продолжительность жизни. Так, средняя продолжительность жизни пациентов с МЗСД ниже по сравнению с пациентами без диабета, медиана выживаемости у пациентов с МЗСД составляет 24 года, по сравнению с 32 годами у пациентов с МВ, но без диабета [27].
У большинства пациентов мужского пола снижена фертильность.
В большинстве случаев фертильность женщин, больных муковисцидозом, сохранена. Однако в определенных случаях возможно бесплодие, обусловленное ановуляторным менструальным циклом и вторичной аменореей, вызванной истощением пациентки.
Наиболее частой причиной снижения фертильности у пациенток с нормальным овуляторным циклом является изменения водного и электролитного состава цервикальной слизи, в связи с большим количеством МВТР в цилиндрическом эпителии шейки матки. В результате цервикальный секрет (отделяемое шейки матки) становится слишком вязким, что снижает способность к оплодотворению [28,29].
Наличие у пациента симптомов, указанных в таблице 3, требует проведения дифференциального диагноза МВ. Необходимо учитывать, что перечни симптомов, представленные в таблице 3, составлены в примерном соответствии каждой из рассматриваемых возрастных групп пациентов с МВ. Любой из указанных симптомов может наблюдаться у детей младшего или старшего возраста
Таблица 3. Клинические проявления, требующие дифференциального диагноза с МВ [1,2,30].
| Возраст | Симптомы и синдромы |
| Грудной |
Рецидивирующие или хронические респираторные симптомы, такие как кашель или одышка Рецидивирующая или хроническая пневмония Отставание в физическом развитии Неоформленный, обильный, маслянистый и зловонный стул Хроническая диарея Выпадение прямой кишки Затяжная неонатальная желтуха Соленый вкус кожи Тепловой удар или дегидратация при жаркой погоде Хроническая гипоэлектролитемия Данные семейного анамнеза о смерти детей на первом году жизни или наличие сибсов со сходными клиническими проявлениями Гипопротеинемия / отеки Мекониевый илеус |
| Дошкольный |
Стойкий кашель с или без гнойной мокроты Диагностически неясная рецидивирующая или хроническая одышка Хронический гнойный/полипозно-гнойный синусит Отставание в весе и росте Выпадение прямой кишки Инвагинация Хроническая диарея Симптом «барабанных палочек» Кристаллы соли на коже Гипотоническая дегидратация Гипоэлектролитемия и метаболический алкалоз Гепатомегалия или диагностически неясное нарушение функции печени |
| Школьный |
Хронические респираторные симптомы неясной этиологии Pseudomonas aeruginosa в мокроте Хронический синусит Назальный полипоз Бронхоэктазы Симптом «барабанных палочек» Хроническая диарея Синдром дистальной интестинальной обструкции Панкреатит Выпадение прямой кишки Сахарный диабет в сочетании с респираторными симптомами Гепатомегалия Заболевание печени неясной этиологии |
| Подростки и взрослые |
Гнойное заболевание легких неясной этиологии Симптом «барабанных палочек» Панкреатит Синдром дистальной интестинальной обструкции Сахарный диабет в сочетании с респираторными симптомами Признаки цирроза печени и портальной гипертензии Отставание в росте Задержка полового развития Инфертильность с азооспермией у лиц мужского пола Снижение фертильности у лиц женского пола |
Таблица 4. Клинические проявления, характерные для муковисцидоза [2,30].
| Высокоспецифичные для МВ | Менее специфичные для МВ |
Со стороны системы пищеварения:
|
Со стороны системы пищеварения:
|
Со стороны дыхательных путей:
|
Со стороны дыхательных путей:
|
Другое:
|
Другое:
|
При МВ нередко встречается остеопороз, который у этих пациентов всегда носит вторичный характер.
К причинам его развития у пациентов с МВ относят: хронический микробно – воспалительный процесс, дефицит витамина D и K; низкое потребление кальция; низкая физическая активность, сахарный диабет на фоне МВ, трансплантация органов и иммуносупрессивная терапия; гипоксия и гиперкапния; дефицит костной массы и нарушение микроархитектоники кости вследствие недостаточного набора пика костной массы в период активного роста и избыточной костной потери у взрослых.
В некоторых работах показана взаимосвязь различных мутаций и/или их комбинаций (F508del и др.) c развитием низкой костной массы [31,32], большинство других авторов не отмечают данной связи.
Рекомендации по формулировке диагноза изложены в клинических рекомендациях по остеопорозу. Согласительная комиссия по европейскому консенсусу решила использовать термин «болезни кости при МВ» (включающий низкую минеральную плотность кости и переломы), а не «остеопороз». Для РФ, учитывая особенности медицинского обеспечения, рекомендуется оставить диагноз – остеопороз [33,34,35].
Частота остеопороза при МВ в детском и подростковом возрасте составляет от 20 до 50% и увеличивается после 18 лет жизни (50 — 75%) [36].
По данным российских исследователей в детском возрасте частота снижения минеральной плотности кости (МПК) составляет от 33 до 65,2% и остеопороза — от 7,7% до 15,6% [37,32].
Во взрослой популяции пациентов с муковисцидозом частота низких показателей МПК составляла 43,6%, остеопороза — 8,4% [33].
Классификация аспергиллеза легких представлена в приложении Г1.
Аллергический бронхолегочный аспергиллез у пациентов с МВ протекает хронически с периодическими обострениями. Основными клиническими признаками обострения АБЛА являются неконтролируемое течение МВ, приступы удушья, кашель с мокротой, содержащей коричневые или черные включения и слизистые пробки, бронхообструктивный синдром и/или возникновение эозинофильных инфильтратов, боли в грудной клетке, рефрактерное к применению антибактеральных препаратов повышение температуры тела, а также снижение дыхательной функции. При длительном течении АБЛА развивается зависимость от кортикостероидов для системного применения, формируется и фиброз легких, приводящий к дыхательной недостаточности [15].
Хронический аспергиллез легких. Продолжительность ХАЛ ≥ 3 мес. Наиболее частые пульмональные симптомы – продуктивный кашель, одышка и кровохарканье, прогрессивное снижение легочной функции, общие – субфебрилитет, общая слабость и снижение массы тела, снижение толерантности к нагрузкам, отсутствие или неполный ответ на полноценный курс антибактериальной терапии широкого спектра действия. ХАЛ часто принимают за
обострение МВ, обусловленное бактериальным возбудителем, и назначают неэффективную в этих случаях терапию антибактериальными препаратами резерва [15,17,18].
Прогноз: ХАЛ нередко диагностируют поздно и лечение проводят неадекватно. Без лечения ХАЛ приводит к ухудшению качества жизни пациентов с МВ и увеличению летальности. Летальность при ХАЛ в первые 6 месяцев после диагноза составляет 15 – 30%. Наиболее частая непосредственная причина смерти – легочное кровотечение.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Диагноз МВ подтверждается при наличии одного или более характерных фенотипических проявлений МВ в сочетании с доказательствами нарушения функции МВТР, такими как: выявление клинически значимых мутаций гена МВТР при генотипировании или увеличение уровня хлоридов в секрете потовых желез пациента. Для решения проблем диагностики МВ были разработаны критерии, согласно которым обязательным для МВ является наличие характерного клинического синдрома плюс доказательство какого-либо нарушения функции хлорного канала одним из методов.
В настоящее время существует несколько вариантов диагностических критериев МВ, которыми пользуются специалисты [1,2].
Наиболее распространено использование диагностических критериев, утвержденных Европейскими стандартами и национальным консенсусом (таблица 5) [1,22].
Таблица 5. Диагностические критерии, утвержденные Европейскими стандартами 2014 года, пересмотр 2018 года [22,38] и национальным консенсусом (2016) [2].
| Положительный результат потового теста |
| и/или |
| Две мутации МВТР (CFTR), вызывающие МВ (согласно базе CFTR-2 http://www.cftr2.org) |
| И |
| Неонатальная гипертрипсиногенемия |
| Или |
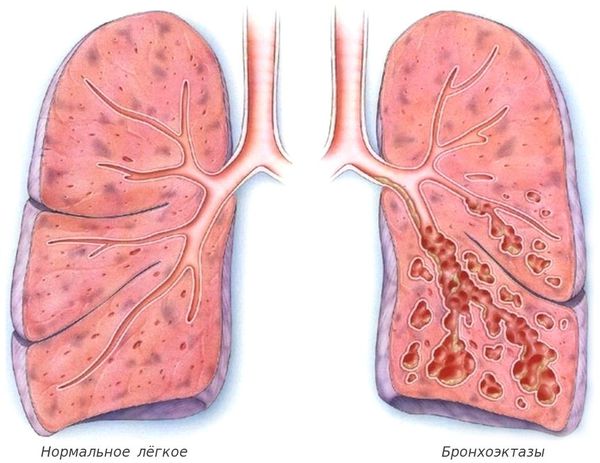
| Характерные клинические проявления, такие как диффузные бронхоэктазы, высев из мокроты значимой для МВ патогенной микрофлоры (особенно синегнойной палочки), экзокринная панкреатическая недостаточность, синдром потери солей, обструктивная азооспермия |
Диагностика обтурационной кишечной непроходимости (в т.ч., мекониевого илеуса)в периоде новорожденности
Кишечные проявления муковисцидоза в периоде новорожденности могут сводиться не только к формированию мекониевого илеуса. Также муковисцидоз может быть диагностирован у пациентов с внутриутробной перфорацией тонкой кишки, признаками перенесенного внутриутробного энероколита (внутриутробное формирование спаек, перитонит) и при нарушении проходимости толстой кишки, при нормальном формировании ее нервного аппарата.
Антенатальная – описанные заболевания относятся к поздним фетопатиям, поэтому возможные проявления могут быть визуализированы в III триместре. При наличии у плода по данным УЗИ признаков гиперэхогенного кишечника целесообразно направить родителей на ДНК диагностику муковисцидоза – поиск наиболее частых мутаций, а ребенка при рождении – как составляющего группу риска по мекониевому илеусу и кишечной непроходимости.
После рождения – диагностика кишечной непроходимости и осложнений в соответствии с клинической практикой пациентов с мекониевым илеусом, обязательная консультация специалиста по муковисцидозу, проведение потовой пробы, ДНК-диагностики. При невозможности проведения потовой пробы – обязательная ДНК-диагностика [22].
Диагностика Псевдо-Барттер синдрома у пациентов с МВ
Псевдо-Барттер синдром диагностируется на основании наличия у ребенка установленного диагноза «Муковисцидоз», характерной клинической картины (см. раздел 1.6 «Клиническая картина» и биохимических изменений: гипонатриемии, гипокалиемии, гипохлоремии, метаболического алкалоза [2].
Диагностика аспергиллеза при муковисцидозе сложна и нередко запаздывает, поскольку многие диагностические критерии пересекаются с типичными проявлениями основного заболевания.
Для постановки диагноза необходимо комплексное специализированное обследование (табл 6,7).
Таблица 6. Диагностические критерии АБЛА согласно консенсусу Фонда МВ (2003) [39].
Таблица 7. Диагностические критерии ХАЛ согласно руководству по диагностике и лечению хронического аспергиллеза (2016) [2].
Диагностика цирроза печени у пациентов с МВ:
- Повышение аланинаминотрансферазы, аспартатаминотрансферазы и гаммаглютамилтрансферазы, в течение более, чем 6 месяцев при исключении других причин [42,43] (следует учесть, что данные показатели имеют невысокую специфичность у пациентов с кистозным фиброзом (муковисцидозом));
- Пальпаторное увеличение размеров печени и селезенки [43];
- Удлинение протромбинового (тромбопластинового) времени в крови или в плазме [43,89]
- Характерная УЗИ-картина (неоднородная эхогенность паренхимы, тяжистость, закругление печеночного края, прорастание соединительной ткани в ворота печени), выявление избыточной свободной жидкости в брюшной полости как признак асцита [44,45,46];
- Обеднение венозного кровотока и формирование признаков портальной гипертензии по данным УЗДГ;
- Признаки формирования фиброза/цирроза по данным непрямой эластометрии печени с оценкой степени фиброза по морфологической классификации METAVIR (Приложение Г2):5 стадий фиброза — от 0 до 4, где F0 — отсутствие фиброза, F1 — портальный фиброз (звездчатое расширение портальных трактов) без септ, F2 — портальный фиброз и единичные септы, F3 — портальный фиброз и множественные септы без ЦП, F4 –цирроз печени [47];
- Выявление варикозно-расширенных вен пищевода и желудка при проведении диагностической ФЭГДС.
- Тяжесть и степень компенсации МВ-ассоциированного цирроза печени в клинической практике проводится по классификации Чайлд-Пью (Сhild-Pugh)(Приложение Г3) [48,49].
Диагностические критерии муковисцидоз-зависимого сахарного диабета (МЗСД): гипергликемия натощак (уровень глюкозы плазмы натощак ≥7,0 ммоль/л) или «диабетический» уровень глюкозы крови в ходе СГТТ (при уровне глюкозы плазмы натощак <7,0 ммоль/л и глюкозы плазмы через 2 часа в ходе ОГТТ ≥11,1 ммоль/л), или постпрандиальная гипергликемия, определяемая непрерывным мониторингом глюкозы (CGM) при отсутствии симптомов [50].
Диагностика остеопороза у пациентов с МВ включает оценку клинической картины, рентгеноденситометрию (Приложение Г4), лабораторные методы исследования.
Диагноз остеопороза при МВ ставится при наличии:
- 1 и более компрессионных переломов тел позвонков, которые не связаны с высокоэнергетической травмой или локальным заболеванием, приводящим к изменению минеральной плотности кости (МПК). При наличии компрессионных переломов позвонков для постановки диагноза остеопороза не требуется, чтобы Z-критерий был ≤ -2 SD. или
- Клинически значимого анамнеза переломов и МПК по Z-критерию ≤-2 SD (стандартные отклонения). Клинически значимый анамнез переломов ‒ это:
1) 2 и более переломов длинных костей в возрасте до 10 лет;
2) 3 и более переломов длинных костей в любом возрасте до 19 лет [51].
2.1 Жалобы и анамнез
См. раздел 1.6 Клиническая картина.
2.2 Физикальное обследование
Ребенку с подозрением на МВ следует провести полное физикальное обследование, т.к. при этом заболевании имеются мультиорганные проявления.
См. раздел 1.6 Клиническая картина.
2.3 Лабораторные диагностические исследованияТесты для установления диагноза муковисцидоз
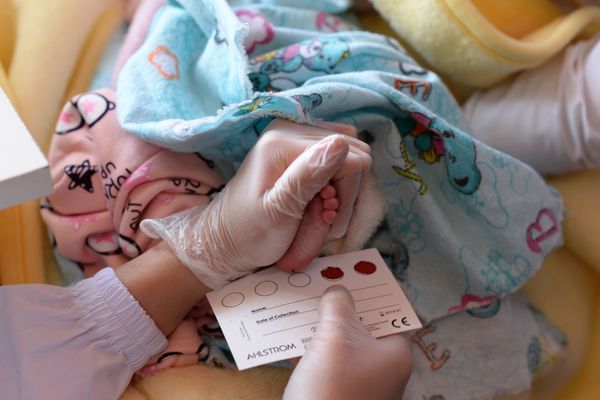
- Рекомендуется проведение скрининга новорожденных на муковисцидоз (неонатальный скрининг, комплекс исследований для диагностики муковисцидоза), так как раннее выявление и своевременное начало терапии позволяет предупредить развитие тяжелых осложнений, улучшает показатели физического развития, замедляет темпы снижения функции легких, снижает потребность в госпитализации [1, 52,53,19,30,2,22,54].
(УУР – B, УДД — 2).
Комментарий: Проводится в Российской Федерации у всех новорожденных.
Протокол скрининга в РФ включает 3 обязательных этапа: ИРТ1, ИРТ2, потовая проба (таблица 8). На первом этапе в крови новорожденных (4-5 день у доношенных, 7-8 день у недоношенных) определяется уровень ИРТ. Взятие образцов крови осуществляется в соответствии с Приказом №185 от 22.03.2006 «О массовом обследовании новорожденных детей на наследственные заболевания». При превышении порогового уровня ИРТ проводится ретест на 21-28 день жизни. При положительном ретесте проводится потовая проба. Позитивная потовая проба расценивается как положительный результат скрининга, и пациента направляют в Центр муковисцидоза (либо профильное отделение). Дети с мекониевым илеусом независимо от уровня ИРТ нуждаются в проведении потовой пробы из-за возможного у них ложно отрицательного результата [2,22].
Оптимальные сроки установки диагноза и начала наблюдения пациента, выявленного по программе неонатального скрининга — первые 2 месяца жизни [2,22].
Обследование и наблюдение новорожденных по программе массового скрининга должно проводиться с соблюдением принципов профилактики перекрестного и внутрибольничного инфицирования, оптимально амбулаторно или в условиях дневного стационара [2].
Таблица 8. Этапы неонатального скрининга в Российской Федерации (Приказ №185 от 22.03.2006 «О массовом обследовании новорожденных детей на наследственные заболевания»).
| I этап | На 4-5 день у доношенного (на 7-8 –й – у недоношенного) новорожденного – определение иммунореактивного трипсина (ИРТ) в высушенной капле крови |
| II этап | При положительном результате (cut-off>99,5 центиля) на 21-28-й день повторный тест на ИРТ |
| III этап | При положительном результате – потовая проба |
| IV этап | При пограничном результате потовой пробы – дополнительные методы обследования, включая ДНК-диагностику, определение разности кишечных потенциалов и другие. |
- Для диагностики муковисцидоза рекомендуется проведение потовой пробы (исследование уровня хлоридов в поте, комплекс исследований для диагностики муковисцидоза). Для установления диагноза необходимо получить как минимум 2 положительных результата. Потовая проба может быть проведена ребенку в возрасте 48 часов с весом не менее 2 кг [1,2,22,55,56].
(УУР – В, УДД — 2).
Комментарии: Потовая проба является «золотым стандартом» диагностики муковисцидоза, проводится как минимум дважды. В РФ используются 2 методики потового теста.
1) Классический прямой метод определения электролитного состава пота (хлора или натрия) методом пилокарпинового электрофореза по Гибсону и Куку (1959 г.). Норма – до 30 ммоль/л, пограничные значения 30-59 ммоль/л, положительный результат — 60 ммоль/л и выше (при навеске пота не менее 100 мг) [1,2,6,38,]. Показатели хлоридов выше 150 ммоль/л должны быть подвергнуты сомнению.
2) Потовая проба путем определения проводимости пота с помощью специальных потовых анализаторов коррелирует с определением уровня хлоридов, позволяет получить адекватный результат при количестве пота в образце – 3-10 мкл. Получил широкое распространение при внедрении массового скрининга новорожденных.
При определении проводимости положительным результатом для муковисцидоза считается показатель: выше 80 ммоль/л; пограничным значением – 50-80 ммоль/л; нормальным – до 50 ммоль/л. Показатели проводимости выше 170 ммоль/л должны быть подвергнуты сомнению. Время сбора пота не должно превышать 30 минут, минимально допустимое количество пота – 75-100 мг (15 мкл в коллекторе “Macroduct”), скорость потоотделения должна быть не менее 1 г/м2/мин [22]. Обязательным является предварительное тщательное очищение кожи пациента [2]. Особого внимания требует подготовка кожи у пациентов, длительно находящихся в стационаре.
Пограничные результаты потовой пробы.
Возможные причины пограничных результатов потовой пробы:
- Индивидуальные особенности у людей без муковисцидоза, особенно у взрослых
- Неправильная подготовка к пробе
- Носительство «мягких» мутаций при муковисцидозе [22]
Рекомендации:
- использование разных методов определения хлоридов пота, повторные исследования;
- расширенный ДНК-анализ (секвенирование гена);
-
расширенное клинико-лабораторное и инструментальное обследование: Копрологическое исследование и Определение активности панкреатической эластазы-1 в кале, электролиты в биохимическом общетерапевтическом анализе крови (Исследование уровня калия в крови, Исследование уровня хлоридов в крови), посев мокроты/ мазок с задней стенки глотки (Микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы, Микробиологическое (культуральное) исследование мокроты на аэробные и факультативно-анаэробные микроорганизмы), рентгенография органов грудной клетки, пазух носа, спермограмма;
- наблюдение в центре муковисцидоза до окончательного принятия решения о диагнозе. Не снимаются с учета, пока диагноз не будет исключен;
- метод определения разности назальных потенциалов или измерение электрического тока в биоптате кишки, отражающие нарушение функции хлорного канала*.
Примечание: *В качестве дополнительного теста пациентам с подозрением на муковисцидоз, особенно в сомнительных случаях при пограничных значениях потового теста, при невыраженной симптоматике и/или при неполных классических проявлениях болезни может быть рекомендовано проведение исследования разности кишечных потенциалов [1,2,6,38,57].
Согласно стандартным операционным процедурам, для измерения разности кишечных потенциалов используются ректальные биоптаты, полученные при ректороманоскопии. Для проведения исследования необходимо не менее 4 образцов биоптатов. Рекомендуемые референтные значения (контрольные показатели здоровых людей) при использовании метода ОРКП в РФ: плотность тока короткого замыкания (ΔISC) в ответ на введение амилорида (стимуляция натриевых каналов) в контрольной группе составила 8.98±3.42 µA/cm2. Изменение ΔISC в ответ на введение форсколина (стимуляция хлорных каналов) составило 25.78±4.41 µA/cm2. В ответ на введение гистамина ΔISC изменяется в положительную сторону, что отражает вход ионов калия в клетки. При этом плотность тока составила 101.68±10.99 µA/cm2[58].
- Рекомендовано проведение молекулярно-генетического исследования для идентификации мутаций гена МВТР (CFTR) (молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) в крови, комплекс исследований для диагностики муковисцидоза) по показаниям:
- Новорожденным с положительным ИРТ и положительными или пограничными значениями потовой пробы, мекониевым илеусом
- Людям с пограничными значениями потовой пробы (см. Раздел «Диагностика муковисцидоза»)
- Пациентам с клиническими проявлениями классического или моносимптомного МВ
- При CFTR-ассоциированных заболеваниях (панкреатит, врожденное двустороннее отсутствие семявыносящего протока/обструктивная азооспермия)
- Родственникам пациентов с МВ (для определения статуса носительства по желанию)
- Женщинам после рождения первого ребенка с муковисцидозом, а также во время последующих беременностей при наличии ребенка с муковисцидозом
- Плод на 10-12-й неделе при подозрении на МВ (при наличии сибса с МВ) или обнаружении гиперэхогенного кишечника при УЗ-обследовании
- Донорам гамет и эмбрионов в программах ЭКО (ЭКО-ИКСИ), внутриматочной инсеминации
- Супружеским парам с высоким генетическим риском МВ, желающим пройти ЭКО- ПГТ МВ для предотвращения рождения ребенка с МВ (при отсутствии противопоказаний и ограничений) [2,22,59].
(УУР – C, УДД – 5).
Комментарии: Клиническую значимость обнаруженных генетических вариантов следует устанавливать с учетом рекомендаций Консенсуса [2], постоянно обновляемых баз данных: [60].
Стратегия молекулярно-генетической диагностики МВ включает несколько этапов.
На первом этапе проводится поиск вариантов, наиболее частых в популяции, к которой принадлежит обследуемый [2].
На втором этапе проводят расширенный поиск более редких вариантов, используя секвенирование по Сэнгеру или высокопроизводительное секвенирование генома (MPS/NGS). Анализ включает исследование всей кодирующей последовательности гена CFTR (27 экзонов), областей экзон-интронных соединений, 5’- и 3’- некодирующих областей (до 200-300 нуклеотидов), а также, желательно, глубоких интронных областей, где расположены варианты с доказанной патогенностью.
Примечание: применение данного метода необходимо при назначении CFTR-модуляторов с целью исключения комплексных аллелей, влияющих на эффективность терапии
Третий этап. Обычными сканирующими методами, в том числе секвенированием, можно выявить нарушения последовательности гена, незначительные по протяженности: нуклеотидные замены, небольшие делеции/инсерции. Перестройки, охватывающие несколько экзонов/интронов, такими методами не выявляются. Рекомендуется использовать следующие технологии: MLPA – мультиплексную лигазную зондовую амплификацию либо QFMP – количественную флуоресцентную мультиплексную ПЦР [22,30,61].
Требования к лаборатории, проводящей анализы на патогенные варианты гена CFTR, изложены в Консенсусе [2].
Согласно данным Европейского консенсуса по МВ, проведение расширенного молекулярного исследования гена CFTR позволяет выявить патогенный вариант в 98%. Это может быть связано либо с тем, что использованные методы не позволили проанализировать регионы гена, где располагаются патогенные генетические варианты, либо с явлением однородительской дисомии, либо с фенокопиями МВ [22].
Прочие лабораторные исследования, проводящиеся при диагностике и в процессе динамического наблюдения
- Рекомендовано проведение всем пациентам с МВ общего (клинического) анализа крови развернутого с целью ориентировочной оценки воспалительного процесса, контроля влияния на показатели крови проводимой терапии и в комплексной оценке нутритивного статуса [2,62,63,64].
(УУР – B, УДД – 3).
Комментарии: в среднем необходимая частота проведения исследования – ежеквартально. В рамках общего (клинического) анализа крови необходимо: исследование уровня общего гемоглобина в крови, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, дифференцированный подсчет лейкоцитов (лейкоцитарная формула), просмотр мазка крови для анализа аномалий морфологии эритроцитов, тромбоцитов и лейкоцитов, определение цветового показателя, определение размеров эритроцитов, исследование скорости оседания эритроцитов.
- Рекомендовано проведение общего (клинического) анализа мочи всем пациентам с муковисцидозом при первичной диагностике и динамическом наблюдении с целью своевременного выявления поражения почек [65].
(УУР – С, УДД – 5)
Комментарий: кратность исследования – не реже 1-2 раз в год, при необходимости — чаще
Определение наличия панкреатической недостаточности
- Рекомендуется проведение лабораторных тестов для определения степени панкреатической недостаточности всем пациентам с подозрением на муковисцидоз и пациентам с муковисцидозом (определение активности панкреатической эластазы-1 в кале), степени коррекции панкреатической недостаточности – копрологическое исследование с определением нейтрального жира в кале [1,2,22].
(УУР – C, УДД – 5).
Комментарии: у пациентов с сохранной функцией поджелудочной железы определение активности панкреатической эластазы-1 в кале проводится ежегодно.
Средняя частота исследований у пациентов с муковисцидозом приведена в Приложении 7.
Микробиологическая диагностика
- Рекомендуется всем пациентам с муковисцидозом (или с подозрением на муковисцидоз) микробиологическое исследование мокроты (индуцированной мокроты или трахеального аспирата), или, в исключительных ситуациях (для младенцев), орофарингеального мазка и/или жидкости бронхоальвеолярного лаважа для идентификации патогена/-ов и определения чувствительности выделенной микрофлоры [1,2,6,22].
(УУР – C, УДД – 5).
Комментарии: Исследование проводится при первичной диагностике и в процессе динамического наблюдения, в том числе, для контроля эффективности терапии, не реже 1 раза в 3 мес., по показаниям — чаще. Также проводится контрольное исследование после курса антимикробной терапии при госпитализации или с целью оценки эффективности проведения эрадикации при первичном высеве P. aeruginosa и другой грамотрицательной антибиотикорезистентной флоры (через 7-10 дней от начала терапии).
При хронической грамотрицательной антибиотикорезистентной флоре рекомендуется направлять на микробиологическое обследование больных пациентов с МВ в период проведения эрадикационной терапии – ежемесячно с целью оценки эффективности элиминации возбудителей;
Направлять детей до 5 лет на диагностику микробной флоры, полученной с помощью глубокого мазка из зева. Для детей старше 5-6-летнего возраста и взрослых рекомендуется приоритетным считать анализ мокроты. У детей с полипозным синуситом – исследование рекомендуется проводить путем получения глубокого мазка при риноскопии;
При наличии непроизвольного отхаркивания у пациентов со стабильным течением болезни рекомендовано направлять пациентов ежегодно для исследования диагностического материала на выявление НТМБ. Для скрининга НТМБ нужно использовать посевы и мазки на наличие кислотоустойчивых бактерий, которые берутся из мокроты пациента.
Основным микробиологическим методом диагностики бронхолегочной инфекции является культуральный метод с посевом респираторных образцов на неселективные, селективные и хромогенные питательные среды.
Целесообразно проведение микробиологического исследования респираторных образцов по рекомендации врача в одной из лабораторий экспертного уровня по МВ не реже 1 раза в год.
Важным является использование селективных сред для выделения микроорганизмов, требующих особые условия культивирования или для выделения их специфических, связанных с МВ морфотипов. Особенно для B. cepacia complex, а также S.aureus в виде фенотипа мелких
колоний [66,69].
Для повышения вероятности выделения S.aureus у пациентов с МВ рекомендуется использовать одну из селективных сред – мясо солевой агар/железо солевой агар или хромогенный агар для S.aureus.
В случае выделения SCVs фенотипа S.aureus следует использовать дополнительные методы идентификации (ПЦР, масс-спектрометрию).
Скрининг на MRSA проводить путем прямого посева биоматериала на плотные питательные среды, с дальнейшим определением чувствительности выделенного S.aureus к цефокситину диско-диффузионным методом или посевом образцов на хромогенные среды для MRSA.
Использование селективных сред (агар МакКонки, агар Эндо, цетримидный агар с цетримидом) может помочь в идентификации P.aeruginosa.
Для повышения вероятности обнаружения B.cepacia complex в респираторном образце от пациента с МВ строго рекомендуется использование селективной среды для B.cepacia complex (BCSA или другие полимиксин содержащие среды).
На селективных средах для B.cepacia complex может быть получен рост других НГОБ (B.gladioli, Ralstonia spp., Cupriavidus spp., Pandoraea spp., Inquilinus spp. и др.).
Для всех бактерий B. cepacia complex, идентифицированных фенотипическими методами на тест-системах, провести подтверждающую идентификацию методами молекулярной идентификации (масс-спектрометрии или молекулярно-генетическими методами).
Идентификацию до рода микроорганизмов, относящихся к Achromobacter spp. рекомендуется проводить фенотипическими методами на коммерческих тест-системах. Видовую идентификацию рекомендуется проводить молекулярными методами ( с помощью — масс-спектрометрии или молекулярно-генетическими методами).
Идентификацию S.maltophilia рекомендуется проводить фенотипическими методами с использованием коммерческих тест-систем).
На селективных средах для B.cepacia complex при рутинном микробиологическом исследовании может наблюдаться рост быстрорастущих НТМБ (наиболее часто M.abscessus), что требует проведения идентификации молекулярными методами (с помощью масс- спектрометрии или молекулярно-генетическими методами).
Идентификацию H.influenzae следует проводить в соответствии с Рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам», 2021 г. https://www.antibiotic.ru/files/321/clrec-dsma2018.pdf, Методическими рекомендациями для микробиологов «Выделение, идентификация и определение чувствительности к антибиотикам Haemophilus influenzae», 2000 года [67,68].
Длительность инкубации первичного посева необходима сроком не менее 7 суток с ежедневным просмотром и изучением всех выросших видов колоний [69].
Идентификация микроорганизмов с использованием коммерческих тест-систем, может потребовать пролонгированного периода инкубации (до 48 часов).
Все микроорганизмы, выделенные из дыхательных путей от пациентов с МВ должны быть идентифицированы как минимум до рода, микроорганизмы, имеющие клиническое значение – до вида [70].
В случае выделения из образца микроорганизмов, идентификацию которых технически невозможно провести в лаборатории, необходимо сохранение культуры для ее последующей реидентификации с использованием масс-спектрометрии или молекулярно-генетических методов [71].
Определение чувствительности выделенной микрофлоры к антибактериальным препаратам и интерпретацию результатов исследования необходимо проводить в соответствии с актуальной версией рекомендаций по определению чувствительности микроорганизмов к антибактериальным препаратам или новых версий после их вступления в силу [67].
Бактерии, вызывающие хроническую инфекцию при муковисцидозе могут расти в виде смеси колониальных морфотипов одного и того же микроорганизма. Чувствительность различных морфотипов в пределах одного образца может значительно варьировать. Необходимо определение антибиотикорезистентности каждого выделенного морфотипа [67].
Определение чувствительности типичных штаммов S.aureus к противомикробным препаратам может быть выполнено диско-диффузионным методом, методом градиентной дмффузии, с использованием тест-систем, основанных на методе определения пограничных концентраций или методами серийных разведений (определение минимальной подавляющей концентрации (МПК)) [
67]. Определение чувствительности S.aureus ко всему перечню перечисленных для тестирования противомикробных препаратов следует проводить не чаще 2 раз в год. При всех последующих микробиологических исследованиях при выделении S.aureus следует проводить скрининг резистентности к β-лактамам у выделенного штамма с помощью цефокситина. [72].
Определение чувствительности штаммов P.aeruginosa. Для типичных штаммов P.aeruginosa тестирование может быть выполнено как диско-диффузионным методом, так и с использованием тест-систем, созданных на основе последовательных разведений как в варианте пограничных концентраций, так и серийных разведений с определением МПК, а также определение МПК методом градиента [73,74,75]. Определение чувствительности P.aeruginosa следует проводить отдельно для каждого морфотипа с указанием профиля чувствительности по каждому морфотипу. [76].
Для ингаляционных форм тобрамицина наряду с определением степени чувствительности P.aeruginosa следует определять значение МПК. [77].
Комментарии: Испанским советом по стандартизации чувствительности и резистентности к антибиотикам MENSURA (Mese Espanola de Normalizacion de la Suseptibilitad y Resistencia a los Antimicrobianos) в 2005 году пересмотрены и установлены более высокие точки отсечения для ингаляционных форм введения тобрамицина при определении чувствительности P. aeruginosa точки для чувствительных штаммов <64мг/л, для устойчивых штаммов >128мг/л, по сравнению со значением ≤4мг/л для чувствительных штаммов и >4 мг/л для устойчивых штаммов при парентеральном введении [78].
Определение чувствительности к колистину проводится методом МПК. МПК колистина следует определять только методом микроразведений в бульоне [67].
Следует учитывать, что критерии для определения категорий активности колистина по отношению к микробу основаны на сывороточной концентрации антибактериального препарата системного действия. В связи с широким применением ингаляционных форм препарата эти критерии теряют свою значимость, поскольку в случае ингаляции локальные концентрации действующих веществ многократно превышают те, которые можно достичь при парентеральном способе введения. В то же время к настоящему времени не определены критерии значения МПК для колистина при ингаляционном его применении. Использование критериев, основанных на сывороточных концентрациях, таким образом, может привести к ошибкам интерпретации результатов исследования чувствительности микроорганизмов для ингаляционных форм антибиотиков [2,77].
Определение чувствительности Burkholderia cepacia complex. По идеологии EUCAST не представляется возможным рекомендовать определение чувствительности бактерий B.cepacia complex для выбора противомикробных препаратов для терапии инфекций, вызванных представителями этой группы микроорганизмов. [67]. В случае необходимости определения чувствительности B.cepacia complex следует использовать методы и критерии, определенные актуальными стандартами CLSI (Clinical and Laboratory Standards Institute, Институт клинических и лабораторных стандартов). [67].
Определение чувствительности Stenotrophomonas maltophilia. При определении чувствительности штаммов S.maltophilia следует руководствоваться актуальной версией рекомендаций по определению чувствительности микроорганизмов к противомикробным препаратам [79].
Определение чувствительности Achromobacter spp. В настоящее время не определены стандарты определения чувствительности штаммов Achromobacter spp. При необходимости определения чувствительности A.xylosoxidans следует руководствоваться ФК/ФД (невидоспецифическими) пограничными значениями для МПК в соответствии с рекомендациями EUCAST либо согласно актуальной версии рекомендаций. [67].
При выдаче заключения по микробиологическому исследованию целесообразно указывать группу выделенных микроорганизмов в соответствии ранжированием бактерий по их клиническому значению при муковицидозе. В отчете о результате исследования материала от больного пациента с МВ рекомендуется указывать наличие мукоидных и немукоидных фенотипов P.aeruginosa [80].
При интерпретации результатов определения чувствительности микроорганизмов следует указывать стандарт и год издания, по которому проводилось исследование [67,81,82].
При интерпретации результатов определения чувствительности следует использовать пограничные значения EUCAST 10.0 для оценки результата по одной из трех категорий чувствительности:
Ч — Чувствительный при стандартном режиме дозирования: микроорганизм оценивается как «Чувствительный при стандартном режиме дозирования» в том случае, если уровень активности противомикробного препарата свидетельствует о высокой вероятности эффективности терапии при стандартном режиме дозирования.
У — Чувствительный при увеличенной экспозиции: микроорганизм оценивается как «Чувствительный при увеличенной экспозиции»*, если уровень активности препарата свидетельствует о высокой вероятности эффективности терапии при увеличении экспозиции препарата путем коррекции режима дозирования или благодаря его концентрации в очаге инфекции.
Р — Резистентный: микроорганизм оценивается как «Резистентный» при высокой вероятности терапевтической неудачи даже при увеличенной экспозиции препарата. *Экспозиция отражает зависимость влияния противомикробного препарата на возбудителя в очаге инфекции от пути введения, дозы, интервала дозирования, продолжительности инфузии препарата, а также его распределения и пути выведения.
Кроме этого, следует указывать в заключении, что интерпретация значений минимальной подавляющей концентрации как чувствительный /резистентный осуществляется на основании критериев, рассчитанных для сывороточных концентраций препарата при его внутривенном введении. При других путях применения препарата аналогичное значение минимальной подавляющей концентрации может быть интерпретировано иначе.
В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг» есть несколько услуг: микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы, микробиологическое (культуральное) исследование мокроты на аэробные и факультативно-анаэробные микроорганизмы, Микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы, Определение чувствительности микроорганизмов к противомикробным химиотерапевтическим препаратам дискодифузионным методом, Определение чувствительности микроорганизмов к противомикробным химиотерапевтическим препаратам методом градиентной диффузии, Определение чувствительности микроорганизмов к противомикробным химиотерапевтическим препаратам методом разведений, Определение чувствительности микроорганизмов к противомикробным химиотерапевтическим препаратам с использованием автоматических анализаторов, Определение чувствительности микроорганизмов к противомикробным химиотерапевтическим препаратам методом пограничных концентраций.
Пациентам с МВ с подозрением на микобактериоз, вызванный НТМБ необходимо исследование образцов диагностического материала как минимум один раз в год в динамике [1,2,6,22].
Показанием к исследованию диагностического материала на НТМБ служат: отрицательная клиническая и/или рентгенологическая динамика при отсутствии новых патогенов, отсутствие эффекта от проводимой антибактериальной терапии. В качестве диагностического материала используют: мокроту (или индуцированную мокроту), в случаях отсутствия мокроты – смыв с ротоглотки (СРГ), бронхоальвеолярный лаваж (БАЛ).
Для проверки подозрений, что пациент с МВ заражен микобактериями, в качестве диагностического материала используют мокроту или индуцированную мокроту (в исключительных случаях — исследование трахеального аспирата при невозможности получить мокроту/индуцированную мокроту. Следует помнить, что в данном случае эффективность выявления микобактерий очень низкая).
Для исследований на наличие НТМБ не следует использовать трансбронхиальную биопсию (ТББ) и взятие орофарингеальных мазков.
У пациентов, выделяющих мокроту в достаточном количестве, для исследования собирают ее утреннюю порцию. Достаточный объем исследуемой порции мокроты составляет 3 — 5 мл, в целях повышения информативности необходимо исследовать мокроту, которую собирают для исследования три дня подряд.
Значимыми критериями микобактериоза у пациентов с МВ являются следующие результаты материала из дыхательных путей: положительный результат на наличие кислотоустойчивых бактерий (КУБ) при микроскопии препаратов с окраской по Цилю-Нильсену или люминесцентными красителями (Микроскопическое исследование мокроты на микобактерии (Mycobacterium spp.), наличие роста НТМБ на питательных средах и подтверждение одного и того же вида микобактерий как минимум из двух образцов (Микробиологическое (культуральное) исследование мокроты на аэробные и факультативно- анаэробные микроорганизмы).
Тесты на лекарственную чувствительность НТМБ проводят исключительно методом, определяющим минимальную подавляющую концентрацию препарата (МПК) (А26.30.004 Определение чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам методом разведений).
С целью контроля эффективности химиотерапии не реже, чем раз в 1-3 месяца необходимо проводить посев мокроты на выявление НТМБ в диагностическом материале [83,84].
Критерием эффективного лечения является отсутствие роста микобактерий на питательных средах не менее чем в трех последовательно взятых образцах диагностического материала.
После завершения курса химиотерапии микобактериоза необходимо постоянное динамическое наблюдение за состоянием пациента и регулярное, не реже чем раз в 6 месяцев лабораторное обследование на наличие или отсутствие НТМБ в диагностическом материале.
Методы диагностики микобактериоза.
Необходимо исследование методом ПЦР для исключения наличия в исследуемом материале Mycobacterium tuberculosis complex (МТБК) (Молекулярно-биологическое исследование мокроты, бронхоальвеолярной лаважной жидкости или промывных вод бронхов на Mycobacterium tuberculosis complex (микобактерии туберкулеза)).
Методы микроскопии с окраской по Цилю-Нильсену или люминесцентными красителями настоятельно рекомендуется включать в алгоритм микробиологической диагностики микобактериальных инфекций.
Выделение культуры микробактерий НТМБ осуществляется исключительно в специализированных лабораториях фтизиатрической службы.
Посевы на жидкую питательную среду Бульон Миддлбрука 7H9 (в автоматической системе учета роста (Анализатор бактериологический для идентификации микроорганизмов ИВД (для in vitro диагностики), автоматический) (для культивирования микобактерий)) Продолжительность исследования 45 дней.
Посевы на плотные питательные среды Левенштейна-Йенсена, Финн-II используются как резервные диагностические методы. Продолжительность исследования 84 дня. Достоверная клиническая интерпретация результатов микробиологического обследования на наличие микобактерий достигается при обязательном соблюдении следующего правила: молекулярно-генетическое, микроскопическое и культуральное исследование должны производиться параллельно только из одной и той же пробы диагностического материала.
При выделении из респираторных образцов быстрорастущих НТМБ, следует направлять штаммы в микробиологическую лабораторию экспертного уровня для определения чувствительности к антибактериальным препаратам.
При первичном выделении В. cepacia complex, Achromobacter spp., Ralstonia spp., Pandorea spp., Cupriavidus spp., Inquilinus spp., идентификацию рекомендуется использовать масс-спектрометрию или молекулярно-генетические методы с целью диагностики наличия перечисленных микроорганизмов у пациента с МВ [71].
(УУР – C, УДД – 5).
Комментарий: в Приказе Минздрава России от 13 октября 2017 г № 804н «Об утверждении номенклатуры медицинских услуг» данные услуги не представлены.
- Рекомендуется микологическое исследование биоматериала пациентам с МВ с подозрением на грибковые поражения легких и для контроля проводимой терапии: мокрота, промывные воды бронхов, бронхоальвеолярный лаваж, биоптаты, операционный материал (прямая микроскопия биоматериала, метод люминесцентной (флуоресцентной) микроскопии с окраской калькофлюором белым, посев биоматериала на агаризованную среду Сабуро в модификации Эммонса), для идентификации патогена/-ов и определения чувствительности выделенных микромицетов [17,39,85,86].
(УУР – С, УДД – 5).
Комментарии: в соответствии с Приказом Минздрава России от 13 октября 2017 г № 804н «Об утверждении номенклатуры медицинских услуг» есть несколько услуг:микроскопическое исследование мокроты на грибы (дрожжевые и мицелиальные), микробиологическое (культуральное) исследование мокроты на мицелиальные грибы, микроскопическое исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелиальные), микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелиальные).
— Посев на грибы и микроскопическое исследование – по показаниям, кратность по потребности, в том числе, при контроле проводимого лечения.
— Центрифугирование БАЛ и бронхиального аспирата, а также применение муколитиков повышает эффективность диагностики.
— Микроскопия и посев мокроты позволяют выявить колонизацию дыхательных путей Aspergillus spp. у 20–60% пациентов с АБЛА.
— При микроскопии и посеве БАЛ или мокроты Aspergillus spp. выявляют у 25 – 80% пациентов с ХАЛ. Необходимы повторные исследования с применением специфических микологических методов окраски и питательных сред. Определение вида Aspergillus играет роль при назначении противогрибковых препаратов для системного применения (антимикотиков) (редкие виды могут быть устойчивы к азолам).
— Эффективность микроскопического исследования увеличивается после обработки респираторных субстратов калькофлуором белым. Посев на микологические среды следует проводить при температуре 300°С и 370°С, продолжительность инкубации не менее 5 суток. Количественные показатели посева респираторных биосубстратов не позволяют отличить колонизацию дыхательных путей от инфекции.
- Рекомендуется проведение лабораторных исследований для диагностики аллергического бронхолегочного аспергиллеза: уровень общего иммуноглобулина Е (IgE), специфические IgE и IgG к Aspergillus fumigates. При подозрении на ХАЛ – рекомендованы те же исследования и определение галактоманнана в крови (метаболита Aspergillus fumigates) (определение метаболитов грибов) [1,2,17,22,39,85,86].
(УУР – C, УДД – 5).
Комментарий:
— Эозинофилию периферической крови > 0,4×109/л обычно выявляют в острой стадии и при обострении АБЛА, во время ремиссии и в стадии фиброза количество эозинофилов может быть нормальным.
— Для АБЛА характерно значительное увеличение уровня общего IgE в сыворотке крови, обычно более 500 мкг/л. Во время ремиссии в поздних стадиях содержание общего IgE в сыворотке крови снижается, хотя остается выше нормальных показателей. Повышение уровня общего IgE – ранний признак обострения АБЛА, который возникает до клинических проявлений заболевания.
— Специфические IgE и IgG к Aspergillus выявляют при дебюте или обострении АБЛА.
— Чувствительность определения специфического Aspergillus IgG в сыворотке крови у пациентов с ХАЛ составляет около 90%. При этом у 50% пациентов с МВ выявляют повышение специфического Aspergillus IgG в сыворотке крови без клинико-рентгенологических признаков ХАЛ.
— Изолированное повышение уровня специфического Aspergillus IgG в сыворотке крови без дополнительных критериев диагностики ХАЛ не является основанием для проведения антимикотической терапии.
— Содержание общего IgE при ХАЛ может быть умеренно повышено (100–500 Ед/л), иногда определяют специфический Aspergillus IgE.
— При ХАЛ у пациентов с МВ эффективно определение метаболитов грибов (галактоманнана (компонента клеточной стенки Aspergillus spp. тест Platelia Aspergillus, Bio-Rad) в БАЛ.
— Специфичность и чувствительность определения галактоманнана в БАЛ превышают 80%, что выше результатов исследования сыворотки крови. Оптимальный диагностический индекс оптической плотности теста Platelia Aspergillus в БАЛ не определен: при использовании показателя 0,5 — повышается чувствительность метода, при 1,0 — специфичность.
В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг» есть несколько услуг: исследование уровня общего иммуноглобулина Е в крови, определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови, комплекс исследований для выявления аллергена, определение метаболитов грибов).
Пациентам с МВ следует ежегодно опрделять концентрацию общего IgE в сыворотке крови.
Если уровень общего IgE составляет 200–500мкг/л и есть подозрение на АБЛА, следует повторить анализ через 1–3 месяца;
После начала лечения АБЛА необходим мониторинг с клинической оценкой, уровнем общего IgE в сыворотке, спирометрией (исследование неспровоцированных объемов и потоков) и рентгенографией грудной клетки (рентгенография легких). Во время лечения концентрацию общего IgE в сыворотке следует измерять каждые 6–8 недель.
В период ремиссии мониторинг общего IgE в сыворотке следует проводить каждые 3 месяца в течение первого года, а затем каждые 6 месяцев.
Измерение Aspergillus-специфических IgE и IgG (определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови) во время лечения не целосообразно, поскольку их уровни не коррелируют со снижением общего сывороточного IgE или клинических или рентгенологических проявлений)
- Рекомендовано пациентам с МВ с подозрением на АБЛА для исключения/подтверждения микогенной сенсибилизации проведение кожной пробы с антигеном Aspergillus (накожные исследования реакции на аллергены) [39].
(УУР – С, УДД – 5).
Комментарий: В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг»: накожные исследования реакции на аллергены.
Кожная проба с антигеном Aspergillus отличается высокой диагностической чувствительностью, но низкой специфичностью. Положительные результаты кожной пробы нередко выявляют у больных муковисцидозом без АБЛА.
- Рекомендуется патологоанатомическое исследование биопсийного (операционного) материала тканей легкого у пациентов с МВ и ХАЛ с импрегнацией серебром по Гомори–Грокотт с целью диагностики нодулярного аспергиллеза, а также исключения новообразования легких, туберкулеза [17,85,86].
(УУР – С, УДД – 5).
Комментарии: В соответствии с Приказом Минздрава России от 13 октября 2017 г № 804н «Об утверждении номенклатуры медицинских услуг»: патолого-анатомическое исследование биопсийного (операционного) материала тканей легкого; патолого-анатомическое исследование биопсийного (операционного) материала тканей легкого с применением гистобактериоскопических методов, микробиологическое (культуральное) исследование биоптата на мицелиальные грибы.
— При гистологическом исследовании биоптата (патолого-анатомическом исследовании биопсийного материала) при ХАЛ из каверны или зоны воспаления определяют гифы Aspergillus, признаки хронического воспаления. Основное назначение биопсии очага поражения – диагностика нодулярного аспергиллеза, а также исключение новообразования легких, туберкулеза и пр. Отсутствие гиф Aspergillus в биоптате из очага поражения не исключает диагноза ХАЛ при наличии других критериев диагностики [15].
- Рекомендуется микробиологическое исследование отделяемого из околоносовых пазух (ОНП) (микробиологическое (культуральное) исследование смывов из околоносовых полостей на аэробные и факультативно-анаэробные микроорганизмы, микробиологическое (культуральное) исследование пунктатов из околоносовых полостей на неспорообразующие анаэробные микроорганизмы) для идентификации патогена/-ов и определения его (их) чувствительности к антимикробным препаратам при ХРС на фоне муковисцидоза [87,88].
(УУР – C, УДД – 4).
Комментарий: колонизация синегнойной палочкой обычно начинается именно с ОНП; в более раннем возрасте и достоверно чаще имеет место у больных МВ с полипозным ХРС. Материал должен быть получен на стерильный марлевый тампон из верхнечелюстных пазух методом диагностической пункции пазухи, интраоперационно путем забора экссудата из верхнечелюстных пазух или при зондировании через расширенное соустье у пациентов после эндоскопического ринохирургического лечения.
Биохимическое исследование крови
- Рекомендовано проведение всем пациентам с МВ биохимического анализа крови общетерапевтического (общий белок, альбумин, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня холестерина в крови, исследование уровня триглицеридов в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня хлоридов в крови, определение активности амилазы в крови, определение активности липазы в сыворотке крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня С- реактивного белка), ежегодно, по показаниям — чаще. Исследование проводится с целью контроля состояния печени, функции поджелудочной железы, электролитного обмена и хронического воспаления согласно показаниям (Табл. 10, раздел 6 «Организация оказания медицинской помощи») [2,62].
(УУР – C, УДД – 5).
Комментарий: контроль электролитов при псевдо-Барттер синдроме проводить по потребности.
- Рекомендовано исследование кислотно-основного состояния крови (исследование кислотно-основного состояния и газов крови, исследование уровня буферных веществ в крови), уровней натрия и калия при подозрении на синдром Псевдо-Барттер у пациентов с МВ и при контроле терапии синдрома Псевдо-Барттер [2,89,90].
(УУР – С, УДД – 5).
Комментарий: исследование кислотно-основного состояния и газов крови, исследование уровня буферных веществ в крови проводится также при других состояниях (например, при мекониевом илеусе, синдроме дистальной интестинальной обструкции, при хирургических вмешательствах и обострении бронхолегочного процесса, потребовавшего госпитализации)
- Рекомендовано выполнение коагулограммы (ориентировочного исследования системы гемостаза) всем пациентам при первичной диагностике МВ, и при наличии цирроза печени 1 раз в 6-3 мес. с целью контроля белковосинтетической функции печени и своевременного предотвращения геморрагических осложнений [22].
(УУР – C, УДД – 5).
Комментарий: также исследование коагулограммы может потребоваться при диагностике и терапии мекониевого илеуса, перед хирургическими вмешательствами и перед постановкой порт-системы (порт инфузионный/инъекционный, имплантируемый***) согласно соответствующим рекомендациям.
В качестве скрининг-метода могут проводиться: Исследование времени свертывания нестабилизированной крови или рекальцификации плазмы неактивированное, Исследование времени кровотечения.
В некоторых ситуациях может потребоваться определение тромбинового времени в крови, определение активности антитромбина III в крови, исследование активности и свойств фактора Виллебранда в крови.
- Рекомендовано исследование уровня глюкозы в крови всем пациентам с МВ 1 раз в 6 мес. с целью контроля эндокринной функции поджелудочной железы, своевременной диагностики МЗСД [50,91].
(УУР – C, УДД – 5).
- Рекомендовано в качестве скрининга для своевременной диагностики МЗСД проведение орального глюкозотолерантного теста (ОГТТ, проведение глюкозотолерантного теста) с нагрузкой глюкозой (1,75 г глюкозы/кг, не более 75 г), (точки контроля – натощак, через 60 минут, через 120 минут) всем детям старше 10 лет (по показаниям раньше) ежегодно в период клинической стабильности [50,92,93].
(УУР – C, УДД – 5).
Комментарий: Отклонения, выявленные в ходе единичного орального глюкозотолерантного теста, должны быть подтверждены повторным тестом. Возможно для диагностики использовать непрерывный мониторинг уровня глюкозы.
Определение гликемии натощак и через 2 часа после приема пищи в течение первых 48 часов и/или ОГТТ чаще проводятся в следующих случаях:
- обострение легочного заболевания,
- внутривенная антибактериальная терапия,
- начало приема кортикостероидов для системного применения,
- энтеральное кормление через зонд или гастростому,
- планирование беременности и период беременности (12-16 нед и 24 -28 нед) и через 6- 12 недель после беременности,
- плановая трансплантация органов,
- оперативное вмешательство,
- наличие симптомов диабета [50,91].
- Использование гликированного гемоглобина (HbA1c) в качестве скрининг-теста не рекомендуется в связи с недостаточной информативностью для пациентов с МВ по этим показаниям [50,92].
(УУР – C, УДД – 5).
Комментарий: у пациентов с муковисцидозом нормальный профиль гликированного гемоглобина не исключает наличие сахарного диабета. Исследование может быть назначено с целью коррекции инсулинотерапии у пациентов с МВ и МЗСД, а также пациентам с нарушением толерантности к глюкозе [94]. При нарушении толерантности к глюкозе кроме того исследуется уровень С-пептида в крови [95]. По показаниям могут исследоваться трехдневный гликемический профиль
- Рекомендуется пациентам с МВ и МЗСД проведение регулярного контроля углеводного обмена (определение уровня глюкозы в крови не менее 3 раз в день) с целью самостоятельного мониторирования состояния. Измерение гликированного гемоглобина рекомендуется ежеквартально с целью коррекции инсулинотерапии у пациентов с МВ и МЗСД [50,92].
(УУР – C, УДД – 5).
Комментарии: целевое значение уровня гликированного гемоглобина на фоне лечения МЗСД составляет <7%.
- Рекомендовано для комплексной диагностики остеопороза и диагностики патологии почек пациентам с МВ определение уровня общего и ионизированного кальция, фосфора крови, креатинина сыворотки крови и клиренса креатинина (расчет по формуле Кокрофта-Голта), щелочной фосфатазы сыворотки крови [2].
(УУР – C, УДД – 5).
Комментарии: Изменения лабораторных показателей не являются критериями постановки диагноза остеопороза. Лабораторные методы используются по показаниям для проведения дифференциальной диагностики остеопороза с другими заболеваниями скелета, оценки безопасности назначения препаратов, влияющих на минерализацию костей (антиостеопоротических препаратов), анализа процессов формирования и резорбции костной ткани.
- У всех пациентов с МВ рекомендовано ежегодное измерение уровня 25-OH витамина Д в крови, предпочтительнее летом и зимой, с целью своевременного выявления дефицита витамина D, подбора дозы витамина D и, соответственно, профилактики остеопороза [96].
(УУР – C, УДД – 5).
Комментарий: Нормальный уровень 25(ОН)D сыворотки крови — более 30 нг/мл (75 нмоль/л) и менее 100 нг/мл (250 нмоль/л).
Исследование 1,25 (ОН)-D не рекомендовано [96].
Рабочая группа Международного Фонда Остеопороза (International Osteoporosis Foundation) и Международной Федерации Клинической Химии и Лабораторной Медицины (International Federation of Clinical Chemistry and Laboratory Medicine) рекомендует для исследования костного обмена ограничиться двумя маркерами сыворотки крови: N-концевые пропептиды проколлагена I типа (P1N -маркер костеообразования) сыворотки крови и С- концевые телопептиды молекул коллагена I типа, связанные поперечными сшивками (CTX- маркер резорбции кости) [97]. Оценка этих маркеров может проводиться у взрослых пациентов для ранней оценки (через 3 мес.) эффективности антирезорбтивной (CTX сыворотки) или костноанаболической (P1NP сыворотки) терапии.
- Рекомендуется проводить мониторинг Исследования уровня железа сыворотки крови (ежегодно, по показаниям — чаще) с целью выявления дефицита железа и/или хронического воспаления [62].
(УУР – C, УДД – 5).
- Рекомендуется проводить мониторинг уровней жирорастворимых витаминов (A, E, K) и витамина В12 в сыворотке крови всем пациентам с МВ, по показаниям с целью своевременного выявления их недостаточности и адекватной коррекции терапии (Табл. 9, Приложение 7) [2,62].
(УУР – C, УДД – 5).
Комментарий:
Таблица 9. Нормативы уровней витаминов в сыворотке крови пациентов с МВ
| Витамин А (ретинол) | 30-72 нг/мл |
|
Витамин Е α-токоферол/холестерин |
>0,7 мг/дл >5,4 мг/г |
| Витамин К (менадиона натрия бисульфит) | Протромбиновое время |
| Витамин В12 (Цианокобаламин*) | 187-883 пг/мл |
* рекомендуется определять у пациентов с МВ с синдромом короткой кишки, после обширной резекции кишечника.
Низкие уровни жирорастворимых витаминов регистрируются практически у всех пациентов, несмотря на адекватную заместительную терапию.
Показано, что умеренно повышенные уровни ретинола (до 110 мг/дл) в сыворотке крови положительно коррелируют с ОФВ1 (ОФВ1 >80% у 90% из таких пациентов), независимо от возраста, панкреатической функции и нутритивного статуса, без каких-либо признаков токсичности.
У нелеченных пациентов с МВ геморрагический синдром может манифестировать витамин-К недостаточностью. У новорожденных и грудных детей она может проявиться необъяснимой геморрагической пурпурой, интестинальными кровотечениями, длительной кровоточивостью в местах инъекций. Старшие дети, находящиеся на интенсивной антибактериальной терапии или с сопутствующим поражением печени, также склонны к нарушению процессов коагуляции, даже на фоне приема витамина К.
- Рекомендовано всем пациентам мужского пола в возрасте старше 15 лет с муковисцидозом проведение спермограммы и молекулярно-генетического (анализ гена CFTR, если не был ранее выполнен) исследования с целью определения прогноза и тактики решения вопроса репродукции [98,100,101].
(УУР – C, УДД – 4).
Комментарии: спермограмму также следует выполнять пациентам мужского пола с установленным диагнозом МВ в процессе динамического наблюдения при отсутствии азооспермии с частотой, в среднем, 1 раз в год.
- Рекомендовано всем пациентам мужского пола в возрасте старше 15 лет с муковисцидозом проведение гормонального исследования – определение уровня общего тестостерона и стероидсвязывающего глобулина (исследование уровня глобулина, связывающего половые гормоны, в крови) в сыворотке крови с целью диагностики гипогонадизма [102,103,104].
(УУР – В, УДД – 3).
Комментарии: при выявлении эндокринологических нарушений- наблюдение 1 раз в год и лечение у врача-эндокринолога. При отсутствии эндокринологических нарушений-с частотой не реже 1 раз в 3 года.
Методы подбора патогенетической терапии (ивакафтор+лумакафтор)
- При назначении препарата ивакафтор+лумакафтор рекомендуется иметь данные о гетерозиготном носительстве обоими родителями мутации F508del (согласно инструкции). При отсутствии такой информации рекомендуется провести молекулярно-генетическую диагностику с целью выяснения гетерозиготного носительства родителями варианта F508del. Если родители (или хотя бы один из родителей) по каким-либо причинам не доступны для проведения данного исследования, то рекомендуется пациенту дополнительно провести анализ с целью исключения наличия протяженной делеции в области мутации F508del, то есть для исключения гемизиготности по данной мутации. Рекомендуется также исключить носительство варианта L467F гена CFTR (NM_000492.3:c.1399C>T; NP_000483.3:p.(Leu467Phe)) в составе комплексного аллеля с мутацией F508del, доказанно приводящего к резистентности к терапии [105,106,107,108,109,110].
(УУР – С УДД – 4).
- Рекомендуется применение форсколинового теста на кишечных органоидах, полученных от пациента в результате биопсии прямой кишки с целью определения показаний к таргетной терапии:
-
При редких мутациях гена CFTR с целью оценки возможности проведения патогенетической терапии [111,112,113,114].
- При отсутствии эффекта от (согласно инструкции) через 6 месяцев с начала терапии
- Всем пациентам — носителям комплексного аллеля для выяснения чувствительности к ивакафтору и лумакафтору [115,116,117]
(УУР – C, УДД – 5).
Комментарии:
При получении культур органоидов и выполнении форсколинового теста должны использоваться протоколы, разработанные под руководством Д. Бекмана [111, 112, 113, 114] и описанные в отечественной работе [118].
2.4 Инструментальные диагностические исследования
Методы визуализации легких
- Рекомендуется проведение рентгенографии органов грудной клетки (Рентгенография легких, Рентгенография легких цифровая) пациентам с подозрением на муковисцидоз и пациентам с муковисцидозом с целью определения характера и объема поражения легочной ткани [1,2,22].
(УУР – C, УДД – 5).
Комментарии: рентгенография может выявить такие признаки, как деформация и усиление легочного рисунка, пневмофиброз, перибронхиальная инфильтрация, консолидация (ателектазы), бронхоэктазы, буллы, выявить проявления бронхиальной обструкции: локальные участки вздутия легочной ткани, увеличение ретростернального пространства, уплощение диафрагмы, а также кифоз, утолщение бронхиальных стенок, слизистые пробки. Пациентам с муковисцидозом проводится по показаниям, в среднем 1 раз в 2 года (Приложение 7).
Данный метод может быть недостаточно информативен для точного описания характера изменений в легких, но имеет меньшую лучевую нагрузку. До настоящего времени в разных центрах, курирующих пациентов с муковисцидозом, в том числе зарубежных, для динамического наблюдения за пациентом чаще используется рентгенография, в ряде центров — компьютерная томография [22].
- Рекомендуется проведение компьютерной томографии (КТ) органов грудной полости пациентам с подозрением на муковисцидоз и пациентам с муковисцидозом с целью определения характера и объема поражения легочной ткани [1,2,22].
(УУР – C, УДД – 5).
Комментарий: В настоящее время компьютерная томография является основным методом диагностики изменений в легких при МВ.
Компьютерная томография органов грудной полости (КТ) — экспертная методика для детализации изменений. Проводится низкодозная компьютерная томография (НДКТ) – снижение силы тока до 1 мА/кг массы для детей и молодых взрослых весом <50 кг в сочетании с напряжением на трубке 100 кВ. Выполняется на глубине вдоха, при невозможности задержки дыхания, детям до 3-х лет – в условиях седации. 1 раз в 2 года, при обострении – внеочередное исследование. Функциональное КТ-исследование органов грудной полости «на выдохе» для оценки бронхиальной обструкции при невозможности выполнения КИФВД.
— КТ-ангиография органов грудной полости (КТ + внутривенное болюсное контрастирование) / перфузионная сцинтиграфия легких при подозрении на ТЭЛА, перед трансплантацией легких, при кровохарканьи)
— Компьютерная томография является, в том числе, основным методом диагностики аспергиллеза при МВ. Компьютерная томография легких органов грудной клетки может выявить такие признаки, как деформация и усиление легочного рисунка, пневмофиброз, перибронхиальную инфильтрацию, ателектазы, бронхоэктазы, буллы.
— При АБЛА на КТ легких выявляют «летучие» инфильтраты в легких, бронхоэктазы, расширение бронхов из-за скопившейся слизи («симптом перчатки»), так называемые симптомы «кольца» и «трамвайных путей», представляющие собой утолщение стенок периферических бронхов в результате перибронхиальной инфильтрации и фиброза, возможны ателектазы. Основными рентгенологическими признаками ранних стадий АБЛА являются двусторонние инфильтраты, исчезающие после применения кортикостероидов для системного применения; признаки хронического перибронхиального воспаления и мукоидных пробок. Позднее выявляют двусторонние, проксимальные, чаще верхнедолевые бронхоэктазы; фиброз и утолщение плевры. КТ – более чувствительный метод выявления указанных признаков, чем рентгенография.
— У пациентов с ХАЛ на КТ обычно выявляют комплекс бронхоэктазов, окруженный зоной воспаления, иногда содержащих аспергилломы. КТ признак аспергилломы: одиночная полость с содержимым, смещающимся при перемене положения тела (симптом «погремушки»), с характерной прослойкой воздуха (симптом «серпа») [17,39,85,86].
- Рекомендовано проведение магнитно-резонансной томографии органов грудной клетки пациентам с МВ в качестве уточняющего метода для снижения лучевой нагрузки при многократном контроле воспалительного процесса. До 7 лет – в условиях седации, после – на свободном дыхании [119,120].
(УУР – C, УДД – 5).
Методы визуализации околоносовых пазух
- Рекомендуется проведение компьютерной томографии ОНП (конусно-лучевая или мультиспиральная) или МРТ ОНП при первичной оценке патологического процесса в околоносовых пазухах и при подготовке к каждому ринохирургическому вмешательству [121,122].
(УУР – С, УДД – 4).
Комментарий: КТ ОНП производится в аксиальной плоскости с реконструкцией изображения в коронарной и сагиттальной проекциях. Детям не рекомендуется выполнение КТ ОНП без клинических показаний (с целью динамического наблюдения), т.к. это в значительной мере увеличивает суммарную лучевую нагрузку (в связи с необходимостью периодического выполнения КТ органов грудной клетки). Взрослым КТ ОНП проводится 1 раз в 1-2 года или чаще по показаниям. В значительной мере патогномоничными для ХРС при МВ КТ-признаками являются: деминерализация и медиализация крючковидного отростка в сочетании с заполнением верхнечелюстной пазухи плотным содержимым; гипоплазия (вплоть до агенезии) лобных и клиновидных пазух; медиализация («медиальное выбухание») латеральной стенки полости носа; более быстрый рост задних клеток решетчатого лабиринта по сравнению с передними. Должны оцениваться: наличие полипов носа (степень ПН I-III, согласно классификации Johansen LV, 1993), послеоперационные изменения. Рентгенография ОНП не является информативным методом диагностики ХРС при МВ. МРТ околоносовых пазух также не может быть альтернативой КТ, т.к. не позволяет оценить состояние костных структур.
В соответствии с Приказом Минздрава России 13 октября 2017 г. № 804н от «Об утверждении номенклатуры медицинских услуг»: компьютерная томография придаточных пазух носа, гортани, спиральная компьютерная томография придаточных пазух носа, магнитно-резонансная томография околоносовых пазух.
Абдоминальная рентгенография
- Рекомендовано проведение абдоминальной рентгенографии (Обзорная рентгенография органов брюшной полости) при мекониевом илеусе и синдроме дистальной интестинальной обструкции (СДИО) с целью диагностики непроходимости кишечника [123,124].
(УУР –С, УДД -5).
Комментарий: обзорная рентгенография органов брюшной полости проводится в вертикальном положении пациента, в прямой проекции. С той же целью при синдроме дистальной интестинальной обструкции может применяться компьютерная томография органов брюшной полости.
Методы диагностики остеопороза
Определение исходной МПК при проведении рентгеноденситометрии назначается детям старше 8 лет. Раньше — при наличии таких факторов риска как:
- низкий ИМТ (<90% от идеального ИМТ),
- активность легочного заболевания (ОФВ1 <50% должной),
- длительная (3 мес и более) терапия пероральными кортикостероидами для системного применения,
- задержка полового созревания, гипогонадизм;
- наличии низкоэнергетических переломов в анамнезе.
Повторные исследования рекомендовано проводить детям и взрослым до 50 лет:
- приблизительно через 5 лет, если Z-критерий выше -1 SD и пациент клинически стабилен,
- каждые 2 года, если Z-критерий между -1 и -2 SD,
- каждый год, если Z-критерий -2 SD и ниже или есть низкоэнергетические переломы в анамнезе или имеются значимые факторы риска остеопороза.
У женщин в постменопаузе и мужчин 50 лет и старше рекомендуется проведение остеоденситометрии приблизительно:
- каждые 5 лет, если Т-критерий выше -1 SD,
- каждые 2 года, если Т-критерий между -1 и -2,5 SD,
- ежегодно, если Т-критерий ≤ -2,5 SD или имеются значимые факторы риска остеопороза.
Остеоденситометрия должна быть проведена до назначения антиостеопоротической терапии [2].
- Для оценки динамики МПК на фоне лечения остеопороза рекомендовано проводить рентгеноденситометрию (DXA) 1 раз в 6-12 мес у детей старше 8 лет и 1 раз в 12 мес у взрослых [36,125,126].
(УУР – С, УДД – 5).
Комментарий: рентгеноденситометрию желательно проводить на одном и том же аппарате (денситометре костном рентгеновском) одним и тем же специалистом.
Рентгенография костей скелета пациентам с МВ для диагностики остеопороза не проводится, применяется при переломах [36].
- У детей и подростков с МВ рекомендуется проводить рентгеноденситометрию поясничного отдела позвоночника в передне-задней проекции (от 0 лет) и по программе «все тело» (с 3 лет по показаниям), исключая голову из расчетов костной минеральной плотности с целью своевременного выявления снижения МПК и коррекции выявленных изменений [51]
(УУР – С, УДД – 5).
Комментарии: Исследование МПК проксимального отдела бедра у детей и подростков не проводится в связи вариабельностью развития скелета.
У детей с задержкой линейного роста и развития результаты МПК должны анализироваться с учетом абсолютного роста или ростового возраста, или сравниваться с соответствующими педиатрическими базами данных, включающих специфические для возраста, пола и возраста Z- критерии [51,127].
- У взрослых пациентов с МВ рекомендуется проводить остеоденситометрическое исследование (рентгеноденситометрию) поясничного отдела позвоночника в передне-задней проекции и с 20 лет — проксимального отдела бедренной кости (анализируется область шейки бедра (Neck) и общий показатель бедра (TotalHip), для заключения выбирается наименьшее значение Z- или Т-критерия) с целью своевременной диагностики нарушения костной минерализации [36,127].
(УУР – С, УДД – 5).
Определение функции внешнего дыхания
- Рекомендовано при подозрении на МВ и у пациентов с МВ исследовать функцию внешнего дыхания: спирометрия – в среднем каждые 3 месяца (исследование неспровоцированных дыхательных объемов и потоков, при необходимости – дополнительно исследование дыхательных объемов с применением лекарственных препаратов), бодиплетизмография – по показаниям, в среднем — ежегодно с целью определения и динамического контроля легочной функции, определения обратимости обструкции при ее наличии (при отсутствии возрастных или иных противопоказаний) [1,2,22].
(УУР – C, УДД – 5).
Комментарий: исследование функции внешнего дыхания (спирометрия) возможно у детей с 5-6 лет, в том случае, если пациент может выполнить маневр форсированного выдоха, диагностическая ценность исследования у детей младше 5 лет ниже. Спирометрия позволяет косвенно оценить легочные объемы, бодиплетизмографию проводят для более точной оценки легочных объемов по показаниям.
Наиболее часто у пациентов с МВ выявляются обструктивные и рестриктивные нарушения вентиляции (в зависимости от объема и характера поражения бронхиального дерева).
При исследовании ФВД на ранних стадиях АБЛА обычно выявляют признаки бронхиальной обструкции, по мере прогрессирования заболевания – сочетание обструктивных и рестриктивных нарушений.
В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг»: исследование неспровоцированных дыхательных объемов и потоков, исследование дыхательных объемов с применением лекарственных препаратов, бодиплетизмография.
- Рекомендовано проведение пульсоксиметрии и/или исследование газового состава крови (исследование уровня кислорода крови, исследование уровня углекислого газа в крови) всем пациентам с подозрением на МВ и всем пациентам с МВ при каждой госпитализации, по показаниям (обострение хронического бронхолегочного процесса, наличие дыхательной недостаточности, требующей оксигенотерапии) – чаще [2,128,129].
(УУР – С, УДД – 5).
Ультразвуковые методы исследования
- Рекомендовано проведение ультразвукового исследования органов брюшной полости и печени (ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование печени, ультразвуковое исследование гепатобилиарной зоны) всем пациентам с подозрением на муковисцидоз и пациентам с муковисцидозом, особое внимание уделять структуре поджелудочной железы, определять тип кровотока в печени (допплерография сосудов портальной системы, дуплексное сканирование сосудов печени) с целью выявления изменений, характерных для данного заболевания и их динамики [1,2,22].
(УУР – C, УДД – 5).
Комментарий: наличие линейного кровотока в печени свидетельствует о формировании фиброза. Целесообразно сопоставить с данными фиброэластометрии.
- Рекомендовано проведение фиброэластометрии печени (эластометрия печени) всем пациентам с МВ с целью оценки степени выраженности фиброза по шкале METAVIR (Приложение Г1) [2, 22, 130].
(УУР – A, УДД –1).
Комментарии: исследование также целесообразно назначать пациентам с подозрением на МВ при наличии неясного поражения печени.
- Рекомендовано всем пациентам мужского пола в возрасте старше 15 лет с муковисцидозом выполнение урологического/андрологического обследования с проведением ультразвукового исследования половых органов (УЗИ органов мошонки, Ультразвуковое исследование предстательной железы трансректальное, Ультразвуковое исследование органов малого таза (комплексное) для выявления структурных и морфологических изменений [98,104,119,131].
(УУР – С, УДД – 4).
Комментарии: при наличии нарушений- повторное обследование 1 раз в год, при отсутствии нарушений- по мере необходимости, но не реже 1 раза в 3 года
- Рекомендовано регулярное периодическое эхокардиографическое исследование (эхокардиография, Эхо-КГ) с допплеровским анализом (измерение градиента давления на легочной артерии) у пациентов с МВ, так как при этой патологии, особенно при распространенном поражении, возможно развитие легочной гипертензии и формирование легочного сердца [2].
(УУР – C, УДД – 5).
Комментарий: средняя частота проведения Эхо-КГ – 1 р/год (представлена в Приложении 7).
Электрокардиография
- Рекомендовано проведение электрокардиографии пациентам с муковисцидозом при Псевдо-Барттер синдроме с целью контроля влияния электролитных нарушений на сердечную деятельность, перед началом терапии ингибиторами протонного насоса, препаратами против НТМБ, при длительном применении азитромицина** по другим показаниям, на фоне терапии высокими дозами селективных β2-адреномиметиков (2 недели) с целью оценки интервала QT [89, 132]
(УУР – C, УДД – 4).
Эндоскопические методы исследования
- Рекомендовано проведение трахеобронхоскопии пациентам с муковисцидозом в случаях необходимости проведения дополнительного микробиологического исследования жидкости бронхоальвеолярного лаважа, с санационной целью при попытке расправить ателектаз доли легкого в случае неэффективности проведения консервативной терапии [1,2,17,85,86].
(УУР – C, УДД – 5).
Комментарий:
— Трахеобронхоскопия с санационной целью рассматривается в клинических случаях, когда стандартная консервативная терапия ателектаза (ингаляции Дорназой альфа**, кортикостероидами для системного применения (Преднизолон**)) не эффективна, и требуется подтверждение идентификации микробного пейзажа пациента с определением чувствительности к антимикробным препаратам.
— Высокий риск развития трахеобронхита при аспергиллезе требует проведения ранних бронхоскопий с последующим лабораторным исследованием БАЛ. Критерием диагностики аспергиллезного трахеобронхита является выявление при бронхоскопии специфических изменений (эритема, изъязвления, псвдомембранозные изменения).
В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг»: трахеобронхоскопия, видеотрахеобронхоскопия.
- Рекомендуется проведение эндоскопии полости носа (эндоскопическая эндоназальная ревизия полости носа, носоглотки) пациентам с МВ по показаниям: при необходимости оценки выраженности хронического риносинусита, степени назального полипоза, уточнения показаний к ринохирургическому лечению, оценки результатов эндоназальных эндоскопических хирургических вмешательств [133,134,135,136].
(УУР – С, УДД – 4).
Комментарий: эндоскопия полости носа выполняется оториноларингологом. Частота исследования определяется индивидуально в зависимости от течения ХРС.
- Фиброэзофагогастродуоденоскопию (эзофагогастродуоденоскопию) рекомендуется проводить всем пациентам с МВ с циррозом печени для контроля варикозно расширенных вен пищевода (ВРВП) 1 раз в 6-12 мес, при подозрении на ГЭРБ, эрозивно-язвенные поражения, воспалительные заболевания слизистой пищевода и желудка [2].
(УУР – С, УДД – 5).
- Ректороманоскопия с биопсией рекомендуется по показаниям пациентам с подозрением на МВ для проведения измерения разности кишечных потенциалов [2,137,138].
(УУР – С, УДД – 5).
Инструментальная диагностика мекониевого илеуса
- Рекомендовано проведение обзорной рентгенографии грудной и брюшной полости в прямой проекции вертикальном положении пациентам с МВ и подозрением на мекониевый илеус с целью оценки состояния органов брюшной полости [139].
(УУР – С, УДД – 5).
- Пациентам с подозрением на мекониевый илеус рекомендуется УЗИ брюшной полости для оценки скорости кровотока и индекс резистентности на сосудах брыжейки в различных уровнях, определения наличие и характер свободной жидкости в межпетлевом пространстве, латеральных каналах, малом тазу (ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковая допплерография сосудов брыжейки, ультразвуковое определение жидкости в брюшной полости, ультразвуковое исследование органов мошонки, ультразвуковое исследование органов малого таза (комплексное)) [139].
(УУР – С, УДД – 5).
Комментарий: исследование рекомендуется проводить врачом ультразвуковой диагностики совместно с врачом-детским хирургом.
- Рекомендуется проведение рентгеноконтрастных методов исследования при подозрении на мекониевый илеус для установления диагноза, оценки уровня поражения, определения объема контрастного вещества для проведения повторного тугого контрастирования [139].
(УУР – С, УДД – 5).
Комментарии:
Диагностические методы, применяемые при обследовании: ирригография (ретроградная), интервальная рентгенография для оценки пассажа по желудочно-кишечному тракту (A06.17.002 Рентгеноконтроль прохождения контрастного вещества по желудку, тонкой и ободочной кишке, А06.18.002 Рентгеноконтроль прохождения контраста по толстой кишке).
- У новорожденных детей применяются водорастворимые рентгенконтрастные вещества на основе йода. Контрастное вещество вводится эндопросветно, что минимизирует системное воздействие, но нужно учитывать воздействие на кишечную стенку, поскольку данный раствор гиперосмолярный и может провоцировать дегидратацию и желудочно- кишечные кровотечения. Также водорастворимое контрастное вещество может всасываться в кишечнике, выводится в этом случае оно почками, и мы можем визуализировать на отсроченных снимках контраст в собирательной системе почек. Чтобы минимизировать риск поражения слизистой, рекомендуется разведение с физиологическим раствором в соотношении 1:1.
- Введение бариевой взвеси недопустимо у данной группы пациентов, поскольку продвижение бария по ЖКТ требует соответствующей перистальтической активности, которой у новорожденных детей нет. Это может привести к формированию обтурационной кишечной непроходимости бариевыми камнями на фоне всасывания жидкой части контрастной взвеси.
- Ретроградная ирригография с водорастворимым контрастным веществом. Контрастное вещество вводится в толстую кишку через зонд, заведенный в анус на глубину 2- 3 см, с контролем заполнения толстой кишки под рентгеноскопией. Объем заполнения толстой кишки 20 мл/кг, для тугого контрастирования возможно увеличение объема до 25 мл/кг. Контраст вводится медленно, контролируется ход толстой кишки, диаметр просвета кишки, характер гаустрации, наличие содержимого внутри просвета кишки. При достижении контрастом купола слепой кишки необходимо оценить его расположение. Далее продолжается введение контрастного вещества, оценивается растяжимость кишки, заброс контраста выше Баугиниевой заслонки, характер подвздошной кишки (диаметр просвета, гаустрация, содержимое), а также возможность попадания контрастного вещества в расширенный отдел тонкой кишки и расстояние от илеоцекального угла до расширенного отдела. Для лучшего продвижения контраста по кишечнику, возможно использовать легкий массаж передней брюшной стенки. По завершении исследовании необходимо зафиксировать объем использованного контрастного вещества в медицинской документации для проведения повторного тугого контрастирования в качестве консервативного лечения мекониевого илеуса.
- Рекомендовано проведение диагностической лапароскопии пациентам с подозрением на мекониевый илеус для установления причины кишечной непроходимости [123,139].
(УУР – С, УДД – 5).
Комментарий: в настоящий момент в связи с активным развитием лапароскопической техники и анестезиологического пособия новорожденным и недоношенным детям, данный метод является наиболее информативным и наименее травматичным для верификации причин кишечной непроходимости. Если есть возможность, хирургическое лечение можно выполнить лапароскопически или расширить объем лечения до минилапаротомии в зоне интереса, либо, исключив анатомический дефект, поставить показания к консервативному лечению.
Инструментальная диагностика синдрома дистальной интестинальной обструкции
Синдром дистальной интестинальной обструкции – это частный случай низкой обтурационной кишечной непроходимости, возникающий при нарушении кишечного транзита у пациентов с муковисцидозом, старше неонатального возраста. Данное заболевание редко встречается в возрасте до 2 лет, в силу особенности диеты и сохранении перстальтической активности кишки. Для развития описываемого синдрома необходимо сочетание нескольких факторов – нарушенная секреция пищеварительных ферментов, пищевой рацион, состоящий из продуктов, приводящих к загустению кишечного химуса (рис, яблоко, груша, банан, хлебобулочные изделия: пшеничный хлеб, макароны, печенье; картофель, чай, желе, мясо, курица или рыба), а также декомпенсация кишки на фоне хронического растяжения кишечной стенки. Заболевание проявляется по типу калового завала, но характерной особенностью является то, что обструкция происходит выше толстой кишки и стандартные консервативные методы разрешения калового завала будут не эффективны.
Понимая вышеописанные факторы, возможно сформировать группы риска, создать систему профилактики, диагностики и лечения.
- Рекомендовано проведение обзорной рентгенографии брюшной полости в прямой проекции вертикальном положении пациентам с МВ и клиникой низкой обтурационной кишечной непроходимости с целью оценки состояния органов брюшной полости [140,141,142].
(УУР – С, УДД – 5).
Комментарии: при описании рентгенограммы брюшной полости следует обратить внимание также на состояние диафрагмы.
- Пациентам с подозрением на синдром дистальной интестинальной обструкции рекомендуется УЗИ брюшной полости для оценки характера содержимого кишечника, преимущественно в правых отделах брюшной полости. Определение наличия свободной жидкости в межпетлевом пространстве, латеральных каналах, малом тазу (ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое определение жидкости в брюшной полости, ультразвуковое исследование органов мошонки, ультразвуковое исследование органов малого таза (комплексное)) [140,141].
(УУР – С, УДД – 5).
Комментарий: исследование рекомендуется проводить врачом ультразвуковой диагностики совместно с врачом-детским хирургом. Ультразвук может не обеспечить адекватной визуализации причины формирования обструкции, тогда в принятии хирургического решения необходимо руководствоваться клинической картиной и данным рентгенографии
- Рекомендуется проведение рентгеноконтрастных методов исследования при подозрении на синдром дистальной интестинальной обструкции для установления диагноза, оценки уровня поражения [140, 142].
(УУР – С, УДД – 5).
Комментарии:
Диагностические методы, применяемые при обследовании: ирригография (ретроградная), интервальная рентгенография для оценки пассажа по желудочно-кишечному тракту (А06.17.002 Рентгеноконтроль прохождения контрастного вещества по желудку, тонкой и ободочной кишке, А06.18.002 Рентгеноконтроль прохождения контраста по толстой кишке).
- У детей с муковисцидозом и синдромом дистальной интестинальной обструкции целесообразно применение водорастворимых рентгенконтрастны средств, содержащих йод. Контрастное средство вводится эндопросветно, что минимизирует системное воздействие, но нужно учитывать воздействие на кишечную стенку. Также водорастворимое контрастное средство может всасываться в кишечнике, выводится в этом случае оно почками, и мы можем визуализировать на отсроченных снимках контрастное средство в собирательной системе почек. Чтобы минимизировать риск поражения слизистой, рекомендуется разведение с раствором натрия хлорида** 0,9% в соотношении 1:1.
- Введение бария сульфата** допустимо у данной группы пациентов, но не желательно поскольку продвижение бария по ЖКТ может быть нарушено, в следствие декомпесированного состояния ишкиперистальтической активности, которой у новорожденных детей нет. Это может привести к формированию обтурационной кишечной непроходимости бариевыми камнями на фоне всасывания жидкой части контрастного средства.
Ретроградная ирригография с водорастворимым контрастным средством. Контрастное средство вводится в толстую кишку через зонд, заведенный в анус на глубину 2-3 см, с контролем заполнения толстой кишки под рентгеноскопией. Объем заполнения толстой кишки 20 мл/кг, для тугого контрастирования возможно увеличение объема до 25 мл/кг. Контраст вводится медленно, контролируется ход толстой кишки, диаметр просвета кишки, характер гаустрации, наличие содержимого внутри просвета кишки. При достижении контрастом купола слепой кишки необходимо оценить его расположение. Далее продолжается введение контрастного средства, оценивается растяжимость кишки, заброс контраста выше Баугиниевой заслонки, характер подвздошной кишки (диаметр просвета, гаустрация, содержимое), а также возможность попадания контрастного средства в расширенный отдел тонкой кишки и расстояние от илеоцекального угла до расширенного отдела. Для лучшего продвижения контраста по кишечнику, возможно использовать легкий массаж передней брюшной стенки.
- Рекомендовано рассмотреть проведение диагностической лапароскопии пациентам с подозрением на синдром дистальной интестинальной обструкции без анамнеза оперативных вмешательств на брюшной полости (при отсутствии спаек) для верификации причины кишечной непроходимости и для обеспечения визуализации места обструкции при применении минилапоротомного доступа при интестинотомии [142, 143,144].
(УУР – С, УДД – 4).
Исследование слуха
- Рекомендуется проведение тональной пороговой аудиометрии при субъективном снижении слуха и/или появлении ушного шума; до и после курса терапии аминогликозидами; при уже выявленной сенсоневральной тугоухости в связи с риском развития сенсоневральной тугоухости на фоне применения системной антибактериальной терапии препаратами аминогликозидного ряда, обладающими ототоксичностью [2,22,145,146,147]
(УУР – С, УДД – 5).
Комментарий: Тональная пороговая аудиометрия должна выполняться: а) при субъективном снижении слуха и/или появлении ушного шума; б) до и после курса терапии аминогликозидами; в) при уже выявленной сенсоневральной тугоухости не реже 1 раза в год. Для детей младше 4-7 лет (в зависимости от способности к кооперации во время субъективного исследования слуха) альтернативными объективными методами являются регистрация вызванной отоакустической эмиссии и/или регистрация коротколатентных слуховых вызванных потенциалов, ASSR-тест.
2.5 Иные диагностические исследования
Дифференциальный диагноз
Наиболее частые нозологические формы для дифференциального диагноза при МВ:
- врожденные аномалии бронхиального дерева (КТ, трахеобронхоскопия);
- туберкулезная инфекция (консультация врача-фтизиатра, проба Манту, при необходимости – аллерген туберкулезный рекомбинантный, квантифероновый тест);
- иммунодефицитное состояние (необходима консультация врача-иммунолога (аллерголога- иммунолога), определение уровней иммуноглобулинов основных классов (G, M, A, Е), а также, по показаниям, субклассов иммуноглобулинов, уровня и функции T-клеток, В-клеток, фагоцитоза, компонентов комплемента, естественных киллеров, тесты на вирус иммунодефицита человека (ВИЧ);
- первичная цилиарная дискинезия (ПЦД) – респираторные симптомы, сходные с муковисцидозом, при отсутствии частого обильного стула с примесью жира и зловонным запахом, «соленого» привкуса кожных покровов могут наблюдаться у пациентов с первичной цилиарной дискинезией. Характерные клинические проявления: хронический бронхит, бронхоэктазы (у части пациентов), хронический синусит, хронический отит (триада Картагенера у половины пациентов первичной цилиарной дискинезией сопровождаются сходными клиническими проявлениями и обратным расположеним внутренних органов), патологические изменения по данным световой микроскопии (отсутствие движения или неадекватный паттерн движения ресничек мерцательного эпителия) и/или электронной микроскопии (патология строения ресничек) биоптата слизистой оболочки носа и/или бронха, генетическое исследование (с помощью панелей, включающих гены DNAH5, DNAH11, DNAI1, DNAI2, NME8 (TXNDC3), DNAL1 , CCDC151, CCDC114, ARMC4, CCDC114, ARMC4, CCDC103, DYX1C1, SPAG1, LRRC6, DNAAF2, DNAAF1 (LRRC50), C21orf59, DNAAF3, ZMYND10, DNAAF5 (HEATR2), HYDIN [84], RSPH1, RSPH9, RSPH4A, RSPH3, DRC1 (CCDC164), GAS8 (DRC4), CCDC65(DRC2), CCDC39, CCDC40, OFD1 (редкий фенотип), CCNO, RPGR и MCIDAS (два последних – пигментные ретиниты, обычно диагностируемые у взрослых пациентов), как скрининг-метод может быть использовано исследование уровня оксида азота в выдыхаемом назальном воздухе (у большинства пациентов с первичной цилиарной дискинезией – снижен, см. КР по оказанию медицинской помощи детям с первичной цилиарной дискинезией).
Дифференциальная диагностика мекониального илеуса:
- Болезнь Гиршпрунга, нейроинтестинальная дисплазия
- Внутриутробная инфекция, внутриутробный некротизирующий энтероколит новорожденного
- Внутриутробный перитонит, адгезивный перитонит
- Поражения нервного аппарата толстой кишки [148].
Консультации специалистов
- Рекомендуется в ведении пациентов с муковисцидозом использовать мультидисциплинарный подход в виду того, что заболевание характеризуется поражением многих органов и систем, требует комплексной терапии, что диктует необходимость совместного ведения пациента специалистами разных профилей [2,22].
(УУР – С, УДД – 5).
Комментарии: пациентов с МВ наблюдает врач-пульмонолог (и/или, в детской практике, врач- педиатр), иногда – врач-инфекционист а также врач-генетик, необходима консультация врача- гастроэнтеролога (или врача-диетолога) для исключения гиперацидного состояния и его коррекции при отсутствии эффекта от ферментозаместительной терапии и (по показаниям) при других патологических проявлениях со стороны желудочно-кишечного тракта, врача- диетолога – для подбора диеты и ферментной терапии, консультация врача- оториноларинголога при обострении хронического синусита, диагностики или динамического наблюдения назального полипоза, врача- сурдолога-оториноларинголога – при необходимости контроля слуховой функции у пациентов, получающих препараты, обладающие ототоксичностью, консультация врача-эндокринолога — при задержке роста, полового развития и нарушенииях углеводного обмена, врача по лечебной физкультуре (или врача по медицинской реабилитации, или врача–физиотерапевта или специалиста с высшим (немедицинским) образованием (инструктор–методист по лечебной физкультуре; или специалиста со средним профессиональным (медицинским) образованием (инструктор по лечебной физкультуре, медицинская сестра по массажу, медицинская сестра по физиотерапии) — для обучения ингаляционной терапии, кинезитерапии, дыхательными тренажерами, консультация врача–кардиолога (врача-кардиолога детского) при наличии легочной гипертензии (легочного сердца), консультация врача-уролога, врача-уролога-андролога детского, врача- акушера-гинеколога по поводу репродуктивной функции, клинического фармаколога для решения сложных вопросов по терапии и предотвращению/лечению нежелательных явлений лекарственной терапии, консультации врача-фтизиатра при диагностике и терапии легочного микобактериоза, консультация врача-трансплантолога при наличии цирроза печени, показаний для трансплантации легких и постановки в лист трансплантации.
- Рекомендована пациентам мужского пола в возрасте с 15 лет консультация врача- уролога/врача — уролога-андролога детского для оценки состояния репродуктивной системы и определения тактики дальнейшего наблюдения [98,104].
(УУР – С, УДД – 5).
Комментарии:алгоритм обследования и тактика решения вопроса репродукции у мужчин с МВ представлена в Приложении Г5.
Консультирование в процессе динамического наблюдения осуществляется по мере необходимости.
- Рекомендовано пациентам мужского пола с муковисцидозом при гипоплазии тестикул, гипогонадизме – наблюдение и обследование у врача-эндокринолога или врача-уролога/уролога- андролога детского для выявления признаков эндокринных, андрологических нарушений и решения вопроса о необходимости гормональной коррекции [98,99,104].
(УУР – С, УДД – 5).
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к
применению методов лечения
Цели лечения:
- Обеспечивать максимально высокое качество жизни пациента;
- Предупреждать и лечить обострения хронического инфекционно-воспалительного процесса в бронхолёгочной системе;
- Обеспечить физическое развитие пациента согласно возрастным нормам (достижение оказателей физического развития в границе 25-75 перцентиль после коррекции нутритивного статуса, рекомендуемая цель — 50 перцентиль);
- Обеспечить профилактику осложнений;
- Лечение осложнений (псевдо-Барттер синдром, мекониевый илеус, СДИО, МЗСД, (муковисцидоз-связанный сахарный диабет) цирроз печени безс синдромом портальной гипертензии, гиперспленизмом, ЖКБ (желчнокаменная болезнь), полипозный риносинусит, БЭН (белково-энергетическая недостаточность), кровохаркание, кровотечения легочные, кровотечения из ВРВП (варикозно расширенных вен пищевода) и верхней трети желудка.
Обязательные составляющие лечения:
- Диетотерапия;
- Заместительная терапия недостаточности экзокринной функции поджелудочной железы;
- Муколитическая терапия;
- Дренирование бронхиального дерева и лечебная физкультура;
- Антибактериальная терапия;
- Витаминотерапия;
- Предупреждать и лечить обострения инфекционно-воспалительного процесса в околоносовых пазухах (ОНП) для уменьшения степени нисходящей контаминации бронхолегочной системы;
- Терапия осложнений[1,2,6].
3.1 Консервативное лечение
3.1.1 Муколитическая терапия
- Рекомендовано всем пациентам с МВ (за исключением имеющих медицинские противопоказания) проведение активной муколитической терапии с целью уменьшения вязкости мокроты и облегчения ее эвакуации [1,2,6,22].
(УУР – C, УДД – 5).
Комментарии: выбор лекарственных средств определяется индивидуально.
Выбор пути введения: предпочтение отдается ингаляционному введению муколитиков.
Оценка эффективности лечения: клинически (оценка суточного количества мокроты, изменений ее консистенции, оценка степени дыхательной недостаточности).
Оценка безопасности лечения: клинически (специальных стандартизованных методик оценки безопасности этих лекарственных средств не существует).
Дополнительные замечания: все способы разжижения мокроты необходимо комбинировать с удалением ее из дыхательных путей, используя методы кинезитерапии. Перед сеансом кинезитерапии желательно, а при наличии бронхообструкции – обязательно, перед ингаляциями муколитиков провести ингаляции бронхолитиков.
В клинической практике для муколитической терапии используются:
- дорназа альфа** — разрывает водородные связи молекул ДНК, которые являются основной составляющей гнойной мокроты, и является базисной муколитической терапией, обеспечивает эффект в течение суток. Применяется ингаляционно в дозе 2,5 мг в сутки; при необходимости (распространенные бронхоэктазы- 5 мг в сутки (по 2,5 мг х 2 р/дн через небулайзер); хронический полипозный синусит — 5 мг в сутки (2,5 мг – через небулайзер, 2,5 мг — с использованием универсальной ингаляционной системы с функцией пульсирующей подачи аэрозоля по 1.25мг=1.25мл в каждый носовой ход) [1,2,22,149].
- 7% гипертонический раствор натрия хлорида с 0,1% натрием гиалуронатом применяется ингаляционно через небулайзер по 5 мл 2 раза в день, улучшает клиренс дыхательных путей и является базисной муколитической терапией с быстрым муколитическим эффектом [1,2,22,150,38], Также может применяться 3% гипертонический раствор натрия хлорида, особенно у детей младшего возраста [151].
- Маннитол** в форме порошка для ингаляций улучшает клиренс дыхательных путей, способствует гидратации слизи [2,22,152].
Маннитол** применяется в дозе 400 мг дважды в день через специальный ингалятор. Перед назначением маннитола** пациент должен пройти тест на бронхиальную гиперреактивность при назначении начальной дозы в соответствии с инструкцией к препарату. Противопоказан детям до 6 лет. Повышает комплаентность подростков [153].
Маннитол** и 7% гипертонический раствор натрия хлорида с 0,1% натрием гиалуронатом являются муколитиками быстрого действия и сочетаются с дорназой альфа**. Первая ингаляция муколитического препарата проводится в МО в присутствии врача.
3.1.2 Бронхолитическая терапия
- Рекомендовано назначение ингаляционной бронхолитической терапии пациентам с МВ при наличии обратимой или частично обратимой бронхиальной обструкции (прирост уровня ОФВ1 после ингаляции бронхолитика >15%) с целью улучшения эвакуации мокроты, перед применением ингаляцией антибактериальных препаратов, гипертонического раствора натрия хлорида, перед кинезитерапией [1,2,6,22].
(УУР – C, УДД – 5).
Комментарий: противопоказанием является индивидуальная непереносимость.
- Рекомендуется пациентам с МВ в качестве бронхолитической терапии назначить бронхолитический препарат из групп: селективные β2-адреномиметики или адренергические средства в комбинации с антихолинергическими или антихолинергические средства либо другой препарат для лечения обструктивных заболеваний дыхательных путей по индивидуальным показаниям в режиме «по требованию» [1,2,22,154,155,156,157].
(УУР – B, УДД – 2).
Комментарий: в режиме «по требованию» используется селективный бета-2-адреномиметик сальбутамол** в монотерапии или в сочетании с М-холинергническими препаратами (ипратропия бромид**) или фиксированная комбинация фенотерол+ипратропия бромид** или препараты пролонгированного действия (тиотропия бромид**) либо другой препарат для лечения обструктивных заболеваний дыхательных путей по индивидуальным показаниям.
Использование дозированных аэрозольных ингаляторов обязательно со спейсером, при назначении ингаляционных бронхолитиков (препаратов для лечения обструктивных заболеваний дыхательных путей) (селективный бета-2-адреномиметик сальбутамол** в монотерапии или в сочетании с М-холинергническими препаратами (ипратропия бромид**) или фиксированная комбинация фенотерол+ипратропия бромид** или препараты пролонгированного действия (тиотропия бромид**) либо другого препарата для лечения обструктивных заболеваний дыхательных путей по индивидуальным показаниям) пациентам с тяжелой бронхообструкцией (ОФВ1 <30% от должного) ингаляции должны проводиться при помощи небулайзера.
Выбор пути введения препарата для лечения обструктивных заболеваний дыхательных путей: предпочтение отдается ингаляционному пути введения.
Оценка эффективности лечения: клинически (симптомы бронхообструкции) и по данным спирометрии.
Оценка безопасности лечения: клинически и по результатам объективного осмотра (число сердечных сокращений, сердечный ритм).
Применение препаратов вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет.
3.1.3 Антибактериальная терапия (АБТ)
3.1.3.1 Общие принципы антибактериальной терапии
- Рекомендована антибактериальная терапия (плановые курсы АБП в виде ингаляций через небулайзер или совместно с таблетированными формами, или внутривенно) всем пациентам с легочными проявлениями МВ, у которых отмечается обострение МВ (включая обострения на фоне острой респираторной инфекции) или выявляются новые патогенные возбудители респираторной инфекции в количестве более 105 колониеобразующих единиц при плановом микробиологическом исследовании с целью эрадикации причиннозначимых микроорганизмов [2,6,22,158,159,160,161].
(УУР – В, УДД – 2).
Комментарий: Для грамотрицательной микрофлоры (P. aeruginosa, В. cepacia complex, Stenotrophomonas maltophilia, Achromobacter spp), MRSA, нетуберкулезных микобактерий или при их хроническом высеве значение имеет любое количество колоний, определенное по результатам микробиологического исследования.
- При проведении антибактериальной терапии (АБТ) бактериальной инфекции в бронхолегочной системе пациентам с муковисцидозом рекомендовано ориентироваться на чувствительность выделенного микроорганизма (Pseudomonas aeruginosa, MRSA, Burkholderia cepacia complex, Stenotrophomonas maltophilia, Staphylococcus aureus и Haemophilus infuenzae и др.) к антибактериальным препаратам с целью повышения эффективности лечения [2].
(УУР – C, УДД –5).
Комментарии: Лабораторное определение чувствительности микроорганизма к антибиотикам не всегда полностью совпадает с клиническим ответом на проводимую терапию [2,6,22,159,160,161].
При выборе антибиотика целесообразно учесть эффективность ранее проводимых курсов антибактериальной терапии [2].
Пациентам с МВ назначают максимальные возрастные дозы препаратов или дозы, рекомендуемые для пациентов с МВ. В связи с тяжестью заболевания, необходимостью максимальных дозировок антимикробных препаратов и дефицитом лекарственных форм для ингаляционного применения в мировой клинической практике традиционно применяются off- label (вне инструкции) инъекционные антимикробные средства в виде ингаляций [89,162,163,164,165,166,167,168,169,170].
- Противопоказания: определяются индивидуально и зависят от индивидуальной непереносимости (в том числе аллергии), характера сопутствующих заболеваний (главным образом заболевания печени и почек) и возраста пациента.
-
Выбор лекарственных средств определяется: видом возбудителя, выявленного у пациента; чувствительностью возбудителя (in vitro) к данному АБП; фазой заболевания (обострения – ремиссия); продолжительностью инфекционного процесса (хроническая инфекция – впервые выявленный возбудитель); эффективностью терапии предшествующего обострения легочной инфекции (данные о природной резистентности основных патогенов, характерных для пациентов с МВ представлен в Приложении Г6).
- Выбор пути введения определяется: видом возбудителя, выявленного у пациента; фазой заболевания (обострение – ремиссия); продолжительностью инфекционного процесса (хроническая инфекция – впервые выявленный возбудитель); местом оказания медицинской помощи (амбулаторная – стационарная); эффективностью предшествующей антибактериальной терапии. Внутривенное введение антибиотиков начинается в стационаре с курсом лечения 14-21 день. Введение осуществляется через периферический венозный катетер (катетер периферический) или через порт-систему (порт инфузионный/инъекционный, имплантируемый***), которые устанавливаются согласно методическим руководствам «Венозный доступ, 2019 (https://msestra.ru/download/file.php?id=4763) с использованием необходимых лекарственных средств. Порт-системы устанавливаются согласно Распоряжению Правительства Российской Федерации от 31.12.2018 № 3053-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг». Лечение может проводиться в стационаре и в амбулаторных условиях. Внутримышечный путь введения при муковисцидозе применяться не должен в связи с необходимостью длительных частых курсов терапии, так как при МВ имеются особенности в фармакокинетике АМГ, β-лактамных антибиотиков, выражающиеся в увеличении объема распределения на килограмм массы тела и снижении периода полувыведения. Увеличение системного клиренса за счет ускорения метаболизма в печени и увеличение почечного клиренса определяют необходимость применения высоких доз антибиотиков с более частым их введением [2,22,163,171,172,173,174].
- Безопасность: в связи с применением у пациентов с муковисцидозом высоких доз, длительных курсов и комбинаций антибактериальных препаратов, одновременной терапии лекарственными препаратами разных групп, а также в связи с возможным нарушением функции печени, следует осуществлять соответствующие контролирующие мероприятия (клинические, лабораторные, инструментальные) для мониторирования возможных нежелательных эффектов лекарственных препаратов, их предупреждения и, при необходимости, терапии [2,176].
- При острой респираторной инфекции пациентам с муковисцидозом рекомендовано назначение антибактериальной терапии в домашних условиях согласно профилю чувствительности выделенной респираторной микрофлоры в сязи с активацией хронического воспалительного процесса на фоне присоединения острой респираторной инфекции [2,22,89].
(УУР – С, УДД – 5).
Оценка эффективности АБТ: клинически (лихорадка, респираторные симптомы), по данным лабораторных методов обследования (лейкоцитоз, уровень С-реактивного белка, по показаниям — прокальцитонина (исследование уровня прокальцитонина в крови)) и по данным микробиологического исследования (эрадикация возбудителя, персистирование, суперинфекция, снижение выделения возбудителя <104 колониеобразующих единиц или отрицательный результат посева и т.д.).
Оценка безопасности лечения: зависит от применяемого лекарственного средства (ЛС) и проводится с учетом возможных нежелательных явлений.
Дополнительные замечания:
- При назначении АБП следует использовать комбинации ЛС с различным механизмом действия (например, β-лактамные антибиотики в комбинации с аминогликозидами). При выделении в мокроте пациента одновременно двух микроорганизмов выбор АБП зависит от свойств более резистентного возбудителя.
- Одновременное назначение препаратов для ингаляционного и внутривенного путей введения одной фармакологической группы не рекомендуется. Возможно назначение ингаляционной и внутривенной АБТ одновременно по решению консилиума специалистов и с учетом фармакологической группы препаратов.
- Применение АБП в виде ингаляций через небулайзер:
- может проводиться как в стационаре, так и в домашних условиях;
- для решения вопроса о назначении ингаляционной терапии следует провести спирометрию до первой ингаляции антибиотика и через несколько минут после ингаляции (для выявления возможного бронхоспазма (при отсутствии возрастных и/или иных противопоказаний)) (см. раздел «Бронхолитическая терапия») — перед ингаляцией АБП необходимо провести ингаляцию бронхолитика (препарата для лечения обструктивных заболеваний дыхательных путей). Симпатомиметики для ингаляционного применения, например, сальбутамол** 2,5 мг через небулайзер (или дозированный аэрозольный ингалятор по 200 – 400 мкг с использованием спейсера) за 15-30 минут до ингаляции антибиотика в монотерапии или в сочетании с М- холинергическими препаратами (ипратропия бромид**) или фиксированная комбинация фенотерол+ипратропия бромид** или препараты пролонгированного действия (тиотропия бромид**)) или другие препараты для лечения обструктивных заболеваний дыхательных путей, муколитиков, а также дренаж;
- при ингаляции АБП в домашних условиях желательно использовать небулайзер, оснащенный фильтром для выдыхаемого воздуха;
- при ингаляции АБП предпочтительнее применять мундштук, по сравнению с маской. Следует рекомендовать пациентам переходить на применение мундштука в максмально ранние сроки, как правило, с 3-х летнего возраста [177]. Вдыхание препарата лучше осуществлять через рот, применение носовых зажимов во время ингаляции увеличивает эффективность лечения;
- при проведении ингаляций в условиях медицинской организации и амбулаторно пациенты с МВ, должны пользоваться индивидуальным небулайзером с возможностью замены каждые 3 месяца комплекта распылителя и трубки воздуховода и фильтра;
- оптимальным небулайзером для пациента с МВ является ингаляционный прибор с низкопоточным компрессором (уровень потока сжатого воздуха до 6 л/мин), с производительностью 450 мг/мин, снабженный системой контроля инспираторного потока и системой клапанов вдоха и выдоха, позволяющей сократить потери медикамента в окружающую среду, обеспечивающий максимальную эффективность терапии, приспособленный к химической и термической дезинфекции и к автоклавированию;
- для введения медикамента в ОНП применяется небулайзер с универсальной ингаляционной системой функции пульсирующей подачи аэрозоля;
- в качестве мобильного устройства возможно использование мэш-небулайзера — Ингаляционного прибора с емкостью для лекарства с генератором аэрозоля (mesh), камерой распылителя, блоком управления и приспособлением для очистки генератора аэрозоля (Ингаляционный прибор Velox тип 055 с принадлежностями) с производительностью не менее 457 мг/мин, с системой клапанов вдоха и выдоха и накопителем для аэрозоля, с устройством для очистки мембраны, с нераспыляемым (остаточным) объемом не более 0,5 мл. Все части мэшнебулайзера должны подлежать термической дезинфекции. Для пациента с МВ важно производить замену компонентов мэш-небулайзера каждые 3 месяца [178].
- Применение АБП внутрь используется для терапии обострений МВ (включая обострения на фоне ОРИ) в домашних условиях или для профилактического лечения пациентов, хронически инфицированных P. aeruginosa, В. cepacia comрlex, MRSA, Achromobacter spp., НТМБ.
- Применение АБП внутривенно показано:
- при тяжелых обострениях МВ (лечение в условиях медицинской организации) (не менее, чем двумя препаратами);
- в тех случаях, когда применение АБП внутрь и ингаляционно оказалось неэффективным;
- для плановой терапии пациентов, инфицированных P. aeruginosa, В. cepacia comрlex, MRSA, Achromobacter spp., нетуберкулезных микобактерий;
- при ухудшении течения заболевания и появлении новых симптомов у пациентов, получающих АБП внутрь.
- Организация внутривенной терапии в амбулаторных условиях способствует повышению комплаентности, профилактике обострений. Пребывание в больнице отягощается риском перекрестного и суперинфицирования резистентными к антибиотикам штаммами микроорганизмов, стрессом, пропуском школьных занятий. Кроме того, пребывание пациента в стационаре значительно дороже, чем амбулаторное лечение. Катетеризация вен давно стала рутинной медицинской процедурой в мире для обеспечения различных видов внутривенной терапии. Проведение внутривенной терапии через периферический венозный катетер (катетер периферический) или порт-систему (порт инфузионный/инъекционный, имплантируемый***) является практически безопасным, если соблюдаются основные условия: метод должен стать постоянным и привычным в практике, должен быть обеспечен безупречный уход за катетером. Катетер устанавливается в условиях дневного стационара или выездной бригадой на дому [2,179,180,181,182].
Профиль пациента, которому может проводиться внутривенная антибактериальная терапия в домашних условиях
- Опыт ранее проводимой внутривенной антибактериальной терапии в условиях стационара
- Пациент, нуждающийся в проведении планового курса антибактериальной терапии, или имеющий обострение хронического бронхолегочного процесса, не требующий круглосуточного наблюдения медицинским специалистом, в том числе пациенты с тяжелым течением заболевания в стабильном состоянии, получающие на дому кислородотерапию (обеспечены концентратором кислорода, аппаратурой для неинвазивной вентиляции легких)
- Положительное отношение пациента и членов семьи к проведению внутривенной антибактериальной терапии, отсутствие неврологических и психогенных нарушений, которые могут препятствовать безопасному проведению лечения в домашних условиях
Условия, необходимые для начала терапии в домашних условиях:
- Удовлетворительные санитарные условия проживания семьи
- Способность пациента или его родственников к обучению правилам ухода за катетером/порт-системой, прохождение обучения практическим навыкам;
- Комплаентность семьи по выполнению рекомендации врача за предыдущий период наблюдения;
- Предварительный осмотр специалистом по муковисцидозу в условиях медицинского учреждения, первое введение антибактериального препарата/препаратов в ЛПУ (стационар одного дня, дневной стационар), оценка переносимости терапии, за исключением случаев, когда уже имеется опыт применения конкретного лекарственного препарата;
- Подписание информированного согласия пациентом/законными представителями (подробная информация – вметодических рекомендациях «Организация внутривенной терапии пациентам с муковисцидозом в амбулаторных условиях»
3.1.3.2 Антибактериальная терапия при высеве метициллинчувствительного
Staphylococcus aureus (MSSA) и Haemophilus influenzae
- Рекомендовано при выборе антибактериальных препаратов для терапии пациентов с муковисцидозом с высевом Staphylococcus aureus и Haemophilus influenzae применять ЛС в соответствии с чувствительностью с целью эрадикации причиннозначимого возбудителя (препараты, дозировки и кратность введения, представлены в таблицах 10,11) [2].
(УУР – C, УДД – 5).
Таблица 10. Антибактериальные препараты, применяемые у пациентов с муковисцидозом, при высеве из мокроты/ бронхиального секрета Staphylococcus aureus (MSSA)
Таблица 11. Антибактериальные препараты, применяемые у пациентов с муковисцидозом, при высеве из мокроты/бронхиального секрета Haemophilus influenzae
3.1.3.3 Антибактериальная терапия при MRSA (метициллинрезистентный стафилококк) — инфекции
- При первичном высеве MRSA у стабильных пациентов (вне обострения хронического воспалительного процесса) в качестве первой линии терапии при отсутствии противопоказаний рекомендуется назначение двух антибактериальных препаратов per os в течение 1-3 месяцев, чаще это комбинация рифампицина** с фузидовой кислотой или Сульфаметоксазол+Триметоприм** (табл.12) [2,22].
(УУР – C, УДД – 5).
Комментарии:
- У пациентов старше 12 лет рифампицин** может сочетаться с доксициклином** (#миноциклином) для приёма per os (табл.12). Допускается монотерапия доксициклином** или Сульфаметоксазолом+Триметоприм** (табл.12) [6, 7]. Необходимо помнить о гепатотоксичности препаратов.
- Возможной альтернативой является использование #ванкомицина** в форме для инъекционного применения ингаляционно (применение вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет) в течение 3-4 недель [162,163,168,169,170,183,184] (табл. 12).
- С учетом знаний о местах возможной колонизации MRSA, параллельно, одновременно с началом эрадикационной терапии, необходима обработка кожи, полости носа и ротоглотки антисептиками, а также дезинфекция окружающей среды:
- эндоназально мупироцин 2% 2 раза в день + обработка кожи водным раствором хлоргексидина** 0,5% в течение 5 дней;
- полоскание полости рта 0,5% водным раствором хлоргексидина** в течение 2-х недель;
- генеральная уборка жилого помещения;
- ежедневная смена нательного белья в течение 5 дней;
- стирка постельных принадлежностей, белья, полотенец в режиме высокой температуры еженедельно в течение всего периода лечения;
- после инициации лечения необходима смена зубных щеток, расчесок, шариковых дезодорантов, губной помады;
- все члены семьи, а также домашние животные должны быть обследованы и, в случае идентификации MRSA, санированы.
- При первичном высеве MRSA у нестабильных пациентов (при обострении хронического воспалительного процесса), рекомендуется проведение внутривенной или пероральной терапии в течение 2-х недель линезолидом** или тейкопланином, прочими антибиотиками, активными в отношении MRSA (табл.12) [2,163,183,184,185].
(УУР – C, УДД – 5).
Комментарии: У пациентов с частыми обострениями при хроническом инфицировании MRSA возможно использование ингаляций #ванкомицина** в форме для инъекционного применения в непрерывном режиме (табл.12) [183,184].
Таблица 12. Антибактриальные препараты, применяемые у пациентов с муковисцидозом, при высеве из мокроты/бронхиального секрета метициллинрезистентного Staphylococcus aureus (MRSA)1.
Примечания:
# — применение лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет.
1 — [89,162,163,168,169,170,183,184].
Эпидемиологические исследования демонстрируют, что MRSA ассоциируется со сниженной лёгочной функцией, большей потребностью в медикаментозной терапии и худшей выживаемостью. Для эрадикации возбудителя используют достаточно агрессивные схемы лечения.
3.1.3.4 Антибактериальная терапия при выявлении в мокроте/бронхиальном секрете
P.aeruginosa
- Рекомендуется одновременное назначение 2–3 противомикробных препаратов из разных групп, что предотвращает развитие устойчивости P.aeruginosa и способствует достижению максимального клинического эффекта (эрадикации P. aeruginosa) (табл.13) [2,6,22,158,159,160, 186,187].
(УУР – C, УДД – 5).
Комментарии: наиболее часто применяют комбинации аминогликозидов с цефалоспоринами 3–4 поколения (табл.13). Целесообразно периодически менять комбинации антибиотиков, эффективных в отношении синегнойной палочки. Следует помнить, что лабораторное определение чувствительности микроорганизма к антибиотикам не всегда полностью совпадает с клиническим ответом на проводимую терапию
В тяжелых случаях, при нестабильном состоянии, допускается непрерывное применение препарата [188].
Решение о назначении незарегистрированных препаратов по жизненным показаниям принимается консилиумом федеральной медицинской организации; ввоз препарата осуществляется в соответствии с законодательной базой для обеспечения пациентов незарегистрированными в РФ лекарственными препаратами по жизненным показаниям (Приказ Министерства здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у пациентов по жизненным показаниям» от 9 августа 2005 г. № 494).
Таблица 13. Антибактериальные препараты, применяемые у пациентов с муковисцидозом, при высеве из мокроты/бронхиального секрета P. аeruginosa.
Примечания:
#Применение лекарственого препарата у детей вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии) при наличии подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет
При наличии медицинских показаний (по жизненным показаниям, включая индивидуальую непереносимость, далее – по жизненным показаниям) по решению врачебной комиссии осущеcтвляется назначение лекарственных препаратов не по международному непантентованному наименованию, а по торговому наименованию (часть 15 статьи 37 Федерального закона от 21.11 2011 № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и пункт 6 Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения, утвержденного приказом Минздрава России от 14.01.2019 №4н). Решение врачебной комиссии оформляется протоколом и вносится в медицинскую документацию пациента.
Решение о назначении незарегистрированных препаратов по жизненным показаниям принимается консилиумом федеральной медицинской организации; ввоз препарата осуществляется в соответствии с законодательной базой для обеспечения пациентов незарегистрированными в РФ лекарственными препаратами по жизненным показаниям (Приказ Министерства здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у больных по жизненным показаниям» от 9 августа 2005 г. № 494).
- Рекомендуется проведение профилактических курсов антибактериальной терапии при хронической колонизации нижних дыхательных путей P. аeruginosa, для увеличения продолжительности жизни пациентов [2,89,163,184,185].
(УУР – C, УДД – 5).
Комментарий: следует помнить, что проведение профилактических курсов антибактериальной терапии практически не сказывается на устойчивости штаммов микроорганизмов только при своевременной смене применяемых препаратов.
При частых обострениях инфекционно-воспалительного процесса в бронхолёгочной системе следует увеличивать продолжительность курсов антибактериальной терапии до 3 недель и более, использовать внутривенный способ введения и /или сокращать интервалы между курсами и/или между курсами в/в терапии применять ципрофлоксацин** в таблетках. Ципрофлоксацин** применяется также при каждой острой респираторной инфекции и обострении бронхолегочного процесса легкой степени)[1,6,38,158,161,163,189,190]. У детей младше 5 лет назначать ципрофлоксацин** по решению врачебного консилиума ввиду отсутствия альтернативного АБП.
Стратегия антибиотикотерапии P. aeruginosa инфекции при МВ
Эрадикация Pseudomonas aeruginosa при первичном высеве
- При отсутствии у пациента клинически значимых респираторных симптомов, при минимальных структурных изменениях в лёгких и при условии проведения бактериологического мониторинга не реже 4-х раз в год рекомендуется проведение одного из 2-х режимов антибактериальной терапии с целью эрадикации P. aeruginosa для увеличения продолжительности жизни и профилактики снижения функции легких для всех возрастов пациентов [10, 11, 31]:
— ингаляции тобрамицина** в виде раствора 300 мг х 2 раза в день или в виде капсул с порошком для ингаляций (обе лекарственные формы противопоказаны для детей до 6 лет) 112 мг х 2 раза в день в течение 28 дней [1,2,6,22,158,159,160] (УУР – А, УДД – 2), возможна комбинация с ципрофлоксацином** (табл.13) в течение 3-х недель [1,2,22,89,158,159,160,163,185].
(УУР – А, УДД – 2).
или
— комбинация ингаляционного колистиметата натрия** (1млн. ЕД х 2 раза в день у детей младше 8-10 лет, 2 млн. ЕД х 2 раза в день у пациентов 8-10 лет и старше) (для детей младше 6 лет назначать по решению врачебного консилиума) [163] в течение 3-х месяцев в сочетании с ципрофлоксацином** (табл.13) per os из расчета 30-40 мг/кг/сутки в два приёма в течение от 3 недель до 3-х месяцев в зависимости от возраста [2,22,163,185].
(УУР – С, УДД – 5).
Комментарии: в настоящее время безопасность и эффективность ингаляционного тобрамицина** доказана у детей с 6 месячного возраста [191].
В случае использования ингаляционного антибиотика впервые, первая ингаляция должна проводиться под врачебным наблюдением. При наличии явлений бронхоспазма за 10-15 минут до ингаляции следует использовать бронхолитики.
Через 7 – 14 дней после окончания курса антибактериальной терапии необходимо провести бактериологическое исследование мокроты (глубокого орофарингеального мазка [163]) для оценки эффективности эрадикационной терапии [2].
У стабильных пациентов с более тяжёлым заболеванием лёгких (при наличии сформировавшихся бронхоэктазов, ателектазах, низкими функциональными показателями), в отсутствии должного бактериологического контроля (реже, чем 1 раз в 3 месяца) возможно инициирующее длительное применение ингаляций тобрамицина в непрерывном режиме до 3-6 месяцев (по решению лечащего врача) [163]. Возможно добавление к терапии перорального ципрофлоксацина в течение 3-4 недель [2].
- При наличии клинически значимых респираторных симптомов, признаков обострения бронхолёгочного процесса, у некомплаентых пациентов рекомендован двухнедельный курс внутривенной комбинированной (два препарата) антисинегнойной терапии с целью эрадикации возбудителя [89,163,185,190].
(УУР –С, УДД-5).
Комментарии: предпочтение отдаётся комбинации цефтазидима** с аминогликозидами (тобрамицин** или амикацин**). В случае сочетания P. aeruginosa cо S. aureus рекомендуется комбинация меропенема** с тобрамцином** или амикацином** (табл. 13) [89].
Контроль эффективности также показан через 7-14 дней после окончания терапии.
Интермиттирующая и хроническая инфекции P. aeruginosa
При интермиттирующей инфекции P. aeruginosa возможность санации мокроты пациентов с МВ значительно выше, чем при хронической. В многолетних исследованиях показано, что активная антимикробная терапия позволяет предупредить или отсрочить развитие хронической P. aeruginosa инфекции более чем у 80% пациентов с МВ.
- Рекомендовано, если эрадикация P.аeruginosa после проведенного курса антибиотикотерапии у пациента с муковисцидозом не произошла и у пациента развилась хроническая синегнойная инфекция, назначение ингаляционной противосинегнойной терапии (тобрамицин** (капсулы с порошком для ингаляций, раствор для ингаляций) или колистиметат натрия (раствор для ингаляций)) (табл. 14) [289].
(УУР – С, УДД – 5).
Комментарии: позволяет уменьшить риск развития обострений бронхолегочного процесса, степень выраженности респираторных проявлений, сократить число курсов таблетированной или внутривенной антибактериальной терпи и улучшить показатели функции внешнего дыхания [2,89].
Таблица 14. Схема антибактериальной терапии при хронической синегнойной инфекции [2,22,190].
Примечание:
# применение у детей лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет;
Тобрамицин** (раствор для ингаляций), Тобрамицин** (капсулы с порошком для ингаляций), Колистиметат натрия (раствор для ингаляций) -противопоказаны детям до 6 лет);
Офлоксацин – противопоказан детям (до 18 лет);
Противопоказания для остальных ЛС – см. табл.13.
3.1.3.5 Антибактериальная терапия при высеве из мокроты/бронхиального секрета
Burkholderia cepacia complex
Общие правила антимикробной терапии:
- Рекомендуется при инфицировании Burkholderia cepacia complex немедленная антибактериальная терапиия вследствие ее высокой вирулентности [1,2,89,163,184,185,192,193]. (УУР – C, УДД – 5).
Комментарий: инфицирование Burkholderia cepacia complex достоверно ухудшает клиническое состояние пациента и прогноз. Есть отдельные сообщения об успешной эрадикации некоторых изолятов Burkholderia cepacia complex c применением ранней агрессивной антибактериальной терапии до формирования хронической инфекции. При этом следует учесть, что доказательная база в отношении терапии данной инфекции в настоящее время невелика. Препараты, применяемые при данной инфекции представлены в таблице 16.
- Рекомендовано для терапии пациента с муковисцидозом с высевом Burkholderia cepacia complex, как при первичном высеве, так и для лечения обострения бронхолегочного процесса отдавать предпочтение комбинации из трёх препаратов (как более эффективной), курсом от 3 недель и более, а также комбинировать внутривенный и ингаляционный и/или пероральный путь введения антибактериальных препаратов [163,184,194].
(УУР – C, УДД – 5).
Комментарии: Наибольшую активность in vitro сохраняют Цефтазидим**, Цефтазидим + авибактам** Пиперациллин+Тазобактам, Меропенем**, Имипенем**, #Сульфаметоксазол+Триметоприм** и #Тетрациклины. В клинических исследованиях наиболее эффективны Меропенем**, #Тобрамицин**, #Сульфаметоксазол+Триметоприм**, #Пиперацилин+Тазобактам, #Доксициклин** и #Цефтазидим** (табл.15). Для оптимизации исходов «cepacia syndrome» рекомендуется обязательное включение в схему лечения #Сульфаметоксазол+Триметоприма**. Эффективно применение трёхкомпонентной схемы внутривенного введения Меропенема**, Тобрамицина** с Цефтазидимом** в течение 2 -х недель и более (табл.15) **[1,2,163,184,196].
- Эффективна длительная, от 3 до 12 недель, терапия пероральными препаратами #Сульфаметоксазолом+Триметопримом** и/или #Доксициклином** и /или #Хлорамфениколом** (на фоне внутривенной терапии или после нее) (табл. 15). При хронической инфекции Burkholderia cepacia complex рекомендуется прием таблетированных форм #Сульфаметоксазола+Триметоприма** (табл.15) [1,2,163,184].
- Большинство микроорганизмов Burkholderia cepacia complex демонстрируют резистентность к антипсевдомонадным антибиотикам, включая природную резистентность к Колистиметату натрия** (противопоказан детям до 6 лет) и аминогликозидам. В то же время, накоплена информация об эффективности применения Тобрамицина**(противопоказан детям до 6 лет) [1,2,163,184,196].
- В ряде случаев при крайне тяжелом течении болезни (терапия сепация-синдрома) допустимо сочетание двух β-лактамных антибиотиков (внутривенно+внутривенно и внутривенно+ингаляционно) и применения сверхвысоких доз антибиотиков (по решению консилиума или врачебной комиссии). Имеется положительный опыт применения трех β- лактамных антибиотиков, включая два карбапенема. Целесообразна ротация и наращивание доз антибактериальных препаратов до стабилизации клинико- рентгенологической и лабораторной картины [1,2,163,194,196].
- Для детей старше 12 лет и взрослых рекомендовано ингаляционное применение #Тобрамицина** (в виде раствора или в виде капсул с порошком для ингаляций), а также #Меропенема** и #Цефтазидима**, предназначенных для внутривенного использования (табл.15). Возможно ингаляционное применение #тиамфеникола глицината ацетилцистината (табл.15), выбор ингаляционного антибиотика в зависимости от клинической эффективности, переносимости и результат чувствительности в посеве мокроты [2,89,162,163,184].
(УУР – C, УДД – 5).
Комментарий: об эрадикации Burkholderia cepacia complex можно судить только через год после последнего положительного результата посева при условии, как минимум, трёх отрицательных бактериологических анализов мокроты. В отношении пациентов с положительными результатами посевов на Burkholderia cepacia complex, проводится политика строжайшего инфекционного контроля и гигиенических мер [2].
Таблица 15. Антибактериальные препараты, применяемые у пациентов с муковисцидозом, при эрадикации и терапии инфекции, вызванной Burkholderia cepacia compleх [2,89,162,163,184]
| Антибактериальный препарат | Суточная доза для детей |
Суточная доза для взрослых |
Способ введения | Кратность введения/сут |
| Цефтазидим+[Авибактам]** (противопоказан детям до 3 мес. жизни) | в возрасте 3-6 мес. 40 мг/кг/10мг/кг;В возрасте 6мес- 18лет 50мг/кг/12,5мг/кг (максимально 2000/500мг) | 7,5 г (15г при сепация-синдроме) | В/в | 3 |
| #Цефтазидим** (форма для инъекционного применения) | 2г | 2 г | Ингаляции | 2 |
| #Цефтазидим** | 300 мг/кг |
9 г (12г при сепация- синдроме) |
В/в | 3 |
|
Меропенем** (противопоказан детям до 3 мес. жизни) |
120 мг/кг |
6,0г (9,0 г при сепация- синдроме) |
В/в | 3 |
| #Дорипенем | Не разрешен |
1,5-3,0 (4,5г при сепация-синдроме) |
В/в | 3 |
|
Пиперациллин+[Тазобактам] (противопоказан детям до 3 мес. жизни) |
400-500 мг/кг | 13,5 | В/в | 3 |
|
#Азтреонам (противопоказан детям до 9 мес. жизни) |
150-250мг | 8 | В/в | 2-4 |
|
# Ко-тримоксазол [Сульфаметоксазол+ Триметоприм]** (суспензия для перорального применения — противопоказана детям до 6 нед, инъекционная форма — противопоказание до 3 лет –) |
20 мг/кг (по триметоприму) | 2880мг | В/в и внутрь | 3 |
| #Миноциклин (противопоказан детям до 8 лет) | После 8 лет: 2-3мг/кг | 200мг | Внутрь | 1-2 |
| Ципрофлоксацин** (противопоказан детям до 5 лет с МВ и высевом P.aeruginosa, по остальным показаниям — до 18 лет,) |
<1 мес. 30 мг/кг; >1 мес. 40 мг/кг (750 мг — макс.) [8,9] |
1,5 г | Внутрь | 2 |
| 10 мг/кг | 800 мг | В/в | 2 | |
| #Левофлоксацин ** | 16–20 мг/кг | 500-1000 мг/сут | Внутрь | 1-2 |
| 16–20 мг/кг | 1000 | В/в | 2 | |
| Доксициклин** (противопоказан детям до 8 лет) |
Детям с массой тела менее 45 кг в первый день лечения 4 мг/кг, в последующие дни — 2-4 мг/кг. Детям с массой тела более 45 кг — как взрослым |
1 день-200 мг затем 100 мг один раз в сутки | Внутрь | 1- 2 |
|
#Хлорамфеникол** (таблетки противопоказаны детям до 3 лет или с массой тела ˂20кг) |
50-100 мг/кг | 2 – 4 г | Внутрь, В/в | 3-4 |
| #Тиамфеникола глицинат ацетилцистеинат | 500-1000 мг | 1000мг | Ингаляции | 2 |
Примечания:
При наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее — по жизненным показаниям) по решению врачебной комиссии осущетвляется назначение лекарственных препаратов не по международному непантентованному наименованию, а по торговому наименованию (часть 15 статьи 37 Федерального закона от 21.11 2011 № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и пункт 6 Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения, утвержденного приказом Минздрава России от 14.01.2019 №4н). Решение врачебной комиссии оформляется протоколом и вносится в медцинскую документацию пациента.
#Применение лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний производится по решению врачебной комиссии с разрешения Локального этического комитета медицинской организации (при наличии), при наличии подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет.
3.1.3.6 Антибактериальная терапия при высеве из бронхиального секрета Achromobacter spp.
Общие правила антимикробной терапии:
- При высеве из бронхиального секрета Achromobacter spp. рекомендовано применять антибактериальную терапию в соответствии с чувствительностью микроорганизма (таблица 16) [1,2,89,162,163,199,200,202].
(УУР – C, УДД – 5).
Комментарии: Аchromobacter spp. характеризуется мультирезистентностью, способностью формировать биофильм, что объясняет неудачи антибактериальной эрадикационной терапии микроорганизма при хронической инфекции.
Повторный высев Achromobacter spp., сопровождающийся увеличением продукции специфических преципитирующих антител, ассоциируется с более быстрым падением лёгочной функции, сопоставимым с таковым при хронической синегнойной инфекции (к заболеванию предрасполагает иммунодефицит).
Наиболее активными антибактериальными препаратами для внутривенного введения являются пиперациллин-тазобактам, #меропенем** и #сульфаметоксазол+ триметоприм**, #цефтазидим**, #цефепим**, для ингаляций -#колистиметат натрия и #цефтазидим** (форма для инъекционного применения) (табл.16) .
- Рекомендовано пациентам с МВ при первом высеве Achromobacter spp. или при обострении бронхолегочного процесса, связанном с Achromobacter spp. внутривенное введение комбинации двух антибиотиков различных классов курсом 14–21 день с целью эрадикации возбудителя:
- 1 линия — Пиперациллин+Тазобактам/#Меропенем**/ #Сульфаметоксазол+Триметоприм** (табл.16);
- 2 линия –#Цефтазидим**, #Миноциклин, #Колистиметат натрия**, #Хлорамфеникол**; комбинированная терапия #Меропенем** и #Ципрофлоксацин** (Левофлоксацин**) (табл.16).
- Альтернативная терапия: #Меропенем** + #Миноциклин#Левофлоксацин** + #Хлорамфеникол**+ #Колистиметат натрия**(раствор для ингаляций) (табл.16) [1,2,89,162,163,184,199,203].
(УУР – C, УДД – 5).
- После основного курса антибактериальной терапии рекомендовано назначать #Колистиметат натрия**(раствор для ингаляций) (противопоказан детям до 6 мес.) на 3 месяца. Можно использовать #Сульфаметоксазол+Триметоприм** (табл.16) в течение 1 месяца [1,2,89,162,163,184,199,200,201,202,203].
(УУР – C, УДД – 5).
- Рекомендовано при хронической инфекции Achromobacter spp. у пациентов с МВ применять длительно ингаляции (нформация о препаратах – табл.16):
1- я линия: #Колистиметата натрия** (раствор для ингаляций)
2- я линия: #Меропенема**
Альтернативная терапия: #Цефтазидим** и #Тобрамицин (раствор для ингаляций или капсулы с порошком для ингаляций)**
3- я линия: Для лечения обострений, обусловленных Аchromobacter spp., используют комбинацию двух антисинегнойных антибиотиков различных классов [1,2,89,162,163,184,199,200,201,202].
(УУР – C, УДД – 5).
Таблица 16. Антибактериальные препараты, применяемые у пациентов с муковисцидозом, при высеве из мокроты/бронхиального секрета Achromobacter spp. [1,2,89,162,163,184,199,200,201,202].
| Антибактериальные препараты | Суточная доза для детей | Суточная Доза для взрослых | Способ введения | Кратность введения |
|
#Цефтазидим** (форма для инъекционного примменения) |
В возрасте до 2 мес: 25 – 50 мг/кг/сут, старше 2 мес — 50–100 мг/кг/сут |
2 г | Ингаляции | 2 |
| #Цефтазидим ** | 300 мг/кг | 9 – 12 г | В/в | 3 |
|
#Меропенем** (форма для инъекционного применения) |
250 мг — 500 мг | — | Ингаляции | 2 |
| #Меропенем** | 120 мг/кг | 6 г | В/в | 3 |
| Пиперациллин+Тазобактам | 400 — 500 мг/кг | 13,5 | В/в | 3 |
| # Ко-тримоксазол [Сульфаметоксазол+Тримет оприм] ** | 20 мг/кг (по триметоприму) | 2880 мг | В/в и внутрь | 3 |
| #Доксициклин** |
Дети с массой тела до 45 кг в первый день — 4 мг/кг, в последующие дни — 2-4 мг/кг. Детям с массой тела более 45 кг — как взрослым |
1 день-200 мг затем 100 мг один раз в сутки |
Внутрь | 1- 2 |
| #Хлорамфеникол** | 50-100 мг/кг | 2 – 4 г | Внутрь, в/в | 3-4 |
| #Тиамфеникола глицинат ацетилцистеинат | 500 -1000 мг | 1000 мг | Ингаляции | 2 |
| #Колистиметат натрия | 2-4 млн ЕД | 2 – 4 млн ЕД | Ингаляции | 1 |
| #Цефоперазон + [Сульбактам]** | 150-200 мг/кг | 8 г | В/в | 2 |
| #Имипенем + [Циластатин]** | 50-100 мг/кг в день по имипенему | 2-4 г | В/в | 3-4 |
|
#Имипенем +[Циластатин]** |
250 мг -500 мг | — | Ингаляции | 2 |
| #Миноциклин | Детям старше 8 лет назначают в начальной дозе 4 мг/кг массы тела, в дальнейшем — 2 мг/кг массы тела каждые 12ч. |
Средняя начальная доза препарата для взрослых составляет 0,2 г, в дальнейшем — 0,1 г каждые 12 ч |
Внутрь | 2 |
|
#Тобрамицин** (раствор для ингаляций) (противопоказан детям до 6 мес. жизни) |
600 мг | 600 мг | Ингаляции | 2 |
Примечания:
При наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее — по жизненным показаниям) по решению врачебной комиссии осущетвляется назначение лекарственных препаратов не по международному непантентованному наименованию, а по торговому наименованию (часть 15 статьи 37 Федерального закона от 21.11 2011 № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и пункт 6 Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения, утвержденного приказом Минздрава России от 14.01.2019 №4н). Решение врачебной комиссии оформляется протоколом и вносится в медцинскую документацию пациента.
Применение лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний производится по решению врачебной комиссии с разрешения Локального этического комитета медицинской организации (при наличии), при наличии подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет.
3.1.3.7 Антибактериальная терапия микобактериоза
Поражение легких, вызванное нетуберкулезными микобактериями (НТМБ), может представлять серьезную опасность для здоровья пациентов с МВ, однако на современном этапе диагностика и лечение микобактериоза не стандартизированы.
- Рекомендуется диагностически значимыми критериями микобактериоза у пациентов с МВ считать: положительный мазок на наличие кислотоустойчивых бактерий (КУБ) в материале из дыхательных путей, наличие роста НТМБ или МБТ на питательных средах, подтверждение одного и того же вида микобактерий как минимум из двух образцов, наличие результатов теста лекарственной чувствительности НТМБ [204,205,206,207,208], (Приказ Минздрава РФ от 21.03.2003 № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации». (Приложение 11) Инструкция по унифицированным методам микробиологических исследований при выявлении, диагностики и лечении туберкулеза).
(УУР – C, УДД – 5).
- При выборе антибиотиков для терапии инфекции НТМБ у пациентов с МВ рекомендовано ориентироваться на тест на лекарственную чувствительность с целью повышения эффективности терапии [206,207].
(УУР – C, УДД – 5).
Комментарии: Схемы лечения НТМБ на основе Согласованных рекомендаций Американского фонда кистозного фиброза (муковисцидоза) и Европейского общества кистозного фиброза по лечению микобактериоза у пациентов с кистозным фиброзом.
Режимы приема антибиотиков при инфекции НТМБ представлены в Таблице 17, а значимые побочные эффекты/явления токсичности описаны в Таблице 18.
Следует учесть, что тест на лекарственную чувствительность НТМБ не всегда коррелирует с терапевтической эффективностью препарата.
- Рекомендовано критерием эффективного лечения НТМБ у пациентов с МВ считать отсутствие роста микобактерий на питательных средах не менее чем в трех последовательно взятых образцах диагностического материала (мокрота) [204,205,206,207,208], (Приказ Минздрава РФ от 21.03.2003 № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации» (Приложение 11), Инструкция по унифицированным методам микробиологических исследований при выявлении, диагностики и лечении туберкулеза).
(УУР – C, УДД – 5).
3.1.3.7.1 Антибактериальная терапия микобактериоза, вызванного M. abscessus
Учитывая недостаток данных клинических исследований, существует большое разнообразие назначаемых режимов терапии. Общими следует считать следующие согласованные рекомендации по антибиотикотерапии пациентов с МВ при M. аbscessus [206,207]:
- Рекомендовано пациентам с МВ и НТБМ проводить двухфазное лечение микобактериоза, вызванного представителями M. abscessus complex – фаза интенсивного лечения должна сменяться фазой поддерживающего лечения с целью эрадикации данного возбудителя [206,207].
(УУР – C, УДД – 5).
Комментарии: Указанные в таблицах и схемах анитибактериальные препараты в РФ не имеют показания НТМБ, но это показание указано во всех в зарубежных клинических рекомендациях по МВ [206,207].
— интенсивная фаза должна включать ежедневный пероральный прием макролида (предпочтительно #азитромицина**) в сочетании с #амикацином** внутривенно на протяжении 3-12 недель, а также одного или нескольких из следующих препаратов: внутривенно #тигециклин**, #имипенем+циластатин** или #цефокситин (табл.17), что определяется (но не диктуется) результатами тестов на чувствительность к антибиотикам; Длительность фазы интенсивного лечения зависит от степени тяжести заболевания, результатов назначенного лечения и переносимости пациентом лекарственной схемы;
— поддерживающая фаза должна включать ежедневный пероральный прием макролида (предпочтительно #азитромицина**) и ингаляции #амикацином** в сочетании с двумя-тремя из следующих дополнительных антибиотиков перорально: #миноциклин, #моксифлоксацин** и #линезолид** (табл.17). Выбор препаратов определяется (но не диктуется) результатами тестов на чувствительность к антибиотикам;
лечением пациентов с микобактериозом, вызванным НТМБ из группы M.abscessus complex должны совместно заниматься специалисты по МВ и микобактериозам, поскольку довольно часто у таких пациентов появляется лекарственная непереносимость и интоксикация, и тогда требуется изменить схему приема антибиотиков;
Схема внутривенного введения #амикацина** с #цефокситином и/или #имипенемом и/или #тигециклином является наиболее распространенной. К препаратам с установленной in vitro активностью относятся макролиды (#кларитромицин** и #азитромицин**), #линезолид**, а также периодически: #ципрофлоксацин** и/или #моксифлоксацин**(табл.17).
Возникает все больше опасений по поводу того, что лечению пациентов с инфекцией, вызванной M. abscessus, у которых имеется либо ген erm [209] (что фенотипически выражается в индуцибельной резистентности к макролиду), либо мутация 23S rRNA (что приводит к высокой конститутивной резистентности к макролиду) может препятствовать переход с внутривенной на пероральную терапию (учитывая относительно низкую эффективность перорального приема антибиотиков), и в таком случае может быть показана продолжительная/сверхпродолжительная внутривенная терапия двумя и более эффективными антибиотиками.
Наряду с #амикацином**, #имипенем+циластатин**, а также меропенем** являются препаратами выбора в качестве сопутствующей внутривенной терапии; препараты имеют высокую активность in vitro, в то время как профиль побочных эффектов благоприятнее, чем у цефокситина и тигециклина** (табл.17).
Активность in vitro #кларитромицина** несколько выше, чем у #азитромицина**, однако данные по влиянию каждого из этих препаратов на экспрессию гена erm [209] противоречивы [210,211,212]. #Кларитромицин** (табл.17) является более сильным ингибитором ферментной системы P450, чем #азитромицин**, поэтому побочные взаимодействия препаратов с ним более распространены.
#Линезолид** (табл.17) демонстрирует активность in vitro в приблизительно 50% культур M. abscessus. Тем не менее, необходимо действовать с особой осторожностью при лечении пациентов с хроническими сопутствующими инфекциями метициллин-резистентного золотистого стафилококка, т.к. длительная терапия линезолидом может спровоцировать резистентность MRSA.
Фторхинолоны и #миноциклин и #доксициклин**(табл.17). редко демонстрируют активность in vitro, хотя они и включены в стандартную схему лечения [205,206,207].
- Категорически не рекомендуется применение монотерапии макролидами или иным антимикробным средством при лечении микобактериоза, вызванного НТМБ из группы M. abscessus complex с целью предотвращения развития резистентности НТМБ [205,206,207].
(УУР – C, УДД – 5).
Таблица 17. Антибактериальные препараты, применяемые у пациентов с муковисцидозом, при высеве из мокроты/бронхиального секрета микобактерий Micobacterium avium complex (MAC) и Mycobacterium abscessus complex (MABSC) [2,205,206,207], Приказ Минздрава РФ от 21.03.2003 № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации». Инструкция по унифицированным методам микробиологических исследований при выявлении, диагностики и лечении туберкулеза.
Примечание:
#Применение лекарственного препарата вне зарегистрированных в инструкции лекарственного средства показаний производится по решению врачебной комиссии с разрешения Локального этического комитета медицинской организации (при наличии), при наличии подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет.
Все препараты, применяемые при Micobacterium avium complex (MAC) и Mycobacterium abscessus complex (MABSC) назначаются вне инструкции (off-label) по жизненным показаниям.
Возрастные ограничения указаны в дозировках для детей, расчет приводится в соответствии с Согласованными рекомендациями Американского фонда кистозного фиброза (муковисцидоза) и Европейского общества кистозного фиброза по лечению микобактериоза у пациентов с кистозным фиброзом, рекомендациями по ведению болезней легких, вызванных нетуберкулезными микобактериями и другими согласительными документами [2,205,206,207].
Таблица 18. Важные побочные/токсические действия антибактериальных препаратов и рекомендуемые методы контроля за бактериями MAC и MABSC при МВ [1,2,176,205,206,207]
1Для получения максимального уровня в 20-30 µг/мл и минимального уровня <5-10 µг/мл.
2При приеме 25 мг/кг/день необходимо проходить ежемесячные осмотры
3У лиц с почечной достаточностью
3.1.3.7.2 Антибактериальная терапия микобактериозов, вызванных MAC (Mycobacterium avium complex)
Общими следует считать следующие рекомендации по антибиотикотерапии пациентов с МВ, инфицированных МАС (Mycobacterium avium complex): [205,206,207]
- В случае с чувствительной к #кларитромицину** формой поражения нетуберкулезными микобактериями легких (НТМБ) группы MAC рекомендовано применять лекарственную схему лечения на основе ежедневного перорального приема макролида (предпочтительно #азитромицина**), #рифампицина** и #этамбутола** (табл. 17) [205,213];
(УУР –С; УДД –5).
Комментарии:
Не рекомендуется применять прерывистую схему (три раза в неделю) перорального приема антибиотиков для лечения НТМБЛ группы MAC;
При лечении НТМБЛ группы MAC проводить начальный курс #амикацина** внутривенно при наличии одного или нескольких нижеследующих условий:
- положительный мазок на наличие кислотоустойчивых бактерий (КУБ) в материале из дыхательных путей;
- рентгенологическая картина образования в легких каверн или тяжелой инфекции;
- системные признаки заболевания;
Лечением пациентов с формой НТМБЛ группы MAC, резистентной к #кларитромицину**, должны совместно заниматься специалисты в области НТМБ и МВ.
Пациенты с высокой бактериальной нагрузкой (согласно положительному результату в тесте микроскопии мазка мокроты, наличию каверны и/или существенных воспалительных процессов в легких, или систематических симптомов на рентгене) могут почувствовать улучшение после первоначального (1-3 месяца) курса инъекций #амикацина** или #стрептомицина**(табл. 17) в дополнение к стандартному курсу лечения из трех препаратов для пациентов с заболеваниями легких, вызванными МАС. Имеющиеся данные не показывают различий между токсичностью при приеме 15 мг/кг #амикацина** (табл. 17) 1 раз в день или 25 мг/кг три раза в неделю [214].
Применение #амикацина** в виде ингаляций (лекарственная форма для инъекций) (табл. 17) вместо внутривенного аминогликозида может быть более предпочтительным ввиду менее тщательного наблюдения и меньшего токсического действия, однако данные результатов лечения остаются неполными, и эффективность такого лечения для пациентов с каверной легких, с субтерапевтическими уровнями лекарств сомнительна [162].
- Категорически не рекомендуется применение монотерапии макролидным препаратом или иным антимикробным средством при лечении НТМБЛ группы MAC с целью профилактики развития резистентности [206,207].
(УУР –С; УДД –5).
Комментарий: Основными факторами риска для развития у пациентов с заболеваниями легких, вызванными МАС, устойчивости к #кларитромицину** являются макролидная монотерапия и предыдущее лечение макролидами с несоответствующими дополняющими препаратами. Поэтому, необходимо незамедлительно прекратить прием макролидов (обычно прописываемых в качестве противовоспалительных препаратов при МВ) после изоляции микобактерий, при этом макролиды никогда не должны прописываться для лечения заболеваний легких, вызванных МАС, без двух соответствующих дополняющих препаратов.
Макролидная терапия обычно не рекомендована при заболеваниях легких, вызванных МАС, при устойчивости к #кларитромицину** [213] однако макролиды могут оказывать благоприятное влияние при МВ благодаря своим свойствам не-антибиотиков. Кларитромицин-устойчивые пациенты с заболеваниями легких, вызванными МАС, могут испытывать эффект от лечения парентерального аминогликозида, #рифампицина** (обычно #рифабутина**) и #этамбутола** в сочетании с одним или несколькими дополняющими препаратами (учитывая небольшое количество данных практических рекомендаций) (табл. 17), такими как #фторхинолоны [213,215,216]. #Рифабутин**(табл. 17) может давать положительный эффект при лечении кларитромицин-устойчивых пациентов с заболеваниями легких, вызванными МАС, однако часто проявляются побочные действия (особенно, патологическое изменение крови, расстройство желудочно-кишечного тракта, полиартралгия), которые требуют снижения дозы или полной остановки лечения [217,218,219].
- В случаях выявления у пациентов с МВ более одного вида НТМБ рекомендуется проводить микробиологическое исследование для определения того, какая/какие из микобактерий выделяется постоянно, и какая/какие являются причиной появления заболевания. [220,221].
(УУР –С УДД –5).
- Рекомендовано пациентов с муковисцидозом с заболеваниями легких, вызванными НТМБ обследовать на предмет АБЛА, так как микобактериозы, нередко сочетаются с аллергическим бронхолёгочным аспергиллезом и/или высевами грибов рода Aspergillus в мокроте или образцах бронхоальвеолярного лаважа [205].
(УУР –С УДД –5).
Комментарии: В таких случаях рекомендовано проводить терапию обеих инфекций. Поскольку #рифампицин** (группа противотуберкулезные препараты) ускоряет почечный метаболизм триазоловых противогрибковых препаратов, лечение аспергиллеза при заболеваниях легких, вызванных МАС, представляется более сложным. Первый способ – применять #рифабутин** вместо #рифампицина** (лечение #рифабутином** сопровождается индукцией печеночных ферментов, относящихся к подсемейству цитохрома Р450) в сочетании с обычными дополняющими препаратами для эрадикации МАС и #вориконазолом** или #позаконазолом**, который может быть меньше подвержен действию дополняющих препаратов #рифабутина**, чем #вориконазол**, с корректировкой дозировки в соответствии с уровнями концентраций (табл. 17) [205,222,223]. При недоступности терапевтического лекарственного мониторинга вместо #рифампицина** может применяться #амикацин* через небулайзер [162,205,224].
3.1.4 Терапия поражений легких, вызванных грибами рода Aspergillus
Результаты проведенного в НИИ медицинской микологии им. П.Н. Кашкина в 2014-2017 гг. исследования свидетельствуют, что колонизация дыхательных путей Aspergillus spp. возникает у 22% пациентов с МВ, а различные варианты аспергиллеза — 9,2% [225].
Наиболее частый вариант аспергиллеза у пациентов с МВ — аллергический бронхолегочный аспергиллез (АБЛА). Частота АБЛА у подростков и взрослых пациентов с МВ — 10-15%, реже у детей младшего возраста [40,41].
ХАЛ развивается у 2-5% пациентов с МВ. Инвазивный аспергиллез легких у пациентов с МВ возникает редко (0,5-1%) [225].
Грибы рода Aspergillus могут колонизировать дыхательные пути пациентов с МВ или вызывать, в зависимости от состояния иммунной системы пациента, аллергический бронхолегочный аспергиллез (АБЛА), хронический аспергиллез легких (ХАЛ) и инвазивный аспергиллез (ИА) [17,39,85,86].
- Рекомендовано применение антимикотических препаратов как этиотропной терапии при АБЛА и ХАЛ (табл.19) [17,39,85,86].
(УУР – С, УДД – 5).
Таблица 19. Антимикотики, применяемые при АБЛА и ХАЛ [17,39,85,86]
Примечания:
#Применение лекарственного препарата у детей вне зарегистрированных в инструкции лекарственного средства показаний производится по решению врачебной комиссии с разрешения Локального этического комитета медицинской организации (при наличии), при наличии подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет.
1 — Применение лекарственных форм для парентерального применения в виде ингаляций разрешается консилиумом специалистов по жизненным показаниям с разрешения Локального этического комитета медицинской организации, при наличии подписанного информированного согласия родителей (опекуна) и ребенка в возрасте старше 15 лет, в условиях специализированного стационара. В дальнейшем при хорошей переносимости прием препарата разрешен в амбулаторных условиях.
2 — Ингаляции #Амфотерицина В [липосомального] или #Амфотерицина В [Липидного комплекса] могут быть альтернативой или дополнительной противогрибковой терапией в лечении AБЛA при недостаточной эффективности терапии системными антимикотиками, непереносимости азольных ЛС или потенциально опасных лекарственных взаимодействиях [162,226,227].
При наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее – по жизненным показаниям) по решению врачебной комиссии осущетвляется назначение лекарственных препаратов не по международному непантентованному наименованию, а по торговому наименованию (часть 15 статьи 37 Федерального закона от 21.11 2011 № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и пункт 6 Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения, утвержденного приказом Минздрава России от 14.01.2019 №4н). Решение врачебной комиссии оформляется протоколом и вносится в медцинскую документацию пациента.
При использовании #вориконазола** и других средств группы триазолов всегда следует учитывать возможность лекарственных взаимодействий. Например, при назначении #вориконазола** следует отменить рифампицин** или другие индукторы ферментов цитохрома Р-450 (ингибиторы протонной помпы, карбамазепин**, фенитоин**), поскольку в этих случаях терапевтическая концентрация #вориконазола** в плазме и тканях обычно не достигается.
У пациентов, получающих длительную терапию #вориконазолом**, могут развиться кожные реакции фоточувствительности. Во время лечения пациентам рекомендуется избегать интенсивного или длительного облучения прямым солнечным светом.
Терапия АБЛА
- При АБЛА рекомендовано применение кортикостероидов для системного применения и противогрибковых лекарственных средств группы триазолов (#вориконазол** и #итраконазол) (табл.19)[39,85,228].
(УУР – C, УДД – 5).
Комментарий: #Позаконазол** применяют при непереносимости или невозможности применения #вориконазола** или #итраконазола
Использование кортикостероидов для системного применения рекомендовано при выраженном бронхообструктивном синдроме (БОС), наличии эозинофильных инфильтратов в легких или неэффективности применения противогрибковых лекарственных средств группы триазолов [39,85,228].
Для купирования бронхообструктивного синдрома и эозинофильных инфильтратов в легких назначают преднизолон** по 0,5–1,0 мг/кг/сут или другой кортикостероид системного действия в эквивалентной дозе (например, метилпреднизолон**) в течение 14 дней в зависимости от степени бронхообструктивного синдрома. Последующее снижение дозы (от 5 до 10 мг каждые две недели) в течение 1-3-5 месяцев. Продолжительность лечения зависит от активности и тяжести заболевания. Низкая поддерживающая доза (от 5,0 до 7,5 мг / сут) может потребоваться в течение длительного времени для контроля заболевания и предотвращения рецидивов у некоторых пациентов. [229,230 ].
Критериями эффективности служат купирование клинических признаков, исчезновение эозинофильных инфильтратов в легких и снижение уровня общего IgE в сыворотке крови. После достижения эффекта постепенно снижают дозу препарата вплоть до отмены в течение 3-4 недель.
Во время ремиссии пациенты в специфической терапии не нуждаются.
При рецидиве АБЛА вновь применяют #вориконазол** или #итраконазол (табл.19) в течение 2– 4 мес, при выраженном БОС – преднизолон** или метилпреднизолон**.
Кроме рецидива АБЛА показаниями к назначению триазолов является зависимость от кортикостероидов для системного применения, их недостаточная эффективность и выраженные нежелательные эффекты.
Применение противогрибковых лекарственных средств группы триазолов у пациентов АБЛА позволяет достоверно уменьшить применение кортикостероидов для системного применения, приводит к улучшению функции внешнего дыхания и уменьшению частоты рецидивов АБЛА.
Терапия ХАЛ
- Рекомендовано в качестве лечения ХАЛ у пациентов с МВ использовать длительный курс противогрибковых лекарственных средств, лечение «фонового» заболевания и уменьшение ятрогенной иммуносупрессии, а также хирургического удаления очагов поражения. [15,17,18].
(УУР – C, УДД – 5).
Комментарий: Пациенты с ХАЛ нуждаются в длительном наблюдении для контроля заболевания и своевременного лечения рецидива. Основу антимикотической терапии составляет применение пероральных #вориконазола** или #итраконазола (табл.19)). #Позаконазол** применяют при непереносимости или невозможности применения #вориконазола** или #итраконазола. #Каспофунгин** (табл.19), а также #Амфотерицин В [липосомальный] или #Амфотерицин В [Липидный комплекс] или обычный (табл.19) назначают в/в при неэффективности пероральных противогрибковых лекарственных средств группы триазолов.
Альтернативный метод лечения – #внутриполостное введение амфотерицина В**.
Важной составляющей лечения ХАЛ у больных МВ является улучшение экспекторации мокроты.
Коррекция иммунного дефекта обычно достигается успешным лечением основного заболевания и снижением дозы кортикостероидов для системного применения.
Хирургическое вмешательство – важный компонент комплексного лечения ХАЛ. Однозначным показанием является высокий риск или развитие легочного кровотечения. Чтобы уменьшить вероятность инфицирования тканей и развития специфической эмпиемы плевры, до и после оперативного лечения применяют #вориконазол** или #итраконазол (хирургическому лечению могут препятствовать распространенность поражения, тяжесть состояния пациента и выраженная дыхательная недостаточность, а также множественные аспергилломы. Частота осложнений (кровотечение и пр.) при оперативном лечении может достигать 5–20%.
3.1.5 Терапия внешнесекреторной недостаточности поджелудочной железы
- Заместительную терапию панкреатическими ферментами (Панкреатин**), (в виде минимикросфер, с рН-чувствительным покрытием без применения метакриловой кислоты [231,232,233,234,235] с или без желатиновой капсулы) рекомендовано назначать всем пациентам, включая новорождённых с МВ, имеющим клинические проявления кишечного синдрома или низкую концентрацию панкреатической эластазы-1 в кале (<200 мкг/г) при отсутствии противопоказаний. Цель вмешательства – коррекция внешнесекреторной панкреатической недостаточности (по клиническим показателям и отсутствие нейтрального жира в копрограмме) [2,19,233,234,235,236].
(УУР – B, УДД – 3).
Комментарий: При проведении заместительной терапии необходимо контролировать:
- показатели копрограммы, в первую очередь количество нейтрального жира;
- частоту и характер стула;
- ежемесячную прибавку массы тела и динамику роста пациента.
Для восстановления адекватной ассимиляции жира следует применять высокоэффективные панкреатические ферменты в виде минимикросфер, что в большинстве случаев позволяет компенсировать стеаторею и уменьшить дефицит массы тела.
Показания: все пациенты с признаками недостаточности экзокринной функции поджелудочной железы (стеаторея (нейтральный жир в копрограмме), снижение панкреатической эластазы-1 менее 200 мкг/г).
Противопоказания: индивидуальная непереносимость.
Выбор пути введения: внутрь до и во время каждого приема пищи. Панкреатические ферменты не следует назначать после еды. Капсулы, содержащие минимикросферы, можно вскрывать и принимать их содержимое одновременно с небольшим количеством пищи, или принимать целиком, не вскрывая, если ребенок уже достаточно большой и может проглотить капсулу.
Оценка эффективности лечения: к клиническим показателям адекватной дозировки панкреатических ферментов следует отнести: улучшение прибавки веса детей, уменьшение объема стула, его частоты, уменьшение зловонного запаха, исчезновение болей в животе.
Лабораторные показатели – уменьшение степени стеатореи.
Оценка безопасности лечения — по клиническим признакам.
Дополнительные замечания:
Подбор доз панкреатических ферментов проводится эмпирически.
- Доза панкреатина индивидуальна для каждого пациента.
- У большинства пациентов доза должна оставаться меньше или не превышать 10 000 ЕД по липазе на 1 кг массы тела в сутки или 4000 ЕД на 1 г потребленного жира.
- Подбор дозы можно начать в зависимости от массы тела, что составляет в начале лечения 1000 ЕД/кг по липазе на каждый прием пищи для детей младше четырех лет и 500 ЕД/кг по липазе во время приема пищи для детей старше четырех лет и взрослых. В дальнейшем доза может постепенно повышаться до нормализации симптомов стеатореи. Дозу следует определять также в зависимости от выраженности кишечного синдрома, результатов контроля за стеатореей и поддержания адекватного нутритивного статуса.
- Новорожденным на каждые 120 мл питания (смесь или женское молоко) стартовая доза рассчитывается как 2500-3333 ЕД липазы (1/4-1/3 капсулы препарата с активностью 10 000 ЕД липазы в капсуле). Эти дозы соответствуют примерно 600-800 ЕД липазы на 1 г пищевых жиров или по ½-1 мерной ложке кишечнорастворимых гранул из флаконов [11, 12, 37]. В настоящее время рекомендуется подсчет панкреатических ферментов по потребляемому жиру с расчетом коэффициента на 1 гр жира. Доза рассчитывается индивидуально. Допустимые значения коэффициента от 500 до 4000 ЕД на 1 гр жира.
- У ряда пациентов, особенно при белково–энергетической недостаточности, гиперацидности и других состояниях, может понадобиться повышенная доза панкреатина более 10 000 ЕД по липазе на 1 кг массы тела в сутки или 4000 ЕД на 1 г потребленного жира [237,238,239,240,241,242,243,244,245].
- Не следует повышать дозу ферментов до очень высокой (>18000-20000 Eд липазы/кг в сутки). В дальнейшем доза подвергается коррекции на основе клинических симптомов и лабораторных данных. Следует помнить, что примерно у 10% пациентов недостаточность поджелудочной железы не поддается полной коррекции [19].
- эффективность терапии панкреатическими ферментами иногда можно повысить при одновременном применении #фамотидина** (противопоказан в детском возрасте), ранитидина** (противопоказан детям до 12 лет), омепразола** (противопоказан детям до 2 лет) или эзомепразола** (пеллеты — противопоказаны детям до 1 года, таблетки противопоказаны детям до 12 лет. Данные препараты могут быть назначены в случае потребности значительного увеличения доз панкреатических ферментов и/или при отсутствии их лечебного эффекта, что может быть обусловлено повышенной кислотностью желудочного сока и недостаточным ощелачиванием химуса в 12-перстной кишке [22,89].
3.1.6 Терапия эндокринной недостаточности поджелудочной железы (МЗСД)
Лечение диабета при МВ (МЗСД) в целом должно соответствовать стандартам помощи всем пациентам с диабетом; но имеются особые требования к лечению пациентов с муковисцидозом [50,91].
- Рекомендовано лечение пациентов с МЗСД у специалистов многопрофильной команды, имеющей опыт работы с МЗСД, и при этом поддерживать контакт и консультироваться со специалистами по муковисцидозу с целью эффективного ведения пациентов с учетом особенностей основного заболевания [50,91].
(УУР – C, УДД – 5).
- При лечении МЗСД рекомендуется обучение самостоятельному уходу при диабете, инсулинотерапия и аэробная нагрузка не менее 150 мин в неделю с целью адекватного контроля МЗСД и предотвращения осложнений [50,91].
(УУР – C, УДД – 5).
- Рекомендовано соблюдение рекомендаций по питанию пациентов с муковисцидозом для пациентов с МЗСД. Изменение потребления калорий, жиров, белков, углеводов или соли в результате диагностики диабета не допускается. Рекомендуется равномерное распределение углеводов в течение суток и замена рафинированных на защищенные с целью поддержания нутритивного статуса [50,91].
(УУР – C, УДД – 5).
- Рекомендуется лечить МЗСД у пациентов с МВ инсулинами, а не пероральными гипогликемическими препаратами с целью оптимального контроля уровня глюкозы в крови [50,91,246,247].
(УУР – C, УДД – 5).
Комментарий: Эффективность пероральных гипогликемических средств для терапии МЗСД не доказана. При лечении МЗСД рекомендуется применять болюсную схему приема инсулинов. Может применяться стандартный режим базально-болюсного введения инсулинов, включая комбинацию базального (Инсулины и аналоги длительного действия) и быстродействующего (Инсулины и аналоги быстрого действия) инсулина путем многократных ежедневных подкожных инъекций или быстродействующего инсулина (Инсулины и аналоги быстрого действия) путем непрерывной подкожной инфузии (инсулиновая помпа). Пациентов следует научить устанавливать дозу инсулинов в соответствии с содержанием углеводов в их пище.
Есть очень ограниченные данные об использовании пероральных гипогликемических препаратов при МЗСД. Из пероральных гипогликемических препаратов, зарегистрированных на территории Российской Федерации изучены производные сульфонилмочевины, метформин**, прочие противогликемические препараты (репаглинид**) и тиазолидиндионы. Эффект не доказан.
Аналоги глюкагоноподобного пептида-1(инкретины или инкретинмиметические агенты) могут играть важную роль, но пока требуется провести дополнительные исследования, чтобы вынести доказательные рекомендации.
- Во время обострений легочного процесса рекомендуется чаще проверять уровень гликемии (до 3-6 раз в день), которая повышается на фоне воспаления и увеличить дозу инсулина, как болюсного, так и базисного с целью оптимального контроля уровня глюкозы в крови и своевременной коррекции дозы инсулинов [50,91].
(УУР – C, УДД – 5).
Комментарий: Пациентам с муковисцидозом при нарушении толерантности к глюкозе (НТГ), особенно во время обострения заболевания так же может потребоваться инсулиновая терапия.
- Рекомендуется проведение мониторинга осложнений МЗСД согласно мониторингу других форм диабета для организации профилактических мероприятий [50,91].
(УУР – C, УДД – 5).
3.1.7 Терапия поражения печени
- Рекомендуется назначение препаратов урсодезоксихолевой кислоты** (УДХК) (противопоказание до 3 лет для капсул, нет противопоказаний для суспензии для приема внутрь) пациентам с МВ с целью предотвращения гепатобилиарной патологии и терапии имеющихся поражений печени при отсутствии медицинских противопоказаний [1,2,22,248,249].
(УУР – C, УДД – 5).
Комментарий:
Противопоказания: индивидуальная непереносимость, острые воспалительные заболевания желчного пузыря.
Выбор лекарственных форм: препараты, выпускаемые в виде капсул и сиропа (для детей с массой до 34 кг), дозировка 15-30 мг/кг в сутки.
Оценка эффективности лечения: клинически и по данным УЗИ и фиброэластографии (1 раз в 12 месяцев) (см. раздел2. Диагностика).
Оценка безопасности лечения: необходим периодический (2 раза в год) контроль активности аланинаминотрансферазы, аспартатаминторансферазы, щелочной фосфатазы в крови (см. Раздел 2. Диагностика).
Тем не менее, в настоящее время, убедительных доказательных данных о предотвращении развития фиброза и цирроза на фоне приема УДХК нет [250].
Пациентам с МВ рекомендуется минимизировать применение гепатотоксичных лекарственных средств, исключение алкоголя [2,249].
- Рекомендовано при развитии хронической печеночной энцефалопатии, асцита, варикозно- расширенных вен пищевода и желудка 3-4 степени и кровотечения из них проводить терапию согласно соответствующим клиническим рекомендациям [2,249,251].
(УУР — С; УДД-5).
Комментарии: формирование таких осложнений встречаются нечасто, но, тем не менее, требуют экстренных мер лечения. Ряду пациентов может понадобиться трансплантация печени (см.раздел 3.4 Хирургическое лечение), в настоящее время в Российской Федерации проведено 16 трансплантаций.
3.1.8 Терапия остеопороза у пациентов с МВ
Задачами лечения остеопороза являются: предотвращение переломов костей, повышение качества жизни, замедление или прекращение потери костной массы, у детей — обеспечение нормального роста.
- Рекомендовано лечение основного заболевания при вторичном остеопорозе у пациентов с МВ [36,96,125,252].
(УУР – С, УДД – 5).
- Колекальциферол**, в том числе, в виде капель для приема внутрь, рекомендован всем пациентам с МВ в качестве терапии недостаточности витамина D в виде приема один раз в день ежедневно или один раз в неделю (в эквивалентных дозах) для поддержания концентрации 25(ОН)D сыворотки не менее 30 нг/мл (75 нмоль/л) (табл.20) [96,253,254, 255].
(УУР – С, УДД –5).
Комментарии:
Таблица 20. Дозы колекальциферола** (витамина D3) и рекомендации по лечению дефицита витамина D у детей и взрослых с МВ (ЕД)
| Возраст, годы | Профилактическая доза, МЕ |
Максимальная лечебная доза, МЕ |
|
0-3 |
1500-2000 |
2000 |
|
4-10 |
2000-3000 |
4000 |
|
11-18 |
2000-4000 |
10000 |
|
>18 |
2000-4000 |
10000 |
- Рекомендовано терапию остеопороза при МВ проводить согласно клиническим рекомендациям по остеопорозу [36,125,252].
(УУР – С, УДД –5).
Комментарий: Вопрос о применении бисфосфонатов решается в индивидуальном порядке с учетом минеральной плотности костной ткани, малотравматичных переломов в анамнезе и трансплантационного статуса
При лечении бисфосфонатами у пациентов с МВ получены доказательства увеличения МПК Однако малое число наблюдений не позволило выявить снижение риска переломов при длительности лечения 2 года [256].
Длительность лечения бисфосфонатами определяется индивидуально. Назначаются бисфосфонаты в детской практике решением консилиума врачей или при разрешении Этического комитета и подписании информированного добровольного согласия родителями ребенка [257].
3.1.9 Терапия хронического риносинусита и назального полипоза
- Рекомендуется ирригационная терапия при наличии ХРС [122,258].
(УУР – A, УДД – 1).
Комментарии: промывания полости носа проводятся изотоническими (0,9%) или гипертоническими (3%) солевыми растворами 2 раза в сутки (или чаще по показаниям) ежедневно перед проведением ингаляций в полость носа.
- Рекомендуется терапия кортикостероидами в виде назального спрея при наличии назального полипоза [96,259,260].
(УУР – А, УДД – 1).
Комментарии: доказана эффективность в отношении уменьшения размера полипов; предпочтение следует отдавать кортикостероидам в виде назального спрея с наименьшей степенью системной абсорбции (мометазона фуроат в дозе 400 мкг в сутки у взрослых, 200 мкг в сутки у детей с 2-х лет, длительными курсами от 2 до 12 месяцев, в некоторых случаях – дольше), в т.ч. после ринохирургического лечения.
Терапия хронического полипозного риносинусита дорназой альфа** — см. раздел 3.1.2 Муколитическая терапия.
3.1.10 Консервативная терапия легочного кровотечения и кровохарканья
Легочное кровотечение встречается ежегодно у 4,0% взрослых пациентов (регистр 2017 г.), кровохарканье разной интенсивности встречается чаще. Причина развития этих осложнений заключается в ремоделировании легочной ткани и развитии патологически извитых и увеличенных бронхиальных артерий. В ряде случаев ангиографически не подтверждается развитие патологических бронхиальных артерий и причиной кровохарканья является эрозивное поражение слизистой бронхоэктазов. Лечебные мероприятия включают в себя снижение активности гнойного воспаления в бронхах, гемостатическую терапию и хирургическое пособие.
- Рекомендовано в качестве гемостатической терапии пациентам с кровохарканьем применять этамзилат** (внутривенно или внутрь) и/или ингибиторы фибринолиза: аминокапроновая кислота** и транексамовая кислота**. При неэффективности вышеперечисленных препаратов рекомендовано применение препаратов крови: свежезамороженная плазма, Фактор свертывания крови VIII**, факторы свертывания крови (Факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]**, Эптаког альфа (активированный)**) [261,263,264,265].
(УУР – C, УДД – 5).
Комментарии: Курс гемостатических препаратов назначается на несколько дней до купирования кровохарканья. На высоте легочного кровотечения дополнительный эффект может оказать обкладывание грудной клетки льдом.
- Рекомендовано при возникновении кровохарканья у пациентов с МВ на фоне манифестации обострения бронхолегочного процесса обязательное назначение антибиотиков [261,264].
(УУР – C, УДД – 5).
Комментарии: Необходимо помнить, что кровохарканье может быть следствием или усугубляться передозировкой гепарина**, использующегося для промывания периферических венозных катетеров.
- Рекомендовано проведение бронхоскопии пациентам с кровохарканьем на фоне МВ по показаниям во время кровотечения/кровохарканья с целью выяснения источника кровотечения, как этап подготовки к дальнейшему хирургическому пособию, непосредственного купирования кровохарканья проведением бронхоблокации, санации трахеобронхиального дерева от сгустков крови при проведении искусственной вентиляции легких [261,264].
(УУР – C, УДД – 5).
- При неэффективности консервативных методов, нарастании эпизодов кровохарканья и развитии легочных кровотечений пациентам с МВ рекомендовано хирургическое пособие [261,264].
(УУР – C, УДД – 5).
Комментарий: см. раздел 3.4 «Хирургическое лечение».
3.1.11 Терапия дыхательной недостаточности
Дыхательная недостаточность — это патологический синдром, при котором парциальное напряжение кислорода в артериальной крови меньше 80 мм рт.ст. (SpO2 95%) и/или парциальное напряжение углекислого газа больше 45 мм рт.ст.
По времени развития различают острую (нарастание симптомов в течение часов или дней) и хроническую (в течение недель или месяцев) ДН. С клинической точки зрения целесообразно еще выделять острую дыхательную недостаточность на фоне хронической (ОДН на фоне ХДН).
Причина развития хронической ДН у пациентов с МВ — структурные изменения легких, которые развиваются вследствие хронического бронхолегочного процесса и приводящие к снижению абсолютной площади газообмена. Причиной развития ОДН – обострение хронического гнойного бронхолегочного процесса в легких, легочное кровотечение, пневмоторакс. Причиной для развития ОДН могут быть и общими, в частности развитие вирусной пневмонии в разгар эпидемии гриппа.
Другим, важным компонентом в развитии ДН у пациентов с МВ является слабость и утомление дыхательной мускулатуры, очень часто сопровождающие тяжелое течение заболевания.
- Рекомендовано проведение кислородотерапии при PaO2 <55 мм рт.ст. в покое, или при PaO2 <60 мм.рт.ст. в покое, но при наличии отеков, полицитемии, легочной гипертензии [128,129].
(УУР – C, УДД – 5).
Комментарии: «Золотой» стандарт диагностики нарушений газообмена – забор анализ крови на кислотно-основное состояние из лучевой артерии.
— Кислородотерапия рекомендована не менее 15-24 часов в день
— Целевой уровень: SpO2 90-92%
- Рекомендована неинвазивная вентиляция легких (НИВЛ) при гиперкапнической дыхательной недостаточности у пациентов с МВ [266,267,268]. Цель проведения НИВЛ — нормализация или улучшение газообмена. К положительным эффектам НИВЛ также можно отнести эффект улучшения дренажа мокроты за счет значительного улучшения коллатеральной вентиляции [261,262].
(УУР – C, УДД – 5).
Комментарии: Показания к неинвазивной вентиляции легких при ОДН (при соблюдении трех условий):
- Тяжелая одышка, участие в дыхании вспомогательных мышц и парадоксальное дыхание
- Частота дыхания>25 в минуту
- Респираторный ацидоз (pH<7,35) и гиперкапния (PaCO2>45 мм рт.ст.)
- Выраженная гипоксемия (PaO2/FiO2)<200 мм рт.ст.
Показания для вентиляции легких при ХДН:
- PaCO2>55 мм рт.ст.
- PaCO2 50-54 мм рт.ст. и эпизоды ночной гипоксемии
- PaCO2 50-54 мм рт.ст. и частые госпитализации вследствие повторных обращений
Подбор режима и параметров вентиляции очень индивидуально и во много зависит от исходного состояния пациента.
Хроническая дыхательная недостаточность – является показанием для рассмотрения направления пациента на трансплантацию легких (см. раздел 3.4 «Хирургическое лечение»).
3.1.12 Консервативная терапия мекониевого илеуса
Формы мекониевого илеуса:
Неосложненная форма — плотный меконий формируется внутриутробно и забивает дистальные отделы тонкой кишки, вызывая дилатацию проксимальных, утолщение кишечной стенки и кишечную непроходимость.
При неосложненном мекониевом илеусе возможна консервативная терапия. Осложненная форма обструкции кишки приводит к сегментарному завороту, атрезии, некрозу или перфорации кишки, мекониевому перитониту или происходит образование гигантской мекониевой псевдокисты.
Осложненный мекониевый илеус всегда требует экстренного хирургического лечения [22,269].
- Консервативная терапия мекониевого илеуса для ликвидации непроходимости кишечника у пациентов с МВ может быть рекомендована для ликвидации непроходимости кишечника при соблюдении необходимых условий:
- Отсутствие рентгенологических признаков хирургических осложнений
- Отсутствие патологического отделяемого из желудка
- Отсутствие болевого синдрома
- Компенсированный метаболический и волемический статус [123,270,271].
(УУР – C, УДД – 5).
Комментарии:
Консервативные мероприятия:
- Пероральное введение водорастворимого контрастного вещества с рентгенконтролем пассажа по ЖКТ (A06.17.002 Рентгеноконтроль прохождения контрастного вещества по желудку, тонкой и ободочной кишке)
- Перорально муколитики (#N-ацетилцистеин в разведении 1:5 в дозе 1,0 мл/кг)
- Высокая очистительная клизма с муколитиками — #N-ацетилцистеин в разведении 3 мл на 200,0 мл физиологического раствора NaCl под ультразвуковым контролем заполнения кишечника или без такового максимально щадящим способом выверенным объемом жидкости
- Повторное тугое контрастирование толстой кишки рентгеноконтрастными водорастворимыми растворами с созданием коло-илеального рефлюкса [270].
3.1.13 Консервативная терапия синдрома дистальной интестинальной обструкции
- Терапия синдрома дистальной интестинальной обструкции (СДИО) у пациентов с муковисцидозом с целью восстановления пассажа кишечника – рекомендуется при отсутствии признаков кишечной непроходимости применение больших доз #ацетилцистеина** 600- 1200мгсутки, лактулозы** от 5 до 45 мл в сутки в 3 приема в зависимости от возраста, обильное питье, гиперосмолярные растворы, нормализация режима и дозировки приема панкреатических ферментов [1,2,272,273].
(УУР – C, УДД – 5).
Комментарий: При неэффективности проводимой консервативной терапии, признаках кишечной непроходимости – оперативное лечение в соответствии с рекомендациями по кишечной непроходимости.
В настоящее время отсутствуют доказательства высокого уровня о преимуществе того или иного терапевтического вмешательства при СДИО ввиду небольшого числа исследований и редкости данной патологии у пациентов с МВ [274].
3.1.14 Терапия псевдо — Барттер синдрома
- Лечение развившегося ПБС у пациентов с МВ рекомендовано проводить препаратами калия хлорида**, калийсберегающими диуретиками для профилактики электролитных нарушений [1,2,89,90].
(УУР – C, УДД – 5).
Комментарии: Пероральное введение хлорида калия** возможно при снижении калия от 3,5 до 3,0 ммоль/л, отсутствии изменений на ЭКГ. Внутривенная терапия — при снижении калия ниже 2,5 ммоль/л, при наличии изменений на ЭКГ, при длительном нарушении состояния ребенка.
Профилактика гипокалиемии 1-2 ммоль/кг массы тела по 7% раствору калия хлорида**, терапевтическая доза вводится внутривенно из расчета 2-4 ммоль/кг и более в зависимости от уровня калия в крови.
В комплексной терапии используются калийсберегающие диуретики – спиронолактон** (противопоказан детям до 3 лет) из расчета 1-3 мг/кг.
Отмена терапии проводится постепенно, после полной стойкой нормализации уровня электролитов в крови, при стабильных прибавках веса и под контролем концентрации электролитов в венозной крови.
3.1.15 Патогенетическая терапия (ивакафтор+лумакафтор)
- Рекомендуется применение комбинации ивакафтор+лумакафтор (ивакафтор (потенциатор белка CFTR) + лумакафтор (корректор белка CFTR)) у пациентов с муковисцидозом гомозиготных по мутации F508del в гене CFTR с целью патогенетического лечения, повышения количества активного белка CFTR на поверхности клеток экзокринных желёз, повышения лёгочной функции, снижения частоты лёгочных обострений и замедления прогрессирования заболевания. [117, 275,276].
(УУР – A, УДД – 1).
Комментарии:
Комбинация ивакафтор+лумакафтор показана для лечения муковисцидоза у пациентов в возрасте 2 лет и старше, гомозиготных по мутации F508del в гене CFTR (эффективность и безопасность комбинации ивакафтор+лумакафтор установлена только у пациентов с муковисцидозом, гомозиготных по мутации F508del в гене CFTR). При отсутствии данных о гетерозиготном носительстве мутации F508del у родителей, рекомендуется дополнительное обследование ( см. Раздел: «лабораторные диагностические исследования»).
Таблица. Рекомендуемая дозировка препарата ивакафтор+лумакафтор у пациентов в возрасте 2 лет и старше.
| Возраст | Доза | Общая суточная доза |
| детский возраст 2-5 лет и масса тела менее 14 кг |
одно саше ивакафтор 125 мг/ лумакафтор 100 мг каждые 12 часов |
Ивакафтор 250 мг/ лумакафтор 200 мг |
| детский возраст 2-5 лет и масса тела 14 кг и более |
одно саше ивакафтор 188 мг/ лумакафтор 150 мг каждые 12 часов |
Ивакафтор 376 мг/ лумакафтор 300 мг |
| детский возраст 6-11 лет |
2 таблетки Ивакафтор 125мг/ Лумакафтор 100 мг каждые 12 ч |
Ивакафтор 500 мг/ лумакафтор 400 мг |
| детский возраст с 12 лет и старше, а также взрослые пациенты |
2 таблетки Ивакафтор 125 мг/ Лумакафтор 200 мг каждые 12 ч |
Ивакафтор 500 мг/ лумакафтор 800 мг |
Препарат следует принимать с жиросодержащей пищей
- Противопоказания
Детский возраст до 2 лет для лекарственной формы в гранулах;
Детский возраст до 6 лет для лекарственной формы в таблетках.
-
Во время приема препарата ивакафтор+лумакафтор необходимо контролировать
- Активность аланинаминотрансферазы и аспартатаминотрансферазы в крови и Исследование уровня общего билирубина в крови, Исследование уровня свободного и связанного билирубина в крови перед началом лечения препаратом ивакафтор+лумакафтор, каждые 3 месяца в течение первого года терапии, а затем один раз в год.
- При назначении ивакафтор+лумакафтор необходимо проводить исходное и последующие обследования органа зрения на предмет катаракты (Консультация врача- офтальмолога, Офтальмоскопия, Визометрия, Биомикроскопия глаза)
- Эффективность терапии следует оценивать через 6 месяцев по снижению числа обострений, потребности в АБТ, функциональным тестам (потовая проба, метод ОРКП – при отсутствии снижения показателей потовой пробы), показателям спирометрии, ИМТ. [117]
- При отсутствии эффекта через 6 месяцев терапии препаратом ивакафтор+лумакафтор необходимо:
дополнительное обследование на носительство комплексного аллеля — секвенирование всего гена CFTR для выявления носительства комплексных аллей, которые могут обуславливать устойчивость к таргетной терапии (см раздел «лабораторные диагностические исследования») (в тех случаях, когда секвенирование не было выполнено перед началом терапии). При этом минимальным необходимым объемом исследования в данном случае будет анализ варианта L467F (NM_000492.3:c.1399C>T; NP_000483.3:p.(Leu467Phe)), доказанно приводящего к резистентности к терапии [105] любым доступным методом исследования.
проведение форсколинового теста на кишечных органоидах (см. раздел Методы подбора патогенетической терапии)
- Лечение пациентов следует прекратить при повышении активности АЛТ или АСТ >5 верхних границ нормы (ВНГ) или при повышении активности АЛТ или АСТ >3 ВГН в сочетании с уровнем общего билирубина >2 ВГН. при выявлении катаракты.
- Следует помнить о возможных лекарственных взаимодействиях (согласно инструкции к препарату), в т.ч., с противогрибковыми препаратами для системного применения- производными триазола, рифампицином** и зверобоем продырявленным [115]
3.1.16 Терапия препаратами других групп и/или по особым показаниям
Для терапии МВ применяется ряд лекарственных препаратов других фармакотерапевтических групп. Как правило, решение о назначении этих ЛС должно приниматься специалистами медицинской организации федерального уровня на основании индивидуальных показаний.
- Рекомендуется рассмотреть назначение кортикостероидов для системного применения при:
- тяжелом течении, обусловленном частыми обострениями с явлениями выраженной дыхательной недостаточности;
- длительном воспалительном процессе, осложненном образованием ателектатических изменений в легких;
- выраженном и стойком обструктивном синдроме, рефрактерном к действию β2- агонистов;
- аллергическом бронхолегочном аспергиллезе (АБЛА) [1,2,22]
(УУР – C, УДД – 5).
Комментарий: кортикостероиды для системного применения в малых дозах помогают не только стабилизировать состояние пациента, но и улучшить функциональные и клинические показатели. Чаще всего для поддерживающей терапии назначают преднизолон** по 0,3– 0,5 мг/кг массы тела пациента в сутки альтернирующим курсом. Его следует принимать внутрь через сутки (постоянно). При использовании ингаляционных форм глюкокортикостероидов медленнее и в меньшем количестве развиваются побочные эффекты, хотя оценка их эффективности требует проведения исследований [1,2,277].
- Рекомендовано назначение макролидов (#Кларитромицин**, #Азитромицин**) пациентам с МВ и хронической синегнойной инфекцией в качестве противовоспалительных ЛС с целью замедления прогрессирования снижения легочной функции [1,2,6,22,163,278,279,280,281]:
- #Азитромицин** в дозе 250 мг (пациентам с весом менее 40 кг) и 500 мг (пациентам с весом 40 кг и более) через два дня на третий между приемами пищи. Длительность терапии индивидуальна у каждого больного [2,163,278,279,280].
(УУР – С, УДД – 5).
- #Кларитромицин** в дозе 125 мг (пациентам с весом менее 40 кг) или 250 мг (пациентам с весом 40 кг и более) через день независимо от приема пищи [2,163,281].
(УУР – C, УДД – 4).
- Нестероидные противовоспалительные препараты (НПВП) в настоящее время могут рассматриваться как альтернатива кортикостероидам для системного применения с противовоспалительной целью. Однако это касается только #ибупрофена**. Методика назначения: #ибупрофен** назначается в дозе 20-30 мг на 1 кг массы тела дважды в день детям в возрасте от 6 лет. Максимальная суточная доза для взрослых составляет 1,2 г. Максимальная суточная доза для детей и подростков в возрасте от 12 до 17 лет – 1 г [1,2,22,282,283,284].
(УУР – A, УДД – 1).
Комментарии: Нестероидные противовоспалительные препараты оказывают достаточно выраженный противовоспалительный эффект, но при их длительном применении высок риск нежелательных явлений. Обсуждается возможность длительного применения препаратов, селективно ингибирующих циклооксигеназу-2 (нестероидные противовоспалительные и противоревматические препараты), однако их противовоспалительная активность ниже, чем у более ранних аналогов.
Парацетамол** метаболизируется в печени и обладает гепатотоксическим эффектом, что крайне нежелательноу пациентов с муковисцидозом, при котором поражения печени являются одним из проявлений данного заболевания.
Длительность терапии определяется индивидуально. Следует одновременно назначить ингибитор протонного насоса.
Использование селективных ингибиторов циклооксигеназы-2 (ЦОГ-2) (нестероидные противовоспалительные и противоревматические препараты группы коксибы) не рекомендовано из-за риска нежелательных явлений на сердечно-сосудистую систему при длительных курсах лечения [285].
Применение нимесулида (противопоказан до 12 лет) при МВ не выявило положительной динамики маркеров воспаления и показателей функции легких [286], препарат не рекомендован к применению.
- Рекомендуется #ацетилцистеин** в дозе 1200 мг в сутки у пациентов старше 12 лет и 600 мг в сутки у детей младше 12 лет в 2 приёма непрерывно с первого дня применения #амикацина** в течение всего курса применения и 7 дней после его окончания (минимум 6 недель) для снижения ототоксичности. Препарат имеет отчетливый слухосохраняющий эффект при аминогликозд- связанной потере слуха, понижает риск ототоксичности на 80% и предупреждает развитие антибиотикорезистентности, является антиоксидантом [2].
(УУР – C, УДД – 5).
3.2. Кинезитерапия
- Всем пациентам с муковисцидозом в обязательном порядке рекомендовано проведение кинезитерапии (КНТ) по индивидуальной программе (методики дренирования бронхиального дерева и лечебная физкультура) с целью улучшения эвакуации мокроты [1,2,22,178,268].
(УУР – C, УДД – 5).
Комментарий: кинезитерапия — один из важных компонентов комплексного лечения МВ. Главная цель проведения кинезитерапии — очищение бронхиального дерева от вязкой мокроты, которая блокирует бронхи, создавая условия для развития инфекции в бронхолёгочной системе, а также поддержание легких в максимально функциональном состоянии [1,2,6,178]. Основными методиками КНТ являются:
- постуральный дренаж;
- перкуссионный массаж грудной клетки;
- активный цикл дыхания;
- дренажные положения;
- аутогенный дренаж;
- терапия, с помощью дыхательных тренажеров, создающих положительное давление на выдохе, в том числе, с контролем и регулированием этого давления (специальные маски, PARI PEP I, PEP S системы, Тренажер дыхательный с переменным положительным давлением на выдохе PARI o-PEP тип 018 (флаттер) и др.);
- дренаж с помощью специальных приборов по показаниям: Система очистки дыхательных путей «The Vest Airway Clearance System, модель 105» с принадлежностями, (система очищения дыхательных путей от секрета методом высокочастотной осцилляции грудной клетки), аппарат для интрапульмональной перкуссионной вентиляции легких, Инсуффлятор-аспиратор механический Comfort Cough Plus (Комфортный кашель плюс), SICC2001 Plus с принадлежностями (откашливатель) и др.
Кинезитерапия назначается всем пациентам с момента постановки диагноза, в любом возрасте, как с легочными проявлениями заболевания, так и с кишечными симптомами. У грудных детей обычно применяют пассивную технику кинезитерапии, включающую:
- специальные дренажные положения, в которых улучшается эвакуация слизи из лёгких;
- контактное дыхание;
- массаж с лёгкой вибрацией и поглаживанием;
- клопфмассаж (постукивание в 8-ми точках грудной клетки);
- занятия на гимнастическом мяче;
- дыхание с помощью маски, создающей положительное давление на выдохе;
- дренаж с помощью специального вибрационного жилета: у пациентов с муковисцидозом в любом возрасте (от новорожденного до взрослого).
Эффективность тех или иных методов КНТ варьирует в зависимости от индивидуальных особенностей пациентов с МВ. Чем младше ребёнок, тем более пассивные методики дренирования следует использовать. Новорождённым выполняют только перкуссию и компрессию грудной клетки. По мере роста ребёнка следует постепенно вводить более активные методики, обучая пациентов технике контролируемого откашливания.
Услуги по приказу Минздрава России от 13.10.2017 N 804н «Об утверждении номенклатуры медицинских услуг»:
- Массаж при хронических неспецифических заболеваниях легких
- Общий массаж и гимнастика у детей раннего возраста
- Массаж грудной клетки медицинский
- Рекомендуются пациентам с муковисцидозом регулярные занятия лечебной физкультурой с целью улучшения эвакуации мокроты, укрепления дыхательной мускулатуры, повышения эмоционального тонуса пациента [1,2,22,178].
(УУР – C, УДД – 5).
Комментарии: занятия лечебной физкультурой позволяют:
- эффективно лечить и предупреждать обострения хронического бронхолёгочного процесса;
- формировать правильное дыхание;
- тренировать дыхательную мускулатуру;
- улучшать вентиляцию лёгких;
- повышать эмоциональный тонус пациента.
С раннего детства (начиная 3-х лет) необходимо стимулировать пациентов заниматься динамическими видами спорта, связанными с нагрузками средней интенсивности, особенно сопряжёнными с пребыванием на свежем воздухе. Физические упражнения облегчают очищение бронхов от вязкой мокроты и развивают дыхательную и общую мускулатуру. Некоторые упражнения укрепляют грудную клетку и исправляют осанку.
В редких случаях тяжесть состояния пациента полностью исключает возможность занятия физическими упражнениями. Поэтому вопросы спортивной активности (выбор вида спорта и нагрузки) должен решать лечащий врач.
Пациентам с МВ не следует заниматься особенно травматичными видами спорта (тяжёлая атлетика, футбол, хоккей и т.п.), поскольку длительное ограничение физической активности, связанное с восстановлением после травмы, неблагоприятно сказывается на дренажной функции лёгких.
Услуги по приказу Минздрава России от 13.10.2017 N 804н «Об утверждении номенклатуры медицинских услуг»:
- Лечебная физкультура при заболеваниях бронхолегочной системы
- Механотерапия при заболеваниях бронхолегочной системы
- Лечебная физкультура с использованием аппаратов и тренажеров при заболеваниях бронхолегочной системы
- Дыхательные упражнения дренирующие
- Лечебная физкультура с биологической обратной связью при заболеваниях бронхолегочной системы
3.3 Диетотерапия и витаминотерапия
3.3.1 Общие принципы диетотерапии у пациентов с МВ
Диетотерапия составляет важную часть комплексной терапии при МВ [1,2,22].
- Рекомендуется всем пациентам с муковисцидозом увеличение суточного потребления калорий до 120-150% по сравнению с нормами по возрасту, пропорциональное увеличение потребления высококачественного белка (20% от суточного калоража) и жира (35-40% от суточного калоража) с целью поддержания адекватного нутритивного статуса [62].
(УУР – C, УДД – 5).
Комментарий: Пациентам с МВ необходима ранняя нутритивная поддержка. Установлена непосредственная связь между состоянием питания и функцией легких. Существует прямая корреляция между показателем индекса массы тела, функцией легких и продолжительностью жизни.
Индекс массы тела (ИМТ) = масса тела (кг) / квадрат роста (м2).
При ИМТ >50 перцентиля (при ИМТ = 21 – 22 кг/м2 у взрослых) зарегистрировано существенное улучшение показателя ОФВ1.
Высокий перцентиль показателя вес/возраст ассоциируется с лучшими показателями ОФВ1, линейного роста, снижением сроков госпитализации, снижением количества бронхолегочных обострений, а также увеличением продолжительности жизни.
Белки
Пациенты с МВ нуждаются в повышенном количестве белка из-за его потерь (мальабсорбции) и в дополнительном поступлении его в период катаболизма при легочных обострениях. Источниками полноценного белка являются натуральные продукты (мясо, птица, рыба, морепродукты, молоко, кисломолочные продукты, творог, сыры, яйца). Детям старше года рекомендуется включать в рацион высокобелковые продукты (яйца, рыба, творог, сыр) не реже 3 раз в день, молоко и кисломолочные продукты не менее 500 – 800 мл в день.
Взрослым пациентам с муковисцидозом рекомендовано употреблять в день 2 – 3 порции продуктов, содержащих белок высокой биологической ценности (мясо, птица, рыба, яйца, творог, сыр).
В качестве дополнительного источника белка рекомендуется использование лечебных смесей для энтерального и дополнительного питания. Дополнительное питание назначают по 150 — 200 – 250 мл 1 – 3 раза в день (например, на второй завтрак, на полдник или перед сном, возможно в сочетании с фруктовым пюре, печеньем, хлопьями и т.п.). К использованию рекомендуются смеси на основе цельного молочного белка (стандартные специализированные продукты энтерального питания) с нормальным или повышенным содержанием белка. В случае недостаточной эффективности стандартных продуктов используются смеси на основе гидролизованного молочного белка (специализированные продуты энерального питания на основе гидролизованного белка молочной сыворотки) с нормальным или повышенным количеством калорий
Объем дополнительного питания определяется степенью нутритивной недостаточности и аппетитом.
У взрослых пациентов при расчете объема дополнительного питания необходимо учитывать тяжесть дыхательной недостаточности. Соблюдение принципа «много, не значит хорошо» у пациентов с тяжелой дыхательной недостаточностью – профилактика усиления синдрома гиперкатаболизма при перегрузке питательными субстратами.
Жиры
Чрезвычайно важно сохранение высокого потребления жиров пациентами с МВ. Жиры являются наиболее энергетически «плотным» энергоносителем (9 ккал/г); увеличение квоты жира в энергообеспечении снижает образование CO2, минимизирует его задержку в организме, положительно влияет на газообмен в легких. Возможность высокого потребления жира обеспечивается адекватной заместительной ферментной терапией.
Хотя количество жира в диете пациентов с МВ не ограничивается, важное значение приобретает его качественный состав. В связи с нарушениями в гепатобилиарной сфере, количество насыщенных и трансжиров (животные жиры, содержащиеся в жареных продуктах, колбасных изделиях, коже птицы, кулинарные жиры, маргарин) необходимо ограничивать, отдавая предпочтение жирам, богатым полиненасыщенными жирными кислотами (ПНЖК): омега-6 (кукурузное, подсолнечное масло) и омега-3 (льняное масло, жир морских рыб) жирными кислотами, природным витамином Е. Такие масла как – кукурузное подсолнечное, рапсовое следует использовать в качестве базовых продуктов для приготовления пищи. А такие масла, как льняное, тыквенное, сафлоровое, масло, масло грецких орехов, виноградных косточек и др. в качестве дополнительной, биологически активной добавки к пище, в небольшом объеме, без термической обработки, добавляя в готовые блюда.
Растительное кокосовое масло — содержит в своем составе среднецепочечные триглицериды (СЦТ). Триглицериды со средней длиной углеродной цепи (С6-С12) являются легко доступным источником энергии, так как не нуждаются в эмульгации желчными солями и гидролизе панкреатической липазой и легко всасываются, минуя лимфатическую систему, непосредственно в кровеносные сосуды системы воротной вены. Однако, следует знать, что СЦТ относятся к насыщенным жирам, обладают кетогенным эффектом, в связи с этим следует избегать избыточного употребления их в рационе.
Ряд смесей для лечебного питания содержат в своём составе СЦТ. Содержание их варьирует в пределах 20-70% жирового компонента, остальные жиры представлены липидами с высоким содержанием эссенциальных (полиненасыщенных) жирных кислот. Модульные жировые смеси (эмульсии) имеют в своем составе только СЦТ. Показанием к использованию таких продуктов, смесей является невозможность увеличить калорийность рациона и компенсировать стеаторею с помощью адекватных доз микросферических ферментов, выраженная степень нутритивной недостаточности.
Углеводы
Энергетический дефицит восполняется также за счет углеводов. Дисахариды, в том числе сахар, в большинстве случаев переносятся хорошо. В диету по аппетиту включают сахар, фрукты, сладкие напитки, мед, варенье, конфеты. В рационе питания простые углеводы не ограничиваются, однако, в связи с возрастающим риском возникновения ассоциированного с МВ сахарного диабета, их рекомендуется употреблять только после основных приемов пищи, во избежание резких колебаний уровня гликемии.
Необходимо помнить, что у 91% пациентов отмечается кариозное поражение зубов, что требует тщательной гигиены полости рта и регулярного наблюдения врача-стоматолога.
У пациентов, сохраняющих жалобы на диарею, вздутие живота, боли в животе и повышенное газообразование при употреблении молочных продуктов, необходимо исключить лактазную недостаточность. Снижение лактазной активности в биоптатах слизистой оболочки тонкой кишки 103 детей с МВ и тяжелой панкреатической недостаточностью было
обнаружено в 58% (тяжелая гиполактазия в 31% и умеренная в 28% случаев)[287].
Особую группу составляют дети, оперированные по поводу мекониевого илеуса, а также пациенты, оперированные по поводу СДИО, которые могут иметь лактазную недостаточность в той или иной степени, в зависимости от длины резекции тонкой кишки (пострезекционный синдром/синдром короткой кишки).
Детям на грудном вскармливании, при наличии лактазной недостаточности, используют биологически активные добавки, содержащие лактазу (лактазар, лактаза –беби и др.), при смешанном или искусственном вскармливании — низколактозные заменители грудного молока, а также безлактозные смеси на основе глубокого гидролиза белка. Детям старше года при сохраняющихся симтомах лактазной недостаточности, кишечной дисфункции показаны полуэлементные смеси для энтерального питания.
В дигестии полимеров глюкозы – мальтодекстринов с небольшим числом глюкозных остатков (5-8) в большей степени принимает участие глюкоамилаза и мальтаза (ферменты кишечного пристеночного пищеварения), чем панкреатическая амилаза. Мальтодекстрины имеют более низкую осмолярность, чем моно- и дисахариды, поэтому их использование в составе специализированных смесей для энтерального и дополнительного питания позволяет существенно увеличить калорийность без увеличения осмотической нагрузки на кишку.
Расщепление крахмала зависит от панкреатической амилазы, поэтому он усваивается хуже, чем ди- и моносахариды. Амилорея, также как креаторея и стеаторея, нуждается в коррекции панкреатином**. Излишки нерасщепленного крахмала, поступая в толстую кишку, гидролизируются кишечной микрофлорой, что приводит к повышенному газообразованию, вздутию и болям в животе.
Пациентам с МВ не ограничиваются продукты и блюда, богатые растворимыми пищевыми волокнами (пектины, камеди), которые способствуют профилактике запоров и синдрома дистальной интестинальной обструкции (СДИО). Однако, при сохранении диспептических явлений не рекомендуется в больших количествах пища, богатая грубой клетчаткой и волокнами (бобовые, каши из цельного зерна, цельнозерновой и ржаной хлеб, отруби, косточки, кожица от фруктов и овощей, сухофрукты, низкосортное мясо с большим содержанием соединительной ткани), которые увеличивают объем каловых масс и усиливают метеоризм.
- Для обеспечения повышенных энергетических потребностей калорийность суточного рациона пациентам с муковисцидозом рекомендуется рассчитывать не на фактический, а на долженствующий вес с учетом катаболических процессов при хроническом воспалении и исходя из дефицита массы тела (табл. 21) [2,62].
(УУР – C, УДД – 5).
Комментарий: Потребность в энергии у детей и взрослых с МВ, по данным различных источников, должна быть повышена до 120-150%, по сравнению с теоретическими расчетами на фактический вес, в зависимости от возраста и нутритивного статуса пациента (таблица 21). 35-40% всей энергетической потребности должно обеспечиваться жирами, 20% белками и 60-65% — углеводами.
При тяжелой дыхательной недостаточности 50 – 60% небелковых калорий должно приходиться на жиры (имеют наименьший дыхательный коэффициент – 0,7) [288 ] Существуют довольно сложные формулы для расчета необходимых дополнительных калорий, однако в повседневной практике можно пользоваться следующими ориентирами:
- 1-2 года — 200 ккал,
- 3-5 лет — 400 ккал,
- 6-11 лет — 600 ккал,
- старше 12 лет и для взрослых — 800 ккал в сутки [1].
Таблица 21. Рекомендуемые величины потребления белка и энергии
| Возраст | Белок, г/кг/сут | Энергия, ккал/кг/сут | |
| Минимальная | Максимальная | ||
| 0 — 1 год | 3 — 4 (до 6) | 130 | 200 |
| 1 — 3 года | 4 – 3 | 90 — 100 | 150 |
| 3 — 10 лет | 3 – 2,5 | 70 — 80 | 100 |
| 11-14 лет | 2,5 — 1,5 | 45 — 70 | 90 |
| Взрослые | 2-2,5 | 35 | 50 |
- Недостаточность питания рекомендуется диагностировать, если процент соответствия массы по росту и полу или массо-ростовой индекс (МРИ), фактическая масса/идеальная масса по росту и полу х 100% меньше 90% у пациентов детского возраста, а у подростков и взрослых — если ИМТ составляет менее 18,5кг/м2. Ведение пациентов с МВ осуществляют в зависимости от их физического статуса (табл.22). При показаниях Z-score по ИМТ от -1 до -2 следует диагностировать среднетяжелую недостаточность питания, а при >-2 – тяжелую недостаточность питания [289].
(УУР – C, УДД – 5).
- У взрослых тяжесть недостаточности питания рекомендуется оценивать по показателям ИМТ: ИМТ – 17 — 15 кг/м2 — соответствует недостаточности питания средней степени тяжести, ИМТ – менее 15 кг/м2 — тяжелой степени недостаточности питания [288 ].
(УУР – C, УДД – 5).
Комментарий:
Таблица 22. Диетологические рекомендации по ведению пациентов с МВ в зависимости от физического статуса [62]
- Рекомендованная цель нутритивной поддержки при МВ — обеспечить физическое развитие пациента согласно возрастным нормам (достижение оказателей физического развития в границе 25-75 перцентиль после коррекции нутритивного статуса, рекомендуемая цель — 50 перцентиль), Для взрослых — целевой ИМТ = 21 кг/м2 у женщин и 22 кг/м2 у мужчин и прирост % мышечной массы [62].
(УУР – C, УДД – 5).
Комментарий:
Систематический подход к оценке питания при МВ
| Возраст |
|
| Старшие дети и взрослые | Мониторинг массы тела, роста, ИМТ каждые 3 месяца |
| Мониторинг питания | |
| Дети и взрослые |
|
| Диетологическое консультирование | |
| Дети и взрослые | Дети – каждые три месяца, взрослые – каждые 6 месяцев |
3.3.2 Дети первого года жизни
Грудное вскармливание
Идеальным для новорожденных и детей первого года жизни является непастеризованное грудное материнское молоко, так как оно содержит широкий спектр защитных факторов и биологически активных веществ. Важную роль играет активность термолабильной липазы в нативном (непастеризованном) женском молоке. Для детей с МВ показана защитная роль естественного вскармливания: младенцы, получающие грудное молоко, имеют лучшие показатели легочных функций и низкую частоту инфекционных эпизодов, по сравнению с детьми на искусственном вскармливании. Новорожденные и дети первых месяцев жизни, которые не могут самостоятельно высасывать необходимый объем молока из груди ввиду тяжести состояния (общая слабость, одышка, сердечно-легочная недостаточность) должны получать сцеженное непастеризованное материнское молоко из бутылочки или через назогастральный зонд.
В некоторых случаях требуется дополнительное поступление энергии с помощью обогащения грудного молока. Так, при недостаточной прибавке в весе молоко можно обогащать добавлением на каждые 100 мл приблизительно 5 г (1 мерная ложка) сухой смеси на основе гидролизата белка с СЦТ.
- Детям грудного возраста с МВ и панкреатической недостаточностью рекомендуется назначать ферментную заместительную терапию препаратами панкреатина** (в виде минимикросфер) в каждое кормление с целью коррекции панкреатической недостаточности [2,62].
(УУР – C, УДД – 5).
Комментарий: с момента введения неонатального скрининга на МВ в России (2006 г.) появилась возможность раннего начала лечения, однако вопрос, когда и кому начинать заместительную терапию панкреатическими ферментами, не всегда ясен. Уровень панкреатической эластазы-1 в стуле в течение первого года жизни может существенно варьировать и однократного его измерения не всегда достаточно. Следует ориентироваться на темпы прибавки в массе и показатели копрограммы (наличие стеатореи) [62].
Смешанное/искусственное вскармливание
У детей, сохраняющих удовлетворительные темпы физического развития, могут использоваться обычные адаптированные молочные смеси.
При смешанном/искусственном вскармливании большинство младенцев, при своевременной диагностике панкреатической недостаточности и ее коррекции панкреатическими ферментами, хорошо растут и развиваются при использовании обычных адаптированных молочных смесей с преобладанием сывороточных белков в составе белкового компонента (60:40) [62].
- У детей первого года жизни с муковисцидозом не рекомендуется использовать заменители молока с низким содержанием белка (1,1 – 1,3 г/100 мл) и жира (менее 3,5 г/100 мл), так как они не обеспечивают нутритивные потребности пациентов с МВ [290].
(УУР – C, УДД – 5).
- При недостаточной прибавке в весе у пациентов с муковисцидозом рекомендуется отдавать предпочтение высококалорийным смесям, имеющим в качестве жирового компонента СЦТ и растительные жиры в эмульгированной форме, что позволяет улучшить утилизацию жира и снизить дозу панкреатических ферментов [291].
(УУР – C, УДД – 5).
Комментарии: этим требованиям отвечают отдельные смеси для недоношенных и маловесных детей.
Могут применяться: Антирефлюксная смесь, Жидкая специальная молочная смесь для вскармливания недоношенных и маловесных детей, Специализированный продукт детского диетического лечебного питания для детей раннего возраста, смесь специализированная сухая безлактозная (мелкий сухой порошок), Сухая специализированная смесь без лактозы, Сухая специальная молочная смесь для вскармливания недоношенных и маловесных детей и другие.
При смешанном/искусственном вскармливании большинство младенцев, при своевременной диагностике панкреатической недостаточности и ее коррекции панкреатическими ферментами, хорошо растут и развиваются при использовании обычных адаптированных молочных смесей с преобладанием сывороточных белков в составе белкового компонента (60:40).
- Рекомендовано назначение смесей на основе гидролизатов молочного белка при аллергии к белкам коровьего молока и временно – после оперативного вмешательства по-поводу мекониевого илеуса или СДИО или других оперативных вмешательствах на кишечнике с лечебной целью [290].
(УУР – C, УДД – 5).
- Пациентам, получающим массивную антибактериальную терапию, а также повторные курсы антибиотиков, рекомендовано ввести адаптированную кисломолочную смесь или смесь, обогащенную пробиотиками, в количестве до 1/3 суточного объема кормления для поддержания нормальной микрофлоры кишечника [290].
(УУР – C, УДД – 5).
- Прикорм рекомендуется вводить в 4–5 мес. (как и в популяции здоровых детей), а некоторым детям, при низкой прибавке в массе — раньше с целью коррекции данных нарушений (табл. 23) [290].
(УУР – C, УДД – 5).
Комментарий: первыми блюдами прикорма служат энергетически плотные блюда: каши на сцеженном молоке или молочной смеси со сливочным маслом, детский творог 4,5-5% жирности, далее вводят овощное пюре с мясным пюре и растительным маслом, желток.
Следует использовать высококалорийные продукты прикорма, обогащенные витаминно- минеральным комплексом: детские молочные каши промышленного производства с добавлением сливочного масла, овощные пюре с добавлением растительного масла, мяса.
Возможно введение мясного пюре в качестве первого прикорма детям на естественном вскармливании, как хороший источник железа и цинка.
Коровье и козье молоко можно использовать только для приготовления блюд с 8–9 месяцев. В эти же сроки можно вводить неадаптированные кисломолочные продукты (кефир, натуральный йогурт), обогащенные живыми бифидо- и лактобактериями. Блюда прикорма, в отличие от здоровых детей, подсаливают. Дополнительное количество поваренной соли в день ориентировочно составляет 1/8 чайной ложки (0,6 – 0,7 г) для ребенка первого полугодия и ¼ ч. л. (1,25 г) для ребенка 6-12 месяцев [290].
Таблица 23. Особенности введения прикорма детям первого года жизни с МВ
| Продукты и блюда | Возраст (мес) |
| Фруктовое пюре | 7 |
| Творог | 4 — 5 |
| Желток | 5 — 6 |
| Овощное пюре | 5 — 6 |
| Растительное масло | 4 — 5 |
| Каша |
4 (на сцеженном грудном молоке, молочной смеси или гидролизате) |
| Сливочное масло | 4-5 |
| Мясное пюре | 4,5 – 5,5 |
|
Неадаптированные кисломолочные напитки (кефир, йогурт) |
8 – 9 |
| Сухари, хлеб | 7 – 8 |
| Рыба | 8 — 9 |
3.3.3 Питание дошкольников и школьников и взрослых
Стандартные принципы питания одинаковы для детей, подростков и взрослых
Основной принцип — «активный» подход к питанию пациента с МВ в любом возрасте
- Питание ребенка должно быть регулярным (6 раз в день даже для школьников, а также для взрослых, формула 3+3): 3 основных приема пищи (завтрак, обед, ужин) и 3 дополнительных перекуса (2-й завтрак, полдник, на ночь);
- Питание должно быть «плотным»: в каждый основной прием пищи должны включаться блюда, содержащие качественные животные белки, цинк (мясо, субпродукты, рыба, яйца или молочные продукты – сыр, творог), качественные жиры (растительное, сливочное масло, сметана, сливки), сложные (крупы, хлеб, овощи) и в меньшей степени простые (фрукты, сладости, варенье, мед) углеводы;
- Дополнительные приемы пищи (перекусы: 2-й завтрак, полдник, перед сном) обязательны; они состоят, как правило, из кисломолочных продуктов, творога, фруктов, выпечки и умеренного количества сладостей.
При муковисцидозе до 10% пациентов к подростковому возрасту формируют фиброз и цирроз печени (CFLD — цирроз печени, ассоциированный с МВ); до 13% пациентов к 20-летнему возрасту и до 50% к 30 годам формируют ассоциированный с МВ сахарный диабет (CFRD — диабет, ассоциированный с МВ). Поэтому, несмотря на то, что при МВ, при отсутствии аллергических реакций, в международных рекомендациях разрешены любые продукты, некоторые блюда не рекомендуется употреблять постоянно и в больших количествах:
- продукты и блюда, осложняющие работу печени и желчевыводящих путей — тугоплавкие и транс-жиры (см. выше), крепкие бульоны, острые, кислые блюда и пряности;
- продукты промышленного производства, содержащие большое количество стабилизаторов, искусственных красителей и консервантов, майонез промышленного производства;
- т.н. «мусорную пищу», готовые сухие полуфабрикаты, фаст-фуд;
- сладкие газированные напитки и неразбавленные фруктовые напитки промышленного производства;
- в большом количестве и отдельно от других приемов пищи – рафинированные простые углеводы (сахар, конфеты) с целью не допускать резкого подъема уровня гликемии;
- при диспепсических явлениях – большие объемы продуктов, усиливающих газообразование в кишечнике: цельнозерновой и отрубной хлеб, свежую и кислую белокочанную, краснокочанную капусту, бобовые, свеклу, кожицу и семечки от фруктов, орехи, грибы.
- При бронхолегочных обострениях, значительном отставании в весе для увеличения поступления энергии, высококачественного белка, витаминов и минеральных веществ в качестве перекусов рекомендуется использовать специализированные высокоэнергетические коктейли или смеси для энтерального питания [2,62].
(УУР – C, УДД – 5).
- Рекомендовано обогащение рациона полиненасыщенными жирными кислотами, кальцием, пробиотиками для восполнения повышенных нутритивных потребностей пациентов с МВ (см. раздел 3.3.1 «Общие принципы диетотерапии у пациентов с МВ», жиры). С целью обогащения рациона омега-3 жирными кислотами рекомендовано использовать слабосоленую (не копченую) жирную морскую рыбу: сельдь, семгу, форель и др. лососевые, икру 3- 4 раза в неделю в качестве закуски [62].
(УУР – C, УДД – 5).
- Растительное масло (льняное, тыквенное, кедровое, масло грецкого ореха, соевое, рапсовое, подсолнечное, кукурузное, оливковое) рекомендуется использовать в нерафинированном виде без термической обработки, добавляя в салаты и готовые овощные блюда, для приготовления домашнего майонеза с целью обогащения рациона полиненасыщенными жирными кислотами и биологически активными веществами [2,62].
(УУР – C, УДД – 5).
- Пациентам с МВ рекомендуется ежедневно употреблять, как основной источник кальция и высококачественного белка — необезжиренные молоко, творог, сыр, кисломолочные продукты, обогащенные живыми штаммами пробиотиков (бифидобактерий и лактобактерий) – йогурты короткого срока хранения, биокефир и т.п. [2,62].
(УУР – C, УДД – 5).
- При формировании сахарного диабета, ассоциированного с муковисцидозом (МЗСД (CFRD)), рекомендуется калорийность рациона и содержание жиров сохранять повышенным для восполнения повышенных нутритивных потребностей пациентов с МВ [2,50,62,91] (см. раздел 3.1.6 «Терапия эндокринной недостаточности поджелудочной железы (МЗСД)»).
(УУР – C, УДД – 5).
3.3.4 Микронутриенты и витамины
- Всем детям с МВ рекомендовано подсаливание пищи с целью коррекции баланса хлора и натрия (табл. 24,25) [2,62].
(УУР – C, УДД – 5).
Таблица 24. Суточные потребности в соли (NaCl) у детей с МВ [2,62]
|
Вес ребенка/ температура окружающей среды |
< 5 кг | 5 – 10 кг | > 10 кг |
| 20 ºС | 0,8 г/день | 0,5 г/день |
Минимум + 0,8 г/день/10 кг |
| 25 ºС | 1,5 г/день | 2 г/день |
Минимум 2 г/день + 1 г/день/10 кг |
| 30 ºС | 2,8 г/день | 4 г/день |
Минимум 4 г/день + 2 г/день/10 кг |
Примечание: старшие дети, как правило, сами регулируют количество соли в своих блюдах по принципу «солонка на столе».
Таблица 25. Профилактические дозы натрия для пациентов с МВ [62]
| Возраст | Дотация натрия | Примечания |
| Дети 0-6 мес | 1–2 ммоль/кг/дн |
Для детей с риском соледефицита – соль, разведенная в воде или фруктовом соке небольшими порциями втечение дня, |
| Детям по показаниям (см. примечания) | до 4 ммоль/кг/дн |
Побъем соли у грудных детей, проживающих в жарком климате или при повышенных потерях жидкости (рвота, повышенная температура тела, диарея, тахипноэ, или при наличии стомы у грудного ребенка). |
| Дети после 6 мес и взрослые | Соленая пища или соль |
Применять в стрессовых ситуациях с избыточных потливостью (лихорадка, физические нагрузки, жаркая погода). |
Примечания:
1/5-1/6 чайной ложки примерно соответствует 15 ммоль NaCl солевых растворов, предназначенных для пероральной регидратации [2];
Для перевода ммоль в мг натрия, хлора или натрия хлорида необходимо умножить количество ммоль на 23, 35 или 58 (молекулярную массу натрия, хлора или натрия хлорида) соответственно [62].
- Всем пациентам с МВ рекомендовано дополнительное введение препаратов кальция: с целью профилактики недостаточности кальция в организме и остеопенических состяний [2,62].
(УУР – C, УДД – 5).
Комментарии: применяются препараты кальция (кальция глюконат**, кальция глицерофосфат) и комбинированные препараты (Кальция карбонат+Колекальциферол)
- Всем пациентам с МВ рекомендовано назначение жирорастворимых витаминов с целью восполнения дефицита их поступления с пищей на фоне мальдигестии и мальабсорбции [2,62,96,291].
(УУР – C, УДД – 5).
Комментарий: вследствие мальабсорбции жира у пациентов с МВ нарушается всасывание жирорастворимых витаминов.
У пациентов с МВ хорошо известно о недостаточности витамина D и нарушениях фосфорно- кальциевого обмена. Лечебный эффект высоких доз витаминов А и D нуждается в дальнейшем изучении. Однако хорошо известно, что все пациенты с МВ с панкреатической недостаточностью ежедневно должны получать дополнительно жирорастворимые витамины (А, D, Е и К) и бета-каротин, оптимально в водорастворимой форме. Пациенты с сохранной функцией поджелудочной железы обязательно должны получать дополнительно витамин Е. Водорастворимые витамины назначаются пациентам с МВ в обычных профилактических дозировках, рекомендуемых здоровым лицам соответствующего возраста, за исключением витамина С, потребность в котором у пациентов повышена, и витамина В12 случаях резекции подвздошной кишки.
В таблице 26 приведены рекомендуемые профилактические дозировки для дополнительного введения жирорастворимых витаминов, и терапевтические дозы витамина D для пациентов с МВ.
Таблица 26. Рекомендуемые профилактические дозы жирорастворимых витаминов и бетакаротена для пациентов с МВ [2,62,96,255,292,282,283].
Примечания: * — терапевтические дозы витамина D указаны в таблице 20 (терапия остеопороза) Могут применяться комбинированные препараты, например, Витамин Е+Ретинол
3.3.5 Агрессивные методы нутритивной поддержки у пациентов с МВ
К «агрессивным» методам нутритивной поддержки у пациентов с МВ относятся:
- Зондовое энтеральное питание в виде ночной гипералиментации, через назогастральный зонд или через перкутанную гастростому (трубки питательные гастростомические и еюнальные MIC, MIC-KEY с принадлежностями). С помощью ночной гипералиментации, при адекватном контроле панкреатическими заменителями, можно дополнительно обеспечить от 30 до 50% рассчитанной энергопотребности [9].
- Парентеральное питание
- Полное (центральный венозный катетер); показаниями являются:
— состояния после операции на кишечнике;
— синдром короткой кишки;
— острый панкреатит.
- Частичное (с целью дополнительного питания), используется периферическая вена:
— жировые эмульсии;
— глюкозо-аминокислотные смеси, витамины.
-
Рекомендовано применение «агрессивных» методов нутритивной поддержки при:
- отсутствии прибавки в весе или снижение веса в течение 6 месяцев;
- фактической массе тела ниже 3 перцентиля;
- фактической массе тела ниже должного значения на 15% или менее 25 перцентиля на фоне дополнительного питания специальными смесями [2,22,62].
(УУР – C, УДД – 5).
Комментарий: «агрессивные» методы нутритивной поддержки показали весьма высокую эффективность, в особенности у пациентов с МВ с выраженными нарушениями нутритивного статуса. Однако, оптимальные методики, схемы применения, виды и способы введения питательных смесей, способы заместительной ферментной терапии при проведении зондовой гипералиментации нуждаются в дальнейшей отработке в практике отечественной пульмонологии и педиатрии.
Показано, что только применение энтерального зондового питания через гастростому достоверно приводит к улучшению нутритивного статуса пациентов с МВ.
3.3.6 Программы ЭВМ для подбора диеты и ферментной терапии для врачей и пациентов
Разработаны программы для ЭВМ, которые направлены на оптимизацию комплексной терапии муковисцидоза и применяются в ряде регинов РФ [293]. Программа ЭВМ «Мониторинг нутритивного статуса, рациона питания и ферментной терапии при муковисцидозе» (Государственная регистрация № 2016 660762 от 21.09.16) позволяет сократить трудозатраты врача при расчетах индивидуальной диеты и дозы заместительной ферментной терапии. Мобильная версия программы ЭВМ «Мониторинг нутритивного статуса, рациона питания и ферментной терапии при муковисцидозе. Мобильная версия» (Государственная регистрация № 2017 661283 от 09.10.17) помогает пациентам самостоятельно подбирать дозу ферментов на каждый прием пищи; в режиме онлайн передавать данные (в деперсонифицированном виде) о физическом развитии, рационе питания, дозах панкреатина для консультации с лечащим врачом, обучает самоконтролю над своим заболеванием. Использование данных программ показало свою эффективность в клинической практике [241,293,294,295].
3.4 Хирургическое лечение
- При неэффективности консервативных методов, нарастании эпизодов кровохарканья и развитии легочных кровотечений пациентам с МВ рекомендовано хирургическое пособие с целью остановки кровотечения [261,263,264,265].
(УУР – C, УДД – 5).
Комментарий: методикой выбора является эмболизация бронхиальных артерий, достаточная простая процедура, заключающаяся в эндоваскулярной эмболизации кровоточащего сосуда инертными материалами. Эмболизация позволяет купировать эпизоды кровохарканья или значительно отсрочить следующие в 2/3 случаев. Также может проводиться эндоскопическая клапанная бронхолокация. Резекция кровоточащего сегмента, доли или целого легкого может проводиться только в чрезвычайных случаях по витальным показаниям.
Нарастание легочных кровотечений и невозможность их контролировать эмболизацией – показание для рассмотрения пациента как кандидата на трансплантацию легких.
- Лечение пневмоторакса у пациентов с МВ рекомендуется проводить согласно клиническим рекомендациям по пневмотораксу с целью выбора оптимальной тактики ведения пациента [261,262,296].
(УУР – C; УДД – 5).
Комментарии: пневмоторакс, по данным Национального Регистра, в Российской Федерации встречается ежегодно у 2,39% взрослых пациентов с муковисцидозом, что намного чаще чем у детей, и является следствием разрыва субплевральных булл. При рецидивах его рассматривается необходимость применения плевродеза. В таком случае манипуляцией выбора является локальный химический плевродез или плеврэктомия. К таким операциям, как резекция субплевральных булл, необходимо относится с осторожностью, учитывая возникновение дополнительного спаечного процесса, что может затруднять в дальнейшем трансплантацию легких.
- Рекомендуется эндоскопическое хирургическое лечение хронического риносинусита (ХРС) на фоне муковисцидоза при выраженном затруднении носового дыхания за счет назального полипоза и/или медиализации латеральной стенки полости носа; некупируемом консервативными методами обострении инфекционно-воспалительного процесса в ОНП, который рассматривается в качестве важной причины контаминации бронхолегочной системы; развитии синусогенных орбитальных и/или внутричерепных осложнений; необходимости санации полости носа и ОНП перед трансплантацией легких [297,298,299,300].
(УУР – В, УДД – 3).
Комментарий: для детей и взрослых пациентов оптимальным методом хирургического лечения ХРС во всем мире признана расширенная эндоскопическая функциональная риносинусохирургия (FESS-Functional Endoscopic Sinus Surgery) – малоинвазивный, органосохраняющий, физиологичный метод хирургического лечения заболеваний носа и околоносовых пазух. По классификации P. J. Wormald (Австралия, 2012), расширенная FESS включает в себя полипотомию в сочетании с полисинусотомией (максимально широким вскрытием всех пораженных полипозом пазух, расширением соустий верхнечелюстных пазух до 7 мм и более, вскрытием клеток решетчатого лабиринта с обнажением основания черепа). Показаниями к хирургическому лечению являются: выраженное затруднение носового дыхания за счет назального полипоза и/или медиализации латеральной стенки полости носа; некупируемое консервативными методами обострение инфекционно-воспалительного процесса в ОНП, который рассматривается в качестве важной причины контаминации бронхолегочной системы; развитие синусогенных орбитальных и/или внутричерепных осложнений; санация полости носа и ОНП перед трансплантацией легких. Изолированная оценка результатов КТ ОНП не может служить показанием к хиругическому лечению. На данный момент есть убедительные доказательства снижения степени контаминации нижних дыхательных путей после ринохирургического лечения. Тем не менее, пациенты и/или родители/законные представители должны быть информированы, что хирургическое лечение не является средством излечения от ХРС и назального полипоза и о высокой вероятности рецидивов и потребности в повторных вмешательствах.
- Рекомендовано направить пациента с муковисцидозом в терминальной стадии цирроза печени, но с относительно сохранной функцией внешнего дыхания к врачу-трансплантологу для оценки возможности проведения трансплантации печени [1,2,22].
(УУР – C, УДД – 5).
Комментарий: радикальный метод лечения. Первая операция в РФ проведена только в 2009 г.
Хирургическое лечение мекониевого илеуса
- Пациентам с МВ и мекониевым илеусом при отсутствии возможности консервативного лечения или при его неэффективности рекомендуется проведение оперативного лечения с целью разрешения кишечной непроходимости и предотвращения осложнений [123,271,301].
(УУР – C, УДД – 4).
Комментарии:
Оперативное лечение
- Диагностическая лапароскопия → лапаротомия (преимущественно правосторонним нижнепоперечным доступом, удобным для выведения илеостомы)
- Интестинотомия на границе расширенной и суженной кишки
- Опорожнение отводящего отдела кишечника
- Поэтажная биопсия кишки
- Выведение кишечной стомы на границе расширенной и суженной кишки (операция выбора)
- Наложение межкишечного анастомоза (при достаточном опыте оперирующего хирурга и отсутствии сомнений в патологии толстой кишки, желательно с проведением интраоперационной биопсии)
Послеоперационное ведение:
- По восстановлении пассажа по кишечнику энтеральная нагрузка не ранее 3 послеоперационных суток
- Расширение объема кормления при адекватной толерантности объему кормления
- Приоритетно грудное молоко, необходимо строгое соблюдение матерью щадящей диеты.
- При подозрении на муковисцидоз назначение панкреатина** из расчета начальной дозы 600-800 ед липазы на 1 грамм жира в смеси или в грудном молоке [22,271]
- При больших потерях по кишечной стоме переход на лечебные смеси с частичным или полным гидролизом белка
- Уход за отводящим отделом кишечника
- Верификация причин возникновения:
- Морфология биоптата
- Генетическое исследование
- Кал на панкреатическую эластазу
- Консультация специалиста по муковисцидозу.
- Верификация внутриутробной инфекции
Осложнения кишечной стомы
- Эвагинация кишки
- Перистомальный дерматит
- Парастомальная грыжа
- Мальабсорбция на фоне кишечной стомы
- Отсутствие прибавки в весе
Радикальный этап хирургической коррекции
-
Плановая через 2-3 месяца после первичной операции при:
- Стабилизации состояния пациента
- Адекватной прибавки в весе
- Смене внутрибольничной флоры на «домашнюю»
-
Срочная — через 2-3 недели после первичной операции:
- Отсутствие возможности достичь возрастного объема кормления
- Некорригируемые потери по стоме
- Сохраняющаяся зависимость от инфузионной терапии
- Клинически значимые очаги инфекции в отключенном отделе кишки
- Осложнения кишечной стомы, создающих угрозу жизни пациента
-
Обязательное предоперационное обследование:
- Результаты микроскопического обследования
- Исследование микробиологического пейзажа
- Антеградная рентгенконтрастная ирригоскопия
- Получение результатов нормальной морфологии биоптата стенки кишки
Оперативное лечение радикального этапа хирургической коррекции
Закрытие кишечной стомы с наложением межкишечного анастомоза
Примечание
- Любой вариант врожденной низкой кишечной непроходимости у новорожденного требует проведения дообследования у ребенка на муковисцидоз, а наличие внутриутробного псевдокистозного перитонита у новорожденного позволяет максимально рано заподозрить смешанную форму муковисцидоза и начать лечение уже с периода новорожденности (см. раздел «Клиническая картина заболевания или состояния (группы заболеваний или состояний)») [301].
- Необходимо стремиться к как можно более раннему закрытию кишечной стомы.
Трансплантация легких
- Рекомендовано направить пациента с муковисцидозом тяжелого течения, торпидного к терапии, частыми обострениями и осложнениями к врачу-трансплантологу для решения вопроса о проведении трансплантации легких [302].
(УУР – C, УДД – 5).
Комментарии: в мировой практике трансплантация лёгких (ТЛ) является общепризнанным методом лечения пациентов в терминальной стадии заболеваний лёгких различной этиологии. Среди показаний к ТЛ у пациентов старше 18 лет муковисцидоз (МВ) занимает 3 позицию, уступая ХОБЛ и лёгочному фиброзу, и занимает первое место у пациентов детского возраста от 6 до 17 лет. ТЛ при тщательном отборе пациентов достоверно улучшает показатели выживаемости и качество жизни. Медиана продолжительности жизни пациентов после ТЛ по поводу МВ характеризуется наилучшими показателями при сравнении с другими заболеваниями и составляет более 11 лет.
Основанием для направления пациента с МВ в Центр трансплантации (ЦТ) является:
- ОФВ1 ≤30% или прогрессивное снижение показателя ОФВ1, несмотря на максимально возможную терапию
- Дистанция в тесте 6-минутной ходьбы менее 400 м
- Развитие лёгочной гипертензии в отсутствие гипоксемической дыхательной недостаточности
- Прогрессивное ухудшение состояния пациента, приводящее к частым госпитализациям вследствие:
a) Развития и нарастания дыхательной недостаточности с потребностью в проведении НВЛ
b) Повышения антибиотикорезистентности, ухудшения клинического восстановления при обострениях, роста частоты обострений и госпитализаций
c) Ухудшения нутритивного статуса, несмотря на дополнительное энтеральное питание
d) Рецидивирующих пневмотораксов
e) Лёгочных кровотечений и кровохарканий, резистентных к эмболизации бронхиальных артерий.
Целью обращению в ЦТ является установление показаний и исключение противопоказаний к трансплантации лёгких.
Показания к трансплантации лёгких:
- Хроническая дыхательная недостаточность (гипоксемическая форма PaO2<60 мм.рт.ст.; гиперкапническая форма PaCO2 >50 мм.рт.ст.)
- Длительная неинвазивная вентиляция лёгких
- Лёгочная гипертензия (СДЛА>35 мм.рт.ст при ЭХО-КГ, или СДЛА> 25 мм.рт.ст. по результатам катетеризации сердца)
- Частые обострения заболевания, требующие стационарного лечения
- Прогрессивное снижение показателей функции внешнего дыхания
- 4 функциональный класс по NYHA.
Противопоказания к трансплантации лёгких делятся на абсолютные и относительные. Вклад последних в принятие решения о постановке в лист ожидания определяется на основании локальных протоколов и собственного опыта ЦТ.
Абсолютные противопоказания к трансплантации легких при МВ:
- Наличие в анамнезе злокачественных онкологических заболеваний со сроками ремиссии после соответствующей терапии менее 5 лет (исключение – рак кожи T1-2N0M0, после радикального лечения, с ремиссией более 2 лет)
- Тяжелая дисфункция или заболевание других органов и/или систем при отсутствии возможности симультантной коррекции
- Тяжелое состояние пациента, характеризующееся нарушением витальных функций организма (острое нарушение мозгового кровообращения, отсрый инфаркт миокарда и т.д.)
- Некоррегируемые нарушения гемостаза
- Хроническая персистирующая неконтролируемая микробная инфекция, туберкулёз
- Выраженная деформация грудной клетки и позвоночника
- ИМТ ≥35 кг/м2
- Психические нарушения с потерей дееспособности, адекватного контакта, зависимости от психоактивных веществ, алкоголя и/или табака
- Отсутствие комплаентности и надлежащей социальной поддержки
Относительные противопоказания:
- Возраст старше 65 лет
- Ожирение 1 степени (ИМТ 30,0–34,9 кг/м2)
- Прогрессирующее или тяжелое истощение (ИМТ менее 15 кг/м2)
- Тяжелый остеопороз с наличием патологических переломов или болевого синдрома
- Предшествующие операции на грудной клетке с резекцией легких и/или проведением плевродеза
- Искусственная вентиляция легких и/или наличие у реципиента вспомогательного кровообращения и/или экстракорпоральной мембранной оксигенации
- Внелегочная колонизация или инфицирование высокорезистентными или высоковирулентными бактериями или грибами
- Наличие хронического вирусного гепатита В и/или С, ВИЧ-инфекции и/или СПИДа
- Хроническое инфицирование дыхательных путей такими микроорганизмами, как Burkholderia cepacia, Mycobacterium abscessus
- Другие заболевания или состояния без клинических признаков терминального поражения органов-мишеней.
Показания к направлению в ЦТ и постановке в лист ожидания пациента детского возраста в целом не отличаются от таковых у пациентов старше 18 лет. Однако в каждом конкретном случае взвешенное решение принимается консилиумом в составе хирургов-трансплантологов, анестезиологов, педиатров, пульмонологов и специалистов по муковисцидозу.
3.5. Репродуктивное здоровье мужчин с муковисцидозом
Диагностику состояния репродуктивной системы мужчин с МВ см. в разделе 2. «Диагностика»
- Рекомендуется пациентам мужского пола с муковисцидозом, имеющим азооспермию/криптозооспермию, проведение биопсии тестикул (с 18-летнего возраста). При получении сперматозоидов, пригодных для оплодотворения, возможно их использование в процедурах ЭКО/ICSI (и криоконсервация при возможности и необходимости), при отсутствии сперматозоидов – рекомендовано использование донорских гамет в программах ВРТ для сохранения возможности деторождения [101,104,130].
(УУР – C, УДД – 5).
- Рекомендуется пациентам мужского пола в возрасте с 15 лет с муковисцидозом без азооспермии/криптозооспермии криоконсервация сперматозоидов (по возможности ранняя) для последующего их использования в программах ЭКО/ICSI для возможности деторождения, в частности у носителей патогенного варианта 3849+10kbC>T в гене CFTR [99,303].
(УУР – C, УДД – 4).
3.6 Беременность при муковисцидозе
Планирование беременности у женщин с любым тяжелым экстрагенитальным заболеванием является важным фактором профилактики осложненного течения беременности и залогом успешного её завершения.
Подготовка к беременности должна проводится по трем направлениям:
- Генетическое консультирование с целью уточнения риска рождения ребенка с муковисцидозом.
- Оценка клинического и функционального состояния пациентки:
— весо-ростовые характеристики
— показатели респираторной функции
— инфекция дыхательных путей
- Социальная адаптация (помощь в понимании последствий принятого решения) Пациентка должна быть осведомлена о возможном взаимном влиянии муковисцидоза и беременности, риске рождения ребенка с муковисцидозом. Принимая во внимание наличие тяжелого недуга у матери, следует уточнить, кто при необходимости, будет оказывать помощь в уходе за ребенком. Существенным моментом при тяжелом течении заболевания является планирование будущего для ребенка.
Во время беременности дыхательная система женщины претерпевает значительные анатомические и функциональные изменения:
Подъем диафрагмы до 4 см
Снижение ОЕЛ, ФОЕ, ОО
Увеличение минутной вентиляции
Рост потребления кислорода
Гиперсекреция и отек слизистой дыхательных путей (преимущественно в третьем триместре).
Снижение легочных объемов в сочетании с бронхиальной обструкцией (ОФВ1<50%) вызывает закрытие мелких дыхательных путей (<2 мм) во время спокойного выдоха, до достижения легочной системой точки равновесия (т.е. достижения ФОЕ). Ранний экспираторный коллапс приводит к затруднению отхождения мокроты у пациентов с муковисцидозом. В случае выраженных обструктивных нарушений высока опасность развития мукостаза, обострения инфекционного процесса, а также изменения диффузионно-перфузионных отношений и развития артериальной гипоксемии.
Энергетические затраты организма матери и плода, возросшие во время беременности, требуют дополнительного усвоения 300 ккал/сутки. Внешнесекреторная недостаточность поджелудочной железы, приводящая к мальдигестии и мальабсорбции, требует особенного внимания к вопросам питания и заместительной терапии у пациенток с муковисцидозом во время беременности.
Во время беременности увеличивается объем циркулирующей плазмы, что приводит к увеличению частоты сердечных сокращений и ударного объема. Механическое сдавление растущим плодом нижней полой вены вызывает дополнительное увеличение преднагрузки. У пациенток, страдающих тяжелой легочной патологией, это может привести к развитию легочной гипертензии, перегрузке правых отделов сердца, развитием сердечной недостаточности [304,305].
Факторы риска жизнеугрожающих осложнений
Наиболее значимым фактором, снижающим показатели выживаемости у родивших женщин, является инфицирование дыхательных путей Burkholderia cepacia complex.
Другими факторами, определяющими неблагоприятный прогноз при беременности у пациентки с муковисцидозом, являются:
Снижение ОФВ1 менее 50% от должного
Низкий нутритивный статус пациентки, прибавление беременной в весе менее 4,5 кг
Легочная гипертензия
Инфицирование дыхательных путей Burkholderia cepacia complex.
Сахарный диабет [306].
- Для определения риска рождения ребенка с муковисцидозом, рекомендовано провести генетическое исследование будущего отца ребенка, так как в случае выявления у него мутации в гене МВТР, риск рождения больного ребенка составит 50% [304].
(УУР – C, УДД – 5).
Комментарий: следует также сообщить пациентке, что даже если результат анализа по выявлению наиболее частых мутаций отрицательный, остается риск носительства вторым родителем ребенка неизвестной мутации. В этом случае необходимо дальнейшее генетическое исследование гена МВТР. Если второй родитель не является носителем мутации муковисцидоза, то ребенок будет облигатным носителем одной из мутаций матери, фенотипически здоровым.
- Пациенток, планирующих беременность, рекомендовано вести мультидисциплинарной командой специалистов в связи с тем, что беременность для пациенток с МВ является дополнительной нагрузкой при имеющемся хроническом заболевании, кроме того, необходимо тщательно подбирать лекарственные препараты для терапии МВ с учетом их эффективности для женщины и безопасности для плода [304].
(УУР – С, УДД – 5).
Комментарий: наряду с наблюдением и лечением у врача-пульмонолога самое пристальное внимание следует уделить оценке нутритивного статуса. Обязательна консультация врача- диетолога. При необходимости назначается лечебное питание.
Оптимизации состояния здоровья (подавление хронической инфекции, улучшение функции внешнего дыхания, компенсация сахарного диабета, адекватное питание и нормализация процессов пищеварения) повышает шансы на скорое наступление беременности и является профилактикой обострения болезни, что позволяет снизить медикаментозную нагрузку в первом триместре, в период органогенеза.
Лечение муковисцидоза во время беременности
- Рекомендовано адекватное (в полном объеме) лечение муковисцидоза у пациенток с МВ и беременностью, что является основным методом профилактики осложненного течения беременности и лечения фетоплацентарной недостаточности [304].
(УУР – С, УДД – 5).
Комментарии: особенности физиологической адаптации к беременности, увеличивающие нагрузку на системы дыхания, кровообращения, требующие увеличения энергетических затрат организма матери, определяют необходимость значительного расширения программы лечения этой группы пациенток [304].
Необходимо максимально увеличить калораж суточного рациона беременных, используя высококалорийные пищевые добавки, продолжать заместительную ферментную терапию и при необходимости антацидную терапию. В связи с высокой степенью проникновения блокаторов Н2-рецепторов через плацентарный барьер, рекомендовано заменить их игибиторами протонной помпы.
- Рекомендовано при необходимсти назначения лекарственной терапии беременным пациенткам с МВ осуществлять выбор ЛС в соответствии с классификацией фармакологических препаратов по степени возможного риска для плода с целью предупреждения фетотоксических эффектов [304,307].
(УУР – С, УДД – 5).
Комментарии:
Классификация лекарственного ущерба для плода:
Категория А Риск мало вероятен
Категория В В испытаниях на животных препарат безвреден; клинические испытания не проводились
Категория С В испытаниях на животных доказан потенциальный риск для плода; клинические испытания не проводились
Категория D Доказан потенциальный риск для плода; клинический эффект препарата превышает потенциальный риск для плода;
Категория X Риск для плода доказан и превышает лечебное действие препарата.
Из перечисленных групп только препараты группы Х полностью исключаются во время беременности.
Для лечения хронического инфицирования дыхательных путей золотистым стафилококком и неферментирующей Грам-отрицательной палочкой (преимущественно синегнойная инфекция) во время беременности, необходимо активно продолжать таблетированную, внутривенную и ингаляционную антибактериальную терапию.
К антибиотикам категории В относятся все препараты из группы пенициллинов и цефалоспоринов, а также меропенем**, азитромицин**, эритромицин, азтреонам (противопоказания: гиперчувствительность)
К антибиотикам категории С относятся все препараты из группы фторхинолонов, сульфаниламидов, а также имипенем/циластин**, кларитромицин**, гентамицин**, ванкомицин**, линезолид** (противопоказания: гиперчувствительность).
К антибиотикам категории D относятся все препараты из группы тетрациклинов, аминогликозидов, кроме гентамицина**, а также сульфаниламиды в поздние сроки беременности.
Ингаляционная форма терапии приобретает особенное значение во время беременности, так как позволяет доставлять препараты в бронхиальное дерево, в меньшей степени повышая пороговую концентрацию в крови.
Женщины, инфицированные неферментирующей Грам-отрицательной флорой, нуждаются в проведении нескольких курсов внутривенной антибактериальной терапии за время беременности с учетом возможного риска для плода. Чаще всего применяются цефтазидим**, цефепим**, меропенем** (противопоказания: гиперчувствительность) [304,307].
Кинезитерапия пациенток с муковисцидозом во время беременности
- При беременности пациенткам с МВ рекомендовано максимально интенсифицировать применение муколитических препаратов и кинезитерапии для сохранения дренажных функций бронхиального дерева [304,307].
(УУР – С, УДД – 5).
Комментарии: ежедневные занятия кинезитерапией следует продолжать и во время беременности. Дыхательные упражнения не должны вызывать утомления или одышки, порядок их выполнения следует приспосабливать к индивидуальным особенностям пациентки. Необходимо обеспечить возможность выполнения дыхательных упражнений при различных положениях тела (сидя или лежа). Этим требованиям соответствуют такие техники кинезитерапии, как цикл активного дыхания и аутогенный дренаж. Терапия, с помощью дыхательных тренажеров, создающих вибрации бронхиальной стенки и/или положительное давление на выдохе, в том числе, с контролем и регулированием этого давления (специальные маски, PARI PEP I, PEP S системы, Тренажер дыхательный с переменным положительным давлением на выдохе PARI o-PEP тип 018 (флаттер) и др.); позволяет увеличить дренажный эффект выполняемых дыхательных упражнений.
Ежедневные физические упражнения также улучшают дренаж бронхиального дерева, однако физическая нагрузка не должна быть максимальной, так как на фоне понижения ФОЕ и повышения потребления кислорода существует опасность развития кислородного голодания для плода. В качестве динамических упражнений можно рекомендовать плавание, гимнастику. В комплекс гимнастики необходимо включить упражнения по укреплению мышц тазового дна [308].
Роды
- Беременным с МВ рекомендовано плановое родоразрешение (програмированные роды) вследствие наличия тяжелого экстрагенитального заболевания, обуславливающего риск развития осложнений и возникновения необходимости экстренного оказания акушерских пособий [304,307,309].
(УУР – С, УДД – 5).
Комментарии: роды следует вести через естественные родовые пути с мониторным контролем за состоянием роженицы, сердцебиением плода и характером родовой деятельности. При тяжелом течении болезни необходимо ограничить длительные и сильные потуги. С этой целью рекомендована эпизио- или перинеотомия.
Проведение кесарева сечения у пациенток с муковисцидозом связано с высоким риском инфекционных осложнений, нарушения бронхиального дренажа и усиления бронхиальной обструкции. Ограничение физической активности в раннем послеоперационном периоде и болевые ощущения, провоцируемые кашлем, затрудняют отхождение мокроты. Терапевтическими показаниями для проведения кесарева сечения являются наличие спонтанного пневмоторакса в анамнезе, дыхательная недостаточность со снижением сатурации ниже 92%, показатели функции внешнего дыхания менее 50% от должных величин.
Акушерские показания для абдоминального родоразрешения: декомпенсированная фето- плацентарная недостаточность, острая гипоксия плода, упорная слабость родовой деятельности.
Предпочтительный метод обезболивания родов и кесарева сечения — эпидуральная анестезия.
Послеродовый период
- После рождения ребенка рекомендовано не снижать интенсивность проводимой терапии, так как заботы о новорожденном потребуют от пациентки больших физических сил [304,307].
(УУР – С, УДД – 5).
Комментарий: нарушение режима сна, питания, постоянная занятость заставляют пациенток пренебрегать регулярной киензитерапией, пропускать курсы антибактериального лечения, что приводит к снижению веса, ухудшению респираторной функции.
К лактации и грудному вскармливанию у родильниц с муковисцидозом следует подходить индивидуально. Большинству таких родильниц лактация не противопоказана. Однако при тяжелом течении заболевания и развитии акушерских осложнений, потребовавших досрочного родоразрешения, возникают показания к выключению лактации.
Обсуждая с пациенткой с муковисцидозом ее желание стать матерью, необходимо уточнить, в какой степени члены семьи готовы помочь в уходе за ребенком, так как заботы о новорожденном потребуют больших физических сил.
3.7 Паллиативная помощь
Палллиативная помощь пациентам с муковисцидозом оказывается на основании соответствующих нормативных документов (см. Приложение А3).
6. ОРГАНИЗАЦИЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
При оказании медицинской помощи пациентам с муковисцидозом необходимо использовать мультидисциплинарный подход, что обусловлено как тяжестью состояния, так и поражением различных органов и систем (Приложение Г7).
Ведение пациентов с МВ предпочтительно проводить в специализированных центрах (кабинетах или отделениях муковисцидоза). Следует испольовать стационарозамещающие технологии.
Динамическое наблюдение в амбулаторно-поликлинических условиях при оказании первичной медико-санитарной помощи осуществляет врач-педиатр участковый (врач-педиатр, или врач-пульмонолог, или врач общей практики, которые прошли соответствующий тематический курс в рамках программ непрерывного медицинского образования, а также имеют опыт ведения пациентов с данной нозологией; консультации специалистов – по показаниям) с частотой, определяемой тяжестью состояния пациента и имеющимися осложнениями болезни (1 раз в 1-3 месяца или по показаниям). Впервые диагностированные дети или пациенты с тяжелыми формами заболевания должны наблюдаться чаще (ежемесячно), пациенты с легким или атипичным течением МВ могут наблюдаться реже (каждые 3-6 мес.).
Наблюдение за пациентом и контроль состояния необходимо осуществлять регулярно в условиях дневного стационара. Госпиализация проводится по показаниям (Приложение Г10) в круглосуточный стационар (в пульмонологическое, инфекционное или иное отделение, в штате которого есть специалисты, имеющие опыт ведения пациентов с данной нозологией). Пациента госпитализируют в палату с учетом подтвержденного ранее микробиологического пейзажа (особенно для Р. aeruginosa, В. cepacia comрlex, MRSA, Stenotrophomonas maltophilia, Achromobacter spp., нетуберкулезных микобактерий, хронический аспергиллеза), при возможности – индивидуальный бокс. В зависимости от состояния пациента срок госпитализации может составить от 4 до 21 дня.
Пациенты с МВ, нуждающиеся в стационарном лечении в рамках первичной специализированной медико-санитарной помощи, направляются по медицинским показаниям в пульмонологическое, инфекционное или иное отделение (по показаниям, условия – указаны выше) медицинской организации врачом скорой медицинской помощи, врачом-педиатром участковым, врачом-пульмонологом или иным специалистом амбулаторно-поликлинического звена.
Пациентов с муковисцидозом, нуждающихся в оказании специализированной медицинской помощи, в том числе высокотехнологичной, в стационарных условиях, по медицинским показаниям направляют в соответствующее отделение медицинской организации врач-пульмонолог или врач-педиатр.
Маршрутизация пациента детского возраста во взрослую сеть – во взрослый центр МВ, осуществляется к 18 годам.
Пациенты с муковисцидозом получают:
- в рамках первичной медико-санитарной помощи – плановую и неотложную амбулаторно-поликлиническую и первичную специализированную помощь (соответствующего профиля, по показаниям и в зависимости от тяжести состояния, а также скорую медицинскую помощь);
- в рамках специализированной медицинской помощи – специализированную, в том числе высокотехнологичную медицинскую помощь, в соответствующих условиях дневного или круглосуточного стационара.
При направлении в отделение (центр или кабинет) муковисцидоза, врачом-педиатром участковым или врачом другой специальности предоставляется выписка из амбулаторной карты (истории болезни) с указанием предварительного (или заключительного) диагноза, сопутствующих заболеваний, а также имеющихся результатов лабораторных и функциональных исследований.
Правила профилактики перекрестной инфекции при муковисцидозе
[2,309]
Организация оказания помощи пациентам. Профилактика инфекции.
Общие меры профилактики
- Меры по изоляции биологических жидкостей (мокрота, кровь) пациента с МВ.
- Дезинфекция оборудования или предметов, которые могут быть загрязнены жидкостями и выделениями.
-
Строгое соблюдение мер предосторожности медицинскими работниками при контакте с пациентами с МВ:
- использование одноразовых медицинских перчаток, обработка фонендоскопа, пульсоксиметра и т.д.
- использование одноразовых пеленок для осмотра.
- использование одноразовых халатов при работе с пациентами, требующими соблюдения мер контактной изоляции (B. cepacia complex, MRSA, мультирезистентная P. aeruginosa, Achromobacter spp., НТМБ), и во время кинезитерапии.
- использование одноразовых антибактериальных фильтров при спирометрии.
- Контакты между пациентами с МВ должны быть сведены к минимуму.
- Гигиена рук медицинских работников:
-
Мытье и дезинфекция рук проводится:
-
после снятия перчаток.
-
до и после контакта с пациентом.
-
после контакта со:
- слизистыми пациента.
- мокротой пациента.
- предметами, загрязненными мокротой пациента.
- дыхательным оборудованием, которым пользовался пациент.
- Использование спиртовых антисептиков (в виде салфеток, в диспенсерах) в кабинетах и в общем коридоре.
- Медицинские работники, непосредственно контактирующие с пациентами, не должны использовать накладные ногти.
- Использование перчаток необходимо при: контакте с пациентами, требующими изоляции, контакте с мокротой или кровью пациента
- Использование одноразовых пеленок, халатов, масок, защитных очков: при контакте с больными, требующими изоляции, при контакте с мокротой пациента (при дренаже, аспирации, осмотре пациента с приступообразным кашлем) или при контакте с кровью.
- Гигиена рук пациентов:
–обработка спиртовыми антисептиками (в нескольких клинических исследованиях показано, что обработка спиртовыми антисептиками удаляет бактерии с рук эффективнее, чем мытье рук с антисептическим мылом). Если есть видимое загрязнение, то используют мыло и антисептик.
–после пульсоксиметрии.
–после контакта с медицинским оборудованием.
–после проведения кинезитерапии.
–после посещения санузла.
–после приема врачом.
- Предметы (платки, салфетки, маски, баночки и др.), загрязненные мокротой пациента, должны утилизироваться согласно СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами» как отходы класса Б.
Дезинфекция в амбулаторных условиях
Оборудование:
- Спирометры – внутренние механизмы аппарата не стерилизуются, не дезинфицируются. Обработка турбины или датчика производится в соответствии с инструкцией изготовителя, обязательно использование одноразовых антибактериальных фильтров, предпочтительны одноразовые загубники или стерилизация многоразовых. У пациентов, подлежащих мерам контактной изоляции, спирометрия должна проводиться на отдельном аппарате. Категория А
- Пульсоксиметры – обработка рук спиртовым антисептиком после использования.
- Кинезитерапевтическое оборудование, мячи, манжета тонометра обрабатываются дезинфицирующими средствами.
- Небулайзеры и дыхательные тренажеры должны быть только индивидуального использования.
- Твердые поверхности (плановые текущие уборки, а также уборка после окончания приема пациента).
- Обработка фонендоскопа после каждого осмотра пациента.
Выявление источника, путей и факторов передачи.
Врачам-бактериологам и врачам-эпидемиологам:
- при первичном выявлении у пациента с МВ Всс, Achromobacter spp., мультирезистеного клона P. aeruginosa и MRSA, а также при выявлении нового генотипа необходимо проводить эпидемиологическое расследование с целью выявления источника инфекции, факторов передачи, а также контактировавших пациентов с МВ.
- при выявлении источников и факторов инфекции требуется провести дополнительные действия, например, изоляцию госпитализированного пациента с МВ, т.е. источника инфекции, внеплановю профилактическую дезинфекцию больницы, а также микробиологическое обследование контактировавших пациентов.
- для выявления источника инфекции и факторов передачи необходимо собрать эпидемиологический анамнез и провести внутривидовое типирование выделенных микроорганизмов. При этом исходить из предположения, что штаммы Всс, Achromobacter spp., P. aeruginosa и MRSA, выделенные от источника инфекции, с объектов внешней среды, являющихся факторами передачи, и от обследуемого пациента с МВ, должны быть идентичными по фенотипическим и генотипическим свойствам.
- бактерии Всс и Achromobacter spp. типировать молекулярно-генетическими методами, так как типирование по фенотипическим свойствам имеет низкую дискриминационную способность.
Для оперативного анализа и выявления источника использовать быстрые методы, основанные на ПЦР или другие методы типирования.
- генетическое типирование на данном этапе могут выполнять лаборатории стационаров, использующие в своей практике метод ПЦР.
- при невозможности внутривидового типирования в лаборатории стационара для генотипирования направлять изоляты бактерий в специализированные лаборатории, имеющие оборудование для молекулярного типирования.
- в специализированную лабораторию следует направлять:
— все изоляты (Всс, Achromobacter spp., мультирезистентные P. aeruginosa и MRSA), впервые выделенные от каждого пациента;
- по крайней мере, по одному изоляту Всс, Achromobacter spp., мультирезистентного P. aeruginosa и MRSA в год от каждого пациента;
- любой изолят, подозрительный на возможную связь со вспышкой или трансмиссией между пациентами;
- грамотрицательные колистинрезистентные микроорганизмы, которые не были идентифицированы окончательно после рутинного анализа или при сомнительных результатах.
-
доставка изолятов должна осуществляться максимально быстро с соблюдением мер биологической безопасности, применяемых при упаковке и транспортировке штаммов микроорганизмов согласно санитарным правилам СП 1.2.036095. Штаммы должны сопровождаться направлением, содержащим информацию о пациенте, о предполагаемых источниках и факторах риска колонизации данным микроорганизмом.
- на основании данных типирования рекомендуется осуществлять слежение за динамикой распространения среди пациентов МВ клонов, имеющих эпидемическое значение, а также оценить циркуляцию международных эпидемических клонов.
Мониторинг антибиотикочувствительности.
Кроме подтверждение принадлежности штаммов к Всс и Achromobacter spp. с помощью MALDI- TOF или молекулярно-генетическим методом и внутривидового типирования в референс-лаборатории должно проводиться также определение антибиотикочувствительности и мониторинг антибиотикорезистентности (таблица 5), молекулярно-генетический мониторинг за популяцией возбудителя — секвенирование возбудителей, исследование микроэволюционных процессов, слежение за изменчивостью возбудителей, а также необходимо создание и ведение баз данных возбудителей.
В таблице 27 приведены антимикробные препараты, резистентность к которым основных возбудителей хронической инфекции легких у пациентов с МВ является клинически и эпидемиологически значимой и подлежит мониторингу.
Таблица 27. Антимикробные препараты, резистентность к которым подлежит мониторингу.
Молекулярно-генетический мониторинг позволит выявить возникновение новых эпидемических клонов; возникновение новых клонов с высокой вирулентностью в результате горизонтального переноса генов или межвидовой рекомбинации; новых антибиотикорезистентных клонов, изменения антигенных свойств. Это поможет сделать эпидемическое прогнозирование и обосновать своевременное вмешательство в ход эпидемического процесса.
На основе полученных данных проводится эпидемиологическая диагностика с определением типа эпидемического процесса по ведущему пути передачи и эпидемическое прогнозирование. Данные эпидемиологического мониторинга могут быть использованы в качестве основы при разработке научно обоснованных эффективных мер по борьбе с распространением Всс, Achromobacter spp., мультирезистентных P. aeruginosa и MRSA, микобактерий и грибов среди пациентов с МВ и в популяции в целом. При этом, в случае с МВ, как и при других хронических инфекциях, результаты проводимых мероприятий будут заметны через многие годы.
Организация амбулаторной и стационарной помощи
- Прием пациентов с МВ не должен осуществляться в поликлиниках, где находятся одновременно другие пациенты с МВ. Работа амбулаторного центра и стационара регулируется Постановлением Главного государственного санитарного врача РФ от 28 января 2021 г. N 4 «Об утверждении санитарных правил и норм СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней», Приказом МЗиСР РФ от 15 мая 2012 г. № 535н «Об утверждении перечня медицинских и эпидемиологических показаний к размещению пациентов в маломестных палатах (боксах)» (http:// legalacts.ru/doc/prikaz-minzdravsotsrazvitija- rossii-ot-15052012-n-535n/) и рекомендациями European Cystic Fibrosis Society.
- Пациенты должны быть разделены на потоки в зависимости от микрофлоры дыхательного тракта. Пациенты не должны контактировать в зонах ожидания, как, например, в регистратуре, палатах, отделениях аптеки и рентгенологии. Во время пребывания в стационаре пациенты не должны пользоваться одной комнатой, ванной или туалетом. Пациент с микробиологическим высевом из мокроты бактерий Burkholderia cepacia complex, метициллин-резистентных Staphylococcus aureus, Achromobacter spp., нетуберкулезных микобактерий должен приниматься на амбулаторном приеме в отдельном боксе с отдельным входом, не заходя в центр муковисцидоза (или в МО).
- Пациенты с муковисцидозом не должны контактировать в зонах ожидания, как, например, в регистратуре, палатах, отделениях аптеки и рентгенологии. Пациенты с муковисцидозом должны обеспечиваться одноразовыми лицевыми масками, бахилами. Пациенты с муковисцидозом при нахождении в одном помещении должны держаться на расстоянии не менее 2 м друг от друга и соблюдать все меры профилактики. После приема каждого пациента проводится обработка поверхностей мебели, приборов и дверных ручек.
- Пациенты обеспечиваются одноразовыми масками, бахилами.
- Врачи должны быть обеспечены одноразовыми халатами, масками, перчатками, должен быть обеспечен доступ к средствам дезинфекции рук и приборов.
Правила ожидания приема врача в поликлинике
- Все пациенты с муковисцидозом, ожидая начала приема, обязаны находиться в лицевой маске.
- Гигиена рук (обработка дезинфицирующим раствором из бесконтактных диспенсеров в зоне ожидания, использование антибактериальных гелей или спиртовых салфеток для индивидуального использования).
- Сплевывание мокроты должно осуществляться пациентом в бумажный платок или салфетку, можно баночку (одноразовый стакан) с крышкой. Категорически запрещается эвакуация мокроты в раковину, душевую кабину или унитаз.
- Пациенты в зоне ожидания должны находиться друг от друга на расстоянии не менее 2 метров.
- Не рекомендуется использовать предметы, которые нельзя обработать после посещения Центра муковисицидоза (мягкие игрушки и пр.).
- Не рекомендуется принимать пищу, находясь в общей зоне ожидания приема.
- В центре муковисцидоза правила поведения пациентов должны быть размещены на доске объявлений, на сайте организации (www.mukoviscidoz.org) и доступны для ознакомления.
Правила нахождения пациентов с МВ в стационаре.
- Перед госпитализацией пациенты с муковисцидозом сдают микробиологический анализ мокроты (не позднее чем за 1 месяц). Пациенты размещаются в одноместные палаты (боксы) согласно микрофлоре дыхательного тракта.
- Госпитализация пациентов с Burkholderia cepacia complex осуществляется в лечебные учреждения, имеющие специализированные боксы для данной инфекции. Пациенты, инфицированные Burkholderia cepacia complex, Achromobacter spp., нетуберкулезными микобактериями или устойчивыми к ванкомицину энтерококками, должны размещаться в отдельной палате/боксе с душем и туалетом, желательно с отдельным входом. Госпитализация пациентов с резистентной флорой ведется в приемном отделении для инфекционных пациентов; пациенты проходят в палаты (боксы) через отдельный вход.
- Пациенты с муковисцидозом, инфицированные иной флорой, размещаются в одноместной палате с душем и туалетом или с другими пациентами, не страдающими муковисцидозом и с низким риском инфицирования.
- Боксы для пациентов со стафилококковой и синегнойной инфекцией желательно размещать при планировании отделения в противоположных концах коридора или на разных этажах.
- Все пациенты c муковисцидозом после трансплантации должны находиться в одноместной палате.
- Для пациентов с муковисцидозом с Burkholderia cepacia complex и Achromobacter spp., нетуберкулезными микобактериями или устойчивыми к ванкомицину энтерококками, должно быть отдельное медицинское оборудование для каждого пациента (индивидуальный спирометр, фонендоскоп, пульсоксиметр, глюкометр, тонометр и т.д.).
- Посещение диагностических процедур пациентов муковисцидозом должно планироваться согласно микрофлоре дыхательного тракта.
- Дезинфекция помещений, оборудования и т.д. проводится согласно Санитарно- эпидемиологические правила и нормативы СанПиН 2.1.3.2630-10 «Санитарно- эпидемиологические требования к организациям, осуществляющим медицинскую деятельность» (утв. постановлением Главного государственного санитарного врача РФ от 18 мая 2010 г. N 58)Пациенты, инфицированные Bсс, MRSA, НТМБ или устойчивыми к ванкомицину** энтерококками, должны размещаться в отдельной палате/боксе с душем и туалетом, желательно с отдельным входом.
- Пациенты с МВ, которые дома спят в одной комнате, могут в стационаре находиться в одной палате.
- Пациентов обучают кашлять в бумажный платок, в салфетку или одноразовый стакан с крышкой, которые затем утилизируют.
- Салфетки, испачканные мокротой, пациенты должны утилизировать в закрытые контейнеры, открывающиеся без касания рук.
- В стационарных условиях пациенты с МВ используют только индивидуальное оборудование (дыхательные тренажеры, аппараты для кинезитерапии, ингаляторы), которое приносят с собой из дома.
- Обрабатывать руки перед выходом из палаты.
- Избегать контактов с другими пациентами с МВ.
- В общих помещениях держаться от других пациентов на расстоянии не менее 2 метров.
- Использовать лицевую маску.
- Диагностические службы (кабинет рентген-диагностики, УЗИ и др.) должны быть осведомлены о правилах изоляции пациентов с МВ.
- Правила поведения в стационаре должны быть выданы родителям и ребенку/пациенту при госпитализации и размещены сайте медицинской организации.
Инженерный путь решения инфекционного контроля при планировке отделения, вентиляции.
Планирование отделения проводится согласно Постановлению Главного государственного санитарного врача РФ от 18 мая 2010 г. N 58 «Об утверждении СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность» с изменениями и дополнениями от: 4 марта, 10 июня 2016 г.
План бокса для пациентов со стафилококковой и синегнойной инфекцией: вход из коридора отделения, при возможности — тамбур на входе с раковиной; санитарный узел с раковиной и желательно душем; палата.
План бокса для пациентов с B. cepacia complex и Achromobacter spp: для медицинского персонала рекомендуется планировать вход из коридора отделения в шлюз на входе из отделения, тамбур при наличии нескольких палат с раковиной; санитарный узел в каждой палате с раковиной; палата(ы), для пациентов и родственников вход с улицы.
Правила и методы обработки и смены ингаляторов, небулайзеров и дыхательных тренажеров (при индивидуальном использовании и в стационаре)
! Неполная дезинфекция способствует росту бактерий, и тем самым увеличивает риск инфицирования.
Небулайзер и использованные принадлежности должны быть тщательно очищены после каждого применения. Дезинфекция должна проводиться не реже одного раза в день.
Подготовка к очистке
- Отсоедините трубку от небулайзера;
- Разберите небулайзер на составные части;
- При использовании мундштука с клапаном осторожно вытащить синий клапан выдоха из гнезда в наконечнике. Клапан должен оставаться присоединенным к мундштуку;
- Подключить соединительную трубку к компрессору;
- Включить компрессор;
- Оставить компрессор в работающем состоянии до тех пор, пока конденсат, образовавшийся в трубке, не будет удален воздухом, проходящим через трубку;
— при загрязнении и изменении цвета пластмассы трубку-воздуховод следует заменить.
Очистка
- Поместить все детали небулайзера в теплую водопроводную воду с небольшим количеством жидкости для мытья посуды не менее чем на 5 мин;
- Тщательно промыть все детали в проточной воде;
- Для удаления лишней воды встряхнуть детали;
Дезинфекция
После очистки проводится дезинфекция составных частей небулайзера и использованных принадлежностей (кроме соединительных трубок). Эффективная дезинфекция возможна только если небулайзер был тщательно очищен.
При использовании маски с резиновыми лентами: резиновые ленты могут подвергаться только очистке (стирке), так как при действии высоких температур, используемых при дезинфекции, они могут быть повреждены.
Дезинфекция кипячением
- Поместить все детали в кипящую воду не менее чем на 5 минут. Используется чистая кастрюля и свежая вода с пониженным содержанием кальция.
Пластик может расплавиться, если он вступит в контакт с горячим дном кастрюли. Поэтому следует убедиться, что в кастрюле достаточно воды.
Дезинфекция с помощью стандартного термического дезинфектора для детских бутылочек (не для микроволновой печи)
Для эффективной дезинфекции используется дезинфектор с рабочим циклом не менее 6 минут. Во время дезинфекции, чтобы определить продолжительность процедуры дезинфекции и количество воды, необходимое для этого, необходимо следовать инструкции по эксплуатации дезинфектора, который используется.
Неполная дезинфекция способствует росту бактерий, и тем самым увеличивает риск инфицирования. Дезинфекция не завершена, если была прекращена до автоматического выключения дезинфектора, или минимальное время дезинфекции, указанное в инструкции по эксплуатации дезинфектора не истекло. Дезинфектор должен содержаться в чистоте, и его работоспособность следует регулярно контролировать.
Дезинфекция с помощью микроволнового дезинфектора
Микроволновые дезинфекторы обеспечивают эффективную дезинфекцию компонентов изделия в стандартной коммерческой микроволновой печи.
Составные части небулайзеров, содержащие металлические компоненты не является устойчивыми к воздействию микроволн, и, следовательно, они не должны дезинфицироваться в микроволновой печи.
Поместить компоненты изделия в дезинфектор, оставив достаточное пространство между ними, чтобы пар мог надежно проникнуть ко всем поверхностям.
Условия дезинфекции в микроволновой печи:
Мощность в ваттах Время дезинфекции Время охлаждения
850–950 4 мин. 2 мин.
600–850 6 мин. 2 мин.
Информация о количестве воды, необходимой для процесса дезинфекции, включена в инструкции по эксплуатации дезинфектора и микроволновой печи.
Компоненты изделия не должны подвергаться воздействию микроволнового излучения, если они не находятся в микроволновом дезинфекторе. Если компоненты изделия подвергаются нагреву в микроволновой печи без защиты дезинфектора, отдельные детали могут быть повреждены.
Нельзя для дезинфекции использовать функцию гриля, так как это тоже может привести к повреждению обрабатываемых частей небулайзера.
Дезинфекция не считается завершенной должным образом, если не соблюдено указанное минимальное время дезинфекции, а также требуемая выходная мощность микроволновой печи. Дезинфектор также должен быть чистым. Регулярно проверяйте работоспособность микроволнового дезинфектора. Для дезинфекции используется только вода, никогда не используются химические вещества.
Химическая очистка с дезинфекцией
Очистка и дезинфекция могут быть проведены в рамках одного цикла при помощи химических веществ. С этой целью используется средство дезинфицирующее «Бомикс плюс» («Bomix plus»). Для обеспечения безопасности при обращении с химическими веществами следуйте инструкции по эксплуатации дезинфицирующего средства, в частности прилагаемой инструкции по технике безопасности.
Приготовьте 2% раствор средства дезинфицирующего «Бомикс плюс» («Bomix plus») путем смешивания 10 мл концентрата с 500 мл водопроводной воды.
- Поместить все детали в приготовленный раствор и оставьте их там на 5 мин.
Если значительно превысить период применения, то пластмассовые детали могут иметь запах дезинфицирующего средства.
- Тщательно вымыть все детали в проточной (свежевскипяченной или дистиллированной) воде (остатки дезинфицирующего средства могут вызывать аллергические реакции или раздражение слизистой оболочки).
-Утилизировать использованный раствор (разбавленный раствор можно вылить в канализацию).
Визуальный контроль
Требуется осмотреть все компоненты изделия после каждой чистки и дезинфекции.
Замените неисправные, деформированные или сильно обесцвеченные части.
Влажная среда может способствовать росту бактерий. Поэтому следует удалить все части устройства из кастрюли или дезинфектора после окончания дезинфекции. Необходимо высушить все детали. Риск инфицирования снижается, когда детали полностью высушены.
Сушка и хранение
- Поместить все детали на сухую, чистую и впитывающую поверхность для просушки.
- Завернуть небулайзер в чистую салфетку без ворса (например, в чистое кухонное полотенце) и держите его в сухом, защищенном от пыли месте.
Не следует оставлять небулайзер для хранения в ванной комнате.
Стерилизация в условиях стационара
При нахождении пациента в стационаре небулайзер и принадлежности могут подвергаться автоклавированию каждые 3-4 дня. Метод стерилизации может быть применен для изделий, которые прошли очистку и дезинфекцию.
Подготовка и процедура автоклавирования
Упакуйте все отдельные детали в систему со стерильным барьером согласно DIN EN 11607 (например, в бумажно-пленочную упаковку).
Максимальная температура и время стерилизации: 121 °C, по меньшей мере, в течение 20 мин. или 132 °C / 134 °C, по меньшей мере в течение 3 мин.
Хранение
Стерильный небулайзер может храниться в бумажном пакете до 3 суток, в биксе – до 7 суток.
Не следует подвергать стерилизации взрослую и детскую мягкие маски без стабилизатора маски, так как это может привести к потере формы под воздействием высоких температур.
Содержание и очистка компрессора
- Очистку разрешается проводить только в том случае, если устройство выключено и сетевая вилка вынута из розетки.
- Существует опасность повреждения устройства из-за проникновения жидкостей.
- Запрещается распылять жидкость на компрессор или сетевой кабель.
- Для очистки наружной поверхности компрессора следует использовать чистую влажную (смоченную дезинфекционным средством) салфетку.
Замена фильтра
При стандартных условиях эксплуатации фильтр компрессора требуется заменять через каждые 200 часов работы, но не реже одного раза в год.
Следует регулярно проверять фильтр (после каждой 10-й процедуры). Если он загрязнен (имеет серый или коричневый оттенок) или засорен, его необходимо заменить. Если фильтр стал влажным, его также требуется заменить новым.
Очищать фильтр и использовать его повторно запрещается!
Хранить компрессор и принадлежности следует в сухом месте, защищенном от продолжительного действия прямых солнечных лучей. Не рекомендуется хранить компрессор на балконе, в автомобиле, в запыленных и влажных помещениях.
Сроки использования небулайзера и компрессора.
- Быстро изнашиваемые комплектующие, такие как небулайзер, мундштук или маска, трубка-воздуховод и фильтр к компрессору подлежат регулярной замене, не реже одного раза в год, а в случае сильного загрязнения, деформации или поломки — немедленно.
- При колонизации антибиотикорезистентной микробной флорой смену небулайзера рекомендуется производить после каждого курса ингаляционной антибактериальной терапии или 1 раз в 2-3 мес. В остальных случаях не реже 2 раз в год.
- Компрессор должен быть ежегодно протестирован специалистами технической поддержки.
- Ожидаемый средний срок службы компрессора ингаляционной системы определяется согласно эксплуатационной документации.
Дыхательные тренажеры используются и обрабатываются аналогично. Дыхательные тренажеры без возможности их дезинфекции не должны использоваться более 1 месяца.
Организация обучения и досуга пациентов с муковисцидозомДДУ, школы, и другие образовательные учреждения
- В одной школе могут учиться несколько пациентов МВ, но они не должны обучаться в одном классе. Категория А
- Пациенты МВ не должны находиться в одном помещении (столовая, физкультурный зал) одновременно. Категория В
- Если они находятся в одном помещении, должны держаться на расстоянии не менее 2 м друг от друга и соблюдать все меры профилактики. Категория В
- Учителя и медицинские работники должны быть информированы о правилах поведения детей в школе.
Школы для родителей и другие мероприятия, посвященные МВ
Организация школ для пациентов, совместного отдыха и мероприятий, проведение праздников для пациентов с МВ недопустимы! Школы проводятся для родителей, родственников и их попечителей. Для пациентов возможны школы в системе он-лайн, в виде вебинаров. Пациентвы с МВ должны избегать прямого контакта. Необходимо разрабатывать образовательные программы по МВ, не требующие прямого контакта между пациентами: видеозаписи, видеоконференции, образовательные порталы в Интернете [110; 23].
Строительство, ремонт, садоводческие работы
Пациенты с МВ должны избегать мест, где проводятся строительство, ремонт и садоводческие работы, чтобы избежать контакта со спорами Aspergillus spp. Пациентам с МВ не следует работать на приусадебных участках с использованием компоста и пр.
Организация санаторно-курортного лечения
Организация спортивных лагерей, летних школ, совместного отдыха для пациентов с МВ недопустима!
При организации санаторно-курортного лечения требования предъявляются аналогично, как при госпитализации (см. Организация амбулаторной и стационарной помощи). При организации санаторно–курортного лечения в один заезд должны быть направлены пациенты с однотипной микрофлорой. Следует размещать пациентов на отдельных этажах или в разных корпусах, не допускать их контакта при выполнении диагностических и лечебных процедур, в столовой и игровых комнатах.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
МВ — хроническое неизлечимое заболевание, поэтому пациенты нуждаются в активном диспансерном наблюдении и непрерывном лечении. У одних пациентов, несмотря на своевременную диагностику и адекватную терапию, поражение бронхолёгочной системы быстро прогрессирует, у других — динамика изменений более благоприятна. Многие пациенты доживают до взрослого и даже зрелого возраста.
Медицинская реабилитация
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Пациентам с МВ рекомендуется проведение индивидуально подобранных реабилитационных мероприятий, нацеленных на поддержание легочной функции.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Способов первичной профилактики МВ – не существует. В качестве мер вторичной профилактики этого заболевания выступают:
- дородовая диагностика и
- неонатальная диагностика МВ.
- Рекомендуется всем пациентам с муковисцидозом, планирующим деторождение, консультация врача-генетика и молекулярно-генетическое обследование супруги/супруга на носительство мутаций гена CFTR. В случае обнаружения патогенных вариантов рекомендуется преимплантационное генетическое тестирование (ПГТ-М) на МВ [2,101,130,303].
(УУР – C, УДД – 5).
Профилактика Псевдо-Барттер синдрома
- Рекомендованы следующие меры для профилактики Псевдо-Барттер синдрома:
- Своевременная диагностика муковисцидоза;
- Информирование родителей о симптомах ПБС;
- Контроль уровня электролитов крови особенно у детей раннего возраста;
- Профилактическое назначение натрия из расчета 1-2 ммоль/кг/сут в виде поваренной соли (1/5-1/6 чайной ложки примерно соответствует 15 ммоль NaCl), солевых растворов, предназначенных для пероральной регидратации [2].
(УУР – C, УДД – 5).
Вакцинация
Известно, что дети с муковисцидозом являются группой риска по развитию инфекционных заболеваний и носительства таких микроорганизмов, как S. aureus, H. influenzae, S. pneumoniae, мукоидных и немукоидных форм P. aeruginosa и Burkholderia cepacia complex. Высока распространенность среди этих детей сопутствующей хронической патологии, усугубляющей тяжесть течения инфекции и предрасполагающей к возникновению различных осложнений. Профилактика инфекций у пациентов с МВ должна осуществляться не эпизодически, а путем планомерного выполнения мероприятий, предупреждающих распространение инфекции, а также мер, повышающих общую и специфическую сопротивляемость организма. Эффективным средством в предупреждении инфекционной заболеваемости является вакцинопрофилактика.
- Рекомендовано проведение вакцинации согласно национальному календарю прививок и календарю профилактических прививок по эпидемическим показаниям. Вакцинировать детей рекомендуется в фазу ремиссии, на фоне стабильного соматического состояния и проводимой терапии [310,311,312,313].
(УУР – C, УДД – 5).
Комментарий: противопоказания: индивидуальная непереносимость.
— Пациенты с хроническим гепатитом, в т.ч. с начинающимся циррозом печени могут быть привиты в периоде ремиссии или низкой активности заболевания на фоне выраженного снижения уровня трансаминаз до максимально достижимых величин [312].
— Терапия кортикостероидами для системного применения приводит к выраженной иммуносупрессии лишь при использовании высоких доз (преднизолон** ≥2 мг/кг/сут или 20 мг/сут для ребенка весом >10 кг) в течение 14 дней и более. Таким детям убитые вакцины вводятся в обычные сроки по выздоровлении, живые вакцины вводят не ранее, чем через 1 месяц от окончания лечения. Как живые, так и инактивированные вакцины вводят в обычном порядке лицам, получающим стероидные препараты: кратковременно (до 1 недели) любые дозы; курсами длительностью до 2 недель низкие или средние (до 1 мг/кг преднизолона**) дозы; длительно поддерживающие дозы (например, 5-10 мг преднизолона** через день); в качестве заместительной терапии низкие (физиологические) дозы; местно: накожно, ингаляционно, в виде глазных капель, внутрь сустава [312].
— Пациентам, которым планируется проведение трансплантации органов (печень, легкие), следует провести вакцинацию до проведения операции, в связи с дальнейшим применением цитостатической терапии по общепринятым при трансплантации органов рекомендациям [310,312,314].
- Рекомендована вакцинация пациентов с МВ против пневмококковой инфекции с целью предотвращения инфекций, вызванных S.pneumoniae[310,312,314,315,316,317,318,319,320]
(УУР – C, УДД – 5).
Комментарий: для вакцинации детей до 2 лет используется Пневмококковая конъюгированная вакцина (ПКВ – 13). Схема зависит от возраста начала иммунизации. Вакцинация проводится согласно инструкции к препарату.
У детей старше 2 лет, возможно применение Пневмококковой полисахаридной вакцины (ППВ – 23) однократно, с повторным введением через 3-5 лет.
Вакцинация взрослых проводится при отсутствии иммунизации против пневмококковой инфекции ПКВ – 13, затем через 12 месяцев вводится ППВ – 23 с ревакцинацией через 4-5 лет. При уже имеющейся прежней вакцинации против пневмококковой инфекции вводится ППВ – 23, однократно, с ревакцинацией через 4-5 лет [317].
- Рекомендована вакцинация против гриппа с целью предотвращения сезонного гриппа и, соответственно, обострения хронического воспалительного процесса в легких и ОНП у пациентов с МВ [314,319,321,322,323].
(УУР – C, УДД – 5).
Комментарий: Вакцинация против гриппа всех возрастных групп проводится 3 и 4 валентными инактивированными вакцинами 1 раз в год, осенью, до начала эпидемии гриппа. Детям дошкольного возраста, которые первый раз начали вакцинироваться против гриппа, необходимо введение двух доз по 0,25 мл с интервалом 4 недели.
При этом в настоящее время недостаточно рандомизированных исследований, доказывающих эффективность вакцинации против гриппа, что связано с небольшим количеством проведенных исследований и низким их качеством. Есть необходимость в проведении исследований более высокого качества [323].
- Рекомендована вакцинация против гемофильной инфекции типа b с целью предотвращения инфекций, вызванных H. influenzae [314,320,324,325,326].
(УУР – C, УДД – 5).
Комментарий: проводится моновакцинами или в составе комбинированных вакцин. Принимая во внимание важное клиническое значение инфекций, вызванных гемофильной палочкой типа b, вакцинация пациентов с МВ должна быть начата в максимально ранние сроки, предусмотренные национальным календарем прививок (с трехмесячного возраста), трехкратно с интервалом в 1,5 месяца; ревакцинация проводится через 12 месяцев после третьей прививки. При начале вакцинации в 6–12 месяцев жизни достаточно двух инъекций с интервалом 1–2 месяца и ревакцинации через 12 месяцев после второй дозы. После года вакцинируют однократно.
- Рекомендована вакцинация против ветряной оспы с целью предотвращения данного заболевания и его осложнений [310,327].
(УУР – C, УДД – 5).
Комментарий: вакцинация детей осуществляется с 12-ти месяцев жизни согласно инструкции по применению препарата. Также показано проведение экстренной профилактики ветряной оспы контактных детей, не привитых в течение первых 72- 96 часов после контакта с заболевшим ветряной оспой.
Особое значение инфекция Varicella zoster имеет у пациентов после проведения трансплантации и получающих препараты группы кортикостероиды для системного применения, кроме того, описаны повреждения легких на фоне заболевания ветряной оспой в популяции взрослых людей.
- Рекомендована вакцинация против менингококковой инфекции с целью предотвращения менингитов и его осложнений [328].
(УУР – C, УДД – 5).
Комментарий: допускается проведение полисахаридными и конъюгированными вакцинами у всех возрастных групп, зарегистрированными на территории РФ. Следует иметь в виду, что применение полисахаридных вакцин у детей до 2 лет может быть неэффективным. При наличии прежней вакцинации детей полисахаридной вакциной следует провести ревакцинацию конъюгированной вакциной через 12 месяцев. Вакцинация проводится согласно инструкции по применению препарата.
- Рекомендована вакцинация против гепатита А и гепатита В с целью предотвращения данных заболеваний, учитывая наличие поражений печени в рамках основной патологии [310].
(УУР – C, УДД – 5).
Комментарий: вакцинация проводится согласно инструкции по применению препарата.
- Рекомендована вакцинация против ротавирусной инфекции [329].
(УУР – C, УДД – 5).
Комментарий: вакцинация проводится согласно инструкции по применению препарата.
- Рекомендована пассивная иммунизация против респираторно-синцитиальной вирусной инфекции (РС) с целью предупреждения тяжелых форм острых бронхиолитов у детей с МВ [329,330].
(УУР – B, УДД – 2).
Комментарий: рекомендовано применение препарата Паливизумаб** ― гуманизированные моноклональные антитела к белку слияния (белок F) РС – вируса, 1 раз в месяц перед началом эпидемического подъема РС-вирусной заболеваемости, который начинается в ноябре и продолжается до апреля (4−5 введений за эпидемический сезон). Однако для окончательного решения об однозначной целесообразности данного вмешательства необходимо проведение дальнейших исследований [331].
Профилактика аспергиллеза
- Рекомендовано принимать меры по минимизации вероятности инфицировани Aspergillus spp., в связи с тем, что данный патоген распространен повсеместно, постоянно присутствуют в воздухе внешней среды и внутри помещений, а полностью исключить контакт пациента с микромицетами невозможно. Цель вмешательства – предупреждение АБЛА и ХАЛ [2].
(УУР – C, УДД – 5).
Комментарии: пациенты с МВ не должны находиться в жилых и больничных помещениях, пораженных плесенью. Необходимо следить за соблюдением температурно-влажностного режима в помещениях, не допускать протечек, аварий, затоплений подвалов и т.п. В случае появления признаков плесени в помещениях необходимо перевести пациентов с МВ в другое помещение. Для ликвидации последствий появления плесени в зданиях необходимо выявить и устранить причину появления сырости в здании, провести просушку и обработку очагов биоповреждений строительными биоцидами, активными против грибов.
ВквартирахпациентовсМВ,атакжебольничныхпомещенияхи поликлиниках, не должно быть цветов в горшках, зимних садов и пр. В связи с тем, что большое количество спор грибов присутствует на частичках пыли, необходимо избегать контакта пациентов с МВ с пылью, тщательно проводить влажную уборку помещений.
Пациентам с МВ следует избегать мест с большой концентрацией спор грибов в окружающей среде – парки, сады, леса, места скопления разлагающихся органических веществ (компостные массы, гниющая древесина, трава), зернохранилища, строительные площадки, помещения с текущим ремонтом, не следует работать в таких сферах, как садоводство, земледелие, строительство, пребывать в специализированных помещениях (конюшни, курятники и т. д.).
Пациенты с МВ не должны использовать в пищу подгнившие или заплесневелые овощи, ягоды, фрукты, так как в процессе контакта возможна инспирация спор микромицтов, обсеменение кожи и одежды пациента.
При нарушении правил эксплуатации Aspergillus spp. могут поражать системы вентиляции, поэтому следует своевременно обслуживать и осуществлять замену фильтров кондиционеров.
Информация
Источники и литература
-
Клинические рекомендации Российского респираторного общества
- 1. Муковисцидоз. Под редакцией Н.И. Капранова, Н.Ю. Каширской. МЕДПРАКТИКА-М.: 2014. 672 с.
2. Национальный консенсус «Муковисцидоз: определение, диагностические критерии, терапия» Под редакцией Е.И. Кондратьевой, Н.Ю. Каширской, Н.И. Капранова. Москва, ООО
«Компания БОРГЕС». 2016, 205 с. https://mukoviscidoz.org/doc/konsensus/CF_consensus_2017.pdf
3. De Boeck K. Cystic fibrosis in the year 2020: disease with a new face. Acta Paediatr. 2020; 109(5): 893– 899. DOI: 10.1111/apa.151554. Lopes-Pacheco M. CFTR modulators: Shedding light on precision medicine for cystic fibrosis. Front. Pharmacol. 2016; 7: 275. DOI: 10.3389/fphar.2016.00275.]
5. Регистр больных муковисцидозом в Российской Федерации. 2019 год. / Под редакцией А.Ю. Воронковой, Е.Л. Амелиной, Н.Ю. Каширской, Е.И. Кондратьевой, С.А. Красовского, М.А. Стариновой, Н.И. Капранова. – М.: ИД «МЕДПРАКТИКА-М», 2021, 68 с. https://mukoviscidoz.org/doc/registr/10472_block_Registre_2017 site.pdf 4
6. P.J. Mogayzel, E.T. Naureckas, K.A. Robinson Cystic Fibrosis Pulmonary Guidelines. Am. J. Respir. Crit. Care Med. 2013; 187: 680–689.
7. Шагинян И.А., Капранов Н.И., Чернуха М.Ю., Г.В. Алексеева, С.Ю. Семыкин, Аветисян Л.Р., Н.Ю. Каширская, Н.В. Пивкина, Г.А. Данилина, А.Б. Батов, Г.П. Бусуек. Микробный пейзаж нижних дыхательных путей у различных возрастных групп детей, больных муковисцидозом. ЖМЭИ 2010; № 1: с. 15-20
8. Чернуха М.Ю., Шагинян И.А., Капранов Н.И., Алексеева Г.В., Каширская Н.Ю., Аветисян Л.Р., Семыкин С.Ю., Данилина Г.А., Поликарпова С.В., Пивкина Н.В. Персистенция Burkholderia cepacia у больных муковисцидозом. ЖМЭИ 2012; № 4: с. 93-98
9. Demco C.A., Stern R.C., Doershuk C.F. Stenotrophomonas maltophilia in cystic fibrosis: incidence and prevalence. Pediatr. Pulmonol 1998; 25(5):304-8.; Liu L., Coenye T., Burns J.L., Whitby P.W., Stull T.L., LiPuma J.J. Ribosomal DNA-directed PCR for identification of Achromobacter (Alcaligenes) xylooxidans recovered from sputum samples from cystic fibrosis patients. J. Clin. Microdiol 2002; 40(4):1210-3.
10. Аветисян Л.Р., Медведева О.С., Чернуха М.Ю., Шагинян И.А., Тихомиров Е.Е., Прилипов А.Г., Русакова Е.В., Хачиян М.М., Кондратьева Е.И., Воронкова А.Ю., Шерман В.Д., Красовский С.А., Афанасьева М.В. Эпидемиологические и микробиологические особенности хронической инфекции легких у больных муковисцидозом вызванной Staphylococcus aureus. Педиатрия. Журнал им. Г.Н. Сперанского. 2020. Т. 99. № 2. С. 102-11110.24110/0031-403X- 2020-99-2-102-111
11. Сиянова Е.А., Чернуха М.Ю., Аветисян Л.Р., Шагинян И.А, А.Г. Прилипов, Е.И. Кондратьева, Припутневич Т.В., Гордеев А.В., Каширская Н.Ю, Н.И. Капранов, И.А. Ильенкова, Красовский С.А..Воронкова Л.Ю., Амелина Е.Л., М.В. Усачева Мониторинг хронической инфекции легких у больных муковисцидозом, вызванной бактериями Pseudomonas аeruginosa. Педиатрия. Журнал им. Г.Н. Сперанского: Науч. журн./ Изд-во: ООО «Педиатрия» Москва, Том 97, №2, 2018 C.77- 86.
12. LiuJ.C. etal. What is the clinical significance of filamentous fungi positive sputum cultures in patients with cystic fibrosis? Journal of Cystic Fibrosis 12 (2013) 187–193
13. Aaron SD, Vandemheen KL, Freitag A, Pedder L, Cameron W, Lavoie A, et al. Treatment of Aspergillus fumigates in patients with cystic fibrosis: a randomized, placebo-controlled pilot study. PLoSOne 2012; 7:e36077.
14. Eickmeier O., Hector A., Singh A., Hart D. Fungi in Cystic Fibrosis: Recent Findings and Unresolved Questions. CurrentFungalInfectionReports •2014
15. Климко Н.Н. Микозы: диагностика и лечение Руководство для врачей. — 3-е изд., перераб. и доп. — М.:Фармтек, 2017. — 272 с.16. PinetM, CarrereJ., CimonB., etal. Occurrence and relevance of filamentous fungi in respiratory secretions of patients with cystic fibrosis—a review. MedicalMycologyJune 2009, 47 (SpecialIssue), 387-397
17. Denning D.W., Cadranel J., Beigelman-Aubry C., etal. Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management. Eur Respir J 2016; 47: 45–68
18. Кosmidis C, Denning DW. The clinical spectrum of pulmonary aspergillosis. Thorax 2015; 70: 270–277
19. Bombieri C, Claustres M, De Boeck K, Derichs N, Dodge J, Girodon E, Sermet I, Schwarz M, Tzetis M, Wilschanski M, Bareil C, Bilton D, Castellani C, Cuppens H, Cutting GR, Drevínek P, Farrell P, Elborn JS, Jarvi K, Kerem B, Kerem E, Knowles M, Macek M Jr, Munck A, Radojkovic D, Seia M, Sheppard DN, Southern KW, Stuhrmann M, Tullis E, Zielenski J, Pignatti PF, Ferec C. Recommendations for the classification of diseases as CFTR-related disorders. J Cyst Fibros. 2011; 10(2): 86–102.
20. De Boeck K, Wilschanski M, Castellani C,Taylor C , Cuppens H, Dodge J, Sinaasappel M. Cystic fibrosis: terminology and diagnostic algorithms. Thorax. 2006;61:627–635.
21. Burke M.S., Ragi J.M., Karamanoukian H.L. et al. New strategies in thenon-operative management of meconium ileus. J. Pediat. Surg. 2002; 37: 760—764
22. CastellaniC, DuffAJA, BellSC, HeijermanHGM, MunckA, RatjenF, Sermet-GaudelusI, SouthernKW, BarbenJ, FlumePA, Hodková P, KashirskayaN, KirszenbaumMN, MadgeS, OxleyH, PlantB, SchwarzenbergSJ, SmythAR, TaccettiG, Wagner TOF, Wolfe SP, Drevinek P. ECFS best practice guidelines: the 2018 revision. JCystFibros. 2018 Mar;17(2):153-17
23. Кондратьева Е.И., Шерман В. Д., Амелина Е.Л., Воронкова А.Ю., Красовский С.А., Каширская Н.Ю., Петрова Н.В., Черняк А. В., Капранов Н. И., Никонова В.С., Шабалова Л.А.Клинико-генетическая характеристика и исходы мекониевого илеуса при муковисцидозе Российский вестник перинаталогии и педиатрии, 2016, 61:6; 77-81 DOI 10.21508/1027-4065-2016- 6-77-81
24. Debray D, Narkewicz MR, Bodewes FA, et al. Cystic Fibrosis– related Liver Disease: Research Challenges and Future Perspectives. J Pediatr Gastroenterol Nutr. 2017;65:443-448
25. Ciucă IM, Pop L, Tămaş L, et al. Cystic fibrosis liver disease-from diagnosis to risk factors. RomJMorpholEmbryol. 2014;55:91-95
26. Klotter V, Gunchick C, Siemers E, et al. Assessment of pathologic increase in liver stiffness enables earlier diagnosis of CFLD: Results from a prospective longitudinal cohort study. PloSone. 2017;12:e0178784
27. Terliesner N, Vogel M, Steighardt A, Gausche R, Henn C, Hentschel J, Kapellen T, Klamt S, Gebhardt J, Kiess W, Prenzel F. Cystic-fibrosis related-diabetes (CFRD) is preceded by and associated with growth failure and deteriorating lung function. JPediatrEndocrinolMetab. 2017;34-51.doi: 10.1002/ppul.21127
28. Edenborough FP. Women with cystic fibrosis and their potential for reproduction. Thorax 2001;Aug 56(8):649–5529. Амелина Е.Л., Красовский С.А., Шугинин И.О. Муковисцидоз и беременность: клинико- генетические, функциональные и микробиологические характеристики пациенток. Педиатрия. Журнал им. Г.Н. Сперанского. 2014. Т. 93. № 4. С. 38-43
30. Farrell PM, Rosenstein BJ, White TB, Accurso FJ, Castellani C, Cutting GR, Durie PR, Legrys VA, Massie J, Parad RB, Rock MJ, Campbell PW 3rd. Cystic fibrosis foundation. Guidelines for diagnosis of cystic fibrosis in newborns through older adults: Cystic Fibrosis Foundation consensus report. J Pediatr. 2008; 153 (2): 4–14.
31. King S.L., Topliss D.J., Kotsimbos T. et al. Reduced bone density in cystic fibrosis: ∆F508 mutation is an independent risk factor. Eur. Respir. J. 2005; 25: 54-61.
32. Симанова Т. В. Клинико-генетические особенности и костный метаболизм у больных муковисцидозом: автореф…. канд. мед.наук. М., 2009-28с.
33. Красовский С.А. Остеопороз у взрослых больных муковисцидозом: автореф. дис… канд. мед.наук. М., 2012
34. Горинова Ю.В. Остеопения при хронических болезнях легких у детей: автореф. дис.
…канд. мед.наук. М., 2005
35. Соболенкова В.С. Системный анализ в ранней диагностике и лечении остеопенического синдрома при муковисцидозе: автореф. дис….канд. мед.наук. Тула, 2009
36. ArisR.M., MerkelP.A., BachrachL.K., etal. Consensus statement: Guide to bone health and disease in cystic fibrosis. J.Clin.Endocrinol.Metab. 2005; 90(3): 1888-1896
37. Ашерова И.К., 2006, Капранов Н.И., Капустина Т.Ю.Состояние минеральной плотности костной ткани у пациентов с муковисцидозом Педиатрия. 2008.-N 5.-С.36-41
38. A. R. Smyth, S.C. Bell , S.Bojcin , M.Bryon, A. Duff, P.A. Flume European Cystic Fibrosis Society Standards of Care: Best Practice guidelines J Cyst Fibrosis. 2014. v.13. S23–S42.
39. StevensD.A., MossR.B., KurupV.P., etal. Allergic bronchopulmonary aspergillosis in cystic fibrosis–state of the art: Cystic Fibrosis Foundation Consensus Conference. Clin Infect Dis. 2003; 37 Suppl 3:S225–64
40. Geller DE, Kaplowitz H, Light MJ, Colin AA. Allergic bronchopulmonary aspergillosis in cystic fibrosis: reported prevalence, regional distribution, and patient characteristics. Scientific Advisory Group, Investigators, and Coordinators of the Epidemiologic Study of Cystic Fibrosis. Chest 1999 116: 639–646
41. Mastella G., et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis: a European epidemiological study. Epidemiologic Registry of Cystic Fibrosis. 2000 Sep;16(3):464-71
42. Zolin A., Orenti A., Naehrlich L., van Rens J. Et al. ECFSPR European Cystic Fibrosis Society Patient Registry Annual data report (year 2017) version 1.2019. Available at www.ecfs.eu/ecfs-patient- registry
43. Leung DH, Narkewicz MR. Cystic Fibrosis-related cirrhosis. J Cyst Fibros. 2017 Nov;16 Suppl 2:S50-S61
44. Mayer-Hamblett N, Kloster M, Ramsey BW, et al. Incidence and clinical significance of elevated liver function tests in cystic fibrosis clinical trials. ContempClin Trials. 2013;34:232-238.
45. Akata D, Akhan O. Liver manifestations of cystic fibrosis. Eur J Radiol. 2007;61:11-1746. Williams SM, Goodman R, Thomson A, et al. Ultrasound evaluation of liver disease in cystic fibrosis as part of an annual assessment clinic: a 9-year review. ClinRadiol. 2002;57:365-370, Tanner MS, Taylor CJ. Liver disease in cystic fibrosis. Arch Rev Clin Med 2018; Vol 5 (No 4) Published by: Mashhad University of Medical Sciences (http://rcm.mums.ac.ir) 149 Kianifar HR et al. Dis Child. 1995;72:281-284
47. Mueller-Abt PR, Frawley KJ, Greer RM, et al. Comparison of ultrasound and biopsy findings in children with cystic fibrosis related liver disease. J CystFibros. 2008;7:215-221
48. Durand F, Valla D. Assessment of the prognosis of cirrhosis: Child-Pugh versus MELD. J Hepatol. 2005;42 Suppl(1):S100-7. Epub 2004 Dec 24
49. Brunt, M.E. Grading and staging the histopathological lesions of chronic hepatitis: The Knodell histology activity index and beyond. / M.E. Brunt // Hepatology. – 2000. – Vol. 31 (1). – Р. 241-246
50. Moran A, Brunzell C, Cohen RC. Clinical care guidelines for cystic fibrosis-related diabetes: a position statement of the American Diabetes Association and a clinical practice guideline of the Cystic Fibrosis Foundation, endorsed by the Pediatric Endocrine Society. DiabetesCare. 2010;33(12):2697- 708. doi: 10.2337/dc10-1768
- 1. Муковисцидоз. Под редакцией Н.И. Капранова, Н.Ю. Каширской. МЕДПРАКТИКА-М.: 2014. 672 с.
Информация
Список сокращений
АБЛА – аллергический бронхолегочный аспергиллез
АБП – антибактериальные препараты
АБТ – антибактериальная терапия
БАЛ – бронхоальвеолярный лаваж
БОС – бронхообструктивный синдром
БЭ – бронхоэктазы
БЭН – белково-энергетическая недостаточность
ВИЧ – вирус иммунодефицита человека
ВРВП – варикозно расширенные вены пищевода
ДНК – дезоксирибонуклеиновая кислота
ЖКБ – желчнокаменная болезнь
ИА – инвазивный аспергиллез
ИВД — для in vitro диагностики
ИКСИ – интрацитоплазматическая инъекция сперматозоида
ИМТ – индекс массы тела
ИРТ – иммунореактивный трипсин
КИФВД – комплексное исследование функции внешнего дыхания
КС – кортикостероидные препараты
КНТ– кинезитерапия
КТ – компьютерная томография
ЛС – лекарственные средства
МБЛ – карбапенемазы класса металло-β-лактамаз МВ – муковисцидоз
МВТР – муковисцидозный трансмембранный регулятор проводимости (CFTR – Cystic Fibrosis Transmembrane conductance Regulator)
МЗСД – муковисцидоз-зависимый сахарный диабет (CFRD- cystic fibrosis related diabetes)
МО – медицинская организация
МПК – минимальная подавляющая концентрация
МРТ – магнитно-резонансная томография
НГОБ — неферментирующие грамотрицательные бактерии
НВЛ – неинвазивная вентиляция легких
НПВП – нестероидные противовоспалительные и противоревматические препараты
НТБМ – нетуберкулезный микобактериоз
НТГ – нарушение толерантности к глюкозе
ОДН – острая дыхательная недостаточность
ОНП – околоносовые пазухи
ОРИ – острая респираторная инфекция
ОФВ1 – объем форсированного выдоха за секунду
ОГТТ – оральный глюкозотолерантный тест
ОЕЛ – общая емкость легких
ОО – остаточный объем легких
ПБС – псевдо-Барттер синдром (синдром псевдо-Барттера)
ПГТ-М – преимплантационное генетическое тестирование на муковисцидоз
ПН – полипы носа
ПНЖК – полиненасыщенные жирные кислоты
ПЦД – первичная цилиарная дискинезия
ПЦР – полимеразно-цепная реакция
РС -вирус – респираторно-синцитиальный вирус
СДИО – синдром дистальной интестинальной обструкции
СДЛА – систолическое давление в легочной артерии
СПИД – синдром приобретенного иммунодефицита
СЦТ – среднецепочечные триглицериды
ТЛ – трансплантация легких
ТЭЛА – тромбоэмболия легочной артерии
УДХК – урсодезоксихолевая кислота
ФЭГДС – фиброэзофагогастродуоденоскопия
ФОЕ – функциональный остаточный объем легких
ХАЛ – хронический аспергиллез легких
ХРС – хронический риносинусит
ЦОГ-2 – ингибиторы циклооксигеназы-2 (нестероидные противовоспалительные и противоревматические препараты группы коксибы)
ЦТ– центр трансплантации
ЭВМ – электронно-вычислительная машина
ЭКО – экстракорпоральное оплодотворение
Эхо-КГ – эхокардиография
ΔISC – плотность тока короткого замыкания
ASSR тест – auditory steady-state response (регистрация вызванных акустических ответов мозга на постоянные модулированные тоны)
Bcc — Burkholderia cepacia complex
CGM – continuous glucose monitoring (непрерывный мониторинг глюкозы)
CLSI — Clinical and Laboratory Standards Institute (Институт клинических и лабораторных стандартов)
EUCAST — EuropeanCommittee on Antimicrobial Susceptibility Testing, Европейский комитет по определению чувствительности к антимикробным препаратам MENSURA — Mese Espanola de Normalizacion de la Suseptibilitad y Resistencia a los Antimicrobianos – Испанский совет по стандартизации чувствительности и резистентности к антибиотикам
MLPA – мультиплексная лигазная зондовая амплификация
MRSA – methicillin-resistant Staphylococcus aureus (метициллинрезистентный Staphylococcus aureus)
MSSA – methicillin-sensitive Staphylococcus aureus (метициллинчувствительный Staphylococcus aureus)
NYHA – классификация хронической сердечной недостаточности по функциональному классу (классификация Нью-Йоркской кардиологической ассоциации)
PI – классический муковисцидоз с абсолютной панкреатической недостаточностью
PS – классический муковисцидоз с ненарушенной функцией поджелудочной железы
QFMP – количественная флуоресцентная мультиплексная ПЦР
Термины и определения
E84.0 — Кистозный фиброз с лёгочными проявлениями (МКБ 10 — E84.0) или классический муковисцидоз с ненарушенной функцией поджелудочной железы (PS) — случаи с нормальной экзокринной функцией поджелудочной железы, подтвержденной результатами лабораторного исследования (отсутствие нейтрального жира в копрограмме, уровень панкреатической эластазы-1 в стуле не ниже 200 мкг/г кала). При генетическом исследовании выявляются мутации, при которых функция поджелудочной железы остается относительно сохранной.
E84.8 — Кистозный фиброз с другими проявлениями (МКБ10- E84.8) или классический муковисцидоз с панкреатической недостаточностью (PI) соответствует классическому муковисцидозу с абсолютной панкреатической недостаточностью без и с осложнениями.
Хроническая панкреатическая недостаточность у пациентов с кистозным фиброзом (муковисцидозом) определяется активностью панкреатической эластазы-1 в стуле: колебания активности эластазы-1 в стуле от 100 до 200 мкг/г кала свидетельствуют об умеренной степени экзокринной недостаточности поджелудочной железы; снижение показателя активности эластазы-1 в стуле менее 100 мкг/г кала выявляет тяжелую степень панкреатической недостаточности.
Стадии цирроза у пациентов с кистозным фиброзом (муковисцидозом) устанавливаются по шкале METAVIR (Приложение Г1): F1 – фиброз только портальных трактов; F2 – портальный фиброз с одиночными септами; F3 – фиброз портальных трактов с множественными септами без цирроза; F4 – цирроз.
Жизненными показаниями при муковисцидозе являются жизнеугрожающие состояния (мекониевый илеус, синдром потери соли, лёгочное кровотечение, пневмоторакс, белково- энергетическая недостаточность 3 ст, ДН (дыхательная недостаточность) и ЛСН (легочно- сердечная недостаточность) любой степени, а также состояния, отсутствие адекватной терапии которых влечёт за собой уменьшение продолжительности жизни пациентов, а именно, внешнесекреторная панкреатическая недостаточность, первичный высев (выявление), интермиттирующая и хроническая инфекция лёгких, билиарный цирроз печени, муковисцидоз- ассоциированный сахарный диабет (инсулинозависимый). При наличии выше указанных «жизненных показаний» по решению врачебной комиссии могут быть назначены препараты по торговому наименованию.
Критерии оценки качества медицинской помощи
Таблица 28. Критерии оценки качества медико-санитарной помощи взрослым и детям при кистозном фиброзе (муковисцидозе) (коды по МКБ — 10: E84)
| № п/п | Критерии качества | Оценка выполнения |
| 1 | Выполнено определение активности панкреатической эластазы- 1 в кале не реже 1 раза в 12 месяцев (у первичных пациентов при установлении диагноза и у пациентов с сохранной экзокринной функцией поджелудочной железы (с панкреатической эластазой-1 более 200 мкг в г кала)) |
|
| 2 | Выполнен прием (осмотр, консультация) врача- гастроэнтеролога (или врача-диетолога или врача-педиатра, прошедшего обучение на тематическом цикле по муковисцидозу), для исключения гиперацидного состояния и его коррекции при отсутствии эффекта от ферментозаместительной терапии и при наличии белково-энергетической недостаточности |
|
| 3 | Выполнен прием (осмотр, консультация) врача- оториноларинголога при обострении хронического синусита и если не был выполнен в предшествующий год |
|
| 4 |
Выполнено микробиологическое исследование посева флоры в мокроте (фарингеальном мазке или индуцированной мокроте или трахеальном аспирате) не реже 1 раза в 3 месяца |
|
| 5 | Выполнено определение функции внешнего дыхания пациенту старше 5 лет (если не было выполнено в предшествующие 3 месяца) |
|
| 6 | Проведена антибактериальная терапия не менее, чем двумя препаратами внутривенно (при тяжелом обострении со стороны дыхательного тракта) |
|
| 7 | Проводится ферментозаместительная терапия препаратом панкреатина в виде минимикросфер с кислотоустойчивой оболочкой (при снижении уровня панкреатической эластазы-1 в кале менее 200 мкг в г кала при отсутствии медицинских противопоказаний) | Да/Нет |
Таблица 29. Критерии оценки качества специализированной медицинской помощи взрослым и детям при кистозном фиброзе (муковисцидоз) (коды по МКБ — 10: E84)
| № п/п | Критерии качества | Оценка выполнения |
| 1 | Выполнено определение активности панкреатической эластазы- 1 в кале (если не проводилось в предшествующие 12 мес) (у первичных пациентов при установлении диагноза и у пациентов с сохранной экзокринной функцией поджелудочной железы (с панкреатической эластазой-1 более 200 мкг в г кала)) |
|
| 2 | Выполнен прием (осмотр, консультация) врача- гастроэнтеролога (или врача-диетолога или врача-педиатра, прошедшего обучение на тематическом цикле по муковисцидозу), для исключения гиперацидного состояния и его коррекции при отсутствии эффекта от ферментозаместительной терапии и при наличии белково-энергетической недостаточности |
|
| 3 | Выполнен прием (осмотр, консультация) врача-оториноларинголога при обострении хронического синусита и если не был выполнен в предшествующий год |
|
| 4 | Выполнено микробиологическое исследование посева флоры в мокроте (фарингеальном мазке или индуцированной мокроте или трахеальном аспирате) (если не было выполнено в предшествующие 3 месяца, либо при наличии дополнительных показаний) |
|
| 5 | Выполнено определение функции внешнего дыхания пациенту старше 5 лет |
Да/Нет |
| 6 | Проведена антибактериальная терапия не менее, чем двумя препаратами внутривенно (при тяжелом обострении со стороны дыхательного тракта) |
|
| 7 | Проведена ферментозаместительная терапия препаратом панкреатина в виде минимикросфер с кислотоустойчивой оболочкой при снижении уровня панкреатической эластазы-1 в кале (менее 200 мкг в г кала) при отсутствии медицинских противопоказаний |
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Баранов А. А. — акад. РАН, профессор, д.м.н., почетный Президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН, главный внештатный специалист педиатр Минздрава России
Намазова-Баранова Л.С. — акад. РАН, профессор, д.м.н., Президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей ЦКБ РАН, заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России
Куцев С.И. — чл.-корр. РАН, профессор, д.м.н., Президент Ассоциации медицинских генетиков (АМГ), директор ФГБНУ «Медико-генетический научный центр им академика Н.П Бочкова» Минобрнауки России, главный внештатный специалист по медицинской генетике Минздрава России
Авдеев С. Н.
— д.м.н., проф., член-корреспондент РАН, заведующий кафедрой пульмонологии Института Клинической Медицины ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет); руководитель клинического отдела ФГБУ «Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства», главный внештатный специалист пульмонолог Минздрава России
Полевиченко Е.В. – д.м.н., профессор кафедры онкологии, гематологии и лучевой терапии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный детский специалист по паллиативной медицинской помощи Минздрава России
Белевский А.С. — д.м.н., проф., Президент МОО «Российское Респираторное Общество» главный внештатный пульмонолог Департамента здравоохранения Москвы, заведующий кафедрой пульмонологии факультета дополнительного профессионального образования ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России
Кондратьева Е.И. — д.м.н, проф., руководитель научно-клинического отдела муковисцидоза ФГБНУ «Медико-генетический научный центр им. академика Н.П Бочкова» Минобрнауки России, Руководитель центра муковисцидоза «Научно-исследовательский клинический институт детства Министерства здравоохранения Московской области», заведующая кафедрой Генетики болезней дыхательной системы Института высшего и дополнительного профессионального образования ФГБНУ «МГНЦ, эксперт комитета по диагностике и регистру Европейского общества по муковисцидозу (ECFS)
Симонова О.И. — д.м.н., заведующая пульмонологическим отделением ФГАУ «НМИЦ здоровья детей» Минздрава России; профессор кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет); руководитель кабинета муковисцидоза Морозовской ДГКБ №1
Каширская Н.Ю. — д.м.н, проф., главный научный сотрудник лаборатории генетической эпидемиологии ФГБНУ «Медико-генетический научный центр им. академика Н.П Бочкова» Минобрнауки России, член рабочих групп экспертов по неонатальному скринингу и регистру Европейского общества по муковисцидозу (ECFS)
Шерман В.Д. — к.м.н., ведущий научный сотрудник научно-клинического отдела муковисцидоза и доцент кафедры Генетики болезней дыхательной системы Института высшего и дополнительного профессионального образования ФГБНУ «Медико-генетический научный центр им. академика Н.П Бочкова» Минобрнауки России, член рабочей группы экспертов по неонатальному скринингу Европейского общества по муковисцидозу (ECFS)
Воронкова А.Ю. —
к.м.н., ведущий научный сотрудник научно-клинического отдела муковисцидоза, ФГБНУ «Медико-генетический научный центр им. академика Н.П Бочкова» Минобрнауки России
Амелина Е.Л. — к.м.н. заведующая лабораторией муковисцидоза, ФГБУ НИИ Пульмонологии ФМБА России, доцент кафедры Генетики болезней дыхательной системы Института высшего и дополнительного профессионального образования ФГБНУ «МГНЦ.
Гембицкая Т.Е. — д.м.н., профессор, руководитель отдела терапевтической пульмонологии НИИ пульмонологии НКИЦ, ФГБОУ ВО ПСПб ГМУ имени академика И.П.Павлова Минздрава России.
Красовский С.А. — к.м.н., старший научный сотрудник лаборатории муковисцидоза ФГБУ НИИ пульмонологии ФМБА России, ведущий научный сотрудник научно-клинического отдела муковисцидоза ФГБНУ «Медико-генетический научный центр им. академика Н.П Бочкова» Минобрнауки России.
Черменский А.Г. – к.м.н., старший научный сотрудник НИИ пульмонологии НКИЦ, ФГБОУ ВО ПСПб ГМУ имени академика И.П.Павлова Минздрава России
Степаненко Т. А. — к.м.н., заведующая пульмонологическим отделением №2, Санкт- Петербургское ГБУЗ ‘’ Городская многопрофильная больница № 2’’
Селимзянова Л.Р. — к.м.н., ведущий научный сотрудник НИИ педиатрии и охраны здоровья детей ЦКБ РАН Министерства науки и высшего образования Российской Федерации, доцент кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России Вишнева Е.А. — д.м.н., заместитель руководителя по науке НИИ педиатрии и охраны здоровья детей ЦКБ РАН, профессор кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России
Горинова Ю.В. — к.м.н., старший научный сотрудник ФГАУ «НМИЦ здоровья детей» Минздрава России
Рославцева Е.А. — к.м.н., ведущий научный сотрудник ФГАУ «НМИЦ здоровья детей» Минздрава России.
Ашерова И.К. — д.м.н., заведующая отделением пульмонологии ГБКУЗ ЯО «ЦГБ»
Ильенкова Н. А. — д.м.н., проф., заведующая кафедрой детских болезней с курсом ПО, Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого Зырянов С.К. — профессор, д.м.н., заведующий кафедрой общей и клинической фармакологии, ФГБОУ ВПО Российский университет дружбы народов
Одинаева Н.Д.
— профессор, д.м.н., директор ГБУЗ МЗ МО «Научно-исследовательский клинический институт детства Министерства здравоохранения Московской области», главный педиатр Московской области
Максимычева Т.Ю. – старший научный сотрудник научно-клинического отдела муковисцидоза ФГБНУ «Медико-генетический научный центр им. академика Н.П Бочкова» Минобрнауки России
Орлов А.В. – к.м.н., зав. отделением пульмонологии, доцент кафедры педиатрии и неонатологии СЗГМУ, ГБУЗ «Детская городская больница Святой Ольги»
Семыкин С. Ю. — к.м.н., заведующий отделением педиатрии, ФГБУ «Российская детская клиническая больница» Минздрава России
Чернуха М. Ю. — д.м.н., ведущий научный сотрудник лаборатории молекулярной эпидемиологии госпитальных инфекций, ФГБУ «НИЦЭМ им. Н.Ф.Гамалеи » Минздрава России
Шагинян И. А. – профессор, д.м.н., заведующий лабораторией молекулярной эпидемиологии госпитальных инфекций, ФГБУ «ФНИЦЭМ им. Н.Ф. Гамалеи» Минздрава России
Аветисян Л. Р. – д.м.н., ведущий научный сотрудник лаборатории эпидемиологии госпитальных инфекций ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Шумкова Г.Л. — научный сотрудник лаборатории муковисцидоза ФГБУ НИИ пульмонологии ФМБА России.
Крылова Н.А. — научный сотрудник лаборатории муковисцидоза ФГБУ НИИ пульмонологии ФМБА России
Дронов И. А. — к.м.н., доцент кафедры детских болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), врач-клинический фармаколог ГБУЗ МЗ МО «Научно-исследовательский клинический институт детства Министерства здравоохранения Московской области»
Костылева М. Н. — к.м.н., доцент кафедры клинической фармакологии РНИМУ им. Н.И. Пирогова, зав. отделением клинической фармакологии ФГБУ РДКБ
Желенина Л.А. – профессор, д.м.н., заведующая кафедрой педиатрии, эндокринологии и абилитологии ФП и ДПО СПбГПМУ, г. Санкт-Петербург.
Климко Н.Н. – д.м.н, профессор, заведующий кафедрой клинической микологии, аллергологии и иммунологии ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Минздрава России
Борзова Ю. В.
– к.м.н., заведующая микологической клиникой, доцент кафедры медицинской микробиологии ФГБОУ ВО «Северо-западный государственный медицинский университет им. И.И.Мечникова Минздрава России
Васильева Н. В. – д.б.н., профессор, директор НИИ медицинской микологии им. П.Н. Кашкина Зав. кафедрой медицинской микробиологии ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Минздрава России
Богомолова Т. С. – к.б.н., заведующая НИЛ микологического мониторинга и биологии грибов, доцент кафедры медицинской микробиологии ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Минздрава России
Сперанская А. А. — д.м.н., профессор кафедры рентгенологии и радиационной медицины, Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова.
Баранова И.А. — д.м.н., профессор кафедры госпитальной терапии педиатрического факультета, ГБОУ ВПО РНИМУ Минздрава России им. Н.И. Пирогова, г. Москва.
Фурман Е.Г — член-корреспондент РАН, профессор, заведующий кафедрой факультетской и госпитальной педиатрии, проректор по науке Пермский государственный медицинский университет (ПГМУ) им. академика Е. А. Вагнера
Шадрина В.В. — доцент кафедры факультетской и госпитальной педиатрии, Пермский государственный медицинский университет (ПГМУ) им. академика Е. А. Вагнера (ФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России.
Щапов Н. Ф., заведующий отделением хирургии новорожденных Неонатологического стационара ГБУЗ МО «Московский областной центра охраны материнства и детсва», врач- детский хирург, кандидат медицинских наук.
Петрова Н.В. — д.б.н., ведущий научный сотрудник лаборатории генетической эпидемиологии ФГБНУ «Медико-генетический научный центр им. академика Н.П Бочкова» Минобрнауки России
Пашков И. В. – к.м.н., зав 3 хирургическим отделением ФГБУ «Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И.Шумакова»
Цирульникова О. М. – д.м.н., профессор кафедры трансплантологии и искусственных органов Первого Московского государственного медицинского университета имени И.М.Сеченова
Поляков Д. П. – к.м.н., заведующий детским оториноларингологическим отделением ведущий научный сотрудник ФГБУ Национальный медицинский исследовательский центр оториноларингологии ФМБА, России, доцент кафедры оториноларингологии ФДПО ФГБОУ ВО РНИМУ им. Н.И.Пирогова
Свистушкин В.М. – профессор, д.м.н., директор клиники Клиники Болезней уха, горла и носа ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), главный внештатный оториноларинголог Центрального Федерального округа России, врач высшей категории
Синьков Э.В. – к.м.н., доцент кафедры Болезней уха, горла и носа, врач высшей категории. Кафедра Болезней уха, горла и носа ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
Черных В.Б. – д.м.н., г.н.с., заведующий лаборатории генетики нарушений репродукции ФГБНУ «Медико-генетический научный центр им. академика Н.П Бочкова»
Репина С.А. – врач-генетик, консультативное отделение ФГБНУ «Медико-генетический научный центр им. академика Н.П Бочкова»
Благовидов Д.А. – к.м.н., врач педиатр, аллерголог/иммунолог, младший научный сотрудник лаборатории вакцинопрофилактики и иммунотерапии аллергических заболеваний ФГБНУ НИИ вакцин и сывороток им. И.И.Мечникова; ассистент кафедры педиатрии им. академика М.Я. Студеникина, Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
Костинов М.П. – д.м.н., профессор, заслуженный деятель науки РФ, заведующий лабораторией вакцинопрофилактики и иммунотерапии аллергических заболеваний НИИ вакцин и сывороток им. И.И. Мечникова.
Кондратенко О.В. – д.м.н., доцент кафедры общей и клинической микробиологии, иммунологии и аллергологии ФГБОУ ВО СамГМУ Минздрава России
Лямин А.В. — д.м.н., доцент кафедры общей и клинической микробиологии, иммунологии и аллергологии ФГБОУ ВО СамГМУ Минздрава России
Поликарпова С.В. – к.м.н., заведующая бактериологической лабораторией ГБУЗ «ГКБ№15 им.О.М.Филатова ДЗМ»
Поляков А.В. — чл.-корр. РАН, профессор, д.б.н., зав. лаб. ДНК-диагностики ФГБНУ МГНЦ, главный научный сотрудник лаб. ДНК-диагностики ФГБНУ МГНЦ, заведующий кафедрой молекулярной генетики и биоинформатики ИВиДПО ФГБНУ МГНЦ, советник.
Адян Т.А. — к.м.н., старший научный сотрудник лаб. ДНК-диагностики ФГБНУ МГНЦ, врач- лабораторный генетики лаб. молекулярно-генетической диагностики №1 ФГБНУ МГНЦ, доцент кафедры молекулярной генетики и биоинформатики ИВиДПО ФГБНУ МГНЦ, доцент кафедры общей и медицинской генетики МБФ РНИМУ им.Н.И.Пирогова.Гольдштейн Д.В. — д.б.н., профессор, заведующий Лабораторией генетики стволовых клеток; ФГБНУ «Медико- генетический научный центр имени академика Н.П. Бочкова» Минобрнауки России.
Бухарова Т.Б. — к.б.н., ведущий научный сотрудник Лаборатории генетики стволовых клеток; директор Института высшего и дополнительного профессионального образования, ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова» Минобрнауки России. Ефремова А.С. — к.б.н., старший научный сотрудник Лаборатории генетики стволовых клеток; ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова» Минобрнауки России.
Овсянкина Е.С. – д.м.н., профессор, Заслуженный врач РФ, руководитель детско-подросткового отдела ФГБНУ «Центральный НИИ туберкулеза»
Панова Л.В. – д.м.н., в.н.с. детско-подросткового отдела ФГБНУ «Центральный НИИ туберкулеза»
Черкашина И.В. д.м.н., ФГБУ «Детский научно-клинический центр инфекционных болезней ФМБА России», заведующая отделением медицинской реабилитации
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи-пульмонологи
- Врачи-педиатры
- Врачи общей врачебной практики (семейные врачи)
- Врачи-генетики
- Врачи аллергологи-иммунологи
- Врачи-гастроэнтерологи
- Врачи-эндокринологи
- Врачи–диетологи
- Врачи-оториноларингологи
- Врачи – сурдологи — оториноларингологи
- Врачи по лечебной физкультуре (или врачи по медицинской реабилитации, или врачи– физиотерапевты, или специалисты с высшим (немедицинским) образованием (инструкторы–методисты по лечебной физкультуре, или специалисты со средним профессиональным (медицинским) образованием (инструкторы по лечебной физкультуре, медицинские сестры по массажу, медицинские сестры по физиотерапии)).
- Врачи функциональной диагностики
- Врачи –акушеры-гинекологи
- Врачи – урологи
- Врачи урологи-андрологи детские
- Врачи – кардиологи
- Врачи кардиологи детские
- Студенты медицинских ВУЗов
- Обучающиеся в ординатуре и интернатуре
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций являются публикации, вошедшие в Кокрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 5 лет.
Методы, использованные для оценки качества и силы доказательств:
-
Консенсус экспертов;
-
Оценка значимости в соответствии с рейтинговой схемой.
Таблица 1. Шкала оценки уровней̆ достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
|
1. |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2. |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3. |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4. | Несравнительные исследования, описание клинического случая |
| 5. | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
| 1. | Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2. |
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3. | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4. | Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль» |
| 5. | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней̆ убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Методы, использованные для анализа доказательств:
- Обзоры опубликованных мета-анализов;
- Систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств:
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
На процессе оценки, несомненно, может сказываться и субъективный фактор. Для минимизации потенциальных ошибок каждое исследование оценивалось независимо, т.е. по меньшей мере двумя независимыми членами рабочей группы. Какие-либо различия в оценках обсуждались уже всей группой в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств:
Таблицы доказательств заполнялись членами рабочей группы.
Методы, использованные для формулирования рекомендаций:
Консенсус экспертов.
Экономический анализ:
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
-
Внешняя экспертная оценка;
-
Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Проект рекомендаций был рецензирован независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Рабочая группа:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Порядки оказания медицинской помощи:
-
Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н «Об утверждении Порядка оказания педиатрической помощи»
-
Приказ Министерства здравоохранения РФ «Об утверждении Порядка оказания медицинской помощи больным с врожденными и (или) наследственными заболеваниями» от 15 ноября 2012 г. № 917н.
Стандарты оказания медицинской помощи:
-
Стандарт специализированной медицинской помощи при кистозном фиброзе (Приказ Минздрава России от 28.12.2012 № 1605н).
-
Стандарт первичной медико-санитарной помощи при кистозном фиброзе (Приказ Минздрава России от 20.12.2012 № 1206н)
Информация о лекарственных средствах: https://grls.rosminzdrav.ru/
Основные нормативно-правовые акты, регулирующие оказание паллиативной медицинской помощи
-
Федеральный закон «О внесении изменений в Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам оказания паллиативной медицинской помощи» от 06.03.2019 № 18-ФЗ.
-
Приказ Минздрава России № 345н, Минтруда России от 31.05.2019 № 372н «Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья».
-
Приказ Минздрава России № 348н от 31 мая 2019 года «Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому».
-
Приказ Минздрава России № 505н от 10 июля 2019 года «Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи».
-
Приказ МЗ РФ № 831 от 3 октября 2019 года «Об утверждении ведомственной целевой программы «Развитие системы оказания паллиативной медицинской помощи».
Прочие нормативно-правовые документы, с учетом которых разработаны клинические рекомендации:
-
Федеральный закон от 30.03.1999 N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» (Собрание законодательства Российской Федерации, N 14, ст. 1650; 2002, N 1 (ч. I), ст. 2; 2003, N 2, ст. 167; N 27 (ч. I), ст. 2700; 2004, N 35, ст. 3607; 2005, N 19, ст. 1752; 2006, N 1, ст. 10; 2007, N 1 (ч. I), ст. 21, 29; N 27, ст. 3213; N 46, ст. 5554; N 49, ст. 6070; 2008, N 24, ст. 2801; N 29 (ч. I), ст. 3418);
-
Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011 г., № 48, ст. 6724);
-
Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ – 10);
-
ГОСТ Р 52600 -2006 «Протоколы ведения больных. Общие положения» (Приказ Федерального агентства по техническому регулированию и метрологии от 05.12.2006 № 288);
-
Приказ МЗ РФ от 19 января 1995г. № 8 О развитии и совершенствовании деятельности лабораторий клинической микробиологии (бактериологии) лечебно-профилактических учреждений.
-
Приказ МЗ РФ от 20 декабря 2012г. № 1183н Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников.
-
Приказ МЗ РФ от 23 июля 2010 г. № 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
-
СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность»
-
МР 4.2.0114-16 Методы контроля. Биологические и микробиологические факторы. Лабораторная диагностика внебольничной пневмонии пневмококковой этиологии. МР МЗ РСФСР от 19.12.1991. Методы бактериологического исследования условно-патогенных микроорганизмов в клинической микробиологии
-
Федеральный закон от 25.12.2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций».
-
Приказ Минздрава России № 103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
-
Приказ Минздрава России от 13.10.2017 N 804н «Об утверждении номенклатуры медицинских услуг».
-
Приказ Министерства труда и социальной защиты РФ от 27 августа 2019 г. n 585н «О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы» (вступает в силу с 1 января 2020 года);
-
Приказ Министерства здравоохранения РФ от 14 января 2019 г. № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения»
-
Приказ Министерство здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у больных по жизненным показаниям» от 9 августа 2005 г. № 494
-
Информационное письмо Минздрава России по возможности закупки лекарственного препарата по торговому наименованию (https://www.rosminzdrav.ru/news/2019/12/18/13043-minzdrav-podgotovil-informatsionnoe- pismo-po-vozmozhnosti-zakupki-lekarstvennogo-preparata-po-torgovomu-naimenovaniyu);
-
Перечень специализированных продуктов лечебного питания для детей-инвалидов на 2020 год, Распоряжение Правительства Российской Федерации от 11 декабря 2019 года № 2984-р
Примеры диагнозов:
–Кистозный фиброз поджелудочной железы (муковисцидоз – Е84.0) [генотип F508del/F508del], лёгочно-кишечная форма, среднетяжелое течение. Хронический бронхит. Дыхательная недостаточность 0-1 степени. Хроническая инфекция Ps.aeruginosa. Хроническая панкреатическая недостаточность, тяжелая степень. Отставание в физическом развитии. БЭН 2ст.
– Кистозный фиброз (муковисцидоз – Е84.8) [генотип: 2143delT/ не известна], легочно- кишечная форма, тяжёлое течение. Хронический диффузный бронхит. Распространённые цилиндрические бронхоэктазы обоих лёгких. Обострение бронхолегочного процесса по бронхитическому типу. Дыхательная недостаточность II степени. Хроническая инфекция Staphylococcus aureus, хроническая инфекция Pseudomonas aeruginosa, Achromobacter ruhlandii (первичный высев). Хронический полипозно-гнойный пансинусит. Хроническая панкреатическая недостаточность, тяжелая степень. Дуоденит. Бульбит. Недостаточность привратника. Дуоденогастральный рефлюкс. Антральный гастрит. Цирроз печени (F4 по шкале METAVIR — по данным фиброэластометрии печени). Нарушение толерантности к глюкозе.
Приложение Б. Алгоритмы действий врача
Приложение В. Информация для пациента
Муковисцидоз – генетическое заболевание, которое обусловлено мутациями в гене муковисцидозного трансмембранного регулятора проводимости. В результате генетического дефекта секрет большинства желез внешней секреции сгущается, затрудняется его эвакуация.
При муковисцидозе нарушен нормальный отток слизи из дыхательных путей, что приводит к застою мокроты и воспалению, поэтому у пациентов часто отмечается кашель с выделением мокроты, нередко у такого ребенка доктора выслушивают влажные и/или сухие локальные или распространенные хрипы в легких
Заболевание муковисцидоз (кистозный фиброз) характеризуется тем, что в той или иной степени в патологический процесс вовлекается весь организм, но в большей степени — органы дыхания, поджелудочная железа, печень, желчные пути, желудочно-кишечный тракт, потовые железы. Благодаря ранней диагностике и новейшим терапевтическим режимам, муковисцидоз (кистозный фиброз) давно перестал быть только педиатрической проблемой.
Адекватное своевременное и регулярное лечение, а также реабилитация способствуют улучшению прогноза и качества жизни у большинства пациентов.
Диагностика и лечение пациентов с муковисцидозом проводится мультидисциплинарной командой, включающей врача–пульмонолога (педиатра), врача–диетолога, врача по лечебной физкультуре (или врача по медицинской реабилитации, или врача–физиотерапевта, или специалиста с высшим (немедицинским) образованием (инструктора–методиста по лечебной физкультуре, врача по лечебной физкультуре) или специалиста со средним профессиональным (медицинским) образованием (инструктора по лечебной физкультуре, медицинскую сестру по массажу, медицинскую сестру по физиотерапии), врача — оториноларинголога, врача- гастроэнтеролога, психолога.
Исключительно важным является ежедневное проведение мероприятий, способствующих очистке дыхательных путей. Этим техникам и методикам обучает врач-физиотерапевт в специализированном центре муковисцидоза.
Общественные места
При посещении мест массового скопления людей пациентам с муковисицидозом необходимо соблюдать стандартные меры профилактики инфекций, прежде всего включающие в себя:
— Гигиену рук.
Обрабатывать руки антибактериальным гелем или спиртовыми салфетками перед принятием пищи, после посещения туалета, после контакта с животными или игры на детской площадке (работе на огороде и т.д)
— Ношение лицевой маски.
Особенно в таких высокорисковых по вирусной нагрузке местах, как метро, аэропорт, вокзал, на детских праздниках, культурно-массовых мероприятиях в закрытых помещениях. При организации мероприятий на воздухе ношение лицевой маски не обязательно.
— После возвращения из мест массового скопления людей вымыть руки, умыть лицо, промыть назальным душем нос, сменить одежду.
Пациенты МВ в одной семье
-
Не использовать общие предметы (зубные щетки, посуда, дыхательное и кинезитерапевтическое оборудование).
-
Проводить кинезитерапию в разных комнатах и в разное время, не использовать дыхательные тренажеры друг друга.
-
Пациенты с МВ, не живущие в одной семье, должны соблюдать меры предосторожности: не здороваться за руку, избегать тесных контактов, держаться друг от друг на расстоянии 2 м.
Обработка небулайзера (очистка, дезинфекция) после каждого использования.
5.10. Профилактика водного пути инфицирования
-
Вода из-под крана. Может содержать атипичные микобактерии, синегнойную палочку, грибы. Вода, очищенная с помощью фильтров, не пропускающих частицы > 0,2 мкм, безопасна, но тем не менее использовать ее как питьевую можно только после кипячения. Для разведения ингаляционных растворов использовать стерильную воду. Стерильная вода может со временем контаминироваться, как быстро это происходит, неизвестно.
-
Аспираторы, небулайзеры (возможна передача инфекции от оборудования пациенту). Для аэрозольной терапии используются только стерильные растворы, применять их следует с соблюдением асептики. После каждого использования необходимо проводить дезобработку и стерилизацию оборудования.
-
Душевые кабины в бассейне, аквапарки, бассейны малого объема (в том числе детские бассейны при отелях), бани/сауны могут стать источником инфекции.
-
Водоемы со стоячей или загрязненной водой, родники (небольшие озера и водохранилища, особенно с большим количеством диких птиц и др.) могут стать источником инфекции.
Профилактика водного пути инфицирования
-
Полоскать рот и употреблять в пищу только кипяченую или бутилированную воду.
-
Использовать для ингаляционной терапии только стерильные растворы.
-
Смывать воду в унитазе только при закрытой крышке.
-
Обрабатывать небулайзер после каждого использования.
-
Менять фильтры и небулайзер 1 раз в 6 месяцев и при проведении эрадикационной терапии инфекций.
-
Дезинфицировать назальный душ после каждого использования.
-
У детей раннего возраста для анализа микробной флоры проводить глубокий мазок из зева или получать мокроту, используя индивидуальный аспиратор.
-
Не мыться в душевой кабине до и после посещения бассейна.
-
Избегать купания в мелких бассейнах, аквапарках, загрязненных водоемах.
-
Не употреблять воду из источников и родников.
5.11. Пищевой путь инфицирования. Профилактика пищевого пути инфицирования
Пищевой путь инфицирования
- Недостаточно промытые овощи/фрукты/ягоды
- Некачественная термическая обработка продуктов
- Использование в пищу несвежих овощей/фруктов/ягод
- Грибы Aspergillus spp. могут содержаться в кукурузе, орехах, семенах и зерне
Профилактика пищевого пути инфицирования
-
Использовать для обработки овощей, ягод и фруктов специальные дезинфицирующие средства.
-
Адекватная термическая обработка мясных и морепродуктов.
-
Не использовать в пищу подгнившие или заплесневелые овощи, ягоды, фрукты.
5.12. Воздушно – капельный и контактный пути заражения. Профилактика
Воздушно –капельный и контактный пути заражения.
-
Воздушно-капельный путь передачи инфекции — это заражение через воздух, в который попадают и распространяются на расстояние около 2 м при разговоре, кашле и чихании пациентов мельчайшие брызги и капли слюны и носовой слизи, содержащие возбудителей болезней — капельная инфекция (основные возбудители хронического микробно – воспалительного процесса дыхательного тракта (Bсс, MRSA, мультирезистентная P. aeruginosa, Achromobacter spp., НТМБ), а также грипп, ангина, дифтерия, коклюш, корь, скарлатина, туберкулез). При высыхании этих брызг и капель возбудители болезни долго сохраняются в пыли— пылевая инфекция. Заражение происходит при вдыхании возбудителей болезней.
-
Контактные путь через поверхности, также может быть причиной инфицирования.
-
Aspergillus spp. обитают в почве и на растительных остатках. В связи с этим они постоянно присутствуют в воздухе внешней среды и внутри помещений. Поскольку Aspergillus spp. распространены повсеместно, полностью исключить контакт пациента с микромицетами невозможно, тем не менее следует стремиться максимально снизить риск инфицирования.
-
Респираторные вирусы являются важными патогенами для пациентов с МВ. Вирусы, такие как респираторно-синцитиальный вирус (RSV), вирус гриппа, вирус парагриппа, аденовирус и риновирусы, имеют относительно короткие периоды инкубации (менее 1 недели), а передача происходит в основном посредством прямого контакта с инфицированными людьми или косвенного контакта, касаясь инфицированных предметов. Капельная передача инфекционных респираторных секретов происходит с вирусом гриппа и аденовирусами. Дети с МВ не более восприимчивы к инфекциям вирусных респираторных путей, чем их здоровые сверстники. Однако респираторные вирусные заболевания могут у них протекать тяжелее и способствовать развитию бактериальной инфекции.
Профилактика .
-
Не подходить к другим пациентам с МВ ближе, чем на 2 м.
-
Использовать лицевые маски.
-
Использовать лицевую маску во время повышенной заболеваемости и посещения общественных учреждений, а также при посещении лечебных учреждений.
-
Обрабатывать поверхности после пациентов.
-
Обработка рук.
-
Пациенты с МВ не должны находиться в жилых и больничных помещениях, пораженных плесенью.
-
Необходимо следить за соблюдением температурно-влажностного режима в помещениях, не допускать протечек, аварий, затоплений подвалов и т.п.
-
В случае появления признаков плесени в помещениях необходимо перевести пациентов МВ в другое помещение.
-
Для ликвидации последствий появления плесени в зданиях необходимо выявить и устранить причину появления сырости в здании, провести просушку и обработку очагов биоповреждений строительными биоцидами, активными против грибов.
-
В квартирах пациентов с МВ, а также больничных помещениях и поликлиниках, не должно быть цветов в горшках, зимних садов и пр.
-
В связи с тем, что большое количество спор грибов присутствует на частичках пыли, необходимо избегать контакта пациентов с МВ с пылью, тщательно проводить влажную уборку помещений.
Приложение Г. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки степени фиброза печени METAVIR (Meta- Analysis of Hisological Data In Viral Hepatitis) – Мета-анализ гистологических данных при вирусных гепатитах
Источник: [332 (в модификации 333, 334,335].
Тип: шкала оценки
Назначение: оценка степени фиброза печени
Оценочный инструмент: шкала
Содержание и ключ:
Значения эластичности печени при различных стадиях фиброза (транзиентная фиброэластометрия) (Эластометрия печени)
|
Стадия фиброза |
Значения эластичности |
|
F0 (отсутствие фиброза) |
< 5,8 |
|
F1 (легкий фиброз) |
5,8-7,2 |
|
F2 (умеренный фиброз) |
7,2-9,5 |
|
F3 (выраженный фиброз) |
9,5-12,5 |
|
F4 (цирроз) |
≥ 12,5 |
Приложение Г2. Классификация аспергиллеза
Выделяют пять стадий Аллергического бронхолегочного аспергиллеза (АБЛА)*:
-
острая стадия,
-
ремиссия,
-
обострение,
-
ГКС-зависимая
-
фиброз.
*у пациентов с муковисцидозом АБЛА нередко протекает как медленно прогрессирующее заболевание, указанные стадии выделить не удается [15,39].
-
Хронический аспергиллез легких (ХАЛ)
Хронический аспергиллез легких – сборное понятие, которое включает**:
-
нодулярный аспергиллез,
-
одиночнай аспергиллома,
-
хронический кавернозный аспергиллез,
-
хронический фиброзирующий аспергиллез,
-
подострый инвазивный аспергиллез/
** у пациентов с муковисцидозом ХАЛ протекает преимущественно как нодулярный аспергиллез, одиночная аспергиллома или хронический кавернозный аспергиллез [17,18].
-
Аспергиллезный трахеобронхит
Приложение Г3. Шкала oценки тяжести и степени компенсации цирроза Чайлд-Пью (the Child–Pugh score)
Источник: [48], валидация шкалы в РФ не проводилась.
Тип: шкала оценки
Назначение: оценка степени компенсации цирроза печени
Оценочный инструмент: шкала
Содержание:
1 – Значения протромбинового времени 4-6 сек. соответствует приблизительно 50% и 40% от нормы соответственно
Класс цирроза выставляется в зависимости от суммы баллов по всем параметрам.
Ключ:
Сумма баллов 5—6 соответствует классу A, при сумме 7-9 — класс B, а при общей сумме в 10 -15 баллов выставляется класс C.
Ожидаемая продолжительность жизни у пациентов класса А составляет 15—20 лет, послеоперационная летальность при полостном хирургическом вмешательстве — 10 %.
Класс В является показанием для рассмотрения вопроса о пересадке печени; при этом послеоперационная летальность при полостном хирургическом вмешательстве достигает 30 %.
У больных класса С ожидаемая продолжительность жизни достигает 1-3 года, а послеоперационная летальность при полостном вмешательстве — 82 %.
На основании критериев Чайлда — Пью предложено оценивать необходимость в трансплантации печени: высокая необходимость у пациентов, относящихся к классу С, умеренная — у пациентов класса В и низкая — у пациентов класса А [336]
Оценка выживаемости пациентов с циррозом печени [https://www.gastroscan.ru/handbook/117/7543].
|
Класс по Чайлд-Пью |
Баллы |
Годичная выживаемость, % |
Двухлетняя выживаемость, % |
|
A |
5–6 |
100 |
85 |
| B | 7–9 | 81 | 57 |
| C | 10–15 | 45 | 35 |
Приложение Г4. Рентгеноденситометрия у пациентов с МВ
Двуэнергетическая рентгеновская денситометрия (Рентгеноденситометрия) (DXA) является «золотым стандартом» количественного определения костной массы (минеральной плотности кости или МПК).
В современной клинической практике индивидуальная МПК сравнивается с референсной базой данных. Наиболее приемлемым способом оценки МПК является оценка с помощью Т-и Z- критериев.
Т-критерий представляет собой количество стандартных отклонений выше и ниже среднего показателя пика костной массы у молодых. Применим только у женщин в пери- и постменопаузе и у мужчин 50 лет и старше [127,337].
У детей, подростков, взрослых (мужчин младше 50 лет и женщин в пременопаузе) для оценки МПК используется Z-критерий (количество стандартных отклонений выше и ниже среднего показателя для лиц аналогичного возраста). Т-критерий никогда не используется (А).
В случае, когда содержание костных минералов или МПК по Z-критерию соответствует уровню ≤ -2 SD, следует применять термин «низкое содержание минерала в кости или низкая МПК для данного хронологического возраста» [51,127,337].
Приложение Г5. Алгоритм обследования и тактика решения вопроса репродукции у мужчин с МВ
Алгоритм обследования и тактика решения вопроса репродукции, который зависит от трех составляющих: результатов генетического обследования, результатов спермиологического исследования и статуса фертильности супруги.
Приложение Г6. Данные о природной резистентности ведущих микроорганизмов при МВ
[Error! Reference source not found.]
S. aureus обладает природной устойчивостью к азтреонаму, темоциллину, полимиксину В/ колистину, налидиксовой кислоте и цефтазидиму**.
Все НГОБ обладают природной устойчивостью к бензилпенициллину**, цефалоспоринам первого и второго поколения, гликопептидам, фузидовой кислоте, макролидам, линкозамидам, стрептограминам, рифампицину**, даптомицину** и линезолиду**.
P.aeruginosa природно устойчива к ампициллину, амоксициллин/клавулановая кислоте, цефазолину**, цефалексину**, цефалотину, цефадроксилу, цефотаксиму**, цефтриаксону**, эртапенему**, хлорамфениколу**, канамицину**, неомицину, триметоприму, тетрациклину, тигециклину**.
Achromobacter xylosoxydans природно устойчив к ампициллину**, цефазолину**, цефалексину**, цефалотину, цефадроксилу, цефотаксиму**, цефтриаксону**, эртапенему**.
B.cepacia complex природно устойчива к ампициллину**, амоксициллин/клавулановой кислоте**, ампициллин/сульбактаму**, тикарциллину, пиперациллину, тикарциллин/клавулановой кислоте, пиперациллин/тазобактаму, цефазолину**, цефалексину**, цефалотину, цефадроксилу, цефотаксиму**, цефтриаксону**, азтреонаму, эртапенему**, ципрофлоксацину**, хлорамфениколу**, аминогликозидам, триметоприму, фосфомицину**, полимиксину В/ колистину.
Stenotrophomonas maltophilia природно устойчива к ампициллину**, амоксициллин/клавулановой кислоте**, ампициллин/сульбактаму**, тикарциллину, пиперациллину, пиперациллин/тазобактаму, цефазолину**, цефалексину**, цефалотин, цефадроксилу, цефотаксиму**, цефтриаксону**, азтреонаму, эртапенему**, имипенему, меропенему**, аминогликозидам, триметоприму, фосфомицину**, тетрациклину. Но может быть чувствительна к триметоприм/сульфаметоксазолу**.
Haemophilus influenzae природно устойчива к гликопептидам, линкозамидам, даптомицину**, линезолиду**, фузидовой кислоте, стрептограминам.
Приложение Г7. Перечень лабораторных и инструментальных исследований и консультаций специалистов, осуществляемых в среднем при динамическом наблюдении пациентов с муковисцидозом
|
|
При первичном обращении |
Плановый визит (каждые 3 |
Каждые 6 месяцев |
|
Каждые 2 года |
По показаниям |
|
Жалобы, анамнез |
+ |
+ |
||||
|
Антропометрия с оценкой |
+ |
+ |
||||
|
Клинический осмотр |
+ |
+ |
||||
|
Спирометрия1 (исследование неспровоцированных дыхательных объемов и |
+ |
+ |
||||
|
Спирометрия с пробой с бронхолитиком1 (исследование дыхательных объемов с применением лекарственных |
+ |
+ |
||||
|
Бодиплетизмография1 |
+ |
+ |
+ |
|||
|
Пульсоксиметрия |
+ |
+ |
||||
|
Общий анализ крови (Общий (клинический) |
+ |
+ |
||||
|
Биохимический анализ крови1 |
+ |
+ |
||||
|
Ориентировочное |
+ |
+ (по показаниям) |
+ |
+ |
||
|
Оральный глюкозотолерантный тест (ОГТТ), суточное мониторирование |
+ |
+ |
+ |
|
|
При первичном обращении |
Плановый визит (каждые 3 |
Каждые 6 месяцев |
|
Каждые 2 года |
По показаниям |
|
(проведение глюкозотолерантного теста, исследование уровня глюкозы в крови методом непрерывного |
||||||
|
Микробиологический анализ мокроты (наименования услуг в соответствии с Номенклатурой медицинских услуг услуг см. комментарий в разделе 2.3. |
+ |
+ |
+ |
|||
|
Копрология |
+ |
+ |
+ |
|||
|
Определение активности панкреатической эластазы-1 в кале2 |
+ |
+ (при сохранной экзокринной функции поджелудоч |
+ |
|||
|
Электрокардиография (ЭКГ) |
+ |
+ |
||||
|
Эхокардиография (ЭХО- |
+ |
+ |
||||
|
УЗИ органов брюшной полости, допплерография (ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование печени, ультразвуковое исследование |
+ |
+ |
||||
|
Эластометрия печени |
+ |
+ |
||||
|
Рентгенография органов грудной клетки |
+ |
+ |
+ |
|||
|
КТ органов грудной клетки (с 5 лет или по показаниям) |
+ |
+ |
|
|
При первичном обращении |
Плановый визит (каждые 3 |
Каждые 6 месяцев |
|
Каждые 2 года |
По показаниям |
|
Магнитно-резонансная томография органов |
+ |
|||||
|
КТ пазух носа (с 5 лет) (компьютерная томография придаточных пазух носа, гортани)1 |
+ |
+ |
+ |
|||
|
Магнитно-резонансная томография |
+ |
|||||
|
Остеоденситометрия1 |
± |
± |
± |
+ |
||
|
Абдоминальная |
+ |
|||||
|
Оценка дефицита витамин А (определение концентрации витамина А (ретинола) в сыворотке крови4) |
+ |
|||||
|
Оценка дефицита витамин D – (исследование уровня 25- |
+ |
|||||
|
Оценка дефицита витамин Е: (определение уровней ɑ- токоферола3 и холестерина в сыворотке крови, а также их соотношения) |
+ |
|||||
|
Оценка дефицита витамина К: (определение протромбинового (тромбопластинового) времени в крови или в |
+ (обязательно- перед оперативным вмешательство м, при кровотечениях) |
|||||
|
Оценка дефицита витамина К (определение уровня витамина К в |
+ |
|||||
|
Витамин В12 (определение уровня витамина В12(цианокобаламин) в крови) |
+ (всем пациентам с МВ с синдромом короткой |
|||||
|
Консультация оториноларинголога |
+4 |
|
|
При первичном обращении |
Плановый визит (каждые 3 |
Каждые 6 месяцев |
|
Каждые 2 года |
По показаниям |
|
Эндоскопия носоглотки (эндоскопическая эндоназальная ревизия полости носа, носоглотки) |
+ |
|||||
|
Тональная пороговая аудиометрия (регистрация вызванной отоакустической эмиссии и/или регистрация коротколатентных |
+ |
|||||
|
Консультация врача-диетолога |
+ |
|||||
|
Консультация психолога |
+ |
|||||
|
Контроль навыков кинезитерапии и использования дыхательных тренажеров и приборов |
+ |
|||||
|
Консультация врача- |
+ |
|||||
|
Фиброэзофагогастродуоденоскопия (эзофагогастродуоденоскопия) |
+ |
|||||
|
Консультация врача- эндокринолога |
+ |
|||||
|
Консультация врача- |
+ |
|||||
|
Консультация врача- кардиолога (кардиолога |
+ |
|||||
|
Консультация врача- |
+ |
|||||
|
Консультация врача- |
+ |
|||||
|
Рекомендации по лекарственному обеспечению, внесение изменений в региональный реестр по лекарственному |
+ |
|||||
|
Годовой эпикриз (выписка для МСЭ) с рекомендациями и |
+ |
|
|
При первичном обращении |
Плановый визит (каждые 3 |
Каждые 6 месяцев |
|
Каждые 2 года |
По показаниям |
|
планом наблюдения на год |
||||||
|
Подписание информированного согласия и внесение данных пациента в национальный регистр |
+ |
Примечания:
1 В отдельных возрастных группах с учетом возраста [2]
2 Для пациентов с нормальным уровнем эластазы, т.е. сохранной функцией поджелудочной железы (МКБ 10 – Е.84. 0).
3 Отсутствует в утвержденной Номенклатуре медицинских услуг (Приказ Минздрава России от 13.10.2017 № 804н).
4 При наличии полисинусита и полипов носа – чаще
Приложение Г8. Расшифровка примечаний
…** – препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов (Распоряжение Правительства РФ от 12.10.2019 № 2406-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2020 год, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи» », Распоряжение Правительства РФ от 23 ноября 2020 г. № 3073-р
# — применение off-label – вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет;
*** — медицинское изделие, имплантируемое в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи.
**** — продукт питания, включен в Распоряжение Правительства РФ от 7 декабря 2020 г. № 3242- р Об утверждении перечня специализированных продуктов лечебного питания для детей- инвалидов на 2021 г.
Приложение Г9. Смеси для лечебного и дополнительного питания для пациентов с муковисцидозом
****Включены в Распоряжение Правительства РФ от 7 декабря 2020 г. № 3242-р Об утверждении перечня специализированных продуктов лечебного питания для детей-инвалидов на 2021 г.
ПРИЛОЖЕНИЕ Г10 ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ (СТАЦИОНАРНОМУ ЛЕЧЕНИЮ) ДЕТЕЙ И ВЗРОСЛЫХ С МУКОВИСЦИДОЗОМ
[ Капранов Н. И. Современная диагностика, терапия и социальная адаптация больных муковисцидозом в Российской Федерации // Педиатрия. – 2014. – № 4. – С. 6-11.].
-
Тяжелое обострение бронхолегочного процесса с признаками дыхательной недостаточности.
-
Легочное кровотечение, кровохарканье некупирующееся.
-
Пневмоторакс.
-
Кровотечение из варикозно-расширенных вен (ВРВ) пищевода, ВРВ верхних отделов желудка.
-
Признаки кишечной непроходимости
-
Синдром потери солей (псевдо-Барттера синдром – гипокалиемия, гипонатриемия, гипохлоремия, алкалоз) тяжелой степени, требующий круглосуточного мониторинга электролитов, внутривенного введения электролитов.
-
Необходимость проведения плановой или, при развитии нетяжелого обострения, внутривенной антибактериальной терапии при отсутствии возможности проведения ее в условиях дневного стационара или стационара на дому.
-
Необходимость планового оперативного вмешательства.
-
Установка венозных портов, гастростомы.
-
Необходимость оперативного лечения осложнений муковисцидоза (полипотомия, радикальная гайморотомия, спленэктомия, склерозирование вен пищевода и т.д.).
-
Острый панкреатит и обострение хронического.
-
Трансплантация легких, печени.
-
Терминальная фаза муковисцидоза.
-
Другие, не связанные с муковисцидозом жизнеугрожающие состояния.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Дата публикации 9 октября 2020Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
Муковисцидоз — это наследственное заболевание, при котором нарушаются функции желёз внешней секреции. Болезнь поражает весь организм, но сильнее всего страдает дыхательная система и поджелудочная железа.
Заболевание также называется кистозным фиброзом, синдромом Фанкони. Характеризуется системным поражением экзокринных желез: слизеообразующих (респираторных, кишечника, поджелудочной) и серозных (слюнных, потовых, слезных).
Частота болезни в России составляет 1:10000 новорождённых [1]. В 10-15 % случаев симптомы муковисцидоза проявляются у ребёнка с первых дней жизни. У таких детей возникает мекониальный илеус, или непроходимость кишечника, при котором его просвет закупорен слишком густым и вязким первородным калом — меконием.
В некоторых случаях симптомы болезни проявляются не сразу. Это связано с тем, что тяжесть и форма заболевания у разных больных отличаются. Кроме того, признаки муковисцидоза могут напоминать симптомы других болезней, что затрудняет диагностику. Без лечения подавляющее большинство больных умирает в детском возрасте, но благодаря современным лекарственным препаратам и другим методам лечения продолжительность жизни пациентов постоянно растёт.
Муковисцидоз — это аутосомно-рецессивное заболевание, то есть болезнь проявляется в том случае, если «дефектный» ген унаследован от обоих родителей. Для этого и отец, и мать должны быть носителями мутации, вероятность рождения больного ребёнка у них составляет 25 % [7].
Дефектный ген муковисцидоза широко распространен — каждый 25-й житель Северной Европы является гетерозиготным носителем мутантного гена. Высокая смертность в сочетании с повышенной фертильностью должны были бы привести к быстром устранению дефектного гена из популяции. Существует теория, по которой ген муковисцдоза сохранился потому, что его носители имели преимущество во время эпидемии холеры — холерная диарея сопровождается потерей натрия и хлора, а при муковисцидозе эти ионы удерживаются в организме [15].
Чаще всего без адекватного лечения болезнь протекает тяжело и имеет плохой прогноз, на который во многом влияет развитие хронической инфекции в нижних дыхательных путях. Бактериальные агенты при муковисцидозе специфичны, например, для раннего возраста характерно развитие инфекции, вызванной золотистым стафилококком, в дальнейшем к нему присоединяются синегнойная и гемофильная палочки. Данные возбудители устойчивы к лекарственным препаратам, что осложняет лечение, поэтому важно своевременно идентифицировать возбудителя и подобрать подходящие антибактериальные средства.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы муковисцидоза
При муковисцидозе симптомы болезни зачастую видны сразу после рождения ребёнка и проявляются признаками непроходимости кишечника (мекониальным илеусом):
- выраженное беспокойство и постоянный плач;
- сильное вздутие живота;
- рвота;
- повышенное слюноотделение;
- длительная задержка стула;
- повышенная температура тела;
- частые поносы;
- непереносимость жирной пищи;
- характерный стул — вязкий, липкий, жирный.
Непроходимость кишечника может привести к его перфорации. По статистике, до 70-80 % детей с мекониальным илеусом больны муковисцидозом [3]. Для его исключения каждому новорождённому с кишечной непроходимостью необходимо провести диагностическое обследование.
В возрасте одного года у ребёнка с муковисцидозом может наблюдаться обильный, зловонный стул непереваренной пищей, частый сухой кашель, отставание в физическом развитии и длительная желтуха.
Одним из главных признаков муковисцидоза является повышенная солёность пота. Её замечают родители, когда при усиленном потоотделении на коже ребёнка выделяются крошечные кристаллы соли. Они образуются вследствие повышенной концентрации в потовой жидкости ионов натрия и хлора. Их концентрация увеличивается в результате нарушения транспорта и секреции в клетках, выстилающих потовые железы. При этом потери соли из организма при потоотделении могут превышать её поступление с пищей. При болезни, протекающей с высокой температурой и значительной потерей с потом хлора и натрия, может возникнуть токсикоз и шок [7].
Иногда признаки заболевания проявляются только в школьном возрасте. Дети с муковисцидозом из-за нехватки питательных веществ страдают дефицитом массы тела и отстают в росте.
Для заболевания также характерны:
- изменение стула;
- хроническая диарея;
- вздутие кишечника;
- частые гнойные заболевания лёгких неясной этиологии;
- одышка;
- гаймориты и синуситы.
У заболевших в раннем детстве и доживших до взрослого возраста отмечаются постоянный сухой кашель, вне обострения чаще наблюдается постоянное отделение мокроты от 5-10 мл до 200 мл и более. Характер мокроты — от слизистой до гнойной. Одышка, которая в начале болезни может возникать только при небольшой нагрузке, но со временем усиливается, частые респираторные заболевания и гаймориты. У пациентов выражена задержка роста, фаланги пальцев и ногти изменяются по типу «барабанных палочек» и «часовых стёкол».
Грудная клетка чаще бочкообразной формы. Появляется бледность, одутловатость лица и цианоз видимых слизистых.
У больных может наблюдаться задержка в половом развитии или отсутствие вторичных половых признаков:
- отсутствие волос в подмышечных впадинах и на лобке;
- замедленный рост половых органов;
- недоразвитие молочных желёз у девочек;
- отсутствие менструального цикла.
У женщин с муковисцидозом снижена фертильность, у мужчин наблюдается азооспермия — отсутствие сперматозоидов в эякуляте [3][4].
Патогенез муковисцидоза
Патогенез муковисцидоза обусловлен мутацией гена CFTR (Cystic Fibrosis Transmembrane conductance Regulator) — муковисцидозного трансмембранного регулятора проводимости. Этот ген кодирует белок, который обеспечивает транспорт солей и воды в эпителиальном слое бронхолёгочной системы и в клетках, выстилающих железы, вырабатывающие секрет и выводящие его во внешнюю среду организма. Из-за дефекта структуры белка нарушается перемещение ионов натрия и хлора в клетках, что в итоге приводит к повышенной вязкости секрета экзокринных желез. Происходит увеличение всасывания ионов натрия и дефект секреции хлора, что ведёт к снижению или прекращению выделения жидкости в просвет бронхов. Из-за этого мокрота теряет свою жидкую часть, становится вязкой и густой. Впоследствии это ведёт к тому, что бронхи забиваются вязким секретом.
Таким образом, при муковисцидозе нарушаются функции желёз, которые вырабатывают пот, слизь, слёзы, слюну и пищеварительные соки. Через протоки этих желёз выделения выходят на поверхность тела или в полые органы, такие как кишечник или дыхательные пути. У пациентов с муковисцидозом в этих органах возникают серьёзные изменения, особенно они затрагивают бронхолёгочную систему — вязкий секрет закупоривает мелкие дыхательные пути.
Слизь, выделяемая в дыхательных путях, необходима для удаления из них пыли и бактерий, но при муковисцидозе выработка и структура бронхиального секрета нарушаются. В результате на стенках дыхательных путей развивается хроническое воспаление, которое впоследствии приводит к формированию бронхоэктазов (расширения и деструкции бронхов) и рубцов в лёгочной ткани.
При муковисцидозе страдает не только дренажная функция дыхательных путей, но и клеточный и гуморальный иммунитет. Это происходит из-за нарушений в работе клеток и затруднённого движения ресничек мерцательного эпителия бронхов.
Помимо этого, при муковисцидозе ферменты, вырабатываемые поджелудочной железой, не поступают в кишечник. Они начинают разрушать ткань поджелудочной железы, в результате чего в ней формируются рубцы и кисты. Также необратимо нарушается весь процесс пищеварения. Это приводит к недостаточности массы тела, отставанию в росте и весе, хронической диарее и выпадению прямой кишки.
При муковисцидозе у мужчин отмечается обструкция (непроходимость) семявыносящих протоков, отсюда и высокий процент мужского бесплодия при заболевании.
Классификация и стадии развития муковисцидоза
В зависимости от преобладающих симптомов выделяют три основные клинические формы заболевания: кишечную, бронхолёгочную и смешанную.
Кишечная форма муковисцидоза. Кистозный фиброз с кишечными проявлениями Е84.1 (код по МКБ-10)
Из-за неправильной секреции ферментов нарушается работа органов желудочно-кишечного тракта. Ухудшается расщепление жиров, белков и углеводов, а также их усвоение. Не вся пища переваривается, стул становится обильным, частым и зловонным.
Отмечается вздутие, повышенное газообразование и боли в различных областях живота. Даже при хорошем аппетите дети теряют вес, отстают в росте и развитии. Кишечная форма выявляется у 5—10 % больных муковисцидозом [7].
Бронхолёгочная форма муковисцидоза. Кистозный фиброз с лёгочными проявлениями Е84.0
Нарушения затрагивают всю бронхолёгочную систему. Вязкая мокрота скапливается в дыхательных путях и её тяжело откашлять. При инфицировании золотистым стафилококком, синегнойной и гемофильной палочками возникают тяжёлые бронхиты и пневмонии, для которых характерно осложнённое течение с развитием одышки, интоксикации и выраженной слабостью. Со временем развиваются следующие необратимые изменения:
- деформация грудной клетки;
- расширение дистальных отделов бронхов (бронхоэктазы);
- замещение лёгочной ткани соединительной рубцовой (пневмосклероз);
- «лёгочное сердце» — из-за повышенного давления в малом круге кровообращения происходит увеличение правых отделов сердца.
Бронхолёгочная форма характерна для 15—20 % случаев муковисцидоза [7].
Смешанная форма (лёгочно-кишечная)
Включает проявления лёгочной и кишечной форм. Это самый распространённый тип (65—75 % от всех случаев) и, как правило, самый тяжёлый [7].
Различают четыре стадии развития муковисцидоза:
1. Непостоянство симптомов, пациент жалуется на частый сухой кашель и небольшую одышку при физических нагрузках. Стадия может длиться до 10 лет.
2. Кашель с отделением мокроты, одышка появляется в покое и усиливается при физической нагрузке, фаланги пальцев и ногтевые пластины деформируются по типу «барабанных палочек» и «часовых стёкол». Стадия продолжается от 2 до 15 лет.
3. Бронхолёгочные симптомы прогрессируют, развиваются тяжёлые осложнения. У пациентов усиливается одышка и появляются признаки сердечной недостаточности: отёки на ногах, одышка при небольшой активности или в покое, быстрая утомляемость, непереносимость физических нагрузок. На УЗИ сердца видны признаки гипертрофии левых и правых отделов, а также снижение сердечной фракции выброса левого желудочка. На рентгенологических снимках можно обнаружить зоны пневмофиброза, бронхоэктазы и кисты. Формируется сердечная недостаточность по правожелудочковому типу, так называемое «лёгочное сердце». Длительность стадии от 3 до 5 лет.
4. Тяжёлая кардио-респираторная недостаточность. Из-за дисфункции левого желудочка нарушается работа сердца и лёгких, снижается фракция выброса левого желудочка, учащается сердцебиение, прогрессирует гипотензия. Стадия длится несколько месяцев и завершается смертью больного, вызванной развитием дыхательной недостаточности и остановкой сердечной деятельности.
Различают стадии обострения и ремиссии:
- лёгкое обострение — не чаще раза в год, в период ремиссии клинических проявлений нет, работоспособность пациентов не изменена;
- обострение средней тяжести — 2-3 раза в год, сохраняется кашель, периодически поднимается температура, страдает работоспособность;
- тяжёлые обострения – следуют одно за другим, ремиссии почти нет, масса тела больного снижается, больные становятся инвалидами.
Критерии обострения:
- увеличивается частота дыхания;
- повышается температура тела;
- вес снижается более чем на 1 кг;
- усиливается кашель;
- увеличивается количество мокроты;
- появляются хрипы;
- снижается ОФВ1 (объём форсированного выдоха за первую секунду манёвра) на 10 % и более в сравнении с измеренным за последние три месяца;
- снижается уровень сатурации кислорода на 10 % и более по сравнению с измерением за три последних месяца;
- ухудшается переносимость физических нагрузок.
Осложнения муковисцидоза
Для муковисцидоза характерны следующие бронхолёгочные осложнения:
- ателектаз — спадание части лёгкого;
- абсцессы в лёгких — развитие в них полости с гнойным содержимым.
Пациенты жалуются на выраженную одышку, отмечаются симптомы сильной интоксикации, повышается температура и выделяется большое количество зловонной гнойной мокроты.
Одним из тяжёлых осложнений является спонтанный пневмоторакс — скопление воздуха в плевральной полости. Нарушение проявляется резкой колющей болью в грудной клетке, усиливающейся при дыхании, кашле и движениях. Больной начинает дышать часто и поверхностно, отмечается сильная одышка и чувство нехватки воздуха, беспокоит кашель, появляется синюшность кожных покровов лица.
У больных старше 12 лет высока вероятность развития сахарного диабета I типа, может наблюдаться остеопороз, артриты и отёки нижних конечностей.
Постоянные или частые боли в животе могут указывать на панкреатит, эзофагит или язвенную болезнь желудка и двенадцатиперстной кишки.
Осложнять течение болезни может развитие фиброза печени различной степени выраженности, который чаще всего прогрессирует и в дальнейшем приводит к билиарному циррозу печени и портальной гипертензии. Муковисцидоз влияет на транспортировку ионов хлора, участвующих в перемещении желчи. При заболевании желчь по протокам не попадает в печень и её каналы, что ведёт к негативным последствиям — желчные протоки обезвоживаются, ткань печени замещаются соединительной тканью, происходит застой желчи (холестаз), развивается фиброз печени (цирроз)[11].
У больных муковисцидозом часто наблюдаются такие осложнения, как выпадение прямой кишки и кишечная непроходимость, связанные с вязкостью кала. Кишечная непроходимость вызвана дегидратацией кишечного содержимого, нарушением моторики кишечника и внешнесекреторной недостаточностью функции поджелудочной железы. При патологии пациенты жалуются на боль в животе, вздутие, запор, рвоту и задержку газов. Если больному вовремя не оказана специализированная медицинская помощь, то он может погибнуть от развившегося некроза и перитонита [12].
Диагностика муковисцидоза
Основной критерий постановки диагноза — увеличение концентрации ионов хлора в потовых железах более 60 ммоль/л вместе с одним или более из следующих критериев:
- хроническое заболевание дыхательных путей;
- экзокринная недостаточность поджелудочной железы;
- муковисцидоз близких – не далее двоюродных-родственников.
Эти критерии позволяют установить диагноз в 95 % случаев при недоступности генетического исследования мутации гена CFTR.
Характерные клинические проявления болезни:
- желудочно-кишечные нарушения;
- патологии бронхолёгочной системы и придаточных пазух носа;
- синдром потери солей;
- обструктивная азооспермия — сперматозоиды вырабатываются в нормальном количестве, но из-за нарушенной проходимости протоков не могут выйти наружу.
Скрининг на муковисцидоз проводится в роддоме всем новорождённым и направлен на выявление заболевания ещё до клинических проявлений. Для этого у ребёнка на 4-7 день жизни берётся кровь из пятки на фильтровальную бумагу и определяют уровень иммунореактивного трипсина (ИРТ). Если показатели ИРТ превышены (норма не более 65-70 нг/мл), то на 21-28 день анализ повторяют. Если показатели остаются повышенными, ребёнку проводится потовая проба и генетическое обследование.
Потовая проба — это один из методов диагностики муковисцидоза, с помощью которого определяется уровень хлоридов в секрете потовых желез. Анализ проводится троекратно. Положительным результатом для постановки диагноза считается показатель выше 60 ммоль/л.
Методика проведения потовой пробы: кожу правого бедра новорождённого протирают раствором натрия хлорида, дают высохнуть, после кладут салфетку, смоченную раствором пилокарпина для провоцирования гипергидроза и вторую салфетку, смоченную солёной водой. На салфетках закрепляются электроды, в течение 5 минут подаётся разряд 4 мА, после чего электроды снимаются, и кожа протирается. На простимулированном участке фиксируется кусочек фильтровальной бумаги. Выделяющийся пот собирается в течение 30 минут, после чего бумагу снимают и отсылают в лабораторию для определения концентрации электролитов хлора и натрия.
Обзорную рентгенограмму брюшной полости проводят для выявления вздутых петель кишечника и признаков кишечной непроходимости. При осмотре может быть обнаружено увеличение печени (гепатомегалия). Также у пациентов выявляют сахарный диабет I типа, который сочетается с респираторными симптомами: одышкой, частым кашлем с трудноотделяемой вязкой мокротой и панкреатитом, проявляющимся опоясывающими болями в области живота и частым стулом непереваренной пищей.
Обследование в несколько этапов необходимо, чтобы исключить ложноположительные результаты и подтвердить или опровергнуть диагноз [6].
Молекулярно-генетический анализ позволяет диагностировать муковисцидоз приблизительно в 90 % случаев. Для его проведения нужна кровь из вены. Генетический метод обнаруживает в хромосомах пациента «дефектный» ген с мутацией F508del. При тестировании на муковисцидоз невозможно проверить все мутации, так как их более 1900, а большинство лабораторий выявляет только 20-30 самых частых вариантов.
Если в хромосомах не обнаруживается ни одной из 10-20 наиболее распространённых мутаций, то диагноз «муковисцидоз» маловероятен. В России генетические анализы недостаточно распространены, и не во всех регионах есть возможность такого тестирования [8].
Лечение муковисцидоза
Муковисцидоз носит наследственный характер, поэтому его лечение большей частью симптоматическое, оно направлено на восстановление функций дыхательного и желудочно-кишечного тракта и проводится на протяжении всей жизни пациента. Больным муковисцидозом важно соблюдать диету, выполнять специальный комплекс упражнений и принимать препараты, предотвращающие развитие инфекций.
Основной целью лечения при муковисцидозе является удаление из дыхательных путей вязкой мокроты. Для этого применяют различные методики дренирования бронхиального дерева, например кинезотерапию — одну из форм лечебной физкультуры, способствующую очищению бронхов от вязкой и агрессивной слизи.
Приёмы кинезотерапии:
- Углублённые вдох и выдох, позволяющие слизи легче отделяться от стенок бронхов.
- Дыхание с сопротивлением губами.
- Мобилизация — упражнения для повышения эластичности грудной клетки, позвоночника и мышечного баланса тела.
Физиотерапевтическое лечение младенцев и детей раннего возраста включает как активную, так и пассивную техники.
Пассивная техника:
• принятие телом ребёнка определённого положения на короткое время, затем его изменение;
• сопровождение и стимуляция дыхательных движений при помощи рук (контакт-дыхание) — техника, при которой рука физиотерапевта ведёт и стимулирует дыхательные движения;
• ручная вибрация на выдохе — для поддержки выдоха и помощи высвобождению мокроты потряхивается грудную клетку рукой;
• потряхивание — ритмические движения, выполняемые в одной из частей тела для возникновения реакции в грудной клетке;
• терапевтические положения тела — расположение грудной клетки в состоянии, при котором растягивается лёгочная ткань и расширяются дыхательные пути.
Активная техника:
• влияние на дыхание, например с помощью акустической стимуляции — поощряя ребёнка повторять громкие крики, которые он издаёт;
• упражнения для развития эластичности грудной клетки, позвоночника и мышечного баланса тела;
• упражнения, повышающие ловкость, выносливость и формирующие наслаждение от мышечной активности.
Важную роль при лечении играют аппаратные методы. Широкое распространение получил аппарат «виброжилет», состоящий из надувного жилета и блока генератора пневмоимпульсов, который создаёт давление на грудную клетку. Такие колебания воспроизводят эффект кашля и помогают очистить бронхи от вязкой мокроты. Аппаратные методы применяют вместе с медикаментозной терапией [13].
При муковисцидозе важно соблюдать диету — питание должно быть высококалорийным, с повышенным содержанием белков и жиров. Пищу принимают часто и небольшими порциями, дополнительно подсаливая. Из рациона исключается еда, которая тяжела для переваривания: грубая клетчатка, навары из супов, жареные блюда, шоколад, торты, пирожные. Суточный калораж должен превышать возрастную норму на 20—40 %, главным образом за счёт увеличенного количества белка (до 6 г на 1 кг массы тела в сутки). Из-за нарушенной функции поджелудочной железы у больных не усваиваются жиры и жирорастворимые витамины А, Д, Е и К, поэтому необходим их дополнительный приём.
Для облегчения отхождения мокроты применяют следующие препараты:
- Амброксол в таблетках по 30 мг. В период ремиссии лекарство принимают один раз в сутки, во время обострения заболевания — до шести раз.
- Дорназа альфа — генно-инженерный вариант природного фермента человека, который помогает расщеплять гнойную мокроту. Применяется с помощью небулайзера по 2,5 мг один раз в сутки.
Для ингаляционной терапии используют бронхолитики:
- «Беродуал» — на одну процедуру в небулайзере нужно 20 капель беродуала + 3,0 мл физраствора. Ингаляции делают два раза в день утром и вечером в течение 7-10 дней.
- «Вентолин» — препарат заливают в небулайзер в неразбавленном виде, стандартная доза 2,5 мл, в сутки разрешается делать не больше четырёх ингаляций.
- «Пульмикорт» — на одну процедуру нужно 1 мл препарата + 1 мл. физраствора, дважды в день утром и вечером в течение пяти дней.
Следует иметь в виду, что у трети больных бронхолитики оказывают положительный ответ, но у большей части может возникнуть коллапс мышц дыхательных путей и резкое снижение объёма выдыхаемого воздуха. В связи с этим больные, получающие такую терапию, должны находиться под наблюдением врача.
Антибактериальные препараты назначаются всем пациентам с лёгочными симптомами, при обострениях заболевания или выявлении возбудителей респираторных инфекций для подавления их роста.
Для лечения применяют эффективные комбинации антисинегнойных антибиотиков:
Ингаляционные антибактериальные средства: «Брамитоб», «Тобрамицин», «Тоби подхалер», «Колистин».
Пероральные антибиотики: ципрофлоксацин, кларитромицин.
Парентеральные антибиотики:
- цефалоспорины + аминогликозиды;
- антисинегнойные пенициллины + аминогликозиды;
- карбапенемы + аминогликозиды;
- фторхинолоны + аминогликозиды;
- цефалоспорины + фторхинолоны;
- антисинегнойные пенициллины + фторхинолоны;
- карбапенемы + фторхинолоны;
- цефалоспорины + карбапенемы + аминогликозиды [10].
Доза вводимого антибактериального препарата должна превышать среднюю терапевтическую в полтора раза. Курс антибактериальной терапии может продолжаться до 3-4 недель,в случае хронизации инфекционного процесса — до 12 недель.
Для улучшения функции пищеварения используют ферментные препараты, которые содержат липазу, протеазу и амилазу, облегчающие переваривание жиров, углеводов и белков, а также способствующие их лучшему всасыванию в тонком кишечнике. Подбор доз панкреатических ферментов проводится индивидуально исходя из клинических проявлений болезни. Применяются препараты: «Панкреатин», «Мезим», «Креон». Ферментные препараты назначаются в больших дозах, чем больным с другими заболеваниями желудочно-кишечного тракта — до 30 капсул «Креона» в сутки.
Лечение муковисцидоза пожизненное. Выбор схемы терапии зависит от вида бактерий, обнаруженных в бронхиальном секрете дыхательных путей, а также от преобладающих клинических форм заболевания.
«В последние годы для лечения муковисцидоза начали применять таргетную генетическую терапию, которая направлена на исправление дефекта в самой распространённой мутации F508del [14]. Препарат продаётся в США под маркой «Trikafta». В августе 2020 года лекарство было одобрено Европейской комиссией для применения в ЕС под наименованием «Kaftrio»». — прим. ред. «ПроБолезни».
В России оригинальные препараты для лечения муковисцидоза заменяются дженерикам отечественного производства. Дженерики сходны с оригинальными препаратами по составу действующего вещества. Многие пациенты жалуются на их плохое качество и появление побочных эффектов. В последнее время пациентами и родителями больных муковисцидозом проводятся кампании, цель которых — вернуть государственное обеспечение качественными иностранными лекарствами.
Назвать побочные эффекты дженериков на данный момент сложно, так как отсутствуют их сравнительные исследования с оригинальными препаратами.
В рамках 44-ого ФЗ закупки лекарственных препаратов идут по международному непатентованному названию. Перечень лекарственных препаратов утверждается правительством РФ. Врачам за назначение препаратов под торговыми названиями или купленными родителями и благотворительными фондами грозит ответственность. В рецептах, выписанных врачом, должны быть указаны только международные названия, а не торговые. За нарушение этого правила врачей ждет штраф.
Хотя есть одно условие: при наличии медицинских показаний (аллергия, индивидуальная непереносимость дженерика по жизненным показаниям) по решению врачебной комиссии пациент может получить лекарство под торговым названием. Поэтому возможность получить оригинальный препарат — индивидуальная непереносимость дженерика (которую нужно доказать) и решение врачебной комиссии.
Муковисцидоз — наиболее частое показание для трансплантации лёгких. Основные показания для этой операции: прогрессирующее снижение веса, ухудшение лёгочной функции, частые обострения, потребность в кислородотерапии. Противопоказания: аспергиллома (опухолевоподобное неинвазивное новообразование шаровидной формы, состоящее в основном из клеток мицелия микроскопического плесневого гриба), курение, психосоциальные факторы. Сахарный диабет и лечение кортикостероидами не являются препятствием для трансплантации.
Прогноз. Профилактика
Муковисцидоз — это неизлечимое хроническое заболевание, но при своевременной диагностике и адекватной постоянной терапии многие пациенты доживают до взрослого возраста.
Для больных муковисцидозом возможна полноценная жизнь, но только при условии постоянного получения необходимых препаратов. Основными причинами смертности этих пациентов являются бронхолёгочные осложнения: развитие инфекции в нижних дыхательных путях, бронхоэктазы и хроническая обструктивная болезнь легких (ХОБЛ).
Доля пациентов старше 18 лет за последнее 10 лет увеличилась, выживаемость составила 31,8 % [3]. Увеличение продолжительности жизни обусловлено ранним выявлением заболевания, оптимизацией работы центров муковисцидоза и применением эффективных медикаментозных препаратов, в частности дорназы альфа («Пульмозим»), некоторых ингаляционных и системных антибиотиков и макролидов [9]. Дорназа альфа способствует снижению вязкости мокроты и обладает отхаркивающим действием. Использование небулайзера помогает быстро доставить ингаляционные антибиотики в поражённую область.
Главным способом профилактики является дородовая и неонатальная диагностика. Семейным парам, планирующим рождение ребенка, рекомендуется пройти ДНК-диагностику на носительство мутаций, приводящих к муковисцидозу, с последующей консультацией врача-генетика.
Пренатальная ДНК-диагностика выполняется при заборе околоплодных вод в ранний (13-14 недель) и поздний (16-20 недель беременности) сроки. Обследование проводят для семей, в которых выявлено носительство мутации гена CFTR и имеющих ребёнка больного муковисцидозом.
Клинические рекомендации
https://doi.org/10.15690/pf.v19i 2.2417 igÜ^
А.А. Баранов1, 2, Л.С. Намазова-Баранова1, 3 4, С.И. Куцев5, С.Н. Авдеев2, 6, Е.В. Полевиченко2, А.С. Белевский3, Е.И. Кондратьева5, 7, О.И. Симонова2, 8, 9, Н.Ю. Каширская5, В.Д. Шерман5, А.Ю. Воронкова5, Е.Л. Амелина5, 6, Т.Е. Гембицкая10, С.А. Красовский5, 6, А.Г. Черменский10, Т.А. Степаненко11, Л.Р. Селимзянова1, 2, Е.А. Вишнева1, 3, Ю.В. Горинова8, Е.А. Рославцева8, И.К. Ашерова12, Н.А. Ильенкова13, С.К. Зырянов14, Н.Д. Одинаева7, Т.Ю. Максимычева5, А.В. Орлов15, 16, С.Ю. Семыкин17, М.Ю. Чернуха18, И.А. Шагинян18, Л.Р. Аветисян18,
Г.Л. Шумкова6, Н.А. Крылова6, И.А. Дронов2, 7 , М.Н. Костылева3, 17, Л.А. Желенина19,
Н.Н. Климко15, Ю.В. Борзова15, Н.В. Васильева15, 20, Т.С. Богомолова15, А.А. Сперанская10,
И.А. Баранова3, Е.Г. Фурман21, В.В. Шадрина21, Н.Ф. Щапов22, Н.В. Петрова5, И.В. Пашков23,
О.М. Цирульникова2, Д.П. Поляков3, 24, В.М. Свистушкин2, Э.В. Синьков2, В.Б. Черных5,
С.А. Репина5, Д.А. Благовидов3, 25, М.П. Костинов25, О.В. Кондратенко26, А.В. Лямин26,
С.В. Поликарпова27, А.В. Поляков5, Т.А. Адян3, 5, Д.В. Гольдштейн5, Т.Б. Бухарова5,
А.С. Ефремова5, Е.С. Овсянкина28, Л.В. Панова28, И.В. Черкашина29
1 НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», Москва, Российская Федерация
2 Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет), Москва, Российская Федерация
3 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, Москва, Российская Федерация g
4 Белгородский государственный национальный исследовательский университет, Белгород, Российская Федерация
5 Медико-генетический научный центр им. академика Н.П. Бочкова, Москва, Российская Федерация
6 Научно-исследовательский институт пульмонологии ФМБА, Москва, Российская Федерация ^
7 Научно-исследовательский клинический институт детства Министерства здравоохранения о Московской области, Москва, Российская Федерация 5
8 Национальный медицинский исследовательский центр здоровья детей, g Москва, Российская Федерация
Морозовская детская городская клиническая больница ДЗМ, Москва, Российская Федерация
9
Московский областной центр охраны материнства и детства, Люберцы, Российская Федерация
от
vH
10 Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова, Санкт-Петербург, Российская Федерация
11 Городская многопрофильная больница № 2, Санкт-Петербург, Российская Федерация
12 Центральная городская больница, Ярославль, Российская Федерация
13 Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого, Красноярск, Российская Федерация о
14 Российский университет дружбы народов, Москва, Российская Федерация ^
15 Северо-Западный государственный медицинский университет им. И.И. Мечникова, о Санкт-Петербург, Российская Федерация
16 Детская городская больница Святой Ольги, Санкт-Петербург, Российская Федерация |
17 Российская детская клиническая больница, Москва, Российская Федерация
18 Национальный исследовательский центр эпидемиологии и микробиологии имени почетного
о §
академика Н.Ф. Гамалеи, Москва, Российская Федерация 5
19 Санкт-Петербургский государственный педиатрический медицинский университет, <
е
Санкт-Петербург, Российская Федерация к
20 НИИ медицинской микологии им. П.Н. Кашкина, Санкт-Петербург, Российская Федерация ^
21 Пермский государственный медицинский университет им. академика Е. А. Вагнера, £
Пермь, Российская Федерация |
<1
22
1У1ииииии11Г1П 1и7 I I I к I I I илри1 11_>! IV1I к I I 1_/1 I_’ 1—-1 у I ^ ^ I I ии, у | , | иииппи1ил л
23 Национальный медицинский исследовательский центр трансплантологии и искусственных органов ш имени академика В.И. Шумакова, Москва, Российская Федерация
24 Национальный медицинский исследовательский центр оториноларингологии ФМБА, Москва, Российская Федерация
25 НИИ вакцин и сывороток им. И.И. Мечникова, Москва, Российская Федерация
26 Самарский государственный медицинский университет, Самара, Российская Федерация
27 Городская клиническая больница № 15 им. О.М. Филатова, Москва, Российская Федерация
28 Центральный НИИ туберкулеза, Москва, Российская Федерация
29 Детский научно-клинический центр инфекционных болезней ФМБА России, Москва, Российская Федерация
Современные подходы
к ведению детей с муковисцидозом
V) Z
о
< а
о о ш а
_j <
о
Автор, ответственный за переписку:
Намазова-Баранова Лейла Сеймуровна, доктор медицинских наук, профессор, академик РАН, заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, руководитель НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», президент Союза педиатров России Адрес: 119333, Москва, ул. Фотиевой, д. 10, тел.: +7 (499) 400-47-33, e-mail: lsnamazova@yandex.ru
Проблема своевременной диагностики и правильного ведения пациентов с муковисцидозом актуальна не только в нашей стране, но и во всем мире. Экспертами Союза педиатров России с современных позиций рассмотрены проблемы этиологии, патогенеза, эпидемиологии, диагностики и лечения этого генетического заболевания. Особое внимание уделено методам скрининга для раннего выявления муковисцидоза. Обоснованы принципы комплексной терапии, в том числе рационального использования антибактериальных, муколитических препаратов и ферменто-заместительной терапии, во многом определяющие прогноз болезни.
Ключевые слова: муковисцидоз, диагностика, лечение, кинезитерапия, ферментозаместительная терапия, дети Для цитирования: Баранов А.А., Намазова-Баранова Л.С., Куцев С.И., Авдеев С.Н., Полевиченко Е.В., Белевский А.С., Кондратьева Е.И., Симонова О.И., Каширская Н.Ю., Шерман В.Д., Воронкова А.Ю., Амелина Е.Л., Гембицкая Т.Е., Красовский С.А., Черменский А.Г., Степаненко Т.А., Селимзянова Л.Р., Вишнева Е.А., Горинова Ю.В., Рославцева Е.А., Ашерова И.К., Ильенкова Н.А., Зырянов С.К., Одинаева Н.Д., Максимычева Т.Ю., Орлов А.В., Семыкин С.Ю., Чернуха М.Ю., Шагинян И.А., Аветисян Л.Р., Шумкова Г.Л., Крылова Н.А., Дронов И.А., Костылева М.Н., Желенина Л.А., Климко Н.Н., Борзова Ю.В., Васильева Н.В., Богомолова Т.С., Сперанская А.А., Баранова И.А., Фурман Е.Г., Шадрина В.В., Щапов Н.Ф., Петрова Н.В., Пашков И.В., Цирульникова О.М., Поляков Д.П., Свистушкин В.М., Синьков Э.В., Черных В.Б., Репина С.А., Благовидов Д.А., Костинов М.П., Кондратенко О.В., Лямин А.В., Поликарпова С.В., Поляков А.В., Адян Т.А., Гольдштейн Д.В., Бухарова Т.Б., Ефремова А.С., Овсянкина Е.С., Панова Л.В., Черкашина И.В. Современные подходы к ведению детей с муковисцидозом. Педиатрическая фармакология. 2022;19(2):153-195. doi: https://doi.org/10.15690/pf.v19i2.2417
< ч
о 2£ Ш Q. Ш S 2£ О ш з-
2£
Alexander A. Baranov1, 2, Leyla S. Namazova-Baranova1, 3 4, Sergey I. Kutsev5, Sergey N. Avdeev2′ 6,
Elena V. Polevichenko2, Andrey S. Belevskiy3, Elena I. Kondratyeva5, 7, Olga I. Simonova2, 8, 9,
Nataliya Yu. Kashirskaya5, Victoria D. Sherman5, Anna Yu. Voronkova5, Evgeniya L. Amelina5, 6,
Tatyana E. Gembitskaya10, Stanislav A. Krasovskiy5, 6, Alexey G. Chermenskiy10, Tatyana A. Stepanenko11,
Liliia R. Selimzyanova1, 2, Elena A. Vishneva1,3, Yulia V. Gorinova8, Elena A. Roslavtseva8, Irina K. Asherova12,
Natalya A. Ilyenkova13, Sergey K. Zyryanov14, Niso D. Odinayeva7, Tatyana Yu. Maksimycheva5,
Alexander V. Orlov15, 16, Sergey Yu. Semykin17, Marina Yu. Chemukha18, Igor A. Shaginyan18, Lusine R. Avetisyan18,
Galina L. Shumkova6, Natalya A. Krylova6, | Ivan A. Dronov2, 71 , Maria N. Kostyleva3, 17, Ludmila A. Zhelenina19,
Nikolay N. Klimko15, Yuliya V. Borzova15, Natalya V. Vasilyeva15, 20, Tatyana S. Bogomolova15,
Anna A. Speranskaya10, Irina A. Baranova3, Evgeny G. Furman21, Vera V. Shadrina21, Nikolay F. Shchapov22,
Nika V. Petrova5, Ivan V. Pashkov23, Olga M. Tsirulnikova2, Dmitriy P. Polyakov3, 24, Valeriy M. Svistushkin2,
Eduard V. Sin’kov2, Vyacheslav B. Chernykh5, Svetlana A. Repina5, Dmitriy A. Blagovidov3,25,
Mikhail P. Kostinov25, Olga V. Kondratenko26, Artem V. Lyamin26, Svetlana V. Polikarpova27,
Alexander V. Polyakov5, Tagui A. Adyan3,5, Dmitry V. Goldshtein5, Tatiana B. Bukharova5, Anna S. Efremova5,
Elena S. Ovsyankina28, Ludmila V. Panova28, Irina V. Cherkashina29
I Research Institute of Pediatrics and Children’s Health in Petrovsky National Research Centre of Surgery, Moscow, Russian Federation
Sechenov First Moscow State Medical University, Moscow, Russian Federation Pirogov Russian National Research Medical University, Moscow, Russian Federation Belgorod National Research University, Belgorod, Russian Federation Research Centre for Medical Genetics, Moscow, Russian Federation
Pulmonology Research Institute of Federal Medico-Biological Agency of Russia, Moscow, Russian Federation Research Clinical Institute of Childhood of the Ministry of Health of Moscow Region, Moscow, Russian Federation National Medical Research Center of Children’s Health, Moscow, Russian Federation Morozov Children’s City Hospital, Moscow, Russian Federation 10 Pavlov First Saint Petersburg State Medical University, Saint Petersburg, Russian Federation
II City Multidisciplinary Hospital № 2, Saint Petersburg, Russian Federation
12 Central Clinical Hospital, Yaroslavl, Russian Federation
13 Krasnoyarsk State Medical University named after prof. V.F. Voino-Yasenetsky, Krasnoyarsk, Russian Federation
14 RUDN University, Moscow, Russian Federation
15 North-Western State Medical University named after I.I. Mechnikov, Saint-Petersburg, Russian Federation
16 St. Olga Children’s City Hospital, Saint Petersburg, Russian Federation
17 Russian Children’s Clinical Hospital, Moscow, Russian Federation
18 National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya, Moscow, Russian Federation
154
19 Saint Petersburg State Pediatric Medical University, Saint Petersburg, Russian Federation
20 Kashkin Research Institute of Medical Mycology, Saint Petersburg, Russian Federation
21 Perm State Medical University named after academician E. A. Wagner, Perm, Russian Federation
22 Moscow Regional Center for Maternity and Childhood Protection, Luybertsy, Russian Federation
23 V.I. Shumakov National Medical Research Center of Transplantology and Artificial Organs of the Ministry of Healthcare of Russian Federation, Moscow, Russian Federation
24 National Medical Research Center for Otorhinolaryngology of Federal Medico-Biological Agency of Russia, Moscow, Russian Federation
25 I.I. Mechnikov Research Institute of Vaccines and Sera, Moscow, Russian Federation
26 Samara State Medical University, Samara, Russian Federation
27 City Clinical Hospital № 15 named after O.M. Filatov, Moscow, Russian Federation
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
28 Central Research Institute of Tuberculosis, Moscow, Russian Federation
29 Children’s Research and Clinical Center for Infectious Diseases of Federal Medico-Biological Agency of Russia, Moscow, Russian Federation
Modern Approaches in Management of Children with Cystic Fibrosis
The problem of timely diagnosis and proper management of patients with cystic fibrosis Is crucial not only in our country, but throughout the world. Experts of the Union of Pediatricians of Russia have considered various issues of etiology, pathogenesis, epidemiology, diagnosis, and treatment of this genetic disease in a modern light. Particular attention was paid to screening methods for early diagnosis of cystic fibrosis. The principles of complex therapy were justified, including rational use of antibacterial and mucolytic drugs and enzyme replacement therapy that significantly determine the disease prognosis. Keywords: cystic fibrosis, diagnosis, treatment, kinesitherapy, enzyme replacement therapy, children
For citation: Baranov Alexander A., Namazova-Baranova Leyla S., Kutsev Sergey I., Avdeev Sergey N., Polevichenko Elena V., Belevskiy Andrey S., Kondratyeva Elena I., Simonova Olga I., Kashirskaya Nataliya Yu., Sherman Victoria D., Voronkova Anna Yu., Amelina Evgeniya L., Gembitskaya Tatyana E., Krasovskiy Stanislav A., Chermenskiy Alexey G., Stepanenko Tatyana A., Selimzyanova Liliia R., Vishneva Elena A., Gorinova Yulia V., Roslavtseva Elena A., Asherova Irina K., Ilyenkova Natalya A., Zyryanov Sergey K., Odinayeva Niso D., Maksimycheva Tatyana Yu., Orlov Alexander V., Semykin Sergey Yu., Chernukha Marina Yu., Shaginyan Igor A., Avetisyan Lusine R., Shumkova Galina L., Krylova Natalya A., Dronov Ivan A., Kostyleva Maria N., Zhelenina Ludmila A., Klimko Nikolay N., Borzova Yuliya V., Vasilyeva Natalya V., Bogomolova Tatyana S., Speranskaya Anna A., Baranova Irina A., Furman Evgeny G., Shadrina Vera V., Shchapov Nikolay F., Petrova Nika V., Pashkov Ivan V., Tsirulnikova Olga M., Polyakov Dmitriy P., Svistushkin Valeriy M., Sin’kov Eduard V., Chernykh Vyacheslav B., Repina Svetlana A., Blagovidov Dmitriy A., Kostinov Mikhail P., Kondratenko Olga V., Lyamin Artem V., Polikarpova Svetlana V., Polyakov Alexander V., Adyan Tagui A., Goldshtein Dmitry V., Bukharova Tatiana B., Efremova Anna S., Ovsyankina Elena S., Panova Ludmila V., Cherkashina Irina V. Modern Approaches in Management of Children with Cystic Fibrosis. Pediatricheskaya farmakologiya — Pediatric pharmacology. 2022;19(2):153-195. (In Russ). doi: https://doi.org/10.15690/pf.v19i2.2417
о)
vH
<N CM
о
CM <5
о -1 о
о <
s
ее. <
X Q.
О
ВС
о ш Q.
155
ОПРЕДЕЛЕНИЕ
Кистозный фиброз (муковисцидоз, МВ) — аутосом-но-рецессивное моногенное наследственное заболевание, характеризующееся поражением всех экзокринных желез, а также жизненно важных органов и систем [1, 2].
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Ген CFTR (МВТР — трансмембранный регулятор проводимости муковисцидоза) был идентифицирован в 1989 г. Ген расположен в середине длинного плеча 7-й аутосомы, содержит 27 экзонов и охватывает 250 000 пар нуклеоти-дов. Он контролирует структуру и функцию одноименного белка. Последние исследования показали, что МВТР является собственно хлоридным каналом.
Белок МВТР локализуется в апикальной части мембраны эпителиальных клеток, выстилающих выводные протоки желез внешней секреции (потовых, слюнных, желез в бронхах, поджелудочной железе, кишечнике, урогенитальном тракте), он регулирует транспорт электролитов (главным образом хлора) между этими клетками и межклеточной жидкостью. В базе HGMD (The Human Gene Mutation Database; https:// my.qiagendigitalinsights.com/bbp/view/hgmd/pro/all. php) описано около 2000 мутаций гена CFTR, ответственных за развитие симптомов МВ. По состоянию на 31 июля 2020 г. на вебсайте международного проекта CFTR2 (https://CFTR2.org) представлено 360 патогенных вариантов нуклеотидной последовательности гена CFTR. Они препятствуют синтезу белка МВТР, его транспорту к апикальной мембране клетки или нарушают его функцию в качестве канала анионов хлора. В зависимости от влияния на функцию белка МВТР все
варианты нуклеотидной последовательности гена CFTR подразделяют на 7 основных классов [3, 4].
Известно, что один и тот же вариант может вызвать несколько видов нарушения структуры или функции белка, и не для всех вариантов нуклеотидной последовательности гена CFTR определен класс.
Согласно данным национального регистра, наиболее часто встречаются следующие мутации: F508del (53,14%), СFTRdele2,3 (6,18%), Е92К (3,11%), 3849+10кЬС>Т (2,29%), 2143delT (2,05%), 2184^А (1,88%), 1677delTA (1,76%), N1303K (1,69%), W1282X (1,63%), L138ins (1,46%), G542X (1,43%) [5]. Мутации гена CFTR нарушают не только транспорт, но и секрецию ионов хлора. При затруднении их прохождения через клеточную мембрану увеличивается реабсорбция натрия железистыми клетками, нарушается электрический потенциал просвета, что вызывает изменение электролитного состава и дегидратацию секрета желез внешней секреции. В результате выделяемый секрет становится чрезмерно густым и вязким. При этом страдают легкие, желудочно-кишечный тракт, печень, поджелудочная железа, мочеполовая система [1, 6].
Прогрессирование легочной и сердечной недостаточности является наиболее частой причиной смерти пациентов (95%).
Спектр микроорганизмов, связанных с инфекциями дыхательных путей у пациентов с МВ, продолжает расширяться, и исследования микробиома легких у данной категории больных демонстрируют сложный синергизм между культивируемыми и некультивируемыми микроорганизмами. Микробиологическая диагностика у пациентов с МВ имеет ряд особенностей, которые необходимо
от
vH
см см о см
о §
< s
Q.
<
е
к <
ас о ш х s
Q.
I— <
S
Ч ш
V)
z о
< a
о о ш СЕ
-1 <
О
< ч
о ас ш Q. ш S
о ш 3″
ас
учитывать при организации работы с данной категорией больных.
Чаще всего в отделяемом нижних дыхательных путей у пациентов с МВ выявляются Staphylococcus aureus, Pseudomonas aeruginosa, Burkholderia cepacia complex, Stenotrophomonas maltophilia, Achromobacter spp. Более типичные респираторные патогены, такие как Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis, также могут играть важную роль в развитии бронхолегочного процесса. У пациентов с МВ может встречаться хроническая колонизация микроорганизмами семейства Enterobacteria^s.
Имеются наблюдения выделения из нижних дыхательных путей пациентов с МВ неферментирующих грам-отрицательных бактерий (НГОБ) — Burkholderia gladioli, Inquilinus spp., Ralstonia spp., Cupriavidus spp., Pandoraea spp. Данные виды являются близкородственными, имеют генетическое сходство с бактериями рода Burkholderia. Они редко выделяются у пациентов с МВ, однако описаны случаи выделения их при хронической инфекции. Нет достаточного количества исследований, указывающих на возможность передачи штаммов от пациента пациенту.
Другие микроорганизмы, имеющие этиологическое значение при МВ: нетуберкулезные микобак-терии (НТМБ) — Mycobacterium abscessus complex (MABSC), Mycobacterium avium complex (MAC) и другие микобактерии, грибы — Aspergillus spp., Scedosporium spp., Trichosporon spp., вирусы — Respiratory syncytial virus, Influenza virus, Adenovirus, Rhinovirus, Coronavirus, Parainfluenza virus, Human metapneumovirus. Возрастает выявляемость НТМБ у пациентов старшего возраста. MABSC и MAC являются наиболее часто встречающимися [2].
Особенностями хронической инфекции легких у больных муковисцидозом является то, что данная инфекция в 2/3 случаев вызывается не монокультурой, а ассоциацией микроорганизмов. За рубежом эти показатели в два раз ниже — в 35% исследуемых образцов бронхо-альвеолярного лаважа (БАЛ) выявляют рост двух микроорганизмов и в 10% случаев ассоциации представлены тремя и более видами микроорганизмов. Наиболее часто встречающейся ассоциацией является сочетание P. aeruginosa и S. aureus [7, 8]. В составе микробных ассоциаций выделяли одновременно мукоидный и нему-коидный фенотипы P. aeruginosa. Кроме P. aeruginosa часто выделяли других представителей НГОБ — Burkholderia cepacia complex, Achromobacter spp., S. maltophilia, A. baumannii и др. [9].
При анализе данных микробиологических исследований установлено, что микроорганизмы были выделены у 61,9% детей в возрасте до 1 года, у 92,9% — в возрасте 1-4 лет, у 93,8% — в возрасте 5-7 лет и в возрасте 8-14 и 15-18 — у 100% детей. Это свидетельствует о том, что колонизация легких больных муко-висцидозом микроорганизмами начинается фактически с первых дней после рождения и достигает максимума уже к 5 годам жизни. В возрасте до 1 года более чем у 1/3 пациентов с муковисцидозом нижние дыхательные пути еще не обсеменены микроорганизмами, в возрасте 1-4 лет нижние дыхательные пути обсеменены почти у всех больных (92,9%), а к 8-18 годам — у 100%. Хроническую стафилококковую, синегнойную или смешанную инфекцию диагностируют у 25% детей уже в возрасте 1-4 лет, в возрасте 5-7 лет — у 50%, в возрасте 8-14 лет — у 65% и к 18 годам — у 80% больных муко-висцидозом [7].
При оценке микробиологического профиля респираторного тракта выявлен рост частоты высева грамотри-цательной флоры с увеличением возраста больных.
Наибольшая частота инфицирования S. aureus отмечена в возрастной группе 12-16 лет, где она составила 64,5%, P. aeruginosa — в группе 24-28 лет с частотой 55,0%, в этой же возрастной группе максимальное инфицирование Burkholderia cepacia complex, которое составило 22,6%, S. maltophilia в 16-20 лет — 5,6%. Achromobacter spp. достигает своего пика у пациентов старше 36 лет, где ее частота составила 14,3%. Метициллин-резистентный стафилококк (MRSA) имеет два пика максимальной частоты: в 20-24 года и 32-36 лет — 11,4 и 10,5% соответственно.
Частота хронического инфицирования дыхательных путей S. aureus составляет 56,0%, P. aeruginosa — 32,1%, Bcc — 6,6%, MRSA — 6,4%, Achromobacter spp. — 3,9%, S. maltophilia — 3,4%. В 7,5% случаев дыхательные пути больных хронически инфицированы другой грамотрица-тельной флорой, среди которой наиболее часто встречающиеся представители семейства Enterobacteriales (Klebsiella spp.: Klebsiella pneumoniae, Klebsiella oxytoca, Raoultella (Klebsiella) ornithinolytica; Escherichia coli, Serratia spp., Proteus spp. и др.), а также представители НГОБ (Pseudomonas spp.: P. stutzeri, P. oryzihabitans, P. monteilii, P. putida, P. koreensis, P. fluorescens, P. fragi, P. luteola; Acinetobacter spp.: A. baumannii, A. lwoffii, A. haemolyticus, A. calcoaceticus, A. junii, A. pittii, A. anitratus). У ряда пациентов встречается микст-инфицирование респираторного тракта различной не-псевдомонадной грамотрицательной флорой. Доля пациентов, инфицированных НТМБ, составляет 0,9%.
Другой особенностью микрофлоры при хронической инфекции легких у больных муковисцидозом является различная резистентность к антибиотикам представителей одного и того же вида персистирующего в них возбудителя. Это обусловлено как фенотипической гетерогенностью, которая является результатом адаптации микроорганизма при персистенции под воздействием антибиотикотерапии и/или иммунной системы, так и вариативностью, связанной с генетическими изменениями, происходящими в бактериях при персистенции, — приобретением или потерей мобильных генетических элементов, имеющих в своем составе гены резистентности к антибиотикам. Данная особенность имеет как клиническое, так и эпидемиологическое значение и должна рассматриваться как фактор, ограничивающий эффективность антибиотикотерапии, способствующий выживанию бактерий и формированию хронической инфекции. Этот факт является важным для клиницистов, еще раз подтверждает необходимость исследования антибиоти-кочувствительности выделенных изолятов при назначении антибиотикотерапии и указывает на необходимость применения комбинированной антибиотикотерапии при лечении хронической инфекции у больных МВ [10, 11].
Развитию аспергиллеза легких у пациентов с МВ способствуют нарушение мукоцилиарного клиренса и иммунного ответа, а также продолжительная антибактериальная и глюкокортикостероидная терапия.
Колонизация дыхательных путей у пациентов с МВ Aspergillus spp. — выявление грибов рода Aspergillus в > 50% образцов мокроты или в течение > 6 мес в год, отсутствие инструментальных признаков ухудшения легочной функции, а также отсутствие клинических признаков обострения МВ [12, 13].
В настоящее время нет убедительных данных о негативном влиянии колонизации Aspergillus spp. дыхатель-
156
ных путей на функцию дыхания пациентов с МВ [12-14]. Колонизация дыхательных путей пациентов с МВ грибами Aspergillus spp. не является показанием для назначения противогрибковых лекарственных средств (ЛС).
Наиболее распространенным осложнением, обусловленным Aspergillus spp., у пациентов с МВ является аллергический бронхолегочный аспергиллез (АБЛА). АБЛА характеризуется развитием реакции гиперчувствительности I типа при колонизации дыхательных путей Aspergillus spp., которая без лечения приводит к развитию фиброза легких и необратимой дыхательной недостаточности. У пациентов с МВ инвазивный аспергиллез встречается редко, чаще как осложнение после трансплантации легких (ТЛ) на фоне иммуносупрессив-ной терапии.
Инвазивного поражения тканей легких при АБЛА обычно не происходит, хотя сочетание с хроническим аспергиллезом легких (ХАЛ) выявляют у 10% пациентов. Основные возбудители АБЛА — A. fumigatus и A. niger [15, 16].
ХАЛ представляет собой медленно прогрессирующий деструктивный процесс в легких, обусловленный грибами Aspergillus spp., в ранее существовавших бронхоэкта-зах, полостях и пр. Описана генетическая предрасположенность к этому заболеванию, связанная с дефицитом или дисфункцией Т1п17-лимфоцитов [17, 18].
Многие пациенты с МВ до развития ХАЛ получали ингаляционные или низкие дозы кортикостероидов для системного применения. Кроме того, развитию ХАЛ способствует повышенное содержание конидий Aspergillus spp. в окружающей среде, в том числе в жилых и производственных помещениях. Основные возбудители ХАЛ — A. fumigatus, A. flavus и A. niger. Без лечения ХАЛ приводит к ухудшению качества жизни пациентов с МВ и увеличению летальности.
ЭПИДЕМИОЛОГИЯ
Частота МВ колеблется среди представителей европеоидов от 1 : 600 до 1 : 17 000 новорожденных. В Российской Федерации частота МВ составляет, по данным ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова», 1 : 9000 новорожденных [1, 5].
КЛАССИФИКАЦИЯ
Классификация, принятая ВОЗ, Международной ассоциацией муковисцидоза, Европейской ассоциацией муковисцидоза [1-5, 7-9]:
• классический муковисцидоз с панкреатической недостаточностью (смешанная или легочно-кишечная форма заболевания), E84.8;
• классический муковисцидоз с ненарушенной функцией поджелудочной железы (преимущественно легочная форма заболевания), E84.0;
• неопределенный диагноз при положительном неона-тальном скрининге на муковисцидоз E84.9;
• заболевания, ассоциированные с геном CFTR (МВТР):
— изолированная обструктивная азооспермия;
— хронический панкреатит;
— диссеминированные бронхоэктазы.
В клинической практике используется классификация, представленная в табл. 1 [2].
В будущем, по мере углубления знаний, эта классификация также потребует пересмотра.
КЛИНИЧЕСКАЯ КАРТИНА
Муковисцидоз может быть заподозрен по следующим признакам.
Наличие внутриутробно по данным УЗИ гиперэхоген-ного кишечника, при рождении — мекониевый илеус.
В периоде новорожденности — затяжная неонаталь-ная желтуха, витамин-К-зависимые геморрагические состояния, мекониевый илеус.
• Мекониевый илеус — это синдром, характеризующийся проявлением низкой обтурационной кишечной непроходимости без перерыва просвета кишечной трубки. Данное заболевание при муковисцидозе обусловлено механическими причинами — облитерацией просвета плотной мекониальной пробкой.
В мировой общепринятой практике считается, что в 90-95% случаев этиологией мекониевого илеуса является муковисцидоз [19]. Мекониевый илеус диагностируется у 15-20% новорожденных с муковисцидозом. В европейских странах пациенты с мекониевым илеусом подлежат обязательному обследованию на муковисцидоз [1, 20]. По данным регистра пациентов с муковисцидозом Российской Федерации, доля больных муковисцидозом, перенесших мекониевый илеус при рождении, в группе детей первого года жизни составила 22,1%, что отражает его реальную распространенность [21].
• Задержка прибавки массы тела, частый, обильный, с примесью жира и зловонным запахом стул, повышенный аппетит, в возрасте после года эпизоды выпадения прямой кишки, эпизоды задержки стула с клиническими проявлениями частичной или полной кишечной непроходимости (синдром дистальной интестинальной обструкции — СДИО).
• С раннего возраста возможны навязчивый коклюшеподобный кашель, часто рецидивирующие респираторные инфекции с явлениями бронхитов, пневмоний, могут отмечаться свистящее дыхание и/или «оральная крепитация», одышка, кашель с выделением гнойной мокроты, в том числе вне периодов обострения, влажные разнокалиберные хрипы разной степени локализации в зависимости от распространенности процесса.
• В раннем возрасте отмечаются эпизоды проявлений синдрома потери солей (гипокалиемия, гипона-триемия, гипохлоремия) — потеря массы тела, срыги-вания, рвота, вялость, отказ от еды. Вследствие потери электролитов с потовой жидкостью, особенно в условиях усиленного потоотделения (лихорадка, жаркая погода, пребывание в сауне, физические нагрузки), через желудочно-кишечный тракт, недостаточного поступления солей с пищей и водой (особенно у детей первого года жизни при отсутствии дотации соли) может развиваться псевдо-Барттер-синдром (ПБС).
Синдром манифестирует преимущественно на первом году жизни у пациентов с муковисцидозом и является жизнеугрожающим состоянием, поэтому рассматривается с точки зрения тяжелого и опасного осложнения МВ, требующего в определенных случаях экстренного вмешательства. ПБС может быть первым симптомом МВ. Клинические проявления: от задержки физического развития до острого состояния, протекающего с отказом от еды и питья, вялостью, срыгиваниями и рвотой, признаками дегидратации. Часто ошибочно принимается за острую кишечную инфекцию, патологию почек, адре-ногенитальный синдром [2]. Также присутствуют такие симптомы, как «соленый» привкус» кожных покровов, деформации грудной клетки, формирование признаков хронической гипоксии в виде деформации концевых фаланг и ногтей по типу «барабанных палочек» и «часовых стекол», признаки хронического гайморита, полипоз-ного синусита.
о
vH
<N CM О CM
«5 О -1 О
О <
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ш
ее <
х
Q.
О ее
о ш Q.
О
vH
CM CM О CNI
О §
< s
Q.
<
в
К <
2£ О ш X S Q.
I— <
S
Ч ш
157
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
CLINICAL RECOMMENDATIONS
Таблица 1. Клиническая классификация муковисцидоза (предложена на основе Рабочей классификации муковисцидоза (Рачинский С.В., Капранов Н.И., 2000), рекомендаций ВОЗ и Европейской ассоциации муковисцидоза; опубликована — https://mukoviscidoz.org/doc/konsensus/CF_consensus_2017.pdf)
Table 1. Clinical classification of cystic fibrosis (based on the Working Classification of Cystic Fibrosis (Rachinsky S.V., Kapranov N.I., 2000), WHO and European Cystic Fibrosis Association guidelines; published on https://mukoviscidoz.org/doc/konsensus/CF_consensus_2017.pdf)
Форма Характеристика бронхолегочных изменений Проявления Осложнения
Клиническая Фаза и активность процесса Степень дыхательной недостаточности**
Классический муковисцидоз* Смешанная или легочно-кишечная форма заболевания (муковисцидоз с панкреатической недостаточностью — Е84.8) Легочная форма заболевания (муковисцидоз с ненарушенной функцией поджелудочной железы — Е84.0) Хронический обструктивный бронхит Бронхоэктазы (локализованные и диссеминированные) с указанием локализации Пневмофиброз Вне обострения Обострение Тип обострения: обострение хронического бронхита; пневмония (с указанием локализации); смешанный тип 1 II III Хронический (гнойный, П0ЛИП03Н0-ГН0ЙНЫЙ) риносинусит Псевдо-Барттер-синдром Азооспермия Рецидивирующий панкреатит Абсцессы, ателектазы, пневмо-/пиопневмоторакс, кровохарканье, кровотечение (легочное, желудочное), аллергический бронхолегочный аспергиллез, легочная гипертензия, полипоз носа Мекониевый илеус, эквиваленты мекониевого илеуса, выпадение прямой кишки Цирроз печени (без и с портальной гипертензией) Желчнокаменная болезнь Отставание в физическом развитии Белково-энергетическая недостаточность Нарушение толерантности к углеводам Муковисцидоз-ассоциированный сахарный диабет Снижение минеральной плотности костной ткани Вторичный остеопороз Амилоидоз почек Сиалоаденит Витамин-К-дефицитные состояния (геморрагическая болезнь)
Генотип (мутации гена СР77? (МВТР)) Указать согласно базе данных CFTR2.org и Консенсусу по клиническим эффектам генетических вариантов (база данных SeqDB http:// seqdb.med-gen.ru)
Микробиологический статус (указывается дата первичного высева (выявления) микробного патогена/патогенов и, если есть, последнего) Стафилококковая инфекция. Синегнойная инфекция. Инфекция, вызванная В. cepacia complex Другие инфекции Микробные ассоциации
Другие формы: неопределенный диагноз при положительном неонатальном скрининге на муковисцидоз*** — Е84.9; заболевания, ассоциированные с геном СР77? (МВТР):**** • изолированная обструктивная азооспермия; • хронический панкреатит; диссеминированные бронхоэктазы
Примечание. <*> — форма из классификации MB Рачинского С.В., Капранова Н.И. (2000); <**> — степень дыхательной недостаточности устанавливается согласно «Классификации дыхательной недостаточности» (Национальное руководство по болезням органов дыхания, 2010). Степень тяжести заболевания рекомендуется не указывать исходя из первично-хронического течения, полиорганного поражения и прогредиентного течения; <***> — положительный неонатальный скрининг или неонатальная гипертрипсиногенемия не являются диагнозом и в классификацию не включены, пациентам с неонатальной гипертрипсиногенемией рекомендуется в 1 год провести повторно потовую пробу. Используется новый диагноз — «неопределенный диагноз при положительном неонатальном скрининге на муковисцидоз»; <****> — код МКБ рекомендуется использовать из соответствующих разделов. Тяжесть состояния устанавливается согласно Приложению к приказу Министерства труда и социальной защиты Российской Федерации «О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы» (с 01 января 2019 г.).
Note. <*> — the form from the classification of cystic fibrosis by Rachinsky S.V., Kapranova N.I. (2000); <**> — the degree of respiratory failure is established according to the «Respiratory Failure Classification» (National Guidelines for Respiratory Diseases, 2010). It is recommended not to indicate the disease severity based on the primary chronic course, multisystemic lesion and progressive course; <***> — positive neonatal screening or neonatal hypertrypsinogenemia is not a diagnosis and is not included in the classification, patients with neonatal hypertrypsinogenemia are recommended to repeat sweat test at the age of 1 year. The new diagnosis is used — «uncertain diagnosis with positive neonatal screening for cystic fibrosis»; <****> — it is recommended to use the ICD code from the corresponding sections. The disease severity is established according to the Appendix to the Order of the Ministry of Labor and Social Protection of Russian Federation «On Classifications and Criteria Used in the Implementation of Medical and Social Expertise of Citizens by Federal State Institutions of Medical and Social Expertise» (from 01.01.2019).
• Муковисцидоз-ассоциированные заболевания печени (cystic fibrosis-associated liver disease — CFLD) включают в себя такое многообразие нозологий, как билиарный цирроз печени с и без синдрома вну-трипеченочной портальной гипертензии, персистирую-щее повышение уровня печеночных ферментов, фиброз, стеатоз, желчнокаменная болезнь и изолированно лишь ультразвуковые изменения паренхимы печени [22, 23].
Встречаемость муковисцидоз-ассоциированной гепатобилиарной патологии во всем мире составляет примерно 37,9%, причем 2,5% летальных исходов отмечается именно по причине декомпенсации заболеваний печени [24]. По Европейскому регистру пациентов с муко-висцидозом за 2017 г., процент пациентов с циррозом печени и портальной гипертензией в Великобритании составляет 1,51% (149 пациентов от 8344), в России же — 4,42% (136 пациентов от 2291) [5]. Цирроз печени с портальной гипертензией в Российской Федерации в 2017 г. зафиксирован у 4,5% пациентов, без портальной гипертензии — у 2,3%, цирроз печени (гипертензия неизвестна) — у 0,7% больных и поражение печени без цирроза — у 15,9%.
У 1,5% пациентов поражение печени является первым клиническим симптомом МВ; именно поэтому в диагностический алгоритм при циррозе печени неясной этиологии рекомендуется включать потовый тест для его исключения [22, 23].
Поражение печени, как и многие другие фенотипи-ческие проявления МВ, зависит не только и не столько от генетического дефекта и типа мутации CFTR, но и от действия генов-модификаторов, находящихся вне локуса CFTR, например аллеля Z гена SERPINA1 (a1-antitrypsin или a1-antiprotease) [2, 5] и аллеля A VNTR в гене eNOS4 [25], и от факторов окружающей среды, включая ятрогенные.
Клинически при формировании цирроза печени диагностируются увеличение живота за счет гепатосплено-мегалии, расширение поверхностных вен на передней брюшной стенке.
Как правило, у пациентов с сохранной функцией поджелудочной железы могут развиться рецидивирующие панкреатиты.
• С возрастом у пациентов с МВ нередко развивается и эндокринная недостаточность поджелудочной железы — муковисцидоз-зависимый сахарный диабет (МЗСД), который, как правило, протекает бессимптомно и может долгое время оставаться недиагностированным. При этом известно, что уже за 2-4 года до манифестации диабета ухудшаются показатели нутритивного статуса и дыхательной функции. Комбинация МВ и диабета оказывает негативное влияние на продолжительность жизни. Так, средняя продолжительность жизни пациентов с МЗСД ниже по сравнению с пациентами без диабета, медиана выживаемости у пациентов с МЗСД составляет 24 года по сравнению с 32 годами у пациентов с МВ, но без диабета [26].
• У большинства пациентов мужского пола снижена фертильность. В большинстве случаев фертильность женщин, больных муковисцидозом, сохранена. Однако в определенных случаях возможно бесплодие, обусловленное ановуляторным менструальным циклом и вторичной аменореей, вызванной истощением пациентки. Наиболее частой причиной снижения фертильности у больных с нормальным овуляторным циклом является изменение водного и электролитного состава цервикальной слизи в связи с большим количеством МВТР в цилиндрическом эпителии шейки матки. В результате цервикальный секрет
(отделяемое шейки матки) становится слишком вязким, что снижает способность к оплодотворению [27, 28].
• При МВ нередко встречается остеопороз, который у этих пациентов всегда носит вторичный характер. К причинам его развития у больных МВ относят хронический микробно-воспалительный процесс, дефицит витаминов D и К, низкое потребление кальция, низкую физическую активность, сахарный диабет на фоне МВ, трансплантацию органов и иммуносупрессивную терапию, гипоксию и гиперкапнию, дефицит костной массы и нарушение микроархитектоники кости вследствие недостаточного набора пика костной массы в период активного роста и избыточной костной потери у взрослых.
В некоторых работах показана взаимосвязь различных мутаций и/или их комбинаций (F508del и др.) с низкой костной массой [29, 30], большинство других авторов не отмечают данной связи.
Рекомендации по формулировке диагноза изложены в клинических рекомендациях по остеопоро-зу. Согласительная комиссия по европейскому консенсусу решила использовать термин «болезни кости при МВ» (включающий низкую минеральную плотность кости (МПК) и переломы), а не «остеопороз». Для Российской Федерации, учитывая особенности медицинского обеспечения, рекомендуется оставить диагноз «остеопороз» [31-33].
Частота остеопороза при МВ в детском и подростковом возрасте составляет от 20 до 50% и увеличивается после 18 лет жизни (50-75%) [34]. По данным российских исследователей, в детском возрасте частота снижения МПК составляет от 33 до 65,2% и остеопороза — от 7,7 до 15,6% [30, 35]. Во взрослой популяции пациентов с муковисцидозом частота низких показателей МПК составляла 43,6%, остеопороза — 8,4% [31].
• Аллергический бронхолегочный аспергиллез у пациентов с МВ протекает хронически с периодическими обострениями. Основными клиническими признаками обострения АБЛА являются неконтролируемое течение МВ, приступы удушья, кашель с мокротой, содержащей коричневые или черные включения и слизистые пробки, бронхообструктивный синдром и/или возникновение эозинофильных инфильтратов, боли в грудной клетке, рефрактерное к применению антибактериальных препаратов повышение температуры тела, а также снижение дыхательной функции. При длительном течении АБЛА развивается зависимость от кортикостерои-дов для системного применения, формируется и фиброз легких, приводящий к дыхательной недостаточности [15].
• Хронический аспергиллез легких. Продолжительность ХАЛ — > 3 мес. Наиболее частые пульмональ-ные симптомы: продуктивный кашель, одышка и кровохарканье, прогрессивное снижение легочной функции; общие: субфебрилитет, общая слабость и снижение массы тела, снижение толерантности к нагрузкам, отсутствие или неполный ответ на полноценный курс антибактериальной терапии широкого спектра действия. ХАЛ часто принимают за обострение МВ, обусловленное бактериальным возбудителем, и назначают неэффективную в этих случаях терапию антибактериальными препаратами резерва [15, 17, 18].
ХАЛ нередко диагностируют поздно, и лечение проводят неадекватно. Без лечения ХАЛ приводит к ухудшению качества жизни пациентов с МВ и увеличению летальности. Летальность при ХАЛ в первые 6 мес после постановки диагноза составляет 15-30%. Наиболее частая непосредственная причина смерти — легочное кровотечение.
от
vH
<N CM О CM
«5 О -1 О
О <
ш
ее <
х
Q.
О ее
о ш Q.
ОТ
vH
см см о см
о §
< s
Q.
<
в
К <
2£ О ш X S Q.
I— <
S
Ч ш
159
Таблица 2. Диагностические критерии, утвержденные Европейскими стандартами 2014 г. (пересмотр 2018 г.) [20, 36] и национальным консенсусом (2016) [2]
Table 2. Diagnostic criteria approved by European Standards in 2014 (revised in 2018) [20, 36] and by national consensus (2016) [2]
Положительный результат потового теста и/или
Две мутации CFTR, вызывающие МВ (согласно базе CFTR2 http://www.cftr2.org)
И
Неонатальная гипертрипсиногенемия или
Характерные клинические проявления, такие как диффузные бронхоэктазы, высев из мокроты значимой для МВ патогенной микрофлоры (особенно синегнойной палочки), экзокринная панкреатическая недостаточность, синдром потери солей, обструктивная азооспермия
V) Z
о
< о
о о ш
а _j
<
о
< ч
о se ш Q. ш s se о ш 3-
se
ДИАГНОСТИКА
Диагноз МВ подтверждается при наличии одного или более характерных фенотипических его проявлений в сочетании с доказательствами нарушения функции МВТР, такими как выявление клинически значимых мутаций гена CFTR при генотипировании или увеличение уровня хлоридов в секрете потовых желез пациента. Для решения проблем диагностики МВ были разработаны критерии, согласно которым обязательным для МВ является наличие характерного клинического синдрома плюс доказательство какого-либо нарушения функции хлорного канала одним из методов.
В настоящее время существуют несколько вариантов диагностических критериев МВ, которыми пользуются специалисты [1, 2].
Наиболее распространено использование диагностических критериев, утвержденных Европейскими стандартами и национальным консенсусом (табл. 2) [1, 20].
Диагностика обтурационной кишечной
непроходимости (в т.ч. мекониевого илеуса)
в периоде новорожденности
Кишечные проявления МВ в периоде новорожденности могут сводиться не только к формированию мекониевого илеуса. Также МВ может быть диагностирован у пациентов с внутриутробной перфорацией тонкой кишки, признаками перенесенного внутриутробного энтероколита (внутриутробное формирование спаек, перитонит) и при нарушении проходимости толстой кишки при нормальном формировании ее нервного аппарата.
Антенатальная диагностика — описанные заболевания относятся к поздним фетопатиям, поэтому возможные проявления могут быть визуализированы в III триместре. При наличии у внутриутробного ребенка по данным УЗИ признаков гиперэхогенного кишечника целесообразно направить родителей на ДНК-диагностику муко-висцидоза — поиск наиболее частых мутаций, а ребенка при рождении — как входящего в группу риска по меко-ниевому илеусу и кишечной непроходимости.
После рождения — диагностика кишечной непроходимости и осложнений в соответствии с клинической
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
практикой пациентов с мекониевым илеусом, обязательная консультация специалиста по муковисцидозу, проведение потовой пробы, ДНК-диагностики. При невозможности проведения потовой пробы — обязательная ДНК-диагностика [20].
Диагностика псевдо-Барттер-синдрома у пациентов с муковисцидозом
ПБС диагностируется на основании наличия у ребенка установленного диагноза «муковисцидоз», характерной клинической картины и биохимических изменений: гипонатриемии, гипокалиемии, гипохлоремии, метаболического алкалоза [2].
Диагностика аспергиллеза при муковисцидозе
Диагностика аспергиллеза при МВ сложна и нередко запаздывает, поскольку многие диагностические критерии пересекаются с типичными проявлениями основного заболевания. Для постановки диагноза необходимо комплексное специализированное обследование (табл. 3, 4).
Диагностика цирроза печени у пациентов с муковисцидозом:
• повышение аланинаминотрансферазы, аспартат-аминотрансферазы и гамма-глутамилтрансферазы в течение более чем 6 мес при исключении других причин [40, 41] — следует учесть, что данные показатели имеют невысокую специфичность у пациентов с кистозным фиброзом (муковисцидозом);
• пальпаторное увеличение размеров печени и селезенки [41];
• удлинение протромбинового (тромбопластинового) времени в крови или в плазме [41, 42];
• характерная УЗИ-картина (неоднородная эхогенность паренхимы, тяжистость, закругление печеночного края, прорастание соединительной ткани в ворота печени), выявление избыточной свободной жидкости в брюшной полости как признак асцита [43-45];
• обеднение венозного кровотока и формирование признаков портальной гипертензии по данным УЗДГ;
Таблица 3. Диагностические критерии АБЛА согласно консенсусу Фонда муковисцидоза (2003) [37]
Table 3. Diagnostic criteria of allergic bronchopulmonary aspergillosis according to Cystic Fibrosis Foundation consensus (2003) [37]
160
• ухудшение течения муковисцидоза: кашель с мокротой, содержащей слизистые пробки, одышка, приступы удушья, снижение ЖЕЛ (жизненная емкость легких), ОФВ1 (объем форсированного выдоха за 1 с), острое или персистирующее ухудшение состояния, не связанное с другими причинами;
• уровень общего IgE > 500 ед/мл;
• наличие специфических Aspergillus IgE или положительная кожная проба с антигеном Aspergillus;
• наличие специфических Aspergillus IgG;
• изменения на рентгенограмме или КТ, рефрактерные к «стандартной» терапии [12, 38].
Таблица 4. Диагностические критерии ХАЛ согласно руководству по диагностике и лечению хронического аспергиллеза (2016) [2] Table 4. Diagnostic criteria of chronic aspergillosis according to guidelines for its diagnosis and treatment (2016) [2]
Ухудшение течения МВ, отсутствие или неполный ответ на 2-4-недельный курс антибактериальной терапии широкого спектра действия
И
Наличие КТ-признаков хронического аспергиллеза легких Наличие специфического IgG к Aspergillus в сыворотке крови
Выявление мицелия Aspergillus в окрашенных мазках и/или в биопсийном материале или выделение Aspergillus spp. при посеве биопсийного материала, БАЛ, мокроты [39]
Примечание. МВ — муковисцидоз; КТ — компьютерная томография; БАЛ — бронхоальвеолярный лаваж. Note. CF (МВ) — cystic fibrosis; CT (КТ) — computed tomography; BAL (БАЛ) — bronchoalveolar lavage.
• признаки формирования фиброза/цирроза по данным непрямой эластометрии печени с оценкой степени фиброза по морфологической классификации METAVIR: 5 стадий фиброза — от 0 до 4, где F0 — отсутствие фиброза, F1 — портальный фиброз (звездчатое расширение портальных трактов) без септ, F2 — портальный фиброз и единичные септы, F3 — портальный фиброз и множественные септы без цирроза печени, F4 — цирроз печени [46];
• выявление варикозно расширенных вен пищевода (ВРВП) и желудка при проведении диагностической фиброэзофагогастродуоденоскопии (ФЭГДС);
• тяжесть и степень компенсации МВ-ассоцииро-ванного цирроза печени в клинической практике проводится по классификации Чайлда — Пью (Child -Pugh) [47, 48].
Диагностические критерии муковисцидоз-зависимого сахарного диабета
Диагностические критерии МЗСД: гипергликемия натощак (уровень глюкозы плазмы натощак > 7,0 ммоль/л), или «диабетический» уровень глюкозы крови в ходе стандартного глюкозотолерантного теста (при уровне глюкозы плазмы натощак < 7,0 ммоль/л и глюкозы плазмы через 2 ч в ходе орального глюкозотолерантного теста > 11,1 ммоль/л), или постпрандиальная гипергликемия, определяемая непрерывным мониторингом глюкозы при отсутствии симптомов [49].
Диагностика остеопороза у пациентов с муковсисцидозом
Диагностика остеопороза у пациентов с МВ включает оценку клинической картины, рентгеноденситометрию, лабораторные методы исследования.
Диагноз остеопороза при МВ ставится при наличии:
• 1 и более компрессионных переломов тел позвонков, которые не связаны с высокоэнергетической травмой или локальным заболеванием, приводящим к изменению МПК. При наличии компрессионных переломов позвонков для постановки диагноза остео-
пороза не требуется, чтобы г-критерий был < -2 SD или
• клинически значимого анамнеза переломов и МПК по г-критерию < -2 SD (стандартные отклонения). Клинически значимый анамнез переломов — это:
— 2 и более перелома длинных костей в возрасте до 10 лет;
— 3 и более перелома длинных костей в любом возрасте до 19 лет [50].
Физикальное обследование
Ребенку с подозрением на МВ следует провести полное физикальное обследование, так как при этом заболевании имеются мультиорганные проявления (см. раздел «Клиническая картина»).
Лабораторные диагностические исследования Тесты для установления диагноза «муковисцидоз»
Рекомендуется проведение скрининга новорожденных на муковисцидоз (неонатальный скрининг, комплекс исследований для диагностики муковисцидоза), так как раннее выявление и своевременное начало терапии позволяют предупредить развитие тяжелых осложнений, улучшают показатели физического развития, замедляют темпы снижения функции легких, снижают потребность в госпитализации [1, 2, 20, 25, 51-54] (УУР — В, УДД — 2). Проводится в Российской Федерации у всех новорожденных.
Протокол скрининга включает три обязательных этапа: ИРТ1, ИРТ2, потовая проба (табл. 5). На первом этапе в крови новорожденных (4-5-й день у доношенных, 7-8-й день у недоношенных) определяется уровень ИРТ. Взятие образцов крови осуществляется в соответствии с приказом № 185 от 22 марта 2006 г. «О массовом обследовании новорожденных детей на наследственные заболевания». При превышении порогового уровня ИРТ проводится ретест на 21-28-й день жизни. При положительном ретесте проводится потовая проба. Позитивная потовая проба расценивается как положительный результат скрининга, и пациента направляют
от
vH
<N CM О CM
«5 О -1 О
О <
ш
ее <
х
Q.
О ее
о ш Q.
Таблица 5. Этапы неонатального скрининга в Российской Федерации (приказ № 185 от 22 марта 2006 г. «О массовом обследовании новорожденных детей на наследственные заболевания»)
Table 5. Stages of neonatal screening in Russian Federation (Order №185, dated March 22, 2006 «On screening of newborns on hereditary diseases»)
от
vH
CM CM О CM
О
S <
s
Q.
<
e
к <
ae о ш X
s
Q.
I— <
s Ч ш
161
I этап На 4-5-й день у доношенного (на 7-8-й у недоношенного) новорожденного — определение иммунореактивного трипсина (ИРТ) в высушенной капле крови
II этап При положительном результате (cut-off > 99,5 центиля) на 21-28-й день — повторный тест на ИРТ
III этап При положительном результате — потовая проба
IV этап При пограничном результате потовой пробы — дополнительные методы обследования, включая ДНК-диагностику, определение разности кишечных потенциалов и др.
V)
г о
< а
о о ш а
_1 <
о
< ч
о 2£ ш а. ш
И
2£ О ш 3″
2£
в центр муковисцидоза (либо профильное отделение). Дети с мекониевым илеусом независимо от уровня ИРТ нуждаются в проведении потовой пробы из-за возможного у них ложноотрицательного результата [2, 20].
Оптимальные сроки установки диагноза и начала наблюдения пациента, выявленного по программе нео-натального скрининга, — первые 2 мес жизни [2, 20].
Обследование и наблюдение новорожденных по программе массового скрининга должно проводиться с соблюдением принципов профилактики перекрестного и внутрибольничного инфицирования — оптимально амбулаторно или в условиях дневного стационара [2].
Для диагностики муковисцидоза рекомендуется проведение потовой пробы. Для установления диагноза необходимо получить как минимум 2 положительных результата. Потовая проба может быть проведена ребенку в возрасте 48 ч с массой тела не менее 2 кг [1, 2, 20, 55, 56] (УУР — В, УДД — 2). Потовая проба является «золотым стандартом» диагностики муковисцидоза, проводится как минимум дважды.
В Российской Федерации используются две методики потового теста.
1. Классический прямой метод определения электролитного состава пота (хлора или натрия) методом пило-карпинового электрофореза по Гибсону и Куку (1959 г.). Норма — до 30 ммоль/л, пограничные значения — 30-59 ммоль/л, положительный результат — 60 ммоль/л и выше (при навеске пота не менее 100 мг) [1, 2, 6, 36]. Показатели хлоридов выше 150 ммоль/л должны быть подвергнуты сомнению.
2. Потовая проба путем определения проводимости пота с помощью специальных потовых анализаторов коррелирует с определением уровня хлоридов, позволяет получить адекватный результат при количестве пота в образце 3-10 мкл. Получила широкое распространение при внедрении массового скрининга новорожденных.
При определении проводимости положительным результатом для муковисцидоза считается показатель выше 80 ммоль/л; пограничным значением — 50-80 ммоль/л; нормальным — до 50 ммоль/л. Показатели проводимости выше 170 ммоль/л должны быть подвергнуты сомнению.
Время сбора пота не должно превышать 30 мин, минимально допустимое количество пота — 75-100 мг (15 мкл в коллекторе Мас1^ий), скорость потоотделения должна быть не менее 1 г/м2/мин [20]. Обязательным является предварительное тщательное очищение кожи пациента [2]. Особого внимания требует подготовка кожи у пациентов, длительно находящихся в стационаре. Возможные причины пограничных результатов потовой пробы:
• индивидуальные особенности у людей без муковисцидоза, особенно у взрослых;
• неправильная подготовка к пробе;
• носительство «мягких» мутаций при муковисцидозе [20].
Рекомендации:
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
• использование разных методов определения хлоридов пота, повторные исследования;
• расширенный ДНК-анализ (секвенирование гена);
• расширенное клинико-лабораторное и инструментальное обследование (копрологическое исследование и определение активности панкреатической эластазы-1 в кале, электролиты в биохимическом общетерапевтическом анализе крови, посев мокроты / мазок с задней стенки глотки, рентгенография органов грудной клетки, пазух носа, спермограмма);
• наблюдение в центре муковисцидоза до окончательного принятия решения о диагнозе — не снимаются с учета, пока диагноз не будет исключен;
• метод определения разности назальных потенциалов или измерение электрического тока в биоптате кишки, отражающие нарушение функции хлорного канала.
В качестве дополнительного теста пациентам с подозрением на муковисцидоз, особенно в сомнительных случаях — при пограничных значениях потового теста, при невыраженной симптоматике и/или при неполных классических проявлениях болезни, может быть рекомендовано проведение исследования разности кишечных потенциалов [1, 2, 6, 36, 57].
Молекулярно-генетическое исследование
Рекомендовано проведение молекулярно-генетиче-ского исследования для идентификации мутаций гена CFTR по показаниям:
• новорожденным с положительным ИРТ и положительными или пограничными значениями потовой пробы, мекониевым илеусом;
• людям с пограничными значениями потовой пробы (см. раздел «Диагностика муковисцидоза»);
• пациентам с клиническими проявлениями классического или моносимптомного МВ;
• при CFTR-ассоциированных заболеваниях (панкреатит, врожденное двустороннее отсутствие семявыно-сящего протока / обструктивная азооспермия);
• родственникам пациентов с МВ (для определения статуса носительства по желанию);
• женщинам после рождения первого ребенка с муко-висцидозом, а также во время последующих беременностей при наличии ребенка с муковисцидозом;
• внутриутробному ребенку на 10-12-й нед при подозрении на МВ (при наличии сибса с МВ) или обнаружении гиперэхогенного кишечника при УЗ-обследовании;
• донорам гамет и эмбрионов в программах ЭКО (ЭКО-ИКСИ), внутриматочной инсеминации;
• супружеским парам с высоким генетическим риском МВ, желающим пройти ЭКО, — преимплантационное генетическое тестирование (ПГТ) на МВ для предотвращения рождения ребенка с МВ (при отсутствии противопоказаний и ограничений) [2, 20, 58] (УУР — ^ УДД — 5).
Клиническую значимость обнаруженных генетических вариантов следует устанавливать с учетом рекомендаций Консенсуса [2], постоянно обновляемых баз данных [59].
Стратегия молекулярно-генетической диагностики МВ включает несколько этапов.
1. На первом этапе проводится поиск вариантов, наиболее частых в популяции, к которой принадлежит обследуемый [2].
2. На втором этапе проводят расширенный поиск более редких вариантов, используя секвенирование по Сэнгеру или высокопроизводительное секвениро-вание генома (MPS/NGS). Анализ включает исследование всей кодирующей последовательности гена CFTR (27 экзонов), областей экзон-интронных соединений, 5′-и 3′-некодирующих областей (до 200-300 нуклеотидов), а также, желательно, глубоких интронных областей, где расположены варианты с доказанной патогенностью.
3. Третий этап. Обычными сканирующими методами, в том числе секвенированием, можно выявить нарушения последовательности гена, незначительные по про-
162
тяженности: нуклеотидные замены, небольшие деле-ции/инсерции. Перестройки, охватывающие несколько экзонов/интронов, такими методами не выявляются. Рекомендуется использовать следующие технологии: MLPA (мультиплексную лигазную зондовую амплификацию) либо QFMP (количественную флуоресцентную мультиплексную ПЦР) [20, 54, 60].
Согласно данным Европейского консенсуса по МВ, проведение расширенного молекулярного исследования гена CFTR позволяет выявить патогенный вариант в 98%. Это может быть связано либо с тем, что использованные методы не позволили проанализировать регионы гена, где располагаются патогенные генетические варианты, либо с явлением однородительской дисомии, либо с фенокопиями МВ [20].
Прочие лабораторные исследования,
проводящиеся при диагностике и в процессе
динамического наблюдения
Всем пациентам с МВ показано проведение клинического анализа крови с целью ориентировочной оценки воспалительного процесса, контроля влияния проводимой терапии на показатели крови и в комплексной оценке нутритивного статуса [2, 61-63] (УУР — B, УДД — 3). Также рекомендовано проведение клинического анализа мочи всем пациентам с МВ при первичной диагностике и динамическом наблюдении с целью своевременного выявления поражения почек [64] (УУР — С, УДД — 5).
Определение наличия панкреатической
недостаточности
Рекомендуется проведение лабораторных тестов для определения степени панкреатической недостаточности всем пациентам с подозрением на МВ и пациентам с МВ (определение активности панкреатической эластазы-1 в кале), степени коррекции панкреатической недостаточности — копрологическое исследование с определением нейтрального жира в кале [1, 2, 20] (УУР — C, УДД — 5).
Микробиологическая диагностика
Всем пациентам с МВ (или с подозрением на МВ) показано проведение микробиологического исследования мокроты (индуцированной мокроты или трахеально-го аспирата), или, в исключительных ситуациях (для младенцев), орофарингеального мазка и/или жидкости БАЛ для идентификации патогена/патогенов и определения чувствительности выделенной микрофлоры [1, 2, 6, 20] (УУР — C, УДД — 5).
Исследование проводится при первичной диагностике и в процессе динамического наблюдения, в том числе для контроля эффективности терапии, не реже 1 раза в 3 мес, по показаниям — чаще. Также проводится контрольное исследование после курса антимикробной терапии при госпитализации или с целью оценки эффективности проведения эрадикации при первичном высеве P. aeruginosa и другой грамотрицательной анти-биотикорезистентной флоры (через 7-10 дней от начала терапии).
При хронической грамотрицательной антибиотико-резистентной флоре пациентов с МВ в период проведения эрадикационной терапии рекомендуется ежемесячно направлять на микробиологическое обследование с целью оценки эффективности элиминации возбудителей; направлять детей до 5 лет на диагностику микробной флоры, полученной с помощью глубокого мазка из зева. Для детей старше 5-6-летнего возраста и взрослых
приоритетным целесообразно считать анализ мокроты. У детей с полипозным синуситом исследование рекомендуется проводить путем получения глубокого мазка при риноскопии.
Все микроорганизмы, выделенные из дыхательных путей пациентов с МВ, должны быть идентифицированы как минимум до рода, микроорганизмы, имеющие клиническое значение, — до вида [65]. В случае выделения из образца микроорганизмов, идентификацию которых технически невозможно провести в лаборатории, необходимо сохранение культуры для ее последующей реидентификации с использованием масс-спектрометрии или молекулярно-генетических методов [66]. Определение чувствительности выделенной микрофлоры к антибактериальным препаратам и интерпретацию результатов исследования необходимо проводить в соответствии с актуальной версией рекомендаций по определению чувствительности микроорганизмов к антибактериальным препаратам или новых версий после их вступления в силу [67].
Пациентам с МВ с подозрением на микобактериоз, вызванный НТМБ, необходимо исследование образцов диагностического материала как минимум один раз в год в динамике [1, 2, 6, 20]. Показанием к исследованию диагностического материала на НТМБ служат отрицательная клиническая и/или рентгенологическая динамика при отсутствии новых патогенов, отсутствие эффекта от проводимой антибактериальной терапии. В качестве диагностического материала используют мокроту (или индуцированную мокроту), в случаях отсутствия мокроты — смыв с ротоглотки, БАЛ.
Для проверки подозрений, что пациент с МВ заражен микобактериями, в качестве диагностического материала используют мокроту или индуцированную мокроту (в исключительных случаях, при невозможности получить мокроту / индуцированную мокроту, проводят исследование трахеального аспирата, но следует помнить, что в данном случае эффективность выявления мико-бактерий очень низкая). Для исследований на наличие НТМБ не рекомендуется прибегать к трансбронхиальной биопсии и взятию орофарингеальных мазков.
Необходимо проводить исследование методом ПЦР для исключения наличия в исследуемом материале Mycobacterium tuberculosis complex.
При первичном выделении В. cepacia complex, Achromobacter spp., Ralstonia spp., Pandorea spp., Cupriavidus spp., Inquilinus spp. рекомендуется использовать масс-спектрометрию или молекулярно-генетиче-ские методы с целью диагностики наличия перечисленных микроорганизмов у пациента с МВ [66] (УУР — C, УДД — 5).
Больным МВ с подозрением на грибковые поражения легких и для контроля проводимой терапии рекомендуется проводить микологическое исследование биоматериала (мокрота, промывные воды бронхов, БАЛ, биоптаты, операционный материал) для идентификации патогена/патогенов и определения чувствительности выделенных микромицетов [17, 37, 68, 69] (УУР — С, УДД — 5).
Необходимо рассмотреть проведение лабораторных исследований для диагностики АБЛА: уровень общего иммуноглобулина Е (IgE), специфические IgE и IgG к Aspergillus fumigatus. При подозрении на ХАЛ рекомендованы те же исследования и определение галак-томаннана (метаболита Aspergillus fumigatus) в крови (определение метаболитов грибов) [1, 2, 17, 20, 37, 68, 69] (УУР — C, УДД — 5).
о
vH
<N CM О CM
«5 О -i О
О <
ш
ее <
х
Q.
О
ее
о ш Q.
О
vH
СМ СМ О CNI
О §
< s
Q.
<
в
К <
ас о ш х
S Q.
I— <
S
Ч ш
163
V)
z о
< a
о о ш а
_j <
о
< ч
о 2£ ш Q. Ш S 2£ О Ш 3″
ас
Пациентам с МВ с подозрением на АБЛА для исключения/подтверждения микогенной сенсибилизации показано проведение кожной пробы с антигеном Aspergillus (накожные исследования реакции на аллергены) [37] (УУР — С, УДД — 5).
С целью диагностики нодулярного аспергиллеза, а также исключения новообразования легких, туберкулеза рекомендовано проведение патологоанатоми-ческого исследования биопсийного (операционного) материала тканей легкого у пациентов с МВ и ХАЛ с импрегнацией серебром по Гомори — Грокотт [17, 68, 69] (УУР — С, УДД — 5).
Микробиологическое исследование отделяемого из околоносовых пазух (ОНП) показано для идентификации патогена/патогенов и определения его/их чувствительности к антимикробным препаратам при хроническом риносинусите (ХРС) на фоне муковисцидоза [70, 71] (УУР — C, УДД — 4).
Биохимическое исследование крови
Всем пациентам с МВ рекомендовано проведение биохимического анализа крови (общий белок, альбумин, определение активности аспартатаминотрансферазы, аланинаминотрансферазы, гамма-глутамилтрансфе-разы, щелочной фосфатазы, амилазы, липазы в крови, исследование уровня холестерина, триглицеридов, натрия, калия, хлоридов, общего билирубина, свободного и связанного билирубина, С-реактивного белка в крови) ежегодно, по показаниям — чаще. Исследование проводится с целью контроля состояния печени, функции поджелудочной железы, электролитного обмена и хронического воспаления согласно показаниям [2, 61] (УУР — C, УДД — 5).
Исследование кислотно-основного состояния крови, уровней натрия и калия необходимо проводить при подозрении на ПБС у пациентов с МВ и при контроле терапии ПБС [2, 42, 72] (УУР — С, УДД — 5).
Всем пациентам при первичной диагностике МВ и при наличии цирроза печени рекомендовано выполнение коагулограммы (ориентировочного исследования системы гемостаза) 1 раз в 3-6 мес с целью контроля белково-синтетической функции печени и своевременного предотвращения геморрагических осложнений [20] (УУР — C, УДД — 5).
Всем пациентам с МВ 1 раз в 6 мес с целью контроля эндокринной функции поджелудочной железы, своевременной диагностики МЗСД необходимо исследовать уровень глюкозы в крови [49, 73] (УУР — C, УДД — 5).
В качестве скрининга для своевременной диагностики МЗСД рекомендовано рассмотреть проведение орального глюкозотолерантного теста с нагрузкой глюкозой 1,75 г глюкозы/кг (не более 75 г; точки контроля — натощак, через 60 мин, через 120 мин) всем детям старше 10 лет (по показаниям — раньше) ежегодно в период клинической стабильности [49, 74, 75] (УУР — C, УДД — 5). Использование гликированного гемоглобина (HbA1c) в качестве скрининг-теста не показано в связи с недостаточной информативностью для пациентов с МВ по этим показаниям [49, 74] (УУР — C, УДД — 5).
Всем пациентам с МВ и МЗСД необходимо проведение регулярного контроля углеводного обмена (определение уровня глюкозы в крови не менее 3 раз в день) с целью самостоятельного мониторирования состояния. Измерение гликированного гемоглобина рекомендуется ежеквартально с целью коррекции инсулинотерапии у пациентов с МВ и МЗСД [49, 74, 75] (УУР — C, УДД — 5).
Для комплексной диагностики остеопороза и диагностики патологии почек пациентам с МВ показано определение уровня общего и ионизированного кальция, фосфора крови, креатинина сыворотки крови и клиренса креатинина (расчет по формуле Кокрофта — Голта), щелочной фосфатазы сыворотки крови [2] (УУР — С, УДД — 5).
У всех пациентов с МВ рекомендовано ежегодное измерение уровня 25-ОН витамина D в крови, предпочтительнее летом и зимой, с целью своевременного выявления дефицита витамина D, подбора дозы витамина D и, соответственно, профилактики остеопороза [76] (УУР — С, УДД — 5). Нормальный уровень 25(ОН^ сыворотки крови — более 30 нг/мл и менее 100 нг/мл.
Рекомендуется проводить мониторинг уровня железа сыворотки крови (ежегодно, по показаниям — чаще) с целью выявления дефицита железа и/или хронического воспаления [61] (УУР — С, УДД — 5). Кроме того, необходимо проводить мониторинг уровней жирорастворимых витаминов (А, Е, К) и витамина В12 в сыворотке крови всем пациентам с МВ по показаниям с целью своевременного выявления их недостаточности и адекватной коррекции терапии [2, 61] (УУР — С, УДД — 5).
Всем пациентам мужского пола в возрасте старше 15 лет с МВ необходимо рассмотреть вопрос о проведении спермограммы и молекулярно-генетического (анализ гена CFTR, если не был ранее выполнен) исследования с целью определения прогноза и тактики решения вопроса репродукции [77-79] (УУР — C, УДД — 4). А с целью диагностики гипогонадизма всем пациентам мужского пола в возрасте старше 15 лет с МВ необходимо определять уровень общего тестостерона и стеро-идсвязывающего глобулина в сыворотке крови [80-82] (УУР — В, УДД — 3).
Методы подбора патогенетической терапии (ивакафтор + лумакафтор)
При назначении препарата ивакафтор + лумакафтор рекомендуется иметь данные о гетерозиготном носи-тельстве обоими родителями мутации F508del (согласно инструкции). При отсутствии такой информации рекомендуется провести молекулярно-генетическую диагностику с целью выяснения гетерозиготного носительства родителями варианта F508del. Если родители (или хотя бы один из родителей) по каким-либо причинам недоступны для проведения данного исследования, то рекомендуется дополнительно провести пациенту анализ с целью исключения наличия протяженной делеции в области мутации F508del, то есть для исключения гемизиготности по данной мутации. Рекомендуется также исключить носительство варианта L467F гена CFTR ^М_000492.3:с.1399С>Т; NP_000483.3:p.(Leu467Phe)) в составе комплексного аллеля с мутацией F508del, доказанно приводящего к резистентности к терапии [83-88] (УУР — С УДД — 4).
Рекомендуется применение форсколинового теста на кишечных органоидах, полученных от пациента в результате биопсии прямой кишки, для определения показаний к таргетной терапии:
• при редких мутациях гена CFTR с целью оценки возможности проведения патогенетической терапии [89-92];
• при отсутствии эффекта (согласно инструкции) через 6 мес с начала терапии;
• всем пациентам — носителям комплексного алле-ля для выяснения чувствительности к ивакафтору и лумакафтору [93-95] (УУР — ^ УДД — 5).
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
164
Инструментальные диагностические исследования
Методы визуализации легких
Рекомендуется проведение рентгенографии и компьютерной томографии (КТ) органов грудной клетки пациентам с подозрением на МВ и пациентам с МВ с целью определения характера и объема поражения легочной ткани [1, 2, 20] (УУР — С, УДД — 5). Рентгенография может выявить такие признаки, как деформация и усиление легочного рисунка, пневмофиброз, перибронхи-альная инфильтрация, консолидация (ателектазы), брон-хоэктазы, буллы, проявления бронхиальной обструкции (локальные участки вздутия легочной ткани, увеличение ретростернального пространства, уплощение диафрагмы), а также кифоз, утолщение бронхиальных стенок, слизистые пробки. Данный метод может быть недостаточно информативен для точного описания характера изменений в легких, но имеет меньшую лучевую нагрузку. До настоящего времени в разных центрах, курирующих пациентов с МВ, в том числе зарубежных, для динамического наблюдения чаще используется рентгенография, в ряде центров — КТ [20], которая в настоящее время является основным методом диагностики изменений в легких при МВ.
В качестве уточняющего метода для снижения лучевой нагрузки при многократном контроле воспалительного процесса пациентам с МВ рекомендовано проведение магнитно-резонансной томографии (МРТ) органов грудной клетки. До 7 лет — в условиях седации, после — на свободном дыхании [96, 97] (УУР — С, УДД — 5).
Методы визуализации околоносовых пазух
Рекомендуется проведение КТ ОНП (конусно-лучевая или мультиспиральная) или МРТ ОНП при первичной оценке патологического процесса в околоносовых пазухах и при подготовке к каждому ринохирургическо-му вмешательству [98, 99] (УУР — С, УДД — 4). КТ ОНП проводится в аксиальной плоскости с реконструкцией изображения в корональной и сагиттальной проекциях. Детям не рекомендуется выполнение КТ ОНП без клинических показаний (с целью динамического наблюдения), так как это в значительной мере увеличивает суммарную лучевую нагрузку (в связи с необходимостью периодического выполнения КТ органов грудной клетки).
Абдоминальная рентгенография
Проведение абдоминальной рентгенографии рекомендовано при мекониевом илеусе и СДИО с целью диагностики непроходимости кишечника [100, 101] (УУР — С, УДД — 5). Обзорная рентгенография органов брюшной полости проводится в вертикальном положении пациента, в прямой проекции. С той же целью при СДИО может применяться КТ органов брюшной полости.
Методы диагностики остеопороза
Определение исходной МПК при проведении рент-геноденситометрии назначается детям старше 8 лет. Раньше — при наличии таких факторов риска, как:
• низкий индекс массы тела (ИМТ) — < 90% от идеального;
• активность легочного заболевания (ОФВ± < 50% должной);
• длительная (3 мес и более) терапия пероральными кортикостероидами для системного применения;
• задержка полового созревания, гипогонадизм;
• низкоэнергетические переломы в анамнезе.
Повторные исследования рекомендовано проводить детям и взрослым до 50 лет:
• приблизительно через 5 лет, если z-критерий выше
-1 SD и пациент клинически стабилен;
• каждые 2 года, если z-критерий между -1 и -2 SD;
• каждый год, если г-критерий -2 SD и ниже, или есть
низкоэнергетические переломы в анамнезе, или имеются значимые факторы риска остеопороза.
Остеоденситометрия должна быть проведена
до назначения антиостеопоротической терапии [2].
Для оценки динамики МПК на фоне лечения остео-пороза рекомендовано проводить рентгеноденситоме-трию рХА) 1 раз в 6-12 мес у детей старше 8 лет [34, 102, 103] (УУР — С, УДД — 5). Рентгеноденситометрию желательно проводить на одном и том же аппарате (денситометре костном рентгеновском) одним и тем же специалистом. Рентгенография костей скелета пациентам с МВ для диагностики остеопороза не проводится, применяется при переломах [34].
У детей и подростков с МВ рекомендуется проводить рентгеноденситометрию поясничного отдела позвоночника в передне-задней проекции (от 0 лет) и по программе «все тело» (с 3 лет по показаниям), исключая голову из расчетов костной минеральной плотности, с целью своевременного выявления снижения МПК и коррекции выявленных изменений [50] (УУР — С, УДД — 5). Исследование МПК проксимального отдела бедра у детей и подростков не проводится в связи с вариабельностью развития скелета. У детей с задержкой линейного роста и развития результаты МПК должны анализироваться с учетом абсолютного роста или ростового возраста либо сравниваться с соответствующими педиатрическими базами данных, включающими специфические для возраста, пола и роста г-критерии [50, 104].
Определение функции внешнего дыхания
При подозрении на МВ и у пациентов с МВ рекомендовано исследовать функцию внешнего дыхания: спирометрия — в среднем каждые 3 мес (исследование неспровоцированных дыхательных объемов и потоков, при необходимости — дополнительно исследование дыхательных объемов с применением лекарственных препаратов), бодиплетизмография — по показаниям, в среднем — ежегодно с целью определения и динамического контроля легочной функции, определения обратимости обструкции при ее наличии (при отсутствии возрастных или иных противопоказаний) [1, 2, 20] (УУР — С, УДД — 5). Исследование функции внешнего дыхания (спирометрия) возможно у детей с 5-6 лет в том случае, если пациент может выполнить маневр форсированного выдоха, диагностическая ценность исследования у детей младше 5 лет ниже. Спирометрия позволяет косвенно оценить легочные объемы, бодиплетизмографию проводят для более точной оценки легочных объемов по показаниям.
При каждой госпитализации всем пациентам с подозрением на МВ и всем пациентам с МВ рекомендовано проведение пульсоксиметрии и/или исследование газового состава крови, по показаниям (обострение хронического бронхолегочного процесса, наличие дыхательной недостаточности, требующей оксигенотерапии) — чаще [2, 105, 106] (УУР — С, УДД — 5).
Ультразвуковые методы исследования
Всем пациентам с подозрением на МВ и пациентам с МВ рекомендовано проведение ультразвукового исследования органов брюшной полости и печени, осо-
от
тН
сч» см о см
«5
о -1 О
О <
ш
ее <
х а.
О
ее
о ш а.
от
см см о см
о §
< г
а.
<
в
к <
2£ О Ш X X
а.
I— <
х Ч ш
165
V)
г о
< а
о о ш а
_1 <
о
< ч
о 2£ ш а. ш
И
2£ О ш 3″
2£
бое внимание следует уделять структуре поджелудочной железы, определять тип кровотока в печени с целью выявления изменений, характерных для данного заболевания, и их динамики [1, 2, 20] (УУР — ^ УДД — 5).Также рекомендовано проведение фиброэластометрии печени (эластометрия печени) всем пациентам с МВ с целью оценки степени выраженности фиброза по шкале METAVIR [2, 20, 107] (УУР — А, УДД -1).
Всем пациентам мужского пола в возрасте старше 15 лет с МВ необходимо выполнять урологическое/андро-логическое обследование с проведением ультразвукового исследования половых органов для выявления структурных и морфологических изменений [77, 82, 96, 108] (УУР — С, УДД — 4).
Рекомендовано регулярное периодическое эхо-кардиографическое исследование (эхокардиография, ЭхоКГ) с доплеровским анализом (измерение градиента давления на легочной артерии) у пациентов с МВ, так как при этой патологии, особенно при распространенном поражении, возможно развитие легочной гипертензии и формирование легочного сердца [2] (УУР — ^ УДД — 5).
Электрокардиография
Рекомендовано проведение электрокардиографии пациентам с МВ при ПБС с целью контроля влияния электролитных нарушений на сердечную деятельность, перед началом терапии ингибиторами протонной помпы, препаратами против НТМБ, при длительном применении азитромицина по другим показаниям, на фоне терапии высокими дозами селективных в2-адреномиметиков (2 нед) с целью оценки интервала РТ [42, 109] (УУР — ^ УДД — 4).
Эндоскопические методы исследования
Трахеобронхоскопия пациентам с МВ рекомендована в случаях необходимости проведения дополнительного микробиологического исследования жидкости БАЛ, с санационной целью при попытке расправить ателектаз доли легкого в случае неэффективности консервативной терапии [1, 2, 17, 68, 69] (УУР — ^ УДД — 5).
Эндоскопия полости носа (эндоскопическая эндона-зальная ревизия полости носа, носоглотки) пациентам с МВ рекомендуется по показаниям: при необходимости оценки выраженности ХРС, степени назального полипоза, уточнения показаний к ринохирургическому лечению, оценки результатов эндоназальных эндоскопических хирургических вмешательств [70, 110-112] (УУР — С, УДД — 4).
ЭГДС (эзофагогастродуоденоскопию) рекомендуется проводить всем пациентам с МВ с циррозом печени для контроля ВРВП 1 раз в 6-12 мес, при подозрении на гастроэзофагеальную рефлюксную болезнь, эрозив-но-язвенные поражения, воспалительные заболевания слизистой оболочки пищевода и желудка [2] (УУР — С, УДД — 5).
Ректороманоскопия с биопсией рекомендуется по показаниям пациентам с подозрением на МВ для проведения измерения разности кишечных потенциалов [2, 113, 114] (УУР — С, УДД — 5).
Инструментальная диагностика мекониевого
илеуса
Проведение обзорной рентгенографии грудной и брюшной полости в прямой проекции в вертикальном положении рекомендовано пациентам с МВ и подозрением на мекониевый илеус с целью оценки состояния органов брюшной полости [115] (УУР — С, УДД — 5).
Также пациентам с подозрением на мекониевый илеус рекомендуется УЗИ брюшной полости для оценки скорости кровотока и индекса резистентности на сосудах брыжейки в различных уровнях, определения наличия и характера свободной жидкости в межпетлевом пространстве, латеральных каналах, малом тазу [115] (УУР — С, УДД — 5).
Рекомендуется проведение рентгеноконтрастных методов исследования при подозрении на мекониевый илеус для установления диагноза, оценки уровня поражения, определения объема контрастного вещества для повторного тугого контрастирования [115] (УУР — С, УДД — 5).
Пациентам с подозрением на мекониевый илеус для установления причины кишечной непроходимости рекомендовано проведение диагностической лапароскопии [100, 115] (УУР — С, УДД — 5). В настоящий момент в связи с активным развитием лапароскопической техники и анестезиологического пособия новорожденным и недоношенным детям данный метод является наиболее информативным и наименее травматичным для верификации причин кишечной непроходимости. Если есть возможность, хирургическое лечение можно выполнить лапароскопически или расширить объем лечения до мини-лапаротомии в зоне интереса либо, исключив анатомический дефект, поставить показания к консервативному лечению.
Инструментальная диагностика синдрома
дистальной интестинальной обструкции
СДИО — это частный случай низкой обтурационной кишечной непроходимости, возникающий при нарушении кишечного транзита у пациентов с муковисцидозом старше неонатального возраста. Данное заболевание редко встречается в возрасте до 2 лет в силу особенности диеты и сохранения перистальтической активности кишки. Для развития описываемого синдрома необходимо сочетание нескольких факторов: нарушенная секреция пищеварительных ферментов, пищевой рацион, состоящий из продуктов, приводящих к загустению кишечного химуса (рис, яблоко, груша, банан, хлебобулочные изделия (пшеничный хлеб), макароны, печенье; картофель, чай, желе, мясо, курица или рыба), а также декомпенсация кишки на фоне хронического растяжения кишечной стенки. Заболевание проявляется по типу калового завала, но характерной особенностью является то, что обструкция происходит выше толстой кишки, и стандартные консервативные методы разрешения калового завала будут неэффективны. Понимая вышеописанные факторы, возможно сформировать группы риска, создать систему профилактики, диагностики и лечения.
Пациентам с МВ и клиникой низкой обтурационной кишечной непроходимости рекомендовано проведение обзорной рентгенографии брюшной полости в прямой проекции в вертикальном положении с целью оценки состояния органов брюшной полости [116-118] (УУР — С, УДД — 5).
Пациентам с подозрением на СДИО рекомендуется УЗИ брюшной полости для оценки характера содержимого кишечника, преимущественно в правых отделах брюшной полости, определения наличия свободной жидкости в межпетлевом пространстве, латеральных каналах, малом тазу [116, 117] (УУР — С, УДД — 5).
Рекомендуется проведение рентгеноконтрастных методов исследования при подозрении на СДИО для установления диагноза, оценки уровня поражения [116, 118] (УУР — С, УДД — 5).
166
Пациентам с подозрением на СДИО без анамнеза оперативных вмешательств на брюшной полости (при отсутствии спаек) рекомендовано рассмотреть проведение диагностической лапароскопии для верификации причины кишечной непроходимости и для обеспечения визуализации места обструкции при применении мини-лапаротомного доступа при интестинотомии [118-120] (УУР — С, УДД — 4).
Исследование слуха
Проведение тональной пороговой аудиометрии рекомендуется при субъективном снижении слуха и/или появлении ушного шума, до и после курса терапии ами-ногликозидами, при уже выявленной сенсоневральной тугоухости, в связи с риском развития сенсоневральной тугоухости на фоне применения системной антибактериальной терапии препаратами аминогликозидного ряда, обладающими ототоксичностью [2, 20, 121-123] (УУР — С, УДД — 5).
Консультации специалистов
В ведении пациентов с МВ рекомендуется использовать мультидисциплинарный подход, ввиду того что заболевание характеризуется поражением многих органов и систем, требует комплексной терапии, что диктует необходимость совместного ведения пациента специалистами разных профилей [2, 20] (УУР — С, УДД — 5).
Пациентам мужского пола в возрасте с 15 лет рекомендована консультация врача-уролога/уролога-андро-лога детского для оценки состояния репродуктивной системы и определения тактики дальнейшего наблюдения [77, 82] (УУР — С, УДД — 5).
Пациентам мужского пола с муковисцидозом при гипоплазии тестикул, гипогонадизме показано наблюдение и обследование у врача-эндокринолога или врача-уроло-га/уролога-андролога детского для выявления признаков эндокринных, андрологических нарушений и решения вопроса о необходимости гормональной коррекции [77, 82, 124] (УУР — С, УДД — 5).
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
Наиболее частые нозологические формы для дифференциального диагноза при МВ:
• врожденные аномалии бронхиального дерева (КТ, трахеобронхоскопия);
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
• туберкулезная инфекция (консультация врача-фтизиатра, проба Манту, при необходимости — аллерген туберкулезный рекомбинантный, квантифероновый тест);
• иммунодефицитное состояние (необходимы консультация врача-иммунолога (аллерголога-иммунолога), определение уровней иммуноглобулинов основных классов М, А, Е), а также, по показаниям, субклассов иммуноглобулинов, уровня и функции Т-клеток, В-клеток, фагоцитоза, компонентов комплемента, естественных киллеров, тесты на вирус иммунодефицита человека (ВИЧ));
• первичная цилиарная дискинезия — респираторные симптомы, сходные с муковисцидозом, при отсутствии частого обильного стула с примесью жира и зловонным запахом, «соленого» привкуса кожных покровов могут наблюдаться у пациентов с первичной цилиарной дискинезией. Характерные клинические проявления: хронический бронхит, бронхоэктазы (у части пациентов), хронический синусит, хронический отит (триада Картагенера у половины пациентов первичной цилиарной дискинезией сопровождается
сходными клиническими проявлениями и обратным расположением внутренних органов), патологические изменения по данным световой микроскопии (отсутствие движения или неадекватный паттерн движения ресничек мерцательного эпителия) и/или электронной микроскопии (патология строения ресничек) биоптата слизистой оболочки носа и/или бронха, генетическое исследование (с помощью панелей, включающих гены DNAH5, DNAH11, DNAI1, DNAI2, NME8 (TXNDC3), DNAL1, CCDC151, CCDC114, ARMC4, CCDC114, ARMC4, CCDC103, DYX1C1, SPAG1, LRRC6, DNAAF2, DNAAF1 (LRRC50), С21огГ59, DNAAF3, ZMYND10, DNAAF5 (HEATR2), HYDIN, RSPH1, RSPH9, RSPH4A, RSPH3, DRC1 (CCDC164), GAS8 (DRC4), CCDC65 ^С2), CCDC39, CCDC40, OFD1 (редкий фенотип), ^N0, RPGR и MCIDAS (два последних — пигментные ретиниты, обычно диагностируемые у взрослых пациентов)), как скрининг-метод может быть использовано исследование уровня оксида азота в выдыхаемом назальном воздухе (у большинства пациентов с первичной цилиарной дискинезией — снижен).
Дифференциальная диагностика мекониального илеуса:
болезнь Гиршпрунга, нейроинтестинальная диспла-зия;
внутриутробная инфекция, внутриутробный некроти-зирующий энтероколит новорожденного; внутриутробный перитонит, адгезивный перитонит; поражения нервного аппарата толстой кишки [125].
ЛЕЧЕНИЕ
Цели лечения:
обеспечивать максимально высокое качество жизни пациента;
предупреждать и лечить обострения хронического инфекционно-воспалительного процесса в бронхо-легочной системе;
обеспечить физическое развитие пациента согласно возрастным нормам (достижение показателей физического развития в границе 25-75-й перцентили после коррекции нутритивного статуса, рекомендуемая цель — 50-й перцентиль); обеспечить профилактику осложнений; лечение осложнений (ПБС, мекониевый илеус, СДИО, МЗСД, цирроз печени без/с синдромом портальной гипертензии, гиперспленизмом, желчнокаменная болезнь, полипозный риносинусит, белково-энерге-тическая недостаточность, кровохарканье, кровотечения легочные, кровотечения из ВРВП и верхней трети желудка).
Обязательные составляющие лечения:
диетотерапия;
заместительная терапия недостаточности экзокрин-ной функции поджелудочной железы; муколитическая терапия;
дренирование бронхиального дерева и лечебная физкультура;
антибактериальная терапия; витаминотерапия;
предупреждение и лечение обострений инфекцион-но-воспалительного процесса в ОНП для уменьшения степени нисходящей контаминации бронхолегочной системы;
терапия осложнений [1, 2, 6].
от
тН
сч» см о см
«5
о -1 О
О <
ш
ее <
х а.
О
ее
о ш а.
от
см см о см
о §
< г
а.
<
в
к <
2£ О Ш X X
а.
I— <
х Ч ш
167
V)
z о
< a
о о ш а
_j <
о
< ч
о 2£ ш Q. Ш S 2£ О Ш 3″
ас
Консервативное лечение Муколитическая терапия
Всем пациентам с МВ (за исключением имеющих медицинские противопоказания) рекомендовано проведение активной муколитической терапии с целью уменьшения вязкости мокроты и облегчения ее эвакуации [1, 2, 6, 20] (УУР — ^ УДД — 5).
В клинической практике для муколитической терапии используются:
• дорназа альфа — разрывает водородные связи молекул ДНК, которые являются основной составляющей гнойной мокроты, и назначается в качестве базисной муколитической терапии, обеспечивает эффект в течение суток. Применяется ингаляционно в дозе 2,5 мг/сут; при необходимости (распространенные бронхоэктазы) — 5 мг/сут (по 2,5 мг х 2 раза в день через небулайзер); при хроническом полипоз-ном синусите — 5 мг/сут (2,5 мг — через небулайзер, 2,5 мг — с использованием универсальной ингаляционной системы с функцией пульсирующей подачи аэрозоля по 1,25 мг = 1,25 мл в каждый носовой ход) [1, 2, 20, 126];
• 7% гипертонический раствор натрия хлорида с 0,1% натрия гиалуронатом применяется ингаляционно через небулайзер по 5 мл 2 раза в день, улучшает клиренс дыхательных путей и назначается в качестве базисной муколитической терапии с быстрым муко-литическим эффектом [1, 2, 20, 36, 127], также может применяться 3% гипертонический раствор натрия хлорида, особенно у детей младшего возраста [128];
• маннитол в форме порошка для ингаляций улучшает клиренс дыхательных путей, способствует гидратации слизи [2, 20, 129].
Маннитол и 7% гипертонический раствор натрия хлорида с 0,1% натрия гиалуронатом являются муколитика-ми быстрого действия и сочетаются с дорназой альфа.
Бронхолитическая терапия
Назначение ингаляционной бронхолитической терапии пациентам с МВ рекомендовано при наличии обратимой или частично обратимой бронхиальной обструкции (прирост уровня ОФВ± после ингаляции брон-холитика > 15%) с целью улучшения эвакуации мокроты, перед применением ингаляций антибактериальных препаратов, гипертонического раствора натрия хлорида, перед кинезитерапией [1, 2, 6, 20] (УУР — ^ УДД — 5).
В качестве бронхолитической терапии пациентам с МВ рекомендуется назначить бронхолитический препарат из группы селективных в2-адреномиметиков, или адренергические средства в комбинации с антихоли-нергическими, или антихолинергические средства либо другой препарат для лечения обструктивных заболеваний дыхательных путей по индивидуальным показаниям в режиме «по требованию» [1, 2, 20, 130-133] (УУР — В, УДД — 2).
Антибактериальная терапия
Общие принципы антибактериальной терапии Антибактериальная терапия (плановые курсы антибактериальных препаратов в виде ингаляций через небулайзер, или совместно с таблетированны-ми формами, или внутривенно) рекомендована всем пациентам с легочными проявлениями МВ, у которых отмечается обострение МВ (включая обострения на фоне острой респираторной инфекции) или выявляются новые патогенные возбудители респираторной инфекции в количестве более 105 колониеобразующих
единиц, при плановом микробиологическом исследовании с целью эрадикации причинно-значимых микроорганизмов [2, 6, 20, 134-137] (УУР — В, УДД — 2).
При проведении пациентам с МВ антибактериальной терапии бактериальной инфекции в бронхолегочной системе рекомендовано ориентироваться на чувствительность выделенного микроорганизма (Pseudomonas aeruginosa, MRSA, Burkholderia cepacia complex, Stenotrophomonas maltophilia, Staphylococcus aureus и Haemophilus infuenzae и др.) к антибактериальным препаратам с целью повышения эффективности лечения [2] (УУР — C, УДД — 5). Лабораторное определение чувствительности микроорганизма к антибиотикам не всегда полностью совпадает с клиническим ответом на проводимую терапию [2, 6, 20, 135-137]. При выборе антибиотика целесообразно учесть эффективность ранее проводимых курсов антибактериальной терапии [2].
Пациентам с МВ назначают максимальные возрастные дозы препаратов или дозы, рекомендуемые для пациентов с МВ. В связи с тяжестью заболевания, необходимостью максимальных дозировок антимикробных препаратов и дефицитом лекарственных форм для ингаляционного применения в мировой клинической практике традиционно применяются off-label (вне инструкции) инъекционные антимикробные средства в виде ингаляций [42, 138-146].
При острой респираторной инфекции пациентам с МВ рекомендовано назначение антибактериальной терапии в домашних условиях согласно профилю чувствительности выделенной респираторной микрофлоры в связи с активацией хронического воспалительного процесса на фоне присоединения острой респираторной инфекции [2, 20, 42] (УУР — С, УДД — 5).
Антибактериальная терапия при высеве метициллин-чувствительного Staphylococcus aureus (MSSA) и Haemophilus influenzae При выборе антибактериальных препаратов для терапии пациентов с муковисцидозом с высевом Staphylococcus aureus и Haemophilus influenzae рекомендовано применять ЛС в соответствии с чувствительностью с целью эрадикации причинно-значимого возбудителя (препараты, дозировки и кратность введения представлены в табл. 6, 7) [2] (УУР — C, УДД — 5).
Антибактериальная терапия при MRSA-инфекции При первичном высеве MRSA у стабильных пациентов (вне обострения хронического воспалительного процесса) в качестве первой линии терапии при отсутствии противопоказаний рекомендуется назначение двух антибактериальных препаратов per os в течение 1-3 мес, чаще это комбинация рифампицина с фузи-довой кислотой или сульфаметоксазол + триметоприм (табл. 
При первичном высеве MRSA у нестабильных пациентов (при обострении хронического воспалительного процесса) рекомендуется проведение внутривенной или пероральной терапии в течение 2 нед линезолидом или тейкопланином, прочими антибиотиками, активными в отношении MRSA (см. табл. 
Эпидемиологические исследования демонстрируют, что MRSA ассоциируется со сниженной легочной функцией, большей потребностью в медикаментозной терапии и худшей выживаемостью. Для эрадикации возбудителя используют достаточно агрессивные схемы лечения.
168
Таблица 6. Антибактериальные препараты, применяемые у пациентов с муковисцидозом при высеве из мокроты / бронхиального секрета метициллин-чувствительного Staphylococcus aureus (MSSA)
Table 6. Antibacterial drugs used in patients with cystic fibrosis when cultured methicillin-sensitive Staphylococcus aureus (MSSA) from sputum/bronchial secretion
Антибактериальный препарат Суточные дозы для детей Способ введения Кратность введения
Амоксициллин + [клавулановая кислота] (суспензия для приема внутрь противопоказана детям до 3 мес, таблетки диспергируемые противопоказаны детям до 2 лет, таблетки, покрытые пленочной оболочкой, противопоказаны детям до 12 лет и с массой тела менее 40 кг) 60-90 мг/кг (расчет по амоксициллину) Внутрь 2-3
90-120 мг/кг В/в 3-4
Оксациллин 200-300 мг/кг В/в 4-6
Цефалексин (капсулы 250 мг противопоказаны детям до 10 лет, таблетки 250 мг противопоказаны детям до 7 лет) 25-50-100 мг/кг Внутрь 3-4
Цефазолин 100-150 мг/кг В/в 2-3
Цефуроксим (суспензия для приема внутрь противопоказана детям до 3 мес, таблетки противопоказаны детям до 3 лет) 20-30 мг/кг Внутрь 2
150-200 мг/кг В/в 3-4
Цефтриаксон 50-80 мг/кг В/в 1-2
Цефепим (противопоказан детям до 2 мес жизни) 100-150 мг/кг В/в 2-3
Азитромицин (таблетки 125 мг противопоказаны детям до 3 лет, суспензия для приема внутрь противопоказана детям до 6 мес) > 6 мес — 10 мг/кг Внутрь 1 Курс 7-10 дней
Кларитромицин (таблетки противопоказаны детям до 12 лет) 15 мг/кг Внутрь 2
Джозамицин (противопоказан при массе тела более 10 кг) 40-50 мг/кг Внутрь 2-3
Клиндамицин (р-р для в/в и в/м введения противопоказан детям до 3 лет, капсулы противопоказаны детям до 8 лет с массой тела до 25 кг) 20-40 мг/кг Внутрь 3-4
Детям старше 3 лет 40 мг/кг В/в 3-4
Доксициклин (противопоказан детям до 8 лет) Детям с массой тела менее 45 кг в первый день лечения 4 мг/кг, в последующие дни — 2-4 мг/кг Детям с массой тела более 45 кг — как взрослым Внутрь 1-2
Ко-тримоксазол [сульфаметоксазол + триметоприм] (суспензия для приема внутрь противопоказана детям до 6 нед, таблетки противопоказаны детям до 3 лет, раствор для инфузий противопоказан детям до 3 лет) 6-10 мг/кг по триметоприму При тяжелой инфекции возможно увеличение дозы на 50% Внутрь В/в 2
Тиамфеникола глицинат ацетилцистеинат 250 мг (в первые 2-3 дня лечения доза может быть увеличена в 2 раза) Ингаляционно 2
Антибактериальная терапия при выявлении в мокроте / бронхиальном секрете Pseudomonas aeruginosa
Рекомендуется одновременное назначение 2-3 про-тивомикробных препаратов из разных групп, что предотвращает развитие устойчивости P. aeruginosa и способствует достижению максимального клинического эффекта (эрадикации P. aeruginosa) (табл. 9) [2, 6, 20, 134-136, 150, 151] (УУР — C, УДД — 5).
Наиболее часто применяют комбинации аминоглико-зидов с цефалоспоринами 3-4-го поколения (см. табл. 9). Целесообразно периодически менять комбинации антибиотиков, эффективных в отношении синегнойной палочки. Следует помнить, что лабораторное определение чувствительности микроорганизма к антибиотикам
не всегда полностью совпадает с клиническим ответом на проводимую терапию. В тяжелых случаях, при нестабильном состоянии допускается непрерывное применение препарата [152].
Решение о назначении незарегистрированных препаратов по жизненным показаниям принимается консилиумом федеральной медицинской организации; ввоз препарата осуществляется в соответствии с законодательной базой для обеспечения пациентов не зарегистрированными в Российской Федерации лекарственными препаратами по жизненным показаниям (приказ Министерства здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у пациентов по жизненным показаниям» от 9 августа 2005 г. № 494).
Q.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
I— <
ч
ш
169
Таблица 7. Антибактериальные препараты, применяемые у пациентов с муковисцидозом при высеве из мокроты / бронхиального секрета Haemophilus influenzae
Table 7. Antibacterial drugs used in patients with cystic fibrosis when cultured Haemophilus influenzae from sputum / bronchial secretion
V)
z о
< о
о о ш а
<
о
170
Антибиотик Суточные дозы для детей Способ введения Кратность введения
Амоксициллин 60-90 мг/кг Внутрь 2-3
Амоксициллин + [клавулановая кислота] (суспензия для приема внутрь противопоказана детям до 3 мес, таблетки диспергируемые противопоказаны детям до 2 лет, таблетки, покрытые пленочной оболочкой, противопоказаны детям до 12 лет и с массой тела менее 40 кг) 60-90 мг/кг (расчет по амоксициллину) Внутрь 2-3
90-120 мг/кг В/в 3-4
Цефуроксим (суспензия для приема внутрь противопоказана детям до 3 мес, таблетки противопоказаны детям до 3 лет) 20-30 мг/кг Внутрь 2
150-200мг/кг В/в 3-4
Цефиксим (суспензия для приема внутрь противопоказана детям до 6 мес, таблетки диспергируемые противопоказаны детям с массой тела до 25 кг, таблетки, покрытые пленочной оболочкой, и капсулы противопоказаны детям до 12 лет) 8 мг/кг Внутрь 1-2
Цефтриаксон 50-80 мг/кг В/в 1-2
Цефотаксим 100-150 мг/кг В/в 2-4
Цефепим (противопоказан детям до 2 мес жизни) Детям с массой тела < 40 кг — 100-150 мг/кг Детям с массой тела > 40 кг — 4-6 г В/в 2-3
Доксициклин (противопоказан детям до 8 лет) Детям с массой тела до 45 кг в первый день — 4 мг/кг, в последующие дни — 2-4 мг/кг Детям с массой тела более 45 кг — как взрослым Внутрь 1-2
Тиамфеникола глицинат ацетилцистеинат 500-1000 мг Ингаляции 2
< ч
Таблица 8. Антибактериальные препараты, применяемые у пациентов с муковисцидозом при высеве из мокроты / бронхиального секрета метициллин-резистентного Staphylococcus aureus (MRSA) [42, 138, 139, 144-148]
Table 8. Antibacterial drugs used in patients with cystic fibrosis when cultured methicillin-resistant Staphylococcus aureus (MRSA) from sputum / bronchial secretion [42, 138, 139, 144-148]
Антибактериальный препарат Суточная доза для детей Способ введения Кратность введения
Рифампицин (в монотерапии не назначают) (противопоказан детям до 1 года) 20 мг/кг/сут (максимально 600 мг/сут) Внутрь 2
Ко-тримоксазол [сульфаметоксазол + триметоприм] (суспензия для приема внутрь противопоказана детям до 6 нед, таблетки противопоказаны детям до 3 лет, раствор для инфузий противопоказан детям до 3 лет) 6-10 мг/кг/сут по триметоприму, при тяжелой инфекции возможно увеличение дозы на 50% Внутрь 2
В/в
Фузидовая кислота (противопоказана детям до 3 лет) 40-60 мг/кг #< 1 года: 15 мг/кг 3 раза в день #(до 3 лет) 1-4 года: 250 мг 3 раза в день 5-12 лет: 500 мг 3 раза в день > 12 лет: 750 мг 3 раза в день Внутрь 3
Клиндамицин (противопоказан детям до 3 лет) 20-40 мг/кг/сут Внутрь 3-4
40 мг/кг/сут В/в 3-4
Доксициклин (противопоказан детям до 8 лет) Детям с массой тела менее 45 кг в первый день лечения 4 мг/кг/сут, в последующие дни — 2-4 мг/кг/сут Детям с массой тела более 45 кг — как взрослым Внутрь 1-2
Таблица 8. Окончание Table 8. Ending
Антибактериальный препарат Суточная доза для детей Способ введения Кратность введения
Тигециклин (противопоказан детям до 8 лет) В возрасте 8-11 лет — 2,4 мг/кг/сут Максимальная доза — 100 мг Доза с 12 до 17 лет — 100 мг В/в в течение 30-60 мин 2
Линезолид (таблетированные формы противопоказаны детям до 12 лет) До 12 лет — 20-40 мг/кг/сут (максимально 600 мг) Старше 12 лет — 1200 мг Внутрь, в/в 3 — до 12 лет 2 — старше 12
Ванкомицин 40 мг/кг/сут В/в 2-4
#Ванкомицин (формы для инъекционного применения) 250 мг 2 раза в день К отмеренной дозе добавить хлорида натрия 0,9% до 4 мл Ингаляционно 2
Тейкопланин > 1 мес — 10 мг/кг (максимально 400 мг) — 3 дозы каждые 12 ч (нагрузочная доза) Последующие 24 ч 10 мг/кг (максимально 400 мг) — однократно/сут В/в 1-2
Цефтаролина фосамил (противопоказан детям до 2 мес) 2 мес — 2 года — 24 мг/кг 2-12 лет — 36 мг/кг 12-18 лет 36 мг/кг — разовая доза (разовая доза не должна превышать 400 мг) В/в 2
Телаванцин Пациентам старше 18 лет В/в (не менее 60 мин) 1
от
vH
<N Cl О Cl
<5 О
-J
О
о <
s
ее. <
x
Q.
О et
a ш Q.
Примечание. #Применение лекарственного препарата вне зарегистрированных в инструкции ЛС показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет. Note. #The administration of medication outside the indications registered in the drug instructions is performed by the decision of health authorities with the permission of Local Ethical Committee of the medical facility (if any) and with signed informed consent from parents (legal representative) and a child over the age of 15 years.
от
vH
При хронической колонизации нижних дыхательных путей P. aeruginosa для увеличения продолжительности жизни пациентов рекомендуется проведение профилактических курсов антибактериальной терапии [2, 42, 138, 148, 149] (УУР — C, УДД — 5).
Стратегия антибиотикотерапии инфекции Pseudomona aeruginosa при муковисцидозе Эрадикация P. aeruginosa при первичном высеве. При отсутствии у пациента клинически значимых респираторных симптомов, при минимальных структурных изменениях в легких и при условии проведения бактериологического мониторинга не реже 4 раз в год рекомендуется проведение одного из 2 режимов антибактериальной терапии с целью эрадикации P. aeruginosa для увеличения продолжительности жизни и профилактики снижения функции легких для пациентов всех возрастов [10, 11, 29]:
• ингаляции тобрамицина в виде раствора 300 мг 2 раза в день или в виде капсул с порошком для ингаляций (обе лекарственные формы противопоказаны для детей до 6 лет) 112 мг х 2 раза в день в течение 28 дней [1, 2, 6, 20, 134-136] (УУР — А, УДД — 2), возможна комбинация с ципрофлоксацином (см. табл. 9) в течение 3 нед [1, 2, 20, 42, 134-136, 139, 149] (УУР — А, УДД — 2)
или
• комбинация ингаляционного колистиметата натрия (1 млн ЕД х 2 раза в день у детей младше 8-10 лет, 2 млн ЕД х 2 раза в день у пациентов 8-10 лет и старше; для детей младше 6 лет назначать по решению врачебного консилиума) [139] в течение 3 мес в сочетании с ципрофлоксацином (см. табл. 9) per os из расчета 30-40 мг/кг/сут в два приема в течение от 3 нед до 3 мес в зависимости от возраста [2, 20, 139, 149] (УУР — С, УДД — 5).
При наличии клинически значимых респираторных симптомов, признаков обострения бронхолегочного процесса, у некомплаентых пациентов рекомендован двухнедельный курс внутривенной комбинированной (два препарата) антисинегнойной терапии с целью эрадика-ции возбудителя [42,139,149,153] (УУР — С, УДД — 5).
Интермиттирующая и хроническая инфекции P. aeruginosa. При интермиттирующей инфекции P. aeruginosa возможность санации мокроты пациентов с МВ значительно выше, чем при хронической. В многолетних исследованиях показано, что активная антимикробная терапия позволяет предупредить или отсрочить развитие хронической инфекции P. aeruginosa более чем у 80% пациентов с МВ.
Если эрадикация P. аeruginosa после проведенного курса антибиотикотерапии у пациента с муковисцидо-зом не произошла и у пациента развилась хроническая
см
С|
о
С|
о §
< s
Q.
<
в
К <
ас о ш х s
Q.
I— <
S
Ч ш
171
Таблица 9. Антибактериальные препараты, применяемые у пациентов с муковисцидозом при высеве из мокроты / бронхиального секрета Pseudomonas aeruginosa
Table 9. Antibacterial drugs used in patients with cystic fibrosis when cultured Pseudomonas aeruginosa from sputum / bronchial secretion
Антибактериальный препарат Суточная доза для детей Способ введения Кратность введения
Амикацин 20-30 мг/кг В/в 1
Гентамицин 10 мг/кг В/в 1
Ципрофлоксацин (противопоказан детям с муковисцидозом до 5 лет) #< 1 мес — 30 мг/кг > 1 мес — 40 мг/кг (максимально 750 мг) Внутрь 2
10 мг/кг В/в 2
#Левофлоксацин (противопоказан до 18 лет) 16-20 мг/кг Внутрь 1-2
16-20 мг/кг В/в 2
Цефтазидим 150-250 мг/кг В/в 2-3
Цефепим (противопоказан детям до 2 мес жизни) 100-150 мг/кг В/в 2-3
Цефепим + [сульбактам] (противопоказан детям до 2 мес жизни) с 2 мес — 50-80 мг/кг В/в 2-3
Цефтазидим + [авибактам] До 18 лет не применяется В/в 3
Цефтолозан + [тазобактам] #90-120 мг/кг В/в 3 (в случае, если МПК для Р. aerugeinosa равна или более 2 мг/л — 30-40 мг/кг (по цефтолозану) 4 введения в сутки (каждые 6 ч))
Пиперациллин + [тазобактам] (противопоказан детям до 2 лет) 270-360 мг/кг В/в 3-4
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Цефоперазон + [сульбактам] 150-200 мг/кг В/в 2
Азтреонам (противопоказан до возраста 9 мес) 150-250 мг/кг В/в 4
Имипенем + циластатин (противопоказан детям до 3 мес жизни) 50-100 мг/кг по имипенему В/в 3-4
Меропенем (противопоказан детям до 3 мес жизни) 60-120 мг/кг В/в 3
Дорипенем До 18 лет не применяется В/в 3
Фосфомицин (противопоказан детям до 12 лет) 0,2-0,4 г/кг В/в 3-4
V)
z о
< о
о о ш
а _j
<
о
< ч
о
К
ш Q. ш s
К С
ш 3″
К
Примечание. #Применение лекарственного препарата у детей вне зарегистрированных в инструкции ЛС показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет. При наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее — по жизненным показаниям) по решению врачебной комиссии осуществляется назначение лекарственных препаратов не по международному непатентованному наименованию, а по торговому наименованию (ч. 15 ст. 37 Федерального закона от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и п. 6 Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения, утвержденного приказом Минздрава России от 14 января 2019 г. № 4н). Решение врачебной комиссии оформляется протоколом и вносится в медицинскую документацию пациента. Решение о назначении незарегистрированных препаратов по жизненным показаниям принимается консилиумом федеральной медицинской организации; ввоз препарата осуществляется в соответствии с законодательной базой для обеспечения пациентов не зарегистрированными в Российской Федерации лекарственными препаратами по жизненным показаниям (приказ Министерства здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у больных по жизненным показаниям» от 9 августа 2005 г. № 494).
Note. #The administration of medication outside the indications registered in the drug instructions is performed by the decision of health authorities with the permission of Local Ethical Committee of the medical facility (if any) and with signed informed consent from parents (legal representative) and a child over the age of 15 years. If clinically indicated (for vital indications, including individual intolerance, hereinafter — for vital indications) and by decision of health authorities, medications are prescribed not by the international nonproprietary name but by the commercial name (part 15 of art. 37 of the Federal Law dated November 21, 2011 № 323 «On fundamental healthcare principles in the Russian Federation» and paragraph 6 of the Procedure for prescribing drugs, prescription forms for drugs, procedure for issuing these forms, its accounting and storage, approved by the Order of the Ministry of Health of Russian Federation, dated January 14, 2019 № 4н). The decision of health authorities is drawn up by the protocol and recorded into the patient’s medical record. The decision on administration of unregistered drugs for vital indications is made by the council of federal medical facility; medication import is carried out according to the legislation on providing patients with medicinal products not registered in Russian Federation for vital indications (Order of the Ministry of Health and Social Development of Russian Federation «On the procedure for the use of medications in patients for vital indications» dated August 9, 2005, № 494).
172
синегнойная инфекция, рекомендовано назначение ингаляционной противосинегнойной терапии (тобрами-цин или колистиметат натрия) (табл. 10) [154] (УУР — С, УДД — 5).
Антибактериальная терапия при высеве
из мокроты / бронхиального секрета
Burkholderia cepacia complex
Общими следует считать следующие правила антимикробной терапии пациентов с МВ, инфицированных B. cepacia complex.
При инфицировании Burkholderia cepacia complex вследствие ее высокой вирулентности рекомендуется немедленная антибактериальная терапия [1, 2, 42, 139, 148, 149, 155, 156] (УУР — C, УДД — 5).
Инфицирование Burkholderia cepacia complex достоверно ухудшает клиническое состояние пациента и прогноз. Есть отдельные сообщения об успешной эрадикации некоторых изолятов c применением ранней агрессивной антибактериальной терапии до формирования хронической инфекции. При этом следует учесть, что доказательная база в отношении терапии данной инфекции в настоящее время невелика. Препараты, применяемые при данной инфекции, представлены в табл. 11.
Для терапии пациента с МВ с высевом Burkholderia cepacia complex (как при первичном высеве, так и для лечения обострения бронхолегочного процесса) рекомендовано отдавать предпочтение комбинации из трех препаратов (как более эффективной) курсом от 3 нед и более, а также комбинировать внутривенный и ингаляционный и/или пероральный путь введения антибактериальных препаратов [139, 148, 157] (УУР — C, УДД — 5).
Для детей старше 12 лет и взрослых рекомендовано ингаляционное применение тобрамицина (в виде рас-
твора или в виде капсул с порошком для ингаляций), а также меропенема и цефтазидима, предназначенных для внутривенного использования (см. табл. 11). Возможно ингаляционное применение тиамфеникола глицината ацетилцистеината (см. табл. 11). Выбор ингаляционного антибиотика осуществляется в зависимости от клинической эффективности, переносимости и результата чувствительности в посеве мокроты [2, 42, 138, 139, 148] (УУР — ^ УДД — 5).
Антибактериальная терапия при высеве
из бронхиального секрета АсЬготоЬааег spp.
Общими следует считать следующие правила антимикробной терапии пациентов с МВ, инфицированных АсЬготоЬааег spp.
При высеве из бронхиального секрета АсЬютоЬааег spp. рекомендовано применять антибактериальную терапию в соответствии с чувствительностью микроорганизма (табл. 12) [1, 2, 42, 138, 139, 158-160] (УУР — C, УДД — 5).
АсЬготоЬааег spp. характеризуется мультирези-стентностью, способностью формировать биопленки, что объясняет неудачи антибактериальной эрадика-ционной терапии микроорганизма при хронической инфекции. Повторный высев АсЬготоЬааег spp., сопровождающийся увеличением продукции специфических преципитирующих антител, ассоциируется с более быстрым падением легочной функции, сопоставимым с таковым при хронической синегнойной инфекции (к заболеванию предрасполагает иммунодефицит).
При первом высеве АсЬготоЬааег spp. или при обострении бронхолегочного процесса, связанном с АсЬютоЬааег spp., пациентам с МВ рекомендовано внутривенное введение комбинации двух антибио-
ОТ
vH
<N Cl О
Cl ^
«5 О
-J
О
о <
ш
ее <
х
Q.
О
ее
о ш Q.
Таблица 10. Схема антибактериальной терапии при хронической синегнойной инфекции [2, 20, 153] Table 10. Antibacterial therapy regimen for chronic Pseudomonas infection [2, 20, 153]
от
vH
Cl Cl О Cl
О §
< s
Q.
<
e
к <
ae о ш x s
Q.
I— <
S
Ч ш
Ингаляции тобрамицина в растворе для ингаляций 300 мг или тобрамицина в капсулах с порошком для ингаляций — 112 мг (4 капсулы) дважды в сутки интермиттирующими курсами 28 дней приема, 28 дней перерыв, всего 6 курсов в год (обе лекарственные формы противопоказаны детям до 6 лет)
Раствор для ингаляций колистиметат натрия 1-4 млн ЕД/24 ч постоянно или другой антибиотик в ингаляциях постоянно всем детям с хронической колонизацией синегнойной палочки (противопоказан детям до 6 лет)
У пациентов с прогрессирующим снижением функции легких и частыми обострениями, а также при недостаточном эффекте от ингаляционной антибактериальной терапии основной режим терапии включает 2-недельный курс внутривенной антимикробной терапии каждые 3 мес
Препараты для внутривенного введения: тобрамицин 10 мг/кг, или амикацин 20 мг/кг 1 раз в день, или тобрамицин 10-12 мг/кг в день (до достижения в сыворотке крови концентрации 1-2 мкг/мл) + цефтазидим 150-200 мг/кг в день в/в, или + меропенем 60-120 мг/кг/24 ч в/в, или + другой антибиотик, активный против синегнойной палочки. При клинической нестабильности, в т.ч. при присоединении острой респираторной инфекции, — увеличение продолжительности курсов в/в антибактериальной терапии до 3 нед, и/или сокращение интервалов между курсами, и/или прием ципрофлоксацина/#офлоксацина 20-40 мг/кг/сут внутрь между курсами в/в антибактериальной терапии, а также непрерывная ингаляционная антибактериальная терапия курсами тобрамицина и колистиметата натрия (обе лекарственные формы противопоказаны детям до 6 лет)
173
Примечание. #Применение у детей лекарственного препарата вне зарегистрированных в инструкции ЛС показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет; тобрамицин (раствор для ингаляций), тобрамицин (капсулы с порошком для ингаляций), колистиметат натрия (раствор для ингаляций) противопоказаны детям до 6 лет; офлоксацин противопоказан детям до 18 лет; противопоказания для остальных ЛС — см. табл. 9. Note. #The administration of medication outside the indications registered in the drug instructions is performed by the decision of health authorities with the permission of Local Ethical Committee of the medical facility (if any) and with signed informed consent from parents (legal representative) and a child over the age of 15 years; tobramycin (inhalation solution), tobramycin (inhalation powder capsules), colistimethate sodium (inhalation solution) are contraindicated to children under 6 years of age; ofloxacin is contraindicated to children under 18 years of age; contraindications for other drugs are presented in table 9.
Таблица 11. Антибактериальные препараты, применяемые у пациентов с муковисцидозом при эрадикации и терапии инфекции, вызванной Burkholderia cepacia comp^ [2, 42, 138, 139, 148]
Table 11. Antibacterial drugs used in patients with cystic fibrosis during eradication and treatment of infection caused by Burkholderia cepacia comp^ [2, 42, 138, 139, 148]
Антибактериальный препарат Суточная доза для детей Способ введения Кратность введения/сут
Цефтазидим + [авибактам] (противопоказан детям до 3 мес жизни) В возрасте 3-6 мес — 40 мг/кг/10 мг/кг В возрасте 6 мес — 18 лет — 50 мг/кг/12,5 мг/кг (максимально 2000/500 мг) В/в 3
#Цефтазидим (форма для инъекционного применения) 2 г Ингаляционно 2
#Цефтазидим 300 мг/кг В/в 3
Меропенем (противопоказан детям до 3 мес жизни) 120 мг/кг В/в 3
#Дорипенем Не разрешен В/в 3
Пиперациллин + [тазобактам] (противопоказан детям до 3 мес жизни) 400-500 мг/кг В/в 3
#Азтреонам (противопоказан детям до 9 мес жизни) 150-250 мг В/в 2-4
#Ко-тримоксазол [сульфаметоксазол + триметоприм] (суспензия для перорального применения противопоказана детям до 6 нед, инъекционная форма противопоказана до 3 лет) 20 мг/кг (по триметоприму) В/в и внутрь 3
#Миноциклин (противопоказан детям до 8 лет) После 8 лет: 2-3 мг/кг Внутрь 1-2
Ципрофлоксацин (противопоказан детям до 5 лет с МВ и высевом P. aeruginosa, по остальным показаниям — до 18 лет) < 1 мес — 30 мг/кг > 1 мес — 40 мг/кг (максимально 750 мг) [8, 9] Внутрь 2
10 мг/кг В/в 2
#Левофлоксацин 16-20 мг/кг Внутрь 1-2
16-20 мг/кг В/в 2
Доксициклин (противопоказан детям до 8 лет) Детям с массой тела менее 45 кг в первый день лечения 4 мг/кг, в последующие дни — 2-4 мг/кг. Детям с массой тела более 45 кг — как взрослым Внутрь 1-2
#Хлорамфеникол (таблетки противопоказаны детям до 3 лет или с массой тела < 20 кг) 50-100 мг/кг Внутрь, в/в 3-4
#Тиамфеникола глицинат ацетилцистеинат 500-1000 мг Ингаляционно 2
Примечание. При наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее — по жизненным показаниям) по решению врачебной комиссии осуществляется назначение лекарственных препаратов не по международному непатентованному наименованию, а по торговому наименованию (ч. 15 ст. 37 Федерального закона от 21 ноября 2011 г. № 323-ф3 «Об основах охраны здоровья граждан Российской Федерации» и п. 6 Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения, утвержденного приказом Минздрава России от 14 января 2019 г. № 4н). Решение врачебной комиссии оформляется протоколом и вносится в медицинскую документацию пациента. #Применение лекарственного препарата вне зарегистрированных в инструкции ЛС показаний проводится по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет.
Note. If clinically indicated (for vital indications, including individual intolerance, hereinafter — for vital indications) and by decision of health authorities, medications are prescribed not by the international nonproprietary name but by the commercial name (part 15 of art. 37 of the Federal Law dated November 21, 2011 № 323 «On fundamental healthcare principles in the Russian Federation» and paragraph 6 of the Procedure for prescribing drugs, prescription forms for drugs, procedure for issuing these forms, its accounting and storage, approved by the Order of the Ministry of Health of Russian Federation, dated January 14, 2019 № 4н). #The administration of medication outside the indications registered in the drug instructions is performed by the decision of health authorities with the permission of Local Ethical Committee of the medical facility (if any) and with signed informed consent from parents (legal representative) and a child over the age of 15 years.
174
тиков различных классов курсом 14-21 день с целью эрадикации возбудителя:
• 1-я линия — пиперациллин + тазобактам/меро-пенем/сульфаметоксазол + триметоприм (см. табл. 12);
• 2-я линия — цефтазидим, миноциклин, колистиметат натрия, хлорамфеникол; комбинированная терапия — меропенем и ципрофлоксацин (левофлокса-цин) (см. табл. 12);
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
• альтернативная терапия — меропенем + миноци-клин/левофлоксацин + хлорамфеникол + колистиметат натрия (раствор для ингаляций) (см. табл. 12) [1, 2, 42, 138, 139, 148, 158, 161] (УУР — C, УДД — 5).
После основного курса антибактериальной терапии рекомендовано назначать колистиметат натрия (раствор для ингаляций; противопоказан детям до 6 мес) на 3 мес. Можно использовать сульфаметоксазол + триметоприм
Таблица 12. Антибактериальные препараты, применяемые у пациентов с муковисцидозом при высеве из мокроты / бронхиального секрета Achromobacter spp. [1, 2, 42, 138, 139, 148, 158-160, 162]
Table 12. Antibacterial drugs used in patients with cystic fibrosis when cultured Achromobacter spp. from sputum / bronchial secretion [1, 2, 42, 138, 139, 148, 158-160, 162]
Антибактериальные препараты Суточная доза для детей Способ введения Кратность введения
#Цефтазидим (форма для инъекционного применения) В возрасте до 2 мес — 25-50 мг/кг/сут Старше 2 мес — 50-100 мг/кг/сут Ингаляционно 2
#Цефтазидим 300 мг/кг В/в 3
#Меропенем (форма для инъекционного применения) 250-500 мг Ингаляционно 2
#Меропенем 120 мг/кг В/в 3
Пиперациллин +тазобактам 400-500 мг/кг В/в 3
#Ко-тримоксазол [сульфаметоксазол + триметоприм] 20 мг/кг (по триметоприму) В/в и внутрь 3
#Доксициклин Детям с массой тела до 45 кг в первый день 4 мг/кг, в последующие дни — 2-4 мг/кг Детям с массой тела более 45 кг — как взрослым Внутрь 1-2
#Хлорамфеникол 50-100 мг/кг Внутрь, в/в 3-4
#Тиамфеникола глицинат ацетилцистеинат 500-1000 мг Ингаляционно 2
#Колистиметат натрия 2-4 млн ЕД Ингаляционно 1
#Цефоперазон + [сульбактам] 150-200 мг/кг В/в 2
#Имипенем + [циластатин] 50-100 мг/кг в день по имипенему В/в 3-4
#Имипенем +[циластатин] 250-500 мг Ингаляционно 2
#Миноциклин Детям старше 8 лет — в начальной дозе 4 мг/кг, в дальнейшем — 2 мг/кг каждые 12 ч Внутрь 2
#Тобрамицин (раствор для ингаляций противопоказан детям до 6 мес жизни) 600 мг Ингаляционно 2
о
vH
<N Cl О Cl
<5 О -1 О
о <
s
et <
х
Q.
О et
о ш Q.
О
vH
С| С|
о
С|
о §
< s
Q.
<
в
К <
ае о ш х s
Q.
I— <
S
Ч ш
Примечание. #Применение лекарственного препарата вне зарегистрированных в инструкции ЛС показаний проводится по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет. При наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее — по жизненным показаниям) по решению врачебной комиссии осуществляется назначение лекарственных препаратов не по международному непатентованному наименованию, а по торговому наименованию (ч. 15 ст. 37 Федерального закона от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и п. 6 Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения, утвержденного приказом Минздрава России от 14 января 2019 г. № 4н). Решение врачебной комиссии оформляется протоколом и вносится в медицинскую документацию пациента.
Note. #The administration of medication outside the indications registered in the drug instructions is performed by the decision of health authorities with the permission of Local Ethical Committee of the medical facility (if any) and with signed informed consent from parents (legal representative) and a child over the age of 15 years. If clinically indicated (for vital indications, including individual intolerance, hereinafter — for vital indications) and by decision of health authorities, medications are prescribed not by the international nonproprietary name but by the commercial name (part 15 of art. 37 of the Federal Law dated November 21, 2011 № 323 «On fundamental healthcare principles in the Russian Federation» and paragraph 6 of the Procedure for prescribing drugs, prescription forms for drugs, procedure for issuing these forms, its accounting and storage, approved by the Order of the Ministry of Health of Russian Federation, dated January 14, 2019 № 4н). The decision of health authorities is drawn up by the protocol and recorded into the patient’s medical record.
175
V)
z о
< a
о о ш
а _j
<
о
(см. табл. 12) в течение 1 мес [1, 2, 42, 138, 139, 148, 158-162] (УУР — С, УДД — 5).
При хронической инфекции АсЫотоЬааег spp. у пациентов с МВ рекомендовано применять ингаляции длительно:
• 1-я линия — колистиметата натрия (раствор для ингаляций);
• 2-я линия — меропенем;
• альтернативная терапия — цефтазидим и тобрами-цин (раствор для ингаляций или капсулы с порошком для ингаляций);
• 3-я линия — для лечения обострений, обусловленных АсЬготоЬаЛег spp., используют комбинацию двух антисинегнойных антибиотиков различных классов [1,2,42,138,139,148,158-160, 162] (УУР — С, УДД — 5).
Антибактериальная терапия микобактериоза Поражение легких, вызванное НТМБ, может представлять серьезную опасность для здоровья пациентов с МВ, однако на современном этапе диагностика и лечение микобактериоза не стандартизированы.
Диагностически значимыми критериями микобактериоза у пациентов с МВ рекомендуется считать положительный мазок на наличие кислотоустойчивых бактерий в материале из дыхательных путей, наличие роста НТМБ или микобактерий туберкулеза на питательных средах, подтверждение одного и того же вида микобактерий как минимум из двух образцов, наличие результатов теста лекарственной чувствительности НТМБ [163-167] (УУР — С, УДД — 5).
При выборе антибиотиков для терапии инфекции НТМБ у пациентов с МВ рекомендовано ориентироваться на тест на лекарственную чувствительность с целью повышения эффективности терапии [165, 166] (УУР — С, УДД — 5). Режимы приема антибиотиков при инфекции НТМБ представлены в табл. 13.
Критерием эффективного лечения НТМБ у пациентов с МВ рекомендовано считать отсутствие роста микобактерий на питательных средах не менее чем в трех последовательно взятых образцах диагностического материала (мокрота) [163-167] (УУР — С, УДД — 5).
Таблица 13. Антибактериальные препараты, применяемые у пациентов с муковисцидозом при высеве из мокроты / бронхиального секрета микобактерий Mycobacterium avium complex и Mycobacterium abscessus complex [2, 164-166] Table 13. Antibacterial drugs used in patients with cystic fibrosis when cultured Mycobacterium avium complex and Mycobacterium abscessus complex from sputum / bronchial secretion [2, 164-166]
Антибактериальный препарат Суточная доза для детей Способ введения Кратность введения
#Амикацин Детям: 15-30 мг/кг Подросткам: 10-15 мг/кг Максимальная доза: 1500 мг В/в 1
#Амикацин 250-500 мг Ингаляционно 2
#Азитромицин Детям: 10-12 мг/кг Подросткам:дозировка для взрослых Максимальная доза: 500 мг Внутрь 1
#Цефокситин 150 мг/кг Максимальная доза: 12 г/день В/в 3-4
#Кларитромицин 7,5 мг/кг Максимальная доза: 500 мг Внутрь 2
Не рекомендуется В/в 2
#Ко-тримоксазол [сульфаметоксазол + триметоприм] 10-20 мг/кг (по триметоприму) Внутрь 2
В/в 2
#Этамбутол Младенцам и детям: 15 мг/кг Подросткам: 15 мг/кг Внутрь 1
#Имипенем + [циластатин] Расчет дозы по имипенему: при массе тела до 40 кг — 60-120 мг/кг Максимальная доза: 2000 мг В/в 2-3
#Линезолид < 12 лет: 10 мг/кг 12 лет и старше: 10 мг/кг Максимальная доза: 600 мг Внутрь 1-2
< 12 лет: 10 мг/кг 12 лет и старше: 10 мг/кг Максимальная доза: 600 мг В/в 1-2
#Моксифлоксацин 7,5-10 мг/кг Максимальная доза: 400 мг/день Внутрь 1
7,5-10 мг/кг Максимальная доза: 400 мг/день В/в 1
< 4
О ae ш Q. Ш
s ас о ш 3-
ас
176
Таблица 13. Окончание Table 13. Ending
Антибактериальный препарат Суточная доза для детей Способ введения Кратность введения
#Миноциклин 2 мг/кг Максимальная доза: 200 мг Внутрь 1-2
#Доксициклин (противопоказан детям до 8 лет) < 12 лет с массой тела < 50 кг: 4 мг/кг 12 лет и старше: 200 мг Внутрь 2
#Рифампицин 10-20 мг/кг Максимальная доза: 600 мг Внутрь 1
Рифабутин 5-10 мг/кг Максимальная доза: 300 мг Внутрь 1
#Стрептомицин 20-40 мг/кг Максимальная доза: 1000 мг В/в В/м 1
#Тигециклин 8-11 лет: 1,2 мг/кг Максимальная доза: 50 мг 12 лет и старше: ударная доза 100 мг, затем — 50 мг В/в 2
от
vH
<N CM О CM
<5
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
О -j
О
О <
s
et <
x
Q.
О et
a ш Q.
Примечание. #Применение лекарственного препарата вне зарегистрированных в инструкции ЛС показаний проводится по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет. Все препараты, применяемые при MAC и MABSC, назначаются вне инструкции (off-label) по жизненным показаниям. Возрастные ограничения указаны в дозировках для детей, расчет приводится в соответствии с Согласованными рекомендациями Американского фонда кистоз-ного фиброза (муковисцидоза) и Европейского общества кистозного фиброза по лечению микобактериоза у пациентов с кистозным фиброзом, рекомендациями по ведению болезней легких, вызванных НТМБ, и другими согласительными документами [2, 164-166]. Note. #The administration of medication outside the indications registered in the drug instructions is performed by the decision of health authorities with the permission of Local Ethical Committee of the medical facility (if any) and with signed informed consent from parents (legal representative) and a child over the age of 15 years. All drugs used at MAC and MABSC are prescribed off-label for vital indications. Age limits are indicated in pediatric dosages calculated according to the American Cystic Fibrosis Foundation and European Cystic Fibrosis Society Guidelines for the treatment of mycobacteriosis in patients with cystic fibrosis, Guidelines for the management of nontuberculous mycobacteria-induced lung diseases, and other consensus papers [2, 164-166].
Антибактериальная терапия микобактериоза, вызванного Micobacterium abscessus complex Учитывая недостаток данных клинических исследований, существует большое разнообразие назначаемых режимов терапии. Общими следует считать следующие согласованные рекомендации по антибио-тикотерапии пациентов с МВ при MABSC [165, 166]. Пациентам с МВ и НТБМ рекомендовано проводить двухфазное лечение микобактериоза, вызванного представителями MABSC, — фаза интенсивного лечения должна сменяться фазой поддерживающего лечения с целью эрадикации данного возбудителя [165, 166] (УУР — C, УДД — 5).
Категорически не рекомендуется применение монотерапии макролидами или иным антимикробным средством при лечении микобактериоза, вызванного НТМБ из группы MABSC, с целью предотвращения развития резистентности НТМБ [164-166] (УУР — C, УДД — 5).
Антибактериальная терапия микобактериозов, вызванных Mycobacterium avium complex Общими следует считать следующие рекомендации по антибиотикотерапии пациентов с МВ, инфицированных МАС [164-166].
В случае с чувствительной к кларитромицину формой поражения НТМБ группы MAC рекомендовано применять лекарственную схему лечения на основе ежедневного перорального приема макролида (предпочтительно ази-тромицина), рифампицина и этамбутола (см. табл. 13) [164, 168] (УУР — С; УДД — 5).
Категорически не рекомендуется применение монотерапии макролидным препаратом или иным антимикробным средством при лечении НТМБЛ группы MAC с целью профилактики развития резистентности [165, 166] (УУР — С; УДД — 5).
В случаях выявления у пациентов с МВ более одного вида НТМБ рекомендуется проводить микробиологическое исследование для определения того, какая/какие из микобактерий выделяются постоянно и какая/какие являются причиной заболевания [169, 170] (УУР — С, УДД — 5).
Пациентов с МВ с заболеваниями легких, вызванными НТМБ, рекомендовано обследовать на предмет АБЛА, так как микобактериозы, нередко сочетаются с АБЛА и/или высевами грибов рода Aspergillus в мокроте или образцах БАЛ [164] (УУР — С, УДД — 5).
Терапия поражений легких,
вызванных грибами рода Aspergillus
Результаты проведенного в НИИ медицинской микологии им. П.Н. Кашкина в 2014-2017 гг. исследования свидетельствуют, что колонизация дыхательных путей Aspergillus spp. возникает у 22% пациентов с МВ, а различные варианты аспергиллеза — у 9,2% [171].
Наиболее частый вариант аспергиллеза у пациентов с МВ — АБЛА. Его частота у подростков и взрослых пациентов с МВ — 10-15%, у детей младшего возраста — реже [38, 39]. ХАЛ развивается у 2-5% пациентов с МВ. Инвазивный аспергиллез легких у пациентов с МВ возникает редко (0,5-1%) [171].
от
vH
см см о см
о §
< s
Q.
<
е
к <
ас о ш х
X Q.
I— <
X
Ч ш
177
V)
z о
< a
о о ш а
_j <
о
< ч
о 2£ ш Q. Ш S 2£ О Ш 3″
ас
Грибы рода Aspergillus могут колонизировать дыхательные пути пациентов с МВ или вызывать, в зависимости от состояния иммунной системы пациента, АБЛА, ХАЛ и инвазивный аспергиллез [17, 37, 68, 69].
При АБЛА и ХАЛ рекомендовано применение анти-микотических препаратов как этиотропной терапии (табл. 14) [17, 37, 68, 69] (УУР — С, УДД — 5).
Терапия аллергического бронхолегочного
аспергиллеза
При АБЛА рекомендовано применение кортикосте-роидов для системного применения и противогрибковых ЛС группы триазолов (вориконазол и итраконазол) [37, 68, 174] (УУР — C, УДД — 5).
Терапия хронического аспергиллеза легких
В качестве лечения ХАЛ у пациентов с МВ рекомендовано использование длительного курса противогрибковых ЛС, лечение фонового заболевания и уменьшение ятрогенной иммуносупрессии, а также хирургическое удаление очагов поражения [15, 17, 18] (УУР — C, УДД — 5).
Терапия внешнесекреторной недостаточности
поджелудочной железы
Заместительную терапию панкреатическими ферментами (панкреатин) в виде мини-микросфер с рН-чувствительным покрытием без применения мета-криловой кислоты [175-179] с или без желатиновой капсулы рекомендовано назначать всем пациентам с МВ, включая новорожденных, имеющим клинические проявления кишечного синдрома или низкую концентрацию панкреатической эластазы 1 в кале (< 200 мкг/г), при отсутствии противопоказаний. Цель вмешательства — коррекция внешнесекреторной панкреатической недостаточности (по клиническим показателям и отсутствию нейтрального жира в копрограмме) [2, 25, 177180] (УУР — B, УДД — 3).
Терапия эндокринной недостаточности
поджелудочной железы (МЗСД)
Терапия диабета при МВ (МЗСД) в целом должна соответствовать стандартам помощи всем пациентам с диабетом, но имеются особые требования к лечению больных МВ [49, 73].
Лечить пациентов с МЗСД рекомендовано у специалистов многопрофильной команды, имеющей опыт работы с МЗСД, и при этом поддерживать контакт и консультироваться со специалистами по МВ с целью эффективного ведения больных с учетом особенностей основной нозологии [49, 73] (УУР — C, УДД — 5).
При лечении МЗСД рекомендуются обучение самостоятельному уходу при диабете, инсулинотерапия и аэробная нагрузка не менее 150 мин в неделю с целью адекватного контроля МЗСД и предотвращения осложнений [49, 73] (УУР — C, УДД — 5).
Также целесообразно соблюдение рекомендаций по питанию пациентов с муковисцидозом для больных с МЗСД. Изменение потребления калорий, жиров, белков, углеводов или соли в результате диагностики диабета не допускается. Рекомендуются равномерное распределение углеводов в течение суток и замена рафинированных на защищенные с целью поддержания нутритивного статуса [49, 73] (УУР — C, УДД — 5).
Лечить МЗСД у пациентов с МВ рекомендуется инсу-линами, а не пероральными гипогликемическими препа-
ратами с целью оптимального контроля уровня глюкозы в крови [49, 73, 181, 182] (УУР — ^ УДД — 5).
Во время обострений легочного процесса рекомендуется чаще проверять уровень гликемии (до 3-6 раз в день), которая повышается на фоне воспаления, и увеличить дозу инсулина — как болюсного, так и базисного — с целью оптимального контроля уровня глюкозы в крови и своевременной коррекции дозы инсулинов [49, 73] (УУР — ^ УДД — 5).
Рекомендуется проведение мониторинга осложнений МЗСД согласно мониторингу других форм диабета для организации профилактических мероприятий [49, 73] (УУР — ^ УДД — 5).
Терапия поражения печени
Пациентам с МВ с целью предотвращения гепатобили-арной патологии и терапии имеющихся поражений печени рекомендуется назначение препаратов урсодезоксихо-левой кислоты (противопоказание до 3 лет для капсул, нет противопоказаний для суспензии для приема внутрь) при отсутствии медицинских противопоказаний [1, 2, 20, 183, 184] (УУР — ^ УДД — 5).
При развитии хронической печеночной энцефалопатии, асцита, варикозно расширенных вен пищевода и желудка 3-4-й степени и кровотечения из них рекомендовано проводить терапию согласно соответствующим клиническим рекомендациям [2, 184, 185] (УУР — С; УДД — 5).
Терапия остеопороза
у пациентов с муковисцидозом
Задачами лечения остеопороза являются предотвращение переломов костей, повышение качества жизни, замедление или прекращение потери костной массы, у детей — обеспечение нормального роста. Рекомендовано лечение основного заболевания при вторичном остеопорозе у пациентов с МВ [34, 76, 102, 186] (УУР — С, УДД — 5).
Колекальциферол, в том числе в форме капель для приема внутрь, рекомендован всем пациентам с МВ в качестве терапии недостаточности витамина D. Прием один раз в день ежедневно или один раз в неделю (в эквивалентных дозах) для поддержания концентрации 25(ОНр сыворотки не менее 30 нг/мл [76, 187-189] (УУР — С, УДД — 5).
Терапию остеопороза при МВ рекомендовано проводить согласно клиническим рекомендациям по остеопо-розу [34, 102, 186] (УУР — С, УДД — 5).
Терапия хронического риносинусита
и назального полипоза
При наличии ХРС рекомендуется ирригационная терапия [99, 190] (УУР — А, УДД — 1).
При наличии назального полипоза рекомендуется терапия кортикостероидами в виде назального спрея [76, 191, 192] (УУР — А, УДД — 1). Доказана эффективность в отношении уменьшения размера полипов; предпочтение следует отдавать кортикостероидам в виде назального спрея с наименьшей степенью системной абсорбции (мометазона фуроат в дозе 400 мкг/сут у взрослых, 200 мкг/сут у детей с 2 лет, длительными курсами от 2 до 12 мес, в некоторых случаях — дольше), в т.ч. после ринохирургического лечения.
Терапия хронического полипозного риносинусита проводится дорназой альфа (см. раздел «Муколитическая терапия»).
178
Таблица 14. Антимикотики, применяемые при аллергическом бронхолегочном аспергиллезе и хроническом аспергиллезе легких [17, 37, 68, 69]
Антимикотик Суточные дозы для детей Путь введения Кратность приема в день
#Вориконазол (противопоказан детям до 2 лет) 18 мг/кг Внутрь 2
#Вориконазол (противопоказан детям до 2 лет) 18 мг/кг в 1-е сут, затем 16 мг/кг В/в 2
#Итраконазол таблетки (противопоказаны детям до 3 лет) До 12 лет: 5 мг/кг Старше 12 лет: 200 мг Внутрь 2
#Позаконазол таблетки — Внутрь 1 (в первый день — 2 раза в день)
#Позаконазол суспензия для приема внутрь (противопоказан детям до 13 лет) — Внутрь 2-4
#Каспофунгин (противопоказан детям до 3 мес жизни) 70 мг/м2 в 1-й день, затем по 50 мг/м2 (суточная доза не выше 70 мг) В/в 1
#Амфотерицин В [липосомальный] 3-5 мг/кг/сут В/в 1
#Амфотерицин В [липидный комплекс] 5 мг/кг/сут В/в 1
#Амфотерицин В 0,6-1,0 мг/кг/сут В/в 1
#Амфотерицин В [липосомальный] форма для инъекционного применения (противопоказан детям до 1 мес жизни) 12,5 мг #Ингаляционно через небулайзер1- 2 2 раза в неделю
#Амфотерицин В [липидный комплекс] (форма для инъекционного применения) 12,5 мг #Ингаляционно через небулайзер1′ 2 2 раза в неделю
от
vH
<N Cl О Cl
«5 О -1 О
о <
ш
ее <
х
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Q.
О ее
а ш а.
Примечание. #Применение лекарственного препарата у детей вне зарегистрированных в инструкции ЛС показаний проводится по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законных представителей) и ребенка в возрасте старше 15 лет; 1 — применение лекарственных форм для парентерального применения в виде ингаляций разрешается консилиумом специалистов по жизненным показаниям, с разрешения Локального этического комитета медицинской организации, при наличии подписанного информированного согласия родителей (опекуна) и ребенка в возрасте старше 15 лет, в условиях специализированного стационара. В дальнейшем при хорошей переносимости прием препарата разрешен в амбулаторных условиях; 2 — ингаляции #амфотерицина В [липосомального] или #амфотерицина В [липидного комплекса] могут быть альтернативой или дополнительной противогрибковой терапией в лечении AБЛA при недостаточной эффективности терапии системными антимикотиками, непереносимости азольных ЛС или при потенциально опасных лекарственных взаимодействиях [138, 172, 173]. При наличии медицинских показаний (по жизненным показаниям, включая индивидуальную непереносимость, далее — по жизненным показаниям) по решению врачебной комиссии осуществляется назначение лекарственных препаратов не по международному непатентованному наименованию, а по торговому наименованию (ч. 15 ст. 37 Федерального закона от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации» и п. 6 Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения, утвержденного приказом Минздрава России от 14 января 2019 г. № 4н). Решение врачебной комиссии оформляется протоколом и вносится в медицинскую документацию пациента. При использовании #вориконазола и других средств группы триазолов всегда следует учитывать возможность лекарственных взаимодействий. Например, при назначении #вориконазола следует отменить рифампицин или другие индукторы ферментов цитохрома Р-450 (ингибиторы протонной помпы, карбамазепин, фени-тоин), поскольку в этих случаях терапевтическая концентрация #вориконазола в плазме и тканях обычно не достигается. У пациентов, получающих длительную терапию #вориконазолом, могут развиться кожные реакции фоточувствительности. Во время лечения пациентам рекомендуется избегать интенсивного или длительного облучения прямым солнечным светом.
Note. #The administration of medication outside the indications registered in the drug instructions is performed by the decision of health authorities with the permission of Local Ethical Committee of the medical facility (if any) and with signed informed consent from parents (legal representative) and a child over the age of 15 years; 1 — administration of medications for parenteral use in the form of inhalations is allowed by specialists council for vital indications, with the permission of Local Ethical Committee of the medical facility (if any) and with signed informed consent from parents (legal representative) and a child over the age of 15 years, within special hospitals. Lately, in case of good tolerance, the medication is allowed within outpatient clinics; 2 — inhalation of #amphotericin B [liposomal] or #amphotericin B [lipid complex] may be an alternative or additional antifungal therapy in the treatment of allergic bronchopulmonary aspergillosis in case of lack of efficacy of systemic antimycotic therapy, intolerance to aerosol therapy, or in case of potentially dangerous drug-drug interaction [138, 172, 173]. If clinically indicated (for vital indications, including individual intolerance, hereinafter — for vital indications) and by decision of health authorities, medications are prescribed not by the international nonproprietary name but by the commercial name (part 15 of art. 37 of the Federal Law dated November 21, 2011 № 323 «On fundamental healthcare principles in the Russian Federation» and paragraph 6 of the Procedure for prescribing drugs, prescription forms for drugs, procedure for issuing these forms, its accounting and storage, approved by the Order of the Ministry of Health of Russian Federation, dated January 14, 2019 № 4н). The decision of health authorities is drawn up by the protocol and recorded into the patient’s medical record. We should consider the possibility of drug-drug interactions at administration of #voriconazole or other medications from triazole group. For example, when prescribing #voriconazole, rifampicin or other inducers of cytochrome R-450 enzymes (proton pump inhibitors, carbamazepine, phenytoin) should be discontinued, since the therapeutic concentration of #voriconazole in plasma and tissues cannot be usually achieved in these cases. Patients receiving long-term #voriconazole therapy may develop cutaneous photosensitivity reactions. Thus, patients are advised to avoid intense or prolonged exposure to direct sunlight during the treatment.
от
vH
Cl Cl О Cl
О §
< s
Q.
<
e
к <
2£ О Ш X
s
Q.
I— <
S
4 ш
179
V)
г о
< а
о о ш а
_1 <
о
< ч
о 2£ ш а. ш 5 2£
С
Ш 3″
2£
Терапия дыхательной недостаточности
Дыхательная недостаточность — это патологический синдром, при котором парциальное напряжение кислорода в артериальной крови меньше 80 мм рт. ст. ^р02 95%) и/или парциальное напряжение углекислого газа больше 45 мм рт. ст.
По времени развития различают острую (нарастание симптомов в течение часов или дней) и хроническую (в течение недель или месяцев) дыхательную недостаточность. С клинической точки зрения целесообразно еще выделять острую дыхательную недостаточность на фоне хронической.
Причина развития хронической дыхательной недостаточности у пациентов с МВ — структурные изменения легких, которые развиваются вследствие хронического бронхолегочного процесса и приводят к снижению абсолютной площади газообмена. Причина развития острой дыхательной недостаточности — обострение хронического гнойного бронхолегочного процесса в легких, легочное кровотечение, пневмоторакс. Причины могут быть и общими, в частности развитие вирусной пневмонии в разгар эпидемии гриппа.
Другим важным компонентом в развитии дыхательной недостаточности у пациентов с МВ является слабость и утомление дыхательной мускулатуры, очень часто сопровождающие тяжелое течение заболевания.
Проведение кислородотерапии рекомендовано при Ра02 < 55 мм рт. ст. в покое или при Ра02 < 60 мм рт. ст. в покое, но при наличии отеков, полицитемии, легочной гипертензии [105, 106] (УУР — С, УДД — 5). «Золотой стандарт» диагностики нарушений газообмена — анализ крови на кислотно-основное состояние с забором из лучевой артерии.
• Кислородотерапия рекомендована не менее 15-24 ч
в день.
• Целевой уровень: SpO2 90-92%.
При гиперкапнической дыхательной недостаточности у пациентов с МВ рекомендована неинвазивная вентиляция легких [193-195]. Цель ее проведения — нормализация или улучшение газообмена. К положительным эффектам также можно отнести эффект улучшения дренажа мокроты за счет значительного улучшения коллатеральной вентиляции [196, 197] (УУР — С, УДД — 5).
Консервативная терапия мекониевого илеуса
Выделяют две формы мекониевого илеуса.
Неосложненная форма — плотный меконий формируется внутриутробно и забивает дистальные отделы тонкой кишки, вызывая дилатацию проксимальных, утолщение кишечной стенки и кишечную непроходимость. При неосложненном мекониевом илеусе возможна консервативная терапия.
Осложненная форма обструкции кишки приводит к сегментарному завороту, атрезии, некрозу или перфорации кишки, мекониевому перитониту или образованию гигантской мекониевой псевдокисты. Осложненный мекониевый илеус всегда требует экстренного хирургического лечения [20, 115].
Консервативная терапия мекониевого илеуса для ликвидации непроходимости кишечника у пациентов с МВ может быть рекомендована при соблюдении необходимых условий:
• отсутствие рентгенологических признаков хирургических осложнений;
• отсутствие патологического отделяемого из желудка;
• отсутствие болевого синдрома;
• компенсированный метаболический и волемический статус [100, 198, 199] (УУР — С, УДД — 5).
Консервативная терапия синдрома дистальной интестинальной обструкции
Для лечения СДИО у пациентов с муковисцидозом с целью восстановления пассажа кишечника при отсутствии признаков кишечной непроходимости рекомендуются применение больших доз ацетилцистеина (6001200 мг/сут), лактулозы (от 5 до 45 мл/сут) в 3 приема в зависимости от возраста, обильное питье, гиперосмо-лярные растворы, нормализация режима и дозировки приема панкреатических ферментов [1, 2, 200, 201] (УУР — С, УДД — 5).
Терапия псевдо-Барттер-синдрома
Лечение развившегося ПБС у пациентов с МВ рекомендовано проводить препаратами калия хлорида, калийсбе-регающими диуретиками для профилактики электролитных нарушений [1, 2 ,42, 72] (УУР — С, УДД — 5).
Патогенетическая терапия (ивакафтор + лумакафтор)
Рекомендуется применение комбинации ивакафтор + лумакафтор (ивакафтор (потенциатор белка МВТР) + лумакафтор (корректор белка МВТР)) у пациентов с МВ, гомозиготных по мутации F508del в гене CFTR, с целью патогенетического лечения, повышения количества активного белка МВТР на поверхности клеток экзокринных желез, повышения легочной функции, снижения частоты легочных обострений и замедления прогрессирования заболевания [95, 202, 203] (УУР — А, УДД — 1). Комбинация ивакафтор + лумакафтор показана для лечения МВ у пациентов в возрасте 2 лет и старше (эффективность и безопасность комбинации ивакафтор + лумакафтор установлена только у пациентов с МВ, гомозиготных по мутации F508del в гене CFTR). При отсутствии данных о гетерозиготном носительстве мутации F508del у родителей рекомендуется дополнительное обследование (см. раздел «Лабораторные диагностические исследования»).
Терапия препаратами других групп и/или по особым показаниям
Для терапии МВ применяется ряд лекарственных препаратов других фармакотерапевтических групп. Как правило, решение о назначении этих ЛС должно приниматься специалистами медицинской организации федерального уровня на основании индивидуальных показаний.
Рекомендуется рассмотреть назначение кортикосте-роидов для системного применения при:
• тяжелом течении, обусловленном частыми обострениями с явлениями выраженной дыхательной недостаточности;
• длительном воспалительном процессе, осложненном образованием ателектатических изменений в легких;
• выраженном и стойком обструктивном синдроме, рефрактерном к действию в2-агонистов;
• АБЛА [1, 2, 20] (УУР — С, УДД — 5).
Пациентам с МВ и хронической синегнойной инфекцией в качестве противовоспалительных ЛС рекомендовано назначение макролидов (кларитромицин, азитро-мицин) с целью замедления прогрессирования снижения легочной функции [1, 2, 6, 20, 139, 204-207]:
• азитромицин в дозе 250 мг (пациентам с массой тела менее 40 кг) и 500 мг (пациентам с массой тела 40 кг
180
и более) через два дня на третий между приемами пищи, длительность терапии индивидуальна у каждого больного [2, 139, 204-206] (УУР — С, УДД — 5); • кларитромицин в дозе 125 мг (пациентам с массой тела менее 40 кг) или 250 мг (пациентам с массой тела 40 кг и более) через день независимо от приема пищи [2, 139, 207] (УУР — С, УДД — 4). Нестероидные противовоспалительные препараты в настоящее время могут рассматриваться как альтернатива кортикостероидам для системного применения с противовоспалительной целью. Однако это касается только ибупрофена. Методика назначения: ибупрофен назначается в дозе 20-30 мг на 1 кг массы тела дважды в день детям в возрасте от 6 лет. Максимальная суточная доза для взрослых составляет 1,2 г. Максимальная суточная доза для детей и подростков в возрасте от 12 до 17 лет — 1 г [1, 2, 20, 208-210] (УУР — А, УДД — 1).
Ацетилцистеин рекомендуется в дозе 1200 мг/сут у пациентов старше 12 лет и в дозе 600 мг/сут у детей младше 12 лет в 2 приема непрерывно с первого дня применения амикацина в течение всего курса и 7 дней после его окончания (минимум 6 нед) для снижения ото-токсичности. Препарат имеет отчетливый слухосохра-няющий эффект при аминогликозид-связанной потере слуха, понижает риск ототоксичности на 80% и предупреждает развитие антибиотикорезистентности, является антиоксидантом [2] (УУР — С, УДД — 5).
Кинезитерапия
Всем пациентам с МВ в обязательном порядке рекомендовано проведение кинезитерапии по индивидуальной программе (методики дренирования бронхиального дерева и лечебная физкультура) с целью улучшения эвакуации мокроты [1, 2, 20, 195, 211] (УУР — С, УДД — 5).
Пациентам с МВ рекомендуются регулярные занятия лечебной физкультурой с целью улучшения эвакуации мокроты, укрепления дыхательной мускулатуры, повышения эмоционального тонуса [1, 2, 20, 211] (УУР — С, УДД — 5).
Диетотерапия и витаминотерапия Общие принципы диетотерапии у пациентов смуковисцидозом
Диетотерапия составляет важную часть комплексной терапии при МВ [1, 2, 20].
Потребность в энергии у детей и взрослых с МВ, по данным различных источников, должна быть повышена до 120-150% по сравнению с теоретическими расчетами на фактическую массу тела в зависимости от возраста и нутритивного статуса пациента. 35-40% всей энергетической потребности должно обеспечиваться жирами, 20% — белками и 60-65% — углеводами [61] (УУР — С, УДД — 5). Пациентам с МВ необходима ранняя нутритивная поддержка. Установлена непосредственная связь между состоянием питания и функцией легких. Существует прямая корреляция между показателем ИМТ, функцией легких и продолжительностью жизни.
Для обеспечения повышенных энергетических потребностей калорийность суточного рациона пациентам с МВ рекомендуется рассчитывать не на фактическую, а на долженствующую массу тела с учетом катаболических процессов при хроническом воспалении и исходя из дефицита массы тела [2, 61] (УУР — С, УДД — 5).
При тяжелой дыхательной недостаточности 50-60% небелковых калорий должно приходиться на жиры (имеют наименьший дыхательный коэффициент — 0,7) [212].
Существуют довольно сложные формулы для расчета необходимых дополнительных калорий, однако в повседневной практике можно пользоваться следующими ориентирами:
• 1-2 года — 200 ккал,
• 3-5 лет — 400 ккал,
• 6-11 лет — 600 ккал,
• старше 12 лет и для взрослых — 800 ккал/сут [1].
Недостаточность питания рекомендуется диагностировать, если процент соответствия массы по росту и полу или массо-ростовой индекс, фактическая масса / идеальная масса по росту и полу х 100% меньше 90% у пациентов детского возраста, а у подростков и взрослых — если ИМТ составляет менее 18,5 кг/м2. Ведение пациентов с МВ осуществляют в зависимости от их физического статуса. При показателях г-критерия по ИМТ от -1 до -2 следует диагностировать среднетя-желую недостаточность питания, а при > -2 — тяжелую недостаточность питания [154] (УУР — С, УДД — 5).
Рекомендованная цель нутритивной поддержки при МВ — обеспечить физическое развитие пациента согласно возрастным нормам (достижение показателей физического развития в границе 25-75-й перцентили после коррекции нутритивного статуса, рекомендуемая цель — 50-й перцентиль) [61] (УУР — С, УДД — 5).
Дети первого года жизни
Грудное вскармливание
Идеальным для новорожденных и детей первого года жизни является непастеризованное грудное материнское молоко, так как оно содержит широкий спектр защитных факторов и биологически активных веществ. Важную роль играет активность термолабильной липазы в нативном (непастеризованном) женском молоке. Для детей с МВ показана защитная роль естественного вскармливания: младенцы, получающие грудное молоко, имеют лучшие показатели легочных функций и низкую частоту инфекционных эпизодов по сравнению с детьми на искусственном вскармливании. Новорожденные и дети первых месяцев жизни, которые не могут самостоятельно высасывать необходимый объем молока из груди ввиду тяжести состояния (общая слабость, одышка, сердечно-легочная недостаточность), должны получать сцеженное непастеризованное материнское молоко из бутылочки или через назогастральный зонд.
В некоторых случаях требуется дополнительное поступление энергии с помощью обогащения грудного молока. Так, при недостаточной прибавке массы тела молоко можно обогащать добавлением на каждые 100 мл приблизительно 5 г (1 мерная ложка) сухой смеси на основе гидролизата белка со среднецепочечными триглицеридами (СЦТ).
Детям грудного возраста с МВ и панкреатической недостаточностью рекомендуется назначать ферментную заместительную терапию препаратами панкреатина (в виде мини-микросфер) в каждое кормление с целью коррекции панкреатической недостаточности [2, 61] (УУР — С, УДД — 5). С момента введения неонатального скрининга на МВ в России (2006 г.) появилась возможность раннего начала лечения, однако вопрос, когда и кому начинать заместительную терапию панкреатическими ферментами, не всегда ясен. Уровень панкреатической эластазы 1 в стуле в течение первого года жизни может существенно варьировать, и однократного его измерения не всегда достаточно. Следует ориентироваться на темпы прибавки в массе и показатели копро-граммы (наличие стеатореи) [61].
от
тН
сч» см о см
«5
о -1 О
О <
ш
ее <
х а.
О
ее
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
о ш а.
от
см см о см
о §
< г
а.
<
в
к <
2£ О Ш X X
а.
I— <
х Ч ш
181
V)
г о
< а
о о ш а
_1 <
о
А
ч
о
К
ш а. ш х
К С
ш 3-
К
Смешанное/искусственное вскармливание У детей, сохраняющих удовлетворительные темпы физического развития, могут использоваться обычные адаптированные молочные смеси.
При смешанном/искусственном вскармливании большинство младенцев в случае своевременной диагностики панкреатической недостаточности и ее коррекции панкреатическими ферментами хорошо растут и развиваются при использовании обычных адаптированных молочных смесей с преобладанием сывороточных белков в составе белкового компонента (60 : 40) [61].
У детей первого года жизни с МВ не рекомендуется использовать заменители молока с низким содержанием белка (1,1-1,3 г/100 мл) и жира (менее 3,5 г/100 мл), так как они не обеспечивают нутритивные потребности таких пациентов [213] (УУР — ^ УДД — 5).
При недостаточной прибавке массы тела у пациентов с МВ рекомендуется отдавать предпочтение высококалорийным смесям, имеющим в качестве жирового компонента СЦТ и растительные жиры в эмульгированной форме, что позволяет улучшить утилизацию жира и снизить дозу панкреатических ферментов [214] (УУР — ^ УДД — 5).
Рекомендовано назначение смесей на основе гидро-лизатов молочного белка при аллергии к белкам коровьего молока и временно — после оперативного вмешательства по поводу мекониевого илеуса или СДИО либо других оперативных вмешательств на кишечнике с лечебной целью [213] (УУР — ^ УДД — 5).
Пациентам, получающим массивную антибактериальную терапию, а также повторные курсы антибиотиков рекомендовано ввести адаптированную кисломолочную смесь или смесь, обогащенную пробиотиками, в количестве до 1/3 суточного объема кормления для поддержания нормальной микрофлоры кишечника [213] (УУР — ^ УДД — 5).
Прикорм рекомендуется вводить в 4-5 мес (как и в популяции здоровых детей), а некоторым детям, при низкой прибавке в массе, — раньше с целью коррекции данных нарушений [213] (УУР — ^ УДД — 5).
Питание дошкольников и школьников и взрослых
Стандартные принципы питания одинаковы для детей, подростков и взрослых.
Основной принцип — «активный» подход к питанию пациента с МВ в любом возрасте:
• питание ребенка должно быть регулярным (6 раз в день даже для школьников, а также для взрослых, формула 3 + 3): 3 основных приема пищи (завтрак, обед, ужин) и 3 дополнительных перекуса (второй завтрак, полдник, на ночь);
• питание должно быть «плотным»: в каждый основной прием пищи должны включаться блюда, содержащие качественные животные белки, цинк (мясо, субпродукты, рыба, яйца или молочные продукты — сыр, творог), качественные жиры (растительное, сливочное масло, сметана, сливки), сложные (крупы, хлеб, овощи) и в меньшей степени простые (фрукты, сладости, варенье, мед) углеводы;
• дополнительные приемы пищи (перекусы: второй завтрак, полдник, перед сном) обязательны; они состоят, как правило, из кисломолочных продуктов, творога, фруктов, выпечки и умеренного количества сладостей.
При муковисцидозе до 10% пациентов к подростковому возрасту формируют фиброз и цирроз печени; до 13% пациентов к 20-летнему возрасту и до 50%
к 30 годам — МЗСД. Поэтому, несмотря на то, что при МВ, при отсутствии аллергических реакций, в международных рекомендациях разрешены любые продукты, некоторые блюда не рекомендуется употреблять постоянно и в больших количествах:
• продукты и блюда, осложняющие работу печени и желчевыводящих путей — тугоплавкие и трансжиры (см. выше), крепкие бульоны, острые, кислые блюда и пряности;
• продукты промышленного производства, содержащие большое количество стабилизаторов, искусственных красителей и консервантов, майонез промышленного производства;
• т.н. «мусорную пищу», готовые сухие полуфабрикаты, фастфуд;
• сладкие газированные напитки и неразбавленные фруктовые напитки промышленного производства;
• в большом количестве и отдельно от других приемов пищи — рафинированные простые углеводы (сахар, конфеты) с целью не допускать резкого подъема уровня гликемии;
• при диспепсических явлениях — большие объемы продуктов, усиливающих газообразование в кишечнике: цельнозерновой и отрубной хлеб, свежую и кислую белокочанную, краснокочанную капусту, бобовые, свеклу, кожицу и семечки от фруктов, орехи, грибы. При бронхолегочных обострениях, значительном
отставании в массе тела для увеличения поступления энергии, высококачественного белка, витаминов и минеральных веществ в качестве перекусов рекомендуется использовать специализированные высокоэнергетические коктейли или смеси для энтерального питания [2, 61] (УУР — ^ УДД — 5).
Рекомендовано обогащение рациона полиненасыщенными жирными кислотами, кальцием, пробиотиками для восполнения повышенных нутритивных потребностей пациентов с МВ. С целью обогащения рациона оме-га-3 жирными кислотами рекомендовано использовать слабосоленую (не копченую) жирную морскую рыбу: сельдь, семгу, форель и другие лососевые, икру 3-4 раза в неделю в качестве закуски [61] (УУР — ^ УДД — 5).
Растительное масло (льняное, тыквенное, кедровое, масло грецкого ореха, соевое, рапсовое, подсолнечное, кукурузное, оливковое) рекомендуется использовать в нерафинированном виде без термической обработки, добавляя в салаты и готовые овощные блюда, для приготовления домашнего майонеза с целью обогащения рациона полиненасыщенными жирными кислотами и биологически активными веществами [2, 61] (УУР — C, УДД — 5).
Пациентам с МВ рекомендуется ежедневно употреблять в качестве основного источника кальция и высококачественного белка необезжиренные молоко, творог, сыр, кисломолочные продукты, обогащенные живыми штаммами пробиотиков (бифидобактерий и лактобак-терий) — йогурты короткого срока хранения, биокефир и т.п. [1, 2] (УУР — ^ УДД — 5).
При формировании МЗСД, рекомендуется калорийность рациона и содержание жиров сохранять повышенными для восполнения повышенных нутритивных потребностей пациентов с МВ [1, 2, 49, 73] (УУР — ^ УДД — 5).
Микронутриенты и витамины
Всем детям с МВ рекомендовано подсаливание пищи с целью коррекции баланса хлора и натрия (табл. 15) [2, 61] (УУР — ^ УДД — 5).
182
Таблица 15. Суточные потребности в соли (NaCl) у детей с муковисцидозом [2, 61] Table 15. Daily salt requirements (NaCl) in children with cystic fibrosis [2, 61]
Масса тела ребенка / температура окружающей среды < 5 кг 5-10 кг > 10 кг
20 °С 0,8 г/день 0,5 г/день Минимум + 0,8 г/день/10 кг
25 °С 1,5 г/день 2 г/день Минимум 2 г/день + 1 г/день/10 кг
30 °С 2,8 г/день 4 г/день Минимум 4 г/день + 2 г/день/10 кг
Примечание. Старшие дети, как правило, сами регулируют количество соли в своих блюдах по принципу «солонка на столе». Note. Older children usually regulate the amount of salt in their dishes themselves on the principle of «salt on the table».
Всем пациентам с МВ рекомендовано дополнительное введение препаратов кальция с целью профилактики недостаточности кальция в организме и остеопениче-ских состояний [2, 61] (УУР — С, УДД — 5).
Всем пациентам с МВ рекомендовано назначение жирорастворимых витаминов с целью восполнения дефицита их поступления с пищей на фоне мальди-гестии и мальабсорбции [2, 61, 76, 214] (УУР — С, УДД — 5).
«Агрессивные»методы нутритивной поддержки у пациентов с муковисцидозом
К «агрессивным» методам нутритивной поддержки у пациентов с МВ относятся:
1) зондовое энтеральное питание в виде ночной гипералиментации через назогастральный зонд или через перкутанную гастростому (трубки питательные гастростомические и еюнальные М1С, MIC-KEY с принадлежностями). С помощью ночной гипералиментации при адекватном контроле панкреатическими заменителями можно дополнительно обеспечить от 30 до 50% рассчитанной энергопотребности [9];
2) парентеральное питание:
• полное (центральный венозный катетер); показаниями являются:
— состояния после операции на кишечнике;
— синдром короткой кишки;
— острый панкреатит;
• частичное (с целью дополнительного питания), используется периферическая вена:
— жировые эмульсии;
— глюкозо-аминокислотные смеси, витамины. Рекомендовано применение «агрессивных» методов
нутритивной поддержки при:
• отсутствии прибавки массы тела или ее снижении в течение 6 мес;
• фактической массе тела ниже 3-го перцентиля;
• фактической массе тела ниже должного значения на 15% или менее 25-го перцентиля на фоне дополнительного питания специальными смесями [2, 20, 61] (УУР — С, УДД — 5).
«Агрессивные» методы нутритивной поддержки показали весьма высокую эффективность, в особенности у пациентов с МВ с выраженными нарушениями нутри-тивного статуса. Однако оптимальные методики, схемы применения, виды и способы введения питательных смесей, способы заместительной ферментной терапии при проведении зондовой гипералиментации нуждаются
в дальнейшей отработке в практике отечественной пульмонологии и педиатрии.
Показано, что только применение энтерального зон-дового питания через гастростому достоверно приводит к улучшению нутритивного статуса пациентов с МВ.
Компьютерные программы для подбора диеты
и ферментной терапии для врачей и пациентов
Разработаны программы для ЭВМ, которые направлены на оптимизацию комплексной терапии МВ и применяются в ряде регионов Российской Федерации [215]. Программа ЭВМ «Мониторинг нутритивного статуса, рациона питания и ферментной терапии при муковисцидозе» позволяет сократить трудозатраты врача при расчетах индивидуальной диеты и дозы заместительной ферментной терапии. Мобильная версия программы ЭВМ «Мониторинг нутритивного статуса, рациона питания и ферментной терапии при муковисцидозе. Мобильная версия» помогает пациентам самостоятельно подбирать дозу ферментов на каждый прием пищи, в режиме онлайн передавать данные (в деперсонализированном виде) о физическом развитии, рационе питания, дозах панкреатина для консультации с лечащим врачом, обучает самоконтролю над своим заболеванием. Использование данных программ показало свою эффективность в клинической практике [215-218].
Хирургическое лечение
При неэффективности консервативных методов, нарастании эпизодов кровохарканья и развитии легочных кровотечений пациентам с МВ рекомендовано хирургическое пособие с целью остановки кровотечения [169, 196, 219, 220] (УУР — С, УДД — 5).
Рекомендуется эндоскопическое хирургическое лечение ХРС на фоне МВ при выраженном затруднении носового дыхания за счет назального полипоза и/или медиализации латеральной стенки полости носа; не купируемом консервативными методами обострении инфекционно-воспалительного процесса в ОНП, который рассматривается в качестве важной причины контаминации бронхолегочной системы; развитии синусоген-ных орбитальных и/или внутричерепных осложнений; необходимости санации полости носа и ОНП перед ТЛ [221-224] (УУР — В, УДД — 3).
Пациента с МВ в терминальной стадии цирроза печени, но с относительно сохранной функцией внешнего дыхания необходимо направить к врачу-трансплантологу
о
vH
<N CM О CM
«5 О -1 О
О <
ш
ее <
х
Q.
О ее
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
о ш Q.
О
vH
CM CM О CNI
О §
< s
Q.
<
в
К <
2£ О ш X X Q.
I— <
X
Ч ш
183
V)
z о
< a
о о ш а
_j <
о
< ч
о 2£ ш Q. Ш S 2£ О Ш 3″
ас
для оценки возможности проведения трансплантации печени [1, 2, 20] (УУР — C, УДД — 5).
Хирургическое лечение мекониевого илеуса
Пациентам с МВ и мекониевым илеусом при отсутствии возможности консервативного лечения или при его неэффективности рекомендуется проведение оперативного лечения с целью разрешения кишечной непроходимости и предотвращения осложнений [100, 199, 225] (УУР — C, УДД — 4).
Трансплантация легких
Пациента с МВ тяжелого течения, торпидного к терапии, c частыми обострениями и осложнениями рекомендовано направить к врачу-трансплантологу для решения вопроса о проведении ТЛ [226] (УУР — C, УДД — 5).
В мировой практике ТЛ является общепризнанным методом лечения пациентов в терминальной стадии заболеваний легких различной этиологии. Среди показаний к ТЛ у пациентов старше 18 лет МВ занимает третью позицию, уступая ХОБЛ и легочному фиброзу, и занимает первое место у пациентов детского возраста от 6 до 17 лет. ТЛ при тщательном отборе пациентов достоверно улучшает показатели выживаемости и качество жизни. Медиана продолжительности жизни пациентов после ТЛ по поводу МВ характеризуется наилучшими показателями при сравнении с другими заболеваниями и составляет более 11 лет.
ПРОФИЛАКТИКА
Способов первичной профилактики МВ не существует. В качестве мер вторичной профилактики этого заболевания выступают:
1) дородовая диагностика;
2) неонатальная диагностика МВ.
Всем пациентам с МВ, планирующим деторождение, рекомендуется консультация врача-генетика и моле-кулярно-генетическое обследование супруги/супруга на носительство мутаций гена CFTR. В случае обнаружения патогенных вариантов рекомендуется ПГТ-М на МВ [2, 79, 107, 227] (УУР — C, УДД — 5).
Профилактика псевдо-Барттер-синдрома
Рекомендованы следующие меры для профилактики ПБС:
• своевременная диагностика муковисцидоза;
• информирование родителей о симптомах ПБС;
• контроль уровня электролитов крови, особенно у детей раннего возраста;
• профилактическое назначение натрия из расчета 1-2 ммоль/кг/сут в виде поваренной соли (1/5-1/6 чайной ложки примерно соответствует 15 ммоль NaCl), солевых растворов, предназначенных для пер-оральной регидратации [2] (УУР — C, УДД — 5).
Вакцинация
Известно, что дети с МВ являются группой риска по развитию инфекционных заболеваний и носитель-ства таких микроорганизмов, как S. aureus, H. influenzae, S. pneumoniae, мукоидных и немукоидных форм P. aeruginosa и Burkholderia cepacia complex. Высока распространенность среди этих детей сопутствующей хронической патологии, усугубляющей тяжесть течения инфекции и предрасполагающей к возникновению различных осложнений. Профилактика инфекций у пациентов с МВ должна осуществляться не эпизодически, а путем планомерного выполнения мероприятий, предупреждающих
распространение инфекции, а также мер, повышающих общую и специфическую сопротивляемость организма. Эффективным средством в предупреждении инфекционной заболеваемости является вакцинопрофилактика.
Рекомендовано проведение вакцинации согласно НКПП и календарю профилактических прививок по эпидемическим показаниям. Вакцинировать детей рекомендуется в фазу ремиссии, на фоне стабильного соматического состояния и проводимой терапии [228-231] (УУР — C, УДД — 5).
Пациенты с хроническим гепатитом, в т.ч. с начинающимся циррозом печени, могут быть привиты в периоде ремиссии или низкой активности заболевания на фоне выраженного снижения уровня трансаминаз до максимально достижимых величин [230].
Терапия кортикостероидами для системного применения приводит к выраженной иммуносупрессии лишь при использовании высоких доз (преднизолон
> 2 мг/кг/сут или 20 мг/сут для ребенка массой тела
> 10 кг) в течение 14 дней и более. Таким детям убитые вакцины вводятся в обычные сроки по выздоровлении, живые вакцины вводят не ранее, чем через 1 мес от окончания лечения. Как живые, так и инактивирован-ные вакцины вводят в обычном порядке лицам, получающим стероидные препараты: кратковременно (до 1 нед) любые дозы; курсами длительностью до 2 нед низкие или средние (до 1 мг/кг преднизолона) дозы; длительно поддерживающие дозы (например, 5-10 мг преднизолона через день); в качестве заместительной терапии низкие (физиологические) дозы; местно — накожно, инга-ляционно, в виде глазных капель, внутрь сустава [230].
Пациентам, которым планируется проведение трансплантации органов (печень, легкие), следует провести вакцинацию до операции в связи с дальнейшим применением цитостатической терапии по общепринятым при трансплантации органов рекомендациям [228, 230, 232].
Рекомендована вакцинация пациентов с МВ против пневмококковой инфекции с целью предотвращения инфекций, вызванных S. pneumoniae [228, 230, 232238] (УУР — C, УДД — 5). Для вакцинации детей до 2 лет используется пневмококковая конъюгированная вакцина (ПКВ13). Схема зависит от возраста начала иммунизации. У детей старше 2 лет возможно применение пневмококковой полисахаридной вакцины (ППВ23) однократно, с повторным введением через 3-5 лет.
Рекомендована вакцинация против гриппа с целью предотвращения сезонного гриппа и, соответственно, обострения хронического воспалительного процесса в легких и ОНП у пациентов с МВ [232, 237, 239-241] (УУР — C, УДД — 5). Вакцинация против гриппа всех возрастных групп проводится 3- и 4-валентными инакти-вированными вакцинами 1 раз в год, осенью, до начала эпидемии гриппа. Детям дошкольного возраста, которые первый раз начали вакцинироваться против гриппа, необходимо введение двух доз по 0,25 мл с интервалом 4 нед.
Рекомендована вакцинация против гемофильной инфекции типа b с целью предотвращения инфекций, вызванных H. influenzae [232, 238, 242-244] (УУР — C, УДД — 5). Проводится моновакцинами или в составе комбинированных вакцин. Принимая во внимание важное клиническое значение инфекций, вызванных гемо-фильной палочкой типа b, вакцинация пациентов с МВ должна быть начата в максимально ранние сроки, предусмотренные НКПП (с трехмесячного возраста), трехкратно с интервалом в 1,5 мес; ревакцинация прово-
184
дится через 12 мес после третьей прививки. При начале вакцинации в 6-12 мес жизни достаточно двух инъекций с интервалом 1-2 мес и ревакцинации через 12 мес после второй дозы. После года вакцинируют однократно.
Рекомендована вакцинация против ветряной оспы с целью предотвращения данного заболевания и его осложнений [228, 245] (УУР — C, УДД — 5). Вакцинация детей осуществляется с 12 мес жизни согласно инструкции по применению препарата. Также показано проведение экстренной профилактики ветряной оспы контактных детей, не привитых в течение первых 72-96 ч после контакта с заболевшим ветряной оспой.
Особое значение инфекция Varicella zoster имеет у пациентов после проведения трансплантации и получающих кортикостероиды для системного применения, кроме того, описаны повреждения легких на фоне заболевания ветряной оспой в популяции взрослых людей.
Рекомендована вакцинация против менингококко-вой инфекции с целью предотвращения менингитов и их осложнений [246] (УУР — C, УДД — 5). Допускается проведение полисахаридными и конъюгированными вакцинами у всех возрастных групп, зарегистрированными на территории Российской Федерации. Следует иметь в виду, что применение полисахаридных вакцин у детей до 2 лет может быть неэффективным. При наличии прежней вакцинации полисахаридной вакциной следует провести ревакцинацию конъюгированной вакциной через 12 мес. Вакцинация проводится согласно инструкции по применению препарата.
Рекомендована вакцинация против гепатита А и гепатита В с целью предотвращения данных заболеваний, учитывая наличие поражений печени в рамках основной патологии [228] (УУР — C, УДД — 5).
Рекомендована вакцинация против ротавирусной инфекции [247] (УУР — C, УДД — 5).
Рекомендована пассивная иммунизация против респираторно-синцитиальной (РС) вирусной инфекции с целью предупреждения тяжелых форм острых брон-хиолитов у детей с МВ [247, 248] (УУР — B, УДД — 2). Рекомендовано применение препарата паливизумаб (гуманизированные моноклональные антитела к белку слияния (белок F) РС-вируса) 1 раз в месяц перед началом эпидемического подъема РС-вирусной заболеваемости, который начинается в ноябре и продолжается до апреля (4-5 введений за эпидемический сезон). Однако для окончательного решения об однозначной целесообразности данного вмешательства необходимо проведение дальнейших исследований [249].
Профилактика аспергиллеза
Рекомендовано принимать меры по минимизации вероятности инфицирования Aspergillus spp. в связи с тем, что данный патоген распространен повсеместно, постоянно присутствует в воздухе внешней среды и внутри помещений, а полностью исключить контакт пациента с микромицетами невозможно. Цель вмешательства — предупреждение АБЛА и ХАЛ [2] (УУР — C, УДД — 5). Пациенты с МВ не должны находиться в жилых и больничных помещениях, пораженных плесенью. Необходимо следить за соблюдением температур-но-влажностного режима в помещениях, не допускать протечек, аварий, затоплений подвалов и т.п. В случае появления признаков плесени в помещениях необходимо перевести пациентов с МВ в другое помещение. Для ликвидации последствий появления плесени в зданиях необходимо выявить и устранить причину появления сырости в здании, провести просушку и обработку
очагов биоповреждений строительными биоцидами, активными против грибов.
В квартирах пациентов с МВ, а также больничных помещениях и поликлиниках не должно быть цветов в горшках, зимних садов и пр. В связи с тем что большое количество спор грибов присутствует на частичках пыли, необходимо избегать контакта больного МВ с пылью, тщательно проводить влажную уборку помещений.
Пациентам с МВ следует избегать мест с большой концентрацией спор грибов в окружающей среде — парки, сады, леса, места скопления разлагающихся органических веществ (компостные массы, гниющая древесина, трава), зернохранилища, строительные площадки, помещения с текущим ремонтом, не следует работать в таких сферах, как садоводство, земледелие, строительство, пребывать в специализированных помещениях (конюшни, курятники и т.д.).
Пациенты с МВ не должны использовать в пищу подгнившие или заплесневелые овощи, ягоды, фрукты, так как в процессе контакта возможна инспирация спор микромицетов, обсеменение кожи и одежды пациента.
При нарушении правил эксплуатации Aspergillus spp. могут поражать системы вентиляции, поэтому следует своевременно обслуживать и осуществлять замену фильтров кондиционеров.
ОРГАНИЗАЦИЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ
ПОМОЩИ
При оказании медицинской помощи пациентам с муко-висцидозом необходимо использовать мультидисципли-нарный подход, что обусловлено как тяжестью состояния, так и поражением различных органов и систем.
Ведение пациентов с МВ предпочтительно проводить в специализированных центрах (кабинетах или отделениях муковисцидоза). Следует использовать стационаро-замещающие технологии.
Динамическое наблюдение в амбулаторно-поликли-нических условиях при оказании первичной медико-санитарной помощи осуществляет врач-педиатр участковый (врач-педиатр, или врач-пульмонолог, или врач общей практики, которые прошли соответствующий тематический курс в рамках программ непрерывного медицинского образования, а также имеют опыт ведения пациентов с данной нозологией; консультации специалистов — по показаниям) с частотой, определяемой тяжестью состояния пациента и имеющимися осложнениями болезни (1 раз в 1-3 мес или по показаниям). Впервые диагностированные дети или пациенты с тяжелыми формами заболевания должны наблюдаться чаще (ежемесячно), пациенты с легким или атипичным течением МВ могут наблюдаться реже (каждые 3-6 мес).
Наблюдение за пациентом и контроль состояния необходимо осуществлять регулярно в условиях дневного стационара. Госпитализация проводится по показаниям в круглосуточный стационар (в пульмонологическое, инфекционное или иное отделение, в штате которого есть специалисты, имеющие опыт ведения пациентов с данной нозологией).
Пациента госпитализируют в палату с учетом подтвержденного ранее микробиологического пейзажа (особенно для Р. aeruginosa, В. cepacia гатр^х, MRSA, Stenotrophomonas maltophilia, Achromobacter spp., НТМБ, хронического аспергиллеза), при возможности — в индивидуальный бокс. В зависимости от состояния пациента срок госпитализации может составить от 4 до 21 дня.
Пациенты с МВ, нуждающиеся в стационарном лечении в рамках первичной специализированной меди-
О)
vH
<N CM О CM
«5 О -1 О
О <
ш
ее <
х
Q.
О ее
о ш Q.
О
vH
CM CM О CNI
О §
< s
Q.
<
в
К <
2£ О ш X X Q.
I— <
X
Ч ш
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
185
V)
z о
< a
о о ш СЕ
-1 <
О
< ч
о ас ш Q. ш S
о ш 3″
ас
ко-санитарнои помощи, направляются по медицинским показаниям в пульмонологическое, инфекционное или иное отделение (по показаниям, условия указаны выше) медицинской организации врачом скороИ меди-цинскои помощи, врачом-педиатром участковым, врачом-пульмонологом или иным специалистом амбулатор-но-поликлинического звена.
Пациентов с МВ, нуждающихся в оказании специализированной медицинской помощи, в том числе высокотехнологичной, в стационарных условиях, по медицинским показаниям направляют в соответствующее отделение медицинской организации врач-пульмонолог или врач-педиатр.
Маршрутизация пациента детского возраста во взрослую сеть — во взрослый центр муковисцидо-за — осуществляется к 18 годам.
Пациенты с муковисцидозом получают:
• в рамках первичной медико-санитарной помощи — плановую и неотложную амбулаторно-поликлини-ческую и первичную специализированную помощь (соответствующего профиля, по показаниям и в зависимости от тяжести состояния, а также скорую медицинскую помощь);
• в рамках специализированной медицинской помощи — специализированную, в том числе высокотехнологичную медицинскую помощь, в соответствующих условиях дневного или круглосуточного стационара.
При направлении в отделение (центр или кабинет) муковисцидоза врачом-педиатром участковым или врачом другой специальности предоставляется выписка из амбулаторной карты (истории болезни) с указанием предварительного (или заключительного) диагноза, сопутствующих заболеваний, а также имеющихся результатов лабораторных и функциональных исследований.
ИСХОДЫ И ПРОГНОЗ
МВ — хроническое неизлечимое заболевание, поэтому пациенты нуждаются в активном диспансерном наблюдении и непрерывном лечении. У одних пациентов, несмотря на своевременную диагностику и адекватную терапию, поражение бронхолегочной системы быстро прогрессирует, у других динамика изменений более благоприятна. Многие пациенты доживают до взрослого и даже зрелого возраста.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Не указан.
FINANCING SOURCE
Not specified.
РАСКРЫТИЕ ИНТЕРЕСОВ
Авторы подтвердили отсутствие конфликта интересов, о котором необходимо сообщить. DISCLOSURE OF INTERESTS
Not declared.
ORCID
А.А. Баранов
https://orcid.org/0000-0003-3987-8112 Л.С. Намазова-Баранова https://orcid.org/0000-0002-2209-7531 С.И. Куцев
https://orcid.org/0000-0002-3133-8018 С.Н. Авдеев
https://orcid.org/0000-0002-5999-2150
A.С. Белевский
https://orcid.org/0000-Е.И. Кондратьева https://orcid.org/0000-О.И. Симонова https://orcid.org/0000-Н.Ю. Каширская https://orcid.org/0000-
B.Д. Шерман https://orcid.org/0000-А.Ю. Воронкова https://orcid.org/0000-Е.Л. Амелина https://orcid.org/0000-Т.Е. Гембицкая https://orcid.org/0000-
C.А. Красовский https://orcid.org/0000-А.Г. Черменский https://orcid.org/0000-Т.А. Степаненко https://orcid.org/0000-Л.Р. Селимзянова https://orcid.org/0000-Е.А. Вишнева https://orcid.org/0000-Ю.В.Горинова https://orcid.org/0000-Е.А. Рославцева https://orcid.org/0000-Н.А. Ильенкова https://orcid.org/0000-С.К. Зырянов https://orcid.org/0000-Н.Д. Одинаева https://orcid.org/0000-Т.Ю. Максимычева https://orcid.org/0000-С.Ю. Семыкин https://orcid.org/0000-М.Ю. Чернуха https://orcid.org/0000-И.А. Шагинян https://orcid.org/0000-Л.Р. Аветисян https://orcid.org/0000-Г.Л. Шумкова https://orcid.org/0000-Н.А. Крылова https://orcid.org/0000-И.А. Дронов https://orcid.org/0000-М.Н. Костылева https://orcid.org/0000-Н.Н. Климко https://orcid.org/0000-Ю.В.Борзова https://orcid.org/0000-Н.В. Васильева https://orcid.org/0000-Т.С. Богомолова https://orcid.org/0000-А.А. Сперанская https://orcid.org/0000-И.А. Баранова https://orcid.org/0000-
0001-6050-724X
0001-6395-0407
0002-3236-6942
0003-0503-6371 0003-2206-1528 0002-8183-7990
0001-7537-3846
0002-2293-3739
0001-9642-0947
0003-1487-4182
0002-6509-172X 0002-3678-7939
0001-7398-0562
0002-3881-3483 0002-3993-1246
0001-8058-7806
0002-6348-6867
0001-5214-8072
0003-4029-7921 0003-1419-6756
0002-2349-8556
0003-2951-1755 0002-9053-2515
0001-9076-2348
0002-6679-6385 0002-6304-0355
0002-7656-1539
0001-6095-7531
0003-1793-8970 0003-3693-5468
0002-2450-687X
0001-6326-1249
0002-2469-7346
186
Е.Г. Фурман
https://orcid.org/0000-В.В. Шадрина https://orcid.org/0000-Н.В. Петрова https://orcid.org/0000-О.М. Цирульникова https://orcid.org/0000-Д.П. Поляков https://orcid.org/0000-В.М. Свистушкин https://orcid.org/0000-Э.В. Синьков https://orcid.org/0000-
B.Б. Черных https://orcid.org/0000-
C.А. Репина https://orcid.org/0000-М.П. Костинов https://orcid.org/0000-О.В. Кондратенко https://orcid.org/0000-
0002-1751-5532
0002-2588-2260)
0001-5933-6594
0003-3965-5277 0003-1767-5461
0002-1257-9879
0003-4870-5977 0002-7615-8512
0001-5244-3901
0002-1382-9403 0002-7750-9468
СПИСОК ЛИТЕРАТУРЫ / REFERENCES
1. Муковисцидоз / под ред. Н.И. Капранова, Н.Ю. Каширской. — М.: МЕДПРАКТИКА-М; 2014. — 672 с. [Mukoviscidoz. Kapranov NI, Kashirskaja NJ, eds. Moscow: MEDPRAKTIKA-M; 2014. 672 p. (In Russ).]
2. Национальный консенсус «Муковисцидоз: определение, диагностические критерии, терапия» / под ред. Е.И. Кондратьевой, Н.Ю. Каширской, Н.И. Капранова. — М.: ООО «Компания БОРГЕС»; 2016. — 205 с. [Nacional’nyj konsensus «Mukoviscidoz: opredele-nie, diagnosticheskie kriterii, terapija». Kondrat’eva EI, Kashirskaja NJu, Kapranov NI, eds. Moscow: OOO «Kompanija BORGES»; 2016. 205 p. (In Russ).] Доступно по: https://mukoviscidoz.org/ doc/konsensus/CF_consensus_2017.pdf. Ссылка активна на 17.04.2022.
3. De Boeck K. Cystic fibrosis in the year 2020: disease with a new face. Acta Paediatr. 2020;109(5):893-899. doi: https://doi.org/10.1111/apa.15155
4. Lopes-Pacheco M. CFTR modulators: Shedding light on precision medicine for cystic fibrosis. Front Pharmacol. 2016;7:275. doi: https://doi.org/10.3389/fphar.2016.00275
5. Регистр больных муковисцидозом в Российской Федерации. 2019 год / под ред. А.Ю. Воронковой, Е.Л. Амелиной, Н.Ю. Каширской и др. — М.: ИД «МЕДПРАКТИКА-М»; 2021. — 68 с. [Registr bol’nyh mukoviscidozom v Rossijskoj Federacii. 2019 god. Voronkova AJu, Amelina EL, Kashirskaja NJu, et al. Moscow: ID «MEDPRAKTIKA-M»; 2021. — 68 p. (In Russ).] Доступно по: https:// mukoviscidoz.org/doc/registr/10472_block_Registre_2017%20 site.pdf. Ссылка активна на 17.04.2022.
6. Mogayzel PJ, Naureckas ET, Robinson KA. Cystic Fibrosis Pulmonary Guidelines. Am J Respir Crit Care Med. 2013;187(7):680-689. doi: https://doi.org/10.1164/rccm.201207-1160oe
7. Шагинян И.А., Капранов Н.И., Чернуха М.Ю. и др. Микробный пейзаж нижних дыхательных путей у различных возрастных групп детей, больных муковисцидозом // Журнал микробиологии, эпидемиологии и иммунобиологии. — 2010. — № 1. — С. 15-20. [Shaginjan IA, Kapranov NI, Chernuha MJu, et al. Mikrobnyj pejzazh nizhnih dyhatel’nyh putej u razlichnyh vozrastnyh grupp detej, bol’nyh mukoviscidozom. Journal of microbiology, epidemiology and immunobiology = Zhurnal mikrobiologii, epidemiologic i immunobiologii. 2010;(1):15-20. (In Russ).]
8. Чернуха М.Ю., Шагинян И.А., Капранов Н.И. и др. Персистенция Burkholderia cepacia у больных муковисцидозом // Журнал микробиологии, эпидемиологии и иммунобиологии. — 2012. — № 4. — С. 93-98. [Chernuha MJu, Shaginjan IA, Kapranov NI, et al. Persistencija Burkholderia cepacia u bol’nyh mukoviscidozom. Journal of microbiology, epidemiology and immunobiology = Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2012;(4):93-98. (In Russ).]
А.В. Лямин
https://orcid.org/0000-С.В.Поликарпова https://orcid.org/0000-А.В. Поляков https://orcid.org/0000-Т.А. Адян
https://orcid.org/0000-Д.В. Гольдштейн https://orcid.org/0000-Т.Б. Бухарова https://orcid.org/0000-А.С. Ефремова https://orcid.org/0000-Е.С. Овсянкина https://orcid.org/0000-Л.В. Панова https://orcid.org/0000-И.В. Черкашина https://orcid.org/0000-
0002-5905-1895
0003-3201-0804 0002-0105-1833
0002-7714-9538
0003-2438-1605 0003-0481-256X
0001-5035-6396
0002-0460-7585 0001-8660-3977
0003-3825-3946
9. Demco CA, Stern RC, Doershuk CF. Stenotrophomonas maltophilia in cystic fibrosis: incidence and prevalence. Pediatr Pulmonol. 1998;25(5):304-308. doi: https://doi.org/10.1002/ (sici)1099-0496(199805)25:5<304::aid-ppul3>3.0.co;2-i
10. Аветисян Л.Р., Медведева О.С., Чернуха М.Ю. и др. Эпидемиологические и микробиологические особенности хронической инфекции легких у больных муковисцидозом вызванной Staphylococcus aureus // Педиатрия. Журнал им. Г.Н. Сперанского. — 2020. — Т. 99. — № 2. — С. 102-111. — doi: https://doi.org/10.24110/0031-403X-2020-99-2-102-111 [Avetisyan LR, Medvedeva OS, Chernukha MYu, et al. Epidemiological and microbiological peculiarities of chronic lung infection in patients with cystic fibrosis caused by Staphylococcus aureus. Pediatria. Journal n.a. G.N. Speransky. 2020;99(2):102-111. (In Russ). doi: https://doi.org/10.24110/0031-403X-2020-99-2-102-111]
11. Сиянова Е.А., Чернуха М.Ю., Аветисян Л.Р. и др. Мониторинг хронической инфекции легких у больных муковисцидозом, вызванной бактериями Pseudomonas aeruginosa // Педиатрия. Журнал им. Г.Н. Сперанского. — 2018. — Т. 97. — № 2. — C. 77-86. doi: https://doi.org/10.24110/0031-403X-2018-97-2-77-86 [Siyanova EA, Chernukha MYy, Avetisyan LR, et al. Monitoring of chronic lung infection in patients with cystic fibrosis caused by Pseudomonas aeruginosa. Pediatria. Journal n.a. G.N. Speransky. 2018;97(2):77-86. (In Russ). doi: https://doi.org/10.24110/0031-403X-2018-97-2-77-86]
12. Liu JC, Modha DE, Gaillard EA. What is the clinical significance of filamentous fungi positive sputum cultures in patients with cystic fibrosis? J Cyst Fibros. 2013;12(3);187-193. doi: https://doi.org/10.1016/jjcf.2013.02.003
13. Aaron SD, Vandemheen KL, Freitag A, et al. Treatment of Aspergillus fumigatus in patients with cystic fibrosis: a randomized, placebo-controlled pilot study. PLoS One. 2012;7(4):e36077. doi: https://doi.org/10.1371/journal.pone.0036077
14. Eickmeier O, Hector A, Singh A, Hart D. Fungi in Cystic Fibrosis: Recent Findings and Unresolved Questions. Curr Fungal Infect Rep. 2015;9:1-5. doi: https://doi.org/10.1007/s12281-014-0211-0
15. Климко Н.Н. Микозы: диагностика и лечение: руководство для врачей. — 3-е изд., перераб. и доп. — М.: Фармтек; 2017. — 272 с. [Klimko NN. Mikozy: diagnostika i lechenie: guide for doctors. 3rd ed., rev. and add. Moscow: Farmtek; 2017. 272 p. (In Russ).]
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
16. Pinet M, Carrere J, Cimon B, et al. Occurrence and relevance of filamentous fungi in respiratory secretions of patients with cystic fibrosis — a review. Med Mycol. 2009;47(4):387-397. doi: https://doi.org/10.1080/13693780802609604
17. Denning DW, Cadranel J, Beigelman-Aubry C, et al. Chronic pulmonary aspergillosis: rationale and clinical guidelines for
о
vH
<N CM О CM
<5 О
О
О <
s
ее <
х
Q.
О ее
о ш Q.
О
vH
СМ СМ О CNI
О §
< г
Q.
<
в
К <
о ш х
S Q.
I— <
S
Ч ш
187
V)
z о
< a
о о ш СЕ
-1 <
О
< ч
о ас ш Q. ш S
о ш 3″
ас
diagnosis and management. Eur Respir J. 2016;47(1):45-68. doi: https://doi.org/10.1183/13993003.00583-2015
18. Kosmidis C, Denning DW. The clinical spectrum of pulmonary aspergillosis. Thorax. 2015;70(3):270-277. doi: https://doi.org/10.1136/thoraxjnl-2014-206291
19. Burke MS, Ragi JM, Karamanoukian HL, et al. New strategies in thenon-operative management of meconium ileus. J Pediat Surg. 2002;37(5):760-764. doi: https://doi.org/10.1053/jpsu.2002.32272
20. Castellani C, Duff AJA, Bell SC, et al. ECFS best practice guidelines: the 2018 revision. J Cyst Fibros. 2018;17(2):153-178. doi: https://doi.org/10.1016/jjcf.2018.02.006
21. Кондратьева Е.И., Шерман В.Д., Амелина Е.Л. и др. Клинико-генетическая характеристика и исходы мекониевого илеуса при муковисцидозе // Российский вестник перината-логии и педиатрии. — 2016. — Т. 61. — № 6. — С. 77-81. — doi: https://doi.org/10.21508/1027-4065-2016-6-77-81 [Kondratyeva EI, Sherman VD, Amelina EL, et al The clinical and genetic characteristics and outcomes of meconium ileus in cystic fibrosis. Rossiyskiy Vestnik Perinatologii i Pediatrii = Russian Bulletin of Perinatology and Pediatrics. 2016;61(6):77-81. (In Russ). doi: https://doi.org/10.21508/1027-4065-2016-61-6-77-81]
22. Debray D, Narkewicz MR, Bodewes FA, et al. Cystic Fibrosis-related Liver Disease: Research Challenges and Future Perspectives. J Pediatr Gastroenterol Nutr. 2017;65(4):443-448. doi: https://doi.org/10.1097/MPG.0000000000001676
23. Ciuca IM, Pop L, Tama§ L, et al. Cystic fibrosis liver disease-from diagnosis to risk factors. Rom J Morphol Embryol. 2014;55(1):91-95.
24. Klotter V, Gunchick C, Siemers E, et al. Assessment of pathologic increase in liver stiffness enables earlier diagnosis of CFLD: Results from a prospective longitudinal cohort study. PLoS One. 2017;12(6):e0178784. doi: https://doi.org/10.1371/journal.pone.0178784
25. Bombieri C, Claustres M, De Boeck K, et al. Recommendations for the classification of diseases as CFTR-related disorders. J Cyst Fibros. 2011;10(Suppl 2):86-102. doi: https://doi.org/10.1016/S1569-1993(11)60014-3
26. Terliesner N, Vogel M, Steighardt A, et al. Cystic-fibrosis related-diabetes (CFRD) is preceded by and associated with growth failure and deteriorating lung function. J Pediatr Endocrinol Metab. 2017;30(8):815-821. doi: https://doi.org/10.1515/jpem-2017-0005
27. Edenborough FP. Women with cystic fibrosis and their potential for reproduction. Thorax. 2001;56(8):649-655. doi: https://doi.org/10.1136/thorax.56.8.649
28. Амелина Е.Л., Красовский С.А., Шугинин И.О. Муковисцидоз и беременность: клинико-генетические, функциональные и микробиологические характеристики пациенток // Педиатрия. Журнал им. Г.Н. Сперанского. — 2014. — Т. 93. — № 4. — С. 38-43. [Amelina EL, Krasovskij SA, Shuginin IO. Mukoviscidoz i beremennost’: kliniko-geneticheskie, funkcional’nye i mikrobiologicheskie harakteristiki pacientok. Pediatria. Journal n.a. G.N. Speransky. 2014;93(4):38-43. (In Russ).]
29. King SL, Topliss DJ, Kotsimbos T, et al. Reduced bone density in cystic fibrosis: AF508 mutation is an independent risk factor. Eur Respir J. 2005;25(1):54-61. doi: https://doi.org/10.1183/09031936.04.00050204
30. Симанова Т. В. Клинико-генетические особенности и костный метаболизм у больных муковисцидозом: автореф дис. … канд. мед. наук. — М.; 2009. — 28 с. [Simanova TV. Kliniko-geneticheskie osobennosti i kostnyj metabolizm u bol’nyh mukoviscidozom. [abstract of dissertation]. Moscow; 2009. 28 p. (In Russ).]
31. Красовский С.А. Остеопороз у взрослых больных муковисцидозом: автореф. дис. … канд. мед. наук. — М.; 2012. [Krasovskij S.A. Osteoporoz u vzroslyh bol’nyh mukoviscidozom. [abstract of dissertation]. Moscow; 2012. (In Russ).]
32. (оринова Ю.В. Остеопения при хронических болезнях легких у детей: автореф. дис. . канд. мед. наук. — М., 2005. [Gorinova Ju.V. Osteopenija pri hronicheskih boleznjah legkih u detej. [abstract of dissertation]. Moscow; 2005. (In Russ).]
33. Соболенкова В.С. Системный анализ в ранней диагностике и лечении остеопенического синдрома при муковисцидозе: автореф. дис. … канд. мед. наук. Тула; 2009. [Sobolenkova VS. Sistemnyj analiz v rannej diagnostike i lechenii osteopenicheskogo sindroma pri mukoviscidoze. [abstract of dissertation]. Tula; 2009. (In Russ).]
34. Aris RM, Merkel PA, Bachrach LK, et al. Consensus statement: Guide to bone health and disease in cystic fibrosis. J Clin Endocrinol Metab. 2005;90(3):1888-1896. doi: https://doi.org/10.1210/jc.2004-1629
35. Капустина Т.Ю., Капранов Н.И. Состояние минеральной плотности костной ткани у пациентов с муковисцидозом // Педиатрия. Журнал им. Г.Н. Сперанского. — 2008. — Т. 87. — № 5. — С. 36-41. [Kapustina TJu, Kapranov NI. Sostojanie mineral’noj plotnosti kostnoj tkani u pacientov s mukoviscidozom. Pediatria. Journal n.a. G.N. Speransky. 2008;87(5):36-41. (In Russ).]
36. Smyth AR, Bell SC, Bojcin S, et al. Flume European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J Cyst Fibrosis. 2014;13(Suppl 1):S23-S42. doi: https://doi.org/10.1016/jjcf.2014.03.010
37. Stevens DA, Moss RB, Kurup VP et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis — state of the art: Cystic Fibrosis Foundation Consensus Conference. Clin Infect Dis. 2003;37(Suppl 3):S225-S264. doi: https://doi.org/10.1086/376525
38. Geller DE, Kaplowitz H, Light MJ, Colin AA. Allergic bronchopulmonary aspergillosis in cystic fibrosis: reported prevalence, regional distribution, and patient characteristics. Scientific Advisory Group, Investigators, and Coordinators of the Epidemiologic Study of Cystic Fibrosis. Chest. 1999;116(3):639-646. doi: https://doi.org/10.1378/chest.116.3.639
39. Mastella G, Rainisio M, Harms HK, et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis: a European epidemiological study. Eur Respir J. 2000;16(3):464-471. doi: https://doi.org/10.1034/j.1399-3003.2000.016003464.x
40. Zolin A, Orenti A, van Rens J., Et al. ECFS Patient Registry. Annual Data Report (2017 data). Version 1.2019. Available online: https:// www.ecfs.eu/sites/default/files/general-content-images/working-groups/ecfs-patient-registry/ECFSPR_Report2017_v1.3.pdf. Accessed on April 17, 2022.
41. Leung DH, Narkewicz MR. Cystic Fibrosis-related cirrhosis. J Cyst Fibros. 2017;16(Suppl 2):S50-S61. doi: https://doi.org/10.1016/jjcf.2017.07.002
42. Pseudo-Bartter’s syndrome. In: Clinical Guidelines: Care of Children with Cystic Fibrosis. Royal Brompton Hospital; 2020. 8th ed. pp. 173-174. Available online: https://www.rbht.nhs.uk/sites/ nhs/files/Cystic%20fibrosis%20guidelines/CF%20G%202020/ CF%20guideline%202020%20FINAL_edited.pdf. Accessed on April 17, 2022.
43. Mayer-Hamblett N, Kloster M, Ramsey BW, et al. Incidence and clinical significance of elevated liver function tests in cystic fibrosis clinical trials. Contemp Clin Trials. 2013;34(2):232-238. doi: https://doi.org/10.1016/j.cct.2012.11.005
44. Akata D, Akhan O. Liver manifestations of cystic fibrosis. Eur J Radiol. 2007;61(1):11-17. doi: https://doi.org/10.1016/j.ejrad.2006.11.008
45. Williams SM, Goodman R, Thomson A, et al. Ultrasound evaluation of liver disease in cystic fibrosis as part of an annual assessment clinic: a 9-year review. Clin Radiol. 2002;57(5):365-370. doi: https://doi.org/10.1053/crad.2001.0861
46. Mueller-Abt PR, Frawley KJ, Greer RM, et al. Comparison of ultrasound and biopsy findings in children with cystic fibrosis related liver disease. J Cyst Fibros. 2008;7(3):215-221. doi: https://doi.org/10.1016/j.jcf.2007.08.001
47. Durand F, Valla D. Assessment of the prognosis of cirrhosis: Child-Pugh versus MELD. J Hepatol. 2005;42(Suppl 1):S100-S107. doi: https://doi.org/10.1016/j.jhep.2004.11.015
48. Brunt ME. Grading and staging the histopathological lesions of chronic hepatitis: The Knodell histology activity index and beyond. Hepatology. 2000;31(1):241-246. doi: https://doi.org/10.1002/hep.510310136
49. Moran A, Brunzell C, Cohen RC. Clinical care guidelines for cystic fibrosis-related diabetes: a position statement of the American Diabetes Association and a clinical practice guideline of the Cystic Fibrosis Foundation, endorsed by the Pediatric Endocrine Society. Diabetes Care. 2010;33(12):2697-2708. doi: https://doi.org/10.2337/dc10-1768
50. Gordon CM, Leonard MB, Zemel BS. 2013 Pediatric Position Development Conference: Executive Summary and Reflections. J Clin Densitom. 2014;17(2):219-224. doi: https://doi.org/10.1016/j.jocd.2014.01.007
51. Southern KW, Merelle MM, Dankert-Roelse JE, Nagelkerke AD. Newborn screening for cystic fibrosis.
188
Cochrane Database Syst Rev. 2009;2009(1):CD001402. doi: https://doi.org/10.1002/14651858.CD001402.pub2
52. Шерман В.Д., Кондратьева Е.И., Воронкова А.Ю. и др. Влияние неонатального скрининга на течение муковисцидоза на примере группы пациентов Московского региона // Медицинский Совет. — 2017. — № 18. — С. 124-128. doi: https://doi. org/10.21518/2079-701X-2017-18-124-128 [Sherman VD, Kondratieva EI, Voronkova AY, et al. Influence of neonatal screening for cystic fibrosis by the example of patients of the Moscow region. Meditsinskiy sovet = Medical Council. 2017;(18):124-28. (In Russ). doi: https://doi.org/10.21518/2079-701X-2017-18-124-128]
53. Шерман В.Д., Капранов Н.И., Каширская Н.Ю., Кондратьева Е.И. Роль неонатального скрининга в оптимизации медицинской помощи больным муковисцидозом в РФ // Медицинская генетика. — 2013. — Т. 12. — № 11. — С. 24-29. [Sherman VD, Kapranov NI, Kashirskaya NY, Kondrateva EI. The role of neonatal screening program in the optimization of medical care for patients with cystic fibrosis in the Russian Federation. Medical Genetics. 2013;12(11):24-29. (In Russ).]
54. Farrell PM, Rosenstein BJ, White TB, et al. Cystic fibrosis foundation. Guidelines for diagnosis of cystic fibro-sis in newborns through older adults: Cystic Fibrosis Foundation consensus report. J Pediatr. 2008;153(2):4-14. doi: https://doi.org/10.1016/jjpeds.2008.05.005
55. Collie JT, Massie RJ, Jones OA, et al. Sixty-five years since the New York heat wave: advances in sweat testing for cystic fibrosis. Pediatr Pulmonol. 2014;49(2):106-117. doi: https://doi.org/10.1002/ppul.22945
56. Mattar ACV, Leone C, Rodrigues JC, Adde FV. Sweat conductivity: an accurate diagnostic test for cystic fibrosis? J Cyst Fibros. 2014;13(5):528-533. doi: https://doi.org/10.1016/jjcf.2014.01.002
57. Hug MJ, Tümmler B. Intestinal current measurements to diagnose cystic fibrosis. J Cyst Fibros. 2004;3(Suppl 2):157-158. doi: https://doi.org/10.1016/jjcf.2004.05.033
58. Sosnay PR, White TB, Farrell PM, et al. Diagnosis of Cystic Fibrosis in Nonscreened Populations. J Pediatr. 2017;181S:S52-S57.e7. doi: http://doi.org/10.1016/j.jpeds.2016.09.068
59. Cystic Fibrosis Mutation Database. Available online: http:// www.genet.sickkids.on.ca. Accessed on April 17, 2022.
60. Richards S, Aziz N, Bale S, et al. Rehm, the ACMG Laboratory Quality Assurance Committee Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405-424. doi: http://doi.org/10.1038/gim.2015.30
61. Turck D, Braegger CP Colombo C, et al. ESPEN-ESPGHAN-ECFS guidelines on nutrition care for infants, children, and adults with cystic fibrosis. Clin Nutr. 2016;35(3):557-577. doi: http://doi.org/10.1016/jxlnu.2016.03.004
62. Cystic fibrosis: diagnosis and management NICE guideline. National Institute for Health and Care Excellence; 2017. Available online: https://www.nice.org.uk/guidance/ng78/resources/ cystic-fibrosis-diagnosis-and-management-pdf-1837640946373. Accessed on April 17, 2022.
63. Goss CH, Mayer-Hamblett N, Kronmal RA, et al. Laboratory parameter profiles among patients with cystic fibrosis. J Cyst Fibros. 2007;6(2):117-123. doi: http://doi.org/10.1016/jjcf.2006.05.012
64. Nazareth D, Walshaw M. A review of renal disease in cystic fibrosis. J Cyst Fibros. 2013;12(4):309-317. doi: http://doi.org/10.1016/j.jcf.2013.03.005
65. Public Health England. Identification of Pseudomonas species and other NonGlucose Fermenters. UK Standards for Microbiology Investigations. 2015. ID 17. Issue 3. 41 p. Available online: https:// assets.publishing.service.gov.uk/government/uploads/system/ uploads/attachment_data/file/422699/ID_17i3.pdf. Accessed on April 17, 2022.
66. H0iby N, Ciofu O, Bjarnsholt T. Pseudomonas. In: Pfaller MA, Richter SS, Funke G, et al. Manual of Clinical Microbiology. 11th ed. ASM Press; 2015. p. 774. doi: https://doi.org/10.1128/9781555817381.ch42
67. Определение чувствительности микроорганизмов к антимикробным препаратам: клинические рекомендации. — Межрегиональная ассоциация по клинической микробиологии и антимикробной терапии; 2021. [Opredelenie chuvstvitel’nosti
mikroorganizmov k antimikrobnym preparatam: Clinical guidelines. International Association for Clinical Microbiology and Antimicrobial Chemotherapy; 2021. (In Russ).] Доступно по: https://www. antibiotic.ru/files/321/clrec-dsma2018.pdf. Ссылка активна на 17.04.2022.
68. Patterson TF. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016;63(4):e1-e60. doi: https://doi.org/10.1093/cid/ciw326
69. Ullmann AJ, Aguado JM, Arikan-Akdagli S, et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline. Clin Microbiol Infect. 2018;24(Suppl 1):e1-e38. doi: https://doi.org/10.1016/j.cmi.2018.01.002
70. Chaaban MR, Kejner A, Rowe SM, Woodworth BA. Cystic fibrosis chronic rhinosinusitis: a comprehensive review. Am J Rhinol Allerg. 2013;27(5):387-395. doi: https://doi.org/10.2500/ajra.2013.27.3919
71. Roby BB, McNamara J, Finkelstein M, Sidman J. Sinus surgery in cystic fibrosis patients: Comparison of sinus and lower airway cultures. Int J Pediatr Otorhinolaryngol. 2008;72(9):1365-1369. doi: https://doi.org/10.1016/j.ijporl.2008.05.011
72. Decision Making in Medicine: An Algorithmic Approach. Mushlin SB, Greene HL, eds. 3rd ed. Philadelphia, PA: Mosby Elsevier; 2009. 768 p. Available online: https://books.google.ru/books?id=kdBRlPl U3aUC&printsec=frontcover&hl=ru&source=gbs_ge_summary_r&c ad=0#v=onepage&q&f=false. Accessed on: April 17, 2022.
73. Middleton PG, Wagenaar M, Matson AG, et al. Australian standards of care for cystic fibrosis-related diabetes. Respirology. 2014;19(2):185-192. doi: https://doi. org/10.1111/resp.12227
74. Moran A, Pillay K, Becker DJ, et al. ISPAD Clinical Practice Consensus Guidelines 2014. Management of cystic fibrosis-related diabetes in children and adolescents. Pediatr Diabetes 2014;15(Suppl. 20):65-76. doi: https://doi.org/10.1111/pedi.12178
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
75. Prentice B, Hameed S, Verge CF, et al. Diagnosing cystic fibrosis-related diabetes: current methods and challenges. Expert Rev Respir Med. 2016;10(7):799-811. doi: https://doi.org/10.1080/17476348.2016.1190646
76. Tangpricha V, Kelly A, Stephenson A, et al. An Update on the Screening, Diagnosis, Management, and Treatment of Vitamin D Deficiency in Individuals with Cystic Fibrosis: Evidence-Based Recommendations from the Cystic Fibrosis Foundation. J Clin Endocrinol Metab. 2012;97(4):1082-1093. doi: https://doi.org/10.1210/jc.2011-3050
77. Репина С.А., Красовский С.А., Роживанов Р.В. и др. Андрологическое обследование пациентов с легочной и смешанной формой муковисцидоза // Андрология и генитальная хирургия. — 2018. — Т. 19. — № 2. — С. 31-39. — doi: https:// doi.org/10.17650/2070-9781-2018-19-2-31-39 [Repina SA, Krasovskiy SA, Rozhivanov RV, et al. Andrology examination of patients with pancreatic-sufficient and pancreatic-insufficient cystic fibrosis. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery. 2018;19(2):31-39. (In Russ). doi: https://doi.org/10.17650/2070-9781-2018-19-2-31-39]
78. Штаут М.И., Шилейко Л.В., Репина С.А. и др. Комплексное сперматологическое обследование пациентов с муковисцидозом // Андрология и генитальная хирургия. — 2017. — T. 18. — № 4. — С. 69-76. — doi: https:// doi.org/10.17650/2070-9781-2017-18-4-69-76 [Shtaut MI, Schileiko LV, Repina SA, et al. Comprehensive semen examination in patients with cystic fibrosis. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery. 2017;18(4):69-76. (In Russ). doi: https://doi.org/10.17650/2070-9781-2017-18-4-69-76]
79. Jungwirth A, Diemer T, Kopa Z, et al. EAU Guidelines on Male Infertility. European Association of Urology; 2018. 46 p. Available online: https://d56bochluxqnz.cloudfront.net/media/EAU-Guidelines-on-Male-Infertility-2018-large-text.pdf. Accessed on April 17, 2022.
80. Leifke E, Friemert M, Heilmann M, et al. Sex steroid sand body composition in men with cystic fibrosis. Eur J Endocrinol. 2003;148(5):551-557. doi: https://doi.org/10.1530/eje.0.1480551
81. Blackman SM, Tangpricha V. Endocrine Disordersin Cystic Fibrosis. Pediatr Clin North Am. 2016;63(4):699-708. doi: https://doi.org/10.1016/j.pcl.2016.04.009
82. Yoon JC, Casella JL, Litvin M, Dobs AS. Male reproductive health in cystic fibrosis. J Cyst Fibros. 2019;18(Suppl 2):S105-S110. doi: https://doi.org/10.1016/j.jcf.2019.08.007
о
vH
<N CM О CM
<5 О -1 О
О <
s
ее <
х
Q.
О ее
о ш Q.
О
vH
СМ СМ О CNI
О §
< s
Q.
<
в
К <
ас о ш х s
Q.
I— <
S
Ч ш
189
V)
z о
< a
о о ш
а _j
<
о
< ч
о ас ш Q. ш S
о ш 3″
ас
83. Baatallah N, Bitam S, Martin N, et al. Cis variants identified in F508del complex alleles modulate CFTR channel rescue by small molecules. Hum Mutat. 2018;39(4):506-514. doi: https://doi.org/10.1002/humu.23389
84. Landsverk ML, Douglas GV, Tang S, et al. Diagnostic approaches to apparent homozygosity. Genet Med. 2012;14(10):877-882. doi: https://doi.org/10.1038/gim.2012.58
85. Hantash FM, Rebuyon A, Peng M, et al. Apparent homozygosity of a novel frame shift mutation in the CFTR gene because of a large deletion. J Mol Diagn. 2009;11(3):253-256. doi: https://doi.org/10.2353/jmoldx.2009.080117
86. Rechitsky S, Strom C, Verlinsky O, et al. Allele dropout in polar bodies and blastomeres. J Assist Reprod Genet. 1998;15(5):253-257. doi: https://doi.org/10.1023/a:1022532108472
87. Hantash FM, Redman JB, Goos D, et al. Characterization of a recurrent novel large duplication in the cystic fibrosis transmembrane conductance regulator gene. J Mol Diagn. 2007;9(4):556-560. doi: https://doi.org/10.2353/jmoldx.2007.060141
88. Hantash FM, Redman JB, Starn K, et al. Novel and recurrent rearrangements in the CFTR gene: clinical and laboratory implications for cystic fibrosis screening. Hum Genet. 2006;119(1-2):126-136. doi: https://doi.org/10.1007/s00439-005-0082-0
89. Dekkers JF, van der Ent CK, Beekman JM. Novel opportunities for CFTR-targeting drug development using organoids. Rare Dis. 2013;1:e27112. doi: https://doi.org/10.4161/rdis.27112
90. Boj SF, Vonk AM, Statia M, et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. J Vis Exp. 2017;(120):55159. doi: https://doi.org/10.3791/55159
91. Dekkers JF, Berkers G, Kruisselbrink E, et al. Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Sci Transl Med. 2016;8(344):344ra384. doi: https://doi.org/10.1126/SCITRANSLMED.AAD8278
92. Vonk AM, van Mourik P, Ramalho AS, et al. Protocol for Application, Standardization and Validation of the Forskolin-Induced Swelling Assay in Cystic Fibrosis Human Colon Organoids. STAR Protoc. 2020;1(1):100019. doi: https://doi.org/10.1016/J.XPR0.2020.10001
93. Connett GJ. Lumacaftor-ivacaftor in the treatment of cystic fibrosis: design, development and place in therapy. Drug Des Devel Ther. 2019;13:2405-2412. doi: https://doi.org/10.2147/DDDT.S153719
94. Berkers G, van Mourik P, Vonk AM, et al. Rectal Organoids Enable Personalized Treatment of Cystic Fibrosis. Cell Rep. 2019;26(7):1701-1708.e3. doi: https://doi.org/10.1016/j.celrep.2019.01.068
95. Southern KW, Patel S, Sinha IP, Nevitt SJ. Correctors (specific therapies for class II CFTR mutations) for cystic fibrosis. Cochrane Database Syst Rev. 2018;8(8):CD010966. doi: https://doi.org/10.1002/14651858.CD010966.pub2
96. Kotodziej M, de Veer MJ, Cholewa M, et al. Thompson Lung function imaging methods in Cystic Fibrosis pulmonary disease. Respir Res. 2017;18(1):96. doi: https://doi.org/10.1186/s12931-017-0578-x
97. Leutz-Shmidt P, Eichinger M, Stahl M, et al. Ten years of chest MRI for patients with cystic fibrosis: Translation from the bench to clinical routine. Radiologe. 2019;59(Suppl 1):10-20. doi: https://doi.org/10.1007/s00117-019-0553-2
98. Carter JM, Johnson BT, Patel A, et al. Lund-Mackay staging system in cystic fibrosis: a prognostic factor for revision surgery? The Ochsner J. 2014;14:184-187.
99. Kang SH, Dalcin PTR, Piltcher OB, Migliavacca RO. Chronic rhinosinusitis and nasal polyposis in cystic fibrosis: update on diagnosis and treatment. J Bras Pneumol. 2015;41(1):65-76. doi: https://doi.org/10.1590/S1806-37132015000100009
100. Детская хирургия: национальное руководство / под ред. Ю.Ф. Исакова, А.Ф. Дронова. — М.: ГЭОТАР-Медиа; 2009. — С. 328331. [Detskaja hirurgija: National guide. Isakov JuF, Dronova AF, eds. Moscow: GEOTAR-Media; 2009. pp. 328-331. (In Russ).]
101. De Backer AI, De Schepper AM, Deprettere A, et al. Radiographic manifestations of intestinal obstruction in the newborn. JBR-BTR. 1999;82(4):159-166.
102. Sermet-Gaudelus I, Bianchi ML, Garabedian M, et al. European cystic fibrosis bone mineralisation guidelines. J Cyst Fibros. 2011;10(2):S16-S23. doi: https://doi.org/10.1016/S1569-1993(11)60004-0
103. Bone mineralisation in cystic fibrosis: Report of the UK Cystic Fibrosis Trust Bone Mineralisation Working Group. Bromley:
Cystic Fibrosis Trust; 2007. Available online: https://www.sifc. it/wp-content/uploads/2020/09/LineeGuidaSifc_Febbraio2007_ BoneMineralisationInCF_UK_CFTrust_1.pdf. Accessed on April 17, 2022.
104. Скрипникова И.А., Щеплягина Л.А., Новиков В.Е. и др. Возможности костной рентгеновской денситометрии в клинической практике: методические рекомендации. — 2-е изд., доп. — М.; 2015. [Skripnikova IA, Shhepljagina LA, Novikov VE. et al. Vozmozhnosti kostnoj rentgenovskoj densitometrii v klinicheskoj praktike: Guidelines. 2nd ed., add. Moscow; 2015. (In Russ).]
105. Hardinge M, Annandale J, Bourne S, et al. British Thoracic Society Standards of Care Committee British Thoracic Society guidelines for home oxygen use in adults. Thorax. 2015;70(Suppl 1):i1-i43. doi: https://doi.org/10.1136/thoraxjnl-2015-206865
106. Hayes D Jr, Wilson K, Krivchenia K, et al. Home Oxygen Therapy for Children. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med. 2019;199(3):e5-e23. doi: https://doi.org/10.1164/rccm.201812-2276ST
107. Lam S, Nettel-Aguirre A, Van Biervliet S, et al. Transient Elastography in the Evaluation of Cystic Fibrosis-Associated Liver Disease: Systematic Review and Meta-analysis. J Can Assoc Gastroenterol. 2019;2(2):71-80. doi: https://doi.org/10.1093/jcag/gwy029
108. Jungwirth A, Giwercman A, Tournaye H, et al. European Association of Urology guidelines on Male Infertility: the 2012 update. Eur Urol. 2012;62(2):324-332. doi: https://doi.org/10.1016/j.eururo.2012.04.048
109. Zivanovic S, Saranac L, Kostic G. The case of pseudo-Bartter’s syndrome: an atypical presentation of cystic fibrosis. Facta universitatis Series Medicine and biology. 2008;15(1):33-36.
110. Franco LP, Camargos PA, Becker HM, Guimaraes RE. Nasal endoscopic evaluation of children and adolescents with cystic fibrosis. Braz J Otorhinolaryngol. 2009;75(6):806-813. doi: https://doi.org/10.1016/s1808-8694(15)30541-3
111. Поляков Д.П., Карнеева О.В., Белавина П.И. Хронический риносинусит у детей с муковисцидозом: современные тенденции и собственный опыт // Российская ринология. — 2018. — Т. 26. — № 4. — С. 17-25. — doi: https://doi. org/10.17116/rosrino20182604117 [Polyakov DP, Karneeva OV, Belavina PI.Chronic rhinosinusitis in the children presenting with mucoviscidosis: the current trends in diagnostics and treatment. Rossiyskaya Rinologiya = Russian Rhinology. 2018;26(4):17-25. (In Russ). doi: https://doi.org/10.17116/rosrino20182604117]
112. Okafor S, Kelly KM, Halderman AA. Management of Sinusitis in the Cystic Fibrosis Patient. Immunol Allergy Clin North Am. 2020;40(2):371-383. doi: https://doi.org/10.1016/j.iac.2019.12.008
113. Hug MJ, Derichs N, Bronsveld I, Clancy JP Measurement of ion transport function in rectal biopsies. Methods Mol Biol. 2011;741:87-107. doi: https://doi.org/10.1007/978-1-61779-117-8_7
114. Zommer-van Ommen DD, de Poel E, Krusselbrink E, et al. Comparison of Ex Vivo and in Vitro Intestinal Cystic Fibrosis Models to measure CFTR-dependent Ion Chanel Activity. J Cyst Fibros. 2018;17(3):316-324. doi: https://doi.org/10.1016/j.jcf.2018.02.007
115. Carlyle BE, Borowitz DS, Glick PL. A review of pathophysiology and management of fetuses and neonates with meconium ileus for the pediatric surgeon. J Pediat Surg. 2012;47(4):772-781. doi: https://doi.org/10.1016/j.jpedsurg.2012.02.019
116. Munck A, Alberti C, Colombo C, et al. International prospective study of distal intestinal obstruction syndrome in cystic fibrosis: Associated factors and outcome. J Cyst Fibros. 2016;15(4):531-539. doi: https://doi.org/10.1016/j.jcf.2016.02.002
117. Sandy NS, Massabki LHP, Gon^alves AC, et al. Distal intestinal obstruction syndrome: a diagnostic and therapeutic challenge in cystic fibrosis. J Pediatr (Rio J). 2020;96(6):732-740. doi: https://doi.org/10.1016/j.jped.2019.08.009
118. Canny JD, Brookes A, Bowley DB. Distal intestinal obstruction syndrome and colonic pathologies in cystic fibrosis. Br J Hosp Med (Lond). 2017;78(1):38-43. doi: https://doi.org/10.12968/hmed.2017.78.1.38
119. Alattar Z, Thornley C, Behbahaninia M, Sisley A. Proximal small bowel obstruction in a patient with cystic fibrosis: a case report. Surg Case Rep. 2019;5(1):143. doi: https://doi.org/10.1186/s40792-019-0701-y
120. Abicht T, Jones C, Coyan G, et al. A technique for the surgical treatment of distal intestinal obstructive syndrome by hand-assisted
190
laparoscopy. SurgLaparoscEndoscPercutan Tech. 2012;22(3):e142-e143. doi: https://doi.org/10.1097/SLE.0b013e318248b463
121. Martins LM, Camargos PA, Becker HM, et al. Guimaraes. Hearing loss in cystic fibrosis. Int J Pediat Otorhinolaryngol. 2010;74(5):469-473. doi: https://doi.org/10.1016/j.ijporl.2010.01.021
122. ENT complications. In: Clinical Guidelines: Care of children with cystic fibrosis. Royal Brompton Hospital; 2017. 7th ed. pp. 149-1521. Available online: https://www.rbht.nhs.uk/sites/ nhs/files/Cystic%20fibrosis%20guidelines/CF%20guideMne%20 2017%20FINAL%20-%2013%201%2017.pdf. Accessed on April 17, 2022.
123. Kreicher KL, Bauschard MJ, Clemmens CS, et al. Audiometric Assessment of Pediatric Patients With Cystic Fibrosis. J Cyst Fibros. 2018;17(3):383-390. doi: https://doi.org/10.1016/j.jcf.2017.10.007
124. Репина С.А., Красовский С.А., Сорокина Т.М. и др. Патогенный вариант 3849+10kbC>T гена CFTR как главный предиктор сохранения фертильности у мужчин с муковисцидозом // Генетика. — 2019. — Т. 55. — № 12. — C. 1481-1486. — doi: https://doi. org/10.1134/S0016675819120105 [Repina SA, Krasovskiy SA, Sorokina TM, et al. CFTR Gene Pathogenic Variant 3849+10kbC>T as a Major Predictor of Preserved Fertility in Male Patients with Cystic Fibrosis. Russian Journal of Genetics. 2019;55(12):1481-1486. (In Russ). doi: https://doi.org/10.1134/S0016675819120105]
125. Хирургические болезни недоношенных детей: национальное руководство / под ред. Ю.А. Козлова, В.А. Новожилова, А.Ю. Разумовского. — М.: ГЭОТАР-Медиа; 2019. — С. 329-393. [Hirurgicheskie bolezni nedonoshennyh detej: National guide. Kozlov JuA, Novozhilov VA, Razumovskij AJu, eds. GEOTAR-Media; 2019. pp. 329-393. (In Russ).]
126. Yang C, Montgomery M. Dornase alfa for cystic fibrosis. Cochrane Database Syst Rev. 2018;9(9):CD001127. doi: https://doi.org/10.1002/14651858.CD001127.pub4
127. Casale M, Vella P, Moffa A, et al. Hyaluronic acid and upper airway inflammation in pediatric population: a systematic review. Int J Pediatr Otorhinolaryngol. 2016;85:22-26. doi: https://doi.org/10.1016/j.ijporl.2016.03.015
128. Wark P, McDonald VM Nebulised hypertonic saline for cystic fibrosis. Cochrane Database Syst Rev. 2018;9(9):CD001506. doi: https://doi.org/10.1002/14651858.CD001506.pub4
129. Nevitt SJ, Thornton J, Murray CS, Dwyer T. Inhaled mannitol for cystic fibrosis. Cochrane Database Syst Rev. 2020;5(5):CD008649. doi: https://doi.org/10.1002/14651858.CD008649.pub4
130. Ziebach R, Pietsch-Breitfeld B, Bichler M, et al. Bronchodilatory effects of salbutamol, ipratropium bromide, and their combination: double-blind, placebo-controlled crossover study in cystic fibrosis. Pediatr Pulmonol. 2001;31(6):431-435. doi: https://doi.org/10.1002/ppul.1071
131. Avital A, Sanchez I, Chernick V. Efficacy of salbutamol and ipratropium bromide in decreasing bronchial hyperreactivity in children with cystic fibrosis. Pediatr Pulmonol. 1992;13(1):34-37. doi: https://doi.org/10.1002/ppul.1950130109
132. Smith S, Edwards CT. Long-acting inhaled bronchodilators for cystic fibrosis. CochraneDatabase Syst Rev.2017;12(12):CD012102. doi: https://doi.org/10.1002/14651858.CD012102.pub2
133. Halfhide C, Evans HJ, Couriel J. Inhaled bronchodilators for cystic fibrosis. Cochrane Database Syst Rev. 2005;(4):CD003428. doi: https://doi.org/10.1002/14651858.CD003428.pub2
134. Ratjen F, Munck A, Kho P, Angyalosi G. Treatment of early Pseudomonas aeruginosa infection in patients with cystic fibrosis: the ELITE trial. Thorax. 2010;65(4): 286-291. doi: https://doi.org/10.1136/thx.2009.121657
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
135. Taccetti G, Bianchini E, Cariani L. Early antibiotic treatment for Pseudomonas aeruginosa eradication in patients with cystic fibrosis: A randomised multicentre study comparing two different protocols. Thorax. 2012;67(10):853-859. doi: https://doi.org/10.1136/thoraxjnl-2011-200832
136. Proesmans M, Vermeulen F, Boulanger L, et al. Comparison of two treatment regimens for eradication of Pseudomonas aeruginosa infection in children with cystic fibrosis. J Cyst Fibros. 2013;12(1):29-34. doi: https://doi.org/10.1016/j.jcf.2012.06.001
137. Flume PA, Mogayzel PJ, Robinson KA. Cystic Fibrosis Pulmonary Guidelines: Treatment of Pulmonary Exacerbations. Am J Respir Crit Care Med. 2009;180(9):802-808. doi: https://doi.org/10.1164/rccm.200812-1845PP
138. McKinzie CJ, Chen L, Ehlert K, et al. Off-label use of intravenous antimicrobials for inhalation in patients with cystic fibrosis. Pediatr Pulmonol. 2019;54(Suppl 3):S27-S45. doi: https://doi.org/10.1002/ppul.24511
139. Antibiotic treatment for cystic fibrosis: Report of the UK Cystic Fibrosis Trust Antibiotic Group. London: Cystic Fibrosis Trust; 2009. Available online: https://www.cysticfibrosis.org.uk/sites/default/ files/2020-11/Anitbiotic%20Treatment.pdf. Accessed on April 17, 2022.
140. Solis A, Brown D, Hughes J. Methicillin-resistant Staphylococcus aureus in children with cystic fibrosis: An eradication protocol. Pediatr Pulmonol. 2003;36(3):189-195. doi: https://doi.org/10.1002/ppul.10231
141. Zobell JT, Epps KL, Young DC, et al. Utilization of antibiotics for methicillin-resistant Staphylococcus aureus infection in cystic fibrosis. Pediatr Pulmonol. 2015;50(6):552-559. doi: https://doi.org/10.1002/ppul.23132
142. Jennings MT, Boyle MF, Weaver D, et al. Eradication strategy for persistent methicillin-resistant infection in individuals with cystic fibrosis — the FMEF trial: study protocol for a randomized controlled trial. Trials. 2014;15:223. doi: https://doi.org/10.1186/1745-6215-15-223
143. Kiefer A, Bogdan C, Melichar VO. Successful eradication of newly acquired MRSA in six of seven patients with cystic fibrosis applying a short-term local and systemic antibiotic scheme. BMC Pulm Med. 2018;18(1):20. doi: https://doi.org/10.1186/s12890-018-0588-6
144. Maiz L, Canton R, Mir N. Aerosolized vancomycin for the treatment of methicillin-resistant Staphylococcus aureus infection in cystic fibrosis. Pediatr Pulmonol. 1998;26(4):287-289. doi: https://doi.org/10.1002/(sici)1099-0496(199810)26:4<287::aid-ppul9>3.0.co;2-#
145. Weathers L, Riggs D, Santeiro M, Weibley RE. Aerosolized vancomycin for treatment of airway colonization by methicillin resistant Staphylococcus aureus. Pediatr Infect Dis J. 1990;9(3):220-221. doi: https://doi.org/10.1097/00006454-199003000-00017
146. Jennings MJ, Boyle MF, Bucur C, et al. Pharmacokinetics and safety of inhaled vancomycin in patients with cystic fibrosis. Pediatr Pulmonol. 2012;47(S35):320.
147. Boyle MF, Chmiel J. Persistent methicillin resistant Staphylococcus aureus eradication protocol (FMEF). In: ClinicalTrials. gov. May 9, 2012. Available online: http://clinicaltrials.Gov/ct2/ show/nct01594827. Accessed on April 17, 2022.
148. Chmiel JF, Aksamit TR, Chotirmall SH, et al. Antibiotic Management of Lung Infections in Cystic Fibrosis. I. The Microbiome, Methicillin-Resistant Staphylococcus aureus, Gram-Negative Bacteria, and Multiple Infections. Ann Am Thorac Soc. 2014;11(7):1120-1129. doi: https://doi.org/10.1513/AnnalsATS.201402-050AS
149. Döring G, Flume F, Heijerman H, et al. Treatment of lung infection in patients with cystic fibrosis: current and future strategies. J Cyst Fibros. 2012;11(6):461-479. doi: https://doi.org/10.1016/j.jcf.2012.10.004
150. Garazzino S, Altieri E, Silvestro E, et al. Ceftolozane/Tazobactam for Treating Children With Exacerbations of Cystic Fibrosis Due to Fseudomonas aeruginosa: A Review of Available Data. Front Pediatr. 2020;8:173. doi: https://doi.org/10.3389/fped.2020.00173
151. European Society of Clinical Microbiology and Infection Diseases. Rational for EUCAST clinical breakpoints. In: EUCAST. European Committee on Antimicrobial Susceptibility Testing. Version 1.0. pp. 1-16. Available online: https://www.eucast.org/ fileadmin/src/media/FDFs/EUCAST_files/Rationale_documents/ Ceftolozane-tazobactam_Rationale_1.0_20200515_v1.pdf. Accessed on April 17, 2022.
152. Morton R, Doe S, Banya W, Simmond NJ. Clinical benefit of continuous nebulised Aztreonam Lysine for Inhalation (AZLI) in adults with cystic fibrosis — a retrospective cohort study. J Cyst Fibros. 2017;16(Suppl 1):S55.
153. Smith S, Rowbotham NJ, Regan KH. Inhaled anti-pseudomonal antibiotics for long-term therapy in cystic fibrosis. Cochrane Database Syst Rev. 2018;3(3):CD001021. doi: https://doi.org/10.1002/14651858.CD001021.pub3
154. WHO AnthroPlus for personal computers Manual: Software for assessing growth of the world’s children and adolescents. Geneva: World Health Organization; 2009. Available online: http://www.who. int/growthref/tools/en. Accessed on April 17, 2022.
155. Regan KH, Bhatt J. Eradication therapy for Burkholderia cepacia complex in people with cystic fibrosis.
O)
vH
<N CM
о
CM <5
о
-J
о
о <
ш
ее <
X Q.
О
ее
о ш Q.
О
vH
СМ СМ О CNI
О §
< s
Q.
<
в
К <
ас о ш х s
Q.
I— <
S
Ч ш
191
V)
z о
< a
о о ш СЕ
-1 <
О
< ч
о se ш а. ш S
se о ш 3″
se
Cochrane Database Syst Rev. 2019;4(4):CD009876. doi: https://doi.org/10.1002/14651858.CD009876.pub4
156. Frost F, Shaw M, Nazareth D. Antibiotic therapy for chronic infection with Burkholderia cepacia complex in people with cystic fibrosis. Cochrane Database Syst Rev. 2019;6(6):CD013079. doi: https://doi.org/10.1002/14651858.CD013079.pub2
157. Weidmann A, Webb AK, Dodd ME, Jones AM. Successful treatment of cepacia syndrome with combination nebulised and intravenous antibiotic therapy. J Cyst Fibros. 2008;7(5):409-411. doi: https://doi.org/10.1016/j.jcf.2008.02.005
158. Abbott IJ, Peleg AY. Stenotrophomonas, Achromobacter, and nonmelioid Burkholderia species: antimicrobial resistance and therapeutic strategies. Semin Respir Crit Care Med. 2015;36(1):99-110. doi: https://doi.org/10.1055/s-0034-1396929
159. Swenson CE, Sadikot RT. Achromobacter Respiratory Infections. Ann Am Troc Soc. 2015;12(2);252-258. doi: https://doi.org/10.1513/AnnalsATS.201406-288FR
160. Wang M, Ridderberg W, Hansen CR, et al. Early treatment with inhaled antibiotics postpones next occurrence of Achromobacter in cystic fibrosis. J Cyst Fibros. 2013;12(6):638-643. doi: https://doi.org/10.1016/j.jcf.2013.04.013
161. Edwards BD, Greysson-Wong J, Somayaji R, et al. Forbes Prevalence and Outcomes of Achromobacter Species Infections in Adults with Cystic Fibrosis: a North American Cohort Study. J Clin Microbiol. 2017;55(7):2074-2085. doi: https://doi.org/10.1128/JCM.02556-16
162. Dupont C, Jumas-Bilak E, Michon AL, et al. Impact of High Diversity of Achromobacter Populations within Cystic Fibrosis Sputum Samples on Antimicrobial Susceptibility Testing. J Clin Microbiol. 2016;55(1):206-215. doi: https://doi.org/10.1128/JCM.01843-16
163. Woods GL, Brown-Elliott BA, Conville PS, et al. Susceptibility testing of Mycobacteria, Nocardiae, and Aerobic Actinomycetes. 2nd ed. Wayne (PA): Clinical and Laboratory Standards Institute; 2011. Report No.: M24-A2.
164. Haworth CS, Banks J, Capstick T, et al. British Thoracic Society guidelines for the management of non-tuberculous mycobacterial pulmonary disease (NTM-PD). Thorax. 2017;72(Suppl 2):ii1-ii64. doi: https://doi.org/10.1136/thoraxjnl-2017-210927
165. Floto RA, Olivier KN, Saiman L, et al. US Cystic Fibrosis Foundation and European Cystic Fibrosis Society consensus recommendations for the management of non-tuberculous mycobacteria in individuals with cystic fibrosis. Thorax. 2015;71(Suppl 1):i1-i22 doi: https://doi.org/10.1136/thoraxjnl-2015-207360
166. Согласованные рекомендации Американского фонда кистозного фиброза (муковисцидоза) и Европейского общества кистозного фиброза по лечению микобактериоза у пациентов с кистозным фиброзом / pед. пер. Н.Ю. Каширская. — СПб.: Благотворительный фонд «Острова»; 2017. — 32 с. [Soglasovannye rekomendacii Amerikanskogo fonda kistoznogo fibroza (mukoviscidoza) i Evropejskogo obshhestva kistoznogo fibroza po lecheniju mikobakterioza u pacientov s kistoznym fibrozom / Kashirskaja NJu, translation ed. St. Petersburg: Blagotvoritel’nyj fond «Ostrova»; 2017. 32 p. (In Russ).]
167. Федеральные клинические рекомендации по организации и проведению микробиологической и молекулярно-генетиче-ской диагностики туберкулеза. — М.-Тверь: ООО «Издательство «Триада», 2014. — 56 с. [Federal’nye klinicheskie rekomendacii po organizacii i provedeniju mikrobiologicheskoj i molekuljarno-geneticheskoj diagnostiki tuberkuleza. Moskow-Tver: OOO «Izdatel’stvo «Triada»»; 2014. 56 P (In Russ).]
168. Griffith DE, AksamitT, Brown-Elliott BA, et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med. 2007;175:367-416. doi: https://doi.org/10.1164/rccm.200604-571ST
169. Olivier KN, Weber DJ, Wallace RJ Jr, et al. Nontuberculous mycobacteria. I: multicenter prevalence study in cystic fibrosis. Am J Respir Crit Care Med. 2003;167(6):828-834. doi: https://doi.org/10.1164/rccm.200207-678OC
170. Martiniano SL, Sontag MK, Daley CL, et al. Clinical significance of a first positive nontuberculous mycobacteria culture in cystic fibrosis. Ann Am Thorac Soc. 2014;11(1):36-44. doi: https://doi.org/10.1513/AnnalsATS.201309-310OC
171. Козлова Я.И., Борзова Ю.В., Суслова И.Е. и др. Аспергиллез легких у больных муковисцидозом // Журнал инфектологии. — 2018. — Т 10. — № 2. — С. 48-54. —
doi: https://doi.org/10.22625/2072-6732-2018-10-2-48-54 [Kozlova YaI, Borzova YuV, Shadrivova OV. Pulmonary Aspergillosis in Patients with Cystic Fibrosis in Russian Federation. Jurnal infektologii = Journal Infectology. 2018;10(2):48-54. (In Russ). doi: https://doi.org/10.22625/2072-6732-2018-10-2-48-54]
172. Proesmans M, Vermeulen F, Vreys M, De Boeck K. Use of nebulized amphotericin B in the treatment of allergic bronchopulmonary aspergillosis in cystic fibrosis. Int J Pediatr. 2010;2010:376287. doi: https://doi.org/10.1155/2010/376287
173. Hayes D Jr, Murphy BS, Lynch JE, Feola DJ. Aerosolized amphotericin for the treatment of allergic bronchopulmonary aspergillosis. Pediatr Pulmonol. 2010;45(11):1145-1148. doi: https://doi.org/10.1002/ppul.21300
174. Elphick HE, Southern KW Antifungal therapies for allergic bronchopulmonary aspergillosis in people with cystic fibrosis. Cochrane Database Syst Rev. 2016;11:CD002204.
175. Ассоциация клинических фармакологов. Официальный ответ на письмо № А-3/2 от 06 марта 2018. — 14 марта 2018. — № 29-2018. [Association of Clinical Pharmacologists. Official response to letter No. A-3/2 dated March 06, 2018. March 14, 2018. No. 29-2018. (In Russ).] Available online: https:// mukoviscidoz.org/doc/med_doc/otvet-farmakologov.pdf. Accessed on April 17, 2022.
176. Burks TF. 10.08.3.2.3. Pancreatic enzyme preparations. In: Comprehensive Toxicology. Elsevier, NY; 2010. Vol. 10. Available online: https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/fibrosing-colonopathy. Accessed on April 17, 2022.
177. Somaraju UR, Solis-Moya A. Pancreatic enzyme replacement therapy for people with cystic fibrosis. Cochrane Database Syst Rev. 2014;(10):CD008227. doi: https://doi.org/10.1002/14651858. CD008227.pub2
178. Meyer JH, Elashoff J, Porter-Fink V, et al. Human postprandial gastric emptying of 1-3 millimeter spheres. Gastroenterology. 1988;94(6):1315-1325. doi: https://doi.org/10.1016/0016-5085(88)90669-5
179. Mundlos S, Kuehnelt P, Adler G. Monitoring enzyme re-placement treatment in exocrine pancreatic insufficiency using the cholesteryl octanoate breath test. Gut. 1990;31(11):1324-1328. doi: https://doi.org/10.1136/gut.31.11.1324
180. Singh VK, Schwarzenberg SJ. Pancreatic insufficiency in Cystic Fibrosis. J Cyst Fibros. 2017;16(Suppl 2):S70-S78. doi: https://doi.org/10.1016/j.jcf.2017.06.011
181. Brodsky J, Dougherty S, Ramkrishna M, et al. Elevation of 1-hour plasma glucose during oral glucose tolerance testing is associated with worse pulmonary function in cystic fibrosis. Diabetes Care. 2011;34(2):292-295. doi: https://doi.org/10.2337/dc10-1604
182. Hardin DS, Rice J, Rice M, Rosenblatt R. Use of the insulin pump in treat cystic fibrosis related diabetes. J Cyst Fibros. 2009;8(3):174-178. doi: https://doi.org/10.1016/j.jcf.2008.12.001
183. van der Feen C, van der Doef HP, van der Ent CK, Houwen RH. Ursodeoxycholic acid treatment is associated with improvement of liver stiffness in cystic fibrosis patients. J Cyst Fibros. 2016;15(6):834-838. doi: https://doi.org/10.1016/j.jcf.2016.07.009
184. Cheng K, Ashby D, Smyth RL, et al. Best practice guidance for the diagnosis and management of cystic fibrosis-associated liver disease. J Cyst Fibros. 2011;10(2):S29-S36. doi: http://doi.org/10.1016/ S1569-1993(11)60006-4
185. Ивашкин В.Т., Маевская М.В., Павлов Ч.С. и др. Клинические рекомендации Российского общества по изучению печени и Российской гастроэнтерологической ассоциации по лечению осложнений цирроза печени // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2016. — Т. 26. — № 4. — С. 71-102. — doi: https://doi.org/10.22416/1382-4376-2016-26-4-71-102 [Ivashkin VT, Mayevskaya MV, Pavlov CS, et al. Treatment of liver cirrhosis complications: Clinical guidelines of the Russian Scientific Liver Society and Russian gas-troenterological association. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2016;26(4):71-102. (In Russ). doi: https://doi.org/10.22416/1382-4376-2021-31-6-56-102]
186. Marquette M., Haworth C.S. Bone health and disease in cystic fibrosis. Paediatr Respir Rev. 2016;20(Suppl):2-5. doi: https://doi.org/10.1016/j. prrv.2016.06.003
187. Zhekaite E, Kondratyeva E, Ilenkova N, et al. The model for determining risk groups for the development of vitamin D deficiency and
192
prevention algorithm in children with cystic fibrosis using the multifac-tor dimensionality reduction method. J Cyst Fibros. 2021;20(S1):S34. doi: https://doi.org/ 10.1016/S1569-1993(21)01015-8
188. Жекайте Е.К. Изучение влияния генетических и экзогенных факторов на развитие дефицита витамина D у детей и подростков с муковисцидозом в возрастном аспекте. Вопросы профилактики: автореф. дис. … канд. мед. наук. M.; 2020. [Zhekajte EK. Izuchenie vlijanija geneticheskih i jekzogennyh faktorov na razvitie deficita vitamina D u detej i podrostkov s mukoviscidozom v vozrastnom aspekte. Voprosy profilaktiki. [abstract of dissertation]. Moscow; 2020. (In Russ).]
189. Баранов А.А., Hамазова-Баранова Л.С., Симонова О.И. и др. Современные представления о диагностике и лечении детей с муковисцидозом // Педиатрическая фармакология. — 2015. — Т. 12. — №. 5. — С. 589-604. — doi: https://doi.org/10.15690/ pf.v12i5.1462 [Baranov AA, Namazova-Baranova LS, Simonova OI, et al. Contemporary Understanding of Diagnosis and Treatment of Children with Cystic Fibrosi. Pediatricheskaya farmakologiya — Pediatric pharmacology. 2015;12(5):589-604. (In Russ). doi: https://doi.org/10.15690/pf.v12i5.1462
190. Harvey R, Hannan S.A, Badia L, Scadding G. Nasal saline irrigations for the symptoms of chronic rhinosinusitis. Cochrane Database Syst Rev. 2007;(3):CD006394. doi: https://doi.org/10.1002/14651858.CD006394.pub2
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
191. Fokkens WJ, Lund VJ, Mullol J, et al. EPOS 2012: European position paper on rhinosinusitis and nasal polyps 2012. A summary for otorhinolaryngologists. Rhinology. 2012;50(1):):1-12. doi: https://doi.org/10.4193/Rhino12.000.
192. Beer H, Southern KW, Swift AC. Topical nasal steroids for treating nasal polyposis in people with cystic fibrosis. Cochrane Database Syst Rev. 2015;(6):CD008253. doi: https://doi.org/10.1002/14651858.CD008253.pub4
193. Mehta S, Hill NS. Noninvasive ventilation. Am J Respir Crit Care Med. 2001;163(2):540-577. doi: https://doi.org/10.1164/ajrccm.163.2.9906116
194. Clinical indications for noninvasive positive pressure ventilation in chronic respiratory failure due to restrictive lung disease, COPD, and nocturnal hypoventilation — a consensus conference report. Consensus conference. Chest. 1999;116(2):521-534. doi: https://doi.org/10.1378/chest.116.2.521
195. Kapnadak SG, Dimango E, Hadjiliadis D, et al. Cystic Fibrosis Foundation consensus guidelines for the care of individuals with advanced cystic fibrosis lung disease. J Cyst Fibros. 2020;19(3):344-354. doi: https://doi.org/10.1016/j.jcf.2020.02.015
196. King CS, Brown AW, Aryal S, et al. Critical Care of the Adult Patient With Cystic Fibrosis. Chest. 2019;155(1):202-214. doi: https://doi.org/10.1016/j.chest.2018.07.025
197. Flume PA. Pneumothorax in cystic fibrosis. Curr Opin Pulm Med. 2011;17(4):220-225. doi: https://doi.org/10.1097/MCP.0b013e328345e1f8
198. Shinohara T, Tsuda M, Koyama N. Management of meconium-related ileus in very low-birthweight infants. PediatInt. 2007;49: 641644. doi: https://doi.org/10.1111/j.1442-200X.2007.02457.x
199. Parikh NS, Ahlawat R, Ahlawat R. Meconium Ileus. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020. Available online: https://www.ncbi.nlm.nih.gov/books/ NBK537008. Accessed on April 17, 2022.
200. Colombo C, Ellemunter H, Houwen R, et al. ECFS Guidelines for the diagnosis and management of distal intestinal obstruction syndrome in cystic fibrosis patients. J Cyst Fibros. 2011;10(Suppl 2):S24-S28. doi: https://doi.org/10.1016/S1569-1993(11)60005-2
201. Schauble AL, Bisaccia EK, Lee G, Nasr SZ. N-acetylcysteine for Management of Distal Intestinal Obstruction Syndrome. J Pediatr Pharmacol Ther. 2019;24(5):390-397. doi: https://doi.org/10.5863/1551-6776-24.5.390
202. Wu HX, Zhu M, Xiong XF, et al. Efficacy and Safety of CFTR Corrector and Potentiator Combination Therapy in Patients with Cystic Fibrosis for the F508del-CFTR Homozygous Mutation: A Systematic Review and Meta-analysis. Adv Ther. 2019;36(2):451-461. doi: https://doi.org/10.1007/s12325-018-0860-4
203. Wainwright CE, Elborn JS, Ramsey BW, et al. Lumacaftor-Ivacaftor in Patients with Cystic Fibrosis Homozygous for Phe508del CFTR. N Engl J Med. 2015;373(3):220-231. doi: https://doi.org/10.1056/NEJMoa1409547
204. Mayer-Hamblett N, Retsch-Bogart G, Kloster M, et al OPTIMIZE Study Group Azithromycin for Early Pseudomonas Infection in Cystic Fibrosis. The OPTIMIZE Randomized Trial. Am J Respir Crit Care Med. 2018;198(9):1177-1187. doi: https://doi.org/10.1164/rccm.201802-02150C
205. Nichols DP, Odem-Davis K, Cogen JD, et al. Pulmonary Outcomes Associated with Long-Term Azithromycin Therapy in Cystic Fibrosis. Am J Respir Crit Care Med. 2020;201(4):430-437. doi: https://doi.org/10.1164/rccm.201906-1206OC
206. Southern KW, Barker PM, Solis-Moya A, Patel L. Macrolide antibiotics for cystic fibrosis. Cochrane Database Syst Rev. 2011;(12):CD002203. doi: https://doi.org/10.1002/14651858.CD002203.pub3
207. Pukhalsky AL, Shmarina GV, Kapranov NI, et al. Anti-inflammatory and immunomodulating effects of clarithromycin in patients with cystic fibrosis lung disease. Mediators Inflamm. 2004;13(2):111-117. doi: https://doi.org/10.1080/09629350410001688495
208. Konstan MW, Schluchter MD, Storfer-Isser A, Davis PB. Use of ibuprofen for the treatment of airway in flammation in CF: an update. Pediatr Pulmonol. 2002;34(S24):164.
209. Schluchter MD, Konstan MW, Xue L, Davis PB. Relationship between high-dose ibuprofen use and rate of decline in FEV1 among young patients with mild lung disease in the CFF Registry. Pediatr Pulmonol. 2004;38(S27):322.
210. Lands LC, Stanojevic S. Oral non-steroidal antiinflammatory drug therapy for lung disease in cystic fibrosis. Cochrane Database Syst Rev. 2019;9(9):CD001505. doi: https://doi.org/10.1002/14651858.CD001505.pub5
211. Physiotherapy for People with Cystic Fibrosis: from Infant to Adult. 7th ed. IPG/CF; 2019. Available online: https://www. ecfs.eu/sites/default/files/general-content-files/working-groups/ IPG%20CF_Blue%20Booklet_7th%20edition%202019.pdf. Accessed on April 30, 2022.
212. Руководство по клиническому питанию / под ред. В.М. Луфта. — 3-е изд., перераб. — СПб.: Арт-Экспресс; 2016. — 409 с. [Rukovodstvo po klinicheskomu pitaniju. Luft VM, ed. 3rd ed., add. St. Petersburg: Art-Jekspress; 2016. 409 p. (In Russ).]
213. Программа оптимизации вскармливания детей первого года жизни в Российской Федерации: методические рекомендации / ФГАУ «НМИЦ здоровья детей» Минздрава России. — М.; 2019. — C. 70-71. [Programma optimizacii vskarmlivanija detej pervogo goda zhizni v Rossijskoj Federacii: Guidelines. Federal State Autonomous Institution «National Medical Research Center for Children’s Health» of the Ministry of Health of Russia. Moscow; 2019. C. 70-71. (In Russ).]
214. Sinaasappel M, Stern M, Littlewood J, et al. Nutrition in patients with cystic fibrosis: a European Consensus. J Cyst Fibrosis. 2002;1(2): 51-75. doi: https://doi.org/10.1016/S1569-1993(02)00032-2
215. Кондратьева Е.И., Максимычева Т.Ю., Портнов Н.М. и др. Первые результаты применения компьютерной программы «Мониторинг нутритивного статуса, рациона питания и ферментной терапии» // Вопросы детской диетологии. — 2016. — Т. 14. — № 6. — С. 5-12. — doi: https:// doi.org/10.20953/1727-5784-2016-6-5-12 [Kondrat’eva EI, Maksimycheva TYu, Portnov NM, et al. First results of using a computer programme «Monitoring of nutritional status, dietary intake and enzyme therapy in cystic fibrosis». Voprosy detskoy dietologii = Pediatric Nutrition. 2016;14(6):5-12. (In Russ). doi: https://doi.org/10.20953/1727-5784-2016-6-5-12]
216. Кондратьева Е.И., Орлов А.В., Максимычева Т.Ю. и др. Возможности оптимизации ферментной терапии при муко-висцидозе // Педиатрия. Журнал им Г.Н. Сперанского. — 2018. — Т. 97. — № 6. — С. 104-112. — doi: https://doi. org/ 10.24110/0031-403X-2018-97-6-104-112 [Kondrateva EI, Orlov AV, Maksimycheva TYu, et al. Optimization possibilities of enzyme therapy for cystic fibrosis. Pediatria Journal n.a. G.N. Speransky. 2018;97(6):104-112. (In Russ). doi: https://doi.org/ 10.24110/0031-403X-2018-97-6-104-112]
217. Максимычева Т.Ю., Кондратьева Е.И., Сорвачёва Т.Н. Оценка и коррекция нутритивного статуса у детей с муковисци-дозом // Вопросы практической педиатрии. — 2018. — Т. 13. — № 5. — С. 24-32. — doi: https://doi.org/10.20953/1817-7646-2018-5-24-32 [Maksimycheva TYu, Kondrat’eva EI, Sorvacheva TN. Assessment and correction of nutritional status in children with cystic fibrosis. Voprosy prakticheskoy pediatrii
о
vH
<N CM О
CM ^
<5 О -i О
О <
s
ее <
X Q.
О
ее
о ш Q.
О
vH
СМ СМ О CNI
О §
< s
Q.
<
в
К <
ае о ш X X Q.
I— <
X
Ч ш
193
V)
z о
< a
о о ш
а _j
<
о
< ч
о ас ш Q. ш S
о ш 3″
ас
= Clinical Practice in Pediatrics. 2018;13(5):24-32. (In Russ). doi: https://doi.org/10.20953/1817-7646-2018-5-24-32]
218. Максимычева Т.Ю., Кондратьева Е.И., Сорвачёва Т.Н., Одинаева Н.Д. Опыт коррекции нутритивного статуса нутритивно-го статуса у детей с муковисцидозом с использованием компьютерных систем и средств сетевой коммуникации // Сибирское медицинское обозрение. — 2019. — № 4. — С. 67-73. — doi: https://doi.org/10.20333/2500136-2019-4-67-73 [Maksimycheva TY, Kondratyeva EI, Sorvacheva TN, Odinaeva ND. Experience of correcting nutritional status in children with cystic fibrosis using computer systems and network communications. Siberian Medical Review. 2019;(4):67-73. (In Russ). doi: https://doi.org/10.20333/2500136-2019-4-67-73]
219. Flume PA, Mogayzel PJ, Robinson KA, et al. Cystic fibrosis pulmonary guidelines: pulmonary complications: hemoptysis and pneumothorax. Am J Respir Crit Care Med. 2010;182(3):298-306. doi: https://doi.org/10.1164/rccm.201002-0157OC
220. Flume PA, Yankaskas JR, Ebeling M, et al. Massive hemoptysis in cystic fibrosis. Chest. 2005;128(2):729-738. doi: https://doi.org/10.1378/chest.128.2.729
221. Hamilos DL. Nasal and sinus problems in cystic fibrosis patients. In: The Nose and Sinuses in Respiratory Disorders (ERS Monograph). Bachert C, Bourdin A, Chanez P, eds. Sheffield: European Respiratory Society; 2017. pp. 48-66. doi: https://doi.org/10.1183/2312508X.10009616
222. Moss RB, King VV. Management of sinusitis in cystic fibrosis by endoscopic surgery and serial antimicrobial lavage. Reduction in recurrence requiring surgery. Arch Otolaryngol Head Neck Surg. 1995;121(5):566-572. doi: https://doi.org/10.1001/archotol.1995.01890050058011
223. Keck T, Rozsasi A. Medium-term symptom outcomes after paranasal sinus surgery in children and young adults with cystic fibrosis. Laryngoscope. 2007;117:475-479. doi: https://doi.org/10.1097/MLG.0b013e31802d6e4f.
224. Liang J, Higgins TS, Ishman SL, et al. Surgical management of chronic rhinosinusitis in cystic fibrosis: a systematic review. Int Forum Allergy Rhinol. 2013;3(10):814-822. doi: https://doi.org/10.1002/alr.21190
225. Boczar M, Sawicka E, Zybert K, Meconium ileus in newborns with cystic fibrosis — results of treatment in the group of patients operated on in the years 2000-2014. Dev Period Med. 2015;19(1):32-40.
226. Yusen R, Edwards L, Dipchand A. The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Lung and Heart-Lung Transplant Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant. J Heart Lung Transplant. 2016;35(11):1170-1184. doi: https://doi.org/10.1016/j.healun.2016.09.001
227. Репина С.А., Красовский С.А., Шмарина Г.В. и др. Состояние репродуктивной системы и алгоритм решения вопроса деторождения у мужчин с муковисцидозом // Альманах клинической медицины. — 2019. — Т. 47. — № 1. — С. 26-37. doi: https://doi.org/10.18786/2072-0505-2019-47-001 [Repina SA, Krasovskiy SA, Shmarina GV, et al. Reproductive system status and the algorithm to solve fertility issues in men with cystic fibrosis. Almanac of Clinical Medicine. 2019;47(1):26-37. (In Russ). doi: https://doi.org/10.18786/2072-0505-2019-47-001]
228. Malfroot A, Adam G, Ciofu O, et al. Immunisation in the current management of cystic fibrosis patients J Cyst Fibros. 2005;4(2):77-87. doi: https://doi.org/10.1016/j.jcf.2004.10.003
229. Муковисцидоз, хронические воспалительные болезни легких // МУ 3.3.1.1123-02. Мониторинг поствакцинальных осложнений и их профилактика: методические указания. — М.; 2002. — 44 с. — Ч. 9.6.5. [Mukoviscidoz, hronicheskie vospalitel’nye bolezni legkih. In: MU 3.3.1123-02. Monitoringpostvakcinal’nyh oslozhnenij i ih profilaktika: Methodological guidelines. Moscow; 2002. 44 p. Part 9.6.5. (In Russ).]
230. Федеральное руководство по использованию лекарственных средств (формулярная система) / под ред. А.Г. Чучалина, В.В. Яснецова. — 17-е изд., перераб. и доп. — М.: ООО «Видокс»; 2016. — С. 745-768. [Federal’noe rukovodstvo po ispol’zovaniju lekarstvennyh sredstv (formuljarnaja sistema). Chuchalin AG, Jasnecov VV, eds. 17th ed., rev. and add. Moscow: OOO «Vidoks»; 2016. pp. 745-768. (In Russ).]
231. Чучалин А.Г., Биличенко Т.И., Осипова Г.Л. и др. Вакцинопрофилактика болезней органов дыхания в рамках первичной медико-санитарной помощи населению: клинические
рекомендации // Пульмонология. — 2015. — № 2. — С. 1-19. [Chuchalin AG, Bilichenko TI, Osipova GL, et al. Vakcinoprofilaktika boleznej organov dyhanija v ramkah pervichnoj mediko-sanitarnoj pomoshhi naseleniju: Clinical guidelines. Pulmonologiya = Russian Pulmonology. 2015;(2):1-19. (In Russ).]
232. Зверев В.В., Костинов М.П., Магаршак О.О. и др. Руководство по клинической иммунологии в респираторной медицине / под ред. М.П. Костинова, А.Г. Чучалина. — 2-е изд. — М.: Группа МДВ; 2018. — 304 с. [Zverev VV, Kostinov MP Magarshak OO, et al. Rukovodstvo po klinicheskoj immunologic v respiratornoj medicine. Kostinov MP Chuchalina AG, eds. 2nd ed. Moscow: Gruppa MDV; 2018. 304 p. (In Russ).]
233. Ежлова Е.Б., Мельникова А.А., Баранов А.А. и др. Эпидемиология и вакцинопрофилактика инфекции, вызываемой Streptococcus pneumoniae: методические рекомендации // Вакцинация. — 2011. — № 2. — С. 36-47. [Ezhlova EB, Mel’nikova AA, Baranov AA, et al. Jepidemiologija i vakcinoprofilaktika infekcii, vyzyvaemoj Streptococcus pneumoniae: metodicheskie rekomendacii. Vakcinacija. 2011;(2):36-47. (In Russ).]
234. Pneumococcal: Chapter 25. In: The Green Book. 2013. Available online: https://www.gov.uk/government/publications/ pneumococcal-the-green-book-chapter-25. Accessed on April 17, 2022.
235. Kobayashi M, Bennett NM, Gierke R, et al. Intervals Between PCV13 and PPSV23 Vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep. 2015;64(34):944-947. doi: https://doi.org/10.15585/mmwr.mm6434a4
236. Burgess L, Southern KW. Pneumococcal vaccines for cystic fibrosis. Cochrane Database Syst Rev. 2014;(8):CD008865. doi: https://doi.org/10.1002/14651858.CD008865.pub3
237. Костинов М.П., Магаршак О.О., Полищук В.Б. и др. Вакцинация взрослых с бронхолегочной патологией: руководство для врачей / под ред. М.П. Костинова. — М.: Арт-студия «Созвездие»; 2013. — 112 с. [Kostinov MP Magarshak OO, Polishhuk VB, et al. Vakcinacija vzroslyh s bronholegochnoj patologiej: rukovodstvo dlja vrachej. Kostinov MP ed. Moscow: Art-studija «Sozvezdie»; 2013. 112 p. (In Russ).]
238. Рыжов А.А., Костинов М.П., Магаршак О.О. Применение вакцин против пневмококковой и гемофильной типа b инфекций у лиц с хронической патологией // Эпидемиология и вакцинопрофилактика. — 2004. — № 6. — С. 24-27. [Ryzhov AA, Kostinov MP Magarshak OO. Primenenie vakcin protiv pnevmokokkovoj i gemofil’noj tipa b infekcij u lic s hronicheskoj patologiej. Epidemiology and Vaccinal Prevention. 2004;6:24-27. (In Russ).]
239. Ong EL. Bilton D, Abbott J. et al. Influenza vaccination in adults with cystic fibrosis. BMJ. 1991;303(6802):6557-6802. doi: https://doi.org/10.1136/bmj.303.6802.557
240. Gross PA, Denning CR, Gaerlan PF, et al. Annual influenza vaccination: immune response in patients over 10 years. Vaccine. 1996;14(13):1280-1284. doi: https://doi.org/10.1016/s0264-410x(96)00004-7
241. Dharmaraj P, Smyth RL. Vaccines for preventing influenza in people with cystic fibrosis. Cochrane Database Syst Rev. 2014;2014(3):CD001753. doi: https://doi.org/10.1002/14651858.CD001753.pub3
242. МР 3.3.1.0001-10. Эпидемиология и вакцинопрофилактика инфекции, вызываемой Haemophilus influenzae типа b: методические рекомендации. — М.; 2010. — С. 10. [MR 3.3.1.0001-10. Jepidemiologija i vakcinoprofilaktika infekcii, vyzyvaemoj Haemophilus influenzae tipa b: Guidelines. Moscow; 2010. p. 10. (In Russ).]
243. Haemophilus influenzae type b (Hib) Vaccination Position Paper — July 2013. Wkly Epidemiol Rec. 2013;88(39):413-428.
244. Cerquetti M, Giufre M. Why we need a vaccine for non-typeable Haemophilus influenzae. Hum Vaccin Immunother. 2016;12(9):2357-2361. doi: https://doi.org/10.1080/21645515.2016.1174354.
245. Баранов А.А., Брико Н.И., Горелов А.В. и др. Стратегии контроля ветряной оспы в России. Итоги Международного совещания Экспертного Совета по вопросам профилактики ветряной оспы (W.A.V.E) // Вопросы современной педиатрии. — 2010. — Т. 9. — № 3. — С. 5-12. [Baranov AA, Briko NI, Gorelov AV, et al. Strategies of control of varicella in Russia. Resume of International conference of Expert Council «Working against varicella in Europe» (W.A.V.E.). Voprosy sovremennoi pediatrii — Current Pediatrics. 2010;9(3):5-12.]
194
246. Баранов А.А., Намазова-Баранова Л.С., Таточенко В.К. и др. Иммунопрофилактика менингококковой инфекции у детей: методические рекомендации. 2-е изд., доп. М.:Педиатр; 2019. 36 с. [Baranov AA, Namazova-Baranova LS, Tatochenko VK, et al. Immunoprofilaktika meningokokkovoj infekcii u detej: Guidelines. 2nd ed., add. Moscow: Pediatr; 2019. 36 p. (In Russ).]
247. Баранов А.А., Намазова-Баранова Л.С., Таточенко В.К. и др. Вакцинопрофилактика ротавирусной инфекции: клинические рекомендации. — М.; 2017. — 24 с. [Baranov AA, Namazova-Baranova LS, Tatochenko VK, et al. Vakcinoprofilaktika rotavirusnoj infekcii: Guidelines. Moscow; 2017. 24 p. (In Russ).]
248. Баранов А.А., Намазова-Баранова Л.С., Давыдова И.В. и др. Иммунопрофилактика респираторно-синцитиальной вирусной инфекции у детей: федеральные клинические рекомендации. М.: ПедиатрЪ; 2016. 28 с. [Baranov AA, Namazova-Baranova LS, Davydova IV, et al. Immunoprofilaktika respiratorno-sintsitial’noi virusnoi infektsii u detei: Federal guidelines. Moscow: Pediatr; 2016. 28 p. (In Russ).]
249. Kua KP, Lee SWH. Systematic Review of the Safety and Efficacy of Palivizumab among Infants and Young Children with Cystic Fibrosis. Pharmacotherapy. 2017;37(6):755-769. doi: https://doi.org/10.1002/phar.1936
Статья поступила: 16.02.2022, принята к печати: 14.03.2022 The article was submitted 16.02.2022, accepted for publication 14.03.2022
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств) Table 1. Grade scale for levels of evidence (LoE) for diagnostic methods (diagnostic interventions)
УДД Расшифровка
1. Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2. Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3. Исследования без последовательного контроля референсным методом, или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4. Несравнительные исследования, описание клинического случая
5. Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств) Table 2. Grade scale for levels of evidence (LoE) for prevention, treatment, and rehabilitation methods (preventive, treatment, rehabilitation interventions)
УДД Расшифровка
1. Систематический обзор рандомизированных клинических исследований с применением метаанализа
2. Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3. Нерандомизированные сравнительные исследования, в том числе когортные исследования
4. Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль»
5. Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств) Table 3. Grade scale for grades of recommendation (GoR) for prevention, diagnostic, treatment, and rehabilitation methods (preventive, diagnostic, treatment, rehabilitation interventions)
УУР Расшифровка
A Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными))
195