
Разнообразие форм прокариот
1-5 — кокки; 6 — палочки; 7 — спириллы; 8 — вибрион; 9 — кольцевидные; 10 — бактерии, образующие выросты (простеки); 11 —червеобразные; 12 — в виде звезды; 13 — актиномицеты; 14 —миксобактерии; 15,16 — нитчатые; 8, 15, 17, 18 — бактерии с разными типами жгутикования; 19 — бактерии, образующая капсулу; 20 — нитчатые бактерии, заключенные в чехол, инкрустированный гидратом окиси железа; 21 — бактерия, образующая шипы; 22
— Galionella

(грамотрицательные палочки)
Окраска по Граму Staphylococcus
aureus (грамположительные кокки) и Escherichia coli
Окраска по Граму
•Грамположительные бактерии хорошо удерживают комплекс генцианового фиолетового с йодом и устойчивы к обесцвечиванию спиртом. После обработки фуксином они окрашиваются в фиолетово-пурпурный цвет.
•Грамотрицательные бактерии
обесцвечиваются спиртом, то есть теряют комплекс генцианового фиолетового с йодом, и хорошо поглощают фуксин. В мазках они окрашиваются в малиново- красный цвет.

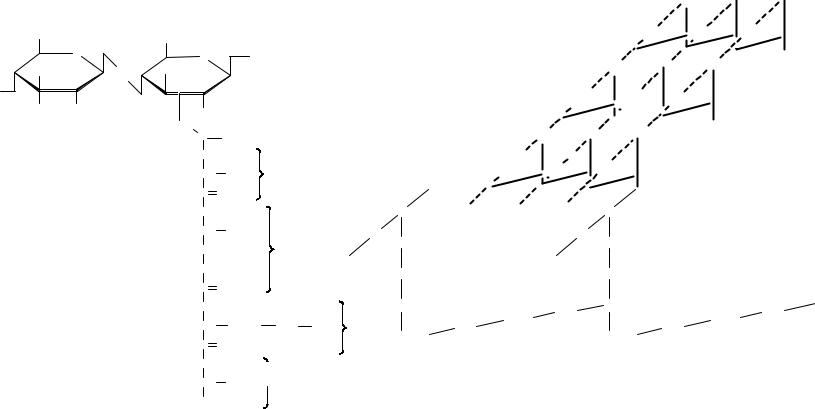
Строение клеточной стенки бактерий
|
А – |
||
|
грамположительные |
||
|
4 |
бактерии |
|
|
Б – |
||
|
3 |
грамотрицательные |
|
|
бактерии |
1 — цитоплазматическая мембрана, 2 – пептидогликан, 3 – периплазматическое пространство, 4 – наружная мембрана
C O
NH
CH COOH CH2
CH2
C O
NH
CH (CH2)3 C O
NH
CH CH3 COOH
Муреин — пептидогликан бактериальных клеточных стенок представляет собой дисахарид из N- ацетилглюкозамина и N-ацетилмурамовой кислоты, к которому присоединена тетрапептидная боковая цепь из
|
OH |
X |
||||
|
L-аланина,CHD2 -глутаминовой кислоты, L-лизина и D- |
|||||
|
O |
CH2OH |
боковые связи всех |
|||
|
O |
Y |
Y |
|||
|
OH |
|||||
|
аланина. ТетрапептидныеO |
|||||
|
O |
O |
X |
X |
||
|
NHOCCH |
|||||
|
дисахаридныH х един3 |
иц связаны с соседними цепями при |
||||
|
NHOCCH3 |
мостиковY из Y |
||||
|
H3C CH |
|||||
|
помощи поперечных пентапептидныхC O |
Y |
||||
|
глицина. |
NH |
L—Ala |
X X X |
||
|
CH CH3 |
|||||
|
Y |
Y |
|||||
|
X |
X |
|||||
|
D—Glu |
Ala |
Ala |
||||
|
D-Glu |
D-Glu |
|||||
|
Lys |
Gly |
Lys |
Gly |
|||
|
CH2 NH2 L—Lis |
Gly |
(Gly)3 |
Gly |
(Gly)3 |
||
|
D-Ala |
D-Ala |
|||||


«Руководство по определению бактерий Берджи»
(D. H. Bergey, I860 — 1937)
Таксономические признаки бактерий:
морфологические признаки:
-форма клеток (кокки, палочки или спириллами), -наличие капсулы, -наличие агрегатов клеток (нити, тетрады, пакеты),
-наличие жгутиков и их расположение, -образование эндоспор, -особенности внутриклеточного строения, -окрашивание по Граму,
культуральные признаки (признаки, выявляемые при культивировании в лаборатории чистой культуры).
Таксономические признаки бактерий:
Физиолого-биохимические признаки:
1)отношение к кислороду, т.е. растут ли клетки в аэробных или в анаэробных условиях, либо в тех и других;
2)каким образом они получают необходимую энергию — в процессе дыхания, брожения или фотосинтеза;
3)зависимость роста от температуры и рН, с указанием оптимума и пределов устойчивости;
4)усваиваемые клетками питательные вещества;
5)места обитания;
6)наличие симбиотических или паразитических взаимоотношений;
7)клеточные включения, пигментация и состав капсулы;

9)серологическая дифференциация (поверхностные антигены, гомологичные белки);
10)состав оснований ДНК (мол. % GC);
11)гибридизация ДНК/ДНК, трансформируемость при межвидовом переносе ДНК;
12)последовательность нуклеотидов в 16S или 5S рРНК;
13)чувствительность к антибиотикам.

Классификация на основе различий в строении клеточной стенки
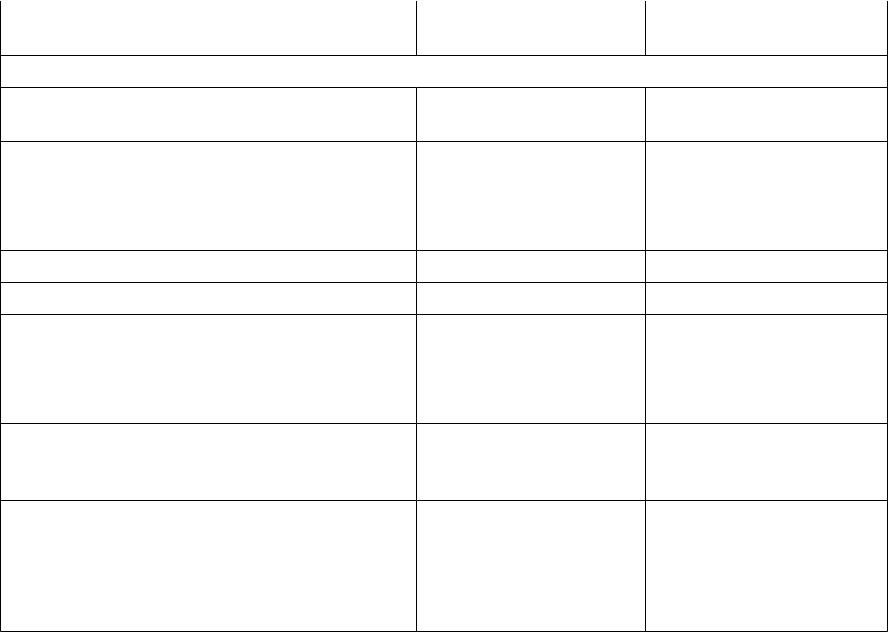
Бактерии – продуценты важнейших продуктов
|
Бактерии |
Субстрат, источник |
Продукты |
|
углерода |
||
|
Аэробные бактерии |
||
|
Acetobacter aceti |
Этанол, уксусная |
Уксусная кислота |
|
кислота |
||
|
Gluconobacter oxydans |
1. Глицерин |
1. Диоксиацетон |
|
2. D-сорбит |
2. L-сорбоза |
|
|
Corynebacterium glutamicum |
Сахароза (меласса) |
L-глутаминовая кислота |
|
L-лизин |
||
|
Streptomyces griseus |
Глюкоза, соевая мука |
Стрептомицин |
|
Streptomyces aureofciencs |
Сахароза |
Тетрациклин |
|
Bacillus subtilis |
Крахмал или |
Амилолитические |
|
кукурузная мука |
ферменты |
|
|
Xanthomonas campestris |
Меласса, гидролизаты |
Экзополисахарид |
|
крахмала |
ксантан |
|
|
Micobacterium globiform |
Глюкоза |
Биотрансформация |
|
гидрокортизона в |
||
|
преднизолон |
||
|
Alcaligenes eutrophus |
Диоксид углерода |
Поли-3-гидроксибутират, |
|
биоразлагаемый |
||
|
полимер |
||
|
Zoogloea rumigera, нитчатые бактерии, |
Органические вещества |
Биологическая очистка |
|
тионовые бактерии, псевдомонады |
сточных вод |
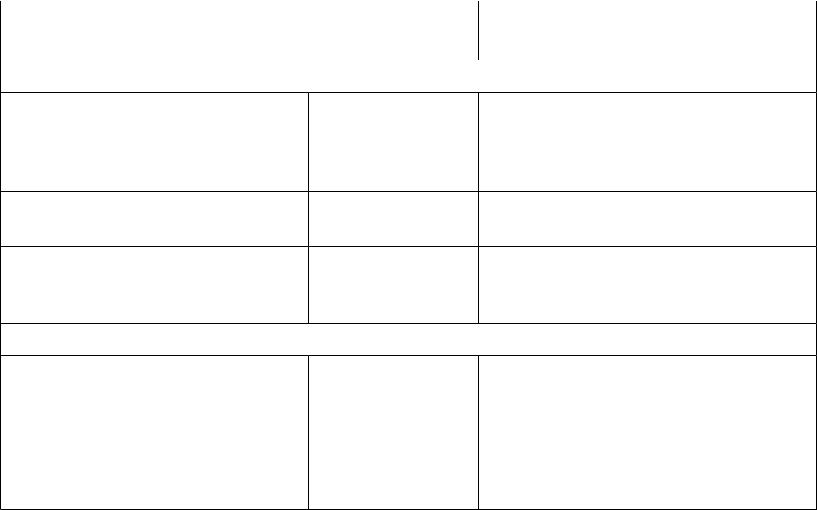
Бактерии – продуценты важнейших продуктов
|
Бактерии |
Субстрат, источник |
Продукты |
|
углерода |
||
|
Факультативные анаэробные бактерии |
||
|
Lactobacillus bulgaricus |
Сахароза |
L-молочная кислота |
|
(меласса), |
||
|
гидролизаты |
||
|
крахмала |
||
|
Генномодифицированные |
Глюкоза |
Инсулин |
|
штаммы Escherichia coli |
Соматотропин и другие белки |
|
|
Propionbacterium freudenreichii |
Гидролизаты |
Витамин В12 |
|
Propionbacterium shermanii |
казеина, |
|
|
пептоны |
||
|
Анаэробные бактерии |
||
|
Clostridium acetobuthylicum |
Меласса, |
Ацетон, бутанол |
|
гидролизаты |
||
|
крахмала, |
||
|
мука |
||
|
Methanococcus, Methanosarcina, |
Низшие жирные |
Биогаз (метан+диоксид углерода) |
|
Methanobacterium |
кислоты |
Для эффективного воздействия на бактериальный состав среды необходимо иметь достоверную информацию о его качественном и количественном содержании. Существует много методов определения бактерий, и выбор способа изучения образца зависит от того, какие результаты должны быть получены. Метод определения молочнокислых бактерий отличается от методики выявления Listeria monocytogenes, а определение ферментативной активности производится иначе, чем определение биохимических свойств.
Методы определения по получаемому результату можно разделить на две большие группы:
- определение количества микробов;
- качественное исследование.
Результаты анализа бактериального состава образцов выражают общим микробным числом, выраженным в КОЕ (колониеобразующие единицы).
Количественный учет микрофлоры
Анализ количества микробов, в зависимости от его возможностей, может определять:
- число всех микроорганизмов, содержащихся в образце;
- только жизнеспособные микробы.
В зависимости от способа получения результата, методы определения количества микроорганизмов подразделяют на:
- прямые (микроскопические);
- косвенные.
В свою очередь, косвенные методы разделяют в зависимости от применяемого критерия как:
- методы оптического исследования (спектрофотометрия, нефелометрия) – измеряемый параметр зависит от количества микроорганизмов;
- высев – метод измерения образовавшихся колоний.
Методы определения общего количества бактерий опираются на значение титра образца.
Методика титра
Метод предельного разбавления образца (метод титра) позволяет с высокой точностью определить количественное значение группы микроорганизмов.
Сущность методики заключается в том, что исследуемая проба разводится определенным образом и высевается в специфические для микроорганизмов среды. Так создаются благоприятные условия для роста. По прошествии времени исследуют образцы, устанавливая, при каком предельном разведении выявляются бактерии определенной группы. Выводы делаются по специфическим изменениям питательного субстрата.
Подобная методика, учитывающая индивидуальные свойства микробов, хорошо зарекомендовала себя при обнаружении микроорганизмов кишечной палочки и родственных ей видов.
Прямой подсчет
Метод удобен для исследования проб почвы и воды. Осуществляется прямой подсчет в предназначенных для этого счетных камерах, на мембранных фильтрах или фиксированных мазках. Метод не требует сложного оборудования, непродолжителен по времени и минимален по стоимости.
Ограничением использования метода является обязательная высокая концентрация микробов в образцах.
Нефелометрия
Метод оптического определения количества бактерий, основанный на определении светорассеивания взвесью образца. Данный способ позволяет определить число клеток в образце, что делает метод востребованным при микробиологических исследованиях.
Метод нефелометрии
Подсчет жизнеспособных микробов
Методика базируется на посеве определенного количества бактерий в виде суспензии на среду агара. После этого осуществляют подсчет сформированных колоний, имея в виду, что каждая из них является потомством жизнеспособной бактерии.
Существует две разновидности способа посева образца:
- исследуемый образец вносится в среду агара и перемешивается;
- образец высевается на поверхностном слое агара.
Подвижность как важный фактор идентификации бактерий
Значимым фактором идентификации бактерий является подвижность, которая обеспечивается жгутиками. Так как количество и расположение жгутиков, обеспечивающих подвижность, может быть различным, все имеющие жгутики микробы подразделяют для удобства идентификации на:
- монотрихи – один жгутик на полюсе;
- лофотрихи – пучок жгутиков, расположенный на одном из полюсов;
- амфитрихи – жгутики или пучки расположены на обоих полюсах;
- перитихи – жгутики расположены по периметру клетки.
Определение подвижности бактерий проводят в культурах не старше суток. У старых культур способность передвигаться утрачивается.
Определение качественного бактериального состава
Определение качественного состава бактерий опирается на несколько факторов.
Биолого-химические особенности микроорганизмов
Изучение биохимических свойств микроорганизмов помогает определению качественного состава бактерий.
Идентификации микроорганизмов способствует знание биохимических процессов. Методы определения количества и качества бактерий опираются на протеолитические и сахаролитические свойства микроорганизмов, а также токсино- и пигментообразование.
Ферменты микробов
Одним из факторов жизнедеятельности бактерий является ферментативная активность: ферментный состав и свойства регламентируются геномом микроорганизма и является стабильным критерием идентификации микробов. Поэтому обнаружение протеолитических, сахаролитических и других ферментов имеет большое значение в идентификации микроорганизмов.
К примеру, критерием протеолитической активности микроорганизмов является способность бактерий расщеплять белок до продуктов глубокого распада (сероводород и индол). На этом результате ферментативной активности основан метод определения числа микроорганизмов, имеющий важное практическое значение.
Свойство пигментообразования
Другим стойким генетическим признаком бактерий является пигментообразование. Данное свойство предназначено для защиты бактериальной клетки от воздействия ультрафиолетовых лучей.
Большая часть патогенных микроорганизмов не обладает подобными защитными свойствами – пигментообразование для них не характерно.
Изучение микрофлоры молока
Определение бактерий имеет значение в практической деятельности человека, например, в пищевой промышленности. Так, бактериальная обсемененность молока является основным показателем санитарных условий его получения. В случае превышения порогового количества микроорганизмов в молоке, сортность продукта снижается.
С 1987 г. страны ЕЭС приняли единые стандарты по степени бактериальной обсемененности молока, подразделяя продукт на три категории:
- А – 20 тыс./мл;
- В – 100 тыс./мл;
- С – свыше 100 тыс./мл.
В данном случае числа указывают на максимально возможное количество микроорганизмов в 1 мл молока (обсемененность).
Бактериальная обсемененность молока напрямую зависит от санитарных условий получения и первоначальной обработки продукта. Так, использование для очистки молока многоразовых фильтров может приводить к дополнительному бактериальному обсеменению.
Наличие в молоке соматических клеток является важным критерием качества. Эти клетки являются частичками биомассы животного. Они образуются в вымени и отражают естественные процессы старения и обновления организма.
Число соматических клеток в молоке возрастает при наличии у животных травм, заболеваний ЖКТ или других патологий, что приводит к росту показателя бактериальной обсемененности молока.
Определение молочнокислых бактерий
Большое значение в пищевой промышленности уделяется молочнокислым микроорганизмам благодаря их антагонистической и протеолитеческой активности.
К примеру, пластичная консистенция и выраженный вкус различных сортов сыра связаны с протеолитической активностью молочнокислых микробов закваски. Исследованиям активностью молочнокислых бактерий в этой области уделяется большое значение, но, до сих пор не удалось создать критерий определения штаммов молочнокислых бактерий закваски по показателю протеолитеческой активности.
Антагонистическая активность молочнокислых микробов используется не только в пищевой промышленности, но и в медицине, ветеринарии сельском хозяйстве и т.д.
Примеры применения молочнокислых бактерий как антагонистов к определенным микроорганизмам:
- производство сыров – антагонисты к масляным микробам и кишечной палочке;
- хлебопекарное производство – антагонисты к споровой палочке, возбудителю «картофельной болезни» хлеба;
- молочнокислые продукты – антагонисты к бактериям, провоцирующим развитие желудочно-кишечных инфекций.
При необходимости подсчета в закваске количества молочнокислых бактерий используют метод посева микробов на агаре и молоке с добавлением мела. Образующаяся молочная кислота растворяет мел, и вокруг колоний молочнокислых бактерий появляются светлые зоны.
Для подсчета молочнокислых стрептококков используют метод предельного разведения, высевая их в молоко. В зависимости от термофильности молочнокислых бактерий выбирается оптимальный термальный режим посева. Образцы со свернувшимся молоком используют для приготовления микроскопических препаратов. После этого выявляют минимальное разведение, содержащее молочнокислые палочки.
Воздушный микробиологический контроль
Для жизнедеятельности бактерий воздушная среда не является благоприятной, но большинство микроорганизмов, попадая в воздух, способны временно сохранять активность и свои свойства. Среди них такие патогенные бактерии, как возбудители кори, скарлатины, коклюша, оспы, туберкулеза, легочной чумы и другие инфекции дыхательных путей, передающиеся воздушно-капельным методом.
Микробиологический контроль воздушной среды оценивает общую бактериальную обсемененность воздуха и разрабатывает профилактические методы снижения числа возбудителей инфекционных заболеваний.
Объектами исследования степени бактериальной обсемененности в закрытых помещениях являются больницы и поликлиники, детские учреждения и места постоянного скопления людей (кинотеатры, спортзалы и другие). Определение степени бактериальной обсемененности воздуха в помещениях проводится по отработанным методикам, включающим следующие действия:
- забор образца;
- транспортировка и подготовка пробы;
- бактериальный посев;
- определение микроорганизмов посредством идентификации.
В случае выявления высокой степени бактериальной обсемененности, для понижения количества бактерий используют различные методы:
- химические – обработка помещения двуокисью азота, озоном или суспензией молочной кислоты;
- механические – принудительная фильтрация воздуха;
- физические – облучение ультрафиолетом.
Исследование бактериального состава воды
Анализ воды проводят на наличие следующих групп микроорганизмов:
- колиформные микробы – микроорганизмы группы кишечной палочки, используются как маркеры фекальной контаминации (обсеменения);
- клостридии – микробы, обладающие высокой устойчивостью к обеззараживаннию; реперный показатель (ориентир) – если в пробе нет клостридий, то нет и других патогенных микробов;
- вирусы;
- лямблии.
Колиформные бактерии являются грамотрицательными бактериями группы кишечной палочки, обитающими в кишечнике млекопитающих и птиц. В воду они попадают с фекалиями, способны существовать в ней неделями, но теряют свойство размножения.
Наличие колиформных микроорганизмов в образце воды указывает на высокую вероятность присутствия сточных вод. Наличие вирулентных (болезнетворных) штаммов колиформных бактерий – показатель риска возникновения заболеваний.
Колиформные микробы включают в себя группу термотолерантных колиформных микроорганизмов, обладающих свойством выживать при высоких (45°С) температурах. Термотолерантные колиформные бактерии являются индикатором недавнего фекального заражения, аналитически легко определяются.
Согласно СанПиН, колиформные бактерии не могут присутствовать в системах водоснабжения, а наличие колиформных микроорганизмов указывает либо на некачественную очистку, либо на вторичное фекальное загрязнение. Нормой считается наличие колиформных микробов в количестве не более 5% от общего числа. Критерием эффективности очистки от фекальных стоков являются термотолерантные колиформные бактерии, как легко определяемые.
Выявление возбудителя листериоза
Бактерия Listeria monocytogenes является возбудителем листериоза – инфекционного заболевания людей и животных.
Listeria monocytogenes
Возбудитель листериоза – имеющая высокую подвижность неспорообразующая грамположительная кишечная палочка Listeria monocytogenes. У людей заражение Listeria monocytogenes протекает как острый сепсис, поражая центральную нервную систему, лимфосистему, миндалины, селезенку и печень. Поражение Listeria monocytogenes у человека может протекать как в острой, так и в хронической форме.
Статистическая группа риска по Listeria monocytogenes:
- люди преклонного возраста;
- беременные;
- лица с ослабленным иммунитетом, ВИЧ-инфицированные и онкобольные;
- алкоголики и наркоманы.
Определяется зараженность Listeria monocytogenes методом ПЦР (полимеразная цепная реакция) – в плазме крови выявляется ДНК Listeria monocytogenes. Подтверждением наличия листериоза является выявление специфичного участка ДНК Listeria monocytogenes. Специфичность определения ДНК Listeria monocytogenes – 100%; метод является высокочувствительным.
Взаимодействие бактерий с антибиотиками
Выявление чувствительности бактерий к антибиотикам имеет большое практическое значение для расчета дозировки препаратов при профилактике и лечении инфекционных заболеваний.
Для выявления чувствительности микробов к различным антибиотикам применяются два основных метода:
- определение чувствительности к антибиотиками при помощи дисков;
- изучение чувствительности микроорганизмов к антибиотикам посредством серийного разведения.
Методика с использованием дисков
Для выявления степени чувствительности к антибиотикам, в питательную культуру засевают изучаемые бактерии. На поверхности размещают диски, содержащие различные антибиотики в известных дозировках.
Пробу выдерживают при оптимальной температуре (37°С) сутки, после чего, сравнивая диаметр кольцевых безмикробных зон вокруг различных дисков, делают вывод о чувствительности бактерий к различным антибиотикам и их концентрациям.
Для получения воспроизводимых результатов следует пользоваться стандартными дисками и питательной средой, а в качестве контроля применять эталонные штаммы. Методика дисков не позволяет получить надежные результаты, а так же очень критична к слабодифундирующим антибиотикам (ристомицин или полимиксин).
Серийное разведение
Чувствительность микробов к антибиотикам методом серийного разведения позволяет выявить минимальную концентрацию лекарственного препарата, оказывающую терапевтический эффект. Чувствительность микроорганизмов определяют, как:
- чувствительные штаммы – жизнедеятельность бактерий подавляется обычной дозировкой антибиотиков в крови;
- умеренно устойчивые штаммы – для ингибирования бактерий необходимо использование максимальных доз антибиотиков;
- устойчивые бактерии – жизнедеятельность бактерий не подавляется даже при максимальной концентрации антибиотика, то есть отсутствие чувствительности.
Определение чувствительности бактериофагов
Бактериофаги являются естественными врагами бактерий. Характер взаимодействия бактериофага с бактериями описывается как:
- вирулентное, вызывающее лизис (гибель) микробной клетки;
- умеренное – переход бактерии в неинфекционную форму фага (профаг).
Бактериофаги специфичны к определенным группам микроорганизмов, что отражается в их названии – стрептококковые фаги, стафилококковые фаги и т.д. Способом определения количества бактериофагов в единице объема является метод агаровых слоев. Он прост в исполнении и обладает достаточной точностью.
Таким образом, существует большое количество методов определения микроорганизмов. Выбор оптимального зависит от заданного критерия отбора.
Работаю врачом ветеринарной медицины. Увлекаюсь бальными танцами, спортом и йогой. В приоритет ставлю личностное развитие и освоение духовных практик. Любимые темы: ветеринария, биология, строительство, ремонт, путешествия. Табу: юриспруденция, политика, IT-технологии и компьютерные игры.
Определение качественного бактериального состава
Определение качественного состава бактерий опирается на несколько факторов.
Биолого-химические особенности микроорганизмов
Изучение биохимических свойств микроорганизмов помогает определению качественного состава бактерий.
Идентификации микроорганизмов способствует знание биохимических процессов. Методы определения количества и качества бактерий опираются на протеолитические и сахаролитические свойства микроорганизмов, а также токсино- и пигментообразование.
Ферменты микробов
Одним из факторов жизнедеятельности бактерий является ферментативная активность: ферментный состав и свойства регламентируются геномом микроорганизма и является стабильным критерием идентификации микробов. Поэтому обнаружение протеолитических, сахаролитических и других ферментов имеет большое значение в идентификации микроорганизмов.
К примеру, критерием протеолитической активности микроорганизмов является способность бактерий расщеплять белок до продуктов глубокого распада (сероводород и индол)
На этом результате ферментативной активности основан метод определения числа микроорганизмов, имеющий важное практическое значение
Свойство пигментообразования
Другим стойким генетическим признаком бактерий является пигментообразование. Данное свойство предназначено для защиты бактериальной клетки от воздействия ультрафиолетовых лучей.
Большая часть патогенных микроорганизмов не обладает подобными защитными свойствами – пигментообразование для них не характерно.
Определение молочнокислых бактерий
Большое значение в пищевой промышленности уделяется молочнокислым микроорганизмам благодаря их антагонистической и протеолитеческой активности.
К примеру, пластичная консистенция и выраженный вкус различных сортов сыра связаны с протеолитической активностью молочнокислых микробов закваски. Исследованиям активностью молочнокислых бактерий в этой области уделяется большое значение, но, до сих пор не удалось создать критерий определения штаммов молочнокислых бактерий закваски по показателю протеолитеческой активности.
Антагонистическая активность молочнокислых микробов используется не только в пищевой промышленности, но и в медицине, ветеринарии сельском хозяйстве и т.д.
Примеры применения молочнокислых бактерий как антагонистов к определенным микроорганизмам:
- производство сыров – антагонисты к масляным микробам и кишечной палочке;
- хлебопекарное производство – антагонисты к споровой палочке, возбудителю «картофельной болезни» хлеба;
- молочнокислые продукты – антагонисты к бактериям, провоцирующим развитие желудочно-кишечных инфекций.
При необходимости подсчета в закваске количества молочнокислых бактерий используют метод посева микробов на агаре и молоке с добавлением мела. Образующаяся молочная кислота растворяет мел, и вокруг колоний молочнокислых бактерий появляются светлые зоны.
Для подсчета молочнокислых стрептококков используют метод предельного разведения, высевая их в молоко. В зависимости от термофильности молочнокислых бактерий выбирается оптимальный термальный режим посева. Образцы со свернувшимся молоком используют для приготовления микроскопических препаратов. После этого выявляют минимальное разведение, содержащее молочнокислые палочки.
Воздушный микробиологический контроль
Для жизнедеятельности бактерий воздушная среда не является благоприятной, но большинство микроорганизмов, попадая в воздух, способны временно сохранять активность и свои свойства. Среди них такие патогенные бактерии, как возбудители кори, скарлатины, коклюша, оспы, туберкулеза, легочной чумы и другие инфекции дыхательных путей, передающиеся воздушно-капельным методом.
Микробиологический контроль воздушной среды оценивает общую бактериальную обсемененность воздуха и разрабатывает профилактические методы снижения числа возбудителей инфекционных заболеваний.
Объектами исследования степени бактериальной обсемененности в закрытых помещениях являются больницы и поликлиники, детские учреждения и места постоянного скопления людей (кинотеатры, спортзалы и другие). Определение степени бактериальной обсемененности воздуха в помещениях проводится по отработанным методикам, включающим следующие действия:
- забор образца;
- транспортировка и подготовка пробы;
- бактериальный посев;
- определение микроорганизмов посредством идентификации.
В случае выявления высокой степени бактериальной обсемененности, для понижения количества бактерий используют различные методы:
- химические – обработка помещения двуокисью азота, озоном или суспензией молочной кислоты;
- механические – принудительная фильтрация воздуха;
- физические – облучение ультрафиолетом.
Взаимодействие бактерий с антибиотиками
Выявление чувствительности бактерий к антибиотикам имеет большое практическое значение для расчета дозировки препаратов при профилактике и лечении инфекционных заболеваний.
Для выявления чувствительности микробов к различным антибиотикам применяются два основных метода:
- определение чувствительности к антибиотиками при помощи дисков;
- изучение чувствительности микроорганизмов к антибиотикам посредством серийного разведения.
Методика с использованием дисков
Для выявления степени чувствительности к антибиотикам, в питательную культуру засевают изучаемые бактерии. На поверхности размещают диски, содержащие различные антибиотики в известных дозировках.
Пробу выдерживают при оптимальной температуре (37°С) сутки, после чего, сравнивая диаметр кольцевых безмикробных зон вокруг различных дисков, делают вывод о чувствительности бактерий к различным антибиотикам и их концентрациям.
Для получения воспроизводимых результатов следует пользоваться стандартными дисками и питательной средой, а в качестве контроля применять эталонные штаммы. Методика дисков не позволяет получить надежные результаты, а так же очень критична к слабодифундирующим антибиотикам (ристомицин или полимиксин).
Серийное разведение
Чувствительность микробов к антибиотикам методом серийного разведения позволяет выявить минимальную концентрацию лекарственного препарата, оказывающую терапевтический эффект. Чувствительность микроорганизмов определяют, как:
- чувствительные штаммы – жизнедеятельность бактерий подавляется обычной дозировкой антибиотиков в крови;
- умеренно устойчивые штаммы – для ингибирования бактерий необходимо использование максимальных доз антибиотиков;
- устойчивые бактерии – жизнедеятельность бактерий не подавляется даже при максимальной концентрации антибиотика, то есть отсутствие чувствительности.
Определение чувствительности бактериофагов
Бактериофаги являются естественными врагами бактерий. Характер взаимодействия бактериофага с бактериями описывается как:
- вирулентное, вызывающее лизис (гибель) микробной клетки;
- умеренное – переход бактерии в неинфекционную форму фага (профаг).
Бактериофаги специфичны к определенным группам микроорганизмов, что отражается в их названии – стрептококковые фаги, стафилококковые фаги и т.д. Способом определения количества бактериофагов в единице объема является метод агаровых слоев. Он прост в исполнении и обладает достаточной точностью.
Таким образом, существует большое количество методов определения микроорганизмов. Выбор оптимального зависит от заданного критерия отбора.
Количественный учет микрофлоры
Анализ количества микробов, в зависимости от его возможностей, может определять:
- число всех микроорганизмов, содержащихся в образце;
- только жизнеспособные микробы.
В зависимости от способа получения результата, методы определения количества микроорганизмов подразделяют на:
- прямые (микроскопические);
- косвенные.
В свою очередь, косвенные методы разделяют в зависимости от применяемого критерия как:
- методы оптического исследования (спектрофотометрия, нефелометрия) – измеряемый параметр зависит от количества микроорганизмов;
- высев – метод измерения образовавшихся колоний.
Методы определения общего количества бактерий опираются на значение титра образца.
Методика титра
Метод предельного разбавления образца (метод титра) позволяет с высокой точностью определить количественное значение группы микроорганизмов.
Сущность методики заключается в том, что исследуемая проба разводится определенным образом и высевается в специфические для микроорганизмов среды. Так создаются благоприятные условия для роста. По прошествии времени исследуют образцы, устанавливая, при каком предельном разведении выявляются бактерии определенной группы. Выводы делаются по специфическим изменениям питательного субстрата.
Подобная методика, учитывающая индивидуальные свойства микробов, хорошо зарекомендовала себя при обнаружении микроорганизмов кишечной палочки и родственных ей видов.
Прямой подсчет
Метод удобен для исследования проб почвы и воды. Осуществляется прямой подсчет в предназначенных для этого счетных камерах, на мембранных фильтрах или фиксированных мазках. Метод не требует сложного оборудования, непродолжителен по времени и минимален по стоимости.
Ограничением использования метода является обязательная высокая концентрация микробов в образцах.
Нефелометрия
Метод оптического определения количества бактерий, основанный на определении светорассеивания взвесью образца. Данный способ позволяет определить число клеток в образце, что делает метод востребованным при микробиологических исследованиях.

Подсчет жизнеспособных микробов
Методика базируется на посеве определенного количества бактерий в виде суспензии на среду агара. После этого осуществляют подсчет сформированных колоний, имея в виду, что каждая из них является потомством жизнеспособной бактерии.
Существует две разновидности способа посева образца:
- исследуемый образец вносится в среду агара и перемешивается;
- образец высевается на поверхностном слое агара.
Исследование ферментативной активности и метаболизма бактериальных клеток начинается с подбора питательных сред, на которых изучаемые микроорганизмы смогут проявить нужные исследователю свойства.
Для приготовления питательных сред используются:
- продукты животного происхождения;
- продукты растительного происхождения;
- органические и неорганические соединения определенного химического состава.
По своему составу питательная среда должна быть:
с подходящим для конкретного вида микроорганизмов уровнем рН (кислотностью);
с достаточным уровнем влажности, поскольку для бактерий важно состояние осмотического давления внешней среды;
изотоничной и стерильной.
После создания питательной среды осуществляется посев на нее биологического материала и выделение чистой культуры.
После выделения и идентификации чистой культуры изучаются ее биохимические свойства и ферментативная активность.
Для определения ферментативной активности бактериальной клетки выделенную культуру засевают на дифференциально-диагностические питательные среды, которые заранее созданы под выявление того или иного фермента.
- Для обнаружения сахаролитической биохимической активности клетки исследуемой культуры засевают в пять пробирок, в которые закладывают разные органические сахара. В зависимости от того, в какой из пробирок будет выявлена биохимическая активность (сработает цветовой индикатор), определяется, какими сахаролитическими свойствами обладает исследуемая бактериальная клетка.
- Для определения протеолитической активности чистую бактериальную культуру засевают на мясопептонный желатин. Там, где под действием протеолитического фермента происходит расщепление белков желатина (разжижение), там и фиксируется присутствие протеолитического фермента. Для определения глубины работы протеолитических ферментов при данных анализах проводят исследование на выявление индола и сероводорода (конечных продуктов протеолитического распада).
- Установление редуцирующей способности бактерий производится с засеванием лакмусового молока. Присутствие редуктазы проявляется специфическим обесцвечиванием молока.
- Выявление каталазы происходит путем фиксации на плотной питательной среде в чашке Петри появления пузырьков газа, который выделяется в результате расщепления перекиси водорода под действием каталазы.
Данные исследования позволяют определить основные свойства тех или иных микробов. Так, присутствие протеолитического или сахаролитического фермента – свидетельство наличия патогенных для человека, животных и растений свойств изучаемого микроорганизма.
Исследование бактериального состава воды
Анализ воды проводят на наличие следующих групп микроорганизмов:
- колиформные микробы – микроорганизмы группы кишечной палочки, используются как маркеры фекальной контаминации (обсеменения);
- клостридии – микробы, обладающие высокой устойчивостью к обеззараживаннию; реперный показатель (ориентир) – если в пробе нет клостридий, то нет и других патогенных микробов;
- вирусы;
- лямблии.
Колиформные бактерии являются грамотрицательными бактериями группы кишечной палочки, обитающими в кишечнике млекопитающих и птиц. В воду они попадают с фекалиями, способны существовать в ней неделями, но теряют свойство размножения.
Колиформные микробы включают в себя группу термотолерантных колиформных микроорганизмов, обладающих свойством выживать при высоких (45°С) температурах. Термотолерантные колиформные бактерии являются индикатором недавнего фекального заражения, аналитически легко определяются.
Согласно СанПиН, колиформные бактерии не могут присутствовать в системах водоснабжения, а наличие колиформных микроорганизмов указывает либо на некачественную очистку, либо на вторичное фекальное загрязнение. Нормой считается наличие колиформных микробов в количестве не более 5% от общего числа. Критерием эффективности очистки от фекальных стоков являются термотолерантные колиформные бактерии, как легко определяемые.
4.2 Метод НВЧ — определение количества колиформных бактерий
4.2.1 Три пробирки с жидкой обогатительной
средой двойной концентрации инокулируют определенным количеством продукта, если
исходный продукт жидкий, или определенным количеством исходной суспензии в
случае другого продукта.
4.2.2 Три пробирки с жидкой обогатительной средой нормальной
концентрации инокулируют определенным количеством продукта и/или разведением
продукта, если исходный продукт жидкий, или определенным количеством исходной
суспензии и/или разведением в случае другого продукта.
4.2.3 Посевы в пробирках, содержащие обогатительную среду
двойной концентрации, инкубируют при температуре 37 °С 24ч. Посевы в пробирках
со средой нормальной концентрации, инкубируют 24 или 48 ч, после этого в этих
пробирках отмечают наличие газа и/или помутнения, мешающего выявлению
образования газа.
4.2.4 Пробирки с подтверждающей средой
инокулируют культурами из пробирок с обогатительной селективной средой двойной
концентрации и культурами из пробирок с обогатительной селективной средой
нормальной концентрации, в которых отмечено образование газа и/или помутнение.
Посевы в пробирках с подтверждающей средой инкубируют при
температуре 37 °С 24 или 48 ч, после этого в пробирках отмечают образование
газа.
4.2.5 Наиболее вероятное число колиформных
бактерий в 1 см3 или 1 г пробы продукта (НВЧ) рассчитывают, исходя
из числа пробирок с подтверждающей средой (),
показавших образование газа. Для определения наиболее вероятного числа
пользуются таблицей ГОСТ
26670.
5 Методы определения количества колиформных
бактерий — подсчет колоний
Сущность методов
Методы определения количества колиформных бактерий посевом в
или на агаризованные селективно-диагностические среды основаны на высеве
определенного количества продукта и/или его разведений в или на
агаризованную селективно-диагностическую среду с лактозой, инкубировании
посевов, подсчете типичных и атипичных колоний, пересеве типичных колоний и
атипичных колоний в жидкую селективную среду с лактозой для определения
газообразования, подтверждения, при необходимости, по биохимическим
признакам принадлежности выделенных колоний к колиформным бактериям.
Изучение морфологии и подвижности
Морфологическое исследование в основном направлено на идентификацию бактерий.
Изучение форм и выявление подвижности проводится методом микроскопирования живых бактерий.
Основные структуры микроорганизма анализируются в препаратах раздавленной или висячей капли. Это способ нанесения бульонного раствора с бактериальной культурой на предметное стекло.
Этот метод определения строения бактерии может проводиться путем наблюдений в «темном поле зрения».
Анализ с использованием различных способов окрашивания предполагает, что окрашиваться будут убитые микробные клетки, поскольку они лучше окрашиваются.
Для проведения анализа необходимо осуществить несколько манипуляций:
- Приготовить мазок исследуемого материала. В эту стадию входит работа с исследуемым материалом (кровь, мокрота и т.д.).
- Высушивание и фиксация мазка химическим или физическим способом.
- Выбор вида окрашивания (сложный или простой).
Простым способом бактериальные клетки окрашивают в большинстве случаев только для того, чтобы выявить в исследуемом материале присутствие микроорганизмов. Этот способ представляет собой окрашивание мазка метиленовым синим. Данный краситель окрашивает фон мазка на порядок слабее, чем клетки самих микроорганизмов.
Обнаружение основных структур бактериальной клетки осуществляется с использованием сложного окрашивания:
- метод Грама (определение свойств клеточной стенки);
- окраска на выявление спор;
- окраска по Романовскому-Гимзе окрашивает в разные цвета основные структуры клетки;
- выявление капсул по способу Гинса;
- выявление зерен волютина (внутриплазматические гранулы, состоящие из неорганических полифосфатов), их присутствие указывает на наличие возбудителя дифтерии.
Подвижность как важный фактор идентификации бактерий
Значимым фактором идентификации бактерий является подвижность, которая обеспечивается жгутиками. Так как количество и расположение жгутиков, обеспечивающих подвижность, может быть различным, все имеющие жгутики микробы подразделяют для удобства идентификации на:
- монотрихи – один жгутик на полюсе;
- лофотрихи – пучок жгутиков, расположенный на одном из полюсов;
- амфитрихи – жгутики или пучки расположены на обоих полюсах;
- перитихи – жгутики расположены по периметру клетки.
Определение подвижности бактерий проводят в культурах не старше суток. У старых культур способность передвигаться утрачивается.
Исследование генетики бактерий
Генетика позволяет определить свойства наследственности и изменчивости конкретного микроорганизма
Изучение этих свойств очень важно, поскольку дает возможность понять механизм тех мутаций в генном коде, которые позволяют бактериям с такой невероятной скоростью и легкостью приспосабливаться к изменяющимся внешним условиям
Еще одной важной особенностью генетики бактерий является то, что ее принципы справедливы для всего органического мира. Изучив генетику бактерий, можно на молекулярном уровне установить все основные эволюционные законы
Основной предмет изучения генетики бактерий – мутации (скачкообразное изменение наследственного признака).
Исследование мутаций происходит с использованием бактериофагов (вирусы бактерий, которые разрушают бактериальную клетку).
Вырабатываемая бактериями в результате мутаций устойчивость к фагам фиксируется разными методами:
- флуктуационный тест;
- перераспределительный тест;
- метод реплик и т.д.
Изменение в генетике исследуемой бактерии фиксируется только тогда, когда приобретенной одной колонией свойство передается по наследству следующим поколениям.
Мутантов среди бактерий выявляют следующими методами:
- прямой отбор (посев на специально подобранную селективную среду);
- непрямое выявление, так называемый метод перепечатывания колоний с одной чашки Петри на другую до обнаружения прогнозированных мутантов;
- пенициллиновый метод позволяет достаточно быстро выявить мутантов, поскольку вводимый исследователем пенициллин угнетает рост немутировавших клеток.
Исследование генетики бактерий производится с использованием новейшего оборудования, которое позволяет не только выявить изменения наследственности, но и на молекулярном уровне определить их природу.
Сегодня такие исследования генетики бактерий находятся в активной фазе. Микробиологи регулярно делятся зафиксированными новинками. О завершении исследований в этой области говорить пока еще очень рано.
Выявление возбудителя листериоза
Бактерия Listeria monocytogenes является возбудителем листериоза – инфекционного заболевания людей и животных.

Возбудитель листериоза – имеющая высокую подвижность неспорообразующая грамположительная кишечная палочка Listeria monocytogenes. У людей заражение Listeria monocytogenes протекает как острый сепсис, поражая центральную нервную систему, лимфосистему, миндалины, селезенку и печень. Поражение Listeria monocytogenes у человека может протекать как в острой, так и в хронической форме.
Статистическая группа риска по Listeria monocytogenes:
- люди преклонного возраста;
- беременные;
- лица с ослабленным иммунитетом, ВИЧ-инфицированные и онкобольные;
- алкоголики и наркоманы.
Определяется зараженность Listeria monocytogenes методом ПЦР (полимеразная цепная реакция) – в плазме крови выявляется ДНК Listeria monocytogenes. Подтверждением наличия листериоза является выявление специфичного участка ДНК Listeria monocytogenes. Специфичность определения ДНК Listeria monocytogenes – 100%; метод является высокочувствительным.



























