Название: Респираторная медицина. Том 1.
Автор: Чучалин А.Г.
Год издания: 2017
Размер: 30.42 МБ
Формат: pdf
Язык: Русский
Первый том руководства «Респираторная медицина» под редакцией А.Г. Чучалина рассматривает анатомо-физиологические, генетические и морфофункциональные особенности дыхательной системы, в книге приведена пропедевтика болезней дыхательной системы, симптомы и синдромальная диагностика в пульмонологии. В книге «Респираторная медицина. Том 1.» содержатся такие главы, как общие принципы респираторной медицины, диагностика (в том числе — методы визуализации, торакоскопия, бронхоскопия, УЗИ в пульмонологии, функциональные и нагрузочные тесты) и клинические аспекты заболеваний легких: пульмонологические синдромы — одышка, кашель, боль в грудной клетке; болезни легких — бронхиальная астма, ХОБЛ, Муковисцидоз, бронхиолиты, бронхоэктатическая болезнь. Книга «Респираторная медицина. Том 1» Чучалина А.Г. (2-е издание) ориентирована на студентов, клинических ординаторов, пульмонологов и смежных специалистов.

Также рекомендуем скачать
Название: Хронический бронхит.
Автор: Лещенко И.В., Демко И.В., Зайцев А.А.
Год издания: 2021
Размер: 0.91 МБ
Формат: pdf
Язык: Русский
Описание: Книга «Хронический бронхит» — смарт-справочник по указанной нозологии, где отражены все необходимые врачу и студенту данные по хроническому бронхиту, охарактеризованы факторы риска, патогенез и нозоло… Скачать книгу бесплатно
Название: Ингаляционная терапия.
Автор: Авдеев С.Н., Архипов В.В.
Год издания: 2022
Размер: 5.04 МБ
Формат: pdf
Язык: Русский
Описание: Книга «Ингаляционная терапия» рассматривает не только историю возникновения ингаляционного лечения, но и основные принципы аэрозольной терапии. В книге приведена характеристика небулайзеров, основные … Скачать книгу бесплатно
Название: Хроническая дыхательная недостаточность.
Автор: Титова О.Н., Кузубова Н.А.
Год издания: 2021
Размер: 1.57 МБ
Формат: pdf
Язык: Русский
Описание: Книга «Хроническая дыхательная недостаточность» как руководство по респираторной медицине рассматривает такие вопросы, как причины, классификацию и механизмы развития хронической дыхательной недостато… Скачать книгу бесплатно
Название: Реабилитация при заболеваниях органов дыхания.
Автор: Малявин А.Г., Епифанов В.А., Глазкова И.И.
Год издания: 2010
Размер: 2.25 МБ
Формат: pdf
Язык: Русский
Описание: Книга «Реабилитация при заболеваниях органов дыхания» рассматривает такие вопросы, как общие сведения в респираторной реабилитологии, синдромно-патогенетический подход и методы респираторной реабилита… Скачать книгу бесплатно
Название: Внебольничная пневмония
Автор: Синопальников А.И., Фесенко О.В.
Год издания: 2017
Размер: 2.03 МБ
Формат: pdf
Язык: Русский
Описание: Книга «Внебольничная пневмония» характеризует такую проблему современной медицины, как внебольничная пневмония — довольно распространенное заболевание, которое несмотря на свою изученность продолжает … Скачать книгу бесплатно
Название: Респираторная медицина. Том 2.
Автор: Чучалин А.Г.
Год издания: 2017
Размер: 22.05 МБ
Формат: pdf
Язык: Русский
Описание: Второй том руководства «Респираторная медицина» под редакцией А.Г. Чучалина рассматривает респираторные инфекции (вирусные инфекции, пневмонии, острый абсцесс и гангрена легких, туберкулез дыхательной… Скачать книгу бесплатно
Название: Респираторная медицина. Том 3.
Автор: Чучалин А.Г.
Год издания: 2017
Размер: 15.22 МБ
Формат: pdf
Язык: Русский
Описание: Третий том руководства «Респираторная медицина» под редакцией А.Г. Чучалина освещает такие вопросы пульмонологии, как инфильтративные и интерстициальные болезни легких (идиопатическая интерстициальная… Скачать книгу бесплатно
Название: Хроническая обструктивная болезнь легких. Руководство для практикующих врачей.
Автор: Чучалин А.Г., Овчаренко С.И., Лещенко И.В.
Год издания: 2016
Размер: 3.14 МБ
Формат: pdf
Язык: Русский
Описание: Представленная книга «Хроническая обструктивная болезнь легких. Руководство для практикующих врачей» рассматривает базовые вопросы ХОБЛ, необходимые в понимании врачу-практику, освещая такие практичес… Скачать книгу бесплатно
Название: Нозокомиальная пневмония у взрослых. 2-е издание
Автор: Гельфанд Б.Р.
Год издания: 2016
Размер: 0.94 МБ
Формат: pdf
Язык: Русский
Описание: Клиническое руководство «Нозокомиальная пневмония у взрослых» под ред., Гельфанда Б.Р., рассматривает современные данные о эпидемиологии, этиопатогенезе, клинической картине, принципах диагностики, и … Скачать книгу бесплатно
Название: Бронхиальная астма и хроническая обструктивная болезнь легких.
Автор: Баур К., Прейссер А., Лещенко И.В.
Год издания: 2010
Размер: 11.07 МБ
Формат: pdf
Язык: Русский
Описание: Представленное руководство «Бронхиальная астма и хроническая обструктивная болезнь легких» содержит развернуто основные вопросы рассматриваемых патологий, где освещены определение понятия, эпидемиолог… Скачать книгу бесплатно
8.5.Хроническая обструктивная болезнь легких
И.В. Лещенко, С.И. Овчаренко
Эпидемиология и определение хронической обструктивной болезни легких
ХОБЛ — заболевание, которое ложится тяжелым бременем на общество и приобретает все большую социальную значимость.
В настоящее время ХОБЛ относится к наиболее распространенным заболеваниям человека, что обусловлено непрекращающимся загрязнением окружающей среды, усиливающимся табакокурением и повторяющимися респираторными инфекционными заболеваниями. По данным ВОЗ, в мире более 210 млн человек страдают ХОБЛ. В РФ в 2012 г. было зарегистрировано 2,7 млн больных с ХОБЛ, но, согласно оценке экспертов, реальное количество может быть в несколько раз больше и достигать 16 млн человек.
Одно из глобальных исследований, посвященных ХОБЛ (проект BOLD), обеспечило уникальную возможность оценить распространенность ХОБЛ с помощью стандартизированных вопросников и легочных функциональных тестов в популяциях взрослых людей старше 40 лет как в развитых, так и в развивающихся странах [1]. Распространенность ХОБЛ II стадии и выше (GOLD 2008), по данным исследования BOLD, среди лиц старше 40 лет составила 10,1±4,8%; в том числе среди мужчин — 11,8±7,9% и женщин — 8,5±5,8% [1]. Распространенность ХОБЛ увеличивалась с возрастом: в возрастной группе от 50 до 69 лет заболеванием страдали 10,1% мужчин в городе и 22,6% — в сельской местности. Причинами такой вариабельности служат различия в образе жизни людей, их поведении и контакте с разнообразными повреждающими агентами.
В большом двухгодичном исследовании (2010–2011), охватившем 12 регионов России и включавшим 7164 жителя старше 18 лет (3067 мужчин и 4093 женщины), изучалась распространенность хронических респираторных заболеваний и факторов риска их возникновения [2]. Курение установлено у 45,7% жителей (69,5% мужчин и 28,1% женщин). В 34% (30,3% мужчин и 36,1% женщин) случаев причина заболевания связана с воздействием биоорганического топлива. Распространенность ХОБЛ в этом исследовании у пациентов с факторами риска, респираторными жалобами составляла 21,8%. При экстраполяции на всю исследуемую популяцию распространенность ХОБЛ составила 15,3%.
В России, по официальным данным докладов МЗ РФ, ХОБЛ занимает 4-е место среди всех причин смертности от хронических неинфекционных заболеваний после ССЗ, сахарного диабета (СД) и травм.
Для российской популяции больных с ХОБЛ характерен высокий процент выхода на инвалидность, достигающий в некоторых регионах половины всех заболевших. Согласно прогнозам, ХОБЛ станет 5-й причиной потерь по показателю DALY в 2020 г. повсеместно, пропуская вперед ИБС, большие депрессии, несчастные случаи на дороге и цереброваскулярные заболевания. Одновременно к 2020 г. ХОБЛ войдет в первую тройку заболеваний по показателям смертности, достигнув 4,7 млн смертей в год [3, 4].
Бремя экономических затрат, связанных с ХОБЛ, которые несут государства, огромны. Так, например, только в США в 2002 г. затраты, обусловленные этим заболеванием, составили 32,1 млрд долларов [5]. В развитых странах общие экономические расходы, связанные с ХОБЛ, в структуре легочных заболеваний занимают 2-е место после рака легких и 1-е место по прямым затратам, превышая прямые расходы на БА в 1,9 раза. Экономические расходы на одного больного, связанные с ХОБЛ, в 3 раза выше, чем на больного БА. Немногочисленные сообщения о прямых медицинских расходах при ХОБЛ свидетельствуют о том, что более 80% материальных средств приходится на стационарную помощь больным и менее 20% на амбулаторную. Установлено, что 73% средств расходуются на 10% больных с тяжелым течением заболевания. Наибольший экономический ущерб приносит лечение обострений ХОБЛ. В России экономическое бремя ХОБЛ с учетом непрямых затрат, в том числе абсентеизма (невыхода на работу) и презентеизма (менее эффективной работы в связи с плохим самочувствием), составляет 24,1 млрд руб.
Подсчитано, что в странах Европейского сообщества только прямые расходы на респираторные заболевания составляют около 6% всего бюджета здравоохранения, при этом на долю затрат, связанных с ХОБЛ, приходится 56%, а в денежном выражении 38,6 млрд евро [6]. Имеется выраженная прямая взаимосвязь степени тяжести ХОБЛ с затратами на ее лечение, и по мере прогрессирования заболевания происходит перераспределение затрат. Так, увеличение степени тяжести ХОБЛ приводит к многократному росту затрат, связанных с госпитализациями и амбулаторной кислородотерапией.
Другая важная проблема ХОБЛ — ее поздняя диагностика. Даже в экономически развитых странах ранняя диагностика заболевания осуществляется не более чем в 25% случаев [7]. С этими же трудностями сталкивается и российская медицина. Гиподиагностика не исчерпывается только клиническими аспектами проблемы. Неполная медицинская статистика чревата сильной недооценкой социально-экономического ущерба, наносимого заболеванием обществу. Знание достоверных показателей распространенности, заболеваемости и смертности служит необходимой предпосылкой для оценки социального бремени ХОБЛ, без чего невозможно планирование и внедрение экономически эффективных стратегий профилактики и лечения данного заболевания [8].
Отвечая на вопрос, почему так широко распространена ХОБЛ в современном человеческом обществе, следует обратить внимание на то, что она относится к группе экологически опосредованных болезней органов дыхания. Тем самым подчеркивается роль поллютантов окружающей среды, как в развитии самой болезни, так и ее обострений.
Признавая возрастающую значимость ХОБЛ как проблемы национального здоровья во всех странах мира, Национальный институт «Сердце, легкие и кровь» США и ВОЗ совместно работали над созданием программы GOLD. Программа была создана и вышла в свет в 2001 г. и до сих пор представляет собой методику управления ХОБЛ — глобальную стратегию диагностики, лечения и профилактики ХОБЛ. Этот документ с учетом появления новых данных, накапливающихся от года к году, пересматривался в 2006, 2008, 2011 гг. (с небольшими изменениями выходил в 2013–2015 гг.).
Определение ХОБЛ: заболевание, которое можно предупредить и лечить, характеризуемое персистирующей обструкцией дыхательных путей, которая прогрессирует и ассоциируется с усиленной воспалительной реакцией дыхательных путей и легких на вредные частицы или газы. У ряда пациентов обострения и сопутствующие заболевания могут влиять на общую тяжесть ХОБЛ (GOLD, 2015).
Этиология и механизмы развития (патогенез) хронической обструктивной болезни легких
Факторы риска ХОБЛ представлены в табл. 8.17. Механизм развития ХОБЛ представлен на рис. 8.23, см. .
| Вероятность значимости факторов | Внешние факторы | Внутренние факторы |
|---|---|---|
|
Установленная |
Курение. |
Дефицит ААТ |
|
Высокая |
Загрязнение окружающего воздуха (SO2, NO2, O3). |
Недоношенность. |
|
Возможная |
Аденовирусная инфекция. |
Генетическая предрасположенность. |
Основными механизмами развития ХОБЛ служат: хронический воспалительный процесс, окислительный (оксидативный) стресс, дисбаланс в системе протеиназ–антипротеиназ.
Ведущая роль в становлении и развитии ХОБЛ, начиная с ранних стадий, принадлежит воспалению, которое усиливается по мере прогрессирования заболевания.
Хронический воспалительный процесс в дыхательных путях затрагивает все отделы дыхательных путей, паренхиму и сосуды легких и характеризуется увеличением числа нейтрофилов, макрофагов и Т-лимфоцитов, преимущественно CD8+, выделением большого числа медиаторов воспаления (рис. 8.24, см. ).
Окислительный (оксидативный) стресс выражается в нарушении баланса между оксидантами и антиоксидантами в пользу первых, что проявляется ослаблением антиоксидантной защиты, избыточной продукцией активных форм кислорода и азота с закономерным повреждением структуры белков, нуклеиновых кислот, ферментов, биомембран, повреждением фибробластов, снижением активности сурфактанта, повышением проницаемости эпителия и эндотелия, усилением секреции слизи и др. [9].
Дисбаланс в системе протеиназ и антипротеиназ проявляется в первую очередь дефицитом ААТ, активацией сывороточных протеиназ (нейтрофильный катепсин G, нейтрофильная протеиназа-3, катепсины макрофагов, матриксные металлопротеиназы), приводящих к разрушению альвеолярных стенок, поддержанию местного воспаления и развитию эмфиземы легких.
Взаимодействие основных параметров становления ХОБЛ представлено на рис. 8.25.
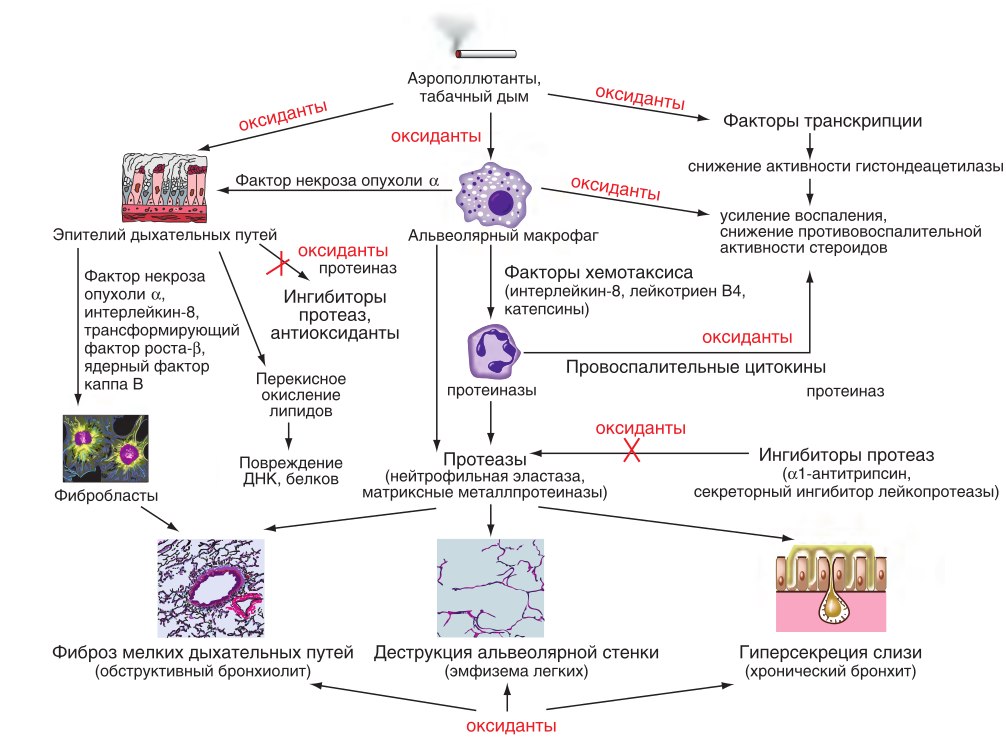
Рис. 8.25. Оксиданты и протеиназы в патогенезе хронической обструктивной болезни легких [10]
Патофизиологические изменения при ХОБЛ, начинаясь, как правило, с гиперсекреции слизи, изменений ее состава, дисфункции ресничек мерцательного эпителия и нарушения мукоцилиарного клиренса, сопровождаются в дальнейшем потерей эластической тяги легких в результате разрушения альвеол, исчезновения альвеолярной поддержки мелких дыхательных путей, что приводит к ограничению воздушного потока и как результат — к формированию бронхиальной обструкции в дебюте болезни, частично обратимой, а по мере прогрессирования заболевания — необратимой. Все перечисленное выше приводит к нарушению газообмена (вначале гипоксемия, при прогрессировании — гиперкапния), легочной гипертензии, в дальнейшем с формированием легочного сердца и развитием правожелудочковой недостаточности. С увеличением тяжести болезни воспалительный процесс приобретает системный характер с вовлечением эндотелия сосудов и развитием системных эффектов [11]. Точные механизмы системного воспаления при ХОБЛ изучены недостаточно. Предполагается, что взаимосвязь местного (т.е. бронхолегочного) с системным воспалением осуществляется несколькими путями:
-
Выходом стресс-индуцированных цитокинов и свободных радикалов из бронхолегочной системы в системную циркуляцию.
-
Активацией лейкоцитов периферической крови или клеток-предшественников в костном мозге.
-
Стимуляцией костного мозга и печени провоспалительными медиаторами, высвобождаемыми воспалительными и структурными клетками [12]. Стимуляция этих органов приводит к еще большей продукции лейкоцитов, тромбоцитов, СРБ и фибриногена.
Параллельно формируются системные эффекты: со стороны скелетных мышц — дисфункция и слабость, костной ткани — остеопороз, органов кроветворения — анемия или эритроцитоз, сердечно-сосудистой системы — АГ, поражение сосудов сердца, нижних конечностей; изменения психоэмоциональной сферы и др.
Клиническая картина хронической обструктивной болезни легких (стабильное течение)
В условиях воздействия факторов риска (курение, как активное, так и пассивное, экзогенные поллютанты, биоорганическое топливо и т.п.) ХОБЛ развивается обычно медленно и прогрессирует постепенно. Особенность клинической картины ХОБЛ состоит в том, что долгое время болезнь протекает без выраженных клинических проявлений. Возникновению первых клинических симптомов у больных с ХОБЛ, как правило, предшествует курение, по крайней мере 20 сигарет в день на протяжении более 20 лет [13].
При описании клинической картины ХОБЛ необходимо учитывать черты, характерные именно для этой болезни: субклиническое ее начало, отсутствие специфических симптомов, неуклонное прогрессирование заболевания.
Первыми признаками, с которыми пациенты обращаются к врачу, является кашель, часто с выделением мокроты и/или одышка. Эти симптомы бывают наиболее выражены по утрам. В холодные сезоны возникают «частые простуды». Такова клиническая картина дебюта заболевания, которая врачом расценивается как проявление бронхита курильщика, и диагноз «ХОБЛ» на этой стадии практически не ставится.
Хронический кашель — обычно первый симптом ХОБЛ, часто недооценивается и пациентами, так как считается ожидаемым следствием курения и/или воздействия неблагоприятных факторов окружающей среды. Обычно у больных выделяется небольшое количество вязкой мокроты. Нарастание кашля и продукции мокроты происходит чаще всего в зимние месяцы, во время инфекционных обострений.
Одышка — наиболее важный симптом ХОБЛ, нередко служит причиной обращения за медицинской помощью и основной причиной, ограничивающей трудовую деятельность больного. Вначале одышка отмечается при относительно высоком уровне физической нагрузки, например при беге по ровной местности или ходьбе по ступенькам. По мере прогрессирования заболевания одышка усиливается и может ограничивать даже ежедневную активность, а в дальнейшем возникает и в покое, заставляя больного оставаться дома.
Очень важным показателем оценки состояния здоровья является объективизация тяжести одышки. Существует несколько специальных шкал для оценки одышки. Чаще всего в практической деятельности используется 4-балльная шкала MRC — модификация шкалы Флетчера, которая используется для градации одышки соразмерно уровню нагрузки, необходимой для ее возникновения [14].
Имеется также визуальная шкала BORG [15], которая позволяет качественному признаку одышки дать количественную характеристику в баллах (рис. 8.26). Шкала BORG в основном используется при проведении 6-МТ.
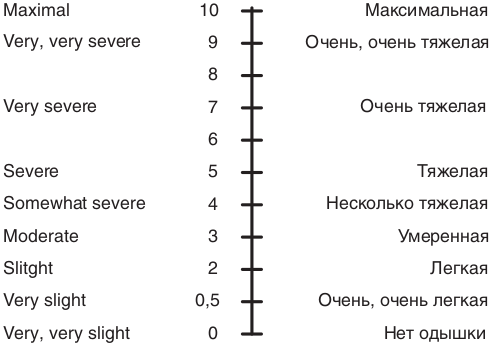
Рис. 8.26. Оценка выраженности одышки по шкале Borg
Основным механизмом появления на ранних стадиях заболевания одышки при физической нагрузке можно считать гиперинфляцию [16]. Легочная гиперинфляция (или повышение воздушности легких) развивается из-за неполного опорожнения альвеол во время выдоха вследствие потери эластической тяги легких и недостаточного времени выдоха. Уже в начале болезни при физической нагрузке и учащении дыхания происходит сокращение времени выдоха, задержка воздуха в альвеолах, что и способствует развитию легочной гиперинфляции, характерной для ХОБЛ, и ее клиническому проявлению — одышке. В дальнейшем происходит нарушение газообмена, что приводит к гипоксии и гиперкапнии, а со временем на поздних стадиях ХОБЛ — к развитию легочной гипертензии [17].
Прогрессирующая легочная гипертензия может приводить к гипертрофии ПЖ и в итоге — к легочному сердцу и правожелудочковой недостаточности. Подъем давления в яремных венах и наличие небольших отеков на голеностопных суставах являются наиболее частыми признаками, по которым судят в клинической практике о наличии легочного сердца. Однако у больных с ХОБЛ давление в яремных венах трудно измерить из-за значительных перепадов внутригрудного давления, а отеки могут быть результатом сопутствующей сердечно-сосудистой патологии. Отсюда следует, что для диагностики легочного сердца необходимо выполнение ряда диагностических процедур, включая рентгенографию органов грудной клетки, ЭКГ, ЭхоКГ, а иногда требуется проведение радионуклидной сцинтиграфии и МРТ [18].
Когда выраженность одышки не соответствует значениям ОФВ1, необходимо провести пробу с физической нагрузкой. Предпочтение отдается выполнению 6-МТ. Этот метод является наиболее простым средством для индивидуального наблюдения и мониторирования течения заболевания и может быть выполнен в условиях амбулаторной практики.
Тест проводится в соответствии со стандартным протоколом [19]. Пациентов инструктируют о целях теста. Им предлагают ходить по измеренному коридору в собственном темпе и стараться пройти максимальное расстояние в течение 6 мин. При этом пациентам разрешено останавливаться и отдыхать во время теста, но они должны возобновлять ходьбу, когда сочтут это возможным. Во время ходьбы разрешается подбадривать пациента. Перед началом и в конце теста оцениваются одышка по шкале Борга (0–10 баллов), наличие и тяжесть ДН по величине SpO2, определяемая по пульсоксиметрии [11–20]. Расстояние, пройденное в течение 6 мин в метрах (6-МТ), сравнивается с должным показателем. Пациентам следует прекратить ходьбу при возникновении следующих симптомов: боль в грудной клетке, головокружение, боль в ногах, резкое нарастание одышки и снижение SpO2 до 88%.
Скорость прогрессирования и выраженность симптомов ХОБЛ зависят от интенсивности воздействия этиологических факторов и их суммации. Помимо этого, выраженность симптомов характеризуется фазой течения заболевания. Выделяют стабильное течение заболевания и обострение. Стабильным следует считать то состояние, при котором выраженность симптомов существенно не меняется в течение недель или даже месяцев, а прогрессирование заболевания можно обнаружить лишь при длительном (6–12 мес) динамическом наблюдении за больным [12–21].
Клиническая картина хронической обструктивной болезни легких (обострение)
Обострения ХОБЛ — периодически возникающие ухудшения состояния (длительностью не менее 2–3 дней), сопровождаемые нарастанием интенсивности симптоматики и функциональными расстройствами. Во время обострения отмечается усиление выраженности гиперинфляции и так называемых воздушных ловушек в сочетании со сниженным экспираторным потоком, что приводит к усилению одышки [22], которая обычно сопровождается появлением или усилением дистанционных хрипов, чувством сдавления в груди, снижением толерантности к физической нагрузке. Помимо этого, происходит нарастание интенсивности кашля, изменяются (увеличиваются или резко уменьшаются) количество мокроты, характер ее отделения, цвет и вязкость. Одновременно ухудшаются показатели ФВД и газов крови: снижаются скоростные показатели (ОФВ1 и др.), может возникнуть гипоксемия и даже гиперкапния.
Обострения могут начинаться постепенно, исподволь, а могут характеризоваться и стремительным ухудшением состояния больного с развитием острой дыхательной и правожелудочковой недостаточности.
Выделяют два типа обострения [18]: I тип обострения характеризуется нарастанием проявлений воспалительного синдрома и сопровождается повышением температуры тела, увеличением количества, вязкости и «гнойности» мокроты, ростом острофазовых показателей крови (лейкоцитоз, повышение скорости оседания эритроцитов, α2-глобулинов, СРБ) — инфекционный фенотип обострения; II тип обострения проявляется нарастанием одышки, усилением внелегочных проявлений ХОБЛ (слабость, усталость, головная боль, плохой сон, депрессия), может появиться удушье — неинфекционный фенотип обострения.
Классическими (кардинальными) признаками, характеризующими обострение заболевания, являются критерии, предложенные N. Anthonisen и соавт. [23]:
-
появление или усиление одышки;
-
увеличение объема отделяемой мокроты;
-
усиление гнойности мокроты.
Наличие двух и более из трех указанных выше критериев описывается как I тип обострения заболевания.
Помимо кардинальных признаков обострения ХОБЛ, рекомендуется учитывать дополнительные признаки:
-
симптомы инфекции верхних дыхательных путей, сохраняющиеся в течение последних 5 дней;
-
лихорадка без других видимых причин;
-
нарастание свистящих хрипов над легочными полями;
-
усиление кашля, повышение ЧД или ЧСС.
Чем более выражена тяжесть ХОБЛ, тем более тяжело протекает обострение. Обострения ХОБЛ разделяются по тяжести проявлений на легкое, среднетяжелое или умеренное и тяжелое. В свою очередь, легкое и среднетяжелое обострение характеризуется как неосложненные, а тяжелое — как осложненное. Однако и среднетяжелое обострение ХОБЛ может протекать с осложнениями, если развивается у лиц с тяжелыми сопутствующими заболеваниями.
Для оценки тяжести обострения особое внимание уделяется установлению таких клинических, функциональных и лабораторных признаков, как участие в акте дыхания вспомогательной мускулатуры, парадоксальное движение грудной клетки, появление или усугубление центрального цианоза, появление периферических отеков, гемодинамическая нестабильность. Большое значение придается оценке внелегочной симптоматики — вегетативным расстройствам, слабости, апатии. Классификация тяжести обострения ХОБЛ представлена в табл. 8.18.
| Тяжесть обострения | Клинические симптомы обострения ХОБЛ и уровень оказания медицинской помощи | Характеристика обострения |
|---|---|---|
|
Легкое |
Усиление симптомов, возможно, с потребностью в увеличении дозы принимаемых «скоропомощных» препаратов |
Неосложненное |
|
Среднетяжелое |
Стойкое усиление симптомов (2–3 дня), например:
Требуется назначение антибиотиков и/или глюкокортикоидов |
Неосложненное/осложненное |
|
Тяжелое |
Пациент/врач отмечают явное и/или быстрое ухудшение состояния больного, требуется госпитализация |
Осложненное |
Неосложненное обострение ХОБЛ — относительно редкое обострение, проявляется с частотой менее 2 раз в год, не требует госпитализации, возникает у больных в возрасте до 65 лет с нетяжелым течением заболевания (при постбронходилатационном значении ОФВ1 ≥50% должной величины) без тяжелых сопутствующих заболеваний.
Отличительными чертами тяжелого обострения ХОБЛ являются цианоз, тахипноэ, тахикардия, тремор, повышение работы дыхательной мускулатуры (втяжение нади подключичных промежутков, втяжение межреберных промежутков), сопровождаемые падением PaO2 до 35–60 мм рт.ст., десатурацией (снижение SpO2) до 75–90% с признаками декомпенсированного респираторного ацидоза.
Тяжелое, как правило, осложненное обострение ХОБЛ характеризуется частыми обострениями в течение года (2 и более обострений в течение года и/или госпитализация по поводу обострения в предшествующие 12 мес), возникающее у больных в возрасте 65 лет и старше с тяжелым течением заболевания (при постбронходилатационном значении ОФВ1 <50% должной величины) или на фоне тяжелых сопутствующих заболеваний (СД, хронические заболевания печени, почек с функциональными нарушениями, СН).
Обострения могут осложняться развитием ОДН, ТЭЛА, пневмотораксом, СН. В течение обострения может развиваться пневмония, происходить декомпенсация ССЗ (АГ, ИБС и др.) Развившиеся осложнения могут существенно ухудшать течение ХОБЛ и требуют изменения тактики лечения.
В процессе обследования больного необходимо уточнить длительность текущего обострения, частоту предшествовавших обострений (в том числе потребовавших госпитализации), а также характер лечения в период стабильного течения ХОБЛ.
Клинические особенности хронической обструктивной болезни легких
Течение ХОБЛ представляет собой чередование стабильной фазы и обострения заболевания, но у разных людей оно протекает неодинаково. Вместе с тем общим является прогрессирование ХОБЛ, особенно если продолжается воздействие на пациента ингалируемых патогенных частиц или газов. Поскольку прогрессирование ХОБЛ, проявляемое неуклонным нарастанием бронхиальной обструкции, служит основополагающей чертой, которая усугубляет ДН, оно в целом определяет тяжесть течения заболевания и его прогноз.
В зависимости от индивидуальных особенностей больных уже давно выделяют
2 основные клинические формы заболевания — эмфизематозную и бронхитическую, имеющие четкие разграничительные признаки, определяемые как фенотипы.
Эмфизематозный фенотип ХОБЛ связывают преимущественно с панацинарной эмфиземой. Таких больных образно называют «розовыми пыхтельщиками» (рис. 8.27, см. ), поскольку для преодоления преждевременно наступающего экспираторного коллапса бронхов выдох производится через сложенные в трубочку губы и сопровождается своеобразным пыхтением. В клинической картине превалирует одышка в покое вследствие уменьшения диффузионной поверхности легких. Такие больные обычно худые, кашель у них чаще сухой или с небольшим количеством густой и вязкой мокроты. Цвет лица розовый, так как достаточная оксигенация крови поддерживается максимально возможным увеличением вентиляции. Предел вентиляции достигается в состоянии покоя, и больные очень плохо переносят физическую нагрузку. Легочная гипертензия умеренно выражена, так как редукция артериального русла, вызванная атрофией межальвеолярных перегородок, не достигает значительных величин. Легочное сердце длительное время компенсировано. Таким образом, эмфизематозный тип ХОБЛ характеризуется преимущественным развитием ДН, и такие больные «пыхтят» очень долго и уходят из жизни в пожилом возрасте.
Бронхитический фенотип (рис. 8.28, см. ) наблюдается, как правило, при центриацинарной эмфиземе и в основе своей имеет картину хронического бронхита. Постоянная гиперсекреция вызывает увеличение сопротивления на вдохе и выдохе, что способствует существенному нарушению вентиляции. В свою очередь, резкое уменьшение вентиляции приводит к значительному уменьшению содержания кислорода в альвеолах, последующему нарушению перфузионно-диффузионных соотношений и шунтированию крови. Это и обусловливает характерный синий оттенок диффузного цианоза у больных данной категории. Такие больные тучные («синие одутловатики»), в клинической картине преобладает кашель с обильным выделением мокроты. Прогрессирующие фиброзные изменения легочной ткани и облитерация просвета кровеносных сосудов ведут к развитию легочного сердца и его декомпенсации. Этому способствуют стойкая легочная гипертензия, значительная гипоксемия, эритроцитоз и постоянная интоксикация вследствие выраженного воспалительного процесса в бронхах.
Более подробно особенности фенотипов представлены в табл. 8.19.
| Признаки | Преимущественно эмфизематозный тип («розовый пыхтельщик») | Преимущественно бронхитический тип («синий одутловатик») |
|---|---|---|
|
Возраст (лет) на момент диагностики ХОБЛ |
Около 60 |
Около 50 |
|
Особенности внешнего вида |
|
|
|
Преобладающий симптом |
Одышка |
Кашель |
|
Мокрота |
Скудная — чаще слизистая |
Обильная — чаще слизисто-гнойная |
|
Бронхиальная инфекция |
Нечасто |
Часто |
|
Легочное сердце |
Редко, лишь в терминальной стадии |
Часто |
|
Рентгенография органов грудной клетки |
Гиперинфляция, буллезные изменения, «вертикальное» сердце |
Усиление легочного рисунка, увеличение размеров сердца |
|
Гематокрит, % |
35–45 |
50–55 |
|
PaO2 |
65–75 |
45–60 |
|
PaCO2 |
35–40 |
50–60 |
|
Диффузионная способность |
Снижена |
Норма, небольшое снижение |
Однако в клинической практике очень редко можно выделить эмфизематозный или бронхитический фенотип ХОБЛ в так называемом чистом виде (правильнее было бы говорить о преимущественно бронхитическом или о преимущественно эмфизематозном фенотипе заболевания). Наряду с этим может быть сочетание этих двух фенотипов у одного больного. Можно сказать, что в клинических условиях чаще встречаются больные со смешанным (сочетанным) фенотипом заболевания.
Кроме перечисленных выше, в настоящее время выделяют и иные фенотипы заболевания.
В первую очередь это относится к так называемому фенотипу «ХОБЛ + БА». Несмотря на то что необходимо тщательно дифференцировать больных с ХОБЛ и БА (см. Дифференциальная диагностика ХОБЛ) и значительным различием хронического воспаления при этих заболеваниях, у некоторых пациентов ХОБЛ и астма могут присутствовать одновременно. Частота сочетания ХОБЛ и БА у одного пациента составляет от 13 до 22% с нарастанием частоты встречаемости в пожилом возрасте — около 50% в возрасте ≥70 годам. В первую очередь этот фенотип может развиться у курящих больных, страдающих БА.
Наряду с этим в результате широкомасштабных исследований было показано, что около 20–30% больных с ХОБЛ могут иметь обратимую бронхиальную обструкцию, а в клеточном составе при воспалении появляются эозинофилы. Часть из этих больных также можно отнести к фенотипу «ХОБЛ + БА». Такие пациенты хорошо отвечают на терапию глюкокортикоидами. Они описываются с помощью ряда диагностических терминов, большинство из которых включают в себя термин «перекрестный синдром» (overlap syndrome) [24].
Научными комитетами GINA и GOLD был разработан и опубликован в 2014 г. документ, в котором дается обоснование для диагностики этого «перекрестного синдрома» и тактики ведения таких больных [25].
Перекрестный синдром БА–ХОБЛ характеризуется персистирующим ограничением воздушного потока и рядом симптомов, которые обычно связаны с БА, а также рядом симптомов, которые обычно свойственны ХОБЛ. В соответствии с этим перекрестный синдром БА–ХОБЛ определяется симптомами, которые характерны как для БА, так и для ХОБЛ.
Чаще всего ХОБЛ развивается на фоне БА, чем наоборот. У таких больных прослеживается длительное воздействие факторов риска ХОБЛ (курение, профессиональные или бытовые вредности).
Клинические особенности смешанного фенотипа ХОБЛ–БА (overlap phenotype) представлены ниже [26]:
-
обычно это больные старше 40 лет с клинико-функциональными параметрами ХОБЛ, у которых ранее (чаще до 40 лет) диагностировалась БА;
-
ХОБЛ при смешанном фенотипе развивается в более молодом возрасте, при меньшей продолжительности и интенсивности курения;
-
смешанный фенотип протекает более тяжело и с большей частотой обострений, чем изолированные БА и ХОБЛ;
-
выделяется 2 смешанных фенотипа — эозинофильный и нейтрофильный, различаемые ответом на терапию ИГК.
Убедительно говорить о таких ситуациях можно тогда, когда больной находится в стабильном состоянии по БА, т.е. имеет:
-
контролируемые симптомы;
-
малую вариабельность значений ПСВ, при сохраняющейся сниженной величине ОФВ1, даже если есть прирост в пробе с короткодействующими бронходилататорами (КДБД).
При этом:
-
уменьшается эффективность глюкокортикоидов, ранее обеспечивающих хороший эффект;
-
снижаются переносимость физической нагрузки и качество жизни;
-
при длительном наблюдении за больными отмечается прогрессирование ДН, носящее неуклонный характер.
Присоединение БА к ХОБЛ встречается значительно реже. В этом случае появляется ранее отсутствовавшая волнообразность клинических симптомов, связанных с бронхиальной обструкцией, возникают эпизоды приступов малопродуктивного кашля в ночные и/или в ранние утренние часы, удушья, сопровождаемые ощущением «свистящего» дыхания и потребностью применения КДБД.
Диагностические критерии смешанного фенотипа БА + ХОБЛ
А. Большие критерии.
-
Бронходилатационный ответ >400 мл и >15% ОФВ1.
-
Эозинофилия мокроты (>3%, специфичность и чувствительность 82 и 85%).
-
Верифицированный ранее диагноз БА.
Б. Малые критерии.
-
Повышенный уровень общего IgE.
-
Предсуществующий анамнез атопии.
-
Бронходилатационный ответ >200 мл и >12% ОФВ1.
Диагноз сочетания БА и ХОБЛ ставится:
-
при наличии двух больших или
-
одного большого и двух малых критериев.
Дополнительные методы обследования, используемые при диагностике сочетания БА и ХОБЛ, см. в табл. 8.20 [27].
| Показатель | Астма | ХОБЛ |
|---|---|---|
|
Диффузия газов |
Нормальная или незначительно снижена |
Часто снижена |
|
Газы артериальной крови |
Между обострениями в норме |
При тяжелой ХОБЛ между обострениями могут быть нарушены |
|
Тест на гиперреактивность |
Не имеет значительной пользы для дифференциальной диагностики. Высокая гиперреактивность характерна больше для БА |
|
|
КТ высокого разрешения |
Обычно в норме, может выявить воздушные ловушки и увеличение толщины стенок дыхательных путей |
Воздушные ловушки или эмфизема, возможно выявление увеличения толщины стенок дыхательных путей и признаки легочной гипертензии |
|
Определение IgE и/или кожные пробы |
Необязательные для верификации диагноза, (+) более характерны для БА |
Соответствуют фоновой распространенности аллергии, не исключают ХОБЛ |
|
NO в выдыхаемом воздухе |
Если высокий (>50 ppb), характерно для эозинофильного воспаления |
Обычно нормальный, низкий у активных курильщиков |
|
Эозинофилия крови |
Встречается при БА |
Может быть во время обострений |
|
Воспалительные элементы в мокроте |
Их роль в дифференциальной диагностике не установлена на большой популяции пациентов |
У пациентов с признаками как БА, так и ХОБЛ симптомы со стороны органов дыхания, включая одышку при физической нагрузке, персистируют, но их вариабельность может быть выраженной. Ограничение воздушного потока не является полностью обратимым, но часто отмечается его вариабельность. В мокроте — эозинофилы и нейтрофилы. Отмечаются более частые обострения. Такие пациенты характеризуются более низким качеством жизни, более быстрым ухудшением ФВД и более высокой смертностью. Кроме того, эти пациенты нуждаются в более интенсивном использовании ресурсов здравоохранения, чем пациенты только с БА или с ХОБЛ [27].
Еще один фенотип, о котором говорят в последнее время, это пациенты с частыми обострениями (2 или более обострений в год или 1 и более обострений, приведших к госпитализации) и определяют его как устойчивый во времени фенотип «пациент с частыми обострениями» [28].
Вместе с тем следует помнить и о том, что встречается и рецидив обострения. Рецидивом обострения ХОБЛ считается сохранение или усугубление ее симптомов в течение 14 дней после возникновения, несмотря на проводимую терапию или сохранение симптомов обострения ХОБЛ на фоне антибактериальной терапии, продолжающейся более 7 дней. Рецидивы обострения ХОБЛ возникают в 21–40% случаев. Весьма важным является оценка факторов риска рецидивирующих обострений ХОБЛ, к которым относятся [29]:
-
низкие показатели ОФВ1;
-
увеличение потребности в бронхолитиках и системных ГК;
-
предыдущие обострения ХОБЛ (более 3 в течение последних 2 лет);
-
ранее проводимая антибактериальная терапия (преимущественно ампициллином);
-
наличие сопутствующих заболеваний (СН, коронарная, почечная или/и печеночная недостаточность).
Важность этого фенотипа определяется тем, что из обострения пациент выходит с уменьшенными функциональными показателями легких, а частота обострений напрямую влияет на продолжительность жизни больных и требует индивидуального подхода к лечению.
Выделение других многочисленных фенотипов требует дальнейшего уточнения. В нескольких недавних исследованиях привлекло внимание различие в клинических проявлениях ХОБЛ между мужчинами и женщинами. Как оказалось, женщины характеризуются более выраженной ГДП, отмечают более выраженную одышку при тех же самых, что у мужчин, значениях бронхиальной обструкции и т.д. При одних и тех же функциональных показателях у женщин оксигенация происходит лучше, чем у мужчин. Однако у женщин чаще отмечают развитие обострений, они демонстрируют меньший эффект физических тренировок в реабилитационных программах, более низко оценивают качество жизни по данным стандартных вопросников (SF-36, Респираторный вопросник госпиталя Святого Георгия — SGRQ). Вероятнее всего, все описанные выше особенности течения ХОБЛ у женщин укладываются в гендерные особенности и не могут соответствовать понятию фенотипа ХОБЛ.
В целом качественная оценка состояния больных дается, используя показатели, изучающие качество жизни, которые, с одной стороны, объективно оценивают основные аспекты жизнедеятельности человека, а с другой — отражают субъективный уровень его благополучия.
Для того чтобы помочь пациентам самим охарактеризовать состояние здоровья, можно использовать ВАШ (рис. 8.29), где наилучшее состояние оценивается как 100, а наихудшее как 0, и пациент сам выбирает показатель шкалы, оценивающий его состояние на день визита к врачу.

Рис. 8.29. Визуально-аналоговая шкала
Являясь основой ХОБЛ, воспаление проявляется не только в дыхательной системе, но оно носит и системный характер. Это подтверждается повышением уровня СРБ, ФНО-α и других провоспалительных цитокинов (IL-6, -8 и др.).
Циркулирующие в крови воспалительные медиаторы могут способствовать потере мышечной массы и кахексии, а также способны провоцировать развитие или усугублять течение сопутствующих заболеваний, таких как ИБС, СН, остеопороз, нормоцитарная анемия, СД, метаболический синдром и депрессия.
Основные системные эффекты при ХОБЛ могут иметь следующие клинические и лабораторные проявления (рис. 8.30, см. ):
-
потеря массы тела;
-
нарушение питания;
-
дисфункция скелетной мускулатуры (снижение мышечной силы, атрофия верхнего плечевого пояса, атрофия мышц);
-
остеопороз;
-
анемия;
-
сердечно-сосудистые эффекты.
Они оказывают существенное влияние на клиническую картину заболевания и нередко определяют выживаемость пациентов.
Установлено, что системное воспаление усиливается по мере прогрессирования ХОБЛ и его проявления становятся очевидными у тяжелых больных. Механизмы, лежащие в основе системных проявлений ХОБЛ, представлены в табл. 8.21.
| Основные механизмы | Характеристика |
|---|---|
|
Системное воспаление |
Основная локализация воспаления при ХОБЛ — малые дыхательные пути, но активное воспаление присутствует также и в крупных бронхах, и в легочной паренхиме, и в легочных сосудах [30]. Взаимосвязь местного (т.е. бронхолегочного) с системным воспалением осуществляют:
|
|
Снижение питательного статуса (кахексия) |
Увеличение базального метаболического уровня, причиной которого может быть увеличение потребления кислорода дыхательными мышцами вследствие одышки [32] |
|
Дисфункция скелетных мышц |
2 феномена: атрофия мышц (митохондриальные нарушения, потеря сократительных белков); нарушение функции «оставшейся» мускулатуры [33] |
|
Остеопороз |
Причинами развития, кроме приема стероидов, могут быть: низкая физическая активность, курение, снижение уровня половых гормонов, гиперкапния, снижение массы тела [34] |
|
Анемия |
Сывороточные цитокины и хемокины могут нарушать основные этапы гемопоэза, возможными механизмами анемии при ХОБЛ являются укорочение времени жизни эритроцитов, нарушение мобилизации и утилизации железа, нарушение ответа костного мозга на эритропоэтин [35] |
|
Сердечно-сосудистые эффекты |
ССЗ обнаруживают не менее чем у 50% больных с ХОБЛ [36]. Наличие ХОБЛ у больного повышает риск развития ССЗ в 2–3 раза [37] |
Хроническое персистирующее системное воспаление играет важную роль в патогенезе сердечно-сосудистых расстройств у больных с ХОБЛ. Отмечается увеличение риска ССЗ, коррелирующее с повышением уровня СРБ [38], который является мощным независимым фактором — предиктором роста ССЗ и летальности пациентов с ХОБЛ [39]. Основу сердечно-сосудистой патологии следует трактовать как результат дисфункции эндотелия и ее патологических последствий, проявляющихся в усилении вазоконстрикции в ответ на стимулы, усилении сосудистого тонуса, пролиферации и миграции гладкомышечных клеток, экспрессии адгезивных молекул, увеличении агрегации тромбоцитов, адгезией моноцитов и т.п. Все изложенное выше и приводит к прогрессированию АГ, ускоренному развитию атеросклероза, склонности к тромбообразованию и т.д.
Исследования, проведенные в Великобритании, объединяющие более 5 млн историй болезни, показали, что [40]:
-
пациенты с ХОБЛ в 5 раз чаще страдают ССЗ;
-
в группе от 35 до 45 лет в 7,6 раза у пациентов с ХОБЛ выше шансы развития сопутствующей сердечно-сосудистой патологии;
-
у молодых пациентов с ХОБЛ риск ИМ возрастает в 12 раз.
Системное воспаление вносит свой вклад и в развитие остеопороза [41, 42]. У больных с ХОБЛ остеопороз встречается чаще, чем в здоровой популяции (30%), и достигает 69%. Так, известно, что ФНО-α является ингибитором синтеза коллагена и стимулятором остеокластической резорбции кости. Вместе с тем следует подчеркнуть, что важную роль в развитии остеопороза играют другие факторы, включая курение, недостаток витамина D, низкий ИМТ, малоподвижный образ жизни, гипогонадизм, применение глюкокортикоидных гормонов, а также генетический фактор. Пациенты с ХОБЛ имеют более высокий риск снижения плотности костной ткани и развития переломов, причем этот риск в большей степени обусловлен хроническим системным воспалением, чем применением ГК, включая ИГК. Степень выраженности остеопороза можно определить по данным денситометрии и/или сканирования опорно-двигательного аппарата.
Наряду со свойственной больным с ХОБЛ полицитемией, у них отмечается высокая распространенность анемии: по данным М. John и соавт. (2005), у 13% больных выявляется анемия, как правило, нормохромная и нормоцитарная, в то время как полицитемия отмечена у 8,4% больных [43]. Основной причиной развития анемии у больных с ХОБЛ является персистенция системного воспаления, проявляющаяся повышением концентрации воспалительных медиаторов, в том числе ФНО-α, ИЛ-6 и свободных кислородных радикалов. Все это приводит к уменьшению срока жизни эритроцитов (ускоренный их распад), недостаточной выработке эритропоэтина в ответ на физиологические стимулы, нарушению регуляции обмена железа (снижение мобилизации железа из депо, повышение связывания с ферритином), нарушению эритропоэза в костном мозге (резистентность клеток-предшественников к эритропоэтину, апоптоз клеток-предшественников) [44].
Одни из отягчающих проявлений системных эффектов, оказывающих существенное влияние на клиническую картину и прогноз у больных с ХОБЛ, — нервно-психические нарушения, проявляющиеся снижением памяти, депрессией, «страхами» и нарушением сна [45]. Все начинается с развития у больных так называемых страхов, связанных с ограничением повседневной активности из-за одышки, невозможностью справиться с ней, нарастанием тяжести симптомов и частыми простудами.
Увеличение частоты депрессий ассоциируется с высокой частотой обострений и повторными госпитализациями, а также с более высокой ценой медицинского обслуживания.
Помимо таких расстройств, могут встречаться и другие нарушения, которые существенно влияют на поведение в болезни, в том числе встречаемая нередко у больных с ХОБЛ и малоизученная гипонозогнозическая реакция на заболевание, характеризуемая отрицанием воздействия на жизнь даже такого тяжелого заболевания, как ХОБЛ [46].
У ряда больных с ХОБЛ отмечается снижение питательного статуса (кахексия), основной причиной которого служит потеря мышечной массы [47]. Причиной этой потери и слабости мышц, возможно, является активация апоптоза и/или бездействие мышц в связи с практически обездвиженным образом жизни, который вынуждены вести больные с ХОБЛ тяжелого течения [48].
В последние годы все большее внимание обращается на сопутствующие заболевания со стороны органов пищеварения. Отмечается рост эзофагита, гастрита или язвы желудка, а особенно ГЭРБ [49].
Сопутствующие заболевания могут изменять клиническую картину ХОБЛ и оказывать существенное влияние на лечение таких больных. Помимо изложенного выше, клиническую картину ХОБЛ следует рассматривать в рамках комплекса болезней, свойственных людям пожилого возраста. Известно, что пожилые больные часто страдают несколькими хроническими заболеваниями. По данным исследования, проведенного С. van Well (1996) в Нидерландах, во всем мире 25% людей в возрасте старше 65 лет страдают двумя из пяти наиболее распространенных заболеваний (к которым относится и ХОБЛ), а 10% страдают тремя и более из этих заболеваний. В возрасте 75 лет и старше показатели достигают 40 и 25% соответственно [50].
Для ХОБЛ характерно частое развитие сопутствующих заболеваний. Некоторые (например, ИБС, бронхиальная карцинома, остеопороз), как правило, являются косвенным следствием ХОБЛ, возникая у пожилых больных независимо, но при наличии ХОБЛ — с большей вероятностью. Другие сопутствующие патологии (СД, гастроэзофагеальный рефлюкс, артрит, аденома простаты) могут существовать одновременно с ХОБЛ, поскольку они являются частью процесса старения. В целом следует подчеркнуть, поскольку ХОБЛ обычно развивается у длительно курящих, такие люди очень часто страдают другими различными заболеваниями, связанными или с курением, или с возрастом (старше 40–45 лет), которые отягчают клиническую картину ХОБЛ, могут существенно модифицировать ее течение. Это положение постоянно подчеркивается и в программах GOLD (2006, 2011, 2013–2015 гг.). Недоучет влияния сопутствующих болезней на основные симптомы ХОБЛ нередко может стать причиной диагностических и лечебных ошибок у этой категории больных.
Подводя итог описанию клинической картины, следует подчеркнуть, что выраженность клинических проявлений у больных с ХОБЛ зависит от многочисленных факторов, включающих:
-
фазу процесса (стабильное течение или обострение);
-
тяжесть течения;
-
фенотип болезни (бронхитический, эмфизематозный, смешанный, ХОБЛ + астма и др.);
-
выраженность внелегочных проявлений или/и сопутствующих заболеваний;
-
наличие осложнений и их характер.
Все описанное выше наряду с интенсивностью воздействия факторов риска, скоростью прогрессирования болезни и создает облик больного с ХОБЛ в разные периоды его жизни.
Диагностика хронической обструктивной болезни легких
Диагноз «хроническая обструктивная болезнь легких» должен предполагаться у всех пациентов при наличии кашля, выделении мокроты или одышке и выявлении факторов риска развития ХОБЛ.
Особенность клинической картины ХОБЛ состоит в том, что болезнь долгое время протекает без выраженных клинических проявлений и это может затруднять своевременную постановку диагноза. Проблема гиподиагностики связана также с тем, что многие люди, страдающие ХОБЛ, не ощущают себя больными. В реальной жизни на ранних стадиях заболевания курильщик не считает себя больным ХОБЛ, так как оценивает кашель как нормальное состояние, если трудовая деятельность его еще не нарушена. Из-за отсутствия одышки на определенном этапе развития заболевания больные не попадают в поле зрения врача. Отсюда следует, что в подавляющем большинстве случаев диагностика ХОБЛ осуществляется на инвалидизирующих стадиях болезни, а наличие кашля с мокротой курильщики не считают проявлением заболевания, объясняя это тем, что все курильщики кашляют. Даже появление одышки, возникающей при физической нагрузке, расценивается ими как результат пожилого возраста или детренированности.
Будучи уже больным ХОБЛ, курильщик на ранних стадиях болезни и вне обострения обращается к врачам-специалистам по поводу других заболеваний, также являющихся результатом курения. Так, например, если у курильщика «стынут» или «зябнут» ноги — он обращается к хирургу, а если беспокоит одышка и появляется чувство нехватки воздуха — пациент направляется к кардиологу. Из этого нужно сделать вывод, что и специалисты должны знать и помнить о развитии ХОБЛ у курящего и направлять его на исследование ФВД или на консультацию к пульмонологу.
Диагноз ХОБЛ всегда необходимо подтверждать результатами исследования ФВД. Спирометрия должна проводиться всем пациентам, имеющим в анамнезе:
-
курение или контакт с поллютантами окружающей среды либо профессиональными вредностями;
-
респираторные болезни у родственников;
-
наличие длительного кашля, продукции мокроты и/или одышки.
Основные направления диагностики ХОБЛ включают:
-
выявление факторов риска (установление ингаляционного воздействия патогенных агентов, в первую очередь табачного дыма);
-
сведения, полученные из беседы с больным (анализ словесного портрета больного) — кашель, его характер, одышка, ее выраженность, определяемая у больных с ХОБЛ, на основании вопросника mMRC [51] (табл. 8.22);
-
для оценки клинической картины применение оценочного теста COPD Assessment Test (CAT) [18, 25] (табл. 8.23);
-
объективизацию симптомов обструкции (данные объективного обследования);
-
исследование респираторной функции легких (диагноз ХОБЛ должен быть подтвержден данными спирометрии: постбронходилатационные значения ОФВ1/ФЖЕЛ <70% на всех стадиях заболевания). Показатель ОФВ1 отражает степень нарушения бронхиальной проходимости [52].
Рентгенография органов грудной клетки должна быть проведена всем больным с предполагаемым диагнозом ХОБЛ. Этот метод не является чувствительным инструментом для постановки диагноза, но позволяет исключить другие заболевания, сопровождаемые аналогичными с ХОБЛ клиническими симптомами (опухоль, туберкулез, ЗСН и т.п.), а в период обострения — выявить пневмонию, плевральный выпот, спонтанный пневмоторакс и т.д. В типичных случаях обструктивные изменения рентгенографически характеризуются увеличением объема легких за счет гипервоздушности респираторных отделов (на ранних стадиях заболевания эти проявления, как правило, отсутствуют). И.Е. Тюрин [53] приводит следующие рентгенологические признаки бронхиальной обструкции (рис. 8.31, см. ):
-
уплощение купола диафрагмы;
-
ограничение подвижности диафрагмы при дыхательных движениях;
-
изменение переднезаднего размера грудной полости;
-
расширение ретростернального пространства;
-
«саблевидная трахея»;
-
вертикальное расположение сердца.
| Степень | Тяжесть | Описание |
|---|---|---|
|
0 |
Нет |
Я чувствую одышку только при сильной физической нагрузке |
|
1 |
Легкая |
Я задыхаюсь, когда быстро иду по ровной местности или поднимаюсь по пологому холму |
|
2 |
Средняя |
Из-за одышки я хожу по ровной местности медленнее, чем люди того же возраста, или у меня останавливается дыхание, когда я иду по ровной местности в привычном для меня темпе |
|
3 |
Тяжелая |
Я задыхаюсь после того, как пройду примерно 100 м или после нескольких минут ходьбы по ровной местности |
|
4 |
Очень тяжелая |
У меня слишком сильная одышка, чтобы выходить из дому, или я задыхаюсь, когда одеваюсь или раздеваюсь |
|
Я никогда не кашляю |
0 |
1 |
2 |
3 |
4 |
5 |
Я постоянно кашляю |
|
У меня в легких совсем нет мокроты (слизи) |
0 |
1 |
2 |
3 |
4 |
5 |
Мои легкие наполнены мокротой (слизью) |
|
У меня совсем нет ощущения сдавления в грудной клетке |
0 |
1 |
2 |
3 |
4 |
5 |
У меня очень сильное ощущение сдавления в грудной клетке |
|
Когда я иду в гору или поднимаюсь вверх на один лестничный пролет, у меня нет |
0 |
1 |
2 |
3 |
4 |
5 |
Когда я иду в гору или поднимаюсь вверх на один лестничный пролет, возникает сильная одышка |
|
Моя повседневная деятельность в пределах дома не ограничена |
0 |
1 |
2 |
3 |
4 |
5 |
Моя повседневная деятельность в пределах дома очень ограничена |
|
Несмотря на мое заболевание легких, я чувствую себя уверенно, когда выхожу из дома |
0 |
1 |
2 |
3 |
4 |
5 |
Из-за моего заболевания легких я совсем не чувствую себя уверенно, когда выхожу из дома |
|
Я сплю очень хорошо |
0 |
1 |
2 |
3 |
4 |
5 |
Из-за моего заболевания легких я сплю очень плохо |
|
У меня много энергии |
0 |
1 |
2 |
3 |
4 |
5 |
У меня совсем нет энергии |
Примечание: 0–10 баллов — незначительное влияние ХОБЛ на жизнь пациента; 11–20 баллов — умеренное влияние ХОБЛ на жизнь пациента; 21–30 баллов — сильное влияние ХОБЛ на жизнь пациента; 31–40 баллов — чрезвычайно сильное влияние ХОБЛ на жизнь пациента.
Обширные участки легочных полей, лишенные легочного рисунка, обычно в сочетании с оттеснением или обрывом легочных сосудов — так рентгенологически могут выглядеть проявления эмфиземы.
Рентгенография может выявить тонкостенные воздушные полости — результат развития буллезной эмфиземы, однако внутридольковая, парасептальная и другие формы эмфиземы могут быть выявлены с помощью КТ высоких разрешений. КТ помогает не только уточнить природу эмфиземы, но и обнаружить БЭ.
ЭКГ относится к обязательным методам обследования и позволяет у ряда больных обнаружить признаки гипертрофии и/или перегрузки правых отделов сердца, однако эти признаки могут изменяться при развитии эмфиземы и не соответствовать общепринятым критериям. Данные ЭКГ в большинстве случаев помогают исключить (или уточнить) кардиальный генез респираторной симптоматики.
Из числа лабораторных методов диагностики к обязательно выполняемым относятся исследования клинического анализа крови и цитологии мокроты.
При обострении заболевания наиболее часто встречаются нейтрофильный лейкоцитоз с палочкоядерным сдвигом и увеличение скорости оседания эритроцитов. Наличие лейкоцитоза служит дополнительным аргументом в пользу инфекционного фактора как причины обострения ХОБЛ.
При стабильном течении ХОБЛ существенных изменений содержания лейкоцитов в периферической крови не происходит.
При исследовании клинического анализа крови может быть выявлена как анемия (результат общего воспалительного синдрома), так и полицитемия. Полицитемический синдром (повышение числа эритроцитов, высокий уровень гемоглобина — более 16 г/дл у женщин и более 18 г/дл у мужчин, и повышение гематокрита >47% у женщин и >52% у мужчин) может указывать на существование выраженной и длительной гипоксемии. Существование этого синдрома свойственно, как правило, тяжелому течению ХОБЛ, и если болезнь диагностируется на таком этапе, это свидетельствует об очень поздней постановке диагноза.
Цитологическое исследование мокроты дает информацию о характере воспалительного процесса и степени его выраженности. Определение атипичных клеток усиливает онкологическую настороженность и требует проведения дополнительных методов обследования.
Культуральное микробиологическое исследование мокроты целесообразно проводить при неконтролируемом прогрессировании инфекционного процесса и использовать для подбора рациональной антибиотикотерапии [54]. С этой же целью проводится бактериологическое исследование бронхиального содержимого, полученного при бронхоскопии.
Бронхоскопическое исследование служит дополнительным при диагностике ХОБЛ. Оно проводится для оценки состояния слизистой оболочки бронхов и дифференциальной диагностики с другими заболеваниями органов дыхания, которые могут быть причиной хронической бронхиальной обструкции.
Исследование может включать:
-
осмотр слизистой оболочки бронхов;
-
культуральное исследование бронхиального содержимого;
-
бронхиальный лаваж с определением клеточного состава;
-
биопсию стенки бронхов.
α-1-Антитрипсин
У относительно молодых больных (моложе 40 лет) или у больных с явным семейным анамнезом ХОБЛ имеет смысл исследовать уровень ААТ. Если его сывороточная концентрация составляет менее 15–20% нормального уровня, то очень высока вероятность, что у больного гомозиготный тип дефицита ААТ, который может быть причиной развития ХОБЛ.
Газовый состав артериальной крови. У больных при диагностике ХОБЛ на поздних стадиях развития заболевания (ОФВ1 <50% должного или при наличии признаков тяжелой ДН либо правожелудочковой СН) следует провести исследование газового состава артериальной крови. Наиболее важными показателями являются PaO2, PaCO2, рH и уровень бикарбонатов НСО3 артериальной крови (рекомендуется серийное исследование этих показателей).
При отсутствии возможности определить PaO2 артериальной крови ориентировочную информацию о степени гипоксемии позволяет получить исследование SpO2 с помощью пульсоксиметра.
Диффузионная способность. Для дифференциальной диагностики БА и эмфиземы дополнительно изучается DLCO. Так, при эмфиземе этот параметр значительно снижен вследствие редукции капиллярного русла.
ЭхоКГ. Врач дополнительно может направить пациента на УЗИ сердца для выявления и оценки дисфункции правых (а при наличии изменений — и левых) отделов сердца и определения легочной гипертензии и степени ее выраженности.
Проба с физической нагрузкой. Для объективизации степени ограничения физических возможностей рекомендуется провести пробу с физической нагрузкой [55]. Предпочтение отдается тесту 6-МТ, который выполняется по стандартному протоколу. Тест 6-МТ используется в тех случаях, когда выраженность одышки не соответствует снижению ОФВ1, а также применяется для отбора больных на реабилитационные программы.
С учетом того, что постановка диагноза «хроническая обструктивная болезню легких» — прерогатива врача первичного звена, для улучшения диагностики ХОБЛ предлагается следующий алгоритм действий врача-терапевта, который включает следующее.
-
Выявление факторов риска и определение индекса курящего человека (ИКЧ).
-
Анкетирование каждого курящего и/или имеющего контакт с пылью, используя опросник CAT.
-
Определение наличия и степени выраженности одышки по вопроснику mMRС.
-
Выявление объективных признаков бронхиальной обструкции и/или эмфиземы (необходимо знать, что клинические признаки ограничения воздушного потока обычно не выражены до развития существенного нарушения функции легких и имеют относительно невысокую чувствительность).
-
Проведение пикфлоуметрии и теста с бронхолитиками.
-
Постановка вероятного диагноза ХОБЛ и назначение лекарственных препаратов для регулярной терапии.
-
Проведение лабораторно-инструментального обследования (согласно принятым стандартам: клинический анализ крови, мокроты, рентгенологическое исследование органов грудной клетки и ЭКГ).
-
Спирометрия.
-
Направление к специалисту-пульмонологу.
Таким образом, диагностика ХОБЛ базируется на суммировании следующих данных:
-
наличие факторов риска, в том числе табакокурения;
-
клинических признаков, главными из которых являются кашель и экспираторная одышка, сухие свистящие хрипы;
-
по данным ФВД — неуклонно прогрессирующие нарушения бронхиальной проходимости и наличие частично (слабо) обратимой или необратимой обструкции;
-
исключение других заболеваний, которые могут привести к появлению указанных выше симптомов.
Классификация хронической обструктивной болезни легких
Классификация ХОБЛ с учетом рекомендаций программы GOLD (2016) основана на интегральной оценке тяжести больных с ХОБЛ и включает постбронходилатационные значения показателей ОФВ1 и ФЖЕЛ (табл. 8.24).
| Стадия ХОБЛ | Степень тяжести | ОФВ1/ФЖЕЛ | ОФВ1, % должного |
|---|---|---|---|
|
I |
Легкая |
<0,7 (70%) |
ОФВ1 ≥80 |
|
II |
Среднетяжелая |
<0,7 (70%) |
50% ≤ОФВ1 <80 |
|
III |
Тяжелая |
<0,7 (70%) |
30% ≤ОФВ1 <50 |
|
IV |
Крайне тяжелая |
<0,7 (70%) |
ОФВ1 <30 |
Классификация ХОБЛ включает клинические данные о пациенте: количество обострений ХОБЛ за год и выраженность клинических симптомов, используя тест CAT (см. табл. 8.23). Оценку одышки по результатам вопросника mMRC (см. табл. 8.22) следует использовать только у больных с установленным диагнозом ХОБЛ. В табл. 8.25 представлена классификация ХОБЛ.
| Группа больных | Характеристика | Спирометрическая классификация | Число обострений за год | mMRC-шкала одышки | CAT-тест оценки симптомов ХОБЛ |
|---|---|---|---|---|---|
|
A |
Низкий риск обострений. |
GOLD 1–2 |
≤1 |
0–1 |
<10 |
|
B |
Низкий риск обострений. |
GOLD 1–2 |
≤1 |
≥2 |
≥10 |
|
C |
Высокий риск обострений. |
GOLD 3–4 |
≥2 |
0–1 |
<10 |
|
D |
Высокий риск обострений. |
GOLD 3–4 |
≥2 |
≥2 |
≥10 |
При оценке степени риска рекомендуется выбирать наивысшую степень в соответствии с ограничением скорости воздушного потока по классификации GOLD или с частотой обострений в анамнезе.
Дифференциальная диагностика хронической обструктивной болезни легких
Основная задача дифференциальной диагностики ХОБЛ — исключение заболеваний со сходной симптоматикой. Несмотря на вполне определенные различия между БА и ХОБЛ по механизмам развития, в клинических проявлениях и принципах профилактики и лечения эти два заболевания имеют некоторые общие черты.
Дифференциальная диагностика БА и ХОБЛ основана на интеграции основных данных клинической картины, результатов функциональных и лабораторных тестов.
Особенности воспаления при ХОБЛ и БА представлены на рис. 8.32.
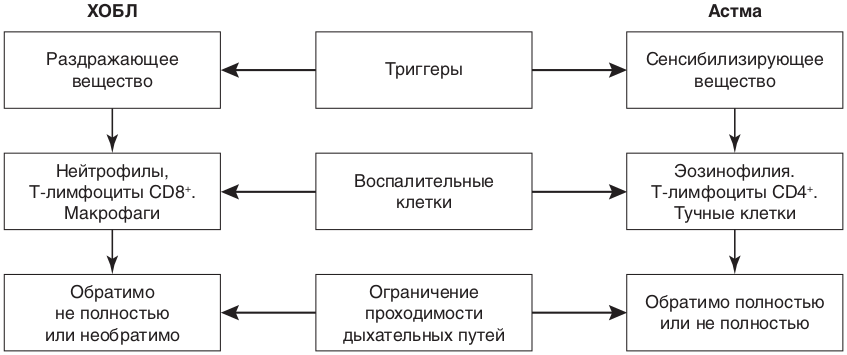
Рис. 8.32. Характеристика воспаления при хронической обструктивной болезни легких и при астме
Ведущие отправные пункты для дифференциальной диагностики этих болезней даны в табл. 8.26.
| Признаки | ХОБЛ | БА |
|---|---|---|
|
Возраст начала болезни |
Как правило, старше 40 лет |
Чаще детский и молодой |
|
Курение в анамнезе |
Характерно |
Нехарактерно |
|
Факторы риска |
Курение (до 90%), продукты сгорания некоторых видов бытового топлива, промышленного загрязнения и некоторые производственные факторы (кремний, кадмий) |
Бытовые аллергены, пыльца растений, некоторые производственные факторы |
|
Отягощенная наследственность по астме |
Нехарактерна |
Характерна |
|
Внелегочные проявления аллергии |
Нехарактерны |
Характерны |
|
Характер воспаления |
Локализуется преимущественно в периферических дыхательных путях, распространяется на интерстициальную ткань и паренхиму легких, приводя к деструкции эластического каркаса стенок альвеол и формированию эмфиземы легких |
Локализуется преимущественно в периферических дыхательных путях без распространения на интерстициальную ткань и паренхиму легких |
|
Тип воспаления |
Преобладают нейтрофилы |
Преобладают эозинофилы |
|
Характер течения заболевания |
Позднее появление и медленное неуклонное нарастание респираторных симптомов. Поздняя диагностика. |
Волнообразность и яркость клинических проявлений, их обратимость (либо спонтанно, либо под влиянием терапии), отсутствие прогрессирования при неосложненных формах БА |
|
Симптомы (кашель и одышка) |
Постоянны, прогрессируют медленно |
Изменчивы, появляются приступообразно, сезонность |
|
Наличие легочного сердца |
Характерно при тяжелом течении |
Нехарактерно |
|
Бронхиальная обструкция |
Малообратима или необратима |
Обратима |
|
Показатели ФВД |
Снижение ОФВ1/ФЖЕЛ <70%. |
Прирост ОФВ1 ≥12% исходной величины и ≥200 мл в ингаляционной пробе с короткодействующими бронходилататорами |
|
Суточная вариабельность ПСВ |
<10% |
>20% |
|
Эффективность глюкокортикоидной терапии |
Низкая |
Высокая |
* Положительный результат теста не исключает ХОБЛ.
Вместе с тем следует помнить о том, что ХОБЛ может сочетаться с БА, создавая так называемый синдром перекреста (overlap syndrome), о чем подробно изложено в разделе «Клиническая картина ХОБЛ».
Помимо бронхиальной астмы, на определенных стадиях развития ХОБЛ (особенно при первой встрече с больным) возникает необходимость дифференцировать ХОБЛ от ряда других заболеваний со сходной симптоматикой. Их основные отличительные признаки приведены в табл. 8.27.
| Диагноз | Основные диагностические критерии |
|---|---|
|
Хроническая обструктивная болезнь легких |
Начало в зрелом возрасте. Симптомы медленно прогрессируют. Длительный анамнез курильщика. Одышка при нагрузке. В основном малообратимое или необратимое ограничение воздушного потока |
|
Сердечная недостаточность |
Хрипы в нижних отделах легких при аускультации. Значительное снижение фракции выброса ЛЖ. Дилатация отделов сердца. На рентгенограмме расширение контуров сердца, застойные явления, вплоть до отека легких. При исследовании функции легких определяются нарушения по рестриктивному типу, без ограничения воздушного потока |
|
Бронхоэктазы |
Большие объемы гнойной мокроты. Частая связь с бактериальной инфекцией. Грубые влажные разнокалиберные хрипы при аускультации. Симптом «барабанных палочек». На рентгенограмме или КТ расширение бронхов, утолщение их стенок |
|
Туберкулез |
Начинается в любом возрасте. Рентгенография демонстрирует инфильтрат в легких или очаговые поражения. Микробиологическое подтверждение. Высокая заболеваемость в данном регионе. При подозрении на туберкулез легких: томография и/или КТ легких, исследования мокроты на МБТ, в том числе методом флотации, посев мокроты на МБТ, исследования плеврального экссудата, диагностическая бронхоскопия с биопсией при подозрении на туберкулез бронха, реакция Манту |
|
Облитерирующий бронхиолит |
Развитие в молодом возрасте. Связи с курением не установлено. Ревматоидный артрит. Контакт с парами, дымом. На КТ определяются очаги пониженной плотности при выдохе |
|
Диффузный панбронхиолит |
Большинство пациентов — некурящие мужчины, почти все больны хроническим пансинуситом. На рентгенограмме или КТ высокого разрешения — диффузные малые центрилобулярные узловые затемнения и гиперинфляция |
Дифференциальная диагностика на разных стадиях развития ХОБЛ имеет свои особенности. При легком течении ХОБЛ главное — выявить отличия от других заболеваний, связанных с факторами экологической агрессии, протекающих субклинически или с малой симптоматикой, в первую очередь — различных вариантов хронических бронхитов. Сложность возникает при проведении дифференциальной диагностики у больных с тяжелым течением ХОБЛ. Она определяется не только тяжестью больных, выраженностью необратимых изменений, а также большим набором сопутствующих заболеваний (ИБС, гипертоническая болезнь, болезни обмена и т.д.).
Сопутствующие заболевания
Наиболее частые сопутствующие заболевания при ХОБЛ показаны в табл. 8.28.
| Нозологическая форма | Частота встречаемости, % |
|---|---|
|
Сердечно-сосудистые заболевания |
42,0 |
|
Остеопороз |
28–34 |
|
Депрессия |
35–42 |
|
Инфекция нижних дыхательных путей |
67–72 |
|
Синдром апноэ сна |
17–26 |
|
Катаракта |
31–32 |
|
ТЭЛА* |
10–20 |
|
Импотенция |
37–43 |
* ТЭЛА — тромбоэмболия легочной артерии.
Прогноз наиболее неблагоприятен при сочетании ХОБЛ с группой ССЗ. Среди лидирующих, но нераспознанных причин смерти у больных с ХОБЛ — ИБС и СН. По данным крупных популяционных исследований, риск смерти от сердечно-сосудистых патологий у больных с ХОБЛ повышен в 2–3 раза и составляет приблизительно 50% общего количества смертельных случаев. Причины смерти пациентов с ХОБЛ отражены в табл. 8.29.
| Причина смерти | % |
|---|---|
|
Легочная |
35 |
|
Сердечно-сосудистая |
27 |
|
Рак |
21 |
|
Другая |
10 |
|
Причина неизвестна |
7 |
Доказано, что ОФВ1 может быть маркером будущего кардиоваскулярного риска, т.е. прогрессирующее снижение ОФВ1 опосредует манифестацию внелегочных заболеваний, негативно отражаясь на величине общей и кардиоваскулярной смертности.
Взаимосвязь сопутствующей патологии при ХОБЛ и риска смерти показана на рис. 8.33.
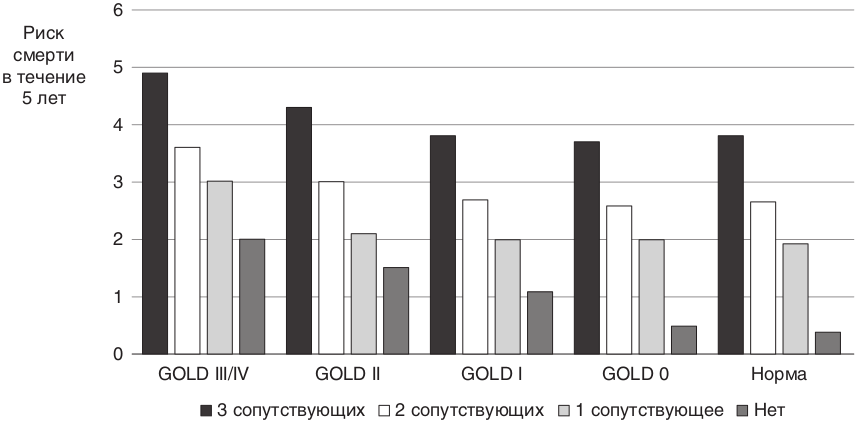
Рис. 8.33. Сопутствующие заболевания и риск смерти [57]
Хроническая обструктивная болезнь легких и сердечно-сосудистые заболевания
На рис. 8.34 показан риск развития ССЗ у пациентов с ХОБЛ.
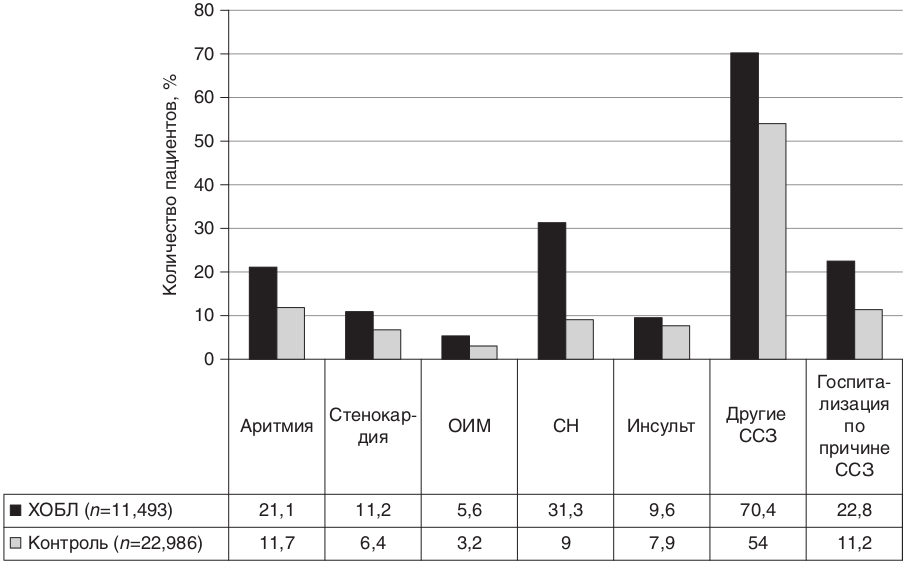
Рис. 8.34. Риск развития сердечно-сосудистых заболеваний у пациентов с хронической обструктивной болезнью легких [58]
Больные, страдающие тяжелыми формами ХОБЛ, относятся к группе высокого риска внезапной смерти. Одной из причин, которая может лежать в основе развития внезапной смерти, является нарушение ритма сердечных сокращений. Суправентрикулярные и вентрикулярные формы нарушения ритма сердца являются достаточно частой клинической проблемой у больных.
Несомненно, большую роль в прогнозе для жизни пациента с ХОБЛ играет сопутствующая ИБС и СН. В случаях ХОБЛ другую важную причину возникновения эпизодов аритмии связывают с приемом определенных лекарственных средств: теофиллина, дигоксина, агонистов β2-рецепторов. Весь спектр перечисленных условий возникновения аритмий у больных с ХОБЛ затрудняет получение полной картины данной клинической проблемы. Особое место в изучении аритмий сердца у больных с ХОБЛ занимает мультифокальная предсердная тахикардия. Основными морфологическими признаками этой формы нарушения ритма сердечных сокращений является вариабельность зубца Р, зубцы Р различаются по форме, полярности, амплитуде, что лучше регистрируется в отведениях I, II, III; ЧСС более 100 в минуту, интервалы Р–Р и Р–R, R–R разные. Мультифокальная предсердная тахикардия ассоциируется в значительной степени с ДН, причем с ее возникновением связывают функциональные изменения в работе сердечной мышцы. Прогноз течения ХОБЛ при появлении этого типа сердечной аритмии принято считать неблагоприятным.
Сочетание АГ и ХОБЛ достаточно часто встречается в клинической практике. Нередко пациенты с этими формами сочетанных болезней представляют одну и ту же возрастную группу. Трудности в ведении этой категории больных связаны в первую очередь с тем, что некоторые антигипертензивные лекарственные средства могут оказывать эффект бронхоконстрикции, тем самым усугубляя течение БА и ХОБЛ. Общие рекомендации построены на предельно осторожном назначении β-адреноблокаторов; в меньшей степени эти рекомендации распространяются на группу иАПФ. Необходимо подчеркнуть патогенетическую роль гипоксемии в развитии артериальной гипертензии.
ИБС и ХОБЛ достаточно часто бывают сопутствующими заболеваниями. В клинической практике порой бывает трудно определить, какая из болезней у данного конкретного больного в данной клинической ситуации является ведущей. Большую роль отводят развитию гипоксемии, которая существенно ухудшает течение ИБС. Особенно пагубно сказываются снижение SpO2 до 80% и продолжительность гипоксии более 5 мин. Наиболее опасную группу больных составляют те, у которых гипоксия сочетается с гиперкапнией. В лечебные программы этой категории больных обязательно включается назначение кислорода. Неоднократно было показано, что длительная терапия кислородом (время ингаляции превышает
15 ч/сут) значительно повышает выживаемость больных.
Хроническая обструктивная болезнь легких и сердечная недостаточность
Отдельного внимания заслуживают больные с ХОБЛ и СН. Селективные β-адреноблокаторы, имеющие большое значение при лечении СН, не влияют значимо на краткосрочную функцию легких и не ослабляют β2-индуцированную бронходилатацию. Селективные β1-адреноблокаторы могут безопасно применяться у всех пациентов с СН и заболеваниями легких.
Доказаны положительные эффекты статинов, иАПФ, антагонистов рецепторов ангиотензина на кардиоваскулярную и респираторную заболеваемость и смертность у пациентов с ХОБЛ.
Хроническая обструктивная болезнь легких, метаболический синдром и сахарный диабет
К экстрапульмональным эффектам относят и сахарный диабет, который манифестирует у пациентов старше 40 лет. Среди госпитализированных больных с ХОБЛ у 14% выявлялся сахарный диабет. Среди пациентов с СД 2-го типа и сопутствующей ХОБЛ наблюдаются более высокие концентрации СРБ, фибриногена, ИЛ-6 и TNF-α по сравнению с пациентами без обструктивных заболеваний легких, независимо от их пола и возраста.
Особенности течения ХОБЛ при СД 2-го типа:
-
более выражена ДН;
-
частые обострения ХОБЛ;
-
гиперреактивность бронхов;
-
преобладание смешанного фенотипа ХОБЛ;
-
увеличение частоты развития и более тяжелое течение коронарной болезни сердца, ХСН и АГ (рефрактерность к терапии);
-
гипоксемия, нарастание легочной гипертензии и легочного сосудистого сопротивления;
-
меньшая выраженность гиперинфляция легких.
Хроническая обструктивная болезнь легких и остеопороз
Основными причинами и механизмами развития остеопороза при ХОБЛ могут быть следующие: курение, низкая масса тела, дефицит витамина D, гипогонадизм, гипомобильность, глюкокортикоидная терапия.
Основные клинические проявления остеопороза:
-
болевой синдром;
-
переломы (позвоночник, проксимальная часть бедра);
-
снижение мышечной массы тела.
Диагностика остеопороза: двуэнергетическая рентгеновская абсорбциометрия.
Основные направления терапии больных остеопорозом в сочетании с ХОБЛ:
-
контроль ХОБЛ в фазе обострений и ремиссий (бронхолитики, муколитики, антибиотики, глюкокортикоиды, вакцины, реабилитация, кинезотерапия, образовательные программы и др.);
-
контроль сопутствующей патологии;
-
физическая активность;
-
борьба с алиментарной недостаточностью;
-
антиостеопоротические препараты.
Исследования по применению антиостеопоротических препаратов у больных с ХОБЛ касаются главным образом больных, получающих глюкокортикоиды, являющиеся доказанным фактором риска остеопороза.
Хроническая обструктивная болезнь легких и психические расстройства
Депрессия отмечается как наиболее часто встречаемое эмоциональное расстройство, связанное с ХОБЛ. Такие симптомы, как пессимизм, безнадежность и безысходность, указываются практически всеми исследователями психологических аспектов ХОБЛ.
Причины депрессии у больных с ХОБЛ:
-
социальные проблемы, вызванные заболеванием, — потеря интереса к различным видам деятельности, снижение возможности выполнять привычную для себя работу, адаптационные сложности в коллективе и в семье;
-
материальные проблемы, связанные с частой нетрудоспособностью;
-
физиологические факторы, в частности хроническая гипоксия головного мозга.
Дифференциально-диагностические критерии ХОБЛ и БА изложены в разделе «Клинические особенности ХОБЛ».
Список литературы
См.
Лечение хронической обструктивной болезни легких стабильного течения
Основные направления терапии при стабильном течении ХОБЛ включают:
-
Немедикаментозное лечение.
-
Медикаментозную терапию.
-
Другие методы лечения.
Немедикаментозное лечение
Задачи немедикаментозной терапии:
-
снижение влияния факторов риска развития и прогрессирования ХОБЛ (антиникотиновые программы, снижение и предупреждение влияния производственных вредностей, атмосферных и домашних поллютантов);
-
распространение среди населения профильных образовательных программ;
-
вакцинопрофилактика;
-
поддержание физической активности больного с ХОБЛ;
-
легочная реабилитация.
Медикаментозная терапия
Задачи медикаментозной терапии:
-
контроль симптомов заболевания;
-
улучшение функции легких;
-
сокращение частоты и тяжести обострений;
-
улучшение общего состояния и повышение толерантности к физической нагрузке;
-
предотвращение смертельного исхода от основного заболевания и сопутствующей патологии.
В сравнительном исследовании по оценке выживаемости больных с ХОБЛ между подгруппами 1–4 (по GOLD, 2007) и A–D (по GOLD, 2011) показано, что выживаемость при ХОБЛ хуже в группе B, чем в группе C, т.е. у больных с выраженными симптомами, несмотря на удовлетворительные показатели ОФВ1 (≥50% должной величины) по сравнению с пациентами с невыраженными симптомами, но с низкими показателями ОФВ1 (<50% должной величины) (рис. 8.35) [1]. Следовательно, основная задача, стоящая перед лечащим врачом, — влияние на симптомы заболевания и, следовательно, предотвращение обострений ХОБЛ и снижение риска смертельного исхода.
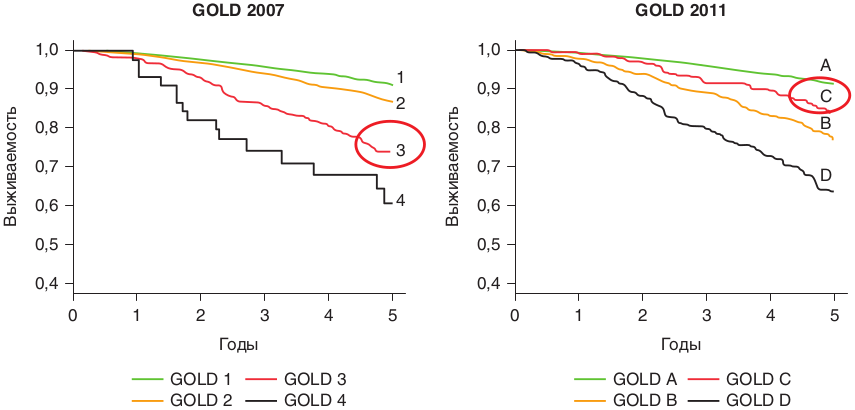
Рис. 8.35. Выживаемость больных в соответствии с подгруппами хронической обструктивной болезни легких 1–4 и A–D [1]
Ни одно из имеющихся средств для лечения ХОБЛ на данный момент не влияет на долгосрочное снижение легочной функции, что служит отличительной чертой этой болезни [2, 3]. В результате лечения возможно снижение темпов прогрессирования ХОБЛ. Выбор лекарственных средств для регулярной терапии и объем препаратов для больных с ХОБЛ зависят от выраженности симптомов, степени ограничения воздушного потока (оценка ФВД), риска обострений, сопутствующих заболеваний [2].
Перечень основных лекарственных препаратов, зарегистрированных в России и применяемых для базисной терапии больных с ХОБЛ, представлен в табл. 8.30 [2, 3].
|
Препараты, международное непатентованное наименование (торговое название) |
Разовые дозы |
Длительность действия, ч |
||
|
ингалятор, мкг |
раствор для небулайзера, мг/мл |
для приема внутрь, мг |
||
|
β2-Агонисты |
||||
|
Короткодействующие |
||||
|
Фенотерол (Беротек Н♠) |
100–200 (ДАИ1) |
1/1 |
– |
4–6 |
|
Сальбутамол (Вентолин♠, Саламол♠, Саламол Эко Легкое дыхание♠, Сальбутамол♠, Сальбувент♠⊗, Сальбутамол-натив♠) |
200 (ДАИ) |
2,5–5,0/2,5–5,0 |
4 |
4–6 |
|
Длительнодействующие |
||||
|
Формотерол (Оксис Турбухалер♠, Атимос♠, Формотерол Изихейлер♠, Форадил♠) |
4,5; 9 (ДПИ2); 12 (ДАИ, ПИ3) |
– |
– |
12 |
|
Индакатерол (Онбрез Бризхалер♠) |
150(ПИ) |
– |
– |
24 |
|
Олодатерол (Стриверди Респимат♠) |
5 (Респимат6) |
– |
– |
24 |
|
Антихолинергические препараты |
||||
|
Кoроткодействующие |
||||
|
Ипратропия бромид (Атровент Н♠) |
20–40 (ДАИ) |
0,5/2,0 |
– |
6–8 |
|
Длительнодействующие |
||||
|
Тиотропия бромид (Спирива Ханди Халер℘, Спирива Респимат♠) |
18 (ПИ); |
– |
– |
24 |
|
Гликопиррония бромид (Сибри Бризхалер♠) |
50 (ПИ) |
– |
– |
24 |
|
Аклидиния бромид (Бретарис Дженуэйр♠) |
322 (ПИ) |
– |
– |
12 |
|
Комбинация короткодействующих β2-агонистов с антихолинергическими препаратами |
||||
|
Ипратропия бромид + фенотерол (Беродуал Н♠, Ипратерол-натив♠) |
100+40; |
1,0+0,5/2,0 |
– |
6–8 |
|
Ипратропия бромид + сальбутамол (Ипрамол Стери-Неб♠) |
– |
2,5+0,5/2,5 |
– |
6–8 |
|
Комбинация ДДБА с антихолинергическими препаратами в одном ингаляторе |
||||
|
Вилантерол + умеклидиния бромид (Аноро Эллипта♠) |
25 + 62,5 (ДПИ) |
– |
– |
24 |
|
Гликопиррония бромид + индакатерол (Ультибро Бризхалер♠) |
110+50 (ПИ) |
– |
– |
24 |
|
Олодатерол + тиотропия бромид (Спиолто Респимат♠)* |
5+5 (Респимат®) |
24 |
||
|
Метилксантины |
||||
|
Теофиллин медленного высвобождения (Теопэк♠, Теотард♠, Ретафил♠⊗ и др.) |
– |
– |
100–600 таблетки |
Различная, до 24 |
|
Комбинация ДДБА + ГК в одном ингаляторе |
||||
|
Будесонид + формотерол (Симбикорт Турбухалер♠) |
4,5+160; |
– |
– |
12 |
|
Мометазон + формотерол (Зенхейл♠) |
10+200; |
– |
– |
12 |
|
Салметерол + флутиказон (Серетид♠, Тевакомб♠) |
50+250;50+500 |
– |
– |
12 |
|
Беклометазон + формотерол (Фостер♠) |
12+200 |
– |
– |
12 |
|
Вилантерол + флутиказона фуроат (Релвар Эллипта♠) |
25+100 |
24 |
||
|
Ингибиторы ФДЭ-4 |
||||
|
Рофлумиласт (Даксас♠) |
– |
– |
500 мкг |
24 |
Примечание:
1 ДАИ — дозированный аэрозольный ингалятор.
2 ДПИ — дозированный порошковый ингалятор.
3 ПИ — порошковый ингалятор.
4 ЭМД ДАИ — экстрамелкодисперсный ДАИ.
Общая характеристика лекарственных препаратов, применяемых для лечения больных с ХОБЛ стабильного течения в соответствии с уровнями доказательств и силой рекомендаций, представлена в табл. 8.31 [3].
| Класс препаратов | Наименование препаратов | Уровень доказательности | Степень рекомендаций |
|---|---|---|---|
|
Бронходилататоры |
Бронхолитические препараты являются основными средствами в лечении больных с ХОБЛ. |
1+ |
А |
|
Ингаляционная терапия предпочтительнее таблетированных форм. |
1+ |
А |
|
|
Бронходилататоры назначаются либо «по потребности», либо систематически. |
1++ |
А |
|
|
Преимущество отдается длительно действующим бронходилататорам (ДДБД). |
1+ |
А |
|
|
Тиотропия бромид — ДДАХ, обладая 24-часовым действием, уменьшает частоту обострений и госпитализаций, улучшает симптомы и качество жизни (группы В, С, D). |
1++ |
А |
|
|
Тиотропия бромид улучшает эффективность легочной реабилитации. |
2++ |
В |
|
|
Аклидиния бромид — ДДАХ 12-часового действия, оказывает выраженное действие на симптомы ХОБЛ, значительно повышает переносимость физической нагрузки, улучшает качество жизни, а также обладает профилем безопасности, сопоставимым с плацебо. |
2++ |
В |
|
|
Гликопиррония бромид — ДДАХ 24-часового действия, оказывает выраженное действие на симптомы ХОБЛ, повышает переносимость физической нагрузки. улучшает качество жизни и обладает профилем безопасности. |
2++ |
В |
|
|
Формотерол достоверно улучшает ОФВ1 и другие легочные объемы, качество жизни, снижает выраженность симптомов и частоту обострений, не влияя на смертность и падение легочной функции (группа В). |
2++ |
В |
|
|
Индакатерол — ультра-ДДБА позволяет значительно увеличить ОФВ1, уменьшить выраженность одышки, частоту обострений и повысить качество жизни (группа В) |
1+ |
А |
|
|
Комбинации бронходилататоров |
Комбинации ДДБД повышают эффективность лечения, снижают риск побочных эффектов и оказывают большее влияние на ОФВ1, чем каждый из препаратов в отдельности (больные группы В, С, D) |
2++ |
В |
|
ИГК |
Положительно влияют на симптоматику заболевания, функцию легких, качество жизни, уменьшают частоту обострений, не оказывая влияния на постепенное снижение ОФВ1, не снижают общую смертность. |
1+ |
А |
|
ИГК назначаются только в сочетании с ДДБА (больные группы C, D) или |
2++ |
B |
|
|
в составе трехкомпонентной терапии с ДДАХ или инг. ФДЭ-47 (больные группы D) |
2++ |
В |
|
|
Комбинации ИГК с ДДБД |
Комбинированная терапия ИГК и ДДБА может снижать смертность у больных с ХОБЛ (больные группы C, D). |
2++ |
В |
|
Комбинированная терапия ИГК и ДДБА повышает риск развития пневмонии, но не имеет других побочных явлений. |
1+ |
А |
|
|
Добавление к комбинации ДДБА с ИГК тиотропия бромида (ДДАХ) улучшает функцию легких, качество жизни и способно предотвратить повторные обострения у больных с высоким риском обострений (больные группы D) |
2++ |
В |
|
|
инг. ФДЭ-4 |
Рофлумиласт применяется в сочетании с ДДБД (группа С) или в составе трехкомпонентной терапии с ИГК и ДДБА (группа D). |
1+ |
A |
|
Рофлумиласт снижает частоту среднетяжелых и тяжелых обострений у пациентов с бронхитическим вариантом ХОБЛ тяжелого и крайне тяжелого течения и обострениями в анамнезе |
2++ |
В |
|
|
Метилксантины |
При ХОБЛ теофиллин оказывает умеренный бронхолитический эффект по сравнению с плацебо. |
1+ |
А |
|
Теофиллин в низких дозах уменьшает количество обострений у больных с ХОБЛ, но не увеличивает пост- бронходилатационную функцию легких |
2++ |
В |
|
|
Антиоксиданты |
Препараты, такие как ацетилцистеин (N-ацетилцистеин♠), способны проявлять антиоксидантные свойства и могут играть роль в лечении больных с повторяющимися обострениями ХОБЛ. |
2++ |
В |
|
У пациентов с ХОБЛ, не получающих ИГК, лечение карбоцистеином и ацетилцистеином (N-ацетилцистеином♠) может уменьшить число обострений |
2++ |
В |
Здесь и в последующих таблицах:
1 ХОБЛ — хроническая обструктивная болезнь легких.
2 ДДБД — длительно действующие бронходилататоры.
3 ДДАХ — длительно действующие антихолинергетики.
4 ДДБА — длительно действующие β2-агонисты.
5 ИГК — ингаляционные глюкокортикоиды.
6 ОФВ1 — объем форсированного выдоха в 1-ю секунду.
7 инг.ФДЭ-4 — ингибитор фосфодиэстеразы-4.
Характеристика лекарственных препаратов для регулярной терапии хронической обструктивной болезни легких
Бронхолитические препараты представляют основной и единственный класс лекарственных средств, рекомендуемый больным с ХОБЛ в качестве монотерапии или в комбинации с ИГК и/или инг.ФДЭ-4 независимо от принадлежности пациента к каким-либо группам больных с ХОБЛ стабильного течения (A-D) (табл. 8.32) [2, 3].
| Показания и режим дозирования | ДДБД1 | КДБД2 |
|---|---|---|
|
Больные ХОБЛ, группы, степень тяжести |
Любая степень тяжести (GOLD II, III, IV; группы В, С, D) |
ХОБЛ легкого течения (GOLD I; группа А) |
|
Режим дозирования |
Постоянная терапия |
Режим по требованию |
Примечание: 1 ДДБД — длительно действующие бронходилататоры; 2 КДБД — короткодействующие бронходилататоры.
Бронхолитические средства оказывают положительное влияние на симптомы, более выраженные в сравнении с минимальной динамикой или отсутствием изменений показателя ОФВ1, особенно у пациентов со среднетяжелым и тяжелым течением ХОБЛ. Расслабление гладких мышц, снижение динамической гиперинфляции, сопровождаемое уменьшением ОО и ОЕЛ, улучшение функции дыхательных мышц, усиление мукоцилиарного клиренса объясняют редукцию симптомов у больных с ХОБЛ. Основные механизмы ДДБД у больных с ХОБЛ отражены на рис. 8.36.
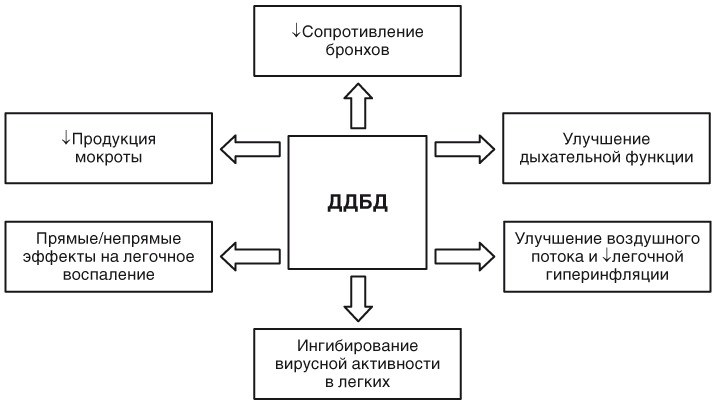
Рис. 8.36. Основные механизмы длительно действующих бронходилататоров [4]
Длительно действующие антихолинергические препараты. Среди ДДБД ведущая роль в лечении больных с ХОБЛ принадлежит ДДАХ. Наиболее важным эффектом ДДАХ у больных с ХОБЛ является блокирование действия ацетилхолина на уровне М3-рецепторов, расположенных на гладких мышцах дыхательных путей, что приводит к их расслаблению.
В терапии больных с ХОБЛ стабильного течения, согласно рекомендациям GOLD, 2015 [2] и Федеральным клиническим рекомендациям по диагностике и лечению ХОБЛ [3], ДДАХ рекомендуются в качестве препаратов 1-го ряда для монотерапии при любой тяжести ХОБЛ и входят в состав практически всех схем лекарственной комбинированной терапии (группы больных А–D по классификации GOLD, 2011).
Длительно действующие β2-агонисты. Принципом действия β2-агонистов является расслабление гладкой мускулатуры бронхов благодаря стимуляции β2-адренергических рецепторов, которые повышают уровень цАМФ и вызывают функциональный антагонизм к бронхоконстрикции. Не рекомендуется применять высокие дозы β2-агонистов короткого действия по потребности у пациентов, использующих ДДБД, так как подобная тактика не поддерживается результатами клинических исследований и может вызывать развитие побочных эффектов.
Показаниями к назначению ДДБА при стабильном течении ХОБЛ в качестве монотерапии являются только пациенты с нетяжелым течением и низким риском обострений (группы больных А, В).
Применение ДДБА для лечения больных ХОБЛ значительно расширяется в следующих случаях:
-
сочетания с ДДАХ и инг.ФДЭ-4 (группы больных В, C, D);
-
в фиксированной комбинации с ИГК (группы больных C, D);
-
в составе трехкомпонентной комбинации с ИГК и ДДАХ (больные группы D).
Комбинированная терапия длительно действующими бронходилататорами
Одновременное назначение ДДБА и ДДАХ повышает эффективность лечения, снижает риск побочных эффектов, оказывает большее влияние на ОФВ1, чем каждый из препаратов в отдельности, и расширяет возможности бронхолитической терапии у больных с ХОБЛ [5]. Доказано преимущество в виде более выраженного влияния на ОФВ1 при одновременном применении двух препаратов с различными механизмами действия и точками приложения, в частности: ДДАХ — тиотропия бромида и ДДБА — формотерола [5]. В соответствии с Федеральными клиническими рекомендациями по диагностике и лечению ХОБЛ комбинация ДДБД повышает эффективность лечения, снижает риск побочных эффектов и оказывает большее влияние на ОФВ1, чем каждый из препаратов в отдельности [3]. Применение ДДБД с различным механизмом действия существенно расширяет возможности лечения больных с ХОБЛ. Принципы выбора ДДБД при ХОБЛ изложены в табл. 8.33.
|
ДДБА |
ДДАХ |
|
|
|
|
|
+ |
|
Двойная терапия ДДАХ + ДДБА показана следующим категориям больных с ХОБЛ:
-
при впервые выявленном заболевании, с выраженными симптомами независимо от тяжести течения (с учетом показаний к назначению ИГК).
Ингаляционные глюкокортикоиды
Роль ИГК в лечении стабильной ХОБЛ ограничена специфическими показаниями, и их роль менее заметна, чем при БА. Назначение ИГК больным с ХОБЛ не приводит к такому значимому быстрому положительному клиническому эффекту, как при БА. При назначении ИГК необходимо учесть, что высокие и средние дозы ИГК у больных с ХОБЛ одинаково эффективны.
Принципиальным является положение о том, что ни один из ИГК не лицензирован для монотерапии ХОБЛ. Результаты большинства рандомизированных клинических исследований, посвященных фармакотерапии ХОБЛ и проведенных в течение последних 10 лет, свидетельствуют об уменьшении выраженности симптомов и числа обострений заболеваний, улучшении качества жизни больных с ХОБЛ при длительном применении фиксированной комбинации ИГК и ДДБА [6]. С высокой степенью доказательности установлено, что включение в схему лечения больным с тяжелым и крайне тяжелым течением и/или высоким риском обострений ХОБЛ ИГК позволяет уменьшить частоту обострений заболевания, увеличить время до развития первого обострения, повышает уровень качества жизни. Заслуживает внимания, что применение ИГК у больных со среднетяжелым и тяжелым течением (GOLD II–III) оказывает позитивное влияние на уровень ОФВ1 только в первые 6 мес, особенно у бывших курильщиков по сравнению с теми, кто продолжает курить, однако после 6 мес терапии ИГК не влияют на падение ОФВ1 [7].
Применение ИГК при тяжелом течении ХОБЛ и ДН, требующей ДКТ, приводит к снижению риска смерти от всех причин в течение 1 года на 54%. В то же время ИГК не оказывают значительного влияния на кардиоваскулярную смертность [8].
Комбинированная терапия ИГК и ДДБА может повышать риск развития пневмонии, но не имеет других побочных явлений [9–12].
Показания к назначению ИГК в сочетании с ДДБА при стабильном течении ХОБЛ зависят от ряда факторов. Так, в отличие от больных БА, когда ИГК являются основным лекарственным средством для базисной терапии, показания к применению ИГК определяются фенотипом ХОБЛ. Анализ литературных данных позволил выделить следующие показания к применению ИГК с ДДБА при ХОБЛ.
Ингаляционные ГК в качестве комбинированной терапии показаны больным с ХОБЛ тяжелого/ крайне тяжелого течения (ХОБЛ III–IV / группы С и D) с учетом следующих клинико-лабораторных и анамнестических показателей:
-
при 2 и более неинфекционных обострений в году, не требующих госпитализации, или при 1-й и более госпитализаций по поводу неинфекционного обострения;
-
больным с эозинофилией мокроты (более 3%) и/или крови (более 300 кл/мл) [13];
-
больным с ХОБЛ в сочетании с БА [2].
При назначении ИГК необходимо учитывать риск побочных эффектов, высокие суточные дозы ИГК не имеют преимуществ по сравнению со средними суточными дозами. Не следует назначать ИГК больным с ХОБЛ с ОФВ1 постдилатационным ≥50% должной величины или низким риском обострений (при I–II степени тяжести — группы А и В по GOLD, 2015).
Показания к отмене ИГК у пациентов с ХОБЛ:
-
ИГК могут быть отменены, если они были назначены не по показаниям;
-
нет общепринятых клинических рекомендаций по режиму отмены;
-
при отмене ИГК пациент должен находиться под активным наблюдением в течение года, регулярно принимая ДДБД (контроль легочной функции и клиническая оценка 1 раз в 3 мес).
Системные глюкокортикоиды
Постоянное применение системных ГК больным с ХОБЛ не показано, в первую очередь в связи с неблагоприятным отношением польза/риск, и количество исследований по оценке долговременного эффекта этого вида лечения невелико [14, 15].
Ингибитор фосфодиэстеразы-4
Основным действием ингибиторов ФДЭ-4 является подавление воспаления путем блокирования распада внутриклеточной цАМФ [16–18].
Инг.ФДЭ-4 используются только в качестве комбинированной терапии при лечении ХОБЛ. Добавление инг.ФДЭ-4 к регулярной терапии ДДБД применяется у больных с ХОБЛ с высоким риском обострений и редкими симптомами (группа больных С) и в составе трехкомпонентной лекарственной терапии с ИГК и ДДБА у больных с высоким риском обострений и частыми симптомами (группа больных D).
Схема начальной терапии ХОБЛ с учетом выраженности симптомов и риска обострений пред- ставлена в табл. 8.34 [1]*.
| Группа больного с ХОБЛ и характеристика | Рекомендуемый выбор препаратов 1-го ряда | Альтернативные препараты | Другие возможные группы препараты** |
|---|---|---|---|
|
Группа А |
1-я схема: |
1-я схема: |
|
|
Группа В |
1-я схема: |
1-я схема: |
|
|
Группа С |
1-я схема: |
1-я схема: |
|
|
Группа D |
1-я схема: |
1-я схема: |
|
* Выбор препаратов 1-го и 2-го столбца основывается на фенотипе ХОБЛ, право выбора принадлежит лечащему врачу.
** Данные препараты могут быть использованы самостоятельно или в комбинации с другими препаратами из первого или второго столбца.
В табл. 8.35 представлены схемы регулярной стартовой медикаментозной терапии в зависимости от фенотипа ХОБЛ, которая послужит ориентиром в выборе лекарственных средств в качестве регулярной терапии ХОБЛ.
| Фенотипы ХОБЛ и их характеристика | Лекарственные препараты, группы | |
|---|---|---|
|
I |
Фенотип ХОБЛ, нетяжелое течение (GOLD 1, 2 или GOLD А, В) с невыраженными симптомами |
ДДАХ; |
|
II |
Фенотип ХОБЛ, нетяжелое течение (GOLD 1, 2 или GOLD А, В) с выраженными симптомами |
ДДАХ и ДДБА; |
|
III |
Фенотип ХОБЛ, эмфизематозный, тяжелое/крайне тяжелое течение (GOLD 3, 4 или GOLD C, D) |
ДДАХ; |
|
IV |
Фенотип ХОБЛ, бронхитический, тяжелое/крайне тяжелое течение (GOLD 3, 4 или GOLD C, D) без эозинофилии мокроты (≤3%) и/или крови (≤300 кл/мл) |
ДДАХ; |
|
V |
Фенотип ХОБЛ, бронхитический, тяжелое/крайне тяжелое течение (GOLD 3, 4 или GOLD C, D) с эозинофилией мокроты (>3%) и/или крови (>300 кл/мл) |
ИГК + ДДБА; |
|
VI |
Фенотип ХОБЛ, бронхитический, тяжелое/крайне тяжелое течение (GOLD 3, 4 или GOLD C, D) с инфицированной бронхоэктазией и/или инфекционными обострениями |
ДДАХ и инг.ФДЭ-4; |
|
VII |
Фенотип сочетания БА и ХОБЛ (нетяжелое течение) |
ИГК и ДДАХ; |
|
VIII |
Фенотип сочетания БА и ХОБЛ (тяжелое/крайне тяжелое течение) |
ИГК + ДДБА и ДДАХ |
В помощь практическому врачу в табл. 8.36 представлены схемы регулярной фармакологической терапии при стабильном течении ХОБЛ.
| Группа больного с ХОБЛ | Препараты 1-го ряда* | Альтернативные препараты* | Другие возможные препараты** |
|---|---|---|---|
|
Группа А |
1-я схема |
1-я схема |
Теофиллин 300 мг 2 раза в сутки внутрь |
|
Группа В |
1-я схема |
1-я схема |
1-я схема |
|
Группа С |
1-я схема |
1-я схема |
1-я схема |
|
Группа D |
1-я схема |
1-я схема |
1-я схема |
* Каждая схема лечения имеет равнозначное значение; ** медикаменты из этой колонки могут применяться в качестве монотерапии либо в сочетании с препаратами 1-го ряда или альтернативными препаратами; # в настоящее время препараты в РФ не зарегистрированы.
Подавляющее большинство лекарственных средств, назначаемых больным с ХОБЛ независимо от тяжести течения и риска обострения болезни, — ингаляционные препараты. Считается доказанным, что ингаляционная терапия — наиболее предпочтительный метод лекарственной терапии для больных с ХОБЛ. Существенное значение для достижения эффекта имеют форма доставки и техника ингаляций у каждого индивидуума.
Ингаляционные устройства, применяемые больными с ХОБЛ в качестве способа доставки лекарственных средств, представлены ДАИ, ПИ, небулайзерами и инновационной формой доставки Респимат®.
Среди ДАИ наиболее эффективным является обеспечивающий создание экстрамелкодисперсных форм аэрозолей. Доля частиц оптимального диаметра в процентах отмеренной дозы, создаваемая экстрамелкодисперсным ДАИ, составляет 37–55%, а ингаляция обычным ДАИ — до 27% [19].
Ингаляторы, содержащие препарат в виде сухой пудры, — ПИ, активируются вдохом больного: Тубухалер®, Дискхалер®, Аэролайзер®, Мультидиск®, Хандихалер®, Изихейлер® и более современные Бризхалер®, Эллипта®, Дженуэйр®. Эффективность ПИ зависит от скорости инспираторного потока, при которой они используются. Чем меньше разница между минимальной и оптимальной пиковой скоростью вдоха, тем меньше вариабельность доставленной дозы. Минимальные скорости инспираторного воздушного потока для различных ПИ представлены в табл. 8.37 [20].
| Наименование ПИ (представлены в алфавитном порядке) | Минимальные скорости инспираторного воздушного потока, л/мин |
|---|---|
|
Аэролайзер |
Минимальная — более 60 |
|
Дженуэйр |
Минимальная — 30 |
|
Дискус |
Минимальная — 30 |
|
Изихейлер |
Минимальная — 28 |
|
Турбухалер |
Минимальная — 30 |
|
Хандихалер |
Минимальная — 30 |
Кроме того, эффективность ингаляционных препаратов, помимо скорости инспираторного потока, зависит от внутреннего сопротивления ингалятора. Современные ПИ имеют низкое внутреннее сопротивление, что позволяет при пользовании ими выполнить ингаляцию даже пациентам со значительно сниженной функцией легких.
Многие препараты доступны в виде растворов для небулайзера, и у пациентов со значительной гиперинфляцией и соответственно с очень низкой скоростью потока на вдохе небулайзерная терапия теоретически может иметь преимущества. Если отдается предпочтение небулайзеру, то больной должен быть обеспечен необходимыми инструкциями по его использованию. Небулайзерная терапия лекарственными средствами проводится больным с тяжелым и крайне тяжелым течением заболевания. В 2012 г. в России зарегистрировано ингаляционное устройство Респимат®, представляющее инновационную форму доставки лекарственных средств. Особенностью ингалятора Респимат является способность образовывать медленное скоростное облако аэрозоля, что обеспечивает высокую респирабельную фракцию тиотропиума в нижние дыхательные пути (до 55%) и минимальную ротоглоточную депозицию [21].
Другие методы лечения
Так называемые другие, но не менее важные, а в ряде случаев жизнеспасающие методы лечения включают:
-
длительную кислородотерапию;
-
вентиляционную поддержку;
-
хирургическое лечение.
ДКТ. Одним из наиболее тяжелых осложнений ХОБЛ является ХДН. Главным признаком ХДН служит развитие гипоксемии, т.е. снижение содержания кислорода в артериальной крови. Коррекция гипоксемии с помощью кислорода — наиболее патофизиологически обоснованный метод терапии тяжелой ДН. Использование кислорода у больных с хронической гипоксемией должно быть постоянным, длительным и, как правило, проводиться в домашних условиях, поэтому такая форма терапии называется «длительная кислородотерапия». ДКТ — единственный метод лечения, способный снизить летальность больных с ХОБЛ и предотвратить развитие ОДН, являющейся основной причиной смерти больных с ХОБЛ.
Показания к ДКТ при ХОБЛ представлены в табл. 8.38.
| Показания | PaO2, мм рт.ст. | SpO2, % | Показания |
|---|---|---|---|
|
Абсолютные |
≤55 |
≤88 |
Нет |
|
Относительные (при наличии особых условий) |
55–59 |
89 |
Легочное сердце, отеки, полицитемия (гематокрит >55%) |
|
Нет показаний (за исключением особых условий) |
≥60 |
≥90 |
Десатурация при нагрузке. |
Целью оксигенотерапии является повышение PaO2 не менее чем до 60 мм рт.ст. в покое и SpO2 выше 90%. У больных с ХОБЛ с ХДН рекомендуется поддержание PaO2 в пределах 60–65 мм рт.ст. и SpO2 в пределах 90–92%. ДКТ не показана больным с умеренной гипоксемией (PaO2 >60 мм рт.ст. и/или SpO2 выше 90%) [22].
Параметры газообмена, на которых основываются показания к ДКТ, должны оцениваться только во время стабильного состояния больных, т.е. через 3–4 нед после обострения ХОБЛ, так как именно такое время требуется для восстановления газообмена и кислородного транспорта после периода ОДН. При проведении ДКТ необходимо проведение пульсоксиметрии, а также двукратное исследование КОС в течение 3 нед [23].
Что касается режимов назначения кислородотерапии, то большинству больных с ХОБЛ достаточно потока O2 1–2 л/мин, хотя, конечно, у наиболее тяжелых больных поток может быть увеличен и до 4–5 л/мин. Оптимальным режимом считается ДКТ от 15 до 20 ч/сут. ДКТ увеличивает выживаемость больных с ХДН. Максимальные перерывы между сеансами O2-терапии не должны превышать 2 ч подряд.
Благоприятные эффекты ДКТ не были получены у больных, продолжающих курить и имеющих повышенный уровень карбоксигемоглобина. В ночное время, при физической нагрузке и при воздушных перелетах пациенты должны увеличивать поток кислорода в среднем на 1 л/мин по сравнению с оптимальным дневным потоком. Алгоритм ДКТ у больных с ХОБЛ представлен на рис. 8.37.
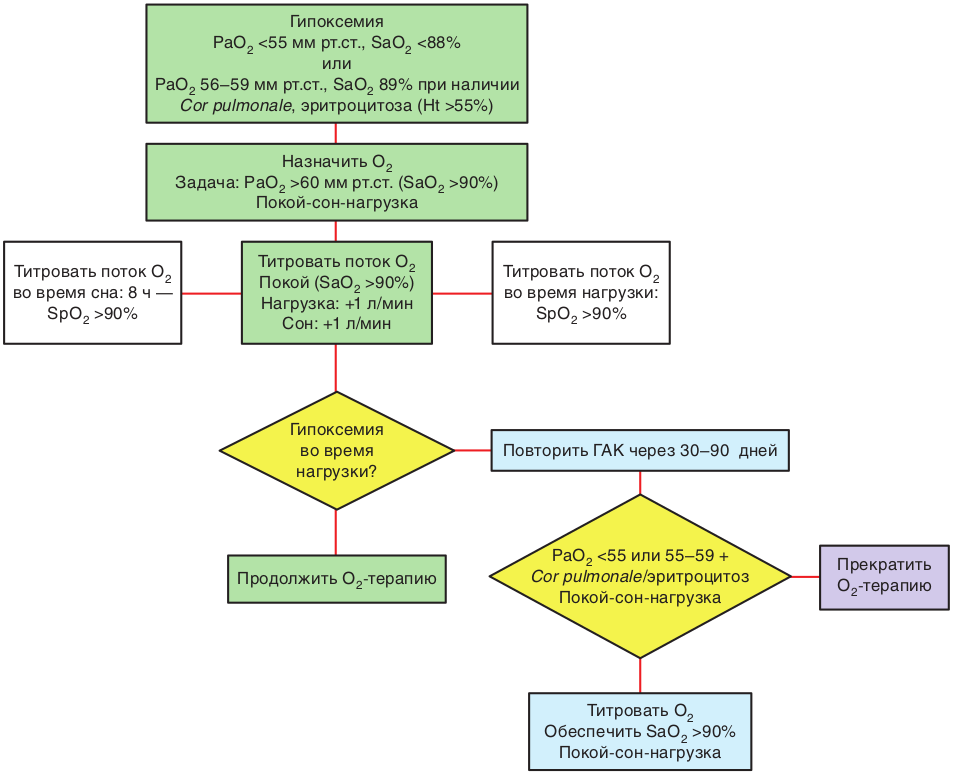
Рис. 8.37. Алгоритм длительной кислородотерапии
Длительная вентиляционная поддержка — метод долговременной респираторной поддержки больных со стабильным течением ХДН и не нуждающихся в интенсивной терапии.
Клиническими показаниями к длительной домашней вентиляции легких являются [24]:
-
инвалидизирующая одышка, слабость, утренние головные боли;
-
расстройства сна и изменения личности;
-
легочная гипертензия и легочное сердце, не поддающееся консервативной терапии.
Функциональные показания к длительной домашней вентиляции легких:
-
PaCO2 >55 мм рт.ст.,
или -
PaCO2 в пределах 50–54 мм рт.ст. в сочетании с ночной десатурацией (SpO2 <88% продолжительностью более 5 мин во время проведения кислородотерапии с потоком более 2 л/мин),
или -
PaCO2 50–54 мм рт.ст. в сочетании с частыми эпизодами госпитализации больного по поводу гиперкапнической ДН (более 2 эпизодов в течение 12 мес).
Параметры вентиляции подбираются в условиях стационара. Масочная НВЛ является основным методом длительной домашней вентиляции легких и обеспечивает снижение числа инфекционных и механических осложнений респираторной поддержки.
Применение масочной НВЛ у больных с ХОБЛ и тяжелой ДН снижает пребывание больных в стационаре, приводит к повышению толерантности к физическим нагрузкам, улучшает качество сна, субъективное улучшение самочувствия больных, снижение PaCO2. Длительная домашняя вентиляция легких считается более предпочтительной для лечения больных с ХОБЛ с гиперкапнической ДН.
Хирургическое лечение. Буллэктомия приводит к снижению одышки и улучшению легочной функции легких у больных с ХОБЛ. Оперативная коррекция легочного объема остается паллиативной хирургической процедурой с неподтвержденной эффективностью. Трансплантация легкого улучшает качество жизни и функциональные показатели у тщательно отобранных больных с очень тяжелым течением ХОБЛ. Критериями отбора к хирургическому лечению считаются ОФВ1 <25% должной величины, PaO2 <55 мм рт.ст., PaCO2 >50 мм рт.ст. при дыхании комнатным воздухом и легочная гипертензия (Рра >40 мм рт.ст).
Прогноз ХОБЛ во многом зависит от отношения пациента к своей болезни. Для облегчения состояния многие больные вынуждены до конца жизни пользоваться кислородным концентратором и принимать лекарственные средства в постепенно возрастающих дозах, а также использовать дополнительные средства в период обострений.
Терапия обострения хронической обструктивной болезни легких
Терапия обострения ХОБЛ во многом определяется его тяжестью. Обычно тяжесть обострения соответствует выраженности клинических проявлений заболевания. Так, у пациентов с легким или среднетяжелым течением ХОБЛ (GOLD I–II стадии) обострение, как правило, характеризуется усилением одышки, кашля и увеличением объема мокроты, что позволяет вести больных в амбулаторных условиях. Напротив, у пациентов с тяжелым течением ХОБЛ (GOLD III–IV стадии) обострение сопровождается прогрессированием ХДН, вплоть до развития ОДН.
Факторами риска развития обострений являются возраст пациента старше 65 лет, сопутствующие ССЗ, а также частота и тяжесть обострений в предшествующий год.
Наиболее частыми причинами обострения оказываются респираторные инфекции верхних и нижних дыхательных путей (вирусные или бактериальные). В возникновении обострений ХОБЛ играет роль и воздействие неинфекционных факторов. В первую очередь — вредные факторы окружающей среды (NO2, SO2, озон), ДКТ, неэффективная легочная реанимация, ТЭЛА, развитие пневмоторакса, а также дисфункция ЛЖ (СН). Примерно в 1/3 случаев причина тяжелых обострений ХОБЛ может быть не установлена. Повышение числа обострений ХОБЛ в холодное время года часто связано с повышением распространенности респираторных вирусных инфекций в зимние месяцы и чувствительности к ним эпителия верхних дыхательных путей.
Исходя из положения, что все обострения с клинической точки зрения следует рассматривать как фактор прогрессирования ХОБЛ, основной целью лечения ХОБЛ является предупреждение обострений заболевания. Лечебные мероприятия, которые могут уменьшить количество обострений и госпитализаций:
-
отказ от курения;
-
вакцинация против гриппа и пневмококковой инфекции;
-
осведомленность пациента о проводимой терапии, в том числе о технике выполнения ингаляций;
-
терапия адекватная тяжести течения ХОБЛ с учетом риска последующих обострений.
Цель лечения обострений ХОБЛ — минимизация воздействия текущего обострения и предотвращение развития обострений в будущем.
Медикаментозное и немедикаментозное лечение обострений ХОБЛ
Принципы медикаментозной терапии обострения ХОБЛ
-
КДБД:
-
увеличение дозы и/или частоты приема применяемого бронходилататора (КДБА, фиксированная комбинация КДБА и КДАХ);
-
при монотерапии КДБА добавляются КДАХ до улучшения симптомов;
-
предпочтение отдается комбинированным КДБД.
-
-
ГК:
-
30–40 мг/сут преднизолона внутрь или другого системного ГК в дозе, эквивалентной преднизолону, или небулизированный будесонид 2–4 мг/сут в течение 5 дней.
-
-
Антибиотики (при I и II типе обострения по N. Anthonisen) в течение
5–7 сут: β-лактамы, макролиды, β-лактам/ингибитор β-лактамаз, респираторные фторхинолоны.
Перечень групп лекарственных препаратов и немедикаментозных средств, применяемых у больных с различной тяжестью обострения ХОБЛ, в соответствии с уровнями доказательности представлены в табл. 8.39.
| Степень рекомендаций | Уровень доказательности | Лекарственные препараты и немедикаментозные средства |
|---|---|---|
|
А В В |
1+++ 2++ 2++ |
Бронходилататоры [2, 5]:
|
|
В С В |
2++ 2+ 2++ |
ГК:
|
|
В |
2++ |
Антибиотики (показания и схемы применения представлены в табл. 8.40 и на рис. 8.38) [29–31] |
|
С |
2+ |
Мукоактивные препараты [ацетилцистеин (N-ацетилцистеин♠), карбоцистеин, эрдостеин и другие препараты] [32] |
|
В |
2++ |
Кислородотерапия [33] |
|
А |
1++ |
НВЛ [34, 35] |
|
В |
2++ |
ИВЛ [3] |
КДБД относятся к лекарственным средствам, которые применяются независимо от характеристики обострения, имеющие наивысшую степень доказательности их эффективности. Перечень КДБД и их характеристика представлена в табл. 8.40.
|
Препарат, международное непатентованное наименование |
Разовая лечебная доза, мг |
Пик действия, мин |
Продолжительность действия, ч |
|
|
дозированный ингалятор |
небулайзер |
|||
|
Сальбутамол |
0,1–0,2 |
2,5–5,0 |
30–60 |
4–6 |
|
Фенотерол |
0,1–0,2 |
0,5–1,0 |
30 |
4–6 |
|
Ипратропия бромид |
0,02–0,08 |
0,50 |
45 |
6–8 |
|
Ипратропия бромид + фенотерол |
0,2/0,50–0,4/1,0 |
1,0/0,5 |
30 |
6 |
|
Ипратропия бромид + сальбутамол |
– |
2,5/ 0,5 |
30 |
6 |
Интенсификация бронходилатирующей терапии не всегда дает ощутимый лечебный эффект и улучшает бронхиальную проходимость при обострении ХОБЛ. Синдром фиксированной бронхиальной обструкции и гиперинфляция, характерные для больных с ХОБЛ, являются причиной менее выраженной эффективности бронхолитической терапии при обострении ХОБЛ по сравнению с эффективностью бронходилататоров у больных БА [37]. Во всех случаях обострения ХОБЛ, независимо от тяжести обострения и причин, его вызвавших, назначаются, если не применялись ранее, ингаляционные бронхолитические лекарственные средства или увеличивается их доза и/или кратность приема [3].
В отличие от КДБД, которые применяются всегда при обострении ХОБЛ, антибиотики и ГК назначаются в соответствии с конкретными показаниями [2, 3].
ИГК, в отличие от системных ГК, оказывают более быстрый клинический эффект за счет «прямого» действия на слизистую оболочку бронхов, а именно:
-
сосудосуживающий эффект и снижение бронхиального кровотока;
-
уменьшение экссудации плазмы и продукции мокроты в дыхательных путях.
У некоторых пациентов с ХОБЛ частота обострений очень высока, и эти пациенты нуждаются в высоких и повторных дозах глюкокортикоидов [38]. Установлено, что короткие, но частые курсы терапии системных ГК приводят к развитию тяжелых нежелательных реакций. В отличие от системных ГК, небулизированные ГК проявляют высокую эффективность за счет выраженного местного действия в сочетании с минимальными системными эффектами.
Одной из наиболее частых причин обострений ХОБЛ является бактериальная инфекция. Продолжительность АБТ больных, переносящих обострение ХОБЛ, составляет, как правило, 5–7 дней.
Определенным ориентиром в выборе антибиотиков является тяжесть бронхиальной обструкции, что в значительной мере связано с характером микробной колонизации. Так, при ОФВ1 ≥50% чаще причиной обострения являются: H. influenzae, M. сatarrhalis и S. рneumoniae с возможной резистентностью к β-лактамам. При ОФВ1 <50% к указанным выше микроорганизмам присоединяется грамотрицательная флора (Klebsiella pneumoniae и др.), часто развивается резистентность к β-лактамам. При постоянной продукции гнойной мокроты возрастает вероятность, помимо вышеуказанных агентов, участия в воспалении Enterobacteriaceae и P. аerogenosa.
Показания к АБТ при обострении ХОБЛ в зависимости от типа обострения по N. Anthonisen (табл. 8.41) [34].
| Показание | Степень рекомендаций | Уровень доказательности |
|---|---|---|
|
Обострение 1-го типа: гнойная мокрота, увеличение объема мокроты, нарастание одышки |
В |
2++ |
|
Обострение 2-го типа: гнойная мокрота в сочетании с одним из основных признаков — увеличение объема мокроты или нарастание одышки |
В |
2++ |
|
Тяжелое обострение с потребностью ИВЛ или НВЛ |
D |
3 |
|
Уровень С-реактивного белка ≥10–15 мг/л [20] |
С |
2+ |
|
Антибактериальная терапия (АБТ), как правило, не рекомендуются при обострении 2-го типа при отсутствии гнойной мокроты |
А |
2++ |
Большое влияние на эффективность АБТ оказывает резистентность микроорганизмов к назначаемым антибиотикам. Выделяют так называемые модифицирующие факторы, т.е. факторы риска формирования резистентности микроорганизмов:
-
для пневмококков — возраст старше 65 лет, терапия β-лактамами в течение последних 3 мес, алкоголизм, иммуносупрессия (включая терапию системными ГК), наличие сердечно-сосудистых или нескольких других сопутствующих заболеваний, частые обострения (≥2 в год);
-
для грамотрицательных энтеробактерий — проживание в доме престарелых, сопутствующие сердечно-сосудистые и легочные заболевания, наличие нескольких сопутствующих заболеваний, недавняя антибактериальная терапия;
-
для P. aeruginosa — структурные заболевания легких (бронхоэктазия), терапия ГК (более 10 мг преднизолона в течение последних 2 нед), частые курсы антибиотиков (4 и более в течение последнего года), выделение P. aeruginosa в предыдущие обострения, колонизация P. aeruginosa.
Схемы антибиотикотерапии у больных с инфекционным обострением ХОБЛ представлены в табл. 8.42.
| Вид обострений | Показатель ОФВ1, % должного значения | Наиболее частые патогенные микроорганизмы | Наименование антибиотиков (МНН) |
|---|---|---|---|
|
ХОБЛ легкого, среднетяжелого течения, без факторов риска обострений |
>50 |
H. influenzae, |
Амоксициллин, |
|
ХОБЛ легкого, среднетяжелого течения, с факторами риска обострения |
>50 |
H. influenzae, PRSP |
Амоксициллин + клавулановая кислота; левофлоксацин, моксифлоксацин |
|
ХОБЛ тяжелого течения |
30–50 |
H. nfluenzae, |
|
|
ХОБЛ крайне тяжелого течения |
<30 |
H. influenzae, |
Ципрофлоксацин и другие антибиотики с антисинегнойной активностью |
PRSP — пенициллин-резистентные Streptococcus pneumoniae.
* Предикторы инфекции P. aeruginosa:
-
частые курсы антибиотиков (>4 за последний год);
-
ОФВ1 <30%;
-
выделение P. aeruginosa в предыдущие обострения, колонизация P. aeruginosa;
-
частые курсы системных ГК (>10 мг преднизолона в последние 2 нед);
-
наличие БЭ.
Представляем алгоритм лечебно-диагностических мероприятий, в зависимости от тяжести обострения ХОБЛ (рис. 8.38).
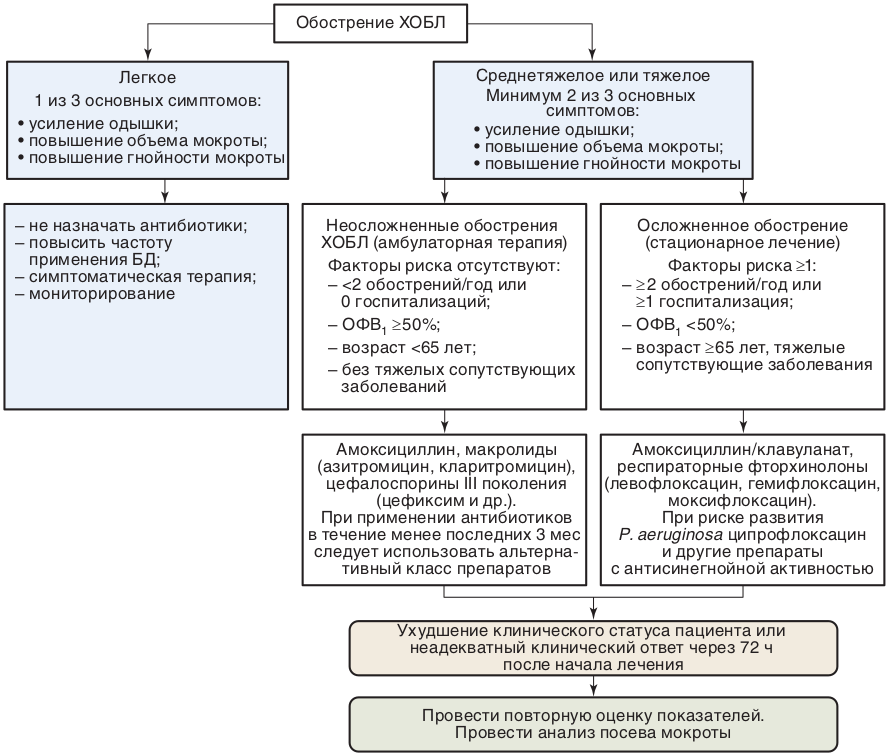
Рис. 8.38. Алгоритм лечебно-диагностических мероприятий в зависимости от тяжести обострения хронической обструктивной болезни легких
Кислородотерапия
Целью кислородотерапии является достижение PaO2 в пределах 60–65 мм рт.ст. и/или SpO2 >90– 93% (в норме PaO2 80–100 мм рт.ст., SpO2 ≥95%) [39]. При ОДН у больных с ХОБЛ для доставки O2 используются носовые канюли или маска Вентури. При назначении O2 через канюли большинству больных достаточно потока O2 1–2 л/мин, причем в ночные часы поток кислорода увеличивается на 1 л/мин. После назначения кислородотерапии в течение ближайших 30–60 мин рекомендовано проведение газового анализа артериальной крови для контроля показателей PaCO2 и рН или, по крайней мере, определение SpO2.
Показания проведения респираторной поддержки (НВЛ и ИВЛ) по поводу ОДН при обострении ХОБЛ осуществляются врачом-реаниматологом в отделении реанимации и интенсивной терапии или специализированной палате интенсивного наблюдения, желательно совместно с пульмонологом.
Неинвазивная вентиляция легких
Показания и противопоказания для проведения НВЛ представлены в табл. 8.43 [40, 41].
| Показатели | Характеристика |
|---|---|
|
Симптомы и признаки ОДН |
|
|
Признаки нарушения газообмена |
|
|
Критерии исключения для НВЛ при ОДН |
|
НВЛ является единственно доказанным методом терапии, способным снизить летальность у больных с ХОБЛ с ОДН.
Инвазивная респираторная поддержка
ИВЛ показана пациентам ХОБЛ с ОДН, у которых медикаментозная или другая консервативная терапия, в том числе НВЛ, не приводит к дальнейшему улучшению состояния. Показания к проведению вентиляции должны учитывать не только отсутствие эффекта от консервативных методов терапии, степень тяжести функциональных показателей, но и быстроту их развития и потенциальную обратимость процесса, вызвавшего ОДН (табл. 8.44) [42].
| Показатели | Характеристика |
|---|---|
|
Абсолютные показания |
|
|
Относительные показания |
|
Как правило, при назначении респираторной поддержки проводится комплексная клиническая и функциональная оценка статуса больного. Отлучение от ИВЛ должно начинаться как можно раньше у больных с ХОБЛ, так как каждый дополнительный день инвазивной респираторной поддержки значительно повышает риск развития осложнений ИВЛ, особенно таких как вентилятор-ассоциированная пневмония.
В помощь практическому врачу ниже приводим схемы лечения и показания к госпитализации больных с обострением ХОБЛ.
Лечение больных с обострением ХОБЛ в амбулаторных условиях
-
Образование больных. Проверить технику применения ингаляторов.
-
Применение КДБА и/или КДАХ или их комбинации с помощью спейсера 2–4 дозы либо небулайзера 2 мл «по требованию» 3–4 раза в сутки в течение 5–7 дней.
-
Глюкокортикоиды:
-
преднизолон 30–40 мг/сут внутрь или небулизированный будесонид 2–4 мг/сут в течение 5 дней.
-
-
Антибиотики в соответствии с критериями обострения ХОБЛ по N. Anthonisen для больных с легким или среднетяжелым неосложненным обострением и ОФВ1 ≥50% назначаются внутрь (один из ниже перечисленных):
-
амоксициллин 500 мг 3 раза в сутки — до 7 дней;
-
азитромицин 500 мг 1 раз в сутки 3 дня, кларитромицин 500 мг 2 раза в сутки или кларитромицин СР 1000 мг 1 раз в сутки — 7–10 дней;
-
цефиксим 400 мг 1 раз в сутки — до 7 дней.
-
При отсутствии эффекта от первоначально назначенной АБТ (гнойная мокрота, одышка, фебрильная температура тела) в течение 3 сут:
-
амоксициллин/клавулановая кислота 1000 мг 2 раза в сутки — 7 дней
или -
левофлоксацин 500 мг 1 раз в день — 7 дней;
-
моксифлоксацин 400 мг 1 раз в день — 5 дней.
Показания для госпитализации больных с обострением ХОБЛ:
-
с высоким риском и тяжелыми сопутствующими заболеваниями (пневмония, аритмия, СН, СД, почечная и/или печеночная недостаточность);
-
резистентность к ранее проводимой амбулаторной терапии:
-
усиление одышки;
-
нарушение сна из-за усиления симптомов;
-
гипоксемия (SpO2 <90%);
-
гиперкапния (PaCO2 >45 мм рт.ст.);
-
нарушение сознания;
-
невозможность пациентом обслуживать себя;
-
неуточненный диагноз.
Лечение госпитализированных больных с обострением ХОБЛ
-
Применение КДБА и/или КДАХ либо их комбинации с помощью спейсера 2–4 дозы либо небулайзера 2 мл «по требованию» 3–4 раза в сутки в течение 7–10 дней.
-
Малопоточная кислородотерапия 1–2 л/мин, если SpO2 <90%, и/или PaO2 <60 мм рт.ст., и/или PaCO2 >45 мм рт.ст.
-
Глюкокортикоиды:
-
преднизолон 30–40 мг/сут внутрь или небулизированный будесонид 2–4 мг/сут в течение 5 дней;
-
при невозможности приема ГК внутрь назначается эквивалентная доза ГК внутривенно.
-
-
Антибиотики в соответствии с рекомендациями по N. Anthonisen для больных с осложненным обострением ХОБЛ и ОФВ1 <50%, назначаемые по принципу ступенчатой терапии, один из перечисленных ниже:
-
амоксициллин/клавуланат 1,2 г 3 раза в сутки внутривенно и 1000 мг 2 раза в сутки внутрь;
-
левофлоксацин 500 мг 1 раз в сутки или моксифлоксацин 400 мг 1 раз в сутки.
-
При подозрении на Pseudomonas spp. и/или другие Enterobactereaces spp. рассматривается вопрос о назначении комбинированной АБТ с активностью против Pseudomonas spp.:
-
ципрофлоксацин 400 мг 2 раза в сутки внутривенно и 500–750 мг 2 раза в сутки внутрь
или -
цефтазидим 2,0 г 3 раза в сутки внутривенно и другие антибиотики с активностью против Pseudomonas spp.
Показания для лечения больных в отделении реанимации и интенсивной терапии:
-
угроза развития ОДН или ее наличие;
-
полиорганная дисфункция (шок, почечная, печеночная недостаточность, нарушение сознания);
-
гемодинамические нарушения;
-
прогрессирующее снижение PaO2 <55 мм рт.ст., SpO2 <88% и/или повышение PaCO2 >45 мм рт. ст., несмотря на оксигенотерапию.
Критерии возможной выписки из стационара при обострении ХОБЛ:
-
потребность в КДБА не более чем через 4–6 ч;
-
стабильное состояние больного в течение последних 24 ч;
-
стабильные показатели газов крови или SpO2 в последние 24 ч;
-
пациент способен передвигаться в пределах палаты, самостоятельно принимать пищу и спать без частых приступов одышки;
-
пациент и члены семьи полностью понимают необходимые режимы терапии;
-
наличие кислородного концентратора;
-
при выписке больного из отделения реанимации и интенсивной терапии домой больному обеспечены необходимые условия домашнего наблюдения и ухода.
Список литературы
См.
Респираторная медицина, Руководство, Том 1, Чучалина А.Г., 2017.
В первом томе руководства изложена информация об анатомии, морфологии, генетике и физиологии дыхательной системы, также подробно отражены пропедевтические данные по симптомам и синдромам респираторных болезней. Отдельная глава посвящена диагностическим методам в пульмонологии. В руководстве обсуждаются все основные клинические проблемы, рассмотрена клиническая картина самых разнообразных форм легочной патологии, включая и редкие заболевания, представлены диагностика и современные методы лечения.
Издание рассчитано на широкий круг врачей: терапевтов, пульмонологов, фтизиатров, аллергологов, онкологов и других специалистов разной степени квалификации и подготовки.
Изучение руководства позволит врачам достичь высокого уровня компетенции и будет способствовать решению сложнейших вопросов клинической практики.
Анатомия и гистология легких.
Анатомия, топографическая анатомия легких и структура их отдельных элементов изучены достаточно подробно и представлены в учебниках, руководствах и атласах по анатомии человека. В данном разделе будут рассмотрены анатомия и гистология воздухопроводящих путей (трахея, бронхи, альвеолярные ходы), респираторной части легких (альвеолярные ходы, мешочки, альвеолы, аэрогематический барьер), сосудов легких, нервной и лимфатической системы легких, плевры и диафрагмы.
Воздухоносные пути — это струклуры между окружающей средой и терминальной респираторной единицей. Терминальная респираторная единица является структурно-функциональным образованием, которое включает в себя 100 альвеолярных ходов и около 2000 альвеол, расположенных дистальнее респираторных бронхиол первого порядка. В легких насчитывается всего 150 000 терминальных респираторных единиц. Эту структурно-функциональную единицу клинические физиологи, анатомы и патологоанатомы традиционно выделяют как основную структурную единицу — ацинус |1|.
Оглавление.
Предисловие.
Участники издания.
Список сокращений и условных обозначений.
ЧАСТЬ 1. ОБЩИЕ ПРИНЦИПЫ РЕСПИРАТОРНОЙ МЕДИЦИНЫ
Раздел 1. Анатомия и онтогенез респираторной системы.
1.1. Анатомия и гистология легких. АЛ. Черняев.
1.2. Развитие легких. М.В. Самсонова, Е.Л. Туманова, Д.А. Жакота, Т.Э. Ворожбиева.
1.3. Генетика заболеваний легких. Г.Ю. Бабаджанова, Н.А. Дидковский.
Раздел 2. Респираторная физиология.
2.1. Респираторная функция легких: вентиляция, газообмен и кровообращение. З.Р. Айсанов, ЕЛ. Калманова, А.В. Черняк, С.Ю. Чикина, Ж.К. Науменко.
2.2. Механика дыхания. А.В. Черняк, СИ. Авдеев, З.Р. Айсанов.
2.3. Кровообращение и регуляция водного баланса в легких. Г.В. Неклюдова, Ж.К. Науменко, З.Р. Айсанов.
2.4. Кислотно-основное состояние крови. Ж.К. Науменко, Г.В. Неклюдова, З.Р. Айсанов.
Раздел 3. Механизмы защиты и регуляции иммунного ответа.
3.1. Альвеолярный эпителий и легочный сурфактант. Л.Н. Лепеха, М.В. Ерохина.
3.2. Транспорт жидкости на поверхности альвеол. В.А. Штабницкий.
3.3. Эпителий дыхательных путей и образование секрета. Т.Н. Молостова.
3.4. Иммунологические аспекты респираторной медицины. К.А. Зыков.
3.5. Макрофаги и дендритные клетки легких. Л.Н. Лепеха
Раздел 4. Респираторная патология и воспаление.
4.1. Патология: рак легкого на фоне идиопатического легочного фиброза. Е.А. Коган, С.А. Демура.
4.2. Общая и частная патология легких. А.Л. Черняев, М.В. Самсонова.
4.3. Роль дисфункции эндотелия в развитии хронической обструктивной патологии легких. О.Н. Титова, Н.А. Кузубова, Е.С. Лебедева.
ЧАСТЬ 2. ДИАГНОСТИКА РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ.
Раздел 5. Методы обследования.
5.1. История заболевания и физикальное обследование. Е.В. Бобков.
5.2. Микробиологическая диагностика при легочных заболеваниях. М.Ю. Чернуха, И.А. Шагинян.
5.3. Методы визуализации. И.Е. Тюрин.
5.4. Диагностическая бронхоскопия. Н.В. Черниченко.
5.5. Торакоскопия. Е.А. Тарабрин.
5.6. Ультразвуковые методы в пульмонологии. Е.В. Неклюдова, Ж.К. Науменко.
Раздел 6. Функциональные исследования.
6.1. Функциональные тесты в пульмонологии. З.Р. Айсанов, А.В. Черняк, Е.Н. Калманова, С.Ю. Чикина, Г.В. Неклюдова, Ж.К. Науменко.
6.2. Нагрузочное тестирование в клинической практике. А.В. Черняк, З.Р. Аманов, СЮ. Чикина, Е.Н. Калманова.
6.3. Предоперационная оценка. А.В. Черняк.
6.4. Оценка утраты трудоспособности при болезнях органов дыхания. О. Н. Титова, В.А. Волчков, Н.А. Кузубова, Е.Ю. Харитоненко.
ЧАСТЬ 3. КЛИНИЧЕСКИЕ АСПЕКТЫ РЕСПИРАТОРНОЙ МЕДИЦИНЫ.
Раздел 7. Основные синдромы в практике пульмонолога.
7.1. Одышка. С.Ю. Чикина, Н.В. Трушенко.
7.2. Кашель. В.Н. Абросимов.
7.3. Воль в грудной клетке. М.А. Куценко.
Раздел 8. Заболевания респираторного тракта.
8.1. Генетика бронхиальной астмы. Ж.А. Миронова, В.И. Трофимов, Е.Ю. Бабаджанова.
8.2. Бронхиальная астма: патогенез и фенотипы. Н.М. Ненашева, Н.Г. Астафьева.
8.3. Бронхиальная астма: клиническая диагностика и лечение. Н.П. Княжеская, А.С. Велевский.
8.4. Обострение бронхиальной астмы. С. Н. Авдеев.
8.5. Хроническая обструктивная болезнь легких. Н.В. Лещенко, С. И. Овчаренко.
8.6. Табакокурение — фактор риска бронхолегочных заболеваний. Н.С. Антонов, Г.М. Сахарова.
8.7. Муковисцидоз. Е.Л. Амелина, С. А. Красовский, М.В. Самсонова.
8.8. Бронхоэктазы. А.Е.Чучалин.
8.9. Заболевания верхних дыхательных путей и трахеи. В.М. Свистушкин, Д.М. Мустафаев.
8.10. Бронхиолиты. Н.П. Княжеская, А.С. Велевский.
Предметный указатель.
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу Респираторная медицина, Руководство, Том 1, Чучалина А.Г., 2017 — fileskachat.com, быстрое и бесплатное скачивание.
Скачать pdf
Ниже можно купить эту книгу по лучшей цене со скидкой с доставкой по всей России.Купить эту книгу
Скачать
— pdf — Яндекс.Диск.
Дата публикации: 23.09.2020 08:04 UTC
Теги:
учебник по медицине :: медицина :: Чучалина
Следующие учебники и книги:
- Руководство по лечению внутренних болезней, Том 1, Лечение болезней органов дыхания, Окороков А.Н., 2008
- Внутренние болезни, Система органов дыхания, Ройтберг Г.Е., Струтынский А.В., 2005
- Клиническое руководство по ультразвуковой диагностике, Том 5, Митьков В.В., 1996
- Клиническое руководство по ультразвуковой диагностике, Том 4, Митьков В.В., 1996
Предыдущие статьи:
- Ревматические заболевания, Том 1, Основы ревматологии, Клиппел Д.X., Стоун Д.Х., Кроффорд Л.Д., 2011
- Расшифровка клинических лабораторных анализов, Хиггинс К., 2016
- Процедуры и техники в неотложной медицине, Ирвин Р.С., Риппе Дж.М., Лисбон А., Херд С.О., 2015
- Пропедевтика внутренних болезней, Кардиология, Ивашкин В.Т., Драпкина О.М.
оровье«Здоровье»
АССОЦИАЦИЯ МЕДИЦИНСКИХ ОБЩЕСТВ ПО КАЧЕСТВУПУЛЬМОНОЛОГИЯНЛиИОНАЛЬНОЕ РУКОВОАСТВОГпавный редактор академик РАМН А.Г. ЧучалинПодготовлено под эгидой Российского респираторного общества и Ассоциации медицинских обществ по качествуМоскваИЗДАТЕЛЬСКАЯ ГРУППА«ГЭОТАР-Медиа»2009
УДК 616.12 (035) ББК 54.101 П34Национальное руководство по пульмонологии разработано и рекомендовано Российским респираторньш обществом и Ассоциацией медицинских обществ по кагеству.П34 Пульмонология: национальное руководство / под ред. А.Г. Чучалина, — М.: ГЭОТАР-Медиа, 2009. — 960 с. — (Серия «Национальные руководства»),15ВМ 978-5-9704-1076-9В книге обсуждаются общие и частные вопросы пульмонологии, даются рекомендации по диагностике, лечению и профилактике заболеваний органов дыхания.В подготовке настоящего издания в качестве авторов-составителей и рецен¬ зентов участвовали ведущие сотрудники НИИ пульмонологии ФМБА РФ, ЦНИИ туберкулёза РАМН, Института иммунологии ФМБА РФ, Санкт-Петербургского государственного университета, Рязанского государственного медицинского университета им, акад. И.П. Павлова и других медицинских учреждений Росши.Руководство включает всю основную информацию, необходимую врачу для непрерывного последипломного образования.Предназначено терапевтам, пульмонологам, студентам старших курсов меди¬ цинских вузов, интернам, ординаторам, аспирантам.УДК 616.12 (035) ББК 54.101Авторы, редакторы и издатели руководства предприняли максимум усилий, чтобы обеспечить точность представленной информации, в том числе дозировок лекарственных средств. Осознавая высокую ответственность, связанную с под¬ готовкой руководства, и учитывая постоянные изменения, происходящие в меди¬ цинской науке, мы рекомендуем уточнять дозы лекарственных средств по соот¬ ветствующим инструкциям. Пациенты не могут использовать эту информацию для диагностики и самолечения.Права на данное издание принадлежат издательской группе «ТЭОТАР-Медиа*. Воспроизведение и распространение в каком бы то ни было виде гасти или целого издания не могут быть осуществлены без письменного разрешения издательской группы.© Коллектив авторов, 2008 ISBN 978-5-9704-1076-9 © Издательская группа «ГЭОТАР-Медиа», 2009
ОГЛАВЛЕНИЕЦроякяовве 6Умкишсн издания 71Мггвр|ояогия создания и программа обеспечения качества 12Гиииг сокращений 15МДДЕЛI. МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХ . .18Шжяшл 1. Анамнез и физикальное обследование. А.Г. Чугалин 19Гвава 2. Микробиологическая диагностика. М.Н. Зубков 27Гжава 3. Радиологические методы. И.Е. Тюрин 38Гхава 4. Диагностическая и лечебная бронхоскопия. Н.Е. Чернеховская 92Гжава 5. Торакоскопия и другие инвазивные вмешательства.те Яблонский, B.L Пищик 102Гхава 6. Исследование функции дыхания. 3.F. Айсонов, A.B. Черняк,Е.Н. Калманова, С.ЯЗ. Чикина, Г.В. Неклюдова 117Гжава 7. Нагрузочные тесты. З.Р. Айсанов, ЕМ. Калманова 0РАЗДЕЛ П. РЕСПИРАТОРНАЯ ФАРМАКОЛОГИЯ 138Глава 8. Фармакология препаратов, воздействующих на дыхательные п)ти.A.Я. Цой, В.В. Архипов 139РАЗДЕЛ П1. ОСНОВНЫЕ СИМПТОМЫ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕ 154Глава 9. Одышка. В.Н. Абросимов 155Глава 10. Кашель. А.В. Аверьянов 165Глава 11. Боли в грудной клетке. ЕЖ Бобков 177РАЗДЕЛ IV. ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ 190Глава 12. Вирусные инфекции дыхательных путей. Л.В. Колобухина 191Глава 13. Бактериальная пневмония. А.И. Сииопальников 218Глава 14. Острый абсцесс и гангрена лёгкого. Я.Н. Шойхет,И.П. Рощев, С.В. Заремба 256Глава 15. Туберкулёз и другие микобактериальные инфекции. В.Ю. Мишин ....270Глава 16. Микозы лёгких. КН. Климко, Н.В. Васильева 282Глава 17. Паразитарные заболевания. Т.Н. Суханова, А.Ф. Попов 0РАЗДЕЛ V. ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ 302Глава 18. Хроническая обструктивная болезнь лёгких. Е.И. Шмелёв 303Глава 19. Эмфизема лёгких. A.B. Аверьянов 360Глава 20. Бронхиальная астма. A.B. Емельянов. ЕЛ. Черняк, Н.П. Княжеская,М.О. Потапова, A.C. Белевский 375Глава 21. Муковисцидоз. ЕЛ. Амелина, М.В. Самсонова <й>Глава 22. Бронхоэктазы. Я.Н. Шойхет, Н.М. Лепихин, Д.Н. Лепихина 406Глава 23. Поражения трахеи. В.Д. Паршин 426Глава 24. Бронхиолиты. С.Я. Авдеев, О.Е. Авдеева 436Глава 25. Заболевания верхних дыхательных путей.B.М. Свистушкип, А.Ю. Овгинников @РАЗДЕЛ VI. ОПУХОЛИ ЛЁГКИХ 450Глава 26. Рак лёгкого. А.Х. Трахтенберг, К.И. Колбанов, С.А. Седых 451Глава 27. Карциноидные опухоли лёгких. АХ Трахтенберг, К.И. Колбанов,В.В. Соколов, Л.В. Телегина 477
ОГЛАВЛЕНИЕГлава 28. Первичные злокачественные неэпителиальные опухоли лёгких.Л.Х. Трахтенберг, ГЛ. Франк, КМ. Колбанов 484Глава 29. Метастатические опухоли лёгких. А.Х. Трахтенберг,О.В. Пикин, ад Паршин 497Глава 30. Доброкачественные опухоли лёгких, А.Х, Трахтенберг,К.И. Колбанов, В.В. Соколов, О.В. Пикин, Л.В. Телегина «РАЗДЕЛ VII. НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ 510Глава 31. Тромбоэмболия лёгочной артерии, U.K. Яблонский,ТЛ. Фёдорова, Е.В. Павлушков 511Глава 32. Лёгочные васкулиты. А.А. Баранов 541Глава 33. Отёк и острое повреждение лёгких. А.Т. Чугалин ..564Глава 34. Идиопатическая лёгочная гипертензия. И.£ Чазова, Т.В. Мартынюк....589 Глава 35. Лёгочная гипертензия при хронических респираторныхзаболеваниях. С.Я. Авдеев 599Глава 36. Хроническая тромбоэмболическая лёгочная гипертензия.НЛ. Царёва, С.Н. Авдеев 620Глава 37. Тромбозы и тромбофилии в пульмонологии. С.Я, Овгаренко РАЗДЕЛ VIII. ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ 634Глава 38. Идиопатические интерстициальные пневмонии. С.Я. Авдеев 635Глава 39. Поражения органов дыхания при системных заболеваниях соединительной ткани. Л.П. Ананьева, А.В. Волков, А.В. Смирнов, ОЛ. Аятелава....674Глава 40. Саркоидоз. А.А. Визель 681Глава 41. Лангерганс-клеточный гистиоцитоз лёгких. Е.Н. Попова 696Глава 42. Синдром гудпасчера. Е,И. П1мелёв 703Глава 43. Идиопатический гемосидероз лёгких. Е.И. Шмелёв 707Глава 44. Лёгочные эозинофилии. И.Э. Степанян 712Глава 45. Лимфангиолейомиоматоз лёгких. М.М. Илъковиг 722Глава 46. Альвеолярный протеиноз. М.М. Илъковиг 731РАЗДЕЛ IX. ПРОФЕССИОНАЛЬНЫЕ И СВЯЗАННЫЕ С ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯ 740Глава 47. Профессиональная бронхиальная астма. О.С Васильева,A.B. Жесткое 741Глава 48. Пневмокониозы. И.Н. Полякова 0Глава 49, Птерчувствительный пневмонит. О.С. Васильева ^Глава 50. Острые токсические поражения дыхательных путей.О.С. Васильева, С.А. Корвяков 750Глава 51. Поражения лёгких, вызванные лекарствами. Е.Н. Попова 754РАЗДЕЛ X. ЗАБОЛЕВАНИЯ ПЛЕВРЫ 766Глава 52. Плевральный выпот. А.Г. Чугалин, Я.Н. Шойхет, ЕЛ. Цеймах 767Глава 53. Пневмоторакс, гемоторакс, хилоторакс и фиброторакс.ЯМ. Шойхет, ЕЛ. Цеймах 790Глава 54. Опухоли плевры. Я.Н. Шойхет 812РАЗДЕЛ XI. ЗАБОЛЕВАНИЯ СРЕДОСТЕНИЯ ^Глава 55. Опухоли и кисты средостения. П.К. Яблонский, В.Т. Пищик Глава 56. Пневмомедиастинум и медиастинит. П.К. Яблонский,Т.В. Николаев, А.В. Решетов, М.А. АтюковРАЗДЕЛ ХП. НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯ 830Глава 57. Дыхательные расстройства во время сна, СЛ. Бабак, Л.А. Голубев 831
ОГЛАВЛЕНИЕ 5РАЗДЕЛ XIII. РЕСПИРАТОРНЫЕ ПРОЯВЛЕНИЯ ВНЕЛЁГОЧНЫХ ЗАБОЛЕВАНИЙ Глава 58. Трансплантация органов и первичные иммунодефициты.П,К. Яблонский, ТЛ. СтепаненкоГлава 59. Заболевания сердца. А.Р. ТатарскийГлава 60. Заболевания органов брюшной полости и почек. ЕЗ. Бобков Глава 61. Гематологические заболевания. А.Н. Соколов, В.Г. Савгенко Глава 62. Акушерская и гинекологическая патология. В.И. Краснопольский,И.О. ШугининГлава 63. Нейромышечные заболевания. И.В. Леи^енко, Е.Р. ЛебедеваГлава 64. Патология грудной стенки. П.К. Яблонский, Г.В, Николаев. А.В. РешетовГлава 65. Синдром ожирения-гшювентиляции. СЛ, АвдеевРАЗДЕЛ XIV. ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ 854Глава 66. Дыхательная недостаточность: определение, классификация,подходы к диагностике и терапии. С.Н. Авдеев 855Глава 67. Острая гипоксемическая дыхательная недостаточность,включая острый респираторный дистресс-синдром. С.Н. Авдеев 867Глава 68. Острая вентиляционная дыхательная недостаточность. С.Я. Авдеев 884Глава 69. Искусственная вентиляция лёгких. С.Н. Авдеев 903Глава 70. Неинвазивная вентиляция лёгких при острой дыхательнойнедостаточности, С.Н. Авдеев 916Глава 71. Трансплантация лёгких. С.Н. Авдеев, А.Г. Чугалин 930РАЗДЕЛ XV. ПРОФИЛАКТИКА И КОНТРОЛЬ V*Глава 72. Курение. Г.М. Сахарова, Н.С. Антонов, С.А. Андреева.Глава 73. Обучение пациентов и комплайнс. А.С. Белевский, С.А. СеменюкПредметный указатель 951СОДЕРЖАНИЕ КОМПАКТ-ДИСКАДополнительные главы Фармакологический справочник Нормативно-правовые документыСсылки на ведущие российские и зарубежные информационные ресурсыпо пульмонологииМКБ-10Медицинские калькуляторы
ПРЕДИСЛОВИЕНациональное руководство по пульмонологии представляет собой фунда¬ ментальный труд, отражающий современный уровень развития данной области медицины. Работа над изданием проводилась под эгидой Российского респи¬ раторного общества при активном участии сотрудников крупнейших научно- исследовательских учреждений России. Благодаря объединению в авторский коллектив большинства ведущих специалистов России по респираторной меди¬ цине удалось создать руководство, отражающее согласованную позицию отече¬ ственной научной школы по всем актуальным проблемам заболеваний дыхатель¬ ной системы.В России, как и в большинстве развитых стран мира, чрезвычайно распростра¬ нены заболевания дыхательной системы, в частности бронхиальная астма, хрони¬ ческая обструктивная болезнь лёгких, которые представляют огромную социально значимую проблему. В национальном руководстве приведены современные реко¬ мендации по профилактике, диагностике, лечению респираторных заболеваний. Особое внимание уделено ведению больных с инфекционными и обструктивными заболеваниями лёгких. Изложены диагностические подходы к пациентам с основ¬ ными пульмонологическими синдромами: одышкой, кашлем, болью в груди.Рекомендации по диагностике и лечению основаны на обширном клиническом опыте работы ведущих отечественных учреждений и результатах многоцентровых научных исследований, проведённых как в нашей стране, так и за рубежом.Мы надеемся, что информация, изложенная в руководстве, послужит стандар¬ том оказания пульмонологической помощи в России, будет способствовать даль¬ нейшему снижению заболеваемости и смертности от заболеваний респираторной системы.Любые замечания и предложения по совершенствованию данного руководства будут с благодарностью приняты авторами и учтены при переиздании книги.Главный редакторАкадемик РАМН А.Г. Чугалин
УЧАСТНИКИ ИЗДАНИЯГЛАВНЫЙ РЕДАКТОРЧучалин Александр Григорьевич - д-р мед. наук, проф., акад. РАМН, дирек¬ тор ФГУ «Научно-исследовательский институт пульмонологии ФМБА РФ»ОТВЕТСТВЕННЫЙ РЕДАКТОРВознесенский Николай Арнольдович - канд. мед. наук, зав. лаборатори¬ ей ФГУ «НИИ пульмонологии ФМБА РФ»НАУЧНЫЕ РЕДАКТОРЫБаранова Ирина Александровна - д-р мед. наук, доцент кафедры внутренних болезней педиатрического факультета РГМУСтепанян Игорь Эмильевич - д-р мед. наук, ведущий научный сотрудник ФГУ «ЦНИИ туберкулёза РАМН»Черняев Андрей Львович - д-р мед. наук, проф., зав. отделом патологии ФГУ «НИИ пульмонологии ФМБА РФ»Бродская Ольга Наумовна - канд. мед. наук, старший научный сотрудник ФГУ «НИИ пульмонологии ФМБА РФ»АВТОРЫАбросимов Владимир Николаевич - д-р мед. наук, проф., зав. кафедрой терапии ФПДО с курсом семейной медицины Рязанского государственного меди¬ цинского университета им. акад. И.П. ПавловаАвдеев Сергей Николаевич - д-р мед. наук, заместитель директора по науке ФГУ «НИИ пульмонологии ФМБА РФ»Авдеева Ольга Евгеньевна - канд. мед. наук, старший научный сотрудник ФГУ «НИИ пульмонологии ФМБА РФ»Аверьянов Александр Вячеславович - канд. мед. наук, зам. директора ФГУ «НИИ пульмонологии ФМБА РФ»Айсанов Заурбек Рамазанович - д-р мед. наук, проф., зав. отделом клинической физиологии и клинических исследований ФГУ «НИИ пульмонологии ФМБА РФ» Амелина Елена Львовна - канд. мед. наук, зав. лабораторией муковисцидоза ФГУ «НИИ пульмонологии ФМБА РФ»Ананьева Лидия Петровна - д-р мед. наук, проф., зав, лабораторией микро- циркуляции и воспаления ГУ «Институт ревматологии РАМН»Андреева Светлана Александровна - младший научный сотрудник лабора¬ тории медицинских информационных систем ФГУ «НИИ пульмонологии ФМБА РФ»Антелава Ольга Алексеевна - канд. мед. наук, научный сотрудник лаборато¬ рии интенсивных методов терапии ГУ «Институт ревматологии РАМН»Антонов Николай Сергеевич - д-р мед. наук, зав. отделом профилактической пульмонологии ФГУ «НИИ пульмонологии ФМБА РФ»Архипов Владимир Владимирович - канд. мед. наук, доцент ММА им. И.М. СеченоваАтюков Михаил Александрович - канд. мед. наук, торакальный хирург Центра интенсивной пульмонологии и торакальной хирургии Городской много¬ профильной больницы № 2, г. Санкт-ПетербургБабак Сергей Львович - д-р мед. наук, зав. лабораторией по изучению дыха¬ тельных расстройств в период сна ФГУ «НИИ пульмонологии ФМБА РФ»Баранов Андрей Анатольевич - д-р мед. наук, проф., зав. кафедрой клини¬ ческой лабораторной диагностики Ярославской государственной медицинской академии Федерального агентства по здравоохранению и социальному развитию
8 УЧАСТНИКИ ИЗДАНИЯБелевский Андрей Станиславович - д-р мед. наук, проф. кафедры пульмо¬ нологии ФУБ РГМУБобков Евгений Валерьевич ~ канд. мед. наук, доцент кафедры госпитальной терапии педиатрического факультета РГМУВасильева Наталья Всеволодовна - д-р биол. наук, зав. кафедрой лабо¬ раторной микологии и патоморфологии микозов Санкт-Петербургской медицин¬ ской академии последипломного образованияВасильева Ольга Сергеевна - д-р мед. наук, зав. лабораторией экологозави¬ симых и профессиональных лёгочных заболеваний ФГУ «НИИ пульмонологии ФМБА РФ»Визель Александр Андреевич — д-р мед. наук, проф., зав. кафедрой фтизио- пульмонологии Казанского медицинского университетаВолков Александр Витальевич - канд. мед. наук, старший научный сотруд¬ ник лаборатории инструментальной и УЗ-диагностики ГУ «Институт ревматоло¬ гии РАМН»Голубев Лев Аркадьевич - канд. мед. наук, старший научный сотрудник лабо¬ ратории по изучению дыхательных расстройств в период сна ФГУ «НИИ пульмо¬ нологии ФМБА РФ»Емельянов Александр Викторович - д-р мед. наук, проф. кафедры госпи¬ тальной терапии Санкт-Петербургского государственного медицинского универ¬ ситета им. И.П. ПавловаЖестков Александр Викторович - д-р мед. наук, проф. кафедры про¬ фессиональных болезней, клинической фармакологии и фармакотерапии ФГУ «Самарский государственный медуниверситет»Заремба Сергей Владимирович - канд. мед. наук, доцент кафедры тера¬ пии, семейной медицины ГОУ ВПО «Алтайский государственный медицинский университет Федерального агентства по здравоохранению и социальному раз¬ витию»Зубков Михаил Николаевич - д-р мед. наук, проф., зам. главного врача по КДР ГКБ № 23 им. МедсантрудаИлькович Михаил Михайлович - д-р мед. наук, проф., директор научно- исследовательского института пульмонологии СПбГМУ им. акад. И.П, Павлова Калманова Елена Николаевна - канд. мед. наук, зав. отделением функцио¬ нальной и ультразвуковой диагностики городской клинической больницы № 57 г. МосквыКлимко Николай Николаевич - д-р мед. наук, проф., зав. кафедрой клини¬ ческой микологии, аллергологии и иммунологии Санкт-Петербургской медицин¬ ской академии последипломного образованияКняжеская Надежда Павловна - канд. мед. наук, доцент кафедры пульмоно¬ логии ФУБ РГМУКолбанов Константин Иванович - канд. мед. наук, старший научный сотрудник хирургического торакального отделения ФГУ «Московский научно- исследовательский онкологический институт им. П.А. Герцена Росздрава»Колобухина Людмила Васильевна - д-р мед. наук, проф., руководитель лабо¬ ратории острых респираторных вирусных инфекций с апробацией лекарственных средств ГУУ «НИИ вирусологии им. Д.И. Ивановского РАМН»Корвяков Сергей Александрович - канд. мед. наук, старший научный сотруд¬ ник лаборатории экологозависимых и профессиональных лёгочных заболеваний ФГУ «НИИ пульмонологии ФМБА РФ»Краснопольский Владислав Иванович - д-р мед, наук, проф., чл.-кор. РАМН, директор МОНИИАГЛебедева Елена Разумовна - канд. мед. наук, врач-невролог МО «Новая боль¬ ница», Екатеринбург
УЧАСТНИКИ ИЗДАНИЯ 3Лепихин Николай Михайлович - канд. мед. наук, врач-рентгенолог ФГУ «Поликлиника № 4» УД Президента РоссииЛепихина Дарья Николаевна - канд. мед. наук, врач-рентгенолог ФГУ «Поликлиника № 1» УД Президента РоссииЛещенко Игорь Викторович - д-р мед. НЭ5ТС, проф., зав. курсом пульмоноло¬ гии ФПК и ПП ГОУ ВПО «Уральская государственная медицинская академия» Мартынюк Тамила Витальевна - канд. мед. наук, старший научный сотруд¬ ник отдела системных гипертензий РКНПК М3 РФМишин Владимир Юрьевич - д-р мед наук, проф.. зав, кафедрой туберкулёза Московского медико-стоматологического университетаНеклюдова Галина Васильевна - канд. мед. наук, старший научный сотруд¬ ник лаборатории функциональных и ультразвуковых методов исследования ФГУ «НИИ пульмонологии ФМБА РФ»Николаев Герман Викторович - канд. мед. наук, старший научный сотрудник Института высоких медицинских технологий медицинского факультета Санкт- Петербургского государственного университетаОвчаренко Светлана Ивановна - д-р мед. наук. проф. кафедры факультет¬ ской терапии № 1 ММА им. И.М. СеченоваОвчинников Андрей Юрьевич - д-р мед. наук, доцент кафедры болезней уха, горла и носа ММА им. И.М. СеченоваПавлушков Евгений Вячеславович - канд. мед. наук, торакальный хирург Центра интенсивной пульмонологии и торакальной хирургии городской больни¬ цы № 2, Санкт-ПетербургПаршин Владимир Дмитриевич - д-р мед. наук, руководитель отделе¬ ния хирургии лёгких и средостения ГУ «Российский научный центр хирургии РАМН»Пикин Олег Валентинович - д-р мед. наук, старший научный сотруд¬ ник хирургического торакального отделения ФГУ «Московский научно- исследовательский онкологический институт им. П.А. Герцена Росздрава» Пищик Вадим Григорьевич - канд. мед. наук, доцент кафедры госпитальной хирургии медицинского факультета Санкт-Петербургского государственного уни¬ верситетаПолякова Ирина Николаевна - канд. мед. наук, зав. отделением заболеваний внутренних органов клиники ГУ «НИИ медицины труда РАМН»Попов Александр Фёдорович — д-р мед. наук, проф. кафедры инфекционных болезней Владивостокского государственного медицинского университетаПопова Елена Николаевна - д-р мед, наук, доцент кафедры терапии и проф- болезней ММА им. И.М. СеченоваПотапова Марина Олеговна - врач городской клинической больницы № 57 г. МосквыРешетов Алексей Викторович - канд. мед. наук, торакальный хирург Центра интенсивной пульмонологии и торакальной хирургии городской многопрофиль¬ ной больницы № 2 Санкт-ПетербургаРощев Игорь Петрович - канд. мед. наук, ассистент кафедры факультетской хирургии ГОУ ВПО «Алтайский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»Савченко Валерий Григорьевич - д-р мед. наук, проф., чл.-кор. РАМН, зам. директора Гематологического научного центра РАМНСамсонова Мария Викторовна - д-р мед. наук, зав. лабораторией патологи¬ ческой анатомии и иммунологии ФГУ «НИИ пульмонологии ФМБА РФ»Сахарова Галина Михайловна - д-р мед. наук, зав. лабораторией медицин¬ ских информационных систем ФГУ «НИИ пульмонологии ФМБА РФ»
10 УЧАСТНИКИ ИЗДАНИЯСвистушкин Валерий Михайлович - д-р мед, наук, проф, кафедры болезней уха, горла и носа ММА им. И.М. СеченоваСедых Сергей Анатольевич - д-р мед. наук, проф., руководитель отдела луче- Щ вых методов диагностики ФГУ «Московский научно-исследовательский онколо¬ гический институт им. П.А. Герцена Росздрава»Семенюк Светлана Анатольевна - младший научный сотрудник лаборатории гуманистических исследований ФГУ «НИИ пульмонологии ФМБА РФ»Сииопальников Александр Игоревич - д-р мед. наук, проф., ГИУВ МО РФ Смирнов Александр Викторович - д-р мед. наук, ведущий научный сотрудник группы денситометрической диагностики ГУ «Институт ревматологии РАМН» Соколов Андрей Николаевич - канд. мед. наук, старший научный сотрудник отделения высокодозной химиотерапии гемобласгозов и трансплантации костно¬ го мозга Гематологического научного центра РАМНСоколов Виктор Викторович - д-р мед, наук, проф., руководитель отделения эндоскопических методов диагностики и лечения ФГУ «Московский научно- исследовательский онкологический институт им. П.А. Герцена Росздрава»Степаненко Татьяна Александровна - зав. отделением пульмонологии Центра интенсивной пульмонологии и торакальной хирургии, Санкт-Петербург Степанян Игорь Эмильевич - д-р мед. наук, ведущий научный сотрудник ГУ «ЦНИИ туберкулёза РАМН»Суханова Галина Ивановна - д-р мед, наук, проф., зав, кафедрой госпиталь¬ ной терапии Владивостокского государственного медицинского университета Татарский Алексей Романович- д-р мед. наук, проф. кафедры госпитальной терапии педиатрического факультета РГМУТелегина Лариса Валентиновна - канд. мед. наук, старший научный сотруд¬ ник отделения эндоскопических методов диагностики и лечения ФГУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена Росздрава» Трахтенберг Александр Харитонович - д-р мед. наук, проф., руково¬ дитель хирургического торакального отделения ФГУ «Московский научно- исследовательский онкологический институт им, П.А. Герцена Росздрава»Тюрин Игорь Евгеньевич - д-р мед. наук, проф., зав. кафедрой лучевой диа¬ гностики, лучевой терапии и медицинской физики РМАПО ФМБА РФФёдорова Татьяна Александровна - канд. мед. наук, зав. амбулаторно¬ консультативным отделением Центра интенсивной пульмонологии и торакальной хирургии городской больницы № 2 Санкт-ПетербургаФранк Георгий Абрамович - д-р мед. наук, проф., чл.-кор. РАМН, руково¬ дитель патологоанатомического отделения ФГУ «Московский научно-исследова¬ тельский онкологический институт им. П.А. Герцена Росздрава»Царёва Наталья Анатольевна - канд. мед. наук, старший на}*чный сотрудник ФГУ «НИИ пульмонологии ФМБА РФ»Цеймах Евгений Александрович - д-р мед. наук, проф., зав. кафедрой опе¬ ративной хирургии и топографической анатомии ГОУ ВПО «Алтайский государ¬ ственный медицинский университет Росздрава»Цой Алла Николаевна - д-р мед, наук, проф. кафедры клинической фармако¬ логии и пропедевтики внутренних болезней ММА им, И,М, СеченоваЧазова Ирина Евгеньевна - д-р мед. наук, проф., руководитель отдела систем¬ ных гипертензий РКНПК М3 РФЧернеховская Наталья Евгеньевна - д-р мед. наук, проф. кафедры эндоско¬ пии РМАПОЧерняк Борис Анатольевич - д-р мед. наук, проф., зав. кафедрой аллерголо¬ гии и пульмонологии Иркутского государственного университета усовершенство¬ вания врачей
УЧАСТНИКИ ИЗДАНИЯ ЦЧерняк Александр Владимирович - канд. мед. наук, зав. лабораторией функ¬ циональных и ультразвуковых методов исследования ФГУ «НИИ пульмонологии ФМБА РФ»Чикина Светлана Юрьевна - канд. мед. наук, старший научный сотрудник лаборатории функциональных и ультразвуковых методов исследования ФГУ «НИИ пульмонологии ФМБА РФ»Чучалин Александр Григорьевич - д-р мед. наук, проф., акад. РАМН, дирек¬ тор ФГУ «НИИ пульмонологии ФМБА РФ»Шмелёв Евгений Иванович - д-р мед, наук, проф., руководитель отдела гра¬ нулематозных заболеваний лёгких ГУ «ЦНИИ туберкулёза РАМН»Шойхет Яков Нахманович - д-р мед. наук, проф., чл.-кор. РАМН, зав. кафе¬ дрой факультетской хирургии ГОУ ВПО «Алтайский государственный медицин¬ ский университет Росздрава»Шугинин Игорь Олегович - д-р мед. наук, ведущий научный сотрудник МОНИИАГЯблонский Пётр Казимирович - д-р мед. наук, проф., зав. кафедрой госпи¬ тальной хирургии медицинского факультета Санкт-Петербургского государствен¬ ного университета
МЕТОДОЛОГИЯ СОЗДАНИЯ И ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВАНациональные руководства - первая в России серия практических руководств по медицинским специальностям, включающих всю основную информацию, необ¬ ходимую врачу для практической деятельности и непрерывного медицинского образования. В отличие от большинства других руководств в национальных руко¬ водствах равное внимание уделено профилактике, диагностике, фармакотерапии и немедикаментозным методам лечения заболеваний.Почему необходимы национальные руководства? Динамичное развитие меди¬ цинской науки, быстрое внедрение в клиническую практику новых высокотехноло¬ гичных методов диагностики и лечения требуют от врача непрерывного повьппения профессионализма и обновления знаний на протяжении всей его профессиональной жизни. Эта задача решается системой последипломного образования и периодиче¬ ской сертификацией специалистов лишь частично. Быстро возрастающий объём научной медицинской информации предъявляет особые требования к качеству учебных и справочных руководств, особенно с учётом внедрения в широкую клиническую практику достижений медицины, основанной на доказательствах. Имеющиеся на сегодня руководства для врачей и фармакологические справочники не в полной мере отвечают современным потребностям врачебной аудитории.Ниже приведено описание требований и мероприятий по их обеспечению, которые были проведены при подготовке национального руководства по пульмо¬ нологии.КОНЦЕПЦИЯ И УПРАВЛЕНИЕ ПРОЕКТОМДля работы над проектом была создана группа управления в составе руководи¬ теля и менеджеров проекта.Для разработки концепции и системы управления проектом его менеджеры провели множество консультаций с отечественными и зарубежными специали¬ стами: руководителями профессиональных обществ, ведущими разработчиками клинических рекомендаций, организаторами здравоохранения, представителями страховых компаний и компаний, производящих лекарственные средства и меди¬ цинское оборудование.В результате разработана концепция проекта, сформулированы этапы, опреде¬ лены их последовательность и сроки исполнения, требования к этапам и исполни¬ телям; утверждены инструкции и методы контроля,ЦЕЛЬОбеспечить врача всей современной информацией в области пульмоноло¬ гии, необходимой для непрерывного медицинского образования, что позволит значительно повысить качество специализированной медицинской помощи в Российской Федерации.ЗАДАЧИ• Проанализировать все современные источники достоверной высококаче¬ ственной информации.• На основе полученных данных составить обобщающие материалы с учётом особенностей отечественного здравоохранения по следующим направлениям:клинические рекомендации;❖ диагностические методы;❖ немедикаментозные методы лечения;<> лекарственные средства.• Подготовить издание, соответствующее всем современным требованиям к национальному руководству по отдельной специальности.
МЕТОДОЛОГИЯ СОЗДАНИЯ И ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВА 13АУДИТОРИЯНациональное руководство по пульмонологии предназначено пульмонологам, терапевтам, педиатрам, студентам старших курсов медицинских вузов, интернам, ординаторам, аспирантам.ЭТАПЫ РАЗРАБОТКИСоздание команды управления, команды разработчиков, концепции, выбор тем, поиск литературы, написание авторских материалов, экспертиза, редактирование, независимое рецензирование с получением обратной связи от рецензентов (спе¬ циалисты, практикующие врачи, организаторы здравоохранения, производители лекарственных средств, медицинского оборудования, представители страховых компаний и др.), публикация, внедрение, получение обратной связи и дальнейшее улучшение,СОДЕРЖАНИЕКак и все книги серии, национальное руководство по пульмонологии включает описание методов диагностики и лечения, клинико-анатомических форм заболе¬ вания с особенностями у разных групп пациентов.РАЗРАБОТЧИКИ• Авторы-составители — практикующие врачи, сотрудники научно-исследо¬ вательских учреждений России, руководители кафедр;• главный редактор — акад. РАМН А.Г. Чучалин;• научные редакторы — ведущие специалисты в области респираторной меди¬ цины в России;• редакторы издательства — практикующие врачи с опьггом работы в издатель¬ стве не менее 5 лет;• руководители проекта — сотрудники издательства, имеющие опыт руковод¬ ства проектами с большим числом участников при ограниченных сроках подготовки, владеющие методологией создания специализированных меди¬ цинских руководств.Всем специалистам были предоставлены описание проекта, формат статьи, инструкция по составлению каждого элемента содержания, источники информа¬ ции и инструкции по их использованию, пример каждого элемента содержания. В инструкциях для составителей указывалось, что необходимо подтверждать эффективность (польза/вред) вмешательств в независимых источниках информа¬ ции, недопустимо упоминать какие-либо коммерческие наименования. Приведены международные (некоммерческие) названия лекарственных препаратов, которые проверялись редакторами издательства по Государственному реестру лекарственных средств (по состоянию на 1 сентября 2008 г.). В требованиях к авторам-составителям подчёркивалось, что материалы должны кратко и конкретно отвечать на клиниче¬ ские вопросы. После редактирования текст согласовывали с авторами.Со всеми разработчиками руководитель проекта и ответственные редакторы поддерживали непрерывную связь по телефону и электронной почте с целью решения оперативных вопросов.Мнение разработчиков не зависело от производителей лекарственных средств я медицинской техники.РЕЗУЛЬТАТНациональное руководство по пульмонологии в удобной и доступной форме содержит всю необходимую информацию для практической деятельности и непре¬ рывного медицинского образования.
14 МЕТОДОЛОГИЯ СОЗДАНИЯ и ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВАРЕКЛАМАВ инструкциях для авторов, научных редакторов и рецензентов подчёркивалась необходимость использовать при работе над национальным руководством только достоверные источники информаций, не зависящие от мнения производителей лекарственных средств и медицинской техники, что в конечном счёте обеспечило отсутствие информации рекламного характера в авторских материалах руковод¬ ства.Реклама производителей лекарственных средств и медицинской техники в этом издании представлена в следующих видах:1) цветные рекламные вставки;2) тематические врезы, публикуемые на цветном фоне;3) подстраничные примечания, содержащие торговые наименования лекар¬ ственных средств.Все рекламные материалы снабжены примечаниями о том, что данная инфор¬ мация публикуется на правах рекламы.КОМПАКТ-ДИСК - ЭЛЕКТРОННОЕ ПРИЛОЖЕНИЕ К НАЦИОНАЛЬНОМУ РУКОВОДСТВУКаждый экземпляр национального руководства по пульмонологии снабжён бесплатным электронным приложением на компакт-диске. Электронное при¬ ложение содержит фармакологический справочник, медицинские калькуляторы, стандарты, утверждённые Минздравсоцразвития России, и другие дополнитель¬ ные материалы.КОМПАКТ-ДИСК «КОНСУЛЬТАНТ ВРАЧА. ПУЛЬМОНОЛОГИЯ»Б рамках проекта «Национальное руководство по пульмонологии» также под¬ готовлена электронная информационно-образовательная система «Консультант врача. Пульмонология» (на компакт-диске). Система содержит полный текст национального руководства, атлас иллюстраций, стандарты, утверждённые Минздравсоцразвития России, и другие дополнительные материалы. Программа снабжена уникальной системой поиска. Информацию об электронной информа¬ ционной системе «Консультант врача. Пульмонология» можно получить по тел.: (495) 228-09-74, 228-99-75; по электронной почте: bookpost@geotar.m, а также на интернет-сайте: www.geotar.ru.ОБРАТНАЯ СВЯЗЬЗамечания и пожелания по подготовке книги «Национальное руководство. Пульмонология» можно направлять по адресу: 119435, ул. Малая Пироговская, 1а; электронный адрес: info@asraok.ru.Таким образом, национальное руководство по пульмонологии в удобной и доступной форме содержит всю необходимую информацию для практической деятельности и непрерывного медицинского образования.Национальное руководство будет регулярно пересматриваться и обновляться не реже одного раза в 3-4 года.Дополнительную информацию о проекте «Национальные руководства» можно получить на интернет-сайте: http://nr.asinok.ru.
список СОКРАЩЕНИЙ* — торговое наименование лекарственного препарата не зарегистрированный в РФ лекарственный препарат ААТ - а^-антитрипсинАБЛА - аллергический бронхолёгочный аспергиллёзАПФ - ангиотензинпревращающий ферментАР - аллергический ринитАТФ - аденозинтрифосфорная кислотаАХП - антихолинергические препаратыБА - бронхиальная астмаБАЛ - бронхоальвеолярный лаважБАС - бронхоальвеолярный смывБОС - бронхообструктивный синдромБС - бронхиальный смывBATO - видеоассистированная торакоскопическая операцияВДП - верхние дыхательные путиВИЧ - вирус иммунодефицита человекаВОЗ - Всемирная организация здравоохраненияВП - внебольничная пневмонияВПГ - вирус простого герпесаГКС - глюкокортикостероидыГМФ - гуанозинмонофосфатГЭРБ - гастроэзофагеальная рефлюксная болезньДАД - диастолическое артериальное давлениеДАП - диффузное альвеолярное повреждениедве - диссеминированное внутрисосудистое свёртываниеДД - длительное действиеДН - дыхательная недостаточностьДНК - дезоксирибонуклеиновая кислотаДО - дыхательный объёмДП - дыхательные путиДПБ - диффузный панбронхиолитдел - диффузионная способность лёгкихЕвд - ёмкость вдохаЖЁЛ - жизненная ёмкость лёгкихЖКТ - желудочно-кишечный трактЗСН - застойная сердечная недостаточностьИБС - ишемическая болезнь сердцаИВЛ - искусственная вентиляция лёгкихИГКС - ингаляционные глюкокортикостероидыИЗЛ - интерстициальные заболевания лёгкихИЛ - интерлейкинИЛГ - идиопатическая лёгочная гипертензияИМ - инфаркт миокардаИМТ - индекс массы телаИНДП - инфекции нижних дыхательных путейИФА - иммуноферментный анализКВБА - кашлевой вариант бронхиальной астмыКД - короткое действиеКОЕ - колониеобразующие единицыКСФ-М - макрофагальный колониестимулирующий факторКТ - компьютерная томография
16 список СОКРАЩЕНИЙКТВР - компьютерная томография высокого разрешенияЛА - лёгочная артерияЛАМ - лимфангиолейомиоматоз лёгкихЛДГ - лактатдегидрогеназаЛПС - липополисахаридЛПУ - лечебно-профилактическое учреждениеЛТ - лейкотриеныМАО - моноаминоксидазаМВТ “ микобактерии туберкулёзаМВЛ - максимальная произвольная вентиляция лёгкихМДКТ - мультидетекторная КТМКБ-10 - Международная классификация болезней 10-го пересмотраМОД - минутный объём дыханиямРНК - матричная рибонуклеиновая кислотаМРТ - магнитно-резонансная томографияМСКТ - мультиспиральная КТМСЭ - медико-социальная экспертизаНВЛ - неинвазивная вентиляция лёгкихНМРЛ - немелкоклеточный рак лёгкогоНПВП - нестероидные противовоспалительные препаратыОБ - облитерирующий бронхиолитОБОП - облитерирующий бронхиолит с организующейся пневмониейОДН - острая дыхательная недостаточностьОЁЛ - общая ёмкость лёгкихОИТ - отделение интенсивной терапииООЛ - остаточный объём лёгкихОР - относительный рискОРВИ - острые респираторные вирусные инфекции ОРДС - острый респираторный дистресс-синдром ОРЗ - острое респираторное заболевание OOBj - объём форсированного выдоха за 1-ю секунду ПГ ~ простагландиныПДК - предельно допустимые концентрациипев - пиковая скорость выдохаПЦД - первичная цилиарная дискинезияПЦР - полимеразная цепная реакцияПЭТ - позитронно-эмиссионная томографияРА - ревматоидный артритРБ - респираторный бронхиолитРБ-ИЗЛ - респираторный бронхиолит, ассоциированный с интерстициальнымзаболеванием лёгкихРГА - реакция гемагглютинацииРИФ - реакция прямой иммунофлюоресценцииРК - реснитчатая(ые) клетка(и)РКТ - рентгеновская компьютерная томографияРКФМ - растворимые комплексы фибрина-мономераРЛА - реакция латекс-агглютинацииPH - реакция нейтрализацииРИГА - реакция непрямой гемагглютинацииРНИФ - реакция непрямой иммунофлюоресценцииРНК - рибонуклеиновая кислотаРО^ - резервный объём вдохаРО^ыд “ резервный объёй выдоха .РРО - Российское респираторное общество
список СОКРАЩЕНИЙ 17РСВ - респираторно-синцитиальный вирус РСК - реакция связывания комплемента РТГА - реакция торможения гемагглютинации РТПХ - реакция «трансплантат против хозяина»СЗСТ - системные заболевания соединительной тканиСИТ - специфическая иммунотерапияСКВ - системная красная волчанкаСОАГС - синдром обструктивного апноэ-гипопноэ снаСОЭ - скорость оседания эритроцитовСПИД - синдром приобретённого иммунодефицитаТИМП - тканевые ингибиторы металлопротеиназТОРС - тяжёлый острый респираторный синдромтРНК - транспортная РНКТЭЛА - тромбоэмболия лёгочной артерииУЗИ - ультразвуковое исследованиеФАТ - фактор активации тромбоцитовФБС - фибробронхоскопияФВД - функция внешнего дыханияФЛІ^Л - форсированная жизненная ёмкость лёгкихФНО - фактор некроза опухолиФОЕ - функциональная остаточная ёмкостьХДН - хроническая дыхательная недостаточностьХОБЛ - хроническая обструктивная болезнь лёгкихХРОЛ - хирургическая редукция объёма лёгочной тканиХСН - хроническая сердечная недостаточностьцАМФ - циклический аденозинмонофосфатЦЛТ - цистеиниловые лейкотриеныЦНС - центральная нервная системаЧББ - чрезбронхиальная биопсияЧД - частота дыханияЭАА - экзогенный аллергический альвеолит ЭхоКГ - эхокардиография ATS - Американское торакальное общество CL - растяжимостьDLco “ диффузионная способность лёгких по монооксиду углерода ERS - Европейское респираторное обществоGINA (Global Initiative for Asthma) - Гпобальная стратегия лечения и профилакти¬ ки бронхиальной астмы ни - число Хаунсфилда Ig - иммуноглобулин- парциальное напряжение кислорода в артериальной крови Р^СО^ - парциальное напряжение двуокиси углерода в артериальной крови SaOj - насыщение артериальной крови кислородом Th2 - Т“хелперы 2-го типаTNM - классификация злокачественных опухолей (Т - опухоль, N - лимфатиче¬ ский узел. М - метастаз)- дыхательный объём
АЗДЕЛ ІМЕГОМІ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХГлава 1. Анамнез и физикальное обследованиеГлава 2. Микробиологическая диагностикаГлава 3. Радиологические методыГлава 4. Диагностическая и лечебная бронхоскопияГлава 5. Торакоскопия и другие инвазивные вмешательстваГлава 6. Исследование функции дыхания Глава 7. Нагрузочные тесты @
Глава 1Анамнез и физикальное обследованиеОбследование больного с патологией органов дыхания отно¬ сится к числу трудных задач внутренней медицины. Врачу необ¬ ходимо обладать широким профессиональным кругозором: уметь оказывать неотложную помощь при угрожающих жизни осложне¬ ниях, развивающихся при заболеваниях органов дыхания; прово¬ дить порой сложный диагностический поиск причин, приведших к развитию болезни или же к её обострению. Наконец, врач дол¬ жен иметь высокий уровень компетенции для решения сложных диагностических и лечебных вопросов респираторной медицины, в клинической практике врачу приходится ежедневно иметь дело с больными, которые к нему обратились по поводу заболеваний дыхательных путей. Эпидемиологические исследования, которые были проведены во многих странах мира, свидетельствуют о том, что на долю больных, обратившихся к врачу общей практики с патологией органов дыхания, приходится от 25 до 30%, а в период эпидемических вспышек острых вирусных заболеваний респира¬ торной системы данная группа больных доминирует.Обследование больного, пришедшего на приём к врачу, или же если врач был вызван для консультации, начинается с их встречи. Первый взгляд на больного формирует у врача и первое впечатле¬ ние о проблемах его лёгочного здоровья. Внимательно посмотрим на пациента, который изображён на рис. 1-1. Постараемся сделать анализ ещё не диагностических признаков, но уже важных ощуще¬ ний, которые позволяют врачу формировать образ пациента и тех, актуальных проблем, которые лежат в основе его лёгочного здоро¬ вья. Его общий вид и первое впечатление свидетельствует о том, что это тяжело больной человек.об этом свидетельствует облик больного. Он занимает вынужден¬ ное сидячее положение в кресле, так как все другие положения усу¬ губляют тягостное чувство одышки, в акте дыхания участвует вспо¬ могательная мускулатура плечевого пояса, грудной клетки, живота. Положение больного человека свидетельствует отом, что всё вего позе и поведении подчинено тому, чтобы облегчить и придать дыханию свободу. Обращает на себя внимание не только участие вспомогатель¬ ной мускулатуры в дыхании, но и появление ряда признаков, свиде¬ тельствующих о развитии синдрома утомления дыхательных мышц, в респираторной физиологии известна диаграмма СашрЬеІІ, в кото¬ рой отражено взаимоотношение между объёмом и давлением груд-
20 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 1-1. Пациент с хронической обструктивной болезнью лёгких (эмфизематозный тип).ной клетки, что имеет принципиальное значение для формирования эффективной вентиляционной ф)шкции лёгких. Короткое расстояние между перстневидным хрящом щитовидной железы и рукояткой грудины известно как признак Campbell. Его появление свидетельствует о развитии хронической дыхательной недостаточ¬ ности у больных ХОБЛ, бронхиальной астмой и другими заболеваниями дыха¬ тельной системы, при которых развивается вентиляционная недостаточность. Особую диагностическую ценность приобретает сочетание симптомов Campbell и Hoover. Последний признак отражает появление парадоксального дыхания у лиц с дыхательной недостаточностью. Признак Hoover свидетельствует о парадоксаль¬ ном движении той части грудной клетки, которая прилежит непосредственно к диафрагме. В период вдоха грудная клетка в этой части парадоксально начинает двигаться наружу, а в период выдоха — начинает движение внутрь грудной клетки. Указанные два признака — Campbell и Hoover — относят к числу тех, которые появ¬ ляются у больных с хронической дыхательной недостаточностью. Клиническая картина может дополняться появлением симптома Magendy, который указал на участие т. stemodeidomastoideus в акте дыхания у тяжёлых больных с заболевания¬ ми органов дыхания. Если вновь обратиться к внешнему виду больного, представ¬ ленного на рис. 1-1, то необходимо обратить внимание, что свои губы он собрал в трубочку. Этим движением он помогает себе дополнительно облегчить дыхание: рефлекторно он стремится увеличить давление в респираторных бронхиолах во время выдоха и тем самым препятствовать их коллапсу. Рекомендуется тщательно осмотреть шею больного человека, обратив особое внимание на характеристику венозного пульса. В норме венозный пульс отрицательный. Во время вдоха, когда проявляется присасывающаяся функция грудной клетки, яремная вена опадает, а во время вьщоха можно заметить её наполнение. Однако у больных с развитием лёгочного сердца формируется и положительный венозный пульс (рис. 1-2).
С;-.--;АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ21Рис. 1*2. Анатомические харак-теристики, позволяющие отличить пульсацию сонной артерии и веноз¬ ное наполнение яремной вены.Так, больной, изображённый на рис. 1*1, кахектичного вида и страдает выра¬ женной степенью дыхательной недостаточности. Врачи чаще всего встречаются с больными, у которых развилась тяжёлая степень эмфиземы лёгких. Так это происходит у больных ХОБЛ, раком лёгких, некоторыми профессиональными заболеваниями лёгких.Образование и совершенствование практических навыков позволяет врачу видеть проявления болезни, не пропустить признаки, которые могут встречаться нечасто. Несмотря на важность первых впечатлений при встрече врача с больным, они не должны стать догмой в сложном процессе постановки диагноза. При этом, как показывает практический опыт, диагноз является динамическим процессом, и врачу приходится постоянно совершенствоваться в его постановке.Искусство общения врача с больным человеком приходит с опытом и требует от врача кропотливой работы. В современной клинической практике встречают¬ ся больные, которые неохотно, а порой и умышленно не рассказывают о своей болезни. Подобного рода истории встречаются у больных, инфицированных ВИЧ, туберкулёзом, при наркомании и некоторых других заболеваниях. Врачам реко¬ мендуется задавать прямые вопросы, на которые чаще всего больные отвечают. Следует также исходить из положения, что пациентам с заболеваниями органов дыхания бывает трудно рассказать о своих болезнях. Так, например, при развитии одышки больным чаще всего затруднительно создать словесный портрет своего болезненного ощущения. Врач, собирая анамнез жизни и болезни у своего паци¬ ента, пытается понять как можно полнее больного человека, истоки его болезни и основные этапы её развития, сформировать рабочую гипотезу, наметить основные диагностические процедуры. Врач всегда должен стремиться к тому, чтобы боль¬ ной аоивно сотрудничал и помогал в диагностическом процессе, был аккуратен в выполнении лечебной программы. В повседневной практике врач по несколько раз возвращается к сбору анамнеза болезни. Это связано с тем, что больному часто
22 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХтрудно бывает рассказать те обстоятельства его жизни и болезни, которые могут играть важную роль в постановке диагноза заболевания, а врачу порой трудно предвидеть и учесть то многообразие проявлений болезни, которое встречается в жизни любого человека.Современная клиническая практика рекомендует врачебному сообществу стро¬ ить этот этап своей деятельности, основываясь на принципах проблемно ориен¬ тированной медицины, В основе этих принципов лежит активный поиск врачом актуальных проблем, в данном контексте связанных с заболеванием органов дыхания и общими проявлениями. Это ещё не диагноз, но предельно важный этап к тому, чтобы рационально и эффективно построить рабочую гипотезу, разо¬ браться в болезни своего пациента и поставить диагноз. Наиболее часты жалобы больных с патологией дыхательной системы на появление кашля, одышки, боли в грудной клетке и повышение температуры тела. Логика данного процесса диктует проведение конкретных диагностических процедур. Так, если актуальная пробле¬ ма у больного одышка, то обычно врач предлагает ему аналоговую шкалу Борга, с тем чтобы, с позиций больного человека, оценить степень её выраженности. Необходимые диагностические процедуры — тест с шестиминутной ходьбой, про¬ ведение пульсоксиметрии, рентгенологическое исследование органов дыхания, а также электрокардиографическое исследование. Вновь вернёмся к актуальной проблеме одышки, которая, с позиций проблемно ориентированной медицины, диктует проведение определённого диагностического алгоритма. Субъективная оценка больным своей жалобы на одышку — аналоговая шкала Борга; пульсокси- метрия предполагает сделать первый шаг в оценке транспорта кислорода и вьще- лить больных с гипоксемией; рентгенография органов грудной клетки может дать принципиальную диагностическую информацию о причинах, приведших к раз¬ витию одышки (опухоль лёгких, плеврит, пневмоторакс и другие болезни органов дыхания). Наконец, необходимо снять ЭКГ с тем, чтобы исключить возможную патологию сердца (острый инфаркт миокарда, постинфарктный кардиосклероз и другие причины). Каждая из проведённых диагностических процедур может поставить новые актуальные проблемы в оценке состояния лёгочного здоровья пациента. Так, можно рассмотреть несколько клинических примеров. При рентге¬ нологическом исследовании органов грудной клетки выявляется опухолевая масса в лёгких, что в последующем требует проведения целенаправленных диагности¬ ческих процедур, которые позволят верифицировать морфологический субстрат опухоли, её анатомическую распространённость, вовлечение в процесс лимфати¬ ческого аппарата и наличие метастазов.Таким образом, проблемно ориентированная медицина позволяет врачу осу¬ ществить последовательно ряд диагностических алгоритмов, сделав свою работу рациональной и высокоэффективной, сохраняя при этом необходимые высокие принципы гуманистической медицины. Целесообразно не только фиксировать актуальные проблемы легочного здоровья обследуемого больного, но и сразу намечать, с помощью каких диагностических процедур будут разрешаться выяв¬ ленные актуальные проблемы.Существует много рекомендаций по сбору анамнеза у больных с заболевания¬ ми органов дыхания. Так, важным является сбор эпидемиологического анамнеза. Пребывание больного в разных географических зонах земного шара и различных странах может помочь врачу в разрешении сложных диагностических вопросов. Особенно это касается больных, у которых актуальной проблемой является лихо¬ радка неясной этиологии. Профессия больного человека и его профессиональный маршрут также могут сыграть важную роль в постановке диагноза. Так, если боль¬ ной с гранулематозным процессом в лёгких работал на химических предприятиях по производству бериллия, то вполне вероятно, что гранулематозный лёгочный процесс обусловлен депонированием солей бериллия в лёгочной ткани. Предельно
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ 23актуально собрать генеалогический анамнез. Современный уровень знаний позво¬ лил существенно расширить наши представления о генетических факторах в воз¬ никновении значительной группы заболеваний органов дыхания. Обязательным пунктом в сборе анамнеза является постановка диагноза у табакокурильщиков. При этом следует учитывать стаж (пачка-лет) и интенсивность табакокурения (количество выкуренных сигарет в течение суток необходимо умножить на 12). Если индекс табакокурения превышает 120, то у больного возникают болезни, вызванные курением табака. У взрослого человека необходимо собрать анамнез по заболеваниям органов дыхания в детском возрасте. Многие заболевания лёгких у взрослого человека начинаются в детском возрасте; в качестве примера можно привести бронхиальную астму, туберкулёз, муковисцидоз. Возраст, пол, профес¬ сия, путешествия, семейный и лекарственный анамнез, а также сопутствующие заболевания должны учитываться врачами при анализе болезни дыхательной системы человека. При сборе анамнеза необходимо провести детальный разбор по наиболее частым жалобам больных, с которыми они обращаются к врачам. К этим жалобам относятся одышка, боль в грудной клетке, кашель и в разной степени проявления интоксикационного синдрома. В настоящее время существует боль¬ шое количество различных вариантов вопросников, которые позволяют, с одной стороны, больному более полно осветить жалобу, с другой стороны — врачу иметь достоверную информацию о болезных проявлениях у человека и не упустить в процессе сбора анамнеза важных аспектов её проявления. В исследовательских целях, но уже и в практической деятельности врачей стали встречаться технологии телемедицины. Так, они стали применяться при ведении больных бронхиальной астмой и муковисцидозом. Электронное досье на больного человека и ежеднев¬ ный дневник, отражающий основные жалобы и приём лекарственных средств, позволяют качественно повысить эффективность проводимого лечения. Следует ещё раз подчеркнуть, что ближайшей целью кропотливой работы по сбору данных анамнеза жизни и болезни является попытка сформировать актуальные проблемы болезни человека для того, чтобы наметить диагностическую программу для реше¬ ния вопроса о диагнозе болезни.Врачи с большим опытом клинической работы часто сетуют на то, что их начи¬ нающие коллеги мало уделяют внимания общему клиническому обследованию, сбору анамнеза, неохотно применяют метод перкуссии и аускультации, а отдают предпочтение инструментальным методам обследования. Этот процесс повсеме¬ стен. Действительно, искусство аускультации и перкуссии требует большого усер¬ дия со стороны врача, эти навыки приходят с годами, когда накапливается опыт клинической работы с больными, страдающими заболеваниями дыхательной системы, О сложности клинической работы в области респираторной медицины говорит и такой факт, что в ней, как в никакой другой области медицины, сконцен¬ трировано большое количество врачебных специальностей: пульмонолог, аллерго¬ лог, фтизиатр, онколог, торакальный хирург, реаниматолог, врач общей практики, реабилитолог, профпатолог. В области респираторной медицины также тесно взаимодействуют врачи таких специальностей, как кардиолог, ревматолог, отола* ринголог, гематолог и многие другие специалисты. Основные принципы осмотра больных остаются незыблемыми. Больной должен быть обследован в буквальном смысле «с головы до ног». Старая школа фтизиатров заложила эти прогрессивные принципы в обследование больных с патологией дыхательной системы. Так, кож¬ ные покровы головы могут помочь врачу в диагностике саркоидоза, лимфограну¬ лематоза, туберкулёза и многих других заболеваний. Патологические изменения кожных покровов встречаются при аллергических, онкологических заболеваниях, туберкулёзе, саркоидозе и целом ряде других болезней. В настоящее время, когда врачи во всём мире объединились в борьбе с табакокурением, обращается внима¬ ние на изменение кожных покровов у курильщиков. Симптоматология кожных
Si24МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХЛпатологических изменений касается как острых заболеваний {erythema nodosum, отёк Квинке и целый ряд других дерматологических синдромов), так и хрониче¬ ских {lupuspernio и др.).в респираторной медицине подчёркивается необходимость исследовать лим¬ фатическую систему у больного человека. Это важно делать особенно при таких заболеваниях, как саркоидоз, лимфопролиферативные заболевания, туберкулёз, рак лёгких. Врачу рекомендуется строго выполнять рекомендации по обследова¬ нию лимфатической системы у больного с патологией респираторной системы; порой необходимо применить такие методы диагностики, как рентгенография органов грудной клетки, сканирование с использованием галлия-67, позитрон эмиссионная томография, биопсия лимфатических узлов. Данные, получаемые уже после применения специальных методов обследования, обсуждают врачи раз¬ ных специальностей: рентгенолог, морфолог, онколог, радиолог, химиотерапевт и лечащий врач.Патология опорно-двигательного аппарата имеет большое значение в пони¬ мании тех изменений, которые происходят у человека со стороны дыхательной системы, примером может служить пневмония и дыхательная недостаточность при кифосколиозе, врождённой аномалии грудной клетки (грудь «сапожни¬ ка», «куриная грудь» и некоторые другие аномалии развития грудной клетки). Рекомендуется уделять внимание такому признаку, как «часовые стёкла» и «бара- банные палочки». Эти патологические изменения ногтевых фаланг могут свиде¬ тельствовать о фиброзирующем процессе в лёгочной ткани, развитии бронхоэкта- зов, бронхиолоэктазов и целом ряде других заболеваний дыхательной системы.Приступая к обследованию больного с заболеванием респираторной системы, необходимо обратить внимание на его питательный статус. Так, если больной имеет избыточный вес, то часто возникает проблема ночного апноэ, приводящего к развитию вторичной гипертонии малого круга кровообращения. Дефицит веса более характерен для больных эмфиземой, туберкулёзом, раком лёгкого и другими заболеваниями.Исследование ЛОР-органов имеет большое диагностическое и прогностическое значение. Многим хроническим заболеваниям с поражением нижнего отдела дыхательных путей предшествует развитие ринита. Классическим примером слу¬ жит бронхиальная астма, которой может предшествовать развитие аллергического или сезонного круглогодичного ринита. Иногда ринит на несколько лет предше¬ ствует возникновению клинических проявлений бронхиальной астмы. В другой клинической ситуации, когда наблюдается больной человек по поводу гнойных и кровянистых выделений из полости носа, могут проявляться и другие признаки гранулематозного процесса (гранулематоз Вегенера). Необходимо особенно под¬ черкнуть связь многих заболеваний верхнего отдела дыхательных путей с заболе¬ ваниями нижнего отдела дыхательного тракта.Рекомендуется исследовать полость рта. Некоторые инфекционные заболева¬ ния респираторной системы возникают вследствие аспирации секрета из полости рта в нижние отделы дыхательной системы. Особого внимания заслуживают ортодонтические операции с использованием металлоконструкций или же мате¬ риалов из пластмассы. Лёгкие могут реагировать на эти материалы самыми раз¬ нообразными реакциями: бронхиальная астма, гиперчувствительная пневмония, гранулематозный процесс, фиброз лёгких. Полость рта может стать источником серьёзных, порой инвалидизирующих по своему течению заболеваний.Осмотр грудной клетки в состоянии покоя и при акте вдоха и вьщоха имеет большое диагностическое значение, так как даёт представление об участии груд¬ ной клетки в дыхательном цикле. У больных с ограниченным участием левой или правой половины грудной клетки в акте дыхания можно предполагать образова¬ ние выпота в плевральную полость или развитие пневмоторакса, или же какие-то
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ25другие причины, которые привели к ассиметрии грудной клетки при дыхатель¬ ном цикле. Визуальный осмотр позволяет более подробно оценить дыхательную аритмию: если она проявляется, то всегда свидетельствует о тяжести заболевания. Выделяют тахипноэ, когда число дыхательных экскурсий превышает 22-24 в минуту; шумное и глубокое дыхание, которое можно наблюдать при кетоацидо- тической коме и известное как дыхание Куссмауля. Поверхностное неглубокое дыхание с периодами апноэ, которое во время следующих дыхательных циклов становится глубоким и шумным, известно как дыхание Чейна-Стокса; неправиль¬ ный тип дыхательных циклов, в котором можно наблюдать как циклы глубокого дыхания, так и поверхностного дыхания известны как дыхание Биота. На рис. 1-3 схематично представлены дыхательные циклы при различных формах нарушения дыхания.Приступая к непосредственному исследованию органов грудной клетки, врач использует традиционные методы: пальпацию, перкуссию и аускультацию. Каждый из классических методов обследования позволяет получить определён-1000-500-ФОЕа)ДО 700 мл, ЧД 12/мин I IЮООп500-ФОЕб)ДДАДДЛДЛЛДЛДдо 400 мл, ЧД 24/мин1000-500ФОЕ^./хАІМ МЛДО и ЧД варьируют' ! ' ' IРис. 1-3. Типы нарушения дыхатель¬ ных циклов (схема), а — дыхание в норме; б — тахипноэ, в “ дыхание Куссмауля; г — дыхание Чейна-Сгокса; д — дыхание Биота. ФОЕ — функциональная остаточная ёмкость; ДО — дыхательный объём.
Ш26 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХ“У*® диагностическую информацию. При пальпации грудной клетки исследуют ригидность, синхронность участия левой и правой половины в акте дыхания. :.гг Определённую диагностическую ценность имеет определение голосового дрожа¬ния. Исследование рекомендуется проводить в определённой последовательности: начинать следует с верхних отделов грудной клетки и двигаться в сторону диа- фрагмы. Это условие необходимо соблюдать также при проведении перкуссии и > аускультации. Соблюдение методики обследования больного позволяет получить в более полном объёме диагностическую информацию. На рис. 1-4,1-5 (см, цвет¬ ную вклейку) схематично изображена последовательность проводимой пальпа¬ ции, перкуссии и аускультации лёгких. С приобретением клинического опыта врач приобретает навыки обследования больных полных, кахектичных и нормального телосложения.Перкуссия — один из основных методов физикального обследования больного с патологией органов дыхания. Во время проведения перкуссии выявляется патоло¬ гический характер лёгочного звука: тупость, укорочение, тимпанический оттенок. Перечисленные изменения лёгочного звука помогают в постановке таких диагно¬ зов как пневмония, плеврит, пневмоторакс и других лёгочных заболеваний.Аускультация лёгких является необходимым методом обследования больных с патологией органов дыхания. Методическая последовательность в проведении аускультации позволяет получить необходимую информацию для диагностики таких заболеваний, как бронхиальная астма, пневмония, стридор, интерстициаль¬ ные заболевания лёгких, застойная сердечная недостаточность и целый ряд других заболеваний органов дыхания.ВОЗ рекомендует повсеместно внедрять исследование функции дыхания. На рис, 1-6 (см. цветную вклейку) изображено проведение исследования пиковой скорости выдоха.В заключение хотелось бы отметить, что в процессе первого знакомства с паци¬ ентом, на этапе сбора анамнеза жизни и болезни и данных физикального обследо¬ вания врач должен стремиться выделить наиболее актуальные проблемы лёгоч¬ ного здоровья своего пациента. Это позволит ему в более короткие сроки решить вопросы диагноза и назначить лечение, порой спасающее жизнь человека.
Глава 2МикробиологическаядиагностикаВ настоящее время описано более 100 микроорганизмов, спо¬ собных вызывать инфекции нижних дыхательных путей (ИНДП), почти все они были хотя бы однократно обнаружены при биопсии лёгочной ткани (рис. 2-1).У амбулаторных пациентов с внебольничными пневмониями (ВП) и хронической обструктивной болезнью лёгких (ХОБЛ) рутинные микробиологические исследования не рекомендуются. Только при неэффективности стартовой эмпирической антимикроб¬ ной терапии (AMT) показано бактериологическое исследование мокроты. Серодиагностика может понадобиться в период эпидемийГРИБЫAspergillus spp.Blastomices dermatidäis Candida spp.Coccidioides immitis Cryptacoccus neoformans flistoplasma capsulatum Pneumocystis jiroveci ZygomycetesВИРУСЫАденовирусы Вариаделла-зостер Гриппа А и В Парагриппа Простого герпеса Респираторно-синцитиальный ТОРС* (коронавирусы) Цитомегаяовирусы Энтеровирусы Эпштейна-Барр ПРОСТЕЙШИЕ Toxoplasma gondii ГЕЛЬМИНТЫ Ascaris lumbricoides Paragonimus spp.Strongiloides stercoralis Trichinella spirulisБАКТЕРИИУсловные патогеныАэробы и факультативные аначробыStreptococcus pneumoniae Streptococcus pyogenes StaphylococcHS aureus Klebsiella pneumoniae Прочие Enterobacteriaccae Haemophilus influenzae Moraxella catarrhalis Legionella spp.Neisseria meningitidis Pseudomonas aeruginosa Acinetohacter spp. Nocardia asteroides Облигатные анаэробы Actinomyces israelii Acidaminococcaceae Peptostreptococcaccae Eubacteriaceae Anaemrhabdus fitrcosa Bilophila wadswonhia Fmobacteriaccae PrevotellaceaeОблигатные патогеныBacillus anthracis. Francisella tularensis Pseudomonas pseudomallei Yersinia pestisМикобактерииMycobacterium tuberculosis Mycobacterium spp.ХламидинCklamydophila pneumoniae Chlamydophila psittaci Chlamydia trachomatisМикоплазмыMycoplasma pneumoniaeРиккетсивCoxiella burnetiiРис. 2-1. Этиологические агенты при ИНДП. *ТОРС — тяжёлый острый респираторный синдром.
28 МЕТОДЫ ОбСЯЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХлегионеллёза, микоплазменной, вирусной инфекции или по особым клиническим ^ эпидемиологическим причинам.Набор исследований, проводимый госпитализированным пациентам, опреде¬ ляется тяжестью заболевания, наличием эпидемиологических факторов риска, неэффективностью проводимой эмпирической AMT.Характеристика биологических материаловМОКРОТАМокрота — наиболее досгупный для анализа материал. Для исследования у больных собирают утреннюю порцию мокроты натощак в объёме 3-5 мл в стерильные флаконы с плотно завинчивающейся крышкой. Желательно пред¬ варительно почистить зубы и прополоскать рот кипячёной водой или раствором натрия гидрокарбоната (1 чайная ложка на стакан воды). Если пациент плохо выделяет мокроту или откашливает её эпизодически и в скудном объёме, то нака¬ нуне вечером и рано утром в день сбора мокроты ему следует дать отхаркиваю¬ щее средство. При подозрении на туберкулёз, пневмоцисгную и легионеллёзную пневмонию необходимо применять раздражающие аэрозольные ингаляции путём вдыхания в течение 10-15 мин 30-60 мл подогретого до 42-45 °С раствора, при¬ готовленного на стерильной дистиллированной воде, содержащего 150 г/л натрия хлорида и 10 г/л натрия бикарбоната. Получаемая индуцированная мокрота по качеству идентична откашливаемой мокроте [10].Для диагностики острой бактериальной инфекции достаточно одного образца мокроты, при исследовании на туберкулёз или грибковую инфекцию собирают утреннюю мокроту 3 дня подряд.сроки доставки мокроты в лабораторию не должны превышать 1,5-2 ч от момента её получения, так как задержка ведёт к аутолизу Streptococcus pneumoniae, а размножение бактерий-контаминантов изменяет истинное соотношение микро¬ флоры бронхиального секрета.Перед посевом мокроту промывают в стерильном 0.9% растворе натрия хло¬ рида, готовят мазки для микроскопии, разжижают муколитиками или гомоге¬ низируют в асептических условиях в ступке со стерильным песком, производят десятикратные серийные разведения в бульоне, из которых делают дозированные высевы на питательные среды с последующей количественной оценкой каждого типа колоний выросших микроорганизмов.Образцы, отправляемые в референсную лабораторию для посева на микобакте¬ рии туберкулёза (МВТ), перевозят в охлаждённом состоянии или их изначально обрабатывают 0,9% раствором натрия хлорида во флаконах или пробирках с плот¬ но завинчивающимися крышками, которые помещают в предназначенный для транспортировки контейнер. Образцы для вирусного культивирования должны быть охлаждёнными, но не замороженньпйи, в то время как для культивирования на хламидии образцы для транспортировки помещают в сахарозо-фосфатную среду и замораживают.При исследовании на МВТ для разжижения мокроты перед посевом её обра¬ батывают муколитиком в течение 24-48 ч и проводят деконтаминацию от посто¬ ронних бактерий 2% раствором каустической соды по Ганеману (не более 15 мин). Затем образцы центрифугируют, осадок микроскопируют и производят посев.ПРОМЫВНЫЕ ВОДЫ БРОНХОВПациенту во время вдоха специальным шприцем в трахею вводят 7-10 мл стерильного изотонического раствора натрия хлорида, вызывающего кашле¬ вой рефлекс для получения секрета из глубоких отделов бронхиального дерева. Промывные воды бронхов (ПВБ) собирают в стерильный флакон и немедленно
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА29отправляют в лабораторию* Недостаток — значительное разведение трахеоброн¬ хиального содержимого снижает концентрацию бактерий примерно в 100 раз по сравнению с мокротой.ТРАНСТРАХЕАЛЬНЫЙ АСПИРАТАспират из трахеи (ТТА) и дренирующих бронхов получают с помощью брон¬ хоскопа. В отличие от мокроты ТТА можно исследовать на анаэробы.БРОНХОАЛЬВЕОЛЯРНЫЙ СМЫВБронхоальвеолярный смыв (БАС), при котором промывают сегмент лёгких сте¬ рильным изотоническим раствором натрия хлорида, имеет наибольшее значение при постановке диагноза пневмонии, вызванной микобактериями, Pneumocystis jiroveci у больных СПИДом, цитомегаловирусом (ЦМВ) у пациентов с иммуноде¬ фицитом или после трансплантации органов. БАС можно использовать для куль¬ туральной диагностики легионеллёзной, хламидийной и вирусной инфекций и для изучения с помощью молекулярных методов.Дополнительно можно готовить окрашенные мазки из осадка после центрифу¬ гирования жидкости для выявления бактерий, МТБ, легионелл и грибов, у боль¬ ных с иммунодефицитом — пневмоцист.БРАШ-БИОПТАТМатериал получают из бронхов специальной канюлей с защищёнными щётка¬ ми (ЗЩ) с помощью фиброоптического бронхоскопа. Принцип метода состоит в использовании системы выдвижных каналов, предохраняющих материал от конта¬ минации микрофлорой ротоглотки при введении и удалении бронхоскопа из ниж¬ них отделов дыхательного тракта. Браш-биоптат заливают 1 мл стерильного 0,9% раствора натрия хлорида или раствора Рингера лактата в асептических условиях и доставляют в лабораторию. Диагностический титр составляет >10^ КОЕ/мл,ПЛЕВРАЛЬНАЯ ЖИДКОСТЬПеред пункцией плевральной полости кожу обрабатывают 70% этиловым спир¬ том, затем 1-2% раствором йода, который после завершения процедуры удаляют 70% этиловым спиртом. Плевральную жидкость (ПЖ) собирают стерильным шпри¬ цем и помещают в анаэробную транспортную систему или отправляют её в шприце, предварительно сняв (или загнув) иглу и надев на канюлю шприца защитный сте¬ рильный колпачок. Для вьщеления бактерий необходимо 1-5 мл ПЖ, грибов или микобактерий — не менее 10 мл. При большом количестве материала производят посев в аэробные и анаэробные флаконы со средой для гемокультур в объёмном соотношении 1:3-1:10. Взятие ПЖ тампоном не рекомендуется. Нежелательно применять антикоагулянты (натрия цитрат), подавляющие рост некоторых видов бактерий, при необходимости лучше использовать гепарин натрия.ПУНКТАХ ИНФИЛЬТРАТА ИЛИ АБСЦЕССА ЛЁГКОГООбразцы получают при трансторакальной пункции под рентгенологическим контролем. Материал из абсцесса включает не только гной, но и ткань капсулы, отграничивающей абсцесс. Гной собирают шприцем, в котором его доставляют в лабораторию, либо содержимое переносят в анаэробные системы для транспор¬ тировки. Использование тампонов для взятия гноя на анаэробное исследование запрещено.БИОПТАТ ЛЁГОЧНОЙ ТКАНИОткрытая биопсия лёгкого позволяет получить необходимый объём ткани для гистологического и микробиологического исследований. Свежесрезанную поверх¬ ность используют для приготовления мазков-отпечатков с последующей окраской
30 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХна легионеллы, пневмоцисты и грибы. Около 1/3 или 1/2 части образца раз¬ мельчают в асептических условиях в ступке с абразивным веществом с помощью пестика, либо в механическом гомогенизаторе. Размельчённую суспензию или гомогенизированный экстракт используют для посева на легионеллы. Экстракт центрифугируют, из осадка готовят окрашенные мазки для выявления пневмо¬ цист. Оставшуюся часть образца размельчают (или гомогенизируют) для после¬ дующего микроскопического изучения и культурального исследования суспензии (или экстракта) на бактерии, грибы, вирусы, микоплазмы, хламидии. Гомогенат можно использовать для изучения молекулярно-генетическими методами.КРОВЬ НА ГЕМОКУЛЬТУРУКровь целесообразно исследовать в первые 3-4 дня от начала заболевания. Производят посев двух образцов крови, взятых раздельными венепункциями с интервалом в 30-40 мин. Если в предшествующие 1-2 нед больному проводилась AMT, кровь на посев берут 2-3 раза в сутки в течение 3 дней. Не следует собирать кровь из внутрисосудистых катетеров, кроме случаев, когда предполагают сепсис катетерного происхождения.Кожу над пунктируемой веной тщательно обрабатывают 70% этиловым спир¬ том, затем 1-2% настойкой йода в течение 30 с (обработку кожи начинают от центра будущего прокола по направлению к периферии). Дают высохнуть обрабо¬ танному участку кожи, затем производят венопункцию, после чего вновь обраба¬ тывают ^'часток 70% этиловым спиртом для удаления избытка йода.Посев осуществляют во флаконы с питательными средами для аэробного и ана¬ эробного культивирования. Перед использованием флаконов визуально опреде¬ ляют прозрачность среды: любое помутнение свидетельствует о её непригодности. Флаконы хранят в холодильнике, перед использованием (за 30-60 мин) - при комнатной температуре. Оптимальный объём крови для исследования у взрослых составляет 20-30 мл, соотношение крови и жидкой питательной среды должно быть 1:5-1:10.При отсутствии флаконов для гемокультур используют 20-миллилитровый шприц. В шприц предварительно набирают 0,5-0,7 мл стерильного гепарина, заме¬ няют иглу и затем пунктируют вену. Набирают 10 мл крови (для дополнительного исследования на анаэробы — 15 мл), перемешивают её с гепарином осторожным покачиванием шприца (иглу с него не снимают) и в этом же шприце с согнутой у основания иглой отправляют в лабораторию. Посевы крови инкубируют не менее7 дней и ежедневно контролируют наличие роста.МОЧАДля посева исследуют утреннюю среднюю порцию свободно выпущенной мочи в объёме 3-5 мл, используя стерильные ёмкости. Предварительно осуществляют тщательный туалет наружных половых органов с мылом и кипячёной водой. Посев мочи следует проводить не позднее 2 ч после взятия материала либо в течение 8 ч при условии её хранения в холодильнике. Нежелательно исследовать мочу, полу¬ ченную катетером. При наличии постоянного катетера протирают его наружное отверстие 70% спиртом, затем шприцем с иглой через отверстие собирают мочу и переносят её в стерильную ёмкость (собирать мочу из мешка нельзя!).При проведении скрининговых исследований на МТБ мочу (в объёме не менее 20 мл) исследуют 3 дня подряд. Для проведения вирусологических исследований (на аденовирусы, ЦМВ) мочу в замороженном виде в объёме 10-15 мл доставляют в лабораторию.Мочу также исследуют на наличие пневмококкового и легионеллёзного анти¬ генов.
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА 31МАЗКИ ИЗ НОСА, ЗЕВА И СМЫВЫ ИЗ РОТОГЛОТКИОбразцы используют для выявления респираторных вирусов. Мазки из зева исследуют на наличие Chlamydophila pneumoniae. Mycoplasma pneumoniae, Legionella spp. методом полимеразной цепной реакции (ПЦР).СЫВОРОТКА КРОВИОбразцы сыворотки крови изучают с помощью серологических методов в острый период инфекции и у реконвалесцентоБ для диагностики ВП, вызванных Legionella pneumophila, С. pneumoniae. Chlamydia psittaci, М. pneumoniae, S. pneumo¬ niae, вирусами и грибами.Прямые методы изучения образцовМЕТОДЫ МИКРОСКОПИИМикроскопический метод изучения нативных и окрашенных препаратов, в том числе с использованием меченных флюорохромом специфических антисыворо¬ ток (антительные диагностикумы), обеспечивает быструю предварительную или окончательную диагностику ИНДП и позволяет судить об адекватности материала (в первую очередь мокроты).При исследовании мокроты начальный этап — отбор гнойных или опалесци- рующих участков и перенос их в стерильную чашку Петри. Интересующая часть образца используется для приготовления влажного или окрашенного по Граму мазка для микроскопии. Дифференциацию слущенных эпителиальных клеток (СЭК)» реснитчатых эпителиальных клеток, альвеолярных макрофагов и гистио¬ цитов проводят под малым увеличением микроскопа (объектив х10). Присутствие большого числа СЭК (>25 в поле зрения) свидетельствует о контаминации микро¬ флорой ротоглотки. Такой образец не пригоден для посева, и материал следует взять повторно. Преобладание в образце полиморфно-ядерных лейкоцитов (ПЯЛ), клеток реснитчатого эпителия или альвеолярных макрофагов при отсутствии или незначительном числе СЭК (<10 в поле зрения) свидетельствует о наличии секрета из нижних отделов дыхательного тракта, который подлежит дальнейшему иссле¬ дованию с помощью иммерсионного объектива при увеличении в 1000 раз и посе¬ ву. Диагностический критерий качества мокроты — наличие не менее 25 ПЯЛ и менее 10 СЭК при исследовании в 10 полях зрения под малым увеличением микро¬ скопа. Цитологическая оценка пригодности мокроты важна для бактериального исследования, но не для культуральной индикации МВТ, грибов и вирусов, где перед культивированием производится деконтаминация образцов, используются селективные феды, а обнаружение МВТ, патогенных грибов или вирусных изо- лятов не вызывает сомнения в их клинической значимости.Под большим увеличением (иммерсионный объектив хЮО) изучают морфоло¬ гию бактерий. Чувствительность микроскопического метода при окраске по Граму по разным оценкам варьирует от 35 до 96%, а специфичность — от 12 до 85% [11]. Его диагностическое значение, в основном, ограничивается пневмококковой инфекцией, где совпадение с результатами культуральной диагностики составляет 75% [8].У взрослых при ВП, вызванных Н. influenzae, высокую диагностическую цен¬ ность имеет исследование ТТА и БАС. Присутствие в образцах большого числа плеоморфных тонких коккобацилл, часто внутри ПЯЛ, достоверно свидетельству¬ ет в пользу пневмонии, обусловленной гемофильной палочкой.Среди других возможных возбудителей ИНДП Moraxella catarrhalis — коммен¬ сал ВДП, а носительство Neisseria meningitidis в ротоглотке может варьировать от 10% у взрослого населения до 70% у военнослужащих в закрытых воинских коллективах. Обнаружение в мокроте или ТТА большого числа грамотрицатель-
32МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХных диплококков, локализованных внутри и вне ПЯЛ, с высокой вероятностью свидетельствует о возможном участии в этиологии пневмонии морфологически сходных между собой М, catarrhalis или Neisseria Ц)р.Для выявления МВТ микроскопические методы при окраске мазков по Цилю- Нильсену и флюоресцентным красителем имеют одинаковую чувствительность (до 50%) и специфичность (до 99%) [6]. Для обнаружения МВТ в световом микро- скопе при окраске по Цилю-Нильсену необходимо содержание в мокроте не менее 5000-10 ООО КОЕ/мл. При окраске мазка аурамин-родамином микроскопия ста¬ новится более продуктивной в рутинных исследованиях, так как за равный проме¬ жуток времени в люминесцентном микроскопе при малом увеличении (объектив х25) можно просмотреть больше полей зрения, чем в световом микроскопе под иммерсией (объектив х90).При диагностике актиномикоза лёгких материалом для микроскопии служат гной, мокрота, плевральная жидкость, пунктаты закрытых очагов поражения, биопсийный материал. Наиболее подходящие для исследования — твёрдые зерни¬ стые образования, из которых сначала готовят неокрашенные препараты в капле 10% щёлочи или смеси спирта с глицерином, затем мазки, окрашенные по Граму и Цилю-Нильсену. При малом увеличении микроскопа видны комочки (друзы) с плотным, тёмным центром, с лучистыми образованиями по периферии, которые в дальнейшем изучают под большим увеличением микроскопа. Обнаружение друз, мицелия, отдельных веточек и цепочек из спор — ценное подтверждение актино¬ микотической природы болезни.Прямая фазово-контрастная микроскопия бронхиального секрета позволяет проводить быструю идентификацию грибов Blastomyces dermatitidis, Coccidioides immitis. Cryptococcus necformans и Aspergillus spp,, добавление специальных красите¬ лей позволяет улучшить очертания элементов гриба, включая R jiroveci.Для обнаружения L. pneumophila непосредственно в мокроте, ТТА, БАС, биопта- тах ткани лёгкого применяется реакция прямой иммунофлюоресценции (РИФ), которую требуется подтверждать любым другим методом: культуральным иссле¬ дованием, определением антигена в моче, либо серологическими реакциями с сьгоороткой крови больного.Для определения антигенов Р. jiroveci в индуцированной мокроте и БАС можно использовать РИФ с моноклональными антителами. Преимущество метода — высокая чувствительность (90-97%) и быстрое получение результатов, недоста¬ ток — техническая сложность исполнения [2].РИФ позволяет диагностировать инфекции, вызванные респираторно¬ синцитиальным вирусом (РСВ), вирусами гриппа А и В, парагриппа, аденовиру¬ сами, вирусом кори.МЕТОДЫ ВЫЯВЛЕНИЯ АНТИГЕНОВВ качестве дополнительного метода диагностики пневмококковой пневмонии рекомендован иммунохроматографический тест для выявления антигена (АГ) S. pneumoniae в моче в течение 15 мин (чувствительность — 86%, специфичность — 94%).При диагностике легионеллёзной пневмонии рекомендованы ИФА и радио- иммунологический метод для выявления в моче АГ I. pneumophila серогруппы 1, на долю которой приходится 70-90% всех наблюдений болезни легионеров. Их чувствительность достигает 80-99 и 99%, специфичность — 99 и 100%, соответ¬ ственно [12].При криптококкозе определяют наличие АГ Cryptococcus neoformans в БАС, плевральном экссудате, сыворотке крови и ликворе, а при аспергиллёзе исполь¬ зуют ИФА для выявления в сыворотке крови белкового АГ (галактоманнана), превалирующего в клеточной стенке Aspergillus spp. При лёгочном бластомикозе в
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА 33сыворотке крови, моче и БАС можно выявить АГ Blastomyces dermatitidisy больных в зависимости от формы инфекции (локализованная или генерализован¬ ная) [1].В назофарингеальном аспирате, БАС и мокроте в инфицированных эпители¬ альных клетках с помощью РИФ и ИФА можно быстро обнаружить АГ вирусов гриппа, парагриппа, аденовирусов, ЦМВ в ранние сроки заболевания.Культуральная диагностикаБАКТЕРИОЛОГИЧЕСКАЯ ДИАГНОСТИКАМокроту засевают на питательные среды, если она удовлетворяет цитологи¬ ческим критериям. Для первичного посева достаточно использовать чашки с кровяным агаром, обеспечивающим рост неприхотливых микроорганизмов и 5. pneumoniae, и с шоколадным агаром для культивирования Н. inßuenzae и ряда других прихотливых бактерий. Чашки инкубируют в атмосфере 5% COj для улуч¬ шения роста пневмококков.Селективные обогащённые среды используют, если при микроскопическом исследовании в мазках превалируют расположенные внутри и вне клетки грам- отрицательные диплококки или когда предполагается легионеллёзная инфек¬ ция.ТТА, плевральную и лаважную жидкости сеют в аэробных и анаэробных услови¬ ях. У пациентов с тяжёлой пневмонией, госпитализированных в отделение общего профиля, целесообразно использовать среды для вьщеления грамотрицательных бактерий (агар МакКонки, агар Эндо).Повторное микробиологическое исследование мокроты проводится при нека¬ чественно взятом материале при первом исследовании, неэффективности AMT, затяжном течении пневмонии, появлении рентгенологических, клинических, лабораторных данных, указывающих на возникновение суперинфекции, выделе¬ нии нетипичных условных патогенов в диагностических титрах.При пневмонии необходимо сеять кровь, несмотря на то, что частота роста гемокультуры при внебольничной инфекции не превышает 37%, а при нозокоми¬ альной пневмонии составляет менее 25% [7].Диагностика микобактерийПосле разжижения мокроты и центрифугирования из осадка производят высевы на яичную среду (Левенштейна-Йенсена) или агаровую основу (среда Миддлбрука 7Н10). Селективные среды содержат ингредиенты, тормозящие рост сопутствующих бактерий и грибов. Инкубацию проводят во влажной атмосфере с содержанием 8-12% диоксида углерода. Образцы можно инокулировать в жид¬ кую среду с ^^С-пальмитиновой кислотой, используя радиометрический метод и аппарат ВАСТЕС 480ТВ. Чувствительность радиометрического метода достигает 10 КОЕ/мл, а исследование в среднем занимает 18 дней, обычным методом — 36 дней [13].Диагностика аэробных актиномицетовАэробные патогенные актиномицеты включают роды Nocardia, Streptomyces, Actinomadura и Rhodococcus, Micromonospora, Micropolyspora, Thermoactinomyces и Saccharomonospora. Они вызывают пневмониты (альвеолиты) и хорошо растут (в течение 3-7 дней) на простых бактериальных и грибковых средах при 50 '’С во влажной атмосфере. Идентификацию актиномицетов проводят по морфологиче¬ ским признакам колоний, микроскопическому строению микроорганизмов, спо¬ собности гидролизовать различные субстраты, взаимодействию чистых культур с антительными диагностикумами в серологических реакциях.
34 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХДиагностика грибовЛабораторную диагностику пневмомикозов проводят культуральным, гисто¬ логическим и серологическими методами. Для посева используют специальные среды. В отличие от бактерий, которые культивируют при 35 “С. посевы грибов инкубируют при 30 "С.Грибы рода Candida часто обнаруживают в БАС, но они редко бывают истинны¬ ми возбудителями ИНДП. Определение кандидозного АГ непосредственно в сыво¬ ротке крови или клинических образцах мало помогает в диагностике локального или диссеминированного кандидоза, поскольку ИФА выявляет его присутствие и у здоровых лиц.Инвазивный лёгочный аспергиллёз (ИЛА) встречается чаще, чем лёгочный кан- дидоз, в 90% наблюдений выделение аспергилл из мокроты и БАС связано с коло¬ низацией НДП [5]. В то же время при подтвержденном ИЛА лишь у 10% больных из мокроты были выделены Aspergillus spp. Необходимо производить посевы двух образцов, полученных при трансграхеальной лёгочной биопсии и методом ЗЩ. Для ранней диагностики ИЛА может быть полезным обнаружение аспергиллёзно- го АГ в сыворотке крови методом ИФА,Выделение с. пефгтап$ из респираторного тракта следует трактовать с осто¬ рожностью, так как в половине наблюдений у пациентов отсутствуют признаки поражения паренхимы лёгких, рентгенологические изменения и другие симптомы заболевания, это свидетельствует лишь о колонизации грибами [3]. Для под¬ тверждения диагноза криптококкоза помогает обнаружение криптококкового АГ в сыворотке крови и ликворе: его можно определять также в плевральном выпоте и БАС.В отличие от оппортунистических возбудителей пневмомикозов, выделе¬ ние патогенных диморфных грибов Blastomyces dermatitidis, Coccidioides immiUs, Histoplasma capsulatum, Paracoccidioides brasiliensis и Sporothrix schenckii из респира¬ торных образцов, ткани лёгких и биоматериалов других локализаций имеет несо¬ мненную клиническую значимость. Эти грибы существуют в мицелярной и дрож¬ жевой (или в виде сферул) формах. В среднем, их рост на средах появляется через 14 дней (грибов рода Candida — через 1-3 дня, Aspergillus spp. — через 4-7 дней). В рутинной практике посевы инкубируют до 4 нед у пациентов при серологически подтверждённой грибковой инфекции или у больных, получавших антигрибковую терапию при неустановленной этиологии инфекционного процесса, Прис>тствие орофарингеальной микрофлоры в респираторных образцах не препятствует интер¬ претации результатов посевов на диморфные грибы. При диссеминированной грибковой инфекции исследуют материалы из других анатомических областей. При генерализованном гистоплазмозе микроскопия окрашенных мазков костного мозга помогает поставить диагноз у 50% больных, положительный посев обнару¬ живается в 84% наблюдений [9]. Дополнительный диагностический тест — обна¬ ружение полисахаридного АГ Н. capsulatum в моче методом ИФА у 90% больных, однако этот тест может быть положительным и у пациентов с диссеминированной инфекцией, вызванной Р. brasiliensis, В. dermatitidis, Penicillium mam^ei [16].Диагностика хлаиидийУ детей хламидийную пневмонию, вызванную Chlamydia trachomatis, можно диагностировать методом РИФ, культуральным и серологическими методами. Для посева используют гетероплоидные мышиные клетки МакКой, которые инкуби¬ руют 40-72 ч, после чего исследуют наличие внутриплазматических включений хламидий при световой микроскопии. Более быстрый и чувствительный метод — РИФ при окраске культуры клеток моноклональными антителами.У С. psittaci вн>триплазматические включения выявляют после 5-10 дней инку¬ бации. Но чаще диагноз пситтакоза з'^станавливают серологическими методами.
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА 35С pneumoniae можно обнаружить при заражении респираторными образцами жшослоя культуры клеток HeLa-229. После инкубации в течение 3-5 дней готовят окрашенные специфическими моноклональными антителами препараты и изуча¬ ют в РИФ.Диагноз хламидийной пневмонии ставят серологическими методами. Однако у больных с иммунодефицитами, неспособными синтезировать в достаточном коли¬ честве антитела, может потребоваться культуральное исследование или использо¬ вание молекулярно-генетических методов.Диагностика микоплазмДля культивирования микоплазм используют специальную двухфазную среду и селективный агар. Рост типичных колоний обычно виден в конце 2-й недели инкубации, при отсутствии роста двухфазную среду инкубируют до 30 дней. Разрешающая способность культурального метода 10^ КОЕ/мл, при прямом опре¬ делении АГ в респираторном секрете методом ИФА — 10“* КОЕ/мл. Для диагноза ннфекции М. pneumoniae чаще используют определение специфических антител или ДНК-амплификационный тест.Диагностика вирусовДля заражения вирусами используют разные культуры клеток. Культуральный метод при изучении респираторных образцов более чувствительный, чем опреде¬ ление АГ, и занимает в среднем 3-4 дня при вирусе гриппа А и 8-9 дней при ЦМВ.Выделение вирусов гриппа, парагриппа, РСВ и риновирусов из респираторных образцов и ткани лёгкого имеет одинаково важное клиническое значение, в отли¬ чие от аденовирусов, вирусов простого герпеса (ВПГ) и ЦМВ, обнаружение кото¬ рых в респираторных образцах не столь существенно, как в ткани лёгкого.СеродиагностикаСеродиагностика основана на выявлении специфических антител (АТ) разных классов иммуноглобулинов (IgM, IgA, IgG) в сыворотке крови у инфицированных пациентов и определении их титров при однократном исследовании или в динами¬ ке заболевания (в парных сыворотках, взятых с интервалом 10-14 дней) с помо- [цью антигенных диагностику мов в различных серологических реакциях in vitro.Известны коммерческие наборы на основе ИФА и РНИФ для определения IgM и IgG к широкому кругу респираторных патогенов: Legionella spp., Francisella tularensis. Yersinia pestis, M. pneumoniae, C, pneumoniae, C. psittaci, Coxiella burnetii. Toxoplasma gondii, Trichinella spiralis, Strongiloides stercoralis, вирусов гриппа, пара¬ гриппа, PCB, аденовирусов, ТОРС-коронавирусов, ВПГ, ЦМВ, вирусов краснухи и оспы, Эпштейна-Барр.Для диагностики инфекции, вызванной С. pneumoniae, обычно используется метод микроиммунофлюоресценции (МИФ). Результат считается положительным при четырёхкратном увеличении титра АТ в парных сыворотках или при одно¬ кратном определении титра IgM >1:16 или IgG >1:512. Аналогичные критерии применяются для С. psittaci. Чувствительность МИФ составляет 39-100%, специ¬ фичность — 94-100% [14].При неонатальной пневмонии, вызванной С. trachomatis, титр видоспецифиче¬ ских IgM 1:32 — диагностический и коррелирует с результатами культуральной диагностики. Определение IgG малоинформативно из-за циркуляции у детей до 12 мес материнских АТ.Серологические тесты составляют основу диагностики микоплазменной инфек¬ ции. Холодовые агглютинины (ХА), выявляемые в реакции агглютинации с резус- отрицательными эритроцитами 0(1) группы крови при 4 X, присутствуют прибли¬
36 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХзительно у 50% больных ВП, обусловленной м. pneumoniae. Их уровень приходит в норму через 6 нед после острой инфекции. Однако ХА могут образовываться при целом ряде вирусных инфекций, лимфомах, аутоиммунных нарушениях, что снижает их диагностическую ценность, Комплементсвязывающие АТ выявляют в РСК у 85% пациентов, что согласуется с результатами культурального метода. При этом важно четьфёхкратное нарастание титров АТ, либо титр >1:80 при однократ¬ ном исследовании сыворотки, В последние годы получил развитие метод ИФА для выявления микоплазменных IgM и IgA; его чувствительность и специфичность выше, чем РСК [14]. IgM обнаруживаются на 1-й неделе заболевания и достигают пика на 3-й неделе, у взрослых они продуцируются нерегулярно, поэтому отри¬ цательный результат не исключает наличие инфекции. IgA более постоянны, их продукция не зависит от возраста пациентов.Определение АТ к С. albicans не позволяет провести дифференциальную диа¬ гностику локализованного и диссеминированного кандидоза, так как эти АТ при¬ сутствуют и у больных и у здоровых пациентов.РСК для выявления АТ к В. dermatitidis характеризуется низкой чувствитель¬ ностью и специфичностью (25%), титр АТ может повышаться при инфекциях, вызванных С. immitis и Histoplasma capsulatum. Иммунодиффузионный тест для выявления АТ к В. dermatitidis более чувствительный и специфичный (40-70%), чем РСК, Однако и отрицательный результат не исключает диагноз бластомикоза.При серодиагностике криптококкоза используют реакцию преципитации для определения IgM, которые обнаруживают на 2-3-й неделе заболевания у 75% больных. Комплементсвязывающие IgG появляются позднее, их титр 1:32 и выше предполагает возможность диссеминированной инфекции.При лёгочном гистоплазмозе у 90% больных определяются АТ к Я. capsulatum в РСК и методом иммунодиффузии, при диссеминированном процессе они встреча¬ ются в 80% наблюдений [17], Перекрёстные реакции наблюдаются при бластоми¬ козах, кокцидиоидомикозе и паракокцидиоидомикозе.Молекулярно-генетические методыОснову молекулярно-генетических методов составляет ПЦР и её модификации. Принцип ПЦР заключается в многократном повторении (амплификации) иссле¬ дуемых локусов нуклеиновых кислот термостабильной полимеразой для нара¬ ботки достаточного количества ДНК и обнаружения её методами электрофореза и гибридизации.Существуют наборы ПЦР для выявления отдельных микроорганизмов и одно¬ временного выявления нескольких возбудителей.Наиболее перспективна мультиплексная ПЦР в реальном времени, позволяю¬ щая определять наличие ДНК различных возбудителей в одной пробирке в тече¬ ние менее 3 ч. Принцип основан на непосредственном иммунофлюоресцентном определении амплифицированных генов по мере их генерации in vitro [15].Некоторые организмы трудно или невозможно выявить другими методами и молекулярная диагностика становится единственно возможной. Диагностическая специфичность и чувствительность могут достигать 98-100%.ЗаключениеЛаборатории клинической микробиологии играют важную роль в этиологиче¬ ской диагностике ИНДП. Надёжность результатов микробиологического исследо¬ вания зависит от целого ряда условий:• правильного получения адекватного материала;• своевременной его доставки в лабораторию в соответствующих средах или контейнерах;
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА37• преданалитической обработки образцов в соответствии с задачами исследова¬ ния;• чувствительности и специфичности используемых методов для выявления возбудителя и его маркеров;• грамотной трактовки результатов исследования в соответствии с клинически¬ ми, радиологическими и лабораторными данными пациента.СПИСОК ЛИТЕРАТУРЫ г
Глава 3Радиологические методыВведениеМетоды лучевой диагностики (синонимы: методы визуализации, методы диагностической радиологии) играют ключевую роль в выявлении, определении характера и распространённости патоло¬ гического процесса органов дыхания, а также в оценке эффектив¬ ности проводимого лечения.В течение последних 20 лет в торакальной радиологии произош¬ ли кардинальные изменения. В начале 70-х гг. XX века появи¬ лись первые образцы рентгеновских компьютерных томографов, и уже в середине десятилетия стало возможным аксиальное ска¬ нирование различных анатомических областей тела, в том числе и органов грудной полости на задержанном дыхании. В 80-х гг. разработана методика высокоразрешающей компьютерной томо¬ графии для изучения патологии лёгких, началось клиническое применение магнитно-резонансной томографии и ультразвуковых методов исследования, которые получили широкое распростра¬ нение в последнем десятилетии прошлого века, в том числе и при исследовании органов дыхания. В этот же период времени произо¬ шло становление спиральной технологии сканирования в компью¬ терной томографии. На её основе возникли первые клинические образцы программ для трёхмерных преобразований и методи¬ ки компьютерно-томографической ангиографии. Начало нового века характеризуется созданием КТ-аппаратов с многорядными детекторами и интенсивным внедрением в клиническую практику позитронно-эмиссионной томографии как в виде самостоятельного исследования, так и в сочетании с компьютерной томографией.В результате произошедших технологических изменений тради¬ ционное рентгенорадиологическое исследование больных с забо¬ леваниями органов дыхания переросло торакальную радиологию, использующую все современные методы лучевой диагностики:• традиционное рентгенологическое исследование;• рентгеновская компьютерная томография (КТ);• магнитно-резонансная томография (МРТ);• ультразвуковое исследование (УЗИ);• радионуклидные исследования;• позитронно-эмиссионная томография (ПЭТ), в том числе в сочетании с КТ (ПЭТ/КТ);• интервенционные диагностические и лечебные процедуры под лучевым наведением (рентгеноскопия, УЗИ, КТ).
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ 39Традиционное рентгеновское исследованиеИсторически все методики традиционного рентгеновского исследования раз¬ деляют на основные и специальные. Под этим подразумевается, что рентгеновское исследование органов грудной полости при любом виде патологии должно начи¬ наться с одной из основных методик и, в случае необходимости, продолжаться с использованием набора специальных методик. К основным методикам традици¬ онно относят обзорные изображения анатомической области, такие как рентгено¬ графия, рентгеноскопия или флюорография. Среди специальных методик принято выделять томографические исследозания (линейная томография, зонография), методики контрастирования и рентгенофункциональные исследования. Во второй половине прошлого века эти методики являлись основным инструментом обследо¬ вания больных с патологией органов дыхания, в том числе раком лёгкого.С внедрением в клиническую практику КТ, а также МРТ, УЗИ и ЭхоКГ, боль¬ шинство из них перестало использоваться или объём таких исследований значи¬ тельно уменьшился. Так, практически все методики контрастирования (бронхов, сосудов, плевральной и брюшной полости, средостения и перикарда) представ¬ ляют сегодня лишь исторический интерес. Вся необходимая информация об этих анатомических структурах может бьггь получена с помощью современных томо¬ графических технологий. Исключением являются ангиографические исследова¬ ния сосудов грудной полости в тех случаях, когда они являются составной частью интервенционных радиологических процедур. Многократно сократилось количе¬ ство линейных томографий, которые выполняются в тех лечебных учреждениях, где проведение КТ больным с лёгочной патологией не представляется возможным. Резко сократились показания к рентгеноскопии, она перешла из разряда основных методик рентгеновского исследования лёгочных больных в категорию специаль¬ ных методик, проводимых по специальным и относительно узким показаниям. Обычно это контроль состояния грудной полости после торакальных операций, выявление жидкости в плевральной полости или проведение инвазивных проце¬ дур под контролем рентгеноскопии,ПЛЁНОЧНАЯ РЕНТГЕНОГРАФИЯРентгенография является наиболее частой рентгенологической процедурой вооб¬ ще и органов грудной полости в частности. Исследование может представл5пъ собой обзорный снимок всей анатомической обласги в одной из стандартных проекций юш снимок части грудной полости. В первом случае речь идёт об обзорной рентге¬ нографии, во втором — о прицельных и парциальных рентгеновских снимках.Показанием к проведению рентгенографии является любое подозрение на патологический процесс в лёгких, средостении, плевральной полости или грудной стенке, а также оценка выявленных изменений в динамике.Специальной подготовки к проведению рентгенографии органов грудной поло¬ сти не требуется. Обзорные рентгенофаммы выполняют при вертикальном поло¬ жении пациента в двух проекциях — прямой передней и одной из боковых, правой или левой (рис. 3-1). При рентгенографии в прямой передней проекции пациента устанавливают лицом к вертикальной стойке и плотно прислоняют грудью к вос¬ принимающему устройству. Это может быть кассета с рентгеновской плёнкой, цифровая камера или другое приспособление. Плечи пациента опущены, подбо¬ родок приподнят. Для отведения лопаток кисти рук прижимают к бёдрам, а локти направляют вперёд.Кроме стандартного снимка в прямой передней проекции, аналогичные изобра¬ жения можно получить при исследовании в прямой задней проекции и в положе¬ нии лёжа на боку при горизонтальном ходе рентгеновских лучей (латерография). Эти снимки чаще выполняют вне рентгеновского кабинета, в условиях реанима¬ ции или приёмного покоя (рис. 3-2).
40 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 3-1. Обзорные рентгено¬ граммы органов грудной полости в пере^^ей прямой (а) и правой боковой (б) проекциях.Рентгенография в боковой проекции также проводится в вертикальном поло¬ жении. Пациент прижимается к воспринимающему устройству соответствующим боком, руки его подняты кверху и скрещены на голове. Оптимальный размер рент¬ геновской плёнки 30x40 см. Верхний край кассеты на уровне VI шейного позвонка, центральный пучок направляют на среднюю подмышечную линию, на ширину кисти ниже подмышечной ямки.Помимо рентгенографии в стандартных, прямой и боковой проекциях, обзор¬ ные снимки могут быть получены и в атипичных проекциях. Обычно это правая или левая косые проекции, когда пациент разворачивается соответствующим боком к кассете под углом 45°. В прошлом такие рентгенограммы имели большое значение для оценки состояния камер сердца. В настоящее время они практически не используются.Прицельные рентгенограммы выполняют для детализации изменений, выяв¬ ленных при обзорной рентгенографии. Они могут выполняться у вертикальной
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ 41Рис, 3-2. Рентгенограмма (а) и латерограмма (б) в положении больной на правом боку. При латерографии жидкость в правой плевральной полости растекает¬ ся вдоль боковой поверхности лёгкого.стойки, с использованием плёнки меньшего формата (парциальные снимки), или во время рентгеноскопии, когда пациент устанавливается в оптимальное поло¬ жение под визуальным контролем рентгенолога (рис. 3-3). Другим видом специ¬ альных рентгенографических исследований являются рентгенофуикциональные пробы, проводимые на выдохе, при натуживании (проба Вальсальвы) и других физиологических маневрах. Особым видом прицельных снимков являются рент¬ генограммы области верхушек лёгких в положении лордоза, часто используемые во фтизиатрической практике.
ш42МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 3-3. Рентгенограмма {а} и прицельный снимок, выпол¬ ненный при рентгеноскопии (б), в верхней доле правого лёгкого патологическое образование с нечёткими контурами - перифе¬ рический рак.Технологические стандартыДля обеспечения высокого качества рентгеновских снимков лёгких и вос¬ производимости рентгенографических данных обзорные рентгенограммы долж¬ ны выполняться с использованием оптимальных физико-технических условий. Современный стандарт предусматривает использование следующих параметров:• использование рентгеновских аппаратов, оснащённых высокочастотными трансформаторами, позволяющими достичь адекватной мощности генериро¬ вания рентгеновского излучения;• минимально возможная для данного типа рентгеновского аппарата выдержка, но не превышающая 0,04 с при исследовании в прямой проекции для исклю¬
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ 43чения динамической нерезкости от движений камер сердца и крупных сосу¬ дов;• жёсткое рентгеновское излучение при напряжении генерирования 120 кВ/с целью снижения контрастности изображения костных структур и массивных мягкотканных объектов, таких как средостение, диафрагма, грудная стенка;• использование отсеивающей решётки с отношением не менее 1:6 для устра¬ нения вторичного рассеянного излучения, возникающего при использовании жёсткого рентгеновского излучения;• фокусное расстояние не менее 150 см для устранения геометрической нерез¬ кости;• наличие фотоэкспонометра для автоматического выбора минимально доста¬ точной экспозиции;• наличие проявочного автомата для обработки экспонированной рентгенов¬ ской плёнки.Соблюдение указанных выше параметров позволяет стандартизировать техно¬ логию и избежать грубых ошибок, связанных с неправильным выбором физико- технических условий рентгенографии лёгких. Эта методика сокращает долю брака при рентгеновских исследованиях лёгких, а также упрощает сопоставление серий рентгеновских снимков, выполненных на разных рентгеновских аппаратах.Технологические стандарты American College of Radiology для рентгенографии лёгких у взрослых пациентов:• расстояние фокус/трубка 72 дюйма (182 см);• размеры фокусного пятна трубки не превышают 2 мм (рекомендуется 0,6- 1,2 мм);• обязательная коллимация (диафрагмирование) пучка излучения по размеру кассеты и фильтрация излучения;• чувствительность комбинации экран/плёнка 200 ед.;• использование жёсткого излучения (120-150 кВ);• применение средств снижения вторичного рассеянного излучения (решётка или воздушная прослойка), эквивалентных отсеивающей решётке с отноше¬ нием 10:1;• максимально допустимое время экспозиции 40 мс;• максимально допустимая доза на поверхности кожи не должна превышать3 мГр, что возможно при использовании автоматического фотоэкспонометра, жёсткого рентгеновского излучения, стандартного сочетания экран/плёнка и отсеивающей решётки 12:1.Рентгенография вне рентгеновского кабинетаРентгеновские исследования органов грудной полости могут выполняться как в рентгеновском кабинете, с использованием стационарного рентгеновского аппа¬ рата, так и в других помещениях лечебного учреждения. Обычно это приёмный покой, палата интенсивной терапии, отделение реанимации, операционная, пере¬ вязочная или процедурная и даже обычная палата. Это необходимо в тех случаях, когда пациенты в силу тяжести своего состояния или особенностей оказания им медицинской помощи не могут быть доставлены в рентгеновский кабинет. Частой причиной рентгенографии вне рентгеновского кабинета является проведение искусственной вентиляции лёгких, необходимость выполнения исследования в ходе хирургического вмешательства, экстренное исследование больного непосред¬ ственно при поступлении в приёмный покой.Рентгеновские исследования органов грудной полости, проводимые вне рент¬ геновского кабинета, разнообразны. Это может быть обычная рентгенография в стандартной или атипичной проекции^ выполняемая на передвижном рентгено¬ графическом аппарате, рентгеноскопия с использованием мобильного рентгено¬
44 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХхирургического аппарата. Такие исследования могут проводиться в различных положениях пациента — лёжа на спине, на боку, на животе, а также полулёжа или сидя. Рентгенография лёгких является наиболее частым лучевым исследованием пациентов в тяжёлом состоянии, которые не могут быть доставлены в отделение лучевой диагностики.Технологические стандарты American College of Radiology для рентгенографии лёгких на палатных аппаратах взрослых пациентов:• расстояние фокус/трубка 40-72 дюйма (100-182 см);• может применяться напряжение 70-100 кВ, если использование жёсткого излучения (120-150 кВ) невозможно;• отсеивающая решётка необходима при использовании напряжения более 100 кВ;• максимально допустимое время экспозиции составляет 100 мс.Значительным шагом вперёд в области рентгенографии лёгких на палатных аппа¬ ратах стало внедрение систем компьютерной радиографии в середине 80-х годов. Технологический принцип методики подробно описан в разделе «цифровая рент- генография»-. Весплёночная кассета со специальными экранами, покрытыми спе¬ циальным соединением фосфора, устанавливается позади больного, производится экспозиция, а затем кассета помещается в дигитайзер, который считывает скрытое изображение с экранов. На сегодняшний день это единственный и исключительно эффективный способ получения цифровых изображений вне рентгеновского каби¬ нета. Оцифровка рентгеноскопического сигнала в рентгенохирургических аппаратах фактически не является рентгенографией в прямом смысле этого слова.ЦИФРОВАЯ РЕНТГЕНОГРАФИЯЦифровая рентгенография прочно заняла своё место в арсенале традиционной рентгенодиагностики и постепенно вытесняет плёночную рентгенографию из повседневной практики. Цифровые рентгеновские аппараты, специально предна¬ значенные для исследования органов грудной полости, называются в нашей стране цифровыми флюорографами.Основные технологии цифровой радиографии основаны на использовании фосфорных запоминающих экранов, систем «экран—оптика—ПЗС» матрица и так называемых плоских панелей (flat panels). В нашей стране также использу¬ ются цифровые системы, основанные на сканирующем принципе получения изо¬ бражения, Основными преимуществами цифровой рентгенографии являются: более высокая информативность по сравнению с плёночным снимком, ускорение процесса получения изображения за исключением фотохимической обработки плёнки, возможность постпроцессорной обработки полученного изображения с помощью компьютерных программ, удобства хранения и передачи диагностиче¬ ской информации в цифровом виде.Системы компьютерной радиографии исторически являются первой разработкой для цифровой рентгенографии. Принцип действия этих систем основан на эффекте фотостимулируемой люминесценции (рис. 3-4), После прохождения через объект ослабленное рентгеновское излучение попадает на специальный экран, покрытый слоем люминофора. Экран размещён в стандартной кассете обычных размеров. Скрытое изображение, сформированное на экране, может сохраняться несколько часов. Для получения видимого изображения кассету помещают в дигитайзер, в котором она раскрьшается. Тонкий луч инфракрасного лазера построчно сканирует экран, вызывая свечение люминофора. Это свечение пропорционально количеству квантов рентгеновского излучения, попавшего на экран. Свечение экрана регистри¬ руется фотоэлектронным умножителем и преобразуется в электрические сигналы, из которых строится видимое изображение. Экран облучается вспышкой яркого света и может использоваться для следующей экспозиции.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ 45 ,ПЛАСТИНА={>экспозицияРЕНТГЕНОВСКАЯТРУБКАСТИРАНИЕЛАЗЕР<>СВЕТРис. 3-4. Схема рентгенографии с помощью запоминающих люминофоров.Фотоны Фотоны СцинтилляторПЗС-матрицаЛинзыЗеркалаРис. 3-5. Схема цифровой рентгенографии с использованием системы «экран-опт^ка-ПЗС- матрица».Вторая группа аппаратов использует воспринимающее устройство, состоящее из люминесцентного экрана, оптической системы и ПЗС-матрицы (ПЗС - при¬ бор зарядовой связи). Принцип действия этих приборов аналогичен плёночной флюорографии (рис. 3-5). Ослабленное рентгеновское излучение попадает на люминесцентный экран, вызывая его свечение. Видимое изображение фокуси-
46МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХруется системой линз до размера около 3 см^ и проецируется на ПЗС-матрицу, в которой происходит преобразование видимого света в электрические сигналы. После аналого-цифрового преобразования на экране монитора возникает диагно¬ стическое изображение. Время, необходимое для получения изображения, обычно составляет 8-15 с.Третья группа приборов основана на использовании полноразмерных матриц или плоских панелей. Каждая из таких панелей представляет собой совокупность множества дискретных детекторов, помещённых в рентгенопрозрачный корпус, каждый из которых самостоятельно воспринимает ослабленное рентгеновское излучение, а из совокупности множества сигналов формируется диагностическое изображение. Существует два основньгх типа подобных устройств.Первый из них основан на применении аморфного кремния. В качестве воспри¬ нимающего элемента на поверхности детектора используется соединение цезия и йода — СзГ, в котором ослабленное рентгеновское излучение преобразуется в световой сигнал (рис. 3-6), Сформированный световой поток достигает фотодио¬ дов на основе аморфного кремния, в которых свет преобразуется в электрические сигналы. С помощью аналого-цифрового преобразователя формируется цифровое изображение. Размеры каждого детектора составляют 140-200 мкм, а общее коли¬ чество детекторов в плоской панели достигает нескольких миллионов.Второй тип плоских панелей основан на использовании аморфного селена (рис. 3-7). В этом случае ослабленное рентгеновское излучение попадает на поверхностный слой аморфного селена, который находится в постоянном элек¬ трическом поле. Изменение электрического заряда под действием квантов рент¬ геновского излучения фиксируется слоем полупроводниковых элементов на базе аморфного кремния. В результате формируются электрические сигналы, которые передаются в аналогово-цифровой преобразователь, после чего возникает диагно¬ стическое изображение.РентгеновскиелучиРис. 3-6. Схема рентгенографии с исполь¬ зованием плоских панелей на основе йоди¬ да цезия.Изображение
г:РАДИОЛОГИЧЕСКИЕ МЕТОДЫРентгеновскиелучи♦ ♦ ♦47СлоцселейаРис. 3-7. Схема рентгенографии с использованием плоских панелей на осно¬ ве аморфного селена.Считывающее усфойсгвоИзображениеОбе технологии имеют высокие технологические характеристики и постепенно начинают использоваться в диагностической радиологии, однако в скрининговых исследованиях до настоящего времени не используются из-за высокой стоимости оборудования.Сканирующие флюорографические системы получили распространение в стра¬ нах СНГ в середине 90-х гг. Вместо полноразмерной матрицы, предусмотренной в технологии плоских панелей, в них используется одна линейка детекторов шириной 35-40 см. В этом случае рентгеновская трубка снабжена коллиматором, суживающим пучок рентгеновского излучения до величины линейки детекторов. При включении высокого напряжения рентгеновская трубка и линейка детекторов перемещаются вдоль грудной клетки, обычно в течение 5-8 с. Детекторы вос¬ принимают ослабленное излучение, преобразуют его в электрические сигналы, из совокупности которых с помощью аналогово-цифрового преобразователя строит¬ ся изображение.Вне зависимости от способа получения цифрового изображения, подобные аппараты имеют сходную комплектацию: штатив, на котором закреплены излу¬ чатель и воспринимающее устройство, высоковольтный генератор и средства управления процессом рентгенографии, рабочая консоль лаборанта, рабочее место врача-рентгенолога, рабочее место регистратора, средства архивирования и полу¬ чения твёрдых копий изображений.ФЛЮОРОГРАФИЯПроверочные флюорографические исследования в настоящее время являют¬ ся основным методом активного выявления скрыто протекающих заболеваний лёгких, В первую очередь это относится к лёгочным формам туберкулёза и пери¬ ферическому раку лёгкого. На ранних стадиях их развития, когда субъективные и объективные симптомы болезни отсутствуют или выражены незначительно, свое-
1148 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХвременно выполненное флюорографическое исследование позволяет обнаружить изменения в грудной полости и начать необходимое лечение.Порядок и сроки их проведения определяются инструкцией о проведении про¬ филактических медицинских осмотров населения, утверждаемой руководящим органом здравоохранения РФ.Работа по флюорографическому обследованию населения состоит из трёх основных разделов. К первому разделу относится планирование флюорографиче¬ ских осмотров, учёт и привлечение населения, а в дальнейшем составление отчётов по проделанной работе с обязательным анализом выявленной патологии.Ко второму разделу относится собственно флюорографическое исследова¬ ние. Ответственность за его проведение возложена на рентгеновские отделения лечебно-профилактических учреждений, в состав которых входят стационарные и передвижные рентгеновские кабинеты.Третьим разделом работы является дообследование лиц с выявленной или пред¬ полагаемой по данным флюорографии патологией. Оно осуществляется в общих и специализированных лечебно-профилактических учреждениях, с использовани¬ ем всего имеющегося арсенала клинических, лабораторных, инструментальных, функциональных методов исследования. При профилактическом обследовании органов грудной полости производится один кадр на умеренном вдохе с использо¬ ванием высокого напряжения и максимально коротких выдержек.Результаты расшифровки флюорограмм фиксируются рентгенологом в картах проверочных флюорографических обследований, подобранных регистратором или лаборантом, соответственно номерам кадров, в строке «результаты оценки флюорограмм».Для исключения пропусков патологии и неправильной интерпретации при расшифровке флюорограмм целесообразно применять двойной независимый про¬ смотр плёнки (двумя врачами) или повторный просмотр плёнки (одним врачом на следующий день) с обязательным учётом и сопоставлением результатов предыду¬ щего просмотра.РЕНТГЕНОСКОПИЯВ настоящее время рентгеноскопия не является основной, т.е. обязательной для каждого пациента с известной или предполагаемой лёгочной патологий, методикой рентгенологического исследования. Применение рентгеноскопии огра¬ ничено более высокой в сравнении с рентгенографией лучевой нагрузкой, мень¬ шей разрешающей способностью, субъективностью восприятия диагностической информации, отсутствием документальности. Внедрение в клиническую практику электронно-оптических усилителей рентгеновского изображения позволило про¬ водить рентгеноскопию при дневном свете, а получаемое изображение изучать на экране монитора. Это существенно повысило информативность методики при изучений состояния лёгких и средостения.Приоритетными являются три направления в применении рентгеноскопии. Первое из них — полипозиционное исследование, которое позволяет выбрать оптимальную проекцию для изучения патологического процесса или необходи¬ мое положение пациента, например при разграничении жидкости в плевральной полости и изменений в лёгочной ткани. Однако эти проблемы всё чаще реша¬ ются с помощью ультразвукового исследования и КТ, чем при рентгеноскопии. Второе — оценка органов дыхания в их естественном функциональном состоянии, определение подвижности диафрагмы, раскрытия реберно-диафрагмальных сину¬ сов, пульсация сердца и крупных сосудов средостения, смещаемость патологи¬ ческих образований в грудной полости при дыхании и т.п. Третье — проведение рентгеноконтрастных исследований под контролем рентгеноскопии. Чаще это контрастирование пищевода и желудка взвесью сульфата бария, реже контраст¬
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ49ные исследования предпринимаются для оценки состояния плевральной полости (плеврография), бронхиальных свищей (бронхография). Несмотря на имеющие¬ ся ограничения и недостатки данной методики, наличие рентгеноскопического штатива до настоящего времени является обязательным в клинике торакальной хирзфгии.ЛИНЕЙНАЯ ТОМОГРАФИЯЛинейная томография предназначена для уменьшения суммационного эффекта, свойственного всем рентгенографическим изображениям. При рентгенографии пучок рентгеновского излучения проходит через весь анатомический объект,В результате на рентгеновской плёнке формируется двухмерное (плоскостное) изображение сложной трёхмерной анатомической структуры. Трудности диагно¬ стики могут быть частично преодолены при использовании послойного исследо¬ вания.Технологически смысл линейной томографии заключается в синхронном движении излучателя и кассеты с рентгеновской плёнкой вдоль выбранной анатомической области во взаимно противоположных направлениях (рис. 3*8). Пациент располагается на столе томографического штатива, в положении на спине, на животе или на боку. Направление движения трубки может совпадать с продольной осью тела и тогда исследование определяется как продольная томография, В некоторых случаях движение трубки и кассеты осуществляется перпендикулярно продольной оси тела, поэтому томография обозначается как поперечная.Линейная томография имеет два основных назначения. Во-первых, оценка состояния трахеи и крупных бронхов, а также расположенных рядом с ними ана¬ томических структур (рис, 3-9). Томография средостения и корней лёгких позво-Рис. 3-8. Схема линейной томографии, Выделение продольного слоя заданной толщины, Точка «а» расположена вне томографического слоя, её изображение оказывается размазанным. Точка «Ь» рас¬ положена внутри слоя и получает чёткое изображение на снимке.
тШ:50МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХляет выявить изменение просвета крупного бронха, прежде всего его сужение или деформацию, патологическое образование или увеличенные лимфатические узлы в средостении и в корне лёгкого- Это исследование направлено прежде всего на диагностику центрального рака лёгкого и на выявление увеличенных лимфатиче¬ ских узлов при периферическом раке.Во-вторых, линейная томография позволяет уточнить характер изменений в лёгочной ткани, определить характер контуров, структуру, форму и размеры пато¬ логического образования (рис. 3-10). Томография позволяет выявлять полости распада и обызвествления в инфильтратах, очаги и ретикулярные изменения в прилежащей лёгочной ткани. Томография лёгких имеет значение в дифференци-Рис. 3-9. Линейная томография. Обзорная рентгенограмма (а) и линейная томограмма (б) в пря¬ мой проекции. Ателектаз ниж¬ ней доли правого лёгкого. При томографическом исследовании отчётливо видна культя проме¬ жуточного бронха в результате обтурации его новообразовани¬ ем.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ51Рис. 3-10. Линейная томограмма левого лёгкого. Новообразование нижней доли левого лёгкого,альной диагаостике периферического рака с другими патологическими процесса¬ ми в лёгочной ткани, такими как пневмонии, абсцессы, туберкулёзные инфильтра¬ ты, инфаркты и другие.Основным недостатком линейной томографии является низкая контрастная чувствительность, вследствие чего выявление значительной части патологиче¬ ских изменений в средостении, корнях лёгких и в лёгочной ткани оказывается затруднительным. В настоящее время происходит процесс замены линейной томографии на аксиальную, КТ. В тех случаях, когда есть возможность проведения КТ-исследования органов дыхания, необходимость в предварительной линейной томографии отпадает, а КТ выполняется непосредственно после обзорной рентге¬ нографии.Методики контрастированияРентгеновские методики контрастирования при обследовании больных раком лёгкого можно условно разделить на несколько основных групп:• контрастирование трахеи и бронхов — бронхография;• контрастирование сосудов — ангиопульмонография, аортография, бронхи¬ альная артериография, верхняя каваграфия;• контрастирование полостей — плеврография, диагностический пневмоторакс, пневмомедиастинография и пневмомедиастинотомография, пневмоперитоне- ум и пневморетроперитонеум, пневмоперикард, фистулография;• контрастирование глотки, пищевода и желудка.
52 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХЗа исключением рентгеноконтрастного исследования верхних отделов желудочно-кишечного тракта, все остальные методики представляют собой лишь исторический интерес и практически не используются в клинической практике. Все они связаны с высокой лучевой нагрузкой, поскольку выполняются под кон¬ тролем рентгеноскопии, трудоёмки, обременительны для пациента, небезопасны из-за риска возникновения тяжёлых осложнений. Большая часть из этих методик заменена компьютерной томографией, реже для уточнения характера изменений выполняется МРТ и УЗИ. Описание технических подробностей проведения каж¬ дой из перечисленных процедур можно найти в специальных руководствах по рентгенодиагностике.ПРЯМАЯ АНГИОГРАФИЯКонтрастирование сосудов в грудной полости может проводиться в виде ангио- пульмонографии (АПГ), аортографии, исследования бронхиальных артерий, верхней или нижней каваграфии.Ангиопульмонография — способ контрастного исследования сосудов мало¬ го круга кровообращения (рис. 3-11). Основным показанием к проведению АПГ является подозрение на развитие ТЭЛА. Кроме того, она может проводиться при пороках развития лёгкого, нагноительных заболеваниях, новообразованиях. Исследование также даёт возможность определить функциональное состояние паренхимы лёгкого, оценить внутрилёгочную и сердечную гемодинамику.Различают несколько видов ангиопульмонографии, к которым можно отнести общую АПГ, выполняемую путём внутривенного введения контрастного вещества или посредством ангиокардиографии из правого желудочка сердца; селективную АПГ, выполняемую из ствола или ветвей лёгочной артерии; суперселективную АПГ, включающую контрастирование из долевых, сегментарных ветвей лёгочной артерии; окклюзионную АПГ, выполняемую при заклинивании субсегментарной или лобулярной ветви лёгочной артерии концевой частью сердечного катетера или при блокировании баллоном катетера магистральной ветви лёгочной артерии.Бронхиальную артериографию целесообразно выполнять в сочетании с кате¬ теризацией лёгочной артерии и изучением показателей давления, оксиметрией в регионах выше и ниже выявляемых анастомозов двух систем кровообращения лёгких. Это исследование имеет большое значение в выявлении причин лёгочного кровотечения. Источником поступления крови в бронхиальное дерево в большин¬ стве случаев являются бронхиальные сосуды. Их эмболизация после проведённой бронхиальной артериографии является эффективным способом лечения крово¬ харканья и лёгочного кровотечения, особенно у лиц, страдающих хроническими воспалительными заболеваниями дыхательных путей и лёгких.В прошлые годы нередко выполнялось контрастное исследование сосудов средостения, которое включало в себя также флебографию и аортографию. Флебографию выполняли с учётом характера патологического процесса, выяв¬ ленного при помощи рентгенографии и томографии. При указании на вероятное поражение лимфатических узлов переднего средостения по данным обычного рентгеновского исследования выполняли верхнюю кавографию и контрастное исследование внутренних грудных вен, а при подозрении на поражение лимфати¬ ческих узлов заднего федостения — азигографию.Ультразвуковое исследованиеПрименение УЗИ у больных с заболеваниями органов дыхания, в том числе раком лёгкого, может быть направлено на решение трёх задач. Во-первых, это оценка распространённости опухолевого процесса, поиск метастазов в различных органах и тканях, в лимфатических узлах, при изучении нескольких анатомиче¬ ских областей, таких как шея, грудь, живот и таз. Во-вторых, УЗИ может быть
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ53Рис. 3-11. Ангиопульмоно¬ графия. Катетер проведён через нижнюю полую вену, правое предсердие и правый желудочек в общий ствол лёгочной артерии.Артериальная (а) и венозная (б) фазы контрастирования сосудов малого круга кровообращения.использовано для оценки внутригрудных проявлений опухолевого роста, как соб¬ ственно первичной опухоли, так и возникающих при её развитии осложнений при обычном чрескожном исследовании органов грудной полости. Наконец, третье направление связано с проведением эндосонографических процедур, при введе¬ нии эндоскопа с ультразвуковым датчиком в просвет трахеи и крупных бронхов или пищевода. Целью таких исследований является прецизионная оценка стенок воздухопроводящих путей, расположенных перибронхиально или перитрахеально лимфатических узлов, их биопсия под контролем ультразвука.Первая задача является рутинной процедурой в онкологической практике и решается при стандартном исследовании через кожные покровы, проводимом
54МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХсекторным или конвексным датчиком с частотой 3,5-5,0 МП^. Это исследование позволяет уверенно выявлять увеличенные лимфатические узлы области шеи, подмышечных, над- и подключичных областей с точной оценкой локализации, количества и размеров лимфатических узлов. Следует отметить, что современные ультразвуковые приборы позволяют достоверно разграничить опухолевое пора¬ жение лимфатических узлов и их воспалительную гиперплазию на основании характерного изменения эхосигнала и кровотока в них. У части больных удаётся выявить увеличение лимфатических узлов переднего верхнего средостения, а при исследовании нижнего этажа грудной полости — преперикардиальные лимфати¬ ческие узлы нижнего средостения, жидкость в плевральной полости и полости перикарда, патологические образования (обычно метастазы) в плевре и в лёгоч¬ ной ткани в случае пристеночного их расположения.При патологии органов грудной полости УЗИ в виде ЭхоКГ традиционно используется для оценки состояния сердца и расположенных интраперикардиаль- но крупных сосудов. Получаемые данные имеют большое значение для выявления артериальной лёгочной гипертензии, сопутствующей патологии сердца (пороки, аномалии развития и др.), а также признаков распространения опухоли в лёгком на перикард и камеры сердца.Чрескожное УЗИ органов грудной полости с целью изучения собственно опухо¬ левого поражения анатомических структур грудной полости выполняется значи¬ тельно реже. Причиной является воздухосодержащая лёгочная ткань, через кото¬ рую ультразвук практически не распространяется. Для изучения органов и тканей грудной полости необходимо акустическое окно, через которое ультразвук может проникать в грудную полость. Естественными окнами являются переднее средо¬ стение, прилежащее к передней грудной стенке, а также органы и ткани поддиаф- рагмального пространства. Известны исследования, свидетельствующие о высо¬ кой информативности УЗИ в оценке лимфатических узлов переднего средостения, перикарда и диафрагмы. Это исследование имеет несомненные преимущества в сравнении с рентгеновским методом в разграничении жидкости в плевральной полости и патологических изменений в лёгочной ткани (рис. 3-12).Рис. 3-12. УЗИ органов грудной полости. На рентгенограмме (а) определяется субтотальное затем¬ нение левого лёгочного поля, что может быть обусловлено пневмонией, плевритом, ателектазом или сочетанием нескольких процессов. При УЗИ (б) выявляется жидкость в плевральной полости над диафрагмой и уплотненная за счёт воспалительной инфильтрации нижняя доля левого лёгкого.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ55Изучение лёгочной ткани становится возможным при возникновении без¬ воздушного участка, прилежащего к грудной стенке или диафрагме. Обычно им является ателектаз доли или всего лёгкого, реже — воспалительный инфильтрат или опухолевый узел. Через безвоздушную лёгочную ткань удаётся оценить лока¬ лизацию и размеры центрально расположенной опухоли, её взаимоотношения с прилежащими сосудами и бронхами, выявить признаки врастания перифериче¬ ской опухоли в плевру и грудную стенку. Метод имеет высокую информативность, однако субъективизм оценки результатов и трудность его воспроизведения огра¬ ничивают его практическое применение.Эндосонография приобретает всё большее значение в стадировании рака лёг¬ кого. Метод позволяет выявлять опухолевую инвазию сосудов средостения при чреспищеводном исследовании, глубину прорастания опухоли в стенке трахеи и бронха при чрезбронхиальном исследовании. Особое значение приобретают транстрахеальные и трансбронхиальные пункции патологических образований и лимфатических узлов при эндосонографии.Компьютерная томографияСмысл КТ как диагностической процедуры заключается в том, что излучатель (обычно рентгеновская трубка) и линейка детекторов (одна или несколько) враща¬ ются вокруг изучаемой области (рис. 3-13). Количество детекторов в одной линей¬ ке может варьировать от 500 до 1200 единиц. Поскольку пациент располагается на столе компьютерного томографа в горизонтальном положении, обычно на спине, широкий веерообразный пучок рентгеновского излучения пересекает выбранную анатомическую область в поперечном направлении, перпендикулярно продольной оси тела. Ослабленное рентгеновское излучение попадает на детекторы, в каждом из которых возникает световая вспышка (сцинтилляция). Видимый свет преоб¬ разуется в электрический сигнал и далее кодируется в цифровом виде с помощью аналого-цифрового преобразователя.Регистрация ослабленного рентгенов¬ ского излучения происходит в каждом детекторе через каждый градус смещения рентгеновской трубки. Таю5м образом, за одно вращение рентгеновской труб¬ ки регистрируется несколько десятков тысяч значений ослабленного излучения (количество детекторов X количество проекций), из которых и строится конеч¬ ное изображение. Для этого все вычис¬ ленные коэффициенты ослабления рент¬ геновского излучения распределяются по матрице томограммы, состоящей из 512 строк и столбцов. Каждому коэффи¬ циенту ослабления присваивается чис¬ ловое значение в условных единицах и соответствующий оттенок серой шкалы.Совокупность всех оттенков в каждой элементарной ячейке матрице (воксе- ле) формирует диагностическое изобра¬ жение аксиального (поперечного) среза исследуемой области.Учитывая, что объём информации в матрице томограммы существенноРис. 3-13. Схема КТ.
56МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЕГОЧНЫХ ЗАБОЛЕВАНИЯХвыше физиологических возможностей органа зрения, томограммы изучаются в электронных окнах, адаптированных к определённым средам: мягкотканном, лёгочном, плевральном и костном. Поскольку каждый элемент КТ-изображения представляет собой числовое значение коэффициента ослабления, его можно измерить в условных единицах — числах Хаунсфилда (HU). Нулевое значение шкалы соответствует плотности воды, минимальное значение (-1000) ~ плотно¬ сти воздуха. Верхняя граница шкалы не имеет фиксированного значения. Мягкие ткани и кровь имеют положительные значения плотности +30...+70 HU, лёгочная ткань характеризуется низкими значениями плотности -700,..-900 HU, жировая ткань ~100.,.-120 HU, костная ткань - более +120 HU.Принято выделять две основные технологии сканирования: пошаговую (после¬ довательную, аксиальную) и спиральную (объёмную). Пошаговая технология сканирования предполагает обязательную остановку рентгеновской трубки после каждого цикла вращения. Это необходимо для того, чтобы установить её в исход¬ ное положение перед следующим циклом сканирования. В этот момент стол с пациентом передвигается на необходимое расстояние, называемое шагом стола, для получения следующей томограммы. При исследовании груди и живота вре¬ менной промежуток между циклами вращения рентгеновской трубки необходим также для того, чтобы пациент мог сделать вдох или выдох, а затем задержать дыхание на следующий период сканирования. Процесс сканирования в этом слу¬ чае является дискретным, фрагментарным и разделён на отдельные циклы, рав¬ ные одному обороту рентгеновской трубки вокруг объекта. Исследование груди при пошаговом сканировании может занимать 10-20 мин в зависимости от типа аппарата.Новая концепция сканирования, названная спиральной КТ, используется в клинической практике с 1990 г. В англоязычной литературеч , используется несколько терминов для обозна- чения этой технологии — spiral СТ, helical СТ,volumetric СТ. Каждый из них подчёркивает наи¬ более существенные особенности этой техно¬ логии. Спиральное сканирование заключается в одновременном выполнении двух действий: непрерывного вращения источника излучения вокруг объекта и непрерывного поступательного движения стола с пациентом через окно гентри. В этом случае траектория пучка рентгеновских лучей, проецируемая на тело пациента, приоб¬ ретает форму спирали (рис, 3-14).Основное преимущество спиральной КТ заключается в значительном ускоре¬ нии процесса сканирования, поскольку отсутствуют временные интервалы между отдельными циклами вращения рентгеновской трубки. Сканирование одной ана¬ томической обласги на установках третьего или четвёртого поколения может бьггь проведено в течение 15-25 с.Другим важным преимущесгвом спирального сканирования является возмож¬ ность проведения эффективных ангиографических исследований. При быстром внутривенном введении йодсодержащего кошрастного вещества, обычно через лок¬ тевую вену, сканирование удаётся осуществить в момент прохождения его по круп¬ ным сосудам. В результате собственно КТ-исследование дополняется полноценной ангиографией, но без сложных инвазивных вмешательств в виде проведения вну- трисосудисгых катетеров и общей анестезии. В настоящее время КТ-ангиография широко используется для оценки состояния крупных сосудов грудной полости, в том числе аорты и её ветвей, лёгочных артерий, системных вен.Рис. 3-14. Схема спиральной КТ.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ57Рис. 3-15. Схема многослойной КТ. Аппарат с одной линейкой детекторов (а) и четырьмя линейками детекторов (б).Принцип объёмного или непрерывного сканирования создаёт совершенно новые возможности для постпроцессорной обработки полученных данных, в част¬ ности для преобразования аксиальных томограмм в многоплоскостные реформа¬ ции и трёхмерные изображения. Получаемые изображения не зависят от различ¬ ной глубины вдоха или выдоха пациента, а возможности построения томограмм с частичным взаимным наложением сводят к минимуму ступенчатые артефакты, свойственные многоплоскостным реформациям при КТ. Результаты исследования в этом случае становятся более наглядными, демонстративными, доступными для пространственного восприятия не только специалистов-рентгенологов, но и леча¬ щих врачей.Многослойная или мультидетекторная спиральная компьютерная томография (МСКТ или МДКТ) определила существенный прорыв в клиническом примене¬ нии всех томографических технологий. Технология была впервые представлена в 1999 г. и в последние годы приобрела статус основной модификации компьютерно¬ томографических установок. Суть данной технологии заключается в том, что при вращении рентгеновской трубки вокруг пациента пучок рентгеновских лучей разделяется на несколько томографических слоев с помощью так называемых многорядных детекторов (рис. 3-15), Во всех прошлых поколениях КТ-установок имелся только один ряд детекторов, что позволяло получать одну томограмму за одно вращение рентгеновской трубки. В настоящее время разработаны установ¬ ки, позволяющие получать от 2 до 64 томографических срезов за одно вращение рентгеновской трубки. Использование МСКТ позволяет реализовать два основных преимущества данной технологии: увеличить скорость сканирования и повысить пространственное разрешение,ФИЗИЧЕСКИЕ ПРИНЦИПЫ КОМПЬЮТЕРНОЙ ТОМОГРАФИИОсновой компьютерно-томографического процесса является регистрация интенсивности ослабленного рентгеновского излучения во множестве проекций.
- -is:«58МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХВ англоязычной литературе этот процесс определяется как data acquisition — сбор или регистрация данных.Чем больше интенсивность рентгеновского луча, достигшего детектор, тем сильнее электрический сигнал, возникающий в фотоэлектронном преобразовате¬ ле детектора. Соотношение исходной интенсивности рентгеновского излучения ІЦ и интенсивности прошедшего через объект излучения I выражается следующим уравнением:где:• Iq — интенсивность исходного рентгеновского излучения;• I — интенсивность ослабленного рентгеновского излз^ения;• р. — линейный коэффициент ослабления рентгеновского излучения;• d — расстояние от источника излучения до воспринимающего устройства;• е - математическая константа (основание натурального логарифма).В соответствии с приведённым уравнением коэффициент линейного ослабления может быть вычислен по следующей формуле:p.d=lnl-lnl„.В реальном исследовании измеряется множество коэффициентов ослабле¬ ния соответственно количеству детекторов в каждой использованной проекции. Результатом однократного измерения является профиль исследуемого объекта в данной проекции. Фундаментальным способом вычисления коэффициентов осла¬ бления является метод фильтрованных обратных проекций, который использует¬ ся в большинстве вычислительных машин КТ-установок.Коэффициенты ослабления при КТ-исследовании определяются во время движения рентгеновской трубки, но не постоянно, а в определённых её позициях или, как это принято называть в КТ, проекциях. Количество проекций, в которых производится сбор данных, может варьировать от 180 до 720. Это означает, что в течение одного цикла вращения источника излучения вокруг объекта детекторы воспринимают рентгеновское излучение 360 раз, при смещении источника на каж¬ дый последующий градус окружности. Таким образом, каждый элемент объекта исследования «осматривается» из сотен проекций, а совокупность полученных проекционных данных анализируется вычислительной машиной с помощью спе¬ циальных математических программ — алгоритмов реконструкции. Увеличение числа проекций способствует повышению пространственной разрешающей спо¬ собности, но увеличивает время сканирования (время сбора проекционных дан¬ ных). Уменьшение числа проекций позволяет ускорить процесс сканирования при одновременном ухудшении пространственного разрешения.После измерения детекторами ослабленного рентгеновского излучения элек¬ трические сигналы преобразуются (кодируются) в цифровые значения коэффици¬ ентов ослабления, которые распределяются в электронной матрице томограммы.Матрица томограммы представляет собой электронную таблицу с равным количеством строк и столбцов (рис. 3-16). Матрица отражает пространственное распределение коэффициентов ослабления в изучаемом слое. Первоначально в матрицу записываются коэффициенты ослабления в каждой из использованных проекций. Совокупность всех исходных коэффициентов ослабления составляет так называемые проекционные данные (projection data) или сырые данные (raw data). Следующий этап заключается в формировании единой матрицы попереч¬ ной томограммы из набора проекционных данных. Конечное число, записанное в каждой ячейке матрицы, является результатом вычисления среднего значения коэффициента ослабления в использованных проекциях с помощью определённой математической программы — алгоритма реконструкции томограммы.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ59Матрица томограммы состоит из элементарных ячеек — вокселей (voxel — volume element, элемент объёма). В каждый воксель записываются суммарные коэффициенты ослабления рентгеновского излучения, собранные детекторами в различных проекциях и выраженные в числах Хаунсфилда. В современных уста¬ новках матрица томограммы обычно состоит из 512^ вокселей.Грань вокселя, расположенная параллельно плоскости сканирования, опреде¬ ляется как пиксель (pixel - picture element, элемент картины). Размеры пикселей определяют пространственное разрешение в поперечной (аксиальной) плоскости сканирования. Чем меньше размеры пикселей, тем выше разрешающая способ¬ ность, и наоборот. Эта закономерность напоминает особенности мозаичной картины, когда уменьшение размеров отдельных элементов мозаики делает изо¬ бражение более чётким и однородным. Размеры пикселей зависят от величины поля изображения (англ. Field Of View, FOV — поле изображения), т.е. той части апертуры гентри, которая проецируется на матрицу томограммы.Электронная матрица томограммы является основой для формирования изо¬ бражения поперечного сечения объекта исследования. Такое изображение может быть представлено в двух видах: как полутоновая картина, состоящая из различ¬ ных оттенков серого цвета, или как таблица распределения абсолютных значений коэффициентов ослабления в матрице томограммы.В первом случае результат сканирования выводится на монитор, где каждому пикселю присваивается определённый оттенок серой шкалы в зависимости от величины коэффициента ослабления. Низким значениям соответствуют более тёмные участки изображения, высоким значениям — более светлые. Поэтому на компьютерных томограммах, как и на рентгенограммах, воздух изображается в виде участков тёмного (чёрного) цвета, мягкие ткани и кровеносные сосуды — серого, кости — светло-серого или белого.Совокупность чисел Хаунсфилда составляет шкалу Хаунсфилда, Нулевое зна¬ чение числа Хаунсфилда соответствует коэффициенту ослабления рентгеновского излучения воды в нормальных условиях. Нижней границей шкалы является чис¬ ловое значение коэффициента ослабления рентгеновского излучения воздухом и равно 1000 ни. Наибольшие значения коэффициентов ослабления регистри¬ руются в пирамидах височной кости. Значения относительной плотности для большинства паренхиматозных органов составляют +30,..+70 HU, крови в сосудах и камерах сердца — в пределах Ч-40...+45 HU. Относительная плотность жировых тканей меньше плотности воды и колеблется от -30 ни до -120 HU.
60 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХшРис. 3-17. КТ. Электронные окна; а — мяпкотканное, б — лёгочное, в — плевральное, г — костное.Ширина и зфовень электронного окна выбираются оператором, исходя из усло¬ вий наилучшего изучения определённой группы тканей (рис. 3-17). Так, коэффи¬ циенты ослабления большинства мягких тканей (кожных покровов, мышц, сухо¬ жилий), паренхиматозных органов, лимфатических узлов и кровеносных сосудов находятся в пределах +30,..+70 HU. Жировая клетчатка имеет более низкую плот¬ ность (-30...-120 ни). При изучении на компьютерных томограммах этих струк¬ тур, а также патологических образований в грудной полости, жидкости в плевраль¬ ных полостях, безвоздушных участков лёгочной ткани, необходимо использовать относительно узкое окно (350„.500 HU) при уровне окна +35...+45 HU, Такое окно условно обозначается как мягкотканное (soft window).Лёгочное окно (lung window) характеризуется относительно небольшой шири¬ ной (1000 ни), уровень его соответствует -800 HU. Изображение отличается высокой контрастностью, что позволяет детально оценить состояние воздухо¬ содержащей лёгочной ткани, элементы лёгочного рисунка, вьшвить воздушные полости в лёгочной ткани. Вместе с тем избыточная контрастность может привести к искажению контуров мягкотканных структур и сосудов на границе с лёгочной тканью. Этот эффект особенно важно з^итывать при изучении стенок бронхов и междолевой плевры, применение одного лёгочного окна может привести к оши¬ бочному заключению об утолщении стенок бронхов и листков плевры при отсут¬ ствии в них патологических изменений.Плевральное окно (pleural window) характеризуется значительно боль¬ шей шириной и более высокими значениями центра: уровень окна достигает ~250,„-500 ни при ширине 1500...2000 HU. В этом режиме контрастность изобра¬ жения уменьшается, что позволяет более объективно оценивать контуры сосудов и бронхов, грудной стенки и плевры.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ61Коэффициенты ослабления костной ткани обычно превьипают +100 HU и могут достигать +2000...-н^000 HU (например, компактное вещество височной кости). Из-за значительных различий в плотности компактного и губчатого вещества кости ширина окна при изучении костей должна быть значрггельной, в пределах 1000,..2000 ни. Уровень окна необходимо сместить в сторону более высоких зна¬ чений коэффициентов ослабления: +150...+350 HU. Такое окно определяется как костное (bone window).В повседневной работе при исследовании органов грудной полости помимо мягкотканного можно применять одно из двух окон, лёгочное или плевральное, в качестве основного. Важным является не столько выбор конкретных параметров электронного окна, сколько сохранение их значений постоянными в процессе исследования всех пациентов. Это позволяет избежать диагностических ошибок и получать сопоставимые отпечатки компьютерных томограмм при повторных исследованиях.ПРОТОКОЛЫ СКАНИРОВАНИЯКомпьютерная томография органов дыхания как самостоятельное диагностиче¬ ское исследование включает несколько последовательных этапов, к числу которых следует отнести:• изучение данных клинического обследования больного;• анализ результатов предшествующего рентгенологического и бронхологиче¬ ского исследований;• определение цели и задач КТ;• определение параметров сканирования с учётом характера предполагаемой патологии, психосоматического состояния пациента и технических возмож¬ ностей КТ-установки;• регистрация, укладка больного и выполнение процедуры сканирования;• предварительный анализ результатов КТ на рабочей консоли;• постпроцессорная обработка изображений с построением, в сл)^ае необходи¬ мости и возможности, многоплоскостных реформаций и трёхмерных преоб¬ разований;• анализ полученных результатов (на рабочей станции) и сопоставление их с данными других диагностических исследований;• оформление протокола исследования с описанием выявленных изменений, заключением и рекомендациями по дальнейшему обследованию или верифи¬ кации выявленных изменений;• архивирование изображений, оформление технической документации.Всё исследование можно условно разделить на три части. Первая часть состоит в изучении медицинских документов больного, определении задач исследования, необходимых методик и параметров сканирования. План проведения КТ орга¬ нов дыхания определяется не только конкретными задачами исследования, но и состоянием больного на момент его выполнения, а также техническими возмож¬ ностями аппарата. Вторая часть представляет собой собственно процедуру скани¬ рования. Третья часть включает анализ результатов исследования и оформление заключения.Первичное КТ-исследование органов грудной полости должно проводиться в определённой последовательности.• I. Стандартное исследование.• II. Применение специальных методик, к числу которых относятся:❖ прицельная реконструкция томограмм с применением специальных алго¬ ритмов и изменением толщины томографического слоя, в том числе высо¬ коразрешающая КТ;❖ КТ-ангиография;
62МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХ'■•Ф- динамическая КТ; полипозиционные исследования; экспираторная КТ.Стандартное исследование является обязательным для всех больных вне зави¬ симости от характера выявленных или предполагаемых патологических изме¬ нений, Оно заключается в выполнении серии примыкающих томографических срезов от верхушек лёгких до задних отделов рёберно-диафрагмальных синусов на высоте задержанного вдоха без применения контрастного усиления. Следует иметь в виду, что при КТ могут быть выявлены патологические изменения, невидимые на обзорных рентгенограммах и томограммах. Чаще это наблюдается у больных с интерстициальными болезнями лёгких и эмфиземой, метастазами злокачествен¬ ных опухолей в лёгкие, бронхоэктазами, ТЭЛА. Поэтому искусственное ограни¬ чение области исследования только зоной изменений, видимых на рентгеновских снимках, может привести к грубым диагностическим ошибкам. Уменьшение зоны исследования возможно лишь при повторных КТ-исследованиях, в которых реша¬ ются частные задачи: уточнение характера уже выявленных изменений, динами¬ ческое наблюдение, пункционная биопсия и другие.Исследование начинают с выполнения обзорной цифровой рентгенограммы (топограммы, сканограммы), которая представляет собой обзорный снимок груд¬ ной полости в прямой проекции. Оценка состояния органов грудной полости по топограмме не проводится, поскольку выдержка при её выполнении составляет 3-5 с. Цифровая рентгенограмма предназначена для определения уровня первого поперечного среза или всей зоны (нескольких зон) предстоящего сканирования. По окончании исследования на ней отображается положение всех выполненных поперечных томограмм с указанием их порядкового номера.После определения уровня первой поперечной томограммы выполняют серию примыкающих томографических срезов от верхушек лёгких до задних отделов рёберно-диафрагмальных синусов. Исследование проводят в положении больно¬ го на спине с заведёнными за голову руками. Сканирование проводят на высоте обычного (нефорсированного) вдоха. Томограммы восстанавливают в стандарт¬ ном алгоритме реконструкции, поле изображения составляет 35-40 см, в зону интереса включается весь поперечный срез грудной полости.После сканирования врач анализирует полученные изображения на экране монитора с использованием различных электронных окон, из которых два (мяг¬ котканное и лёгочное) являются обязательными и стандартными. Первичный ана¬ лиз изображений позволяет подтвердить, предположить или исключить наличие патологических изменений в грудной полости. При отсутствии изменений иссле¬ дование может быть закончено уже на этом этапе.В случае выявления на стандартных томограммах патологических изменений определяют их локализацию, проводят анатомический и денситометрический ана¬ лизы, При необходимости уточнить характер патологии применяют специальные методики КТ-исследования.ВЫСОКОРАЗРЕШАЮЩАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯОсновой технологии КТ высокого разрешения (КТВР) является уменьшение толщины томографического слоя до 1-2 мм и использование алгоритма высокого пространственного разрешения (костного алгоритма). Ещё большее повышение разрешающей способности достигается с помощью прицельной реконструкции, при которой величина поля изображения адаптирована к анатомическим разме¬ рам индивидуальной грудной полости (рис. 3-18).В настоящее время нет единого общепринятого протокола для КТВР лёгких. Традиционно существуют два основных варианта исследования. Первый пред¬ полагает выполнение обычной (последовательной рши спиральной) КТ грудной
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ63Рис. 3-18. КТВР, В сравнении с обычной КТ (а) использование технологии высокого разрешения (б) позволяет улучшить изображение мелких анатомических структур, таких как бронхи, сосуды и листки междолевой плевры.полости, которая затем дополняется большим или меньшим количеством томо¬ грамм в условиях высокого разрешения. В литературе нет единого мнения о количестве и расположении таких аксиальных срезов. Они могут выполняться на расстоянии 2-3-4 см друг от друга, иногда на заранее определённых уровнях (дуга аорты, корень лёгкого, основание лёгкого и т.д.). Преимущества такого подхода заключаются в экономии времени и уменьшении лучевой нагрузки на пациента. Основной недостаток состоит в ограничении зоны исследования и возможном пропуске патологических изменений.Второй протокол предполагает выполнение первой и, как правило, единствен¬ ной серии томограмм в условиях КТВР. Исследование проводят от верхушек до диафрагмы, при шаге стола 1-2 см, в положении больного на спине, на животе или на спине и на животе. Оптимальное количество томограмм и положение больного определяется клинической ситуацией. Например, профессиональный анамнез определяет высокую вероятность развития фиброзных изменений в кортикальных отделах задних, гравитационно-зависимых зонах лёгких. Для разграничения их с зонами функциональной гиповентиляции необходимо заранее предусмотреть выполнение томограмм в положении больного как на спине, так и на животе.Несмотря на отсутствие единого мнения о стандартном протоколе КТВР, для пациентов с предполагаемым диффузным заболеванием лёгких рекомендуется выполнять полноценную серию томограмм в условиях высокого разрешения в качестве первоочередного и, как правило, единственного исследования. При этом толщина слоя составляет 1-2 мм, шаг стола — 1 см, томограммы выполняются от верхушек лёгких до диафрагмы. Дальнейшая тактика, в том числе выполнение стандартного сканирования, исследование в положении больного на животе, экс¬ пираторная КТ и другие методические приёмы, определяется выявленными при КТВР изменениями.КОНТРАСТНОЕ УСИЛЕНИЕОсновным вариантом контрастного усиления при исследовании органов дыха¬ ния является КТ-ангиография. Это исследование предполагает быстрое внутри¬ венное введение значительного объёма водорастворимого КВ при одновременном сканировании выбранной области исследования. Технология КТ-ангиографии позволяет изучать внутренние просветы сосуды и камеры сердца, отличать сосуды от прилежащих мягкотканных анатомических структур и патологических образо¬ ваний, а при необходимости определять степень накопления КВ в патологических образованиях. Без введения КВ не представляется возможным отличить кровь в
64МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 3-19. КТ-ангиография. Нативное исследование (а) и болюсное усиление (б).просвете сосуда от стенки сосуда, выявить сужение внутреннего просвета за счёт тромбообразования, а также утолщение, расслоение или повреждение сосудистой стенки. При нативном КТ-исследовании достаточно отчётливо видны лишь внеш¬ ние контуры сосуда, причём в случае, если он окружён жировой или лёгочной тканью (рис. 3-19).Изображение сосудов грудной полости при КТ существенно различается в зави¬ симости от их топографии, Внутрилёгочные сосуды, включая крупные артерии и вены малого круга кровообращения в корне лёгкого, окружены воздухосодержа¬ щей лёгочной тканью и поэтому в норме отчётливо видны без дополнительного контрастирования. Сосуды средостения и грудной клетки выявляются только в том случае, если они окружены жировой клетчаткой. Как правило, прослойки жира в средостении недостаточно выражены у детей, подростков, лиц астениче¬ ской конституции, что существенно затрудняет оценку сосудов. Ещё большие труд¬ ности возникают при наличии мягкотканных образований в средостении, корне лёгкого или лёгочной ткани.На протяжении последних лет спиральная КТ-ангиография стала стандартной методикой для диагностики ТЭЛА, определения стадии опухолевого процесса при злокачественных новообразованиях грудной полости, оценки разнообразных вариантов и аномалий развития сосудов малого и большого круга кровообраще¬ ния.В целом, КТ-ангиография как самостоятельное исследование должна соответ¬ ствовать следующим требованиям;• хорошая переносимость и отсутствие осложнений;• воспроизводимость при последующих исследованиях;• применимость для большинства клинических ситуаций;• выполнение с оптимальным (минимально возможным) количеством КВ;• повышение плотности крови в системных и лёгочных артериях, камерах серд¬ ца должно быть не менее 150 ни в сравнении с нативным исследованием;• отсутствие артефактов, в том числе от КВ в верхней полой вене и брахиоце¬ фальной вене на стороне введения.Перед выполнением КТ-ангиографии всем больным проводят нативное КТ-иссле¬ дование всей грудной клетки без введения КВ. Оно необходимо для первичного анализа патологических изменений в лёгочной ткани, плевре и средостении. Нативное исследование позволяет выявить обызвествления в лимфатических узлах, стенках сосудов, внутрисосудистых тромбах, а также рентгеноконтрастные инородные тела, которые могут быть пропущены после введения контрастного вещества. Наконец, бесконтрастное исследование помогает выбрать оптимальное положение и протяжённость зоны сканирования.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ65Результативность КТ-ангиографии определяется несколькими факторами, наи¬ более важными из которых являются:♦ технологии сканирования выбранной области и реконстрз^кции томограмм;• способ введения, объём, концентрация и скорость введения КВ.Сканирование необходимо выполнять при полностью задержанном дыха¬ нии. Это не исключает выполнение исследования при поверхностном дыхании пациентов с тяжёлой дыхательной или сердечной недостаточностью. Однако в этом случае правильная трактовка выявленных изменений возможна только на уровне крупных лёгочных артерий, расположенных в средостении. Кроме того, построение информативных двух- и трёхмерных преобразований оказьшается невозможным. Наиболее выгодной фазой дыхательного цикла для проведения КТ-ангиографии является глубокий вдох. Физиологические исследования показа¬ ли, что в момент окончания глубокого вдоха возрастает сопротивление в мелких кровеносных сосудах лёгкого из-за сдавления их растянутыми воздухом альвеол. Это обстоятельство создаёт условия для замедления скорости прохождения болю¬ са КВ в сосудах малого круга кровообращения.Вторая группа параметров КТ-ангиографии определяет способ введения, объём и концентрацию КВ. Обязательным условием выполнения КТ-ангиографии является наличие механического шприца-инжектора, позволяющего точно опре¬ делять скорость введения контрастного вещества в диапазоне 2-7 мл/с. Объём шприца должен быть не менее 100 мл, предпочтительнее 150-200 мл. Для успешного проведения ангиографического исследования необходим надёжный доступ к периферической вене, в комплекте с ангиографическим шприцем обыч¬ но предлагается игла, с помощью которой может осуществляться пункция вены локтевого сгиба, кисти или голени. Однако быстрое введение контрастного веще¬ ства через иглу при ангиографических исследованиях нередко сопровождается осложнениями.Магнитно-резонансная томографияПри обследовании больных с патологией органов дыхания МРТ применяется значительно реже, чем при изучении головного мозга, позвоночника и крупных суставов. Несомненными преимуществами метода в оценке состояния грудной полости являются: более высокая в сравнении с КТ контрастная (тканевая) чув¬ ствительность, возможность визуализации движущейся крови без внутривен¬ ного введения контрастного вещества, отсутствие ионизирующего излучения, многопроекционное представление результатов исследования. Многочисленные исследования показали, что результаты МРТ и КТ с болюсным внутривенным контрастированием в оценке первичной опухоли и метастазов в регионарные лим¬ фатические узлы имеют большое сходство. Отмечены некоторые преимущества МРТ в выявлении инвазии опухолевого узла в грудную стенку, разграничении центрально расположенной опухоли и обтурационного пневмонита, оценке лим¬ фатических узлов средостения (рис. 3-20). Однако эти преимущества не являются общепризнанными, во многом зависят от структуры изучаемых больных и техно¬ логических характеристик используемого оборудования, а также в большинстве случаев не оказывают существенного влияния на лечебно-диагностический про¬ цесс.В диагностике заболеваний органов дыхания, в том числе рака лёгкого, МРТ имеет ограниченное значение. Это обусловлено трудностями оценки ретикуляр¬ ных и мелкоочаговых изменений в лёгочной ткани, невозможностью правильной интерпретации обызвествлений, сложностью проведения одномоментного иссле¬ дования нескольких анатомических зон, например области груди при наличии первичной опухоли в лёгком и области живота для исключения метастатического поражения печени и других органов. В большинстве лечебных учреждений МРТ
66 МЕТОДЬ! ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 3-20. МРТ при боковой кисте шеи с распространением на грудную стенку: а — КТ-реформация в сагипальной плоскости; б — МРТ во фронтальной плоскости; в — МРТ в сагиттальной плоскости.по-прежнему остаётся более длительной, дорогостоящей и труднодоступной про¬ цедурой, Появление МДКТ позволило представлять данные КТ в любой плоскости с одинаковым разрешением, что сопоставимо с технологаей МРТ. Использование метода ограничено для пациентов с одышкой, при тяжёлом их состоянии, в после¬ операционном периоде.В настоящее время МРТ используется как уточняющий метод при обследовании больных раком лёгкого, проведение которого показано после или вместо КТ при соответствующих показаниях. К ним относятся:непереносимость рентгеноконтрастных веществ; невозможность проведения спиральной КТ-ангиографии; опухоли верхней борозды;опухоли паравертебральной локализации с высоким риском распространения в спинномозговой канал;кортикоплевральные опухоли при трудности оценки изменений грудной стен¬ ки по данным УЗИ и КТ;
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ 67• дифференциальная диагностика тканевых и кистозных образований в лёгком и средостении при невозможности дифференциальной диагностики по дан¬ ным УЗИ и КТ.В некоторых клиниках показания к проведению МРТ расширяются за счёт более частого использования метода при центральном раке лёгкого и при стадиро¬ вании злокачественных новообразований. Особенно это касается ситуаций, когда технический уровень КТ не соответствует существующим стандартам диагностики и стадирования рака лёгкого.Радионуклидная диагностика и позитронно-эмиссионная томографияНовое направление в клинической медицине было обозначено в начале 90-х годов в связи с внедрением в клиническую практику нового метода молекулярной визуализации — позитронно-эмиссионной томографии (ПЭТ). Сегодня ПЭТ явля¬ ется наиболее эффективным методом разграничения доброкачественных и злока¬ чественных тканей любой локализации, а также эффективным методом оценки метаболизма некоторых тканей, в частности миокарда и головного мозга.Значение ПЭТ постоянно повышается благодаря совершенствованию оборудова¬ ния и разработке новых радионуклидных препаратов для оценки функционального состояния и метаболизма различных органов и систем [30,31]. В настоящее время онкология, наряду с кардиологией, является одной из основных точек приложения этой технологии [32]. Многочисленные исследования, как проспективные, так и ретроспективные показали, что ПЭТ является одним из наиболее эффективных методов выявления опухолевой ткани [33-36], Если показатели чувствительности и специфичности КТ и МРТ в выявлении новообразований различной локализации составляют от 60 до 90%, то аналогичные показатели для ПЭТ практически во всех исследованиях превьипают 80%. При этом минимальные размеры патологических образований, выявляемых с помощью ПЭТ, составляют 5-7 мм. Основное значение ПЭТ имеет в дифференциальной диагностике доброкачественных и злокачествен¬ ных новообразований, выявления первичной опухоли у больных с метастатиче¬ ским поражением различных органов и тканей, определения распространённости первичной опухоли при неизвестных метастазах в регионарных лимфатических узлах и отдалённых органах. Уникальное значение приобретает технология ПЭТ в оценке эффективности проведённого противоопухолевого лечения. Во всех пере¬ численных клинических ситуациях информативность ПЭТ оказывается выше тра¬ диционных технологий морфологической визуализации [34,36].Основным недостатком ПЭТ. как и большинства других методов ядерной меди¬ цины, является трудность точной топической диагностики выявленных патоло¬ гических образований, невозможность определения взаимоотношений опухоли с окружающими её органами и тканями. Для этой цели в настоящее время исполь¬ зуются КТ и МРТ. Закономерньпй стало появление сочетанных установок ПЭТ/КТ, которые позволяют провести два исследования практически одновременно, с после¬ дующим совмещением анатомических КТ-изображений и метаболических ПЭТ- изображений в одну картину. Целесообразность подобного подхода к диагностике новообразований в настоящее время широко обсуждается в литературе [36-39].Интервенционные процедуры под лучевым наведениемИнтервенционная радиология (ИР) возникла на основе ангиографии и рентге- нохирургии. Она находится на стыке нескольких направлений клинической меди¬ цины: лучевой диагностики, хирургии, ангиологии.В торакальной радиологии методики ИР используются прежде всего для осу¬ ществления пункционных процедур под лучевым наведением, к ним относят-
68МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 3-21. Пункционная игловая биопсия пери¬ ферического образования в правом лёгком под контролем КТ.ся чрескожные пункционные биопсии патологических образований в лёгоч¬ ной ткани, средостении, плевре, груд¬ ной стенке. Они могут выполняться под контролем рентгеноскопии, УЗИ, КТ. другим направлением являются эндо¬ скопические процедуры под контролем рентгеноскопии или с использовани¬ ем УЗ-наведения при эндосонографии. Примерами могут служить чрезброн¬ хиальная биопсия лёгочной ткани или патологического образования в лёгком, чрестрахеальная пункционная биоп¬ сия лимфатического узла или патоло¬ гического образования в средостении (рис. 3-21).Показаниями к проведению трансто¬ ракальной игловой биопсии являются:одиночный очаг в лёгком; стадирование рака лёгкого; образование в средостении;патологический процесс в грудной стенке или в плевре; патологическое образование в корне лёгкого при отрицательных результатах бронхоскопии;• локальные изменения у больных в состоянии иммунодефицита.Противопоказаниями к проведению трансторакальной игловой биопсии явля¬ ются:• неспособность пациента принять необходимое положение;• неспособность пациента дышать и задерживать дыхание в соответствии с ука¬ заниями врача;• невозможность получить информированное согласие пациента или его род¬ ственников;неспособность пациента следовать указаниям врача; коагулопатия при числе тромбоцитов менее 50 ООО/мл; контралатеральная пневмонэктомия или пневмоторакс; крайняя степень выраженности ХОБЛ.В последние годы всё шире технологии ИР используются для восстановления проходимости при стриктурах трубчатых органов и систем, в том числе трахеи и крупных бронхов при раке лёгкого. Эти операции могут носить характер разовых пособий (дилатация) с последующим удалением инструмента или постоянно дей¬ ствующих имплантированных протезов (стентов).Тактика лучевого исследованияс возрастанием числа технологий, методов и методик лучевой диагностики, повышением их сложности и, в большинстве случаев, стоимости становится оче¬ видным неэффективность традиционных подходов к организации лучевых иссле¬ дований органов грудной полости и других анатомических областей.В середине прошлого века в отечественной рентгенорадиологии сформировался принцип последовательного продвижения от простой методики к более сложной, дорогостоящей или труднодоступной. Этот подход был совершенно оправдан при ограниченном числе обязательных (общих, основных) методик рентгеновского исследования органов грудной полости, таких как рентгеноскопия и рентгеногра¬ фия, и малой доступности специальных высокотехнологических исследований.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ 69К последним можно отнести большинство методик контрастирования, например бронхографию, ангиографию, пневмомедиастинографию и ряд других.В современных условиях поэтапное выполнение бесконечного числа всё более сложных и дорогих методик приводит не только к существенному удорожанию стоимости процесса диагностики, увеличению его продолжительности, но и к искусственному увеличению объёма проводимых исследований, созданию очере- . V - - - дей и надуманного дефицита технологий. В экстренной ситуации пациент в этих условиях может вообще не дожить до начала лечения из-за отсутствия диагноза.В течение последних лет всё большее распространение получает принципиально иной подход. Он заключается в выборе наиболее результативных, в том числе и наиболее дорогостоящих, методик или их сочетания для получения максимально быстрого и эффективного результата [1-3]. Так, внедрение КТ и МРТ в нейрора¬ диологию привело к практически полному исчезновению большинства специаль¬ ных рентгеновских исследований, в том числе и рентгеноконтрастных. Типичным примером нового подхода к диагностике является применение ПЭТ всего тела с последующим КТ- или МР-исследованием зон поражения для оценки распростра¬ нённости опухолевого процесса [25, 32].КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕНТГЕНОГРАФИИ ЛЁГКИХВ настоящее время обзорная рентгенография лёгких является основной методи¬ кой первичного выявления и динамического наблюдения при патологии органов дыхания. Несмотря на противоречивые представления об эффективности этой методики у пациентов с отсутствием клинической симптоматики заболевания органов дыхания, рентгенография легюіх в нашей стране остаётся обязательным диагностическим тестом при большинстве заболеваний бронхолёгочной системы.В том числе при госпитализации пациента в стационар, перед хирургическим вме¬ шательством, при динамическом наблюдении за пациентами, перенёсшими тубер¬ кулёз органов дыхания, имеющими в анамнезе злокачественное новообразование и в некоторых других клинических ситуациях,У больных с наличием клинических симптомов рентгенография лёгких обычно является первоочередным диагностическим тестом. Показанием к выполнению рентгенографии лёгких являются;• клиника острого воспалительного процесса при подозрении на возникнове¬ ние пневмонии;• травма груди, сочетанные травмы нескольких анатомических областей с вовлечением грудной клетки;• одышка при её возникновении или немотивированном усилении;• хронический кашель для определения причины клинической симптоматики;• избыточное отделение мокроты при подозрении на бронхоэктазы.В целом, можно констатировать, что любое клиническое подозрение на нали¬ чие патологических изменений в лёгких, средостении, плевре или грудной стенке является обоснованным показанием для проведения рентгенографии лёгких.ПРИМЕНЕНИЕ ТОМОГРАФИЧЕСКИХ ТЕХНОЛОГИИОдиночные очаги в лёгкихНесмотря на многообразие проявлений при лучевом исследовании, перифе¬ рический рак обычно изображается на снимках как патологическое образование округлой или близкой к ней формы. В связи с этим проблемы дифференциальной диагностики этой формы рака обычно рассматривают в контексте распознавания одиночных округлых образований. В литературе предложены многочисленные схемы и алгоритмы диагностики этого рентгеновского синдрома, которые посте¬ пенно меняются в связи с накоплением знаний в этой области, появлением новых технологий диагностики и патоморфоза самого рака лёгкого. Рациональный
тшшт70 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХПОДХОД к дифференциальной диагностике должен учитывать ряд важных обстоя¬ тельств.• Среди всех впервые выявленных округлых образований в лёгких злокаче¬ ственные опухоли составляют не более 50%, причём эта цифра включает и метастатические изменения. Около половины округлых образований являют¬ ся доброкачественными и значительная часть из них не нуждаются в хирур-; ?;г;гическом лечении.. ‘-.v'у;,}.: ?:. • Среди патологических образований размером более 3 см частота рака лёгкогодостигает 70-90%, при этом лучистые контуры такого образования увеличи¬ вают вероятность до 85-95%.• Патологические образования размером менее 1 см в 80% являются доброкаче¬ ственными. Для их оценки должны использоваться алгоритмы, предложенные в программах скрининга рака лёгкого с использованием низкодозной КТ,• Патогномоничных лучевых признаков рака лёгкого, отдельных или их соче¬ таний, не существует. Например, более 20% злокачественных периферических опухолей имеют ровные чёткие контуры, в 5-7% новообразований содержат¬ ся включения кальция, до 5% новообразований имеют срок удвоения более 720 сут. Поэтому заключение о наличии или отсутствии злокачественной опухоли по данным лучевого исследования имеет вероятностный характер.• Основной задачей лучевого исследования является поиск признаков добро¬ качественного процесса. При отсутствии таковых образование следует рас¬ ценивать как потенциально злокачественное.• Лучевыми признаками, более характерными для доброкачественных образо¬ ваний, являются:❖ отсутствие динамики процесса в течение 2 лет и более по данным ретроспек¬ тивного анализа предшествующих рентгеновских снимков, флюорограмм или компьютерных томограмм;❖ наличие «доброкачественных» обызвествлений в структуре патологическо¬ го образования — диффузных, очаговых, кольцевидных, а также включений жира или жидкости (киста).Известно, что структура патологического образования в лёгочной ткани наи¬ более точно оценивается при высокоразрешающей КТ (рис. 3-22). Эта технология имеет существенные преимущества в сравнении с традиционным рентгеното¬ мографическим исследованием в выявлении обызвествлений. Включения жира и кистовидную структуру образования можно установить и при МРТ, а также при УЗИ в случае простеночного его расположения. Кроме того, КТВР является оптимальным методом для характеристики контуров образования и его формы. Последнее имеет значение при наличии ретенционной кисты, заполненной жид¬ костью, артериовенозной мальформации, секвестрации и других более редких заболеваний.В настоящее время наиболее распространённым является следующий алгоритм дифференциальной диагностики одиночных округлых образований в лёгких, выявленных при флюорографии, рентгенографии или КТ:• Размеры более 3 см, нечёткие контуры КТ (линейная томография) + вери¬ фикация (оптимальный вид биопсии).• Размеры менее 1 см -> архив рентгеновских снимков + наблюдение по КТ (см. «Скрининг рака лёгкого с использованием низкодозной КТ»).• Размеры от 1 см до 3 см архив рентгеновских снимков + КТВР:❖ лучистые контуры, тканевая плотность образования верификация (опти¬ мальный вид биопсии).❖ любые контуры, включения кальция (доброкачественные обызвествления), жира или признаки жидкостной кисты, мальформации и т.п. ^ наблюдение (3, 6,12 мес).
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ71Рис. 3-22. КТВР при одиночном округлом образовании в лёгком. На рентгенограммах в прямой (а) и боковой (б) проекциях определяется округлое образование в нижней доле правого лёгко¬ го. При КТВР (в) образование имеет ровные чёткие контуры, включения кальция. При нативном КТ-исследовании (г) большую часть образования составляют жировые включения. КТ-картина типич¬ на для гамартомы.❖ чёткие контуры, нет включений ^ промежуточный очаг:- верификация (оптимальный вид биопсии);- динамическая КТ;-ПЭТ.Представленный алгоритм не является абсолютным, поскольку не учитывает диагностические возможности лечебного учреждения, доступность технологии, клиническую ситуацию, личностные особенности пациента и многое другое. Тем не менее такая тактика позволяет избежать большинства диагностических оши¬ бок, возникающих в процессе дифференциальной диагностики и, с другой сторо¬ ны, уменьшить риск ненужных торакотомий при выявлении доброкачественных образований.
72МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХМножественные очаги в лёгкихМножественные очаги в лёгких представляют собой часть рентгеновского син¬ дрома диссеминации. Наиболее частой причиной возникновения множественных очагов в лёгких являются гематогенные метастазы в лёгких. Известно, что 45ПВ- ствительность КТ в обнаружении очагов в лёгочной ткани существенно выше, чем обзорной рентгенографии. Применение КТ позволяет выявить очаги, невидимые на обычных рентгенограммах не менее чем у 30% больных с внелёгочной локали¬ зацией первичной опухоли (рис. 3-23). При этом большая часть выявленных при КТ очагов оказывается метастазами. Вторым аспектом этой проблемы является тот факт, что при наличии одиночного, по данным рентгенографии, образования в лёгком дополнительное применение КТ позволяет выявить дополнительные очаги почти у 25% больных. Тем не менее необходимость применения КТ в качестве основного теста для всех онкологических пациентов до сих пор обсуждается из-за высокой стоимости исследования.у больных с выявленными множественными очаговыми изменениями исполь¬ зование КТ направлено на решение задачи дифференциальной диагностики. Множественные очаги, в том числе и у онкологических больных, могут быть обусловлены не только метастатическим поражением лёгких, но и целым рядом инфекционных заболеваний и интерстициальных процессов. К числу наиболее распространённых следует отнести множественный диссеминированный туберку¬ лёз, септические эмболии в лёгких, паразитарные инфекции, саркоидоз, гиперчув- ствительный пневмонит.Рис. 3-23. Метастазы опухоли матки в лёгкие, При КТ выявляются множественные крупные очаги с чёткими ровными контурами и типичной для гематогенных метастазов связью с артери¬ альными сосудами.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ73Рис. 3-24. КТ; малый рак лёгкого. В верхней доле правого лёгкого определяется очаг разме¬ ром 4 мм, невидимый при обычной рентгеногра¬ фии. Морфологически установлен плоококлеточ- ный рак лёгкого.Скрининг рака лёгкого с использованием низкодозной компьютерной томографииВ ряде медицинских центров низкодозная КТ используется для скрининга рака лёгкого у пациентов с высоким уровнем риска развития этого заболевания. Систематическое повторение программ скрининга рака лёгкого с использованием низкодозной КТ в различных странах, с различными критериями включения, с использованием различного оборудования позволяет сделать некоторые выводы.Прежде всего, низкодозная КТ позво¬ ляет выявлять значительно больше опухолевых образований в лёгких, чем рентгенография. Как минимум полови¬ на всех образований, видимых на акси¬ альных срезах, не определяется при рентгенографии. Причинами являются небольшие размеры очагов, низкая их плотность и отсутствие чётких кон¬ туров, интерпозиция анатомических структур грудной клетки, прежде всего костей и крупных сосудов (рис. 3-24).Во всех исследованиях отмечается исключительно высокий уровень диа¬ гностики опухолей I стадии, который обычно превышает 75%. Это означает, что КТ-скрининг рака лёгкого удовлет¬ воряет одному из важнейших требо¬ ваний любых скрининговых программ диагностики — выявлению бессимптомно развивающейся опухоли в наиболее ранней стадии опухолевого роста.Выявление рака лёгкого зависит от выбранных критериев включения. Наиболее высокие показатели достигаются при обследовании лиц старше 60 лет и пациентов с длительным стажем интенсивного курения, В среднем, рак лёгкого выявляется при первоначальном КТ-исследовании у 0,79%. Для сравнения, рак молочных желез выявляется на начальном этапе маммографического скрининга у 0,7 пациентов.Частота рака лёгкого значительно уменьшается при повторных исследованиях. В ряде исследований показана выявляемость до 0,2%, т.е. до половины и даже 1/4 от исходного уровня.Более 90% всех вьшвляемых при КТ некальцинированных очагов являются доброкачественными. Так, в исследовании ЕЬСАР, при низкодозной КТ у 1000 паци¬ ентов было выявлено 233 не кальцинированных очага, причём 90% из них имели размер менее 10 мм. В этом заключается одна из основных проблем КТ-скрининга. Большое количество ложноположительных результатов привело к необходимости разработки специальных алгоритмов диагностики и динамического наблюдения за выявленными при скрининге очагами без излишних инвазивных процедур. В том же исследовании биопсия всех 28 некальцинированных очагов размером более 10 мм позволила диагностировать рак лёгкого в 27 случаях, в то время как доброкаче¬ ственное образование выявлено только в одном наблюдении.Потенциальная польза КТ-скрининга рака лёгкого заключается в ожидаемом увеличении продолжительности жизни пациентов за счёт снижения смертности от этого заболевания. Потенциальный вред обусловлен избыточным облучением от повторяющихся КТ-исследований, а также ложноположительными заключения¬ ми, которые приводят к увеличению страха или беспокойства пациентов, выпол¬ нению ненужных повторных исследований, биопсий или даже хирургических вмешательств.
74МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХв медицинской литературе продолжается широкая дискуссия в связи с возмож¬ ностью применения КТ-скрининга рака лёгкого в широкой клинической практике. Наиболее острыми вопросами являются погрешности скрининга, возникающие от длительности наблюдения и от гипердиагностики, а также недоказанность истин¬ ного снижения смертности от рака лёгкого при использовании КТ-скрининга. Выходом из этого положения является проведение масштабных рандомизирован¬ ных исследований в группах риска, которые позволят количественно определить вклад КТ в снижение смертности от рака лёгкого.Образования в средостении и корнях лёгкихПатологические изменения в средостении и корнях лёгких обычно выявляются при обзорной рентгенографии. Исключение составляют небольшие образования» не выходящие за контуры срединной тени и не изменяющие структуру средосте¬ ния на рентгенограммах в прямой проекции. Типичным примером могут служить тимомы или увеличенные лимфатические узлы средостения, в связи с этим любое подозрение на патологию средостения или корня лёгкого по данным рентгеногра¬ фии является безусловным показанием к проведению томографического иссле¬ дования. Таким исследованием может бьггь линейная томография, однако более информативным методом является КТ (рис. 3-25).Спиральная КТ-ангиография и МРТ имеют одинаковые возможности в оценке патологии средостения, причём каждый метод отличается собственными преиму¬ ществами и недостатками. В целом, спиральная КТ является более дешёвым, доступным и быстрым методом, позволяет более точно выявлять обызвествления, оценивать состояние лёгочной ткани и бронхиального дерева. МРТ не связана с ионизирующим излучением, обычно не требует введения контрастного вещества для оценки крупных сосудов средостения, в сравнении с последовательной КТ применение МРТ позволяет более точно изучить средостение и корни лёгких за счёт лучшей визуализации магистральных сосудов (рис. 3-26).Протокол исследования при патологии средостения включает стандартное бес¬ контрастное исследование, которое затем дополняется КТ-ангиографией при:• невозможности отграничить патологическое образование от прилежащих к нему сосудов;• необходимости отличить мягкотканное образование от кисты;• подозрении на сосудистую природу патологических изменений.Рис. 3-25. Новсюбразование средостения — ангиосаркома. КТ-ангиография (а) и реформация изо¬ бражения во фронтальной плоскости (б) позволяет определить локализацию опухоли и её взаимоот¬ ношения с камерами сердца и крупными венозными сосудами.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ 75Рис. 3-26. МРТ. Злокачественная неври- нома с инвазией опухоли в правое пред¬ сердие и правый желудочек.После проведения КТ уточняющая диагностика может осуществляться с исполь¬ зованием других лучевых технологий, с целью верификации новообразований применяется трансторакальная игловая биопсия, в том числе под контролем КТ или УЗИ. Оценка активности опухолевого процесса на фоне проводимого лечения требует проведения радионуклидного исследования — сцинтиграфии или ПЭТ. Уточнение анатомических характеристик выявленного образования, особенно при локализации его в заднем средостении, возможны при МРТ.Диффузные (интерстициальные) заболевания лёгкихПризнаки патологических изменений в лёгочной ткани, выявляемые при высо¬ коразрешающей КТ, можно условно сгруппировать следующим образом:• линейные и ретикулярные изменения;• очаговые изменения;• «матовое стекло» (уплотнения по типу «матового стекла»);• консолидация (безвоздушные участки лёгочной ткани);• понижение плотности лёгочной ткани.Линейные и ретикулярные измененияЛинейные и ретикулярные изменения возникают в результате утолщения лёгочного интерстиция при заполнении его жидкостью, клеточными элемен¬ тами, фиброзной тканью или другим патологическим субстратом. Наиболее ранним признаком этого процесса является изменение контуров анатомических структур в лёгком, в частности контуров сосудов, бронхов, плевральных листков. Нечеткость и неровность контуров отражает изменения лёгочного, преимуще¬ ственно центрального интерстиция. Этот признак является достаточно частым, но неспецифичным. Другими симптомами являются: утолщение стенок бронхов (перибронхиальные муфты), утолщение междольковьгх перегородок и утолщение внутридольковых перегородок.Характерным признаком инфильтративных изменений в лёгких является формирование перибронховаскулярных муфт. Они возникают в результате увели¬ чения объёма перибронхиального и периваскулярного интерстиция, расположен¬ ного вокруг артерий и бронхов. При этом наружный диаметр бронха и артерии имеет одинаковые размеры, а внутренний просвет бронхов часто уменьшен за счёт одновременного утолщения слизистой оболочки. Перибронхиальные муфты
ШШ-76МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЕГОЧНЫХ ЗАБОЛЕВАНИЯХнаблюдаются прежде всего у больных с интерстициальным отёком лёгких, а также при заболеваниях, связанных с нарушением лимфооттока, — саркоидозе, лимфо¬ генном туберкулёзе и лимфогенном карциноматозе.Утолщение интерстиция вдоль сосудов и бронхов может быть равномерным, что чаще возникает при интерстициальном отёке лёгких. При метастатических поражениях и гранулематозных заболеваниях утолщённые стенки бронхов и арте¬ рий могут иметь как ровные, так и неровные контуры. При одновременном разви¬ тии фиброза наблюдается не только утолщение стенок бронхов, но и расширение их просвета, смещение и деформация бронхососудистых пучков. Такие изменения бронхов описываются как тракционные бронхоэктазы.Изменённые, утолщённые перегородки изображаются как линейные структу¬ ры длиной 1-2 см или полигональные структуры диаметром 1-2 см (рис. 3-27). Утолщение перегородок может быть равномерным, неравномерным или оча¬ говым. Широко распространённым синонимом термина «очаговое» утолщение является термин «чёткообразное» (рис. 3-28). Равномерное утолщение чаще наблюдается при интерстициальном отёке и лимфогенном карциноматозе. При этом на аксиальных срезах выявляют линейные или полигональные структуры с ровными, чёткими, гладкими контурами. Неравномерное, фрагментарное утол¬ щение характерно для всех заболеваний, связанных с прогрессирующим фибро¬ зом лёгочной ткани. Эти изменения часто сопровождаются другими признаками фиброза в виде тракционных бронхоэктазов и нарушения архитектоники лёгоч¬ ной ткани. Наконец, очаговое или чёткообразное утолщение типично для грану¬ лематозных процессов, таких как саркоидоз, силикоз, а также для лимфогенного карциноматоза. Мелкие очаги в утолщённых стенках долек представляют собой перилимфатические гранулёмы или опухолевые узелки.Утолщение внутридольковых перегородок возникает при патологических изме¬ нениях внутри вторичной лёгочной дольки. При КТ эти изменения проявляются в виде нежной тонкой сетки, диаметр отдельных ячеек которой не превышает нескольких миллиметров. Утолщение внутрйдолькового интерстиция наиболее часто возникает при фиброзе. При идиопатическом лёгочном фиброзе (идиопа- тическом фиброзирующем альвеолите) или фиброзирующих альвеолитах при системных заболеваниях соединительной ткани эти изменения наиболее оче¬ видны в кортикальных отделах лёгких, особенно в базальных сегментах нижних долей (рис. 3-29). Аналогичные изменения в сочетании с утолщением косталь¬Рис. 3-27. КТВР. Диффузное утолщение меж- дольковых перегородок. Лимфогенный карци- номатоз.Рис. 3-28. КТВР. Диффузное утолщение меж- дольковых перегородок с перилимфатическими очагами в них. Метастазы рака молочной железы в лёгкие.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ77Рис. 3-29. КТВР. Утолщение внутридольковых перегородок. Идиопатический лёгочный фиброз. Типичная локализация нежных ретикулярных изменений в кортикальных отделах лёгких.ной плевры могут наблюдаться и при асбестозе. У больных с гиперчувстви- тельным пневмонитом (экзогенным аллергическим альвеолитом) процессы фиброза раньше развиваются в средних и верхних отделах лёгких и не имеют столь очевидной субплевральной лока¬ лизации.Очаговые измененияОчаги размером от 1 до 10 мм выяв¬ ляются при многочисленных диффуз¬ ных заболеваниях лёгких (рис. 3-30).Очаги высокой плотности с относи¬ тельно чёткими ровными контурами чаще возникают в лёгочном интерсти- ции. Очаги низкой плотности, по типу матового стекла, с нечёткими плохо очерченными контурами в большин¬ стве случаев отражают патологические изменения в респираторных отделах лёгко¬ го. Вместе с тем разграничение очагов по плотности и размерам имеет небольшое дифференциально-диагностическое значение. Более важной является оценка рас¬ пределения очагов в лёгочной ткани.Перилимфатические очаги локализуются в стенках бронхов, сосудов, в меж- дольковых перегородках и плевральных листках. Это создаёт картину неровных контуров анатомических структур и чёткообразного утолщения перегородок и стенок сосудов и бронхов. Такие изменения наблюдаются при саркоидозе, лимфогенном туберкулёзе, силикозе и антракозе, лимфогенном карциноматозе (рис. 3-30, б). Очаги, как правило, имеют небольшие размеры, в пределах 2-5 мм. Морфологической их основой являются гранулёмы или метастатические узелки, возникающие вдоль лимфатических сосудов в лёгочной ткани и в плевре.Центрилобулярные очаги возникают в или вокруг внутридольковых арте¬ рий и бронхов, в первом варианте они могут быть достаточно плотными, ясно видимыми, чётко очерченными, однородными (рис. 3-30, г). Морфологическим субстратом таких очагов чаще является расширение просвета внутридольковых бронхов в результате заполнения их бронхиальным секретом. Кроме того, причи¬ ной их возникновения может быть формирование гранулём в стенках внутридоль¬ ковых артерий и бронхов или утолщение стенок этих анатомических структур. Центрилобулярные изменения такого типа наблюдаются при гиперчувствитель- ных пневмонитах, эндобронхиальном распространении туберкулёза, различных формах бронхиолита, прежде всего инфекционной природы. Характерным прояв¬ лением патологии внутридольковых бронхов является симптом «дерева в почках» {tree-in-Ъud). в кортикальных отделах лёгкого, на расстоянии 3-5 мм от поверх¬ ности висцеральной плевры выявляются своеобразные У-образные структуры толщиной 1-2 мм с утолщениями на концах. Этот симптом является томографи¬ ческим отображением расширенных и заполненных секретом внутридольковых бронхов в продольном сечении.Второй вариант центрилобулярных очагов представлен плохо очерченными мелкими уплотнениями лёгочной ткани по типу матового стекла (рис. 3-30, в). Эти очаги возникают в результате клеточной инфильтрации перибронхиолярной лёгочной ткани и наблюдаются при гиперчувствительных пневмонитах и некото¬ рых формах бронхиолитов. Значительное количество таких очагов может созда¬ вать иллюзию изменений по типу матового стекла.Ш.
78 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХВ 1кк.'Рис. 3‘30. Виды очагов при КТВР: а — хаотичные очаги, гематогенные метастазы; б — перилимфа¬ тические очаги, саркоидоз II стадии; в — центрилобулярные очаги по типу «матового стекла», гилер- чувствительный пневмонит; г — центрилобулярные очаги, симптом «дерева в почках», бронхогенная туберкулёзная диссеминация.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ79Хаотичное распределение очагов типично для гематогенных процессов, таких как милиарный и гематогенно-диссеминированный туберкулёз, гематогенная грибковая инфекция, гематогенные метастазы (рис. 3-30, а). Очаговые образо¬ вания располагаются в лёгочной ткани вне связи с отдельными элементами вто¬ ричной лёгочной дольки. Лишь в отдельных случаях, например при гематогенном метастазировании, удаётся установить связь очагов с мелкими ветвями лёгочной артерии.Крупные множественные очаги размером более 10 мм (патологические обра¬ зования, инфильтраты) возникают при диссеминированном туберкулёзе, септи¬ ческих эмболиях, грибковых инфекциях, гранулематозе Вегенера, гематогенных метастазах. Некоторые из них имеют характерные отличия, что позволяет пред¬ положить правильный диагноз. Так, септические эмболии характеризуются почти постоянной связью некротического инфильтрата в лёгочной ткани с ветвями лёгочной артерии. Аналогичные изменения можно обнаружить и при других про¬ цессах, возникающих гематогенно. Но тонкостенные полости округлой формы, нередко с уровнями жидкости, характерны именно для септических эмболий. Грибковые инфильтраты, обусловленные гематогенным распространением аспер- гиллёза, в типичных случаях имеют своеобразный ободок матового стекла вокруг более плотной части.Симптом «матового стекла»^Симптом «матового стекла» характеризуется незначительным повышением плотности лёгочной ткани при сохранении видимости сосудов и стенок бронхов в зоне патологических изменений. Если сосуды в зоне уплотнения не видны, исполь¬ зуется термин «консолидация», или «безвоздушный участок лёгочной ткани».Симптом матового стекла возникает в результате уфеднения плотностных пока¬ зателей воздуха и изменённых анатомических структур лёгочной ткани, величина которых находится за пределами разрешающей способности КТ. Морфологической основой матового стекла являются: утолщение интерстиция межальвеолярных перегородок, частичное заполнение альвеол патологическим содержимым или оба процесса одновременно.Симптом «матового сгекла» можно оценивать только по тонким томографиче¬ ским срезам, выполненным на высоте глубокого задержанного вдоха (рис. 3-31). На толстых срезах эффект полупрозрачности лёгочной ткани может возникать за счёт частичного объёмного эффекта, что не является отражением морфологиче¬ ских изменений в лёгочной ткани. При исследовании на выдохе зоны, аналогич« ные матовому стеклу, возникают за счёт физиологического уменьшения воздушно¬ сти лёгочной ткани (физиологической гиповентиляции) и не являются при¬ знаком патологии. Для правильной интерпретации изменений необходи¬ мо использовать широкое электрон¬ ное окно (не менее 1500 Ни), так как излишняя контрастность изображения при выборе более узкого электронного окна может привести к ошибкам интер¬ претации.Симптом матового стекла имеет большое практическое значение как в оценке активности воспалительно¬ го процесса, так и в дифференциаль- „ „ ^ной диагаостике заболеваний лёгких. Гиперчувствительныи пневмо-нит. Множественные участки уплотнения легоч- Наличие симптома матового стекла ^ ^без признаков фиброза (тракционных лёгких
80 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХбронхоэктазов, нарушения архитектоники лёгочной паренхимы) является отраже¬ нием активного и потенциально обратимого воспалительного процесса.Наиболее часто симптом матового стекла наблюдается при идиопатических лёгочных фиброзах, фиброзирующем альвеолите при системных заболеваниях соединительной ткани, десквамативной интерстициальной пневмонии, гипер- чувствительном пневмоните, саркоидозе и, значительно реже, при альвеолярном протеинозе.Консолидация (безвоздушные участки лёгочной ткани)Такие изменения возникают при заполнении альвеол патологическим содержи¬ мым в виде жидкости, клеточных элементов, фиброзной ткани и другого субстрата. Потенциально, все факторы, лежащие в основе симптома матового стекла, могут привести к полной потере воздушности участка лёгочной ткани. В большинстве случаев в этих участках лёгочной ткани видны просветы относительно крупных бронхов. Диффузные двухсторонние изменения такого типа наблюдаются при бактериальных и грибковых пневмониях, туберкулёзе лёгких, альвеолярном отёке лёгких, респираторном дистресс-синдроме взрослых, острой интерстициальной пневмонии, криптогенной организующейся пневмонии (облитерирующем брон¬ хиол ите с организующейся пневмонией).Применение КТ, как правило, не оказывает существенного влияния на интер¬ претацию изменений, уже выявленных при обзорной рентгенографии. Участки консолидации лёгочной ткани изображаются практически одинаково и на рентге¬ нограммах, и на компьютерных томограммах. Вместе с тем на аксиальных срезах удаётся более наглядно оценить распределение изменений в лёгочной ткани, осо¬ бенно при субплевральной их локализации (рис. 3-32). Наличие суммационного эффекта при рентгенографии в ряде случаев затрудняет правильную локализацию безвоздушных участков по отношению к корню лёгкого, костальной или междо¬ левой плевре. При КТ эти топографические особенности выглядят значительно более демонстративно. Относительно редко при КТ можно выявить некоторые особенности безвоздушных участков, характерные для отдельных патологических процессов. Так, скопления жира в уплотнённой лёгочной ткани типичны для липо- идных пневмонитов, более плотные участки йодсодержащих включений, напоми¬ нающие обызвествления, возникают у больных на фоне приёма амиодарона.Понижение плотности лёгочной тканиПонижение плотности лёгочной ткани может бьггь обусловлено разрушением лёгочной ткани при эмфиземе и сотовом лёгком или связано с уменьшением кро¬ вотока в результате патологии сосудов и мелких бронхов.Эмфизема характеризуется наличием зон патологически низкой плотности без отчётливых стенок (рис. 3-33). Если деструкция лёгочной ткани распро¬ страняется на всю вторичную лёгочную дольку, стенками воздушных полостейРис. 3-32. КТВР. Блеомициновое поражение лёгких. Двусторонние участхи уплотнения в субплев- ральных отделах с видимыми 8 них просветами бронхов.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ81Рис. 3-33. КТВР. Эмфизема. В обоих лёгких тон¬ костенные воздушные полости панлобулярной и парасептальной эмфиземы.становятся неизменённые междоль- ковые перегородки. Аналогичные по толщине стенки могут иметь и буллы.Они представляют собой воздухосо¬ держащие полости диаметром более1 см, границами которых являются соединительнотканные перегородки.Патоморфологически принято выде¬ лять три основных типа эмфиземы: центрилобулярная, панлобулярная и дистальная ацинарная.Центрилобулярная эмфизема, обу¬ словленная вдыханием табачного дыма, имеет вид небольших участков пониженной плотности в центре вто¬ ричных лёгочных долек. Как прави¬ ло, изменения наиболее выраженыв верхних долях лёгких. Панлобулярная эмфизема возникает при дефиците а^-антитрипсина. Изменения локализуются преимущественно в нижних долях лёгких и характеризуются обширными зонами пониженной плотности без чётких контуров. Дистальная ацинарная эмфизема представлена мелкими воздушными полостями в непосредственной близости от плевральных листков. Буллы пред¬ ставляют собой тонкостенные воздушные полости диаметром более 1 см, образо¬ вавшиеся в результате слияния нескольких полостей панлобулярной или парасеп¬ тальной эмфиземы.Эмфизему необходимо дифференцировать с лёгочными кистами, сотовым лёг¬ ким и мешотчатыми бронхоэктазами. Все перечисленные патологические структу¬ ры имеют ясные, чётко очерченные контуры и значительно более толстые стенки. Кисты обычно представляют собой растянутые мелкие внутридольковые бронхи. Они типичны для больных гистиоцитозом и лейомиоматозом. Сотовое лёгкое является исходом воспалительного процесса в лёгочной паренхиме. Изменения характеризуются множественными мелкими воздушными полостями с толстыми стенками, чаще расположенными в кортикальных отделах, в сочетании с другими признаками фиброза. Бронхоэктазы отличаются чёткой взаимосвязью кольце¬ видной полости расширенного бронха с параллельно расположенным мелким артериальным сосудом.Мозаичная плотностьПонижение плотности лёгочной ткани может также быть связано с уменьшени¬ ем перфузии, что достаточно часто наблюдается у больных с хронической тромбо¬ эмболией лёгочной артерии. Перераспределение крови из зон обтурации артери¬ альных сосудов в зону сохранённого кровотока приводит к повышению плотности нормальной лёгочной ткани. Это сочетание участков повышенной и пониженной плотности, иногда напоминающее географическую карту, носит название моза¬ ичной перфузии или мозаичной плотности лёгочной ткани. Значительно чаще картина мозаичной плотности возникает в результате патологических изменений в мелких бронхах с последующей рефлекторной вазоконсгрикцией и перераспре¬ делением крови в здоровые участки лёгкого,В ряде случаев возникают трудности в разграничении картины мозаичной плот¬ ности лёгочной ткани и неравномерно расположенных зон уплотнения лёгочной ткани по типу матового стекла. Дифференциальная диагностика осуществляется на основании изучения калибра сосудов в зонах пониженной и повышенной плот¬ ности и анализа данных экспираторной КТ, При наличии перераспределения крови сосуды в зонах пониженной плотности сужены, количество их уменьшено.
'§Ш. 82 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХНаоборот, в зонах повышенной плотности сосуды представляются расширенными, количество их увеличено, у больных с воспалительными процессами в лёгочном интерстиции, проявляющимися симптомом матового стекла, диаметр сосудов в зонах различной плотности одинаков.При экспираторной КТ у больных с сосудистой патологией участки пониженной и повышенной плотности становятся в равной степени более плотными.у пациентов с патологией дыхательных путей, при исследовании их на высо¬ те задержанного выдоха, различия в плотности ещё больше увеличиваются. Этот феномен понижения или сохранения низкой плотности отдельных участков лёгочной ткани при экспираторной КТ обозначается как клапанная ловушка или клапанное вздутие. Участки клапанного вздутия характеризуют нарушение прохо¬ димости мелких бронхов. Они имеют большое дифференциально-диагностическое значение для разграничения патологических процессов в дистальной части брон¬ хиального дерева и в лёгочной паренхиме.Выбор метода и места биопсииОдним из наиболее важных показаний к проведению высокоразрешающей КТ является определение места и вида биопсии лёгкого. Множество заболеваний лёг¬ ких имеют неравномерное распределение с чередованием зон изменённой и нор¬ мальной паренхимы. Более того, в одном лёгком и даже в одной доле лёгкого могут сочетаться активное воспаление и фиброз. Возможность высокоразрешающей КТ предельно точно выявлять, характеризовать и определять распространённость паренхиматозных изменений определяет значение этой методики для планиро¬ вания вида биопсии (чрезбронхиальная, открытая) и места взятия материала для морфологического исследования.С учётом объективных трудностей ЧББ, ВТС и открытой биопсии становится понятной важная роль высокоразрешающей КТ в определении места биопсии и метода верификации. Данные КТ позволяют выявить участки лёгочной парен¬ химы без признаков фиброза и, следовательно, наиболее перспективные с точки зрения получения информативного материала. Кроме того, результаты КТ имеют решающее значение в определении способа верификации, выбора между ЧББ, БАЛ и открытой биопсией. Исключительно важными в этом смысле являются признаки перибронхиальных изменений, характерных для саркоидоза и лимфо¬ генного карциноматоза.Представленные данные свидетельствуют об эффективности использования КТВР для проведения различных видов биопсии. Но может ли КТВР заменить биопсию? Такая возможность оценивается сегодня неоднозначно. Тем не менее можно выделить достаточно очерченную группу патологических процессов и кон¬ кретных клинических ситуаций, когда такое решение может быть принято. К ним относятся:• пациенты с известной причиной интерстициального пневмонита, например системное заболевание соединительной ткани или асбестоз;• пациенты с классической картиной саркоидоза, которая включает перилим¬ фатические очаги в сочетании с увеличением лимфатических узлов средосте¬ ния и корней лёгких:• пациенты с известным анамнезом пылевой вредности (кремниевая и угольная пыль) при наличии типичных очаговых изменений в задних сегментах верх¬ них долей лёгких;• пациенты с известной злокачественной опухолью в анамнезе и признаками лимфогенного карциноматоза;• пациенты, страдающие подострым гиперчувствительным пневмонитом (экзо¬ генным аллергическим альвеолитом) при известной причине заболевания и типичными центрилобулярными очагами в лёгких;• пациенты с сотовым лёгким любой этиологии.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ 83Данные КТВР могут иметь такое же определяющее значение и у отдельных пациентов, страдающих гистиоцитозом и лимфангиомиоматозом при типичной клинической картине и характерных кистовидных изменениях в лёгких. Более спорным и индивидуальным является такой подход к больным идиопатическим лёгочным фиброзом при наличии характерных изменений по типу матового стек¬ ла в кортикальных отделах нижних долей лёгких.Не менее сложной является проблема выполнения биопсии больным с клиниче¬ скими симптомами патологии органов дыхания и нормальной картиной при КТВР. Ряд исследований последних лет показал, что у больных с морфологически вери¬ фицированными диффузными инфильтративными заболеваниями лёгких данные КТВР были расценены как нормальные в 12-18% наблюдений. Эти результаты показывают, что отсутствие изменений при высокоразрешающей КТ не позволяет исключить диффузное инфильтративное заболевание лёгких, если имеются веские клинические симптомы такого заболевания.Болезни дыхательных путейВведение в клиническую практику спиральной технологии сканирования и МДКТ существенно изменило подход к изучению дыхательных путей. В настоя¬ щее время не существует единого протокола при патологических изменениях бронхов. Конкретный протокол определяется типом сканирующего устройства и характером предполагаемой патологии. Условно можно выделить три клини¬ ческие ситуации, при которых особое внимание должно быть уделено изучению бронхиального дерева:• предполагаемое заболевание бронхов у больных с нормальной рентгенограм¬ мой грудной клетки; эти состояния включают кровохарканье неясной этиоло¬ гии, а также скрининг рака лёгкого у больных с метастазами в головной мозг или надпочечники;• ателектаз, выявляемый при рентгенографии органов грудной полости; к этой же группе относятся пациенты с затяжной пневмонией, причиной которой может быть бронхостеноз различной этиологии, и пациенты с патологиче¬ ским образованием в корне лёгкого;• воспалительные заболевания бронхов, к которым относятся бронхоэктазы и бронхиолиты.В каждой из этих клинических ситуаций необходимо применять отдельный протокол сканирования. Общее правило исследования крупных бронхов в обла¬ сти корня лёгкого заключается в выборе толщины слоя (величины коллимации), равной диаметру изучаемых бронхов. На практике это означает, что исследование долевых и сегментарных бронхов необходимо проводить при толщине слоя менее3 мм. Последовательная технология сканирования позволяет выполнять лишь прилегающие томографические срезы, толщина которых обычно составляет 5 мм. Спиральное сканирование и особенно МДКТ создаёт условия для уменьшения толщины слоя до 3 мм. Вне зависимости от величины коллимации использование спирального сканирования определяет необходимость частичного наложения томографических срезов. Интервал реконструкции обычно составляет 2/3 от вели¬ чины коллимации.Наличие патологического образования в непосредственной близости от круп¬ ного бронха, как правило, требует выполнения спиральной КТ-ангиографии. Несмотря на то что большинство таких образований является бронхогенным раком, существует немало других причин сдавления крупных бронхов. Среди них следует выделить увеличение лимфатических узлов различной этиологии и аневризматические расширения прилежащих сосудов. Дифференциальная их диа¬ гностика достаточно сложна и основана на точном понимании сложных взаимоот¬ ношений собственно бронхиальных ветвей, артерий, вен и лимфатических узлов.
I - ' 84 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХАтелектазЗакупорка крупного бронха сопровождается возникновением целого ряда при- знаков, отражающих как природу и распространённость патологического заболе- вания, так и компенсаторные изменения в прилежащей лёгочной ткани, средосте¬ нии, диафрагме и грудной сгенке.ІЇ ’ і Общими признаками любого обтурационного ателектаза являются:. • уплотнение лёгочной ткани в пределах анатомической части лёгкого;• чёткие, как правило, вогнутые контуры уплотнённого участка;• уменьшение объёма безвоздушной части лёгкого с типичным смещением её в сторону средостения;• сужение вплоть до полной обтурации соответствующего бронха;• увеличение объёма (компенсаторное вздутие) прилежащих долей и сегмен¬ тов, смещение органов грудной полости в сторону уплотнения.Все перечисленные признаки могут быть выражены в различной степени, что создаёт определённое разнообразие в типичной картине ателектазов. Однако самым важным КТ-признаком обтзфационного ателектаза является отсутствие просвета крупного бронха (рис. 3-34). С другой стороны, обтурация крупного бронха не обязательно приводит к одновременному спадению лёгочной ткани. В некоторых случаях лёгочная ткань дистальнее сужения остаётся совершенно нор¬ мальной даже при полном отсутствии просвета долевого бронха.Определению причины бронхостеноза способствует изучение контуров спав¬ шейся доли. В зоне расположения патологического образования рядом с корнем лёгкого контуры ателектаза нередко становятся выпуклыми, в то время как в остальной части они вогнуты в сторону уплотнения. Однако отличить опухоль от безвоздушной лёгочной ткани на нативных томограммах обычно не пред¬ ставляется возможным, так как денситометрические их показатели практически одинаковы.Внутривенное введение контрастного вещества может помочь в определении границ опухоли и разграничении опухолевых масс и безвоздушной лёгочной ткани. Обычно опухоль накапливает контрастное вещество в меньшей степени, чем ателектаз. Это различие удаётся обнаружить при быстром введении контраста в условиях КТ-ангиографии. Тем не менее у части больных ателектазированная ткань не накапливает контрастное вещество из-за распространённого вторичного воспалительного процесса или сужения лёгочных артерий. Кроме того, некоторые опухоли, например, карциноиды, отличаются значительным повышением плотно¬ сти на фоне введения контрастного вещества, что также затрудняет разграничение патологического образования и ателектаза.Фиброателектазы возникают в результате перенесённых ранее воспалительных процессов, которые закончились развитием грубых обширных фиброзных изме¬ нений в лёгочной ткани. В большинстве случаев причиной фиброателектаза явля¬ ется неразрешившаяся плевропневмония (рис. 3-35). Другими распространённы¬ ми причинами является туберкулёзное воспаление или инфекционная деструкция лёгких.Фиброателектаз имеет характерные КТ-признаки, позволяющие уверенно отличать его от обтурационного ателектаза. Прежде всего, просветы долевого и сегментарных бронхов остаются свободными. Часто они смещаются в сторону средостения в значительно большей степени, чем при обтурационных ателек¬ тазах. Длительный воспалительный процесс с последующим склерозированием лёгочной ткани приводит к расширению и деформации бронхов, формированию бронхоэктазов, которые отчётливо видны на аксиальных срезах. В прилежащей лёгочной ткани нередко можно выявить участки эмфиземы. Структура уплот¬ нённого участка в большинстве случаев неоднородна, с наличием в нём участков вздутия.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ85Рис. 3-34. Ателектаз нижней доли правого лёгкого. Типичные признаки ателектаза при рентгено¬ графии в прямой (а) и боковой (б) проекциях. На аксиальных срезах (КТ-ангиофафия) определяется патологическое образование, суживающее просвет промежуточного бронха (в), и ателектаз нижней доли с видимыми в нем сосудами и заполненными секретом бронхами (г).
86МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 3-34, Окончание.Рис. 3-35. КТ. Фиброателектаз нижней доли правого лёгкого. Просвет нижнедолевого бронха и В6 свободен. В частично безвоздушной нижней доле расширенные деформированные просветы мелких бронхов.БронхоэктазыИзучение патологических процессов мелких бронхов, в частности бронхоэкта¬ зов и бронхиолитов, основано на применении высокоразрешающей КТ. В послед¬ ние годы появились исследования, свидетельствующие о высокой эффективности тонкослойной спиральной КТ с последующими преобразованиями изображений в программе шш1Р.Бронхоэктазы представляют собой локализованное необратимое расширение бронхов. В настоящее время основным методом диагностики бронхоэктазов является КТ. Основным преимуществом метода является возможность выявления расширенных бронхов без искусственного их контрастирования, причём одновре¬ менно в обоих лёгких. Кроме того, удаётся более точно, чем при рентгенографии и бронхографии, оценить состояние лёгочной ткани вокруг изменённых бронхов.Бронхоэктазы принято разделять на цилиндрические, веретенообразные (вари¬ козные) и мешотчатые. Такое разделение имеет определённое значение для диа¬ гностики и дифференциальной диагностики бронхоэктазов по данным бронхогра¬ фии и КТ, однако не влияет существенно на выбор лечебной тактики. Сзтцественно большее значение имеет распространённость и локализация изменений в пределах конкретньпг бронхолёгочных сегментов. Методикой выбора в диагностике брон¬ хоэктазов является КТВР.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ87Рис. 3-36, КТВР. Цилиндрические (а) и мешотчатые (б) бронхоэктазы в средней и нижней долях правого лёгкого.Принято выделять прямые и косвенные признаки бронхоэктазов. К прямым признакам относят; расширение просвета бронха, отсутствие нормального умень¬ шения диаметра бронхов по направлению к периферии и видимость просветов бронхов в кортикальных отделах лёгких (рис. 3-36). Непрямые или косвенные признаки включают утолщение или неровность стенок бронхов и наличие мукоце- ле, т.е. расширенных бронхов, заполненных бронхиальным секретом.На аксиальных срезах бронхоэктазы обычно локализуются в центре лёгочных полей, на середине расстояния между грудной стенкой и средостением. Исключение составляют ателектатические бронхоэктазы, при развитии которых безвоздушная доля смещена и прилежит к средостению. Форма цилиндрических бронхоэктазов зависит от расположения изменённых бронхов по отношению к плоскости ска¬ нирования. Изображение бронха в продольном сечении представляет собой две параллельные линии, между которыми располагается полоска воздуха. В попереч¬ ном сечении такой бронх имеет кольцевидную форму. Мешотчатые бронхоэктазы имеют вид тонкостенных полостей. Изменённые бронхи могут быть заполнены воздухом или содержать жидкость, в последнем случае в просветах бронхов появляются уровни жидкости. Основным критерием расширения бронха является увеличение его внутреннего диаметра в сравнении с рядом расположенной ветвью лёгочной артерии. Этот признак позволяет отличить бронхоэктатические полости от воздушных кист и эмфиземы.Другим важным симптомом является отсутствие равномерного сужения про¬ светов бронхов по направлению к периферии. Этот признак можно выявить при анализе серии прилежащих срезов. Однако использование для диагностики КТВР затрудняет оценку этого симптома, поскольку расстояние между тонкими срезами составляет 5 или 10 мм.Информативность КТ и бронхографии в диагностике бронхоэктазов равна. Многочисленные исследования последних лет показали, что чувствительность КТ в выявлении бронхоэктазов составляет 93-98%, в то время как специфичность метода достигает 93-99%. При КТ удаётся более точно выявлять расширение мелких внутридольковых бронхов (бронхиолоэктазы), в которые контрастное вещество при бронхографии часто не проникает. Результаты КТ более объективны в плане оценки распространённости и локализации бронхоэктазов. Однако основ¬ ным достоинством КТ является отсутствие необходимости контрастирования бронхиального дерева, С учётом этого в настоящее время первичная диагностика бронхоэктазов должна осуществляться с помощью КТ.
и1*188 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИI Лучевое исследование больных с предполагаемой ТЭЛА направлено на:!. • выявление тромбов в просвете сосудов;• распознавание осложнений, возникающих в органах грудной полости при 1"^ ' обтурации артериальных сосудов;^ '• установление источника эмболии.Объём лучевого исследования определяется прежде всего клиническими про¬ явлениями патологического процесса. При тяжёлом и крайне тяжёлом состоянии, характерном для тромбоэмболии (ТЭ) общего ствола и наиболее крупных ветвей лёгочной артерии, исследование ограничено выполнением обзорной рентгено¬ граммы органов грудной полости в приёмном покое или отделении реанимации. Если клиническая вероятность ТЭЛА велика и в лечебном учереждении есть отде¬ ление ангиографии, больному может быть выполнена экстренная АПГ с последую¬ щим внутриартериальным введением лекарственных препаратов, реканализацией тромба или тромбоэктомией.В случае более благоприятного течения заболевания лучевое исследование может включать различные методы: перфузионную сцинтиграфию, часто в сочетании с вентиляционной сцинтиграфией, плановую АПГ, обычную КТ или спиральную КТ-ангиографию, МРТ и МР-ангиографию. Выявление источника ТЭЛА осущест¬ вляется с помощью флебографии и/или УЗИ вен таза и нижних конечностей, а также сердца (ЭхоКГ). С этой же целью в настоящее время применяют МРТ и спи¬ ральную КТ-ангиографию. Наконец, для определения вероятности самого процесса тромбообразования используют разнообразные биохимические тесты, наиболее информативным из которых в настоящее время является определение продуктов распада фибрина или ё-димеров в крови с помощью реакции гемагглютинации.Обычное рентгенологическое исследование позволяет лишь предположить развитие ТЭЛА, поскольку прямая визуализация тромбов в просвете сосудов невозможна. Изменения на рентгенограммах возникают у большинства больных ТЭЛА, но они не являются специфичными. Рентгенологические признаки ТЭ крупных ветвей лёгочной артерии можно условно разделить на «прямые» и кос¬ венные [2, 5], «Прямым» признаком обтурации крупного сосуда является обедне¬ ние вплоть до полного исчезновения сосудистого лёгочного рисунка дистальнее места обструкции. Более демонстративная рентгенологическая картина возникает при одновременном локальном расширении крупной ветви лёгочной артерии в корне лёгкого в результате обтурации её тромбом (рис. 3-37).Значительно чаще ТЭ крупных ветвей лёгочной артерии проявляется косвенны¬ ми рентгенологическими симптомами. К их числу следует отнести: высокое распо¬ ложение диафргмы на стороне поражения, дисковидные ателектазы в базальных сегментах лёгких, выпот в плевральной полости, обычно имеющий геморрагиче¬ ский характер, признаки артериальной лёгочной гипертензии (рис. 3-38).Радионуклидное исследование больных с предполагаемой ТЭЛА включает одномоментное выполнение вентиляционной и перфузионной сцинтиграфии. Учитывая техническую сложность выполнения вентиляционной сцинтиграфии и отсутствие необходимой аппаратуры в большинстве лечебных учреждений, это исследование выполняется не всегда. Информативность радионуклидного иссле¬ дования в диагностике ТЭЛА до настоящего времени оценивается противоречиво. Общепризнанно большое значение этого метода как скринингового исследования больных с клиническими симптомами ТЭЛА или высоким риском её развития (рис, 3-39).В соответствии с рекомендациями РЮРЕО результаты перфузионной сцинти¬ графии можно разделить на четыре категории: высокая вероятность ТЭЛА (множе¬ ственные сегментарные или полисегментарные дефекты перфузии при сохранении нормальной вентиляции как минимум в одном из них, общая величина дефектов
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ89Рис. 3-37. Обзорная рентгено¬ грамма. ТЭЛА. Обеднение лёгоч¬ ного рисунка, расширение корней лёгких за счёт лёгочных арте¬ рий, коническое сужение правой лёгочной артерии, митральная конфигурация сердечной тени.4^..Рис. 3-38. ТЭЛА. Обзорная рентгенограмма {а) позволяет выявить большое количество жидкости в правой плевральной полости. При КТ-ангиографии обнаружены тромбы в ветвях правой (б) и левой (в) лёгочных артерий.
Г л.!:п^‘««й1ШШ'®90 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 3-39. ТЭЛА. Перфузионная сцинтиграфия с макроагрегатами альбумина человеческой сыво¬ ротки, меченными ^""Тс. Множественные хаотично расположенные дефекты перфузии преимуще¬ ственно в верхней доле правого лёгкого. При рентгенографии лёгких (не показана) патологии не определяется.перфузии более 75%); промежуточная картина (дефект перфузии 25-75%); низкая вероятность ТЭЛА (дефект перфузии менее 25%); нормальная картина (нет дефек¬ тов перфузии). В целом чувствительность перфузионно-вентиляционной сцинти¬ графии в диагностике ТЭЛА не превышает 85%, в то время как специфичность составляет только 10% [21]. Чувствительность вентиляционно-перфузионной сцинтиграфии наиболее высока в двух ситуациях: результаты исследования ука¬ зывают на высокую вероятность ТЭЛА или сцинтиграфическую картину можно расценить как нормальную.Ангиопульмонография в настоящее время всё реже применяется в диагно¬ стике ТЭЛА в связи с технологическими и организационными трудностями её проведения. Всё большее значение приобретают менее инвазивные методы, такие как спиральная КТ и МРТ.Компьютерная томография применяется для прямой визуализации тромбов в просвете крупных сосудов или для выявления осложнений ТЭЛА, а также при¬ знаков хронической ТЭ мелких ветвей лёгочной артерии. КТ-ангиография позво¬ ляет всесторонне изучить крупные сосуды грудной полости. На аксиальных срезах отчётливо видны тромбы в просвете общего ствола лёгочной артерии, а также в главных, долевых и сегментарных её ветвях (рис. 3-40). Они имеют вид дефектов наполнения в просвете сосуда на фоне контрастированной крови или мягкоткан¬ ных образований, полностью обтурирующих поражённую артерию. Основным преимуществом КТ в сравнении с АПГ является неинвазивный характер исследо¬ вания, что предопределяет снижение риска возможных осложнений. Летальные исходы при выполнении КТ-ангиографии отмечаются в 0,01% исследований, тяжёлые осложнения — в 0,5%. Применение КТ-ангиографии позволяет достовер¬ но отличать внутрипросветные тромбы от сдавления и прорастания сосудов опу¬ холевыми массами или увеличенными лимфатическими узлами. Это обусловлено возможностью одновременного исследования не только собственно сосудов, но и периваскулярных тканей, бронхов, лёгких, плевры и грудной стенки.в диагностике хронической ТЭ мелких ветвей лёгочной артерии может быть использована как обычная, так и спиральная КТ. Основными признаками такого вида ТЭ является не только обтурация кровеносных сосудов, но и изменения в окружающей их лёгочной ткани. Снижение кровотока приводит к понижению
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ91плотности лёгочной ткани и обеднению лёгочного рисунка в пределах опреде¬ лённой анатомической единицы лёгко¬ го — дольки или субсегмента. Диаметр сосудов в этих зонах уменьшается. Наоборот, кровоток в расположенных рядом участках лёгкого компенсатор¬ но увеличивается. В результате плот¬ ность лёгочной ткани в них повыша¬ ется, количество сосудов и их калибр увеличивается. На аксиальных срезах такая картина напоминает мозаику с чередованием участков повышенной и пониженной плотности.ЗаключениеРис. 3-40. КТ-ангиография. ТЭЛА. В нисхо¬ дящей ветви правой лёгочной артерии дефект наполнения неправильной формы -- тромб.Методы лучевой диагностики являются важнейшим инструментом изучения состояния органов дыхания. В большинстве случаев обзорная рентгенография, наряду с анамнезом и физикальным исследованием, позволяет сделать правильное заключение о характере патологии в грудной полости. Вместе с тем обширный ряд специальных методов лучевой диагностики, среди которых наибольшее значение имеет компьютерная томография, позволяет уточнить и детализировать диагноз, выработать адекватную тактику лечения и оценить эффективность проведённых лечебных мероприяггий.список ЛИТЕРАТУРЫ г
Глава 4 Диагностическая и лечебная бронхоскопияКраткий исторический очеркБронхоскопия является одним из наиболее информативных инструментальных методов исследования трахеобронхиального дерева. В 1897 г, немецкий отоларинголог G. Killian произвёл пер¬ вую в мире бронхоскопию и удалил с помощью жёсткого эндоскопа инородное тело из правого главного бронха [1]. Термин «бронхо¬ скопия» также предложил G, Killian. В течение 50 лет бронхоскопия использовалась в основном в практике врачей-оториноларингологов в основном для удаления инородных тел. Применение современного наркоза способствовало дальнейшему совершенствованию бронхо¬ скопии. Прогресс торакальной хирургии, фтизиатрии и пульмоно¬ логии создал предпосылки для быстрого развития бронхологиче¬ ских методов.Изобретение в 1968 г. S. Ikeda и соавт. [2] фибробронхоскопа уве¬ личило ценность как диагностической, так и лечебной бронхоско- ПИИ, и расширило круг её применения. Разрешающие возможности бронхоскопии увеличились: стало возможным осмотреть все брон¬ хи IV порядка, 86% бронхов V порядка и 56% бронхов VI порядка. Недостатком фиброэндоскопов является то, что сильное сдавление прибора, например зубами, приводит к гибели стекловолокон, появлению чёрных точек в поле зрения и ухудшению изображения. Этого недостатка лишён видеоэндоскоп. В 1984 г. в США были соз¬ даны первые видеоэндоскопы EVF-F, EVD-XL, EVC-M, В современ¬ ных видеоэндоскопах, благодаря использованию высокоэффектив¬ ных линз и точных систем цифровой обработки сигнала с помощью мегапиксельных ПЗС-матриц, удаётся получить чёткое высококаче¬ ственное изображение, увеличенное примерно в 100 раз, при этом цветопередача не ухудшается. Видеоэндоскопы более надёжны в работе, так как их можно изгибать под любым углом и даже завязы¬ вать узлом, не боясь повредить эндоскоп. Значительно уменьшилась нагрузка на глаза врача-эндоскописта. Благодаря использованию видеоэндоскопов удаётся выявить мельчайшие изменения слизи¬ стой оболочки трахеи и бронхов, что позволяет диагностировать рак этих органов на ранней стадии развития. Современные способы дезинфекции и стерилизации эндоскопов полностью исключают передачу инфекции от пациента к пациенту.
ДИАГНОСТИЧЕСКАЯ И ЛЕЧЕБНАЯ БРОНХОСКОПИЯ93Показания и противопоказанияПоказания к бронхоскопическому исследованию разделяют на показания к диа¬ гностической бронхоскопии и показания к лечебной бронхоскопии. Однако неред¬ ко бронхоскопию начинают как диагностическое исследование, а заканчивают как лечебную процедуру.Показания к диагностической бронхоскопии чрезвычайно разнообразны, одна¬ ко основными показаниями служат следующие клинические симптомы — кашель, одышка или стридор, кровотечение, а также изменения, выявленные на рентге¬ нограммах и КТ, — центральная или периферическая, доброкачественная или злокачественная опухоль лёгкого, ограниченные или диффузные инфильтраты лёгочной ткани и ателектазы неясной этиологии, полостные образования лёг¬ ких, интерстициальные заболевания лёгких, увеличение бронхопульмональных лимфатических узлов, опухоли пищевода и средостения, стеноз трахеи и крупных бронхов, химические и термические ожоги трахеобронхиального дерева, травмы фуди, инородные тела трахеобронхиального дерева, туберкулёз, плеврит неясной этиологии, бронхопищеводный и бронхоплевральный свищ.Бронхоскопическое исследование выполняют всегда после рентгенологическо¬ го исследования органов фудной полости, так как во время бронхоскопии можно осмотреть бронхи только до 5-6-ГО порядка включительно. Любые изменения на рентгенофаммах, которые ассоциируют с респираторными симптомами, являются показанием к диагностической бронхоскопии.По данным ряда авторов [3, 4], кашель, продолжающийся свыше 12 нед при отсутствии изменений на рентгенофамме, является показанием к диагностической бронхоскопии. При этом рак лёгкого выявляется у 2-16% пациентов. Мы считаем, что абсолютным показанием к бронхоскопии является кашель, продолжающийся свыше 4-6 нед.К бронхоскопии имеется очень немного абсолютных противопоказаний. К ним относятся нестабильная стенокардия, острый инфаркт миокарда, осфый инсульт, лёгочно-сердечная и сердечно-сосудистая недостаточность П1 ст., уфо- жающая жизни больного аритмия, тяжёлая устойчивая гипоксемия, отсутствие контакта врача с пациентом (из-за психического заболевания больного), недо¬ статочное мастерство персонала, отсутствие необходимого оборудования и инструментария.Методика бронхоскопииЗа 30 мин до исследования больному вводят подкожно 1 мл 0,1% раствора атропина сульфата для уменьшения влияния блуждающего нерва. Если у пациента бронхиальная астма, то непосредственно перед началом бронхоскопии внутривен¬ но вводят 10 мл 2,4% раствора аминофиллина (эуфиллина*) на 10 мл изотониче¬ ского раствора натрия хлорида.Бронхоскопию выполняют в специально оборудованном кабинете, который должен располагаться в стационаре или медицинском центре, где имеется реани¬ мационное отделение или палата интенсивной терапии, а также операционная. Бронхоскопию выполняют в положении больного сидя или лёжа. Если у пациента имеется дыхательная недостаточность, но нет опасности возникновения ослож¬ нений, предпочтительнее проводить исследование в положении больного сидя, в положении сидя также удобно выполнять лечебные бронхоскопии, так как в этом случае пациенту легче откашливать санирующий раствор. Прибор можно вводить трансназально, трансорально или через трахеостому. Для анестезии используют 2% раствор лидокаина в количестве 10 мл (всего 300 мг или 4,5 мг на кг массы тела).
94 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХ; § Диагностическая бронхоскопияч Бронхоскопия играет ведущую роль в диагностике доброкачественных и зло-' качественных оп}осолей трахеобронхиального дерева [7]. При центральном раке , лёгкого опухоль возникает из слизистой оболочки бронхов 1-го, 2-го и 3-го поряд- ков, которые составляют рентгенологически корень лёгкого. Эндоскопическая- классификация рака лёгкого основана на характере роста опухоли. По характеру роста центральный рак делится на эндобронхиальный и перибронхиальный, в ■ свою очередь эндобронхизльный делится на экзофитный (узловая форма) и эндо¬фитный (плоские инфильтраты и язвы).Во время бронхоскопического исследования диагноз рака лёгкого ставится на основании прямых и косвенных эндоскопических признаков. К прямым при¬ знакам относят наличие опухоли — экзофитной или эндофитной. Экзофитная опухоль имеет полушаровидную или полуовальную форму, бугрист)т0 поверх¬ ность, серовато-красный цвет, широкое основание. Она частично или полностью обтурирует просвет главного, долевого или сегментарного бронха (рис, 4-1, см. цветную вклейку),Инфильтративно растущая опухоль на ранней стадии своего развития пред¬ ставляет ограниченный инфильтрат неправильной формы, с чёткими контурами, незначительно возвышающийся над окружающей слизистой оболочкой. Окраска инфильтрата может не отличаться от окружающей слизистой оболочки, может быть более тёмной или более светлой (в зависимости от глубины расположения сосудов). В дальнейшем инфильтрат распространяется по стенке бронха прокси¬ мально, поражая все стенки бронха циркулярно, рисунок хрящевых колец не про¬ слеживается. бронх превращается в узкую, ригидную трубку (рис. 4-2, см. цветную вклейку).Сложно провести дифференциальную диагностику между стенозом бронха воспалительной и опухолевой этиологии при инфильтративном росте опухоли. Диагностические затруднения могут быть разрешены с помощью морфологиче¬ ского исследования биопсийного материала, полученного при щипцевой и браш- биопсии.Язвенная форма рака представляет собой язву неправильной формы, с нечёт¬ кими контурами и неровным дном, покрьггым фибринозным налётом (рис. 4-3, см. цветную вклейку) эта форма редко встречается самостоятельно, чаще на фоне инфильтративной опухоли. Биопсия берётся с помощью щипцов из краёв изъяз¬ вления.Наиболее труден для распознавания перибронхиально растущий рак. При брон¬ хоскопии диагноз перибронхиально растущей опухоли устанавливается на осно¬ вании косвенных эндоскопических признаков: конвергенция складок слизистой к опухоли (обычно по задней стенке трахеи и крупных бронхов), деформация, сужение и неподвижность устьев бронхов, изменения сосудистого рисунка (появ¬ ление уродливых, неравномерно расширенных, коротких, извитых, обрывистых сосудов) в сочетании с грубой складчатостью слизистой оболочки (рис. 4-4, см. цветную вклейку).при обнаружении во время бронхоскопии опухоли бронха из неё берут щипцевую и браш-биопсию. Полученные биопсийные фрагменты имеют раз¬ меры 0,1-0,2 см. С них делают мазки-отпечатки для цитологического исследо¬ вания и биопсийный фрагмент погружают во флакон с 10% раствором форма¬ лина для последующего гистологического исследования. Рекомендуется брать не менее 6-8 кусочков для того, чтобы не было ложноотрицательных результатов, эффективность биопсии равна 95%.Кроме определения локализации опухоли и морфологической верификации диагноза, во время бронхоскопии )точняют распространение процесса прокси-
ДИАГНОСТИЧЕСКАЯ И ЛЕЧЕБНАЯ БРОНХОСКОПИЯ95мально по трахеобронхиальному дереву. О распространении процесса свидетель¬ ствуют следующие признаки: неровность слизистой оболочки, наличие бляшек шш бугорков серовато-белого цвета, небольших язвочек неправильной формы, извитые, уродливые, резко обрывающиеся сосуды. Из изменённой слизистой обо¬ лочки берут биопсию в отдельный флакон.Осиплость голоса у больного в сочетании с ограничением в подвижности или полной неподвижностью той половины гортани, где локализуется опухоль в ЛёГ“ ком, свидетельствует о прорастании опухолью возвратного нерва. Расширение карины или седловидная форма карины, сочетающиеся с её неподвижностью, сви¬ детельствуют о метастазах в бифуркационных лимфатических узлах, что является показанием к транстрахеальной пункционной биопсии.Ранняя диагностика рака лёгкого значительно улучшает прогноз. К раннему раку относят опухоль не более 2 см в диаметре, поражающую только слизистую оболочку, без метастазов.Проблема диагностики и дифференциальной диагностики инфильтратов и ателектазов лёгких является чрезвычайно сложной [10]. Нередко больные дли¬ тельно наблюдаются и получают лечение по поводу пневмонии, и лишь с большим опозданием у них диагностируют рак лёгкого. Одной из важных задач, стоящих перед диагностической бронхоскопией, является исключение так называемой ретенционной пневмонии, которая может развиться у больных с центрально растущей опухолью лёгкого или при давно находящихся инородных телах в брон¬ хах. поэтому мы считаем, что отсутствие положительной динамики при лечении больного пневмонией в течение 7 дней является показанием к эндоскопическому исследованию.Для того чтобы во время бронхоскопии правильно оценить распространённость воспалительного процесса по трахеобронхиальному дереву и степень изменений слизистой оболочки, эндоскописты пользуются классификацией, предложенной ]. Ьешоте в 1965 г. [11]. По этой классификации выделяют: диффузный бронхит — распространяется на все видимые бронхи; частичный диффузный бронхит — верхнедолевые бронхи и их сегментарные ветви интактны; строго ограниченный бронхит — поражена одна ветвь.Перечисленные формы могут быть одно- или двусторонними, могут сопрово¬ ждаться трахеитом. Для более точного диагноза введено понятие степени интен¬ сивности воспаления слизистой оболочки. Видимая интенсивность воспаления может бьггь трёх степеней.• I степень интенсивности воспаления: слизистая оболочка бронхов бледно- розового цвета, сосудистый рисунок смазан, отёк слизистой несколько сти¬ рает рельеф хрящевых колец. Секрет слизистый, в умеренном или большом количестве (рис. 4-5, см. цветную вклейку).• П степень интенсивности воспаления: слизистая оболочка бронхов ярко- красного цвета, отёчна, сосудистый рисунок не определяется. Межкольцевые промежутки сглажены за счёт отёка слизистой оболочки. Устья сегментарных и субсегментарных бронхов сужены за счёт отёка слизистой. Секрет слизисто¬ гнойный, вязкий или жидкий, в умеренном или большом количестве (рис. 4-6, см. цветную вклейку),• 1П степень интенсивности воспаления: слизистая оболочка бронхов багрово- синюшного цвета, отёчна, утолщена, сосудистый рисунок не виден, межколь¬ цевые промежз^гки полностью сглажены в уровень с хрящевыми кольцами за счёт отёка слизистой оболочки. Устья долевых и особенно сегментарных бронхов резко сужены за счёт отёка слизистой, иногда представляются точеч¬ ными. Шпоры их расширены, малоподвижны. Секрет гнойный, вязкий или жидкий, в очень большом количестве, требующем постоянной аспирации (рис. 4-7, см. цветную вклейку).
96МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХ№Ш-Эта классификация широко используется эндоскопистами для диагностики хронического бронхита, косвенной диагностики пневмонии, абсцедирующей пневмонии, абсцесса лёгкого, кисты лёгкого, бронхиальной астмы, бронхоэктазий, муковисцидоза.Во время бронхоскопии пневмония проявляется бронхитом, который может быть строго ограниченным, частично диффузным или диффузным в зависимости от локализации пневмонии. Бронхоскопическая семиотика (степень интенсив¬ ности воспаления слизистой оболочки бронха) у больных пневмонией зави¬ сит от возбудителя и характера осложнений (абсцедирование, кровотечение). Легионеллёзная пневмония проявляется диффузным двусторонним атрофическим бронхитом (рис. 4-8, см. цветную вклейку).Диагностическая бронхоскопия у больных пневмонией всегда завершается взятием биопсии. Вначале в стеклянный флакон берут бронхиальный смыв для цитологического исследования на атипические клетки и микобактерии туберку¬ лёза. Точная бактериальная диагностика пневмонии возможна примерно у 50% больных. Этот процент удаётся повысить при заборе материала во время диа¬ гностической бронхоскопии. Бронхиальное содержимое для бактериологического исследования берут с помощью стерильного катетера, проведённого через биоп¬ сийный канал эндоскопа, в стерильную пробирку в количестве 3-4 мл. При иссле¬ довании содержимого бронхов удаётся выделить возбудитель у 60-62% больных [12]. Для получения материала из очага воспаления выполняют браш-биопсию (биопсию соскабливанием) с помощью специальной щётки-скарификатора в защитном футляре, который предохраняет полученный материал от контакта с флорой верхних дыхательных путей. Под контролем зрения стерильную щётку- скарификатор в футляре проводят в субсегментарный и далее в более мелкий бронх, сообщающийся с очагом воспаления, щётку выдвигают из футляра и делают несколько скоблящих движений, затем щётку вновь вводят в футляр и последний вместе с ней извлекают. Делают несколько мазков отпечатков на сухие предметные стёкла. В полученных мазках-отпечатках возможно определение как аэробной, так и анаэробной флоры.Для верификации диагноза при периферических инфильтратах применяют катетер-биопсию. Под контролем бронхоскопа катетер вводят в устье соответ¬ ствующего сегментарного бронха, затем под рентгенологическим контролем его погружают в патологический очаг. С помощью шприца или отсоса в катетере соз¬ дают разрежение и аспирируют содержимое из патологического очага. Затем кате¬ тер извлекают и его содержимое выдувают на предметные стёкла. Эффективность катетер-биопсии в установлении природы инфильтрата (наиболее часто прово¬ дится дифференциальный диагноз между пневмонией, периферическим раком лёгкого и туберкулёзом) приближается к 90-91%.При пневмониях, протекающих на фоне хронического бронхита, независимо от характера возбудителя, во время бронхоскопии определяются множественные линейные или циркулярные рубцы в области устьев и шпор сегментарных и суб¬ сегментарных бронхов, т.е. имеет место деформирующий бронхит [14]. Секрет, как правило, гнойный, в большом количестве (рис. 4-9, см. цветную вклейку).При нарушении дренажной функции бронхов наступает абсцедирование пнев¬ монии. Во время бронхоскопии абсцедирующая пневмония проявляется яркой гиперемией слизистой оболочки бронхов, сужением устьев сегментарных брон¬ хов до точечных за счёт отёка слизистой оболочки, жидким или густым гнойным секретом в большом количестве (рис. 4-10, см. цветную вклейку).при абсцессе лёгкого эндоскопическая картина зависит от того, дренируется ли абсцесс в бронхиальное дерево или не дренируется. Если абсцесс не дренируется в бронхиальное дерево, то изменения в бронхах отсутствуют. В тех случаях, когда абсцесс дренируется в бронхиальное дерево, отмечается гиперемия и отёк слизи-
ДИАГНОСТИЧЕСКАЯ И ЛЕЧЕБНАЯ БРОНХОСКОПИЯ 97СТОЙ оболочки устья дренирующего бронха, из которого поступает жидкий или густой гнойный секрет в большом количестве с гнилостным запахом (рис. 4-11, см. цветную вклейку). Иногда на слизистой оболочке дренирующего бронха опреде¬ ляются полипы или грануляции, что обусловлено постоянным гноетечением.причиной ретенционной пневмонии может быть и доброкачественная опу¬ холь.Диагностика и результаты лечения доброкачественных опухолей лёгких вызы¬ вают обоснованную тревогу, так как на ранних стадиях заболевания процент диагностических ошибок чрезвычайно высок. Большинство центральных добро¬ качественных опухолей лёгких диагностируют поздно, когда уже возникли ослож¬ нения.Все доброкачественные опухоли лёгких разделяют на 3 группы:• эпителиальные опухоли (папиллома, аденома);• опухоли мягких тканей (фиброма, миома, липома, гемангиоэндотелиома);• смешанные опухоли (гамартома, тератома, гемангиома).В классификации доброкачественных опухолей целесообразно вьщелять их осложнения. К ним относятся кровотечение, ателектаз доли или лёгкого, абсцеди¬ рующая пневмония, малигнизация опухоли. Доброкачественные опухоли лёгких чаще локализуются в крупных бронхах (главных и долевых). Они растут эндо- бронхиально, экстрабронхиально или могут иметь смешанный характер роста. Бронхоскопия показана не только больным с рентгенологическими признаками опухоли, но и при стойком кашле, кровотечении, рецидивирующих пневмониях. Однако до сих пор бронхоскопия у абсолютного большинства пациентов произво¬ дится очень поздно. Интервал между появлением первых клинических симптомов и бронхоскопией в среднем составляет 3-5 лет.Среди всех доброкачественных опухолей лёгких наиболее часто встречается аденома (75-95%), как правило, у лиц молодого и среднего возраста, у женщин в2 раза чаще, чем у мужчин. Количественное соотношение между центральными и периферическими опухолями равно 18:1.Аденома — это опухоль овальной или шаровидной формы, бледно-розового или тёмно-розового цвета, с гладкой или несколько бугристой поверхностью, плотноэластической консистенции, сосуды на поверхности опухоли расширены. Размеры аденомы варьируют от 1 до 9 см в диаметре, однако наиболее часто диа¬ метр аденомы составляет 2-3 см (рис. 4-12, см. цветную вклейку).Аденома больших размеров визуально очень похожа на раковую опухоль. Она имеет крупнобугристую поверхность, ярко-розовый цвет, широкое основание или, реже, узкую ножку. Из-за обильной васкуляризации аденома нередко является источником лёгочного кровотечения, и тогда взятие биопсии сопряжено с опреде¬ лённым риском. Во время бронхоскопии проводится местный гемостаз и решается вопрос о дальнейшей тактике.Папиллома бронха обычно встречается в сочетании с папилломатозом гортани и трахеи [15]. Папилломы чаще диагностируют у молодых больных и вначале они протекают бессимптомно. При быстром росте и больших размерах опухолей гортани наступает осиплость голоса и стеноз гортани. Опухоли, локализующиеся в трахее и крупных бронхах, клинически проявляются одышкой и кровотечением.Папиллома — это опухоль различной формы, размером от 0,2 до 1 см в диа¬ метре, серовато-жёлтого цвета, мелкобугристая, на широком основании, мягкой или плотной консистенции в зависимости от количества соединительной ткани. Папилломы склонны к малнгнизации и могут давать начало плоскоклеточному раку, поэтому подлежат обязательному удалению через бронхоскоп (рис. 4-13, см. цветную вклейку).причиной ретенционной пневмонии могут быть давно находящиеся инород¬ ные тела трахеобронхиального дерева, которые встречаются не только у детей,
98 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХНО И у взрослых [17, 18], Наиболее опасны инородные тела органического про¬ исхождения, т.к. они разбухают и суживают просвет бронха вплоть до его полной обтурации, а при рентгенологическом исследовании они определяются лишь у 10% пациентов. Нередко при отсутствии рентгенологических данных врачи отка¬ зываются от проведения бронхоскопии, если отсутствуют чёткие анамнестические указания на возможность аспирации. Знание клинической картины позволяет V.-', ■-> врачам выбрать правильную тактику." При инородных телах трахеи кашель носит приступообразный характер. Приналичии инородного тела в бронхе кашель носит постоянный характер, а при дли¬ тельном нахождении инородного тела в бронхе он сопровождается выделением мокроты, что указывает на реактивное воспаление слизистой оболочки бронха, и кровохарканьем. На бронхоскопическое исследование больных обычно направ¬ ляют с диагнозами: пневмония, рак лёгкого, кровохарканье неясной этиологии, бронхиальная астма.Во время бронхоскопии инородные тела наиболее часто обнаруживают в ниж¬ недолевом и нижнезональном бронхах с обеих сторон, справа несколько чаще, чем слева, и в среднедолевом бронхе. При осмотре бронхов практически у 50% пациентов вокруг инородного тела имеет место выраженный воспалительный вал, который полностью закрывает инородное тело. Кроме воспалительного вала, ино¬ родные тела обычно закрыты грануляциями серовато-розового цвета. Грануляции имеют дольчатое строение, широкое основание или узкую ножку. Они тусклые, мягкие при инструментальной пальпации, активно кровоточат в процессе взятия биопсии. В тех случаях, когда инородное тело полностью закрыто грануляциями, провести дифференциальный диагноз между давно находящимся в бронхе ино¬ родным телом и бронхогенным раком на основании только визуальных данных чрезвычайно сложно (рис. 4-14, а, см. цветную вклейку). В этих случаях показано взятие биопсии, в процессе её после разрушения грануляций становится видно инородное тело, из-под которого поступает гнойный секрет (рис, 4-14, б, см. цвет¬ ную вклейку).Лечебная бронхоскопияВ настоящее время более 50% всех бронхоскопий составляют лечебные брон¬ хоскопии. Во время бронхоскопии используют следующие виды лечебных вме¬ шательств: санационную бронхоскопию, регионарную лимфатическую терапию, терапию лазерным облучением, ЫО-терапию, электрокоагуляцию, аргоноплаз¬ менную коагуляцию, криохирургические вмешательства, лазерные эндохирурги¬ ческие операции, радиоволновые эндоскопические вмешательства, удаление ино¬ родных тел, эндобронхиальную фотодинамическую терапию, эндотрахеальное и эндобронхиальное стентирование [29,30].САНАЦИОННАЯ БРОНХОСКОПИЯБольшое значение в лечении больных с инфекционными заболеваниями лёгких придается санационным бронхоскопиям, благодаря которым можно вводить раз¬ личные по механизму действия лекарственные вещества непосредственно в очаг воспаления.Так как в развитии хронического воспаления бронхов важнейшую роль играет нарушение их дренажной функции, то именно во время бронхоскопии, удаляя гнойное содержимое из бронхиального дерева, можно одновременно добиваться улучшения бронхиальной проходимости, проводить противовоспалительное лече¬ ние, воздействовать на микрофлору бронхов. Для интрабронхиального введения используют различные по механизму действия вещества: антисептики, антибио¬ тики, муколитики, иммуномодуляторы.
ДИАГНОСТИЧЕСКАЯ И ЛЕЧЕБНАЯ БРОНХОСКОПИЯ 99Санирующий раствор готовят непосредственно перед употреблением. Он состоит из антисептика (диксин*, фурагина калиевая соль, мирамистин*), раз¬ ведённого на 2% растворе натрия гидрокарбоната или 0,9% растворе натрия хло¬ рида. Все санирующие растворы перед введением в бронхиальное дерево подо¬ гревают до температуры 36-37 ^С. При одностороннем процессе на одну санацию расходуют 60-80 мл санирующей смеси, при двустороннем — до 120-150 мл раствора. Санационную бронхоскопию начинают с удаления секрета из трахео¬ бронхиального дерева с помощью отсоса. После этого промывают поражённые бронхи санирующим раствором. На курс лечения выполняют 4-5 санационных бронхоскопий через день. В конце каждой из них вводят лимфотропно антибио¬ тик, к которому чувствительна флора больного, и в некоторых случаях — имму- номодулятор.Лечение больных с недренирующимися в бронхиальное дерево абсцессами лёгких начинают с того, что восстанавливают проходимость бронха механиче¬ ским путём с помощью биопсийных щипцов во время первой бронхоскопии под рентгенологическим контролем. Санационные бронхоскопии выполняют через день с введением в бронхиальное дерево 60,0-100,0 мл санирующего раствора в зависимости от размера абсцесса. По окончании бронхоскопии интрабронхиально лимфотропно вводят антибиотик и муколитик (ацетилцистеин). На курс лечения проводят 8-9 лечебных бронхоскопий до образования «сухой» полости или очи¬ стившегося абсцесса, что определяется на рентгенограмме.У больных с множественными и гигантскими абсцессами лёгких эффективным способом лечения является введение 20 мл подогретого 4% раствора глицерола (глицерина*). Глицерол, введённый в гнойную полость, обладает антибактери¬ альными свойствами, восстанавливает микроциркуляцию в тканях, окружающих абсцесс, активизирует лизосомальные ферменты, растворяет фибрин, ускоряет переход воспалительного процесса в продуктивную фазу и способствует быстрей¬ шему развитию грануляционной ткани, не оказывает повреждающего действия на слизистую оболочку бронхов.На курс лечения выполняют 3-4 инстилляции глицерина через 2 дня. Перед этим санационную бронхоскопию не производят. На фоне введения глицерина у больных появляется выраженный кашель, благодаря которому полость абсцесса быстро очищается. Осложнений в процессе лечения не отмечено.ТЕРАПИЯ ЛАЗЕРНЫМ ИЗЛУЧЕНИЕМДля уменьшения отёка слизистой оболочки дренирующего бронха, улучшения микроциркуляции и ускорения процесса очищения полости абсцесса после окон¬ чания санации проводят лечение лазерным излучением [35]. В качестве источника изл)^ения используют гелий-неоновый лазер типа АФЛ-1, дающий излучение с длиной волны 633 нм и мощность на выходе 20 мВт. Через биопсийный канал эндоскопа проводят моноволоконньп! кварцевый световод и вводят его в устье дренирующего бронха. Облучение продолжается 300 с.НО-ТЕРАПИЯС начала 2002 г. мы начали использовать оксид азота в комплексной терапии больных с хроническими специфическими и неспецифическими воспалительными заболеваниями лёгких. Экспериментальные исследования показали, что N0, гене¬ рируемый плазмохимическим способом с помощью аппарата «Плазон»^ из атмос¬ ферного воздуха, нормализует микроциркуляцию, оказывает антибактериальное действие, купирует инфекцию и воспаление, активизирует функцию макрофагов и пролиферацию фибробластов, стимулирует регенерацию тканей [36].Во время сеансов лечебной бронхоскопии в бронхиальное дерево инсуффлиру- ют оксид азота в течение 1 мин.
If®100 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХОбычно для излечения больного необходимо выполнить 6-7 сеансов лечебных бронхоскопий.УДАЛЕНИЕ ДОБРОКАЧЕСТВЕННЫХ ОПУХОЛЕЙВ 1917 г. Ch. Jackson описал бронхоскопическую картину аденомы бронха и удалил её щипцами через эндоскоп. В дальнейшем эндоскопические способы удаления доброкачественных оп)^холей бронхов дополнились удалением с помо¬ щью петли с последующей диатермокоагуляцией основания, гальванокаустикой, прижиганием химическими веществами (30-60% раствор хромовой кислоты, трихлоруксусная кислота* и др.). В настоящее время для эндоскопических хирур¬ гических вмешательств используют высокочастотный электрохирургический блок и диатермические петли. Показаниями к удалению опухоли через бронхо¬ скоп с помощью диатермокоагуляции являются все доброкачественные опухоли, растущие эндобронхиально, за исключением сосудистых опухолей, так как при их удалении высока вероятность развития профузного лёгочного кровотечения. Большие размеры опухоли (свыше 2-3 см в диаметре) не являются противопо¬ казанием к удалению через бронхоскоп, но необходимо соблюдать следующие условия: выполнять удаление опухоли под общим обезболиванием, проводя бронхофиброскоп или через интубационную трубку, или через тубус ригидного бронхоскопа, а диатермическую петлю проводить через биопсийный канал гиб¬ кого бронхоскопа. Удаление больших опухолей можно выполнять кускованием до того момента, пока не будет видно основание опухоли. Последний этап удаления опухоли — набрасывание диатермической петли на её основание, затягивание петли и отсечение опухоли.Большим шагом вперёд явилось внедрение в клиническую практику радиовол- новой хирургии. В отличие от электроножа и лазерного излучения, работающих при прямом воздействии на ткань, радиоволновой разрез осуществляется без ожога и некроза окружающих тканей. Установлено, что радиоволна наносит наи¬ меньшую травму тканям с минимальными морфологическими и сосудистыми нарушениями. При небольших опухолях гортани и трахеи, когда нет опасности возникновения асфиксии, следует удалять опухоль через гибкий эндоскоп под местной анестезией в бронхоскопическом кабинете. Пассивный электрод накла¬ дывают на область грудины. Петлю набрасьшают на опухоль, затягивают у основа¬ ния и на смешанном режиме «коагуляция-резание» опухоль отсекают, извлекают и направляют на гистологическое исследование. На месте удаленной опухоли оста¬ ётся плоский дефект слизистой оболочки без коагуляционного струпа, покрытый белесоватой плёнкой [37].Удаление аденом бронха и всех опухолей, являющихся источником кровотече¬ ния, проводят в операционной, под общим обезболиванием, с проведением гибко¬ го эндоскопа через интубационную трубку.Использование метода радиоволновой хирургии для удаления доброкачествен¬ ных эпителиальных и неэпителиальных опухолей трахеобронхиального дерева позволяет практически избежать послеоперационных кровотечений, а в случае возникновения последнего (при удалении сосудистой опухоли) использование режима «фульгурация» способствует остановке кровотечения.УДАЛЕНИЕ ИНОРОДНЫХ ТЕЛВсе инородные тела бронхов удаляются с помощью специальных инструмен¬ тов, проведённых через биопсийный канал эндоскопа во время бронхоскопии под местной анестезией или (по показаниям, в частности, у детей до 12 лет) под общим обезболиванием в условиях операционной. После удаления давно аспирирован- ных инородных тел выполняют курс санационных бронхоскопий для удаления грануляций и восстановления просвета бронха.
ДИАГНОСТИЧЕСКАЯ И ЛЕЧЕБНАЯ БРОНХОСКОПИЯ 101Осложнения бронхоскопиикрупнейшая сводная статистика [41] свидетельствует о том, что гибкая бронхо¬ скопия представляет минимальный риск для пациентов: тяжёлые и лёгкие ослож¬ нения встречаются в 0,5% и 0,8% случаев, а летальность практически равна нулю.Осложнения со стороны сердечно-сосудистой системы отмечаются у пациентов старше 60 лет, страдающих ишемической болезнью сердца. Во избежание ослож¬ нений бронхоскопию следует выполнять не раньше, чем через 6 нед после инфар¬ кта миокарда, и учитывать противопоказания к исследованию.СПИСОК ЛИТЕРАТУРЫ
Глава 5Торакоскопия и другие инвазивные вмешательстваБиопсия играет исключительно важную роль в диагностике заболеваний органов дыхания. Выбор инвазивных процедур, оче¬ рёдность их применения при диагностике и лечении заболеваний органов грудной полости определяется врачом и зависит от забо¬ левания, опыта врача и стандартов клиники. Однако общим посту¬ латом является необходимость выбора инвазивных процедур в порядке увеличения их травматичности с учётом информативности (табл. 5-1).Таблица 5-1. Показания к проведению инвазивных диагностических процедур в пульмонологии и торакальной хирургииВид инвазивной диатостикнПоказанияНедостаткиБиопсия периферических ЛУУвеличение периферических ЛУ (шейных, над¬ ключичных, скаленных, подмышечных) при подозрении на лимфопролиферативное заболе¬ вание или рак лёгкогоНеприменима при отсутствии поражения периферических ЛУТрансторакальная игловая биопсияПериферическое новообразование лёгкого, расположенное субплеврально Образования переднего средостения (неопе¬ рабельные)Рецидивирующий плеврит при отсутствии вери¬ фикацииЧувствительность и специ¬ фичность около 60%, малое количество материалаЧрезбронхиальная биопсия лёгкогоПериферическое новообразование лёгкого раз¬ мером более 2 смДиссеминированный процесс а лёгких Одышка неясной этиологииЧувствительность и специ¬ фичность около 60%, малое количество материалаМедиастиноскопияСтадирование немелкоклеточного рака лёгкого Лимфаденопатия средостения с поражением паратрахеальных ЛУПрименима лишь для пара- трахеальных и бифуркаци¬ онных ЛУТребует общей анестезииТоракоскопияДиагностические:Плевральный выпот неизвестной этиологии Лимфаденопатии средостения Злокачественные неаерифицированные опухоли средостенияДиссеминированный процесс в лёгких Рак лёгкого (оценка распространённости и стадии)Периферические новообразования в лёгкомЯвляется оперативным вмешательством и требует во многих случаях общей анестезии
ТОРАКОСКОПИЯ и ДРУГИЕ ИНВАЗИВНЫЕ ВМЕШАТЕЛЬСТВА 103Окончание табл. 5-1Диагностические и лечебные;Буллёзная эмфизема и спонтанный пневмо¬ тораксДиффузная эмфизема Солитарные метастазы в лёгкое Периферический рак лёгкого (I стадии) Доброкачественные опухоли и кисты средо¬ стенияТимэктомия (при миастении)Экссудативный и констриктивный перикардит Травмы грудной клетки, гемоторакс {в т.ч. послеоперационный), инородные тела Эмпиема плеврыПарастернальная лимфадиссекция при раке молочной железыДивертикулы пищевода, доброкачественные опухоли пищеводаГипергидроз ладоней, синдром Рейно Болевой синдром при неоперабельных заболе¬ ваниях верхних отделов брюшной полости Диафрагмальные грыжи Грыжи межпозвоночных дисков Имплантация электродов для элекгрокардио¬ стимуляцииКлипирование открытого артериального протока Реваскуляризация миокардаНе всегда может быть выполнена достаточно ради¬ кально и безопасно* ЛУ — лимфатические узлы.Биопсия периферических лимфатических узловТРАНСЦЕРВИКАЛЬНЫЕ БИОПСИИИзвестно, что рак лёгкого, лимфопролиферативные заболевания часто метаста- зируют в шейные и надключичные ЛУ, Кроме того, эти ЛУ могут поражаться при туберкулёзе и саркоидозе. Б таких случаях самым простым и эффективным спосо¬ бом верификации диагноза является биопсия пальпируемого ЛУ, а для злокаче¬ ственных заболеваний такая биопсия является ещё и сталирующей процедурой.Операция выполняется под местной анестезией 0,5% раствором прокаина (новокаина*) в положении больного на спине. Голову поворачивают в сторону, противоположную операции. Разрез кожи длиной 1,5-2 см, как правило, бывает достаточным для вьщеления и иссечения ЛУ Необходимо стремиться к удалению всего лимфатического узла, чтобы, с одной стороны, не произошло рассеивания опухолевых клеток, а с другой — во избежание истечения лимфы.ПРЕСКАЛЕННАЯ БИОПСИЯКогда пальпируемого ЛУ нет, а исключить злокачественный процесс или системное заболевание (саркоидоз) невозможно, диагностические проблемы могут быть разрешены путём биопсии ЛУ, расположенных перед передней лест¬ ничной мышцей. Доказано, что прескаленные Л У соединены с паратрахеальными и корневыми.Под местной анестезией производится разрез длиной 4-7 см от середины кива- тельной мышцы кзади параллельно ключице и на 2 см выше её. Находят переднюю лестничную мышцу, рассекают третью фасцию шеи и клетчатку, из под неё иссека¬ ют ЛУ вместе с клетчаткой для гистологического исследования.В настоящее время прескаленная биопсия выполняется редко, так как в боль¬ шинстве случаев удаётся визуализировать поражённую группу ЛУ и выполнить их биопсию.
104 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХТрансторакальная аспирационная биопсияИгловую биопсию лёгких впервые применил Лейден 1883 г. для уточнения этиологии острых пневмоний, а в 1886 г. Менетрие осуществил трансторакальную пункцию для диагностики рака лёгкого. С 1939 г. трансторакальную пункционную биопсию стали применять под контролем рентгеноскопии, а затем и под контролем КТ. Принято выделять аспирационную (тонкоигольную) биопсию, которая позво¬ ляет получить материал для цитологического исследования и пункционную, под¬ разумевающую получение материала для гистологического исследования. Игловая биопсия образований лёгкого и средостения может быть выполнена тонкой иглой со шприцем (аспирационная), или иглой специальной конструкции, вырезающей кусочек биопсируемой ткани (толстоигольная, трепан-биопсия, резекционная биопсия). За время применения трансторакальной биопсии было изобретено множество разнообразных по конструкции игл. Существуют автоматические, раз¬ двоенные, пробивающие, крючкообразные, гильотинные иглы.Трансторакальная игловая биопсия опасна у больных с дыхательной недоста¬ точностью. связанной с эмфиземой, гипертонической болезнью, заболеваниями крови, сопровождающимися повышенной кровоточивостью, при локализации процесса в единственном лёгком. Такая биопсия чревата серьёзными осложне¬ ниями при пункции центрально расположенных очагов и артериовенозных анев¬ ризм.Результативность аспирационной биопсии колеблется от 57 до 97%, пункцион¬ ной — от 60 до 94%, Наиболее частыми осложнениями являются травматический пневмоторакс (3-30%), гемоторакс (до 5%), кровохарканье (1-5%). Серьёзные осложнения с летальными исходами на материале более 10 ООО биопсий единич¬ ны.МедиастинотомияЭта операция предполагает вскрытие переднего средостения путём парастераль- ного разреза, резекции И хряща и удаление одного или нескольких ЛУ для после¬ дующего гистологического исследования. Техника операции детально разработана Стеммером и Чемберленом в 60-е годы XX века.Показанием к выполнению данного вида биопсии является поражение перед¬ него средостения или корня лёгкого. Эта часть грудной полости трудно доступна для медиастиноскопии. С появлением торакоскопии биопсия зоны переднего сре¬ достения стала производиться при помощи этой методики. Однако при синдроме верхней полой вены, когда общая анестезия может быть опасна или противопо¬ казана, медиастинотомия заменяет видеоторакоскопию, поскольку может быть выполнена под местной анестезией. Кроме того, при необходимости биопсии переднего средостения у ослабленных больных, не переносящих однолёгочную вентиляцию, видеоторакоскопия также невозможна, а наиболее приемлемым вариантом хирургической биопсии остаётся медиастинотомия по Чемберлену.ТоракоскопияТоракоскопия ведёт свою историю с 1910 г., когда шведский терапевт Г.Х. Якобеус опубликовал результаты осмотров плевральной полости у двух паци¬ ентов с туберкулёзным плевритом. Опубликованная им работа «О возможности использования цистоскопа при исследовании серозных полостей» фактически дала начало торакоскопии. Хотя у Якобеуса не было возможности точно оценить изменения в плевральной полости у осмотренных больных, он предположил, что дальнейшее развитие торакоскопии позволит не только осматривать плевральную полость тщательнее, но и производить лечебные процедуры. Собственно он пер¬ вым и произвёл хирургические манипуляции внутри грудной полости: операцию
ТОРАКОСКОПИЯ и ДРУГИЕ ИНВАЗИВНЫЕ ВМЕШАТЕЛЬСТВА 1Q5разделения плевральных сращений при помощи гальванокаутеризации, чтобы наложить лечебный пневмоторакс больному с туберкулёзом. В течение после¬ дующих 40 лет торакоскопия получила широчайшее распространение в мире и активно использовалась до 50-60 гг.. до появления эффективных туберкулёзных химиопрепаратов. К этому времени врачи, владеющие торакоскопией, начали при¬ менять эту методику и для биопсии лёгкого и внутригрудных ЛУ. с появлением современных видеосистем для выполнения торакоскопии стали использоваться видеоторакоскопы, что позволило принимать участие в операции ассистенту и выполнять гораздо более сложные манипуляции внутри грудной полости. Так, в Европе и Америке получила развитие миниинвазивная технология, которую стали называть лечебной или хирургической торакоскопией.В последнее десятилетие возникла некоторая терминологическая путаница, связанная с названием манипуляции. В клиниках, в которых торакоскопия выпол¬ няется преимущественно терапевтами-пульмонологами, до сих пор использу¬ ется устаревший термин «плевроскопия», означающий, по сути, просто осмотр плевральной полости. Для обозначения диагностической торакоскопии также используется термин <imedical thoracoscopy^. Основная идея терапевтов в том, что манипуляция используется лишь для диагностики, не предполагает выполнения оперативного приёма, а потому может выполняться в терапевтических отделени¬ ях под местной анестезией, иногда даже не в условиях операционной. В Европе «плевроскопия» является частью программы обучения пульмонологов, в то время как в США плевроскопию использовали лишь 5% терапевтов-пульмонологов. Мы полагаем, что использовать торакоскопию должен врач, обученный основным принципам открытой хирургии грудной полости. Использование этой техноло¬ гии только для осмотра плевральной полости минимизирует её возможности, что представляется нерациональным.ОБОРУДОВАНИЕ ДЛЯ ВЫПОЛНЕНИЯ ТОРАКОСКОПИИПри торакоскопии используется несколько ключевых устройств. Прежде всего, это устройства, воспринимающие и передающие изображение. Основной оптической частью торакоскопической стойки является ригидный торакоскоп. Торакоскопы могут иметь различный диаметр от 3 до 12 мм, а также различный угол обзора. Хирург может осматривать плевральную полость, непосредственно глядя в окуляр. Однако чаще всего используется видеосистема, которая состоит из видеокамеры, головки видеокамеры, монитора. Для создания нормального осве¬ щения при производстве торакоскопии используется специальный ксеноновый или галогенный источник света и световод. Для выполнения манипуляции с мини¬ мальной кровопотерей при торакоскопии используется хирургический комплекс, позволяющий производить электрокоагуляцию кровоточащих сосудов, резку тканей с помощью тока и биполярную коагуляцию. Кроме того, можно использо¬ вать устройства для ирригации плевральной полости и одновременно аспирации образовавшегося экссудата или промывной жидкости.Для манипуляции внутри грудной полости используются специальные эндо¬ скопические инструменты. Их можно разделить по назначению. Прежде всего, это инструменты для создания доступа в плевральную полость: торакопорты — это металлические гильзы различного диаметра от 3 до 12 мм, имеющие специ¬ альную резьбу на поверхности для фиксации межреберий. Через торакопорты хирург может вводить в плевральную полость любые необходимые инструменты, в торакоскопии, как и при открытых операциях, используются специальные зажимы для захвата тканей и кровоточащих сосудов, диссекторы для выделения сосудов, образований, эндоскопические ножницы, ретракторы, иглодержатели, крючки-коагуляторы. Для выполнения резекции лёгкого используются специаль¬ ные эндоскопические сшивающие аппараты, с помощью которых одновременно
106 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 5-1. Оборудование для торакоскопии: видеокамера, видеомонитор, источник света и свето¬ вод; оптика (торакоскоп), электрохирургический комплекс, ирригатор-аспиратор, эндоскопические инструменты (торакопорты, зажимы и диссекторы, режущие инструменты, инструменты для соеди¬ нения тканей, инструменты для перевязки сосудов и остановки кровотечения, ретракторы, инстру¬ менты для извлечения препарата).накладывается несколько рядов скрепок и рассекается подвергающийся резекции участок. Кроме того, используется специальное устройство для извлечения резе¬ цированных препаратов из плевральной полости (эндоскопические контейнеры; рис. 5-1).Торакоскопическая оптика классифицируется по углу между продольной осью инструмента и осью обзора, для торакоскопии лучше всего подходит оптика с угла¬ ми 0°, 30® и 45°. Кроме того, диаметр торакоскопа также имеет значение. Бывают торакоскопы 2, 5 и 10 мм в диаметре. Чем больше диаметр оптики, тем больший поток света проходит через светопроводящую часть,ТЕХНИКА ТОРАКОСКОПИИБольной укладывается на операционный стол. Положение на операционном столе выбирается в зависимости от вида процедуры и предположительного диа¬ гноза. Стандартным является положение на боку с отведённой в сторону рукой. Именно в таком положении доступна осмотру любая часть плевральной полости.Для выключения лёгкого на стороне операции используется раздельная инту¬ бация бронхов и однолёгочная искусственная вентиляция лёгких (ИВЛ). Если манипуляция выполняется под местной анестезией, на самостоятельном дыхании больного, воздух попадает в плевральную полость пассивно в момент установки первого порта и лёгкое коллабируется.Первый торакопорт вводится в IV или V межреберье по передне- или средне¬ подмышечной линии, в этой зоне нет больших мышечных массивов и расстояние от кожи до плевральной полости наименьшее. Кроме того, кпереди межреберья
ТОРАКОСКОПИЯ и ДРУГИЕ ИНВАЗИВНЫЕ ВМЕШАТЕЛЬСТВА Ю7ЛРис. 5-2. Техника постановки первого торакопорта. Разрез кожи, создание хода в плевральную полость тупым способом, пальцевая ревизия плевральной полости на предмет спаек, введение торакопорта.шире, поэтому введение торакопортов в передних точках уменьшает послеопера¬ ционный болевой синдром и облегчает подвижность инструментов.Поскольку порт накладывается вслепую, необходимо перед его введением дать доступ воздуха в плевральную полость и убедиться с помощью пальца, что в выбранной точке нет спаек (рис. 5-2),Через первый порт вводится камера и производится ревизия плевральной поло¬ сти, Остальные торакопорты. если они нужны, вводятся под контролем зрения следующим образом. После ревизии намечаются точки для дополнительных пор¬ тов, производится трансиллюминация места введения порта. В момент прокола грудной клетки изображение выбирают так, чтобы были видны и грудная стенка и интраторакальные структуры в месте прокола.Для расположения портов используют принцип треугольника или «пирамиды», когда инструменты и торакоскоп располагают в углах равностороннего треуголь¬ ника, чтобы при работе внутри плевральной полости они не перекрещивались (не «фехтовали») (рис. 5-3).Оптимальными считаются углы между инструментом и камерой 20-70°.Правила обзора операционного поля:• изображение на мониторе должно соответствовать виду операционного поля при открытой операции (горизонтальная ось изображения ориентирована параллельно операционному столу);• точка для введения камеры должна быть достаточно удалена от зоны опера¬ ции для получения «панорамы»;• зона проведения манипуляции должна находиться в центре экрана;
108 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХРис. 5-3. Принцип «треугольника» или «пирамиды» при проведении торакоскопии.• торакоскоп следует вводить посередине между рабочими инструментами, под углом к их продольной оси.общие принципы торакоскопического доступа и работы с инструментами:• положение больного должно обеспечивать максимальное расширение межрё- берных промежутков;• порты располагают в углах треугольника и не допускают перекрещивания инструментов;• инструментами работают от себя:• используют обе руки для манипуляций;• следят за гемостазом при наложении порта;• точки для наложения портов выбирают с учётом возможной торакотомии.Дополнительные рекомендации по расположению портов:• межреберья в передних отделах шире, что позволяет использовать порты большего диаметра;• один из портов нужно располагать в нижней точке для последующего введе¬ ния дренажа;• порты во втором-третьем межреберьях по срединно-ключичной линии дают плохой косметический эффект; рубцы от портов, расположенных под молоч¬ ной железой, практически незаметны;• нежелательно использовать для портов точки предьщущих дренирований плевральной полости.ПРОТИВОПОКАЗАНИЯ К ТОРАКОСКОПИИПротивопоказания к торакоскопии носят весьма относительный характер и могут быть разделены на хирургические и общесоматические. Главным хирур¬ гическим противопоказанием к торакоскопическому вмешательству является облитерация плевральной полости. Здесь речь идёт даже не столько о противо¬ показании, сколько о невозможности оперировать с помощью торакоскопии. При наличии выраженного спаечного процесса свободного пространства нет, а потому невозможно ввести инструменты и торакоскоп. Принято считать, что для начала операции необходимо свободное пространство в плевральной полости хотя бы 10 см^ или 10 см в глубину. Но в такой ситуации неизбежное разделе¬ ние сращений может привести к кровопотере, травме лёгкого, необоснованном удлинении операции. Попытка проводить торакоскопическую операцию в обли- терированной плевральной полости должна быть подкреплена соответствующим опытом хирурга.
ТОРАКОСКОПИЯ и ДРУГИЕ ИНВАЗИВНЫЕ ВМЕШАТЕЛЬСТВА 109Другой помехой при проведении торакоскопии может стать коагулопатия. 3 В такой ситуации операционное поле и оптика будут постоянно закрываться кро- ^ вью, что сделает манипуляцию длительной и опасной. Пограничными показателя- ми считается снижение уровня тромбоцитов ниже 60 тыс. в 1 мл.Следует отметить, что при проведении торакоскопии под местной анестезией помехой может стать также упорный кашель и гипоксемия.Относительным противопоказанием к проведению биопсии лёгкого некоторые авторы считают длительный приём глюкокортикоидов и иммуносупрессивных лекарств ввиду повышения риска развития бронхоплевральных свищей после операции. Однако наш опыт показывает, что при использовании сшивающих аппа¬ ратов для биопсии лёгкого этот риск минимален.Противопоказания к проведению торакоскопии:• непереносимость однолёгочной вентиляции;• коагулопатия;• полная облитерация плевральной полости.Общие противопоказания к операциям открытым способом;• острый инфаркт миокарда;• острое нарушение мозгового кровообращения;• текущее острое инфекционное заболевание.Лабораторные критерии отбора больных для торакоскопии:• Ра02>50 мм рт.ст. при дыхании атмосферным воздухом;• коагуляционные показатели:<!► протромбиновый индекс >60%;❖ коалиновое время >70%; число тромбоцитов >60 ООО/мм^;• OФBJ>25%, ЖЁЛ>40% от должного,ОСЛОЖНЕНИЯ ТОРАКОСКОПИИПроцедура торакоскопии достаточно безопасна сама по себе, но, безусловно, её сложность зависит от вида операции и состояния пациента. При диагностической торакоскопии («плевроскопии») случаи летального исхода исключительно редки.Так, при описании 8000 торакоскопий описан лишь один летальный исход 0,01%. в другом обзоре из 4300 торакоскопий уровень летальности составил 0,09%. Осложнения после диагностической торакоскопии встречаются нечасто, однако возможны «обычные» торакальные осложнения: продлённый сброс воздуха, под¬ кожная эмфизема, послеоперационная лихорадка, эмпиема. Встречающиеся при торакоскопии осложнения можно разделить на две группы:• интраоперационные (кровотечение из межрёберных сосудов и сосудов корня лёгкого, ранение лёгкого, диафрагмы, перикарда);• послеоперационные (подкожная эмфизема и эмфизема средостения, прод¬ лённый сброс воздуха, пневмоторакс, гемоторакс, диссеминация опухо¬ ли, эмпиема, раневая инфекция, воздушная эмболия, плевроторакальный свищ).При диагностической торакоскопии, когда перед хирургом ставится лишь задача осмотра и простой биопсии, редко возникает вопрос о переводе операции в открытую. При лечебных же манипуляциях не всегда удаётся выполнить зада¬ чу торакоскопически. Хирург должен помнить, что выполнение операции при помощи торакоскопии не является самоцелью, поэтому при возникновении тех¬ нических трудностей, осложнений, сомнений в радикальности операции следует отказаться от дальнейшего проведения торакоскопии и выполнить стандартную операцию открытым доступом.Показаниями к переводу торакоскопии в открытую операцию являются: отказ видеотехники и сшивающего аппарата, неконтролируемое кровотечение, невоз-
110 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХможность выполнения радикальной операции торакоскопическим способом, зна¬ чительное удлинение срока операции при продолжении торакоскопии (спаечный процесс, недостаточный опыт, неудобство визуализации),ПОКАЗАНИЯ К ТОРАКОСКОПИИ ПлевритыДифференциальная диагностика экссудативных плевритов остаётся серьёзной клинической проблемой. Игловая биопсия плевры с помощью специальных игл позволяет установить диагноз у большего количества больных плевритом. Однако примерно у четверти пациентов верифицировать диагноз не удаётся, несмотря на многократное лабораторное исследование плеврального содержимого, биоптатов плевры, проведение детального радиологического обследования. В исследовании Boutin и соавт. из 1000 пациентов с экссудативным плевритом у 215 диагноз не был установлен, несмотря на исследования плевральной жидкости и слепую игловую биопсию.Использование торакоскопии в подобных ситуациях позволяет решить диа¬ гностические задачи в подавляющем большинстве наблюдений. В одном из самых хорошо организованных исследований, где оценивалась информативность тора¬ коскопии при плеврите, чувствительность составила 91%, специфичность 100%, точность 96%, Единственной проблемой торакоскопии при плевритах принято считать относительно высокий уровень ложноотрицательных результатов при диагностике злокачественных выпотов.Следует принять во внимание, что при плевритах торакоскопия позволяет не только установить диагноз, но также оценить распространённость рака лёгкого, а при необходимости произвести и лечебные процедуры. По мнению Loddenkemper и McKenna, торакоскопия под общей анестезией избыточно инвазивна и не существенно увеличивает информативность процедуры. По нашему мнению, эта точка зрения не бесспорна. Так, использование общей анестезии, дополнительных торакопортов у 168 больных позволило нам провести полную ревизию плев¬ ральной полости, осмотреть участки плевры, недоступные простому осмотру при так называемой «плевроскопии», и в итоге снизить число ложно-отрицательных результатов до 4%. Таким образом, показанием к проведению торакоскопии при плевритах является рецидивирующий характер выпота, отсутствие диагноза после исследования плевральной жидкости, подозрение на злокачественный характер плеврита, а также необходимость проведения плевродеза.Общие принципы проведения диагностической торакоскопии предполагают прежде всего разделение всех плевральных сращений, поскольку лишь полно¬ стью обнажив париетальную плевру, можно быть уверенным в полноценности ревизии. Следует выполнять биопсию из различных участков плевры, при этом биоптат должен содержать все слои плевры до межрёберных мышц. Соблюдение этого принципа позволяет не только устанавливать гистологический диагноз, но и правильно оценивать глубину распространённости опухоли. Хирург, выполняю¬ щий торакоскопию, должен помнить, что участки плевры, покрытые фибрином в местах расположения сращений, могут указывать на патологический процесс и поэтому должны подвергаться биопсии в первую очередь. Биоптат следует извле¬ кать осторожно, не касаясь других отделов плевры или грудной стенки. Особенно это важно для мезотелиом плевры, где практически у 100% больных обнаружива¬ ются имплактационные метастазы в области портов.Злокачественные плевральные выпоты на сегодняшний день являются основ¬ ным показанием для диагностической и лечебной торакоскопии (рис. 5-4). В проспективном исследовании, сравнившем различные способы диагностики злокачественных плевритов 208 пациентов (116 метастатических плевритов, 29 раков лёгких, 58 диффузных мезотелиом, 5 злокачественных лимфом) инфор¬
ТОРАКОСКОПИЯ И ДРУГИЕ ИНВАЗИВНЫЕ ВМЕШАТЕЛЬСТВА 111мативность цитологического исследования плевральной жидкости составила 62%, игло¬ вой биопсии — 44%, а торакоскопии — 95%.Чувствительность торакоскопии практически одинакова для всех типов злокачественных выпотов: при раке лёгкого чувствительность цитологического исследования жидкости при торакоскопии составляет 67 и 96%, при мета¬ стазах раков неторакальной локализации —62 и 95,5%, при диффузной мезотелиоме — 58 и 92%.У больных раком лёгкого с плевритом зада- Рис. 5-4. Метастатический узел на ча торакоскопии сводится не столько к поста- париетальной плевре, новке диагноза, сколько к исключению мета¬ статического поражения париетальной плевры. В результате удаётся избежать необоснованных торакотомий при раке лёгкого. С другой стороны, по данным Canto и соавт., у 8% больных раком лёгкого с плевральным выпотом диагноз метастатического плеврита не подтвердился при торакоскопии, что позволило выполнить им радикальную операцию. При мезотелиоме торакоскопия позволяет установить диагноз на относительно ранних стадиях, что, безусловно, улучшает прогноз дальнейшего хирургического лечения. Кроме того, торакоскопия позво¬ ляет установить диагноз других плевральных выпотов, связанных с воздействием асбеста, и при этом исключить мезотелиому. Гйалинизированные или кальцини¬ рованные плевра или участки её утолщения, а также плевральные бляшки могут указывать на возможный контакт с асбестом. Исследование биоптатов плевры и лёгкого в таких случаях позволяет оценить концентрацию асбестовых волокон и подтвердить диагноз асбесгоза.Индукция плевродезаПомимо диагностических задач при плевритах, существует необходимость индукции плевродеза — формирования сращений между висцеральной и париетальной плеврой, предотвращающих дальнейшее накопление жидкости. Наиболее распространённым показанием к плевродезу служат злокачественные выпоты. Для его создания могут использоваться различные способы воздействия на плевру, вызывающие асептическое воспаление с последующим образованием плоскостных спаек. Чаще используются разнообразные химические вещества. Наиболее эффективным способом химического плевродеза в большинстве иссле¬ дований оказалась инсуффляция порошкообразного талька, который прекращал образование выпота более чем у 90% больных. Нередко используются тетраци¬ клин, блеомицин, циклофосфамид, фибриновый клей^. Однако эффективность этих препаратов при создании плевродеза значительно ниже и составляет от 13 до 62%.Для выполнения плевродеза необходим ряд условий. Прежде всего, полное удаление жидкости из плевральной полости. Второе условие — полное расправле¬ ние лёгкого после эвакуации жидкости. Если у больного за время существования плеврита сформировался фиксированный коллапс лёгкого, несмотря на попытки его расправить, между висцеральной и париетальной плеврой остаётся хотя бы небольшое пространство, эффективного образования сращения не произойдёт. Поскольку индукция плевродеза - это симптоматическая манипуляция, основ¬ ной целью которой является избавление пациента от респираторных расстройств вследствие накопления жидкости, выполнение плевродеза целесообразно только у тех больньпс, у которых после эвакуации жидкости исчезают или значительно уменьшаются симптомы дыхательного дискомфорта.
112 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХТальк инсуффлируется в плевральную полость через жёсткий наконечник и равномерность его распыления контролируется при помощи торакоскопа. Рекомендуется использовать примерно 5 г талька (8-12 мл). После распыления талька в плевральной полости оставляется дренаж. В послеоперационном периоде используется активная аспирация с ежедневным контролем количества отделяе¬ мого по дренажу. Когда объём опекающей жидкости становится меньше 50 мл в сутки, плевральный дренаж может быть удалён. Осложнения при использовании талька развиваются нечасто, однако необходимо помнить, что у некоторых паци¬ ентов может развиваться лихорадка на введение талька, выраженный болевой синдром, а иногда даже респираторный дистресс-синдром. Связаны ли все эти синдромы со свойствами самого талька или в большей степени обусловлены осо¬ бенностями заболевания и организма пациента, определить трудно. Однако число осложнений в целом после талькового плевродеза не превышает 3-5%,Эмпиема плеврыВ первой и второй фазе эмпиемы основной задачей торакоскопии является уда¬ ление всего гнойного экссудата, разделение сращений и устранение разграничений в плевральной полости, удаление фибрина и надёжное дренирование плевральной полости под визуальным контролем в самой низкой точке. На более поздних фазах эмпиемы использование видеоторакоскопии позволяет не только полностью уда¬ лить гной из плевральной полости, но также произвести раннюю декортикацию. При помощи лёгочного зажима захватывается утолщенная висцеральная плевра с налётами фибрина и началом фиброзирования и с помощью режущих инструмен¬ тов имеющаяся «корка» аккуратно снимается с поверхности лёгкого. Это позво¬ ляет расправоть лёгкое, сократить сроки госпитализации пациентов с эмпиемой и предотвратить развитие массивного плевропневмофиброза.Спонтанный пневмотораксСпонтанный пневмоторакс является одним из самых частых показаний для диагностиче¬ ской и лечебной торакоскопии. Оценка состоя¬ ния лёгкого и плевральной полости перед введе¬ нием дренажной трубки — простая процедура, позволяющая в некоторых случаях выявить причину пневмоторакса и оценить вероятность его рецидива. Для оценки изменений выявлен¬ ных при пневмотораксе изменений широко используется классификация Уап(1ег5сЬиегеп. Согласно этой классификации, I стадия ■ неиз¬ менённое лёгкое, П стадия - плевро-лёгочные Рис. 5-5. Мелкая булла верхней доли спайки, П1 стадия — мелкие буллы и блебсы правого легкого. менее 2 см в диаметре, IV стадия — буллы более2 см в диаметре (рис. 5-5).Лечебные возможности торакоскопии при пневмотораксе заключаются в про¬ ведении противорецидивной операции. Для этого проводится вмешательство на изменённой части лёгкого (резекция булл, ушивание булл и индукция плевродеза). Наилучшим способом индукции плевродеза при пневмотораксе считается косталь¬ ная плеврэктомия. Эта операция, более полувека выполнявшаяся при помощи торакотомии, в настоящее время может быть выполнена торакоскопически. Резекция булл в сочетании с механическим плевродезом: позволяет предотвратить рецидивы пневмоторакса у 95-98% больных.Кроме того, при торакоскопии могут быть использованы другие способы меха¬ нического или физического воздействия на плевру: скарификация париетальной
ТОРАКОСКОПИЯ и ДРУГИЕ ИНВАЗИВНЫЕ ВМЕШАТЕЛЬСТВА Ц 3плевры, электрокоагуляция париетальной плевры, лазерная или аргон-плазменная коагуляция плевры. Противорецидивная эффективность этих видов индукции плевродеза несколько меньше, чем у плеврэктомии, однако их выполнение техни¬ чески проще и сопровождается меньшим числом осложнений.Нам представляется нецелесообразным использование талькового плевродеза у пациентов со спонтанным пневмотораксом, поскольку тальк вызывает массивные плевролёгочные фащения, а пациенты, страдающие пневмотораксом — молодые мужчины, курильщики, у которых существует вероятность возникновения брон¬ хиальной карциномы. Выполнение талькового плевродеза у этой группы больных может впоследствии серьёзно ограничить возможности хирургического лечения других лёгочных заболеваний. Кроме того, при использовании талька нужно быть уверенным, что он не содержит асбеста, являющего ведущей причиной развития диффузной мезотелиомы плевры.Диффузные заболевания лёгких и биопсия лёгкогоДиффузные заболевания лёгких нередко представляют трудную диагности¬ ческую задачу для пульмонологов, поскольку идентичная рентгенологическая картина может бьггь присуща различным по этиологии и патогенезу заболева¬ ниям, лечение и прогноз которых диаметрально отличаются. Ключевую роль в дифференциальной диагностике играет биопсия ткани лёгких. Открытая биопсия лёгких была признана «золотым стандартом» в диагностике этих заболеваний. Использование торакоскопической техники и эндоскопических сшивающих аппа¬ ратов позволило практически полностью заменить открытую биопсию лёгкого торакоскопической. При этом информативность такой биопсии не уступает тра¬ диционным вмешательствам и приближается к 100%. Чрезбронхиальная биопсия лёгкого позволяет установить диагноз не более чем у 65% пациентов и не всегда позволяет получить биоптат достаточных размеров. Поэтому в некоторых клини¬ ках диффузные заболевания лёгких являются прямым показанием для выполне¬ ния торакоскопической биопсии.При проведении торакоскопической биопсии лёгкого необходимо прежде всего обратить внимание на выбор стороны и места биопсии. Сторона выбирается по дан¬ ным КТ органов грудной клетки как наиболее поражённой. Для биопсии выбирают участки (как минимум — два), содержащие как изменённую, так и неизменённую лёгочную ткань. Размер резецируемого участка должен быть достаточньпл для гисто¬ логического исследования. Как правило, достаточно участка лёгочной ткани объёмом не больше 5 см1 Осложнения после торакоскопической биопсии лёгкого с использо¬ ванием современных сшивающих аппаратов встречаются исключительно редко.Солитарные узлы в лёгком и метастазэктомияИспользование диагностической торакоскопии при периферических новооб¬ разованиях в лёгких остаётся спорным. С одной стороны, визуализация узла в лёгком при торакоскопии возможна лишь при его субплевральном расположении. Это заставляет искать различные способы дополнительной визуализации узлов в лёгком: интраоперационная ультразвуковая локация, введение иглы или красите¬ ля в образование перед операцией под контролем КТ, использование дополнитель¬ ного разреза для мануальной пальпации.Однако глубокое расположение образования или его прикорневая локализация делают торакоскопическую биопсию опасной или невозможной. При размере узла менее 1 см и/или его расположении более чем в 2 см от грудной стенки рекоменду¬ ется отказаться от торакоскопии или производить диагностическую торакотомию. С другой стороны, при маленьких размерах образования (менее 2 см) другие спо¬ собы диагностики дают ещё меньше информации. МідШпп О.Е et а1. указывают, что 40-50% округлых образований в лёгком имеют злокачественную природу, поэтому такие образования нуждаются в миниинвазивной диагностике.
114 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХИспользование торакоскопии для резекции лёгочных метастазов является довольно спорным. Метастазэктомия может производиться либо путём краевой резекции лёгкого или путём энуклеации метастаза с помощью электрокоагуляции, < л - , При этом ключевой проблемой является невозможность мануальной пальпации ;; : лёгкого, ЧТО может привссти К остзвлению чэсти внутрилёгочно расположенных метастазов. Тщательное изучение компьютерных томограмм до операции не ,У;, -■ может гарантировать полное удаление всех имеющихся метастазов. К сожалению, ни один из существующих на сегодняшний день методов визуализации опухолевой ткани, включая ПЭТ, не позволяет точно локализовать все метастазы в лёгком. Поэтому для резекции метастазов хирурги чаще используют видеоторакоскопию с дополнительным разрезом, сочетающую в себе малотравматичный доступ, хоро¬ шую визуализацию и возможность мануальной пальпации.ЛобэктомияВопреки ожиданиям, торакоскопическое выполнение анатомических резекций лёгкого не получило широкого распространения в мире. Выполнение торакоско- пических лобэктомий возможно при раке лёгкого I стадии и бронхоэктазиях. В сравнении с открытыми операциями, торакоскопические лобэктомии обеспечи¬ вают более быстрое выздоровление, меньшее число осложнений, сокращают пре¬ бывание больного в стационаре, меньше влияют на послеоперационную функцию дыхания. В настоящее время проводится изучение отдалённых результатов тора- коскопических лобэктомий. Только тщательно доказанная удовлетворительная пятилетняя выживаемость после этих операций позволит шире рекомендовать их при начальных стадиях рака лёгкого.Технически операция заключается в стандартном выделении лёгочных сосудов, выделении и перевязке лёгочных артерии и вены, пересечении бронха, разделении междолевых щелей. Для удаления препарата производят небольших размеров торакотомию длиной 4-5 см, через этот дополнительный разрез можно также вводить стандартные хирургические инструменты, что может ускорить операцию и уменьшить её стоимость.Операции редукции лёгочного объёмаВ течение последнего десятилетия получили распространение операции редук¬ ции лёгочного объёма, выполняемые при эмфиземе лёгкого. Для выполнения этой операции используются различные доступы, в том числе и торакоскопиче- ский. Небольшое число наблюдений не позволяет с уверенностью утверждать, что использование торакоскопической техники редукции лёгочного объёма предпо¬ чтительнее. С другой стороны, очевидные преимущества мини-ивазивного хирур¬ гического доступа особенно хорошо проявляют себя у больных со сниженным респираторным резервом. Минимальная травматизация дыхательных мышц, уменьшение кровопотери и болевого синдрома улучшают переносимость этой операции пациентами. В торакальных клиниках госпитальная летальность после редукции лёгочного объёма не превышает 5%.Операция выполняется при помощи последовательного наложения эндоскопиче¬ ских сшивающих аппаратов на верхние доли обоих лёгких. В ходе последовательной краевой резекции удаляется до 50% объёма верхних долей. При этом формируется линия механических швов длиной 30-40 см. Главным осложнением послеоперацион¬ ного периода является продлённый сброс воздуха, поэтому особое внимание хирурги уделяют укреплению линии швов с помощью специальных материалов (полипропи¬ леновые заплаты, консервированный бычий перикард, фибриновый клей),ТОРАКОСКОПИЯ В СРЕДОСТЕНИИ Объёмные процессы в средостенииДифференциальная диагностика лимфаденопатий и объёмных процессов в сре¬ достении зачастую представляет серьёзные трудности. При отсутствии типичной
ТОРАКОСКОПИЯ и ДРУГИЕ ИНВАЗИВНЫЕ ВМЕШАТЕЛЬСТВА 11$клинической картины приходится дифференцировать поражение ЛУ средостения 3 при туберкулёзе, саркоидозе и лимфомах. Пункционные методы диагаостики ^ в таких ситуациях опасны и могут не дать нужной информации. В то же время «я гистологическая верификация в таких случаях бывает абсолютно необходима для назначения специального лечения. Использование торакоскопической техники позволяет произвести биопсию Л У большей части переднего и заднего средосте¬ ния. Наиболее удобными оказываются ЛУ над непарной веной справа. Узел может быть выделен целиком или произведена его биопсия эндоскопическими щипца¬ ми. Торакоскопия также может быть использована для определения стадии рака лёгкого или пищевода. В отличие от медиастиноскопии торакоскопия позволяет оценить также состояние плевры и лёгкого с поражённой стороны, что немаловаж¬ но в оценке распространённости опухоли, хотя при торакоскопии остаются недо¬ ступными лимфатические узлы противоположной стороны. Малотравматичность вмешательства позволяет выполнять биопсию ЛУ амбулаторно.При больших неоперабельных опухолях средостения, когда необходима надёж¬ ная гистологическая верификация для назначения специального лечения, тора¬ коскопическая биопсия опухоли с помощью эндоскопических щипцов позволяет установить диагноз со 100% точностью.Лечебные возможности торакоскопии при заболеваниях средостения также велики. Существуют сообщения об удалении опухолей и кист различной тканевой природы из различных отделов средостения (рис, 5-6, см. цветную вклейку).Отдельного внимания заслуживает операция удаления вилочковой железы — тимэктомия - у больных с аутоиммунной миастенией, В течение последнего десятилетия для тимэктомии всё активнее используется торакоскопия. Показано, что эффективность подобных операций при миастении вполне сопоставима с традиционными вмешательствами, при очевидно меньшей хирургической травме. Скорость послеоперационной реабилитации больных миастенией после торако- скопических операций гораздо выше. При этом положительный эффект торако¬ скопической тимэктомии в отношении миастении обнаружен у 83-97% больных.При опухолях вилочковой железы торакоскопия позволяет хорошо оценить состояние капсулы тимомы, её соотношения с окружающими тканями и в слу^ше необходимости предпринять открытое оперативное вмешательство.Теоретически любое доброкачественное образование средостения может быть удалено с помощью видеоторакоскопии, хотя размер образования существен¬ но влияет на возможность его видеоторакоскопического удаления. Отдельные авторы придерживаются мнения, что максимальный размер опухоли средосте¬ ния, которую можно удалить торакоскопически, составляет 5-8 см. Примерно у 10-15% больных с опухолями средостения требуется конверсия видеоторако¬ скопии в торакотомию. Для кист средостения ограничения по размеру не суще¬ ственны, поскольку при больших размерах кисты её содержимое может быть эвакуировано с последующим иссечением стенки самой кисты. При опасностях манипуляции часть стенки кисты может быть оставлена на жизненно-важных структурах, но при этом необходимо удалить эпителиальную выстилку, чтобы избежать рецидива.Помимо биопсии ЛУ средостения, описано использование видеоторакоскопии для удаления ЛУ (операция лимфаденэктомии). Как правило, лимфаденэктомия является компонентом оперативного вмешательства по поводу рака. А поскольку торакоскопические лобэктомии выполняются довольно редко, торакоскопическая лимфаденэктомия также нечастая процедура. Технически, как правило, удаляются ЛУ, расположенные паратрахеально выше непарной вены справа или дуги аорты слева. При этом удаляется паратрахеальная клетчатка и узлы 2-й, 3-й и 4-й груп¬ пы. Также доступными для торакоскопического удаления являются параэзофаге- альные ЛУ и ЛУ нижней лёгочной связки (8-я и 9-я группы).
116 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХГрудной лимфатический протокТоракоскопическая техника может быть использована для клипирования грудного лимфатического протока при хилотораксе. Хилоторакс может быть осложнением операции на пищеводе, аорте, некоторых других торакальных вмешательствах, либо может быть следствием травмы грудной клетки. При видео* торакоскопии может быть визуализировано место повреждения, и на проток нало¬ жено несколько клипс с каждой стороны. В случаях, когда не удаётся локализовать место повреждения, может быть предпринято клипирование грудного протока над диафрагмой справа.Заболевания перикардаПри помощи торакоскопии можно производить операции фенестрации пери¬ карда. Вмешательство применяется при рецидивирующем экссудативном пери¬ кардите, когда консервативное лечение не приводит к успеху. При помощи тора¬ коскопии иссекается участок перикарда площадью до 6 см^ как правило, позади диафрагмального нерва слева. Жидкость изливается из полости перикарда в плев¬ ральную полость, где возможности её резорбции выше, а пункция при необходи¬ мости безопаснее. Кроме того, можно иссечь больший участок перикарда с целью профилактики констриктивного перикардита. В таких случаях иссекается участок перикарда по передней поверхности между диафрагмальными нервами.Грудная симпатэктомияГрудная симпатэктомия используется при гипергидрозе ладоней и облитери- рующих заболеваниях мелких сосудов кистей (синдром Рейно, облитерирущий эндартериит сосудов верхних конечностей). Ранее операция симпатэктомия выполнялась при торакотомии, когда травматичность доступа отпугивала паци¬ ентов и скрадывала результаты операции. Сейчас через 2-3 минимальных разреза возможно удаление участка симпатического ствола между Th^ и Thj, с удалением симпатических ганглиев и пересечением белых и серых коммуникантных воло¬ кон. Некоторые хирурги предпочитают не иссекать симпатический ствол, а про¬ сто пересекать его или даже накладывать клипсу на непересечённые межузловые волокна. В таких случаях риск неудачи выше.У большинства больных с гипергидрозом ладоней, подмышек, лица удаётся достигнуть прекращения потоотделения, к осложнениям операций можно отнести редко возникающий синдром Горнера (менее 1%), а также компенсаторное повы¬ шенное потоотделение в других частях тела. Однако в целом до 90% пациентов удовлетворены результатом операции.Эффективность этой операции при сосудистых заболеваниях верхних конеч¬ ностей меньше. При облитерирующем эндартериите вмешательство лишь на 1-2 года отдаляет прогрессирование ишемических некрозов. При синдроме Рейно эффект более стойкий, но также не превышает 3-5 лет.Редко применяются вмешательства на нижних отделах грудного симпатическо¬ го ствола. Речь идёт об операции спланхникэктомии (пересечение п.п. splanchnici major et minor), которая используется для купирования тяжёлых болевых синдро¬ мов, связанных с опухолью верхнего этажа брюшной полости (рак поджелудочной железы, рак желудка) или панкреатитом.Кроме описанных показаний, торакоскопическая техника используется при опе¬ рациях на пищеводе, сердце, межпозвоночных дисках, диафрагме. Таким образом, видеоторакоскопия является миниинвазивной и одной из наиболее эффективных технологий современной торакальной хирургии. Важным условием успешного её применения является уровень подготовки всех специалистов, качество аппаратуры и инструментов,список ЛИТЕРАТУРЫ.^
Глава 6 Исследование функции дыханияСпирометрияСпирометрия — самый простой и распространённый метод функ¬ циональной диагаостики и первый этап исследования вентиляцион¬ ной функции лёгких. Спирометрия позволяет выявить нарушения вентиляционной функции и определить их тип (обструктивный, рестриктивный или смешанный), диагностировать экстраторакаль- ную обструкцию верхних дыхательных путей. Спирометрия не устанавливает диагноз, так как эти функциональные нарушения неспецифичны, но даёт возможность:• мониторировать течение заболевания;• определить тяжесть заболевания при хронической обструктив¬ ной болезни лёгких (ХОБЛ) [1], бронхиальной астме [2];• оценить прогноз заболевания [3-11].Таким образом, целями спирометрического исследования явля¬ ются;• выявление причины респираторных симптомов (хронического кашля, одышки, хрипов, стридора);• установление причины нарушений газообмена (гипоксемия, гиперкапния) и некоторых других лабораторных показателей (например, полицитемия и др.);• оценка риска оперативного лечения больного;• оценка физического статуса пациента;• мониторирование бронхиальной обструкции, особенно при БА и ХОБЛ;• мониторирование рестриктивных нарушений у больных с интерстициальными заболеваниями лёгких и патологией нервно-мышечного аппарата;• оценка эффективности лечения бронхолёгочной патологии;• объективизация жалоб больного при профессиональной пато¬ логии лёгких либо заболеваниях, связанных с воздействиями окружающей среды.Метод спирометрии безопасен, поэтому не существует абсолют¬ ных противопоказаний к его применению. Он состоит в измерении лёгочных объёмов при спокойных и форсированных дыхательных манёврах. Однако манёвр форсированного выдоха следует выпол¬ нять с осторожностью;
118 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХ• При пневмотораксе;• в первые 2 нед от развития острого инфаркта миокарда, после глазных и полостных операций;• выраженном продолжающемся кровохарканье;• тяжёлой БА,При подозрении на активный туберкулёз лёгких либо другие заболевания, пере¬ дающиеся воздушно-капельным путём, следует принимать меры предосторожно¬ сти во избежание их распространения через спирометр.Объём лёгких при спирометрии можно измерить двумя способами, В первом случае непосредственно измеряется объём вдыхаемого или выдыхаемого воздуха и строится график зависимости объёма лёгких от времени (кривая «объём-время», или спирограмма) (рис. 6-1, А), В другом случае измеряется объёмная скорость воздушного потока и объём рассчитывается при умножении потока на время, при этом на графике отображается зависимость объёмной скорости воздушного пото¬ ка от объёма лёгких (кривая «поток-объём», рис, 6-1, Б).Таким образом, обе кривые отражают одинаковые параметры: интегральное выражение скорости воздушного потока даёт объём, который в свою очередь можно представить как функцию времени. И наоборот, объём выдыхаемого возду¬ ха можно дифференцировать относительно времени, чтобы определить скоростьВыдох певРис. 6-1. А - Спирограмма форси¬ рованного выдоха. ФЖЁЛ - форси¬ рованная жизненная ёмкость лёгких. ОФВ, - объём форсированного выдО' ха за 1 секунду, - средняяобъёмная скорость экспираторного потока на уровне 25-75% ФЖЁЛ. Б - Нормальная петля «поток-объём», полученная при максимальных вдохе и вьщохе. Пояснения в тексте.
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЫХАНИЯ ^ 19потока. Современные спирометры по своей сути являются пневмотахометрами и .0. позволяют оценивать основные параметры (объём, поток и время) и их взаимо- »• связь с помощью кривых «поток-объём» и «объём-время». V:Для корректной интерпретации результатов спирометрии необходимо правиль- но выполнить исследование [12-15]. Неправильно выполненный дыхательный манёвр является основной причиной вариабельности результатов теста. . -,.,лЛёгочные объёмы при спирометрии можно измерить при спокойном или фор- ,:у;г сированном дыхании. С помощью манёвра форсированного выдоха измеряют форсированную жизненную ёмкость лёгких (ФЖЁЛ) и показатели объёмной ско¬ рости воздушного потока: объём форсированного выдоха за 1-ю секунду — OФBJ. отношение ОФ]^/ФЖЁЛ, СОС25_75 — среднюю объёмную скорость выдоха между 25% и 75% ФЖЕЛ, максимальные объёмные скорости (МОС) на уровнях 25, 50 и 75% ФЖЁЛ, пиковую скорость выдоха (ПСВ^Наиболее важным из них являет¬ ся ОФВр поскольку он относительно независим от усилия, приложенного во время манёвра выдоха, и отражает свойства лёгких и дыхательных путей. ОФВ^ — самый хорошо воспроизводимый, самый информативный и наиболее часто используе¬ мый показатель спирометрии.При тяжёлых обструктивных заболеваниях лёгких время выдоха может превы¬ шать 15-20 с, а экспираторный поток в конце выдоха может быть настолько мал, что спирометр с трудом воспринимает его. Выполнение длительного форсирован¬ ного выдоха может быть затруднительным и вызывать неприятные ощущения у пациента. Во избежание этого вместо ФЖЁЛ в последнее время используют показатель ОФВ^ — объём воздуха, выдыхаемого за 6 с. У здоровых лиц ОФВ^ не намного меньше ФЖЁЛ. Кроме того, ОФВ^ лучше воспроизводим, чем ФЖЁЛ. Аналогично отношению ОФВ,/ФЖЁЛ отношение ОФВуОФВ^ тоже отражает сте¬ пень ограничения экспираторного потока и позволяет прогнозировать снижение ОФВ^ у курильщиков [15,16]. В отличие от манёвра ФЖЁЛ, более короткий манёвр ОФВ^, не требующий достижения плато на кривой «объём-время», снижает риск развития синкопальных состояний во время исследования у тяжёлых больных и уменьшает утомляемость как пациента, так и специалиста, проводящего иссле¬ дование. Однако должные величины ОФВ^ не вполне разработаны, поэтому пока рекомендуется по-прежнему оперировать традиционным показателем ФЖЁЛ.Важным спирометрическим показателем является отношение ОФВ/ФЖЁЛ, кото¬ рое обычно выражается в процентах и является модификацией индекса Тиффно (ОФВ^/ЖЁЛвд, где ЖЁЛ^^ — максимальный объём воздуха, который можно вдохнуть после полного спокойного выдоха). Объём воздуха, вьщыхаемый за 1 с, представляет собой достаточно постоянную долю ФЖЁЛ независимо от размера лёгких. У здоро¬ вого человека это соотношение составляет 75-85%, но с возрастом скорость выдоха снижается в большей степени, чем объём лёгких, и отношение несколько уменьшает¬ ся. У детей, наоборот, скорости воздушных потоков высокие, поэтому ОФВуФЖЁЛ у них, как правило, около 90%. При обструктивных нарушениях ОФВуФЖЁЛ обыч¬ но уменьшается, поскольку ОФВ^ снижается соответственно тяжести обструкции.ФЖЁЛ при этом также снижается, но в меньшей степени. При лёгочной рестрикции без обструктивных изменений ОФВ^ и ФЖЁЛ снижаются пропорционально, сле¬ довательно, их соотношение будет в норме или даже немного повышенным. Таким образом, для дифференцировки обструктивных и рестриктивных нарушений оце¬ нивают ОФВ^/ФЖЁЛ.При форсированной спирометрии можно измерить С0С^5 Некоторые иссле¬ дователи счотают, что при диагностике ранних стадий бронхиальной обструкции С0С25_75 более чувствительна, чем ОФВ^ [17], однако имеет более широкий диа¬ пазон нормальных значений [18].Максимальные объёмные скорости экспираторного потока на разных уров¬ нях ФЖЁЛ не обладают высокой воспроизводимостью, подвержены инстру-
120 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХментальной ошибке и зависят от приложенного экспираторного усилия [19], поэтому не играют существенной роли в диагностике вентиляционных нару¬ шений [14].ПСВ^^^, которая также называется максимальной экспираторной скоростью, измеряется в течение короткого отрезка времени сразу после начала вьщоха. ПСВ^ыд ® большей степени, чем другие показатели, зависит от усилия пациента: для получения воспроизводимых данных пациент должен в начале выдоха приложить максимум усилия [20], Недорогие портативные приборы для измерения ПСВ^^^ в домашних условиях и самоконтроля состояния пациентов — пикфлоуметры — получили широкое распространение у больных БА.КРИВАЯ «ЛОТОК-ОБЪЁМ»По данным литературы [14, 20, 22] и нашему собственному опыту, представле¬ ние результатов спирометрии в виде кривой «поток-объём» является наиболее простым для интерпретации и наиболее информативным. Максимальный поток зависит от механических свойств лёгочной ткани.При форсированном выдохе у любого человека максимальная скорость воздуха ограничена. Этот предел достигается уже при умеренном усилии, и дальнейшее наращивание усилия увеличивает скорость потока выдыхаемого воздуха только в начальной четверти ФЖЁЛ, а при низких и средних объёмах лёгких наращи¬ вание усилия не увеличивает скорость потока. Таким образом, после достижения ПСВ^^^ каждая точка оставшейся части кривой отражает тот максимальный поток, который может быть достигнут при данном объёме лёгких (см. рис. 6-1, А). После выдоха 10-15% ФЖЁЛ максимальная скорость выдоха не может превысить определённого уровня в отличие от вдоха, когда большее инспираторное усилие вызывает больший поток на всех уровнях ФЖЁЛ. Каждый человек имеет уникаль¬ ную кривую «поток-объём» и, поскольку такая кривая определяет максимальную скорость выдоха, кривая «поток-объём» у одного и того же человека высоко вос¬ производима.Лёгочная ткань обладает эластичностью, которая является основной силой, заставляющей воздз^х на вьщохе вьіходїіть из лёгких. Эластичность также играет большую роль в поддержании просвета бронхов (рис, 6-2). При форсированном выдохе по мере уменьшения внутрилёгочного объёма нарастает динамическая компрессия дыхательных путей, что вызывает их критическое сужение и ограни¬ чивает скорость воздушного потока.стенкаполостьРис. 6-2. Упрощённая модель лёг¬ ких. Лёгкие находятся в грудной клетке, объём которой изменяет¬ ся вследствие движения поршня {дыхательные мышцы). При сокра¬ щении диафрагмы грудная клетка увеличивает свой объём, воздух заходит в лёгкие. Во время выдоха объём ФУДНОЙ клетки уменьшает¬ ся и воздух через трахею выходит из лёгких. Лёгкие обладают эла¬ стичностью, которая определяет скорость выдоха и поддерживает бронхи открытыми. При форси¬ рованном выдохе динамическая компрессия дыхательных путей вызывает их сужение.
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЫХАНИЯ 121 -'Тапш образом, эластичность определяет максимальную скорость экспиратор- Бого потока, обеспечивая прохождение воздуха по дыхательным путям и поддер- •. живая просвет бронхов и сопротивление дыхательных путей воздушному потоку. ^Вдох, предшествующий манёвру ФЖЁЛ, оказывает существенное влияние на экспираторные скоростные показатели. Для получения наилучших результатов необходимо после спокойного выдоха сделать максимально глубокий вдох и сразу же после этого без паузы выдохнуть весь воздух с максимальным усилием. Это ’ ' позволяет получить максимальные экспираторные потоки (пауза на высоте вдоха может вызвать «стрессовое расслабление» со снижением эластической тяги и уве¬ личением растяжимости дыхательных путей, что снижает скорость выдоха).Кривая «поток-объём» обладает следующими особенностями. Экспираторная и инспираторная петли имеют различную форму. При экспираторном маневре сразу после быстрого подъёма начинается линейное снижение скорости потока вплоть до окончания вьщоха, поэтому экспираторная кривая «поток-объём» обычно имеет форму почти прямоугольного треугольника, основание которо¬ го соответствует ФЖЁЛ, а вершина — ПСВ^^, Начальная часть экспираторной кривой (25-33% ФЖЁЛ) в большей степени зависит от прилагаемого пациентом мышечного усилия, а не от механических свойств лёгких. После достижения пика выдоха скорость потока плавно снижается и при достижении уровня остаточного объёма лёгких (ООЛ) становится нулевой. Эта часть кривой не зависит от усилий пациента и обладает высокой воспроизводимостью. При заболеваниях органов дыхания изменения механических свойств лёгких приводят к изменениям формы кривой, У людей старше 30 лет и лиц с бронхолёгочной патологией по мере завер¬ шения вьщоха происходит закрытие мелких дыхательных путей, и ООЛ определя¬ ется как объём закрытия, поэтому поток прогрессивно снижается до достижения ООЛ. У людей молодого возраста, а также пациентов с ограничением расширения грудной клетки ООЛ определяется ригидностью грудной стенки, что ограничивает максимальный экспираторный поток. В этом случае в конце выдоха можно наблю¬ дать резкое снижение потока.Во время вдоха поток зависит от приложенного усилия. Инспираторная кривая «поток-объём» является симметричной: максимальный инспираторный поток достигается приблизительно в средней точке кривой. Измерение максимальных инспираторных потоков не пол}^ило широкого распространения, однако каче¬ ственный анализ инспираторной и экспираторной частей кривой «поток-объём» позволяет выявить изолированную обструкцию верхних дыхательных путей. При этой патологии спирограмма гораздо менее информативна, чем кривая «поток- объём».ИСТОЧНИКИ ВАРИАБЕЛЬНОСТИПоказатели спирометрии подвержены суточным колебаниям и могут меняться под действием курения или других химических/физических факторов. Кроме того, состояние респираторной системы может измениться под воздействием самой процедуры спирометрии; например, глубокий вдох может вызвать бронхо- дилатацию и изменить эластические свойства лёгких. Вариабельность показателей у одного и того же пациента может быть обусловлена изменением активности патологического процесса (по причине инфекции, контакта с профессиональными вредностями или аллергеном), влиянием поллютантов при гиперреактивности дыхательных путей, приёмом препаратов, влияющих на просвет бронхов.Биологическая вариабельность сводится к минимуму, если уделять при¬ стальное внимание условиям проведения теста. Техническую вариабельность можно минимизировать при регулярной калибровке, частой проверке работы оборудования, тщательном инструктаже пациента, высокой квалификации персонала.
122 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХНОРМАЛЬНЫЕ ВЕЛИЧИНЫЕвропейское сообщество стали и угля (ECCS) и Американское торакальное общество (ATO) опубликовали уравнения для расчёта должных значений спи¬ рометрических показателей [13, 14, 63, 65. 67] и рекомендации по интерпрета¬ ции результатов Í62, 64]. Должные величины зависят от антропометрических параметров, в основном от роста, пола, возраста, расы. Чем выше человек, тем больше объём его лёгких и протяжённость дыхательных путей, следовательно, максимальная скорость выдоха будет выше. У женщин объём лёгких меньше, чем у мужчин такого же роста. С возрастом эластичность лёгочной ткани снижается, в результате уменьшаются объём и скорость выдоха. Вместе с тем следует принимать во внимание и индивидуальные вариации нормы. Например, у людей с исходными показателями выше среднего уровня при развитии лёгочной патологии эти показа¬ тели будут снижаться относительно исходных, но по-прежнему могут оставаться в пределах популяционной нормы.ПОВТОРНЫЕ ИССЛЕДОВАНИЯСпирометрические показатели (OФBJ и ФЖЁЛ) надёжно отражают динамику лёгочной функции с течением времени, однако при интерпретации повторных результатов могут возникнуть трудности, так как полученные изменения могут быть обусловлены технической и биологической вариабельностью. У здоровых лиц изменения ФЖЁЛ и ОФВ^ являются клинически значимыми, если при повтор¬ ных исследованиях в течение дня различие превышает 5%, в течение нескольких недель - 11-12%, за год - 15% [68].Интерпретация результатов спирометрии основана на отклонении полученных величин от должных значений. Анализ функциональных результатов в сочетании с динамикой клинической картины может улучшить интерпретацию полученных данных.ОБСТРУКТИВНЫЙ ТИП ВЕНТИЛЯЦИОННЫХ НАРУШЕНИЙРанними признаками обструктивных нарушений у пациентов без клинических проявлений бронхиальной обструкции могут служить изменение формы экспира¬ торной кривой «поток-объём» и снижение скоростных показателей, измеренных при низких лёгочных объёмах во время теста ФЖЁЛ (COCj^.^j, МОС.^, МОС^^) [29]. Однако значительная вариабельность этих показателей затрудняет интерпретацию индивидуальных отклонений от должных значений [31].При обструктивных нарушениях экспираторные потоки снижаются и кривая пациента располагается под должной кривой (рис. 6-3). Кроме этого, нарушает-Рис. 6-3. Кривые «поток-объём» у больных с различными заболеваниями органов дыхания: а — бронхиальной астмой; б — эмфиземой лёгких; в — едиопатическим фиброзиругощим альвеолитом. Пунктирной линией обозначена должная кривая.
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЫХАНИЯ 123Рис. 6-4. Сравнение максимальной кривой «поток-объём» и кривой «поток-объём» при спокойном дыхании позволяет выделить следующие варианты: I) поток в покое меньше максимального потока — 1 тип , II) потоки равны — 2 тип, III) поток в покое превышает максимальный поток — 3 тип. Наличие 2-го и 3-го типа свидетельствует об ограничении экспираторного потока.ся обычное линейное снижение скорости потока и нисходящее колено кривой «поток-объём» приобретает вогаутую форму. Нарушение линейности нижней половины кривой «поток-объём» является характерной чертой обструктивных нарушений вентиляции, даже когда ФЖЁЛ, ОФВ, и ОФВуФЖЁЛ не выходят за пределы нормальных значений. Степень изменения формы кривой зависит как от тяжести обструктивных нарушений, так и от вида патологии.Важную клиническую информацию можно получить при сравнении кривых «поток-объём» при спокойном и форсированном дыхании. Если есть ограничение воздушного потока в дыхательных путях, которое приводит к снижению вентиля¬ ционного резерва и гиперинфляции, то объёмная скорость при спокойном выдохе равна или превышает объёмную скорость при форсированном маневре ФЖЁЛ (рис, 6-4).В некоторых случаях возможна парадоксальная ситуация, когда поток при спокойном дыхании превышает поток при форсированном выдохе (см. рис. 6-4). Возможной причиной такого феномена является потеря лёгкими эластической отдачи и ослабление сил, поддерживающих просвет дыхательных путей, что наблюдается при резко выраженных обструктивных нарушениях, эмфиземе.При сравнении кривых спокойного выдоха и ФЖЁЛ можно определить резерв¬ ный объём вьвдоха. При ожирении, беременности и асците резервный объём выдо¬ ха снижается и кривая спокойного дыхания сдвигается вправо.Обструкция верхних дыхательных путейПри обструкции верхних дыхательных путей форма кривой «поток-объём», полученной при форсированном маневре, существенно отличается от должной [20, 22]. Это обусловлено различным воздействием динамических факторов на экстра- и интраторакальные дыхательные пути. На экстраторакальные дыха¬ тельные пути влияет атмосферное давление, на интраторакальные — внутриплев- ральное. Разница между внешним давлением (атмосферным или плевральным) и давлением внутри дыхательных путей называется трансмуральным давлением. Положительное трансмуральное давление создаёт компрессию и сужает просвет дыхательных путей. Наоборот, отрицательное трансмуральное давление поддер¬ живает дыхательные пути открытыми, увеличивая их просвет. Если обструкция возникает только на вдохе или выдохе, она считается переменной. Если воздушные потоки снижены в обе фазы дыхания, обструкция называется фиксированной.
124 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЕГОЧНЫХ ЗАБОЛЕВАНИЯХПеременная экстраторакальная обструкция (например, при параличе голо¬ совых связок, увеличении щитовидной железы) вызывает избирательное огра¬ ничение воздушного потока на вдохе. На выдохе давление внутри дыхательных путей увеличивается и превышает атмосферное, воздействующее на зону пора¬ жения снаружи, поэтому экспираторный поток меняется мало. Во время вдоха наблюдается обратная картина: атмосферное давление значительно превышает давление в дыхательных путях, что приводит к снижению инспираторных пото¬ ков (рис. 6-5, а).При переменной интраторакалъной обструкции (например, при опухоли нижне¬ го отдела трахеи, трахеомаляции, гранулематозе Вегенера или редицивирующем полихондрите) высокое внутриплевральное давление во время форсированного выдоха превышает давление в дыхательных путях, что приводит к выражен¬ ному сужению их просвета с критическим снижением экспираторных потоков. Инспираторные потоки меняются мало, если отрицательное плевральное давле¬ ние меньше, чем давление в дыхательных путях (рис. 6-5, 6).При фиксированной обструкции (например, при опухолях на любом уровне верхних дыхательных путей или параличе голосовых связок с фиксированным стенозом, рубцовых стриктурах гортани и трахеи) инспираторные и экспиратор¬ ные потоки меняются почти в одинаковой степени. Локализация поражения не имеет значения, поскольку размеры трахеи при этом не зависят от давления вну¬ три и снаружи дыхательных путей (рис. 6-5, в).Для характеристики вышеуказанных поражений верхних дыхательных путей используются различные показатели, например, соотношение инспираторных и экспираторных потоков на уровне 50% ФЖЁЛ (МОСдд^^уМОС^о^). Это соотноше¬ ние значительно меняется при переменной экстраторакальной обструкции. При подозрении на изолированную обструкцию верхних дыхательных путей следует подтвердить диагноз эндоскопически или рентгенологически.РЕСТРИКТИВНЫЙ ТИП ВЕНТИЛЯЦИОННЫХ НАРУШЕНИЙРестриктивные нарушения вентиляции характеризуются ограничением наполне¬ ния лёгких воздухом (снижением жизненной ёмкости лёгких — ЖЁЛ). При фиброзе лёгких увеличение лёгочной эластической отдачи усиливает движущее давление экспираторного потока от альвеол к ротовой полости. Кривая «поток-объём» становится высокой и узкой (см. рис. 6-3, в). Пиковая объёмная скорость обычно остаётся нормальной, после пика наблюдается быстрое линейное снижение потока до уровня ООЛ. Кривая может и не менять свою форму, а пропорционально умень¬ шаться по сравнению с должной кривой (например, после пневмонэктомии).Для диагностики рестриктивных нарушений недостаточно одной спирометрии, необходимо также измерить статические лёгочные объёмы.Рис. 6-5. Кривые «поток-объём» у больных с обструкцией верхних дыхательных путей (схема): а — переменной экстраторакальной обструкцией, б — переменной интраторакальной обструкцией и в — фиксированной обструкцией.
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЫХАНИЯ 125Максимальная вентиляция лёгкихПри измерении максимальной вентиляции лёгких (МВЛ) определяют макси¬ мальный объём воздуха, который может быть перемещён по дыхательным путям за 1 мин. Во время исследования пациенту необходимо дышать максимально часто и глубоко. Время выполнения теста обычно составляет 15 с (за исключением про¬ цедуры определения максимальной поддерживаемой вентиляции лёгких, когда время исследования может увеличиваться до 4 мин, при этом вдыхаемый газ должен содержать углекислоту для предотвращения гипокапнии). Частота дыха¬ ния при измерении МВЛ не стандартизована, максимальные результаты обычно регистрируют при частоте 70-120 дыханий в минуту, однако частота не оказывает существенного влияния на результат [32]. Тем не менее, следует указать, при какой частоте дыхания проведено измерение, например, МВЛуц.Результаты измерения МВЛ существенно зависят от прилагаемого пациентом усилия. Несмотря на это, оценка МВЛ полезна при определённых обстоятельствах: например, при нейромышечных и неврологических заболеваниях и выраженных вентиляционных нарушениях МВЛ снижается. При обструктивных нарушениях МВЛ снижается в большей степени, чем при рестриктивных, поскольку при умень¬ шении объёма лёгких частое поверхностное дыхание компенсирует нарушения вентиляции.МВЛ хорошо коррелирует с тяжестью одышки и физической работоспособ¬ ностью, позволяет оценить выносливость дыхательных мышц и выявить ранние признаки их утомления [33].Измерение лёгочных объёмовПод термином «измерение лёгочных объёмов», как правило, подразумевают измерение статических лёгочных объёмов, наиболее важными из которых явля¬ ются ЖЁЛ, ООЛ и ОЕЛ.ОЕЛ представляет собой сумму нескольких лёгочных объёмов и ёмкостей (рис. 6-6): резервного объёма вдоха (РО^), дыхательного объёма (ДО), резервно¬ го объёма выдоха (РО^^,^) и ООЛ. Ёмкостью легких называют сумму двух и более лёгочных объёмов. Выделяют следующие ёмкости: ЖЁЛ, ёмкость вдоха (Е^), функциональную остаточную ёмкость (ФОЕ) и ОЕЛ.ЖЁЛ — объём воздуха, который можно выдохнуть при полном выдохе после максимального вдоха. ЖЁЛ можно измерить одним из следующих способов:ЖЁЛдоФОЕОЕЛООЛОЕЛ100%ЖЄЛ70%ЖЁЛ100%55%до 12%РО8ЫД33%ООЛ30%Рис. 6-6. Схематическое изображение статических лёгочных объёмов и ёмкостей. Объёмы лёг¬ ких: РО^ — резервный объём вдоха, ДО — дыхательный объём, РО — резервный объём выдоха, ООЛ — остаточный объём лёгхих. Емкости лёгких представляет собой сумму лёгочных объёмов: ЖЁЛ — жизненная ёмкость лёгких, — ёмкость вдоха, ФОЕ — функциональная остаточная ёмкость, ОЕЛ — общая ёмкость лёгких.
126 МЕТОДЫ ОБСЛЕДОВАНИЙ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХ• ЖЁЛзд — после полного спокойного выдоха делается максимально глубокий спокойный вдох;• — после максимально глубокого вдоха делается полный выдох;• двустадийная ЖЁЛ определяется в два этапа как сумма ёмкости вдоха и резервного объёма выдоха.Для определения ЖЁЛ рекомендуется измерять ЖЁЛ^^; если же это невозмож¬ но, то в качестве альтернативы может быть использована ЖЁЛ^^^^. Использовать двустадийную ЖЁЛ в повседневной практике не рекомендуется, за исключением обследования больных с тяжёлой одышкой.У здоровых лиц разница между ЖЁЛ и ФЖЁЛ минимальна. У больных с ограни¬ чением экспираторного воздушного потока манёвр ФЖЁЛ может приводить к пере¬ крытию дыхательных путей, и ФЖЁЛ будет значительно ниже, чем ЖЁЛ [14]. ЖЁЛ в норме составляет приблизительно 70% ОЕЛ и включает в себя ДО, РО^^ и РО^^^.Дыхательный объём — объём газа, вдыхаемый и выдыхаемый при спокойном дыхании. Его следует рассчитывать как среднее значение как минимум шести дыхательных циклов. Окончание фазы вдоха называют конечно-инспираторным уровнем, окончание фазы выдоха — конечно-экспираторным уровнем.Резервный объём вдоха — максимальный объём воздуха, который можно вдохнуть после обычного спокойного вдоха (конечно-инспираторного уровня).Резервный объём выдоха — максимальный объём воздуха, который можно выдо¬ хнуть после спокойного выдоха (конечно-экспираторного уровня).Сумма ДО и РО^д в норме обычно составляет 60-70% ЖЁЛ, этот показатель называют ёмкостью вдоха.Остатогный объём лёгких — объём воздуха, который остаётся в лёгких по окон¬ чании полного выдоха. Из всех вышеперечисленных объёмов только ООЛ нельзя измерить напрямую. Он рассчитывается путём вычитания РО^^ из ФОЕ или ЖЁЛ из ОЕЛ (последний способ предпочтителен).Снижение ООЛ может быть единственным изменённым функциональным пока¬ зателем у пациентов с патологией грудной клетки (скелетной деформацией, фибро- тораксом) или внутренних органов (застойной сердечной недостаточностью, сар- коидозом, инфекционными заболеваниями). Повышение ООЛ часто наблюдается при обструктивных заболеваниях лёгких, когда из-за отёка бронхиальной стенки, сокращения гладкой мускулатуры бронхов, воспалительных изменений увеличи¬ вается время выдоха, затрудняется опустошение альвеол и возникают так назы¬ ваемые «воздушные ловушки». При этом увеличивается и ОЕЛ, хотя на начальных этапах заболевания ОЕЛ может оставаться в пределах нормальных значений.ОЕЛ рассчитывается двумя способами: ОЕЛ=ООЛ-ьЖЁЛ, или ОЕЛ=ФОЕ+Е^^. Последний способ более предпочтителен. При рестриктивных нарушениях ОЕЛ снижается.ФОЕ — объём воздуха в лёгких и дыхательных путях после спокойного выдоха, ФОЕ — объём, при котором эластическая отдача лёгких уравновешена эластиче¬ ской отдачей грудной клетки. На уровне ФОЕ дыхательная система находится в покое. ФОЕ=РО^^^+ООЛ и в норме обычно составляет 40-50% ОЕЛ. При сниже¬ нии эластической отдачи лёгких (например, при эмфиземе) ФОЕ увеличивается и, наоборот, при увеличении эластической отдачи (например, при лёгочном фибро¬ зе) ФОЕ снижается.Существует несколько методов определения ФОЕ. Самыми распространёнными являются метод разведения газов (метод газовой дилюции) и бодиплетизмогра- фия.МЕТОДЫ РАЗВЕДЕНИЯ ГАЗОВМетоды разведения газов подразделяются на методы, основанные на разве¬ дении (обычно гелия) или вымывании (обычно азота) инертных индикаторных
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЬ1ХАНИЯ 127газов при многократных дыхательных циклах или при одиночном вдохе в закры¬ той или открытой системе. Методы разведения газов широко применяются благо¬ даря простоте методики и относительной дешевизне оборудования.Метод вымывания азота основан на принципе сохранения массы. Для вымы¬ вания азота используют открытый контур. Лёгкие содержат неизвестный объём газа, концентрация азота в котором приблизительно 80%. Во время исследования пациент дышит 100% кислородом. Выдыхаемый газ собирается до тех пор, пока весь азот не будет вымыт из лёгких. По совокупному объёму выдыхаемого воз¬ духа и концентрации азота можно вычислить исходный объём лёгких. Процедура измерения занимает около 7 мин.У пациентов с тяжёлым нарушением бронхиальной проводимости или эмфизе¬ мой истинное значение ФОЕ при измерении этим методом занижается, поскольку вдыхаемый газ не проникает в гиповентилируемые и невентилируемые простран¬ ства. Для более точной оценки ФОЕ у таких больных необходимо увеличить время исследования до 15-20 мин, однако длительное исследование утомительно для пациентов и, кроме того, у некоторых из них дыхание 100% кислородом может угнетать дыхательный центр. Метод технически сложен (необходима тщательная синхронизация сигналов потока и концентрации азота), чувствителен к утечке в дыхательном контуре (особенно в ротовой полости) [34]. Чтобы избежать завы¬ шения ФОЕ вследствие элиминации азота из крови и тканей (приблизительно 30 мл/мин), необходима соответствующая коррекция.Метод разведения гелия — наиболее широко используемый метод определе¬ ния ФОЕ, рекомендуемый для рутинного применения. Он основан на равенстве неизвестного объёма газа в лёгких и известного объёма газа, содержащего гелий [35, 36]. Пациент в закрытой системе дышит этой газовой смесью до выравни¬ вания концентраций гелия в спирометре и в лёгких (когда концентрация гелия меняется менее чем на 0,02% за 30 с), что требует около 5 мин.Как и при использовании метода вымывания азота, у больных с обструктив¬ ными нарушениями ФОЕ, вычисленная методом разведения гелия, может быть занижена.Метод вътывания азота при одиногном вдохе кислорода. ОЕЛ можно измерить путём вымывания азота после вдоха 100% кислорода, равного по объёму ЖЁЛ[37]. У здоровых людей с минимальной неоднородностью вентиляции концентра¬ ция азота в выдыхаемой смеси будет чуть ниже его концентрации в альвеолах, поэ¬ тому данный метод незначительно искажает истинный объём лёгких. У пациентов с ограничением воздушного потока занижение истинного лёгочного объёма может быть гораздо большим вследствие неравномерности распределения вдыхаемого газа. Данный метод не рекомендуется для рутинного использования.Измерение диффузионной способности лёгких. При измерении диффузионной способности лёгких для угарного газа (ВЬ^,д) методом однократного вдоха с задержкой дыхания можно измерить альвеолярный объём с помощью гелия, кото¬ рый служит инертным индикаторном газом [38, 39]. У больных с ограничением воздушного потока этот метод тоже занижает истинный лёгочный объём, вероят¬ но, за счёт диффузии гелия в кровь во время задержки дыхания, и не рекомендует¬ ся для рутинного измерения ОЕЛ в клинической практике.БОДИПЛЕТИЗМОГРАФИЯБодиплетизмография позволяет определить внутригрудной объём (ВГО) газа [40-44]. Пациент для этого помещается внутрь измерительного устройства (каме¬ ры). На сегодняшний день существуют три типа плетизмографов: измеряющие объём, давление или оба эти параметра.Плетизмограф, измеряющий давление, является закрытой камерой фиксиро¬ ванного объёма, в которой дышит пациент. Изменения объёма вследствие ежа-
128 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХтия и расширения внутригрудного газа определяются по изменению давления в камере, Внутригрудной объём и сопротивление дыхательных путей измеряют при частом дыхании. Этот тип плетизмографов предназначен для оценки лишь небольших изменений объёма, поскольку обладает высокой чувствительностью и превосходным частотным ответом. Использование камеры постоянного объёма является наиболее универсальным методом.Плетизмограф, измеряющий объём, является камерой переменного объёма с постоянным давлением. При изменеиии внутригрудного объёма газ перемеща¬ ется через отверстие в стенке камеры; в таком плетизмографе измеряют объём этого газа. Этот тип плетизмографов позволяет оценивать как небольшие, так и значительные изменения объёма. Однако для достижения хорошего частотного ответа система должна обладать маленьким импедансом, что является технически сложной задачей, поэтому такие плетизмографы не рекомендуются для рутинного использования.Плетизмограф, измеряющий объём и давление, сочетает в себе особенности плетизмографа постоянного объёма и плетизмографа постоянного давления. Поскольку пациент дышит комнатным воздухом, изменения внутригрудного объёма приводят к сжатию или расширению воздуха в камере, а также перемеща¬ ют его через отверстие в стенке камеры. Компрессия или декомпрессия воздуха определяется по изменению давления, объём перемещённого воздуха измеряют спирометром/пневмотахометром,Метод измерения внутригрудного объёма газа основан на законе Бойля: объём определённого количества газа при постоянной температуре меняется обратно пропорционально давлению. В конце выдоха альвеолярное давление равняется атмосферному давлению в ротовой полости, потому что в этот момент отсутству¬ ет поток воздуха. Когда дыхательные пути перекрываются на уровне ротовой полости, пациент делает попытки вдохов и выдохов. Газ, содержащийся в лёгких, попеременно сжимается и разрежается, При попытке вдоха объём грудной клетки увеличивается, а давление внутригрудного газа снижается. При использовании камеры с постоянным объёмом изменение объёма лёгких равно изменению объёма камеры, которое можно вычислить по изменению давления в камере. При перекрытии дыхательных путей строится график зависимости изменений объёма в ротовой полости от изменений объёма камеры (рис. 6-7), что позволяет оценить внутригрудной объём.У больных с выраженными обструктивными нарушениями бодиплетизмогра¬ фия может завышать истинное значение ФОЕ [45] из-за того, что у таких пациен¬ тов колебания ротового давления при перекрытии дыхательных путей отстают от колебаний альвеолярного давления. Ошибка может быть сведена к минимуму при проведении исследования с частотой дыхания менее 60 в минуту [46, 47]. У детей некоторое завышение ФОЕ может быть обусловлено перепадами альвеолярного давления из-за очень податливой грудной клетки [48].Бодиплетизмография позволяет за короткое время многократно измерить ФОЕ, что выгодно отличает её от методов вымывания азота или разведения гелия, поскольку повторные измерения при использовании двух последних мето¬ дов можно проводить только после «отмьгеочного» периода, необходимого для возвращения альвеолярного газа в исходное состояние (для больных ХОБЛ он составляет 10-20 мин). Кроме того, ФОЕ, измеренная методом бодиплетизмогра- фии, включает в себя как вентилируемые, так и невентилируемые отделы лёгких, в связи с чем у пациентов с лёгочными кистами и «воздушными ловушками» этот показатель будет выше, чем при использовании методов разведения газов. Сопоставление результатов этих двух методов даёт важную информацию о нали¬ чии невентилируемого воздушного пространства в грудной клетке и позволяет вычислить объём «воздушной ловушки». Бодиплетизмография является дорогим
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЫХАНИЯ 129Рис. 6-7. графическое представление респираторных усилий при перекрытии дыхательных путей: изменение ротового давления (ось V) соответствует изме¬ нению объема в боди-камере (ось X). Экспираторные усилия приводят к увели¬ чению ротового давления и разрежению объёма в камере, инспираторные усилия - с точностью наоборот. Угол наклона оси пропорционален виутригрудному объёму. Эти кривые указывают на хорошее выпол¬ нение манёвров, практически отсутствуют отклонения от линии наклона.и технически более сложным методом и требует от пациента больших усилий и более чёткого выполнения указаний специалиста, чем при методе разведения газов. Тем не менее метод бодиплетизмографии является предпочтительным, поскольку позволяет более точно оценить ФОЕ [44J,РЕНТГЕНОГРАФИЧЕСКОЕ ИЗМЕРЕНИЕ ОБЪЁМА ЛЁГКИХОбъём лёгких можно измерить с помощью рентгенографии грудной клетки в переднезадней и латеральной проекциях [49-54]. Метод позволяет оценить ОЕЛ, при этом результаты незначительно отличаются от полученных при бодиплетиз¬ мографии даже у больных с бронхиальной обструкцией [50, 55]. При исполь¬ зовании бодиплетизмографии измеряют объём компрессионного воздуха, при применении методов разведения — объём сообщающегося воздуха, а при рентге¬ нографии юмеряют объём воздуха вместе с тканями лёгких, поэтому результаты требуют коррекции [49,50, 56].Сопротивление дыхательных путейСопротивление дыхательных путей (respiratory airway resistance — равно отношению движущего давления (разница между альвеолярным давлением и дав¬ лением в ротовой полости) к потоку воздуха.В клинической практике часто используют величину, обратную сопротивле¬ нию - проводимость дыхательных путей (G^^=1/R^J.Сопротивление дыхательных путей увеличивается:• при сужении просвета дыхательных путей вследствие воспаления, отёка сли¬ зистой оболочки, сокращения гладкой мускулатуры бронхов и избыточной секреции слизи (при Б А и ХОБЛ);• при снижении эластичности лёгких и утрате сил, поддерживающих просвет дыхательных путей открытым (при эмфиземе);• при обтурации просвета дыхательных путей опухолью (при бронхогенном раке).Измерение сопротивления дыхательных путей применяется для дифферен¬ циальной диагностики респираторных заболеваний и для уточнения уровня обструкции [57]. Сопротивление дыхательных путей легко измеряется методом бодиплетизмографии.
€130 МЕТОДЫ обследования при лёгочных ЗАБОЛЕВАНИЯХг ^ разных )гчастках лёгких сопротивление дыхательных путей различно. Приэтом измеренное бодиплетизмографически, является не средним значением сопротивления в разных участках лёгких, а средним альвеолярным давлением на единицу объёма, делённым на среднюю скорость воздушного потока, поэтому у конкретного пациента трудно оценить вклад отдельных физиологических фак¬ торов (например, потери эластичности лёгких или бронхоспазма) в увеличение сопротивления дыхательных путей.Импульсная осциллометрияМетод импульсной осциллометрии является модификацией метода форсиро¬ ванных осцилляций, с помощью которого можно измерить импеданс — общее сопротивление дыхательных путей, лёгких и грудной клетки воздушному потоку [58-60].в дыхательные пути подаётся поток воздуха с навязанными осцилляциями в диапазоне от 5 до 35 П;, а в выдыхаемом воздухе измеряются давление и скорость потока. Частота навязанных осцилляций гораздо выше, чем частота дыхания пациента. Математический анализ позволяет рассчитать общее сопротивление и определить частотную зависимость фрикционного сопротивления (сопротивления трения дыхательных путей, тканей лёгких и грудной клетки) и реактанса (суммы эластического сопротивления лёгких и грудной клетки и инерционного сопротив¬ ления смещающихся при дыхании тканей лёгких, грудной клетки, дыхательнь[х путей и воздуха).Исследование необременительно для пациента и требует дыхания с обычной частотой в течение 30-60 с. Метод применяется для дифференцировки рестрик¬ тивных и обструктивных нарушений [61, 62], уточнения локализации 0бстр5т(ции (проксимальной или дистальной), оценки бронходилатационного и бронхокон- стрикторного ответа [63-65], мониторирования течения заболевания [66, 67], скрининга в эпидемиологических исследованиях.Эластическая отдача лёгкихЭластичность (эластическая отдача) лёгких представляет собой меру упругости лёгочной ткани. Величина, обратная эластичности, называется растяжимостью.При рестриктивных нарушениях, сопровождаемых уменьшением объёма лёг¬ ких, эластическая отдача возрастает, при обструктивных нарушениях снижается; у пациентов с хроническим бронхитом и БА — в незначительной мере, а у пациентов с эмфиземой — существенно.Исследование эластической отдачи является трудоёмким, дорогостоящим и инвазивным и не применяется в повседневной практике, однако играет важную роль в предоперационной оценке пациентов с буллёзной и диффузной эмфиземой, направляемых на резекцию нефункционирующих или очень плохо функциони¬ рующих участков лёгочной ткани.Диффузионная способность лёгкихТест исследования диффузионной способности лёгких (ДСЛ) — наиболее используемый в клинической практике тест лёгочной функции после спи¬ рометрии. в Европе ДСЛ называется ещё фактором переноса или трансфер- фактором для окиси углерода, так как тест измеряет способность лёгких к пере¬ носу газа из вдыхаемого воздуха к эритроцитам, проходящим через лёгочные капилляры.Диффузия в лёгких (В^ как процесс обеспечивает перенос кислорода из альвеолярного газа до эритроцитов. Количество переданного кислорода в зна¬ чительной степени определяется тремя основными факторами: площади (А)
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЫХАНИЯ 131альвеолярно-капиллярной мембраны, толщины (Т) мембраны и движущего дав¬ ления (разницы в напряжении кислорода между альвеолярным газом и венозной кровью — APOj. Взаимосвязь этих факторов можно приблизительно выразить следующим образом:_ AxDPq^Ul- jСтандарты и требования к аппаратуре, проведение тестов и расчёт результатов были опубликованы ATO в 1987 г., переработаны и дополнены в 1995 и 2005 гг. [13].ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ ДСЛСуществует целый ряд показаний к проведению теста, в то время как про¬ тивопоказания и побочные эффекты отсутствуют. Однако в тех случаях, когда ЖЁЛ составляет менее 1,5 л, большинство приборов не дают возможности измерить ДСЛ. Кроме того, для получения корректных данных кислородотера- пия должна быть отменена по меньшей мере за 15 мин до теста и во время его проведения.Наиболее часто тест используется для дифференциальной диагностики причин бронхиальной обструкции:• ДСЛ — чувствительный маркёр степени выраженности анатомической эмфи¬ земы у курильщиков с обструктивными вентиляционными проявлениями. Низкие показатели ДСЛ сильно коррелируют (г >0,85) с низкой плотностью лёгочной ткани на компьютерной томограмме лёгких и степенью анатомиче¬ ской эмфиземы [56];• курильщики с проявлениями бронхиальной обструкции и нормальными показателями ДСЛ обычно имеют хронический обструктивный бронхит, но не эмфизему;• больные БА с обструктивными нарушениями демонстрируют нормальные или повышенные показатели ДСЛ [46].Другой областью применения исследования лёгочной диффузии является выявление преклинических интерстициальных поражений лёгких у пациентов с саркоидозом, аллергическим альвеолитом, радиационным поражением лёгких, поражением лёгких лекарственного происхождения (амиодароном, блеомицином, нитрофурантоином), связанным с трансплантацией лёгких или костного мозга, ВИЧ-инфекцией и др. [38].ДСЛ помогает в дифференциальной диагностике рестрикции, проявляющейся снижением лёгочных объёмов (ОЕЛ или ЖЁЛ):• низкие показатели ДСЛ подтверждают интерстициальное лёгочное заболева¬ ние (ИЛЗ) [68].• нормальная ДСЛ характерна для внелёгочных причин рестрикции, напри¬ мер, ожирения, плеврального выпота, нейромышечной слабости или кифо- сколиоза.Диапазон нормальных значений для ДСЛ широк. Поэтому для повышения чувствительности при контроле эффективности терапии представляется более правильным провести исходный тест исследования ДСЛ, по сравнению с которым будут оцениваться другие исследования в динамике.Сравнение последующих значений ДСЛ с исходными у пациентов, получающих терапию по поводу ИЛЗ, даёт более точную оценку улучшения или ухудшения их состояния, чем измерение лёгочных объёмов (ОЕЛ или ЖЁЛ) [69J,Изменения ДСЛ могут быть связаны также с заболеваниями сосудов лёгких, когда у пациентов отмечается постоянная одышка при нормальных спирометри¬ ческих показателях и неизменённых статических лёгочных объёмах. Снижение ДСЛ в этом случае является чувствительным индикатором следующих состоя¬ ний:
■f'5.’ '?'рл ' ’-i'■‘ШШ;.ШЩ132 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХ• Хронической рецидивирующей лёгочной эмболии;• первичной лёгочной гипертензии [70];• поражения лёгочных сосудов при болезнях соединительной ткани и васкули- тах (системном склерозе, системной красной волчанке — СКВ и ревматоид¬ ном артрите [71,72]).Исследование ДСЛ может использоватся для оценки нетрудоспособности больных тяжёлой ХОБЛ и ИЛЗ. В соответствии со стандартами Управления социальной защиты США пациент со значениями ДСЛ ниже 30% должных [или 9 мл/(минхмм рт.ст)] может быть расценен как больной с полной утра¬ той трудоспособности. ATO использует пороговый уровень снижения ДСЛ для определения полной утраты трудоспособности — 40% от должных показателей [73, 74].МЕТОДОЛОГИЯ ИССЛЕДОВАНИЯПрактически все лаборатории для измерения ДСЛ используют метод одиноч¬ ного вдоха, когда пациент делает быстрый максимальный вдох смеси, содержа¬ щей 0,3% СО и 10% гелия, задерживает воздух в течение 10 с, после чего делает быстрый выдох (рис. 6-8). Альвеолярная порция выдыхаемого газа после этого анализируется для расчёта дилюции гелия и захвата СО. Тест повторяется через 5 мин и, если результаты двух технически приемлемых тестов варьируют в преде¬ лах не более 10% [или 3 млДминхмм рт.ст)], то рассчитывается федняя величина для итогового заключения.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВБез результатов предшествующего исследования ДСЛ результаты пациента интерпретируются путём сравнения их с должными величинами, В соответствии с критериями ATO тяжёлое респираторное нарушение интерпретируется как сниже¬ ние ДСЛ ниже 40% от должных величин.Если у пациента есть данные качественно проведённого предшествующего диф¬ фузионного теста из той же лаборатории, то изменение по сравнению с предьщу- щим результатом ДСЛ должно быть использовано как критерий прогрессирования состояния или напротив его улучшения. В лабораториях, где осуществляется стро> гий контроль качества проведения процедур, изменение показателя больше чем на 4 мл/(минхмм рт.ст) выходит за пределы вариабельности или погрешности теста.ВдохВыдохЗадержка дыханияМёртвоепространствоСбор пробыВремя задержки по Jones 1 1 1 4 6 8Время, сРис. 6-8. Пациент выполняет быстрый максимально глубокий вдох, задерживает дыхание на 10 с, после чего делает быстрый выдох. По методике Jones время задержки рассчитывается начиная с завершения 30% времени вдоха и заканчивая серединой времени забора пробы.
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЫХАНИЯ 133У курильщиков показатели диффузии существенно ниже, чем у некурящих.Этот фактор необходимо учитывать в процессе интерпретации в ситуациях, когда оценивается влияние различных факторов (например, воздействие асбеста). Поскольку снижение дел не так велико у бывших курильщиков, как у настоящих, ». 1 снижение этого показателя у курильщиков в настоящем не может быть отнесено только за счёт эмфиземы.Повышение ДСЛНарушения, при которых ДСЛ выше нормы (обычно более 140% должного), включают следующие состояния:• полицитемия;• выраженное ожирение;• БА;• лёгочное кровотечение;• внутрисердечный шунт слева направо;• левожелудочковая недостаточность (вследствие повышения объёма крови в лёгочных капиллярах);• нагрузка, выполненная непосредственно перед тестом (вследствие повышен¬ ного сердечного выброса).Лабораторные погрешности, такие как введение неправильных показателей роста, возраста, неточность работы датчика измерения СО, следует всегда при¬ нимать во внимание.Низкая ДСЛ при нормальной спирометрииНарушения, приводящие к изолированному снижению ДСЛ, включают в себя следующие состояния:• анемия (незначительное снижение ДСЛ);• лёгочное сосудистое заболевание (снижение ДСЛ различной степени), такое как хроническая рецидивирующая лёгочная эмболия, первичная лёгочная гипертензия, поражение лёгочных сосудов при заболеваниях соединительной ткани и васкулитах;• ранняя стадия ИЛЗ (лёгкое или средней степени нарушение ДСЛ), когда ЖЁЛ ещё находится в пределах нормальных величин.Низкая ДСЛ с обструктивными нарушениямиПри длительном курении низкая ДСЛ в сочетании с обструктивными наруше¬ ниями обычно возникает вследствие эмфиземы. Соответствующая скорость паде¬ ния ОФВ, определяется степенью бронхиальной обструкции и гиперреактивности дыхательных путей. Есть данные о том, что, чем ниже ДСЛ, тем выше показатели заболеваемости и смертности от ХОБЛ (для соответствующих показателей ОФВ^ и степени бронхиальной гиперреактивности).При ХОБЛ потеря ДСЛ обычно возникает после снижения ОФВ^, таким обра¬ зом, что процент от должного показателя ДСЛ у пациента обычно выше, чем процент от должного ОФВ,^. Если ДСЛ существенно снижена при незначительной бронхиальной обструкции, необходимо рассмотреть иные причины, чем влияние эмфиземы (см. выше).Муковисцидоз и а^-антитрипсиновая недостаточность должны приниматься во внимание у детей, подростков и молодых лиц при сочетании обструкции и снижен¬ ной ДСЛ, Такие же изменения могут наблюдаться у взрослых с облитерирующим бронхиолитом, бронхоэктазами и лимфангиолейомиоматозом [75].Снижение ДСЛ в сочетании с рестрикциейСниженная ДСЛ у пациентов с низкими лёгочными объёмами — характерные признаки рестриктивного типа нарушений, обычно наблюдаются при ИЗЛ и пнев-
l " ‘ 134 МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЛЁГОЧНЫХ ЗАБОЛЕВАНИЯХ ^ монитах. Очень часто отмечается пограничная или лёгкой степени обструкция, сочетающаяся с рестрикцией, вследствие сужения периферических дыхательных путей при интерстициальном поражении. Такой тип сочетания низкой ДСЛ с ' 4 ^ - рестрикцией и обструкцией мелких дыхательных путей может отмечаться; i':* / ■ • при саркоидозе II-IV стадии;ч ■ '. • асбестозе;У' • милиарном туберкулёзе;’ “ ' “ • застойной сердечной недостаточности (в этом случае рестрикция и сниже¬ние ДСЛ возникают вследствие альвеолярного заполнения, в то время как незначительная обструкция может быть из-за отёка мелких дыхательных путей).Снижение ДСЛ происходит также при анемии: потеря крови у здорового муж¬ чины, приводящая к снижению гемоглобина с 160 до 80 г/л приводит к снижению ДСЛ со 100 до 75% от должных величин. Это будет интерпретировано как лёгкая степень снижения ДСЛ. Поэтому, если у пациента существует риск анемии или имеет место анемия, необходимо обязательно принимать во внимание показате¬ ли недавнего исследования гемоглобина для того, чтобы наряду с измеренными привести и скорректированные по гемоглобину данные ДСЛ, Скорректированные показатели ДСЛ рассчитывают так, как если бы у пациента был нормальный уро¬ вень гемоглобина (146 г/л для мужчин и 134 г/л для женщин и детей в возрасте младше 15 лет). ДСЛ падает примерно на 9% во время менструации, но это сниже¬ ние обусловлено не гемоглобином [38].Уровень карбоксигемоглобина (НЬСО) может быть повышен в том случае, если пациент курил непосредственно перед проведением теста [76]. Повышение НЬСО на 1% приводит к снижению показателя диффузии на 1%. В большинстве лабо¬ раторий пациентов просто просят воздержаться от курения в течение 4 ч перед проведением теста, но не измеряют при этом НЬСО или пересчитывают изме¬ ренную ДСЛ по отношению к незначительному эффекту «остаточного давления» повышенной СО. Прекращение курения обычно приводит к повышению ДСЛ на 2-4 мл/(минхмм рт.ст.) в течение нескольких дней [77].Если лаборатория, в которой проводятся исследования, расположена высоко над уровнем моря, концентрация кислорода в окружающей среде, альвеолярном воздухе и артериях ниже, чем на уровне моря. Это приводит к снижению конку¬ ренции за связывание с гемоглобином, повышенному поглощению СО и, следова¬ тельно, повышению ДСЛ по сравнению с показателями, полученными на уровне моря.Лица, живущие в высокогорной местности, имеют несколько повышенный уро¬ вень гемоглобина, который приводит к повышению ДСЛ. Для того чтобы скоррек¬ тировать вышеуказанные эффекты, лабораториям, расположенным в высокогор¬ ной местности, могут быть рекомендованы соответствующие коэффициенты [78].Коррекция ДСЛ по объёмуМногие лаборатории в заключениях приводят ДСЛ, «скорректированную» для измеренного лёгочного объёма, т.е. DL^^y/V, где — альвеолярный объём во время манёвра с задержкой дыхания [79], Однако это соотношение не помогает в дифференциальной диагностике рестрикции, так как практически все пациенты с верифицированным ИЛЗ имеют низкие показатели ДСЛ, но многие при этом имеют нормальное соотношение DL^-y/V [80], Изменения DL^¡y/V^ могут также дезориентировать во время повторных измерений при ИЛЗ, так как при успеш¬ ной терапии происходит одновременное улучшение обоих показателей: ДСЛ и лёгочных объёмов (числителя и знаменателя). Поэтому обычно не рекомендуется использовать DL^^/V^, как маркёр для оценки динамики у этой категории боль¬ ных.
ИССЛЕДОВАНИЕ ФУНКЦИИ ДЫХАНИЯ 135К сожалению, несмотря на широкое использование и ценность исследования ДСЛ, качество получаемых результатов исследования остаётся проблемой для многих лабораторий исследования лёгочной функции. Когда здоровые лица J:.:обследуются в разных лабораториях, результаты (как абсолютные, так и выражен- ные в процентах от должного) существенно различаются [81].СЛИСОК ЛИТЕРАТУРЫ 0
Глава 7Нагрузочные тестыС
; ;АЗДЕЛ IIРЕСПИРАТОРНАЯ ФАРМАКОЛОГИЯГлава 8. Фармакология препаратов, воздействующих на дыхательные пути
Глава 8 Фармакология преларатов, воздействующих на дыхательные пути3-АдреностимуляторыПервым адреностимулятором, применявшимся в качестве бран- ходйлататора, был адреналин*, который вошёл в клиническую практику ещё в начале XX в. и до сегодняшнего дня сохранил своё значение в качестве средства для купирования угрожающих жизни эпизодов бронхообструкции. Другой неизбирательный СИМ- патомиметик — эфедрин, стали применять для терапии БА с 1924 г. Наконец, в 1940-х годах появился первый избирательно стимулиру¬ ющий (3-адренорецепторы препарат — изопреналин. Опыт исполь¬ зования этих препаратов показал, что средства, воздействующие как на Рз-, так и на р,-подвиды адренорецепторов, представляют существенную опасность при применении у больных. Поэтому с середины 1960-х годов разработка новых р-адреностимуляторов шла в направлении создания препаратов с более селективным воз¬ действием на р2-адренорецепторы (сальбутамол), а также с более продолжительным бронхолитическим действием (формотерол, салметерол). Селективные препараты несколько уступают изопре- налину по выраженности бронхолитического действия, но более безопасны.|3,-АДРЕН0РЕЦЕПТ0РЫр2-Адренорецепторы представляют собой трансмембранные рецепторы, связанные с регуляторными О-протеинами. В основе их структуры лежит полипептидная цепочка из нескольких сотен нуклеотидов. Строение (3^- и (^-адренергических рецепторов гомо¬ логично на 48,9%. Рецептор образует в клеточной мембране гидро¬ фобный участок, состоящий из семи трансмембранных доменов, Ы-терминальный участок находится вне клетки, С-терминальный — в цитоплазме. Структура, отвечающая за взаимодействие с агони¬ стом, располагается на наружной поверхности клетки. Внутри неё рецепторы связаны с регуляторными О-протеинами различных типов. О-протеины взаимодействуют с аденилатциклазой, которая отвечает за синтез вторичного мессенджера — циклического адено- зинмонофосфата (цАМФ) [3].
Sv140 РЕСПИРАТОРНАЯ ФАРМАКОЛОГИЯМЕХАНИЗМ ДЕЙСТВИЯЦиклический АМФ активирует ряд ферментов, обозначаемых как цАМФ- зависимые протеинкиназы. Каскад передачи сигнала, в конечном счёте, приводит к фосфорилированию факторов транскрипции и изменению экспрессии генов. Кроме того, одна из цАМФ-зависимых протеинкиназ — киназа лёгких цепей мио¬ зина, обеспечивает снижение активности комплекса актин-миозин, что, в конеч¬ ном счёте, и приводит к расслаблению бронхиальной мускулатуры [4],Активация ^2‘адренорецепторов [5]:• вызывает расслабление мышц бронхов;• блокирует синтез лейкотриенов, интерлейкинов и фактора некроза опухоли а (ФНО-а) тучными клетками и эозинофилами;• препятствует дегрануляции тучных клеток и эозинофилов, прекращая выде¬ ление гистамина;• снижает проницаемость кровеносных сосудов;• тормозит секрецию слизи и улучшает мукоцилиарный клиренс;• подавляет кашлевой рефлекс.Таким образом, Р2*адреностимуляторы обладают определённой противовоспа¬ лительной активностью. Значительно уступая в этом плане ингаляционным ГКС и антилейкотриеновым препаратам, агонисты (32-адренорецепторов, тем не менее, дополняют и усиливают противовоспалительное действие ИГКС при их совмест¬ ном назначении.РЕГУЛЯЦИЯ ПЕРЕДАЧИ СИГНАЛА В СИСТЕМЕ (3-АДРЕНОРЕЦЕПТОРОВИнтенсивная стимуляция р-адренорецепторов приводит к торможению пере¬ дачи сигнала (десенситизация рецептора), интернированию рецепторов (умень¬ шение числа рецепторов на поверхности клеточной мембраны), а в дальнейшем и к прекращению синтеза новых рецепторов («downi-регуляция). В основе десен- ситизации рецепторов лежит фосфорилирование цитоплазматических участков рецептора цАМФ-зависимыми протеинкиназами [6]. Десенситизация вызывает снижение ответа на применение Р2'-адреностимуляторов (на 38-40% после 2 нед приёма формотерола и на 54% — после аналогичного курса салметерола) [7]. Однако вскоре после прекращения стимуляции ¡5-адренорецепторов происходит сравнительно быстрое (несколько часов) восстановление их активности. Но в случае «down»-регуляции восстановление нормальной плотности рецепторов на поверхности клеток может потребовать нескольких суток. Назначение ГКС позво¬ ляет быстрее (в течение часа) восстановить активность (i-адренорецепторов [8].ФАРМАХОДИНАМИКАОбщая характеристика основных р2”ЭДреностимуляторов приведена в табли¬ це 8-1. Формотерол является полным агонистом р2-адренорецепторов: после его назначения концентрация цАМФ в клетках увеличивается более чем в 4 раза. Частичные агонисты (сальбутамол, салметерол) увеличивают концентрацию цАМФ только в 2-2,5 раза [9,10] и уступают полным агонистам по выраженности бронхолитического эффекта [11]. Последнее обстоятельство, впрочем, не имеет существенного клинического значения, однако в ходе клинических исследований было показано, что полный агонист [32-адренорецепторов (формотерол) может быть эффективен у больных, не отвечающих на лечение сальбутамолом [12].Зз'Адреностимуляторы с быстрым началом действия (сальбутамол, фенотерол) обладают сравнительно небольшой липофильностью, благодаря чему активно распределяются в интерстициальной жидкости и очень быстро стимулируют рецепторы. Формотерол — препарат с промежуточной липофильностью, также хорошо распределяется в интерстициальной жидкости, но при этом значительная доля препарата накапливается между слоями клеточных мембран, образуя депо,
ФАРМАКОЛОГИЯ ПРЕПАРАТОВ, ВОЗДЕЙСТВУЮЩИХ НА ДЫХАТЕЛЬНЫЕ ПУТИ 141которое расходуется по мере уменьшения концентрации внеклеточного формоте¬ рола. Это обеспечивает более длительное (12 ч) действие препарата, в отличие от сальбутамола и фенотерола, эффект которых сохраняется на протяжении 3-5 ч.Таблица 8-1. Сравнительная характеристика основных р-адреностимуляторов [13]Свойства препаратов-Адреностимулято|МсальбутамолформотеролсалметеролЛипофильность (КрО), моль’11±5420+4012 450+200Свойства агонистаЧастичныйПолныйЧастичныйВнуфенняя активность, % (актмвность адреналина* принята за4,920<2Интервал между введением и началом бронхорасширяющего действия, мин1-31-330Пpoдoлжитeлы^ocть бронхорасширяю¬ щего действия, ч3-51212Наиболее липофильный р2'ЭДР^и^^™мулятор — салметерол, практически отсутствует в интерстициальной жидкости. Поступая в клеточные мембраны и распределяясь вдоль них, салметерол активирует р^-адренорецепторы, не выходя за пределы клеток [14], при этом начало действия препарата замедляется пример¬ но на 30 мин.Салметерол связывается с р^-адренорецептором примерно на 12 ч. Объясняется это тем, что довольно протяжённая молекула препарата прикрепляется к неак¬ тивной области рецептора. Будучи плотно связанной с рецептором, молекула салметерола подвижна, благодаря чему она многократно активирует рецептор в те моменты, когда активная салигениновая часть молекулы салметерола оказывается в активной области рецептора [15]. In vitro, в опытах на изолированных бронхах, салметерол (в отличие от формотерола) может выступать в качестве антагониста других р^-адреностимуляторов [16], но до сих пор не ясно, имеет ли этот факт клиническое значение. Применение р-адреностимуляторов у больных БА и ХОБЛ имеет ряд различий, которые суммированы в таблице 8-2.Таблица 8-2. Особенности ответа на действие р -адреностимуляторов при бронхиальной астме ихронической обструктивной болезни лёгких [17]БАХОБЛОтвет на применение р^-адреностимулятора больше 15% (по степени прироста ОФВ,)Ответ на применение ^2-адреностимулятора меньше 15% (по степени прироста ОФВ,)Прием р^-адреностимулятора снижает уровень неспецифической гиперреактивности дыхательных путейНеспецифическая гиперреактивность дыхательных путей, как правило, отсутствуетР2'Адреностимуляторы эффективно устраняют сим¬ птомы БА или уменьшают их выраженностьР^-Адреностимуляторы незначительно влияют на сим¬ птомыПрепараты с длительным действием используются для постоянной длительной терапииНе влияют на течение заболеванияФАРМАКОКИНЕТИКАПри ингаляциях с использованием дозированных аэрозолей непосредственно в лёгкие поступает около 7% дозы р^-адреностимулятора. Еще 3-6% оказывается
‘ йй.=I''' 142 РЕСПИРАТОРНАЯ ФАРМАКОЛОГИЯ^ИЫ-а«;ь A', ‘..■1ЯИ111ШШШШС1Ш№Ш&® альвеолах, а 77% дозы — в орофарингеальной области [18]. Таким образом, ^ ввиду высокой биодоступности р^-эдреностимуляторов значительная часть дозы(до 28% при ингаляции сальбутамола) поступает в системный кровоток. Пиковая концентрация сальбутамола в плазме после ингаляции в зависимости от типа ингалятора составляет от 2,5 до 8,5 нг/л [19], что сопоставимо с концентрацией после введения препарата внутривенно [20]. Большинство р2-адреностимуляторов подвергается метаболизму в печени.НЕЖЕЛАТЕЛЬНЫЕ ЛЕКАРСТВЕННЫЕ РЕАКЦИИБольшинство нежелательных эффектов р^'ЭДреностимуляторов определяет¬ ся взаимодействием с Рз-адренорецепторами миокарда (на долю этих рецеп¬ торов приходится до 30%, а у больных с ХСН — до 50% от общего числа р-адренорецепторов) и кровеносньЕх сосудов. Воздействие препаратов этой груп¬ пы на сердечно-сосудистую систему заключается в их положительном хроно- и инотропном воздействии на миокард, периферической вазодилатации (вплоть до коллапса), проаритмогенном действии, проявляющемся в удлинении интервала QT, а также в снижении концентрации ионов К" и в крови [21].При адекватном уровне кислорода в крови р^-адреностимуляторы безопасны даже в очень высоких дозах. Например, после назначения 3200 мкг фенотерола (соответствует 32 стандартным дозам) или 1600 мкг сальбутамола (16 доз) не было клинически значимых нарушений ритма. Удлинение корригированного интервала QT^ на 15-25% от исходного отмечалось только у 5% больных, а удлинения QT^ более чем на 25% от исходного не отмечалось вообще [22].В условиях гипоксии риск развития нежелательных эффектов при использовании Р^-адреностимуляторов короткого действия существенно увеличивается [23]. Напри¬ мер, после назначения 800 мкг сальбутамола общее периферическое сопротивление у больных снижалось в среднем на 18%, но если при этом пациент находился в состоянии гипоксии, степень снижения периферического сопротивления достигала 30%.Эпидемиологические исследования показали, что использование р^-адрено- стимуляторов может сопровождаться увеличением риска острого инфаркта мио¬ карда, особенно у больных с ишемической болезнью сердца (ИБС) и у тех пациентов, которым р^-адреностимуляторы назначаются впервые. В подгруппе больных, получавших р-адреноблокаторы, риск оказался меньше, что подтверж¬ дает взаимосвязь острого коронарного синдрома с нежелательным влиянием р^-адреностимуляторов на миокард [24, 25].Результаты нескольких исследований указывают на повышение риска летально¬ го исхода у больных, принимавших р2-адреностимуляторы длительного действия [26]. Особые опасения в этом плане вызывает салметерол. Смертность от БА при использовании этого препарата в ходе клинического исследования у 13176 больных оказалась существенно выше, чем при использовании плацебо: 24 случая против 11 при использовании плацебо, относительный риск (ОР) 2,16 [27]. Особенно значи¬ тельное повышение смертности при использовании салметерола наблюдалось среди афроамериканцев, С другой стороны, анализ примерно 6000 больных, принимав¬ ших участие в исследованиях формотерола [28], и результаты исследования RELIEF (более 9000 взрослых и детей, получавших формотерол в режиме по требованию) [29] не выявили отрицательного влияния формотерола на риск гибели от БА.Ингаляционные глюкокортикостероидыГКС-РЕЦЕПТОРЫРецепторы к ГКС циркулируют в цитоплазме клеток. Взаимодействие между препаратом и его рецептором в этом случае выглядит сложнее, а реализация эффекта занимает больше времени, чем при взаимодействии с поверхностно¬ расположенными трансмембранными рецепторами.
ФАРМАКОЛОГИЯ ПРЕПАРАТОВ, ВОЗДЕЙСТВУЮЩИХ НА ДЫХАТЕЛЬНЫЕ ПУТИ 143Неактивный рецептор, циркулирующий в цитоплазме, обладает низкой аффин¬ ностью к ГКС и не может взаимодействовать с молекулой ГКС непосредственно. Для того чтобы произошла активация рецептора, он должен предварительно обра¬ зовать комплекс с двумя протеинами Ь5р90 (относятся к группе протеинов тепло¬ вого шока) и одним Ь5р56 протеином [30], которые придают рецептору высокую аффинность. После присоединения молекулы ГКС связь рецептора и протеинов теплового шока распадается.В цитоплазме комплексы ГКС-рецептор подвергаются димеризации и переме¬ щаются в ядро в виде димеров. Для того чтобы спаренные рецепторы могли при¬ соединиться к ДНК и реализовать свои биологические эффекты; каждый димер объединяется с ещё одним протеином теплового шока ~ Ьр$70.В регуляции активности ГКС-рецепторов принимает участие целый ряд фак¬ торов: интерферон-у, липополисахариды, тиоредоксин, рецептор эпидермаль¬ ного фактора роста, транспортная РНК, протеинкиназа С и ряд других [31]. Интерлейкины (ИЛ-2 и ИЛ-4) также могут влиять на аффинность ГКС-рецепторов, снижая её (один из механизмов ГКС-резистентности у больных БА) [32]. С другой стороны, находясь в клетке, ГКС могут нарушать стабильность мРНК некоторых медиаторов воспаления (ИЛ-1, ИЛ-6) независимо от воздействия на ДНК [33].Активация ГКС-рецепторов и последующая транскрипция генов, отвечающих за биологические (фармакологические) эффекты ГКС, требует значительного вре¬ мени; между тем у ГКС имеются эффекты, которые проявляются спустя минуты или в первые часы после приёма препарата, например повышение числа активных р2-адренорецепторов (60 мин) [8] и активация эндотелиальной НО-синтетазы (30 мин) [34]. Предполагается, что подобные эффекты могут быть реализованы через трансмембранные ГКС-рецепторы, подобные реагирующим на ГКС кислым гликопротеинам, обнаруженным у рептилий [35, 36].МЕХАНИЗМ ДЕЙСТВИЯСчитается, что ГКС контролируют (напрямую или благодаря взаимодействию с другими факторами транскрипции) от 10 до 100 различных генов [37]. Кроме того, имеются данные о том, что ГКС, взаимодействуя с такими факторами транскрип¬ ции, как активатор протеина-1 (АР-1) и нуклеарный фактор кВ (ЫР-кВ), способны подавлять экспрессию генов целого ряда белков, участвующих в процессах воспа¬ ления в дыхательных путях (цитокины, ферменты каскада воспаления, молекулы адгезии, рецепторы для медиаторов воспаления) [38].Опосредованная ГКС транскрипция целого ряда биологически активных белков вызывает изменения функционального состояния клеток респираторного тракта, обеспечивая тем самым противовоспалительное действие ГКС (табл. 8-3).Табдмца 8-3, Изменение функционального состояния клеток респираторного тракта под влиянием ГКСРазновидность клетокИзменение функционального состоянияЭозинофилыУменьшение числа клеток (апоптоз) [40]Т-лимфоциты, макрофагиУменьшение синтеза цитокинов [42]Тучные и дендритныеУменьшение числа клеток [42. 43]ЭпителиальныеУменьшение синтеза цитокинов и медиаторов воспаления [44]ЭндотелиальныеУменьшение проницаемости эндотелияМышечныеУвеличение числа Р^-Ешренорецегтторов, уменьшение цитокиновБронхиальные железыУменьшение отделения секрета [45]■
»ІІІІіШй»««іШі*іШКЇ^Фїи«і»ШШШішиши:іш144 РЕСПИРАТОРНАЯ ФАРМАКОЛОГИЯФАРМАКОДИНАМИКАПри назначении больным БА в виде ингаляций ИГКС начинают действовать уже через несколько десятков минут, при этом эффект ИГКС (их влияние на пока¬ затели спирометрии и уменьшение риска госпитализации в стационар) выше, чем у плацебо [46] и ГКС, назначаемых в виде инъекций [47], однако о полном эффекте регулярной терапии ИГКС можно судить лишь спустя 3-4 мес лечения [48,49].У препаратов, способных накапливаться в клетках в эстерифицированном виде (будесонид. циклесонид*’), и у мометазона была доказана хорошая эффективность при приёме один раз в день [50, 51], однако, в целом, более частое назначение ИГКС (4 раза в день) позволяет добиться лучшего ответа на лечение, чем исполь¬ зование такой же суточной дозы, разделённой на два приёма в день [52].Соотношение «доза-эффект» для ГКС носит нелинейный характер. Так, на биологических моделях показано, что десятикратное увеличение дозы ГКС сопро¬ вождается увеличением максимальной выраженности эффекта только на 50% и удвоением продолжительности действия препарата [53]. У больных БА эффектив¬ ность будесонида в дозе 200-400 мкг составляет 80%, а в дозе 400-600 мкг - 90% от препарата в дозе 1600 мкг [54]. Аналогичные данные были получены для флу- тиказона (рис. 8-1).Графики доза-эффект по отношению к различным проявлениям заболевания имеют различную форму; таким образом, у больных БА дозы ГКС, обеспечиваю¬ щие отсутствие симптомов, недостаточны для поддержания оптимальных показа¬ телей спирометрии или хорошей переносимости физической нагрузки (рис. 8-2). Кроме того, степень ответа на назначение ГКС может существенно варьировать (рис. 8-3), а у ряда больных ответ на ГКС может полностью отсутствовать (рези¬ стентность к ГКС) [56].ФАРМАКОКИНЕТИКАОсновные параметры фармакокинетики и фармакодинамики ИГКС приведе¬ ны в таблице 8-4. Доля лёгочной депозиции ИГКС в значительной степени зави¬ сит от средства доставки. Однако, в любом случае значительная часть препарата осаждается в орофарингеальной области, проглатывается со слюной или поки¬ дает дыхательные пути на выдохе. Часть препарата, попадающая в желудочно- кишечный тракт, не вызывает опасений относительно нежелательных явлений,Р-агонистов обострений пробужденияРис. 8-1. Дозы флутиказона, вызывающие 80% и 90% от максимального эффекта препарата у больных БА [55].
ФАРМАКОЛОГИЯ ПРЕПАРАТОВ, ВОЗДЕЙСТВУЮЩИХ НА ДЫХАТЕЛЬНЫЕ ПУТИ “| 45Выраженность, % от оптимального уровнямкг/сутРис. 8>2. Будесонид: соотношение доза-ответ для различных проявлений БА [57, 58].во<-30 -30...-20 -20...-10 -10-0 0-10 10-20 20-30 30-40 40-50 >50 Степень изменения пев в процентах от исходного значенияРис. 8-3. Степень изменения ПСВ (% от исходного) через 12 нед терапии ИГКС у 895 больных БА в возрасте от 15 до 85 лет [59].так как благодаря эффекту первого прохождения через печень пероральная био¬ доступность современных ИГКС весьма низкая. С другой стороны, эти препара¬ ты могут поступать в кровь, минуя печень, благодаря абсорбции в дыхательных путях.Активные метаболиты имеются только у двух современных ИГКС — бекломе- тазона дипропионата (образует три активных метаболита, из которых наиболь¬ шее значение имеет беклометазон-17-монопропионат — БМП) [60] и циклесо- нида^ [61].Метаболизм циклесонида^ происходит непосредственно в дыхательных путях. За счёт гидролиза практически не обладавший ГКС-активностью циклесонид^'' превращается в активный метаболит десциклесонид, аффинность которого в
^iSfш:ттшшт146РЕСПИРАТОРНАЯ ФАРМАКОЛОГИЯ100 раз выше, чем у исходного препарата [61]. Благодаря тому, что метаболизм (и, как следствие, активация) циклесонида*^ происходит исключительно в лёгочной ткани, препарат не вызывает системных нежелательных эффектов [62].Таблица 8-4, Основные параметры фармакокинетики и фармакодинамики ингаляционных глюко¬ кортикостероидовИнгаляционные ГКСПараметрБДП/БМПбудесонидфлушкаэонциклесо-нидр/дес-циклесоннд^мометазонБиодоступность (при приё¬ ме внутрь), %<1/2611<1<1/<1<1Депозиция в лёгких, %51 (БДП)281652 (циклесонид»')14Активация 8 ткани лёгкихЧастично--+-Аффинность к рецептору53/1345935180012/12001235Местная ГКС-активность (активность дексаметазо- на = 1)6009801200Нет данныхНет данныхЭстерификация-+-+-Липофильность++/+++++++++++/++++Связь с белками плазмы, %87 (БДП)88909998-99Период полувыведения, ч0,5/2,72,87,80,36/3,44,5Объём распределения, л20/424183318207/897Нет данныхКлиренс, л/ч15/1208469152/22853,5Обратимая эстерификация (образование эфиров) ряда ГКС (будесонид, цикле- сонид*') позволяет накапливать в клетках депо препарата, благодаря чему увели¬ чивается продолжительность их действия.НЕЖЕЛАТЕЛЬНЫЕ ЛЕКАРСТВЕННЫЕ РЕАКЦИИРиск появления и выраженность нежелательных лекарственных реакций уве¬ личиваются пропорционально дозе ГКС и продолжительности лечения. К числу нежелательных эффектов относят орофарингеальный кандидоз, изменение голоса (дисфония), угнетение гипоталамо-гипофизарно-надпочечниковой системы, раз¬ личные проявления синдрома Кушинга, снижение костной плотности у взрослых, развитие катаракты (пожилые) и глаукомы, появление капилляропатий и истон¬ чение кожного покрова [63] (табл. 8-5).Таблица 8'5. Риск нежелательных эффектов ИГКСНежелательный эффв1аРискУгнетение гипоталамо-гипофизарно'надпочечниковой системыМинимальный, при использовании БДП в дозах менее 1500 мкг/сут {у детей менее 400 мкг/сут) или эквивалентных доз других ИГКСОстеопорозУмеренный, но статистически значимый уже при дозе 500 мкг/сут*
ФАРМАКОЛОГИЯ ПРЕПАРАТОВ, ВОЗДЕЙСТВУЮЩИХ НА ДЫХАТЕЛЬНЫЕ ПУТИ 147Окончание табл. 8-5Нарушения углеводного и липидного обменаИстончение кожиГеморрагическая сыпьДисфонияКандидоз полости рта и глоткиЗадержка ростаНизкий, клинически значимые нарушения отмечают¬ ся только при дозах более 1000 мкг/сут*Может отмечаться уже при приёме 400 мкг/сут*Встречается часто, но обычно не имеет клиническо¬ го значенияМенее 5%Противоречивые данные, трудно отделить влияние ГКС от влияния заболевания* Дозы приведены в пересчёте на БДП.Дисфония (охриплость голоса) встречается в той или иной степени почти у половины больных, принимающих ингаляционные ГКС в виде дозированного аэрозоля. Причина дисфонии заключается в миопатии мышц гортани. Применение спейсера не уменьшает риска развития этого нежелательного явления, однако после отмены ГКС дисфония исчезает [64], Другим частым нежелательным эффек¬ том ГКС является развитие орофарингеального кандидоза (риск кандидоза имеет дозозависимый характер). Ингаляции через спейсер и полоскание полости рта после ингаляции достоверно снижают риск этой инфекции [65]. Все остальные нежелательные явления при использовании ГКС встречаются значительно реже.Особенно остро встаёт вопрос о безопасности ИГКС у детей. В частности, пред¬ метом постоянной дискуссии является задержка роста у детей, принимавших ИГКС [63], Исследования показывают, что влияние ИГКС на рост может колебать¬ ся от слабого замедления роста в течение первого года лечения [66] до отсутствия долгосрочного влияния на рост во взрослом состоянии [67].ТЕОФИЛЛИНИстория применения теофиллина для терапии бронхообструкции насчитывает уже более 60 лет. Препарат обладает выраженным бронхолитическим действием, механизм которого заключается в неселективном ингибировании всех подтипов фосфодиэстеразы.МЕХАНИЗМ ДЕЙСТВИЯ И ФАРМАКОДИНАМИКАФосфодиэстераза в клетках дыхательных путей отвечает за снижение концен¬ трации:• циклического аденозинмонофосфата (вторичный мессенджер, вызывающий бронходилатацию);• циклического гуанозинмонофосфата (обладает противовоспалительным эффектом).Теофиллин в терапевтических дозах снижает активность фосфодиэстеразы лишь на 15%, чего, однако, достаточно для выраженного бронхолитического действия [68]. Кроме того, теофиллин выступает в качестве антагониста аденозиновых рецеп¬ торов [69], стимулирует высвобождение катехоламинов в нервных окончаниях [70], ингибирует активность простагландинов [71] и фактора некроза опухолей а [72] и повышает эффективносгь ГКС. Благодаря этому теофиллин обладает не только бронхолитическим дозозависимым действием, но и слабым противовоспалитель¬ ным эффектом, а также стимулирует диафрагмальное дыхание [73].Бронхолитический эффект теофиллина зависит от дозы. В терапевтических концентрациях препарат не достигает максимально возможного эффекта.'•’'КШШг'Й
148 РЕСПИРАТОРНАЯ ФАРМАКОЛОГИЯФАРМАКОКИНЕТИКАДостоинства препарата существенно ограничены тем обстоятельством, что теофиллин обладает очень узким диапазоном терапевтической концентрации (от 10 до 15-20 мкг/мл); кроме того, на фармакокинетику теофиллина оказывает разнонаправленное влияние большое число различных факторов. Таким образом, безопасное применение теофиллина возможно лишь при индивидуальном под¬ боре дозы и требует проведения терапевтического мониторинга концентрации препарата в крови.Теофиллин при приёме внутрь относительно быстро и почти полностью вса¬ сывается из желудочно-кишечного тракта, при этом достигая в плазме приблизи¬ тельно таких же концентраций, что и при внутривенном введении. Метаболизм препарата происходит в печени путём окисления и метилирования. Период полу- выведения теофиллина у взрослых составляет около 8-9 ч, однако эта величина подвержена существенным индивидуальным вариациям (табл. 8-6).Таблица 8-6. Факторы, влияющие на период полувыведения теофиллина [74]Состояние больного, клиническая ситуацияПериод полувыведения, чЗдоровые некурящие4-16 (в среднем 8,7)Дети3.5Цирроз печени и хроническая сердечная недостаточность (ХСН)20-30После вакцинации БЦЖ и противогриппозной вакциной. У больных с herpes zoster, пневмонией.У больных с хроническим лёгочным сердцем.При приёме пищи, богатой белками и витаминамиУдлинениеКурящие4,4-5При приёме кофеинсодержащих напитков. У больных с гипертиреозомУменьшениеНекоторые параметры фармакокинетики теофиллина также зависят от времени суток. Так, при приёме препарата внутрь в утренние часы максимальная концентра¬ ция в плазме наблюдается уже через 2 ч. В вечерние часы для достижения пиковой концентрации может потребоваться в 2-3 раза больший промежуток времени.Многие лекарственные средства, влияющие на активность изоферментов цито¬ хрома Р450, оказывают существенное влияние на клиренс теофиллина, модифи¬ цируя его печёночный метаболизм. Например, аллопуринол в дозе 600 мг/сут снижает клиренс теофиллина на 25%, эритромицин к 5-му дню приёма уменьшает величину клиренса теофиллина на 25%, олеандомицин — на 50%, гормональные контрацептивы — в среднем на 30%, а циметидин — на 40%. Эффект циметидина проявляется через 24 ч после начала приёма и исчезает только через 3 дня после его отмены. Рифампицин и дифенин* способны увеличить клиренс креатинина на 50-75%.НЕЖЕЛАТЕЛЬНЫЕ ЛЕКАРСТВЕННЫЕ РЕАКЦИИК нежелательным эффектам теофиллина относятся беспокойство, головная боль, тремор, расстройства желудочно-кишечного тракта, проявляющиеся тош¬ нотой, рвотой, болями в животе, диареей. Кроме того, возможен выраженный диуретический эффект. Развитие тяжёлого синдрома передозировки вплоть до возникновения угрожающих жизни больного аритмий отмечается при концентра¬ ции теофиллина крови на уровне 20-25 мкг/мл.
ФАРМАКОЛОГИЯ ПРЕПАРАТОВ, ВОЗДЕЙСТВУЮЩИХ НА ДЫХАТЕЛЬНЫЕ ПУТИ 149Использование лекарственных форм теофиллина с длительным высвобождени¬ ем активного вещества позволяет несколько уменьшить колебания концентрации препарата в крови, характерные для обычных лекарственных форм.АНТИЛЕЙКОТРИЕНОВЫЕ ПРЕПАРАТЫЦистеиниловые лейкотриены (ЦЛТ): и — биологически активныевещества, относящиеся к числу наиболее важных медиаторов аллергического воспаления. По своей химической природе ЦЛТ — жирные кислоты, за синтез которых из арахидоновой кислоты отвечает фермент 5-липооксигеназа. Из числа эффектов ЦЛТ в дыхательных путях следует упомянуть стойкий бронхоспазм, гиперсекрецию слизи, увеличение проницаемости мелких сосудов. ЦЛТ способ¬ ствуют таким процессам, как инфильтрация стенок бронхов клетками воспаления и гипертрофия гладкой мускулатуры бронхов. Взаимодействие лейкотриенов с клетками дыхательных путей происходит через цистеиниловые лейкотриеновые рецепторы.МЕХАНИЗМ ДЕЙСТВИЯСуществуют антилейкотриеновые препараты с различными механизмами дей¬ ствия: зафирлукаст и монтелукаст являются антагонистами цистеиниловых лейко- триеновых рецепторов I типа (ЦЛТ^-рецепторы), а зилеутон^ ингибирует актив¬ ность 5-липооксигеназы [75].ФАРМАКОДИНАМИКАКонкурентные селективные антагонисты ЦЛТ^-рецепторов (зафирлукаст и мон¬ телукаст) ингибируют эффекты ЦЛТ С^, и Е^, но не воздействуют на рецепторы И типа, отвечающие за взаимодействие с простагландинами и тромбоксанами [75]. Блокаторы ЦЛТ^ способны устранять спазм гладкой мускулатуры бронхов; они также уменьшают проницаемость сосудов и гиперсекрецию слизи, оказывают положительное влияние на мукоцилиарный клиренс и уменьшают хемотаксис эозинофилов [76]. Доказана способность для этих препаратов предупреждать при¬ ступы БА, вызванные аспирином*, контактом с антигенами, физической нагрузкой и холодным воздухом [77].Терапевтический эффект монтелукаста достигается после первой дозы и под¬ держивается на протяжении 24 ч. Терапевтический эффект зафирлукаста развива¬ ется в течение первых недель или дней приёма этого препарата.В настоящее время продемонсгрирована клиническая эффективность приме¬ нения монтелукаста, зафирлукаста и других антилейкотриеновых препаратов для лечения различных форм БА, в том числе у детей, — атопической, аспириновой, астмы физического усилия. Антилейкотриеновые препараты успешно применя¬ ются в качестве основного средства базисной терапии при БА лёгкого течения и в сочетании с ГКС при более тяжёлом течении БА [78].Часть своих эффектов лейкотриены реализуют через цистеиниловые лейкотри¬ еновые рецепторы II типа. Несмотря на то, что ингибитор синтеза лейкотриенов зилеутон^ нарушает действие лейкотриенов независимо от типа рецептора, клини¬ чески этот препарат не имеет преимуществ перед антагонистами лейкотриеновых рецепторов I типа.ФАРМАКОКИНЕТИКАВсе антилейкотриеновые препараты назначаются внутрь. Монтелукаст. зафирлу¬ каст и зилеутон^ всасываются быстро и достаточно полно (табл. 8-7). Монтелукаст и зафирлукаст связываются с белками плазмы почти полностью, зилеутон^’ — на 93%. Все эти препараты метаболизируются в печени, а их экскреция происходит преимущественно с жёлчью.
150 РЕСПИРАТОРНАЯ ФАРМАКОЛОГИЯТаблица 8-7. Основные параметры фармакокинетики антилейкотриеновых препаратовПараметрЗафирлукастМонтелукастЗилеутон»’Биодосгупность, %>9060-70>90Связь с белками плазмы. %999993Метаболизм/активные мета¬ болитыМетаболизм в печени (С¥Р2С9). Метаболиты в 10 раз менее активны, чем зафирлукастМетаболизм в печени (CYP3A4)Метаболизм в печени {CYP1A2, CYP2C9. CYP3A4)Период полувыведения, ч103-62,5НЕЖЕЛАТЕЛЬНЫЕ ЛЕКАРСТВЕННЫЕ РЕАКЦИИАнтилейкотриеновые средства, как правило, хорошо переносятся. В крупных клинических исследованиях зафирлукаст и монтелукаст не отличались от плацебо по частоте нежелательных явлений. Встречались единичные случаи эозинофилии и васкулита; это осложнение часто совпадало с уменьшением дозы ГКС, что позво¬ ляет заподозрить заболевание, начавшееся ещё до терапии антилейкотриеновыми средствами. Зилеутон^-’ практически столь же безопасен, однако у 4-5% больных отмечалось повышение активности печёночных ферментов в первые 2 мес лечения.ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯЗафирлукаст является ингибитором активности изоферментов цитохро¬ ма Р450 CYP2C9 и CYP3A4. Таким образом, при одновременном назначении с пре¬ паратами — субстратами этого изофермента, возможен целый ряд нежелательнь^х взаимодействий. В частотности, при его назначении с теофиллином повышается концентрация теофиллина в плазме крови и увеличивается риск развития побоч¬ ных эффектов. Теофиллин, в свою очередь, вызывает снижение концентрации зафирлукаста на 30%. Подавляя активность CYP2C9, зафирлукаст также способен увеличивать концентрацию варфарина, что приводит к удлинению протромбино- вого времени в среднем на 35%.Зилеутон«^ ингибирует изофермент CYP3A4 и может увеличивать концентра¬ цию препаратов, метаболизируемых этим изоферментом,М-ХОЛИНОБЛОКАТОРЫМ-холиноблокаторы — одни из первых средств, которые стали использовать для терапии бронхообструктивного синдрома. Из пяти подтипов известных сегод¬ ня М-холинорецепторов для регуляции тонуса бронхов наибольшее значение имеют:• Mj-подтип — рецепторы парасимпатических ганглиев. Их активация сопрово¬ ждается ускорением передачи нервного импульса;• Мз'подтип располагается в парасимпатических постганглиопарных волок¬ нах, При активации рецепторов этого подтипа прекращается высвобождение ацетилхолина; таким образом, эти рецепторы осуществляют торможение в парасимпатических нервных волокнах. Селективная активация этого подвида холинорецепторов ш vivo вызывает уменьшение выраженности бронхоспазма, индуцированного повышенной активностью блуждающего нерва на 80%. В то же время блокада М2-рецепторов приводит к увеличению уровня бронхокон- стрикции в 5-10 раз [79];• М3-П0ДТИП располагается на поверхности мышечных клеток бронхов. При активации этих рецепторов происходит сокращение мышечного слоя брон¬ хов.
ФАРМАКОЛОГИЯ ПРЕПАРАТОВ, ВОЗДЕЙСТВУЮЩИХ НА ДЫХАТЕЛЬНЫЕ ПУТИ 151Атропин и ипратропия бромид неселективно блокируют все три подтипа М-холинорецепторов в бронхах. При этом за счёт блокады Мз-холинорецепторов эффективность этих средств ниже, чем могла бы быть. Более новый тиотропия бро¬ мид отчасти лишён этого недостатка. Он так же, как ипратропия бромид, является антагонистом всех трёх подтипов холинорецепторов, однако если период полувы¬ ведения для связи с и Мз-холинорецепторами у тиотропия бромида составляет14.6 и 34,7 ч соответственно, то для М,-рецепторов эта величина равна всего лишь3.6 ч [80]. Таким образом, тиотропия бромид обладает временной селективностью по отношению к М,- и Мз-подтипам холинорецепторов. Кроме того, высокая про¬ должительность связи этого препарата с холинорецепторами позволяет использо¬ вать его один раз в сутки, что значительно удобнее, чем использование ипратропия бромида 3-4 раза в день [81].По эффективности бронхолитики этой группы существенно уступают р2-адреностимуляторам. Ответ на применение М-холиноблокаторов зависит от состояния парасимпатического тонуса. У больных с тяжёлыми обострениями БА, которые сопровождаются десенситизацией Р2'адренорецепторов, использование М-холиноблокаторов даёт более выраженный эффект по фавнению с более лёг¬ кими больными [82].Препараты данной группы можно назвать одними из самых безопасных брон- холитиков. При их использовании больные изредка отмечают сухость во рту, при¬ ступы кашля и парадоксальный бронхоспазм.Моноклональные антитела к IgEIgE является ключевой молекулой в патогенезе гиперчувствительности немед¬ ленного типа [83]. У значительной части больных БА отмечается генетически обусловленная гиперпродукция IgE. Первым из препаратов, влияющих на цирку¬ лирующие IgE, стал омализумаб, одобренный в США в 2003 г. Омализумаб отно¬ сится к числу гуманизированных моноклональных антител, производимых путём слияния фрагментов мышиных и человеческих антител (рис. 8-4, см. цв. вклейку). Таким образом, аминокислотная последовательность препарата на 95% гомоло¬ гична человеческим антителам.МЕХАНИЗМ ДЕЙСТВИЯПрепарат избирательно блокирует IgE на зфовне СЗ-домена, образуя различ¬ ные по строению биологически неактивные комплексы (рис. 8-5, см. цв, вклейку). Аффинность связи омализумаб-IgE выше, чем аффинность IgE к РсеКЬрецептору на поверхности базофилов и т)^ньгх клеток (этот высокоаффинный рецептор к IgE отвечает за высвобождение медиаторов воспаления) [85].Каждая молекула IgE имеет по паре доменов для связи с РсеКЬрецепторами на поверхности базофилов и тучных клеток и с РсеКП-рецепторами лимфоцитов, моноцитов, эозинофилов и тромбоцитов (низкоаффинные РсеКП-рецепторы отвечают за регуляцию уровня IgE) [86], Однако, если один из таких доменов связывается со своим рецептором, конформация парного домена изменяется [87] и IgE становится недоступным для взаимодействия с омализумабом [88]. Таким образом, препарат блокирует только свободные IgE. Омализумаб также не взаи¬ модействует с РсеКЬрецепторами базофилов. Препятствуя взаимодействию IgE с базофилами и тучными клетками, препарат предотвращает дегрануляцию послед¬ них и выброс гистамина и других медиаторов воспаления [89].У омализумаба имеется и другой механизм действия: препарат вызывает «downs»-регуляцию FceRI- и, возможно, РсеКП-рецепторов: например, в исследо¬ вании у людей после назначения омализумаба среднее число РсеКЬрецепторов на поверхности базофилов сокращалось с 220 ООО до 8000 [90]. В результате «downi>- регуляции РсеКЬрецепторов высвобождение гистамина базофилами при исполь¬ зовании омализумаба сокращается на 90% [90].
PiІ¿Ж152 РЕСПИРАТОРНАЯ ФАРМАКОЛОГИЯI ФАРМАКОДИНАМИКА^ Уже в первых клинических исследованиях было установлено, что препаратпозволяет снизить уровень сывороточного IgE в среднем на 90% [92]. Результаты дальнейших исследований продемонстрировали достоверное уменьшение количе¬ ства обострений БА приблизительно на 50% [93] и потребности в ИГКС в среднем на 119 мкг/сут (метаанализ 3 исследований) у больных, применявших омализумаб [94]. Имеются положительные результаты терапии омализумабом атопического ринита.В июне 2003 г. омализумаб был разрешён FDA для лечения аллергической БА среднетяжёлой/тяжёлой степени у пациентов, невосприимчивых к действию ИГКС. Препарат доказал свою эффективность при терапии тяжёлой Б А в целом ряде крупных клинических исследований (назначался в сочетании с ИГКС) [95]. Последняя редакция GINA 2006 г. [96] рекомендует применение этого препарата в тех случаях, когда контроль над атопической БА не достигается в результате при¬ менения высоких доз ИГКС или ГКС для приёма внутрь.Препарат назначают в виде инъекций исходя из массы тела больного и уровня циркулирующего IgE (омализумаб блокирует только циркулирующий в плазме IgE).ФАРМАКОКИНЕТИКАПри подкожных инъекциях биодоступность омализумаба составляет 62% (от 53 до 71%) [97]. Пиковая концентрация в плазме достигается спустя 7-8 сут после однократной инъекции препарата, а при многократном назначении спустя 14-28 сут препарат достигает равновесной концентрации в крови. Объём рас¬ пределения препарата примерно соответствует объёму циркулирующей плазмы [98]. Метаболизм омализумаба не вполне ясен. Вероятно, разрушение препарата происходит в ретикулоэндотелиальной системе печени и эндотелиальных клетках. Комплексы омализумаб-IgE разрушаются в организме быстрее, чем свободный омализумаб. но медленнее, чем свободный IgE [99]. Период полувыведения пре- парата варьирует от 1 до 4 нед.НЕЖЕЛАТЕЛЬНЫЕ ЛЕКАРСТВЕННЫЕ РЕАКЦИИВ ходе клинических исследований препарат хорошо переносился больными. Имеются данные метаанализа по безопасности омализумаба у 1763 пациентов, получавших его 24-52 нед, в ходе ПЬ и III фаз клинических исследований [100]. Серьёзные нежелательные явления при использовании омализумаба отмечали лишь 2,6% больных (в группе плацебо — 2,8%). причём лишь в 0,6% случаев боль¬ ные, получавшие омализумаб, были вынуждены прекратить участие в исследова¬ нии из-за серьёзных нежелательных явлений (в группе плацебо - 1,1%).В ходе исследований не было зарегистрировано случаев сывороточной болезни. Симптомы аллергии (крапивница, лихорадка, сыпь, насморк) отмечались у при¬ нимавших омализумаб больных примерно так же часто, как в контрольной группе (1-8%). Не было зарегистрировано и случаев анафилаксии, которые можно было бы строго связывать с приёмом препарата (общая частота случаев анафилаксии меньше 0,1%). У одного из 1723 больных, получавших омализумаб, были обнару¬ жены антитела к препарату (в низком титре).Инъекции препарата сопровождались местными реакциями несколько чаще, чем при инъекциях плацебо (12 и 9% соответственно) [101].У 20 из 4127 (0,5%) больных, получавших омализумаб. были выявлены раз¬ личные злокачественные новообразования, однако нет оснований связывать малигнизацию с действием препарата, так как различия с контрольной группой по количеству и форме выявленных новообразований оказались статистически недо¬ стоверными [91].
ФАРМАКОЛОГИЯ ПРЕПАРАТОВ, ВОЗДЕЙСТВУЮЩИХ НА ДЫХАТЕЛЬНЫЕ ПУТИ 153Стабилизаторы мембран тучных клетокСтабилизаторы мембран тучных клеток ингибируют высвобождение гистами¬ на, лейкотриена С^, простагландина и других биологически активных веществ из различных клеток, находящихся в просвете бронхиального дерева и в слизистой оболочке бронхов. Благодаря этому они обладают умеренным (по сравнению с ГКС) противовоспалительным действием. Кромолин-натрий и недокромил- натрий имеют разную химическую структуру, но обладают примерно одинаковой эффективностью: улучшают течение атопической Б А и астмы физического усилия. Терапевтическая ценность этих средств невелика [102].МуколитикиПрепараты этой группы в значительной степени утратили свое положение в фармакотерапии респираторных заболеваний, но, тем не менее, они остаются незаменимыми при ряде заболеваний, таких, как муковисцидоз и бронхоэктати- ческая болезнь [103].АЦЕТИЛЦИСТЕИНЭффект препарата связан с наличием в его молекуле свободной сульфгидриль- ной группы, которая расщепляет дисульфидные связи гликопротеинов слизи. В результате образуются дисульфиды N-ацетилцистеина, имеющие значительно меньший молекулярный вес, и уменьшается вязкость мокроты. Длительное при¬ менение ацетилцистеина нецелесообразно, так как в целом он подавляет мукоци¬ лиарный транспорт и продукцию секреторного IgA. При использовании ацетил¬ цистеина должны быть обеспечены условия для адекватного удаления мокроты: постуральный дренаж, вибромассаж. При приёме внутрь препарат быстро и хоро¬ шо всасывается, в печени метаболизируется до своего активного метаболита — цистеина. Максимальная концентрация в плазме крови достигается через 1-3 ч, период полувыведения короткий — около 1 ч.РЕКОМБИНАНТНАЯ АЛЬФА-ДНКазаВязкий гнойный секрет в дыхательных путях больных муковисцидозом содержит очень высокие концентрации внеклеточной ДНК, которая высвобождается из разру¬ шающихся лейкоцитов. Альфа-ДНКаза специфически расщепляет высокомолекуляр¬ ные нуклеиновые кислоты и нуклеопротеиды до небольших и растворимых молекул, что способствует уменьшению вязкости мокроты, а также оказывает противовос¬ палительное действие. Альфа-ДНКаза<^ — генноинженерный вариант природного фермента человека, расщепляющий внеклеточную ДНК. В норме ДНКаза присут¬ ствует в сыворотке человека. В терапевтических дозах ингаляции альфаДНКазы^ не вызывают повышения концентрации фермента в крови, что свидетельствует о малом системном всасывании или малой кумуляции. Препарат достаточно безопасен [104].БРОМГЕКСИН И АМБРОКСОЛБромгексин оказывает му колитическое (секретолитическое) и отхаркиваю¬ щее действие, что связано с деполимеризацией и разрушением мукопротеинов и мукополисахаридов, входящих в состав мокроты. Кроме того, препарат обладает незначительным противокашлевым действием. Активный метаболит бромгекси- на — амброксол, значительно превосходит его по клинической эффективности. После приёма внутрь амброксол быстро и полностью всасывается, однако 20-30% препарата подвергается быстрому печёночному метаболизму вследствие феномена «первого прохождениям через печень, продолжительность действия после приёма одной дозы 6-12 ч. Препарат метаболизируется в печени,СПИСОК ЛИТЕРАТУРЫ
РАЗДЕЛ IIIОСНОВНЫЕ СИМПТОМЫ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕГлава 9. Одышка Глава 10. Кашель Глава 11. Боль в груди
Глава 9 ОдышкаОдышка является одним из наиболее тягостных клинических симптомов у больных с заболеваниями дыхательной и сердечно¬ сосудистой систем, имеет различные толкования в определении, сложное понимание патофизиологических механизмов, разнообра¬ зие используемых лечебных программ [5, 17, 39]. Одышка является основным фактором, лимитирующим физическую активность и тру¬ доспособность и относится к одному из основных симптомов, опреде¬ ляющих качество жизни. Одышка - основной критерий хронической дыхательной недостаточности, хотя дыхательная недостаточность может быть без одышки и наоборот одышка может быть без дыха¬ тельной недостаточности [13]. Одышка по эмоциональной значимо¬ сти превышает боль, ассоциируется с чувством тревоги и страха [7].Одышка является одной из наиболее частых причин обращения больного за медицинской помощью. По данным Фремингемского исследования, распространённость одышки в общей популяции населения в зависимости от пола и возраста (изучались лица 37- 70 лет) составляет 6-27% [43]. Проведение Российского эпиде¬ миологического исследования хронической сердечной недостаточ¬ ности — «ЭПОХА-ХСН» показало, что больных, которые имеют одышку в РФ - 11,7%, разброс составляет от 7 до 17% в различных регионах [3].Определение понятияБ.Е, Вотчал и Н.А. Магазаник указывали: «Одышка — это в первую очередь жалоба, с которой обращаются к врачу. Не изме¬ нение дыхания, а именно тягостное и непреодолимое чувство, называемое одышкой, вынуждает больного ограничивать свою физическую активность». J. Comroe дано следующее определение одышки: «Диспноэ — это не тахипноэ — быстрое дыхание, это не гиперпноэ — когда вентиляция увеличивается пропорционально увеличивающемуся метаболизму, это не гипервентиляция, когда вентиляция превышает требования метаболизма. Диспноэ — это трудное, мучительное, неприятное дыхание, хотя оно и не болезнен¬ но в обьршом смысле этого слова. Диспноэ субъективно подобно боли, оно включает как ощущение, так и реакцию на него» (цитиру¬ ется по KJ. Killian [31]),Трактовка одышки представлена междисциплинарной рабочей группой (Dyspnea Work Group) Национального института по изуче-
156ОСНОВНЫЕ СИМПТОМЫ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕнию сердца, лёгких и крови (США). Экспертами было предложено следующее тол¬ кование; «Одышка это термин, используемый для характеристики субъективного ощущения дыхательного дискомфорта, различающееся качеством ощущений и их различной интенсивностью. Одышка является следствием взаимодействия много¬ численных физиологических, психологических, социальных факторов и факторов окружающей среды, которые могут инициировать вторичные физиологические и поведенческие реакции» [17],Механизмы одышкиК наиболее принятым механизмам одышки у больных с заболеваниями систе¬ мы дыхания относят:1) стимуляцию афферентных внутрилёгочных рецепторов;2) увеличение чувствительности к изменениям вентиляции, реализующейся через центральную нервную систему;3) уменьшение дыхательного резерва;4) повышенную стимуляцию рецепторов межрёберных мышц и диафрагмы.Указанные механизмы реализуются последовательным ростом респираторнойдвигательной активности и обратной реакцией хемо- и механорецепторов лёгких и грудной клетки, при активации сенсорных систем, участвующих в акте дыхания [31, 49]. Ощущения одышки и переносимость физических нагрузок связаны с функциональным состоянием диафрагмы, респираторных мышц, периферической мышечной дисфункцией [15,33,44].Существующие унифицированные теории объясняют одышку следствием несо¬ ответствия между центральной респираторной моторной активностью и входя¬ щей афферентной информацией рецепторов дыхательных путей, лёгких и других структур грудной клетки [34, 49]. Если изменения респираторного давления, скорости воздушного потока, объёма лёгких и экскурсии грудной клетки не соот¬ ветствуют выходящему моторному импульсу, интенсивность одышки увеличива¬ ется. Концепция одышки как «несоответствие длины и напряжения дыхательных мышц» впервые была предложена в 1963 г. Е. Campbell,]. Howell. Они считали, что одышка является результатом несоответствия центральной респираторной мотор¬ ной активности и афферентной информации от рецепторов дыхательных путей, лёгких и грудной клетки. В данной теории роль отводится не только информации, поступающей к дыхательным мышцам, но и информации от рецепторов респира¬ торной системы. Поэтому она получила ещё название как «нейро-механическое несоответсвие» или «афферентно-реафферентное несоответствие». Сторонники этой теории утверждают, что ощущение дыхательного дискомфорта может воз¬ никать как у больных при небольшом объёме вентиляции и низкой частоте дыха¬ ния, так и у больных, которые не в состоянии увеличить глубину и частоту своего дыхания.У больных ХОБЛ к одному из ключевых механизмов развития одышки и дыха¬ тельной недостаточности относят феномен «воздушной ловушки». При нагрузке и учащении числа дыханий повышается функциональная остаточная ёмкость лёгких, прогрессирует динамическая лёгочная гиперинфляция и возникает «воз¬ душная ловушка», которая способствует прогрессированию гиперинфляции [11], Уровень лёгочной гиперинфляции вариабелен и составляет обычно 0,3-0,6 л. Развитие «воздушной ловушки» считают классическим примером формирования «порочного круга» одышки [1,16].Перцепция одышкиПри обсуждении патофизиологии нарушений дыхания важным является определение таких категорий, как «респираторное ощущение» и «перцепция».
ОДЫШКА 157Понятие «респираторное ощущение» отражает следствие нейральной активации, как результата стимуляции периферических рецепторов. Перцепция — это психи¬ ческий процесс распознавания объектов, включающий три аспекта: восприятие — осознание — понимание (воспринимаемость). Понятие «перцепция» включает в себя реакцию человека на ощущение, на которое могут влиять психологические и культурные факторы [25].Проблемы клинической оценки восприятия одышки имеют научную и практи¬ ческую значимость. Причем интересы исследователей обращены как к больным БА с повышенным восприятием одышки, что тесно связано с проблемой гипервен- тиляционного синдрома, так и к больным с пониженным восприятием одышки — это проблема жизнеугрожающей БА, включая фатальные риски. Многие исследо¬ ватели указывают, что недостаточная оценка больным тяжести бронхообструкции при БА приводит к несвоевременной и неадекватной медицинской помощи, угрозе внезапной смерти [8, 30,35]. Считается, что среди больных астмой 5-15% имеют низкую степень восприятия одышки. И напротив, чрезмерное восприятие боль¬ ным ощущений одышки при БА ведёт к излишней терапии и возможным нежела¬ тельным ятрогенным эффектам.«Язык одышки»Современная диагностика, как и в давние времена, во многом опирается на оцен¬ ку словесного описания больным своих субъективных ощущений. Активизируются исследования системного анализа субъективных ощущений и описания больным чувства одышки [5]. Считается, что анализ представления больным ощущений одышки позволит дать более тонкую клиническую интерпретацию нарушений дыхания. Сформировалось понятие — «язык одышки» («Language of dyspnea») [18, 19, 37] Скрупулёзное исследование «языка одышки» проведено в Китае. Было проанализировано 61 описание одышки, свистящего дыхания, кашля [26]. В Германии установлена сложность взаимоотношений «языка одышки» с гиперин¬ фляцией, другими объективными параметрами дыхания [46]. В описании одышки имеет значение образовательный ценз человека, который позволяет ему более полно передать свои ощущения. Расовая принадлежность также оказывает влияние на чувственное восприятие одышки. При изучении одышки во время метахолино- вого провокационного теста у больных БА афроамериканцы и белые по-разному характеризовали появление дыхательного дискомфорта. Афроамериканские паци¬ енты отмечали чувство раздражения в носоглотке, в области верхних дыхательных путей, (например, «сжатое горло»), в то время как в белой популяции было больше тех, кто осознавал развитие лёгкого бронхоспазма [27].Измерение одышкиДля измерения одышки используются различные подходы. Это является необ¬ ходимым для определения изменений степени одышки в процессе лечения, сопо¬ ставления одышки с клинико-функциональными параметрами, оценке одышки в различных группах больных, прогнозе заболевания [6, 14, 29]. Применяются методики, которые включают различные вопросники, анкеты, психофизиологи¬ ческие тесты, аналоговые шкалы. Используются рейтинги качества жизни. Для оценки сердечной и лёгочной одышки используется тест с 6-минутной ходьбой. У больных с тяжёлой дыхательной недостаточностью является актуальной оценка одышки при разговоре. Учитывается, говорит больной отдельными фразами или прерывает предложение из-за одышки.Степень одышки принято оценивать с помощью следующих методов:• дискриминативных шкал одышки (Medical Research Council — MRC, Oxigen Cost Diagram — OCD, Baseline Dyspnea Index — BDI),
158ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕ• шкалы Борга, визуальной аналоговой шкалы,• прогулочных тестов (3, 6 и 12 минут).ШКАЛА MRCНаиболее простым методом измерения одышки является сопоставле¬ ние дыхательного дискомфорта с той степенью физической нагрузки, кото¬ рую способен выполнить больной в условиях повседневной деятельности, в 1978 г. Медицинским исследовательским советом (Medical Research Council) Великобритании была предложена версия 5-балльной шкалы (табл. 9-1). Эта шкала в настоящее время является наиболее популярной. Степень тяжести одыш¬ ки определяется в зависимости от условий её возникновения во время ходьбы по ровной поверхности или подъёме на небольшое возвышение [9J,Таблица 9-1. Шкала одышки MRCСтепеньТяжестьОписаниеНетОдышка не беспокоит, за исключением очень интенсив¬ ной нагрузкиЛёгкаяОдышка при быстрой ходьбе или при подъёме на небольшое возвышениеСредняяОдышка приводит к более медленной ходьбе больного по сравнению с другими людьми того же возраста, или появляется необходимость делать остановки при ходь¬ бе в обычном темпе по ровной поверхностиТяжёлаяОдышка заставляет больного делать остановки при ходьбе на расстояние около 100 метров или через несколько минут ходьбы по ровной поверхностиОчень тяжёлаяОдышка делает невозможным для больного выход за пределы своего дома, или одышка появляется при оде¬ вании и раздеванииШКАЛА БОРГАС целью оценки одышки во время физической нагрузки при исследовании различных методов лечения и реабилитации используют методы клинического шкалирования. Одна из наиболее надёжных и воспроизводимых — шкала, предло¬ женная Боргом [10]. Вначале её использовали в спортивной медицине. Оценочная шкала одышки, первоначально имевшая деления от 6 до 20 баллов, затем была уменьшена до 10 баллов.Одышку по шкале Борга определяют следующим образом:0 — вовсе отсутствует;0,5 — очень, очень лёгкая;1 — очень лёгкая;2 — лёгкая;3 — умеренная;4 — отчасти сильная:5-6 — сильная;7-9 — очень сильная;10 — очень, очень сильная.ВИЗУАЛЬНАЯ АНАЛОГОВАЯ ШКАЛАВизуальная аналоговая шкала — один из наиболее популярных методов оценки одышки [6]. Её изображают в виде отрезка длиной 10 см с описательными фазами
ОДЫШКА 159на конечных точках. Начальная точка шкалы указывает на отсутствие одышки, а конечная — обозначает самую сильную одышку.О 10Нет одышки Невозможно дышать Самая тяжёлая одышкаНа этом отрезке пациент делает отметки, соответствующие степени субъектив¬ ного восприятия одышки и её изменениям при проведении нагрузочных тестов и различных лечебных мероприятий. Расстояние от нулевой точки до спгметки, сделанной больным, измеряют в сантиметрах и обозначают баллами,ТЕСТЫ С ФИЗИЧЕСКИМИ НАГРУЗКАМИК наиболее используемым клинико-функциональным методам оценки одышки относят тесты с физическими нагрузками, У больных с заболеваниями дыхатель¬ ной и сердечно-сосудистой систем отмечают снижение физической работоспо¬ собности, и поэтому проведение функциональных исследований переносимости физических нагрузок даёт весьма полезную информацию. При проведении тестов с физической нагрузкой наряду с оценкой субъективных симптомов регистриру¬ ют данные электрокардиографии (ЭКГ), объём выполненной нагрузки, частоту сердечных сокращений (ЧСС) и уровень артериального давления, артериальную оксигенацию.ТЕСТЫ С ХОДЬБОЙТесты с ходьбой относят к наиболее лёгко выполняемым. Нормальная скорость человека при ходьбе составляет около 83 м/мин. Эта скорость сопоставима со ско¬ ростью, необходимой для перехода улицы при разрешающем сигнале светофора. Измерение расстояния, пройденного пациентом во время ходьбы за определённый отрезок времени, характеризует толерантность к физической нагрузке. Шаговые тесты являются физиологичными, информативными. В настоящее время наибо¬ лее распространено проведение теста с 6-минутной ходьбой, который относят к субмаксимальным тестам низкой мощности. Выявлена высокая корреляция дис¬ танции, пройденной испытуемым при проведении этой функциональной пробы, с тредмил-тестом и велоэргометрией [24].Методы исследованияДиагностическая программа больных с одышкой включает клинические, инструментальные, функциональные и лабораторные методы исследования. С их помощью определяют степень функциональных нарушений дыхания и газообме¬ на; осуществляют дифференциальную диагностику одышки.Используют следующие методы:• общий анализ крови и рутинные биохимические исследования;• рентгенографию и компьютерную томографию грудной клетки;• ЭКГ и ультразвуковое исследование (УЗИ) сердечно-сосудистой системы;• исследование функции внешнего дыхания;• определение газового состава крови,В сложных диагностических ситуациях применяют и другие методы: фибро- бронхоскопию, радиоизотопное сканирование лёгких, ангргографию лёгочных сосудов, полисомнографию, изучение механики дыхания и функции респиратор¬ ной мускулатуры, тесты с физической нагрузкой [17,21,33].При подозрении на метаболические причины одышки у больных необходимо определить уровень креатинина, глюкозы, билирубина крови, маркёры поврежде¬ ния печени. Гипоальбуминемия и уменьшение уровня сывороточного трансферри- на указывают на нарушения белкового обмена при кахексии, В некоторых случаях оправдано исследование спектра гормонов щитовидной железы.
160 ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕУ лиц с одышкой и респираторными симптомами в возрасте до 45 лет или с семейной историей лёгочных заболеваний необходимо определить уровень а,-антитрипсина с целью исключения генетических дефектов предрасположен¬ ности к эмфиземе лёгких. Определение -антитрипсина показано в следующих ЩРЙ случаях:• при развитии ХОБЛ у некурящих;• при бронхоэктазах, особенно при отсутствии факторов риска;• при тяжёлом течении ХОБЛ у лиц до 50 лет;• при преобладании базиллярной эмфиземы;• при семейной недостаточности а^-антитрипсина;• при циррозе печени в отсутствие факторов риска.С целью дифференциальной диагностики больных с хронической сердеч¬ ной недостаточностью и пациентов с одышкой внесердечного происхождения используют экспресс-оценку мозгового натрийуретического пептида. Он выде¬ ляется в основном кардиомиоцитами левого желудочка в ответ на перегрузку давлением. У больных с сердечной недостаточностью регистрируют достоверно более высокую концентрацию пептида в плазме крови, чем у больных с лёгочной одышкой [36].Лечение одышкиСтратегия современного менеджмента (управления) одышкой строится с учётом существующих концепций её развития. Выбор тех или иных лечебных и реабилитационных программ зависит от тяжести заболевания, степени наруше¬ ний лёгочной вентиляции и газообмена, наличия сопутствующих заболеваний [38, 48, 51]. Предлагаемые в настоящее время методы рационального менед¬ жмента одышки включают использование лекарственных препаратов, методов реабилитации, терапевтического обучения, социальной помощи. Развитие гипоксемии требует использования длительной оксигенотерапии. В случае тяжёлой эмфиземы или наличия лёгочных булл возможно оперативное вмеша¬ тельство.ЛЕКАРСТВЕННАЯ ТЕРАПИЯСреди влияющих на одышку лекарственных препаратов ведущее место занима¬ ют бронхорасширяющие средства трёх основных групп: р^-агонисгы, антихоли¬ нергические препараты (АХП) и теофиллины [21]. Эффективность их применения с целью уменьшения одышки очевидна, однако важно понимание того, что абсо¬ лютной взаимосвязи между бронхолитическим эффектом препаратов и степенью их влияния на одышку нет [12]. Назначение бронходилататоров приводит к сни¬ жению бронхиального сопротивления, что способствует уменьшению респиратор¬ ного усилия, необходимого дыхательным мышцам для достижения соответствую¬ щего уровня вентиляции, и уменьшению одышки. Эффективность бронхолитиков объясняется не только их бронхорасширяющим действием; в большинстве случаев отмечают плохую корреляцию между изменением O0Bj и уменьшением одышки после применения бронходилататоров.р^-АгонистыВ основе действия Зз^згонистов лежит расслабление гладкой мускулатуры бронхов путём стимуляции р-адренергических рецепторов. Препараты подавляют бронхоспастические эффекты медиаторов воспаления — ацетилхолина, гистами¬ на, простагландинов, лейкотриенов, ингибируют in vivo дегрануляцию тучных кле¬ ток, предупреждают высвобождение лизосомальных ферментов из нейтрофилов, снижают проницаемость мембран.
ОДЫШКА 161АХПЭти препараты обладают бронхолитичесю!м эффектом благодаря угнетению парасимпатической импульсации вследствие конкурентного антагонизма с аце- тилхолином на уровне мускариночувствительных рецепторов. АХП избиратель¬ но действуют на средние и крупные бронхи. В настоящее время одним из дока¬ занных механизмов уменьшения одышки у больных ХОБЛ при использовании АХП считают уменьшение динамической лёгочной гиперинфляции, «воздушной ловушки».ТеофиллиныФармакологические эффекты теофиллина обусловлены сложным, многоком¬ понентным и окончательно не раскрытым взаимодействием различных его био¬ химических механизмов. Считают, что наибольшее значение имеет способность теофиллина увеличивать уровень цАМФ и изменять содержание ионизированного кальция в клетке. К основным положительным эффектам при использовании тео- филлинов больными ХОБЛ относят уменьшение одышки и повышение физиче¬ ской работоспособности. Благотворное влияние теофиллина на систему дыхания осуществляется благодаря действию следующих механизмов:• бронхолитическому воздействию,• уменьшению феномена «воздушной ловушки»,• улучшению работы дыхательных мышц и диафрагмы (положительному ино- тропному действию),• повышению активности дыхательного центра (центральному эффекту),• увеличению дыхательной реакции на гипоксию,• уменьшению периодов гипопноэ-апноэ сна.БензодиазепиныО влиянии бензодиазепинов на одышку известно давно [48]. Существуют указания на возможность применения бензодиазепинов для уменьшения одыш¬ ки у больных с эмфизематозным типом ХОБЛ — «розовых пыхтельщиков». Применение бензодиазепинов оправдано при лечении больных ХОБЛ, в случае, если одьппка сочетается с чувством страха и депрессией.Блокада лёгочных рецепторовНа развитие одышки при патологических процессах в воздухоносных путях влияег усиленная стимуляция со стороны ирритантных и ]-рецепторов лёгких. Это послу¬ жило основанием для применения местно-анесгезирующих препаратов. С целью облегчения тягостного ощущения одьппки у пациентов с ХОБЛ используют аэрозоли лидокаина, уменьшающего афферентную импульсацию лёгочных рецепторов.Альмитрина биомезилатЭто препарат, рекомендуемый для лечения пациентов ХОБЛ с тяжёлой формой дыхательной недостаточности. Альмитрин — специфический агонист хеморе¬ цепторов периферических артерий; при гипоксемии он потенцирует лёгочную вазоконстрикцию в зонах гиповентиляции. Поэтому основным положитель¬ ным механизмом альмитрина является существенное улучшение вентиляционно- перфузионных отношений. Назначение альмитрина усиливает гипоксическую вазоконстрикцию в плохо вентилируемьгх зонах и способствует перераспределе¬ нию тока крови в хорошо вентилируемые зоны, другая сторона положительного эффекта заключается в повышении минутной лёгочной вентиляции благодаря стимуляции хеморецепторов каротидных телец. Считаются оправданными реко¬ мендации по применению препарата для лечения больных с умеренной гипоксе¬ мией (РаОз — 56-65 мм рт.ст.) и при использовании длительной оксигенотерапии у больных с гиперкапнией.
162ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИИ И ИХ ЛЕЧЕНИЕОпиоидыв последние годы изучается ингаляционное использование опиоидов при пал¬ лиативной помощи больным с терминальной стадией лёгочных заболеваний с целью уменьшения одышки. Есть данные об использовании цитрата фентанила с помощью небулайзеров для лечения больных раком лёгкого. Это довольно доступ¬ ный и недорогой метод лечения, дающий существенное облегчение при одышке, особенно в терминальных стадиях заболевания [28,41].ДЛИТЕЛЬНАЯ КИСЛОРОДОТЕРАПИЯПрогрессирование ХОБЛ приводит к усилению одышки, нарастанию гипок¬ семии и гаперкапнии. В этих случаях следует использовать методы длительной терапии кислородом. Показанием для подобного лечения служит снижение РаОз <55 мм рт.ст. или ЗаОз <88% в покое. Основная цель — достижение РаОз, равного 60-65 мм рт.ст., или ЗаОз >90%. Для этих целей используют концентраторы кис¬ лорода или баллоны с жидким кислородом [23].Следует помнить, что вдыхание кислорода больными с выраженной дыхатель¬ ной недостаточностью и глубокими нарушениями газообмена может привести к снижению лёгочной вентиляции и повышению уровня углекислоты, кислород- индуцированной гиперкапнии. В этом случае отмечают клинические симптомы респираторного ацидоза (головную боль, сонливость, нарушение сознания, а в некоторых случаях развитие гиперкапнической комы, тремор и др.). К средствам профилактики кислородиндуцированной гиперкапнии относят механическую поддержку дыхания и назначение медикаментов, стимулирующих дыхание.Существует предположение, что уменьшение одышки при оксигенотерапии также связано с охлаждающим воздействием потока кислорода на рецепторы кожи лица и слизистой верхних дыхательных путей.ЛЁГОЧНАЯ РЕАБИЛИТАЦИЯЛёгочная реабилитация — одна из важнейших мер, влияющих на одышку, её значимость возрастает при прогрессировании хронических лёгочных заболеваний [51,58].Образовательные программія. Это одна из главных составляющих лёгочной реабилитации при лечении больных с синдромом одышки; их практическая значи¬ мость несомненна- Улучшение объективных клинических данных имеет вторичное значение. Польза образовательных программ заключена прежде всего в достиже¬ нии максимально оптимального газообмена, увеличении возможностей ежеднев¬ ных физических нагрузок и самообслуживания пациента в быту. Программа тру¬ дотерапии помогает пациентам узнать новые способы ограничения расходования энергии при ежедневных нагрузках, например, применение трансформации рабо¬ чих зон. Образовательные программы тесно связаны с программами самообеспе¬ чения больных с одышкой при ХОБЛ и других заболеваниях [40,42].Нутритивная поддержка. Более калорийное, белковое питание может улуч¬ шить состояние дыхательной мускулатуры, респираторных функций и уменьшить одышку [53]. Некоторые пациенты, наоборот, связывают возникновение одышки с приёмом пищи и считают необходимым принимать пищу в меньшем количестве.Использование различных приёмов дыхательной техники способствует опти¬ мизации дыхания и уменьшению субъективного восприятия одышки, к основным методам относят дыхание через сжатые губы и диафрагмальное дыхание.Выдох через сжатые губы. Больные с выраженной эмфиземой лёгких ста¬ раются делать выдох через сжатые губы, при котором создаётся внутриротовое давление около 5 см вод.ст. Эмпирический выбор дыхания через сжатые губы обусловлен уменьшением ощущения одышки и облегчением переносимости физической нагрузки. Механизм уменьшения одышки объясняется уменьшени¬
ОДЫШКА 163ем частоты дыхания и удлинением времени выдоха, повышением внзтриальвео- лярного давления на выдохе, улучшением внутрилёгочного распределения воз¬ духа, предотвращением коллапса мелких бронхов и уменьшением «воздушной ловушки».Диафрагмальное дыхание. Методика диафрагмального дыхания преследует своей целью повышение эффективности дыхания. Этот метод позволяет умень¬ шить одышку, к предполагаемым механизмам уменьшения одышки относят уменьшение уровня бронхиальной обструкции и гиперинфляции, улучшение функции диафрагмы и вспомогательной респираторной мускулатуры. Важный фактор, дающий положительный эффект, — устранение торакодиафрагмального асинхронизма и уменьшение работы дыхания.Положение тела. Очень давно врачи подметили, что больные с лёгочной недостаточностью принимают положение тела, при котором облегчается одышка. Считают, что положение с наклоном вперёд с упором на предплечья редуцирует активность дыхательных мышц, положительно влияет на лёгочную вентиляцию, уменьшает гиперинфляцию.Физические тренировки. В комплекс физических тренировок, направленных на поддержание физической активности больного, входят: занятия на велоэр¬ гометре, тредмил, ходьба, бег трусцой, плавание. При физических тренировках обязательно выполнение упражнений, развивающих силу и выносливость нижних конечностей и повышающих силу мышц плечевого пояса f20]. Следует использо¬ вать дозированную ходьбу с предварительной Ю-минутной разминкой. В упраж¬ нения для рук может входить поднятие гантелей весом от 0,2 до 1,4 кг в течение2 минут с числом повторов до 6-8 в день. Рекомендуемая длительность курсов физической тренировки — 4-12 недель, по 2-5 занятий в неделю, продолжитель¬ ность занятия 20-30 мин.Респираторный мышечный тренинг. Для уменьшения чувства одышки и повышения физической работоспособности больных используют тренировки дыхательной мускулатуры. Улучшение функции респираторной мускулатуры спо¬ собствует повышению эффективности лёгочной вентиляции, снижению работы дыхания, что ведёт к улучшению газообмена. Используют дыхательные упражне¬ ния для мышц грудной клетки, брюшного пресса и верхних конечностей. Тренинг респираторных мышц, направленный на повышение их силы и выносливости, построен, как правило, на респираторных резистивных нагрузках.Массаж и вибрация грудной клетки. Вибрация инспираторных мышц груд¬ ной клетки во время вдоха уменьшает одышку, связанную с гиперкапнией у боль¬ ных с ХОБЛ [18]. Установлено, что вибрация дыхательных мышц сопровождается у больного ощущением увеличения объёма грудной клетки. Массаж грудной клет¬ ки снимает утомление респираторной мускулатуры.Веер. Создаваемые веером движения холодного воздуха уменьшают одышку у пациентов с лёгочными заболеваниями [32]. Уменьшение одышки у открытого окна или при обмахивании веером эмпирически давно подметили и здоровые, и больные. Считают, что снижение температуры лица с помощью потока воздуха стимулирует механорецепторы веточек тройничного нерва, связанных с мозгом, и уменьшает ощущение одышки.ХИРУРГИЧЕСКАЯ РЕДУКЦИЯ ЛЁГКИХПоказания для хирургической редукции лёгких с целью уменьшения одышки — буллы лёгких и эмфизема. Одышку можно облегчить путём хирургической редук¬ ции лёгких больным с массивными буллами (более 1/3 гемиторакса) при выполне¬ нии унилатеральной буллэктомии. Билатеральная редукция лёгких у пациентов с тяжёлой гиперинфляцией при эмфиземе способствует уменьшению динамической гиперинфляции и улучшению лёгочной вентиляции, к альтернативным методам
Д,-: л .у 164 ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИИ И ИХ ЛЕЧЕНИЕхирургического лечения эмфиземы относят бронхоскопическое введение зонтич-ного клапана [50].Одышка в конечной стадии заболеваний: i-ti Одышка — один из наиболее частых симптомов у крайне тяжёлых и умирающих. больных. В зарубежной литературе существует понятие «dyspnea at end-of-life» —«одышка конца жизни», которая относится к синдромам надвигающейся смерти. . %• Одышку отмечают приблизительно у 50-70% всех больных, находящихся в тер¬ минальной стадии заболевания [22]. Прежде всего это больные с раком и метаста¬ зами в лёгких, лёгочной и сердечной недостаточностью, уремией. Не всегда просто определить, когда лечение основного заболевания следует дополнять методами паллиативной медицины. Остаются нерешёнными вопросы менеджмента одышки, организации паллиативной помощи в финальной стадии респираторных забо¬ леваний, практического применения опиатов, ингаляционных анестетиков [41]. Проблема терминальной одышки — это и проблема показаний к использованию механической поддержки дыхания.СЛИСОК ЛИТЕРАТУРЫ^
Глава 10 КашельКашель — важнейший защитный механизм, помогающий очи¬ щать воздухоносные пути от секрета, ингалированных или аспири- рованных частиц.Эпидемиологические исследования, проведённые в 16 евро¬ пейских странах на более чем 18 тыс. человек, свидетельствуют о том, что около 10% взрослого населения страдают хроническим сухим кашлем и почти столько же имеют постоянный продук¬ тивный кашель [1], и хотя далеко не все больные обращаются по этому поводу к врачу, тем не менее, кашель стоит на 5-м месте среди остальных симптомов как причина визита к специалисту [2],О широкой распространённости кашля свидетельствует и огром¬ ный рынок противокашлевых препаратов. Так, в США ежегодный объём продаж безрецептурных противокашлевых средств составля¬ ет около 1 млрд долларов [2],Физиология кашлевого рефлексаВозникновение кашля связано с активизацией одного из звеньев кашлевого рефлекса. Первым компонентом кашлевой рефлектор¬ ной дуги являются кашлевые рецепторы (КР), возбуждение кото¬ рых чаще всего запускает кашлевой механизм. Существуют две основные группы кашлевых рецепторов: быстро адаптирующиеся, или ирритантные (ИКР), и рецепторы немиелинизированных брон¬ хиальных С-волокон (С-рецепторы) (табл. 10-1) [З]. Ирритантные рецепторы локализуются преимущественно в области карины и делений крупных бронхов, задней стенки глотки, трахеи и над¬ гортанника. Кроме того, возможно атипичное расположение ИКР в наружном слзгховом проходе и среднем ухе, околоносовых пазухах, диафрагме, плевре, перикарде и желудке. Реагирует данная группа рецепторов, главным образом, на термическую и механическую стимуляцию. В последние годы появились доказательства суще¬ ствования двух подтипов С-рецепторов, которые назвали ноцицеп- торами [4]. Первая группа С-рецепторов имеет связь с яремными ганглиями. Они располагаются в слизистой воздухоносных путей (гортани, трахеи, бронхов), убывая в количестве по мере разветвле¬ ния бронхиального дерева.
166 ОСНОВНЫЕ СИМПТОМЫ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХЛЕЧЕНИЕ Таблица 10-1. Типы и характеристики кашлевых рецепторовПреимущественная лока¬ лизацияСкорость проведения импульса, м/сНервные волокнаСтимуляцияИрритантные 0ыстро адапти¬ рующиеся)Меаду эпителиальными клетками глотки, гортани, трахеи, карины2-25МиелинизированныеМеханическая, термическая, лимонная кислотаС-рецепторыяремныеноцицелторыПод эпителием и в артериолах главных, долевых, сегментар¬ ных бронховнижние ганглионар¬ ные ноцицепторыЛёгочный интерстиций<2Нем иелин изи рованныеБрадикинин, суб¬ станция Р, ПГЕ2, капсаицинБрадикининВторая группа ноцицепторов связана с нижними грудными нервными ганглия¬ ми и локализуется в лёгочной ткани. Открытие внутрилёгочных ноцицепторов дало возможность объяснить происхождение кашля при интерстициальных болез¬ нях лёгких. В состояние возбуждения С-рецепторы приводят химические раздра¬ жители: медиаторы воспаления, нейропептиды, изменения pH, газовые примеси в ингалированном воздухе. Следующим звеном дуги кашлевого рефлекса являются проводящие нервные пути, которые идут в составе блуждающего нерва от КР трахеобронхиального дерева и гортани, в то время как иннервация КР глотки осуществляется через языкоглоточный и тройничный нервы. Через афферентные пути импульсы от кашлевых рецепторов поступают в кашлевой центр, локализо¬ ванный в продолговатом мозге в области nucleus tractus solitarius. Электрическая стимуляция различных медуллярных участков позволила сделать вывод, что каш¬ левой центр расположен диффузно и тесно связан с центрами регуляции дыхания. От кашлевого центра импульсы поступают через эфферентные нисходящие пути в передние рога спинного мозга и далее на спинальные двигательные нервы, иннер¬ вирующие диафрагму, торакальную и абдоминальную мускулатуру, участвующую в кашлевом акте, N. vagus также принимает участие в эфферентном звене кашлево¬ го рефлекса через возвратный гортанный нерв, осуществляя иннервацию гортани и надгортанника, а с другой стороны стимулируя спазм гладкой мускулатуры тра¬ хеобронхиального дерева.Механика кашляКашлевой акт состоит из трёх фаз: инспираторной, компрессионной и экспи¬ раторной. Во время первой фазы кашля происходит вдох, благодаря которому в дальнейшем формируется достаточный экспираторный поток. Затем на 0,2 с про¬ исходит закрытие надгортанника с одновременным сокращением экспираторных мышц, в результате чего происходит резкое повышение внутригрудного давления до 300 мм, рт.ст. Данная фаза необходима для динамической компрессии центральных воздз'хоносных путей (ВП) и создания высокой пиковой скорости экспираторного воздушного потока, которая в первое мгновение после открытия надгортанника достигает 11 л/с, а затем падает по мере опорожнения лёгких в среднем до 3-4 л/с. Динамическое сужение ВП высоким интраторакальным давлением и спазмом гладкой мускулатуры бронхов в экспираторную фазу играет очень важную роль в эффективности кашля. Благодаря уменьшению площади ВП, линейная скорость воздушного потока возрастает до 25 раз и достигает при сильном кашле 280 м/с.
КАШЕЛЬ167приближаясь к скорости звука. Уже при скорости 25 м/с кусочки бронхиального секрета или инородные частицы отрьшаются от слизистой оболочки и увлекаются экспираторным потоком. Снижение эффективности кашля, т.е. способности эвакуи¬ ровать патологическое бронхиальное содержимое, может быть обусловлено либо нарушением механики кашля, либо изменением реологических свойств мокроты в сторону увеличения её вязкости и адгезивности, в свою очередь, полноценный кашлевой акт определяется целым рядом факторов: удовлетворительным состояни¬ ем дыхательной мускулатуры, сохранённой эластической отдачей лёгочной ткани, проходимостью дистальных отделов дыхательных путей, адекватной иннервацией всех звеньев кашлевой рефлекторной дуги. Нарушение хотя бы одного из данных условий приводит к уменьшению эффективности кашля [5].Методы оценки кашляпри научных исследованиях, а также в случаях экспертизы важным бывает про¬ ведение оценки частоты и интенсивности кашля. Методы оценки кашля делятся на субъективные и объективные. Первые включают в себя визуальную аналоговую шкалу, балльную оценку кашля пациентом, ведение кашлевого дневника и запол¬ нение специализированного опросника по влиянию кашля на качество жизни. Визуальная аналоговая шкала для кашля строится по аналогии со шкалой Борга, на которой пациент самостоятельно отмечает степень выраженности кашля на отрезке от О до 10 баллов. В кашлевом дневнике больной, а в случае ребёнка — родитель фиксирует эпизоды и серии кашлевых толчков. При балльной оценке кашля применяются в основном 4- и 6-балльная шкалы (табл. 10-2), где каждому баллу соответствует описание кашля по его силе и частоте,В качестве опросника по оценке влияния кашля на качество жизни чаще всего используется Leicester Cough Questionnaire, содержащий 19 вопросов с 7 вариан¬ тами ответов [6]. Среди объективных методов оценки кашля наибольшее распро¬ странение получило 24-часовое мониторирование кашлевых толчков при помощи портативных устройств, фиксирующих электромиографические импульсы от диа¬ фрагмы во время кашля с одновременной записью звукового спектра и последую¬ щей компьютерной обработкой [7].Таблица 10-2. Шестибапльная шкала оценки дневного и ночного кашляБаллДневкой кашельНочной кашель0Нет кашляНет кашля1Единичные кашлевые толчкиКашель, не прерывающий сон2Редкий кашель в течение дняКашель, прерывающий сон не чаще 2 раз за ночь3Частый кашель, не влияющий на дневную активностьКашель, приводящий к прерыванию сна больше 2 раз за ночь4Частый кашель, снижающий дневную актив¬ ностьЧастое прерывание сна из-за кашля5Тяжёлый кашель, невозможность вести обыч¬ ную активностьКашель, не дающий возможности уснутьПровокационные кашлевые тестыБ ряде случаев, особенно для изучения противокашлевых механизмов лекар¬ ственных средств, используются методы оценки чувствительности кашлевых рецепторов путем ингаляции провоцирующих кашель агентов. В их качестве обычно используются экстракт красного перца — капсаицин, лимонная кислота
168ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕИЛИ гипотонический раствор хлорида натрия. Кашлевой порог рассчитывают по минимальной дозе, способной вызвать 2 или 5 кашлевых толчков (КТ) [8]. В норме кашлевой порог, индуцирующий 2 КТ, составляет 10 мкМ, а 5 КТ - 30 мкМ капсаицина. В случае острых заболеваний, сопровождающихся кашлем вследствие возбуждения кашлевых рецепторов, кашлевой порог, как правило, снижается. Женщины имеют более низкий кашлевой порог, чем мужчины, чем, вероятно, объясняется более широкая распространённость кашля среди женщин.КлассификацияТрадиционно кашель классифицируют в зависимости от его длительности и экспекторации.В настоящее время большинство исследователей проблемы кашля вьщеляют три варианта: острый кашель (продолжительностью до 3 нед), подострый (для¬ щийся 4-8 нед) и хронический, сохраняющийся больше 8-недельного срока [9] (табл. 10-3).По экспекторации кашель делится на продуктивный и непродуктивный (сухой). Такая классификация весьма условна, так как основывается на субъективной оценке пациентом. Например, длительно кашляющие курящие больные склон¬ ны игнорировать не только вьщеление мокроты, но и сам кашель, считая его естественным спутником своей привычки. Наоборот, молодые эмоциональные женщины нередко драматизируют картину кашля, описывая его как интенсивный и продуктивный, в то время как объективные методы диагностики не подтверж¬ дают присутствия патологического секрета в воздухоносных путях. Разумеется, на разных стадиях одного заболевания кашель может бьггь как сухим, так и продук¬ тивным, кроме того, всякий хронический кашель проходит через стадию острого и подострого. Тем не менее, приведённая классификация удобна с практической точки зрения, поскольку позволяет врачу ориентироваться на наиболее вероятные причины различных вариантов кашля.ОСТРЫЙ КАШЕЛЬНесмотря на то что спектр заболеваний, сопровождающихся острым кашлем, весьма широк и включает в себя не только поражения дыхательных путей, но и процессы иной локализации, подавляющее большинство случаев острого кашля (до 86%) связано с респираторными вирусными инфекциями [10]. Развивающееся в таких случаях острое катаральное воспаление слизистой оболочки имеет кашель в качестве ведущего клинического симптома. Лечение подобных состояний обыч¬ но симптоматическое.Таблица 10-3. Причины различных вариантов кашляПрОДу1СГИВНЫЙНепродуктивныйОстрыйОстрый бронхитИнфекции ВДППневмонияОстрый ринит Острый синусит Острый фарингит Острый ларингит Острый трахеит ТЭЛАСердечная астма Сухой плеврит Пневмоторакс Аспирация инородных тел Перикардит Наружный отит
ПодострыйПостинфекционный кашельКАШЕЛЬ 169Окончание табл. Ю-3КоклюшХламидийные, микоплазменные инфекции Воспалительные заболевания носоглоткиХроническийХронический бронхит ХОБЛБронхоэктазыБронхиальная астма (кроме кашлевого варианта)Туберкулёз Рак бронха МуковисцидозЗастойная левожелудочковая недо¬ статочностьКашлевой вариант БА Гастроэзофагеальный рефлюкс Воспалительные заболевания верхних дыха¬ тельных путей Приём ингибиторов АПФ Интерстициальные болезни лёгких Объёмные процессы в средостении Невротический кашель Эозинофильный бронхитс первого дня назначаются противокашлевые препараты (бутамират, декстра- меторфан, леводропропизин, преноксдиазин и др.) Эффективным способом лече¬ ния является увлажнение слизистой оболочки дыхательных путей. Этот эффект может быть достигнут путём многократных ингаляций через небулайзер подогре¬ того до температуры тела физиологического раствора хлорида натрия.Острый кашель, вызванный пневмонией, тромбоэмболией лёгочной артерии, сердечной астмой, пневмотораксом и другими серьёзными заболеваниями, явля¬ ется лишь одним из клинических симптомов и обычно не требует специальных диагностических и терапевтических подходов.ПОДОСТРЫЙ КАШЕЛЬВ случаях подострых вариантов течения чаще всего говорят о «постинфекци- онном» кашле, понятии, редко использующемся в русскоязычной терминологии. В данном контексте речь идет о сохраняющемся кашле после перенесённых респи¬ раторных инфекций, не связанным с другими возможными причинами [11]. Кашель может быть обусловлен как сохраняющимися элементами воспаления воздухо¬ носных путей, так и снижением порога чувствительности кашлевых рецепторов, реагирующих на незначительную ирритацию холодным воздухом, бронхиальным секретом, пылью и т.д. Как правило, такой кашель имеет тенденцию к уменьшению частоты и интенсивности. Терминологическими аналогами «постинфекционно- го» кашля фактически являются бронхит или трахеобронхит затяжного течения. В некоторых случаях подострый кашель обусловлен не перенесённым, а активным или латентным инфекционным процессом, обусловленным персистенцией внутри¬ клеточных возбудителей Chlamydophila pneumoniae и Mycoplasma pneumoniae [12],Ещё одной из возможных причин подострого кашля является коклюшная инфек- 1ЩЯ. Несмотря на то что диагноз коклюша у взрослых ставится редко, истинная распространённость этого заболевания во взрослой популяции достаточно великаи, по данным ряда исследователей, достигает 21% среди пациентов с кашлем, продол¬ жающимся более 2 нед [13]. Коклюшный кашель у взрослых, особенно у привитых коклюшной вакциной, редко имеет классическую картину — судорожного вдоха с последующей серией интенсивных кашлевых толчков, заканчивающейся рвотой. Чаще кашель значительно слабее, без инспираторного стридора, однако имеет характерные черты приступообразности — внезапного начала и окончания, в перерывах между кашлевыми репризами больной совершенно не кашляет. Нередко среди окружающих удаётся выявить либо больных коклюшем, либо лиц, имеющих похожий кашель. Для заболевания характерна сезонность в осеннее-зимний период. Диагностика коклюша возможна лишь в специализированных лабораториях. В назальной слизи Bordetella pertussis можно выявить лишь в первые 2 нед заболевания, в дальнейшем необходимо (Нфеделять нарастание титра антител к коклюшному токсину.
Ш.' "Р^ ' 170 ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕХРОНИЧЕСКИЙ КАШЕЛЬ® основе синдрома хронического кашля может лежать разнообразная патоло- ‘ ^ ГИЯ. Воспалительные заболевания дыхательных путей, инфильтративные процес-¿'дН сы в лёгочной паренхиме, средостении, поражения плевры, застойная сердечная недостаточность, как правило, сопровождаются хроническим кашлем. В тех слу- чаях, когда диагноз очевиден, кашель редко рассматривается как самостоятельная проблема. Гораздо более сложной является клиническая ситуация, когда кашель выступает в качестве ведущего симптома, а рутинные методы диагностики, такие, как рентгенография и спирометрия, не выявляют нарушений структуры и функции лёгких.Если оставить в стороне хронический кашель, связанный с курением, когда его причина вполне очевидна, то среди оставшихся больных более чем случаев приходится на долю так называемой «кашлевой триады»: кашлевого варианта БА (6-59%), группы воспалительных процессов верхних дыхательных путей (8-58%) и гастроэзофагеального рефлюкса (5-40%) [14], Именно эти заболевания нужно иметь в виду у больных с хроническим кашлем и направлять диагностический поиск в сторону наиболее вероятной патологии.Кашлевой вариант Б А (КВБА) — вариант течения заболевания, при котором доминирующим или единственным симптомом является хронический кашель. Этот тип БА был впервые описан в 1960 Соггао и соавт. [15]. В отличие от клас¬ сической БА, больные не жалуются на одышку, приступы удушья. Периодически они могут отмечать появление свистящего дыхания, ощущения хрипов в грудной клетке, которые, однако, не сопровождаются диспноэ. Кашель у них частый, интенсивный, сухой или с незначительным количеством мокроты, досаждающий самому пациентз^ и окружающим, нередко нарушающий повседневную активность и сон больных. Кашель провоцируется холодным воздухом, гипервентиляцией, резкими запахами, усиливается на фоне респираторных инфекций. Как правило, лечение муколитиками, противокашлевыми средствами, бронходилататорами не снижает интенсивность кашля. При КВБА не наблюдается бронхиальной обструк¬ ции и значимой реакции на бронходилататоры, поэтому такое стандартное иссле¬ дование. как спирометрия не имеет диагностической ценности. Определённую пользу может принести мониторирование пиковой скорости выдоха, однако диа¬ гностическая ценность пикфлоуметрии при КВБА значительно уступает таковой при обычных формах Б А. Тем не менее, такой неотъемлемый признак Б А, как бронхиальная гиперреактивность, сохраняется и является тем критерием, на выяв- лении которого строится диагностика данной формы заболевания. Фактически провокационный ингаляционный тест с метахолином или гистамином является «золотым стандартом» диагностики КВБА [16]. Если выполнение провокационно¬ го теста невозможно, допустимо проведение 2-недельного лечебного курса ИГКС в средних дозах (эквивалент 400-800 мкг беклометазона). В случае КВБА уже через несколько дней терапии наблюдается выраженный клинический эффект — кашель минимизируется или полностью исчезает. При сохранении кашля на фоне ИГКС рекомендуют недельный курс системных ГКС (40 мг/сут преднизолона) [17]. Как альтернатива ГКС при КВБА могут выступать антилейкотриеновые препараты. В частности, выраженный противокашлевой эффект описан в случае 2-недельного приема зафирлукаста [18]. Длительность курсового лечения и пересмотра доз ИГКС при КВБА определяется клиническими рекомендациями по ведению боль¬ ных БА.Близким состоянием к КВБА является эозинофильный бронхит (ЭБ), нозо¬ логическая самостоятельность которого оспаривается до настоящего времени. Клинически ЭБ проявляется длительным сухим или малопродуктивным кашлем небольшой или умеренной интенсивности без очевидной связи с экзогенными факторами. Диагностическими критериями ЭБ являются эозинофилия индуци-
КАШЕЛЬ171рованной мокроты >3% или бронхоальвеолярного лаважа >1%, при условии нор¬ мальных значений спирометрии и отрицательных результатах бронхопровокаци¬ онных тестов (отличие от КВБА) [19]. Дифференциальные признаки классической БА, КВБА и ЭБ представлены в табл. 10-4 [20].Таблица 10-4. Дифференциальные признаки БА и эозинофильного бронхитаОбратимаяобструкцияБронхиальнаягиперреактивностьЭозинофилиямокротыКлассическая БАКашлевой вариант БАЭозинофильный бронхитЛечение ЭБ проводится ИГКС в средних дозах с хорошим клиническим эффек¬ том. Рефрактерности к терапии не наблюдается. Считают, что ЭБ, который неко¬ торые исследователи обозначают термином «атопический кашель» [21], лежит в основе до 13% случаев хронического кашля у взрослых некурящих пациентов.Значительную часть в этиологическом спектре хронического кашля занимает группа болезней, объединённых единым механизмом возникновения кашля — ирритацией кашлевых рецепторов задней стенки глотки патологическим секретом, образующимся в носоглотке или придаточных пазухах, либо воспалением в зонах локализации кашлевых рецепторов верхних дыхательных путей [22]. Главными представителями такой патологии являются аллергический и вазомоторный рини¬ ты, хронический синусит. До последнего времени в качестве термина, объединяю¬ щего данные заболевания, фигурировал postnasal drip syndrome (синдром назаль¬ ного затека). Однако в 2006 г. комитет экспертов Американского торакального общества предложил отказаться от него, как не полностью отражающего патогене¬ тическую суть, в пользу термина «upper airway cough syndrome» (кашлевой синдром болезней верхних дыхательных путей) [23]. Тем самым подчёркивается, что кашель в данном слу^гае может возникать не только за счет раздражения назальным секретом кашлевых зон, но и при самостоятельных воспалительных процессах в глотке и гортани. Диагностика этих состояний проводится клинически — на основании жалоб, анамнеза и инструментального осмотра рото- и носоглотки, который является неотъемлемой частью обследования кашляющего больного. Как правило, у таких пациентов удается обнаружить тяжи слизистого или слизисто- гнойного секрета в ретроназальной области и на задней стенке глотки. В случаях атрофического фарингита наблюдается истончение и сухость слизистой глотки. Дополнительную помощь могут оказать рентгенография или компьютерная томо¬ графия придаточных пазух носа. Кашлевой синдром болезней верхних дыхатель¬ ных путей является доминирующей причиной хронического кашля у детей (более 60% случаев), именно его следует в первую очередь иметь ввиду в педиатрической практике, особенно у детей первых лет жизни.Гастроэзофагеальный рефлюкс (ГЭР) — широко распространённая патология, которая встречается у 21-40% взрослого населения [24]. Хорошо известно влия¬ ние ГЭР на тяжесть течения и частоту обострений БА, Такая же связь прослежи¬ вается между ГЭР и хроническим кашлем. Патогенез хронического кашля при ГЭР может определяться микроаспирацией желудочного сока или пищеводно- бронхиальным рефлексом в ответ на кислотную стимуляцию вследствие релак¬ сации пищеводно-желудочного сфинктера. Кашель при ГЭР сухой, усиливается в положении лежа на спине, после еды, смеха, употребления в пищу стимуляторов желудочной секреции, часто сопровождается чувством сухости в горле и призна¬ ками атрофического фарингита. Тем не менее, данные особенности кашля при ГЭР
172 ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕмалоспецифичны и не могут быть положены в основу диагностики. Традиционные симптомы ГЭР, такие, как изжога, отрыжка, чувство горечи во рту, полезны для подозрения на данную патологию, однако они далеко не всегда сопровождают ГЭР. Около 75% больных хроническим кашлем рефлюксного генеза имеют кашель в качестве единственного симптома заболевания [25]. Кашель развивается далеко не у всех больных с ГЭР. При этом частота и интенсивность кашля не имеют кор¬ реляционных связей со степенью тяжести ГЭР. Кроме того, лишь 35-55% пациен¬ тов с хроническим кашлем и подтвержденным ГЭР отвечают на антирефлюксную терапию [26, 27]. Другими словами, наличие ГЭР у кашляющего больного ещё не означает, что именно рефлюкс вызывает кашель. Лишь противокашлевой эффект от 3-месячного курса комплексного лечения рефлюксной болезни, включающе¬ го сон с приподнятым изголовьем, изменение режима питания и диеты, прием ингибиторов протонной помпы или Н.^-гистаминоблокаторов в сочетании с про- кинетиками, является доказательством участия ГЭР в генезе кашля [28]. Наиболее точным методом диагностики ГЭР считается 24-часовое мониторирование pH пищевода, однако в связи с ограниченной доступностью данной методики, врачу приходится ориентироваться на результаты эзофагоскопии и рентгеноскопии пищевода, чувствительность которых не превышает 50%. При исключении иных вероятных причин кашля и невозможности точной диагностики ГЭР, рекомендуй ется проведение пробного 12-недельного курса лечения ингибиторами протонной помпы с рекомендациями по режиму питания и сна.Особенную сложность для определения этиологии хронического кашля пред¬ ставляют больные с сочетанием нескольких возможных механизмов. Ряд иссле¬ дований доказывает, что в основе хронического кашля одно заболевание лежит в 38-82% случаев, а несколько — в 18-62% [29]. Комбинация БА с аллергическим ринитом или ГЭР — весьма нередкая ситуация. Поэтому, не получив ожидаемого противокашлевого эффекта при лечении вероятной причины кашля, необходимо подумать о возможности его мультифакторного происхождения.Существует ряд заболеваний, отличных от «кашлевой триады», которые могут вызвать хронический кашель. Среди них — бронхоэктазии, начальные стадии интерстициальных болезней лёгких, инородные тела бронхов (более характер¬ ные для детей первых лет жизни) и, наконец, психогенный или невротический кашель.С внедрением современных методов компьютерной томографии значительно упростилась диагностика бронхоэктазий, не сопровождающихся классической клинической картиной бронхоэктатической болезни. Больные с ограниченными бронхоэктазами небольших размеров хотя и имеют хронический продуктивный кашель, усиливающийся на фоне респираторных инфекций, часто расцениваются как больные хроническим бронхитом ввиду отсутствия обильной гнойной мокро¬ ты, нерезкой общей воспалительной реакции, нормальной аускультативной карти¬ ны. Чувствительность КТ в диагностике бронхоэктазов составляет 60-100% [30]. Данный метод практически вытеснил бронхографию из клинической практики.Кашель часто сопровождает интерстициальные заболевания лёгких, В развер¬ нутой стадии этих процессов, когда сформировались выраженные структурные изменения лёгочной паренхимы, природа кашля не вызывает сомнений. Однако в дебюте болезней, особенно в случае интерстициальных пневмоний, кашель может быть вторым доминирующим симптомом наряду с одышкой — неотъем¬ лемым признаком данной группы заболеваний. Важно отметить, что на ранних стадиях интерстициальных пневмоний рентгенография лёгких обычно выявляет неспецифические изменения (усиление лёгочного рисунка), недостаточные для постановки диагноза. Это характерно как для идиопатических интерстициальных пневмоний, так и для тех, которые вызываются оппортунистическими инфекция¬ ми {Cytomegalovirus, Pneumocystis carinii и др.) у больных с иммунодефицитом. Как и
КАШЕЛЬ 173при бронхоэктазах, ведущим методом диагностики в таких случаях является КТВР, позволяющая выявить характерные признаки интерстициальной инфильтрации.Инородные тела бронхов — редкая ситуация, встречающаяся обычно у детей (чаще мальчиков) в возрасте до 4-х лет. Трудности в диагностике возникают при невозможности собрать анамнез и рентгенонегативных инородных телах. Фибробронхоскопия в данном случае позволяет поставить правильный диагноз и извлечь инородный предмет.Психогенный или невротигеский кашель должен являться диагнозом исключения и обсуждаться лишь после детального обследования больного и отрицательных результатов диагностического поиска. Данная форма кашля чаще встречается у детей и молодых женщин. В качестве аналога в некоторых работах используется термин «кашлевой тик». Психогенный кашель необходимо дифференцировать с синдромом Туретта [31] — нервно-психическим расстройством, характеризую¬ щимся нарушением внимания, навязчивыми состояниями, гиперкинезами и тика¬ ми, в том числе пароксизмальным кашлем как проявлением тика мышц гортани. Начало тиков при синдроме Туретта приходится обычно на 5-летний возраст, достигая максимума к 10 годам и исчезая у половины больных после завершения полового созревания [32].Ранее считалось, что особенностями психогенного кашля являются его исчез¬ новение во время сна и специфические звуковые характеристики — гулкий, напо¬ минающий гусиное гоготанье, «лающий». В недавно выполненном исследовании показано, что при объективном мониторировании кашля, расценивавшегося как психогенный, в ночное время также фиксировались кашлевые толчки [33]. Кроме того, гулкий и лающий кашель описан у больных с ГЭР, бронхоэктазами, заболева¬ ниями верхних дыхательных путей [34]. Рекомендации Американского торакаль¬ ного общества [35] в качестве клинических особенностей психогенного кашля и характеристик больного предлагают следующие:• кашель, нарушающий общественную адаптацию;• кашель, уменьшающийся после позитивных событий или физической нагруз¬ ки;• кашлю предшествует инфекция верхних дыхательных путей;• в результате кашля больной получает определённую выгоду (повышенное внимание со стороны родителей, пропуски школы и Т.Д.);• больной демонстрирует свое безразличие к кашлю;• кашель усиливается в присутствии родителей, учителей, медицинского персо¬ нала;• ощущение щекотания в горле, улучшается в положении «подбородок на груди»;• одинокие больные;• усиление кашля на фоне эмоций;• семейная история кашля, которую подсознательно копирует больной;• неразрешённые сексуальные проблемы;• жёсткий родительский контроль;• страх перед школой;• сопутствующая дисфункция голосовых связок;• повышенная потребность во внимании.Лечение истинного психогенного кашля — сложная задача, которая требует кооперации с психологами и психиатрами. Признаки невроза, сопутствующие депрессивные расстройства нередко диктуют применение психотропных препа¬ ратов, суггестивного воздействия. Использование противокашлевых препаратов возможно, но, как правило, не решает проблемы, У лиц с гипервентиляционным синдромом показано проведение дыхательных гимнастик, направленных на воле¬ вую регуляцию дыхания.
йул.--‘'174 ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕДиагностические подходы к больному с кашлемАНАМНЕЗдиагностики причин кашля первостепенное значение имеет подробный анамнез пациента. Разработаны специальные вопросники для кашляющего боль¬ ного [36]. Уже на стадии расспроса во многих случаях удаётся предположить вероятную причину кашля. Обязательными являются вопросы о профессиональ¬ ном маршруте, курении, лекарственном анамнезе, связи кашля с респираторными инфекциями и контактами с инфекционными больными, факторах, усиливающих и уменьшающих кашель, сопутствующих заболеваниях верхних дыхательных путей, желудочно-кишечного тракта, сердечно-сосудистой системы, наружного и среднего уха.Важными являются сведения о контактах с возможными поллютантами и аллергенами: бытовой и производственной пылью, табачным дымом, газами, летучими или сыпучими химическими соединениями, плесенью, животными. Среди лекарственных препаратов наибольшее значение в возникновении кашле¬ вого синдрома имеют ингибиторы АПФ, приём которых вызывает сухой кашель разной интенсивности у 10-15% больных. Сами пациенты не всегда связывают кашель с лечением данной группой препаратов, поэтому должны быть прицельно расспрошены по данному вопросу. Прекращение приёма ингибиторов АПФ обыч¬ но ведет к уменьшению и полному исчезновению кашля в течение 1-4 нед, однако в некоторых случаях может затягиваться до 3 мес [37], При необходимости после прекращения кашля можно возобновить лекарственную терапию ингибитором АПФ другого химического состава. Если отмена ингибитора АПФ невозможна по витальным показаниям, то допустимо применение некоторых средств, кото¬ рые могут подавить индуцированный ингибитором АПФ кашель - кромогликат натрия, теофиллин, индометацин, амлодипин, нифедипин, сульфат железа.р-Адреноблокаторы также могут вызывать кашель вследствие развития брон¬ хообструктивного синдрома.ОСМОТРОсмотр больного с кашлем проводится по общим правилам, однако непременно должен включать в себя более тщательное обследование ЛОР-органов: переднюю и заднюю риноскопию, фарингоскопию, отоскопию. Исследование наружных слуховых проходов необходимо, так как у 2,3% популяции имеется атипичное расположение кашлевых рецепторов в наружном ухе, патология которого может проявиться неожиданным образом [34].ДИАГНОСТИЧЕСКИЙ АЛГОРИТМДальнейший алгоритм действий врача направлен на последовательное исклю¬ чение или подтверждение наиболее вероятных причин кашля путем применения ряда диагностических методов, а если это невозможно ~ проведения курса тера¬ пии exjuvantibus (рис, 10*1).Использование диагностического алгоритма позволяет в подавляющем боль¬ шинстве случаев (-95%) определить этиологию кашля и, как правило, путем пато¬ генетической терапии добиться его ослабления или исчезновения [38].Традиционными методами первичной диагностики при синдроме кашля явля¬ ется рентгенография органов грудной клетки и функциональное исследование лёгких, включающее в себя спирометрию и динамическую пикфлоуметрию. При наличии симптомов со стороны верхних дыхательных путей показано проведение рентгенографии придаточных пазух носа. Большинство инфильтративных процес¬ сов в лёгочной ткани, обструктивных болезней лёгких, синуситов, приводящих к кашлю, может быть установлено данными методами. При подостром кашле целе-
КАШЕЛЬ 175Рис, 10-1. Диагностический алгоритм при хроническом кашле.сообразно исследование тиров иммуноглобулинов классов А, М, G к Chlamydophila pneumoniae и Mycoplasma pneumoniae, а также динамики титров антител к коклюш¬ ному токсину в реакциях агглютинации и непрямой гемагглютинации.Если происхождение кашля остается непонятным, то требуется более углублён¬ ное исследование, направленное на диагностику кашлевого варианта бронхиаль¬ ной астмы, эозинофильного бронхита и гастроэзофагеального рефлюкса. Оно включает в себя провокационные бронхоконстрикторные тесты, исследование клеточного состава индуцированной мокроты, 24-часовое мониторирование pH пищевода. Когда перечисленные методы недоступны, возможно проведение проб¬ ных курсов противоастматического и антирефлюксного лечения либо дальнейший диагностический поиск в виде компьютерной томографии органов грудной клетки и фибробронхоскопии. Если полученные результаты не подтверждают присут-
.-'■'гЙЇ:,- 176 ОСНОВНЫЕ СИМПТОМЫ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕствия патологии, которая могла бы вызвать кашель, следует проанализировать соответствие клинической картины признакам психогенного кашля.Порой, несмотря на все диагностические усилия и попытки лечения, не удаётся установить причину и устранить кашель. В таких случаях говорят об идиопатиге- ском или необъяснимом кагиле [39]. Однако прежде чем утверждать о невозмож¬ ности определить этиологию кашля, необходимо пересмотреть результаты диа¬ гностики и оценить адекватность терапевтических подходов.Например, выявление бронхиальной гиперреактивности у больного с кашлем не всегда должно бьггь интерпретировано как доказательство кашлевого варианта БА. Аллергический ринит нередко сопровождается подобным феноменом и кашель обу¬ словливается раздражением кашлевых рецепторов глотки, в то время как терапия ИГКС эффекта не приносит. Как уже упоминалось, доказательством «виновности» гастроэзофагеального рефлюкса в генезе кашля является противокашлевой эффект антирефлюксной терапии, а не только признаки несостоятельности кардиального сфинктера желудка. Кроме того, кашель может бьггь обусловлен несколькими забо¬ леваниями, и лечение лишь одного из них не приведёт к значительному результату. Часто требуется время для того, чтобы проявился клинический эффект проводимого лечения. Например, при ГЭР редукция кашля проявляется через несколько недель лечения и при условии сочетании приёма фармакологических препаратов с реко¬ мендациями по режиму питания и диете. При отмене ингибиторов АПФ кашель может сохраняться до 3 мес. Важной является оценка адекватности дозировок лекарств. При кашлевом варианте БА средние дозы ИГКС не всегда эффективны, более того, порой кашель может усиливаться на ингалируемый аэрозольный или порошковый носитель. Такой эффект в частности описан у беклометазона [40]. Описаны варианты некислотного ГЭР, когда имеются анатомические признаки рефлюкса, но pH пищевода не меняется. Кашель, сопровождающий такой реф¬ люкс, не реагирует на антисекреторную терапию ингибиторами протонной помпы, Н2-гистаминоблокаторами, но исчезает после хирургической коррекции рефлюкса [41]. Все вышеперечисленные ситуации не имеют отношения к идиопатическому кашлю, а определяются вполне конкретными причинами.Тем не менее, у больных с истинным идиопатическим кашлем, по-видимому, происходят изменения чувствительности рецепторного аппарата воздухонос¬ ных путей. Описана избыточная экспрессия нейрокинина и тахикининов в ответ на персистенцию вирусов у животных. Нейропептидная стимуляция приводит к гиперчувствительности нервных окончаний и снижению кашлевого порога. У больных с идиопатическим кашлем при биопсии слизистой оболочки бронхов обнаружены дополнительные межэпителиальные нервные волокна и повышение уровня нейрокининов.Замечено, что у женщин с идиопатическим кашлем в слизистой оболочке бронхов и бронхоальвеолярном лаваже обнаруживается повышенное содержание лимфоцитов [42]. В одних случаях лимфоцитарная инфильтрация наблюдается у больных аутоиммунным тиреоидитом, в других — в менопаузе. Механизмы, приводящие к таким клеточным реакциям, не вполне понятны. Высказывается гипотеза о возможном аутоиммунном процессе в лёгочной ткани и влиянии дис¬ баланса половых гормонов на нейроиммунные механизмы в дыхательных путях с формированием гиперчувствительности кашлевых рецепторов. Во всяком случае, существуют половые различия в кашлевом пороге, который ниже у женщин, в то время как у детей до пубертатного периода подобных отличий не наблюдается. При идиопатическом кашле в качестве лечения могут быть эффективны сред¬ ства, снижающие чувствительность кашлевых рецепторов: терапевтические дозы баклофена [43] и ингаляции через небулайзер раствора лидокаина в дозе от 10 до 40 мг, в зависимости от интенсивности кашля [44].СПИСОК ЛИТЕРАТУРЬи°'
Глава 11 Боли в грудной клеткеПо определению группы экспертов Международной ассоциации по изучению боли (1А8Р, 1986), «боль - это неприятное ощуще¬ ние и эмоциональное переживание, связанное с действительным или возможным повреждением тканей и описываемое терминами, применяемыми при данном повреждении» [1]. Боль в большинстве случаев обусловлена травмирующими воздействиями [2, 3] и всег¬ да субъективна. С эволюционной точки зрения она направлена на сохранение биологических видов.Боли в грудной клетке - один из частых симптомов, предъяв¬ ляемых пациентами. Перечень заболеваний, сопровождающихся болью в груди, чрезвычайно широк, от классической стенокардии до мифического «синдрома гигантской молочной железы». Наиболее распространённые из них кратко обсуждаются в этом разделе.Оценка болиДостижения в оценке интенсивности боли невелики. Попытки объективизировать ощущение боли осложняется не только тем, что она субъективна, но и тем, что боль является многомерным ощущением, включающим в себя сенсорный, эмоциональный, дви¬ гательный, вегетативный и когнитивный (мыслительный) ком¬ поненты [3]. Современные подходы к изучению боли включают методы самооценки боли пациентом и оценки его поведения меди¬ цинским персоналом при помощи различных вопросников и шкал [7], а также методы «объективной» альгезиметрии путём измерения двигательных и вегетативных реакций на боль. Значительный про¬ гресс в этой области связан с появлением новых методов функ¬ ционального картирования нейрональной активности мозговых структур: позитронно-эмиссионная томография, метод функцио¬ нального магнитного резонанса [6]. Однако до сих пор ни один из этих методов не является универсальным, и не существует строгих рекомендаций, регламентирующих их применение в той или иной клинической ситуации.РаспространённостьПроблема боли является одной из актуальных в современной медицине [3, 8]. Согласно одному из эпидемиологических иссле¬ дований, проведённому в 80-х годах прошлого века в Канаде, 16% из 827 случайных респондентов указали, что испытывали боль в
178 OCHOBHblE симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕтечение последних 2 нед. Постоянные боли отмечались в 2 раза чаще, чем крат¬ ковременные; чаще на боли жаловались женщины, чем мужчины. Боли в груди оказались лишь на 5-м месте среди возможных локализаций боли [9]. В другом исследовании, посвящённом хронической боли, наиболее часто отмечались голов¬ ные боли (мигрень) и боли в суставах [13]. На 1-е место боли в грудной клетке выходят лишь среди причин острой боли, заставляющей пациентов обращаться за медицинской помощью. Среди госпитализированных больных боли в груди как новый симптом отметили 9,6% пациентов [14]. Основную группу больных с болями в груди составили лица среднего возраста, у пожилых пациентов они встре¬ чались реже, несмотря на большую распространённость ИБС.КлассификацияПо этиологии выделяют боли травматического генеза, послеоперационные, сте¬ нокардию и др. [3]. По временным параметрам выделяют острую и хроническую боль. Если острая боль возникает в результате травмы или острого заболевания, то хроническая боль, как правило, остается после острой фазы заболевания, про¬ должается длительное время и приобретает черты самостоятельного заболевания (синдром «боль-болезнь»). В связи с этим выделяют физиологическую и пато¬ логическую боль. По патогенезу вьщеляют соматогенные, нейрогенные и психо¬ генные болевые синдромы. Б свою очередь соматогенная боль подразделяется на соматическую и висцеральную боль. По характеру ощущений выделяют короткое колющее болевое ощущение («первая», эпикритическая боль) и тупое и длитель¬ ное ощущение «жжения» («вторая», протопатическая боль). В том случае, когда боль не совпадает с местом повреждения, говорят о проецируемой или отражённой (иррадиирующей) боли.Патофизиология висцеральной болиГипотезу о существовании специфических болевых рецепторов в форме сво¬ бодных неинкапсулированных нервных окончаний первым предложил Мах von Frey (1884), Ч. Шеррингтон поддержал предположение о специфичности ноци- цепции и назвал активируемые ими нейронные структуры — ноцицептивной системой [15]. Эта система осуществляет восприятие, проведение и обработку болевой информации [8].В настоящее время болевые рецепторы активно изучаются [19]. Среди них выде¬ ляют высокоаффинный рецептор фактора роста нервов (ТгкА), тетродотоксин- устойчивые натриевые каналы (например. Navi.8), пуринергические рецепторы (Р2Х2, Р2Х3), протон-чувствительные ионные каналы (ASIC) и ванилоидные рецепторы (TRPV^), Одним из наиболее «адекватных» (по Шеррингтону) болевых стимулов является растяжение и напряжение стенки полого органа, а также ише¬ мия тканей. Раздражение мелких бронхов табачным дымом или парами аммиака также вызывает ощущение дискомфорта в грудной клетке, однако не ясно, связано ли оно с активацией болевых рецепторов.За редким исключением аксоны висцеральных сенсорных нейронов представле¬ ны тонкими миелинизированными (группа П1, или А5) и немиелинизированными (группа IV, или С) нервными волокнами. Волокон группы IV гораздо больше, чем волокон группы III. Тела С-аксонов малы по размеру (диаметр менее 40 мкм в дорсальных ганглиях крыс), не содержат нейрофиламентов, в них обнаруживается множество внутриклеточных пептидов и белков (рецепторы, ферменты и нейро¬ трансмиттеры).Цитоархитектоника задних рогов спинного мозга состоит из 10 пластин (по Rexed В,, 1952). Из них I-VI пластины образуют дорсальный рог, VII-IX пласти¬ ны — вентральный, X пластина окружает спинномозговой канал. Специфические
БОЛИ в ГРУДНОЙ КЛЕТКЕ 179ноцицептивные соматические нейроны обнаружены в поверхностных I-II пла¬ стинах дорсального рога. Другие пластины содержат нейроны, отвечающие одно¬ временно на болевые и не болевые раздражения кожи, т.е. содержат нейроны широкого динамического диапазона. Важно отметить, что болевые импульсы от внутренних органов входят в наружные отделы дорсальных рогов, т.е. пластиныI и II, где создаются условия для центральной висцеро-соматической конверген¬ ции болевых импульсов. Эти механизмы конвергенции лежат в основе развития отражённой боли, присущей висцеральным болевым синдромам.Клинические наблюдения внесли большой вклад в понимание механизмов висцеральной боли. Впервые Ritchie описал феномен гипералгезии при синдроме раздражённого кишечника (СРК) [32]. В развитии гипералгезии участвуют как центральные, так и периферические механизмы. Периферические механизмы связаны с сенситизацией нервных окончаний, а центральные — с повышенной возбудимостью («взвинчивание» или «wind-up-феномен») спинномозговых и супраспинальных нейронов [3, 8]. Под сенситизацией понимается возрастание рецепторного ответа при повреждении (воспалении) ткани, в ряде случаев в соче¬ тании со спонтанной активацией и снижением порога возбуждения. При развитии состояния сенситизации стимулы, которые в норме не вызывают боли, начинают восприниматься как болевые (аллодиния), а болевые стимулы — как гиперболе- вые [38].Химические вещества, вызывающие сенситизацию рецепторов, разнообразны[38]. Многие из них выделяются из повреждённых клеток или клеток, участвую¬ щих в развитии воспаления. В эту группу веществ входят амины (гистамин, серо¬ тонин), пептиды (субстанция Р, пептид ассоциированный с геном кальцитонина), кинины (брадикинин), нейротрофины и цитокины, простагландины и лейкотрие¬ ны, аминокислоты (глютамат) и свободные радикалы, а также АТФ. Важную роль играет снижение pH в межклеточном пространстве. Максимальный эффект сенси¬ тизации нервных волокон был отмечен при инстилляции «коктейля» медиаторов боли, участвующих в развитии «нейрогенного воспаления», в частности серотони¬ на, гистамина, брадикинина и ПГЕ^ в условиях низкой pH (6,1) [39]. Вряд ли одно из веществ может бьггь полностью ответственно за развитие этого феномена.Вся ноцицептивная информация в составе спиноталамического, спиноретику¬ лярного и спиномезэнцефалического трактов направляется к таламусу и по лучи¬ стому венцу достигает посгцентральной извилины коры головного мозга (S ^ ц,, или поля 1-3 по Брод манну).Висцеральные боли, возникающие при поражении внутренних органов, прин¬ ципиально отличаются по своим характеристикам от болей соматического гене¬ за. Висцеральные боли имеют протопатический характер, часто иррадиируют в соматические структуры, сопровождаются выраженными двигательными, веге¬ тативными и психоэмоциональными реакциями. Большинство этих признаков отмечается, например, при классической стенокардии (ишемии миокарда). Боль, возникающая при поражении других внутренних органов (например, пищевода), в значительной мере похожа на боль при стенокардии, что затрудняет дифференци¬ альную диагностику. Эти черты висцеральной боли обусловлены особенностями иннервации внутренних органов грудной полости,Внутригрудные органы имеют двойную иннервацию. Органы грудной полости иннервируются афферентными волокнами как блуждающего нерва, тела нейронов которого находятся в верхнем (g.jugulare) и нижнем (g. nodosae) узлах блуждающе¬ го нерва, так и спинномозговыми нервами. В отличие от соматических структур, афферентные волокна которых достигают ЦНС по спинномозговым нервам, аффе¬ рентная иннервация внутренних органов достигает центральных отделов нервной (всгемы двумя путями: через ядра солитарного тракта (стволовая афферентация) и через задние рога грудного отдела спинного мозга (спинномозговая афферента-f
180ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕция). Это создает условия для взаимодействия между сигналами, поступающими в ЦНС по разным каналам, и лежит в основе феномена модуляции (от лат. modula¬ tion — размеренность; закономерное изменение) болевых ощущений.Другие отличия в иннервации соматических и висцеральных структур каса¬ ются плотности болевых рецепторов и межнейронных связей в спинном мозге. Отмечено, что количество висцеральных афферентных волокон значительно меньше, чем соматических (например, в задних корешках грудного и поясничного отделов спинного мозга их количество не превышает 10%) [18]. Вместе с тем цен¬ тральные терминали висцеральных афферентов образуют многочисленные раз¬ ветвления (синапсы). Перед переключением на вторые нейроны, расположенные в сером веществе задних рогов спинного мозга, они в составе тракта Лиссауэра поднимаются или опускаются на высоту нескольких сегментов спинного мозга. Это нарушает дискриминационное чувство, и висцеральная боль воспринимается как тупая, плохо локализованная или протопатическая боль.Предложенная в ]965 г. Мелзаком и Уоллом теория «воротного контроля» спи¬ нальной переработки ноцицептивной информации [42] постулировала, что тормо¬ жение ноцицептивных нейронов задних рогов обусловлено возбуждением толстых неноцицептивных афферентов («ворота закрыты»), а активацию их — возбуж¬ дением тонких ноцицептивных афферентов («ворота открыты»). Считалось, что такое торможение генерируется в студенистом веществе заднего рога спинного мозга (П пластина) и обеспечивается пресинаптическим тормозным механизмом. Многие положения этой теории сегодня уточняются и дополняются. В настоящее время подтверждено, что передача ноцицептивной информации модулируется электрической или химической стимуляцией среднего или продолговатого мозга. Если первоначально основное внимание было привлечено к тормозному нисхо¬ дящему влиянию, то в последующем было описано и активирующее нисходящее воздействие, которое играет важную роль в развитии и поддержании вторичной гипералгезии [43].Из химических веществ в эндогенной системе подавления болей наиболь¬ шую роль играют опиатные рецепторы (ц-рецепторы) и связывающиеся с ними лиганды (эндорфины, энкефалины, динорфины), вырабатываемые самим орга¬ низмом при определённых видах стимуляции нервной системы. В регуляции боли принимают участие и неопиоидные рецепторно-гуморальные системы, различаю¬ щиеся по своим нейротрансмитгерам — адренергическая, серотонинергическая и ГАМК-ергическая.Таким образом, в процесс формирования боли вовлечено большое число раз¬ личных химических веществ, которые условно можно разделить на две группы — вещества, вызывающие боль (медиаторы боли), и вещества, уменьшающие боль (модуляторы боли). Ощущение боли — это комбинация индивидуального взаимо¬ действия этих веществ, многие из которых влияют друг на друга.Болевые синдромыИсточником болевых ощущений в груди могут быть грудная стенка или органы грудной клетки. Причины болей можно сгруппировать следующим образом:• патология органов дыхания;• костно-мышечная патология;• заболевания сердца и крупных сосудов;• болезни органов пищеварения;• нервно-психические расстройства.На практике нередко имеет место комбинация причин.Причины острой боли в грудной клетке, по данным ряда исследований, пред¬ ставлены в табл. 11-1 [10-12].
БОЛИ В ГРУДНОЙ КЛЕТКЕ 181Таблица 11-1. Причины болей в груди у амбулаторных больныхЗаболеванияASPN(19S0) [11]MIRNET(1994) {12]STARNETÍ1997) [13]Всего больных83251Желудочно-кишечные114 (14%}18,9%5 (9%)Костно-мышечные239 (28%)36,2%9 (17%)Психические62 (7%)7,5%19 (35%)Респираторные36 (4%)5,1%2 (4%)Сердечно-сосудистые287 (34%)16,1%4(7%)Другие заболевания94(11%)16,1%12 (22%)Учитывая анатомическую близость органов грудной полости и особенности их иннервации, становится понятной природа «перекреста» болевых синдромов, возникающих при их поражении. Конвергенция висцеральных и соматических афферентов на ноцицептивных нейронах спинного мозга приводит к тому, что при поражении большинства внутренних органов боль отмечается в зоне шести груд¬ ных дерматомов (Т^-Т^) [44,45].Патология органов дыханияПЛЕВРИТЫНаиболее своеобразная по своим клиническим проявлениям боль возникает при воспалении париетальной плевры. Паренхима лёгких и висцеральная плевра не имеют ноцицепторов. При воспалении париетального листка плевры возникают характерные боли, проводящиеся по соматическим (межрёберным) нервам. При поражении париетальной плевры купола диафрагмы возможна иррадиация боли в плечо и шею (точки Мюссе) за счёт раздражения диафрагмальных нервов.Больных беспокоит лихорадка, боли в грудной клетке. Выслушивается шум трения плевры, который может быть плевральным или плевроперикардиальным. Плевральные боли усиливаются при кашле и глубоком дыхании. Пациенты часто занимают вынужденное положение, лёжа на больном боку, тем самым ограничи¬ вая подвижность грудной клетки.Острота развития болевого синдрома позволяет судить о его этиологии. Внезапная боль характерна для травмы или пневмоторакса. Острая боль в сочетании с одышкой подозрительна в отношении тромбоэмболии лёгочной артерии (ТЭЛА). Подострые боли в сочетании с лихорадкой и ознобами характерны для пневмонии (чаще пневмококкового генеза). Рецидивирующие острые боли плеврального типа отмечаются при периодической болезни. Постепенное развитие болевого синдрома (дни, недели) в сочетании с лихорадкой, слабостью, потливостью в ночное время и похуданием характерно для туберкулёза или опухолевого поражения плевры. Поражение плевры — частый симптом при синдроме Дресслера.ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯПри лёгочной гипертензии могут возникать боли давящего или сжимающего характера за фудиной с иррадиацией в плечо, шею — «angina hypercyanotica^ или ♦синдром правожелудочковой грудной жабы» [46, 47]. Боли возникают как при остром (например, при ТЭЛА), так и при хроническом (например, при ХОБЛ или шггральном стенозе) повышении давлен11я в лёгочной артерии. Почти половина
182 ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕбольных с первичной лёгочной гипертензией также отмечают периодически воз¬ никающие боли за грудиной.Механизмы развития болевого синдрома у этой группы больных различны. При массивной ТЭЛА боли могут быть обусловлены внезапным растяжением лёгочной артерии с раздражением её механорецепторов. При хронической гипертензии боли обусловлены развитием гипертрофии правого желудочка с относительной недо¬ статочностью его кровоснабжения или сдавлением левой коронарной артерии рас¬ ширенным лёгочным стволом. Хотя при ТЭЛА возможны боли за грудиной, более характерны для этого заболевания боли плеврального генеза, нередко возникающие и без признаков инфаркта лёгкого (инфарктная пневмония возникает менее чем в 10% случаев эмболии в сосуды малого круга кровообращения). Предположеть ТЭЛА позволяет классическая тетрада признаков: кровохарканье, тахипноэ, тахикардия, лихорадка. У большинства больных отмечается снижение АД, одышка без ортопноэ. Боли за грудиной отмечаются при стенозе лёгочной артерии. Возникновение болей в груди при диспозиции подключичного катетера свидетельствует о том, что источ¬ ником болей могут являться и крупные венозные сосуды.ТРАХЕОБРОНХИТБоли за грудиной отмечаются при поражении трахеи или крупных бронхов. Они носят саднящий или царапающий характер, усиливаются при глубоком дыхании, В основе их чаще лежит острый вирусный трахеобронхит, реже — опухолевое поражение трахеи или крупного бронха. Неприятные ощущения за грудиной может испытывать и здоровый человек в случае гипервентиляции. Боли трахеаль¬ ного типа удалось спровоцировать ингаляцией или внутривенной инъекцией раз¬ личных химических агентов [48], что, по-видимому, обусловлено раздражением бронхиальных С-афферентов, причём эти боли купировались блокадой блуждаю¬ щего нерва или после ваготомии.Костно-мышечная патологияПОРАЖЕНИЕ ГРУДНОЙ СТЕНКИВоспаление или травмы суставов, мышц, сухожилий, костных структур, фасций грудной клетки нередко служат причиной болей в грудной клетке. По данным одного исследования, патология грудной стенки была выявлена у 58 (31%) из 186 больных, госпитализированных по поводу болей в грудной клетке [49]. Среди воз¬ можных причин следует отметить фибромиалгию, анкилозирующий спондилит, ксифоидию, мигрирующий тромбофлебит вен грудной стенки (болезнь Мондора). Причиной боли по ходу рёбер могут оказаться травмы и метастатические пораже¬ ния рёбер. Своеобразный болевой синдром развивается при воспалении рёберных хрящей у места их прикрепления к грудине (синдром Титце). Боли обычно тупые, не связаны с дыханием, беспокоят по ночам. Диагностике помогает локальная болезненность в области хрящей, а иногда — покраснение кожи и припухлость в области грудино-рёберных сочленений. Возможными причинами боли в грудной клетке служат рефлекторные мышечно-фасциальные синдромы (синдром перед¬ ней грудной стенки, межлопаточный болевой синдром, синдром малой грудной мышцы и др.), причину которых установить удаётся не всегда. Одной из причин болей в грудной клетке у септических больных является инфекционный артрит грудино-ключичного сустава.МЕЖРЁБЕРНАЯ НЕВРАЛГИЯМежрёберная невралгия также может служить одной из причин развития болей в грудной клетке. В этом случае нередко отмечается и поражение нервных корешков (радикулит). Боли при невралгии лёгко воспроизводятся при паль¬
БОЛИ 8 ГРУДНОЙ КЛЕТКЕ 183пации по ходу межреберий и в точках Валле, они усиливаются при поворотах туловища, работе руками. Нередко обнаруживают рентгенологические признаки остеохондроза щейно-грудного отдела позвоночника. В диагностике помогает правильная оценка болей (при развитии радикулита они не связаны с ходьбой), а также выявление зон кожной гипер- или гипоалгезии. В ряде случаев в зоне соот¬ ветствующего дерматома появляются везикулярные высыпания (опоясывающий лищай) [50]. Развитие болезненного радикулита также описано в дебюте болезни Лайма [51].СИНДРОМ ВЕРХНЕЙ АПЕРТУРЫ ГРУДНОЙ КЛЕТКИСиндром верхней апертуры грудной клетки возникает вследствие сдавления подключичных сосудов и плечевого сплетения на уровне верхнего выходного отверстия грудной клетки между первым ребром и ключицей. Для этого синдрома характерны жгучие боли (симпаталгии) и парестезии в грудной клетке, шее, плече, предплечье, кисти (в зоне иннервации корешков Cjj-Tj), а также слабость, отёк и побледнение кисти и пальцев. Иногда у больных развивается синдром Горнера- Бернара (птоз, миоз, энофтальм, нарушение слезоотделения). Одной из возмож¬ ных причин развития синдрома верхней апертуры является периферический рак лёгкого (чаще плоскоклеточный) с синдромом Панкоста. Локализация оп)псоли в верхушке лёгкого в этом случае приводит к её прорастанию в плечевое сплетение, симпатическую цепочку, звёздчатый узел, верхние рёбра, тела позвонков. Развитие синдрома Панкоста может бьггь обусловлено увеличенргем щитовидной железы (кисты, рак), поражением верхушек лёгких при туберкулёзе, реже — при других инфекциях [52], Среди более редких причин развития этого синдрома отмечают наличие добавочного шейного ребра, гипертрофию передней лестничной мышцы, аномалию I ребра, ключицы или поперечного отростка VH шейного позвонка, а также аномальное расположение правой подключичной артерии [53].Сердечно-сосудистые заболеванияИШЕМИЯ МИОКАРДАБоль при ишемии миокарда имеет особенности, которые важно з^итывать в диагностике. В 80-90% случаев она ощущается как давящая или сжимающая и локализуется за грудиной или чуть влево от неё. Пациент не может указать паль¬ цем на участок болей. С этой целью он сжимает руку в кулак и прикладывает её к грудине. Боли часто иррадиируют в шею, в нижнюю челюсть, в руки, особенно левую, вдоль её локтевого края.Ишемия миокарда возникает при несоответствии между потребностью миокар¬ да в кислороде и его доставкой по коронарным артериям. Патологические изме¬ нения коронарных сосудов варьируют от атеросклеротической бляшки до тромбо¬ тической окклюзии, что определяет клиническую форму заболевания от эпизодов безболевой ишемии до трансмурального инфаркта миокарда.В случаях стенокардии загрудинные боли возникают на высоте физической нагрузки, исчезают через 2-5 мин после её прекращения или приёма нитрогли¬ церина. К нестабильной стенокардии (острому коронарному синдрому) относят впервые возникшую и прогрессирующую стенокардию напряжения. В современ¬ ной классификации выделяют два варианта инфаркта миокарда: инфаркт мио¬ карда с подъёмом сегмента ST и инфаркт миокарда без подъёма сегмента ST [54]. Они отличаются по подходам к лечению и прогнозу. Боль при инфаркте миокарда шггенсивная, возникает в покое и купируется введением наркотических анальге¬ тиков. Важным признаком инфаркта является выраженная вегетативная симпто¬ матика (тошнота, рвота, потливость и др.) [55],тй
184 ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕПо данным коронарографии, у 10-20% больных со стенокардией не обнаружива¬ ется значимого сужения коронарных артерий (кардиальный синдром X), а отмечает¬ ся депрессия сегмента ST во время физической нагрузки. По данным МРТ оказалось, что в основе болей при этом лежит ишемия субэндокардиальных слоев миокарда [31]. Считается, что в основе микроваскулярных нарушений лежит дисфункция эндотелия, продуцирующего мощные вазоконстрикторы, такие как эндотелии-1.Ищемия миокарда не всегда ведёт к боли. До 40% зафиксированных на ЭКГ приступов ишемии у больных с выраженным атеросклерозом коронарных арте¬ рий и стенокардией являются безболевыми, вероятно под влиянием центральных модуляторных механизмов. Инфаркт миокарда также может протекать без боли (наиболее часто при сахарном диабете, для которого характерен синдром вис¬ церальной гипестезии). Связь боли с физической нагрузкой требует проведения дифференциальной диагностики стенокардии со спонтанным пневмотораксом и приступами астмы физического усилия. Другие болезни миокарда, не связанные с нарушением коронарного кровотока, также могут сопровождаться болями в грудной клетке. Среди них описаны больные пролапсом митрального клапана, миокардитом и кардиомиопатиями [53],ПЕРИКАРДИТВ перикарде находится небольшое количество болевых рецепторов, главным образом в диафрагмальных отделах его париетального листка. Ноцицептивные волокна от перикарда идут в составе диафрагмальных, межрёберных и, возможно, симпатических нервов. При их раздражении отмечается острая или длительная боль в области сердца, отдающая в верхний латеральный край т. trapezius (спец¬ ифичный признак). Боли при перикардите могут бьггь плеврального характера (чаще слева), что связано с распространением воспаления на прилежащую плев¬ ру. Нередко боль при перикардите ошибочно принимают за стенокардию, хотя при нём OTqT'CTByeT типичная для стенокардии иррадиация и связь с физической нагрузкой. Боли при перикардите усиливаются в положении лёжа, на левом боку и уменьшаются в сидячем положении, наклоне кпереди или на правом боку. Характерны шум трения перикарда, лихорадка, лейкоцитоз.Причинами развития перикардита могут быть инфекции (чаще вирусные), диф¬ фузные заболевания соединительной ткани (например, системная красная волчан¬ ка, ревматоидный артрит), тяжёлая уремия. Перикардит в сочетании с лихорадкой может отмечаться у больных после операции на сердце (постперикардиотомиче- ский синдром) или инфаркта миокарда (синдром Дресслера), что связано с разви¬ тием аутоиммунных нарушений. Если причину перикардита установить не удаётся, то болезнь рассматривается как идиопатическая.БОЛЕЗНИ АОРТЫБоли по типу стенокардии отмечаются при выраженном стенозе устья аорты. При стенозе устья аорты боли в грудной клетке отмечаются чаще, чем при других пороках сердца. В их генезе важную роль играют такие факторы, как укорочение диастолы, ограничение коронарного кровотока. При недостаточности аортального клапана ведущим механизмом боли считается низкое диастолическое давление в аорте в сочетании с коронарным атеросклерозом. Классические приступы стено¬ кардии могут быть следствием сифилитического аортита или болезни Такаясу.Расслаивающая аневризма аорты ведёт к развитию болей в грудной клетке, при¬ чём частота диагностических ошибок при этом заболевании достаточно высока. Сильнейшие боли при этом возникают внезапно («как удар кинжалом»), сразу же достигая своего максимума. Кроме того, характерны иррадиация болей в спину, постепенная миграция боли в нижние отделы живота и ноги, асимметрия пульса и артериального давления на руках и ногах, значительное расширение тени дуги аорты на рентгенограмме.
БОЛИ В ГРУДНОЙ КЛЕТКЕ 185ИНТОКСИКАЦИЯ КОКАИНОМОдной из возможных причин госпитализации больных в блок интенсивной терапии (БИТ) является интоксикация кокаином. При этом больные жалуются на боли, требующие исключения инфаркта миокарда. По клиническим данным, отвергнуть инфаркт миокарда у этих больных, как правило, не удаётся. Кокаин способен вызывать некрозы в миокарде вследствие повышения потребности мио¬ карда в кислороде и спазма коронарных артерий. Больным инфарктом миокарда крайне редко задают вопросы о наркомании, хотя это имеет принципиальное значение, поскольку р-блокаторы, широко использующиеся в лечении больных инфарктом миокарда, противопоказаны этой группе пациентов [56].Болезни органов пищеваренияЗАБОЛЕВАНИЯ ПИЩЕВОДАБолезни пищевода у людей молодого и среднего возраста могут вызывать боли в грудной клетке. Как отмечалось выше, ноцицепторы не были обнаружены в пищеводе, однако были выявлены низко- и высокопороговые механорецеп¬ торы, хеморецепторы и терморецепторы, которые при раздражении вызывали появление боли в грудной клетке. По своим характеристикам эти боли в зна¬ чительной мере напоминают боли при истинной стенокардии. Купирующий эффект нитроглицерина ещё больше затрудняет дифференциальную диагности¬ ку. Сопровождающие боль изжога, дисфагия, боли при глотании, срыгивание пищей, похудание указывают на возможную патологию пищевода, среди которой могут быть эзофагит, опухоли, гастроэзофагеальный рефлюкс, диффузный спазм пищевода, ахалазия пищевода. Важную роль в генезе болевого синдрома играет вторичная гипералгезии вследствие заброса кислого содержимого в нижние отделы пищевода,ДРУГИЕ ЗАБОЛЕВАНИЯКак при бактериальной пневмонии могут ощущаться боли в животе, так и при некоторых заболеваниях брюшной полости (холецистит, язвенная болезнь, острый панкреатит, нарушения моторики кишечника) могут возникать боли в нижних отделах грудной клетки. Одной из труднейших задач остается дифферен¬ циальная диагностика инфаркта миокарда и острого панкреатита. Повышение уровня панкреатических ферментов в крови и моче характерно для последнего, однако их нормальный уровень не исключает возможности развития у больного геморрагического панкреатита.Нервно-психические заболеванияСреди амбулаторных больных психогенная природа болей была установлена у 7-35% больных [10-12]. После того как Da Costa (1871) во время Гражданской войны в США впервые описал «возбудимое сердце солдата», многие исследо¬ ватели отмечали у больных аналогичную симптоматику. В настоящее время это заболевание чаще называется «неврастенией», «нейроциркуляторной астенией», «астеническим неврозом» [57]. Оно проявляется такими признаками, как кар¬ диалгия, сердцебиение, одышка, слабость, различные фобии. Ранее предполага¬ лось, что в основе появления этих жалоб лежит гипервентиляция, однако тест из 20 глубоких дыханий вызывает указанные симптомы лишь у половины больных веврастенией. Более поздние исследования показали тесную связь кардиалгии с тревожными расстройствами, в частности с паническими атаками и депрессией. Механизмы этой связи предстоит уточнить. В настоящее время ясно, что назначе- Ю1е психотропных препаратов приносит облегчение этой группе больных.
яШ1Ш186 ОСНОВНЫЕ симптомы респираторных заболеваний и их лечениеДифференциальная диагностикаУчитывая разнообразие заболеваний, сопровождающихся болью в грудной клет¬ ке, выяснение её причины порой напоминает ращение головоломки. Приходится сопоставлять множество фактов — данные анамнеза, факторы риска, результаты физикального, инструментальных (ЭКГ и др.) и лабораторных исследований.При жалобах на боли в грудной клетке важно выделить больных, которым требуется неотложная помощь. Это больные инфарктом миокарда, нестабильной стенокардией, напряжённым пневмотораксом, расслаивающей аневризмой аорты или ТЭЛА. Боль внимательно оценивается по основным параметрам: характер боли, её локализация, иррадиация, временные характеристики, факторы, облег¬ чающие или усиливающие боль, сопутствующие симптомы. Следует помнить, что сильные боли чаще свидетельствуют о неблагоприятном прогнозе.Склониться Б пользу того или иного диагноза помогает тщательная оценка фак¬ торов риска [58]. Например, факторами риска расслаивающей аневризмы аорты служат высокая артериальная гипертензия, врождённая или приобретённая пато¬ логия дуги аорты, системные заболевания соединительной ткани, беременность и курение. Риск развития ИБС можно оценить с помощью специально разработан¬ ных для этих целей компьютерных программ [60]. Для диагностики отдельных заболеваний существуют специально разработанные алгоритмы, например извест¬ ный протокол СоМтап Ь. позволяет с высокой степенью достоверности диагно¬ стировать инфаркт миокарда (чувствительность 88%, специфичность 74%) [59].Физикальное обследование позволяет выявить признаки поражения плевры, лёгких, грудной стенки, клапанных пороков сердца. Выраженный цианоз свидетель¬ ствует о гипоксемии вследствие респираторных нарушений или низкого сердечного выброса. Холодный липкий пот наблюдается у больных инфарктом миокарда, рас¬ слаивающей аневризмой аорты. Тревога и беспокойство встречаются при опасных для жизни заболеваниях, при панических атаках. Тахикардия характерна для тревожных состояний, инфаркта миокарда, пневмоторакса, ТЭЛА. Брадикардия нередко отмечается у хорошо физически тренированных лиц или при инфаркте миокарда. На фоне артериальной гипертензии часто развиваются острые сердечно¬ сосудистые осложнения, а гипотензия более характерна для инфаркта миокарда, массивной ТЭЛА или напряжённого пневмоторакса. Резкое падение АД при приёме нитроглицерина характерно для инфаркта миокарда правого желудочка. Следует отметить, что АД должно быть тщательно измерено на обеих руках и ногах, что в определённьк ситуациях позволяет исключить расслаивающую аневризму аорты. Боли в груди часто сопровождаются одышкой, а выраженное тахипноэ встречается при приступах паники, инфаркте миокарда, ТЭЛА, пневмотораксе, поражении плев¬ ры и других респираторных нарушениях (табл. 11-2).При обследовании грудной клетки может отмечаться одностороннее ослабление дыхания, смещение трахеи в здоровую сторону, характерные для пневмоторакса. Шум трения плевры свидетельствует о патологии плевры, а признаки консоли¬ дации лёгочной ткани — о пневмонии или ТЭЛА. Двусторонние влажные хрипы, локализация которых меняется при изменении положения тела, характерны для сердечной недостаточности. При выслушивании сердца может не быть изменений, однако III тон сердца (ритм галопа), острая митральная недостаточность (дис¬ функция папиллярных мышц) встречаются при инфаркте миокарда. Шум трения перикарда свидетельствует о перикардите. Пальпация грудной клетки, плечевого пояса, живота имеет важное диагностическое значение. В том случае, если боль вос¬ производится при пальпации грудной клетки, следует думать о нервно-мышечной патологии. Тщательный осмотр и пальпация голеней позволяют выявить признаки тромбоза глубоких вен у больных ТЭЛА. Частые глубокие вдохи, неудовлетворён¬ ность дыханием, признаки беспокойства и продолжительная «тяжесть» в грудной клетке указывают на психогенную природу болезни.
Таблица 11>2. Дифференциальный диагноз при болях в грудной клеткеДиапюзБольХарактер болиЭКГРентгенологические данныеПрочееВнезапная больСтенокардияЗагрудинная, сжи¬ мающаяПреходящая {при нафузке)Очаговая депрессия ST {?)НормаКупируют нитратыИнфаркт миокардаЗагрудинная, давящаяПостоянная (в покое), страх смертиОчаговый подъём ST (?)Застой крови (?), кардиоме- галия (?)Купируют наркотики, гипотензия, тропонин ТТЭЛАПлевральнаяВнезапная, одышка {без ортоп¬ ноэ)Синдром SI, QUI, право- граммаНорма, инфильтрат (?), выпот в плевруФакторы риска венозного тром¬ бозаПневмонияПлевральнаяНачало: часы, минутыНормаЛёгочный инфильтрат ¡уплот¬ нение)Лихорадка, кашель с мокрогтойПневмотораксОстраяВнезапная, одышкаНормаКоллапс лёгкогоАстеники, рецидивы (?)ПерикардитПлевральнаяС любой стороныДиффузный подъём STКардиомегалия {?)Ослабление: сидя, наклон кпередиПостепенная больРасслоение аортыЗагрудинная как «удар кинжала*Отдает в спину, мигрирует в жиеот, страх смертиГЛЖ, нижний инфаркт миокарда (?)Расширение средостенияАсимметрия пульса, АДСпазм пищевода, рефлюксЗагрудинная. после едыПо типу стенокардии (?), изжо¬ га (?)Норма, изменения ST, ГНормаКупируют; нитраты, антацидыСиндром титцеТупая, локальнаяУсиление при кашле, глубоком дыханииНормаНормаЛокальная болезненностьГерпесОстрая, с одной сто¬ роныДизестезияНормаНормаВезикулярная сыпьгпоПримечание: ГЛЖ— гипертрофия левого желудочка, НАК — недостаточность аортального клапана, ? - вероятный признак.
“Я188 ОСНОВНЫЕ симптомы РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И ИХ ЛЕЧЕНИЕПри оценке ЭКГ важно не пропустить признаки крупноочаговых изменений миокарда (подъём сегмента 5Г, реципрокные изменения, зубцы О, аритмии), острого перикардита (подъёмы сегмента 8Т во многих отведениях, депрессия сег¬ мента Р1?), ТЭЛА (синдром блокада правой ножки пучка Лиса, смещение оси вправо, перегрузка предсердий), пневмоторакса (смещение оси сердца). Следует помнить, что почти у 20% больных инфарктом миокарда при обращении за меди¬ цинской помощью изменения на ЭКГ отсутствуют. Диагностика расслаивающей аневризмы аорты, ТЭЛА, пневмоторакса значительно облегчается при проведении рентгенографии, КТ органов грудной клетки. При исключении острых состояний проводится дальнейшая дифференциальная диагностика.ЛечениеЭффективность лечебных мероприятий зависит от точности диагноза. Существует множество клинических рекомендаций по ведению больных с инфар¬ ктом миокарда, ТЭЛА и другими неотложными состояниями в условиях ста¬ ционара. Вместе с тем по ведению больных кардиалгией существуют лишь самые общие рекомендации. При подозрении на ГЭРБ, например, показан пробный курс лечения омепразолом. О положительных результатах теста говорят при уменьше¬ нии клинических симптомов ГЭРБ в течение первых 3-5 дней после ежедневного приёма 40 мг омепразола. Многим больным с хронической болью неясного генеза помогает психотерапевтическое воздействие.ЗаключениеПроблема боли крайне актуальна в современной медицине, поскольку ухудшает качество жизни человека, а в ряде случаев она представляет непосредственную угрозу для его существования. Боль прошла длительный путь биологической эволюции и сформировалась как многоуровневая система ноцицепции. Болевые ощущения связаны с рядом физиологических процессов, которые активно изуча¬ ются в настоящее время. Болевой синдром в грудной клетке требует исключения таких жизнеугрожающих заболеваний, как инфаркт миокарда, нестабильная сте¬ нокардия, пневмоторакс, расслаивающая аневризма аорты, ТЭЛА. Висцеральный характер большинства болевых синдромов в грудной клетке затрудняет диагно¬ стику заболеваний по клинической картине. Пути диагностики и лечения болевых синдромов постоянно совершенствуются.список ЛИТЕРАТУРЬи^
РАЗДЕЛ IVИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХГлава 12. Вирусные инфекции дыхательных путейГлава 13. Бактериальная пневмонияГлава 14. Острый абсцесс и гангрена лёгкихГлава 15. Туберрёз и другие микобактериальные инфекцииГлава 16. Микозы лёгкихГлава 17. Паразитарные заболевания ®
Глава 12Вирусные инфекции дыхательных путейВведениеОстрые респираторные вирусные инфекции (ОРВИ) — самые распространённые заболевания и составляют до 90% от всех других инфекционных болезней, в России ежегодно регистрируется от 27,3 до 41,2 млн больных, из них 45-60% дети. В мире, по данным ВОЗ, ежегодно болеют гриппом 5-10% взрослых и 20-30% детей; от вирусассоциированных осложнений умирают от 250 ООО до 500 ООО человек, а экономический ущерб оценивается 1-6 млн долларов США на 100 ООО населения [1]. В России экономические потери от гриппа и других ОРВИ составили 82,6 млрд рублей (2004 г.) или 86,0% от ущерба, наносимого инфекционными болезнями в целом.В структуре ОРВИ основное место занимает грипп, который ассоциируется с высоким уровнем заболеваемости, значительными экономическими затратами и летальностью. По данным ВОЗ, 60% летальных случаев связано с вирус-ассоциированными осложне¬ ниями — пневмонией, поражением ЦНС, сепсисом. Серьёзную опасность грипп представляет для детей первого года жизни, пожи¬ лых людей, а также лиц с сопутствующими заболеваниями сердца, лёгких, сахарным диабетом, другой хронической патологией и является причиной избыточной смертности, составляющей от 104 до 870 случаев на 100 ООО населения [2].Острые респираторные вирусные заболевания остаются неконтро¬ лируемыми инфекциями, что связано с антигенной изменчивостью, прежде всего, вирусов гриппа и отсутствием вакцинопрофилактики при других ОРВИ. Заболевания объединены в одну группу ОРВИ по единому воздушно-капельному механизму передачи возбудителя и развитию основного патологического процесса в респираторном тракте больного со сходными клиническими симптомами.Вирусы, вызьшающие острые респираторные заболевания, относят¬ ся к разным таксономическим семействам, различаются по структуре и биологической характеристике. Патогенные для человека респи¬ раторные вирусы таксономически входят в пять вирусных семейств [РНК-содержащие: Orthomyxoviridae, Paramyxoviridae, Picomaviridae, Coronavtridae] ДНК-содержащие: Adenoviridae, представленные семью родами {Ir^uenzavirus, Paramyxovirus, Pneumovirus, Rhinovirus, Enterovirus, Coronavirus, Mastadenovirus), Parvoviridae (Bocavirus)]. В настоящее время насчитывается более 200 охарактеризованных
192 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХвирусов, вызывающих заболевания респираторного тракта, особенности клини¬ ческой картины каждого из них обусловлены тропизмом вирусов к определённым участкам дыхательных путей (табл. 12-1), Репликация и репродукция вирусов гриппа, парагриппа, респираторно-синцитиального, рино- и коронавирусов ограни¬ чивается респираторным трактом, аденовирусы и энтеровирусы размножаются как в респираторном, так и в желудочно-кишечном тракте, нередко с проникновением в ЦНС.В последние годы от больных людей были изолированы и идентифициро¬ ваны ранее неизвестные вирусы из семейств Parvovints (бокавирус — HBoV), Paramyxovirus (метапневмовирус человека — hMPV) и три коронавируса, вызы¬ вающие тяжёлое поражение нижних отделов респираторного тракта, в том числе и тяжёлый острый респираторный синдром (ТОРС) [3,4].Отмечаются существенные изменения эпидемиологического процесса при гриппе, для которого стали характерными длительная циркуляция антигенно¬ родственных вариантов вирусов гриппа А и В, увеличение доли иммунного насе¬ ления. В последние годы эпидемическая ситуация в мире осложнилась случаями инфицирования людей вирусами гриппа птиц: А (H5N1), А (H7N7), А (H9N2). Высокопатогенный вирус гриппа птиц подтипа H5N1 вызвал чрезвычайно тяжё¬ лые клинические формы заболевания у людей с высокой летальностью во многих странах Юго-Восточной Азии. Сложившаяся ситуация представляет опасность в плане формирования нового пандемического варианта вируса, что может приве¬ сти к многократному росту заболеваемости, когда может заболеть каждый второй житель планеты, и по меньшей мере 10-кратному росту летальности [5].Таблица 12-1. Вирусные заболевания респираторного трашОсновные симптомы пораже¬ ния респираторного трактаВирусыСемейство (род)Ринит, фарингитРиновирусыPicomaviridae (Rhinovirus)РинофарингитЭнтеровирусы (Коксаки А21: 81,3,4, 5; ЕСНО'Вирусы 4, 8, 20 и др.)Picomaviridae (Enterovirus)Геморрапический коньюнюивитЭнтеровирус 70, Коксаки А24, ЕСИО-вирус 7Picomaviridae (Enterovirus)Трахеит, ринофарингитГрипп А, В. СOrthomyxoviridae {fnduenzavirus A, B, C)Геморрагический отёк лёгкихгрипп А, В,Вирус гриппа А птиц Н5М1Orthomyxoviridae (Influerizavirus A, B)ЛарингитПарагрипп 1-4Paramyxoviridae(Paramyxovirus)Бронхит, бронхиолит, пнев¬ монияРеспираторно-синцитиальныйМетапнеамовирусБокавирусParamyxoviridae (Pneumoms, Meiapneumovirus}; Par^avihdae (Bocavirus)Фарингит, конъюнктивит, кератит эпидемическийНА(1У-А12,18, 31;НДаУ-ВЗ, 7, 11, 14, 16, 21,34,35,50; НДс1У-С1, 2, 5, 6;НАс1У-08, 9, 10, 13, 15, 17. 19. 20, 22-30, 32, 33, 36-39, 42-49, 51;НАс1У-Е4;НАЙУ-Р40, 41Adenoviridae (Adenovirus)
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 103Окончание табл. 12- íФарингит, гастроэнтерит, коронавирусная «атипичная» пневмонияКоронавирусы, Коронавирус SARS-CoVCoronaviádae (Coromvim}Мононуклеоз, фарингитВирус Эпштейна-БаррHerpesviridae(Lymphocrypíovims)Кардио-пульмонарныйСин-НомбреBunyavííidae (Hantavirus)синдромГриппЭпидемии гриппа известны очень давно. Ещё Гиппократом в 412 г. до н.э. опи¬ саны гриппоподобные заболевания, но достоверные данные появились гораздо позднее. Описания эпидемических вспышек встречаются в документах 1510 г., а пандемии — в 1580 г. В XIX веке описаны 12 крупных подъёмов заболеваемости, 8 из которых по масштабу приближались к пандемии или крупной эпидемии. Однако достоверные данные о возникновении эпидемии гриппа, получены тогда, когда стала возможна изоляция вируса.Начало системному изучению гриппа положило выделение вируса гриппа A/WS/33/H1N1 в 1933 г. W. Smith, С.Н. Andrews, и P.P. Leidlow. Отличный по антигенным свойствам от вируса 1933 г. изолят. выделенный Т, Francis в 1940 г., классифицировали как вирус гриппа В (штамм B/Lee/40). Вирус гриппа С впервые получен в 1947 г. R.M. Taylor.КОДЫ по МКБ-10J10 Грипп, вызванный идентифицированным вирусом гриппа.J11 Грипп, вирус не идентифицирован.ЭТИОЛОГИЯВирусы гриппа относятся к семейству Orthomyxoviridae, роду Injîuenzavirus, включающего три типа вируса А, В и С, сходных между собой морфологически, но различающиеся антигенными свойствами внутренних белков [6]. Вирусы гриппа содержат сегментированную линейную нитчатую отрицательную РНК. Число сегментов — 8 у вирусов гриппа А и В, 7 — у вируса группы С. Длинна отдельных фрагментов РНК для каждого штамма вируса носит индивидуальный характер, что является важным при изучении эпидемических штаммов.Вирусы гриппа А и В имеют два поверхностных гликопротеина, обладаю¬ щих гемагглютинирующей (НА) и нейраминидазной (NA) активностью, вирус гриппа С в своей структуре имеет только один поверхностный гликопротеин HEF {Haemagglutinine esterase fusion). Вирусы гриппа А подразделяются на под¬ типы соответственно антигенным свойствам поверхностных белков НА и NA. В настоящее время известны 16 подтипов гемагглютинина (у человека извест¬ ны три подтипа — Н1, Н2, НЗ) и 9 подтипов нейраминидазы (у вирусов гриппа человека N1, N2).Вирусы гриппа А широко циркулируют в природе, инфицируют не только человека, но и многие виды млекопитающих и птиц, главным образом, водного и околоводного комплекса [7]. Все вирусы, циркулирующие среди людей, домаш¬ них и диких животных, способны к обмену генетическим материалом в процессе реассортации [8]. От птиц изолированы вирусы со всеми известными сочетания¬ ми поверхностных белков. При этом каждый из подтипов вирусов гриппа имеет определённый круг хозяев [9]. Межвидовая передача вируса гриппа А является
194 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХмногофакторным процессом и происходит крайне редко. Примерами преодоления межвидового барьера являются случаи инфицирования людей вирусами гриппа птиц А(Н5Н1), А(Н9Ы2), А(Н7Н7), А(Н7ЫЗ) в странах Юго-Восточной Азии и некоторых странах Европы.ЭПИДЕМИОЛОГИЯНаибольшее эпидемическое значение имеют вирусы гриппа А из-за их уни¬ кальной способности к антигенной изменчивости, в результате которой появились высокопатогенные штаммы, вызвавшие в XX веке три пандемии гриппа (1918, 1957 и 1968 гг.) и одну эпидемию, близкую по масштабу к пандемии (1977 г.).Первая пандемия 1918-1919 гг. («Испанка») была самой драматичной, в короткое время охватившей практически все страны мира. По последним данным заболело 35% населения Земли, умерли более 40 млн человек [10]. Результаты ретроспективного анализа серологических исследований показали принадлеж¬ ность возбудителя к подтипу А (Н1Ы1). Данные секвенирования генов НА, 2УА, N5, выделенных из сохранившихся в мерзлоте тканей погибших людей, выявили их близость к генам и белкам вируса гриппа свиней A/Swine/Iowa/30 (Н1Ы1). Филогенетический анализ показал, что гены НА, КА, N8, находились в фило¬ генетическом дереве на ветви вирусов млекопитающих, но были расположены очень близко от точки расхождения с вирусами гриппа птиц. При этом ген NA по аминокислотной последовательности белка попадает на «птичью» ветвь фило¬ генетического дерева [11]. Эти данные трактуются как указания на занос вируса в человеческую популяцию от птиц [12].В последующие годы вирус гриппа А (НШ1) уже с изменённой антигенной структурой явился этиологическим фактором эпидемий 1936-1937, 1943-1944 и 1947-1952 гг. [13].Концепция реассортантного происхождения пандемических штаммов вируса гриппа, свидетельствующая о происхождении генов, кодирующих поверхностные белки НА и НА от вирусов птиц, а большей части внутренних генов от вирусов гриппа человека достоверно (по данным секвенирования) объясняла свойства пандемических вирусов 1957 и 1968 гг. [14].Вирусы гриппа пандемии 1957 г. («азиатский грипп») и 1968 г. («гонконгский грипп») появились в районе Юго-Восточной Азии и по антигенной специфичности НА и НА отличались от вирусов гриппа А, циркулировавших в человеческой попу¬ ляции ранее. Вирус 1957 г. относился к подтипу Н2Ы2, а 1968 г. — к подтипу НЗЫ2. Установлено, что в обоих случаях вирусы появлялись в результате реассортации геномов между вирусами человека и птиц. Вирус гриппа А (Н2Ы2) получил три гена (НА, МА и РВ1) от вируса гриппа птиц, а пять генов — от циркулировавшего среди людей в то время вируса гриппа А (Н1Ы1). Гонконгский вариант вируса гриппа НЗЫ2 наследовал НА и РВ1 от птичьего вируса, ЫА и пять других генов от вируса гриппа А (Н2М2), циркулировавшего в течение 11 лет [14].Появление новых пандемических вирусов с полным изменением групповых и щтаммовых детерминант (антигенный шифт) всегда сопровождалось исчезнове¬ нием из человеческой популяции предшествующего вируса. Однако до настоящего времени не ясен механизм возврата в активную циркуляцию вируса гриппа А (Н1Ы1) в 1977 г.Для вирусов гриппа С характерна меньшая изменчивость поверхностных бел¬ ков. Вирусы гриппа С вызывают спорадическую заболеваемость, редко являются причиной вспышек в детских коллективах. Наиболее тяжело заболевание проте¬ кает у новорождённых.Вирусы гриппа, являющиеся родоначальниками пандемического цикла, харак¬ теризуются эпидемической активностью и высокой контагиозностью. В меж- пандемический период в человеческой популяции циркулируют эпидемические
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 195штаммы появившиеся в результате точечных мутаций в структуре вирусного гено¬ ма, прежде всего его поверхностных белков (антигенный дрейф). Эпидемические штаммы являются вариантами раннее циркулировавшего вируса гриппа с тем же подтипом гемагглютинина.Характерной особенностью последних двух десятилетий является социркуля- ция всех трёх вирусов гриппа: А (H1N1), А (HЗN2) и В, вызывающих ежегодные подъёмы заболеваемости с разной долей активности.Вирус гриппа А (НЗЫ2) был ведущим этиологическим агентом в восьми эпи¬ демических сезонах. За длительный период циркуляции (с 1968 г.) вирус грип¬ па А (НЗМ2) полностью утратил антигенное сходство с пандемическим эталоном А/Гонконг/1/68. Очевидным является факт меньшей антигенной изменчивости вирусов группы А (НІМІ) и в сравнении с вирусами группы А (HЗN2) [15].В России за последнее десятилетие в динамике эпидемического процесса при гриппе произошли значительные изменения: отмечается снижение интенсивно¬ сти эпидемий в крупных городах в 1,4-1,9 раза; снижение доли гриппа в общей заболеваемости респираторными инфекциями, и рост годовой и эпидемической заболеваемости среди детей (54,2% и 58,8% соответственно). Одним из основных факторов, определяющих современные тенденции, является формирование высо¬ кого уровня популяционного иммунитета при длительной циркуляции вирусов гриппа с относительно малоизмененными антигенными свойствами. Как правило, регистрируется средняя интенсивность эпидемического процесса с вовлечением до 5-10% населения страны. При этом наблюдается рост годовой и эпидемической заболеваемости среди детей, значительно превышающей показатели заболеваемо¬ сти взрослого населения [15,16].Сезонные эпидемии возникают ежегодно зимой, спорадическая заболеваемость выявляется и в другие месяцы. Основной источник инфекции — больной человек, эпидемическая опасность которого коррелирует с выраженностью катаральных симптомов, а также больные с лёгкими и инаппарантными формами болезни.В результате перенесённого заболевания приобретается типоспецифический иммунитет, повторные заболевания обусловлены заражением штаммами вируса гриппа с новыми антигенными свойствами.ПАТОГЕНЕЗВирус гриппа реплицируется и репродуцируется в эпителиальных клетках ели- зистой оболочки респираторного тракта. Характерно поверхностное поражение клеток трахеи и бронхов, сопровождающееся процессами дегенерации и некроза, отторжением поражённых клеток.Патологический процесс развивается быстро, вслед за фазой репродукции вируса в клетках эпителия развивается вирусемия, продолжительность которой составляет, как правило, 10-14 дней.Главным звеном в патогенезе гриппа является поражение сосудистой и нервной систем, возникающее вследствие токсического действия вируса.Одним из основных механизмов влияния вируса гриппа на сосудистую систе¬ му является образование свободных радикалов кислорода, С генерированием активных форм кислорода (АФК) связаны процессы протеолитической актив¬ ности вируса гриппа, деструкцией стенок капилляров и развития отёка лёгких. Образующиеся в процессе генерации АФК гидроперекиси взаимодействуют с фос¬ фолипидами клеточных мембран, вызывая в них процесс перекисного окисления липидов, нарушение мембранного транспорта и барьерных функций, способствуя дальнейшему развитию вирусной инфекции [17].Лизосомальные ферменты — эластаза, катепсины, коллагеназа, секретируемые нейтрофилами, повреждают эпителий капилляров, базальную мембрану клеток, что способствует распространению гриппозной инфекции и вирусемии [18],
196 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХІІПовышение проницаемости сосудов, ломкость их стенок, нарушение микро- циркуляции является причиной возникновения геморрагических проявлений — от носовых кровотечений до геморрагического отёка лёгких и кровоизлияний в вещество головного мозга. Резкое падение тонуса мелких сосудов, повышение проницаемости эндотелиальных и эпителиальных клеток альвеол, возникающее вследствие повреждения альвеолокапиллярной мембраны, приводит к множе¬ ственным кровоизлияниям в итерстиций и развитию отёка лёгких [19].Циркуляторные расстройства лежат в основе поражения нервной системы. Нарзтпение проницаемости сосудов, токсического влияния вируса на рецепторы сосудистого сплетения мозга вызывают гиперсекрецию спинномозговой жидко¬ сти с развитием синдрома внутричерепной гипертензии и отёка мозга. В основе сложного комплекса функциональных расстройств нервной системы лежит пора¬ жение её вегетативного отдела, а также зоны межуточного мозга (гипоталамус, гипофиз), как области наиболее высокой васкуляризации, выполняющей нейро- вегетативную, нейроэндокринную и нейрогуморальную регуляцию. При аутопсии наблюдается полнокровие сосудов головного мозга, набухание и обширные гемор¬ рагии мозговых оболочек, отёк мозговой ткани. Патоморфологическая картина характеризуется наличием лимфомоноцитарных инфильтратов вокруг мелких и средних вен, гиперплазией глиальных элементов и очаговой демиелинизацией, что свидетельствует о токсико-аллергической природе патологического процесса в центральной нервной системе при гриппе [20].Основной чертой репаративного процесса слизистой оболочки трахеи и бронхов является метаплазия цилиндрического эпителия с вовлечением в патологический процесс подслизистой ткани и сосудистой сети. Эти изменения более интенсивны в трахее и крупных бронхах, менее — в средних и редко наблюдаются в мелких бронхах. Степень выраженности морфологических изменений зависит от сроков болезни: дистрофические изменения эпителиальных клеток, полнокровие сосудов с небольшими очагами инфильтрации в верхней части трахеи имеются уже на 1-2-й день болезни, к 3-5-му дню нарастают по интенсивности и сохраняются до 7-го дня, а нередко и позже. Пюйный, фиброзно-геморрагический трахеобронхит связан с активацией бактериальной флоры, что в нередких случаях наблюдается уже в первые дни болезни.Одним из важных факторов противовирусной защиты является система интер¬ ферона (ИФН), действие которой направлено на распознавание и элиминацию чужеродной генетической информации. Интерфероны действуют непосредствен¬ но на систему репродукции вируса, блокируя процессы трансляции белков [21]. Известно также то, что ИФН является важным фактором иммунитета: а- и у-ИФН воздействуют на активность естественных киллеров, усиливается экспрессия на поверхности клеток антигенов гистосовмесмости I и П класса, что приводит к активности Т-клеток, повышению секреции лимфокинов. Активация неспецифи¬ ческого иммунного ответа за счет продукции противовоспалительных и антиви¬ русных лимфокинов в инфицированных клетках обеспечивает противовирусный эффект макроорганизма и препятствует генерализации инфекции. Подавление функциональной активности Т-системы иммунитета характеризует тяжёлые и осложнённые бактериальной инфекцией формы болезни.КЛИНИЧЕСКАЯ КАРТИНАИнкубационный период при гриппе короткий — от нескольких часов до суток. Начало острое с озноба, быстрого повышения температуры до высоких цифр, быстрого нарастания симптомов токсикоза, который определяет тяжесть болез¬ ни. Температура достигает максимальных значений (39-40 °С) в первые сутки, нарастают признаки токсикоза — озноб, сильная головная боль, головокружение, миалгии, артралгии, выраженная слабость.
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 197Средняя длительность лихорадочного периода составляет, по данным большин¬ ства исследований, 4 дня. Снижается температзфа критически или ускоренным лизисом. Продолжительность лихорадки более 5 сут может свидетельствовать о развитии осложнений.Характерен внешний вид больного — лицо гиперимировано, одутловато, сосуды склер инфицированы, определяется гиперемия конъюнктив, цианоз губ и слизи- . стой оболочки ротоглотки, у части больных отмечается зернистость и точечные геморрагии на мягком нёбе.Головная боль локализуется преимущественно в лобно-височной области и, как правило, сопровождается болью при движении глазных яблок. При сильной головной боли может возникать рвота, нередко определяются менингеальные знаки. При исследовании спинномозговой жидкости у этих больных плеоцитоз отсутствует, глобулиновые реакции отрицательные, содержание белка ниже нор¬ мальных значений. Синдром менингизма исчезает с уменьшением интоксикации и снижением температуры тела.Катаральные симптомы в виде заложенности носа или небольшого ринита, кашля бывают в той или иной степени у всех больных и возникают, как правило, к концу первых суток болезни. Кашель сухой, мучительный из-за характерного для гриппа трахеита. Аускультативно в лёгких нередко выслушиваются сухие хрипы.Выделяют четыре фазы изменений в лёгких по тяжести и рентгенологическим данным [17]:• 1-я фаза — сосудистое полнокровие. На рентгенограммах определяется двух¬ стороннее усиление лёгочного рисунка за счёт расширения крупных сосуди¬ стых теней.• 2-я фаза — интерстициальный отёк. На фоне преобладающего сосудистого компонента отмечается параваскулярный отёк и отёк междольковых и аль¬ веолярных перегородок.• 3-я фаза — альвеолярный отёк. Характеризуется пропотеванием форменных элементов крови в альвеолы. У больных появляется одышка, нарушение газо¬ обмена и кислотно-щёлочного состояния. Гриппозная инфекция в эти сроки (3-5-й день болезни) осложняется пневмонией в результате присоединения бактериальной инфекции.• 4-я фаза — диффузный альвеолярный отёк. Рентгенологически определяются обширные зоны геморрагического отёка, занимающего значительную часть лёгких.Изменение сердечно-сосудистой системы при гриппе проявляется прежде всего диффузным поражением миокарда вследствие токсического действия вируса. При аускультации сердца определяется приглушённость тонов, мягкий систолический шум на верхушке, который исчезает после нормализации температуры. Частота сердечных сокращений соответствует температуре, у части больных может выяв¬ ляться относительная брадикардия. Стойкая тахикардия, как правило, встреча¬ ется у лиц с сопутствующими сердечно-сосудистыми заболеваниями и является прогностически неблагоприятной. Артериальное давление чаще нормальное или умеренно снижено. Электрокардиографические изменения (диффузное измене¬ ние миокарда, удлинение интервала Р(^ снижение зубца Т) имеют транзиторный характер.Диапазон клинических проявлений со стороны нервной системы достаточно широкий: от функциональных расстройств до серозных менингитов и тяжёлых менингоэнцефалитов. Функциональные нарушения, как правило, проявляются вегетативно-сосудистыми симптомами: лабильностью сосудистого тонуса, при¬ знаками внутричерепной гипертензии. Симптомы поражения ЦНС чаще всего определяются на 3-7-й день болезни, когда на фоне общемозговых симптомов (головная боль, рвота) появляются клоникотонические судороги и изменение
198 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХсознания от заторможенности до глубокой комы. Выявляется очаговая симптома¬ тика, стволовые симптомы с парезами черепных нервов, двигательными наруше¬ ниями по проводниковому типу. В отдельных случаях возможны миелитические симптомы и явления полирадикулонейропатии [20].Наиболее частым и нередко тяжёлым осложнением является пневмония, которая может развиться в любые сроки болезни, но наиболее часто возникает на 3-4-й день болезни на фоне активной вирусной инфекции. Этиологическим фактором чаще всего является стрептококк (70%). В последние годы стафилокок¬ ковые пневмонии, склонные к деструкции, наблюдаются у лиц с хроническими заболеваниями и иммунной недостаточностью.Грипп, вызванный вирусом гриппа птиц A/H5N1В мае 1997 г. в Гонконге от 3-летнего ребёнка, умершего от пневмонии, ослож¬ нённой синдромом Рея, был выделен вирус, идентифицированный как вирус А (Hong Kong/97/H5Nl). В этот период заболели всего 18 человек, 6 из них умер¬ ли [22], Вспышка заболевания среди населения в Гонконге по времени совпала с эпизоотией среди домашней птицы, вызванной вирусом гриппа птиц А (H5N1) с 75% гибели поголовья. Установлено, что во всех случаях заражения произошли в результате контакта людей с инфицированной птицей или контаминации окружа¬ ющих предметов. Вспышка 1997 г. послужила тревожным сигналом о возможности новой пандемии гриппа.В 1999 г, в Китае зарегистрировано два случая заболевания людей, вызван¬ ных вирусом H9N2 и H5N1. В Нидерландах возникла крупная вспышка гриппа, вызванного вирусом типа H7N7. Заболевшие были в основном работницами пти¬ цеферм. Заболевание протекало с явлениями выраженного конъюнктивита (77%) и гриппоподобными симптомами. Кроме того, у лиц, контактирующих с больными и не имевших контактов с птицей, были обнаружены антитела к вирусу гриппа А (H7N7) [23].В 2004 г. в ряде стран Юго-Восточной Азии стали вновь регистрироваться вспышки гриппа, вызванного вирусом H5N1, с высоким процентом случаев смер¬ ти больных. Это подтвердило данные о возросшей патогенности вируса — новый штамм H5N1 по ряду позиций отличался от вирусов А (H5N1), выделенных в Гонконге в 1997 г. [24]. Вирус не только преодолел межвидовой барьер, но и вызвал чрезвычайно тяжёлые клинические формы, 50% из которых закончились летальным исходом.По данным ВОЗ на январь 2008 г.. в 14 странах Азии зарегистрировано 348 больных гриппом, вызванным вирусом H5N1, 216 из них умерли. В Российской Федерации, начиная с июля 2005 г., эпизоотия среди домашней птицы охватила регионы Западной Сибири и Европейской части [8]. Случаев передачи вируса А (H5N1) от больного здоровым людям пока не установлено.Клинические проявления гриппа, вызванного высокопатогенным вирусом гриппа H5N1, отличаются от эпидемического прогрессирующим течением и зна¬ чительно более высоким риском смертельного острого повреждения лёгких.Заболевание клинически характеризуется высокой лихорадкой, выраженной интоксикацией, ранним поражением нижних дыхательных путей, развитием респираторного дистресс-синдрома и полиорганной недостаточности (поражени¬ ем мозга, печени, почек) [25].Продолжительность инкубационного периода колеблется от 1 до 7 дней, в среднем 2-3 дня. Повышение температуры, кашель являются ранними и посто¬ янными симптомами заболевания. Температура тела часто достигает гиперпи- ретических значений. Примерно у половины больных наблюдается дисфункция желудочно-кишечного тракта в виде повторной рвоты и диареи. Катаральные симптомы; ринит, боль в горле, как правило, умеренные. На 2-3-й день болезни
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 199появляется одышка» кашель приобретает влажный характер, мокрота с примесью крови. В этот период на рентгенограмме имеются диффузные изменения лёгочно¬ го рисунка, могут определяться отдельные инфильтраты с тенденцией к слиянию. При дальнейшем прогрессировании заболевания развиваются острый респира¬ торный дистресс-синдром, почечная недостаточность, у детей младшего возрас¬ та — менингоэнцефалит, В периферической крови характерны лейко-, лимфо- и тромбоцитопения.Продолжающиеся эпизоотии с проникновением вируса в свиные популяции, рост заболеваний людей с высоким риском смертельных исходов свидетельствуют о реальной возможности появления нового штамма вируса с высокой пандемиче¬ ской потенцией.ДИАГНОСТИКАЛабораторная диагностика гриппа основывается на выявлении вирусных анти¬ генов методом флюоресцирующих антител (МФА), иммуноферментным анализом (ИФА); выделении вирусов из носоглоточных смывов на культуре клеток МВСК и куриных эмбрионах с последующим подтверждением в реакции гемагглютинации (РГА) и их идентификации в реакции торможения гемагглютинирующей актив¬ ности (РТГА). Разработан метод ОТ-ПЦР для выявления специфической РНК для вирусов гриппа типа А с последующим субтипированием в отношении А(Н5Ы1). Изучение динамики специфических антител в парных сыворотках, взятых в ранний период заболевания и через 2-3 нед, проводят в РТГА. Для выявления специфических антител в сыворотках людей к вирусу гриппа птиц А (H5N1) с боль¬ шей эффективностью рекомендовано применение реакции микронейтрализации в культуре клеток МПСК.ЛЕЧЕНИЕПрепараты, применяемые для лечения гриппа, могут быть разделены на сле¬ дующие группы:• этиотропные — действующие на вирус; к ним относится химиопрепараты;• интерфероны и их индукторы, оказывающие комбинированное действие: противовоспалительное и иммуномодулирующее;• патогенетические средства, направленные на борьбу с интоксикацией, сосуди¬ стыми нарушениями, полиорганной недостаточностью и осложнениями;• симптоматические средства для купирования отдельных симптомов.К средствам, оказывающим прямое противовирусное действие, относятсяпрепараты адамантанового ряда (амантадин, римантадин) и ингибиторы ней¬ раминидазы (занамивир, осельтамивир). Римантадин успешно использовался для раннего лечения гриппа А, так как подавлял репродукцию всех штаммов, циркулировавших в эти годы. Однако узкий спектр действия (препараты явля¬ ются селективными ингибиторами вируса гриппа), частые побочные эффекты со стороны ЦНС, желудочно-кишечного тракта и быстрое формирование рези¬ стентных штаммов значительно ограничивают возможности лечения этими пре¬ паратами [26, 27].Занамивир и осельтамивир ингибируют ферментативную активность нейра¬ минидазы. Занамивир выпускается в виде аэрозоля и эффективен только при топическом применении — ингаляционном, интраназальном или парентеральном введении препарата. Осельтамивир блокирует способность ЫА отщеплять остатки сиаловой кислоты с поверхности инфицированной клетки, подавляя выход новых вирионов [28]. Осельтамивир показан для лечения гриппа у больных в возрасте от 1 года и старше. Доза взрослых составляет 75 мг 2 раза в сутки, у детей дозу рассчитывают в зависимости от массы тела ребёнка. С профилактической целью препарат принимают 1 раз в сутки в течение всего периода эпидемии (6-8 нед).
200ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХОсельтамивир рекомендуется ВОЗ для лечения больных гриппом, вызванным вирусом гриппа А (H5N1). В последнее время появились данные о резистентно¬ сти вирусов к осельтамивиру. Мутации, приводящие к развитию осельтамивир- резистентности, накапливаются в труднодоступном участке активного центра нейраминидазы: E->V (в позиции 119), R->K(292) и N->8 (294) для подтипа N2 и H-^Y (274) и N^S (294) для подтипа N1 [29].Арбидол* — химиопрепарат класса гидрохинонов, действует на ранней стадии вирусной репродукции: взаимодействует с НА вируса гриппа, ингибирует процесс слияния липидной оболочки вируса с мембранами эндосом, приводящей к осво¬ бождению вирусного нуклеокапсида и начала транскрипции вирусного генома [30]. Кроме того арбидол* обладает интерферониндуцирующей активностью, стимулирует фагоцитоз.В комплексное лечение гриппа включают иммунотропные лекарственные средства — препараты интерферона (ИФН) и индукторы ИФН, оказывающие противовирусный и иммуномодулирующий эффекты. Механизм действия основан на подавлении синтеза нуклеиновых кислот и репродукции белков нуклеокапсида [21]. В клинической практике широко используются природные и рекомбинант¬ ные ИФН, наиболее перспективными являются рекомбинантные а-ИФН [31].ПРОФИЛАКТИКАПринципы профилактики гриппа:• специфическая иммунопрофилактика с использованием гриппозных вакцин;• избирательное проведение курсов сезонной профилактики с помощью специ¬ фических и неспецифических препаратов;• экстренная профилактика заболеваний в период эпидемии гриппа;• санитарно-гигиенические и оздоровительные мероприятия.Вакцинопрофилактике против гриппа в предэпидемический период, в первуюочередь, подлежат лица группы высокого риска развития осложнений после пере¬ несённого гриппа, к которым необходимо отнести детей дошкольного возраста, пожилых людей в возрасте 65 лет и старше, а также взрослых и детей, имеющих в анамнезе хронические сердечно-сосудистые заболевания, заболевания дыхатель¬ ных путей, хронической почечной недостаточности.В настоящее время в нашей стране прошли регистрацию и разрешены к приме¬ нению следующие вакцины: живая гриппозная вакцина (ЖГВ); инактивированные вакцины цельновирионного типа (Т])ипповак™), расщеплённого типа (Бегривак™, Ваксигрип™, Флюарикс™), субъединичного типа (Агриппал™, Инфлювак™) и полимер-субъединичного типа (Гриппол™). Вакцинопрофилактика позволяет не только снизить сезонную заболеваемость (эффективность 50-75%), но и умень¬ шить риск тяжёлого и осложнённого течения болезни.ПарагриппВ1952 г. N. Kuroga в г. Синдай выделил вирус из лёгких мышей, инфицированных биологическим материалом (суспензия лёгочной ткани) больного, погибшего от пневмонии (вирус получил название Sendai). В 1954 г. в США R. Chanock выделил ассоциированный с крупом вирус на культуре клеток почек обезьян из носоглоточ¬ ных смывов больного ребёнка крупом. Из-за сходства с вирусами гриппа выделен¬ ные штаммы были названы парагриппозными (Aduws, Bang, Chanock, В. Жданов, 1959 г.) и отнесены к семейству Paramyxoviridae, роду Paramyxovirus [32].ЭТИОЛОГИЯВирусы парагриппа человека относятся к семейству Paramyxoviridae, состоящего из двух подсемейств: Paramyxovirinae и Pneumovirinae. Paramyxorinae включает род AvulavifTis (Newcastle disease virus), Henipavirus (Henda virus), Morbillivirus (Measles
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 201virus), Respirovirus (Sendai virus, Human parainfluenza 1,3), Rubulavirus (Mups virus,Human parainfluenza 2,4). В подсемейство Pneumovirinae входят род Pneumovirus щЦ (Human respiratory syncytial virus) и род Metapneumovirus (Human Metapnemovirus,Avian pneumovirus) [33].Вирион семейства Paramyxoviridae содержит однонитчатую отрицательную РНК, белки, представленные 6-8 классами полипептидов, включает РНК-зависимую РНК-полимеразу (транскриптазу). Вирион имеет оболочку, включающую вирус¬ ные гликопротеины — гемагглютинин и нейтраминидазу, определяющие специ¬ фичность антигенных свойств для каждого из родов.ЭПИДЕМИОЛОГИЯИсточником инфекции служит больной человек, наиболее интенсивно выде¬ ляющий вирус во внешнюю среду в первые 2-3 дня болезни. Путь передачи воздушно-капельный. Болеют люди всех возрастов, но наиболее восприимчивы дети раннего возраста.Парагриппозная инфекция распространяется повсеместно. Спорадические слу¬ чаи регистрируются в течение всего года, подъём заболеваемости — в осенне¬ весенний период. При неосложнённых формах парагриппа чаще изолируется 2-й иммунотип вируса, при поражении нижних отделов респираторного тракта — 1-й и 3-й; 4-й иммунотип встречается гораздо реже.ПАТОГЕНЕЗРепродукция вируса парагриппа происходит в цитоплазме клеток цилиндриче¬ ского эпителия респираторного тракта, вызывая их деструкцию. Типичным являет¬ ся поражение слизистой оболочки гортани — отёк и набухание. Слизистая оболоч¬ ка нижнего отдела трахеи, бронхов гиперимирована, отёчна, выражены явления экссудации, инфильтрации её лимфоцитами и моноцитами. Сужение просвета гор¬ тани обусловлено отёком слизистой оболочки, воспалительной клеточной инфиль¬ трацией, гиперсекрецией слизистых желёз и скоплением экссудата. Характер вос¬ паления может быть катаральным, катарально-гнойным, фибринозно-гнойным и язвенно-некротическим. Следствием возникшей обструкции является гипоксия, гиперкапния, а в тяжёлых случаях — асфиксия. Развиваются метаболические нару¬ шения и угроза отёка мозга.КЛИНИЧЕСКАЯ КАРТИНАИнкубационный период колеблется от 2 до 7 дней, в среднем продолжается 3-4 дня. Заболевание начинается постепенно с катаральных симптомов и харак¬ теризуется медленным (в течение 2-3 дней) повышением температуры тела, не превышающей субфебрильных значений. Особенность лихорадочного периода заключается в более длительной и менее высокой, чем при гриппе, температуре. Длительность лихорадки у детей колеблется от 1 до 14 дней, у взрослых от 1 до 8 дней. Токсикоз выражен слабо — головная боль, слабость наблюдается у боль¬ шинства больных, но выражена умеренно.Разные отделы респираторного тракта вовлекаются в патологический процесс не в одинаковой степени.Ринит — наиболее частый симптом заболевания. Носовое дыхание затруднено из-за набухания слизистой оболочки носовых раковин; выделения серозные или слизисто-серозные. Фарингит умеренный отмечается примерно у каждого второго больного. Ларингит — типичное проявление парагриппозной инфекции. Боль в горле, сухой грубый кашель, охриплость голоса — основные признаки поражения слизистой оболочки гортани. У детей (чаще в возрасте 1-2 лет) возможен стеноз гортани (круп). В редких случаях, при вовлечении слизистой оболочки трахеи, развивается стенозирующий ларинготрахеит. Круп может развиваться в различ¬ ные сроки от начала болезни — от первых часов заболевания до 2-3-х суток и
202 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХпозднее. Характеризуется триадой симптомов — изменением тембра голоса, «лаю¬ щим» кашлем, шумным стенотическим дыханием. йуШ ^ зависимости от выраженности клинических проявлений крупа и затруднениядыхания, выделяют четыре степени стеноза гортани (табл. 12-2) [34].У взрослых течение болезни, как правило, благоприятное. Затянувшиеся брон¬ хиты, особенно при наличии слизисто-гнойной мокроты, связаны с присоединени¬ ем вторичной бактериальной инфекции.Пневмония относится к частым и серьёзным осложнениям. При раннем её воз¬ никновении характерен выраженный токсикоз и нередко тяжёлое течение.Таблица 12-2. Классификация синдрома крупаСтепень стеноза гортаниКритерии диагаостики1 степень {компенсированная стадия)Затруднение дыхания на вдохе, втяжение яремной ямки усиливается при беспокойстве или физиче¬ ской нагрузке Цианоза нетГипоксемии нет или она незначительна (Ра0,>70 мм рт.ст.)Гиперкапнии нетПродолжительность стеноза ~ от нескольких часов до 1-2 сутII степень {субкомпенсированный стеноз, стадия непол¬ ной компенсаи^и)Дыхание шумное с участием в акте дыхания вспо¬ могательной мускулатуры Беспокойство Периорапьный цианоз Гипоксемия (Ра02<?0 мм рт.ст.)Гиперкапнии нетЯвления стеноза гортани сохраняются до 3-4 днейIII степень (декомпенсированная стадия)Дыхание шумное с резким втяжением всех уступ¬ чивых мест грудной клетки, западанием нижнего конца грудиныОслабление дыхательных шумов в лёгких Парадоксальный пульс Цианоз губ, акроцианоз Беспокойство выраженное Гипоксемия (Ра02<60 мм рт.ст.)Гиперкапния (РаО^>45 мм рт.ст.) Комбинированный или только респираторный ацвдозtv степень (асфиксия, терминальная стадия)Выраженные признаки дыхательной недостаточ¬ ностиДыхание поверхностное с нарушением ритма Общий цианоз Явления капилляростазаТемпература тела падает до нормальных или суб¬ нормальных цифрДыхание 8 лёгких едва прослушиваетсяТенденций к брадикардииКомаГипоксемия (Ра0<50 мм рт.ст.)Гиперкапния (РаСО>70 мм рт.ст.)ДИАГНОСТИКАЛабораторная диагностика основывается на выявлении вирусных антигенов методом ПЦР, методом флюоресцентного анализа, выделением вирусов из носо¬ глоточных смывов на культуре клеток Нер-2 с последующим подтверждением в
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 203РГА (реакция гемагглютинации с эритроцитами морской свинки) и их иденти¬ фикации в РТГА, РСК, PH. Оценка динамики специфических антител в парных сыворотках, взятых в ранний период заболевания и через 2-3 дня, проводят в РТГА и РСК.ЛЕЧЕНИЕСимптоматическое. При высокой температуре тела рекомендуются жаропони¬ жающие средства — НПВС (парацетамол, ибупрофен) в возрастных дозировках. Для улучшения носового дыхания используются сосудосулсивающие назальные капли и спреи. Широко применяются муколитические препараты с отхаркиваю¬ щим эффектом — бромгексин, амброксол.Б случаях осложнения парагиппа крупом у детей лечебную помощь оказывают в специализированном отделении, оборудованном парокислородными палатка¬ ми. Существенное место в лечении крупа принадлежит гликопротеидам, оказы¬ вающим противовоспалительное и противоотёчное действие. Предпочтительно ГКС использовать ингаляционно в виде аэрозолей. При тяжёлых декомпенсиро- ванных формах стеноза гортани ГКС вводятся парентерально (дексаметазон — внутривенно в дозе 0,6 мг/кг 3-4 раза в сутки). Продолжительность ГКС-терапии определяется улучшением состояния больного и степенью обструктивного син¬ дрома [33].Респираторно-синцитиальная вирусная инфекцияРеспираторно-синцитиальный вирус был впервые выделен в США Дж. Моррисом от обезьян в 1956 г. Chanock, Roiman&Myers в 1957 г. изолировали два штамма вируса от детей с пневмонией и бронхиолитом. Все штаммы были изолированы на клеточных культурах, где они образовали синцитий, откуда вирус и получил свое название [32].ЭТИОЛОГИЯРеспираторно-синцитиальный вирус (РС-вирус) относится к семейству Рага- myxoviridae, роду Pneumovirus. Геном образует линейная, несегментированная молекула РНК. В отличие от других членов семейства, не имеет гемагглютинина и нейраминидазы. Репродукция осуществляется в цитоплазме клетки хозяина. Цитопатический эффект выражается в образовании гигантских клеток и син¬ цития. Выделяют две антигенные группы (А и В), отличающиеся по G-глико- протеину.ЭПИДЕМИОЛОГИЯРС-вирусное заболевание встречается повсеместно, регистрируется в течение всего года с наиболее высокими показателями заболеваемости в холодное время года. Как правило, отмечается двухволновый подъём с пиком в начале зимы и весной и часто совпадают с эпидемией гриппа, что приводит к формирова¬ нию смешанных форм инфекции. Продолжительность эпидемического подъёма РС-вирусного заболевания ограничивается 3-5 мес. Типы РС-вирусов А и В могут циркулировать одновременно в период одной эпидемической вспышки, но чаще происходит постепенная замена одного типа на другой. Отмечено, что РС-вирус типа А вызывает тяжёлые формы болезни с резкими проявлениями бронхиолита, а РС-вирус типа В чаще этиологически связан с пневмонией [35].Источником заражения является больной с клинически выраженной или стёр¬ той формой болезни, реже — вирусоносители. Передача возбудителя происходит воздушно-капельным путём при близком общении и через инфицированные пред¬ меты обихода, игрушки, а также при контаминации рук назальным секретом. Больной заразен в течение 5-7 дней. Болеют в основном дети, у которых вое-
204ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХприимчивость к вирусу высокая: от 75% в возрасте 1-2 лет до 30% — среди детей более старшего возрасга [32]. Большинство детей инфицируются РС-вирусом уже с 2-4 годам, в возрасте 5-10 лет специфические антитела обнаруживаются у 63-68% обследованных. В семейных очагах РС-вирусная инфекция развивается у 30% взрослых.Наиболее тяжело заболевание протекает у детей первого года жизни, В США ежегодно госпитализируются до 90 тыс. детей этой возрастной группы, а смерт¬ ность достигает 4,5 тыс. в год [36]. Группу риска по развитию тяжёлой формы забо¬ левания составляют лица старших возрастных групп, отягощённые хроническими заболеваниями органов дыхания и сердечно-сосудистой системы.ПАТОГЕНЕЗВирус реплицируется в эпителиальных клетках слизистой оболочки респи¬ раторного тракта, поражая практически все его отделы. Созревание вирионов осуществляется на цитоплазматической мембране (освобождение их происходит через почкование), вызывая гибель клеток. Ведущим звеном в патогенезе син¬ дрома острой бронхиальной обструкции является нарушение дренажной функции бронхиального дерева из-за отёка, утолщения стенки бронха, обусловленной воспалительной клеточной инфильтрацией, а также закупорки просвета бронхов клетками слущенного эпителия и слизью. Особенно быстро этот процесс раз¬ вивается у детей раннего возраста. Все это приводит к ателектазам и эмфиземе лёгких. Нарушение бронхиальной проходимости затрудняет процессы газообме¬ на в лёгких, развивается гипоксемия, гиперкапния, респираторный ацидоз из-за сдвигов кислотно-основного метаболизма. В возникновении пневмонии важную роль играет активизация бактериальной флоры. Примерно у каждого 5-го ребёнка в раннем возрасте РС-вирусное заболевание протекает с пневмонией, из которых у 50% выражен астмоидный компонент [37].При патоморфологическом исследовании в средних и мелких бронхах выявля¬ ются сосочкообразные разрастания эпителия, группирование их в многоядерные конгломераты, утолщение межальвеолярных перегородок. Антигены РС-вируса обнаруживаются в циркулирующих мононуклеарных лейкоцитах. В тяжёлых слу¬ чаях у больных с выраженной иммуносупрессией антиген вируса определяется в печени, почках, миокарде [38].Важное значение в патогенезе хронизации РС-вирусной инфекции имеют состояние иммунитета, цитокиновый статус больных, отсроченная или смешанная продукция. РС-вирус обладает иммуносупрессивным действием, вызывает имму¬ нопатологические реакции за счёт длительной циркуляции иммунных комплек¬ сов. Выраженное снижение активности Т-супрессоров, длительное более 10 дней определение специфических иммуноглобулинов IgM, низкое содержание IgG к концу 3-4 нед заболевания создают условия для персистенции вируса и формиро¬ вания хронической инфекции [39]. Тяжёлое течение инфекции у пожилых связано с увеличением числа повторных эпизодов заболевания и преобладанием Th^ типа иммунного ответа. У детей на фоне иммунопатологических реакций содержание специфических IgG снижено, что препятствует элиминации вируса и способствует длительному течению болезни. Высокая активность Th^ опосредованных реакций (высокий уровень IgE, IgA в крови) у детей раннего возраста является прогно¬ стически неблагоприятным из-за высокого риска формирования в дальнейшем атопии и астмы [40], Уровень IgE коррелирует с выраженностью экспираторной одышки и тяжёлой гипоксией в течение острого периода болезни.Сывороточные и секреторные антитела продуцируются в ответ на инфекцию, как правило, в низких титрах и не защищают от реинфекции.
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 205КЛИНЙЧЕСШ КАРТИНАИнкубационный период в среднем составляет 4-5 дней, с колебаниями от 2 до8 дней. Заболевание может начинаться как остро, так и постепенно. Клиническая форма заболевания зависит от возраста больного и его иммунологического ста¬ туса. Риск развития тяжёлых бронхитов и дыхательной недостаточности высок у детей раннего возраста, у лиц с хроническими заболеваниями сердца, бронхо¬ лёгочной системы и иммунодефицитным состоянием, включая больных после трансплантации органов, ВИЧ-инфицированных и стариков. У взрослых заболе¬ вание протекает относительно лёгко и ограничивается областью верхних отделов респираторного тракта, преобладанием катаральных симптомов (назофарингит, ларингит). Наиболее частым симптомом является кашель — непродуктивный в первые дни болезни, затем приобретает влажный характер, появляется мокрота.У детей раннего возраста чаще наблюдаются вовлечение в процесс нижних дыхательных путей: бронхиолиты и пневмонии. Заболевание начинается с рино- фарингита, на 2-3-й день появляются признаки поражения нижних дыхательных путей с развитием бронхита и бронхиолита. Возникает синдром острой бронхи¬ альной обструкций. Тяжесть состояния больного в этот период определяет нарас¬ тающая дыхательная недостаточность. Появляются одышка и цианоз. В лёгких при бронхите на фоне жёсткого дыхания при аускультации выслушиваются сухие свистящие хрипы, у части больных — множество рассеянных мелких и среднепу¬ зырчатых влажных хрипов; для бронхиолита характерно обилие мелкопузырча¬ тых влажных и крепитирующих хрипов. Характерен коробочный оттенок перку¬ торного звука из-за развившейся эмфиземы.Одышка (60-80 в минуту), как правило, смешанного типа с преобладанием экс¬ пирации, с втяжением мышц эпигастральной области и межрёберньск промежутков. Кашель приступообразный, мучительный. Может регистрироваться апноэ, суще¬ ствует угроза развития крупа, особенно у детей первых лет жизни (10%) [41].При рентгенологическом обследовании выявляется резкое вздутие лёгких, повышение прозрачности лёгочных полей, усиление лёгочного рисунка за счёт расширения крупных сосудов и обогащения его мелкими линейными тенями. Могут наблюдаться очаговые тени и ателектазы.При развитии пневмонии состояние больных ухудшается — повышается тем¬ пература до фебрильных цифр, нарастает дыхательная недостаточность, цианоз, увеличена печень и селезёнка, в периферической крови лейкощггоз, высокая СОЭ, Частым осложнением (40%) является острый средний отит, развивающийся в результате обструкции евстахиевой трубы. Длительность заболевания зависит от его формы и тяжести. Летальность среди госпитализированных составляет0,5-1,5%, При синдроме внезапной детской смертности в лёгких на аутопсии обна¬ руживается РС-вирус [41].У детей старшего возраста РС-вирусное заболевание часто протекает в стёртой форме, без лихорадочной реакции, у взрослых — в виде обострения хронического бронхита.ДИАГНОСТИКАЛабораторная диагностика РС-вирусной инфекции включает изоляцию воз¬ будителя на культуре клеток, индикацию антигена или РНК в назофарингеальных смывах или аспирата методами флюоресценции, ПЦР, ИФА и определение нарас¬ тания титра специфических антител в динамике болезни в РСК.ЛЕЧЕНИЕЭтиотропная терапия РСВ-инфекции включает рибавирин (в ингаляционной форме) у детей раннего возраста [42]. Более широкое применение рибавирина опшшчено из-за серьёзных побочных эффектов.
206 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХПри формах РС-вирусного заболевания, протекающего без обструктивного синдрома, применяются симптоматические средства. При наличии у больного кащля с вязкой, трудноотделяемой мокротой рекомендуются муколитические и отхаркивающие средства.С целью профилактики тяжёлых форм заболевания в группах риска использу¬ ют иммунотерапию — человеческие моноклональные антитела — «Palivizumab» и иммуноглобулиновый препарат с высоким содержанием нейтрализующих проти¬ вовирусных антител — «Respígame. При частых эпизодах обострения хронической РС-вирусной инфекции рекомендуется интерферонотерапия [42].Основные лечебные мероприятия при острой бронхиальной обструкции, исхо¬ дя из патогенеза дыхательной недостаточности, включают:• борьбу с отёком и воспалительным процессом в бронхах:• купирование бронхоспазма и улучшение кровообращения;• разжижение и удаление секрета из дыхательных путей;• восстановление дренажной функции бронхов;• уменьшение гипоксемии.Важной задачей является обеспечение адекватной оксигенации крови посред¬ ством прямой ингаляции кислорода, а также мероприятий, направленных на ул)^- шение проходимости дыхательных путей.При тяжёлом обструктивном синдроме в качестве неотложной терапии пока¬ зано применение ГКС, оказывающих противовоспалительное и противоотечное действие. ГКС применяют в сочетании с бронхолитиками. В период наиболее тяжёлого состояния преднизолон или дексаметазон вводят внутривенно, затем переходят на приём внутрь или в виде ингаляции. Продолжительность ГКС-тера¬ пии определяется состоянием больного и стойкостью обструктивного синдрома. Патогенетически обосновано применение диуретиков быстрого действия с целью уменьшения отёка слизистой оболочки бронхов, улучшения бронхиальной про¬ ходимости.Оптимальным вариантом поддержания функционального состояния слизистой оболочки дыхательных путей и разжижения секрета является пребывание ребён¬ ка в камере в условиях кислородного аэрозоля и применения медикаментозных аэрозольных ингаляций с 50-60% содержанием кислорода и 100% влажностью [42]. Продолжительность одной ингаляции 30-60 мин, повторяется 3 раза в день. Курс — 5-7 дней, при необходимости — до 2 нед,С целью поддержания гомеостаза почти всем детям, находящимся в тяжёлом состоянии, проводится инфузионная терапия (полноценное энтеральное корм¬ ление не может быть обеспечено из-за тяжести состояния). Она осуществляется в небольших объёмах (20-25 мл/кг массы) и кратковременно — в период наибо¬ лее тяжёлого состояния. Обычно вводят 10% раствор глюкозы с электролитами. Кроме того, инфузионная терапия включает и различные фармакотерапевтиче- ские препараты: эуфиллин (2,4% раствор — 0,1 мл/кг), преднизолон или дексаме¬ тазон, кокарбоксилазу (25-50 мг). Фуросемид вводят внутримышечно за 30 мин до внутривенного вливания. Наступление диуреза вследствие действия диуретика обеспечивает хорошую переносимость внутривенной инфузии у детей первых месяцев жизни.Наличие тахикардии, нарушений сократительной функции миокарда (преиму¬ щественно правого желудочка), увеличения размеров печени оправдывает вклю¬ чение в комплексную терапию сердечных гликозидов (0,05% раствор строфантина в дозе 0,02 мл/кг внутривенно на 5% растворе глюкозы или изотонического рас¬ твора хлорида натрия). Такая комплексная терапия неизменно приводит к улучше¬ нию бронхиальной проходимости, кровообращения, газообмена в лёгких.В последнее время появились сообщения об использовании иммунотерапии. Клинические испытания иммуноглобулина G для внутривенного введения (в дозе
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 2072 ед/кг в день) показали сходный эффект с тем, что наблюдается при аэрозольном применении рибавирина. хотя иммунотерапия не уменьшила сроков госпитализа¬ ции больных. Применяют для лечения и анти-РСВ иммуноглобулин [41]. Лечение тяжёлых форм РСБИ, протекающих с обструктивным синдромом и нередко осложняющихся пневмонией, включает обычно и антибиотикотерапию.Дети, перенёсшие РС-заболевание с обструктивным синдромом, нуждаются в диспансерном наблюдении. По нашим данным, выздоровление наступает в 72% случаев, в 15% — развивается рецидивирующий обструктивный бронхит, а в 10% — бронхиальная астма [42].ПРОФИЛАКТИКАЭкспериментальные инактивированные, живьге аттенуированные и субъеди- ничные РСВ-вакцины оказались неэффективными и не получили практического применения,Метапневмовирусная инфекцияСообщение о новом инфекционном агенте, вызвавшем респираторные заболе¬ вания у 28 детей, поступило из Нидерландов в 2001 г. [43]. Вирус был идентифи¬ цирован как новый тип метапневмовируса, способного вызывать заболевания у людей.ЭТИОЛОГИЯМетапневмовирус человека (hMPV) и метапневмовирус птиц (APV) образу¬ ют род Metapneumovirus в подсемействе Pneumovirinae семейства Paramyxoviridae. Подсемейство Pneumovirinae включает также респираторно-синцитиальный вирус человека (hRSV), респираторно-синцитиальный вирус бычий (bRSV), и вирус пнев¬ монии мышей (PMV). Филогенетически hMPV близок к APV серотипа С: сходство аминокислотных последовательностей белков N, Р, М и F достигает 66-89 % [44].Идентифицированы две эволюционные линии (генотип) и два генетических кластера (субтипа) в пределах каждой линии [45]. Генотипы А и В близки между собой по нуклеотидным и аминокислотным последовательностям (80-90%) и нередко циркулируют Б пределах одного эпидсезона одновременно.ЭПИДЕМИОЛОГИЯЭпидемиологический монрггоринг за hMPV, проведённый во многих стра¬ нах, показал, что вирус циркулирует в человеческой популяции не менее 50 лет. Инфекция документирована у 12% амбулаторных и у 7% госпитализированных детей в странах Европы, Канады и США. При трёхлетнем эпидемиологическом мониторинге за больными детьми в Италии частота hMPV-инфекции среди госпи¬ тализированных детей с ОРЗ широко варьировала — от 7 до 43% [46].ПАТОГЕНЕЗПатогенез hMPV-инфекции у человека изучен недостаточно. При эксперимен¬ тальной инфекции у хомяков и хлопковых крыс в ответ на репликацию вируса продуцируются hMPV-нейтрализующие антитела в высоких титрах. Показана персистенция вируса в лёгких BALB/c мышей в течение нескольких недель после инфицирования на фоне циркулирующих антител [47]. Исчезновение вируса из лёгких отмечалось к концу второго месяца, однако РНК определялась в лёгочной ткани в течении 6 мес. Специфические антитела в сыворотке крови людей появля¬ ются на 14-й день, максимальные значения — на 28-й день.ІЛИНИЧЕСКАЯ КАРТИНАЗаболевания, ассоциированные с hMPV, характеризуются широким диапазо- вом клинических проявлений — от инаппарантных и лёгких форм до поражения
208ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХНИЖНИХ отделов респираторного тракта в виде тяжёлых бронхитов и пневмоний. Быстрое появление одышки, развитие гипоксии у детей требует срочной госпи¬ тализации. Развивающаяся дыхательная недостаточность в ряде случаев требует искусственной вентиляции лёгких. По-видимому, hMPV играет определяющую роль в развитии бронхиальной астмы [48]. Кроме того, hMPV был идентифи¬ цирован методом ПЦР в ткани головного мозга и лёгких ребёнка, погибшего от тяжёлого энцефалита [49].У взрослых больных hMPV-инфекция, как правило, протекает в виде ОРВЗ. Однако у пожилых возможны бронхиты и пневмонии, осложнённые дыхательной недостаточностью.ДИАГНОСТИКАВысокоточным методом идентификации hMPV в биологическом материале (носоглоточные смывы) является ПЦР. Описаны количественные методы ПЦР в режиме реального времени, позволяющие провести амплификацию и детекцию агента менее чем за 2 ч [50].Серологическим подтверждением перенесённого заболевания (ретроспектив¬ ный метод) является 4-кратное и более повышение титров антител при непря¬ мом иммунофлюоресцентном анализе с использованием hMPV-инфицированных клеток [46]. В последнее время разрабатываются варианты иммуноферментного метода (ELISA) для детекции антител к hMPV.Вирус слабо реплицируется в обычных клеточных культурах, используемых для диагностики респираторных вирусов. Цитопатический эффект очевиден лишь в третичных клетках почек обезьян, некоторых вариантов клеток Vero, QT-35, А-549 и культурах LLC-MK2.ЛЕЧЕНИЕ И ПРОФИЛАКТИКАЕсть основание считать, что в качестве этиотропного средства может быть акти¬ вен рибавирин (учитывая полученные результаты ш vitro). Лечение патогенетиче¬ ское и симптоматическое.Специфическая профилактика разрабатывается: ведутся исследования по созда¬ нию живых аттенуированных вакцин [47].Риновирусная инфекцияВирус впервые выделил Tyrrell в 1960 г. из носовых смывов больных острым насморком, инфекционная природа которого доказана целым рядом исследова¬ телей в первой половине XX века (Kruss — 1914 г.; Dochez — 1930 г.; Andrewes — 1946 г.) [32].ЭТИОЛОГИЯРод Rhinovirus входит в семейство Picomaviridae. Пикорнавирусы — небольшие (pico - очень малый, та — РНК) РНК-содержащие вирусы, имеющие нефрагмен- тированный РНК-геном.К роду Rhinovirus относятся риновирусы человека А (1,2,3 серотипы), В (4,5,6), риновирус Напк$ и риновирусы крупного рогатого скота (1,2,3) [51].ЭПИДЕМИОЛОГИЯРиновирусы широко распространены особенно в северных и средних широтах. Подъём заболеваемости отмечается дважды в год: ранней осенью и поздней вес¬ ной. Источником инфекции является больной человек, основной путь передачи — воздушно-капельный, возможна и непрямая передача инфекции — через пред¬ меты обихода. Больной наиболее заразен в период максимального проявления катаральных симптомов, когда вирус передаётся наиболее интенсивно. Особенно
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 209быстро заболевание распространяется среди детей в организованных и закрытых коллективах.ПАТОГЕНЕЗВходными воротами инфекции является слизистая оболочка носа. Патологический процесс ограничивается верхними отделами дыхательных путей. В отличие от других ОРВИ при риновирусной инфекции страдает плоский эпите¬ лий, покрывающий носовые ходы. Секреторные клетки эпителия продуцируют слизь, им же принадлежит адсорбционная функция. В состав слизи входят фак¬ торы неспецифической защиты — муцин, лизоцим, оказывающие бактерицидное действие, и лактоферрин, обладающий бактериостатическим действием и опсони- ны, обеспечивающие усиление фагоцитоза.Макрофаги, содержащиеся в назальном секрете, вьщеляют противовоспали¬ тельные цитокины — ИЛ-1, ИЛ-6, ИЛ-8. Однако главная роль в развитии местного иммунитета принадлежит иммунным механизмам — Т- и В-клеткам. Т-клетки опосредуют цитотоксические и хелперные функции, а В-клетки продуцируют секреторные иммуноглобулины А (slgA), которые локализуются под эпители¬ альной мембраной и представляют собой первую линию защиты организма; sIgA связываются с вирусными или бактериальными патогенами и блокируют возмож¬ ность их адгезии к клеткам эпителия, предотвращая начало инфекционного про¬ цесса. Нейтрализованные sIgA патогены легко удаляются за счёт мукоцилиарного клиренса [52,53].При развитии инфекционного процесса неспецифическая местная защита сни¬ жается: уменьшается мукоцилиарный транспорт, снижается продукция sIgA, т.е. создаются условия способствующие вирусу противостоять мукоцилиарному кли¬ ренсу и активизироваться. Нарушается мукорегуляция и состав слизи, что приво¬ дит к застою и нарушению её отделения и, как следствие, к скоплению в полостях околоносовых пазух и среднем ухе. В этот период назальный секрет приобретает слизистый или слизисто-гнойный характер. К числу бактериальных патоге¬ нов, осложняющих риновирусную инфекцию, относятся Staphylococcus aureus, Haemophilus influenzae, различные штаммы Streptococcus pneumoniae, Klebsiella sp., Moraxella sp., Neisseria sp, [52, 53]. Всё это вносит вклад в патогенез синуситов и отитов, ассоциированных с риновирусами.КЛИНИЧЕСКАЯ КАРТИНАИнкубационный период составляет от 1 до 3 дней, реже — до 6 дней. Заболевание начинается с недомогания и лёгкого познабливания. С первых часов болезни появ¬ ляется заложенность носа, многократное чихание и обильное серозное отделяе¬ мое, нарушается обоняние и вкус, снижается слух.Общее состояние больного страдает мало. Температура тела, как правило, суб- фебрильная или остается нормальной.Через 2-3 дня ринит достигает максимальных проявлений. При осмотре в области крыльев и преддверья носа определяется мацерация кожи, гиперемия слизистой оболочки ротоглотки, преимущественно в области задней стенки глот¬ ки, инъекция сосудов склер и конъюнктив. Могут увеличиваться подчелюстные лимфатические узлы. Продолжительность заболевания редко превышает 7 дней, у части больных клинические симптомы сохраняются до 14-го дня. При затяжном рините (более 2 нед) в результате присоединения бактериальной флоры вьщеле- из носа приобретают слизисто-гнойный характер, что может свидетельство- 0 начинающемся остром синусите.ЦМГНОСТИКАВысокочувствительным методом, позволяющим быстро получить при иссле- жкканни назальных смывов, является ПЦР. Риновирус может быть изолирован в
210 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХклеточной культуре Vero через 2-7 дней после заражения с последующим опреде¬ лением специфических антител к выделенному штамму,ЛЕЧЕНИЕ И ПРОФИЛАКТИКАЛечение симптоматическое. Специфическая профилактика не разработана.Коронавирусная инфекцияКоронавирус человека впервые был вьщелен D. Tyrrell и М. Вупое в 1965 г. от больных ОРВИ. В 1967 г. К. McIntosh изолировал штаммы коронавирусов в куль¬ туре трахеи [32].ЭТИОЛОГИЯРод Coronavirus относится к семейству Coronaviridae и включает коронавирусы человека и животных.Вирион содержит однонитевую положительную РНК. Поверхность вирио- на покрыта булавовидными отростками, придающими вирусной частице вид короны. Геном вируса кодирует 4 структурных белка: мембранный (М), обо- лочечный (Е), оболочечный гликопротеин (S) и гемагглютинин-эстераза, иден¬ тифицированный только в некоторых штаммах коронавирусов, в SARS-CoV — отсутствует.На основании генетических и антигенных свойств все извесгные коронавирусы разделены на три группы. К первой принадлежат коронавирусы человека 229Е, кошек, собак и гастроэнтерита свиней; ко второй — коронавирусы человека ОС43, гепатита мышей и крупного рогатого скота; в третью входят кишечные коронави¬ русы человека и вирусы инфекционного бронхита кур.Сравнение аминокислотных последовательностей генов полимеразы матрикс- ного и оболочечного белков показал, что SARS-CoV не принадлежит ни к одной из серологических групп [54].ЭПИДЕМИОЛОГИЯКоронавирусная инфекция регистрируется в течение всего года, подъём заболе¬ ваемости — зимой и ранней весной, когда эпидемическая значимость её колеблет¬ ся от 15 до 33,7% [55]. Дети болеют в 5-7 раз чаще, чем взрослые. Инфекция рас¬ пространяется воздушно-капельным, фекально-оральным и контактным путём. Источником инфекции являются больные с клинически выраженной или стёртой формой заболевания.В структуре ОРВИ коронавирусная инфекция среди госпитализированных пациентов в среднем составляет 12,4% (с колебаниями в отдельные годы от 6,8 до 28,6%), Коронавирусы, как правило, лидируют среди других вирусов в этиологии нозокомиальных инфекций. Иммунитет после перенесённого заболевания непро¬ должительный и не защищает от реинфекции [55] ,В ноябре 2002 г. в китайской провинции Гуандун впервые было выявлено и опи¬ сано Карлом Урбани ранее неизвестное заболевание — тяжёлый острый респира¬ торный синдром ТОРС или SARS-Severe Acute Respiratory Syndrome. Весной 2003 г. был установлен этиологический агент — вирус SARS, относящийся к семейству коронавирусов [56]. Вирус имеет животное происхождение. Была показана воз¬ можность источника инфекции от циветг Poguma larvada, в частности через плохо обработанное мясо в ресторанах [57]. По данным ВОЗ, было зарегистрировано 8098 случаев заболеваемости [54].Наиболее широкое распространение заболевание получило в странах Юго- Восточной Азии (Китай, Гонконг, Тайвань, Сингапур, Вьетнам) и в Северной Америке (США, Канада). Случаи заболевания SARS зарегистрированы также в странах Европы (Франция, Германия, Италия, Ирландия, Румыния, Испания,
¡xxffr::ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПТЕЙ 211Швейцария, Великобритания), Южной Америки (Бразилия), Японии, Малайзии, g Хайланде и Южной Африке. Наибольшее количество заболевших зарегистриро- # : ■ мшо в Китае, Сингапуре, Канаде. Б большинстве случаев SARS распространился _ шз Юго-Восточной Азии по международным транспортным авиалиниям в связи с ’достаточно коротким инкубационным периодом [54,56].Механизм передачи возбудителя воздушно-капельный, не исключается ■оздушно-пылевой, а также наличие возбудителя не только в слюне, но и в рвот¬ ных массах, моче и других биологических средах. Особой опасности подвергаются медицинские работники, контактирующие с больным в наиболее опасный, с точки зрения эпидемиологии, период. Поэтому распространение заболевания проис¬ ходило в основном в госпитальных условиях. При отсутствии достаточных мер иштроля и профилактики один больной в среднем заражал 3 контактных лиц [58].В Сингапуре зафиксирована сит}’^ация, когда один больной оказался источником заражения не только медицинских работников, но и пациентов и посетителей, ■онтактировавших с ним [59]. По разным источникам летальность составляет от 4 до 10%, причем 60% от всех летальных исходов приходится на медицинских работников [57].1АТ0ГЕНЕЗВозбудитель передается аэрозольным, фекально-оральным и контактным путя¬ ми. Как правило, коронавирусы вызывают поражение верхних дыхательных путей н желудочно-кишечного тракта. Показана нейротропность вируса, имеются сооб- ■кния о выделении коронавирусов из мозга больных рассеянным склерозом [60].При тяжёлой форме коронавирусной инфекции (пневмонии) SARS-CoV вызы¬ вает диффузное повреждение альвеол. Нарушается целостность их стенок, повы¬ шается проницаемость альвеолокапиллярной мембраны, регулирующей водно¬ электролитный и газовый обмен. Альвеолы содержат лейкоциты, эритроциты, иродукты разрушения клеточных элементов. Клинически это соответствует разви¬ вающемуся отёку лёгких [19]. Характерной особенностью в первые дни развития острого дистресс-синдрома является наличие эозинофильных гиалиновых мем- ^»ан и повреждение альвеоцитов 1 типа. Разрушение сурфактанта, выстилающего аяьвеолы и бронхиолы приводит к спадению альвеол, что ещё больше нарушает газообмен. Развивается гипоксия, артериальная гипоксемия, респираторный аци¬ доз и алкалоз.Основной патогенетический механизм развития острого повреждения лёгких заключается в пропотевании плазмы и клеток крови в альвеолы и интерстиций лёгких. Возникающая воспалительная инфильтрация носит мультифокальный характер с тенденцией к слиянию и в последующем приводит к формированию фиброзных рубцов в лёгочной ткани [61]. Установлена корреляция между низкой жонцентрацией цитокинов ИЛ8 и TNF-p в периферической крови больных и тяже¬ стью заболевания [21],КЛИНИЧЕСКАЯ КАРТИНАПри коронавирусном заболевании, протекающем как ОРВИ, инкубационный период составляет 2-3 дня. Заболевание начинается остро и в большинстве слу¬ чаев протекает с умеренно выраженной интоксикацией и симптомами поражения верхних отделов респираторного тракта. При этом часто основным симптомом шляется ринит с обильным серозным отделяемым. Иногда заболевание сопро¬ вождается слабостью, недомоганием, больные отмечают першение в горле, сухой хашель. При объективном обследовании отмечается гиперемия и отёк слизистой оболочки носа, гиперемия слизистой задней стенки глотки.Температура тела, как правило, нормальная. Продолжительность болезни 5-7 дней. У части больных (9-24%) наблюдается лихорадка, симптомы интоксика-
212 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХции, кашель сухой или с мокротой, в лёгких при аускультации могут выслушиваться хрипы. В ряде случаев (3-8%) коронавирусная инфекция протекает с поражением нижних дыхательных путей и характеризуется развитием пневмонии, наиболее тяжёлой у детей раннего возраста. Описаны нозокомиальные вспышки коронави¬ русной инфекции, проявляюш;иеся синдромом острого гастроэнтерита [55].КЛИНИЧЕСКАЯ КАРТИНА ТОРСИнкубационный период в феднем продолжается от 2 до 7 дней, в ряде случаев составляет 10 дней. Начало болезни острое, возникает озноб (97%), температу¬ ра тела повышается до 38-39 °С (100%). В первые дни преобладают симптомы интоксикации: головная боль (84%), головокружение (61%), слабость (100%), боли в мышцах (81%). Катаральные симптомы в начальном периоде выражены умеренно: может наблюдаться лёгкий кашель (39%), боли в горле (23%) и ринит (23%) [62]. После 3-7 дней болезни развивается респираторная фаза с выражен¬ ными признаками поражения нижних дыхательных путей: усиливается кашель, появляется одьппка, чувство нехватки воздуха. При осмотре больных в нижнебо¬ ковых и задних отделах грудной клетки определяется притупление перкуторного звука, при аускультации на фоне ослабленного дыхания выслушиваются влажные мелкопузырчатые и крепитирующие хрипы, тахикардия. Нарастает гипоксия и гипоксемия. При рентгенологическом исследовании в лёгких выявляются мульти¬ фокальные инфильтраты с тенденцией к слиянию.у части больных помимо респираторного синдрома наблюдаются признаки поражения желудочно-кишечного тракта: тошнота, повторная рвота, диарея, которая отмечается, по данным, полученным в различных исследованиях от 1 до 31,6% [62]. У подавляющего большинства больных (80-90%), заболевание закан¬ чивается выздоровлением.При прогрессировании болезни у части больных (10-20%) развивается син¬ дром острого повреждения лёгких или острый респираторный дистресс-синдром (ОРДС). ОРДС чаще всего диагностируется на 3-5-е сутки развития пневмонии, однако есть данные о его развитии в первые 2 сут болезни. У больного усиливается сухой кашель одышка, выявляется тахипноэ, тахикардия. Как правило темпера¬ турные значения в этот период очень высокие, артериальное давление снижается. Нарастание РаСОз вызывает угнетение дыхания, алкалоз сменяется ацидозом, нарастает отёк лёгких, экссудат заполняет интерстициальные пространства, раз¬ вивается острая дыхательная недостаточность.Рентгенологически в лёгких определяются односторонние и двусторонние плотные инфильтраты. Вирус-индуцированные изменения в нижних дыхатель¬ ных путях, активизация бактериальной флоры формируют двусторонние сливные долевые пневмонии, В участках некротических изменений в последующем разрас¬ тается соединительная ткань, образуются фиброзные рубцы (10%).В периферической крови уже в начале болезни отмечается лимфопения, при развёрнутом респираторном синдроме наблюдается лейкопения (2,6х10Ул), тром¬ боцитопения (50-150xl0^/л). Повышенный уровень креатинкиназы, печёночных ферментов (ACT и АЛТ), С-реактивного белка отмечаются у подавляющего числа больных пневмонией. Мультивариантный анализ клинических данных свидетель¬ ствует, что тяжёлые сопутствующие заболевания и высокий С-реактивный белок в начале болезни являются плохим прогностическим признаком. Летальность по данным различных исследований колеблется от 4 до 19,7%, в группе больных, находящихся на искусственной вентиляции лёгких, летальность составляет 57,7%.Из осложнений отмечается: периферическая полинейропатия, острая почечная недостаточность, бактериальная и грибковая суперинфекция. Сопутствующие заболевания и пожилой возраст повышают риск тяжёлого течения болезни с неблагоприятным исходом.
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 213ДІАГНОСТИКА -Лабораторная диагностика коронавирусной инфекции включает выявление “ РНК вируса ОТ-ПЦР-тестом в биологическом материале (кровь, моча, назальный -¡ф, секрет). Этот метод особенно важен для ранней диагностики ТОРС. Для изоляции ■яруса используются клеточные культуры VERO, Тестирование антител прово¬ дится методом ELISA, используются также РСК и РИГА, позволяющие определить диагностические титры антител уже на 5-е сутки после инфицирования (РИГА) л[54, 61].МЕМЕНИЕ И ПРОФИЛАКТИКАВ настоящее время нет достоверных данных о клинической эффективности противовирусных препаратов при лечении ТОРС из-за отсутствия контролируе¬ мых исследований. Однако экстраординарность эпидемической ситуации по ТОРС индуцировала поиски возможностей противовирусной терапии. Было протестиро¬ вано (in vitro) 19 антивирусных препаратов: 7 интерферонов, 5 аналогов нуклеози- да, 3 ингибитора протеаз, 2 RT ингибитора и 2 ингибитора нейраминидазы. При этом 100% подавления цитопатогенного действия (ЦПД) получили при 5000 ИЕ/ мл бетаферона*, алферона и веллферона. Рибавирин оказывает ингибирующую активность, но только при высоких концентрациях (0,5-5 мг/мл), оказывая цито- токсическое действие на клеточную культуру [63]. Предполагается, что лечение ннтерферонами в дозах, используемых для лечения гепатита С может быть эффек¬ тивным.Рибавирин может применяться при ТОРС по 8-12 мг/мл каждые 8 ч в течение 7-10 дней, при тяжёлых формах рекомендуется внутривенное введение рибави- рвна.Проводится дезинтоксикационная терапия (гемодез*, peonoлиглюкин* и др.).Объём вводимой жидкости не превыщает 400-800 мл в сутки. Наряду с инфузи- оиной терапией необходимо назначение диуретиков из-за >трозы отёка лёгких.Показано введение донорского иммуноглобулина, содержащего антитела в высо¬ ком титре к коронавирусам.При ОРДС основой патогенетической терапии являются препараты сурфак¬ танта, восстанавливающие поверхностное натяжение в альвеолах. Сурфактант вазначается эндотрахеально (150-200 мл). Показано введение ГКС (преднизолон, гадрокортизон), в тяжёлых случаях рекомендуется внутривенное введение метил- преднизолона. Для респираторной поддержки показана интубация трахеи и ИВЛ с использованием малых дыхательных объёмов (V^ 6 мл/кг) [64].Антибиотики широкого спектра действия назначают при риске активизации собственной бактериальной флоры больного.ІРОФИЛАКТИКАВ настоящее время вакцинопрофилактика при коронавирусной инфекции, в том числе ТОРС, не разработана.Аденовирусные инфекциив 1953 г. Rowe, Hnebner, Gilmore выделили серию штаммов вируса из ткани аденоидов и миндалин здоровых детей. Hilleman и Werner, изучая этиологию ■ашшки острого заболевания дыхательных путей 1952-1953 гг, выделили на і^льтуре клеток HeLa целый ряд вирусов, которые были сходны друг с другом по антигенным свойствам и нейтрализовались сыворотками реконвалесцентов.В 1954 г. Neva и Enders изолировали вирус из кишечника ребёнка. Дальнейшие исследования показали, что все вирусы были сходны по биологическим и анти- гсиньш свойствам штаммам, выделенным Huebner и Rowe. Все штаммы были
214 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХобъединены в группу АРС (adenoid-pharyngeal-conjunctiva), а в дальнейшем назва¬ ны аденовирусами.ЭТИОЛОГИЯАденовирусы относятся к ДНК-содержащим вирусам. Семейство Adenoviridae составляют аденовирусы человека, животных и птиц. У человека аденовирусы вызывают острую, хроническую и латентную инфекцию, в то время как животные и птицы являются их естественным хозяевами. Аденовирусы обладают онкоген- ной активностью.Семейство Adenoviridae включает 101 вирус и состоит из четырёх родов; Mastadenovirus, Atadenovirus, Aviadenovirus и Siadenovirus [65]. Аденовирусы челове¬ ка {Mastadenovirus) по гемагглютинивирующей активности делятся на 6 групп: А,В, С, D, Е, F (табл. 12-3).Таблица 12-3. Групповая принадлежность аденовирусовГруппаСеротипы12, 18. 313, 7,11,14, 16,21,34, 35, 501 ,2, 5, 6а, 9, 10, 13, 15, 17. 19, 20. 22-30, 32, 33, 36-39, 42-49, 5140, 41Аденовирусы, изолированные от человека, играют в инфекционной патологии не одинаковую роль. Аденовирусы группы В (серотипы 3, 7,14. 21, 34, 35), груп¬ пы С (серотипы 4, 2,1) вызывают острую инфекцию респираторного тракта и глаз (бронхит, пневмония, конъюнктивит). Аденовирус серотипа 8 связан с поражени¬ ем роговицы — эпидемическим кератоконъюнктивитом. Аденовирусы серотипов1, 2, 5, 6 и 7 (группы С), вызывая острое заболевание, имеют склонность к перси¬ стенции в лимфоидной ткани миндалин глоточного кольца, а также в лимфоидных образованиях кишечника. В развитии тяжёлых пневмоний, бронхитов и бронхио¬ литов установлена роль аденовирусов серотипов 34, 35, 7, И (подгруппа В), 1, 2, 5, 21 (подгруппа С), 31 (подгруппа А) у больных с хроническими заболеваниями и иммунодефицитным состоянием, в том числе и ВИЧ-инфицированных. Кроме того, у последних изолированы аденовирусы подгруппы О (субтипы 8, 22, 29, 30, 37, 43, 44, 45, 46,47) [65, 66].ЭПИДЕМИОЛОГИЯАденовирусные заболевания распространены повсеместно, регистрируются в течение всего года с сезонным подъёмом в зимне-весенний период. Известны крупные вспышки фарингоконъюнктивальной лихорадки в летнее время при передаче инфекции через воду. Болеют преимущественно дети и молодые люди, особенно военнослужащие. Наблюдаются спорадические случаи, нозокомиальные и локальные вспышки в закрытых коллективах детей и взрослых.Источником инфекции является больной человек. Механизм заражения воздушно-капельный, контактный и алиментарный. Передача аденовирусов между детьми в детских коллективах и семейных очагах происходит главным образом фекально-оральным путём, при передаче же вируса в случае ОРВИ среди военно¬ служащих основным является респираторный путь.
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 215Для аденовирусной инфекции характерно медленное развитие эпидемического процесса и высокий процент латентных форм, что определяется серотипом вируса: эпидемические относятся к подгруппе в, латентные - к подгруппе с. в детских коллективах, где восприимчивость к инфекции наиболее высокая, чаще наблюда¬ ются вспышки фарингоконъюнктивальной лихорадки (3,7,14 серотипы), у детей младшего возраста — острый фарингит (1,2,3,5,6,7 серотипы). Среди новобран- пев нередки вспышки ринофарингитов, вызванных серотипами 3, 4, 7, 14, 21 и кератоконъюнктивита, связанного с 8,11 и 19 серотипами аденовирусов.Коклюшеподобный синдром детей раннего возраста вызывает 5 серотип адено¬ вируса, острый геморрагический синдром — 11 серотип.Латентные вирусы изолируют, как правило, от больных с острым и хрониче¬ ским тонзиллитом.ПАТОГЕНЕЗАденовирусы обладают эпителиотропностью, что проявляется изменениями эпителиальных клеток на всей протяжённости респираторного тракта: от слизистой оболочки носа до альвеол. Характерен экссудативный тип поражения. Вирусемия является важным звеном в развитии заболевания, вирус можно выделить из крови на 8-й день болезни при острой инфекции и на 21-35-й дни при латентной.В результате цитопатогенного действия вирусы в эпителиальных клетках раз¬ виваются дегенеративные процессы: клетки округляются, отмечается пикноз и рексис ядра с образованием внутриядерных включений; в тяжёлых случаях наблюдается некроз эпителия. Скорость прогрессирования изменений в клетках пропорциональна длительности инкубационного периода.Отличительной особенностью патологического процесса при аденовирусной инфекции является его «ползучий» характер. В начале болезни поражается сли¬ зистая оболочка носа, задней стенки глотки и миндалин. Вследствие выраженного экссудативного компонента резко выражен отёк слизистых оболочек и лимфо¬ идной ткани (миндалин, регионарных лимфатических узлов). В ряде случаев в области миндалин и задней стенки глотки появляется выпот с нежными фибри¬ нозными наложениями. Бронхогенным путём вирус проникает в нижние отделы респираторного тракта. У детей раннего возраста существует высокий риск раз¬ вития тяжёлой пневмонии, в клетках цилиндрического эпителия, подслизистом слое трахеи, бронхов, в альвеолярных и мононуклеарных клетках развиваются процессы дегенерации, некроза, вызывающие гибель клеток. При этом отягощаю¬ щую роль играет активизация бактериальной флоры [20].По лимфатическим путям аденовирусы проникают в регионарные лимфатиче¬ ские узлы, вызывая гиперплазию бронхопульмональных и мезентериальных лим¬ фоузлов. Особенностью аденовирусной инфекции является способность вируса размножаться в кишечнике, куда возбудитель попадает с заглатываемой слизью, у детей развиваются мезадениты.Аденовирусы занимают особое место среди других респираторных вирусов в связи с присущей им способностью к персистенции.КЛИНИЧЕСКАЯ КАРТИНАИнкубационный период в среднем составляет 6 дней, при фарингоконъюнкти¬ вальной лихорадке, как правило, бывает 2-3 дня и может продолжаться от 3 до 22 дней (в среднем 9 дней) при эпидемическом кератоконъюнктивите.Основными клиническими формами аденовирусного заболевания являются ринофаринготонзиллит, фарингоконъюнктивальная лихорадка, вирусная пневмо¬ ния, эпидемический кератоконъюнктивит [20].К особенностям течения болезни относится последовательное появление кли¬ нических симптомов в процессе заболевания.
216 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХНаиболее часто субфебрильная температура сочетается с фарингитом, тра¬ хеитом, бронхитом. Из-за гипертрофии лимфоидной ткани в глотке и отёка про¬ должительного по времени у детей возможна обструкция евстахиевой трубы и вос¬ паление среднего уха.У взрослых назофарингит сочетается с охриплостью голоса и сухим кашлем. Как правило, увеличиваются шейные и подчелюстные лимфатические узлы.Фарингоконъюнктивальная лихорадка характеризуется триадой симптомов — лихорадкой, конъюнктивитом, фарингитом — и этиологически связана, как пра¬ вило, с серотипами 3, 4, 7, Однако типичная триада наблюдается не всегда, чаще отмечаются первые два симптома. Конъюнктивит во всех случаях начинается как односторонний, в дальнейшем, особенно у взрослых, может возникнуть и с другой стороны, процесс может бьггь катаральным, фолликулярным и плёнчатым.Начало болезни внезапное, у части больных температура тела повышается до 39-40 °С, в других случаях температура может быть невысокой или оставаться нормальной. В целом заболевание протекает доброкачественно, лихорадочный период в среднем длится 5-6 дней.С первого дня болезни пациенты отмечают ощущение «песка» в глазу, слё- зотечение, определяется сужение глазной щели, инъекция сосудов склер гипе¬ ремия конъюнктивы, в ряде случаев — кровоизлияние на слизистой оболочке. Характерна зернистость конъюнктивы за счёт увеличения фолликулов в подсли¬ зистой лимфоидной ткани, а также симптомы фарингита: боль в горле, инъекция сосудов слизистой оболочки задней стенки глотки, гиперплазия лимфоидных образований (гранулёзный, боковой фарингит), увеличение регионарных лимфа¬ тических узлов. Симптомы токсикоза выражены слабо, даже при наличии высо¬ кой лихорадки. Сочетание фарингоконъюнктивальной лихорадки и пневмонии у детей раннего возраста характеризуется тяжёлым течением.При любой форме аденовирусной инфекции развивается поражение носоглот¬ ки: слизистая оболочка носовых ходов набухшая, отёчна особенно в области ниж¬ них носовых раковин. Длительность ринита от 1 до 4 нед, отделяемое серозное и слизисто-серозного характера.Острые тонзиллиты при аденовирусном заболевании у большинства больных возникают с первых дней болезни, причём лакунарная и фолликулярная ангины могут протекать в сочетании с респираторным синдромом или быть единственным проявлением обострения хронической аденовирусной инфекции [67].Один из основных симптомов болезни является кашель, как правило, влажный. Бронхиты развиваются преимущественно у детей младшего возраста и часто усу¬ губляются присоединением вторичной бактериальной флоры.При рентгенологическом исследовании лёгких отчётливо видны расширенные корни, перибронхиальные и интерстициальные изменения, усиление бронхосо¬ судистого рисунка, очаги пневмонической инфильтрации, иногда с тенденцией к слиянию.в случае развития пневмонии состояние больных ухудшается, нарастает инток¬ сикация, одышка, усиливается кашель. В лёгких перкуторный звук коробочный вследствие развития эмфиземы, при аускультации выслушиваются сухие и разно¬ калиберные влажные хрипы.Пневмонии чаще развиваются у детей, наиболее тяжело болеют дети раннего возраста.В целом аденовирусному заболеванию свойственно длительное волнообразное течение. Осложнения: синусит, отит, миокардит.ДИАГНОСТИКАЛабораторная диагностика основывается на выявлении вирусного антигена методом флюоресцирующих антител, изоляции вирусов из носоглоточных смывов
ВИРУСНЫЕ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ 217НЗ культуре клеток Нер-2 и HeLa с последующим подтверждением в РСК и PH. Оценку динамики специфических антител проводят в парных сыворотках крови, взятых в ранний период заболевания и через 2-3 нед,ЛЕЧЕНИЕГанцикловир, рибавирин, цидофир эффективны в отношении аденовирусов in vitro, Ганцикловир может быть использован лишь при тяжелой форме болезни, принимая во внимание серьёзную нефротоксичность. Изучается возможность применения рибавирина в качестве монотерапии или сочетание его с иммунными препаратами.Бокавирусная инфекцияВирус (Bocavirus humanes — HBoV) впервые был обнаружен методом ПЦР в клинических образцах у новорождённых и детей с заболеваниями дыхательных путей в Швеции [68],Возбудитель является ДНК-содержащим вирусом, относится к роду Bocavirus, подсемейства Parvavirinae, семейству Parvoviridae.До недавнего времени единственным вирусом семейства, патогенным для чело¬ века, являлся вирус В19, вызывающий инфекционную эритему («пятую болезнь» - экзантематозную болезнь у детей), артропатию и хроническую гемолитическую анемию.HBoV выявлен у 1,5% детей с ОРВИ при исследовании 1209 проб биологиче¬ ского материала в Канаде [69]. Основными симптомами заболевания являются кашель (78%), лихорадка (67%) и боли в горле (44%). отмечаются также головная боль (22%), тошнота (17%), миалгия (11%). Среди заболевших 89% составили дети младше 5 лет, половина из них были госпитализированы в связи с поражени¬ ем нижних отделов дыхательных путей (пневмония, бронхиолит) [69, 70].О выявлении бокавирусной инфекции у пациентов ОРВИ сообщали из Франции [70], Австралии [71], Японии [72]. По данным исследований, полученных во Франции, значимой разницы в частоте заболеваний в возрастных группах от 10 мес до 60 лет не наблюдалось [70].СПИСОК ЛИТЕРАТУРЫ
Глава 13БактериальнаяпневмонияВведениеПневмония - инфекция дистальных отделов респираторного тракта, характеризующаяся вовлечением в патологический процесс прежде всего альвеол, а также бронхов мелкого калибра и брон¬ хиол. С патофизиологической точки зрения, пневмония является результатом размножения возбудителей и ответом хозяина на их присутствие в респираторных отделах лёгких. При этом важно под¬ черкнуть, что само по себе размножение микроорганизмов вовсе не обязательно приведёт к развитию пневмонии. Так, например, из респираторных секретов больных, длительное время находящихся на механической вентиляции лёгких, нередко выделяются возбу¬ дители в клинически значимых концентрациях, однако при этом отсутствуют субъективные и объективные симптомы заболева¬ ния — такую ситуацию принято именовать колонизацией.Развитие очагового инфекционного воспаления на уровне альве¬ ол принципиально отличает пневмонию от других инфекций респи¬ раторного тракта, с которыми она нередко оказывается клинически схожей. Инфекции воздухоносных путей дистальнее голосовых свя¬ зок (трахеит, бронхит, бронхиолит) принято именовать инфекция¬ ми нижних дыхательных путей. Инфекции верхних дыхательных путей (ларингит, фарингит и ринит) имеют, как правило, вирусное происхождение и характеризуются в целом благоприятным про¬ гнозом.Ещё относительно недавно была распространена расширитель¬ ная трактовка термина «пневмония», когда его использовали для описания едва ли не всякого случая очагового воспаления лёгочной ткани независимо от его природы. Отражением подобного подхода являлась, в частности, известная классификация острой пневмонии Н.С. Молчанова (1962), в которой вьщелялись такие этиологиче¬ ские формы болезни, как «пневмонии, обусловленные химическими и физическими раздражителями», «аллергические пневмонии», «инфекционно-аллергические пневмонии» и пр.в настоящее время под пневмониями понимается группа различ¬ ных по этиологии, патогенезу и морфологической характеристике острых инфекционных (преимущественно бактериальных) заболе¬ ваний, характеризующихся очаговым поражением респираторных отделов лёгких с внутриальвеолярной экссудацией (что выявляется при физикальном и рентгенологическом исследовании), а также
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 219выраженными в различной степени лихорадочной реакцией и интоксикацией flj. Поскольку пневмонии в принципе являются острыми инфекционными забо¬ леваниями, то определение «острая» перед диагнозом «пневмония» является излишним (тем более что термин «хроническая пневмония» практически вышел из употребления).в Международной классификации болезней, травм и причин смерти (МКБ) І0-ГО пересмотра (1992) пневмонии чётко обособлены от других очаговых воспа¬ лительных заболеваний лёгких неинфекционного происхождения. Так, из рубрики ’«Пневмония» исключены заболевания, обусловленные воздействием физических (например, лучевой пневмонит) или химических (в частности, «бензиновая» пнев¬ мония) факторов, имеющие аллергическое («эозинофильная» пневмония) или сос’^дистое (инфаркт лёгкого при ТЭЛА, гранулематоз Вегенера) происхождение, а также воспалительные процессы в лёгких, вызываемые облигатными бактери¬ альными или вирусными патогенами (чума, брюшной тиф, корь, краснуха, грипп и другие, которые рассматриваются в рамках соответствующих нозологических форм).Особенно важным является разграничение вирусных респираторных инфек¬ ций и собственно пневмонии. Вирусные респираторные инфекции (прежде всего грипп), безусловно, являются основным фактором риска воспаления лёгких. Однако вызываемые вирусами патологические изменения в лёгочной ткани назы¬ вать пневмонией не следует и более того — необходимо чётко от неё отграничивать, поскольку подход к лечению этих 2 состояний принципиально различен. С этой точки зрения представляется не вполне удачным термин «вирусно-бактериальная пневмония», поскольку собственно бактериальная пневмония качественно отли¬ чается от вирусного (чаще всего интерстициального) поражения лёгких.ПатофизиологияПневмонию могут вызывать различные возбудители. Так, из ткани лёгких боль¬ ных, умерших от пневмонии, в разное время удалось выделить более 100 видов микроорганизмов. Однако на практике в подавляющем большинстве случаев пнев¬ монию вызывает ограниченное число возбудителей.Противоинфекционную защиту нижних дыхательных путей осуществляют механические факторы (аэродинамическая фильтрация, разветвление бронхов, надгортанник, кашель и чиханье, колебательные движения ресничек мерцательно¬ го эпителия слизистой оболочки бронхов), а также механизмы неспецифического и специфического иммунитета, которые, в свою очередь, подразделяются на кле¬ точные и гуморальные [2]. Причинами развития воспалительной реакции в респи¬ раторных отделах лёгких могут быть как уменьшение эффективности защитных механизмов макроорганизма, так и массивность дозы микроорганизмов и/или их повышенная вирулентность.Оюжность состоит в том, что со временем происходят расширение и модифика¬ ция перечня возбудителей пневмонии. Так, например, ещё относительно недавно внебольничная пневмония если не исключительно, то главным образом связыва¬ лась со Streptococcus pneumoniae. Сегодня же этиология заболевания значительно расширилась и помимо бактерий может бьггь вызвана вирусами [вирусом птичьего гриппа (H5N1), ассоциированным с тяжёлым острым респрфаторным синдромом, коронавирусом, метапневмовирусом и др.], грибами, а также недавно идентифици¬ рованными «атипичными» возбудителями {Legionella pneumophila, Chlamydophila pneumoniae). Впрочем, острота проблемы пневмонии определяется не столько расширением круга возбудителей, сколько распространением антибиотикоустой- чнвых штаммов ключевых респираторных патогенов [3, 4].В случае развития пневмонии у иммунокомпетентного пациента происходит быстрое заполнение альвеолярного пространства клетками воспаления и экс-
УіІ220 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХщ судатом. Пневмония развивается в тех случаях, когда возбудитель превосходит противоинфекционную защиту хозяина. Подобное может случиться, в частности, когда формируется несовершенный иммунный ответ вследствие сопутствующих заболеваний (застойной сердечной недостаточности, сахарного диабета, почечной недостаточности, ХОБЛ, упадка питания), анатомических нарушений (эндоброн- хиальной обструкции, бронхоэктазии), остро развившейся иммунной дисфунк¬ ции (при сепсисе, остром повреждении лёгких), медикаментозно обусловленных нарушений иммунитета (ГКС). Пневмония может также развиться у пациентов с сохранным иммунным ответом, когда противоинфекционная защита организма «прорывается» массивной микробной агрессией (например, при аспирации содер¬ жимого желудка). Пневмония при сохранной иммунной системе также может быть вызвана особо вирулентными микроорганизмами, к которым ещё не был сформи¬ рован иммунитет или же на которые организм оказался не в состоянии сформиро¬ вать адекватный иммунный ответ.Бактерии могут проникнуть в лёгкие несколькими путями, однако наиболее важным из них является аспирация секрета ротоглотки с содержащимися в нём колонизирующими микроорганизмами [5J. Хотя основным механизмом инфици¬ рования лёгочной ткани служит микроаспирация, больной может аспирировать и массивный объём бактерий, если нарушены нейрогенные механизмы защиты верхних дыхательных путей (острое нарушение мозгового кровообращения, судорожный синдром) или если сопутствующее заболевание внутренних органов предрасполагает к повторной рвоте. Механизм микроаспирации/аспирации в раз¬ витии пневмонии наиболее характерен для Streptococcus pneumoniae, Haemophilus influenzae, грамотрицательных энтеробактерий и анаэробов.Другими путями инфицирования лёгочной ткани могут быть ингаляция микробного аэрозоля {Mycoplasma pneumoniae, Chlamydophila pneumoniae, Legionella pneumophila, Chlamydophila psittaci), гематогенная диссеминация из внелёгочного очага инфекции (например, в случае инфекционного эндокардита правых отделов сердца — Staphylococcus aureus), непосредственное распространение инфекции с прилежащих очагов (например, внутрипечёночный или поддиафрагмальный абсцесс) или реактивация латентной инфекции {Pneumocystisjiroveci).Если принять во внимание сказанное выше, становится понятным, почему у исходно здорового человека вдруг развивается лёгочная инфекция, вызван¬ ная такими пневмотропными возбудителями, как L pneumophila, М. pneumoniae,С. pneumoniae или S. pneumoniae. С другой стороны, у пациентов с предсуществу- ющими хроническими заболеваниями внутренних органов может иметь место как одна из указанных инфекций, так и инфекция, вызываемая постоянно колонизи¬ рующими в организме микроорганизмами (Escherichia coU, Klebsiella pneumoniae, Pseudomonas aeruginosa, Acinetobacter spp.), поскольку последний не в состоянии сформировать адекватный иммунный ответ.Исследования, проведённые в настоящее время, свидетельствуют, что в случа¬ ях формирования адекватного иммунного ответа при инфицировании лёгочной ткани происходит своеобразная компартментализация, то есть ограничение рас¬ пространения воспалительного процесса, в связи с чем пневмония в абсолютном большинстве случаев имеет одностороннюю локализацию и не выходит за рамки пораженного лёгкого (т.е. в контралатеральное лёгкое или системный кровоток). У больных с локализованной (односторонней) пневмонией уровни фактора некро¬ за опухоли альфа (ФНО-а) и интерлейкинов-6 и -8 оказываются повышенными в поражённом лёгком, но остаются нормальными в интактном лёгком и сыворотке крови [6].Б случаях же тяжёлой пневмонии воспалительный ответ выходит за пределы пораженного лёгкого, приобретая системный характер; это, в частности, отража¬ ется в повышении уровня указанных провоспалительных медиаторов в сыворотке
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 221Крови. Впрочем, до настоящего дня остаётся неясным, почему локализованная форма воспаления лёгких наблюдается не у всех пациентов и почему у некоторых НЗ них в ответ на локальное инфицирование лёгочной ткани формируется диффуз¬ ное поражение лёгких (острый респираторный дистресс-синдром - ОРДС) или генерализованный ответ (сепсис). Современные исследования позволяют считать, *гто гетерогенность ответа хозяина на очаговую лёгочную инфекцию может быть объяснена генетическим полиморфизмом, у части пациентов предрасполагающим к генерализованному воспалительному/иммунному ответу и даже к фатальному исходу заболевания. Так, определённый генетический полиморфизм (ТМР-308) ассоциируется с возрастанием риска летального исхода от сепсиса, но не от пнев- ионии; степень тяжести пневмонии ассоциируется с генетическими изменениями локуса ИЛ-10-1082', генетическое отклонение, связываемое с модификацией белка теплового щока 70-2, характеризуется возрастанием риска септического шока при пневмонии [6]. В настоящее время есть сведения о больщом числе генов, оказы¬ вающих влияние на тяжесть течения и исходы пневмонии, однако ещё предстоит установить истинный клинический контекст тех или иных генетических находок.КлассификацияПодходы к классификации пневмонии различны; можно основываться на учёте этиологии, исходного состояния противоинфекционной защиты, клинической жартины заболевания (типичная, «атипичная») и др.Не вызывает сомнений, что классификация, наиболее полно отражающая особен¬ ности течения пневмонии и позволяющая обосновать этиотропную (антибактери¬ альную) терапию, должна быть построена по этиологическому принципу, который положен в основу классификации пневмонии, представленной в Международной чассификации болезней, травм и причин смерти 10-го пересмотра (табл. 13-1). Однако недостаточная информативность и значительная продолжительность традиционных микробиологических исследований (отсутствие у 20-30% больных продуктивного кашля, невозможность выделить культуру внутриклеточных воз¬ будителей при использовании стандартных диагностических подходов, выделение культуры возбудителя лишь спустя 24-48 ч от момента получения материала, трудности в разграничении «микроба-свидетеля» и «микроба-возбудителя», рас¬ пространённая практика приёма антибактериальных препаратов до обращения за медицинской помощью), объясняющие отсутствие этиологического диагноза едва ли не у каждого второго больного, делают невозможным широкое практическое использование этиологической классификации пневмонии.Таблица 13-1. Классификация пневмонии в соответствии с Международной классификацией болез¬ ней, травм и причин смерти 10-го пересмотра (1992)ГРубрикаНозологическая форма: лзПневмония, вызванная Streptococcus pneumoniaeJ14Пневмония, вызванная Haemophilus influenzaeJ15Бактериальная пневмония, не классифицированная в других рубриках (исключены пневмония, вызванная Chlamydia $рр., — Л6.0 и «болезнь легионеров» — А48.1)J15.0Пневмония, вызванная Klebsiella pneumoniaeJ15.1Пневмония, вызванная Pseudomonas spp.J15.2Пневмония, вызванная Staphylococcus spp.J15.3Пневмония, вызванная стрептококками группы В
222ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХОкончание табл. 13-1J15.4Пневмония, вызванная другими стрептококкамиJ15.5Пневмония, вызванная Escherichia coliJ15.6Пневмония, вызванная другим/ аэробными грамотрицательными бактериямиJ15.7Пневмония, вызванная Mycoplasma рпеитог1аеЛ5.8Другие бактериальные пневмонииJ15.9Бактериальная пневмония неуточнённой этиологииJ16Пневмония, вызванная возбудителями, не классифицированными в других рубриках (исклю¬ чены орнитоз — А70, пневмоцистная пневмония — В59)J16.0Пневмония, вызванная Chlamydia spp.J16.8Пневмония, вызванная другими установленными возбудителямиJ17*Пневмония при заболеваниях, классифицированных в доугих рубрикахЛ 7.0*Пневмония при заболеваниях бактериальной природы, классифицированных в других рубри¬ ках; пневмония при актиномикозе (А42.0), сибирской язве (А22.1), гонорее (А54.8}, нокардио- зе (А43.0), сальмонеллёзе (А02.2), туляремии (А21.2), брюшном тифе (А01.0), коклюше (А37)Л7.ГПневмония при вирусных заболеваниях, классифицированных в других рубриках: пневмония при цитомегаловирусной болезни (В25.0), кори (В05.2), краснухе (В06.8), ветряной оспе (В01.2}Л7.2‘Пневмония при микозахЛ7.3*Пневмония при паразитозахJt7.8*Пневмония при заболеваниях, классифицированных в других рубриках: пневмония при орни- тозе (А70), ку-лихорадке (А78), острой ревматической лихорадке (100), спирохетозе (А69.6)Л8Пневмония без уточнения возбудителя* Указаны пневмонии при заболеваниях, классифицированных в других рубриках.В последнее десятилетие с улучшением техники этиологической диагностики пневмонии и углублением наших знаний о факторах, влияющих на клиническую картину болезни, утратил большое число своих сторонников и синдромный подход с разделением пневмонии на типичную и «атипичную». Как сейчас представляет¬ ся, клинические проявления болезни определяются не только свойствами возбуди¬ теля, но и иммунологическим статусом пациента. Опубликованные исследования свидетельствуют также, что пневмония, вызванная «атипичными» возбудителями (прежде всего Legionella spp.), нередко имеет проявления типичной и, напротив, пневмококковая пневмония (особенно у пациентов пожилого и старческого воз¬ раста) может иметь «атипичную» симптоматику [7, 8].В настоящее время наиболее важным представляется разделение пневмоний с у'іетом условий и времени инфицирования лёгочной ткани (табл. 13-2) на вне- больничную (домашнюю, амбулаторную) и нозокомиальную (больничную, вну- тригоспитальную); в последние годы стали выделять пневмонии, связанные с ока¬ занием медицинской помощи (англ. healthcare-associated pneumonia). Выделение последней категории объясняется тем, что по условиям возникновения их следо¬ вало бы рассматривать как внебольничные, но спектр возбудителей (и их профиль антибиотикорезистентности) приближает пневмонии, связанные с оказанием медицинской помощи, к нозокомиальным [9J.
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 22313-2. Классификация пневмонии {[6], с изменениями)ВнебольничнаяI Тшпная (у пациентов с в1супгтвием выраженных нару- ■омн иммунитета);• бЭ1Стериальная;• грибковая;• 1мко6а1аериальная;• паразитарная.1. У пациентов с выраженными шрушениями иммунитета;• с»4Дром приобретенного ■мунодефицита (СПИД);• прение заболевания и патоло- пр«(жие состояния.■- Аспирационная пневмония/ йсцесс лёгкогоНозокомиальнаяI. Собственно нозокомиальнаяюII. ВентиляторассоциированнаяIII. Нозокомиальная пневмония у паци¬ ентов с выраженными нарушениями иммунитета;• у реципиентов донорских органов;• у пациентов, получающих цитостати- ческую терапиюСвязанная с оказанием меди¬ цинской помощиI. Пневмония у жителей домов престарелых.II. Прочие категории пациентов:• антибактериальная терапия в предшествовавшие 3 мес;• госпитализация {по любому поводу) а течение 2 сут и более а предшествовавшие 90 дней;• пребывание в других учреждени¬ ях длительного ухода;• хронический гемодиализ в тече¬ ние 30 сут и более;• обработка раневой поверхности в домашних условиях;• иммунодефицитные состояния/ заболеванияВнебольничная пневмонияВнебольничная пневмония (ВП) — острое заболевание, возникшее во внебольнич- вых условиях (вне стационара, либо диагаостированное в первые 48 ч от момента госпитализации, либо развившееся у пациентов, не находившихся в домах сестринско¬ го ухода/отделениях длительного медицинского наблюдения 14 сут и более) и сопро¬ вождающееся симптомами инфекции нижних отделов дыхательных путей (лихо¬ радкой, кашлем, выделением мокроты, возможно гнойной, болью в грудной клетке, одышкой) и рентгенологическими признаками «свежих» очагово-инфильтративных юменений в лёгких при отсутствии очевидной диагностической альтернативы [10].ЭПИДЕМИОЛОГИЯНесмотря на доступность современных антибиотиков и эффективных вакцин, ВП остаётся широко распространённым и потенциально жизнеугрожающим забо¬ леванием. Так, например, в США пневмония занимает 6-е место в перечне главных причин смерти и является лидером по числу летальных исходов в ряду инфекци- 0Ш1ЫХ заболеваний. В большинстве развитых стран показатель смертности при пневмонии составляет 50-60 на 100 ООО населения. Впрочем, справедливости ради следует сказать, что эти данные представляются заниженными, поскольку пневмо¬ ния не относится к числу заболеваний, подлежащих обязательной регистрации.Что же касается заболеваемости ВП, то этот показатель в большинстве стран составляет 10-12 на 1000 населения, варьируя в зависимости от возраста, пола, расовой принадлежности и социально-экономических условий обследуемых попу- Juщий. Так, например, в США наибольшие показатели заболеваемости ВП реги- стрирзаотся у детей младше 4 лет (12-18 на 1000 населения), что сравнимо с {мспространённостью заболевания среди лиц старших возрастных групп (>60 лет) в странах Европы (20%о) [11, 12]. ВП обусловливает каждую вторую смерть от инфекционных заболеваний в гериатрической популяции и 90% летальных исхо¬ дов от респираторных инфекций среди лиц старше 64 лет. При этом, несмотря на то что наибольшие показатели распространённости и смертности регистрируются у детей младшего возраста и пожилых, половина всех летальных исходов от пнев¬ мококковой ВП приходится на возрастной диапазон 18-65 лет.Ежегодно в США регистрируют более 4 млн больных ВП, 600 тыс. из которых 1^ждаются в госпитализации [13]. При этом, несмотря на широкую распространён- вость, ВП занимает весьма скромное место среди всех внебольничных инфекцийЖ:
224 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХНИЖНИХ дыхательных путей (согласно результатам проспективного исследования, 12% среди всех пациентов с такими инфекциями, получающих в связи с этим анти¬ бактериальную терапию).В США и ряде стран Европы более 80% больных ВП пол)^ают лечение в амбулаторно-поликлинических условиях (прогнозируемый уровень летальности для этой категории пациентов — <1%). Частота госпитализации больных ВП в значительной степени зависит от организации системы здравоохранения и пред¬ почтений врача, составляя от 15 до 42%. Общей тенденцией является переоценка врачом риска летального исхода ВП и госпитализация пациентов с минимальным риском. В тех же случаях, когда госпитализация больного ВП оправдана с меди¬ цинских позиций, показатели ожидаемой летальности колеблются от 4 до 37% (у лиц старших возрастных групп).Согласно официальной статистике (Центральный научно-исследовательский институт организации и информатизации здравоохранения), в 1999 году в России среди лиц в возрасте 18 лет и старше было зарегистрировано 440 тыс, случаев ВП (3,9%о), а в 2003 году во всех возрастных группах распространённость ВП соста* вила 4,1%о. Сходными с федеральными данными оказываются показатели распро¬ странённости ВП и в отдельных регионах нашей страны: в Республике Татарстан (2004) — 2,8%о, Свердловской области (2004) - 3,5%о, Санкт-Петербурге (2003) - 2,96%о [10]. Очевидно, однако, что эти цифры не отражают истинной заболевае¬ мости ВП в России, которая, согласно расчётам, достигает 14-15%о, а общее число больных ежегодно превышает 1,5 млн человек [14]. Но даже эти цифры не являются окончательными, поскольку у отдельных категорий обследуемых показатель забо¬ леваемости ВП оказывается сущесгвенно выше. Так, в частности, по данным ежегод¬ ных отчётов медицинской службы Министерства обороны РФ, распространённость ВП у военнослужащих срочной службы в 2000-2003 гг. превышала 40%о.В 2003 году в РФ от ВП умерли 44 438 человек (31 на 100 тыс. населения). Смертность от ВП в Республике Татарстан в 2002 году составляла 23 на 100 тыс. населения, в Санкт-Петербурге в 2003 году — 34,4 на 100 тыс., в Екатеринбурге с 2000 по 2004 год — 35,8-39,9 на 100 тыс. Анализ данных в отдельных регионах РФ свидетельствует, что наиболее высокая смертность от ВП регистрируется у мужчин трудоспособного возраста [10].ПАТОГЕНЕЗАспирация содержимого ротоглотки — главный путь инфицирования респи¬ раторных отделов лёгких и основной патогенетический механизм развития ВП. Б нормальных условиях ряд микроорганизмов, например Streptococcus pneumoniae, может колонизировать ротоглотку, но нижние отделы дыхательных путей при этом остаются стерильными. Микроаспирация секрета ротоглотки — физиологи¬ ческий феномен, наблюдающийся практически у половины здоровых лиц преиму¬ щественно во время сна. Однако кашлевой рефлекс, мукоцилиарный клиренс, антибактериальная активность альвеолярных макрофагов и секреторных имму¬ ноглобулинов обеспечивают элиминацию инфицированного секрета из нижних отделов дыхательных путей и их стерильность.При повреждении механизмов «самоочищения» трахеобронхиального дерева, например, при вирусной респираторной инфекции, когда нарушается функция ресничек эпителия бронхов и снижается фагоцитарная активность альвеолярных макрофагов, создаются благоприятные условия для развития ВП. В отдельных случаях самостоятельным патогенетическим фактором могут быть массивность дозы микроорганизмов или проникновение в респираторные отделы лёгких даже единичных высоковирулентных патогенов.Ингаляция микробного аэрозоля — менее частый путь развития ВП. Он играет основную роль при инфицировании нижних отделов дыхательных путей облигат¬ ными возбудителями, например С. pneumoniae или Legionella spp.
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 225£)№ меньшее значение (по частоте встречаемости) имеет гематогенное (напри- ■ср. Staphylococcus spp.) и прямое распространение возбудителя из очага инфекции,С учётом описанных особенностей патогенеза ВП очевидно, что её этиология9 подавляющем больщинстве случаев связана с микрофлорой верхних отделов 1Р1хательных путей, состав которой зависит от внешней среды, возраста пациента■ общего состояния здоровья.9ПОЛОГИЯДаже используя широкий круг микробиологических исследований, установить эгаологию ВП удаётся едва ли в половине случаев. Этот факт, с одной стороны, указывает на ограниченные возможности современной этиологической диагно- онки лёгочных инфекций, а с другой стороны, позволяет предположить, что нам ■эвестны далеко не все потенциальные возбудители заболевания [15]. В пользу справедливости последнего предположения свидетельствовали многочисленные шходки последних лет, существенно расширившие и видоизменившие наши 1радиционные представления об этиологии ВП (L pneumophila, С. pneumoniae, ТОРС-ассоциированный коронавирус, Hantavirus и др.). Современные знания ■мюлнились и многочисленными свидетельствами едва ли не повсеместного рас- Чюстранения лекарственно-устойчивых штаммов основного возбудителя ВП — S. pneumoniae.Как уже говорилось, этиология ВП непосредственно связана с нормальной мирофлорой, колонизующей верхние отделы дыхательных путей. Из многочис- жяных микроорганизмов лишь некоторые, обладающие повышенной вирулент- ■остъю, способны при попадании в нижние отделы дыхательных путей вызывать «ошалительную реакцию [10]. К числу таких возбудителей следует прежде всего •шести пневмококк (30-50% случаев заболевания).Существенное значение в этиологии ВП имеют и так называемые «атипичные» ■вqюopгaнизмы (которые не удаётся идентифицировать при бактериоскопии или ■всеве на обычные питательные среды), на долю которых в сумме приходится от Шяр 30% случаев заболевания:• Chlamydophila pneumoniae',• Mycoplasma pneumoniae',• LeponeUa pneumophila.К редким (3-5%) возбудителям ВП относят:;; • Haemophilus influenzae',• Staphylococcus aureus’,• Klebsiella pneumoniae',• ещё реже — другие энтеробактерии;• в очень редких случаях ВП может вызывать Pseudomonas aeruginosa (у боль¬ ных муковисцидозом, при наличии бронхоэктазов).Важно подчеркнуть, что нередко у взрослых пациентов, переносящих ВП, выяв- якгся смешанная или коинфекция. Так, например, едва ли не у каждого второго бааьного с пневмококковой этиологией заболевания одновременно удаётся обна- |§Ж1ПЪ серологические признаки активной микоплазменной или хламидийной ■шфекшш [16]." Для некоторых микроорганизмов не характерно развитие бронхолёгочного ■ошаления, поэтому их выделение из мокроты, скорее всего, свидетельствует о шпаминации материала флорой верхних отделов дыхательных путей, а не об |рюж)гической значимости этих микробов. К таким микроорганизмам относятся 9lnftococcus viridans. Staphylococcus epidermidis и другие коагулазонегативные ста- ^■жжокки, Enterococcus spp.. Neisseria spp., Candida spp. и др. [10].^ Этиологические структуры ВП могут различаться в зависимости от возраста [, тяжести заболевания, наличия сопутствующей патологии. У пациентов.
226ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХгоспитализированных в терапевтическое отделение, в этиологии ВП преоблада¬ ют пневмококки, на долю микоплазм и хламидий суммарно приходится около 25%. Напротив, микоплазмы и хламидии не имеют существенного значения в этиологии тяжёлой ВП, требующей лечения в ОИТ, но у этой категории больных возрастает роль Legionella spp., а также 5, aureus и грамотрицательных энтеробак¬ терий.С практических позиций целесообразно выделять группы пациентов с ВП с учётом возраста, сопутствующей патологии и тяжести заболевания. Между этими группами могут наблюдаться различия не только в этиологической структуре, но и в прогнозе заболевания (табл. 13-3),Таблица 13-3. Группы пациентов с ВП и вероятные возбудители [10]ГруппаХарактеристика пациентовВероятные возбудителиАмбулаторные пацнекты:ВП нетяжёлого течения у лиц моложе 60 лет без сопут¬ ствующей патологииS. рпетоше М. pneumoniae С. pneumoniaeАмбулаторные пациенты:ВП нетяжёлого течения у лиц старше 60 лет и/или с сопутствующей патологиейS. pneumoniae Н. influenzae С. pneumoniae S. aureusEnterobacteriaceaeГоспитализированные пациенты {отделение общего про¬филя):ВП нетяжёлого теченияS. pneumoniae И. influenzae С. pneumoniae S. aureusEntenjbacteriaceaeГоспитализированные пациенты (ОИТ):ВП тяжёлого теченияS. pneumoniae Legionella spp.S. aureusEnterobacteriaceaeВесьма важным (прежде всего для выбора соответствующего направления эмпирической антибактериальной терапии) является и знание структуры рези¬ стентности ключевых возбудителей ВП, тем более что, во-первых, в настоящее время стали доступны результаты масштабного многоцентрового национального исследования (ПеГАС), а во-вторых, уровни резистентности возбудителей вне¬ больничных инфекций (в отличие от нозокомиальных) удаётся предсказать в пределах обширных географических регионов.Важной проблемой в настоящее время является распространение среди пневмо¬ кокков штаммов со сниженной чувствительностью к пенициллину, в некоторых странах устойчивость пневмококков к пенициллину достигает 60%, причём мно¬ гие из них обладают резистентностью к 3 и более классам антибиотиков. Такие штаммы пневмококков называются полирезистентными. Резистентность пневмо¬ кокков к пенициллину обычно сочетается с устойчивостью к цефалоспоринам I-II поколений, тетрациклинам, ко-тримоксазолу. В то же время сохраняют активность цефалоспорины III-IV поколений (кроме цефтазидима), респираторные фторхи- нолоны (левофлоксацин, моксифлоксацин), ванкомицин и линезолид.Данные мониторинга резистентности клинических штаммов S. pneumoniae в РФ в рамках многоцентрового исследования ПеГАС с 1999 по 2005 год (табл. 13-4) свидетельствуют, что уровень устойчивости пневмококков к пенициллину в нашей стране остаётся стабильным и не превышает 10%, при этом в больщинстве случа¬ ев выявляются умеренно резистентные штаммы. Все пенициллинорезистентные
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ227шококки сохраняют чувствительность к амоксициллину' + клавулановои кис- Ж1ТБ, а резистентность к цефтриаксону варьирует от О до 2% [17j,Резистентность 5, pneumoniae к макролидам также остаётся невысокой: частота »¿явления штаммов, не чувствительных к 14- и 15-членным макролидам (эритро- мнцин, кларитромицин, азитромицин^), составляет 6-9%. Уровень устойчивости к 16-членным макролидам (спирамицин, мидекамицин) и линкозамидам находится ва ещё более низком уровне (< 4,5%).Высокую активность в отношении S. pneumoniae сохраняют респираторные фторхинолоны (резистентность пневмококков к левофлоксацину в 2003-2005 гг. составила 0Д%) и ванкомицин.Следует отметить тенденцию к росту устойчивости пневмококков к тетрацикли- щ и ко-тримоксазолу, несмотря на существенное сокращение их использования щ)и респираторных инфекциях в амбулаторной практике.Основной механизм резистентности Я. inßuenzae связан с продукцией р-лактамаз, гидролизующих аминопенициллины. Однако, как показывает иссле¬ дование ПеГАС-П, уровень устойчивости к аминопенициллинам среди клини¬ ческих штаммов Я. inßuenzae в РФ в 2003-2005 гг. составил 4,7%, Не было выявлено штаммов, устойчивых к амоксициллину + клавулановой кислоте, цефа- доспоринам III-IV поколений (цефтриаксон, цефепим), карбапенемам, хиноло- кш. Резистентность к рифампицину составила 3,5%, к тетрациклину — 5,0%. Наиболее высоким оказался уровень устойчивости Я. inßuenzae к ко-тримоксазолу (29,8% нечувствительных штаммов).Таблица 13-4. Резистентность S. рпеитотае к различным антибактериальным препаратам {по цмшм исследования ПеГАС, 1999-2005) [10]АнтибактериальныйДоля умеренно резистентных/резистентных штаммов, %препарат1999-2000 гг, (п=210)2001-2003 гг. (п=581)2003-2005 гг. (п=919)Бензкппенициллин7/28,3/1,96,9/1,2Ажксициллин0,5/00/00,3/0Авжсициллин + клавулановая вслота0/00/00.3/01|вфтриаксон1Л0/0М/0.9Э(>промицин0/60,2/8,80,2/6,4Лаитромицин0,5/5,50,5/8,30,2/6,2Кяар|промицин0,5/5,50,5/8,10,3/6,11Мекамицин3/10.5/4,00/0,1Кя*шамицин0/20,2/3,33,6/0Левофлоксацин0/00/00,1/0Тетр(^иикпин2/252,4/25,14,8/24,8io-'фимоксазол26/726,5/529/11,7&к»амфеникол0/50/8,60/5,9Вкомицин0/00/00/0* Пднклян (Хемофарм А.Д.), производитель - Сербия, форма выпуска: таблетки 375 мг № 15 ■ ■габлегки 625 мг № 20 (на правах рекламы),^Хемошщин (Хемофарм А.Д.), производитель - Сербия, форма выпуска: капсулы 250 мг № 6 жпб.'ктки 500 мг № 3 (на правах рекламы).
-да:-:.228 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХДИАГНОСТИКАУстановление диагноза «пневмония» затруднено тем обстоятельством, что не существует какого-либо специфического клинического признака или комбинации признаков, на которые можно было бы всецело полагаться при подозрении на этот диагноз [18,19]. Скорее, отсутствие какого-либо из числа неспецифичных симпто¬ мов или локальных физикальных изменений в лёгких делает диагноз пневмонии менее вероятным.- Подозрение на пневмонию должно возникать при наличии у больного лихорад¬ки в сочетании с жалобами на кашель, одышку, отделение мокроты и/или боли в грудной клетке. Больные также могут жаловаться на немотивированную слабость, }томляемость, сильное потоотделение по ночам. У пациентов пожилого и старче¬ ского возраста симптомы со стороны дыхательной системы менее демонстративны или могут отсутствовать вовсе, а на первый план в картине заболевания выходят симптомы общего характера: сонливость, спутанность сознания, беспокойство, нарушения цикла сна и бодрствования, ухудшение аппетита, тошнота, рвота, при¬ знаки обострения/декомпенсации хронических заболеваний внутренних органов 1201-Информация, получаемая при физикальном обследовании пациента, зависит от многих факторов, включая степень тяжести заболевания, распространённость пневмонической инфильтрации, возраст, наличие сопутствующих заболеваний. Классическими объективными признаками ВП являются укорочение (тупость) перкуторного звука над поражённым участком лёгкого, локально выслушиваемое бронхиальное дыхание, фокус звучных мелкопузырчатых хрипов или крепитации, усиление бронхофонии и голосового дрожания. Впрочем, у части пациентов объ¬ ективные признаки ВП могут отличаться от типичных или отсутствовать вовсе (примерно у 20%).Наиболее важным диагностическим исследованием является рентгенография грудной клетки. Практически всегда для диагностики ВП требуется обнаружить очагово-инфильтративные изменения в лёгких в сочетании с соответствующей симптоматикой поражения органов дыхания, И хотя существует распространённое мнение, что физикальные признаки очаговой инфильтрации в большинстве слу¬ чаев совпадают с данными рентгенографии, многочисленными исследованиями показано, что выслушиваемая инспираторная крепитация и перкуторно опреде¬ ляемое уплотнение лёгочной ткани обладают невысокой чувствительностью и специфичностью в диагностике пневмонии.В части случаев причиной клинико-рентгенологической диссоциации оказы¬ вается и ложноотрицательный результат рентгенографии органов грудной клетки у больных пневмонией, что может быть объяснено обезвоживанием (впрочем, данных в пользу этой теории недостаточно), глубокой нейтропенией (невоз¬ можность развития локализованной острой воспалительной реакции в лёгочной ткани), ранними стадиями заболевания (существует мнение, что по физикальным данным можно распознать пневмонию ещё до появления лёгочного инфильтрата на рентгенограмме, и этот промежуток времени составляет 24-48 ч) и, наконец, инфекцией Pиeиwoc>'srisjIГOved у ВИЧ-инфицированных больных (у 10-20% боль¬ ных с пневмоцистной пневмонией на рентгенограмме отсутствуют патологические изменения).Иногда возникают диагностические проблемы, связанные и с ложноположи¬ тельными результатами рентгенологического исследования, поскольку большое число заболеваний органов дыхания, как инфекционных, так и неинфекционных, сопровождается развитием неспецифичных очагово-инфильтративных изменений на рентгенограмме. Тем не менее ценность рентгенографии очевидна и состоит не только в самом факте визуализации пневмонической инфильтрации, но и в оцен¬ ке динамики патологического процесса и полноты выздоровления. Изменения на
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 229реятгенограмме (распространённость инфильтрации, наличие или отсутствие плев- g рального выпота, полости деструкции) соответствуют степени тяжести заболевания да■ могут служить «проводником» при выборе антибактериальной терапии. ^Однако следует иметь в виду, что рентгенография органов грудной клетки не обла¬ дает абсолютной чувствительностью в визуализации очагово-инфильтративных изменений в лёгких. Важно представлять те клинические ситуации, при которых назначение КТ больному с предполагаемой пневмонией является вполне обосно- юнным и целесообразным:• у пациента с очевидной клинической симптоматикой пневмонии изменения в лёгких на рентгенограмме (флюорограмме) отсутствуют;• при рентгенологическом исследовании больного с предполагаемой пневмони¬ ей выявлены нетипичные для данного заболевания изменения (обтурацион- ный ателектаз, инфаркт лёгкого на почве ТЭЛА, абсцесс лёгкого и др.);• рецидивирующая пневмония, при которой инфильтративные изменения воз¬ никают в той же доле (сегменте), что и в предыдущем эпизоде заболевания, или затяжная пневмония, при которой длительность существования инфиль¬ тративных изменений в лёгочной ткани превышает 4 нед.Данные клинического анализа крови не позволяют высказаться о потенциаль- аом возбудителе ВП. Однако лейкоцитоз более ЮхЮУл указывает на высокую вероятность бактериальной инфекции, а лейкопения ниже ЗхЮУл или лейкоци¬ тоз выше 25х10’/л является неблагоприятным прогностическим признаком.Биохимические анализы крови (функциональные тесты печени, почек, глике¬ мия и др.) не дают какой-либо специфической информации, но обнаруживаемые опслонения могут указывать на поражение ряда органов/систем, что имеет про- гаосгическое значение.У пациентов с явлениями дыхательной недостаточности, обусловленной рас¬ пространённой пневмонической инфильтрацией, массивным плевральным выпо¬ том, развитием ВП на фоне ХОБЛ, необходимо определение газов артериальной жрови (при недоступности этого метода исследования приемлемой альтернативой является пульсоксиметрия с определением Sp^). Гипоксемия со снижением уровня Р^О^ ниже 60 мм рт.ст. (при дыхании атмосферным воздухом) является прогно¬ стически неблагоприятным признаком и указывает на необходимость помещения больного в ОИТ. Распространённая в нашей стране практика исследования газов капиллярной крови имеет относительную диагностическую ценность, плохую вос¬ производимость, и её данные зачастую не соответствуют результатам исследова¬ ния артериальной крови.Результативность микробиологической диагностики во многом зависит от свое¬ временности и правильности забора клинического материала. Наиболее часто исследуемым материалом является мокрота, получаемая при кашле. Следует пом¬ нить, что достоверность получаемых результатов во многом зависит от соблюде¬ ния правил её забора и последующей транспортировки в лабораторию.Первым этапом микробиологического исследования служит окраска мазка шжроты по Г]раму. При менее 25 полиморфно-ядерных лейкоцитов и более 10 эпителиальных клеток (при просмотре не менее 10 полей зрения при увели¬ чении 100) культуральное исследование образца нецелесообразно, так как в этом стучае, скорее всего, изучаемый материал значительно контаминирован содержи¬ мым ротовой полости. Выявление в мазке значительного количества грамполо- жительных или грамотрицательных микроорганизмов с типичной морфологией (ланцетовидные грамположительные диплококки — 5. pneumoniae', слабоокрашен- иые грамотрицательные коккобациллы — Н. influenzae) может служить ориенти¬ ром для выбора антибактериальной терапии.Интерпретация результатов бактериоскопии и культурального исследования мокроты должна проводиться с учётом клинических данных.
230 ИНФЕКЦИОННЬ!Е ЗАБОЛЕВАНИЯ ЛЁГКИХТяжелобольным пациентам следует до начала антибактериальной терапии про¬ извести посевы венозной крови (производится взятие 2 образцов крови из двух разных вен). Необходимо отбирать не менее 10 мл крови на каждый образец, так как это приводит к существенному увеличению частоты положительных результа¬ тов гемокультуры.Несмотря на важность получения лабораторного материала (мокрота, кровь) до назначения антибиотиков, микробиологическое исследование не должно служить причиной задержки антибактериальной терапии. В первую очередь это относится к пациентам с тяжёлым течением заболевания.Серологическая диагностика инфекций, ъызъаияых М. pneumoniae, С. pneumoniae и Legionella spp., не рассматривается в ряду обязательных методов исследования, поскольку с учётом повторного взятия сыворотки крови в остром периоде заболе¬ вания и в периоде реконвалесценции (через несколько недель от начала заболева¬ ния) это не клинический, а эпидемиологический уровень диагностики.В настоящее время получили распространение иммуноферментный тест с опреде¬ лением в моче специфичного растворимого антигена I. pneumophila (1-й серотип), а также иммунохроматографический тест с определением пневмококкового антигена в моче. Однако в нашей стране эти методы экспресс-диагностики не зарегистрирова¬ ны и их применение не вышло за рамки отдельных клинических центров.Метод полимеразной цепной реакции является перспективным для диагностики таких возбудителей, как С. pneumoniae, М. pneumoniae, I. pneumophila. Однако место этого метода в этиологической диагностике ВП ещё не определено и в настоящее время он не рекомендуется для широкого использования.при наличии плеврального выпота и условий для безопасного проведения плев¬ ральной пункции (визуализация на латерограмме свободно смещаемой жидкости с толщиной слоя более 1,0 см) необходимо провести исследование плевральной жидкости, которое должно включать подсчёт лейкоцитов с лейкоцитарной форму¬ лой, определение pH, активности лактатдегидрогеназы, содержания белка, окра¬ шивание мазков по Граму и на кислотоустойчивость, посев на аэробы, анаэробы и микобактерии.ФБС (фиброоптическая бронхоскопия) с количественной оценкой микробной обсеменённости полученного материала («защищённая» браш-биопсия, брон¬ хоальвеолярный лаваж) или другие методы инвазивной диагностики (транс¬ трахеальная аспирация, трансторакальная биопсия и др.) рекомендуются только при подозрении на туберкулёз лёгких при отсутствии продуктивного кашля, при «обструктивной пневмонии» на почве бронхогенной карциномы, при аспириро- ванном инородным телом бронхе и т.д.В последние годы у госпитализированных пациентов для определения тяже¬ сти пневмонии все большее внимание привлекает исследование сывороточного уровня С-реактивного белка и прокальцитонина. Наиболее высокая концентра¬ ция С-реактивного белка отмечается у пациентов с тяжёлой пневмококковой или легионеллёзной пневмонией. Уровень прокальцитонина, по разным данным, также коррелирует с тяжестью состояния больных ВП и может бьггь предиктором развития осложнений и неблагоприятного исхода. Однако окончательного мнения о целесообразности использования этих тестов для дифференциации этиологии и определения тяжести течения ВП пока нет.КРИТЕРИИ ДИАГНОЗАДиагноз «ВП» является определённым при наличии у больного рентгенологи¬ чески подтвержденной очаговой инфильтрации лёгочной ткани и по крайней мере двух клинических признаков из числа следующих:• остро возникшей лихорадки в начале заболевания (>38,0 X);• кашля с мокротой;
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ231• физикальных признаков (фокус крепитации и/или мелкопузырчатые хрипы, бронхиальное дыхание, укорочение перкуторного звука);• лейкоцитоза более іохіоул и/или палочкоядерного сдвига (>10%).В связи с этим следует по возможности стремиться к клинико-рентгенологи¬ ческому подтверждению диагноза ВП [10]. При этом необходимо учитывать и вероятность синдромосходных заболеваний и патологических состояний, среди которых;• ТЭЛА/инфаркт лёгкого;• застойная сердечная недостаточность;• злокачественные новообразования (центральный рак лёгкого с обструкцией бронха, бронхиолоальвеолярный рак);• ОРДС (внелёгочного происхождения);• лекарственные пневмопатии;• лучевой пневмонит;• васкулиты (системная красная волчанка, гранулематоз Вегенера);• гиперчувствительный пневмонит;• острая эозинофильная пневмония;• облитерирующий бронхиолит с организующейся пневмонией;• мукоидная закупорка бронха.Диагностика ВП, основывающаяся на результатах физикального и рентге¬ нологического обследования, может быть приравнена лишь к синдромному диагнозу, нозологическим же он становится после определения возбудителя заболевания.Определённую помощь для прогнозирования этиологии ВП может оказать тща¬ тельное изучение эпидемиологического анамнеза (табл. 13-5).Таблица 13-5. Характерные условия возникновения ВП различной этиологии [21]Условия возникновенияВероятные возбудителиАлкоголизмS. pneumoniae, анаэробы, аэробные грамотрицательные бактерии (чаще К. pneumoniae)ХОБЛ и курениеS. pneumoniae, Н. influenzae, М. catarrhalis, Legionella spp.Декомпенсированный сахарный диабетS. pneumoniae, S. aureusПребывание в домах престарелыхS. pneumoniae, Enterobacteriaceae, H. influenzae, S aureus, C. pneumoniae, анаэробыНесанированная полость ртаАнаэробыЭпидемия гриппаS. pneumoniae, S. aureus, S, pyogenes. H. influenzaeПредполагаемая массивная аспирацияАнаэробыБронхоэктазы, муковисцидозP. aeruginosa, B. cepacia, S. aureus&|утривенное введение наркотиковS. aureus, анаэробыЛжальная бронхиальная обструкция (например. Оронхогенная карцинома)АнаэробыКоктакт с кондиционерами, увлажнителями воз¬ духа, системами охлаждения водыL pneumophilaш.Необходимо также учитывать и особенности клинического течения ВП в зави¬ симости от её этиологии. Так, для пневмококковой ВП характерны острое начало, сильная лихорадка, боли в грудной клетке; для легионеллёзной - диарея, невро-
232 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХлогическая симптоматика, тяжёлое течение заболевания, нарушения функции печени; для микоплазменной — мышечные и головные боли, симптомы инфекции верхних дыхательных путей.Хотя в отдельных слз^аях прослеживается связь между возбудителем ВП и её клиническими и рентгенологическими проявлениями, особенности клинико¬ рентгенологического течения ВП не могут считаться адекватными предикторами этиологии заболевания (табл. 13-6). При этом конкретные клинические проявле¬ ния чаще связываются не с биологией возбудителя, а с факторами макроорганизма (возраст, наличие или отсутствие сопутствующих заболеваний), В связи с этим разделение ВП на типичную (вызываемую прежде всего S. pneumoniae) и «атипич¬ ную» (обусловленную М. pneumoniae, С. pneumoniae, L. pneumophila) лишено осо¬ бого клинического смысла [10,13].Таблица 13-6. Этиология и симптоматология ВП у взрослых [22]СимптомыОдышкаКашельБоли в грудиМокротаКровохарканьеОзнобыДиарбяБоли в животеРвотаГоловная боль«Вирусная продрома’>Частота в зависимости от этиологии заболевания, %$. pneumoniae679446741758151227Н. influenzae66100338735161139L pneumophila50791475134221171729С. pneumoniae607632622053201737Для установления этиологии ВП проводятся бактериоскопия окрашенного по Граму мазка мокроты и культуральное исследование мокроты. Такое исследование является обязательным в стационаре и не обязательным в амбулаторных услови¬ ях. Однако ввиду ограниченной чувствительности методов бактериологического исследования этиологию ВП не удаётся установить в 25-60% случаев.ВЫБОР МЕСТА ЛЕЧЕНИЯРазделение больных ВП на амбулаторных (те, кого можно лечить в амбулаторно¬ поликлинических условиях) и стационарных (те, кто в силу тяжести основного заболевания или социальных условий нуждается в госпитализации) является принципиально важным. В соответствии с этим разделением разнятся объём диа¬ гностических исследований и тактика антимикробной химиотерапии (с учётом своеобразия прогнозируемой этиологии). Примерно 30-50% пациентов, госпита¬ лизируемых по поводу ВП, характеризуются как прогностически благоприятные и с успехом могут лечиться в домашних условиях. Однако на практике клиницисты склонны преувеличивать вероятность неблагоприятного исхода заболевания.Принятие решения о целесообразности госпитализации предполагает учёт стабильности клинического состояния пациента, его психосоциального статуса.
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ233риска смерти и развития осложнений заболевания, наличия или отсутствия иных медицинских проблем, в связи с этим наиболее важны вопросы о вьщелении паци¬ ентов, нуждающихся в госпитализации, а также об определении показаний для выписки больных из стационара.В настоящее время доступен ряд клинико-лабораторных шкал, которые на основании оценки тяжести ВП и/или прогноза дают рекомендации по выбо¬ ру места лечения. Наибольшее распространение в мире получила шкала PORT (^eumonia Outcomes Research Team), предполагающая определение 20 клиниче¬ ских и лабораторных параметров, на основании которых устанавливается индекс тяжести пневмонии, прогнозируется риск летального исхода и даются рекоменда¬ ции по выбору места лечения [23]. Однако для определения данного индекса необ¬ ходимо исследование целого ряда биохимических параметров, включая уровни мочевины, натрия, глюкозы, гематокрит, pH артериальной крови, что недоступно в амбулаторно-поликлинических учреждениях и большинстве стационаров РФ.Определённые перспективы при решении вопроса о месте лечения пациентов с ВП в настоящее время связываются с использованием прогностических шкал CURB-65/CRB-65, предполагающие оценку 5 или 4 параметров (наличие — 1 балл, отсутствие — 0) соответственно [8]:С - нарушение сознания;и - азот мочевины крови более 7 ммоль/л (не учитывается в шкале CRB-65);R - ЧД >30 в мин;В — диастолическое (ДАД) <60 мм рт.ст. или систолическое (САД) АД <90 мм рт.ст.;65 — возраст 65 лет и старше.Минимальное число баллов по данной шкале составляет О, максимальное —4 или 5 баллов. С практической точки зрения наибольший интерес вызывает шкала CRB-65, применение которой возможно в амбулаторных условиях, так как для этого не требуется измерения азота мочевины крови (рис. 13-1).Однако любая из прогностических шкал является только ориентиром при выбо¬ ре места лечения, и в каждом конкретном случае этот вопрос должен решаться лечащим врачом индивидуально. Иными словами, определение места лечения пациента с ВП остаётся клиническим решением, которое не способен подменить ни один из имеющихся алгоритмов оценки прогноза.1ЕДЕНИЕ БОЛЬНЫХ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИЕЙ В АМБУЛАТОРНЫХ УСЛОВИЯХПомимо сбора анамнеза и физикального обследования, диагностический мини¬ мум должен включать исследования, позволяющие установить диагноз ВП и решитьи оценка в стационарегоспитализация13-1. Использование шкалы СРВ-65 для выбора места лечения при ВП [24].
234 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХвопрос о тяжести течения и необходимости госпитализации пациента, — рентгено¬ графию органов грудной клетки в 2 проекциях и общий анализ крови.Диагноз ВП может быть установлен и на основании клинической картины забо¬ левания и данных физикального обследования без проведения рентгенологиче¬ ского исследования. Однако рентгенографию грудной клетки целесообразно про¬ водить, чтобы оценить тяжесть заболевания и решить вопрос о госпитализации.Ругинная микробиологическая диагностика ВП в амбулаторной практике недо¬ статочно информативна и не оказывает существенного влияния на выбор анти¬ бактериального препарата.В соответствии с рекомендациями Российского респираторного общества среди пациентов, которые могуг получать лечение в амбулаторных условиях, выделяют 2 группы, различающиеся между собой по этиологической структуре и тактике антибактериальной терапии.В первую группу включены пациенты в возрасте до 60 лет без сопутствующей патологии. У этих пациентов адекватный клинический эффект может быть получен при применении пероральных препаратов. В качестве препаратов выбора реко¬ мендуются амоксициллин или макролидные антибиотики, при этом предпочтение отдаётся препаратам с улучшенной фармакокинетикой — азитромицину клари- тромицину (табл. 13-7). Несмотря на то что in vitro аминопенициллины не активны в отношении «атипичных» возбудителей ВП, в ходе клинических исследований не выявлено различий в эффективности этих антибиотиков, а также отдельных пред¬ ставителей класса макролидов или респираторных фторхинолонов, спектр антими¬ кробного действия которых включает как типичные, так и «атипичные» патогены.Таблица 13-7. Антибактериальная терапия ВП у амбулаторных пациентов [10]ГруппаНаиболее частые возбудителиПрепараты выбораАльтернативныепрепаратыКомментарии1. Нетяжёлая ВП у пациентов в воз¬ расте до 60 лет без сопутствующих заболеванийS. рпетоШае М. РпетоШае С. Pneumoniae Н. influenzaeАмоксициллин внутрь или макролиды* внутрьРеспираторныефторхинолоны**(левофлоксацин,моксифлоксацин,гемифлоксацин)внутрьII. Нетяжёлая ВП у пациентов 60 лет и старше и/ или пациентов с сопутствующими заболеваниямиS. pneumoniae Н. influenzae С. pneumoniae S. aureus EnterobacteriaceaeАмоксициллин + кла- вуланоаая кислота или амоксициллин + сульбашм внутрьРеспираторныефторхинолоны(левофлоксацин,моксифлоксацин,гемифлоксацин}внутрьСопутствующие забо¬ левания, влияющие на этиологию и прогноз при ВП: ХОБЛ, сахарный диабет, застойная сер¬ дечная недостаточность. 1улрроз печени, злоупо¬ требление алкоголем, наркомания, истощение* Следует отдавать предпочтение макролидным антибиотикам с улучшенными фармакокинетиче¬ скими свойствами (кларитромицин, азитромицин, спирамицин). Макролиды являются препара¬ тами выбора при подозрении на «атипичную» этиологию ВП (С. pneumoniae, М. pneumoniae).** Доксициклин также можно назначать исключительно при подозрении на «атипичную» этио¬ логию пневмонии, однако следует }'читывать высокий (>25%) уровень резистентности к нему пневмококков в России.Макролидам следует отдавать предпочтение в первую очередь при непере¬ носимости (3-лактамов или подозрении на «атипичную» этиологию заболевания (микоплазма, хламидии). Б качестве альтернативных препаратов у этой группы пациентов рекомендуются респираторные фторхинолоны.^ Зитролид форте (азитромицин, 250 мг № 6 и 500 мг № 3) - препарат для эффективной терапии внебольничных пневмоний и бронхитов с доказанной способностью действовать на бактериаль¬ ные биоплёнки, отличной переносимостъю и высокой комплайентностью (на правах рекламы).
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 235Во вторую группу включены лица пожилого возраста (60 лет и старше) и/или пациенты с сопутствующими заболеваниями, которые оказывают влияние на этиологию и являются факторами риска неблагоприятного прогноза при ВП:• ХОБЛ;• сахарный диабет;■ застойная сердечная недостаточность:• хроническая почечная недостаточность:• цирроз печени:• алкоголизм, наркомания;• дефицит массы тела.У пациентов этой группы адекватный клинический эффект также может быть получен при назначении пероральных антибиотиков. Поскольку вероятность этиологической роли грамотрицательных микроорганизмов (в том числе обла¬ дающих некоторыми механизмами резистентности) у этих больных возрастает, в качестве препарата выбора рекомендуются амоксициллин + клавулановая кислота или амоксициллин + сульбактам. У пациентов данной категории возможно про¬ ведение комбинированной терапии Р-лактамами и макролидами в связи с воз¬ можной хламидийной этиологией ВП. Альтернативой комбинированной терапии ^-лактамами и макролидами может быть применение респираторных фторхино¬ лонов (левофлоксацина, моксифлоксацина, гемифлоксацина).Парентеральные антибиотики при лечении ВП в амбулаторных условиях не имеют доказанных преимуществ перед пероральными. Они могут применяться лишь в единичных случаях (например, предполагаемый низкий комплайенс при приёме пероральных препаратов, невозможность своевременной госпитализации или отказ от неё; в подобных клинических ситуациях предпочтение отдают цеф¬ триаксону, вводимому внутримышечно).Первоначальную оценку эффективности терапии следует проводить через 48-72 ч после начала лечения (повторный осмотр). Целесообразен телефонный контакт с пациентом на следующий день после начала терапии. Основными крите¬ риями эффективности в эти сроки являются снижение температуры, уменьшение симптомов интоксикации и других клинических проявлений заболевания. Если у пациента сохраняются сильная лихорадка и интоксикация или симптоматика прогрессирует, то лечение следует признать неэффективным. В этом случае необ¬ ходимо пересмотреть тактику антибактериальной терапии (например, в случае отсутствия адекватного эффекта при терапии амоксициллином его следует заме¬ нить макролидом или добавить к лечению макролид) и повторно оценить целесо¬ образность госпитализации пациента.При нетяжёлой ВП антибактериальная терапия может быть завершена при аойкой нормализации температуры тела на протяжении 3-4 дней. При таком под¬ ходе длительность лечения составляет 7-10 дней. В эти же сроки обычно наблю¬ дается исчезновение лейкоцитоза. При клинических и/или эпидемиологических данных о микоплазменной или хламидийной этиологии ВП продолжительность терапии должна составлять 14 дней, хотя имеются клинические данные об эффек¬ тивности и более коротких курсов антибактериальной терапии при ВП, вызванной «атипичными» микроорганизмами.Сохранение отдельных клинических, лабораторных или рентгенологических признаков ВП не является абсолютным показанием к продолжению антибакте¬ риальной терапии или её модификации. В подавляющем большинстве случаев их разрешение происходит самостоятельно или под влиянием симптоматической терапии. Рентгенологические проявления ВП разрешаются медленнее клиниче¬ ских симптомов, поэтому контрольная рентгенография грудной клетки не может ст^’жить критерием для определения длительности антибактериальной терапии.
236 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХВместе с тем при длительно сохраняющейся клинической, лабораторной и рентгенологической симптоматике ВП необходимо провести дифференциальную диагностику с такими заболеваниями, как рак лёгкого, туберкулёз, застойная сер¬ дечная недостаточность и др.ВЕДЕНИЕ БОЛЬНЫХ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИЕЙ В УСЛОВИЯХ СТАЦИОНАРАПри принятии решения о госпитализации пациента следует сразу очертить круг исследований, позволяющих установить диагноз ВП и решить вопрос о тяжести течения и месте лечения пациента (палата терапевтического отделения или ОИТ). К ним относят;• рентгенографию грудной клетки в 2 проекциях;• общий анализ крови;• биохимический анализ крови (мочевина, креатинин, электролиты, печёноч¬ ные ферменты);• микробиологическую диагностику:❖ микроскопию мазка, окрашенного по Граму;❖ культуральное исследование мокроты для выделения возбудителя и оценки его чувствительности к антибиотикам;❖ исследование гемокультуры, обязательное при тяжёлом течении заболевания (оптимально проводить забор 2 проб венозной крови из разньгх вен).При тяжёлой ВП также целесообразно исследовать газы артериальной крови, чтобы уточнить потребность в проведении ИВЛ.При наличии плеврального выпота производят плевральную пункцию и выпол¬ няют цитологическое, биохимическое и микробиологическое исследование плев¬ ральной жидкости.При ВП крайне важно быстро оценить тяжесть состояния пациента, чтобы выявить признаки тяжёлой ВП, требующие неотложной терапии в условиях ОИТ (табл. 13-8).Табли11а 13*8. Критерии ВП тяжёлого теченияРекомендацій Российского респираторного общества [10]Рекомендации Американского общества инфекционньи болезней и Американского торакального общества [13]клинические критерии'лабораторные критерии'большие критерии^малые критерии^• Острая дыхательная недостаточность(ЧД >30 8 мин)• г ипотензия(САД <90 мм рт.ст., ДАД <60 мм рт.ст.)• Двух- или многодолееое поражение• Нарушение сознания• Внелёгочиый очаг инфекции (менингит, перикардит и др.)• Лейкопения (<4x107л)• Г ипоксемия (5 0^ <90%,рД <60 мм рт.ст.)• Гемоглобин <100 г/л• Гематокрит <30%• Острая почечная недоста¬ точность (анурия, креати“ НИН крови >176 мкмоль/л, азот мочевины >20 мг/дл)• Необходимость проведения ИВЛ• Септический шок, потребность во вве¬ дении вазопрессоров• ЧД >30 в мин. РруПО/ <250• Многадолевая инфиль¬ трация• Расстройства сознания/ дезориентация• Уремия (азот мочевины >20 мг/дл)• Лейкопения (<4х107л)• Тромбоцитопения (<100х1№/л)• Гипотермия (<36 °С)• Гипотензия, требующая заместительного введения жидкости^ При наличии хотя бы одного критерия ВП расценивается как тяжёлая.^ При наличии одного большого или по крайней мере трёх малых критериев ВП расценивается как тяжёлая.РіО^ — фракция кислорода во вдыхаемом воздухе.
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ237У госпитализированных пациентов подразумевается более тяжёлое течение ВП, поэтому целесообразно начинать терапию с парентеральных антибиотиков. Через 3-4 дня лечения при условии нормализации температуры, уменьшения интокси¬ кации и другах симптомов заболевания возможен переход с парентерального на пероральное применение антибиотика до завершения полного курса терапии.При нетяжёлой ВП рекомендуется парентеральное применение бензилпени- циллина, ампициллина, ингибиторзащищённых аминопенициллинов (амоксицил- ЛИН + клавулановая кислота) или цефалоспоринов П-П1 поколений (табл. 13-9). По данным ряда исследований, наличие в составе стартовой терапии препарата, активного в отношении «атипичных» микроорганизмов, улучшает прогноз и сокращает продолжительность пребывания пациентов в стационаре, что делает оправданным применение комбинированной терапии (Р-лактам + макролид) [25]. Альтернативой этой комбинации может служить монотерапия респираторными фторхинолонами (левофлоксацин, моксифлоксацин, гемифлоксацин).Таблица 13-9. Антибактериальная терапия ВП у госпитализированных пациентов [10]Рекомендуемые режимы терапииГруппаНаиболее частые возбудителиПрепараты выбораАльтернативныепрепаратыПневмония нетя¬ жёлого течения'S. pneumoniae Н. influenzae С. pneumoniae S. aureusEnterobacteriaceaeБензилпенициллин в/в, 8/м ± макро- лид^ внутрь;Ампициллин в/в, в/м ± макролид^ внутрь;Амоксициллин + клавулановая кислота в/в ± макролид^ внутрь;Цефуроксим в/а, в/м ± макролид^ внутрь;Цефотаксим в/в, в/м + макролид^ внутрь;Цефтриаксон в/в, в/м ± макролид^ внутрьРеспираторные фтор¬ хинолоны (левофлокса¬ цин, моксифлоксацин) в/вАзитромицин в/в^Пневмония тяжё- лого течения^S. pneumoniae Legionella spp.S. Aureus EnterobacteriaceaeАмоксициллин + клавулановая кислота в/в + макролид в/в Цефотаксим 8/в + макролид в/в Цефтриаксон в/е + макролид в/вРеспираторные фтор¬ хинолоны (левофлокса¬ цин, моксифлоксацин) в/в + цефалоспорины III поколения в/в- Предпочтительна ступенчатая терапия. При стабильном состоянии пациента допускается сразу назначать препараты внутрь.^Следует отдавать предпочтение макролидным антибиотикам с улучшенными фармакокинетиче¬ скими свойствами (кларитромицин, азитромицин, спирамицин).'При отсутствии факторов риска, связанных с наличием антибиотикорезистентных S.pneumoniae (возраст старше 65 лет, терапия р-лактамами в течение последних 3 мес, хронический алкоголизм, иммунодефицитные заболевания/состояния, включая терапию СГКС), грамотрицательных энте¬ робактерий (пребывание в домах престарелых, сопутствующие сердечно-сосудистые и бронхолё¬ гочные заболевания, антибактериальная терапия) или синегнойной инфекции.- *При наличии факторов риска инфекции Р. aeruginosa (бронхоэктазы, приём СГКС, терапия анти¬ биотиками широкого спектра действия сверх 7 дней в течение последнего месяца, истощение) пре¬ паратами выбора являются цефтазидим, [{ефепим, цефоперазон + сульбактам, тикарциллин + кла- »рановая кислота, пиперациллин/тазобактам, меропенем, имипенем, ципрофлоксацин. Все эти препараты можно применять в монотерапии или в комбинации с аминогликозидами II-III поко¬ ления. При подозрении на аспирацию — амоксициллин + клавулановая кислота, цефоперазон + сульбактам, тикарциллин + клавулановая кислота, пиперациллин/тазобактам^', карбапенемы (меропенем, имипенем).при тяжёлой ВП назначение антибиотиков должно быть неотложным: отсроч¬ ка в их назначении на 4 ч и более существенно ухудшает прогноз заболевания (возрастание летальности, удлинение сроков пребывания в стационаре) [26].v:Si1;
238 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХПрепаратами выбора в данной клинической ситуации являются внутривенные Щ цефалоспорины 1П поколения или ингибиторзащищённые пенициллины (амок- сициллин + клавулановая кислота) в комбинации с внутривенными макролидами (эритромицин, кларитромицин, спирамицин, азитромицин). Указанные комби¬ нации перекрывают практически весь спектр потенциальных возбудителей (как типичных, так и «атипичных») тяжёлой ВП.Из фторхинолонов предпочтение следует отдавать респираторным фторхино- лонам (левофлоксацину, моксифлоксацину), которые вводятся внутривенно. Они обладают повышенной антипневмококковой активностью и перекрывают прак¬ тически весь спектр возможных возбудителей. Имеются данные контролируемых клинических исследований о сравнимой со стандартным режимом терапии (ком¬ бинация р-лактамного антибиотика и макролид а) эффективности монотерапии респираторными фторхинолонами при тяжёлой ВП. Однако подобные исследова¬ ния немногочисленны, поэтому более надёжной является их комбинация с цефа- лоспоринами П1 поколения (цефотаксимом, цефтриаксоном) [12,13].Первоначальная оценка эффективности антибактериальной терапии больного ВП в стационаре должна проводиться через 48 ч после начала лечения (в случаях тяжёлого течения заболевания — через 24 ч). Основными критериями эффектив¬ ности лечения в эти сроки являются уменьшение температуры тела, интоксикации и дыхательной недостаточности. Если у пациента сохраняются высокая лихорадка и интоксикация или прогрессируют симптомы заболевания, то лечение следует признать неэффективным и пересмотреть его тактикуПри нетяжёлой ВП антибактериальная терапия может быть завершена по достижении стойкой нормализации температуры тела в течение 3-4 дней. При таком подходе длительность лечения обычно составляет 7-10 дней. При тяжёлой ВП неуточнённой этиологии рекомендуется 10-дневный курс антибактериальной терапии. В эти же сроки обычно наблюдается исчезновение лейкоцитоза. При наличии клинических и/или эпидемиологических данных о микоплазменной или хламидийной этиологии ВП продолжительность антибактериальной терапии должна составлять 14 дней, хотя имеются клинические данные об эффективности и более коротких курсов лечения. Более длительная терапия показана при ВП стафилококковой этиологии или ВП, вызванной грамотрицательными энтеробак¬ териями (14-21 день). При указании на легионеллёзную пневмонию длительность антибактериальной терапии составляет 14-21 день, однако есть доказательства высокой эффективности более коротких курсов респираторных фторхинолонов.ЗАТЯЖНАЯ ПНЕВМОНИЯУ большинства больных ВП через 3-5 дней эффективной антибактериальной терапии нормализуется температура тела и регрессируют другие клинические про¬ явления заболевания. При этом рентгенологическое выздоровление, как правило, отстаёт от клинического. В тех же случаях, когда на фоне улучшения клинической картины к исходу 4-й нед от начала заболевания не удаётся достичь полного рентгенологического разрешения очагово-инфильтративных изменений в лёгких, следует говорить о затяжной или неразрешающейся (медленно разрешающейся) ВП [27].В подобной клинической ситуации следует прежде всего установить возможные факторы риска затяжного течения заболевания;• возраст старше 55 лет;• алкоголизм:• наличие сопутствующих инвалидизирующих заболеваний внутренних орга¬ нов (ХОБЛ, застойная сердечная недостаточность, почечная недостаточность, злокачественные новообразования, сахарный диабет и др.);• тяжёлое течение ВП;
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ239• многодолевая инфильтрация;• высоковирулентные возбудители (L. pneumophila, S. aureus, грамотрицатель¬ ные энтеробактерии);• курение;• клиническая неэффективность стартовой терапии (сохраняющиеся лейкоци¬ тоз и лихорадка);• вторичная бактериемия.В ряду возможных причин медленного разрешения ВП может быть вторичная резистентность возбудителей к антибиотикам. Так, например, факторами риска антибиотикорезистентности 5. pneumoniae являются возраст старше 65 лет, терапия р-лактамами в течение предшествовавших 3 мес, алкоголизм, иммунодефицитные заболевания/состояния (включая приём ГКС), множественные сопутствующие заболевания внутренних органов.Особое внимание должно быть уделено правильности выбора эмпирической антибактериальной терапии, режима дозирования и соблюдению пациентом вра¬ чебных рекомендаций. Необходимо быть уверенным в том, что при назначенном режиме терапии создаётся необходимая концентрация препарата в очаге инфек¬ ции, а значит, должны быть исключены секвестрированные фокусы инфекции (например, эмпиема плевры, абсцесс лёгкого, внеторакальные отсевы).Исключительное значение имеет дифференциальная диагностика ВП затяжно¬ го течения с очагово-инфильтративным туберкулёзом лёгких.Наконец, следует иметь в виду широкий круг неинфекционных заболеваний (злокачественные новообразования, ТЭЛА и инфаркт лёгкого, застойная сердеч¬ ная недостаточность, лекарственные пневмопатии и др.), порой весьма напомина¬ ющих пневмонию и создающих в связи с этим дифференциально-диагностические трудности.Если факторы риска медленного разрешения ВП присутствуют и одновременно в течении заболевания наблюдается клиническое улучшение, то целесообразно спустя 4 нед провести контрольное рентгенологическое исследование органов грудной клетки.Если же клинического улучшения не отмечается и/или у пациента отсутствуют факторы риска медленного разрешения ВП, то, безусловно, показано проведение в незамедлительном порядке дополнительного обследования: КТ органов груд¬ ной клетки, ФБС и других методовЗатяжная пневмония Медленно разрешающаяся пневмонияIНаличие факторов риска затяжного течения заболеванияисследования (рис. 13-2). ПРОФИЛАКТИКАКак уже говорилось, в основе патогенеза большинства случаев бактериальной пневмонии у имму- нокомпетентных пациентов лежит колонизация (порой весьма непро¬ должительная) ротоглотки пнев¬ мотропными микроорганизмами с последующей их аспирацией в дистальные отделы бронхиально¬ го дерева. При этом в отсутствие эффективной местной противо- ин^кционной защиты начинает¬ ся быстрое размножение бактерий в респираторных отделах лёгких. Поэтому вероятность развития пневмонии максимальна при нали-Да'Контрольное рентгенографическое обследование через 4 недРазрешениепневмоническойинфильтрацииНетДополнительное обследование (КТ. фибробронхоскопия и др.)Нет-ДаIБольной в дополнительном обследовании не нуждаетсяРис. 13-2. Схема обследования больного с синдро¬ мом затяжной ВП [10].
240 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХS' чии у человека тех или иных нарушений локальной или системной противо- ^ инфекционной защиты, факторов риска аспирации, дефектов мукоцилиарного ^ клиренса. Справедливость данного предположения оказалась подтверждённой результатами ряда исследований, в которых изучали факторы риска развития ВП. Так, пожилой возраст, сопутствующие хронические бронхолёгочные заболевания, курение, застойная сердечная недостаточность, нарушения глотания, хронический алкоголизм, перенесённое острое нарушение мозгового кровообращения и дру¬ гие рассматриваются как независимые факторы риска развития пневмонии [28]. В ряде исследований в качестве единственных или главных факторов риска ВП рассматриваются курение и сопутствующая ХОБЛ, Поскольку курение является основным фактором риска ХОБЛ, очевидна необходимость максимально широко¬ го распространения программ по борьбе с курением как наиболее эффективной возможности уменьшить риск ВП [29J. К числу других неспецифических про¬ филактических подходов следует отнести оптимизацию лечения сопутствующих хронических сердечно-сосудистых и бронхолёгочных заболеваний, профилактику аспирации.Пневмония рассматривается как весьма частое и нередко тяжёлое осложне¬ ние гриппа. Поэтому профилактика гриппа приобретает особое значение у лиц с известными факторами риска пневмонии; в возрасте 60 лет и старше, пребы¬ вающих в учреждениях длительного ухода, имеющих сопугствующие хронические сердечно-сосудистые, бронхолёгочные, почечные заболевания, неконтролиру¬ емый сахарный диабет, гемоглобинопатии и др. Профилактика гриппа без при¬ менения вакцины заключается в назначении одного из противовирусных пре¬ паратов: М2'Ингибиторов (амантадин или римантадин, активные только против вируса гриппа А) или ингибиторов нейраминидазы (занамивир или осельтамивир, активные против вирусов гриппа А и В) [30, 31]. Однако поскольку противови¬ русные препараты необходимо употреблять с профилактической целью в течение нескольких недель, то стоимость лечения, риск нежелательных явлений и веро¬ ятность развития устойчивости делают это направление профилактики гриппа менее привлекательным, нежели вакцинация. В связи с этим профилактика гриппа с помощью противовирусных препаратов может быть рекомендована только в определённых а^туациях (например, вспышка гриппа в замкнутом коллективе).В настоящее время вакцинация осуществляется главным образом гриппозными вакцинами, приготовленными из инактивированных вирусов [32]. У здоровых лиц молодого и среднего возраста применение инактивированной вакцины сопро¬ вождается существенным (на 70-80%) уменьшением частоты развития гриппа А. В отношении лиц пожилого и старческого возраста было проведено только одно контролируемое исследование, продемонстрировавшее профилактическую эффек¬ тивность в отношении гриппа А на уровне 50%, Многие когортные исследования и исследования «случай-контроль» подтвердили ранее установленную профилак¬ тическую ценность вакцин, свидетельствуя одновременно, что этот способ про¬ филактики позволяет также уменьшить число случаев тяжёлого и осложнённого течения заболевания, требующих госпитализации.Оптимальное время для проведения вакцинации — октябрь и первая половина ноября, так как активность гриппа в северном полушарии обычно наблюдается с декабря по март. Вакцинации до октября следует избегать, поскольку уровень противовирусных антител может начать снижаться уже через несколько месяцев после введения вакцины. Если локальные эпидемиологические службы прогно¬ зируют более раннюю вспышку гриппа, то вакцинацию можно проводить раньше обычных сроков.Целесообразность применения пневмококковой вакцины объясняется тем, что S. pneumoniae остаётся главным возбудителем ВП у взрослых и, несмотря на доступ- щто эффективную антибактериальную терапию, обусловливает высокую заболева-
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 241С целью специфической профилактики инвазивных пневмо- , в том числе и пневмококковой ВП со вторичной бактериемией, '23г«1жшную неконъюгарованную вакцину, содержащую очищенные ►■пямгитяридные антигены 23 серотипов S. pneumoniae [33]. ішюеятам. нуждающимся во введении пневмококковой вакцины, гчурИбуется применение и гриппозной вакцины, надо помнить, что обе [шиуг водиться одновремешо (в разные руки) без увеличения частоты реакций или снижения иммунного ответа.Нозокомиальная пневмония>ная (госпитальная, внутрибольничная) пневмония (НП) - забо- иражтеризующееся появлением на рентгенограмме «свежих» очагово- изменений в лёгких спустя 48 ч и более после госпитализации с клиническими данными, подтверждающими их инфекционную (новая волна лихорадки, гнойная мокрота или гнойное отделяемое тра- юго дерева, лейкоцитоз и пр.), при исключении инфекций, которые , ш инкубационном периоде на момент поступления больного в стационарлогиязавямает 2-е место среди всех нозокомиальных инфекций (13-18%) и явля- звіой частой госпитальной инфекцией (>45%) в ОИТ [35]. Последнее может объяснено частотой инвазивных вмешательств (эндотрахеальная интубация .), одновременно следует учитывать и более тяжёлое течение основного и щих заболеваний у данной категории пациентов. Согласно большин- ■сследований, частота НП составляет 0,5-1% общего числа госпитализиро- больных и 15-20% — числа больных, находящихся в ОИТ. Так, в США НП диагностируют у 250-300 тыс. пациентов [36]. Данные о распространён- НП в Российской Федерации отсутствуют. fflimpocrpaHeHHOCTb НП зависит от возраста, составляя 5%о среди пациентов імврасте до 35 лет и более, 15%о — у лиц старше 65 лет. Хотя большинство слу- заболевания диагностируется в отделениях общего профиля, максимальную НП отмечают в ОИТ, особенно у больных, находящихся на ИВЛ [венти- ссоциированная пневмония (БАП) — более 30%]. Временные интервалы Інжду госпитализацией пациента в ОИТ и интубацией, интубацией и развитием 'шш составляют в среднем 4,5 и 5,4 сут [37].Однако данные, характеризующие распространённость НП, не являются бес- сшрными. Так, если у больных с типичными симптомами НП (лихорадка, гнойная 1|вхеобронхиальная секреция, «свежие» очагово-инфильтративные изменения ш жгких на рентгенограмме) осуществить количественную оценку микробной5 «бссменённости фибробронхоскопических аспираторов, то клинический диагноз шажется подтверждённым микробиологически менее чем в половине случаев. При этом часть больных с отрицательными результатами микробиологиче- оого исследования, не получавших антибактериальной терапии, впоследствии ■їздоравливают, а у умерших при проведении аутопсии не удаётся обнаружить признаков пневмонии. Это позволяет предположить, что данные о частоте НП бывают преувеличенными и за ними могут стоять совершенно другие заболевания (юфаркт лёгкого, ателектаз и пр.).Среди всех нозокомиальных инфекций НП ассоциируется с наибольшими пока- аипгелями летальности, при этом общая летальность достигает 50%. Впрочем, столь высокие показатели могут вводить в заблуждение, поскольку у большого числа ашшентов с НП имеются тяжёлые сопугствующие заболевания и пневмония не сжужит непосредственной причиной смерти. Однако при этом очень сложно быва¬
242ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХет определить атрибутивную (непосредственно связываемую с НП) летальность. Наличие множества привходящих факторов у большинства пациентов (пред¬ шествовавшие заболевания, перенесённые оперативные вмешательства, сложные диагностические и лечебные манипуляции) объясняет сложность или даже невоз¬ можность определения «вклада» НП в танатогенез в конкретном случае. Тем не менее согласно имеющимся данным, атрибутивная летальность у пациентов с НП колеблется в широких пределах — от 10 до 50%, составляя в среднем 30%, а у пациентов с В АП она достигает 50% и более [38].КЛАССИФИКАЦИЯСерьёзность прогноза, значительное разнообразие возбудителей НП, объ¬ ективные трудности микробиологической диагностики диктуют необходимость создания классификации, которая позволила бы с большей вероятностью пред¬ положить этиологию заболевания и облегчить выбор адекватной эмпирической антибактериальной терапии. К сожалению, в отличие от внебольничных инфек¬ ций (например, ВП), характеризующихся ограниченным перечнем возбудителей, предсказуемым уровнем резистентности в пределах обширных географических регионов и возможностью обоснованной и эффективной эмпирической терапии, для нозокомиальных инфекций (в том числе и НП) характерны широкий круг вероятных возбудителей, невозможность предсказать уровень резистентности без локального мониторинга и, как следствие этого, большие трудности в разработке универсальных лечебных рекомендаций.В настоящее время наибольшей популярностью пользуется классификация, в основе которой лежат сроки развития НП, тяжесть течения, наличие или отсут¬ ствие факторов риска полирезистентных возбудителей [34, 35]. В соответствии с ней выделяют;• раннюю НП, возникающую в течение первых 5 дней с момента госпитализа¬ ции, вызываемую определёнными возбудителями (чаще — чувствительными к традиционно используемым антимикробным препаратам) и имеющую более благоприятный прогноз;• позднюю НП, развивающуюся не ранее 6-го дня госпитализации, которую характеризуют более высокий риск наличия полирезистентных возбудителей и менее благоприятный прогноз.Необходимо отметить, что пациенты с ранней НП характеризуются также высо¬ кой вероятностью выделения полирезистентных возбудителей при следующих факторах риска:• антимикробной терапии в предшествовавшие 90 дней;• широкой распространённости антимикробной резистентности среди основ¬ ных возбудрггелей во внебольничных условиях или в конкретных отделениях стационаров;• госпитализации продолжительностью 2 дня и более в предшествовавшие 90 дней;• пребывании в домах длительного ухода (дома престарелых, инвалидов и др.);• проведении инфузионной терапии на дому;• хроническом гемодиализе в течение предшествовавших 30 дней;• лечении ран в домашних условиях;• наличии члена семьи с заболеванием, вызванным полирезистентным возбу¬ дителем;• наличии иммунодефицитного состояния и/или при иммуносупрессивной терапии.Такие пациенты должны получать эмпирическую терапию, как пациенты с поздней НП,
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ243ШОГЕНЕЗПатогенез НП является мультифакторным, причём эти факторы нередко взаи- ■юдетствуют между собой (рис. 13-3). Как и в случаях любой другой пневмонии, вбязательным условием развития НП является преодоление известных механиз* мж противоинфекционной защиты дыхательных путей.Важным для понимания основ патогенеза НП является знание соответствующих 1^тей проникновения инфекции в нижние дыхательные пуги и лёгочную ткань:• аспирация секрета ротоглотки, содержащего потенциальных возбудителей НП;• аспирация нестерильного содержимого пищевода/желудка;• ингаляция микробного аэрозоля;• гематогенное распространение из отдалённого очага инфекции;• непосредственное проникновение возбудителей в дыхательные пути через интубационную трубку или от медицинских работников.Очевидно, что патогенетическое значение упомянугых путей проникновения ■м|>екции в дыхательные пути не равнозначно; основным является аспирация спдержимого ротоглотки, контаминированного соответствующими микроорга- ■Бмами.Колонизация ротоглотки отдельными микроорганизмами (в их числе пневмо- вжк, анаэробы, реже Я. irifluenzae) является универсальным процессом, наблю- jpewjM у здоровых индивидов. Напротив, колонизация секрета ротоглотки грам- вярицательными микроорганизмами (прежде всего такими высоковирулентными, жш R aeruginosa и Acinetobacter spp.) у здоровых людей встречается крайне редко. Окнако вероятность орофарингеальной/трахеальной колонизации Р. aeruginosa и жрамотрицательными энтеробактериями возрастает по мере того, как увеличива¬ ется продолжительность пребывания в стационаре и/или утяжеляется заболева- ■к. Это, в частности, объясняется тем, что клетки слизистой оболочки ротоглотки -ЯЕряют поверхностный фибронектин и обнажаются соответствующие рецептор- шше образования, аффинные к грамотрицательным микроорганизмам.При этом вероятность развития НП у пациентов с колонизацией верхних дыха- 1Сяьных путей грамотрицательными микроорганизмами возрастает практически в Ю раз (по сравнению с пациентами без грамотрицательной колонизации).Частота аспирации орофарингеального секрета наблюдается едва ли не у поло¬ ны здоровых лиц, особенно во время сна, существенно возрастая при следующихПерекрестная колонизация (руки, пврчап-ки)Неадекватная дезинфекция/ стерилизация медицинского оборудования Контаминацияводы,растворовХирургическоевмешательствоПрименение антибиотиков, других лекарственных средствФакторырискапациентаИнвазивныеманипуляцииКонтаминациямедицинскогооборудованияКолонизация LКолонизацияжелудкаротоглотки Г ''L1Образование кантаминированных аэрозолей>j Аспираций-j—[ингаляция[■БактериемияПреодоление защитных механизмов4-Транслокациябактерийбронхолёгочной системыПневмония13-3. Схема патогенеза НП [39].
244 ИНФЕКЦИОННЫЕ заболевания лёгкихситуациях: нарушении сознания, расстройстве глотания, снижении рвотного реф¬ лекса, замедлении опорожнения желудка и др.Ещё одним возможным путём инфицирования лёгочной ткани (и, соответствен¬ но, развития НП) может быть аспирация желудочного содержимого. Как известно, содержимое желудка обычно является стерильным прежде всего вследствие его кислой реакции (низкие значения pH). Колонизация содержимого желудка может произойти в следующих ситуациях: ахлоргидрия, гипохлоргидрия, мальнутриция, питание через назогасгральный зонд, приём лекарственных средств, повышающих pH желудочного содержимого (антациды, блокаторы Н^-гистаминовых рецепто¬ ров и особенно ингибиторы протонной помпы). Рефлюкс и аспирация нестериль¬ ного содержимого желудка являются возможным механизмом проникновения возбудителей в дистальные дыхательные пути и респираторные отделы лёгких, однако роль этого механизма в развитии НП существенно скромнее, нежели аспи¬ рации секрета ротоглотки.Вероятность развития НП существенно возрастает при наличии у пациента соответствующих факторов риска [34].• Факторы риска у пациента:❖ пожилой возраст;❖ курение и его интенсивность;❖ заболевания органов дыхания (ХОБЛ, дыхательная недостаточность, грипп);прочие заболевания (сахарный диабет, почечная недостаточность, алкого¬ лизм, мальнутриция и пр.);❖ кома;❖ метаболический ацидоз;о- носительство (на слизистой носа) S. aureus,❖ любой очаг инфекции в организме, потенциально могущий стать источни¬ ком её гематогенного распространения,• Факторы контроля инфекционных заболеваний:❖ перекрёстные инфекции;❖ плохая гигиена полости рта.• Факторы риска, связанные с медицинскими манипуляциями:<}■ длительная госпитализация;❖ эндотрахеальная интубация;❖ медикаментозная терапия (седативные препараты, миорелаксанты, антаци¬ ды, блокаторы Н^-рецепторов, ГКС и другие иммуносупрессанты, цитоток¬ сические препараты);❖ длительные и сложные оперативные вмешательства (особенно на органах грудной клетки и брюшной полости);установка назогастрального зонда и питание через него;❖ использование внутривенных катетеров;❖ кормление в лежачем положении.Мальнутриция ассоциируется с большим риском развития НП, возможно, вследствие транслокации бактерий через повреждённый эпителий желудочно- кишечного тракта. Рано начатое питание через назогастральный зонд способствует сохранению целостности слизистой оболочки желудочно-кишечного тракта и пре¬ дотвращает тем самым траслокацию бактерий через этот барьер, но в то же время эта манипуляция сама по себе увеличивает риск развития НП, Отчасти это объяс¬ няется тем, что при назогастральном питании повышается pH содержимого желуд¬ ка, способствуя тем самым колонизации желудка, увеличивается объём желудка и возрастает внутрижелудочное давление, что в свою очередь может привести к рефлюксу и аспирации. Помимо этого сам назогастральный зонд может обусло¬ вить развитие НП вследствие миграции потенциальных патогенов в ротоглотку;
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 245следует учитывать и возможность развития нозокомиального синусита, который является дополнительным фактором риска развития НП. Примечательно, что «^гастральная интубация характеризуется меньшей частотой нозокомиального бактериального синусита по сравнению с назогастральным расположением зонда.Риск развития НП возрастает после оперативных вмешательств, особенно на органах грудной клетки и брюшной полости, для которых характерны развитие аггелектазов, а также послеоперационные боли, нарушающие клиренс бронхиально¬ го секрета. При этом относительно простые манипуляции (подходы) — адекватное обезболивание, регулярная физиотерапия грудной клетки (массаж, постуральный дренаж, дыхательные упражнения), поошрение кашля у невентилируемых пациентов, ранняя активизация (насколько это возможно), приём пищи в положении полусидя — аюсобны существенно уменьшить риск послеоперационной пневмонии.ФБС является самостоятельным фактором риска развития НП у пациентов, находящихся на ИВЛ. Отчасти это может быть связано с тем, что продвигаемый через ротоглотку бронхоскоп вызывает колонизацию нижних отделов дыхатель¬ ных путей потенциально патогенными бактериями. Продвижение бронхоскопа способсгвует также смещению бактерий, локализующихся на биоплёнках, которые выстилают слизистую бронхов. Помимо этого нередко большие объёмы жидкости, вводимой через бронхоскоп, затрудняют клиренс бактерий из нижних отделов дыхательных путей. И хотя связь между этой врачебной манипуляцией и коло¬ низацией дыхательных путей не является безусловной, тем не менее предлагается сдержанный подход к применению ФБС у пациентов, находящихся на ИВЛ.На поверхности интубационной трубки часто образуются биоплёнки. Источниками бактерий являются поверхность кожи самого пациента, руки врача и медицинской сестры, медицинское оборудование и пр. Биоплёнки усиливают акку¬ муляцию бактерий и вырабатывают факторы, снижающие эффективность анти¬ бактериальной терапии. Это происходит вследствие того, что в биоплёнках более вязкое напряжение кислорода и меньшее содержание железа, что способсгвует атаэробному росту бактерий и меньшей скорости деления клеток. Вследствие этого, например, снижается активность р-лактамов, поскольку эти антибиотики иаиболее активны в отношении делящихся клеток, и аминогликозидов, активных в отношении аэробных бактерий.Применение отдельных классов лекарственных средств сопровождается уве- 1впением риска развития НП. Так, седативные препараты увеличивают риск аширации, снижают кашлевой рефлекс, тем самым способствуя застою бронхи- мьного секрета. Наиболее показательны эти эффекты у лиц пожилого возраста н пациентов, страдающих расстройствами глотания. У пациентов, находящихся ■а ИВЛ, седация замедляет возвращение к спонтанному дыханию, увеличивает джнтельность ИВЛ, а значит, и риск развития ВАП. Имеются доказательства, что цишенение миорелаксантов также служит самостоятельным фактором риска НП. Увеличивают вероятность развития НП также ГКС и цитотоксичные пре- мц>аты. Применение антацидов и блокаторов Н^-рецепторов, назначаемых в шяаа профилактики стрессорных кровотечений из желудочно-кишечного тракта у тяжелобольных пациентов, приводит к повышению pH содержимого желудка, смособствуя тем самым бактериальной колонизации его слизистой. Применение сукральфата характеризуется меньшим риском развития ВАП для профилактики гастроинтестинального кровотечения.Имеются многочисленные доказательства значительного возрастания риска НП у пациентов, находящихся на ИВЛ, равно как и связи между частотой НП и Ji■treльнocтью ИВЛ. Нахождение эндотрахеальной трубки в дыхательных путях ншехгга нарушает многие защитные механизмы, а именно;! * затрудняет или полностью исключает отделение в норме образующегося бронхиального секрета посредством мукоцилиарного клиренса и кашля;
246 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ• нарушает целостность эпителиальной выстилки трахеи;• эндотрахеальная трубка представляет собой своеобразную ловушку для секрета, локализующегося выше раздуваемой манжеты, то есть проксималь¬ неє трахеи. Это может привести к колонизации ротоглотки нозокомиальными бактериями, и контаминированный секрет, просачиваясь между раздутой манжетой и стенкой трахеи, проникает в нижние отделы дыхательных путей;• бактериальная колонизация происходит и в процессе отсасывания секрета выше манжеты эндотрахеальной трубки, когда бактерии могут оказаться непосредственно в нижних отделах респираторного тракта;• возможна контаминация увлажняющего резервуара в контуре ИВЛ, в резуль¬ тате чего пациент ингалирует микробный аэрозоль.Несмотря на то что в традиционном определении НП фигурирует известный временной критерий (пребывание в стационаре более 48 ч), в настоящее время есть основания считать, что у пациентов, находящихся на ИВЛ, ВАП может раз¬ виться и в первые 2 сут. Самостоятельными факторами развития ВАП в эти сроки являются сердечно-лёгочная реанимация, остановка сердечной деятельности или дыхания или нарушения сознания, потребовавшие проведения интубации, экс¬ тренная интубация независимо от причины, её вызвавшей, интегральная оценка состояния пациента по шкале Глазго менее 9 баллов, макроаспирация, продол¬ жающаяся седация [40]. Предшествующее назначение антибиотиков уменьшает вероятность развития ВАП в первые 48 ч, но не оказывает профилактического действия в отношении заболевания, развивающегося спустя 2 сут от момента госпитализации.ДИАГНОСТИКАНесмотря на известные ограничения, клиническое обследование остаётся точкой отсчёта в диагностике НП и данные других методов исследования (в том числе и инвазивных) интерпретируются с учётом их возможности уменьшить частоту ложноположительных случаев клинически диагностируемого заболевания (рис. 13-4)[41].Клиническая картина НП характеризуется появлением «свежих» очагово- инфильтративных изменений на рентгенограмме грудной клетки в сочетании с такими признаками инфекционного заболевания, как лихорадка, экспекторация гнойной мокроты и/или лейкоцитоз, в связи с этим к числу формализованных диагностических критериев НП следует отнести следующие [34, 35].Рис. 13-4. Соотношение НП и синдромосходных заболеваний [42]. БАЛ — бронхоальвеолярный лаваж.
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 247• Появление на рентгенограмме «свежих» очагово-инфильтративных измене- ^ gний в лёгких.• Два из приведённых ниже признаков:❖ лихорадка с подъёмом температуры тела выше 39,3 '"С;❖ бронхиальная гиперсекреция;❖ Р.О^/КОз <240.• Два из приведённых ниже признаков:❖ кашель, тахипноэ, локально выслушиваемые инспираторная крепитация, влажные хрипы, бронхиальное дыхание;❖ лейкопения (<4,0х10^/л) или лейкоцитоз (>12,0х10Ул), палочкоядерный сдвиг (>10%);❖ гнойная мокрота/бронхиальный секрет (>25 полиморфно-ядерных лейко¬ цитов в поле зрения при увеличении хЮО).Однако на практике представленные клинические, лабораторные и рентгено¬ логические критерии в диагностике НП оказываются не вполне надёжными, осо¬ бенно у пациентов, находящихся на ИВЛ. Сходную картину могуг давать ТЭЛА с развитием инфаркта лёгкого, ателектазы, лекарственные реакции, лёгочные геморрагии, ОРДС и др. Указанные критерии могут оказаться слишком «либе¬ ральными» и для пациентов с конкурирующими сердечно-сосудистыми или брон¬ холёгочными заболеваниями. Так, клинический диагноз НП в 10-29% случаев не находит подтверждения post mortem; с другой стороны, обнаруживаемая при аутопсии НП оказывается нераспознанной по данным прижизненного клинико¬ рентгенологического обследования в 20-40% случаев [43].Независимо от актуальной клинической ситуации и доступности соответству¬ ющих методов инвазивного исследования все пациенты при подозрении на НП должны подвергаться определённому клиническому обследованию. Оно включает изучение истории заболевания, учёт специфических клинических ситуаций, пред¬ полагающих большую вероятность конкретных возбудителей заболевания, физи- кальное обследование.У всех пациентов должна быть выполнена рентгенография органов грудной клетки в заднепередней и боковой проекциях. Рентгенография даёт возмож¬ ность установить не только сам факт очаговой инфильтрации лёгочной ткани (с определением её локализации), но и оценить степень тяжести НП (многодолевое поражение, быстрое прогрессирование пневмонической инфильтрации, кавита¬ ция). Очевидна польза рентгенографии и в выявлении такого осложнения НП, как плеврит.У всех пациентов должны быть исследованы газы артериальной крови или про¬ ведена пульсоксиметрия с оценкой 5^2*Исследование гемокультуры, имеющее определённое диагностическое и про¬ гностическое значение, обязательно при обследовании пациента с подозрением на НП. К сожалению, чувствительность этого метода не превышает 10-25%, а специфичность ограничивается большой вероятностью того, что у госпитализиро¬ ванных пациентов (особенно тяжелобольных) могут иметь место многочисленные источники бактериемии. Соответственно микроорганизмы, выделенные из крови, могут рассматриваться как возбудители НП лишь в тех случаях, если их удаётся обнаружить, и при исследовании респираторных секретов.Диагностический торакоцентез, безусловно, показан при наличии плеврального выпота с толщиной слоя свободно смещаемой жидкости на латерограмме более10 мм, прежде всего, для исключения эмпиемы плевры. Исследование плевраль¬ ной жидкости должно включать определение содержания белка, глюкозы, актив¬ ности лактатдегидрогеназы, pH, подсчёт форменных элементов крови, микроско¬ пию мазков с окраской по Граму и на кислотоустойчивые бактерии, посев, в том числе на Mycobacterium tuberculosis.
248 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХСерологические исследования имеют ограниченную диагностическую ценность и, как правило, при обследовании пациентов с подозрением на НП не использу¬ ются. Эти тесты, имеющие эпидемиологическое значение, в части случаев могут оказаться полезными в ретроспективной диагностике, например, легионеллёзной инфекции.Значение микробиологического исследования мокроты (бактериоскопия окра¬ шенных по Граму мазков, посев) у неинтубированных пациентов с подозрением на НП ограниченно и состоит в обнаружении устойчивых штаммов вероятных возбудителей заболевания. Однако специфичность этого метода в плане выявле¬ ния возможной этиологии заболевания оказывается весьма низкой (0-30%), что объясняется контаминацией образцов мокроты микрофлорой, привычно колони¬ зирующей ротоглотку/верхние дыхательные пути у госпитализированных паци¬ ентов- У пациентов, не получавших антибактериальной терапии, отрицательные результаты бактериоскопии/посева мокроты с большой вероятностью указывают на отсутствие НП как возможной причины лихорадки и инфильтрации лёгочной ткани.У интубированных пациентов с подозрением на НП наиболее доступным спосо¬ бом получения материала для микробиологического исследования является эндо¬ трахеальная аспирация (ЭТА). Подобно исследованию мокроты у неинтубирован¬ ных пациентов, ЭТА характеризуется ограниченной диагностической ценностью: при чувствительности 82-88% специфичность метода не превышает 27-33%. В связи с этим основное значение ЭТА состоит в исключении определённых видов возбудителей НП при отрицательных результатах исследования. Так, отсутствие Pseudomonas spp, в материале указывает на крайне низкую вероятность синегной¬ ной инфекции. При количественной оценке микробной обсеменённости аспиратов диагностически значимыми являются титры не менее 10^ колониеобразующих единиц (КОЕ). При повышении указанных пороговых значений микробной обсе¬ менённости значительно возрастает специфичность исследования (до 95%), но одновременно его чувствительность существенно (до 43%) снижается.Роль инвазивных диагностических методов при обследовании пациентов с клинически предполагаемой НП остаётся противоречивой [44, 45]. Наиболее популярным из них является защищённая браш-биопсия слизистой бронхов. Диагностически значимым зфовнем микробной обсеменённости, разделяющим колонизацию и инфекцию, является титр не менее 10^ КОЕ. При этом чувствитель¬ ность и специфичность защищённой браш-биопсии достигают 82 и 89%. К сожа¬ лению, воспроизводимость результатов этого метода у одного и того же больного невысока. Ещё одно обстоятельство, ограничивающее диагностическую ценность защищённой браш-биопсии, — падение числа микробных тел в случаях предше¬ ствовавшей антибактериальной терапии.В отличие от защищённой браш-биопсии при исследовании жидкости бронхо- альвеолярного лаважа (БАЛ) можно судить о микробной обсеменённости огром¬ ного числа альвеол (10^). Чувствительность и специфичность посева жидкости БАЛ при титре микробных тел более КОЕ сравнимы с таковыми защищённой браш-биопсии (91 и 100%).Очевидно, что роль и место неинвазивных (ЭТА) и инвазивных (защищённая браш-биопсия, БАЛ) диагностических методов при обследовании пациентов с подозрением на НП должны определяться исходя из клинической целесообраз¬ ности их применения и доступности, при этом следует иметь в виду, что внедре¬ ние микробиологической диагностики в целях минимизировать частоту лож¬ ноположительной диагностики НП не даёт ожидаемого результата в случаях высокой вероятности диагноза заболевания с клинико-рентгенологических пози¬ ций. Конечной точкой, определяющей диагностическую ценность неинвазивных и инвазивных методов исследования, являются результаты лечения. В связи с этим
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ249важно подчеркнуть, что до настоящего времени не получено доказательств, кото¬ рые бы свидетельствовали об оптимизации исходов НП при проведении агрессив¬ ной диагностической тактики.Чтобы оценить вероятность наличия у пациентов НП, может быть использо¬ вана шкала клинической оценки инфекции лёгких {Clinical Pulmonary Infection Score — CPIS), которая представляет собой балльную оценку 7 клинических, лабо¬ раторных и рентгенологических параметров (табл. 13-10). Общая сумма баллов >7 с высокой долей вероятности указывает на то, что определяемая у пациента клиническая симптоматика обусловлена инфекционным процессом в лёгких, а при показателе <6 диагноз НП является сомнительным. Шкалу CPIS также можно при¬ менять, чтобы контролировать динамику состояния пациента в процессе лечения и принимать решение о необходимости изменить или прекратить антибактериаль¬ ную терапию.Таблица 13-10. Шкапа иіинической оценки инфекции лёгких (CPIS) [46]ПоказательБаллыТемпература тела, °С36,1-38,4038.5-38,91>39,0 или <36,02Чкло лейкоцитов крови в 1 мкл4000-11 ООО0<4000 или >11 ООО1 (+1 при наличии юных форм>50%)трахеальный секретОіеугствие0Непсмный1Гяатй2^»енация (P^Oj/FiO,, мм рт.ст.)или наличие ОРДС*0420 отсутствие ОРДС2І^ігсиография органов грудной клетжи
шш.%^'MtШШ-250 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХОкончание табл. 13-10Культуральное исследование трахеального аспиратаМалое количество патогенных (преобладающих) бактерий или отсутствие ростаУмеренное или значительное количество патогенных (преобладающих) бак¬ терий1 (+1 при наличии аналогичных бактерий при окраске по Граму)* Диагноз «ОРДС» ставится при соотношении pp/FiO^ <200 или при давлении заклинивания в лёгочной артерии <18 мм рт.ст, и наличии двусторонних очагов инфильтрации.ЭТИОЛОГИЯНП может вызываться различными возбудителями (табл. 13-11) и иметь поли- микробный характер. НП и ВАП наиболее часто вызываются аэробными грамотри- цателъными микроорганизмами, такими, как Р. aeruginosa, Escherichia coli, Klebsiella pneumoniae и Acinetobacter spp. В последнее время отмечается увеличение частоты НП, вызываемых грамположительными бактериями, включая метициллинрези- стентные S. aureus (MRSA). Частота полирезистентных возбудителей НП, таких, как Stenotropkomonas mattophilia и Burkholderia cepacia, варьирует в зависимости от стацио¬ нара, популяции пациентов, типа ОИТ, что ещё раз свидетельствует о необходимости проводить локальный эпидемиологический надзор за этиологией и антимикробной резистентностью. НП, вызываемая анаэробами, может являться следствием аспира¬ ции у неинтубированных пациентов, однако редко встречается у пациентов с ВАП. НП, вызванная несколькими возбудителями, чаще возникает у взрослых пациентов с ОРДС. Значение L. pneumophila как возбудителя НП более высоко у пациентов с иммунодефицитными состояниями и в частности после трансплантации органов.Таблица 13-11. Этиология НП [35]Основные возбудители НПЧастота встречаемости/ вид НПЧастота встречаемости при ВАППолиреэистентныештаммыГрамотрицательные возбудителиР. шид'товаЧасто/поздняяЧастоЧастоEnterobacteriaceae:Е. СОІІЧасто/ранняя, поздняяЧастоРедкоК. рпешоп/ае БЛРС(-)*Часто/ранняя, поздняяЧастоРедкоК. pneumoniae БЛРС(+)*Часто/поэдняяВарьируетЧастоEnierobacter spp.Часто/ранняя, поздняяЧастоРедкоS. MarcescensЧасто/ранняя, поздняяЧастоРедкоAcinetobacter spp.Варьирует/поздняяВарьируетЧастоS. maliophiiiaРедко/поздняяРедкоЧастоB. cepaciaРедш/поздняяРедкоЧастоH. influenzaeВарьирует/ранняяВарьируетНетL pneumoptilaВарьирует/поздняяВарьируетНетГрамположительные возбудителиМетициллинчувствителы1ые S. aureusЧасто/ранняя, поздняяЧастоНетМетициллинрезистентные S. aureusЧасто/поздняяЧастоЧастоS. pneumoniaeВарьирует/ранняяВарьируетВарьируетАнаэробыРедко/ранняяРедкоНетБЛРС - (3-лактамазы расширенного спектра.
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 251АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯИсследования, выполненные в последние годы, определили два важнейших правила ведения больных НП: обеспечение адекватной антибактериальной тера¬ пии и сокращение нерационального/избыточного применения антибиотиков у данной категории пациентов.Для выполнения первого из указанных правил необходимы своевременная диа¬ гностика НП и незамедлительное назначение эмпирической антибактериальной терапии, которая предположительно должна быть эффективной в конкретной клинической ситуации на основании сведений о наиболее вероятных возбудите¬ лях инфекции и локальных данных о профиле их устойчивости к антибиотикам. Важным, во многом определяющим исход лечения пациента с НП является неза¬ медлительное назначение эффективной эмпирической антибактериальной тера¬ пии. Результаты многочисленных клинических исследований свидетельствуют, что при неадекватном выборе стартового режима терапии изменения его в процес¬ се лечения уже не могут благоприятно повлиять на показатели летальности [47].Для реализации второго правила в последние годы были предложены различ¬ ные подходы, включая улучшение качества диагностики НП и отказ от проведения антибактериальной терапии при сомнительном диагнозе НП, тактика деэскала- ционной терапии (смена режима антибактериальной терапии широкого спектра на более узкий), сокращение общей длительности применения антибиотиков на основании регулярного контроля за состоянием пациента и результатов микро¬ биологических исследований [48].Наиболее обоснованным представляется подход к назначению антибактериаль¬ ной терапии в зависимости от сроков развития НП. Так, при ранней НП, развившей¬ ся у пациентов, у которых наличие полирезистентных возбудителей маловероятно, рекомендуется проведение монотерапии. При поздней НП или НП, развившейся у пациентов, у которых возможно наличие полирезистентных возбудителей, исполь¬ зование комбинаций антибиотиков более оправданно по крайней мере до выделе¬ ния возбудителя и определения его чувствительности (табл. 13-12),Таблица 13-12. Эмпирическая антиба1аериальная терапия НП [34]НПВероятные возбудителиРекомендуемые антибиотикиРанняяS. pneumoniaeЦефалоспорин без антисинегнойиой активности (цефтриаксон,дней) НПН. influenzaeцефотаксим),любой сте¬S. aureusилипени тяжестиE. coliингибиторзащищённый аминопенициллин (амоксициллин + кла¬у пациентовK. pneumoniaeвулановая кислота, ампициллин + сульбашм),без факторовEnterobacter spp.илирискаProteus spp.фторхинолон (левофлоксацин, моксифлоксацин, ципрофлоксацин),S. marcescensиликарбапенем без антисинегнойной активности (эртапенем)ПгалняяP. aeruginosaЦефалоспорин с антисинегнойной активностью (цефепим, цеф¬(>5 дней) НПK. pneumoniae 5ЛРС(+)тазидим),иобой сте-Acinetobacter spp.илияени тяжестиМетициллинрезистентныйкарбапенем с антисинегнойной активностью (имипенем, меро¬■йи НП уS. aureusпенем),памиентоб силифакторамиР-лактам с антисинегнойной активностью (цефоперазон -I- суль¬бактам, пиперациллин/тазобактам»’. тикарциллин + клавулановая кислота)-I-фторхинолон с антисинегнойной активностью (ципрофлоксацин,левофлоксацин),илиамикацин+линезолид или ванкомицин
252 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХТрадиционно рекомендуемая длительность антибактериальной терапии НП составляет 14-21 сут. Однако в последние годы были получены многочисленные свидетельства того, что можно сократить длительность терапии без ущерба для конечной эффективности лечения, что сопровождается (помимо очевидных эко¬ номических преимуществ) снижением частоты колонизации дыхательных путей р. aeruginosa и микроорганизмами семейства Enterobacteriaceae. В связи с этим в настоящее время рекомендуется при эффективной эмпирической антибактериаль¬ ной терапии сокращать её длительность до 7 дней.Клиническая оценка эффективности терапии базируется на динамике таких параметров, как лихорадка, количество и характер мокроты, лейкоцитоз или лейкопения, оксигенация крови, рентгенологическая картина, показатели со сто¬ роны других органов и систем. В большинстве случаев клиническое улучшение наблюдается в ближайшие 48-72 ч после начала терапии и в течение этого перио¬ да обычно не следует менять стартовое лечение. Исключение составляют случаи, когда состояние пациента прогрессирующе ухудшается или получены результаты микробиологического исследования, требующие модификации антибактериаль¬ ной терапии-Рентгенография органов грудной клетки имеет ограниченную ценность при оценке динамики тяжёлой НП. поскольку нередко отмечается первоначальное рентгенологическое ухудшение, особенно у пациентов с бактериемией или инфек¬ цией, вызванной высоковирулентными патогенами. Кроме того, у пациентов пожилого и старческого возраста, а также при наличии сопутствующих заболева¬ ний (например, ХОБЛ) рентгенологические изменения существенно отстают от клинического улучшения. Прогностически неблагоприятными рентгенологиче¬ скими признаками являются прогрессирование пневмонической инфильтрации с увеличением в ближайшие 48 ч её первоначального размера более чем на 50%, очаги деструкции в лёгочной ткани (кавитация), наличие большого плеврального выпота.Как уже говорилось, использование шкалы CPIS существенно помогает клини¬ чески оценить динамику состояния пациента с НП.В общем виде тактика ведения больного с НП (или с подозрением на НП) пред¬ ставлена на рис. 13-5.ПРОФИЛАКТИКАШирокая распространённость НП (в особенности у хирургических больных, пациентов с тяжёлой механической и термической травмой, при нарушениях сознания) в сочетании с увеличением сроков госпитализации и материальных затрат, а также высокая атрибутивная летальность диктуют необходимость раз¬ работать и внедрить меры профилактики НП.Если принять во внимание факторы риска и патогенез НП. становится очевид¬ ным, что профилактика должна включать комплекс взаимосвязанных мероприя¬ тий организационного, технического и медицинского характера, уменьшающих вероятность контаминации и инфицирования, а также усиливающих антиинфек- ционную защиту самого пациента. Наиболее высокую степень обоснованности имеют следующие направления профилактики НП [49, 50].• Обучение персонала правилам ухода за больными с нарушенным сознанием и бульбарными расстройствами, получающими респираторную поддержку, небу- лайзерную терапию или питание через желудочный зонд, должно быть направ¬ лено на то, чтобы предупредить действие факторов, провоцирующих развитие пневмонии. Наиболее важно соблюдать угол наклона головного конца кровати (30-40°), периодически контролировать положение желудочного зонда, пери¬ стальтику и усвоение вводимой смеси, давление в манжете эндотрахеальной или трахеостомической трубки, обрабатывать кожные покровы.
БАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 253Рис. 13*5. Тактика ведения пациента с подозрением на НП (включая ВАП) [34].Прерывание путей передачи инфекции;❖ использование одноразовых стерильных расходных материалов, контакти¬ рующих с дыхательными путями пациента;❖ ежедневная стерилизация небулайзеров;❖ смена увлажнителей при их контаминации; своевременное удаление конденсата из дыхательного контура;❖ использование стерильных растворов для небулайзерной терапии, увлажне¬ ния воздуха и пр.;❖ стерилизация многоразовых дыхательных контуров перед их использова¬ нием у нового пациента; не рекомендуется замена контура у одного пациен¬ та чаще чем каждые 48 ч;❖ тщательная аспирация секрета из надманжеточного пространства с промы¬ ванием катетеров только стерильными растворами;❖ смена ёмкости для сбора аспирата перед использованием у другого пациента. Предупреждение переноса бактерий медицинским персоналом. Этому способствуют правильная организация обработки рук: использование жид¬ кого мыла, антисептиков и одноразовых салфеток. Рекомендуется мыть р)т<и перед надеванием и после снятия чистых перчаток с их сменой у каж¬ дого пациента, что позволяет предотвратить перекрёстную контаминацию.
254 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХНеобходимы выявление и санация носительства MRSA среди персонала лечебных згчреждений, например, с помощью мупироцина. Весьма действен¬ ной мерой является изоляция пациентов с инфекционными заболеваниями и организация помощи в ОИТ по принципу «один пациент — одна сестра». Такая тактика особенно оправдана при инфекциях, вызванных полирези¬ стентными бактериями (например, MRS А).• Ограничение использования лекарственных средств, способствующих повышению риска эндогенного инфицирования. Риск инфицирова¬ ния трахеобронхиального дерева микрофлорой ротоглотки и желудочно- кишечного тракта неизбежно увеличивается при угнетении сознания, подавле¬ нии кашлевого рефлекса, повышении pH желудка. Рациональное назначение гипнотиков, наркотических анальгетиков, миорелаксантов, антацидов зна¬ чительно сокращает частоту развития НП за счёт ограничения транслокации микрофлоры в дыхательные пути. Важным подспорьем этому служат исполь¬ зование современных вспомогательных режимов ИВЛ и ненаркотических анальгетиков, борьба с парезом кишечника. При профилактике развития стрессовых язв предпочтение следует отдавать блокаторам Hj-peuenTopoB и сукральфату, причём первые являются препаратами выбора.• Эпидемиологический контроль заключается в наблюдении за пациентами из группы риска развития нозокомиальных инфекций, в учёте их распро¬ странённости, анализе этиологической структуры возбудрггелей, характера и частоты антибиотикорезистентности. Для контроля распространённости НП следует ориентироваться на стандартизованные показатели и рассчитывать её на 100 койко-дней или на 1000 дней ИВЛ.• Селективная деконтаминация ротоглотки и желудочно-кишечного тракта. Классическая схема деконтаминации основана на назначении энте- рально (через зонд) вводимых неабсорбируемых антибиотиков (аминоглико- зиды и полимиксин) с амфотерицином В, обработке ротоглотки содержащей эти препараты пастой в сочетании с парентеральным введением антибиоти¬ ков широкого спектра действия (цефалоспорины III поколения или ципро¬ флоксацин). Главная цель селективной деконтаминации — предотвратить избыточную колонизацию ротоглотки и кишечника грамотрицательными аэробами и, следовательно, предупредить первичное и вторичное эндогенное инфицирование.Сочетание системного назначения антибиотиков с селективной деконтами¬ нацией сопровождается статистически значимым уменьшением числа инфек¬ ций нижних отделов дыхательных путей и летальности у пациентов с ОИТ, находящихся на ИВЛ. Влияние селективной деконтаминации на летальность у больных терапевтического профиля не доказано. Возможно, это связано со значительно меньшей обратимостью основного патологического процесса (острые нарушения мозгового кровообращения, декомпенсация хронической сердечной недостаточности, острая печёночная недостаточность и др.), а также с выведением из анализа некоторых категорий хирургических больных, в том числе с высоким риском развития осложнений (операции на пищеводе и сердце, трансплантация печени).Проведение селективной деконтаминации можно рекомендовать отдельным категориям хирургических больных с высоким риском развития ВАП. но с потенциально обратимым основным патологическим процессом (например, с политравмой, изолированной черепно-мозговой травмой, абдоминальным сепсисом). Применение селективной деконтаминации в качестве обязатель¬ ного стандарта профилактики не оправдано как с экономической точки зре¬ ния, так и с позиций экологических последствий для данного ОИТ.
IБАКТЕРИАЛЬНАЯ ПНЕВМОНИЯ 255 'Риск развития НП уменьшается при проведении антисептической деконтами- g нации зубных пластинок с помощью их обработки 0,2% хлоргексидиновым ^ гелем (трижды в сутки) в течение всего периода проведения ИВЛ. ^ J• Профилактическое назначение антибактериальных препаратов. Не доказано, насколько эффективно системное назначение антибактериальных препаратов для профилактики НП у пациентов с факторами риска, в том числе находящихся на ИВЛ. Цефалоспорины 1-1П поколений, уменьшая риск ранней НП, одновременно способствуют развитию поздней НП, вызываемой неферментирующими грамотрицательными бактериями и MRSA. Отсутствуют и рекомендации экспертов по обязательному назначению антибиотиков в целях профилактики ВАП у больных без исходного инфекционного процесса бактериальной природы. В основу индивидуально принятого решения долж¬ ны быть положены характер основной и сопутствующей патологии, прогно¬ зируемая длительность ИВЛ и риск аспирации на догоспитальном этапе при нарушениях сознания.СЛИСОК ЛИТЕРАТУРЫ гd.
Глава 14 Острый абсцесс и гангрена лёгкогоТерминологияОстрый абсцесс и гангрена лёгкого представляют собой патоло¬ гический процесс, характеризующийся некрозом и последующим гнойным или гнилостным распадом лёгочной ткани в результате воздействия различных патогенных факторов.В литератзфе можно встретить разные названия данного процес¬ са (острое лёгочное нагноение, острая инфекционная деструкция лёгких, деструктивные пневмониты, острые гнойные заболевания лёгких) [1-3].Острые лёгочные нагноения известны с древних времён и упо¬ минаются ещё у Гиппократа. В работах основателя пульмонологииА. Ьаеппес (1819) лёгочные гнойники рассмотрены как особое забо¬ левание и выделены из группы бронхитов, пневмоний и плевритов.в нашей стране большое внимание проблеме нагноений лёгких и плевры уделял С.И, Спасокукоцкий, опубликовавший в 1938 году монографию «Хирургия гнойных заболеваний плевры и лёгких».в 1967 году В.И. Стручков [1] рассматривал абсцесс как огра¬ ниченное скопление гноя, имеющее полость, стенки и содержимое (гной, секвестры), а гангрену — как некроз лёгочной ткани под воздействием токсинов и нарушения кровообращения, который не имеет чётких границ и сопровождается тяжёлым состоянием боль¬ ного.Н.В. Путов [3] выделил 3 вида деструкции лёгкого:• абсцесс — более или менее отграниченная полость, формиру¬ ющаяся в результате гнойного расплавления лёгочной парен¬ химы;• гангрену лёгкого — значительно более тяжёлое патологическое состояние, отличающееся обширным некрозом и ихорозным распадом поражённой ткани лёгкого, не склонным к чёткому отграничению и быстрому гнойному расплавлению;• гангренозный абсцесс — промежуточную форму: некроз и гнойно-ихорозный распад имеют менее распространённый характер, в процессе отграничения формируется полость, содержащая медленно расплавляющиеся и отторгающиеся сек¬ вестры.Е.Г. Григорьев [4] выделяет острый абсцесс и гангрену лёгкого, которую подразделяет на ограниченную (гангренозный абсцесс) и распространённую.
ОСТРЫЙ АБСЦЕСС И ГАНГРЕНА ЛЁГКОГО 257Острый абсцесс без секвестрации — гнойно-некротическое поражение лёгкого сбаггериальным и/или аутолитическим протеолизом некроза по мере его форми¬ рования с образованием одиночной или множественных полостей с демаркацией т жизнеспособной лёгочной ткани [5]. Острый абсцесс с секвестрацией (гангре- ■азяый абсцесс) — некроз участка лёгкого с последующим протеолизом его по ■срнферии, с формированием полости с демаркацией от жизнеспособной лёгоч- нй ткани и секвестрацией зоны некроза [6]. Наиболее распространённой формой «офой деструкции лёгкого является абсцесс, не содержащий секвестров.Межоочаговая диссеминированная гнойная деструкция лёгких — гнойно- ■гкротическое воспаление лёгкого с бактериальным и/или аутолитическим про- полюом некроза без демаркации от жизнеспособных тканей.Гангрена лёгкого — бурно прогрессирующий гнойно-гнилостный некроз всего легкого или отделённой плеврой анатомической структуры (доли), в которых шремежаются зоны гнойного расплавления, неотторгнутого и секвестрированно¬ го некроза [7].Из понятия острого абсцесса и гангрены лёгкого исключаются острые деструк- wm лёгких, обусловленные специфическими возбудителями, способными вызвать распял лёгочной ткани (туберкулёз, сифилис).ЭтиологияЭтиологическими факторами в развитии острого абсцесса и гангрены лёгкого могут ^пъ грамположительные кокки (стафилококки, стрептококки), грамотрицательные шлочки (Enterobacteriaceae, синегнойная палочка), неклостридиальные анаэробные 1вроорганизмы, Haemophilus itfluenzae, патогенные микоплазмы, грибы.Возбудителями острой инфекционной деструкции лёгких чаще являются аэроб- ше и условно-анаэробные микроорганизмы: синегнойная палочка, клебсиелла, 1фОтей и другие виды энтеробактерий, которые большинство авторов относят ж условно-патогенной микрофлоре [8-14]. По данным ВНИИ пульмонологии, »¿юбные посевы материала из гнойных полостей давали отрицательные результа- ш в 48% наблюдений [3]. Важным этапом в развитии представлений об этиологии оогрой инфекционной деструкции лёгких было установление роли неспорообра- атощих облигатно-анаэробных микроорганизмов [8, 14]. Неспоробразующие, Ш1И неклостридиальные, анаэробы, к которым относят бактероиды (В. fra^lis,В. melaninogenicus), фузобактерии (F. nucleatum, F. necrophorum, F. ramosus) и ана¬ эробные кокки (Peptococcus, Peptostreptococcus), обычно сапрофитируют в полости рта, особенно у людей с кариесом зубов, пульпитом, пародонтитом.Вопросы течения гнойных деструктивных процессов в зависимости от вызвав- »X их возбудителей остаются сложными и до конца не решёнными. Пневмококк •едет к значительной инфильтрации бронхиолярно-альвеолярной ткани лёгкого, а вторичная инвазия условно-патогенными микроорганизмами - к гнойно- даструктивному процессу. Вирусное поражение эпителия бронхиального дерева ошаёт условия для инвазии в ткань лёгкого условно-патогенной микрофлоры, обычно находящейся в дыхательных путях. Возможна грибковая деструкция лёг- шшх. (аспергиллёз и др.).Для предположительного определения этиологического фактора при выборе змшфической антибактериальной терапии целесообразно использовать неко- юрые клинико-лабораторные данные. Бактериоскопия отделяемого с окраской кзка по Граму позволит выявить грамположительные кокки, грамотрицательные ■иочки, грибы. Анаэробный генез острых гнойных деструкций лёгких вероятен при гнилостном запахе мокроты, отсутствии роста аэробной микрофлоры, в слу- •вях аспирации, обтурации бронхов опухолью, инородным телом.Имеет значение анализ путей проникновения повреждающего агента в лёгкое, Ч»«фасполагающих факторов к развитию гнойно-деструктивного процесса.ШШ'
258 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХВозможны следующие пути проникновения повреждающего агента в лёгкое:• эндобронхиальный (ингаляционный, аспирационный, обтурационный);• гематогенный: тромбоэмболический (постинфарктный), септический;• травматический, из пограничных тканей и органов (контактный, лимфоген¬ ный).Предрасполагающими к развитию гнойно-деструктивного процесса факторами могут бьггь респираторная вирусная инфекция, пневмония, иммунодефицитные состояния, бессознательное состояние, алкоголизм, черепно-мозговая травма, осложнения наркоза и др.Патогенез и патологическая анатомияКоррекция развивающихся нарушений микроциркуляции при остром абсцес¬ се и гангрене лёгкого возможна только на основе понимания генеза различных состояний, обусловленных особенностями микроциркуляторных расстройств на разных этапах инфекционно-воспалительного процесса.Отёк тканей — универсальная реакция поддержания гомеостаза в условиях действия повреждающих агентов. Плазма крови несёт с собой в повреждён¬ ные участки тканей ингибиторы протеаз, антиоксиданты, опсонины, формирует микросреду, необходимую фагоцитам. Воздух альвеол — чужеродная среда для нейтрофилов; экстравазация компонентов плазмы крови обеспечит в дальнейшем опсонизацию микробных клеток, а с началом фагоцитоза — нейтрализацию лей¬ коцитарных протеаз и активных кислородных радикалов, потенциально способ¬ ных повреждать собственные ткани. Если баланс бактерицидных, цитотоксичных агентов и их ингибиторов обеспечивается, а фагоцитоз оказывается завершённым, воспалительный процесс разрешается естественным путём.Острое воспаление в лёгком с тенденцией возможного нагноения в очаге повреж¬ дения лёгочной ткани характеризуется обилием клеточных элементов (преиму¬ щественно палочкоядерных лейкоцитов). Микрососуды проходимы практически на всём протяжении. Определяется нежная сеть «молодого» фибрина, который не образует своеобразного фибринового блока, что в условиях прогрессирования патологического процесса в сочетании с синдромом диссеминированного внутрисо- судистого свёртывания (ДВС) на высоте протеолитической активности лейкоцитов может привести к распространённому гистолизу с формированием абсцесса. Если в очаге воспаления начинают в небольшом количестве определяться макрофаги, то возможны последующие репаративные преобразования 115]. Процессы образова¬ ния фибрина и последующей его стабилизации (созревания и организации) могут очень быстро прогрессировать на фоне скудной клеточной реакции.Существенное значение придают вторичному тромбозу питающих сосудов лёг¬ ких, часто встречаемому в очагах гнойной деструкции [16],Синдром системной воспалительной реакции есть следствие отсутствия доста¬ точного первичного, локального блока перфузии в месте тканевого повреждения. Практически любая инфекция вначале имеет проявления системного характера. Необходим определённый промежуток времени для формирования барьера, создаваемого локальным блоком перфузии в повреждённых тканях. Принятие критериев синдрома системной воспалительной реакции внесло определённость в широко используемое понятие интоксикации [17,18].Системная воспалительная реакция первых часов обеспечивает целостную реакцию всего организма на локальное повреждение. Факторы, обеспечивающие развитие компенсаторной противовоспалительной реакции, уравновешивают эффекты провоспалительных медиаторов. Баланс процессов альтеративной и репаративной направленности в повреждённых тканях невозможен без морфо¬ логической перестройки. Фибрину в этой перестройке отводится особая роль: он выполняет основную барьерную функцию в тканях. Благодаря фибрину ограничи¬
ОСТРЫЙ АБСЦЕСС И ГАНГРЕНА ЛЁГКОГО 259вается распространение не только микробов и их токсинов, но, что не менее важно, цитокинов. Возможности выполнения барьерных функций другими белками, в частности фибронектином, С-реактивным протеином, ещё малоизучены [19].На состояние полупроницаемого динамического барьера, формируемого эндо- телиоцитами, оказывает влияние множество факторов [20].Критически важными и ранними процессами в ответ на повреждение являются адгезия и агрегация тромбоцитов, индуцируемая тромбином. Активация эндоте¬ лиальных клеток, обусловленная воздействием тромбина и рецепторов, активи¬ руемых протеиназой, вызывает повышение проницаемости сосудов, освобождение оксида азота, простагландинов, эндотелина, фактора Виллебранда, улучшение экс¬ прессии адгезивных белков [21].Тромбин в концентрациях, тысячекратно более низких, чем необходимо для образования нерастворимого фибрина, принимает участие в формировании локального обратимого блока перфузии. Стаз крови обеспечивает экстравазацию плазмы крови, инфильтрацию места повреждения фагоцитами и другими клетка¬ ми, участвующими в процессах альтерации и репарации.Регуляция фибринообразования идёт не только на уровне ограниченного про- теолиза фибриногена тромбином и накопления исходного материала (мономеров фибрина), но и на уровне последующей полимеризации.Комплексообразование — классический, очень эффективный путь устране¬ ния из кровотока патологических агентов (физиологическая детоксикация). Биологическая целесообразность ДВС состоит в том, что с участием растворимых комплексов фибрина-мономера (РКФМ), продуктов деградации фибрина (ПДФ), плазменного фибронектина, острофазовых белков и т.д. происходит образование «омплексов экзогенных и эндогенных патогенов, затем осаждаемых на капилляр¬ ных фильтрах паренхиматозных органов.Проблема две как критического состояния начинается не с появления РКФМ и ПДФ, а с перегрузки системы мононуклеарных фагоцитов — основной системы, осуществляющей захват и полный лизис крупномолекулярных белковых ком¬ плексов. Купферовские клетки печени и сосудистые макрофаги лёгких своими протеазами завершают процессы, начатые в плазме крови, активацией каскадов ограниченного протеолиза, то есть процесс детоксикации идёт ступенчато: огра¬ ниченный протеолиз компонентов каскадно-комплексных систем плазмы (в основном сериновыми протеазами) — синтез, или полимеризация, с образованием крупномолекулярных белковых комплексов — полный протеолиз этих комплек¬ сов (в основном лейкоцитарными протеазами). Только с момента истощения или угнетения системы мононуклеарных фагоцитов РКФМ и ПДФ в составе крупномо¬ лекулярных белковых комплексов станут агентами повреждения и необратимого вторичного блока перфузии паренхиматозных органов.Раннее угнетение и/или повреждение системы мононуклеарных фагоцитов, эндотелиоцитов, тромбоцитов приводит к тому, что процесс не достигает поздних стадий ДВС, а завершается полиорганной недостаточностью вследствие тотально¬ го блока перфузии паренхиматозных органов. Фатальный исход, видимо, связан с глубокими и необратимыми изменениями интимы [21]. Таким образом, несо¬ стоятельность первичного, локального блока перфузии в зоне перифокального воспаления может привести к вторичному тотальному блоку перфузии изначально ее поражённых органов и тканей.Среди множества нереспираторных функций роль лёгких в качестве капилляр¬ ного фильтра уникальна. Лёгкие — первый барьер на пути всей венозной крови и лимфы. Поэтому блок перфузии лёгочных капилляров, анатомические и функ¬ циональные возможности сброса (шунтирования) крови справа налево играют осзобую роль при любом лёгочном воспалении. Установлено, что распространён-
260 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ■ I ' 'Рис. 14-1. Распространённость микроциркуляторных наруше¬ ний в левом лёгком при остром абсцессе VI сегмента: а - рент¬ генограмма органов грудной полости; б — сканограмма лёг¬ ких.ность нарушений перфузии всегда превышает распространённость воспалительной инфильтрации (рис. 14-1).Глубина, обратимость или необратимость блока перфузии собственно лёгочных капилляров (малый круг) определяют тяжесть и характер газообменных и гемо- динамических нарушений, степень выраженности, обратимый или необратимый характер блока перфузии системы бронхиальных артерий (большой круг), а также тяжесть нарушений трофики тканей лёгкого.Чрезмерный глубокий блок перфузии повреждённых тканей с прекращением их оксигенации создаёт благоприятные условия для вегетирования неклостридиаль- ных анаэробов, то есть не условно-патогенные анаэробы (постоянные обитатели полости рта) вызывают гангрену, а глубокий, необратимый блок перфузии создаёт анаэробные условия, благоприятные для вегетирования анаэробов. По мере про¬ грессирования гангрены токсины анаэробов принимают всевозрастающее участие в формировании блока перфузии, но никогда его не запускают и не определяют.Для такого глубокого блока перфузии необходимо соответствующее исходное (т.е, до повреждения тканей и инвазии в эти ткани анаэробов) состояние системы гемостаза и капиллярного кровотока.Развитию острого абсцесса и гангрены лёгкого способствуют следующие пато¬ генетические механизмы:• парапневмоническая и постпневмоническая деструкция лёгкого;• аспирация пищевых масс, желудочного содержимого, инородных тел;• тромбоэмболия ветвей лёгочной артерии;• обтурация бронхов опухолью;
ОСТРЫЙ АБСЦЕСС И ГАНГРЕНА ЛЁГКОГО 261• заброс гнойного отделяемого из одного лёгкого в другое;• обострение хронических нагноительных заболеваний лёгких;• сепсис;• интраоперационная перевязка лёгочной артерии;• поддиафрагмальный абсцесс, прорыв нагноившейся полости распада альвео- кокка печени через диафрагму в бронхи нижней доли правого лёгкого.При формировании гнойного абсцесса в центре воспалительного инфильтрата происходит гнойное расплавление, причём полость приобретает форму шара. В определённый момент наступает прорыв гноя из полости через один из дре¬ нирующих бронхов. При хорошем дренировании гноя через бронхиальное дерево инфильтрация в окружающей ткани постепенно рассасывается, сама полость уменьшается в размерах, выстилается внутри грануляционной тканью и может полностью облитерироваться. Хорошо дренирующаяся полость больших размеров может стабилизироваться и эпителизироваться изнутри благодаря покрывающему грануляции бронхиальному эпителию. Такую полость иногда называют кистоподобной и рассматривают как особую форму клинического выздоровления. При недостаточном дренировании гнойной полости, высокой вирулентности микроорганизмов, снижении сопротивляемости макроорганизма шли неадекватном лечении в полости абсцесса задерживается гной, инфильтра- цвя лёгочной ткани не имеет тенденции к уменьшению, гнойное расплавление увеличивается; в результате возможны различные осложнения: пиопневмото- ракс, лёгочное кровотечение и т.д. При отсутствии эффекта лечения формируется хронический абсцесс — полость с неровными рубцовыми стенками, выстланны¬ ми изнутри грануляциями, в которой поддерживается периодически обостряю¬ щийся нагноительный процесс.При остром абсцессе с секвестрацией (гангренозном абсцессе) участок лёгоч¬ ной ткани, находящийся в состоянии ихорозного распада, отграничивается от жизнеспособной ткани лёгкого. Формируется гнойная полость, в той или иной мере дренирующаяся через бронх, содержащая пристеночно расположенные или свободно лежащие секвестры лёгочной ткани и гной, В результате лечения может ■аступить постепенное очищение полости гнойника от секвестров с последующим формированием хронического абсцесса или (реже) эпителизированной воздушной ■олости. Полная ликвидация полости при гангренозных абсцессах с секвестрацией встречается довольно часто.При гангрене лёгкого после кратковременного периода воспалительной инфиль¬ трации вследствие воздействия продуктов жизнедеятельности микроорганизмов ш массивного тромбоза сосудов возникает обширный некроз лёгочной ткани. В некротизированной лёгочной ткани формируются множественные, чаще всего мелкие полости распада, которые частично дренируются через бронхи. Процесс быстро распространяется на плевру, что приводит к ихорозному (гнилостному) ■вс^нту. Расплавление лёгочной ткани, как правило, идёт медленно.При развитии септического ДВС-синдрома, выраженной клеточной реакции ш отсутствии фибринового стромального блока на фоне высокой протеолитиче- сжсж активности лейкоцитов может прогрессировать процесс гнойной деструкции шцкнхимы лёгкого. Данная картина наблюдается при множественных абсцессах и «шгрене лёгкого. В этом случае фагоциты не блокируются фибрином — остаются «свободными», а микроциркуляторное русло — проходимым.КлассификацияПредложено множество классификаций острого абсцесса и гангрены лёгкого, •аюванных на учёте характера процесса, количества очагов деструкции, их генеза, жииического течения, характера осложнений [2, 3,9,22-27].
<»--і262 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХМы предлагаем клиническую классификацию острого абсцесса и гангрены лёг¬ кого, которая характеризует острые деструкции лёгкого с точки зрения клинике- морфологических форм, распространения, тяжести течения, осложнений [28].I. Клинико-морфологические формы:^ острый абсцесс; без секвестрации, с секвестрацией; очаговая гнойно-некротическая деструкция лёгкого;❖ гангрена.II. Распространённость процесса1. Односторонние поражения:абсцессы: одиночные, множественные;<>• гангрена: лобарная, субтотальная, тотальная.2. Двусторонние поражения:❖ множественные абсцессы, гангрена;Д абсцессы одного лёгкого и гангрена другого;❖ абсцессы или гангрена одного лёгкого и пневмония другого.III. Осложнения1. Со стороны плевральной полости:❖ серозный плеврит;❖ эмпиема плевры;❖ спонтанный пневмоторакс; пиопневмоторакс.2. Со стороны грудной стенки;empyema necessitates;❖ наружные торакальные свищи (плевроторакальный, бронхопульмоплевро- торакальный);❖ флегмона грудной стенки.3. Перикардит (серозный, гнойный).4. Со стороны лёгких:❖ кровохарканье;❖ кровотечение; аспирация;❖ пневмония;❖ острый респираторный дистресс-синдром.5. Сепсис:❖ гнойные метастазы в другие органы и ткани;❖ шок;^ полиорганная недостаточность (анемия, менингоэнцефалит, миокардит, почечная недостаточность и др.).6. ДВС-синдром (асептический, септический).IV. Тяжесть течения1. Лёгкая — бронхолёгочная симптоматика без признаков дыхательной недо¬ статочности, сепсиса.2. Средняя:❖ бронхолёгочная симптоматика с дыхательной недостаточностью; сочетание бронхолёгочной симптоматики, дыхательной недостаточности с сепсисом (системный ответ на воспаление инфекционного генеза);❖ выраженный протеолиз лёгочной ткани с быстрым образованием полостей на фоне невыраженной клинической бронхолёгочной симптоматики.3. Тяжёлая — сочетание бронхолёгочной симптоматики, дыхательной, недо¬ статочности с тяжёлым сепсисом, сопровождающимся дисфункцией органов, гипоперфузией или гипотензией.4. Крайне тяжёлая — септический шок, сохраняющийся, несмотря на адекват¬ ную инфузионную терапию (с превалированием гипотензии, со снижением
ОСТРЫЙ АБСЦЕСС И ГАНГРЕНА ЛЁГКОГО 263перфузии органов при отсутствии гипотензии), синдром полиорганной недо¬ статочности.Клиническая картинаСреди больных острым абсцессом и гангреной лёгкого соотношение мужчин и женщин, по нашим данным, составляет 8:1. У большинства больных (95%) пора¬ жается одно лёгкое. Чаще процесс локализуется в правом лёгком, при этом в нём превалирует поражение верхней доли, в левом — нижней.У всех больных отмечают кашель. Он может возникать преимущественно по утрам или по мере накопления мокроты. Мокроту выделяют 91,9% больных; она может быть гнойной, чаще с запахом, белого, серовато-белого, грязно-зелёного цвета или гнилостной с резким, труднопереносимым запахом, грязно-серого, шоколадного цвета, с примесью крови. Нередко на стороне поражения возникает болевой синдром, связанный с дыханием, кашлем. Часто имеется одышка. Почти у всех больных отмечают лихорадку, нередко гектического характера, сопрово¬ ждающуюся ознобом, интоксикационным синдромом (энцефалопатией, наруше¬ нием функции паренхиматозных органов). У всех больных наблюдают астениза- цию, потерю массы тела, гиподинамию, ухудшение аппетита вплоть до анорексии. Наряду с вышеназванными симптомами клиническая картина включает симпто¬ матику, обусловленную осложнениями острого абсцесса и гангрены лёгкого.Течение острого абсцесса и гангрены лёгкого не однообразно. Мы выделили5 вариантов течения заболевания [29,30].I вариант. Выраженное фазное течение заболевания:• 1-я фаза - нарастающие клинические признаки пневмонии и тяжёлой инток¬ сикации;• 2-я фаза — прорыв в бронхи гнойного содержимого с резким усилением кашля и отделением большого количества гнойной мокроты;• 3-я фаза — уменьшение выраженности интоксикации и интенсивности кашля с отделением мокроты.II вариант. Стабильно тяжёлое длительное (2-3 нед) течение с постепенным нарастанием частоты кашля, увеличивающимся количеством отделяемой гнойной или гнилостной мокроты и возможным присоединением осложнений,III вариант. Постепенное уменьшение выраженности пневмонии, прерываю¬ щееся резко нарастающей интоксикацией, усиливающимся кашлем с отделением гнойной или гнилостной мокроты, присоединением осложнений.W вариант. Уменьшение выраженности пневмонии, интоксикации, урежение кашля с незначительным количеством гнойной мокроты и быстрым появлением в лёгких полостей с незначительными уровнями жидкости.V вариант. Быстро прогрессирующее течение процесса, тяжёлая интоксикация с резким увеличением количества гнойной или гнилостной мокроты, присоедине¬ нием осложнений.ДиагностикаАнализ характерных основных симптомов позволяет высказать подозрение о наличии острой гнойной деструкции лёгких, её клинико-морфологической форме, видах осложнений, тяжести заболевания. Информация о заболевании способ¬ ствует предположительному заключению об этиологическом факторе, что важно при выборе эмпирической антибиотикотерапии. Анализ течения заболевания помогает определить клинико-морфологическую форму, вероятность развития осложнений, прогноз болезни. Чрезвычайно важно установить признаки иммун¬ ной недостаточности и других заболеваний, неблагоприятных для течения острых абсцессов и гангрены лёгкого, наличие вредньгх привычек (наркомании, курения, алоупотребления алкоголем).
264 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХНаиболее типичными физикальными признаками являются отставание поло- ' М вины грудной клетки при дыхании, ослабление голосового дрожания, лёгочного Щ, звука, жёсткое или резко ослабленное дыхание со множеством разнокалиберных хрипов на стороне поражения. При периферическом расположении полости могут определяться тимпанит, амфорическое дыхание. Физикальные данные позволяют ', ' определить локализацию и распространённость патологического процесса [30].В крови отмечают лейкоцитоз с нейтрофилёзом (при тяжёлой интоксикации количество лейкоцитов может быть нормальнь(м и даже уменьшенным), гипохром- ную анемию, гипопротеинемию, гипоксемию, гиперкапнию.При исследовании мокроты определяют двух-, трёхслойный её характер. Микроскопически выявляют нейтрофильные лейкоциты, бактерии, некротизиро- ванные элементы лёгочной ткани.Рентгенография грудной клетки в 2 проекциях позволяет определить наличие деструкции лёгких, её распространённость и клинико-морфологическую форму [31]. Острый абсцесс без секвестрации во всех проекциях проявляется в виде шарообразной полости с уровнем жидкости (рис. 14-2).При большом инфильтративном процессе вокруг полости для её выявления и определения в ней секвестров необходимо применить линейную томографию или КТ. Небольшие скопления жидкости в плевральной полости определяют с помо¬ щью МРТ,При абсцессе лёгкого с секвестром в центре полости выявляют отделившийся от лёгочной ткани участок некроза неправильной формы (рис. 14-3). Иногда видны перемычки, соединяющие секвестр со стенками полости. Они лучше выявляются на томограмме.Стафилококковая деструкция лёгкого на рентгенограммах проявляется в виде множества полостей без содержимого или с небольшим уровнем жидкости (рис. 14-4).Гангрена лёгкого на рентгенограммах проявляется обширным негомогенным затемнением лёгкого с полостями неправильной формы, перифокальной инфиль¬ трацией, наличием секвестров (рис. 14-5).Бронхоскопия позволяет определить дренирующий бронх, выраженность «дре¬ нажного» бронхита, наличие инородного тела в бронхе, а также установить или исключить заболевания бронхов, которые могли бы привести к нагноительному процессу.Рис. 14-2. Рентгенограмма грудной клетки пациента с острым абсцессом верхней доли правого лёгкого без секвестрации: а — прямая проекция: б — боковая проекция.
ОСТРЫЙ АБСЦЕСС И ГАНГРЕНА ЛЁГКОГО 265Рис. 14-3. Острый абсцесс с секвестрацией в нижней доле левого лёгкого: а — боковая рентгено¬ грамма; б — боковая томограмма.Рис. 14-4. Рентгенограмма грудной клетки пацієнта с острой стафилококковой деструкцией лёгких: а — в прямой проекции; б — в боковой проекции.В бактериологическое исследование мокроты и смыва из бронхов включена бактериоскопия, которая в ряде случаев позволяет быстро определить наличие грамположительных кокков, грамотрицательных палочек, грибов для назначения антибактериальной терапии, и культуральное исследование — для идентификации микрофлоры и определения её чувствительности к антибиотикам.В острой фазе оценка функции дыхания нередко затруднительна. При стиха¬ нии острых явлений функциональное исследование лёгких помогает осуществить динамический контроль над восстановлением функции дыхания.
266 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХРис. 14-5. Рентгенограмма грудкой клетки пациента с гангреной левого лёгкого и острым абсцес¬ сом правого лёгкого.Дифференциальная диагностикаПрежде всего абсцесс лёгкого приходрггся дифференцировать от полостной формы рака лёгкого и абсцедирования в ателектазе при центральном раке лёгкого. При полостной форме рака лёгкого толщина стенок полости неравномерна; наиболее тол¬ стая стенка медиальная, в полости содержится незначительное количество жидкости. Перифокальная реакция больше всего вьфажена по направлению к корню лёгкого. Форма полости не изменяется при дыхании. Абсцесс лёгкого в ателектазе при цен¬ тральном раке лёгкого отличается тем, что он проявляется на фоне гиповентиляции соответствующего отдела лёгкого, уплотнения лёгочной ткани. Окончательный диа¬ гноз ставят на основании бронхоскопии и биопсии опухоли, а при полостной форме рака — на основании трансторакальной пункции с цитологическим исследованием.Туберкулёзная каверна отличается от острого абсцесса лёгкого отсутствием содер¬ жимого в полости, наличием очагов в лёгких и петрификатов во внутригрудных лим¬ фатических узлах. Окончательный диагноз ставится на основании бактериологиче¬ ского исследования мокроты, смывов из бронхов на туберкулёзную палочку. Гангрену лёгкого иногда приходится дифференцировать от казеозной пневмонии. Для гангре¬ ны, в отличие от туберкулёза, характерна гнилостная мокрота с труднопереносимым запахом. Важнейшая роль отводится бактериологическому исследованию.Эхинококковую кисту редко приходится дифференцировать от абсцесса лёгко¬ го, так как клиническая картина при эхинококкозе очень скудная, а гомогенное затемнение при эхинококке может быть сопоставимым лишь с «блокированным» абсцессом. Однако при последнем резко выражен интоксикационный синдром.ЛечениеЦель лечения — предотвращение неблагоприятного исхода, уменьшение зоны деструкции лёгкого, максимальное сохранение лёгочной ткани, восстановление функции лёгкого.Алгоритм лечения острого абсцесса и гангрены лёгкого включает 3 этапа: интенсивную терапию (до 2 нед), консервативное лечение (4-6 нед), реабилита¬ цию [32-36].При поступлении больных в стационар проводится интенсивная терапия, которая включает восстановление основных гемодинамических параметров, ста¬
ОСТРЫЙ АБСЦЕСС И ГАНГРЕНА ЛЁГКОГО 267билизацию гемодинамики, плазмацитоферез, парентеральную антибактериаль¬ ную терапию, дренирование гнойников в лёгком, плевральной полости, грудной стенке, коррекцию волемических, электролитных, реологических нарушений, кислотно-щелочного равновесия, устранение тканевой гипоксии, экстракорпо¬ ральную иммунокоррекцию.Важнейшим условием эффективности лечения является определение програм¬ мы антибактериальной терапии. При поступлении осуществляется эмпирическая, а затем этиотропная антибактериальная терапия (табл. 14-1) [29].Таблица 14-1. Эмпирическая антибактериальная терапия при остром абсцессе и гангрене лёгкогоВероятный возбудительАнаэробыEnterobacteriaceaePseudomonas aeruginosaStaphyiococcus aureus (сепсис инъекционный, катетеризационный, у нар¬ команов)Препараты выбора«Защищённые^' пенициллины Цефоперазон/сульбактамАминогликозиды ІІ-ІП поколений + цефалоспорины ПІ-ІУ поколений с антисинегнойной активностью {цефтазидим, цефоперазон, цефе¬ пим)Оксациллин, цефаэолинАльтернативные препаратыКарбапенемыФторхинолоны + метронидазол Линкозамиды + аминогликозиды 11-111 поко¬ ленийКарбапенемы с антисинегнойной актив¬ ностью (имипенем, меропенем) + фтор¬ хинолоны с антисинегнойной активностью (ципрофлоксацин, левофлоксацин)Ванкомицин, линезолидЭффективность антибактериальной терапии при локальном микротромбозе, ориентировочным тестом которого является тромбинемия, достигается благодаря сочетанию антибактериальной и противотромботической терапии, включающей введение низкомолекулярных гепаринов.Эффективность антибактериальной терапии при ДВС-синдроме, который про¬ является коагуляционной тромбинемией, активацией агрегации тромбоцитов, обеспечивается благодаря сочетанию антибактериальной терапии с антитромби- новым и антикоагулянтным воздействием.Для деблокирования микроциркуляции у больных с острым абсцессом и гангре¬ ной лёгких разработаны 3 варианта криоплазменно-антиферментного комплекса (табл. 14-2). [29].Комплексное лечение больных с тяжелыми формами абсцессов и гангрены лёгких с применением плазмафереза и криоплазменно-антиферментной терапии позволяет улучшить исходы лечения, уменьшить необходимость применения опе¬ ративных вмешательств, время пребывания больных в стационаре.Адекватная инфузионная терапия гнойно-септических больных во многом определяет исход заболевания [37]. Основу инфузионной терапии, которую проводят с учётом показателей электролитного и кислотно-основного баланса, составляют растворы кристаллоидов. При тяжёлой анемии, высоком тромбоцито¬ зе. агрегационной активности тромбоцитов, гиперкоагуляции показаны инфузии гидроксиэтилкрахмала, который модифицирует взаимодействие поверхности клеток с белками плазмы, оказывая протекторное действие — от 0,5 до 20,0 мл/кг. В ситуациях, когда уровень О-димера превышает 3,6 мг/л, количество тромбоци¬ тов ниже ЮОхЮул, индуцированная агрегационная активность тромбоцитов не достигает 25%, показано назначение криоплазмы и гепарина натрия.Определённую роль в лечении острых гнойных деструкций лёгких имеет специфическая иммунотерапия (антистафилококковый гамма-глобулин, антиста- фнлококковая плазма).ШШ
268ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХТаблица 14-2. Варианты криоплазменно-антиферментного комплекса лри лечении острого абсцес¬ са и гангрены лёгкихВариантыБольшие дозы свежезамороженной плазмы (600-800 мл), малые или средние дозы гепарина натрия (до 20 ООО ЕД). Дополнительное введение больших доз ингибиторов протеазУмеренные дозы свежезамороженной плазмы (300-450 мл) и большие дозы гепарина натрия (30 ООО ЕД и более)Свежезамороженная плазма (300- 1000 мл) с малыми или средними дозами гепарина натрия (20 ООО ВД) и большими дозами ингибиторов про¬ теаз (100 000-200 ООО ЕД в течение 3-6 дней)Показания• Прогрессирование деструкции лёгкого без бурной клиниче¬ ской картины• Умеренные геморрагий, выраженное истощение противосвёр- тывающих факторов• Резкий дефицит антитромбина III, активаторов фибринолиза• Увеличение ХН-а калликреинзависимого фибринолиза• г иперкоагуляция• Разнонаправленные сдвиги в различных тестах• Резкое прогрессирование деструкции лёгкого• Появление множественных затемнений в лёгких с образова¬ нием мелких полостей• Образование абсцесса с секвестрацией• Умеренное истощение противосвёртывающих факторов• Дефицит антитромбина III, активаторов фибринолиза• Гиперкоагуляция• Бурное прогрессирование клинической картины• Перифокальная инфильтрация с распространением процесса, дальнейшей деструкцией, некрозом лёгкого• Геморрагический синдром• Превалирование гиперфибринолиза, гипокоагуляция• Увеличение спонтанной агрегации тромбоцитовЭвакуацию гнойного содержимого из гнойных полостей осуществляют различ¬ ными методами. Не потеряли своей актуальности постуральный дренаж, фибро¬ бронхоскопия, Новые возможности лечебной бронхоскопии открывает видеоэн- доскопическая технология. Оказать локальное воздействие на полость абсцесса позволяет транстрахеальная селективная катетеризация её через дренирующий бронх с последующей санацией.Введение катетера в бронхиальное дерево осуществляют различными путями: через микротрахеостому, трансназально [38-401.При выраженном гнойном дренажном бронхите целесообразно применение комплексной санационной фибробронхоскопии, включающей предварительную санацию слизистой оболочки главных, долевых, сегментарных бронхов, допол¬ нительную анестезию бронхиального дерева, посегментарную и субсегментарную санацию бронхиального дерева, в том числе проточную санацию через катетер растворами антисептиков (100-1500 мл).При наличии сращений между париетальной и висцеральной плеврой эффективно чресторакальное дренирование полости абсцесса по Сельдингеру или по Мональди.При дыхательной недостаточности методы респираторной поддержки приме¬ няют Б определённой последовательности: дозируемая, контролируемая оксиге¬ нация — вспомогательная вентиляция с постоянным положительным давлением в дыхательных путях при спонтанном дыхании - неинвазивная масочная вентиля¬ ция — искусственная вентиляция лёгких (ИВЛ) — принудительная, управляемая, контролируемая вентиляция с поддержкой по объёму; с поддержкой по давле¬ нию — вспомогательная вентиляция лёгких — спонтанное дыхание.На первом этапе хирургическое лечение применяют в ситуациях, угрожающих жизни больного. Показаниями к операции являются: кровотечение, напряжённый пиопневмоторакс, прогрессирующая флегмона груди, особенно гнилостная, угроза асфиксии при большом количестве мокроты.После решения проблемы интенсивной терапии проводится консервативное лечение, включающее антибактериальную терапию, дренирование гнойников.
ОСТРЫЙ АБСЦЕСС И ГАНГРЕНА ЛЁГКОГО 269поддерживающую криоплазменно-антиферментную терапию, лечебные бронхо¬ скопии, селективную катетеризацию бронхов, иммунокоррекцию, транспозицию экстракорпорально стимулированных фагоцитов, коррекцию волемических и рео¬ логических нарушений, устранение анемии, восполнение энергетических затрат и белковых потерь, десенсибилизирующую и общеукрепляющую терапию, физио¬ терапию, лечебную физкультуру.Хирургическое вмешательство на этапе консервативного лечения показано при кровотечении, пиопневмотораксе (напряжённом, бронхоплевральном свище с большим сбросом воздуха, стабилизации остаточной плевральной полости), флег¬ моне груди, угрозе асфиксии, прогрессировании гангрены.После завершения консервативного лечения необходимо оценить состояние патологического процесса, возможности выздоровления при проведении реаби¬ литационных мероприятий или необходимости перехода к хирургическому лече¬ нию, чтобы обеспечить выздоровление, восстановить функциональное состояние лёгких. Показаниями к операции в этот период являются отсутствие эффекта от консервативного лечения, переход процесса в хронический, ухудшение функции лёгкого, устранимое хирургическим путём.Исходы лечения острого абсцесса и гангрены лёгкого во многом зависят от эффективности лечения осложнений.Применение бронхоблокатора A.B. Левина при лёгочных кровотечениях позво¬ ляет предотвратить аспирацию, уменьшить острую кровопотерю и в спокойной обстановке окончательно остановить кровотечение с помощью хирургической операции. Летальность при этом снижается в 1,6 раза [41].Лечение эмпиемы плевры с помощью адекватного дренирования и локальной коррекции протеазно-ингибиторного баланса в плевральной полости в комплекс¬ ном лечении позволяет снизить летальность в 2,2 раза. При пиопневмотораксе дополнительное применение бронхоблокатора позволяет прекратить сброс через свищ Б плевральную полость и улучшить исход.Лечение септического шока, сепсиса с использованием деблокирования микро¬ циркуляции путём дифференцированного применения свежезамороженной плазмы, плазмафереза, плазмолейкофереза, криосупернатанта плазмы, анти- ферментных препаратов, методов аппаратной детоксикации позволяет повысить доступность очагов инфекции для антибиотиков и снизить летальность в 3,2, при септическом шоке — в 9,6 раза.По данным Алтайского краевого пульмонологического центра, летальность среди больных с острым абсцессом лёгкого без секвестрации составила 2,1, у боль¬ ных с острым абсцессом с секвестрацией — 1,6, при гангрене лёгкого — 21,3%. Использование комплексного этапного лечения больных с гангреной лёгкого позволило уменьшить летальность до 9,8%.СПИСОК ЛИТЕРАТУРЫ
Глава 15 Туберкулёз и другие микобактериальные инфекцииЭтиология туберкулёза и микобактериозовВозбудитель туберкулёза, открытый в 1882 году R. Koch, отно¬ сится к классу Schízomycetes, к порядку Actinomicetales, семейству Mycobacteriaceae, роду Mycobacterium.Группа Mycobacterium tuberculosis complex представлена 5 видами [1.2]:• М. tuberculosis humanus — человеческий тип, вызывающий 80-85% всех заболеваний туберкулёзом у людей;• М. tuberculosis bovines — бычий тип, вызывающий 10-15% всех заболеваний у людей (исходно устойчивый к пиразинамид}'');• М. tuberculosis bovines BCG — вакцинный штамм;• М. tuberculosis africanus — африканский тип, вызывающий до 90% заболеваний у людей Южной Африки (исходно устойчи¬ вый к тиацетазону);• М. tuberculosis microti — мышиный тип, вызывающий заболева¬ ние у полевых мышей и редко — у человека.Возбудителями туберкулёза у человека наиболее часто (в 92% случаев) являются М. tuberculosis humanus, а М. tuberculosis bovis и М. tuberculosis africanum вызывают развитие туберкулёза у человека примерно в 5 и 3% случаев.Отличительным свойством микобактерий туберкулёза (МВТ) является кислотоустойчивость, которая проявляется в способно¬ сти их сохранять окраску даже при интенсивном обесцвечивании кислотами, щелочами и спиртом, что обусловлено высоким содер¬ жанием в клеточных стенках микобактерий миколевой кислоты, липидов и восков.Лекарственная устойчивость к противотуберкулёзным препара¬ там является одним из самых значимых проявлений приобретённой изменчивости МВТ [1].Выделяют МВТ с монорезистентностью к одному препарату, полирезистентностью к 2 и более препаратам, но не к сочетанию изониазида и рифампицина, и с множественной лекарственной устойчивостью к изониазиду и рифампицину. При этом полире¬ зистентность и множественная лекарственная устойчивость могут быть к сочетанию основных (изониазид, рифампицин, пиразина- мид, этамбутол и фторхинолоны) и к сочетанию основных и резерв¬ ных (протионамид, канамицин, капреомицин, циклосерин и амино¬ салициловая кислота) противотуберкулёзных препаратов [2].
ТУБЕРКУЛЁЗ И ДРУГИЕ МИКОБАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ 271Для выявления МБТ используют световую и люминесцентную микроскопию, культуральные методы и автоматизированные системы ВАСТЕС, Достаточно активно развиваются и молекулярно-генетические методы. Исследование раз¬ личных диагностических материалов для выявления МБТ играет ведущую роль в диагностике туберкулёза [1],Последнее издание -«Определителя бактерий Берджи«» включает 45 видов и ком¬ плексов микобактерий, которые по своим морфологическим свойствам не отли¬ чаются от МБТ, но являются самостоятельными видами микобактерий, которые были названы как нетуберкулёзные микобактерии (НТМБ). К НТМБ относятся сапрофитные и потенциально-патогенные виды. НТМБ слабопатогенны для лабо¬ раторных животных, относительно контагиозны и свободно живут в почве, воде, на полях и пастбищах, за что получили название потенциально-патогенных МБ окружающей среды [3].Заболевания, вызываемые НТМБ, получили название микобактериозов вслед¬ ствие естественной устойчивости этих микобактерий к большинству противо¬ туберкулёзных препаратов. Лечение микобактериозов вызывает определённые трудности.Было много попыток классифицировать НТМБ, но до настоящего времени оста¬ ётся акт}?альной классификация Е, Runyon (1965), в основу которой положены ско¬ рость роста на питательных средах и способность образования пигмента [4, 5].Группа 1 — фотохромогенные, образующие пигмент после экспозиции на свету. Потенциально патогенными для человека являются: М. kansasii, М. marinum, М. simiae.Группа 2 — скотохромогенные, образующие пигмент жёлто-оранжевого цвета в темноте. Это самая большая группа среди нетуберкулезных микобактерий (60-70%). Потенциально патогенными для человека являются: М. scrofitlaceum, М. xenopi, М. szulgali.Группа 3 — нехромогенные, не образующие пигмент. Потенциально патогенны¬ ми для человека являются: М. avium complex, М. ulcerans, М. heamophilum.М, avium complex (MAC) включает 4 вида — М. avium, М. inracellulare, М. paratu- berculosis и М. silvaticum.Первые 3 группы отличаются тем, что они медленно в течение 1-12 нед растут на питательных средах.Группа 4 — быстро растущие в течение 3-5 дней. Потенциально патогенными для человека являются: M.fortuitum complex, М, abscessus.M.fortuitum complex включает 2 вида - M.fortuitum и М. chelonae.Наиболее частыми возбудителями микобактериозов у людей являются М. avium complex, М. Kansasii и M.fortuitum complex [4. 6, 7].Многие НТМК имеют природную устойчивость ко многим противотуберку¬ лёзным препаратам, поэтому их лечение вызывает определённые трудности и для лечения микобактериозов используют антимикробные средства, такие как фторхи¬ нолоны, сульфаниламидные препараты и макролиды нового поколения [8-10],MAC и M.fortuitum complex обладают высокой естественной устойчивостью практически ко всем противотуберкулёзным препаратам.М. kansasii проявляют устойчивость к изониазиду, этамбутолу и стрептомицину, но чувствительны к рифампицину,М. xenopi проявляют достаточно хорошую чувствительность к ПТП, поэтому исход заболевания благоприятный.М. scrofulaceum устойчивы к изониазиду, стрептомицину, этамбутолу и ПАСК.М. malmoense устойчивы к изониазиду, стрептомицину, рифампицину, ПАСК и ипреомицину.м. gordonae устойчивы к изониазиду, стрептомицину, но проявляют чувстви¬ тельность к рифампицину и этамбутолу.
272 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХПатогенез и патоморфологияЗаражение туберкулёзом чаще всего возникает через дыхательные пути (аспи- ращюнный путь) при контакте с заразным больным.Для инфицирования и развития заболевания туберкулёзом основное значе¬ ние имеют, во-первых, массивность инфекции, доза и длительность поступления микобактерий в организм человека, во-вторых, состояние неспецифических и специфических факторов защиты организма в период воздействия инфекционного агента [1].Неповреждённая слизистая оболочка полости рта, носоглотки и верхних дыха¬ тельных путей является непроницаемым барьером для МБТ. Здесь осуществляется механическая очистка воздуха за счёт фильтрации и осаждения инородных частиц, удаления их вследствие чихания и кашля. Наиболее значимой частью механиче¬ ской очистки является мукоцилиарный клиренс на уровне бронхов и бронхиол. Клиренс обеспечивается секретом, содержащим лизоцим, протеазы, сурфактант, иммуноглобулин А (IgA), которые опсонируют МБТ и движением ресничек рес¬ нитчатого эпителия выводят их из организма.В трахее и крупных бронхах МБТ, как правило, не задерживаются и оседают в нижних дыхательных путях и альвеолах. Локальные изменения в месте внедрения МБТ обусловлены, прежде всего, неспецифической реакцией полинуклеарных клеток (нейтрофилы), которые фагоцитируют возбудитель.Под влиянием токсинов МБТ нейтрофилы разрушаются, вызывая воспали¬ тельную реакцию, которая сменяется более совершенной защитной реакцией с участием макрофагов, осуществляющих фагоцитоз и разрушение возбудителя. От активности фагоцитоза во многом зависит эффективность всей системы противо¬ туберкулёзной защиты организма [1, 2].Макрофаги фиксируют микобактерии на клеточной мембране, затем погружают (инвагинируют) их в цитоплазму клетки с образованием фагосомо-лизосомальных комплексов.Однако МБТ, попадая в макрофаги, могут сохраняться в фагосомах и даже про¬ должать размножение. При этом фагоцитоз может носить незавершённый харак¬ тер. В этих случаях, когда процесс переваривания микобактерий блокируется, про¬ исходит разрушение макрофагов и выход возбудителей из поглотивших их клеток. Доказано, что это связано с токсическими веществами, освобождающимися при разрушении MET. Это, в первую очередь, относится к корд-фактору (фактору вирулентности МБТ).Корд-фактор, во-первых, разрушительно действует на энергетический мета¬ болизм клеток макроорганизма, вызывая поражение митохондрий и нарушение переноса электронов по дыхательной цепи между коэнзимом Q и цитохромом С„ во-вторых, тормозит синтез лизосомальных ферментов, что предохраняет внутри¬ клеточное расположение МБТ от разрушения и, в-третьих, угнетает синтез CD4+ лимфоцитами интерферона-у, который относится к важному фактору активации макрофагов в их способности усиливать продукцию Нр^» оказывает токсиче¬ ское действие на макрофаги при фагоцитозе МБТ,Важный антимикробный механизм активированных макрофагов, направлен¬ ный против внутриклеточных возбудителей, связан с цитотоксическим действием 1-аргинина. Цитотоксический эффект этого механизма опосредован оксидом азота (N0) и связан с реактивными посредниками кислорода, которые генериру¬ ются с участием L-аргинина и с помощью действия фактора некроза опухоли-а, синтезируемого активированными макрофагами.Морфологическим эквивалентом защитных клеточных реакций организма про¬ тив туберкулёзной инфекции является специфическая гранулёма,В гранулёме имеются 3 вида клеточных элементов. Центр и главную масс>' её составляют эпителиоидные клетки. По периферии располагаются лимфошпы
ТУБЕРКУЛЁЗ И ДРУГИЕ МИКОБАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ 273И плазматические клетки, а также нейтрофильные лейкоциты. В качестве третьего элемента присутствуют гигантские многоядерные клетки (Пирогова-Лангханса). Именно от состояния функциональной системы клеточного иммунитета в конеч¬ ном счёте зависит результат взаимодействия макро- и микроорганизма, который может закончиться формированием специфического иммунитета, или же при его несостоятельности — к развитию заболевания и прогрессированию туберкулёза. В этих случаях тканевые клеточные реакции не в состоянии отграничить и лока¬ лизовать специфическое воспаление и его распространение в поражённом органе, и тогда развивается заболевание.Ведущая роль в сопротивляемости организма туберкулёзной инфекции отво¬ дится приобретённому клеточному иммунитету, В его основе лежит активация макрофагов и эффекторное воздействие их на Т-лимфоциты. При этом макрофаги представляют собой собственно эффекторы, а Т-лимфоциты вьшолняют роль индукторов повышенной чувствительности замедленного типа (ПЧЗТ),Формирование противотуберкулёзного иммунитета обеспечивается всеми популяциями Т-лимфоцитов, но основная роль всё-таки принадлежит СВ4^- и СБ8^-клеткам. С04*^-клетки способны распознавать антигены микобактерий, фагоцитированных макрофагами, и играют важную роль в противотуберкулёзном иммунитете.В развитии туберкулёза можно проследить 2 периода, когда клеточные реакции организма на внедрение микобактерии туберкулёза носят чётко разграниченные иммунологические, морфологические и клинические проявления. Эти периоды связаны с реакцией организма на первичное экзогенное заражение, определяющи¬ мися как первигный туберкулёз, и на реакцию, вызванную вторичным заражением (экзогенная суперинфекция) или реактивацией уже заживших постпервичных изменений (эндогенная инфекция), носящих название вторигный туберкулёз.При первичном и вторичном туберкулёзе может возникнуть форма туберкулёзно¬ го поражения, проявляющаяся распространённой гематогенной или лимфогенной диссеминацией. Такой вид туберкулёзного поражения, определяемый как диссеми¬ нированный туберкулёз, генетически связан или с прогрессированием первичной инфекции, или с реактивацией постпервичных очагов [1,11-16].Патогенез микобактериоза сходен с патогенезом туберкулёза. НТМБ существу¬ ют и размножаются в окружающей среде, их источником служат также домашние и дикие животные и птицы. Некоторые микобактерии из окружающей среды идентичны тем НТМБ, которые вызывают заболевания у человека. НТМБ очень редко передаются непосредственно от человека к человеку, главным источником его инфицирования всё же являются объекты окружающей природы и животные [4,5,8].НТМБ, попадающие в организм человека, элиминируются из респираторного тракта благодаря защитным силам хозяина. У лиц, у которых имеется общий или местный дефект защиты (например, снижение общей реактивности организма вследствие соматического заболевания или наличия туберкулёзной каверны), НТМБ не гибнут, а размножаются в респираторном тракте или в поражённом участке лёгкого. Размножившиеся микробы спорадически обнаруживаются в диа¬ гностическом материале и оцениваются как заселение некоторых отделов орга¬ низма, или колонизация [8]. При этом колонизация определяется как состояние, жогда НТМБ выявляются из диагностического материала бактериоскопическим или культуральным методом, но у человека отсутствуют признаки заболевания. Колонизация может быть транзиторной, перемежающейся и длительной [4, 5],В отличие от колонизации инфицирование имеет место тогда, когда хозяин реагирует на присутствие паразита в организме. Механизм инфицирования доста¬ точно ясен при локальных поражениях мягких тканей, но остаётся нерасшифро¬ ванным при большинстве заболеваний лёгких. В одних случаях заражение проис-
274 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ& ходит мельчайшими частицами инфицированных аэрозолей, поднимающихся над поверхностью воды. В других случаях имеющиеся заболевания лёгких являются предрасполагающим фактором к инфицированию и заболеванию человека мико- бактериозом [8].При микобактериозе, как и при туберкулёзе, НТМБ оседают в нижних дыха¬ тельных путях и альвеолах, где развивается очаг первичного поражения. При этом их некоторая часть проникает в лимфатические сосуды и с током лимфы заносится в региональные лимфатические узлы. В дальнейшем происходит гематогенное обсеменение лёгкого из первичного очага поражения или из лим¬ фатических узлов. Однако если этот механизм развития микобактериоза и суще¬ ствует, то первичный очаг или инфицированные лимфатические узлы пока не идентифицированы.Гистологическое исследование пораженной лёгочной ткани показало различ¬ ную степень гранулематозных изменений, которые укладывались в соответству¬ ющие варианты поражений, вызванных МБТ. Среди этих структур наблюдались лимфоциты, скопления эпителиоидных клеток и характерные для туберкулёза лёгких казеозные бугорки [17, 60].Клиническая классификацияСовременная отечественная классификация туберкулёза закреплена Приказом М3 РФ от 21 марта 2003 года № 109: «О совершенствовании противотуберкулёз¬ ных мероприятий в Российской Федерации» [18].Основными клиническими формами туберкулёза органов дыхания являются:• первичный туберкулёзный комплекс;• туберкулёз внутригрудных лимфатических узлов;• диссеминированный туберкулёз лёгких;• милиарный туберкулёз лёгких;• очаговый туберкулёз лёгких:• инфильтративный туберкулёз лёгких;• казеозная пневмония;• туберкулёма лёгких;• кавернозный туберкулёз лёгких;• фиброзно-кавернозный туберкулёз лёгких;• цирротический туберкулёз лёгких;• туберкулёзный плеврит (в том числе эмпиема);• туберкулёз бронхов, трахеи, верхних дыхательных путей;• т^еркулёз органов дыхания, комбинированный с профессиональными пыле¬ выми заболеваниями лёгких (кониотуберкулёз).Характеристика туберкулёзного процесса даётся по локализации процесса, по клинико-рентгенологическим признакам по наличию или отсутствию МБТ в диаг¬ ностическом материале, полученном от больного, характера их лекарственной устойчивости.Локализация и распространённость специфического процесса даётся по соотвествующим долям и сегментам лёгких.Фаза і^еркулезного процесса определяет активность туберкулёзных изме¬ нений и отражает в динамике обратное его развитие:• инфильтрацию, распад, обсеменение;• рассасывание, уплотнение, рубцевание, обызвествление. Бактериовыделение:• с выделением микобактерий туберкулёза (МБТ+);• без выделения микобактерий туберкулёза (МВТ-);• с наличием или отсутствием лекарственной устойчивости MET к противоту¬ беркулёзным препаратам.
ТУБЕРКУЛЁЗ И ДРУГИЕ МИКОБАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ 275Осложнения туберкулёза: кровохарканье и лёгочное кровотечение, спонтан¬ ный пневмоторакс, лёгочно-сердечная недостаточность, ателектаз, амилоидов, свищи бронхиальные, торакальные и др.Остаточные изменения после излеченного туберкулёза органов дыха- ■ия; фиброзные, фиброзно-очаговые, буллёзно-дистрофические, кальщінатьі в лёгких и лимфатических узлах, плевропневмосклероз, цирроз.Формулировка диагноза у больного туберкулёзомДиагноз больного туберкулёзом должен быть сформулирован в следующей последовательности:• клиническая форма туберкулёза;• локализация и протяжённость туберкулёзного процесса;• фаза развития туберкулёзного процесса;• бактериовыделение (МБТ+ или МБТ-);• лекарственная устойчивость МБТ к противотуберкулёзным препаратам;• имеющиеся осложнения;• сопутствующие заболевания.В процессе лечения и наблюдения за больным периодически осуществляется пересмотр диагноза. Изменение формы туберкулёза рекомендуется осуществлять іюшь по окончании основного курса лечения, а уточнение фазы заболевания воз¬ можно на любом этапе ведения больного.Применяемая в РФ клиническая классификация туберкулёза адаптирована к Международной классификации болезней десятого пересмотра (МКБ-10), при¬ нятой ВОЗ в 1995 г., где предусмотрены все формы лёгочного и внелёгочного туберкулёза.В РФ МКБ-10 введена в действие Приказом М3 РФ № 170 от 27.05.1997 года. Согласно МКБ-10, туберкулёз обозначен шифром А15, А16, А19.• А15 — туберкулёз органов дыхания, подтверждённый бактериологически и гистологически;• А16 — туберкулёз органов дыхания, не подтверждённый бактериологически и гистологически;• А19 — милиарный туберкулёз.Клинической классификации микобактериозов у нас в стране не существу¬ ет. Однако исторически сложилось использование клинической классификации туберкулёза и для микобактериозов. При этом в диагнозе указываются форма и фаза процесса, выделение конкретного возбудителя микобактериоза, лекарствен¬ ная устойчивость, осложнения и сопутствующие заболевания.Клинические проявленияТуберкулёзу лёгких свойственно большое многообразие клинических симпто¬ мов, которые варьируют в широких пределах по вьфаженности и тяжести. Обычно отмечают прямую зависимость между выраженностью клинических симптомов и изменениями в лёгких, но возможно и их несоответствие: тяжёлый туберкулёзный процесс и маловыраженная клиническая симптоматика или незначительные изме- веяня и достаточно яркая клиническая картина [1].По тяжести локальных изменений можно выделить:• остропрогрессирующие формы туберкулёза (казеозная пневмония и милиарный туберкулёз);• деструктивные формы туберкулёза (кавернозный и фиброзно-кавернозный туберкулёз, а также фаза распада при любой клинической форме);• распространённый т^еркулёз без распада (диссеминированный и инфильтративный туберкулёз, туберкулёзный плеврит);• малые формы туберкулёза (очаговый туберкулёз, ограниченные инфиль¬ траты и плевриты, небольшие туберкулёмы).
276 ИНФЕКЦИОННЫЕ заболевания лёгких^ ' “ Наиболее выражена клиническая симптоматика у больных с остро прогрессиру- ющими и распространёнными деструктивными формами туберкулёза, при малыж Ш,, формах обычно отмечают малосимптомное течение заболевания.Начало заболевания туберкулёзом органов дыхания может быть острым в постепенным, медленным и малосимптомным, а течение — волнообразным, с периодами обострения (вспышки) и затихания процесса.В клинической картине туберкулёза органов дыхания в основном выделяют синдром воспалительной интоксикации и бронхолёгочные симптомы, обуслов¬ ленные специфическим воспалительным процессом в лёгких.Для установления клинической формы туберкулёза делают рентгенограмму грудной клетки в прямой и боковой проекциях, продольные и компьютерные томограммы. После определения клинической формы туберкулёза (в стационаре общего профиля или в поликлинике с обязательным участием фтизиатра) больно¬ го направляют в противотуберкулёзные учреждения для лечения [1].Клинические симптомы микобактериозов органов дыхания, вызванных НТМБ. обычно не отличаются от таковых при туберкулёзе. Однако следует отметить, что одним из типичных признаков микобактериозов, отличающих их от туберкулёза, является длительный продромальный период, составляющий в феднем до 21 мес (1-72 мес), а у некоторых больных данный период может продолжаться и более 10 лет [19].В клинической картине микобактериозов, как и при тубер1^?лёзе, вьщеляют син¬ дром воспалительной интоксикации (недомогание, слабость, лихорадку, ночные поты, снижение массы тела, потерю аппетита) и бронхолёгочные проявления (сухой или влажный кашель, выделение мокроты, кровохарканье, одьпшсу, боль в грудной клетке). Выраженность клинических проявлений микобактериоза органов дыхания зависит от распространённости поражения лёгких. При этом микобактериоз часго сопровождается клиническими признаками, ассоциирующимися с предшествующи¬ ми заболеваниями лёгких, такими как ХОБЛ, пневмокониоз или рак лёгкого [8].Несмотря на однотипность клинической картины заболевания микобактерио¬ зов и туберкулёза, рядом авторов всё же отмечаются особенности течения заболе¬ вания при различном виде НТМБ [6,1,17,20, 21].MAC вызывает заболевание лёгких, как правило, начинающееся с высокой температуры тела и кровохарканья. Лишь в единичных случаях микобактериоз не сопровождался симптомами интоксикации и выявлялся при профилактической флюорографии. Рентгенологически у больных определялись одно- или двусто¬ ронние верхушечные инфильтративные изменения, участки фиброза, казеозные очаги, тонкостенные полости распада (последние встречались довольно часто, при этом бронхогенная диссеминация наблюдалась редко).Наибольший подъём MAC-инфекции ассоциируется с эпидемией СПИДа. К наиболее характерным клиническим признакам микобактериоза относятся лихо¬ радка, значительное снижение массы тела, анемия и диарея. Поражаются почти все органы и системы, причём чаще всего желудочно-кишечный тракт, костный мозг, лимфатические узлы, печень и селезёнка, реже — лёгкие. При этом основными кли¬ ническими проявлениями являются диссеминированные процессы. Присоединение МАС-инфекции, как правило, приводит к смертельному исходу больных СПИДом, при этом продолжительность жизни составляет в среднем 107 дней (от 55 до 179) против 275 дней (от 230 до 318) у больных, не инфицированных MAC [20].При этом выделение НТМБ из любого источника (открытого или закрытого) независимо от числа колоний и выделенных культур следует расценивать как кли¬ нически значимое; можно ставить диагноз микобактериоза и начинать специфи¬ ческую антибактериальную терапию [8].М. kansasii вызывают хронические заболевания лёгких, по клинической карти¬ не напоминающие классический туберкулёз, с вовлечением верхних долей лёгкого и деструкцией лёгочной ткани.
ТУБЕРКУЛЁЗ И ДРУГИЕ МИКОБАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ 277М, xenopi часто вызывают заболевания лёгких, которые имеют хроническое, з острое и подострое течение. Внелёгочная локализация процесса и диссеминиро- § ■анные поражения встречаются крайне редко, ¿5.М. scrofiilaceum наиболее часто приводит к развитию шейных лимфаденитов у детей в возрасте до 5 лет.М. malmoense вызывает у человека хронические заболевания лёгких,М. fortuitum complex вызывает наибольшее число заболеваний, связанных с быстрорастущими НТМБ. Заболевания, вызываемые M.fortuitum complex, включа¬ ют генерализованные диссеминированные процессы, заболевания лёгких, кожные я послеоперационные инфекции.ДиагностикаДиагностика туберкулёза включает несколько последовательных этапов. При этом все методы исследований для диагностики туберкулёза можно разделить ш 3 группы: обязательный диагностический минимум (ОДМ), дополнительные методы исследования неинвазивного (ДМИ-1) и инвазивного (ДМИ-2) характераи, наконец, факультативные методы (ФМИ) [1.12.22].ОДМ включает: изучение жалоб, анамнеза болезни и жизни, объективного исследования, клинические анализы крови и мочи, микроскопию мокроты по Цилю-Нельсену не менее 3 проб с количественной оценкой массивности бакте- рйовыделения, рентгенографию органов грудной клетки в прямой и боковой про¬ екциях и постановку пробы Манту с 2 ТЕ ППД-Л.К ДМИ-1 относятся: расширенная микробиологическая диагностика с исследо¬ ванием мокроты методом ПЦР и посевом мокроты на питательные среды с опреде¬ лением лекарственной устойчивости МБТ к противотуберкулёзным препаратам, а также посев мокроты на неспецифическую микрофлору и грибы; углублённая лучевая диагностика с использованием томографии лёгких и средостения, в том числе КТ, ультразвукового исследования при плеврите и субплеврально располо¬ женных округлых образованиях; углублённая иммунодиагностика с применением иммуноферментного анализа (ИФА) для выявления в крови противотуберкулёз¬ ных антител (АТ) и антигенов (АГ).ДМИ-2 включают: бронхоскопию с различными видами биопсий {аспираци¬ онная, щёточная и др.) и БАЛ; пункцию плевральной полости и плевробиопсию; трансторакальную биопсию лёгкого; торакоскопию, медиастиноскопию и, нако¬ нец, открытую биопсию лёгкого с последующими цитологическими, гистоло¬ гическими и микробиологическими исследованиями полученного материала. Обнаружение в биоптате специфических элементов туберкулёзной гранулёмы (казеоз, эпителиоидные и многоядерные клетки) позволяет морфологически верифицировать туберкулёз лёгких и своевременно начать противотуберкулёз¬ ное лечение.ФМИ весьма многочисленны и направлены не столько на диагностику туберку- жза, сколько на определение функционального состояния различных внутренних органов и обменных процессов. Это исследования уровня глюкозы в крови, функ¬ ции печени, сердечно-сосудистой системы, функции внешнего дыхания, газового состава крови, лёгочного кровотока и т.д.ОДМ следует выполнять, как это следует из самого названия, в полном объёме, дми и ФМИ применяют по показаниям. Правильная и своевременная диагно- ппика туберкулёза органов дыхания позволяет выявить больных на ранних этапах развития заболевания, а химиотерапия, начатая вовремя, позволит предотвратить развитие у них распространённых, прогрессирующих форм с выделением МБТ.Все эти методы исследования, каждый в отдельности или в комбинации, при- шавототся у лиц с повышенным риском заболевания туберкулёзом, находящихся ва диспансерном учёте в лечебных учреждениях общей медицинской сети, обра*
- 278 ИНФЕКЦИОННЫЕ заболевания лёгких1 щающихся в поликлиники и поступающих в стационар на лечение с симптомами• V, § заболевания, подозрительными на туберкулёз., ' Особое внимание следует обращать на пациентов, входящих в группы повы¬шенного риска заболевания туберкулёзом [1,12].Особую группу повышенного риска заболевания туберкулёзом лёгких составля- , ■ ют лица, имеющие контакт с больными туберкулёзом лёгких. При этом наиболее‘ опасен тесный семейный или производственный контакт с бактериовыделителя- ми.Наиболее подвержены заболеванию туберкулёзом лёгких лица из следующих социальных групп: бомжи, беженцы, мигранты, освободившиеся из пенитенциар" ных учреждений, проживающие в приютах, ночлежках, интернатах для престаре¬ лых, пациенты наркологических и психиатрических учреждений.Группу повышенного риска составляют также лица с рентгенологическими признаками остаточных посттуберкулёзных изменений в лёгких и внутригрудных лимфатических узлах в виде кальцинатов, фиброзных очагов, плевральных спаек, участков пневмосклероза и лица молодого возраста с гиперергическими реакция¬ ми на пробу Манту с 2 ТЕ ППД-Л.К группе высокого риска по заболеванию туберкулёзом относятся пациенты, имеющие различные сопутствующие заболевания, такие как профессиональные (пылевые) заболевания лёгких, хронические неспецифические болезни лёгких (в том числе врождённые пороки развития), сахарный диабет, язвенная болезнь желудка и двенадцатиперстной кишки, сердечно-сосудистые заболевания с недо¬ статочностью кровообращения (особенно врождённые пороки сердца), онколо¬ гические заболевания, хронический алкоголизм и наркомания, инфицированные ВИЧ и больные СПИДом.Высок риск развития туберкулёза у лиц, получавших цитосгатическую, корти¬ костероидную и лучевую терапию, у лиц молодого возраста, перенёсших экссуда¬ тивный плеврит, и у женщин в послеродовом периоде и после абортов.Первоочередной задачей остаётся выявление бациллярных больных туберку¬ лёзом органов дыхания, так как у таких больных имеется, как правило, прогрес¬ сирующий деструктивный туберкулёзный процесс и они представляют большую эпидемиологическую опасность для окружающих. Излечение впервые выявлен¬ ных бациллярных больных имеет как клиническое, так и эпидемиологическое значение, так как позволяет не только предотвратить смерть от прогрессирова¬ ния туберкулёза и избежать развития хронического процесса с постоянным или периодическим выделением МБТ, но и прекратить распространение возбудителе туберкулёза в обществе [1,14].У всех пациентов с симптомами, подозрительными на туберкулёз органов дыха^ ния (кашель с мокротой более 2-3 нед, кровохарканье, боли в грудной клетку субфебрильная и фебрильная температура, ночные поты и потеря массы тела), необходимо провести рентгенографию грудной клетки, общие анализы крови н мочи и исследовать 3 мазка мокроты на кислотоустойчивые микобактерии мето¬ дом микроскопии мазка с окраской по методу Циля-Нильсена [23].Кроме микроскопии мокроты и другого патологического материала как обяза¬ тельного диагностического минимума возможно их исследование методом люмв- несцентной микроскопии, ПЦР и бактериологическим (культуральным) методом посева на питательные среды, которые осуществляются в специализированвш; лабораториях противотуберкулёзных учреждений [23],Рентгенологическая картина туберкулёза лёгких отличается полиморфизмом«* по характеру инфильтративных изменений, так и по локализации специфичесив изменений и требует целенаправленной дифференциальной диагностики [13,15|.В случаях сомнительной активности туберкулёзных изменений в лёгких МОВШ : использовать терапию ех]иуапИЬи5. При этом назначают химиотерапию 4 проя1; >
ТУБЕРКУЛЁЗ И ДРУГИЕ МИКОБАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ 279тезными препаратами (изониазид, рифампицин, пиразинамид и эхам- (g В таких случаях через 2 мес необходимо повторное рентгенологическое ' ^1Є. При заболевании туберкулёзной этиологии отмечается частичное «а. . їжіхвое рассасывание воспалительных изменений. Это так называемый отсро-t диагноз, К этому времени удаётся получить результаты посева мокроты на ; _ > '■ ьные среды, сделанного перед началом химиотерапии. Рост культуры при ^ ^I в материале микобактерий туберкулёза обычно отмечается через 4-8 нед, >, »отжит подтверждением диагноза. - :у ’Івхтоящее время одним из главных факторов риска развития микобактериоза -f „іподавление иммунного ответа организма, которое является либо следстви- іосупрессивной терапии, либо следствием таких заболеваний, как лейкоз,|унные поражения и СПИД [4, 7, 8,19].^Лсяичивается риск развития заболевания у работающих в тесном контакте с юхозяйственными животными и птицей [3]. i^Spoue того, лица, перенёсшие туберкулёз лёгких, спустя много лет после пол- t излечения часто заболевали микобактериозом лёгких. Причём отмечено, что 1 имели большую степень риска заболеть микобактериозом лёгких, вызванным Заболеваемость микобактериозом среди перенёсших туберкулёз составляла 'ва 100 ООО населения, что в 10 раз превышало этот показатель среди не имев- ; ж анамнезе туберкулёза лёгких [21].іска и микроскопия мазков для поиска НТМБ проводятся по тем же пра- которые применяются для обнаружения МБТ. Обе окраски (по Цилю- ену и люминесцентными красителями) эффективны при поиске НТМБ в іеском материале.Диагноз микобактериозов лёгких устанавливают при условии выделения куль- I НТМБ, её идентификации и наличия специфической клинической симптома- , Только в этом случае можно с уверенностью сказать, что это микобактериоз,¡туберкулёз [8, 24, 25].Бактериологическая диагностика до настоящего времени остаётся единственным рЦрсховерным методом дифференциации микобактериоза от туберкулёза [8, 24].Дія выделения НТМБ клинические образцы засевают на яичные питатель- їшш q)eflbi Левенштейна-Йенсена, Финна-2 или агаровые питательные среды [ІіЬидлбрука 7Н10. При использовании культурального метода как наиболее в^рмативного из бактериологических методов положительный результат ю получить через несколько недель или месяцев [8],Современный радиометрический метод или индикаторные пробирки MGIT с іьзованием системы ВАСТЕС позволяют сократить время, необходимое для ршвления НТМБ, до 7-14 дней [8,13, 24].Щ)и обнаружении культуры НТМБ необходимо в максимально короткий срок «Чіеделить её видовую принадлежность. В настоящее время для видовой иденти- ^■кации используют коммерческие наборы для ДНК-зондирования (АКУ-проба,-проба). Они рассчитаны на идентификацию наиболее часто встречающих- видов НТМБ: МАС, М. kansasii и М. gordonae. Тесты основаны на видовой іфичности ДНК-зонда, который гибридизируется с рРНК, освобождённой из кобактерий. Зонды метят акридиновым эфиром, результаты считывают с помо- I люминометра. Для выполнения ДНК-пробы требуется всего несколько часов, жхэтому этот метод стал рутинным в диагностических лабораториях США и мно- шх европейских стран. Он характеризуется 100% чувствительностью и специфич- ■осгью. При сочетании системы культивирования ВАСТЕС с ДНК-зондированием жачительно сокращается время, необходимое для выявления и идентификации НТМБ [8].Рентгенологическая картина не позволяет дифференцировать поражения лёг- вызванные НТМБ, от поражений, вызванных классическими МБТ. В то же
280 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХвремя встречающиеся у части больных (у 15-20%) одиночные гигантские кавер¬ ны с тонкой стенкой, отсутствием бронхогенной диссеминации, незначительной инфильтрацией вокруг неё могут наводить на мысль о микобактериозе лёгких. При микобактерисзе редко происходит обширное распространение поражения в окружающие ткани, отмечаются грубые плевральные изменения соответственно локализации поражения, в то время как основная плевра не имеет специфических очагов. Иногда НТМБ могут вызывать затемнение лёгочной ткани или образова¬ ние солитарных узлов. Выпот в плевральную полость встречается редко [24,26].Американское торакальное общество предложило следующие диагностические критерии микобактериоза лёгких [27]:• наличие на рентгенограмме грудной клетки инфильтрата, этиологию которого не удалось установить с помощью клинических и лабораторных исследований;• повторное массивное выделение одного и того же вида МБ при отсутствии других патогенных микробов;• выделение МБ из закрытого очага, из которого проба получена в стерильных условиях (абсцесс, биопсия и операционный материал).ЛечениеПринимая во внимание необходимость лечения всех больных туберкулёзом, общее признание получило разделение больных по следующим режимам химио¬ терапии с учётом региональной множественной лекарственной устойчивости [18, 28-33].В регионах, где уровень первичной множественной лекарственной устойчиво¬ сти МБТ не превышает 5%, впервые выявленным больным туберкулёзом органов дыхания назначается стандартный режим химиотерапии, состоящий из комбина¬ ции 4 основных препаратов: изониазида, рифампицина, пиразинамида и этамбуто- ла в течение 3 мес. После получения данных лекарственной чувствительности МБТ проводят коррекцию химиотерапии, при этом общий курс лечения составляет 6-10 мес.В регионах, где уровень первичной множественной лекарственной устойчивости МБТ превышает 5%, впервые выявленным больным туберкулёзом органов дыха¬ ния назначается стандартный режим химиотерапии, состоящий из комбинации 6 основных препаратов: изониазида, рифампицина, пиразинамида, этамб^тола, канамицина и фторхинолона в течение 3 мес. После получения данных лекар¬ ственной чувствительности проводят коррекцию химиотерапии и дальнейший срок лечения определяют данными лекарственной чувствительности МБТ.Лечение больных хроническим туберкулёзом органов дыхания, выделяющих множественно лекарственно-устойчивые МБТ, проводится по индивидуальным режимам химиотерапии комбинацией резервных противотуберкулёзных препа¬ ратов: протионамидом, канамицином (амикацином), капреомицином, циклосери- ном и аминосалициловой кислотой.Для лечения заболеваний, вызванных НТМБ, которые характеризуются высо¬ кой естественной устойчивостью к противотуберкулёзным препаратам, в настоя¬ щее время всё шире применяются препараты нового поколения — фторхинолоны. При этом поворотной точкой в антибактериальной терапии микобактериоза, вызванного МАС, стало открытие 2 новых макролидов — кларитромицина и ази- тромицина, так как бактерии МАС являются внутриклеточными паразитами и во время своего роста внутри фагосомы и фаголипосомы они могут индуцировать изменение функции макрофага [8].В настоящее время рекомендуется применение следующих схем для лечения микобактериозов [35-37] (табл. 15-1).
ТУБЕРКУЛЁЗ И ДРУГИЕ МИКОБАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ 281 Таблица 15И. Препараты и режимы лечения микобактериозов, вызванных рааличными НТМБВид НТМКОсновной режим леченияДополнительные препаратыMAC,Рифампицин (рифабутин).КларитромицинW. scrofulaceum,этамбутол,(или азитромицин).и. simiae,этионамид,фторхинолоны,W. malmoenseстрептомицин (или амикацин)клофазиминМ. kansas/;,Рифампицин (рифабутин),Стрептомицин,М. szulgaiизониазид,фторхинолоны.этамбутолкларитромицинМ. xenopiРифампицин {рифабутин),Стрептомицин,изониазид,этамбутолфторхинолоныW. marinumЭтамбутол,Стрептомицин,рифабутин, доксициклин, (или бисепгол*)фторхинолоныM. cftefonaeАмикацин,Клофамизин,рифабутмн,доксициклин.кларитромицинфторхинолоныM. fortuitum complexРифабутин, кларитромицин, бисептол*ФторхинолоныТаким образом, больным микобактериозом показана интенсивная комбиниро¬ ванная антибактериальная терапия. Комбинации препаратов, традиционно при¬ меняемых для лечения туберкулёза, обычно малоэффективны при МАС-инфекции н заболеваниях, вызванных быстрорастущими НТМБ. Лечение микобактериоза должно быть длительным — 12-18 мес.У больных СПИДом с диссеминированными поражениями, вызванными МБТ, интенсивное противотуберкулёзное лечение почти во всех случаях даёт благо¬ приятный исход. Попытки лечения больных с диссеминированными процессами, вызванными МАС, ранее в большинстве случаев оказывались безуспешными. Значительный прогресс в лечении микобактериоза наметился при открытии новых лекарственных препаратов, таких как фторхинолоны и современные макролиды.СПИСОК ЛИТЕРАТУРЫ г
Глава 16 Микозы лёгкихВозбудители микозов лёгких — микроскопические грибы (микро- мицеты) значительно отличаются от других возбудителей инфек¬ ций (бактерий, вирусов и простейших). Возбудителей грибковых инфекций подразделяют на оппортунистические и контагиозные (эндемичные), вызывающие микозы у иммунокомпетентных людей и распространённые в определённых регионах. В России эндемиче¬ ские зоны для этих возбудителей {Coccidioides immitis, Histoplasma capsulatum, Blastomyces dermatitidis, Paracoccidioides brasiliensis) не обнаружены, известны единичные случаи «завоза» эндемичных микозов из-за рубежа. Наиболее распространёнными возбудите¬ лями микозов лёгких являются оппортунистические микроми- цеты Aspergillus spp., реже встречаются Candida spp.. Cryptococcus neoformans, зигомицеты {RHizopus, Absidia, Mucor spp.), гиалогифо- мицеты {Fusarium, Acremonium, Paecilomyces и Scedosporium spp.) и феогифомицеты {Bipolaris spicifera, Cladophialophora bantiana. Alternaría, Cladosporium, Curvularia spp.). Идентификация возбуди¬ телей грибковых пневмоний является важным условием успешного лечения.АспергиллёзАспергиллёз — наиболее распространённый из микозов лёгких. Возбудители — Aspergillusfumigatus, A.ßavus.A. niger, A. terreus, A. nidu- lans (A. niduleUus) и другие — распространены повсеместно. Aspergälus spp. растут в почве, часто встречаются на строительных материалах, в системе вентиляции зданий, а также на некоторых пищевых продук¬ тах, органических отбросах, гниющих растениях и др.Aspergillus spp. могут вызывать различающиеся по патогенезу, клиническим проявлениям и прогнозу заболевания лёгких, которые возникают у разных контингентов больных и требуют различных диагностических и лечебных мероприятий. Клинический вариант и тяжесть заболевания определяются состоянием иммунной системы больного, а не особенностями возбудителя.ИНВАЗИВНЫЙ АСПЕРГИЛЛЁЗ Этиология, эпидемиология и факторы рискаОсновными возбудителями инвазивного аспергиллёза (ИА) явля¬ ются: A.fumigatus (60-90%), A.ßavus (10-30%) и А. niger (2-15%); другие: А. terreus, А. nidulans (А. niduleUus и пр.) — встречаются реже.
микозы ЛЁГКИХ 283Частота ИА в экономически развитых странах составляет 12-34 случаев на 1 млн населения в год.Инфицирование обычно происходит в результате вдыхания конидий Aspergillus 9р.; другие пути инфицирования (пищевой, травматическая имплантация воз¬ будителя, контактный — при ожогах) имеют меньшее значение. От человека к человеку любые формы аспергиллёза не передаются.Наиболее часто ИА развивается у больных острым лейкозом во время цитоста- тической терапии, у реципиентов аллотрансплантатов костного мозга при развитии реакции «трансплантат против хозяина» (РТПХ) и цитомегаловирусной инфекции, у пациентов с хронической гранулематозной болезнью (ХГБ), а также у пациентов, дмительно получающих ГКС и иммуносупрессоры. В последние годы отмечено увеличение частоты ИА у больных без типичных факторов риска, например в хирургических и терапевтических отделениях реанимации и интенсивной терапии. Вспышки внутрибольничного ИА у иммунокомпетентных больных могут быть свя¬ заны с высокой концентрацией конидий Aspergillus spp. в воздухе при проведении ремонта, поражении этими грибами системы вентиляции, водоснабжения и др.Клинические проявленияПродолжительность инкубационного периода не определена. У многих больных до появления клинических признаков ИА выявляют поверхностную колонизацию Aspergillus spp. дыхательных путей.Наиболее частыми клиническими признаками ИА являются рефрактерное к антибиотикам широкого спектра повышение температуры тела более 38 '’С дли¬ тельностью более 96 ч, непродуктивный кашель, боли в грудной клетке, кровохар¬ канье и одышка. У 10-35% больных повышения температуры тела не отмечают. Иногда проявления ИА напоминают признаки тромбоза ветвей лёгочной артерии; ■везапно возникшие боли в груди и выраженная одышка.У больных с выраженной иммуносупрессией типичные проявления локально¬ го и системного воспаления могут отсутствовать даже при угрожающей жизни инфекции. Нередко единственным проявлением заболевания служат изменения на рентгенограмме или КТ лёгких.ДиагностикаОсновной метод выявления очагов поражения — КТ, микробиологического подтверждения диагноза - микроскопия и посев респираторных субстратов, серо¬ логической диагностики определение галактоманнана в сыворотке крови.Следует подчеркнуть, что у иммуноскомпрометированных больных выражен¬ ность симптомов не отражает тяжести заболевания, поэтому у пациентов с факто¬ рами риска обязательны раннее выявление клинических признаков и незамедли¬ тельные диагностические мероприятия.Методы диагностики:• КТ или рентгенография лёгких, придаточных пазух носа;• при наличии неврологической симптоматики — КТ или МРТ головного мозга (или других органов при выявлении симптомов диссеминации);• определение антигена Aspergillus (галактоманнана) в сыворотке крови;• бронхоскопия, БАЛ, биопсия очагов поражения;• микроскопия и посев БАЛ, мокроты, отделяемого из носа, биопсийного мате¬ риала.КТВР является основным методом радиологической диагностики ИА лёгких. В отличие от КТ результаты рентгенографии лёгких при ИА обычно неспецифич¬ ны, раннее выявление признаков заболевания с помощью этого метода часто невозможно. Установлено, что систематическое применение КТ у больных с высо¬ ким риском развития ИА достоверно снижает общую и атрибутивную летальность.
' ■284 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХах При наличии факторов риска и предполагаемых клинических признаков у имму-S. носкомпрометированного больного показано проведение КТВР в течение 24 ч.Ранними КТ-признаками ИА лёгких являются мелкие (<2 см), связанные с сосу- дами округлые очаги, обычно расположенные субплеврально, изменения по типу «матового стекла», симптом «ореола», а также уплотнения треугольной формы, примыкающие основанием к плевре. По мере прогрессирования заболевания при КТ лёгких определяют поздние признаки: очаги деструкции, а также полости с содержимым и прослойкой воздуха (симптом «полумесяца», или «погремушки»). Признаки плеврита обычно выявляют редко.Симптом «ореола», характерный признак ИА, является изображением зоны кровоизлияния вокруг очага микотического поражения лёгких. Симптом «ореола» обычно возникает в течение первых 3-7 дней И А у больных с агранулоцитозом. Следует отметить, что симптом «ореола» нельзя расценивать как патогномо- ничный признак ИА: он описан при поражениях лёгких, вызванных другими микотическими (Fusarium, Pseudallescheria spp., зигомицеты) или бактериальными (Pseudomonas spp.) патогенами.Симптом «полумесяца», или «погремушки», свидетельствует об образовании полости в лёгких. У гематологических пациентов этот симптом обычно выявляют после завершения периода нейтропении. Симптом «полумесяца» также не явля¬ ется патогномоничным, но у больных с нейтропенией он с высокой вероятностью свидетельствует об ИА.Кроме того, следует учитывать динамику КТ-признаков ИА. Наиболее харак¬ терный признак — симптом «ореола» обычно выявляют на первой неделе заболе¬ вания, «неспецифические» изменения — на второй, симптом «полумесяца» — на третьей.Важным методом ранней диагностики ИА является определение антигена Aspergillus (галактоманнана) в сьгеоротке крови. Чувствительность и специфич¬ ность теста Platelia Aspef^llus составляют 70-90%, Диагностическая эффективность определения галактоманнана в сыворотке крови повышается при проведении скри¬ нинга 2-3 раза в нед во время высокого риска развития ИА. При этом у большинства больных галактоманнан методом Platelia Aspergillus выявляют на 4-8 дней раньше первых клинических и рентгенографических признаков заболевания.Определение специфических антител в сыворотке крови для диагностики острого ИА не применяют в связи с нарушением их продукции у данной категории больных.Характерный признак ИА — выявление при микроскопии мокроты, БАЛ и биоп¬ сийного материала септированного мицелия, ветвящегося под углом 45". Однако частота обнаружения Aspergillus spp. при микроскопии и посеве БАЛ у больных с доказанным ИА лёгких составляет около 50%, а проведение инвазивных процедур у большинства таких пациентов невозможно, поэтому отрицательный результат микологического исследования мокроты и БАЛ не исключает наличия у больного ИА. Идентификация вида возбудителя ИА имеет клиническое значение в связи с их различной чувствительностью к антимикотикам.При гистологическом исследовании материала обнаруживают некротизиро- ванные абсцессы и инфаркты, AsperpJlus spp. в тканях относительно хорошо окра¬ шиваются гематоксилином и эозином. П1фы Aspergillus spp., 2-3 мкм в диаметре, разрастаются радиально от центрального фокуса в виде «кустарника». Характерно дихотомическое ветвление под углом 45*'. В отличие от возбудителей зигомикоза мицелий Aspergillus spp. септированный. С другой стороны, Aspergillus spp. в гисто¬ логических препаратах иногда трудно отличить от возбудителей гиалогифомикоза, поэтому для идентификации возбудителя необходимо его выделение в культуре.Диагноз устанавливают при наличии факторов риска, клинических и радио¬ логических признаков инвазивного микоза лёгких в сочетании с выявлением
микозы ЛЁГКИХ 285антигена Aspergillus (галактоманнана) в сыворотке крови или Aspergillus spp. при микроскопии, гистологическом исследовании и/или посеве материала из очагов поражения, мокроты, БАЛ.ЛечениеКомплекс лечебных мер включает антифунгальную терапию (АФТ), устранение или уменьшение выраженности факторов риска и хирургическое удаление пора¬ жённых тканей. При выявлении диагностических признаков ИА лечение должно быть начато незамедлительно. Кроме лечения установленного заболевания воз¬ можно назначение эмпирической АФТ (в ситуациях, когда имеется высокий риск ИА, есть предполагаемые клинические признаки, но лабораторное подтверждение отсутствует) или превентивной АФТ (когда высок риск ИА, есть предполагаемые лабораторные, но нет клинических признаков).Возбудители ИА чувствительны к вориконазолу, позаконазолу, итраконазолу, амфотерицину В и каспофунгину, резистентны к флуконазолу и кетоконазолу. Вторичная резистентность развивается редко, описана при длительном примене¬ нии итраконазола.Препаратом выбора для лечения ИА является вориконазол внутривенно в дозе6 мг/кг каждые 12 ч в первый день, затем внутривенно по 4 мг/кг каждые 12 ч, а после стабилизации состояния больного — внутрь по 200 мг/сут (при массе тела <40 кг) или по 400 мг/сут (при массе тела >40кг).Удетей (2-12 лет): внутривенно — по 7 мг/кг 2 раза в сут; внутрь — по 0,2 г 2 раза в сут.Альтернативные препараты:• каспофунгин по 70 мг в первый день, затем по 50 мг/сут;• позаконазол по 800 мг/сут;• липидный комплекс амфотерицина В по 3-5 мг/кг в сут;• комбинированная терапия — каспофунгин в сочетании с вориконазолом или липидным амфотерицином В;• амфотерицин В по 1,0-1,5 мг/кг в сут;• итраконазол по 600 мг/сут — 4 дня, затем по 400 мг/сут — у клинически ста¬ бильных больных.Оценку эффекта антифунгальной терапии, если не отмечено быстрого ухудше¬ ния состояния, следует проводить на 4-7-е сут. При неэффективности начального лечения применяют альтернативные препараты или комбинации антимикотиков с разными механизмами действия (каспофунгин и вориконазол или каспофунгин и липидный амфотерицин В).Амфотерицин В отличается низкой эффективностью и высокой токсично¬ стью, поэтому его применяют преимущественно по экономическим причинам. Амфотерицин в не рекомендуют больным с нарушением функций почек и паци¬ ентам, получающим нефротоксичные препараты (циклоспорин А и др.). При необходимости использования амфотерицина В в таких случаях его стартовая доза составляет 0,8 мг/кг в сут с последующим повышением до 1,0 мг/кг в сут. Показано тщательное мониторирование функций почек и уровня циклоспорина А в сыворотке крови. Для уменьшения нефротоксичности применяют гидратацию изотоническим раствором натрия хлорида, восполнение дефицита калия и магния, а также отменяют другие нефротоксичные препараты. Совместное применение фуросемида и амфотерицина В повышает нефротоксичность последнего. При про¬ ведении хронического гемодиализа амфотерицин В используют в обычной дозе —1-1,5 мг/кг в сут.Липидный комплекс амфотерицина В назначают вместо обычного амфотерици¬ на В пациентам с почечной недостаточностью при неэффективности стандартного амфотерицина В, его нефротоксичности или некупируемых премедикацией выра¬ женных реакциях на внутривенную инфузию.
286 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХИтраконазол обычно назначают при стабилизации состояния больного после начального применения вориконазола, амфотерицина В или каспофунгина. В связи с вариабельной биодоступностью капсул рекомендуют пероральный приём раствора итраконазола. Кроме того, итраконазол назначают при стабиль¬ ном состоянии больного и отсутствии предикторов летального исхода ИА.При назначении азольных антимикотиков необходимо учитывать возможные лекарственные взаимодействия. Например, одновременное применение рифам- пицина и других индукторов ферментов цитохрома Р-450 приводит к резкому снижению концентрации вориконазола, итраконазола и позаконазола в плазме и тканях. Дозу циклоспорина А, такролимуса и сиролимуса при назначении азолов следует уменьшить, а затем тщательно мониторировать уровень циклоспорина А в плазме.Антифунгальную терапию продолжают до исчезновения клинических при¬ знаков заболевания, эрадикации возбудителя из очага инфекции, купирования или стабилизации радиологических признаков, а также до завершения периода нейтропении. Средняя продолжительность лечения до стабилизации состояния больного составляет 20 дней, обычно антифунгальную терапию продолжают не менее 3 мес. Однако у больных с сохраняющейся иммуносупрессией необходимо более длительное лечение.Устранение или снижение выраженности факторов риска достигается успешным лечением основного заболевания, коррекцией нейтропении, а также отменой или снижением дозы ГКС или иммуносупрессоров.Основным показанием к резекции поражённого участка лёгкого является высо¬ кий риск лёгочного кровотечения (выраженное кровохарканье, расположение очагов поражения вблизи крупных сосудов). Массивное лёгочное кровотечение является непосредственной причиной летального исхода у 10-15% больных ИА. Основной причиной лёгочных кровотечений при ИА считают связанное с ангио¬ тропизмом AspergiUus spp. поражение сосудов. Лёгочные кровотечения обычно возникают после завершения периода нейтропении, когда вьщеляемые грануло¬ цитами протеолитические ферменты способствуют дестрз^ции тканей в очагах ИА. Во время и после хирургического вмешательства необходимо продолжать применение антимикотиков.Удаление одиночных очагов поражения лёгких одновременно со вторичной антифунгальной профилактикой уменьшает риск рецидива ИА. В этих случаях хирургическое вмешательство проводят после завершения периода нейтропении и стабилизации состояния больного на фоне антифунгальной терапии.Наконец, получение материала из периферически расположенного очага пора¬ жения может способствовать установлению диагноза, особенно при неэффектив¬ ности других диагностических мероприятий.Эмпирическую АФТ проводят у больных с высоким риском развития ИА и предполагаемыми его клиническими признаками до получения лабораторного подтверждения диагноза. В настоящее время установлена эффективность эмпи¬ рической АФТ у пациентов с рефрактерной к антибиотикам фебрильной ней¬ тропенией. Показанием к проведению эмпирической АФТ является сочетание агранулоцитоза (количество палочкоядерных и сегментоядерных нейтрофильных гранулоцитов в периферической крови <0,5х10Ул) и рефрактерной к адекватной терапии антибиотиками широкого спектра действия лихорадки неясной этиоло¬ гии продолжїггельностью более 4 сут. Препаратом выбора для эмпирической АФТ при фебрильной нейтропении является каспофунгин по 70 мг в первый день, затем по 50 мг/сут. Продолжительность эмпирической АФТ должна составлять не менее7 дней после нормализации температуры тела, а также до завершения периода нейтропении (когда уровень нейтрофилов составит более 1,0х10Ул).
микозы ЛЁГКИХ 287Альтернативные препараты для эмпирической АФТ:• липосомальный амфотерицин В по 1-3 мг/кг в сут• вориконазол внутривенно по 6 мг/кг каждые 12 ч в первый день, затем вну¬ тривенно по 4 мг/кг каждые 12 ч или перорально по 200 мг/сут (масса тела <40 кг) или по 400 мг/сут (масса тела >40 кг);• амфотерицин В по 0,6-0,7 мг/кг в сут.Превентивную АФТ проводят у больных с высоким риском развития ИА при выявлении предполагаемых лабораторных и инструментальных признаков (например, аспергиллёзного антигена в сыворотке крови и симптома «ореола» на КТ лёгких) еще до появления клинических признаков (лихорадка, кашель и пр.). Несмотря на то что превентивную АФТ активно применяют в различных центрах, её эффективность не доказана в контролируемых исследованиях. Обычно используют применяемые схемы лечения ИА, Превентивную АФТ продолжают до исчезновения лабораторных и инструментальных признаков ИА, а также до тех пор, пока не завершится период высокого риска развития аспергиллёза, например агранулоцитоза.ПрогнозБез лечения ИА практически всегда заканчивается летальным исходом в тече¬ ние 1-4 нед после начала заболевания. При проведении лечения летальность в настоящее время составляет 30-50%, Более 80% связанных с ИА летальных исхо¬ дов возникают в течение 3 мес после начала заболевания. Летальность зависит от ♦фоновогозаболевания или состояния (неконтролируемый острый лейкоз и др.), а также распространённости или локализации заболевания (диссеминация, пора¬ жение ЦНС). Кроме того, прогностически неблагоприятным является применение высоких доз ГКС перед выявлением ИА, а также сохранение иммуносупрессии и нейтропении после начала лечения.ПрофилактикаВ настоящее время установлена эффективность первичной антифунгальной профилактики лишь для некоторых категорий больных с высоким риском раз¬ вития ИА: для пациентов с длительной нейтропенией, для реципиентов аллотран¬ сплантата костного мозга и трансплантатов лёгких, а также больных ХГБ. Для других категорий пациентов эффективные методы первичной антифунгальной профилактики ИА не разработаны. У гематологических пациентов препаратом выбора является позаконазол по 600 мг/сут, у реципиентов трансплантатов лёгких — вориконазол, у больных ХГБ — итраконазол.Основными методами, предотвращающими развитие рецидива ИА при про¬ должении цитостатической или иммуносупрессивной терапии, сохранении выра¬ женной иммуносупрессии, являются применение антимикотиков и хирургическое удаление очагов поражения. У гематологических и онкологических больных профилактику рецидива следует проводить после достижения ремиссии при каж¬ дом последующем курсе цитостатической терапии, приводящей к нейтропении или выраженной иммуносупрессии. Обычно используют вориконазол, каспо¬ фунгин, позаконазол, итраконазол или амфотерицин В. Азолы начинают приме¬ нять по окончании применения цитостатиков, каспофунгин и амфотерицин В — после развития нейтропении. Лечение продолжают до завершения нейтропении (>1,0х10ул) или выраженной иммуносупрессии. Если прогнозируется длительная нейтропения, используют гранулоцитарный или гранулоцитарно-макрофагальный колониестимулирующие факторы. В периоде высокого риска целесообразно про¬ водить регулярное, 2 раза в нед, определение галактоманнана в сыворотке крови. При положительном тесте проводят полное обследование, в том числе КТ лёгких с последующей модификацией антифунгальной терапии.
288 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХШшШШ.ХРОНИЧЕСКИЙ НЕКРОТИЗИРУЮЩИЙ АСПЕРГИЛЛЁЗ ЛЁГКИХХронический некротизирующий аспергиллёз лёгких (ХНАЛ) — относитель- но редкое заболевание, составляющее примерно 5% всех случаев аспергиллёза■ лёгких. Возбудитель — A.fumigatus, реже - А. ftavus, А. terreus и др. Факторы •}. риска — СПИД, хроническая гранулематозная болезнь, сахарный диабет, алкого- ^ лизм, применение ГК при ХОБЛ, повыщенное количество конидий Aspergillus spp. в окружающей среде. ХНАЛ развивается преимущественно у больных с «умеренны- '• MH3s> нарз^иениями функции фагоцитов и Т-клеток, возможно его возникновение у иммунокомпетентных людей, кроме того, развитие ХНАЛ возможно на фоне дру¬ гих инфекционных заболеваний, например туберкулёза. ХНАЛ обычно возникает у людей среднего возраста, мужчины болеют чаще женщин.Клинические проявленияСимптомы характерны, но не специфичны. Обычно развивается хронический продуктивный кашель, нередко с умеренным или минимальным кровохарканьем. Фебрильное повышение температуры тела не характерно, может быть субфебрили¬ тет. Обычно развиваются общая слабость и снижение массы тела. Наиболее часто болезнь протекает хронически с периодическими обострениями и прогрессиру¬ ющим нарушением функций лёгких вследствие развития фиброза. Осложнениями являются распространение процесса с поражением плевры, рёбер, позвонков и т.д., а также лёгочное кровотечение, требующее хирургического вмешательства. При нарастании иммуносупрессии возможно быстрое прогрессирование заболевания с развитием типичного ИА лёгких, гематогенной диссеминации с поражением головного мозга и внутренних органов.ДиагностикаМетоды диагностики:• КТ или рентгенография лёгких;• бронхоскопия, БАЛ, биопсия очагов поражения;• микроскопия и посев БАЛ, мокроты, биопсийного материала;• определение специфического IgG к Aspergillus в сыворотке крови.критерии диагностики: хроническое (более 1 мес) течение заболевание, нали¬ чие КТ или рентгенографических признаков хронического некротизирующего аспергиллёза лёгких, характерные изменения при бронхоскопии, выявление мице¬ лия Aspergillus spp. в окрашенных мазках и/или признаков инвазивного роста гри¬ бов в биопсийном материале, или выделение Aspergillus spp. при посеве биопсий¬ ного материала, БАЛ, мокроты, или выявление специфического IgG к Aspergillus в сыворотке крови.На рентгенограмме лёгких почти всегда выявляют полости, окружённые зоной воспаления. Чаще поражаются верхние доли. Зона воспаления может быть рас¬ пространённой и занимать долю или всё лёгкое. Эти признаки изменяются отно¬ сительно медленно. В отличие от обычной аспергилломы, утолщение плевры не характерно, но возможно развитие специфического плеврита. Выявление связан¬ ных с сосудами узелковых образований может свидетельствовать о гематогенной диссеминации процесса.Для ХГБ наличие полостей не характерно: чаще выявляют двусторонние очаги поражения, нередко с вовлечением в процесс костей и мягких тканей лёгочной стенки. Применение КТ позволяет обнаружить изменения, не определяемые на рентгенограмме. При КТ обычно выявляют комплекс полостей, содержащих аспергилломы, окруженный зоной воспаления.Чувствительность определения специфического IgG к Asper^llus в сыворотае крови у больных ХНАЛ составляет около 90%. Содержание общего IgE может быть умеренно повышено (200-2000 Ед/л), иногда определяют специфический IgE.
шмикозы ЛЁГКИХ 289При гистологическом исследовании биоптата из каверны или зоны воспаления определяют признаки хронического воспаления. Основное назначение биопсии очага поражения при ХНАЛ — исключение новообразования лёгких, туберкулёза и др. Отсутствие гиф Aspergillus в биоптате из очага поражения не исключает диа¬ гноза ХНАЛ при наличии других критериев диагностики.Дифференциальную диагностику проводят с аспергилл омой, новообразова¬ ниями, абсцедирующей бактериальной пневмонией, а также туберкулёзом лёгких, микобактериозами. Важными признаками, отличающими ХНАЛ от аспергилло¬ мы, являются наличие множественных полостей, увеличение размеров полостей, появление признаков воспаления окружающей лёгочной ткани, вовлечение в про¬ цесс плевры или грудной клетки.Лечениес з^ётом хронического рецидивирующего течения заболевания необходимо длительное, повторное применение противогрибковых препаратов. Наиболее часто применяют вориконазол, раствор итраконазола для приёма внутрь или амфотерицин В, но длительное использование последнего часто невозможно из-за нефротоксичности. Основным показанием к хирургическому лечению явля¬ ется высокий риск лёгочного кровотечения, реже — наличие одиночного очага, рефрактерного к антифунгальной терапии. Во время и после хирургического вмешательства необходимо продолжать применение антимикотиков. Коррекция иммунного дефекта обычно достигается успешным лечением основного заболева¬ ния. Описаны единичные случаи успешного длительного (6-12 мес) применения у-интерферона.Препараты выбора:• вориконазол внутривенно по 6 мг/кг каждые 12 ч в первый день, затем вну¬ тривенно по 4 мг/кг каждые 12 ч или перорально по 200 мг/сут (масса тела <40 кг) или по 400 мг/сут (масса тела >40 кг) в течение 3-6 мес с повторными курсами лечения в дальнейшем;• раствор итраконазола для приёма внутрь по 400 мг/сут в течение 3-6 мес с повторными курсами лечения в дальнейшем.Альтернативный препарат — амфотерицин В по 0,6-1,0 мг/кг до суммарной дозы 1,5-2,5 г с повторными курсами лечения в дальнейшем.АСПЕРГИЛЛОМААспергиллома, или «грибной шар», представляет собой массу мицелш Aspergillus $рр., разрастающегося в ранее возникших полостях лёгких (например, вследствие туберкулёза, опухоли и др.). Аспергиллома может возникать не только в лёгких, но и в придаточных пазухах носа.Этиология и факторы рискаВозбудитель — Aspergillus fumigatus, реже A.ßavus. Очень редко полости лёгких и придаточных пазух носа заполняются другими микромицетами, например,5. apiospermum или зигомицетами, а также некоторыми бактериями, например, Actinomyces spp. Туберкулёз является причиной образования полости при аспер- гилломе в 40-70% случаев; деструктивная пневмония — в 10-20%; буллёзная эмфизема — в 10-20%; бронхоэктазы ~ в 5-10%; опухоли — в 3-7% случаев. Вероятность развития аспергилломы в каверне размером не менее 2 см составляет 15-20%. Аспергиллома чаще возникает в возрасте от 40 до 70 лет, у мужчин чаще, чем у женщин.Клинические проявленияВначале аспергиллома обычно протекает бессимптомно, но по мере прогрес¬ сирования пациентов начинает беспокоить кашель, у части больных возникают
290ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХкровохарканье, субфебрилитет. При вторичном бактериальном инфицировании поражённой грибами полости могут развиваться признаки острого воспаления. В большинстве случаев аспергиллома возникает в верхней доле правого лёгкого (50-75%), реже — в верхней доле левого лёгкого (20-30%). Приблизительно у 10% больных признаки аспергилломы проходят спонтанно, без лечения. У боль¬ шинства больных по крайней мере 1 раз в течение заболевания возникает эпизод кровохарканья, у 20% — лёгочное кровотечение. Осложнениями аспергилломы являются лёгочное кровотечение и инвазивный рост Aspergillus spp, с развитием ХНАЛ или специфического плеврита. Риск развития хронического некротизи¬ рующего аспергиллёза повышен при иммуносупрессии (СПИД, длительное при¬ менение системных ГК и др.), выраженной патологии лёгких и множественных аспергилл омах. При СПИДе аспергиллома часто осложняется развитием ХНАЛ или ИА.ДиагностикаМетоды диагностики:• КТ или рентгенография лёгких;• микроскопия и посев мокроты, БАЛ;• определение специфического IgG к Aspergillus в сыворотке крови.Критерии диагностики: КТ или рентгенографические признаки аспергилломы всочетании с выявлением специфического IgG к Aspergillus в сыворотке крови.При рентгенографии или КТ лёгких выявляют полость, заполненную содержи¬ мым, смещающимся при перемене положения тела (симптом «погремзоики»), с характерной прослойкой воздуха (симптом «серпа» ), В ходе обследования необ¬ ходимо исключить наличие признаков инвазивного поражения лёгких. Выявление специфических IgG к Aspergillus в сыворотке крови (у 90% больных) и Aspergillus spp. при микроскопий и посеве мокроты и БАЛ (у 50%) помогает провести диффе¬ ренциальную диагностику с новообразованием, туберкулёзом, гематомой и бакте¬ риальным абсцессом. Определение вида Aspergillus spp. играет роль при назначении антимикотиков.ЛечениеЛечение проводят при развитии или высоком риске осложнений (повторное кровохарканье, лёгочное кровотечение, иммуносупрессия и др.), при бессимптом¬ ной аспергилломе показано наблюдение.Основным методом лечения является хирургическое удаление поражённого участка лёгкого. Чтобы уменьшить вероятность инфицирования тканей, до и после оперативного лечения проводят АФТ итраконазолом или амфотерицином В. Хирургическому лечению могут препятствовать тяжесть состояния больного, выраженная дыхательная недостаточность, а также множественные аспергилло¬ мы. Частота осложнений (кровотечение и др.) при оперативном лечений может достигать 5-20%. Альтернативными методами лечения являются длительное применение итраконазола и многократное внутриполостное введение амфотери¬ цина В.Выбор противогрибкового препарата;• до и после удаления аспергилломы (7-14 сут) — вориконазол внутривенно по6 мг/кг каждые 12 ч в первый день, затем внутривенно по 4 мг/кг каждые 12 ч или вн)Т'рь по 200 мг/сут (масса тела <40 кг) или по 400 мг/сут (масса тела >40 кг); раствор итраконазола для приёма внутрь по 400 мг/сут или амфоте¬ рицин В по 0,5-0,7 мг/кг в сут;• итраконазол по 200-400 мг/сут в течение 3-6 мес;• вориконазол внутривенно по 6 мг/кг каждые 12 ч в первый день, затем вну¬ тривенно по 4 мг/кг каждые 12 ч или перорально по 200 мг/сут (масса тела
микозы ЛЁГКИХ291<40 кг) или по 400 мг/сут (масса тела >40 кг) в течение 3-6 мес с повторными курсами лечения в дальнейшем;• внутриполостное введение амфотерицина В по 10-20 мг в 10-20 мл дистилли¬ рованной воды, 10-15 процедур,АЛЛЕРГИЧЕСКИЙ БРОНХОЛЁГОЧНЫЙ АСПЕРГИЛЛЁЗАллергический бронхолёгочный аспергиллёз (АБЛА) характеризуется разви¬ тием реакции гиперчувствительности I типа при колонизации дыхательных путей Aspergillus spp. Инвазивного поражения тканей лёгких при АБЛА не происходит. Частота АБЛА у больных бронхиальной астмой составляет 1-5%, у больных муко¬ висцидозом - 5-14%.Этиология и факторы рискаВозбудители — Aspergillus fumigatus, А. davatus, реже — другие Aspergillus spp. Возникновению АБЛА способствуют врождённая предрасположенность, для которой характерно повышение количества и/или активности специфических Th2 CD4^-клеток, а также присутствие повышенного количества антигенов Aspergillus spp. во вдыхаемом воздухе и дыхательных путях. В бронхах возникают мукоидные пробки, содержащие Aspergillus spp., что способствует развитию бронхоэктазов и эозинофильных инфильтратов. Хроническое воспаление приводит к возникнове¬ нию проксимальных бронхоэктазов и фиброза лёгких.Клинические проявленияЗаболевание обычно протекает хронически с периодическими обострениями бронхообструктивного синдрома и/или возникновением эозинофильных инфиль¬ тратов.Основными признаками обострения АБЛА являются приступы удушья, повы¬ шение температуры тела, боли в грудной клетке и кашель с мокротой, содержа¬ щей коричневые включения и слизистые пробки. При рентгенографии выявляют «летучие» инфильтраты в лёгких, при микроскопии мокроты — мицелий или другие элементы грибов Aspergillus.Выделяют 5 стадий АБЛА (табл. 16-1). Следует отметить, что данная класси¬ фикация применима преимущественно к пациентам, у которых АБЛА развился на фоне БА. У больных муковисцидозом АБЛА нередко протекает как медленно про¬ грессирующее заболевание, указанные стадии обычно выделить не удаётся. При длительном течении АБЛА развивается зависимость от системных ГК, формиру¬ ются проксимальные бронхоэктазы и фиброз лёгких, приводящие к дыхательной недостаточности.Таблица 16-1. Классификация аллергического бронхолёгочного аспергиллёза [Patterson, 1982]СтадииПризнакиобщий IgEэозинофилиякровирентгенологическиепризнакиigEk4spefyj//U5IgG к AspergHIus1 — острая++++-t-++II — ремиссия+--±Hi - обострение+++++++IV - ГК-зависимая БА++±±±±V — фиброз+-+±±
Ш'йШ-? 292 ИНФЕКЦИОННЫЕ заболевания лёгкихДиагностикаДля постановки диагноза необходимо комплексное специализированное обсле¬ дование. Характер и вьфаженность признаков АБЛА зависят от стадии процесса и «фонового» заболевания. Основными рентгенологическими признаками ранних стадий АБЛА являются двусторонние инфильтраты, исчезающие после применения системных ГК; признаки хронического перибронхиального воспаления и мукоид- ных пробок (симптом «кольца» ). Позднее выявляют двусторонние, проксималь¬ ные, чаще верхнедолевые бронхоэктазы, фиброз и утолщение плевры. КТ — более чувствительный метод выявления указанных признаков, чем рентгенография.При исследовании ФВД в ранних стадиях АБЛА обычно выявляют признаки бронхиальной обструкции, по мере прогрессирования заболевания — сочетание обструктивных и рестриктивных нарушений.Микроскопия и посев мокроты позволяют выявить Aspergillus spp., что свиде¬ тельствует о микотической колонизации дыхательных путей.Эозинофилию крови более 0,4х10Ул выявляют в острой стадии и при обостре¬ нии заболевания, а во время ремиссии и в стадии фиброза количество эозинофи¬ лов может быть нормальным.Для АБЛА характерно значительное увеличение уровня общего IgE в сыворотке крови, обычно более 1000 мкг/л. Во время ремиссии в поздних стадиях содержа¬ ние общего IgE в сыворотке крови снижается, хотя остаётся выше нормальных показателей. Повышение уровня общего IgE — ранний признак обострения АБЛА. который возникает до клинических проявлений заболевания. Специфические IgE и IgG к Aspergillus выявляют при дебюте или обострении заболевания. Кожная проба с антигеном Aspergillus отличается высокой диагностической чувствитель¬ ностью, но низкой специфичностью. Положительные результаты кожной пробы нередко выявляют у больных муковисцидозом или БА без АБЛА.Кроме указанных диагностических мероприятий необходимо обследовать жилые и производственные помещения, чтобы исключить контаминацию грибами рода Aspergillus.Поскольку патогномоничных признаков АБЛА нет, диагноз устанавливают при наличии у больного в момент обследования или в анамнезе не менее 6 из приве¬ дённых ниже критериев диагностики;• бронхообструктивный синдром;• «летучие» инфильтраты на рентгенограмме или КТ лёгких;• проксимальные бронхоэктазы;• увеличение абсолютного количества эозинофилов в крови более 0,4x1 Оул;• увеличение концентрации общего IgE в сыворотке крови более 1000 мкг/л;• выявление специфического IgE к Aspergillus в сыворотке крови;• выявление специфического IgG к Aspergillus в сыворотке крови;• положительная кожная проба с антигеном Aspergillus.У больных муковисцидозом минимальными диагностическими критериями АБЛА являются;• наличие бронхообструктивного синдрома;• увеличение концентрации общего IgE в сыворотке крови более 1000 мкг/л;• положительная кожная проба с антигеном Aspergillus или выявление специфи¬ ческого IgE к Aspergillus в сыворотке крови;• резистентные к антибактериальным препаратам инфильтративные изменения на рентгенограмме или КТ либо выявление специфического IgG к Aspergillus ш сыворотке крови.Лечениев острой стадии АБЛА основой лечения является применение системных ГК. Для купирования бронхообструктивного синдрома и эозинофильных инфильтра-
микозы ЛЁГКИХ 293TOB в лёгких преднизолон назначают по 0,5-2,0 мг/кг в сут в течение 7-14 дней. Критериями эффективности служат купирование клинических признаков, исчез¬ новение эозинофильных инфильтратов в лёгких и снижение уровня общего IgE в сыворотке крови. После достижения эффекта дозу препарата снижают и продол¬ жают его применение через день Б течение 3-6 мес.Во время ремиссии больные в специфической терапии обычно не нуждаются. При рецидиве вновь применяют преднизолон, после снижения активносги АБЛА назна¬ чают итраконазол по 200-400 мг/сут в течение 2-4 мес. Кроме рецидива АБЛА пока¬ заниями к назначению итраконазола являются зависимость от ГК, их недостаточная эффективность и выраженные нежелательные эффекты. В контролируемых иссле¬ дованиях было показано, что применение итраконазола у таких больных позволяет достоверно уменьшить применение системных ГК, приводит к улучшению фз^КЦИИ внешнего дыхания и уменьшению частоты рецидивов АБЛА. При использовании итраконазола необходимо мониторировать показатели функции печени.Применение ингаляционных ГКС и бронходилататоров позволяет уменьшить дозу системных ГК, особенно у больных с частыми обострениями, эффективность применения системных и ингаляционных ГК, итраконазола для предотвращения фиброза лёгких не определена.Удаление Aspergillus spp. из жилых и производственных помещений позволяет уменьшить антигенную нагрузку и снизить вероятность рецидива заболевания.Инвазивный кандидоз лёгкихИнвазивный кандидоз лёгких (ИКЛ, кандидозная пневмония) встречается относительно редко и составляет приблизительно 5-15% всех случаев инвазивно¬ го кандидоза. Он может быть первичным, например, образовавшимся при аспира¬ ции возбудителя в лёгкие, или вторичным, возникшим в результате гематогенной диссеминации Candida spp, из другого источника.ЭТИОЛОГИЯ и ФАКТОРЫ РИСКАИКЛ развивается преимущественно у больных с длительной нейтропенией; дру¬ гими факторами риска являются длительное пребывание в хирургическом ОИТ, распространённая (два локуса и более) поверхностная колонизация Candida spp., наличие центрального венозного катетера, тяжёлое состояние больного, перфора¬ ция или хирургическое лечение желудочно-кишечного тракта, инфицированный панкреонекроз, полное парентеральное питание, применение ГК или иммуносу¬ прессоров, искусственная вентиляция лёгких, гемодиализ, повторные гемотранс¬ фузии, сахарный диабет.Основными возбудителями кандидозной пневмонии являются С. albicans, С, tropicalis, С. parapsilosis, С. glabrata и С. krusei. Значительно реже выявляют С, lusitaniae, С. guilliemiondii, С. rugosa и др. Многие Candida spp. являются обита¬ телями организма человека. Они выявляются при посевах со слизистой оболочки полости рта и желудочно-кишечного тракта у 30-50% здоровых людей, поэтому важно различать кандидоз и поверхностную колонизацию слизистых оболочек или кожи.КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯКлинические признаки ИКЛ (повышение температуры тела, непродуктивный кашель, одышка и боль в груди) неспецифичны и не позволяют отличить канди- дозную пневмонию от бактериальной или другой микотической.ДИАГНОСТИКАВыявление Candida spp. при микроскопии и посеве мокроты или БАЛ обычно свидетельствует о поверхностной колонизации бронхов или глотки и не является
294 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХIКритерием диагностики ИКЛ (вместе с тем многофокусная поверхностная коло¬ низация является фактором риска развития ИКЛ). Биопсия лёгкого может быть затруднена в связи с высоким риском кровотечения.Диагноз обычно устанавливают при наличии КТ или рентгенографических признаков инвазивного микоза лёгких у больных с кандидемией или острым дис¬ семинированным кандидозом. Основными радиологическими признаками ИКЛ являются двусторонние фокусы с нечёткими контурами однородной или неодно¬ родной структуры — 40%, наличие интерстициальных изменений — 55%, экссу¬ дативный плеврит — 25%, реже — диффузное мелкоочаговое поражение лёгких и образование полостей.Методы диагностики:• КТ или рентгенография лёгких;• биопсия очагов поражения (чрезбронхиальная, трансгоракальная, открытая);• микроскопия биопсийного материала, БАЛ с обработкой калькофлюором белым;• посев биопсийного материала, крови, дистального фрагмента катетера, БАЛ;• обязательна идентификация вида выявленного возбудителя;• гистологическое исследование биопсийного материала;• обследование больного для выявления источника инфекции и других очагов диссеминации.Критерии диагностики: выявление Candida spp. при гистологическом исследо¬ вании и/или посеве биоптата лёгкого или признаки кандидемии, острого диссеми¬ нированного кандидоза в сочетании с КТ или рентгенографическими признаками микоза лёгких,ЛЕЧЕНИЕВажным условием успешного лечения ИКЛ является идентификация возбу¬ дителя. Вид Candida spp. весьма чётко коррелирует с чувствительностью к анти¬ микотикам (табл. 16-2). Вторичная устойчивость Candida spp. к антимикотикам развивается относительно редко, она может возникать при длительном лечении у иммуноскомпрометированных больных.Основными препаратами для лечения ИКЛ являются каспофунгин, амфотери¬ цин В, флуконазол и вориконазол (см, табл. 16-2). Роль других системных азоль¬ ных препаратов (итраконазол и кетоконазол) менее значима в связи с вариабель¬ ной биодоступностью при пероральном приёме.Таблица 16-2. Выбор противогрибкового препарата для лечения инвазивного кандидоза лёгкихКлиническая ситуация или известный вид Сэп(1ШаСхемы леченияСостояние пациента нестабильно (июк, полиорганная недостаточность и др.)Каспофунгин в/в по 70 мг/сут в 1-й день, в последующие дни по 50 мг/сут;амфотерицин В по 0,6 мг/кг в сутНейтропенияКаспофунгин в/в по 70 мг/сут в 1-й день, в последующие дни по 50 мг/сут;вориконазол в/в по 6 мг/кг в 2 введения в 1-й день, затем по 4 мг^ в 2 введения; амфотерицин В по 0,6 мг/кг в сутНоворождённые с очень низкой мас¬ сой телаАмфотерицин В по 0,6-1,0 мг/кг в сут; флуконазол по 5-12 мг/кг е сутВид возбудителя не определёнКаспофунгин в/в по 70 мг/сут в 1-й день, в последующиедни по 50 мг/сут;амфотерицин В по 1,0 мг/кг в сут
Возбудитель: С, albicans, С, iiopicalis,С. parapsilosisМИКОЗЫ ЛЁГКИХ 295Окончание табл. 16-2Флуконазол по 6,0 мг/кг в сут;каспофунгин в/в по 70 мг/сут в 1-й день, в последующие дни по 50 мг/сут;амфотерицин В по 0,6 мг/кг в суг;вориконазол в/в по 6 мг/кг в 2 введения в 1-й день, затемпо 4 мг/кг в 2 введенияВозбудитель; С. giabrataКаспофунгин в/а по 70 мг/сут в 1-й день, в последующие дни по 50 мг/сут;амфотерицин В по 0,8-1,0 мг/кг в суг; флуконазол по 12 мг/кг в сугВозбудитель: С. kruseiКаспофунгин в/в по 70 мг/сут в 1-й день, в последующие дни по 50 мг/суг;вориконазол в/в по 6 мг/кг в 2 введения в 1-й день, затем по 4 мг/кг в 2 введенияВозбудитель: С. С. guilliernnondiilusiteniae,Каспофунгин в/в по 70 мг/сут в 1-й день, в последующие дни по 50 мг/сут;флуконазол по 6,0 мг/кг в суг;вориконазол в/8 по 6 мг/кг в 2 введения в 1-й день,затем по 4 мг/кг в 2 введенияПри назначении антимикотиков следует учитывать локальную эпидемиологи¬ ческую ситуацию. Если в лечебном учреждении или отделении имеется высокая частота выявления m-albicans Candida spp., вначале назначают препарат широкого спектра действия, например каспофунгин или амфотерицин В, а после стабилиза¬ ции состояния больного и определения возбудителя — флуконазол. Если пациент до возникновения ИКЛ получал флуконазол или итраконазол, то назначают пре¬ параты других классов.Оценивать эффект антифунгальной терапии, если нет быстрого ухудшения состояния, следует на 4-7-е сутки. Неэффективность лечения инвазивного канди¬ доза может быть обусловлена как резистентностью к антимикотику возбудителя, так и контаминацией внутрисосудистого и мочевого катетера, протезов сосудов или клапанов сердца, сохраняющейся иммуносупрессией, а также наличием требу¬ ющих хирургического лечения очагов диссеминации (эндокардит, флебит, абсцес¬ сы и др.). Поэтому при неэффективности начального лечения назначают анти- микотик другого класса с учётом вида и чувствительности возбудителя, проводят повторное обследование пациента для выявления очагов диссеминации, удаляют возможные источники инфекции и при необходимости проводят хирургическое лечение. АФТ продолжают не менее 2 нед после исчезновения всех клинических признаков инвазивного кандидоза и последнего выявления Candida spp, при посеве крови и биосубстратов из очагов поражения. По завершении лечения показано наблюдение в течение не менее 2 мес, чтобы исключить возникновение поздних очагов гематогенной диссеминации. Важным компонентом лечения инвазивного кандидоза являются устранение или снижение выраженности факторов риска (например, удаление внутривенных катетеров и др,).Криптококкоз лёгких этиология и ФАКТОРЫ РИСКАЧастота криптококкоза в последние десятилетия значительно увеличилась в связи с пандемией ВИЧ-инфекции. В подавляющем большинстве случаев возбудителем криптококкоза является Cryptococcus пефтат, а инфекции, обусловленные С aWidus и С, laurentii, встречаются очень редко. Возбудители распространены повсеместно, сапрофитируют в почве, на некоторых растениях, в испражнениях птиц.
296 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХОсновные факторы риска — выраженные нарушения клеточного иммунитета, обусловленные СПИДом, лимфомой, хроническим лимфолейкозом, Т-клеточным лейкозом, РТПХ при трансплантации органов и тканей, а также длительным применением ГК и иммуносупрессоров. Вероятность развития криптококкоза определяется степенью выраженности иммунодефицита. Частота криптококкоза у больных СПИДом составляет 4-30%. У иммунокомпетентных пациентов криптс- коккоз развивается редко. У женщин он возникает реже, чем у мужчин, у детей — реже, чем у взрослых. Заражение происходит ингаляционным путём.КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯКриптококкоз может протекать как острое, подострое или хроническое заболе¬ вание. Клинические проявления криптококкоза зависят от характера и выражен- ности иммунодефицита. У больных со СПИДом наиболее часто поражаются ЦНС, лёгкие, кожа и развиваются диссеминированные варианты инфекции с вовлечени¬ ем костей, почек, надпочечников и т.д.У пациентов со СПИДом основными признаками острого криптококкоза лёгких являются лихорадка (81%), кашель (63%), одышка (50%), снижение массы тела (47%), редко — боли в грудной клетке и кровохарканье. У иммуноскомпромети¬ рованных больных без СПИДа — лихорадка (63%), общее недомогание (61%), боли в грудной клетке (44%), снижение массы тела (37%), одышка (27%), кашель (17%) и кровохарканье (7%). У иммунокомпетентных пациентов - кашель (54%), боли в грудной клетке (46%), снижение массы тела (26%), лихорадка (26%) и кровохарканье (18%).ДИАГНОСТИКАМетоды диагностики:• КТ или рентгенография лёгких;• микроскопия и посев мокроты, БАЛ, крови, мочи, материала из очагов пора¬ жения;• определение антигена С. neoformans в сыворотке крови тестом латекс- агглютинации;• люмбальная пункция с определением давления спинномозговой жидкости (СМЖ), микроскопия её и посев СМЖ.Ранняя диагностика — важное условие успешного лечения. Основным методом диагностики криптококкоза служит выявление С. neoformans при микроскопии и посеве мокроты, БАЛ, СМЖ, крови и других биосубстратов, а также биоптата из очагов поражения. Люмбальная пункция с определением давления СМЖ должна быть проведена при любой локализации криптококковой инфекции.Важное диагностическое значение также имеет определение криптококкового антигена в сыворотке крови и СМЖ. Показатели специфичности и чувствитель¬ ности стандартных тестов для определения криптококкового антигена (например, Pastorex Crypto Plus, Bio-Rad) превышают 90%, в то время как чувствительность микроскопии СМЖ с окраской тушью составляет 40-80%, посева — 70%. Поэтому при подозрении на криптококкоз любой локализации всем больным показано определение криптококкового антигена в сыворотке крови или СМЖ.Основными радиологическими признаками криптококкоза лёгких у больных со СПИДом являются интерстициальная инфильтрация и лимфоаденопатия, у иммуноскомпрометированных больных без СПИДа — зоны инфильтрации одно¬ родного характера, субплевральные очаги с нечёткими контурами, шаровидные образования в субплевральных отделах верхних долей и образование полостей; у иммунокомпетентных — одиночные или множественные округлые образования, реже — плеврит и формирование полостей. КТ лёгких — более эффективный метод диагностики криптококкоза лёгких, чем рентгенография. У больных со
микозы ЛЁГКИХ 297СПИДом необходимо исключить пневмонию, обусловленную р. jiroveci М, avium- а intracellulare, у больных без СПИДа — М. tuberculosis. ® >Критерии диагностики; КТ или рентгенографические признаки микоза лёгких в сочетании с выявлением С. neoformans при микологическом исследовании мокро- ты, БАЛ, биоптата из очага поражения или определение антигена С. neoformans в сыворотке крови. ' лЛЕЧЕНИЕВыбор и продолжительность применения антимикотиков определяются состоя- нием больного и локализацией процесса. С. neoformans устойчив к каспофунгину, первичная резистентность к основным препаратам для лечения криптококкоза (амфотерицину В, флуконазолу и итраконазолу) встречается редко. При длитель¬ ном лечении возможно развитие вторичной резистентности к азольным антими¬ котикам.Обязательными условиями успешного лечения криптококкового менингита являются снижение внутричерепного давления (повторные люмбальные пункции, шунтирование), антифунгальная профилактика рецидива, а также устранение или уменьшение выраженности факторов риска, например, высокоактивная анти¬ ретровирусная терапия при СПИДе. Первичная антифунгальная профилактика криптококкоза у ВИЧ-инфицированных больных не рекомендуется.При криптоккозе лёгких у больного без иммунодефицита препаратом выбора является флуконазол по 400 мг/сут в течение 3-12 мес.Альтернативными препаратами являются; итраконазол по 400 мг/сут в течение 3-12 мес; амфотерицин В по 0,5-1,0 мг/кг/сут (продолжительность лечения зави¬ сит от выраженности заболевания).При криптококкозе лёгких у иммуноскомпрометированного больного препа¬ ратом выбора является флуконазол по 400 мг/сут. Альтернативный препарат — итраконазол по 400 мг/сут'.Зигомикоз лёгких этиология и ФАКТОРЫ РИСКАВозбудители - относящиеся к классу Zygomycetes низшие грибы: Rhizopus spp.(R. oryzae, R. microsponis, R. stolonifer), Absidia spp. (A. corymbifera, A. coerulea), Rhizomucor pussilus и Mucor spp, Зигомицеты распространены повсеместно, обита¬ ют в почве, часто встречаются на пищевых продуктах и в гниющих растительных отходах.Факторами риска развития зигомикозов являются декомпенсированный сахар¬ ный диабет, выраженная нейтропения, трансплантация органов и тканей, СПИД, длительное применение высоких доз ГК, распространённые глубокие ожоги, а также длительное лечение дефероксамином. Инфицирование обычно происходит при вдыхании или травматической имплантации возбудителя.Зигомикоз характеризуется чрезвычайно агрессивным течением с очень быстрым разрушением всех тканевых барьеров, поражением кровеносных сосу¬ дов, гематогенной диссеминацией с последующим развитием тромбозов, инфарк¬ тов и некрозов тканей. При зигомикозе возможно поражение любых органов, но наиболее часто в процесс вовлекаются придаточные пазухи носа (35-50% всех случаев), лёгкие (20-30%), кожа и подкожная клетчатка (10%), а также желудочно-кишечный тракт (5-10%).Возбудитель попадает в лёгкие при вдыхании спор, реже — в результате гемато¬ генной или лимфогенной диссеминации.- Антифунгальная терапия может быть прекращена при эффективной в течение бмес высокоактивной антиретровирусной терапии (количество СВ4'‘ Т-лимфоцитов >100-200 в 1 мкл).
iil'í?'№тш.-■I -Ч":Щ&г-/т298 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХКЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯЗигомикоз лёгких обычно проявляется повышением температуры тела более 38 ""С, не снижающейся на фоне лечения антибиотиками широкого спектра дей¬ ствия, кашлем, болями в груди, обильным кровохарканьем или лёгочным крово¬ течением. Прогрессирование процесса может привести к поражению различных органов, включая головной мозг. В этих случаях высока вероятность летального исхода в течение 2-3 нед от начала заболевания.ДИАГНОСТИКАМетоды диагностики:• КТ или рентгенография лёгких, придаточных пазух носа, при неврологиче¬ ской симптоматике — МРТ или КТ головного мозга;• микроскопия с окраской калькофлюором белым и посев мокроты, ВАЛ, отде¬ ляемого из придаточных пазух, биопсийного материала;• гистологическое исследование биопсийного материала.Рентгенологические признаки зигомикоза лёгких неспецифичны. Наиболеечасто определяются очаги и фокусы с центральной зоной некроза в одной или нескольких долях лёгких, в 40% случаев — образование полостей и симптом «полумесяца«>, реже — лимфоаденопатия, плеврит и (у больных с агранулоцито¬ зом) симптом «ореола».Даже при распространённом зигомикозе лёгких возбудитель не всегда выделя¬ ют при исследовании мокроты или БАЛ. Зигомицеты при микроскопии исследуе¬ мых биосубстратов выявляют чаще, чем при посеве.Критерии диагностики: КТ или рентгенологические признаки микоза лёгких в сочетании с выявлением возбудителя зигомикоза при микроскопии, гистологиче¬ ском исследовании и/или посеве материала из очага поражения,ЛЕЧЕНИЕОбязательными условиями успешного лечения зигомикоза являются ранняя диагностика, активное хирургическое удаление поражённых тканей, устранение или уменьшение выраженности факторов риска (компенсация сахарного диабета, отмена цитостатиков и др.) и высокодозная АФТ. Зигомицеты малочувствительны к амфотерицину В и устойчивы к азолам (кроме позаконазола) и эхинокандинам.Препаратами выбора являются липидный комплекс амфотерицина В по 5,0 мг/кг в сут, позаконазол по 800 мг в сут, альтернативный препарат — амфотерицин В по1,0-1,5 мг/кг в сут.ГиалогифомикозыГиалогифомикозы — группа заболеваний, вызываемых светлоокрашен¬ ными мицелиальными грибами Fusarium spp,, Acremonium spp., Paecilomyces spp., Scedosporium spp., Scopulariopsis brevicaulis и Trichoderma longibrachiatum. Возбудители распространены повсеместно, часто встречаются в почве, на раз¬ личных растениях.ЭТИОЛОГИЯ и ФАКТОРЫ РИСКАFusarium spp. считают вторыми по частоте возбудителями инвазивных мицели- альных микозов лёгких после Aspergillus spp. Кроме пневмонии гиалогифомицеты у иммунокомпетентных пациентов вызывают локальные поражения, у иммуно¬ скомпрометированных — фунгемию и диссеминированные инфекции, которые характеризуются очень высокой летальностью. Неблагоприятный прогноз связан как с выраженностью иммуносупрессии у больных, так и с низкой чувствительно¬ стью гиалогифомицетов к большинству применяемых антимикотиков. Поэтому идентификация возбудителей имеет принципиальное значение.
микозы ЛЁГКИХ 299Гиалогифомикозы лёгких наиболее часто развиваются у больных гемобласто- зами с длительной нейтропенией или реципиентов аллогенных трансплантатов g костного мозга, значительно реже — у больных с распространёнными глубокими ^ ожогами. Инфицирование обычно происходит ингаляционным путём, реже — ** через внутрисосудистый катетер. Одним из возможных источников возбудителя являются поражённые ногти при онихомикозе. Возбудители ангиоинвазивны, могут поражать артерии с последующим развитием тромбозов, инфарктов и гема¬ тогенной диссеминацией. ’КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯЗаболевание обычно начинается как пневмония или синусит, при прогрессиро¬ вании развивается гематогенная диссеминация с поражением кожи, внутренних органов, костей и головного мозга, ЬСлиническая картина заболевания определя¬ ется локализацией процесса; общим признаком является рефрактерная к антибио¬ тикам лихорадка. У 54-71% больных развивается характерное поражение кожи и подкожной клетчатки: болезненные эритематозные папулы или подкожные узел¬ ки с последующим образованием очага некроза в центре.ДИАГНОСТИКАМетоды диагностики:• КТ или рентгенография лёгких, придаточных пазух носа, при неврологиче¬ ской симптоматике — МРТ или КТ головного мозга;• микроскопия и посев мокроты, БАЛ, аспирата придаточных пазух носа, крови, дистального фрагмента внутрисосудистого катетера, биоптатов из оча¬ гов поражения;• гистологическое исследование биоптата из очагов поражения;• микроскопия и посев материала из пораженных ноггей при наличии онихо- микоза;• обследование больного для выявления источника, распространённости инфек¬ ции и очагов диссеминации.Для идентификации необходимо выделение возбудителя в культуре. Частота выявления Fusarium spp. при посеве крови больных с инвазивным фузариозом составляет 40-60%. Патоморфология инфекций, вызываемых гиалогифомицета- ми (Fusarium, Acremonium, Scedosporium spp., S. brevicaulis и др.), в целом сходна, в тканях грибы в виде мицелия выявить трудно.Критерии диагностики: КТ или рентгенологические признаки микоза лёгких в сочетании с выявлением гиалогифомицетов при микологическом исследовании материала из очагов поражения, крови.ЛЕЧЕНИЕВозбудители гиалогифомикозов характеризуются низкой чувствительностью или резистентностью к антимикотикам, в том числе к амфотерицину В и итра¬ коназолу. Fusarium spp, отличаются низкой чувствительностью ко всем приме¬ няемым в настоящее время антимикотикам, за исключением вориконазола. При локализованных и системных вариантах инфекции показано комбинированное (хирургическое и антимикотическое) лечение на фоне своевременного устранения факторов риска.Выбор противогрибкового препарата:• вориконазол внутривенно по 6 мг/кг каждые 12 ч в первый день, затем в/в по 4 мг/кг каждые 12 ч или перорально по 200 мг/сут (масса тела <40 кг) или по 400 мг/сут (масса тела >40 кг);• липидный амфотерицин В по 3-5 мг/кг в сут;• позаконазол по 800 мг/сут.
300 ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХI Феогифомикозы' t Vt.' !^ Возбудители — мицелиальные грибы Altemaria spp., Bipolaris spicifera,Cladophialophora bantiana, Exophiala dermatitidis и др. Отличительной особенностью . ' данных грибов является наличие меланиноподобных пигментов в клеточной стен¬ ке, окрашивающих мицелий в тёмный цвет.Инвазивные феогифомикозы обычно развиваются как внутрибольничная инфекция у иммуноскомпрометированных больных. Факторы риска — грануло- цитопения, длительная катетеризация сосудов, выраженная иммуносупрессия.Наиболее распространёнными клиническими вариантами феогифомикозов у иммуноскомпрометированных пациентов являются поражения лёгких, придаточ¬ ных пазух носа, а также диссеминированные инфекции с формированием абсцес¬ сов головного мозга.ДИАГНОСТИКАМетоды диагностики:• КТ или рентгенография лёгких, придаточных пазух носа, при неврологиче¬ ской симптоматике — МРТ или КТ головного мозга;• микроскопия и посев мокроты, БАЛ, аспиратов придаточных пазух носа, крови, дистального фрагмента внутрисосудистого катетера, биоптатов из оча¬ гов поражения;• гистологическое исследование биоптатов из очагов поражения;• обследование больного для выявления источника, распространённости инфек¬ ции и очагов диссеминации.Критерии диагностики: КТ или рентгенологические признаки микоза лёгких в сочетании с выявлением возбудителя феогифомикоза при микологическом иссле¬ довании материала из очагов поражения,ЛЕЧЕНИЕКомбинированное (хирзфгическое и антимикотическое) лечение должно соче¬ таться с устранением факторов риска. Некоторые возбудители феогифомикозов, например В. spicfera, характеризуются низкой чувствительностью к амфотерици¬ ну В.Выбор противогрибкового препарата:• вориконазол в/в по 6 мг/кг каждые 12 ч в первый день, затем в/в по 4 мг/кг каждые 12 ч или перорально по 200 мг/сут (масса тела <40 кг) или по 400 мг/ сут (масса тела >40 кг);• липосомальный амфотерицин В по 3-5 мг/кг в сут;• позаконазол по 800 мг/сут;• амфотерицин В по 1,0-1,5 мг/кг в сут;• итраконазол по 400-800 мг/сут.СПИСОК ЛИТЕРАТУРЫ г
Глава 17Паразитарные заболевания @
АЗДЕЛ VОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯГлава 18. Хроническая обструктивная болезнь лёгкихГлава 19. Эмфизема лёгкихГлава 20. Бронхиальная астмаГлава 21. Муковисцидоз @Глава 22. БронхоэктазыГлава 23. Поражения трахеиГлава 24. БронхиолитыГлава 25. Заболевания верхних дыхательных путей @
Глава 18 Хроническая обструктивная болезнь лёгкихВведениеХроническая обструктивная болезнь лёгких (ХОБЛ) — понятие, с начала 1990-х годов используемое российскими пульмонологами. В связи с разночтениями в определении, диагностике и лече¬ нии ХОБЛ в 90-х годах стали создаваться национальные и меж¬ дународные стандарты по этой проблеме (Канада, 1992; США, 1995; Европейское респираторное общество, 1995; Россия, 1995; Великобритания, 1997). В этих документах определение ХОБЛ было нечётким, вело к разночтению некоторых положений. Появление нового термина, особенно с нечётким определением, порождает множество вопросов, в частности, касающихся замены одного термина другим. В сентябре 2001 года на очередном конгрессе Европейского респираторного общества (ЕРО) был обнародован проект документа под названием GOLD (Global initiative for chronic obstructive lung disease) — результат деятельности экспертов ВОЗ по проблеме ХОБЛ. Этот документ постоянно дополняется и обновля¬ ется и по сути своей является ориентиром, позволяющим получать представление об основных положениях проблемы ХОБЛ, рекомен¬ дуемых экспертами ВОЗ для принятия на национальных уровнях.Одной из наиболее важных проблем является формулировка понятия ХОБЛ. Как бы сложно это ни было, но для того чтобы пуль¬ монологи разных регионов (или разных школ) понимали друг друга и «говорили на одном языке», необходимо использовать формули¬ ровку ХОБЛ, которая включала бы все основополагающие признаки болезни, позволяющие отличать ХОБЛ от других патологических состояний, В GOLD приведена следующая формулировка понятия: «ХОБЛ — болезненное состояние, характеризующееся не полностью обратимой бронхиальной обструкцией. Обструкция прогрессирует и является следствием атипичной воспалительной реакции лёгких на раздражающие частицы и газы». При этом подчёркивается, что ни бронхит, ни эмфизема не отражают весь объём патологических состояний в паренхиме лёгких и воздухоносных путях, поэтому их не используют в формулировке ХОБЛ. Национальные документы по проблеме ХОБЛ (Федеральная программа, монографии по ХОБЛ) подчёркивают наличие трудностей в создании чёткой формулиров¬ ки ХОБЛ. К настоящему времени можно выделить ряд положений, обязательных для формулировки ХОБЛ.
304 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ> • Хроническое воспаление, обусловленное факторами экологической агрессии§■ (раздражающие частицы и газы).2, • Поражение наряду с воздухоносными путями и паренхимы лёгких (поэтомузаболевание называется болезнью лёгких, а не воздухоносных путей).• Прогрессирующая бронхиальная обструкция.С учётом современных представлений о ХОБЛ в России использовалась следу¬ ющая рабочая формулировка: «Хроническая обструктивная болезнь лёгких (ХОБЛ) — хроническое, экологически опосредованное воспалительное заболе¬ вание респираторной системы с преимущественным поражением дистальных отделов дыхательных путей и лёгочной паренхимы с развитием эмфиземы, про¬ являющееся частично обратимой бронхиальной обструкцией, характеризующееся прогрессированием и нарастающими явлениями хронической дыхательной недо¬ статочности».Эта формулировка включает воспалительную природу болезни, поражение наряду с воздухоносными путями паренхимы лёгких и прогрессирование частично обратимой обструкции. Понятие «эмфизема» целесообразно временно включить в формулировку ХОБЛ для того, чтобы подчеркнуть обязательность эмфиземы при ХОБЛ. Это имеет значение для России, так как ещё до сих пор при формулировке диагноза ХОБЛ нередко приписывается «эмфизема». Это предполагает, что может быть ХОБЛ без эмфиземы, что не соответствует современным представлениям об этой болезни. Речь может идти только о степени выраженности эмфиземы, что устанавливается соответствующими исследованиями. Известно, что коварство ХОБЛ заключается в медленном, но неуклонном прогрессировании. Выраженная клиническая симптоматика появляется лишь в развернутой стадии болезни (П стадия). На ранних же стадиях ХОБЛ протекает скрытно, без постоянной клиниче¬ ской симптоматики. Называть эту болезнь хроническим бронхитом, астмоидным бронхитом и другими аналогичными терминами на начальных этапах развития заболевания некорректно, поскольку тут демонстрируется двуфазность болезнк на первых этапах это бронхит, а позже — ХОБЛ. На самом деле: ХОБЛ как са»ю- стоятельная нозологическая форма начинается с одновременного включения всех патогенетических механизмов. Поэтому выделение стадии бронхита искусственв» и не соответствует истинному положению патогенетических механизмов. Конец 1990-х и начало 2000 года знаменовались весьма мрачными перспективами дп больных ХОБЛ. Однако в результате интенсивных исследований на всех уров¬ нях (от эпидемиологии до генетико-молекулярного анализа) в последние годы появилось много важной информации, позволившей внести некоторые изменена» (обнадёживающие) в формулировку понятия ХОБЛ.• ХОБЛ - болезнь, которую можно предотвращать и лечить.• Наряду с поражением респираторной системы при ХОБЛ выражен системшЛ компонент.• Прогрессирование ХОБЛ может иметь различный характер у разных индиш- дуумов.• На тяжесть состояния больных ХОБЛ наряду с вентиляционными расстрой¬ ствами существенное влияние оказывают системный эффект и сосуществу¬ ющие болезни.Б связи с терминологической неопределённостью, существовавшей мвсгае годы, назвать точные данные о распространённости ХОБЛ затруднительно. Во всех сформированных к настоящему времени международных стандартах по*- чёркивается, что пока нет надёжных и точных эпидемиологических данных ов ХОБЛ. Сравнение эпидемиологических характеристик ХОБЛ в различных страпх мира затруднено из-за больших различий в использовании терминов «бронхит», «эмфизема» и «ХОБЛ». Так, в США в 1995 году ХОБЛ болели 14 млн человек, яз них у 12,5 млн диагностирована ХОБЛ, С 1982 по 1995 годы в США число бояк'
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ305шта возросло на 41,5%, и около 6% мужчин и 3% женщин болеют ХОБЛ. А среди JHi старше 55 лет эта цифра достигает 10%. В стандартах Европейского респи¬ раторного общества подчёркивается, что только около 25% случаев заболевания Жмгностируется своевременно. Понятие «своевременная диагностика» условно. Корректнее говорить о ранней диагностике, так как ещё не получено достаточно скяений о том, что есть период в развитии ХОБЛ, своевременная диагностика ■огорого может радикально повлиять на ход болезни, то есть приостановить её шргарессирование.Исследования, проведённые в 1996 году под эгидой Всемирной организации звфавоохранения и Всемирного Банка, установили средние цифры распростра- ■еяности ХОБЛ: 9,34/1000 среди мужчин и 7,33/1000 среди женщин. Однако результаты последних исследований в европейских странах говорят, что в регио¬ нах с очень высокой распространённостью курения частота ХОБЛ приближается Е 80-100/1000. Распространённость ХОБЛ максимальная в странах, где табако- 17рение было или всё ещё остаётся характерной чертой населения, в то время как самая низкая — в странах, где табакокурение — явление относительно редкое или истребление табака отдельными индивидуумами низкое. В среднем ежегодно на жаждые 30-45 случаев ХОБЛ выявляется 5-7 новых.ХОБЛ — болезнь второй половины жизни, чаще возникающая после 40 лет. Эпидемиологические данные свидетельствуют о большей распространённости ХОБЛ среди мужчин. Однако в тех регионах, где произошло нарастание числа 1^ящих женщин, эти различия стираются.Эпидемиологические исследования демонстрируют определённую связь раз¬ вития ХОБЛ с социально-экономическим состоянием человека, его образован- еостью. интеллектом, что в значительной мере позволяет личности осознавать известные факторы риска и иметь материальную и психологическую готовность избегать их патогенного действия.При оценке заболеваемости регистрируются посещения врача, вызовы «скорой медицинской помощи» и госпитализации. Имеющиеся ограниченные данные позволяют сделать вывод об увеличении заболеваемости ХОБЛ с возрастом и о преобладании этого статистического показателя среди мужчин. ХОБЛ является причиной значительной части визитов к врачу, обращений в отделение неотлож¬ ной помощи и госпитализаций.В России ХОБЛ в общей структуре болезней органов дыхания в 1996 году занимала 13-е место и на неё приходилось 12,3% заболеваемости. Показатели распространённости ХОБЛ в России неоднородны. Это определяется разли¬ чиями в экологической обстановке в разных регионах и отсутствием стан¬ дартизированных современных методов эпидемиологического исследования. В 1990-х годах в Москве распространённость достигала 25,6/1000: в Смоленской области — 29,8; в Алтайском крае — 45. В Западно-Сибирском регионе распростра¬ нённость ХОБЛ была самой высокой, в Северном и Северо-Западном регионах — самой низкой. В России по подсчётам с использованием эпидемиологических маркёров должно бьггь около 11 млн больных ХОБЛ. Однако в официальной медрщинской статистике числится около полумиллиона больных ХОБЛ, то есть налицо диагностика в поздних стадиях заболевания, когда самые современные лечебные программы не в состоянии тормозить неуклонное прогрессирование болезни. Несмотря на то что эти приблизительные цифры требуют уточнения, не вызывает сомнения социально-экономическая значимость этого широко распро¬ странённого заболевания.ХОБЛ как причина смертности занимает 4-е место в мире в возрастной группе старше 45 лет и является единственной болезнью, при которой смертность продол¬ жает увеличиваться. По данным Национального института здоровья США, пока¬ затели смертности от ХОБЛ невелики среди людей моложе 45 лет, но в старших«9
306ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯвозрастных группах она занимает 4-5-е место, то есть входит в число основных причин в структуре смертности США. Это отражает так называемый «накопитель¬ ный эффект» от курения. Различные показатели смертности в странах могут сви¬ детельствовать о качестве диагностики, структуре системы оказания медицинской помощи, об образе жизни населения. В Европе смертность от ХОБЛ колеблется от 2,3 (Греция) до 41,4 (Венгрия) на 100 ООО населения. В России, по данным стати¬ стики, за 1995 год показатель смертности для мужчин составил 141,7 на 100 ООО. В 1996 году опубликованы данные исследований, организованных ВОЗ, о потерях, связанных с преждевременной смертью от заболевания и нетрудоспособностью, связанной с тяжестью болезни. В 1990 году ХОБЛ по этому показателю занимала 13-е место, оставляя впереди инфекции нижних дыхательных путей (1-е место) и туберкулёз (7-е место); к 2020 году предполагается, что ХОБЛ будет на 5-м месте, превосходя все заболевания органов дыхания.В связи с широким распространением ХОБЛ прямые медицинские и непрямые расходы, связанные с заболеваемостью и преждевременной смертностью, могут представлять серьёзную экономическую и социальную проблему для обще¬ ства, населения и органов здравоохранения. Эксперты Европейского респира¬ торного общества считают, что адекватное лечение, требующее значительных финансовых затрат, может значительно улучшить качество и продолжительность жизни больных, страдающих этим хроническим прогрессирующим заболеванием. Экономические потери от ХОБЛ, рассчитанные в 1996 году в Великобритании, составляют 4090 млн долларов США в год, в США этот показатель равен 23 900 млн долларов в год. Расходы на одного больного, связанные с ХОБЛ, в 3 раза выше, чем при бронхиальной астме, и составляют 1522 доллара США в год. В США общие расходы на ХОБЛ в структуре лёгочных заболеваний занимают2-е место после рака лёгких и 1-е место по прямым затратам, превышая прямые расходы на бронхиальную астму в 1,9 раза.Немногочисленные сообщения о прямых медицинских расходах при ХОБЛ свидетельствуют о том, что более 80% материальных средств приходится на ста¬ ционарную помощь больным и менее 20% — на амбулаторную. Установлено, что 73% расходов при ХОБЛ приходится на 10% больных с тяжёлым течением забо¬ левания.Любые расчёты по прямым медицинским расходам на дому недостаточно отра¬ жают реальную её стоимость для общества, так как они не учитывают экономиче¬ ский вклад в медицинскую помощь членов семьи больного. Прямые медицинские расходы, особенно в развивающихся странах, менее значимы, чем влияние ХОБЛ на трудовую и бытовую активность. Когда человеческие ресурсы станут наиболее важным достоянием в стране, ХОБЛ будет представлять важную проблему для экономики.Таким образом, распространённость ХОБЛ очень высока и имеется тенденция её роста, экономический ущерб от этого заболевания громаден, приводимые эпи¬ демиологические данные являются приблизительными в связи с несовершенством массовых эпидемиологических обследований.Этиология и патогенезХОБЛ вне зависимости от степени тяжести проявляется хроническим вос¬ палительным процессом с преимущественным поражением дистального отдела дыхательных путей и лёгочной паренхимы. Для больных ХОБЛ характерны снижение максимальной скорости выдоха и медленное, постепенное ухудшение газообменной функции лёгких, что отражает необратимый характер обструкции дыхательных путей. Этиология ХОБЛ напрямую связана с факторами риска, вызывающими заболевание. Основные факторы риска ХОБЛ представлены ниже (GOLD, 2006).
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 307Генетические.Вдыхание вредоносных частиц;❖ табакокурение;<■ производственные пыли (органические и неорганические);❖ домашние пыли (экология жилища);❖ пыли вне дома (экология окружающей среды).Рост и развитие лёгких.Оксидативный стресс.Пол.Возраст.• Респираторные инфекции.• Социоэкономический статус.• Питание,If • Коморбидные состояния,р ХОБЛ — классический пример полигенной болезни, в которой действие внещ- |рк факторов риска реализуется при определённой генетической предрасполо- жвности. Ярким примером этого положения является весьма немногочисленная шяуляция больных с врождённым дефицитом а^-антитрипсина (ААТ). У куря- ■PQL лиц с этим генетическим дефектом значительно быстрее происходит разви- ще и прогрессирование эмфиземы. Другим подтверждением суммации внешних »внутренних (генетических) факторов является наблюдение, демонстрирующее, чиоу курящих родственников больных тяжёлой ХОБЛ довольно быстро развива- скя эта болезнь (в сравнении с курящими, не состоящими в родстве с больным ХОБЛ). Предполагается наличие группы генов восприимчивости ХОБЛ, включа¬ вших хромосому 2q7, трансформирующий фактор роста бета-1 (TGF-(31), микро- еошльную гидролазу эпоксида 1 (mEPHXl), фактор некроза опухоли альфа (ФНО-а). Однако ещё нет чётких данных о локализации этих генов. Дефицит ААТ яыяется в настоящее время единственной хорошо изученной генетической пато¬ логией, ведущей к ХОБЛ. Но вклад этой причины в формирование всей когорты бальных ХОБЛ значительно меньший, чем от курения. Так, в США среди больных ХОБЛ врождённый дефицит ААТ выявляется менее чем в 1% случаев. Дефицит ААТ ведёт к эмфиземе, ХОБЛ и формированию бронхоэктазов. Начало болезни ускоряется курением.Главный фактор риска в 80-90% случаев ХОБЛ — курение. Курильщики имеют максимальные показатели смертности, у них быстрее развиваются необратимые обструктивные изменения функции дыхания и все известные признаки ХОБЛ, Классическое исследование С. Fletcher и R. Peto (1977) показало влияние курения ва темпы ежегодного уменьшения ОФВ^. Так, у здоровых некурящих лиц после 35 лет этот темп равен в среднем 30 мл в год. В исследовании за основу взято положе¬ ние о том, что клинические проявления ХОБЛ вторичны от степени уменьшения ОФВ,. Методом экстраполирования авторы показали, что при таком темпе клини¬ ческие признаки ХОБЛ должны появляться на 120-м году жизни. У курящих этот qwK сокращается вдвое. В то же время только у 15-20% особо чувствительных курильщиков темп снижения ОФВ^ вдвое выше, чем у всех курильщиков. Эта груп¬ па и составляет категорию больных ХОБЛ с возникновением болезни после 40 лет. На рис. 18-1 показаны основные этапы изменения ОФВ^ по С. Fletcher и R. Peto,Считается, что демография ХОБЛ отражает распространённость курения. Среди основных факторов риска профессиональной природы наиболее вредо¬ носными являются кадмий и кремний. Профессии с повышенным риском раз¬ вития ХОБЛ: шахтёры; строительные рабочие, связанные с цементом; рабочие металлургической промышленности (горячая обработка металлов); железнодо¬ рожники; рабочие, занятые переработкой зерна, хлопка и производством бумаги. Но на 1-м месте стоит горнодобывающая промышленность. В России, по данным
308ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ5ш. Некурящие— Бывшие курильщики КурильщикиОдышкаОксигенотерапияИнвалидизацияСмэрть10 20 30 40 50 60 Возраст (годы)Рис. 18-1. Возрастное уменьшение показателя ОФВ,.70 80Б.Т. Величковского (1997), среди рабочих угольной промышленности происходит увеличение числа лиц с заболеваниями лёгких пылевой этиологии, в том числе и хронического бронхита. В 1996 году показатели заболеваемости превысили в 6,4 раза показатели 1988 года. Следует подчеркнуть, что курение усиливает действие профессиональных факторов риска.Многочисленными исследованиями в развивающихся странах показана роль экологии жилища в развитии ХОБЛ. Основное — воздействие продуктов сгорания устаревших видов топлива (дрова, торф, уголь, биомасса) в плохо вентилируемых помещениях. Описано появление респираторных симптомов, связанное с эколо¬ гией жилища: уровнем диоксида азота и высокой влажностью жилых помещений. С этих позиций определённый интерес представляют данные, полученные в Китае, где более 50% мужчин курят. Распространённость курения феди женщин остается низкой (6%). В то же время распространённость ХОБЛ среди мужчин и женщин примерно одинаковая. Наряду с этим хронические респираторные болезни в сель¬ ских районах занимают 1-е место среди причин смерти, а в городских — только 4-е, Эти материалы подчёркивают значение других (кроме курения) факторов риска, в том числе и экологии жилища, которая в сельской местности хуже, чем в городе.Всемирная организация здравоохранения предлагает следующие допустимые концентрации основных факторов загрязнения воздуха: ЗОз — 2860 мкг/м^, ЫОз — 1880 мкг/м О3 — 2000 мкг/м^. Острое влияние загрязнения воздуха на челове¬ ка описано при различных экологических катастрофах. Эпидемиологическое обследование показало, что уровень 50^ и твёрдых частиц (чёрный дым) ниже 500 мкг/м^ существенно не влияет на смертность. Хроническое действие аэропо- лютантов объективно оценить трудно из-за необходимости наряду с экологиче¬ ским анализом учитывать и миграцию населения. Большинство исследователей указывает на увеличение ежегодного темпа снижения ОФВ^ при содержании 50^ выше 50 мкг/м^Известны факты возникновения ХОБЛ у лиц с низким весом при рождении. Предполагается, что факторы, влияющие на развитие респираторной системы в период беременности и раннего детства, могут в дальнейшем способствовать раз¬ витию ХОБЛ.Экологически агрессивные факторы внешней среды, вызывающие оксидатив¬ ный стресс в альвеолярных макрофагах и нейтрофилах, при их систематическом воздействии могут вести к снижению ОФВ^.в странах, где число курящих женщин приравнивается к числу курящих муж¬ чин, получены первые данные о большей ранимости женщин и большей вероят¬ ности развития у них ХОБЛ.Хотя ХОБЛ классически считается болезнью 2-й половины жизни, однако появились сообщения об обнаружении признаков болезни у молодых лиц (до 30 лет), причём у большинства из них был громадный стаж курения (с 5-6 лет
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 309ПО пачке в день). Поэтому для этой категории лиц и 30-летний возрастной рубеж аюжет знаменовать 2-ю половину жизни.Респираторные инфекции являются скорее фактором патогенеза ХОБЛ, тесно связанным со скоростью прогрессирования болезни. Однако рецидивирующие респираторные инфекции в детском возрасте могут послужить дополнительным фактором риска ХОБЛ.Окончательно не установлены конкретные механизмы влияния социоэкономи- ческого статуса на возникновение ХОБЛ, тем не менее эпидемиологические иссле¬ дования отмечают превалирование ХОБЛ у лиц с низким статусом.Питание не является первичным фактором риска, но при развитой ХОБЛ нару¬ шения питания могут способствовать прогрессированию болезни.В последние годы установлено значительное влияние сопутствующих болезней ва вероятность возникновения ХОБЛ. К этим болезням в первую очередь относят¬ ся бронхиальная астма, туберкулёз лёгких.Завершая краткое описание факторов риска ХОБЛ, следует подчеркнуть обя¬ зательное сочетанное действие известных и предполагаемых факторов риска. При этом вклад каждого из суммируемых факторов может быть различным, что и определяет вариабельность характера течения ХОБЛ у индивидуума и множе¬ ственность вариантов течения в популяции.Под влиянием длительного воздействия факторов риска формируется хрониче- схое воспаление, являющееся основным последствием действия факторов риска и основной причиной всех последующих изменений в респираторной системе и за её пределами. Другими словами, воспаление — ключевой механизм патогенеза ХОБЛ.Вследствие суммации факторов риска окружающей среды и генетической пред¬ расположенности развивается хронический воспалительный процесс, в который вовлекаются все морфологические структуры бронхов разного калибра, интерсти¬ циальная (перибронхиальная) ткань и альвеолы. Главным следствием действия этаологических (факторов риска) факторов является хроническое воспаление. Локализация воспаления и особенности пусковых факторов определяют специфику патологического процесса. Хроническому воспалению принадлежит особая роль в ХОБЛ. С одной стороны, это универсальная реакция воздействия всех известных (и предполагаемых) факторов риска. С другой стороны, хроническое воспаление - главная причина всех функциональных и морфологических проявлений ХОБЛ.На рис. 18-2 схематично показана последовательность патологических процес¬ сов, составляющих хроническое воспаление.ФакторыКурениеГенетическиевнешней среды(до 90% значимости)факторыАктивация клеток воспаления респираторной системыПовреждениеЭмфиземаТРепарацияСпазм, отёк, гиперсекрецияКолонизациямикрорганизмовИммуннаянедостаточностьФиброз, метаплазия эпителияВентиляционные расстройства, гипоксемия, гиперкапнияРис. 18-2. Место воспаления в патогенезе ХОБЛ.
31 о ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯПервый этап — воздействие этиологических факторов на клеточные элементы, участвующие в воспалении. Второй этап представлен процессами повреждения и репарации, идущими одновременно и определяющими морфологические и функ¬ циональные проявления ХОБЛ. Практически все клеточные элементы респиратор¬ ной системы под влиянием этиологических факторов активируются и участвуют в воспалительной реакции, которая по сути своей является результатом клеточной кооперации. Но в сложной иерархии межклеточных взаимоотношений, проис¬ ходящих в разные фазы воспаления, ключевая роль принадлежит нейтрофилам.В норме вся популяция зрелых нейтрофилов условно делится на циркулиру¬ ющий пул и краевой пул, то есть клетки, находящиеся в депо. Одним из важ¬ ных мест депонирования нейтрофилов являются посткапиллярные венулы лёгких. Курение ведет к 10-кратному увеличению содержания нейтрофилов в дистальных отделах респираторной системы. Нейтрофилы, имея средний диаметр 7,03 мкм, постоянно преодолевают микроциркуляторные сегменты альвеол, диаметр кото¬ рых в среднем равен 5 мкм, то есть меньше, чем диаметр нейтрофила. В среднем путь каждого нейтрофила от артериолы к венуле состоит из преодоления 60 капиллярных сегментов. При этом каждая альвеола содержит около 1000 капил¬ лярных сегментов. Скорость преодоления капиллярного ложа в значительной мере зависит от способности нейтрофилов к изменению формы, то есть деформа¬ ции. Под влиянием курения происходит полимеризация актина нейтрофилов, что существенно снижает их деформации. При этом задерживающиеся в капиллярах нейтрофилы окружены очень малым количеством плазмы, несущей антиокси- дантный и антипротеолитический потенциал, что создаёт условия для патогенного действия нейтрофилов.Одновременно с этим механизмом включается следующий, определяемый эндо¬ телием сосудов. Под влиянием воспалительных медиаторов (гистамин, фактор акти¬ вации тромбоцитов, ФНО-а, интерлейкин-1Р) усиливается экспрессия адгезивных молекул (Р- и Е-селектинов) на эндотелиальных клетках, что ведёт к прикрепле¬ нию нейтрофилов к сосудистой стенке с помощью специальных рецепторов. После прикрепления к эндотелию нейтрофилы мигрируют через пространства между эндотелиальными клетками, которые увеличиваются под влиянием медиаторов воспаления. Направленность движения нейтрофилов определяется различными хемоаттрактантами, самым сильным из которых является интерлейкин-8 (ИЛ-8). Помимо ИЛ-8, хемоаттрактантами для нейтрофилов служат лейкотриены-В^, фактор активации тромбоцитов, С5 и никотин.Нейтрофилы, проникая в межклеточное пространство, в полной мере проявля¬ ют свой патогенный потенциал. Наряду с выделением ряда провоспалительных медиаторов, обладающих хемотаксическим действием для других нейтрофилов (ФАТ, лейкотриены-В^, 12-НЕТЕ), вазоактивные простагландины (Е2 и Р2а), ней¬ трофилы выделяют ряд субстанций, обладающих мощным деструктивным потен¬ циалом, распространяющимся практически на все молекулярные компоненты тканей: липиды, белки, нуклеиновые кислоты. Это в первую очередь нейтральные протеазы (эластин) и кислородные радикалы. Помимо этого катионные белки и р-глюкуронидаза нейтрофилов обладают цитопатогенным действием. В норме весь этот комплекс «патогенных» компонентов направлен на разрушение чуже¬ родных субстанций, попавших во внутреннюю среду. Но под влиянием факторот риска ХОБЛ, главным из которых является курение, запускается механизм (опи¬ санный выше), извращающий защитное действие нейтрофила. Наряду с нейтро¬ филами в формирование воспаления вносят свой вклад макрофаги, Т-лимфоциты, эозинофилы и эпителиальные клетки. Макрофаги скапливаются в местах деструк¬ ции альвеолярных стенок. Их основное участие — в регуляции воспаления путём секреции медиаторов (ФНО-а, ИЛ-8, лейкотриены-В^), усиливающих нейтро- фильное воспаление. Гйстопатологические исследования показывают увеличение
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ311содержания Т-лимфоцитов, особенно клеток CD8^ (цитотоксических) во всех отделах лёгких. И хотя их роль в формировании воспаления при ХОБЛ полностью ве установлена, но CD8' моїут быть ответственными за выделение перфорина, гранзима-В и ФНО-а, которые вызывают цитолиз и апоптоз клеток альвеоляр- вого эпителия, что способствует персистенции воспаления. При тяжёлой ХОБЛ отмечается и увеличение содержания естественных киллеров (NK). Участие и роль эозинофилов при ХОБЛ до конца не выяснены. Некоторые исследователи обнару¬ живают при стабильной ХОБЛ нарастание числа эозинофилов в воздухоносных путях. Однако это может быть результатом сосуществующей бронхиальной астмы, так как другие авторы не обнаруживают увеличения эозинофилов при стабильной ХОБЛ. Большинство исследователей приводят данные о повышении содержания эозинофилов при обострении ХОБЛ.В условиях гигантского скопления нейтрофилов в капиллярной сети альвеол, где местный антипротеазный потенциал, определяемый плазменными факторами, быстро истощается, происходят разрушение структурных элементов альвеол и формирование эмфиземы. В первую очередь разрушаются участки альвеолярных стенок, прикрепляющиеся к терминальным бронхиолам.М. Saetta и соавт. (1985) показали (рис. 18-3, см. также цветную вклейку), что это разрушение является проявлением воспалительного процесса в мелких возду¬ хоносных путях, представляет собой ранние стадии разрушения лёгочной парен¬ химы и ответственно за утрату эластического сопротивления.Помимо этого оксиданты и другие компоненты табачного дыма могут инакти¬ вировать а,-антипротеазный ингибитор, тем самым усугубляя локальный дефицит антиБротеаз. Кроме того, эластаза разрушает эпителиальные клетки, ведёт к мета¬ плазии бокаловидных клеток.Второй, очень важный элемент патогенного воздействия нейтрофилов — окси¬ дативный стресс, то есть выделение непомерно большого (превышающего физио¬ логические потребности) количества свободных радикалов, обладающих мощным повреждающим действием (рис. 18-4). Кислород, озон, NOj оказывают мощное оксидантное действие на все структуры респираторной системы. Сигаретный дым — наиболее опасный и изученный инициатор оксидативного стресса в лёгких.Основными оксидантами табачного дыма являются О^, О,, ОН, N0, НОСІ. Реализацию своего действия оксиданты осуществляют при участии ионов железа в качестве катализатора. Известно, что при ХОБЛ в лёгких и особенно в альвеоляр¬ ных макрофагах скапливается большое количество железа.Наиболее изученным экзогенным источников оксидантов является курение, а эндогенным — нейтрофилы и альвеолярные макрофаги. Лёгочная антиокси¬ дантная защита состоит из энзимных и неэнзимных систем. Оіавньїе энзимныеФМSaetta-Рмс. 18-3. Морфологические проявления формирования эмфиземы и утраты эластического сопро¬ тивления (по М. Заейа): а — терминальная бронхиола больного ХОБЛ с остатками участков прикре¬ пления альвеол; б — лёгкое здорового человека.
Ш'-ШШшт&312 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯРис. 18-4. Роль оксидативного стресса в патогенезе ХОБЛ.антиоксиданты — супероксиддисмутаза и глутатион. Витамин Е, р-каротин, витамин С, мочевая кислота, билирубин — представители неэнзимной антиокси- дантной системы. Глутатион и витамин С являются главными внутриклеточными антиоксидантами и их эндобронхиальное содержание значительно превосходит концентрацию в плазме.Оксиданты оказывают прямое токсическое действие на ключевые структуры лёгких; соединительную ткань, ДНК, липиды, протеины. Оксиданты усиливают синтез гликоконъюгатов слизи эпителиальными клетками, повреждают функции ресничек. Оксиданты стимулируют формирование тромбоксанов, уменьшают активность сурфактанта, повреждают фибробласты, усиливают эндотелиальную проницаемость.Оксиданты инактивируют ингибиторы протеаз. В ответ на это эластаза разру¬ шает альвеолярные стенки, экстрацеллюлярные мембранные протеины, стимули¬ рует синтез ИЛ-8. Таким образом, оксидативный стресс оказывает разностороннее повреждающее действие практически на все лёгочные структуры и выраженность его регулируется состоятельностью антиоксидантных систем.В последнее десятилетие интенсивно исследуется роль N0 в патогенезе болеа- ней лёгких. N0 синтезируется из L-аргинина под влиянием NO-синтаз (NOS) при участии кальция. Известны 3 формы NOS; эндотелиальная, макрофагальная в нейронная, которые ведут к локальному синтезу N0 и определяют его влияние ва респираторную систему. N0, выделяемый эндотелиальными клетками, обладает сосудорасширяющим действием на уровне мелких артерий и артериол, регулируя сосудистое сопротивление, при этом установлено, что гипоксия снижает синтез N0. N0 ингибирует адгезию, активацию и агрегацию тромбоцитов, препятст^ внутрисосудистому тромбообразованию. N0 обладает прямым бронходилаш- рующим действием, а также нейтрализует бронхоконстрикторное влияние аце- тилхолина. Макрофагальный N0 участвует в противоинфекционной защите путём усиления внутриклеточного разрушения микобактерий туберкулёза и другнх микроорганизмов. N0 усиливает функцию реснитчатого аппарата и способствует стерилизации респираторного тракта. Способность альвеолярных макрофагов продуцировать N0 играет важную роль в поддержании местного иммунного гомеостаза респираторного тракта.
'■:ШХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 313Процессы повреждения и репарации, происходящие при ХОБЛ, составляют суть хронически текущего воспаления, регулируются громадным количеством экзо¬ генных и эндогенных провоспалительных и противовоспалительных медиаторов н проявляются на всех уровнях респираторной системы: уровне защитной слизи, эпителиальных клеток и интерстициальной ткани.Слизь, покрывающая эпителий, является постоянно действующим фильтром, разделяющим воздух и поверхность эпителиального слоя. Этот барьер транспор¬ табелен, постоянно обновляется, способен нейтрализовать патогенное действие токсических и инфекционных факторов. Мозаичный набор гликопротеиновых рецепторов муцина слизи в норме распознаёт и фиксирует микроорганизмы, шоггорые затем элиминируются мукоцилиарно-транспортным механизмом. Под влиянием этиологических факторов нарушаются реологические свойства слизи, соотношения фракций гель/золь, снижается противоинфекционный потенциал. Эго все повреждает клиренс и лишает эпителий первой линии защиты.Процесс повреждения и регенерации альвеолярного эпителия при ХОБЛ — постоянно идущий, многокомпонентный процесс, который в общих чертах харак¬ теризуется следующими закономерностями.• Миграцией базальных клеток в зоны повреждения.• Восстановлением плотных межклеточных соединений.• Дифференциацией клеток в направлении сквамозной и бокаловидной мета¬ плазии. Метаплазия бокаловидных клеток в первую очередь проявляется уве¬ личением их числа и гиперсекрецией. Сквамозная метаплазия происходит из клеток, потерявших контакт с базальной мембраной и напоминающих либо клетки пищевода, либо кожи.• Активными митозами, ведущими к гиперплазии базальных и мукозных кле¬ ток.Естественно, что регенерация эпителия происходит с участием белков экстра- ОЕЯлюлярного матрикса. Фибронектин создаёт первичное ложе для клеток; IV тип жоллагена и ламинин действуют как якорные молекулы для мигрирующих клеток.После повреждения клетки должны быть удалены. Большую роль в удалении этих клеток играют матриксные металлопротеазы — семейство энзимов, разру¬ шающих практически все компоненты экстрацеллюлярного матрикса — желатина- ш и стромелизины. Особое место среди эпителиальных клеток занимают клетки Кларка, которые являются важным источником репаративных процессов, а секре¬ торные протеины этих клеток обладают противовоспалительной активностью.Повреждение эпителия создает благоприятные условия для имплантации микроорганизмов, У обнажённого матрикса есть рецепторы к бактериям, что создаёт условия для колонизации микрофлоры. В экстрацеллюлярном матриксе происходят аналогичные процессы. После оксидативного или протеолитического повреждения интерстиция происходит пролиферация фибробластов. В поздних стадиях хронического воспаления преобладает фиброз с отложением экстрацел- яолярного матрикса в стенках бронхиол, что ведёт к формированию перибронхи¬ ального фиброза, который наряду с эмфиземой вносит свой вклад в формирование обструкции.На разных стадиях дифференциации клеток в процессе репарации, а также■ во внеклеточных субстанциях активируются рецепторы к цитокинам, являю¬ щиеся основными регуляторами репарации. Цитокины продуцируются в основ¬ ном альвеолярными макрофагами, нейтрофилами, эпителиальными клетками, JШыфoцитaми и фибробластами. Трансформирующий фактор роста р, фактор роста тромбоцитарного происхождения, гранулоцитарно-макрофагальный коло- ннестимулирующий фактор и основной фактор роста фибробластов — основные ^йрогенные цитокины. При этом в межклеточных взаимоотношениях важней- шшми факторами являются время и концентрация цитокина. При изменении этих
314 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯусловий один и тот же цитокин может оказывать диаметрально противоположное действие,В результате хронического воспаления происходит ремоделирование бронхов, которое проявляется;• увеличением подслизистого и адвентициального слоя (отёк, отложение про- теогликонов, коллагена);• увеличением размеров и числа слизистых и бокаловидных клеток;• увеличением бронхиальной микрососудистой сети;• гипертрофией и гиперплазией гладкой мускулатуры воздухоносных путей.Обобщая результаты многочисленных патоморфологических исследований боль¬ ных ХОБЛ, можно выделить 4 основных уровня патологических изменений: цен- тральные воздухоносные пути, периферические воздухоносные пути, лёгочная паренхима и лёгочные сосуды. В центральных воздухоносных путях, включающих трахею, бронхи и бронхиолы с внутренним диаметром более 2-4 мм, наблюдаются отёк, инфильтрация макрофагами и CD8* Т-лимфоцитами. Наряду с этим происхо¬ дят: увеличение числа бокаловидных клеток и плоскоклеточная метаплазия эпите¬ лия; дисфункция, повреждение и/или потеря ресничек; гипертрофия и гиперплазия желёз подслизисгого слоя с гиперсекрецией слизи; гипертрофия гладкой мускулату¬ ры, увеличение объёма соединительной ткани в стенках воздухоносных путей; деге¬ нерация хрящей воздухоносных путей. Перечисленные изменения в центральных воздухоносных путях клинически проявляются кашлем и выделением мокроты, что обычно сопровождает течение ХОБЛ. Раннее нарушение лёгочных функций у боль¬ ных ХОБЛ связано преимущественно с воспалительными изменениями перифери¬ ческих воздухоносных путей (мелкие бронхи и бронхиолы с внутренним диаметром менее 2 мм). Эти изменения аналогичны таковым в центральных воздухоносных путях, но наиболее характерные изменения в периферических воздухоносных путях — это их сужение. Повторяющиеся (идущие постоянно) явления повреждения и репарации, составляющие суть хронического воспаления при ХОБЛ, ведут к ремо¬ делированию бронхов, описанному выше. Эти изменения можно регистрировать при измерении периферического сопротивления воздухоносных путей. Наиболее характерный тип паренхиматозного повреждения при ХОБЛ — центролобулярная форма эмфиземы лёгких. Этот феномен вначале наблюдается в верхних долях лёг¬ ких и по мере прогрессирования заболевания распространяется и на нижележащие отделы. В дальнейшем эмфизема лёгких может приобретать характер панацинарном и панлобулярной, являясь проявлением местного дефицита антипротеазных систем. Изменения сосудов лёгких при ХОБЛ наблюдаются ещё до появления нарушений функции внешнего дыхания (ФВД) или возникновения лёгочной гипертензии. Эндотелиальная дисфункция является пусковым механизмом лёгочной гипертен¬ зии. Значительный вклад в формирование лёгочной гипертензии вносит и запуст- вание капиллярного ложа, наблюдающееся при эмфиземе лёгких.Прогрессирующий характер ХОБЛ предполагает неуклонное ослабление есте¬ ственных защитных систем органов дыхания, что создаёт благоприятные условия для инфицирования респираторной системы.Микробиологическое исследование дистальных отделов дыхательных путей с использованием специальной бронхологической техники, защищающей пробы от загрязнения, у больных ХОБЛ в 20-30% выявляют пневмотропные вирусы (респираторно-синцитиальный вирус, аденовирусы, вирусы гриппа), в 50% — бак¬ терии, причём наиболее часто — Streptococcus pneumoniae, Haemophilus influenzae и Moraxella catarrhalis. Каждый из этих микроорганизмов имеет свои особеннояи взаимоотношения с хозяином.Г)1авным условием участия микроорганизмов в патогенезе ХОБЛ является их колонизация. У вирусов механизмы колонизации во многом определяюия генетическим аппаратом хозяина и проявляются адгезией и проникновением ш
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ315клетки эпителия, эндотелия сосудов, моноциты-макрофаги, нейтрофилы и другие жлетки-мишени. Вирусы, обладая мощным деструктивным потенциалом, непо- Чредственно и через изменение функций поражённых вирусом клеток, вызывают воспалительную реакцию поражённого участка. Сложность и многоступенчатость повреждающего действия вирусов на респираторный тракт хорошо иллюстрирует¬ ся на примере вирусного поражения альвеолярного макрофага (табл. 18-1).Таблица 18-1. Патогенное действие вирусов, реализуемое через альвеолярные макрофагиНепосредственное действие вирусовНезавершённый фагоципгозНарушение коопераіііии с Т-клеткамиДиссеминация аирусовОксидативный стрессСіммуляция синтеза металлопротеиназВыделение провоспалительных медиаторовВысокие титры противоеирусных антителПоследствия вирусного пораженияПерсистенция внутриклеточной инфекцииИммунодефицитГенерализация инфекцииДеструкция тканейДеструкция альвеол, фиброгенезОтёк, гиперсекрецйя, бронхоспазмУсиление тканевого протеолизаОбычно вслед за вирусным поражением респираторного тракта происходит присоединение или активация бактериальной инфекции.Основными факторами, способствующими колонизации бактерий в респира¬ торном тракте, являются: адгезия бактерий, ослабление мукоцилиарного транс¬ порта, повреждение целостности бронхиального эпителия, нарушения местного и системного иммунитета, факторы инвазивности микроорганизмов, курение, длительное применение ИГКС.Адгезия бактерий — первый этап колонизации. Процесс этот носит специфиче¬ ский характер и осуществляется на уровне муцина бронхиальной слизи, эпителия и экстрацеллюлярного матрикса. Специфичность адгезии определяется наличием на каждой бактерии и на объектах адгезии структур, специфически комплементар¬ ных друг к другу, что обеспечивает фиксацию бактерии. Так, в муцине адгезивные молекулы представлены различными гликопротеинами. Их структура расшиф¬ рована для пневмококка и синегнойной палочки. В норме специфическая связь бактерий с муцином хороша тем, что при сохранном мукоцилиарном клиренсе происходит их эвакуация из респираторного тракта. Поэтому вторым условием «вляется нарушение мукоцилиарного транспорта. Известно, что нарушение муко- инлиарного транспорта — обязательный компонент патогенеза ХОБЛ, происходя- ■щй под влиянием факторов риска, главным из которых является курение. Однако я сами бактерии за счёт своих факторов инвазивности вносят существенный вклад в формирование мукоцилиарной недостаточности. Факторы инвазивности пнев- мотропных бактерий представлены следующими системами:• экзоэнзимами,• эластазами,• фосфолипазами,• пигментами,• 1§А-протеазами,• цилиостатическими факторами,• нейраминидазами.Под действием бактериальных факторов инвазивности нарушается опсони- зацйя бактерий, что ведёт к дефектам фагоцитоза, подавляется мукоцилиарный кжяренс и в конечном итоге усиливается адгезия.
316ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯСледующим уровнем адгезии бактерий являются эпителиальные клетки (клетки мерцательного эпителия, бокаловидные и базальные клетки). Основным условием адгезии бактерий к эпителиальным клеткам является их повреждение, что ведёт ¡Ш'Гг к обнажению трансмембранных гликолипидов и гликопротеинов, являющихся рецепторами адгезии для бактерий. Поэтому адгезия бактерий происходит как при повреждении эпителия, так и в процессе регенерации.Основными компонентами экстрацеллюлярного матрикса, являющимися адге¬ зивными рецепторами для бактерий, являются ламинин, I и IV типы коллагена, фибронектин, то есть важные составляющие репаративного процесса. Детальная идентификация адгезивных рецепторов для различных микроорганизмов ещё не завершена, однако дальнейшие исследования в этой области смогут подготовить плацдарм для нового терапевтического направления, заключающегося в селек¬ тивном подавлении процессов бактериальной адгезии, что должно ограничивать колонизацию микроорганизмов.Взаимоотношение колонизирующихся микроорганизмов с местными и систем¬ ными структурами иммунитета таково, что иммунный ответ на персистирующую инфекцию не в состоянии эффективно элиминировать персистирующие бактерии, а лишь в определённой мере ограничивает безудержный рост бактериальной популяции, другими словами, колонизация бактерий в респираторном тракте - свидетельство недостаточности факторов защиты, одним из которых является иммунитет. Основными компонентами местного иммунитета, ответственными за ограничение пролиферации бактерий, являются секреторный IgA, лизоцим и лактоферин бронхиального секрета. Причинами, нарушающими адекватный иммунный ответ на бактерии, являются иммуносупрессивные воздействия фак¬ торов риска ХОБЛ и некоторые медикаментозные воздействия. В частности, в настоящее время уже накоплено достаточно данных, подтверждающих повышение частоты колонизации бактерий в респираторном тракте при длительной ингаля¬ ционной терапии кортикостероидами. Другими словами, относительная иммунная недостаточность — важное условие персистенции и пролиферации бронхиальной популяции в респираторном тракте. Это положение является предпосылкой для систематического применения вакцинации, что нашло уже реальное воплощение в жизнь как в виде отдельных публикаций об успехах вакцинации, так и в GOLD в виде включения вакцинации в обязательный перечень лечебных мероприятий на всех стадиях ХОБЛ,Персистирующие микроорганизмы запускают целый каскад иммунологических реакций с выделением большого числа провоспалительных медиаторов и хемо- аттрактантов, что хорошо иллюстрируется на примере реакции альвеолярных макрофагов на бактериальные липополисахариды (табл. 18-2).Таблица 18-2. Цитокины и их ингибиторы, выделяемые альвеолярными макрофагами под влиянием бактериальных липополисахаридовЦитокиныНазваниеПровоспалительныеИнтерлейкин-1 Интерлейкин-6 Интерлейкин-12 Фактор некроза опухоли аХемоаттраюантыИнтерлейкин-8Макрофагальные воспалительные протеины 1а, 1рПептиды роста а, р. уМоноцитарный хемотаксический пептидРегулятор экспрессии и секреции нормальных Т-клеток при акту|вац*1Факторы созреванияГранулоцитарно-макрофагальный колониестимулирующий фаетор
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 317Окончание табл. 18-2І^гибиторьі цитокмновАнтагонист рецепторов к интерлейкину-1 Растворимые рецепторы к ФНОПротивовоспапительныеИнтерлейкин-10Трансформирующий фактор роста рСвязываясь с С014 на поверхности макрофагов, бактериальные липополиса¬ хариды запускают каскад реакций, направленных на формирование иммунного ответа, что проявляется воспалительной реакцией в местах локализации альвео¬ лярных макрофагов.Среди множества провоспалительных следствий колонизации микроорганиз¬ мов особое место занимают привлечение нейтрофилов в респираторную систему и их активация. Таким образом, персистирующие микроорганизмы являются важным элементом, поддерживающим хроническое воспаление не столько непосредственно, сколько опосредованно — через активацию основных клеток- эффекторов: нейтрофилов, макрофагов, лимфоцитов, эпителиальных и эндоте¬ лиальных клеток.В условиях длительного воздействия факторов риска (курение и др.), провос¬ палительных медиаторов нейтрофилов, влияния оксидативного стресса, коло¬ низации микроорганизмов происходит определённая модификация иммунного ответа, в первую очередь местного. Это проявляется изменением силы и направ¬ ленности иммунного ответа на стандартные раздражители, которые можно рас¬ ценивать как местный иммунодефицит, усугубление которого происходит при обострениях ХОБЛ. Наиболее характерные признаки местного иммунодефицита при ХОБЛ - снижение продукции 8І§А, лактоферрина и лизоцима, снижение ответа Т-лимфоцитов на стандартные митогены, а также присоединение гриб¬ ковой инфекции (в III стадии). Наиболее ощутимо это во ІІ-ІІІ стадиях ХОБЛ и ююнически проявляется учащением рецидивирования ХОБЛ. Бактериальная и вирусно-бактериальная инфекция способна повышать потребность в р2-агонистах и холинолитиках за счёт ингибирования соответствующих рецепторов. Инфекции нижних отделов респираторного тракта в детстве нарушают рост лёгкого и ведут к уменьшению лёгочных объёмов во взрослом состоянии. Причём наиболее суще¬ ственно это влияние в первые 2 года жизни ребёнка.Следующий весьма важный вопрос, касающийся значения инфекции при ХОБЛ, это соотношение состояний «колонизация/инфекция». Понятие «колонизация» означает заселение, которое может наблюдаться без явных (клинических) призна¬ ков инфекции и сочетаться с клиническими признаками заболевания, что обычно называется термином «инфекция». Деление это весьма условно, поскольку клини¬ ческие признаки инфекции могут маскироваться иными проявлениями болезни. Другой вопрос о том, каждое ли обострение является следствием или проявлением активации респираторной инфекции?Итак, колонизация может быть состоянием равновесия популяции микроор¬ ганизмов с дефектными системами защиты хозяина (мукоцилиарный клиренс, юшунитет), обеспечивающими сдерживание роста и наращивания патогенного яействия этих микроорганизмов.Инфекция — колонизация с клиническими признаками инфекции — состояние, жарактеризующееся нарушением равновесия между микроорганизмом и хозяином, проявляющееся значительной пролиферацией микроорганизмов, что выражается ждиническими и лабораторными признаками активного воспаления.Обострение ХОБЛ клинически проявляется нарастанием респираторной сим¬ птоматики, появлением гнойных элементов в мокроте, интоксикацией и снижени¬ ем толерантности физической нагрузки.
318ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯФаеторы риска ХОБЛНарушение мукоцилиарнопо клиренса, повреждение эпителия, иммунодефицитжКолонизация бактерийПовреждениедыхательногоэпителия~1Нарушение мукоцилиарного клиренсаВыделение провоспалительных медиаторов и токсиновтНарастаниебактериальнойадгезииПКумуляциянейтрофиловпАктивация клеток воспаления респираторной системы1ГНарушения адренергической и холинергической иннервацииIIПрогрессирование ХОБЛРис. 18-5. Место инфекционных агентов в патогенезе ХОБЛ,Таким образом, исходя из концепции, что ХОБЛ является хроническим вос¬ палительным процессом с неуклонным прогрессированием и утратой обратимого компонента бронхиальной обструкции, можно условно определить место инфек¬ ционных агентов в этом процессе в виде схемы (рис. 18-5), из которой следует, что персистирующие микроорганизмы у больных ХОБЛ - важный элемент, поддерживающий хроническое воспаление не столько непосредственно, сколько опосредованно — через активацию основных клеток-эффекторов; нейтрофилов, макрофагов, лимфоцитов, эпителиальных и эндотелиальных клеток. Поэтому инфекционные агенты являются обязательной составной частью патогенеза и даже вне обострения участвуют в прогрессировании ХОБЛ.Итак, хроническое воспаление при ХОБЛ — ключевой элемент прогрессирова¬ ния заболевания. Основными компонентами патогенеза хронического воспаления являются оксидативный стресс, протеолитическая деструкция ткани, иммунная недостаточность, колонизация микроорганизмов. Реализация этих компонентов патогенеза в дебюте заболевания осуществляется под влиянием факторов риска ХОБЛ, а при сформировавшейся болезни принимает характер самоподдержн- Бающегося процесса. Основными клетками-эффекторами являются нейтрофилы» действие которых усиливается другими элементами респираторной системы: лимфоцитами, макрофагами, эозинофилами, тучными клетками, эпителиальными клетками, клетками сосудистого эндотелия. Б процессе воспаления выделяется большой ансамбль провоспалительных медиаторов, под влиянием которых фор¬ мируются основные патофизиологические компоненты ХОБЛ, определяющие бронхиальную обструкцию. Известно, что бронхиальная обструкция при ХОБЛ состоит из 2 компонентов — обратимого и необратимого. Обратимый компонент представляет собой последствия (проявления) воспаления, которые могут был устранены под влиянием соответствующих лечебных воздействий, — это отёк.
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ319пшерсекреция, бронхоспазм. Необратимый компонент — проявления воспаления, которые не могут быть устранены с помощью медикаментов — эмфизема лёгких, ремоделирование воздухоносных путей, включая и перибронхиальный фиброз. При этом эмфизема лёгких занимает определяющее положение в формировании необратимого компонента бронхиальной обструкции (90%) и начинается с ран¬ них стадий ХОБЛ параллельно спазму, отёку и гиперсекреции. Именно поэтому эмфизему лёгких не следует рассматривать как осложнение ХОБЛ, поскольку она является важнейшим и обязательным её проявлением. Представленные выше материалы имеют принципиальное значение с позиций определения лечебной тактики у больных ХОБЛ.До той поры, пока не утрачен обратимый компонент бронхиальной обструкции, можно рассчитывать на достижение ощутимого лечебного эффекта от бронходи¬ лататоров, которым отводится роль базисных препаратов при ХОБЛ. По мере про¬ грессирования заболевания и утраты обратимого компонента (что наблюдается в терминальной стадии ХОБЛ) тактика лечения этих больных изменяется и акцент делается на оксигенотерапии, улучшении функции дыхательной мускулатуры, профилактике и лечении инфекционных эпизодов.Схематично основные этапы патогенеза ХОБЛ представлены в табл. 18-3.Таблица 18-3. Схема патогенеза ХОБЛФакторы рискаНарушениямукоцилиарноготранспортаДефекты сли- зеобрааованияИнфильтрация клетками- эффекторамиМестный иммуноде¬ фицитКолонизациямикроорганизмовСпазм, отёк, мукостазВентиляционные нарушения по обструктивному типу с формированием центролобулярной эмфиземыНарушенияГипоксияАшвацияЛёгочная гипер¬ЭритроцитозУтомление дыха¬вентиляционно-ГиперкапнияинфекциитензияГипервискозныйтельной мускула¬перфузионныхЛёгочное сердцесиндромтурыотношенийСнижение качества жизниВесь этот комплекс механизмов воспаления ведёт к формированию 2 основных процессов, характерных для ХОБЛ: нарушению бронхиальной проходимости и развитию эмфиземы.Возникающие в результате морфологических изменений функциональные нарушения вначале проявляются только при физической нагрузке, а по мере про¬ грессирования болезни — и в покое. Главные функциональные нарушения при ХОБЛ: гиперсекреция слизи, дисфункция реснитчатого аппарата, вентиляционные нарушения, лёгочная гипертензия и лёгочное сердце. Именно эти изменения и проявляются клинически основными симптомами ХОБЛ: кашлем, выделением мокроты и одышкой. Гиперсекреция — результат стимуляции лейкотриенами, про- теиназами и нейропептидами увеличенного числа секретирующих слизь клеток эпителия и желёз подслизистого слоя, что является естественным проявлением хронического воспаления. Плоскоклеточная метаплазия эпителия бронхов и дис¬ плазия усугубляют нарушения мукоцилиарного клиренса. Эти нарушения являют¬ ся первыми в цепи патологических изменений при ХОБЛ и возникают за много лет до появления других признаков болезни. Нарушения потока выдоха — характер¬ ный функциональный признак ХОБЛ. Нарушение бронхиальной проходимости у больных ХОБЛ формируется за счёт 2 компонентов: обратимого и необратимого. Обратимый компонент складывается из спазма гладкой мускулатуры, отёка ели-
320 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯЗИСТОЙ бронхов и гиперсекреции слизи, возникающих под влиянием большого спектра провоспалительных медиаторов (ИЛ-8, ФНО-а, нейтрофильных протеаз и свободных радикалов).В процессе прогрессирования болезни постепенно утрачивается обратимый компонент. Утратой обратимого компонента бронхиальной обструкции условно принято считать ситуацию, когда после 3-месячного курса адекватной терапии у I"' '1*1 больного не произошло улучшения ОФВ ^.О Необратимый компонент бронхиальной обструкции определяется эмфиземойлёгких и перибронхиальным фиброзом. Эмфизема лёгких формируется в основном в результате истощения (инактивации вследствие оксидативного стресса) местных ингибиторов протеаз и под влиянием нейтрофильных протеаз, разрушающих эластическую строму альвеол. Вследствие этого из-за нарушения эластических свойств лёгких изменяется механика дыхания и формируется экспираторный коллапс, являющийся важной причиной необратимой бронхиальной обструкции. Замедление опорожнения лёгких ведёт к формированию динамической гиперин¬ фляции (перерастяжению) лёгких. Нарастание функционального остаточного объёма обычно ведёт к нарушению функций и координации дыхательной мускула¬ туры. Весьма весомым компонентом патогенеза ХОБЛ является утомление дыха¬ тельной мускулатуры, что в свою очередь ухудшает работу дыхания и усугубляет вентиляционные нарушения.Одним из важных элементов патогенеза ХОБЛ является неравномерность вентиляционно-перфузионных отношений. Перфузия плоховентилируемых зон ведёт к снижению артериальной оксигенации, избыточная вентиляция недостаточно перфузируемых зон приводит к росту вентиляции мертвого пространства и задержке вьщеления СОз- Наиболее выражены эти явления при физической нагрузке.Хроническая гипоксия ведёт к компенсаторному эритроцитозу — вторичной полицитемии с соответствующим гипервискозным синдромом и нарушениями микроциркуляции, которые усугубляют вентиляционно-перфузионные несоответ¬ ствия. Всё это создаёт условия для повышения давления в системе лёгочной арте¬ рии и для формирования лёгочного сердца. Факторами, ответственными за фор¬ мирование лёгочной гипертензии у больных ХОБЛ, являются ремоделирование лёгочных артерий, запустевание капиллярного ложа стенок альвеол вследствие эмфиземы лёгких, что требует увеличения давления для преодоления указанных препятствий кровотоку, чтобы обеспечить нормальную перфузию. Причинами сосудистых изменений могут быть гипоксия, нарушение синтеза или вьщеления N0, повышенная продукция вазоконстрикторных пептидов.Под хроническим лёгочным сердцем понимают изменения правого желудочка, его гипертрофию или сочетание гипертрофии с дилатацией и недостаточностью, возника¬ ющие вследствие функциональных или структурных изменений в лёгких и не связан¬ ные с первичным поражением левого предсердия или врождёнными пороками сердца. Работы последних лет свидетельствуют о ранних изменеш1ях и левого желудочка.Развитие лёгочной гипертензии и лёгочного сердца является закономерным исходом длительного течения ХОБЛ. Среди всех случаев сердечной недостаточно¬ сти хроническое лёгочное сердце как её причина составляет 25%. Декомпенсация хронического лёгочного сердца приводит к недостаточности кровообращения и в 30% случаев является причиной смерти больных ХОБЛ, занимая 2-е место среди причин смерти у этих больных после острой дыхательной недостаточности.Важным фактором, усугубляющим бронхиальную обструкцию и ведущим к нарастанию всех признаков болезни, является обострение инфекционного про¬ цесса в респираторной системе. В условиях мукостаза, местного, а иногда и систем¬ ного иммунодефицита колонизация микроорганизмов может принять неконтро¬ лируемый характер и перейти качественно в другую форму взаимоотношения с макроорганизмом — инфекционный эпизод. Возможен и другой путь — обычное
ХРОНИЧЕСКАЯ 0БСТРУ1аИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 321заражение высоковирулентной флорой воздушно-капельным п}?тём, что легко реализуется в условиях нарушенных защитных механизмов.У ряда больных ХОБЛ наблюдается синдром обструктивного апноэ во сне. Расстройства дыхания во время сна у пациентов с ХОБЛ носят гиповентиляци- онный характер и могут быть объединены термином «синдром обструктивных адноэ-гипопноэ сна» (СОАГС).Причиной СОАГС являются коллапс/обструкция верхних дыхательных путей или гиповентиляционные изменения рисунка дыхания с развитием ночной гипок¬ сии. Основные клинические формы проявления СОАГС:• синдром повышенного сопротивления (СПС) дыхательных путей во время сна;• синдром ожирения-гиповентиляции во время сна (СОГ);• синдром гиповентиляции во время сна (СГС);• синдром сочетанной обструкции дыхательных путей во время сна (ССО);• синдром апноэ во время сна (САС).Апноэ во время сна — это потенциально угрожающее жизни пациента дыхатель¬ ное расстройство, определяемое как период асфиксии во время сна, приводящее к развитию избыточной дневной сонливости, гемодинамическим расстройствам и нестабильности сердечной деятельности.Сочетание ХОБЛ и СОАГС обычно способствует резкому прогрессированию заболевания и обструкции дыхательных путей, приводящих к ранней нетрудоспо¬ собности и сокращению продолжительности жизни. Неинвазивная чрезмасочная вентиляция лёгких предотвращает развитие ночных дыхательных расстройств и снижает смертность при минимальной частоте развития побочных эффектов. Сочетание бронхиальной обструкции, характерной для ХОБЛ с ночным апноэ, называется синдромом перекреста, при котором максимально выражены нару¬ шения газообмена. Существует мнение, что у большинства больных хроническая гиперкапния формируется преимущественно в ночное время.Для больных ХОБЛ характерно наличие системных (внелёгочных) проявлений болезни, что связано с системным проявлением оксидативного стресса и высокой концентрацией провоспалительных цитокинов, а также дисфункцией скелетных мышц. Дисфункция скелетной мускулатуры проявляется потерей мышечной массы и различными отклонениями в биоэнергетике. Системные проявления ХОБЛ про¬ гностически значимы и имеют прямое отношение к общему состоянию здоровья больных, их качеству жизни.Итак, хроническое воспаление является важнейшим компонентом патогенеза ХОБЛ. Воспаление при ХОБЛ имеет свои отличительные черты и определяет весь каскад патологических процессов, протекающих у этих больных. Перспективы успешного контроля прогрессирования ХОБЛ напрямую связаны с решением про¬ блемы контроля хронического воспаления при этом заболевании.Совершенствование наших представлений о сущности заболевания — патогенезе ХОБЛ — является важнейшим инструментом, влияющим на основные стратегические положения классификации ХОБЛ, способов слежения за течением болезни, проблем профилактики и лечения. Условно основные механизмы патогенеза ХОБЛ можно раз¬ делить на 5 составных частей, взаимно дополняющих друг друга (табл, 18-4).Перечисленные механизмы не исчерпывают всей сложной иерархии патогенеза ХОБЛ, а скорее представляют объекты проводимых в настоящее время фундамен¬ тальных и клинических исследований, а также потенциальные точки приложения методов диагностики и лечения. При этом следует подчеркнуть, что по мере про¬ грессирования ХОБЛ, нарастания эмфиземы и ремоделирования периферических бронхов болезнь приобретает качественно новый характер, проявляющийся снижением эффективности фармакотерапии (бронходилататоры) и нарастанием дыхательной недостаточности.
322 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ Таблица 18-4. Основные патогенетические механизмы ХОБЛГруппы механизмовУровни нарушенияВоспаление• Увеличение числа клеток воспаления и их активация: СОЗ'^-яимфоциты, моноциты/макрофаги, нейтрофилы• Увеличение продукции медиаторов воспаления; ИЛ-8, ФНО-а, лейкотриены-В^, оксиданты• Нарушения баланса протеаэы/антипротеазы• Колонизаций микроорганизмовМукоцилиарная дисфункция• Гиперсекреция бронхиальной слизи• Редукция мукоцилиарного транспорта• Повреждение слизистойСтруктурные изменения• Гиперплазия/метаплазия бокаловидных клеток• Гипертрофия слизистых желез• Гипертрофия гладкой мускулатуры• Фиброз воздухоносных путей• Разрушение альвеолСнижение скорости потока выдыхаемого воздуха• Обструкция/нарушение прикрепления альвеол к бронхиолам, спазм и гипертрофия гладкой мускулатуры, отёк слизистой• Потеря эластической тяги альвеолСистемные (внелёгочные) механизмы• Гипотрофия• Снижение индекса массы тела• Остеопения, остеопороз• Повреждение скелетных мышц: слабость, гипотрофияКлассификацияПоскольку основным характерным признаком ХОБЛ является прогрессиро¬ вание болезни, которое проявляется неуклонным нарастанием бронхиальной обструкции, вызывающей усугубляющуюся дыхательную недостаточность, то во всём мире используют классификационные принципы, основанные на опреде¬ лении степени тяжести заболевания. И это имеет принципиальное значение, поскольку именно тяжесть заболевания определяет объём и качество лечебного вмешательства. А так как тяжесть состояния больного ХОБЛ определяется в пер¬ вую очередь выраженностью бронхиальной обструкции, то наряду с клинически¬ ми признаками в классификацию обязательно вводятся показатели бронхиальной проходимости, а именно ОФБ^ — объём форсированного выдоха за первую секун¬ ду. Этот показатель выбран как наиболее стабильный и объективно отражающий выраженность бронхиальной обструкции (табл. 18-5).Таблица 18-5. Классификация тяжести ХОБЛ (по показаниям спирограммы)СтадииХарактеристики1. ЛёгкаяОФВ/ФЖЁЛ <70%ОФВ^ >80%2. СреднетяжёлаяОФВ/ФЖЁЛ <70%50% < ОФВ, <80%3. ТяжёлаяОФВ/ФЖЁЛ <70%30% < ОФВ, <50%4. КрайнетяжёлаяОФВ/ФЖЁЛ <70%ОФВ, <30 (или <50% -1- хроническая дыхательная недостаточность ншправожелудочковая недостаточность)
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 323Благодаря хорошей воспроизводимости и простоте измерения ОФВ, в настоя¬ щее время является общепринятым показателем для оценки степени обструкции при ХОБЛ. На основе этого показателя определяется и степень тяжести ХОБЛ. Все основные классификации (Европейского респираторного общества, Британского и Американского торакальных обществ) подразделяют больных на основании показателя ОФВ^ который принят за стандарт, характеризующий бронхиальную обструкцию. Клинические проявления ХОБЛ расцениваются как вторичные от ОФВ, и не являются факторами, определяющими стадию болезни. При этом сле¬ дует подчеркнуть, что для оценки состояния больных наряду с классификацией по показателям спирограммы в настоящее время используются дополнительные методы оценки одышки (MRS-шкала одышки), интегральный показатель BODE- индекс (масса тела, обструкция, одышка, физическая нагрузка: Body mass index, Obstructin, Dyspnoea, Exercise) и опросники по определению качества жизни. Однако в практической жизни у больных в одной и той же стадии ХОБЛ могут быть получены различные цифры вышеприведённых показателей состояния больных. Поэтому эти показатели в большей мере отражают адаптацию больного к бронхиальной обструкции и системным проявлениям ХОБЛ в пределах каждой стадии. И, тем не менее, в общих чертах соответствие клинических признаков определённым стадиям представлено в табл. 18-6.Таблица 18-6. Соответствие основных клинических признаков показателям ФВД при разных ста¬ диях ХОБЛСтадии ХОБЛОсновные клинические признакиФункциональные показатели1 стадая (лёгкая)Непостоянный кашель. Одышка лишь при физической нагрузке или отсугствуетОФВ/ФЖЁЛ <70%ОФВ, >80% должных величинII стадия (среднетйжёлая)Постоянный кашель, наиболее выраженный по уграм. Скудная мокрота. Одышка при физической нагрузкеОФВ,/ФЖЁЛ <70% ОФВ, - 50-80%III стадия (тяжёлая)Постоянный кашель. Одышка в покое. Цианоз. Участие вспомога¬ тельной мускулатуры в дыханииОФВ,/ФЖЁЛ <70% ОФВ, - 30-50%[V стадия {крайнетяжёлая)Постоянный кашель. Одышка в покое. Цианоз. Участие вспомога¬ тельной мускулатуры в дыхании. Признаки дыхательной или право¬ желудочковой недостаточностиОФВ,/ФЖЁЛ <70%ОФВ, <30 или <50% + дыхательная недостаточностьКлиническая картинаКлиническая картина ХОБЛ зависит от характера и интенсивности воздей¬ ствия факторов риска, стадии заболевания и скорости прогрессирования болез¬ ни. Обычно ХОБЛ развивается в условиях действия факторов риска медленно и прогрессирует постепенно. Так, в стандартах Американского торакального обще¬ ства подчёркивается, что появлению первых клинических симптомов у больных ХОБЛ, как правило, предшествует курение по крайней мере 20 сигарет в день на протяжении 20 лет и более. Скорость прогрессирования и выраженность симпто¬ мов ХОБЛ зависят от интенсивности воздействия этиологических факторов и их суммации. При описании клиники ХОБЛ обыкновенно учитывается ряд факто¬ ров, специфичных именно для этой болезни: субклиническое начало болезни и
к;»-:-324 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ" неуклонное её прогрессирование. Самым ранним симптомом, появляющимся к40-50 годам жизни, являются кашель. Следующий симптом, возникающий вслед за кашлем, — одышка. Одышка, ощущаемая вначале при физической нагрузке, возникает значительно позже появления кашля. Временной промежуток между , истинным началом болезни и обращением больного за медицинской помощью, ? связанным с возникновением одышки, весьма значителен и составляет около 10Это затрудняет эпидемиологические исследования, раннюю диагностику и лечение болезни в ранней стадии. Первыми признаками, с которыми пациен¬ ты обычно обращаются к врачу, являются кашель и одышка, иногда сопрово¬ ждающиеся свистящим дыханием с выделением мокроты: чаще всего сочетание этих симптомов характерно уже для И стадии болезни. Мокрота выделяется в небольшом количестве (редко >60 мл/сут) утром, имеет слизистый характер и приобретает гнойный характер лишь при присоединении инфекционных эпизо¬ дов, которые обычно расцениваются как обострения. По мере прогрессирования ХОБЛ промежутки между обострениями становятся короче. Симптомы ХОБЛ наиболее выражены по утрам.К этому же времени в холодные сезоны начинают возникать эпизоды респира¬ торной инфекции, не связываемые вначале в одно заболевание.Описывая клинические признаки ХОБЛ, следует выделять основные фазы течения: стабильную и обострение. Стабильным считается состояние, когда выраженность симптомов существенно не меняется в течение недель и даже меся¬ цев, а прогрессирование заболевания можно обнаружить лишь при длительном динамическом наблюдении за больным (6-12 мес). Обострения ХОБЛ — острые, периодически возникающие ухудшения состояния (длительностью >2-3 дней). При обострении ХОБЛ, как правило, нарастает интенсивность симптоматики заболевания. Основным симптомом обострения ХОБЛ является усиление одышки, которое обычно сопровождается появлением или усилением дистанционных хри¬ пов, чувством сдавления в груди.Симптоматика стабильной ХОБЛ определяется тяжестью болезни: при I ста¬ дии болезни — доклиническое течение и респираторные симптомы появляются лишь при обострении болезни, нередко принимаемой за ОРЗ. Кашель — един¬ ственный симптом, наблюдаемый у больных ХОБЛ I стадии. При этом кашель* практически всегда сочетается с воздействием факторов риска, главным из кото¬ рых является курение. Обычно это лёгкое покашливание по утрам с небольшим количеством слизистой мокроты. Психология курильщика, определяемая его возрастом и социальным положением, часто ведёт к игнорированию «малых» признаков начала болезни, которые если и замечаются, то не являются поводом для обращения к врачу. У этих лиц для обращения за медицинской помощью нужен более серьёзный аргумент в виде ограничения трудоспособности. Других симптомов, характерных для ХОБЛ, в I стадии при стабильном состоянии не выявляется.При II стадии ХОБЛ наблюдается развёрнутая клиническая картина со всем комплексом симптомов. Кашель становится постоянным, но не приступообраз¬ ным, а покашливанием в течение дня. Больные обычно привыкают к покашлива¬ нию, и особого дискомфорта этот симптом у них не вызывает. Ночное покашлива¬ ние наблюдается у этих больных редко. При ночном кашле следует искать другие причины этого признака. Мокрота, выделяемая при покашливании, обычно скуд¬ ная, слизистая. Но к этим 2 симптомам присоединяется одышка, носящая эксп»- раторный характер. Вначале одышка ощущается только при физической нагрузке, ранее легко переносимой, а затем и в покое. С этим симптомокомплексом больные обычно впервые обращаются за медицинской помощью.
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 325Результаты физикального обследования пациентов с ХОБЛ зависят от степе¬ ни выраженности бронхиальной обструкции, тяжести лёгочной гиперинфляции (перерастяжения лёгких) и телосложения. По мере прогрессирования болезни к кашлю присоединяется свистящее дыхание, наиболее ощутимое при ускоренном вьщохе. Нередко при аускультации выявляются сухие разнотембровые хрипы. Одышка может варьировать в очень широких пределах: от ощущения нехватки воздуха при стандартных физических нагрузках до тяжёлой дыхательной недо¬ статочности, По мере прогрессирования бронхиальной обструкции и нарас¬ тания гиперинфляции лёгких переднезадний размер грудной клетки нарастает. Подвижность диафрагмы ограничивается, аускультативная картина меняется: уменьшается выраженность хрипов, выдох удлиняется. Чувствительность физи¬ ческих методов для определения степени тяжести ХОБЛ невелика. Среди класси¬ ческих признаков можно назвать свистящий выдох и удлинённое время выдоха (>5 с), которые могут свидетельствовать о бронхиальной обструкции.При III-IV стадиях к комплексу респираторных симптомов (кашлю, одышке) присоединяются признаки хронического лёгочного сердца, гипоксии и гиперкап¬ нии, реологических расстройств, недостаточности кровообращения, утомления дыхательной мускулатуры, самое главное — рефрактерности к бронходилати- рующим средствам. Рефрактерность к бронходилатирующим средствам — важный признак утраты обратимого компонента бронхиальной обструкции и прогрес¬ сирования эмфиземы лёгких. Поскольку большинство указанных осложнений возникает одновременно, бывает трудно выделить вклад каждого из них в общий симптомокомплекс больных ХОБЛ HI-IV стадий. И всё же для лёгочного сердца характерны нарастание тахикардии, возможно появление кардиалгий. Наличие мерцательной аритмии не характерно для хронического лёгочного сердца. При этом определяются признаки гипертрофии правого желудочка. При декомпенса¬ ции хронического лёгочного сердца (IV стадия) появляются классические при¬ знаки правожелудочковой недостаточности: увеличение печени, отёки ног, асцит; набухание вен шеи, положительный венный пульс; пульсация печени, положи¬ тельный симптом Плеша; систолический шум у основания грудины; увеличение венозного давления. Цианоз, его распространённость и особенности окраски определяются сочетанием ряда признаков: гипоксии, гиперкапнии и эритроцито- за. Для гипоксии и гиперкапнии характерны головные боли, сонливость днём и бессонница ночью.Основной причиной смерти больных ХОБЛ является дыхательная недостаточ¬ ность (ДН). Общепринято определение ДН как состояние, при котором р^О^ менее 60 мм рт.ст,, а РзСО.^ — более 45 мм рт.ст. В зависимости от скорости развития ДН различаются хроническая дыхательная недостаточность (ХДН) и острая дыха¬ тельная недостаточность (ОДН). ХДН развивается постепенно и вначале прояв¬ ляется лишь при нагрузке, а затем и в покое. ОДН развивается в течение корот¬ кого промежутка времени (часы, минуты) и обычно является ответом на острые патологические процессы (обострение ХОБЛ, пневмонию, тромбоэмболию ветвей лёгочной артерии, острую сердечную недостаточность и др.). Нарушение созна¬ ния — симптом, нередко наблюдаемый при ОДН. Этот признак отражает реакцию ЦНС на изменения газового и электролитного состава крови и может варьировать от сохранного сознания до его глубокого угнетения вплоть до комы. Нередко усу¬ гублению угнетения сознания может способствовать седативная терапия.Центральный серый цианоз обычно является проявлением гипоксемии. Выявляемый в это же время акроцианоз обычно является следствием сердечной недостаточности. Многие больные часто выдыхают через губы, сложенные тру¬ бочкой, что может оптимизировать использование работы дыхательной мускула¬ туры. Аускультативная картина обычно скудная — ослабление дыхания. Тахипноэ
326 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯИ изменение дыхательного стереотипа — важнейшие признаки дисфункции дыхательной мускулатуры. Увеличение частоты дыхания более 25 в мин при¬ нято считать начальным признаком утомления дыхательной мускулатуры. Ещё более грозным симптомом может быть брадипноэ (менее 12 в мин), являющееся предвестником остановки дыхания. Изменение дыхательного стереотипа, поми¬ мо дыхательных аритмий, включает вовлечение вспомогательных дыхательных мышц (мышцы шеи и живота).В зависимости от индивидуальных особенностей больных выделяют 2 клиниче¬ ские формы заболевания — эмфизематозную и бронхитическую.Эмфизематозную форму (тип) ХОБЛ связывают преимущественно с панацинар- ной эмфиземой- Таких больных образно называют «розовыми пыхтельщиками», поскольку для преодоления преждевременно наступающего экспираторного кол¬ лапса бронхов выдох производится через сложенные в трубочку губы и сопрово¬ ждается своеобразным пыхтением. Б клинической картине превалирует одышка в покое вследствие уменьшения диффузионной поверхности лёгких. Такие больные обычно худые, кашель у них чаще сухой или с небольшим количеством густой и вязкой мокроты. Цвет лица розовый, так как достаточная оксигенация крови под¬ держивается максимально возможным увеличением вентиляции. Предел вентиля¬ ции достигается в состоянии покоя, и больные очень плохо переносят физическую нагрузку. Лёгочная гипертензия умеренно выражена, так как редукция артери¬ ального русла, вызванная атрофией межальвеолярных перегородок, не достигает значительных величин. Лёгочное сердце длительное время компенсировано. Таким образом, эмфизематозный тип ХОБЛ характеризуется преимущественным развитием дыхательной недостаточности.Бронхитическая форма (тип) наблюдается при центриацинарной эмфиземе. Постоянная гиперсекреция вызывает увеличение сопротивления на вдохе и выдо¬ хе, что способствует существенному нарушению вентиляции, в свою очередь, рез¬ кое уменьшение вентиляции приводит к значительному уменьшению содержания О2 в альвеолах, последующему нарушению перфузионно-диффузионных соотно¬ шений и шунтированию крови. Это и обусловливает характерный синий оттенок диффузного цианоза у больных данной категории. Такие больные тучные («синие одутловатики»), в клинической картине преобладает кашель с обильным вьщеле- нием мокроты. Диффузный пневмосклероз и облитерация просвета кровеносных сосудов ведут к быстрому развитию лёгочного сердца и его декомпенсации. Этому способствуют стойкая лёгочная гипертензия, значительная гипоксемия, эритро¬ цитоз и постоянная интоксикация вследствие выраженного воспалительного про¬ цесса в бронхах.Вьщеление 2 форм имеет прогностическое значение. Так, при эмфизематоз¬ ном типе в более поздних стадиях наступает декомпенсация лёгочного сердца по сравнению с бронхитическим вариантом ХОБЛ. В оинических же условиях чаще встречаются больные со смешанным типом заболевания.Таким образом, развитие и прогрессирование ХОБЛ происходят в условиях действия факторов риска, характеризуются медленным, постепенным (по край¬ ней мере в начале болезни) началом. Наиболее ранним признаком ХОБЛ явля¬ ется кашель. Остальные признаки присоединяются позже по мере прогрессиро¬ вания болезни, при этом происходит постепенное ускорение прогрессирования болезни.Обострение представляет собой ухудшение состояния больного, проявляющее¬ ся нарастанием симптоматики и функциональными расстройствами, возникающее внезапно и длящееся не менее 2 дней. В монотонную картину прогрессирования стабильной ХОБЛ обязательно вклиниваются обострения, возникающие 2-5 раз в год и более. Обострения ХОБЛ ~ острые, периодически возникающие ухудшени»
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 327СОСТОЯНИЯ. При обострении ХОБЛ, как правило, нарастает интенсивность симпто¬ матики заболевания. Основным симптомом обострения ХОБЛ является усиление одышки, которое обычно сопровождается появлением или усилением дистанци¬ онных хрипов, чувством сдавления в груди, снижением толерантности физической нагрузки, нарастанием интенсивности кашля и количества мокроты, изменение её цвета и вязкости. При этом существенно ухудшаются показатели ФВД и газов крови: снижаются скоростные показатели (ОФВ^ и др.), может возникнуть гипок¬ семия и даже гиперкапния. Обострения могут начинаться постепенно, исподволь, а могут характеризоваться и стремительным ухудшением состояния больного с развитием острой дыхательной и правожелудочковой недостаточности.Тяжесть обострения обычно соответствует выраженности клинических про¬ явлений заболевания в период стабильного его течения. Так, у пациентов с лёг¬ ким или среднетяжёлым течением ХОБЛ (I-II стадии) обострение, как правило, характеризуется усилением одышки, кашля и увеличением объёма мокроты, что позволяет вести их в амбулаторных условиях. Напротив, у больных с тяжёлым течением ХОБЛ (UI-IV стадии) обострение нередко сопровождается развити¬ ем острой дыхательной недостаточности, что требует проведения мероприятий интенсивной терапии в условиях стационара, В процессе обследования больного необходимо уточнить длительность текущего обострения, частоту предшествовав¬ ших обострений (в том числе и требовавших госпитализации), а также характер лечения в период стабильного течения ХОБЛ. Для оценки тяжести обострения особое внимание уделяется установлению таких клинических, функциональных и лабораторных признаков, как участие в акте дыхания вспомогательной муску¬ латуры, парадоксальное движение грудной клетки, появление или усугубление центрального цианоза, появление периферических отеков, гемодинамическая нестабильность, ОФВ, <1,0 л/с, ПСВ <100 л/мин, р^О^ <60 мм рт.ст., SPj <90%. Важное значение придаётся оценке внелёгочной симптоматики — вегетативным расстройствам, слабости, апатии. В зависимости от интенсивности симптоматики и ответа на лечение выделяют 3 степени тяжести обострения. Лёгкая — незначи¬ тельное усиление симптоматики, купируемое при усилении бронхорасширяющей терапии. Среднетяжёлая требует врачебного вмешательства и, возможно, купи¬ рования в амбулаторных условиях. Обычно такое обострение наблюдается приII стадии болезни. Тяжёлая — безусловно требующая стационарного лечения и проявляющаяся усилением симптоматики не только основного заболевания, но и осложнений.ХОБЛ - болезнь второй половины жизни и может сочетаться с другими болезнями органов дыхания, существенно изменяющими клиническую картину основного заболевания и требующими изменения диагностического и лечебного подходов. Важной особенностью условий возникновения ХОБЛ у конкретного индивидуума является длительное (исчисляемое порой десятилетиями) действие этиологических факторов (факторов риска). Длительное малодозное воздействие факторов риска определяет наличие длительного «субклинического» течения заболевания. И хотя этот субклинический период по своей продолжительности может варьировать от 3-4 до 10 лет, в этот период обычно пациент не обращается за медицинской помощью и не предпринимается активных мер по устранению (минимизации) действия внешних факторов риска. Таким образом, факторы риска продолжают действовать на пациента на протяжении длительного времени, затра¬ гивая не только респираторную систему.Следует подчеркнуть, что факторы риска ХОБЛ не являются строго специфиче¬ скими, а могут вести к формированию и других заболеваний как в респираторной системе, так и за её пределами (табл. 18-7).
328 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯТаблица 18-7. Общность факторов риска ХОБЛ и других болезнейФакторы риска ХОБЛЗаболевания, общие с ХОБЛ по факторам рискаТабакокурениеИБС, артериальная гипертензия, рак, пневмонии, хрониче¬ ский гастритСоциально-экономический статусПневмонии, туберкулёзПрофессияБронхиальная асша, рак, пневмонии, хронический гастритЗагрязнение окружающей средыБронхиальная астма, рак, пневмонии, хронический гастритРецидивирующая бронхолёгочная инфекцияПневмония, туберкулёз, бронхиальная астмаПеринатальная патология и детские болезниБронхиальная астма, бронхолёгочная дисплазияПитаниеБронхиальная астма, гастроэзофагеальнорефлюксная болезнь, артериальная гипертензия, хронический гастритБронхиальная гиперреактивностьБронхиальная астмаКак видно из приведённой таблицы, перечень заболеваний, имеющих общие причины, достаточно разнообразен. Но это относится к категории впервые выяв¬ ленных больных ХОБЛ. Что же касается всей популяции больных ХОБЛ, то сюда, по-видимому, можно отнести и ятрогенные заболевания, напрямую связанные с терапией ХОБЛ (табл. 18-8).Таблица 18-8. Ятрогенные болезни при ХОБЛЯтрогенные причиныЗаболевания, этиологически связанные с лечением ХОБЛПероральный приём теофиллинов, ГКС (в том числе и ингаляционных)Хронический гастрит, гастроэзофагеальный рефлюкс, микозы, остеопения, остеопороз, нарушения сердечного ритмаАнтибиотикиДисбактериозы, микозыР^-АгонистыОбострения ИБС, артериальная гипертензияТаким образом, напрашивается вывод, что сама сущность ХОБЛ с её хрониче¬ ским течением, кумуляцией длительно действующих факторов риска и длитель¬ ным приёмом лекарственных средств предполагает возникновение и сосущество¬ вание других заболеваний, которые могут существенно модифицировать течение ХОБЛ, Это положение подчёркивается и последней версией GOLD (2006).Следующий вопрос заключается во взаимоотношении патогенетических меха¬ низмов разных заболеваний у индивидуума с ХОБЛ. Ниже приводится таблица, демонстрирующая возможности взаимного отягощения ХОБЛ и сопутствующих болезней (табл. 18-9).Основные патогенетические механизмы проявления и прогрессирования ХОБЛ, имеющие на разных этапах и фазах болезни различную выраженность и значимость, являются, в свою очередь, факторами риска возникновения (пнев¬ монии, микозов, туберкулёза) и усугубления хронических сопутствующих забо¬ леваний.Немаловажным является изменение симптоматики заболеваний у больного н, соответственно, изменение диагностических алгоритмов (табл. 18-10).
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 329 Таблица 18-9. Механизмы взаимного отягощения ХОБЛ и сопутствующих заболеванийПатогенетические механизмы ХОБЛСопутствующие заболеванияГипоксемияИБС, гипертоническая болезнь, хронический гастрит, пневмонии, туберкулёз лёгкихНарушения микроциркуляции, эритроцитозПневмонии, бронхиальная астма, туберкулёз лёгких, микозИнфекция персистирующая + местный иммуноде¬ фицитТуберкулёз лёгких, бронхиальная астма, пневмонии, микозыИнфекционные эпизодыПневмонии, бронхиальная астма, туберкулёз лёгких, микозБронхиальная обструкцияТуберкулёз лёгких, бронхиальная астма, пневмонииТаблица 18-10. Модификация симптоматиш ХОБЛ сопутствующими заболеваниямиСопутствукнцие заболеванияМоди(}жцирующее действие на основные признаки ХОБЛБАКашель и одышка — приступообразные, ночные приступы. Вариабельность ОФВ,. ЭозинофилияИБСКашель и одышка в положении лёжа как лроявление недостаточности кровообращения. Периферические отёки. Нарушения сердечного ритма. Кардиалгии, купируемые нитратами. ФВД-признаки рестрикции. ЭКГ- ишемия миокарда, аритмииАртериальная гипертензияМожет изменяться характер кашля от ингибиторов АПФ. Гипертензия, На ЭКГ-признаки гипертрофии левых отделов миокардаГастроэзофагеальный рефлюксОдышка и кашель после еды, в положении лёжа, изжога. Рентгенологические и эндоскопические признаки недостаточности кардииОпухоли лёгкихВозможно кровохарканье. Могут быть постоянные тупые боли в грудной клетке. Объёмный процесс на рентгенограмме. Клетки опухоли в мокро¬ те и БАЛТуберкулёз лёгкихПоложительная проба Манту, Возможно кровохарканье. Характерна лихорадка. Микобактерии в мокроте. Инфильтрат, каверна или диссеми¬ нация на рентгенограммеПневмонииИнфильтрат на рентгенограммеНедоучёт влияния сопутствующих болезней на основные проявления ХОБЛ является нередкой причиной диагностических и лечебных ошибок у этой катего¬ рии больных. Не исключено, что это разнообразие вариантов неучтённых сопзт:'- ствующих болезней и, соответственно, не полностью адекватная терапия больного вносят свой вклад в разнообразие скорости прогрессирования ХОБЛ.Диагностика сопутствующей патологии относительно проста, надо только всегда иметь в виду возможность наличия сосуществующей болезни у пациента с ХОБЛ.Определённые сложности могут возникать при сочетании БА и ХОБЛ. БА и ХОБЛ — 2 самостоятельных хронических заболевания респираторной системы, наиболее распространённые среди населения. Несмотря на вполне определённые различия между Б А и ХОБЛ по механизмам развития, в клинических проявлениях и принципах профилактики и лечения эти 2 заболевания имеют некоторые общие
330 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯчерты. Кроме того, возможно и сочетание этих 2 болезней у одного человека. Всё ^ это создаёт известные трудности в практической работе даже хорошо информиро-ванного врача. Особую (и весьма существенную) популяцию составляют больные, сочетающие обе болезни. Обычно это лица старше 35 лет, с длительным анамнезом одной из болезней. Чаще всего ХОБЛ присоединяется к БА, чем наоборот. При присоединении ХОБЛ прослеживается длительное воздействие факторов риска (курение, профессиональные или бытовые вредности). Присоединением ХОБЛ к БА можно считать ту ситуацию, когда в стабильном состоянии БА (контролируе¬ мые симптомы, малая вариабельность ПСВ) сохраняется сниженный ОФВ^, даже если есть высокий прирост в пробе с ßj-aroHHCTOM. При длительном наблюдении за этими больными отмечается прогрессирование дыхательной недостаточности, носящей неуклонный характер, снижается эффективность кортикостероидов, ранее бывших вь[сокоэффективными. Для этих больных характерно снижение переносимости физической нагрузки, У этих больных, по сути дела, происходит суммация признаков обоих заболеваний. При присоединении БА к ХОБЛ появ¬ ляется волнообразность симптоматики, ранее отсутствующей, возникают ночные приступы респираторных симптомов.Эпидемиология этой микст-патологии практически не изучена. Однако если обратиться к данным по частоте обнаружения тяжёлой БА с резистентностью к стандартным средствам базисной терапии (глюкокортикостероидам) с нарас¬ тающими признаками дыхательной недостаточности и формированием лёгочного сердца, то это будет близко к числу лиц с сочетанием Б А и ХОБЛ (от 10 до 25% больных Б А).Особое место среди сопутствующих ХОБЛ болезней занимает туберкулёз лёг¬ ких. При наличии такого сочетания на 1-е место всегда выставляется туберкулёз и назначается соответствующая химиотерапия. Бронхообструктивный синдром (БОС) встречается при всех формах туберкулёза лёгких, частота его выявления зависит от длительности течения специфического процесса и от выраженности остаточных изменений в лёгких. При очаговом туберкулёзе БОС встречается в 52,7%, инфильтративном — в 56,6%, фиброзно-кавернозном — в 76,9%, при дис¬ семинированном — в 88,2% случаев. Распространённость БОС среди лиц с пост¬ туберкулёзными изменениями в лёгких отмечается в 2-3 раза чаще, чем среди остального населения, и составляет от 59,5 до 83,9%, а также является одной из основных причин временной потери трудоспособности, инвалидизации и пре¬ ждевременной гибели этих больных.Различают 3 формы сочетания БОС с туберкулёзом лёгких.• Паратуберкулёзный БОС (предшествующий туберкулёзу лёгких) вследствие ХОБЛ или других причин.• Метатуберкулёзный БОС, возникающий при длительно текущем активном туберкулёзе лёгких.• Посттуберкулёзный БОС, развивающийся после излечения активного тубер¬ кулёза на фоне остаточных посттуберкулёзных изменений в лёгких.Бронхиальная обструкция, которая предшествует туберкулёзу лёгких, чаще всего является ХОБЛ и диагностируется в 21% случаев.Метатз'беркулёзный БОС возникает при длительном течении туберкулёза в 75,8% случаев. При этом на степень выраженности БОС оказывает влияние рас¬ пространённость специфического процесса в лёгких. У больных с ограниченными процессами выраженные и резко выраженные нарушения бронхиальной прохо¬ димости выявлены в 40,1%, а при распространённых изменениях — в 83,3% слу¬ чаев. Развитию БОС при наличии туберкулёза лёгких способствует хирургическое лечение заболевания, когда в результате оперативного вмешательства нарушается архитектоника структурных элементов лёгочной ткани, происходит деформация бронхов. Такие формы возникают при кавернозном, фиброзно-кавернозном.
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 331Ешрротическом, диссеминированном туберкулёзе лёгких. Отличительная черта возникновения БОС при туберкулёзе - сочетание «неспецифических» этиоло¬ гических факторов: курение, хроническое раздражение, связанное с бытовым или производственным запылением и действием ирритантов со специфическим компонентом (интоксикация, раздражение дренирующих бронхов). Диагностика сочетания ХОБЛ с туберкулёзом успешна при проведении стандартного иссле¬ дования, принятого во фтизиатрии: исследование мокроты на микобактерии, рентгенография, туберкулиновая проба, определение антител к микобактериям в крови.Итак, наличие сопутствующих болезней при ХОБЛ — закономерность, которую следует учитывать при работе с этим контингентом больных. Не исключено, что недооценка сопутствующей патологии — одна из причин, определяющих неудачи в контроле ХОБЛ. И чем дольше будут жить больные ХОБЛ, тем больше будет возникать у них проблем в связи с присоединяющимися сопутствующими забо¬ леваниями, что требует большой гибкости от врача и проведения специальных исследований для изучения этой сочетанной патологии.ДиагностикаДиагностика ХОБЛ является ключевым элементом успешной последующей работы с больными ХОБЛ. Для ХОБЛ характерен относительно большой «докли¬ нический» период болезни с нарастанием влияния формирующейся эмфиземы лёгких, что проявляется неуклонным уменьшением обратимого компонента бронхиальной обструкции и естественным снижением эффективности бронхорас¬ ширяющей терапии ХОБЛ. Большинство исследований, демонстрирующих неэф¬ фективность мер, направленных на прогрессирование ХОБЛ, основаны на работе с контингентами в стадиях клинической манифестации болезни (II-IV стадии). В этих условиях актуальной проблемой является раніїяя диагностика ХОБЛ с ран¬ ним применением терапии, направленной на ключевые звенья патогенеза ХОБЛ. Основными ориентирами для постановки диагноза являются выявление влияния факторов риска ХОБЛ, обнаружение ранних клинических признаков болезни и функциональное исследование лёгких. Во II стадии ХОБЛ диагностика относи¬ тельно проста, так как больной сам обращается за медицинской помощью и у него обычно легко определимы все клинические и функциональные признаки ХОБЛ. ВI стадии и доклинических этапах большее значение имеет выявление факторов риска и малых клинических признаков респираторной патологии (рецидивирую¬ щие сезонные ОРЗ). К сожалению, ХОБЛ начинается раньше, чем возникают изме¬ нения ОФВ^. Функциональные исследования, документирующие доклиническую фазу ХОБЛ, трудоёмки и недоступны для широкого применения (определение объёма закрытия, зависимости экспираторного потока от плотности газа, иссле¬ дование кривой вымывания азота и кислорода и др.). Это возможно лишь при активном выявлении потенциальных больных в контингентах риска и проведении исследований по оценке эффективности терапии ранних стадий ХОБЛ, что может существенно изменить общепринятое положение о невозможности влиять на про¬ грессирование ХОБЛ. На сегодняшний день приходится констатировать тоталь¬ ную гиподиагностику ХОБЛ. Примером может служить исследование, проведён¬ ное Т. Кашіпига и соавт. в 2002 году (Япония). Исследовано 1496 пациентов старше 40 лет, поступивших в хирургические отделения для планового лечения нелё¬ гочных болезней. При поступлении у 6% были указания в анамнезе на ХОБЛ. При проведении им стандартного обследования у 36% верифицирована ХОБЛ. Приведённое наблюдение демонстрирует возможности диагностики ХОБЛ даже стандартными методами с использованием спирометрии. В 2000 году опубликованы результаты многоцентровых исследований более 4000 пациен¬ тов, проведённых в Испании с использованием спирометрии (IBERPOC study).
332ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯЯййгйа:.'В результате ХОБЛ была диагностирована в 9,3% случаев, причем у 78,2% из них ХОБЛ была диагностирована впервые. Лишь один из пяти больных ХОБЛ получал какое-либо лечение. Не получали терапии 90% больныхI стадии, 88,2% — П стадии и 50,7% больных III стадии ХОБЛ. Приведенные дан¬ ные демонстрируют возможности диагностики ХОБЛ путем повышения доступ¬ ности спирографии.Установление диагноза ХОБЛ основано на выявлении главных клинических признаков с учетом действия факторов риска и исключения заболеваний лёгких со сходными признаками. Условно все диагностические методы можно относить к категории обязательного минимума, используемого у всех больных, и к дополни¬ тельным методам, применяемым по специальным показаниям, что представлено в табл. 18-11.Таблица 18-11. Методы обследования больных ХОБЛМетоды исследованияОбязательный даа- гносшческий мини¬ мум (для всех боль¬ ных)Дополнительные методы исследования (по специальным показаниям)Анамнез+Физикальное обследование+Исследование ФВД (ЖЁЛ. ФЖЁЛ, ОФВ,)+Пробы с бронхолитикамиПри показателях ОФВ, <80% от должных величинОпределение газового состава кровиПри ОФВ. менее 40% или при несоответ¬ ствии одышки показателям ФВДРентгенография грудной клетки+Общий анализ крови+Цитологическое исследование мокро¬ ты+Микробиологическое (культуральное) исследование мокротыПри неконтролируемом прогрессировании респираторной инфекции для идентифика¬ ции инфекционного агента (вирусы, бакте¬ рии, грибы) и установления их чувствитель¬ ности к этиотропным средствамСканирование лёгких с ®^сОценка лёгочной микроциркуляцииСканирование лёгких с ксенономОценка вентиляционно'перфузионных отно¬ шенийОпределение основных показателей центральной гемодинамики и изме¬ рение давления в лёгочной артерии методом допплерэхокардиографииПри признаках формирования лёгочного сердца и для подбора средств адекватного контроля лёгочной гипертензииЭКГ+Сомнологическое исследованиеПри признаках обструктивных нарушений дыхания, связанных со сном
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 333Окончание табл. 18-11Бронхологическое исследование {осмотр, БАЛ, биопсия)Лу1Ркгунолопическое исследование фови и БАЛКТ лёгкихИсследование диффузионной способ¬ ности лёгкихКоагулологическое исследованиеИсследование качества жизниДля уточнения характера воспаления {цито¬ логическая характеристика) и для дифферен¬ циальной диагностики с другими заболева¬ ниями лёгкихПри неуправляемом прогрессировании инфекционных осложнений ХОБЛ. Для уточ¬ нения характера нарушения иммунорегуля- торных функций и подбора иммунорегуля- торных средствДля уточнения выраженности эмфиземы, для дифференциальной диагностикиДля уточнения характера вент;1ляционных расстройств (на уровне альвеолярно¬ капиллярной мембраны)При полицитйиии для подбора адекватной дезагрегирующей терапииДля оценки степени адаптации больного к заболеваниюПри изучении анамнеза заболевания экспертами БОЗ (GOLD) рекомендовано особое внимание уделять следующим моментам, имеющим диагностическое зна¬ чение:• Воздействие факторов риска.• Указания на диагностируемую в прошлом БА, аллергию любой формы и локализации, синуситы и полипы носовых ходов, респираторные инфекции в детстве и другие респираторные заболевания.• Наследственная предрасположенность к ХОБЛ и другим лёгочным болезням.• Характер развития признаков заболевания.• Данные об обострениях или предшествующих госпитализациях в связи с респираторными болезнями.• Наличие сопутствующих заболеваний, таких как болезни сердца или ревмати¬ ческие болезни, которые могут вести к снижению переносимости физической нагрузки.• Оценка адекватности проводимой терапии.• Влияние болезни на жизнь пациента: ограничение активности, нетрудоспо¬ собность и её экономические последствия, влияние на взаимоотношения в семье, ощущения депрессии и беспокойства.• общественная и семейная поддержка, доступная пациенту.• Возможности для ограничения действия факторов риска, особенно прекраще¬ ние курения.Необходимым условием для постановки диагноза ХОБЛ, по рекомендащ1И ВОЗ, является подсчет индекса курящего человека. Расчёт индекса курящего человека проводится следующим образом: количество выкуренных в день сигарет умно¬ жают на число месяцев в году, то есть на 12. Если эта величина превышает 160, то к]фение у данного пациента представляет риск в отношении развития ХОБЛ. При ■ревышении значений этого индекса более 200 больного следует относить к кате¬ гории злостных курильщиков.Анамнез курения рекомендуется рассчитывать в единицах «пачки/лет». Анамнез курения должен включать подсчет числа выкуриваемых сигарет в день, умножен¬ ного на количество лет и деленного на 20. Считается, что если данное значение■адй.ш
334ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯпревышает 25 пачек/лет, то больной может быть отнесен к «злостным куриль¬ щикам». В том случае, если этот показатель достигает значения 10 пачек/лет, то пациент считается «безусловным курильщиком». Бывшим курильщиком пациент считается в случае прекращения курения на срок 6 мес и более. Это необходимо учитывать при диагностике ХОБЛ.Одышка ~ основной, наиболее яркий клинический признак ХОБЛ, приносящий максимальные неудобства больным. Для определения выраженности одышки,D.A. Mahler и соавт. (1984) предлагают использовать опросник, определяющий исходный индекс одышки (ИИО) и транзиторный индекс одышки (ТИО). ИИО основан на суммировании ответов на вопросы, характеризующие функциональные нарушения, связанные с наличием одышки, сложность деятельности, вызывающей одышку, степень усилий, вызывающих одышку. При этом выраженность каждого признака оценивается по пятибалльной шкале (от 4 до 0) с максимальным коли¬ чеством баллов 12 (при наиболее выраженной одышке). ТИО дает возможность оценки изменения одышки в процессе наблюдения за больным. При подсчете ТИО учитывается сумма баллов при отклонении от показателей ИИО как в положи¬ тельную (уменьшение признака), так и в отрицательную (нарастание признака) сторону. Использование опросника позволяет учитывать все многообразие ощу¬ щений, суммированных в понятии «одышка», и измерять отклонения одышки от исходного уровня. Несколько проще оценка одышки по шкале одышки MRC (табл. 8-12).Таблица 8-12. Шкала одышки MRCСтепеньТяжестьОписание0НетОдышка не беспокоит, за исключением очень интенсивной нафузки1ЛёгкаяОдышка при быстрой ходьбе или при подъеме на небольшое возвышение2СредняяОдышка приводит к более медленной ходьбе по сравнению с другими людьми того же возраста, или появляется необходимость делать остановки при ходьбе 0 своем темпе по ровной поверхности3ТяжёлаяОдышка заставляет делать остановки при ходьбе на расстояние около 100 м или через несколько минут ходьбы по ровной поверхности4Крайне тяжёлаяОдышка не позволяет выходить из дому или появляется при одевании и раздеванииРезультаты объективного исследования пациентов с ХОБЛ зависят от степени выраженности бронхиальной обструкции и эмфиземы. По мере прогрессирова¬ ния болезни к кашлю присоединяется свистящее дыхание, наиболее ощутимое при ускоренном выдохе. Нередко при аускультации выявляются сухие разнотем¬ бровые хрипы. При выраженной эмфиземе изменяется внешний вид больного, появляется бочкообразная форма грудной клетки (увеличение в переднезаднем направлении), В связи с расширением грудной клетки и смещёнием вверх ключиц шея кажется короткой и утолщенной, надключичные ямки выпячены (заполнены расширенными верхушками лёгких). При перкуссии грудной клетки отмечается коробочный перкуторный звук, в случаях выраженной эмфиземы может полно¬ стью не определяться абсолютная тупость сердца. Края лёгких смещены вниз, подвижность их при дыхании ограничена. Вследствие этого из-под края реберной дуги может выступать мягкий безболезненный край печени при нормальных её размерах. Подвижность диафрагмы ограничивается, аускультативная картина изменяется: появляется ослабленное дыхание, уменьшается выраженность хри¬ пов, выдох удлиняется.
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 335Чувствительность объективных методов для определения степени тяжести ХОБЛ невелика. Среди классических признаков можно назвать свистящий выдох R удлинённое время выдоха (более 5 с), которые свидетельствуют о бронхиаль- вой обструкции. Результаты объективного обследования не полностью отражают тяжесть заболевания, а отсутствие клинических симптомов не исключает наличия ХОБЛ у пациента. Другие признаки, такие как дискоординация дыхательных дви¬ жений, центральный цианоз, также не характеризуют степень обструкции дыха¬ тельных путей.При I стадии ХОБЛ обычно не выявляется патологии со стороны органов дыхания, У больных со II стадией заболевания при исследовании органов дыха¬ ния могут выслушиваться сухие хрипы или отмечается несколько ослабленное дыхание (признак эмфиземы), однако по этим симптомам бывает невозможно определить степень выраженности обструкции дыхательных путей. При утрате обратимого компонента обструкции доминирзтот стойкие признаки дыхательной недостаточности, нарастает лёгочная гипертензия, формируется хроническое лёгочное сердце. Выявить признаки компенсированного лёгочного сердца при физическом обследовании затруднительно. По мере прогрессирования заболева¬ ния наблюдаются сначала транзиторные, а затем и постоянные гипоксия и гипер- юпния, нередко повышается вязкость крови, что обусловлено вторичной полици- темией. Развивается декомпенсированное лёгочное сердце. Для больных с III-IV стадией ХОБЛ характерны усугубление одышки, диффузный цианоз, признаки осложнений ХОБЛ, уменьшение массы тела. Большинство больных — заядлые курильщики, в анамнезе — частые респираторные заболевания, преимущественно в холодное время года. Таким образом, данные физикального обследования при ХОБЛ недостаточны для установления диагноза заболевания, а дают лишь ориен¬ тиры для дальнейшего направления диагностического исследования с применени¬ ем инструментальных и лабораторных методов.ІССЛЕДОВАНИЕ ФВДВедущее значение в диагностике ХОБЛ и объективной оценке степени тяжести заболевания имеет исследование функции внешнего дыхания. Экспертами ВОЗ (GOLD) значение спирометрии в диагностике ХОБЛ подчёркивается в виде сле¬ дующих ключевых положений:• Диагноз ХОБЛ базируется на данных о действии факторов риска и выявлении не полностью обратимого ограничения воздушного потока, при наличии или отсутствии симптомов.• Пациенты с продуктивным хроническим кашлем должны бьггь подвергнуты исследованию ФВД для обнаружения ограничения воздушного потока, даже если у них нет одышки.• Спирометрия является золотым стандартом в диагностике ХОБЛ и наблюде¬ нии за этими больными, так как показатели спирометрии лучше всего стан¬ дартизируются, воспроизводятся и являются наиболее объективными.Обязательным является определение следующих объёмных и скоростных пока¬ зателей: жизненная ёмкость лёгких (ЖЁЛ), форсированная жизненная ёмкость лёгких (ФЖЁЛ), ОФВ^ и ОФВуФЖЁЛ. Изучение этих показателей формирует функциональный диагноз ХОБЛ.Наиболее важным для диагностики ХОБЛ является определение хрони¬ ческого ограничения воздушного потока, то есть бронхиальной обструкции. Общепринятыми методами регистрации бронхиальной обструкции являются спи¬ рометрия и пневмотахометрия, проведенные во время форсированного экспира¬ торного маневра. Основным критерием, определяющим хроническое ограничение воздушного потока, является падение показателя OФBJ до уровня менее 80% от жшжных величин, а ОФВ/ФЖЁЛ — менее 70%, Обладая высокой степенью вос¬
у*/'.' 336 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯпроизводимости. данные параметры позволяют документально зарегистрировать у пациента наличие обструкции и в дальнейшем следить за состоянием бронхи¬ альной проходимости и её изменчивостью. Бронхиальная обструкция считается хронической, если она регистрируется при проведении повторных спирометриче¬ ских исследований как минимум 3 раза в течение 1 года, несмотря на проводимую терапию. Одного обнаружения бронхиальной обструкции в процессе диагностики ХОБЛ недостаточно. Необходимо также определять наличие и выраженность обратимого и необратимого компонентов бронхиальной обструкции.Для исследования обратимости обструкции используются пробы с ингаляци¬ онными бронходилататорами и оценивается их влияние на показатели кривой «поток-объём», главным образом на ОФБ,^, Параметры, обозначающие уровень форсированных экспираторных потоков при различных уровнях ФЖЁЛ, не могут сравниваться, так как сама ФЖЁЛ, по отношению к которой рассчитываются эти потоки, изменяется при повторных тестах. Для расчёта бронходилатационного ответа рекомендуется использовать параметр ОФВ^,Бронходилатационный ответ зависит от фармакологической группы бронхо- литика, путей его введения и техники ингаляции. Факторами, влияющими на бронходилатационный ответ, также являются: назначаемая доза; время, про¬ шедшее после ингаляции; бронхиальная лабильность во время исследования: исходное состояние легочной функции; воспроизводимость сравниваемых пока¬ зателей; погрешности исследования. При обследовании конкретного пациента с ХОБЛ необходимо помнить, что обратимость обструкции — величина вариа¬ бельная, и у одного и того же больного может быть разной при обострении н ремиссии.в качестве бронходилатационных препаратов при проведении тестов у взрос¬ лых рекомендуется назначать:• ^2-агонисты короткого действия (начиная с минимальной дозы до макси¬ мально допустимой: фенотерол — от 100 до 800 мкг; сальбутамол — от 200 до 800 мкг, тербуталин^ — от 250 до 1000 мкг) с измерением бронходилатацион¬ ного ответа через 15 мин;• антихолинергические препараты — в качестве стандартного препарата реко¬ мендуется использовать ипратропиум бромид (начиная с минимальных доз — 40 мкг, до максимально возможных доз — 80 мкг) с измерением бронходила¬ тационного ответа через 30-45 мин.Во избежание искажения результатов и для правильного выполнения бронходи¬ латационного теста необходимо отменить проводимую терапию в соответствии с фармакокинетическими свойствами принимаемого препарата (Рз-агонисты корот¬ кого действия — за 6 ч до начала теста, длительно действующие р^'згонисты — за12 ч, пролонгированные теофиллины — за 24 ч).Прирост ОФВ, более чем на 15% исходных показателей принято расценивать как обратимую обструкцию. Следует подчеркнуть, что нормализации ОФВ^ в тесте с бронходилататорами у больных ХОБЛ практически никогда не происходит. В то же время отрицательные результаты в тесте с бронхолитиками (прирост <15%) не исключают увеличения ОФВ, на большую величину в процессе длительного адек¬ ватного лечения. После однократного теста с Рд-агонистами примерно у Уз паци¬ ентов с ХОБЛ происходит существенное увеличение ОФВ,, у остальных обычно это наблюдается после серии тестов.Важным методом, позволяющим подтвердить диагноз ХОБЛ, является мони¬ торирование ОФВ, — многолетнее повторное измерение этого спирометриче¬ ского показателя. В домашних условиях для мониторирования выраженности обструкции удобно использовать показатель пиковой скорости выдоха (ПСВ). определяемой с помощью индивидуального пикфлоуметра. Для ХОБЛ пикфлоу- метрия имеет относительное значение. Тем не менее метод позволяет определить
Ж:ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 337суточную изменчивость выраженности бронхиальной обструкции, которая при д ХОБЛ обычно не превышает 15%. Наиболее ценным является измерение показа¬ телей ПСВ для дифференциации ХОБЛ и БА. При классических неосложнённых формах БА суточная изменчивость ПСВ обычно превышает 15%. Наряду с этим реіулярное измерение ПСВ служит легкодоступным методом объективной оценки эффективности бронходилатирующей терапии в условиях ежедневного самокон- чроля как в амбулаторных, так и в стационарных условиях.Функциональные расстройства при ХОБЛ проявляются не только нарушени¬ ем бронхиальной проходимости, но также изменением структуры статических объёмов, нарушением эластических свойств, диффузионной способности лёгких, снижением физической работоспособности. Определение этих групп расстройств является дополнительным.Бронхиальная обструкция может приводить к изменению структуры статических объёмов в сторону гипервоздушности (гиперинфляции — перерастяжения) лёгких, в целях выявления изменений соотношений статических объёмов, составляющих структуру общей емкости лёгких при гипервоздушности и эмфиземе лёгких, обще¬ принято применение 2 основных методов; бодиплетизмографии и измерения лёгоч¬ ных объёмов. Основным проявлением гипервоздушности лёгких служит повышение общей емкости лёгких.Анатомические изменения паренхимы лёгких при эмфиземе (уменьшение пло¬ щади альвеолярной поверхности, расширение воздушных пространств, деструкция эластического каркаса стенок альвеол, запустевание капиллярного русла межаль- веолярньгх перегородок) функционально проявляются изменением эластических свойств лёгочной ткани — повышением статической растяжимости. Отмечается изменение формы и угла наклона петли «давление-объём».Измерение диффузионной способности лёгких выполняется на втором этапе оценки лёгочной функции после проведения форсированных спирометрии или пневмотахометрии и определения структуры статических объёмов. Исследование диффузии применяется для выявления поражения лёгочной паренхимы вслед¬ ствие эмфиземы лёгких.При эмфиземе показатели диффузионной способности лёгких — и её отно¬ шения к альвеолярному объёму 01^^^ — снижены, главным образом, вследствие деструкции альвеолярно-капиллярной мембраны, уменьшающей эффективную площадь газообмена. Однако снижение диффузионной способности лёгких на еди¬ ницу объёма (то есть площади альвеолярно-капиллярной мембраны) может быть компенсировано возрастанием общей ёмкости лёгких. Обычно диффузионная способность при наличии симптомов ХОБЛ снижена, что означает присоединение эмфиземы.ХОБЛ сопровождается нарушением вентиляционно-перфузионных соотно¬ шений, что может приводить к артериальной гипоксемии - снижению напря¬ жения кислорода в артериальной крови (РРг)- Кроме того, вентиляционная дыхательная недостаточность приводит к повышению напряжения углекислоты в артериальной крови (Р^СОз). У больных ХОБЛ с хронической дыхательной недостаточностью наступающий ацидоз метаболически компенсируется повы¬ шенной продукцией гидрокарбоната, что позволяет поддерживать относительно нормальный уровень pH.Взаимосвязь между ОФВ, и газовым составом крови незначительна. Определять газовый состав крови рекомендуется при ОФВ, менее 40% должных величин либо при клинических признаках дыхательной или правожелудочковой недостаточ¬ ности. Это необходимо для оценки лёгочного газообмена, уточнения характера прогрессирования болезни и выраженности дыхательной недостаточности.У некоторых пациентов ХОБЛ усугубляется гипоксемией и гиперкапнией во сне, особенно в периоды быстрого движения глаз. У этих пациентов более выражена и
338 обструктивные заболеваниялёгочная гипертензия в лёгочной артерии. При сочетании ХОБЛ с обструктивным "8. нарушением дыхания во сне (то есть с синдромом перекреста) показаны специаль-> мое сомнологическое исследование и коррекция этого расстройства.:Пульсоксиметрия применяется для измерения и мониторирования насыщения гемоглобина крови кислородом однако она даёт возможность регистриро-вать лишь уровень оксигенации и не позволяет следить за изменениями Р^СОз. Если показатель составляет менее 94%, то показано исследование газов крови.При прогрессировании ХОБЛ достаточно часто наблюдается повышение дав¬ ления в лёгочной артерии. Выраженность лёгочной гипертензии имеет плохое прогностическое значение. Среди неинвазивных методов контроля лёгочной гипертензии наилучшие результаты получены с помощью допплерэхокардиогра¬ фии. В обычной практике ведения больных ХОБЛ использование прямых методов измерения давления в лёгочной артерии не рекомендуется.в ряде случаев у больных ХОБЛ требуется функциональное исследование дыхательных мышц. Особенно это важно при похудании больных, подозрении на стероидную миопатию и при гиперкапнии, не пропорциональной показателям ОФВ,.ИССЛЕДОВАНИЯ С ФИЗИЧЕСКОЙ НАГРУЗКОЙВ начальных стадиях заболевания могут отсутствовать нарушения диффузи¬ онной способности и газового состава крови в покое и проявляться только при физической нагрузке. У пациентов более тяжёлой категории решение о целесоо¬ бразности назначения кислородной терапии может зависеть и от степени ограни¬ чения физической работоспособности. Для объективизации и документирования степени снижения толерантности к нагрузке существуют различные методы. Пробы с физической нагрузкой могут проводиться с использованием различных устройств для дозирования нагрузки (велоэргометры, тредмилы) или без них, когда в качестве критерия физической толерантности используется величина дис¬ танции, пройденной пациентом за определённое время (шаговая проба). При про¬ ведении 6-минутной шаговой пробы больному ставится задача пройти как можно большую дистанцию за 6 мин, после чего пройденное расстояние регистрируется. При возможности во время проведения теста следует определять насыщение крови кислородом методом пульсоксиметрии. Есть данные о корреляции величины пройденного расстояния с показателями лёгочной диффузии. Обычно больной ХОБЛ с показателем ОФВ^ около 1 л, или 40% должного, проходит за 6 мин около 400 м. Показатели 6-минутного теста очень вариабельны и зависят в значительной степени от эмоционального состояния и мотивации. Этот метод является наиболее простым средством для индивидуального наблюдения и мониторирования тече¬ ния заболевания. Проба с физической нагрузкой используется в случаях, когда выраженность одышки не соответствует снижению ОФВ,. Она используется для отбора больных на реабилитационные программы.ИССЛЕДОВАНИЯ МОКРОТЫЦитологигеское исследование мокроты даёт информацию о характере воспали¬ тельного процесса и его выраженности.Культуральное микробиологическое исследование мокроты целесообразно про¬ водить при неконтролируемом прогрессировании инфекционного процесса и подборе рациональной антибиотикотерапии. Является дополнительным методом обследования.ИССЛЕДОВАНИЕ КРОВИКлинигеский анализ. При стабильном течении ХОБЛ существенных изменений содержания лейкоцитов периферической крови не происходит. При обострении
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 339наиболее часто наблюдаются нейтрофильный лейкоцитоз с палочкоядерным сдвигом и увеличение СОЭ, Однако эти изменения наблюдаются не всегда,С развитием гипоксемии у больных ХОБЛ формируется полицитемический синдром, для которого характерны изменение гематокрита (гештокрит >47% у женщин и >52% — у мужчин), повышение числа эритроцитов, высокий уровень гемоглобина, низкая СОЭ и повышенная вязкость крови.Илшунологигеское исследование крови является дополнительным и проводится при неуклонном прогрессировании инфекционного воспалительного процесса для выявления признаков иммунной недостаточности.РЕНТГЕНОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯРентгенологигеское исследование органов грудной клетки является обязатель¬ ным методом обследования. При рентгенографии лёгких в прямой и боковой проекциях при ХОБЛ обнаруживаются увеличение прозрачности лёгочной ткани, низкое стояние купола диафрагмы, ограничение её подвижности, увеличение регростернального пространства, что характерно для эмфиземы.При I стадии ХОБЛ существенные рентгенологические изменения могут не обнаруживаться. У больных во II и П1 стадиях ХОБЛ возможно обнаружение низкого стояния купола диафрагмы, уплощение и ограничение её подвижности, гапервоздушность лёгочных полей, буллы и увеличение ретростернального про¬ странства; сужение и вытянутость сердечной тени; на фоне обеднения сосудисты- ыи. тенями определяются высокая плотность стенок бронхов, инфильтрация по их ходу, то есть выявляется ряд признаков, характеризующих воспалительный про¬ цесс в бронхиальном дереве и наличие эмфиземы.При первичном рентгенологическом обследовании важно исключение других заболеваний лёгких, в частности неопластических процессов и туберкулёза. При обострении ХОБЛ рентгенография лёгких позволяет исключить пневмонию, спон¬ танный пневмоторакс и другие осложнения.Компьютерная томография лёгких является дополнительным методом и про¬ водится по специальным показаниям. Она позволяет количественно определить морфологические изменения лёгких, в первую очередь эмфизему, более чётко выявить буллы, их локализацию и размеры,ДРУГИЕ МЕТОДЫ ИССЛЕДОВАНИЯЭлектрокардиография позволяет у ряда больных выявить признаки гипертро¬ фии правых отделов сердца, однако её ЭКГ-критерии резко изменяются из-за эмфиземы. Данные ЭКГ в большинстве случаев позволяют исключить кардиаль¬ ный генез респираторной симптоматики.Парадоксальный пульс: при вдохе наполнение пульса на лучевой артерии уменьшается. Парадоксальный пульс определяется как снижение амплитуды пуль¬ совой волны при неглубоком вдохе. Если изменения амплитуды слабовыражены, необходимо использовать манжетку сфигмоманометра. Систолическое давление во время вдоха снижается более чем на 10 мм рт.ст.Бронхологическое исследование является дополнительным для больных ХОБЛ. Оно проводится для оценки состояния слизистой оболочки бронхов и дифференци¬ ального диагноза с другими заболеваниями лёгких. В ряде случаев могут быть выяв- жт>1 заболевания, являющиеся причиной хронической бронхиальной обструкции.Исследование может включать;• осмотр слизистой оболочки бронхов;• культ)фальное исследование бронхиального содержимого;• БАЛ с определением клеточного состава для уточнения характера воспале¬ ния;• биопсию стенки бронха.
340 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯВ последнее десятилетие для оценки характера течения заболевания и адапта¬ ции пациента к ХОБЛ определяют качество жизни. Качество жизни — интеграль¬ ный показатель, определяющий адаптацию больного к болезни и возможность выполнения привычных для больного функций, связанных с его социально- экономическим положением (на работе и в быту). Для определения качества жизни применяются специальные анкеты. Наиболее известной для больных ХОБЛ является анкета госпиталя святого Георгия.Итак, диагностика ХОБЛ осуществляется при суммировании следующих дан¬ ных: факторах риска, клинических признаках, главными из которых являются кашель и экспираторная одышка, и при обнаружении нарушения бронхиальной проходимости при исследовании ФВД (снижение ОФВ^). Важным компонентом диагностики является указание на прогрессирование болезни. Обязательное усло¬ вие диагностики — исключение других заболеваний, которые могут привести к появлению аналогичных симптомов.Дифференциальная диагностикаОсновная задача дифференциальной диагностики ХОБЛ — исключение забо¬ леваний со сходной симптоматикой. В дифференциально-диагностический ряд в первую очередь следует ставить фиброзирующие альвеолиты (хронические формы экзогенных аллергических альвеолитов) и бронхиальную астму. Проведение рентгенологического и бронхологического исследований легко исключает нали¬ чие фиброзирующих альвеолитов, для которых типичны интерстициальная инфильтрация лёгочной ткани, лимфоцитарный (а иногда и эозинофильно¬ лимфоцитарный) характер БАЛ и соответствующие результаты чрезбронхиальной лёгочной биопсии (гранулёмы, инфильтрация иммунокомпетентными клетками).Несмотря на вполне определённые различия между БА и ХОБЛ по механизмам развития, в клинических проявлениях и принципах профилактики и лечения эти 2 заболевания имеют некоторые общие черты. Кроме того, возможно и сочетание этих 2 болезней у одного человека. Все это создаёт известные трудности в практи¬ ческой работе даже хорошо информированного врача. Мало того, существовавшая многие годы терминологическая неопределенность по меньшей мере не вносила ясности и простоты в лечебно-диагностический процесс и способствовала возник¬ новению большого числа погрешностей как в диагностике, так и в лечении этих2 широко распространённых болезней. К началу нового тысячелетия (2000-2002) появилось достаточно информации, позволяющей более чётко определять пози¬ цию врачей относительно БА и ХОБЛ, Конечно, в крайних позициях, то есть при ярко выраженных (классических) клинико-лабораторных признаках БА и ХОБЛ, дифференциальную диагностику и дифференцированное лечение проводить легко и просто.Общим для этих заболеваний являются хронический воспалительный про¬ цесс, который и определяет клиническую картину заболевания, а также методы диагностики и лечения. И если при БА воспалительный процесс имеет аллерги¬ ческий характер и локализуется преимущественно в воздухоносных путях, то при ХОБЛ наблюдается совершенно иная картина. Во-первых, характер хронического воспаления ещё не до конца установлен, но это не аллергическое воспаление. Отличительной чертой ХОБЛ является и локализация воспаления. Так же как при БА воспаление локализуется преимущественно в периферических дыхатель¬ ных путях, но, в отличие от БА, воспаление при ХОБЛ этим не ограничивается, а распространяется на интерстициальную ткань и паренхиму лёгких, приводя к деструкции эластического каркаса стенок альвеол и формированию эмфиземы лёгких. Именно этот механизм является основным в формировании необрати¬ мого компонента бронхиальной обструкции. Поэтому и заболевание называется «хроническая обструктивная болезнь лёгких», что предполагает поражение всех
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ341компонентов лёгких, а не только воздухоносных путей. Следующей важной отли¬ чительной чертой ХОБЛ является прогрессирующий характер течения заболева- ния, что не свойственно классической БА. Для БА характерны волнообразность и обратимость респираторных симптомов. При ХОБЛ наблюдается медленное, но неуклонное нарастание одышки, плохо контролируемой обычными бронходила- таторами.Дифференциальная диагностика Б А и ХОБЛ основана на интеграции основ¬ ных данных клиники, результатов функциональных и лабораторных тестов. В настоящее время ещё нет лабораторного маркёра, надёжно дифференцирующего эти 2 болезни. Основной акцент в дифференциальной диагностике делается на установлении главных признаков, определяющих сущность болезни; для БА это волнообразность и обратимость симптоматики, а для ХОБЛ ~ неуклонное про¬ грессирование и отсутствие обратимости. Основные пункты для современной диа¬ гностики этих болезней представлены в табл. 18-13.Таблица 18-13. Ведущие отправные пункты диатостики БА и ХОБЛБронхиальная астмаХроническая обструктивная болезнь лёгких• Действие факторов риска• Отягощённая наследственность• Волнообразность клинических проявлений, отсутствие прогрессирования при неосложнённых формах БА• Прирост ОФВ. >15% в пробе с р^-агонистами• Внелёгочные проявления аллергии• Действие факторов риска »Возраст >35 лет• Позднее появление и медленное неуклонное нарас¬ тание респираторных симптомов• Снижение ОФВ, и ОФВуФЖЁЛ• Прирост ОФВ, <15% а пробе с ^^-агонистами• Ранняя диагностика (в I стадии) возможна лишь при активном выявлении больных в контингентах рискаДля больных БА характерен классический список факторов риска — аллерге¬ нов, вызывающих развитие заболевания. Это бытовые аллергены, пыльца рас¬ тений, некоторые производственные факторы. Список возможных причинных факторов велик и изложен в специальных руководствах по БА. Что касается ХОБЛ, то тут главным фактором риска является курение (до 90%), но в последние годы появились данные о влиянии продуктов сгорания некоторых видов бытового топлива, промышленного загрязнения и некоторых производственных факторах (кремний, кадмий).Для большинства больных БА прослеживается наследственная предрасполо¬ женность, чего не наблюдается у больных ХОБЛ. В то же время БА может начаться в любом периоде жизни больного, а ХОБЛ — болезнь второй половины жизни, и нужны очень серьёзные аргументы для постановки диагноза ХОБЛ в молодом возрасте. Это связано отчасти с кумулированием действия фактора риска в течение многих лет.Важнейшим компонентом диагностики является анализ клинических про¬ явлений. Тут выявляются вполне определённые и основополагающие различия. Для больных БА характерны волнообразность симптоматики, яркость клиниче¬ ских проявлений и их обратимость либо спонтанно, либо под влиянием терапии. Тяжесть состояния больного БА не определяется стажем болезни и может быть максимальной в дебюте заболевания, а затем при адекватной терапии может наступить полное исчезновение основных признаков болезни. При ХОБЛ болезнь подкрадывается постепенно при условии длительного действия фактора риска. Первые симптомы замечаются больным обычно уже во II стадии болезни. Следует подчеркнуть определённые различия в социальном статусе среднего больного БА и ХОБЛ. Если больной БА может принадлежать к любым слоям населения, то ХОБЛ наиболее часто развивается у больных с низким социально-экономическим уров¬ нем. Это в значительной мере и определяет возможности больных реагировать на
342 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯранние признаки болезни. У больных БА чувствительность к минимальным сим¬ птомам болезни высока, что в большинстве случаев заставляет их без промедления обращаться за медицинской помощью. Больной ХОБЛ ранний признак болезни — кашель, проявляющийся по утрам, обычно относит к естественному состоянию курящего человека и не предпринимает никаких мер, а задумывается о состоянии своего здоровья только тогда, когда появляется одышка, а это обычно происходит через 8-10 лет после появления кашля. Таким образом, налицо предпосылки для поздней диагностики ХОБЛ.Изменения ФВД также подчёркивают основную отличительную черту этих двух заболеваний — волнообразность симптоматики, которая характерна для больных БА и отсутствует при ХОБЛ. При этом функциональные изменения при ХОБЛ носят прогрессирующий, инвалидизирующий характер.Особую (и весьма существенную — до 25%) популяцию составляют больные с сочетанием обеих болезней. В таких случаях смысл проведения дифференциаль¬ ной диагностики утрачивается, а диагностируются оба заболевания.Таким образом, современное развитие пульмонологии предлагает довольно простые и надежные критерии дифференциальной диагностики больных БА и ХОБЛ, что позволяет избежать большого количества стандартных ошибок.На определённых стадиях развития ХОБЛ, особенно при однократной (первой) встрече с больным, может возникать необходимость дифференцировать ХОБЛ от ряда заболеваний со сходной (внешне) симптоматикой. Приведённая ниже табл. 18-14 суммирует основные отличительные признаки этих заболеваний, позволяющих легко избежать диагностических ошибок.Таблица 18-14. Отличительные от ХОБЛ признаки некоторых хронических заболеваний, протекаю¬ щих со сходной симптоматикойЗаболеванияОсновные дифференциальные признакиЗастойная сердечная недостаточ¬ ность• Характерные базальные хрипы при аускультации• Рентгенография — расширение тени сердца и признаки отёка лёгочной ткани• ФВД — рестрикция, отсутствие обструкцииБронхозктазии• Большое количество гнойной мокроты• Частые рецидивы бактериальной респираторной инфекции• Грубые разнотембровые сухие и разнокалиберные хрипы при аускуль¬ тации• Рентгенологическое исследование (КТ) - расширение бронхов и уплот¬ нение их стенокТуберкулёз• Начало в любом возрасте* Характерные рентгенологические признаки* Микробиологическое подтверждение• Эпидемиологические признаки (высокая распространённость туберку¬ лёза в регионе)Облитерирующий бронхиолит• Начало в молодом возрасте у некурящих• Указание на ревматоидный полиартрит или вдыхание дыма в анамнезе• КТ обнаруживает зоны пониженной плотностиДиффузный панбронхиолит• Некурящие мужчины• У подавляющего большинства хронические синуситы• КТ — диффузно расположенные центролобулярные узелковые тени, признаки гиперинфляцииДифференциальная диагностика на разных стадиях развития ХОБЛ имеет свои особенности. При I стадии — это выявление отличий от других заболеваний, связанных с факторами экологической агрессии, протекающих субклиническн
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 343ИЛИ с малой симптоматикой. Это в первую очередь различные варианты хрони¬ ческих бронхитов и полисинуситов, в подобных ситуациях помогает применение специальных фармакологических тестов на выявление бронхиальной гиперре¬ активности и тестов с физической нагрузкой, а также наблюдение за динамикой ОФВ^. Особые сложности возникают при проведении дифференциального диа¬ гноза у больных с IV стадией ХОБЛ. Сложность заключается не только в тяже¬ сти больных и выраженности необратимых изменений, но и в большом наборе сосуществующих заболеваний (ИБС, гипертоническая болезнь, болезни обмена), которые нередко возникают во второй половине жизни, особенно при длитель¬ ном воздействии факторов экологической агрессии, ставших для больных при¬ вычным явлением.в этих ситуациях необходимо выявлять ведущее заболевание, приносящее в момент обследования максимальные неудобства больному. При формулирова¬ нии диагноза следует указывать стадию, фазу заболевания (стабильная или обо¬ стрение) и осложнения. Следует подчеркнуть, что указание в диагнозе эмфиземы или хронического бронхита нецелесообразно, поскольку эти обязательные ком¬ поненты ХОБЛ не отражающие весь объём патологических состояний в парен¬ химе лёгких и воздухоносных путях, поэтому их не используют в формулировке (GOLD, 2006).ЛечениеЦелью лечения ХОБЛ является снижение темпов прогрессирования диффуз¬ ного повреждения бронхов, ведущего к нарастанию бронхиальной обструкции и дыхательной недостаточности, уменьшение частоты и продолжительности обо¬ стрений, повышение толерантности к физической нагрузке и улучшение качества жизни. Сегодняшнее состояние проблемы лечения ХОБЛ предполагает учитывать некоторые главные положения.• Необходимо систематическое слежение за характером прогрессирования ХОБЛ.• Отсутствие метода или средства, способного остановить прогрессирование болезни, являющегося отличительной чертой ХОБЛ.• При выборе наиболее эффективных средств и методов лечения больного ХОБЛ следует пользоваться принципами «медицины доказательств».• Необходимо создавать индивидуализированные программы лечения ХОБЛ с учётом степени тяжести (стадии развития) заболевания.• Уменьшение действия факторов риска.• Лечение стабильной ХОБЛ (вне обострения).• Лечение обострений ХОБЛ.Систематическое наблюдение за больными осуществляется по принципам, юложенным в предыдущем разделе, посвящённом диагностике. Сроки повторных плановых обследований определяются индивидуально в зависимости от характера течения, но не реже 1 раза в год. В GOLD подчеркивается: «...ещё не создано метода или средства, способного прекратить прогрессирование ХОБЛ. Ни одно из извест¬ ных средств не в состоянии приостановить прогрессирование хронического вос¬ паления и каскада вызываемых им функциональных и морфологических послед¬ ствий». Не исключено, что это связано с нарастающей экологической агрессией и малозаметным началом болезни, что создаёт предпосылки для позднего выявле¬ ния и позднего начала лечения. Как бы там ни было, при построении лечебных планов следует ставить реально выполнимые задачи.Естественным следствием отсутствия средства, вылечивающего ХОБЛ, является постоянный его поиск, что порождает множество предложений, эффективность которых может вызывать сомнения, в связи с этим экспертами ВОЗ рекомендуется пользоваться критериями «медицины доказательств» при формировании лечеб-
344 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯНОЙ программы. Эти критерии основаны на степени достоверности и надёжности сведений о средстве лечения.• «А» — наивысшая категория доказательности: данные получены в результате рандомизированных контролированных исследований с большим числом наблюдений.• «В» — следуюш;ий, более низкий уровень очевидности, основанный на дан¬ ных, полученных в рандомизированных контролированных исследованиях с ограниченным числом наблюдений.• «С» — еш;ё более низкий уровень очевидности, базирующийся на результатах нерандомизированных исследований.• «В» — самый низкий уровень, представляющий набор мнений, основанных на клиническом опыте.в дальнейшем все основные предложения по лечению ХОБЛ будут марки¬ роваться соответствующими индексами в зависимости от критериев медицины доказательств.Независимо от принципов индивидуализации больных для каждой степени тяжести (стадии прогрессирования) заболевания разработаны определённые стан¬ дарты, регламентирующие объёмы и характер лечебных воздействий, которых следует придерживаться.Важнейший элемент, без которого лечение ХОБЛ теряет свою эффективность и смысл, — это ограничение, а если это достижимо, то и прекращение действия факторов риска, из которых ведущим является табакокурение.Программы поддерживающей терапии и лечения обострений ХОБЛ существен¬ но отличаются и поэтому должны формироваться отдельно.Указанные стратегические направления являются основным ориентиром для индивидуальной работы с больным. При определении стратегии лечения конкрет¬ ного больного цель лечения должна быть реальной и достаточной. Необходима ранняя и последовательная терапия на всех этапах развития ХОБЛ. Реализация стратегических целей обычно осуществляется путём проведения ряда индивидуа¬ лизированных организационных и лечебных мероприятий (тактика лечения).• Обучение пациентов.• Бронходилатирующая терапия.• Глюкокортикоидная терапия (противовоспалительная),• Мукорегуляторная терапия.• Противоинфекционная терапия.• Коррекция дыхательной недостаточности.• Реабилитационная терапия.ОБУЧЕНИЕ ПАЦИЕНТОВОтветственный этап индивидуальной работы с больным. Пациент должен бьггь хорошо осведомлён о сущности заболевания, особенностях его течения. Больной должен быть активным, сознательным участником лечебного процесса. На этом этапе врачом при участии больного разрабатывается индивидуальный план лечения. Очень важно, чтобы при составлении плана лечения ставились реальные, выполнимые цели с учётом выраженности бронхиальной обструкции, значимости обратимого его компонента и характера прогрессирования заболе¬ вания. Постановка невыполнимых задач вызывает у пациента разочарование, снижает веру в целесообразность выполнения лечебной программы и в конечном итоге нарушает готовность больного следовать рекомендациям лечащего врача. Прекращение курения — первый обязательный шаг. Пациент должен чётко осо¬ знавать вредоносное действие курения на его дыхательную систему. Составляется конкретная программа по ограничению и прекращению курения. Экспертами ВОЗ подчёркиваются ключевые положения по преодолению табакокурения.
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 345• Прекращение курения — единственный наиболее эффективный и экономи¬ чески оправданный метод ограничения действия факторов риска развития ХОБЛ и торможения его прогрессирования.• Даже короткие программы лечения табакозависимости эффективны, и каж¬ дый курильщик должен подвергаться хотя бы короткому лечению,• три типа нелекарственного лечения наиболее эффективны: практические рекомендации, социальная поддержка как часть лечения и социальная под¬ держка, не входящая в лечебную программу.• Фармакотерапия табакозависимости достаточно эффективна и при отсут¬ ствии противопоказаний к ней должна присоединяться к нелекарственной терапии табакокурения.Возможно привлечение психотерапевтов, иглорефлексотерапевтов. Преодоле¬ ние табакокурения — большая проблема, имеющая государственное значение.В странах Восточной Европы (Польша, Венгрия, Чехия) созданы десятки спе¬ циализированных клиник для лечения табакозависимости. В России решение этой проблемы пока находится в зачаточном состоянии.В образовательные программы для больных включается обучение правильно¬ му применению лекарственных средств (индивидуальные ингаляторы, спейсеры, небулайзеры). Пациенты должны быть обучены основным правилам самокон¬ троля, в том числе и с использованием пикфлоуметров. При этом они должны уметь объективно оценивать свое состояние и при необходимости предприни¬ мать меры по оказанию себе неотложной помощи. Важным этапом образования пациентов является их профессиональная ориентация, особенно в случаях, когда экологическая агрессия связана с профессиональной деятельностью больного. Сюда же входят и меры по ограничению вредоносного воздействия экологии жилища,В лечении больных ХОБЛ особая роль принадлежит редукции действия факторов риска, в первую очередь борьба с курением. Прекращение курения — единственный экономически оправданный способ уменьшения риска развития и прогрессирования ХОБЛ. Даже короткая антисмоукинговая программа эффек¬ тивна, и каждый курильщик должен подвергаться хотя бы короткому лечению. Применение фармакопрепаратов (никотинзамещающие средства, антидепрессан¬ ты) для преодоления табачной зависимости усиливает эффективность антисмоу- кинговой терапии,ЛЕКАРСТВЕННАЯ ТЕРАПИЯОбъём и направленность лекарственной терапии определяются в первую оче¬ редь существующей концепцией патогенеза заболевания с применением средств, действующих на его ключевые звенья в зависимости от стадии заболевания и темпов его прогрессирования. Сегодняшние представления о сущности ХОБЛ декларируют бронхиальную обструкцию главным и универсальным источником всех последующих патологических событий, развивающихся при ХОБЛ. Поэтому применение бронходилатирующих препаратов принято называть базисной тера¬ пией, то есть терапией, обязательной при лечении ХОБЛ. Все остальные средства я методы должны применяться в сочетании со средствами базисной терапии. Ниже приводятся рекомендации экспертов ВОЗ по применению бронходилататоров вне обострения ХОБЛ.• Бронходилатирующая терапия — главное в симптоматическом лечении ХОБЛ.• Ингаляционная терапия предпочтительнее.• Выбор между Рз'агонистами, холинолитиками, теофиллином или их комби¬ нациями зависит от доступности препарата, его влияния на выраженность симптомов и переносимости.
346ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ• Бронходилататоры назначаются либо «по потребности», либо систематически применяют для предотвращения или уменьшения выраженности симптомов.• Долгодействующие бронходилататоры предпочтительнее.• Комбинации бронходилататоров повышают эффективность лечения и сни¬ жают риск побочных эффектов в сравнении с наращиванием интенсивности монотерапии.Перечень наиболее употребляемых бронхорасширяющих средств (GOLD, 2006) представлен в табл. 18-15.Таблица 18-15. Перечень наиболее употребляемых бронхорасширяющих средств (GOLD, 2006).БронходилататорыРекомендуемые разовые дозь|Длительность действия, чПрепаратыдозирующие ингаляторы, мкгнебулайзеры, мгIper OS, мгР,-АгонисгтыФенотерол100-200--:14-64Сальбутамол100-2002,5-5,044-6Тербуталин250-5005-1054-6Формотерол12-24--Более 12iСалметерол50-100--Более 12Антихолинергические препаратыИпратропия бромид40-800,25-0,5-6-8Тиотропия бромид1824Метилксантины ■*Теофиллин100-400Различная, до 12 iВ Российской федеральной программе по ХОБЛ к препаратам первого ряда относятся антихолинергические препараты АХП.АХП тормозят рефлекторную бронхоконстрикцию, а уровень их активности в этом отношении зависит от выраженности реакции бронхиальной мускулатуры. Механизм действия АХП при ХОБЛ не исчерпывается влиянием на тонус гладкой мускулатуры. Существенную роль играет и их влияние на секрецию бронхиальной слизи. Известно, что прямая или опосредованная холинергическая стимуляция вызывает активацию секреторной функции подслизистых желёз и бокаловидных клеток слизистой дыхательных путей, что усиливает бронхиальную обструкцию при ХОБЛ. Использование АХП может способствовать улучшению проходимости в периферических отделах бронхолёгочной системы за счёт ограничения секреции бронхиальной слизи. Современные АХП характеризуются способностью полно ш продолжительно связываться с М-холинорецепторами, что ведет к практическим утрате этими соединениями центральных свойств и повышает их периферическую холинолитическую активность. Они отличаются хорошей переносимостью, ВОЭ“ можностью длительного использования без заметного снижения эффективности (тахифилаксии).
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 347Ингаляционное назначение АХП целесообразно при всех степенях тяже¬ сти заболевания (при отсутствии индивидуальной непереносимости). Наиболее известным из них является ипратропиум бромид. Благодаря низкой всасываемо¬ сти через слизистую оболочку бронхов ингаляционные холинолитики практиче¬ ски не вызывают системных побочных эффектов. Бронходилатирующий эффект после одной дозы ипратропиума бромида наступает обычно через 30-45 мин и не всегда субъективно ощущается больным. Обычно бронходилатирующий эффект ипратропиума бромида нарастает в течение 3 нед непрерывного употребления, а затем наступает стабилизация, позволяющая перейти на поддерживающую дозу, определяемую индивидуально.Чувствительность М-холинорецепторов бронхов не ослабевает с возрастом. Это особенно важно, так как позволяет применять холинолитики у пожилых больных ХОБЛ и у пациентов с сердечными и циркуляторными нарушениями. АХП про¬ лонгированного действия — тиотропиум бромид (ТБ) — четвертичное аммоние¬ вое соединение. Этот препарат селективен для М^^- и М3-холинорецепторов, что и определяет его превосходство перед неселективными АХП. в настоящее время получено достаточно данных о высокой эффективности ТБ при ХОБЛ в соответ¬ ствии с высшим критерием доказательности.Селективные ^^"^гонисты рекомендуется присоединять к АХП при недо¬ статочной эффективности последних. Благодаря присутствию (3-рецепторов на большом количестве клеток респираторной системы: на гладкомышечных клетках, эпителии воздухоносных путей, эндотелии сосудов, циркулирующих клетках воспаления (нейтрофилы, лимфоциты), пневмоцитах 2-го типа, ске¬ летных мышцах, фибробластах — Рз-агонисты обладают быстрым действием, интегрально проявляющимся уменьшением обструкции и выраженности дисп¬ ноэ, Предпочтительнее назначение р^-агонистов в ингаляциях. При лёгком течении ХОБЛ рекомендуется применение ингаляционных бронходилататоров короткого действия «по требованию». Действие рз^агониста короткого действия начинается в течение нескольких минут, достигая пика через 15-30 мин, и про¬ должается в течение 4-5 ч. Больные в большинстве случаев отмечают облегчение дыхания сразу после применения З^-агониста, что является несомненным досто¬ инством препарата. Бронходилатирующее действие р^'^гонистов обеспечивается за счёт стимуляции Р2-рецепторов гладкомышечных клеток. Кроме того, вслед¬ ствие увеличения концентрации АМФ под влиянием (З^-агонистов происходит не только расслабление гладкой мускулатуры бронхов, но и улучшение подвиж¬ ности ресничек эпителия и улучшение функции мукоцилиарного транспорта. Бронходилатирующий эффект тем выше, чем дистальнее преимущественное нарушение бронхиальной проходимости. После применения З^'Эгонистов корот¬ кого действия больные в течение нескольких минут ощущают существенное улучшение состояния, положительный эффект которого нередко ими переоце¬ нивается. Не рекомендуется регулярное применение Р^’^^ОНИСТОВ короткого действия в качестве монотерапии при ХОБЛ. Препараты этой группы нередко вызывают системные реакции в виде транзиторной дрожи, возбуждения, повы¬ шения артериального давления. У больных с ишемической и гипертонической болезнью это небезопасно.Бронхолитики продолжительного действия более удобны для применения. р,-Агонисты длительного действия (салметерол и формотерол) независимо от изменений функциональных лёгочных показателей могут улучшить клинические симптомы и качество жизни больных ХОБЛ, снизить число обострений. При ХОБЛ бактериальная инфекция носит хронический характер и может вызвать обострения. Показана in vitro способность салметерола защищать респираторный эпителий от повреждения, вызываемого бактериальными токсинами, что может приводить к снижению числа обострений ХОБЛ. Пролонгированный ¡З^-агонист
Im348 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯсалметерол улучшает состояние больного ХОБЛ при использовании в дозе 50 мг дважды в день. В ряде исследований доказано, что формотерол благоприятно влияет на показатели функции внешнего дыхания, симптомы и качество жизни у больных ХОБЛ, в том числе с необратимой обструкцией.Преимуществами р^-агонистов длительного действия являются ингаляционный путь доставки, длительный период действия, различные средства доставки (ДАИ, ДПИ), отсутствие тахифилаксии. Одним из недостатков салметерола является медленное начало действия (через 30-45 мин), в отличие от формотерола (через5-7 мин).Весьма удобными являются фиксированные комбинации препаратов в одном ингаляторе (беродуал* = ипратропия бромид + фенотерол). В последние годы стал накапливаться положительный опыт сочетания АХП с р2‘агонистами пролонги¬ рованного действия (например, с салметеролом). М-холинолитики и {З^-агонисты используются в основном с помощью дозирующих ингаляторов.Ингаляционная терапия в лечении больных ХОБЛ является ведущим методом лечения этого заболевания. Эффективность и надёжность ингаляционного спосо¬ ба введения лекарств отражена в основных стандартах ХОБЛ: GOLD, националь¬ ные стандарты США, Великобритании, Европейского респираторного общества, России.При недостаточной эффективности сочетания холинолитиков и р^'^гонистов следует использовать препараты метил ксантинов. Ввиду многообразия нежела¬ тельных явлений теофиллина (в том числе и серьёзных) его применение должно проводиться с определённой осторожностью. В то же время при невозможно¬ сти, по разным причинам, использования ингаляционных форм лекарственных средств, а также при недостаточно эффективном или безуспешном применении более эффективных бронхолитиков и глюкокортикоидов назначение препара¬ тов теофиллина представляется вполне оправданным. Их бронходилатирующий эффект уступает таковому у р^'^гонистов и холинолитиков, но приём внутрь (пролонгированные формы) или парентерально (ингаляционно метилксантины не назначаются) вызывает ряд дополнительных действий: уменьшение системной лёгочной гипертензии, усиление диуреза, стимуляцию центральной нервной систе¬ мы, усиление работы дыхательных мышц, которые могут оказаться полезными у ряда больных. В последние годы появились сообщения о способности малых доз теофиллина потенцировать эффект ГКС.В соответствии со степенью тяжести ХОБЛ предлагается ориентировочный перечень средств базисной терапии (табл. 18-16),Таблица 18*16. Базисная терапия ХОБЛ1 стадияМ-холинолитикиII стадияМ-холинолитики 1^2-АгонистыМетилксантины (по показаниям)Модификация способов доставки (спейсеры, небулайзеры)lil-IV стадииМ-холинолитикиР^-АгонистыМетилксантиныДостаака ингаляционных препаратов с помощью сп814серов или небулайзеровГлюкокортикостероиды обладают, пожалуй, самым большим спектром протн- вовоспалительного действия из всех известных противовоспалительных препара¬ тов. ГКС снижают содержание провоспалительных клеток в лёгких, тормозят их активацию. ГКС уменьшают уровень основных провоспалительных медиаторов в респираторной системе и обладают антиоксидантным действием. Эффективность
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 349ГКС в качестве средства, уменьшающего выраженность бронхиальной обструкции, г больных ХОБЛ неодинакова.Лишь у 10-30% пациентов происходит существенное улучшение при их при¬ менении. Предпочтительнее назначать ГКС ингаляционно, однако выраженная бронхиальная обструкция может препятствовать доставке препарата, вводимого ингаляционным путём, в нижние отделы респираторного тракта.В таких случаях рекомендуется начать введение ГКС перорально или инфузи- (жным методом с последующим переходом (при достижении бронходилатации) на ингаляционный способ введения. Длительное системное назначение влечёт за собой большой спектр системных побочных эффектов и не рекомендуется. Наряду с множеством хорошо известных побочных эффектов системно назначаемых ГКС, важное место принадлежит стероидной миопатии, усугубляющей синдром утомления дыхательной мускулатуры и ведущей к нарастанию дыхательной недо¬ статочности, Многочисленные многоцентровые изучения эффективности ИГКС стабильной ХОБЛ показали возможность снижения числа обострений на 25% (ISOLDE) и даже 53% (TRISTAN) при трёхгодичном применении. Существенно повышается эффективность ИГКС при их фиксированной комбинации с пролон¬ гированными р2‘агонистами. Следует подчеркнуть, что даже длительное примене¬ ние ИГКС не снижает темпы ежегодного снижения OФBJ.Большие надежды возлагаются на новое поколение ингибиторов провоспали¬ тельных медиаторов или рецепторов к ним как средств противовоспалительной терапии для длительного применения у больных ХОБЛ, Одним из таких препа¬ ратов является фенспирид. Фенспирид обладает многокомпонентным противо¬ воспалительным действием благодаря воздействию на метаболизм арахидоно¬ вой кислоты и уменьшению образования простагландинов и лейкотриенов, а также уменьшению синтеза ФНО-а. Наряду с этим он является антагонистом гастаминовых Н^-рецепторов и -адренорецепторов. Благодаря указанным свой¬ ствам фенспирид подавляет миграцию клеток эффекторов в зоны воспаления. Контролируемые исследования по длительному приёму фенспирида у больных с разными вариантами бронхиальной обструкции показали высокую противовос¬ палительную эффективность препарата при отсутствии побочных эффектов в отли¬ чие от кортикостероидов. Отмечена также способность фенспирида потенцировать эффективность антибактериальной терапии при обострении ХОБЛ.Другим перспективным противовоспалительным препаратом для лечения ХОБЛ является рофлумиласт*'. Рофлумиласт^ — ингибитор фосфодиэстеразы (ФДЭ), избирательно действующий на её изофермент IV. Изоферменты ФДЭ различным образом распределены в тканях и клетках организма, что позволяет осуществлять избирательное фармакологическое вмешательство. ФДЭ IV — изо¬ фермент, преобладающий в клетках воспаления. Исследование эксперименталь¬ ных моделей на животных показало, что рофлумиласт^ обладает сильным про¬ тивовоспалительным действием (на эозинофилы и нейтрофилы) в дыхательных путях. Результаты исследований фаз II и III у больных БА показали, что введение рофлумиласта^ вызывает клинически значимое улучшение функции лёгких. В этих исследованиях, проведённых более чем на 2000 пациентов, которые принимали препарат один раз в день внутрь, выявлена его клиническая эффек¬ тивность, а также высокая безопасность и хорошая переносимость. Такие же эффекты наблюдались в исследованиях, проведённых более чем на 1000 боль¬ ных ХОБЛ. При этом клиническом показании были также продемонстрированы эффективность и хороший профиль безопасности препарата. Исследования этого препарата продолжаются.Мукорегуляторные средства. Улучшение мукоцилиарного клиренса в значи¬ тельной степени достигается при целенаправленном воздействии на бронхиальный секрет с применением мукорегуляторных препаратов (ацетилцистеина, бромгекси-
350 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯна). Несмотря на то что у отдельных больных наблюдается улучшение после приёма мукорегуляторных средств, эксперты воз относят их к категории D и не рекоменду¬ ют широкое использование этой категории препаратов. По-видимому, это связано с сильным мукорегулирующим действием средств базисной терапии ХОБЛ. В то же время ряд мукорегуляторных средств благодаря полифункциональносги своего дей¬ ствия могут быть полезными при ХОБЛ. Ацетилцистеин оказывает разжижающее действие на мокрот)^ Наличие в структуре ацетилцистеина сульфгидрильных групп способствует разрыву дисульфидных связей кислых мукополисахаридов мокроты, что приводит к деполяризации мукопротеидов и к )’меньшению вязкости слизи. Препарат сохраняет активность при наличии гнойной мокроты. Ацетилцистеин оказывает антиоксидантное действие, обусловленное наличием нуклеофильной тиоловой SH-группы, которая легко отдаёт водород, нейтрализуя окислительные радикалы. При профилактическом применении ацетилцистеина отмечается умень- шение частоты и тяжести обострений у пациентов с хроническим бронхитом и муко¬ висцидозом. Защитный механизм ацетилцистеина основан на способности его реак¬ тивных сульфгидрильных групп связывать химические радикалы. Ацетилцистеин легко проникает внутрь клетки, деацетилируется до L-цистеина, из которого синтезируется внутриклеточный глутатион. Глутатион — высокореактивный три- пептид, мощный антиоксидант, цитопротектор, улавливающий эндогенные и экзо¬ генные свободные радикалы и токсины. Ацетилцистеин предупреждает истощение и способствует повышению синтеза внутриклеточного глутатиона, участвующего в окислительно-восстановительных процессах клеток, таким образом способствуя детоксикации. Ацетилцистеин в определённой мере нейтрализует оксидантное дей¬ ствие факторов риска, особенно курения. Использование в качестве муколитических средств протеолитических ферментов недопустимо.Противоинфекционная терапия. В холодное время года у больных ХОБЛ нередко возникают обострения инфекционного происхождения. Их лечение будет рассмотрено в разделе «Лечение обострений». Антибиотики не рекомендуется назначать профилактически. Одним из критериев качественной работы с больным ХОБЛ является ограничение в использовании антибиотиков. Большие перспекти¬ вы в этом направлении определяются с помощью вакцинации. Экспертами ВОЗ рекомендована ежегодная вакцинация противогриппозной вакциной. Идёт нако¬ пление опыта по применению бактериальных вакцин. Российская федеральная программа по ХОБЛ на основании опыта российских исследователей рекомендует ежегодную профилактическую вакцинацию больных ХОБЛ при частоте инфек¬ ционных рецидивов более 3 раз в год. Предпочтительнее поливалентные бакте¬ риальные вакцины, применяемые перорально. Наилучшие результаты при этом достигаются при І-П степенях тяжести заболевания.КОРРЕКЦИЯ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИКоррекция дыхательной недостаточности достигается пзтём использования медикаментозных средств, оксигенотерапии, тренировки дыхательной мускулату¬ ры. Следует подчеркнуть, что интенсивность, объём и характер медикаментозного лечения зависят от тяжести состояния и соотношения обратимого и необратимого компонентов бронхиальной обструкции. При истощении обратимого компонента характер проводимой терапии меняется. На 1-е место выходят методы, направлен¬ ные на коррекцию дыхательной недостаточности. При этом объём и интенсивность базисной терапии сохраняются. Поскольку важнейшим механизмом формирова¬ ния хронической гипоксемии является нарушение вентиляционно-перфузионных отношений, то и сейчас изучается возможность фармакологической коррекции этого показателя, что должно вести к повышению оксигенации артериальной крови. В настоящее время создан препарат, способный в течение длительного времени улучшать оксигенацию крови у больных ХОБЛ. Это альмитрин^ бисме-
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 351омат*". Альмитрин*’ — специфический агонист периферических хеморецепторов. Его действие основано на влиянии на рецепторы каротидного узла. Под влиянием альмитрина^ происходит улучшение перфузионно-вентиляционных отношений, снггамизируется стереотип вентиляции. При этом не происходит повышения давления в лёгочной артерии. Исследования по оценке действия альмитрина#’ установили дозозависимый эффект действия препарата и оптимальный диапазон дозировок (50-100 мг). Длительное использование альмитрина^ у 70-80% боль¬ ных ХОБЛ ведёт к увеличению оксигенации крови на 5-12 мм рт.ст. При этом при более выраженной гипоксемии наблюдаются больший прирост и снижение р^СОз- Причины неэффективности альмитрина*^ у 20-30% больных еще не выяс¬ нены, поэтому эффективность препарата трудно прогнозировать и она определя¬ ется по результатам применения альмитрина^^ в течение 3 мес.Оксигенотерапия является наиболее эффективным методом устранения гипок- «мии. Показаниями к систематической оксигенотерапии являются снижение Р^2 в крови до 60 мм рт.ст., снижение 8^2 менее 85% при стандартной пробе с6-минутной ходьбой и менее 88% — в покое. Предпочтение отдаётся длительной (18 ч/сут) малопоточной (2-5 л/мин) кислородотерапии как в стационарных условиях, так и на дому. При тяжёлой дыхательной недостаточности применяются гелиево-кислородные смеси. Для домашней оксигенотерапии используются кон¬ центраторы кислорода, а также приборы для проведения неинвазивной вентиля¬ ции с отрицательным и положительным давлением на вдохе и выдохе. Тренировка дыхательной мускулатуры достигается с помощью индивидуально подобранной дыхательной гимнастики. Возможно применение чрескожной электростимуляции диафрагмы.При выраженном полицитемическом синдроме (НЬ >155 г/л) рекомендуется проведение эритроцитафереза с удалением 500-600 мл деплазмированной эри- троцитной массы. В случае если проведение эритроцитафереза технически невы¬ полнимо, можно проводить кровопускание в объёме 800 мл крови с адекватным замещением изотоническим раствором хлорида натрия.Реабилитационную терапию назначают при ХОБЛ любой степени тяжести. Врач определяет индивидуальную программу реабилитации для каждого больно¬ го. Б зависимости от тяжести, фазы болезни и степени компенсации дыхательной в сердечно-сосудистой систем программа включает режим, ЛФК, физиотерапевти¬ ческие процедуры, санаторно-курортное лечение.Особым разделом в лечении стабильной ХОБЛ является лечение больных с сопутствующей патологией. Простое суммирование препаратов и методов для лечения соответствующих заболеваний может только усугубить состояние боль¬ ных и породить «третьи» болезни — ятрогенные.На основании литературных данных и личного опыта можно давать неко¬ торые рекомендации по смещению акцентов в терапии сочетанной патологии (табл. 18-17).Таблица 18-17. Рекомендации по изменению терапии больных ХОБЛ при наличии сопутствующих заболеванийБолезни, сочетаю¬ щиеся с ХОБЛОсобенности терапииИБС, артериальная гопертензияОграничение ^-блокаторовОсторожность при использовании ингибиторов АПФОграничение [^^-агонистовОграничение ГКСОсновные бронходилататоры — АХП, в том числе и пролонгированные (тиотропиум)
352ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯОкончание табл. 18-17Бронхиальная астмаОбязательное применение АХП (в том числе и длительного действия — тиотропиум) Комбинированная терапия ИГКС + бронходилататоры (фиксированные комбинации ИГКС + пролонгированные р^-агонисты)Возможность гибкого дозирования ИГКС в зависимости от бариабельности ПСВ Вероятность снижения эффективности ГКСУчитывать вероятность грибковой суперинфекции (побочное действие ИГКС)При обострениях высока вероятность осложнений антибиотикотерапии (ограничивать р-лактамы)ПневмонииВыбор антибиотика в соответствии со степенью нарушений бронхиальной обструк¬ цииПо мере усугубления бронхиальной обструкции нарастает вероятность инфицирова¬ ния грамотрицательной флорой Сочетание антибиотиков с ГКС (системными)ГастроэзофагеальныйрефлюксНаращивание интенсивности терапии ХОБЛ (бронходилататоры + ГКС) не улучшает,а отягощает состояние больныхОфаничение теофиллиновОфаничение ГКСДиетаВозвышенное изголовье кроватиТуберкулёз лёгкихСтупенчатая терапия бронхиальной обструкции при туберкулёзе лёгких существенно повышает эффективность леченияЕстественно, что эти рекомендации служат лишь ориентиром при формирова¬ нии индивидуализированной программы лечения больного с сочетанной пато¬ логией, Примером может служить схема ступенчатой коррекции бронхиальной обструкции у больных туберкулёзом лёгких, внедренная нами и успешно приме¬ няемая в клиниках ЦНИИТ РАМН (табл. 18-18).Таблица 18-18. Ступенчатая терапия бронхиальной обструкции при туберкулёзе лёгкихСтупениПоказатели ОФВ^,%>7069-50<501АХП по потребностиАХП короткого действия + Р^-агонисты (короткого действия)АХП + р^-агонисты (короткого действия) + системные ГКС2АХП -1- р^-агонисты (длительного действия)АХП + р^-агонисты (длительного дей¬ ствия) -I- системные ГКС3+ ИГКС-4Замена ИГКС на системные ГКС-ЛЕЧЕНИЕ ОБОСТРЕНИЙЛечение обострений ХОБЛ требует существенно изменять количественные и качественные параметры проводимой ранее терапии.Главные положения лечения обострений ХОБЛ (GOLD, 2006).• Каждое обострение ХОБЛ требует обязательного медицинского вмешательства.• Причины многих обострений ХОБЛ остаются нераспознанными. Инфекция при этом, вероятно, играет важную роль.• В лечении обострений ХОБЛ эффективны ингаляционные бронхолитики, теофиллины и системные (преимущественно при назначении per os) ГКС,• Лечение антибиотиками обострений ХОБЛ бывает успешным при наличии клинических признаков инфекции воздухоносных путей (увеличение количе¬ ства и изменение цвета мокроты и/или лихорадка).
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 353• Неинвазивная вентиляция при обострениях ХОБЛ улучшает газовый состав крови и pH, уменьшает внутрибольничную смертность, уменьшает потреб¬ ность в ИВЛ, снижает продолжительность стационарного лечения.При лечении обострений ХОБЛ необходимо наращивать бронхорасширяющую ісрапию. При снижении ОФВ^ < 50% должных величин необходимо назначение системных ГКС, что будет способствовать быстрому улучшению бронхиальной ■роходимости. Вопрос о целесообразности назначения антибиотиков решает¬ ся положительно лишь при неоспоримом доказательстве инфекционной при¬ роды обострения. Появление гнойных элементов в мокроте при обострении ХОБЛ считается достаточным аргументом для начала антибиотической терапии. Антибиотики назначаются эмпирически. Ориентирами для выбора антибиотика шляются данные о чувствительности 5. pneumoniae, Н. influenzae и М. catarrhalis в данном регионе. Культуральное исследование мокроты с антибиотикограммой следует проводить при недостаточной эффективности начальной антибиотикоте¬ рапии.Одним из основных принципов ведения больных ХОБЛ является обязательная ■оррекция терапии при возникновении обострения. Необходимость коррекции терапии ХОБЛ определяется тем, что при обострении происходит вполне опреде¬ лённое усиление действия патогенетических механизмов ХОБЛ. Независимо от пускового механизма обострения происходит активация инфекции, колонизи¬ рующейся в дыхательных путях больного ХОБЛ и/или суперинфицирование. При обострении нарастает бронхиальная обструкция, что влечёт за собой усугу¬ бление лёгочной гипертензии, гипоксемию с возможной гиперкапнией. При этом показатели ФВД могут бьггь сущесгвенно ниже, чем при стабильном состоянии у того же пациента. Коррекция терапии при обострении предполагает тормозящее воздействие на активировавшиеся звенья патогенеза, что должно предотвратить преждевременную декомпенсацию дыхательной, сердечно-сосудистой систем, происходящую в поздних стадиях ХОБЛ. Другими словами, раннее и энергичное лечение ХОБЛ является залогом более медленного прогрессирования основного заболевания.Первым и обязательным шагом в лечении обострений ХОБЛ является интен¬ сификация бронходилатирующей терапии. Основные бронходилатирующие пре¬ параты хорошо известны: р^'^гонисты, АХП, теофиллины. Суть интенсификации бронходилатирующей терапии сводится к более рациональному использованию этих средств в изменившейся клинической ситуации.Хорошо известно, что комбинации бронходилатирующих препаратов более эффективны, чем монотерапия. Наиболее используемая комбинация у большин¬ ства больных — ^І2’агонистн с АХП. Не исключается возможность применения и теофиллинов. При этом следует учитывать довольно узкий диапазон их терапев¬ тического действия, возможные кардиотоксические эффекты и совместимость с другими назначаемыми больному с обострением ХОБЛ препаратами.В понятие «интенсификация бронходилатирующей терапии» входит и спо¬ соб доставки препарата. Выбор метода зависит от выраженности бронхиальной обструкции при обострении. Если ОФВ^ выше 50% должных величин, то исполь¬ зование спейсеров и увеличение доз (не превосходя допустимые) могут оказать желаемый эффект, а также при более глубоких нарушениях бронхиальной про¬ ходимости даже применение небулайзеров может оказаться малоэффективным и стедует предпочесть парентеральный способ введения р^-агонистов и теофилли¬ нов. В современном арсенале пульмонолога есть не только короткодействующие, ио и пролонгированные бронходилататоры. В России это Р2‘агонисты салметерол и формотерол и АХП тиотропия бромид. Их применение при обострении заман¬ чиво с позиций возможности создания хорошего фона и потенцирования эффекта короткодействующих средств. Однако ещё нет больших клинических исследо-
354 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ> ваний, демонстрирующих целесообразность использования пролонгированных ^ бронходилататоров при обострении ХОБЛ (GOLD, 2006). При этом следует всегда помнить о возможных передозировках. Главным показателем эффективности бронходилатирующей терапии, наряду с клиническим улучшением, является изменение ОФВ,. Желательно этот показатель возвращать к уровню, бывшему т больного до обострения.Интенсификация бронходилатирующей терапии сама по себе не всегда даёт ощу¬ тимый лечебный эффект и улучшает бронхиальную проходимость при обострении ХОБЛ. В таких случаях несомненную помощь оказывает назначение системных ГКС. Именно системных, поскольку в условиях выраженной бронхиальной обструкции (а именно для её купирования и назначаются ГКС) доставка аэрозоль¬ ной формы препарата в зону воспаления будет затруднена. Кроме того, местное назначение ГКС в зону инфекционного (что чаще всего бывает при обострении) воспаления может угнетать систему местного иммунитета. Экспертами ВОЗ с высокой степенью доказательности рекомендуется при снижении ОФВ^ ниже 50% должных величин использовать системные ГКС на протяжении периода обостре¬ ния (в среднем 10 дней). Что касается суточных доз, то они не должны быть боль¬ шими и превосходить 40 мг по преднизолону в сутки. При этом конечно должны учитываться индивидуальные особенности больного и наличие сопутствующих болезней. Личный опыт показывает, что для больного весом 80-90 кг достаточным является 20-25 мг преднизолона в сутки. Применение ГКС действует практически на все звенья воспаления, усугубляющие обструкцию: уменьшает поступление нейтрофилов в очаги воспаления, тем самым снижая их деструктивный потенциал и ограничивая прогрессирование эмфиземы; снижает сосудистую проницаемость и уменьшает гиперсекрецию и отёк слизистой; тормозит выработку провоспалитель¬ ных медиаторов, обладающих бронхоконстрикторным действием.Назначение антибиотиков является весьма ответственным компонентом лече¬ ния обострения ХОБЛ, независимо от причины, вызвавшей обострение. При обо¬ стрениях ХОБЛ бактериальная популяция в бронхах из состояния колонизации и равновесия со сдерживающими защитными системами переходит в состояние инфекционного эпизода, когда размножающаяся бактериальная популяция выхо¬ дит из-под контроля, что проявляется соответствующими клиническими и лабо¬ раторными признаками. Вопрос о целесообразности назначения антибиотиков решается положительно лишь при неоспоримом доказательстве инфекционной природы обострения. Появление гнойных элементов в мокроте при обострении ХОБЛ считается достаточным аргументом для начала антибиотической терапии (GOLD, 2006). Выбор антибиотика для лечения обострения ХОБЛ осуществляется обычно эмпирически. При этом ориентирами для выбора антибиотика являются эпидемиологическая ситуация, предполагаемая чувствительность флоры, ответ¬ ственной за обострение, и некоторые другие отягощающие факторы. Известно, что эффективность антибиотика, применяемого для начальной эмпирической терапии ХОБЛ, может с годами уменьшаться вследствие формирования резистентных штаммов микроорганизмов. Естественно, что на смену этому «устаревающему» антибиотику приходит новый. Культуральное исследование мокроты с антибиоти¬ кограммой следует проводить при недостаточной эффективности начальной анти¬ биотикотерапии. При этом к антибиотику предъявляются следующие требования:• Высокая активность в отношении патогенного микроорганизма.• Высокая концентрация в «шоковом органе» (респираторной системе).• Удобства в применении (возможность перорального применения в 1-2 приё¬ ма в сутки).• Минимальный риск побочных эффектов.Antonisen и соавт. (1987) предложили три важных критерия обострения, тре¬ бующего антибактериальной терапии:
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ355• Нарастание одышки.• Нарастание объёма выделяемой мокроты.• Появление гнойной мокроты.Антибиотики назначаются эмпирически в сочетании с системными ГКС и интенсифицированной бронходилатирующей терапией. Ориентирами для выбо¬ ра антибиотика являются данные о чувствительности S. pneumoniae, Я. influenzae и М. catarrhalis в данном регионе. Основные тенденции по выбору антибиоти¬ ка 1-й линии (начало терапии) и 2-й линии (при неэффективной терапии 1-й линии) больных с обострением ХОБЛ (табл. 18-19) в различных руководствах аналогичны.Таблица 18-19. Выбор антибиотика при обострении ХОБЛ•к У;'гтРекомендацииПрепараты 1-й линииПрепараты 2-й линииЕвропейское респиратор¬ ное обществоАминопенициллины, тетрациклин, амокси¬ циллин + клавулановая кислотаНовые цефалоспорины, макролиды, фторхинолоныБританское торакальное обществоАмоксициллин, тетрациклинНовые цефалоспорины. макролидыАмериканское торакальное обществоТетрациклин, доксициклин, амоксициллин, эритромицин, цефаклор, сульфаметоксазол + триметопримПенициллины широкого спектра, цефалоспориныКанадское торакальное обществоАминопенициллины, тетрациклин, сульфа¬ метоксазол + триметопримНовые цефалоспорины, амоксицил¬ лин + клавулановая кислота, новые макролиды, фторхинолоныОпределённым ориентиром в выборе антибиотика является тяжесть брон¬ хиальной обструкции, что в значительной мере связано с характером микроб¬ ной колонизации. Так, при ОФВ^ > 50% чаще причиной обострения являютсяН. influenzae, М. catarrhalis и S. pneumoniae с возможной резистентностью к р-лактамам. При ОФВ^ < 50% к вышеуказанным микроорганизмам присоединяет¬ ся грамотрицательная флора (Klebsiellapneumoniae и др.), часто — резистентность к р'Лактамам. При постоянной продукции гнойной мокроты возрастает вероят¬ ность, помимо вышеуказанных агентов, участия в воспалении Enterobacteriaceae и Р. aerogenosa. Большое влияние на эффективность антибиотикотерапии оказывает резистентность микроорганизмов к назначаемым антибиотикам. Выделяют так называемые модифицирующие факторы, то есть факторы риска формирования резистентности микроорганизмов. Наиболее значимые из них следующие:• для пневмококков — возраст более 65 лет, терапия (5-лактамами в течение последних 3 мес, алкоголизм, иммуносупрессия (включая терапию ГКС), наличие нескольких сопутствующих заболеваний:• для грамотрицательных энтеробактерий — проживание в доме престарелых, сопутствующие сердечно-сосудистые и лёгочные заболевания, наличие несколь¬ ких сопутствующих заболеваний, недавняя антибактериальная терапия;• для Р. aeruginosa — структурные заболевания лёгких (бронхоэктазия), терапия ГКС (более 10 мг преднизолона в день), терапия антибиотиками широкого спектра более 7 дней в последний месяц, недоедание.В зависимости от тяжести обострения М. Niederman (2000) предлагает выде¬ лять три категории обострений ХОБЛ: неосложнённые, осложнённые обострения н обострения с риском инфицирования синегнойной палочкой, для которых предлагаются ориентировочные схемы начальной антибактериальной терапии (табл. 18-20).
356 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯТаблица 18-20. Категории обострений ХОБЛ (по М. Niederman, 2000)Характеристика больныхВероятные патогеныАнтибактериальные средстваНеосложнённые обострения ХОБЛЛюбой возраст, ОФВ, >50% должного, менее 4 обострений в год, отсутствие тяжёлых сопут¬ ствующих заболеванийS. рпешотае Н. influenzae М. catarrhalisМакролиды, р-лашмыОсложнённые обострения ХОБЛВозраст >65 лет, ОФВ, 35-50% должного, более 4 обострений в год, с сопутствующими забо¬ леваниямиS. рпеитогч'ае Н. inflver)zaeМ. catarrhalis (часто резистент¬ ность патогенов к антибактери¬ альным препаратам) Грамотрицательная флораФторхинолоныамоксициллин + клавулановая кислотаОбострения с риском инфицирования Р. aeruginosaЛюбой возраст, ОФВ, <35% должного, более 4 обострений в год, потребность в терапии ГКС, нередко бронхоэктазыS. pneumonia Н. influer)zae М. catarrhalisГрамотрицательная флора Р. aenigir)osa (часто резистент¬ ность патогенов к актибактери- альным препаратам)Фторхинолоны, р-лактамы (цефта¬ зидим, пиперациллин/тазобактам'”', тикарциллин + клавулановая кислота) и др.Продолжительность антибактериальной терапии больных, переносящих обо¬ стрение ХОБЛ, составляет, как правило, 7-10 дней. Быстрое формирование анти¬ биотикорезистентности к широко уттотребляемым препаратам снижает ценность конкретных рекомендаций по выбору того или иного препарата, поскольку созда¬ ние рекомендаций порой не успевает за изменчивостью возбудителей.Традиционно в России при хронических заболеваниях респираторной системы использовались мукорегуляторные средства. Практически ни одно из обострений ранее не лечилось без использования одного из громадного количества мукоре¬ гуляторных средств, считавшихся по меньшей мере безобидными, в настоящее время, в эпоху медицины доказательств, в основных документах по лечению ХОБЛ (GOLD, 2006) мукорегуляторы не включены в перечень средств, обязательньге к применению при обострениях этого заболевания, тем не менее при явлениях муко¬ стаза, наличии гнойной, трудноотделяемой мокроты целесообразно примененве мукорегуляторных средств, среди которых препаратами выбора могут быть аде- тилцистеин и амброксол. Ацетилцистеин оказывает разжижающее на мокроту дей¬ ствие, Наличие в структуре ацетилцистеина сульфгидрильных групп способствует разрыву дисульфидных связей кислых мукополисахаридов мокроты, что приво¬ дит к деполяризации мукопротеидов и к уменьшению вязкости слизи. Препарат сохраняет активность при наличии гнойной мокроты. Ацетилцистеин оказьюает антиоксидантное действие, обусловленное наличием нуклеофильной тиоловой 5Н‘Группы, которая легко отдаёт водород, нейтрализуя окислительные радикалы. Тем самым наряду с мукорегуляторным действием ацетилцистеин благодаря анти¬ оксидантному влиянию может тормозить деструкцию тканей, связанную с действи¬ ем свободных радикалов. Дозировки ацетилцистеина определяются индивидуально и составляют от 100 до 600 мг/сут на протяжении периода мукостаза. Амброксол — единственный мукорегулятор, способный стимулировать синтез сурфактанта.Усугубление дыхательной недостаточности, нередко возникающее при о6с>* стрениях П-ІП стадий ХОБЛ и проявляющееся снижением р^2 менее 60 мм pr.cn.
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 3571'Щтребует применения кислородотерапии. Основная цель кислородотерапии — достижение р^О^ по меньшей мере 8.0 кПа (60 мм рт.ст.) в покое и достижение > >$^0^ не менее 90%, что обеспечит жизненно важным органам адекватную доставку укислорода. Кислородотерапии повышает содержание кислорода в артериальной крови, приводя к увеличению доставки 0^ к сердцу, головному мозгу и другим жиз- ненно важным органам. Кислородотерапия уменьшает лёгочную вазоконстрик- цию и лёгочное сосудистое сопротивление, вследствие чего повышаются ударный объём и сердечный выброс, уменьшается почечная вазоконстрикция и возрастает почечная экскреция натрия,Оксигенотерапия является одним из важнейших направлений комплексного лече¬ ния больных с обострением ХОБЛ в условиях стационара. Усугубление гипоксемии при обострении ХОБЛ представляет наибольшую опасность для жизни больных ХОБЛ, В то же время оксигенотерапия высокими концентрациями О2 закономерно ведёт к гиперкапнии и ацидозу, что может стать препятствием к проведению этого вида лечения. Однако риск острой гипоксемии значительно превышает риск тяжё¬ лой гиперкапнии. Таким образом, назначение контролируемой оксигенотерапии должно быть рекомендовано для всех больных с тяжёлым обострением ХОБЛ.Адекватный уровень оксигенации — рРз более 8,0 кПа (60 мм рт.ст.) или 5^0^ более 90%, — как правило, быстро достигается при неосложнённых обострениях ХОБЛ, в то же время развитие гиперкапнии происходит бессимптомно. После начала оксигенотерапии через назальные катетеры (скорость потока 1-2 л/мин) или маску Вентури (содержание кислорода во вдыхаемой кислородно-воздушной смеси 24-28%) газовый состав крови должен контролироваться через 30-45 мин (адекватность оксигенации, исключение ацидоза, гиперкапнии). Большинству больных ХОБЛ достаточно потока 0^ 1-2 л/мин, у наиболее тяжёлых больных поток может быть увеличен и до 4-5 л/мин. Проведение кислородотерапии реко¬ мендуется не менее 15 ч/сут. Максимальные перерывы между сеансами кислоро¬ дотерапии не должны превышать 2 ч подряд, так как это приводит к значительно¬ му нарастанию лёгочной гипертензии.Для эффективного лечения кислородом необходим полный отказ больного от курения. Если после 30-45-минутной ингаляции 0^ больного с острой дыха¬ тельной недостаточностью эффективность оксигенотерапии минимальна или отсутствует, следует принимать решение о вспомогательной вентиляции лёгких.В последнее время особое внимание уделяется неинвазивной вентиляции лёгких (НВЛ) с положительным давлением. Показания к проведению НВЛ:• Тяжёлая одышка, не купирующаяся начальными средствами неотложной терапии.• Спутанное сознание, летаргия, кома.• Постоянная или нарастающая гипоксемия (р^2 рт.ст.), несмотря на применение оксигенотерапии, и/или тяжёлая/прогрессирующая гиперкапния (р^С02 >70 мм рт.ст,), и/или тяжёлый/нарастающий респираторный ацидоз (pH <7,3).Эффективность НВЛ достигает 80-85% и сопровождается повышением pH, снижением уровня гиперкапнии, уменьшением одышки уже в первые 4 ч лече¬ ния. в тех случаях, когда у больного, переносящего тяжёлое обострение ХОБЛ (выраженная одышка, участие в акте дыхания вспомогательной мускулатуры, варадоксальное движение передней брюшной стенки, частота дыхания >35 в мин, гипотензия, шок и др.), НВЛ оказывается неэффективной (или недоступной) и р^О, <40 мм рт.ст., или рР2/Р102 <200 мм рт.ст., и/или pH <7,25, и/или р^^С02 мм рт.ст., показано проведение интубации трахеи и ИВЛ.Показания к проведению ИВЛ:• Тяжёлая одышка с участием вспомогательных мышц и парадоксальными дви¬ жениями передней брюшной стенки.
358 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ• Тахипноэ более 35 в мин.• Угрожающая жизни гипоксемия (р^02<40 мм рт.ст.).• Тяжёлый ацидоз (рН<7,25) и гиперкапния (р^С02>60 мм рт.ст.).• Остановка дыхания.• Нарушения сознания.• Сердечно-сосудистые осложнения (гипотензия, шок, сердечная недостаточ¬ ность).• Другие осложнения (метаболические расстройства, сепсис, пневмония, ТЭЛА, баротравма, массивный плевральный выпот).• Неэффективность НВЛ.Подавляющее большинство больных с обострением ХОБЛ должно лечиться в амбулаторных условиях, по индивидуальной программе, разработанной лечащим врачом. Госпитализация показана лишь при обострении ХОБЛ, которое не контро¬ лируется в амбулаторных условиях: нарастание гипоксемии, возникновение или нарастание гиперкапнии, декомпенсация лёгочного сердца. Пребывание в стацио¬ наре должно быть краткосрочным, направленным на купирование обострения и установление нового режима амбулаторного лечения. Ниже приводятся основные положения GOLD по лечению обострений ХОБЛ в стационаре.Показания для госпитализации в пульмонологическое отделение;• Значительное нарастание интенсивности симптомов, таких как внезапно раз¬ вившаяся тяжёлая одышка.• Тяжёлая ХОБЛ.• Появление новых клинических признаков (например, цианоз, перифериче¬ ские отеки).• Неэффективность начальной лекарственной терапии обострения.• Возникновение острых или обострение хронических сопутствующих заболе¬ ваний.• Впервые возникшие аритмии.• Диагностическая неопределённость.• Старческий возраст.• Неэффективное лечение на дому.Показания для госпитализации в отделение интенсивной терапии;• Тяжёлая одышка, не купирующаяся начальными средствами неотложной терапии.• Спутанное сознание, летаргия, кома.• Постоянная или нарастающая гипоксемия (р^О^ <50 мм рт.ст.), несмотря на применение оксигенотерапии, и/или тяжёлая/прогрессирующая гиперкапния (PgCOj >70 мм рт.ст.), и/или тяжёлый/нарастающий респираторный ацидоз (pH <7,3).Показания для выписки больных из стационара:• Потребность в ингаляциях р^-агонистов не чаще, чем через каждые 4 ч.• Пациент может самостоятельно ходить по комнате.• Пациент может самостоятельно есть, спать без частого пробуждения от одышки.• Состояние пациента стабильное на протяжении 12-24 ч.• Газы артериальной крови стабильны на протяжении 12-24 ч.• Пациент (или лицо, ухаживающее за ним дома) полностью понимает, как правильно принимать лекарства.• Длительное наблюдение и домашний уход обеспечены (патронажная медсе* стра, доставка кислорода, диета).• Пациент, члены его семьи и врач уверены в том, что пациент сможет успеошо лечиться дома.При этом экспертами ВОЗ оговаривается необходимость учёта местных условий при выполнении указанных рекомендаций. И даже если некоторые положения в настоящее время невыполнимы, то к ним надо стремиться, как к эталону.
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЁГКИХ 350Таким образом, обострение ХОБЛ — серьёзное испытание не только для боль¬ ного, но и для лечащего врача, успешный выход из которого определяется сво¬ евременностью диагностики обострения и адекватной коррекцией проводимой терапии.ЗаключениеСледует подчеркнуть, что проблемы ХОБЛ имеют прямое отношение не только к пульмонологам, а в первую очередь к врачам первичного звена — участковым терапевтам и врачам общей практики. В подавляющем большинстве именно к этой категории врачей впервые обращаются больные ХОБЛ. И на этом уровне совер¬ шаются основные диагностические и лечебные ошибки. В то же время развитие учения о ХОБЛ идёт настолько быстро, что в ближайшее время можно ожидать кардинальных изменений в тактике работы с этими больными. В первую очередь, это организация ранней диагностики ХОБЛ. Вероятнее всего, эта проблема будет решаться в разных странах по-разному, но главное — работа с контингентами риска и источники её финансирования. Второе — раннее применение высокоэффектив¬ ных средств противовоспалительной терапии, которые пока уступают лидерство бронходилататорам. Не исключено, что будут созданы эффективные ингибиторы провоспалительных медиаторов, способные тормозить хроническое воспаление. Возможны и совсем неожиданные решения проблем системных проявлений ХОБЛ и пр. Всё это требует постоянного обновления руководства и совершенствования знаний врачей.СПИСОК ЛИТЕРАТУРЫ1а
Глава 19 Эмфизема лёгкихВпервые эмфизему как самостоятельную нозологическую форму с её клиническими и морфологическими особенностями описал в 1826 году р. Лаэннек. В настоящее время эмфизема лёгких опреде¬ ляется как необратимое увеличение воздушного пространства дис¬ тальнее терминальных бронхиол, сопровождающееся деструкцией стенок ацинуса, без сопутствующего их фиброза [1]. Необратимое увеличение альвеолярного пространства не всегда бывает связано с деструкцией ацинуса. Например, такое состояние наблюдается при врождённой дисплазии лёгочной паренхимы при болезни Дауна. После пульмонэктомии в большинстве случаев развивается гиперинфляция (викарная гипертрофия) оставшегося лёгкого при сохранении его структуры.КлассификацияСовременная классификация эмфиземы выделяет 3 её варианта в зависимости от места поражения ацинуса [2].1. Проксимальная ацинарная эмфизема (центроацинарная), включающая в себя центролобулярную и фокальную формы.2. Дистальная ацинарная (парасептальная) эмфизема.3.Панацинарная.Наиболее распространённой является центролобулярная эмфи¬ зема (ЦЛЭ), развивающаяся у большинства больных ХОБЛ, свя¬ занная с длительным курением. При этом происходит расширение центральных отделов ацинуса — респираторных бронхиол, альвео¬ лярных ходов и альвеолярных мешочков (рис. 19-1). Как правило, изменения больше выражены в верхних долях, по мере прибли¬ жения к базальным отделам наблюдается уменьшение степени деструкции.Фокальная форма центроацинарной эмфиземы встречается у работников пылевых производств (обычно у шахтёров) и ассоции¬ руется со скоплениями макрофагов, нагруженных пылью (конио- фагов). Фокусы эмфиземы могут чередоваться с участками неиз¬ менённого лёгкого, причём распределены они обычно равномерно в отличие от ЦЛЭ.При дистальной ацинарной эмфиземе (ДАЭ) респираторные бронхиолы остаются неизменёнными, но происходит деструкция эластического каркаса межальвеолярных перегородок, что приво¬ дит к образованию булл или блебсов (пузырьков). Расположены подобные изменения на периферии лёгочной ткани, чаще всего
ЭМФИЗЕМА ЛЁГКИХ 361Норма ТБ РБЦентролобулярная эмфизема ТБ РБПанацинариая эмфизема ТБ РБйю. 19-1. Наиболее распространённые формы эмфиземы. РБ — респираторная бронхиола; А ~ альвеолы.ТБ — терминальная бронхиола;субплеврально (рис. 19-2) и являются главной причиной спонтанных пневмо¬ тораксов. При ДАЭ оставшаяся часть лёгочной ткани не изменена и нарушений лёгочной функции не наблюдается.Панацинариая эмфизема (ПАЭ) характеризуется диффузным расширением ацинуса, слиянием внутридольковых структур в единое воздушное пространство (см. рис. 19-1). Локальные формы ПАЭ нередко превращаются в буллы; они, как правило, наблюдаются у активных курильщиков одновременно с ЦАЭ или у стари- жов. Диффузные формы ПАЭ в большинстве своём встречаются у больных с дефи¬ цитом а^-антитрипсина (ААТ). Помимо сравнительно раннего возникновения, эта форма эмфиземы отличается своей локализацией преимущественно в базальных отделах лёгких. ПАЭ нередко наблюдается у больных ХОБЛ тяжёлого и крайнеЛю. 19-2. Компьютерная томо¬ грамма больного с дистальной а»4нзрной эмфиземой.
362ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯРис. 19-3. Компьютерная томо¬ грамма иррегулярной эмфиземы и кист у больной с идиопатиче¬ ским лёгочным фиброзом.тяжёлого течения без дефицита ААТ наряду с ЦАЭ и также может локализоваться в нижних зонах.Особое место занимают ситуации сочетания эмфизематозных и фиброзных изменений лёгочной ткани. Такие состояния наблюдаются при саркоидозе, сили¬ козе, идиопатическом лёгочном фиброзе и других интерстициальных заболевани¬ ях. Ингаляции солей кадмия и блеомицина также приводят к развитию эмфиземы и фиброза. Многие исследователи относят формы расширения терминальных отделов нижних дыхательных путей на фоне фиброзных изменений к варианту иррегулярной, или рубцовой, эмфиземы, в практической работе при интер¬ стициальных заболеваниях лёгких бывает сложно дифференцировать эмфизема¬ тозные изменения от кистозной дегенерации, при которой имеется эпителиальная выстилка (рис. 19-3).Буллёзная эмфизема (участки паренхиматозной деструкции размером более1 см) может быть исходом любой формы эмфиземы.Среди редких вариантов эмфиземы необходимо выделить синдром МакЛеода — одностороннюю деструкцию альвеолярных пространств в сочетании с локальным облитерирующим бронхиолитом.Факторы риска и патогенезГлавными экзогенными факторами риска развития эмфиземы, так же как и ХОБЛ в целом, являются продолжительные ингаляции частиц или газов, прежде всего — курение, обсуждается роль инфекции, в частности, аденовирусов [3] и хламидий, как возможной причины возникновения и прогрессирования лёгочной эмфиземы [4]. ДАЭ, «спаянная» с висцеральной плеврой, возможно, является следствием плевритов, перенесённых во внутриутробном периоде или в первые годы жизни. Баротравма в результате искусственной вентиляции лёгких у ново¬ рождённых может стать причиной локальных форм эмфиземы,Среди эндогенных факторов риска эмфиземы доказана роль врождённого дефи¬ цита ААТ.Пол имеет определённое, хотя и не изученное до конца влияние на формирование эмфиземы. Известно, что у женщин эмфизема развивается медленнее, её распро¬ странённость и тяжесть деструктивных изменений меньше, чем у мужчин со сход¬ ными факторами риска. Однако при одинаковой степени эмфиземы среди женщин
ЭМФИЗЕМА ЛЁГКИХ 303больше выражены клинические проявления — одышка, снижение переносимости физических нагрузок, депрессивные симптомы, ухудшение качества жизни [5].Патогенез эмфиземы лёгких сложен, в нём принимает участие множество эндо¬ генных факторов. Существует несколько механизмов развития данного заболе¬ вания, изолированно или комбинированно определяющих индивидуальный путь формирования патологических изменений.Одной из первых теорий происхождения эмфиземы явилась «сосудистая гипо¬ теза» российского з^ченого Э. Изаксона. В её основе лежит постулат о том, что первичные изменения происходят в капиллярном русле альвеол, где развиваются 1шкротромбозы с нарушением кровоснабжения, атрофией альвеолярных стенок и их последующей деструкцией [6J. Спустя более 100 лет, с открытием фактора роста эндотелия (ФРЭ), сосудистая гипотеза генеза эмфиземы получила своё биохимическое и экспериментальное подтверждение. ФРЭ определяет рост и жизнеспособность эндотелиальных клеток, в том числе и в лёгочных капилля¬ рах. Его подавление вызывает апоптоз эндотелия, редукцию сосудов и, вероятно, способствует деструкции эластического каркаса межальвеолярных перегородок. У больных с тяжёлой эмфиземой, подвергшихся лёгочной трансплантации или редукции лёгочной ткани, уровень ФРЭ и его рецепторов, определённый методом иммуногистохимии, значительно ниже, чем у здоровых [7]. На ранних стадиях ХОБЛ продукция ФРЭ резко возрастает в противоположность вариантам крайне тяжёлого течения, когда наблюдается значительное снижение его концентрации [8,9]. Блокада рецепторов ФРЭ у крыс приводит к развитию у них эмфиземы, при¬ чём продукты оксидативного стресса усиливают этот процесс [10].Следующим шагом, объяснявшим развитие эмфиземы, стала «механическая гипотеза», господствовавшая вплоть до 60-х годов прошлого века. Её авторы W.H. Harris и F.P. Chillingworth опубликовали в 1919 году результаты экспери¬ ментов по искусственному воспроизведению эмфиземы у собак при раздувании отдельных участков лёгких [11]. Согласно данной концепции, эмфизема является следствием перерастяжения лёгочной ткани с разрывом внутриацинарных струк¬ тур. Действительно, динамическая гиперинфляция лёгких появляется у больных ХОБЛ раньше видимых признаков эмфиземы и, по-видимому, вносит определён¬ ный вклад в дальнейшие деструктивные процессы.В 1963 году шведские ученые С.-В. Laurel и S. Ericsson сообщили о том, что у 3 из5 больных с тяжёлым дефицитом ААТ наблюдались признаки выраженной эмфи¬ земы [12]. В дальнейшем, после экспериментальных работ по интратрахеальному введению животным сначала папаина (фермент с эластолитической активностью) [13], а позднее — панкреатической эластазы [14] с последующим быстрым разви¬ тием эмфиземы, гипотеза протеазно-антипротеазного дисбаланса стала домини¬ рующей. Согласно ей, причиной развития эмфиземы является нарушение баланса в системе «протеолиз-антипротеолиз» вследствие увеличения активности протеаз и/или снижения концентрации (активности) антипротеаз.ПРОТЕАЗЫ И АНТИПРОТЕАЗЫЭкстрацеллюлярный матрикс лёгочной паренхимы состоит из длинных бел¬ ковых цепей, представленных эластином, коллагеном, желатином и ламинином. Несмотря на то что эласгин составляет лишь 2,5% сухого веса лёгочной ткани, его роль в поддержании тонуса и предотвращении экспираторного коллапса терминальных отделов нижних дыхательных путей является первостепенной. Традиционно считается, что в результате протеазно-антипротеазного дисбаланса происходит повреждение эластического каркаса лёгких, которое ещё в 1907 году было описано F. Orsos [15]. Однако ремоделирование альвеолярных стенок при эмфиземе происходит не только за счёт деструкции эластина, но и деградации коллагена и ламинина [16]. Увеличение протеолитической активности в лёгких
364ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯл?'.Происходит в результате хронического воспаления, миграции макрофагов и ней¬ трофилов с выбросом протеолитических ферментов (сериновых, цистеиновых, металлопротеиназ). Недостаток ингибиторов протеаз возникает либо вследствие генетически детерминированного дефекта синтеза или секреции (врождённый дефицит ААТ), либо из-за чрезмерной дезактивации их продуктами оксидативно- го стресса.В процессе деградации элементов экстрацеллюлярного матрикса лёгких уча¬ ствует множество протеолитических ферментов, представленных тремя группами: сериновые и цистеиновые протеазы, матриксные металлопротеиназы (ММП) (табл. 19-1).Таблица 19-1. Протеазы — участники патогенеза эмфиземы лёгкихСериновые протеазыНейтрофильная эластазаКатепсин ОЦистеиновые протеазыКатепсин ВКатепсин КМатриксные металлопротеиназыММП 1 (коллагеназа)ММП 2 (желатиназа А)Протеиназа 3ММП 3 (стромелизин)Катепсин 3ММП 7 (матрилизин)ММП 9 (желатиназа В)ММП 12 (макрофагальная металло- эластаза)Сериновые протеазы содержат в своём активном центре аминокислоту серии, цистеиновые — цистеин, а матриксные металлопротеиназы — цинк.Сериновые протеазыНаиболее изучена роль сериновых протеаз, прежде всего нейтрофильной эласта¬ зы (НЭ). Этот фермент концентрируется в азурофильных цитоплазматических гра¬ нулах полиморфноядерных лейкоцитов. Синтез НЭ происходит на стадии роста гра- нулоцита, а в кровоток поступают уже клетки с готовыми ферментами. Наибольшая концентрация НЭ содержится в нейтрофилах (1-2 пикограмма), которым протеаза обязана своим названием, незначительные концентрации определяются в моно¬ цитах и Т-лимфоцитах. НЭ участвует в естественной деградации матриксных белков — эластина, коллагена, фибронектина, ламинина, протеогликанов.Выделение НЭ из нейтрофилов в экстрацеллюлярное пространство происходит под влиянием различных субстанций; цитокинов (ФНО-а, ИЛ-8), липополисаха¬ ридов, фрагментов бактериальной стенки.Избыточная продукция нейтрофильной эластазы либо невозможность её адек¬ ватного ингибирования наблюдаются не только при эмфиземе, но и в случаях муковисцидоза и острого респираторного дистресс-синдрома.Инактивация НЭ осуществляется ингибиторами сериновых протеаз, полу¬ чивших название «серпины». к семейству которых относятся -антитрипсин, оз'макроглобулин, секреторный лейкопротеазный ингибитор, а также элафин (табл, 19-2).Таблица 19-2. Ингибиторы протеаз в лёгкихПротеазный ингибиторИсточникФизиологическая цельа,-АнтитрипсинСыворотка крови (гепатоциты),Нейтрофильная эластаза,бронхиальный эпителий,протеиназа 3, катепсин 6макрофаги
ЭМФИЗЕМА ЛЁГКИХ з$5Окончание табл. 19-2о,-Ашихимотрипсино^4лафогло6улинСыворотка крови (гепатоциты)Сыворотка крови {гепатоциты)Катепсин GЦистеиновые протеиназы, нейтрофильная эластазаСефеторный лейкопротеазный инги¬ биторТканевые макрофагиСериновые протеазыЦжпатины А, С, SМакрофагиЦистеиновые протеазыТеневые ингибиторы ММП, тип 1. 2Альвеолярные и тканевые макрофагиМеталлопротеиназыААТ синтезируется и секретируется эндоплазматическим ретикулумом гепа- тоцитов, в меньшей степени макрофагами и бронхиальным эпителием. Он имеет широкий спектр антипротеазной активности, включающий подавление протеиназы3. катепсина G, активатора плазминогена, трипсина. Однако главной его физиоло¬ гической целью является НЭ. Ген, кодирующий синтез ААТ, обладает выраженным полиморфизмом, в международной базе данных генома человека зафиксировано более 180 его мутаций. На основании анализа электрофоретической подвижности молекул аллелям гена ААТ присваивается буквенный код от А до Z. Нормальный вариант аллелей ААТ обозначается буквой М (существуют варианты М^, М2 и М3), 0>еди дефицитных чаще всего встречаются S- и Z-аллели, Различные комбинации существуюш[их аллелей определяют фенотип конкретного человека, который обо- звачается как Pi (Proteinase inhibitor). Нормальным является PiMM-фенотип, он характеризуется уровнем ААТ в сыворотке крови более 20 мкмоль/л. При осталь¬ ных вариантах происходит снижение концентрации ААТ в той или иной степени (табл, 19-3). Как видно из таблицы, наибольший вклад в дефицит ААТ вносят аллели О (null) и Z. В случае редкого фенотипа РЮО ААТ в крови полностью отсут¬ ствует. Тяжёлым дефицитом, определяющим высокий риск развития эмфиземы, считаются концентрации менее И мкмоль/л [17]. Весьма важным представляется не только абсолютный дефицит ААТ, но и потеря его антизластазной активности при сохранении нормальной концентрации фермента. Определена главная причина функциональной недостаточности ААТ. В её основе лежит окисление метионина (положение 351 и 358) в активном центре молекулы ААТ в результате хронического воздействия табачного дыма, содержащего оксиданты, а также избыточного обра¬ зования пероксида водорода у больных ХОБЛ [18, 19]. Именно продолжающимся оксидативным стрессом объясняется сниженная активность ААТ у пациентов, пре¬ кративших курение, на поздних стадиях ХОБЛ.Таблица 19-3. Уровень а,-антитрипсина в сыворотке крови и риск развития эмфиземы при раз¬ личных фенотипахФенотипУровень ААТ, мкмоль/л (мг/дл)Риск развития эмфиземымм20-50 (150-350)Не возрастаетMZ12-35 (90-210)Не возрастаетSS15-33 (100Ч40)Не возрастаетMS18-52 (94-270)Не возрастаетSZ8-19 (75-120)Средний рискZZ2,5-7 (20-45)Высокий рискNull null0(0)Очень высокий риск
366 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ> Подозрение на наличие дефицита ААТ должно возникать при клинически выра-& женной эмфиземе у лиц 45 лет и моложе; при развитии её в отсутствие факторов риска (провоцирующих факторов): при наличии бронхоэктазов неясной этиоло¬ гии или отягощённой наследственности по бронхолёгочным заболеваниям [20].Матриксные металлопротеиназы и их ингибиторыМатриксные металлопротеиназы — группа эндопептидаз, содержащих в своём активном центре молекулу цинка, что дало название их семейству, именуемому иначе «матриксины». Для развития лёгочной патологии у человека наибольшее значение имеют металлоколлагеназы (ММП-1, ММП*8, ММП-13), металложе- латиназы (ММП-2, ММП-9), стромелизин (ММП-3) и макрофагальная эластаза (ММП-12) (см. табл. 9-1).Физиологическая роль ММП состоит в облегчении внутритканевого движения различных клеток. В частности, ММП «расчищают» путь нейтрофилам в зону воспаления. Эндогенными регуляторами ММП являются тканевые ингибиторы металлопротеиназ (ТИМП). К настоящему времени описано 4 типа ТИМП, имею¬ щих соответствующую нумерацию (ТИМП-1, ТИМП-2, ТИМП-3, ТИМП-4).В противоположность матриксинам ТИМП подавляют клеточное передви¬ жение, ангиогенез и обладают природными противоопухолевыми эффектами. Антагонистами ММП, участвующих в деструкции лёгочной паренхимы, считаются ТИМП-1 и ТИМП-2.Роль ММП в патогенезе эмфиземы ещё требует изучения, однако целый ряд фак¬ тов говорит о существенном вкладе данной группы протеаз в процессы миграции клеток - участников воспаления в зоны паренхиматозной деструкции и в протеоли- тический процесс в лёгочной ткани. Известно, что альвеолярные макрофаги больных эмфиземой продуцируют значительно большие объёмы ММП-1 и ММП-9 по срав¬ нению с теми же клетками здоровых добровольцев [21]. В индуцированной мокроте больных ХОБЛ обнаруживаются высокие концентрации ММП-8 и ММП-9, уровень которых прямо коррелирует с числом нейтрофилов в мокроте, в то время как у здо¬ ровых курильщиков подобньгх изменений не наблюдается [22]. При исследовании методом ПЦР тканей больных эмфиземой обнаруживаются значимые различия в повышенном содержании ММП-1 в отличие от контрольных групп [23]. Применение универсального синтетического ингибитора ММП в экспериментальной модели эмфиземы у животных способно предотвращать альвеолярную деструкцию [24].Важным представляется не только изолированное содержание ММП. но и их соотношение с уровнем ТИМП. Однако изучение таких взаимосвязей даёт проти¬ воречивые результаты. В ряде работ было показано возрастание относительного показателя ММП/ТИМП у больных ХОБЛ [25], другие исследования свидетель¬ ствуют о том, что при ХОБЛ наблюдается увеличение активности ТИМП-1 в боль¬ шей степени, чем ММП [26,27], ММП играют заметную роль в ангиогенезе физио¬ логических и патологических процессов (например, опухолевом росте), расщепляя белки базальной мембраны и способствуя проникновению эндотелиальных клеток в ткань, окружающую сосудистую стенку. Кроме того, ММП индуцируют выра¬ ботку эндотелиальных факторов роста — медиаторов ангиогенеза. Напротив, тканевые ингибиторы металлопротеиназ, подавляя активность последних, замед¬ ляют процессы сосудистого роста [28]. Вероятно, преобладание уровня ТИМП над ММП приводит к деградации капиллярного русла межальвеолярных перегородок, определяя сосудистый путь формирования эмфиземы, в то время как обратное соотношение ведёт к лизису компонентов экстрацеллюлярного матрикса.Цистеиновые протеазыСреди большого числа цистеиновых протеаз (ЦП) связь с лёгочной эмфиземой прослеживается лишь у некоторых представителей лизосомальных протеаз -
ЭМФИЗЕМА ЛЁГКИХ 367жатепсинов. Эластолитической активностью обладают катепсины В, К, Ь, 5 и Установлено, что у больных ХОБЛ альвеолярные макрофаги продуцируют повы- юекшое количество ЦП в сравнении с некурящими и здоровыми курильщиками1291-Уже на доклинических стадиях развития эмфиземы в супернатанте бронхоаль¬ веолярных смывов обнаруживаются повышенные концентрации ЦП и их инги¬ биторов [30]. Эксперименты на животных также подтвердили увеличение уровня жатепсинов при искусственно индуцированной эмфиземе [31]. Однако в целом место ЦП в общем спектре протеолитических энзимов при лёгочной патологии €щё не слишком очевидно. Вероятно, недостаток исследований связан с особенно¬ стями механизма действия ЦП, которые приобретают активность только в кислой среде, что происходит кратковременно при активном воспалительном процессе.Помимо протеаз, антипротеаз, эндотелиального фактора роста, в качестве одного из элементов патогенеза эмфиземы лёгких выступает трансформирующий фактор роста (ТСР-р^). Хорошо известно, что ТСР-р^ является одним из важ- иейших цитокинов фиброгенеза. Его уровень значительно повышается при интер¬ стициальных болезнях лёгких, сопровождающихся пневмофиброзом. Имеются свидетельства того, что ТОР-р, выполняет протективные функции в отношении деструкции лёгочной паренхимы [32]. Он способен подавлять продукцию метал¬ лопротеиназ и стимулировать образование эластина [33, 34]. Физиологическая роль ТСР-р^ состоит в стимуляции восстановления баланса клеток, подвергшихся шоптозу, ускорении репаративных процессов при воспалении, В случае его избы¬ точной продукции исходом воспаления является фиброз. Замечено, что у мышей с дефектом сигнальной системы ТСР-р^ фиброз не развивается, зато очень быстро ирогрессирует эмфизема [35], У больных ХОБЛ также наблюдается снижение про¬ дукции данного цитокина [36].АПОПТОЗАпоптоз является универсальным естественным механизмом программируемой побели клеток, выполнивших свою физиологическую роль. Воспаление любой жжализации резко ускоряет апоптоз. При эмфиземе данному процессу в наи¬ большей степени подвержены альвеолоциты 1-го типа и эндотелиальные клетки лёгочных капилляров [37]. В процессе апоптоза умершие клетки захватываются макрофагами и подвергаются перевариванию. При этом макрофаги экспресси¬ руют целый ряд субстанций, направленных на восстановление структуры ткани, гмотерявшей клеточный состав, в том числе УЕСР и TGF-pJ^. Важно, что адек¬ ватная макрофагальная реакция не допускает разрушения клеточной стенки до захвата макрофагом и таким образом предотвращает антигенную стимуляцию. Существуют доказательства снижения макрофагальной активности в отноше- шии апоптозных клеток при ХОБЛ [38]. Возможно, это связано с разрушением фосфатидил-сериновых рецепторов на поверхности макрофагов избытком НЭ Ї39]. Снижение активности макрофагов приводит к подавлению экспрессии эндо¬ телиального фактора роста и ТОР-р^, что, в свою очередь, уменьшает репаративные ; ироцессы в альвеолярной ткани и капиллярах, а также ослабляет антипротеазный резерв. Кроме того, деструкция накопившихся апоптозных клеток ведёт к каскаду шгокиновых реакций и миграции нейтрофилов с освобождением протеаз.Таким образом, в патогенезе эмфиземы лёгких существует ряд взаимодейству- вшщх механизмов, которые, объединяясь в «порочные круги», создают условия ДІЯ неуклонного прогрессирования болезни даже при прекращении действия экзогенных индуцирующих факторов, таких как курение и хроническое ингаляци- «гаое действие поллютантов (рис. 19-4).Традиционное представление об эмфиземе как необратимом процессе было швдвергнуто сомнению исследованием по оценке содержания эластина и коллаге-
368ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯКурение,поллютаиггыРис. 19-4. «Порочные круги» патогенеза эмфиземы лёгких.на в лёгочной ткани больных, подвергшихся хирургической редукции лёгких по поводу эмфиземы. Оказалось, что, несмотря на деструкцию и истончение альвео¬ лярных стенок, типичное для эмфиземы, объём коллагена и эластина в септаль- ном интерстиции значительно выше, чем в неповреждённых лёгких [40]. В этих же зонах наблюдается скопление фибробластов. Таким образом, при эмфиземе происходят не только процессы повреждения компонентов экстрацеллюлярно¬ го матрикса, но и активный синтез нового материала, что представляет её как потенциально обратимое состояние с возможностью регенерации разрушенных тканевых структур. Такова последняя гипотеза патогенеза эмфиземы, получившая название дисбаланса «повреждения-регенерации». Её экспериментальным под¬ тверждением стали исследования, доказывающие восстановление архитектуры эмфизематозной ткани у мышей под влиянием ретиноевой кислоты [41], которая рассматривается как возможный кандидат в лекарственные препараты у больньгх эмфиземой [42].Описанные выше патогенетические механизмы развития эмфиземы связаны с хроническим воспалением, однако суш;ествуют и невоспалительные варианты эмфиземы, такие как сенильная эмфизема (старческая инволюция лёгких) и эмфизема голодаюш1их. В первом случае объяснение генеза эмфиземы сводится к старческой инволюции эластического каркаса лёгких и системным нарушениям микроциркуляции. Происхождение эмфиземы вследствие длительного голодания не вполне понятно. Между тем связь между лишением пиш;и и формированием эмфиземы прослеживается довольно отчетливо. Первое описание подобных слу¬ чаев принадлежит врачам J. Stein и Н. Fenigstein, проводившим вскрытие умерших узников Варшавского гетто во время Второй мировой войны. Из 370 аутопсий в 50 случаях была обнаружена эмфизема, причём более 60% из них составляли лица моложе 40 лет [43]. В дальнейшем исследования на крысах, подвергавшихся голоданию [44], и наблюдения у людей с нервной анорексией [45] выявили эмфи¬ земоподобные изменения лёгочной ткани, которые, однако, могли восстанавли¬
ЭМФИЗЕМА ЛЁГКИХ 369ваться до нормы при возвращении к естественному режиму питания. Существуют2 объяснения развития эмфиземы у голодающих. Первое говорит о том, что при голодании снижается синтез структурных белков лёгочной паренхимы. Второе представляет эмфизему как компенсаторный механизм, необходимый для сниже¬ ния кислородной нагрузки, так как кислород у таких лиц ускоряет процессы рас¬ щепления жировой, мышечной и других тканей. Однако оба эти предположения не имеют доказательного подтверждения.ДиагностикаТрадиционно в диагностике эмфиземы используются клинический, функцио¬ нальный и рентгенологический методы. Клинический фенотип больного эмфизе¬ мой общеизвестен и определяется как «розовый пыхтельщик» — это худощавый больной с бочкообразной грудной клеткой с ограниченной экскурсией, выбуха- ющими надключичными ямками и межрёберными промежутками. Такой пациент дышит часто, но поверхностно, «отдуваясь» — вытягивая губы и надувая щёки во время выдоха, тем самым создавая положительное давление на выдохе и компен¬ сируя экспираторный коллапс респираторных бронхиол. За счёт гипервентиляции у больных с эмфиземой гиперкапния развивается поздно и кожные покровы долго сохраняют естественный цвет. Некоторые исследователи указывают на большее число морщин на лице у больных эмфиземой как отражение общей потери эласти¬ ческих элементов [46], Однако классическое описание эмфизематозного фенотипа отражает финальные стадии диффузных форм эмфиземы. При локальных вари¬ антах или на ранних этапах развития эмфиземы клинический метод не обладает диагностической ценностью.Функциональные методы исследования, прежде всего спирометрия, являются главными методами диагностики таких обструктивных заболеваний лёгких, как бронхиальная астма и ХОБЛ. Несмотря на то что эмфизема в большинстве случаев является неотъемлемой частью структурных изменений лёгких при ХОБЛ, метод апфометрии не имеет серьёзного диагностического значения для изолированной оценки состояния респираторных бронхиол на первых стадиях болезни. Признаки бронхиальной обструкции появляются после того, как Уз лёгкого занята эмфизе¬ мой [47]. Даже при наличии диффузной эмфиземы и гигантских булл показатели бронхиальной проходимости могут быть близкими к нормальным величинам. При выраженной эмфиземе с формированием воздушных «ловушек» появляется харак¬ терная картина кривой «поток-объём» — так называемый симптом «зуба акулы» — резкое снижение скорости экспираторного потока сразу после пика сменяется пологим участком кривой, отражающим экспираторный коллапс респираторных ^нхиол (рис. 19-5). Более чувствительными являются методы исследования диффузионной способности лёгких и определения лёгочных объёмов, которые были взяты за основу для разработки функциональных критериев эмфиземы лёг¬ ких, предложенных Американским торакальным обществом. Ими стали снижение коэффициента диффузии (менее 80% должных величин) при одновременном снижении ОФВ^ менее 80% должных величин и/или повышении остаточного объ¬ ёма лёгких более 120% [48]. Распределение эмфиземы имеет влияние на функцио¬ нальные показатели. Преобладание верхнедолевой эмфиземы в большей степени ооределяет уменьшение диффузионной способности лёгких, в то время как ниж- ведолевая эмфизема, характерная для больных с дефицитом ААТ, сопровождается более значительным снижением ОФВ^ при минимальном измененииРентгенологическое исследование органов грудной клетки при диагностике эмфиземы выявляет 2 характерные группы признаков; увеличение объёма лёгких (уплощение и низкое расположение купола диафрагмы, расширение межрёберных щюмежутков, увеличение ретростернального пространства, сужение сердечной тени) и признаки лёгочной деструкции (обеднение сосудистого рисунка, буллы)
Рис. 19-5. Характерная кри¬ вая «поток-объём» у бОЛЬН(Ж) с эмфиземой лёгких. Пунктиром обозначена должная кривая.(рис. 19-6). При наличии обеих групп признаков чувствительность рентгеногра¬ фии возрастает до 80%, но вероятность постановки диагноза зависит от тяжести болезни [49]. Увеличение объёма и повышение воздушности лёгких являются важными рентгенологическими критериями в постановке диагноза эмфиземы, но не всегда наблюдаются на ранних стадиях болезни или, наоборот, присутствуют у пациентов с динамической гиперинфляцией без эмфиземы (например, при обо¬ стрении бронхиальной астмы, бронхиолитах).Рис. 19-6. Рентгенограмма боль¬ ного с эмфиземой лёгких,
ЭМФИЗЕМА ЛЁГКИХ 371в отличие от рентгенографии КТ позволяет обнаружить эмфизему уже на пер¬ вых этапах заболевания, чётко выявляя локализацию, размеры и распространён- вость эмфизематозных зон.КТ, особенно с высоким разрешением (КТВР), обладает гораздо более высокой чувствительностью в диагностике эмфиземы, превышающей 90%. Различные ткани в зависимости от плотности по-разному поглощают излучение, поэтому в настоящее время для каждой ткани и органа установлен физиологический коэф¬ фициент абсорбции (КА) по шкале Хаунсфилда. Согласно этой шкале, КА воды принят за О HU; воздух, имеющий наименьшую плотность, за —1000 HU. КА нор¬ мального лёгкого колеблется от —500 до —900 HU при средней плотности около —740 ни [501- Плотность нижележащих отделов лёгких в силу гравитационного фактора несколько выше по сравнению с вышележащими участками. Большинство исследований доказывает, что эмфизематозным изменениям лёгочной ткани в наибольшей степени соответствуют зоны лёгких с КА менее —950 HU [51].Для повышения точности количественной оценки эмфиземы лёгких методом КТ многие производители компьютерных томографов разработали программные про¬ дукты по автоматическому или полуавтоматическому анализу плотности лёгочной ткани (денситометрии). Программы определяют объём лёгочной ткани с заданны¬ ми порогами поглощения, расцениваемые как эмфизема. Преимуществом программ денситометрии является исключение субъективного компонента, зависящего от квалификации, опыта и качества изображения. Объективная оценка эмфиземы позволяет сопоставлять результаты, полученные в разных лечебных учреждениях Б процессе динамического наблюдения и при проведении научньк исследований. В настоящее время КТ с программной денситометрией лёгочной ткани ряд иссле¬ дователей рассматривают как «золотой стандарт» диагностики эмфиземы, однако данные денситометрии для оценки эмфиземы необходимо интерпретировать только в совокупности с визуальными признаками альвеолярной деструкции [52J. В последние годы разработаны методы микрокомпьютерной томографии, позво¬ ляющие с помощью особых оптических усилителей визуализировать тканевые структуры размером до 1 мкм. Таким образом, появилась возможность ш vivo ана¬ лизировать архитектуру ацинуса с разрешающей способностью, близкой к транс¬ миссионной электронной микроскопии. Первые исследования по оценке эмфиземы микрокомпьютерной томографией с трёхмерной реконструкцией дистальных воз¬ духоносных путей (виртуальной бронхоскопией) открывают перспективу дальней¬ шего совершенствования методов диагностики эмфиземы лёгких [53].ЛечениеСовременные подходы к лечению эмфиземы лёгких делятся на консервативные и хирургические.Поскольку в настоящее время эмфизема лёгких рассматривается как один из морфологических субстратов ХОБЛ, не существует изолированных консерватив¬ ных методов лечения больных эмфиземой, за исключением случаев тяжёлого дефицита -антитрипсина. Все терапевтические мероприятия проводятся в рам¬ ках программы ведения больных ХОБЛ и включают:• уменьшение действия факторов риска (отказ от курения, прекращение работы в условиях запылённости, загазованности);• лекарственную терапию;• реабилитационные мероприятия;• длительную кислородотерапию;• неинвазивную вентиляцию лёгких.Детальное освещение принципов консервативного лечения изложено в главе 18.У больных с эмфиземой лёгких вследствие тяжёлого дефицита -антитрипсина проводится внутривенная заместительная терапия очищенными лиофилизирован-
372 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯными экстрактами ААТ из человеческой плазмы. Существуют строгие показания к назначению заместительной терапии [17].• Больные с фенотипами PiZZ, PiZnull, PiNullNull.• Клинически выраженная эмфизема.• Уровень ААТ в сыворотке ниже 11 мкмоль/л.Только сочетание всех 3 условий даёт право врачу рекомендовать лечение пре¬ паратами ААТ.Наряду с традиционными противопоказаниями для введения белковых экс¬ трактов не рекомендуется проведение заместительной терапии у больных, про¬ должающих курить.Препараты ААТ вводятся внутривенно капельно один раз в нед из расчёта 60 мг/кг массы тела больного. Лечение проводится пожизненно.Результаты метаанализа свидетельствуют о снижении скорости падения ОФБ^ в группе заместительной терапии на 23%, причём этот эффект наблюдается только у больных с показателями бронхиальной обструкции средней степени тяжести.При ОФБ^ ниже 30 и выше 65% должных величин сдерживающий эффект заместительной терапии не доказан [54]. Позитивным следствием заместительной терапии, помимо торможения скорости нарастания бронхиальной обструкции, является снижение числа инфекционных обострений у больных с тяжёлым дефи¬ цитом ААТ [55,56].Принципиально важным для больных с клинически выраженной эмфиземой лёгких является проведение реабилитационных мероприятий. Физические трени¬ ровки по специально разработанным программам улучшают качество жизни боль¬ ных, повышают переносимость физических нагрузок, уменьшают одышку [57].Важно, что физические тренировки замедляют потерю мышечной массы, являющуюся серьёзной проблемой у больных эмфиземой, в таких случаях эффект реабилитационных мероприятий оценивается «значительно выше, чем фармако¬ логическое лечение» [58], несмотря на то что показатели бронхиальной проходи¬ мости фактически не меняются.Изучены факторы, влияющие на смертность при тяжёлой эмфиземе лёгких у больных, получающих консервативное лечение [59]. К ним относят:• старший возраст:• необходимость постоянного использования ю^слорода;• низкий уровень гемоглобина;• более высокий остаточный объём лёгких;• низкая диффузионная способность лёгких;• низкая толерантность к физическим нагрузкам;• преобладание нижнедолевой эмфиземы;• более высокий индекс массы тела.Интересно, что предикторами смертности при эмфиземе легких не являются такие факторы, как низкий ОФВ^, индекс массы тела, одышка, гипоксемия. гипер¬ капния, имеющие влияние в единой популяции больных ХОБЛ без разделения на фенотипы [60, 61].Хирургическое лечение эмфиземы лёгких включает 3 варианта: редукцию объема лёгочной ткани, удаление булл и лёгочную трансплантацию.Буллэктомия выполняется в случае рецидивирующих пневмотораксов или при наличии гигантских булл, ограничивающих функцию здоровых участков лёгко¬ го. Наилучшие результаты при буллэктомии наблюдаются, если они занимают 30-50% гемиторакса при ОФВ^ около 50% должных величин и не сопровождаются диффузной эмфиземой оставшейся лёгочной ткани [62].Хирургическая редукция объёма лёгочной ткани (ХРОЛ) при эмфиземе лёгких была впервые предложена в середине 50-х годов прошлого века О. Brantigan вЕ. Mueller, однако не получила широкого распространения из-за высокой послео¬
ЭМФИЗЕМА ЛЁГКИХ373перационной смертности, достигавшей 16% [63]. И лишь в 1995 году J.D. Cooper и соавт. опубликовали результаты собственного успешного опыта ХРОЛ у 20 больных с резекцией 20-30% каждого лёгкого [64]. С этого момента во всём мире активно развивается данное направление торакальной хирургии. В основе эффек¬ тивности ХРОЛ при эмфиземе лёгких лежат несколько механизмов: во-первых, удаление эмфизематозных, малофункциональных участков лёгочной ткани при¬ водит к снижению компрессии оставшихся альвеол, увеличению их эластической тяги и уменьшению выраженности «воздушных ловушек»; во-вторых, улучшается кровообращение в лёгочных капиллярах; в-третьих, увеличивается экскурсия диа¬ фрагмы. Таким образом, за счёт улучшения вентиляционно-перфузионных соотно¬ шений и снижения гиперинфляции происходит уменьшение главного симптома — одышки “ и положительная динамика функциональных показателей, прежде всего увеличение жизненной ёмкости и диффузионной способности лёгких.в 1999 году в США был дан старт программе «Национальное исследование по лечению эмфиземы», проводившей сравнение эффективности консервативных и хирургических подходов. Исследование показало, что ХРОЛ в течение нескольких лет после операции улучшает функциональные показатели, работоспособность и общее самочувствие по сравнению с медикаментозной терапией. Однако этот эффект наблюдается только у больных с гетерогенной эмфиземой верхнедолевой локализации. В то же время у больных с нижнедолевой или диффузной эмфизе¬ мой, а также при ОФВ^ менее 20% или DLco менее 20% должных величин послео¬ перационная 30-дневная летальность составила 16% [65]. Таким образом, далеко не все больные тяжёлой эмфиземой являются кандидатами для ХРОЛ. В табл. 19-4 суммированы показания и противопоказания к ХРОЛ, основанные на результатах рандомизированных исследований последних лет, проведённых в США, Канаде и странах Западной Европы.Таблица 19-4. Показания и противопоказания к ХРОЛ при эмфиземе лёгкихПоказанияПротивопоказания20% < ОФВ, < 40% должногоВозраст >75 лет00 >200% должногоПродолжение куренияОЕЛ >125% должюгоБронхоэктазы, острые инфекции дыхательных путей20% < DLco < 50% должногоПредшествующие операции на грудной клеткеВерхнедолевая локализаиция эмфиземыНижнедолевая локализация эмфиземыГетерогенность эмфиземы (наличие участков неизме¬ ненной лёгочной ткани по КТ}«Исчезающие» лёгкие по данным КТИндекс массы тела 17-32 кг/м“р^СОг >55 мм рт.ст.Низкая физическая выносливостьСреднее давление в лёгочной артерии >35 мм рт.ст.Мотивация больногоФракция выброса левого желудочка <40%Готовность больного к реабилитационным мероприя¬ тиям после операцииПриём ГКС >10-15 мг/сут преднизолонаНекоторые авторы считают, что ХРОЛ является альтернативой трансплантации лёгких (ТЛ) или во всяком случае может отодвинуть необходимость последней на 4-5 лет. Анализ функционального состояния и пятилетней выживаемости у 216 пациентов, подвергшихся ХРОЛ, показал, что у 53% больных, имевших показания к ТЛ, ХРОЛ привела к функциональному улучшению в течение 1 года и субъектив¬
374 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯному улучшению в течение 5 лет [66]. у тех, кто перенёс трансплантацию, наблю¬ дались сходные результаты выживаемости, даже если трансплантация следовала за ранее проведённой ХРОЛ.Оперативный доступ при ХРОЛ осуществляется 3 основными способами - через фединную стернотомию. путём видеоторакоскопии и видеобронхоскопии с использованием силиконового эндобронхиального клапана. Эндоскопический пзпгь считается менее травматичным, позволяющим снизить число осложнений н послеоперационную летальность, однако в отношении бронхоскопической ХРОЛ ещё недостаточно данных для суждения об отдалённых результатах [67].Показанием к ТЛ является выраженная эмфизема лёгких с дыхательной недо¬ статочностью, отсутствием эффекта от лекарственной терапии и реабилитацион¬ ных мероприятий с прогнозом предстоящей жизни не более 2-3 лет. критериями включения больных в лист ожидания на трансплантацию служат ОФВ, <25% от должных величин, DLco <20%, Рр^ <55-60 мм рт.сг., Р^СОз >50-55 мм рт.ст., вторичная артериальная лёгочная гипертензия. Первая успешная лёгочная транс¬ плантация в России была выполнена в 2006 году под руководством академика РАМН А.Г. Чучалина 53-летней больной с синдромом «исчезающего лёгкого» — гигантскими буллами, занимающими 85% лёгочного объёма.ЗаключениеЗа последние 10 лет произошли существенные изменения в понимании патоге¬ нетических процессов, лежащих как в основе эмфиземы, так и в разработке новых подходов к ведению больных. Внедрение новых методов лучевой диагностики позволяет устанавливать диагноз эмфиземы уже на ранних стадиях болезни, до появления клинических проявлений. Современные лечебные технологии дают возможность уменьшить симптомы заболевания, улучшить качество и продолжи¬ тельность жизни пациентов с эмфиземой лёгких.список ЛИТЕРАТУРЫ г
Глава 20 Бронхиальная астмаВВЕДЕНИЕБронхиальная астма (БА) является важнейшей проблемой меди¬ цины, Несмотря на то что эта патология известна очень давно, особое внимание ей стали уделять в последние 30-40 лет. За это время распространённость БА значительно возросла, а ущерб от этой болезни, определяемый как для индивидуума, так и для обще¬ ства, признаётся весьма значительным [1]. Исследования, посвя¬ щённые этому заболеванию, чрезвычайно обширны и включают полный набор научных направлений, начиная от эпидемиологи¬ ческих исследований и заканчивая изучением тонких механизмов реализации болезни на молекулярном уровне. Несмотря на это, в понимании БА, её течении, механизмах развития и подходах к лече¬ нию существует много неясностей и противоречий, что заставляет продолжать исследования в этой области.ОпределениеМножественность Проявлений болезни в известной степени затрудняет разработку точного определения патологии. Фенотипы БА имеют различную клиническую картину, что рождает мне¬ ние о том, что за термином БА скрывается на самом деле разная патология, проявляющаяся развитием обструкции бронхиального дерева. Слово «астма» в переводе с греческого означает «удушье». Действительно, в течение многих лет астма ассоциировалась с уду¬ шьем как обязательным проявлением заболевания. Непременным критерием установления диагноза была фиксация подобного эпи¬ зода. Патоморфоз заболевания, с одной стороны, многочислен¬ ные исследования клинической картины и особенностей развития болезни — с другой, заставили пересмотреть подходы к определе¬ нию болезни. Эволюция понимания БА хорошо отражена в опреде¬ лении, данном в «Вюбальной стратегии по лечению и профилактике бронхиальной астмы» пересмотра 2006 году (GINA, 2006). В этом документе БА определяется как «хроническое воспалительное забо¬ левание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление связано с бронхиальной гиперреактивностью, которая ведёт к повторяющим¬ ся эпизодам хрипов, одышки, чувства стеснения в грудной клетке и кашля, в особенности ночью или ранним утром. Эти эпизоды обычно связаны с распространённой, но вариабельной бронхиаль-
i»7376 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯg НОЙ обструкцией, которая часто обратима спонтанно или под влиянием лечения». §■ В этом же документе имеется важное уточнение; «...клиническая картина заболе¬ вания чрезвычайно разнообразна... Это замечание показывает, что Б А нередко легче диагностировать, чем определить. Ни одна из черт, приведённых выше, не является уникальной для БА, и в то же время нет черты, безусловно обязательной для этой болезни. Например, проходимость бронхиального дерева может быть нормальной между приступами БА, даже если они очень тяжелы [2]. Хорошо известно, что при типичной клинической картине БА может не наблюдаться эозинофильного воспаления, которое некоторое время назад считалось чуть ли не патогномоничным для этой болезни [3], и т.д.Тем не менее согласительное определение, приведённое выше, на сегодняшний день является основным рабочим определением как для клинической практики, так и для научных исследований.ЭпидемиологияБА относится к наиболее распространённым заболеваниям человека во всех возрастных группах. Резкий рост заболеваемости Б А произошёл во 2-й половине прошедшего столетия, когда за 50-летний период, с 1930-х по 1980-е годы, произо¬ шло 7-10-кратное увеличение её распространённости, регистрируемое в США и странах Европы как среди детского, так и взрослого населения [4, 5]. Тенденция роста частоты БА сохранялась и в дальнейшем, вплоть да настоящего времени. Обобщая результаты исследований, проведённых в 2 последних десятилетия, можно отметить, что за этот временной промежуток во многих странах мира произошло еще примерно двукратное увеличение распространённости Б А [6-9]. Относительно увеличения числа больных БА не составляет исключения и Россия. Так, распространённость БА в России всего лишь за 4-летний период, с 1991 по 1994 год, возросла на 32,3% [10], а с 1998 по 2002 годы отмечается дальнейший рост этого показателя ещё на 28,2% [11].Наряду с общей закономерностью, характеризующейся повсеместным увели¬ чением распространённости БА, следует отметить и ещё одно важное обстоятель¬ ство, касающееся не только количественного, но и качественного изменения в эволюции БА. Отмечается нарастание её тяжёлых форм [8,12], что подтвержда¬ ется увеличением числа госпитализаций больных [13] и смертности, причиной которой является астма [14,15]. Таким образом, к настоящему времени накоплено достаточно большое количество фактов, свидетельствующих об увеличении рас¬ пространённости БА и более тяжёлом её течении.Несмотря на однонаправленную динамику, показатели распространённости БА, как свидетельствуют многочисленные исследования, варьируют в широком диапа¬ зоне. Поэтому важнейшими задачами, которые призвана решать эпидемиология, являются сравнительное изучение заболеваемости БА в различных климатогео- графических зонах как внутри отдельных стран, так и между ними, оценка взаимо¬ отношений между генетическими факторами, образом жизни, внешнесредовыми факторами и распространённосгью этого заболевания [10,12,16].Сложность сравнительной оценки распространённости БА долгое время состоя¬ ла в том, что не было чёткого эпидемиологического определения заболева¬ ния, отсутствовали универсальные диагностические критерии и стандартные инструменты для описательной эпидемиологии Б А [8, 10, 17]. Вследствие этого результаты многих исследований трудносравнимы, так как в них использовались различные методы и нестандартизованные вопросники, являющиеся важнейшим эпидемиологическим инструментом. На преодоление указанных методологиче¬ ских трудностей направлены разработанные и проводимые в последнее десятиле¬ тие во многих странах мира международные программы по изучению распростра¬ нённости БА на основе стандартизованных методик: ISAAC (International Study
БРОНХИАЛЬНАЯ АСТМА 377of Asthma and Allergy in child-hood) и ECRHS (European Community Respiratory Health Survey) [16, 18]. Опубликованные результаты этих исследований, обоб¬ щающие данные о распространённости симптомов БА среди детей в 56 и взрослых в 22 странах [19, 20], подтвердили 2 широко обсуждающихся в настоящее время обстоятельства. Во-первых, высокую распространённость Б А как среди детей, так и взрослых, а во-вторых, большую вариабельность частоты симптомов заболева¬ ния не только между различными странами, но и среди отдельных их регионов, что связано, по-видимому, с внешнесредовыми, социально-экономическими и этническими различиями.Обобщённые результаты международных исследований по программе ISAAC показали, что распространённость основного симптома текущей БА — свистящего затруднённого дыхания — в среднем составляет 11,3% для младшей возрастной группы и несколько больше — 13,8% — для подростков. При этом различия между странами достигают многократных значений. Наибольшая распространённость симптомов БА регистрируется в Австралии, Новой Зеландии, Великобритании, минимальные показатели отмечены в Индонезии, Греции, Тайване, Албании. Характеризуя структуру тяжести БА у детей, следует отметить, что, по данным эпидемиологических исследований, примерно у 70% больных Б А носит лёгкий характер, в 25% случаев она характеризуется среднетяжёлым и в 5% — тяжёлым течением [21].В России первые исследования по программе ISAAC были выполнены в 1993-1998 годах в Москве, Новосибирске, Иркутске, Наро-Фоминске [21-25] и к настоящему времени проведены во многих регионах страны [26]. Результаты эпидемиологических исследований с использованием стандартизованных вопро¬ сников и единой методологии убедительно показали высокую распространённость БА в России среди детей как младшего возраста, так и подростков, сопоставимую с общемировыми показателями и, в частности, северо-восточноевропейскими стра¬ нами. Так, частота текущих признаков БА (свистящее затруднённое дыхание за последние 12 мес) в популяции школьников 13-14 лет составила в среднем 9,7%, варьируя в разных регионах более чем в 2 раза [26].Анализ результатов эпидемиологических исследований свидетельствует ещё об одной важной закономерности. Во многих странах, включая и Россию, частота симптомов текущей БА в 1,5-6 раз выше, чем «когда-либо диагностированная астма», что может свидетельствовать о гиподиагностике врачами Б А или о низкой специфичности вопросника. Исследования, проведённые в России [23, 27] и ряде других стран, где выполнялось клиническое обследование детей в рамках эпиде¬ миологического исследования, показывают, что на самом деле имеется широко распространённая гиподиагностика БА врачами общей практики. Основной при¬ чиной гиподиагностики БА, по мнению как отечественных, так и зарубежных исследователей, является недооценка лёгких и редких эпизодов заболевания, что приводит к поздней диагностике, когда имеет место уже среднетяжёлое или тяжё¬ лое течение БА. При этом подчёркивается, что неадекватная диагностика ведёт и к неадекватному лечению БА.Для Б А у взрослых характерны те же закономерности, что и в детском возрасте; высокая вариабельность показателей распространённости и меньшая частота БА, диагностированной врачами, по сравнению с результатами эпидемиологических исследований.В табл, 20-1 приводятся показатели распространённости симптомов БА среди 20-44-летних лиц, полученные в результате исследований, выполненных по про¬ грамме ECRHS в 48 центрах 22 стран [17]. Из представленных данных видно, что различия в частоте симптомов БА между разными странами достигают 7-11-кратных значений. Еще в большей степени — в 16 раз — различается частота приёма противоастматических препаратов.
378ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯТаблица 20-1. Распространённость симптомов БА среди лиц 20-44-летнего возраста по данным исследований ECRHS [17]Симптомы за последние 12 месРаспространённость, %в среднемминимуммаксимумСвистящее дыхание27,04.135,0Свистящее дыхание без предшествующей простуды12,72,021,6Пробуждение с чувством стеснения в груди13,56,217,5Пробуждение от затруднённого дыхания7,31,511,4Пробуждение из-за кашля27,96,042,6Приступы удушья3,11,39,7Приём противоастматических препаратов3,50,69,8По уровню распространённости БА среди взрослого населения соотношение разных стран остаётся примерно таким же, как и для «детской» БА. Наиболее высокие показатели распространённости БА в пределах 11-14% характерны для Англии, Австралии, Новой Зеландии, в 1,5-2 раза ниже частота БА в странах Западной Европы и Скандинавии и, наконец, ещё более редко (в пределах 2-3%) БА регистрируется в Албании, Турции, Чехии, Румынии.При оценке распространённости БА среди взрослого населения в России сле¬ дует отметить низкие показатели, определяемые на основании обращаемости за медицинской помощью. По данным Министерства здравоохранения и социаль¬ ного развития, в 1994 году распространённость БА в РФ составила 410 на 100 ООО населения (0,41%) [10]. Несмотря на увеличение этого показателя в последующие годы, распространённость БА на 100 ООО взрослого населения в 2002 году достигла 659 (0,66%) [28], что значительно ниже, чем в странах Европы.Истинную распространённость БА среди взрослого населения в России позво¬ ляют оценить эпидемиологические исследования, проведённые в последние годы в Москве, Санкт-Петербурге, Екатеринбурге и Иркутске с использованием вопро¬ сников ECRHS и по унифицированной методологии [25, 29-31]. На 1-м этапе исследования в случайных выборках взрослого населения этих городов проводился анкетный скрининг. Ответившим положительно хотя бы на один из вопросов скри¬ нингового вопросника на 2-м этапе проводилось клинико-функциональное иссле¬ дование, включающее оценку ФВД и обратимости бронхиальной обструкции при её наличии, в сомнительных случаях — 2-недельную пикфлоуметрию и/или тест на бронхиальную гиперреактивность, аллергологическое обследование [25, 30].Результаты анкетного скрининга показали, что астмоподобные симптомы, и в частности свистящее дыхание, отмечают 15-16% российских респондентов. Эти данные хорошо согласуются с результатами исследований по программе ECRHS, согласно которым симптомы БА феди взрослого населения большинства европей¬ ских стран выявляются в 12-17%, а их частота ниже в России только по сравнению с такими странами, как Англия, Австралия и Новая Зеландия [17].Несмотря на то что показатель распространённости симптомов БА является важным популяционным параметром заболевания, позволяющим проводить сравнительную оценку между отдельными странами и регионами, для полной эпидемиологической характеристики БА он недостаточен, так как астмоподобные симптомы могут быть обусловлены и другими бронхообструктивными заболе¬ ваниями, в частности ХОБЛ и сердечно-сосудистой патологией. Такому подхо;^
БРОНХИАЛЬНАЯ АСТМА379наиболее полно соответствует известный клинический постулат о том, что «всё, что сопровождается свистящими хрипами, следует считать БА до тех пор, пока не будет доказано обратное;^ [32]. Поэтому наиболее точно о распространённо¬ сти БА в изучаемой популяции можно судить по таким показателям, как текущая и/или диагностированная БА [33]. Критериями текущей Б А в эпидемиологических исследованиях являются: 1) сочетание одного из симптомов БА с бронхиальной гиперреактивностью, подтверждённой в гистаминовом или метахолиновом тесте; 2) сочетание свистящего дыхания с ночными эпизодами астмы, или приступами удушья, либо с приёмом противоастматических препаратов.Важное значение в эпидемиологии БА имеет определение бронхиальной гипер¬ реактивности (БГР), выявленной с помощью гистаминового или метахолипового тестов и являющейся диагностическим маркёром заболевания [10,19,32]. В насто¬ ящее время накоплены убедительные данные о целесообразности применения метода суточной пикфлоуметрии, проводимой в течение 1-2 нед, для выявления вариабельности бронхиальной проходимости, которая в условиях эпидемиологи¬ ческих исследований БА может рассматриваться как клинико-функциональный эквивалент бронхиальной гиперреактивности, выявляемой в ингаляционном тесте с гистамином или метахолином [34,35].Таким образом, текущая БА интерпретируется как симптомокомплекс в течение последнего года (хрипы, стеснение в груди, кашель, одышка), ассоциированный с гиперреактивностью дыхательных путей, что позволяет выделить лиц с клиниче¬ ски значимой Б А, требующей назначения базисной терапии [32]. С этих позиций 2-й этап исследования, включающий клинико-функциональное обследование пациентов с астмоподобными симптомами, выявленными при анкетном скринин¬ ге, является очень важным, поскольку позволяет диагностировать текущую БА и исключить другие заболевания с бронхообструктивным синдромом.Результаты углублённого клинического обследования пациентов с астмопо¬ добными симптомами, выявленными при анкетном скрининге, свидетельствуют, что далеко не у всех из них речь идёт о БА. Так, распространённость текущей БА, по данным эпидемиологических исследований, составила в Москве, Санкт- Петербурге, Екатеринбурге и Иркутске достаточно близкие показатели: соответ¬ ственно 6,3; 7,3; 6,2 и 5,6%, что хорошо корреспондирует с данными по другим странам (табл. 20-2).Таблица 20-2. Показатели распространённости симптомов и текущей БА у взрослых, %СтранаГ од изученияВозраст,летСимптомы БАТекущая БАИсточникиАнглия199616-5026,0-30,413,8-14,0[77, 98]Португалия199320-441610,6[37]Франция199520-44144,0[103]Италия199320-44179,4[56]Швеция199516-697,8-12.94,9-10,8[86, 89]Финляндия199518-697,0-16,74,6-6,9(88, 94]Греция199620-44162,4[105]Румыния1994>186-121.7-6,6[67]Албания199520-446,72,1[111]
380ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯОкончание табл. 20-2Австралия199420-442810-25,5[36, 85]Новая Зеландия РоссияМоскваЕкатеринбургИркутскСанкт-Петербург1994199219971997200220-4425-6418-6420-5916-9825-3516,115,116,35,5-22,16.3 6,2 5,67.3[92][5][20][33][13]Вместе с тем так же как и при детской БА, эпидемиологические показатели её распространённости значительно превосходят данные официальной медицинской статистики. По экспертной оценке А.Г. Чучалина, основанной на сопоставлении результатов эпидемиологических исследований и данных медицинской статистики по обращаемости, общее число больных БА в России приближается к 7 млн чело¬ век, тогда как по официальной статистике — в пределах 1 млн.Каковы же возможные причины указанных различий? Сравнение структуры тяжести клинически диагностированной БА при эпидемиологическом исследова¬ нии и у больных, наблюдающихся участковыми врачами, показало, что в первом случае преобладает БА лёгкого течения, а тяжёлые формы заболевания встреча¬ ются только в 6-7% [27, 30], тогда как среди наблюдающихся больных в поли¬ клиниках преобладает БА тяжёлого и среднетяжёлого течения. Отсюда становится очевидной гиподиагностика БА лёгкого течения, то есть в ранних стадиях забо¬ левания. Подтверждает гиподиагностику астмы и то обстоятельство, что почти в половине случаев (48%) диагноз БА при эпидемиологическом исследовании был выставлен впервые [30].Вместе с тем заниженные показатели заболеваемости БА связаны не только с гиподиагностикой её лёгких форм, с которыми больные часто не обращаются к врачу. Экспертная оценка амбулаторных карт больных БА, выявленных в ходе исследования, показала, что 29% из них систематически наблюдались у врачей, но по поводу различных вариантов бронхита, главным образом хронического обструктивного, или ХОБЛ [25]. Близкие результаты получены и другими авто¬ рами [36]. Причинами ошибочной диагностики (в том числе гиподиагностики) являются недооценка анамнеза, переоценка значимости «классического» приступа удушья в качестве основного критерия БА, недостаточное использование в повсед¬ невной практике методов оценки обратимости бронхиальной обструкции (пробы с бронхолитиком, определения суточной вариабельности ПСВ с помощью пик¬ флоуметрии) и, наконец, недостаточное аллергологическое обследование. В связи с этим одной из важных мер, направленных на профилактику тяжёлых форм БА и своевременность назначаемой терапии, является совершенствование диагностики болезни в её ранних стадиях.Касаясь возрастных аспектов эпидемиологии БА среди взрослого населения, следует отметить, что большинство исследований ограничивается молодым воз¬ растом (до 44 лет), поскольку специфичность вопросников в старшей возрастной группе снижается в связи с нарастанием частоты ХОБЛ и сердечно-сосудистых заболеваний [25, 36, 37]. Поэтому неудивительно, что распространённость БА среди пожилых и лиц старческого возраста остаётся наименее изученной пробле¬ мой. При клиническом обследовании пожилых пациентов Б А также часто не диа¬ гностируется, так как врачи нередко предпочитают «возрастно-обусловленные» заболевания, такие как ХОБЛ [38], что связано с неоправданно широко распро¬ странёнными представлениями о низкой частоте астмы у пожилых и её гиподи- агностикой [37, 39]. Вместе с тем те немногочисленные исследования, которые
БРОНХИАЛЬНАЯ АСТМА 381имеются, свидетельствуют об обратном. Так, в 2 исследованиях, проведённых в разных городах США [37, 40J, среди лиц пожилого возраста (5201 и 1223 чело¬ века) БА была выявлена в 6-9%. Одна треть больных на момент исследования регулярно пользовалась бронхолитиками, 14% — ингаляционными и 10% — перо¬ ральными ГКС. Аналогичные результаты получены среди французских пенсио¬ неров: частота когда-либо диагностированной БА в случайной выборке из 3777 человек старше 65 лет составила 6,1%, из которых 40,3% имели признаки текущей астмы [41]. Авторы проведённых исследований подчёркивают, что БА у пожилых и стариков имеет истоки не только в молодом возрасте, но нередки случаи, когда она дебютирует и после 60 лет [42, 43]. При характеристике БА у пожилых и при поздно возникшей астме отмечается, что для неё присущи те же маркёрные при¬ знаки, что и у больных молодого возраста: обратимость бронхиальной обструкции в пробе с бронхолитиками, вариабельность суточной ПСБ при пикфлоуметрии, бронхиальная гиперреактивность по результатам ингаляционного теста с гистами¬ ном или метахолином [37, 38]. Вопреки распространённому мнению, в ряде работ показано, что аллергия по данным рпск-чесча и определения специфических IgE встречается у пожилых больных БА в 29-72% [44, 45].С приведёнными данными хорошо согласуются результаты отечественных эпиде¬ миологических исследований. Так, в московской популяции БА после 45 лет встре¬ чалась в 1,5 раза чаще, чем в молодом возрасте. Среди мужчин распространённость БА была максимальной в возрасте 45-54 лет (8,9%), а феди женщин — 55-64 лет (8,2%) [29]. В Санкт-Петербурге наибольшая частота астмы среди женщин (11Д%) зафиксирована в возрасте 45-59 лет, а у мужчин старше 25 — среди лиц старше 60 лет (4,2%), В целом же Б А несколько чаще болеют женщины, особенно это замет¬ но в старших возрастных группах [25,30].БРОНХИАЛЬНАЯ АСТМА И АЛЛЕРГИЯВ связи с этиологически значимой ролью аллергенов в развитии БА важное место в эпидемиологических исследованиях занимает оценка аллергологического статуса обследуемых лиц. Показано, что 61,1-90,5% больных БА в различных популяциях имеют положительный prick-ieci или повышенный уровень сыворо¬ точных специфических IgE [46] в сравнении с распространённостью сенсибилиза¬ ции в общей популяции в пределах 16-45% [17]. В России, согласно эпидемиологи¬ ческим исследованиям, получены близкие показатели: распространённость атопии по результатам ;?пс:^-тестов в общей популяции подростков составила 35,7%, тогда как среди детей, больных Б А, аллергия имела место в 91,3%, а у взрослых больных атопический вариант Б А диагностирован в 68,3-72,8% случаев [27, 30,47].Удельный вес тех или иных причинно-значимых аллергенов в разных регионах значительно колеблется. Тем не менее в большинстве обследованных популяций преобладающими этиологическими факторами атопической БА являются аллер¬ гены клещей домашней пыли, тараканов, плесневых грибов, пыльцы растений, эпидермальные аллергены. Широкое распространение клещей домашней пыли и их выраженные аллергенные свойства обусловливают высокую частоту клещевой сен¬ сибилизации, которая отмечается у 5-30% населения [17,48], в связи с чем эксперты ВОЗ рассматривают эту проблему как глобальную [49]. Среди больных атопической БА сенсибилизация к дерматофагоидным клещам в разных популяциях колеблется от 35 до 86% [43,50]. По данным отечественных авторов, частота клещевой аллергии при БА составляет 46-76% у детей и 53-84% — у взрослых [27,51-53],Высокая частота клещевой аллергии в России не случайна. Акарологические исследования, проведённые в Москве, Санкт-Петербурге, Иркутске, Владивостоке, показали, что в абсолютном большинстве квартир больных БА обнаруживают¬ ся в большом количестве пироглифидные клещи, среди которых доминируют Dermatofagoides pteronissinus и Dermatofagoides farinae [36, 54, 55], Между числен¬
382 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯностью клещей и концентрацией их аллергенов в пыли имеется высокая корреля¬ ция. В половине московских квартир концентрация аллергена составила от 2 до 10 мкг/г пыли, а в 14% превысила 10 мкг, что соответствует результатам, получен¬ ным в другах странах [56]. В то же время известна связь между уровнем экспозиция аллергена, развитием Б А и степенью её тяжести [57]. При содержании в домашней пыли аллергена Der р I выше 10 мкг у 50% детей отмечается сенсибилизация, а к 11-летнему возрасту Б А развивается почти в 5 раз чаще, чем в контрольной группе [58]. И наоборот, уменьшение концентрации аллергенов клещей значительно сни¬ жает клинические проявления БА и бронхиальной гиперреактивности [59,60],Другими причинно-значимыми для БА и широко распространёнными вну- трижилищными сенсибилизаторами являются аллергены домашних животных, главным образом кошки и собаки. Частота аллергии к этим животным при БД варьирует в пределах 5-37% для собак и 15-67% - для кошек [50, 53, 61, 62], достигая наибольших значений в некоторых штатах США и Скандинавии [59], где эпидермальная аллергия является ведущей. В России эпидермальная аллергия при БА также является достаточно распространённой и колеблется в пределах 22-58% в зависимости от региона, возраста пациентов, методов диагностики [27. 30, 51-53]. Отличительными особенностями аллергена кошек являются их дли¬ тельная персистенция и чрезвычайно широкая распространённость. Показано, что даже после удаления животного из квартиры аллерген Fel d I определяется в её воз¬ душной среде от нескольких месяцев до 5 лет [63]. Вместе с тем около половины лиц, имеющих гиперчувствительность к аллергену кошек, никогда не держали их в своих квартирах, что указывает на возможность сенсибилизации вне собствен¬ ного дома [64], И действительно, достаточно высокие уровни Fel d I определяются в различных общественных заведениях, в том числе и там, где кошки не живут яслях, детских садах, школах, торговых центрах, кинотеатрах и даже в лечебных учреждениях [62,65]. Доказано, что аллергены кошек и собак могут переноситься на одежде [59], Особое внимание обращается на школы, где нередко содержание аллергена кошек сопоставимо с таковым в квартирах школьников или учителей, имеющих этих животных дома. В результате кошачьи аллергены в школах могут играть роль триггера для детей, больных БА [59, 65].Среди причин внутрижилищной аллергии при БА немаловажная роль отводит¬ ся антигенам таракана.Для многих стран, в том числе и России, бытовая инсектная аллергия становит¬ ся в последние годы актуальной проблемой в связи с высокой степенью заселения жилых и общественных помещений тараканами [66-68]. Наиболее распростра¬ нёнными видами являются американский {Periplaneta americana) и обитающий преимущественно в Европе немецкий {Blatella germanica) тараканы. Показана высокая связь между численностью больных БА с сенсибилизацией к аллергенам таракана и уровнем их содержания в домашней пыли [67]. Частота сенсибилиза¬ ции к аллергенам тараканов у больных БА колеблется в популяциях разных стран в пределах 11-84% [68-71], В России среди больных БА аллергия к таракану определяется в 19-63,7% [27,66,72, 73].Аллергены плесневых грибов, широко распространённых в природе, относятся одновременно к группе внутрижилищных и внешних причинных факторов БА, что обусловлено высоким содержанием микромицетов как в атмосферном воздухе, так и внутренней среде помещений [57, 65, 74, 75]. Наибольшее количество спор плесневых грибов обнаруживается в сырых, плохо проветриваемых помещениях, что сопровождается прямой коррелятивной связью между частотой аллергии и величиной микогенной загрязненности жилья [69]. Несмотря на то что способно¬ стью индуцировать IgE-зависимый ответ обладают антигены нескольких десятков видов грибов, наибольшее значение в этиологии БА имеют Altemaria, CladosporiuirL, AspergiUus, Peniciliium, Rhyzopus, Mucor, удельный вес которых в структуре грибко-
БРОНХИАЛЬНАЯ АСТМА 383роя сенсибилизации в разных климатогеографических зонах может меняться. Так, вфимер, в США, Франции, Италии наибольшее значение имеет Altemaria [76], в Семрной Европе — Cladosporium [77]. В России у больных БА преобладает аллергия mA^ergillus, Penicillium, Cladosporium, Altemaria [27,52,53,74,78]. В целом же часто¬ та грибковой сенсибилизации у больных БА по результатам кожного тестирования и «шределения специфических IgE колеблется от 5 до 60% [27, 39, 50,52, 69,78,79].Помимо грибковых, к внешним сенсибилизирующим факторам относятся ^ пыльцевые аллергены. Распространённость и этиология пыльцевой аллергии ирактеризуется значительными региональными особенностями, что связано с жяиматогеографическими условиями, видовым составом растений, календарём их щветения, аллергенностью пыльцы. Так, в США, южных областях некоторых евро¬ пейских стран и России основным аллергеном является пыльца амброзии [80]. В большинстве стран Европы и центральных районах европейской части нашей страны наиболее распространёнными являются аллергены пыльцы луговых трав,• меньшей степени деревьев и сорняков [55,81, 82]. Б Восточной Сибири, в отли¬ чие от центральноевропейских регионов, больший удельный вес занимают пыльца березы и полыни [83].Частота пыльцевой аллергии в европейских странах и России составляет 1-16%, в США достигает 39% [81,84]. При этом удельный вес пыльцевой сенсибилизации в эггиологической структуре респираторных аллергических заболеваний в некоторых штатах США и в южных областях Европы достигает 66,5% и превьппает частоту гаперчувствительности к внутрижилищным аллергенам [70, 71]. В России пыль¬ цевая сенсибилизация является доминирующей в Северо-Кавказском регионе и некоторых южных областях [52,80]. При аллергологическом обследовании разных популяций больных БА пыльцевая аллергия выявляется в 16-52% случаев, однако единственной причиной БА она является в 5-6 раз реже [27,50, 78],Завершая эпидемиологический обзор аллергии как фактора риска Б А, необхо¬ димо отметить 2 следующих обстоятельства. Во-первых, сенсибилизация только к одному из аллергенов (моновалентная аллергия) встречается достаточно редко, не превышая 20-25%, тогда как в большинстве случаев имеет место полисенсибили¬ зация, что способствует более тяжёлому течению БА и затрудняет её лечение [27, 50,78, 85]. Во-вторых, бытовая аллергия (клещевая, микогенная, эпидермальная) должна рассматриваться в более широком контексте экологии жилья, имеющей не менее важное значение, чем экология внешней среды. В первую очередь это касается детей, поскольку контакт ребёнка в первые годы жизни с широким кругом аллергенов и сенсибилизация к ним являются чрезвычайно важными факторами для развития в дальнейшем аллергических заболеваний, включая БА [12, 22, 49, 74].РАСПРОСТРАНЁННОСТЬ БРОНХИАЛЬНОЙ АСТМЫ И АЭРОПОЛЛЮТАНТЫВ настоящее время Б А часто рассматривается как экологически зависимое забо¬ левание, между распространённостью которого и уровнем промышленного загряз¬ нения атмосферы существует устойчивая связь [10,14, 86]. С этих позиций боль¬ шая частота БА среди жителей индустриальных городов связывается с высоким уровнем загрязнения воздушной среды техногенными поллютантами. При нарас¬ тании суммарного загрязнения атмосферного воздуха до средней интенсивности в 2 раза увеличивается распространённость аллергических заболеваний органов дыхания [22]. Близкие результаты получены при сравнении распространённости БА среди жителей сельской местности (отсутствие промышленных предприятий) и промышленного города. Распространённость БА среди городского населения (как детского, так и взрослого) оказалась в 1,6-1,8 раза выше, чем в сельской мест¬ ности [27].
384 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯЗначимость эпидемиологических исследований по изучению распространённо¬ сти БА в крупном промышленном регионе возрастает при одновременном изуче¬ нии загрязнения атмосферного воздуха [87-89], Для осуществления подобных исследований обязательным является анкетирование репрезентативных гр^ш населения с использованием стандартизованных вопросников и одновременное определение концентрации различных аэрополлютантов [90],В исследованиях ряда авторов доказана связь между такими воздушными пол¬ лютантами, как озон, двуокись азота, двуокись серы, кислых аэрозолей, и симпто¬ мами астмы [31,89,91-93]. Двуокись серы, озон и оксиды азота в концентрациях, которые обнаруживаются в сильно загрязнённых городах, могут вызвать повреж¬ дающее действие на респираторный эпителий, бронхоконстрикцию, транзиторную БГР и оказать влияние на аллергический ответ [94, 95], Повреждающее действие аэрополлютантов на органы дыхания проявляется в подавлении системы место# защиты против вирусных и бактериальных агентов и формировании острого н хронического воспаления.Озон и двуокись азота являются компонентами фотохимического смога. Двуокись азота — общераспространённый загрязнитель воздуха в домах и воздуш¬ ной среде. Во многих городах вне помещений определено, что повышенная ко«- центрация двуокиси азота поражает дыхательные пути примерно так же, как озсаи По данным экспертов ВОЗ и ЕЭС, максимальные концентрации диоксида азоп» атмосферном воздухе выше 100 ppb {parts per billion) могут оказывать отрицател- ное влияние на состояние бронхов [91]. Результаты ряда исследований [96, 97§ показывают, что в 70% случаев у астматиков и у здоровых лиц обнаружено стати¬ стически значимое влияние на бронхиальную реактивность концентрации двуоки¬ си азота от 50 до 300 ppb. Значения этих концентраций двуокиси азота во внешагй среде являются нижними пороговыми величинами, вызывающими бронхоспазм. Двуокись азота во время фотохимических реакций способна взаимодействовать с другими аэрополлютантами, такими как озон и гидрокарбонаты [91,94].Двуокись серы, побочный продукт сжигания ископаемых видов топлива т тяжёлой индустрии, относится к компонентам индустриального смога. Она мохвог вызвать бронхоконстрикцию, повышение БГР, вьщеление из С-волокон нейропешг тидов и развитие нейрогенного воспаления [93], Экспертами ВОЗ установлено, чт в атмосфере максимальные концентрации диоксида серы до 125 ppb не влияют ш состояние здоровья [98]. Бронхиальная обструкция может появляться при мип- мальной концентрации двуокиси серы (1 ppm). Загрязнение окружающего воздуха мелкими частицами с аэродинамическим диаметром менее 10 мкм, глубоко про¬ никающими в респираторный тракт, имеет прямую корреляцию с респираторными симптомами, снижением пиковой скорости вьщоха (ПСВ) и применением больны¬ ми Б А медикаментов.В крупном промышленном регионе, безусловно, возникает необходимости изучения влияния аэрополлютантов на частоту развития симптомов астмы, суточной вариабельности ПСВ и распространённости БА. С этой целью в Екатеринбурге Уральским гидрометеорологическим центром определялась загрязненность атмосферного воздуха по концентрации примесей NO2, SO^, СХ), формальдегида и фенола [31]. Оценивали среднесуточные и максимальные часо^ вые концентрации аэрополлютантов и их предельно допустимые концентрацв (ПДК), рассчитывали ежемесячные значения средних и максимальных кошкя- траций вредных примесей.С помощью корреляционного анализа определена прямая зависимость мело^ частотой вызовов скорой медицинской помощи по поводу астматического присту¬ па (АП) и максимальными концентрациями NOj (г = 0,52, р <0,05), 50^ (г = 0,91, р <0,001), средними и максимальными концентрациями формальдегида (г = 0,78, р <0,01 и г = 0,79, р <0,01) и максимальными концентрациями фенола (г = 0.73,
БРОНХИАЛЬНАЯ АСТМА385р <0,01). Данное исследование доказывает, что одним из провоцирующих факторов в развитии АП у больных Б А является выброс в атмосферу вредных примесей (максимальные концентрации аэрополлютантов), а не общий фон загазованности воздуха. Установлено, что средние и максимальные концентра¬ ции двуокиси азота и максимальные концентрации двуокиси серы способствуют развитию симптомов БА.Современные эпидемиологические данные демонстрируют определённую связь между увеличением концентрации аэрополлютантов и увеличением рас¬ пространённости и тяжести аллергических заболеваний дыхательных путей, включая Б А [22, 90, 95]. При этом распространённость атопии в регионах с различным уровнем загрязнения атмосферного воздуха не различается (35,7 и 38,2%, р >0,05), тогда как клинически манифестная атопия в виде БА у городско* го населения с высоким уровнем загрязнения воздушной среды распространена почти в 2 раза чаще по сравнению с сельским населением, где отсутствуют про¬ мышленные предприятия [11]. Приведённые данные хорошо корреспондируют с результатами исследований, в которых показана важная роль промышленных поллютантов в формировании аллергического воспаления в дыхательных путях [89, 94, 95].В исследованиях, посвящённых изучению взаимосвязи неспецифических техно¬ генных и аллергических факторов в механизмах развития воспаления дыхательных 1^й, показано, что окислы азота, повреждая респираторный эпителий, способ¬ ствуют проникновению аллергенов в слизистые оболочки [95]. С другой стороны, взаимодействие оксидов серы и азота с аллергенами усиливает их иммуногенные свойства, что снижает пороговую дозу аллергенов, вызывающую сенсибилизацию, н обусловливает более высокий уровень аллергенспецифических IgE [90, 94, 99]. Так, предварительная экспозиция с окси¬ дом серы и азота у больных БА, сенсибили- Атопическая БА зированных к дерматофагоидным клещам, увеличивает кроме неспецифической и специфическую БГР, а также уровень эози- иофильного катионного белка в лаважной юідкости после провокационной пробы сыещевым аллергеном [100-102], Схема | Аллергены! I Аллергены!возможного взаимодействия между про- мыпшенными поллютантами воздушной средм и аллергенными механизмами при Армировании и эволюции аллергической ЕЛ в условиях индустриально развитого города представлена на рис. 20-1.СМЕРТНОСТЬ ПРИ БРОНХИАЛЬНОЙ АСТМЕАллергическоеБронхиальнаявоспаление ►ГРГ ■Поллютанты | 1СенсибилизацияАтопияРис. 20-1. Возможная патогенетическая роль техногенных поллютантов при атопиче¬ ской бронхиальной астме (АБА) [27],Одной из важнейших проблем эпиде¬ миологии БА является вопрос, касающийся смертности при БА. В 20-х годах про¬ шлого столетия Труссо заявил, что «астма не смертельна». С тех пор совершенно очевидно, что отношение к БА изменилось по ряду причин. Несмотря на то что БА по-прежнему считается редкой причиной смерти, тем не менее, по данным с. Meza ш М.Е. Gershwin (1997), во многих странах Европы, в Канаде, Австралии отмеча¬ ется тенденция роста уровня смертности [103]. В то же время в Англии и Уэльсе с 1983 по 1995 год установлено снижение этого показателя во всех возрастных груп- вах от 2 до 6% [104]. В Италии с 1988 года смертность от БА стабилизировалась на |рюне 4Д7 на 100 ООО населения [105].Сведения о смерти при БА имеют ограниченную ценность и достоверность в связи с ложноположительными диагнозами БА, особенно у пожилых людей [106].
386 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯВозможны ятрогенные причины смерти. Ретроспективные исследования причин смерти при БА показали, что связь между высокими дозами ^2'агонистов и количе¬ ством смертей, особенно в молодом возрасте, незначима [107]. Основной причиной ; , ;í v смертности больных БА являются ошибки в лечении, а именно: недостаточное при-‘ - 5 V менение противовоспалительных препаратов, несоблюдение назначений больными V, . неадекватная оценка тяжести болезни медицинскими работниками [108].Факторы рискаНа основании многочисленных исследований можно сделать однозначный вывод, что наиболее важным фактором риска для развития БА является семейный анамнез атопии — он в 3-5 раз увеличивает риск развития как аллергического ринита, так и БА [109]. У детей от 3 до 14 лет как положительные кожные тесты, так и высокий уровень сывороточного IgE тесно связаны с развитием БА и бронхи¬ альной гиперреактивностью [38, 39]. Это же касается и взрослых [110], К другим факторам риска относятся малый или чрезмерный вес при рождении, недоношен¬ ность, курение матери во время беременности, курение родителей после родов, чрезмерное употребление соли, наличие животных дома и ожирение [111-113].Считается, что западный стиль жизни предрасполагает к развитию БА. Исследователи полагают, что в странах, где распространено загрязнение атмос¬ феры твёрдыми частицами и двуокисью серы (Китай, Восточная Европа), имеется более низкий уровень БА. В то же время автомобильные выхлопы, особенно дизельные (как «маркёр» западного образа жизни), ассоциируются с увеличением распространённости Б А [114]. Следует подчеркнуть, что эти выводы нельзя счи¬ тать однозначными. Последние исследования в Российской Федерации показали распространённость БА, сравнимую с основными данными в западных странах (см. выше), поэтому, вероятно, объяснение данных, показывающих большую рас¬ пространённость Б А при западном образе жизни, следует искать в другой плоско¬ сти.Аллергены, и в особенности аллерген домашнего клеща, рассматривается каж важный фактор риска для развития БА [115]. Среди значимых аллергенов, кроь« того, упоминаются эпидермис животных, тараканы, пыльца растений, Altemaria [116-119], Полагают, что условия, способствующие размножению домашнего клеща, — тёплый и влажный климат — объясняют высокую распространенность астмы в странах, расположенных в тёплых прибрежных регионах. В то же время существуют исследования, которые не подтверждают важности аллергена домаш¬ него клеща для развития Б А [115]. С другой стороны, показано, что значимое снижение концентрации домашнего клеща снижает риск БА в возрасте до 8 лет [120-123], Однако контакт с кошкой или собакой в течение первого года жизни снижает риск сенсибилизации к ряду аллергенов и возникновение БА в дальней¬ шем [124-126]. Эти противоречия показывают сложное влияние факторов риска на организм, а также то, что процесс реализации предрасположенности является многофакторным и пока труднообъяснимым. Многие другие обстоятельства могут играть роль в том, разовьётся БА или нет, К примеру, показано, что ожирение у детей — надёжный маркёр повышенного риска развития болезни [127]. Это же относится и к сниженной функции лёгких при рождении [128].ВИРУСНАЯ ИНФЕКЦИЯИсследование вирусной инфекции как участника развития БА также показывает противоречивые данные. С одной стороны, имеются сведения, что рецидивиру¬ ющие респираторные вирусные инфекции могут обусловливать снижение частоты возникновения Б А в детстве [129], а с другой — вирусная инфекция вызывает обострения болезни [130], причём наиболее часто при обострении Б А выделяется риновирус. Скорее всего, и те и другие данные отражают действительное поло-
БРОНХИАЛЬНАЯ АСТМА387жние дел, когда в различном возрасте на разных стадиях заболевания вирусная инфекция может играть различную роль в течении заболевания.J^yPHE МИКРОБНЫЕ АГЕНТЫКак показывает ряд исследований, хроническая инфекция С. Pneumoniae и Л, Pneumoniae может иметь значение для объяснения тяжести течения БА. У больных тяжёлой БА чаще наблюдаются серологические признаки персистенции данной инфекции, а при биопсии бронхиального дерева больных БА почти в поло- шше случаев находят признаки М. Pneumoniae, что значительно реже наблюдается »контрольной группе [131]. В то же время неизвестно, является ли это причиной шш следствием тяжёлого течения заболевания.Некоторые исследования показывают, что проживание в контаминированной мшфобами среде снижает риск развития БА у детей [132]. У детей раннего воз¬ раста, страдающих аллергией, в качестве кишечной флоры чаще выступают кло- стридия и стафилококки, нежели энтерококки и бифидобактерии [133]. Согласно этой теории также предлагается лечебная программа, в соответствии с которой юедение в пищевой рацргон микробных агентов может уменьшить риск развития атопических заболеваний. Так, добавление лактобактерий в пищу в первые 6 мес жизни снижало риск развития экземы, но не уменьшало риск получения положи¬ тельных кожных тестов [134]. Для уточнения подобных предположений нужны дальнейшие исследования,ГЕНЕТИЧЕСКИЕ ФАКТОРЫВо многих исследованиях показано увеличение распространённости БА среди кровных родственников больных, страдающих этим заболеванием (20-25% по ц)авнению с 4% в общей популяции) [135], что предполагает участие в его раз¬ витии генетических факторов. Считается, что их вклад в формирование болезни составляет 35-70% [136,137].В современной генетике в течение последних десятилетий достигнуты большие успехи в понимании структуры и функции человеческого генома. Значительный прогресс наблюдался и в определении роли генетических факторов в развитии фенотипов астмы. Установлено, что отсутствует конкретный и единственный «ген астмы». Вероятно, эта болезнь возникает в результате взаимодействия генов между собой и с окружающей федой [138, 139]. Вместе с тем остаётся неясным, какое количество генов способствует развитию БА в различных этнических группах.Поиск генов, связанных с формированием астмы, осуществлялся в 4 направле¬ ниях: выработке аллергенспецифических IgE (атопия), развитии бронхиальной гиперреактивности, синтезе медиаторов воспаления (цитокинов, хемокинов, факторов роста), соотношении между типами иммунного ответа с участием Thj- и ТЬ^-лимфоцитов.Изучение семей и анализ взаимосвязи в исследованиях «случай-контроль*^ пока¬ зали, что фенотипы астмы могут определяться рядом локусов хромосом [140-143]. Идентифицировано более 100 генов, связанных с БА [144,145]. Основные группы генов приведены в табл. 20-3.Таблица 20-3. Основные группы генов, связанных с БАШГруппы геновЛокализация генов и их функцияГены, кодирующие синтез цитокинов и хемокинов, ассоциированных с ТЬ^-ответом5q23-q31: ИЛ-4, 13; 17q11.2-q21; СС-хемокиныГины, кодирующие рецепторы, ассоциированные с Т^1,-ответом11д13: ген Я цепи высокоаффинного рецептора 1дЕ5р23-д31: гены Н^-рецепторов 16р11.2-р12.1: гены рецептора ИЛ-4
i 388 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯОкончание табл. 20^3Гены, участвующие в распознавании антигенов6 р21.1-р23; HLAD7q35, 14q11; гены Т-клеточных рецепторовсинтез медиаторов воспаленияб р21.1-р23: ФНО-а; 5q23-q3l: ИЛ-3, -5, -9; 5-липоксигеназа12р14-д 24.33: STAT6, SCF и др. 20р13: ADAM33Вместе с тем имеются расхождения между результатами проведённых исследо¬ ваний. Они могут быть частично объяснены анализом различных фенотипов БА, этническими различиями обследованных популяций и наличием ложноположи¬ тельных взаимосвязей. Несмотря на это, были неоднократно выявлены несколько областей генома, касающихся развития БА: хромосомная область 5q31-33 [146, 147], llq [148] и 12q [149,150]. Однако следует отметить, что пока не существует необходимого числа исследований, которые бы повторяли эти результаты.Один из возможных локусов, связанных с развитием БА, локализован на 5-й хромосоме (5q23-31). Эта область содержит 14 генов, относящихся к БА, повы¬ шению уровня IgE [151, 152] и развитию бронхиальной гиперреактивности [151]. В области 5q23-31 локализуются гены ИЛ-4, ИЛ-13, ИЛ-5, ИЛ-9 и гены, кодирующие CD14 и р2-адренергические рецепторы. В нескольких исследованши продемонстрирована их интегральная роль в патогенезе БА, продукции иммуно¬ глобулина Е и гиперсекреции слизи [153,154].В последние годы с помощью позиционного клонирования были выявлены новые гены, связанные с БА и атопией (ADAM-33, DPP10 и др.) [144].Помимо генов, связанных с предрасположенностью к Б А, изучаются гены, опре¬ деляющие эффективность противоастматических препаратов. Установлен поли¬ морфизм генов, кодирующих синтез ß^-адренорецепторов. Вероятно, наибольшее значение имеет замена в них аминокислот в положении 16 (аргинина на глицин) и 27 (глутамина на глутамат). Показано, что гомозиготные гаплотипы Глутамин- 16-Глутамин-16 или Аргинин-16-Аргинин-16 ассоциированы со снижением брон- хопротективного действия З^-адреномиметиков и снижением контроля БА при лечении салметеролом и сальбутамолом [155-157], Существуют также гены, рег^’- лирующие ответ пациентов на ГКС и антилейкотриеновые препараты [158].Исследования, касающиеся генетических основ БА, весьма многообещающи. Несмотря на последние успехи в изучении человеческой генетики, на многие вопросы еще только предстоит ответить, в настоящее время установлено, что большинство генетических факторов, определяющих болезнь, проявляется во вза¬ имодействии с окружающей средой и другими генами. Объяснение этих сложных механизмов позволит приблизиться к пониманию законов формирования астмы и, в соответствии с этим, развивать новые терапевтические подходы, учитывая индивидуальные особенности заболевания у каждого пациента.ПатогенезБА — это хроническое воспаление дыхательных путей, в развитии которого принимают участие различные клетки и медиаторы [159, 160]. Воспалительный процесс в бронхах ассоциирован с БГР и симптомами заболевания. Механизмы этой связи изучены недостаточно.Клинические проявления БА очень разнообразны, и степень участия различ¬ ных клеток в развитии заболевания различна. Воспаление дыхательных путей является персистирующим, даже при эпизодических симптомах болезни. Вместе с тем взаимосвязь между тяжестью БА и интенсивностью воспаления до конца не установлена [161,162]. Воспаление при БА распространяется на проксимальные н дистальные бронхи. У большинства больных оно также затрагивает верхние дыха-
БРОНХИАЛЬНАЯ АСТМА389тЕльные пути, включая полость носа. Его патофизиологические эффекты наиболее отчётливо представлены в бронхах среднего калибра. Хроническое воспаление имеет место при всех клинических формах Б А (аллергической, неаллергической, аспириновой и др.) у пациентов любого возраста и пола. Это обосновывает необ¬ ходимость лечения этого заболевания препаратами, обладающими противовос¬ палительным действием.Воспаление характеризуется активацией тучных клеток, повышением количества активированных эозинофилов, увеличением числа Т-лимфоцитов ■ естественных киллеров, экспрессирующих инвариантный рецептор Т-клеток (iNKT-клетки) и Т-хелперов 2-го типа, которые освобождают медиаторы, способствующие проявле¬ нию симптомов. Структурные клетки бронхов, продуцируя воспалительные медиа¬ торы, способствуют персистенции воспалительного процесса в дыхательных путях.В бронхиальном дереве у больных Б А выявляются тучные клетки, эозинофилы, Т-лимфоциты, дендритные клетки, макрофаги и нейтрофилы (табл. 20-4),Тучные клетки слизистой оболочки дыхательных путей высвобождают бронхо¬ констрикторные медиаторы (гистамин, цистеиниловые лейкотриены, простаглан¬ дин Dj) [163]. Эти клетки активируются как аллергенами через высокоаффинные IgE-рецепторы, так и осмотическими стимулами (этот механизм вызывает бронхо¬ констрикцию, индуцируемую физической нагрузкой). Установлено, что увеличе¬ ние числа тучных клеток в гладкомышечной мускулатуре бронхов ассоциировано с БГР [164].Таблица 20-4. «Воспалительные» клетки и их роль в развитии БАТип клетокПатофизиологическая рольТучные клетхиСефеция бронхоконстрикторных медиаторов (гистамин, цистеиниловые лейкотриены, простагландин 0^)ЭозинофилыВысвобоадение основных протеинов, повреждающих эпителий.Секреция факторов роста, участвующих в ремоделировании бронхиальной стенкиТ-лимфоцитыВысвобождение цитокинов (ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-13), способствующих развитию эозинофильного воспаления и продукции иммуноглобулина Е В-лимфоцитаыиДендритные клеткиЗахват аллергенов с поверхности бронхов и их перенос в региональные лимфатиче¬ ские узлы.Стимуляция продукции ТЬ^-клеток из их предшественниковМакрофагиВысвобождение различных медиаторов воспаления и цитокиновНейтрофилыРоль неясна. Количество нейтрофилов возрастает при тяжёлой БА и у курящих боль¬ ных. Увеличение их числа может быть следствием ГКС-терапииЭозинофилы присутствуют в большом количестве в бронхах. Они секретируют основные протеины, которые могут повреждать эпителиальные клетки дыхатель¬ ных путей. Эти клетки также способны высвобождать факторы роста и участво¬ вать в развитии ремоделирования бронхиальной стенки [165].Т-лимфоциты, присутствующие в значительном количестве в дыхательных путях, продуцируют ИЛ-4, ИЛ-5, ИЛ-9 и ИЛ-13, которые способствуют эозино¬ фильному воспалению и продукции иммуноглобулина Е В-лимфоцитами [166]. Увеличение активности Т-хелперов 2-го типа может быть частично связано с ^-меньшением регуляторных Т-клеток, которые в норме подавляют Т-хелперы 2-го типа. Показано, что в бронхоальвеолярном лаваже у больных БА увеличено содержание 1НКТ-клеток, которые высвобождают большое количество ИЛ-4 и интерферона у. Предполагается, что они участвуют в развитии воспаления дыха¬ тельных путей [167].
390ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯДендритные клетки захватывают аллергены с поверхности бронхов и переносят их Б региональные лимфатические узлы» где они взаимодействуют с регуляторны¬ ми Т-клетками. Это стимулирует образование Т-хелперов 2-го типа из их пред¬ шественников [168].Количество макрофагов в бронхиальной сгенке увеличивается. Они могут акти¬ вироваться аллергенами через низкоаффинные IgE-peцenтopы, секретируя медиа¬ торы воспаления и цитокины, которые способствуют развитию воспаления [169].У больных тяжёлой БА и у курящих астматиков увеличивается число нейтро¬ филов в бронхах и мокроте, но патофизиологическая роль этих клеток до сих пор не установлена. Более того, не исключено, что увеличение их числа может быть связано с ГКС-терапией [170]. Предполагается, что нейтрофилы играют роль пр* обострении БА, тяжёлом течении болезни, стероидной резистентности, летальных исходах.Б развитии БА принимают участие структурные клетки дыхательных путет (табл. 20-5),Клетки бронхиального эпителия в ответ на раздражающее воздействие факто¬ ров окружающей среды выделяют множество воспалительных протеинов и осво¬ бождают цитокины, хемокины и липидные медиаторы. На эпителиальные клетки действуют вирусы, поллютанты и ингаляционные аллергены. Гладкомышечные клетки бронхов влияют на эпителий посредством секреции провоспалительных медиаторов [171],Эндотелиальные клетки сосудов бронхов принимают участие в переходе вос¬ палительных клеток из кровотока в просвет бронхов.В процесс бронхиального ремоделирования вовлечены фибробласты и миофи- бробласты, которые продуцируют соединительнотканные компоненты, такие каж коллагены и протеогликаны.Таблица 20-5. Структурные клетки бронхиального дерева, участвующие в развитии воспалении дыхательных путей при БАТип клетокПатофизиологическая рольЭпителиальные клетки бронховВьювобождение ИЛ-6, ИЛ-8, ГМ-КСФ, ИЛ-18, ФНО-а, липидных медиаторовГладкомышечные клетки бронховВыделение множества воспалительных протеинов: цитокинов, хемокиновЭндотелиальные клеткиВысвобождение ИЛ-8, ИЛ-5, ГМ-КСФ.Переход воспалительных клеток из кровотока в просвет бронховФибробласты и миофибробластыСинтез соединительнотканных компонентов (коллагены и протеогликаны), участвующих в ремоделировании дыхательных путей.Продукция факторов роста тучных и стволовых клеток, ИЛ-8, ГМ-КСФНервные волокнаВысвобождение воспалительных нейропептидов (субстанция Р, нейроги- нин А, нейрокинин в, пептид, связанный с геном кальцитонина (CGRP), вазоактивный интестинальный пептид (VIP)В патогенезе астмы также имеет значение нарушение иннервации бронхоа. Холинергические нервы могут рефлекторно активироваться триггерами и вызы¬ вать бронхоконстрикцию и гиперсекрецию слизи. На чувствительные нервы воздействуют медиаторы воспаления, которые вызывают кашель и дискомфорт в грудной клетке. Кроме того, они могут высвобождать воспалительные нейропеп¬ тиды [172].Б настоящее время известны более 100 различных медиаторов, которые вовле¬ чены в процесс воспаления при БА. К ключевым медиаторам при БА относятся хемокины, цистеиниловые лейкотриены, цитокины, гистамин, оксид азота и про¬ стагландин D.^ (табл. 20-6).
БРОНХИАЛЬНАЯ АСТМА391Таблица 20-6. Ключевые медиаторы при БАМедиаторПатофизиологическая рольХемокиныЭотаксинСелею-ивное воздействие на эозинофилы, их накопление в очаге воспале¬ нияТимусактивирующие регулятор- №ІЄ хемокины (Т^С) и относя¬ щиеся к макрофагам хемокины (MDC)Накопление Т-хелпероа 2-го типаЦистеиниловые лейкотриенылтс,БронхоконстрикцияЛТО,Повышение секреции слизи в бронхиальном деревеЛТЕ^Вазоконстрикция, повышение сосудистой проницаемостиПростагландинБронхоконстрикция, привлечение Т-хелперов 2-го типа в дыхательные пути, увеличение сосудистой проницаемостиГистаминРазвитие бронхоспазма и воспалителы1ой реакцииОксид азота (N0)ВазодилатацияЦитокиныИЛ-1р, ФНО-аУсиление воспалительной реакции, клеточной пролиферацииГМ-КСФУвеличение продолжительности жизни эозинофилов в дыхателыных путяхИЛ-4Дифференцировка Т-хелперов 2-го типа, образование IgEИЛ-5Дифференцировка и увеличение продолжительности жизни эозинофиловИЛ-13Участие в образовании IgEХемокины, выделяясь главным образом эпителиальными клетками бронхов, играют важную роль в накоплении воспалительных клеток в дыхательных путях [173]. Эотаксин вызывает накопление преимущественно эозинофилов, в то время как тимусактивирующие регуляторные хемокины (ТАКС) и относящиеся к макро¬ фагам хемокины (МОС) способствуют накоплению Т-хелперов 2-го типа,Цистеиниловые лейкотриены являются потенциальными бронхоконстриктора¬ ми и провоспалительными медиаторами, которые выделяются главным образом тучными клетками и эозинофилами. Это единственный вид медиаторов, ингиби¬ рование которых связано с улучшением лёгочной функции и уменьшением выра¬ женности симптомов БА [174], что было показано при использовании антилей¬ котриеновых препаратов. Простагландин 02 обладает бронхоконстрикторными свойствами. Он продуцируется преимущественно тучными клетками и участвует в накоплении Т-хелперов 2-го типа в дыхательных путях.Пістамин высвобождается из тучных клеток и способствует бронхоконстрикции и накоплению воспалительных клеток в дыхательных путях.Оксид азота (N0), сильный вазодилататор, продуцируется главным образом индуцибельной NO-cинтaзoй в эпителиальных клетках бронхов [175], Он опреде¬ ляется у больных БА в выдыхаемом воздухе и является маркером воспаления дыхательных путей, который может использоваться для диагностики БА и оценки эффективности противовоспалительной терапии [176].
392ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯЦитокины обусловливают воспаление дыхательных путей при астме и опреде¬ ляют её тяжесть [177]. К ключевым цитокинам относятся ИЛ-ір и ФНО-а, кото¬ рые усиливают воспалительный ответ, а также ГМ-КСФ, который пролонгирует выживание эозинофилов в бронхах. К цитокинам, связанным с Т-хелперами 2-го типа, относятся ИЛ-5, ИЛ-13 и ИЛ-4 (см. табл. 20-6).В бронхах у больных БА помимо воспалительных процессов присутствуют характерные структурные изменения, часто описываемые как ремоделирование бронхов (субэпителиальный фиброз, увеличение гладких мышц, образование новых сосудов, повышение количества бокаловидных клеток и размера субмукоз- ных желёз). Некоторые из них связаны с тяжестью заболевания и могут приводить к частично необратимому сужению дыхательных путей [178, 179]. Указанные нарушения, возможно, являются результатом процессов репарации в ответ на хро¬ ническое воспаление.Субэпителиальный фиброз формируется в результате отложения коллагеновых волокон и протеогликанов в подслизистую мембрану и обнаруживается у больных БА, в том числе и у детей. Его выраженность может уменьшаться под влиянием лечения. Фиброз с отложением коллагена и протеогликанов обнаруживается и в других слоях бронхиальной стенки.Масса гладкомышечной мускулатуры бронхов увеличивается из-за гипертро¬ фии (увеличения размера отдельных клеток) и гиперплазии (^^еличения количе¬ ства клеток). Это способствует увеличению толщины бронхиальной стенки [180]. Вьфаженносгь указанного процесса пропорциональна тяжести заболевания, и т может быть опосредован воспалительными медиаторами, такими как факторы роста.Кровеносные сосуды бронхиальной стенки пролиферируют под влиянием сосу¬ дистого эндотелиального фактора роста. Это способствует увеличению толщины бронхиальной стенки.Слизистая гиперсекреция происходит вследствие повышения числа бокаловид¬ ных клеток в эпителии бронхов и увеличения размера подслизистых желёз.Сужение бронхов представляет собой заключительный этап, приводящий к раэ- витию симптомов Б А; оно возникает в результате бронхоспазма, отёка слизистой оболочки, дискринии и ремоделирования дыхательных путей.Основным механизмом нарушения бронхиальной проходимости является сокращение гладкомышечной мускулатуры бронхов в ответ на действие множества бронхоконстрикторных медиаторов и нейротрансмитгеров. Этот процесс полно¬ стью обратим под действием бронходилататоров.Отёк бронхиальной стенки происходит вследствие повышения проницаемосга сосудов в ответ на действие воспалительных медиаторов. Это имеет особое значе- ние при развитии обострений заболевания.Утолщение бронхов обусловлено структурными изменениями. Особую значи¬ мость этот процесс приобретает при более тяжёлом течении заболевания, когда не наблюдается полной обратимости под действием проводимой терапии.Піперсекреция слизи может приводить к закупорке просвета бронхов слизи¬ стыми пробками. Это происходит из-за повышения слизистой секреции и воспа¬ лительной экссудации.Бронхиальная гиперреактивность является важной патофизиологической осо¬ бенностью БА, а также характеризуется сужением бронхов у больных астмой в ответ на стимулы, которые не вызывают этого у здоровых людей. Бронхосоазм приводит к вариабельному ограничению бронхиальной проходимости и интер- мигрирующим симптомам. Бронхиальная гиперреактивность связана с воспалени¬ ем и восстановительными процессами в бронхиальной стенке, она частично обра¬ тима под воздействием терапии. Механизмы её развития изучены недостаточно.Установлено, что избыточное сокращение гладкомышечной мускулатуры брон¬ хов может происходить из-за увеличенного объёма и/или сократимости гладко-
БРОНХИАЛЬНАЯ АСТМА393пышечных клеток бронхов [181]. Десинхронизация сокращения гладких мышц приводит к избыточному сужению бронхов и исчезновению максимального плато ^юнхоспазма, которое обнаруживается в нормальной бронхиальной стенке при вдыхании бронхоконстрикторных препаратов [182].Утолщение бронхиальной стенки вследствие отёка и структурных изменений увеличивает степень сужения бронхов при сокращении гладкомышечной муску¬ латуры за счет изменения геометрии бронхов [183]. В процессе воспаления могут foin затронуты чувствительные нервы, что приводит к избыточной бронхокон¬ стрикции в ответ на стимуляцию нервов.Обострения БА могут развиваться в результате воздействия триггеров: аллер¬ генов, вирусов, поллютантов, физической нагрузки, изменений погоды и др. [184, 185]. Наиболее продолжительные ухудшения самочувствия связаны обычно с вирусной инфекцией верхних дыхательных путей (особенно риновирусной инфек¬ цией и респираторно-синцитиальной вирусной инфекцией) [186], а также воздей¬ ствием аллергенов, что увеличивает воспалительный процесс в нижних отделах респираторного тракта, который может персисгировать в течение нескольких дней или недель.Механизмы, принимающие участие в ухудшении астматических симптомов вочью, изучены не до конца. Они могут быть опосредованы циркадными ритмами циркулирзтощих гормонов (адреналин, кортизол и мелатонин) и нейрогенными механизмами (изменение тонуса холинергической нервной системы). Отмечалось нарастание воспаления дыхательных путей в ночное время. Не исключено, что это является отражением снижения эндогенных противовоспалительных механизмов [187].У некоторых больных тяжёлой БА наблюдается прогрессирующее ограничение воздушного потока, которое неполностью обратимо под воздействием прово¬ димой противоасгматической терапии. Вероятно, это может быть обусловлено структурными изменениями (ремоделированием) бронхов при БА [188].Причины, по которым у некоторых пациентов развивается Б А, трудно поддаю¬ щаяся лечению и относительно нечувствительная к эффектам ГКС, остаются невы¬ ясненными. Наиболее часто это связано с плохим выполнением врачебных назна¬ чений, психологическими и психиатрическими нарушениями. Однако в некоторых случаях значение имеют и генетические факторы. У многих больных Б А, трудно поддающаяся лечению, отмечалась с самого начала терапии, а не развивалась из лёгких форм. У таких пациентов в результате тяжёлой бронхиальной обструкции наблюдались гиперинфляция и образование «воздушных ловушек». Несмотря на сходство с другими формами БА, при этом варианте заболевания выявлялись увеличение числа нейтрофилов, поражения мелких бронхов и выраженные струк¬ турные изменения [189].Курение затрудняет контроль над БА, в результате чего увеличивается частота обострений и госпитализаций, быстрее развивается прогрессивное ухудшение лёгочной функции и увеличивается риск летального исхода [190]. Для курящих пациентов характерны преимущественно нейтрофильное воспаление и слабый ответ на терапию ГКС. В последние годы появились сообщения о снижении под влиянием курения и свободных радикалов активности деацетилазы гистонов, являющейся мишенью для действия ГКС. Это может уменьшать тормозящее влия¬ ние ГКС на транскрипцию «воспалительных» генов.Основными изменениями в бронхиальном дереве, приводящими к сужению его просвета, являются сокращение гладкой мускулатуры стенки бронха, отёк дыхательных путей, увеличение толщины стенки бронха и гиперсекреция слизи. Оценку этих изменений производят с помощью исследования ФВД. бронходила¬ тационных и бронхопровокационных тестов, определяя таким образом нарушениещ
394 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯпроходимости бронхиального дерева и степень обратимости этих изменений, а также БГР.КЛИНИЧЕСКАЯ КАРТИНАОсновными симптомами БА являются хрипы, чувство стеснения в грудной клетке и одышка. Эти симптомы часто имеют связь с физической нагрузкой, воздействием аллергенов или вирусной инфекцией. Изменения интенсивности проявлений симптомов (что является весьма характерным для БА) могут наблю¬ даться ото дня ко дню, но могут быть и Б течение дня. Существуют формы болез¬ ни, когда время развития симптомов может исчисляться минутами. Симптомы болезни могут быть значительно менее яркими, в течение длительного времени болезнь может проявляться только ощущением заложенности в грудной клетке или одышкой при физической нагрузке. Эти симптомы не являются патогномо- ничными для болезни, поэтому необходима всесторонняя тщательная оценка состояния.Кашель может быть основным симптомом заболевания, причём чаще такой вариант (кашлевой вариант БА) наблюдается у детей. Если кашель является про¬ явлением БА, почти всегда можно установить связь появления симптома и воздей¬ ствия физической нагрузки, холодного воздуха, резких запахов, аллергенов или респираторной инфекции, Бронхолитическая и противовоспалительная терапия при этом оказывает значительное облегчающее действие. Отделение мокроты пра кашле бывает редко, не являясь значимым признаком, однако в отдельных слу¬ чаях может вносить значимую роль в клиническую картину заболевания. Тем не менее выраженная продукция мокроты заставляет проводить дифференциальный диагноз.В определении симптомов как маркёров БА может помочь наличие других аллергических заболеваний (аллергический ринит, дерматит). Синдром постна- грузочного бронхоспазма — появление бронхиальной обструкции после выпол¬ ненной физической нагрузки. Этот синдром долгое время может быть единствен¬ ным проявлением БА, однако в дальнейшем, как правило, появляются и другие признаки болезни.ДиагностикаОбычно клиническая картина БА такова, что диагноз может быть установлен только на основании сбора анамнеза. Тем не менее нередким бывает факт ошибоч¬ ного определения болезни как острого или обострения хронического бронхита, особенно при наличии стертой клинической картины болезни. Важнейшим фак¬ тором установления правильного диагноза является не обнаружение причинно- следственных связей, а поиск причины респираторных симптомов и снижение до минимума необоснованного установления диагноза бронхита, острого или хронического.Отдельная глава в диагностике заболевания — случаи внезапного ухудшения состояния, нередко требующие оказания неотложной помощи. При этом необ¬ ходимо произвести тщательный поиск провоцирующего обстоятельства или агента, как например, аспирина или других препаратов или веществ, содержащих салицилаты или сульфиты. При оценке тяжести заболевания следует учитывать и сопутствующую патологию, в частности состояние верхних дыхательных путей и гастроэзофагеальный рефлюкс, которые нередко способны объяснить персистен¬ цию клинической картины [191].ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕФизикальное обследование является важной частью процесса установления диагноза и мониторирования состояния и в то же время может не выявлять ника-
БРОНХИАЛЬНАЯ АСТМА 395ШШ0ШУ§Я>Й5Й'ШШШ'‘Уі •ких патологических изменений. Если бронхиальная обструкция значима, то воз¬ можны внешние признаки гиперинфляции, вовлечения дополнительной мускула¬ туры в акт дыхания, при перкуссии — коробочный звук, при аускультации — масса " i сухих разнокалиберных хрипов, которые при нарастании тяжести состояния могут ^тиеньшаться вплоть до полного отсутствия при астматическом статусе (слишком низкая скорость воздушного потока не создаёт аускультативные феномены; при этом также резко ослабевают и дыхательные шумы). В состоянии полной ремис¬ сии физикальные изменения могут полностью отсутствовать. В большинстве случаев при неполностью контролируемой БА выслушиваются сухие хрипы, при отсутствии таковых необходимо попросить пациента сделать форсированный выдох, при котором могут появляться хрипы, не слышные при обычном дыхании, обнаружение полипов в носу, постназальный затек, констатация ожирения могут дать дополнительную диагностическую информацию.ЛАБОРАТОРНАЯ И ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКАДиагностика БА заключается в выявлении обратимой бронхиальной обструк¬ ции и признаков гиперреактивности бронхов. Рентгенологическое исследование может выявить признаки гиперинфляции при тяжёлой обструкции, но может и не показать никаких патологических изменений. Исследование уровня IgE сыворотки крови, кожное аллергологическое тестирование, выявление эозинофилии в крови и мокроте MorjT' свидетельствовать об атопии, но не являются диагностическим маркером БА. Проводятся попытки ввести в практику исследование индуцирован¬ ной мокроты с определением в ней клеточных элементов (эозинофилы) и медиа¬ торов воспаления (эозинофильный катионный пептид, другие цитокины) [192,193], однако в практической деятельности эти тесты не несут ощутимой пользы.Менее инвазивным, а потому более лёгко выполняемым является исследование маркёров в выдыхаемом воздухе, в частности оксида азота (N0). Уровень N0 более 16 ppb характерен для БА и обладает высокой чувствительностью и специ¬ фичностью [194]. Б то же время N0 крайне чувствителен к терапии ГКС, и даже небольшие дозы ИГКС, не приводящие к контролю заболевания, могут нормали¬ зовать уровень N0 [195], в связи с чем N0 мало пригоден для мониторирования заболевания.ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКАВо многих случаях диагностика БА не представляет затруднений. Однако в практической деятельности врач нередко охотно устанавливает диагноз Б А при любом свойственном ей симптоме (сухие хрипы, одышка, ночной кашель), а с дру¬ гой стороны — может длительное время рассматривать больного Б А как страдаю¬ щего бронхитом, что ведет к слишком поздней диагностике болезни и позднему назначению лечения.В настоящее время в дифференциально-диагностическом списке можно насчи¬ тать около 60 заболеваний и состояний, с которыми необходимо проводить дифференциальный диагноз [196]. На практике обычно проводится дифферен¬ циальная диагностика с немногими, самыми распространенными заболеваниями, сопровождающимися сходной клинической картиной:• хронический риносинусит;• гастроэзофагеальный рефлюкс;• повторные вирусные инфекции нижних дыхательных путей;• муковисцидоз;• бронхолёгочная дисплазия;• туберкулёз;• пороки развития, обусловливающие сужение внутригрудных дыхательных путей;
< -•-'•■•.•■.'í'ii'X'íír;.' - 396 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯíisaiÉKi^ • аспирация инородного тела;• синдром первичной цилиарной дискинезии;• иммунодефицит;• врождённый порок сердца;• гипервентиляционный синдром и панические атаки.Обструктивный синдром у курящего 50-летнего человека, никогда не сгра- ‘ ív' давшего аллергическими болезнями, >тсажет на возможную ХОБЛ; стридорозное ' дыхание и характерная кривая при исследовании ФВД, указывающая на внеле-гочную обструкцию, заставят искать препятствие току воздуха на уровне трахеи или гортани. Ночной кашель может быть проявлением постназального затека и/или гастроэзофагеального рефлюкса. Одышка может быть проявлением застой¬ ной сердечной недостаточности, а чувство нехватки воздуха, тяжести в груди при отсутствии объективных признаков соматической патологии заставит врача запо¬ дозрить гипервентиляционный синдром. Высокое содержание IgE в сыворотке крови, высокая эозинофилия крови и мокроты 1’ребуют проведения дифференци¬ альной диагностики с грибковым поражением лёгких и некоторыми васкулитами. Респираторные инфекции, перенесенные в детском возрасте, указания на воздей¬ ствие токсических газов, наличие системного заболевания позволяют заподозрить бронхиолит. Рецидивирующее гнойное воспаление в сочетании с обструктивным синдромом может быть признаком муковисцидоза (у молодых пациентов) илн бронхоэктатической болезни. Рентгенологические изменения, нехарактерные для БА, должны заставить рассматривать клиническую картину как синдром при дру¬ гой патологии. Следует подчеркнуть, что в пожилом возрасте БА редко дебютиру¬ ет, что вынуждает искать другие причины астмоподобных симптомов (например, патология верхних дыхательных путей, ГЭРБ, прием ингибиторов АПФ, застой¬ ная сердечная недостаточность).КлассификацияСовременная классификация БА, приведённая ниже, касается в первую очередь степени тяжести заболевания [197].Интермиттирующая:• Симптомы реже 1 раза в неделю.• Обострения кратковременные.• Ночные симптомы < 2 раз в месяц.• ОФВ^ или ПСВ > 80% должных.• Вариабельность ПСВ или ОФВ^ <20%>Лёгкая персистирующая;• Симптомы >1 раза в неделю, но реже 1 раза в день.• Обострения могут нарушать активность и сон.• Ночные симптомы > 2 раз в месяц.• ОФВ^ или ПСБ > 80% от должных.• Вариабельность ПСВ или ОФВ^ <20-30%,Среднетяжёлая персистирующая:• Симптомы ежедневно.• Обострения могут нарушать активность и сон.• Ночные симптомы > 1 раза в неделю.• Ежедневное использование ингаляционных р^'эгонистов короткого дей¬ ствия.• ОФВ^ или ПСВ 60-80% должных.• Вариабельность ПСВ или OФBJ >30%.Тяжёлая персистирующая:• Симптомы ежедневно.• Частые обострения.
БРОНХИАЛЬНАЯ АСТМА 307• Частые ночные симптомы БА.• Ограничение физической активности.• ОФВ^ или ПСВ <60% должных.• Вариабельность ПСВ или ОФВ^ >30%.В последнем пересмотре Глобальной стратегии лечения и профилактики БА 1198} введено понятие контроля болезни. Считается, что понятие контроля явля¬ ется более прогрессивным классификационным признаком, чем степень тяжести.Таблица 20-7. Классификация БА по степени контроляХарактеристикиА^вные симптомыОграничение активностиНочные симптомы/пробуж- леиияПотребность в препаратах неотложной помощиГкжазатели ФВД (ПС8 или 0Ф6ЛОбостренияКонтролируемая БА (все перечисленное)Нет {< 2 в неделю)Нет (< 2 в неделю)НетНет (< 2 в неделю)НормаНетЧастично контроли¬ руемая БА (наличие любого проявления в течение 1 нед)> 2 в неделюЕсть — любой выра¬ женностиЕсть - любой выра¬ женности> 2 в неделю< 80% от должного (или от наилучшего показателя для дан¬ ного пациента, если такой показатель известен)1 или более а годНеконтролируемая БАНаличие 3 или более при¬ знаков частично контроли¬ руемой БА а течение любой недели1 в течение любой неделиОднако в Российской Федерации, как было заявлено на совещании экспертов Российского респираторного общества (Заседание экспертов РРО, 2007, неопубли¬ кованные данные), классификация по степени тяжести будет сохранена, так как с ней связаны социальные, финансовые и организационно-медицинские обстоя¬ тельства.Классификация БА по форме заболевания, причинному агенту болезни подверга¬ ется как признанию, так и критике. В нашей стране принято разделять БА на аллерги¬ ческую (выявлены маркеры аллергии, имеется причинно-следственная связь) и неал¬ лергическую (при наличии болезни аллергический фактор не найден, нет признаков аллергического процесса). Кроме того, выделяют профессиональную БА и аспири- новую БА (непереносимость аспирина и других НПВП, часто сочетание с полипозом воса). Постнагрузочный бронхоспазм не является отдельной классификационной формой болезни, а представляет собой синдром как одно из проявлений БА.Ряд пациентов с БА могут демонстрировать развитие необратимой бронхиаль¬ ной обструкции. Это может быть связано с сопутствующей ХОБЛ [199], а также с ремоделированием стенки мелких бронхов, заключающемся в отложении колла¬ гена, ангионеогенеза, гипертрофии гладкой мускулатуры и подслизистых желез [200]. Причины этого феномена до конца не ясны, видимо, лежат в генетической предрасположенности и в настоящее время интенсивно изучаются.ЛечениеОсновной задачей терапии БА является установление длительного контроля над заболеванием, а не просто симптоматическое лечение. Рекомендации по лечению
398 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯсконцентрированы вокруг 4 основных аспектов: 1) использование показателе ФВД как объективного отражения степени тяжести течения и мониторирования ответа на терапию; 2) идентификация и элиминация факторов, усугубляющих сим¬ птомы, провоцирующие обострение и поддерживающие воспаление дыхательных путей; 3) адекватное фармакологическое лечение для устранения бронхоконстриж- ции, предотвращения и устранения воспаления дыхательных путей; 4) достижение партнерских отношений между пациентом и врачом.ФАРМАКОТЕРАПИЯФармакотерапия БА подразделяется на два класса препаратов: препараты короткого действия для купирования симптомов, которые устраняют симптомы острой бронхоконстрикции, и препараты для длительного контроля заболевания, которые при регулярном применении улучшают контроль БА в целом.Наиболее эффективными и часто используемыми короткодействующими пре¬ паратами для купирования симптомов являются агонисты р-адренорецепторов. такие как сальбутамол, фенотерол. Другими представителями этой группы явля¬ ются антихолинергический препарат ипратропиума бромид и метилксантин тео¬ филлин. Все эти препараты увеличивают просвет бронхов путем расслабления гладкой мускулатуры дыхательных путей.Наиболее эффективными и часто применяемыми препаратами для длительного контроля заболевания являются ИГКС, чей положительный эффект объясняется противовоспалительной активностью. Группа препаратов, контролирующих БА, включает антагонисты лейкотриеновых рецепторов и ингибиторы дегрануляцин тучных клеток (кромогликат и недокромил).Граница между препаратами для купирования симптомов и для контроля заболевания иногда не столь отчетливо выражена. Теофиллин обладает уме¬ ренным противовоспалительным действием, а ИГКС будесонид вызывает уме¬ ренную бронходилатацию. Аналогичным образом два длительно действующих агониста р-адренорецепторов (ДДБА), салметерол и формотерол, эффективно улучшают контроль БА при регулярном применении в комбинации с ИГКС. Наконец, было показано, что терапия гуманизированными моноклональными aнти-IgE-aнтитeлaми эффективна при лечении тяжёлой стероидозависимой БА (табл. 20-8).Препараты короткого действия для купирования симптомовНаилучшим способом доставки селективных агонистов р^-адренорецепторов является ингаляция аэрозоля, так как это обеспечивает максимальное попадание препарата в дыхательные пути и минимальную системную абсорбцию. Уровень бронхиального дерева, на котором происходит депозиция ингалируемых аэро¬ золей, зависит от размера частиц, скорости ингаляции и геометрии дыхатель¬ ных путей [201]. Даже при ингаляции частиц оптимального размера, диаметром 2-5 мкм, доставка препарата в дыхательные пути ниже уровня голосовых связок составляет только 20-40% дозы. Большая часть препарата откладывается во рту и глотке. Частицы диаметром менее 1-2 мкм остаются во взвешенном состоянии и выдыхаются.Другим короткодействующим препаратом для купирования симптомов явля¬ ется АХП ипратропиума бромид. Наилучшим способом доставки ипратропиума бромида также является ингаляции аэрозоля через небулайзер или дозированный аэрозольный ингалятор. АХП блокируют действие ацетилхолина, высвобож¬ даемого из моторных ветвей блуждающего нерва, наиболее важными из которых являются эффекты, опосредованные Мз-рецепторами в гладкой мускулатуре дыха¬ тельных путей и в подслизистых железах. Пик действия ипратропиума бромида приходится на 30 мин после ингаляции, длительность действия 4-6 ч. Несмотря на
БРОНХИАЛЬНАЯ АСТМА 399Таблица 20-8. Ступенчатый подход к терапии бронхиальной астмыСнижатьСтупени терапииПовышатьСгупень 1Ступень 2Ступ0и> 3 Ступень 4Ступень 5Обучение пациентаКокгроль над окружающей средойАлтеркативные препараты для купирования сиытсмов: ингш1яционныв антихолинертческие гт1а1араты, пероральные рг-агонисть короткого действия, некоторые ДДБА и теофиллин корожого действия.Регулярное назначение Рг-агонистов короткого и длигального действия не рекомендуется при отсутствии регулярной терапии ИГКС.ТО что его бронходилатационный эффект при астме несколько ниже, чем у сальбу¬ тамола, добавление ипратропиума бромида к небулайзерной терапии сальбутамо- ж>м усиливает бронходилатацию при тяжёлом приступе Б А [202]. Внутривенное медение теофиллина, ранее являвшееся основой терапии острой бронхоконстрик- 1ЩИ. практически полностью вытеснено аэрозольной терапией р2”Эгонистами, мвогда в комбинации с ипратропиумом.■репараты длительного действияК длительно действующим селективным [^2-агонистам (продолжительность действия >12 ч) относятся салметерол и формотерол. Действие сальметерола щачинается слишком медленно для того, чтобы этот препарат мог применяться для быстрого купирования симптомов, тогда как формотерол обладает быстрым ■ачалом действия, сравнимым с сальбутамолом. Наилучшим способом приме¬ нения этих препаратов является их назначение в комбинации с ИГКС. В такой комбинации они обеспечивают дальнейшее }шучшение контроля Б А. ДДБА рекомендуются к применению только в комбинации с ИГКС, но не в качестве .шонотерапии БА,Базисные препаратыНаиболее эффективными и наиболее часто применяемыми препаратами для ■юнтроля заболевания являются ИГКС (например, беклометазон, будесонид, фяунизолид, флутиказон, триамсинолон) [203]. ГКС подавляют продукцию про- шюшлительных цитокинов и могут стимулировать продукцию противовоспали- шьных протеинов [204]. Они не обладают прямым расслабляющим действием на
400 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯгладкую мускулатуру, но снижают бронхиальную гиперреактивность и умены частоту обострений БА благодаря их широкому спектру противовоспалительвого ■ действия. Это действие наиболее ярко проявляется в подавлении лимфоцитарно¬ эозинофильного воспаления слизистой дыхательных путей при БА. Как и у дру¬ гих видов терапии БА, самый высокий терапевтический индекс наблюдается пщ. i ингаляционном назначении данных препаратов. При регулярном применетиш. ИГКС улучшают все индексы контроля астмы: степень тяжести симптомов, 4acTOff | использования ингаляционных р^-агонистов для купирования симптомов, но пробуждения, OФB^ и ПСВ, бронхиальную гиперреактивность, частоту об» и качество жизни [205]. Из-за своей эффективности и безопасности ИГКС рекомв^ дуются всем пациентам с БА, нуждающимся в более активной терапии, чем эпиэ»? дические ингаляции р^-агонистов для купирования симптомов [206]. Пероралм1К|; и парентеральные ГКС также эффективны, но их применяют для лечения пац1ий1| тов, нуждающихся в ургентной терапии, или пациентов с наличием тяжёлых перш- ; стрфующих или рецидивирующих симптомов несмотря на терапию ИГКС. >Ингаляционное назначение ГКС сводит к минимуму риск системных побочш||" эффектов, но не исключает их полностью. Ежедневное применение будесонида i ■ дозе 1000 мкг эквивалентно 35-50 мг перорального преднизолона в день в отй шении контроля БА, но по своим системным эффектам — менее 10 мг/день [207^^ iВ пульмонологий успешно применяются Беклазон Эко Лёгкое ЙІ (беклометазона дйпропионат 50;, 100 и 250 мкг/1 доза, 200 доз) й Саламол і Лёгкое Дыхание® (сальбутамола сульфат 100 мкг/1 доза, 200 доз). вируемые вдохом, дозированные аэрозольные ингаляторы, которые обес чивают оптимальную доставку препарата в Дь1хательные пути, эффеь^4н5то4 безопасную терапию Б А и ХОБЛ.В прог^шме БАЗИС доказана эффективность и безопасность даения | Беклазоном Эко Лёгкое Дыхание® у больных с БА: улучшаются показатели ^ ФВД, больные не отмечают дневные и ночные симптомы астзиы, умеїпотребность в бррцхолитиках. Благодаря простой и правильной технике инга-^ ляции Лёгким Дыханием® повышается эффективность базисной терапии по^ сравнению с использованием обычных ингаляторов, ^Саламол Эко Лёгкое Дыхание благодаря уникальной системе доставк^— имеет оптимальную лёгочную депозицию, высокую эффективность;« безопас-^ ность применения у больных БА и ХОБЛ по сравнению с другими короткодей- - ствующими бронхолитиками в обычных ингаляторах. ^ (И1Йнгал^ор Дёгкое Дыхание® — это идеальный по простоте использования аэрозольный ингалятор, активируемый вдохом, для любого больного с БА ^ХОБЛ., / ' . г,,:;'-Шечйтается на правах рекламы. ' ^У детей особым поводом для беспокойства при проведении терапии ИГКС явля¬ ется замедление роста, но этот эффект выражен незначительно, является кратков¬ ременным и не связан с изменением окончательного роста во взрослом состоянии по сравнению с ожидаемым или ростом родных братьев и сестёр, не страдающиж БА [208, 209].Два препарата — блокаторы цистеиниловых лейкотриенов: зафирлукаст и мон¬ телукаст — в настоящее время широко применяются при БА как препараты для длительного контроля заболевания. Оба препарата уменьшают выраженность сим¬ птомов, просвет бронхов, снижают бронхиальную гиперреактивность и воспаление дыхательных путей, уменьшают частоту обострений БА, тем не менее они уступают
БРОНХИАЛЬНАЯ АСТМА 4Q-|ПО эффективности низким дозам ИГКС [210, 211]. Препараты применяются перо¬ рально, что позволяет избежать возможных проблем с нежеланием пациентов про- ■Офпъ ингаляционную терапию или с техникой ингаляций. Они также эффективны П|« аллергическом рините и, таким образом, могут применяться у пациентов с кпош аллергическим ринитом и лёгкой атопической астмой. Антилейкотриеновые препараты обладают, судя по всему, малой токсичностью. Случаи синдрома Черджа- Cipocc у очень небольшого числа пациентов оказались совпадением, так как анализ ■сюрий болезни этих пациентов показал, что во всех рассматриваемых сл}^аях •оаникновение васкулита связано с отменой терапии системными ГКС, что, в свою очередь, привело к манифестации лёгочного васкулита, который ранее расценивался как вариант течения БА. Как полагают, синдром маскировался приёмом преднизо- лжа и выявлялся в результате снижения дозы преднизолона после начала терапии автагонистами лейкотриеновых рецепторов [212].Эффективность и безопасность ИГКС, разработка антилейкотриеновых препа¬ ратов привели к вытеснению кромогликата и недокромила из широкой практики. Что касается теофиллина, то у него есть большое преимущество — он недорог, поэ- ишу продолжает применяться в развивающихся странах. Однако его применение вересматривается в странах с высоким уровнем жизни, поскольку было выявлено, что он облегчает симптомы и обладает противовоспалительными эффектами даже ■рт применении в низких дозах, при которых риск токсических эффектов невелик. Новый механизм действия, приписываемый теофиллину, — это индукция активно- сп гистондеацетилазы, что приводит к усилению действия ГКС [213]. Этим может •бьясняться его эффективность при назначении в комбинации с ИГКС [214].Новым подходом к лечению БА являются гуманизированные анти-1§Е-антитела, швализумаб. Исходные моноклональные антитела были получены от мышей, сен- вбилизированных к IgE. Были отобраны антитела, направленные против фраг- ■ента IgE, который связывается с рецепторами тучных клеток, базофилов и других ■рспалительных клеток, таким образом ингибируя связывание IgE без активации связанного с клетками, и провокации дегрануляции тучных клеток. Успехи в «■ределении иммунопатогенеза Б А побуждают к разработке новых методов лече- ■п« направленных против специфических звеньев иммунного каскада. Первые из жтих методов, тестированных на добровольцах с БА, — моноклональные антите- я против ил-5, рекомбинантный препарат ИЛ-12, растворимый рецептор ИЛ-4 и шгагонисты селектинов не оправдали ожиданий, возникших после исследований ■1 моделях животных [215], но все они ещё нуждаются в изучении.РШЕДИКАМЕНТОЗНЫЕ МЕТОДЫ ЛЕЧЕНИЯ, Поскольку БА в большинстве случаев, особенно у детей, является аллерги¬ ческой по своей природе, наиболее распространённым подходом к немедика- жнтозному лечению БА является снижение экспозиции аллергенов. Состояние ■щиентов с атопической Б А улучшается, когда они уезжают из своего обычного рипмшего окружения в высокогорный санаторий или находятся в безаллергенной ■иате в стационаре [216, 217]. Однако подобное улучшение трудно воспроиз- ЯВСП1 с помощью мер, которые пациенты стараются предпринимать в домашних ]Сяовиях. Из-за сильной эмоциональной привязанности к домашним животным е пациенты или их родители не желают расставаться с ними, даже если имо, что это животное является источником причинно-значимых аллерге- Агрессивные меры по контролю окружающей среды, включая мьггьё кошки е 2 нед, приводят к умеренному улучшению симптомов и ФВД пациентов, I я«горые предпочли оставить животное [218]. Основным источником аллергенов й домашней пыли является матрас, но при этом помещение матраса в непро- й чехол эффективно снижает уровень аллергенов клеща домашней пыли, ве улучшает контроль БА [219]. Возможно, для достижения эффективности
І402 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯнеобходимо основательное и продолжительное снижение экспозиции аллері что труднодостижимо для большинства семей. Другой стратегией стало воз ствие на Т-клетки в целях их переключения на неаллергический тип ответа с щ щью аллергенспецифической иммунотерапии [220]. Повторные инъекции доз аллергена могут стимулировать переключение иммунного ответа на ответ і ThJ-типy, что, возможно, является причиной сохранения положительного э< та после окончания лечения [221]. Однако эти положительные эффекты легші полз^іить при аллергическом рините, чем при БА. Попытки совершенсгвованш иммунотерапии фокусируются на модифицировании вводимых аллергенов илн с помощью конъюгации их с иммуностимулирующими последовательностями ДНК (например, СрС-динуклеотиды), или путём введения ДНК-вакцин, состоящих га ДНК, комплементарной аллергену [222]. Весьма интересным подходом к лечению резистентной БА стало применение бронхиальной термопластики, при которой т время бронхоскопии с помощью специального приспособления в терминальны» отделах бронхов производят нагревание воздуха до 65 °С, в результате чего сни¬ жается гипертрофия мышц бронхиальной стенки и изменяется гиперреактивносл бронхов, что отражается в клиническом и функциональном улучшении [223]. Т« не менее подобные методы нуждаются в дальнейшем изучении.ТАКТИКА ВЕДЕНИЯ БОЛЬНЫХ БРОНХИАЛЬНОЙ АСТМОЙ ОбострениеДиагностика обострений БА обьино не представляет затруднений. Таким обра- зом, задачей клинического обследования является оценка тяжести обострения для определения необходимой степени вмешательства. За исключением пациентов с жизнеугрожающим обострением БА, симптомы слабо коррелируют со степе¬ нью тяжести обструкции, так что следует проводить измерение ОФВ^ или ПСВІ Серийные повторные измерения дают ценную информацию об ответе на терапию и помогают избежать как ненужных назначений, так и преждевременного сниже¬ ния доз препаратов. Всем пациентам следует назначить ингаляционный р^-агоннст через небулайзер или с помощью дозированного аэрозольного ингалятора со спейсером (каждые 20-30 мин в течение 1 ч). В дальнейшем частоту проведения ингаляций следует корректировать в зависимости от степени улучшения брон¬ хиальной обструкции, при тяжёлых обострениях может бьггь назначена непре¬ рывная небулизация — постоянное введение небулизированного Рз-агонисга в течение 1 ч. Было показано, что добавление антихолинергического препарата к небулайзерному р^'Згонисту вызывает дополнительную бронходилатацию [202]. Для поддержания 5^2 вьшіе 90% должно проводиться дополнительное назначение кислорода с помощью назальных канюлей или маски. Лечение должно быть начато сразу, как только установлен диагноз обострения БА и оценена степень его тяжести. Проводить повторные измерения ФВД следует периодически, через определённые промежутки времени, например, через 2 ч после начала терапии.При среднетяжёлых, тяжёлых обострениях и обострениях с неполным ответом на начальную терапию Рз-агонистами должно быть начато лечение пероральными ГКС и оно должно продолжаться в течение 7-10 дней (например, преднизолон 40-60 мг/сут). Даже при лёгком обострении пациентам, регулярно принима¬ ющим ГКС, должны быть назначены дополнительные дозы перорального ГКС. Добавление ИГКС при снижении дозы пероральных ГКС уменьшает число реци¬ дивов (224], и некоторые исследования показали, что ИГКС эффективны как пре¬ параты для продолжения лечения после отмены пероральных ГКС [225].Плановое лечение бронхиальной астмыВсе руководства по ведению БА рекомендуют корректировать интенсивность терапии в зависимости от клинической степени тяжести БА [226,227]. Пациентам
БРОНХИАЛЬНАЯ АСТМА 403С эпизодическими симптомами, быстро купируемыми бронходилататорами, с нор¬ мальной ФВД в промежутках между эпизодами (лёгкая интермиттирующая Б А) не требуется никакого лечения, кроме ингаляционного р^-агониста по потребности. Если симптомы появляются больше 2 раз в неделю, ограничивают активность, приводят к ночным пробуждениям больше 2 раз в месяц (лёгкая персистирующая БА), рекомендуется применение препарата для длительного контроля заболева¬ ния. Наиболее эффективной терапией является регулярное применение ИГКС. во антилейкотриеновые препараты, кромолин и недокромил, а также теофиллин рассматриваются как приемлемые альтернативные варианты. Для среднетяжёлой н тяжёлой персистирующей БА рекомендуются либо высокие дозы ИГКС, или комбинация ИГКС и ДДБА [228].Невыполнение назначений — частое обстоятельство, к которому надо отно¬ ситься с вниманием [229]. Как и при любом хроническом заболевании, условием успешного лечения является установление партнерских отношений с пациентом. Это, в свою очередь, требует обучения пациента, объяснения ему природы заболе¬ вания, целей лечения и действий, которые необходимо предпринять при усилении симптомов (план действий). Просто предоставления необходимой информации недостаточно. Самоведение требует овладевания определёнными навыками, осо¬ бенно навыками самооценки своего состояния (например, измерение ПСВ и интерпретация результатов) и лечения (например, правильное применение инга¬ ляторов, правильное дозирование пероральных ГКС),Вторая возможная причина плохого контроля БА отражает отягчающие эффек¬ ты нелеченых сопутствующих заболеваний [230], Таким пациентам, возможно, следует провести компьютерную томографию пазух носа и мониторирование пищеводного pH даже при отсутствии типичных симптомов синусита или эзо- фатального рефлюкса, поскольку все увеличивающееся количество клинических наблюдений свидетельствует, что лечение этих заболеваний может улучшить кон¬ троль БА [231, 232].Исследование кривых зависимости реакции от дозы ИГКС делает третью воз¬ можность — предположение о недостаточности дозы ИГКС — менее вероятной. У 30% пациентов с БА, особенно с длительным анамнезом заболевания и не имею¬ щих признаков активности воспаления (нет эозинофилии мокроты, низкий уро¬ вень N0 в выдыхаемом воздухе), отмечаются незначительные изменения ОФВ^ и БГР после лечения низкими и средними дозами ИГКС; кроме того, назначение высоких доз ИГКС усиливает подавление функции надпочечников, не улз^шая каких-либо показателей ФВД [233]. В отношении этих конечных точек кривая зависимости реакции от дозы вначале крутая, а в дальнейшем плоская, поэтому наибольшее улучшение достигается при низких дозах [234]. Однако нельзя быть уверенным, что отсутствие улучшения показателей ФВД указывает на отсутствие других преимуществ лечения ИГКС — снижения риска обострений.Растущая осведомленность о характере кривой зависимости реакции от дозы и обеспокоенность возможностью токсичности высоких доз ИГКС при длительных сроках лечения вызвали интерес к эффективности добавления других препаратов для контроля заболевания. Из всех изученных комбинаций наиболее эффективно сочетание ИГКС и ДДБА. В ходе многих клинических испытаний было показано, что у пациентов со среднетяжёлой и тяжёлой БА, недостаточно контролируемой ИГКС, добавление к терапии ДДБА является более эффективным, чем удвоение дозы ИГКС, по показателям улучшения симптомов и количества ночных пробуж¬ дений, ФВД и качества жизни [228]. Одно время бытовало мнение о возможности улучшения контроля при добавлении ДДБА просто за счет того, что их бронходи¬ латирующее действие маскирует БГР и усугубляет воспаление дыхательных путей [235]. Было показано, что монотерапия ДДБА контролирует симптомы и повы¬ шает пиковую скорость выдоха так же, как и ИГКС, но не контролирует воспале-
404 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯНИЄ дыхательных путей и не предотвращает обострения [236]. Именно поэтому ДДБА не рекомендуются в качестве единственного препарата для контроля астшя. Однако несколько проспективных исследований показали, что комбинированна* терапия ИГКС и ДДБА снижает частоту обострений БА [237]: добавление формо^ терола к низким или высоким дозам будесонида снижает частоту как лёгких, такв V.*: тяжёлых обострений, причём наиболее низкий уровень обострений наблюдается Iпри терапии комбинацией «высокие дозы будесонида-формотерол» [238].I ^ Другие исследования показали, что добавление теофиллина к низким дозамГ ИГКС повышает терапевтическую эффективность лечения, но не является болееэффективным, чем удвоение доз ИГКС. То же самое относится и к антилейкотриено¬ вым препаратам. Продемонстрирована большая эффективность добавления ДДБА ж ИГКС по сравнению с добавлением зафирлукаста или монтелукаста [239].Выделяются подгр)шпы пациентов с хронической тяжёлой БА, которая характе¬ ризуется высокой потребностью в медикаментах или в персистированием симпто¬ мов, рецидивировании обострений или в сохранении бронхиальной обструкции несмотря на высокие дозы препаратов. Термин ^хропигеская тяжёлая астма* включает несколько вариантов тяжёлого течения БА, такие как рефрактерная БА, стероидозависимая БА, трудноконтролируемая БА, нестабильная БА и БА с необ¬ ратимой обструкцией. Эта подгруппа логично должна включать пациентов со сте- роидорезистентной астмой, но обычно они рассматриваются как отдельный фено¬ тип [240]. Пациенты с атопической тяжёлой БА и IgE-oпocpeдoвaнным ответом, в том числе и принимающие системные ГКС, представляют собой тот фенотип, для которого была показана эффективность применения aнти-IgE-мoнoклoнaльныI антител (омализумаб) в отношении снижения доз ингаляционных или перораль¬ ных ГКС, необходимых для контроля заболевания [241].СПИСОК ЛИТЕРАТУРЫ г
Глава 21 Муковисцидоз
Глава 22 БронхоэктазыОПРЕДЕЛЕНИЕБронхоэктазы (БЭ) — стойкое, необратимое расширение ветвей ; бронхиального дерева, обусловленное деструкцией стенок бронхов ; и/или нарушением нервно-мышечного тонуса вследствие воспале- , ния, склероза, дистрофии, гипоплазии их структурных элементов. (Впервые БЭ были описаны Р. Лаэннеком в 1819 году. Проблеме ] их генеза, диагностики и лечения за последние 50 лет посвящено ] много работ [1, 2, 3,7,8, 9,10,12,13]. |Бронхоэктатическая болезнь (бронхоэктазии) — гнойно- | воспалительный процесс в резко расширенных деформированных | бронхах с инфильтративными и склеротическими изменениями в I перибронхиальном пространстве, ведущий к дальнейшему необ- ) ратимому расширению бронхов с нарушением их дренажной функ- | ции, развитию ателектазов, эмфиземы, цирроза в регионарной зоне | паренхимы лёгкого. |Классификация Iпредложено немало классификаций, подразделяющих БЭ по | форме (цилиндрические, варикозные, кистозные), содержимо¬ му (сухие, влажные, заполненные), механизмам возникновения (обструктивные, деструктивные, тракционные, ятрогенные после лучевой Терапии, агрессивной антибиотикотерапии и др.) [5, 47]. Наиболее полно современное направление в разработке проблем классификации БЭ отражают Ш.М. ТЬигЬеск и М.П. 1$ешап [40, 49], в основу их классификации положены этиопатогенетические принципы.Этиопатогенетическая классификация БЭ:• Постинфекционные (инфекции нижних дыхательных путей у детей, абсцедирующие пневмонии у взрослых, туберкулёз; аденовирусная инфекция, коклюш, корь; другие инфекции дыхательных путей).• Обструктивные (инородное тело, опухоли, внешняя компрес¬ сия дыхательных путей).• Ингаляционные повреждения (вдыхание токсинов, раздража¬ ющих газов, паров, дыма, включая термические поврежде¬ ния).• Аслирационные (гастроэзофагеальный рефлюкс, аспирацион- ные пневмонии, санационные процедуры).
БРОНХОЭКТАЗЫ 407• Генетически детерминированные (муковисцидоз, синдром цилиарной диски¬ незии, синдром Юинга),• врождённые аномалии — дисплазии (агенезии, гипоплазии, секвестрации, шунты, карликовость),• Первичные иммунные расстройства (г}шоральные дефекты, клеточные или смешанные расстройства, дисфункция нейтрофилов).• Дефицит или аномалии а^^-антитрипсина.• Хронические диффузные заболевания лёгких известной или неустановленной этиологии (идиопатический лёгочный фиброз, коллагенозы, саркоидоз).• Идиопатические воспалительные расстройства (анкилозирующий спондило¬ артрит, воспалительные заболевания кишечника, рецидивирующий полихон- дрит).• Другие причины (аллергический бронхолёгочный аспергиллёз, ВИЧ-инфек¬ ция/СПИД, «синдром жёлтых ногтей», радиационное повреждение).Остаются открытыми вопросы о врождённых и приобретённых причинах БЭ, нх первичности и вторичности. Вероятно, повреждение бронхов возникает у лиц с генетическими дефектами или предрасположенностью к патологии, так как подавляющее большинство БЭ формируется в детском и юношеском возрасте, к ■ервичным относят БЭ при врождённых аномалиях и генетических заболеваниях легких. Вторичные БЭ могут быть обусловлены любыми причинами, вызьшающи- ІІИ повреждения лёгких.Сохраняет свою актуальность деление БЭ по клиническому течению (фазы ремис¬ сии и обострения), по распросгранённости (поражение сегментов, доли, лёгкого, двусторонний процесс). Расширение эндоскопических возможностей обусловило подразделение БЭ на центральные (проксимальные бронхи, включая субсегментар- ные) и периферические (дистальнее субсегментарных, с 5-й по 16-ю градации).По форме БЭ подразделяют на цилиндрические, веретенообразные, мешотча¬ тые, кистоподобные, смешанные.Для выбора тактики лечения БЭ целесообразно вьщелять формы их течения:1. Интермиттирующее.2. Осложнённое:• лёгочным кровотечением;• патологией плевральной полости:❖ спонтанным пневмотораксом;❖ эмпиемой плевры;• патологией ткани лёгкого:<>• абсцессом и гангреной;❖ циррозом;• сепсисом;• внелёгочными процессами:❖ язвой желудка и двенадцатиперстной кишки;^ амилоидозом.ЭпидемиологияБЭ феди других заболеваний лёгких составляют от 10 до 30% [10], При флюо¬ рографии органов грудной клетки их выявляют у 1-2 из 1000 человек, а при обсле¬ довании с применением бронхографий — у 0,5% населения. По данным патоло¬ гоанатомических исследований, БЭ диагностируют у 2-4% взрослого населения. Выявление бронхоэктазий у больных отмечено в возрасте до 20 лет. При этом в возрасте до 10 лет БЭ одинаково часто наблюдаются у мальчиков и девочек, а среци взрослых мужчины болеют чаще, чем женщины в 1,5-3 раза, В последние годы количество больных БЭ в специализированной клинике, несмотря на повы¬ шение диагностических возможностей, уменьшилось. Это, вероятно, связано с
Ш-Шу408 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ'• . повышением эффективности лечения болезней органов дыхания в детском возрас¬ те, включая патологии, способствзтощие развитию БЭ.ПатогенезБЭ относятся к полиэтиологическим процессам. Основная причина развктв бронхоэктазии в детском и юношеском возрасте - это продуктивное воспаленж дистальных воздухопроводящих путей. Деструктивные изменения мышечного ■ эластического компонентов стенки сопровождаются дилатацией бронхов и функ*- циональными нарушениями [14]. Застой слизи вызывает надсадный кашель с рас¬ тяжением стенок, разбрызгиванием секрета, закупоркой терминальных бронхиож. Спадение альвеолярной ткани приводит к объёмному уменьшению долек, уплот¬ нению перибронховаскулярного интерстиция. Параллельно с вентиляционными нарушениями снижается перфузия лёгочной паренхимы. Формирование бронхо¬ эктазов часто сочетается с хроническим бронхитом и эмфиземой (ХОБЛ). Среде больных ХОБЛ их выявляют в 18-27% [25],Патологическое истончение и повреждение бронхов может быть вследствж вытяжения (тракции), выпячивания (пульсации), снижения упругости дыхатель¬ ных путей, хронического инфекционного воспалительного процесса, Проходимосл воздухоносных путей поддерживается хряш;ами бронхов, отрицательным вну- тригрудным давлением (через диффузную систему интерстициальной ткани). Фиброзные изменения в интерстициальной ткани (саркоидоз, туберкулёз и другие воспаления) приводят к расширению участков воздухоносных путей в результате тракции (вытяжения). Локальные повреждения стенки бронха (например, при аспергиллёзе вследствие формирования мукоидных конгломератов) обусловлива¬ ют пульсионный механизм формирования БЭ.Развитие БЭ может быть вызвано слабостью бронхиальной стенки при врож¬ дённой трахеобронхомегалии (синдром Мунье-Куна), отсутствии хрящевых колец (синдром Вильямса-Кэмпбелла), синдроме Марфана, рецидивирующем полихон¬ дрите.Развитию воспалительного процесса в бронхах способствует ухудшение отделе¬ ния бронхиального содержимого при неэффективном кашле при патологическом пролабировании мембранозной части бронхов.В литературе описано множество факторов и механизмов, способствующих развитию БЭ. Cole [19] придаёт важное значение возникновению «порочного круга», при котором врождённая предрасположенность ведёт к рецидивирующему воспалению с деструктивными изменениями в бронхах, а впоследствии способ¬ ствует хронической микробной колонизации из-за снижения к ней устойчивости слизистой оболочки и экспансивному распространению процесса. Однако БЭ не обязательно присутствуют при хроническом воспалении в бронхах.Возникло предположение о снижении защиты бронхиального дерева от вос¬ паления вследствие формирования при некоторых видах инфекциях (Pseudomonas aeroginosd) биомембраны, которая покрывает слизистую оболочку, блокирует рес¬ нички, делает недоступными для антибиотиков микроорганизмы [23],Дефекты в лечении острых воспалительных процессов в лёгких могут приво¬ дить к локальным повреждениям структуры лёгочной ткани и способствовать развитию БЭ [44].Имеется связь БЭ с муковисцидозом, определённое значение в возникновении которого придают кистозно-фиброзному трансмембранному регулятору (КФТР) [26]. Среди пациентов этой группы отмечается хроническая дыхательная обструк¬ ция, синуситы и т.д. Наряду с классическим вариантом КФТР-мутации установле¬ ны другие нарушения — вне КФТР-генома и в сочетании с ним [32], что опреде¬ ляет клинические фенотипы больных. Выделяют 2 группы больных с кистозным фиброзом, приводящим к БЭ [35]. У одних заболевание развилось в детстве, и
БРОНХОЭКТАЗЫ 409оно было подтверждено клинически и лабораторно, У других тяжесть процесса была меньше и диагностика затруднена. К этой группе больных относятся лица с синдромом Юинга (БЭ, синуситы, обструктивная азоспермия) у мужчин с врож¬ дённым отсутствием выносящих протоков [31].Воспалительные процессы в бронхиальном дереве, способствующие развитию БЭ, могут быть обусловлены иммунными расстройствами - мутациями, снижаю¬ щими количество Т- и В-лимфоцитов, NK-лимфоцитов, нейтрофилов, белков ком¬ племента. Это обусловлено общей вариабельной иммунной недостаточностью или птогамма-глобулинемией [24]. Среди других форм первичных иммунных нару¬ шений, приводящих к БЭ, отмечают гипер-IgM-, гипер-IgE-синдром, гипоплазию тимуса с ненормальным клеточным иммунитетом (синдром Ди Джорджа), гене¬ тические аномалии (синдром врождённого комбинированного иммунодефицита, синдром «голых лимфоцитов», синдром Вискотта-Олдриджа — Х-сцепленное рецессивное заболевание, ассоциированное с маленькими тромбоцитами и экзе¬ мой, гипоплазия хрящей и волос, атаксия-телеангиоэктазия).У пациентов с БЭ, ассоциированными с нетуберкулёзной микобактерией, выяв¬ лены различные фенотипические отклонения aj-антитрипсина [17].Наследственные структурные аномалии лёгких могут способствовать развитию БЭ, Среди них — врождённые структурные и функциональные нарущения клеток реснитчатого эпителия [16], синдром Мунье-Куна (врождённая трахеомегалия, ассоциированная с удлинением и расщирением С-колец трахеи и сегментарных бронхов) [52], синдром Вильямса-Кэмпбелла — врождённая недостаточность бронхиальных хрящей [53], различные врождённые расстройства соединительной ткани: синдром Марфана [27], врождённые и возрастные аномалии (секвестрация, агенезия, гипоплазия), которые могут сочетаться с рецидивирующей и/или хро¬ нической инфекцией нижних дыхательных путей, односторонним бронхолитиа- зом - (синдром МакЛеода),Причиной развития БЭ может быть тяжёлая вентиляционная рестрикция при карликовости.Саркоидоз способствует развитию БЭ вследствие диффузного паренхиматоз¬ ного рубцевания с деформацией дыхательных путей, внутрибронхиальному гра¬ нулематозному воспалению с постстенотической инфекцией, перибронхиальной лимфоаденопатией [43],При ревматоидном артрите имеются склонность к инфекциям, изменения, обу- стовленные применением стероидной и цитотоксической терапии [22]. Развитие БЭ отмечено при анкилозирующем спондилите с анкилозом соединения рёбер и позвоночника, что сопровождается ограничением вентиляции, фиброкистозной дегенерацией верхушки лёгких [45]. Остаётся малоизученным механизм развития БЭ при системной красной волчанке [28],При синдроме Шёгрена (кератоконъюнктивит, ксеростомия — сухость глаз и рта) в изолированном варианте или в сочетании с коллагенозами (системной крае¬ вой волчанкой, ревматоидным артритом) возникают лимфоцитарная интерсти¬ циальная пневмония, лимфомы, лёгочная гипертензия, уменьшение количества слизи и увеличение её вязкости с обструкцией дыхательных путей, что увеличива¬ ет риск формирования БЭ [20].Развитию БЭ при язвенном колите и болезни Крона способствуют криптогенная инфекция, аутоиммунный компонент, направленный на эпителий [27],Рецидивирующий полихондрит сопровождается воспалением и деформацией трахеобронхиального дерева и другой хрящевой ткани различной локализации [50],Значительную роль в развитии БЭ играют аспирация и другие ингаляцион¬ ные повреждения. Имеет значение аспирация секрета из носоглотки (микро¬ организмы), рефлюкс из пищевода и желудка, ингаляция токсинов, термиче-I
410 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ>> ские повреждения [52]. БЭ могут развиваться при аспирации инородных тел.Щ обструкции дыхательных путей опухолью, внешней компрессией дыхательныхЙ путей.При бронхолёгочном аспергиллёзе возникают слизистые пробки в бронхах с развитием воспаления и их расширением с формированием тонкостенных БЭ.БЭ отмечены у больных СПИДом [41].При пожелтении, утолщении, дистрофии ногтей, хронической лимфедеме лица, рук, ног, билатеральном плеврите («синдром жёлтых ногтей») часто наблюдают синуситы, воспаления нижних дыхательных путей, патологию лимфатических структур, повышенную сосудистую проницаемость, недостаток иммуноглобули¬ нов, цилиарную дисфункцию. Всё это способствует развитию БЭ [21]. БЭ также возникают у больных с лучевым пневмонитом.Клиническая характеристикаБолезнь носит хронический характер с периодическими обострениями процесса и возлюжным развитием осложнений. У 82,6% больных БЭ локализуются в одном лёгком, в том числе в правом в 23,7%, в левом — в 58,9% случаев. При правосто¬ ронней локализации процесса наиболее часто поражена нижняя доля (45,9%), а при левосторонней — нижняя доля (58%) и её сочетание с язычковыми сегмента¬ ми (26%). При двусторонних БЭ чаще всего поражаются нижние доли (41,8%) илн оба лёгких (36,8%).Клинические проявления болезни зависят от фазы заболевания — ремиссии илн обострения. Ведущий клинический симптом — кашель с отделением мокроты. может отсутствовать при сухих БЭ. В остальных случаях в период ремиссии кашель с мокротой имеет постоянный характер или периодический, обычно по утрам, не превышая выделения за сутки 50 мл слизисто-гнойной, без запаха мокроты. В период обострения количество мокроты с самого начала быстро увеличивается, достигая 300-500 мл и более.Частота кровохарканья, по данным литературы, колеблется от 10-15 [3] до 25-34% [10]. Лёгочные кровотечения отмечают у 10% больных [10]. По нашим данным, из 562 больных БЭ кровохарканье было отмечено у 8,2, а лёгочное крово¬ течение — у 11,1%. Заслуживают внимания лёгочные кровотечения при сочетании БЭ с эндометриозом.В период обострения появляются жалобы на боль. Есть мнение, что болевой синдром иногда имитирует картину ТЭЛА [10]. Болевой синдром чаще проявля¬ ется 2 формами. При первой боль носит плевральный характер (локальное про¬ явление с усилениями во время глубокого вдоха), при второй — не имеет чёткой локализации, а ощущается в виде чувства сдавления, распирания, затруднённого дыхания.Нередко повышается температура тела. В период ремиссии повышение темпе¬ ратуры до субфебрильного уровня бывает эпизодическим. В период обострения наблюдается длительная лихорадка в сочетании со слабостью, потливостью, ино¬ гда ознобами.Нередко больных беспокоит одышка, которая не соответствует выраженности дыхательной недостаточности. Отмечается общая слабость, утомляемость, сниже¬ ние физических возможностей.К симптомам БЭ может присоединиться картина развившихся осложнений: кровохарканья и лёгочного кровотечения (у 19,3% больных), спонтанного пнев¬ моторакса (0,7%), абсцедирования (1,8%), эмпиемы плевры и пиопневмоторакса (0,4%), кроме того, отмечаются сепсис, аспирация, эрозивный гастродуоденнг, язва желудка и двенадцатиперстной кишки, желудочно-кишечные кровотечения и др.
БРОНХОЭКТАЗЫ 411ДиагностикаАНАМНЕЗВ диагностике БЭ важно зачесть характерные признаки, указания в анамнезе на хронические, с обострениями, в течении длительного времени инфекционные заболевания нижних дыхательных путей (бронхиты, пневмонии), семейный анамнез со сведениями о факторах риска. Мотивом для обследования может стать сообщение об «астме», кровохарканье.Поводом для обследования в целях диагностики БЭ могут быть выявленный при рентгенографии усиленный, с деформацией лёгочный рисунок в нижних лёгочных полях, доходящий до периферических отделов лёгких, ателектаз в сред¬ ней, нижних долях язьиковых сегментах.Диагностика БЭ преследует цель установления болезни, факторов риска воз¬ никновения и разврггия процесса, формы заболевания и его особенностей, знание которых необходимо для адекватного лечения,ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕПри длительном течении заболевания могут наблюдаться утолщение концевых фаланг («барабанные палочки») и деформация ногтей («часовые стёкла»). Дети могут отставать в умственном и физическом развитии. Возможна деформация грудной клетки в зависимости от развития пневмофиброза (уменьшение) или эмфиземы (бочкообразность) и распространённости последних (симметричные или асимметричные деформации).При развитии пневмофиброза голосовое дрожание усилено, перкуторно — укорочение лёгочного звука, аускультативно — бронхофония, а при выраженной эмфизематозности голосовое дрожание ослаблено, лёгочной звук с коробочным оттенком, аускультативно — дыхание ослаблено. При аускультации могут быть определены локализация (зона выявления хрипов), активность процесса (коли¬ чество и разнокалибренность влажных хрипов), объём и вязкая консистенция содержимого бронхов (характер сз'^хих хрипов), динамика процесса (интенсив¬ ность, количество, характер хрипов). При грубых изменениях объёма лёгкого физикально может быть выявлено смещение сердца.ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯИсследования крови должны быть направлены на определение выраженности воспалительного процесса (уровень лейкоцитоза, С-реактивного белка, тромбо¬ цитов, СОЭ). грибкового поражения лёгких (наличие эозинофилии), хронической инфекции (анемии).Исследование мокроты предусматривает определение вида возбудителя (куль¬ туральные исследования) неспецифического воспалительного процесса, микобак¬ терий, грибов, а также чувствительности микрофлоры к антибиотикам.ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯВ окончательной постановке диагноза важнейшее значение имеют лучевые методы. При рентгенографии выявляются тяжистость, ячеистость, кистовидные изменения лёгочного рисунка, уменьшение объёмов отдельных зон лёгкого, прежде всего базальных сегментов, средней доли и язычковых сегментов, эмфи- зематозность в смежных участках лёгкого, смещение средостения в поражённую сторону, в последние годы главным диагностическим исследованием стала компьютерная томография. Это связано с большой информативностью (чув¬ ствительностью и специфичностью) метода при неинвазивном, безопасном его применении.в норме ширина бронха на высоте обьгчного вдоха достаточно стабильна и варьирует от 10 мм на уровне долевых ветвей до десятых миллиметра на периферии.
412ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯВизуализировать неизменные бронхиолы в плащовом слое лёгкого невозмоз даже с использованием ВРКТ. Следовательно, обнаружение просветов бронхиои всегда указывает на имеющуюся патологию воздухопроводящих путей [54].На аксиальных срезах КТ регистрируют тангенциальные сечения воздуш* ных бронхов с вертикальной ориентацией — кольца. Сечения горизонтальво ориентированных бронхов проявляются в виде равномерно суживающихся ж периферии трубок. Следз^ет признать некоторую условность в определении дила- тации бронхов с вертикальной ориентацией, поскольку возможны колебани* ширины просветов, зависящие от конституции или глубины вдоха. Для объеж- тивной оценки сравнивают ширину бронха с калибром сопровождающей лёго«1- ной артерии. Двойное превышение ширины бронха над сосудом указывает Ш1 дилатацию — так называемый симптом «перстня», где кольцом служит просвет бронха, а «камнем» — сечение артерии. Отсутствие сужения просвета бронха по направлению к периферии однозначно указывает на эктазию — так называемый «трамвайный путь». Оба симптома отражают цилиндрический тип БЭ. Следует отметить возможность ошибочной оценки ширины бронхов при БА, лечения бронходилататорами (рис. 22-1).Неравномерность просвета бронха с дивертикулоподобными выпячиваниями («чётками») характерна для варикозных БЭ, Разнокалиберные, часто сгруппи¬ рованные, тонкостенные воздушные полости по ходу магистральных бронхов характеризуют кистозные бронхоэктазы. Размеры и количество их вариабельны- Мелкокистозные бронхиолоэктазии размером 2-5 мм, локализованные в плащо¬ вом слое, типичны для терминальных стадий диффузных интерстициальных забо¬ леваний, Более крупные сгруппированные кистозные БЭ также определяют сото¬ вый тип перестройки лёгочной архитектоники. Сопутствующими проявлениями БЭ являются симптомы регионарных нарушений вентиляции и перфузии — увели-Рис. 22-1. Фрагменты КТ с различными типами БЭ; а - поперечное сечение — симптом «перстня»; б — продольное сечение — симптом «трамвайного пути»: в — постлучевые БЭ варикозного типа: г — мелкие кистозные БЭ с выраженной регионарной олигемией слева.
БРОНХОЭКТАЗЫ 413чение пневматизации свыше 850 НИ и разрежение сосудистого рисунка (мозаич¬ ный тип). На этом фоне нередко огфеделяются слабоочерченные центрилобуляр¬ ные очаги, указывающие на закупорку терминальных бронхиол [15]. Заполненные секретом (экссудатом) терминальные бронхиолы и альвеолы, в зависимости от их положения в томографическом срезе, образуют V-образные структуры, «розетки», «ветки с почками». Эти проявления свойственны инфекционному процессу (брон- хиолиту, осложняющему течение основной патологии). Наличие секрета в более крупных БЭ проявляется уровнями жидкости, слизистыми пробками, слепками («палец в перчатке»). Облитерированные локальные БЭ или ретенционные кисты, заполненные казеозным детритом или слизью, наблюдают при туберкз^лёзе, брон¬ холёгочном аспергиллёзе. Наиболее частая локализация ретенционных кист — граница плащового и ядерного слоён лёгкого, размеры округлых или ветвистых структур варьируют от 1 до 10 см.ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКАДиагностика БЭ не представляет сложностей, но иногда не удаётся разграничить воздушные кисты и кистозные БЭ. Кроме того, нередко и сочетание этих состоя¬ ний при дисплазии лёгких [6J. Заполненные БЭ (ретенционные кисты) могут ими¬ тировать опухолевую патологию: у молодых — гамартому, аденому, карциноид, у пожилых — рак лёгкого. Отложение солей кальция на стенках ретенционных кист вызывает подозрения о туберкулёме [11]. В этих случаях внутривенное введение контрастных препаратов помогает установить характер изменений по степени накопления в образовании или его отсутствии. В аваскулярных образованиях - ретенционных и паразитарных кистах, зрелых туберкулёмах, инфарктах лёгко¬ го — после введения контрастного препарата регистрируют даже незначительное снижение плотности.Ошибки в диагностике бронхо-бронхиолоэктазии могут объясняться артефак¬ тами от движения сердца, проявляющихся удвоением контуров бронхов и сосудов, что симулирует цилиндрические БЭ, Ложная бронхоэктазия может быть вызвана суммированием просветов бронхов на бифуркационных уровнях томографии [15]. Сходная с БЭ картина наблюдается при Лангерганс-клеточном гистиоцитозе, деструктивных воспалениях (туберкулёз, септико-метастатическая пневмония), некоторых псевдополостных формированиях — пневмоцистной пневмонии, брон- хиолоальвеолярном раке (рис. 22-2).Кровохарканье — частое осложнение БЭ. Связи между количеством, размерами БЭ и кровохарканьем нет, нередко одиночные, мелкие БЭ являются источником )трожающих кровотечений. В таких случаях КТ совместно с эндоскопией исполь¬ зуют для локализации источника кровотечения. На стороне поражения видны ско¬ пления крови в бронхах и субплевральные фокусы аспирационной пневмонии.Провоцирует кровохарканье персистирующая грибковая инфекция [30^ Банальная колонизация аспергилл проявляется симптомом «погремушки» — наличием клубка мицелия в полости бронхоэктаза. Воспаление не выходит за пределы стенки заселённого бронха и длительное время протекает бессимптомно (рис. 22-3). На активизацию процесса указывают утолщение стенки БЭ и появля¬ ющееся кровохарканье.Заполненные БЭ (ретенционные кисты) у больных атопической БА наводят на размышления о возможном аллергическом бронхолёгочном аспергиллёзе (АБЛА). Вследствие длительной аллергической реакции антиген-антитело на сли¬ зистой оболочке бронхов возникает гранулематозное воспаление с облитерацией просветов и последующим растяжением слизью. Типично вовлечение бронхов субсегментарного уровня (рис. 22-4).Ретенционные кисты сочетаются с нарушением вентиляции, регионарной эмфи¬ земой, БЭ. Пістологически при АБЛА определяют различные стадии хронического
414 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯРис. 22-2. Дифференциально-диагностические аспекты БЭ. Фрагменты КТ лёгких: а — ранняя стадия Лангерганс-клеточного гистиоцитоза — перибронхиолярные утолщения в плащовом слое, имитирующие бронхиолоэктаэию (стрелка); б — поздняя стадия Лангерганс-клеточного гистиоци¬ тоза — разнокалиберные, сливающиеся кисты, способные имитировать кистозные БЭ; в, г — пост- воспалительные деструктивные полости; д — пневматоцеле.Рис. 22-3. Фрагменты КТ при колонизационном аспергиллёзе бронхоэктаза — симптом «погремушки»,
•v-vБРОНХОЭКТАЗЫ 415Рис. 22-4. фрагменты КТ лёгких при аллергическом бронхолёгочном аспергиллёзе у пациента с бронхиальной астмой: а — цилиндрические БЭ (стрелка); б — крупная ретенционная киста (косая проекция),нешецифического воспаления, распространяющегося за пределы бронхов в лёгоч¬ ную паренхиму, в бронхиальном секрете находят эозинофилы и мицелий гриба. Диагностика заболевания основывается на данных лаборатории (эозинофилия, повышение уровня IgE, определении мицелия гриба в мокроте, антител к аспер- гиллам в сыворотке крови, положительные кожные тесты), симптомов (одышка, астматический компонент) и дополняется КТ-картиной [29]. Кроме тяжёлой БА, АБЛА нередко осложняет муковисцидоз.Муковисцидоз — системное заболевание экзокринной железистой ткани, сопро¬ вождающееся синуситами, полипами носовой полости, бронхоэктазами. Это наследственное заболевание передаётся по а}Т'осомно-рецессивному признаку. Генетический дефект нарушает транспорт электролетов в железистом эпителии[4]. В частности, клетки слизистой бронхов становятся непроницаемыми для ионов хлора, что увеличивает вязкость секрета и затрудняет работу мукоцили¬ арного аппарата. Присоединяющаяся инфекция разрушает структуру нижних дыхательных путей и приводит к необратимой бронхоэктазии. Муковисцидоз наблюдается исключительно в детском и молодом возрасте, характеризуется распространёнными центральными цилиндрическими бронхоэктазами и множе¬ ственными слизистыми закупорками [33]. Поражение чаще начинается с верхней доли правого лёгкого. Типичны ранние нарушения перфузии лёгочной паренхимы, утолщения стенок бронхиального дерева (рис. 22-5),Патогенетическое сходство, обусловленное нарушением очищения дыхательных путей, наблюдается при других врождённых дисфункциях мукоцилиарного аппа¬ рата, например, синдроме Картагенера. Установлено, что зеркальное положение органов «дезориентирует» работу мерцательного эпителия, приводит к стагнации, накоплению слизи и присоединению вторичной инфекции. В отличие от муко¬ висцидоза, прежде всего поражаются средняя и нижние доли. Рецидивирующие
ІіІШШШ&їШр416 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯРис. 22>5. Фрагменты КТ лёгких при муковисцидозе, Центральные БЭ с утолщёнными стенка¬ ми, просветы сегментарных бронхов сужены за счёт пристеночных наложений слизи (стрелки). Заполнение и растяжение дистальных бронхов.воспаления вызывают левосторонний среднедолевой синдром с диссеминиро¬ ванными очагами и ветвистыми структурами в нижележащих отделах лёгких, что отражает картину распространённого инфекционного бронхиолита [54]. Периоды обострения сменяются стойкими ремиссиями. БЭ развиваются поздно. Прогноз значительно благоприятнее, чем при муковисцидозе (рис. 22-6).Сходная КТ-картина — сочетание БЭ с центрилобулярными очагами, ветви¬ стыми структурами — типична для нетуберкулёзного микобактериоза лёгких. Это хроническое заболевание вызывается различными штаммами микобактерий, ноРис. 22-6. Фрагменты КТ лёгких при синдроме Картагенера: а — Situs inversus, среднедолевой лево¬ сторонний синдром; б — инфекционный бронхиолит — распространённые центрилобулярные очаги и ветвистые структуры: в — фрагмент увеличения — симптом «ветки с почками» (стрелка).
БРОНХОЭКТАЗЫ 417Рис. 22-7. фрагменты КТ лёгких при микобактериозе. Цилиндрические БЭ в средней доле, одиноч¬ ная субплевральная киста с уровнем жидкости, разнокалиберные очаговые уплотнения.чаще других М. аугит-т1гасе11и1аге. Страдают преимущественно женщины стар¬ ше 60 лет с ослабленным иммунитетом [36,38,48]. В отличие от муковисцидоза, развиваются периферические БЭ и бронхиолоэктазии, локализованные в перед¬ них сегментах средней и нижней зон. Характерны распространённые, разнока¬ либерные, чётко очерченные центрилобулярные очаги, У-образные структуры, ■«ветки с почками». Размеры элементов варьируют от 2 до 20 мм. Рентгеновскую картину дополняют субплевральные, тонкостенные полости. Визуальные и кли¬ нические проявления весьма напоминают хронический диссеминированный туберкулёз. Отличительным признаком служит преимущественное поражение передних сегментов средней и нижней зон и отсутствие динамики на протяже¬ нии длительного времени. Эти больные подвержены высокому риску заражения туберкулёзом при обследовании или лечении в противотуберкулёзных учрежде¬ ниях (рис. 22-7).Различные типы БЭ при туберкулёзе возникают как в острые, так и хрони¬ ческие стадии болезни. Интраканикулярное распространение жидкого казеоза в острую стадию приводит к заполненным бронхо-бронхиолоэктазиям, ретен- ционным кистам, способным к реактивации болезни даже спустя многие годы. Специфический эндобронхит деформирует бронхи в так называемые бронхиаль¬ ные каверны — разнокалиберные мешотчатые БЭ. Бронхообструкция, цирроз неотделимы от различных типов БЭ на поздних стадиях туберкулёза (рис. 22-8).Ателектатические БЭ могут быть обусловлены целым рядом состояний: аспира¬ цией желудочного содержимого, инородного тела, бронхолитом, доброкачествен-Рис. 22-8. Фрагменты КТ лёгких. Различные типы БЭ при туберкулёзе: а — фиброзно-кавернозный туберкулёз, БЭ после дренирования казеозного детрита из ретенционных кист (стрелка); б — последствия туберкулёзного бронхоаденита — мешотчатые БЭ, так называемые бронхиальные каверны; в — цилиндрические БЭ в фиброателектазе.
418ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯРис. 22-9. Фрагменты КТ лёгких при бронхолите язычкового броиха'. а — обструктивный пневмонит язычковых сегментов; б — состояние после извлечения бронхолита; в — редуцирующиеся цилин¬ дрические БЭ.ной опухолью, сдавлением бронха лимфатическими узлами, следствием лучевого воздействия и др. Восстановление проходимости бронха до стадии фиброателекта- за заканчивается расправлением поражённого отдела лёгкого. Даже значительное расширение бронхов, выявляемое при инфекционных заболеваниях в различных консолидациях (лобите, ателектазе, рубце), обратимо и по мере выздоровления регрессирует (рис. 22-9).Врождённые БЭ — одно из названий секвестрации лёгкого [6]. Эта аномалия развития обусловлена патологическим зачатком лёгочной ткани, локализованной внутри грудной полости или непосредственно в лёгком. Наличие серозного листка» отделяющего аномальную паренхиму, указывает на внелёгочную секвестрацию. Аберрантный артериальный сосуд, отходящий от аорты или магистральных артерий — обязательный компонент аномалии. Парамедиастинальные сегменты левого лёгкого — излюбленная локализация секвестрации. В секвестрированной ткани находят воздушные или заполненные БЭ. В отличие от истинных БЭ, в них имеются перегородки различной толщины, создающие многокамерность. Венозный отток осуществляется в систему непарной вены или непосредственно в предсердия. Для однозначного доказательства секвестрации необходима аорто¬ графия, поскольку обнаружить аберрантную артерию с помощью КТ удаётся не всегда (рис, 22-10).Гипоплазия лёгкого проявляется недоразвитием сосудистой сети, бронхиально¬ го дерева с объёмным уменьшением. БЭ могут быть обнаружены как на стороне поражения, так и в викарно увеличенном контралатеральном лёгком, где перерас¬ пределение бронхов и нарушение ламинарности воздушного потока приводят к бронхообструкции, рецидивирующим воспалениям и БЭ (рис. 22-11).Односторонняя долевая эмфизема (синдром МакЛеода) напоминает врождён¬ ную долевую гипоплазию, при этом также находят разрежение сосудистой сети.Рис. 22-10. Фрагменты КТ лёгких при внутрилёгочной секвесгтра1;ии. Случайная находка врождён¬ ных воздушных БЭ в секвестрированном фрагменте аномальной лёгочной паренхимы.
БРОНХОЭКТАЗЫ419Рмс. 22-11. Фрагменты КТ лёгких при врождённых аномалиях: а, б — аплазия лёгкого, медиасти- нальная грыжа, смещение средостения, в викарно увеличенном правом лёгком бронхоэктазы. Левое лёгкое замещено воздушными полостями; в, г — кистозная дисплазия нижних долей лёгких, множе¬ ственные разнокалиберные кисты и БЭ. Нерасправленная лёгочная ткань слева (стрелка),обеднение ветвлений бронхиального дерева. Однако в отличие от гипоплазии за счёт эмфиземы имеется объёмное увеличение пораженной доли. Причиной изменений служат детские инфекции, вызывающие локальные бронхиолиты и артерииты (рис. 22-12).Рутинное использование КТ значительно увеличило количество наблюдений односторонних вентиляционно-перфузионных нарушений у больных ХОБЛ с БЭ. В периоды обострения нарастающие одышка, кашель, кровохарканье вызывают подозрения в отношении тромбоэмболии ветвей лёгочной артерии (ТЭЛА). При этом радиоизотопные исследования (сцинтиграфии, ПЭТ) отражают различную степень нарушения перфузии в лёгких, увеличивая ложноположительную диа¬ гностику ТЭЛА. КТ более объективна в диагностике подобных состояний, выяв¬ лении скрытых БЭ и установлении причины кровохарканья у больных с ХОБЛ (рис. 22-13).Ию. 22-12. Фрагменты КТ лёгких при синдроме МакЛеода. Долевая эмфизема с увеличением объ¬ ёма нижней доли правого лёгкого, выраженной олигемией и разнокалиберными кистозными БЭ.
420ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯРис. 22-13. Фрагменты КТ лёгких при ХОБЛ. Мозаичная перфузия правого лёгкого с разрежением сосудистого рисунка, мелкими ретенционными кистами, БЭ (стрелки). Ошибочное предположение ТЭЛА.Тракционные БЭ чаще развиваются на фоне хронических диффузных забо* леваниях лёгких, реже возникают в рубцах вследствие перенесенных острых инфекционных воспалений. Дислокация, сближение мелких бронхов вследствие интерстициального склероза с относительно небольшой степенью дилатации характеризуют тракционные БЭ [18]. Варикозные или цилиндрические БЭ в при¬ корневых зонах встречаются при саркоидозе, туберкулёзе. На периферии мелкие тракционные бронхо- и бронхиолоэктазии характерны для идиопатического фиброза лёгких (рис. 22-14).Вне зависимости от этиологии и патогенеза, клинические и рентгенологические проявления БЭ стереотипны и не вызывают серьёзных диагностических затруд¬ нений. Первоочередная задача — определение распространённости БЭ в лёгких. Ограниченное (локальное) поражение — повод для обсуждения целесообразности радикального хирургического лечения (рис. 22-15).Рис. 22-14. Фрагменты КТ лёгких при тракционных БЭ у больного с десквамативной интерстици¬ альной пневмонией (стрелка).Рис. 22*15. Фрагменты КТ лёгких при поствоспалительных локальных БЭ 10-го сегмента правого лёгкого у пациента с эпизодическим кровохарканьем: а, б — фокус поствоспалительного фиброза с БЭ, парасептальной эмфиземой; в — реформированное изображение в боковой проекции.
БРОНХОЭКТАЗЫ421Рис. 22-16. Фрагменты КТ лёгких при кистозных БЭ в верхней доле правого лёгкого с её объём¬ ным уменьшением, олигемией. На «толстых» срезах визуализируются устья бронхов в продольной и аксиальной проекциях.Наилучшие результаты КТ-диагностики БЭ могут быть получены при соче- танин стандартной и высокоразрешающей методик. Каждая из них вносит дополнительную информацию, в частности, абсолютная визуализация лёгоч¬ ной паренхимы достигается только при стандартной спиральной КТ. Нередко длинные цилиндрические БЭ могут быть визуализированы на всем протяжении только на томографических срезах толщиной до 1 см. Кроме того, суммацион- ный эффект таких срезов позволяет находить устья кистозных БЭ, необходимые для дифференциации с истинными кистами лёгких (рис. 22-16). На КТВР могут быть упущены уровни жидкости Б БЭ, так как интервал между срезами чаще всего 10 мм. С другой стороны, тонкосрезная КТ резко увеличивает качество и количество изображений мелких деталей бронхо-бронхиолоэктазии, уточняет распространённость, находит сопутствующий бронхиолит, интерстициальный склероз. Появление мультиспиральной КТ объединяет возможности обеих мето¬ дик в одном исследовании.Определение этиологических признаков БЭ нечасто, но чрезвычайно важно в установлении природы патологии и адекватной терапии у данного больного (situs inversus при синдроме Картагенера, центральные, цилиндрические, частично заполненные секретом БЭ в верхней доле справа у юных больных муковисцидо- зом, ретенционные кисты у больных АБЛА и др.).Для осложнений бронхоэктатической болезни весьма характерны симптомы заполнения экссудатом дистальных бронхов и бронхиол, указывающие на распро¬ странение воспаления. При обострении заболеваний лёгких с БЭ прослеживается чёткая корреляция между клинической и КТ-картиной. Появление в бронхоэкта¬ зах уровней жидкости, перибронхиальных утолщений и инфильтрации свидетель¬ ствует о рецидиве воспаления (рис. 22-17).КТ также имеет значение для диагностики риносинуситов как возможной при¬ чины кистозного фиброза, дефицита иммуноглобулинов, цилиарной недостаточ¬ ности.В связи с высокой диагностической способностью КТ бронхография утрачивает свою роль в определении наличия бронхоэктазий. Однако её можно применять в дифференциальной диагностике кистозных БЭ и воздушных кист лёгких, при пла¬ нировании оперативного лечения для определения распространённости процесса и решения вопроса об объёме операции (рис. 22-18).При БЭ значимую роль в оценке активности процесса, диагностике изменений в бронхах, санации бронхиального дерева играет бронхоскопия. С ее помощью уста¬ навливают ограниченный или диффузный характер бронхита, интенсивность вос¬ паления слизистой оболочки, количество и характер секрета в бронхах, состояние
422 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯРис. 22-17. Фрагменты КТ лёгких при обострении бронхоэктатической болезни. Уровни жидкости в кистозных бронхоэктазах обоих лёгких, перибронхиальное воспаление,Рис. 22-18. Бронхограммы при БЭ: а — лёгкого: б — нижней доли и язычковых сегментов; в — ниж¬ ней доли; г — нижнего язычкового бронха.
БРОНХОЭКТАЗЫ 423их дренажной функции, развитие в бронхиальном дереве полипов, грануляций, гнойных пробок, выход из заполненных гноем бронхов пузырьков воздуха (при¬ знак Суля), сужение устьев сегментарных или субсегментарных бронхов отёчной слизистой оболочкой (обычно при обострении процесса) или, наоборот, зияющие расширенные бронхи (в фазе ремиссии).При принятии решения о лечебной тактике важна оценка гемодинамики и функции дыхания. В целях оценки гемодинамики целесообразно применение эхокардиографии (центральная, лёгочная гемодинамика), сканирование лёгких (лёгочная микроциркуляция), ангиопульмонография. Сосудистые нарушения в лёгких более распространены, чем зона поражения бронхов, но это пока не может служить основанием для расширения объёма операции.Функциональные исследования лёгких включают оценку ФВД, кислотно- щелочного равновесия, сатурации, бронходилатационную реактивность, диффу¬ зионную способность.Для решения вопроса о факторах риска, обусловливающих возникновение или прогрессирование БЭ, применяют ряд специальных исследований [40].Для скрининга и диагностики муковисцидоза используют определение хло¬ рида потовой жидкости, генотипирование и наличие назальных проявлений. Установлению возможного риска бронхоэктазий способствует определение уровня а^-антитрипсина, фенотипирование, оценка уровня IgG, IgA, IgE (возможность бронхолёгочного аспергиллёза), IgM (возможность хронической инфекции). Выявлению первичной цилиарной цискинезии способствует биопсия назального цилиарного эпителия.ЛечениеОсновными факторами, влияющими на выбор лечения, являются распростра¬ нённость процесса, его активность, осложнения.ЦЕЛИ ЛЕЧЕНИЯСохраняют свою актуальность методы лечения — консервативный и хирурги¬ ческий. Попытки придания одному из них главенствующий характер не оправда¬ лись. Каждый из них преследует определённые цели на отдельных этапах развития болезни. Консервативное лечение может проводиться с самостоятельной задачей клинического выздоровления и стабилизации процесса, обеспечения качества жизни, профилактики обострения процесса, его прогрессирования. С другой стороны, консервативное лечение можно рассматривать в качестве предопераци¬ онной подготовки, послеоперационной реабилитации и профилактики прогресси¬ рования болезни, её рецидива. Консервативное лечение предусматривает гигиену дыхательных путей, санацию бронхиального дерева, антимикробную терапию, вакцинацию, специфическое лечение при отдельных причинах развития болезни, снижение гипоксии и др.НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕГигиена дыхательных путей включает методы мобилизации мокроты, технику обеспечения трахеобронхиального клиренса, противовоспалительное лечение, антиаспирационные меры. Необходимо осуществить санацию полости рта, глот¬ ки, придаточных пазух носа, трахеобронхиального дерева. Среди этих мето¬ дов наиболее распространены постуральный дренаж и грудная физиотерапия. Постуральный дренаж осуществляется приданием положения тела вниз головой (положение тренд ел енбурга) или горизонтально. Мобилизация мокроты в этих положениях может быть улучшена похлопыванием или вибрационным массажем. Применяются различные приспособления для передачи вибрации в дыхательные пути, в том числе пневматически накачиваемый жилет [39].
424 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ. > МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕсоМобилизацию мокроты можно улучшить путём усиления частоты цилиарных движений, уменьшением бронхоспазма ингаляциями адреномиметиков и/или антихолинергических бронходилататоров [55]. Ингаляция разжижающих вяз¬ кие секреты растворов с помощью небулайзеров также способствует отделению мокроты.Противовоспалительное лечение призвано уменьшить продукцию воспалитель¬ ного секрета. С этой целью применялись ГКС [46], в том числе ингаляционным методом [42], макролиды (азитромицин) [51], нестероидная противовоспалитель¬ ная терапия.Важное значение имеет снижение риска аспирации в дыхательные пути. Необходимы меры по улучшению глотания, снижению гастроэзофагеального реф- люкса, желудочной кислотности.В фазе обострения болезни применяют антибактериальные средства, комплекс¬ ную санацию бронхиального дерева, противовоспалительные препараты, дезин¬ токсикацию, иммунокоррегирующую, антигипоксическую терапию.Ряд авторов для санации бронхиального дерева применяют введение через назотрахеальный катетер в трахеобронхиальное дерево тёплого раствора антисеп¬ тиков, санационные фибробронхоскопии (от 1 раза в сут до 1 раза в нед), транс¬ торакальное эндобронхиальное дренирование бронхов [10].Авторы широко применяют курсовую методику санационной фибробронхоско¬ пии под местной анестезией. Она включает обезболивание дыхательных п)?тей, аспирацию содержимого бронхов, посегментарную санацию с инстилляцией анти¬ септиков.При выраженной обструкции бронхов густой и вязкой мокротой на уровне субсегментов и дистальнее проводится проточная санация через катетер, напо¬ минающая лечебный, бронхиальный лаваж. Катетер при санации постепенно продвигают в дистальном направлении субсегментарного бронха до упора и воз¬ вращают назад к его устью. При проточной санации отмывают сгустки — пробки мокроты. Просвет между инструментальным каналом фибробронхоскопов и катетером позволяет проводить постоянную аспирацию промывных вод бронхов. Качественная санация бронхиального дерева под местной анестезией выполняется введением от 100 до 1500 мл жидкости в бронхи. Любую санационную бронхо¬ скопию завершают тщательной аспирацией промывных вод из просвета бронхов, включая субсегменты. Перед удалением фибробронхоскопа в просвет бронхов вводят антибактериальные препараты в соответствии с чувствительностью микро¬ флоры.Показанием к применению эндобронхиальной лазеротерапии служило наличие в слизистой оболочке диффузной гиперемий ЇІ-ПЇ степени. Для проведения эндо¬ бронхиальной лазеротерапии использовался гелий-неоновый лазер.Продолжаются попытки применения в целях профилактики обострения про¬ цесса вакцинации против Streptococcus pneumoniae, гриппа.При генетических дефектах а,-антитрипсина целесообразна заместительная терапия. Длительная оксигенотерапия способствует снижению риска развития лёгочной гипертензии.ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕПоказания к хирургическому лечению:• лёгочные кровотечения;• пневмоторакс, не купируемый дренированием;• частые обострения процесса, не поддающиеся консервативному лечению;• невозможность достигнуть стойкой ремиссии в течение 2-3 лет;• цирроз зоны лёгкого с гнойным процессом в резко расширенных бронхах.
БРОНХОЭКТАЗЫ 425Условия проведения операций:• купирование процесса в зоне предполагаемого пересечения бронхов;• бронхоскопия с обтурацией регионарного бронха при значительном гнойном ^ отделяемом;• бронхоскопия в конце операции;• ограниченные зоны лёгкого с бронхоэктазиями;• максимальное удаление сегментов лёгкого с БЭ и сохранение интактной лёгочной ткани.Противопоказания к хирургическому лечению:• двусторонний распространённый процесс;• тяжёлые сопутствующие заболевания и синдромы;• лёгочное сердце.Объём хирургического вмешательства обусловлен распространённостью про¬ цесса. Резко превалирует удаление доли лёгкого (86,7%). У 9,5% больных выпол¬ нялась пневмонэктомия, у 3,8% — сегментэктомия.Осложнения при хирургическом лечении отмечены у 11,2% больных, в том числе недостаточность культи бронхов — у 5,8%, эмпиема плевры — у 1,7%, нагноение шва и внутриплевральное раннее послеоперационное кровотечение — по 1,2%, ограниченный свернувшийся гемоторакс — у 0,8%, ТЭЛА с летальным исходом — у 0,4%.Непосредственные исходы лечения бронхоэктатической болезни свидетель¬ ствуют о высокой эффективности хирургического лечения. Из 241, перенёсших операции, выздоровели 99,6%, умер 1 больной (0,4%). Из 562 леченых консер¬ вативными и хирургическими методами больных бронхоэктатической болезнью выздоровление достигнуто у 42,7%, улучшение — у 56,9%, летальный исход — у 0,2%,СПИСОК ЛИТЕРАТУРЫ^
Глава 23 Поражения трахеиСпектр патологам трахеи широко варьирует: от врождённых ано¬ малий, порой несовместимых с жизнью новорождённого, до протя¬ жённых поражений опухолевого и неопухолевого генеза.Занимая промежуточное положение между гортанью и лёгкими с бронхами, трахея связана с ними не только анатомически, но и функционально. Часто трахеальная патология предопределяет воз¬ никновение и течение лёгочных заболеваний. С другой стороны, поражение лёгочной паренхимы, особенно хронического течения, может приводить к поражению трахеи не только функционального, но и органического характера.Классификация трахеальной патологии (по М.И. Перельману, 1972)1. Пороки развития трахеи: агенезия, остеохондропатия, атре- зия, врождённый стеноз (первичный или вторичный), трахеаль¬ ный бронх и дивертикул трахеи, а также врождённые трахеальные свищи.2. Воспалительные заболевания трахеи: неспецифические и специфические.3. Травмы трахеи: закрытые и открытые.4. Опухоли: первичные и вторичные (прорастание из опухолей соседних органов, метастатические поражения).5. Стенозы трахеи: первичные, вторичные (компрессионные) и экспираторный стеноз.6. Трахеопищеводные свищи.ПОРОКИ РАЗВИТИЯ ТРАХЕИАгенезия — редкое тяжёлое врождённое заболевание, несовме¬ стимое с жизнью ребёнка.Остеохондропатия — по всей вероятности, не столь редкое забо¬ левание, как считается в настоящее время. Диагноз устанавливают лишь в тяжёлых случаях, когда возникает нарушение дыхания. Изменение трахеальной стенки по типу остеохондропатии может диагностироваться лишь при аутопсии как случайная находка.Атрезия трахеи — тяжёлая врождённая патология, связанная с отсутствием трахеи, наличием единого бронха для обоих лёгких и соустья между пищеводом и этим бронхом. Первые вдохи ново-
ПОРАЖЕНИЯ ТРАХЕИ 427рождённый делает через пищевод с прохождением воздуха через пищеводно¬ бронхиальную фистулу. Если своевременно поставлен диагаоз и новорождённый интубирован через пищевод для ИВЛ, возможно хирургическое лечение. Однако в литературе случаи подобных операций носят казуистический характер и сопрово¬ ждаются большой летальностью [10].Врождённый стеноз — первичный или вторичный (сдавление трахеи извне аномальными крупными сосудами, щитовидными или вилочковой железами, кистой шеи и др.). Первичный врождённый стеноз представляет собой порок раз¬ вития хрящей трахеальной стенки, которые приобретают форму кольца с отсут¬ ствием перепончатой части. Подобные стенозы по протяжённости подразделяют на ограниченные, воронкообразные и распространённые. Дифференциальный диагноз приходится проводить между острым отёком гортани у новорождённых, инородными телами дыхательного пути или сдавлением его извне, а также редкой хондропатологией гортани. Основным методом диагностики остаётся фибротра- хеоскопия. В настоящее время даже при распространённых врождённых стенозах своевременное оперативное лечение со сложной реконструкцией дыхательного пути позволяет добиться излечения новорождённого.Трахеальный бронх у человека считается аномалией, хотя часто его наличие не имеет каких-либо последствий и не требует лечения. Он встречается у 0,2-0,8% больных, оперированных на лёгких, перенёсших эндоскопическое или рентгенов¬ ское исследование дыхательной системы [4]. Оперативное лечение показано при появлении гнойно-воспалительных осложнений как со стороны самого бронха, так и в соответствующем отделе лёгкого. Если бронх заканчивается слепо, следует говорить о врождённом дивертикуле трахеи. Показаниями к операциям при нём являются инфицирование дивертикула, раздувание его воздухом со сдавлением трахеи, крупных сосудов или лёгкого.Врождённые трахеальные свищи — это один из вариантов так называемых жаберных свищей шеи. Они образуются в результате неполного закрьггия жаберных карманов и бороздок при внутриутробном развитии. Свищи могут быть полными (сообщение между кожей и трахеей) и неполными. Неполные встречаются в 2 вариантах: наружные, когда есть сообщение только с кожными покровами, и внутренние — сообщение только с просветом трахеи, а другим концом они слепо заканчиваются в мягких тканях шеи. Осмотр кожи шеи с последующей фистулографией, а также трахеоскопия позволяют правильно установить диагноз. Операция заключается в полном иссечении свища и пока¬ зана при полных и неполных наружных свищах. Иссечение неполного внутрен¬ него свища может быть решено только при появлении гнойно-воспалительных осложнений.Воспалительные заболевания трахеиВоспалительные заболевания трахеи бывают неспецифического и специфи¬ ческого характера. В большинстве случаев диагностика и лечение пациентов с воспалительными процессами в трахее является уделом фтизиатров, терапевтов и пульмонологов.Хирургическое лечение неспецифических трахеитов требуется только при появлении серьёзных осложнений в виде стенотического процесса в дыхательном пути, формирования абсцесса в стенке трахеи. Особую группу составляют пациен¬ ты с трахеомегалией часто в сочетании с бронхомегалией. Трахеобронхомегалия, с одной стороны, может поддерживать хронический воспалительный процесс в системе дыхания, вплоть до возникновения бронхоэктазов, а с другой — хрониче¬ ский бронхит с выраженным кашлевым компонентом вызывает прогрессирование патологического расширения. Хирургическое лечение трахеомегалии и трахео-
428ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯбронхомегалии в настоящее время не разработано, и пациентам проводится толь¬ ко симптоматическое лечение.Специфические воспалительные процессы в стенке трахеи могут иметь различ¬ ный патогенез. Грибковое поражение трахеи, например, актиномикоз, встречает¬ ся исключительно редко и часто связано с иммунодефицитными состояниями. Учитывая рост патологии, связанной с нарушением иммунитета, в дальнейшем возможен рост числа грибковых поражений. С появлением противодифтерий¬ ной сыворотки и профилактических прививок дифтерийное поражение трахеи наблюдается крайне редко. Рост в последние годы заболеваемости туберкулёзом меняет современную ситуацию со специфическим туберкулёзным повреждением трахеи.Другим специфическим воспалительным процессом в трахее служит склерома. Это хроническое гранулематозное воспаление слизистой оболочки трахеи. Часто диагностика вызывает трудности. Верификация возможна лишь в фазе острого вос¬ паления, когда есть возможность определить гранулёмы. При склеротической фазе рубцовая ткань не имеет своих специфических проявлений. Вспомогательными методами могут быть специфические серологические реакции. Патогенетической терапии склеромы нет. Хирургическому лечению подлежат пациенты, у которых развивается стенотический процесс дыхательного пути.ТравмыЭтиология травм трахеи различна (табл. 23-1), они относятся к тяжёлым повреждениям и часто сопряжены с угрозой для жизни пациента. Частота повреж¬ дений трахеи в последние годы возрастает. Это связано с ростом общего трав¬ матизма, увеличением случаев дорожного травматизма, широким внедрением в клиническую практику ИВЛ, когда выполняется интубация трахеи. При оказании неотложной помощи приходится решать следующие задачи: восстановление про¬ ходимости дыхательного пути, соответствующее дренирование при «газовом» синдроме, окончательная реконструкция трахеи.Таблица 23-1, Классификация травм трахеиВид травмыХарактерисл1ка«Воздушный зоб» — грыжеподобное выпячи¬ ваниеМузыканты-трубачи, глашатаи минаретов и т.п.Частичные и полные разрывы.Шейный и грудной отдел.Продольный, поперечный и косой разрывы“Открытая травмаСопровождается повреждением соседних органов и струк-Т^'РЗакрытая травмаПри тупой травме груди.Ятрогенные повреадения.При рвоте, кашле, физическом перенапряженииСреди различных повреждений трахеи её трансмуральные разрывы наиболее опасны. Чаще они происходят в результате тупой и открытой травмы шеи или груди, сочетаются с повреждением соседних органов и структур. Кроме этого, могут иметь место различные повреждения трахеи, связанные с теми или иными медицинскими манипуляциями. Изолированное ятрогенное повреждение трахеи возможно при интубации одно- или двупросветной трубками, длительной ИВЛ с баротравмой, трахеостомии с повреждением задней стенки, эндотрахеальной лазерной фотокоагуляции новообразований или стриктур, при медиастиноскопии.
ПОРАЖЕНИЯ ТРАХЕИ 429стернотомии, эзофагэктомии и тиреоидэктомии. Эндотрахеальная интубация для поддержания газообмена во время хирургических вмешательств и при длительной дыхательной реанимации вошла в повседневную практику, а количество данных манипуляций исчисляется многими тысячами. В этой связи не следует ожидать уменьшения числа трахеальных повреждений. Благоприятный исход во многом определяется характером оказанной первой медицинской помощи. На практике она часто оказывается тактически и технически неправильной. Наиболее опасные ситуации возникают у экстубированных больных, когда достаточно быстро нарас¬ тают пневмоторакс, пневмомедиастинум и гипоксия, а попытки вспомогательной масочной вентиляции лишь усугубляют ситуацию. Экстренная повторная инту¬ бация трахеи вслепую часто вызывает технические трудности, может увеличеть размеры дефекта, усугубить гипоксию при выходе конца трубки через разрыв в паратрахеальное пространство или плевральную полость.Нельзя считать адекватной помощью выполнение трахеостомии при разрыве дыхательного пути. Эта манипуляция усугубляет травму, выполняется в неблаго¬ приятных условиях, может приводить к асфиксии и к осложнениям в отдалённом периоде в виде рубцового стеноза. К трахеостомии в этих ситуациях следует отно¬ ситься как к вынужденной операции, когда нет технических возможностей для адекватной интубации трахеи, а промедление крайне рискованно для пациента. В настоящее время нет общепризнанной тактики лечения изолированных разры¬ вов трахеи. Одни авторы указывают на необходимость срочной операции [11,14, 18, 19, 21], другие [9, 15, 17] — на благоприятный исход после консервативного лечения без каких-либо отдалённых осложнений. К активной хирургической тактике при изолированных постинтубационных разрывах трахеи отношение довольно сдержанное. Правильно выполненная интубация трахеи с изоляцией места разрьша от паратрахеального пространства, адекватное дренирование соот- ветств)гющей плевральной полости, антибактериальная и противовоспалительная терапия, нормализация кислотно-щелочного равновесия позволяют успешно справиться с этим тяжёлым осложнением без большой хирургической операции. Определять тактику лечения должен специалист, владеющий хирургическим и консервативным лечением.Опухоли трахеиВопросам хирургического или комбинированного лечения опухолевых забо¬ леваний трахеи в последние годы было посвящено много научных исследований, и сегодня достаточно хорошо разработаны диагностика и хирургическое лечение данной патологии. Тактика и объём оказания помощи во многом определяются морфологическим строением опухоли и степенью нарушения дыхания. Опухоли трахеи подразделяют на первичные, когда процесс изначально локализуется в стенке дыхательного пути, и вторичные, когда опухоль прорастает из соседних органов или имеет метастатический характер. Из доброкачественных опухолей наиболее часго встречаются папилломы, реже бывают аденомы, фибромы и гемантиомы. Первичные злокачественные опухоли составляют 0,1-0,2% всех злокачественных новообразований [4]. Большинство злокачественных новооб¬ разований чаще имеют структуру аденоидно-кистозного и эпидермоидного рака. Значительно реже отмечаются карциноиды, саркомы. Кроме истинных опухолей трахеи целесообразно вьщелять псевдоопухоли: интратрахеальный зоб и амило¬ идные новообразования.Наиболее часто первым проявлением заболевания служит кашель, который может меняться при изменении положения тела и пальпации трахеи. Появление кровохарканья, как и при опухолях лёгких, является показанием к эндоскопи¬ ческому обследованию. Затруднение дыхания при опухолях не может считаться ранним симптомом. Только сужение дыхательного пути на Уг~Уз диаметра
430 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯПриводит к нарушению вентиляции. Опухоли трахеи развиваются достаточно медленно, и пациентов могут длительное время лечить по поводу различных обструктивных заболеваний лёгких, например, БА. Болевой синдром, как и общие симптомы, при опухолях трахеи нехарактерен. Основным методом диагностики следует считать фибробронхоскопию, которая позволяет не только осмотреть слизистую оболочку трахеобронхиального дерева, но и выполнить биопсию опу¬ холи, а при угрозе асфиксии произвести реканализацию просвета дыхательного пути. Из рентгенологических методов исследования наиболее информативным является КТ.Основным методом лечения остаётся хирургический, и операцией выбора следует считать циркулярную резекцию поражённого отдела с последующим анастомозом. Несмотря на то что первичные опухоли трахеи, в отличие от рака лёгкого, реже метастазируют в лимфатические узлы средостения, целесообразна комбинированная терапия с применением лучевых методов. Кроме этого, облу¬ чение может иметь хороший эффект при гемангиомах, лимфопролиферативных заболеваниях трахеи. Прогноз в большей степени зависит от распространённо¬ сти процесса и от возможности радикального удаления поражённого сегмента. По данным РНЦХ РАМН, после хирургического и комбинированного лечения злокачественных опухолей трахеи 5 лет и более суммарно живут около 40% больных. Из оперированных и выписанных больных с аденоид но-кистозным раком трахеи 5 лет жили 65%, 10 лет — 56%. При плоскоклеточном раке резуль¬ таты хуже: 5 и 10 лет жили 13% оперированных больных. В случаях карциноида трахеи 5 и 10 лет жили 75%. Результаты после циркулярной резекции оказались значительно лучше, чем после более экономных операций.Стенозы трахеиСтенозы трахеи неопухолевого генеза целесообразно разделить на первичные и вторичные. К первичным относят поражения, когда патологический процесс локализуется непосредственно в стенке дыхательного пути, а к вторичным — когда просвет его сдавлен извне. Сдавление трахеи может быть обусловлено пороками развития или возникновением различных патологических процессов в прилежа¬ щих к ней органах или тканях. Из пороков развития наиболее часто встречаются аномалии аорты и её ветвей, лёгочной артерии, врождённые кисты и опухоли. Среди пороков развития сосудов, приводящих к сдавлению дыхательного пути с нарушением вентиляции, наиболее значимый ~ двойная дуга аорты (рис. 23-1). Возможны и другие варианты: сдавление трахеи аномально расположенными вет¬ вями дуги аорты, лёгочной артерией.Чаще, чем при сосудистой патологии, дыхательные пути сдавливаются зобом, в том числе в его грудной части; значительно реже — абсцессами и увеличенными лимфатическими узлами туберкулёзной или неспецифической воспалительной природы, опухолями и кистами и др. Рентгенография и КТ являются стандартны¬ ми методами диагностики данной патологии. Хирургический метод в большинстве случаев остаётся основным, и он достаточно эффективен.Особую группу стенозов трахеи составляют пациенты с так называемым экс¬ пираторным стенозом, В основе патогенеза этого заболевания лежит патологи¬ ческая подвижность перепончатой части трахеи, которая в момент дыхательных движений может достигать вентральной стенки и препятствовать прохождению воздуха. Мокрота отделяется с трудом, что в свою очередь усугубляет нарушение трахеобронхиальной проходимости. Приступы кашля нарушают вентиляцию лёгких вплоть до её серьёзных нарушений, включая обморок. Облегчение может приносить горизонтальное положение тела, физическое напряжение, например, поднятие тяжестей и т.п.
ПОРАЖЕНИЯ ТРАХЕИ431Рис. 23-1. Схема врождённых сосудистых ано¬ малий, приводящих к компрессионному стенозу (по М.И. Перельману, 1972): а — двойная дуга аорты; б — аномалии ветвей дуги аорты; в — сдавление трахеи лёгочной артерией: 1 — пищевод; 2 — левая лёгочная артерия; 3 - трахея; 4 — правая лёгочная артерия.Хирургическое лечение показано при выраженных нарушениях дыхания. В других случаях хороший эффект имеет медикаментозная терапия, направленная на купирование воспалительного процесса в лёгких. Используемые ранее откры¬ тые операции по наружному укреплению перепончатой части трахеи с помощью различных материалов, в том числе хрящами, сосудистыми протезами, в настоя¬ щее время практически не производятся. Метод выбора — эндоскопическое укре¬ пление дорсальной стенки трахеи, основной целью которого является создание рубцового каркаса в паратрахеальном пространстве, препятствующего движению перепончатой стенки. Для этого через бронхоскоп в ретротрахеальную клетчатку инъецируют склерозирующий раствор.РУБЦОВЫЙ СТЕНОЗ ТРАХЕИСтатистика свидетельствует об отсутствии в нашей стране тенденции к сниже¬ нию частоты возникновения рубцовых стенозов трахеи. На современном этапе в подавляющем большинстве случаев рубцовые стенозы имеют ятрогенную причину я связаны с широким внедрением в реаниматологическую практику при лечении острой дыхательной недостаточности длительной ИВЛ и трахеостомии [2, 8].Жалобы пациента на затруднённое дыхание в сочетании с указанием на имевшую место травму шеи или проведение в прошлом ИВЛ, трахеостомии всегда должны вастораживать на возможность рубцовой окклюзии дыхательных путей. Сроки клинических проявлений стеноза трахеи варьируют от нескольких дней до многих месяцев [3. 4], Основным методом диагностики продолжает оставаться эндоско¬ пический, который позволяет не только уточнить степень, локализацию, характер
432ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯЖстеноза, выраженность воспалительного процесса со стороны слизистой, но ■ предпринять экстренное расширение просвета трахеи при угрозе асфиксии. Успех лечения больных с рубцовыми сужениями трахеи во многом зависит от правшиг ной тактики на различных этапах оказания медицинской помощи. Диагноз стенов в фазе грануляционного сужения позволяет вовремя предпринять консервативное, эндоскопическое лечение и тем самым добиться выздоровления части пациент без открытых оперативных вмешательств и в более короткие сроки. При остро* дыхательной недостаточности, критическом сужении показано экстренное эндо> скопическое одномоментное расширение просвета трахеи. Выполнение трахеосто¬ мии увеличивает трахеальное повреждение и делает окончательное хирургическое излечение затруднительным. В настоящее время при рубцовых стенозах трахея возможны различные виды лечения. К ним относятся эндоскопическая дилатация, лазерная реканализация просвета, использование эндотрахеальных стентов, этап¬ ные реконструктивно-пластические операции, циркулярные резекции суженного отдела с анастомозом, трансплантация трахеи.С 1963 по 2006 года в Российском научном центре хирургии РАМН находи¬ лись на лечении 553 больных с рубцовыми стенозами трахеи в возрасте от 9 до 77 лет. Этиология рубцовых стенозов у этих больных представлена в табл. 23-2> Показания к хирургическому лечению рубцовых стенозов трахеи установлены у 448 больных (81,0%). У остальных 105 пациентов (19,0%) использовали эндоско¬ пические методы расширения и поддержания просвета трахеи. Всего выполнено 1184 оперативных вмешательства.Таблица 23-2. Этиология рубцовых стенозов трахеиЭтиология СТЄН038Число больных%Посттрахеостомический34562,4Постинтубационный15528,0Посттравматический295,3Идиопатический244,3Из клиники выписан 531 пациент, умерли 22. Общая госпт’альная летальность составила 4,0%. Неблагоприятное послеоперационное течение и осложнения во время операций отмечены после 143 из 1184 вмешательств (12,1%). Наиболее часто это было в группе больных, оперированных в годы становления трахеаль¬ ной хирургии (1963-1980). В дальнейшем летальность и частоту послеопераци¬ онных осложнений удалось снизить соответственно с 21,9 и 41,4 до 0,4 и 8,2% в 1991-2006 годах.ОПЕРАЦИИ НА ТРАХЕЕБлагодаря развитию хирургии, анестезиологии, появлению новых техниче¬ ских возможностей, прежде всего эндоскопических, операции на трахее стали достаточно безопасными. В хирургии трахеи, как ни в каком другом разделе хирургической специальности, проведение наркоза тесно связано с обеспечением безопасного дыхания, газообмена. Сбалансированная анестезия, чередование во время операций различных вариантов ИВЛ в зависимости от требований безо¬ пасности пациента и комфортных условий в зоне операции для оперирующего хирурга позволяют выполнять резекции дыхательного пути с хорошим исходом. Анестезиологическое обеспечение операции в каждом конкретном случае реша¬ ется анестезиологом совместно с хирургом и эндоскопистом (рис. 23см, цвет¬ ную вклейку).
ПОРАЖЕНИЯ ТРАХЕИ433•ороны слизистой, но и ! угрозе асфиксии. Успех гом зависит от правиль- юмощи. Диагноз стеноза хринять консервативное, «ления части пациентов ггкие сроки. При острой казано экстренное эндо- . Выполнение трахеосто- 1ательное хирургическое бцовых стенозах трахеи эскопическая дилатация, 1хеальных стентов, этап- ше резекции суженногомрургии РАМН находи- рахеи в возрасте от 9 до »едставлена в табл. 23-2. )в трахеи установлены у () использовали эндоско- грахеи. Всего выполненобольных%34562,415526,0295,3244,3оспитальная летальность ечение и осложнения во іьств (12,1%). Наиболее ы становления трахеаль- и частоту послеопераци- Э и 41,4 до 0,4 и 8,2% ввлению новых техниче- 1ерации на трахее стали в каком другом разделе о связано с обеспечением яестезия, чередование во сги от требований безо- ации для оперирующего 1ути с хорошим исходом, сонкретном случае реша- [том (рис. 23-2, см. цвет-Резекция трахеиРезекцию трахеи производят в 2 вариантах (окончатая и циркулярная). Основными показаниями к окончатой резекции трахеи являются ограниченные доброкачественные поражения трахеальной стенки. При этом оптимальным представляется выполнение первичного трахеального шва. В редких случаях может возникать потребность устранения обширных окончатых дефектов трахеи. Попытки применения синтетических материалов для этих целей успеха не имели и сегодня не могут быть рекомендованы в клинической практике. Перспективным представляется замещение обширных дефектов дыхательного пути сложными реваскуляризированными микрохирургическими комплексами аутотканей. Они устойчивы к инфекции, отвечают всем необходимым требованиям.Циркулярная резекция трахеи с анастомозом является операцией выбора при злокачественных опухолевых поражениях, а также у значительной части паци¬ ентов с рубцовыми стенозами [4, 5, 7, 12,13]. Показания к ней и хирургическая техника в настоящее время хорошо разработаны и прочно вошли в арсенал торакальной хирургии. В основном это относится к ограниченным поражениям дыхательного пути. Трудной и до конца нерешённой проблемой является лечение протяжённых и мультифокальных стенозов дыхательного пути, когда в процесс вовлекаются разные отделы трахеи и гортань.Кроме стандартной циркулярной резекции трахеи с анастомозом, были пред¬ ложены и иногда используются в клинической практике достаточно сложные реконструктивные вмешательства на трахее и главных бронхах. Все эти операции высокотехнологичны и требуют серьёзного материального обеспечения, подго¬ товки и слаженной работы всей хирургической бригады, наличия высококвалифи¬ цированной трахеобронхоскопической службы.Это в полной мере относится к стенозам трахеогортанной локализации [11, 12]. Подобные резекции из-за высокого риска несостоятельности швов ана¬ стомоза и последующего рестеноза в нашей стране выполняются относительно редко. Кроме того, имеется повышенная опасность повреждения возвратных гортанных нервов и развития паралича гортани. Послеоперационный период после подобных операций имеет свои особенности, обусловленные дыхатель¬ ными расстройствами вследствие подскладочного отёка. В настоящее время нет единого мнения об этом виде резекции: одни хирурги широко применяют её, а другие отказываются [6].Этапные реконструктивно-пластические операцииПринцип этапных реконструктивно-пластических операций (ЭРПО) основан на постепенном формировании стойкого просвета дыхательных путей на различных стентах-протекторах. ЭРПО показаны при наличии противопоказаний к ради¬ кальной операции — циркулярной резекции суженного отдела дыхательного пути с анастомозом. По существу ЭРПО являются паллиативным вмешательством, так как сохраняется поражённая стенка трахеи и из неё формируется новый просвет дыхательный путей, достаточный для свободного дыхания. В этой связи данный вариант хирургического лечения невозможен при злокачественных опухолевых поражениях (рис. 23-3, см. цветную вклейку).Эндоскопические методы леченияСовременное развитие трахеальной хирургии невозможно без квалифициро¬ ванной эндоскопической трахеобронхологической службы. Все больные с пато¬ логией трахеи на различных этапах диагностики и лечения получают эндоско¬ пическую помощь. Широкое распространение эндоскопия получила в последние 3 десятилетия. Это произошло благодаря внедрению в клиническую практику современной эндоскопической техники, методов инжекционной и высокочастот-'/'•С'?-№ІІШШЩІШШШ
434 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯНОЙ ИВЛ, появлению методов эндоскопического внутритрахеального воздейс на патологические ткани (электрохирургическая техника, ультразвуковая и лаэе|и ная деструкция).Расширение просвета трахеи возможно различными методами. Наиболее 1410- стым и доступным является механическое бужирование суженного отдела тубуса- ми ригидного бронхоскопа или пластмассовыми бужами. Одномоментное расп»- - рение просвета трахеи бужированием предпочтительно в экстренных ситуация^ при критическом стенозе дыхательных путей и необходимости быстро устраншь препятствие для дыхания.Однако подобные операции могут давать лишь временный эффект. Поэтол^ часто их приходится дополнять стентированием зоны поражения. Для этого используют полые трубки различных модификаций из силиконовой резины, кото¬ рые отличаются главным образом методом фиксации к трахеальной стенке. По этому признаку их можно разделить на 2 группы: требующие фиксации к мягюш тканям шеи с помощью лигатуры и не требующие этого (так называемые само- фиксирующиеся эндопротезы) (рис. 23-4, см. цветную вклейку). Второй тип эндо¬ протезов может быть 2 вариантов: а) сплошные протезы из силиконовой резины, имеющие на наружной поверхности выступы, благодаря которым происходит их фиксация к стенке трахеи; б) металлические спиральные или сетчатые эндопро¬ тезы. Последние фиксируются в стенку трахеи врезанием проволоки, из которой они сделаны.Альтернативой расширению области стеноза трахеи тубусом жёсткого брон¬ хоскопа является баллонная дилатация. По мнению ряда авторов, эта процедура позволяет расширить просвет дыхательного пути с минимальной травмой слизи- стой оболочки (рис. 23-5, см. цветную вклейку).Трансплантация трахеиТотальное или субтотальное поражение трахеи патологическим процессом различного генеза вызывает необходимость замещения обширных циркулярных дефектов дыхательного пути, образующихся после резекции. Трахея остаётся одним из немногих органов, которых до недавнего времени было невозможно пересадить с благоприятным клиническим результатом. Попытки использования для этих целей синтетических протезов оказались бесперспективными, и в настоя¬ щее время они могут рассматриваться лишь как паллиативный метод, Применение биологических протезов и донорской трахеи без сохранения её полноценного кровоснабжения сопряжено с высоким риском развития послеоперационных осложнений и не может быть рекомендовано для использования в клинической практике [12]. Экспериментальные исследования последних лет [1, 16], а также клинические наблюдения трансплантации трахеи и гортани [20,22] показали воз¬ можность сохранения источников кровоснабжения и кровоотгока этих органов.Анатомические исследования [1], многочисленные опыты на животных пока¬ зали, что возможна пересадка жизнеспособной трахеи с сохранённым кровоо¬ бращением через сосуды щитовидной железы. Первая успешная подобная опе¬ рация (В.Д, Паршин, И.О. Миланов) была выполнена 19 октября 2006 года в ГУ РНЦХ РАМН больному с субтотальным рубцовым стенозом трахеи (рис, 23-6, см. цветную вклейку). Трансплантат был получен у донора со смертью головного мозга как часть мультиорганного забора. В этом разделе российская хирургия имеет приоритет.Больной получает иммуносупрессивную терапию, аналогичную таковой после пересадки лёгких. Четырёхмесячное наблюдение за ним показало, что в тече¬ ние данного периода сохраняется кровоснабжение стенки трахеи без признаков её повреждения. Трансплантат полностью обеспечивает все функции трахеи. Доказана на практике состоятельность концепции о возможности трансплантации
ПОРАЖЕНИЯ ТРАХЕИ 435сизнеспособной трахеи с сохранением её кровоснабжения, что имеет место ив 3отдалённом периоде. Этот вариант лечения позволяет оказывать помощь ранее Щ читавшимся обречённым больным. Имеющиеся иммунологические и эндокрино-югические вопросы требуют дальнейшего изучения и решения. ,:ПИСОК ЛИТЕРАТУРЫ^
Глава 24 БронхиолитыПоражения малых дыхательных путей (бронхиол) довольно часто встречаются при различных заболеваниях: респираторных инфекциях, Б А, ХОБЛ, системных заболеваниях соединительной ткани (СЗСТ), ингаляции токсичных продуктов, посттранспланта- ционных осложнениях и многих других [1]. Однако в ряде случаев воспалительное поражение бронхиол (бронхиолит) является пре¬ валирующим патологическим процессом, определяющим клини¬ ческую картину и прогноз заболевания. Несмотря на то что первое описание бронхиолита было сделано в 1901 году [2], диагностика и лечение бронхиолитов по-прежнему является сложной клиниче¬ ской задачей.Анатомия и функция бронхиолк бронхиолам относят дыхательные пути (ДП) диаметром менее 2 мм, не имеющие хрящевых колец и слизистых желёз [3]. Различают терминальные и респираторные бронхиолы. Терми¬ нальные бронхиолы относятся к воздухопроводящим ДП, их стен¬ ка содержит гладкомышечные клетки. В состав каждой вторичной лёгочной дольки входит от 4 до 8 терминальных бронхиол с соот¬ ветствующими им первичными дольками (ацинусами). Стенка респираторных бронхиол содержит реснитчатые эпителиальные клетки и альвеолоциты и не имеет гладкомышечных клеток, поэ¬ тому респираторные бронхиолы относятся к переходным ДП, то есть принимают участие и в проведении воздуха, и в газообмене. У человека в среднем имеется 30 тыс. терминальных бронхиол, 224 тыс. респираторных бронхиол, 13,8 млн альвеолярных ходов и 300 млн альвеол [4].На долю малых ДП, общая площадь сечения которых (53-186 см^) во много раз превышает площадь сечения трахеи (3-4 см^) и круп¬ ных бронхов (4-10 см^), приходится лишь 20% общего сопро¬ тивления ДП [4]. Поэтому поражение малых бронхиол на ран¬ них этапах может протекать бессимптомно и не сопровождаться изменениями традиционных функциональных тестов, которые обнаруживают, как правило, при уже далеко зашедшем поражении малых ДП.
БРОНХИОЛИТЫ437КлассификацияБронхиолиты являются гетерогенной группой заболеваний, характеризу¬ ющихся различными причинами, морфологическими особенностями и прогнозом. К наиболее частым формам бронхиолитов относят: облитерирующий, острый, респираторный панбронхиолит, фолликулярный, облитерирующий с организую* щейся пневмонией, бронхиолит, индуцированный ингаляцией минеральной пыли[5]. Кроме того, бронхиолит является одним из важнейших морфологических изменений при ряде интерстициальных заболеваний лёгких; гиперчувствитель- ном пневмоните (экзогенном аллергическом альвеолите), Лангергансо-клеточном гистиоцитозе и др. Современная классификация бронхиолитов представлена в табл. 24-1 [1].Таблица 24-1. Классификация бронхиолитовПервичные бронхиолитыИнтерстициальные заболевания лёгких с выраженным поражением бронхиолПоражение бронхиол в соче¬ тании с заболеваниями круп¬ ных бронховОблитерирующий.Респираторный (бронхиолит курильщика).Острый (клеточный).Бронхиолит. индуцированный мине¬ ральной пылью.Фолликулярный.Диффузный панбронхиолит,Дзугие первичные поражения брон¬ хиол (диффузный аспирационный, лимфоцитарный)Пролиферативный (облитерирующий бронхиолит с организующейся пнев¬ монией).Респираторный бронхиолит. ассоции¬ рованный с интерстициальным забо¬ леванием лёгких. Гиперчувствительный пневмонит. Другие интерстициальные заболева¬ ния лёгких (Лангергансо-клеточный гистиоцитоз лёгких, саркоидоз)Бронхиальная астма, бронхоэк¬ тазии, ХОБЛПатогенезСчитается, что бронхиолит — проявление неспецифичных тканевых реакций на различные повреждающие стимулы. Первичным событием являются повреж¬ дение и деструкция эпителия бронхиол, затем следует воспалительный ответ с аккумуляцией и миграцией нейтрофилов в место повреждения. Высвобождение медиаторов воспаления из нейтрофилов приводит к дальнейшему повреждению эпителия. Эпителиальные клетки секретируют фибронектин и другие цитокины, являющиеся хемоаттрактантами для фибробластов, усиливают их пролиферацию н продукцию фибробластами компонентов экстрацеллюлярного матрикса [5]. Репаративный процесс может приводить к полному восстановлению повреждения шш к избыточной пролиферации и формированию грануляционной ткани, сжима¬ ющей или полностью облитерирующей просвет бронхиол (рис. 24-1). Основными клеточными компонентами грануляционной ткани являются фибробласты и эндо¬ телиальные клетки, а основными протеинами внеклеточного матрикса — фибро- вектин и фибрин/фибриноген [6],авлитЕРИрующий бронхиолитОблитерирующий бронхиолит (синоним — констриктивный бронхиолит) был впервые описан W. Lange в 1901 году [2]. П1Стологическая картина облитерирую- щего бронхиолита (ОБ) характеризуется концентрическим сужением преимуще¬ ственно терминальных бронхиол, которые частично или практически полностью облитерированы грубой рубцовой соединительной тканью, располагающейся в подслизистом слое и/или в адвентиции (рис. 24-2, см. также цветную вклейку) [7]. Другой важной особенностью морфологической картины является нали¬ чие бронхиолярного или перибронхиолярного хронического воспалительного
Л-1-Ш1йШ438ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯВоспалениеРис. 24‘1. Патогенез бронхиолита.инфильтрата различной плотности, развитие бронхиолоэктазов со стазом секрета, скоплением макрофагов, формирующих слизистые пробки в люминальном отдеж бронхиол. На ранних этапах развития ОБ может быть представлен картиной брон¬ хиолярного воспаления с минимальным рубцеванием или только лимфоцитарным воспалением без признаков фиброзообразования [8]. Паттерн морфологического повреждения обычно «пятнистыйз>, то есть наряду с грубыми изменениями парен¬ химы встречаются и сохранные структурно-анатомические единицы [3].Рис. 24-2. Облитерирующий бронхиолит (больная с ревматоидным артритом, 61 год). Морфологжг пролиферация фибробластов и делоэиция коллагена в подслизистом слое приводят к уменьшению просвета бронхиолы.
БРОНХИОЛИТЫ 439Основные состояния, ассоциированные с ОБ:• постинфекционные состояния {Mycoplasma pneumoniae, респираторно-синци- тиальный вирус, цитомегаловирус, аденовирус, ВИЧ и др,);• ингаляции токсичных веществ:❖ минеральная пыль (силикаты, асбест, оксид железа, оксид алюминия, тальк);❖ газы (окислы серы, азота, аммиак, фосген и др.);^ кокаин;• приём токсичных продуктов внутрь {Sauropus androgynus)',• осложнения медикаментозной терапии (пеницилламин, препараты золота, сульфасалазин, ломустин);• СЗСТ (ревматоидный артрит, системная красная волчанка, синдром Шёгрена, эозинофильный фасциит);• посттрансплантационные осложнения (пересадка лёгких, комплекса сердце¬ лёгкие, костного мозга):• другие (воспалительные заболевания кишечника, осложнения лучевой тера¬ пии; синдром Стивенса-Джонсона, гиперчувствительный пневмонит, аспира¬ ция);• идиопатический (криптогенный).В большинстве случаев удаётся выяснить причину развития ОБ, идиопатиче¬ ские формы ОБ встречаются редко.Прогрессирующая одышка является кардинальным признаком заболевания. Сначала одышка появляется только при физической нагрузке, однако в дальней¬ шем отмечается нарастание её тяжести, на терминальных стадиях заболевания малейшее напряжение вызывает одышку. Одышка часто сопровождается мало¬ продуктивным кашлем. При аускультации на ранних этапах развития заболевания выслушиваются сухие свистящие хрипы, или крепитация, особенно в базальных отделах, иногда слышен характерный инспираторный «писк», однако по мере нарастания гиперинфляции лёгких дыхание ослабевает и хрипы практически исчезают [3J. В некоторых случаях дебют заболевания напоминает картину вирус¬ ного бронхита: острое или подострое начало, сухой кашель, свистящее дыхание, субфебрильная лихорадка [3],Но симптомы носят «застывший«» характер: отсутствует какое-либо улучшение ■ли разрешение заболевания [9]. Несмотря на то что ОБ относится к болезням малых дыхательных путей, часто в процесс вовлекаются и крупные бронхи, что проявляется клиническими симптомами бактериальной суперинфекции или бронхоэктазов. Прогрессирование заболевания у многих пациентов имеет скач¬ кообразный или ступенчатый характер: периоды ухудшения общего состояния и функциональных параметров чередуются с периодами относительно стабильного состояния [6]. На поздних стадиях заболевания развивается диффузный тёплый цианоз, выраженное напряжение вспомогательных респираторных мышц шеи, •*ш>1хтящее» дыхание, что дало повод Burke и соавт. назвать больных ОБ «синими мыггельщиками» [10],Стандартные рентгенограммы грудной клетки часто оказываются без изме- ■еяий, хотя могут наблюдаться признаки гиперинфляции (гипервоздушносги) локих, реже определяется слабовыраженная диссеминация по очагово-сетчатому «[!>'. Более чувствительным диагностическим методом является КТВР: измене- ■ня обнаруживают более чем в 90% случаев [11]. Различают прямые и непрямые ^агностические признаки ОБ, обнаруживаемые с помощью КТВР. К прямым цязнакам ОБ относятся мелкие разветвлённые затемнения или центролобуляр- Ш1е узелки, отражающие перибронхиальные утолщения, слизистые пробки и бронхиолоэктазы. Прямые признаки встречаются лишь в 10-20% случаев [12]. Наиболее частыми непрямыми признаками ОБ являются бронхоэктазы и участ¬
8Ш1§440ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯРис. 24*3. Облитерирующий бронхиолит, КТВР на выдохе: пятнистые участки воздуш¬ ных ловушек, мозаичной олигемии и сохра¬ нённой лёгочной паренхимы.ки мозаичной олигемии, особенно хоро¬ шо выявляемые на выдохе (около 70%). Мозаичная олигемия имеет «пятнистый» или «географический^^ тип распростране¬ ния и является результатом гиповентиля¬ ции и «воздушной ловушки» в сегментах и дольках (рис. 24-3) [12]. На выдохе области паренхимы лёгких, соответству¬ ющей неизменённым бронхиолам, ста¬ новятся более плотными, в то время как поражённые сегменты остаются сверх- прозрачными, так как облитерация брон¬ хиол препятствует полной эвакуации воз¬ духа — «воздушная ловушка» (рис. 24-4).По данным тестов ФВД выявляется обструктивный синдром; уплощение кри¬ вой «поток-объём», снижение скорост¬ ных потоковых показателей, повышение статических лёгочных объёмов. Обструкция, как правило, необратимая. Наиболее чувствительным функциональным изменением является снижение максимального среднеэкспираторного потока (СОС^^ „) [3]. Существуют определённые законо¬ мерности изменения функциональных показателей*, раньше всего происходит сни¬ жение СОС^- ^д при относительно нормальной величине ОФВ^, затем происходит и снижение ФЖЁЛ, сопровождаемое значительным повышением остаточного объёма лёгких [6], Очень чувствительным методом для выявления поражения малых дыхательных путей является тест вымывания азота при одиночном вдохе. Так, при посттрансплантационном ОБ наклон альвеолярного плато (фаза 3) явля¬ ется более ранним и более специфическим показателем, чем OФBJ, Диффузионная способность лёгких обычно умеренно снижена. Изменения в газовом анализе артериальной крови обычно несколько отличны от других обструктивных забо¬ леваний лёгких: чаще находят гипоксемию и гипокапнию, гиперкапния редка [10]. Характерно увеличение альвеоло-артериального градиента до 20 мм рт.ст. и выше.Посттрамсплантационный ОБ развивается в 25-60% после пересадки лёгких и комплекса сердце-лёгкие, в 10-12% случаев — после пересадки костного мозга [5]. Считается, что данный синдром — проявление реакции отторжения. ОБ может развиться практически в любые сроки после трансплантации, хотя наиболее типичным является начало заболевания через 3-12 мес после операции.КТВР на вдохеКТВР на выдохеРис. 24-4. Облитерирующий бронхиолит; а — КТВР на вдохе; б — на выдохе: площадь регионов воздушных ловушек и мозаичной олигемии значительно увеличивается во время выдоха.
БРОНХИОЛИТЫ 441Факторы риска посттрансплантационного ОБ [13]:• Неконтролируемые реакции острого отторжения.• Цитомегаловирусная инфекция (пневмония).• НЬА-несовместимость.• Лимфоцитарный бронхит и бронхиолит.• Низкий комплайнс к иммуносупрессивной терапии.• Лимфоцитарный бронхит или бронхиолит.• Пожилой возраст донора.• Ишемически-реперфузионный отёк лёгкого,• Длительная ишемия трансплантата.« Гастроэзофагеальная рефлюксная болезнь.Клиническая картина посттрансплантационного ОБ зависит от стадии развития заболевания (табл. 24-2).Таблица 24-2. Клиническая картина посттрансплантационного облитерирующего бронхиолитаПараметрыСимптомыРентгенография лёгкихФизикальное обследованиеФВДПосев мокротыРанний ОБНепродуктивный кашель Одышка при нагрузкеНет измененийНет измененийОбструкцияВыраженное снижение C0Cjs.y5Поздний ОБПродуктивный кашель Одышка в покоеГиперинфляцияБронхоэктазыИнспираторный «писк» КрепитацияВыраженная обструкцияНет ростаPseudomonas sp.Другой большой группой заболеваний, при которых может встречаться ОБ, являются СЗСТ. Чаще всего ОБ встречается при ревматоидном артрите, хотя имеются сообщения о возможности развития заболевания при ювенильном ревматоидном артрите, системной склеродермии, системной красной волчан¬ ке, синдроме Шёгрена [9, 14, 15]. Чаще ОБ развивается у пациентов, имеющих длительный анамнез ревматоидного артрита, в основном у женщин в возрасте 50-60 лет. Заболевание характеризуется резистентностью к терапии ГКС, разви¬ тием неуклонно прогрессирующей дыхательной недостаточности, приводящей в итоге к гибели больного.ОБ может явиться осложнением некоторых лёгочных инфекций. Чаще всего причиной являются вирусные инфекции: респираторно-синцитиальный вирус, цитомегаловирус, аденовирус, БИЧ, риновирусы, коронавирусы и другие [16], Описано развитие ОБ при Mycoplasma pneumonia. Последствием вирусного брон¬ хиолита может быть синдром МакЛеода или Свиера-Джеймса; развитие одно¬ стороннего сверхпрозрачного лёкого, гипоплазии лёгочной артерии и бронхоэк¬ тазов.Лекарственный ОБ бывает связан с такими препаратами, как пеницилла¬ мин, сульфасалазин, препараты золота, тиопронин, амфотерицин В, топотекан (17].Ассоциация постингаляционного ОБ отмечена с широким спектром токсичных веществ: диоксид азота, диоксид серы, хлор, аммиак, фосген и др, [16]. Обычно ингаляциям токсических веществ подвержены работники промышленных пред¬ приятий, особенно там, где производятся или используются горючие материалы, проводится выплавка металлов, сварка и т.д. [9].
442 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯКриптогениый ОБ развивается чаще всего у женщин. Клинико-морфологиче¬ ская картина описана недостаточно. Криптогенный ОБ является диагнозов исключения, требуя исключения других известных обструктивных заболеваяні лёгких [18].Другие формы ОБ. Развитие ОБ описано также при приёме внутрь сока троп*- ческого овоща Sauropus androgynus, у работников фабрики попкорна, при геморра- гическом ретроколите, при хронической аспирации [17,19].Терапия ОБ зависит от причины и ассоциированных заболеваний. Часто назначаются ГКС в больших дозах; преднизолон per os 1 мг/кг массы тела [9). Применение преднизолона в дозе 60-100 мг в сутки в течение 6-8 нед рекомендо¬ вано при постингаляционном ОБ [20], При ревматоидном артрите и лекарствен¬ ном ОБ чаще всего ГКС неэффективны.Следует учесть, что несмотря на включение в посттрансплантационный период в современные режимы иммуносупрессии трёх препаратов — предни¬ золона, циклоспорина и азатиоприна, примерно у трети пациентов всё равно развивается ОБ, т.е. даже цитостатики не гарантируют успеха лечения таких больных.В некоторых ситуациях большое значение имеют ингаляционные ГКС, осо¬ бенно выраженное улучшение наступает при развитии ОБ после ингаляции N0, [9]. При постингаляционном ОБ ИГКС должны применяться с первых же часов заболевания. ИГКС у больных с посттрасплантационным ОБ могут быть более эффективны, чем системные ГКС, что было показано при использовании высоких доз будесонида через Турбухалер (1600 мкг/сут) и через небулайзер (2 мг х 2 раза в сутки) [21].Была показана высокая эффективность ингаляционного циклоспорина А; инга¬ ляция препарата в дозе 300 мг 3 раза в неделю привела к улучшению выживаемо¬ сти больных с посттрансплантационным ОБ [22].Большие надежды связаны с использованием макролидных антибиотиков. Макролиды позволили значительно улучшить симптомы, показатели ФВД и про¬ гноз у больных с диффузным панбронхиолитом [23]. В недавно проведённом исследовании продемонстрирован выраженный положительный эффект азитро- мицина (250 мг 3 раза в неделю в течение 12 нед) на функциональные показатели у больных с ОБ, развившемся после трансплантации костного мозга [24]. Также представлен положительный опыт длительного использования кларитромицина (250 мг 2 раза в сутки) у больного с криптогенным ОБ [25].При ОБ применяется также и симптоматическая терапия: инагаляционные бронхолитики, при инфекционных осложнениях - антибиотики и противогрибко¬ вые препараты, при развитии гипоксемии - кислородотерапия.Облитерирующий бронхиолит с организующейся пневмониейОБОП является заболеванием, имеющим чёткие клинико-морфологические отличия от изолированного ОБ. Синонимами ОБОП являются термины крипто- генная организующаяся пневмония [25] и пролиферативный бронхиолит [12].Морфологическая картина ОБОП характеризуется наличием в просвете респи¬ раторных бронхиол и альвеол полиповидной грануляционной ткани, состоящей из пролиферирующих фибробластов и миофибробластов и хронического вос¬ паления, окружающего альвеолы (рис. 24-5, см. также цветную вклейку) [1, 26]. При ОБОП изменения альвеол (организующаяся пневмония) всегда преобладают над поражением бронхиол (бронхиолит), поэтому данное заболевание характе¬ ризуется рестриктивными нарушениями и относится к группе интерстициальных заболеваний лёгких (см. более подробное описание в главе «Идиопатические интерстициальные пневмонии»).
БРОНХИОЛИТЫ443Облитерирующий бронхиолит Рмс. 24-5. Облитерирующий бронхиолит с организующейся пневмонией: локализация воспаления.В отличие от изолированного ОБ, ОБОП в большинстве случаев (70-90%) является идиопатическим, то есть причина остаётся не установленной [27]. Среди установленных причин наибольшее значение имеют СЗСТ и осложнения лекар¬ ственной терапии. В некоторых случаях ОБОП вызывают те же причины, что и ОБ (ревматоидный артрит, терапия препаратами золота, посттрансплантационные осложнения и др.).Основные состояния, ассоциированные с ОБОП.• Криптогенный (идиопатический).• СЗСТ (ревматоидный артрит, полимиозит/дерматомиозит, системная склеро¬ дермия, болезнь Бехчета, синдром Шёгрена).• Посттрансплантационные осложнения (пересадка лёгких, костного мозга).• Инфекции {Mycoplasma pneumonia. Chlamydia, Legionella, HIV и др.).• Осложнения медикаментозной терапии (триптофан, амиодарон, бусульфан, сотолол, амфотерицин Б, метотрексат, соли золота и др.).• Лучевая терапия.• Ингаляции токсичных веществ (окислы азота, аэрозоль акриловых красите¬ лей и др.).• Воспалительные заболевания кишечника.• Другие (хронический тиреоидит, алкогольный цирроз, аспирация, криоглобу- линемия, вирусный гепатит С, IgA-нефропатия),Препараты, вызывающие ОБОП.• Ацебутолол®.• Амиодарон.• Амфотерицин В.• Барбитураты.• Блеомицин,• Бусульфан.• Триптофан.• Метотрексат.• Сотолол.• Соли золота.
ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ• Сульфасалазин.• Интерферон а.• Циклофосфамид. ЩРЕСПИРАТОРНЫЙ БРОНХИОЛИТРеспираторный бронхиолит (РБ) — заболевание дыхательных путей, связанней почти исключительно с курением, впервые было описано Niewoehner и соавт, 1974 году [28]. Данное заболевание, как правило, протекает бессимптомно я і сопровождается изменениями ФВД, чаще всего является находкой при гистол ческом исследовании (а сейчас и при КТВР).Морфологическая картина РБ характеризуется аккумуляцией пигментиро¬ ванных макрофагов в просвете респираторных бронхиол и подлежащих альве¬ ол (рис. 24-6) [29]. Также наблюдается утолщение альвеолярных перегородощ; вокруг бронхиолы. Пигмент в макрофагах является следствием курения, част даёт положительную окраску на железо. Морфологические признаки РБ могуг сохраняться на протяжении 5 лет даже после полного отказа от курения [2^ Рентгенологическая картина не изменена, при КТВР могут быть видны центроло¬ булярные микроузелки [30].РБ может сочетаться с интерстициальным заболеванием лёгких; данная форі заболевания была описана Myers в 1987 году [31] и называется «респи^тор- ный бронхиолит, ассоциированный с интерстициальным заболеванием легких* (РБ-ИЗЛ). Данное заболевание встречается у курильщиков со стажем более 30 пачек/год. В одном из исследований морфологическая картина РБ-ИЗЛ наблю¬ далась в 67% случаев у больных с первичным спонтанным пневмотораксом [32]. Морфологическая картина характеризуется более выраженным воспалительным процессом в лёгочном интерстиции (более подробно см. в главе «Идиопатические интерстициальные пневмонии»),ОСТРЫЙ БРОНХИОЛИТОстрый (клеточный) бронхиолит является частым заболеванием дыхательных путей обычно вирусной природы у детей первого года жизни, однако у взрослых встречается довольно редко. Для морфологической картины острого бронхио-Рис. 24-6. Респираторный бронхиолит {у курильщика 45 лет}. Морфология: пигментированные макрофаги заполняют просвет бронхиол и распространяются на подлежащие перибронхиальные пространства.
Рис. 24-7. Острый бронхиолит при вирусной инфекции. Морфология: перибронхиальные инфильтраты из лимфоцитов и плазматических клеток.лита характерны воспалительная лимфоидная инфильтрация в стенке бронхиол, некроз и слущивание эпителия (рис, 24-7, см. также цветную вклейку). Наиболее частой причиной острого бронхиолита является респираторно-синтициальный вирус, большое значение имеют также аденовирусы, вирусы гриппа и парагриппа. Причиной острого бронхиолита у взрослых также могут быть аспирация, инга¬ ляция токсичных веществ, синдром Стивенса-Джонсона, реакция «трансплантат против хозяина» в ранний посттрансплантационный период [1].Клиническая картина острого бронхиолита у взрослых не такая яркая, как у детей, что объясняется относительно меньшим вкладом бронхиол в общее сопро¬ тивление дыхательных путей у взрослых. Основной жалобой больных является одышка, при физикальном осмотре обнаруживают тахипноэ, тахикардию, удли¬ нение фазы выдоха, сутсие свистящие хрипы. Рентгенологическая картина при остром бронхиолите неспецифична: признаки гиперинфляции, линейные тени, плохо очерченные узелки. При КТВР выявляют центролобулярные узелки и мел¬ кие разветвлённые затемнения (картина «дерево в почках«^) [30]. Терапия острого бронхиолита в основном поддерживающая: бронхолитики, ГКС, кислород.Бронхиолит, индуцированный минеральной пыльюХорошо известно, что длительный контакт с минеральной пылью приводит к развитию пневмокониозов, однако может также привести к заболеванию бронхиол с развитием бронхиальной обструкции [33]. Бронхиолит, индуцированный мине¬ ральной пылью, является следствием отложения частиц пыли в стенке бронхиол с последующим развитием в них и вокруг них хронического воспаления и фиброза. Выраженность фиброза в стенке бронхиолы тесно отражает продолжительность и интенсивность «пылевой нагрузки» [33]. Среди причин данной формы бронхиолита стедует отметить такие виды неорганической пыли, как асбест, оксид железа, оксид алюминия, тальк, кремний, угольную пыль [3]. Клиническая и рентгенологическая картина данного бронхиолита неспецифична и может напоминать проявления РБ на ранних стадиях и ОБ — на поздних.Фолликулярный бронхиолитФолликулярный бронхиолит (ФБ) — заболевание бронхиол, морфологиче¬ ской особенностью которого является наличие в стенке бронхиол гиперплази-
ШііФЖї-:»їгї'Ь«"446 ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯРис. 24-8. Фолликулярный бронхиолит (больная с синдромом Шёгрена, 55 лет). Морфология: хро¬ нический воспалительный процесс вокруг бронхиолы с формированием лимфоидного фолликула (внизу). КТВР; маленькие центролобулярные и перибронхиальные узелки, перибронхиальные утол¬ щения и небольшие пятнистые поля «матового стекла».рованных лимфоидных фолликулов (рис. 24-8, см. также цветную вклейку) [34]. Лимфоцитарные инфильтраты могут распространяться и на лёгочный интер¬ стиций; в таких ситуациях часто встречается ассоциация ФБ и лимофицитарной интерстициальной пневмонии. Чаще всего ФБ встречается у больных с СЗСТ (рев¬ матоидный полиартрит, синдром Шёгрена), иммунодефицитными состояниями, вирусными и микоплазменными инфекциями, реже ФБ может быть идиопатиче¬ ским [35].Основные клинические признаки включают кашель, прогрессирующую одышку при физических нагрузках, лихорадку, иногда рецидивирующие пневмонии [36]. Функциональные лёгочные тесты могут выявлять обструктивный, рестриктивный и смешанный типы нарушений вентиляции. Для рентгенологической картины характерны диффузные мелкоузелковые или узелково-сетчатые изменения иногда в сочетании с лимфоаденопатией средостения [30]. При КТВР находят центроло¬ булярные узелки размерами от 1 до 12 мм. расположенные преимущественно по ходу сосудов и субплеврально. У половины больных присутствуют очаги «мато¬ вого стекла», отражающие наличие лимфоидной инфильтрации интерстиция (рис. 24-8, см. цветную вклейку).Терапия ФБ заключается, в первую очередь, в лечении основного заболевания. В случаях изолированного ФБ используют бронходилататоры и ГКС [1].Диффузный панбронхиолитДиффузный панбронхиолит (ДПБ) — заболевание, характеризующееся пораже¬ нием пазух носа, бронхов и бронхиол. Встречается в основном у жителей Японии, Китая и Кореи, несколько случаев ДПБ было описано в Европе и в США [1, 5]. Природа заболевания неясна. Существует сильная генетическая предрасположен¬ ность; наличие лейкоцитарного антигена НЬА-Вш54 повышает риск развития ДПБ в 13 раз [37].Морфологическая картина ДПБ включает бронхиолоцентричные воспалитель¬ ные инфильтраты респираторных бронхиол, состоящие из лимфоцитов, плазма¬ тических клеток и пенистых макрофагов (рис. 24-9, см. также цветную вклейку). Внутри просвета бронхиол преобладают нейтрофилы.Большинство больных ДПБ не имеют анамнеза курения, немного чаще болезнь встречается у мужчин, средний возраст больных — около 50 лет [38], Основными симптомами ДПБ являются хронический синусит (более 75%), продуктивный
БРОНХИОЛИТЫ447кРис. 24-9. Диффузный панбронхиолит. Морфология: плотный перибронхиолярный инфильтрат, состоящий в основном из мононуклеарных клеток и вакуолизированных гистиоцитов. КТВР: центро¬ лобулярные узелки, синдром «дерево в почках» в нижних долях, утолщение и дилатация бронхов.кашель, часто с продукцией гнойной мокроты, одышка при физических нагруз¬ ках, снижение массы тела [37]. При аускультации выслушивают крепитацию и сухие хрипы. Характерными изменениями в лабораторных тестах являются повышение уровня сьшороточных агглютининов (при нормальном уровне анти¬ тел к микоплазме), повышение уровней сывороточного IgA, возможно наличие положительного ревматоидного фактора или антинуклеарных антител. При бак¬ териологическом исследовании мокроты часто высевают Haemophilus influenzae. Streptococcus pneumoniae, Klebsiella pneumoniae, Pseudomonas aeruginosa [37, 38].Для ДПБ характерен обструктивный тип ФВД, умеренное снижение лёгочная гиперинфляция, на поздних стадиях — гипоксемия и гиперкапния.Рентгенологическая картина ДПБ включает диффузные симметричные, плохо очерченные узелковые тени (до 3 мм), более выраженные в базальных отделах, повышение лёгочных объёмов, на поздних стадиях — признаки цилиндрических бронхоэктазов [37, 39]. На КТВР типичными признаками ДПБ являются развет¬ влённые затемнения («дерево в почках»), отражающие бронхиолы, заполненные экссудатом, центролобулярные узелки, участки «воздушных ловушек», цилиндри¬ ческие бронхоэктазы (рис. 24-9, см. цветную вклейку) [30, 40].До разработки схем современной терапии прогноз при ДПБ был относитель¬ но плохой: пятилетняя выживаемость составляла 42, десятилетняя — 25% [23]. Основной причиной смерти больных ДПБ, как правило, является прогрессирую¬ щая дыхательная недостаточность. Использование макролидов в относительно малых дозах (эритромицин в дозе 200-600 мг/сут) в течение длительного времени (6-20 мес) позволило значительно улучшить клинические симптомы, параме¬ тры ФВД и рентгенологическую картину больных ДПБ [23]. Эффект макроли¬ дов связан не с их антибактериальным, а с противовоспалительным действием. Макролиды способны уменьшать хемотаксис нейтрофилов, продукцию нейтро¬ филами супероксида и эластазы, снижать циркулирующий пул Т-лифоцитов, несу¬ щих HLA-DR — маркёр клеточной активации [5]. В настоящее время десятилетняя выживаемость больных с ДПБ на фоне терапии макролидами составляет 94% [23]. В качестве симптоматической терапии при ДПБ используются [З^-агонисты и ипра¬ тропия бромид, при инфекционных обострениях — антибиотики [37].СПИСОК ЛИТЕРАТУРЫ^
Глава 25Заболевания верхних дыхательных путей
АЗДЕЛ VIIОПУХОЛИ ЛЕГКИХГлава 26. Рак лёгкогоГлава 27. Карциноидные опрли лёгкихГлава 28. Первичные злокачественные неэпителиальные опухоли лёгкихГлава 29. Метастатические опухоли лёгкихГлава 30. Доброкачественные опухоли лёгких®
Глава 26 Рак лёгкогоВВЕДЕНИЕРак лёгкого — наиболее распространённое в мировой популяции злокачественное новообразование. С начала XX в. заболеваемость населения выросла в несколько десятков раз. Особенно выражен её рост в индустриально развитых странах, где в структуре онкологи¬ ческой заболеваемости рак лёгкого занимает первое место [1].В России заболеваемость раком лёгкого в последние 20 лет выросла более чем в 2 раза. Ежегодно рак лёгкого диагностируют более чем у 50 тыс. пациентов, в настоящее время данная патология занимает первое место (12%) в структуре заболеваемости населения злокачественными новообразованиями [2], Мужчины болеют зна¬ чительно чаще, чем женщины (соотношение 9:1).Ни одно из широко распространённых онкологаческих заболе¬ ваний не имеет столь очевидной связи с факторами окружающей среды, условиями производства, вредными привычками и индиви¬ дуальным стилем жизни, как рак лёгкого. Канцерогенное действие на лёгочную ткань оказывают многие химические вещества: поли¬ цикл ические ароматические углеводороды, входящие в состав про¬ дуктов термической обработки угля и нефти (смолы, коксы, газы и др.), ряд простых органических веществ (хлорметиловые эфиры, винилхлорид и др.), некоторые металлы и их соединения (мышьяк, хром, кадмий).Повышена заболеваемость раком лёгкого у рабочих сталелитей¬ ной, деревообрабатывающей, металлургической промышленности, керамического, асбестоцементного и фосфатного производства: у лиц, контактирующих с соединениями хрома, подвергающихся воздействию каменной пыли, занятых в никелевой и алюминиевой промышленности, шофёров [3]. Между тем промышленное загряз¬ нение и профессиональные вредности не играли бы столь большой роли в росте заболеваемости, если бы не сочетались с курением [4]. Курящие шахтёры в урановых рудниках, как и курящие рабочие асбестовой промышленности, заболевают раком лёгкого гораздо чаще, чем некурящие. Увеличение заболеваемости раком лёгкого во всех странах находится в прямой зависимости от роста потребления сигарет и числа курящих. Однако около 10% больных раком лёгко¬ го в США никогда не курили [5].До сих пор не изучены причины, влияющие на возникновение различных подтипов рака лёгкого, наибольшую частоту ветре-
' . 452 ОПУХОЛИ ЛЁГКИХ5 чаемости аденокарциномы у некурящих, особенно женщин [6, 7]. Совокупные ■5 неблагоприятные воздействия внешних факторов, наследственная предрасполо¬ женность играют важную роль в развитии фоновых предраковых изменений н патогенезе рака лёгкого [8,9].ПрофилактикаСогласно терминологии ВОЗ профилактические мероприятия предусматривают первичную и вторичную профилактику.Первичной (онкогигиенической, иммунобиологической, законодательно- правовой) профилактикой является система государственных и медицинских мероприятий, направленных на устранение или резкое уменьшение воздействия на организм веществ и факторов, признаваемых в настоящее время канцерогенны¬ ми и играющими значительную роль в возникновении и развитии злокачественно¬ го процесса. Основной целью гигиенической профилактики рака лёгкого является борьба с загрязнением вдыхаемого воздуха или хотя бы уменьшение степени его зафязнения, а также борьба с производственными (профессиональными) вред¬ ностями и курением табака.Вторичная, или клиническая (медицинская) профилактика предусматривает планово-организационную систему обследования (диспансеризация) населения с целью выявления, учёта и лечения фоновых процессов и предопухолевых заболе¬ ваний лёгких — факторов повышенного риска рака лёгкого. К категории «повы¬ шенного риска» относятся пациенты, болеющие хроническим бронхитом, пневмо¬ нией или туберкулёзом, длительно курящие мужчины в возрасте 50 лет и старше, а также излеченные от злокачественного заболевания. Диспансерное наблюдение с периодическим обследованием этого контингента больных направлено на выяв¬ ление истинно ранних форм рака лёгкого, лечение которых даёт хорошие отдалён¬ ные результаты.Основным и единственным методом раннего активного выявления рака лёг¬ кого в нашей стране является профилактическая флюорография, эффективность которой при центральной форме болезни низка, позволяя лишь заподозрить бес¬ симптомную, но уже распространённую стадию заболевания. Проведение флюоро¬ графического исследования в одной (прямой) проекции снижает ценность метода в диагностике периферических округлых теней в лёгком.КлассификацииКЛИНИКО-АНАТОМИЧЕСКАЯ КЛАССИФИКАЦИЯI. Центральная форма,И, Периферическая форма.1П. Медиастинальная форма.IV. Диссеминированная форма.Среди типичных форм различают центральный рак лёгкого, возникающий в крупных бронхах (главном, промежуточном, долевом, сегментарном и субсегмен- тарном), и периферический, исходящий из эпителия более мелких бронхов или локализующийся в паренхиме лёгкого.При центральном раке по направлению роста выделяют экзофитный (эндоброн¬ хиальный) рак, когда опухоль растёт в просвет бронха; эндофитный (экзобронхи- альный) рак с преимущественным ростом опухоли в толщу лёгочной паренхимы; разветвлённый рак с муфтообразно перибронхиальным ростом опухоли вокруг бронхов. На практике чаще наблюдается смешанный характер роста опухоли с преобладанием того или иного компонента.При периферическом раке различают узловую округлую опухоль, пневмониепо¬ добный рак и рак верхушки лёгкого с синдромом Панкоста. При диаметре опухоли
РАК ЛЁГКОГО 453более 5 см за счёт недостаточного кровоснабжения всего массива опухоли может наблюдаться некроз и распад в центре узла с образованием полости. Её внутренняя поверхность бугристая, стенки имеют различную толщину, и она редко имеет связь ; с просветом бронха. В литературе данная форма периферического рака получила название полостной формы.Множественное метастатическое поражение лимфатических узлов средостения без установленной локализации первичной опухоли в лёгком принято считать , медиастинальной формой рака лёгкого.Нередко в паренхиме лёгкого выявляют множественные узловые образования различных размеров с преобладанием просовидных (до 5 мм). При отсутствии опухолевой патологии в других органах и морфологическом подтверждении рака в лёгком правомочен диагноз диссеминированной формы рака лёгкого. Из прак¬ тических же соображений и для удобства статистической обработки сведений онкологического регистра целесообразно в случае исключения центрального рака считать наибольший опухолевый узел в лёгком первичным очагом, а остальные — множественными метастазами в лёгочной ткани.ГИСТОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯМеждународная гистологическая классификация опухолей лёгкого включает многообразие эпителиальных опухолей.• I. Плоскоклеточный (эпидермоидный) рак:❖ а) веретеноклеточный (плоскоклеточный) рак.• II. Мелкоклеточный рак:❖ а) овсяноклеточный;❖ б) рак из клеток промежуточного типа;❖ в) комбинированный овсяноклеточный рак,• III. Железистый рак (аденокарцинома):❖ а) ацинарная аденокарцинома;^ б) папиллярная аденокарцинома;❖ в) бронхиолоальвеолярный рак;❖ г) солидный рак с образованием слизи.• IV. Крупноклеточный рак:❖ а) крупноклеточный нейроэндокринный;❖ б) базалоидный;❖ в) лимфоэпителиоподобный;■<> г) светлоклеточный;❖ д) крупноклеточный с рабдоподобным фенотипом.• V. Железисто-плоскоклеточный (диморфный) рак,• VI. Рак бронхиальных желёз:^ а) аденокистозный рак;❖ б) мукоэпидермоидный рак;❖ в) другие типы.• VII. Другие,В практической работе чаще используют отечественную гистологическую классификацию, учитывающую направление и степень дифференцировки клеток: плоскоклеточный рак делят на высокодифференцированный, умеренно диффе¬ ренцированный, малодифференцированный; аденокарциному — на высокодиф¬ ференцированную, умеренно дифференцированную, малодифференцированную и бронхиолоальвеолярный рак [14].С клинической точки зрения типы рака лёгкого различают по темпу роста и прогнозу. Медленнее всего развивается дифференцированный плоскоклеточный или железистый рак, быстрее — недифференцированный (мелкоклеточный, круп¬ ноклеточный). Недифференцированные формы рака лёгкого характеризуются
454 ОПУХОЛИ ЛЁГКИХбурным развитием, быстрым и обильным лимфогенным, а также ранним гемато¬ генным метастазированием.У мужчин преобладает плоскоклеточный рак (68%), аденокарцинома развива¬ ется редко (9,0%). У женщин аденокарцинома возникает в 4 раза чаще (до 40%). При среднем соотношении заболевших раком лёгкого мужчины/женщины 8,7:1, при плоскоклеточном раке это соотношение составляет 14,8:1, недифференци¬ рованном — 11:1 и аденокарциноме — только 2:1. При центральном раке лёгкого чаще встречаются плоскоклеточная и недифференцированные формы, а аденокар¬ цинома наблюдается в 4 раза чаще при периферическом раке. Лица моложе 40 лет чаще болеют недифференцированным раком.Бронхиолоальвеолярный рак (БАР), составляющий 3,6% всех наблюдений рака лёгкого, в прошлом имел много синонимов: альвеолярно-клеточный рак, аденоматоз лёгких, бронхиолярный рак и др. Морфологическими свойствами БАР являются незначительная способность ракового эпителия к разрушению тканей, в связи с чем сохраняются межальвеолярные сосуды и перегородки; слабость меж¬ клеточных связей, способность клеток опухоли к отторжению в просвет альвеол и миграция с образованием новых очагов роста (аэрогенное метастазирование). Выделяют локализованную (одноузловую и пневмониеподобную) и распростра¬ нённую (многоузловую, диссеминированную) формы БАР.КЛАССИФИКАЦИЯ РЕГИОНАРНЫХ ЛИМФАТИЧЕСКИХ УЗЛОВЛимфогенное метастазирование во внутригрудные лимфатические узлы идёт по путям лимфооттока. В настоящее время многие торакальные хирурги пользуются классификацией, предложенной Т. Naruke [15].С учётом анатомического строения бронхиального дерева, известных путей лимфооттока, топического расположения органов и структур средостения, техни¬ ческих особенностей операций на лёгком представляем адаптированную русифи¬ цированную систематизацию лимфатических узлов лёгкого и средостения.• I. Внутрилёгочные узлы:❖ лёгочные (пульмональные);❖ бронхолёгочные (бронхопульмональные);❖ корневые.• II. Верхние средостенные узлы:❖ трахеобронхиальные: паратрахеальные;❖ претрахеальные;❖ субаортальные;о- парааортальные;❖ ретротрахеальные;о передние средостенные;❖ наивысшие средостенные.• III. Нижние средостенные узлы:❖ бифуркационные (нижние трахеобронхиальные);❖ параэзофагеальные;❖ узлы лёгочной связки.Лёгогные лгтфатигеские узлы {lymph nodes pulmonales) располагаются внутри лёгкого у корней сегментов, окружают сегментарные и субсегментарные бронхи, принимая лимфу от сегментов лёгкого. По классификации Т. Naruke описанные узлы соответствуют субсегментарным (#14) и сегментарным (#13).Бронхолёгогные лимфатигеские узлы {lymph nodes bronchopulmonales) располага¬ ются вокруг (долевые — #12) и между (интерлобарные — #11) долевых бронхов. Бронхолёгочные узлы получают лимфу от доли(ей) лёгких соответствующей сто¬ роны. Выносящие лимфу сосуды анастомозируют между собой, создавая возмож¬
РАК ЛЁГКОГО 455ность дальнейшего поступления лимфы как в корневые, так и в трахеобронхиаль¬ ные (для верхней доли справа), субаортальные (для 1, 2,3 сегментов верхней доли слева) и бифуркационные узлы (для средней и нижних долей).Корневые лимфатигеские узлы (lymph nodes hilar) локализуются в клетчатке корня лёгкого; по передней, верхней и задней стенкам главных бронхов, вокруг лёгочной артерии и лёгочных вен соответствующих сторон (#10). Зона локализации корневых лимфатических узлов спереди офаничена диафрагмальным, сзади — блуждающим нервом, сверху — нижней стенкой непарной вены, снизу — нижней лёгочной веной. Некоторые авторы отдельно вьщеляют лимфатический узел нижней лёгочной вены, который прилежит к её нижней стенке и, относясь к корневым, является погранич¬ ным со средостенными лимфатическими узлами лёгочной связки. Таким образом, в зависимости от локализации в группе корневых лимфатических узлов вьщеляют передние и задние, верхние и нижние. Корневые лимфатические узлы получают лимфу от всего лёгкого, направляя её из передневерхних узлов по лимфатическим сосудам вдоль лёгочной артерии в верхние трахеобронхиальные, а из задненижних — в нижние трахеобронхиальные (бифуркационные).Группы пульмональных, бронхопульмональных и корневых лимфатических узлов составляют лимфатическую систему лёгкого и нередко в литературе имеют название — внутрилёгочные лимфатические узлы. Дальнейший ток лимфы проис¬ ходит через средостенные (медиастинальные) лимфатические узлы.Нижние трахеобронхиальные узлы (lymph nodes tracheobronchiales inferiores) рас¬ полагаются под бифуркацией трахеи в её развилке, между главными бронхами, и относятся к среднему средостению. Их чаще называют бифуркационными, а по классификации Т. Naruke — субкаринальными (#7). Спереди эта группа узлов прилежит к перикарду над левым предсердием, а сзади — к пищеводу. По суще¬ ству, это центральные лимфатические узлы для нижних долей обоих лёгких. В них впадают лимфатические сосуды, идущие от лёгких, сердца, пищевода, перикарда, а также от пульмональных и бронхолёгочных лимфатических узлов нижних долей. Выносящие лимфу сосуды идут к следующим группам средостенных узлов: верх¬ ним трахеобронхиальным (правым и левым), пре- и ретротрахеальным, а также часть сосудов впадают непосредственно в грудной лимфатический проток.Верхние трахеобронхиальные лимфатигеские узлы (lymph nodes tracheobronchiales superiores) располагаются латеральнее трахеи у места отхождения главного бронха соответствующей стороны (#4). Вверх (краниально) с обеих сторон от трахеи эти узлы плавно переходят в паратрахеальные, вниз — в корневые. Условной верхней границей между двумя группами средостенных лимфатических узлов справа явля¬ ется верхняя стенка непарной вены у места её впадения в верхнюю полую. Таким образом, правые трахеобронхиальные узлы медиально выполняют угол, образо¬ ванный трахеей и главным бронхом, а латерально прилежат к медиальной стенке непарной вены. Левые трахеобронхиальные узлы медиально прилежат к трахее и главному бронху у места формирования одноимённого угла, спереди — к артери¬ альной связке и начальному отделу левой лёгочной артерии, сзади — к пищеводу.К верхним трахеобронхиальным лимфатическим узлам лимфа поступает от нижних трахеобронхиальных (бифуркационных), бронхопульмональных верх¬ них долей и корневых соответствующих сторон, а также трахеи и пищевода. Выносящие лимфу сосуды идут в пара-, пре- и ретротрахеальные узлы и непосред¬ ственно анастомозируют с лимфатическим протоком.Паратрахеальные лимфатигеские узлы (lymph nodes paratracheáles) расположены цепочкой и залегают в клетчатке по бокам от трахеи (#2). Верхняя граница правых и левых лимфатических узлов данной группы проходит по уровню пересечения трахеи левой плечеголовной веной, передняя и задняя — на уровне условных лший, проведённых в сагиттальной плоскости по передней и задней стенкам тра¬ хеи соответственно.
456 ОПУХОЛИ ЛЁГКИХПравые паратрахеальные лимфатические узлы спереди прилежат к задней ст»- ке верхней полой вены, медиально — к боковой стенке трахеи, сзади граничат с блуждающим нервом, а латерально покрыты медиастинальной плеврой. Нижнжж граница — верхняя стенка непарной вены.Слева данная группа выражена слабо и представлена небольшими единичны}« лимфатическими узлами, прилежащими к дуге аорты, начальному отделу левм общей сонной артерии, трахее и пищеводу. Особенностью лимфатического аппара¬ та левого лёгкого является наличие дополнительных групп узлов, обусловленных анатомическим строением органов средостения: парааортальных, субаортальных.Парааортальные лимфатигеские узлы {lymph nodes paraaortic) относятся к переднему средостению и локализуются в клетчатке слева от восходящего отдела аорты и её дуги (#6). Зона данной группы медиастинальных узлов ограничена сзади диафрагмальным нервом, а спереди, сверху и снизу — условными линиями, проведёнными по передней стенке восходящего отдела аорты, верхней стенке дуги аорты, верхней стенке левой лёгочной артерии соответственно. Лимфоотток от парааортальных узлов возможен в пре- и левые паратрахеальные и передние средостенные.Субаортальные лимфатигеские узлы {lymph nodes subaorUc) расположены в заднем средостении, так называемом подаортальном окне, которое ограничено медиально — артериальной связкой, сверху — нижней стенкой дуги аорты, снизу — лёгочной артерией, сзади — передней стенкой нисходящего отдела аорты (#5). Данные лимфатические узлы непосредственно граничат каудально с корневыми и краниально с левыми трахеобронхиальными, что обусловливает лимфоток в дан¬ ной зоне. Через субаортальную зону проходят полунепарная вена и блуждающий нерв с отходящим от него возвратным, иннервирующем левую голосовую связку.Претрахеальные лимфатигеские узлы {lymph nodes pretracheales) локализуются в клетчатке впереди трахеи, от её бифуркации до уровня пересечения трахеи левой безымянной веной (#3). Богатая сеть лимфатических анастомозов, общность путей лимфооттока обусловливают интимную связь с узлами паратрахеальной клетчатки, преимущественно правой стороны и бифуркационной зоны.Пара- и претрахеальные лимфатические узлы получают лимфу от узлов преды¬ дущих групп, расположенных каудально, т.е. верхних и нижних трахеобронхиаль¬ ных, а также от трахеи и ретросгернальной клетчатки. Отсюда лимфа направляет¬ ся в наивысшие средостенные узлы и грудной лимфатический проток.Наивысшие средостенные лимфатигеские узлы (lymph nodes mediastinal superior) локализуются вокруг трахеи, вдоль общих сонных артерий, яремных вен и воз¬ вратных нервов выше уровня пересечения трахеи с левой плечеголовной веной (#1). в эту группу узлов впадают лимфатические сосуды от гортани, трахеи и лёг¬ кого, пищевода (шейная и верхняя части грудного отдела), щитовидной железы. Отводящие лимфатические сосуды впадают в глубокие шейные (надключичные) узлы, а также непосредственно в лимфатический проток.Передние средостенные лимфатигеские узлы (lymph nodes mediastinales anterior) располагаются в переднем средостении в верхнем межплевральном поле, кпере¬ ди от верхней полой вены, лёгочного ствола, восходящего отдела аорты (#3а). Условная верхняя граница — левая плечеголовная вена. В эти узлы лимфа оттекает от трахеи, лёгких, сердца, перикарда, вилочковой железы, щитовидной железы, диафрагмы. Выносящие лимфу сосуды идут к глубоким шейным и трахеальным лимфатическим узлам, а также впадают непосредственно в правый и левый ярем¬ ный лимфатические стволы, правый лимфатический проток, грудной проток и в некоторых случаях непосредственно в подключичную и внутреннюю яремную вены в венозном углу, у места их слияния.Задние средостенные лимфатигеские узлы (lymph nodes mediastinales posterior) располагаются вокруг пищевода, около грудного отдела аорты, в заднем сред осте-
РАК ЛЁГКОГО 457НИИ. в них лимфа поступает из лёгких, диафрагмы и пищевода. Выносящие лимфу g сосуды впадают в правые, левые и нижние трахеобронхиальные лимфатические . ё узлы, а в части случаев непосредственно в грудной проток. К данной группе узлов относятся параэзофагеальные, ретротрахеальные и предпозвоночные. Последняя группа лимфатических узлов заднего средостения не является регионарной для í;;. . лёгких.Параэзофагеальные лимфатигеские узлы {lymph nodes paraesophageat) расположе- ;;; мы по бокам от пищевода ниже уровня бифуркации трахеи, т.е. в среднем и нижнем ;,• > этажах (#8).Ретротрахеальные лимфатигеские узлы {lymph nodes retrotracheal) залегают вдоль пищевода за трахеей (#3р) — в верхнезаднем средостении.Лимфатигеские узлы лёгогных связок {lymph nodes ligamentum pulmonales) нахо¬ дятся в дупликатуре париетальной плевры, образующей лёгочные связки (#9). Топографически расположены парамедиастинально в заднем средостении, на 2-3 см ниже уровня отхождения нижней лёгочной вены и до диафрагмы.К ним направляется лимфа частично от плевры и нижних (внутренних) участ¬ ков лёгкого. Отток лимфы от данной группы узлов происходит в задние средостен¬ ные лимфатические узлы.Существующая закономерность и последовательность лимфооттока предопре¬ деляет этапность регионарного лимфогенного метастазирования рака лёгкого.В некоторых ситуациях (ранее перенесённые воспалительные заболевания) последовательность метастазирования нарушается: метастазы поражают лимфа¬ тические узлы следующего (высшего) этапа, минуя первоначальные группы узлов (<«^скачущий» вариант метастазирования), или метастазы выявляются в нижних федостенных узлах при локализации опухоли в верхних долях, т.е. против тока лимфы (ретроградное метастазирование).КЛАССИФИКАЦИЯ РАКА ЛЁГКОГО ПО СТАДИЯМ И СИСТЕМЕ TNMС целью систематизации распространённости опухолевого процесса общепри¬ нята Международная классификация рака лёгкого по системе TNM (пересмотр 2002 г.) [16].Символ «Т» характеризует размер или локализацию первичной опухоли:• Т^ — недостаточно данных для оценки первичной опухоли, наличие которой доказано только на основании выявления клеток рака в мокроте;• Тр — первичная опухоль не определяется;• Tjj — внутриэпителиальный (преинвазивный) рак {carcinoma in situ)',• Т^ — микроинвазивный рак сегментарного, долевого бронха, или опухоль до 3 см в наибольшем измерении, окружённая лёгочной тканью или висцераль¬ ной плеврой, без поражения последней;• Тз — периферическая опухоль более 3 см в наибольшем измерении или про¬ растающая в висцеральную плевру, а также центральный рак с поражением главного бронха дистальнее 2 см от киля бифуркации трахеи; или опухоль, сопровождающаяся ателектазом не всего лёгкого;• Tj — опухоль любого размера, непосредственно распространяющаяся на фудную стенку, диафрагму, медиастинальную плевру, перикард; или опухоль, поражающая главный бронх проксимальнеє 2 см от киля бифуркации трахеи, но без вовлечения последней; или опухоль с ателектазом всего лёгкого;• Т^ — опухоль любого размера, непосредственно распространяющаяся на серд¬ це (миокард), магистральные сосуды (аорта, общий ствол лёгочной артерии, верхняя полая вена), трахею, пищевод, тела позвонков, клетчатку и сфукту- ры средостения; или опухоль любого размера и локализации в сочетании со злокачественным плевральным выпотом, а также наличие дополнительного очага (отсев, метастаз) в той же доле на стороне поражения.
458ОПУХОЛИ ЛЁГКИХСимвол «N» характеризует состояние регионарных лимфатических узлов:• — регионарные лимфатические узлы не могут быть оценены;• Nq — нет метастазов во внутригрудных лимфатических узлах;• Nj — метастатическое поражение ипсилатеральных лёгочных, бронхопульмо¬ нальных и/или лимфатических узлов корня лёгкого, включая их вовлечение путём непосредственного распространения самой опухоли;• N2 — метастатическое поражение ипсилатеральных средостенных лимфатиче¬ ских узлов;• N3 — поражение контралатеральных средостенных, и/или корневых лимфа¬ тических узлов, и/или надключичных независимо от стороны поражения.Символ «М» характеризует отдалённые метастазы:• — отдалённые матастазы не могут бьггь оценены;• М„ — нет отдалённых метастазов;• — имеются отдалённые метастазы, включая узел в другой доле на стороне поражения.Для уточнения локализации очага метастазирования категория «М» может быть дополнена в соответствии со следующей номенклатурой: PUL — лёгкое, PER - брюшная полость, MAR — костный мозг, BRA — головной мозг, OSS — кости, SKI — кожа, PLE — плевра, LYM — лимфатические узлы, ADP — почки, SADP — надпочечники, НЕР — печень, ОТН — другие.При клинической оценке распространённости опухолевого процесса перед символа¬ ми TNM необходимо ставить критерий «с», а при посгхирургической оценке стадийно¬ сти (патогистологическая классификация) — критерий «р». Требования к определению категории рТ, pN, рМ аналогичны таковым при категориях сТ, cN, сМ. Категория «N» может бьггь оценена при исследовании не менее шести лимфатических узлов.С учётом особенностей клинического течения и прогноза в зависимости от соче¬ тания категорий, определяющих распространённость процесса (Т, N, М), опреде¬ лены следующие стадии рака лёгкого (табл. 26-1).Таблица 26-1. Стадии рака лёгкого с учётом Международной системы TNMСтадияПервичная опухоль (I)Регионарные лимфатические уалы (N)Отдалённые метастазы (М)Скрытый рактЧ0IN,Я1Ат,N„КIBт.ЧМсНАт,N,МпIIBт.N.Мо. т,Ч1I1Aт,N,м.т.N,м„т.N..IIIBт,N,Ма_.т.N.Мот.N,Ят.N..КIVМ-А. .. .М, ..
РАК ЛЁГКОГО 459До последнего времени при мелкоклеточном раке применяли систематизацию, предложенную Б1973 г. Veteran’s Administration Lung Cancer Study Group: «локали¬ зованный процесс» — поражение гемиторакса, ипсилатеральных средостенных и надключичных лимфатических узлов, контралатеральных корневых узлов, специ¬ фический экссудативный плеврит на стороне поражения; «распространённый процесс» — поражение обоих лёгких и метастазы в отдалённых органах. Между тем многолетние исследования показали, что и мелкоклеточный рак лёгкого имеет локорегионарную стадию развития, определяющую возможность хирур¬ гического компонента комплексного лечения, в настоящее время и для данной гистологической структуры рака лёгкого используется классификация по стадиям и Международной системе TNM.Анамнез и физикальное обследованиеКлиническая симптоматика зависит от клинико-анатомической формы и гисто¬ логической структуры, локализации, размеров и типа роста опухоли, характера метастазирования, сопутствующих воспалительных изменений в бронхах и лёгоч¬ ной ткани.При центральном раке лёгкого в самом начале развития опухоли в бронхе у 80-90% больных рефлекторно возникает сухой, временами надсадный кашель. Позднее, с нарастанием обтурации бронха, кашель становится продуктивным с отделением слизистой или слизисто-гнойной мокроты. Следует отметить, что у многих курильщиков кашель постоянный, особенно по утрам, нередко с мокротой. Изменение характера кашля у больных с хроническими обструктивными забо¬ леваниями лёгких, появление кровохарканья должно вызывать онкологическую настороженность.Кровохарканье, наблюдаемое у половины больных, проявляется в виде прожи¬ лок алой крови в мокроте; реже мокрота диффузно окрашена. В поздних стадиях заболевания мокрота приобретает вид «малинового желе».Одышка, наблюдаемая у 30-40% больных, выражена тем ярче, чем крупнее просвет поражённого бронха при центральном раке, или зависит от размера пери¬ ферической опухоли, т.е. степени сдавления анатомических структур средостения, особенно крупных венозных стволов, бронхов и трахеи.Боли в грудной клетке различной интенсивности на стороне поражения могут быть обусловлены локализацией новообразования в плащевой зоне лёгкого, осо¬ бенно при прорастании висцеральной плевры и грудной стенки, а также наличием плеврального выпота или ателектазом лёгкого с признаками обтурационного пневмонита.Таким образом, при раке лёгкого выделяют первигные, или местные симптомы, обусловленные появлением в просвете бронха опухолевого узла (кашель, крово¬ харканье, одышка и боли в грудной клетке), — эти симптомы, как правило, ранние; вторигные, обусловленные регионарным или отдалённьш метастазированием, вовлечением соседних органов и воспалительными осложнениями (боль в костях, лихорадка, осиплость голоса, отёчность лица); общие — следствие воздействия ва организм развивающейся опухоли и воспалительной интоксикации (слабость, утомляемость, похудание, снижение трудоспособности и др.).Объективное обследование (наружный осмотр, перкуссия, аускультация) имеет при раке лёгкого второстепенное значение, особенно при его распознавании на ранних этапах заболевания.Осмотр больного позволяет выявить асимметрию грудной клетки и отставание одной из её половин при дыхании.У 10% пациентов наблюдаются паранеопластические синдромы, связанные с пшерпродукцией гормонов (синдром секреции адренокортикотропного, анти- диуретического, паратиреоидного гормонов, эстрогенов, серотонина) [8, 17, 18],
460 ОПУХОЛИ ЛЁГКИХтромбофлебитом, различными вариантами нейро- и миопатии, своеобразш дерматозами, нарушениями жирового и липидного обмена, артралгическими ■ ревматоидноподобными состояниями [19, 20]. Нередко проявляется остеоартро- патия (синдром Мари-Бамбергера).Наиболее характерными симптомами периферического рака лёгкого являются боли в грудной клетке и одышка. Прорастание в бронхи сопровождается кашлем ■ кровохарканьем, но эти симптомы, в отличие от центрального рака, не являются ранними. Дальнейшая клиническая симптоматика не отличается от центрального рака лёгкого.При периферическом раке верхушки лёгкого возможно появление синдрома Бернара-Горнера (миоз, птоз, энофтальм) в сочетании с болями в плечевом суста¬ ве и плече, прогрессирующей атрофией мышц дистальных отделов предплечья, обусловленными непосредственным распространением опухоли через купол плев¬ ры на плечевое сплетение, поперечные отростки и дужки нижних шейных позвон¬ ков, а также симпатические нервы.Пальпация позволяет выявить увеличение печени и периферических лимфати¬ ческих узлов, в случае обнаружения увеличенных лимфатических узлов нижней трети шеи, надключичной, подмышечной групп или иных плотноэластичных образований в мягких тканях различных зон тела необходимо выполнить их пункцию с целью получения тонкоигольного биоптата (аспирата) для морфологи¬ ческого исследования.Перкуссия может помочь определить ателектаз легкого, заподозрить наличие жидкости в плевральной полости.Аускультация, один из ведущих методов клинического обследования (ослаблен¬ ное дыхание, хрипы стенотического характера), имеет определённое значение при оценке динамики развития рака лёгкого и диагностики осложнений.ДиагностикаПри подозрении на рак лёгкого, помимо тщательного анализа особенностей течения заболевания и патогенетического подхода к основным клиническим симп¬ томам, решающая роль принадлежит специальным методам исследования.РЕНТГЕНОЛОГИЧЕСКИЕ МЕТОДЫ Рентгенография и продольная томография органов грудной клеткиРешающее значение в рентгенологической диагностике центрального рака лёгкого имеют проявления стеноза бронха (сегментарного или долевого): экспи¬ раторная эмфизема, гиповентиляция, ателектаз, отчётливо видимые на обзорных рентгенограммах в прямой и боковой проекциях (рис. 26-1). Эти симптомы рань¬ ше обнаруживают при эндобронхиальном росте опухоли. При экзобронхиальном росте опухоль увеличивается вначале экспансивно в форме узла и лишь по дости¬ жении им определённых размеров, при сдавлении или прорастании бронха рентге¬ нологически проявляются нарушения бронхиальной проходимости.Томография, особенно в специальных проекциях, позволяет получить исчер¬ пывающую информацию о состоянии бронхиального дерева (стеноз, окклюзия, протяжённость поражения), характере и степени распространения опухоли на лёгочную ткань, окружающие органы и структуры (средостение, плевра, грудная стенка, диафрагма, внутригрудные лимфатические узлы). Поэтому у всех больных с заболеваниями лёгких томография является неотъемлемой составной частью рентгенологического исследования, позволяющей выявить или заподозрить сте¬ ноз, окклюзию бронха (ов) и оценить состояние проксимального бронха.Примерно у 30-40% больных центральный рак лёгкого диагностируют в стадии гиповентиляции и у половины — уже при возникновении рентгенологического синдрома ателектаза, являющегося завершающим этапом стеноза бронха.
РАК ЛЁГКОГО461Рис. 26-1. Центральный рак верхней доли левого лёгкого (ателектаз переднего сегмента). Рентгенограммы в прямой (а), боковой (б) проекциях.Диагностика периферического рака лёгкого сложна вследствие схоже¬ сти его рентгенологических симптомов с проявлениями многих заболеваний. Рентгенологическую диагностику этой формы рака лёгкого у абсолютного боль¬ шинства больных начинают с анализа патологических изменений, ранее обна¬ руженных на флюорограммах. Распространённое мнение о преимущественно шаровидной форме периферического рака лёгкого относится к опухолям, диаметр которых превышает 3-4 см (рис. 26-2). Опухоль диаметром до 2 см чаще представ¬ ляет собой полигональную тень в лёгочной паренхиме с неодинаковыми по про¬ тяжённости сторонами, напоминающую звёздчатый рубец. Относительно редко опухоль с самого начала имеет овальную или округлую форму. Характерна нечёт-^•с. 26-2. Периферический рак нижней доли левого лёгкого. Рентгенограммы в прямой (а) и боко¬ вой (6) проекциях.
462 ОПУХОЛИ ЛЁГКИХ- ¿' кость, как бы размытость контуров тени. Опухолевая инфильтрация окружающе! Щ. лёгочной ткани приводит к образованию вокруг узла своеобразной лучистости ^• ^ так называемой corona maligna. Полицикличность и лучистость контуров 6otACC характерны для недифференцированных форм рака, что, вероятно, обусловливае» / ' быстрый рост и высокие инвазивные свойства этих опухолей.. ■ ‘ Независимо от клинико-анатомической формы рака лёгкого выполняют тош»>' граммы в прямой и боковой проекциях на органы средостения, позволяющж уточнить состояние различных групп средостенных лимфатргческих узлов (бифур¬ кационных, паратрахеальных, клетчатки переднего средостения).Компьютерная томографияСовременные возможности КТ позволяют не только диагностировать цеи- тральный рак до появления симптомов нарушения вентиляции лёгочной тканяи но и выявлять начальные его формы, включая перибронхиально (разветвлённая^ узловая) растущие опухоли (рис. 26-3).Информативность КТ в первичной диагностике центрального рака лёгкого сопоставима с фибробронхоскопией, превышая последнюю при перибронхиаль¬ ном росте опухоли [24].КТ-семиотика периферического рака лёгкого до 3 см в диаметре при стандарт¬ ной методике исследования многообразна; образование шаровидной (59,7%) или овоидной (32,3%) формы со спикулообразными (45,2%) либо мелкобугристыми (30,6%) контурами, преимущественно однородной структуры (75,8%). Симптом «лимфогенной дорожки» к корню или плевре (рис. 26-4), характерный для рака лёгкого, определяется не во всех наблюдениях (19,4 и 30,5% соответственно).Реакцию висцеральной плевры над периферическим узлом — «пупковидное втяжение плевры» (рис. 26-5), являющуюся симптомом первичного рака лёгкого, обнаруживают только в 30% исследований.По мере увеличения размеров опухоли (свыше 3 см) чаще выявляют неправиль¬ но округлую (68,7%) или многоузловую (18,7%) форму новообразования, преоб¬ ладают крупнобугристые очертания (24,2%) и неоднородность структуры (94,5%) за счёт участков некроза или распада (рис. 26-6) [25].Наибольшие трудности для диагностики представляет пневмониеподоб¬ ная форма периферического рака лёгкого, особенно бронхиолоальвеолярного (рис. 26-7). При этой гистологической форме рака тень малоинтенсивная, но определяется симптом воздушной бронхограммы.Рис. 26-3. КТ органов грудной клетки в лёгочном окне (а) и мягкотканом окне (б). Центральный перибронхиальный рак верхней доли правого лёгкого (а) с переходом на главный бронх. Центральный перибронхиально-узловой рак верхней доли правого лёгкого (б) на уровне деления сегментарных бронхов.
РАК ЛЁГКОГО463Рис. 26-4. КТ органов грудной клетки в лёгочном окне (правый гемиторакс): а — периферический рак нижней доли правого лёгкого. Лимфогенная дорожка к корню лёгкого; б — периферический рак верхней доли правого лёгкого. Лимфогенная дорожка к плевре,Рис. 26-5. КТ органов грудной клетки в лёгочном окне (левый гемиторакс). Периферический рак верхней доли левого лёгкого с реакцией висцеральной плевры над образованием в виде пупковид¬ ного втяжения.При «полостной» форме периферического рака на компьютерных томограммах определяют толщину стенок полости, внутренняя поверхность полостей обычно шероховатая, бугристая (рис. 26-8),
464ОПУХОЛИ ЛЁГКИХРис. 26-6. КТ органов грудной клетки в лёгоч¬ ном окне. Периферический рак верхней доли правого лёгкого. Распад в опухолевом узле. Состояние после правосторонней мастэктомии.Рис. 26-7. КТ органов грудной клетки в лёгоч¬ ном окне (правый гемиторакс). Периферичесов бронхиолоальвеолярный рак верхней доли пра¬ вого лёгкого. Симптом воздушной бронхогрэ!*- мы на фоне опухолевого узла.Рис. 26-8. КТ в мягкотканом и лёгочном окне. «Полостная» форма периферического рака нижней доли правого лёгкого.
Рт. 26-9. Центральный рак верхней доли лево¬ го лёгкого на уровне деления верхнезонального бронха на сегментарные.РАК ЛЕГКОГО 465Неоспорима важность КТ в выявлении дополнительных мелких очагов (мета¬ стазов) в лёгочной ткани и визуальной оценке состояния медиастинальных лимфатических узлов, их взаимосвязи с соседними органами и структурами сре¬ достения. Однако выявление увеличенных (более 1 см) лимфатических узлов не всегда даёт возможность высказаться в пользу их метастатического поражения .'V :;- 127-29].Магнитно-резонансная томография не имеет преимуществ перед КТ в диагно¬ стике рака лёгкого,ФИБРОБРОНХОСКОПИЯФибробронхоскопию (ФБС) относят к основным и обязательным методам диа¬ гностики рака лёгкого. Различают прямые и косвенные, анатомические и функ¬ циональные бронхоскопические признаки рака лёгкого.К прямым анатомическим признакам рака относят:• инфильтраты слизистой оболочки в виде возвышения с бугристой, шерохова¬ той или ровной поверхностью;• бугристые, папилломатозные опухолевые разрастания различной формы и цвета с грибовидной гранулематозной и бугристой поверхностью (рис. 26-9, см. также цветную вклейку);• сужение просвета бронха эксцентрического или концентрического характера с ригидностью стенок.Эти признаки характерны для центрального рака с эндобронхиальным ростом н периферического с прорастанием бронхов.Косвенными анатомическими признаками рака являются:• седлообразная, уплощённая шпора бифуркации трахеи и главных бронхов;• уплотнение стенок бронхов, определяемое инструментальной пальпацией;• деформация гребня межсегментарной или субсегментарной шпоры;• стёртость рисунка хрящевых колец;• рыхлая, отёчная с локальной гиперемией, лёгко кровоточащая слизистая обо¬ лочка;• ограниченное расширение сосудов петлеобразного характера.Эти признаки бывают при центральном раке с перибронхиальным ростом,периферическом с подрастанием к стенкам бронхов и метастазах во внутригруд¬ ных лимфатических узлах.Косвенные функциональные признаки рака выражаются в:• неподвижности одной из половин гортани, стенок трахеи и бронхов;• локальном выпячивании мембранозной части крупных бронхов;
ШШ!?466 ОПУХОЛИ ЛЁГКИХ• отсутствии или ограниченной респираторной подвижности устьев сегмента^бронхов;• отсутствии передаточной пульсации сердца и крупных сосудов.Фибробронхоскопия — более эффективный метод диагностики при центражг*;ном раке, чем при периферическом [38]. Морфологическая верификация диагнояіі ^ достигается в 98-100% при центральной и в 66% при периферической форш*; заболевания. Направленная катетеризация бронхов под рентгенологическим кот- тролем повышает частоту морфологической верификации диагноза при перифе^ рическом раке до 95%.Наибольшие трудности в верификации диагноза возникают при перибронх»- альной форме центрального рака лёгкого, в подобных случаях биопсия стеши бронха имеет меньшую (55%) информативность в сравнении с трансбронхиал^ ной пункцией (71%) [39],Менее инвазивным методом морфологической верификации увеличенныж лимфатических узлов средостения является их трансбронхиальная и транстрахе¬ альная пункция при ФБС с учётом данных КТ [40-42]. Информативность цип>- логического исследования пунктатов увеличенных средостенных лимфатических; узлов при транстрахеобронхиальной пункции достигает 71-92%.В последние годы в первичной и уточняющей диагностике центрального рака лёгкого всё шире используются бронхоскопические аппараты, включающие • себя возможности рентгеноэндоскопии, эндосонографии и флюоресцентной эндо¬ скопии. Наиболее перспективным методом выявления скрытых микроочапж рака слизистой оболочки считается флюоресцентная эндоскопия, основанная на эффекте флюоресценции и регистрации концентрации в опухоли эндогенных фотосенсибилизаторов [43, 44].ТРАНСТОРАКАЛЬНАЯ (ЧРЕСКОЖНАЯ) ПУНКЦИЯТрансгоракальную (чрескожную) пункцию (ТТП) под ультразвуковым, рентге¬ нологическим или КТ-контролем с морфологическим исследованием полученного материала применяют при периферическом раке лёгкого в отсутствие морфо¬ логического подтверждения диагноза другими методами (рис. 26-10). Диагноз рака удаётся подтвердить в 83%: при локализации опухоли в прикорневой зоне — у 62%, в средней — у 79% и плащевой — у 88% больных. При диаметре новооб¬ разования до 3 см (Т^) результативность метода составляет около 70%, более 3 см (Т^-Тз) — 85-90% [8]. При периферической опухоли до 1 см результативность пункции составила 48,5%, от 1 до 1,5 см — 62,5% и от 1,6 до 2 см — 83,9% [45]. Цитологическое исследование материала позволяет определить гистологическую структуру опухоли примерно у 65% больных, причём у 40% — установить степень её дифференцировки.Возможны осложнения; пневмоторакс, гидроторакс, кровохарканье. Описаны крайне редкие осложнения ~ гемоторакс, воздзшіная эмболия, имплантационное метастазирование. Метод не применяют при патологической тени в единственном лёгком, подозрении на эхинококковую кисту, геморрагических диатезах, выра¬ женной сердечно-сосудистой недостаточности и лёгочной гипертензии.С целью морфологического подтверждения состояния увеличенных лимфа¬ тических узлов клетчатки переднего средостения трансторакальную пункцию вьшолняют под ультразвуковым контролем [46].ЭНДОСКОПИЧЕСКОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕИспользование эндоскопических датчиков при ФБС позволяет визуализировать периферический рак лёгкого, расположенный в прикорневой зоне, увеличенные бронхопульмональные, трахеобронхиальные, претрахеальные и бифуркационные лимфатические узлы и выполнить их трансбронхиальную пункцию [47]. При нали-
РАК ЛЁГКОГО 467:й^:аищй/Рмс. 26-10. КТ органов грудной 1слетки в лёгочном окне (положение больного на левом боку), Трансторакапьная пункция опухоли нижней доли правого лёгкого (опухолевый узел отмечен стрел- шй; по верхней полуокружности опухоли на фоне лёгочной ткани виден дистальный отдел иглы, входящей в новообразование).1чии увеличенных бифуркационных лимфатических узлов возможна пункционная биопсия под контролем эндоскопического УЗИ при эзофагоскопии [48,49].МЕДИАСТИНОСКОПИЯМедиастиноскопия остаётся «золотым стандартом» в диагностике лимф- аденопатии средостения при невозможности использования менее инвазивных методов диагностики [50, 51]. Наиболее часто используется для биопсии претра- хеальных, паратрахеальных лимфатических узлов, реже — узлов субаортальной и бифуркационной зон. Чувствительность метода 69-81% [52-54].ДМАГНОСТИЧЕСКАЯ ТОРАКОТОМИЯ И ВИДЕОТОРАКОСКОПИЯДанные диагностические операции показаны больным с периферическим шаро¬ видным образованием в лёгком, когда совокупность результатов перечисленных ранее методов диагностики не позволяет верифицировать процесс, а вероятность мокачественной опухоли остаётся высокой. Удельный вес таких операций среди ■сех торакотомий по поводу рака лёгкого составляет 9%. После интраоперацион- ■№ ревизии и срочной морфологической диагностики в зависимости от клиниче¬ ской ситуации операцию завершают адекватным объёмом резекции лёгкого, а при ■еобходимости дополняют медиастинальной лимфаденэктомией.ЛечениеДля правильного выбора метода лечения следует знать основные факторы про¬ гноза: стадию заболевания в соответствии с Международной классификацией по системе TNM, гистологическую структуру опухоли, степень её анаплазии, характер
468ОПУХОЛИ ЛЁГКИХ■1! 1ЯШ1зршши тяжесть сопутствующих заболеваний, функциональные показатели жизнен» важных органов и систем.ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕХирургическое лечение больных с резектабельными формами рака лёгкого является наиболее эффективным методом, дающим реальные перспективы изле¬ чения.Систематизация оперативных вмешательств при злокачественных опухолях лёгких• А. Объём оперативного вмешательства.I. Пневмонэктомия.❖ II. Резекция лёгкого:- анатомическая: лобэктомия; лобэктомия с резекцией и пластикой брон¬ хов; билобэктомия; сегментэктомия;- неанатолшческая (атипичная): клиновидная; плоскостная; прецизионная.^ III. Резекция трахеи (её бифуркации) и крупных бронхов с формированиемтрахеобронхиального(ых) или межбронхиального(ых) анастомозов (безудаления лёгочной ткани).❖ IV. Эндобронхоскопическая операция и фотодинамическая терапия:- удаление опухоли: электроэксцизия; лазерная деструкция; фотодинамиче¬ ская терапия;- реканализация трахеи и бронхов.• Б. Вариант оперативного вмешательства.❖ I. Типичная операция,❖ II. Расширенная операция,❖ III. Комбинированная операция.• В. Характер операции.❖ I. Радикальная.❖ II. Паллиативная.❖ III. Пробная (эксплоративная) торакотомия.Следует отметить, что при раке лёгкого наиболее оправданы пневмонэктомия (при необходимости с резекцией бифуркации трахеи), лобэктомия и её вари¬ анты, билобэктомия. При распространении опухоли на устье долевого бронха, когда невозможно выполнить типичную лобэктомию, проводят бронхопла¬ стическую операцию в объёме лобэктомии с клиновидной или циркулярной резекцией «соседних» бронхов и формированием межбронхиального анастомоза (рис. 26-11). Бронхопластические операции расширяют возможности хирур¬ гического метода и способствуют повышению резектабельности до 20% среди впервые выявленных больных раком этой локализации. У отдельных групп боль¬ ных в последние годы возможно проведение эндобронхоскопической операции- Меньшие объёмы резекции лёгочной ткани (сегментэктомия, неанатомическая резекция) оправданы при метастазах в лёгком и как компромиссный вариант у ряда больных с низкими функциональными резервами. Выбор объёма и характе¬ ра операции зависит от локализации и распространённости первичной опухоли, её отношения к окружающим органам и структурам, состояния внутригрудных лимфатических узлов.Под радикальной операцией (К^) следует подразумевать онкологически обо¬ снованное удаление поражённого органа или его резекцию в пределах здоровых тканей с клетчаткой и лимфатическими узлами зон регионарного метастазирова¬ ния. Радикальность вмешательства обязательно подтверждают макроскопически и результатами срочного и планового морфологического исследований ткани, рас¬ положенной по краю резекции.
РАК ЛЁГКОГО469Рис. 26-11. Верхняя лобэктомия справа с резекцией главного и промежуточного бронхов с формированием межбронхи¬ ального анастомоза; а — макропрепа¬ рат ~ удалённая верхняя доля правого лёгкого с резецированными участками главного и промежуточного бронхов; б — в глубине раны культя главного брон¬ ха с «клювом» двухпросветной эндоско¬ пической трубки; лёгочная ткань нижней и средней доли с культёй промежуточ¬ ного бронха; в — узловыми швами сфор¬ мирована медиальная стенка межброн¬ хиального анастомоза между культями главного и промежуточного бронхов.Операцию следует считать паллиативной при микроскопически (К,) выявлен¬ ных опухолевых клетках по линии резекции бронха, сосудов лёгкого или дополни¬ тельно резецированных структур и органов; макроскопически (К^) определяемой опухоли в остающейся части лёгкого, федостении, на плевре; интраоперационно морфологически подтверждённом опухолевом плеврите или перикардите; неадек¬ ватно выполненной медиастинальной лимфаденэктомии или неполном удалении метастатических средостенных лимфатических узлов.В случае невыполнения вмешательства на первичном очаге, регионарных вмфатических путях по объективным онкологическим и/или функциональным ■оказаниям операцию называют пробной.При типичной операции удаляют орган (лёгкое) или его часть (доля, сег¬ мент) с соответствующими внутрилёгочными (пульмональные, бронхопуль¬ мональные), корневыми лимфатическими узлами. Обязательно выполняют стандартную медиастинальную лимфаденэктомию, подразумевающую удаление трахеобронхиальных, бифуркационных, претрахеальных, параэзофагеальных, ■аратрахеальных (справа), субаортальных и парааортальных (слева), также Згзлов лёгочной связки.Расширенная операция преследует цель повышения радикализма за счёт балее широкого, чем при типичной, удаления средостенных лимфатических узлов.
470 ОПУХОЛИ ЛЁГКИХт.е. расширенную лимфаденэктомию (лимфатические узлы переднего средоствшиЦ ретротрахеальные, наивысшие средостенные и паратрахеальные слева). 4Комбинированная операция преследует, помимо типичного объёма вмея^, тельства, дополнительную резекцию по онкологическим показаниям соседи1|1| органов и/или структур средостения, диафрагмы, грудной стенки. Подобв1|| вмешательства включают множество различных по характеру, объёму и техня!' выполнения оперативных приёмов. В зависимости от выполненной резекций, соседних органов и анатомических структур грудной полости выделяют следу»: щие типы комбинированных операций.• I, Трахеобронхопищеводный тип:❖ резекция трахеобронхиального угла;❖ циркулярная резекция бифуркации трахеи;❖ резекция мышечной стенки пищевода.• II. Сосудисто-предсердный тип:-о- резекция перикарда;❖ резекция предсердия;❖ резекция лёгочного ствола;❖ резекция верхней полой вены;❖ резекция аорты или её адвентиции.• III. Париетально-диафрагмальный тип:резекция грудной стенки:- костальной плевры и внутригрудной фасции;- межрёберных мышц;- костных структур (рёбра, позвонки, ключица, грудина, лопатка);- тканей и структур поверхностного и среднего слоя грудной стенки;резекция диафрагмы.Противопоказания к хирургическому лечениюАбсолютными онкологическими противопоказаниями к операции на лёг¬ ком при злокачественных опухолях являются морфологически подтверждённьв метастазы в отдалённых лимфатических узлах (шейные, надключичные) или вну¬ тренних органах и тканях (головной мозг, плевра, печень, почки, надпочечники и др.); обширное прорастание первичной опухоли или метастазов в трахею, аорту, слизистую оболочку пищевода, дистальную треть противоположного главного бронха, верхнюю полую вену с образованием внутрипросветного опухолевого тромба, особенно в её интраперикардиальном фрагменте; вовлечение в опухоле¬ вый процесс лёгочного ствола, правой плечеголовной, левой общей сонной и под¬ ключичной артерий; опухолевая инфильтрация клетчатки средостения; специфи¬ ческий плеврит, перикардит.Серозная жидкость в плевральной полости, распространение опухоли на пери¬ кард, блуждающий и диафрагмальный нервы, грудную стенку, диафрагму, прокси¬ мальную часть правого главного бронха, правый трахеобронхиальный угол, пра¬ вую стенку трахеи или её бифуркацию, иногда на верхнюю полую вену, адвентицию аорты, ограниченное поражение мышечной стенки пищевода и множественные метастазы в средостенных лимфатических узлах не являются на сегодняшний день абсолютными противопоказаниями к оперативному вмешательству, поскольку расширенная и комбинированная операция, иногда в сочетании с лучевой или медикаментозной противоопухолевой терапией, у селективной группы больных даёт удовлетворительные результаты. Любой из перечисленных признаков, безу¬ словно, свидетельствует о значительном распространении опухолевого процесса, что ставит под сомнение возможность радикального хирургического и даже ком¬ бинированного лечения в биологическом смысле. Однако сочетание нескольких
РАК ЛЁГКОГО 471вышеперечисленных, так называемых относительных признаков неоперабель- ности может служить противопоказанием к хирургическому лечению, особенно у больнь^х с клиническими признаками «функциональной» неоперабельности.К функциональным противопоказаниям относят сердечную недостаточ¬ ность II и III степеней, обусловленную различными заболеваниями сердца; выра¬ женные органические изменения в сердце; декомпенсацию дыхания и снижение показателей ФБД на 40% от должных величин; гипертоническую болезнь, некон¬ тролируемую медикаментозно; выраженную почечную или печёночную недоста¬ точность; кахексию,КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЁГКОГОПод комбинированным лечением немелкоклеточного рака лёгкого (НМРЛ) подразумевают различные варианты сочетания радикальной операции и консер¬ вативных методов лечения (химиотерапия, лучевая терапия).Предоперационная лучевая терапия теоретически способствует уменьшению диссеминации опухолевых клеток при хирургических манипуляциях, создаёт предпосылки для расширения показаний к выполнению органосохраняющих опе¬ раций.Задачи послеоперационной лучевой терапии как компонента комбинированно¬ го лечения сводятся к воздействию на субклинические метастазы, которые могут оставаться в неудалённой клетчатке средостения и порой служат источником раз¬ вития внутригрудного рецидива и дальнейшего прогрессирования заболевания.Предоперационная химиотерапия заключается в повреждении опухолевых клеток, снижении степени их злокачественности, «санации» лимфатических путей лёгкого и средостения с целью предупреждения лимфогенного и гематогенного метастазирования.Послеоперационная химиотерапия воздействует на субклинические отдалён¬ ные метастазы с целью подавления жизнедеятельности опухолевой клетки.ЛУЧЕВОЕ ЛЕЧЕНИЕ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЁГКОГОРадикальная лучевая терапия предусматривает получение длительного и стой¬ кого эффекта в результате гибели всех клеток первичной опухоли и внутригрудных метастазов. При малодифференцированных формах рака в поле облучения вклю¬ чают и надключичные зоны.Существует много методических вариантов лучевой терапии рака лёгкого. Распространёнными являются методики классического фракционирования дозы (ежедневно в дозе 2 Гр); крупного фракционирования (4-5 Гр 2-3 раза в неделю); «уперфракционирования (двукратно по 1-1,5 Гр с интервалом 4-5 ч ежедневно); облучение расщеплённым курсом (суммарную очаговую дозу подводят в два этапа с 2-3-недельным перерывом), динамического фракционирования (по 4 Гр еже¬ дневно в течение 3 дней, затем по 2 Г^ ежедневно, 5 раз в неделю) [57,58]. Лучевая терапия по радикальной программе предусматривает подведение суммарных оча¬ говых доз не менее 60-80 Гр.С целью увеличения радиочувствительности опухоли применяют так называе¬ мые радиомодификаторы: гипербарическая оксигенация, искусственная гипертер¬ мия и др. С целью повышения устойчивости нормальных тканей облучение прово¬ дят в условиях гипоксии.Противопоказаниями к лучевому лечению обычно считают обильное крово¬ харканье или кровотечение, опухолевый плеврит, множественные отдалённые метастазы, обширное прорастание первичной опухоли или метастазов в сосуды средостения, пищевод, трахею; лейкопения (менее ЗхЮУл), тромбоцитопения (менее 100x1 оул), тяжёлая стенокардия, инфаркт миокарда, декомпенсирован- ные формы лёгочной, сердечно-сосудистой, печёночной и почечной патологии.
472ОПУХОЛИ ЛЁГКИХПОЛИХИМЙОТЕРАПИЯ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЁГКОГОХимиотерапию при немелкоклеточном раке лёгкого проводят при противопсиян^ занййх к хирургическому и лучевому лечению. Объективное улучшение (частйчняі; резорбция первичной опухоли, регионарных и отдалённых метастазов) настущвг у 6-30% больных, однако полная резорбция наблюдается редко. Химиотерашш малоэффективна при метастазах в костях, головном мозге и печени,ЗНДОБРОНХОСКОПИЧЕСКОЕ ЛЕЧЕНИЕПри ранних формах центрального НМРЛ (carcinoma in situ, микроинвазивный рак) основным методом лечения остаётся хирургический.В последние годы большое распространение получили альтернативные мето¬ ды эндоскопического лечения: лазерная деструкция, электроэксцизия опухош (рис. 26-12, см. также цветную вклейку), фотодинамическая терапия как в каче¬ стве самостоятельного варианта лечения, так и в сочетании с лучевой терапией [62-65]. Основными критериями в отборе больных для малойнвазивного эндоскоп пического лечения являются отсутствие рентгенологических, косвенных ЭНДОСКО“ пических признаков увеличения внутригрудных лимфатических узлов, отсутств! перибронхиального компонента опухоли по данным КТ, т.е, центральный неме»- коклеточный рак лёгкого Т, T^N^M^, TjNqMo. TjN^Mg.Метод фотодйиамической терапии центрального начального рака лёгкого осно- ваи на введении в организм пациента фотосеисибилизатора, который накаплива¬ ется в раковых клетках, затем с помощью бронхоскопа осуществляют облученжРис. 26-12. Электрокоагулйция начального центрального рака верхней доли правого лёг¬ кого: а — бугристые опухолевые разраста¬ ния на слизистой оболочке межсегментарной (01-2) шпоры; б — подведён злектрозонд для деструкции опухоли; в — состояние бронхиаль¬ ного дерева через 6 мес после лечения.
РАК ЛЁГКОГО 473опухоли лучами лазера определённой длины волны, что вызывает химические реакции на уровне клеточных структур, приводящие к гибели клетки [66, 67]. Метод имеет свои ограничения к использованию. Непосредственные результаты данного лечения хорошие, полная регрессия опухоли наблюдается у 62-98% боль¬ ных [68-70].ЛЕЧЕНИЕ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЁГКОГО I СТАДИИУ больных периферическим или центральным НМРЛ с поражением сегментар¬ ного или долевого бронха в отсутствие данных об отдалённых метастазах, увели¬ чении внутригрудных (средостенных и внутрилёгочных) лимфатических узлов, без инвазии новообразования в соседние органы, то есть при Т^Н^Мд, Т^НцМ^ про¬ водят хирургическое лечение. Пятилетняя выживаемость больных при ІА стадии (Т^ЫдМ^) составляет 63-81%, Ш стадии (T2NgMo) - 44-60%.При расположении злокачественной опухоли в паренхиме лёгкого некоторые исследователи допускают выполнение неанатомической сублобарной (клиновид¬ ной, плоскостной) резекции лёгкого у больных немелкоклеточным раком лёгкогоI стадии [77-79], При подобных операциях невозможно произвести ревизию бронхопульмональных лимфатических узлов. Частота локорегионарного реци¬ дива после подобных операций колеблется от 12 до 22,7% [80, 81], а отдалённые результаты на 14% ниже таковых после лобэктомии [82]. Полученные данные не позволяют считать экономные (сублобарные) резекции лёгкого без лимфа¬ денэктомии радикальным объёмом операции при периферическом раке лёгкого [Я Следовательно, «золотым стандартом» при НМРЛ ІА стадии следует считать лобэктомию с внутригрудной лимфаденэктомией.При отказе больного от хирургического лечения или невозможности его про¬ ведения по функциональным показателям применяют лучевую терапию как само¬ стоятельный метод лечения.ЛЕЧЕНИЕ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЁГКОГО II СТАДИИПри П стадии НМРЛ, т.е. распространении опухоли на главный бронх дис¬ тальнее 2 см от киля трахеи, поражении медиастинальной плевры, перикарда или врастании периферического узла в структуры грудной стенки, диафрагму без регионарных и отдалённых метастазов (Т^М^М^,), а также при меньшем размере первичной опухоли, но с метастазами в бронхопульмональных и/или корневых лимфатических узлах (Т^Ы,Мр, Т^М^М^), основным методом лечения также оста¬ ётся хирургический. При распространении опухоли на главный бронх, перикард, медиастинальную клетчатку, диафрагму, структуры грудной стенки необходимо выполнять комбинированную (с резекцией соответствующих структур) лоб-, бшюб- или пневмонэктомию.Пятилетняя выживаемость больных после хирургического лечения при II стадии НМРЛ в среднем составляет 46%: при ПА стадии — 32-59% и при ПВ — 32-69%. У пациентов с ^ и метастазами в лимфатические узлы Ы, пятилетняя выживае¬ мость существенно варьирует в зависимости от уровня поражения последних. Так, при метастазах только в бронхопульмональных лимфатических узлах она состав- иет 53-64%, а бронхопульмональных и корневых — 21-39%. Объём операции сам по себе не влияет на отдалённые результаты, так как лобэктомию или пневмо- юктомию выполняют по общим онкологргческим принципам.Послеоперационная полихимиотерапия у радикально оперированных больных по поводу НМРЛ II стадии не получила должного применения, сведения единич¬ ны, эффективность данного варианта комбинированного лечения не определена, |®еличения выживаемости не получено [93-95].По сводным данным литературы, трёхлетняя выживаемость больных НМРЛ1-11 стадий после самостоятельной Л)гчевой терапии составляет 20-75%, более5 лет переживают от 6 до 32% [58]. Проведение лучевой терапии с использовани¬
474ОПУХОЛИ ЛЁГКИХем в качестве радиомодификатора химиопрепаратов позволяет в целом повысит отдалённые результаты при НМРЛ I-II стадий до 43% [96],ЛЕЧЕНИЕ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЁГКОГО IIIA И IIIB СТАДИЙЗа последние два десятилетия расширены показания к хирургическому лечение больных раком лёгкого IIIА-В стадий за счёт выполнения сложных расширенных и комбинированных операций,Пневмонэктомию с резекцией бифуркации трахеи обычно вьшолняют при поражении проксимальной части главного бронха (Т^), распространении первин ной опухоли или прорастании метастазов средостенных лимфатических узлов ш трахеобронхиальный угол или карину (Т^,Комбинированная пневмонэктомия с различными вариантами резекции (кляк новидная, циркулярная) и реконструкции бифуркации трахеи при немелкоклеточь ном раке лёгкого (Тз_^) нами выполнена у 92 больных: более 5 лет пережили 42% при Ng и 12% при N^. Более благоприятные результаты достигаются при плоско- клеточном раке лёгкого, преимущественно эндобронхиальном росте, и отсутствии метастазов в средостенных лимфатических узлах.Лучшие отдалённые результаты достигаются при монорезекциях (только бифур¬ кации трахеи), чем в сочетании с резекцией соседних органов и структур средосте¬ ния (верхняя полая вена, пищевод, предсердие). Метастазы во внутрилёгочныж лимфатических узлах (N^) менее неблагоприятный фактор, чем в средостенных (N3) [8.103,105].Нередко операцию выполняют при врастании в мышечную стенку пищевода метастазов бифуркационных лимфатических узлов [106, 107J. Нами выполнены 31 пневмонэктомия с резекцией мышечной стенки пищевода, более 5 лет пере¬ жили 4 больных (12,9%).Резекцию предсердия при операциях по поводу рака лёгкого начали выполнять еще в 50~х годах прошлого века. До сих пор такое вмешательство остаётся наибо¬ лее сложным у больных, которым выполняют комбинированные операции. Нами обобщены данные литературы, согласно которым после 348 операций средний показатель пятилетней выживаемости больных равняется 13%, колеблясь от О до 25,6%. Лучшие показатели пятилетней выживаемости достигаются при отсутствии метастазов в регионарных лимфатических узлах, радикальном характере операции и плоскоклеточном раке лёгкого. При сочетанных комбинированных резекциях и поражении средостенных лимфатических узлов ни один больной не переживает пятилетний рубеж. Все больные, которым после пробной торакотомии при таком характере распространения процесса проводили консервативную противоопу¬ холевую терапию, умерли в течение первого полугодия, медиана выживаемости составила 3,9 мес.Публикации, посвящённые комбинированным операциям с резекцией верхней полой вены при раке лёгкого, единичны [106, 107, 112-114]. Пятилетняя выжи¬ ваемость составляет 11-36%. Следует отметить, что на отдалённые результаты не влияет объём удалённой лёгочной ткани и тип резекции верхней полой вены. Локорегионарный рецидив наблюдается реже при комбинированном лечении.При вовлечении первичной опухолью лёгкого или метастазами в средостенных лимфатических узлах аорты наиболее часто выполняют резекцию её адвентициа, реже — всей толщи стенки со вскрытием её просвета.F. Facciolo и соавт. (2001) дополнительным прогностическим фактором справед¬ ливо считают глубину инвазии грудной стенки и метод лечения. При инвазии опу¬ холи только в париетальную плевру пятилетняя выживаемость больных составля¬ ет 79,1%, мягкие ткани и рёбра — 52%. Лучшие результаты в целом достигаютс* при комбинированном лечении с послеоперационной лучевой терапией (74,1%) по сравнению с только хирургическим (46,7%) [125].
РАК ЛЁГКОГО 475Еще в 1982 г. F.G. Pearson и соавт. показали лучшие отдалённые результаты хирургического и комбинированного лечения больных НМРЛ с метастазами в средостенных лимфатических узлах, выявленных при плановом морфологическом исследовании, по сравнению с пациентами, у которых таковые были диагностиро¬ ваны до операции: пятилетняя выживаемость больных составила 41 и 15% соот¬ ветственно [127]. Прогноз лечения достоверно лучше у больных при единичных метастазах в средостенных лимфатических узлах, чем при их множественном поражении [128,129].Полученные нами данные подтверждают прогностическую значимость как локализации первичного очага, так и характера поражения средостенных лим¬ фатических узлов. При метастазах в одной группе средостенных узлов пятилет¬ няя выживаемость составила 31,6%, а в нескольких группах — 16,2%. Следует отметить, что при локализации опухоли в верхних долях с метастазами только в верхних федостенных узлах этот срок пережили 45,0%, а при поражении верхних и нижних — 7,2%. Аналогичная зависимость получена при раке нижних долей лёгких: более 5 лет пережили 17,4% больных с метастазами только в бифуркаци¬ онных и лишь 5,1% — в узлах нижнего и верхнего средостения.Таким образом, больные раком лёгкого с метастазами в средостенных лимфати¬ ческих узлах (pN^) — неоднородная группа с разным прогнозом. Неблагоприятными прогностическими факторами у больных НМРЛ niA(N2+) стадии являются пора¬ жение нескольких групп средостенных лимфатических узлов, локализация пер¬ вичной опухоли в нижних долях, особенно с метастазами одновременно в узлах нижнего и верхнего средостения.Послеоперационная летальность — основной показатель в оценке непосред¬ ственных результатов хирургического лечения больных раком лёгкого. В послед¬ ние два десятилетия прогресс в хирургии привёл к заметному снижению леталь¬ ности, составляющей 3,2-6,2%.Большинству пациентов с ПІА и ПІВ стадиями НМРЛ (исключая специфиче¬ ский плеврит, перикардит и метастатическое поражение лимфатических узлов группы N3) проводят дополнительное консервативное лечение [131-136]. Следует отметить, что у половины больных констатируют прогрессирование опухолевого процесса, преимущественно за счёт отдалённых метастазов [137], что обусловли¬ вает более широкое использование химиотерапевтичекого компонента в лечении.G. Stamatis и соавт. (1994) сообщают о клиническом эффекте неоадъювантной химиотерапии или химиолучевой терапии у 66,8 и 77,5% больных соответственно [138]. У 13-41% больных после предоперационной химиолучевой терапии уда¬ ётся добиться полной резорбции регионарных метастазов, что подтверждается патологоанатомическим исследованием [139, 140J. Однако на сегодняшний день ве удаётся получить достоверно значимое улучшение отдалённых результатов: пятилетняя выживаемость колеблется от 13 до 38% [141-143].При местно-распространённом НМРЛ (ПІА-В стадии) после самостоятельной лучевой терапии по радикальной программе более 5 лет переживают от 6 до 12% больных. Последовательное применение химиотерапии и лучевого лечения позво¬ лило добиться более высоких показателей выживаемости (до 20%) [144].В последние годы лучшие пятилетние результаты консервативного лечения НМРЛ при данных стадиях получены при одновременном использовании этих дв)’х методов [145].Лечение больных НМРЛ ПІВ стадии со специфическим плевритом и перикарди¬ том направлено на уменьшение степени выраженности проявления клинических симптомов. Химиотерапия на основе платиносодержащих препаратов увеличивает продолжительность жизни до 9 мес. Показатели отдалённой выживаемости низ- жие, приближаются к таковым при IV стадии болезни; более 1 года переживают 15% больных.
t ■’ 476 ОПУХОЛИ ЛЁГКИХliiiiiЛечение мелкоклеточиого рака лёгкогоМелкоклеточный рак лёгкого (МРЛ) характеризуется быстрым развитием, ним интенсивным лимфогенным и гематогенным метастазированием и плої прогнозом, У 80-90% больных диагностируют распространённый опухолевіЛ процесс. Поэтому многие годы МРЛ считали «терапевтическим» и противопоказа- ■ нием к хирургическому лечению.’: Сочетанное применение комбинированной химиотерапии и лучевой терашиї-Ї . i ;4“; МРЛ давно получило всеобщее признание и подтверждено многочисленными ра»*домизированными исследованиями [146,147],В настоящее время при І-П стадиях, особенно неовсяноклеточном морфологиь ческом подтипе МРЛ, возможно хирургическое лечение с последующей полихи¬ миотерапией (до 6 курсбв). Некоторые исследователи считают целесообразным проведение неоадъювантной (2-4 кзфса) и адъювантной полихимиотерапии даже при III стадии МРЛ. Пятилетняя выживаемость после комбинированного леченм в сочетании с хирургическим методом при I-II стадиях составляет 28-36%, луч¬ шие результаты достигаются при отсутствии метастазов в лимфатических узлах (45-49%). При III (N2+) стадии сведения противоречивы — более 5 лет пережива¬ ют от 5 до 40% больных [8,148-152]. Задача лучевой терапии при комбинировад- ном лечении - улучшить локальный контроль.Профилактическое облучение головного мозга показано пациентам с полной ремиссией при исходно ограниченном (I-II стадии) опухолевом процессе [153J.Больным с неоперабельным МРЛ III-IV стадий проводят консервативную про¬ тивоопухолевую терапию, сочетая химиотерапию с л>^евой [8,154], Современные методики такого лечения позволяют у 80-90% больных получить непосредствен¬ ный объективно регистрируемый эффект, у 20-30% из них — полную регрессию опухоли. Достижение полной клинической ремиссии после основного К}фса лече¬ ния увеличивает выживаемость больных и открывает перспективу излечения.список ЛИТЕРАТУРЬи>
Глава 27 Карциноидные опухоли лёгкихВведениеКарциноид — редкая злокачественная нейроэндокринная опухоль лёгкого, составляет 3-5% среди оперированных по поводу новооб¬ разований этой локализации. В отличие от рака лёгкого одинаково часто болеют мужчины и женщины, средний возраст пациентов — 45 лет [1-7], Отмечено, что в возрасте моложе 50 лет у женщин карциноид выявляют в 2 раза чаще, чем у мужчин [8]. Чаще встре¬ чается центральная клинико-анатомическая форма [9], преобладает (61%) правосторонняя локализация [10, 11], Развитие первично- множественньгк гормонозависимых опухолей (молочной железы, простаты) у пациентов, излеченных от лёгочного карциноида, может быть обусловлено генетической предрасположенностью [17].в связи с высокой выживаемостью больных после хирурги¬ ческого лечения долгое время карциноид относили к аденомам. Изучение ультраструктуры клеток выявило наличие специфических нейросекреторных гранул в цитоплазме клеточных элементов, при¬ сущих опухолям АРио-системы — апудомам, В 5-7% наблюдений ткань данной опухоли может секретировать гормонально-активные вещества (серотонин, адреналин, адренокортикотропный гормон (АКТГ)идр.) [18,19].КлассификацииКЛИНИКО-АНАТОМИЧЕСКАЯ КЛАССИФИКАЦИЯПо аналогии с раком лёгкого карциноид может локализоваться в лёгочной паренхиме и в бронхах, что предопределяет выделение центральной и периферигеской клинико-анатомической форм. При центральной карциноидной опухоли выделяют экзофитный, эндо¬ фитный и смешанный типы роста.ГИСТОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯСвоеобразие гистологической структуры и функциональной активности, наличие лимфогенного и гематогенного метастази¬ рования, возможность рецидивирования послужили основанием для выделения карциноидов в самостоятельную подгруппу злока¬ чественных эпителиальных опухолей лёгкого. В Международной гистологической классификации опухолей лёгких выделяют типиг- ный и атипигный варианты карциноида [20],
478 ОПУХОЛИ ЛЁГКИХ> . На основании морфологаческой структуры, электронно-микроскопических хар»-& теристик. клинического течения и прогаоза некоторые учёные предлагают с учёлщS дифференцировки клеток вьщелять три подтипа карциноида: высокодифференщ;^ ^ рованный (типичный), умеренно дифференцированный (атипичный), низкодиффе? ренцированный (анаплазированный) [5, 21]. Другие исследователи, рассматриважщ; целом нейроэндокринные опухоли лёгкого (карциноид, нейроэндокринный крупно¬ клеточный и межоклеточный рак), считают атипичный карциноид промежуточно* ступенью между типичным карциноидом и мелкоклеточным раком лёгкого [22-24].КЛАССИФИКАЦИЯ ПО СТАДИЯМ И СИСТЕМЕ TNMИспользуется классификация, аналогичная таковой для рака лёгкого.Клиническая симптоматикау 25% больных при центральной форме карциноида течение бессимптомное [25], у 50% отмечается кровохарканье, что обусловлено богатой васкуляризацией новообразования [26,27]. При медленном темпе роста карциноида вентиляцион¬ ные нарушения нарастают постепенно, что не приводит к резкой декомпенсащш дыхания. Однако некоторые пациенты предъявляют жалобы на приступы одыш¬ ки, напоминающие БА [28, 29], обусловленные, по всей видимости, клапанным механизмом обтурации на уровне главного бронха. Нередко в ателектазированной части лёгкого развиваются бронхоэктазы, пневмофиброз, пневмония, абсцесс, что приводит к функциональной недостаточности.Несмотря на секрецию опухолью гормонов и биологически активных веществ, карциноидный синдром при бронхолёгочной локализации наблюдается редко (1,5-5%) и чаще связан с микроинвазивными хирургическими манипуляциями или проявлением генерализации опухолевого процесса [4, 5, 30-35], Пациенты могут предъявлять жалобы на периодические приступы жара, чувство прилива крови к голове, шее и верхним конечностям, бронхоспазм, диарею, дерматоз, пси¬ хические расстройства.ДиагностикаОсновными методами диагностики карциноидных опухолей лёгких служат рентгенологическое, бронхологическое и морфологическое исследования. За счёт повышения содержания серотонина в крови в моче возможно повышение его метаболита (5-оксииндолуксусная кислота), что может быть подтверждено соответствующими лабораторными анализами, однако часто эти показатели не изменены [14],РЕНТГЕНОГРАФИЯ ОРГАНОВ ГРУДНОЙ КЛЕТКИПри центральном карциноиде в зависимости от уровня и характера поражения бронха на рентгенограммах выявляют нарушения бронхиальной проходимости (гиповентиляция, ателектаз) соответствующих отделов лёгкого. На томограммах у половины больных определяют типичную картину «аденомы» бронха: экзофитное образование с гладкой, чётко очерченной поверхностью, широким основанием, прилежащее к стенке бронха, частично или полностью обтурирующее его просвет. У Уз больных выявляют культю бронха с вогнзггой линией обрыва, выпуклостью в сторону главного бронха. Соответствующие отделы лёгкого уменьшены в объёме, а при ателектазе всего лёгкого наблюдается смещение средостения в сторону пора¬ жённого лёгкого.Семиотика низкодифференцированного карциноида мало отличается от рака (рис. 27-1). Для типичного периферического карциноида характерен медленный рост опухолевого узла и отсутствие данных за увеличение внутригрудных лимфа¬ тических узлов.
КАРЦИНОИДНЫЕ ОПУХОЛИ ЛЁГКИХ 470Рис. 27-1. Рентгенограммы органов грудной клетки в прямой (а) и боковой (б) проекциях. Умеренно дифференцированный (атипичный) периферический карциноид верхней доли правого лёгкого.КОМПЬЮТЕРНАЯ ТОМОГРАФИЯПри КТ карциноидные опухоли имеют высокую интенсивность сигнала, при¬ ближаясь к таковой при бронхолитиазе [38]. Для типичного центрального кар¬ циноида характерны ровные, чёткие контуры узла в просвете бронха, чаще при отсутствии утолщения стенки бронха и перибронхиальных тканей (рис. 27-2) [39]. При полной обтурации просвета бронха отмечается уменьшение объёма соответ¬ ствующего отдела лёгочной ткани, порой со смещением средостения (рис. 27-3). При периферическом карциноиде опухоль небольших размеров имеет округлую или овоидную форму с ровными, чётко очерченными контурами [39, 42]. Нередко в структуре определяются очаги большей плотности, расположенные хаотично или в центре новообразования [43, 44]. Для атипичного карциноида характерен больший размер узла при малых темпах роста, нечёткость контуров (рис. 27-4), ЗаРис. 27-2. КТ органов фудной клетки. Высоко¬ дифференцированный карциноид правого главно¬ го бронха.Рис. 27-3. КТ органов фудной клетки. Высокодифференцированный карциноид дистальной трети левого главного бронха. Уменьшение объёма левого лёгкого, смеще¬ ние средостения влево.
480 ОПУХОЛИ ЛЁГКИХІЙ'¥б-іРис. 27«4. КТ органов грудной клетш. Периферический атипичный карциноид верхне! доли правого лёгкого,Рис. 27-5. КТ органов грудной клетки • стандартном (а) режиме и с болюсным (6^ контрастным усилением. Периферическм1 типичный карциноид нижней доли левого лёгкого. Интенсивное накопление контра¬ ста и крупный «питающий» сосуд были вначале расценены как аневризма.счёт богатой васкуляризации карциноида изменения в паренхиме лёгкого могут имитировать артериовенозную аневризму (рис. 27-5).Выявление при КТ увеличенных средостенных лимфатических узлов более характерно для атипичного карциноида, обладающего более агрессивным течени¬ ем, однако при воспалительных явлениях в ателектазе лимфаденопатия нередко имеет и неопухолевый генез [46-48].ПОЗИТРОННО-ЭМИССИОННАЯ ТОМОГРАФИЯВ плане дифференциальной диагностики доброкачественной и злокачественной природы выявляемых изменений в лёгком ПЭТ не имеет дополнительных воз¬ можностей ввиду низкого метаболизма бронхиального карциноида [49,50].ФИБРОБРОНХОСКОПИЯПри ФБС карциноид бронха имеет чёткие ровные контуры, может локализо¬ ваться в любом бронхе, имеет хорошо выраженную сосудистую сеть и в связи с
КАРЦИНОИДНЫЕ ОПУХОЛИ ЛЁГКИХ 48tэтим розово-красноватый или темно-вишневый цвет, Ріадкая поверхность опухо¬ ли обусловлена неповреждённым зпителиальньш слоем слизистой оболочки. При инструментальной пальпации опухоль чаще мягкоэластичная, реже — плотной консистенции. Опухоль, как правило, подвижна, её можно обойти инструментом. Типичный карциноид чаще имеет неширокую ножку,С целью определения инфильтрации окружающей слизистой оболочки может выполняться флюоресцентная диагностика.После биопсии возможна повышенная кровоточивость опухоли за счёт вьфа- женного кровоснабжения [51], М.Е. Dusmet и соавт. (1996) наблюдали крово- течение лишь у 15 (2,6%) из 587 больных, которым была выполнена биопсия карциноида, кровотечение потребовало переливания препаратов крови и кровоза- менителей или экстренной операции [30].ДОПОЛНИТЕЛЬНЫЕ МЕТОДЫ ДИАГНОСТИКИС целью морфологической верификации периферических новообразований, как и при раке лёгкого, выполняют трансторакальную пункцию [14]. При атипич¬ ном карциноиде выявляют отдалённые метастазы, наиболее часто в печени, над¬ почечниках, костях и головном мозге [52]. С целью выявления локорегионарных и отдалённых метастазов применяют ультразвуковое исследование печени, надпо¬ чечников, забрюшинного пространства, надключичных зон, при необходимости — КТ органов брюшной полости, радионуклидное исследование костей скелета, МРТ позвоночного столба, костей таза, КТ головного мозга, морфологическое исследо- вание костного мозга и др.Пістологическая интерпретация биоптатов сложна, только у 76% больных на дооперационном этапе удаётся морфологически верифицировать карциноид [9]. Нередко для дифференциальной диагностики атипичного карциноида и мелко- клеточного рака лёгкого проводят иммуногистохимическое исследование или электронную микроскопию.ЛечениеОсновным и единственным методом радикального лечения карциноида лёгкого является хирургический [4,5,10, И, 14,28,29,53-56]. Некоторые авторы сообща¬ ют о применении послеоперационной лучевой терапии как этапа комбинирован¬ ного лечения у пациентов с метастазами во внз^’ригрудных лимфатических узлах, особенно средостенных [8, 56, 57]. В последние десятилетия активно применяют эндобронхоскопические операции, основная задача которых — попытка радикаль¬ ного излечения, восстановление проходимости дыхательных путей, ликвидация обструктивного пневмонита или ателектаза лёгкого (доли). Химиотерапия имеет ограниченные возможности, но возможна у больных с отдалёнными метастазами [58-61], В качестве симптоматической помощи применяют препараты, снижаю¬ щие уровень серотонина в крови, и группы интерферона [62-64]. Однако побоч¬ ные реакции некоторых препаратов превышают ожидаемый клинический эффект [63],ЭНДОБРОНХОСКОПИЧЕСКОЕ ЛЕЧЕНИЕЭндобронхоскопическуго хирургию применяют как этап подготовки больно¬ го к хирургическому лечению с целью реканализации просвета бронха [53], как самостоятельный альтернативный метод лечения высокоселективной группы пациентов [6, 65-70], При высоко- и умеренно дифференцированных централь¬ ных карциноидах с эндобронхиальным ростом опухоли, отсутствии увеличенных внутригрудных лимфатических узлов в плане радикального лечения выполняют эндобронхоскопические операции в виде петлевой электроэксцизии или лазерной термоабляции. Лазерную термоабляцию выполняют на первом этапе удаления
482 ОПУХОЛИ ЛЁГКИХРис. 27-6. ФБС в белом свете. Петлевая эле«* троэксцизия карциноидной опухоли шпоры доле¬ вого бронха.экзофитного компонента новообразования с целью тромбоза сосудов и предотвра¬ щения кровотечения. Коагуляцию опухоли осуществляют при последовательном использовании режимов дистанционного и контактного лазерного воздействия. За один сеанс возможна обработка всей поверхности экзофитной части опухоли для создания условий проведения второго этапа — тотальной петлевой электро¬ эксцизии. Третий, завершающий этап операции — аргоно-плазменная коагуляция (АПК) основания удалённой опухоли с целью обработки ножки и зоны роста опухоли в стенке бронха. При АПК практически отсутствует образование дьпла, риск перфорации стенки органа минимальный. В случае небольших размеров экзофитной опухоли с тонкой ножкой возможно петлевое удаление с последующей обработкой основания плазменными потоками (рис. 27-6).ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕХарактер и объём оперативного вмешательства при карциноидных опухолях отличаются от таковых при раке лёгкого. Во-первых, необходимость выполне¬ ния пневмонэктомии возникает в 3 раза реже, её удельный вес составляет 7-16% [5, 9, 65, 71]. Такой объём операции при центральном карциноиде обусловлен вторичными необратимыми гнойно-воспалительными изменениями в лёгочной паренхиме в результате длительной обтурации главного бронха. Во-вторых, при карциноидах линия пересечения бронха может отстоять от видимого края опухо¬ ли на 0,5-1 см без риска развития локального рецидива. В-третьих, основными оперативными вмешательствами при карциноидах являются органосохраняю¬ щие операции типа лобэктомии (67-71,8%) [9,11, 65, 71]. Следует подчеркнуть необходимость соблюдения принципов онкологического радикализма, т.е. удале¬ ния клетчатки с регионарными лимфатическими узлами, включая средостенные (рис. 27-7).Метастатическое поражение внутригрудных лимфатических узлов (К+) зависит от морфологического подтипа карциноида [9]. Метастазы (включая микромета¬ стазы) в лимфатических узлах выявляют в целом у 36% больных, при типичном внутрилёгочные узлы (NJ) поражаются у 27%, при атипичном — у 85%, а сре¬ достенные (N2) — у каждого четвертого при атипичном карциноиде. Рецидив в регионарных лимфатических узлах наблюдается у 5,4% оперированных [71].Пятилетняя выживаемость больных после хирургического лечения без учёта гистологического типа опухоли составляет 81%: при типичном карциноиде — 100% и атипичном — 90%. Отдалённые результаты лечения больных с низко дифференци¬ рованной формой карциноида (анаплазированный) малоутешительны: более 5 лет живут 37%, причём этот срок переживают лишь пациенты без метастазов (Ы^) или с поражением бронхопульмональных и корневых лимфатических узлов (М^),
КАРЦИНОИДНЫЕ ОПУХОЛИ ЛЁГКИХ 483ь j. J //i / -"г f; (пгн Í i| и;: íí ш ¡i;ii i f; W м [í '5Рис. 27-7. Бронхопластическая операция при типичном центральном карциноиде лёгкого; а — этап изолированной резекции левого главного бронха с последующим формированием полиброн- хиальных анастомозов. Отсечённые верхнедолеаой и нижнедолевой бронхи взяты на держалки. В просвете дистальной трети главного бронха карциноидная опухоль (рядом с кончиком зажима);б — макропрепарат—резецированный участок главного бронха с опухолью (смешанная форма роста с преобладанием эндобронхиального компонента).По данным зарубежных источников, при атипичном карциноиде более 5 лет при I стадии переживают 71%, при II - 46%, а при 1П - 37% больных [52]. В своих наблюдениях G. Cardillo и соавт. (2004) отмечают 100% пятилетнюю выживаемость при отсутствии регионарных метастазов (NJ независимо от типа карциноида. Однако при таковые показатели достоверно разнятся при типич¬ ном и атипичном карциноиде, 90 и 78,8% соответственно. Худшие пятилетние результаты отмечены в группе больных с атипичным карциноидом при N2 (22,2%) [7]. Показатели десятилетней выживаемости при I стадии удовлетворительны [14] и существенно не отличаются при типичном (87,3%) и атипичном (73,5%) карци¬ ноиде [9]. Общая пятнадцагилетняя выживаемость достигает 76% [25],Таким образом, карциноиды — наиболее благоприятно протекающие злокаче* ственные опухоли лёгкого. Морфологические подтипы карциноида отличаются разным потенциалом злокачественности в виде выраженности инфильтративного роста, темпа прогрессии и способности к метастазированию. Основным методом лечения является хирургический. Большинству пациентов удаётся выполнить органосохраняющие операции, а часто и сверхорганосохраняющие эндоскопи¬ ческие или полостнь1е вмешательства с сохранением всей лёгочной паренхимы. Значительному числу больных удаётся продлить жизнь на 15 лет и более.СПИСОК ЛИТЕРАТУРЫ г
Глава 28 Первичные злокачественные неэпителиальные опухоли лёгкихВведениеПервичные злокачественные неэпителиальные опухоли лёгкого (ПЗНОЛ) — собирательное понятие, объединяющее различные, клинически по-разному протекающие заболевания (саркомы, зло¬ качественные лимфомы и др.). Частота этой патологии составляет до 5% среди оперированных больных со злокачественными опухо¬ лями лёгких [1-3]. По данным одних авторов, ПЗНОЛ одинаково часто болеют мужчины и женщины, другие отмечают преоблада¬ ние мужчин, хотя значительно менее вьфаженное, чем при раке, В действительности этот показатель во многом зависит от гисто¬ логического варианта злокачественной опухоли [4]. Так, при ана¬ лизе 48 пациентов с неходжкинской первичной лимфомой лёгкого Р. Ferraro и соавт. (2000) сообщают о среднем возрасте 61,8 года и преобладании женщин (56%) [5].КлассификацииДо настоящего времени отсутствуют общепризнанные классифи¬ кации и систематизации ПЗНОЛ,КЛИНИКО-АНАТОМИЧЕСКАЯ КЛАССИФИКАЦИЯПервичные злокачественные неэпителиальные опухоли лёгких, подобно раку лёгкого, принято делить на центральные и перифе¬ рические. Целесообразно выделять эндобронхиальную, периброн- хиальную и смешанную форму роста при локализации опухоли в бронхе, а также одноузловую, многоузловую и пневмониеподоб¬ ную (инфильтративную) — при поражении паренхимы лёгкого. В отличие от рака лёгкого и карциноидных опухолей при ПЗНОЛ преимущественно (в 81,2%) встречается периферическая клинико¬ анатомическая форма [1J.ГИСТОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯДанные мировой литературы и многолетний опыт МНИОИ им. П.А. Герцена позволяют на основании клинического течения и отдалённых результатов лечения с учётом гистологических клас¬ сификаций опухолей мягких тканей и лёгких выделить основные морфологические группы ПЗНОЛ [1]:
ПЕРВИЧНЫЕ ЗЛОКАЧЕСТВЕННЫЕ НЕЭПИТЕЛИАЛЬНЫЕ ОПУХОЛИ ЛЁГКИХ485• саркомы (мягкотканые, хондросаркома, остеосаркома);• злокачественные опухоли лимфоидной ткани (болезнь Ходжкина, неходж- кинская лимфома, солитарная плазмацитома):• карциносаркома;• злокачественная параганглиома;• бластома;• неклассифицируемые саркомы.Среди первичных мягкотканых сарком лёгкого встречаются миогенные (лейо- миосаркома, рабдомиосаркома), ангиогенные (злокачественная гемангиопери- цитома или гемангиоэндотелиома), злокачественная фиброзная гистиоцитома, злокачественная шваннома, фибросаркома, липосаркома [2,6-12],КЛАССИФИКАЦИЯ ПО СТАДИЯМРазмер и локализация первичной опухоли, её отношение к окружающим орга¬ нам и тканям, а также характер (регионарное, отдалённое) метастазирования являются основополагающими факторами в оценке распространённости сарком и карциносарком, что позволяет использовать критерии TNM, как и при раке лёгкого, для определения стадии. Поскольку степень дифференцировки опухоли при саркоме является исключительно важным прогностическим фактором, целе¬ сообразно при окончательном установлении стадии добавлять категорию на основании которой определяют лечебную тактику (табл. 28-1).Таблица 28'1. Систематизация сарком по стадиям [1]ІСтадияВариантТ, G, N, М1аТ1 G1-4 NOMO, 12 G1-2 NOMOЬТ2 G3-4 NOMOIIаT1-2G1-2N1M0ЬТ1-2 63-4 N1M0IIIAаT3G1-2N1M0ЬТЗ G3-4 N0-1 МО, Т1-2 G1-4 N2M0IIIBа14 G1-2 NOMOЬТ4 G3-4 NOMO, Т1-4 G1-4 N3M0IVT1-4G1-4N1-3M1Клиническая симптоматикаКлиническая симптоматология ПЗНОЛ лишена патогномоничных призна¬ ков. Частота и выраженность симптоматики зависит от клинико-анатомической формы опухоли и степени её распросгранённости. У 7з больных с перифериче¬ ской опухолью небольших размеров заболевание протекает бессимптомно. При центральных опухолях наиболее частыми жалобами являются кашель, отделение мокроты, кровохарканье, боли в грудной клетке, а при развитии обтурационного пневмонита — повышение температуры тела, одышка и др. При злокачественных лимфомах преобладают общие симптомы — слабость, повышенная утомляемость, потливость, анемия, данные симптомы менее характерны для сарком.ІІ ; V*у';.'
486ОПУХОЛИ ЛёгкихДиагностикаЛУЧЕВЫЕ МЕТОДЫ ДИАГНОСТИКИДиагностика основывается на тех же принципах, что и при раке лёгкого. Отличительной особенностью периферической узловой формы саркомы диаме¬ тром до 5 см служит чёткая очерченность контуров тени на рентгенограммах и КТ органов грудной клетки, как при доброкачественной опухоли (рис. 28-1). При больших размерах контуры тени бугристые, бронхи оттеснены и раздвинуты. У ряда больных тень имеет причудливую форму (рис. 28-2) — грушевидную, бобо¬ видную или в виде трилистника. Пневмониеподобная форма чаще встречается при лимфомах, при этом тень неоднородная в связи с наличием на её фоне просветов сегментарных бронхов и их делений — симптом «воздушной бронхограммы*- (рис. 28-3).Выявление очагов высокой плотности в структуре узла может быть характер¬ ным для остеосаркомы, хондросаркомы, синовиальной или недифференцирован¬ ной саркомы [13].ФИБРОБРОНХОСКОПИЯПри бронхологическом исследовании визуальная семиотика непатогномонич- на. При пневмониеподобной и центральной форме наиболее результативна ФБС сРис. 28-1. Рентгенограммы в прямой (а), боковой (б) проекциях. КТ в лёгочном (в) и мягкотканом (г) окне. Периферическая саркома (морфологически — бластома) средней доли правого лёгкого.
ПЕРВИЧНЫЕ ЗЛОКАЧЕСТВЕННЫЕ НЕЭПИТЕЛИАЛЬНЫЕ ОПУХОЛИ ЛЁГКИХ 487морфологическим исследованием биоптата. В целом верифицировать диагноз до лече¬ ния удаётся у половины больных,МОРФОЛОГИЧЕСКАЯ ДИАГНОСТИКАВесьма низка информативность (15%) цитологического исследования мокроты. У половины больных диагноз устанавлива¬ ют интраоперационно. Дифференциальная гистологическая диагностика этих новооб¬ разований на светооптическом уровне часто затруднительна и для их идентификации необходимо применение дополнительных методик: иммуногистохимических, элек¬ тронной микроскопии и др.Рис. 28-2. Рентгенотомограмма правого гемиторакса. Периферическая гемангиоэн¬ дотелиома верхней доли правого лёгкого,Рис. 28-3. КТ в лёгочном {а) и мягкотканом окне (б). Симптом «воздушной бронхограммы». Неходжкинская лимфома верхней доли правого лёгкого.Клинико-морфологические характеристики первичных неэпителиальных злокачественных опухолейМЯГКОТКАНЫЕ САРКОМЫк гистологическим вариантам этой наиболее многочисленной группы относят миогенные саркомы (лейомиосаркома, рабдомиосаркома), ангиогенные сарко¬ мы (гемангиоперицитома, гемангиоэндотелиома). злокачественную фиброзную гистиоцитому, злокачественную шванному (нейросаркому), фибросаркому, липо- саркому и синовиальную саркому.
-^.и.»;= .л ®Й?| шя488 ОПУХОЛИ ЛЁГКИХМиогенные саркомыМиогенные саркомы — это наиболее часто встречаемая форма первичных мяг¬ котканных сарком лёгкого.Лейомиосаркома составляет 13-32% от всех сарком лёгкого и 1-1,4% от всех злокачественных опухолей лёгкого [15]. К данным новообразованиям относят опухоли, образующиеся в результате деления беспорядочно расположенных ати¬ пичных гладкомышечных волокон, проникающих в окружающие ткани и дающие метастазы. Их источником могут быть мышечные волокна бронхов и кровеносных сосудов. Макроскопически опухоль имеет вид серо-белого или серо-жёлтого узла с участками кровоизлияний и некроза [1, 16, 17]. При эндобронхиальной лока¬ лизации опухоль обычно мягкоэластичной консистенции с фиброзной капсулой- Микроскопически лейомиосаркома состоит из тесно расположенных овальных, удлинённых и веретенообразных клеток, кое-где ориентированных вокруг сосудов, которые иногда имеются в большом количестве. Клетки способны формировать короткие переплетающиеся пучки, характерна высокая митотическая активность (рис. 28-4, см. цветную вклейку). У каждого четвёртого больного (26,7%) обнару¬ живают очаги некроза в опухоли, а у каждого третьего - опухолевую инфильтра¬ цию окружающих тканей (37,6%). Этот гистологический тип чаще встречается в виде периферической (91,2%) клинико-анатомической формы, нередко (16,6%) выявляют врастание в бронх (централизация) [1].Рабдомиосаркома — редкая миогенная опухоль лёгкого. Выделяют следую¬ щие морфологические подтипы: альвеолярный, эмбриональный, плеоморфный. Последний характеризуется вьфаженным полиморфизмом клеток, часто встреча¬ ются гигантские клетки с одним или несколькими уродливыми ядрами (рис. 28-5. см. также цветную вклейку). Морфологический диагноз рабдомиосаркомы сло¬ жен и требует применения иммуногистохимических методик или электронно¬ микроскопического исследования,Ангиогенные саркомыСосудистые опухоли занимают второе место среди мягкотканых сарком. Им свойственна преимущественно периферическая (84,4%) форма, с вовлечением (18,5%) сегментарных или долевых бронхов. Увеличение регионарных лимфати-Рис. 28-5. Рабдомиосаркома (плеоморфная) лёгкого. Многоядерные клетки и клетки с уродливыми ядрами. Окраска гематоксилином и эозином. х400.
ПЕРВИЧНЫЕ ЗЛОКАЧЕСТВЕННЫЕ НЕЗПИТЕЛИАЛЬНЫЕ ОПУХОЛИ ЛЁГКИХ 489Рис. 28-6, Злокачественная гемангиоперицитома лёгкого, Веретенообразные клетки местами ори¬ ентированы к сосудам. Окраска гематоксилином и эозином. х400.ческих узлов при рентгенологическом исследовании констатируют у 43% боль¬ ных, при этом метастатическое их поражение при морфологическом исследовании выявляют лишь у 12,5% [1].Злокачественная гемангиоперицитома - опухоль сосудистого происхожде¬ ния, возникающая из периоцитов Циммермана. Микроскопически характе¬ ризуется пролиферацией умеренно полиморфных клеток, нередко с гиперх- ромными ядрами. Опухоль обладает высокой митотической активностью, постоянно встречаются очаги некроза и кровоизлияния (рис. 28-6, см. также цветную вклейку). Макроскопически она представляет собой узел серовато¬ розоватого цвета мягкой консистенции. Размер опухоли колеблется от 1,5 до 16 см [18]. Неблагоприятными прогностическими факторами считают размер образования более 8 см, распространение на соседние структуры и органы, а также наличие более трёх митозов в полях зрения [19]. До настоящего време¬ ни в литературе опубликованы сведения о 136 случаях данной разновидности сосудистой опухоли [1,19-22]. Рентгенологически опухоль определяется чаще в виде солитарного периферического узла, имеющего чёткие ровные контуры. На КТ имеет место мягкотканый характер узла, нередко с некрозом в центре [20].Злокачественная гемангиоэндотелиома (ангиосаркома) — более редкая форма сосудистых сарком, состоящая из неправильно анастомозирующих сосудов, выстланных одним или чаще несколькими рядами укрупнённых атипичных с полиморфными гиперхромными ядрами эндотелиальных клеток разной высоты (рис, 28-7, см. цветную вклейку), которые местами нагромождаются друг на друга, образуя многослойные пласты и сосочки [1]. Макроскопически периферическая гемангиоэндотелиома чётко отграничена от окружающей лёгочной ткани, на раз¬ резе серо-белого цвета, может напоминать хрящевую ткань [23]. В литературе описано не более 50 наблюдений гемангиоэндотелиом лёгкого [1, 24]. Данная опухоль развивается в любом возрасте, одинаково часто у лиц обоего пола [25, 26]. Нередко при КТ выявляют множественные, мелкие (до 3 см), хорошо очер¬ ченные очаги в обоих лёгких, иногда в сочетании с плевральным выпотом [27-29]. Морфологическая верификация подобных диссеминаций необходима в плане дифференциальной диагностики с гранулематозными процессами и метастатиче¬ ским поражением лёгких.
ІШіЛІШШ?490ОПУХОЛИ ЛЁГКИХЗлокачественная фиброзная гистиоцитомаЗлокачественная фиброзная гастиоцитома — наименее изученная из мягкотканых сарком лёгкого. Микроскопически опухоль образована переплетающимися пучками клеток и коллагеновыми волокнами, местами образующими «муаровые» структуры (рис. 28-8, см. цветную вклейку). Выделяют четыре гистологических подтипа этой саркомы: веретеноклеточная, плеоморфная, миксоидная и гигантоклеточная, или воспалительная [30]. Макроскопически опухоль имеет вид узла без чётких границ, серовато-жёлтого цвета мягкоэластичной консистенции [1, 31], С момента первого описания лёгочной локализащіи гистиоцитомы опубликованы данные о 36 больных: у 35 диагностирована периферическая, у 1 — центральная клинико-анатомическая форма [1,32]. Рентгенологически проявляется в виде медленно растущего солитарно¬ го узла со спикулообразными контурами [23], реже определяется многоузловая форма [33]. При расположении периферической опухоли в прикорневой зоне может вызы¬ вать пневмонит или ателектаз соответствующего отдела лёгкого за счёт централиза¬ ции [34]. Дополнительных семиотических признаков при КТ не выявлено [35,36].НейросаркомаНейросаркома (злокачественная шваннома) — опухоль, исходящая из оболочек периферических нервов, представлена веретенообразными клетками с овальными палочковидными или слегка изогнутыми гиперхромными ядрами, образующими переплетающиеся пучки, местами клетки располагаются равномерно, формируя палисадообразные структуры (рис. 28-9, см. также цветную вклейку). Основным дифференциальнодиагностическим критерием нейросаркомы является выявление с помощью иммуногистохимической реакции секреции белка 5-100. Макроскопически опухоль, как правило, представлена узлом плотноэластической консистенции серо¬ жёлтого или серого цвета с нечёткими контурами.ФибросаркомаФибросаркома — крайне редкая опухоль лёгкого, составляет около 16% всех первичных сарком данной локализации [37]. Пістологически она неотличима от соответствующих опухолей мягких тканей других локализаций (рис. 28-10, см. также цветную вклейку).Рис. 28-9. Злокачественная шваннома (нейросаркома) лёгкого. Полиморфные веретенообразные и многоядерные клетки. Окраска гематоксилином и эозином. х400.
ПЕРВИЧНЫЕ ЗЛОКАЧЕСТВЕННЫЕ НЕЭПИТЕЛИАЛЬНЫЕ ОПУХОЛИ ЛЁГКИХ 49*]Рис. 28-10. Фибросаркома лёгкого (опухоль из атипичных фибробластов), Видна зона инфильтра¬ ции лёгочной ткани. Окраска гематоксилином и эозином. х200.ЛипосаркомаЛипосаркома лёгкого встречается исключительно редко. В литературе описаны не более 16 наблюдений [1,8,38,39]. Макроскопически это плотный узел, на раз¬ резе жёлтого цвета, со структурами жировой ткани. Гистологически чаще соответ¬ ствует высокодифференцированным вариантам — фиброзирующая или миксоид¬ ная липосаркома (рис. 28-11, см, цветную вклейку). Рентгенологически липосаркома выглядит как периферический узел в паренхиме лёгкого с чёткими контурами, не имеющий дополнительных семиотических признаков. При высоко дифференциро¬ ванных морфологических типах и размерах более 3 см структура узла на КТ имеет жировую плотность. В плане дифференциальной диагностики, по всей видимости, может быть использована МРТ, позволяющая при жировых опухолях других локализаций выявить дополнительные семиотические признаки [23].Синовиальная саркомаСиновиальная саркома — недавно признанная, необычная первичная саркома лёгкого. Микроскопически опухоль включает эпителиальный и мезенхимальный компонент, в зависимости от преобладания которых может быть представлена четырьмя подтипами — бифазным, монофазным мезенхимальным, монофазным эпителиальным и недифференцированным [40-42]. В определении морфологиче¬ ской структуры и первичности синовиальной саркомы большое значение имеют иммуногистохимические реакции [43-45]. До настоящего времени опубликованы сведения о 60 случаях данной саркомы лёгкого [46], Средний возраст пациентов 47 лет, некоторые авторы сообщают о преобладании заболеваемости среди жен- пщн (83%) [46, 47]. Неблагоприятными факторами прогноза являются размер опухоли более 5 см, мужской пол и возраст старше 20 лет, обширные поля некроза, наличие более 10 митозов в 10 полях зрения [48].ХендросаркомаХондросаркома — крайне редкая опухоль лёгкого, происходящая из стенки брон¬ ха или из хондрогамартомы [1,49-51]. Микроскопически характерен полиморфизм и атипия клеток в межуточном веществе хондроидного характера (рис, 28-12, см. также цветную вклейку). Возможны кальцификация или оссификация.
492ОПУХОЛИ ЛЁГКИХРис, 28-12. Хондросаркома лёгкого. Видны элементы незрелого гиалинового хряща. Окраска гема¬ токсилином и эозином. х400.ОстеосаркомаОстеосаркома лёгкого встречается редко. Суммированные данные литературы отображают не более 18 случаев [3, 13, 52, 53, 54]. Морфологически она пред¬ ставлена веретенообразными клетками, миксоидной, хрящевой и костной тканью (рис. 28-13, см. также цветную вклейку). Средний возраст пациентов 62 года. Рентгенологически во всех наблюдениях выявлен солитарный периферический узел, чаще более 4 см. Практически все авторы сообщают о выявлении очагов высокой плотности в структуре узла на КТ, В литературе мы также встретили един¬ ственный случай описания первичной остеомы лёгкого [55].Рис. 28-13. Остеосаркома лёгкого. Формирование остеоида среди полиморфных клеток. Окраска гематоксилином и эозином. х400.
ПЕРВИЧНЫЕ ЗЛОКАЧЕСТВЕННЫЕ НЕЭПИТЕЛИАЛЬНЫЕ ОПУХОЛИ ЛЁГКИХ 493ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ ЛИМФОИДНОЙ ТКАНИЛимфомы развиваются в лимфатических узлах или лимфоидных тканях парен¬ химатозных органов (лёгкие, желудок, кишечник), а также в коже. Многие кли¬ ницисты полагают, что в большинстве случаев при первичной болезни Ходжкина лёгкого речь идёт о локальном проявлении системного заболевания. Однако за последние три десятилетия накоплен коллективный опыт клинических наблюде¬ ний изолированного поражения лёгкого.Болезнь ХоджкинаВ связи с редкостью заболевания лишь некоторые клиники располагают отно¬ сительно большим количеством наблюдений. Критериями первичности болезни Ходжкина в лёгком, по мнению большинства авторов, являются изолированная локализация опухоли в лёгком без поражения внутригрудных лимфатических узлов или с минимальным поражением последних [56]; исключение — пораже¬ ния внегрудных дистанционных лимфатических узлов и органов на основании клинических и патоморфологических данных [57]. Излюбленная локализация — перибронхиальная ткань прикорневой зоны. Микроскопически чаще выявляют смешанно-клеточный вариант и нодулярный склероз (рис. 28-14, см. цветную вклейку). Типичной ошибкой при гистологическом исследовании является непра¬ вильная трактовка полиморфных клеток с наличием клеток, напоминающих клетки Штернберга, как проявление лимфогранулематоза, а не крупноклеточной неходжкинской лимфомы [1].Неходжкимская лимфомаПервичная неходжкинская лимфома лёгкого составляет 4% от экстранодаль- ных поражений данной опухоли, менее 1% от всех больньпс с неходжкинской лимфомой и 0,5-1% среди злокачественных неэпителиальных опухолей лёгкого [58, 59]. В-клеточные лимфомы низкой степени злокачественности составляют до 87% неходжкинских лимфом (рис. 28-15, см. цветную вклейку), причём около 90% из них — это мукозоассоциированная лимфома [60, 61]. Одинаково часто болеют мужчины и женщины, средний возраст — 50-60 лет [62,63], При рутинном рентгенологическом исследовании выявляют нарушение лёгочной вентиляции или пневмонит сегмента или доли [62], Характерным КТ-признаком является симптом воздушной бронхограммы на фоне инфильтрации лёгочной ткани [64]. Менее чем у 10% больных выявляют двусторонние изменения, порой в сочета¬ нии с плевральным выпотом. При ФБС изменений в бронхиальном дереве чаще не наблюдается [62, 65]. Дооперационный диагноз лимфомы лёгкого труден, клинико-рентгенологическая картина в 75% случаев трактуется как рак лёгкого [66], Лишь у 25% больных удаётся морфологически верифицировать процесс в лёгком при трансторакальной пункции под контролем КТ [67]. Большинству (66,7%) пациентов с неходжкинской лимфомой требуется выполнение видеото¬ ракоскопии или диагностической торакотомии с целью морфологического под¬ тверждения диагноза [68].Солитарная плазмоцитомаСолитарная плазмоцитома лёгкого встречается редко [69-73]. Генез этого ново¬ образования окончательно не установлен. При микроскопическом исследовании опухоль представлена зрелыми плазматическими клетками в сочетании с лимфо¬ цитами, гистиоцитами и эозинофилами (рис, 28-16, см. также цветную вклейку). Фиброзная строма варьирует от едва заметных волокон до широких коллагено¬ вых пучков. Присутствуют тонкостенные сосуды [1]. Как и при лимфоме лёгкого, морфологическая верификация диагноза на дооперационном этапе затруднена, рентгенологическая картина не имеет своих особенностей.
494ОПУХОЛИ ЛЁГКИХРис, 28-16. Солитарная экстрамедуллярная плазмоцитома лёгкого. Атипичные плазматические клетки. Окраска гематоксилином и эозином. х400.КарциносаркомаКарциносаркома — опухоль, состоящая из двух злокачественных компонен¬ тов, — эпителиального и мезенхимального. Чаще эпителиальный компонент пред¬ ставлен плоскоклеточным раком, а стромальный — структурами полиморфно¬ клеточной и веретеноклеточной фибросаркомы (рис. 28-17, см. цветную вклейку). Макроскопически представляет собой узел серо-жёлтого цвета (у 64,3% больных), мягко- или плотноэластичной консистенции. Её чаще выявляют у мужчин, преи¬ мущественно пожилого возраста [1,3]. Диагноз карциносаркомы обычно устанав¬ ливают при плановом гистологическом исследовании операционного препарата.БластомаБластома — своеобразная опухоль, по строению нередко напоминающая лёгкое плода. В более ранних публикациях можно встретить синонимы «эмбриома», «эмбри¬ ональная саркома», «карциносаркома эмбрионального типа». При микроскопиче¬ ском исследовании эта опухоль имеет бифазное строение с преобладанием одного из незрелых компонентов (мезенхимального или эпителиального). Картина лишена каких-либо специфических признаков. Эпителиальные элементы представлены вет¬ вящимися, достаточно однотипными трубчатыми структ)фами, выстланными куби¬ ческими или полигональными клетками, которые могут формировать участки псев¬ достратификации (рис. 28-18, см. цветную вклейку). Строма бластомы представлена примитивной эмбриональной мезенхимой [1]. Бластома встречается одинаково часто у мужчин и женщин (1,4:1) в различные периоды жизни (1-77 лет). Чаще встречается периферическая клинико-анатомическая форма, размеры узла от 1 до 28 см [70],ЛечениеЛечение сарком лёгкого должно быть строго индивидуализировано с учётом факторов, влияющих на его результаты. При резектабельных формах боль¬ шинства злокачественных неэпителиальных опухолей лёгких хирургическое лечение до настоящего времени остаётся основным и наиболее эффективным. Дискутабельными остаются вопросы о комбинированном и комплексном лечении
%ПЕРВИЧНЫЕ ЗЛОКАЧЕСТВЕННЫЕ НЕЭПИТЕЛИАЛЬНЫЕ ОПУХОЛИ ЛЁГКИХ 495* • “ Карциноиды ■А Нвмелкоклеточный рак> “ СаркомыМелкоклеточный ракРис. 28-19. Отдалённые результаты хирургического (комбинированного) лечения больных со зло¬ качественными опухолями лёгких.сарком. Большинству (74%) больных удаётся выполнить органосохраняюш;ие опе¬ рации в объёме сублобарной резекции, лобэктомии, нередко с резекцией и пласти¬ кой бронхов, с соблюдением принципов онкологического радикализма [1].В целом пятилетняя выживаемость больных с первичной саркомой лёгкого составляет 52,0%, что статистически достоверно выше таковой при немелкокле¬ точном и особенно мелкоклеточном раке (рис. 28-19). Критическим периодом являются первые 3 года после операции, в течение которых умирают 43% боль¬ ных, как правило, от отдалённых метастазов, что подтверждает ведущую роль гематогенного метастазирования сарком лёгких [4].По данным P.M. McCormak и N. Martini (1989), из общего числа (42) больных с первичной мягкотканой саркомой лёгкого в целом более 1 года прожили 55%, 3 лет — 31%, 5 лет — 25%. После хирургического лечения более 5 лет прожили 37% больных, а из 13 пациентов, которым была проведена лучевая или симптома¬ тическая терапия, ни один не пережил двухлетний рубеж [2].Из 106 находившихся под нашим наблюдением больных с мягкоткаными сарко¬ мами лёгких после хирургического лечения более 5 лет в целом пережили 50,4%. Прогностическими факторами являются размер первичной опухоли; состояние внутригрудных лимфатических узлов; гистологический тип и степень дифферен¬ цировки саркомы. Больные с опухолью диаметром до 3 см, независимо от степени её дифференцировки, пережили 5 лет в два раза чаще, чем при опухоли размером 3,1-6 см и в три раза чаще, чем при опухоли 6 см и более — соответственно 86, 37 и 24%. В группе низкодифференцированных сарком, особенно диаметром более6 см, прогноз неблагоприятен, ни один больной не дожил до 5 лет, а при высоко¬ дифференцированных опухолях этот срок переживают около половины больных. Существует также прямая зависимость отдалённых результатов хирургического лечения больных с саркомами лёгкого от состояния внутригрудных лимфатиче¬ ских узлов. При их интактности трёхлетняя выживаемость в 2 раза больше (62 и 29%), а пятилетняя — в 4 раза больше (59 и 14%), чем при их метастатическом поражении. Лучшие отдалённые результаты в целом достигаются при ангиогенных саркомах (60,2%), злокачественной фиброзной гистиоцитоме (62,5%) и нейросар¬ коме (55,5%), менее благоприятен прогноз при миогенных саркомах (35,2%).
496 ОПУХОЛИ ЛЁГКИХ::.: в отдаленные сроки после операции по поводу саркомы легкого основной приьЩ чиной смерти (75,7%) явилось метастазирование в отдалённые органы, а у 24,3% — ||;,1, внутригрудной локорегионарный рецидив без поражения отдалённых органов.^ . Пятилетняя выживаемость оперированных нами больных с карциносаркомоя^’й-‘ ; > : лёгкого составляет 25%, что не отличается от таковой по данным зарубежнойШ-Г.'- " ^ ■ *■ литературы [3,74]. Прогноз при данной форме ПЗНОЛ зависит от стадии заболе- ^ ■ ■« вания и преобладания гистологического компонента опухоли — эпителиального или мезенхимального.Отдалённые результаты хирургического лечения больных с солитарной злока¬ чественной экстрамедуллярной плазмоцитомой лёгкого несколько выше (40%), что совпадает с таковыми в зарубежных публикациях: двух- и пятилетняя выжи¬ ваемость после хирургического лечения составляет соответственно 66 и 40% [70], Несмотря на радикальный характер операций, у 15-30% в ближайшие годы после лечения выявляют прогрессирование заболевания в виде множественных узлов [69]. Ввиду малого числа наблюдений достоверных сведений об эффективности лучевой и полихимиотерапии в плане комбинированного лечения злокачествен¬ ной опухоли лимфоидной ткани нет [7, 69,70].Наконец, удовлетворителен прогноз при первичной злокачественной неходж¬ кинской лимфоме лёгкого, пятилетняя выживаемость больных в целом составила 64%: при мелкоклеточной форме (низкой степени злокачественности) — 79,8% и крупноклеточной (высокой степени злокачественности) — 40%. Аналогичные показатели выживаемости больных опубликовали другие клиницисты [62, 75]. При крупноклеточной лимфоме целесообразно проведение адъювантной полихи¬ миотерапии [62].Таким образом, ПЗНОЛ следует рассматривать как излечимую болезнь, неред¬ ко с лучшим прогнозом, чем при немелкоклеточном раке лёгкого. Успех лечения зависит от своевременной диагностики заболевания. При резектабельных формах большинства ПЗНОЛ хирургическое лечение до настоящего времени остаётся основным, позволяющим продлить жизнь больных на 5 лет и более, у пациентов при Т^ 2 высокодифференцированной саркомы удаётся выполнить органосохраня¬ ющие операции с благоприятным прогнозом. Нерешённым остаётся вопрос о ком¬ бинированном лечении больных с саркомами лёгких. Применение современных, более активных противоопухолевых препаратов, возможно, позволит улучшить отдалённые результаты при умеренно и низкодифференцированных саркомах П и П1 стадий.СПИСОК ЛИТЕРАТУРЫ^
Рис. 1 -4. Последовательность проведения пальпации, перкуссии и аускультации грудной клетки.Рис. 1'5. Проекция долей лёгких на грудную стенку.
Рис. 1-6. Проведение исследования пиковой скорости выдоха.Рис. 4-1. Экзофитная опухоль.Рис. 4-2. Инфильтративный рак.
Рис. 4-3. Язвенная форма рака.Рис. 4-4. Перибронхиальный рак верх¬ ней доли правого лёгкого.Рис. 4-5. Бронхит I степени интенсив- -юсти воспаления.Рис. 4-6. Бронхит II степени интенсив¬ ности воспаления.Рис. 4-7. Бронхит III степени интенсив¬ ности воспаления.Рис. 4-8. Атрофический бронхит.
Рис. 4-9. Деформирующий бронхит.Рис. 4-10. Абсцедирующая пневмония — бронхит II степени интенсивности вос¬ паления.Рис. 4-11. Абсцесс лёгкого — густой гнойный секрет поступает из устья дре¬ нирующего бронха.Рис. 4-12. Аденома среднедолевого бронха.Рис. 4-13. Папилломатоз гортани.
Рис. 4-14. Инородное тело среднедолевого бронха.а — инородное тело полностью закрыто грануляциями; б — инородное тело (зуб) захвачено щипцами и извлечено.Рис. 5-6. Невринома заднего средостения слева. Гладкое округлое образование исходит из сим¬ патического ствола.
Рис. 8-4. Структура омализумаба [84]. ]1 — тяжёлые цепи; 2 — лёгкие цепи; 3 — мыии- | ный гипервариабельный участок. ^ОмализумабРис. 8-5. Комплексы омализумаба и IgE [91]. Структура комплексов зависит от соотношения количе¬ ства омализумаба и IgE. При молярном соотношении 1:1 иммунные комплексы образуют гексамеры {на рисунке справа).Рис. 18-3. Морфологические проявления формирования эмфиземы и утраты эластического сопро¬ тивления (по М. Saetta).а — терминальная бронхиола больного ХОБЛ с остатками участков прикрепления альвеол; б — лёгкое здорового человека.
Рис. 23-2. Этап операции. Циркулярная резекция трахеи. В каудальный отрезок трахеи проведён тонкий катетер ВЧ ИВЛ.Рис. 23-3. Стенты. используемые при ЭРПО: Т-образная силиконовая трубка, «расщеплённый зонд», созданный из участка термопластичной интубационной трубки.
Рис. 23-4. Виды эндопротезов: самофиксирующийся за счёт выступов на наружной поверхности: эндопротез с фиксацией лигатурой к мягким тканям шеи.Рис. 23-5. Баллонная дилатация стеноза трахеи (схема).с=С>Рис. 23-6. Схема операции (резекция трахеи, трансплантация тиреопаратиреотрахеального ком¬ плекса, реваскуляризация трансплантата), выполненной в ГУ «РНЦХ РАМН».
I Рис. 24-2. Облитерирующий бронхиолит {больная с ревматоидным артритом, 61 год}.I Морфология: пролиферация фибробластов и депозиция коллагена в подслизистом слое приводят кI уменьшению просвета бронхиолы, х 100.Облитерирующий бронхиолит Рис. 24-5. Облитерирущий бронхиолит с организующейся пневмонией: локализация воспаления.
Рис. 24-7. Острый бронхиолит при вирусной инфекции.Морфология; перибронхиальные инфильтраты из лимфоцитов и плазматических клеток, х 40.Рис. 24-8. Фолликулярный бронхиолит (больная с синдромом Шёгрена, 55 лет).Морфология; хронический воспалительный процесс вокруг бронхиолы с формированием лимфоид¬ ного фолликула (внизу), х 100. КТВР: маленькие центролобулярные (указано стрелками) и периброн¬ хиальные узелки, перибронхиальные утолщения и небольшие пятнистые поля «матового стекла».
Рте. 24-9. Диффузный панбронхиолит,Морфология: плогный перибронхиолярный инфильтрат состоящий в основном из мононуклеарных меток и вакуолизированных гистиоцитов, х 200. КТВР: центролобулярные узелки, синдром «дерево в почках» в нижних долях, утолщение и дилатация бронхов.Рис. 26-9. Центральный рак верх¬ ней доли левого лёгкого на уровне деления верхнезонального бронха на сегментарные.
Рис. 26-12. Элеетрокоагуляция начального цен¬ трального рака верхней доли правого лёгкого, а — бугристые опухолевые разрастания на слиз!*- стой оболочке межсегментарной (01-2) шпоры; б — подведён электрозонд для деструкции опу¬ холи; в — состояние бронхиального дерева через 6 мес после лечения.Рис. 28-4. Лейомиосаркома (эпителиоидно-клеточная) лёгкого. Умеренный полиморфизм. Окраска гематоксилином и эозином, х 400.
Рис. 28-5. Рабдомиосаркома (плеоморфная) лёгкого, Многоядерные клетки и клетки с уродливыми ядрами. Окраска гематоксилином и эозином. х400,Рис. 28-6. Злокачественная гемангиоперицитома лёгкого. Веретенообразные клетки местами ори- е!т1рованы к сосудам. Окраска гематоксилином и эозином, х 400.
Рис. 28-7. Злокачественная гемангиоэндотелиома (ангиосаркома) лёгкого. Полиморфные клеїш формируют атипичные сосудистые щели. Окраска гематоксилином и эозином, х 200.Рис. 28-8. Злокачественная фиброзная гистиоцитома лёгкого. Усиленное коллагенообразование, пёстрый клеточный состав, клетки типа клеток Тутона. Окраска гематоксилином и эозином, х 200.
Ліс. 28-9. Злокачественная шваннома (нейросаркома) лёгкого. Полиморфные веретенообразные и |»югоядерные клетки. Окраска гематоксилином и эозином. х400.Ліс. 28-10. Фибросаркома лёгкого (опухоль из атипичных фибробластов). Видна зона инфильтра- ірм лёгочной ткани. Окраска гематоксилином и эозином, х 200.
Рис. 28-11. Липосаркома (высокодифференцироеанная) лёгкого, Гиперхромия ядер, coxpaн^ зрелых лейкоцитов. Окраска гематоксилином и эозином. х200.Рис. 28-12. Хондросаркома лёгкого. Видны элементы незрелого гиалинового хряща. Окраска гема¬ токсилином и эозином. X 400.
Рис. 28-13. Остеосаркома лёгкого. Формирование остеоида среди полиморфных клеток. Окраска гематоксилином и эозином, х 400,Рис. 28-14. Первичный лимфогранулематоз {нодулярный склероз) лёгких. Крупные лакунарные оетхи Березовского-Штернберга. Окраска гематоксилином и эозином, х 200.
Рис. 28-15. Неходжкинская мелкоклеточная (высокодифференцированная) лимфома. Крупные кла¬ ки типа лимфоцитов. Окраска гематоксилином и эозином, х 200.Рис. 28-16. Солитарная экстрамедуллярная плазмоцитома лёгкого. Атипичные плазматическме клетки. Окраска гематоксилином и эозином, х 400.
9шс. 28-17. Карциносаркома лёгкого. Окраска гематоксилином и эозином.а — сочетание структур аденокарциномы и лейомиосаркомы. х200; б — саркоматозный компонент.*400.
Рис. 28-18. Бластома лёгкого. Строма напоминает эмбриональную ткань лёгкого, тубулярные стрр> туры. Окраска гематоксилином и эозином. х200.Рис. 29-6. Вадеоторакоскопическое удаление солитарного метастаза (а) с интраоперацион»**! ультразвуковым исследованием (б).
Рис. 31-2. Эхокардиограмма при массивной тромбоэмолии лёгочной артерии. Тромб в левой глав¬ ной ветви лёгочной артерии.Лю. 31-6. Ультразвуковая допплерофафия сосудов нижних конечностей. Флотирующий тромб в общей бедренной вене.
Рис. 31-9. Эхокардиограмма при ХТЭЛГ. Дилатация правого желудочка, парадоксальное движение межжелудочковой перегородки, уменьшение конечного диастолического объёма левого желудочка.Рис. 33-2. Интерстициальный и енутриальвеолярный отёк. Альвеолоциты второго типа: отёк, фраг¬ менты цитоплазматической мембраны, дегенеративные изменения базальной мембраны. Окраска гематоксилином и эозином, х 100 (препарат проф. А.Л. Черняева).
Рис. 33-3. Выраженная гиалиновая мембрана по контуру альвеол; интерстициальный отёк; ско¬ пление эритроцитов в альвеолах; полнокровие сосудов. Окраска гематоксилином и эозином, х 100 (препарат проф, А.Л. Черняева).Рис. 33-4. Фибриновый обтурирующий тромб; пролиферация эндотелиоцитов; умеренный отёк стенки сосуда с единичными лимфо1Д^тами. Окраска гематоксилином и эозином, х 400 (препарат проф. А.Л. Черняева).
Рис. 33-5. Организация экссудата в альвеолах; гиперплазия альвеолоцитов второго типа. Окраса гематоксилином и эозином, х 400 (препарат проф. А.Л. Черняева).Рис. 35-6. Ветвь лёгочной артерии (артериола) у больного ХОБЛ: гиперплазия интимы, умеренно выраженная гипертрофия медии. Окраска гематоксилином и эозином, х 200.
Рис. 35-8. Фиброз интммы сосуда с полной облитерацией просвета у больного с ИЛФ (указано стрелкой). Окраска гематоксилином и эозином. х200.Рмс. 36-3. Допплер-ЭхоКГ (расширение правых отделов сердца).
Рис. 38-2. Идиопатический лёгочный фиброз; КТВР (а) и гистологическая картина (б) (стрелкаш указаны фибропластические фокусы). Окраска гематоксилином и эозином. х20.Рис. 38-5. Обострение ИЛФ. КТ лёгких за 2 мес (а) и во время обострения ИЛФ (б). Гистологическая картииа (в); организация фибрина, гиалиновые мембраны по контуру альвеол, лимфоидная инфильтрация стенок альвеол. Окраска гематоксилином и эозином. х200.
Рис. 38-6. Неспецифическая интерстициальная пневмония: гистологическая картина (а) и КТВР (б).Рис. 38-8. Криптогенная организующаяся пневмония: гистологическая картина (а) и КТ (б),Рмс. 38-9. Десквамативная интерстициальная пневмония: гистологическая картина (а) и КТ
Рис. 38-10. Констриктивный бронхиолит, ассоциированный с интерстициальным заболеванием лёгких: гистологическая картина (а) и КТ (б).Рис. 38-11. Лимфоидная интерстициальная пневмония: гистологическая картина (а) и КТ (б).Рис. 38-12. Острая интерстициальная пневмония: гистологическая картина (а) и КТ (б). Стрелкаш показаны гиалиновые ленты.
Рмс. 43-1. Гемосадерофаш, полученные при бронхоскопии у больного ИГЛ.Рис. 44-1. Острая эозинофильная пневмония; скопление эозинофилов и нейіїрофилов в полостях альвеол и инфильтрация межальвеолярных перегородок. Материал аутопсии. Окраска гематоксили¬ ном и эозином. X100.
Рис. 44-2. Эозинофилы в осадке бронхоальвеолярного смыва пациента с лёгочной эозинофилией. Окраска азур-эозином, х 1000.Рис. 46-1. Гистологический препарат лёгкого при альвеолярном протеинозе. Структура альвеол не нарушена. Аморфное ацидофильное содержимое в альвеолярных пространствах. Окраска реактивом Шиффа (из архива д-ра мед. наук И.В. Двораковской).
Рис. 50-1. Диффузное альвеолярное повреждение: гиалиновые мембраны по контуру альвеол. Окраска гематоксилином и эозином, х 200.Рис. 71-7. Чрезбронхиальная биопсия лёгких: картина цитомегаловирусной пневмонии с типичными включениями в виде «совиного глаза». Окраска гематоксилином и эозином, х 200.
ШмМ ^ л^:.::^^Ш^...Рис. 71*9. Чрезбронхиальная биопсия лёгких: острое опоржение. Лимфоц1<ттарные инфильтрам вокруг артериолы, с распространением воспалительных клеток инфильтрата на альвеолярные пере¬ городки и воздушные пространства. Окраска гематоксилином и эозином, х 100.Рис. 71-10. Чрезбронхиальная биопсия лёгких; облитерируюш,ий бронхиолит. Асимметричное сужение просвета бронхиолы грубой рубцовой тканью (указано стрелкой). Окраска гематоксилином и эозином, X 250.
Глава 29 Метастатические опрли лёгкихВведениеМетастазирование опухолей является одной из важнейших про¬ блем современной онкологии. Впервые термин «метастаз» ввёл Recamier в 1829 г. Метастазирование (от греческого metastasis — перемещение) злокачественных опухолей в лёгкие подчиняется общим закономерностям, детально изученным в эксперименте и онкологической клинике, и вместе с автономностью роста и инва- зивностью является признаком опухолевой прогрессии. Основным путём метастазирования в лёгкие является гематогенный, реже — лимфогенный, аэрогенный и через диафрагму (их частота не пре¬ вышает 2-5%). Большое количество кровеносных сосудов в лёг¬ ких, густая капиллярная сеть, артериовенозные соустья, развитая лимфатическая система создают предпосылки для часгого развития метастазов в системе органов дыхания [1],ПатогенезПри гематогенном пути распространения опухолевые эмболы попадают в лёгкие через систему полых вен, оседают в артериолах, венулах, капиллярах и при наличии необходимых условий в лёгоч¬ ной ткани дают начало развитию метастаза. Метастазы чаще рас¬ полагаются в периферических отделах паренхимы лёгкого, нередко субплеврально. В некоторых случаях по мере роста опухолевые клетки проникают в лимфатические щели и сосуды, начинают распространяться перибронхиально и периваскулярно в направ¬ лении движения тока лимфы к корню. При массивном поражении паренхимы лёгких развивается картина ракового лимфангита, и лимфатические сосуды становятся основным путём распростра¬ нения метастазов. По лимфатическим сосудам опухолевые клетки достигают лимфатических узлов корней лёгких и средостения. В них опухолевые клетки задерживаются, размножаются, постепен¬ но замещая ткань лимфатического узла. Изменения в лимфатиче¬ ских узлах приводят к застою, функциональной недостаточности клапанного аппарата лимфатических сосудов, что создаёт условия для ретроградного метастазирования в лёгочную ткань. Опухолевые эмболы новообразований органов брюшной полости могут проде¬ лать иной путь. В результате ортоградного метастазирования этих опухолей в забрюшинные лимфатические узлы опухолевые клетки
Ö- •498 ОПУХОЛИ ЛЁГКИХпопадают в грудной лимфатический проток и током лимфы заносятся в веноэцщ) систему большого круга кровообращения и далее по гематогенному пути, омгг ш! ному выше [1-3]. ЦМетастазы в лёгких выявляют при первичном обследовании или в различии! сроки после лечения злокачественных новообразований у 6-30% больных с аш^ холями любой локализации. По данным аутопсий, метастазы в лёгких наибоощ часто обнаруживают при хорионэпителиоме, меланоме, остеогенной саркоме, почки и яичка (табл. 29-1).Таблица 29-1. Частота обнаружения метастазов некоторых злокачественных опухолей в легши (данные аутопсий) [4]Локализация первичной опухолиЖелудокОбодочная/прямая кишкаТело маткиМочевой пузырьГолова/шеяМеланомаШейка маткиПредстательная железаСаркома мягких тканейМолочная железаЯичкоПочкаОстеогенная саркомаХорионэпителиомаОтдалённые метастазы, %20-3020-4030-4225-3020-4060-8020-3015-2040-606070-8050-7550-7070-90Метастазы толысо в лёгких, %10121418182127273035КлассификацияВ клинической практике лёгочные метастазы подразделяют на солитарные (1 узел; рис. 29-1), единичные (2-3 узла; рис. 29-2) и множественные (>3 узлов; рис. 29-3), а по локализации — на одно- и двусторонние. Эта классификация про¬ ста и удобна для практического применения.Клиническая картинаКлинические проявления метастатического поражения лёгких скудные, посколь¬ ку в большинстве наблюдений метастазы располагаются в плащевой зоне лёгкого. Примерно у 70% больных заболевание протекает бессимптомно, поэтому обра¬ зование в лёгком выявляют случайно при рентгенологическом исследовании или в процессе динамического наблюдения. Лишь при прорастании в висцеральную плевру, грудную стенку или бронх появляются клинические симптомы (кашель, боли в грудной клетке, кровохарканье, одышка, повышение температуры тела). В 2-10% наблюдений опухоли метастазируют непосредственно в стенку бронха и проявляются симптоматикой, характерной для центральной первичной злокаче-
МЕТАСТАТИЧЕСКИЕ ОПУХОЛИ ЛЁГКИХ499Рис. 29-1. КТ органов грудной клетки: солитарный метастаз саркомы мягких тка¬ ней в верхней доле левого лёгкого.Рис. 29-2. КТ органов грудной клетки: единичные метастазы рака шейки матки в лёгких.шРис. 29-3. КТ органов грудной клетки; множественные метастазы рака почки в лёгких.сгвенной опухоли лёгкого с нарушением вентиляции соответствующей доли или сегмента [1, 5-7].Осложнениями солитарного, единичных и множественных метастазов могут бьггь перифокальная пневмония, распад в опухолевом узле, спонтанный пневмо¬ торакс, кровотечение, гиповентиляция сегмента либо доли, пневмония с абсцеди- рованием, плеврит и эмпиема плевры.ДиагностикаСолитарный метастаз — понятие клинико-рентгенологическое, под которым понимают выявление солитарной тени в лёгком доступными на сегодняшний день методами исследования. Действительно, у 10-15% больных диагностируют истинно солитарный метастаз, что подтверждают операционными находками и материалами аутопсий [2, 8].Основным методом диагностики метастатической опухоли лёгкого является рентгенологический. Возможности рутинного рентгенологического исследования при определении истинного количества метастазов в лёгких ограничены, посколь¬ ку мелкие узлы не всегда видны на рентгенограммах и томограммах, особенно при локализации в труднодоступных отделах лёгких, а также при диаметре не больше
500ОПУХОЛИ ЛЁГКИХпоперечного сечения сосудов лёгкого [9, 10]. Сложно при рентгенологичеаиіІ исследовании выявить метастазы в верхушках лёгких, диафрагмальных синуок прикорневых и субплевральных зонах. ^КТ позволяет выявить на 50-70% образований больше по сравнению с руімі| ным рентгенологическим исследованием. По мнению большинства исследоваїеі лей, КТ необходимо включать в обязательный алгоритм обследования больных метастазами в лёгких [9,11-13]. ^В последние годы активно изучают возможности ПЭТ в диагностике метастаз» в лёгких. Её чувствительность, специфичность и диагностическая точность, данным различных авторов, составляет 85-92%, 63-84% и 87-91% соответствев- но, что не превышает результативность КТ [14-16]. 1Чаще метастаз в лёгких приходится дифференцировать от периферическЫ1 первичной злокачественной, доброкачественной опухоли и очаговых пораженні неоп}^холевого генеза.При единичных, а тем более множественных тенях в лёгких на этапе начальной диагностики или после излеченной первичной опухоли диагноз метастатического поражения наиболее вероятен. Необходимо помнить, что рентгенологическая кар¬ тина ряда интерстициальных и очаговых неопухолевых заболеваний лёгких может имитировать их метастатическое поражение. Это подтверждается в публикациях зарубежных авторов, посвящённых синдрому организующейся пневмонии, имею¬ щей крайне динамичную рентгенологическую картину. Именно с наличием этого синдрома связывают ошибочные заключения о спонтанной регрессии метастати¬ ческих очагов в лёгких при раке почки и меланоме, если учесть, что гистологиче¬ ское подтверждение изменений в лёгочной ткани имелось всего у 20% больных [17,18],Сложнее обстоит дело при выявлении солитарной тени в лёгком у ранее лечен¬ ных больных по поводу онкологической патологии. Дифференциальная диагно¬ стика первичной опухоли и метастатического поражения лёгкого в этой сшуации сложна. Только хирургическое вмешательство с гистологическим исследованием удалённого препарата помогает установить правильный диагноз. По данньлм А,Х. Трахтенберга, В.И. Чиссова (2000), из 219 больных с выявленной солитар¬ ной тенью в лёгком после излеченной ранее первичной опухоли метастатический характер был подтверждён лишь у 139 (63,5%), а у остальных (36,5%) образова¬ ние оказалось метахронной первичной злокачественной опухолью.По данным литературы, метастатическое поражение лёгких подтверждают в среднем у 60%, метахронный первичный рак лёгкого — у 28% и доброкачествен¬ ную опухоль - у 12% больных (табл. 29-2) [1, 6,19-21].Таблица 29-2. Вероятная природа солитарной метахронной тени в лёгком у больных, ранее лечен¬ ных по поводу злокачественных новообразованийЛокализация первичной опухолиВероятность, %МетастазПервичный рак лёгкогоДоброкачественная опухольСаркома10000Толстая кишка70-9010-3010-15Молочная железа70-8020-3010-15Почка60-7020-3010Кожа40-5050-6010Матка40-5050-6010Полость рта4060-Гортань10-2080-90-При появлении очагов в лёгких, изменений на плевре и увеличении внутригруд¬ ных лимфатических узлов у больных, ранее леченных по поводу различных зло¬
МЕТАСТАТИЧЕСКИЕ ОПУХОЛИ ЛЁГКИХ 501качественных новообразований, возникает проблема их трактовки. Является ли это проявлением прогрессирования заболевания или неопухолевой патологией? В этой ситуации клиницист находится перед дилеммой: проводить лекарственное противоопухолевое лечение или нет? Даже выявление единичных и множествен¬ ных теней в лёгких на этапе начальной диагностики или после излеченной первич¬ ной опухоли не всегда свидетельствует о метастатическом поражении.В МНИОИ им. П.А. Герцена в качестве завершающего этапа диагности¬ ки используют видесторакоскопию. У всех пациентов при рентгенологическом исследовании органов грудной клетки, включая КТ, определялись изменения в лёгочной ткани, плевре и/или внутригрудных лимфатических узлах, которые трактовали как метастатическое поражение. Изолированное поражение лёгкого констатировано у 24 (70,6%), плевры — у 4 (11,8%), внутригрудных лимфати¬ ческих узлов — у 2 (5,8%) больных. Сочетание изменений лёгочной паренхи¬ мы и лимфатических узлов диагностировали у 2 (5,8%), лёгкого и плевры — у 2 (5,8%) больных.Таким образом, видеоторакоскопия является информативным методом завер¬ шающей диагностики патологии лёгкого, плевры и средостения, выявленной при динамическом наблюдении онкологических больных.ЛечениеВыбор метода лечения больных с метастазами в лёгкие зависит от локализации и гистологической структуры первичной опухоли, характера ранее проведённого лечения и его эффективности, сроков выявления метастазов после окончания лечения первичной опухоли, количества и локализации метастазов в лёгком, состояния внутригрудных лимфатических узлов. Принципиальньпй моментом считаем дифференцированный подход к выбору лечебной тактики у больных с метастазами в лёгких. В зависимости от чувствительности метастазов к химио- гормоноиммунотерапии выделяем две группы:• I группа — метастазы, чувствительные к лекарственному противоопухолевому лечению (злокачественные опухоли яичка, остеогенная саркома, хорионэпи- телиома, рак молочной железы, высоко дифференцированный рак эндометрия идр.);• П группа — метастазы, резистентные или обладающие низкой чувствительно¬ стью к указанному методу терапии (рак толстой кишки, почки, шейки матки, меланома, саркома мягких тканей, хондросаркома).При морфологически подтверждённых лёгочных метастазах I группы на первом этапе предпочтение отдают лекарственному противоопухолевому лечению и только при его неэффективности решают вопрос об оперативном вмешательстве. У больных с метастазами II группы в первую очередь рассматривают возможность их удаления.Оперативные вмешательства при внутрилёгочных метастазах условно разделя¬ ют на следующие типы:• «радикальные», когда возможно полное удаление всех метастатических очагов;• паллиативные, с целью предупреждения или устранения осложнений опухо¬ левого процесса (кровотечение, пневмоторакс, бронхостеноз, абсцедирова¬ ние в зоне ателектаза, распад в опухолевом узле), а также для уменьшения опухолевой массы с целью создания благоприятных условий для проведения последующего консервативного противоопухолевого лечения;• пробные.В настоящее время сформулированы критерии отбора больных, у которых воз¬ можно хирургическое лечение внутрилёгочных метастазов: отсутствие рецидива нервичной опухоли по данным комплексного обследования, изолированное мета¬
«Ш®:-502 ОПУХОЛИ ЛЁГКИХстатическое поражение лёгких, техническая возможность удаления метастаза (<^ функциональная операбельность больного [1, 8,19, 24,25].Активная хирургическая тактика при метастатическом поражении лёгких нахо¬ дит все больше сторонников, хотя по отношению ко всем больным с лёгочньаш метастазами хирургическое лечение удаётся провести не более чем у 5-10% боль¬ ных. Резектабельность, по данным различных исследователей, составляет 76-97% [24-26]. Значительному контингенту больных отказывают в оперативном вме¬ шательстве и проводят лекарственное противоопухолевое лечение, зачастую 6в учёта чувствительности метастазов.В настоящее время общепринятыми доступами при хирургическом лечении лёгочных метастазов является торакотомия, стернотомия и билатеральная торв- котомия. Стернотомию и билатеральную торакотомию используют для удалениш двусторонних метастазов. В последнее время чётко просматривается тенденции к одноэтапным хирургическим вмешательствам. Стернотомия, торакотомия, таи более билатеральная — травматичные оперативные доступы.Альтернативой является видеоассистированное удаление метастазов с испольг зованием доступа под мечевидным отростком для двусторонней ревизии плев¬ ральных полостей (рис. 29-4). Методика выполнения операции подробно onncaiB Т.е. Mineo и соавт. (2001) [27]. Преимущества доступа: возможность мануальной пальпации всех сегментов лёгкого; одноэтапное удаление билатеральных мета¬ стазов; меньшая травматичность по сравнению со сгернотомией и билатеральной торакотомией.Общепринятым является щадящий подход при хирургическом лечении мета¬ статических опухолей лёгких, у 60-70% больных выполняют экономную субло- барную резекцию (краевую, клиновидную, прецизионную) и сегментэктомию, реже выполняют лоб- и пневмонэктомию. Пневмонэктомию при внутрилёгочных метастазах большинство исследователей считают операцией отчаяния, когда меньший объём вмешательства невозможен. Отдалённые результаты пневмонэк¬ томии зависят от совокупности прогностических факторов [28-30].Частота осложнений после операций по поводу метастатических опухолей лёг¬ ких не превьппает 10-15%. Наиболее часто развивается пневмоторакс, ателектаз и нарушение дренажной функции бронхов. Тяжёлые послеоперационные осложнения констатируют у 2-5% больных. Летальность после операций по поводу метастатиче¬ ских опухолей лёгких варьирует от 1,2 до 6%, она возрастает с увеличением объёма вмешательства и достигает максимума после пневмонэктомии [1,23,25,31J.Результаты хирургического лечения солитарного метастаза следует признать удовлетворительными. После удаления солитарного метастаза пятилетняя выжи-Рис. 29-4. Схема оперативного доступа для видеоассистиро- ванного удаления двусторонних метастазов.
МЕТАСТАТИЧЕСКИЕ ОПУХОЛИ ЛЁГКИХ503ГадыРак почки Саркома“О" Колоректальный рак Рак молочной железыРис. 29-5. Безрецидивная выживаемость больных после удаления солитарного внутрилёгочного метастаза в зависимости от гистогенеза и локализации первичной опухоли.ваемость, по сводным данным отечественных и зарубежных авторов, составляет 30-52% [1,10, 22, 23, 25, 32-36].Показатели длительной безрецидивной выживаемости подтверждают эффек¬ тивность хирургического метода в лечении больных с солитарным метастазом (рис. 29-5).Внедрение в клиническую практику видеоторакоскопии существенно расширило возможности хирургического лечения метастазов. Сочетание высокой информа¬ тивности и малой инвазивности вмешательства позволило расширить контингент больных, подлежапдих хирургическому лечению [37-40]. Наибольшим опытом (80 больных) видеоторакоскопических резекций лёгкого по поводу метастазов колоректального рака обладают R.J. Ьап(1гепеаи и соавт. (2000). Пятилетняя выжи¬ ваемость составила 30,8%, что соответствует результатам хирургического лечения торакотомным доступом. Частота рецидива по линии шва лёгочной ткани ~ 8% [39]. В МНИОИ им. П.А. Герцена видеоторакоскопическая резекция лёгкого выполнена 24 больным (рис. 29-6, см, также цветную вклейку), трёхлетняя выживаемость составила 33,3%.Рис, 29-6. Видеоторакоскопическое удаление солитарного метастаза (а) с интраоперационным ультразвуковым исследованием (б).
504 ОПУХОЛИ ЛЁГКИХЛечебная тактика при единичных и множественных метастазах в лёгких, осо¬ бенно при двустороннем поражении, остаётся противоречивой. Большинслв исследователей проводят полихимиотерапию по одной из схем в зависимости от гистогенеза первичной опухоли. Однако незначительная эффективность лека|к ственного лечения лёгочных метастазов целого ряда злокачественных новооб¬ разований заставила исследователей изучить целесообразность их удаления. За последние 10 лет в литературе появились публикации, посвящённые эффекти»- ности хирургического метода как компонента комбинированного и комплексного лечения больных с единичными и множественными метастазами в лёгких. Авторы сообщают о 20-35% пятилетней выживаемости [41-43].По данным крупнейшего исследования (18 клиник Западной Европы и США), основанного на анализе результатов хирургического лечения 5206 больных с внутрилёгочными метастазами, было установлено, что пятилетняя выживаемость после удаления солитарного метастаза составляет 43%, 2-3 метастазов — 34%,4 и более — 27%. По поводу единичных и множественных метастазов оперирова¬ ны 2349 (45,1%) больных. Наиболее благоприятные отдалённые результаты полу¬ чены у больных после удаления метастазов герминогенных опухолей (пятилетиям выживаемость составила 68%), худшие — при метастазах меланомы (пятилетняш выживаемость - 21%) [23]. Анализ результатов многоцентрового исследованім позволил выделить наиболее значимые прогностические факторы и создать инте¬ гральную систему их оценки. Основной вывод — хирургическое лечение метаста¬ зов в лёгких с учётом факторов прогноза оправдано, поскольку позволяет добить¬ ся пятилетней выживаемости даже при единичных и множественных метастазах. По данным МНИОИ им П.А. Герцена, пятилетняя выживаемость после удаленим единичных метастазов составила 21,7%, множественных — 14,7%.Имеющиеся в литературе сведения о преимуществе хирургического или кон¬ сервативного противоопухолевого лечения внутрилёгочных метастазов порой противоречивы, в частности,]. Wedman и соавт. (1996) считают оправданным опе¬ ративное вмешательство при единичных и множественных метастазах, поскольку пятилетняя выживаемость достигает 59%, в то время как в группе больных, лечен¬ ных консервативно, — лишь 4% [44], По материалам Mayo Clinic, более благопри¬ ятные результаты получены при хирургическом лечении метастазов сарком в лёг¬ кие, чем при использовании химиотерапии: пятилетняя выживаемость составила 40 и 20% соответственно [45]. М. Antunes и соавт. (1999) при лечении метастазов остеогенной саркомы отдают предпочтение комбинации химиотерапевтического и хирургического методов лечения: трёхлетняя выживаемость составила 61%, что сравнимо с отдалёнными результатами лечения больных первичной опухолью без лёгочных метастазов [46].Эффективность существующих сегодня методов противоопухолевого лечения сарком и их метастазов различна. Наибольшей чувствительностью к химиопрепа¬ ратам обладает остеогенная саркома, в то время как хондросаркома, злокачествен¬ ный вариант остеобластокластомы и большинство морфологических типов сарком мягких тканей резистентны или характеризуются невысокой чувствительностью к указанному лечению. Внедрение в клиническую практику таких химиопрепаратов, как доксорубицин, метотрексат, цисплатин, ифосфамид позволило снизить частоту^ развития метастазов остеогенной саркомы в лёгких до 31%, а пятилетнюю выжи¬ ваемость после их удаления увеличить до 35-50% [45-48].При резектабельных метастазах остеогенной саркомы в лёгких предпочтение отдают оперативному вмешательству с последующей многокурсовой полихимио¬ терапией, В случае сомнительной резектабельности проводят лекарственное лече¬ ние, по завершению которого решают вопрос об операции по поводу «остаточной опухоли». Применение только химиотерапии для лечения метастазов остеогенной саркомы в лёгких не даёт повода для оптимизма — 5 лет переживает не более
МЕТАСТАТИЧЕСКИЕ ОПУХОЛИ ЛЁГКИХ50510% больных [49, 50]. Если в лечении остеогенной саркомы наметился прогресс благодаря внедрению эффективных химиопрепаратов, то результаты лечения метастазов сарком мягких тканей в лёгкие не имеют тенденции к улучшению на протяжении десятков лет. Учитывая невысокую чувствительность этих опухолей к лекарственному лечению (частичный ответ регистрируют не более чем у 20-40% больных, медиана выживаемости не превышает 12 мес), единственным методом помощи является оперативное вмешательство. После удаления метастазов в лёгких 5 лет живут 20-30% больных в зависимости от морфологического типа опухоли [50-52], Адъювантная химиотерапия (доксорубицин, адриобластин^, ифосфамид, винкристин, цисплатин) не приводит к достоверному улучшению результатов лече¬ ния. По данным G. Billingsley и соавт. (1999), после полихимиотерапии метастазов мягкотканых сарком в лёгких средняя продолжительность жизни не превышала11 мес. в то время как после хирургического лечения — 33 мес (трёхлетняя выжи¬ ваемость 46%), Те же авторы, основываясь на анализе результатов хирургического лечения 138 больных с метастазами сарком мягких тканей в лёгких, показали, что лучшие результаты достигаются после удаления метастазов лейомиосаркомы. злокачественной фиброзной гистиоцитомы, синовиальной саркомы, хуже — при фибро-, липо- и нейрофибросаркоме [48].Лёгкие являются наиболее частой локализацией экстраабдоминальных мета¬ стазов колоректального рака, причём их изолированное поражение констатируют у 10% больных, что составляет всего 1-3% от числа впервые выявленных больных с опухолью данной локализации. Именно этот контингент больных рассматрива¬ ют потенциальными кандидатами для оперативного вмешательства [6].Резекцию лёгкого по поводу солитарного метастаза колоректального рака впер¬ вые выполнил Blalock в 1944 г, [53], Возможности консервативного противоопухо¬ левого лечения метастазов колоректального рака ограничены, поэтому большин¬ ство исследователей отдают предпочтение хирургическому методу [53-55].Общеизвестные критерии отбора больных для операции по поводу метастазов в лёгких, предложенные Thomford и соавт. в 1965 г. (первичная опухоль надёжно излечена, поражение только лёгких, удовлетворительные функциональные резер¬ вы больного), в настоящее время пересматривают [8]. Наличие резектабельных метастазов колоректального рака в печени не сдерживает хирургов от активной лечебной тактики в отношении метастазов в лёгких независимо от сроков их выяв¬ ления. Отдалённые результаты подобных операций сравнимы с таковыми при солитарном поражении органа (табл. 29-3).Таблица 29-3. Пятилетняя выживаемость больных после хирургического лечения метастазов коло¬ ректального рака в лёгком и печениАвторыГод публикацииЧисло больныхПятилвтняя выживаемость, %Robinson J, et al. [56]19992532,4Hedrick J. et al. [57]20015830,0Ite H. et al. [58]20021550,0Labow D.W. et al. [59]20021231.0Sarto Y. et al. [53]20022Б34,1Yamada H. et al. (60]200210Ю.Оhoue M. et al. [61]20042826,4В последние годы активно развиваются альтернативные методы лечения больных с метастазами в лёгких. Так, М. СгооІепЬоегз и соавт. (2006) применили
506ОПУХОЛИ ЛЁГКИХоригинальный метод лечения внутрилёгочных метастазов мягкотканых саркоЩ Во время операции осуществляли нормотермическую изолированную перфуя^И лёгкого в течение 1 ч раствором, содержащим препараты платины, затем удалачЯ метастазы. При этой концентрация препарата в лёгочной ткани в 43 раза пренУ шала таковую в системном кровотоке. Авторы полагают, что такой комплексшяШ подход позволит улучщить результаты лечения больных с метастатическим п(ХрШ жением лёгких [67].Имеются публикации, посвящённые применению радиочастотной абляшш Ш; лечении больных с метастазами в лёгких, с благоприятными непосредствешп п1 и ближайшими результатами [68-71]. Принцип метода — воздействие током выаи<' кой частоты, что приводит к разрушению опухолевых клеток. Применяют его • основном у функционально неоперабельных больных или при отказе от операдж Манипуляцию вьшолняют под контролем КТ в условиях раздельной вентиляцш лёгких. Оптимальный размер опухолевого узла до 4 см. Основное осложнение — пневмоторакс, который ликвидируют пункциями или дренированием плев¬ ральной полости. Отдалённые результаты радиочастотной абляции изучаются (табл. 29-4).Таблица 29-4. Некоторые показатели радиочастотной абляции метастазов в лёгкихАвторы, год публикацииЧисло больныхКоличествоузловОсложнения,%Регрессия,%Herrera L.J. et а!.. 2003 [68]181853,666,6Steinke К. et al.. 2004 [69]235243,073.1Yasui К. et al.. 2004 [70]359976,090,2van Sonnenberg E. et al., 2005 [71]112520,081,9Совершенствуются методики оперативных вмешательств на лёгком при мета¬ стазах. Исследованиями на 100 больных А. Rolle и соавт. (2002) доказали преим}"- щество неодимового лазера на алюмоиттриевом гранате с длиной волны 1318 нм в хирургии метастазов по сравнению со стандартными методиками резекции лёгкого [72]. Применение лазерного скальпеля позволяет достигнуть надёжного аэростаза без дополнительного ушивания лёгочной ткани [73].Актуальной является проблема повторных операций при «рецидивных» мета¬ стазах в лёгких. Новые метастазы в лёгочной паренхиме возникают в среднем у 25-35% больных [1, 6, 8]. До недавнего времени обоснованность повторных опе¬ раций многими исследователями ставилась под сомнение, однако полученные благоприятные непосредственные и отдалённые результаты позволили рекомен¬ довать выполнение подобных операций в специализированных онкологических учреждениях [25, 31,74, 75]. Сводные данные литературы о результатах повтор¬ ных операций по поводу «рецидивных» метастазов представлены в табл. 29-5.Таблица 29-5. Отдалённые результаты хирургического лечения «рецидивных» метастазов в лёгкихАвторыГод публикацииЧисло больныхПятилетняя выживаемость, %Накашидзе Д.Я. [24]199122 (45)'20,4Groeger A.M. et al. [76]19974248,1Weiser M.R. et al. [77]200086 (198)'36.2Salto Y. et al. [53]20022336,2
МЕТАСТАТИЧЕСКИЕ ОПУХОЛИ ЛЁГКИХ 507Окончание табл, 29-5Ogata Y. et al. [78]20051433,0МНИОИ им, П.А. Герцена200629 (40)'25,7’ В скобках указано количество выполненных операций.ПрогнозАнализ результатов хирургического лечения метастатических опухолей лёгких позволил выделить группу прогностических факторов, оказывающих существен¬ ное влияние на отдалённые результаты. Наиболее значимыми являются:• характер выполненной операции («радикальная» или паллиативная);• количество метастазов в лёгких;• ОДНО' или двусторонняя их локализация;• гистогенез первичной опухоли;• интервал с момента излечения первичной опухоли до появления лёгочных метастазов (DFI — disease free interval);• время удвоения объёма лёгочных метастазов;• состояние внутригрудных лимфатических узлов;• степень дифференцировки первичной опухоли и метастазов;• статус рецепторов при гормонозависимых опухолях;• уровень серологических маркёров до операции на лёгком.Исследования, проведённые в МНИОИ им. П.А. Герцена и РНЦХ РАМН иоснованные на анализе результатов хирургического лечения 412 больных с мета¬ стазами в лёгких опухолей различных локализаций, позволили выделить факторы благоприятного прогноза (солитарный метастаз, DFI >36 мес, одностороннее поражение лёгкого при единичных и множественных метастазах, интактность вну¬ тригрудных лимфатических узлов, «радикальный» характер операции) и небла¬ гоприятного прогноза (билатеральные, единичные/множественные метастазы, DFI <36 мес, метастаз меланомы, поражение внутригрудных лимфатических узлов, паллиативный характер операции).Результаты наших исследований, данные отечественной и зарубежной литера¬ туры позволяют выделить наиболее важные тенденции в хирургическом лечении метастатических опухолей лёгких;• обоснованность операции при солитарном метастазе;• расширение показаний к хирургическому лечению единичных и множествен¬ ных метастазов, включая двусторонние;• разработка новых методик удаления метастазов с использованием видеотора- коскопической и лазерной техники;• одноэтапное удаление всех метастатических очагов;• расширение показаний к удалению «рецидивных» метастазов.Таким образом, стратегия лечения больных с метастазами в лёгких должна осно¬ вываться на дифференцированном подходе к выбору лечебной тактики в зависи¬ мости от чувствительности первичной опухоли и её метастазов к лекарственному противоопухолевому лечению, комплексной оценке совокупности прогностиче¬ ских факторов, агрессивной тактике в отношении единичных, множественных, включая двусторонние, а также «рецидивных» метастазов. Одновременное или последовательное выявление первичной опухоли и метастаза, метастазов коло¬ ректального рака в лёгком и печени не являются противопоказанием к активной лечебной тактике.СПИСОК ЛИТЕРАТУРЫ
Глава 30Доброкачественные опухоли лёгких г
АЗДЕЛ VIIНАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯГлава 31. Тромбоэмболия лёгочной артерииГлава 32. Лёгочные васкулитыГлава 33. Отёк и острое повреждение лёгкихГлава 34. Идиопатическая лёгочная гипертензияГлава 35. Лёгочная гипертензия при хронических респираторных заболеванияхГлава 36. Хроническая тромбозмболическая лёгочная гипертензияГлава 37. Тромбозы и тромбофилии в пульмонологии @
Глава 31 Тромбоэмболия лёгочной артерииОпределениетромбоэмболия лёгочной артерии (ТЭЛА) — синдром, характе¬ ризующийся закупоркой ветвей лёгочной артерии тромбом и рядом патофизиологических реакций, выраженность которых находится в прямой зависимости от размеров тромба, степени шунта, ком¬ пенсаторных возможностей правого желудочка и тяжести фоновых заболеваний.Код по МКБ-10I 26.0 Лёгочная эмболия с упоминанием об остром лёгочном сердце.I 26.9 Лёгочная эмболия без упоминания об остром лёгочном сердце.ЭпидемиологияПроблема ТЭЛА остаётся актуальной для современной меди¬ цины, что обусловлено увеличением количества больных, под¬ верженных риску её возникновения, и высокой летальностью [22]. Считают, что 1 человек из 1000 живущих на земле ежегодно поги¬ бает от ТЭЛА [7]. С другой стороны, летальность среди нелеченых пациентов с ТЭЛА составляет 30-40%, а среди больных, своевре¬ менно начавших получать адекватное лечение, — 8-10% [1],ВЕНОЗНЫЙ ТРОМБОЭМБОЛИЗМВенозный тромбоэмболизм (ВТЭ) — относительно новое поня¬ тие, пришедшее к нам из англоязычной литературы, которым в настоящее время объединяют тромбоз глубоких вен (ТГВ) и ТЭЛА. Действительно, эти два состояния имеют не только общий патогенез и факторы риска, но и отчётливую причинно-следственную связь. Фактически это части одного патологаческого процесса. Сегодня уже доказано, что глубокие вены нижних конечностей служат основным источником тромбов при ТЭЛА [1]. В самом деле, почти у половины больных с ТГВ имеются либо клинические, либо сцинтиграфические признаки ТЭЛА [33], С другой стороны, у трети больных, перенёсших ТЭЛА, при ультразвуковой допплерографии обнаруживают тромбы в глубоких венах нижних конечностей [46]. Несомненно, это коли¬ чество было бы значительно больше, если бы существовала возмож¬ ность выполнить исследование сосудов непосредственно перед ТЭЛА, т.е. до того, как произошёл отрыв тромба. Соответственно методы профилактики и лечения этих двух состояний, по сути, одни и те же.
512 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯФакторы рискаВзаимосвязь между ТГВ и ТЭЛА впервые была установлена Р. Вирховьш 1845 г., он же описал классическую триаду условий для образования тромбок; нарушение свёртывающей системы крови, венозный стаз и повреждение сос^'ди- стой стенки. Принято считать, что первые два условия играют ведущую роль прв ТГВ, тогда как повреждение сосудистой стенки, как правило, вторично.Основные факторы риска ТГВ и ТЭЛА.• Состояния:пожилой возраст;❖ тромбоэмболии и тромбоз глубоких вен в анамнезе; тромбофилия;❖ беременность; ожирение;❖ курение.• Заболевания:массивная травма или травма нижних конечностей;❖ онкологическое заболевание;❖ любое острое заболевание;❖ сердечная или дыхательная недостаточность;❖ воспалительные заболевания кишечника; нефротический синдром;❖ миелопролиферативные заболевания;❖ пароксизмальная ночная гемоглобинурия.• Вмешательства:хирургическое вмешательство;❖ иммобилизация;❖ противоопухолевая терапия (гормональная, химио- или лучевая терапия);❖ катетеризация центральных вен;❖ приём пероральных контрацептивов или гормональная заместительная терапия.Хотя генетическая предрасположенность объясняет не более одной пятой всех случаев ТГВ и ТЭЛА, определение других факторов риска может иметь решающее значение. Высокую частоту тромбозов наблюдают среди женщин старше 60 лет с высоким индексом массы тела. Курение и артериальная гипертензия также служат факторами риска ВТЭ. Однако не обнаружено связи между ТГВ и ТЭЛА и повы¬ шением уровня холестерина или сахарным диабетом [21].Риск ТЭЛА у женщин, использующих пероральные контрацептивы второго поколения, в три раза выше, чем у женщин, не употребляющих эти препараты. При использовании контрацептивов третьего поколения риск, возможно, ещё в два раза выше, чем при использовании препаратов второго поколения. Если же пероральные контрацептивы принимает женщина, имеющая наследственную тромбофилию, риск ТЭЛА увеличивается в 35-100 раз [47].В два раза увеличивает риск возникновения ТЭЛА гормонозамещающая тера¬ пия, причём важно помнить, что этот риск наиболее велик в первые месяцы лече¬ ния, затем он заметно уменьшается.Больные онкологическими заболеваниями, безусловно, входят в группу риска ВТЭ, более того, ТЭЛА для них служит одной из основных причин смерти- Считают, что клетки опухоли могут генерировать тромбин или различные проко¬ агулянты. Иногда именно рецидивирующие тромбозы, флебиты либо ТЭЛА слу¬ жит поводом для специального обследования больных, в ходе которого и выявля¬ ют онкологическое заболевание.Часто ТГВ и ТЭЛА возникают после хирургических вмешательств, причём наибольшую частоту этого состояния отмечают в течение месяца после опера-
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 513ЦИИ. Частота ТГВ после различных оперативных вмешательств представлена в табл. 31-1.Таблица 31-1. Частота тромбоза глубоких вен в различных хирургических стационарах [8]ПрофильЧастота ТГВОбщая хирургия15-40%ГинекологияУрологияНейрохирургияОртопедия40-60%травма40-80%Г^вреждение спинного мозга60-80%ТромбофилияТромбофилиями называют состояния свёртывающей системы крови, приво¬ дящие к гипокоагуляции. При ТЭЛА наиболее часто встречают тромбофилии у больных с [31];• мутацией фактора V (Лейдена);• гипергомоцистеинемией;• дефицитом антитромбина ТП;• гиперфибриногенемией;• антифосфолипидным синдромом;• дефицитом протеинов с и S;• мутацией гена протромбина 20210G/A;• увеличением активности ингибитора активатора плазминогена.Мутация Лейдена наследуется по аутосомно-доминантному типу и вызывает резистентность к активированному протеину С — самому мощному эндогенному антикоагулянту. Гетерозиготное состояние увеличивает риск возникновения ТЭЛА в течение жизни в 5-10 раз в сравнении с популяцией, а гомозиготное — в 80 раз [2]. Генетически детермированнный дефицит протеина С сам по себе может быть причиной возникновения ТГВ и ТЭЛА. Однако следует помнить, что к аналогич¬ ному результату может привести использование пероральных контрацептивов, которые увеличивают частоту резистентности к протеину С даже у женщин без мутации Лейдена. Если женщина с гетерозиготным состоянием этой мутации пользуется пероральными контрацептивами, риск венозного тромбоза у неё уве¬ личивается в 35 раз. При беременности также отмечают физиологическое увели¬ чение резистентности к протеину с.Гипергомоцистеинемия может быть генетически обусловленной, а может вызы¬ ваться некоторыми заболеваниями (почечная недостаточность, гипотиреоз и др.), недостатком фолиевой кислоты или витаминов В^ и в организме. Она увеличи¬ вает риск ТГВ в 2-3 раза, а в сочетании с мутацией Лейдена — в 10 раз.Дефект антитромбина 1П — первая из известных тромбофилий. Антитромбин П1 относят к естественным антикоагулянтам, он ингибирует фактор Ха и тромбин, а также обеспечивает антикоагулянтное действие гепарина. Частота развития тром¬ бозов у гетерозигот-носителей дефектного гена антитромбина П1 увеличивается в 10-40 раз [2]. Мутация гена протромбина 20210G/A приводит к повышенной продукции протромбина, что увеличивает риск ТЭЛА в 3-4 раза в сравнении с популяцией.Первичный антифосфолипидный синдром и наличие антифосфолипидных антител у больных системной красной волчанкой также увеличивает риск воз¬ никновения венозного тромбоза. Клиническое значение других тромбофилийI
514 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯпока изучено недостаточно, однако их роль в возникновении ТЭЛА не выз1 сомнений.Лабораторное выявление тромбофилий достаточно дорого и не всегда досгунш^, поэтому его редко используют в качестве скринингового метода. Однако его сж^' дует проводить в обязательном порядке при наличии клинико-анамнестичеоов данных, указывающих на возможность тромбофилии [1].К ним относят:• отягощённую наследственность — наличие тромбозов у ближайших родствев- ников, сердечно-сосудистые заболевания (инсульты, инфаркты) в молодое возрасте;• повторные тромбозы без видимых причин (идиопатические тромбозы), осо^ бенно в молодом возрасте;• тромбозы, возникающие во время ситуаций, обычно лёгко переносимых здоровыми людьми: длительные поездки, приём противозачаточных средсяк беременность и т.д.;• тромбозы, возникающие в молодом возрасте (у лиц моложе 50 лет);• сочетание артериальных и венозных тромбозов;• повторные выкидыши;• тромбозы необычных локализаций (вен мозга, мезентериальных вен);• тромбозы поверхностных вен;• некрозы кожи, вызванные приёмом куыаринов.ПатогенезОсновным источником тромбов для ТЭЛА служит система нижней полой вены (до 85%). Значительно реже тромбы образуются в системе верхней полой вены (13-1,7%) или в правых отделах сердца (10-12%). Чаще всего местом образова¬ ния тромба служат вены голеней. Оттуда тромб распространяется проксимально. Наибольшую опасность представляют так называемые флотирующие тромбы, имеющие единственную точку фиксации в дистальном отделе. Первичное обра¬ зование тромбов в крупных сосудах — бедренных и подзвдошных венах, нижней полой вене — происходит обычно после травм или хирургических операций.После отрыва тромб с током крови проходит через правые отделы сердца и попадает в лёгочную артерию, приводя к закупорке её ветвей. От размера тромба зависят калибр обтурированного сосуда и в значительной степени клинические проявления ТЭЛА.Обструкция лёгочных артерий и высвобождение вазоактивных агентов из тром¬ боцитов увеличивают лёгочное сосудистое сопротивление, в результате возрастает альвеолярное мёртвое пространство и происходит перераспределение кровото¬ ка, что ухудшает газообмен. Стимуляция рецепторов приводит к альвеолярной гипервентиляции. Рефлекторная бронхообструкция увеличивает сопротивление дыхательных путей, а лёгочный отёк уменьшает эластичность лёгких. Происходит снижение выработки сурфактанта, в результате чего развивается ателектаз части лёгкого. Возрастание постнагрузки правого желудочка увеличивает давление на его стенки и может приводить к дилатации, дисфункции и ишемии правого желу¬ дочка. При наличии открытого овального окна происходит сброс крови справа налево, что усугубляет расстройства газообмена и может стать причиной парадок¬ сальной эмболии в артерии большого круга кровообращения.Развитие инфаркта лёгкого связывают с кровоизлиянием в лёгочную ткань. Истинный инфаркт лёгочной ткани, как правило, не развивается, поскольку кро¬ воснабжение её осуществляется из системы бронхиальных артерий. Считают, что инфаркт лёгкого чаще развивается у больных с предшествующей сердечной или лёгочной патологией, т.е. в условиях уже нарушенного кровообращения в лёгоч¬ ной ткани.
СимптомыЧастота встречаемостиОдышка73%Боль в грудной клетке66%Тахикардия и нарушения ритма сердца30%Кашель37%Кровохарканье13%Повышение температуры тела14%■Зй*';ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 515КлассификацияНаиболее ценна в практическом отношении классификация, предложенная Европейским кардиологическим обществом, в основе которой лежит степень пора- ^ жения правого желудочка [42]. В ней выделяют: :• массивную тромбоэмболию — развивается при закупорке 50-75% сосудисто- ;/> го русла, она сопровождается клинической картиной шока, гипотонии, острой ; • недостаточности правого желудочка;• субмассивную тромбоэмболию — возникает при закупорке менее 30% сосу¬ дистого русла, сопровождается развитием лёгочной гипертензии, дисфункции правых камер сердца, но без их недостаточности;• немассивную тромбоэмболию, или тромбоэмболию мелких ветвей лёгочной артерии, она не сопровождается гемодинамическими нарушениями.Клиническая картинапри сборе анамнеза у больного с подозрением на ТЭЛА необходимо в первую очередь обратить внимание на наличие факторов риска, таких, как недавнее хирургическое лечение, травмы, онкологические заболевания; для женщин — приём пероральных контрацептивов, невынашивание беременности. Тщательный сбор семейного анамнеза, при котором необходимо выяснять наличие у кровных родственников тромбофлебитов и тромбоэмболий, а также инфарктов и инсультов в молодом возрасте, позволяет заподозрить наследственные тромбофилии.Основные клинические симптомы, характерные для ТЭЛА, представлены в табл. 31-2.Таблица 31-2. Клинические проявления тромбоэмболии лёгочной артерии [40]Одышка — наиболее часгый симптом, однако степень её может варьировать в очень широких пределах. Внезапно развившаяся резкая одышка характерна для массивной ТЭЛА. При субмассивной ТЭЛА одышка чаще развивается постепенно, однако может нарастать быстро (в течение нескольких часов или дней). При тром¬ боэмболии мелких ветвей лёгочной артерии одышки может не быть вовсе либо она слабо выражена, больные часто характеризуют её как снижение толерантности к физическим нагрузкам и не могут оценить точные сроки её возникновения.Болевой синдром, являясь одним из наиболее частых симптомов ТЭЛА, в то же время наиболее разнообразен. Давящие боли за грудиной, значительно выра¬ женные, не связанные с актом дыхания (ангинозноподобный вариант), обуслов¬ лены ишемией миокарда правого желудочка вследствие его острой перегрузки и характерны для массивной и субмассивной ТЭЛА. При немассивной ТЭЛА воз¬ никает плевральный болевой синдром, обусловленный развитием инфарктной пневмонии в кортикальных отделах лёгких. Возможен также абдоминальный вариант болевого синдрома, характеризующийся болями в правом подреберье,
' 516 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯсвязанный с острым набуханием печени при развитии правожелудочковой статочности.Тахикардия — симптом, развивающийся почти у каждого больного с динамически значимой ТЭЛА, не имеет, тем не менее, самостоятельной гностической ценности из-за крайне низкой специфичности. Другие наруше ритма — экстрасистолия, мерцательная аритмия — чаще возникают у больныи уже имеющейся патологией сердечно-сосудистой системы, что также затр) диагностику.Кашель при ТЭЛА чаще носит рефлекторный характер, бывает сухим и на чивым. При развитии инфаркта лёгкого кашель может сопровождаться выде ем мокроты, иногда с примесью крови, чаще в виде прожилок или мелких > Обильное кровохарканье с выделением алой крови встречают редко, однако также не исключает диагноз ТЭЛА.Температура тела при ТЭЛА может повышаться со 2-3-х сут. Как правило, обусловлено развитием инфарктной пневмонии и присоединением инфекционяви] го процесса, однако можно также наблюдать длительную, чаще субфебрильнуш] лихорадку, которая связана с лизисом тромба. Следует отметить, что ни один клинических критериев не патогномоничен для ТЭЛА и диагностическая инфорк мативность их крайне невысока.ДиагностикаТрудность диагностики ТЭЛА определяют неспецифичность клинической кар“ тины и отсутствие патогномоничных симптомов. Фактически нет ни одного клинического, лабораторного или инструментального теста, который мог бы со стопроцентной вероятностью подтвердить или опровергнуть диагноз ТЭЛА. Даже «золотой стандарт» диагностики — ангиопульмонография — даёт точный диагно» в 98% случаев. Кроме того, ТЭЛА часто возникает у пациентов, уже имеющих ряд различных заболеваний. Они находятся в крайне тяжёлом состоянии, что затруд¬ няет диагностику.ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ Д-ДимерД-димер — продукт протеолиза плазмином перекрёстно сшитого фибрина, служит показателем наличия тромбоза в организме. Ценность его в диагностике ТЭЛА продолжает оставаться спорной. Уровень Д-димера повышается почти у всех пациентов с ТЭЛА или ТГВ, однако он может быть повышенным при многих других состояниях, таких, как инфаркт миокарда, сердечная недостаточность, тяжёлая пневмония, опухолевые заболевания, беременность и т.д. Низкое зна¬ чение Д'димера с высокой степенью вероятности (85-97%) исключает ТЭЛА, особенно при её малой клинической вероятности. Повышения концентрации Д-димера может не быть при тромбоэмболии мелких ветвей лёгочной артерии с небольшими первичными тромбами. Высокий уровень Д-димера имеет небольшое положительное прогностическое значение (порядка 30-50%) [50]. Таким образом, определение Д-димера служит скрининговым методом для исключения диагноза ТЭЛА, однако не играет существенной роли для подтверждения его.Определение газового состава кровиТипичными для больных с ТЭЛА считают гапоксемию и гипокапнию, но эти изменения встречают далеко не у всех больных, особенно при гемодинамически незначимой ТЭЛА. Специфичность этих тестов крайне невысока, поэтому опреде¬ ление газового состава крови имеет небольшое диагностическое значение и может использоваться лишь для оценки тяжести состояния больного.
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 51 ^ТропонинТропонин — чувствительный биомаркёр повреждения миокарда. Повышение давления в правом желудочке при острой ТЭЛА приводит к его перегрузке. В результате развиваются микроинфаркты миокарда правого желудочка с разруше¬ нием миофибрилл и высвобождением тропонина. Повышение уровня тропонина наблюдают у 10-50% больных с острым эпизодом ТЭЛА, оно коррелирует со степенью дисфункции правого желудочка. Положительный тропониновый тест можно наблюдать через 6-12 ч после развития ТЭЛА, однако уровень тропонина обычно ниже, чем при инфаркте миокарда. Отрицательный результат тропонино- вого теста у больного с ТЭЛА свидетельствует о благоприятном развитии заболе¬ вания [18]. Не имея самостоятельного значения в диагностике ТЭЛА, тропонино¬ вый тест, тем не менее, может служить для оценки тяжести состояния больного и прогнозирования возможного исхода.Натрийуретический пептидМозговой натрийуретический пептид выделяется из миоцитов правого желу¬ дочка при их механическом растяжении вследствие его дисфункции и дилатации во время острого эпизода ТЭЛА. Раннее повышение мозгового натрийуретическо¬ го пептида (в течение 6 ч после появления симптомов ТЭЛА) может свидетель¬ ствовать о предшествующем заболевании сердца с нарушением функции правого или левого желудочка. Однако его нарастание в течение последующих 6-12 ч используется для оценки возможного прогноза заболевания.ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ ЭлектрокардиографияЭлектрокардиографические симптомы острой ТЭЛА неспецифичны. Примерно у 40% пациентов с ТЭЛА наблюдают синусовую тахикардию и феномен 0,ц5,. Инверсия зубца Г и зубец Q,b передних грудных отведениях могут свидетельство¬ вать об увеличении правого желудочка. Встречают также блокаду правой ножки пучка Лиса и фибрилляцию предсердий. Чувствительность ЭКГ в диагностике ТЭЛА низка, однако она позволяет исключить другие заболевания со схожей симптоматикой и определить дальнейший план обследования.Рентгенография грудной клеткиНормальную рентгенограмму наблюдают только у трети больных ТЭЛА. Наиболее частые рентгенологические изменения включают периферические инфильтраты (вследствие инфарктов лёгкого), дистелектазы, области обедне¬ ния лёгочного рисунка, расширение и обрыв тени лёгочной артерии (рис. 31-1). Можно также наблюдать высокое стояние диафрагмы и жидкость в плевральной полости. Хотя обычная рентгенография может дать лишь косвенные признаки ТЭЛА, это исследование необходимо для исключения других заболеваний со сход¬ ной клинической симптоматикой.ОЦЕНКА КЛИНИЧЕСКОЙ ВЕРОЯТНОСТИ ТЭЛАНи один из клинических симптомов достаточно специфичен для достоверной диагностики ТЭЛА. Рутинные методы диагностики, такие, как рентгенография, ЭКГ, лабораторные тесты, позволяют только заподозрить этот диагноз. Однако для выбора эффективного способа лечения необходима верификация диагноза с помощью высокотехнологичных специализированных методов исследования, таких, как транспищеводная эхокардиография, ангиопульмонография, компью¬ терная ангиография или вентиляционно-перфузионная сцинтиграфия. Поэтому важное значение в ведении больных с ТЭЛА имеет оценка клинической вероят¬ ности этого диагноза, для чего предложены специальные шкалы, наиболее распро¬ странённой из которых является шкала М. Rodger и P.S. Wells (табл. 31-3) [51],
518 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯРис. 31-1. Обзорная рентгенограмма органов грудной клетки больного с острой ТЭЛА. Таблица 31-3. Шкала оценки клинической вероятности тромбоэмболии лёгочной артерии [51]ПараметрыБаллыНаличие симптомов ТГВ3,0Низкая вероятность другого диагноза3,0ЧСС более 100 в минуту1,5Иммобилизация/операция за последние 4 нед1,5ТГаДЭЛА в анамнезе1.5Кровохарканье1,0Злокачественное новообразование1,0Клиническую вероятность ТЭЛА считают высокой при сумме баллов более 6, умеренной — от 2 до 6 и низкой — <2 баллов.Женевская шкала оценки клинической вероятности ТЭЛА, помимо собственно клинических показателей, включает результаты рутинных диагностических меро¬ приятий (табл. 31-4) [52].Таблица 31-4. Женевская шкала оценки клинической вероятности ТЭЛА [52]ПараметрыБаллыВозраст:60-79 лет1>79 лет2
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 519Окончание табл. 31-4ТГВДЭЛА в анамнезеНедавнее хирургическое вмешательствоЧСС более 100 в минутуР,СО,<36 мм рт.ст.36-39 мм рт.ст.Р,0,<50 мм рт.ст.50-60 мм рт.ст.61-72 мм рт.ст.73-83 мм рт.ст.Находки на рентгенограммах;дисковидные ателектазывысокое стояние купола диафрагмыКлиническая вероятность ТЭЛА считается высокой при сумме баллов от 9 до 16, средней — от 5 до 8 и низкой — от О до 4.МЕТОДЫ ВЕРИФИКАЦИИ ДИАГНОЗА ТЭЛА ЭхокардиографияЭхокардиография (ЭхоКГ) - наиболее важный неинвазивный метод диагно¬ стики ТЭЛА. Даже трансторакальная ЭхоКГ может выявить признаки лёгочной гипертензии, дилатации и перегрузки правого желудочка. При отсутствии других причин лёгочной гипертензии эти находки делают диагноз ТЭЛА весьма вероят¬ ным. Чреспищеводная ЭхоКГ позволяет визуализировать тромбы, находящиеся в стволе и главных ветвях лёгочной артерии, после чего диагностический поиск может быть завершён (рис. 31-2, см. также цветную вклейку). Чувствительность и специфичность этого метода при массивной ТЭЛА достигают 90%. ЭхоКГ позво¬ ляет выявить другие заболевания, имеющие сходную с ТЭЛА клиническую кар¬ тину: инфаркт миокарда, эндокардит, перикардит, расслоение аневризмы аорты. Безусловными преимуществами ЭхоКГ служат её неинвазивность и быстрота выполнения, что может играть решающую роль у больных с массивной ТЭЛА.Перфузионная сцинтиграфияПерфузионная сцинтиграфия лёгких долгое время была основным методом диагностики ТЭЛА. Отсутствие дефектов перфузии при сцинтиграфии с высокой степенью вероятности (до 98%) исключает диагноз ТЭЛА. Однако в последнее время многие исследователи указывают, что у большого числа больных с доказан¬ ной ТЭЛА не имелось убедительных сцинтиграфических данных в пользу этого диагноза; с другой стороны, у многих больных, не имеющих ТЭЛА, наблюдались отклонения от нормы на перфузионных сцинтиграммах, особенно при предше¬ ствующей сердечно-лёгочной патологии. Характерными для ТЭЛА являются тре¬ угольная форма перфузионного дефекта и соответствие его анатомическим струк-
520 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯРис. 31-2. Эхокардиограмма при массивной ТЭЛА. Тромб в левой главной ветви лёгочной арте¬ рии.турам — сегментам или долям лёгкого; нередко встречают множественные или двусторонние дефекты (рис. 31-3). Следует подчеркнуть, что высокой диагности¬ ческой ценностью обладает наличие дефектов перфузии при отсутствии наруше¬ ний вентиляции, поэтому желательно выполнять вентиляционно-перфузионную сцинтиграфию. К сожалению, этот метод недоступен в большинстве медицинских центров нашей страны. При невозможности выполнения вентиляционной сцин¬ тиграфии необходимо сопоставление результатов перфузионной сцинтиграфии с данными рентгенограмм, а лучше КТ лёгких.Компьютерная томографияСпиральная КТ лёгких с контрастированием лёгочных сосудов в настоящее время занимает всё большее место в диагностике ТЭЛА и служит методом выбораРис. 31-3. Перфузионная сцинтиграмма лёгких больного с острой тромбоэмболией лёгочной арте¬ рии.
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 521Рис. 31-4. фрагменты спиральных компьютерных томограмм: а — больного с массивной ТЭЛА (тромб в левой главной ветви лёгочной артерии); б - больного с немассивной ТЭЛА (тромб в сег¬ ментарной ветви лёгочной артерии).при подозрении на ТЭЛА. Это неинвазивный тест с высокой диагностической цен¬ ностью, которая всё возрастает по мере совершенствования компьютерных томо¬ графов. Если однодетекторная КТ в диагностике ТЭЛА имеет чувствительность 61% и специфичность 84%, то современные 16-, 32- и 64-детекторные спиральные компьютерные томографы, обладающие большей разрешающей способностью, повышают информативность до 95% [35]. Контрастирование лёгочных сосудов при спиральной КТ позволяет выявить тромбы на уровне субсегментарных вет¬ вей лёгочной артерии, что сопоставимо с возможностями ангиопульмонографии. Одновременно КТ позволяет выявить изменения в лёгочной паренхиме, такие, как инфаркты лёгкого или другие заболевания внутригрудных органов, которые могут симулировать ТЭЛА. Кроме того, возможно одномоментное исследование веноз¬ ного русла нижних конечностей. Типичные находки при КТ у больных острой ТЭЛА [23] (рис. 31-4);• дефект заполнения сосуда контрастным веществом;• расширение лёгочных сосудов проксимальнеє дефекта;• субплевральные инфильтраты в лёгочной ткани;• плевральный выпот;• увеличение полости правого желудочка при нормальной толщине его стенки. Магнито-резонансная ангиографияМагнито-резонансная ангиография — относительно новый метод диагностики ТЭЛА. Преимуществами его служат малоинвазивность, отсутствие рентгеновского излучения, малотоксичный, не содержащий йод контраст, что делает этот метод особенно привлекательным для исследования беременных женщин и пациентов с непереносимостью йода. По данным различных исследователей, чувствительность магнито-резонансной ангиографии в диагностике ТЭЛА достигает 70-100%, а специфичность — 95-98%, однако опьгг использования этого метода пока невелик.АнгиопульмонографияАнгиопульмонография остаётся до сих пор «золотым стандартом» диагностики ТЭЛА. Как и КТ, она позволяет визуализировать тромбы на уровне субсегментар¬ ных артерий, а также выявить периферические нарушения перфузии (рис. 31-5). Будучи сопоставимой с КТ по информативности, катетеризация правых камер сердца, обязательная для выполнения ангиопульмонографии, даёт возможность
522 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯРис. 31-5. Ангиопульмонограммы; а — больного с массивной ТЭЛА (тромбы в правой главной ветш лёгочной артерии и нижнедолевой ветви слева); б — больного с немассивной ТЭЛА (необтурируо- щий тромб на бифуркации правой ветви лёгочной артерии).одновременно осуществить прямую манометрию и оценить лёгочную гемодина¬ мику, выполнить ретроградную флебографию, а также провести ряд лечебных мероприятий, направленных на фрагментацию тромба, а также при наличии показаний установить кава-фильтр. Недостатки этого метода — инвазивносгь, необходимость использования йодсодержащего контраста, достаточно высокая доза рентгеновского облучения.Ультразвуковая допллерографияИсследование сосудов системы нижней полой вены - необходимое звено диа¬ гностической цепочки при подозрении на ТЭЛА, Хотя наличие тромбов в венах нижних конечностей или малого таза не доказывают наличие ТЭЛА у конкретного больного, а их отсутствие не исключает этот диагноз, это исследование необходи¬ мо для выбора правильной врачебной тактики. Наиболее распространённым мето¬ дом служит ультразвуковая допплерография. Этот неинвазивный и безопасный для больного метод позволяет выявить ТГВ вплоть до нижней полой вены, а также определить наличие флотирующих, эмбологенных тромбов, что может потре¬ бовать немедленных лечебных мероприятий для профилактики рецидива ТЭЛА (рис. 31-6, см. также цветную вклейку). Чувствительность этого метода для прокси¬ мальных венозных тромбозов достигает 94-100%, специфичность — 98-100%.ВенографияВенографию с введением контрастного вещества в дистальную вену в настоящее время используют редко, несмотря на почти стопроцентную чувствительность, из-за значительного числа развивающихся осложнений. Последнее время раз¬ рабатывают методики спиральной КТ с введением контраста в венозную систем)^ что может позволить выяврггь тромбы в венах таза и брюшной полости, которые невозможно оценить с помощью ультразвуковой допплерографии, однако этот метод ещё не внедрён в клиническую практику.Дифференциальная диагностикаДифференциальную диагностику у больного с подозрением на ТЭЛА необходи¬ мо проводить со следующими заболеваниями и синдромами [20]:
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 523Рис. 31-6. Ультразвуковая допплерография сосудов нижних конечностей, Флотирующий тромб в общей бедренной вене.• пневмония;• бронхиальная астма;• обострение ХОБЛ;• инфаркт миокарда;• отёк лёгких;• тревожно-депрессивное состояние;• расслоение аорты;• тампонада перикарда;• рак лёгкого;• опухоли лёгочной артерии;• первичная лёгочная гипертензия;• перелом рёбер;• пневмоторакс;• хондрит.Лечениетромб, находящийся в сосудистом русле лёгких, подвергается лизису за счёт системы естественных антикоагулянтов- Даже при отсутствии антикоагулянтной терапии у большинства выживших больных с ТЭЛА наблюдают частичный или полный лизис тромба и восстановление кровотока. Поэтому основные задачи терапии при остром эпизоде ТЭЛА — устранение угрожающих жизни нарушений гемодинамики и предотвращение возможных рецидивов ТЭЛА.АНТИКОАГУЛЯНТНАЯ ТЕРАПИЯНачинать антикоагулянтную терапию необходимо как можно раньше, при высокой клинической вероятности ТЭЛА и отсутствии противопоказаний — ещё до завершения диагностических мероприятий. Учитывая высокий риск быстрого развития угрожающих жизни осложнений, необходимость агрессивной терапии и тщательного её клинико-лабораторного контроля, целесообразно все лечебно-
]524 нарушения лёгочного кровообращениядиагностические мероприятия у больных с подозрением на острую ТЭЛА прово- : ■ дить в отделениях интенсивной терапии. Начинают лечение с быстродействующи! § прямых антикоагулянтов с последующим, возможно, ранним переходом на непрв- мые.Нефракционированный гепарин>5Гепарин служит стандартом для лечения гемодинамически стабильной ТЭЛА. "Я Г:; Начинать терапию необходимо с болюсного введения гепарина в дозе 80 ЕД/жг, переходя затем к постоянной внутривенной инфузии в дозе 18 ЕД/(кгхч), титрун дозу таким образом, чтобы АЧТВ удлинилось до 60-80 с. Осложнения гепа!»- нотерапии, помимо очевидного увеличения частоты кровотечений, — гепарин- индуцированная тромбоцитопения и остеопороз (при длительном применении). Гепарин-индуцированная тромбоцитопения развивается обьшно на 4-10-й день терапии и обусловлена иммунными механизмами. Необходимо регулярно (ве реже раза в неделю) контролировать число тромбоцитов и при их снижении более чем на 50% от исходного уровня гепарин следует отменить [48].Низкомолекулярные гепариныДоказали, по крайней мере, не меньшую эффективность в лечении немассив¬ ной ТЭЛА. Адекватных клинических исследований относительно их применения при массивной ТЭЛА не проводили по очевидным этическим соображениям. Низкомолекулярные гепарины имеют ряд фармакокинетических преимуществ перед гепарином [49].Преимущества;• более предсказуемый антикоагулянтный эффект;• лучшая биодоступность при низких дозах;• дозозависимый механизм клиренса;• большее время полужизни.Механизмы;• меньшее связывание с белками плазмы и белками, высвобождаемыми из активированных тромбоцитов и эндотелиальных клеток;• меньшее связывание с эндотелием;• меньшее связывание с макрофагами.В практическом смысле это означает возможность применять их один раз в сутки, отсутствие необходимости в лабораторном контроле, а также меньший риск развития кровотечений и тромбоцитопении.Рекомендуемые дозы низкомолекулярных гепаринов для лечения ТЭЛА:• эноксапарин натрия — 1 мг/кг 2 раза в сутки или 1,5 мг/кг один раз в сутки;• надропарин кальция — 86 МЕ/кг 2 раза в сутки.При длительном применении низкомолекулярных гепаринов также может раз¬ виться тромбоцитопения, хотя и реже, чем при использовании гепарина, поэтому необходимо периодически контролировать число тромбоцитов.ПентасахаридыПентасахариды — относительно новые препараты антикоагулянтного действия, это селективные ингибиторы фактора Ха. Их эффективность в лечении ТЭЛА изу¬ чена недостаточно. Имеются данные, что фондапаринукс натрия при подкожном применении в дозе 7,5 мг один раз в день сравним с гепарином по эффективности и безопасности в лечении гемодинамически стабильной ТЭЛА. Новый препарат идрапаринукс* в настоящее время находится на стадии клинических исследова¬ ний. Предполагают, что он станет лучшим препаратом для длительного лечения тромботических состояний, поскольку крайне долгое время полужизни позволяет вводить его 1 раз в неделю.
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 525Прямые ингибиторы тромбинаПрямые ингибиторы тромбина — ксимелгатран и аргатробан — также в настоя¬ щее время находятся в стадии клинических исследований. Их преимущества — пероральная форма и отсутствие необходимости контроля системы коагуляции, однако недостатком является высокая гепатотоксичность.ТРОМБОЛИЗИСТромболизис — признанный метод лечения массивной ТЭЛА. Хотя полноцен¬ ных контролируемых исследований не проводили, известно, что тромболизис в сравнении с антикоагулянтами приводит к более быстрому снижению давления в лёгочной артерии и улучшению сердечного выброса и восстановлению кровотока [25]. У гемодинамически нестабильных больных тромболизис следует начинать в более ранние сроки, даже на фоне проведения реанимационных мероприятий. Проведение тромболизиса у больных со стабильной гемодинамикой и признаками дисфункции правого желудочка (т.е. с субмассивной ТЭЛА) остаётся предметом дискуссий, поскольку неясно, превышает ли в данном случае ожидаемая польза возможный риск. Показано, что в группах больных, получавших тромболитики и только антикоагулянты, на 7-й день наблюдения нет различий по гемодинамиче¬ ским параметрам, а также смертности [29], Неясно также влияние тромболизиса на развитие постэмболической лёгочной гипертензии, поскольку данные длитель¬ ного наблюдения таких больных противоречивы. В целом рекомедуют индиви¬ дуальную оценку возможного риска тромболитической терапии у конкретного больного.Показанием к назначению тромболитиков служит доказанная путём чрес- пищеводной эхокардиографии, ангиопульмонографии или вентиляционно- перфузионной сцинтиграфии массивная ТЭЛА с наличием правожелудочковой недостаточности или значимой гипоксемии.Противопоказания к тромболитической терапии:• недавние (до 3 нед) оперативное вмешательство, серьёзная травма или пере¬ несённый геморрагический инсульт;• заболевания с высоким риском кровотечения (обострение язвенной болезни, неконтролируемая артериальная гипертензия);• непереносимость тромболитических препаратов:• беременность.Есть данные, что проведение тромболизиса женщинам во время менструаций не приводит к увеличению числа серьёзных кровотечений, поэтому в этих случаях введение тромболитиков разрешено.Многочисленные исследования не выявили значимой разницы в эффектив¬ ности и безопасности лечения различными тромболитическими препаратами. Наиболее часто применяют алтеплазу и стрептокиназу. В последние годы доказана также одинаковая эффективность и безопасность системного и местного тромбо¬ лизиса, поэтому нет никакой необходимости стремиться доставить тромболитик непосредственно к тромбу,Алтеплазу вводят в дозе 100 мг, причём 10 мг болюсом, затем 90 мг в течение2 ч. Стрептокиназу вводят в дозе 250 тыс. ЕД в течение 30 мин, затем по 100 тыс. ЕД/час в течение 24 ч.После проведения тромболизиса необходим контроль его эффективности, оптимальным способом для этого служит ЭхоКГ. Положительный эффект тромбо¬ лизиса должен выражаться в улучшении функции правого желудочка, снижении давления в лёгочной артерии. При отсутствии эффекта следует рассмотреть вопросо хирургическом лечении. Если эффект достигнут, то после контроля АЧТВ (этот показатель не должен более чем в 2 раза превышать нормальные значения) необ¬ ходимо начинать внутривенную инфузию гепарина.
526 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯДОПОЛНИТЕЛЬНЫЕ ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВАОксигенотерапия показана большинству больных с гемодинамически значимой ТЭЛА. При наличии выраженной дыхательной недостаточности предпочтительв* неинвазивная вентиляция лёгких. Следует избегать ИВЛ, приводящей к повыше- нию внутригрудного давления, поскольку это уменьшает венозный возврат и уве¬ личивает постнагрузку, что приводит к ухудшению функции правого желудочка.Многие врачи эмпирически используют нитраты, чтобы уменьшить болевой синдром, связанный с ишемией миокарда при ТЭЛА, однако это допустимо толь¬ ко у больных со стабильной гемодинамикой. Морфин в низких дозах позволяет уменьшить одышку и способствует расширению лёгочных сосудов. У больных с нарушенной гемодинамикой используют допамин и добутамин для улучшение функции сердца, при этом возрастание лёгочного сосудистого сопротивление минимально,ДЛИТЕЛЬНАЯ АНТИКОАГУЛЯНТНАЯ ТЕРАЛИЯУ больных, перенёсших острый эпизод ТЭЛА, сохраняется риск рецидива этого состояния. По различным данным, у больных после идиопатической ТЭЛА это» риск составляет от 5 до 17,5% в течение первых 3 мес [8, 34] и до 30% в течение 10 лет. Поэтому все больные ТЭЛА нуждаются в длительном приёме антикоагу¬ лянтов.Пероральные антикоагулянтыПосле установления точного диагноза ТЭЛА и начала терапии парентеральны¬ ми антикоагулянтами у пациентов с гемодинамически стабильной немассивной ТЭЛА можно сразу же начинать терапию пероральными антикоагулянтами — антагонистами витамина К. Механизм действия пероральных антикоагулянто» заключается в ингибировании синтеза в печени витамин К зависимых факторов протромбинового комплекса — II, VII, IX, X, а также естественных антикоагулян¬ тов — протеинов С, S и Z. В зависимости от химической структуры пероральные антикоагулянты делят на производные монокумарина, дикумарина, циклокума- рины и индандионы. Наиболее широко применяют варфарин и аценокумарин. Это объясняют их оптимальной продолжительностью действия и хорошей пере¬ носимостью. Популярный в прошлом фениндион в настоящее время исключен из протоколов лечения ТЭЛА из-за небольшой продолжительности действия и высокой гепатотоксичности. Наиболее безопасен и удобен в настоящее время варфарин. Некоторую сложность для терапевта представляет установление адек¬ ватной дозы варфарина, которую невозможно предсказать заранее и необходимо каждый раз подбирать индивидуально. Адекватной считается доза непрямых антикоагулянтов, позволяющая поддерживать показатель международного нор¬ мализованного отношения (МНО) в интервале от 2,0 до 3,0. Для контроля тера¬ пии пероральными антикоагулянтами следует пользоваться именно МНО, а не популярным в прошлом протромбйновым индексом, поскольку этот показатель более стандартизован и менее зависит от лаборатории, проводящей исследова¬ ние. МНО рассчитывается как отношение протромбинового времени больного к протромбиновому времени контрольной плазмы, возведённое в степень, соответ¬ ствующую международному индексу чувствительности тромбопластина, исполь¬ зуемого для анализа.Рекомендуют начинать терапию с небольших доз варфарина (2,5-5 мг), поскольку в этом случае меньше риск развития побочных эффектов. Стандартная начальная доза 5 мг. Меньшие дозы применяют у пожилых пациентов, пациентов с нарушенной функцией печени. Правила коррекции начальной дозы варфарина приведены в табл. 31-5.
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ527Таблица 31 -5. Подбор начальной дозы варфаринаДниМНОДоза варфарина, мг/суг<1,5101,5-1.92,0-2,92,5>3,0<1,5101,5-1,97.52,0-2.9>3.0<2.0102.0-2,9>3.0<1,5101.5-1,97,52,0-2,9>3.0В дальнейшем при коррекции дозы варфарина можно ориентироваться на сум¬ марную недельную дозу, следуя схеме, приведённой в табл, 31-6.Таблица 31-6. Коррекция дозы варфарина в зависимости от МНОМНОИзменение недельной дозыКонтроль МНО<1,5Увеличить на 10-20%Через 4-8 дней1.5-1.9Увеличить на 5-10%Через 7-14 дней2,0-3,0Без изменений3,1-3,9Уменьшить на 5-10%Через 7-14 дней4.0-4.9Пропустить 1 день приёма и снизить дозу на 10%Через 7-14 дней5,0-6.0Пропустить 2 дня и снизить дозу на 10-15%Через 1-5 днейКонтролировать уровень МНО у больных с подобраной дозой варфарина следу¬ ет 1 раз в неделю в течение первого месяца, затем 1 раз в 1-1,5 месяца.Осложнения терапии варфарином, помимо увеличивающейся частоты кровоте¬ чений, — некрозы кожи, обусловленные снижением концентрации протеина С, Они обычно появляются в начале терапии варфарином, чаще у онкологических больных. При появлении кожных некрозов варфарин следует отменить, провести перели-
528 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯІ .у вание свежезамороженной плазмы, а в дальнейшем назначать варфарин,с меньших доз. Иногда на фоне терапии варфарином развивается лека{ й:. ‘‘ 7 4 ^ гепатит, который протекает, как правило, бессимптомно, проявляется повь1'®^ трансаминаз и хорошо корректируется приёмом гепатопротекторов. Чаще всего 3 I: ■ - І.- -' происходит у больных с уже скомпрометированной функцией печени.. Противопоказаниями к приёму варфарина служат любые состояния с вы( риском кровотечений, неконтролируемая артериальная гипертензия, ту5;^ - , печёночная и почечная недостаточность. Нельзя также применять варфарин беременности, поскольку он проникает через плацентарный барьер и об; эмбриотоксическим действием.Продолжительность терапии варфарином должна составлять:• у больных с первым эпизодом ТЭЛА на фоне преходящих факторов (травма, оперативное вмешательство и т.п.) — 3 мес;• при идиопатической ТЭЛА — 6 мес;• при ТЭЛА у больных с тромбофилией или другими непреходящими фаі ми риска (например, онкологическим заболеванием) — 6-12 мес;• у больных с рецидивирующей ТЭЛА и установленным кава-фильтром после тромбэндартерэктомии — пожизненно.Низкомолекулярные гепарины также можно использовать для длителыюШ] антикоагулянтной терапии, хотя у них есть недостатки — парентеральный способ | введения и высокая стоимость. Однако, если больному противопоказан варфарв' (например, беременным женщинам, людям с индивидуальной непереносимостью варфарина), можно назначать низкомолекулярные гепарины в терапевтическнж дозах длительностью не менее 3 мес.ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ТЭЛАРешить вопрос о хирургическом лечении необходимо у пациентов с неэффеж- тивным тромболизисом либо при наличии противопоказаний к нему. Открыта* хирургическая эмболэктомия (операция Тренделенбурга) известна с 20-х гг. про-^ шлого века, однако до 90>х гг. её выполняли редко из-за почти стопроцентна летальности. Но в последние десятилетия благодаря совершенству хирургическое техники и более тщательному отбору больных удалось добиться значительного роста их выживаемости. Тем не менее для проведения этой операции необходи¬ мо сложное оборудование и высококвалифицированный персонал, поэтому она доступна лишь немногам медицинским центрам.Более безопасна для больного эндоваскулярная катетерная фрагментация и экстракция тромба, которые можно выполнять одновременно с диагностической ангиопульмонографией, однако и они требуют специального оборудования и обу¬ ченного персонала, поэтому также малодоступны.ПрофилактикаРациональность профилактики ТЭЛА неоднократно обосновывали. Большин¬ ство больных, госпитализированных в стационар, имеют один или несколько факторов риска ТГВ и ТЭЛА, ТГВ у больных в стационарах часто протекает бес¬ симптомно, и массивная ТЭЛА может оказаться первым его проявлением. ТЭЛА — одно из ведущих осложнений среди всех госпитализированных больных. Около трети всех смертельных исходов в стационарах обусловлено ТЭЛА [17].С другой стороны, из возможных госпитальных осложнений, ведущих к смерти больных, именно тромбоэмболические наиболее предсказуемы и их проще всего предотвратить. Именно поэтому основным способом снижения смертности от ТЭЛА следует признать её профилактику. Доказана экономическая эффективность профилактики ТЭЛА [41].
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 529Профилактика вторичных тромбоэмболий включает:• раннюю активизацию больных, перенёсших хирургические вмешательства;• обеспечение максимально возможной активности мышц нижних конечностей у пациентов при длительном постельном режиме;• механические процедуры, увеличивающие объёмный поток крови через глу¬ бокие вены нижних конечностей;• введение препаратов, снижающих риск тромботических осложнений.К механическим методам профилактики ТЭЛА относят использование компрес¬ сионного трикотажа и переменную пневматическую компрессию. Механическая компрессия нижних конечностей приводит к снижению патологической венозной ёмкости нижних конечностей, улучшению функциональной способности клапан¬ ного аппарата, возрастанию обратного всасывания тканевой жидкости за счёт повышения тканевого давления, увеличению фибринолитической активности крови в результате активации выработки тканевого активатора плазминогена, В сравнении с медикаментозными средствами профилактики механические спосо¬ бы обладают меньшей эффективностью, но и вызывают меньше геморрагических осложнений, поэтому их рекомендуют больным с невысоким риском тромбооб¬ разования и высоким риском кровотечений [17].Для выбора оптимального метода первичной профилактики ТЭЛА у госпитали¬ зированных больных пользуются классификацией степени риска ТЭЛА.• Минимальный риск развития ТЭЛА имеют лица моложе 40 лет, подвергае¬ мые малой хирургической операции (длительность до 30 мин), или имеющие непродолжительную иммобилизацию (до 3 дней), или переносящие лёгкое заболевание, не требующее госпитализации, при отсутствии иных факторов риска.• Средний риск развития ТЭЛА имеют лица, переносящие любую хирурги¬ ческую операцию в возрасте от 40 до 60 лет при отсутствии иных факторов риска, или подвергающиеся большой хирургической операции, длящейся более 30 мин, или страдающие нефротическим синдромом либо воспа¬ лительными заболеваниями кишечника, имеющие недостаточность кро¬ вообращения, тяжёлую пневмонию, хроническую гемолитическую анемию, СЗСТ, беременность в возрасте около 40 лет или иммобилизацию более3 дней.• Высокий риск ТЭЛА имеют лица старше 60 лет, переносящие хирургическое вмешательство, продолжающееся дольше 30 мин. При отсутствии иных фак¬ торов риска лица в возрасте от 40 до 60 лет, подвергающиеся аналогичному хирургическому вмешательству, но имеющие дополнительные факторы риска, беременные женщины, имеющие тромбофилию или ВТЭ в анамнезе, лица с инфарктом миокарда, инсультом или дегидратацией или же имеющие любое неврологическое заболевание и ВТЭ в анамнезе, лица с тяжёлым хроническим заболеванием и тромбофилией, а также лица старше 70 лет.• Очень высок риск развития ТЭЛА у лиц старше 40 лет, имеющих тромбофи¬ лию, новообразование, или тромбоз глубоких вен и подвергающихся опера¬ ции, длительность которой превышает 30 мин; лица, подвергающиеся боль¬ шой ортопедической операции или операции на крупных сосудах; пациенты с обширной травмой; лица, имеющие повреждения спинного мозга.Частота развития и методы профилактики ТЭЛА, в зависимости от степени риска, представлены в табл. 31-7 [17].Применение низкомолекулярных гепаринов для профилактики ТЭЛА у боль¬ ных хирургического профиля снижает частоту симптоматических ТГВ и ТЭЛА в5 раз, а у терапевтических больных — в 2 раза.
ШШ'530 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯТаблица 31-7. Частота развития и методы профилактики тромбоэмболии лёгочной артерии в: симости от степени рискаСтепеньрискаТГВдисталь¬ныйТГВпрокси¬мальныйТЭЛАФатальнаяТЭЛАМеры профилактикиНизкая2,00,40,20,01Нет специфических мер, ранняя мобилиза¬ цияСредняя10-202-41-20.1-0,4Гепарин каждые 12 ч или ииэкомолекуляр- ные гепарины (<3400 ЕД в день), эластине i чулки или переменная пневматическая ком- * ? прессия ... ^Высокая20-404-82-40,4-1,0Гепарин каждые 8 ч или низкомолекулярчв гепарины (>3400 ЕД в день), или переменчии пневматическая компрессия ?Очень высо¬ кая40-8010-204-100,2-5Ниэкомолекулярные гепарины (>3400 ВД ■ день), фондапаринукс натрия, пероральные антикоагулянты (МНО 2,0-3,0) или сочегаж переменной пневматической компрессии с высокими дозами гепаринаФИЛЬТРЫ НИЖНЕЙ ПОЛОЙ ВЕНЫФильтры, устанавливаемые в нижнюю полую вену (кава-фильтры), призвалы механически препятствовать миграции тромба из вен нижних конечностей и мало¬ го таза в лёгочные сосуды. В России в последние годы наблюдают рост интереса к этому способу профилактики ТЭЛА. Практикующему врачу следует чётко пред¬ ставлять показания и возможные осложнения этой инвазивной процедуры.Большинство современных кава-фильтров — съёмные, т.е. они могут быть уда¬ лены после устранения угрозы ТЭЛА. Однако известно, что около половины всех устанавливаемых съёмных фильтров в дальнейшем не удаляют» в том числе из-за технической невозможности [25].В настоящее время показаниями к постановке временнь[х кава-фильтров слу¬ жат:• наличие эмбологенных — флотирующих — тромбов;• противопоказания к антикоагулянтной терапии (недавно перенесённое опе¬ ративное вмешательство, продолжающееся кровотечение и т.п.).Показания к постановке постоянных кава-фильтров:• неэффективность антикоагулянтной терапии (когда происходит рецидив ТЭЛА на фоне адекватного лечения антикоагулянтами);• значительно скомпрометированное сосудистое русло (больные с массивной ТЭЛА или постэмболической лёгочной гипертензией).Осложнения установки кава-фильтров — тромбоз в месте катетеризации вены, тромбоз самого фильтра, миграция его или пенетрация стенки нижней полой вены. Больные с имплантированным постоянным кава-фильтром вынуждены пожизненно получать антикоагулянты, поскольку в противном случае велик риск тромбоза на фильтре, что может привести как к рецидивам тромбоэмболии мел¬ ких ветвей лёгочной артерии, так и к окклюзии нижней полой вены. У больных с постоянными кава-фильтрами достоверно чаще развиваются рецидивы ТГВ ниж¬ них конечностей.Если больному установлен временный кава-фильтр, он может быть удалён в течение 2 недель, когда произойдет фиксация флотирующего тромба к стенке вены
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 531либо будет устранена угроза кровотечения. Удаление фильтра в более поздние фоки, как правило, не удаётся из-за его фиксации к стенке вены.ХРОНИЧЕСКАЯ ТРОМБОЭМБОЛИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ОпределениеХроническая тромбоэмболическая лёгочная гипертензия (ХТЛГ) — стойкое повышение лёгочного сосудистого сопротивления в результате обструкции части лёгочных артерий организовавшимися тромбами, ремоделирования перифериче¬ ского сосудистого русла и вследствие этого развитие прогрессирующей правожелу¬ дочковой недостаточности.Код по МКБ-10127.0 Первичная лёгочная гипертензия.ЭпидемиологияТочных данных о распространённости ХТЛГ не существует, так как большую часть случаев заболевания не диагностируют. В США регистрируют около 600 ООО случаев ТЭЛА, из которых, по данным разных авторов, у ОД-5% больных разви¬ вается ХТЛГ [9, 34, 43]. Оценка истинной распространённости ХТЛГ затруднена ещё и тем, что более половины пациентов не имеют анамнестических признаков перенесённого эпизода венозного тромбоза или ТЭЛА [45].ПатогенезПатофизиологические механизмы, приводящие к развитию клинической карти¬ ны ХТЛГ, складываются из двух составляющих.Первична обтурация проксимальных отделов лёгочной артерии тромботиче¬ скими массами с последующей их организацией и сращением с интимой сосуда. Повреждение эндотелия лёгочной артерии приводит к плотной фиксации тром- боэмбола к интиме лёгочной артерии. В течение недели происходит врастание эластических волокон в тромб, с этого момента тромб и внутренняя оболочка сосуда представляют собой единую структуру, пронизанную фиброзной тканью. В образовавшейся сети тромботических масс снижается тромболитическая актив¬ ность эндотелия, что может приводить к появлению тромбов in situ и дальнейшему сращению с интимой лёгочной артерии.Вторая составляющая патогенеза ХТЛГ связана с ремоделированием дис¬ тальных отделов сосудистого русла на артериолокапиллярном уровне. Подобные изменения наблюдают при первичной лёгочной гипертензии, они проявляются гипертрофией интимы и медии лёгочных сосудов. Вклад второго патогенетиче¬ ского механизма позволяет объяснить прогрессирование лёгочной гипертензии в отсутствие рецидивов ТЭЛА, отсутствие прямой зависимости величины лёгочного сосудистого сопротивления от степени обтурации сосудистого русла по данным ангиопульмонографии, а также значительно более высокое лёгочное сосудистое сопротивление при ХТЛГ по сравнению с таковым при острой ТЭЛА.Нарушение процесса лизирования тромба после перенесённого эпизода острой ТЭЛА служит пусковым фактором для развития патологических изменений в лёгочном сосудистом русле. Развивающаяся с течением времени дистальная арте- риопатия в значительной степени обусловливает повышение давления в лёгочной артерии, а также увеличение лёгочного сосудистого сопротивления. Избирательное дистальное поражение лёгочного русла служит причиной неэффективности лёгоч¬ ной тромбэндартериэктомии у некоторых пациентов.
532 НАРУШЕНИЯ ЛЁГОЧНОГО кровообращенияФакторы рискаУ подавляющего большинства больных, перенёсших ТЭЛА, не происходит] вития ХТЛГ, что указывает на наличие особых факторов риска развития заболевания, отличных от таковых при ТЭЛА [13, 32]. Патогенез ХТЛГ на няшний день изучен не полностью, но принято считать, что повышение генного потенциала крови (приобретённые или наследственные тром( и снижение фибринолитических свойств крови являются двумя Mexaí которые лежат в основе патологических процессов, приводящих к XpOí обтурации лёгочной артерии организовашимися тромботическими массами i перенесённого эпизода ТЭЛА.Не обнаружено зависимости развития ХТЛГ от таких факторов, как гиперг цистеинемия, повышение уровня С-реактивного белка, фибриногена, фактора протеинов S и С, фактора И, мутация Leiden фактора V [30]. В то же вр< исключена связь развития ХТЛГ с повышенным содержанием антифосфо; ных антител и фактора УШ [6, 53].Среди клинических признаков, наличие которых повышает возможность: отмечали следующие:• давление в лёгочной артерии более 50 мм рт.ст. после перенесённой T9J возраст более 70 лет [36];• рецидивы ТЭЛА и обширные дефекты перфузии по данным сцинтиграфи§| [34];• спленэктомия в анамнезе, что приводит к повышению тромбогенного пот» циала крови вследствие утраты фильтрующей функции селезёнки; считакп; что при таком варианте развития ХТЛГ поражение локализуется в дисталь^ ных отделах лёгочной артерии и, следовательно, коррекция путём тромбэв- дартериэктоми лёгочной артерии может быть неэффективна [26];• хронические воспалительные заболевания, такие, как остеомиелит, болезнь Крона, некоторые хронические заболевания дыхательной системы [4].Таким образом, ХТЛГ и ТЭЛА характеризуются наличием разных факторов риска. Тромбофилии или дефекты в системе фибринолиза, если и служат причи¬ нами развития ХТЛГ, то не единственными.Клиническая картинаобтурация просвета лёгочной артерии организовавшимися тромботическими массами служит причиной прогрессивного повышения лёгочного сосудистого сопротивления. Увеличение постнагрузки для правого желудочка приводит к постепенной его дилатации, что вызывает ухудшение диастолической функции левого желудочка (рис. 31-7) [9].Клинические проявления заболевания появляются после так называемого периода мнимого благополучия, который обусловлен компенсаторными возмож¬ ностями правых камер по преодолению возросшего лёгочного сосудистого сопро¬ тивления и продолжается от месяца до года.Начало заболевания всегда постепенное. Основная жалоба — прогрессирующая одышка при физической нагрузке. При обтурации просвета лёгочной артерии более чем на 60% появляются признаки правожелудочковой недостаточности (отёки, асцит, увеличение печени, другие признаки венозной гипертензии), раз¬ вивается гипоксемия. Выраженная дилатация правого желудочка приводит к нарушению сократительной способности левого желудочка. На этом этапе могут появляться симптомы, связанные с диастолической дисфункцией левого желудоч¬ ка и снижением сердечного выброса — стенокардитические боли, синкопальные состояния.
1Ь|С. 31-7. Схема нарушения центрального кровообращения при хронической тромбоэм- болической лёгочной гипер- твнзии. Обструкция лёгочного сосудистого русла приводит к /ршатации правого желудочка, юмпрессии вследствие этого левого желудочка [9].ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ533лпрогноз у больных с ХТЛГ без лечения неблагоприятный и находится в обрат¬ но пропорциональной зависимости от уровня давления в лёгочной артерии. При достижении среднего давления в лёгочной артерии 50 мм рт.ст. 90% больных поги¬ бают в течение ближайших 5 лет (табл. 31-8).Таблица 31-8. Зависимость выживаемости больных с хронической тромбоэмболической лёгочной гигертензией от уровня лёгочной гипертензииСреднее давление в лёгочной артерии, мм рт.ст.Пятилетняя выживаемость, %<30>9031-404541-5035>5010ДиагностикаХТЛГ всегда следует подозревать при наличии одышки, причину которой не удалось установить в ходе обычного обследования. При подозрении на ХТЛГ на диагностическом этапе нужно решить три задачи:• подтвердить наличие лёгочной гипертензии и оценить её выраженность;• выяснить причину развития лёгочной гипертензии;• определить возможности хирургической коррекции.Для подтверждения диагноза ХТЛГ используют те же методы исследования, что и при диагностике острой ТЭЛА, однако существуют определённые диагностиче¬ ские признаки, характерные только для ХТЛГ.СЦИНТИГРАФИЯОтсутствие дефектов перфузии, по данным перфузионной сцинтиграфии, позво¬ ляет исключить ХТЛГ. Форма дефектов перфузии при ХТЛГ определяет объём выключенного сосудистого русла и всегда соответствует анатомо-функциональным единицам лёгочной ткани (сегментарные, долевые дефекты). При первичной лёгочной гипертензии сцинтиграфическая картина выглядит по-другому: дефекты перфузии, как правило, носят множественный характер, незначительны по вели¬ чине и не соответсвуют структурным частям лёгкого (рис. 31-8).
ЖШ;Х-ІШІІ534 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯІШІЭХОКАРДИОГРАФИЯТрансторакальная эхокардиограф| позволяет оценить следующие знаки, имеющие диагностическое чение при ХТЛГ: дилатацию и пшфі трофию правого желудочка и праш предсердия, нарушение систоличеа функции правого желудочка, патш гические движения межжелудочкм перегородки, величину регургитащш трикуспи да льном клапане, наруш систолической и диастолической ции левого желудочка, а также ор тировочно давление в лёгочной а (рис. 31-9, см, также цветную вкле: Чреспищеводная ЭхоКГ позволяет нить состояние межпредсердной пере^ городки (наличие открытого овалы окна), а также визуализировать тромь^ бы в проксимальных отделах лёгочя^| артерии. Эхокардиография также позволяет отслеживать уровень лёгочной гип^ тензии, сократительную способность сердца в периоде последующего наблюдени после выполнения тромбэндартериэктомии лёгочной артерии.КОМПЬЮТЕРНАЯ ТОМОГРАФИЯКТ при ХТЛГ позволяет визуализировать наличие тромботических масс, рас¬ положенных эксцентрично, неравномерное утолщение стенки лёгочной артерищ* увеличение правого желудочка, расширение центральных лёгочных артерищ, анастомозы лёгочных сосудов с бронхиальными артериями, изменения в лёгоч-Рис. 31 -8. Отсутствие перфузии в нижней доле левого лёгкого при перфузионной сцинтигра¬ фии.Рис. 31-9. Эхокардиограмма при хронической тромбоэмболическсй лёгочной гипертензии. Дилатация правого желудочка, парадоксальное движение межжелудочковой перегородки, уменьше¬ ние конечного диастолического объёма левого желудочка.
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 535&//Лю. 31-10. фрагмент компьютерной томографии грудной клетки с контрастированием больного с хронической тромбоэмболической лёгочной гипертензией. Визуализируются организовавшиеся тромботические массы в просвете артерии нижней доли левого лёгкого.ной ткани, свидетельствующие о перенесённых эпизодах ТЭЛА (рис. 31-10). Благодаря высокой разрешающей способности современная КТ может заменить сцинтиграфию и даже иногда ангиопульмонографию.МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯМРТ уступает КТ в разрешающей способности, но обладает одинаковой с пер¬ фузионной сцинтиграфией информативностью для проведения дифференциаль¬ ной диагностики между ХТЛГ и первичной лёгочной гипертензией. МРТ предо¬ ставляет широкие возможности визуализации структур сердца, что, учитывая неинвазивный характер исследования, может использоваться неоднократно для оценки состояния камер сердца в послеоперационном периоде.АНГИОПУЛЬМОНОГРАФИЯАнгиопульмонографические признаки, характерные для ХТЛГ, мог^т’ отличать¬ ся от таковых при острой ТЭЛА. Изменения ветвей лёгочной артерии отражают сложные процессы организации и частичной реканализации тромбов в просвете сосуда с утолщением его интимы (рис. 31-11) [15, 28, 37].АНГИОСКОПИЯАнгиоскопия — метод, специально разработанный для предоперационного обследования больных с ХТЛГ. При хроническом тромбоэмболическом пораже¬ нии лёгочной артерии визуализируются организовавшиеся тромбы, образующие перетяжки и сетчатые структуры в просвете сосуда, а также шероховатости и неровности его внутренней поверхности. Ангиоскопию выполняют при отсутствии признаков поражения проксимальных отделов лёгочной артерии, по данным ангиопульмонографии [13].Дифференциальная диагностикаДифференциально-диагностический ряд включает в себя заболевания, сопрово¬ ждающиеся повышением давления в лёгочной артерии:
536 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯРис. 31-11. Ангиопульмонограмма больного с хронической тромбоэмболической лёгочной тензией. «Ампутация» переднего ствола правой лёгочной артерии.острый эпизод ТЭЛА; ^заболевания лёгких (ХОБЛ, муковисцидоз, буллёзная эмфизема лёг интерстициальные заболевания); ангиосаркома лёгочной артерии; опухолевые эмболы лёгочной артерии; паразитарные эмболы (эмболы эхинококка из печени); артериит (Такаясу, Бехчета): заболевания соединительной ткани; фиброзирующий медиастинит; первичная лёгочная гипертензия.ЛечениеЕдинственным методом лечения ХТЛГ, позволяющим добиться излечения, — тромбэндартериэктомия лёгочной артерии. Следует подчеркнуть, что в отличие от тромбэктомии, достаточной при острой ТЭЛА, принципиально важный элемент операции у больных с ХТЛГ — одномоментная эндартерэктомия. После успешно проведённой операции у большинства пациентов полностью восстанавливаете* уровень физической активности. Без операции пациенты с ХТЛГ погибают от прогрессирующей правожелудочковой, а затем и бивентрикулярной сердечной недостаточности. Консервативное лечение заболевания на сегодняшний день позволяет добиться лишь временной стабилизации состояния больных и неизбеж¬ но заканчивается летальным исходом. Эндартерэктомия служит методом выбора в лечении ХТЛГ, и вопрос о возможности выполнения этого вмешательства нужно рассматривать у каждого больного с ХТЛГ.
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 537■ІІОР ПАЦИЕНТОВ ДЛЯ ЗНДАРТЕРЗКТОМИИ И ИХ ПРЕДОПЕРАЦИОННАЯ ОЦЕНКАСогласно рекомендациям американского общества пульмонологов {American CoBege of Chest Physicians) решать вопрос о целесообразности выполнения эндарте- рактомии у больных с ХТЛГ следует при наличии:• клинических признаков сердечной недостаточности III-1V функционального класса по NYHA [11]:• лёгочного сосудистого сопротивления более 300 дин X с X см'^;• данных ангиопульмонографии, свидетельствующих о проксимальном типе поражения лёгочной артерии (не дистальнее сегментарных артерии).Операция показана лишь при наличии всех трех перечисленных условий. Такой ■одход позволяет выделить группу больных, у которых выполнение хирургиче¬ ского вмешательства будет обладать, с одной стороны, максимальным лечебным эффектом, а с другой — минимальным риском послеоперационных осложнений и JИтaльнocтью [12, 39],С хирургической точки зрения выделяют 4 макроскопических варианта пораже- ■шя лёгочной артерии при ХТЛГ [27,44]:• I - организовавшиеся тромбы в главных или долевых артериях;• II — утолщение интимы и фиброз без видимых тромбов проксимальнеє сег¬ ментарных артерий;• III — фиброз, формирование интимальных сплетений и утолщение интимы дистальнее сегментарных артерий;• IV — микроскопическая дистальная артериопатия без видимых тромбоэмбо¬ лических изменений.Лучшие результаты хирургического лечения с максимальным снижением лёгоч- вого сосудистого сопротивления и самыми низкими показателями летальности люстигнуты у больных с I и II типами ХТЛГ. При IV типе поражения лёгочной артерии эндартерэктомия невозможна, а лечебная тактика аналогична таковой у больных с первичной лёгочной гипертензией.Тромбэндартерэктомия у больных с ХТЛГ противопоказана при наличии:• серьёзной сопутствующей патологии (злокачественные заболевания, деком¬ пенсированный сахарный диабет, выраженная сердечная патология, хрони¬ ческая почечная недостаточность, требующая диализа);• лёгочного заболевания с выраженными рестриктивными или обструктивны¬ ми нарушениями функции внешнего дыхания.Вопрос об установке кава-фильтров перед эндартерэктомией у больных с ХТЛГ следует решать в зависимости от результатов предоперационного обследования глубоких вен нижних конечностей.Техника лёгочной тромбэндартерэктомииЛёгочную тромбэндартерэктомию выполняют под общим обезболиванием путём срединной стернотомии, перикардиотомии, с использованием аппарата искусственного кровообращения, в условиях общей гипотермии (20 °С) с перио¬ дами полной остановки кровообращения в ходе операции. Залогом успеха опера¬ ции, как уже указывалось, служит не только полное удаление организовавшихся тромботических масс, но также интимы и части средней оболочки сосуда — тромб¬ эндартерэктомии. Тщательное соблюдение методики операции позволяет освобо¬ дить просвет лёгочной артерии путём извлечения единого слепка разветвлений сосуда (рис. 31-12),На заключительном этапе выполняют ушивание дефекта в левой артерии, устранение воздуха из камер сердца, снятие зажима с аорты и постепенное согре¬ вание пациента. В этот момент возможно выполнение вмешательств по поводу сочетанной кардиохирургической патологии. Коррекцию трикуспидальной недо¬ статочности не выполняют, поскольку после нормализации давления в лёгочной
И|3|;Ш1»№'538 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ ч, '■Рис. 31-12. Организовавшиеся тромботические массы, удалённые при лёгочной тpoмбэн^ томии. Видны слепки просветов субсегментарных артерий (собственное наблюдение).артерии регургитация на трикуспидальном клапане значительно уменьшается: исчезает совсем.ОсложненияРезультат операции лёгочной тромбэндартерэктомии — резкое снижение нагрузки для правого желудочка, а также перераспределение лёгочного крове Лечение больных в послеоперационном периоде, вентиляционная и воле* скал поддержка направлены на коррекцию этих патогенетических факторов предотвращение возможных осложнений: реперфузионного отёка лёгких, невр|к| логических нарушений, острой почечной недостаточности, полиорганной нед»-] статочности, общих для любых кардиохирургических вмешательств осложнеиЛ! (кровотечения, инфекционные осложнения со стороны раны, перикардит, нарушг* = ния мозгового кровообращения).Реперфузионный отёк лёгких — самое частое осложнение, встречается в той 1 иной степени у большей части больных. Развивается в течение первых 24 ч посж операции, в редких случаях этот интервал может достигать 72 ч. Максимальав выражен в той части лёгкого, где сосудистое русло было закрыто проксимальво расположенными тромбами. Одним из проявлений этого осложнения служит феномен «обкрадывания», когда кровоток устремляется в только что освобождёя- ное русло, а не в ту часть лёгочного русла, которая до операции не была обтуриро- вана тромбами и находилась под воздействием повышенного давления в лёгочнов артерии. Степень выраженности варьирует от лёгкой, которая проявляется незю- чительной гипоксемией, до тяжёлой, когда развивается геморрагический альвео¬ лярный отёк, клинически проявляющийся диффузным лёгочным кровотечением, зачастую фатальным. Лечение: вентиляционная поддержка с использованиш положительного давления к концу выдоха, устранение гиперкапнии, использова¬ ние диуретиков, ингаляция оксида азота (мощный вазодилататор, действующий ва лёгочные сосуды, улучшающий лёгочную гемодинамику и газовый обмен), инга¬ ляция иллопроста* (аналог простациклина), использование глюкокортикоидов с противовоспалительной целью. В некоторых случаях требуется экстракорпораль¬ ная оксигенация крови.
ТРОМБОЭМБОЛИЯ ЛЁГОЧНОЙ АРТЕРИИ 539Неврологические нарушения зависят от длительности остановки кровообра¬ щения во время операции, практически всегда имеют транзиторный характер, уменьшаются при использовании наружного охлаждения головы во время полной остановю^ кровообращения.У10-15% больных сохраняются высокие цифры давления в лёгочной артерии, что указывает на поражение дистального отдела лёгочного русла, недоступного для эндартерэктомии. У этой группы больных принципиально важен подбор оптимальных значений преднагрузки для правого желудочка, частоты сердеч¬ ных сокращений. С этой целью интраоперационно устанавливают временные предсердные и желудочковые электроды, у таких пациентов частыми формами нарушения ритма служат узловой ритм или фибрилляция предсердий. Лёгочное сосудистое сопротивление выше 500 дин X с X см'^ в послеоперационном периоде значительно увеличивает показатели летальности в этой группе больных.Результаты лёгочной тромбэндартерэктомииПослеоперационная летальность составляет 4-25%, по данным разных авторов, и зависит от количества оперированных больных — по мере накопления опыта этот показатель уменьшается. При соблюдении методики операции непосредственные и отдалённые результаты лёгочной тромбэндартерэктомии свидетельствуют о чрезвычайной эффективности оперативного вмешательства при ХТЛГ. У пода¬ вляющего числа больных регрессируют признаки сердечной недостаточности.Окончательное улучшение показателей газообмена, сердечного выброса и толерантности физической нагрузки происходит в течение 3 мес после операции. Пациенты, перенёсшие лёгочную тромбэндартерэктомию, принимают пожизнен¬ но антикоагулянтные препараты под контролем МНО, который должен поддержи¬ ваться в интервале 2,5-3,5.ДРУГИЕ МЕТОДЫ ЛЕЧЕНИЯ ХТЛГ Трансплантация лёгкогоТрансплантацию лёгкого используют в случаях дистального поражения лёгоч¬ ной артерии вместо лёгочной тромбэндартерэктомии, а также после лёгочной тромбэндартерэктомии при сохраняющемся высоком лёгочном сосудистом сопро¬ тивлении.Баллонная ангиопластика лёгочной артерииИспользуют в тех случаях, когда существуют противопоказания к лёгочной тромбэндартерэктомии. Описан положительный эффект этой манипуляции (улуч¬ шение показателя 6-минутного теста и изменение класса сердечной недостаточности по NYHA) у пациентов с дистальным уровнем поражения лёгочной артерии. Опыт применения данного вмешательства, однако, ограничен небольшим количеством центров, где эту методику применяют. Кроме того, не существует данных для сравне¬ ния эффективности ангиопластики и медикаментозного лечения больных ХТЛГ.Предсердная септостомияИспользуют в редких случаях либо интраоперационно при невозможности отключить больного от аппарата искусственного кровообращения, либо в качестве временной меры перед трансплантацией [38].МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕТерапию лекарственными препаратами используют перед операцией у пациен¬ тов, составляющих группу риска (выраженная сердечная недостаточность, высо¬ кая вероятность сохранения лёгочной гипертензии после операции), — «терапев¬ тический мост» к лёгочной тромбэндартерэктомии.
-??>> А".:> , •-ШШЯШ540 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯЗаключениеТЭЛА и её последствия [хроническая тромбоэмболическая лёгочная гипертев- зия (см. главу 36)] — серьёзная медико-социальная проблема, всё ещё не пoJy^ чающая должного внимания в практической медицине. В настоящее время есть высокоинформативные методы диагностики и рациональные алгоритмы леченяа этого опасного для жизни заболевания. Внедрение и активное использование современных подходов к лечению ТЭЛА и её осложнений в клиническую практм^ позволят уменьшить летальность и улучшить качество жизни таких пaциeнтQ■L Ключевым элементом для успешного применения указанных принципов служит тесное взаимодействие и чётко скоординированная работа врачей разных специ¬ альностей — врачей общей практики, пульмонологов, кардиологов, торакальных и кардиохирургов, анестезиологов, реаниматологов, а также среднего медицинского персонала.СПИСОК ЛИТЕРАТУРЫ^
Глава 32 Лёгочные васкулитыЛёгочные васкулиты в основном становятся проявлением систем¬ ных васкулитов, при которых ишемия и некроз лёгочной ткани воз¬ никают вследствие воспаления кровеносных сосудов. Васкулиты, изолированно поражающие лёгкие, встречаются редко.По Международной статистической классификации болезней Всемирной организации здравоохранения (ВОЗ) 10-го пере¬ смотра (Женева, 1995), большинство системных васкулитов, при которых наиболее часто встречаются респираторные синдромы, входят в ХП1 класс (болезни соединительной ткани) и отнесены к системным поражениям соединительной ткани (подгруппы МЗО иМ31).КлассификацияСогласно существующим классификациям и рекомендациям Международной согласительной конференции в Chapel Hill (США, 1993) системные васкулиты подразделяют в зависимости от калибра поражённых сосудов (табл. 32-1) [1, 2J. Патологические изменения лёгких описаны при любом типе васкулита, однако при некоторых они доминируют в клинической картине заболе¬ вания, формируя её нозологическое своеобразие.ЭпидемиологияВаскулиты относятся к числу относительно редких заболеваний (0,4-14 случаев на 100 тыс. населения в год), однако в послед¬ ние годы отмечена тенденция к увеличению их распространён¬ ности, особенно микроскопического полиангиита и гранулематоза Вегенера [3,4J.Системные васкулиты чаще встречаются у мужчин, чем у жен¬ щин, могут развиваться в любом возрасте, но преимущественно в четвёртое-пятое десятилетия жизни, за исключением гемор¬ рагического васкулита и болезни Кавасаки, для которых харак¬ терно преобладание больных детского и юношеского возраста. Пик заболеваемости васкулитами нередко приходится на зиму и весну.
542 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯТаблица 32« 1. Частота поражения лёгких при системных васкулитахКалибр поражённых сосудовЧастота поражения лёпмКлиническиепроявленияДанные инс1|1рН1|ЭН тальных ммщм|^ВПреиму1цествениое поражение сосудов мелкого калибраПурпура Шенлейна-Геноха+яНЭссенциальный криоглобулинемичесшй васкулит++Изолированный мапоиммунный лёгочнь/й капиллярит++++++ ЯМикроскопический пошангиит (полиартериит)*++++ яПреимущественное поражение сосудов мелкого и среднего калибраГранулематоз Вегенера*++++++ щСиндром Черджа-Стросс*+++ 1Преимущественное поражение сосудов среднего калибраУзелковый полиартериит++Болезнь Кавасаки++Преимущественное поражение сосудов крупного калибраГигантоклеточный (височный) артериит4-+Артериит Такаясу+++Смешанные состояния (поражение сосудов мелкого, среднего и крупного калибра)1Болезнь Бехчета++■“ “ iОблитерирующий тромбангиит+/-*АМСА-ассоциированные васкулиты; +++ — очень часто. ++ — часто, + — редко, +/— очан» редко, ANCA - антитела к цитоплазме нейтрофилов.ЭтиологияПричины возникновения большинства первичных системных васкулитов неиз¬ вестны, Наиболее доказана взаимосвязь узелкового полиартериита с инфекцией вирусом гепатита В и эссенциального криоглобулинемического васкулита — с вирусом гепатита С [5], В развитии пурпуры Шенлейна-Геноха обсуждается уча¬ стие стрептококков, стафилококков, парвовируса В19, вируса Эпштейна-Барр, а при болезни Бехчета — вируса простого герпеса. Важную роль в обострении грану¬ лематоза Вегенера играет инфекция, вызванная St aureus и Pneumocystis jiroveci.Морфологические измененияГРАНУЛЕМАТОЗ ВЕГЕНЕРАВ лёгких наблюдаются васкулит и гранулематозное воспаление, некроз парен¬ химы с образованием микроабсцессов, состоящих из распадающихся нейтрофи-
ЛЁГОЧНЫЕ ВАСКУЛИТЫ 543лов, реже лимфоцитов и базофилов. Некротизирующие гранулёмы образуются в основном в органах, контактирующих с внешней средой (воздухоносные пути, желудочно-кишечный тракт) [6]. Характерно наличие эритроцитов внутри альве¬ ол и в интерстиции, а также присутствие сидерофагов, формирование фибриновых тромбов в капиллярах межальвеолярных перегородок. Патологические изменения нижних дыхательных путей протекают в виде острого или хронического брон¬ хиолита, облитерирующего бронхиолита со стенозом просвета за счёт наличия в стенках некротоксических гранулём. Встречается острый фибринозный или хро¬ нический (фиброзный) плеврит [7].МИКРОСКОПИЧЕСКИЙ ПОЛИАНГИИТпри заболевании преобладает поражение сосудов мелкого калибра (артери¬ ол, капилляров, венул). Некротизирующий васкулит носит распространённый характер. Наиболее выраженные изменения встречаются в коже, лёгких и почках. В лёгочной ткани наблюдается некротизирующий альвеолит с поражением капил¬ ляров и нейтрофильной инфильтрацией, что нередко приводит к развитию лёгочных кровотечений, в почках возникает фокальный некротизирующий гло¬ мерулонефрит, который в 80-90% наблюдений сочетается с экстракапиллярным пролиферативным гломерулонефритом.СИНДРОМ ЧЕРДЖА-СТРОССДля синдрома Черджа-Стросс (СЧС) характерно сочетание некротических гра¬ нулём, аллергического ангиита, некротизирующего васкулита и перифокальной пневмонии [8]. Некротические гранулёмы обычно расположены экстраваску- лярно, редко вовлекая сосуды. Васкулит затрагивает мелкие артерии и вены при наличии в их стенках гигантских многоядерных клеток. Исходом данного процес¬ са являются склеротические изменения в сосудах и лёгочной ткани, обычно соче¬ тающиеся с участками активного воспаления. Наблюдаются отёк и инфильтрация слизистой оболочки бронхов эозинофилами, в просветах встречаются кристаллы Шарко-Лейдена и густая слизь, гипертрофия гладких мышц, бокаловидноклеточ¬ ная гиперплазия и плоскоклеточная метаплазия, утолщение базальной мембраны. Интерстициальная ткань лёгких инфильтрирована лимфоцитами, плазматически¬ ми клетками и гистиоцитами.УЗЕЛКОВЫЙ ПОЛИАРТЕРИИТПатогистологические изменения характеризуются сегментарным некроти- зирующим васкулитом артерий среднего и мелкого калибра, реже артери¬ ол и крайне редко — венул. В острую фазу заболевания в стенках артерий выявляется фибриноидный некроз с преимущественным поражением медии. Воспалительный инфильтрат представлен нейтрофилами и в меньшей степени лимфоцитами и эозинофилами. В более поздний период наблюдается формиро¬ вание аневризм артерий с пристеночными тромбами, склерозом стенки, иногда с полной окклюзией просвета сосуда; встречаются очаги кровоизлияний и интер¬ стициального фиброза.БОЛЕЗНЬ КАВАСАКИВ лёгочной ткани выявляются признаки поражения интерстициальной ткани, моноцитарная инфильтрация стенок сосудов и паренхимы лёгких с образованием узелков, содержащих 1^А-плазматические клетки. Последние часто обнаружива¬ ются и в подслизистом слое трахеи и крупных бронхов. Это косвенно подтверж¬ дает возможность проникновения этиологических агентов заболевания через верхние дыхательные пути и важной роли локального IgA-иммyннoгo ответа в патогенезе заболевания.
544 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯГИГАНТОКЛЕТОЧНЫЙ АРТЕРИИТВ основе заболевания лежит гранулематозный артериит височных (и друп артерий, включая крупные ветви лёгочной артерии, с преимущественным жением медии и наличием клеточных инфильтратов, состоящих главным об{ из лимфоцитов, плазмоцитов, макрофагов с примесью гигантских многояд« клеток. Встречается некроз гладкомышечных клеток медии, деструкция и ментация внутренней эластической мембраны. Фибриноидный некроз нетш Часто наблюдаются миоэласгофиброз интимы, клеточная инфильтрация, прис ночные тромбозы.АРТЕРИИТ ТАКАЯСУИзменения в лёгочной артерии в активную фазу заболевания характеризуюте* гранулематозным артериитом с преобладанием в инфильтрате мононуклеарощ^ иногда с примесью гигантских многоядерных клеток. Далее наблюдается форля^ рование фиброзной гранулёмы, разрушение эластических волокон, пролифераци* интимы и гладкомышечных клеток сосудистой стенки с пристеночным тромбозом, в единичных случаях развивается острая интерстициальная пневмония, Возмож» сосуществование воспалительных и фиброзных изменений.БОЛЕЗНЬ БЕХЧЕТАМорфологические признаки артериита характеризуются интенсивной вос¬ палительной инфильтрацией сосудистой стенки, особенно мьппечной оболочки и адвентиции. Наблюдаются исчезновение эластических и мышечных фибрилл, фиброзное утолщение интимы, внутренней эластической мембраны и адвентиции. формирование аневризмы и пролиферация vasa vasorum.ПатогенезОпределённая роль отводится участию иммунных комплексов (геморрагиче¬ ский васкулит, криоглобулинемический васкулит; узелковый полиартериит, ассо¬ циированный с инфекцией вирусом гепатита В, СЧС), органонеспецифическим аутоантителам (антитела к эндотелию — болезнь Кавасаки), активации клеточного иммунитета, дисбалансу цитокиновой сети (гигантоклеточный артериит, артериит Такаясу, гранулематоз Вегенера, СЧС и др,) и дисфункции эндотелия.Участие В-клеток в патогенезе васкулитов связано с синтезом ими аутоантител, вызывающих деструкцию тканей, продукцией фактора некроза опухоли альфа (ФНО-а) и интерлейкина-6 (ИЛ-6), представлением антигена Т-клеткам. форми¬ рованием гранулёмы и поддержанием иммунологической «памяти» к аутоантиге¬ нам [9].Гемореологические нарушения превалируют при криоглобулинемическом васкулите, а продукция повреждающих субстанций клетками воспалительно¬ го инфильтрата (эозинофилы — при СЧС; нейтрофилы — при гранулемато¬ зе Вегенера; микроскопическом полиангиите). Провоспалительные цитокины (гамма-интерферон — ИФ-у) и факторы роста вызывают гиперплазию интимы сосуда с облитерацией его просвета (гигантоклеточный артериит, артериит Такаясу).При СЧС развитие васкулита связывают с отменой ГКС или снижением их эффективности, наступившей вследствие резистентности к ним, обсуждается уча¬ стие в патогенезе заболевания ингибиторов лейкотриеновых рецепторов (зафир¬ лукаст, монтелукаст), использующихся для лечения БА. Для микроскопического полиангиита подобные ассоциации отмечены с пропилтиоурацилом.Важным серологическим маркёром и патогенетическим медиатором васкулитов мелких сосудов являются антитела к цитоплазме нейтрофилов (ANCA). Наиболее часто (80-90%) ANCA встречаются при так называемых ANCA-ассоциированных
ЛЁГОЧНЫЕ ВАСКУЛИТЫ 545васкулитах — гранулематозе Вегенера, микроскопическом полиартериите и СЧС и играют большую роль в их патогенезе [10,11].Клинические проявленияОсновные клинические синдромы васкулитов, исключая респираторные, вклю¬ чают:• Конституциональные синдромы (лихорадка, похудение, артралгии, миалгии): все формы васкулитов.• Недеструктивный олигоартрит: узелковый полиартериит, гранулематоз Вегенера, СЧС, пурпура Шенлейна-Геноха.• Поражение кожи и слизистых:❖ сетчатое ливедо, дигитальные инфаркты, язвы, узелки: узелковый полиар* териит, СЧС, гранулематоз Вегенера;❖ пальпируемая пурпура: любая форма васкулита, за исключением гиганто- клеточного артериита и артериита Такаясу;❖ узловатая эритема: болезнь Бехчета;❖ язвы полости рта, половых органов: болезнь Бехчета.• Множественный мононеврит: узелковый полиартериит, криоглобулинеми¬ ческий васкулит, гранулематоз Вегенера, СЧС, облитерирующий тромбан- гиит,• Ишемическое поражение почек: узелковый полиартериит, артериит Такаясу.• Гломерулонефрит: микроскопический полиангиит, гранулематоз Вегенера, криоглобулинемический васкулит, СЧС, пурпура Шенлейна-Геноха.Оценка активности фазы васкулита и степени повреждения органовОценка активности васкулита проводится на основании индекса клинической активности васкулита - Birmingham vasculitis activity score (BVAS), адаптирован¬ ного к больным гранулематозом Вегенера в 2001 г. (BVAS/WEG) и модифициро¬ ванного в 2003 г. (BVAS 2003) [12-14]. Учитываются признаки, обусловленные только васкулитом, присутствующие на момент осмотра, а также появившиеся или прогрессирующие в течение последнего месяца до настоящего обследования больного.в зависимости от активности выделяют несколько фаз заболевания.Ремиссия — отсутствие признаков активности (общий счёт 0-1 балл) при нор¬ мальном уровне С-реактивного белка (СРБ), на фоне стабильной поддерживаю¬ щей терапии.Ответ на терапию (частичная ремиссия) — уменьшение на фоне лечения общей суммы баллов на 50% от первоначальной.Низкая активность (персистирующая активность) — персистенция общих сим¬ птомов воспаления (артралгии, миалгии и другие), которые купируются незначи¬ тельным повышением дозы ГКС (не требуют эскалации терапии).Неактивная фаза — ремиссия, которая не требует поддерживающей терапии.«Большое» обострение — вовлечение в воспалительный процесс жизненно важных органов или систем (лёгких, почек. ЦНС, сердечно-сосудистой системы) приводит к увеличению общей суммы на 6 и более баллов, требуется назначение адекватной (эскалационной) терапии (ГКС. цитостатики, вн)тривенный иммуно¬ глобулин — ВВИГ, плазмаферез).♦Малое» обострение — возврат заболевания с увеличением общей суммы с 0-1 до 5 баллов (требует увеличения дозы ГКС до 30 мг/сут).
546 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯIПерсистенция активности гранулематоза Вегенера (BVAS/WEG) - нг клинического проявления и отсутствие его ухудшения в течение 28 дней с мс предыдущего осмотра больного.Рефрактерное течение ANCA-ассоцииированных васкулитов;• увеличение или отсутствие положительной динамики при остром васкулита после 4-недельной стандартной терапии, или• плохой ответ (¿50%) на стандартную терапию в течение 6 нед, или• хроническая персистенция активности (один большой признак и три мг на фоне более чем 12-недельной терапии.Под повреждением органов и тканей понимают наличие у больного н€ тимых изменений в них, вызванных воспалительным процессом в сосудах и/i развившихся на фоне лечения [15]. Индекс васкулитного повреждения кумулятивным и представляет собой суммарный счёт по системам или орг отражающий степень нарушения их функции. В каждом конкретном случае может оставаться на прежнем уровне или возрастать, но никогда не умены ся. Оценка степени повреждения органов и тканей имеет большое значение определения прогноза заболевания.Оценка общего функционального состояния больных васкулитами проводите*^ на основании опросника SF-36,ДиагностикаАмериканской коллегией ревматологов (АКР) в 1990 г. разработаны классифв- кационные критерии 7 форм васкулитов, которые в основном предназначены дл эпидемиологических исследований, а не для их диагностики, особенно на ранних стадиях болезни.Для подтверждения диагноза, кроме наличия характерных клинических при¬ знаков, необходимо проведение инструментальной, лабораторной диагностики ■ морфологического исследования.ИНСТРУМЕНТАЛЬНОЕ ОБСЛЕДОВАНИЕЦель инструментального обследования — диагностика органной патологии, подтверждение диагноза и дифференциальная диагностика. При васкулитах при¬ меняются следующие методы инструментальной диагностики:• Ангиография:❖ узелковый полиартериит — показана в случае невозможности провести биопсию или при получении неспецифических результатов; перед биопсией печени или почек для выявления микроаневризм, которые могут привести к кровотечению;❖ артериит Такаясу, болезнь Бехчета, облитерирующий тромбангиит — под¬ тверждение диагноза, оценка динамики и распространения воспалительно¬ го процесса.• Ультразвуковая допплерография: поражение сосудов при артериите Такаясу и облитерирующем тромбангиите, болезни Кавасаки, болезни Бехчета, диа¬ гностика лёгочной гипертензии.• Рентгенография лёгких: диагностика и дифференциальная диагностика пато¬ логии лёгких при гранулематозе Вегенера, микроскопическом полиангиите, СЧС и других васкулитах.• Компьютерная томография (КТ), компьютерная томография высокого раз¬ решения (КТВР), магнитно-резонансная томография (МРТ), КТ и МРТ- ангиография: определение локализации процесса при гранулематозе Вегенера, микроскопическом полиангиите, СЧС, гигантоклеточном артериите, артерии¬ те Такаясу, болезни Бехчета и др.
ЛЁГОЧНЫЕ ВАСКУЛИТЫ 547• функциональные лёгочные тесты: спирометрия, бодиплетизмография, иссле¬ дование диффузионной способности лёгких - выявление субклинических нарушений: все формы васкулитов.• Бронхоскопия: диагностика субглоточного стеноза, диффузных альвеоляр¬ ных геморрагий, проведение трансбронхиальной биопсии.• Бронхоальвеолярный лаваж: диагностика диффузных альвеолярных геморра¬ гий, СЧС, оппортунистических инфекций.МОРФОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕОбязательный компонент постановки диагноза (диагностические критерии) при узелковом полиартериите, гранулематозе Вегенера, микроскопическом поли¬ артериите, СЧС, гигантоклеточном артериите.ЛАБОРАТОРНОЕ ОБСЛЕДОВАНИЕКлинический анализ крови: нормохромная анемия, тромбоцитоз, нейтро¬ фильный лейкоцитоз, эозинофилия, повышение скорости оседания эритроцитов (СОЭ).Биохимия: увеличение уровня СРБ, коррелирующее с активностью заболева¬ ния, измерение концентрации креатинина, печёночных ферментов.Общий анализ мочи, функциональные пробы почек: диагностика патологии и функции почек.Бактериологическое исследование крови и БАЛ: исключение инфекции. Серологическое исследование: маркёры вируса гепатита В и С, ВИЧ — при подозрении на узелковый полиартериит и криоглобулинемический васкулит, серо¬ логические тесты на сифилис.Иммунологическое обследование:• Антинуклеарный фактор (АНФ), ревматоидный фактор (РФ) — исклю¬ чение системного ревматического заболевания;• ANCA — подтверждение диагнозов: гранулематоз Вегенера, микроскопиче¬ ский полиангиит, СЧС;• Криоглобулины — подтверждение диагноза криоглобулинемический васкулит;• Антитела к фосфолипидам — исключение первичного антифосфолипидно- го синдрома;• Антитела к базальной мембране клубочков (аВМК) — исключение син¬ дрома гудпасчера.ЛечениеЭтапы терапии васкулитов включают• Индукцию ремиссии -> 3-6 мес,• Поддержание ремиссии ->2-5 лет.• Эскалационную терапию.ИНДУКЦИЯ РЕМИССИИОсновные задачи — достижение ремиссии, снижение риска обострений и пре¬ дотвращение необратимого поражения жизненно важных органов.На этом этапе назначают ГКС и цитостатики (циклофосфамид, метотрексат, азатиоприн). При ряде форм васкулитов применяется плазмаферез и введение внутривенного иммуноглобулина [16, 17]. Предпочтение, как правило, отдаётся комбинированной терапии ГКС и цитостатиками (табл. 32-2).
548 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ Таблица 32-2. Основные схемы терапии вас1сулитовЭтапы терапииНозологическая формаИндукция ремиссии (3-6 мес)Поддержание ремиссии (2-5 лет)Пурпура Шенлейна-ГенохаГКС, ГКС + циклофосфамид (поражение почек)ГКС, ГКС -I- азатиоприн (пораже¬ ние почек)Эссенциальный криоглобулинемический васкулитГКС + плазмаферез + противо¬ вирусные (циклофосфамид при тяжёлом васкулите)ГКС + противовирусныеИзолированный малоиммунный лёгочный капилляритГКС + циклофосфамидГКС + циклофосфамид или ГКС + азатиопринАМСА-ассоциированные васкулиты (микроскопический полиангиит, фэну- лематоз Вегенера, синдром Черджа- Стросс). Локальное и раннее системное поражение без нарушения функции жизненно важных органов (креати- нин <150 мкмоль/л)ГКС + циклофосфамид или ГКС + метотрексатГКС + азатиоприн или ГКС + метотрексатГенерализованное поражение с наруше¬ нием функции жизненно важных органов (креатинин <500 мкмоль/л)ГКС + циклофосфамидГКС + циклофосфамид или ГКС + азатиопринТяжёлое поражение с нарушением функ¬ ции жизненно важных органов (креати- нин >500 мкмоль/л)ГКС + циклофосфамид (пульс- терапия) + плазмаферезГКС + циклофосфамидРефрактерное течение*ГКС -1- ритуксимаб, или ГКС + микофеналата мофетил, или ГКС + лефлуномид, или ГКС + инфликсимабГКС или их отмена, ГКС + ритук¬ симаб?Узелковый полиартериитГКС + циклофосфамид, ГКС + циклофосфамид + плазмафе¬ рез + противовирусные (при инфекции вирусом гепатита В)ГКС + циклофосфамид или ГКС + азатиопринБолезнь КавасакиВВИГ + ацетилсалициловая кис¬ лота, ГКСАцетилсалициловая кислота, ГКСГигантоклеточный (височный) артериитГКС, ГКС + метотрексат (реф¬ рактерное течение)ГКС, ГКС + метотрексат, ацетил¬ салициловая кислота, статиныАртериит ТакаясуГКС, пульс-терапия ГКС + циклофосфамид, ГКС + мето¬ трексат (рефрактерное течение)ГКС, ГКС + метотрексатБолезнь БехчетаГКС + циклофосфамидГКС + азатиопринОблитерирующий тромбангиитГКС + циклофосфамид + про- стациклинГКС + простациклин, ацетилса¬ лициловая кислота, статины* При всех типах васкулитов.
ЛЁГОЧНЫЕ ВАСКУЛИТЫ $49ГКСГКС — основной метод лечения гигантоклеточного артериита и артериита Такаясу, а также СЧС и криоглобулинемического васкулита при отсутсгвии при¬ знаков прогрессирования заболевания. Применяются для лечения тяжёлых форм геморрагического васкулита с поражением желудочно-кишечного тракта и почек. В связи с высокой частотой прогрессирования заболевания (96%) монотерапия ГКС не используется для лечения гранулематоза Вегенера, микроскопического полиангиита и узелкового полиартериита.Преднизолон назначают в несколько приёмов в дозе 1 мг/(кгхсут) (не более 80 мг), а через 7-10 дней при положительной динамике клинических и лабо¬ раторных показателей переходят на однократный приём в утренние часы. Длительность подавляющей терапии составляет 3-4 нед. После достижения эффекта дозу препарата постепенно уменьшают по 5 мг в 2 нед до поддерживаю¬ щей [0,15-0,2 мг/(кгхсут)] на период от 1 года до 3-5 лет. Пульс-терапию ГКС (метилпреднизолоном) применяют у больных, рефрактерных к стандартной терапии, для индукции ремиссии васкулита и/или подавления его обострений (эскалационная терапия).ЦиклофосфамидПрепарат выбора для индукции ремиссии при генерализованном поражении, с вовлечением жизненно важных органов при системных некротизирующих васкулитах: (гранулематоз Вегенера, микроскопический полиартериит), узелко¬ вом полиартериите (при отсутствии маркёров репликации вируса гепатита В). Применяется при тяжёлых формах геморрагического васкулита и СЧС. при быстропрогрессирующем поражении сосудов и почек, даже несмотря на хороший начальный клинический ответ на ГКС.Циклофосфамид назначается в дозе 2 мг/(кгхсут) внутрь (максимально 200 мг/сут) или в виде пульс-терапии (15 мг/кг) с интервалами между тремя первыми курсами 2 недели, затем — через 3 нед. Обычно через 3 мес ремиссии достигают 80% боль¬ ных, а через 6 мес — 90%. Дозу препарата уменьшают при нарушении функции почек и в пожилом возрасте. При достижении ремиссии дозировку снижают до 1,5 мг/(кгхсут). Рекомендуется назначать препарат в течение 6 мес. Более дли¬ тельный его приём ассоциируется с высокой частотой побочных реакций, одной из которых является респираторная патология с лихорадкой и морфологическими симптомами интерстициального поражения лёгких [18].МетотрексатМетотрексат в дозе 15 мг/нед (максимально 20-25 мг/нед) в сочетании с ГКС применяется для индукции ремиссии при ANCA-ассоциированных васкулитах без быстропрогрессирующего нефрита (креатинин менее 150 ммоль/л) и тяжёлого поражения лёгких (локальная патология верхних дыхательных путей — ВДП). На фоне такой терапии отмечено уменьшение побочных эффектов, но чаще развива¬ ются обострения заболевания и нарушение функции печени.Метотрексат (17,5 мг/нед) назначается при рефрактерном к преднизолону тече¬ нии артериита Такаясу и гигантоклеточного артериита в сочетании с небольшими дозами ГКС. Низкие дозы метотрексата (7,5 мг/нед) не эффективны.Одним из побочных эффектов метотрексата является пневмонит, который осо¬ бенно часто развивается у пожилых больнь[х, при хронической почечной недо¬ статочности и не зависит от кумулятивной дозы препарата [18]. Его симптомы — непродуктивный кашель, одышка, фебрильная лихорадка, интерстициальные или альвеолярные инфильтраты, снижение умеренный лейкоцитоз — могут быть расценены как обострение основного процесса или как присоединение инфекции, вызванной PneumocystisjirovecL
550 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯВнутривенный иммуноглобулинПрепарат выбора при болезни Кавасаки (позволяет предотвратить развитее осложнений заболевания, в первую очередь поражения коронарных артерий). В сочетании с плазмаферезом применяется для лечения СЧС. При других формах васкулитов в основном используется, когда не показаны цитостатические препа¬ раты: при инфекционных осложнениях, беременности, до и после хирургическош вмешательства.ПлазмаферезОсновное показание — комбинированная терапия при остром, прогрессирую¬ щем течении заболевания, проявляющемся быстропрогрессирующим нефритом (уровень креатинина более 500 мкмоль/л) и тяжёлым васкулитом, включая диф¬ фузные альвеолярные геморрагии.В сочетании с ГКС применяется для лечения эссенциального криоглобулине¬ мического васкулита и узелкового полиартериита, ассоциированного с вирусом гепатита В.Противовирусные препаратыПри наличии маркёров репликации вируса гепатита В показаны интерферон-ои ламивудин в дозе 100 мг/сут (длительностью до 6 мес) в сочетании с ГКС и плаз¬ маферезом.При инфекции вирусом гепатита С при криоглобулинемическом васкулите ком¬ бинированную терапию дополняют рибавирином.Тяжёлое течение васкулитовПри некротизирующих васкулитах тяжёлое течение заболевания с нарушени¬ ем функции жизненно важных органов (креатинин >500 мкмоль/л, диффузные альвеолярные геморрагии) требует эскалационной терапии. Назначается 7-10 процедур плазмафереза в течение 14 дней (удаление плазмы в объёме 60 мл/кг с замещением её равным объёмом 4,5-5% человеческого альбумина) в сочетании с пульс-терапией метилпреднизолоном [15 мг/(кгхсут)] и циклофосфамидом [10 мг/(кгхсут)],ПОДДЕРЖАНИЕ РЕМИССИИОсновные задачи этапа — достижение стойкой ремиссии, снижение риска разви¬ тия побочных эффектов лекарственной терапии, увеличение продолжетельности жизни и, возможно, излечение. После достижения ремиссии длительность терапии составляет не менее 24 мес. У больных гранулематозом Вегенера при постоянно высоком уровне ANCA её продолжительность увеличивается до 5 лет. Даже при наличии стойкой ремиссии в этот период необходимо наблюдение за больными, В ряде случаев требуется продолжение иммуносупрессивной терапии.Для поддержания ремиссии обычно используют азатиоприн, метотрексат и другие препараты.АзатиопринПрименяется для поддержания ремиссии при некротизирующих васкулитах, гранулематозе Вегенера и микроскопическом полиангиите. Реже вызывает побоч¬ ные эффекты, чем циклофосфамид [19]. Оптимальная доза — 1-3 мг/(кгхсут), поддерживающая — 50 мг/сут. После достижения ремиссии на фоне циклофосфа- мида его применение оправдано и при других формах васкулитов (см. табл. 32-2).МетотрексатИспользуется для поддержания ремиссии при ANCA-ассоциированных васку- литах без быстропрогрессирующего нефрита (креатинин менее 150 ммоль/л) и
ЛЁГОЧНЫЕ ВАСКУЛИТЫ 551тяжёлого поражения лёгких (локальная патология ВДП), а также при артериите Такаясу и гигантоклеточном артериите.Микофеналата мофетил, лефлуномидМикофеналата мофетил (в дозе 2 г/сут), лефл>тіомид (в дозе 40 мг/сут) в соче¬ тании с преднизолоном (10 мг/сут) МОГ)Т применяться для поддержания ремиссии у больных с Гранулематозом Вегенера при непереносимости или неэффективности азатиоприна или метотрексата.Сульфаметоксазол/триметопримВ дозе 160/800 мг 2 раза в сутки применяется при гранулематозе Вегенера, в первую очередь при ограниченных формах (поражение ЛОР-органов), в период индукции ремиссии для профилактики инфекционных осложнений, вызываемых Pneumocystis jiroveci.Ацетилсалициловая кислотаПоказана в дозе 80-100 мг/сут при артериите Такаясу и гигантоклеточном арте¬ риите для блокирования агрегации тромбоцитов и высвобождения из них веществ, стимулирующих пролиферацию интимы, совместно с применением статинов или сиролимов.РЕФРАКТЕРНОЕ ТЕЧЕНИЕ ВАСКУЛИТАПри рефрактерном течении васкулита наряду с назначением микофеналата мофетила, лефлуномида применяют биологические препараты: антитимоцитар- ный глобулин, антитела к CDw52, инфликсимаб и ритуксимаб.Этанерцепт^ не эффективен для поддержания ремиссии при гранулематозе Вегенера [201 • При ®го назначении, по сравнению с плацебо, отмечено увеличение частоты возникновения солидных опухолей.Применение ритуксимаба по схеме 375 мг/м^ 4 раза еженедельно в сочетании с преднизолоном [1 мг/(кгхсут)] или без него позволяет достичь полной или частичной ремиссии у 88% больных ANCA-ассоциированными васкулитами и эссенциальным криоглобулинемическим васкулитом, ранее не отвечавших на дру¬ гую терапию [21, 22]. Наименьший эффект отмечается у пациентов с гранулёмой орбиты.При СЧС обсуждается эффективность омализумаба, блокирующего связывание IgE с его рецепторами на мембране клеток [23].ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕПоказано при критическом субглоточном стенозе при гранулематозе Вегенера (механическая, лазерная дилатация трахеи в сочетании с местным введением ГКС). хронических гнойных синуситах с разрушением кости, носовой перегород¬ ки, выраженном фиброзе или полостях в лёгких, гигантских аневризмах крупных артерий [24].Гранулематоз ВегенераГранулематоз Вегенера — гранулематозное воспаление респираторного тракта и некротизирующий васкулит, поражающий мелкие и федние сосуды (капилляры, венулы, артериолы, артерии), обычно сочетающийся с некротизирующим гломе¬ рулонефритом [1].Заболевание описано и выделено в отдельную нозологическую форму в конце 30-х годов XX в. [25, 26]. В нашей стране первое упоминание о гранулематозе Вегенера встречается в отчетах клинико-анатомической конференции 1-го ММИ им. И.М. Сеченова за 1957 г. [27].
■* 552 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯI- г ш ПОРАЖЕНИЕ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ$ Поражение верхних дыхательных путей (ВДП) - самое частое (70%) начальное^ ' проявление заболевания. В развёрнутой стадии оно встречается у 90-94% больны* и характеризуется упорным насморком с гнойно-геморрагическим отделяемым, I .' изъязвлением слизистой оболочки носа. Иногда развиваются перфорация носовойI ’ перегородки и седловидная деформация носа. Наблюдаются патологические изме- ^ нения в трахее, придаточных пазухах носа, полости рта, гортани с формирование«’ подскладочной гранулёмы.Проявления ларинготрахеальной патологии разнообразны. Во многих слу¬ чаях она протекает бессимптомно, однако у части больных наблюдается огру¬ бение голоса, инспираторная одышка, стридор в результате обструкции ВДП. Характерно развитие субглоточного стеноза гортани. По сравнению со взрос¬ лыми больными (23%) его частота у детей и подростков значительно выше н достигает 48%.ПОРАЖЕНИЕ НИЖНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙВовлечение в патологический процесс бронхов и лёгких проявляется лихорад¬ кой, часто септического типа, мучительным кашлем, кровохарканьем, болями в грудной клетке, одышкой. Характерны язвенный бронхит, сужение просвета брон¬ хов, без признаков активного воспаления по данным бронхоскопии.На рентгенограммах лёгких изменения встречаются почти у всех больных (95%), причём у 45% — в дебюте заболевания- Выявляются солитарные или мно¬ жественные двусторонние инфильтраты, склонные к распаду и формированию полостей. Диффузные альвеолярные геморрагии диагностируются у 30% больных. Реже наблюдаются плеврит, лёгочные кровотечения и увеличение лимфатических узлов средостения. Описаны бронхоплевральные свищи. Только в 65% случаев рентгенологические признаки патологии лёгких сочетаются с клиническими, в остальных — они протекают бессимптомно.КТ и КТВР выявляют стенозы гортани, трахеи и бронхов, а также утолщение стенки сегментарных, субсегментарных бронхов, межальвеолярных перегородок, ателектазы и признаки поражения периферических лёгочных артерий [17].Диффузионная способность лёгких, как правило, снижена, но при развитии диффузных альвеолярных геморрагий она повышается. Более чем у половины больных отмечается обструктивный, а у 30-40% — рестриктивный тип наруше¬ ния ФВД. Частым осложнением является коллапс бронхов и постобструктивная пневмония. Примерно в 20% случаев развивается прогрессирующая лёгочная недостаточность, связанная с фиброзом лёгкого, пневмонией или пневмонитом, индуцированным циклофосфамидом,В активную фазу заболевания при диффузных инфильтративных изменениях в лёгких в БАЛ преобладают нейтрофилы, альвеолярные макрофаги, содержащие остатки полиморфноядерных клеток, эозинофилы. При умеренной активности заболевания, наличии мелкоочаговых затемнениях на фоне усиления лёгочного рисунка, БАЛ состоит преимущественно из лимфоцитов, фенотипически относя¬ щихся к С04'^ ТЬ^-клеткам. При субклинических или диффузных альвеолярных геморрагиях обнаруживают сидерофаги.Пневмония — одно из наиболее частых (40%) инфекционных осложнений. В 16% случаев она является причиной смертельного исхода.ДИАГНОЗ, ЛЕЧЕНИЕКлассификационные критерии гранулематоза Вегенера включают четыре при¬ знака: язвеннонекротический ринит и/или стоматит, гранулёмы в лёгких при рентгенографии грудной клетки, изменения мочевого осадка в виде микрогема¬ турии и картину гранулематозного васкулита при биопсии [28]. Данные биопсии
ЛЁГОЧНЫЕ ВАСКУЛИТЫ 553играют решающую роль в диагностике болезни. Диагностическая значимость открытой биопсии лёгкого гораздо выше трансбронхиальной или морфологиче¬ ского исследования тканей слизистой носа и его придаточных пазух. Ценность биопсии неповреждённых тканей невысока. Высокоинформативна биопсия пери- орбитальной ткани. При отсутствии результатов гистологического исследования или неинформативности полученных данных в критерии заболевания вводится дополнительный клинический признак — кровохарканье.Комбинированная терапия ГКС и циклофосфамидом является основой лечения болезни. При субглоточном стенозе гортани развитие угрожающих для жизни осложнений может потребовать проведения экстренной трахеотомии или пла¬ новой хирургической коррекции (механическая или лазерная дилатация трахеи, ларинготрахеопластика) в сочетании с местным введением ГКС [24]. Острая дыха¬ тельная недостаточность на фоне диффузных альвеолярных геморрагий является показанием для ИВЛ,При гранулематозе Вегенера пятилетняя выживаемость составляет более 75%. Наиболее частыми причинами летальных исходов являются интеркуррентные инфекции, дыхательная и почечная недостаточность, сердечно-сосудистые ката¬ строфы, злокачественные новообразования (рак мочевого пузыря).Микроскопический полиангиит (полиартериит)Микроскопический полиангиит (полиартериит) — некротизирующий васкулит с минимальными иммунными депозитами, поражающий мелкие сосуды (капилля¬ ры, венулы, артериолы), редко — артерии малого и среднего калибра, в клиниче¬ ской картине которого доминируют явления некротизирующего гломерулонефри- та, реже лёгочного капиллярита [1].Болезнь впервые описана в 1948 г. [29], В отечественной литературе случаи заболевания рассматривались в рамках узелкового полиартериита, гранулематоза Вегенера или системного недифференцируемого некротизирующего васкулита. Сейчас оно выделено в самостоятельную нозологическую форму [30, 31],КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯУ больных в 30% случаев встречаются атрофия слизистой носа и некротический ринит. Они, в отличие от гранулематоза Вегенера, обычно носят обратимый харак¬ тер и не приводят к деструктивным изменениям и деформации носа.У 30-40% больных наблюдаются изменения со стороны придаточных пазух носа и среднего уха. Почти с такой же частотой встречаются эписклерит и боли в животе, реже периферическая полинейропатия. Эти симптомы выражены неярко и, как правило, развиваются на фоне тяжёлой патологии почек и лёгких, определяющих нозологическую самостоятельность и прогноз при данном забо¬ левании.Поражение лёгких наблюдается у 12-29% больных и относится к числу фак¬ торов, ухудшающих прогноз заболевания. Больных беспокоят кашель (40%) и боли в грудной клетке (30%). Часто (70%) имеют место кровохарканье и лёгочное кровотечение.При рентгенографии лёгких наиболее часто (80%) выявляются инфильтраты, без распада, нередко с реакцией плевры, регистрируются признаки альвеолита. Фиброзирующий альвеолит может быть одним из ранних проявлений заболева¬ ния, развиваясь за 2-3 года до появления других клинических признаков болезни (поражение кожи, почек) [32]. На фоне лечения цитотоксическими препаратами обычно отмечается положительная динамика клинических и рентгенологических изменений в лёгких.
: '4’- 554 НАРУШЕНИЯ ЛЕГОЧНОГО КРОВООБРАЩЕНИЯ■:/ív .'-SS/Í!.V;CV'V,':r)!fií->r:Ш&йДИАГНОЗ, ЛЕЧЕНИЕКлассификационных критериев заболевания не существует, и его диагноз осно¬ вывается на клинической картине, данных иммунологического и морфологическо¬ го исследований.Комбинированная терапия ГКС и циклофосфамидом является основой лечение болезни (см. табл, 32-2).Прогноз во многом зависит от степени поражения почек. Пятилетнял выа»- Ф'- . ‘ ваемость таких больных составляет 65%, кроме того, причиной смерти являются массивные лёгочные кровотечения, инфекционные осложнения, связанные с про¬ водимой терапией.Синдром Черджа-СтроссСиндром Черджа-Стросс — эозинофильное, гранулематозное воспаление респи¬ раторного тракта и некротизирующий васкулит, поражающий мелкие и средние сосуды, часто сочетающийся с астмой и эозинофилией [1],Болезнь впервые описана в конце 30-х годов XX в. и включена в рубрику узел¬ кового полиартериита в 1951 г. J. Churg и L, Strauss [33]. В течение длительного времени она рассматривалась в рамках астматической формы этого заболевания или как эозинофильный гранулематозный васкулит. В настоящее время СЧС выделяют в отдельную нозологическую форму [34].Болезнь встречается как у детей, так и в пожилом возрасте, но наиболее часто в период от 35 до 45 лет. Несколько чаще болеют мужчины (соотношение мужчин и женщин колеблется от 1,1:1 до 3,0:1).Несмотря на наличие у большинства больных БА или аллергического ринита, у их родственников не отмечается накопления случаев аллергических заболева¬ ний. Не выявлено также связи СЧС с инфекцией и иммуногенетическими мар¬ кёрами.КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯВ течении заболевания условно выделяют три фазы. В продромальный период, который длится до 30 лет, преобладают аллергический ринит, полиноз и БА. Вторая фаза характеризуется повышенным содержанием эозинофилов крови и выраженной их миграцией в ткани. Нередко диагностируются синдром Лёффлера, эозинофиль¬ ная пневмония или эозинофильный гастроэнтерит. В третьей фазе на фоне частых, тяжело протекающих приступов БА появляются признаки системного васкулита.Основным проявлением заболевания является синдром гиперреактивности бронхов. В большинстве случаев он предшествует васкулиту. На начальном этапе болезни бронхоспазм выражен зшеренно. Затем постепенно наблюдается развитие тяжёлой Б А, требующей системной терапии ГКС более чем у 70% больных [8]. Обострения бывают частыми, плохо контролируются приёмом умеренных доз ГКС. Ремиссии постепенно сокращаются, интенсивность и тяжесть клинических проявлений БА нарастает. Нередко отмечается присоединение лёгочной инфекции с развитием бронхоэктатической болезни. Часто с началом васкулита наблюдается уменьшение астматических приступов, а в некоторых случаях отмечается и ремис¬ сия БА.Поражение верхних дыхательных путей включает аллергический ринит, реци¬ дивирующий синусит и полипоз носа. Изредка наблюдается некроз слизистой.ДАННЫЕ ИНСТРУМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙНа рентгенограммах грудной клетки обнаруживаются инфильтраты неоднород¬ ного, транзиторного характера. Они могут распространяться на всю долю лёгкого, но чаще локализованы в нескольких сегментах. Инфильтраты быстро подвер¬ гаются обратному развитию при назначении ГКС и, в отличие от гранулематоза
ЛЁГОЧНЫЕ ВАСКУЛИТЫ555Вегенера, редко осложняются формированием асептической полости. Иногда наблюдается увеличение лимфатических узлов средостения. Часто встречаются плевральные изменения. Экссудативный плеврит содержит большое число эози¬ нофилов.Данные КТ и КТВР свидетельствуют о наличии периферических паренхи¬ матозных инфильтратов, проявляющихся феноменом «матового стекла», утол¬ щении стенок бронхов и их дилатации вплоть до образования бронхоэктазов. Диагностируются изменения со стороны сосудов лёгких — расширение с остроко¬ нечными окончаниями.Характерным лабораторным признаком СЧС является эозинофилия (более 1,0х10ул у 97% больных), которая может наблюдаться на любой стадии заболева¬ ния. Эозинофилы преобладают (4-66%) и в БАЛ. Данный признак является более чувствительным для оценки активности заболевания, чем эозинофилия крови.ДИАГНОЗ, ЛЕЧЕНИЕКлассификационные критерии включают шесть основных проявлений: БА, эозинофилия более 10%, MOHO- или полинейропатия, летучие лёгочные инфиль¬ траты, синуситы, экстраваскулярная тканевая эозинофилия [34]. Наличие у больного четырёх и более признаков позволяет поставить диагноз с чувстви¬ тельностью 85% и специфичностью 99%. Трансбронхиальная биопсия обычно позволяет получить достаточный материал для приведения гистологического исследования, также информативна биопсия слизистой верхнего отдела дыха¬ тельных путей.Заболевание может быть заподозрено у пациентов среднего возраста с длитель¬ но текущей БА, аллергическим ринитом и эозинофилией при развитии у них при¬ знаков системной патологии, включающей множественный мононеврит, лёгочные инфильтраты, кардиомиопатию.Дополнительную информацию несёт исследование ANCA. Их обнаружение, как правило, свидетельствует о СЧС.Определение ANCA также важно для оптимального выбора терапии. Установ¬ лена определённая взаимосвязь между их наличием и особенностями клинической картины, а также патогенезом заболевания (табл. 32-3) [35].Таблица 32-3. Особенности синдрома Черджа-Стросс в зависимости от наличия АМСАПризнакANCA ■«+>-ANCA«-»Клинические проявленияНекротизирующий гломерулонефрит, пурпура, лёгочные фовотечения, множественный мононевритГиперплазия, полипоз слизистой носа, лёгочные инфильтраты, кардиомиопатия, MOHO- и попинейропатия, эозинофильный гастрит/знтеритМорфологияПоражение мелких сосудовИнфильтрация тканей эозинофиламиПатогенезANCA-ассоциированныйВоздействие токсических продуктов эози¬ нофиловТерапияГКС, циклофосфамид, ритуксимабГКС, омализумаб (IgE)Лечение болезни основывается на тех же принципах, что и АНСА-ассоцииро¬ ванных васкулитов (см. табл. 32-2).Прогноз заболевания зависит от степени дыхательной недостаточности, генера¬ лизации васкулита (полинейропатия, гломерулонефрит), прогностически небла¬ гоприятен короткий период между развитием БА и манифестацией васкулита, пятилетняя выживаемость достигает 80%.ш
Д8Ф^ 55$ НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯИзолированный лёгочный капилляритИзолированный лёгочный капиллярит — васкулит с преимущественным пор»: жением капилляров лёгких и без других системных клинических проявлеш|4, характерных для ангиитов с вовлечением мелких сосудов (почек, нервной систе¬ мы, желудочно-кишечного тракта).Заболевание впервые было описано в 1997 г. [36]. Авторы наблюдали грушу пациентов из 29 человек с диффузными лёгочными геморрагиями, при биопсж лёгких у которых имелись явления лёгочного капиллярита. У восьми больньщ клинико-морфологические изменения носили изолированный характер, У иих, несмотря на длительное наблюдение (в среднем 3,6 года), не развились другие клиническо-лабораторные проявления, характерные для ANCA-ассоциированных васкулитов или синдрома ГУдпасчера, включая наличие ANCA и антител к базаль¬ ной мембране клубочков почки.Терапия предполагает применение ГКС и циклофосфамида по стандартной схеме лечения ANCA-васкулитов.Геморрагический васкулитГеморрагический васкулит — васкулит с IgA иммунными депозитами, пора¬ жающий мелкие сосуды (капилляры, венулы. артериолы). Типичны изменения со стороны кожи, кишечника и почек в сочетании с артралгиями или артррггом [1].Заболевание является одним из иаиболее часто встречающихся системньгх васкулитов, может начинаться в любом возрасте, но преимущественно им болеют дети до 16 лет.Клинические проявления патологии лёгких встречаются редко. Описаны отдельные клинические наблюдения развития лёгочного кровотечения и лёгоч¬ ных геморрагий, а также интерстициальной пневмонии [37].В острую фазу заболевания у большинства (96%) детей, не имеющих клиниче¬ ских проявлений патологии со стороны лёгких, выявляется снижение диффузион¬ ной способности лёгких. Полагают, что это связано с повреждением альвеолярно¬ капиллярной мембраны при отложении в нее IgA-иммунных комплексов. Данные морфологического исследования аутопсийного материала свидетельствуют о некрозе стенки капилляров с септальными и интраальвеолярными геморрагиями, сочетающиеся с депозитами IgA.Терапия данного васкулита предусматривает назначение ГКС в средних дози¬ ровках, а при их неэффективности — циклофосфамида (см. табл, 32-2). Основным фактором, определяющим неблагоприятный прогноз болезни, является персисти- рующее поражение почек.Эссенциальный криоглобулинемический васкулитЭссенциальный криоглобулинемический васкулит — васкулит с криоглобули- немическими иммунными депозитами, поражающий мелкие сосуды (капилляры, венулы, артериолы), преимущественно кожи и клубочков почек, и сочетающийся с сывороточной криоглобулинемией [1].Симптомы поражения лёгких выражены незначительно [7]. Обычно больные предъявляют жалобы на сухой кашель, экспираторную одышку при физической нагрузке, боли в грудной клетке. Крайне редко встречаются диффузные альвеоляр¬ ные геморрагии и респираторный дисстресс-синдром.На рентгенограммах лёгких отмечаются признаки интерстициального фибро¬ за, лёгочные инфильтраты, утолщение плевры. Функциональные тесты свиде¬ тельствуют о снижении диффузионной способности лёгких и патологии мелких бронхов. Морфологические изменения характеризуются васкулитом мелкого и среднего калибра. Данные БАЛ, полученные от пациентов, не имеющих кли¬
ЛЁГОЧНЫЕ ВАСКУЛИТЫ557нических признаков лёгочной патологии, свидетельствуют о субклиническом Т-лимфоцитарном альвеолите (снижение числа альвеолярных макрофагов и уве¬ личение CD3^ Т-лимфоцитов).Терапия заболевания предполагает применение ГКС, плазмафереза в сочетании с противовирусными препаратами, предпочтительно рибавирином. При их неэф¬ фективности применяется циклофосфамид (см. табл. 32-2). Отмечен хороший эффект от ритуксимаба.ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ВАСКУЛИТОВ МЕЛКИХ СОСУДОВОсновные клинические, инструментальные и морфологические признаки поражения лёгких при васкулитах мелких сосудов суммированы в табл. 32-4 (7,17, 38].Узелковый полиартериитУзелковый полиартериит (периартериит) - некротизирующее воспаление фед- них и мелких артерий без гломерулонефрита или васкулита артериол, капилляров и венул [1].Впервые подробную клинико-морфологическую характеристику болезни в 1866 г. дали А. Kussmaul и R. Maier [39]. С выделением из узелкового полиарте¬ риита таких нозологических форм, как микроскопический полиангаит и синдром Черджа-Стросс, частота выявления респираторной патологии при нём, незави¬ симо от наличия инфицированности вирусом гепатита В, не превышает 15% [40]. На рентгенограммах лёгких регистрируются признаки диффузной инфильтрации ткани лёгкого и интерстиция, а при КТВТ - множественные участки уплотнений в обоих лёгких [41]. Описаны отдельные случаи диффузных альвеолїфньїх гемор¬ рагий у пациентов, инфицированных вирусом гепатита В, приведшие к тяжёлой дыхательной недостаточности и смерти больных [42].ДИАГНОЗ, ЛЕЧЕНИЕДиагноз основывается на классификационных критериях, включающих 10 признаков: снижение массы тела более чем на 4 кг; сетчатое ливедо; боль или болезненность яичек; миалгии, слабость или болезненность в мышцах нижних конечностей; моно- или полинейропатия; повышение диастолического АД более 90 мм рт.ст.; увеличение уровня мочевины или креатинина в крови; наличие инфекции вируса гепатита В; артериографические изменения (аневризмы или окклюзии висцеральных артерий); данные биопсии, свидетельствующие о нали¬ чии некротизирующего васкулита [43]. Наличие у больного трёх и более любых критериев позволяет поставить диагноз с чувствительностью 82,2% и специфич¬ ностью 86,6%.Терапия заболевания не отличается от ANCA-ассоциированных васкулитов. При наличии маркёров репликации вируса гепатита В показано применение плаз¬ мафереза, противовирусных препаратов (ламивудин).На фоне комбинированной терапии ГКС и цитостатиками пятилетняя выживае¬ мость составляет 60-80%. Наибольшее число летальных исходов регистрируется в первый год от начала заболевания. Непосредственной причиной смерти являются сердечно-сосудистые катастрофы, К неблагоприятным прогностическим факторам относят начало заболевания в возрасте более 50 лет, поражение почек, желудочно- кишечного тракта, ЦНС и развитие кардиомиопатии.Болезнь КавасакиБолезнь Кавасаки — артериит, обычно встречающийся у детей, поражающий крупные, федние и мелкие артерии (преимущественно коронарные), иногда и вены, часто сочетающийся со слизисто-кожным лимфонодулярным синдромом [1].тш
'.<■Таблица 32-4. Клинические и инструментальные признаки поражения лёгких при васкулитах мелких сосудовСЛр|Нозологические формыПризнакГранулематоз ВегенераСиндромЧерджа-СтроссМикроскопический поли¬ ангиитГеморрагическийваскулитКриоглобулине- мичеокий васкулитИзолированныйлёгочныйкапилляритВнелёгочные проявленияПоражение верхних дыхательных путейЧасто тяжёлый, деструктив¬ ный синуситПолипоз носа, ринитРедко синусит-_-Гломерулонефрит++-Ь-I-+-1-++-1-++-Другие проявленияПоражение кожи, глаз, нервной системыПоражение кожи, сердца, нервной системыПоражение кожи, нервной системыПоражение кожиПоражение кожи, нервной системы-Лабораторные нару¬ шенияANCA80-90% (аПР-3 >аМПО)30-50% (аМПО > аПР-3)80-90% (аМПО > аПР-3)5% (аМПО)--Другие признакиЛейкоцитоз, анемияЭозинофилия, t IgEЛейкоцитоз, анемияt IgAКриоглобулины, вирус гепатита С, РФ (90-100%)Лейкоцитоз,анемияПоражение лёгких+++++++++++++Функциональные тестыОбструкция/рестрикция.или Т при диффузных альвеолярных геморрагияхОбструкцияТ при диффузных аль¬ веолярных геморрагияхDL.tСО01^ Т при диф¬ фузных альвео¬ лярных гемор- рап^яхКТВРМножественные узелки, полости, симптом «матово¬ го стекла»Мигрирующий симптом «матового сгекла» и/или уплотненияСимптом «матового стекла», уплотненияСимптом «матового стекла»Инфильтраты, фиброзСимптом «мато¬ вого стекла»оо-оооg-о>£
Окончание табл. 32-4Основные морфологиче¬ ские признакиНекротмзирующий гра¬ нулематозный васкулит, бронхиолит, капиллярит, диффузные альвеолярные геморрагии (редко)Экстраваскулярная гра¬ нулёма, эозинофильная пневмония, васкулитКапиллярит, диффузные альвеолярные геморрагииКапилляритВаскулит мелких и средних артерийКапиллярит,диффузныеальвеолярныегеморрагииИсследование БАЛНейтрофилы, эритроциты, сидерофаги (>30%)Эозинофилия (>33%)Эритроциты, сидерофаги (>30%)~Т-лимфоцитыЭритроциты,сидерофаги(>30%)Примечания. аПР-3 - антитела к протеиназе-3; аМПО - антитела к миелопероксидазе; +++ шение; I — снижение.очень часто: ++ — часто; + — редко; — отсутствует; Т — повы-слСЛсо
560 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯПо данным японских авторов, рентгенологические признаки поражения встречаются у 14,7% детей [44]. Обычно они появляются в течение 10 двей момента начала заболевания. Преобладает (89,5%) сетчатый характер лёг рисунка с мелкими узелками, перибронхиальные утолщения (21,1%), явлени: судативного плеврита (15,8%) и ателектазы (10,5%).Диагноз болезни может быть поставлен при наличии у больного 5 из 6 мое; резистентная к антибиотикам лихорадка в течение 5 дней и более; ронний конъюнктивит; типичные изменения губ и полости рта; острое негнс увеличение лимфоузлов шеи; полиморфная сыпь, преимущественно на туло! изменения кистей и стоп, в случае наличия у пациента четьфёх симптомов, болезни правомочен при их сочетании с обнаружением (по данным дв) эхокардиографии или коронароангиографии) аневризм венечных артерий.Самым эффективным методом лечения является назначение ВВИГ. Haï оптимальный режим — однократное введение в дозе 2 г/(кгхсут) в первые 10, от начала болезни. При необходимости процедуру повторяют через 5-7 дней, предотвращения тромбоза коронарных артерий оправдано дополнительное ш чение ацетилсалициловой кислоты [3-5 мг/(кгхсут)]. ГКС показаны больньиь! резистентным к такой терапии.Гигантоклеточный артериитГигантоклеточный артериит — гранулематозный артериит аорты и её основны* ветвей, преимущественно экстракраниальных ветвей сонной артерии, с частый поражением височной артерии. Обычно начинается у больных старше 50 лет ■ часто сочетается с ревматической полимиалгией [1].ПОРАЖЕНИЕ ЛЁГКИХРазличные симптомы патологии ВДП встречаются у 10% больных [45. 46]. Преобладает непродуктивный кашель на фоне лихорадки, который может был первым проявлением болезни. Реже отмечаются боли в грудной клетке и горле. Последние часто значительно выражены и, по-видимому, обусловлены поражени¬ ем ветвей наружной сонной артерии, преимущественно а. pkaryngea ascendens.Воспалительные изменения редко затрагивают непосредственно лёгкие. Имеются лишь отдельные описания подобных наблюдений. При рентгеногра¬ фии и КТ лёгких выявляются базальный интерстициальный фиброз, диффузные ретикулярные изменения лёгочного рисунка, множественные узелки, аневризмы грудного отдела аорты.Результаты исследования БАЛ у больных с клиническими признаками пато¬ логии респираторной системы, но без рентгенологических изменений, позво¬ ляют выявить признаки Т-лимфоцитарного альвеолита с преобладанием CD4*- лимфоцитов.ДИАГНОЗ, ЛЕЧЕНИЕДиагноз основывается на классификационных критериях, включающих 5 при¬ знаков: начало заболевания после 50 лет; появление «новых» головных болей; изменения височной артерии; увеличение СОЭ; изменения при биопсии височной артерии [47]. Наличие у больного трёх и более критериев позволяет поставить диагноз с чувствительностью 93,5% и специфичностью 91,2%.ГКС — препараты выбора при гигантоклеточном артериите. Преднизолон применяется в дозе 40-60 мг/сут в несколько приёмов до нормализации СОЭ и исчезновения симптомов с постепенным снижением до поддерживающей дозы. Если в течение 6 мес на фоне приёма 2,5 мг/сут преднизолона клинические про¬ явления заболевания отсутствуют, лечение может быть прекращено. При тяжёлом течении проводят пульс'терапию метилпреднизолоном с последующим переходом
ЛЁГОЧНЫЕ ВАСКУЛИТЫ 561на поддерживающую дозу преднизолона 20-30 мг/сут или к лечению добавляют метотрексат (15-17,5 мг/нед). При назначении метотрексата необходимо помнить о возможности развития на его фоне пневмонита.Пятилетняя выживаемость составляет почти 100%, Однако существует серьёз¬ ная опасность развития различных осложнений заболевания, в первую очередь поражения артерий глаз, приводящих к частичной или полной потере зрения.Артериит ТакаясуАртериит Такаясу — гранулематозное воспаление аорты и её основных ветвей, обычно начинающееся в возрасте до 50 лет [1].ПОРАЖЕНИЕ ЛЁГКИХПатология основного ствола лёгочной артерии или её ветвей в сочетании (или без него) с любым другими патологическими изменениями аорты и отходящих от неё артерий относится к 4-му анатомическому типу заболевания.Клинические проявления встречаются менее чем у больных. Отмечаются боли в грудной клетке, одышка, непродуктивный кашель, редко кровохарканье. Напротив, по данным ангиографии, изменения в лёгочной артерии наблюдаются почти у 60% больных [48]. Преобладают стенозы и/или окклюзии лобарных и субсегментарных её ветвей, особенно кровоснабжающих верхнюю долю правого лёгкого. Лёгочная гипертензия, дилатавдм и аневризмы лёгочной артерии, а также изолированные изменения, клинически напоминающие ТЭЛА, встречаются редко. Результаты ангиографии не позволяют дифференцировать наличие или отсутствие активного воспалительного процесса в стенке лёгочной артерии. Для этих целей предпочтительнее использовать КТ и МРТ-ангиографию [7].Частота выявления инфильтратов лёгких, выпотного плеврита, интерстицио- нального фиброза в базальных отделах и лёгочных геморрагий, приводящих к выраженной дыхательной недостаточности, не превышает 5% случаев. Как ослож¬ нение иммуносупрессивной терапии заболевания описаны единичные случаи раз¬ вития аспергилломы [49].Для выявления субклинического поражения лёгких наряду с КТ и МРТ- ангиографией целесообразно проведение перфузионного сканирования лёгких и функщюнальных лёгочных тестов.У детей респираторная патология наблюдается в 15% случаев. Наряду с одыш¬ кой нередко вфечается кашель с кровохарканьем [50]. При рентгенологическом исследовании лёгких отмечаются усиление сосудистого рисунка, расширение кор¬ ней лёгких, утолщение плевры.ДИАГНОЗ, ЛЕЧЕНИЕДиагноз может быть поставлен согласно классификационным критериям, пред¬ лагаемым рядом авторов [51, 52]. Классификационные критерии АКР включают шесть признаков: возраст <40 лет; перемежающаяся хромота конечностей: осла¬ бление пульса на плечевой артерии; разница систолического АД >10 мм рт.ст. при его измерении на плечевых артериях; шум на подключичных артериях или брюшной аорте; изменения при ангиографии. Наличие у больного трёх и более любых критериев позволяет поставить диагноз с чувствительностью 90,5% и специфичностью 97,8%.Терапия предполагает назначение преднизолона [1 мг/(кгхсут)], не более 60 мг/сут), позволяющее у 60% больных достичь ремиссии и снизить дозу пре¬ парата. У остальных пациентов наступает обострение болезни, требующее приме¬ нения цитотоксических препаратов (метотрексат, циклофосфамид). Метотрексат (17,5 мг/нед) в сочетании с небольшими дозами преднизолона позволяет быстрее снизить дозу ГКС и поддерживать более длительную ремиссию. Для быстрого
ІІ«*?562 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯкупирования воспалительного процесса и достижения стойкой ремиссии в ние 6-9 мес проводят ежемесячные курсы пульс-терапии метилпреднизол( циклофосфамидом [53]. Длительность поддерживающей терапии ГКС, как ло, составляет не менее 2-5 лет.С целью уменьшения пролиферативных изменений в артериях показаны тилсалициловая кислота (100 мг/сут) и статины.При артериите Такаясу пяти-десяти-пятнадцатилетняя выживаемость дс ет 80-90%. Наиболее частой причиной смерти являются инсульт (50%) и ин<; миокарда (около 25%), реже — разрыв аневризмы аорты (5%).Болезнь БехчетаБолезнь Бехчета — системный васкулит неизвестной этиологии, хараї зующийся рецидивами язвенного процесса в ротовой полости и на гени’ частым поражением глаз и рядом проявлений, включающим патологию суі желудочно-кишечного тракта, нервной системы и сосудов [54].ПОРАЖЕНИЕ ЛЁГКИХКлинические симптомы поражения лёгких встречаются в 7-18% случаев в основном связаны с сосудистой патологией. Больные предъявляют жалоба на непродуктивный кашель, одышку, боли в грудной клетке и кровохарканье. В основном (89% больных) они являются проявлением поражения лёгочное артерии, её ветвей с образованием аневризм, обычно множественных, в том чисж расслаивающихся [55]. Диаметр аневризмы более 3 см ассоциируется с плохии прогнозом, при этом её разрыв — основная причина смерти больных. Значительн* реже встречаются окклюзии сосудов или их сочетание с аневризмами.Достаточно часто (76% случаев) обнаруживаются узелковые образования в паренхиме лёгких, локализованные ближе к корню. У 54 и 59% больных отме¬ чается формирование полостей и явления экссудативного плеврита. Встречаютс* лёгочные артериальные и венозные тромбозы, инфаркты.ДИАГНОЗ, ЛЕЧЕНИЕСуществуют диагностические критерии Международной группы по изучению болезни Бехчета [56]. Согласно им для диагноза необходимо наличие афтозного стоматита в сочетании с любыми двумя следующими признаками — рецидивирун>- щим изъязвлением половых органов, поражением глаз, кожи или положительным тестом патергии.Для индукции ремиссии применяют ГКС в сочетании с циклофосфамидом. Только комбинированная терапия приводит к уменьшению размеров аневризм [57]. В период поддержания ремиссии предпочтительнее комбинация пред¬ низолона и азатиоприна. Имеются отдельные наблюдения успешного лечения больного с тяжёлой ТЭЛА циклоспорином А в сочетании с непрямыми анти¬ коагулянтами.Прогноз при болезни Бехчета без поражения сосудов лёгких в целом благопри¬ ятный, пятилетняя выживаемость больных составляет 100%. Неблагоприятным фактором является развитие аневризмы лёгочной артерии. При ней, несмотря на лечение, летальность составляет до 50%.Облитерирующий тромбангиитОблитерирующий тромбангиит — хроническое воспалительное заболевание артерий среднего и мелкого калибра, вен, с преимущественным вовлечением дис¬ тальных отделов сосудов верхних и нижних конечностей, редко церебральных и висцеральных, с последующим распространением патологического процесса на проксимальные зоны сосудистого русла.
ЛЁГОЧНЫЕ ВАСКУЛИТЫ 563Морфологическую основу болезни составляют продуктивные, реже продук- ввно-деструктивные артерииты, часто сочетающиеся с флебитом, а иногда и с тромбофлебитом.в клинической картине болезни доминируют симптомы поражения артери¬ ального (ишемия) и венозного русла нижних конечносгей. В 18% случаев наблю- лаются флебиты и тромбозы глубоких вен нижних конечностей, иногда сопро- шождающиеся ТЭЛА. Изолированное поражение сосудов лёгких наблюдается •ЧЖЗВЫЧаЙНО редко [6]. ' VСамым эффективным способом предотвращения прогрессирования болезни -является полный отказ от курения (активного и пассивного). На этапе индукции ремиссии целесообразно применять ГКС и циклофосфамид в виде повторных ежемесячных курсов пульс-терапии в течение 3-6 мес, в сочетании с ацетилса- жициловой кислотой (100 мг/сут), синтетическими аналогами простациклина и иентоксифиллином (600-800 мг/сут). При ТЭЛА показаны низкомолекулярные гепарины и/или варфарин.Смертность больных при облитерирующем тромбангиите не превышает общую в популяции. Смертельные исходы наиболее часто встречаются при поражении жишечника, ТЭЛА и инфекционных осложнениях заболевания.СПИСОК ЛИТЕРАТУРЫ
Глава 33 Отёк и острое повреждение лёгкихОтёк лёгких является жизнеугрожающим осложнением, которое может развиться при многих заболеваниях разнообразной при¬ роды. В современной практике выделяют несколько клиническяж форм отёка лёгких, в том числе синдром острого повреждения лёгких (СОПЛ), или острый респираторный дистресс-синдром (ОРДС). В последние годы были опубликованы согласительные документы Американского торакального и Европейского респи¬ раторного обществ по определению, диагностическому алгоритму и лечебным программам отёка лёгких, основанных на принципах медицины доказательств,КЛИНИЧЕСКИЕ ФОРМЫ ОТЁКА ЛЁГКИХСовременные подходы к классификации отёка лёгких построены на патогенетическом принципе. Можно выделить два принципи¬ альных патофизиологических процесса, которые лежат в основе развития отёка лёгких. Один из них заключается в повышении гидростатического давления в микрососудах малого круга крово¬ обращения. Другой — в нарушении проницаемости эндотелиальных клеток альвеолярных капилляров вследствие острого повреждения лёгочной ткани, которое может происходить при сепсисе, пневмо¬ нии и некоторых других заболеваниях. Ведущим патогенетическим механизмом при кардиогенном отёке лёгких (КОЛ) и остро про¬ текающем отёке лёгких (ОПОЛ) является повышение гидроста¬ тического давления, а при некардиогенном отёке лёгких (НОЛ), СОПЛ (ОРДС) и неврогенном отёке лёгких (НеОЛ) — повышение сосудистой проницаемости [1, 2]. Такое деление в определённой степени условно. У одного и того же больного может развиться как кардиогенный, так и некардиогенный отёк лёгких.КАРДИОГЕННЫЙ ОТЁК ЛЁГКИХ Этиологиякол может возникать при разнообразных заболеваниях и состо¬ яниях, характеризующихся наличием систолической дисфункции левого предсердия или дисфункции левого желудочка сердца.Хроническое нарушение систолической функции левого пред¬ сердия, с которым связывают развитие отёка лёгких, часто сопро¬ вождается тахикардией, как это бывает при мерцании и трепетании предсердий, желудочковой тахикардии, повышении температуры
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 565тела, что и приводит в конечном счёте к снижению времени наполнения левого желудочка кровью. Эти процессы могут также развиться при увеличении объёма циркулирующей крови, как это может происходить у женщин в период беремен¬ ности или же большой солевой нагрузке. Наиболее типичная ситуация склады¬ вается у больных с ревматическим митральным стенозом. Другими причинами нарушения систолической функции левого предсердия являются миксома левого предсердия и тромбы в ушке левого предсердия или на поверхности искусствен¬ ного клапана. При названных формах патологии сердца происходит повышение > конечного диастолического давления, что и препятствует эффективной работе левого предсердия. Острая недостаточность митрального клапана может раз¬ виться вследствие дисфункции папиллярных мышц, разрыва хорды, но чаще всего это происходит у больных с острым инфарктом миокарда. У некоторых больных с ишемической болезнью сердца митральная регургитация не очень выражена в состоянии покоя, однако она становится клинически значимой при физической нагрузке. Гемодинамические изменения при неизменном коронар¬ ном кровотоке могут наступать вследствие нарушения пространственной ориен¬ тации папиллярной мышцы, возникающей в период физической нагрузки.Дисфункция левого желудочка является наиболее частой причиной развития КОЛ. В настоящее время принято разделять систолическую, диастолическую дис¬ функцию и перегрузку левого желудочка в целом, а также обструкцию выходного тракта левого желудочка.Систолическая дисфункция возникает вследствие нарушения контрактильной функции левого желудочка, что приводит к уменьшению фракции выброса и как следствие этих изменений — к повышению давления в малом круге кровообраще¬ ния, Систолическая дисфункция чаще всего развивается вследствие хронического заболевания коронарных сосудов, гипертонической болезни, клапанного пораже¬ ния миокарда или идиопатической дилатационной кардиомиопатии. Более ред¬ кими заболеваниями, при которых развивается систолическая дисфункция левого желудочка, являются миокардиты, вызванные вирусом Коксаш В, гипотиреоз, а также воздействие токсинов, например антрациклинов. Снижение фракции выбро¬ са при систолической дисфункции приводит к активизации ренин-ангиотензин- альдестероновой системы и симпатической нервной системы. Компенсаторной реакцией при этих метаболических процессах является увеличение ретенции натрия и воды, что способствует развитию отёка лёгких.Диастолическая дисфункция предполагает увеличение ригидности желудочка и снижение комплайнса, что проявляется в период диастолы левого желудочка.Чаще эти гемодинамические изменения возникают при хронических заболевани¬ ях сердечной мышцы — гипертрофической и рестриктивной кардиомиопатии, а также во время острой ишемии миокарда и при гипертоническом кризе. Конечным эффектом этих изменений в функции левого желудочка является повышение конечного диастолического давления. Развитию отёка лёгких также содействует сопутствующая систолическая дисфункция левого желудочка, снижение коронар¬ ного кровообращения в период диастолы, результатом чего является развитие субэндокардиальной ишемии и аритмии сердца.Объёмная перегрузка левого желудочка может возникнуть при разрыве межсеп- тальной перегородки, недостаточности аортальных клапанов, некоторых заболе¬ ваниях почек. Разрыв септальной перегородки является одним из грозных ослож¬ нений у больных инфарктом миокарда, возникающим, как правило, на 5-7 день от начала его развития. При недостаточности аортальных клапанов как остро возникшей, так и хронической отёк лёгких развивается вследствие увеличения объёма крови в левом желудочке, что и является причиной повышения конечного диастолического давления, повышения давления в левом предсердии и в конечном счёте развития отёка лёгких. Недостаточность аортальных клапанов чаще всего
566 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯвозникает у больных с инфекционным эндокардитом, при разрыве анеї аорты или вследствие травмы грудной клетки.Обструкция выходного тракта левого желудочка возникает при крі параметрах аортального стеноза, включая суправальвулярный и субвальву ный стеноз, гипертрофической кардиомиопатии, а также злокачественной артериальной гипертонии. Хроническая обструкция выходного тракта желудочка приводит к развитию гипертрофии левого желудочка, которая, в очередь, обусловливает развитие систолической и диастолической дисфу левого желудочка.ПатогенезПатофизиологической характеристикой КОЛ является транссудация избі ного количества жидкости в лёгочную ткань вследствие вторичного П0ВЫШ( давления в левом предсердии. Этот гемодинамический феномен, в свою 0ЧЄ| является следствием повышения давления в лёгочных венах и лёгочных к« л ярах. Изменения гемодинамики малого круга кровообращения при КОЛ прощ%і ходят в условиях отсутствия первичного повышения проницаемости эндоге**; капилляров и эпителиальных клеток дистального отдела дыхательных путА Согласно закону Старлинга жидкость, электролиты и белки выходят за предеяи сосудистой стенки и аккумулируются в интерстициальной ткани, что значительи» нарушает диффузию кислорода и диоксида углерода. Процесс реабсорбции аю^ мулированной жидкости по разным причинам нарушается.Механизмами защиты, противодействующими выходу воды из циркулирующей крови в случаях повышения давления в левом предсердии и препятствующими развитию отёка лёгких, являются дренажная функция лимфатической системы, резорбция воды в сосуды, дренаж в медиастинальные сосуды и плевральную полость, повышение барьерной функции альвеолярного эпителия, снижение силы натяжения сурфактанта, повышение активного транспорта воды и электролитов из дистального отдела дыхательных путей.Количество жидкости, которое накапливается в интерстиции, в значительной степени регламентируется дренажной функцией лимфатической системы. Через лимфатические сосуды удаляется избыточное количество жидкости, которое фильтровалось через стенку сосуда. Важное значение в реализации дренажной функции лимфатических сосудов имеет временной фактор. При осгром повыше¬ нии гидростатического давления в лёгочных капиллярах лимфатические сосуды не успевают адаптироваться к меняющимся гемодинамическим условиям.Компенсаторным механизмом в период развития КОЛ также служит частичная активация ренин-ангиотензиновой и симпатической нервной системы, результа* том чего является развитие тахикардии. Повышение внутрисосудистого сопротив- ления рассматривается, с одной стороны, как компенсаторный механизм, который направлен на уменьшение фильтрации жидкости из сосудов в интерстиций, с дру¬ гой стороны, повышение сопротивления в сосудах приводит к усугублению гемо¬ динамических расстройств. Ответом на эту приспособительную реакцию является тахикардия и, как её следствие, укорочение времени диастолы, что приводит к снижению способности левого желудочка наполняться кровью. Повышение сосу¬ дистого сопротивления увеличивает работу сердца, что, в свою очередь, приводит к повь[шению потребности миокарда в кислороде. В конечном счёте этот тип при¬ способительной реакции может привести к увеличению конечного диастолическо¬ го давления, тем самым способствовать утяжелению отёка лёгких.Одним из патогенетических механизмов развития отёка лёгких также является снижение онкотического давления. Снижение концентрации протеинов в плазме, что наблюдается при гипоальбуминемии, сопровождается редукцией абсорбцион¬ ного онкотического давления в интерстициальной ткани. Этот механизм приводит
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 567К увеличению транскапиллярной фильтрации жидкости. При аккумуляции жидко¬ сти в интерстициальной ткани с 35 до 50% она начинает проникать на поверхность альвеол, и интерстициальная фаза отёка лёгких переходит в альвеолярную. На этой стадии происходят значительные нарушения диффузии кислорода и диоксида углерода, что сказывается на усилении одышки и падении ЗРз ниже 90%.Клиническая картинаХарактерными жалобами для больных с КОЛ являются кашель и одышка. Интенсивность одышки возрастает, и становится даже за короткое время осмотра мучительной для больного человека. Одышке предшествует тахипноэ, В респира¬ торном цикле участвует вспомогательная мускулатура плечевого пояса, грудной клетки, диафрагма и мышцы брюшного пресса. Необходимо при осмотре больных фиксировать внимание на группах мышц, участвующих в респираторном цикле, выделив особенно признаки парадоксального дыхания: сокращение диафрагмы и мышц грудной клетки находятся в противофазе. Данный признак свидетельствует об утомлении дыхательных мышц и рассматривается как прогностически неблаго¬ приятный. Сочетание тахипноэ и признаков утомления дыхательных мышц, как правило, наблюдается в фазе альвеолярного отёка. Одышка имеет ряд характер¬ ных особенностей, которые более специфичны для больных с сердечной недо¬ статочностью. К ним относится чувство нехватки воздуха, затруднение, которое испытывает больной при вдохе, ощущение утомления или общее затруднение при дыхании.Поскольку тяжесть состояния больного требует незамедлительной помощи, сбор анамнеза и обследование должны проводиться в предельно короткое время. При аускультации в лёгких выслушиваются влажные хрипы. Они локализуются изначально в верхних отделах, но в случаях развёрнутой клинической картины отёка лёгких, влажные хрипы начинают выслушиваться повсеместно. Если они исчезают в задних базальных отделах лёгких, то это, как правило, свидетельствует о скоплении свободной жидкости в плевральной полости. Появление сухих рассе¬ янных хрипов у больных с отёком лёгких объясняется особенностями нарушения микроциркуляции. при интерстициальной фазе отёка лёгких развитие бронхооб- струкции связывают с отёком слизистой оболочки дыхательных путей, включая и дистальный отдел. Однако когда отёк лёгких приобретает развёрнутый характер, то в аускультативной картине доминируют влажные хрипы.Выраженная обструкция дыхательных путей у больных с КОЛ может наблю¬ даться в случаях сочетания заболеваний сердца и лёгких (БА, ХОБЛ и др.). Отёк лёгких может протёкать как на фоне повышенных, так и пониженных цифр АД. Уровень АД имеет большое значение в выборе неотложных мероприятий у боль¬ ных с КОЛ, Піпотензия может указывать на выраженную желудочковую дисфунк¬ цию или развитие кардиогенного шока. Аускультация сердца у больных с отёком лёгких часто выявляет ритм галопа, что всегда свидетельствует о тяжести гемоди¬ намических расстройств. Особенно неблагоприятно при отёке лёгких сочетание таких признаков, как парадоксальное дыхание, ритм галопа, гипотензия и ниже 90%, Переполнение ярёмных вен шеи свидетельствует о дисфункции не толь¬ ко левых, но и правых отделов сердца. Следует обратить внимание на отёчность нижних конечностей. Если у больных не было признаков хронической сердечной недостаточности до того, как у них развился КОЛ, то отёчность не определяется.Диагностика и дифференциальная диагностикаСовокупность электрокардиографических и энзимологических исследований направлена на поиск биологических маркёров некроза сердечной мышцы. Для оценки ишемии миокарда исследуют активность ферментов, отражающих повреж¬ дение миокарда. Эти данные необходимо сопоставить с ЭКГ, исследование кото¬ рой предназначено для установления характера нарушения ритма сердца и ишемии
■|Ж1Й11®я568 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯИЛИ некроза миокарда. Измерение уровня мозгового натрийуретического позволяет подтвердить кардиогенную природу отёка лёгких. Тест чувств] в 90%, специфичен в 74% и его предсказуемость составляет 81%. Конце пептида повышается до 731 пг/мл, тогда как в норме она не превышает 47 пг/ Выраженность гипоксемии определяют с помощью пульс-оксиметрии. С1 8^02<90% указывает на необходимость оксигенотерапии.Рентгенография органов грудной клетки позволяет установить фазу инте]циального или альвеолярного отека легких, скопление транссудата в плевралыи полости, изменения размеров сердца. В начальных стадиях накопление жидкоа! лёгочной тканью приводит к картине очаговых изменений. Появление фе» «манжетки» вокруг сосудов отражает несостоятельность лимфатических сосудик обеспечивающих транспорт жидкости из интерстициальной ткани. Си «бабочки» — скопление жидкости в области корней лёгких — характерен ранней стадии отёка лёгких. Позже явления отёка становятся более распростр#^ нёнными, появляется плевральный выпот. Жидкость в плевральных полостяШ отсутствует, если у пациента с отёком лёгких не было предшествующей хроняч^ ской сердечной недостаточности (рис. 33-1).С помощью эхокардиографии выявляется диастолическая дисфункция, Даншй метод может быть применён даже при острых состояниях таких, как гипертониче«» ский криз, инфаркт миокарда и другие острые состояния, которые встречаются ш практике кардиолога.Постановка катетера Свана-Ганца в лёгочную артерию позволяет получит принципиально важную информацию прямого измерения показателей централь¬ ной гемодинамики и провести дифференциальную диагностику с НОЛ. Высо«® специфичным тестом для дифференциации КОЛ и НОЛ является измерение дав¬ ления заклинивания. Если оно превышает 18 мм рт.ст., то отёк лёгких развивается вследствие высокого гидростатического давления, и речь идет о КОЛ. В ситуация, когда давление заклинивания ниже 18 мм рт.ст., причиной отёка лёгких является повышенная проницаемость альвеолярных капилляров. Б клинической практике встречаются больные, страдающие смешанной патологией. В таких случаях уточ¬ нить природу отёка лёгких можно на основании результатов мониторирования давления заклинивания. Так, если в течение 24-48 ч при проведении лечебных мероприятий удалось нормализовать показатели давления заклинивания, но приРис. 33-1. Рентгенограмма органов грудной клетки паци¬ ента с КОЛ. Двусторонний прикорневой альвеолярный, интерстициальный отёк и пере¬ распределение крови в лёгоч¬ ных венах. Отсутствуют призна¬ ки увеличения размеров сердца и застойной сердечной недо¬ статочности.
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 569ЭТОМ в клинической картине продолжают доминировать признаки НОЛ, можно говорить о сочетании у больного КОЛ и НОЛ.Другим признаком, позволяющим различать КОЛ от НОЛ, является содержание белка в жидкости, поступающей в просвет дистального отдела дыхательных путей. НОЛ, возникающий вследствие повышенной сосудистой проницаемости, в отличие от КОЛ, характеризуется повышенным содержанием белка в отёчной жидкости.В плановом порядке проводится исследование крови и мочи, исключаются при¬ знаки почечной и печёночной недостаточности.По общим клиническим признакам часто бывает трудно разграничить кар¬ диогенный и некардиогенный отёк лёгких. Необходимо учитывать историю заболевания или заболеваний, предшествующих возникновению отёка лёгких, и выполнить определённую программу обследования, включая методы прямого измерения центральной гемодинамики. НОЛ отличается от КОЛ тем, что давление заоинивания не превышает физиологического уровня.В практике возникает необходимость дифференцировать КОЛ с ОПОЛ и НОЛ. ОПОЛ всегда протёкает при проявлениях ОДН. Эта форма отёка лёгких развива¬ ется у больных со стенозом почечной артерии, при массивном переливании крови или её заменителей. Иначе говоря, по клиническим проявлениям ОПОЛ сходен с КОЛ, но при нём сердце может быть интактным.ЛечениеОсновная цель комплексной терапии — снизить гидростатическое давление в лёгочных капиллярах и тем самым уменьшить количество жидкости, которая поступает из сосудов в лёгкие. Решив данную задачу, можно ожидать улучшения транспорта кислорода.Терапию следует начинать незамедлительно, не дожидаясь получения дан¬ ных лабораторного исследования. Однако желательно, приступая к ингаляциям кислорода, определить с тем, чтобы установить выраженность гипоксемии, С клинических позиций, позитивные сдвиги в течении отёка лёгких оценивают¬ ся по уменьшению интенсивности цианоза, одышки, тахикардии, нормализации артериального давления, уменьшении участков лёгких, где выслушиваются влаж¬ ные хрипы. Положительная клиническая динамика сопровождается повышением показателей 5^02, ударного и минутного объёма сердца.В ситуациях, когда по разным причинам невозможно назначить лекарственные средства, прибегают к приёмам, которыми пользовались врачи во все времена. Больного следует освободить от одежды, обеспечить достаточный приток свежего воздуха в помещение, где он находится, и уложить с возвышенным головным кон¬ цом, что даёт возможность венозной крови задерживаться в нижних конечностях. На верхние и нижние конечности следует наложить манжеты или жгуты, кото¬ рые рекомендуется распускать каждые 15 мин. Общая продолжительность этих мероприятий не должна превышать 45 мин. Такие приёмы немедикаментозного лечения позволяют уменьшить венозный приток крови к правым отделам сердца. Спокойная обстановка и уверенные действия врача часто оказывают существен¬ ную помощь в лечении больного с отёком лёгких. Опыт врачей прошлого 1юказал достаточную эффективность кровопусканий. Объём венозной крови, который может бьггь удалён, не должен превышать 500 мл. При наличии артериальной гипотонии у больных с отёком лёгких кровопускание противопоказано.После оказания первой помощи больному назначается комплексная терапия, которая включает применение наркотических анальгетиков, вазодилататоров, диуретиков, лекарственных средств с инотропным действием и некоторых других медикаментов. Перед клиницистом стоит сложная задача индивидуального титро¬ вания дозы лекарственных средств указанных групп с учетом их взаимодействия и оценка эффективности.
570 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯУменьшение проявлений ОДН достигается адекватной респираторной держкой: назначением оксигенотерапии и неинвазивной вентиляции Ингаляцию кислорода необходимо производить через маску, которая плотно лежит к лицу. Обычно используют газовую смесь, содержащую 60% кисло2 до 4 л/мин. Рекомендуется избегать назначения чистого кислорода, так кх может оказать токсическое действие, однако в тяжёлых реанимационных с ях можно использовать и 100% кислород. Эффективность проводимой инп кислорода необходимо мониторировать. Повышение показателя 5^2 на 2- течение 10-15 мин расценивается как эффективный ответ на лечение. Необх стремиться к достижению 95% сатуращіи. Повышенное давление в дыхат путях помогает снизить внутрисосудистое давление в лёгких. При проведении нимационных мероприятий не исключается применение ИВЛ.Для купирования отёка лёгких применяют морфина гидрохлорид^, к нужно вводить внутривенно медленно в течение нескольких минут во изб нежелательных побочных реакций, вызываемых, в частности, угнетением а ности дыхательного центра и либерацией гистамина. Выброс гистамина М( проявиться бронхоспастической реакцией и увеличением сосудистой проница сти, которые в случае отёка лёгких способны усугубить проявления дыхательной недостаточности. Поэтому очень важно при назначении морфина контролирої общее состояние больного. Морфин является очень важным лекарственным сро|г ством, особенно при лечении КОЛ; его центральный механизм действия приводит к выраженному седативному эффекту; с ним связывают также вазодилатацию; ш не угнетает контрактильную функцию миокарда; при его назначении существея- но снижается давление в микрососудах лёгких, что оказывает положительао* влияние на центральную гемодинамику. Гипотензивное действие проявляется іцш введении более 10 мг морфина или в случаях, когда объём циркулирующей кро* снижен и требуется его восполнение.Назначение вазодилататоров позволяет оказывать влияние на острое повышг^ ние давления в микрососудах лёгких. Расширение вен в течение нескольких минут приводит к увеличению ёмкости сосудов, и кровь распределяется по периферии. Конечной целью влияния вазодилататоров является снижение количества крови, которое фильтруется через капилляры лёгких. Ударный и минутный сердечный объёмы возрастают за счёт эффекта дилатации артерий, таким образом, работа сердца становится энергетически более эффективной. В лечении отёка лёгких при¬ меняют один из трёх классов вазодилататоров; венодилататоры (например, нитра¬ ты), дилататоры артериол (например, фентоламин, гидралазин) и вазодилататоры смешанного действия (например, нитропруссид натрия).Нитропруссид натрия обладает прямым дилатирующим действием на гладкие мышцы артериол и вен, что приводит к снижению резистентности сосудов и уве¬ личивает минутный объём посредством снижения постнагрузки; он также снижает сопротивление току крови в аорте и левом желудочке. Назначение нитропрусси- да натрия достаточно быстро купирует отёк лёгких. Однако необходимо строго титровать и индивидуально подбирать эффективную дозу нитропруссида натрия во избежание гипотонии, которая окажет негативное влияние на процесс разреше¬ ния отёка лёгких. Индивидуальное дозирование нитропруссида натрия достигает¬ ся мониторированием артериального давления. Длительное введение нитропрус¬ сида натрия может привести к другому нежелательному эффекту — интоксикации цианидом или тиоцианатом. Период полувыведения тиоцианата колеблется от 3 до 7 сут, в то время как у нитропрз^ссида натрия он существенно короче — 10 мин. Рекомендуется определять в крови концентрацию цианида и тиоцианата, если терапия нитропруссидом натрия проводится в течение нескольких дней. Механизм интоксикации связан с высвобождением цианида из эритроцитов при их реакции с нитропруссидом натрия. Этим метаболическим расстройствам предшествует
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 571развитие метаболического ацидоза, Гипоксемия может нарастать при назначении вазодилататоров. Это явление обусловлено тем, что эффект вазодилатации приво¬ дит к тому, что перфузия крови увеличивается в лёгких через те её участки, кото¬ рые не вентилируются. Другой механизм, с которым связывают увеличение гипок¬ семии, обусловлен образованием метгемоглобина, который образуется в ответ на ведение нитроглицерина или нитропруссида натрия. Стартовая доза нитропрусида натрия обычно составляет 10 мкг/мин, препарат вводится внутривенно. Доза удва¬ ивается каждые 3-5 мин до тех пор, пока не удаётся достичь желаемого эффекта. При этом систолическое артериальное давление не должно снижаться ниже 90, а даастолическое — ниже 60 мм ст.рт.Нитроглицерин и другие нитраты обладают прямым действием на гладкие мьппцы вен, что отличает эту группу лекарственных средств от нитропруссида натрия. Внутривенное ведение нитроглицерина особенно показано больным с инфарктом миокарда или застойной сердечной недостаточностью, у которых раз¬ вился отёк лёгких. Нитроглицерин вызывает эффект дилатации коллатеральных сосудов сердца и тем самым уменьшает гипоксемию миокарда. При пограничной артериальной гипертонии с нитроглицерином связывают также его гипотензивное действие. Пшотензивный эффект средних и высоких доз нитроглицерина имеет разные механизмы. Средние дозы вызывают снижение системного артериального давления преимущественно за счёт эффекта дилатации вен и увеличения количе¬ ства крови в венозных сосудах. Высокие дозы нитроглицерина оказывают гипо¬ тензивный эффект за счёт релаксации мышц артериол. При назначении высоких доз нитроглицерина необходимым условием является строгий контроль за систо¬ лическим и диастолическим артериальным давлением. Внутривенная инфузия нитроглицерина начинается с дозы 10-15 мкг/мин, её увеличивают на 5-10 мкг каждые 5 мин; контролем служат показатели артериального давления, и, если оно снизилось на 20% от исходного уровня, считается, что эффект снижения давления в лёгочных капиллярах достигнут. Больных часто начинает беспокоить головная боль. Если отёк лёгких протекает на фоне ангинозного статуса, то под действием нитроглицерина он часто купируется. Появление тахикардии при инфузии нитро¬ глицерина свидетельствует о снижении сердечного выброса.Изосорбида динитрат также является вазодилататором, который применяют для лечения отёка лёгких. Считается, что внутривенное назначение высоких доз изосорбида динитрата в сочетании с малыми дозами фуросемида является опти¬ мальной схемой ведения больных с КОЛ. Действие лекарственного средства начи¬ нается быстро и пик приходится на пятую минуту от начала его введения. Период его выведения очень короток, поэтому эффект продолжается не более 30 мин. Изосорбид начинают вводить внутривенно болюсно с 3 мг и повторяют его введе¬ ние каждые 5 мин. Эффективной дозой изосорбида считается та, при которой воз¬ растает сатурация крови кислородом, артериальное давление снижается на 30% от исходного уровня, но систолическое давление опускается не ниже 90 мм рт.ст.Если состояние больного позволяет избежать внутривенного введения препа¬ ратов группы нитроглицерина, то могут быть применены другие лекарственные формы: трансдермальная мазь нитроглицерина или изосорбид внутрь (20-100 мг). Вазодилатационный эффект при приёме изосорбида продолжается более 3 ч, поэтому если состояние больного не является критическим, то приём внутрь является адекватной схемой лечения. Однако при пероральном приёме препара¬ тов группы нитроглицерина трудно титровать эффективную дозу, в этом плане внутривенный способ введения имеет существенное преимущество. Толерантность к препаратам группы нитроглицерина развивается достаточно быстро, но после короткого периода их действие вновь восстанавливается.Ингибиторы ангиотензин-превращающего фермента при лечении отёка лёгких имеют ограниченное применение. Теоретическим обоснованием их назначения
ЙВИШ572 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯявляется способность снижать давление в лёгочных капиллярах. В литердцл^ опубликованы данные по применению каптоприла и эналаприла у больны» отёком лёгких. Однако рандомизированных исследований не проведено, поэтшф ' ? ^-1. ' ' рекомендации по их применению до конца не сформировались.Диуретики могут оказывать быстрый эффект на процесс разрешения лёгких, так как влияют на венозное кровообращение и снижают перфузию микрш сосудов лёгких. Однако принципиальный механизм их фармакологической аклщ|^ ности состоит в экскреции почками хлористого натрия и воды. С увеличе: диуреза понижается конечное диастолическое давление в полости левого жо^: дочка, что, в свою очередь, приводит к снижению гидростатического давления щ лёгочных капиллярах. Таким образом, диуретики обладают многими фармаксшк гическими свойствами: прямое дилатирующее действие на лёгочные сосуды, пош^ шение диуреза. Эти фармакологические свойства диуретиков позволяют снизняь гидростатическое давление, уровень фильтрации в лёгочных микрососудах. Нв всех существующих диуретических лекарственных средств предпочтение отдаётся фуросемиду, местом действия которого является клубочки нефрона (клубочков*» диуретики), фуросемид в дозе 20-40 мг вводится медленно внутривенно. ДрупЛ схемой его назначения является начальная доза 80 мг и в последующем — капельг ное введение препарата в дозе 10-20 мг в течение каждого часа. Если в течение 1 ч при мониторировании диуреза ответа на введение препарата нет, то рекомендуется повторить дозу 80 мг. Другие клубочковые диуретики также могут быть испольг зованы в лечении больных с КОЛ: буметандин*^, торсемид^, этакриновая кислота. Однако с этими лекарственными средствами связан целый ряд нежелательных эффектов. С повышением диуреза возрастает потеря калия и больших количеся хлора, что может индуцировать сердечные аритмии. Поэтому при использование диуретиков этого класса рекомендуется прибегать к заместительной терапии пре¬ паратами, содержащими соли калия. Определённые преимущества имеют спиро- нолактоны, которые способны задержать калий, они также оказывают влияние на гидростатическое давление лёгочных сосудов. Однако эффект их действия требует времени, так как фармакологическая активность спиролактонов наступает спустя 1 ч после их введения. Следует указать, что при выраженной гипотензии (систолическое артериальное давление ниже 90 мм рт.ст.) или же при развитии шока назначение диуретиков не оказывает столь выраженного эффекта, что обу¬ словлено низкой перфузией крови через почки. Диуретические препараты также могут быть не эффективны у больных с сопутствующими заболеваниями почек. У этой категории больных эффекта в разрешении отёка лёгких можно добиться, применив экстракорпоральные методы лечения. Наибольший эффект достигнут при применении гемофильтрации.Третья группа лекарственных средств, которые применяются у больных с КОЛ, обладают инотропным эффектом. Целью их назначения является улучшение сердечного выброса и борьба с гипотонией, которые осложняют течение отёка лёгких. Лекарственные средства с инотропным действием особенно эффективны в решении таких клинических проблем, как контроль артериального давления, острой сердечной недостаточности, при проведении механической вентиляции лёгких, когда необходимо особенно уменьшить приток крови к лёгким.Катехоламины часто назначают в современной клинической практике при острых неотложных сит5?ациях. Фармакологическая активность этой группы пре¬ паратов связана с их биологической ролью оказывать влияние на функциональную активность а- и р-адренергических рецепторов. Стимуляция а-адренергических рецепторов приводит к эффекту вазоконстрикции периферических сосудов, сти¬ муляция р-адренергических рецепторов сопровождается эффектом вазо- и брон¬ ходилатации. Неселективные агонисты, к которым относится норэпинефрин (норадреналин*), увеличивают контрактильную способность миокарда, но другим
ОТЁК и ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 573их фармакологическим действием является повышение внутрисосудистого сопро¬ тивления, а также увеличение потребности миокарда в кислороде. Селективный р-агонист изопротеренол^ оказывает влияние на минутный объём сердца, в боль¬ шей степени, чем этот эффект наблюдается при назначении норэпинефрина; он также снижает давление в лёочных капиллярах. Однако его вазодидатирующий эффект может приводить к снижению артериального давления и увеличению числа сердечных сокращений. Эти фармакологические свойства изопротеренола*" могут приводить к усугублению ишемии миокарда.В современной клинической практике для достижения инотропного эффекта чаще прибегают к назначению допамина (непосредственный метаболический предшественник эндогенного синтеза норадреналина) и синтетического катехо¬ ламина — добутамина. Низкие дозы допамина увеличивают контрактильную спо¬ собность миокарда, повышается минутный объём сердца, при этом не возрастает потребность миокарда в кислороде, не нарастает число сердечных сокращений; он также снижает общее сосудистое сопротивление и улучшает кровообращение в почках. Необходимо отметить, что допамин обладает прямым действием через допаминовые рецепторы, улучшая кровоток в почках. Таким образом, при его назначении можно ожидать увеличения диуреза и экскреции натрия. Эти свойства допамина особенно важно учитывать при лечении больного с отёком лёгкого и гипотонией. Конечное диастолическое давление в полости левого желудочка, как правило, остаётся неизменным, в то время как давление в микрососудах малого круга кровообращения может возрасти и увеличить количество жидкости, которая фильтруется, поступая в экстравазальные части лёгких. Перераспределение жид¬ кости во время введения допамина может привести к её депонированию в лёгких, в данном случае это нежелательные эффекты допамина. У той категории больных, у которых отёк лёгких сочетается с низкими цифрами артериального давления, комбинированная терапия допамином и нитроглицерином способна нивелиро¬ вать нежелательные эффекты каждого из них в отдельности. Так, нитроглицерин снизит давление в малом круге кровообращения, в то время как при введении допамина произойдёт повышение системного артериального давления. Сочетание допамина и нитропруссида натрия также является удачной комбинацией для лечения больных с гипотонией и отёком лёгких. Повышение дозы допамина при¬ водит к нарастанию стимуляции а-адренергических рецепторов. Это связано с тем, что нервные окончания симпатической нервной системы начинают выделять больше норадреналина. Высокие дозы допамина приводят к развитию тахикар¬ дии, аритмии, что может усугублять состояние больных и проявиться рециди¬ вом отёка лёгких. Допамин назначают внутривенно, стартовая доза составляет2-5 мкг/(кгхмин). Доза титруется до достижения терапевтического эффекта. Следует подчеркнуть, что доза выше 10-15 мкг/кг в минуту обычно приводит к нежелательным выраженным эффектам стимуляции а-адренергических рецеп¬ торов — может быть выражена вазоконстрикторная реакция артериол, В ряде случаев она может быть настолько выраженной, что приводит к дигитальным некротическим реакциям. Рекомендуется вводить допамин через широкий кате¬ тер, с тем чтобы избежать локальных спастических реакций сосудов и возможного местного некроза тканей,Добутамин отличается от допамина тем, что не вызывает системных спастиче¬ ских реакций сосудов. Он вызывает умеренный инотропный эффект и также не очень выраженный вазодилатационный эффект. При введении добутамина уве¬ личивается минутный объём, так как он обладает прямым инотропным эффектом на сердечную мышцу, под его действием также снижается системное перифери¬ ческое сопротивление сосудов. Снижение конечного диастолического давления способствует уменьшению количества жидкости, фильтруемой через микрососуды лёгких, Добутамин может увеличить клиренс жидкости, которая депонировалась
а-№574 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ§ в альвеолярной фазе отёка лёгких. Повышается почечный кровоток, что огюсрж Щ дуется через увеличение сократительной функции миокарда, Добутамин особей* эффективен при лечении КОЛ, который протекает на фоне выраженной серляц* ной недостаточности, наступившей при падении сократительной деятельносш миокарда. Стартовая доза добутамина составляет 2-3 мкг/(кгхмин) и увели-ж вается каждые 10-30 мин до достижения терапевтического эффекта. Необходиш указать, что порой эффект действия добутамина может наступить через 10 мш от начала его инфузионного введения. Терапевтическая доза колеблется от 5 ш 15 мкг/(кгхмин). Побочные эффекты начинают проявляться, когда доза превышг 15 мкг/(кгхмин). Наиболее частыми побочными реакциями является тахикардии аритмия. Обеспечение миокарда кислородом снижается, что проявляется ишенн- ей миокарда. Оптимальными условиями для эффективного назначения добут*- мина является повышение давления в левом желудочке до 18-20 мм рт.ст., иш же оно выше, препарат следует назначать с большой осторожностью у больны* с мерцательной аритмией, так как препарат способствует ускорению проведенм импульсов через атриовентрикулярный узел, что может привести к желудочковое тахикардии. В такой клинической ситуации предпочтительнее назначать препара- ты дигиталиса, обладающие инотропным эффектом.Основной целью лечения КОЛ является снижение гидростатического давленнш в микрососудах лёгких, но этого следует достичь, не ухудшая работу сердца. Чаще всего эта форма отёка лёгких протекает на фоне ишемической болезни сердца, инфаркта миокарда, клапанного поражения сердца, нарушений ритма сердца. Поэтому стратегически решить проблему отёка лёгких можно лишь тогда, когда удастся повысить контрактильную функцию миокарда, снизить уровень систоли¬ ческой и диастолической дисфункции левого желудочка, нормализовать показа¬ тели артериального давления, уменьшить приток крови к правым отделам сердца. Эффективная работа миокарда оказывает прямое действие на процесс разрешения отёка лёгких, С патофизиологической позиции проводимое медикаментозное лечение должно привести к снижению давления заклинивания, которое должно быть ниже 20 мм рт.ст. Однако необходимо учитывать те клинические варианты отёка лёгких, которые протекают на фоне обострения хронической сердечной недостаточности. У этой категории больных развиваются компенсаторные меха¬ низмы, и их гемодинамические параметры несколько отличаются от тех, которые бывают при острых формах отёка лёгких. Так, положительный ответ на прово¬ димое лечение у больных с хронической сердечной недостаточностью и отёком лёгких купируется при более высоких по сравнению с физиологической нормой показателях давления заклинивания. Более тяжёлые больные с респираторным дистрессом требуют проведения механической вентиляции, которая, в свою оче¬ редь, оказывает существенное влияние на гемодинамические параметры крово¬ обращения как по малому, так и по большому кругу. Меняется чувствительность к лекарственным средствам, назначенным больным с отёком лёгких.В последние годы активно исследуется роль натрийуретического пептида как диагностического теста застойной сердечной недостаточности, так и лекарствен¬ ного средства, в частности, для лечения КОЛ, Внутривенное введение пептида оказывало значительный эффект на основные проявления отёка лёгких: умень¬ шались одышка, общая слабость, повышался диурез. Натрийуретический пептид взаимодействует с рецептором гуанинмонофосфата гладких мышц сосудов и эндо¬ телиальных клеток, что приводит к внутриклеточному увеличению концентрации гуанинмонофосфата и релаксации гладких мышц сосудов. Натрийуретический пептид оказывает заметное влияние на уровень давления заклинивания, уста¬ новлена строго зависимая корреляция давления от дозы лекарственного сред¬ ства. Противопоказаниями к назначению натрийуретического пептида являются гипотония и шок, которые часто встречаются при КОЛ. Препарат не назнача-
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 575от больным с кол, если исходное систолическое давление ниже 100 мм рт.ст.Его назначение является противопоказанием к введению симпатомиметических ккарственных препаратов (норадреналина. допамина, добутамина), особенно Щ|; ^ больных с тахикардией, мерцательной аритмией. Натрийуретический пептид показан в сл5?чаях сниженного ответа на вводимые диуретики. В настоящее время проводятся клинические исследования по сочетанному назначению натрийурети- ческого пептида и катехоламинов, диуретиков, вазодилататоров. Препарат вво- дится болюсно внутривенно в дозе 2 мкг/(кгхмин), В последующем его инфузия в дозе 0,01 мкг/(кгхмин) может повторяться каждые 3 ч, однако, если произо¬ шло снижение исходного систолического АД на 30%, введение препарата следует приостановить.Целесообразность постановки плавающего катетера Свана-Ганца в лёгочную артерию остаётся предметом дискуссии. Сообщалось, что смертность в группе больных, у которых был использован плавающий катетер, выше, чем у тех, у которых он не использовался. В частности, имеются сведения об индуцирован¬ ном катетером сепсисе. В последних клинических рекомендациях американского общества анестезиологов эти данные поставлены под сомнение. Очевидно, что врач и персонал должны в совершенстве владеть техникой постановки катетера и соблюдать требования по уходу за ним. Особенно важно использование плаваю¬ щего катетера у тяжёлых больных, когда природа отёка лёгких не установлена.Оценка центральной гемодинамики также позволяет выбрать оптимальные режи¬ мы вспомогательной вентиляции. Таким образом, постановка катетера 8уап-Сап2 помогает решить многие вопросы диагностики и дать более полную оценку эффек¬ тивности проводимого лечения.ОСТРО ПРОГРЕССИРУЮЩИЙ ОТЁК ЛЁГКИХОПОЛ выделяется в самостоятельную форму, так как имеет целый ряд осо¬ бенностей патогенеза и клинической картины. ОПОЛ — клинический синдром, который характеризуется внезапным и бурным проявлением респираторного дистресс-синдрома. Он возникает вследствие быстрого скопления жидкости в интерстициальной ткани, т.е. гидростатическое давление в лёгочных капиллярах резко повышается за предельно короткое время; также быстро повышается давле¬ ние в левом предсердии и лёгочных венах.ЭтиологияОсновная группа заболеваний, при которых возникает такое грозное ослож¬ нение, как ОПОЛ, связана с ишемическим поражением миокарда. Ишемия мио¬ карда развивается за короткий промежуток времени и приводит к падению как систолической, так и диастолической функции миокарда; ударный объём сердца резко снижается, С развитием систолической дисфункции падает фракция выброса левого желудочка, что приводит в очень скором времени к повышению диастоли¬ ческого давления в полости желудочка. Развитие дисфункции миокарда усугубляет степень выраженности его ишемии. ОПОЛ может также развиться при внезапных патологических изменениях митральных или аортальных клапанов. Эти патоло¬ гические изменения также являются причиной развития острого отёка лёгких. Перфорация створок аортального клапана приводит к регургитации и повышению давления в полости левого желудочка. В клинической практике подобная картина встречается при септическом эндокардите, разрыве расслаивающейся аневризмы аорты; осложнениях, возникших после имплантации искусственного аортального клапана, травматическом поражении аорты. Острая митральная регургитация. которая осложняется развитием ОПОЛ, может возникать при разрыве хорд у больных с миксомой сердца. Другими причинами развития острой митральной регургитации являются поражение папиллярных мышц при инфаркте миокарда.
576 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯосложнения, возникающие после имплантации митрального клапана. ОПОЛ воэ- никает при высокой степени митрального стеноза и значительном повышешш давления в полости левого предсердия.ОПОЛ является специфическим осложнением некоторых заболеваний. Таж, эпизоды ОПОЛ возникают более чем у 25% больных с реноваскулярной гипертев- зией. Предрасполагающим фактором к развитию злокачественной гипертонии у таких больных является стеноз почечной артерии. Особенно часто ОПОЛ возника¬ ет у больных с двусторонним поражением почечных артерий. Причиной развитм отёка лёгких является высокая систоло-диастолическая артериальная гипертонии, приводящая к повышению конечного диастолического давления, в то время кж систолическая дисфункция левого желудочка или же митральная регургитация у данной категории больных не имеют гемодинамически значимого влияния.Необходимо подчеркнуть, что диастолическая дисфункция является опреде¬ ляющим звеном в патогенезе ОПОЛ и может встречаться при большой группе заболеваний, которые сопровождаются высокой температурой, глубокой анемий нарушениями ритма сердца, при сепсисе, тиреотоксическом кризе.ПатогенезОПОЛ близок по своим патогенетическим механизмам к КОЛ. Однако в слу¬ чае развития ОПОЛ изменения, внезапное падение сократительной способности миокарда приводит к острому увеличению конечного диастолического давления в левом желудочке, что, в свою очередь, является причиной повышения давление в полости левого предсердия. Но в отличие от КОЛ при повышенном давлении ш левом предсердии сохраняются нормальные показатели давления заклинивания. Этот признак и позволил разделить две близкие с патофизиологической точки зрения клинические формы отёка лёгких. Патофизиологической особенностью ОПОЛ является быстрое накопление транссудата в интерстиции лёгочной ткани и альвеолярном пространстве. Вследствие быстро изменившихся гемодинамиче¬ ских условий происходит нарушение диффузии кислорода и диоксида углерода, т.е. при ОПОЛ у больных за короткий промежуток времени прогрессивно сни¬ жается 5^2- Необходимо добавить, что и лимфатическая система не успевает адаптироваться к резко изменившимся гемодинамическим условиям, поэтому её дренажная функция не способна адекватно реагировать на количество жидкости, накапливающейся в интерстиции. Компенсаторным механизмом является повы¬ шение активности ренин-ангиотензиновой и симпатической нервной системы, результатом деятельности которых является тахикардия и повышение сосудисто¬ го сопротивления.Клиническая картинаОсновными клиническими проявлениями ОПОЛ являются кашель и одыш¬ ка, впрочем, эти же симптомы в основном формируют клиническую картину КОЛ. Однако имеется отличие. Кашель и особенно одышка развиваются быстро. Одышка перерастает в ощущение удушья. Прогностически неблагоприятньпйи признаками ОПОЛ являются тахипноэ, участие вспомогательной мускулатуры верхнего плечевого пояса и грудной клетки в акте дыхания. Повсеместно над груд¬ ной клеткой выслушиваются влажные хрипы, определяются тахикардия, аритмия и гипотензия. Последние признаки свидетельствуют о диастолической дисфунк¬ ции левого желудочка.Диагностика и дифференциальная диагностикаЛабораторная диагностика не отличается от той, которая проводится в случаях КОЛ.Необходимо подчеркнуть, что в отличие от КОЛ давление заклинивания сохра¬ няется в пределах физиологической нормы. Учитывая остроту клинических про-
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 577явлений ОПОЛ, необходимо проводить дифференциальную диагностику с ТЭЛА, тяжёлой формой пневмонии, инфарктом миокарда. В случае дифференциальной диагностики с ТЭЛА необходимо ориентироваться на данные ЭКГ, рентгенологи¬ ческих методов исследования. Высокоспецифичным методом диагностики ТЭЛА является ангиопульмонография. Следует подчеркнуть, что характер аускультатив¬ ной картины лёгких при ОПОЛ и ТЭЛА различен. Если в первом случае превалиру¬ ет картина «влажного лёгкого», то во втором влажные хрипы появляются гораздо позже, и причиной их появления является развитие инфарктной пневмонии.ЛечениеНеотложная терапия ОПОЛ включает назначение ингаляции кислорода через плотно пригнанную к лицу маску и введение лекарственных средств, которые спо¬ собны поддерживать гемодинамику. В остальном лечебная программа аналогична таковой у больных с КОЛ, После оказания неотложной помощи при ОПОЛ необхо¬ димо решить вопрос о показаниях к реваскуляризации коронарных сосудов, а при стенозе почечных артерий — восстановлению кровоснабжения в ишемизированной почке. ОПОЛ может протекать при высоких цифрах артериального давления, поэто¬ му в лечение этой категории больных включаются гипотензивные средства.НЕКАРДИОГЕННЫЙ ОТЁК ЛЁГКИХНОЛ развивается вследствие повышенной фильтрации жидкости через сосуди¬ стую стенку лёгочных капилляров. Транскапиллярная фильтрация возрастает пре¬ имущественно за счёт повышенной сосудистой проницаемости. В интерстициаль¬ ной ткани накапливается избыточное количество жидкости, в то же самое время дренирующая функция лимфатических сосудов по разным причинам снижена. Накопившаяся в интерстициальной ткани жидкость начинает заполнять поверх¬ ность альвеол, что приводит к значительному ухудшению диффузии кислорода и диоксида углерода.ЭтиологияНОЛ встречается при многих заболеваниях разнообразной природы. Ведущей причиной развития НОЛ является повышение сосудистой проницаемости, которое может происходить в результате острого повреждения легких при сепсисе, острых инфекционных заболеваниях дыхательных путей, вдыхании токсических суб¬ станций (например, ракетного топлива, кокаина), травмах, остром радиационном повреждении лёгких, после проведения коронаропластики.Развитие НОЛ описано при высокогорной болезни. В основе этой формы НОЛ лежит вазоконстрикторная реакция на высотную гипоксию. Отёк лёгких наступа¬ ет у отдельных индивидуумов при быстром подъёме на высоту 3000-4000 м над уровнем моря.Ещё одним заболеванием, которое сопровождается развитием НОЛ, является диффузный альвеолярный геморрагический синдром. При развитии этой пато¬ логии выражен синдром анемии, хотя кровохарканье может быть минимальным. Развитие НОЛ описано при некоторых формах геморрагической лихорадки. НОЛ возникает при массивном метастазировании у больных раком лёгких,НОЛ как результат реакции лёгочных сосудов на реперфузию чаще всего встре¬ чается у хирургических больных, которым было проведено массивное перелива¬ ние растворов, белковых субстанций и препаратов крови.Развитие НОЛ возможно у больных с плевритом после эвакуации выпота из плевральной полости. Признаки отёка лёгких обычно появляются после быстро¬ го удаления более 1,5 л жидкости. В некоторых наблюдениях это осложнение развивалось через 24 ч после проведения процедуры. Описаны случаи НОЛ при ТЭЛА.
578 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯВариант НОЛ, обусловленный токсическим действием салицилатов. описав р пожилых людей, длительно принимающих препараты ацетилсалициловой киоюмйШНОЛ встречается у лиц, употребляющих наркотические средства — гер(жвщ метадон. Отёк лёгких развивается обычно к концу первых суток после их приёшкПатогенез ^Эта форма отёка лёгких развивается в условиях повышенной проницаемосщ эндотелиальных клеток, снижения барьерной функции альвеоцитов, в то времш как гидростатическое давление находится в пределах физиологической нормы иш несколько понижено. Повышенная проницаемость микрососудов лёгких возя^ кает в ответ на повыщенную концентрацию цитокинов (ИЛ-1, -8, ФНО-а и неккк торых других). Высокая активность маркёров воспалительной реакции частич» обусловлена повышенной миграцией нейтрофилов из сосудистого русла в очащ воспалительного повреждения лёгочной ткани. В отличие от КОЛ при этой форме отёка лёгких содержание белка в жидкости, которая аккумулируется в интерст*“ ции лёгких, составляет 60% уровня протеинемии, в то время как при КОЛ этслг показатель не превышает 40%.Точный механизм НОЛ при использовании наркотических средств не установ¬ лен. Предположительно патогенетическую роль играют сами токсические суб¬ станции, оказывающие влияние на сосудистую проницаемость капилляров лёгких. Вторичные эффекты, возникающие при использовании наркотических средств, такие, как гипоксия, отёк головного мозга, ацидоз, другие метаболические рас¬ стройства и гипервентиляция, также играют патогенетическую роль в развитие НОЛ,Острое повреждение лёгочных структур при интоксикации салицилатамн может сопровождаться повышением сосудистой проницаемости, приводящей к интенсивному накоплению жидкости в интерстициальной ткани.Отёк лёгких у больных с ТЭЛА происходит при выпоте жидкости в плевральную полость. В данном случае речь идёт не об острой фазе ТЭЛА, а о стадии форми¬ рования инфарктной пневмонии. Один из патогенетических механизмов, объ¬ ясняющий развитие отёка лёгких, связывают с нарушением дренажной функции лимфатических сосудов при инфарктной пневмонии. Механизмы развития отёка лёгких при патологии плевры изучены мало.Диагностика и дифференциальная диагностикаНОЛ определяется как состояние, при котором радиографическими методами устанавливается скопление жидкости в интерстициальной ткани, в альвеолярном пространстве, но при этом давление заклинивания не превышает 18 мм рт.ст.Дифференцировать НОЛ от КОЛ не всегда представляется возможным. Однако это разделение носит принципиальный характер, так как методы лечения и исход заболевания существенно разнятся. С клинических позиций очень важно устано¬ вить причину развития НОЛ или КОЛ. Поэтому указания на инфаркт миокарда или же сепсис могут помочь в принятии диагностического решения. Однако порой встречаются больные, у которых дифференциальная диагностика затруднена даже при самом тщательном сборе анамнеза. Так. при сепсисе возможно поражение эндокарда с последующей перфорацией клапанов сердца и развитием острого прогрессирующего отёка лёгких. Существенным подспорьем является постановка катетера Свана-Ганца для исследования параметров центральной гемодинамики и определения давления заклинивания.ЛечениеСтратегия лечения больных с отёком лёгких, у которых он развился вследствие повышенной проницаемости сосудов малого круга кровообращения, отличается от таковой в случае КОЛ.
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 579 ' •,'/Основные цели лечения• Минимизировать аккумуляцию отёка, что может быть достигнуто за счёт j снижения объёма циркулирующей крови, контроля гидростатического дав- ления.• Активный поиск инфекционного процесса и его адекватное лечение. ;; "уПоддерживающая терапия: ингаляция кислорода, длительная вентиляционная ,1поддержка с минимальным повреждением лёгочной ткани, контроль артериально- го давления и ударного объёма сердечного выброса.В процессе лечения необходимо избегать: гипотонии, перегрузки объёма цирку¬ лирующей крови, токсического действия кислорода, госпитальной инфекции.Причину, которая привела к развитию НОЛ, часго бывает трудно установить.В клинических случаях, когда причина развития отёка остаётся неясной, рекоменду¬ ется более тщательно проанализировать роль острого инфекционного заболевания.Роль сепсиса сегодня является общепризнанной. Наиболее частыми возбудителями сепсиса могут быть стафилококки, синегнойная палочка и другие возбудители. Поэтому, приступая к назначению антибиотиков, придерживаются рекомендацией по ведению больных с госпитальной инфекцией, т.е. назначаются фторхиноло¬ ны, цефалоспорины третьей и четвертой генераций. Практические рекомендации по ведению больных НОЛ включают эмпирическое назначение антибиотиков. Особенно важно назначить антибиотики тем больным, у которых причина развития НОЛ остаётся неустановленной. Одним из грозных осложнений, возникающих у больных с НОЛ, является развитие гипотонии и шока, Гемодинамические параме¬ тры нестабильны, снижается сатурация кислорода, нарастают признаки дыхатель¬ ной недостаточности — все эти изменения требуют проведения ИВЛ по жизненным показаниям. Эта область интенсивной терапии, которая в последние годы явилась специальным объектом проведения многоцентровых исследований, к проведению которых и составлению исследовательских протоколов, побудили такие нежела¬ тельные эффекты ИВЛ, как баротравма, токсическое действие чистого кислорода, вентиляционные пневмонии, в настоящее время выработаны рекомендации по дли¬ тельной прогективной вентиляционной поддержке. Параметры ИВЛ строятся по вспомогательному вентиляционному объёму, минутному лёгочному объёму, частоте вентиляций, которая определяется параметрами pH. соотношению инспирации к экспирации, Р^Оз и которую необходимо удерживать на уровне 95%, режим положительного давления на выдохе (PEEP) выбирается в зависимости от фракции вдыхаемого кислорода (РРз)-Борьба с гипотензией является одним из важных разделов лечебной программы больных с некардиогенным шоком. Несколько параметров, которые влияют на выбор методов лечения. Уровень гемоглобина, если он ниже 90-70 г/л, необходи¬ мо восстановить переливанием отмытых эритроцитов, которые также восполняют объём циркулирующей крови. Обычно при низких показателях давления закли¬ нивания (10 мм рт.ст, и ниже) прибегают к восполнению циркулирующего объёма кристаллоидами. В тех клинических ситуациях, когда гипотензия не разрешилась внутривеным введением растворов, всегда возникает вопрос о необходимости назначения вазопрессоров. У больных с септическим шоком предпочтение сле¬ дует отдать норэпинефрину и допамину, из-за выраженного вазодилатационного эффекта у больных с сепсисом, В случаях, когда резистентность сосудов стала повышаться, предпочтение следует отдать введению добутамина. Необходимо подчеркнуть, что гемодинамические параметры у больных с НОЛ, могут быть разными. Так, если НОЛ протекает на фоне сниженного давления заклинивания, необходимо прибегать к лечебным методам, которые способны его повысить.В других клинических ситуациях, когда как в случае КОЛ, регистрируется повы¬ шение давления заклинивания, необходимо назначать вазодилататоры, диуретики и лекарственные средства инотропного действия.
580 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯТаким образом, при НОЛ вентиляционные параметры, гемодинамика малт круга кровообращения и системного кровообращения характеризуются болыпн разнообразием, что и диктует разные методы лечения. Однако основными щш- ципами лечения этой категории больных является борьба с возможным инфеищ- онным заболеванием, адекватная щадящая вентиляционная поддержка; борьба с гипотонией и улучшение работы миокарда.Специфическая медикаментозная терапия включает достаточно большой я разнообразный по своему механизму действия список лекарственных препарата*: ГКС, ибупрофен, оксид азотапростагландины (в т.ч. липосомальные) Е^, сурфаж- тант*, антиоксиданты, антитела против фактора некроза опухолей-а, антагонисты тромбоцит-активирующего фактора, антагонисты рецепторов интерлейкина-1, кетоконазол, пентоксифиллин^, ацетилцистеин и некоторые другие.Применение ГКС в лечении больных с НОЛ имеют длительную исторша. Однако и по сегодняшний день ведётся дискуссия об эффективности и безопасно¬ сти терапии ГКС у больных этой группы. Основным аргументом, сдерживающіш включение ГКС в клинические рекомендации по лечению больных с НОЛ, явля¬ ется то, что наиболее частыми причинами его развития являются инфекционные заболевания и сепсис, и под воздействием терапии ГКС возможна эскалациж инфекционного воспалительного процесса. Однако в практической деятельности врачи почти всегда назначают ГКС. При этом исходят из потенциальных свойст* ГКС стабилизировать гемодинамику, усилить действие лекарственных средств с инотропным и диуретическим эффектом, практическими рекомендациями оста¬ ётся их назначение при НОЛ в умеренных дозах.Включение в схему лечения больных с НОЛ сурфактанта* основано на патоге¬ нетической его роли в формировании альвеолярной фазы отёка лёгких. Функция сурфактанта многообразны, в последние годы подчёркивается его роль как иммун- номодулятора. Однако его основная функция — обеспечить диффузию кислорода и диоксида углерода. Сурфактант назначался в виде инстилляции в дыхательные пути у больных с НОЛ, которые находились на искусственной вентиляции лёгких. Сурфактант не оказал у этой категории больных заметного улучшения в их состоя¬ нии, в отличие от респираторного дистресс-синдрома новорождённых [3J.Применение антиоксидантов при НОЛ имеет патогенетическое обоснование. Так, свободным радикалам приписывается ведущая патогенетическая роль в раз¬ витии острого повреждения лёгочной ткани. К антиоксидантам относится большая группа лекарственных средств, однако рандомизированные исследования выпол¬ нены только с использованием ацетилцистеина. Назначение высоких доз ацетил¬ цистеина приводило к повышению антиоксидантов в крови у больных с ОРДС. Следует подчеркнуть, что ацетилцистеин может быть использован как антидот.Пентоксифиллин является ингибитором фосфодиэстеразы, его действие приво¬ дит к увеличению циклического АМФ. Основным показанием к его применению является улучшение микроциркуляции и борьба с образованием микроэмболов. Эти эффекты при назначении пентоксифиллина достигаются за счёт увеличения способности эритроцитов деформироваться, что и приводит к снижению вязкости крови. На экспериментальных моделях было продемонстрировано, что ингибито¬ ры фосфодиэстеразы способны предотвратить острое повреждение лёгких. Однако клиническая картина НОЛ настолько сложна, что дать оценку эффективности этой группы препаратов достаточно сложно.В последние годы большое внимание уделено исследованию патологических процессов, которые протекают при участии оксида азота*"'. Его биологическая роль многообразна, но подчёркивается участие оксида азота^ в формировании дис¬ функции эндотелиальных клеток. Другим свойством оксида азота является его способность регулировать вентиляцию и перфузию, что имеет большое значение в лечении больных с ОРДС. Таким образом, оксид азота^ в качестве лекарственного
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 581средства может быть применён при лечении больных с НОЛ. Успех применения оксида азота зависит от индивидуально подобранной дозы. Критерием эффек¬ тивности дозы является увеличение сатурации на 2-3%. Средняя доза составляет от 15 до 20 ppm. Доза может повышаться, контролем служит увеличение содер¬ жания диоксида азота в выдыхаемом воздухе или же увеличение концентрации метгемоглобина. В литературе ведется дискуссия по вопросу о целесообразности назначения оксида азота^ у больных с НОЛ. Причиной разных точек зрения — назначать или не назначать оксид азота — является отсутствие договорённостей, как титровать индивидуальную дозу оксида азота^. Опыт автора свидетельствуето его высокой эффективности у данной группы больных. Показаниями к назначе¬ нию оксида азота ^ является также сепсис. Можно ожидать, что в ближайшее время появятся более строгие доказательства пользы лечения больных оксидом азота^-" и обоснование эффективных схем лечения.Определённые перспективы в лечении больных сепсисом, осложнённым разви¬ тием ОРДС, связывают с применением простагландинов. Простагландин был исследован у больных с НОЛ. Простагландин^ обладает выраженными свойства¬ ми вазодилататора и показал свою высокую эффективность в лечении больных с первичной лёгочной гипертензией. Однако получить обнадёживающие клиниче¬ ские данные в группе больных с ОРДС не удалось. В основном простагландин Е^ рассматривают как профилактическое средство при возможном развитии острого повреждения лёгких.Другая перспектива открывается с использованием антител, ингибирующих активность ФНО-а, которое увеличивало выживаемость этой тяжёлой категории больных.Наконец, при сепсисе проведены широкие исследования с протеином С»’. Смертность у больных с сепсисом снизилась более чем на 6%, что свидетельствуето большом прогрессе. Противовоспалительные свойства протеина связывают с прокоагулянтной активностью. Исследования эффективности и безопасности про¬ теина при остром повреждении лёгких только начались, так что ещё предстоит определить место и роль данного вида лечения у больных с НОЛ.Для купирования НОЛ, ассоциированного с хронической интоксикацией сали- цилатами, достаточно эффективным средством является гидрокарбонат натрия.Таким образом, лечебная программа больных с НОЛ ставит перед собой задачу обеспечить вентиляционную функцию лёгких на физиологическом уровне и выве¬ сти больных из критического гипоксемического состояния. Это достигается за счёт адекватной оксигенотерапии, однако большинство больных нуждаются как мини¬ мум в проведении неинвазивной вентиляции лёгких, а значительная часть из них в проведении длительной протективной ИВЛ. Важным разделом лечебной про¬ граммы больных с НОЛ является поддержание гемодинамики большого и малого круга кровообращения в пределах физиологической нормы. Исходя из конкретной ситуации, сложившейся у больного, возникает целый ряд терапевтических реше¬ ний: от переливания крови до введения вазопрессоров. Состояние сократительной функции миокарда, оценка систолической и диастолической дисфункции, ише¬ мии миокарда имеют порой определяющее значение для исхода НОЛ. Выше уже подчеркивалось, что наиболее частой причиной развития ОРДС является сепсис, поэтому диагностический поиск причин сепсиса и его входных ворот, а также реа¬ лизация современных программ по борьбе с сепсисом играют определяющую роль в спасении жизни больных.СИНДРОМ ОСТРОГО ПОВРЕЖДЕНИЯ ЛЁГКИХСиндром острого повреждения лёгких (СОПЛ) был впервые описан Ashbaughet и соавт, в 1967 г. у 12 больных с клинической картиной острого респираторного дистресса, который проявился одышкой и диффузным цианозом. Рентгенография лёгких у этих больных выявила диффузные инфильтраты. Ингаляции кислорода
582 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯне приносили облегчения. ИВЛ была невозможна вследствие сниженногоS плайнса лёгких.? « На протяжении последующих 40 лет активно изучалась эпидемиология, иаае-^ довались механизмы развития синдрома, оценивались различные методы лечеаявиI >■ ’ Первое время применялся термин «респираторный дистресс-синдром взрослыж«ичто подразумевало его отличие от респираторного дистресс-синдрома поворот* г . ‘ , дённых. В последующем применялся термин ОРДС [4].I ‘ В 1994 г. состоялась согласительная евро-американская конференция, котс^шгпредложила следующее определение СОПЛ: синдром острого и персистирующе» воспалительного процесса в лёгких, для которого характерно повышение пром- цаемости сосудов малого круга кровообращения. Основными диагностическюш критериями СОПЛ являются появление двусторонних инфильтратов в лёгких при рентгенологическом исследовании; соотношение парциального напряжения кислорода в артериальной крови к фракции вдыхаемого кислорода (P^O/F.Oj) колеблется от 201 до 300 мм рт.ст,, несмотря на уровень давления в конце выдо¬ ха 5-8 см вод.ст.; отсутствие клинических и инструментальных данных, которые свидетельствовали бы о повышении давления в левом предсердии, т.е. давление заклинивания не должно превышать 18 мм рт.ст. Основанием для изменения тер¬ мина ОРДС на СОПЛ явилось внедрение системы количественного определения степени повреждения лёгких, которая включает четыре параметра:• уровень положительного давления на выдохе (PEEP);• отношение парциального давления кислорода в артериальной крови к фрак¬ ции вдыхаемого кислорода;• лёгочный комплайнс;• степень выраженности лёгочных инфильтратов, выявляемых при рентгено¬ графии [5].ЭтиологияЛидирующая роль среди разнообразных заболеваний, приводящих к развитию СОПЛ, принадлежит сепсису, множественным травмам, пневмонии, транспланта¬ ции различных органов и тканей, включая трансплантацию лёгких.ЭпидемиологияЭпидемиология СОПЛ мало изучена. Результаты многоцентровых исследований, проведённых в США, свидетельствуют, что на 100 ООО населения регистрируется около 86 случаев СОПЛ в год, что в абсолютном вьфажении составляет 190 ООО человек, из которых умирает 74 500 человек (38-41%). Иначе говоря, СОПЛ по своей распространённости сопоставим с раком лёгкого. Летальность от СОПЛ до недавнего времени была ещё выше и достигала 70-80%, Таким образом, можно кон¬ статировать достаточно высокий уровень распространения СОПЛ в современной клинической практике и возможно прогнозировать его дальнейший рост, особенно в случаях эпидемических вспышек респираторных вирусных заболеваний или мас¬ совых ингаляционных отравлений. Невзирая на прогресс, достигнутый в лечебных программах СОПЛ, сохраняется достаточно высокий уровень летальности.ПатогенезЭкспериментальными исследованиями, проведёнными за последние тридцать лет, было установлено, что в основе развития НОЛ при СОПЛ лежит повышение сосудистой проницаемости капилляров малого круга кровообращения в результате воспалительного процесса.Основными этапами развития НОЛ при СОПЛ является повышение сосудистой проницаемости эндотелиальных клеток сосудов малого круга кровообращения, депонирование воды, электролитов и белка в интерстициальной ткани лёгких, дис¬ функция альвеолоцитов первого и второго типов, поступление избыточного коли-
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 583чества жидкости в плевральную полость, а на далеко зашедших стадиях отёка ~ и в просвет дыхательных путей. При декомпенсации механизмов защиты жидкость начинает скапливаться на поверхности альвеол, что и приводит к клинически зна¬ чимым нарушениям транспорта кислорода [6].Патологическая анатомияМорфологические изменения при СОПЛ имеют фазный характер. Для первой (экссудативной) фазы характерны диффузные изменения со стороны альвеол. Альвеолокапиллярная мембрана утолщается, происходят вакуолизация и отёк эндотелия, появляется феномен гиалиновых мембран как одно из наиболее спец¬ ифических проявлений диффузного повреждения альвеол. Происходит аккумуля¬ ция клеток воспаления в интраальвеолярном пространстве (рис. 33-2, см. также цветную вклейку). Эти изменения корреспондируют с характером цитоза в БАЛ и в плевральном выпоте.Кроме того, может наблюдаться внутриальвеолярная организация фибрина (рис. 33-3, см. также цветную вклейку),В части сосудов в этот период выявляоотся пристеночные и обтурирующие органи¬ зующиеся, как правило, фибриновые тромбы (рис, 33-4, см. также цветную вклейку).Процесс острого повреждения альвеолокапиллярной мембраны может подверг¬ нуться обратному развитию, оаавив после себя едва заметные участки фиброза. В тех же случаях, когда процесс прогрессирует, он переходит во вторую - фиброти- ческую фазу, и в лёгких формируются изменения, аналогичные тем, которые встреча¬ ются при фиброзирующем альвеолите (рис. 33-5, см. также цветную вклейку).Клиническая картинаОсновой клинических проявлений СОПЛ являются НОЛ и ателектазы лёгких.Рис. 33-2. Интерстициальный и внутриапьвеолярный отёк. Альвеолоциты второго типа: отёк, фраг¬ менты цитоплазматической мембраны, дегенеративные изменения базальной мембраны. Окраска гематоксилином и эозином хЮО (препарат проф. Черняева А.Л.).
йФШР®:Г584 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯРис. 33-3. Выраженная гиалиновая мембрана по контуру альвеол; интерстициальный отёк; ско¬ пление эритроцитов в альвеолах; полнокровие сосудов. Окраска гематоксилином и эозином х100 {препарат проф. Черняева А.Л.).Рис. 33*4, Фибриновый обтурирующий тромб; пролиферация эндотелиоцитов; умеренный отёк стенки сосуда с единичными лимфоцитами. Окраска гематоксилином и эозином х400 (препарат проф, Черняева А.Л.).
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 585Рис. 33-5. Организация экссудата в альвеолах, гиперплазия альвеолоцитов второго типа, фиброз с формированием «сотовых» изменений. Окраска гематоксилином и эозином х400 (препарат проф. Черняева А.Л,).ДиагностикаДля постановки диагноза СОПЛ необходимо выполнить определённую диагно¬ стическую программу: исследовать напряжение кислорода в артериальной крови, провести рентгенологическое исследование органов грудной клетки, монитори¬ ровать параметры кислотно-щёлочного равновесия, исследовать центральную гемодинамику, что необходимо для исключения синдрома дисфункции левого желудочка.Рентгенологическое исследование при СОПЛ выявляет билатеральные инфиль¬ траты в лёгких, которые могут быть представлены в виде очаговых теней, располо¬ женных асимметрично по лёгочным полям. Рентгенологическая картина может дополняться выпотом в плевральную полость. СОПЛ характеризуется, как прави¬ ло, двусторонним выпотом. Компьютерная томография обнаруживает следующие признаки СОПЛ: заполнение альвеол жидкостью, местами консолидация инфиль¬ трата, ателектазы. Фиброзная фаза СОПЛ характеризуется рентгенологическими изменениями, свойственными фиброзирующему альвеолиту. В терминальных ста¬ диях морфологические изменения соответствуют картине «сотового лёгкого», что свидетельствует о дегенеративных изменениях лёгочной ткани. Образовавшиеся буллы могуг стать причиной развития пневмоторакса.Больным в остром периоде СОПЛ рекомендуется часто — до 2 раз в день — повторять рентгенографию органов грудной клетки. Динамика количества и расположения инфильтратов позволяет мониторировать состояние больного и определять ближайший прогноз течения СОПЛ.ЛечениеЛечебная программа предусматривает эффективное лечение заболевания, при¬ ведшего к развитию СОПЛ.
«ц586 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯСреди разнообразных методов лечения, прошедших апробацию в клиндвс. центральное место у этой категории больных принадлежит ИВЛ. Выше уже по*- чёркивалось, что больные СОПЛ резистентны к ингаляционной терапии кнг- лородом и неинвазивной вентиляции лёгких. ИВЛ, которую стали применять с начала 70-х годов прошлого столетия, позволила снизить летальность до 50-60%. Национальный институт здоровья США организовал многоцентровое исследо¬ вание по изучению эффективности различных режимов вентиляции у больныж с СОПЛ. Изначально параметры вентиляции строились из расчёта дыхательного объёма 12-15 мл/кг веса пациента. В этих условиях часто развивались баротрав¬ мы и токсические эффекты кислорода. Использование режима дыхательного объёма 5-6 мл/кг веса пациента позволило снизить летальность у больных СОПЛ до 39% [7].Стратегия современной протективной ИВЛ позволяет решить следующие важ¬ ные задачи:• улучшить транспорт кислорода, при этом фракция кислорода во вдыхаемом воздухе не превышает 50-60%;• снизить объём мышечной работы, что существенно влияет на процесс достав¬ ки кислорода к тканям, и снизить продукцию СО^;• снизить венозный возврат к правым отделам сердца, что влияет на формиро¬ вание трансваскулярного гидростатического давления;• эффективно бороться с ателектазами, формирующимися у больных с СОПЛ.Снижая количество жидкости, поступающей из сосудов в интерстициальнуюткань лёгких, ИВЛ позволяет эффективно бороться с НОЛ при СОПЛ. В антиате- лектатической функции протективной вентиляции большое значение имеет пра¬ вильный выбор режима PEEP. Рекомендуется рассчитывать его по формуле:Crs=VT(Ppl-PEEP),где Crs — комплайнс респираторной системы, VT - дыхательный объём, PEEP - положительное давление в конце выдоха, Рр1 — давление, которое устанавли¬ вается во время плато дыхательного цикла, когда завершается вдох и дыхание задерживается,Рр1 не должно превышать 30 см вод.ст,, PEEP оставаться в пределах 8 см вод.ст., а дыхательный объём — 5 мл/кг веса больного. Это основные параметры протек¬ тивной вентиляции лёгких.Лечение больных СОПЛ включает применение ГКС, оксида азота, простаглан¬ динов, диуретиков. Особое внимание следует уделить тактике назначения раство¬ ров и мониторированию вентиляционной функции лёгких, транспорта кислорода и гемодинамических параметров. Оптимальным является ведение этой категории больных в условиях неглубокой гиповолемии (центральное венозное давление около нуля), что позволяет снизить гидростатическое давление в интерстициаль¬ ной ткани и способствует разрешению НОЛ. В лечебные схемы входят также сим- патомиметики, обладающие инотропным эффектом, что особенно важно в случаях гипотонии и сниженного диуреза. Ингаляции селективных (i-адреномиметиков защищают лёгкие от развития альвеолярной фазы отёка, уменьшая проницаемость интерстициальной жидкости в просвет альвеол.ГКС оказывают влияние на сосудистую проницаемость и неспецифические противовоспалительные эффекты. Целесообразнее всего назначать высокие дозы метил преднизолона по типу пульс-терапии в течение 7 дней [8]. Однако эффектив¬ ность терапии ГКС достигается лишь только в комбинации с другими методами лечения.Патогенетическим обоснованием к назначению оксида азота является наруше¬ ние функции эндотелиалиальных клеток сосудов малого круга кровообращения, и в первую очередь капилляров. Оксид азота^’ не влияет на смертность, но его
ОТЁК И ОСТРОЕ ПОВРЕЖДЕНИЕ ЛЁГКИХ 5$7назначение улучшает транспортную функцию лёгких и повышает сатурацию крови кислородом. Оксид азота^ может влиять на проницаемость сосудов лёгких, таким образом снижать накопление жидкости в интерстициальной ткани лёгких. Другим ^ его свойством является влияние на внутриклеточные микроорганизмы [9].Простагландин (алпростадил) и простациклин (эпопростенол^) улучшают кис¬ лородный статус больных СОПЛ [10,11].Заместительная терапия сурфактантом* достаточно эффективна при респиратор¬ ном дистресс-синдроме детей, однако у взрослых эффект её значительно ниже [12].Достижения последних лет позволили разработать программу лечения и сни¬ зить летальность от СОПЛ более чем на 30%.НЕВРОГЕННЫЙ ОТЁК ЛЁГКИХ ЭтиологияНеОЛ в высоком проценте случаев встречается при черепно-мозговых травмах.Часто с этой клинической проблемой врачи встречаются в период военных дей¬ ствий. В мирное время эта проблема касается пострадавших в транспортных ава¬ риях. Другой частой причиной развития НеОЛ является эпилепсия, НеОЛ может осложнять течение геморрагического инсульта, особенно часто он развивается при субарахноидальном кровоизлиянии. У некоторых больных НеОЛ развивается спустя несколько дней после инсульта.ПатогенезПатогенетические механизмы НеОЛ остаются мало изученной областью, несмо¬ тря на то что эта форма отёка лёгких было описана более ста лет назад. Существует несколько теорий, с позиций которых пытаются объяснить развитие отёка лёгких. Большое место в возникновении НеОЛ отводится роли гипоталамуса. Важным механизмом является повышение внутричерепного давления, которое сопрово¬ ждается активацией симпатического отдела нервной системы. Экспериментально удалось пол}^ить модель НеОЛ при поражении дистального отдела ствола голов¬ ного мозга и считается, что это критическая зона, с которой связывают развитие НеОЛ, В подтверждение этой гипотезы служат фармакологические эффекты фен- толамина. Он способен блокировать центральные а-адренергические рецепторы и тем самым способствовать купированию НеОЛ. Центральные механизмы оказы¬ вают влияние на движение жидкости из микрососудов лёгких в интерстициальную ткань, а также на уровень онкотического давления в интерстиции лёгких. Другой патогенетический механизм развития отёка лёгких связан эффектом вазокон¬ стрикции, Таким образом, патогенетическая особенность НеОЛ состоит в том, что участвуют центральные механизмы ствола головного мозга, локальные изменения гемодинамики лёгких затрагивают регулирующие механизмы гидростатического и онкотического давления как сосудов, так и интерстициальной ткани. Эти механиз¬ мы дополняются участием вазоспастических реакций малого круга кровообраще¬ ния и их повышенной проницаемостью. Нарушение гемодинамики лёгких проис¬ ходит при участии функциональных нарушений левого желудочка. Таким образом, особенностью патогенеза НеОЛ является сочетание механизмов кардиогенного и некардиогенного отёка лёгких.Клиническая картинаПродолжительность отёка лёгких может составлять несколько дней. Он сопро¬ вождается тахипноэ, при котором в акте дыхания участвует вспомогательная мускулатура грудной клетки. Отёчная жидкость, которая выделяется из дыха¬ тельных путей, может содержать небольшое количество крови. Лёгочное крово¬ течение не характерно для этой категории больных, поэтому если оно отмечено, необходимо исключать другие болезни. Аускультация выявляет влажные хрипы
588 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯкак в верхних, так и в нижних отделах лёгких. Рентгенография выявляет npi застоя в лёгких при отсутствии изменений размеров сердца. Артериальное дакж> ние, давление заклинивания, сердечный выброс при НеОЛ остаются в предам* физиологической нормы, что важно для дифференциальной диагностики различ¬ ных форм отёка лёгких. Трудности возникают при проведении дифференциал1лаЛ диагностики с аспирационной пневмонией, которая достаточно часто осложнив черепно-мозговые травмы, В пользу НеОЛ свидетельствует отсутствие гнойного отделяемого из бронхов и двустороннее поражение лёгких. Аспирационная пнев¬ мония имеет склонность к абсцедированию, развитию плеврита, её разрешение происходит в течение 2-3 нед, в то время как отёк лёгких разрешается в более короткие сроки. Необходимо также исключать застойную сердечную недостаточ¬ ность и острый респираторный дистресс-синдром, которые могут развиться у человека, получившего травму головы.Особенностью НеОЛ у больных эпилепсией является то, что отёк лёгких возни¬ кает в период, когда судороги уже прекратились. Прогноз у больных с эпилепсией и НеОЛ принято считать неблагоприятным, у них высока вероятность внезапной смерти.Диагноз НеОЛ представляется достаточно затруднительным. Необходимо исключить другие заболевания, при которых развивается респираторный дистресс- синдром.ЛечениеУспех лечения НеОЛ определяется в первую очередь течением основного заболевания, приведшего к развитию НеОЛ. Больные нуждаются в проведении оксигенотерапии. Рекомендуется ингалировать кислород через маску, в случаях недостаточного транспорта кислорода этой категории больных показана ИВЛ. Особенностью ведения НеОЛ является включение в программу лечения больных фентоламина (блокатора а-адренорецепторов). Одним из показаний к введению фентоламина является артериальная гипертония, часто осложняющая течение НеОЛ. Другие лекарственные препараты, включённые в схему ведения этой кате¬ гории больных, близки к тем, которые используют при КОЛ.список ЛИТЕРАТУРЫ г
Глава 34 Идиопатическая лёгочная гипертензияИдиопатическая (первичная) лёгочная гипертензия (ИЛГ) — редкое заболевание неизвестной этиологии, характеризующееся выраженньш повышением общего лёгочного сосудистого сопро¬ тивления и давления в лёгочной артерии (ДЛА), часто прогресси¬ рующим течением с быстрым развитием декомпенсации правого желудочка и фатальным прогнозом. Диагноз устанавливается при среднем ДЛА более 25 мм рт.ст. в покое и более 30 мм рт.ст. при нагрузке, нормальном давлении заклинивания в лёгочной артерии (до 10-12 мм рт.ст.) и отсутствии возможных причин лёгочной гипертензии (ЛГ) [1, 2].На Третьем мировом симпозиуме по ЛГ (Венеция, 2003 г.) вме¬ сто термина «первичная» ЛГ было рещено использовать «идио¬ патическая» ЛГ, подразумевая спорадические случаи заболевания [3]. Ещё десятилетие назад считалось, что ИЛГ характеризуется быстропрогрессирующим течением. Медиана выживаемости боль¬ ных с момента диагностики заболевания составляла 2,8 года [4, 5]. В 90-е годы с использованием внутривенного простациклина*^ (эпопростенолола^') отмечено существенное улучшение прогноза больных ИЛГ. Однако лишь 60-70% пациентов, не «отвечающих» на терапию вазодилататорами, выживают в течение одного года. Наличие признаков декомпенсации правого желудочка ассоцииру¬ ется с худшим прогнозом больных ИЛГ независимо от возраста [6, 7]. Появление новых терапевтических возможностей, прежде всего антагонистов рецепторов эндотелина, делает современный взгляд на прогноз пациентов ИЛГ более оптимистичным [1].ЭпидемиологияЗаболеваемость ИЛГ в общей популяции составляет 1-2 случая на миллион населения в год [8]. Заболевание может манифестиро¬ вать в любом возрасте, хотя наиболее часто это третья декада жизни у женщин и четвертая — у мужчин. Согласно данным регистра ИЛГ (Национальный институт здоровья США), который включал 187 больных, средний возраст 36 лет, соотношение женщины:муж- чины составило 1,7:1,9% пациентов были старше 60 лет, 8% — моложе 20 лет, не было установлено этнической предрасположен¬ ности [4]. Средний период от дебюта заболевания до момента установления диагноза составляет 2 года.
-т590 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯt Этиология и патогенезПо данным регистра Национального института здоровья США, семейные слу¬ чаи составляют около 6% всех случаев ИЛГ. У половины больных с семеш ЛГ и у четверти в спорадических случаях ЛГ устанавливается ассоциация с муіа- циями гена, кодирующего рецептор II типа к белку костного морфогенеза и гея»,, кодирующего активин-рецептор-подобную киназу 1 [8]. Характерен аутосомн»' доминантный тип наследования с генетической антисипацией — проявленивя заболевания в более раннем возрасте и в более тяжёлой форме в каждом после¬ дующем поколении. Отмечается феномен неполной пенетрантности, т.е. не у всеж носителей мутации гена развивается ЛГ.Современные теории патогенеза ИЛГ фокусируются на дисфункции шш повреждении эндотелия, приводящей к нарушению баланса межд}^ вазоконстрик- тивными и вазодилатирующими веществами и развитию вазоконстрикции [9,10}. Освобождение неидентифицированных хемотаксических агентов из повреждёв- ных клеток эндотелия вызывает миграцию гладкомышечных клеток в интиму лёгочных артериол. Секреция локально активных медиаторов с выраженным вазоконстрикторным действием способствует развитию тромбоза in situ, транс¬ формируя состояние лёгочного сосудистого русла из обычного антикоагулянтного состояния вследствие освобождения простациклина и ингибитора тканевого акти¬ ватора плазминогена в прокоагулянтное. В результате образуется порочный кр>т: повреждение эндотелия неуклонно прогрессирует и приводит к ремоделированию лёгочных сосудов, нарастанию сосудистой обструкции и облитерации [1,10,11].Морфологияпри ИЛГ поражаются мелкие артерии и артериолы лёгких. На ранних этапах болезни характерным морфологическим проявлением является гипертрофия сред¬ ней оболочки артерий и формирование мышечной оболочки в артериолах [12]. По мере прогрессирования заболевания возникают сначала обратимые изменения в интиме вследствие пролиферации клеточных элементов, далее необратимые поражения в виде концентрического фиброза и фиброэластоза. Наряду с концен¬ трическим фиброзом интимы обнаруживаются плексогенные или плексиформ- ные структуры, расположенные, как правило, проксимальнеє места обтурации из-за фиброэластоза интимы [12,13]. Эти поражения возникают либо вследствие фибриноидного некроза на стадии пролиферативной репарации, либо являются анастомозами между лёгочными артериями и венами или аневризмой в местах недоразвитой медии. В стенках лёгочных артерий мышечного типа могут обна¬ руживаться явления некротизирующего артериита, иногда протекающего остро с фибриноидным некрозом медии. Часто отмечаются обструктивные поражения лёгочных артерий мышечного типа и артериол за счёт формирования тромбов на различных стадиях организации. Старые тромбы могут представлять собой интра- васкулярные септы, в ряде случаев реканализируются.Клиническая картинаТрудности диагностики ИЛГ связаны с тем, что клинические симптомы неспеци¬ фичны и имитируют ряд распространённых заболеваний [1,14].• Одышка имеет инспираторный характер, степень выраженности варьирует от минимальной, возникающей лишь при значительной нагрузке, до выра¬ женной даже в покое. Одышка связана с уменьшением минутного объёма сердца при нагрузке, рефлекторным возбуждением дыхательного центра с барорецепторов стенки лёгочной артерии, возникающим в ответ на повыше¬ ние давления в ней [17]. В развёрнутой стадии заболевания присоединяются нарушения газового состава крови, кислотно-щёлочного равновесия. С тече-
ИДИОПАТИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 591нием болезни одышка прогрессивно нарастает. Приступов удушья обычно не наблюдается.• Боли в грудной клетке имеют неопределённый характер: давящие, ноющие, колющие, сжимающие; без чёткого начала, продолжительностью от несколь¬ ких минут до суток, усиливаются при физических нагрузках, обычно не купируются приёмом нитроглицерина. У ряда пациентов ИЛГ отмечаются типичные приступы стенокардии, маскирующие ишемическую болезнь серд¬ ца и даже острый инфаркт миокарда. Боли в области сердца при ИЛГ обуслов¬ лены снижением сердечного выброса и снижением давления в коронарных артериях, выраженным гипертрофией правого желудочка, перерастяжением лёгочной артерии (висцеро-висцеральные рефлексы), гипоксией.• Головокружения и синкопе провоцируются физической нагрузкой и связаны с уменьшением сердечного выброса, возможен рефлекторный механизм (каро¬ тидный рефлекс), церебральный ангиоспазм и гипоксия головного мозга. У больных ИЛГ появляется бледность, затем цианоз кожи лица, конечносгей, затемнение сознания. Продолжительность обмороков составляет от 2-5 до 20-25 мин.• Сердцебиения и перебои в работе сердца. На ЭКГ чаще синусовая тахикардия, злокачественные нарушения ритма, как правило, не регистрируются.• Кашель отмечается у трети больных ИЛГ, связан с застойными явлениями или присоединением воспалительного процесса в лёгких и бронхах.• Кровохарканье обычно возникает однократно, но может продолжаться несколько дней, связано с тромбоэмболиями мелких ветвей лёгочной артерии или разрывом мелких лёгочных сосудов при высокой ЛГ.Для характеристики тяжести течения ИЛГ используется функциональная клас¬ сификация ВОЗ — модифицированный вариант классификации Нью-Йоркской ассоциации сердца (NYHA), предложенной для пациентов с недостаточностью кровообращения [1].• I класс — больные с ЛГ без ограничения физической активности. Обычная физическая актргеность не вызывает появление одышки, слабости, боли в грудной клетке, головокружения.• II класс — больные с ЛГ, приводящей к некоторому снижению физической активности. В покое они ощущают себя комфортно, однако обычная физи¬ ческая активность сопровождается появлением одышки, слабости, боли в грудной клетке, головокружения.• Ш класс — больные с Л Г, приводящей к выраженному ограничению физи¬ ческой активности. Небольшая физическая активность вызывает появление одышки, слабости, боли в грудной клетке, головокружения.• IV класс — больные с ЛГ не способны выполнять любую физическую нагруз¬ ку без вышеперечисленных клинических симптомов. Одышка или слабость могут присутствовать даже в покое, дискомфорт возрастает при минимальной нагрузке.У пациентов с ИЛГ при аускультации сердца выслушивается акцент II тона на лёгочной артерии, ритм галопа, систолический шум трикуспидальной недоста¬ точности, диастолический шум недостаточности клапана лёгочной артерии (шум Грехема-Стилла) [1,15].ИНСТРУМЕНТАЛЬНЫЕ И ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯДля верификации диагноза используются следующие методы ИПГ:• Анамнез, включая семейный, физикальное обследование.• ЭКГ, ЭхоКГ, фонокардиография, рентгенография органов грудной клетки, ФВД.• Перфузионно-вентиляционная сцинтиграфия лёгких, исследование антител к ВИЧ, печёночные тесты, антинуклеарные антитела.
; ' 592 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ• Полисомнографическое исследование, УЗИ внутренних органов.& • Катетеризация правых отделов сердца с проведением фармакологич(проб.ЭКГ выявляет отклонение электрической оси сердца вправо, признаки гипс^ ; ^ трофии и перегрузки правого желудочка, дилатации и гипертрофии правого прое* сердия {Р-ри1топак) [16].Чувствительносгь ЭКГ составляет 55%, специфичность 70%, поэтому нетоц не является скринирующим для диагностики ЛГ. Изменения на ЭКГ у больныж ИЛГ возникают при наличии выраженной гипертрофии правых отделов сердца. С помощью векторкардиографии можно диагностировать эти изменения на болие ранних стадиях [15].Фонокардиография позволяет не только диагностировать гипертензию наш гиперволемию в малом круге кровообращения, относительную недостаточность трикуспидального клапана и клапана лёгочной артерии при ИЛГ, но и исключить приобретённые и врождённые пороки сердца.При рентгенографии органов грудной клетки у большинства больных ИЛГ выявляется повышение прозрачности лёгочных полей на периферии за счет обеднения лёгочного рисунка [1]. Корни лёгких, как правило, резко расшире¬ ны. На более поздних стадиях заболевания увеличены правые отделы сердца. Рентгенография органов грудной клетки так же позволяет выявить интерстици¬ альные заболевания лёгких, приобретённые и врождённые пороки сердца как причину ЛГ.Показатели ФВД во многих случаях ИЛГ в пределах нормы, у ряда больных может наблюдаться умеренное снижение лёгочных объёмов [17].Эхокардиография (ЭхоКГ) — исследование скрининга для больных Р1ЛГ. Выявляется расширение верхней полой вены, правого желудочка, правого пред¬ сердия, сниженная сократительная функция правого желудочка, парадоксальное движение межжелудочковой перегородки, наличие перикардиального выпота [1,18]. С помощью ЭхоКГ можно исключить патологию левого желудочка, пороки митрального и аортального клапанов, врождённые пороки сердца как возможные причины ЛГ.При допплер-ЭхоКГ по скорости трикуспидальной регургитации расчётным путём по модифицированному уравнению Бернулли определяется величина систо¬ лического давления в лёгочной артерии (ДЛА) [15].ДР = 4У^где др — градиент давления через трёхстворчатый клапан. V — скорость трикуспи¬ дальной регургитации в м/с.Если Др <50 мм рт.ст., то систолическое ДЛА = ДР.При ДР <50-85 мм рт.ст. систолическое ДЛА = ДР + 10 мм рт.ст., при ДР >85 мм рт.ст. ДЛА = ДР + 15 мм рт.ст. Измеренное при ЭхоКГ ДЛА коррелирует с определённым при катетеризации лёгочной артерии.При вентиляционно-перфузионной сцинтиграфии лёгких у больных ИЛГ можно обнаружить как абсолютно неизменённую картину, так и небольшие пери¬ ферические несегментарные дефекты перфузии без нарушенной вентиляции [1,19]. В дифференциальной диагностике ИЛГ и хронической тромбоэмболической болезни лёгких чувствительность вентиляционно-перфузионной сцинтиграфии составляет 90-100% и специфичность 94-100%.Мультиспиральная компьютерная томография (МСКТ) и магнитно- резонансная томография (МРТ) играют важную роль в диагностике ИЛГ [20], Основными достоинствами этих методов является возможность получения трёхмерных изображений без артефактов от костей и лёгочных полей, высокое пространственное разрешение. МСКТ позволяет оценить состояние лёгочных
ИДИОПАТИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 593полей, а также сердца и сосудов с помощью контрастирования полостей сердца и просвета сосудов при внутривенном введении 80-120 мл контрастного вещества. Достоинствами МРТ является отсутствие лучевой нагрузки, неинвазивность, есте¬ ственный контраст от движущейся крови.АЛАЛИЗЫ КРОВИ И ИММУНОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИУ больных ИЛГ оцениваются биохимический и общий анализы крови, уровни гормонов щитовидной железы, проводится тест на ВИЧ-инфекцию. У трети боль¬ ных ИЛГ определяются антитела к кардиолипину в низком титре менее 1:80 [1, 21], При более высоком уровне антител, наличии клинических признаков необхо¬ димо серологическое исследование и консультация ревматолога.Полисомнографическое исследование даёт возможность исключить обструктивное апноэ и гипопноэ сна. эпизоды сниженной сатурации [1].УЗИ внутренних органов позволяет исключить цирроз печени и/или пор¬ тальную гипертензию.«Золотым стандартом» для верификации диагноза ИЛГ является катетериза¬ ция правых отделов сердца с прямым измерением ДЛА и определением сердечно¬ го выброса, общего лёгочного сосудистого сопротивления [15,22], ЛГ устанавлива¬ ется при среднем ДЛА более 25 мм рт.ст. в покое или более 30 мм рт.ст. при нагрузке, давлении заклинивания в лёгочной артерии менее 15 мм рт.ст. (прекапиллярная ЛГ), общем лёгочном сосудистом сопротивлении более 3 мм рт.ст./(лхмин). Повышенное среднее давление в правом предсердии и общее лёгочное сосудистое сопротивление, низкий сердечный выброс и сатурация венозной крови свидетельствуют о худшем прогнозе больных ИЛГ [4,5, 6].Острые пробы с вазодилататорами (простагландин Е1, ингаляцинный оксид азота) позволяют оценить вазореактивность лёгочных сосудов (табл. 34-1). Проба считается положительной при снижении среднего ДЛА более чем на 10 мм рт.сг. при увеличении или неизменной величине сердечного выброса. Около 10% боль¬ ных ИЛГ имеют положительную пробу с вазодилататором [1].Таблица 34-1. Острые фармакологические пробы для оценки вазореакгивности больных лёгочной гипертензиейПрепаратПуть введенияПериод полу* выведенияСтартовая дозаЛечебная дозаДлительностьПГ Е,Внутривенный3 мин5 нг/(кгхмин)До 30 нг/(кгхмин)30-40 минОксид азотаИнгаляционный15-30 с10 ррм20-40 ррм5 минДля определения толерантности к физическим нагрузкам наиболее часто исполь¬ зуется тест с 6-минутной ходьбой и кардиопульмональный нагрузочный тест с оценкой газообмена [1,23]. Тест с 6-минутной ходьбой — простой метод, обычно дополняемый оценкой одьшши по Боргу. Дистанция, пройденная в тесте 6-минутной ходьбой, является предиктором выживаемости больных ИЛГ, обратно коррелирует с функциональным классом, считается первичной конечной точкой в большинстве клинических исследований у больных ЛГ. Кардиопульмональный нагрузочный тест дает возможность оценить вентиляцию и газообмен во время дозированной физиче¬ ской нагрузки. У больных ИЛГ отмечается снижение индекса пикового потребления кислорода и анаэробного порога [27].С помощью указанных клинико-инструментальных и лабораторных данных у большинства пациентов с ИЛГ удаётся верифицировать диагноз, поэтому прове¬ дение открытой биопсии лёгких, особенно с учётом высокого риска осложнений, не требуется [24].
594 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ'л-ШйШОбщие принципы леченияВ повседневной жизни больные ИЛГ должны выполнять физические Н£ не вызывающие потенциально опасных симптомов: выраженная одышка, а боли в грудной клетке [1, 25]. Пациентам следует рекомендовать вакцинацию! гриппа и пневмококковой инфекции для предотвращения инфекционных за( ваний.Беременность и роды у пациенток ИЛГ связаны с повышенным риском шения течения заболевания и смертности [7]. Хотя в настоящее время опис случаи успешной беременности, закончившиеся родами, всем пациенткам репродуктивного возраста должны быть рекомендованы методы контрацепцищ,| Взаимосвязи между использованием оральных контрацептивов и возникнове!Л Г в значительном числе исследований выявить не удалось. В то же время р«ж] от использования препаратов с низким содержанием эстрогенов резко снижаете»; при использовании пероральных антикоагулянтов. У больных ИЛГ более пред¬ почтительно использование не содержащих эстроген контрацептивов, барьерных методов контрацепции, проведение хирургической стерилизации. Заместителыищ гормональная терапия показана пациенткам с ИЛГ в постменопаузе при выраже»- ных климактерических симптомах и непременно в условиях адекватной терапм антикоагулянтами.МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯКлючевые направления медикаментозной терапии больных ИЛГ определяются исходя из основных аспектов патогенеза заболевания:• вазодилатация — релаксация гладкомышечных клеток лёгочных сосудов;• предотвращение или регресс ремоделирования лёгочных сосудов;• постоянная антикоагуляция — предотвращение эмболии лёгочных сосудови/или тромбоза in situ.История лечения ИЛГ начиналась с применения вазодилататоров, посколь¬ ку вазоконстрикция является неотъемлемым звеном в патогенезе заболевания [25, 26].Антагонисты кальцияБлагоприятные клинические и прогностические эффекты антагонистов каль¬ ция, применяемых в высоких дозах у больных ИЛГ с положительной острой про¬ бой, были показаны в одноцентровых, нерандомизированных, неконтролируемых исследованиях [25]. Для длительного применения используется нифедипин в пролонгированных формах, ди гидропиридиновые антагонисты кальция П1 поко¬ ления — амлодипин, исрадипин, лацидипин, обладающие исключительно высо¬ ким сродством к гладкой мускулатуре лёгочных сосудов. Отсутствие выраженных побочных эффектов препаратов позволяет назначать их в довольно высоких дозах и достигать существенного снижения среднего ДЛА, регресса гипертрофии и дила¬ тации правого желудочка [26]. В случаях выраженной тахикардии при ИЛГ при¬ меняются бензотиазепины (дилтиазем), которые, однако, обладают более слабым вазодилатирующим действием по сравнению с дигидропиридинами. Верапамил не следует назначать больным ИЛГ из-за выраженного отрицательного инотропного эффекта. Выбор антагониста кальция зависит от исходной частоты сердечных сокращений. Пациентам с относительной брадикардией следует рекомендовать дигидропиридины, при относительной тахикардии — дилтиазем. Дозу препаратов следует титровать, начиная с небольших дозировок и постепенно увеличивая до максимально переносимой с учётом уровня ДЛА (табл, 34-2).Терапия антагонистами кальция показана пациентам с сердечным индексом >2,1 л/(минхм^), и/или сатурацией венозной крови >63%, и/или давлением в правом предсердии <10 мм рт.ст., с положительной острой пробой. У пациентов
ИДИОПАТИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 595С сердечным индексом >2,1 л/(минхм^), и/или сатурацией венозной крови >63% ж/или давлением в правом предсердии <10 мм рт.ст. и отрицательной острой 1Цюбой успех от назначения вазодилататора маловероятен и может вызвать побочные эффекты. При сердечном индексе <2,1 л/мин/м^ и/или сат^фацией венозной крови <63% и/или давлением в правом предсердии <10 мм рт.ст. антаго¬ нисты кальция абсолютно противопоказаны [1, 25].Та6ли1и1 34-2. Дозы антагонистов кальция для лечения больных ИЛГЛекарственныйпрепаратНачальная доза, мгПрирост дозы каждые 3-5 дней, мгСуточная доза (СДЛА <50 мм рт.ст.), мгСуточная доза (СДЛА 50-100 мм рт.ст.), мгСуточная доза (СДЛА >100 мм рт.ст.), мгНифедипин*20-402040-6080-120120-180Исрадипин2.5-52,5-57,5-1010-12,512,5-15Амлодипин2,5-52,51012,515Лацидипин2-4Дилтиазем30-6030120-180180-240240-360• В пролонгированной форме.Антикоагулянты и дезагрегантыПоказания для назначения оральных антикоагулянтов (ОАК) у больных ИЛГ связаны с факторами риска венозных тромбоэмболий, таких как сердечная недо¬ статочность, малоподвижный образ жизни, а также предрасположенности к тромботическим изменениям в лёгочных сосудах — микроциркуляторном русле и эластических лёгочных артериях — из-за гиперкоагуляции и снижения фибрино- литического потенциала [12].Благоприятные эффекты ОАК у больных ИЛГ доказаны результатами одно¬ центровых нерандомизированных ретроспективных исследований [1, 25] Выжи¬ ваемость больных ИЛГ, длительно принимающих непрямые антикоагулянты, в частности варфарин, была достоверно выше. Варфарин практически удваивает 3-летнюю выживаемость больных ИЛГ, причём улучшает прогноз даже у паци¬ ентов, не отвечающих на терапию антагонистами кальция [1]. Целевой уровень международного нормализованного отношения (МНО) при ИЛГ 1,5-2,5. Полная доза препарата назначается 1 раз после вечернего приёма пищи,В качестве альтернативы варфарину у ряда больных ИЛГ с повышенным риском кровотечений или не переносящих этот препарат могут использоваться низ¬ комолекулярные гепарины [15]. Наиболее доступными являются надропарин^"' (15 ООО UAXa 1C 2 раза в сутки в течение 1 мес, далее 7500 UAXa 1C 1-2 раза в сутки) и эноксапарин (1 мг/кг веса 2 раза в сутки, в последующем — 20-40 мг 1-2 раза в сутки).Важно помнить о возможности назначения дезагрегантов больным ИЛГ. Наиболее популярным препаратом из этой группы является ацетилсалициловая кислота, назначение которой не сопряжено с необходимостью лабораторного кон¬ троля, предпочтительно в специальной форме, покрытой кишечнорастворимой оболочкой [15].Сердечные гликозиды и инотропные препаратыАртериальная гипоксемия приводит к развитию стойкой тахикардии, трудно поддающей действию сердечных гликозидов, что осложняет адекватную оценку эффективности препаратов и повышает риск развития быстрой и неконтроли-
596 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯруемой гликозидной интоксикации [15]. Внутривенное назначение дигокс больных ИЛГ вызывает некоторое повышение сердечного выброса, а также і ственное уменьшение уровня норадреналина в крови. Однако данные о ном применении сердечных гликозидов отсутствуют.Добутамин у больных ИЛГ используется в терминальной стадии заболеї целью стабилизации их состояния [1].Л ДкурвтикиМочегонные препараты позволяют улучшить клиническое состояние ных ИЛГ и рекомендуются во всех случаях развития декомпенсации. [1,15, Отсутствие рандомизированных исследований оставляет за клиницистами выбора конкретного препарата. Дозы мочегонных препаратов должны аіїї і 'ітитроваться во избежание резкого падения объёма циркулирующей крови и жения системного АД. Применяются петлевые диуретики (фуросемид, кисжия| этакриновая), антагонист альдостерона — спиронолактон — по 25-150 мг под i тролем уровня калия в крови. При назначении диуретиков необходимо тщательа»! контролировать уровни электролитов крови, а также состояние функции почек.Простагландины — мощные эндогенные вазодилататоры, обладающие целым спектром дополнительных эффектов — антиагрегационным, антипролифератив- ным и цитопротективным, которые направлены на предотвращение ремодел»- рования лёгочных сосудов. У больных ИЛГ доказано нарушение продукции про¬ стациклина, снижение экспрессии простациклин синтазы в лёгочных артериях, уменьшение экскреции метаболитов простациклина с мочой, что является обо¬ снованием для использования простагландинов для лечения больных, хотя до сих пор не установлено, является ли нарушение продукции простациклина причиной или следствием ИЛГ [10, 27].Простагландин я простациклин*’ — это первые препараты, которые в 80-х годах начали использовать для проведения острых проб с целью определе¬ ния реактивности лёгочных сосудов и лечения больных ИЛГ [1, 15, 27]. Однако позднее выяснилось, что позитивный эффект длительного назначения проста¬ гландинов отмечается и у пациентов ИЛГ с отрицательной острой пробой. Такие больные демонстрировали значимое клиническое и гемодинамическое улучшение при длительном лечении простациклином^^, когда достигалось более существен¬ ное по сравнению с острой пробой снижение легочного сосудистого сопротив¬ ления. в нашей стране из этой группы препаратов доступным является только простагландин для внутривенного введения, который назначается курсами в течение 14-21 дней в суточной дозе 40-60 мкг с начальной скоростью инфузии5-10 нг/(кгхмин), постепенным увеличением дозы до 30 нг/(кгхмин) [27],За рубежом клиническое использование простациклина^ у больных ИЛГ свя¬ зано с синтезом его стабильных аналогов с различными фармакокинетическими особенностями, но сходными фармакодинамическими свойствами. Наибольший опыт в мире накоплен по эпопростенолу^ — форме внутривенного простациклина (простагландин Ij^), стабилизированного в буфере глицина (рН=10,5) с коротким периодом полужизни (около 5 мин) для внутривенного назначения с помощью помпы и постоянных катетеров (Hickman). Эпопростеиол^ показан больным ИЛГ с ИХ и IV функциональным классом (ВОЗ) для длительной терапии, так как увеличивает сердечный выброс и уменьшает лёгочное сосудистое сопротивление, а при длительном применении улучшает качество жизни больных, увеличивая толерантность к физическим нагрузкам [1, 25]. Илопрост — стабильный аналог простациклина для внутривенного применения, назначения peros и в аэрозольной форме для ингаляций. В Европе препарат рекомендован для лечения больных
ИДИОПАТИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 597ИЛГ с III функциональным классом (ВОЗ), в Австралии и Новой Зеландии — с III и IV функциональным классом (ВОЗ) [28].Трепростинил^ — трициклический бензидиновый аналог эпопростенола^ — используется внутривенно и подкожно, у больных ИЛГ обеспечивает существен¬ ное улучшение клинических симптомов и гемодинамических параметров, толе¬ рантности к физическим нагрузкам [29]. В 2002 г. трепростинил^ был одобрен Администрацией по контролю пищевых продуктов и лекарственных препаратов (США) для лечения больных ИЛГ II-IV функционального класса (ВОЗ).Берапрост^ — первый стабильный аналог простациклина^ для назначения per os — рекомендован для лечения больных ИЛГ в Японии и Южной Корее [30].Антагонисты рецепторов эндотелинаЭндотелин-1 (ЭТ-1) — это пептид эндотелиального происхождения, характери¬ зующийся мощными вазоконтрикторными и митогенными свойствами в отношении гладкомышечных клеток. ЭТ-1 связывается с двумя типами рецепторов — типа А (ЭТА), локализующимися на гладкомышечных клетках, и типа В (ЭТВ), локализую¬ щимися на эндотелиальных и гладкомышечных клетках. Активация ЭТА- и ЭТВ- рецепторов гладкомышечных клеток вызывает вазоконстрикторный и митогенный эффект. Стимуляция ЭТВ-рецепторов способствует клиренсу ЭТ-1 в лёгких, уве¬ личению продукции оксида азота и освобождению простациклина. Исследования экспрессии ЭТ-1 в лёгочной ткани подтверждают его роль в патогенезе ЛГ, однако не установлено, является ли повышенная продукция ЭТ-1 причиной или следствием ЛГ [10,11]. Активация системы эндотелина у больных ЛГ является обоснованием для использования антагонистов рецепторов эндотелина, блокирующих ЭТА- рецепторы или одновременно оба типа рецепторов — ЭТА и ЭТВ.Бозентан - первый препарат из класса антагонистов рецепторов эндотелина, блокирующий оба типа рецепторов и доказавший в рандомизированных исследо¬ ваниях способность улучшать толерантность к физическим нагрузкам, функцио¬ нальный класс, гемодинамические и ЭхоКГ-параметры у больных ИЛГ [1, 31, 32]. Бозентан считается препаратом выбора для больных с непереносимостью проста- ноидов. Рекомендуемая доза бозентана составляет 62,5-125 мг дважды в день. Из побочных эффектов важно отметить повышение трансаминаз, развитие анемии, в связи с чем необходим ежемесячный контроль общего и биохимического ана¬ лизов крови, появление периферических отёков вследствие задержки жидкости, у женщин, принимающих бозентан, необходима адекватная контрацепция с учё¬ том возможного тератогенного эффекта. Существует мнение о том, что антагони¬ сты рецепторов эндотелина могут вызвать тестикулярную атрофию и стерильность у мужчин. В настоящее время бозентан рекомендуется для лечения больных ИЛГ III-IV функционального класса (ВОЗ) в США, Канаде, странах Европы, с 2006 г. в России.За рубежом успешно внедрены в клиническую практику селективные антаго¬ нисты ЭТА-рецепторов — ситакзентан^ и амбризентан^, улучшающие толе¬ рантность к физическим нагрузкам, гемодинамические параметры, клинические исходы [33,34].Оксид азота и ингибиторы фосфодиэстеразы типа 5Оксид азота — мощный вазодилататор, селективно действующий на сосуды малого круга кровообращения [35, 36]. Эндогенный оксид азота образуется из L-аргинина при помощи кальций-зависимой NO-синтазы. Диффундируя через альвеолярную мембрану, оксид азота попадает в гладкомышечные клетки арте¬ рий и артериол, повышая уровень циклического гуанозин-монофосфата (цГМФ), который запускает каскад реакций, в конечном счёте приводящих к снижению тонуса гладкой мускулатуры сосудов. Затем оксид азота поступает в системный
Si miltI'1|1|Ш598 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯкровоток, где инактивируется путём связывания с оксигемоглобином и обра ния метгемоглобина и нитратов.Нарушение продукции оксида азота, безусловно, вовлекается в патогенез Иммуногистохимические исследования показали снижение экспрессии эндотеашг] альной NO-синтазы в клетках эндотелия больных ИЛГ, Оксид азота испол! для оценки реактивности лёгочных сосудов и выявления больных, отвечанми*1 на терапию вазодилататорами [36]. Острые пробы с ингаляционным оксидаш азота позволяют с точностью до 90% предсказать эффект антагонистов калы Описаны случаи эффективного и безопасного применения длительных ингаляця1 оксида азота до 9 мес и 1,5 лет у больных ИЛГ [18].Силденафил — мощный селективный ингибитор цГМФ-зависимой фосфода-! эстеразы (тип 5). Предотвращая деградацию цГМФ вызывает снижение лёгочного ' сосудистого сопротивления и перегрузки правого желудочка [1,37]. В 2005 г. сиж- денафила цитрат (ревацио^) в дозе 20 мг 3 раза в сутки одобрен Администрацией; по контролю качества продуктов питания и лекарственных средств (США) дм лечения больных ЛГ П-IV функционального класса (ВОЗ) с целью улучшешш переносимости физических нагрузок.Комбинированная терапияИспользование комбинации препаратов, воздействующих на различные пато¬ физиологические механизмы, при ИЛГ представляется рациональным подходо!*. Возможно одновременное назначение двух препаратов либо присоединение второго и третьего препаратов к предшествующей терапии, оказавшейся недо¬ статочно эффективной. У пациентов ИЛГ П и IV функционального класса (ВОЗ) в контролируемых исследованиях продемонстрирована эффективность комбини¬ рованной терапии бозентаном и эпопростенолом^, силденафилом и эпопростено- лом^, бозентаном и силденафилом [1, 38].ХИРУРГИЧЕСКИЕ МЕТОДЫПредсердная септостомияПредсердная септостомия — создание небольшой перфорации в межпредсерд¬ ной перегородке — позволяет снизить среднее давление в правом предсердии, разгрузить правый желудочек, увеличить преднагрузку левого желудочка и, таким образом, сердечный выброс у больных ИЛГ [1,39]. Это способствует уменьшению синкопе, повышению толерантности к физической нагрузке. Из-за риска воз¬ никновения жизнеопасной артериальной гипоксемии и связанного с процедурой увеличения смертности, предсердная септостомия используется при бесперспек¬ тивности медикаментозного лечения или как подготовительный этап перед транс¬ плантацией лёгких.у больных ИЛГ проводятся операции трансплантации одного или обоих лёгких, комплекса сердце-лёгкие [15, 41], В единственном проспективном неконтроли¬ руемом исследовании было показано, что трёхлетняя и пятилетняя выживаемость после проведённых трансплантаций одного или обоих лёгких, комплекса сердце- лёгкие у больных ЛГ, в том числе ИЛГ, составила 55 и 45% [40]. В большинстве центров предпочитают выполнять билатеральную трансплантацию лёгких в связи с меньшим числом послеоперационных осложнений.СПИСОК ЛИТЕРАТУРЫ 0
Глава 35 Лёгочная гипертензия при хронических респираторных заболеванияхЛёгочная гипертензия (ЛГ) и её прямое следствие — хроническое лёгочное сердце — являются частыми осложнениями хронических респираторных заболеваний. Согласно новой классификации ЛГ, принятой на Третьем всемирном симпозиуме по лёгочной артери¬ альной гипертензии, данные формы ЛГ относятся к группе «ЛГ, ассоциированных с заболеваниями лёгких и/или гипоксемией». С учётом того, что к этой же группе ЛГ приводят и внелёгочные заболевания, основным проявлением которых служит гиповентиля¬ ция, то более корректным является название «ЛГ при хронических респираторных заболеваниях».Клиническая классификация лёгочной гипертензии (Венеция, 2003 г.)• 1. Лёгочная артериальная гипертензия (ЛАГ):1.1. Идиопатическая (первичная) ЛАГ;1.2. Семейная ЛАГ;1.3. Ассоциированная с:- 1.3.1. системными заболеваниями соединительной ткани;- 1.3.2. врождёнными пороками сердца (системно-лёгочные шунты);- 1,3.3. портальной гипертензией;- 1,3.4. ВИЧ-инфекцией;- 1.3.5. лекарственными и токсическими воздействиями;- 1,3.6. другими состояниями (поражения щитовидной же¬ лезы, болезнь Гоше, обменные болезни, наследственная геморрагическая телеангиэктазия, гемоглобинопатии, мие¬ лопролиферативные болезни, спленэктомия);1.4. Ассоциированная со значительным поражением вен икапилляров:- 1.4.1. лёгочная веноокклюзионная болезнь;- 1.4.2. лёгочный капиллярный гемангиоматоз;1.5. Персистирующая ЛАГ новорождённых.• 2. ЛГ, ассоциированная с поражениями левых отделов сердца:2.1, нарушение наполнения левого желудочка;2.2. поражения клапанного аппарата сердца (митральныепороки).• 3. ЛГ, ассоциированная с заболеваниями лёгких и/или гипоксе¬ мией:
600 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ3.1. хроническая обструктивная болезнь лёгких; ё 3.2. интерстициальные заболевания лёгких;ОІЇ: нарушения дыхания во время сна;альвеолярная гиповентиляция;31*3.5. высокогорная ЛГ;3.6. неонатальные поражения лёгких.• 4. ЛГ вследствие хронических тромботических или эмболических заболей^! ний:4.1. тромбоэмболическая обструкция проксимальных лёгочных артерий;4.2. тромбоэмболическая обструкция дистального русла лёгочных артерий;4.3. нетромботические лёгочные эмболии (опухоли, паразитарные забоде- вания, инородные тела).• 5. Смешанные формы:саркоидоз. гистиоцитоз X, лимфангиолейомиоматоз, компрессия лёгочны» сосудов (аденопатия, опухоли, фиброзирующий медиастинит).Хронические респираторные заболевания, приводящие к развитию лёгочной гипертензии• обструктивные заболевания лёгких:хроническая обструктивная болезнь лёгких; муковисцидоз;бронхоэктатическая болезнь;❖ облитерирующий бронхиолит.• Интерстициальные заболевания лёгких (ИЗЛ):❖ ИЗЛ, ассоциированные с системными заболеваниями соединительной ткани (СЗСТ);❖ идиопатические интерстициальные пневмонии (ИИП):- идиопатический лёгочный фиброз;- неспецифическая интерстициальная пневмония;- другие формы ИИП;❖ саркоидоз;❖ гистиоцитоз X;❖ лимфангиолейомиоматоз;❖ другие формы ИЗЛ.• Альвеолярная гиповентиляция:❖ синдром «ожирения-гиповентиляции»;❖ кифосколиоз;❖ нейромышечные заболевания.• Нарушения дыхания во время сна:❖ синдром обструктивного апноэ во время сна (СОАС); центральное апноэ во время сна;❖ синдром «перекрёста» (сочетание ХОБЛ и СОАС).• Высокогорная ЛГ.• Неонатальные поражения лёгких.Критерием наличия ЛГ при хронических респираторных заболеваниях являет¬ ся повышение среднего давления в лёгочной артерии (Рра) в условиях покоя выше 20 мм рт.ст. (в норме данный показатель находится в пределах 9 -16 мм рт.ст.). Кроме ЛГ, очень распространённым понятием является согpulmonale — лёгочное сердце. Комитет экспертов ВОЗ предложил следующее определение; «Сог pulmonale - ...гипертрофия правого желудогка, являющаяся следствием заболеваний, нару- шающих функцию и структуру лёгких...^. Однако данное патологоанатомическое определение было дано около 40 лет назад, в настоящее время не совсем удобно
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ 601ДЛЯ использования в клинической практике, поэтому некоторые эксперты пред¬ лагают отожествлять понятия «лёгочная гипертензия» и <iCorpulmonale» и исполь¬ зовать такое определение: ^Согpulmonale — лёгочная артериальная гипертензия, являющаяся следствием заболеваний, нарушающих функцию и/или структуру лёгких; лёгочная артериальная гипертензия приводит к развитию гипертрофии и дилатации правого желудочка и со временем может привести к развитию право- желудочковой сердечной недостаточности».Лёгочная гипертензия у больных ХОБЛХОБЛ является одной из ведущих причин заболеваемости и смертности во всем мире. ХОБЛ определяют как заболевание, характеризующееся ограничением воз¬ душного потока, которое не полностью обратимо; ограничение воздушного потока обычно прогрессирует и связано с патологическим воспалительным ответом дыха¬ тельных путей на повреждающие частицы или газы. ЛГ являются прогностически неблагоприятными осложнениями ХОБЛ. В мультицентровом проспективном исследовании, проведённом в странах Европы, было показано, что лёгочное серд¬ це занимает второе место в структуре причин смертности больных ХОБЛ, уступая лишь дыхательной недостаточности.РАСПРОСТРАНЁННОСТЬ ЛГ ПРИ ХОБЛТочная распространённость ЛГ у больных ХОБЛ неизвестна, так как исследо¬ вания с использованием надёжных методов оценки давления в лёгочной артерии (катетеризация центральных вен) в большой выборке ХОБЛ никогда не проводи¬ лись. Согласно данным аутопсийных исследований, признаки гипертрофии право¬ го желудочка встречается у 40% всех больных, умерших от ХОБЛ. В клинических исследованиях, включавших относительно небольшое число больных, были полу¬ чены сходные данные: при использовании прямых методов оценки давления Рра выше 20 мм рт.ст. в покое было выявлено у 35% больных ХОБЛ тяжёлого течения. Распространённость ЛГ и лёгочного сердца зависит от степени тяжести функцио¬ нальных изменений заболевания, при значениях ОФВ^ ниже 600 мл частота развития лёгочного сердца приближается к 70%. Thabut и кол. оценивали лёгочную гемоди¬ намику у 251 больных ХОБЛ, являвшихся кандидатами для трансплантации лёгких или хирургической редукции лёгочного объёма (средний ОФВ^ 24+12%). Рра выше 25 мм рт.ст. было обнаружено у 50,2% больных, у большинства больных значения Рра находились в диапазоне 25-35 мм рт.ст. (рис. 35-1). В большинстве случаев ЛГ у больных ХОБЛ характеризуется как лёгкая и умеренная, в табл. 35-1 приводится сравнение гемодинамических параметров при идиопатической лёгочной гипертен¬ зии (ИЛГ) и вторичных формах ЛГ. Однако, при ХОБЛ может встречаться и тяжёлая ЛГ: в двух работах Рра более 40 мм рт.ст. было отмечено у 27 из 998 больных ХОБЛ (2%) и у 16 из 215 больных ХОБЛ (7%). Для всех больных ХОБЛ с выраженной ЛГ характерными функциональными особенностями являлись: значительное снижение диффузионной способности лёгких, тяжёлая гипоксемия без гиперкапнии и умерен¬ ное снижение ОФВ^ — около 50%,Согласно традиционным представлениям, больных ХОБЛ условно можно разделить на две большие группы: «синие отёчники» (бронхитический тип) и «розовые пыхтельщики» (эмфизематозный тип). Считалось, что развитие ЛГ характерно для «синих отёчников», однако недавние исследования показали неожиданно высокую частоту ЛГ у больных с эмфиземой. В исследовании Sharf и кол., включавшем 120 больных с тяжёлой эмфиземой (средние 0®Bj — 27% от должных; PaOj — 66 мм рт.ст,), доля больных с Рра>20 мм рт.ст. в покое соста¬ вила 91%.
ЩШШШМі;ц||602 НАРУШЕНИЯ ЛЁГОННОГО КРОВООБРАЩЕНИЯ30 40Рра (мм рт.ст.)Рис. 35-1. Распределение Рра у больных ХОБЛ [Thabut at al., 2005].Таблица 35-1. Сравнение функциональных показателей и параметров гемодинамики при различны* формах лёгочной гипертензииПараметрыИЛГХОБЛИЛФСОАСИсследованиеRich et al., 1987Weitzenbtum etal., 1981Weitzenbtum et al., 1983Chaouat et ai., 1996Число больных187623137Женщины/мужчины110/772/608/232/35Возраст, годы36+1555±858±16sailОФВ,, мл-1.17+0,391.66+0,651,83+0,79РаО^, мм рт.ст.-60+968+1264+9РаСОд, мм рт.сг.-45+635і544±5Рра, мм рт.ст.60±1526±б24±1126±6PAWP, мм рт.ст.8+48+27±48+3Си, л/(минхм^}2,27+0,903,8+1,13,4+0,82,8+0,6ВУР1, мм рт.ст.Дминхм^)26+144,8+1,45,0±3,13+2,0ИЛГСОАС - синдром обструктивного апноэ во время сна, Р АУР - давление заклинивания в лёгочной артерии, Си - сердечный индекс, КУРІ - индекс лёгочного сосудистого сопротивления.ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ЛЁГОЧНОЙ ГИПЕРТЕНЗИИ ДЛЯ ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНЬЮ ЛЁГКИХЛГ является одним из важнейших факторов прогноза больных ХОБЛ. В много¬ численных исследованиях была показана прогностическая значимость таких фак¬ торов, как дисфункция правого желудочка (ПЖ), Рра и лёгочное сосудистое сопро-
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ603гаImSI■| рра >20 мм рт.ст. La^nd <40мм_рт.ст.NSРра >40 мм рт.ст.12 24 36 48 60 72 84 96 108 120 МесяцыРис. 35-2. Выживаемость больных ХОБЛ в зависимости от тяжести лёгочной гипертензии [Chaouat et al., 2005],тивление (PVR). В исследовании Burrows и кол., в ходе семилетнего наблюдения за 50 больными ХОБЛ было показано, что PVR являлось одним из наиболее сильных предикторов выживаемости больных, ни один из пациентов с уровнем PVR выше 550 дин X с X см® не выжил более трёх лет. По совокупным данным, полученным на основании нескольких долгосрочных исследований, летальность больных ХОБЛ тесно связана со степенью ЛГ: при уровне Рра 20-30 мм рт.ст. четырёх-пятилетняя выживаемость пациентов составляет 70-90%, при значениях Рра 30-50 мм рт.ст. — 30%. а при тяжёлой ЛГ (Рра более 50 мм рт.ст.) пятилетняя выживаемость больных практически равна нулю. Близкие данные были получены и в недавно опублико¬ ванном исследовании Страсбургской группы: авторы сравнивали выживаемость больных ХОБЛ с Рра <20 мм рт.ст., 20-40 мм рт.ст. и >40 мм рт.ст., наибольшая летальность была отмечена у больных с выраженной ЛГ (р <0,01; рис. 35-2).Уровень давления в лёгочной артерии (ЛА) является не только фактором про¬ гноза, но и предиктором госпитализации больных ХОБЛ. В исследовании Kessler и кол., включавшем 64 больных ХОБЛ, повышение Рра в покое более 18 мм рт.ст. оказалось наиболее сильным независимым фактором риска госпитализации боль¬ ных (относительный риск равен 2.0; 95% ДИ 1,3-3,1; р=0,001; рис. 35-3). Данная ассоциация указывает на возможность выявления группы наиболее уязвимыхРис. 35-3. Лёгочная гипертензия — предиетор госпитализации больных ХОБЛ [Kessler R. et al,, 1999].
604 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯбольных, нуждающихся в проведении агрессивной терапии, т.е. активная коррв~ ция ЛГ у больных ХОБЛ может значительно улучшить их функциональных rraijr и снизить частоту госпитализации в стационар.МЕХАНИЗМЫ ЛЁГОЧНОЙ ГИПЕРТЕНЗИИ ЛРИ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЁГКИХСистема малого круга кровообращения характеризуется малым сопротивж* нием и высокой податливостью (комплайенсом), поэтому для какого-нибу» значимого повышения Рра у здорового индивидуума необходимо повышение сердечного выброса не менее чем в 2,5 раза. Значительное повышение давления в артериях малого круга происходит только при развитии выраженных изменеим лёгочных сосудов. У больных ХОБЛ лёгкой-средней тяжести Рра и PVR могут быть в пределах нормальных значений или слегка повышены в покое, однако обычно увеличиваются во время физической нагрузки. По мере прогрессировани* заболевания Рра и PVR становятся повышенными и в покое и ещё более возрас¬ тают при физической нагрузке.Причиной развития и становления ЛГ у больных ХОБЛ, как правило, является не один фактор, а комбинация нескольких факторов, оказывающих активное или пассивное влияние на лёгочную гемодинамику (рис. 35-4).Основной причиной ЛГ является артериальная гипоксемия. Впервые роль альвеолярной гипоксии в развитии лёгочной вазоконстрикции была показана в 1946 г. Von Euler и Lijestrand. В нескольких исследованиях была доказана обратная зависимость между тяжестью ЛГ и степенью артериальной гипоксемии (рис. 35-5), кроме того, прогрессирование гипоксемии у больных с хроническими заболе¬ ваниями лёгких почти всегда сопровождается нарастанием ЛГ. Альвеолярная гипоксия вызывает лёгочную вазоконстрикцию посредством прямых и непрямых механизмов. Прямой эффект гипоксии связан с развитием деполяризации гладко¬ мышечных клеток сосудов и их сокращением. В настоящее время доказано, что к деполяризации гладкомышечных клеток и лёгочной вазоконстрикции приводит изменение функции калиевых каналов клеточных мембран. Непрямым механиз¬ мом гипоксической лёгочной вазоконстрикции является воздействие эндогенных медиаторов, таких, как лейкотриены, гистамин, серотонин, ангиотензин П и кате¬ холамины, на стенку сосудов. Все данные медиаторы относятся к вазоконстрикто¬ рам, и их продукция значительно повышается в условиях гипоксии.Развитие легочной гипертензии Рис. 35-4. Патогенез лёгочной гипертензии при ХОБЛ.
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ605PaOj, мм рт.ст.80'оё. 60'S2Ci 40' о.О.20'Оу = 0,72х-1.4 г = 0,48 р < 0,01«* t• « Л15 30 45 60 75 РаСОг, мм рт.ст.Рис. 35-5. Корреляция между Рра и Р 0„ и Р С0„ [Naeije & McNee, 2003].Другие нарушения газообмена, такие, как гиперкапния (повышение PgCOj) (см. рис. 35-5) и ацидоз также приводят к развитию ЛГ, предполагается, что в основе повышения давления в ЛА в данном случае лежит не прямая вазоконстрик¬ ция, а повышение сердечного выброса.В последние годы активно обсуждается роль дисфункции эндотелия лёгоч¬ ных сосудов при ЛГ различного генеза. Хроническая гипоксемия приводит к повреждению сосудистого эндотелия, что сопровождается снижением продукции эндогенных релаксирующих факторов, в том числе простациклина (PGI^), проста¬ гландина Е2 (PGE^) и оксида азота (N0). Особое значение в генезе ЛГ у больных ХОБЛ придаётся недостаточности высвобождения N0. Синтез эндогенного N0 регулируется NO-синтазой, которая постоянно экспрессируется на эндотелиаль¬ ных клетках, Гипоксемия приводит к нарушению продукции и высвобождению N0. Дисфункция эндотелия лёгочных сосудов у больных ХОБЛ может быть связана не только с хронической гипоксемией, но и с воспалением — Zieche и кол. показали, что хроническое воспаление приводит к значительному снижению экспрессии NO-синтазы III и, следовательно, продукции N0. В адвентиции малых мышечных артерий у больных ХОБЛ лёгкой тяжести и у курильщиков обнаружи¬ вают инфильтрацию CD8+-лимфоцитами, выраженность воспалительной реакции коррелирует с утолщением интимы и эндотелиальной дисфункцией.Развитие хронической ЛГ у больных ХОБЛ практически всегда ассоциировано с развитием структурных изменений сосудистого русла — ремоделировани¬ ем лёгочных сосудов, характеризующимся пролиферацией медии, миграцией и пролиферацией гладкомышечных клеток в интиму, фиброэластозом интимы, утолщением адвентиции (рис. 35-6, см. также цветную вклейку). Однако ремоде¬ лирование лёгочных артерий встречается не только при далеко зашедших стадиях ХОБЛ, но и у больных на ранних этапах развития заболевания. К другим струк¬ турным факторам, ведущим к развитию ЛГ при ХОБЛ, относятся сокращение площади капиллярного русла, сопровождающее деструкцию паренхимы лёг¬ ких, что характерно для эмфиземы; компрессия лёгочных сосудов в результате выраженной лёгочной гиперинфляции (эффект создания зон Веста II), что также наблюдается при тяжёлой эмфиземе.Полицитемия, являющаяся следствием хронической артериальной гипок¬ семии, также является независимым от гипоксемии фактором, приводящим к повышению Рра и PVR у больных ХОБЛ. Полицитемия приводит к повышению вязкости крови, кроме того, она является фактором риска развития тромбо¬ эмболий, что также приводит к повышению Рра и PVR. Еще одним механиз-
:вІїів606 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯРис. 35'6. Ветвь лёгочной артерии (арге- риола) у больного ХОБЛ: гиперплаэш иктимы, умеренно выраженная гипертро¬ фия медии. Окраска гематоксилином ш эозином X 200.мом повышения PVR при полицитемии является её ингибиторное действие на эндотелий-зависимую релаксацию сосудов в ответ на ацетилхолин. Данный эффект связан со способностью высоких концентраций гемоглобина к связыва¬ нию N0 в лёгочном кровотоке, что, в свою очередь, усиливает гипоксическую лёгочную вазоконстрикцию.Необходимо обратить внимание ещё на одну причину ЛГ у больных с обструк¬ тивными заболеваниями дыхательных путей — высокая амплитуда отрица¬ тельного инспираторного внутригрудного давления имеет выраженные гемодинамические последствия, в том числе и повышение давления в ЛА.Лёгочная гипертензия при интерстициальных заболеваниях лёгкихИДИОПАТИЧЕСКИЙ ЛЁГОЧНЫЙ ФИБРОЗИдиопатический лёгочный фиброз (ИЛФ) является одним из наиболее часто встречающихся интерстициальных заболеваний лёгких. ИЛФ входит в группу идиопатических интерстициальных пневмоний - клинико-патологических форм ИЗЛ, характеризующихся многими сходными чертами (неизвестная природа болезней, близкие клинические и рентгенологические признаки), однако имею¬ щих достаточное количество различий (в первую очередь морфологических; раз¬ ные подходы к терапии, различный прогноз). Морфологическая картина при ИЛФ соответствует гистологическому паттерну обычной интерстициальной пневмонии. Средняя выживаемость больных ИЛФ составляет около 3 лет. Наиболее частой причиной смерти больных является дыхательная недостаточность как естествен¬ ное следствие прогрессирования заболевания, другими причинами смерти ИЛФ являются сердечная недостаточность, лёгочное сердце, бронхогенная карцинома, ишемическая болезнь сердца и другие события.ЛГ является довольно частым осложнением у больных с ИЛФ. По данным ряда исследований, ЛГ встречается у 32-85% больных ИЛФ. Такой разброс встречае¬ мости ЛГ отражает различные стадии заболевания ИЛФ, на более поздних этапах ЛГ встречается чаще. Данное положение подтверждают данные из исследований, в которых проводилось серийное измерение давления в ЛА у больных ИЛФ; Nathan и кол. при первом обследовании больных выявили ЛГ у 33% больных ИЛФ. а при втором измерении у этой же группы больных, непосредственно перед транс¬ плантацией лёгких, " у 85% больных. Как и у больных ХОБЛ, ЛГ при ИЛФ чаще всего лёгкая или умеренная (рис. 35-7), тяжёлые формы встречаются нечасто (см. табл. 35-1).
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ60710.0020,00 30.00 40.00 50.00 Рра (мм рт.ст.)Рис. 35-7. Распределение Рра у больных ИЛФ [Leítieri et al.. 2005].У больных ИЛФ с ЛГ, как правило, выяв¬ ляют более тяжёлые нарушения газообме¬ на, снижение диффузионной способности лёгких и снижение толерантности к физи¬ ческим нагрузкам, чем у больных ИЛФ без ЛГ. При этом в большинстве проведённых работ не было показано корреляции между Рра и выраженностью рестриктивных изме¬ нений (т.е. величиной лёгочных объёмов),Л Г является неблагоприятным прогности¬ ческим фактором у больных ИЛФ, По дан¬ ным исследования Lettieri и кол., годичная летальность больных ИЛФ с ЛГ составляла 28%, а у больных ИЛФ без ЛГ — 5,5%(р=0,002). В исследовании группы из кли¬ ники Mayo медиана выживаемости больных с Рра >50 мм рт.ст. (по данным ЭхоКГ) составляла 0,7 лет, а у больных с Рра менее 50 мм рт.ст. — 4 года.Морфологические изменения сосудов при ЛГ у больных ИЛФ включают измене¬ ния интимы и медии, похожие на изменения при ХОБЛ, Однако при ИЛФ интималь- ные изменения могут приводить к ацелюллярному фиброзу и полной облитерации просвета лёгочных сосудов (рис. 35-8, см. также цветную вклейку). Деструкция лёгочной паренхимы, сокращение площади капиллярного русла и фиброз сосудов являются важнейшими причинами развития ЛГ при ИЛФ. Плотность сосудистой сети значительно снижена в зонах лёгочного фиброза, а маркёры эндотелиаль¬ ных клеток практически полностью отсутствуют в фибробласгических фокусах, С другой стороны, при ИЛФ наблюдается не только процесс облитерации сосудов, но и образование новых сосудов — ангиогенез. Но морфология вновь сформиро¬ вавшихся сосудов заметно отличается от нормальных сосудов — полностью отсут¬ ствует эластиновый слой, что приводит к снижению комплайенса сосудов и вносит свой вклад в развитие ЛГ.Как и при других заболеваниях лёгких, у больных ИЛФ с ЛГ показана уме¬ ренная корреляция между показателями Рра и РаО,. Однако развитие ЛГ у ряда больных ИЛФ без гипоксемии, отсутствие значимого снижения давления в ЛА во время кислородотерапии и морфологическая картина ремоделирования лёгочных сосудов свидетельствуют о наличии других причин ЛГ при ИЛФ. У больных ИЛФРис. 35-8. Фиброз интимы сосуда с полной облитерацией просвета у боль¬ ного с ИЛФ.
ЙІШ І&:608 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯобнаружена повышенная экспрессия эндотелина в лёгких, причём экспрессия суніе- ственно выше у больных с л г. Кроме того, уровни эндотелина-1 в плазме кр(»и j больных с ИЗЛ значительно повышены и коррелируют с показателями Рра. Таюш образом, в генезе ЛГ при ИЛФ большую роль играет дисфункция эндотелиальны» клеток, что и объясняет некоторую диссоциацию между выраженностью фиброза и ЛГ. Возможными профибротическими цитокинами/факторами роста, участвуж>- щими в ремоделировании сосудов при ИЛФ, являются PDGF и TGF-p,ИНТЕРСТИЦИАЛЬНЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ, АССОЦИИРОВАННЫЕ С СИСТЕМНЫМИ ЗАБОЛЕВАНИЯМИ СОЕДИНИТЕЛЬНОИ ТКАНИИЗЛ являются частой манифестацией поражения лёгких при системной скле¬ родермии, ревматоидном артрите и других системных заболеваниях соединитель¬ ной ткани (СЗСТ). Типичными проявлениями ИЗЛ при СЗСТ является одышка при физической нагрузке и медленное ухудшение функциональных лёгочных показателей на протяжении многих лет. Быстрое утяжеление симптомов, сниже¬ ние и появление гипоксемии может возвещать о появлении ЛГ. По данным анализа данных 619 больных ССД, частота развития Л Г возрастает по мере нарас¬ тания рестриктивных нарушений. Среди больных с лёгкой рестрикцией [обща* ёмкость лёгких 65-79%] 22% пациентов имели систолическое давление в лёгоч¬ ной артерии выше 45 мм рт.ст., в то же время у больных с умеренной рестрикцией (ОЕЛ 50-64%) ЛГ была выявлена у 30% пациентов и при тяжёлой рестрикции (ОЕЛ менее 50%) — у 47% пациентов. Выживаемость больных системной склеро¬ дермией с ЛГ была значительно хуже, чем у больных без ЛГ, и сравнима с выжи¬ ваемостью больных ИЛАГ,САРКОИДОЗ, ГИСТИОЦИТОЗ X и ЛИМФАНГИОЛЕЙОМИОМАТОЗНесмотря на то что саркоидоз, гистиоцитоз X и лимфангиолейомиоматоз (ЛАМ) относятся к группе ИЗЛ, в новой классификации ЛГ они выделены в отдельную группу «Смешанные формы ЛГ», так как при данных заболеваниях происходит непосредственное вовлечение в патологический процесс лёгочных сосудов, и поэтому нередко встречаются тяжёлые формы ЛГ.Активное гранулематозное воспаление при саркоидозе довольно часто затраги¬ вает артерии и вены. Степень поражения сосудов при саркоидозе связана с вьфа- женностью изменений лёгочной паренхимы, что проявляется ассоциацией ЛГ с выраженными рестриктивными и рентгенологическими изменениями. Однако при саркоидозе встречаются тяжёлые формы ЛГ без выраженного фиброза парен¬ химы лёгких, Nîmes и кол. представили описание 22 больных саркоидозом с ЛГ.15 из них имели IV стадию саркоидоза по данным рентгенографии (выраженный лёгочный фиброз), а у 7 оставшихся больных при среднем Рра 52 мм рт.ст. лёгоч¬ ные объёмы были относительно сохранены (средняя ОЕЛ 84%). У всех больных саркоидозом с ЛГ отмечено выраженное снижение Ра02 и Как и при других хронических респираторных заболеваниях, ЛГ у больных саркоидозом приводит к снижению физической толерантности больных и более высокой летальностьи. Среди больных с саркоидозом, находящихся в листе ожидания трансплантации лёгких, Рра более 25 мм рт.ст. имели 74% больных и Рра более 40 мм рт.ст. — 36% больных. У больных — потенциальных реципиентов, умерших от саркоидоза, Рра составляло 41 мм рт.ст., у выживших — 32 мм рт.ст., при этом две группы больных исходно не отличались между собой по показателям ЖЁЛ и ОФВ^.При гистиоцитозе X описана выраженная пролиферативная воспалительная васкулопатия, в патологический процесс вовлекаются и артерии и вены. Fartoukh и кол. описали 21 больного с гистиоцитозом X, ожидавшего трансплантацию лёгких, все больные имели выраженную ЛГ (среднее Рра 59 мм рт.ст.). Несмотря на значи¬ тельные изменения лёгочной паренхимы у больных, не было отмечено корреля¬ ции между Рра и функциональными параметрами. Кроме того, ремоделирование
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ 609лёгочных сосудов наблюдалось и в регионах лёгких с относительно сохранными g альвеолами. ЩПри ЛАМ патогномоничным морфологическим признаком является пролифе- рация гладкомышечных клеток вокруг бронховаскулярных структур, в том числе и лёгочных артерий. Тяжёлые формы ЛГ встречаются нечасто. Изменение сердечно¬ сосудистого ответа в ответ на физическую нагрузку у больных ЛАМ свидетельству¬ ет в пользу вовлечения в патологический процесс лёгочных сосудов.Лёгочная гипертензия при расстройствах дыхания во время снаЭпизодическое, но значительное повышение давления в лёгочной артерии про¬ исходит во время ночных эпизодов апноэ у больных с СОАС, особенно во время REM-фазы сна. Считается, что такая реакции лёгочных сосудов связана с выражен¬ ной гипоксемией, однако большой вклад в развитие ЛГ во время эпизодов апноэ могуг вносить и другие факторы, например высокая амплитуда отрицательного внутригрудного давления, следствием которого может быть повышение венозного возврата и постнагрузки на левый желудочек (ЛЖ). Распространённость ЛГ (Рра более 20 мм рт.ст.) у больных с СОАС составляет около 20%. В большинстве слу¬ чаев ЛГ при СОАС является лёгкой или умеренной, и Рра находится в пределах 25-30 мм рт.ст. (см. табл. 35-1).Несмотря на то что в экспериментальных моделях на животных было под¬ тверждено, что интермиттируюш;ая гипоксемия приводит к развитию ЛГ, дока¬ зательств существования такого механизма ЛГ у человека пока не получено.В нескольких исследованиях показано, что индекс массы тела и тяжесть ночных десатураций больных СОАС имеют более сильную взаимосвязь с ЛГ, чем индекс апноэ-гипопноэ. У больных СОАС с ЛГ, как правило, присутствуют дневные нару¬ шения функциональных лёгочных параметров и газообмена (снижение ОФВ^, жизненной ёмкости лёгких, PaOj, повышение PaCOj). Возможно, это связано с тем, что в больщинстве проведённых исследований из группы больных СОАС не исключали больных с сопутствующими заболеваниями, такими, как ХОБЛ (син¬ дром перекреста) и синдром ожирения-гиповентиляции (СОГ) — два состояния, которые могут быть независимой причиной ЛГ.В исследовании Страсбургской группы проведено сравнение показателей гемо¬ динамики у больных СОАС и СОГ. В группе, состоявшей из 181 больного с «чистым» тяжёлым СОАС (средний индекс апноэ-гипопноэ 73/ч), среднее Рра составило 15±5 мм рт.ст., и лишь у 9% пациентов Рра было более 20 мм рт.ст,В то же время у больных СОГ (индекс массы тела более 30 кг/м^ и РаСОз более 45 мм рт.ст.) среднее Рра составило 23±10 мм рт.ст., и 59% пациентов имели Рра более 20 мм рт.ст. Нарушение функции внешнего дыхания и газообмена в днев¬ ное время являются наиболее вероятной причиной ремоделирования лёгочных сосудов. Дневная ЛГ у больньпс СОАС ассоциирована с повышенным прессорным ответом на гипоксию, а тип изменений взаимоотношений «давление-поток«> сви¬ детельствует в пользу развития сосудистого ремоделирования.Ещё одним сопутствующим заболеванием, которое может быть причиной раз¬ вития ЛГ у больных СОАС, является дисфункция ЛЖ. СОАС является признанным фактором риска системной артериальной гипертензии, которая часто ассоции¬ рована с диастолической дисфункцией (ДД) ЛЖ, кроме того, сам по себе СОАС является независимым фактором риска ДД ЛЖ. Arias и кол. выявили ЭхоКГ при¬ знаки ДД ЛЖ у 9 из 10 больных СОАС с ЛГ, не имевших других факторов риска сердечно-сосудистых заболеваний, в то время как у больных СОАС без ЛГ ДД ЛЖ была выявлена у 4 из 13 пациентов. Давление заклинивания лёгочной артерии довольно часто повышено у больных СОАС с ЛГ и имеет прямую корреляцию
61 о НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯС Рра. Поэтому, несмотря на то что лёгкая ЛГ относительно часто встречаете« у больных СОАС, наиболее вероятными причинами такой ЛГ являются дневные нарушения функции лёгких и газообмена, а также ДД ЛЖ.Обследование больных с лёгочной гипертензиейКЛИНИЧЕСКОЕ ОБСЛЕДОВАНИЕКлинические признаки и симптомы ЛГ у больных с хроническими респиратор¬ ными заболеваниями характеризуются довольно низкой чувствительностью, что связано с картиной основного заболевания. Например, прогрессирование одышкм при физической нагрузке может быть как следствием нарастания бронхиальной обструкции и гиперинфляции, так и снижения транспорта кислорода вследствие нарушения функции правого желудочка. Расширение юг}шярных вен и гепато- мегалия могут быть как отражением правожелудочковой недостаточности, так и следствием лёгочной гиперинфляции, которая затрудняет венозный возврат к сердцу и вызывает смещение печени вниз. Кроме того, лёгочная гиперинфляция значительно затрудняет аускультацию сердца как вследствие ухудшения акустиче¬ ской проводимости, так и из-за ротации сердца кзади.Периферические отёки являются классическим признаком сог pulmonale, однако у больных ХОБЛ часто возникают вследствие других причин: гипоальбуминемии, гиперкапнии, активации системы ренин-ангиотензин-альдостерон.Возможными аускультативными находками при ЛГ у больных ХОБЛ могут быть акцент пульмонального компонента второго тона, клик лёгочного выброса, расщепление второго тона, шум недостаточности лёгочного клапана (высокото- нальный, decrescendo, голодиастолический) и шум трикуспидальной недостаточ¬ ности (систолический decrescendo или голосистолический), интенсивность обоих шумов усиливается во время вдоха.у больных с тяжёлой ЛГ возможно изменение пульса — ослабление и ускоре¬ ние вследствие низкого сердечного выброса и появление парадоксального пульса (снижение систолического АД более 10 мм рт.ст. во время фазы вдоха). У терми¬ нальных больных ХОБЛ с ЛГ могут наблюдаться классические признаки правоже¬ лудочковой недостаточности: гепатомегалия, периферические отёки, асцит.РЕНТГЕНОЛОГИЧЕСКИЕ МЕТОДЫОдним из наиболее надёжных рентгенологических признаков ЛГ у больных ХОБЛ является увеличение диаметра правой нисходящей лёгочной артерии более16 мм (на прямом снимке). В исследовании Matthay и кол. было показано, что данный признак присутствовал у 43 из 48 больных ХОБЛ с ЛГ. Увеличение раз¬ меров корней лёгкого и периферическая олигоэмия также являются признаками Л Г. Другими признаками Л Г при ХОБЛ могут быть кардиомегалия, увеличение кардиоторакального отношения более 0,5, исчезновение ретростернального про¬ странства (на боковом снимке), однако данные признаки обнаруживают достаточ¬ но редко, в основном при выраженной ЛГ.КТ лёгких позволяет с высокой точностью измерять диаметр ствола ЛА. Его расширение более 29 мм является хорошим предиктором ЛГ при паренхиматоз¬ ных заболеваниях лёгких, чувствительность и специфичность данного признака составляет 84 и 75%. Комбинация двух признаков — расширение ствола ЛА и повышение соотношения сегментарная артерия/бронх более 1 — повышают специфичность КТ-признаков наличия ЛГ до 100%.ЭЛЕКТРОКАРДИОГРАФИЯЭКГ-признаки ЛГ при ХОБЛ обычно не имеют такого значения, как при других формах ЛГ, что связано с относительно невысоким повышением Рра и влиянием
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ 011лёгочной гиперинфляции на позиционные изменения сердца- К основным крите¬ риям ЛГ по данным ЭКГ относятся:• поворот электрической оси сердца более НО” (при отсутствии блокады пра¬ вой ножки пучка Шса);• R<S в отведении Vg:• амплитуда зубца Р более 0,20 мВ в отведениях II, III, aVF и поворот электри¬ ческой оси зубца Р более 90°;• блокада (чаще неполная) правой ножки пучка Гиса;• признак• признак• низкий вольтаж QRS.Некоторые из данных признаков могут иметь важное прогностическое зна¬ чение. В исследовании Incalzi и кол., в котором проводилось наблюдение за 263 больными ХОБЛ в течение 13 лет, было показано, что такие ЭКГ-признаки как перегрузка правого предсердия и признак S¡Sj¡Sj¡j являются сильными пре¬ дикторами летальности больных (ОР 1,58; 95% ДИ 1,15-2,18 и ОР 1,81; 95% ДИ 1,22-2,69, соответсгвенно).ЭХОКАРДИОГРАФИЯЭхоКГ является одним из наиболее информативных неинвазивных методов оценки давления в лёгочной артерии, кроме того, ЭхоКГ позволяет оценить размеры камер и толщину стенок сердца, сократительную и насосную функцию миокарда, динамику и форму внутрисердечных потоков. Лёгочная гиперинфля¬ ция, являющаяся постоянным спутником больных ХОБЛ, является фактором, затрудняющим чёткую визуализацию структур сердца и суживающим «окно» ЭхоКГ. Используя М-режим, можно говорить о ЛГ при наличии таких признаков как: замедление открытия клапана лёгочной артерии, его средне-систолическое закрытие и поЕыщение соотношения времени выброса правого желудочка к обще¬ му времени выброса.Двумерная ЭхоКГ позволяет судить о выраженности гипертрофии ПЖ, при толщине свободной стенки ПЖ более 10 мм говорят о его значительной гипер¬ трофии, что обычно встречается у больных с хроническим cor pulmonale (в норме данный показатель меньше 4 мм, при острой ЛГ возможно увеличение толщины стенки ПЖ до 6-8 мм), О дилатации ПЖ лучше всего судить по увеличению отношения площади ПЖ к площади левого желудочка (предпочтительнее из апи¬ кальной 4-камерной позиции), при величине данного отношения 0,6-1,0 говорят о лёгкой дилатации ПЖ, при величине более 1,0 — о выраженной дилатации. Двумерная ЭхоКГ позволяет оценить кинетику межжелудочковой перегородки — парадоксальное систолическое движение при выраженной ЛГ. что, наряду со сни¬ жением лёгочного венозного притока, приводит к нарушение изометрического расслабления левого желудочка.При помощи допплер-ЭхоКГ можно измерить Рра, для чего оценивается поток через клапан лёгочной артерии, обычно используется формула, предложенная Kitabatake и кол.:LgPpa = -2,8х(АТ/ЕТ) -ь 2,4,где АТ — время ускорения потока в выносящем тракте правого желудочка, ЕТ — время выброса (или время изгнания крови из правого желудочка).Величина Рра, полученная при помощи данного метода, у больных ХОБЛ хорошо коррелирует с данными инвазивного обследования (R = -0,82; р <0,001), а возможность получения надёжного сигнала с клапана ЛА во время импульсно¬ волновой ДопплерКГ превышает 90%.
612 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯОпределение максимального систолического давления в лёгочной артерж (PAPs) проводится при помощи постоянно-волнового Допплера, по скоросш струи трикуспидальной регургитации (модифицированное уравнение Bernoulli);PAPs=4xVmax^+RAP.где Vmax — скорость потока трикуспидальной регургитации, RAP — давление s правом предсердии.Визуализация транстрикуспидального потока у больных ХОБЛ более сложна по сравнению с транспульмональным потоком, в ранних исследованиях возможность определения PAPs с помощью данного метода при ХОБЛ составляла всего 30%, однако в настоящее время благодаря более современной технике измерение транс¬ трикуспидального градиента можно выполнить более чем у 75% больных ХОБЛ. Корреляция между PAPs, измеренным с помощью постоянно-волнового Допплера и прямых методов, у больных ХОБЛ в среднем составляет 0,7, однако в абсолют¬ ных цифрах ошибка обычно составляет 5-9 мм рт.ст., причём чаще неинвазивный метод занижает истинные цифры PAPs.Давление в правом предсердии (RAP) можно оценить по величине инспиратор¬ ного коллапса нижней полой вены (НПВ) по методу, предложенному Kirshir и кол.: RAP=20 мм рт.ст. - при экспираторном диаметре НПВ >2 см и инспираторном коллапсе <50%; RAP=10 мм рт.ст. — при экспираторном диаметре НПВ <2 см и инспираторном коллапсе <50%; RAP=5 мм рт.ст. — при экспираторном диаметре НПВ <2 см и инспираторном коллапсе >50%. Наиболее простым методом оценки RAP является клинический метод — анализ пульсации яремных вен.И, наконец, большой интерес представляет индекс Tei — индекс оценки гло¬ бальной функции ПЖ, который оценивается с помощью пульсового Допплера как отношение суммы времени систолического изоволюмического сокращения ПЖ и времени диастолического изоволюмического расслабления ПЖ к времени выбро¬ са ПЖ. На определение данного индекса не оказывают существенное значение ни тахикардия, ни наличие/отсутствие трикуспидальной регургитации, ни выражен¬ ность дилатации ПЖ, по предварительным данным индекс Tei может быть вычис¬ лен у 99% больных ХОБЛ. В исследовании Burgess и кол., в котором проводилось наблюдение за 87 больными ХОБЛ в течение 15,5 мес, было показано, что индекс Tei является хорошим прогностическим фактором: умершие и выжившие больные ХОБЛ достоверно различались по данному параметру (0,58±0,24 и 0,45±0,21 соот¬ ветственно).ттт-?тнтш томографияМРТ является относительно новым методом диагностики ЛГ. МРТ позволяет достаточно точно оценить толщину стенки и объём полости ПЖ, фракцию выбро¬ са ПЖ. По данным Kruger и кол., диаметр правой ЛА, измеренной при МРТ. более 28 мм является высокоспецифичным признаком ЛГ. Также показана высокая кор¬ реляция (R=0,89) МРТ-индекса гипертрофии ПЖ и Рра у больных ХОБЛ. Однако метод МРТ довольно дорог и доступен лишь в специализированных центрах.РАДИОНУКЛИДНАЯ ВЕНТРИКУЛОГРАФИЯРадионуклидная вентрикулография (РВГ) является неинвазивным, хорошо воспроизводимым методом оценки фракции выброса правого желудочка (ФВ ПЖ). Несмотря на то что РВГ в настоящее время рассматривается как «идеальный метод» для оценки ФВ ПЖ, само значение показателя ФВ ПЖ при ЛГ довольно дискутабельно. ФВ ПЖ считается сниженной при значениях менее 40-45%, одна¬ ко данный показатель не является хорошим индексом функции ПЖ, так как очень сильно зависим от постнагрузки, т.е. снижается при повышении Рра и PVR. Таким образом, наблюдающееся снижение ФБ ПЖ у больных с ЛГ является отражением повышения постнагрузки, а не «истинным» маркёром дисфункции ПЖ.
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ 613КАТЕТЕРИЗАЦИЯ ЛЁГОЧНОЙ АРТЕРИИКатетеризация правых отделов сердца и лёгочной артерии является методом «золотого стандарта» при постановке диагноза ЛГ. «Прямой» метод позволяет с наибольшей точностью измерить давление в правом предсердии и ПЖ, в ЛА, окклюзионное давление в ЛА, рассчитать сердечный выброс (чаще используется метод термодилюции, реже метод Фика), PVR, определить уровень оксигенации смешанной венозной крови (PvO^ и SvO^). Данный метод позволяет оценить тяжесть ЛГ и дисфункции ПЖ, а также используется для оценки эффективности вазодилататоров (обычно острые пробы). В силу достаточной инвазивности про¬ цедуры, катетеризация лёгочной артерии больным ХОБЛ с ЛГ проводится только по определённым показаниям: тяжёлая ЛГ (Рра по данным неинвазивных методов более 45 мм рт.ст.), частые эпизоды недостаточности ПЖ, тяжёлое обострение ХОБЛ, сопровождающееся гипотонией и шоком, а также предоперационная под¬ готовка больных к оперативному уменьшению лёгочного объёма или трансплан¬ тации лёгких.В настоящее время появились специальные катетеры, оснащённые микрома¬ нометрами, не требующие коррекции «уровня нуля» внешнего трансдьюсера и позволяющие проводить постоянный мониторинг давления в ЛГ у больных в тече¬ ние суток. Данный метод был недавно опробован у больных ХОБЛ с ЛГ, оказалось, что физические нагрузки, даже повседневная активность больных, и сон приводят к очень выраженному повышению Рра (около 60 мм рт.ст.) и создают значимую гемодинамическую нагрузку на ПЖ.МОЗГОВОЙ НАТРИЙУРЕТИЧШЙЙ ПЕПТИДОдним из наиболее ценных биомаркёров при ЛГ является мозговой натрийуре- тический пептид (brain natriuretic peptide — BNP). BNP секретируется миоцитами желудочков сердца, и высвобождение BNP в системный кровоток прямо пропор¬ ционально степени перегрузки желудочков объёмом или давлением, в настоящее время широко используются диагностические наборы для определения BNP и его концевого N-отрезка (NT-pro-BNP) в плазме крови. У пациентов с систолической дисфункцией ЛЖ концентрации BNP в плазме коррелируют с давлением заклини¬ вания лёгочных капилляров, с конечно-диастолическим диаметром левого желу¬ дочка и фракцией выброса (ФВ), Многие исследования показали, что у пациентов с хронической сердечной недостаточностью (ХСН) уровни BNP увеличиваются пропорционально тяжести ограничения физических нагрузок и соответствуют функциональному классу ХСН.В нескольких исследованиях было показано, что уровни BNP в плазме крови повышены также и при дисфункции ПЖ. У больных ИЛГ уровни BNP были значительно повышены, причём была выявлена выраженная корреляция между значениями BNP и Рра, PVR, давлением в правом предсердии, классом лёгочной гипертензии по NYHA и дистанцией в тесте с 6-минутной ходьбой. При лёгочной гипертензии уровни BNP обычно не превышают 500 пг/мл, однако вариабель¬ ность изменения NT-pro-BNP значительно больше: 250-1000 пг/мл, иногда даже превышает 1000 пг/мл. У пациентов с лёгочной гипертензией и сопутствующей дисфункцией ЛЖ уровни BNP обычно выше.При ЛГ на фоне хронических заболеваний лёгких оценка уровня BNP может иметь важное диагностическое и прогностическое значение. В исследовании Leuchte и кол., включавшем 176 больных с различными хроническими заболева¬ ниями лёгких (ХОБЛ, муковисцидоз, саркоидоз, лёгочные фиброзы и др.), было обнаружено, что у больных с выраженной лёгочной гипертензией (Рра выше 35 мм рт.ст.) уровни BNP были значительно выше по сравнению с пациентами без лёгочной гипертензии (соответственно 297±54 vs 26±4 пг/мл, р <0,001). Для диа¬ гностики лёгочной гипертензии уровень BNP плазмы крови выше 33 пг/мл имел
614 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ~ чувствительность 87% и специфичность 81% (аккуратность 89%). Более того»S уровень BNP имел важное прогностическое значение для данных больных; выжв-J ваемость больных с повышенными уровнями BNP была меньше по сравнению с^ пациентами без повышения BNP: 24,29±3,07 мес vs 33,44±1,93 мес (р <0,01),Методы терапии лёгочной гипертензии при хронических респираторных заболеванияхМедикаментозная терапия при вторичных ЛГ должна быть направлена прежде всего на терапию основного заболевания, т.е., например, у больных ХОБЛ необхо¬ димо использовать в полном объёме все средства для максимального улучшения бронхиальной проходимости, оптимизации показателей газообмена и контроля за воспалением дыхательных путей. К числу основных препаратов для терапии больных ХОБЛ относятся антихолинергические препараты, р2-агонисты, теофил¬ лин, ИГКС, при развитии инфекционных обострений заболевания используются антибиотики. Интересно отметить, что р2‘агонисты и теофиллин, кроме брон¬ хорасширяющего эффекта, обладают также умеренным действием на сосуды мало¬ го круга кровообращения, т.е. способны снизить Рра и PVR, а также увеличить ФВ ПЖ у больных ХОБЛ. В недавно проведённом исследовании Cazzola и кол. было показано, что одна ингаляция длительно действующих Рз'Згонистов формотерола или салметерола приводит к снижению PAPs в течение 1 ч на 3-4 мм рт.ст.ВАЗОДИЛАТАТОРЫПредпринималось множество попыток найти оптимальный вазодилататор. снижающий ЛГ у пациентов с хроническими респираторными заболеваниями. Для этой цели предлагалось использовать блокаторы кальциевых каналов, празозин, нитраты и гидралазин. Несмотря на то что в некоторых краткосрочных иссле¬ дованиях была показана способность данных препаратов улучшать показатели лёгочной гемодинамики, данных об их положительном действии в течение дли- тельного времени (более 3-6 мес) практически нет. Однако серьёзные побочные эффекты вазодилататоров ограничивают их использование у больных с респира¬ торными заболеваниями: основным побочным эффектом является усугубление артериальной гипоксемии, связанной с вазодилатацией лёгочных сосудов в плохо перфузируемых зонах лёгких; все вазодилататоры неселективны, вследствие чего воздействуют как на лёгочное, так и на системное кровообращение, вызывая в итоге системную гипотензию и тахикардию.Например, в ряде исследований показана способность нифедипина приводить к снижению Рра и повышению сердечного выброса у больных ХОБЛ с ЛГ как в покое, так и при физических нагрузках. Однако нифедипин усиливает перфузию плохо вентилируемых регионов лёгких, что ведёт к ух^^^дшению вентиляционно- перфузионых (VyO) соотношений и снижению PaOj, т.е. наблюдается подавление гипоксической лёгочной вазоконстрикции. Кроме того, благоприятное действие антагонистов кальция на параметры лёгочной гемодинамики не наблюдалось при длительной терапии (недели-месяцы) больных ХОБЛ с ЛГ,Аналогичная ситуация наблюдается и при назначении нитратов: острые пробы демонстрируют умеренное снижение Рра и PVR, которое сопровождается ухуд¬ шением газообмена, а длительные исследования — отсутствие положительного эффекта препаратов на лёгочную гемодинамику.Данные об эффективности ингибиторов АПФ довольно противоречивы. С одной стороны, есть данные о том, что на фоне терапии ингибиторами АПФ наблюдается снижение Рра и PVR и повышение сердечного выброса. С другой стороны, эффективность ингибиторов АПФ у больных с хроническими респира¬ торными заболеваниями не была подтверждена в длительных плацебоконтроли-
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ 015руемых исследованиях. Возможным объяснением такого противоречия является недавно открытый полиморфизм гена АПФ, описано три подтипа: DD, П, ID. Kanazawa и кол. показали, что назначение каптоприла приводит к более выра¬ женному снижению Рра и PVR и концентрации лактата крови у больных ХОБЛ с субтипами гена АПФ II и Ш, в то время как у больных с субтипом DD каптоприл не приводил к значимому положительному эффекту. Таким образом, определение полиморфизма гена АПФ может в будущем помочь в подборе эффективной тера¬ пии ЛГ больных с хроническими респираторными заболеваниям.Сегодня в качестве довольно перспективных препаратов для терапии вторичных форм ЛГ рассматриваются антагонисты рецепторов ангиотензина-П. Morrell и кол. провели плацебоконтролируемое исследование эффективности лозартана, который назначали в дозе 50 мг/сут 40 больным ХОБЛ с Л Г. В течение первого года наблюдения в группе плацебо была отмечена тенденция к повышению давле¬ ния в ЛА [транстрикуспидальный градиент (ТТГ) увеличился с 43,4 до 48,4 мм рт. ст.], в то же время давление в Л А было стабильным у больных, получавших лозартан (ТТГ 42,8 и 43,6 мм рт.ст. в начале и конце исследования). Наибольший положительный гемодинамический эффект лозартана наблюдался у больных с ТТГ >40 мм рт.ст.: снижение на 16% в группе лозартана и повышение на 4% в группе плацебо.СЕРДЕЧНЫЕ ГЛИКОЗИДЫ И МОЧЕГОННЫЕЭффективность сердечных гликозидов у больных лёгочным сердцем была показана только при наличии сочетанной патологии левого желудочка, сердеч¬ ные гликозиды могут также быть полезны при развитии мерцательной аритмии. У больных с хроническими респираторными заболеваниям в условиях гипоксемии и приёма р^-агонистов риск развития дигиталисной интоксикации может быть повышен.Уменьшение внутрисосудистого объёма жидкости может привести к улучше¬ нию лёгочной гемодинамики, газообмена и клинических симптомов у больных с лёгочным сердцем. Для этих целей обычно используют терапию диуретиками. Диуретики следует назначать осторожно, с небольших доз, так как при развитии правожелудочковой недостаточности сердечный выброс больше зависит от пред¬ нагрузки, и, следовательно, чрезмерное сокращение внутрисосудистого объёма жидкости может привести к уменьшению объёма наполнения правого желудочка и снижению сердечного выброса, а также к повышению вязкости крови. Простым методом для оценки внутрисосудистого объёма может быть контроль концентра¬ ции мочевины и креатинина крови. Стабильные значения данных параметров говорят о сохранности перфузии почек и других органов. С другой стороны, ухудшение этих показателей требует сокращения терапии диуретиками. Другим серьёзным побочным эффектом мочегонной терапии является метаболический алкалоз, который у больных с дыхательной недостаточностью может приводить к угнетению активности дыхательного центра и ухудшению показателей газооб¬ мена.КРОВОПУСКАНИЕКровопускание также является эффективным методом для уменьшения объёма внутрисосудистой жидкости и вязкости крови. Оно может привести к снижению давления в лёгочной артерии, повышению толерантности больных к физическим нагрузкам, улучшению газообмена и улучшению нейропсихического статуса больных. Показанием к кровопусканию является повышение гематокрита выше 65-70%, целью процедуры является снижение этого показателя до уровня ниже 50%.
6t 6 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯКИСЛОРОДОТЕРАПИЯАльвеолярная гипоксия играет главную роль в развитии ЛГ у больных, поэтому коррекция гипоксии с помощью кислорода является наиболее патофизиологе- чески обоснованным методом терапии ЛГ. В отличие от некоторых неотложных состояний (обострение ХОБЛ, травма, пневмония, отёк лёгких), использование кислорода у больных с хронической гипоксемией должно быть постоянным, дли¬ тельным и, как правило, проводиться в домашних условиях, поэтому такая форма терапии называется длительной кислородотерапией (ДКТ). Первые результата о благоприятном влиянии ДКТ на выживаемость больных с лёгочным сердцем были получены в начале 70-х годов, когда Neff и Petty представили данные о том. что наряду со снижением давления в лёгочной артерии, гематокрита и отёков у больных ХОБЛ, отмечается достоверное снижение летальности этих больных по сравнению с группой исторического контроля, в дальнейшем, эти данные были подтверждены в двух рандомизированных, контролируемых исследованиях.В настоящее время наиболее вероятными причинами благоприятного влияния ДКТ на выживаемость больных с хронической дыхательной недостаточностью являются следующие гипотезы (не исключающие друг друга):• кислородотерапия повышает содержание кислорода в артериальной крови, приводя к увеличению доставки О^ к сердцу, головному мозгу и другим жиз¬ ненно важным органам;• кислородотерапия уменьшает лёгочную вазоконстрикцию (снижает Рра и PVR), вследствие чего повышается ударный объём и сердечный выброс, уменьшается почечная вазоконстрикция и возрастает почечная экскреция натрия.Доказательством второй гипотезы является способность ДКТ вызывать обратное развитие или предотвращение прогрессирования ЛГ у больных ХОБЛ, что также было убедительно показано в нескольких клинических исследованиях. В исследовании MRC Trial у пациентов контрольной группы было отмечено повышение Рра в среднем на 2,8 мм рт.ст. в год, в то время как у больных, получавших терапию Oj, повышения Рра не наблюдалось. По данным небольшого проспективного исследования Weitzenblum и кол., контролировавших физиологические эффекты ДКТ у 24 больных ХОБЛ в тече¬ ние 12-120 мес, ежегодное снижение Рра на фоне ДКТ составляет 1,3±4,5 мм рт.сг.Самое длительное проспективное наблюдение за динамикой показателей давле¬ ния в лёгочной артерии и PVR было представлено группой Zielinski и кол., изучав¬ ших влияние ДКТ на параметры лёгочной гемодинамики и газообмена в течение 6 лет у 95 больных ХОБЛ (табл. 35-2).Таблица 35-2. Изменения параметров гемодинамики на протяжении 6 лет ДКТПараметрыДо терапии2 года4 года€ летРра, мм рт.ст.25±721 ±426±726+6PAWP, мм рт.ст.7±26±26±37+3МОС, л/мин4,55±1.56,58±0,95.87+0,74,43±0,5PVR, динхс/см^313+159268±t10344+82332±205РАУР — давление заклинивания в лёгочной артерии, МОС — минутный объём сердца.Исследование показало, что ДКТ приводит к небольшому снижению давления в лёгочной артерии в течение первых 2 лет, однако затем значения ЛГ приходят к исходному уровню и стабилизируются на этих значениях. Интересной находкой данного исследования явилось повышение сердечного выброса во время проведе¬ ния ДКТ, что может отражать улучшение функции правого желудочка.
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ 617Несмотря на то что ДКТ, проводимая в течение 6 лет, не снизила, а лишь ста¬ билизировала значение лёгочного давления, данный эффект ДКТ следует также расценивать как положительный результат, так как при отсутствии кислородо¬ терапии следовало бы ожидать ежегодный прирост давления на 1,5-2,8 мм рт.ст. Возможным объяснением отсутствия уменьшения ЛГ является уже существующие структурные изменения стенки сосудов (миграция и пролиферация гладкомышеч¬ ных клеток в интиму, фиброзластоз интимы). Кроме того, недостаточное время ДКТ (менее 16 ч), возможно, также является причиной отсутствия снижения дав¬ ления в лёгочной артерии.Продолжаются дискуссии по поводу целесообразности ДКТ больным с изо¬ лированной ночной гипоксемией. в исследовании Fletcher и кол. приняли участие 38 больных с Р^2 мм рт.ст. в дневное время и документированными эпизодами ночной гипоксемии, больные были рандомизированы на две группы — ночной кислородотерапии 3 л/мин и «ложной» терапии (проводилась при помощи неэф¬ фективного концентратора кислорода, FiO^ около 23%) — по 19 пациентов каждой группе. Исследование продолжалось 3 года, в конце исследования не было отмечено различий между группами больных по летальности (умерли 5 больных в группе ДКТ и 6 пациентов в группе контроля). Однако у больных, получавших ночную кисло¬ родотерапию, было отмечено снижение Рра (на 3,7 мм рт.ст./З года), а у больных «ложной» терапии наблюдалось прогрессирование лёгочной гипертензии: прирост Рра составил 3,9 мм рт.ст./З года. Кислородотерапия может быть эффективна и при изолированной гипоксемии, возникающей только во время физических нагрузок. Fujimoto и кол, показали, что назначение О2 во время физических нагрузок больным ХОБЛ любой тяжести приводит к заметно меньшему повышению Рра по сравнению с нагрузками во время дыхания воздухом.НЕИНВАЗИВНАЯ РЕСПИРАТОРНАЯ ПОДДЕРЖКАКак уже подчёркивалось ранее, гипоксемия является главной, но не един¬ ственной причиной развития ЛГ у больных с хроническими респираторными заболеваниям. Важное значение имеют также такие нарушения газообмена, как гиперкапния и респираторный ацидоз. В большинстве случаев ДКТ не приводит к нарастанию гиперкапнии, однако не ведёт и к снижению РаСО^. Тем не менее у ряда больных с дыхательной недостаточностью кислородотерапия может приво¬ дить к нарастанию гиперкапнии, особенно во время сна. Уменьшить гиперкапнию и ацидоз при ХДН способна только респираторная поддержка (вентиляция лёг¬ ких), которая имеет ещё одно преимущество перед ДКТ — снижение амплитуды отрицательного внутригрудного давления, которое также приводит к повышению Рра у больных с обструктивными заболеваниями лёгких. В домашних условиях респираторная поддержка больных в подавляющем большинстве случаев прово¬ дится неинвазивно, т.е. при помощи носовых и лицевых масок, поэтому и получи¬ ла название неинвазивной вентиляции лёгких (НВЛ).Влияние НВЛ на параметры лёгочной гемодинамики было показано как при краткосрочных, так и при длительных наблюдениях. В исследовании Thorens и кол. НВЛ в течение 7 дней приводила к достоверному сниженрпо Рра у больных с СОГ и кифосколиозом от 34±12 до 21±15 мм рт.ст. (р <0,05). В исследовании Schonhofer и кол. при проведении НВЛ в течение первого года у 20 больных с рестриктивными заболеваниями лёгких (кифосколиоз и посттуберкулёзные последствия) было также выявлено значительное снижение Рра от 33±10 до 26±6 мм рт.ст. (р <0,01).У больных с СОАС основным методом терапии является метод создания посто¬ янного положительного давления в дыхательных путях (СРАР). Как оказалось, СРАР не только устраняет ночную гипоксемию и избыточную дневную сонливость, но снижает давление в ЛА. Alchanatis и кол. показали, что использование СРАР в течение 6 мес у больных СОАС с ЛГ сопровождалось снижением Рра от 25,6±4,0
618 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯДО 19,5±1,5 мм рт.ст. (р <0,001). В другом исследовании представлены аналог»»“ ные результаты: 4-месячная СРАР-терапия у больных СОАС привела к снижешА Рра от 16,8±1,2 до 13,9±0,6 мм рт.ст. (р <0,05) и общего РКУ от 231,1±19,6 Ш 186,4±12,3 дупхзхст^ (р <0,05), наибольшие изменения лёгочной гемодинамии наблюдались у больных СОАС с более выраженной ЛГ.ОКСИД АЗОТАОксид азота (N0) является одним из важнейших медиаторов многих физио¬ логических и патофизиологических процессов в большинстве систем организшс сердечно-сосудистой, дыхательной, нервной, иммунной, пищеварительной ш мочеполовой. N0 регулирует тонус, проницаемость и структуру сосудов, тонус гладких мышц внутренних органов, процессы воспаления и иммунной защиты.Впервые ингаляционный N0 для терапии ЛГ был использован Рерке-2аЬа ш кол. в 1991 г. В настоящее время ингаляционная терапия N0 широко используете* для лечения пациентов с острым респираторным дистресс-синдромом, при раз¬ личных состояниях, сопровождающихся ЛГ, а также при заболеваниях, приводя¬ щих к нарушению газообмена, таким, как ХОБЛ и ИЛФ.В отличие от системных вазодилататоров ингаляционный N0 не только обе¬ спечивает мощный вазодилатирующий эффект, но также обладает и селективным действием на сосуды малого круга, т.е. не действует на системное кровообращение и не вызывает системной гипотензии. Благоприятный гемодинамический эффект ингаляционного N0 у больных ХОБЛ с ЛГ был уже продемонстрирован в ряде проведённых исследований. Так, в исследовании Оегтапп и кол. отмечено сниже¬ ние Рра и РУК на 17 и 26%, в исследовании Мотагё и кол. — на 19 и 29%, в одном из наших исследований — на 22 и 32%.В дополнение к своим гемодинамическим эффектам N0 может играть важную роль в предотвращении и обратном развитии ремоделирования лёгочных сосудов и правого желудочка. В работах т п1то была продемонстрирована способность N0 регулировать процесс утолщения интимы лёгочных артерий, включая про¬ лиферацию, миграцию и апоптоз гладкомышечных клеток, а также формирование экстрацеллюлярного матрикса.Оптимальными дозами ингаляционного N0 являются концентрации 2-10 ррга, высокие концентрации N0 (более 20 рт) способны вызвать чрезмерную вазоди¬ латацию лёгогочных сосудов и привести к ухудшению Vд/Q баланса и гипоксемии. Благоприятный эффект N0 на газообмен у больных ХОБЛ показан в исследовани¬ ях, где данный агент использовался в сочетании с кислородом (т.е. N0+0.^ больше увеличивает РаОз по сравнению с О2). Полученные результаты позволяют думать о том, что комбинация N0 и кислорода у пациентов с ХОБЛ и ЛГ может быть серьёз¬ ной альтернативой традиционной терапии у данной категории пациентов.Недавно были получены первые данные о длительной ингаляции N0 в домаш¬ них условиях у больных ХОБЛ с ЛГ. В рандомизированном контролируемом исследовании УопЬапк и кол. на протяжении трёх мес проводилось сравнение эффективности комбинации N0 и О2 и монотерапии 0^ у 40 больных ХОБЛ тяжё¬ лого течения. У больных, получавших комбинацию N0 и 0^, наблюдались значи¬ тельные положительные изменения со стороны гемодинамических показателей: снижение Рра от 27,6±4,4 до 20,6±4,9 мм рт.ст. (р <0,001), повышение сердечного выброса от 5,6+1,3 до 6,1±1,0 л/мин (р=0,025), в то время у больных, получавших монотерапию О2, данные параметры не изменились.НОВЫЕ МЕТОДЫ ТЕРАПИИВ течение последних лет появились несколько перспективных препаратов, эффективность которых уж доказана у больных с первичной лёгочной гипертензи¬ ей. К числу таких препаратов относятся простациклин и его аналоги, антагонисты рецепторов эндотелина и ингибиторы фосфодиэстеразы V типа.
ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКИХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ 019Внутривенное введение простациклина у больных с тяжёлой ХОБЛ и ЛГ при- д.; водило к снижению PVR, однако уже через сутки терапии эффект препарата пол- ностью нивелировался, кроме того, на фоне терапии простациклином набралось снижение РаО^ и повышение фракции шунтирования. Такие же неблагоприятные эффекты внутривенного простациклина были отмечены у больных с ИЛФ. Однако благоприятный эффект простациклина наблюдался при других вторичных ЛГ: у больных с интерстициальным лёгочным фиброзом на фоне системной склеродер- ■мии и у больных с саркоидозом. : •Выбор другого пути доставки аналогов простациклина — ингаляционного — позволяет сохранить положительный эффект препарата на лёгочную гемодинами¬ ку и в то же время устранить неблагоприятные эффекты на газообмен и системную гемодинамику. Olschewski и кол. показали высокую эффективность ингаляционной формы стабильного аналога простациклина илопроста у больных с ЛГ на фоне ИЛФ. Препарат приводил к значительному снижению PVR, но при этом не влиял на РаО^ и на системное артериальное давление. Эффективность ингаляционного илопроста продемонстрирована также у больных с ЛГ на фоне саркоидоза.Силденафил является селективным ингибитором цГМФ-зависимой фосфо¬ диэстеразы V типа, т.е., предотвращая деградацию цГМФ, приводит к снижению давления в ЛА. Эффективность силденафила в дозе 50 мг у больных с ИЛФ и ЛГ сравнима с N0 по влиянию на Рра и PVR, но в отличие от всех известных лекар¬ ственных препаратов силденафил приводит к повышению РаО^, В исследовании Alp и кол. терапия силденафилом 50 мг 2 раза в сутки в течение 3 мес у больных ХОБЛ привела к снижению Рра от 30,2±5,5 мм до 24,6±4,2 мм ртст. (р <0,01) и PVR от 401±108 до 264±52 динхсекхсм^ (р <0,05), кроме того, у больных значительно увеличилась пройденная дистанция в тесте с 6-минутной ходьбой: от 351±49 до 433±52 м (р <0,05). Приблизительно такие же данные об эффективности силде¬ нафила уже получены у больных ИЛФ с ЛГ; терапия препаратом в течение трёх мес приводила к увеличению дистанции в тесте с 6-минутной ходьбой в среднем на 49,0 м.Босентан — антагонист рецепторов эндотелина-1, который блокирует рецеп¬ торы эндотелина типа А и типа В, активация данных рецепторов на гладкомышеч¬ ных клетках вызывает вазоконстрикторный и митогенный эффект. По данным пилотного исследования, терапия бесентаном у больных с ИЛФ не приводила к усугублению vyo, нарущений, шунтирования и снижению Ра02> и при этом наблюдалось небольшое, но достоверное снижение Рра (от 22,4 до 19,7 мм рт.ст.).По данным недавно завершившегося исследования BUILD-1, в которое было включено 158 больных ИЛФ, терапия босентаном на протяжении 1-го года при¬ вела к снижению неблагоприятных совокупных событий (летального исхода и клинического ухудшения): 23% в группе босентана против 36% в группе плацебо (р=0,08), достоверное различие было получено у больных с ИЛФ, доказанном при открытой биопсии лёгких (12 против 38%, р=0,005). С учётом значительного повышения у больных ХОБЛ уровня эндотелина-1 в крови существуют теоретиче¬ ские предпосылки для использования у данных больных антагонистов рецепторов эндотелина.СПИСОК ЛИТЕРАТУРЫ,^
Глава 38’ i 'i-aХроническая тромбозмболичема лёгочная гипе^нзияВ конце девятнадцатого и начале двадцатого столетия было опубликовано несколько сообщений, описывающих массивный тромбоз главных лёгочных сосудов при аутопсии. Эти сообщения типично описывали организованный тромбоз в лёгочных артериях в сочетании с другими болезнями, такими, как туберкулёз, рак лёг¬ кого и врождённые пороки сердца, и очень редко встречались орга¬ низованные тромбы в лёгочных артериях, при отсутствии другой патологии. Посмертный диагноз и описание синдрома хроническо¬ го тромбоза главных лёгочных артерий обратили на себя внимание в 50-х годах. Carroll и соавт. были первыми, кто использовал кате¬ теризацию сердца и ангиографию лёгочных сосудов в характери¬ стике этой необычной болезни. В 1958 г. Hurwitt сообщил о первой хирургической попытке удалить тромбы из лёгочных сосудов. И хотя пациент умер, это вмешательство обеспечило концептуаль¬ ную основу для различия между острой и хронической тромбоэм¬ болической болезнью лёгочных сосудов и показало, что эндарте- риоэктомия является необходимой для успешного хирургического лечения этой болезни.Первая двусторонняя лёгочная тромбартериоэктомия путём поперечной стернотомии с использованием кардиопульмонального доступа относится к 1963 г. Сообщений, описывающих течение и клинические проявления хронической тромбоэмболии, очень мало, однако публикации о хирургических успехах в лечении этой болез¬ ни появлялись с увеличивающейся частотой в последние два десяти¬ летия. Обзор всемирного опыта лёгочных тромбартериоэктомий до 1985 г.. к сожалению, показал высокую интраоперационную смерт¬ ность (22%) у 85 оперированных пациентов. Следовательно, хотя хроническая тромбоэмболическая лёгочная гипертензия (ХТЭЛГ) была подтверждена как потенциально излечимая форма, высокий риск летальных исходов существенно ограничивал готовность спе¬ циалистов активно заниматься этой проблемой. И всемирное меди¬ цинское сообщество продолжало относить ХТЭЛГ к тяжёлым забо¬ леваниям с плохим прогнозом до конца 80-х годов, С улучшением диагностических возможностей, усовершенствованием хирургиче¬ ских методов и эндартериоэктомической аппаратуры, а также адек¬ ватной постоперационной терапией Daily и Moser в Университете Калифорнии, Сан-Диего, опубликовали несколько сообщений о достижениях в лечении ХТЭЛГ. В 1987 г. Moser и соавт. сообщили
ХРОНИЧЕСКАЯ ТРОМБОЭМБОЛИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 021О наблюдении самой большой группы пациентов с ХТЭЛГ в одном медицинском центре (42 человека), где смертность составила 16,6%, Кроме того, эта публикация демонстрировала значительное постоперационное улучшение лёгочной гемодина¬ мики и функциональной способности кардиореспираторной системы у этих паци¬ ентов. что позволило сохранить эти результаты более года,В течение последних двух десятилетий отмечается значительное увеличение числа пациентов с ХТЭЛГ, подвергшихся оперативному вмешательству, а также растёт количество исследовательских программ посвяш;ённых диагностике и лечению этого заболевания. В Университете Сан Диего более 1600 пациентам про¬ ведена тромбэндартериоэктомия из лёгочных сосудов в период с 1989 по 2003 гг. Активно ведутся работы в Северной Америке, Европе, Японии и Австралии, в связи с возрастающим научным интересом к данной проблеме. Хотя, казалось бы, возрастающее число пациентов с ХТЭЛГ отражает увеличивающуюся распро¬ странённость этой патологии, наиболее вероятная причина — более пристальное внимание врачей к этой болезни. Возрастание всемирного интереса поддержива¬ ется пониманием того, что врачебное вмешательство при ХТЭЛГ, а именно тром¬ бэндартериоэктомия, влияет на прогноз болезни, снижает интраоперационную смертность, значительно улучшает лёгочную гемодинамику и увеличивает долго- фочную выживаемость у этой категории больных.ПатофизиологияПатофизиологические механизмы, приводящие к ХТЭЛГ, до конца неясны. Трудность в понимании этих процессов, по всей вероятности, связана с обращени¬ ем пациентов на поздней стадии болезни и часто без предшествующего анамнеза венозного тромбоза. Следовательно, ретроспективный анализ анамнестических и клинических данных, наряду с анализом причин и течения острых тромбоэмбо¬ лий, является основой в понимании развития ХТЭЛГ.Развитие ХТЭЛГ представляется продолжением естественного течения острой ТЭЛА, хотя это происходит лишь у небольшого числа пациентов. Однако хрони¬ ческая тромбоэмболическая болезнь — достаточно серьёзная патология и хирур¬ гические интервенционные вмешательства требуются только приблизительно у 0,1-0,3% пациентов, переживающих острую ТЭЛА. Самостоятельный тромбо¬ лизис с восстановлением газообмена и нормальной толерантности к физическим нагрузкам происходит у большинства пациентов, перенесших эпизод острой ТЭЛА. Последние данные, однако, показывают, что чаще полного анатомическо¬ го и гемодинамического восстановления после острой ТЭЛА не происходит, чем обусловлен высокий риск развития ХТЭЛГ. Очевидно также, что острая ТЭЛА может протекать бессимптомно, а, следовательно, оставаться не диагностирован¬ ной [35, 36], что, несомненно, увеличивает число кандидатов на развитие ХТЭЛГ. В результате неадекватная терапия таких состояний создаёт благоприятный фон для дальнейшего развития хронической тромбоэмболической болезни лёгочных сосудов.Определить основной фактор, который мог бы объяснить неверную тактику веде¬ ния пациентов после эпизода острой ТЭЛА, порой бывает невозможно у пациентов с ХТЭЛГ. У небольшого числа пациентов с доказанной ТЭЛА необоснованный фибри- нолиз может быть идентифицирован как фактор риска ретромбоза. Присутствие волчаночного антикоагулянта или антител к кардиолипину может быть установлено у 10-24% пациентов с ХТЭЛГ. Наследственный дефицит антитромбина III и про¬ теинов С и 8 присутствуют менее чем у 5% пациентов; фактор V (Лейдена) может быть обнаружен у 4-6,5% пациентов с ХТЭЛГ, Действие других тромбофилических факторов, мутации гена протромбина, свёртывающего фактора VII и гипергомоци¬ стеинемия не было достоверно установлено у этой категории больных.
622 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ-- Vft- ... Ä:'Ретроспективный анализ историй болезни большинства пациентов с ХТЭЯГ показывает, что достаточно длительный период времени болезнь протекает 6et^ симптомно, прежде чем появляются жалобы, позволяющие заподозрить тром^ боэмболию. После эпизода острой ТЭЛА пациенты часто имеют нормальвуиГ толерантность к физическим нагрузкам, и нарастание сердечно-лёгочной неявк статочности происходит достаточно медленно. В течение этого периода лёго« гипертония практически не нарастает и происходит компенсация правожелутю»- ковой недостаточности. Вероятно, что многочисленные факторы замедляют про¬ грессию этих состояний: возраст пациента, исходное состояние здоровья, место жительства (условия высокогорья) и наличие сопутствующей патологии (ХОБЛ, ИБС). Неясной остаётся патологическая основа для прогрессирования ЛГ. У неко¬ торых пациентов нестабильная гемодинамика может приводить к рецидиву ТЭЛА или тромбозу т $itu. Различные формы артериопатий и другие сосудистые изме¬ нения, наблюдающиеся при других формах ЛГ, по всей вероятности, развиваютс» и в случае ХТЭЛГ. Эта гипотеза подтверждена несколькими наблюдениями в этой области:• прогрессирование изменений лёгочной гемодинамики обычно происходит при отсутствии текущих ТЭЛА или тромбозов in situ в лёгочной артерии;• имеется низкая корреляция между степенью обструкции лёгочных сосудов, уровнем ЛГ и лёгочным сосудистым сопротивлением;• гистологические исследования демонстрируют гипертоническую артериопа- тию проксимально от тромбированных сосудов-В случае если пациент с ХТЭЛГ не обращался к врачам, либо по каким-то причинам диагноз не был установлен, вероятнее всего ожидать драматичное прогрессирование ЛГ, нарастание правожелудочковой недостаточности, что, в конечном итоге, приведёт к смерти больного. Процент долгосрочного выжи¬ вания нелеченных пациентов с ХТЭЛГ очень низок и коррелирует со степенью ЛГ- Riedel и соавт. продемонстрировали, что 10-летняя выживаемость у паци¬ ентов, перенесших ТЭЛА и имеющих среднее давление в лёгочной артерии 31-40 мм рт.ст,, составляет 50%. Если изначально среднее давление в лёгочной артерии 41-50 мм рт.ст., вероятность 10-летнего выживания снижается до 20%, а при более высоком уровне — до 5%. Недавняя публикация польских авторов демонстрирует подобные результаты. В этом исследовании, 49 пациентов с ХТЭЛГ были неоперабельны, и проводилась только антикоагулянтная терапия. Отрицательное влияние на прогноз оказывало наличие существенной лёгочной гипертонии (среднее давление в лёгочной артерии >30 мм рт.ст.), сопутствую¬ щая хроническая лёгочная патология и низкая толерантность к физическим нагрузкам.Клиническая картина и инструментальные методы исследованияВначале заболевания ХТЭЛГ наиболее часто пациенты жалуются на одышку и резкое снижение двигательной активности. Несмотря на индивидуальные разли¬ чия, физиологическая основа этих жалоб состоит в снижении сердечного выброса, вызванного повышенным лёгочным сосудистым сопротивлением и увеличенной минутной вентиляцией альвеолярного мёртвого пространства. Пациенты могут испытывать кашель, усиливающийся при нагрузке. Кровохарканье отмечается редко, только в случае поражения бронхиальных артерий. Атипичные боли в грудной клетке часто имеют плевральную природу, возможно, вследствие периин- фарктной пневмонии. Связанный с физической нагрузкой дискомфорт в грудной клетке часто приводит к гипердиагностике коронарной болезни сердца. Эта жало¬ ба обычно возникает поздно при ХТЭЛГ и связана с возникновением синкопаль-
ХРОНИЧЕСКАЯ ТРОМБОЭМБОЛИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 623ных состояний и развитием одышки в покое. Это происходит в результате несоот¬ ветствия функции сердца его метаболическим запросам.Отсутствие специфики жалоб приводит к поздней диагностике ХТЭЛГ у боль¬ шинства пациентов. Некоторые исследования показывают, что время от начала появления жалоб до постановки верного диагноза составляет от 2 до 3 лет. Возраст пациента, отсутствие или наличие сопутствующих сердечно-лёгочных заболева¬ ний и определённый образ жизни имеют большое значение и сосредотачивают диагностический поиск на возможной ХТЭЛГ. К сожалению, множество пациен¬ тов с ХТЭЛГ имели в начале заболевания другие диагнозы, такие, как физическое переутомление, ХОБЛ, дебют бронхиальной астмы, пороки сердца и одышку пси¬ хогенного характера.Толерантность к физическим нагрузкам сохраняется достаточно высокой даже при длительном анамнезе ХТЭЛГ, Даже при наличии серьёзной лёгочной гипер¬ тонии, пациенты могут двигаться относительно хорошо. Поэтому клинические признаки Л Г: увеличение правых отделов сердца, акцент II тона на лёгочной артерии, ритм «галопа» и трикуспидальная регургитация, должны тш;атель- но анализироваться врачом. Иногда диагноз становится очевиден только при существенной дисфункции правого желудочка, ведущей к значительной трику- спидальной регургитации, увеличению правых отделов сердца, ритму «галопа гепатомегалии, асциту, периферическим отёкам и диффузному цианозу. Часто при физикальном обследовании выявляются поверхностные варикозные изме¬ нения вен нижних конечностей, указывающие на возможный венозный тром¬ боз. При отсутствии паренхиматозных и обструктивных лёгочных заболеваний аускультация лёгких, как правило, нормальна. Приблизительно у 30% пациентов может выслушиваться мягкий сосудистый шум над лёгочными полями. Этот аускультативный феномен следует отличать от сердечных шумов, так как его возникновение связано с мощным выбросом крови в лёгочную артерию, кото¬ рому препятствуют суженные лёгочные сосуды. Этот феномен отсутствует при идиопатической ЛГ и не патогномоничен для ХТЭЛГ. Эти шумы могут быть обнаружены и при других заболеваниях, характеризующихся сужением главных лёгочных сосудов, таких, как врождённый стеноз лёгочных артерий и различные формы лёгочных васкулитов.При прогрессировании правожелудочковой недостаточности в клинических и биохимических анализах крови могут быть обнаружены существенные изменения, Длительная гипоксемия может приводить к полицитемии, повышению уровней мочевины и креатинина в сыворотке крови в результате снижения сердечного выброса и сокращения почечного кровотока. Также может наблюдаться увеличе¬ ние активности печёночных ферментов, что может быть неправильно интерпре¬ тировано в пользу болезни печени. Тромбоцитопения и увеличение тромбопла- стинового времени при отсутствии антикоагулянтной терапии должны нацелить клинициста на возможное присутствие волчаночного антикоагулянта.Исследование ФВД, обычно выполняемое при оценке характера одышки, явля¬ ется наиболее информативным для исключения сопутствующих паренхиматозных и обструктивных болезней лёгких. Для пациентов с ХТЭЛГ проведение одной лишь спирометрии недостаточно, необходима адекватная оценка лёгочных объёмов, так как они могут быть значительно изменены в случае развития инфарктов лёгкого. Также при ХТЭЛГ может отмечаться умеренное снижение диффузионной способ¬ ности лёгких. Однако необходимо помнить, что нормальные показатели не исключают этого диагноза. Анализ газового состава артериальной крови часто демонстрирует относительно нормальный уровень напряжения кислорода (РаОз), несмотря на гипервентиляцию, присущую этим пациентам. Эти данные отражают несоответствие вентиляционно-перфузионного отношения и уровня сердечного выброса и могут быть подтверждены снижением напряжения кислорода в сме-
624 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯРис. 36*1. Рентгенография грудной клетки при высокой лёгочной гипертензии на фоне тромбоэмболии лёгочной артерии.шанной венозной крови. Гипоксемия в покое указывает на серьёзную дисфункцню правого желудочка, либо на наличие шунта, при котором происходит сброс крови через овальное отверстие.Рентгенография грудной клетки на ранних стадиях ХТЭЛГ остаётся нормаль¬ ной. С развитием существенной ЛГ может наблюдаться расширение границ право¬ го желудочка и лёгочной артерии. Расширение центральных лёгочных сосудов является рентгенологической особенностью в этой стадии болезни, иногда оши¬ бочно принимаемой за внутрилёгочную лимфоаденопатию. Хотя и при невысокой ЛГ, также может наблюдаться расширение сосудистого пучка; для пациентов с ХТЭЛГ характерно именно асимметричное увеличение проксимальных сосудов (рис. 36-1). При отсутствии сопутствующей патологии лёгких инфильтративные тени в лёгких не имеют существенных особенностей и обусловлены зонами гипо- и гипервентиляции, в плохо вентилируемом лёгком отмечаются периферические затемнения, указывающие на наличие инфарктных изменений. Плевральный выпот может наблюдаться лишь в случае драматичной дисфункции правого желу¬ дочка, сопровождающейся высоким давлением в правом предсердии, как результат перегрузки объёмом, с развитием асцита.Клинических данных и результатов рутинных методов обследования иногда достаточно для правильной трактовки жалоб пациента. Однако часто требуется расширение диагностических мероприятий для верификации диагноза. Ценным методом является трансторакальная ЭхоКГ, позволяющая подтвердить повы¬ шение давления в лёгочной артерии и исключить патологию левого желудочка, клапанные поражения сердца и другие внутрисердечные причины лёгочной гипертензии. Систолическое давление в лёгочной артерии измеряется с помо¬ щью допплер-ЭхоКГ (рис. 36-2) по степени трикуспидальной регургитации с оценкой сердечного выброса. Оценка систолической функции правого желудочка (рис. 36-3, см. также цветную вклейку), наличие или отсутствие парадоксального
ХРОНИЧЕСКАЯ ТРОМБОЗМБОЛИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 625ЙЙШ■■31»’Рис. 36-2. Допплер-ЭхоКГ (трикуспидальная регургитация).Рис. 36-3. Допплер-ЭхоКГ (расширение правых отделов сердца).
626НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ>■Ї Р.движения створок трёхстворчатого клапана, скорость заполнения левого желуящь | ка являются дополнительными данными, позволяющими получить более ПОЛЕЦЯв! картину изменений сердца при ХТЭЛГ.Проведение контрастирования полостей сердца при ЭхоКГ имеет дополши тельную диагностическую ценность при подозрении на дефект межпредсердаав перегородки. При отсутствии значимых изменений у пациентов с небольшой ЛГ и незначительной дисфункцией правого желудочка иногда целесообразно про¬ ведение исследования при физической нагрузке, что позволит зафиксировал существенное повышение давления в лёгочной артерии. Этот метод имеет физио¬ логическое обоснование для правильной трактовки характера одышки пациентш с ХТЭЛГ и демонстрирует линейную зависимость между повышением сердечного выброса и давлением в лёгочной артерии.После достоверного установления ЛГ основная роль в дифференциальной диа¬ гностике ХОБЛ и сосудистой патологии лёгочного русла принадлежит радиоизо- топной сцинтиграфии лёгких. У пациентов с ХТЭЛГ, как правило, имеются либо сегментарные, либо долевые дефекты накопления изотопа в зонах с сохранённой вентиляцией, в отличие от нормального или субсегментарного накопления пре¬ парата при идиопатической ЛГ или других заболеваниях, поражающих мелкие лёгочные сосуды.Для более точного определения объёма поражённых сосудов и функциональ¬ ного статуса сосудистого русла лёгких проводится вентиляционно-перфузионная сцинтиграфия (рис. 36-4). Данный метод позволяет объективно судить о процент¬ ном соотношении зон вентиляции и перфузии в лёгких после тромбоэмболии.Величина дефектов накопления при ХТЭЛГ часто не соответствует реальной степени обструкции сосудов, что доказывается при проведении ангиопульмоногра- фии (рис. 36-5), В процессе организации тромбоэмболов происходит реканализа¬ ция сосудистого русла, однако диаметр сосудов заметно сужается, что препятствует нормальному прохождению по таким сосудам радиофармпрепарата, приводя в свою очередь к зонам относительной гипоперфузии при сцинтиграфии. КромеРис. 36*4. Вентиляционно-перфузионная сцинтиграфия лёгких при ХТЭЛГ.
ХРОНИЧЕСКАЯ ТРОМБОЭМБОЛИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 627Рис. 36-5. Ангиопульмонография у больного ХТЭЛГ.того, разнообразные сегментарные дефекты у пациентов с ЛГ не патогномоничны для ХТЭЛГ. Изменения, обнаруживаемые во время вентиляционно-перфузионной сцинтиграфии при таких заболеваниях как внутригрудная лимфоаденопатия, ИЛФ, первичные лёгочные сосудистые опухоли, лёгочная веноокклюзионная болезнь и лёгочные артерииты, неотличимы от ХТЭЛГ. Следовательно, необходимы допол¬ нительные методы диагностики для верификации диагноза.Несмотря на увеличивающуюся распространённость КТ грудной клетки для оценки сосудистой системы лёгких и тромбоэмболической болезни, её роль в случаях подозрения на ХТЭЛГ недостаточно определена. Данные КТ при ХТЭЛГ включают мозаичную перфузию лёгочной паренхимы, расширение главных вет¬ вей лёгочной артерии, сопровождаемое разнородностью диаметра лёгочных сосудов, наиболее малого в областях с выраженным тромбозом, местами подобно нитевидным полоскам. С введением контраста организованные тромбы визуально увеличивают главные лёгочные артерии. Этот феномен необходимо отличать от дефектов заполнения наблюдающихся при острой ТЭЛА. Ценность КТ несомнен¬ на в получении информации относительно состояния лёгочной паренхимы у паци¬ ентов с сопутствующей ХОБЛ, а также при обнаружении патологии средостения, которые могут влиять на состояние центральных лёгочных артерий.Организованные тромбоэмболы часто подвергаются эндотелизации и становят¬ ся недоступны для обнаружения при КТ-ангиографии. Следовательно, отсутствие визуализации тромбов в пределах центральных лёгочных сосудов не исключает диагноза ХТЭЛГ, а, следовательно, и не исключает возможности оперативного вмешательства. И наоборот, наличие тромбов в магистральных лёгочных сосудах было описано при идиопатической лёгочной гипертензии и других заболеваниях. Попытка уменьшить ЛГ путём хирургической эндартериоэктомии в этих случаях имеет серьёзный риск интраоперационной смертности. Таким образом, КТ груд¬ ной клетки, применяемая для диагностики ХТЭЛГ не должна играть приоритет¬ ную роль в решении вопроса об оперативном вмешательстве у данной категории пациентов.У пациентов с подозрением на ХТЭЛГ необходимо проводить катетеризацию правых отделов сердца и ангиопульмонографию. Ангиопульмонография в боль¬ шинстве случаев является наиболее надёжным методом для определения степени и месторасположения организованных тромбоэмболов.Однако, несмотря на диагностическую ценность ангиопульмонографии, диа¬ гноз ХТЭЛГ у некоторых пациентов порой вызывает затруднения. Доказано, что визуализация интимы сосудов при лёгочной ангиоскопии несомненно полезна в
628 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯ^ решении диагностических проблем. Ангиоскопическое оптическое устроиспф»;f имеющее длину 120 см и внешний диаметр 3,0 мм с обзором на 180®, черезключичную вену вводится в лёгочную артерию. Пузырёк воздуха, расположенний* на дистальном конце ангиоскопа, препятствует кровотоку в лёгочной арт^як, позволяя тем самым увидеть внутреннюю структуру сосудов, Организованиі* тромбоэмболы визуализируются как наросты или шероховатости интимы лябв как нити, пересекающие сосудистое русло, что может служить признаком реж»- нализации тромбов. В медицинском центре Сан-Диего ангиоскопия проведай приблизительно у 20-25% пациентов, проходящих обследование, для выполнеши тромбэндартериоэктомии. Это исследование доказало свою ценность для прогноа» хорошего гемодинамического эффекта после тромбэндартериоэктомии у паци«- тоБ с невысокой ЛГ. у пациентов же, имеющих значительную степень ЛГ, даншлі метод также оправдан, поскольку позволяет более полно оценить уровень тромбо¬ за у кандидатов на оперативное вмешательство.ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕВсе пациенты с подозрением на ХТЭЛГ должны проходить детальное обсле¬ дование с целью возможности применения хирургического вмешательства. Необходимо также тщательно оценивать индивидуальные особенности гемо- динамических показателей каждого конкретного пациента. Так, большинство пациентов, подвергшихся тромбартериоэктомии, после операции имели лёгочное сосудистое сопротивление около 300 динхсекхсм’^, тогда как до оперативного вмешательства лёгочное сосудистое сопротивление колеблется в диапазоне от 700 до 1100 динхсекхсм Такая степень лёгочной гипертонии характеризуется значи¬ тельной одышкой в покое, существенно усиливающейся при физической нагрузке, и в отсутствии хирургического лечения имеет плохой прогноз. Для пациентов с менее серьёзной лёгочной гипертонией операционная тактика рассматривается в индивидуальном порядке. Обычно к этой категории относятся пациенты с хрони¬ ческой тромбоэмболией, локализующейся в одной из главных ветвей, и ведущие активный образ жизни, например профессиональные спортсмены или люди, живу¬ щие в условиях высокогорья. Необходимость оперативного вмешательства дикту¬ ется стремлением улучшить лёгочную перфузию зон, блокированных тромбозом- Хирургическое лечение также иногда применяется у пациентов с нормальными показателями лёгочной гемодинамики или умеренной ЛГ в покое, но докумен¬ тально зафиксированным повышением этих показателей при нагрузке. Интерес к такого рода пациентам связан с большой вероятностью прогрессирования со временем ЛГ при отсутствии хирзфгического вмешательства.Абсолютным показанием для тромбэндартериоэктомии является наличие доступного хронического тромба, подтверждённого данными ангиопульмоногра- фии и лёгочной ангиоскопии. Имеющийся опыт хирургической практики чётко определяет, какой тромб может рассматриваться как доступный. Современные хирургические методики позволяют удалить организованный тромб из главных и долевых ветвей вплоть до сегментарных отделов лёгочных артерий. Извлечение тромбов из сегментарных сосудов требует большего хирургического навыка и опыта. В любом слзгчае точная диагностика заболевания и локализации тромбов является необходимым условием для успешной операции. Очевидно, что увеличе¬ ние лёгочного сосудистого сопротивления, связанное с хронической тромбоэмбо¬ лической болезнью, возникает не только в связи с центральным тромбозом, но и с обструкцией дистальных сосудов и развивающейся вследствие этого артериопати- ей. Тромбэндартериоэктомия из лёгочной артерии незначительно снижает лёгоч¬ ное сосудистое сопротивление, которое является лишь одним из множества ком¬ понентов, составляющих хроническую тромбоэмболическую болезнь. Поэтому задача дооперационного обследования пациентов заключается в попытке раз-
ХРОНИЧЕСКАЯ ТРОМБОЭМБОЛИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 029Граничения проксимального и дистального компонентов лёгочного сосудистого сопротивления, у пациентов с преобладающим повреждением дистальных отделов лёгочного сосудистого русла эндартериоэктомия из проксимальных отделов суще¬ ственно не влияет на уровень лёгочного сосудистого сопротивления, у пациентов с серьёзной ЛГ и дисфункцией правого желудочка такой результат связан с высо¬ ким риском развития гемодинамической нестабильности и высокой смертности в раннем послеоперационном периоде. В настоящее время существуют несколько методов для разграничения пре- и постобструкционных компонентов лёгочного сосудистого сопротивления. Kim и соавт., используя технику преграды лёгочной артерии, продемонстрировали, что показатели преобструкционного лёгочного сосудистого сопротивления более чем в 60% случаев имеют высокую корреляцию с существенной лёгочной гипертонией в послеоперационном периоде.Важным аспектом в выборе кандидатов на оперативное лечение является наличие у пациентов с ХТЭЛГ сопутствующей патологии, которая может суще¬ ственно влиять на риск смертности во время операции. Такие заболевания, как ИБС, паренхиматозные заболевания лёгких, почечная и печёночная недостаточ¬ ность, а также состояния, сопровождающиеся синдромом гиперкоагуляции, могут драматично ухудшать течение послеоперационного процесса. В то же время раз¬ решение ЛГ и правожелудочковой недостаточности путём лёгочной тромбэндарте- риоэктомии, часто улучшает печёночно-почечную функцию у пациентов с ХТЭЛГ. У пациентов с ИБС и клапанными пороками сердца проведение аортокоронарного шунтирования и протезирования клапанов возможно во время тромбартериоэк- томии. Следовательно, наличие серьёзной сопутствующей патологии не всегда является абсолютным противопоказанием для хирургического вмешательства при ХТЭЛГ, хотя и сопряжено с определённым риском. Исключение, пожалуй, состав¬ ляет лишь наличие тяжёлой ХОБЛ. Послеоперационный период у этой категории пациентов часто осложняется длительной вентиляционной поддержкой, что прак¬ тически сводит к нулю эффект от проведённой тромбэндартериоэктомии.Исследования последних лет показывают, что дооперационный уровень лёгоч¬ ной гипертензии тесно коррелирует с полеоперационной смертностью пациентов. Hartz и соавт. продемонстрировали, что исходный уровень лёгочного сосудистого сопротивления выше 1100 динхсекхсм‘5 и среднего давления в лёгочной артерии >50 мм рт.ст. являются предикторами высокой интраоперационной смертности. Особый интерес представляет исследование Jamieson и соавт., где на 500 паци¬ ентах с ХТЭЛГ показано, что исходный уровень лёгочного сосудистого сопро¬ тивления более чем 1000 динхсекхсм^ был связан с высокой послеоперационной смертностью в 10Д% случаев по сравнению с 1,3%, где исходное лёгочное сосуди¬ стое сопротивление было ниже. Вышеуказанные исследования вызвали большой интерес к возможности использования вазодилатационной терапии в предопе¬ рационном периоде у пациентов с ХТЭЛГ. Этот метод значительно улучшает гемодинамический профиль пациентов с самой серьёзной степенью ЛГ и снижает высокий риск интраоперационной смертности. При использовании внутривенно¬ го простациклина^ в течение 46±12 дней до оперативного вмешательства Nagaya и соавт. демонстрируют снижение лёгочного сосудистого сопротивления на 28% (с 1510±53 до 1088±58 динхсекхсм^) и снижение уровня мозгового натрийурети¬ ческого пептида у 12 пациентов с ХТЭЛГ. Интраоперационная смертность в этой группе составила 8,3% по сравнению с группой из 21 пациента, имеющей исходное лёгочное сосудистое сопротивление 1200 дин/сек на см'^ и интраоперационную смертность, равную нулю. Послеоперационные показатели лёгочной гемодинами¬ ки были сопоставимы между группами. Однако это исследование не смогло дока¬ зать, достигнет ли группа с большей лёгочной гипертонией низкой смертности при отсутствии предоперационного лечения вазодилататорами.
УШтИЗШ:v 630 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯi Лёгочная троибэндартериоэктомияТонкости лёгочной тромбэндартериоэктомии подробно рассмотрены в работа* Thistlethwaite и Jamieson. Успех хирургического вмешательства зависит от все- ' можности удаления организованного тромба, а не эмболэктомии. Хроничеожтромбоэмболы часто подвергаются фиброзу и плотно спаяны с сосудистой стенкой. Истинная эндартериоэктомия подразумевает под собой извлечение тромба с удале¬ нием интимы сосуда для восстановления адекватного кровотока. Однако слишком глубокое внедрение в стенк5^ артерии влечёт за собой опасность перфорации сосуд».Как правило, такие операции выполняются посредством медиальной стерното- мии, которая позволяет обеспечить доступ к магистральным сосудам обоих лёгких. Поскольку пациенты с выраженной хронической тромбоэмболической болезнью имеют, как правило, двустороннее поражение, преимущества этого доступа оче¬ видны. Кроме того, этот подход оптимален в случае необходимости проведения i манипуляций на коронарных артериях и клапанном аппарате сердца.Из 1190 пациентов, подвергшихся тромбэндартериоэктомии в Медицинском ; центре Сан-Диего, у 90 пациентов (7,6%) потребовалось проведение совместного i вмешательства по поводу закрытия овального отверстия, что происходит в 30% | случаев. 83 пациентам во время проведения тромбэндартериоэктомии было про- | ведено аортокоронарное шунтирование, 3 пациентам — протезирование трикуспн- дальнего клапана, 2 — митрального и 2 — аортального.Операция проводится в условиях периодического включения искусственного кро¬ вообращения и вентиляции лёгких, что, безусловно, является гарантией оптималь¬ ных условий для бескровных манипуляций на интиме лёгочных сосудов. Периоды исскуственного кровообращения ограничены 20 мин и могут начинаться только после полного восстановления нормального напряжения кислорода в смешаннсй венозной крови. При определённом опыте эндартериоэктомия из одной из главных ветвей лёгочной артерии может быть закончена за один период исскуственного кро¬ вообращения, т.е. за 20 мин. Такая техника позволяет проводить удаление тромбов из долевых, сегментарных и субсегмеиггарных артерий в пределах одной операции- За последние несколько лет появилось несколько модификаций хирургического подхода, которые способны снизить интраоперационный риск смертности и улуч¬ шить лёгочную гемодинамику после вмешательства. Dartevelle и соавт. сообщилиоб использовании во время операции видеосопровождаемой ангиоскопии для лучшей визуализации дистальных лёгочных артерий. Избирательная мозговая перфузия в течение периода искусственного кровообращения была предложена для снижения риска неврологических осложнений.Результаты лёгочной тромбэндартериоэктомииДля достижения хороших результатов лёгочной тромбэндартериоэктомии необходимо детальное изучение физиологических процессов, которые происходят в послеоперационном периоде. Хорошо известны осложнения, встречающиеся при различных видах сердечно-лёгочной хирургии, такие, как аритмии, нарушения коагуляции, гнойные осложнения, нарушения сферы сознания, нозокомиальные пневмонии. Пациенты, перенесшие тромбэндартериоэктомию, часто имеют две уникальных проблемы, которые неблагоприятно влияют на оксигенацию в после¬ операционном периоде: нарушение перфузии лёгких и спазм лёгочной артерии.Снижение перфузии лёгких клинически и биохимически связано с деятельно¬ стью нейтрофильного медиатора. Потребность в длительной ИВЛ (более 2 дней) имеется у одной трети всех пациентов, перенесших тромбэндартериоэктомию. что серьёзно увеличивает процент смертности этих пациентов. Хотя точные пато¬ физиологические механизмы нарушений кровоснабжения лёгочной паренхимы остаются неясными, их клинические проявления чётко описаны. В типичных случаях начальные изменения наступают в период от 24 до 72 ч после опера¬ тивного вмешательства. Степень повреждения очень вариабельна; от умеренной
ХРОНИЧЕСКАЯ ТРОМБОЭМБОЛИЧЕСКАЯ ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ 631-ипоксемии до развития острого фатального геморрагического поражения лёгких. Специфика такого рода повреждений заключается в ограничении их областями, в которых проводилась эндартериоэктомия. В этих же областях лёгкого происходит перераспределение артериального кровотока, увеличивая тем самым степень транспульмонального шунтирования крови и гипоксемии. Перераспределение лёгочного кровотока после тромбэндартериоэктомии происходит у большинства пациентов. Были попытки применения больших доз ГКС для контроля этой ситуа- ции, но их эффективность оказалась сомнительной, поскольку некоторое улучше¬ ние вентиляционно-перфузионного отношения было кратковременным. Имеются сообщения, что ингаляционный оксид азота значительно улучшал газообмен; однако этот эффект кратковременный и не замедляет прогрессирование болезни. В чрезвычайных ситуациях ИВЛ может с успехом использоваться для поддержа¬ ния адекватной оксигенации.Необходимо отметить, что отдалённые гемодинамические результаты тромбэн- дартериоэктомиии у пациентов с ХТЭЛГ были благоприятными. С восстановлени¬ ем перфузии происходит улучшение функции правого желудочка, возрастание сер¬ дечного выброса и снижение давления в лёгочной артерии. Вышеперечисленные гемодинамические эффекты были получены в работах нескольких независи¬ мых групп учёных в 1997 году. В Медицинском центре Сан-Диего за период с 1998 по 2002 гг. при наблюдении 500 пациентов до- и послеоперационные показатели лёгочной гемодинамики составляли; среднее давление в лёгочной артерии 46±11,0 и 28±10,1 мм рт.ст. (р <0,0001); сердечный выброс 3,8±1,3 и 5,5±1,5 л/мин (р <0,0001); лёгочное сосудистое сопротивление 893±443,5 и 285±214,7 динхсекхсм’^ (р <0,0001). Такие гемодинамические эффекты сохра¬ нялись в течение года после эндартериоэктомии и сопровождались улучшением функциональных показателей, газообмена и качества жизни пациентов.Однако не у всех пациентов с ХТЭЛГ отмечается положительная динамика сердечно-лёгочного паттерна после эндартериоэктомии. Приблизительно у 10-15% пациентов лёгочное сосудистое сопротивление остаётся выше 500 динхсекхсм а у Уз пациентов оперативное вмешательство не даёт даже минимальной выгоды. Это, по всей вероятности, объясняется тем, что при данной патологии имеет место дистальная васкулопатия, а удаление тромбоэмболов из проксимальных отде¬ лов лёгочных сосудов не влияет на степень лёгочной гипертензии и сердечную функцию. Эта категория пациентов имеет определённые особенности и трудности в течении постоперационного процесса. Нестабильность гемодинамики и высо¬ кий уровень лёгочной гипертензии после оперативного вмешательства зависит, главным образом, от уровня постнагрузки на правый желудочек, а также от физиологических последствий условий искусственного кровообращения: тяжёлой гипотермии, метаболического ацидоза и гипоксемии. Решение вышеуказанных проблем должно сводиться к минимизации системного потребления кислорода, оптимизации преднагрузки на правый желудочек, обеспечения адекватной ино- тропной поддержки при системной гипотензии, а также применению средств, улучшающих перфузию миокарда. Фармакологические попытки уменьшения постнагрузки у этих пациентов часто неэффективны, так как уровень лёгочного сосудистого сопротивления достаточно высок, и имеется риск резкого снижения системного сосудистого сопротивления. Особый интерес представляют данные, демонстрирующие преимущества применения ингаляционного оксида азота, кото¬ рый является селективным лёгочным вазодилататором и имеет минимальное влияние на системное сосудистое давление. Несомненный положительный эффект оказывает длительная вазодилатационная терапия путём внутривенного введения эпопростенола^ или антагонистов эндотелиновых рецепторов.Начиная с 1970 г. во всём мире было произведено более 2500 лёгочных тром- бэндартериоэктомий, причём 1700 из них выполнены на базе Медицинского цен-
632 НАРУШЕНИЯ ЛЁГОЧНОГО КРОВООБРАЩЕНИЯтра Сан-Диего. Смертность от этого рода оперативного вмешательства с 19% п колеблется от 4,4 до 24%. Факторы, определяющие риск интраоперационнай . ^ смертности, до конца не определены. Хотя, несомненно, что IV функциональньй класс по НУНА, возраст старше 70 лет, исходно высокий уровень лёгочного сосу¬ дистого сопротивления, наличие правожелудочковой дисфункции, коррелирую¬ щей с высоким давлением в правом предсердии, ожирение и длительный анамво лёгочной гипертензии отрицательно влияют на постоперационную выживаемость 47'' пациентов. К наиболее частым причинам смерти после лёгочной тромбэндарте-' ' ' риоэктомии относятся:• остановка сердца;• полиорганная недостаточность;• фатальное кровотечение из медиастинальных сосудов;• сепсис;• массивное лёгочное кровотечение.Серьёзное реперфузионное повреждение лёгких, высокая лёгочная гипертензия и дисфункция правого желудочка вносят наиболее существенный вклад в интрао- перационную смертность в большом ряде наблюдений.С развитием программы лёгочной тромбэндартериоэктомии в Медицинском центре Сан-Диего, начиная с 1970 года отмечается стойкое снижение смертносш у пациентов с ХТЭЛГ. Первые 200 пациентов, оперированные в период с 1970 по 1990 гг., имели смертность 17,0%. Смертность в группе 500 пациентов с ХТЭЛГ за период с 1994 по 1998 гг. снизилась до 8,8%, а с 1998 по 2002 гг. составила 4,4% у такого же количества пациентов. При наблюдении в течение 19 лет после тром¬ бэндартериоэктомии когорты, состоящей из 532 пациентов с ХТЭЛГ, АгсЬШаМ и соавт. продемонстрировали 6-летнюю выживаемость у 75% пациентов. Эя обнадёживающие результаты доказывают эффективность лёгочной тромбэндар¬ териоэктомии у пациентов с ХТЭЛГ при условии наличия абсолютных показаний для операции и тщательного отбора больных. Огромное значение для достижения положительных результатов при данном виде оперативного вмешательства игра¬ ют серьёзное дооперационное обследование пациентов, наличие хирургического опыта и грамотное ведение послеоперационного периода,СПИСОК ЛИТЕРАТУРЫ
Глава 37Тромбозы и тромбофилии в пульмонологии
Глава 38 Идиопатические интерстициальные пневмонииИдиопатические интерстициальные пневмонии (ИИП) объединяют несколько заболеваний из группы интерстициальных заболеваний лёгких (ИЗЛ), характеризующихся многими сходными признаками:• неизвестная природа заболеваний;• прогрессирующая одышка при физических нагрузках;• кашель, чаще непродуктивный;• крепитация при аускультации лёгких;• диффузные изменения на рентгенографии и компьютерной томографии лёгких;• рестиктивные вентиляционные изменения (снижение лёгоч¬ ных объёмов), снижение диффузионной способности лёгких, расширение альвеолоартериального градиента (АаР02).Однако данные заболевания имеют достаточное количество раз¬ личий (в первую очередь морфологических; разные подходы к тера¬ пии, различный прогноз), для того чтобы считать каждую из форм ИИП обособленной нозологической единицей. Классификация ИЗЛ представлена на рис. 38-1.Для русскоязычных врачей понятие «интерстициальная пневмо¬ ния» традиционно связано с воспалительным заболеванием парен¬ химы лёгких вирусной или бактериальной природы (атипичные микроорганизмы), что может вносить определённую путаницу при обсуждении проблемы ИИП, поэтому в некоторых согласительных документах подчеркивается, что эквивалентом термина «пневмо¬ ния» является «пневмонит» — термин, более привычный для упо¬ требления в контексте ИЗЛ.Одной из первых классификаций ИИП является классификация иеЬо«^, предложившего в 1969 г. выделять пять морфологических типов ИИП: обычная интерстициальная пневмония, дескваматив¬ ная интерстициальная пневмония, интерстициальная пневмония, ассоциированная с бронхиолитом, гигантоклеточная интерсти¬ циальная пневмония, лимфоидная интерстициальная пневмония. Впоследствии данная классификация несколько раз менялась, были описаны новые виды ИИП — неспецифическая интерстициаль¬ ная пневмония и острая интерстициальная пневмония. В 2000 г. Американским торакальным обществом и Европейским респира-
636 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХИнтерстициальные заболевания лёгких {ИЗЛ)ИЗЛ известной этиологии (СЗСТ, лекарственные и др.)ИИПг ранулематозные ИЗЛ{саркоидоз и др.)Другие ИЗЛ (ЛАМ.ГЦХидр.)ИЛФ1Другие ИИП (не-ИЛФ)ИЛФ - идиопатический лёгочный фиброз; ДИП - десквамативная интерстициальная пневмония; РБ-ИЗЛ - респираторный бронхиолит, ассоциированный с интерстициальным заболеванием лёгких; ОИП - острая интерстициальная пневмония; КОП - криптогенная организующаяся пневмония; НИИ - неспецифическая интерстициальная пневмония; ЛИП - лимфоидная интерстициальная пневмонияСЗСТ - системные заболевания соединительной ткани; ЛАМ - лимфанплолейомиоматоз; ГЦХ - гистиоцитоз X.ДИПОИПНИИРБ-ИЗЛКОПЛИПРис. 38-1. Классификация диффузных паренхиматозных заболеваних лёгких [АТЗ/ЕПЗ, 2002].торным обществом (АТ8/ЕК8) была предложена новая клинике-патологическая классификация, принципом построения которой является соответствие каждой клинической форме ИИП определённого гистологического варианта ИИП. В дан¬ ной классификации рассматривается семь форм ИИП (табл. 38-1).Таблица 38-1. Клинико-патологическая классификация идиопатических интерстициальных пневмо¬ ний {АТ8/ЕР8, 2000)Гистологический паттернКлинический диагнозОбычная интерстициальная пневмонияИдиопатический лёгочный фиброзНеспецифическая интерстициальная пневмонияНеспецифическая интерстициальная пневмонияОрганизующаяся пневмонияКриптогенная организующаяся пневмонияДиффузное альвеолярное повреждениеОстрая интерстициальная пневмонияРеспираторный бронхиолитРеспираторный бронхиолит, ассоциированный с интер¬ стициальным заболеванием лёгкихМакрофагальная интерсшциальная пневмонияДесквамативная интерстициальная пневмонияЛимфоцитарная интерстициальная пневмонияЛимфоцитарная интерстициальная пневмонияОсобенности морфологической и клинической картины больных с ИИП пред¬ ставлены в табл.38-2 и 38-3.
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 637Таблица 38-2. Морфологические особенности больных с идиопатическими интерстициальными пневмониямиМорфологический тип ИИПГистологическая картинаОбИПНарушение архитектуры лёгких, фиброз с «сотовыми» изменениями, ф(жусы фибро¬ бластов. Неоднородность данных изменений в биоптате (временная гетерогенность)НИИВариабельное интерстициальное воспаление и фиброз; однородность данных изменений в биоптате; фибробластические фокусы очень редки или отсутствуютЛИПВыраженная лимфоцитарная инфильтрация интерстиция часто ассоциирована с перибронхиальными лимфовдными фолликулами {фолликулярный бронхиолит)ДАДиффузный процесс. Утолщение альвеолярных перегородок, организация альвеол, гиалиновые мембраныОПЛёгочная архитектоника сохранена. Пятнистое распространение полиповидной гра¬ нуляционной ткани в дистальных воздухоносных путяхДИПРавномерное поражение паренхимы лёгких. Альвеолярные макрофаги в просвете альвеол, минимальное поражение интерстицияРБ-ИЗЛБронхоцентричная аккумуляция альвеолярных макрофагов, минимальное воспаление и фиброзОбИП — обычная интерстициальная пневмония; НИЛ — неспецифическая интерстициальная пнев¬ мония: ЛИП - лимфоидная интерстициальная пневмония; ДА — диффузное альвеолярное повреж¬ дение; ОП— организующаяся пневмония; ДИП — десквамативная интерстициальная пневмония: РБ-ИЗЛ - респираторньгй бронхиолит, ассоциированный с интерстициальным заболеванием лёгких.14диопатический лёгочный фиброзИдиопатический лёгочный фиброз (ИЛФ) является одним из наиболее часто встречающихся заболеваний из группы ИИП. Картину ИЛФ в 1960 г. описал Scadding, и он же впервые ввёл термин «фиброзирующий альвеолит». Возможно, что самое первое описание ИЛФ принадлежит Rindfleisch, описавшим в 1897 г. «кистозный цирроз лёгких» — заболевание лёгких, характеризующееся уплотне¬ нием и сморщиванием паренхимы лёгких и формированием «сотового лёгкого».В Международном согласительном документе ATS/ERS (2000) предложено сле¬ дующее определение ИЛФ: ИЛФ является специфической формой хронической интерстициальной фиброзирующей пневмонии, ограниченной лёгкими, и ассо¬ циированной с гистологической картиной обычной интерстициальной пневмонии по данным хирургической (торакоскопической или открытой) биопсии лёгких. Этиология ИЛФ неизвестна.Синонимами ИЛФ являются «идиопатический фиброзирующий альвеолит» — термин, традиционно используемый в нашей стране, и «криптогенный фибрози¬ рующий альвеолит», получивший большее распространение в Великобритании. Понятия «идиопатический» и «криптогенный», несмотря на небольшое смысло¬ вое различие, в настоящее время принято считать синонимами, обозначающими скрытую, неясную природу заболевания.ПАТОГЕНЕЗЗаболевание рассматривается как процесс, протекающий в несколько этапов:• первичное повреждение эпителиальных и/или эндотелиальных клеток лёгоч¬ ной паренхимы с развитием воспалительной реакции;• восстановление структуры повреждённой ткани с накоплением мезенхималь¬ ных клеток и избыточным развитием экстрацеллюлярного матрикса/фиброза.
Таблица 38-3. Клиническая характеристика больных с идиопатическими интерстициальными пневмониямиИЛФДИПРБ-ИЗЛОИПКОПНИПЛИПСредний возраст (годы)65403550555547Заболевание описа¬ но у детейНетРедкоНетРедкоНетИногдаНетТечениеХроническое (>12 мес)Подострое (месяцы- годы)Подострое (месяцы- годы)Внезапное (1-2 нед)Остро или под- остроПодострое хроническое (месяцы-годы)Хроническое (>12 мес)Барабанные папочкиЧастоЧастоНетНетНетИногдаРедкоЛихорадкаРедкоНетНет50%70%10-30%33%ТерапияПлохой ответ на ГКС и цитостатикиОтказ от курения, хороший ответ на ГКСОтказ от курения, ответ на ГКС не ясенПлохой ответ на ГКСХороший ответ на ГКСХороший ответ на ГКСХороший ответ на ГКСПрогнозПятилетняя летальность 80% (медиана выживаемо¬ сти 2-3 года)ПятилетнАя леталь¬ ность менее 5%Семилетняя леталь¬ ность 25 лет60% леталь¬ ность в течение 6 месПятилетняя летальность менее 5%Клеточный НИП: пяти¬ летняя летальность менее 10% (медиана выживаемости более 10 лет); фиброзный НИП: пятилетняя летальность 10% (медиана выживаемости 6-8 лет)Медиана выживае¬ мости > 11 лето>со09ИЛФ - идиопатический лёгочный фиброз; ДИП - десквамативная интерстициальная интерстициальным заболеванием лёгких: ОИП — острая интерстициальная пневмония; скал интерстициальная пневмония: ЛИП — лимфоидная интерстициальная пневмония.пневмония; РБ-ИЗЛ — респираторный бронхиолит, ассоциированный с КОП— криптогенная организующаяся пневмония: НИП — неспецифиче-
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 639Таким образом, воспалительный процесс не предшествует появлению фиброза и также не играет большой роли в прогрессировании заболевания. В настоящее время наиболее привлекальной является гипотеза, согласно которой ИЛФ — «эпителиально-фибробластическое» заболевание. Согласно данной модели ком¬ плексное взаимодействие между повреждением эпителиальных клеток и мезен- хиамальными клетками приводит к дезрегуляции механизмов восстановления с избыточной продукцией профибротических цитокинов, экстрацелюллярного матрикса и нарушенным ангиогенезом.ЭПИДЕМИОЛОГИЯ И ПРЕДРАСПОЛАГАЮЩИЕ ФАКТОРЫПо данным Raghu и соавт., распространённость ИЛФ в США составляет у лиц 18-34 лет 4 случая на 100 ООО населения общей популяции и 227,5 случаев на 100 ООО населения — у лиц старше 75 лет, заболеваемость ИЛФ составила 1,2-76,4 случаев на 100 ООО в год. В среднем распространённость и заболеваемость ИЛФ в США составляют 42,7 случаев на 100 ООО населения и 16,3 случаев на 100 ООО в год соответственно. В Великобритании распространённость значительно ниже — 6 случаев на 100 ООО населения. Данные разногласия по распространен¬ ности и летальности ИЛФ очень трудно трактовать, в основе лежат различные подходы в кодировании заболевания в национальных регистрах, различия в эко¬ логических условиях, уровне диагностики заболевания и других факторах.Несмотря на наличие в названии заболевания термина идиопатический или криптогенный, предпринимаются активные попытки поиска причины ИЛФ. На роль факторов, способных вызвать первичное повреждение, претендуют несколь¬ ко агентов — курение, определённые виды пыли, вирусы, в исследовании случай- контроль Baumgartner и соавт. было установлено, что курение сигарет повышает риск развития ИЛФ в 1,6-2,9 раза. В нескольких эпидемиологических исследова¬ ниях была показана связь ИЛФ с профессиональным контактом с металлической и древесной пылью.На роль вирусов, принимающих участие в патогенезе ИЛФ, претендуют латент¬ ные, «медленные» вирусы. Обсуждается роль вирусов гепатита С, аденовирусов, вируса Эпштейна-Барр, цитомегаловирусов, парагриппа 1 и 3, герпес-вирусов 6. Вирусные протеины способны усиливать реакции хронического воспаления и репарации, активировать продукцию коллагена I типа и выступать в роли транс- активирующих факторов, т.е. взаимодействовать с генами, рег)^лирующими кле¬ точный рост. Вирусы могут не только выступать в качестве первичного триггера развития повреждения при ИЛФ, репликация вируса в уже повреждённой ткани может потенцировать прогрессирование заболевания на поздних стадиях. Однако убедительных доказательств роли вирусов в генезе развития ИЛФ пока нет.Относительно недавно была установлена ассоциация между рефлюкс-эзофа- гитом и ИЛФ. В исследовании Tobin и соавт. у 16 из 17 больных ИЛФ были обнаружены признаки дистального или проксимального эзофагита, вызванного рефлюксом кислоты из желудка (р=0,02 по сравнению с контролем).КЛИНИЧЕСКАЯ КАРТИНАЗаболевание чаще всего встречается у пациентов в возрасте старше 50 лет. Отмечается преобладание заболевания у мужчин, соотношение полов составляет примерно 1,7-i-l в пользу мужчин. Основными жалобами больных являются одыш¬ ка и непродуктивный кашель. По мере развития заболевания отмечается нараста¬ ние одышки, вплоть до полной инвалидизации больного: из-за одышки больной не способен произнести фразу, предложение, не может ходить, обслуживать себя. Начало болезни, как правило, незаметное, хотя иногда больные описывают дебют ИЛФ как острое респираторное заболевание, что предполагает роль вирусной инфекции в генезе заболевания. Так как болезнь прогрессирует довольно медлен-
640 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХНО, пациенты успевают адаптироваться к своей одышке, постепенно снижая активность и переходя к более пассивному образу жизни. Большинство пациент« на момент обследования имеют анамнез заболевания длительностью до 1-3 жк. и очень редко — менее трёх мес. Частым симптомом ИЛФ является сухой кашеА (около 75%), иногда — продуктивный кашель (до 20%), даже продукция гнойвой мокроты, особенно у больных с тяжёлыми формами ИЛФ (табл. 38-4), Лихорадка не характерна для ИЛФ, Кровохарканье также не характерно для ИЛФ, и появле¬ ние данного признака у больного ИЛФ должно ориентировать врача к поиску опу¬ холи лёгких, которая у больных ИЛФ встречается в 4-12 раз чаще по сравнешш с лицами общей популяции, даже после учёта анамнеза курения. Другими симпто¬ мами может быть общая слабость, артралгии (около 20%), миалгии, изменение ногтевых фаланг в виде <:барабанных палочек» (50-90%).Таблица 38-4. Клиническая картина у больных с идиопатическим лёгочным фиброзом [Costabei et Britton, 2004]ПоказателиМужчиныЖенщиныВсе больныеСредний возраст, лет676867Симптомы, %Одышка879289Кашель737775Артрит/артралгии172419Нет симптомов«Барабанные палочки»544049Анамнез куренияКурящие221319Бывшие курильщики703658Не курившие5124ФВД (% от должных значений)ОФВ,787978ФЖЁЛ787978485350Характерным аускультативным феноменом при ИЛФ является конечно- инспираторная крепитация, которую сравнивают с «треском целлофана» или замком-молнией. По сравнению с крепитацией при других заболеваниях (пнев¬ мония, бронхоэктазы, застойные процессы в лёгких) крепитация при ИЛФ более нежная: менее громкая и более высокая по частоте, выслушивается на высоте вдоха, т.е. в конечно-инспираторный период. Наиболее часто хрипы выслушива¬ ются в заднебазальных отделах, хотя при прогрессировании заболевания крепи¬ тация может выслушиваться над всей поверхностью лёгких и в течение всей фазы вдоха. Сухие хрипы могут быть слышны у 5-10% больных и обычно появляются при сопутствующем бронхите.По мере прогрессирования заболевания появляются признаки дыхательной недостаточности и лёгочного сердца: диффузный серо-пепельный цианоз, усиле¬ ние II тона над лёгочной артерией, тахикардия, 5^ галоп, набухание шейных вен, периферические отёки. Снижение массы тела больных вплоть до развития кахек¬ сии является характерным признаком терминальной стадии ИЛФ.
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 641ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯЛабораторные тесты обычно не имеют большого значения при ИЛФ. До 90% больных имеют умеренное повышение СОЭ, у большинства обнаруживают цирку¬ лирующие иммунные комплексы, у 30-40% пациентов — повышение общего уров¬ ня иммуноглобулинов и криоглобулины. Примерно до 20-30% больных ИЛФ без сопутствующих системных заболеваний имеют повышенные титры ревматоидного фактора и антинуклеарного фактора. У больных ИЛФ может быть повышен сыво¬ роточный уровень общей лактатдегидрогеназы (ЛДГ), возможным источником которой являются альвеолярные макрофаги и альвеолоциты П типа. У больных с гипоксемией может быть повышено число эритроцитов и уровень гематокрита. Лейкоцитоз периферической крови говорит в пользу инфекции, хотя может быть также и признаком приёма больными глюкокорткоидов. Значительное повышение СОЭ у больных ИЛФ может являться маркёром инфекционного или опухолевого заболевания.В качестве суррогатных маркёров активности заболевания могут бьггь исполь¬ зованы некоторые продукты секреции альвеолоцитов И типа, которые при ИЛФ подвержены значительной гиперплазии и гипертрофии, и характеризуются повы¬ шенной секреторной функцией, в условиях усиления проницаемости альвеоло- капиллярной мембраны при активном альвеолите происходит значительное повы¬ шение данных продуктов в сыворотке крови. К числу сывороточных маркёров при ИЛФ относятся протеины сурфактанта А и О и муцин-антигены КЬ-6, альвеоло- муцин ЗЕС5.ФУНКЦИОНАЛЬНЫЕ ЛЁГОЧНЫЕ ТЕСТЫИЛФ относится к рестриктивным лёгочным заболеваниям, поэтому характер¬ ными функциональными особенностями заболевания является снижение лёгочно¬ го комплайенса и снижение статичесюїх лёгочных объёмов. Соотношение ОФВ^/ ФЖЁЛ (коэффициент Тиффно) находіггся в пределах нормы или даже повышено. Одним из ранних признаков заболевания является снижение При ИЛФ является функциональным показателем, наиболее тесно связанным с клиниче¬ скими симптомами (диспноэ) и глобальной протяжённостью патологического процесса в лёгких по данным КТВР. Выраженное снижение ОЦд (<50%), как пра¬ вило, ассоциировано с развитием лёгочной гипертензии и расширением альвеоло- артериального градиента АаРО^ при физической нагрузке.На ранних этапах заболевания газовый анализ артериальной крови, выполнен¬ ный в покое, практически не изменён, хотя при физической нагрузке уже проис¬ ходит десатурация, что отражается снижением парциального напряжения кисло¬ рода артериальной крови РаОз и расширением АаРОз. По мере прогрессирования заболевания гипоксемия появляется и в покое и сопровождается гипокапнией, отражающей особенности дыхательного паггерна больных — частого поверхност¬ ного дыхания, гиперкапния появляется только на терминальных этапах ИЛФ.РЕНТГЕНОГРАФИЯ ГРУДНОЙ КЛЕТКИНаиболее частым рентгенографическими признаками ИЛФ являются двусто¬ ронние изменения ретикулярного характера, более выраженные в нижних отде¬ лах лёгких. На ранних этапах развития заболевания может наблюдаться лишь некоторое уменьшение объёма лёгочных полей и понижение прозрачности лёгких по типу «матового стекла», данные изменения особенно заметны при сравнении серийных рентгенограмм. При прогрессировании заболевания ретикулярный паттерн становится более грубым, тяжистым, появляются округлые кистозные просветления (0,5-2 см), отражающие формирование «сотового лёгкого». Также на поздних стадиях ИЛФ рентгенологическая картина может выявлять девиацию
ч'ёй.'642 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХТрахеи вправо, трахеомегалию. Вовлечение плевры, внутригрудная аденопаящ локализованные паренхиматозные уплотнения не характерны для ИЛФ и шшуг отражать либо другое интерстициальное заболевание лёгких, либо осложнся* заболевания, такие, как инфекции или оп)гхоли.КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ ВЫСОКОГО РАЗРЕШЕНИЯБолее ценную информацию можно получить при помощи КТВР. Характерны!* находками при КТВР являются нерег}^лярные линейные тени, кистозные про^ светления, фокальные очаги снижения прозрачности лёгочных полей по тщ «матового стекла» (не более 30% от общей площади лёгких), утолщение и иррегу¬ лярность бронхиальных стенок. Кроме того, в областях с наиболее выраженньош изменениями часто выявляют признаки дезорганизации лёгочной паренхимы н тракционные бронхоэктазы (рис. 38-2, см. также цветную вклейку). Наибольшие изменения выявляют в базальных и субплевральных отделах лёгких. КТВР пат¬ терн и распределение изменений в большинстве случаев являются патогномо- ничными для ИЛФ. По данным нескольких исследований, аккуратность диагноза ИЛФ по данным КТВР в исследовательских центрах составляет до 90%. В недавно проведённом исследовании Raghu и соавт. чувствительность, специфичность н положительная предсказательная ценность КТВР в диагностике ИЛФ составили соответственно 79, 90 и 95%.КТВР-признаки отражают морфологические признаки ИЛФ: ретикулярный паттерн соответствует фиброзу, а паттерн «матового стекла» — клеточной инфиль¬ трации. Именно поэтому КТВР-картина имеет прогностическое значение, в иссле¬ довании Wells и соавт. лучший прогноз имели пациенты с паттерном «матового стекла», худший — с ретикулярным паттерном и промежуточный — со смешанным паттерном. Больные с паттерном «матового стекла» хорошо отвечали на терапию глюкокортикоидами, улучшение клинического статуса этих больных сопровожда¬ лось улучшением КТВР-картины, в то время как ни в одном случае не наблюдалось уменьшение ретикулярного паттерна.При сочетании ИЛФ с эмфиземой лёгких КТВР является единственным мето¬ дом, позволяющим оценить выраженность эмфиземы, которая преимущественно локализуется в верхних отделах, и разграничить её с кистозными изменениями, характеризующими «сотовое лёгкое».Рис. 38-2. Идиопатический лёгочный фиброз: а — КТВР; указаны ф01сусы фибробластов).б — гистологическая картина (стрелками
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 643МОРФОЛОГИЧЕСКАЯ КАРТИНА ИНТЕРСТИЦИАЛЬНОГО ЛЁГОЧНОГО ФИБРОЗАМорфологическая картина при ИЛФ соответствует гистологическому пат¬ терну обычной интерстициальной пневмонии (ОбИП), Ключевыми чертами ОбИП являются массивный фиброз, вызывающий ремоделирование архитекту¬ ры лёгких с частым формирований «сотовых» изменений; фокусы фибробластов, расположенные по периферии плотных фиброзных полей; «пятнистый» или негомогенный тип распределения морфологических изменений (рис. 38-2, см, цветную вклейку). Пятнистость или гетерогенность поражения паренхимы про¬ является чередованием неизмененных лёгочных единиц, очагов интерстициаль¬ ного воспаления, фиброза и кистозных (сотовых) изменений. Изменения больше выражены в субплевральной и парасептальной областях паренхимы лёгких, осо¬ бенно в заднебазальных сегментах.Зоны фиброза содержат ацеллюлярный коллаген, фокусы фибробластов, актив¬ но синтезирующих коллаген, и миофибробласты. Зоны сотовой дегенерации лёгких представлены грубой соединительной тканью, в которую замурованы кистозно расширенные воздухоносные пространства, выстланные изнутри гипер- плазированным бронхиолярным или кубовидным альвеолярным эпителием, аль¬ веолоциты I типа замещаются альвеолоцитами И типа, иногда присутствуют при¬ знаки метаплазии. Также в полях фиброза часто находят реактивную мышечную гиперплазию, происхождение гиперплазированных миоцитов, вероятнее всего, имеет связь с бронхиолами или мелкими кровеносными сосудами, чем с мио- фибробластами из молодой соединительной ткани. Внутри изменённых альвеол могут обнаруживаться муцин, белковый детрит, кристаллы холестерина, макрофа¬ ги и другие клетки. Стенки сосудов значительно утолщены в области фиброзных полей и могут бьггь нормальными в непораженной ткани лёгких. Следует подчер¬ кнуть, что паттерн ОбИП при ИЛФ практически неотличим при ОбИП, которая может присутствовать и при других ИЗЛ (системные заболевания соединительной ткани, хронический гиперчувствительный пневмонит, лекарственно обусловлен¬ ный лёгочный фиброз), т.е. не является патогномоничным для ИЛФ. Таким обра¬ зом, справедливой является новая догма: «все ИЛФ являются ОИП, но не все ОИП являются ИЛФ».БРОНХОАЛЬВЕОЛЯРНЫЙ ЛАВАЖБАЛ имеет определённое диагностическое значение при ИЛФ, позволяет оценить течение, прогноз и мониторирование воспаления при терапии заболе¬ вания. Характерными находками БАЛ при ИЛФ является повышение общего числа клеток, увеличение числа нейтрофилов и эозинофилов. Однако данные признаки встречаются и при других ИЗЛ (асбестоз, лекарственно обусловлен¬ ные лёгочные фиброзы, силикозы), что ограничивает диагностическую ценность БАЛ. Эозинофилия БАЛ, как абсолютное число, так и процент эозинофилов, может быть связана с неблагоприятным прогнозом ИЛФ. Пациенты с повышен¬ ным числом эозинофилов в БАЛ имеют, как правило, плохой ответ на терапию глюкокортикоидами. Лимфоцитов БАЛ связан с хорошим ответом на терапию глюкокортикоидами и относится к положительным прогностическим факторам заболевания. Однако не исключено, что ранние наблюдения повышения лимфо¬ цитов БАЛ включали не только больных ИЛФ, но и больных с другими формами ИИП (например, НИП),ПОДХОДЫ к ДИАГНОСТИКЕ ИНТЕРСТИЦИАЛЬНОГО ЛЁГОЧНОГО ФИБРОЗАДлительное время считалось, что трансбронхиальная биопсия (ТББ) не имеет диагностического значения при ИЛФ, что связано с малым размером (2-5 мм) получаемого образца и, следовательно, его меньшей информативностью. Учитывая
I 644 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ^ относительную безопасность ТББ, данная процедура часто выполняется на ^ них этапах обследования больных для исключения других ИЗЛ; грануле ^ (саркоидоз, гиперчувствительный пневмонит), криптогенной организующей^! ^ пневмонии, опухолей, инфекционных заболеваний, эозинофильной пневмошн^* гистиоцитоза, альвеолярного протеиноза. Относительно недавно исследоваш|4выполненное в двух известных центрах США, продемонстрировало, что у болыво| доли больных ИЛФ (более 40%) морфологический диагноз ОбИП может биф установлен по данным ТББ (при наличии в образцах ткани фокусов фибробласп» и «сотовых» изменений).Открытая биопсия лёгких является «золотым» диагностическим стандарпяр при ИЛФ и позволяет не только установить диагноз, но и предсказать про¬ гноз заболевания и возможный ответ на терапию. Менее инвазивным методош биопсии, получающим все большую популярность в последнее время являете» торакоскопическая биопсия лёгких (ТСБЛ). ТСБЛ позволяет выполнить забортакого же числа образцов, такого же размера образцов, что и при открытой биопсии, получить информацию в 95%, однако при ТСБЛ сокращается продол¬ жительность дренажа плевральной полости, длительность пребывания больных Б стационаре и число осложнений процедуры (около 9%). Средняя продолжи¬ тельность дренирования плевральной полости зависит не от числа или размера биоптатов, а от выраженности функциональных изменений (например, показана обратная корреляция с общей ёмкостью лёгких). Хирургическая биопсия лёгких требуется далеко не всем больным. По данным крупных эпидемиологических исследований, хирургическая биопсия лёгких проводится только у 11-12% боль¬ ных ИЛФ,Определённый диагноз ИЛФ при наличии хирургической биопсии, доказываю¬ щей ОбИП, должен включать следующие признаки:• исключение других ИЗЛ, вызванных известными причинами, такими, как приём лекарств, экспозиция к вредным факторам внешней среды, СЗСТ;• изменения ФВД включают свидетельства рестриктивных нарушений [сни¬ жение жизненной ёмкости лёгких и, часто, повышение отношения ОФВ^/ ФЖЁЛ] и/или нарушения газообмена [повышение АаР02 (альвеолоартери¬ ального градиента по кислороду) в покое или при нагрузке или снижение DLcoJ;• типичные изменения (описаны ниже), по данным рентгенографии грудной клетки или компьютерной томографии высокого разрешения.Несмотря на то что хирургическая биопсия лёгких позволяет установить самый точный (определённый) диагноз ИЛФ и является «золотым стандартом» диа¬ гностики, она не является обязательным и единственно верным диагностическим методом ИЛФ. Широкое использование хирургической биопсий лёгких при ИЛФ сдерживают её очевидные недостатки: инвазивность, высокая стоимость процеду¬ ры, задержка в назначении терапии, невозможность многократного повторения. Многим больным с предполагаемым ИЛФ хирургическая биопсия не показана из-за тяжести их состояния. Кроме того, хирургическая биопсия сопряжена и с высоким риском для больного, в исследовании Utz и соавт., проанализировавши¬ ми исходы больных ИЛФ после биопсии лёгких за десятилетний период в клинике Mayo, была выявлена довольно высокая летальность больных через 30 дней после данной процедуры — около 22%.Согласительная комиссия ATS/ERS предложила клинико-рентгенологические критерии для определения вероятного диагноза ИЛФ без проведения биопсии лёг¬ ких (см. ниже), у взрослого иммунокомпетентного больного наличие всех четырёх больших критериев и как минимум трёх из четырёх малых критериев повышает вероятность правильного диагноза ИЛФ.
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ $45Клинико-рентгенологические критерии вероятного диагноза ИЛФ 3Большие критерии: g• исключение других ИЗЛ, вызванных известными причинами, такими, как ^ приём лекарств, экспозиция к вредным факторам внешней среды, системные f заболевания соединительной ткани; . у,• изменения функции внешнего дыхания, включающие рестриктивные измене- ' :•> ния и нарушение газообмена;• двусторонние ретикулярные изменения в базальных отделах лёгких с мини- мальными изменениями по типу «матового сгекла» по данным компьютерной томографии высокого разрешения;• по данным трансбронхиальной биопсии или БАЛ нет признаков, свидетель¬ ствующих об альтернативном диагнозе.Малые критерии:• возраст более 50 лет;• незаметное, постепенное появление диспноэ при физической нагрузке;• длительность заболевания более 3 мес;• инспираторная крепитация в базальных отделах лёгких.По данным исследования Raghu и кол., только на основании клинических кри¬ териев можно поставить диагноз ИЛФ с очень высокой специфичностью (97%), однако чувствительность клинических критериев не такая высокая (62%), что предполагает, что до одной трети больных с подозрением на ИЛФ и недавним началом заболевания будут нуждаться в проведении биопсии лёгких.Проведение хирургической биопсии лёгких может быть рекомендовано боль¬ ным с атипичными клиническими и КТВР-признаками ИЛФ при взвешенном риске инвазивного характера данной процедуры (см. ниже).Показания к хирургической биопсии лёгких у больных с ИЗЛ:• клиническая картина, не типичная для ИЛФ;• возраст менее 50 лет;• системные признаки заболевания;• рентгенологическая картина, не характерная для ИЛФ;• «нормальная» рентгенологическая картина;• быстрое прогрессирование заболевания;• рецидивирующие пневмотораксы;• польза от правильного диагноза превышает риск хирургической манипуляции. ЛЕЧЕНИЕК сожалению, приходится признать, что современная медицина пока не распо¬ лагает эффективными методами терапии ИЛФ. До сих пор отсутствуют данные о лечении, способном улучшить выживаемость или качество жизни больных ИЛФ.Противовоспалительная терапияСовременная терапия ИЛФ построена в основном на противовоспалитель¬ ной терапии (ГКС и цитостатики), т.е. препаратах, способных воздейство¬ вать на воспалительные и иммунологические звенья развития заболевания,В основе такого подхода лежит положение, что прогрессирующий фиброз, лежа¬ щий в основе ИЛФ, является следствием хронического персистирующего воспале¬ ния, что хроническое воспаление предшествует и неизбежно ведёт к фиброзу и что агрессивное подавление воспаления может блокировать последующее формирова¬ ние фиброзных изменений.Широко используют три режима противовоспалительной терапии: монотера¬ пия ГКС, комбинация ГКС с азатиоприном и комбинация ГКС с циклофосфами¬ дом. Согласительная комиссия ATS/ERS рекомендует отдавать предпочтение двум последним режимам (см. ниже), хотя веских оснований их превосходства над монотерапией ГКС нет.
646 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХСовременные рекомендации терапии ИЛФ (ATS/ ERS, 2000)• Глюкокортикоиды (преднизолон или другие препараты в дозе, эквивалевг-ной преднизолону)❖ 0.5 мг/кг «тощей» массы тела в сутки в течение 4 нед;❖ 0,25 мг/кг идеальной массы тела в сутки в течение 8 нед;❖ снижать дозу до 0,125 мг/(кгхсут) или 0,25 мг/кг через день.Плюс:• Азатиоприн❖ 2-3 мг/кг «тощей» массы тела в сутки; максимальная доза 150 мг в сутки;начальная доза составляет 25-50 мг в сутки, дозу повышают на 25 мг каж¬ дые 1-2 нед до достижения максимальнойили• Циклофосфамид❖ 2 мг/кг «тощей» массы тела в сутки,❖ максимальная доза 150 мг в сутки,❖ начальная доза составляет 25-50 мг в сутки, дозу повышают на 25 мг каж¬ дые 1-2 нед до достижения максимальной.Лечение проводят, как минимум, в течение 6 мес. Ответ на терапию определяется клиническими симптомами, данными рентгенографии и функциональными показа¬ телями. Обязательно тщательное мониторирование побочных эффектов терапии.Во многих центрах основой медикаментозной терапии ИЛФ по-прежнему оста¬ ются таблетированные ГКС. Терапия ГКС приводит к объективному эффекту липіь у 15-20% больных ИЛФ (табл. 38-5), однако «ответчики» имеют более благо¬ приятный прогноз по сравнению с «неответчиками», и. к сожалению, очень часто до начала терапии нельзя с уверенностью предсказать ответ на терапию. Лучший ответ на ГКС наблюдается у более молодых больных (младше 50 лет), женщин при наличии изменений по типу «матового стекла», по данным КТВР и повышенной пропорции лимфоцитов (>25%) в жидкости БАЛ.Таблица 38-5. Исследования, посвящённые иммуносітірессивной терапии у больных идиопатиче¬ ским лёгочным фиброзомИсследованиеТерапияДизайн исследованияРезультаты исследованияDouglas et al., 1997Преднизолон vs колхицинПроспеетивное исследование,22 больных получали колхицин,22 больных получали преднизолон (исторический контроль)У двух пациентов из группы пред- ниэолона отмечено улучшение ОЦ.д, и у четверых — улучшение ФЖЕЛDouglas et al., 1998Преднизолон vs колхицинРандомизированное исследова¬ ние, включавшее 26 больных; 12 пациентов получали преднизолонНи у одного больного из группы преднизолона не было отмече¬ но улучшения; 9 из 12 больных умерли, стабильное состояние отмечено у 2 из 12 больныхZiesche et al., 1999Преднизолон vs ИФ-7ІЬРандомизированное контролируе¬ мое исследование, включавшее 18 больных, ранее получавших ГКС и цитостатикиУхудшение у всех больных, при¬ нимавших преднизолонDaniil et al., 1999преднизолон vs преднизолон и азатиоприн vs преднизолон и циклофосфамидРетроспективное исследование; включало 12 больных, получав¬ ших либо преднизолон (п=3) или преднизолон и азатиоприн (л=3) или преднизолон и циклофосфа¬ мид (п=6)Улучшение у 1 из 12 больных {прирост ФЖЁЛ и/или 0Ц,д>15%): у 2 из 12 больных — стабильное состояние; у 9 из 12 больных — ухудшение или смерть
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 647Окончание табл. 38-5Nicholson et al,, 2000Преднизолон преднизолон и циклофосфамидРетроспективное исследование; включало 23 больных, которые получали преднизолон (п-10) или преднизолон и циклофосфамид (п-18)Улучшение у 3 из 28 больных (прирост ФЖЁЛ или 0Ц^>15%); у 19 — стабильное состояние; у 8 — ухудшениеZisman et а!., 2000ЦиклофосфамидПроспективное исследование, 19 больных, у которых не было ответа на преднизолонУлучшение у 1 из 19 больных (снижение по шкале CRP >10 баллов)Douglas et al.. 2000Преднизолон УЗ колхицин УЗ отсут¬ ствие терапииРетроспективный анализ 487 больныхНе было отмечено различий в группах больных, получавших и не получавших терапиюRiha, 2002ГКС У8 ГКС и циклофосфамид уз отсутствие терапииРетроспективный анализ 27 боль¬ ных, 8 больных получали только ГКС, 7 пациентов получали ГКС и циклофосфамид, 8 не получали терапиюНе было отмечено различий в группах больных, получавших и не получавших терапиюCollard et al., 2004Преднизолон и циклофосфамид уз отсутствие терапииРетроспективный анализ 164 больных; 82 получали тера¬ пию преднизолоном и цикло¬ фосфамидом; 82 не получали терапиюНе было отмечено различий в группах больных, получавших и не получавших терапиюОбычно начальная суточная доза преднизолона составляет 1,0 мг/кг иде¬ ального веса/сутки (максимум до 80 мг/с). Чаще всего всю суточную дозу назначают в один приём, после завтрака. Через 4 нед проводится оценка пере¬ носимости такой терапии. Критерии оценки эффективности терапии при ИЛФ представлены в табл. 38-6, Если произошло улучшение или стабилизация функ¬ циональных показателей, то в течение последующих трёх месяцев суточную дозу преднизолона уменьшают до 0,5 мг/(кгхсут). В течение дальнейших 6 мес при улучшении или стабилизации течения заболевания дозу преднизолона постепен¬ но уменьшают до 0,25 мг/(кгхсут). При отсутствии ответа на ГКС — добавление азатиоприна. Проблемой назначения высоких доз ГКС является большое число побочных эффектов (до 90%). Наиболее частые побочные эффекты — повы¬ шение веса, кожные изменения, раздражительность, артериальная гипертензия, кушингоид, гипергликемия, катаракта, глаукома, тревога, депрессия, остеопороз, миопатия. Соотношение «польза/риск» при назначении преднизолона боль¬ ным ИЛФ смещено в пользу риска при возрасте старше 70 лет, ожирении (ИМТ >35 кг/м^), остеопорозе, сахарном диабете.Таблица 38-6. Оценка ответа на терапию у больных с идиопатическим лёгочным фиброзом- !УлучшениеСтабилизацияУхудшениеСимптомыi одышки и кашляНет измененийТ одышки и кашляRh-графия и КТi измененийНет измененийТ измененийЖЁЛТ>10%Изменения г10%i>10%ОЦсТ>15%Изменения ±15%^>15%AaPOj4>10 мм рт.ст.Изменения ±10 мм рт.ст.Т>10 мм рт.ст.
648 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХЦиклофосфамид является цитотоксическим алкилирующим препаратом, о« иммуносупрессивное действие опосредуется через уменьшение числа лейкоцит«*, особенно лимфоцитов. Азатиоприн относится к пуриновым аналогам, основные механизмом действия является блокада синтеза ДНК. Азатиоприн индуцирует лимфопению, снижает число Т- и В-лимфоцитов, подавляет синтез антител, сни¬ жает число натуральных киллеров. По сравнению с циклофосфамидом азатиоприн имеет менее выраженный иммуносупрессивный эффект, однако обладает противо¬ воспалительным действием: блокада синтеза простагландинов, снижение проник¬ новения нейтрофилов в очаг воспаления. Оптимальной считается доза цитостата- ков, при которой происходит снижение общего числа лейкоцитов до 3-4х10Ул, или числа лимфоцитов в 2 раза.Базисом для рекомендации назначения комбинированной терапии при ИЛФ являются результаты двух рандомизированных контролируемых исследований, показавших, что комбинированная терапия может снижать летальность больных с ИЛФ.Главным контраргументом в пользу назначения цитостатиков при ИЛФ являет¬ ся высокий потенциал развития побочных эффектов, особенно при использовании циклофосфамида. Основными побочными эффектами обоих препаратов являются панцитопения (при снижении числа лейкоцитов ниже ЗхЮУл или тромбоцитов ниже ЮОхЮУл, доза препаратов должна быть снижена). Кроме лейкопении, на фоне терапии циклофосфамидом могут развиваться такие побочные эффекты, как геморрагический цистит, опухоли мочевого пузыря, стоматит, диарея, повы¬ шенная чувствительность организма к инфекциям, к осложнениям терапии аза- тиоприном — желудочно-кишечные нарушения, гонадо- и тератотоксичность. При назначении цитостатиков мониторинг больных должен включать общий анализ крови еженедельно в течение первого месяца, затем один раз каждые 2-4 нед, при терапии циклофосфаном требуется еженедельный анализ мочи на гематурию. Невозможность обеспечить такого строгого мониторинга в амбулаторных усло¬ виях часто делает невозможным назначение больным ИЛФ препаратов данного класса.Антифиброзная терапияРазочаровывающие результаты терапии ИЛФ противовоспалительными аген¬ тами привело к развитию альтернативного подхода, сфокусированного на сниже¬ нии избыточной депозиции матрикса (коллагена) в лёгких или ускорению распада коллагена. К числу антифиброзных препаратов относятся D-пеницилламин, кол¬ хицин, интерферон-у-1Ь, пирфенидон.D-пеницилламин является одним из самых первых антифиброзных пре¬ паратов, использованных при ИЛФ. D-пеницилламин блокирует образование поперечных связей коллагена и препятствует дальнейшему фиброзообразованию. Препарат, как правило, более эффективен при лечении интерстициальных пнев¬ моний на фоне СЗСТ. В настоящее время D-пеницилламин применяют довольно редко, так как препарат обладает серьёзными побочными эффектами (в том числе нефротический синдром). В проспективном контролируемом исследовании Selman и соавт. терапия больных ИЛФ комбинацией D-пеницилламином (600 мг/сут) с преднизолоном по своему клиническому эффекту не имела отличий от монотера¬ пии преднизолоном.К числу антифиброзных препаратов также относится колхицин. Колхицин способен уменьшать продукцию макрофагами фибронектина, инсулиноподобного фактора роста, снижать конверсию проколлагена в коллаген, ингибировать мигра¬ цию и пролиферацию фибробластов. Препарат назначается в дозе 0,6-1,2 мг/с)гг, обычно в комбинации с низкими дозами преднизолона (10 мг/сут). В рандоми¬ зированном контролируемом исследовании Douglas и соавт. было показано, что
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 649терапия колхицином по сравнению с преднизолоном приводила к более медлен¬ ному ухудшению функциональных показателей у больных ИЛФ. Однако терапия колхицином также не останавливает проп>ессирования заболевания. Побочными эффектами при терапии колхицина могут быть диарея, миопатия, но побочные эффекты при терапии колхицином возникают более редко, чем при лечении глю¬ кокортикоидами.Интерферон-у-1Ь подавляет пролиферацию фибробластов и продукцию матричного протеина соединительной ткани и трансформирующего фактора роста ß (TGF-ß). Результаты первого рандомизированного исследования Ziesche и кол. были достаточно обнадеживающими: годичная терапия интерфероном-у-1Ь (200 мкг подкожно 3 раза в неделю) в сочетании с преднизолоном (7,5 мг/сут) по сравнению с той же дозой преднизолона привела к достоверному улучшению показателей общей ёмкости лёгких и РаО, в покое и при физической нагрузке. Основными побочными эффектами интерферона являются ознобы, лихорадка и мышечные боли. После данного исследования было проведено крупное рандоми¬ зированное исследование, в которое было включено 330 больных ИЛФ. Больные ИЛФ в течение 12 мес получали либо интерферон-"/-1Ь по схеме, представленной выше, либо плацебо. У больных, принимавших интерферон-у-1Ь, была отмечена тенденция к снижению летальности больных (10% VS 17%, р=0,08). Других раз¬ личий между группами терапии не наблюдалось, но ретроспективный субгрупповой анализ показал, что у больных с лёгким-среднетяжёлым ИЛФ (ЖЁЛ >62%) терапия интерфероном-у-1Ь может улучшить прогноз (летальность 4% VS 12%, р=0,04).Перспективным антифиброзным препаратом является пирфенидон(/?г;/е«1- doné). Препарат блокирует митогенные эффекты профибротических цитокинов, снижает синтез экстрацеллюлярного матрикса и ингибирует эффекты TGF-ß. По данным проспективного открытого исследования II фазы, пирфенидон (в дозе до 3,6 г/сут) приводил к стабилизации функциональных показателей больных ИЛФ. В исследовании Azuma и соавт., включавшем 107 больных ИЛФ, проводилось изучение терапии пирфенидоном (больные были рандомизированы в группы пир- фенидона и плацебо в соотношении 2-í-l). Через 9 мес от начала терапии у больных ИЛФ, у которых во время физической нагрузки Зр^О^было >80%, отмечено преи¬ мущество терапии пирфенидоном: различие по показателям ЖЁЛ (0,1 л, р=0,037) и Sp^O^ в конце 6-минутного теста (р=0,031). Интересно отметить, что исследова¬ ние было досрочно прекращено, так как у больных группы плацебо наблюдалось достоверно большее число обострений ИЛФ (14% VS 0%).Антиоксидантная терапиядругим подходом к терапии ИЛФ является применение антиоксидантной терапии, так как имбаланс в системе оксиданты/антиоксиданты играет важную роль в процессах повреждения и воспаления лёгких. В ряде исследований показан дефицит основного естественного экстрацеллюлярного антиоксиданта глютатиона на уровне альвеол. N-ацетилцистеин (NAC) является предшественником глю¬ татиона. В неконтролируемом исследовании Behr и соавт. терапия NAC per os в дозе 1,8 г/сут в течение 12 нед у больных, уже получающих иммуносупрессивную терапию, приводила к достоверному улучшению функциональных лёгочных пока¬ зателей и повышению уровня глютатиона в жидкости БАЛ. Очень обнадёживаю¬ щими являются результаты рандомизированного контролируемого исследования IFIGENIA, в котором проводилось сравнение эффективности терапии NAC в дозе 600 мг 3 раза в сутки per os и стандартной терапии (все больные также получали преднизолон в дозе 0,5 мг/кг веса в сутки и азатиоприн в дозе 2 мг/кг веса в сутки) в течение 1 года. 71 больной получал NAC и стандартную терапию, 68 больных полз^али только стандартную терапию. На фоне терапии NAC у больных ИЛФ было отмечено замедление ухудшения функциональных показателей. Различие
650 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХИЛФ (клинические критерии) ATS/ERS 2000Преднизолон г V Азатиоприн per osper os /2-3 мг/(кгхсут), но не40 мг/сут, 15 дней/ > 15 О мг 40 мг/сут, 3 месNAC 1800 мг/сконтроль ЕСЛИНИЧССКЙП) и бнохимичсского , аиализов крови мере:) 15 дней, затем череч ) месВизиты 3, 6 мес: ФВД,тест с 6-минутной ходьбойД Sp^Oj I Снижение доаыпрелтазолонадо 10-20мг6 месУхудшение Стабилизация УлучшениеОсложнс"^^ ГТродолжение терапииI Прогрессирование ИЛФТерапия Iосложнений Терапия циклофосфамидом, колхицином, новыми препаратамиРис. 38-3. Алгоритм терапии больных ИЛФ [Raghu & Chang, 2004].между группами через 12 мес исследования по показателю VC составило 0,18 л (95% ДИ 0,03-0,32), или относительное различие 9% (р=0,02), и по показателю 0,75 ммоль/(минхкРа) (95% ДИ 0,27-1,23), или относительное различие 24% (р=0,003). Летальность в течение первого года между группами больных достоверно не отличалась: 9% у больных группы NAC и 11% у больных группы стандартной терапии (р=0,69). Более того, у больных, принимавших NAC, отмече¬ но меньшее число миелотоксичных эффектов: (4% VS13%, р=0,03), что, возможно, отражает протективный эффект NAC при приёме азатиоприна.Tomioka и соавт. показали эффективность терапии ингаляционного NAC (352 мг/с) у больных ИЛФ. Исследование носило контролируемый дизайн; 15 больных принимали ингаляционный NAC и 15 больных группы сравнения получали ингаляционный бромгексин, исследование длилось 12 мес. К концу исследования у больных группы NAC, по сравнению с больными группы кон¬ троля, были отмечены положительные различия по показателям Sa02 в конце6-минутного теста (-0.3±2,1% vs -6,8±1,8%, р <0,05), сывороточному муцину KL-6 (-4821220 ед/мл vs 176+204 ед/мл, р <0,05) и балльной оценке синдрома матового стекла по данным КТВР (-1,3±1.6 vs 6,7±1,5, р <0,01).В настоящее время ведущие эксперты при терапии ИЛФ отдают предпочтение схеме терапии, включающей три препарата (преднизолон, азатиоприн и NAC) (рис. 38-3).Новые препараты для терапии идиопатического лёгочного фиброзаПродолжается активный поиск препаратов для терапии ИЛФ. Среди потенци¬ альных лекарственных средств, обладающих противовоспалительными и противо- фиброзными эффектами, можно отметить микофенолата мофетил, циклоспорин, иматиниб мезилат, статины, ингибиторы ангиотензин-превращающего фермента (иАПФ), сиролимус, сурамин, ингибиторы ФНО-а, антитела к TGF-ß, антагони¬ сты рецепторов лейкотриенов. В ретроспективном исследовании приём статинов и иАПФ у больных ИЛФ не приводил к улучшению их выживаемости. Микофенолата мофетил - препарат, близкий к азатиоприну, нарушает функцию лимфоцитов путём блокирования биосинтеза пуринов через ингибирование фермента инозин-
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 651монофосфат-дегидрогеназы. Недавно получены первые данные об эффективности данного препарата у больных ИИП на фоне СЗСТ: микофенолат хорошо переносил¬ ся больными и приводил к небольшому улучшению показателей ФЖЁЛ, ОЕЛ Обоснование возможности использования препаратов при ИЛФ и описание прово¬ димых исследований данных препаратов представлено в табл. 38-7.Таблица 38-7. Новые препараты для терапии идиопатического лёгочного фиброзаПрепаратОбоснование и безопасностьОписание исследованийБосентанЭндотелин-1, секретируемый эндотелиаль¬ ными и гладкомышечными клетками, обла¬ дает вазоактавным, митогенным и имму- номодуляторным эффектами. Он повышает продукцию TGF-P и обладает независимым стимуляторным эффектом на фибробласты. Босентан является антагонистом рецепторов эндотелина А и ВЗавершена 11 фаза исследований. Препарат не приводил к измене¬ нию теста с 6-минутной ходьбой, но уменьшал число неблагоприят¬ ных событий — смертей и неудач терапии, Планируется 111 фаза исследования босентана при ИЛФКаптоприл, лозартанАнгиотензин )1 — ваэоактивный пептид с митогеным эффектом в отношении фибро- бластов. Пролиферация фибробластов, активированная ангиотензиниом 11, может быть связана с аутокринной продукцией TGF-p.Препараты ингибируют АПФ и предотвра¬ щают Газ-индуцированый апоптоз альвео¬ лярных эпителиальных клеток человека. Препараты ингибируют пролиферацию фибробластов in vitro и уменьшают фиброз лёгких in wVoНе было отмечено влияние на летальность в ретроспективном исследовании.Продолжается исследование в National Institute of Respiratory Diseases. MexicoЦиклоспоринИнгибиторный эффект Т-лимфоцитов. Подавляет отсроченные аллергические реакции, отторжение аллофафта и про¬ дукцию антител на Т-клетки-зависимые антигеныНесколько сообщений об эффек¬ тивности препарата при ИЛФ, эффектианость не доказанаЭтанерсептЭтанерсепт — антагонист ФНО-а;ФНО-а — цитокин с митогенным эффектом на фибробласты и синтез коллагенаПродолжается исследование 11 фазыИматинибИнгибитор нескольких протеин-тирозиновых киназ, которые играют роль в пролифера¬ ции опухолевых клеток и мезенхимальных клеток, в том числе и фибробластов; Ингибирует передачу сигнала PDGF, что, как показано на животных моделях, уменьшает фибропролиферативный ответПродолжается исследование 11 фазыФактор роста кератино- цитовИндуцирует пролиферацию альвеолоцитов II типа (анормальная стимуляция альвеоляр¬ ных эпителиальных клеток может приводить к неблагоприятным последствиям, повышая интраальвеолярную антифибринолитиче- скую активность и секретируя фиброгенные цитокины}.Усиливает реэпителизацию ран без индук¬ ции формирования рубца или фиброзаВнутривенный препарат.Не был эффективным при ОРДС. Продолжаются исследования 11 фазы при хронических кожных язвах и язвенном колитеЛовастатинБлокирует формирование грануляционной ткани путём индукции апоптоза фибробла¬ стов in vitro и in woВ ретроспективном исследовании не показано влияния на выживае¬ мость
652 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХОкончание табл. 38-7Микофенолата мофетил {CeltCept)Нарушает функцию лимфоцитов путём бло¬ кирования биосинтеза пуринов через инги¬ бирование фермента инозин'монофосфат- дегидрогеназыЕдиничные сообщения об эффек- тивности препарата при ИЛФСиролимус (Rapamycirt)Иммуносупрессивный агент, используемый при трансплантации, с антипролифератив- нми свойствами.Ингибирует пролиферацию звёздчатых клеток, что снижает потенциальный фибро- тический ответ при рецидивирующих забо¬ леваниях печениПродолжается рандомизированное исследование в АвстралииТрансплантация лёгких является на сегодняшний день наиболее радикаль¬ ным способом терапии ИЛФ. Выживаемость больных в течение 3 лет после транс¬ плантации по поводу ИЛФ составляет около 60%,Показания к трансплантации лёгких:• диспноэ IIT-IV класса по NYHA:• гипоксемия при физической нагрузке;• снижение ЖЁЛ или ФЖЁЛ 60-70% от должных;• снижение < 50% от должных.Ограничивающим фактором для трансплантации часто является пожилой воз¬ раст больных ИЛФ и быстрое прогрессирование заболевания. Поэтому не случай¬ но среди всех больных, ожидающих трансплантацию, самая высокая летальность отмечена у больных ИЛФ.Терапия осложненийКроме медикаментозной терапии, как и при других заболеваниях лёгких, при развитии гипоксемии используется терапия кислородом. Показания к длительной оксигенотерапии обычно не отличаются от принятых при хроническом обструк¬ тивном заболевании лёгких: Ppj менее 55 мм рт.ст, в покое или Р^О^ 55-60 мм рт.ст. в покое при наличии признаков лёгочной гипертензии или полицитемии. Кислородотерапия способна уменьшить диспноэ, повысить интенсивность и дли¬ тельность физических нагрузок у больных ИЛФ. При развитии лёгочной гипер¬ тензии, кроме Oj, возможно использование вазодилататоров. Развитие инфек¬ ций трахеобронхиального дерева требуют использования антибактериальных и противогрибковых препаратов. Всем больных ИЛФ рекомендована регулярная вакцинация противогриппозными и антипневмококковыми вакцинами.ПРОГНОЗ и ПРИЧИНЫ СМЕРТИ БОЛЬНЫХ ИДИОПАТИЧЕСКИМ ФИБРОЗОМ ЛЁГКИХТрадиционно считалось, что выживаемость больных ИЛФ не превышает 5 лет, однако эти данные основаны на исследованиях, проведённых среди пациентов ИЛФ, наблюдающихся в крупных специализированных центрах. Исследование Hubbard и соавт., включавшее больных ИЛФ, наблюдаемых врачами общей прак¬ тики в общей популяции, показало, что реальная выживаемость больных ИЛФ ещё ниже. Средняя выживаемость больных ИЛФ составила всего 2,9 лет. Вероятность летального исхода больных существенно отличалась от ожидаемой для общей попу¬ ляции (отношение шансов 100,1; 95% ДИ 12,5-799,5; р <0,001). Таким образом, в типичной популяции прогноз вновь выявленных больных ИЛФ оказался даже более неблагоприятным, чем у пациентов с I стадией немелкоклеточного рака лёгких.Наиболее частой причиной смерти больных является дыхательная недостаточ¬ ность как естественное следствие прогрессирования заболевания, В исследовании Panos и соавт., посвящённом анализу 550 сл}^аев ИЛФ, дыхательная недостаточ¬ ность в структуре смертности занимала 39%, другими причинами летальности были сердечная недостаточность, бронхогенная карцинома, ишемическая болезнь
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 653ИЛФ [N = 543]наблюдение 1-7 лет60% умерло [N = 326]Дыхательнаянедостаточность,39%Раклёгких,10%ТЭЛА,3%Лёгочныеинфекции,3%Сердечно- Другие сосудистые 18%заболевания,27%Рис. 38*4. Причины смерти больных ИЛФ [Panos et al., 1990].сердца и другие события (рис, 38-4), В исследовании Johnston и соавт. летальность была непосредственно связана с течением ИЛФ в 53% всех случаев, имела воз¬ можную связь с ИЛФ в 28% и не была связана с ИЛФ в 14% случаев. В этом же исследовании рак лёгких был обнаружен у 12,6% умерших больных (на фоне ИЛФ возможно развитие любой формы рака лёгкого: наиболее частыми гистологиче¬ скими вариантами являются плоскоклеточный рак и аденокарцинома, описаны развитие бронхоальвеолярного рака, гигантоклеточного рака).Прогноз несколько лучше у женщин, у более молодых пациентов при анамнезе заболевания менее 1 года. Кроме того, к доказанным прогностическим факторам относятся ответ больных на терапию ГКС (обычно в течение 3 мес), выраженность фиброза по данным биопсии лёгких и КТВР.Безусловно, функциональные лёгочные тесты также являются хорошим инстру¬ ментом прогноза у больных ИЛФ, Причём динамическое изменение показателей ФВД — более ценные показатели для оценки прогноза больных, чем однократные данные. Ретроспективное исследование, проведённое в исследовательском центре Денвера (США), продемонстрировало, что изменения в течение 6 и 12 мес таких параметров, как одышка, ОЕЛ, ФЖЁЛ, SpOj и АаРО^, являются независимыми факторами прогноза у больных ИЛФ. Наиболее сильными предикторами выжи¬ ваемости больных ИЛФ являлись 6-месячные изменения одышки, ФЖЁЛ (%) и AaPOj. Например, среди 30 больных ИЛФ, у которых ФЖЁЛ за 6 мес снизилась на 10% и более, пятилетняя выживаемость составила 22%, а среди больных, у кото¬ рых ФЖЁЛ за 6 мес повысилась на 10% и более, — 68%.Для оценки толерантности больных ИЛФ к физическим нагрузкам чаще всего используется тест с 6-минутной ходьбой (6-MWT), Lederer и соавт. показа¬ ли, что низкая дистанция во время 6-MWT была ассоциирована с повышенной летальностью больных ИЛФ (р <0,0001). У больных с дистанцией <207 м годичная летальность была в 4 раза выше, чем у больных, прошедших во время 6-MWT дис¬ танцию >207 м (отношение шансов 4,7,95% ДИ 2,5-8,9, р <0,0001). Дистанция во время 6-MWT у больных ИЛФ была более хорошим предиктором летальности в течение 6 мес, чем ФЖЁЛ (c-statistic 0,73 vs 0,59, р=0,02). Lama и соавт. выявили взаимосвязь между десатурацией (снижением SpOj) во время 6-MWT и выживае¬ мостью у больных с ИЛФ. Они показали, что десатурация является важным про¬ гностическим фактором у больных с ИЛФ и с неспецифической интерстициальной пневмонией, среди больных, у которых Spp2 во время 6-MWT снижалась менее 88%, четырёхлетняя выживаемость составляла 34,5%, в то время как у больных
654 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХбез выраженной десатурации - 69,1% (р=0,002). Согласно данным недавно бликованного исследования Flaherty и соавт. любая десатурация во время 6-MWT у больных ИЛФ является прогностическим фактором неблагоприятного прогноов больных ИЛФ.Обострение идиопатического лёгочного фиброзаВпервые на проблему развития обострений при ИЛФ обратили вниманк японские врачи, впоследствии это осложнение ИЛФ было описано в рабспах клиницистов из Европы и США. Для определения обострения ИЛФ предложены следующие критерии:• нарастание одышки в течение периода менее 1 мес;• появление новых диффузных изменений на рентгенограмме лёгких;• снижение PaOj на 10 мм рт.ст. и более;• отсутствие связи обострения с инфекционными факторами и сердечной недо¬ статочностью.Обострение ИЛФ не является раритетным или даже редким событием: по дан¬ ным Kim и соавт., развитие обострений в течение 1 года наблюдалось у 9% боль¬ ных ИЛФ, а по данным другого крупного исследования, включавшего 168 больных ИЛФ, обострение ИЛФ предшествовало смерти больных в 47% случаев.Причины обострения ИЛФ, как правило, остаются неизвестными. Так, в боль¬ шинстве исследований, посвящённых данной проблеме, предпринимались все диа¬ гностические возможности для исключения респираторных инфекций, сердечной недостаточности, но причинный фактор обострений так и не был найден. Но ино¬ гда можно проследить связь развития обострения ИЛФ с причинным фактором- В исследовании Kim и соавт. у 3 из 11 больных обострение ИЛФ развилось после выполнения инвазивных диагностических процедур (хирургической биопсии лёг¬ ких или проведения БАЛ).КТВР является важнейшим пособием в диагностике обострения ИЛФ. Харак¬ терными находками при обострении ИЛФ являются «новые» паренхиматозые затем¬ нения по типу «матового стекла?>, реже по типу консолидации, возникающие на фоне изменений, типичных для ИЛФ (нерегулярные линейные тени, кистозные просветле¬ ния, дезорганизация лёгочной паренхимы, тракционные бронхоэктазы; рис, 38-5, см. также цветную вклейку). Распределение свежих паренхиматозных затемнений можетбРис. 38-5. Обострение ИЛФ, КТ лёгких до (а) и во время (б) обострения ИЛФ; в — гистологическая карти¬ на: организация фибрина и разрастание грануляцион¬ ной ткани в полостях альвеол.
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 655иметь прогностическое значение: в исследовании Akira и соавт. летальносгь больных с диффузными паренхиматозными затемнениями составила 100%, с мультифокальны¬ ми затемнениями — 50%, с периферическими затемнениями — 17%.Морфологическим субстратом обострения ИЛФ, по данным большинства известных исследований, является сочетание ОбИП и диффузного ДАП, т.е. фор¬ мирование гиалиновых мембран, реактивная гиперплазия альвеолоцитов II типа, замещение повреждённых эпителиальных клеток альвеол фибробластами и нако¬ пление коллагена (т.н. фибропролиферация; рис. 38-5, см. цветную вклейку).Прогноз больных с обострением ИЛФ очень плохой, госпитальная летальность, по данным проведённых исследований, колеблется от 53 до 86% (в среднем 75%). Большинство больных в опубликованных работах находились на ИВЛ. Основной причиной смерти больных с обострением ИЛФ является острая дыхательная недо¬ статочность.Медикаментозная терапия при обострении ИЛФ обычно включает глюкокор¬ тикоиды и цитостатики. Японские авторы рекомендуют проведение пульс-терапии метилпреднизолоном (500-1000 мг) в течение первых трёх дней с последующим переходом на более низкие дозы.Недавно Kubo и соавт. представили результаты исследования, показавшего, что сочетание антикоагулянтной терапии (гепарин натрия и варфарин) с ГКС, по сравнению с монотерапией ГКС, значительно снижает летальность больных вследствие обострения ИЛФ: 18% vs 71% (р=0,008). Несмотря на такие обнадёжи¬ вающие данные, необходимо отметить, что данное исследование было открытым, включало относительно небольшое число больных (56 пациентов), и большая доля больных в группе антикоагулянтной терапии прекратили исследование досрочно (26%). Возможным объяснением благоприятного эффекта терапии на выживаемость больных можно объяснить тем, что паренхиматозное повреждение при ИЛФ часто ассоциировано с развитием микротромбов, и больные ИЛФ отно¬ сятся к группе риска по развию венозных тромбозов.Среди перспективных иммуносупрессивных препаратов для терапии обострения ИЛФ в последнее время большое внимание уделяется циклоспорину, в небольшом ретроспективном исследовании Нотта и соавт. терапия циклоспорином в дозе 1-2 мг/(кгхсут) привела к уменьшению летальности больных: среди 9 больных, получавших циклоспорин, выжило 6 больных (67%), эти данные выглядят очень обнадёживающе по сравнению со среднестатистическими показателями леталь¬ ности больных с обострением ИЛФ.Неспецифическая интерстициальная пневмонияНеспецифическая интерстициальная пневмония (НИП), наряду с ИЛФ, явля¬ ется одной из наиболее часто встречаемых форм ИИП, Как самостоятельная форма ИИП, НИП была описана относительно недавно, в 1994 г. Katzenstein и Fiorelli опубликовали работу о форме ИЗЛ, которая морфологически характери¬ зовалось специфичным паттерном, не соответствовавшим ни одной из известных форм ИИП. Основной особенностью гистологической картины НИП является временнія гомогенность или униформность морфологических изменений, т.е. все они появились приблизительно в одно и то же время. Следует признать, что данное заболевание было известно и раньше, и те формы ИЗЛ, которые ранее описывали как «клеточная интерстициальная пневмония» или «неклассифи- цируемая интерстициальная пневмония», соответствуют современным крите¬ риям НИП. Поэтому сегодня более ранние исследования, посвящённые ИЛФ (криптогенному фиброзирующему альвеолиту), должны интерпретироваться с определённой долей осторожности, так как эти работы, безусловно, включали в том числе и больных НИП.
656 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХЭпидемиология НИП изучена недостаточно. При ретроспективном гистологических препаратов, которые раньше описывали как ИЛФ/криптая^] ный фиброзирующий альвеолит, оказалось, что до 43% всех морфоло! образцов соответствует картине НИП. Таким образом, распространённость ШШ1 приблизительно такая же, как и ИЛФ. Экстраполируя данные, полученные в: демиологическом исследовании ИЛФ, можно предполагать, что распростраявиг ность НИП составляет около 40 больных на 100 ООО населения,НИП может идиопатическим, именно эта форма входит в группу НИП. Но март* | фологическая картина, соответствующая паттерну НИП, может быть и при жении лёгких у больных СЗСТ, гиперчувствительном пневмоните, радиационное пневмоните, при иммунодефицитных пневмопатиях. НИП описана у больвьо^ принимавщих амиодарон, симвастатин, нитрофураны, соли золота, метотрексат ] другие препараты,ПАТОГЕНЕЗНИП является самостояггельной формой ИИП, В ряде иммуногистохимиче¬ ских и молекулярных исследованиях было продемонстрировано, что при НИП и ИЛФ обнаруживают различные уровни протеина сурфактанта D в жидкост» БАЛ, различные уровни антител к виментину и протеину сурфактанта А в сыво¬ ротке крови, различные уровни р53, рбЗ и внутриклеточных молекул адгезии-1 (ICAM-1) в тканях, а также различные пути митохондрия-опосредованного апоптоза эпителиальных клеток. Значительное повыщение активности ММР-2 я повышенное число лимфоцитов в БАЛ предполагает важную роль Т-лимфоцитов в патогенезе НИП.Относительно недавно Shimizu et al. предложили гипотезу, согласно которой патогенез НИП значительно отличается от ИЛФ и механизмы фиброобразова- ния при НИП ассоциированы с иммунологическими факторами. Данная группа исследователей изучала дендритные клетки (ДК) у больных НИП при помощи иммуногистохимического метода, используя антитела к протеину S-100 и к чело¬ веческому лейкоцитарному антигену HLA-DR, В полях фиброза у больных НИП были обнаружены ДК, которые давали положительную реакцию на протеин S-100 и HLA-DR, однако данный тип ДК не был выявлен в зонах фиброза и «сотовых* изменений у больных ИЛФ, S-100-положительные ДК имеют важную роль в инициации иммунного ответа и при ряде аутоиммунных заболеваниях, таких, как узелковый полиартериит, данные клетки были идентифицированы как клетки- мишени. С учётом этого представляется вероятным, что при НИП хроническое воспаление и персистирующие вирусные инфекции могут синергично поддержи¬ вать аутоиммунный процесс путём активации ДК. Однако причинные антигены при ИЛФ и НИП остаются неизвестными.КЛИНИЧЕСКАЯ КАРТИНАОсновным симптомом при НИП является одышка (около 100%), которая имеет те же особенности, что и у больных ИЛФ. Немного реже больные жалуют¬ ся на непродуктивный кашель (60%), еще реже на системные симптомы: утом¬ ляемость, слабость, снижение массы тела, В ряде случаев (до 30%) у больных присутствует субфебрильная лихорадка (около 30%). У большинства больных НИП (более 80%) выслушивают инспираторную крепитацию и у ряда больных — инспираторный писк (25%), Синдром «барабанных палочек» обнаруживают приблизительно у 40% больных НИП, т.е. примерно в 2 раза реже, чем при ИЛФ (табл. 38-8).
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 057Таблица 38-8. Демофафические, клинические, функ1^ональные и морфологические особенности больных с ИЛФ и НИП [Daniil et al., 1999; Ryu et al., 2007]ПоказателиНИПИЛФПол; м/ж, %45/5580/20Возраст, лет43 [31-66]56 [36-68]Некурящие, %4080Курильщики, %6020Респираторные симптомыДлительность, мес18 Г7-84]18 [3-84]Кашель, %6060Одышка, %100100Физикальные данныеДвусторонняя крепитация, %8093«Барабанные палочки», %*4093Функциональные данныеФЖЁЛ, % от должного73+2474±16ОФВ, % от должж)го72±2173+13ОЕЛ. % от должного7212266+1401^. % от должного44+1844±18РаС^, кРа9,8+1,89,2±1,9Цитология БАЛНейггрофилы*3 [0-381*7[&-85]Лимфоциты*29 [4-76]*5,5 [0-68]Данные представлены как median [range] и (%); *p <0,05.По данным Cottm и соавт., снижение было отмечено у всех больных НИП, у 92% больных — нарушение вентиляции по рестриктивному типу, у 42% — наличие умеренной бронхиальной обструкции. Довольно часто, особенно при фибротической НИП обнаруживают снижение Ра02- Во время проведения теста с физической нагрузкой данный показатель снижался на 4 мм рт.ст. и более у 67% больных. Лабораторные показатели при НИП неспецифичны, довольно часто обнаруживают повышение СОЭ и ЛДГ сыворотки крови.РЕНТГЕНОЛОГИЧЕСКАЯ КАРТИНАРентгенография грудной клетки при НИП чаще всего выявляет двусторон¬ ние изменения по типу «матового стекла» и ретикулярные изменения в ниж¬ них отделах лёгких. Наиболее важным неинвазивным методом диагностики и дифференциальной диагностики НИП является КТВР. Характерным признаком картины КТВР при НИП является синдром «матового стекла», который часто ассоциирован с признаками лёгочного фиброза, такими, как уменьшение объёма лёгких и ретикулярные изменения, а также тракционные бронхоэктазы. Типичная
658ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХІІШІ«Рис. 38-6. Неслецифическая интерстициальная пневмония: а — гистологическая картина (фиброэ- ный вариант); б — КТВР.картина КТВР при НИП включает смешанный паттерн «матового стекла» и кон¬ солидации (в случае выраженного клеточного воспаления) и иррегулярные линии с типичным периферическим, субплевральным, базальным симметричным рас¬ пространением (при фиброзном варианте; рис. 38-6, см. также цветную вклейку). В отличие от ИЛФ, где КТВР позволяет поставить правильный диагноз с высокой точностью, возможности КТВР при НИП ограничены, т.е. без проведения биопсии лёгких нельзя с уверенностью говорить о диагнозе НИП. Согласно данным двух исследований чувствительность КТВР при НИП составляет 70-78%, а специфич¬ ность — 63-64%. Как и у морфологов, среди специалистов по имидж-диагностике самое большое количество ошибок делается при оценке КТВР у больных НИП. В одном из исследований согласие (каппа) среди специалистов при диагностике НИП составило 0,51.МОРФОЛОГИЧЕСКАЯ КАРТИНАМорфологическая картина отлична от всех известных вариантов НИП. Основным отличием от других форм заболевания является гомогенность или униформность морфологической картины. Спектр морфологических изменений варьирует от изолированного воспаления до выраженного фиброза, однако по сравнению, например, с обычной интерстициальной пневмонией, где одновремен¬ но в разных регионах паренхимы сосуществуют воспаление и фиброз различной выраженности, при НИП на данный момент присутствует воспаление или фиброз примерно на одном этапе развития, т.е. гистологическая картина гомогенна. Морфологические изменения при НИП носят диффузный характер.Все случаи НИП по морфологической картине можно разделить на три группы;• клеточный вариант с преобладанием картины воспаления;• смешанный вариант, при котором одновременно присутствует и картина вос¬ паления, и картина фиброза;• фибротический вариант с преобладанием паттерна фиброза.При клеточном варианте мононуклеары (в основном лимфоциты) инфильтри¬ руют межальвеолярные перегородки, кроме того, в воспалительный процесс могут вовлекаться интерстиций вокруг дыхательных путей, сосудов, междольковые перегородки и плевра. Практически всегда присутствует гиперплазия альвеолоци¬ тов И типа. Также при НИП возможно наличие интраальвеолярной организации и лимфоидных агрегатов, но данные изменения не превалируют в гистологической картине. Морфологические критерии фибротического варианта НИП описаны недостаточно чётко, поэтому некоторые эксперты говорят о том, что данный тип НИП часто является «мусорной корзиной» многих неясных фиброзов лёгких. Основным признаком фибротического варианта НИП является диффузный гомо¬
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 659генный интерстицальный фиброз (рис. 38-6, см. цветную вклейку). Фокусы фибро- бласгов при НИП практически не встречаются. Субплевральное распространение изменений, характерное для ИЛФ, для НИП не обязательно. «Сотовые» измене¬ ния при НИП встречаются довольно редко. В некоторых случаях НИП наблюда¬ ется аккумуляция макрофагов в просвете альвеол, однако по сравнению с ДИП при НИП данный феномен имеет «пятнистый», негомогенный тип распределения, преобладает интерстициальное воспаление.На практике трактовка гистологической картины НИП часто зависит от «субъективной» оценки морфолога. По данным исследования, проведённого в Великобритании среди десяти экспертов-морфологов, морфологический диагноз НИП был установлен всего в 50% из всех предоставленных морфологам образцов биопсии лёгких больных НИП, а согласие (каппа) между специалистами составила всего 0,32,Цитологический профиль БАЛ при НИП не является специфичным. Однако цитология БАЛ при НИП довольно сильно отличается от заболеваний, имеющих сходную клинико-рентгенологическую картину (например, от гиперчувствитель- ного пневмонита). При клеточном варианте НИП в БАЛ отмечено преобладание лимфоцитов (около 40%), относительно высокое число эозинофилов (около 6%), число нейтрофилов не превышает 5%. Большие затруднения при интерпретации результатов БАЛ при фибротическом варианте НИП. По данным некоторых авторов, цитологический профиль фибротической НИП неотличим от профиля больных с ИЛФ. Однако в недавно проведённом исследовании Ryu и соавт. было показано, что у больных с ИЛФ число нейтрофилов БАЛ (7,0%) достоверно выше по сравнению с больными фибротическим вариантом НИП (3,0%; см. табл. 38-8). И, напротив, число лимфоцитов существенно выше при НИП (29,0%), чем при ИЛФ (5,5%). У больных с картиной КТВР, не типичной для ИЛФ, лимфоцитоз БА более часто обнаруживали у больных НИП (61%), чем при ИЛФ (14%), и отсут¬ ствие лимфоцитоза БАЛ являлось сильным аргументом в пользу диагноза ИЛФ, а не НИП (отношение шансов 12,7, р <0,001).ДИАГНОСТИКА, ЛЕЧЕНИЕ И ПРОГНОЗДля подтверждения точного диагноза НИП необходимо проведение открытой или торакоскопической биопсии лёгких.Однако Watanabe и соавт. представили данные, согласно которым на основании трансбронхиальной биопсии возможно установить диагноз «клеточная интер¬ стициальная пневмония» при условии исключения ИЛФ по данным КТВР у этих больных. Хотя большинство больных с «клеточной интерстициальной пневмони¬ ей» действительно составляют больные НИП, в эту же группу могут попасть боль¬ ные и с ДИП, и с КОП. Однако Watanabe и соавт. показали, у больных с «клеточной интерстициальной пневмонией» можно ожидать хороший эффект от ГКС и таким образом уменьшить необходимость прове¬ дения хирургической биопсии лёгких.Прогноз больных НИП более благо¬ приятный, чем при ИЛФ (рис. 38-7). рис. 38-7. Выживаемость больных ИЛФ и Клиническое течение и выживаемость НИП [Bjoraker et al„ 1998].Другие
J’:> ’.-^ 660 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХбольных зависят от выраженности лёгочного фиброза. По данным Bjoraker соавт., медиана выживаемости больных НИП составила 13,5 лет. Пятил!' выживаемость при клеточном варианте НИП составляет 100%, при фибре^ варианте НИП — 90%, Десятилетняя выживаемость при НИП составляет oi 35%. Длительное наблюдение за больными НИП свидетельствует против того, НИП является ранней стадией ИЛФ,,гЛ' Спонтанные случаи выздоровления без лечения при НИП неизвестны, терапм!ГКС без или с добавлением цитостатиков приводит к улучшению или сгабилиз*| ции приблизительно у 75% больных. Терапия НИП напоминает терапию при Ю1#| основу составляют ГКС, некоторые эксперты уже на первом этапе рекомендуй# комбинированную терапию ГКС с азатиоприном или циклофосфамидом. ОдопМ в большинстве центрах терапию цитостатиками у больных НИП назначают oqpil недостаточной эффективности терапии ГКС. Рекомендуемые начальные дозы ГКС при НИП — 1 мг/кг веса в сутки (в перерасчёте на преднизолон) в течение 1-2 мес с последующим их снижением в течение 9-12 мес. По данным Watanabe и соавт, средние стартовые дозы ГКС при НИП составляли 60 мг/с. Положительный ответ через 1 мес после начала терапии у больных с ИИП является предиктором хоро¬ шего прогноза.Так же как и у больных с ИЛФ, при НИП в схему терапии включают NAC. При выраженной гипоксемии (РаО^ в покое менее 55 мм рт.ст.) показано назначение длительной кислородотерапии в домашних условиях. Больным НИП рекомендо¬ вана вакцинация против Streptococcus pneumoniae каждые 5 лет, и против гриппа — ежегодно.Криптогенная организующаяся пневмонияКриптогенная организующаяся пневмония (КОП), согласно современной классификации, является одним из семи вариантов идиопатических интерстици¬ альных пневмоний. Заболевание впервые писано Davison в 1983 г. Синонимами КОП являются термины «облитерирующий бронхиолит с организующей¬ ся пневмонией» и «пролиферативный бронхиолит»^, КОП имеет чёткие клинико-морфологические отличия от «изолированного» облитерирующего бронхиолита: наряду с поражением бронхиол наблюдается вовлечение в вос¬ палительный процесс альвеол с наличием в их просвете организованного экс¬ судата.КОП в большинстве случаев (70%) является идиопатическим, т.е, причина оста¬ ётся неустановленной. Среди установленных причин наибольше значение имеют СЗСТ (ревматоидный артрит и др.), осложнения лекарственной терапии (амиода¬ рон, препараты золота и др.).КЛИНИЧЕСКАЯ КАРТИНАЗаболевание чаще всего развивается у людей в возрасте 50-60 лет, мужчины и женщины болеют одинаково часто. КОП характеризуется острым/подострым течением, клиническая картина часто напоминает бактериальную пневмонию. Средняя продолжительность симптомов до момента постановки диагноза состав¬ ляет 2-6 мес. Наиболее частыми симптомами КОП являются кашель (90%), одышка при физической нагрузке (80%), лихорадка (60%), продукция мокроты, слабость, снижение массы тела (50%). Характерным аускультативным фено¬ меном является конечно-инспираторная крепитация (75%), свистящие хрипы выслушиваются реже, обычно вместе с крепитацией. Синдром «барабанных палочек» не характерен для КОП, Рутинные лабораторные тесты выявляют лей¬ коцитоз периферической крови (50%), повышение СОЭ и С-реактивного белка (70-80%).
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 661Рис. 38-8. Криптогенная организующаяся пневмония: а — гистологическая картина; б — картина КТ.РЕНТГЕНОЛОГИЧЕСКАЯ КАРТИНАТипичными рентгенологическим признаками КОП является наличие пятнистых, двусторонних (реже односторонних) плотных очагов консолидации субплевраль- ной локализации, лёгочные объёмы обычно сохранены. Реже выявляют диффузные узелково-сетчатые изменения (20%). При КТ очаги консолидации с «воздушными бронхограммами» и очаги матового стекла обнаруживают в 80% случаев (рис. 38-8, см. также цветную вклейку). Инфильтраты локализованы субплеврально в 60% слу¬ чаев. Размер инфильтратов может варьировать от 2 см до долевого поражения. При КОП описана миграция лёгочных инфильтратов, чаще всего от нижних к верхним отделам лёгких. Более редкими находками при выполнении КТВР у больных КОП являются центролобулярные узелки, линейные тени, плевральный выпот.Дифференциальный диагноз КОП, кроме бактериальной пневмонии, проводят с хронической эозинофильной пневмонией, бронхоальвеолярным раком и лим- фомой лёгких.При функциональных исследованиях чаще всего выявляют умеренные рестрик¬ тивные изменения (снижение ООЛ, ФОН), бронхиальная обструкция встречается редко (20%), в основном у курильщиков. У большинства больных обнаруживают выраженное снижение и признаки нарушения газообмена, П1поксемия в покое или при физической нагрузке встречается более чем у 80% больных.МОРФОЛОГИЧЕСКАЯ КАРТИНАМорфологическая картина КОП характеризуется наличием полиповидной грануляционной ткани, состоящей из пролиферирующих фибробластов и миофи- бробластов, в просвете респираторных бронхиол и альвеол и хронического воспа¬ ления, окружающего альвеолы (рис. 38-8, см, также цветную вклейку). Изменения альвеол (организующаяся пневмония) всегда преобладают над поражением брон¬ хиол (бронхиолит), поэтому данное заболевание характеризуется рестриктивны¬ ми нарушениями и относится к группе интерстициальных заболеваний лёгких. Патологические изменения имеют, как правило, «пятнистое», перибронхиальное распространение, без значительного нарушения лёгочной архитетоники. В аль¬ веолах часто находят пенистые макрофаги. Выраженные фиброзные изменения и формирование «сотового лёгкого» не характерно для КОП.При цитологическом исследовании БАЛ, как правило, обнаруживают высокий лимфоцитоз (>25%), пропорция нейтрофилов и эозинофилов также повышена. Также могут встречаться пенистые макрофаги, тучные и плазматическеи клетки. Соотношение СВ4уСП8^ обычно снижено. Трансбронхиальная биопсия может
662 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХпоказать характерные морфологические признаки КОП, но не позволяет а чить ассоциированные изменения. Для гистологической верификации КОП мендовано проведение открытой или торакоскопической биопсии лёгких.ТЕРАПИЯ И ПРОГНОЗСпонтанное улучшение при КОП описано, но бывает редко. Терапией в] при КОП пероральные ГКС. Клиническое улучшение наступает уже через 1-3€||| от начала приёма первой дозы, рентгенологические изменения обычно исчезаи|§ через несколько недель. Обычно начинают с преднизолона в дозе 0,75 мг/(кгх9ш5^ затем через 2-4 нед дозу постепенно уменьшают, общая длительность терапии составляет 6-12 мес. При снижении дозы ГКС рецидивы заболевания возникашж довольно часто — в 58%, в такой ситуации вновь увеличивают дозу глюкокорти- коидов. Прогноз при КОП обычно благоприятный, большинство больных полно¬ стью излечиваются при приёме ГКС. Однако в редких случаях наблюдается плохо# ответ на стероиды и неуклонно прогрессирующее течение КОП. Предикторами прогрессирующего течения КОП являются преимущественно ретикулярный тии по данным КТ, отсутствие лимфоцитоза в БАЛ. У таких больных рекомендовано использование цитостатиков (циклофосфамида, азатиоприна).Десквамативная интерстициальная пневмонияДесквамативная интерстициальная пневмония (ДИП) является довольно ред¬ ким заболеванием из группы ИИП. Первое описание ДИП было сделано в 1965 г. ЫеЬоу и кол. На протяжении многих лет ДИП рассматривали как раннюю клеточ¬ ную стадию ИЛФ, в то время как считалось, что ОИП является поздней фибро¬ тической стадией того же самого заболевания. Однако в настоящее время ДИП считается самостоятельным заболеванием. Сам термин «десквамативная интер¬ стициальная пневмония» не является точным, скорее всего это дань историческим традициям. Так ранее предполагалось, что основными клеточными элементами, выявляемыми в просвете альвеол, являются десквамированные эпителиальные клетки, а не альвеолярные макрофаги, как было установлено позднее.Эпидемиология ДИП практически не изучена. По данным трёх работ, представ¬ лявших описание больных ДИП, федний возраст пациентов на момент появления симптомов ДИП составлял 42, 42 и 46 лет. Среди всех больных ДИП более 90% являлись курильщиками. Кроме того, описаны редкие случаи ДИП, ассоциирован¬ ной с другими состоянии — СЗСТ. реакциями на лекарственные препараты, экспо¬ зиции к факторам внешней среды. Фокальная аккумуляция макрофагов в паренхиме лёгких получила название «ДИП-подобные реакции», такая картина может присут¬ ствовать при ряде других заболеваний лёгких. Гистологическая картина ДИП была также описана у детей с мутацией гена, кодирующего протеин сурфактанта С.КЛИНИЧЕСКАЯ КАРТИНАСамым частым симптомом ДИП, как и при других ИИП, является одышка, воз¬ никающая сначала при физической нагрузке, а по мере прогрессирования заболе¬ вания и в покое. По данным разных исследований, одышка встречается у 85-100% больных и является главной причиной обращения больных за медицинской помощью. Вторым по частоте симптомом ДИП является кашель, чаще всего сухой или с продукцией скудной мокроты, жалобы на кашель предъявляют 40-80% больных ДИП (табл. 38-9). Начало заболевания обычно незаметное, постепенное. Системные признаки (лихорадка, артралгии и др.) встречаются редко. При физи¬ кальном обследовании примерно у половины больных присутствует крепитация, кроме того, также довольно часто у больных ДИП (13-50%) выявляют симптом «барабанных палочек». Лабораторные показатели при ДИП не дают дополнитель¬ ной информации.
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 663Таблица 38-9. Эпидемиологические, клинические и функциональные особенности больных с ДИП и РБ-ИЗЛПоказателиДИП (п=23)РБ-ИЗЛ (п=12)Мужчины, п (%)11 (48)8(67)Возраст, годы46+1043+7Анамнез куренияКурильщики18 (78)10 (83)Экс-курильщики2(8)2(17)Не курившие3(13)0(0)Статус курения, пачек/лет38±2129+21СимптомыНет1 (4)1(8)Одышка20 (87)9(75)Кашель10 (43)6(50)Боли в грудной клетке4(17)1(8)Физикальные признакиКрепитация13 (57)5(42)«Барабанные палочки»6(26)3(25)ФВДРестрикция6(30)5(50)Обструкция3(15)3(30)Снижение7(35)1 (10)Нет изменений4(20)1(10)Наиболее частым изменением ДИП, выявляемом при проведении функцио¬ нальных тестов, является выраженное снижение У больных ДИП показатели очень редко лежат в нормальном диапазоне и чаще всего снижены до 50% и менее от должных величин. При далеко зашедших стадиях заболевания у больных может наблюдаться гипоксемия, которая заметно усиливается при физической нагрузке. При ДИП возможно нарушение вентиляции и по обструктивному, и по рестриктивному типам, хотя рестриктивные нарушения встречаются в 2 раза чаще (см. табл. 38-9).РЕНТГЕНОЛОГИЧЕСКАЯ КАРТИНАКак правило, у больных ДИП при проведении обычной рентгенографии грудной клетки очень редко не находят никаких изменений. Самыми частыми изменения¬ ми, и по данным рентгенографии и по данным КТВР, являются двусторонние поля затемнений по типу «матового стекла», чаще всего локализующиеся в нижних отделах лёгких (рис. 38-9, см. цветную вклейку). Кроме того, ретикулярные изме¬ нения, обычно локализованные и негрубые, могут быть выявлены на КТВР при¬ мерно у 50% больных ДИП. Зоны фиброза обычно располагаются субплеврально в
V '-■> '-г :664 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХРис. 38-9. Десквамативная интерстициальная пневмония: а — гистологическая картина: б — картина КГ.базальных отделах лёгких. Зоны «матового стекла» у больных ДИП в 60% случаев имеют преимущественно периферическое распределение (рис. 38-9, см. также цвет¬ ную вклейку), у 25% больных — пятнистое распределение и у 15% — диффузное распределение. У большинства больных на фоне терапии ГКС наблюдается умень¬ шение или полное разрешение затемнений по типу «матового стекла». Примерно в 20% случаев изменения по типу «матового стекла» трансформируются в ретику¬ лярные изменения, что означает развитие лёгочного фиброза.МОРФОЛОГИЧЕСКАЯ КАРТИНАКардинальным признаком ДИП является содержание значительного количе¬ ства макрофагов в просвете альвеол. Альвеолы выстланы гиперплазированными альвеолоцитами II типа. Альвеолярные перегородки инфильтрированы лимфоци¬ тами, иногда эозинофилами, может наблюдаться небольшое повышение содержа¬ ния мезенхимальных клеток, однако фиброз, как правило, выражен незначитель¬ но (рис. 38-9, см. также цветную вклейку). Для ДИП характерно наличие картины гомогенного поражения на протяжении всей лёгочной паренхимы. В отличие от ИЛФ фокусы фибробластов для данной формы ИИП не характерны. В жидкости БАЛ основным клеточным элементом является альвеолярный макрофаг с гранула¬ ми «пигмента курильщика». Окраска на железо помогает выявить в альвеолярных макрофагах пигмент гемосидерина.ДИАГНОСТИКА, ЛЕЧЕНИЕ И ПРОГНОЗДиагноз ДИП должен быть рассмотрен при наличии соответствующей клини¬ ческой картины (одышка, сухой кашель, «барабанные палочки»), эпидемиологи¬ ческих факторов (курильщик, возраст 40-60 лет), функциональных параметров (снижение ВЬ^д) и рентгенологических признаков (симметричные двусторонние изменения по типу «матового стекла» в базальных отделах лёгких). При наличии сомнительной картины рекомендовано проведение торакоскопической биопсии лёгких. Биопсия лёгких необходима для исключения более агрессивных форм ИЗЛ.Отказ от курения является первым шагом лечения ДИП, так как показано, что данное мероприятие часто приводит к обратному развитию заболевания. Для большинства больных ДИП основным лечением является терапия преднизоло¬ ном в дозе 40-60 мг/сут. Несмотря на то что нет подтверждения эффективности данной терапии при ДИП, полученных в рандомизированных контролируемых
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 66Sисследованиях, терапия ГКС обычно рекомендована для больных с выраженными симптомами, изменениями ФВД и КТВР, а также при быстром прогрессирова¬ нии заболевания. Начальная доза преднизолона обычно назначается на период 1-2 мес, а затем дозу препарата постепенно снижают на протяжении 6-9 мес. На фоне терапии ГКС клиническое улучшение или стабилизация течения заболевания наблюдается приблизительно у двух третей больных ДИП. Значение цитостатиков при данной форме ИИП пока не ясно.Выживаемость при ДИП выгодно отличается от ИЛФ, пяти- и десяти-летняя выживаемость составляет 95,2 и 69,6%, соответственно. Однако в ряде случаев описано быстрое прогрессирование ДИП с очень плохим прогнозом. При самых тяжёлых формах ДИП единственным методом терапии является трансплантация лёгких, но при ДИП описано развитие заболевания в пересаженном лёгком.Респираторный бронхиолит, ассоциированный с интерстициальным заболеванием лёгкихРеспираторный бронхиолит, ассоциированный с интерстициальным заболева¬ нием лёгких (РБ-ИЗЛ), — заболевание из группы ИИП, при котором, как следует из названия, респираторный бронхиолит сочетается с поражением альвеол и лёгочного интерстиция. Данная форма заболевания была впервые описана Myers в 1987 г. Некоторые эксперты рассматривают РБ-ИЗЛ как вариант ДИП с пятни¬ стым, а не диффузным паттерном поражения лёгочной паренхимы с преимуще¬ ственной локализацией в перибронхиолярных отделах.КЛИНИЧЕСКАЯ КАРТИНАДанное заболевание встречается у курильщиков со стажем курения более 30 пачек/лет. РБ-ИЗЛ, в отличие от простого РБ, протекает с наличием респира¬ торных симптомов — одышка (77%), кашель (77%), продукция мокроты (27%, см. табл. 38-9). Средний возраст больных РБ-ИЗЛ колеблется от 30 до 40 лет. При аускультации выслушивается крепитация. В одном из исследований морфо¬ логическая картина РБ-ИЗЛ наблюдалась в 67% случаев у больных с первичным спонтанным пневмотораксом.Функциональные лёгочные тесты практически всегда выявляют снижение умеренно выраженный рестриктивный синдром, часто в сочетании с бронхиаль¬ ной обструкцией (см. табл, 38-9). При КТВР обычно выявляют центролобулярные узелки и очаги «матового стекла», а также зоны мозаичной олигемии (воздушные ловушки; рис. 38-10, см, также цветную вклейку). Данные изменения чаще всегоРис. 38-10, Респираторный бронхиолит, ассоциированный с интерстициальным заболеванием лёг¬ ких: а — гистологическая картона; 6 — картина Ю".
, г ' 866 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ'■ локализуются в верхних отделах лёгких. В редких случаях на КТВР при РБ-ШВ^ выявляют паттерн «дерево в пачках».' I МОРФОЛОГИЧЕСКАЯ КАРТИНА |? “ . Морфологическая картина РБ-ИЗЛ характеризуется аккумуляцией пигмевш|^ ' рованных макрофагов в просвете респираторных бронхиол и подлежащихвеол, утолщением альвеолярных перегородок вокруг бронхиол (рис. 38-10, (Ж 1 ■' , цветную вклейку). Наличие пигмента в макрофагах является следствием курени^ пигмент даёт положительную окраску на железо. По сравнению с РБ при РБ-ИЗЖ воспалительный процесс в лёгочном интерсгиции более выражен. Для цитолош- ческой картины БАЛ характерны повышенный цитоз, более 90% всех клеток пред¬ ставлены макрофагами, возможен небольшой нейтрофилёз.ДИАГНОСТИКА, ЛЕЧЕНИЕ И ПРОГНОЗПостановка диагноза РБ-ИЗЛ требует наличия характерной клинической ка|>“ тины (особенно курение в течение последних 6 мес), рентгенологической картины и биопсии лёгких, которая позволяет исключить более агрессивные формы диф¬ фузных ИЗЛ. Трансбронхиальная биопсия лёгких не позволяет провести диф¬ ференциальный диагноз между ДИП и РБ-ИЗЛ, поэтому «золотым стандартом» диагностики РБ-ИЗЛ остаётся открытая или торакоскопическая биопсия лёгких.Часто прекращение курения приводит к полному разрешению заболевания, в ряде случаев могут потребоваться небольшие дозы ГКС. По данным одного из исследований, улучшение состояния после прекращения курения наблюдается у 69% больных РБ-ИЗЛ. Роль ГКС при данной форме ИИП точно не установлена. Прогноз при РБ-ИЗЛ более благоприятный, чем при ИЛФ, однако всё-таки данное заболевание в ряде случаев может иметь неуклонно прогрессирующее течение и стать причинной смерти больных. В исследовании Ryu и соавт. семилетняя выжи¬ ваемость больных РБ-ИЗЛ составила 75%.Лимфоцитарная интерстициальная пневмонияЛимфоцитарная интерстициальная пневмония (ЛИП) является одним из самых редко встречающихся заболеваний из группы ИИП. Заболевание было впервые опи¬ сано Liebow и Carrington в 1969 г. как доброкачественное лимфопролиферативное заболевание, ограниченное лёгкими. Как следует из названия, в основе заболевания лежит распространённая гомогенная лимфоцитарная инфильтрация лёгочного интерстиция. Морфологический диагноз ЛИП очень сложен, так как сходную гисто¬ логическую картину имеют некоторые заболевания, ассоциированные с массивной лимфоцитарной инфильтрацией ткани лёгких: псевдолимфома, первичная лимфо- ма, лимфоматозный грануломатоз, доброкачественный лимфоматоидный ангиит с гранулематозом, ангиоиммунобластная лимфаденопатия. ЛИП, в свою очередь, в большшстве случаев ассоциирована с другими иммунологическими заболеваниями (см. ниже), чаще всего с синдромом Шегрена (более 50% всех ЛИП), идиопатиче- ские формы ЛИП занимают около 20% от всех форм ЛИП.Заболевания, ассоциированные с ЛИП:• заболевания с диспротеинемией;• гипогаммаглобулиемия;• моноклональная или поликлональная гаммапатия;• аутоиммунные заболевания;• синдром Шегрена;• хронический активный гепатит;• первичный билиарный склероз;• миастения;• тиреоидит Хашимото;
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 667• аллогенная трансплантация костного мозга;• приобретённый иммунодефицит;• вирус иммунодефицита человека;• вирус Эпштейна-Барр;• человеческий Т-клеточный лимфотропный вирус тип 1 (HTLV-1).КЛИНИЧЕСКАЯ КАРТИНАЛИП встречается чаще всего у женщин обычно в возрасте 40-60 лет. В одном из недавних исследований, представившем серию наблюдений за 15 больны¬ ми ЛИП, женщины составили более 70% всей группы, средний возраст был 47 лет. Заболевание также описано у детей с гипогаммаглобулинемией и ВИЧ. Большинство больных ЛИП — некурящие (около 75%). Начало заболевания чаще всего незаметное, постепенное. Длительность заболевания на момент обращения за медицинской помощью варьирует от 2 до 12 мес. Ведущим клиническим симп¬ томом при ЛИП, как и при других ИИП, является одышка, усиливающаяся при физических нагрузках. Одышка встречается практически у всех больных — 100% в серии больных, описанных Cha и соавт. Кашель является вторым по частоте симптомом, его распространённость среди больных ЛИП более 50%, чаще кашель сухой, но приблизительно у 30% больных отмечается продукция небольшого количества слизистой мокроты. Довольно часто больные ЛИП предъявляют жало¬ бы системного характера: утомляемость (более 80%), артралгаи (около 40%), лихорадка (более 30%), снижение массы тела (более 30%).При аускультации у большинства больных в базальных отделах лёгких выслу¬ шивают крепитацию (более 70%), иногда — сухие свистящие хрипы (около 7%), У ряда больных обнаруживают симптом «барабанных палочек» (более 10%).При проведении ФВД у большинства больных выявляют нарушение вентиля¬ ции по рестриктивному типу и умеренное снижение (в среднем около 60% от должных величин). Нередко на поздних стадиях ЛИП присутствует гипоксемия, которая усиливается во время физической нагрузки.РЕНТГЕНОЛОГИЧЕСКАЯ КАРТИНАРентгенолопіческая картина ЛИП довольно неспецифична, наиболее часто встречаются ретикулярные изменения в базальных отделах. По мере прогрессиро¬ вания заболевания может присутствовать смешанный альвеолярно-ретикулярный паттерн. «Сотовое лёгкое» и признаки лёгочной гипертензии отражают наличие поздних стадий ЛИП.Основными признаками ЛИП, по данным КТВР, являются изменения по типу «матового стекла», утолщение межальвеолярных перегородок, центролобулярные узелки, кистозные полости и небольшие участки консолидации лёгочной парен¬ химы (рис. 38-11, см, цветную вклейку). При благоприятном течении заболевания большинство данных изменений, за исключением кист, претерпевают обратное развитие. При прогрессировании ЛИП описано появление новых кист, которые возникают, как правило, на месте центролобулярных узелков, и появление участ¬ ков «сотового лёгкого» на месте изменений по типу консолидации,МОРФОЛОГИЧЕСКАЯ КАРТИНАМорфологическая картина ЛИП представлена выраженной распространённой лимфоцитарной инфильтрацией альвеолярных перегородок, перибронхиолярного и периваскулярного интерстиция (рис. 38-11, см. цветную вклейку). Лимфоциты при лип являются политипными (могут быть обнаружены и В-, и Т-лимфоциты), что является главным отличием данного заболевания от лёгочной лимфомы, при которой лимфоцитарные инфильтраты состоят из монотипных лимфоцитов. Кроме лимфоцитов, при лип в состав клеточных инфильтратов могут входить плазматические клетки и альвеолярные макрофаги. Также характерными морфо-
668 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХРис. 38-11. Лимфоцитарная интерстициальная пневмония; а — гистологическая картина; б — кар¬ тина КТ.логическими находками при ЛИП являются аккумуляция в интерстиции лёгких крупных ретикулоэндотелиальных клеток, мононуклерных клеток и гигантских клеток, которые формируют неказефицирующиеся гранулёмы; депозиция амилои¬ да в периваскулярном и парасептальном интерстиции; наличие хорошо сформи¬ рованных лимфоидных герминальных центров. Довольно часто лимфоцитарные инфильтраты лёгочной паренхимы ассоциированы с перибронхиальными лимфо¬ идными фолликулами (фолликулярный бронхиолит).ЛИП отличается от других клеточных форм ИИП — ДИП и НИП ~ наличием «монотонной» лимфоцитарной инфильтрации интерстиция и альвеол.Характерной картиной цитологического исследования жидкости БАЛ являются повышенный цитоз и значительное число лимфоцитов (более 30%). Среди пула лимфоцитов преобладают Т-лимфоциты (около V4). число CD4 и CD8 приблизи¬ тельно одинаково. В жидкости БАЛ также повышено число нейтрофилов (более 15%) и эозинофилов (в среднем около 7,5%).ДИАГНОСТИКА, ЛЕЧЕНИЕ И ПРОГНОЗДля постановки диагноза ЛИП во всех случаях требуется проведение откры¬ той биопсии лёгких. Основу терапии ЛИП составляют ГКС. Дозы и длитель¬ ность терапии приблизительно такие же, как и при других клеточных формах ИИП, например, ДИП. На фоне противовоспалительной терапии улучшение или стабилизация заболевания отмечается у большинства больных (около 80%), хотя у остальной небольшой группы больных наблюдается медленное, но неуклонное прогрессирование заболевания. Кроме ГКС, у больных ЛИП применялись попытки терапии азатиоприном, циклофосфамидом, метотрекса¬ том и циклоспорином.Течение ЛИП в целом более благоприятное по сравнению с ИЛФ. Описано полное разрешение заболевания на фоне терапии ГКС. По данным исследо¬ вания Cha и соавт., средняя выживаемость больных ЛИП составляет 11,5 лет. Выживаемость выше у больных с идиопатическими формами ЛИП. Описано несколько случаев трансформации ЛИП в малоактивную лёгочную лимфому, однако данные последних исследований ставят под сомнение возможность такой трансформации.
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ 6(9Острая интерстициальная пневмонияПервые упоминания об ОИП относятся к 1935 г., когда Hamman и Rich описа¬ ли четырёх больных с быстропрогрессирующей дыхательной недостаточностью, приведшей к смерти пациентов в течение 6 мес от начала возникновения болезни. На аутопсии был обнаружен выраженный распространённый фиброз лёгких, и авторы назвали заболевание как «фульминантный диффузный интерстициальный фиброз лёгких» или «острый диффузный интерстициальный фиброз лёгких». Длительное время синдромом Hamman-Rich назывались и заболевания с хрони¬ ческим течением (в первую очередь ИЛФ), однако в настоящее время синдром только ОИП можно отнести к синдрому Hamman-Rich. В 1990 г. аутопсийные препараты больных, описанных Hamman и Rich, были вновь пересмотрены Olson и соавт. Оказалось, что морфологическая картина данных больных полностью соответствует критериям ОИП,Несмотря на то что ОИП была впервые в 1935 г., в самостоятельную форму данное заболевание было выделена в лишь в 1986 г. В современных руководствах ОИП рассматривается как заболевание, характеризующееся прогрессирующей дыхательной недостаточностью, приводящей в большинстве случаев к летально¬ му исходу. Клиническая картина напоминает острый респираторный дистресс- синдром (ОРДС), однако при ОИП неизвестна причина заболевания и отсутствует вовлечение в процесс других систем организма (т.е. полиорганная недостаточ¬ ность). В настоящее время в мировой литературе описано около 150 случаев ОИП, что связано не столько с редкостью заболевания, сколько со сложностью его диа¬ гностики.ПРИЧИНЫ ОСТРОЙ ИНТЕРСТИЦИАЛЬНОЙ ПНЕВМОНИИСреди потенциальных причинных факторов заболевания рассматривают воз¬ действие инфекционных факторов или токсинов, либо генетическую пред¬ расположенность, либо комбинацию этих факторов. В пользу генетической основы ОИП могут свидетельствовать развитие морфологически идентичного заболевания лёгких при некоторых СЗСТ — системной красной волчанки, дерматомиозите-полимиозите, ревматоидного полиартрита и др. Возможно, ОИП является первым проявлением СЗСТ в виде изолированного поражения лёгких, а вовлечение других органов просто не успевает развиться, так как больной поги¬ бает от дыхательной недостаточности, В исследовании Vourkelis и соавт. наличие антинуклеарных антител было обнаружено у 3 из 6 больных ОИП, у которых проводился этот анализ. С другой стороны, у тех единичных больных, которые «пережили» ОИП, пока не описано развитие каких-либо СЗСТ, хотя, возможно, это связано с активной противовоспалительной терапией, которую продолжали получать больные.КЛИНИЧЕСКАЯ КАРТИНАДля ОИП характерно очень быстрое нарастание симптомов заболевания. По данным недавних работ, период от появления первых симптомов до обращения за медицинской помощью у большинства больных составляет не более 3 нед и очень редко превышает 2 мес. У большинства больных начало заболевания сопровождается гриппоподобным синдромом. Заболевание может развиться в любом возрасте: ОИП описан у больных от 13 до 83 лет, средний возраст больных составляет около 54 лет. Заболевание встречается одинаково часто у мужчин и у женщин. Наиболее частыми симптомами ОИП являются непродуктивный кашель и диспноэ. Лихорадка также является довольно частым признаком и встречается, по данным разных исследований, от 35 до 75% всех больных, К другим симптомам ОИП относят миалгии, головную боль, слабость. При осмотре обращает на себяштШшш
670 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХвнимание тахипноэ, тахикардия, цианоз. При аускультации выслушивают крсш- тацию (около 70%), реже сухие свистящие хрипы (около 30%).ФУНКЦИОНАЛЬНЫЕ ЛЁГОЧНЫЕ ТЕСТЫФункциональные тесты неспецифичны и выявляют картину, характерную других диффузных паренхиматозных заболеваний лёгких, — снижение лёгоченж объёмов, снижение диффузионной способности лёгких, однако из-за крайней тяжести больных полноценное функциональное исследование удаётся провесш далеко не всегда. Характерным признаком ОИП является выраженная гипоксемия часто рефрактерная к кислородотерапии, что отражает развитие истинного шуня справа налево. Средний уровень Зр^^ ® исследовании Уоигкеїів и соавт. составля 77%, Поэтому большинство больных, описанных в литературе, требовали прове¬ дения механической вентиляции лёгких.РЕНТГЕНОЛОГИЧЕСКАЯ И КОМПЬЮТЕРНО-ТОМОГРАФИЧЕСКАЯ КАРТИНАРентгенологическая картина при ОИП выявляет двусторонние пятнистые ретикулонодулярные тени, распространяющиеся практически на все лёгочные поля, за исключением рёберно-диафрагмальных синусов, и плотные инфильтраты (консолидация). Лёгочные поля могут быть уменьшены в размерах, в 30% наблю¬ дается появление небольшого плеврального выпота.Типичными находками КТ лёгких являются участки пониженной прозрачности паренхимы по типу «матового стекла» (более 90%), дилатация бронхов и наруше¬ ние лёгочной архитектоники. Изменения по типу «матового стекла» чаще всего имеют пятнистое распространение («географическая карта»), причём редко имеют субплевральную локализацию. Участки консолидации, по данным КТ, встреча¬ ются в 70-90% случаев и чаще расположены в нижних отделах лёгких («зави¬ симых зонах») (рис. 38-12, см. также цветную вклейку). Частыми КТ-находками являются утолщение интерлобулярных перегородок (75%) и интралобулярные ретикулярные затемнения (70%). На поздних стадиях заболевания (фаза органи¬ зации) наблюдается деформация архитектоники лёгких, появление тракционных бронхоэктазов (80%) и реже - кистозных изменений (12%). По данным ІсЬікасіо и соавт., наличие у больного ОИП участков консолидации или «матового стекла» в комбинации с тракционными бронхоэктазами является предиктором плохого про¬ гноза больных. В отличие от больных с ОРДС КТ-картина больных с ОИП имеет некоторые отличия; чаще наблюдается утолщение интерлобулярных перегородок и сотовые изменения.Рис. 38-12. Острая интерстициальная пневмония; а — гистологическая картина (стрелками показа¬ ны гиалиновые ленты); б — картина КТ.
ИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ В71МОРФОЛОГИЧЕСКАЯ КАРТИНАМорфологической основой ОИП является ранняя и поздняя (организующаяся) стадия диффузного альвеолярного повреждения (ДАП).Поражение лёгких носит диффузный характер. В ранней фазе ОИП в лёгких преоб¬ ладают экссудативные изменения в виде интерстициального и внутриальвеолярного отека, кровоизлияний, скоплений фибрина в альвеолах, в последующем появляются гиалиновые мембраны и интерстициальное воспаление (рис. 38-12, см. цветную вклей¬ ку). Гиалиновые мебраны - гомогенные эозинофильные ленты, повторяющие контуры альвеол. Их наличие сочетается с фибриноидным экссудатом в просветах альвеол с единичными нейтрофилами. Шалиновые мембраны образуются в конце первых суток от начала заболевания, достигая своего пика к 4-5 сут и сохраняются до 2 нед.Интерстициальный воспалительный инфильтрат в межальвеолярных перего¬ родках состоит из лимфоцитов, плазматических клеток, макрофагов. Воспаление возникает в конце 2 сут, достигая своего максимума к 10-11 сут. В этот же период в капиллярах межальвеолярных перегородок и в мелких ветвях лёгочной артерии встречаются фибриновые тромбы разной степени организации. В последующем в течение 3-7 сут от момента повреждения развивается гиперплазия альвеолоцитов П типа, наблюдающаяся в конце острой стадии и имеющая место на всём протя¬ жении стадии организации. В этот период большинство альвеол выстланы одно¬ родным слоем кубовидных клеток, появление в просвете альвеолярных макро¬ фагов при трансформации моноцитов крови приводит к фагоцитозу гиалиновых мембран и клеточных обломков. Часть альвеолярного экссудата накапливается в межальвеолярных перегородках, имитируя наличие гиалиновых мембран в них, иногда гиалин определяется в цитоплазме альвеолоцитов П-го типа.В период прогрессирования процесса развивается фиброз вокруг альвеолярных ходов. Этот фиброз вначале характеризуется накоплением фибробластов, миофи¬ бробластов, моноцитов при минимальном отложении коллагеновых волокон. При электронной микроскопии описано преобладание пролиферации фибробластов, коллапс и изменение конфигурации альвеол. Спадение альвеол, реэпителизация и пролиферация альвеолоцитов П типа приводят к утолщению межальвеолярных перегородок. В острой фазе встречаются тромбы разной степени организации, которые можно наблюдать и в последующем. Кроме того, в поздней стадии раз¬ вивается фиброз интимы и гипертрофия мышечной оболочки мелких ветвей лёгочной артерии и артериол с сужением их просветов, вплоть до полной облите¬ рации. При тяжёлом течении ДАП в течение нескольких недель за счёт фиброза происходит реструктуризация лёгочной ткани вплоть до образования «сот». Морфологические изменения при ОИП обычно носят относительно гомогенный характер, что отражает быстрое течение заболевания.Цитологическая картина БАЛ характеризуется повышенным числом клеточных элементов с преобладанием нейтрофилов (37-74%). Также возможными находка¬ ми БАЛ могут быть атипичные эпителиальные клетки с признаками вакуолизации цитоплазмы, часто эпителиальные клетки аккумулированы в виде кластеров, воз¬ можно присутствие в БАЛ цианофильного экстрацеллюлярного материала (при¬ знак диффузного альвеолярного повреждения).ДИАГНОСТИКА, ТЕЧЕНИЕ И ПРОГНОЗДля морфологической верификации диагноза возможно проведение открытой или торакоскопической биопсии лёгких. Однако, к сожалению, из-за крайней тяжести больных с ОИП проведение данной диагностической процедуры чаще всего бывает невозможно. Все описанные в литературе морфологические изме¬ нения ОИП основаны на данных аутопсии или открытой биопсии лёгких, выпол¬ ненной во время проведения больным ИВЛ. В ряде случаев морфологическая диа¬ гностика ОИП может быть основана на материале, полученном при проведении трансбронхиальной биопсии лёгких.
S72 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХЗаболевание характеризуется фульминантным течением, прогноз пломіЬ летальность больных ОИП крайне высока и составляет в среднем 70% (колебашв от 12,5 до 100%), Больные, «пережившие» острую дыхательную недостаточность при ОИП, могут в дальнейшем иметь следующие «сценарии»:• полное восстановление функции лёгких;• стабильное течение с персистирующими нарушениями лёгочных функцио¬ нальных показателей;• прогрессирующий лёгочный фиброз;• рецидив ОИП.По данным Olson и соавт., у больных, выживших после эпизода ОИП, наблк>- далось стабильное состояние в течение как минимум, двух лет наблюдения, у некоторых больных было отмечено стойкое снижение лёгочных функциональных показателей. Больные, «пережившие» острую дыхательную недостаточность пря ОИП, описанные в работе Quefatief и соавт,, также имели благоприятное течение заболевания: отсутствовали какие-либо симптомы, по данным функциональнсяп исследования сохранялись лёгкие рестриктивные нарушения. Эти данные контра¬ стируют с наблюдениями Vourkelis и соавт,, которые отмечали стойкие функцио¬ нальные нарушения у 5 из 6 выживших больных, и у 3 из этих 6 больных отмечено повторное развитие ОИП, приведшее к гибели больных в течение ближайших четырёх лет. В целом прогноз при ОИП не отличается существенно от прогноза ОРДС, при котором летальность составляет около 50%.ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКАДифференциальная диагностика ОИП чаще всего проводится с двусторонней бак¬ териальной пневмонией, ОРДС, ИЛФ, КОП, острой эозинофильной пневмонией.При ОРДС, как правило, известна причина (сепсис, травма, шок и др.), кроме того, ОРДС чаще всего бывает одной из составных частей полиорганной недоста¬ точности. Большие сложности может представлять разграничение ОИП от обо¬ стрения ИЛФ (табл. 38-10).Таблица 38-10. Дифференциальная диагностика острой интерстициальной пневмонииОИПИЛФОбострение ИЛФНачалоОстрое (1-2 нед)Хроническое (>€ мес)Острое на фоне хрониче¬ скогоРентгенофафиялёгкихДиффузные двусторон¬ ние затемненияДиффузные ретикулярные затемнения а нижних зонах + сотовые измененияНовые очаги затемнения на фоне диффузного ретикуляр¬ ного паперна, прогрессирова¬ ние консолидацииКТ лёгкихДиффузные затемнения по тмпу «матового стек¬ ла», консолидацийНерегулярные линейные тени, тракционные бронхоэктазы, сотовые изменения, преиму¬ щественно субплеврально, в нижних зонахНовые тени по типу «матового стекла» на фоне диффузного ретикулярного паттерна, про¬ грессирование консолидацииМорфологияГомогенное диффузное альвеолярное поврежде¬ ние, фокальные гиали¬ новые мембраныОбычная интерстициальная пневмония; гетерогенные очаги субплеврального фибро¬ за, фокусы фибробластов, сотовые измененияСочетание диффузного аль¬ веолярного повреждения и обычной интерстициальной пневмонииЛечениеМеханическая вентиля¬ ция, ГКС, цитостатикиГКС + цитостатикиГКС + цитостатики, повышение дозыПрогнозЛеталы10стъ 75% е тече¬ ние 6 месЛетальность 50% в течение 5 летЛетальность 50% в течение 1 мес
'жттИДИОПАТИЧЕСКИЕ ИНТЕРСТИЦИАЛЬНЫЕ ПНЕВМОНИИ $73ТЕРАПИЯЭффективной терапии ОИП в настоящее время не существует. В большинстве описанных случаев ОИП больные получали высокие дозы ГКС, однако, несмотря на это, летальность при этом заболевании очень высока. Относительно недавно была показана эффективность метилпреднизолона у больных с фибропролифера- i тивной фазой ОРДС (позже 5-10 дня от начала заболевания): отмечено улучшение индекса повреждения лёгких, полиорганной недостаточности и улучшение выжи¬ ваемости больных в течение 60 дней. Однако, несмотря на сходную морфологиче¬ скую картину при ОИП и ОРДС, данные заболевания имеют различный патогенез, что, вероятно, может объяснить различную эффективность терапии ГКС — очень часто при ОИП они не приводят к улучшению клинической картины. Тем не менее эксперты рекомендуют использование при ОИП метилпреднизолона внутривенно в дозе 2 мг/(кгхсут).в ранних работах при быстропрогрессирующем лёгочной фиброзе была отме¬ чена эффективность внутривенной комбинированной терапии преднизолоном (250 мг/сут), циклофосфамидом (1,5 г/сут) и винкристином (2 мг/сут). Robinson и соавт. описал случай эффективной терапии больного с ОИП комбинацией циклоспорина, азатиоприна и преднизолона. Недавно Suratt и соавт. представили положительный опыт использования интерферона-у (50-100 мкг 3 раза в неделю) у пациента с ОИП, индуцированным кармустином и лучевой терапией.Обязательными компонентами терапии ОИП является кислородотерапия и респираторная поддержка. Тактика респираторной поддержки не отличается от той, что принята в настоящее время при ОРДС — протективной вентиляции лёгких. Возможно, улучшить прогноз при ОИП могут помочь новые препараты — экзогенный сурфактант, антицитокиновые антитела, оксид азота.СПИСОК ЛИТЕРАТУРЫ0
Глава 39 Поражения органов дыхания при системных заболеваниях соединительной тканиСистемные заболевания соединительной ткани (СЗСТ) — группа воспалительных аутоиммунных заболеваний неизвестной этио¬ логии с частым вовлечением дыхательной системы. К наиболее распространённым представителям этой группы болезней относят ревматоидный артрит (РА), системную красную волчанку (СКВ), системную склеродермию (СС) и полимиозит/дерматомиозит.При СЗСТ в процесс могут вовлекаться все отделы респиратор¬ ной системы [1, 2, 3]. Одна их часть связана собственно с СЗСТ (лёгочный васкулит, дисфункция диафрагмы и др.), развитие других носит вторичный характер, У одного больного нередко сочетаются поражения разного характера, и эта множественность повреждений лёгких является общей чертой СЗСТ. В то же время каждое заболе¬ вание отличается своеобразием лёгочной патологии.СЗСТ имеют прогрессирующий характер и длительное, часго тяжёлое течение. Лёгочные проявления могут возникнуть на любой стадии или предшествовать болезни за несколько лет. Ведущими симптомами при вовлечении дыхательной системы при СЗСТ явля¬ ются одышка, кашель и боли в грудной клетке. Самые частые синдромы — поражение плевры и интерстициальное заболевание лёгких [4].Свойственная СЗСТ дисфункция иммунной системы, терапия ГКС и цитостатическими препаратами способствуют развитию инфекци¬ онных поражений в респираторном тракте. У больных СЗСТ вос¬ приимчивость к инфекции очень высока. Снижение клеточного иммунитета является причиной склонности к тяжёлому течению инфекций, таких, как пневмонии, сепсис и туберкулёз. Поэтому при появлении у больных СЗСТ новых теней и инфильтратов в лёгких, прежде всего, необходимо думать об инфекции. Наряду с обычными возбудителями пневмоний, инфекционные осложнения нередко вызываются условно-патогенной флорой, микобактериями туберкулёза, вирусами и грибами. Эти осложнения являются одной из самых частых причин смерти при СЗСТ [5].Ряд препаратов, используемых в терапии СЗСТ, может вызвать лёгочные осложнения. Так, препараты золота и В-пеницилламин ассоциируются с развитием облитерирующего бронхиолита и диф¬ фузного альвеолярного повреждения. Лечение сульфасалазином осложняется лекарственным пневмонитом. Острый пневмонит/
ПОРАЖЕНИЯ ОРГАНОВ ДЫХАНИЯ ПРИ СИСТЕМНЫХ ЗАБОЛЕВАНИЯХ СОЕДИНИТЕЛЬНОЙ ТКАНИ 675бронхиолит — тяжёлое осложнение, которое развивается в 0,3-12% случаев у больных РА, леченных метотрексатом, и не связано с его кумулятивной дозой. Лефлуномид и блокаторы ФНО-а также могут индуцировать интерстициальную пневмонию. Гистологически определяется альвеолярная инфильтрация лимфоци¬ тами в отличие от банальных пневмоний, где превалирует нейтрофильная инфиль¬ трация. Эозинофилия встречается у 50% больных. [6, 7]. Лечение проводят высо¬ кими дозами ГКС. Исход обычно благоприятный, но смертность, по некоторым данным, может достигать 15%.Системная красная волчанкаСКВ — аутоиммунное заболевание, патогенетически связанное с нарушениями иммунорегуляции, которые вызывают гиперпродзкцию широкого спектра ауто¬ антител к различным компонентам ядра и иммунных комплексов. СКВ более чем другим СЗСТ присуш1а полиорганность, которая связана с системным поражением сосудов разного калибра, в тяжёлых случаях по типу генерализованного васкулита. [2, 3]. Для СКВ характерно наличие в сыворотке крови высоких титров антину- клеарных факторов (АНФ), антител к нативной ДНК и антигену Смитта (5т-Ад), низкий уровень комплемента. Без лечения прогноз неблагоприятный, но при адек¬ ватной терапии возможно наступление ремиссии.По сравнению с другими СЗСТ вовлечение лёгких при СКВ имеет самый широ¬ кий спектр синдромов: плеврит, острый волчаночный пневмонит, хронический интерстициальный пневмонит (ИЗЛ), РБИЗЛ, альвеолярные кровоизлияния, поражение дыхательной мускулатуры (сидром «усадки» лёгких), облитерирую- щий бронхиолит, лёгочный васкулит с ЛГ, тромбоэмболия ветвей лёгочной арте¬ рии (обычно в рамках антифосфолипидного синдрома), инфекционные осложне¬ ния [1, 2, 3, 6, 8]. Клинически значимое поражение лёгких при СКВ описывают в 1-6% случаев, по данным КТВР — в 30%, а на аутопсии — до 70% случаев. Плевро- лёгочные изменения типичны для СКВ, индуцированной лекарствами, особенно прокаинами дом. Изредка встречается поражение верхних дыхательных путей: язвы твёрдого нёба, подглоточные изъязвления, воспаление гортани, подглоточ- ный стеноз, паралич голосовых связок.Плеврит - экссудативный или адгезивный, чаще двусторонний, нередко соче¬ тается с перикардитом. Выпот имеет серозный, нередко серозно-геморрагический характер, количество глюкозы эквивалентно глюкозе сыворотки (>60 мг/дл), число лейкоцитов — 3-5x1 оул (в острой фазе преобладают нейтрофилы), харак¬ терно высокое содержание иммуноглобулинов и типичных для СКВ антиядерных аутоантител.Острый волчаночный пневмонит (ОВП) наблюдается в 1-4% случаев, сочетает¬ ся с экссудативным плевритом, сопровождается лихорадкой, одышкой, кашлем с мокротой, кровохарканьем. Б патогенезе ОВП ведущую роль играют васкулиты и отложение иммунных комплексов в лёгочной ткани. На рентгенограммах грудной клетки выявляют диффузное усиление лёгочного рисунка, в базальных отделах лёгких — одно- и двусторонние альвеолярные или интерстициальные инфиль¬ траты, ограниченные или диффузные, дисковидные ателектазы, высокое стояние куполов диафрагмы, её деформация за счёт спаек.ОВП редко (<2%) сопровождается диффузными альвеолярными геморрагиями (ДАГ), в основе которых лежит лёгочный капиллярит. Кровохарканье отмечается у 35-58%. На фоне нарастающей тяжёлой гипоксемии более чем у половины боль¬ ных возникает потребность в ИВЛ, летальность достигает 50-90%. Развитие син¬ дрома ассоциируется с тяжёлым люпус-нефритом, применением циклофосфамида. При появлении альвеолярных геморрагий особенно важно исключить вторичную инфекцию. Если изменения в лёгких трактуются как проявление основного забо¬ левания, закономерно назначается активная противоревматическая терапия ГКС
676 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХИ цитостатиками, что при наличии инфекции может приводить к ухудшс Дифференциальную диагностику острого пневмонита с ДАГ нужно npoBoj с пневмонией, коагулопатиями, уремией, ТЭЛА, застойной сердечной недост»- точностью при сердечных заболеваниях, гранулематозом Вегенера, синдрожм Гудпасчера и микроскопическим полиангиитом.ИЗЛ при СКВ встречается в 3-8% случаев, ассоциируется с хроническим тече¬ нием болезни и проявляется мягкими обострениями; может быть резидуальной формой в исходе острого пневмонита. Наряду с одышкой при нагрузке и непро¬ дуктивным кашлем, нередко отмечаются плевральные боли. Морфологические типы ИЗЛ при СКВ не изучены.Синдром «усадки» лёгкого (СУЛ) связан с дисфункцией дыхательных мьшщ. Обычно СУЛ не сочетается с генерализованной мьпиечной слабостью, хотя и может быть проявлением общего мышечного синдрома. Больные предъявляют жалобы на одышку, усиливающуюся в положении сидя (когда роль диафрагмы уБеличивается)* Рентгенологически выявляют высокое стояние куполов диафрагмы, дисковиднью ателектазы, уменьшение лёгочных объёмов, при этом интерстициальные поражения отсутствуют. Линейные ателектазы чаще локализуются в базальных отделах лёгких и связаны с плевритом и высоким стоянием купола диафрагмы.Тромбоэмболические изменения у больных СКВ с антифосфолипидным син¬ дромом обнаруживаются в 35-42% случаев и диагностируются с помощью ангио¬ графии сосудов лёгких и КТВР, У таких больных повышен уровень антител к фос¬ фолипидам и волчаночного антикоагулянта.Лёгочная гипертензия при СКВ чаще ассоциируется с интерстициальным фиброзом, клапанными изменениями, ТЭЛА, острой фазой заболевания. Более редкая причина ЛГ при СКВ — лёгочный васкулит. подтверждением которого является ответ на иммуносупрессивную терапию.Основа лечения СКВ — ГКС и иммуносупрессивные средства. Доза ГКС зависит от остроты и тяжести процесса и составляет в период обострения максимально1-2 мг/кг массы тела в сутки. В тяжёлых случаях применяют плазмаферез, пульс- терапию метилпреднизолоном с циклофосфамидом. Схема пульс-терапии: метил- преднизолон по 1000 мг в сутки вводится в течение 3 дней, циклофосфамид — 1 г однократно на вторые сутки. При необходимости курсы повторяют ежемесячно в течение 3-6 мес [1,9].Ревматоидный артритРевматоидный артрит (РА) — хроническое симметричное воспаление синови¬ альной оболочки, в первую очередь суставов кистей и стоп, постепенно приводя¬ щее к их деструкции. Иммунологическая особенность РА — выработка аутоантител класса IgM к собственным иммуноглобулинам (ревматоидные факторы), которые обнаруживаются в сыворотке крови в умеренных и высоких титрах, а также анти¬ тел к циклическому цитруллинированному пептиду [2].Наряду с поражением суставов у 20-30% больных развиваются внесуставные (системные) проявления, к которым относят ревматоидные узелки (РУ) и васку¬ лит. Наиболее типичные проявления васкулита при РА — дигитальный артериит, язвы кожи, периферическая нейропатия и васкулит внутренних органов (лёгких, сердца, почек) [1], Особенно тяжёлые формы васкулита развиваются у больных с криоглобулинемией. Достоверный диагноз устанавливается по данным гистоло¬ гического исследования биоптатов, в которых обнаруживается некротизирующий панартериит сосудов мелкого и среднего калибров. Риск летального исхода при развитии внесуставных проявлений увеличивается в 5 раз.При РА часто встречаются заболевания дыхательных путей: бронхоэктазы и бронхиолиты (констриктивный, фолликулярный, лимфоидный, диффузный пан¬ бронхиолит), а также поражение плевры, лёгочных сосудов (васкулит, лёгочная
ПОРАЖЕНИЯ ОРГАНОВ ДЫХАНИЯ ПРИ СИСТЕМНЫХ ЗАБОЛЕВАНИЯХ СОЕДИНИТЕЛЬНОЙ ТКАНИ 677гипертензия), диффузные альвеолярные геморрагии с капилляритами и ИЗЛ [3, 11,12,13].Плеврит — самое частое поражение лёгких, выявляется на аутопсии в 50% случаев [13]. Клинически плеврит протекает малосимптомно, с небольшим коли¬ чеством выпота. Двусторонняя локализация отмечается примерно у 25% больных. У трети больных плеврит ассоциируется с ИЗЛ.Плевральный выпот имеет признаки экссудата с высоким цитозом, концентра¬ цией белка >4 г/л (до 30-35 г/л) и повышенным уровнем лактатдегидрогеназы. В выпоте преобладают лимфоциты, иногда с примесью эозинофилов. Уровень гемолитического комплемента снижен, положительны реакции на РФ, выявля¬ ются циркулирующие иммунные комплексы и нейтрофилы, фагоцитировавшие иммунные комплексы. Характерно низкое содержание глюкозы. Экссудаты другой локализации (перикардиальный, синовиальный) имеют близкие характеристики.Ревматоидные узелки (РУ) в лёгких обнаруживаются редко (1-2%). Гисто¬ логически РУ представляют фокусы фибриноидного некроза, окружённого пали¬ садообразно расположенными гистиоцитами. В процессе гранулематозной транс¬ формации формируется наружный слой из фиброзной соединительной ткани, содержащей лимфоциты и фибробласты. РУ встречаются у больных с клас¬ сическим полиартритом и высоким уровнем РФ, преимущественно у мужчин. Типичное расположение — субплевральное, нередко в верхних отделах лёгких. Как правило, РУ не сочетаются с плевритом и ИЗЛ. В редких случаях происходит распад или нагноение ревматоидного узелка, что сопровождается образованием небольших каверн и кровохарканьем, а при субплевральной локализации — раз¬ витием спонтанного пневмоторакса. Единичный РУ нужно дифференцировать с опухолями, туберкулёзом и инфекцией.Клинически очеввдное ИЗЛ при РА выявляется в 2-6% случаев, при КТВР — в 10-47% [14]. Рестриктивное нарушение ФВД с нормальным отношением ОФВу ФЖЁЛ и снижением является типичным функциональным паттерном, однако могут выявляться и смешанные рестриктивно-обструктивные нарушения. Показано, что менее 54% от должного является высокочувствительным пре¬ диктором прогрессирования ИЗЛ при РА.При РА встречаются различные гистологические варианты ИЗЛ: ОИП, НИП, а также организующаяся пневмония. Полагают, что распределение гистологических вариантов ИЗЛ при РА отличается от других СЗСТ с преобладанием паттерна ОИП, а не НИП. Характерной гистологической чертой ИЗЛ при РА является лимфоидная гиперплазия. При КТВР выявляют симпто2й «матового стекла» (до 90%) и сетчатые изменения лёгочного рисунка (98%). Ретикулярные изменения и участки «сотового лёгкого» расположены субплеврально в нижних отделах и часто сочетаются с трак- ционными бронхоэктазами и нарушением архитектоники лёгкого [15].Клиническое течение ИЗЛ при РА может быть очень медленным (в течение 10 лет и более) или фульминантным. Полагают, что ИЗЛ при РА имеют две формы — доброкачественную и злокачественную, которые могут соответствовать двум гистологическим вариантам интерстициального поражения лёгких - НИП и ОИП. При отсутствии отклонений ФВД на момент установления диагноза ИЗЛ течение болезни может быть благоприятным. Пятилетняя выживаемость составляет при¬ мерно 39-44%. С поправкой на возраст, пол, курение и лечение ГКС выживаемость у больных РА с ИЗЛ оказалась хуже, чем при идиопатических ИЗЛ. Смертность, обусловленная ИЗЛ, составляет 6% всех причин смерти больных РА и превышает смертность от всех других вместе взятых внесуставных проявлений РА.у 10-15% больных РА развивается грозное осложнение — вторичный амилои- доз, в том числе с вовлечением лёгких. При РА чаще, чем в популяции здоровых лиц, развиваются лимфомы, миелома и лейкозы, что необходимо учитывать при дифференциальном диагнозе.
678 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХПри лечении внесуставных проявлений РА применяют ГКС в дозах 15-20 мг/суг ; в сочетании с циклоспорином А, сульфасалазином, лефлуномидом, циклофос¬ фамидом. Эффективный метод лечения ревматоидного васкулита — интермиг> | тир)тощая пульс-терапия метилпреднизолоном в течение 3 дней в сочетании с циклофосфамидом или метотрексатом (по 20-40 мг однократно во второй день). ] Такие курсы можно проводить каждые 2-4 нед в течение 6-8 нед с последующим | удлинением интервала между введениями. При снижении активности продоляа- ? ют терапию иммуносупрессантами (монотерапия или комбинация двух базисных ^ препаратов), возможно, в сочетании с малыми дозами ГКС [1, 2]. ^Системная склеродермия |Системная склеродермия (прогрессирующий системный склероз) — группа | фиброзирующих заболеваний, в ранней стадии которых превалируют нарушения ; микроциркуляции и воспаление, постепенно приводящие к генерализованному ; фиброзу. Типичные аутоиммунные нарушения при системной склеродермии — образование антицентромерных антител и антител к антигену топоизомеразы! 1 ($с1-70). Заболевание отличается гетерогенностью появлений, и самым ярким из них является уплотнение кожных покровов.Диффузная форма СС характеризуется острым развитием и быстрым прогресси¬ рованием генерализованного фиброза кожи и внутренних органов (сердца, лёгких, почек). Относительно доброкачественная лимитированная форма СС дебютирует феноменом Рейно, кожные изменения имеют ограниченный характер, прогрес¬ сируют медленно и сопровождаются хроническими сосудистыми ишемическими расстройствами. Прогноз для жизни при разных формах СС различен и серьёзен при остром, быстропрогрессирующем течении болезни. При более ранней диагно¬ стике и современной терапии прогноз у больных СС заметно улучшился [1,2,16].Поражение лёгких при СС встречается чаще, чем при других СЗСТ, и при КТВР обнаруживаются в 80-90% случаев. Риск развития серьёзного лёгочного поражения при СС повышен у мужчин, при диффузной форме болезни, при выраженных при¬ знаках воспаления и наличии антитопоизомеразных антител 8сЬ70, а также при зна¬ чительном снижении Поражение лёгких — главная причина смерти при СС.Основные проявления поражения респираторной системы — ИЗЛ, а также функ¬ циональная и органическая патология сосудистого ложа лёгких с развитием ЛГ. Полагают, что ИЗЛ более свойственно диффузной СС, а ЛГ чаще выявляется при лимитированной форме. Важно, как можно раньше различить эти варианты лёгоч¬ ной патологии, поскольку ЛГ снижает пятилетнюю выживаемость с 90 до 50-70%, а подходы к терапии этих состояний существенно различаются. Инфекционные осложнения — пневмонии, абсцедирование — возникают реже, чем при других СЗСТ. На фоне склеродермического пневмофиброза может возникнуть рак лёгких, риск развития которого при СС выше, чем в общей популяции в 3-5 раз.При ИЗЛ у больных СС наряду с воспалительным процессом в альвеолах происходит редукция микроциркуляторного русла, что является отличительной чертой склеродермического процесса, функциональные, а затем и структурные изменения в микроциркуляции сопровождаются повышением уровней ростовых факторов и цитокинов, таких, как трансформирующий фактор роста р, фактор роста тромбоцитов, инсулиновый фактор роста 1 и др. Под их влиянием проис¬ ходит активация фибробластов и усиленное образование ими белков экстрацел- люлярного матрикса. При прогрессировании болезни эти изменения приводят к развитию ИЗЛ и вторичной ЛГ.ИЗЛ при СС представлено более широким спектром морфологических вариан¬ тов по сравнению с другими СЗСТ. НИП у больных СС встречается чаще других морфологических типов [17]. ОИП отличается вариабельностью изменений в тка¬ нях, тогда как гистологическая картина НИП более мономорфна, характеризуется
ПОРАЖЕНИЯ ОРГАНОВ ДЫХАНИЯ ПРИ СИСТЕМНЫХ ЗАБОПЕ6АНИЯХ СОЕДИНИТЕЛЬНОЙ ТКАНИ 679Преобладанием воспалительных изменений, отсутствием фибробластных фокусов и сотовой деформации, В различных биоптатах одного и того же больного СС могут быть обнаружены два разных морфологических типа, даже при исследова¬ нии нескольких биопсий в пределах одной доли лёгкого. Рестриктивные наруше¬ ния и уменьшение выявляют у 90% больных СС, иногда без соответствующих изменений ФЖЁЛ. Сравнение данных КТ у больных СС и ИИП показало, что при СС фиброз не столь грубый, а относительная доля участков «матового стекла» больше, чем у больных с ИИП [5,18].Необходимо начинать терапию ИЗЛ, ассоциированного с СС, как можно рань¬ ше, до развития необратимых фиброзных изменений. Доказано, что при ИЗЛ у больных СС с помощью комплексной терапии иммуносупрессивными средствами (циклофосфамидом) и ГКС можно добиться остановки прогрессирования процес¬ са и даже улучшения [16, 19]. Активно разрабатываются новые терапевтические подходы — трансплантация стволовых клеток (изолированно или с циклофосфа¬ мидом), антитела к цитокинам, испытываются новые иммуносупрессанты.Лёгочная гипертензия при СС обусловлена либо интерстициальным фибро¬ зом, либо пролиферативным процессами в сосудистой стенке в отсутствие значи¬ мых изменений паренхимы или хронической гипоксии. Ещё одной причиной л г может быть поражение левых отделов сердца, как клапанное, так и собственно миокарда. Частота выявления ЛГ — 12-15% случаев, ЛГ при СС чаще ассоциирует¬ ся с лимитированной формой болезни и выявляется у больных с большой длитель¬ ностью заболевания. Наметившаяся в последние годы тенденция к увеличению частоты интерстициального фиброза у больных СС не привела к существенному преобладанию гипоксемического варианта ЛГ, однако обусловила необходимость выделения сочетанного типа ЛГ. Выделение этого варианта продиктовано необхо¬ димостью иной, чем при интерстициальном фиброзе, терапевтической тактики в связи с его крайне тяжёлым, прогностически неблагоприятным течением.При диагностике ЛГ при СС необходимо подчеркнуть значимость исследования ФВД с определением ВЦр, не нашедшего должного места в диагностических програм¬ мах при идиопатической ЛГ. Показана прогностическая роль этого метода, помимо общепринятных клинико-иммунологических признаков, в определении риска разви¬ тия ЛГ у больных СС. Изолированное снижение ОЬсо при отсутствии других причин — интерстициального фиброза, сопутствующих ХОБЛ или анемии — явилось более достоверным предиктором развития ЛГ, чем другие доступные «скрининговые» мето¬ дики — ЭКГ или эхокардиография [20], Отмечают менее благоприятное течение ЛГ в ассоциации с СС, что, возможно, связано с поздней диагностикой [21].Идиопатические воспалительные миопатиив группу воспалительных миопатий (ВМ), в основе которых лежит воспаление поперечнополосатой мускулатуры, включены полимиозит (ПМ); дерматомиозит (ДМ), ювенильный ДМ; миозит, сочетающийся с СЗСТ; миозит, сочетающийся с опухолями; миозит с внутриклеточными включениями и некоторые другие. Признаки миопатии могут превалировать в клинической картине СЗСТ и систем¬ ных васкулитов [22]. ДМ, реже ПМ, ассоциирующиеся с опухолями, составляют около 20% всех случаев воспалительных миопатий [1, 23]. При воспалительных миопатиях наблюдаются ассоциации определённого клинического шмптомокомп- лекса с иммунологическими маркёрами — миозит-специфическими антителами, направленными к цитоплазматическим белкам и рибонуклеиновым кислотам. Чаще других встречаются антитела к аминоацилсинтетазам тРНК (}о-1 и др.).Поражение мышц при ПМ/ДМ проявляется симметричной слабостью прокси¬ мальных групп мышц верхних и нижних конечностей и мышц, участвующих в сги¬ бании шеи, затруднением при подъёме с низкого стула, при посадке в транспорт, при умывании и причёсывании. Характерно поражение мышц глотки, гортани и
680 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХверхней трети пищевода (дисфония, дисфагия). Поражение дистальной мускула¬ туры нехарактерно.Бнутриорганные проявления ПМ/ДМ весьма разнообразны, наиболее часто встречается поражение дыхательной системы [6, 9, 24]. Оно может протекать субклинически или проявляться яркими клиническими признаками ИЗЛ и при¬ мерно в 10% предшествует мышечному поражению. На фоне типичного для ПМ/ ДМ вовлечения межрёберных мышц и диафрагмы отмечается высокое стояние куполов диафрагмы и вялость её дыхательных экскурсий. Это приводит к экс¬ пираторной одышке, изменению ФВД по рестриктивному типу в 40% случаев. Снижается кашлевой и дыхательный клиренс лёгких, лёгочный кровоток, что является благоприятным условием для развития гиповентиляционной пневмонии и лёгочной гипертензии.Пневмония осложняет течение ПМ/ДМ у 29-54% больных. Ведущую роль в её развитии играет аспирация пищи, связанная с поражением мышц глотки и верхней трети пищевода. Частота аспирационного синдрома у больных ПМ/ДМ достига¬ ет 30%. На состояние больного оказывает дополнительное негативное влияние гиповентиляционный синдром, приводящий к дополнительному риску развития пневмонии [1, 6,24].Наиболее тяжёлым поражением лёгких при ПМ/ДМ является ИЗЛ, признаки которого появляются на ранних этапах болезни. ИЗЛ при ПМ/ДМ диагностируют в 10-63%. Выделяют три его формы: быстропрогрессирующее поражение лёгких с плохим прогнозом, медленно прогрессирующее и субклиническое, когда измене¬ ния в лёгких выявляются при помощи специальных методов исследования [6].Вьщеляют четьфе морфологических типа ИЗЛ, имеющих различный прогноз [25].• РБИЗЛ — облитерирующий бронхиолит. ассоциированный с грануляциями, заполняющими бронхиолы и альвеолы: интерстициальное воспаление раз¬ личной степени выраженности, обусловленное в основном макрофагами, лимфоцитами и плазматическими клетками-• ОИП — участки нормальной лёгочной ткани, перемежаются с участками интерстициального рубцевания и «сотового лёгкого». Степень интерстици¬ ального воспаления выражена умеренно, воспалительный инфильтрат пред¬ ставлен лимфоцитами и большим количеством плазматических клеток.• ОИП/диффузное альвеолярное повреждение ~ повреждение выстилающих альвеолы клеток, гиалиновых мембран; интраальвеолярный отек, геморраги¬ ческие фокусы, отёк и уплотнение интерстиция.• ЛИП — скопление мононуклеарных клеток в интерстиции, в основном лим¬ фоцитов и плазматических клеток с минимальным фиброзом.Раннее начало лечения ДМ/ПМ (в течение первых 3 мес от начала симпто¬ мов) ассоциируется с более благоприятным прогнозом. Назначаются высокие дозы ГКС (начиная с 1 мг/кг массы тела в сутки), в некоторых случаях и более (до 100 мг в сутки) в течение не менее 6 нед [7. 8]. Нарастание мышечной силы при ПМ/ДМ происходит медленно, в среднем через 1-3 мес. При наличии фак¬ торов риска неблагоприятного прогноза, при невозможности назначить адекват¬ ную дозу ГКС из-за побочных эффектов или при недостаточной эффективности ГКС подключаются метотрексат, азатиоприн, циклофосфамид, циклоспорин А, микофенолата мофетил. Препаратом выбора при ИЗЛ является циклофосфамид. Предполагают, что он помогает преодолеть стероидорезистентность ИЗЛ при ПМ/ДМ. Назначается в дозе 100-150 мг в сутки внутривенно, внутрь или по 1 г раз в месяц в сочетании с ГКС (метилпреднизолон по 250-1000 мг) [9, 23, 36].СПИСОК ЛИТЕРАТУРЫ;^
Глава 40 СаркоидозСаркоидоз (синонимы в настоящее время не используются; Бека болезнь, Бека саркоид, Бенье-Бека-Шауманна синдром, Шауманна синдром, гранулематоз доброкачественный, лимфогранулематоз доброкачественный, ретикулоэндотелиоз эпителиоидно-клеточный хронический) — мультисистемный гранулематоз неизвестной этио¬ логии, характеризующийся скоплением активированных Т-лимфо¬ цитов (СВ4") и мононуклеарных фагоцитов, образованием несе- кретирующих эпителиоидн'оклеточных неказеифицирующихся гранулём в различных органах [1]. Саркоидоз наиболее часто воз¬ никает у взрослых и проявляется лимфаденопатией корней лёгких, поражением легочной ткани, глаз и кожи.ЭпидемиологияВновь выявленные случаи чаще всего регистрируются в возрасте до 40 лет (с 20 до 39 лет), имеется некоторое преобладание женщин (выраженность варьирует между странами и расами). Дети и пожи¬ лые люди болеют заметно реже и имеют особенную клиническую картину: у детей до 4 лет редко встречаются внутригрудные пораже¬ ния. В России заболеваемость саркоидозом составляет 3-4 случая на 100 ООО населения в год. Распространённость варьирует от 5,8 до 47 на 100 ООО населения [3], В Республике Татарстан в 2002 г. был собран контролируемый регистр больных саркоидозом, согласно которому заболеваемость составила 5,97, а распространённость —17,8 на 100 ООО населения [4]. В Исландии за период с 1981 до 2003 г. заболеваемость увеличилась с 2,8 до 5,0 на 100 ООО населе¬ ния [5]. Общая заболеваемость саркоидозом в Дании находится в пределах 7-10 на 100 ООО населения [6]. Случаи семейного саркои- доза в Татарстане составляют 0,5% общего числа, в Сербии — 2%, в Ирландии - 2,4%, в Японии - 4,3%, в Финляндии - 4,7%, во Франции — 5%, в Германии — 7,5%, в Голландии — 16,3%, среди афроамериканцев в США - 17% случаев. По мнению большинства исследователей, официально опубликованные данные о распро¬ странённости саркоидоза явно занижены [7]. Активный скрининг саркоидоза не проводится, поскольку заболевание не является кон¬ тагиозным и редко приводит к неблагоприятным исходам.ЭтиологияПринято считать, что саркоидоз вызывают внешние агенты, являющиеся триггерами характерного иммунного ответа у генети¬ чески предрасположенных людей [8].
682 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХВНЕШНИЕ ФАКТОРЫРоль инфекции в патогенезе саркоидоза рассматривается как постоянная анти¬ генная стимуляция, приводящая к нарушению регуляции выработки цитокино* [9]. К инфекционным триггерам относят микобактерии туберкулёза [Ю], хламн- дии, боррелии, пропионокислые бактерии, Helicobacter pylori, риккетсии. Бактерии с дефицитом клеточной стенки способны инфицировать фагоциты иммунной системы и тем самым способствовать гранулематозной реакции при саркоидозе. В пользу бактериального патогенеза саркоидоза свидетельствует не только спо¬ собность некоторых антибиотиков переводить заболевание в ремиссию, но также развитие реакции Яриша-Герксгеймера, вызванной выбросом эндотоксинов уби¬ тых микробов [11]. Рассматривается также роль вирусов герпеса, Эпштейна-Барр, аденовирусов и других латентных вирусов.Как ятрогенную причину саркоидоза рассматривают применение интерферона-а при вирусном гепатите С. Отмена этого препарата приводит к спонтанному раз¬ решению саркоидоза [12]. В экспериментах in vitro было показано, что фактор образования саркоидных гранулём инактивируется при автоклавировании или облучении, но проходит через ультрафильтры, что характерно для вирусов или L-форм бактерий [13]. Описаны случаи передачи саркоидоза от донора к реципи¬ енту при пересадке различных органов и стволовых клеток [14].ГЕНЕТИЧЕСКИЕ ФАКТОРЫВероятность возникновения саркоидоза и тяжесть его течения связывают с таки¬ ми генами, как гены гистосовместимости HLA; гены, ответственные за выработку АПФ, ФНО-ос, гены рецепторов к витамину D и др. В Швейцарии и Ирландии была показана связь восприимчивости к саркоидозу с классом II гаплотипа HLA-DR3, DQ2 [15]. Аллель ФН0-а2 предохраняла от тяжёлого течения саркоидоза, а аллель ФНО-р^ увеличивала риск развития саркоидоза [16].АПФ — металлопегггидаза с ключевой функцией в регуляции АД и объёма крови. Повышение уровня АПФ в сыворотке крови является одним из маркёров активности саркоидоза. Ген АПФ-1 в хромосоме 17 имеет полиморфизм включе¬ ния и исключения (insertion/deletion, I/D) в интроне 16. Аллель D связан с повы¬ шенным содержанием АПФ в сыворотке крови. Изучение I/D-полиморфизма гена АПФ показало, что аллель D оказывает провоспалительное влияние [17].В пользу наличия наследственных факторов саркоидоза свидетельствуют слу¬ чаи семейного саркоидоза. Среди близких родственников больного саркоидозом риск заболевания заметно выше, чем в популяции в целом [18].ПатогенезС морфологической точки зрения саркоидоз относится к эпителиоиднокле- точным гранулематозам — группе заболеваний, субстратом которых является гранулематозное воспаление. Все гранулёмы построены по единому гистогене- тическому плану. Основная структурная единица гранулёмы — макрофаг, моно¬ цитарный фагоцит, возникающий как производное стволовой клетки костного мозга. Недостаточно переваренный антигенный раздражитель представляется макрофагом лимфоциту-хелперу (CD4^) с последующей выработкой комплекса цитокинов (ИЛ-1, ИЛ-4, ИФН-у), стимулирующих трансформацию моноцитов и макрофагов в эпителиоидные и многоядерные гигантские клетки Ланхганса. По мере трансформации макрофагов повышается выработка ИЛ-1, ИЛ-6, ФНО, что стимулирует появление в очаге воспаления новых моноцитов. Продукты секреции активированных лимфоцитов и макрофагов влияют на синтетическую активность фибробластов, что имеет значение для исхода воспаления (отграничение очага воспаления, фибротизация).
САРКОИДОЗ 683Основной тканевой элемент гранулематозного воспаления есть гранулёма, в состав которой входят эпителиоидные клетки, многоядерные гигантские клетки и лимфоциты. Эпителиоидные и гигантские клетки являются моноцитарно- макрофагальными производными, специализированно-секретирующими и фаго¬ цитирующими. Многоядерные клетки образуются путём неполного разделения или клеточного слияния. Лимфоциты в составе гранулёмы — и цитоток-сические Тз; В-лимфоциты обычно располагаются вне гранулёмы. Величина гра- ^ нулёмы, наклонность к слиянию, чёткость очертаний, отношение к некротизации, фиброзирование или гиалиноз, мономорфность или полиморфизм выражены в различной степени. В зоне некроза могут присутствовать ядерный детрит или фибрин, или он может быть казеозным. К некрозу гранулём не приравнивается некробиоз и апоптоз. Морфогенез гранулёмы позволяет выделить три фазы разви¬ тия гранулематозного процесса: пролиферативную, гранулематозную и фиброзно- гиалинозную. Следует отметить монотонность структуры гранулём и отсутствие однозначной корреляции между тканевыми и клиническими проявлениями актив¬ ности заболевания.Интересно, что у больных саркоидозом бактерицидная активность БАЛ выше, чем у здоровых, за счёт лизоцима, а-дефензинов и антилейкопротеазы [19]. Прогрессирование гранулематозного воспаления и увеличение фиброза способ¬ ствуют ухудшению прогноза заболевания. Факторы, приводящие гранулёму к фиброзу, пока мало изучены, вероятно, это связано с локальным изменением продукции ИЛ-4 и ИЛ-5, увеличением экспрессии фактора роста, включая транс¬ формирующий фактор роста р, основной фактор роста фибробластов и инсулино¬ подобный фактор роста 1 [20].Классификация и коды МКБ-10По течению саркоидоз делят на острый, подострый и хронический, В соответ¬ ствии с внутригрудными рентгенологическими изменениями, определяемыми при обзорной рентгенографии, саркоидоз делят на стадии [1]:• Стадия 0. Нет изменений на рентгенограмме органов грудной клетки.• Стадия I. Увеличение лимфатических узлов корней лёгких и средостения при отсутствии изменений паренхимы лёгких,• Стадия II, Увеличение лимфатических узлов корней лёгких и средостения в сочетании с патологическими изменениями паренхимы лёгких.• Стадия III. Патология лёгочной паренхимы без увеличения внутригрудных лимфатических узлов.• Стадия IV. Необратимый фиброз лёгких.Отдельно описывают экстраторакальные проявления саркоидоза (поражение глаз, кожи, костей и др.). Понятие «стадия» при саркоидозе довольно условно, поскольку не всегда они сменяют друг друга в хронологическом порядке. В связи с этим в России описывают клинико-рентгенологические формы саркоидоза, в США — типы течения.Согласно МКБ-10 саркоидоз относят к III классу (050-089. Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный меха¬ низм),086 Саркоидоз.086.0 Саркоидоз лёгких,086.1 Саркоидоз лимфатических узлов.086.2 Саркоидоз лёгких с саркоидозом лимфатических узлов.086.3 Саркоидоз кожи.086.8 Саркоидоз других уточнённых и комбинированных локализаций.Иридоциклит при саркоидозе +(Н22.1*).Множественные параличи черепных нервов при саркоидозе +(053.2*).
684 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХСаркоидная(ый): артропатия +(М14.8*); миокардит +(141.8*); миозит +(М63.3*).D86.9 Саркоидоз неуточнённый.Клинические проявления и диагностикаКлинические Проявления саркоидоза варьируют от случайно выявленного по изменениям на рентгенограмме состояния до хронической прогрессирующей дис¬ функции органов, фатальных церебральных и кардиоваскулярных поражений. Саркоидоз является «диагнозом исключения», требующим гистологического под¬ тверждения.АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕПри сборе анамнеза следует установить наличие признаков артрита (с пора¬ жением голеностопных суставов, мелких суставов рук и ног), узловатой эритемы, снижение зрения, сроки прохождения последнего планового лучевого исследова¬ ния грудной клетки. При осмотре выявляют узловатую эритему, саркоидоз кожи в виде пурпурных плотных бляшек, проявление на лице «ознобленной волчанки» часго сочетается с поражением костей и хроническим прогрессирующим пораже¬ нием лёгких.При остром течении (чаще I-II стадий) характерен синдром Лефгрена (до 30%): лихорадка, двусторонняя внутригрудная лимфаденопатия, полиартралгия и узловатая эритема. Синдром Лефгрена в 80% случаев предполагает спонтанную ремиссию без терапии ГКС. Значительно реже встречается синдром Хеерфордта- Вальденсгрема: лихорадка, увеличение околоушных лимфатических узлов, перед¬ ний увеит и паралич лицевого нерва (паралич Белла — признак доброкачествен¬ ного течения саркоидоза).При хроническом течении (чаще II-IV лучевые стадии) проявления болезни вариа¬ бельны. Для саркоидоза характерны слабость, повышенная утомляемость (до 90%), непродуктивный кашель, дискомфорт и боль в грудной клетке, боль в суставах, сниже¬ ние зрения, одышка смешанного или инспираторного характера, сердцебиение.Физикальное обследование; лёгочные проявления скудные и нетипичные (жёсткое дыхание, сухие хрипы), расширение перкуторно определяемых границ средостения; увеличение размеров печени, селезёнки. Могут вьшвляться паралич лицевого нерва, периферические нейропатии. Поражение сердца проявляется аритмиями, возникающими без предшествующей патологии сердечно-сосудистой системы. Описаны случаи остановки сердца при саркоидозе, явившейся причиной внезапной смерти [21,22].ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯВ клиническом анализе крови могут иметь место лейкопения, лимфопения, повышение СОЭ. Биохимические исследования крови выявляют гипергаммагло- булинемию. гиперкальцийурию, гиперкальциемию; определяется повышение кон¬ центрации АПФ в сыворотке крови и БАЛ. Соотношение лимфоцитов CD4yCD8* в лаважной жидкости более 3.5 является признаком, характерным для саркоидоза, чувствительность которого составляет 53%, а специфичность — 94%. При выявле¬ нии и каждом обострении обязательно не менее 3 раз исследуют мокроту или БАЛ на микобактерии туберкулёза.Проба Квейма в настоящее время не применяется ввиду отсутствия стандарти¬ зированного антигена.Рентгенологические изменения при саркоидозе очень разнообразны, но в пода¬ вляющем большинстве случаев могут быть сведены к синдромам внутригрудной
САРКОИДОЗ 685аденопатии или лёгочной диссеминации, либо к их сочетанию. Фокусы и/или участки инфильтрации лёгочной ткани наблюдаются у примерно 10-12% боль¬ ных; изредка (2%) выявляют полостные изменения. Наблюдают при саркоидозе и выраженные пневмосклеротические изменения (5-10%), явления гиповенти¬ ляции (3-5%). Буллёзная эмфизема имеет место в исходе заболевания у 2-5% больных. Наиболее информативна КТВР.Рентгенография кистей рук направлена на поиск костных кистозных образо¬ ваний. УЗИ и КТ органов брюшной полости выявляют гепато- и/или спленоме- галию.МРТ необходима при саркоидозе центральной нервной системы, печени, сердца для выявления фокусов и гранулём.Исследование ФВД на ранних стадиях позволяет обнаружить снижение макси¬ мальных объёмных скоростей на уровне 50 и 75% ЖЁЛ, позднее — снижение ЖЁЛ, ОЁЛ и DL^-Нарушения ритма и проводимости, выявляемые на ЭКГ, служат признаками поражения сердца и неблагоприятного прогноза. При первичном обследовании показан мониторинг ЭКГ по Холтеру.При бронхоскопии выявляются синдромы сдавления бронхов, расширение карины. Трансбронхиальная видеоторакоскопическая биопсия лёгкого или вну¬ тригрудных лимфатических узлов, биопсия кожи, печени, периферических лим¬ фатических узлов выявляют характерные дискретные, компактные, неказеифици- рованные гранулёмы [23].ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКАПри внутригрудной лимфаденопатии исключают туберкулёз, лимфогранулема¬ тоз, иные злокачественные лимфомы и другие опухоли лёгких и средостения. При синдроме лёгочной диссеминации исключают туберкулёз, опухолевые диссеми¬ нации, гистиоцитоз X, профессиональные заболевания, альвеолиты, поражения лёгких при СЗСТ. При суставном синдроме исключают ревматоидный артрит и другие СЗСТ, а также более редкие симптомокомплексы, сходные с саркоидозом, такие как синдром Блау (семейное мультисистемное гранулематозное воспаление) и синдром Пертеса-Юнглинга (хронический доброкачественный гранулематоз). Сходство с системным саркоидозом имеет болезнь Эрдхайма-Честера — редкий мультисистемный гистиоцитарный синдром неизвестной этиологии, поражающий обычно взрослых: гистиоцитарная инфильтрация вызывает боль в костях, ксан- телазму и ксантому, экзофтальм, несахарный диабет, интерстициальные измене¬ ния в лёгких. При развитии изолированного паралича лицевого нерва саркоидоз необходимо отличать от синдрома Мелькерссона-Розенталя — редкой патологии, характеризующейся триадой из припухания лица и губ, рецидивирующего парали¬ ча лицевого нерва и «складчатого» языка. При поражении глаз дифференциальную диагностику проводят прежде всего с туберкулёзными иридоциклитом и увеитом. Дифференциальной диагностики требует также спленомегалия. При поражении ЦНС дифференциальный диагноз проводится с опухолевыми поражениями и туберкулёмами головного мозга, которые имеют сходство с «саркоидомами» — скоплениями гранулём, образующими фокусы на КТ и МРТ. Саркоидоз включён в дифференциально-диагностический ряд при синдроме внезапной смерти (саркои¬ доз сердца), при метроррагиях (саркоидоз матки), при семиномах (саркоидоз яичка и придатков), при галакторее неясного генеза (саркоидоз гипофиза) [24-26],Саркоидоз органов дыханияПоражение лёгких и внутригрудных лимфатических узлов при саркоидозе встречается наиболее часто — в 90% случаев. Симптомы и объективные данные неспецифичны: кашель (чаще сухой), укорочение дыхания, чувство дискомфорта,
686 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХзаложенности и боль в груди. Аускультативно могут определяться жёсткое дыи- ние, сухие хрипы. Возможно полное отсутствие жалоб и физикально выявляемых изменений. ФВД часто бывает нормальной даже при выраженных изменения! • лёгких на рентгенограммах. Проба с бронхолитиками, как правило, отрицатель¬ ная. Только при формировании распространённого пневмофиброза возникают рестриктивный синдром и снижение диффузионной способности лёгких, В отдель¬ ных случаях ограничение воздушного потока может быть следствием эндоброн¬ хиального поражения, приводящего к локальному стенозу. Динамика нарушенет газообмена при саркоидозе является хорошим индикатором эффективности лече¬ ния [27, 28].Классическое описание изменений при саркоидозе на рентгенограммах органе» грудной клетки по стадиям было сделано Скаддингом [29]. В настоящее время всё чаще прибегают к более совершенному методу получения изображения — КТВР [30]. Рентгенологические стадии саркоидоза (от О до IV) не отражают хроноло¬ гической последовательности развития заболевания, но коррелируют с вероятно¬ стью того или иного исхода.Стадия О характеризуется отсутствием изменений на рентгенограммах орга¬ нов грудной клетки, встречается в 5-10% случаев, однако при проведении КТВР у половины пациентов обнаруживают изменения лёгочной ткани. Кроме того, у 20-30% пациентов со стадией О саркоидоза встречаются нарушения ФВД, а у некоторых при биопсии лёгких выявляют характерные гранулёмы. Тем не менее на этой стадии мала вероятность прогрессирования болезни.I стадия характеризуется двусторонним увеличением лимфатических узлов кор¬ ней лёгких и средостения. Классически они расположены в корнях, паратрахеально и в аортопульмональном окне (рис. 40-1,40-2). Хотя на рентгенограммах в лёгкихРис. 40-1. Обзорная рентгенограмма органов грудной клетки пациента с саркоидозом внутригруд¬ ных лимфатических узлов (1 стадия).
САРКОИДОЗ 687Рис. 40-2. фрагмент КТ органов грудной клетки того же пациента (наблюдение автора).изменений нет, у этих пациентов в 55% случаев при биопсии лёгких обнару¬ живают саркоидные гранулёмы. КТВР при этой стадии позволяет обнаружить лимфаденопатию и в менее типичных местах, таких, как переднее и заднее средостение или подмьппечная область, а также кальцинацию лимфатических узлов [31]. I стадия нередко ограни¬ чивается только рентгенологическими проявлениями, спонтанная регрессия возможна в 55-90% случаев [1].При II стадии на рентгенограммах наряду с двусторонней лимфаденопа¬ тией в корнях лёгких и/или средосте¬ нии выявляют изменения паренхимылёгких, которые могут быть очаговыми (узловыми), ретикулярными (сетчатыми) или по типу «матового стекла». Изменения располагаются чаще в средних и верх¬ них лёгочных зонах (рис. 40-3). КТВР при II стадии выявляет очаги размером2-10 мм с перилимфатическим распределением около корней, вдоль бронхососу¬ дистых ветвей и субплеврально (рис. 40-4). Возможно слияние очагов. Спонтанная регрессия возможна у 40-70% пациентов с этой стадией [1].При III стадии имеют место те же изменения в паренхиме, но отсутствует вну- тригрудная лимфаденопатия (рис. 40-5) [31]. Лишь 10-20% пациентов с этой стадией имеют шанс на спонтанную регрессию.При IV стадии рентгенография выявляет фиброзные изменения. В средних и верхних зонах лёгких развиваются «сотовые» изменения. Нередко объём верхних долей уменьшается в связи с их фиброзированием, происходит втягивание корней, формирование периферических булл и кистозных изменений (рис. 40-6, 40-7). При IV стадии саркоидоза обструкция дыхательных путей может быть следстви-Рис. 40-3. Обзорная рентгенограмма органов грудной клетки пациента с саркоидозом внутригруд¬ ных лимфатических узлов и лёгких (II стадия).
688 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХРис. 40-4. Фрагмент КТ органов грудной клетки пациентки с саркоидозом внутригрудных лимфа¬ тических узлов и лёгких {II стадия).Рис. 40-5. Фрагмент КТ органов грудной клеши пацієнтки с саркоидозом лёгких (III стадия).Рис. 40-6. Фрагмент КТ органов грудной клетки пациентки с саркоидозом IV стадии (картина «сотового лёгкого»).Рис. 40-7. Фрагмент КТ органов грудной клетки пациентки с саркоидозом IV стадии (преоблада¬ ют фиброзные изменения в лёгких).ем смещения и искривления бронхов в результате грубых рубцовых изменений. Спонтанная регрессия изменений при этой стадии невозможна.Эндобронхиальное поражение является другим характерным проявлением лёгочного саркоидоза. Оно может быть подтверждено эндобронхиальной биоп¬ сией. Возможно развитие бронхостено¬ за, проявляющегося упорным кашлем, локальными хрипами и нарушением газообмена [32].При саркоидозе возможно пора¬ жение плевры, включая плевральный выпот, утолщение плевры (рис. 40-8), образование узлов в её листках, раз¬ витие пневмоторакса и хилоторакса. В большинстве случаев поражение одностороннее, чаще справа. Мужчины и женщины страдают с равной часто¬ той. Выпот обычно небольшой, в боль¬ шинстве случаев это лимфоцитарный Рис. 40-8. Фрагмент КТ органов грудной клетки экссудат. Он может рассасываться спон- пациента с левосторонним экссудативным плев- танно или под влиянием ГКС. Очаги в ритом при саркоидозе. плевре и субплевральные буллы выяв¬
САРКОИДОЗ 689ляют при КТВР. При развитии пневмоторакса целесообразность применения ГКС неоднозначна. Хилоторакс был описан в единичных случаях и являлся следствием обструкции грудного протока [33].Внелёгочный саркоидозСаркоидоз способен поражать все органы и системы. Учитывая респираторную направленность данного издания, мы ограничились кратким описанием основных внелёгочных проявлений саркоидоза (табл. 40-1).Таблица 40-1. Основные внелёгочные проявления саркоидоза [1, 34]ЛокализацияЧастотаПроявленияПечень50-80%Гранулёмы в биоптате обнаруживают часто, но пальпируемые измене¬ ния и нарушения функции находят менее чем у 20% пациентовГлаза20-50%Увеит {передний и задний), снижение зрения. Узлы в конъюнктиве, увеличение слёзных железСелезёнка10-40%СпленомегалияСуставы25-39%Артралгия, острый и хронический артритПериферические лимфа¬ тические уалы33%Наиболее часто пальпируются шейные (чаще заднего треугольника, чем переднего), аксиллярные, эпитрохлеарные и паховые лимфатиче¬ ские узлы. Увеличенные узлы дискретны, подвижны, безболезненны, без изъязвлений и дренирующихся кармановКожа; узловатая эритема6-30%Глубокий васкулит кожи, наиболее частый клинико-патологический вариант панникулита (рис. 40-9). В биоптате нет гранулёмыКожа: другие поражения25%Макулопапулярные изменения, подкожные узлы, lupus pernio, гипо- или шперпигментация, келоид (рис. 40-10, 40-11)Кровь4-20%Поражения костного мозгаЛОР-органыt-15%Поражается нос, реже — носовые кости и околоносовые пазухи; хро¬ нический насморк с затруд»«нием дыхания, сухой ринит с корками. Саркоедоз носоглотки напоминает аденоад. Саркоидоз нёбных минда¬ лин обычно выявляется после тонзиллэ«ашии как гистологическая наход¬ ка. Сарковдоз гортани обычно проявляется диффузной инфильфацией наружного кольца, полипо- или опухолевидными инфильтратами, при¬ водящими к стенозу, иногда требукщему трахеостомии. Поражение среднего уха, тугоухость, глухота, вестибулярные расстройстваНервная система10%Менингеальная инфильтрация и воспаление, энцефалопатия. Односторонний паралич лицевого нерва. Нейропатия мелких волоконПочкидо 10%Нефролитиаз и его последствия. Редко интерстициальный нефритЭндокринные железы5-8%Несахарный диабет, гмперпролактинемия. Гипотиреоидизм, гипогона- дизм, гипоадренализм и нарушения ростаОколоушная слюнная железа6%Односторонний или двусторонний паротит, проявляющийся опуханием и болезненностью желёзСердце5%От доброкачественной аритмии или сердечных блокад разной степени до внезапной смертиКости<1%Кистозные образования {рис. 40-12)Мужские половые органы<1%Плотные эластичные образования в придатке яичка, Редкие случаи поражения простаты и полового членаЖенские половые органы<1%Метроррагии. Бесплодие
690 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХРис. 40-9. Узловатая эритема на нижней конечности у пациентки с синдромом Лефгрена.Рис. 40-10. Саркоидные элементы на коже предплечья, виден рубец в месте взятия биопсии.
САРКОИДОЗ 691Шй-с - ;л ■Рис. 40-11. Саркоидоз кожи лица у той же пациентки.Рис. 40-12. Рентгенограмма берцовых костей пациентки с саркоидозом ! стадии. Кистозное образование в большой берцовой кости (наблюдение автора).
692 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХЛечениеЦель лечения — предупреждение и устранение состояний, угрожающих злоро- вью и жизни пациентов в зависимости от преобладающей локализации саркоид»- за. Этиотропная терапия не разработана.Показания к госпитализации: проведение инвазивной диагностики (биопсн*^> при первичном обследовании; тяжёлые нарушения ФВД, недостаточность органов и систем П степени тяжести и выше; подбор лечения при его неэффективности » амбулаторных условиях. Оптимальным для госпитализации пациентов с саркс»-- дозом является многопрофильный неинфекционный стационар, обладающий воз¬ можностью проведения инвазивной диагностики.НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕРекомендуется исключение стрессов, гиперинсоляции, контакта с источниками инфекции (особенно туберкулёза). Разгрузочная диетотерапия (лечебное голо¬ дание) применяется в России при I и П рентгенологических стадиях саркоидоза органов дыхания; отмечены её иммунокорригирующее влияние, стимуляция коры надпочечников, антиоксидантный эффект.МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕПоказано пациентам с поражением глаз, сердца, нервной системы, недостаточ¬ ностью органов и систем П степени тяжести и выше, в частности — с прогресси¬ рующей дыхательной недостаточностью. В остальных случаях после установления диагноза рекомендуется наблюдение в амбулаторных условиях с рентгенологиче¬ ским и функциональным контролем каждые 3-6 мес и консультацией специалистов соответственно локализации поражения. В период наблюдения применяют внутрь витамин Е (200-400 мг/сут), при болевом и суставном синдроме — нестероидные противовоспалительные препараты (лучше пролонгированного действия).Синдром Лефгрена не является прямым показанием для начала терапии ГКС, поскольку часто ассоциируется со спонтанной регрессией саркоидоза. При явном прогрессировании и появлении внелёгочных поражений начинают лечение ГКС.ГКС применяют в дозе 0,5-1,0 мг/кг или 20-40 мг/сут внутрь в течение 2-3 мес, затем дозу снижают до поддерживающей — 5-15 мг/сут и продолжают лечение до 6-9 мес. В случаях сохранения гиперкальциемии и гиперкальцийурии, обезобра¬ живающих поражений кожи, саркоидоза глаз, сердца, нервной системы лечение продлевается на ббльшие сроки. При рецидивах саркоидоза, особенно вероятных через 3-4 мес после отмены ГКС, возобновляют лечение по тем же схемам или применяют пульс-терапию метилпреднизолоном по 1-3 г/сут внутривенно в тече¬ ние 3 дней.Наряду с преднизолоном возможно использование метилпреднизолона, триам- цинолона, дексаметазона и других ГКС в эквивалентных дозировках. При саркои¬ дозе глаз, нервной системы, верхних дыхательных путей назначают 60-80 мг/сут преднизолона на длительное время; при саркоидозе периферических лимфатиче¬ ских узлов, селезёнки, подчелюстных слюнных желёз — по 20-30 мг/сут. В случаях плохой переносимости пероральных ГКС и явном прогрессировании заболевания возможно внутримышечное применение триамцинолона ацетонида* пролонгиро¬ ванного действия. На время лечения ГКС рекомендуют питание с повышенным содержанием белков и калия, ограничение приёма жидкости, поваренной соли, острых блюд.Свою эффективность доказала прерывистая терапия ГКС в тех же дозах через день и даже через 2 дня. Прерывистое применение ГКС возможно и на этапе под¬ держивающей терапии. Доказательная база положительного влияния терапии ГКС продолжительностью более 2 лет на дальнейшее течение болезни отсутствует. СГКС достоверно улучшают состояние пациентов со П и П1 стадиями саркоидоза,
САРКОИДОЗ 693тогда как при I стадии достоверных отличий в сравнении с нелеченными пациен¬ тами не отмечено [35].Роль ИГКС при саркоидозе требует уточнения. Имеется опыт назначения беклометазона дипропионата, будесонида и флутиказона пропионата как для стар¬ товой терапии, так и на этапе отмены СГКС, пациентам с непереносимостью СГКС, а также при выраженном кашлевом синдроме. Тем не менее, доказательная база целесообразности применения ИГКС при саркоидозе недостаточна [351-Другие топические формы ГКС применяют при саркоидозе гортани; мази и кремы — при саркоидозе кожи; при саркоидозе глаз наряду с СГКС — в виде глаз¬ ных капель и инъекций.Противомалярийные препараты — 4-аминохинолоны — хлорохин и гидрок- сихлорохин. Хлорохин назначают по 0,25 г 2-3 раза в день в течение 2-6 мес в качестве монотерапии и в сочетании с тиосульфатом натрия — при снижении дозы и отмене ГКС. Хлорохин применяют при гиперкальциемии, нейросаркоидозе, при хронических формах саркоидоза лёгких, Гидроксихлорохин применяют в дозе 200 мг через день в течение 9 мес, рекомендуют для лечения саркоидоза кожи и костей, а также при гиперкальциемии. Противопоказаниями к лечению хлоро- хином и гидроксихлорохином считают тяжёлые поражения сердца, диффузные поражения почек, нарушения функции печени, поражение кроветворных органов.Метотрексат — антагонист фолиевой кислоты, обладающий противовоспали¬ тельными и иммуносупрессивными свойствами, достаточно широко используется при хроническом течении саркоидоза. Он может быть эффективен при различных проявлениях заболевания, как при саркоидозе лёгких, так и кожи. Метотрексат назначают 1 раз в неделю внутрь или внутримышечно в дозе 7,5-20 мг на протяже¬ нии от 1-6 мес до 2 лет пациентам с недостаточным эффектом ГКС или их непере¬ носимостью. Его используют самостоятельно, либо в период «ухода» от ГКС [36].Циклоспорин А — иммунодепрессант, тормозящий реакции клеточного и гуморального иммунитета, контролируемые Т-лимфоцитами. Препарат предупре¬ ждает активирование лимфоцитов, ингибируя выделение лимфокинов. Его поло¬ жительный эффект проявляется, когда нет альвеолита, обусловленного СП4*- лимфоцитами. Применяют при рефрактерности к СГКС.Азатиоприн — цитостатик и иммунодепрессант, блокирует клеточное деление в результате конкуренции с естественными пуриновыми основаниями ДНК и РНК. Препарат назначают внутрь в суточной дозе 2-3 мг/кг, но не более 150 мг, он может быть использован отдельно или одновременно с ГКС. Курс лечения может составлять до 6 мес и может повторяться после перерыва на 3-4 мес. При саркои¬ дозе, рефрактерном к ГКС, назначают также циклофосфамид, колхицин.Нестероидные противовоспалительные препараты целесообразны только как симптоматическая терапия при артралгии и миалгии, при синдроме Лёфгрена, Влияние на образование и выброс ФНО-а является одним из альтернативных методов лечения саркоидоза, поскольку ФНО-а играет значительную роль в обра¬ зовании гранулём и прогрессировании саркоидоза. Применяют пентоксифиллин в качестве средства лечения активного саркоидоза лёгких вместе с ГКС и самостоя¬ тельно. дозировка 25 мг/(кгхсут) в течение 6 мес [37].Талидомид*^и моноклональные антитела против ФНО-а при саркоидозе нахо¬ дятся в стадии интенсивного изучения. Показана их клиническая эффективность, но есть риск реактивации ранее перенесённого туберкулёза.ЭКСТРАКОРПОРАЛЬНЫЕ МЕТОДЫ ЛЕЧЕНИЯПлазмаферез рекомендован больным с ГКС-зависимостью, плохой переноси¬ мостью ГКС, сопутствующими заболеваниями (сахарный диабет, язвенная болезнь желудка и двенадцатиперстной кишки и др.), при рецидивирующем течении. За процедуру удаляют 500-1200 мл плазмы, замещаемой эквивалентным объёмом
694 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХизотонического раствора натрия хлорида. Процедуры повторяют 3-5 раз с инп^ валами 5-8 дней.Кроме плазмафереза, в лечении пациентов с саркоидозом используют лжм- фоцитаферез с экстракорпоральной модификацией лимфоцитов, суть которой заключается в выделении из крови лейкоконцентрата, содержащего 1-2,5х1<Г лимфоцитов, и дальнейшей его инкубации с 30-60 мг преднизолона (из расчёт 30 мг преднизолона на 1-1,5 млрд лимфоцитов) в течение 2 ч при температуре 37 "С. Цель метода - создание в малом объёме лейкоконцентрата очень высокой концентрации преднизолона и за счёт этого наиболее полное насыщение рецеп¬ торов лимфоцитов ГКС. Лимфоцитаферез с экстракорпоральной модификацией лимфоцитов обычно совмещают с плазмаферезом. Курс лечения состоит из 2-3 процедур с интервалами по 7 дней [38].Применение антибактериальных средствв последние годы начато изучение эффективности сочетания миноциклина я азитромицина с антагонистом рецепторов ангиотензина-П олмесартаном^ при саркоидозе лёгких. Авторы из США противопоставляют это лечение применению ГКС [39]. Отмечены случаи эффективного применения комбинации миноциклина и кларитромицина [40].ВЕДЕНИЕ ПАЦИЕНТОВ Обучение пациентовВажно обеспечить пациента объективной информацией о саркоидозе, что это не туберкулёз, он не заразен; это не опухоль (созвучность с «саркомой» настораживает пациентов); лечение направлено на следствие, а не причину. В некоторых случаях нужна помощь психотерапевта. Неверное представление о собственном заболева¬ нии, пребывание в противотуберкулёзных стационарах приводят к снижению каче¬ ства жизни больных до уровня пациентов онкологического профиля [41].Наблюдение больного саркоидозом осуществляют врач общей практики, участ¬ ковые или семейный врач, пульмонолог или сотрудник саркоидозного центра. В России с 2003 г. наблюдение больных в противотуберкулёзных >чіреждениях прекращено. Обеспечивается изоляция от инфекционных болезней (в период лечения ГКС и иммунодепрессантами — строгая изоляция). Впервые выявленные больные с активными формами саркоидоза любой локализации в течение 1-го года посещают врача каждые 3 мес, 2-й год наблюдения — каждые 6 мес. Длительность наблюдения: при благоприятном течении — 2 года. При обострениях и рецидивах: 1-й год — каждые 3 мес, 2-й — каждые 6 мес. Длительность наблюдения при реци¬ дивирующем течении 3 года и более. Лица с клинически излеченным неактивным саркоидозом: 1-й год наблюдения — 1 раз в 6 мес, 2-й — 1 раз в год. Рентгено- и томограммы делают при выявлении саркоидоза, затем через 1 мес после начала лечения, через 3,6,12 мес в течение 1-го года наблюдения; в течение 2-3-го годов — 1 раз в 6 мес (при отсутствии обострений). Снимать с учёта больных не рекомен¬ дуется из-за волнообразного течения саркоидоза.ПрогнозПрогноз благоприятный при остром начале саркоидоза в молодом возрасте, наличии синдрома Лефгрена — вероятность спонтанной регрессии до 90%. При бессимптомном течении саркоидоза 1-Й стадий прогноз благоприятный, вероят¬ ность спонтанной регрессии до 70%.При внутригрудном саркоидозе ІІ-ІП сгадий с симптомами дыхательной недо¬ статочности, особенно при выявлении заболевания в возрасте старше 40 лет, про¬ гноз неблагоприятный, вероятность спонтанной регрессии не более 30%.
САРКОИДОЗ 595При саркоидозе IV стадии формируется «сотовое лёгкое», вероятность спонтан-ной регрессии отсутствует. При поражении сердца постоянно существует угроза • гвнезапной смерти вследствие поражения проводящей системы сердца. , ШПрименение ГКС облегчает состояние больного, приводит к длительной или краткосрочной ремиссии, но не влияет на десятилетний прогноз течения заболе- 5)вания и может сопровождаться серьёзными побочными реакциями. К факторам ухудшения прогноза относят длительное пребывание в противотуберкулёзных стационарах [34]. ?Маркёрами риска реактивации саркоидоза считают возраст старше 40 лет, гене- ’ ^ рализованное полиорганное поражение, неадекватное лечение, гипотиреоз [42].СПИСОК ЛИТЕРАТУРЫ?
Глава 41 Лангерганс-клеточный гистиоцитоз лёгкихЛангерганс'клеточный гистиоцитоз лёгких (ЛКГЛ) (син. гиспю- цитоз X, эозинофильная гранулёма лёгких, дифференцированные гистиоцитоз) относится к редким формам заболеваний, характери¬ зующихся пролиферацией в органах и тканях клеток Лангерганса [1-2].Активация макрофагальных фагоцитов, к которым кроме клекж Лангерганса относят также деидритические фолликулярные, интер- дйгитирующие дендритические, фибробластические ретикулярные, синусоидальные, макрофаги, вызывает различные типы пролифера- тивных реакций [3, 4],В зависимости от преимущественной локализации изме¬ нений выделяют несколько вариантов гранулематоза из клеток Лангерганса, различающихся по клинической картине (табл. 41-1).Таблица 41-1. Клинические еариакгы гранулематоза из клеток ЛангергансаВариант заболеванияВозрастначалаболезниПоражаемые органыПрогнозВариант Летерера- СивеДеги младше 2 лет, взрос¬ лыеКожа, кости, костный мозг, лёгкие, печень, селезёнка, лимфатические узлы, тимус, гипофизЧасто неблаго¬ приятныйМультифокальная эози¬ нофильная гранулёма; вариант Хенда- Шюллера-КрисченаДети и взрос¬ лыеКости, кожа, лёгкие, оболоч¬ ки головного мозга, гипо¬ физ, лимфатические узлыРазличен, часто неблдголриятныйЛокальная эозино- фильиая гранулёма или ЛКГЛВзрослые до 40 легЛёгкие, кости, реже кожаЧаще благопри¬ ятныйПреимущественный возраст дебюта ЛКГЛ составляет 20-40 лет [5]. Заболевание встречается в основном у курящих мужчин; вместе с тем имеются сообщения о развитии ЛКГЛ у женщин и некуря¬ щих.ИСТОРИЯПредставления о гистиоцитозе X как самостоятельной нозо¬ логической форме стали формироваться в 1921 г., когда А. Hand
ЛАНГЕРГАНС-КЛЕТОЧНЫЙ ГИСТИОЦИТОЗ ЛЁГКИХ 897обобщил наблюдения А. Schuller и Н.А, Christian и собственное, в которых были описаны больные с гепатоспленомегалией, лимфаденопатией и очаговыми пора¬ жениями костей; у многих из них также были отмечены полиурия и экзофтальм.Локализованный вариант гистиоцитоза. характеризующийся образовани¬ ем гранулём из клеток Лангерганса в костях, был впервые описан в 1913 г. Н.И, Таратыновым. Заболевание протекает практически бессимптомно, един¬ ственным признаком могут быть оссалгии; лизис костной ткани может приводить к переломам, часто рецидивирующим [6],В 1924 г. Е. Letterer наблюдал при гистиоцитозе сочетание лихорадки, двусто¬ роннего среднего отита, гепатоспленомегалии и генерализованной лимфаденопа- тии у маленького ребёнка, В 1933 г. А. Siwe описал 16-месячную девочку, заболе¬ вание у которой проявлялось лихорадкой, гепатоспленомегалией, нейтрофилией периферической крови и деструктивным поражением малой берцовой кости. Дети, страдавшие гистиоцитозом, погибали в течение нескольких месяцев.В 1953 г, L. Lichtenstein объединил варианты Hand-Schuller-Christian, Lertterer- Siwe и локальную эозинофильную гранулёму костей в одно заболевание, предло¬ жив термин «гистиоцитоз X». Позже объединить эти столь разнящиеся по клинике заболевания позволило наличие в морфологическом субстрате гранулём из клеток Лангерганса,Эпидемиология и этиологияЛКГЛ встречается чаще у лиц молодого и среднего возраста. Женщины заболе¬ вают в более старшем возрасте. Как правило, диагноз подтверждается не ранее чем через год от начала первых симптомов.Распространённость ЛКГЛ у мужчин составляет 0,27 на 100 ООО населения; у женщин это заболевание встречается почти в 4 раза реже. В регистре интерстици¬ альных болезней лёгких Бельгии доля гистиоцитоза X, наряду с неклассифицируе- мыми вариантами, составила 9% [8].Роль наследственных факторов, предрасполагающих к развитию грануле¬ матоза из клеток Лангерганса, по-видимому, не является определяющей. В регистре International Histiocyte Society, включавшем к 2001 г, 274 больных из 13 стран, зарегистрирован только один семейный случай гистиоцитоза X [3]. Взаимосвязь ЛКГЛ с опухолями до сих пор не нашла исчерпывающего объ¬ яснения. Злокачественные опз^холи были выявлены у 13,7% из 102 больных, наблюдавшихся в клинике Мауо по поводу гистиоцитоза X. В наблюдении ЛКГЛ у 42-летнего ВИЧ-инфицированного курильщика бронхиолоальвеолярный рак стал причиной смерти через несколько лет от начала болезни [10], В регистре International Histiocyte Society злокачественные опухоли были обнаружены у 17 (6,2%) из 274 больных ЛКГЛ [3]. Описаны случаи выявления ЛКГЛ у пациентов с метастазирующей меланомой, карциномой яичника [11, 12]. Известно сочетание гранулематоза из клеток Лангерганса и аденокарциномы лёгкого. Бронхогенная карцинома встречается у 5% больных, также возможны лимфомы, карциноид, медиастинальные опухоли.ПатогенезВ основе патогенеза ЛКГЛ, как и других гистиоцитозов, лежат разнообразные изменения клеток иммунной системы. Клетки Лангерганса участвуют в процессах воспаления и фиброза посредством экспрессии различных факторов, в том числе металлопротеиназ и медиаторов воспаления. Приобретение клетками Лангерганса некоторых черт макрофага (фенотипическое «отдаление» от дендритной клетки) может, по-видимому, рассматриваться как маркёр хронического течения гистио¬ цитоза X [14,15].
698 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХПодавляющее большинство больных гистиоцитозом X — злостные курильщв- ки (табл. 41-2), что позволяет обсуждать роль курения как предрасполагающего фактора вовлечения лёгких. Среди пациентов, страдающих изолированным ЛКГЛ, курящие составляют 96,5% [16]. В развитии ЛКГЛ, по-видимому, большее значе¬ ние имеет не стаж курения, а количество сигарет, выкуриваемых за сутки [17,18].Таблица 41-2. Частота курения среди больных ЛКГЛИсточникЧисло курящих (%)Общее число больныхм. Аг1со и соавт. [3]129 (47,1%)274В. УаззаНо и соает. [5]97 (95,1%)102С. и соавт. [7]51 (87,9%)58О.М. Ноуаг1Ь и соавт. [16]84 (96,5%)87** Приведены только случаи изолированного лёгочного гранулематоза из клеток Лангерганса.Обращает внимание некоторая общность реакций межклеточных взаимодей¬ ствий при гистиоцитозах и повреждении лёгких под воздействием табачного дыма. Предполагают важное значение бомбензин-подобного пептида, который участвует в регуляции активности нейроэндокринных клеток, усиливая их актив¬ ность в лёгких. Компоненты табачного дыма также являются сильными иммуно¬ стимуляторами, инициируют дифференцировку лимфоцитов и продукцию ими лимфокинов [19], Предполагают также, что ЛКГЛ возникает в результате поликло¬ нальной активации клеток иммунной системы под воздействием антигенов табач¬ ного дыма, что отличает данный вариант от форм гистиоцитоза с моноклоновым характером инфильтрата из клеток Лангерганса [20].МорфологияИнициальное повреждение при ЛКГЛ возникает в участках, окружающих бронхиолы и малые дыхательные пути; у части больных вовлекаются вены и арте¬ рии. Инфильтрат включает лимфоциты, нейтрофилы с примесью эозинофилов. Основные патологические изменения в лёгких при ЛКГЛ представлены:• псевдодесквамативной интерстициальной пневмонией, характеризующейся притоком альвеолярных макрофагов в просвете дыхательных путей и альвео¬ лах, интерстициальным воспалением;• респираторным бронхиолитом (бронхиолит курильщиков) в виде накопле¬ ния макрофагов, нагружённых включениями пигмента в просвете бронхиол и ткани, окружающей альвеолы.• фиброзом с накоплением соединительной ткани в просвете дыхательных путей вплоть до полной их облитерации.Изменения, обнаруживаемые при гистиоцитозе, во многом близки к фибро- пролиферативной реакции при других ИЗЛ, завершающейся ремоделированием и фиброзной трансформацией лёгочной ткани. При ЛКГЛ клетки Лангерганса считаются патогномоничным признаком заболевания [20,21].Клиническая картинаВедущими клиническими признаками являются сочетание респираторных симптомов с лихорадкой и потерей веса, спонтанные пневмотораксы, диффузные инфильтративные изменения на рентгенограммах. Симптомы заболевания могут быть представлены в различной степени. В 15% случаев ЛКГЛ протекает стёрто, хотя рентгенологическое исследование позволяет обнаружить признаки, указы¬ вающие на поражение дыхательных путей и интерстиция лёгких. У большинства
ЛАНГЕРГАНС-КЛЕТОЧНЫЙ ГИСТИОЦИТОЗ ЛЁГКИХ 699(50-70%) больных ЛКГЛ наблюдается непродуктивный кашапь. Частота одышки варьирует от 40 до 87%. Кроме того, для ЛКГЛ характерны боли в грудной клетке, в том числе вследствие поражения плевры (19-21%). Боли в грудной клетке не связаны с дыханием и не зависят от характера поражения лёгких и плевры [22]. Треть пациентов предъявляет жалобы на выраженную слабость, потерю массы тела, лихорадку.Аускультативные признаки при ЛКГЛ достаточно скудные, возможно появле¬ ние хрипов, тогда как крепитация отмечается редко. Изменения в костях присут¬ ствуют у 4-20% больных. Переломы костей порой длительно остаются единствен¬ ным проявлением заболевания. Несахарный диабет, обусловленный поражением гипофиза, диагностируется у 15% больных и ассоциируется с неблагоприятным прогнозом [16]. Изменение пальцев кистей в виде «барабанных палочек» даже у больных с выраженными изменениями в лёгких формируется достаточно редко.Осложнения ЛКГЛ развиваются вследствие как лёгочных, так и внелёгочных поражений. Наиболее высок риск пневмоторакса. Спонтанный пневмоторакс считается типичным проявлением ЛКГЛ и регистрируется у 15-25% больных, у 10-15% он наблюдается уже в начале болезни, а у 20-25% спонтанный пневмото¬ ракс и плевральные боли рецидивируют на всём протяжении болезни. Спонтанные пневмотораксы мохут сопровождаться выпотом в полость плевры. Плеврит может возникать и без предшествующего пневмоторакса.Кровохарканье встречается у 13% больных с ЛКГЛ: развитие его, прежде всего, обусловлено деструктивными изменениями вследствие присоединения бронхо¬ лёгочной инфекции. Как правило, у пациентов в посевах мокроты и жидкости БАЛ обнаруживается рост грибов Aspergillus. Б случаях кровохарканья следует также учитывать и возможность опухоли. Для ЛКГЛ свойственно также пораже¬ ние сосудистого русла лёгких в виде плексовидных образований либо изменений, подобных веноокклюзионной болезни. Лёгочная гипертензия является одним из наиболее частых осложнений ЛКГЛ [23].Поражение лёгких при ЛКГЛ сочетается с изменениями в других органах, вклю¬ чая гипоталамус и гипофиз, что приводит к развитию несахарного диабета; также наблюдаются поражения опорно-двигательного аппарата в виде формирования участков деструкции костной ткани, изменений на коже. Кроме того, у больных ЛКГЛ отмечаются шейная лимфаденопатия, увеличение щитовидной железы, гепатоспленомегалия.ДиагностикаЗаподозрить ЛКГЛ помогает наличие характерных внелёгочных проявлений; жалоб на боли в костях, частые переломы, жажду и избыточное выделение мочи. Распространённость отдельных внелёгочных проявлений ЛКГЛ приведена в табл. 41-3.Таблица 41-3. Частота внелёгочных проявлений ЛКГЛшшЛокализация процессаИсточники, количество наблюденийп=102 [5]п=314 [6]п=123 [24]Кости7 {6,9%}114(36,3%)114 (92.7%)Лимфатические узлы2(1.9%)21 (6,7%)14(11,4%)Г ипоталамо-тпофизарные структуры8 (7,8%)44 (14,0%)9 (7,3%)Кожа и слизистые оболочки4 (3,9%)77 (24,5%)30 (24,4%)
700 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХОкончание табл. 41-3СелезёнкаКостный мозгПеченьОрган слуха2(1,9%)12 (9,7%)2 0,Ё18 (14,6%)КТВР и биопсия лёгкого являются обязательной частью стандартного протоко¬ ла обследования больных с подозрением на ЛКГЛ. Рентгенографические измене¬ ния в лёгких при гранулематозе из клеток Лангерганса во многом неспецифичны. КТВР позволяет с большей вероятностью подтвердить диагноз и даже выде¬ лить признаки, имеющие дифференциальнодиагностическое значение. Для ЛКГЛ характерны сочетание звёздчатых изменений, петлистости лёгочного рисунка; очаговые инфильтраты, участки кистозно-фиброзной трансформации в верхних долях лёгкого. «Сотовое лёгкое», характеризующееся кольцевидными тенями до 5-10 мм в диаметре, также нередко обнаруживается при ЛКГЛ. Признаком про¬ грессирования заболевания служит появление новых очагов фиброза, кистозной трансформации, распространённость которой на поздней стадии болезни нараста¬ ет (рис. 41-1) [25]. Очаговые образования без вовлечения интерстиция лёгких при ЛКГЛ встречаются крайне редко. Не свойственно для ЛКГЛ также и увеличение лимфатических узлов корней лёгких.Симптом «матового стекла» при ЛКГЛ встречается не так часто, как при других заболеваниях с вовлечением малых дыхательных путей, например облитерир)Ш)- щем бронхиолите с организующейся пневмонией, гиперчувствительном пневмо¬ ните. Участки «матового стекла» ограничены по протяженности и не коррелируют с тяжестью болезни.Для выявления внелёгочных поражений, в особенности скелета, применяются рентгенологическое исследование и сцинтиграфия костей. МРТ позволяет под¬ твердить вовлечение костей и внутренних органов более чем у половины больных, тогда как сцинтиграфия — у 38%, а рентгенологическое исследование — у 25% [26, 27]. Развитие несахарного диабета, проявляющегося выраженными полиурией (до 16-24 л/сут) и полидипсией, связано с недостаточной секрецией аргинин- вазопрессина вследствие инфильтрации клетками Лангерганса гипоталамическихРис. 41-1. фрагменты КТВР грудной клетки пациента с ЛКГЛ; а — фронтальная проекция; б — сагиттальная проекция. Деформация лёгочного рисунка, пневмосклероз с формированием крупных полостей.
ЛАНГЕРГАНС-КЛЕТОЧНЫЙ ГИСТИОЦИТОЗ ЛЁГКИХ 701и/или гипофизарных структур. Диагаоз подтверждают с помощью МРТ. Крайне редко выполняют стереотаксическую биопсию структур турецкого седла.Морфологическое подтверждение диагноза включает выявление клеток Лангерганса в жидкости БАЛ, лёгочной ткани и, по возможности, типирование характерных поверхностных антигенов с помощью иммуногистохимических мето¬ дов [28]. Верификация клеток Лангерганса возможна на основании обнаружения специфических включений (гранул Бирбека) при цитологическом исследовании и определения поверхностных маркёров, наиболее типичными из которых являются антиген СВ1а и протеин 5-100 [29].При лабораторном исследовании в крови обнаруживается повышение содер¬ жания эозинофилов, ферментов печени, у некоторых больных регистрируются иммунные нарушения в виде появления аутоантител и циркулирующих иммунных комплексов, значительно увеличивается СОЭ.При исследовании ФВД у большинства больных отмечаются рестриктивные изменения со снижением общей ёмкости лёгких и показателей эластичности. Ограничение воздушного потока, гиперинфляция встречаются у половины боль¬ ных ЛКГЛ, Следует отметить, что бронхиальная обструкция может быть обрати¬ мой под влиянием бронходилататоров. Признаки обструктивных респираторных нарушений нарастают по мере увеличения размеров кист, достигая наибольшей выраженности при формировании участков эмфиземы у больных с длительно текущим заболеванием. Патогенез бронхиальной обструкции при ЛКГЛ включает в себя несколько компонентов: с одной стороны — образование кист в лёгочной ткани в сочетании с поражением структур интерстиция приводит к снижению эла¬ стичности стенок терминальных отделов бронхиального дерева и обусловливает их коллапс на выдохе, с другой — большинство больных с ЛКГЛ страдает также ХОБЛ. Уменьшение диффузионной способности лёгких отмечается у большинства больных и усугубляется в условиях нагрузки [22].Дифференциальная диагностикаТак как при ЛКГЛ многие симптомы неспецифичны, диагноз ставится на осно¬ вании сопоставления клинических, рентгенологических и морфологических дан¬ ных. Дифференцировать ЛКГЛ прежде всего следует с теми заболеваниями лёгких, которые проявляются мелкоочаговой диссеминацией и кистозной трансформаци¬ ей, локализующимися в верхних и средних отделах лёгких.Наиболее часто трудности возникают при исключении туберкулёза. Дифференциальная диагностика с туберкулёзом проводится с учётом эпидемио¬ логического анамнеза, результатов лабораторных тестов, туберкулиновых проб, лучевого исследования лёгких. Аускультативные феномены при туберкулёзе и ЛКГЛ практически неотличимы. При КТ у больных туберкулёзом обнаруживаются специфические изменения, локализующиеся преимущественно в верхних долях лёгких, кальцинаты, что позволяет с высокой вероятностью установить диагноз.Симптом «матового стекла» и внутригрудная лимфаденопатия, особенно в сочетании с кистозными изменениями, требуют дифференциальной диагности¬ ки с опухолями, саркоидозом и другими интерстициальными болезнями лёг¬ ких. Мелкокистозные изменения дифференцируют с лимфангиолейомиоматозом, поздней стадией идиопатического лёгочного фиброза.При саркоидозе, в отличие от ЛКГЛ, как правило, наблюдается двустороннее уве¬ личение внутригрудных лимфатических узлов. При любом варианте ЛКГЛ изме¬ нения в лёгких несимметричны, лимфаденопатия встречается редко, поражения кожи характеризуются появлением полиморфной сыпи. Лимфангиолейомиоматоз чаще обнаруживается у женщин, проявляется хилотораксами, внелёгочными пора¬ жениями. ЛКГЛ болеют преимущественно мужчины, курильщики, при ЛКГЛ, в отличие от лимфангиолейомиоматоза, выпот в полость плевры встречается редко
702 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХИ представлен транссудатом, тогда как при лимфангиолейомиоматозе — хилёзной жидкосгью.При исследовании БАЛ у больных ЛКГЛ выявляются СВ 1а. Содержание их более 5% служит критерием диагностики ЛКГЛ. При других формах системных гранулематозов с вовлечением лёгких, в том числе саркоидозе, васкулитах, СВ 1а в БАЛ не обнаруживаются.ЛечениеКлинические исследования эффективности иммуносупрессивной терапии в виде сочетания ГКС и цитостатиков проводились у небольших групп больных, и результаты их разноречивы [30]. Представляется очевидным, что на ранней стадии болезни, когда преобладают инфильтративные изменения без выражен¬ ной кистозной трансформации, ГКС позволяют достигнуть улучшения клинико¬ рентгенологической картины [23].При вовлечении костей применяется радиотерапия.Больных с подтверждённым ЛКГЛ, прогрессирующей дыхательной недоста¬ точностью, фиброзом лёгких следует рассматривать как претендентов на транс¬ плантацию лёгких, хотя это заболевание нередко рецидивирует и в трансплантате. Причины этого феномена остаются неясными. В одном из описаний рецидива ЛКГЛ в трасплантированном лёгком пациенты продолжали курить и после опера¬ ции [31], Предпринимались попытки подавить гистиоцитарную реакцию в лёгких при помощи циклофосфамида [32],Прогноз и профилактикаКак правило, неблагоприятный прогноз заболевания вследствие развития злокачественной опухоли наблюдается в детском возрасте. У взрослых возмож¬ но относительно благоприятное течение, средняя продолжительность болезни достигает 10-12 лет. Причинами смерти при ЛКГЛ чаще становятся дыхательная недостаточность, лёгочная гипертензия [33], опухоли (гемобласгозы, рак лёгко¬ го). Лёгочная гипертензия у больных ЛКГЛ считается ведущим фактором риска неблагоприятного прогноза [23]. Вовлечение плевры (в частности, облитерация рёберно-диафрагмального синуса) коррелирует с неблагоприятным прогнозом. Несахарный диабет также рассматривают как маркёр неблагоприятного прогноза [34].Своевременный отказ от курения позволяет смягчить течение болезни [31]. поэтому первоочередной задачей при лечении ЛКГЛ служит отказ от курения.СПИСОК ЛИТЕРАТУРЫ^)
Глава 42 Синдром ГудпасчераСиндром Гудпасчера (СГ) — заболевание, характеризующееся сочетанием лёгочного гемосидероза с гломерулонефритом (сино¬ нимы геморрагическая интерстициальная пневмония с нефритом, геморрагический лёгочно-почечный синдром, лёгочное кровотече¬ ние с гломерулонефритом, персистиругощий гемофтиз с гломеруло¬ нефритом, гемосидероз лёгких с гломерулонефритом). Был описан впервые Goodpasture в 1919 г. СГ — редкое заболевание аутоиммун¬ ной природы, при котором в патологический процесс вовлекаются базальные мембраны сосудов лёгких и почек. Болеют преимуще¬ ственно мужчины в возрасте 18-35 лет.Этиология и патогенезв качестве провоцирующего агента основная роль отводится вирусной инфекции, что косвенно подтверждается увеличением частоты СГ в период эпидемий гриппа. Предположение о вирусной природе заболевания нельзя считать окончательно доказанным, несмотря на то что при электронно-микроскопическом исследо¬ ваний в клетках эндотелия альвеол и почечных клубочков у части больных выявляются вирусоподобные включения. Имеются указа¬ ния, что СГ может возникать у лиц, имеющих контакт с летучими углеводородами и другими органическими растворителями.В настоящее время доказано, что в основе патогенеза СГ лежит цитотоксическая тканевая реакция. Под влиянием неустановлен¬ ных этиологических факторов формируется аутоиммунная реакция с иммунокомплексным поражением базальных мембран альвеол, мелких сосудов лёгких и почек. Установлено, что антитела типа IgG направлены против неколлагенового домена ад-ветви IV типа кол¬ лагена. Различия в экспрессии и положения этой ветви определяют тканевую селективность антител, а также лёгочные и почечные мишени при СГ. Существуют предположения о связи СГ с HLA, однако ещё не получено убедительных доказательств этого пред¬ положения. По-видимому, у генетически предрасположенных лиц под влиянием вирусных инфекций, курения и других неблагопри¬ ятных факторов экологической агрессии стимулируется продукция антіітел и возникают клинические проявления болезни (начало заболевания или обострение). По сути, СГ можно относить к категории васкулитов с преимущественным поражением лёгких и почек. Последние годы появились публикации об обнаружении у больных васкулитами антител к цитоплазме нейтрофилов — ANCA.
704 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХANCA — специфические антитела к антигенам цитоплазматических гранул ней¬ трофилов и моноцитарных лизосом — были впервые описаны в 1982 г. Эти антите¬ ла обнаруживаются при помощи непрямой иммунофлюоресцентной микроскопик. Выделено два основных варианта ANCA: цитоплазматические — к протеиназе 3 (PR3-ANCA), перинуклеарные — к миелопероксидазе (MPO-ANCA). До настоя¬ щего времени не установлены причины формирования клинически отчерченного симптомокомплекса при возникновении васкулитов. предлагаются различные варианты классификаций васкулитов, основанные на роли ANCA. Ниже приво¬ дится одна из классификаций ANCA-ассоциированных васкулитов, в которой определённое место отводится СГ (табл. 42-1).Таблица 42-1. Клинические проявления ANCA-ассоциированных васкулитов (Mansi 1. А. et й., 2002).ВаскулитыС поражением сосудов сред¬ него кали(!фаС поражением сосудов мелкого калибраС поражением сосудов круп¬ ного калибраУзелковыйпериартериит;БолезньКавасакиANCA-ассоции-рованныеГранулематоз Вегенера; Микроскопи¬ ческий полиан- гиит;СиндромЧерджа-Стросс;ЛекарственныепораженияANCA- неассоциированныеПаранео-пласти-ческиеИммунокомплексные; Пурпура Шенлейна-Геноха; Криоглобулинемические васкулиты;Волчаночные васкулиты; Ревматодный артрит; Синдром Гудпасчера; Болезнь Шегрена;Болезнь Бехчета;Другие (инфекционные, лекарственные) иммуноком¬ плексные васкулитыВаскулиты, связанные с воспалитель¬ ными процес¬ сами 8 толстом кишечникеГиганто¬ клеточные арте¬ рииты;Болезнь ТакаясуПри этом для васкулитов с поражением мелких сосудов характерны различные системные и органные поражения с соответствующими клиническими симптома¬ ми, выраженные в разных соотношениях при различных клинических синдромах (табл, 42-2).Таблица 42-2. Клинические проявления васкулитов с поражением мелких сосудовСистемы и органыПроявленииОбщиеЛихорадка, потеря веса, анорексия, общая слабостьКостно-мышечнаяМиалгия, артралпляКожаПурпура, крапивницаПочкиПротеинурия, гематурия, почечная недостаточность, некротизирующий гломерулонефритРеспираторнаяОдышка, кашель, кровохарканье, лёгочные инфильтраты, лёгочные диссеминации. кровоизлияния в паренхиму лёгкихНервнаяПериферическая нейропатия, мононевритыЖелудочно-кишечный трактОбнаружение крови в кале, повышение уровня печёночных ферментов, диарея, тошнота, рвота, абдоминальные боли
СИНДРОМ ГУДПАСЧЕРА 705Для СГ характерно доминирование поражений респираторной системы в соче¬ тании с поражением почек и общими симптомами.МорфологияМакроскопически на срезе лёгких определяются пятна красновато-коричнева¬ того цвета, свидетельствующие о свежих кровоизлияниях. Микроскопическое исследование лёгких выявляет геморрагический некротизирующий альвеолит: межальвеолярные перегородки, альвеолы, а также прикорневые лимфатические узлы заполнены эритроцитами и гемосидерофагами. Как и при идиопатическом гемосидерозе лёгких, могут выявляться истончение, расщепление и разрушение эластических волокон. В почках обнаруживаются изменения, характерные для острой или по дострой стадии гломерулонефрита.Клиническая картинаОсновные клинические симптомы: кровохарканье (лёгочное кровотечение). Больной во время кашля выделяет пенистую ярко-красную мокроту. Пенистость мокроты определяется её' смешиванием во время лёгочного кровотечения. Этот признак позволяет отличить кровотечение из органов ротовой полости и желудочно-кишечного тракта. Одышка смешанного характера, которая в дебюте болезни может расцениваться как проявление пневмонии и служить поводом для ошибочного назначения антибиотиков. Боли в груди непостоянные. Лихорадка. Резкая слабость.Обычно одновременно возникает симптоматика, характерная для гломеруло¬ нефрита: мочевой синдром (низкий удельный вес мочи, протеинурия, гематурия), отёки. Иногда поражение почек наступает позже появления респираторной сим¬ птоматики. При прогрессировании поражения почек развивается картина почеч¬ ной недостаточности. Появление отёков, сонливости, неукротимой рвоты, анурии свидетельствует о развитии уремии. Повыщение артериального давления отмеча¬ ется у 15 % больных, гепатоспленомегалия — у 10%.ДиагностикаНаряду с общеклиническим исследованием, необходимо лабораторное и инструментальное обследование; анализы крови, мокроты и мочи, биохимическое исследование крови с определением остаточного азота, мочевины, печёночных ферментов, железа, определение антител к базальным мембранам сосудов лёгких и почек, исследование коагулограммы, КТ лёгких, спирометрия, нефрологическое исследование.Диагноз устанавливают на основании сочетания респираторной (с кровохарка¬ ньем) и почечной симптоматики. Практически постоянными признаками являются выраженная гипохромная железодефицитная анемия, анизоцитоз и пойкилоцитоз. Уровень железа в крови снижается, В биохимическом анализе крови выявляются признаки почечной недостаточности разной выраженности. Серологическое иссле¬ дование позволяет выявить циркулирующие антитела против базальных мембран почечных клубочков и альвеол лёгкого, а также повышенное содержание цирку¬ лирующих иммунных комплексов. В моче определяется макрогематурия, протеи¬ нурия, цилиндрурия. При рентгенологическом исследовании выявляются мелкоо¬ чаговые диссеминированные изменения на фоне сетчатой деформации лёгочного рисунка; кровоизлияния в лёгочную паренхиму проявляются затемнением по типу инфаркта лёгкого. Плевральный экссудат выявляется редко. При исследовании ФВД выявляются рестриктивные нарушения.
706 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХДифференциальная диагностикаДифференциальная диагностика СГ основана на исключении заболеваний, сопровождающихся кровохарканьем. В дифференциально-диагностический ряд следует относить;• бронхоэктазии;• муковисцидоз;• рак лёгких;• рак пищевода;• носовые кровотечения;• отёк лёгких;• туберкулёз лёгких;• пневмонию;• гранулематоз Вегенера;• системную красную волчанку;• идиопатический гемосидероз лёгких;• тромбоэмболию лёгочной артерии.Лечение и прогнозОсновная цель лечения — ограничить выраженность иммунокомплексного поражения лёгких и почек. Эффективность терапии в значительной степени зави¬ сит от раннего выявления болезни.ГКС назначают в дозе 1,5-2 мг/кг массы тела в перерасчёте на преднизолон. Монотерапия ГКС может оказать определённый эффект лишь в случаях изолиро¬ ванного поражения лёгких на начальных этапах болезни. Сочетанное поражение лёгких и почек является абсолютным показанием для назначения иммунодепрес¬ сантов — азатиоприна (в дозе 2,5 мг/кг массы тела), циклофосфамида (10-20 мг/кг массы тела). Проведение плазмафереза в сочетании с ГКС и иммуносупрессивной терапией значительно повышают эффективность лечения, особенно на ранних стадиях болезни. Прогрессирование почечной недостаточности является показа¬ нием для проведения гемодиализа, а при некупирующейся уремии жизнь больных может продлить двусторонняя нефрэктомия. Трансплантация почки проводится после нормализации иммунологического статуса больного (т.е. после прекраще¬ ния аутоантителогенеза). Симптоматическая терапия включает повторные гемо¬ трансфузии, назначение препаратов железа.Прогноз неблагоприятный. Средняя продолжительность жизни составляет 8-10 мес (от 2 до 13 мес). Причинами летального исхода являются профузное лёгочное кровотечение или прогрессирующая почечная недостаточность, У муж¬ чин болезнь протекает более злокачественно.Профилактика не разработана. Установление диагноза СГ является основанием для перевода больного на инвалидность.СПИСОК ЛИТЕРАТУРЫ0
Глава 43 Идиопатический гемосидероз лёгкихИдиопатический гемосидероз лёгких (ИГЛ) — редкое заболева¬ ние, характеризующееся рецидивирующими внутриальвеолярными кровоизлияниями, которые проявляются кровохарканьем различ¬ ной интенсивности, вторичной железодефицитной анемией. Для заболевания характерно волнообразное рецидивирующее течение, приводящее к распространённому пневмофиброзу. Заболевание впервые было описано в 1960 г. под названием «бурая индурация лёгких». Разные авторы описывали это заболевание под различ¬ ными названиями: бурая индурация лёгких, лёгочная гемосидере¬ тическая анемия, синдром Целена-Геллерстедта, «железное лёг¬ кое», прогрессирующая пневмогеморрагическая анемия. Болезнь чаще встречается в детском возрасте, однако поражает и взрослых. Истинная распространённость ИГЛ неизвестна, что связано с отно¬ сительной редкостью заболевания.Этиология и факторы рискаЭтиология ИГЛ неизвестна. Одной из первых гипотез патоге¬ неза ИГЛ было предположение о врождённой неполноценности эластических волокон сосудов с последующим диапедезом эритро¬ цитов в лёгочную паренхиму и отложением в ней гемосидерина. Существуют предположения о врождённой аномалии сосудистых анастомозов, соединяющих бронхиальные артерии с лёгочными венами; повышенном гемолизе эритроцитов вследствие гиперспле- низма и неспособности печени ассимилировать освобождающееся железо. Высказываются гипотезы о возникновении ИГЛ под влия¬ нием факторов экологической агрессии, при некоторых заболева¬ ниях желудочно-кишечного тракта. Описаны случаи возникнове¬ ния ИГЛ у кровных родственников. ИГЛ чаще возникает у детей, нередко ведёт к летальному исходу. Попытки установить причину ИГЛ обычно заканчивались неудачей, не получено доказательств о наличии при ИГЛ васкулита и капиллярита.В последние годы наибольшее признание получила гипотеза об иммунопатологической природе заболевания, ведущей к дефектам базальной мембраны лёгочных капилляров. Существует большое количество косвенных указаний на это: положительная реакция Кумбса, аллергические высыпания на коже, бронхоспастический синдром, эозинофилия периферической крови, эффективность ГКС, цитостатиков и плазмафереза.
708 ИНТЕРСТИЦИАЛЬНЫЕ и диссеминированные завопевания легкихПатогенез И патологическая анатомияРеализация в лёгких реакции антиген-антитело ведёт к некрозу стенок сосудс» с микро- и макрокровоизлияниямй в паренхиму лёгких с последующей импрегнацией солями железа сосудистых и бронхиальных стенок, утолщением и фиброзировани- ем межальвеолярных перегородок. Основным гистопатологическим проявлением игл являются внутриальвеолярные кровоизлияния; альвеолярные макрофаги» содержащие гемосидерин. Повторные кровоизлияния в лёгочную паренхиму вед)т к развитию пневмофиброза, лёгочной гипертензии и формированию хронического лёгочного сердца. Иммунопатологическая концепция патогенеза ИГЛ рассматрива¬ ет в качестве основного механизма воздействие антител против базальных мембран капилляров лёгочных альвеол. Однако роль иммунного фактора при ИГЛ нельзя считать полностью доказанной. Возможно, он играет роль лишь пускового меха¬ низма, так как далеко не во всех случаях удаётся выявить иммунные комплексы на базальных мембранах. На возможность системного поражения при ИГЛ указывают случаи менструальных кровотечений в начале болезни.При макроскопическом исследовании лёгкие увеличены в размерах, уплот¬ нены, на разрезе бурого цвета. Могут определяться свежие кровоизлияния. Микроскопическое исследование выявляет диффузную импрегнацию железом межальвеолярных перегородок, и в первую очередь эластических волокон, что ведёт к их истончению и фрагментации. Межальвеолярные перегородки утолщены за счет отёка и отложения фибрина. Мелкие сосуды лёгких расширены, извиты, с участками некроза стенок. В просветах альвеол, в перибронхиальной, перива- скулярной и интралобулярной соединительной ткани определяются макрофаги, содержащие гемосидерин. В фазе обострения в паренхиме лёгких выявляются участки свежих кровоизлияний с гемолизом. Повторные обострения приводят к развитию распространённого пневмофиброза.Гистохимическое исследование выявляет резкое (в 100-200 раз) повышение содержания железа в лёгочной ткани. Электронно-микроскопическое исследова¬ ние выявляет нарушения структуры базальной мембраны капилляров межальвео¬ лярных перегородок.Клиническая картинаНаиболее характерные симптомы — кровохарканье (лёгочное кровотечение), гипохромная анемия и, как правило, двусторонние изменения в лёгких, выяв¬ ляемые при рентгенологическом исследовании. Болезнь может протекать остро или приобретать волнообразное (рецидивирующее) течение. Острое течение (или обострение) характеризуется резкой слабостью, головокружением, одышкой, сердцебиением, болями в груди, брюшной полости, артралгиями, кровохарканьем (лёгочным кровотечением), лихорадкой. Прогрессирование перечисленных при¬ знаков, присоединение инфаркт-пневмонии, рецидивирующего пневмоторакса может закончиться летально. Выраженность одышки тем больше, чем значи¬ тельнее площадь кровоизлияния в лёгочную паренхиму. Рецидив болезни (криз) может продолжаться от нескольких часов до 1-2 нед. Длительность ремиссии также бывает различной (до 1 года и более). Ремиссия может наступить спон¬ танно. Во время ремиссии у больных могут полностью отсутствовать какие-либо жалобы. Длительность ремиссии также может быть различной (от нескольких недель до нескольких лет). Как правило, последующие обострения ИГЛ протекают всё более тяжело. Беременность утяжеляет течение заболевания. Болезнь сопро¬ вождается различными проявлениями аллергии (эозинофилия периферической крови, явления бронхоспазма, артралгии, кожные высыпания и др.).При осмотре больных отмечаются бледность кожных покровов, иктеричность склер, цианоз. Над участками притупления перкуторного тона могут выслуши¬
ИДИОПАТИЧЕСКИЙ ГЕМОСИДЕРОЗ ЛЁГКИХ 709ваться сухие и/или разнокалиберные влажные хрипы. Присоединение бронхоспа¬ стического синдрома или инфаркт-пневмонии вносит соответствующие изменения в аускультативную картину болезни. Приблизительно у трети больных выявляется гепатоспленомегалия.Осложнения ИГЛ — профузное лёгочное кровотечение, закупорка бронхов кровью, аспирационная пневмония, рецидивирующий пневмоторакс, инфаркт- пневмония на фоне выраженной дыхательной и лёгочно-сердечной недостаточ¬ ности, присоединение туберкулёзной инфекции.ДиагностикаОсновные жалобы больных на одышку смешанного характера, кровохарканье различной интенсивности, повышение температуры тела и системные проявле¬ ния интоксикации. В клиническом анализе крови определяются, как правило, признаки гипохромной анемии: анизоцитоз, пойкилоцитоз, ретикулоцитоз. При присоединении инфаркт-пневмонии — лейкоцитоз, сдвиг лейкограммы влево, увеличение СОЭ. Миелограмма указывает на усиленный эритропоэз, В сыворот¬ ке крови определяется повышение уровня непрямого билирубина, в мокроте, бронхиальном смыве, БАЛ обнаруживаются гемосидерофаги (рис. 43-1, см. также цветную вклейку).Рентгенологическая картина изменений в лёгких вариабельна: от вуалепо¬ добного понижения прозрачности лёгочных полей, появления множественных мелкоочаговых (от 1-2 мм до 1-2 см в диаметре) теней, покрывающих равномер¬ но все лёгочные поля или локализующихся преимущественно в средних и ниж¬ них отделах лёгких, до возникновения более крупных полициклических очагов (инфильтратов), местами сливающихся между собой. Характерной особенностью рентгенологических изменений при ИГЛ является внезапное их возникновение и сравнительно быстрая (в течение 3-5 дней) обратная динамика. Повторяющиеся обострения болезни приводят к развитию интерстициального пневмофиброза. Упомянутые изменения на рентгенограммах, как правило, двусторонние, однако могут быть и односторонними. Увеличение лимфатических узлов средостения отмечается в 10-15% случаев, в особенности в период обострения заболевания. Перфузионная сцинтиграфия у больных ИГЛ выявляет двусторонние нарушения лёгочного кровотока.Рис. 43-1. Гемосидерофаги, полученные при бронхоскопии у больного ИГЛ.
710 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХПоказатели ФВД могут быть нормальными, однако в большинстве случав определяются нарушения бронхиальной проходимости. По мере прогрессирова¬ ния заболевания формируется рестриктивный синдром, снижается диффузионвм способность лёгких.Диагноз ИГЛ может быть подтверждён при гистологическом исследовании материала, полученного при чрезбронхиальной биопсии лёгких: в альвеолах выявляется большое количество гемосидерофагов. Показания для биопсийньд методов исследования у больных ИГЛ должны быть максимально сужены в свям с повышенным риском возникновения кровотечения.Дифференциальная диагностикаДифференциальная диагностика представляет определённые трудности в связи с большим число заболеваний, проявляющихся кровохарканьем, одышкой, дис¬ семинацией в лёгких на рентгенограмме и общими симптомами в виде слабости, недомогания и др., а также в связи с редкостью заболевания. В дифференциально¬ диагностический ряд следует включать диссеминированный туберкулёз лёг¬ ких, пневмокониозы, пневмонии с распадом, карциноматоз лёгких, синдром Гудпасчера, тромбоэмболию мелких ветвей лёгочной артерии, заболевания сердца с недостаточностью кровообращения и застоем в малом круге кровообращения (пороки сердца, ИБС и др.).Дифференцировать туберкулёз от ИГЛ позволят классические методы диагно¬ стики туберкулёза: эпидемиологический анализ, обнаружение микобактерий или следов их присутствия (ПЦР, антитела, антигены), результаты туберкулиновой пробы, а при необходимости и биопсии лёгких (казеозный некроз, микобактерии). При пневмокониозах основным дифференцирующим фактором является изуче¬ ние профессионального маршрута. При пневмонии с распадом и кровохарканием отличительными признаками являются преимущественно односторонняя локали¬ зация, характерная для пневмонии, положительный ответ на антибактериальную терапию. Ведущим отличительным признаком опухолевого процесса является обнаружение опухолевых клеток в материале биопсии лёгкого. Наиболее трудна дифференциальная диагностика с синдромом Гудпасчера, Сочетанное поражение лёгких и почек, выраженный аутоиммунный компонент, преобладание среди заболевших лиц мужского пола, прогрессирующее течение болезни, недостаточ¬ ная эффективность ГКС и иммуносупрессивной терапии свидетельствуют в пользу синдрома Гудпасчера. В любом случае, образованность врача и знание основных заболеваний, сходных с ИГЛ, позволяют установить правильный диагноз.Следует предупредить, что наличие гемосидерофагов в мокроте и жидкости БАЛ может определяться при любом попадании эритроцитов в мокроту. Отложение гемосидерина в лёгочной ткани — так называемый вторичный гемосидероз — может наблюдаться также при многократных гемотрансфузиях, митральном стенозе, врождённых пороках сердца с явлениями недостаточности кровообра¬ щения, гемолитической и апластической анемии, бронхоэктатической болезни, туберкулёзе и др. Поэтому диагноз в ряде случаев приходится ставить методом исключения.Лечение и прогнозпроблема лечения больных ИГЛ не решена. Опубликованные разрозненные результаты лечения трудно комментировать из-за отсутсгвия адекватно прове¬ дённых контролируемых исследований (вследствие редкой встречаемости заболе¬ вания). ГКС, несомненно, показаны при ИГЛ, в особенности, при остром течении или обострении заболевания, однако нет доказательств того, что они могут изме¬ нить естественное течение заболевания. Доза системных ГКС в период обострения
ИДИОПАТИЧЕСКИЙ ГЕМОСИДЕРОЗ ЛЁГКИХ 711составляет 1 мг/кг массы тела в сутки. По мере улучшения состояния и достиже¬ ния ремиссии доза снижается до поддерживающей (2,5-10 мг/сут преднизолона). Недостаточная эффективность (в течение первой недели) изолированного приме¬ нения ГКС является основанием для назначения иммуносупрессивных препаратов (азатиоприна, циклофосфамида).При глубокой анемии показана симптоматическая терапия — трансфузия эритроцитной массы. Следует, однако, отметить, что проведение гемотрансфу¬ зий сопряжено с опасностью возникновения у этих больных острого гемолиза иммунной природы. Отмечен определённый положительный эффект при назна¬ чении дефероксамина, связывающего железо и способствующего выведению его почками (суточная доза 50-70 мг/кг). Результаты лечения могут быть более обна¬ дёживающими при удалении селезёнки. В последние годы появились сообщения о положительном влиянии плазмафереза на течение болезни. Автор располагает личным опытом успешного применения плазмафереза в сочетании с ГКС при ИГЛ. Больные должны находиться под наблюдением пульмонолога, в период обостре¬ ния обязательна госпитализация.Прогноз при остром течении неблагоприятный. Летальный исход может насту¬ пить в течение нескольких месяцев. При рецидивирующем течении, которое чаще встречается у взрослых, средняя продолжительность жизни составляет 2,5-5 лет. Описаны случаи спонтанной ремиссии.Профилактика ИГЛ не разработана.СПИСОК ЛИТЕРАТУРЫ г
Глава 44Лёгочные зозино(ЬилииЛёгочные эозинофилии (ЛЭ) - группа различных заболеваний и синдромов, характеризующихся накоплением в паренхиме лёгких и/ или дыхательных путях эозинофильных гранулоцитов (ЭГ)» которые играют ведущую роль в развитии патологического процесса.ЭГ — полиморфноядерные лейкоциты, обладающие характерной морфологией и окрашиваемые в розовый цвет кислым красителем эозином. ЭГ образуются в костном мозге и циркулируют в крови менее суток, а затем направляются в ткани, где остаются в течение 10 дней и затем подвергаются апоптозу. ЭГ способны к фагоцитозу, их активация сопровождается дегрануляцией. Продукты дегрануля¬ ции ЭГ оказывают токсическое действие на гельминтов. ЭГ участву¬ ют в воспалительных процессах и могут накапливаться в различных органах и тканях.Нормальное содержание ЭГ в крови человека — 0,05-0,25х10ул (1-5% лейкоцитов), в БАЛ здоровых людей ЭГ отсутствуют. При ЛЭ наряду с накоплением ЭГ в лёгких (рис. 44-1, см. также цветную вклейку) обычно происходит увеличение их содержания в крови >1х10Ул и в БАЛ до 25% и более (рис. 44-2, см. также цветную вклейку).Рис. 44-1. Острая эозинофильная пневмония; скопление эозинофилов и ней¬ трофилов в альвеолах и инфильтрация межальвеолярных перегородок. Материал аутопсии. Окраска гематоксилином и эозином. хЮО.
ЛЁГОЧНЫЕ ЭОЗИНОФИЛИИ 713Рис. 44-2. Эозинофилы в осадке бронхоальвеолярного смыва. Окраска азур-эозином. хЮОО.ЛЭ были впервые описаны W, Löffler в 1932 г. В 1952 г. J. Crofton и соавт, предложили первую классификацию ЛЭ: простая ЛЭ (синдром Лёффлера); длительная ЛЭ; тропическая эозинофилия; ЛЭ с Б А; узелковый полиартериит. К настоящему времени предложен ряд классификаций ЛЭ по этиологии, нозоло¬ гиям, течению, локализации патологического процесса. В табл, 44-1 приведены основные нозологические формы ЛЭ и даны их этиологическая и топическая характеристики.Таблица 44-1. Этиология и экстрапульмонапьные проявления основных нозологических форм ЛЭНозолотчесюїе формы ЛЭЭтиологияПреимущественная локализация про* цессаПростая лёгочная эозинофилия (ПЛЭ) — синдром ЛёффлераГельминты, грибы, медикаменты, пищевые про¬ дукты, соединения никеля, идиопатическаяЛёгкиеОстрая эозинофильная пневмония (ОЭП)Табачный дым, медикаменты, ассоциированная со СПИДом, идиопатическаяЛёгкиеХроническая эозинофильная пнев¬ мония (ХЭП)Гельминты, грибы, медикаменты, ассоциирован¬ ная с ревматоидным артритом, Т-клеточными лимфомами, саркоидозом. микобактериозами, кщиопатмческаяЛёгкие, бронхиСиндром Черджа-Стросс (СЧС)Идиопатическая, медикаментыПолиорганная: лёгкие, бронхи, сосуды, серд¬ це, нервыГ иперэозинофильный синдром (ГЭС)Клональная пролиферация эозинофилов, Т-лимфоцитовПолиорганная; серд¬ це, лёгкие, плевра, нервная система, кожаАллергический бронхолёгочный аспергиллёз (АБЛА)Сенсибилизация к грибам А5ре/д|(/и5 (ит1даШ5Бронхи, лёгкиеБронхоцентрический гранулема¬ тоз (БГ)Сенсибилизация к плесневым грибамБронхи, лёгкие
714ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХОкончание табл. 44-1тропическая лёгочная эозинофи¬ лия (ТЛЭ)Сенсибилизация к гельминтам Wuchereria Бронхи, лёгкиеbancroffi и Brugia malayiБронхиальная астмаАллергены домашней пыли, насекомых, живот¬ ных, грибов, пыльцы растений, табачный дым, поллютантыБронхи* Примечание; см, главу «Микозы».Наиболее частыми известными причинами ЛЭ являются гельминтозы, мико¬ зы и реакции на медикаменты. Выраженность ЛЭ варьирует от бессимптомных «летучих«> инфильтратов в лёгких до угрожающих жизни состояний — тяжёлой дыхательной недостаточности и полиорганных поражений.Простая лёгочная эозинофилияПЛЭ (синдром Лёффлера) может ассоциироваться с гельминтозами (аскаридо¬ зом, шистосомозом, стронгилоидозом, анкилостомозом, парагонимозом, токсока- розом), микозами, сенсибилизацией к растительным и пищевым аллергенам, при¬ ёмом медикаментов, воздействием соединений никеля или быть идиопатической.Симптомы заболевания — кашель, свистящее дыхание, повышение температу¬ ры тела — слабо выражены и сохраняются в течение нескольких дней, но могут полностью отсутствовать.Заболевание характеризуется наличием мигрирующих инфильтратов в лёг¬ ких на рентгенограммах (рис. 44-3). Выраженная эозинофилия (достигающая 22х10Ул) сохраняется в крови до нескольких недель, а также определяется в БАЛ и биоптатах лёгких, при этом отсутствуют васкулит, некроз, гранулёмы. Уровень общего IgE в крови значительно повышен. В случаях гельминтной этиологии ПЛЭ мокрота может содержать личинки паразита, а стул на протяжении 3 мес после появления инфильтратов в лёгких — сами гельминты и/или их яйца. Возможно спонтанное выздоровление.Лечение системными ГКС в дозе не более 0,5 мг/кг в течение нескольких дней приводит к исчезновению признаков заболевания. В случае установления причи¬ ны ПЛЭ необходимо её устранение. При гельминтозах и микозах назначают соот¬ ветственно антигельминтные и противогрибковые средства.Острая эозинофильная пневмонияОЭП может быть идиопатической, ассоциированной со СПИДом, приёмом медикаментов, ингаляцией бытовых и промышленных поллютантов, табачно-Рис. 44-3. Рентгенограммы грудной клетки пациентки с ПЛЭ. Мигрирующие инфильтраты в обоих лёгких.
ЛЁГОЧНЫЕ ЭОЗИНОФИЛИИ 715Рис. 44-4. фрагмент КТ лёгких пациента с ОЭП. Диффузная инфильтрация лёгких,го дыма. Болезнь может встречаться в любом возрасте, но чаще развивается у мужчин 20-30 лет.В анамнезе пациентов обычно нет сведений о предыдущих эпизодах ЛЭ.ОЭП характеризуется острым началом с лихорадкой, выраженной одышкой, непродуктивным кашлем. Аускультация лёгких выявляет мелкопузырчатые влажные хрипы.На рентгенограммах определяется диффузная паренхиматозная и интер¬ стициальная инфильтрация в обоих лёгких (рис. 44-4), часто наблюдает¬ ся двусторонний плевральный выпот.В начале заболевания в крови выявля¬ ется лейкоцитоз с преобладанием нейтрофилов. Эозинофилия в крови часто отсут¬ ствует, но всегда обнаруживается в БАЛ. Б биоптатах лёгких наблюдается картина диффузного альвеолярного повреждения, интерстициального отёка, обильной эозинофильной инфильтрации интерстиция, альвеолярных стенок и бронхиол, ЭГ в просветах альвеол.В тяжёлых случаях болезнь может протекать по типу ОРДС с выраженной дыха¬ тельной недостаточностью, создающей угрозу жизни. Диагностические критерии идиопатической ОЭП:• отсутствие инфекции или другой известной причины заболевания;• острое начало с лихорадкой и респираторными симптомами;• диффузные инфильтративные изменения в обоих лёгких на рентгенограммах;• гипоксемия (Рр^-бО мм рт.ст., Sa02^90%);• лёгочная эозинофилия (более 25% ЭГ в БАЛ или эозинофилия в биоптате лёгкого);• продолжительность заболевания не более 1 мес.Тяжелая дыхательная недостаточность в первые дни болезни часто вынуждает прибегать к ИВЛ. Лечение системными ГКС в дозе до 2 мг/кг быстро приводит к клиническому улучшению, рассасыванию инфильтрации в лёгких, выпота в плев¬ ральных полостях и к нормализации показателей ФВД. Известны случаи спонтан¬ ного выздоровления от ОЭП. Для ОЭП не характерны рецидивы.ХРОНИЧЕСКАЯ ЭОЗИНОФИЛЬНАЯ ПНЕВМОНИЯХЭП может вызываться медикаментами, ассоциироваться с гельминтозами, микозами, ревматоидным артритом, Т-клеточными лимфомами, саркоидозом, атипичными микобактериозами или быть идиопатической. Классическое описа¬ ние ХЭП принадлежит С. Carrington и соавт. Заболевание обычно развивается в возрасте 40-50 лет, у женщин вдвое чаще, чем у мужчин. Большинство пациентов имеют в анамнезе аллергические заболевания: БА, аллергический ринит, атопиче¬ ский дерматит, описаны случаи развития Б А после дебюта ХЭП.Обычные симптомы ХЭП — кашель, одышка, удушье, лихорадка или субфе¬ брилитет, ночные поты, артралгии, слабость, утомляемость, недомогание, потеря аппетита, похудание. Б лёгких выслушиваются влажные и сухие хрипы.На рентгенограммах и КТ определяются нечётко очерченные участки инфиль¬ трации различной плотности, расположенные периферически, как правило, в верхних долях лёгких (рис. 44-5), В редких случаях возможны очаговая дис- семинация и плевральный выпот. В анализах крови выявляются значительное увеличение содержания общего IgE, воспалительные изменения: повышение СОЭ,
716 ИНТЕРСТИЦИАЛЬНЫЕ И ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХРис. 44-5. Рентгенограмма грудной клетки пациентки с обострением ХЭП. Инфильтраты в верхних долях обоих лёгких и нижней доле левого лёгкого.С-реактивного белка. Эозинофилия в крови определяется не всегда, но в БАЛ, как правило, превышает 25%. Активная дегрануляция ЭГ приводит к значительно¬ му повышению содержания эозинофильного нейротоксина в моче. В биоптатах лёгких наряду с эозинофилией имеются гистологические признаки бронхиолита, васкулита, пневмосклероза и эмфиземы. Более чем у половины пациентов выяв¬ ляются обструктивно-рестриктивные нарушения вентиляции лёгких, снижение гипоксемия.Б отличие от ОЭП длительность заболевания составляет более 2 мес, возможны рецидивы. Лечение системными ГКС в дозе 0,5 мг/кг приводит к быстрому умень¬ шению и исчезновению симптомов, рассасыванию изменений в лёгких, которые могут рецидивировать после прекращения терапии.Синдром Черджа-СтроссСЧС характеризуется полиорганностью с наличием системного васкулита, вовлекающего сосуды лёгких, сердца, желудочно-кишечного тракта, нервной системы, кожи, мышц и суставов, а также Б А, аллергического ринита, синусита, СЧС является идиопатическим аутоиммунным процессом, но известны случаи, когда он был вызван медикаментами. Патологические изменения в лёгких харак¬ теризуются васкулитом артерий лёгких среднего размера и экстраваскулярными гранулёмами, состоящими из гистиоцитов, гигантских клеток и большого количе¬ ства эозинофилов.СЧС является редким заболеванием, наблюдается одинаково часто у мужчин и женщин, обычно в возрасте 35-50 лет. Известны случаи заболевания у детей и подростков.Общими симптомами являются лихорадка, похудание, артралгии и миалгии, слабость. В течении заболевания можно условно выделить три стадии: развитие БА и ринита, эозинофильных инфильтратов в органах (в лёгких — эозинофиль¬ ной пневмонии, напоминающей ХЭП) и, наконец, васкулита с внелёгочными проявлениями. Тяжёлая стероидозависимая БА обычно развивается за несколько лет до появления васкулита. У 3/4 пациентов с СЧС имеет место аллергический ринит, сочетающийся с рецидивирующим синуситом и полипозом. Патология периферических нервов наблюдается также в 3/4 случаев и представлена множе¬ ственным мононевритом или асимметричной полинейропатией. Развитие эози¬ нофильного миокардита, коронарного артериита и перикардита может стать фатальным. Изменения со стороны сердца часто выявляются на стадии разви¬
ЛЁГОЧНЫЕ ЭОЗИНОФИЛИИ717Рис. 44-6. фрагмент КТ грудной клетки пациен¬ та с СЧС. Участки инфильтрации в лёгких, увели¬ чение калибра сосудов, бронхоэктазы.тия левожелудочковой недостаточно¬ сти и дилатационной кардиомиопатии.У половины пациентов имеются кож¬ ные проявления в виде эритемы, кра¬ пивницы и подкожных узелков. У 1/3 пациентов выявляются изменения со стороны желудочно-кишечного трак¬ та: язвенная болезнь желудка и две¬ надцатиперстной кишки, язвенный колит, холецистит, которые проявля¬ ются болью в животе, диареей и могут осложняться кровотечением или пер¬ форацией. у 1/4 определяется умерен¬ но выраженная патология почек.Для пациентов с СЧС характерны ане¬ мия и увеличение СОЭ. Эозинофилия крови обычно достигает 5-20х10Ул, номожет быть и выше. Содержание ЭГ в БАЛ и плевральном выпоте достигает 60%. Более чем у половины больных в крови обнаруживаются антитела к цитоплазме нейтрофилов. Высокое содержание эозинофильного нейротоксина в моче также является маркёром активности СЧС.Изменения на рентгенограммах и КТ грудной клетки не являются специфичны¬ ми для СЧС, Инфильтраты в лёгких различной протяжённости и плотности» часто мигрирующие, обнаруживаются у 2/3 пациентов. Реже наблюдаются узелковые центрилобулярные изменения, утолщение стенок бронхов (рис, 44-6), внутригруд¬ ная лимфаденопатия, плевральный и перикардиальный выпот.Американская ассоциация ревматологов в 1990 г. выделила диагностические критерии СЧС:• приступы БА;• эозинофилия крови >1,5х10ул;• мононеврит или полинейропатия;• лёгочные инфильтраты;• двухсторонний верхнечелюстной синусит;• экстраваскулярные некротизирующиеся гранулёмы и эозинофильная инфиль¬ трация в биоптатах лёгких.Диагноз СЧС может быть установлен при наличии не менее четырёх критериев из шести. Важными диагностическими критериями являются также обнаружение ANCA в крови и характерных патологических изменений в биоптатах кожи, мышц и лёгких,В качестве стартового лечения больных с СЧС применяют пульс-терапию метил¬ преднизолоном, после которой в течение нескольких месяцев продолжается приём системных ГКС в суточной дозе 1 мг/кг с последующим её уменьшением, у поло¬ вины пациентов такое лечение позволяет добиться стойкой ремиссии. Важным показателем достижения ремиссии является поддержание уровня эозинофилии в крови <1х10Ул, В случаях тяжёлого течения СЧС, неэффективности системных ГКС, развития рецидивов после отмены или уменьшения дозы системных ГКС терапию дополняют назначением цитостатиков (азатиоприна или циклофосфами¬ да). Имеется опыт успешного применения а-интерферона, комбинации циклоспо¬ рина с внутривенным иммуноглобулином у пациентов с тяжёлым течением СЧС. Показатель 5-летней выживаемости больных СЧС достигает 79%.Г иперэозинофильный синдромГйперэозинофильный синдром был описан M.J. Chusid и соавт, в 1975 г, как заболевание неизвестной природы, для которой характерны эозинофилия
718 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХкрови более 1,5х10ул, сохраняющаяся дольше 6 мес, и полиорганность: гепато¬ спленомегалия, застойная сердечная недостаточность вследствие поражения серд¬ ца, диффузное или локальное поражение центральной нервной системы, лёгочный фиброз, лихорадка, похудание и анемия. Позже было установлено, что ГЭС раз¬ вивается в результате клональной пролиферации эозинофилов (миелопролифе- ративный вариант) или Т-лимфоцитов, продуцирующих эозинофилопоэтины (в первую очередь ИЛ-5) — лимфоцитарный вариант.ГЭС в большинстве случаев наблюдается у мужчин в возрасте 20-50 лет. Широкий спектр симптомов обусловлен поражением сердца, тромбоэмболиями в головной мозг, периферической нейропатией и кожными проявлениями (папу¬ лами, эритемой, крапивницей, ангионевротическим отёком). Наиболее частыми общими симптомами являются слабость и повышенная утомляемость. Вовлечение органов дыхания, наблюдаемое в 40% случаев ГЭС, характеризуется плевральным выпотом, интерстициальной инфильтрацией и тромбоэмболиями ветвей лёгочной артерии. Характерны приступообразный кашель и одышка. Нередко изменения в лёгких могут быть вторичными вследствие поражения сердца. Поражение серд¬ ца. наблюдаемое в 60% случаев, заключается в развитии эндомиокардиального фиброза, который проявляется кардиомегалией и застойной сердечной недоста¬ точностью.ГЭС характеризуется очень высокой эозинофилией крови (20-100х10Ул). Эозинофилия в БАЛ выражена умеренно. Изменения в лёгких на рентгенограммах и КТ неспецифичны и представлены периферически расположенными участками «матового стекла», мелкими узелковыми образованиями.Для лечения ГЭС применяют СГКС, эффект от которых отмечается менее чем у половины пациентов, а также химиотерапию гидроксимочевиной^, этопозидом, винкристином, циклоспорином, интерфероном-а, иматинибом (ингибитором тиро- зинкиназы, применяемым при лейкозах). За последние 20 лет прогноз при ГЭС зна¬ чительно улучшился, десятилетняя выживаемость пациентов достигает 70%.АЛЛЕРГИЧЕСКИЙ БРОНХОЛЁГОЧНЫЙ АСПЕРГИЛЛЁЗАБЛА развивается в результате сенсибилизации к антигенам плесневых грибов рода AspergШus, колонизирующих бронхи. В лёгочной ткани формируются участки эозинофильной пневмонии. Персистирующее аллергическое воспаление приводит к нарушению структуры бронхиального эпителия, стенок бронхов и прилежащей лёгочной ткани. В расширенных бронхах формируются плотные слизистые проб¬ ки, содержащие нити гриба, ЭГ и кристаллы Шарко-Лейдена.В течении АБЛА выделяют пять стадий: острую, ремиссии, повторных обостре¬ ний, ГКС-зависимой БА и лёгочного фиброза. В острой стадии и при последующих обострениях АБЛА проявляется симптомами БА, аллергического синусита, эпизо¬ дами лихорадки или субфебрилитета.Критериями, позволяющими диагностировать АБЛА, являются наличие БА, обнаружение грибов А$рег^11и$ в мокроте, эозинофилия крови >1х10ул, повы¬ шение общего и антигенспецифического TgE в крови, вьывление в сыворотке крови преципитирующих антител к А$регрИш, положительные немедленная и поздняя кожные реакций с аспергиллёзным антигеном. В острой стадии АБЛА на рентгенограммах и КТ эпизодически выявляются инфильтраты, которые могут рассасываться или фиброзироваться. С течением времени формируются характер¬ ные для АБЛА изменения в лёгких, представленные проксимальными бронхоэк¬ тазами, участками гиповентиляции различной протяжённости, обусловленными обтурацией бронхов разного калибра слизистыми пробками, пневмосклерозом и эмфиземой (рис. 44-7). У пациентов с АБЛА наблюдаются стойкие обструктивно- рестриктивные нарушения вентиляции лёгких с постепенным развитием ДН и хронического лёгочного сердца.
ЛЁГОЧНЫЕ ЭОЗИНОФИЛИИ 719Рис. 44-7. фрагмент КТ ОГК пациента с АБЛА. Участки уплотнения в лёгких, проксимальные бронхоэктазы.В острой стадии и при обострени¬ ях АБЛА применяют лечение СГКС в суточной дозе 1 мг/кг с последую¬ щим её уменьшением и отменой после устранения симптомов и рассасывания инфильтратов. Длительную интермит- тирующую терапию малыми дозами СГКС (менее 0,5 мг/кг) применяют у больных с прогрессирующим течением заболевания. Противогрибковая тера¬ пия итраконазолом продолжительно¬ стью до 4 мес в сочетании с СГКС позволяет уменьшить выраженность симптомов АБЛА, эозинофилии крови и мокроты, частоту обострений и сни¬ зить поддерживающую дозу СГКС.БРОНХОЦЕНТРИЧЕСКИЙ ГРАНУЛЕМАТОЗБГ — продуктивный воспалительный процесс, вызываемый плесневыми гриба¬ ми. БГ в большинстве случаев ассоциируется с БА и АБЛА, поэтому скорее может расцениваться как своеобразный тип тканевой реакции, чем самостоятельная нозологическая форма. БГ характеризуется образованием в стенках бронхиол гранулём из гистиоцитов и ЭГ. Формирующиеся гранулёмы разрушают слизистую оболочку и стенку бронхиол и распространяются на окружающую лёгочную ткань. В центре гранулём часто обнаруживают нити гриба. Гранулёмы окружены плотны¬ ми инфильтратами преимущественно из ЭГ, в прилежащей лёгочной ткани могут обнаруживаться васкулиты.БГ проявляется лихорадкой, кашлем и одышкой. Содержание в крови обычно превышает 1х10Ул, но может оставаться в пределах нормы, особенно у пациентов без сопутствующей БА. На рентгенограммах в лёгких выявляются )^астки вос¬ палительной инфильтрации, сетчато-узелковые образования, которые обычно имеют одностороннюю верхнедолевую локализацию. Диагноз БГ требует гисто¬ логического подтверждения.БГ хорошо поддается терапии системными ГКС, имеет благоприятный прогноз, но может рецидивировать.ТРОПИЧЕСКАЯ ЭОЗИНОФИЛИЯТЭ была впервые описана R.Weingarten как заболевание, характеризующееся тяжёлым спастическим бронхитом, лейкоцитозом и высокой эозинофилией в крови. ТЭ - эндемическое заболевание, распространённое в тропических и суб¬ тропических регионах побережья Азии, островов Тихого океана, Африки, Южной и Центральной Америки, которое вызывается сенсибилизацией к гельминтам- микрофиляриям Wuchereria bancrofii и Brugia malayi. Люди заражаются при укусах москитов в результате отложения личинок паразитов в коже. В течение 6-12 мес личинки трансформируются во взрослых паразитов, которые попадают в кровоток и лимфатические пути. Хронический лимфангиит может приводить к лимфостазу и слоновости конечностей. В случаях ТЭ поражение лимфатических сосудов, как правило, отсутствует, микрофилярии не обнаруживаются в крови, они фиксиру¬ ются в сосудах лёгких и вызывают специфическую сенсибилизацию. На ранней стадии ТЭ (в течение первых 2 нед) в крови появляется высокая эозинофилия, в лёгочной ткани определяется гистиоцитарная инфильтрация. Позже, через1-3 мес, формируется эозинофильная пневмония с участками абсцедирования и формированием гранулём из эпителиоидных, гигантских клеток инородных тел и
•L'v' 720 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХу ЭГ, расположенных по периферии. Б результате длительного течения заболе!• формируется диффузный пневмофиброз.Основные симптомы ТЭ — упорный малопродуктивный кашель в ночные ■ предутренние часы, свистящее дыхание, экспираторная одышка — аналогичны про- ■ ■ • явлениям БА. ТЭ свойственны также лихорадка, похудание и потеря аппетита.'' Обследование пациентов позволяет выявить эозинофилию в крови от 2х10*/лдо бОхЮул. В крови значительно повышен общий IgE, определяются IgG аып- ; Г тела к филяриям. ЭГ и кристаллы Шарко-Лейдена обнаруживаются в мокрота. Дегранулированные ЭГ составляют более половины клеток в осадке БАЛ. Ш рентгенограммах и КТ выявляется диссеминация преимущественно в нижниж отделах лёгких, у большинства пациентов имеются сетчато-узелковые изменени лёгочного рисунка, бронхоэктазы, эмфизема, медиастинальная лимфаденопатив. Исследование ФВД выявляет смешанные обструктивно-рестриктивные измененм вентиляции, обратимое нарушение проходимости дыхательных путей.Диагноз ТЭ устанавливают на основании выявления характерных симпто¬ мов у жителей или выходцев из эндемичных для филяриоза регионов, высокот эозинофилии в крови, мокроте и БАЛ, значительного повышения уровня IgE, присутствия IgG-антител к микрофиляриям в крови и эффекта от специфической антигельминтной терапии. Лечение диэтилкарбамазином приводит к заметному уменьшению выраженности симптомов, эозинофилии в крови и БАЛ в течение 2 нед. Дополнительное назначение ГКС усиливает эффект лечения и ускоряет устранение симптомов.ДРУГИЕ ЛЁГОЧНЫЕ ЭОЗИНОФИЛИИВ конце прошлого века были зарегистрированы два массовых эпизода свое¬ образных форм ЛЭ, вызванных приёмом аллергенных продуктов и пищевых добавок.Массовая вспышка синдрома токсического масла (СТМ) произошла в 1981 г. в Испании. Причиной её явилось употребление в пищу рапсового масла, предназначенного для промышленных целей, но маркированного как оливковое. Пострадали около 20 ООО человек. СТМ характеризовался полиорганностью пора¬ жений с развитием васкулита и эозинофилии, В течение первых 4 мес болезни изменения в лёгких были представлены васкулитом, отёком и эозинофильно- мононуклеарной инфильтрацией интерстиция. Заболевание проявлялось лихо¬ радкой, кашлем, одышкой, кожной сыпью, миалгией. Эозинофилия крови могла достигать 20х10Ул. На рентгенограммах и КТ в лёгких обнаруживалась диффуз¬ ная интерстициальная и паренхиматозная инфильтрация. Смертность в острой фазе СТМ составила более 1,5%, основной причиной смерти была дыхательная недостаточность. Хроническое течение СТМ характеризовалось формированием диффузного интерстициального пневмосклероза, лёгочной гипертензии, сухого синдрома, полинейропатии, сгибательных контрактур, склеродермоподобными изменениями кожи, мышечной слабостью, отёками конечностей. Для лечения СТМ с успехом использовали СГКС.Синдром эозинофилии-миалгин (СЭМ) был впервые описан в 1989 г. в США. Во всех случаях развитию заболевания предшествовал длительный приём амино¬ кислоты L-триптофана в качестве седативного средства. Заболевание вызывали аллергенные примеси, обнаруженные в препарате, поставлявшемся одним и тем же производителем. СЭМ — полиорганное заболевание: описаны эозинофильный фасциит, пневмония, миокардит, восходящая полинейропатия. Респираторные нарушения наблюдались у 67% больных, изменения в лёгких на рентгенограммах и КТ были обнаружены в 13% случаев. СЭМ проявлялся непродуктивным каш¬ лем, одышкой, болью в груди, генерализованной миалгией, мышечной слабостью, парестезиями, артралгиями, кожной сыпью, отёками, повышенной утомляемо-
ЛЁГОЧНЫЕ ЭОЗИНОФИЛИИ 721стью. Уровень эозинофилии в крови мог достигать 5х10Ул. Рентгенография и КТ выявляли диффузные интерсгициальньге изменения и инфильтраты в лёг¬ ких, иногда плевральный выпот. Функциональное обследование обнаруживало рестриктивные нарушения, значительное снижение диффузионной способности лёгких, гипоксемию. В биоптатах лёгких определялись явления васкулита с вовле- ;V ^. ¿ У чением как артерий, так и вен мелкого и среднего калибра, инфильтрацией стенок ^ : сосудов и интерстиция лимфоцитами, ЭГ и макрофагами. Прекращение приема ?. ШйС Ь-триптофана и назначение ГКС приводило к быстрому устранению симптомов . Й СЭМ, нормализации уровня ЭГ в крови. Прогноз СЭМ, как правило, благоприят¬ ный, особенно при своевременном лечении ГКС, но известны случаи смертельного исхода.Повышение содержания ЭГ в лёгочной ткани может наблюдаться также при идиопатических интерстициальных пневмониях, саркоидозе, лангерганс-клеточном гистиоцитозе« узелковом периартериите, экзогенном аллергическом альвеолите, радиационном пневмоните, после трансплантации лёгких, как паранеопластическая реакция; однако патогенетическая роль эозинофилов в названных случаях не явля¬ ется первостепенной. БА подробно рассматривается в отдельной главе,СПИСОК ЛИТЕРАТУРЫ 4^
Глава 45ЛимфангиолейомиоматозлёгкихЛимфангиолейомиоматоз лёгких (ЛАМ) — редкое заболевание, характеризующееся опухолеподобным разрастанием гладкомышеч¬ ных волокон в интерстициальной ткани лёгких вокруг кровеносных и лимфатических сосудов, бронхов, бронхиол, в лимфатических узлах с последующей мелкокистозной трансформацией лёгочной паренхимы («сотовое» лёгкое, мелкокистозное лёгкое). Болезнь впервые была описана в 1918 г, [13], затем в 1937 г. [17],ЭпидемиологияЛАМ поражает только женщин, как правило, детородного воз¬ раста (средний возраст 30 лет), однако может встречаться и в других возрастных диапазонах. В 2000 г. были описаны два случая ЛАМ у лиц мужского пола [3], однако наличие у этих пациентов ангио- фиброматоза лица, ангиомиолипомы почек позволяет эти случаи отнести скорее к туберозному склерозу (ТС), при котором гистоло¬ гические изменения в лёгких (если лёгкие поражены) практически неотличимы от ЛАМ. Эпидемиологические, генетические и моле¬ кулярные исследования показывают связь между ЛАМ и ТС — обу¬ словленным мутацией генов Т5С1 и ТЗС2 аутосомно-доминантным заболеванием с неполной пенетрантностью.Установить истинную распространённость ЛАМ не представляется возможным не только из-за редкой встречаемости заболевания, но и трудностей диагностики, нередко ошибочной трактовки не только клинических, но и аутопсийных данньгх. ЛАМ нередко сочетается с ТС — наследственным заболеванием, при котором могут выявлять гамартомы, ангиофибромы, ангиолипомы почек, дисплазии многих органов. Заболеваемость ЛАМ составляет приблизительно 1-5 на 1 млн женщин, а ориентировочная численность больных ЛАМ по обобщённым статистическим данным составляет от 25 до 50 тыс. ТС, в отличие от ЛАМ, встречается с одинаковой частотой у мужчин и женщин (1,2 случая на 1,5 млн чел.). За последние 10-20 лет были опубликованы результаты наблюдения фавнительно больших групп больных (32-69 человек) [11, 12, 19]. В клинике пульмонологии СПбГМУ диагноз ЛАМ был установлен у 38 больных. Передача ЛАМ от матери к дочери не описана. Имеются единичные сообщения о случаях наследственного сочетания ЛАМ с ТС.
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЁГКИХ 723Этиология, факторы рискаЭтиология ЛАМ неизвестна. О важной роли эндокринных нарушений в возник¬ новении и развитии этого заболевания свидетельствуют следующие факты:• ЛАМ возникает только у женщин и» как правило, в детородном возрасте;• начало болезни или её обострение могут быть спровоцированы лечением эстрогенами;• во время менструации усиливается дыхательная недостаточность;• болезнь обостряется во время беременности;• в ряде случаев после наступления менопаузы или удаления яичников прогрес¬ сирование заболевания замедляется;• ЛАМ часто сочетается с фибромиомой (лейомиомой) матки.В связи с этим некоторые авторы относят ЛАМ к многофокусным гамартомным процессам, в прогрессрфовании которых важную роль играют женские половые гормоны. Обсуждается роль генетической предрасположенности к ЛАМ. Речь идёто наличии генетического дефекта, являющегося причиной аномального ответа мышечных клеток на женские половые гормоны,у больных ЛАМ помимо точечных мутаций гена TSC2 могут также быть выяв¬ лены мутации, называемые утратой гетерозиготности локуса Г5С2 [6]. Эти ано¬ малии приводят к потере функции подавления опухолевого роста клетки и могут объяснить бесконтрольную пролиферацию клеток при ЛАМ [16]. Ряд авторов считает обоснованной гипотезу о развитии ЛАМ вследствие метастазирования клеток ЛАМ из опухоли почек, лимфатических узлов и других органов [16]. Предположение о метастазировании косвенно подтверждает факт возникновения ЛАМ в донорском лёгком после трансплантации [4],В возникновении ЛАМ важную роль играет т.н. сывороточный ответный фактор (serum response factor — SRF). Этот фактор транскрипции избыточно представлен в клетках, пролиферирующих при ЛАМ. Повышенный уровень SRF увеличивает экспрессию матриксных металлопротеиназ 2-го и 14-го типа (ММР-2 и ММР-14), Их содержание при ЛАМ повышается. Уровень тканевых ингибиторов металло¬ протеиназ 3-го типа (TIMP-3), наоборот, снижается. Этот дисбаланс вносит допол¬ нительный вклад в необратимую перестройку лёгочной ткани, выявляющуюся при ЛАМ [21]. Как следует из представленных данных, основная «поломка» при развитии ЛАМ происходит на уроне генов, которые в норме должны подавлять бесконтрольную пролиферацию при прохождении всех этапов клеточного цикла.ПатогенезПатогенез ЛАМ изучен недостаточно. Основа патологического процесса — про¬ лиферация атипичных гладкомышечных клеток в интерстициальной ткани лёг¬ ких, в стенках бронхов и сосудов, в лимфатических узлах, а также в других органах (матка, почки, абдоминальные лимфатические узлы и др.).Недостаточно изучена роль эстрогенов в патогенезе ЛАМ. Известно, что эстрогены регулируют транскрипцию многих генов, а также могут играть роль стимула в пролиферации и миграции гладкомышечных клеток в другие органы и ткани. Наряду с этим клетки ЛАМ участвуют в секреции деструктивных протеаз. Выявляемый в атипичных гладкомышечных клетках больных ЛАМ дисбаланс протеаз (избыточный синтез матриксных металлопротеиназ и угнетение TIMP-3) могут играть, как уже упоминалось, важную роль в формировании деструктивных изменений — множественных кист в лёгочной паренхиме.В гладкомышечных волокнах части больных ЛАМ выявляют прогесгероновые и эстрогеновые рецепторы, которые обычно отсутствуют в нормальных гладкомы¬ шечных клетках, однако эти данные противоречивы [14]. Выявлены два морфоло¬ гических варианта эпителиоидных клеток, формирующих фокусы ЛАМ: верете¬
724 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХнообразные и кубические. Оба вида клеток дают положительную окраску на акт. виментин и десмин. Однако только кубические клетки реагируют с монокло¬ нальными антителами НМВ-45, синтезируемыми против белка gp 100, фермента меланогенеза. Меланом-зависимый маркёр НМВ-45 никогда не определяют в нор¬ мальных гладкомышечных клетках. Такое иммуногистохимическое исследование имеет высокую диагностическзто ценность, так как другие гладкомышечные клет¬ ки не реагируют с упомянугыми моноклональными антителами. Специфичность этого теста сосгавляет >95% [7, 15, 20]. Есть предположения, что формирование бронхообструктивного синдрома при ЛАМ также связано с инфильтрацией и про¬ лиферацией гладкомышечных клеток в дыхательных путях [21].Патологическая анатомияЛАМ лёгких может проявляться в виде двух морфологических форм: очаговой или диффузной. Гистологическая картина очаговой формы ЛАМ характеризуется возникновением в лёгких опухолевидных образований, морфологическая струк¬ тура которых соответствует структуре лейомиом. При диффузной форме ЛАМ можно наблюдать характерную макроскопическую картину: лёгкие увеличены в объёме, на их поверхности видны распространённые кистозные вздутия размером от нескольких миллиметров до нескольких сантиметров в диаметре. По мере про¬ грессирования болезни эмфизематозные вздутия увеличиваются б объёме. Таким образом, для гистологической картины ЛАМ характерны следующие признаки: пролиферация гладкомышечных волокон, деструктивные изменения альвеол, стенок бронхов, лимфатических и кровеносных сосудов. Аналогичные изменения могут бьггь выявлены в средостении, органах брюшной полости, ретроперитоне- альном пространстве и лимфатических узлах. Прогрессирование болезни ведёт к формированию микрокистозного лёгкого.Клиническая картинаКак уже упоминалось, ЛАМ возникает только у лиц женского пола, причем преимущественно в репродуктивном возрасте. Однако переход женщины в мено¬ паузу не исключает возможность возникновения ЛАМ. ЛАМ в очаговой форме может протекать бессимптомно и быть выявлен при профилактическом флюоро¬ графическом исследовании. Выявление лейомиом в брюшной полости, ретропери- тонеальном пространстве, матке, кишечнике, почках и других органах свидетель¬ ствует о системности заболевания. Формирование опухолевидных образований в кишечнике может стать причиной непроходимости, что вызовет необходимость хирургического вмешательства.При диффузной форме ЛАМ одышка нередко бывает первым признаком болезни. По мере прогрессирования заболевания одышка неуклонно усиливается. Кровохарканье регистрируется у 20-40% заболевших. У 50-80% больных ЛАМ развивается пневмоторакс, а приблизительно у 1/3 больных — это первое прояв¬ ление болезни. Пневмоторакс (одно- или двусторонний) в дальнейшем, как прави¬ ло, рецидивирует, часто совпадает с менструацией. При вовлечении в патологиче¬ ский процесс лимфатических сосудов примерно у 20-40% женщин в плевральной полости накапливается хилёзная жидкость. Нередко возникает необходимость в многократной эвакуации этой жидкости.По мере прогрессирования болезни может быть выявлен хилоперикардит, хилёзный асцит (хилоперитонеум), хилурия, хилориноррея. Около половины больных отмечают боль в груди. Лейомиомы (фибромиомы) матки выявляют в 41% случаев, а преимущественно односторонние ангиомиолипомы почек в 15-60% [19]. Ангиомиолипомы почек (как правило, двусторонние) у больных ТС или у больных тс и ЛАМ выявляют значительно чаще - в 70-80% случаев [10],
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЁГКИХ 725Спонтанные кровотечения в ангиомиолипоматозных узлах могут сопровождать¬ ся болями в брюшной полости, острым снижением артериального давления по типу циркуляторного коллапса и/или анемией. Увеличение лимфатических узлов ретроперитонеального пространства может имитировать рак почек, яичников, лимфому.Протекание диффузной формы ЛАМ неуклонно прогрессирующее, однако ско¬ рость прогрессирования у разных больных различна. Более благоприятно течение очаговой формы. Нам приходилось наблюдать случай самопроизвольного обрат¬ ного развития очаговой формы болезни, подтверждённой гистологически. Приём контрацептивных препаратов, беременность, роды способствуют активизации патологического процесса. Однако влияние беременности, а также использование экзогенных эстрогенов, контрацептивов на течение ЛАМ требует дальнейшего изучения.ДиагностикаФИЗИКАЛЬИОЕ ОБСЛЕДОВАНИЕДиагностика ЛАМ представляет значительные трудности. Специфических физикальных признаков болезни нет. Аускультативная картина также не имеет характерных черт. При прослушивании хрипы обнаруживают у 15-20% больных. При наличии признаков воздуха, хилёзной жидкости или крови в плевральной полости, асцита, а также при наличии соответствующих изменений в лёгочной ткани можно предположить у больного ЛАМ.ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯЛабораторные методы исследования {клинический анализ крови, биохимиче¬ ские, иммунологические показатели крови) неинформативны. Определяемая в ряде случаев эозинофилия периферической крови может бьггь обусловлена аллер- гизирующим воздействием на организм хилёзного экссудата плевральной полости или других локализаций.ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯРентгенодиагностика. На рентгенограммах органов грудной клетки у боль¬ ных с диффузной формой ЛАМ выявляют:• двустороннее усиление лёгочного рисунка из-за изменений в интерстициаль¬ ной ткани (рис. 45-1);• сетчато-очаговые затенения;• эмфизематозные вздутия до 2 см в диаметре;• жидкость в плевральной полости (рис. 45-2);• повышенную прозрачность лёгочных полей.При выраженных мелкокистозных образованиях, эмфизематозных вздутиях на рентгенограмме лёгкое приобретает вид кистозно-буллёзного (рис. 45-3). Данная рентгенологическая картина резко отличается от картины «сотового лёгкого», которое формируется при других интерстициальных заболеваниях лёгких, напри¬ мер при идиопатическом лёгочном фиброзе. Преимущественная локализация кисгозно-буллёзных вздутий — периферические, с>^плевральные верхние и сред¬ ние лёгочные поля.Иногда у больных ЛАМ выявляют признаки несостоятельности грудного лим¬ фатического протока.Очаговая форма ЛАМ на рентгенограммах проявляется множественными очагами различной величины (0,5-1,5 см), чётко очерченными, без какой-либо преимущественной локализации.КТВР позволяет выявить двусторонние множественные тонкостенные кисты даже в тех случаях, когда на обычных рентгенограммах определяется лишь сет-
726 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХРис. 45-1. Лимфангиолейомиоматоз лёгких. Двустороннее усиление лёгочного рисунка, вызванное изменениями в интерстициальной ткани, Лейомиома слева.Рис. 45-2. Лимфангиолейомиоматоз лёгких. Усиление и деформация лёгочного рисунка. Хилоторакс спрзвэ.Рис. 45-3. Лимфангиолейомиоматоз лёг¬ ких, диффузная форма. Множественные кистозно-буллёзные образования.
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЁГКИХ 727чатая деформация лёгочного рисунка. Фокальные затемнения по типу «матового стекла» отмечают у 12% больных [19], фокальные кровоизлияния в альвеолы — у 59% больных ЛАМ [12]. Особенность КТ у больных ЛАМ — отсутствие изменений архитектоники сосудистого рисунка даже при почти тотальном замещении лёгоч¬ ной ткани кистами [2]. Увеличение лимфатических узлов средостения выявляют у менее чем 10% пациенток, ретроперитонеальных лимфатических узлов — у 25%. В органах брюшной полости (селезёнка, почки, лимфатические узлы и др.) КТ нередко выявляет ангиомиолипомы, кисты.У больных с очаговой формой ЛАМ показатели ФВД могут не изменяться в течение длительного времени. Для диффузной формы ЛАМ характерен обструк¬ тивный вариант изменений ФВД: уменьшение ОФВ^ и снижение скоростных показателей, увеличение бронхиального сопротивления, перестройка нормальной общей ёмкости лёгких за счёт уменьшения ЖЁЛ и увеличения остаточного объёма лёгких. При такой форме ЛАМ формируется синдром генерализованной обструк¬ ции. Морфологическая основа этих изменений — пролиферация мышечных волокон в мелких дыхательных путях с деструкцией поддерживающих структур, формирование кистозно-буллёзных изменений. Этим можно объяснить рефрак- терность значительной части больных к бронходилататорам.Разрушение эластического каркаса приводит к изменению упругих свойств лёг¬ ких, что проявляется в снижении индекса ретракции и увеличении лёгочной рас¬ тяжимости. Пролиферация гладкомышечных волокон и деструктивные изменения кровеносных и лимфатических сосудов приводят к нарушению лёгочного газооб¬ мена, поэтому для диффузной формы ЛАМ характерны резкое снижение диффузи¬ онной способности лёгких и возникновение гипоксемии в покое. Это подтвержда¬ ют данные исследования ФВД, проведённого в НИИП СПбГМУ (табл, 45-1): число пациентов — 16 (6 — на начальной стадии ЛАМ, 10 — с развернутой клинической картиной). Гиперкапния развивается лишь в терминальных стадиях болезни.Таблица 45-1, Результаты комплексного исследования ФВД у больных с диффузной формой лим- фангиолейомиоматоза лёгких (п^1б)ПоказателиСтадия начальных проявлений заболе¬ ванияСтадия развернутой кли¬ нической картины забО' лвванияДостоверностьразличийОФВ. , % от должного84±840±6<0,05МОС5Д, % от должного51+819+4<0,050,15+0,010,45±0,1<0,05ОЁЛ, % от должного104±12109±5н/дост,ЖЁЛ, % от должного85±1167+7н/дост.ООЛ, % от должного129±12206+15<0,05СОЛ/ОЁЛ, % от должного131+5181±16<0,0501^д, % от должного29+326±4н/дост.РД, мм рт.ст.74+263+3н/дост.Фибробронхоскопическое исследование, как правило, не выявляет каких-либо эндоскопических отклонений от нормы, в 60-80% случаев в жидкости БАЛ обна¬ руживают гемосидерофаги.Чрезбронхиальная биопсия лёгких на ранних стадиях часто бывает неинфор¬ мативна, а на поздних стадиях противопоказана из-за множественных кистозных
728 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХобразований. Диагноз может быть верифицирован с помощью видеоторакоскс ческой или открытой биопсии лёгких. Окрашивание биопсийного материала НМВ-45, в значительной мере специфичное для ЛАМ, может быть использо! для дифференциальной диагностики ЛАМ и гладкомышечных пролифераций • лёгких, вызванных другими причинами (доброкачественная метастазируювд* лейомиома, лейомиосаркома и др.). При невозможности проведения инвазивных биопсийных методов диагноз может быть установлен на основании данных анам' неза (одно- или многократное прерывание беременности, наличие фибромиомм матки, нарушения менструального цикла и др.), характерных клинических про¬ явлений болезни, при выявлении хилоторакса, хилёзного асцита, ангиомиолипом почек, печени, матки, селезенки и других органов брюшной полости, данных КТВР и исследования ФВД.Дифференциальная диагностикаВремя от появления первых Признаков болезни до установления диагноза составляет в среднем от 2 до 4 лет. Редкая встречаемость заболевания, а также неспецифичность симптомов (включая данные рентгенологического исследова¬ ния) — основные причины ошибочной диагностики.Среди ошибочных диагнозов чаще всего встречаются двусторонняя пневмо¬ ния, идиопатический лёгочный фиброз, ХОБЛ и даже бронхиальная астма из-за наличия у больных молодых женщин одышки и бронхообструктивного синдрома. Нередко таким больным правильный диагноз ставят лишь после выявления хило¬ торакса, ангиомиолипомы почек.ЛАМ следует отличать от гистиоцитоза X лёгких, при котором рецидивирую¬ щий пневмоторакс также один из характерных признаков болезни, однако если ЛАМ болеют только женщины, то гистиоцитозом X лёгких — преимущественно мужчины, ЛАМ необходимо дифференцировать также с эмфиземой, другими болезнями слюнных желёз. Более редко встречающиеся метастазирующая лейо¬ миома, эндометриальная стромальная саркома, низкодифференцированная лейо¬ миосаркома могут метастазировать в лёгкие с образованием кистозных измене¬ ний, напоминающих ЛАМ.Среди других заболеваний, схожих с ЛАМ, следует назвать лимфангиоматоз, лимфангиоэктазы и лимфатические дисплазии [9]. Значительные трудности возни¬ кают при проведении дифференциальной диагностики ЛАМ и ТС. Гистологические изменения в лёгких при ТС, идентичные изменениям при ЛАМ, развиваются у1-4% больных. Клинически ТС проявляется у этих больных одышкой, кашлем, кровохарканьем. Беременность вызывает обострение при обоих заболеваниях. В отличие от ЛАМ, ТС — наследственная патология, которая сопровождается умственной отсталостью, неврологическими проявлениями, пальпируемыми кож¬ ными поражениями, называемыми «шагреневой кожей», лицевым ангиофиброма- тозом, подноггевым фиброматозом.В диагнозе следует зпказывать название заболевания, его форму и осложнения, при наличии экстрапульмональных проявлений заболевания (лейомиом) указы¬ вают их локализацию. Например:• лимфангиолейомиоматоз лёгких, диффузная форма, правосторонний хилото¬ ракс, ДН П.• лимфангиолейомиоматоз лёгких, очаговая форма.Лечение и прогнозк настоящему времени нет контролируемых и статистически доказательных исследований, посвящённых лечению больных ЛАМ. В связи с этим отсутству¬ ют национальные и международные консенсусы по лечению этого заболевания.
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЁГКИХ 729Эффективность применяющихся в настоящее время методов лечения ЛАМ крайне низка. Лучевая терапия, ГКС, иммуносупрессанты неэффективны.Лекарственные препараты, содержащие эстрогены, при лечении ЛАМ должны быть отменены. С учётом того, что ЛАМ болеют только лица женского пола и в патогенезе важную роль играют эстрогены, разрабатываются медикаментоз¬ ные (антиэстрогены) или хирургические (удаление яичников) методы редукции синтеза эстрогенов. Однако пока нет достаточных оснований считать удаление яичников эффективным методом лечения. По данным J.R. Taylor и соавт. (1990), овариэктомия оказалась неэффективной для всех 16 женщин, которым она была произведена. В качестве медикаментозной антиэстрогенной терапии применя¬ ют прогестерон, тамоксифен, андрогены, агонисты лютеинизирующего гормона (гонадотропина). Состояние всех 9 больных, которым J.R. Taylor и соавт. (1990) назначали тамоксифен, ухудшилось, и только у двух из 19 пациенток, которым назначали медроксипрогестерон, состояние улучшилось или стабилизировалось.В 3995 г. были опубликованы результаты лечения 40 больных ЛАМ [2]. Как овариэктомия, так и терапия прогестероном оказались неэффективны. При соче¬ тании овариэктомии и терапии прогестероном у одной пациентки было отмечено улучшение, а у другой стабилизация состояния. У девяти больных течение болез¬ ни ухудшилось. Ухудшилось течение болезни также у 12 пациенток, получавших тамоксифен. Болезнь продолжала прогрессировать также у всех шести пациенток, получавших агонист гонадотропина (leuprolide acetate). У одной больной, которой была произведена овариэктомиия и назначен прогестерон в сочетании с тамокси- феном, было отмечено улучшение. Лечение оказалось неэффективным также для шести пациенток на фоне лечения leuprolide acetate. Авторы пришли к выводу, что назначение тамоксифена при ЛАМ нецелесообразно, так как этот препарат обладает лишь частичной антиэстрогенной активностью. Тем не менее, большин¬ ство учёных, имеющих опыт лечения больных ЛАМ, считают, что эмпирическое применение прогестерона, leuprolide acetate, соматостатина, а также овариэктомии целесообразно, учитывая неблагоприятный прогноз естественного течения ЛАМ.При попытках применения для лечения больных ЛАМ антиэстрогенного пре¬ парата гидроксипрогестерона капроата в клинике пульмонологии СПбГМУ было показано, что у ряда больных может быть достигнута некоторая стабилизация патологического процесса (или замедление его прогрессирования), замедление накопления хилёзной жидкости в плевральной полости. Курс лечения состоял в назначении гидроксипрогестерона капроата (12,5%) внутримышечно 1 мл 1 раз в неделю в течение 6 месяцев. В следующие 6 месяцев в зависимости от динами¬ ки патологического процесса эта доза может быть сохранена или уменьшена [1]. Антиэстрогенная терапия, малоподвижный образ жизни — показания для прове¬ дения денситометрии.Как уже упоминалось, больные ЛАМ должны избегать беременности. Прогрессирование нарушений бронхиальной проходимости — показание для назначения ¡З^-агонистов, М-холинолитиков, при необходимости — длительной кислородотерапии. Накопление хилёзной жидкости в плевральной полости — показание для её эвакуации. С целью предупреждения рецидивов пневмо-, гидро- или хилоторакса показана плеврэктомия или плевре дез. Следует однако иметь в виду, что использование склерозирующих плевру препаратов может увеличить риск операционного кровотечения при трансплантации лёгких, возможность которой должна обсуждаться при ОФВ^<30% от должного. Ретроспективный ана¬ лиз результатов трансплантации лёгких у 34 больных ЛАМ показал одно- и двух¬ летнюю выживаемость 69 и 58% [5]. Как уже упоминалось, отмечена возможность развития ЛАМ в пересаженном лёгком.Больным ЛАМ противопоказано курение, их необходимо предупредить о риске возникновения пневмоторакса при авиаперелётах.
ШйШИШЧйЗКйШ!730 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЬЕ ЗАБОЛЕВАНИЯ ЛЁГКИХПРОГНОЗТерапевтический прогноз и прогноз для жизни неблагоприятны. Болезнь мед¬ ленно, но неуклонно прогрессирует, и летальный ИСХОД наступает в сроки от 3 до 15 лет. По данным разных авторов, десятилетняя выживаемость составляет от 21 до 78%. По другим данным [19], пятилетняя выживаемость составила 91%, а десяти¬ летняя — 79%. Есть основания предполагать, что лечение антиэстрогенами может способствовать замедлению прогрессирования заболевания. Случаи спонтанного обратного развития очаговой формы ЛАМ представляют собой исключение.Профилактика ЛАМ не разработана. Однако следует учитывать, что одним из факторов риска развития заболевания может быть искусственное прерывание беременности (в особенности многократное),СПИСОК ЛИТЕРАТУРЫ
Глава 46Альвеолярный протеинозАльвеолярный протеиноз (АП) — заболевание неизвестной этио¬ логии, характеризующееся умеренно прогрессирующей одыщкой вследствие накопления в альвеолах фосфолипидов и белкового мате¬ риала, дающего положительную ШИК-реакцию (PAS-реакцию). Болезнь была впервые описана S.H. Rosen и соавт. в 1958 г. [12].ЭпидемиологияАП относится к редким заболеваниям; встречается от 1 до 4 слу¬ чаев на 1 млн взрослых [16]. Болеют преимущественно лица средне¬ го возраста (20-50 лет), причём мужчины чаще, чем женщины (3:1). Описаны случаи заболевания у детей и лиц пожилого возраста.Этиология, факторы рискаВыделяют следующие формы АП: врождённую, приобретённую и вторичную (псевдопротеиноз). Врождённая форма обусловлена мутациями генов, кодирующих структуру белков сурфактанта В и С или р^-цепи рецептора для ГМ-КСФ [4].В 90% случаев АП заболевание считают приобретённым, или идиопатическим. Среди заболевших преобладают курильщики (70%) [13]. Из наблюдавшихся нами 39 больных АП курили 65%, соотношение мужчин и женщин составило 2:1 [1].Вторичный АП может развиться вследствие вирусных инфекций, пневмоцистной пневмонии у лиц с иммуносупрессией гемобласто- зов, воздействия неорганической (в том числе асбестовой) пыли, токсических паров (особенно при производстве пластмасс), озона.NO^.ПатогенезКлючевую роль в патогенезе заболевания играет нарушение обмена сурфактанта. Сурфактант — белково-липоидный комплекс, снижающий поверхностное натяжение в альвеолах. Сурфактант на 80% состоит из фосфолипидов, на 10% — из холестерола и на 10% — из белков (5Р-А, -В, -С, -В). Липиды и белки сурфактан¬ та синтезирзтотся альвеолоцитами 2-го типа. Белки сурфактанта В и С вместе с фосфолипидами формируют ламеллярные тельца и в альвеолярном пространстве взаимодействуют с белками А иО, образуя тубулярный миелин, из которого и состоит слой, сни-
732 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХ •;жающий поверхностное натяжение. Сурфактант инактивируется путём перехода ш I поверхностно-неактивные агрегаты, основная часть которых (до 80%) реутилизв- | руется альвеолоцитами 2-го типа. Остальная часть сурфактанта катаболизируетс» J альвеолярными макрофагами. Этот процесс регулируется ГМ-КСФ, который, при- | соединяясь к поверхностным рецепторам альвеолярных макрофагов и альвеоле- 1 цитов 2-го типа, обеспечивает реутилизацию сурфактанта. Нарушение взаимо- i действия ГМ-КСФ с клеточными рецепторами ведёт к тому, что клетки-мишенн ] не получают сигнал для расщепления сурфактанта, происходит его избыточное 1 накопление в альвеолах, и функционирующая поверхность газообмена уменьша- j ется [11].У больных АП выявляют также дефекты фагоцитоза, миграции и фаголизо- ? сомальной функции альвеолярных макрофагов, что ведёт к снижению клиренса сурфактанта. Его накопление, в свою очередь, ингибирует функцию альвеолярных макрофагов, что ещё более угнетает клиренс сурфактанта.Гомеостаз сурфактанта регулируется различными цитокинами. Местная гипер¬ продукция интерлейкина-4 клетками Клара ведёт к увеличению синтеза сурфак¬ танта и появлению изменений, напоминающих АП, Предполагают, что дисбаланс интерлейкина-10 и ГМ-КСФ может вести к нарушению метаболизма сурфактанта. Содержание интерлейкина-10 и уровень его мРНК значительно повышены при АП. Концентрация ГМ-КСФ и содержание его мРНК in vitro резко снижаются под действием интерлейкина-10 и увеличиваются после обработки антителами к интерлейкину-10. Показано, что дефицит синтеза ГМ-КСФ при АП возникает именно в результате ингибирования его синтеза интерлейкином-10.Роль первоначального повреждающего фактора при АП не изучена, однако воз¬ действие таких веществ, как углеводороды, кадмий, титан, асбест, алюминий, имеет место приблизительно у половины больных с приобретённым АП. Действие экзо¬ генных поллютантов было подтверждено в экспериментах на мышах: ингаляции солей металлов провоцировали появление в лёгких изменений, напоминающих АП. В смоделированной ситуации пары металлов вызывали приток макрофагов в альвеолярные пространства, за которым следовала пролиферация альвеолоцитов2-го типа и накопление фосфолипидов. Альвеолярные макрофаги переполнялись фосфолипидным материалом. Альвеолы заполнялись липопротеиновыми включе¬ ниями из гиперплазированных альвеолоцитов 2-го типа и нагруженных фосфоли¬ пидами макрофагов.У детей с врождённым АП были выявлены дефекты р^.-рецептора ГМ-КСФ/ ИЛ-З/ИЛ-5 [5]. Многие исследователи описывали у новорождённых различ¬ ные мутации гена SP-B [17]. Однако попытки найти у взрослых больных АП определённые мутации генов ГМ-КСФ или аномалии рецептора, играющие роль в развитии приобретённого АП, в отличие от врождённой формы заболевания, не увенчались успехом [2, 3].Ряд авторов предполагают аутоиммунный механизм возникновения АП. Б жид¬ кости БАЛ и в сыворотке крови больных АП, в отличие от здоровых или пациентов с другими заболеваниями лёгких, были выявлены поликлональные аутоантитела против ГМ-КСФ [9, 15],Патологическая анатомияпри макроскопическом исследовании на поверхности лёгких выявляют серовато-белые плотные бугорки в виде зёрен. Лёгкие уплотнены, альвеолярные пространства и респираторные бронхиолы заполнены гранулярным, аморфным ацидофильным содержимым. Альвеолярные перегородки обычно не изменены. Признаков воспаления или фиброза не обнаруживают, однако отмечают гиперпла¬ зию альвеолоцитов 2-го типа. Материал, содержащийся в альвеолах, представляет
АЛЬВЕОЛЯРНЫЙ ПРОТЕИНОЗ 733Рис. 46-1. Гистологический пре¬ парат лёгкого при альвеолярном протеинозе. Структура альвеол не нарушена. Аморфное ацидофиль¬ ное содержимое в альвеолярных пространствах.Окр. реактивом Шиффа (из архи¬ ва д. м. и. И.В. Двораковской).собой сурфактантоподобное вещество. Это фосфолипиды, которые дают яркий пурпурный цвет при окрашивании реактивом Шиффа (ШИК-реакция) [16].Изменения выявляют преимущественно в субплевральных отделах лёгких. Близлежащие участки лёгочной ткани поражаются неравномерно: часть альвеол может быть заполнена белково-липоид ным материалом, а в соседних участках могут обнаруживаться лишь мелкие вкрапления белкового вещества и абсолютно интактные участки. Структура альвеол и межальвеолярных перегородок не нару¬ шена (рис. 46-1, см. также цветную вклейку).Клиническая картинав течение длительного времени заболевание протекает бессимптомно. Его нередко случайно выявляют при профилактическом флюорографическом иссле¬ довании. Основной клинический признак болезни — медленно прогрессирующая одышка, которая может сопровождаться кашлем (сухим или со скудной мокро¬ той), субфебрильной температурой, болью в груди, похуданием, быстрой утомляе¬ мостью. Редко больные отмечают кровохарканье.При прогрессировании дыхательной недосгаточности (ДН) отмечается цианоз. Периоды обострения болезни, сопровождающиеся ухудшением общего самочув¬ ствия, лихорадкой, следует рассматривать, вероятно, как присоединение суперин¬ фекции, а не как обострение основного заболевания.Течение болезни, как правило, хроническое, однако описаны и острые формы. По мере прогрессирования АП усиливается цианоз, формируются «пальцы Гиппократа». Похудание — непостоянный симптом. Из осложнений следует отме¬ тить присоединение бактериальной или грибковой инфекции, развитие лёгочной гипертензии и формирование лёгочного сердца. Туберкулёз осложняет течение АП в 3-5% случаев.ДиагностикаТрудности диагностики обусловлены отсутствием патогномоничных клиниче¬ ских признаков. От начала заболевания до установления диагноза нередко про¬ ходит около 3 лет. 40% больных с АП первоначально ставят диагноз двусторонней пневмонии, причём даже в случаях выявления изменений при плановой флюоро¬ графии и полном отсутствии жалоб. Почти половине больных АП диагностируют туберкулёз и назначают противотуберкулёзную терапию.
734 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХФизикальное обследованиеПри физикальном обследовании больных АП определяют укорочение пер1дг- торного звука преимущественно над нижними лёгочными полями, а при аускуль¬ тации — ослабленное везикулярное дыхание, иногда — нежную крепитацию.Лабораторные исследованияПри исследовании мокроты может быть выявлено ШИК-положительное веще¬ ство. другие данные лабораторных исследований (клинический анализ кром, показатели иммунного и биохимического статуса) неспецифичны. Повышение лактатдегидрогеназы в сыворотке крови отмечается у 80% больных [1].Инструментальные исследованияНа рентгенограммах у больных АП определяют мелкоочаговые (мелкоточеч¬ ные) затемнения, имеющие тенденцию к слиянию (рис. 46-2),Изменения двусторонние, симметричные; преимущественная локализация — средние и нижние лёгочные поля. Ассиметричные или односторонние измене¬ ния встречаются в 15-20% случаев. Компьютерная томограмма (КТ) помогает детализировать изменения, выявляемые на рентгенограммах (участки «матового стекла», мелкоочаговые затемнения) (рис. 46-3).Корреляция между клиническими и рентгенологическими данными отсутствует, выраженные рентгенологические изменения могут сопровождаться лишь скудной клинической симптоматикой. В связи с этим заболевание в одной трети случаев выявляют случайно при профилактическом флюорографическом исследовании. В далеко зашедших стадиях заболевания могут быть зафиксированы распростра¬ нённые фиброзные изменения.Фибробронхоскопия не выявляет каких-либо признаков, характерных для АП. Жидкость БАЛ при АП имеет характерные особенности. Это маслянистая, непро¬ зрачная, молочно-белая, иногда желтоватая жидкость, которая образует белый осадок при отстаивании. В ней определяется многократно увеличенное (в 10-100 раз) содержание белка. Фаголизосомы и цитоплазма альвеолярных макрофагов, полученных при БАЛ, содержат эозинофильный материал. При помощи имму¬ ногистохимических методов определяют также расположенные внеклеточноРис. 46-2. Обзорная рентгенограмма органов грудной клетки больного с альвеолярным протеиноэом.Рис. 46-3. Фрагмент КТ больного альвео¬ лярным протеинозом. Участки «матового стекла», отграниченные от неизменённых участков. Утолщение междольковых пере¬ городок.
АЛЬВЕОЛЯРНЫЙ ПРОТЕИНОЗ735ШИК-положительный эозинофильный материал, белки сурфактанта SP-A, SP-D, карциноэмбриональный антиген, цитокератин-19, муциноподобный гликопроте¬ ин KL6, моноцит-хемоаттрактантный протеин-1 [7]. Практически у всех больных в жидкости БАЛ и в сыворотке крови выявляют антитела к ГМ-КСФ [9]. При исследовании с помощью электронной микроскопии обнаруживают, что альвео¬ лярные макрофаги заполнены фаголизосомами, ламеллярными тельцами, капля¬ ми холестерола, липидов [16]. Концентрические ламеллярные тельца, содержащие фосфолипиды, тубулярный миелин и миелиновые структуры в альвеолярных про¬ странствах и в жидкости БАЛ, патогномоничны для АП.При исследовании материала биопсии лёгочной ткани в альвеолах также выявля¬ ется материал, дающий пурпурный ил и лил ово- красный цвет при окраске его реакти - вом Шиффа (рис, 46-1, см. цветную вклейку). Однако следует отметить, что окраши¬ вание реактивом Шиффа не позволяет дифференцировать первичный и вторичный АП; реакция положительна в обоих случаях. Более специфичной считается реакция на пероксидазу, которая всегда положительна у больных с первичным АП при иссле¬ довании как биопсийного материала лёгочной паренхимы, так и жидкости БАЛ. У больных с вторичным протеиновом реакция на иммунопероксид азу отрицательна. В осадке БАЛ очень низкое содержание альвеолярных макрофагов, которые в большинстве своём содержат эозинофильные зернистые включения. Наряду с этим в осадке могут быть обнаружены мелкие эозинофильные зёрна, расположен¬ ные внеклеточно. Патогномоничным для АП является обнаружение при электрон¬ ной микроскопии Б альвеолах и альвеолярных макрофагах сурфактанта в виде пластинчатых телец с характерными остроконечными отверстиями — следами выделившихся во время обработки материала кристаллов холестерина.Как правило, для верификации диагноза проводят биопсию лёгочной ткани. Предпочтение отдают открытой биопсии, а в последние годы — видеоторакоско- пической. Гистологическое исследование ткани лёгкого всегда считалось «золотым стандартом» верификации АП. Однако в последние годы многие исследователи считают, что для подтверждения диагноза достаточно исследований жидкости БАЛ (световой и электронной микроскопии, иммуногисгохимии).Показатели ФВД могут быть в пределах нормы. По мере прогрессирования болезни выявляют тенденцию к формированию рестриктивного синдрома: снижа¬ ется диффузионная способность лёгких. Степень гипоксемии зависит от тяжести заболевания.ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКАПрежде всего необходимо дифференцировать первичный и вторичный про¬ теиноз — осложнение других (чаще всего гематологических) заболеваний. При первичном АП наблюдается равномерное окрашивание содержащегося в аль¬ веолах ШИК-положительного вещества, для вторичного протеиноза характерно гранулярное (очаговое) окрашивание. Дополнительным диагностическим тестом является реакция с иммунопероксидазой.АП следует дифференцировать с саркоидозом, диссеминированным туберкулё¬ зом лёгких, нередко протекающим субклинически. Изучение рентгенологического архива и выявление лимфаденопатии средостения на начальных этапах болезни позволяет исключить АП, для которого увеличение лимфоузлов средостения неха¬ рактерно. Проведение целого ряда исследований (микробиологических, сероло¬ гических, эндоскопических, цитологических, кожных тестов, КТ) в большинстве случаев позволяет исключить или подтвердить специфическую природу заболева¬ ния, Однако этих исследований недостаточно для верификации диагноза АП,Трудности диагностики АЛ нередко становятся причиной ошибочной лечебной тактики. Как правило, больных АП лечат в учреждениях фтизиатрического про¬ филя, где они получают противопоказанную им противотуберкулёзную терапию..тш
736 ИНТЕРСТИЦИАЛЬНЫЕ и ДИССЕМИНИРОВАННЫЕ ЗАБОЛЕВАНИЯ ЛЁГКИХТолько гистологическое исследование материала биопсии лёгочной ткани позво¬ ляет избежать диагностических ошибок, наносящих вред здоровью больных. Нередки случаи, когда выявляемые при профилактическом флюорографическом исследовании мелкоочаговые (мелкоточечные) затемнения (иногда сливающиеся и создающие картину инфильтрации) с обеих сторон расцениваются врачом как двусторонняя пневмония, несмотря на отсутствие каких-либо жалоб, хотя бы отдалённо напоминающих пневмонию, нормальные показатели клинического анализа крови, нормальную температуру тела. После безуспешного лечения анти¬ бактериальными препаратами больных направляют для дальнейшего обследова¬ ния и лечения в противотуберкулёзные стационары, что также следует считать ошибочным-В диагнозе указывают название заболевания, характер течения и осложнения. Например: альвеолярный протеиноз, хроническое течение. ДН П степени.Лечение и прогнозПри АП нецелесообразно назначение антибактериальных препаратов, ГКС, иммуносупрессантов в связи с их неэффективностью. Единственный эффектив¬ ный метод лечения больных АП — лечебный БАЛ, который применяется с 1965 г. Процедура проводится под наркозом. Одно лёгкое вентилируется кислородом через двухпросветную трубку, а второе лёгкое промывают тёплым (температуры тела) стерильным изотоническим раствором, с добавлением ферментов (ацетил- цистеина, стрептокиназы, химотрипсина и др.), гепарина натрия. Общий объём жидкости зависит от объёма промываемого участка (сегмент, доля, лёгкое) и составляет от 1 до 10 и более литров. Средняя длительность процедуры 3-5 ч. В результате эффективно проведённого лечебного БАЛ получают мутную жид¬ кость, в которой после отстаивания образуется осадок (рис. 46-4).После лечения у пациентов уменьшается одышка, улучшаются показатели ФВД и газов крови, определяется положительная динамика изменений в лёгких на рент¬ генограммах и КТ (рис, 46-5).Лечебный БАЛ является методом выбора при АП. Клиническое, функциональ¬ ное и рентгенологическое улучшение было достигнуто в наших наблюдениях у 76% больных. Длительная ремиссия после однократного лечебного БАЛ в наших наблюдениях была достигнута в 35% случаев, по данным других авторов, дли¬ тельной ремиссии удавалось достичь в 20-50% случаев [1], После проведения лечебного БАЛ белково-липоидное вещество накапливается в лёгких вновь с разной скоростью. Описаны случаи повторного проведения процедуры до 22 раз. Лечебный БАЛ в достаточной мере безопасен. Возможные осложнения: брон¬ хоспазм, нарастание дыхательной недостаточности, аспирационная пневмония, пневмоторакс, отёк лёгких. Мониторинг напряжения кислорода в артериальной крови, концентрации электролитов и центрального венозного давления показанРис. 46-4. Осадок в жидкости, полученной при проведении лечебного бронхоапьвеолярного лаважа у больного альвеолярным протеинозом. (Из архива проф. В.А. Герасина и проф, Г.Ф. Паламарчук).
АЛЬВЕОЛЯРНЫЙ ПРОТЕИНОЗ 737Рис. 46-5. Динамика изменений в лёгких пациента с альвеолярным протеинозом в результате лечебного бронхоальвеолярного лаважа, Фрагменты КТ: а — до процедуры; б — после. (Из архива НИИП СПбГМУ).больным с выраженной лёгочно-сердечной недостаточностью. Назначение йоди¬ стых препаратов, ингаляции ферментов, а также малообъёмный БАЛ через фибро- бронхоскоп неэффективны.Недавно были получены предварительные результаты клинических исследова¬ ний применения ГМ-КСФ в лечении больных АП. Как уже упоминалось, присут¬ ствие циркулирующих антител к ГМ-КСФ подавляет биологическую активность ГМ-КСФ у пациентов с АП. Эти нейтрализующие иммуноглобулины класса С против ГМ-КСФ были выявлены в сыворотке крови и в жидкости БАЛ у больных идиопатическим АП, но отсутствовали у больных вторичным АП, у пациентов с другими заболеваниями лёгких и у здоровых лиц. При клиническом изучении эффективности ГМ-КСФ было показано, что ежедневное подкожное введение пре¬ парата оказалось эффективным у 3 из 4 пациентов в одном исследовании и у 9 из 14 — в другом [8,14]. Введение аэрозоля ГМ-КСФ было успешным лишь в одном случае [11],На основании полученных данных можно сделать следующие выводы.• Объективное клиническое улучшение наступает в 50% случаев.• От начала лечения до получения клинического эффекта проходит в среднем 8 нед.• Для достижения эффекта требуются различные дозы и разная продолжитель¬ ность лечения.• На фоне лечения титр антител против ГМ-КСФ в жидкости БАЛ и в сыворотке крови снижается.• Терапия ГМ-КСФ не излечивает пациентов; у части из них наступают рециди¬ вы после прекращения лечения.Предиктором ответа на терапию рекомбинантным ГМ-КСФ может быть интерлейкин-10, поскольку максимально высокий уровень его экспрессии отме¬ чается у больных, не отвечающих на лечение.Можно предположить, что использование плазмафереза для удаления циркули¬ рующих аутоантител против ГМ-КСФ может оказаться патогенетически обосно¬ ванным, однако научных подтверждений этому в литературе нет.Лечение врождённых форм АП поддерживающее, хотя имеются отдельные сообщения об успешной трансплантации лёгких [6]. Терапия вторичного АП под¬ разумевает лечение основного заболевания. В этих случаях целесообразность выполнения лечебного БАЛ представляется сомнительной. Так, например, при АП, развившемся на фоне гематологического заболевания, успешная химиотера-
738 интерстициальные и диссеминированные заболевания лёгких; ПИЯ или трансплантация костного мозга значительно уменьшают выраженность ■^я*v':'зg¡V изменений в лёгких [10].ПРОГНОЗТерапевтический прогноз при АП, как правило, благоприятный: течение болез¬ ни доброкачественное, очень медленно прогрессирующее. Спонтанная ремиссия наблюдается в 10-30% случаев. Анализ отдалённых результатов лечения 343 ‘ДvV^ больных АП показал, что пятилетняя выживаемость составила около 75% [15].По нашим данным, пятилетняя выживаемость составила 100%. Летальные исходы обусловлены, прежде всего, прогрессированиием ДН. В 20% случаев пациенты погибают вследствие бактериальной или грибковой суперинфекции. Прогноз ухудшают поздняя диагностика, а также длительное безуспешное лечение больных антибактериальными препаратами, ГКС, физиотерапевтическими процедурами.СПИСОК ЛИТЕРАТУРЫ;^Ж
АЗДЕЛ IXПРОФЕССИОНАЛЬНЫЕ И СВЯЗАННЫЕ С ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯГлава 47. Профессиональная бронхиальная астмаГлава 48. Пневмокониозы @Глава 49. Гиперчувствительный пневмонит ®Глава 50. Острые токсические поражения лёгкихГлава 51. Поражения лёгких, вызванные лекарствами
Глава 47Профессиональная бронхиальная астмаПрофессиональная астма (ПБА) — это преходящая обструкция дыхательных путей, связанная с экспозицией на рабочем месте воз¬ душных поллютантов: газа, пыли, дыма, паров, которь[е вызывают классическую картину гиперчувствительности дыхательных путей с последующим развитием хронического воспаления [1,2,3].В настоящее время насчитывается более 300 производственных агентов, способных вызвать развитие ПБА [4,5]. Они подразделя¬ ются на две основные группы.I группа — сенсибилизирующие вещества с высокой (>5000 D) молекулярной массой (ВММ), обычно протеины или гликопротеи¬ ны биологического происхождения, и низкой (<5000 D) молекуляр¬ ной массой (НММ) представлены естественными или синтетиче¬ скими химическими соединениями.к высокомолекулярньт сенсибилизирующим веществам относят продукты животного, растительного и микробного происхождения, способные вызвать IgE-опосредованную аллергическую реакцию.К аллергенам животного происхождения относятся продукты жизнедеятельности млекопитающих (сельские, домашние и лабо¬ раторные животные), птиц (экскреты, яйца), членистоногих (насе¬ комые, клещи), рыб, рептилий.Наиболее известными аллергенами растительного происхожде¬ ния являются: зерно (пшеница, рожь, ячмень) и мука, бобовые (соя, кофе, перечница), цветы, специи, травы, овощи, фрукты, а также натуральный каучуковый латекс {Hevea brasiliensii), красный кедр (пликатиковая кислота), акация (растительный клей).К продуктам микробного происхождения относятся споры и мице¬ лий грибов, бактерии, а также микробиологические агенты, кото¬ рые могут обсеменять продукты питания, корма, увлажнители воздуха, кондиционеры. Особой категорией высокоаллергенных веществ микробиологического происхождения являются ферменты (протеазы, а-амилаза и др.). Они используются при изготовлении промышленных и бытовых товаров (детергенты, очистительные средства, комбикорма, фармацевтические товары), выпечке хлебо¬ булочных изделий.Сенсибилизация низкомолекулярными веществами происходит в результате связывания гаптенов с белками в организме человека, с последующим запуском иммунологических реакций. К ним отно¬ сятся:
742 ПРОФЕССИОНАЛЬНЫЕ и связанные с факторами ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯ• изоцианаты, которые используются для производства полиуретана, пла¬ стичных, гибких или жёстких соединений, широко применяющихся в про¬ изводстве изоляции, сидений, фурнитуры мебели, подошв, ковровых основ, оболочки кабеля, верхней одежды, клеев и проч.• ангидриды кислот, такие как фталиевый и триметиловый ангидрид, применя¬ ющиеся при производстве эпоксидных смол, некоторых акрилатов и красок.• персульфаты, которые применяются для осветления волос и являются при¬ чиной развития ПБА у парикмахеров.• природные химигеские вещества, содержащиеся в деревьях, например, в запад¬ ном красном кедре (пликатиковая кислота), сосновой смоле (канифоль), акации (растительный клей), используются в электротехнической промыш¬ ленности при паяльных работах.• некоторые металлигеские агенты: соли платины, используемые при обработ¬ ке драгоценных металлов; кобальт, хром и никель.Во II группу причинных факторов ПА входят агенты токсико-раздражающего действия: газы, пары кислот, дым. Чаще они выполняют роль триггеров ПБА, провоцируя бронхоконстрикцию у лиц с БГР. В очень высоких концентрациях летучие и газообразные соединения способны вызвать синдром реактивной дис¬ функции дыхательных путей, обозначаемый в зарубежной литературе термином RADS {Reactive airway dis^ncüon syndrome) [6].К другим стимуляторам астматических приступов у лиц с БГР относятся: табач¬ ный дым в помещениях, физические нагрузки, особенно при низкой температуре окружающего воздуха, острые респираторные вирусные инфекции, эмоциональ¬ ный стресс.ЭпидемиологияВ настоящее время БА, вызванная условиями труда, является самым распро¬ странённым профессиональным лёгочным заболеванием во всех развитых странах мира, В структуре общей профессиональной патологии БА занимает от 12,5 до 15,7%.Согласно опубликованным данным в последние годы, от 8 до 21% лиц, занятых в различных производствах, имеют риск заболеть БА, связанный с экспозицией сенситизаторов на рабочем месте [7-9J.Частота развития ПБА зависит от целого ряда условий: природы и свойств аллергена, уровня запылённости зоны дыхания, дозы вдыхаемых сенситизаторов, а также от состояния защитных свойств организма, наличия генетической пред¬ расположенности, атопии, табакокурения.Случаи ПБА с наибольшей частотой регистрируются среди работников сельско¬ го хозяйства и тех отраслей промышленности, где причиной заболевания служат вещества белковой природы, обладающие высокоаллергенными свойствами, или гаптены с аллергенной активностью [10,15,17, 22, 25, 30].Атопия является важным фактором риска развития БА любой этиологии (посредством IgE-индуцированных реакций), особенно при контакте с высокомо¬ лекулярными соединениями [24, 29],Степень риска развития аллергического воспаления в дыхательных путях, обусловленного IgE-механизмом, повышает курение сигарет. Это подтверждено рядом научных исследований. Однако курение и атопия не играют существенной роли в развитии БА при контакте с агентами НММ, как, например, изоцианаты и красный кедр, в отличие от веществ с ВММ [10,17].Менее 10% всех зарегистрированных случаев острого поражения дыхательных путей (RADS) сопровождаются симптомами персистирующей Б А [11, 34, 35].
ПРОФЕССИОНАЛЬНАЯ БРОНХИАЛЬНАЯ АСТМА 743Клинические варианты ПБА |?ИММУННАЯ ПБАСогласно принятой номенклатуре Европейской академии аллергии и клиниче¬ ской иммунологии, ПБА, опосредованную иммунными механизмами, следует обо¬ значать как ^аллергигескую ПБА». Если в генезе астмы участвует IgE, то использу¬ ется термин ^IgE-зависимая ПБА».Другие неиммунные формы БА, причинно связанной с условиями работы, клас¬ сифицируются как ^неаллергигеская ПБА» [36].НЕИММУННАЯ (ОСТРАЯ) ПБАНеиммунная ПБА характеризуется быстрым развитием симптомов в течение нескольких часов после экспозиции на рабочем месте раздражающих веществ в высоких концентрациях. Заболевание получило название реактивной дисфункции дыхательных путей (RADS) или Б А, индуцированной ирритантами. К сожалению, в России и странах СНГ этот диагноз почти не ставится. Более того, подвергает¬ ся большому сомнению принадлежность сострой астмы» к профессиональным заболеваниям, в связи с чем в списках профессиональных заболеваний синдром реактивной дисфункции дыхательных путей до сих пор не значится.БА, АГРАВИРОВАННАЯ УСЛОВИЯМИ ТРУДА (ПРОИЗВОДСТВЕННО-ОБУСЛОВЛЕННАЯ БА)Условно причислена к профессиональному заболеванию. Её развитие изна¬ чально не связано с работой и может иметь место задолго до контакта с вредными факторами. Как правило, симптомы БА возобновляются или усиливаются под воздействием неблагоприятных профессиональных аллергенов, и её течение резко ухудшается. Несмотря на то, что больные денежной компенсации не получают, за ними устанавливают диспансерное наблюдение с выдачей трудовых рекомендаций по ограничению контакта с профессиональными вредностями.Наряду с перечисленными вариантами ПА существуют разновидности её син¬ дромов. К ним относятся: эозинофильный бронхит, алюминиевая астма, астмопо- добный синдром от органической пыли.Эозинофильный бронхит характеризуется хроническим кашлем, наличием эози¬ нофилов в мокроте, лаважной жидкости и отсутствием БГР, Провокационные ингаляционные тесты с предполагаемыми агентами вызывают значительное уве¬ личение числа эозинофилов в мокроте, но не влияют на реактивность дыхатель¬ ных путей и не вызнают бронхообструкцию [38, 39].Алюминиевая астма представляет собой симптомокомплекс респираторных расстройств, возникающих у рабочих во время плавки алюминия. В развитие симптомов вовлечены различные механизмы, включающие эффект раздражения дыхательных путей экспозицией токсических газов, дымов (диоксид серы, фто¬ ристый ангидрид и др.) и иммуннз^ю реакцию, направленную против больших доз металлов-аллергенов. Характерны развитие БГР в течение экспозиции про¬ фессиональных вредностей и причинно связанные с работой изменения пиковой скорости выдоха.Астмоподобные заболевания охватывают группу синдромов, остро возникающих после вдыхания органической пыли (зерно, хлопок, табак, джут и другие волокни¬ стые пыли), пыли птицеводческих и животноводческих помещений. Дебют забо¬ левания характеризуется быстрым падением ПСВ и OOBj, транзиторным повы¬ шением БГР и нейтрофильным воспалением дыхательных путей [40,41],ПАТОГЕНЕЗ ИММУННОЙ ПРОФЕССИОНАЛЬНОЙ АСТМЫВысокомолекулярные и некоторые низкомолекулярные соединения, такие, как соли платины и ангидриды кислот (уксусной, пликатиковой и др.), индуцируют
744 ПРОФЕССИОНАЛЬНЫЕ и СВЯЗАННЫЕ с ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯ|si астму с помощью специфических IgE-зависимых реакций. Однако термин «иммун- ная» астма не обязательно предусматривает в её генезе участие IgE-опосредованных реакций. Клеточный механизм также может быть вовлечён в развитие заболева¬ ния. В случае IgE-зависимой ПА ингалированные сенситизаторы связываются со специфическими АТ на поверхности тучных клеток, базофилов и. возможно, макрофагов, эозинофилов и тромбоцитов. Специфическая реакция между аллер¬ геном и IgE вызывает каскад реакций, в результате которых происходит активация провоспалительных клеток. Активация тучных клеток ведёт к немедленной аллер¬ гической реакции — бронхоконстрикции, вследствие высвобождения медиаторов: гистамина, лейкотриенов С^, и Е^, простагландина [42J.IgE-зависимая активация тучных клеток также приводит к высвобождению цитокинов, хемокинов и нарастанию экспрессии адгезивных молекул, вовлекае¬ мых в модулирование поздних воспалительных реакций после ингаляции аллер¬ гена.Доказана значимость Т-лимфоцитов в воспалительном процессе наряду с эози¬ нофилами, нейтрофилами, тучными и эпителиальными клетками, придающими характерные патофизиологические признаки БА: спазм гладкой мускулатуры, отёк и гиперсекреция слизи, воспаление воздухоносных путей и повреждение эпителия [43,46,47,49. 50].ПАТОГЕНЕЗ НЕйММУННОЙ ПРОФЕССИОНАЛЬНОЙ АСТМЫПрофессиональные раздражающие вещества приводят к развитию воспаления в воздухоносных путях под воздействием ирритантов.Если концентрация вдыхаемого агента оказалась очень высокой, как правило, развивается RADS. По данным биопсии и гистологических исследований видно, что при RADS патологические изменения в бронхах во многом схожи с таковыми при БА, т.е, имеют место субэпителиальный фиброз, инфильтрация слизистой оболочки и подслизистого слоя эозинофилами и Т-клетками. Однако при RADS фиброз выражен значительнее, а инфильтрация активными Т-клетками — слабее. Существует гипотеза о том, что повреждение эпителия при RADS сопровождается прямой активацией неадренергического нехолинергического пути через аксон- рефлексы с запуском нейрогенного воспаления. При этом возможна неспецифиче¬ ская активация макрофагов и дегран)'ляция тучных клеток.КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ПРОФЕССИОНАЛЬНОЙ АСТМЫКлинические признаки ПА мало отличаются от таковых при БА непрофессио¬ нального генеза. По степени тяжести Б А также делят на интер мигрирующую, лёг¬ кую персистирующую, средней тяжести и тяжёлую.При интермиттирующей БА прекращение контакта с АГ или приём бронходи¬ лататоров быстро купирует симптомы заболевания.Лёгкая персистирующая БА отличается более упорным проявлением астмати¬ ческих симптомов с выраженными симптомами экспозиции и элиминации произ¬ водственной пыли. На этой стадии ПА также легко поддаётся терапии.При БА средней тяжести стираются специфические черты профессионального заболевания из-за выраженности симптомов и отсутствия их временной связи с выполнением трудовых операций.При тяжёлой ПА установить изначальную связь развития заболевания с усло¬ виями труда бывает крайне сложно.Для формирования иммунной ПА типично наличие латентного периода, дляще¬ гося от нескольких месяцев до нескольких лет (в среднем 2,5 года) после начала экспозиции аллергена.Этиологические агенты ПА могут вызывать ранний, поздний или двойной иммунные ответы со стороны дыхательных путей.
ПРОФЕССИОНАЛЬНАЯ БРОНХИАЛЬНАЯ АСТМА 745Ранняя бронхоконстрикторная реакция со снижением ОФВ^ развивается в тече¬ ние нескольких минут после экспозиции АГ. Максимальный эффект достигается по истечении 1 ч контакта с сенситизатором.Поздняя аллергигеская реакция начинается через 4-6 ч после экспозиции АГ с продолжением бронхоконстрикторного эффекта до суток и более.Двойной ответ на ингаляцию АГ характеризуется развитием сначала ранней аст¬ матической реакции, а спустя 4 ч и более появлением позднего ответа.В случае реактивной дисфункции дыхательных путей астматические симптомы выражены ярче, проявляются мгновенно и держатся от нескольких дней до 12 нед. Для БА, вызванной низкими концентрациями химических веществ, характерны персистирующие симптомы раздражения слизистой оболочки дыхательных путей с последующим развитием астматических реакций [10,13,17].ДиагностикаДиагноз ПА основывается в первую очередь на подтверждении наличия заболе¬ вания как такового, а затем — установлении его связи с условиями работы.Причинно-следственная связь БА с условиями труда устанавливается с помо¬ щью объективных диагностических тестов [12,15, 31].Необходимо тщательное изучение анамнеза и профанамнеза заболевания, анализ профмаршрута больного с оценкой санитарно-гигиенических условий его труда. Связь симптомов БА с работой можно предполагать в тех случаях, когда имеется хотя бы один из следующих критериев;• усиление симптомов заболевания или их проявление только на работе;• купирование симптомов в выходные дни или в отпускной период;• регулярное проявление астматических реакций после рабочей смены;• нарастание симптомов к концу рабочей недели;• улучшение самочувствия, вплоть до полного исчезновения симптомов, при смене характера вьшолняемой работы (прекращение контакта с причинными агентами).Для диагностики RADS основным критерием является указание в анамнезе на впервые развившиеся астмоподобные симптомы в течение 24 ч после ингаляции раздражающего газа, токсичных паров, дыма в высоких концентрациях, с перси¬ стенцией симптомов от нескольких дней до 3 мес.Детальное изучение профанамнеза и профмаршрута больного позволяет оце¬ нить возможность влияния условий труда настоящего и предыдущего места рабо¬ ты на формирование болезни (экспозиция вещества, ранее вызвавшего появление астматического приступа или затруднённого дыхания).Анализ связи БА с профессией базируется на предварительном изучении свойств предполагаемого агента, вызвавшего заболевание, информации о подоб¬ ных случаях ПБА на данном предприятии или у работников других производств, где присутствуют аналогичные факторы.Результаты осмотра больного интермитгирующей, а в ряде случаев и лёгкой пер¬ систирующей вне воздействия вредных факторов могут не отличаться от таковых у здоровых лиц. Поэтому необходимы динамические обследования в период экспози¬ ции и элиминации производственных АГ: в ближайшие часы после работы, в конце рабочей недели и после выходных дней.У большинства пациентов с БА изменения на рентгенограмме лёгких отсут¬ ствуют. Это объясняется тем, что заболевание, как правило, ограничивается воспалительным процессом в воздухоносных путях и не затрагивает паренхимы лёгких. В период обострения можно выявить рентгенологические признаки гиперинфляции и низкое стояние диафрагмы во время дыхательных экскурсий. При длительном хроническом воспалении прослеживаются утолщённые стенки бронхов, может быть скопление слизистых пробок в виде летучих инфильтратов [51].
'■ 746 ПРОФЕССИОНАЛЬНЫЕ и СВЯЗАННЫЕ С ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯ^ ИССЛЕДОВАНИЕ ФВД И ПИКФЛОУМЕТРИЯСледует учитывать, что снижение ОФВ^и БГР характерны для лиц, подвергаю- щихся постоянному воздействию производственных аэрозолей без клинических ,. проявлений БА. В периоды высокой запылённости и загазованности воздуха и у - '' здоровых работников могут иметь место кратковременные снижения лёгочных- - объёмов, что не позволяет отличить их от больных ПА. в связи с этим рекомендо- ■. . ваны неоднократные измерения ОФВ^ до начала работы и в разные часы контакта с аллергенами f2, 4,10].Провокационные тесты с метахолином^ и гистамином зарекомендовали себя как высокочзшствительные в определении БГР, вызванной производственными факторами. При отсутствии других методов обследования, в частности аллерго¬ диагностических, провокационный тест, выполненный в динамике экспозиции и элиминации причинных агентов (в период работы и после отпуска), может слу¬ жить альтернативой в решении вопроса о связи БА с профессией.После установления диагноза БА или выявления БГР необходимы дополни¬ тельные серийные измерения пев с помощью пикфлоуметрии. Её желательно проводить в динамике рабочего времени (не менее 2-3 измерений) на протяжении2-4 нед с повторным измерением после 3-4-недельного перерыва в работе. При наличии ПА показатели ПСВ снижаются во время контакта с этиологическим агентом и достоверно возрастают вне его воздействия (вариабельность показате¬ лей >20%).Если результаты метахолинового (гистаминового) теста и пикфлоуметрии не совпадают, показано проведение натурного эксперимента — пробы с реэкспозицией производственных агентов нарабогем месте. Проводится мониторинг ОФВ^ и/или ПСВ до работы и в процессе выполнения привычных операций, а также в разные промежутки времени по окончании трудовой смены. Падение ОФВ^ от базового значения и вариабельность показателей ПСВ >20% будут свидетельствовать в пользу профессионального генеза БА [51,52,53].ИММУНОДИАГНОСТИКАПодтверждением наличия сенсибилизации производственными агентами явля¬ ются кожное аллерготестирование (прик-тест) и определение специфического IgE в сыворотке крови. Эти методы наиболее приемлемы для диагностики ПА, вызван¬ ной агентами с ВММ.Б распознавании агентов с НММ приоритет принадлежит изучению клеточного иммунитета, а именно: обнаружению активных CD®"^ Т-хелперов 2-го типа и экс¬ прессии CD'^'^ в бронхоальвеолярном лаваже и биоптатах, а также эозинофилии в периферической крови после провокационного теста.Дифференциальная диагностика клинических вариантов ПБАПо результатам анкетного скрининга, тщательного изучения санитарно- гигиенической характеристики и анализа данных клинико-функционального и иммунообследования проводится дифференциальная диагностика между отдель¬ ными вариантами ПА:• 1 вариант — иммунная ПБА, которая возникла впервые под влиянием условий труда;• 2 вариант — производственно-обусловленная БА (агравированная профес¬ сиональными факторами):• 3 вариант — ирритантная или неиммунная БА (RADS).Критерии определения варианта ПБА• 1. Ранее существующая БА, симптомы которой возобновились после длитель¬ ной ремиссии (в течение 2 лет и более до устройства на работу) или усилились под воздействием производственных агентов, что послужило основанием
ПРОФЕССИОНАЛЬНАЯ БРОНХИАЛЬНАЯ АСТМА 747ДЛЯ приёма базисной противоасгматической терапии (или увеличения дозы щ лекарств), является производственно-обусловленной Б А {агравированной ^ условиями труда).• 2. Появление первых симптомов БА в течение 24 ч после однократного вды¬ хания на работе высоких доз раздражающего вещества или токсических газов, паров, дыма с персистенцией респираторных расстройств (симптомов БА, наличия БГР и снижения ОФВ^) до 3 мес свидетельствует о наличии RADS.• 3, Для диагностики классического варианта иммунной ПА должно быть не менее трёх из следующих критериев:❖ появление астматических приступов впервые при работе в течение 2 лет и более с агентами, способными вызвать развитие БА;❖ изменения ОФВ^ и ПСВ, связанные с периодом экспозиции и элиминации производственных аэрозолей;❖ наличие БГР, зависимой от контакта с профессиональными факторами, выявленной в результате серийных измерений до и после работы;❖ положительные кожные реакции и/или выявление специфических IgE к предполагаемому агенту;❖ положительный ответ на «натурный эксперимент»: специфический инга¬ ляционный тест с предполагаемым агентом или на пробу с реэкспозицией производственных аэрозолей на рабочем месте [5,6,31] (рис. 47-1),Лечение и профилактикаОсновным В лечении ПА является своевременное отстранение больного от воз¬ действия тех производственных факторов, которые вызвали развитие заболева¬ ния. Если контакт с причинным агентом прекращён на стадии интермитгирующей БА и даже лёгкой персистирующей с давностью заболевания не более 1,5-2 лет, то в 60-70% случаев удаётся добиться не только длительной ремиссии, но и полного выздоровления.Лица с ирритантной БА могут продолжать работать в прежней профессии после обратного развития симптомов, при условии соблюдения правил личной безопас¬ ности и предупреждения повторной ингаляции токсических аэрозолей в высоких концентрациях.В медикаментозной терапии больных с ПА эффективными являются ИГКС.Причём терапевтический эффект ИГКС напрямую зависит от сроков назначения лечения. Раннее назначение ИГКС служит защитой для дыхательных путей от дальнейшего развития аллергического воспаления даже при продолжении контак¬ та с вредными факторами. Тем не менее добиться купирования симптомов астмы и длительной ремиссии заболевания с помощью ИГКС возможно только при исклю¬ чении или ограничении экспозиции вредных аэрозолей.Если причинный фактор ПБА не может быть удалён из рабочей зоны, то про¬ филактикой дальнейшего развития болезни может быть перемещение работника внутри одного и того же предприятия. Например, перевод на участок работы, не связанный с воздействием пыли и аллергенов. Перевод должен быть не времен¬ ным (на период обострения симптомов), а постоянным. Если перемещение вну¬ три предприятия невозможно, необходимо трудоустройство больного на другую работу вне контакта с АГ и другими факторами, способствующими дальнейшему развитию БА.ПРОГНОЗПБА может привести к ранней инвалидности, если вовремя не отстранить больного от воздействия вредных агентов. Поскольку это не всегда оказывается возможным ввиду различных причин, пациенты с ПА вынуждены находиться на стационарном лечении из-за развития дыхательной недостаточности и сердечных
748 ПРОФЕССИОНАЛЬНЫЕ и СВЯЗАННЫЕ с ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯ'Ж:II Анализ данных профанамнеза и I профмаршрута с сопоставлением I санитарно-гигиенических условий трудаКожный тест, РАСТ (если возможно)Оценка бронхиальной чувствительности на фармакологические агенты iЧувствительность в норме [БольнойпродолжаетработатьЧувствительность повышенаБольной прекратил работатьБольнойпродолжаетработатьПровокация профессиональным агентом TIZ7. ZHZ |~псположительнаБА нетотрицательнаizrnz:Решение вопроса о возвращении на работутПровокация на рабочем месте с подозреваемым агентом и/или мониторинг ПСВ ^положительна^ у- 'профессиональнаяБАотрицательна ЗЕнепрофессиональная БАРис. 47-1. Поэтапная диагностика ПБА. РАСТ — радиоаллергосорбентный тест.расстройств. Тем не менее, частота госпитализаций больных с ПА ниже таковой при астме непрофессионального генеза. По-видимому, это обусловлено боязнью потерять работу [10,12, 23].Факторами риска персистенции симптомов ПА являются; длительная экспози¬ ция причинного агента до установления диагноза, давность течения заболевания до отстранения от контакта с профвредностями и тяжесть течения БА до установ¬ ления её связи с условиями работы. При своевременном отстранении от контакта с АГ показатели спирометрии постепенно повышаются, а БГР снижается. Обычно ФВД улучшается в течение 1 года с момента перемены места работы, а БГР исчеза¬ ет в 2-летний период прекращения экспозиции вредных веществ.Отдалённые последствия ирритантной БА могут быть разными: раннее отстра¬ нение больного от повторных ингаляций токсических веществ приводит либо к полному выздоровлению, либо к сохранению БГР на протяжении 1-2 лет. Повторные эпизоды экспозиции раздражающих и токсических веществ могут стать причиной развития иммунной Б А [54].СПИСОК ЛИТЕРАТУРЫ.«*
Глава 48 ПневмокониозыГлава 49Г иперчувствительный пневмонит
Глава 50Острые токсические поражения дыхательных путейОстрые токсические поражения дыхательных путей (ОТПДП) могут быть вызваны ингаляцией различньк газов и аэрозолей в дозах, пре¬ вышающих предельно допустимые концентрации, установленные для их содержания на рабочем месте или в окружающем воздухе.К раздражающим веществам, действующим на дыхательную систему, относят те соединения, которые после их экспозиции вызывают воспаление верхних и нижних дыхательных путей. Соединения, которые могут вызывать повреждение паренхимы, считают токсичными.При ОТПДП можно наблюдать следующие клинические синдро¬ мы: острое поражение верхних дыхательных путей (ВДП), острый токсический бронхит, острый токсический бронхиолит, острый токсический отёк лёгких, острая токсическая пневмония, острый токсический пневмонит (альвеолит) с переходом в фиброз.ПатогенезФизические свойства ингалируемых веществ дают информацию о предполагаемом месте их осаждения, где в первую очередь появят¬ ся признаки раздражения. Частицы крупных размеров (от 10 до 20 мкм) осаждаются в ВДП. меньших (от 5 до 10 мкм) — в трахее и бронхах, а не превышающие 5 мкм могут достигать альвеол.Токсичные газы осаждаются в соответствии с их растворимостью. Растворимый в воде газ адсорбируется слизистой оболочкой ВДП, а менее растворимые газы оседают на протяжении всего трахеоброн¬ хиального дерева.Механизм повреждающего действия ирритантов зависит от их физических свойств, концентрации, времени воздействия, темпе¬ ратуры и влажности воздуха, присутствия болезнетворных микро¬ организмов и сочетанного действия с другими газами.На клеточном уровне повреждение респираторного тракта может быть обусловлено несколькими механизмами: окисление (озон, двуокись азота, двуокись серы, хлор), образование кислоты (дву¬ окись серы, хлор, галоидные соединения) или щёлочи (аммиак). Большинство металлических паров — оксиды нагретых металлов, вызывают повреждение тканей посредством окисления липидов. Первоначально наблюдают выраженное повреждение (альтерация) клеток реснитчатого эпителия дыхательных путей и альвеолоцитов 1-го типа с последующим нарушением поверхностной связи клеток.
ОСТРЫЕ ТОКСИЧЕСКИЕ ПОРАЖЕНИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ 751Рис. 50-1. Диффузное альвеолярное повреждение: гиалиновые мембраны по контуру альвеол. Окраска гематоксилином и эозином, х 200.Это ведёт к субэпителиальному повреждению слизистой оболочки дыхательных путей с активацией гладких мышц и парасимпатических нервных окончаний — развитию бронхоспазма. Происходит запуск механизма воспалительной реакции: нейтрофилы и эозинофилы выделяют медиаторы, которые вызывают дальнейшее окислительное повреждение, в случаях тяжёлого отравления наблюдают очаговые и сливные участки отёка слизистой оболочки бронхов с насыщенным накоплени¬ ем белкового экссудата в полостях альвеол, формирование гиалиновых мембран и десквамацию альвеолоцитов 2-го типа (рис. 50-1. см. также цветную вклейку). Регенерация эпителия происходит за счёт пролиферации альвеолоцитов 2-го типа и плоскоклеточной метаплазии (бронхиолизация эпителия альвеол) [46, 47].Клинические синдромы острых токсических поражений дыхательных путейПри остром поражении верхних дыхательных путей развивается острый ток¬ сический ларингофаринготрахеит. Процесс обычно лёгко обратим и заканчи¬ вается выздоровлением в течение нескольких дней.При воздействии высоких концентраций раздражающих веществ развивают¬ ся участки некроза на месте ожогов, обилие слизисто-гнойного отделяемого в полости носа и трахее со спазмом голосовой щели с затруднением вдоха, сопро¬ вождаемого свистом (стридорозное дыхание). В некоторых случаях происходит молниеносная смерть вследствие асфиксии.Острый токсический бронхит характеризуется диффузным поражением бронхиального дерева. Клиническая картина определяется глубиной поражения стенки бронхов и его распространённостью. Лёгкие случаи заболевания, как пра¬ вило, имеют непродолжительное течение и заканчиваются выздоровлением через 3-7 дней, тяжёлые — через 2-6 нед.
їді.::.•ч-^г-т752 ПРОФЕССИОНАЛЬНЫЕ и СВЯЗАННЫЕ с ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯОстрый токсический бронхиолит. Начальные признаки заболевания про¬ являются через несколько часов, а в отдельных сл)гчаях через 1-2 сут после пре¬ бывания в зоне высоких концентраций токсических веществ. Клиническая карти¬ на сопровождается одышкой, кашлем с густой слизистой мокротой, с примесью крови, приступом удушья, болью в грудной клетке, повышением температуры тела до 38-39 °С. У больного выраженный цианоз кожи и слизистых оболочек, учащение дыхания. В лёгких выслушиваются средне- и мелкопузырчатые влаж¬ ные хрипы. Характерны симптомы общей интоксикации с вовлечением в процесс печени и почек. Рентгенологически на фоне пониженной прозрачности лёгочных полей в средних и нижних отделах заметны мелкоочаговые образования, местами сливающиеся между собой, расширение корней лёгких. Обратное развитие сим¬ птомов возможно только в течение 2-3 мес. Возможен переход в хроническую форму с развитием облитерирующего бронхиолита и пневмосклероза, особенно при повторных воздействиях раздражающего вещества.Острый токсический отёк лёгких — наиболее тяжёлая форма поражения. Ведущее значение в его развитии принадлежит повышению проницаемости аль¬ веолярных и капиллярных мембран. В течении заболевания условно различают несколько стадий: стадию начальных явлений (рефлекторную), которая возникает тотчас после ингаляции токсического вещества, скрытых симптомов, клинических проявлений — через 24 ч, и обратного развития.При тяжёлой форме заболевания можно наблюдать симптомокомплекс «синей», а затем и «серой гипоксемии», приводящей к коллапсу и смерти через 24-48 ч после отравления. В более лёгких случаях и при проведении своевременного лече¬ ния начинается стадия обратного развития — обычно на 3-й сутки после отравле¬ ния. Выздоровление наступает в течение нескольких дней или недель.Острая токсическая пневмония развивается в течение 1-2 сут после воздей¬ ствия токсических веществ. Вначале доминируют признаки токсического ларинго- фаринготрахеита или бронхита, затем — симптомы пневмонии. На рентгенограмме появляются очаговые инфильтративные изменения разной степени выраженности. Первичная токсическая пневмония, не осложнённая инфекцией, имеет обычно бла¬ гоприятное течение. Молниеносная форма отравления может закончиться парали¬ чом дыхательного и сосудистого центров с наступлением смерти.Поражение лёгких при пожарахВ большинстве случаев гибель людей при пожарах происходит не от высоких температур, а от воздействия дыма, содержащего токсические вещества (соля¬ ная, плавиковая и другие кислоты, аммиак, фосген, оксиды азота, альдегиды). Ирританты образуются при термическом распаде как природных, так и синтети¬ ческих полимеров. Как правило, химический мономер-предшественник не стано¬ вится основным продуктом распада полимера. Состав дыма меняется вследствие изменения доли образующихся токсических веществ, различной температуры горения и доступа кислорода.У лиц, подвергшихся воздействию дыма пожаров (как лесного, так и в городских условиях), имеет место наличие острой и персистирующей обструкции, а также неспецифической гиперреактивности дыхательных путей. В отдалённом периоде наблюдается развитие бронхоэктазов и облитерирующего бронхиолита [48].Дыхательные лихорадкиИнгаляция некоторых летучих веществ, образующихся в различных произ¬ водственных процессах (металлических паров, органической пыли, полимерного дыма), может приводить к развитию гриппоподобных синдромов, продолжаю¬ щихся несколько часов [49], Все они относятся к дыхательным лихорадкам.
ОСТРЫЕ ТОКСИЧЕСКИЕ ПОРАЖЕНИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ 753Несмотря на тяжесть течения, симптомы токсического воздействия в большинстве случаев самопроизвольно проходят. Интенсивное воздействие провоцирующих веществ может вызвать более серьёзную симптоматику, включая пневмонию и отёк лёгких. Частые повторные лихорадочные состояния с персистенцией респи¬ раторных симптомов в течение нескольких месяцев могут дать начало развитию гиперсенситивного пневмонита с последующим развитием фиброза, что требует немедленной патогенетической терапии.Лечение острых токсических поражений дыхательных путейПервая помощь заключается в немедленном прекращении контакта с токсиче¬ ским веществом. Пострадавшего выводят из загазованной атмосферы, освобожда¬ ют от одежды, а при попадании яда на кожу обильно промывают её водой с мылом. Зная о наличии скрытого периода при отравлении веществами раздражающего действия, даже при отсутствии признаков интоксикации за пострадавшим следу¬ ет наблюдать не менее 24 ч, создав ему полный покой. Только после этого и при отсутствии симптомов общего отравления отменяют режим покоя.с целью профилактики присоединения инфекции назначают антибиотики. В случаях скопления секрета в просвете дыхательных путей необходимо его уда¬ ление (отсасывание) через катетер. При явлениях рефлекторного бронхоспазма показаны бронхолитики (подкожное введение атропина или эфедрина). Наличие тяжёлого ларингоспазма служит показанием к проведению трахеотомии и инту¬ бации.При бронхите и бронхиолите показаны оксигенотерапия, противокашлевые и антибактериальные препараты, ИГКС.Токсический отёк лёгких требует общепринятой патогенетической терапии.Для лечения дыхательных лихорадок применяют жаропонижающие средства.СПИСОК ЛИТЕРАТУРЫ
Глава 51Поражения лёгких, вызванные лекарствамиК побочному действию лекарственных средств (ЛС) относят раз¬ нообразные состояния, отличающиеся по патогенезу и являющиеся неспецифическими (МКБ, 1999), Они определяются индивиду¬ альной предрасположенностью организма к фармакологическому воздействию лекарств. Поражение лёгких, спровоцированное ЛС, назначаемыми в режиме общепринятой терапии, среди всех про¬ явлений лекарственной болезни составляет от 10 до 15%. В понятие лекарственной болезни не включают патологические процессы, возникающие по причине передозировки ЛС, выдачи или приёма по ошибке другого Л С [1-4].Некоторые препараты, вызывающие поражение органов дыхания (доклады Groupe d’Etudes de la Pathologie Pulmonaire latrogine. Camus P., 2003)• Антибиотики:❖ амфотерицин В;❖ изониазид;❖ нитрофураны;❖ стрептомицин;❖ сульфасалазин;❖ тетрациклин;❖ этамбутол,• Психотропные препараты:❖ анксиолитики;❖ героин;❖ карбамазепин;А кокаин;❖ метадон;❖ метилфенидат;❖ наркотические анальгетики;❖ седативные:❖ тразодон;❖ фенотиазид*®;❖ хлордиазопероксид^".• Противовоспалительные:❖ ацетилсалициловая кислота;❖ метотрексат;❖ пеницилламин;❖ соли золота.
ПОРАЖЕНИЯ ЛЁГКИХ, ВЫЗВАННЫЕ ЛЕКАРСТВАМИ 755• Цитостатики: 3 - > С❖ азатиоприн; ' § ' 5). ^^❖ меркаптопурин; ^ 5;;❖ гемцитабин; • ‘❖ метотрексат;❖ флударабин. -,• Препараты, модифицирующие иммунный ответ:❖ гранулоцитарномакрофагеальный колониестимулирующий фактор; ’❖ интерферон-а;^ интерлейкин-2;❖ фактор некроза опухолей.• Кардиотропные:❖ амиодарон;-о- ингибиторы ренин-ангиотензин-альдостероновой системы;❖ антикоагулянты; о- р-блокаторы;❖ гидралазин; гидрохлоротиазид;❖ дипиридамол; протамина сульфат;❖ токаинамид^^;❖ флекаинид^.• Химиотерапевтические и иммуносупрессивные препараты:^ блеомицин;❖ кармустин;❖ бусульфан;❖ мелфалан;❖ тамоксифен;’О- хлорамбуцил;о- циклоспорин А;❖ этопозид;❖ прокарбазин,• Различные группы;<<>- З^-агонисгы (тербуталин, ритордин^); бромкриптин;❖ дантролен;❖ ингибиторы аппетита;^ метизергин^;минеральные масла;❖ токолитики;❖ триптофан.Клинические проявления изменений в лёгких, вызванных ЛС, чрезвычайно разнообразны и представлены широким спектром различных по тяжести изме¬ нений — от малосимптомных «летучих» инфильтратов до жизнеугрожающих состояний по типу тяжелого респираторного дистресс-синдрома [1].Хотя негативное влияние ЛС на лёгкие представлено сочетанием различных типов цитотоксических реакций, можно выделить преобладающий механизм, определяющий особенности поражения лёгких (табл. 51-1).Риск побочных эффектов лекарственного воздействия увеличивается для носите¬ лей гена быстрого ацетилирования в системе НЬА, что объясняется более быстрым накоплением в крови токсических субстанций лекарственного происхождения [5].Для большинства препаратов риск негативного влияния на лёгкие увеличивается с возрастом [6]. Предполагают, что в стареющем лёгком в условиях ускорения апопто-
а.,'756 ПРОФЕССИОНАЛЬНЫЕ и СВЯЗАННЫЕ С ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯза облегчается восприимчивость структур дыхательных путей, альвеолокапилляр¬ ной мембраны к реакциям повреждения, индуцированным ЛС [7].Таблица 51-1. Механизмы негативного влияния ЛС на лёгкиеМеханизмы поврежденияОксидативный стрессНепосредственно токсическое дей¬ ствие на альвеоло-капиллярный барьерЛС, вызывающее пневмотокси- ческую реакциюНитрофураныЦитостатикиОтложение ЛИП1ДДНЫХ соединений в клеткахАмиодаронОбразование иммунных компгек- Антибиотики сов, антителКлинические проявления, вызванные ЛСБронхиальная обструкцияФиброзирующий альвеолитФиброзирующий альвеолит, обли¬ терирующий бронхиолитВолчаночноподобные реакцииОсобо лекарственно-индуцированным поражениям подвержены женщины. К этому предрасполагает структура заболеваний в женской популяции, что опреде¬ ляет необходимость более широкого применения препаратов с высокой пневмоток¬ сичностью, и физиологические особенности женского организма [8, 9]. Большую проблему представляют лекарственные реакции, вызванные гормональными кон¬ трацептивами, на долю которых приходится до 12% всех ятрогений у женщин.Курение потенцирует патологические изменения в лёгких, спровоцированные ЛС. Под воздействием соединений, входящих в состав табачного дыма, усиливает¬ ся выработка свободных радикалов и активируются интерстициальные макрофа¬ ги, являющиеся источниками факторов повреждения [10]. Под влиянием алкоголя угнетаются местные защитные процессы в лёгких, что повышает риск оппорту¬ нистических инфекций, возникающих вследствие приёма иммуносупрессивных препаратов [11]. Кроме того, у больных с алкогольным гепатитом с исходом в цирроз вследствие портальной гипертензии, перестройки печёночного кровотока, портосистемного шунтирования повышается поступление фиброгенных факторов в лёгкие, источниками которых становятся гепатоциты, эндотелий новообразо¬ ванных сосудов, что также усугубляет негативные влияния лекарственных пре¬ паратов на лёгкие.Риск лёгочной ятрогении увеличивается при сочетанной терапии, например при лечении опухолей, когда возникает необходимость совмещать практически одно¬ временно введение цитостатиков, препаратов группы колониестимулирующего фактора с радиационными методами лечения. Кислородотерапия также потенци¬ рует нежелательные последствия лекарственной терапии [12].Тяжесть лекарственного поражения лёгких, как правило, не зависит от длитель¬ ности лекарственного воздействия [13]. Так, тяжёлый дистресс-синдром может возникнуть в течение нескольких минут после введения гидрохлоротиазида [14].Сроки обратного развития изменений в лёгких после отмены пневмотокси- ческого препарата точно не установлены [15]. Выраженный остаточный фиброз наблюдается у больных после терапии противоопухолевыми препаратами, цито¬ статиками [16], причём эти изменения требуют назначения препаратов для под¬ держания функций лёгких.Общие механизмы повреждений лёгких, вызванных лекарственными средствамиВосприимчивость лёгких к воздействию ЛС определяется тем, что соединения, входящие в состав ЛС, и их метаболиты при прохождении через сосудистое русло
ПОРАЖЕНИЯ ЛЁГКИХ, ВЫЗВАННЫЕ ЛЕКАРСТВАМИ 757Рис. 51-1. Пневмонит, вызванный приёмом сульфасалазина. Симптом «матового стекла» (а). КТ лёгких: картина после отмены сульфасалазина (б).лёгких в условиях высокого напряжения кислорода подвергаются окислению, пре¬ вращаясь в реактогенные субстанции, обладающие свойствами свободных радика¬ лов. Кроме того, в лёгких вырабатывается множество медиаторов, часть которых, например компоненты ренинангиотензинальдостероновой системы, является мишенью для ЛС.Известны особенности реакций повреждения, свойственных тому или иному классу препаратов, индуцирующих изменения в лёгких. Так, нестероидные про¬ тивовоспалительные препараты, ингибиторы АПФ чаще становятся причиной гиперэозинофильного синдрома, алкилирующие средства (противоопухолевые препараты, цитостатики), биодобавки, витамины — фиброза плевры, лёгочного фиброза [17]. Нитрофураны, химиотерапевтические препараты усиливают гене¬ рацию пероксидных радикалов, супероксида, синглетного кислорода, липопереки- сей. Повреждающий эффект цитостатиков реализуется за счёт повышения синтеза р450 и снижения антиоксидантной защиты вследствие истощения содержания глутатиона [18].Варианты лекарственных поражений лёгкихв зависимости от особенностей клинических, радиологических, морфологиче¬ ских особенностей лекарственно-индуцированных поражений лёгких известны следующие варианты заболевания:• синдром бронхиальной обструкции (БА, эозинофильные инфильтраты, обли- терирующий бронхиолит);• отёк лёгких;• интерстициальная болезнь лёгких;• лёгочные васкулопатии;• плевральный выпот;• лекарственная волчанка.Нередко один и тот же препарат индуцирует целый спектр изменений, своеобра¬ зие которых определяется участием реакций клеточного и гуморального иммуни¬ тета. Поэтому предпочтительно классифицировать лекарственную болезнь, пре¬ жде всего, с учётом группы ЛС. С этих позиций для прогнозирования осложнений лекарственной терапии следует предусматривать применение набора методов исследований, позволяющих оценить состояние всех компонентов системы орга¬ нов дыхания. Так, наиболее частым проявлением лекарственной болезни является
-гвйіШіШііШ МШіщ■^влУ.-:758 ПРОФЕССИОНАЛЬНЫЕ и СВЯЗАННЫЕ с ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯреакция гиперчувствительности и бронхообструктивный синдром (табл. 51-2). Лекарственные лёгочные эозинофилии могут развиваться после приёма любых лекарственных препаратов (см. табл. 51-1). Через некоторое время (в среднем от 2 ч до 10 сут) после попадания Л С в организм появляются лихорадка, озноб, сухой кашель, очаговые тени или ограниченное затемнение лёгочных полей; в пери¬ ферической крови у части больных наблюдается плевральный выпот с большим количеством эозинофилов [19].Клиническая картина анафилаксии, БА, гиперреактивности дыхательных путей также возможна при приёме любых ЛС. Наиболее распространены в популя¬ ции лекарственные реакции на препараты, влияющие на ренин - ангиотензин- альдостероновую систему, р-блокаторы, нестероидные противовоспалительные препараты, антибиотики, половые гормоны и др. Лекарственно-индуцированный синдром бронхиальной обструкции, как правило, вынуждает заменить Л С или совсем прекратить лечение [4].Таблица 51-2. Бронхообструктивный синдром лекарственного генезаЛекарственное средствоАцетилсалициловая кислота и другие НПВПХимиотерапевтическиесредстваНеселективные и селектив¬ ные р-блокаторыНервно-мышечные блока- горыПрепараты антихолинэсте- разыПростагландины□-пеницилламинБензилпенициллин и любое лекарственное средствоОсобенности лекарственной реакцииВызывают обострение бронхообструктивного синдрома у 5-10% астматиков; характерны эозинофилия, рино- синусопатияБронхиальная обструкция в сочетании с интерстици¬ альной болезнью лёгких, васкулопатиейДозозависимость;Пути введения;У пациентов с обструктивной болезнью лёгких кар- диоселективные средства теряют избирательность по мере повышения дозы ЛСДозозависимостьДозозависимость;Выраженность тяжести реакции обусловлена путями введения;У восприимчивых пациентов потенцируют холинергиче- ское действиеБронхоспазм, лекарственные геморрагии, тромбо¬ эмболииТяжесть пневмотоксической реакции не зависит от дозы ЛС. Возможен облитерирующий бронхиолит у пациентов с ревматоидным артритомПневмотоксичность не зависит от пути введения, дозы, возможен 1дЕ'Обусловленный бронхоспазмТерапияОтмена ЛС; Симптоматическое назначение бронхоли¬ тиков:ГКСИВЛБронхолитики, антаго¬ нисты антихолинэсте- разы по показаниямОтмена ЛС; Бронхолитики по пока¬ заниямОтмена ЛС;Бронхолитики;ГКСОтмена ЛС; Бронхолитики, ГКС по показаниямОБЛИТЕРИРУЮЩИЙ БРОНХИОЛИТСреди причин облитерирующего бронхиолита (ОБ) известны нитрофураны, сульфаниламиды, пенициллины, аспирация минеральных масел, наркотики, цито¬ статики, соли золота; 25% лекарственного ОБ приходится на амиодарон. Патогенез ОБ включает разнообразные реакции нарушений межклеточных взаимодействий с преимущественным вовлечением малых дыхательных путей. Как и при забо¬ леваниях с бронхиальной обструкцией, при ОБ активируются нейтрофилы как
ПОРАЖЕНИЯ ЛЁП<ИХ, ВЫЗВАННЫЕ ЛЕКАРСТВАМИ 759ИСТОЧНИКИ свободных радикалов, а также другие факторы повреждения и бронхо¬ констрикции. ЛС меняет реологические свойства жидкости, выстилающей эпите¬ лий бронхов, что ус)тубляется той или иной степенью дефищ1та ос^-антитрипсина, IgA. В развитии ОБ з^частвуют факторы транскрипции (активатор протеина 1, у-интерферона, фактора роста тромбоцитов, интегринов и др.), модулирующие функции фибробластов и поддерживающие процессы ремоделирования лёгких. Для ОБ свойственна необратимая перестройка дыхательных путей, с формирова¬ нием пневмосклероза, эмфиземы [20]. Даже при своевременной отмене ЛС воз¬ вращения к первоначальным показателям ФВД не происходит,ОТЁК ЛЁГКИХНекардиогенный отёк лёгких проявляется ОРДС уже через несколько часов после введения препарата. Клинически некардиогенный отёк лёгю^х характеризуется нарастающей одышкой, удушьем, рентгенологически — двусторонней инфильтра¬ цией в лёгких. Вследствие быстроты лекарственной реакции размеры сердца могут сохраняться в пределах нормы, что отличает лекарственную реакцию от лёгочно¬ сердечной недостаточности вследствие декомпенсации лёгочного сердца при хрони¬ ческих заболеваниях лёгких [21].В основе патогенеза лекарственно-индуцированного отёка лёгких лежит повреж¬ дение лёгочного эндотелия с увеличением сосудистой проницаемости, с высоким риском некардиогенного отёка лёгких связано применение наркотиков (героина), наркотических анальгетиков (морфина, тримеперидина, метадона), вдыхание кока¬ ина, местное применение анестетиков (орофарингеальные аппликации лидокаина).Также отёк лёгких может развиться при приёме салицилатов, в особенности при хроническом их использовании и самостоятельном увеличении пациентами дозы для купирования мышечно-суставного синдрома. К факторам риска относят¬ ся пожилой возраст, длительный анамнез курения. Интоксикация салицилатами может сопровождаться потерей сознания, метаболическими нарушениями, лихо¬ радкой. Известно, что отёк лёгких возможен при передозировке ацетилсалицило¬ вой кислоты. Тяжесть побочных эффектов не зависит от концентрации препарата в крови [16].Среди более редких причин отёка лёгких известны диуретики [22]. В патогенезе побочных эффектов терапии диуретиками участвуют реакции гиперчувствитель¬ ности. Заболевание проявляется остро, через 20-60 мин при системном введении. Описана идиосинкразия на приём гидрохлоротиазида внутрь [23].Прогноз при отёке лёгких, вызванном диуретиками, достаточно благоприят¬ ный: заболевание купируется при отмене препарата. В то же время исход некарди¬ огенного отёка лёгких, вызванного другими препаратами, может сопровождаться тяжёлыми последствиями. Так, при лечении цитостатиками частота отёка лёгких возрастает до 20%. Введение блеомицина, циклофосфамида, изофосфамида^, метотрексата интратрахеально приводит к развитию лекарственных осложнений в течение 1 мес лечения [24]. При приёме токолитиков частота отёка лёгких неве¬ лика. Факторами риска являются:• перегрузка парентеральным введением растворов;• многоплодная беременность;• анемия, лечение стероидами с целью ускорения созревания плода и неста¬ бильная гемодинамика у матери.ЛЕКАРСТВЕННАЯ СКВПатогенез лекарственной системной красной волчанки до настоящего времени изучен недостаточно. Лёгкие при лекарственной СКВ вовлекаются в 50-75% слу¬ чаев и нередко являются ведущим в клинической картине органоммишенью [24]. Клинико-лабораторный синдром, вызванный лекарственными средствами, имеет сходство с СКВ — артралгии, миалгии, полисерозит, кожные изменения, анемия.а
760 ПРОФЕССИОНАЛЬНЫЕ И СВЯЗАННЫЕ С ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯповышение СОЭ, поражение почек. Возникает при приёме различных препаратов, в том числе днфенилгидантоина^, гидралазина, противотуберкулёзных средся» метилдопы, сердечных гликозидов, стрептомицина, сульфаниламидов, тетрацн- клинов и др.Особенностью клинической картины лекарственного поражения лёгких явля¬ ются плевральный выпот без плевральных болей, множественная инфильтрация, пневмонит [25]. В отличие от спонтанной волчанки лекарственная СКВ разви¬ вается с одинаковой частотой у женщин и мужчин. Основным отличием лекар¬ ственной СКВ является отсутствие типичных для спонтанной формы заболевания ІЕ-клеток. Поражения кожи в виде дискоидной эритемы, поражение нервной системы, почечная патология при лекарственной СКВ встречаются редко.Приблизительно у 50% пациентов, употребляющих прокаинамид, в течение2 мес могут появиться антиядерные антитела, у 10% развиваются плевральные выпоты, пневмонит [26]. Рентгенологически выявляется симптом «матового стекла», интерстициальный фиброз. Прекращение использования прокаинамида обычно сопровождается исчезновением признаков в течение нескольких недель, в то время как гидралазин-обусловленная волчанка может сохраняться в течение месяцев или лет после прекращения использования лекарственного средства. Дифференциальная диагностика между лекарственной волчанкой и СКВ пред¬ ставлена в табл.51-3.Таблица 51-3. Дифференциальная диагностика лекарственной и спонтанной СКВХарактеристикаСКВЛекарственная СКВВозраст, лет20-4050Женщины/мужчины9:11:1РасаЛюбаяНе чернокожиеТип ацетилированияБыстрые и медленныеБыстрыеАртриты, %9095Плевроперикардит, %5050Гепатомегалия, %2525Поражения кожи, %7410-20Поражение почек, %535Поражение ЦНС, %320Антинуклеарный фактор, %95Редко1Е-кпегки, %90ОтсутствуютКомплементСниженНормаИммунные комплексыПовышеныНормаПОРАЖЕНИЯ ЛЁГКИХ ПРИ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИК лёгочным проявлениям лекарственной болезни, вызванной химиотерапев¬ тическими препаратами, относятся неинфекционные, неопухолевые заболевания. Среди препаратов с высокой пневмотоксичностью известны бихлорэтилнитрозоу- рацил«^, блеомицин, бусульфан, хлорамбуцил, циклофосфамид, мелфалан, мито- мицин [27, 28].
ПОРАЖЕНИЯ ЛЁГКИХ, ВЫЗВАННЫЕ ЛЕКАРСТВАМИ 761Наиболее часто изменения в лёгких представлены широким спектром изме¬ нений и выражены, как правило, в сочетании отёка, различных форм интерсти¬ циальной пневмонии, эозинофильной пневмонии [29]. Предрасполагающими к возникновению реакций со стороны лёгких на противоопухолевую и цитостати- ческую терапию факторами являются пожилой возраст, анамнез курения, высокие дозы препаратов, сочетание химио и радиотерапии, быстрая отмена ГКС, реакции отторжения трансплантата, кислородотерапия, введение колониестимулирующего фактора и стволовых клеток. Замена противоопухолевых средств не исключает возможности новых побочных реакций со стороны органов дыхания [4].Первые признаки поражения лёгких возникают в течение 3-12 нед от начала основного лечения противоопухолевыми средствами. У больных возникает про¬ грессирующая одышка, сопровождающаяся снижением диффузионной способ¬ ности лёгких, гипоксемией, рентгенологически обнаруживаются множествен¬ ные двусторонние инфильтраты. При КТ лёгких обнаруживаются изменения в виде «матового стекла», утолщения межальвеолярных перегородок. В жидкости бронхоальвеолярного лаважа наблюдаются сдвиги за счёт увеличения фракции нейтрофилов и лимфоцитов, повышения активности интерлейкинов-6 и -8. При морфологическом исследовании ткани лёгкого определяется воспалительная реакция с преимущественным вовлечением интерстиция [30]. Представляется очевидным, что тяжесть поражения лёгких у больных лейкемией определяется не только токсическим влиянием метаболитов препаратов, но и массивным лизисом атипических клеток. Последнее усиливает повреждение капилляров лёгочного интерстиция, повышает их проницаемость, вызывая подобные острому дистресс- синдрому расстройства [22,31].Некоторые противоопухолевые препараты, в частности митомицин, являются причиной гемолитико-уремического синдрома (ГУС). Митомицин и его аналоги широко используются в лечении рака желудка и мочевого пузыря и вызывают широкий спектр пневмотоксических реакций [32]. Побочные эффекты на мито¬ мицин возникают у 5% получающих его больных в дозе 40-50 мг/м^ ГУС раз¬ вивается через 4-8 нед после начала терапии, возможен и отсроченный дебют его даже через 9 мес после окончания терапии. После достижения токсической дозы митомицина (часто в сочетании с виндезином) у больных развиваются гемолитическая анемия, тромбоцитопения, ретикулоцитоз, гемодинамические расстройства (системная гипо- или гипертензия), изменения сознания, припадки, неврологические расстройства, почечная недостаточность. В основе указанных изменений лежит микроангиопатия с явлениями тромбоцитопатии, образованием микротромбсв в сосудах лёгких и почках. Предполагают, что иммунопатологиче¬ ские процессы, индуцированные митомицином, связаны с образованием антител к гломерулярным базальным мембранам, а также антител к фосфолипидам, что в сочетании с другими системными проявлениями делает лекарственные формы этого поражения лёгких сходными синдрому ГУдпасчера или антифосфолипидно- му синдрому [33].При развитии лёгочной гипертензии значительно возрастает риск ОРДС, лёгоч¬ ного кровотечения, что становится причиной летального исхода у 95% больных с лекарственной болезнью. Таким больным необходимы методы интенсивной терапии, введение высоких доз ГКС, эфферентные методы лечения (при развитии почечной недостаточности), при необходимости — кислородотерапия. Всем боль¬ ным, получающим митомицин, даже при отсутствии указаний на лекарственную болезнь необходим тщательный контроль функций лёгких и почек с обязательным использованием КТ лёгких, ультразвуковых методов исследования лёгочной и почечной гемодинамики [34-36].До сих пор отсутствуют единые критерии, позволяющие прогнозировать пневмотоксический риск химиотерапевтических препаратов. Наиболее инфор-
■ Ш11Ш ЛГ{ ■. 762 ПРОФЕССИОНАЛЬНЫЕ и СВЯЗАННЫЕ С ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯ1^^’ .мативным считается быстрое снижение диффузионной способности лёгких ш начальных этапах химиотерапии даже при отсутствии значимых изменений ш ^рентгенограммах или КТ-изображениях лёгких. Лёгочные побочные реакции в- ■ ответ на противоопухолевые препараты обычно развиваются у больных с полива- I ,• > лентной аллергией, наследственной предрасположенностью. Нарушение функций '"Л!'.' : почек и печени также усиливает негативное влияние лекарств на органы дыха¬ния.ЛЕКАРСТВЕННО-ИНДУЦИРОВАННЫЕ ПОРАЖЕНИЯ ЛЁГКИХ ПРИ РЕВМАТОИДНОМ АРТРИТЕИзменения в лёгких у больных с системными заболеваниями соединительной ткани, получающих иммуносупрессивную терапию, определяются сочетанным эффектом как иммунопатологических реакций в рамках основного заболевания, так и ятрогении. В отличие от «старых» антиревматических препаратов, «новые*- ЛС для лечения ревматоидного артрита, к которым относятся, например, ингиби¬ торы фактора некроза опухолей, практически не вызывают побочных реакций со стороны лёгких [37].МетотрексатЕжегодно в литературе появляется до 100-200 сообщений о токсичности мето¬ трексата у больных с различными типами опухолей, лейкемией, ревматоидным артритом. Среди больных преобладают женщины (до 62%). Интерстициальный пневмонит и, как результат необратимых изменений в лёгких, лёгочный фиброз развиваются при длительном лечении метотрексатом в суммарной дозе 2.5- 1400 мг/нед. Имеются данные о возникновении ятрогенных последствий приёма метотрексата как через несколько недель, так и через 5 лет от начала терапии. Тяжесть течения не зависит от длительности приёма и недельной дозы препарата. В генезе поражения лёгких, вызванного метотрексатом, имеют значение также и связанные с естественным течением основного заболевания (ревматоидный артрит, опухоли, воспалительные заболевания кишечника) иммунопатологиче¬ ские процессы на территории аэрогематического барьера.Рентгенологические изменения, как и при других заболеваниях лёгких у боль¬ ных, получавших лечение метотрексатом, представлены типичными для интер¬ стициального пневмонита диффузными инфильтратами, усилением лёгочного рисунка, при использовании КТ визуализируется деформация сосудистого русла, периваскулярная инфильтрация. Кроме того, у 20% больных регистрируются явления эозинофильного васкулита, гранулематоз [37]. При тяжёлом течении болезни появляются интерстициальный отёк, диффузное альвеолярное повреж¬ дение, гиалиновые мембраны. Особенностью морфологических изменений в лёгком, индуцированных метотрексатом, являются диспластические изменения эпителия и, прежде всего, гиперплазия пневмоцитов 2 типа, что указывает на риск злокачественной трансформации у таких больных. В эксперименте у животных с вызванным метотрексатом лёгочным фиброзом наблюдается увеличение активно¬ сти фактора роста фибробластов при снижении экспрессии факторов, угнетающих апоптоз, что также указывает на высокий риск появления клеток со свойствами атипии.Дифференциальная диагностика интерстициального пневмонита, вызванного метотрексатом, особенно трудна у гематологических больных из-за частого при¬ соединения к интерстициальным изменениям в лёгких бронхолёгочной инфекции, что маскирует лекарственную реакцию [38], тем более метотрексат сам по себе за счёт иммуносупрессии стимулирует развитие оппортунистической флоры [39]. Важным критерием диагностики поражения лёгких, вызванного метотрексатом, является эозинофильная пневмония, в том числе по типу синдрома Лёффлера с гранулематозом, совпадающая с периодом лечения метотрексатом и возникающая
ПОРАЖЕНИЯ ЛЁГКИХ, ВЫЗВАННЫЕ ЛЕКАРСТВАМИ 763более чем у половины больных, получающих метотрексат, и спонтанно исчезаю¬ щая после отмены препарата [40].Как правило, ИЗЛ, вызванное метотрексатом, хорошо поддаётся лечению уме¬ ренными дозами преднизолона [41]. Обратная эволюция внутригрудных измене¬ ний наступает у большинства больных — в 85% без остаточных явлений в виде следового фиброза. Быстропрогрессирующий фиброз с фатальной дыхательной недостаточностью наблюдается редко [42]. Повторное применение метотрексата у большинства (60-70%) больных не только приводит к рецидиву внутригрудных изменений, но и вызывает более тяжёлые изменения, чем при его первоначальном применении [43],Соли золотаПоражение лёгких при приёме солей золота впервые описано 5ау11аи в 1948 г, и считается достаточно редким (до 1% случаев), тогда как поражение других органов описано чаще (до 20-50%). К.Н. Уш1егЬаиег (1979) описал «золотую» пневмопатию у больных ревматоидным артритом. Хотя терапевтический эффект соединений золота достигается только при стойком насыщении препаратом, для чего необходимая доза в течение длительного времени должна составлять 3000 мг, токсические реакции вследствие лечения солями золота могут возникать даже при относительно кратковременном приёме препарата.Клинически поражение лёгких при приёме препаратов золота проявляется фиброзирующим альвеолитом, чаще подострого течения с сильной одышкой, непродуктивным кашлем, лихорадкой, дерматитом [44]. Рентгенологически у больных обнаруживается инфильтрация, по форме напоминающая крылья бабоч¬ ки, у 39% больных — «летучие» инфильтраты с гиперэозинофилией, бронхооб¬ струкцией.ГКС эффективны у большинства больных [4], но могут сохраняться остаточные явления в лёгких в виде фиброза.АМИОДАРОНОВОЕ ЛЁГКОЕНакопление различных токсических соединений, образующихся в организме человека в результате метаболизма ЛС, известно у больных, принимающих амио¬ дарон.Токсические эффекты оказывает производное амиодарона — дезэтиламиодарон, обладающий свойствами положительно заряженного амфифильного соединения. Амиодарон и его метаболиты накапливаются в лёгких, печени, коже. Побочные эффекты амиодарона являются достаточно частыми и представлены тёмной окра¬ ской кожи, дисфункцией щитовидной железы, помутнением роговицы, нарушени¬ ем функции печени, угнетением костномозгового кроветворения.Так же, как и цитостатики, амиодарон прежде всего вызывает изменения с преимущественным вовлечением интерстиция лёгких (пневмонит, фиброз). Кроме того, возможны организующаяся пневмония, инфильтраты в лёгких. На сегодняшний день амиодарон по-прежнему остаётся одним из главных этиологи¬ ческих факторов тяжёлого интерстициального пневмонита и ОРДС [45]. Высокая частота ятрогенных осложнений, вызванных амиодароном, становится основной причиной отмены препарата, что затрудняет ведение кардиологических больных. В отличие от цитостатиков, при прекращении приёма амиодарона потенциально возможно полное разрешение изменений в лёгких.Морфологическим субстратом амиодаронового лёгкого является фосфолипи- доз. Гистологически обнаруживаются макрофаги, нагруженные каплями жира, в лизосомах накапливается электронно-плотный материал, состоящий из липид- амиодароновых комплексов. В патогенезе амиодарон-индуцированного пораже¬ ния лёгкого обсуждаются иммунные реакции, прямое токсическое воздействие на лёгкое, свободнорадикальные процессы [46, 47]. Как правило, лёгочная токсич¬
764 ПРОФЕССИОНАЛЬНЫЕ и СВЯЗАННЫЕ С ФАКТОРАМИ ОКРУЖАЮЩЕЙ СРЕДЫ ЗАБОЛЕВАНИЯность развивается при поддерживающей дозе препарата более 400 мг/сут. При снижении дозы до 200 мг/сут уменьшается и тяжесть лёгочных поражений.Клинически амиодароновое поражение лёгких характеризуется одышкой, непродуктивным кашлем, реже наблюдаются лихорадка, слабость, потеря массы тела, плевральные боли. Кроме патологии лёгких, обнаруживаются системные поражения: серо-голубое прокрашивание кожи, фотодерматит, гипер- и гипоти- реоидизм, поражение роговицы, диспепсия, периферическая нейропатия, экс- трапирамидные симптомы, печёночные нарушения, угнетение кроветворения, брадикардия. При рентгенологическом исследовании, компьютерной томографии в лёгких выявляется диффузная инфильтрация, в том числе асимметричная и с преобладанием в верхних долях. Показатели ФВД демонстрируют рестриктивный тип дыхательных нарушений [48].У больных, принимающих амиодарон, повышается риск развития ОРДС при проведении торакальных хирургических операций, лёгочной ангиографии. Полагают, что токсический эффект амиодарона усиливается кислородом, входя¬ щим в состав дыхательных смесей, во время хирургических вмешательств. Ведение больных, принимающих амиодарон, предусматривает регулярное исследование ФВД, проведение КТ. До настоящего времени отсутствует однозначное мне¬ ние о назначении ГКС при лекарственной болезни, вызванной амиодароном. При тяжёлом течении токсической реакции рекомендуют назначение преднизолона в дозе 40-60 мг/сут в течение 2-6 мес с постепенным снижением суточной дозы. Следует учитывать вероятность рецидива амиодароновой лёгочной токсической реакции после отмены ГКС [49],НИТРОФУРАНОВЫЕ ПОРАЖЕНИЯ ЛЁГКИХВ 1967 г. С.]. DeMasi описал острую форму лекарственной болезни лёгких у больной, получавшей лечение нитрофуранами по причине мочевой инфекции. В дальнейшем другие авторы отмечали, что осграя нитрофурановая пневмопа¬ тия более свойственна для женщин среднего и пожилого возраста (соотношение мужчинькженщины 1:3) вследствие более частого приёма этого ЛС по причине обострений урогенитальных инфекций. Токсические влияния нитрофурана на лёг¬ кие имитируют бронхолёгочную инфекцию, тяжёлую бронхиальную обструкцию, отёк лёгких и характеризуются лихорадкой с ознобом, одышкой, кашлем, миал- гиями, болями в грудной клетке, кожной сыпью [50,51],Лечение предусматривает отмену препарата, назначение ГКС в умеренных дозах до купирования симптомов заболевания.СПИСОК ЛИТЕРАТУРЫ г
Г:АЗДЕЛ XЗ/ШЕВАШЯ ПЛЕЕРЫГлава 52. Плевральный выпотГлава 53. Пневмоторакс, гемоторакс, хилоторакс и фибротораксГлава 54. Опрли плевры
Глава 52Плевральный выпотПроблема плеврального выпота интересует практических врачей и научных работников в связи с его распространённостью, большим количеством вызывающих причин, сложностью дифференциальной диагностики и необходимостью обеспечения адекватного лечения в зависимости от характера, патогенеза и особенностей течения про¬ цесса [1-3].Плевральная полость: строение и функцияПлевральная полость ограничена висцеральной плеврой, покры¬ вающей лёгкое, и париетальной плеврой, покрывающей грудную стенку и диафрагму. Между листками плевры имеется узкое про¬ странство, в норме содержащее небольшое количество жидкости, до 0,3 мл/кг. Эта жидкость имеет низкое онкотическое давление, и содержание белка в ней приблизительно 10 г/л. Жидкость и белки попадают внутрь этого пространства из системного кровотока и уда¬ ляются лимфатической системой париетальной плевры. Множество факторов влияют на эти процессы, включая гидростатическое и онкотическое давление, дыхательные движения и силу тяжести. Но основным считается степень абсорбции и оттока жидкости по пристеночной плевральной лимфатической системе. В нормальных условиях ток лимфы по ней составляет 0,1-0,15 мл/кг в час, но имеет возможность увеличиваться до 30 мл/ч (около 700 мл/сут) у человека среднего размера. Когда продукция жидкости превосходит указанные возможности плевры по реабсорбции, происходит её накопление.Плевральное давление ниже атмосферного, что способствует раз¬ дуванию лёгкого. Из-за проницаемости мезотелия избыток жидко¬ сти может двигаться в эту область низкого давления и накапливать¬ ся в виде плеврального выпота. Последний может иметь различную этиологию и сформироваться в результате поражения как самих плевральных мембран, так и заболеваний органов грудной клетки или брюшной полости.Толщина субмезотелиального интерстиция как париетального, так и висцерального листков плевры составляет приблизительно 20 мкм. Однако толщина самих листков плевры значительно различается. Париетальный листок плевры в 5 раз толще, чем висцеральный. Кроме того, он содержит лимфатические стоматы (поры, люки). К особенностям париетальной диафрагмальной плевры относятся
768 ЗАБОЛЕВАНИЯ ПЛЕВРЫтрансдиафрагмальные лимфатические связи, которые обеспечивают ток жидкости от брюшины к плевре, в среднем ширина плеврального пространства 18-20 мкм. Вероятно, первичная функция плевральных мембран — способствовать свободному движению лёгкого по отношению к грудной стенке. Если лёгкое подпаяно прямо к грудной стенке, его расправление и сдувание будет несколько ограниченно. Тем не менее, по данным клинических и экспериментальных исследований, облитерация полости плевры не приводит к выраженным нарушениям функции лёгкого [4]. Обычно наблюдается уменьшение объёма лёгкого на поражённой стороне, но может быть выявлено снижение объёма противоположного лёгкого [5]. Если облитера¬ ция полости плевры сочетается с утолщением плевры, изменения функции лёгкого обусловлены больше фибротораксом, чем облитерацией плевральной полости. Висцеральная плевра создаёт механическую поддержку лёгкому, способствуя под¬ держанию его формы, сдуванию лёгкого, а также ограничивая его раздувание [6, 7]. Недавно выявлена ещё одна функция плевральной полости: это путь, по кото¬ рому отёчная жидкость может покинуть лёгкое [8]. Так, причиной транссудата при застойной сердечной недостаточности является выход отёчной жидкости из лёгкого в пространство, где её влияние на функцию лёгкого относительно мало [9].Существует пять плевро-пульмональных образований, которые рассматривают с позиций их анатомической организации: париетальная система микроциркуляции, париетальное интерстициальное пространство, плевральная полость, лёгочный интерстиций, микроциркуляторное ложе висцеральной плевры.Плевральные мембраны покрыты одним слоем мезотелиальных клеток. В зависимости от степени растяжения подлежащей субмезотелиальной ткани эти клетки могут быть различной формы от кубической до плоской. Мезотелиальные клетки секретируют: макромолекулярные компоненты внеклеточного матрикса и организуют его в зрелый матрикс; частицы фагоцитоза; фибринолитические и прокоа- гулянтные факторы; факторы хемотаксиса нейтрофилов и моноцитов, что может быть важно для мобилизации воспалительных клеток в плевральную полость [10-12]. Мезотелиальные клетки продуцируют также цитокины, такие, как трансформирую¬ щий ростовой фактор-р, эпидермальный ростовой фактор-р, тромбоцитарный росто¬ вой фактор, играющие важную роль в плевральном воспалении и фиброзе [13].Мезотелиальные клетки относятся к числу клеток, которые вовлекаются в воспалительный процесс, особенно если он переходит на поверхность плевры. Миграция нейтрофилов в плевральную полость осуществляется под действи¬ ем некоторых химокинов, к которым, в частности, относится интерлейкин-8. Высокая концентрация последнего наблюдается у больных с эмпиемой плевры. Местом синтеза этого цитокина являются вовлечённые в воспалительный процесс мезотелиальные клетки и их ворсинки. Его рассматривают как биомаркёр в диф¬ ференциальной диагностике воспалительных и канцерогенных процессов [14].Мезотелиальные клетки лежат на тонкой базальной мембране над соединитель¬ ной тканью, содержащей в основном коллаген и эластин. В отличие от паренхи¬ мы лёгкого, содержащей эластин, в висцеральной плевре больше коллагена, что определяет механическую роль плевры. В соединительнотканном слое под висце¬ ральной плеврой также проходят кровеносные и лимфатические сосуды, и далее он сливается с соединительной тканью лёгкого [15].Париетальная плевра получает артериальный приток из межрёберных арте¬ рий и дренируется в межрёберные вены. Кровоснабжение висцеральной плевры происходит из бронхиальных артерий, а дренирование — в лёгочные вены. От висцеральной плевры отток осуществляется в венозную систему с более низким давлением. Висцеральная плевра имеет широкую лимфатическую сеть, но она не соединяется с плевральной полостью [15].Лимфатическая система обеспечивает дренаж экстраплеврального париетального интерстиция и плевральной полости, в которую открыты лимфатические стоматы
ПЛЕВРАЛЬНЫЙ ВЫПОТ769диаметром 1-40 мкм, связанные напрямую с пристеночными париетальными лим¬ фатическими сосудами и сформированные прерыванием мезотелиального слоя там, где мезотелий прилежит и соединяется с подлежащим лимфатическим эндотелием [16,17]. Они являются основной системой для вь[ведения плевральной жидкости.в старой модели давление жидкости в плевральной полости рассматривалось как результирующая величина силы, направленной на инспирацию, и эластиче¬ ской силы лёгких, направленной на экспирацию, а также капиллярного и онкоти¬ ческого давлений в мембранах висцерального и париетального листков плевры и онкотического давления самой плевральной жидкости. В этой модели предполага¬ лось. что фактор давления обеспечивает движение жидкости в плевральной поло¬ сти от париетального к висцеральному листку, а затем в лёгочный интерстиций.Позже было установлено, что у человека капиллярное давление в висцеральной плевре достаточно высоко, так как кровоснабжение осуществляется из системного кровотока. Starling и Tubby интерпретировали образование плевральной жидко¬ сти с растворёнными в ней химическими соединениями как итог взаимодействия между гидростатическим и коллоидно-осмотическим давлениями. Это положение сохраняет свою силу и в настоящее время, особенно касается обмена воды, которая проникает через биологические мембраны значительно проще, чем растворённые химические соединения, а также белки плазмы крови. Современная модель транс¬ капиллярного движения жидкости достаточно проста. Жидкость фильтруется в конечной части артериол, переходящих в капиллярную сеть. Её реабсорбция осуществляется в начальной части венул. В последние 15-20 лет был достигнут консенсус, что в норме плевральная жидкость формируется в результате перетока жидкой составляющей крови из системных плевральных сосудов обоих плевраль¬ ных листков через проницаемые плевральные мембраны в плевральную полость и выводится оттуда по лимфатической системе париетальной плевры [14, 18]. Процесс образования фильтрата происходит в апикальных отделах париеталь¬ ной плевры. Омывая плевральную полость, жидкость достигает диафрагмальной и медиастинальной частей париетальной плевры, т.е. мест, где производится её реабсорбция через стомы. В физиологических условиях висцеральная плевра в фильтрации плевральной жидкости не участвует (рис. 52-1).В указанном процессе движения жидкости необходимы два физиологических условия:париетартьная плевра ^ системныйкапилляр.висцеральная шгевралимфатический кшщкустьелимфатического^ каггилляраО /б.тлькая jf микроворскнки мембраналегочныйиитерстицкйлёго'гяый ' лямфагическин 1>л капиллярРис. 52-1. Современная модель движения жидкости в плевральной полости.
770 ЗАБОЛЕВАНИЯ ПЛЕВРЫ;. ^ 1) небольшой объём жидкости, которая фильтруется и поступает в плевральную! 'Щ полость;Д ' -'" 2 2) субатмосферное давление (необходимое для выполнения дренажной функ-^ ции лимфатической системы париетальной плевры),Г . Биофизический процесс генерации субатмосферного давления достигается заЬ “ ‘ счёт функционирования лимфатической системы и играет одну из ключевых ролей ? - ^' во всём процессе обмена плевральной жидкости.1' ; Внутриплевральное давление изменяется приблизительно на 0,5 см вод.ст. на1 см высоты [19]. Такой вертикальный градиент давления подразумевает, что плевральная жидкость не образует статический столб, но медленно течёт от вер¬ шины к основанию плеврального пространства. Плевральное давление у человека приблизительно 5 см вод.ст. в середине грудной клетки при функциональном оста¬ точном объёме, и 30 см вод.ст. при полном лёгочном объёме. Если лёгкое менее эластично, при этих объёмах данные давления будут ниже.Давление в плевральной полости субатмосферное. Хотя давление в плевраль¬ ной полости ниже атмосферного, газы в ней не накапливаются [14,20].Патофизиология плеврального выпотаДля накопления плеврального выпота необходимо увеличение проникновения жидкости в плевральную полость или уменьшение её выведения оттуда более чем в 30 раз. При поиске причины выпота в первую очередь обращают внимание на про¬ цессы. приводящие к увеличению поступления жидкости в плевральную полость. Тем не менее при ряде заболеваний основной причиной накопления жидкости является именно нарушение её оттока. Выход жидкости из плевральной полости может быть снижен из-за обструкции стома, подавления пропульсивной способно¬ сти лимфатических сосудов, инфильтрации лимфатических узлов, дренирующих плевральную полость, или увеличения системного венозного давления. Снижение лимфооттока было подтверждено у больных туберкулёзом и выпотом на фоне злокачественных опухолей [20].Выпот классифицируется как экссудат и транссудат. Такое подразделение помо¬ гает в установлении причины выпота. Транссудат формируется при пропотевании жидкости через интактный барьер (непоражённые плевральные мембраны) вслед¬ ствие увеличения гидростатического давления или снижения осмотического дав¬ ления. Экс^^дат накапливается при поступлении жидкости и белка через повреж¬ дённый барьер с повышенной проницаемостью.Появление транссудата в плевральной полости ассоциируется с дисфункцией левого желудочка и развитием клинических признаков застойной сердечной недо¬ статочности. Возникновение этого клинического феномена связывают с повыше¬ нием давления в лёгочных капиллярах и большим объёмом крови в лёгких, что приводит к пропотеванию транссудата через поверхность висцеральной плевры в плевральную полость. Удаление транссудата из плевральной полости посредством торакоцентеза снижает объём циркулирующей жидкости (крови) и давление в лёгочных капиллярах, поэтому в современные лечебные рекомендации эта мани¬ пуляция включена в качестве обязательной процедуры при ведении больных с застойной сердечной недостаточностью.Частыми симптомами у больных с выпотом являются боль в грудной клетке, кашель и диспноэ. Боль в грудной клетке возникает из-за воспаления париеталь¬ ной плевры. Кашель возникает из-за сдавления лёгкого. По этой же причине кашель появляется при коллапсе лёгкого в результате пневмоторакса. Диспноэ, вероятнее всего, является результатом механической неэффективности дыха¬ тельных мышц, которые растянуты из-за смещения при выпоте грудной стенки наружу, а диафрагмы вниз. После удаления большого количества выпота диспноэ быстро проходит, хотя уменьшение объёма плевральной жидкости ассоцииро-
ПЛЕВРАЛЬНЫЙ ВЫПОТ771вано лишь с небольшим увеличением лёгочного объёма. Это связано с возмож¬ ностью после торакоцентеза создать более отрицательное плевральное давление при дыхательной экскурсии благодаря улучшению механической работы дыха¬ тельных мышц [20].Ведение больных с плевральным выпотомВозможность плеврального выпота должна предполагаться всегда при обсле¬ довании больного, имеющего изменения на рентгенограмме грудной клетки. Повышенная «плотность» при рентгенологическом исследовании часто прини¬ мается за паренхиматозный инфильтрат, хотя это может быть признаком нали¬ чия плевральной жидкости. При вертикальном положении больного свободная жидкость под действием силы тяжести перемещается в плевральной полости в задний рёберно-диафрагмальный синус. Если задний рёберно-диафрагмальный синус затемнён или задняя часть диафрагмы не визуализируется на боковой рентгенограмме, для диагностики плевральной жидкости необходимо с обеих сторон провести рентгенографию в латеропозиции или провести ультразвуковое исследование. Если расстояние между грудной стенкой и лёгким менее 10 мм, плевральный выпот не является клинически значимым, и в этом случае будет трудно получить жидкость с помощью торакоцентеза. Если расстояние превы¬ шает 10 мм, необходимы исследования для установления причины плеврального выпота [20].Дифференциальная диагностика плеврального выпотаПеред клиницистами часто встаёт вопрос о дифференциальной диагностике характера выпота в плевральную полость. Множество заболеваний могут сопро¬ вождаться плевральным выпотом (табл. 52-1). В первую очередь необходимо отдифференцировать экссудат от транссудата [20, 21]. По оценке некоторых авторов, частота диагноза плеврита неустановленной этиологии порой достигает 20% [20].Таблица 52-1. Характер плеврального выпота при различных заболеванияхЭкссудатТранссудатЗаболеванияВнешние воздей¬ ствияЗастойная сердечнаяЗлокачественные новообразования:Плевральныйнедостаточность.метастазы;выпот, индуци¬Заболевания перикарда.первичные злокачественные опухоли плевры.рованный лекар¬Цирроз печени.Инфекционные заболевания;ственными препа¬Нефротический синдром.пиогенные бактериальные инфекции;ратами.Перитонеальный диализ.туберкулёз;Лучевая терапия.Уриноторакс.актиномикоз и нокардаюз;ЭлекфическиеМикседема.грибковые инфекции;ожоги.Операция Фонтана.вирусные инфекции;ЯтрогенныеПосправматическаяпаразитарные инфекции.повреждения.цереброваскулярнаяТЭЛА.Прочие травмыболезнь.Желудочно-кишечные заболевания:Гипоальбуминемия.перфорация пищевода;ТЭЛА.заболевания поджелудочной железы;Обструкция верхней полойабсцессы брюшной полости;вены.диафрагмальные грыжи;Пересадка костного мозга.состояние после абдоминальных операций.Ятрогенные причиныСЗСТ:гшеврит при ревматоидном артрите;.Й'
ш■ 'ШЩ:-■■Л'-К^о:^;"'- й|ІІ772ЗАБОЛЕВАНИЯ ПЛЕВРЫОкончание табл. 52-1СК8;волчанка, индуцированная лекарственными препаратами;иммунобластная лимфаденопатия;синдром Шегрена;синдром Черджа-Стросс;гранулематоз Вегенера.Синдром после повреждения сердца (Дресслера), Синдром после аортокоронарного шунтирования. Асбестоз.Саркоидоз.Уремия.Синдром Мейгса.Синдром гиперстимуляции яичников.Синдром жёлтых ногтей.Фиксированное лёгкое.Гемоторакс.ХилотораксДИАГНОСТИЧЕСКИЙ ТОРАКОЦЕНТЕЗДиагностический торакоцентез должен быть выполнен практически у каждого больного, если при рентгенологическом исследовании, проведённом при поло¬ жении пациента лёжа на боку, толщина свободной жидкости превышает 10 мм. У больного с явной сердечной недостаточностью следует провести её лечение и временно отложить процедуру. Однако, если у такого больного наблюдается фебрильная гипертермия, и/или имеется боль в грудной клетке, и/или выпот с одной стороны значительно больше, чем с другой, то торакоцентез должен быть выполнен без промедления. Даже при наличии коагулопатии, тромбоцитопении, механической вентиляции с положительным давлением торакоцентез может быть без особого риска выполнен тонкой иглой.Необходимо избегать введения иглы медиальнее срединно-ключичной линии. Лучших результатов можно достичь при определении точки пункции под рентгено¬ логическим и УЗИ-контролем, особенно если выпот отграничен. Предпочтительное положение больного — сидя, слегка наклонившись, опершись на столик перед собой. Ещё лучше положить между больным и столиком 1-2 подушки. Для инфильтрации тканей грудной стенки, включая париетальную плевру, использует¬ ся длинная тонкая игла. Вкол в кожу производится ниже межреберья для создания непрямого канала и исключения связи плевральной полости с внешней средой после извлечения иглы.После проникновения в плевральную полость пробно аспирируется немного плевральной жидкости для контроля. После уверенности в достижении иглой экс¬ судата тонкая игла удаляется и на её место аналогичным образом вводится более толстая для проведения аспирации. Не рекомендуется удалять за один раз более1 л жидкости (даже при отсутствии эмпиемы и фибринозных наложений) из-за риска развития отёка лёгкого на фоне его расправления [13]. Осложнения торако¬ центеза — пневмоторакс (4-5%) и гемоторакс (1%). Риск выше у больных после лучевой терапии и предшествующих множественных торакоцентезов.ИССЛЕДОВАНИЯ ПЛЕВРАЛЬНОГО ВЫПОТАВыпот исследуют на лактатдегидрогеназу (ЛДГ) и белок, лейкоциты и лейко¬ цитарную формулу, цитологию и, при подозрении на экссудат, на амилазу, сахар, микрофлору и т.д. [20]. Плевральный выпот может бьггь разделён на экссудат и транссудат в зависимости от концентрации белка, ЛДГ и клеточных компонентов.Общепринятыми считаются критерии Лайта [22]:1) отношение белка в плевральном выпоте к белку в плазме более 0,5;
ПЛЕВРАЛЬНЫЙ ВЫПОТ7732) отношение ЛДГ в выпоте к ЛДГ в плазме более 0,6:3) ЛДГ в выпоте более чем 2/3 от верхней границы нормы ЛДГ в крови.При использовании классических критериев Лайта транссудат может быть ошибочно принят за экссудат, как максимум, у 25% больных. У больных с кли¬ ническими признаками транссудата, но показателями жидкости, относящими её к экссудату, показано определение разницы между белком сыворотки и плевраль¬ ной жидкости. Если эта разница превышает 31 г/л, у больного наиболее вероятен транссудат [23]. Другие показатели, такие, как концентрация холестерина в выпоте и отношение концентрации билирубина в выпоте к билирубину крови, не подтвер¬ дили своего преимущества над критериями Лайта. При подозрении на пневмонию, злокачественную опухоль, ТЭЛА показано определение ЛДГ, белка, глюкозы, лейкоцитов и лейкоцитарной формулы, pH, а также цитологии, микробиологии выпота.Плевральная жидкость в норме имеет следующие параметры: общий объём0,1-0,2 мл/кг; количество клеток в 1 мл — 1000-5000, мезотелиальных клеток —3-70%, моноцитов — 30-75%, лимфоцитов — 2-30%, гранулоцитов — 10%; белок - 10-20 г/л, альбумин — 50-70%; уровень глюкозы соответствует тако¬ вому в плазме, ЛДГ менее 50% от уровня в плазме; pH не ниже уровня в плазме. Исследование плеврального выпота имеет большое значение для определения его характера и генеза [20, 21, 22], По показателям клинико-лабораторного, био¬ химического, цитологического исследований возможно получение ответа о генезе процесса (табл, 52-2).Таблица 52-2. Вероятные причины изменения плевральной жидкостиПоказателиЗначенияНаиболее вероятные причиныСоотношение гематокрита в выпо¬>50%Гемотораксте к крови1-50%Злокачественная опухоль, ТЭЛА, травмаЭритроциты>100 ООО/мм^Злокачественная опухоль, травма, ТЭЛАЛейкоциты>10 ООО/мм’Эмпиема, парапневмонический экссудат, панкреатит, ТЭЛА, СЗСТ, редко — злокаче¬ ственная опухоль, туберкулёз< 1000/мм^ТранссудатНейтрофилы>50%Острый плевритЛимфоциты>90%Туберкулёз, злокачественная опухольЭозинофилы>10%Асбестоз, пневмоторакс, разрешающаяся инфекцияМезотелиальные клеткиОтсутствуютТуберкулёзИмеют признаки злокаче¬ ственностиМезотелиомаСоотношение концентрации в выпоте к концентрации в плазмеБелок>0,5Критерий экссудатаЛДГ>0,6Критерий экссудатаЛДГ в выпоте>200 MEКритерий экссудата
774 ЗАБОЛЕВАНИЯ ПЛЕ8РЫОкотан)ле табл. 32-2ЛДГ 8 выпоте к верхней границе нормы в крови>2/3Критерий экссудатаГлюкоза е выпоте<3,33 ммоль/лПарапневмонический экссудат, туберкулёз, реематощный артрит, гемоторакс, параго- нимоз, синдром Черджа-Стросс>4,44 ммоль/лСистемная красная волчанкаБелок в выпота>50 г/лТуберкулёз<5 г/лУриноторакс, перитонеальный диализpH в выпоте<7,20Осложнённый парапневмонический выпот (эмпиема), повреждение пищевода, тубер¬ кулёз, злокачественное новообразоваиие, ревматоидный артрит, гемоторакс, систем¬ ный ацидоз, парагонимоз, СКВ, уриното¬ раксАмилаза в выпоте по отношению к>1Панкреатитконцбнтрэции в плэзмвБолее верхней фаницы нормы концентрации в плазмеПовреждение пищевода, болезни поджелу¬ дочной железы, злокачественные опухолиу некоторых больных, учитывая предполагаемую причину, целесообразно определять уровень антиядерных антител, ревматоидного фактора, аденозиндеза- миназы, липидов и т.д.Внешний вид жидкости. Зловонный запах свидетельствует о бактериальной инфекции, возможно, анаэробного характера, запах мочи — об уринотораксе. Супернатант плевральной жидкости исследуют на липиды, если он мутный, молочного цвета или кровянистый, осадок — на кристаллы холестерина.Цитология выпота. Первое же исследование плеврального выпота выявляет опухолевые клетки у 60% больных со злокачественными опухолями. При анализе трёх отдельных образцов выявление опухолевых клеток достигает 90%. Результат зависит от вида опухоли, например, при лимфогранулематозе он положителен лишь у 25%, при аденокарциноме — у большинства больных.Среди других диагностических тестов на злокачественную опухоль следует отметить [20]:• флюоресцентную in situ гибридизацию с хромосомо-специфическими пробами;• определение потери гетерозиготности;• сравнительную геномную гибридизацию;• определение опухолевых маркёров;• иммуногистохимические и другие исследования.Наиболее часто для дифференцировки аденокарциномы от мезотелиомы при¬ меняют следующие маркёры:• эпителиальные - В72/3, Вег-ЕР4, Leu-Ml;• мезотелиомные — калретинин, мезотелин, цитокератин 5/6.Бактериологические исследования. Культуральные исследования нааэробные и анаэробные бактерии, микобактерии, грибки. Окраска по Грамму. Бактериоскопия. Определение бактериальных антигенов путём иммуноэлектро¬ фореза, латекс-агглютинации, или бактериальной ДНК с помощью ПЦР.Другие диагностические тесты плевральной жидкости. Тесты на СЗСТ: антиядерные антитела для СКВ; ревматоидный фактор для ревматоидного артрита. Аденозиндезаминаза повышена при туберкулёзе, сохраняет своё диагностическое
ПЛЕВРАЛЬНЫЙ ВЫПОТ 775значение при инфекции вирусом иммунодефицита человека. Может быть повыше¬ на при эмпиеме, лимфомах, лейкозах. Интерферон-у повышен при туберкулёзе.Молекулярные методы для диагностики т^еркулёза: ПЦР; исследования нукле¬ иновых кислот для идентификации организма в культуре и т.д,ПРИМЕНЯЕМЫЕ МЕТОДЫ ВИЗУАЛИЗАЦИИРентгенологические исследоваиия. При вертикальном положении больного жидкость накапливается в первую очередь между задней поверхностью нижней доли и диафрагмой (рис. 52-2). Если объём жидкости менее 75 мл, она не будет видна даже в синусе. Присутствие клинически значимого количества жидко¬ сти в плевральной полости может быть исключено, если оба задних рёберно¬ диафрагмальных угла свободны. Возможно выявление отграничения плеврита на одной из зон плевры (рис. 52-3).При подозрении на наличие жидкости в плевральной полости необходимо провести рентгенографию в латеропозиции или УЗИ. Такое рентгенологическое исследование позволяет выявить минимальное количество жидкости в плевраль¬ ной полости в объёме 5 мл [20, 24]. При отграниченном плевральном выпоте показаны УЗИ и КТ,УЗИ особенно показано при отграниченном плевральном выпоте.КТ в настоящее время считается лучшим методом для визуализации плев¬ рального пространства и дифференциальной диагностики лёгочной патологии от плевральной, в том числе абсцесса лёгкого от эмпиемы плевры (рис. 52-4). При распространённом заболевании плевры КТ позволит дифференцировать добро¬ качественную патологию от злокачественной. Возможна биопсия под контролем КТ.МРТ в настоящее время менее удовлетворяет потребности в диагностике плев¬ ральной жидкости, чем УЗИ и КТ,ПЭТ помогает дифференцировать злокачественные поражения от доброкаче¬ ственных, определить стадию злокачественной опухоли и диагностировать реци¬ дивы.Рис. 52-2. Левосторонний экссудативный плеврит (прямая рентгенофвмма органов фудной полости).
776ЗАБОЛЕВАНИЯ ПЛЕВРЫРис. 52-3. Правосторонний медиастинальный плеврит {прямая рентгенограмма органов грудной полости).Другие методы визуализации. ПриТЭЛА — допплеровское УЗИ сосудов ног, вентиляционно-перфузионное сканирова¬ ние. Спиральная КТ высокочувствительна и специфична для эмболов в проксималь¬ ных сегментарных лёгочных артериях. Если результаты всех методов сомнительны, показана лёгочная ангиография.ИНВАЗИВНЫЕ ИССЛЕДОВАНИЯ У БОЛЬНЫХ С НЕУСТАНОВЛЕННЫМ ДИАГНОЗОМ ПРИ НАЛИЧИИ ЭКССУДАТИВНОГО ПЛЕВРАЛЬНОГО ВЫПОТАИх несколько: пункционная биопсия плевры с помощью иглы, бронхоскопия, торакоскопия, открытая биопсия плевры.Есть три причины, побуждающие к инва¬ зивным исследованиям: 1) увеличение сим¬ птоматики и ухудшение клинического течения заболевания: 2) повышение уровня ЛДГ в выпоте с течением времени; 3) тревожность больного, желание узнать о своём заболевании.Пункциониая биопсия плевры с помощью иглы. Обычно используют иглы Соре и Abrams. Пункционную биопсию плевры назначают при подозрении на туберкулёз и злокачественную опухоль. При злокачественных опухолях при¬ меняют в случае отрицательного результата цитологии выпота. При туберкулёзе позволяет выявить гранулёмы у 50-80% больных, кроме того, даёт возможность получить микобактерии и оценить их чувствительность к препаратам.При подозрении на злокачественную опухоль показана торакоскопия с био¬ псией.Рис. 52-4. Левосторонний экссудативный плеврит (КТ).
ПЛЕВРАЛЬНЫЙ ВЫПОТБронхоскопия. При наличии у больного с выпотом также паренхиматозного поражения или кровохарканья бронхоскопия помогает установить диагноз у 75% больных. Если паренхиматозного поражения или кровохарканья нет, то процент снижается до 10 и менее. Поэтому при наличии кровохарканья необходима брон¬ хоскопия после КТ для выявления паренхиматозной патологии [20].Торакоскопия и торакоскопическая биопсия под видеоконтролем приме¬ няются при неясности диагноза после пункционной биопсии. Однако у больных со злокачественными опухолями эти методы исследования можно применять вместо пункционной биопсии в связи с большей диагностической ценностью и возможно¬ стью проведения плевродеза.Открытая биопсия плевры. Основное показание — недиагностированное прогрессирующее заболевание плевры при отсутствии результата после торакоско¬ пии или невозможности биопсии с помощью торакоскопии.ТРАНССУДАТИВНЫЙ ПЛЕВРАЛЬНЫЙ ВЫПОТВ большинстве случаев первично поражены не плевра или лёгкие, а другие орга¬ ны, в первую очередь сердце, печень и почки.Застойная сердечная недостаточностьЯвляется наиболее частой причиной транссудативного плеврального выпота.ПатофизиологияВыход лёгочной интерстициальной жидкости в плевральную полость через проницаемый мезотелий подтверждается высокой частотой выпота у больных с рентгенологически установленным отёком лёгкого, а также большей корреляцией наличия выпота с лёгочным венозным давлением, чем с системным венозным или лёгочным артериальным давлением [25].Клиническая симптоматикаОсновные симптомы застойной сердечной недостаточности: диспноэ при нагрузке, ортопноэ, никтурия, периферические отёки, растяжение вен шеи, хрипы и расщепление сердечного тона: наличие кардиомегалии при рентгенографии грудной клетки. Симптомы дыхательной недостаточности будут превалировать при большом количестве выпота и выраженном отёке лёгких.Плевральный выпот имеет тенденцию быть двусторонним с большим количе¬ ством жидкости справа.Диагностика и лечениеОбычно подозрение возникает уже по клинической картине. Торакоцентез показан, если; выпот односторонний или на одной стороне несравнимо больше, чем на другой; у пациента фебрильная температура; боль в грудной клетке; отсут¬ ствует кардиомегалия. При отсутствии данных критериев у больного необходимо лечить застойную сердечную недостаточность, а диагностический торакоцентез показан только в случае отсутствия разрешения вьшота.При приёме диуретиков биохимические свойства выпота могут измениться так, что он может походить на экссудат по уровню ЛДГ и белка.Лечение проводится с помощью препаратов, снижающих нагрузку на сердце, диуретиков и, по показаниям, инотропов. При выраженном диспноэ необходим лечебный торакоцентез.Изредка, несмотря на лечение, у больного постоянно накапливается жидкость в большом объёме. При наличии диспноэ и эффективности его купирования тора- коцентезом у таких больных возможно применение плевродеза доксициклином или тальком [20].Заболевания перикардаНесмотря на высокую частоту возникновения плеврального выпота при заболе¬ ваниях перикарда, механизм его возникновения до конца не ясен. При констрик-
778 ЗАБОЛЕВАНИЯ ПЛЕВРЫтивном перикардите объяснением может быть повышение лёгочного и системного § капиллярного давления. При воспалительном заболевании перикарда выпот в ' « основном левосторонний, а возможной его причиной является переход воспале¬ ния с перикарда на прилежащую плевру.Гидроторакс при циррозе печениУ 5-6% больных с циррозом печени развивается плевральный выпот [21, 26]. Такая вероятность больше при асците, хотя у некоторых больных с выпотом асци¬ та может не быть.ПатофизиологияОсновной механизм — движение асцитической жидкости из брюшной полости через поры в диафрагме в плевральную полость [13, 26,27]. Второй фактор — сни¬ жение онкотического давления плазмы.Клиническая симптоматикаОбычно доминируют симптомы цирроза и асцита. При большом количестве жидкости в плевральной полости возникает диспноэ. Обычно выпот справа (у 2/3 больных), но у 1/6 — слева и у 1/6 — двусторонний [21].Диагностика и лечениеВедущими методами являются рентгенологические исследования плевральной полости, диагностика основного заболевания. При наличии сомнений, проводят сканирование грудной клетки после введения в брюшную полость ^’""Тс меченного коллоида. Для получения доказательств, что обе жидкости являются транссуда¬ том, необходимы лапароцентез и торакоцентез.Первичное лечение цирроза с асцитом и плевральным выпотом должно быть направлено на лечение асцита. Показаны низкосолевая диета и диуретики. Декомпрессия портального кровообращения с помощью оперативного трансюгу- лярного внутрипечёночного портосистемного шунтирования может быть показа¬ на для лечения основного заболевания. При отсутствии эффекта методом выбора является трансплантация печени. Дренирования плевральной полости следует избегать в связи с большими потерями жидкости и белка из-за перетока асцити¬ ческой жидкости в плевральную полость и вытекания её по дренажу наружу. Если имплантация шунта и трансплантация печени неосуществимы, то лучшей альтер¬ нативой может быть торакоскопическая операция под видеоконтролем с закры¬ тием диафрагмальных дефектов и плевродезом. У ряда больных возможно еще проведение перитонеальновенозного шунтирования, хотя его результаты часто остаются неудовлетворительными [21].Нефротический синдромПлевральный выпот часто выявляется у таких больных. Механизм возникнове¬ ния — снижение онкотического давления плазмы и повышение гидростатического давления (на фоне солевой задержки и гиперволемии). Обычно выпот двусторон¬ ний и часто инфрапульмональный. Диагностический торакоцентез должен быть выполнен у всех больных с нефротическим синдромом и плевральным выпотом, чтобы доказать, что жидкость является транссудатом. В связи с высоким риском венозных тромбозов у данной категории больных [28] необходимо исключить ТЭЛА, и если плевральный выпот имеет признаки экссудата, показано проведение сцинтиграфии лёгких и спиральной КТ,Лечение направлено на повышение белка в плазме путём снижения его потерь с мочой. Если это неэффективно, то для больных с выраженной симптоматикой из-за плеврального выпота следует рассмотреть вопрос о проведении плевродеза.Перитонеальный диализИногда осложняется гидротораксом. Это результат движения диализата из брюшной полости в плевральную. В 90% случаев выпот правосторонний. Уровень
ПЛЕВРАЛЬНЫЙ выпот 779глюкозы в выпоте промежуточный между диализатом и плазмой, белок менее 3 10 г/л, низкая ЛДГ. Хотя сообщение между брюшной и плевральной полостями § ,'' у некоторых больных закрывается спонтанно, при необходимости продолже- ■ ^ : ния перитонеального диализа показано хирургическое лечение. Методом выбо- >ра является торакоскопия с закрытием дефектов в диафрагме и плевродезом. Альтернативой могут быть просто гшевродез или торакотомия с ушиванием диа¬ фрагмальных дефектов [29, 30].Обструкция иочевыводящих путей (уриноторакс)обструкция мочевыводящих путей, приводящая к забрюшинному накоплению мочи (уринома), может привести к плевральному выпоту. Выпот представляет собой мочу (уриноторакс) и пахнет, как моча. Диагноз ставится на основании одновременного измерения уровня креатинина в крови и выпоте. Только больные с обструкцией мочевыводящих путей могут иметь креатинин в выпоте выше, чем в крови [31], Когда обструкция мочевыводящих путей купирована, выпот быстро исчезает.МикседемаПри наличии изолированного плеврального вьшота у больных микседемой жидкость имеет пограничный характер между экссудатом и транссудатом. Лечение направлено на основное заболевание: проводится заместительная терапия тирео- идными гормонами.ЭКССУДАТИВНЫЙ ПЛЕВРАЛЬНЫЙ ВЫПОТЭто результат воспаления, повреждения или злокачественного новообразования плевры, лёгких или более отдалённых органов (средостения, брюшной полости).Парапневмонический выпот и эмпиемаПарапневмоническим выпотом называется любой плевральный выпот, ассо¬ циированный с бактериальной пневмонией, абсцессом лёгкого или бронхоэкта¬ зами [32-35]. Среди больных, госпитализированных по поводу бактериальной пневмонии, 20-40% имеют плевральный выпот. Термином «осложнённые парап- невмонические выпоты» определяют выпоты, которые требуют дренирования плевральной полости для их разрешения. Эмпиема означает наличие гноя в плев¬ ральной полости. Около 60% эмпием являются осложнением парапневмонических выпотов, 20% происходят после хирургических вмешательств на органах грудной полости, и оставшиеся 20% являются осложнениями различных состояний (травм, перфорации пищевода, торакоцентеза, поддиафрагмальной инфекции) [36-38]. ПатофизиологияВыделяют три стадии в развитии парапневмонического плеврального вьшота:1. Экссудативная — паренхиматозная инфекция в лёгком ведёт к увеличению лёгочной интерстициальной жидкости, часть которой выходит в плевраль¬ ную полость и там накапливается. Это стерильный экссудат с полиморфно¬ ядерными лейкоцитами, нормальным уровнем глюкозы и pH. Назначение антибиотиков приводит к купированию процесса в лёгком и исчезновению плевральной жидкости.2. Фибринозно-гнойная — характеризуется инфицированием вьшота. Жидкости становится больше. В ней много полиморфно-ядерных лейкоцитов, бактерий и клеточного детрита. Фибрин покрывает вовлечённую в процесс часть парие¬ тальной и висцеральной плевры. Снижается уровень pH и глюкозы, растёт ЛДГ в выпоте. Необходимо удаление жидкости и дренирование.3. Стадия организации — фибробласты растут в экссудат из обоих листков плев¬ ры с образованием неэластичной спайки, которая препятствует расправлению лёгкого после удаления плевральной жидкости. Лечение, как правило, вклю-
780 ЗАБОЛЕВАНИЯ ПЛЕВРЫчает декортикацию, так как практически невозможно преодолеть инфекцию при наличии остаточной полости после удаления жидкости, хотя указанная неэластичная спайка может спонтанно рассосаться в течение последующих3-6 мес при ликвидации активного воспалительного процесса.Классификация паралневмонического выпотаКлассификация American College of Chest Physicians (2000) [39].1. Выпот 1-й категории: малый (менее 10 мм на рентгенограмме, КТ или УЗИ), свободный. Торакоцентез не показан, поэтому бактериология и биохимия жидкости неизвестны. Риск плохого прогноза очень низкий,2. Выпот 2-й категории: по размерам от малого до умеренного (более 10 мм, но менее 1/2 гемиторакса), свободный. Бактериоскопия и культуральные иссле¬ дования отрицательные: pH более 7,2 или глюкоза более 3,33 ммоль/л. Риск плохого прогноза низкий.3. Выпот З'й категории имеет хотя бы один из следующих критериев:❖ занимает более 1/2 гемиторакса, ограничен или ассоциирован с утолщени¬ ем париетальной плевры;❖ положительные бактериоскопические и/или культуральные исследования;❖ pH менее 7,2 или глюкоза менее 3,33 ммоль/л.Риск плохого прогноза умеренный.4. Выпот 4-й категории: гной. Высокий риск плохого прогноза.БактериологияБольшинство эмпием вызываются аэробами. При этом у больных с анаэробной пневмонией культуральные исследования в выпоте положительны у 35%, а при пневмококковой пневмонии — менее чем у 5% [20, 36, 37, 40].Клинические проявления и течениепри аэробной бактериальной инфекции начало острое с фебрильной темпера¬ турой, болью в грудной клетке, продукцией мокроты, лейкоцитозом. Характерно, что степень лейкоцитоза коррелирует с наличием плевральных болей в грудной клетке, независимо от наличия выпота [37].При анаэробной бактериальной инфекции обычно подострое течение. Неспецифические симптомы: значительная потеря веса, лейкоцитоз, лёгкая ане¬ мия.Развёрнутая клиническая картина бактериальной эмпиемы плевры при любом виде инфекции сопровождается тяжёлой интоксикацией с признаками синдро¬ ма системной воспалительной реакции или сепсиса различной степени тяжести, вплоть до септического шока, и при накоплении большого количества жидкости или большого объёма поражения лёгкого развивается синдром дыхательной недо¬ статочности.Большое количество жидкости в плевральной ПОЛОСП! приводит к выбуханию соответствующих межрёберных промежутков. Пальпаторно жидкость определя¬ ют по наличию или отсутствию характерного голосового дрожания. Перкуторно будет притупление, а при гидро(пио)пневмотораксе — ещё и тимпанргг выше уровня жидкости. Поколачивание по грудной клетке может бьггь болезненным. Аускультативно дыхание ослаблено, иногда прослушивается шум трения плевры.Уровень жидкости в плевральной полосги при отсутствии в ней газа проходит по линии Дамуазо (рис. 52-5). При гидро(пио)пневмотораксе уровень жидкости имеет горизонтальную линию (рис. 52-6). Большое скопление жидкости вызывает смеще¬ ние средостения в противоположную сторону. При отграниченных вьшотах жид¬ кость скапливается в отдельных областях плевральной полости (рис. 52-7,52-8).ДиагностикаПарапневмонический выпот и эмпиема должны быть исключены у всех боль¬ ных с экссудативным выпотом и у всех больных с бактериальной пневмонией.
ПЛЕВРАЛЬНЫЙ ВЫПОТ 781Рис. 52-5. Рентгенограмма больного с плевральным выпотом слева. Верхняя граница жидкости проходит по линии Дамуазо.Стандартной является рентгено1рафия груд¬ ной клетки в вертикальном положении. Если имеется затемнение рёберно-диафрагмального угла или диафрагма не видна на всём её про¬ тяжении, необходимо проведение рентгено¬ графии в латеропозиции или УЗИ. Если при рентгенографии определяется жидкость более 10 мм толщиной, показан торакоцентез.Дифференциальный диагноз проводится с выпотом на фоне ТЭЛА, острого панкреатита, туберкулёза, синдрома Дресслера.Факторы, определяющие необходимость инвазивного вмешательства для разрешения плеврального выпота: 1) гной в плевральной полосги; 2) положительная бактериоскопия:3) глюкоза ниже 3,33 ммоль/л; 4) pH менее 7,20: 5) положительные бактериологическиеисследования; 6) уровень ЛДГ превышает в три раза верхнюю границу нормы для крови; 7) отграниченный выпот.Лечениепроводится дезинтоксикационная, инфузионно-трансфузионная терапия, соот¬ ветствующая антибиотикотерапия: сначала эмпирическая, затем по чувствитель¬ ности микрофлоры.При показаниях проводятся процедуры, которые по мере увеличения их инва¬ зивности включают: диагностический торакоцентез, лечебный торакоцентез, дре¬ нирование плевральной полости, дренирование плевральной полости с назначени¬ ем тромболитиков, торакоскопические операции и торакотомия с декортикацией. Метод лечения изменяется при его неэффективности в течение 1-2 сут.Рис. 52-6. Рекггенограмма больного с пиопневмотораксом слева. Уровень жид¬ кости имеет горизонтальную линию.
782ЗАБОЛЕВАНИЯ ПЛЕВРЫГ:7<Рис. 52-7. Рентгенограмма органов фудной полости больного с левосторонней медиастинальной эмпиемой плевры.Рис. 52*8. Рентгенограмма органов грудной полости больного с левосторонней костальной эмпие¬ мой плевры.Если толщина жидкости на снимке более 10 мм или она отграничена, пока¬ зан торакоцентез в течение нескольких часов с момента поступления пациента в стационар. Предпочтительнее начинать сразу с лечебного торакоцентеза. Если выпот рецидивирует, назначают торакоцентез или дренирование. Рекомендовано не более трёх торакоцентезов. При невозможности полного удаления жидкости и наличии любого из перечисленных выше факторов необходимо дренирование.
Жидкость и воздух из плевральной полости б0ЛЬН01'0 возду-хПЛЕВРАЛЬНЫЙ ВЫПОТ 783Связь с атаосферным воздухомвоздух ^ К отсасывающейсистемеСобираемая дренажная жидкостьБанка с жидкостной заглушкой (препятств^’ет попаданию возду-ха обратно к болы1ому)Высота воднот столба определяет силу отсасывания прикладываемую к дренажуРис. 52-9. Схема трёхбаночной системы для аспирации плеврального содержимого.Дренирование плевральной полостиПри наличии показаний задержки с дренированием быть не должно, так как отграничение выпота может произойти в течение нескольких часов. Дренаж должен быть установлен в область наибольшего накопления выпота. Диаметр дренажной трубки 9-12 мм, особенно если в плевральной полости находится гной. Лучшие результаты могут быть получены при точной установке дренажа под контролем УЗИ, рентгенографии или КТ. Наиболее распространён пассивный кла¬ панный дренаж по Бюлау, а также устройства РкигЕгас и их аналоги.При активной аспирации для сбора отделяемого из плевральной полости целе¬ сообразны трёхбаночные системы (рис. 52-9).В течение 24-48 ч должна появиться клиническая и рентгенологическая положи¬ тельная динамика. Если улучшения нет, то дренаж не справляется или неправильно выбран антибиотик. При наличии проблемы в дренаже имеются три варианта её решения: установить другой дренаж, провести интраплевральную тромболитическую терапию или произвести более инвазивную хирургическую манипуляцию. Причины неадекватного дренирования: неправильное расположение дренажа, отграниченный плевральный выпот, неадекватное расправление лёгкого из-за плевральных спаек.Внутриплевральная тромболитическая терапияСтрептокиназа 250 ООО МЕ или урокиназа® 100 ООО МЕ в 30-60 мл физиологи¬ ческого раствора внутриплеврально через дренаж. Альтернативный препарат — тканевой активатор плазминогена. Дренаж зажимают на 1-2 ч.ТоракоскопияПри неэффективности дренажа показана лечебная торакоскопия. Во время торакоскопии можно удалить фибринозные перемычки, разделяющие выпот, и иногда покрытие с висцеральной плевры. В конце процедуры устанавливают дре¬ наж в оптимальное положение. Перед торакоскопией проводят КТ для получения информации о размерах и расположении полости с выпотом.Наличие утолщённой висцеральной плевры при отсутствии перемычек в плев¬ ральной полости позволяет предположить хроническую эмпиему, которая, вероят¬ но, не может быть излечена лишь торакоскопическими манипуляциями.Эмпиема плеврыЭмпиема плевры — патологический процесс, обусловленный воздействием на плевру микробного или другого повреждающего агента, инициирующего актива-
784 ЗАБОЛЕВАНИЯ ПЛЕВРЫЦИЮ цитокиновой сети, преимущественно провоспалительной направленности, с развитием дисбаланса и разобщённостью протеолитических и ингибиторных систем.Классификация эмпиемы плевры.I. По содержимому плевральной полости:1) эмпиема плевры;2) пиопневмоторакс.II, По характеру плеврального экссудата:1) серозно-гнойный;2) серозно-фибринозный;3) фибринозный;4) гнойный;5) гнилостный;6) с геморрагическим компонентом.1П. По характеру возбудителей:1) асептическая;2) неспецифическая;3)анаэробная;4) специфическая;5) смешанная.IV. По патогенетическому механизму:1. Первичная (посттравматическая).2. Вторичная:а) связанная с патологией лёгких (пара-, метапневмоническая; осложнение гнойно-деструктивного процесса лёгкого, пневмоторакса; послеопераци¬ онная);б) не связанная с патологией лёгких (контактная; лимфогенная; гематоген¬ ная).V. По распространённосги:1) тотальная;2) распространённая;3) отграниченная (верхушечная; костальная; медиастинальная; диафрагмаль¬ ная; междолевая),VI. По свободе перемещения жидкостей в плевральной полости:1) свободная;2) сегментированная;3) панцирная.VII. По сообщению с внешней средой и воздухоносными путями лёгких;1) закрытая;2) сообщающаяся с внешней средой (плевроторакальный свищ; Empyema neces¬ sitatis);3) сообщающаяся с воздухоносными пзт'ями лёгких (бронхоплевральный свищ; плевропульмональный свищ);4) с бронхо-, пульмоноплевроторакальным свищом.VIII. По степени тяжести и клиническому течению;1) острая (средней тяжести, тяжёлая, крайне тяжёлая);2) хроническая.Клинические проявленияКлиническая картина острой эмпиемы плевры проявляется у большинства больных тяжелейшей интоксикацией с высокой температурой тела (или, наоборот, гипотермией при развёрнутой клинике сепсиса), слабостью, недомоганием, повы¬ шенным потоотделением, бледностью и тахикардией. Постепенно по мере нако¬ пления жидкости развивается одышка, расширяются межрёберные промежутки,
ПЛЕВРАЛЬНЫЙ ВЫПОТ 785выявляется отставание поражённой стороны при дыхании. Может быть сухой кашель, боль в соответствующей половине грудной клетки, цианоз слизистых оболочек и понижение массы тела, пастозность лица, запавшие щёки, контури- рующиеся вены шеи, дыхание ртом, подсушенный, чуть лакированный язык. При перкуссии выявляется притупление звука, увеличивающееся в нижних отделах. Возможно появление болевого симптома при поколачивании по грудной клетке над полостью эмпиемы. Большое скопление жидкости смещает средостение в здоровую сторону. На ней возле позвоночника выявляется притупление треуголь¬ ной формы — треугольник Раухфуса. Дыхание ослаблено или не прослушивается, отсутствует «голосовое дрожание», иногда прослушивается шум трения плевры. При наличии газа в плевральной полости (пиопневмоторакс) верхняя граница имеет горизонтальную линию.Переход острой эмпиемы плевры в хроническую совершается постепенно, общее состояние больных улучшается, хотя нет полного выздоровления. При переходе в гнойное истощение происходит инверсия температурной кривой. Похудание наступает относительно медленно. У больного сухая, пергаментная кожа, одутловатость лица, утолщение ногтевых фаланг в виде «барабанных пало¬ чек», ногти типа часовых стёкол, отёки нижних конечностей. Имеет место втягива¬ ние межрёберных промежутков при податливой париетальной плевре и их сужива¬ ние при фиброзном её утолщении. Дыхательные движения ограничены, особенно по сравнению с другой стороной. Лопатка немного приподнята кверху, отстаёт при дыхании по сравнению с противоположной, что делает её как бы «хромой». При больших остаточных полостях над ними перкуторно определяется тимпанический звук с зоной притупления вокруг, с помощью определения ослабленного голо¬ сового дрожания можно выявить границы полости эмпиемы. Перкуторно при¬ тупление по мере продвижения к верхней границе полости принимает ясный тон, переходя в тимпанический звук - признак Шкоды. Аускультативно дыхание осла¬ блено, принимает характер бронхиального. Разнокалиберные хрипы чаще бывают у больных эмпиемой плевры с деструкцией лёгочной ткани. Длительное течение заболевания сопровождается хронической анемией. Прорыв лёгочного гнойника в плевральную полость может проявиться тремя формами: острая форма ~ клиника сердечного коллапса, внезапно появившийся коробочный звук при перкуссии над притуплением; мягкая форма (прорыв гнойника в ограниченное, осумкованное пространство) — умеренная боль, изменение физикальных признаков; стёртая форма — момент прорыва уловить трудно.ЛечениеКонсервативное лечение острой эмпиемы плевры является предпочтитель¬ ным методом и включает в себя адекватное опорожнение гнойных полостей и их санацию (пункции плевральной полости с её промыванием, закрытое дренирование полости эмпиемы); санацию и облитерацию плевральной полости с последующим расправлением лёгкого (лечебнодиагностическая торакоскопия, расправление кол- лабированного лёгкого на фоне временной окклюзии бронхоплеврального свища, закрытая ультразвуковая и медикаментозная декортикация лёгкого); антимикроб¬ ную терапию с учётом чувствительности микрофлоры; деблокирование микроцир¬ куляции; устранение причины эмпиемы; меры, направленные на восстановление и поддержание общего состояния; иммунокоррекцию; коррекцию гомеостаза.Пункция полости эмпиемы является одновременно лечебным и диагностиче¬ ским методом. Выполняется эвакуация содержимого полости эмпиемы, санация путём промывания и введения лекарственных препаратов, выявления герметизма лёгочной ткани, клинико-лабораторное, бактериологическое и цитологическое исследования экссудата. Калибр пункционной иглы подбирается в зависимости от характера гноя (в основном игла с внутренним диаметром 2-3 мм). При наличии густого гноя, детрита, хлопьев фибрина возможно применение протеолитических
J»786 ЗАБОЛЕВАНИЯ ПЛЕВРЫх'.';" '.J-Ш (трипсина, химотрипсина). фибринолитических (стрептокиназы) препаратов, к Плевральная полость считается санированной в том случае, когда количестволейкоцитов не превышает 20-25 в поле зрения при 3-4 исследованиях экссудата. / ' Отсутствие лечебного эффекта от плевральных пункций является прямым показа- i'lV7. ниєм для закрытого дренирования плевральной полости. Дренирование является наиболее распространённым методом лечения эмпиемы плевры. Оно обеспечива¬ ет эффективную аспирацию гноя не только из полости эмпиемы, но и из сообщаю¬ щихся с ней очагов деструкции лёгкого. Преимущество закрытого дренирования плевральной полости над пункцией заключается в постоянной эвакуации гноя, возможности непрерывного её промывания и расправления коллабированного лёгкого с помощью аспирации. При тотальной эмпиеме плевры нередко возникает необходимость в установлении двух или даже трёх дренажей (над диафрагмой и под куполом полости). В особых случаях (при неэффективности дренирования) про¬ изводится лечебно-диагностическая торакоскопия или плевростомия с открытым ведением полости эмпиемы. Расширяются возможности лечебной торакоскопии с использованием ультразвуковых методов санации, торакоскопии в комплексе с бронхоскопией, Аспирируется содержимое полости, заполняется раствором анти¬ септика и через тубус торакоскопа вводится вращающийся волновод-инструмент. Под визуальным контролем проводится ультразвуковая обработка всех отделов полости. Затем полость осушивается, дренируется или ушивается рана наглухо, в дальнейшем ведётся на пункциях. Для ликвидации бронхоплеврального свища до уровня долевого бронха используются методики клапанной бронхоблокации сви¬ щевого бронха, диатермокоагуляции свищевого бронха на протяжении. Оперативное лечениеПоказания к операции: 1) тотальная эмпиема; 2) эмпиема остаточной полости с бронхоплевральным свищом; 3) выраженный коллапс лёгкого; 4) отсутствие успе¬ ха в лечении эмпиемы более 2 мес.Оперативные вмешательства:• открытые методы дренирования;• открыто-закрытые методы дренирования;• восстановительные и резекционно-восстановительные операции;• корригирующие операции;• оперативные вмешательства, направленные на ликвидацию бронхоплевраль- ного свища;• операции, направленные на ликвидацию дефектов грудной стенки (возник¬ шие в процессе лечения эмпием плевры).Открытые методы имеют низкую эффективность и высокую летальность, в настоящее время применяются по жизненным показаниям: при острой эмпиеме с обширными бронхоплевральными сообщениями, при острой послеоперационной эмпиеме и травме пищевода, а также в сочетании с флегмоной грудной стенки.При открыто-закрытом лечении эмпиемы плевры выполняется широкая тора- котомия, удаляется источник инфицирования, рана ушивается наглухо и в даль¬ нейшем эмпиема лечится пункционным методом. Показания: нагноившийся, свернувшийся гемоторакс; инородные тела грудной стенки с нагноением; несосто¬ ятельность культи бронха или швов лёгочной ткани в условиях острой эмпиемы; при чресплевральных способах устранения бронхиального свища после пневмон- эктомии в условиях хронической послеоперационной эмпиемы плевры.Восстановительные и резекционно-восстановительные операции включают в себя декортикацию, плеврэктомию с декортикацией и плеврэктомию с резекцией лёгкого,в последние годы для ликвидации бронхоплевральных свищей стал применять¬ ся эндобронхиальный клапан (A.B. Левин), показавший высокую эффективность в ликвидации сброса воздуха в плевральную полость (рис, 52-10-52-12).
ПЛЕВРАЛЬНЫЙ ВЫПОТ 787Рис. 52-10. Эндобронхиальный клапан (различные типы в зависимости от размеров).выдохеРис. 52-11. Схема работы клапана.ПриццохеСвищи удаётся закрыть с помощью диатермокоагуляции путём проведения активного электрода через канал фибробронхоскопа.Туберкулёзный плевритТуберкулёзный плевральный выпот является или последствием туберкулёзной инфекции, попавшей в организм на 3-6 мес ранее, или результатом реактивации туберкулёза.Актиномикоз. Нокардиоз. Грибковые инфекцииДиагностика экссудатов при данном генезе процесса осуществляется с помощью культуральных исследований и биопсии плевры [20] (табл. 52-3).
788ЗАБОЛЕВАНИЯ ПЛЕВРЫРис. 52-12, Обтурация клапаном еерхнедолевого бронха: а — клапан, помещённый на конец фибро- бронхоскопа; б — надевание клапана на конец фибробронхоскопа; в — клапан, установленный в верхнедолевом бронхе.Таблица 52-3. Диагностика генеза экссудата при актиномикозе, нокардиозе и грибковых инфекцияхЭтиологияЗона первичного пораженияОсобенности характера экссудата и процессаОснования для диагнозаАктиномикозЛёгкое с переходом на грудную стенкуГной с преимущественно поли¬ морфно-ядерными лейкоцитамиКультуральные исследо¬ вания выпотаНокардиозЛёгочный инфильтратОт серозного до гнойногоКультуральные исследо¬ вания выпотаАспергиллёзОсложнение искусственно¬ го пневмоторакса, опера¬ ций на лёгком. Мицетома в лёгком или в плевраль¬ ной полостиХроническая воспалительная интоксикация, утолщённая плевра с уровнем жадкостиКультуральные исследо¬ вания выпота, положи¬ тельный тест дня антител против AspergillusБластомикозВ плевральной полости и вне еёУтолщение плевры, экссудат с малыми лимфоцитами. Клиника, как при туберкулёзеКультуральные исследо¬ вания выпота и секретов. Биопсия плевры: гранулё¬ ма без казеозаКощидиоидо-микозПаренхиматозный инфиль¬ трат и вне лёгкогоОдносторонний плеврит с высоким уровнем жидкости. Воспалительная интоксикация (фебрильная температура)Культуральные исследова¬ ния выпота и биоптатовКриптококкозСубплевральный узелДиссеминированный процесс, вовлекается паренхима. Экссудат преимущественно с лимфоци¬ тамиКультуральные иссле¬ дования, определение антигенаг истоплазмоэИнфильтрат или субплев¬ ральный узелВыпот редко. Подослэое течение. Экссудат с лимфоцитамиБиопсия — неказеозные гранулёмыПневмоцистыЛёгкоеВыпот редко. Экссудат с низким белком, но высоким ЛДГИсследование выпотаВирусные инфекцииВирусная природа экссудата может быть установлена путём изоляции вируса и выявления роста титров противовирусных антител. По эпидемическим сооб¬ ражениям особую актуальность приобретает диагностика процесса при ТОРС и ВИЧ-инфекции [13]. Плевральный выпот может появиться при инфекционном гепатите, что требует динамического контроля. Плевральный выпот отмечен
ПЛЕВРАЛЬНЫЙ ВЫПОТ 789при хантавирусном лёгочном синдроме (вначале транссудат, а затем экссз^дат), тяжёлой форме лихорадки Денге, инфекционном мононуклеозе, респираторном синцитиальном вирусе, вирусе гриппа, кори (после применения вакцины), цито- мегаловирусе, вирусе герпеса [20].Паразитарные инвазииСреди паразитарных инвазий наиболее значимыми являются амёбиаз, эхино- коккоз, парагонимоз. Амёбный абсцесс и нагноившийся эхинококк могут про¬ рваться в плевральную полость или раздражать плевру при поддиафрагмальном расположении паразита. Амёбный генез процесса устанавливается при иссле¬ довании плевральной полости (вид «шоколадного соуса»), а эхинококкоз диа¬ гностируется рентгенологическими методами. Парагонимоз диагностируется при выявлении яиц паразитов в плевральной жидкости [13, 20].Плевральный выпот различного генезаПлевральный выпот при многих заболеваниях носит вторичный характер. Диагностика, лечение и исход болезни связаны с основным заболеванием. Такая задача встаёт при ТЭЛА, сопровождающейся плевральным выпотом, перфорациях пищевода, заболеваниях поджелудочной железы (острый и хронический панкреа¬ тит), интраабдоминальных абсцессах, диафрагмальных грыжах, осложнивших¬ ся абдоминальных операциях, перитонитах, механических желтухах, жёлчно¬ плевральных свищах.Особого внимания заслуживают плевральные выпоты при ревматоидном и волчаночном плеврите (системной красной волчанке), гранулематозе Вегенера, синдроме Черджа-Стросс, синдроме Шёгрена, ангиоиммунобластной лимфадено¬ патии. Здесь важна ранняя диагностика основного процесса.Наблюдение из-за возможности появления плеврального выпота должно про¬ водиться после аортокоронарного шунтирования, инфаркте миокарда (синдроме Дресслера).Среди причин плеврального выпота отмечены профессиональные факторы (асбестоз), саркоидоз, уремия, синдром Мейгса, эндометриоз, экстрамедуллярное кроветворение, синдром жёлтых ногтей, фиксированное лёгкое, лучевая терапия идр.Наконец, причиной плеврального выпота могут стать медицинские вмеша¬ тельства. Во-первых, это применение ряда лекарств (нитрофурантоин, дантро- лен®, метисергид*", прокарбазин, амиодарон, интерлейкин-2), во-вторых, ряд медицинских методов диагностики и лечения (катетеризация аорты, установка назогастрального и назоинтестинального зондов). Об этих причинах надо всегда помнить, приступая к их выполнению — предупреждать и вовремя распознавать [13,20,41].ЗаключениеПлевральный выпот — часто встречающаяся патология, в генезе которой кроме патологии лёгких имеют значение многие экзо- и эндогенные факторы, обуслов¬ ленные особенностями морфологии, физиологии и патологии плевры, плевраль¬ ной полости, а также большим количеством болезней системного и органного характера, инфекционными факторами и др. Новые представления о структуре и функции плевры позволяют по-новому взглянуть на проблему формирования плеврального выпота и определить дифференцированный подход к диагностике и лечению этой комплексной проблемы,список ЛИТЕРАТУРЫ г
Глава 53 Пневмоторакс, гемоторакс, хилоторакс и фибротораксПневмотораксПод пневмотораксом понимают состояние, характеризующееся скоплением воздуха в плевральной полости, чаще всего вследствие возникновения патологического сообщения плевральной поло¬ сти с воздухоносными путями. При этом свободное сообщение плевральной полосги с просветом дыхательных путей и действие эластической тяги паренхимы лёгкого приводят к его полному или частичному коллапсу. Все пневмотораксы можно разделить на спонтанные, не связанные с какой-либо явной причиной» травма¬ тические, связанные с травмой грудной клетки, и ятрогенные, свя¬ занные с врачебными манипуляциями, а также нетравматические пневмотораксы, вызванные другими причинами, В свою очередь, спонтанные пневмотораксы делятся на первичные, возникающие у практически здоровых людей, и вторичные, возникающие на фоне заболеваний лёгких, чаще всего хронической обструктивной болезни лёгких. Спонтанный пневмоторакс может быть неослож¬ нённым и осложнённым (кровохарканьем, плевритом, эмфиземой средостения) [1]. Проблемы профилактики, диагностики и лечения спонтанного пневмоторакса остаются актуальными [1-3]. В опреде¬ лённой степени это связано с распространённостью процесса, дости¬ гающей 5 случаев спонтанного пневмоторакса на 100 ООО человек: 7,4 случая на 100 ООО мужчин и 1,2 случая на 100 ООО женщин. Вторичный спонтанный пневмоторакс встречается среди мужчин в 6,3 случаях на 100 ООО. среди женщин - в 2,0 случаях на 100 ООО. При этом спонтанный пневмоторакс возникает в основном в возрас¬ те 20-40 лет [5]. В последние годы по многим аспектам проблемы пневмоторакса разработаны новые подходы к пониманию патогене¬ за и, соответственно, лечебной тактики [4-7].ПАТОФИЗИОЛОГИЯВ норме воздух в плевральной полости отсутствует, хотя внутри- гшевральное давление на протяжении дыхательного цикла отрица¬ тельное: при вдохе на 5-9 мм рт.ст., а при выдохе на 3-4 мм рт.ст. ниже атмосферного. Сумма всех парциальных давлений газов в капиллярной крови составляет приблизительно 706 мм рт.ст., поэ¬ тому для движения газов из капилляров в плевральную полость требуется внутриплевральное давление менее 54 мм рт.ст. ниже атмосферного, что практически никогда не происходит в реальной жизни, поэтому плевральная полость не содержит газа [4].
ПНЕВМОТОРАКС, ГЕМОТОРАКС, ХИЛОТОРАКС И ФИБРОТОРАКС 791Газ в плевральную полость может попасть тремя путями;• прямое сообщение между альвеолами и плевральной полостью при сохранён¬ ной целости грудной стенки (закрьггый пневмоторакс);• прямое сообщение между атмосферой и плевральной полостью при наруше¬ нии целостности грудной стенки при ранениях и травмах (открытый пневмо¬ торакс);• присутствие в плевральной полости газообразующих микроорганизмов (при сочетании пневмоторакса с эмпиемой плевры).Пневмоторакс может быть одно- и двусторонним, в зависимости от его рас¬ пространённости — тотальным, субтотальным, частичным, осумкованным, а в зависимости от степени спадения (коллапса) лёгкого — полным и частичным [8, 9]. В зависимости от типа сообщения плевральной полости, содержащей возд}^, с внешней средой различают закрытый, открытый и клапанный пневмоторакс. При открытом пневмотораксе воздух свободно поступает в неё и при выдохе пере¬ мещается в обратном направлении. Поступление воздуха в плевральную полость продолжается до тех пор, пока давление в ней не станет равным атмосферному или не прервётся сообщение. Однако иногда патологическое сообщение пропускает воздух в плевральную полость только во время вдоха, во время выдоха закрывает¬ ся и препятствует эвакуации воздуха, Б результате такого «клапанного» механизма давление в плевральной полости может значительно превышать атмосферное — развивается напряжённый пневмоторакс. Высокое внутриплевральное давление приводит к смещению органов федостения, уплощению диафрагмы и компрессии непоражённого лёгкого. Последствиями такого процесса являются снижение венозного возврата, уменьшение сердечного выброса, гипоксемия, что приводит к развитию острой циркуляторной недостаточности.При анализе газов артериальной крови гипоксемия (Ра0^<80 мм рт.ст.) наблю¬ дается у 75% больных с пневмотораксом. Наличие фонового заболевания лёгких и размер пневмоторакса тесно связаны с изменениями газового состава артериаль¬ ной крови {4,10].Основной причиной гипоксемии является коллапс и снижение вентиляции поражённого органа при сохранённой лёгочной перфузии (эффект шунта). Гиперкапния развивается в основном у больных с тяжёлыми фоновыми заболе¬ ваниями лёгких (ХОБЛ, муковисцидоз и др,). Однако если она имеется, то для исключения её нарастания необходим тщательный контроль газов крови при назначении кислородотерапии. Довольно часто присутствует респираторный алкалоз.Изменения ЭКГ обычно выявляются только при напряжённом пневмотораксе: отклонение электрической оси сердца вправо или влево в зависимости от лока¬ лизации пневмоторакса, изменение вольтажа, зубца Г могут внешне напоминать таковые при инфаркте миокарда [4,11].КЛИНИЧЕСКАЯ КАРТИНАПневмоторакс может вызвать боль или диспноэ, но может протекать практиче¬ ски бессимптомно. Клиническая картина зависит от размера пневмоторакса, лёгоч¬ ной функции, наличия заболеваний. Физикальная картина также может разниться от симптомов напряжённого пневмоторакса до отсутствия изменений. В типичном случае при осмотре и проведении обследования удаётся отметить некоторое уве¬ личение объёма грудной клетки с несколько большим выбуханием её со стороны пневмоторакса. Здесь рельеф межрёберных промежутков сглажен, а при дыхании эта половина грудной клетки малоподвижна, в то время как здоровая, напротив, дышит усиленно. У худощавых людей можно видеть смещение верхушечного толч¬ ка, набухание и расширение шейных вен, Пальпаторное исследование позволяет выявить небольшую, не склонную к нарастанию подкожную эмфизему, опреде-
792ЗАБОЛЕВАНИЯ ПЛЕВРЫК ЛИТЬ ослабление голосового дрожания на стороне коллабированного лёгкого. При § перкуссии здесь слышится громкий коробочный звук различной тональности —2. в зависимости от количества воздуха в грудной полосги. Аускультация даёт воз¬ можность установить ослабление или отсутствие дыхательных шумов на стороне пневмоторакса при сохранении дыхания на здоровой стороне. При физикальном исследовании обычно выявляется смещение границ сердца, сердечные тоны чаще всего приглушены. Определяется тахикардия, небольшое снижение артериального давления.ДИАГНОСТИКАДиагноз ставится на основании клинических данных и объективного обследова¬ ния больного. Для подтверждения диагноза необходимо проведение рентгеногра¬ фии грудной клетки в вертикальном положении больного. Рентгенографическим признаком пневмоторакса является визуализация тонкой линии висцеральной плевры (менее 1 мм), отделённой от грудной стенки (рис, 53-1).Частой находкой при пневмотораксе является смещение тени средостения в противоположную сторону. Так как средостение не является фиксированной структурой, то даже небольшой пневмоторакс может вести к смещению сердца, трахеи и других органов средостения, поэтому контрлатеральный сдвиг средосте¬ ния не является признаком только напряжённого пневмоторакса.Около 10-20% пневмотораксов сопровождается появлением небольшого плев¬ рального выпота (в пределах синуса), причём при отсутствии тенденции к расправ¬ лению лёгкого количество жидкости может увеличиваться (рис. 53-2).При отсутствии признаков пневмоторакса при рентгенологическом обследова¬ нии в передне-задней проекции, но при наличии клинических данных, характер¬ ных для пневмоторакса, показано проведение рентгенографии в латеропозицииРис. 53-1. Спонтанный пневмоторакс. Рентгенограмма органов грудной полости.
ПНЕВМОТОРАКС, ГЕМОТОРАКС, ХИЛОТОРАКС И ФИБРОТОРАКС 793Рис. 53-2. Левосторонний пневмоторакс, осложнённый гидротораксом. Рентгенограмма органов грудной клетки.или латеропозиции на боку, что позволяет подтвердить диагноз дополнительно в 14% случаев [4].Рентгенологическим признаком пневмоторакса у больных в горизонтальном положении (чаще при проведении ИВЛ) является признак «глубокой борозды» — углубление рёберно-диафрагмального угла, что особенно хорошо заметно при сравнении с противоположной стороной.Для диагностики небольших по размеру пневмотораксов, для дифференциаль¬ ной диагностики больших эмфизематозных булл и пневмоторакса КТ является более надёжным методом по сравнению с рентгенографией. КТ также показана для выявления причины вторичного спонтанного пневмоторакса (буллёзная эмфизе¬ ма, кисты, интерстициальные болезни лёгких).ОПРЕДЕЛЕНИЕ РАЗМЕРА ПНЕВМОТОРАКСАРазмер пневмоторакса является одним из наиболее важных параметров, опре¬ деляющих выбор лечебной тактики у больных с первичным спонтанным пневмо¬ тораксом. Наиболее широкое признание получила формула R. Light, основанная на положении, что объём лёгкого и объём гемиторакса пропорциональны величине их диаметра, возведённых в третью степень [4,12]. Размер пневмоторакса по фор¬ муле Light рассчитывается следующим образом:объём пневмоторакса (%)=(l-DL^-i-DH^)xlOO, где DL — диаметр лёгкого, DH — диаметр гемиторакса на рентгенограмме органов грудной клетки.В некоторых согласительных документах предлагается ещё более простой подход к определению объёма пневмоторакса, например, в руководстве British Thoracis Society пневмотораксы подразделяются на малые и большие при рас¬ стоянии между лёгким и грудной стенкой менее 2 см и более 2 см соответственно [13], а руководство American College of Chest Physicians рекомендует делить пнев¬ мотораксы в зависимости от величины расстояния между верхушкой лёгкого и куполом грудной клетки: малый пневмоторакс при расстоянии менее 3 см, боль¬ шой — более 3 см [14].
}:Ч/.-Г' -‘ 794 ЗАБОЛЕВАНИЯ ПЛЕВРЫЛЕЧЕНИЕДля всех пневмотораксов главной целью лечения является удаление воздуха из плевральной полости. С учётом этиологии процесса важно предупредить реци¬ див. Способы лечения варьируют от наблюдения до торакотомии. Б зависимости ..4 --, от тяжести симптоматики, предшествующей истории настоящего заболевания и Iсопутствующей патологии, необходимости вентиляции с положительным давле- ‘Г; ’У.. нием, наличия плеврального выпота, размера пневмоторакса и даже стиля жизни :'^Т;: больного лечение включает:• наблюдение и кислородотерапию;• простую аспирацию воздуха;• установку дренажной трубки;• химический плевродез;• хирургическое лечение.Все больные с пневмотораксами госпитализируются в стационар.Наблюдение и кислородотерапияОбычно применяется при отсутствии клинических симптомов у больных с малым первичным спонтанным пневмотораксом или простым ятрогенным пнев¬ мотораксом размером менее 15% [4,15]. Таким пациентам показан рентгенологи¬ ческий контроль для оценки скорости рассасывания пневмоторакса.Известно, что при использовании для дыхания окружающего воздуха ско¬ рость рассасывания пневмоторакса составляет 1,25% объёма гемиторакса в сутки (50-70 мл) [16]. Кислородотерапия показана всем госпитализированным боль¬ ным, так как она может увеличить это значение до 4,2% [17, 18]. Данный факт связан с тем, что основной объём воздуха составляет азот, объёмная пропорция которого уменьшается при увеличении количества кислорода. В результате про¬ исходит относительная денитрогенизация крови, и азот, составляющий большую часть пневмоторакса, активнее выводится из плевральной полости.Простое наблюдение больных имеет несколько недостатков [19],• Может быть не распознан напряжённый пневмоторакс, что в ряде случаев приводит к смерти больных.• На лёгком, не расправленном полностью в течение 2 нед, возможно образо¬ вание фибриновой «корки», которая препятствует дальнейшему его расправ¬ лению. Это обусловливает необходимость серьёзного хирургического вме¬ шательства, которого можно было бы избежать при эвакуации газа в начале лечения.• Простое наблюдение не уменьшает риск рецидива при спонтанном пневмото¬ раксе.Если пневмоторакс не абсорбировался в течение 1-2 нед, необходимо вмеша¬ тельство для полного расправления лёгкого.Простая аспирацияРекомендована в случае простого пневмоторакса, если нет подозрения на про¬ должающееся поступление воздуха в плевральную полость и когда больной не помещён на вентиляцию с положительным давлением. Данный метод эффективен примерно у 60% больных спонтанным пневмотораксом [20], Процедура выполня¬ ется так же, как для декомпрессии напряжённого пневмоторакса. После местной анестезии игла (и по ней катетер 16 калибра) устанавливается в плевральную полость по среднеключичной линии над верхним краем ІП ребра во втором меж- реберье. Когда воздух перестаёт поступать в шприц, катетер удаляют и проводят первую контрольную рентгенограмму. Если объём удалённого воздуха превышает 4 л, а сопротивления не ощущается, значит, в плевральную полость продолжает поступать воздух, и её следует дренировать [21].
ПНЕВМОТОРАКС, ГЕМОТОРАКС, ХИЛОТОРАКС И ФИБРОТОРАКС 795Дренирование плевральной полостичрескожное дренирование плевральной полости тонким катетером некоторые авторы рекомендуют в качестве метода выбора для лечения простого пневмото¬ ракса. Катетеры размером 3-6 мм вводят, используя технику Сельдингера или методику «катетер на игле». Они имеют ряд преимуществ: терапевтическая и экономическая эффективность, меньшая травма по сравнению с дренированием стандартными трубками [19]. Однако катетер такого диаметра не может справить¬ ся с продолжающимся массивным поступлением воздуха в плевральную полость, особенно у больных на вентиляции с положительным давлением. Им показана установка в плевральную полость стандартных дренажей.Используются дренажи размером 9 мм и более для удаления приблизительно 15 л/мин на отсосе 10 см водного столба.Показания:• неэффективность чрескожного дренирования плевральной полости тонким катетером;• пневмоторакс, ассоциированный со значительным накоплением жидкости;• пневмоторакс с ожидаемым продолжением поступления воздуха, объём кото¬ рого превысит возможности удаления через тонкий катетер, особенно при применении вентиляции с положительным давлением [19].дренажи для воздуха устанавливают в третьем-четвёртом межреберьях по среднеключичной или передней аксиллярной линии. Рекомендуют создать под¬ кожный туннель на одно межреберье вверх до введения в плевральную полость. Этот туннель служит двум целям:• является клапаном для предотвращения попадания воздуха в плевральную полость после удаления дренажа;• позволяет хирургу контролировать направление трубки; вперёд для удаления воздуха и назад для удаления жидкости.Далее трубка устанавливается на активное или пассивное дренирование, кото¬ рое производится с использованием клапанных систем. Активное дренирование лучше способствует полному расправлению лёгкого, но оно сопряжено с более частыми осложнениями, в частности реэкспансионным отёком расправленного лёгкого. Причиной такого отёка является повышенная проницаемость лёгочных капилляров. Клинически реэкспансионный отёк лёгких проявляется кашлем и уси¬ лением одышки или появлением чувства «заложенности» в грудной клетке после введения дренажной трубки. На рентгенограмме органов грудной клетки признаки отёка могут быть видны не только в пораженном лёгком, но и в противополож¬ ном. Распространённость реэкспансионного отёка лёгких составляет в целом по данным ретроспективных исследований около 1% [22], хотя при использовании активной аспирации может достигать 14%, и его риск значительно возрастает при длительности пневмоторакса более 3 сут, полном коллапсе лёгкого. Летальность при реэкспансионном отёке лёгких может достигать 14% и более [4,23]. Удаление дренажной трубки производят через 24 ч после прекращения отхождения по ней воздуха, если по рентгенологическим данным достигнуто полное расправление лёгкого.Химический плевродезХимическим плевродезом называется процедура, при которой в плевральную полость вводятся вещества, вызывающие асептическое воспаление и адгезию висцерального и париетального листков плевры, что приводит к облитерации плевральной полости. Химический плевродез показан больным со вторичным спонтанным пневмотораксом и больным с рецидивирующим первичным спонтан¬ ным пневмотораксом, так как данная процедура позволяет снизить риск возникно¬ вения рецидивов [24], Через дренаж в плевральную полость вводят доксициклин
' v}V796 ЗАБОЛЕВАНИЯ ПЛЕВРЫ(500 мг) или взвесь талька (5-10 г). Анестезия проводится внутриплеврально 25 мл 1% раствора лидокаина через дренажную трубку с дополнительным внутри¬ венным потенцированием. После введения склерозирующего вещества дренажную трубку пережимают на 1-2 ч. Число рецидивов после введения тетрациклинов составляет 9-25%, а после введения талька — 8% [4,24J. Однако с введением таль¬ ка в плевральную полость ассоциирован ОРДС [4, 25» 26]. Развитие ОРДС может быть связано с высокой дозой талька (более 5 г), а также размерами его частиц (более мелкие частицы подвергаются системной абсорбции с последующим раз¬ витием системной воспалительной реакции) [4].Хирургическое лечениеПоказаниями к проведению хирзфгического вмешательства являются [4,13,19];• отсутствие эффекта от менее инвазивного лечения, в частности отсутствие расправления лёгкого после проведения дренирования плевральной полости в течение 3-5 дней, рецидив пневмоторакса после проведения химического плевродеза;• двусторонний спонтанный пневмоторакс;• контрлатеральный пневмоторакс;• спонтанный гемопневмоторакс;• пневмоторакс у людей определённых профессий (связанных с полётами, дай¬ вингом);• наличие пневмоторакса в сочетании с другими показаниями для операции.Задачами хирургического лечения пневмоторакса являются:• резекция булл и субплевральных пузырей;• ушивание дефектов лёгочной ткани;• плевродез.Выполняется двумя путями:• видеоассистированная торакоскопическая операция (BATO);• открытая торакотомия,BATO может быть применена, по крайней мере, в начале лечения для боль¬ шинства пневмотораксов при наличии оборудования и квалифицированного персонала. BATO с ушиванием булл и субплевральных пузырей и проведением механического плевродеза приводит лишь к 5% рецидивов, поэтому она может быть предпочтительнее другого вида плевродеза [4,12].Противопоказания к BATO:• пневмоторакс, возникший в результате перфорации пищевода;• разрыв крупных воздухоносных путей;• пневмоторакс в сочетании со значительным продолжающимся кровотече¬ нием:• сочетанная травма других органов грудной клетки.Когда проведение BATO невозможно и имеются показания к хирургическому лечению, необходимой процедурой становится открытая торакотомия.После выписки из стационара больной должен избегать физических нагрузок в течение 2-4 нед и воздушных перелётов в течение 2 нед.Пациенту необходимо посоветовать избегать эпизодов повышенного барометри¬ ческого давления (прыжки с парашютом, дайвинг) и отказаться от курения [4],ПЕРВИЧНЫЙ СПОНТАННЫЙ ПНЕВМОТОРАКСПервичный спонтанный пневмоторакс чаще встречается у высоких худощавых молодых мужчин, но может возникнуть у лиц любого пола в любом возрасте [4,19].Непосредственной причиной спонтанного пневмоторакса становится прогрес¬ сирующее истончение стенок и разрыв субплеврально расположенных эмфизема¬ тозных булл и субплевральных пузырей [4,19, 27],
ПНЕВМОТОРАКС, ГЕМОТОРАКС. ХИЛОТОРАКС И ФИБРОТОРАКС 797Буллы и с^^бплевральные пузыри найдены у более 75% больных и локализуются преимущественно в апикальных отделах лёгких [27]. Риск развития первичного спонтанного пневмоторакса в 7 (при курении 1-12 сигарет/день) — 100 (более 22 сигарет/день) раз выше у курящих, чем у некурящих [28].Наиболее частой непосредственной причиной, вызывающей разрыв участка такой патологически изменённой ткани, является резкое повышение внутрилё¬ гочного давления. В 80-85% случаев это совпадает по времени с сильным натужи- ванием при выполнении физической работы или силовых упражнений во время занятий спортом.Клинические проявленияВыделяют относительно типичное течение спонтанного пневмоторакса — с умеренными или бурными клиническими проявлениями, и стёртый, или так назы¬ ваемый латентный вариант его развития. Для типичного клинического развития спонтанного пневмоторакса, протекающего с умеренными проявлениями, уже с первых минут от начала заболевания характерно ощущение внезапно возникших острь[х колющих или сжимающих болей в соответствующей половине грудной клетки. Как правило, эти жалобы связывают с выполнением физических нагру¬ зок, сопряжённых с кратковременной задержкой дыхания, внезапным сильным кашлем. Чаще всего боли локализуются в верхних отделах груди, иррадиируют в плечо, шею или руку. Иногда они распространяются преимущественно на область живота и поясницы. Почти одновременно с болями пациенты отмечают появление и нарастание своеобразного ощущения некоторого стеснения в груди, затруднение дыхания. Нередко вследствие усиления болей пациент не может делать глубокий вдох. В течение 30-60 мин интенсивность болей снижается или даже они почти полностью проходят. Состояние больного улучшается, уменьшается дыхатель¬ ный дискомфорт, лишь при физической нагрузке вновь появляется субъективное ощущение «нехватки воздуха», отсутствие «полного вдоха». При этом общее состояние больных сохраняется вполне удовлетворительным, изредка может быть отмечено повышение температуры тела.Иногда клинические проявления ярко выражены. Сильные боли в груди сочетают¬ ся с резкой одышкой. Нередко такие больные испьггьшают кратковременные обмо¬ рочные состояния. Кожа бледнеет, развивается небольшой акроцианоз, появляется холодный пот. Возникает учащённое сердцебиение, чувство тревоги и страха.При латентном течении симптоматика стёрта или вообще отсутствует.Спонтанный пневмоторакс характеризуется рецидивирующим течением. Вероятность рецидива спонтанного пневмоторакса прогрессивно увеличивается с каждым последующим эпизодом, достигая 62% после второго и 83% — после третьего рецидива [4], При возникновении спонтанного пневмоторакса увеличи¬ вается риск развития пневмоторакса и на контрлатеральной стороне.Основными факторами риска развития рецидивов у больных со спонтанными пневмотораксами (как с первичными, так и со вторичными) являются наличие лёгочного фиброза, возраст старше 60 лет и астенический статус больных [4],ЛечениеЦелями лечения являются удаление воздуха из плевральной полости с расправ¬ лением лёгкого и профилактика повторных рецидивов пневмоторакса.В настоящее время имеются два согласительных документа, посвящённых диа¬ гностике и лечению больных со спонтанными пневмотораксами, - руководство British Thoracic Society (BTS) [13] и руководство American College of Chest Physicians (ACCP) [14],Наблюдение и кислородотерапия. Ограничиться только наблюдением (т.е, без выполнения процедур, направленных на аспирацию воздуха) рекомендовано
798 ЗАБОЛЕВАНИЯ ПЛЕВРЫX при первичном спонтанном пневмотораксе небольшого объёма (менее 15% или § при расстоянии между краем лёгкого и грудной стенкой менее 2 см) у больных << без выраженной одьпики. Всем больным, даже при нормальном газовом составе артериальной крови, показано назначение кислорода, так как кислородотерапия позволяет ускорить разрешение пневмоторакса в 4-6 раз [17]. BTS рекомендуют 10 л/мин через маску, однако положительный эффект наблюдается и при назначе¬ нии кислорода через носовые канюли.Простая аспирация. Простая аспирация (плевральные пункции с проведением аспирации) показаны больным первичным спонтанным пневмотораксом объёмом более 15%; больным вторичным спонтанным пневмотораксом (при расстоянии между лёгким и грудной стенкой более 2 см) без выраженного диспноэ [29].Простая аспирация приводит к расправлению лёгкого в 59-83% при первичном спонтанном пневмотораксе и в 33-67% — при вторичном спонтанном пневмо> тораксе [29], поэтому она не может бьггь рекомендована больным вторичным и рецидивным первичным спонтанным пневмотораксом.Дренирование плевральной полости. Установка дренажной трубки показана при неудачной простой аспирации у больных с первичным спонтанным пневмо¬ тораксом; при рецидиве первичного спонтанного пневмоторакса: при вторичном спонтанном пневмотораксе (при расстоянии между краем лёгкого и грудной стен¬ кой более 2 см); у больных с диспноэ и лиц старше 50 лет [4].Больным с первичным и стабильным вторичным спонтанным пневмотораксом, которым не планируется проведение ИБЛ, рекомендуется постановка трубки диа¬ метром 16-22 F (1 French (F)=l/3 мм). При проведении ИВЛ у больных с пнев¬ мотораксом очень высок риск формирования бронхоплевральной фистулы или прогрессирования пневмоторакса, и поэтому рекомендуются трубки большего диаметра (28-36 F) [4].Для предупреждения рецидива показан плевродез.Хирургическое лечение спонтанного пневмоторакса включает в себя резекцию булл, которые обычно присутствуют на верхушке верхней доли или верхнем сег¬ менте нижней доли лёгкого, с помощью сшивающих аппаратов, а также выполне¬ ние механического плевродеза с помощью абразивного материала. Многие хирур¬ ги предпочитают выполнять эти манипуляции торакоскопически.ВТОРИЧНЫЙ СПОНТАННЫЙ ПНЕВМОТОРАКСЯвляется более серьёзной патологией, чем первичный спонтанный пневмо¬ торакс, так как возникает у больных, имеющих значительно меньший лёгочный резерв.Вторичный спонтанный пневмоторакс развивается на фоне многих заболева¬ ний, Sahn S.A. и соавт. [7] выделяют по генезу следующие причины вторичного спонтанного пневмоторакса: муковисцидоз, ХОБЛ, астматический статус, инфек¬ ция в лёгком (стафилококковая, туберкулёзная и др.), интерстициальные заболе¬ вания лёгких, инфаркт лёгкого, злокачественные новообразования, лучевая тера¬ пия, лекарственные воздействия (цитостатики), эндометриоз, синдром Марфана, беременность. В последнее время приобретает актуальность пневмония, вызывае¬ мая Pneumocystis carinii, у больных синдромом приобретённого иммунодефицита. Причиной вторичного пневмоторакса являются СЗСТ [19, 30],По взаимоотношению с атмосферой вторичный спонтанный пневмоторакс может быть закрытым, клапанным (напряжённым), открытым внутрь (через повреждённую плевру с зияющим бронхом, бронхиолоальвеолярным простран¬ ством), открытым наружу (после дренирования). Среди воздушных образова¬ ний, являющихся причиной пневмоторакса при эмфиземе лёгких, выделяют воздушные кисты, находящиеся в толще паренхимы, но близко к висцеральной плевре; буллы, располагающиеся под плеврой и тонким слоем паренхимы;
ПНЕВМОТОРАКС, ГЕМОТОРАКС, ХИЛОТОРАКС И ФИБРОТОРАКС 799пузыри, располагающиеся под висцеральной плеврой, без прикрытия лёгочной паренхимой.Клинические проявленияКлиническая симптоматика при вторичном спонтанном пневмотораксе обычно не отличается от таковой при первичном, но более выражена, что обусловлено заболеванием, на фоне которого развился пневмоторакс.Рецидивы возникают лишь немного чаще, чем при первичном спонтанном пневмотораксе.ДиагностикаДиагностичесю^е затруднения могут возникнуть при интерпретации рентгено¬ грамм в связи с наслоением на изменения, вызванные пневмотораксом, признаков основного патологического процесса в лёгких. Чаще возникает необходимость применения КТ как для диагностики самого пневмоторакса и заболевания, его вызвавшего, так и для дифференциальной диагностики с буллами и кистами.ЛечениеИз-за наличия сопутствующей лёгочной патологии бессимптомное течение вто¬ ричного спонтанного пневмоторакса практически не встречается. Следовательно, наблюдательная тактика применима лишь для отдельных больных, находящихся под тщательным контролем.Простая аспирация также используется в очень редких ситуациях из-за её неэф¬ фективности.Клиническая декомпенсация этой группы больных часто происходит и без раз¬ вития напряжённого пневмоторакса. Поэтому любое показание для применения вентиляции с положительным давлением у больных вторичным спонтанным пневмотораксом должно автоматически рассматриваться как показание для дре¬ нирования плевральной полости.В большинстве случаев в раннем периоде показано проведение плевродеза для предупреждения рецидива. Исключение составляют больные, ожидающие транс¬ плантации лёгких (так как сращения могут значительно затруднить извлечение лёгкого и увеличить кровопотерю). а также пациенты с опухолями или инфек¬ циями, при которых невозможно полностью расправить лёгкое [19], Показания к хирургическому лечению, преимущественно BATO, соответствуют общим показа¬ ниям при пневмотораксе.ТРАВМАТИЧЕСКИЙ ПНЕВМОТОРАКСТравма способствует попаданию воздуха в плевральную полость через грудную стенку или через повреждение висцеральной плевры из воздухоносных путей. При тупой травме пневмоторакс развивается также в результате разрыва висцеральной плевры вследствие повышения альвеолярного давления или её ранения сломанны¬ ми и сместившимися рёбрами.Клинические проявленияКлинические проявления пневмоторакса зачастую перекрываются симптомами, связанными с самой травмой и её последствиями для окружающих тканей и орга¬ нов. Поэтому обследованию подлежат все больные с травмой, которая гготенци- ально может вызвать развитие пневмоторакса.ДиагностикаДиагноз ставится на основании рентгенографии грудной клетки, стоя или лёжа на боку.Компьютерная томография позволяет выявить многие так называемые скры¬ тые пневмотораксы, не видимые на рентгенограммах [31], Имеются данные обI
800ЗАБОЛЕВАНИЯ ПЛЕВРЫуспешном применении ультразвукового исследования для диагностики травмати¬ ческого пневмоторакса [32, 33].Лечениев большинстве случаев лечение травматического пневмоторакса начинают с дренирования плевральной полости. У больных с травматическим пневмоторак¬ сом вследствие его частого сочетания с гемотораксом рекомендуется выбор трубок большого диаметра — 9-12 мм. При наличии показаний, связанных с травмой других органов, необходимо хирургическое лечение. Немедленная торакотомия необходима в следующих случаях:• при переломе и/или отрыве трахеи и крупных бронхов, что обычно проис¬ ходит при одном и более переломах первых трёх рёбер спереди или сбоку; большинства больных наблюдается кровохарканье [34];• при травматическом разрыве пищевода (характерно повышение уровня ами¬ лазы в плевральной жидкости) [12],ЯТРОГЕННЫЙ ПНЕВМОТОРАКСЯвляется наиболее частым видом пневмоторакса. Описаны случаи его воз¬ никновения при проведении следующих процедур: трансторакальной тонко- и толстоигольной биопсии, пункции и катетеризации подключичной вены, тора- коцентезе, трансбронхиальной лёгочной биопсии, ИВЛ с положительным дав¬ лением (рис. 53-3), медиастиноскопии, межрёберных новокаиновых блокадах, установке тонких назогастральных зондов, а также различных торакальных операциях [12],ДиагностикаКлинические симптомы пневмоторакса, возникшие после проведения описан¬ ных выше манипуляций, и/или необъяснимое внезапное ухудшение состояния уРис. 53-3. Пневмоторакс при проведении ИВЛ при синдроме Мендельсона.
ПНЕВМОТОРАКС, ГЕМОТОРАКС. ХИЛОТОРАКС И ФИБРОТОРАКС 801больных на ИВЛ должны заставить лечащего врача провести необходимые диа¬ гностические мероприятия для исключения пневмоторакса, прежде всего рентге¬ нографию и, при необходимости (и возможности), КТ грудной клетки.Лечениепри малых бессимптомных пневмотораксах достаточно простого наблюдения.Для больших пневмотораксов или при выраженной симптоматике у ходячих боль¬ ных, находящихся под наблюдением, возможна аспирация или катетеризация тон¬ кими дренажами. Пневмоторакс на фоне баротравмы или в результате инвазивной ■ ^ процедуры у больного на ИВЛ с положительным давлением является показанием к немедленному стандартному дренированию плевральной полости.Показания к хирургическому лечению, преимущественно BATO, соответству¬ ют общим показаниям при пневмотораксе. Необходимо помнить о возможности сочетания пневмоторакса с повреждением пищевода в результате эндоскопии или дилатации, что следует исключить путём проведения эндоскопии или рентгено¬ скопии [19].НАПРЯЖЁННЫЙ ПНЕВМОТОРАКСЛюбой закрытый пневмоторакс из-за разрыва висцеральной плевры может перейти в напряжённый пневмоторакс, который развивается при накоплении воз¬ духа в плевральной полости под давлением, превышающим атмосферное, и приво¬ дит к сдавливанию ипсилатерального лёгкого. Это происходит, когда плевральный дефект формирует односторонний клапан, позволяющий воздуху выходить из лёгкого в плевральную полость, но не обратно. В конечном итоге это приводит к сдвигу средостения в противоположную сторону, значительному ограничению венозного возврата и снижению сердечного выброса, приводящим к нестабильной гемодинамике (рис, 53-4).Рис. 53-4. Напряжённый пневмоторакс слева. Рентгенограмма органов грудной клетки.
802 ЗАБОЛЕВАНИЯ ПЛЕВРЫ^ Клинические проявления и диагностикаНапряжённый пневмоторакс является угрожающим жизни экстренным сосгоя- нием. При отсутствии лечения он приведёт к остановке сердца и дыхания. При подозрении на напряжённый пневмоторакс недопустимо ожидать рентгенологи¬ ческого подтверждения диагноза при наличии неотложных показаний для дрени- ;; рования плевральной полости у декомпексированного больного. Диагноз у таких больных обычно ставится на основании клинических данных: дыхательной недо¬ статочности в сочетании с гипотензией, расширения ярёмных вен, одностороннего перкуторного гиперрезонанса, смещения и изгиба трахеи.ЛечениеПри отсутствии условий для экстренного дренирования плевральной полости у больного с дыхательной недостаточностью устанавливается внутривенный кате¬ тер 12-16 калибра во втором межреберье по среднеключичной линии, что перево¬ дит напряжённый пневмоторакс в открыгый. После декомпрессии дренирование может быть произведено в обычном порядке [19].ГемотораксГемотораксом называется накопление крови в плевральной полости. При этом гематокрит плевральной жидкости составляет не менее половины от гематокри¬ та периферической крови. Встречаются случаи, когда плевральная жидкость выглядит насыщенно геморрагической, а её гематокрит не превьшает 5% [12]. Подавляющее большинство гемотораксов вызвано травмой, включая ятроген¬ ную. Значительно реже наблюдаются кровотечение из метастатических опухолей с вовлечением плевры, кровотечение во время антикоагулянтной терапии по поводу ТЭЛА, катамениальный гемоторакс [19]. Исходя из причин, гемоторак¬ сы делятся на две большие группы: травматические (в том числе ятрогенные) и нетравматические. Если установить причину гемоторакса не удаётся, несмотря даже на проведённую торакотомию, то такой гемоторакс считается идиопатиче¬ ским [35].ЭТИОЛОГИЯ и ПАТОГЕНЕЗВ большинстве случаев травматический гемоторакс возникает в результате про¬ никающего ранения или тупой травмы грудной клетки. Кровь может изливаться в плевральную полость при травматическом повреждении сосудов грудной стенки, диафрагмы, лёгкого или средостения. Наиболее частой причиной возникнове¬ ния нетравматического гемоторакса являются метастатические злокачественные поражения и первичные опухоли плевры. На втором месте стоит терапия анти¬ коагулянтами. На третьем — спонтанный гемоторакс в результате коагуляционных нарушений у больных с гемофилией или тромбоцитопенией. интраторакального гематопоэза и эндометриоза; как осложнение спонтанного пневмоторакса, раз¬ рыва аномальных сосудов в грудной клетке, таких, как артериовенозные субплев- ральные шунты» аневризмы грудного отдела аорты или лёгочных артерий, неза- ращение артериального протока, коарктации аорты [12, 36],Кровь, поступившая в плевральную полость, как правило, быстро сворачива¬ ется, но, вероятно, в результате сердечных сокращений и дыхательных экскурсий лёгких может произойти дефибринация сгустка крови. При гемотораксе рано про¬ исходит осумкование экссудата,ДИАГНОСТИКАДиагноз гемоторакса обычно устанавливают на основании рентгенологического выявления жидкости в плевральной полости у больных. Уровень жидкости будет располагаться по линии Дамуазо при чистом гемотораксе. Высота расположения
ПНЕВМОТОРАКС, ГЕМОТОРАКС, ХИЛОТОРАКС И ФИБРОТОРАКС 803Рис. 53-5. Схема изменений уровня затемнения на рентгенограммах в зависимости от количе¬ ства крови в плевральной полости при гемотораксе: а — до 350 мл; б — 350-1500 мл; в — более 1500 мл.уровня жидкости зависит от объёма крови в плевральной полости (рис. 53-5). При гемопневмотораксе Зфовень жидкости будет горизонтальным.При первом рентгенологическом обследовании гемоторакс может быть не выявлен. Поскольку в некоторых случаях на рентгенограммах в положении боль¬ ного лёжа не удаётся выявить гемоторакс, то, по возможности, больным с травмой грудной клетки рекомендуется рентгенография грудной клетки в положении стоя. Пациентам с тяжёлой травмой грудной клетки необходима повторная рентгено¬ графия через 24 ч после травмы. Ценную информацию о количестве жидкости в плевральной полости и о форме гемоторакса даёт УЗИ плевральной полости и КТ. Независимо от характера ранения (проникающая или тупая травма грудной клетки) велика частота случаев развития пневмоторакса одновременно с гемото¬ раксом, Диагноз подтверждается пункцией плевральной полости,ЛЕЧЕНИЕВозможные последствия недренированного гемоторакса:• формирование свернувшегося гемоторакса:• переход в эмпиему;• появление плеврального вьшота;• переход в фиброторакс.Начальным лечением гемоторакса должно быть дренирование плевраль¬ ной полости трубкой большого диаметра — 11-12 мм. Если она недостаточ¬ на по производительности, необходимо установить дополнительные [19]. Преимуществами неотложного закрытого дренирования плевральной полости являются:• более полная эвакуация крови из плевральной полости;• полная остановка кровотечения, если оно является следствием разрыва плевры;• возможность количественной оценки величины гемоторакса;• снижение вероятности последующего развития эмпиемы плевры, поскольку кровь является хорошей питательной средой для микроорганизмов;• быстрое и адекватное удаление крови из плевральной полости снижает веро¬ ятность развития фиброторакса;• кровь из плевральной полости, выведенная при дренировании, при отсут¬ ствии противопоказаний может быть вновь перелита больному.Некоторые клиницисты рекомендуют вводить дренаж высоко, по средней под¬ мышечной линии (четвёртое или пятое межреберье), так как при травме грудной клетки может отмечаться высокое стояние купола диафрагмы. По прекращении
804 ЗАБОЛЕВАНИЯ ПЛЕВРЫg - функционирования дренажа его нужно удалить из плевральной полости, так какЩ дренажная трубка может служить проводником инфекции.Хотя вопрос о необходимости неотложной торакотомии в каждом конкрет¬ ном случае решается индивидуально, имеются общепринятые показания к ее проведению: при ранении в «опасную зону» и подозрении на тампонаду сердца, повреждении крупного сосуда (чаще артериального), в случае широкого бронхо¬ плеврального сообщения с напряжённым гемопневмотораксом, не устраняемым дренированием плевральной полости. Кроме этого, неотложная торакотомия про¬ водится при продолжающемся внутриплевральном кровотечении. Торакотомия или BATO (при наличии оборудования и персонала) рекомендуется также, если, несмотря на дренирование, резидуальный гемоторакс занимает более 30% плев¬ ральной полости [19]. BATO показала себя безопасным и эффективным методом эвакуации крови из плевральной полости, сокращающим время нахождения дре¬ нажных трубок, время пребывания в стационаре и стоимость лечения. Чем раньше сделана попытка удаления сгустка, тем больше шансов, что эвакуация с помощью BATO будет полностью успешной [19].Обнадёживающие результаты получены при применении для растворения сгуст¬ ков крови внутриплеврального введения стрептокиназы при высокой активности плазминогена в лаважной жидкости из плевральной полости (выше 8%) и стреп¬ токиназы со свежезамороженной плазмой — при низкой активности плазмогена в плевральном экссудате (ниже 8%) [37, 38]. Следует отметить, что данный мало¬ инвазивный метод лечения нашёл широкое применение не только у пациентов с изолированной травмой груди, но и у больных с тяжёлой сочетанной травмой, пожилых пациентов с тяжёлыми сопутствующими заболеваниями.До 4% гемотораксов инфицируются. Частота такого осложнения может быть уменьшена с помощью антибиотикопрофилактики. Это осложнение встречается чаще у больных, поступивших с шоком, видимым загрязнением плевры во время травмы, сопутствующими повреждениями органов брюшной полости, при длитель¬ ном нахождении дренажа в плевральной полости [19], Важную роль в патогенети¬ ческом лечении эмпиемы плевры играет дифференцированное внутриплевральное применение в фазу разгара воспаления ингибиторов протеиназ [апротинин (кон- трикал*, гордокс*), антагозан*], экстракорпорально стимулированных моноцитов для повышения их коагулянтной активности и улучшения отграничения очага вос¬ паления; использование стрептокиназы (при уровне плазминогена в плевральной полости выше 8%) или свежезамороженной плазмы со стрептокиназой (при уров¬ не плазминогена в плевральной полости ниже 8%) для проведения биохимической декортикации лёгкого в фазу регрессии воспаления [39],ЯТРОГЕННЫЙ ГЕМОТОРАКСГемоторакс может развиваться вследствие ятрогенных причин. Наиболее часты¬ ми являются перфорация центральной вены при чрескожной катетеризации или подтекание крови при проведении транслюмбальной аортографии, Ятрогенный гемоторакс может возникнуть при проведении торакоцентеза. биопсии плевры, чрескожной аспирационной биопсии лёгкого, трансбронхиальной биопсии лёгко¬ го, эндоскопической склерозирующей терапии при варикозном расширении вен пищевода, реанимационных мероприятий по поводу остановки сердца и дыхания. Больных с ятрогенным гемотораксом следует лечить по общей схеме дренирова¬ нием плевральной полости или торакоскопически. При необходимости произво¬ дят торакотомию.ГЕМОТОРАКС КАК ОСЛОЖНЕНИЕ ТЕРАПИИ АНТИКОАГУЛЯНТАМИТерапия антикоагулянтами — варфарином, нефракционированным и низкомолеку¬ лярным гепарином — может осложниться гемотораксом [40,41]. Обычно гемоторакс
ПНЕВМОТОРАКС, ГЕМОТОРАКС, ХИЛОТОРАКС И ФИБРОТОРАКС 805Рис. 53-6. Гемоторакс, возникший через 4 дня после повышения дозы варфарина у больного с про¬ тезированием митрального и аортального клапанов.возникает через 4-7 дней после начала такой терапии, но в отдельных случаях он может возникнуть значительнее позднее, даже через несколько месяцев (рис. 53-6).Показатели свёртываемости крови у этих больных, как правило, соответство¬ вали допустимому терапевтическому уровню. Лечение гемоторакса, возникшего на фоне антикоагулянтной терапии, состоит в немедленном прекращении приёма данного лекарственного препарата и эвакуации крови из плевральной полости. Для эвакуации крови из плевральной полости и оценки скорости кровотечения следует ввести в плевральную полость дренаж. При продолжающемся интенсив¬ ном кровотечении (более 100 мл/ч) показана экстренная торакотомия [40].ХилотораксХилоторакс — это экссудативный плевральный выпот, содержащий лимфу, бога¬ тую триглицеридами и хиломикронами, поступающими в результате всасывания жиров из кишечника по путям лимфооттока в грудной лимфатический проток.ЭТИОЛОГИЯЭтиология хилоторакса на основании литературных [42] и собственных данных может быть представлена в следующем виде:• Врождённый:первичный персистирующий хилоторакс плода:❖ атрезия грудного лимфатического протока:свищ грудного лимфатического протока с плевральной полостью;❖ родовая травма.• Травматический и/или ятрогенный:❖ после тупой травмы;❖ после проникающего ранения;<■ хирургические причины:- шея: удаление лимфатических узлов, радикальная лимфодиссекция шеи;- торакальные операции по поводу незаращения артериального протока, коарктации аорты, врождённых диафрагмальных грыж;
806 ЗАБОЛЕВАНИЯ ПЛЕВРЫ?< - сосудистые операции и манипуляции, вовлекающие устье левой подклю¬чичной артерии (эзофагэктомия; симпатэктомия; аневризмы грудного от¬ дела аорты; удаление опухолей средостения; левосторонняя пневмонэкто¬ мия; трансплантация лёгких и сердца);- абдоминальные и забрюшинные операции: симпатэктомия, радикальная лимфодиссекция;- спинальные операции;❖ диагностические процедуры:- транслюмбарная артериография;- катетеризация подключичной вены;- катетеризация левых отделов сердца;- эзофагоскопия.• Новообразования.• Инфекции:❖ туберкулёзный лимфаденит;❖ неспецифический медиастинит;❖ восходящий лимфангиит;❖ филяриоз.• Прочие:❖ венозный тромбоз:- левого подключично-ярёмного сегмента;- верхней полой вены;❖ лёгочный лимфангиоматоз;❖ хилоперитонеум;О' кишечные лимфангиэктазии (или ретикулярная гиперплазия);❖ синдром «жёлтых ногтей»;❖ фиброз средостения;❖ воспаление грудного лимфатического протока; амилоидоз;❖ синдром Горама.Если причину хилоторакса установить невозможно, то он считается идиопати¬ ческим.Более половины хилотораксов вызвано опухолями, и среди них лимфома зани¬ мает приблизительно 75%. На втором месте стоит травма, чаще всего в результате торакальной или сердечно-сосудистой операции. Частота хилоторакса после кар- диоторакальных операций невысока (0,5-2,5% [43,44]). Хилоторакс развивается наиболее часто после хирургической травмы грудного лимфатического протока или его главных ветвей (рис. 53-7). Обычно он односторонний. Хилоторакс может возникнуть справа после эзофагэктомии, поскольку грудной лимфатический про¬ ток наиболее часто повреждается при диссекции дистального отдела пищевода. Если медиастинальная плевра повреждена с обеих сторон, может возникнуть двухсторонний хилоторакс. Левосторонний хилоторакс может возникнуть после левосторонней шейной диссекции, особенно в области слияния подключичной и внутренней яремной вен, катетеризации центральной вены и других манипуляций. Хилоторакс может также последовать за нехирургическими травмами, такими, как проникающие и тупые травмы грудной клетки или области шеи (например, непе- нетрирующие травмы, сопровождающиеся гиперэкстензией позвоночника или переломом позвонков), и даже явиться следствием подъёма тяжестей, чрезмерных вытягиваний, сильного кашля или рвоты, родов и др. [45]. Он также встречается у новорождённых в результате родовой травмы и в виде так называемого первично¬ го плеврального выпота плода (когда невозможно установить никакую явную при¬ чину) [40]. Наследственные лимфангиэктазии — это редкое заболевание, которое может вызвать хилоторакс плода [46]. Также происхождение хилоторакса может
ПНЕВМОТОРАКС, ГЕМОТОРАКС, ХИЛОТОРАКС И ФИБРОТОРАКС 807Рис. 53-7. Хилоторакс вследствие повреждения грудного лимфатического протока при операции пневмонэктомии с лимфодиссекцией по поводу рака левого лёгкого,быть обусловлено хилоперитонеумом в результате движения хилёзной лимфы через диафрагму в плевральную полость (по уже имевшимся или вновь сформиро¬ ванным порам). Хилоперитонеум имеет многие причины, сходные с таковыми при хилоторакса. Даже цирроз печени может вызвать это осложнение [47].КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯСимптоматика, физикальные и рентгенологические данные при хилотораксе будзт такими же, как и при другом плевральном выпоте соответствзшзщего разме¬ ра. Плевральная боль в грудной клетке и гипертермия встречаются редко, так как лимфа в грудном лимфатическом протоке и его ветвях обладает бактериостатиче- скими свойствами и способна оставаться неинфицированной при комнатной тем¬ пературе несколько недель, кроме того, она не обладает раздражающим действием на ткани и не вызывает утолщения плевры [40]. При хилотораксе нетравматиче¬ ского характера начало и развитие симптомов постепенное. Первыми симптомами, как правило, являются диспноэ при нагрузке и дискомфорт на поражённой сторо¬ не. При травматическом хилотораксе имеется латентный период 2-10 дней между травмой и началом клинических проявлений [48], в течение которого лимфа может накопиться в заднем средостении и сформировать там хилому, имеющую вид опухоли заднего средостения на рентгенографии грудной клетки и исчезаю¬ щую после разрыва медиастинальной плевры и формирования хилоторакса (12].Основная опасность хилоторакса для жизни — потеря дренируемой наружу лимфы, а это 1,5-2,5 л жидкости в день, богатой белком, жирами, электролитами и лимфоцитами. Это быстро истощает больного и приводит к метаболическим нарушениям и иммунодефициту. Поэтому конституциональные симптомы не заставят себя ждать [49]. В норме в каждых 100 мл лимфы содержится 0,4-5 г жира, 65-220 мг холестерина, 2,21-5,9 г белка (обычно более 3 г), в том числе 1,1-4,1 г альбумина, 1 Д-3,1 г глобулина, до 2,4 г фибриногена, 48-200 мг сахара. Основным клеточным компонентом являются Т-лимфоциты [12, 48].ДИАГНОСТИКАНа обзорной рентгенограмме выявляется плевральный выпот. Уровень жидко¬ сти при хилотораксе более пологий, чем при плевритах.
808 ЗАБОЛЕВАНИЯ ПЛЕВРЫДиагноз основывается на анализе жидкости. Классически хилоторакс имеет вид опалесцирующей жидкости, похожей на молоко. Однако по некоторым наблюдениям она может быть серозно-геморрагической. После отстаивания жидкость при хилотораксе разделяется на три слоя: верхний сливкообразный содержит хиломикроны; средний похож на молоко; нижний содержит клеточные элементы. Когда после центрифугирования мутность жидкости остаётся, то это почти всегда является результатом высокого содержания в ней жира. Уровень триглицеридов более 1100 мг/л (1,24 ммоль/л), отношение уровней триглицери¬ дов в плевральной жидкости к крови более 1,0, отношение уровней холестерина в плевральной жидкости и крови менее 1,0 очень подозрительно на лимфу, в то время как уровень триглицеридов менее 50 мг/мл исключает диагноз хилоторак¬ са [42]. Промежуточные уровни требуют анализа липопротеинов для доказатель¬ ства присутствия хиломикронов для обоснования диагноза. Некоторые считают наиболее надёжным тестом дать рег о$ сливки и проследить изменения дренаж¬ ной жидкости, так как больные, не получающие питания(что нередко после травмы), имеют значительно сниженный уровень триглицеридов в плевральной жидкости, что может привести к ложноотрицательному результату.Для установления причины хилоторакса при отсутствии травмы следует в пер¬ вую очередь исключать лимфому, КТ грудной клетки и средостения, брюшной полости и забрюшинного пространства поможет выявить лимфаденопатию, а у женщин с паренхиматозными инфильтратами в лёгких — лёгочный лимфан¬ гиолейомиоматоз. Другой полезной диагностической процедурой у больных нетравматическим хилотораксом может быть двухсторонняя лимфангиография, позволяющая выявить место подтекания лимфы и иногда установить причину. В качестве альтернативы применяется лимфангиосцинтиграфия с меченным ^Тс альбумином [50].Плевральная биопсия и торакоскопия обычно не показаны больным с хилото¬ раксом, так как редко помогают установить его причину.ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКАТолько три состояния могут дать молочноподобный выпот:• хилоторакс;• псевдохилоторакс;• эмпиема плевры.Если после центрифугирования супернатант выпота становится прозрачным, то это, скорее всего, эмпиема плевры. Если он остаётся мутным, то необходима микроскопия осадка и определение холестерина, триглицеридов и хиломикронов в выпоте. При псевдохилотораксе у большинства больных в осадке будут кристаллы холестерина и повышенный уровень холестерина в жидкости (>250 мг/100 мл или >6,45 ммоль/л) [12],ЛЕЧЕНИЕПлан лечения любого хилоторакса зависит от его причины, количества отде¬ ляемой жидкости и состояния больного. Выделяются три основных направления лечения хилоторакса:• нутритивная поддержка и уменьшение подтекания лимфы;• купирование диспноэ удалением скопившейся лимфы и предупреждение её накопления в плевральной полости;• закрытие дефекта.Большинство больных лечат коротким периодом голодания с полным паренте¬ ральным питанием, дренированием плевральной полости и наблюдением в тече¬ ние 2 нед (так как половина дефектов в течение 2 нед закрывается самостоятельно [51]), При продолжении значительного отхождения лимфы (более 500 мл/сут
ПНЕВМОТОРАКС, ГЕМОТОРАКС, ХИЛОТОРАКС И ФИБРОТОРАКС 809У взрослых или более 100 мл/сут в сутки у младенцев), несмотря на полное парентеральное питание и хорошее расправление лёгкого, рекомендуется раннее хирургическое лигирование протока. При небольшом подтекании лимфы и невоз¬ можности полного парентерального питания считается приемлемым использовать безжировую диету или применять триглицериды со средней длиной цепи [52]. Октреотид, по некоторым данным, способствует прекращению подтекания лимфы, хотя механизм его действия не совсем ясен [53].Если по истечении 2 нед потери лимфы остаются высокими, показано хирурги¬ ческое закрытие дефекта, которое может быть выполнено различными доступами. При торакотомии возможно лигирование как самого дефекта при его надёжной идентификации, так и грудного лимфатического протока (рекомендуется прово¬ дить с правой стороны сразу после его появления из-под диафрагмы или с обеих сторон дефекта [54]), а также париетальная плеврэктомия. Непосредственно перед операцией для лучшей визуализации дефекта рекомендуют дать/?его5 сливки. В цен¬ трах, где имеется достаточный опыт, успешно применяют видеоассистированную эндоскопическую торакальную операцию с лигированием дефекта, клипировани- ем или заклеиванием его или лигированием грудного лимфатического протока[19]. Недавно было успешно применено лапароскопическое лигирование грудного лимфатического протока [55]. Также применяется лимфатическая эмболизация и блокада грудного лимфатического протока [56].ПсевдохилотораксДве различные ситуации могут привести к высокому содержанию жиров в плев¬ ральной жидкости:• повреждение грудного лимфатического протока и его главных ветвей, приво¬ дящее к попаданию лимфы в плевральную полость и образованию хилоторак¬ са;• накопление большого количества холестерина или лецитин-глобулиновых комплексов в длительно существующем плевральном выпоте, приводящее к псевдохилотораксу.Эти два состояния необходимо чётко дифференцировать, так как их этиология и лечение абсолютно различны [12]. Псевдохилоторакс является еще более ред¬ ким состоянием, чем хилоторакс, в литературе описано около 200 случаев [57].Плевральные поверхности у большинства больных заметно утолщены, ино¬ гда с кальцификацией, время существования плеврального выпота более 5 лет. В этом случае плевра насыщается холестерином [40], так как во время активного воспаления повышается его фильтрация в плевральную полость. Источником холестерина могут стать гибнущие эритроциты и лейкоциты. Утолщённая плевра ингибирует выведение холестерина из плевральной полости. Основными причи¬ нами псевдохилоторакса являются туберкулёзный плеврит (54%) и хронический ревматоидный плеврит (9%) [57]. Изредка он может бьггь ассоциирован с травмой или хирургическим вмешательством [58]. Диагноз ставится на основании исследо¬ вания плевральной жидкости. После центрифугирования супернатант выпота не становится прозрачным, у большинства больных в осадке определяют кристаллы холестерина характерной ромбовидной формы и повышенный уровень холесте¬ рина в выпоте (>6,45 ммоль/л) [45]. КТ может выявить жировые наложения и утолщение плевры [59]. Лечение псевдохилоторакса должно быть направлено на лечение вызвавшего его заболевания (в основном туберкулёза). При выражен¬ ных дыхательных нарушениях и большом объёме выпота показаны плевральная пункция и дренирование, хотя их выполнение усложняется утолщённой плеврой и отрицательным внутриплевральным давлением [40].
810ЗАБОЛЕВАНИЯ ПЛЕВРЫФибротораксФиброторакс происходит в результате отложения толстого фиброзного слоя на плевре. Недавние исследования предположили значительную роль в этом процессе профиброзных цитокинов, особенно трансформирующего ростового фактора-р [40].Наиболее часто фиброторакс является осложнением эмпиемы или гемоторак¬ са. Также он может быть осложнением туберкулёза, СЗСТ, уремии, парагонимоэе и реакций на препараты. В случаях возникновения фиброторакса в результате контакта с асбестом плевральный фиброз развивается вместе с облитерацией плевральной полосги после плеврального выпота и обычно носит двухсторонний характер [60], Фиброз плевры (с сопутствующим фиброзом лёгкого или без него) может также развиться в результате применения бромокриптина, перголида и метисергида*^, при этом он обычно является двухсторонним, хотя может быть и односторонним [12, 40]. Сообщалось об идиопатическом фибротораксе и случаях наследственного фиброторакса [61]. Фиброторакс также может быть ятрогенным, искусственно вызванным в результате плевродеза, который используется для кон¬ троля, лечения и предотвращения рецидива плеврального выпота и пневмоторакса (при этом ни химический, ни хирургический плевродез не приводят к значитель¬ ным нарушениям лёгочной функции) [62].КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯКлинические проявления у большинства больных обусловлены в первую оче¬ редь основным заболеванием.ДИАГНОСТИКАВ типичных случаях диагноз фиброторакса ставится легко на основании рент¬ генологической картины (рис. 53-8) и анамнеза (плевральный выпот, ранение.Рис. 53-8. Фиброторакс у больного, перенёсшего долевую пневмонию. Рентгенограмма органов грудной полости.
ПНЕВМОТОРАКС, ГЕМОТОРАКС, ХИЛОТОРАКС И ФИБРОТОРАКС $11инфекция и др,). КТ поможет точно выявить фиброзное покрытие на лёгком; отдифференцировать его от жировых отложений, возможных при высокой степе¬ ни ожирения; количественно оценить толщину плевры и фракцию вовлечённого гемиторакса, коррелирующие с нарушениями ФВД [64]. Исследование ФВД пока¬ зывает рестриктивные дыхательные нарушения от лёгкой степени до выраженной [40],ЛЕЧЕНИЕБольным с фибротораксом следует избегать препаратов, которые могут его индуцировать.После периода дыхательной недостаточности у части больных может быть спон¬ танное симптоматическое улучшение и утончение плевры в течение 3-6 мес [63],Декортикация показана больным при значительном нарушении функции лёг¬ ких, у которых фиброторакс стабилен или ухудшается, по меньшей мере, в тече¬ ние нескольких месяцев [21]. Если выявляются значительные паренхиматозные лёгочные нарушения или не ожидается достаточного расправления лёгочной паренхимы после операции, декортикация не показана, равно как и больным с тяжёлой сопутствующей патологией [19].Заключениев диагностике и лечении пневмоторакса, хилоторакса, гемоторакса, фибро¬ торакса есть много общих задач. Пневмоторакс и гемоторакс требуют принятия неотложных мер на основе точной диагностики и незамедлительного лечебного воздействия с целью снижения возможного риска неблагоприятного исхода. Хилоторакс требует также принятия адекватной программы лечения во избежание истощения больного с риском для жизни. Непринятие мер по лечению процессов, сопровождающихся развитием фиброза в плевральной полости, угрожает ограни¬ чением функциональных возможностей лёгкого. Основные принципы диагности¬ ки и лечения этих заболеваний, изложенные в этой главе, могут способствовать улучшению исходов их лечения.список ЛИТЕРАТУРЫ.*
Глава 54 Опухоли плеврыВпервые об опухоли плевры сообщил Lietand [1], а первое гисто¬ логическое описание её сделал Е, Wagner в 1870 г. [2]. Первые рабо¬ ты по гистологическим формам опухоли плевры были опубликова¬ ны в 1927-1942 гг. [3. 4].Опухоли плевры бывают первичными и вторичными. Первичные опухоли могут исходить из мезотелиальных клеток, расположенных на базальной мембране, а также из подлежащей сложно построен¬ ной соединительной ткани. Первичные опухоли могут быть добро¬ качественными и злокачественными. Наиболее частая первичная злокачественная опухоль плевры — злокачественная мезотелиома. Очень редко встречаются первичные саркомы из элементов соеди¬ нительной ткани плевры и лимфомы.Злокачественные опухоли плевры в большинстве своём являются метастатическими. Среди них первое место занимают рак лёгкого, молочной железы, толстой кишки и лимфомы.Очень редко встречаются доброкачественные опухоли, напри¬ мер, нейрофибромы.ЭПИДЕМИОЛОГИЯВ структуре заболеваемости злокачественными новообразова¬ ниями мезотелиома составляет 0,16%, а в структуре смертности -0,38% [5, 6]. Заболеваемость мезотелиомой плевры, по данным российских авторов, составляет 2-9 на 100 ООО населения [7]: среди мужчин — 15-20, среди женщин — 3 [8]. Мезотелиома плевры составляет 57,1% среди всех опухолей мезотелия [6]. Средний воз¬ раст больных мезотелиомой — 50-70 лет [9],Первичные опухоли плеврыГистологическая классификация первичных опухолей плевры ВОЗ [10]:I, Мезотелиальные опухоли.1. Диффузная злокачественная мезотелиома:❖ эпителиоидная мезотелиома;❖ саркоматозная эндотелиома; десмопластическая мезотелиома;❖ двухфазная мезотелиома.2. Локализованная злокачественная мезотелиома.3. Другие опухоли мезотелиального происхождения:❖ высокодифференцированная папиллярная мезотелиома;❖ аденоматоидная опухоль.
ОПУХОЛИ ПЛЕВРЫ 813II. Лимфопролиферативные заболевания.1. Первичная лимфома в виде выпота.2. Лимфома, ассоциированная с пиотораксом.1Ы. Мезенхимальные опухоли.1. Эпителиоидная гемангиоэндотелиома:❖ ангиосаркома.2. Синовиальная саркома:❖ монофазная;❖ двухфазная.3. Солитарная фиброзная опухоль.4. Опухоль плевры с кальцификацией,5. Десмопластическая круглоклеточная опухоль.ДИФФУЗНАЯ ЗЛОКАЧЕСТВЕННАЯ МЕЗОТЕЛИОМА ПЛЕВРЫДиффузная злокачественная мезотелиома — злокачественная опухоль плев¬ ры из мезотелиальных клеток, демонстрирующая диффузный характер роста на поверхности плевры [10],ЭтиологияНаиболее часто выявляемым фактором риска развития мезотелиом является асбест [11-13], В большинстве индустриальных стран более 90% плевральных мезотелиом у мужчин возникают после предшествующего контакта с асбестом [14, 15], Подчёркивая взаимосвязь его с мезотелиомой, последнюю называют «индикаторным заболеванием» асбестовой экспозиции [16, 17]. Проявления мезотелиомы фиксируются через 20-50 лет [18, 19] после начала экспозиции. Принимая во внимание период его максимального промышленного потребления, следует ожидать дальнейшего роста частоты мезотелиомы с пиком в 2010-2025 гг. [8,20,21].Кроме асбеста в генезе мезотелиомы плевры придаётся значение и другим химическим факторам: минералу эриониту [22,23], бериллию, жидкому парафину [8], меди, никелю, резине, кремнезёму, саже, полиуретану, этиленоксиду, диэтил- стильбэстролу и др. [24]. Изучается роль вирусов МС29 птичьего лейкоза, 8У-40 в развитии мезотелиомы [10, 12, 13, 24-26]. Не исключена возможность влия¬ ния генетических поломок [27, 28). В развитии мезотелиом придаётся значение ионизирующему излучению [24, 25], хроническим воспалительным процессам, а также патологическим изменениям, ведущим к интенсивному рубцеванию плевры [10,12, 13, 24, 29, 30].ПатогенезОпределённая фракция попавших при дыхании волокон асбеста навсегда задерживается в лёгочной ткани и может выходить в плевральное простран¬ ство. Небольшое количество волокон асбеста индуцирует скопление моноцитов и инкапсулируется многоядерными макрофагами. Этот процесс ассоциирован с отложениями белка и железа из гемоглобина, приводящими к формированию ферругинозных телец [10].Патологическая анатомияОпухоль характеризуется инфильтрирующим диффузным ростом. Макроскопи¬ чески диффузная мезотелиома представлена узлами различного размера, сливаю¬ щимися друг с другом, мягкой консистенции, с характерным «сальным» блеском, с возможными участками желтоватого или красноватого цвета. Поражается, как правило, и висцеральная, и париетальная плевра. Процесс распространяется далее по междолевым щелям и выглядит как плотный инфильтрат, который оку¬ тывает часть или всё лёгкое, достигая в толщине от нескольких миллиметров до
814ЗАБОЛЕВАНИЯ ПЛЕВРЫ10-15 см [9, 13]. Мезотелиома отличается медленным, но агрессивным ростом[20]. Злокачественная мезотелиома плевры нередко прорастает в перикард, q>e- достение, грудную стенку, диафрагму и брюшину, почти всегда метастазирует по лимфатическим путям, реже гематогенно [20]. Частота поражения различных отделов париетальной плевры примерно одинакова, у большинства больных (до 60%) наблюдается правосторонняя локализация.Анализ литературных данных и собственных наблюдений позволяет отметить следующие особенности роста мезотелиомы плевры:• локально-регионарный рост с распространением вдоль междолевых щелей, инвазией в лёгкое, диафрагму, перикард, грудную стенку (особенно вдоль вколов иглы или мест хирургической биопсии);• поражение одного гемиторакса с тенденцией выстилания плевральной поло¬ сти в виде плотной, похожей на плевральные наложения массы, со спаивани¬ ем плевральных листков, инвагинацией между долями лёгкого;• возможное распространение на другую плевральную полость;• относительно медленный рост;• накопление в плевральной полости серозного, фибринозного, геморрагическо¬ го экссудата с изменяющимся объёмом, а также желатиноподобной жидкости;• возможность имплантационных метастазов;• возникновение отдалённых метастазов в печени, лёгких, почках, надпочечни¬ ках, костях.Клиническая классификацияСтадирование осуществляется согласно классификации TNM (6-й пересмотр) International Mesothelioma Panel и Международного противоракового союза (Union Internationale Contre le Cancer — UICC), где буквой Т (tumor) обозначен размер опухоли, N (nodus) — поражение лимфатических узлов (ЛУ), М (metastasis) — наличие отдалённых метастазов (табл. 54-1, 54-2) [10].Таблица 54-1. Классификация TNM мезотелиомы плеврыТ - первичная опухольТНедостаточно данных для оценки первичной опухолиТоПервичная опухоль не определяетсяОпухоль поражает париетальную плевру на стороне поражения с вовлечением висцеральной плев- ры или без негоТ,яОпухоль вовлекает париетальную плевру (медиастинальную, диафрагмальную) на стороне пораже¬ ния, но не распространяется на висцеральную плевруОпухоль вовлекает париетальную плевру (медиастинальную, диафрагмальную) на стороне пораже¬ ния, имеется очаг опухоли на висцеральной плеврет.Опухоль распространяется на любую поверхность плевры на стороне поражения с любым из сле¬ дующих осложнений; сливается с висцеральной частью опухоли (включая образование фистулы): распространяется на диафрагмальную мышцу; распространяется на лёгочную паренхимуТз*Опухоль распространяется на любую поверхность плевры на стороне поражения с любым из сле¬ дующих осложнений: распространяется на внутригрудную фасцию; распространяется на жировую ткань средостения; локально распространяется на мягкие ткани грудной стенки; распространяется на перикард без сквозного поражения стенкиV*Опухоль распространяется на любую поверхность плевры на стороне поражения с любым из сле¬ дующих осложнений: диффузное или многофокусное распространение на мягкие ткани грудной стенки; любое поражение рёбер; распространение через диафрагму в брюшную полость; распро¬ странение на любой орган средостения; прямое врастание в контралатеральную плевру: пораже¬ ние позвоночника; распросфанение на внутреннюю поверхность перикарда; экссудат в перикарде с опухолевыми клетками: врастание в миокард; врастание в плечевое сплетение
ОПУХОЛИ ПЛЕВРЫ 815Окончание табл. 54-1N - регионарные лимфатические узлыNНедостаточно данных для оценки регионарных ЛУNoНет признаков метастатического поражения регионарных ЛУN.Метастазы в перибронхиальные ЛУ и/или ЛУ корня лёгкого на стороне пораженияМетастазы в бифуркационные ЛУ и/или внутренние грудные ЛУ или медиастинальные ЛУ на сто¬ роне пораженияN3Метастазы в контралатеральные ЛУ: медиастинальные, внутренние грудные или ЛУ корня лёгкого и/или надключичные ЛУМ - отдалённые метастазыМ.Недостаточно данных для определения отдалённых метастазовМ.,Нет признаков отдалённых метастазовм,Имеются отдалённые метастазыПримечание; * - местное распространение, потенциально резектабельная опухоль: ** - местное распространение, технически нерезектабельная опухольТаблица 54-2. Определение стадии мезотелиомы в соответствии с ТЫМ-классификациейСтадиятNM1Ат.NoMoIBNoMoItт.NoIIIN1MoТ,т,N.ЧТзN, N,, N,MoIVтN,Moт.NMoтNM,Не утратили своего значения классификации Е. Butchart (1976), D. Sugarbaker, Brigham and Women’s Hospital (1993), приведённые в табл. 54-3 [31-34].Таблица 54-3. Классификация мезотелиомы плевры по Butchart и SugarbakerСтадииХарактеристика процессапо Е. Ви1сЬаг1по D. SugarbakerОценка распространенияОценка прогноза и показаний к отдельным мето¬ дам лечения1Опухоль не выходит за пределы ипсилатеральной плевральной полости: париетальная плевра, лёгкое, перикард, диафрагмаОпухоль не выходит за пределы ипсила¬ теральной плевралыной полости: парие¬ тальная плевра, лёгкое, перикард, диа¬ фрагма, Прорастание в грудную стенку только в местах выполнения биопсииПолностью резеци¬ руемаШ
816ЗАБОЛЕВАНИЯ ПЛЕВРЫОкончание табл. 54-3Опухоль инвазирует грудную стенку или вовлекает органы средостения, противоположную медиастинальную плевру, пора¬ жены лимфоузлы средостенияОпухоль не выходит за пределы ипсила- теральной плевральной полости: парие¬ тальная плевра, лёгкое, перикард, диа¬ фрагма. Прорастание в грудную стенку в местах выполнения биопсии. Поражение ипсилатеральных лимфоузлов N,-N2На грани опера¬ бельности и/или интраплеврапьное поражение лимфо¬ узловОпухоль пенетрирует диафрагму, вовлекая брюшину, вовлече¬ на противоположная плевра. Поражены лимфоузлы за преде¬ лами грудной полостиРаспространение опухоли на груд¬ ную стенку, средостение, сердце. Распространение через диафрагму на брюшину. Поражение лимфоузлов NЛокальное рас¬ ширение и экс- траплевральное распространениеОтдалённые гематогенные мета¬ стазыОтдалённые гематогенные метастазыКлинические особенностиСемиотика злокачественных мезотелиом плевры неспецифична. Клиническая картина при различных гистологических вариантах злокачественной мезотелио¬ мы и на ранних стадиях сходная. Первыми проявлениями, как правило, бывают боль в грудной клетке при дыхании и повышение температуры тела. Отмечается быстрое накопление в плевральной полости геморрагического экссудата, сопрово¬ ждающееся одышкой [35, 36].В начале развития заболевания боль локализованного характера и непосто¬ янная. Затем нарастает и становится интенсивной, упорной по мере увеличения опухоли в размерах и прорастания в окружающие органы и ткани, симулируя при этом межрёберную невралгию. Если опухоль локализуется в области верхушки лёгкого, то отмечается иррадиация боли в лопатку, плечевой сустав, руку на сто¬ роне поражения. Поражение опухолью рёберной плевры чаще сопровождается болями в грудной клетке. При прорастании купола плевры появляются синдром Горнера, боли в грудной клетке и надключичной области. А если опухоль исходит из медиастинальной плевры, то при её росте развивается компрессионный син¬ дром ~ одутловатость лица и шеи, чувство стеснения за грудиной, расширение поверхностных вен грудной стенки.При выраженном процессе наиболее частые симптомы — одышка (диспноэ), обычно в результате большого количества жидкости в плевральной полости, и боль в грудной клетке. Они могут быть ассоциированы с конституциональными симптомами, особенно с потерей массы и утомляемостью.Дополнительные симптомы включают кашель, гипертермию, потливость, слабость, отсутствие аппетита, вплоть до анорексии. Нехарактерными и нечастыми симптома¬ ми являются миалгия, афония, дисфагия, вздутие живота, тошнота и неприятный вкус во рту, а также спонтанный пневмоторакс, рост в виде опухолевидного образования в лёгком с его сегментарным или лобарным коллапсом, поражение гортанного нерва или сдавление верхней полой вены в результате инвазии в средостение.При осмотре можно выявить сглаженность межрёберных промежутков и отсут¬ ствие изменения формы грудной клетки при дыхании после эвакуации экссудата. На поздних стадиях отмечается уменьшение объёма и подвижности гемиторакса. При перкуссии — укорочение перкуторного звука и отсутствие дыхательной экс¬ курсии лёгких. Прослушать дыхательные шумы при аускультации, как правило, не удаётся из-за выраженного утолщения плевры. Распространение опухоли через диафрагму может привести к обсеменению брюшины и асциту, что часто находят на аутопсии. Изредка это вызывает неуверенность относительно расположения первичного очага. Симптомы, вызванные метастазами в ЛУ, изредка являются превалирующими в клинической картине мезотелиомы. Гематогенные метаста-
ОПУХОЛИ ПЛЕВРЫ817Рис. 54-1. Рентгенограмма органов грудной полости больного с диффузной злокачественной меэо> телиомой плевры справа.зы мезотелиомы плевры могут быть найдены в лёгких, печени, надпочечниках, костях, мозге или почках, хотя клиническая картина мезотелиомы в качестве метастатического заболевания является редкой [10,12,13].ДиагностикаДооперационная диагностика злокачественных мезотелиом включает:• анализ жалоб и анамнеза;• лучевую диагностику (многоплоскосгную рентгеноскопию и рентгенографию, КТ, МРТ, ПЭТ, УЗИ);• эндоскопическую диагностику;• взятие биопсийного материала соответствующего качества;• верификацию диагноза (гистологическими, иммуногистохимическими, электронно-микроскопическими методами).Обзорная рентгенография является ориентировочным первичным методом диагностики (рис. 54-1). Требуется детализация рентгенографической информа¬ ции для того, чтобы заподозрить наличие злокачественной мезотелиомы плевры по следующим признакам: утолщение париетальной плевры, гидроторакс (и ино¬ гда гидропневмоторакс;), уменьшение объёма гемиторакса, смещение средостения в сторону поражения.КТ и/или (в зависимости от предпочтения клиники) МРТ являются основными методами в диагностике и стадировании злокачественной мезотелиомы плевры (рис. 54-2).Признаком мезотелиомы плевры на КТ является диффузное утолщение плев¬ ры с максимальной выраженностью на уровне IV-VII рёбер с зонами бугристого разрастания в виде узлов или пластинчатого равномерного утолщения [37, 38]. На КТ можно выявить вовлечение в процесс лёгкого, контралатеральной плевры, перикарда, диафрагмы, поражение ЛУ, спинного мозга через межпозвонковые
818 ЗАБОЛЕВАНИЯ ПЛЕВРЫIРис. 54-2. КТ органов грудной полости больного с диффузной злокачественной мезотелиомой плев¬ ры: а — на уровне нижней трети трахеи; б — на уровне нижней третм грудной полости.отверстия. Метод также позволяет выявить скопление жидкости, которая в основ¬ ном обнаруживается в нижних отделах или по ходу междолевых щелей, чаще при пластинчатом росте опухолей.ПЭТ в первую очередь применяется для выявления метастатического распро¬ странения злокачественной мезотелиомы плевры, как лимфогенного, так и гема¬ тогенного. Данный метод позволяет уточнить и наметить зоны для биопсии.ПЭТ/КТ является одним из новых методов лучевой диагностики, позволяющим с высокой степенью вероятности сталировать злокачественную мезотелиому плев¬ ры на диагностическом этапе.УЗИ позволяет уточнить локализацию жидкости и осуществить целенаправлен¬ ную пункцию с целью забора материала.Торакоскопия под видеоконтролем позволяет полз^ить достаточное количе¬ ство материала для морфологической верификации диагноза, а также уточнить резектабельность процесса и в отрицательных случаях одномоментно выполнить плевродез. Лапароскопия производится при подозрении на наличие метастазов в брюшной полости и для оценки ипсилатерального купола диафрагмы с одно¬ моментным выполнением биопсии гфи необходимости, даже когда отсутствуют макроскопические изменения. Медиастиноскопия может идентифицировать неко¬ торые, но не все метастатически поражённые ЛУ средостения, так как около 25% из них расположены в местах, недоступных для этого исследования [10,13].Открытая биопсия плевры показана при невозможности проведения торако¬ скопии. Торакотомию применять не следует, так как она повышает риск имплан¬ тации опухолевых клеток в грудную стенку и таким образом может повлиять на техническую возможность последующей радикальной операции. У больных с запаянной плевральной полостью биопсийный материал может быть взят через 5-сантиметровый разрез с очень ограниченной резекцией ребра [10].Морфологическая верификация диагнозаТочный диагноз злокачественной мезотелиомы ставится с помощью биопсии плевры при видеоторакоскопии, хотя возможна также биопсия толстой иглой под контролем КТ [39]. При цитологическом исследовании выявление злокачествен¬ ной мезотелиомы вызывает определённые трудности [13, 40], Нередко необхо¬ димы многократные исследования жидкости и использование дополнительных методов диагностики, Эпителиоидная мезотелиома в цитологическом материале определяется чаще (91%). След)?ет отметить характерный для мезотелиомы при¬ знак — клетки прилежат друг к другу с адаптацией их формы: круглую централь¬ ную клетку охватывают полулунные клетки. Подобные комплексы не обнаружи-
ОПУХОЛИ ПЛЕВРЫ819вались при железистом раке. При высокодифференцированной эпителиоидной мезотелиоме в препаратах имеются многочисленные однотипные образования в виде шаров, состоящие из мелких клеток. Отмечаются митозы. Двухфазная мезо¬ телиома и саркоматозная эндотелиома по цитологическому материалу диагности¬ руются реже, возможно, в результате менее выраженного слущивания клеток в плевральную полость. В этом случае обнаруживаются эпителиальные клеточные скопления, а также единичные опухолевые фибробластоподобные клетки. В сар¬ коматозной эндотелиоме отмечены клеточные скопления, подобные фибросарко- ме. при иммуноцитохимическом исследовании материала больных мезотелиомой в случае отрицательной реакции на раковоэмбриональный антиген (CEA) Вег-ЕР4 и С015"-клетки опухоли положительны на НВМЕ-1, виментин и цитокератины (С MNF 116, С АЕ1/АЕЗ), тромбомодулин, калретинин [42-44].G. Pedio и и. Landolt-Weber (1988) выделяют восемь цитологических признаков злокачественной мезотелиомы [45]:1) однородность клеточной популяции, злокачественные клетки с различной степенью атипии;2) злокачесгвенные клетки разрознены, изолированы или образуют морулопо- добные структуры;3) злокачественные клетки часто многоядерные, с выраженными ядрышками;4) называемое «окном» межклеточное пространство, формируемое между двумя соседними клетками;5) цитоплазма клеток оптически плотная, и её окраска варьирует от базофиль- ной до эозинофильной;6) феномен «клетка в клетке»: более мелкие клеточные элементы внедряются в более крупные;7) фенестрация цитоплазмы, обусловленная образованием мелких светлых вакуолей по периферии цитоплазмы;8) наличие микроворсинок на поверхности клеток.Дифференциальная диагностикаДля дифференциальной диагностики экссудативного плеврита с злокачествен¬ ной мезотелиомой плевры необходимы детальная рентгенологическая инфор¬ мация как до эвакуации жидкости, так и после — «срочный снимок», цитологи¬ ческое исследование выпота. Выжидательная тактика, а тем более проведение exjuvantíbus терапии недопустимы. При подозрении на опухоль плевры, либо невозможности её исключить, в связи с тем, что по клинико-рентгенологическим признакам отмечается сходство её с другими заболеваниями, необходимо про¬ ведение дифференциальной диагностики с опухолями средостения и диафрагмы, периферическим раком лёгкого (в том числе опухолью Панкоста), затянувшимся неспецифическим экссудативным плевритом и с туберкулёзным осумкованным плевритом.Лечениев лечении мезотелиомы плевры применяются хирургические, химиотерапев¬ тические и лучевые методы [5. 8, 20]. Хирургические методы включают пал¬ лиативные, циторедуктивные и относительно радикальные методы. Наиболее применяемое паллиативное вмешательство — плевродез. Для этого используется распыление талька в плевральной полосги при торакоскопии [46] с эффективно¬ стью 80-100% [25]. Реже используется плевроперитонеальный шунт и паллиа¬ тивная плеврэктомия [47]. Циторедуктивные операции (париетальная плеврэк¬ томия, декортикация плевры) применяются с целью улучшения качества жизни и повышения эффективности адъювантной терапии. Появились первые публика¬ ции по видеоторакоскопической плеврэктомии [48]. Относительно радикальной операцией является экстраплевральная пневмонэктомия. Операция сопровожда¬ ется частыми осложнениями (60%) и летальностью 4-11% [8].
820ЗАБОЛЕВАНИЯ ПЛЕВРЫЛучевая терапия уменьшает болевой синдром и накопление жидкости в плев¬ ральной полости, но не влияет на выживаемость больных [20].Для химиотерапии при мезотелиоме плевры применяются производные платины, гемцитабин, антрациклины, пеметрексед, ралтитрексид. Применение этих препаратов даёт эффект при лечении 20-48% больных [201- Увеличивают выживаемость комбинации гемцитабин + цисплатин/карбоплатин; доксору- бицин + цисплатин + митомицин; цисплатин + пеметрексед [20]. Исследуются также другие методы лечения: новые химиопрепараты, иммунотерапия, фото- динамическая терапия [12], локальная и общая гипертермия, генная терапия и их различные сочетания [12,13, 39, 49-51].Наиболее адекватным и эффективным лечением злокачественной мезотелиомы плевры является комбинированный метод лечения (трёхкомпонентный): относи¬ тельно радикальная операция — экстраплевральная пневмонэктомия в сочетании с химио- и лучевой терапией [31,47].Прогнозс плохим прогнозом ассоциированы: боль в грудной клетке, одышка, потеря массы тела, поражение лимфоузлов средостения, саркоматоизный подтип опухо¬ ли, пожилой возраст, мужской пол, стадия опухоли выше первой, общий статус по шкале Карнофски менее 70, уровень ЛДГ более 500 МЕ/л.Факторы, связанные с хорошим прогнозом: молодой возраст при выявлении, эпителиоидный подтип, ранняя стадия заболевания, хороший общий статус, отсут¬ ствие боли в грудной клетке, возраст женщины до 50 лет [10,13]. Средняя продол¬ жительность жизни составляет 4-12 мес, а при 1-П стадиях достигает 33 мес [52].Медиана выживаемости после экстраплевральной пневмонэктомии и плев¬ рэктомии, по данным П.К. Яблонского и соавт. [8], обобщившего литератур¬ ные данные, варьирует от 9 до 14,5 мес. Двухлетняя выживаемость, по данным М.Б. Бычкова и соавт. [20], составляет 10-35%.ЛОКАЛИЗОВАННАЯ ЗЛОКАЧЕСТВЕННАЯ МЕЗОТЕЛИОМАРедкая опухоль, макроскопически представляющая собой локализованное узловое поражение без макро- или микроскопических доказательств диффузного распространения по плевре, но с микроскопическими, гистохимическими, имму- ногистохимическими и ультраструктурными характеристиками диффузной злока¬ чественной мезотелиомы [10].в основном протекает бессимптомно. Большинство описанных случаев были слз^айными находками на рентгенографии грудной клетки или КТ. Иногда име¬ ется плевральный выпот.При макроскопическом исследовании локализованная злокачественная мезо¬ телиома представляет собой хорошо отграниченную узловую опухоль диаметром до 10 см. Эти опухоли могут быть на висцеральной или париетальной плевре, на ножке или широком основании и могут углубляться в прилегающее лёгкое.Диагностика основывается на рентгенографии грудной клетки и КТ (рис, 54-3, 54-4). Некоторые авторы советуют хирургическое иссечение опухоли в целях установления точного диагноза и радикального лечения [25].Некоторые локализованные злокачественные мезотелиомы излечиваются хирургически иссечением. Рецидивные опухоли могут метастазировать как сарко¬ мы, но обычно не распространяются по плевральной поверхности [10].ЛИМФОМЫПервичная лиифома в виде выпотаНовообразование из крупных В-клеток высокой степени злокачественности, проявляющееся как серозный выпот обычно без определяемого опухолевидно-
ОПУХОЛИ ПЛЕВРЫ821Рис. 54-3. Рентгенограмма органов грудной полости больного с локализованной злокачественной мезотелиомой плевры справа.Рис. 54-4. КТ органов фудной поло¬ сти больного с локализованной злокаче¬ ственной мезотелиомой плевры справа.го образования. Другое название: лимфома, локализующаяся в полостях тела. Ассоциирована с вирусом герпеса человека VIII типа (HHV8)/BHpycoM герпеса, вызывающим саркому Капоши. Возникает при иммунодефиците. Большинство случаев выявлены у гомосексуалистов — мужчин, больных СПИДом. Экспрессия вирусного интерлейкина-6 в этих лимфомах также гфедполагает участие этого и других цитокинов в патогенезе опухолей. Характерна частая кооперация HHV8 с вирусом Эпштейна-Барр [13]. Наиболее часто вовлекаются полости перикарда, плевры, брюшины. Наиболее частая внеполостная локализация — в желудочно- кишечном тракте.Больной в типичном случае имеет массивный выпот при отсутствии лимфаде¬ нопатии или органомегалии. Опухолевидные образования и патология ЛУ средо¬ стения не определяются.Плевральный выпот содержит высокий уровень ЛДГ, плеоморфные крупные лимфоциты, негативные на Т- и В-антигены. Для постановки диагноза требуется идентификация ДНК HHV8 [13,14].
822 ЗАБОЛЕВАНИЯ ПЛЕВРЫКлиническое течение крайне агрессивно. Большинство больных умирает ранее, чем через год. Есть сообщения о немногих случаях с положительным эффектом от антивирусной терапии и/или комбинированной химиотерапии с удлинением выживаемости.Лимфома, ассоциированная с пиотораксомЛимфома, ассоциированная с пиотораксом, — это опухоль из крупных В-клеток высокой степени злокачественности с иммунобластной морфологией, обычно представляющая собой опухолевидное образование плевры. Она ассоциирована с вирусом Эпштейна-Барр, но негативна на ННУ8. В различных исследованиях вирусная ДНК или кодированная РНК установлены в 70-100% случаев. Клетки также экспрессируют гены латентной инфекции. Важна роль хронического вос¬ паления в месте пролиферации трансформированных вирусом В-клеток [10,13]. в анамнезе длительно существующий пиоторакс в результате туберкулёза лёгких или туберкулёзного плеврита, лечение с помощью искусственного пневмоторакса.Пациенты отмечают боль в грудной клетке и/или спине или респираторные симптомы, такие, как продуктивный кашель, часто с кровохарканьем, и одышку (диспноэ). Другие частые симптомы — гипертермия и потеря веса. В противопо¬ ложность первичной лимфоме с выпотом ассоциированная с пиотораксом лимфо¬ ма обычно представляет собой опухолевое образование, вовлекающее плевраль¬ ную полость и врастающее в прилегающие структуры, такие, как грудная стенка и диафрагма, в то время как плевральный выпот наблюдается редко. Поэтому у многих больных имеется опухолевая инфильтрация и отёк грудной стенки. Иногда возникает экстраторакальная метастатическая диссеминация (костный мозг, печень, абдоминальные лимфоузлы и т.д.),У большинства больных опухолевое образование может быть локализовано в плевре или лёгком, у половины больных имеет размер более 10 см. ЛДГ сыворотки крови повышена у большинства больных [10,13].Большинство исследований сообщают об очень плохом прогнозе со средней продолжительностью жизни менее года, несмотря на проводимое хирургическое лечение, лучевую и химиотерапию.СОЛИТАРНАЯ ФИБРОЗНАЯ ОПУХОЛЬСолитарная фиброзная опухоль (СФО) — веретеноклеточная мезенхимальная опухоль, возможно, из фибропластического деривата, которая часто имеет очень похожее на гемангиоперицитому сосудистое строение, но может иметь другой гистологический вид.Клинические проявления присутствуют у 60% больных [53]. Наиболее частые симптомы — кашель, боль в грудной клетке и одышка, У некоторых больных может наблюдаться гипертермия, кровохарканье, гипертрофическая остеоартро- патия и изредка симптомы гипогликемии как результат продукции инсулинопо¬ добного фактора роста и даже компрессия правого предсердия и верхней полой вены [52, 54]. Некоторые опухоли являются случайными находками.СФО плевры на рентгенографии грудной клетки видны как мягкотканные образования на плевре, обычно в нижней части гемиторакса [53], Края их чётко очерчены. Может быть плевральный выпот. Опухоли различаются размерами: от маленьких до очень больших, занимающих большую часть гемиторакса. Большие опухоли требуют использования КТ или МРТ для дифференцирования их от образований лёгких. На КТ они имеют вид гетерогенного контрастного усиления и поджимают прилежащее лёгкое, но не врастают в него (рис. 54-5). Большинство опухолей вырастает на висцеральной плевре, но они также могут исходить из лёгочной паренхимы и средостения. Они хорошо отграничены и часто имеют ножку. Изредка они могут быть множественными. Поверхность разреза опухоли
ОПУХОЛИ ПЛЕВРЫ 823Рис. 54-5. Солитарная фиброзная опухоль плевры. Злокачественный вариант.! — рентгенограмма органов грудной полости при первом обследовании. 11 — рентгенограмма и компьютерная томо¬ грамма органов грудной полости через 13 мес после первого обследования; а — прямая проекция; б — боковая проекция; в — КТ.обычно плотная и белёсая. Миксоидные изменения, геморрагии и некрозы, боль¬ шие размеры характерны для злокачественной опухоли. Такие изменения требуют широкой биопсии для гистологии [10].СФО в большинстве своём являются доброкачественными, но некоторые про¬ текают злокачественно. N. Окіке и соавт. предложили различать два варианта СФО: доброкачественный (плотная инкапсулированная дольчатая опухоль, в которой редко можно встретить обызвествление, некрозы и кровоизлияния) и
824 ЗАБОЛЕВАНИЯ ПЛЕВРЫРис. 54-5. Окончание,
ОПУХОЛИ ПЛЕВРЫ 825злокачественный (гомогенная мягкая опухоль с гладкой поверхностью на разре¬ зе, со значительным количеством участков некрозов и геморрагай), при котором отмечаются локальные симптомы, прорастание в грудную стенку и даже деструк- ЦР1Я рёбер [9]. По данным лучевых методов диагностики, злокачественный вариант очень сложно отличить от доброкачественного.Показано хирургическое лечение. Торакотомия с полным иссечением опухоли является методом выбора. В последние годы в связи с внедрением и развитием видеоассистированных торакоскопических операций (BATO) накоплен определён¬ ный опыт их применения в лечении данной патологии. Многие авторы рекоменду¬ ют BATO с исследованием краёв резекции в качестве альтернативы торакотомии [55,56]. Рекомендуется также длительное наблюдение больного после хирургиче¬ ского лечения для исключения рецидива и метастазов, к которым может привести нерадикальное удаление опухоли. Часто больные погибают в течение 2-5 лет [52]. Таким образом, прогноз при СФО всегда сомнителен [9].Метастатические опухоли плеврыОпределённые опухоли имеют предрасположенность к метастазированию в плевру. Плевральный выпот выявляется не у всех таких больных. По данным Британского торакального общества [57], из 2 040 больных с плевральным выпо¬ том на фоне злокачественного новообразования 37,5% составлял рак лёгкого, 16,8% — рак молочной железы, 11,5% — лимфомы, 6,9% — злокачественные опухоли органов желудочно-кишечного тракта, 9,4% — злокачественные новооб¬ разования мочеполовой системы, у 10,7% больных первичная опухоль осталась неизвестной.Наиболее частым симптомом у данной категории больных является одышка, в основном связанная с наличием плеврального выпота, равно как и кашель. Если одышка и кашель являются результатом выпота, то они быстро купируются после удаления жидкости. Также отмечаются анорексия, слабость, похудание, гипер¬ термия и прочие симптомы, обусловленные распространённой метастатической опухолью [13].Плевральный выпот при злокачественных новообразованияхМножество факторов ответственны за накопление плеврального выпота при злокачественных новообразованиях: блокада нормальных плевральных механиз¬ мов абсорбции; увеличение плевральной проницаемости, что способствует ещё большему поступлению жидкости; блокада лимфатического дренажа плевры и, возможно, усугубление отрицательного интраторакального давления в случаях рака лёгкого с ателектазом [58].Среди клинических проявлений одышка — наиболее частый симптом из-за компрессии лёгкого. Плевральный выпот при злокачественных новообразованиях экссудативного характера и часто геморрагический. Диагноз может быть постав¬ лен на основе цитологической диагностики опухолевых клеток в экссудате, но у 40% их не находят [59, 60]. В таких случаях показана закрытая биопсия плевры. Однако она помогает поставить диагноз реже, чем цитология [58]. Другим вари¬ антом может быть торакоскопия |61]. Если после перечисленных исследований диагноз остаётся неясным, методом диагностики остаётся хирургическая биопсия. BATO является методом выбора, сочетающим решение диагностических и неко¬ торых лечебных задач. Если лёгкое полностью расправлено и диагноз вторичного злокачественного новообразования плевральной полости подтверждён, можно сразу произвести склеротерапию тальком [12],Хирургическое паллиативное удаление части опухолевого поражения в основ¬ ном не показано. Большинству больных необходимы химиотерапия с лучевой
826 ЗАБОЛЕВАНИЯ ПЛЕВРЫтерапией (по показаниям) или паллиативные мероприятия, направленные на предупреждение дальнейшего накопления жидкости. Лучевая терапия особен¬ но показана при вовлечении грудного лимфатического протока с образованием хилоторакса. Альтернативой могут быть механический и химический плевродез или создание пути оттока жидкости: наружу, путём наружного дренирования, или периодических пункций; внутрь, путём плевро-перитонеального шунтирования.Плевродез может применяться только в случае полного расправления лёгкого после удаления выпота. После введения склерозирующего вещества дренаж пере¬ жимают на 2 ч, затем открывают и ставят на отсос не менее чем на 24 ч. Дренаж можно удалить, когда отток жидкости сократится до 150 мл в сутки. В качестве склерозирующего вещества применяются: тальк, блеомицин, доксициклин [62,63]. С введением талька в плевральную полость иногда ассоциирован ОРДС [64,65].ЗаключениеЛечение опухолей плевры остаётся сложной проблемой. Среди первичных опухолей наиболее распространена диффузная злокачественная мезотелиома. Прогноз у больного с мезотелиомой, как и с другими первичными злокачествен¬ ными опухолями плевры, неблагоприятный, несмотря на развитие медицинских технологий. Вторичные опухолевые поражения плевры представляют собой отда¬ лённые метастатические поражения распространённого опухолевого процесса, резко ограничивающего продолжительность жизни больного. Лечебные меропри¬ ятия в этом случае носят паллиативный характер или имеют симптоматическую направленность.СПИСОК ЛИТЕРАТУРЫ®
АЗДЕЛ XIЗАБОЛВАНИЯ СРЕДОСТЕНИЯГлава 55. Опрли и кисты средостения @ Глава 56. Пневмомедиастинум и медиастинит
РАЗДЕЛ XIIНАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯГлава 57. Дыхательные расстройства во время сна
Глава 57 Дыхательные расстройства во время снаВВЕДЕНИЕНачиная с 90-х годов XX столетия, клинические исследования, проводимые с применением современных эпидемиологических методов, выявляют широкую распространённость дыхательных расстройств во время сна у жителей Северной Америки и Западной Европы. В настоящее время найдены неопровержимые доказатель¬ ства того, что дыхательные расстройства в период сна влияют не только на качество и структуру самого сна, но и относятся к про¬ гностически неблагоприятным факторам риска развития сердечно¬ сосудистых заболеваний, метаболических нарушений, внезапной смерти в ранние утренние часы.Таким образом, для респираторной медицины изучение дыха¬ тельных расстройств во время сна является важной задачей повсед¬ невной клинической практики.Физиология снаСон — не однородный физиологический процесс. Он состоит из двух основных фаз. Одну из них принято называть «медленным сном», или сном с медленным движением глазных яблок (поп-КЕМ сон); другую фазу — «быстрым сном«-, или сном с быстрым движе¬ нием глаз (КЕМ-сон) [1-4]. Различия между фазами проявляются в поведенческих и электрофизиологических феноменах. Медленный сон подразделяется на 4 стадии, которые различаются по степени синхронизации структур головного мозга и проявлению дельта¬ волновой активности. При наступлении самых глубоких стадий сна (П1 и IV) такая активность максимальна. Быстрый сон, или сон со сновидениями, характеризуется высокой активностью метаболиче¬ ских процессов в головном мозге. Иногда эта фаза носит название парадоксального сна, поскольку наряду с подавлением поступаю¬ щей сенсорной информации и исходящей двигательной активности происходит значительное возбуждение центральной нервной систе¬ мы, У здорового взрослого человека периоды медленного и быстро¬ го сна чередуются циклически. Интересно, что периоды быстрого сна имеют продолжительность от 10 до 20 мин и наступают каждые 90-120 мин с доминированием внутри одного сонного цикла в ран¬ ние утренние часы.Медленный и быстрый сон оказывает воздействие на физиоло¬ гические процессы, связанные с дыханием. Так, сон воздействует
832 НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯна скорость поступления дькательных импульсов и стабильность механизмов вентиляции лёгких [5,6]. При наступлении медленного сна тормозится поступле¬ ние дыхательных импульсов, обусловленное отсутствием стимулирующего эффек¬ та на дыхание, характерного для состояния бодрствования, В этой фазе резко уменьшается чувствительность хеморецепторов, процесс происходит ступенчато. При наступлении I и II стадий сна, когда состояние ЦНС еще варьирует между бодрствованием и глубоким сном, наблюдается нестабильность поступающих дыхательных импульсов, что предрасполагает к периодическому дыханию. При наступлении III и IV стадий сна влияние импульсов нехимической природы на дыхательные процессы прекращается и регуляция дыхательной функции осущест¬ вляется системой «метаболического дыхательного контроля». В таких условиях общий результирующий поток дыхательных стимулов обычно стабилен, но он значительно слабее, чем при бодрствовании. В результате на 1-2 л/мин снижается минутный объём вентиляции, на 2-8 мм рт.ст. увеличивается парциальное напря¬ жение углекислоты в артериальной крови (Р^СО^), на 5-10 мм рт.ст. по сравнению с состоянием бодрствования уменьшается парциальное напряжение кислорода в артериальной крови (Р^^02).При быстром сне пос^пление дыхательных импульсов всегда нерегулярно. Характерно, что вентиляционный ответ на химические и механические дыха¬ тельные стимулы резко снижен или отсутствует. Как правило, в такие моменты наблюдаются короткие периоды центрального апноэ длительностью от 10 до 20 с. По причине подавления общего тонуса скелетной мускулатуры происхо¬ дит выраженное уменьшение активности межрёберных и добавочных мышц. В результате уменьшается степень синхронизации экскурсий и сопряженной актив¬ ности грудной клетки и брюшной стенки (парадоксальное дыхание). Наступает значимое уменьшение минутного объёма вентиляции. Влияние быстрого сна на дыхательные стимулы и мышечную активность опосредовано через мышцы верх¬ них дыхательных путей и мускулатуру грудной стенки [7]. Таким образом, насту¬ пление медленного сна сопровождается умеренным повышением сопротивления дыхательных путей по сравнению с состоянием бодрствования, в то время как при наступлении быстрого сна характерно резкое его увеличение с формированием разнообразных дыхательных расстройств.По причине устойчивости «компенсаторных механизмов» физиологическое воз¬ действие сна на дыхательный процесс у здоровых лиц незначительно. По-другому развивается сценарий событий, когда имеется основное заболевание, приводящее к структурной или функциональной недостаточности дыхательных путей. В таких случаях наступление сна приводит к серьёзным клинически значимым последстви¬ ям. Так, при первичной альвеолярной гиповентиляции отсутствие стимулирующего воздействия на дыхание в период бодрствования закономерно приводит к выражен¬ ной гиповентиляции и апноэ в период сна. У пациентов со слабостью или параличом диафрагмы подавление активности межрёберных и добавочных дыхательных мышц приводит к устойчивой гиповентиляции в период быстрого сна. у лиц с ожирением и анатомически обусловленным малым размером ротоглоточного кольца наступление медленного сна вызывает закономерное снижение тонуса мышц верхних дыхатель¬ ных путей, в то время как дальнейшее его подавление в фазе быстрого сна способ¬ ствует развитию коллапсов вплоть до полной асфиксии,ВЛИЯНИЕ СНА НА ФУНКЦИЮ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫСтупенчатый переход ЦНС от бодрствования ко сну в норме сопровождает¬ ся нарастающим снижением скорости метаболических процессов, подавлени¬ ем активности симпатического звена нервной системы, уменьшением частоты сердечных сокращений, ударного и минутного объёмов, снижением системного артериального давления, а также усилением тонуса блуждающего нерва [8-11J,
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВРЕМЯ СНА 83$Последствием таких физиологических изменений является снижение рабочей нагрузки на сердце. По сравнению с бодрствованием для медленного сна более характерна стабильность вегетативной нервной системы и кровообращения. Однако подобная стабильность время от времени нарушается короткими вспыш¬ ками пробуждений (мозговых активаций) с внезапными эпизодами усиления активности симпатического звена нервной системы, повышением частоты сердеч¬ ных сокращений и уровня артериального давления [11,12].Влияние быстрого сна на функцию сердечно-сосудистой системы является более сложным, чем воздействие медленного сна. Во время быстрого сна у чело¬ века отмечается усиление симпатических импульсов к сосудистой сети скелетных мышц, а также повышение артериального давления до уровня, сопоставимого с таковым в период бодрствования [9,11].Однако можно с уверенностью сказать, что общее воздействие сна на сердечно¬ сосудистую систему человека является успокаивающим, поскольку взрослые люди проводят приблизительно 80-85% от общего времени сна в состоянии его мед¬ ленной фазы. Исключением является сон с развитием дыхательных расстройств (обструктивное апноэ), когда под влиянием интермиттирующей гипоксии «успо¬ каивающее воздействие» прекращается, что приводит к серьёзным расстройствам со стороны сердечной деятельности и кровообращения.РЕАКЦИИ КРАТКОВРЕМЕННЫХ ПРОБУЖДЕНИЙСпособность пробуждаться ото сна или переходить к поверхностной его фазе является неотъемлемым феноменом различных дыхательных расстройств, свя¬ занных со сном. Реакция активации (кратковременного пробуждения), которая сопряжена с «пробуждением» ретикулярной системы и коры головного мозга, приводит в действие каскад физиологических процессов, потенциально обла¬ дающих положительным действием [13]. к таковым относятся следующие важные последствия: во-первых, быстрое нарастание дыхательных импульсов и уровня минутной вентиляции, способствующих прекращению ранее существовавшей гиповентиляции; во-вторых, стимулирование дилататорных и отводящих мышц верхних дыхательных путей, устраняющих апноэ сна; в-третьих, восстановление кашлевого рефлекса, препятствующего аспирации в нижние дыхательные пути и лёгкие; в-четвертых, появление возможности особых поведенческих реакций, относимых к категории жизненно важных, например пробуждение со стремлением убежать из наполненного дымом помещения.Несмотря на очевидную простоту, истинная роль реакций активации в патоге¬ незе расстройств дыхания, связанных со сном, более сложна и мало изучена. Так, активация с пробуждением в ответ на эпизод апноэ сна, с одной стороны, способ¬ ствует его прекращению и уменьшает степень развития острой асфиксии (положи¬ тельное действие), а с другой — приводит к нарушениям продолжительности сна и со временем вызывает выраженную фрагментацию или депривацию сна (отри¬ цательное действие). Аналогичным образом, реакция активации способствует рез¬ ким изменениям уровня артериального давления, что вызывает дополнительную нагрузку на сердечно-сосудистую систему.Таким образом, реакция активации (пробуждения) может выполнять быструю защитнзто функцию, а может являться элементом дезадаптации.ФИЗИОЛОГИЧЕСКИЕ И КЛИНИЧЕСКИЕ ПОСЛЕДСТВИЯНарушения вентиляции в период сна могут приводить к разнообразным физио¬ логическим расстройствам и их клиническим проявлениям (табл. 57-1). В целом, они расцениваются как осложнения заболевания. Осложнения могут развиваться как в результате отрицательного влияния на количественные, качественные и структурные характеристики сна, так и под действием рецидивирующей гипок-ш.■‘Л-:
834 НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯсемии или асфиксии в период сна. Нарушения в структуре и продолжительности сна проявляются со стороны нейропсихологической и поведенческой сферы, в то время как гапоксемия и асфиксия в период сна имеют преимущественно сердечно¬ сосудистую и респираторную природу.Таблица 57-1. Физиологические расстройства и их клинические проявленияФизиологическое расстройствоКлинические проявленияфрагментация сна с частым пробуждениемСнижение медленноволновой фазы снаПовторяющиеся эпизоды пробуждения Беспокойный сонОтсутствие чувства восстановления после сна Головная боль по утрам Дневная сонливость Когнитивные нарушения Изменения личностиРецидивирующее состояние гапоксемии или асфиксии в период снаУвеличение постнагрузки на сердцеАритмии сердца в ночное время Пароксизмальная ночная одышка Ночная стенокардия Лёгочная артериальная гипертензия Системная артериальная гипертензия Дисфункция левого желудочка Хроническая дыхательная недостаточностьДиагностикаПоскольку клинические последствия расстройств дыхания и собственно сна воз¬ никают как в результате нарушения количественных и структурных характеристик сна, так и вследствие дисбаланса газового состава крови, лабораторная диагности¬ ка направлена на оценку как структуры сна, так и дыхательной функции. Наиболее простым лабораторным методом является непрерывный контроль насыщения артериальной крови кислородом (^р^) ^ помощью ушного или пальцевого пуль- соксиметра. Чувствительность такого метода высока и достаточна для выявления быстрого падения показателей насыщения крови кислородом во время эпизодов апноэ сна даже незначительной продолжительности (10-20 с). Регистрируемые в процессе ночной оксиметрии показатели 5^2 являются достоверным источником для суждения о специфических нарушениях дыхания (рис. 57-1) [14], однако диа¬ гностическая специфичность пульсоксиметрии как скринингового теста конкрет¬ ного заболевания дыхательных путей является весьма низкой.Чрескожный мониторинг давления углекислого газа (Р^^С02) в дополнение к ночной регистрации 5^2 позволяет судить о среднем уровне Р^СО-^. Метод позво¬ ляет оценивать эпизоды продолжительностью несколько минут. Однако отсут¬ ствие возможности регистрировать изменения артериального Р^СО^от одного вдоха к другому или на протяжении однократного эпизода апноэ делает его непри¬ годным для регистрации непродолжительных событий, тем не менее информация об изменениях Р^СО^ может оказаться полезной, чтобы оценить тенденции изме¬ нения альвеолярной вентиляции в период сна (см. рис. 57-1).Необходимо отметить, что важным методом скринингового обследования сердечно-сосудистой системы является холтеровское мониторирование [15]. Однако изменения показателей сердечного ритма не являются ни достаточно чув¬ ствительными, ни достаточно специфичными для того, чтобы этот метод приобрёл статус самостоятельного, применяемого для выявления конкретных дыхательнь[х расстройств во время сна.Отдельную линию занимают исследования собственно сна и сопровождающих сон состояний, именуемые полисомнографическими. Они включают регистра¬ цию нескольких электрофизиологических параметров; электроэнцефалограмму,
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВР ЕМЯ СИ А 835со100 п90-80-.70-■60-50-40-30--10 min-Рис. 57-1. Пульсоксиметрическая запись (S^Oj), проведённая методом ушной оксиметрии, и кап- нографическая кривая РСО2 (Р^СО^) у больного с обструктивным апноэ сна, демонстрирующие эпизоды десатурации, которые характерны для данного заболевания. (Взято из статыл; Stradling J.R., Phiilipson ЕА Breathing disorders during sleep // Q. J. Med. —1986. — Vol. 58. — P, 3-18.)Iэлектроокулограмму, электромиограмму, что позволяет определить стадии сна. провести их количественную оценку, а также обнаружить кратковременные эпи¬ зоды активации (проб>'ждения) [4], Проводимая регистрация электромиограм- мы с большеберцовой мышцы позволяет обнаружить периодическое движение нижних конечностей во сне (ночной миоклонус) [16]. в качестве стандартного метода оценки дыхательной функции используется определение с помощью ушной или пальцевой пульсоксиметрии, чрескожное определение Р(^С02 в сочета¬ нии с регистрацией дыхательных движений, что позволяет достоверно выявлять эпизоды апноэ и гипопноэ, а также классифицировать их как обструктивные или центральные (рис. 57-2) [17].Иногда для объективного разграничения событий необходимо использовать датчики на основе поверхностных индуктивных преобразователей по методу респираторной индукционной плетизмографии [18]. В ряде случаев потребуется использование высокочувствительных методик, к которым можно отнесги опреде¬ ление внутриплеврального давления (с использованием пищеводного катетера) или электромиографию с оценкой реакции диафрагмы [19, 20].ОБСТРУКТИВНОЕ АПНОЭ СНАОбструктивное апноэ сна имеет важное клиническое значение. Являясь одной из распространённых причин избыточной дневной сонливости, оно приводит к развитию серьёзных сердечных, дыхательных и метаболических расстройств [21-24].На протяжении последних 15 лет синдром обструктивного апноэ-гипопноэ сна (СОАГС) приобрёл статус распространённого заболевания, которое встреча¬ ется, как минимум, у 2% женщин и 4% мужчин среднего возраста [25]. Распро¬ странённость этого заболевания у женщин более выражена в постменопаузе. Оно чаще встречается у пожилых лиц, чем у пациентов среднего возраста [26, 27]. Несмотря на большое количество исследований, посвящённых данной патологии, большинство случаев апноэ сна остаются нераспознанными [28].Обструктивное апноэ сна определяется как дыхательное расстройство, связанное с прекращением поступления воздуха через носовую и ротовую полости пациента. При обструктивном апноэ сна воздушный поток прерывается в результате полной окклюзии верхних дыхательных путей на уровне ротоглотки, несмотря на продол¬ жающуюся активацию дыхательной мускулатуры [29,30]. При центральном апноэ сна, наоборот, поступление воздуха прекращается вследствие временной останов¬ ки потока нервных импульсов ко всем дыхательным мышцам. Единичные эпизоды центрального апноэ сна могут возникать и у здоровых лиц, особенно во время
Ї0Ш Щй''.іїіидаш836 НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯllgioo^v]Right eye Chin EMG a ECGRib cage 0.51 М» h f ^r^^Abdomen 0.513 ^ Central apneaTidal volume 0.513 SaO, (%)^003Рис. 57-2. Полисомнографическая регистрация эпизодов апноэ сна, показывающая различие между проявлениями центрального (а) и обструктивного (б) апноэ. Запись собы-шй по основным каналам в фазе быстрого сна. Сверху вниз каналы показывают следующее; электроэнцефалограмму (EEG), движения правого и левого глаза (Right eye; Left eye), электромиофамму с подподбородочной мышцы (Chin EMG), электрокардиограмму (ECG), движения грудной клетки и брюшной стенки (Rib cage, Abdomen), дыхательный объём (Tidal volume) и насыщение артериальной крови кислородом (Sa02). Обращает на себя внимание, что при центральном апноэ сна отсутствуют дыхательный поток и движения грудной клетки и брюшной стенки: при обструкгивном апноэ сна отмечаются пара¬ доксальные движения грудной клетки и брюшной стенки, (Phillipson Е.А., Bowes G. Sleep disorders // Fishman A.P. (ed) Update of Pulmonary Diseases and Disorders. — New York: McGraw-Hill, 1982. - P. 256-273.)быстрого сна [5]. Эпизоды обструктивного апноэ сна, как правило, расцениваются как патологические проявления заболевания. У пациентов с клинически значимы¬ ми проявленіїями обструктивного апноэ и гипопноэ сна наблюдается не менее 15 эпизодов патологических событий в течение одного часа. В последние годы были получены убедительные доказательства того, что высокое сопротивление верхних дыхательных путей при явлениях храпа, сопровождающееся повторяющимися эпизодами активации (пробуждения) даже при отсутствии явных периодов апноэ или гипопноэ, приводит к последствиям, схожим с СОАГС [31,32].ПАТОГЕНЕЗОсобым звеном патогенеза СОАГС является движение языка и нёба кзади, что приводит к их соприкосновению с задней стенкой глотки. В результате проис¬ ходит окклюзия носоглотки и ротоглотки [29, 30]. Развившаяся вследствие этого обструкция дыхательных путей является пусковым моментом, провоцирующим первую цепочку событий (рис. 57-3), которая впоследствии может повторяться сотни раз за одну ночь.
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВРЕМЯ СНА 837ПервичноесобытиеНаступление!собственно[АпФизиологическое последствие Снижение плеврального давления Повышение постнагрузки сердцаКлиническоепроявлениеЛевожелудочковаянедостаточностьТОО,. -ірНІ—Вагусная брадикардия Эктопические сердечные сокращения« Необьяснимая » ночная смертьЛегочная вазоконстрикцияЛегочная гипертензия Правожелудочковая недостаточность-•ІСйстемная вазоконстрикция! Ч I іІСистемная гипертензияАктивация^ мозгаОстрая задержка сЩ 1| Хроническая гиповентиляция jВосстановление дыхания—Возврат о снуЦеребральная "*| дисфункция Потеря глубины сна фрагментация снаИзбыточная дневная сонливостьУмственные расстройства Изменения личности Расстройства поведения-»I Повышение моторной активности j >|Беспокойный сон|Рис. 57-3. Схема патогенеза апноэ сна. Показана основная последовательность событий, физио¬ логических последствий и клинических проявлений обструктивного апноэ сна. (Модифицировано из статьи; Phiilipson ЕА Sleep apnea // Med. Clin. North Am. -1982. - Vol. 23. - P, 2314-2323.):§ЩетШШіпри наступлении сна развивается окклюзия верхних дыхательных путей (ВДП), прекращающая поступление воздуха в дыхательные пути. Она сопровождается продолжением дыхательных экскурсий. В результате асфиксии происходит крат¬ ковременная активация (пробуждение) с восстановлением проходимости верх¬ них дыхательных путей и возобновлением движения воздушного потока. После устранения асфиксии пациент быстро засыпает, достигает уровня собственно сна, и последовательность событий многократно повторяется [35],Начало и прекращение окклюзии ВДП в период сна обусловлены несколькими основными механизмами [34]. В целом, коллапс верхних дыхательных путей про¬ исходит в тот момент, когда давление в ротоглотке, отрицательное (ниже атмос¬ ферного давления) во время вдоха, превышает допустимое критическое значение стабилизирующего действия мышц, которые расширяют верхние дыхательные пути [7, 34-37]. Однако в механизмах развития коллапса ВДП свою роль играют не только функциональные, но и анатомические факторы [34]. Так, в некоторых случаях у пациентов имеются явные анатомические сужения верхних дыхательных путей, обусловленные микрогнатией, ретрогнатией, гипертрофией глоточных или нёбных миндалин, макроглоссией или акромегалией [38-40]. Однако необходимо отметить, что у большинства больных без очевидных анатомических нарушений наблюдаются разнообразные менее выраженные изменения структуры, обнару¬ живаемые методами визуальной диагностики. К таким методам относят компью¬ терную томографию верхних дыхательных путей, эхолокационные методы, осно¬ ванные на отражении звуковой волны от глоточных структур, цефалометрическую рентгенографию, магнитно-резонансную томографию, видеоэндоскопию [7, 29, 41-46]. Помимо того, узость ВДП часто обусловлена ожирением [41, 45, 47]. Кроме функциональных и анатомических факторов, уменьшение просвета проис¬ ходит из-за усиления «податливости» и «вялости» верхних дыхательных путей с развитием их спадения под действием отрицательного давления [36,47-50].Поскольку апноэ развивается только во время сна, состояние центральной нервной системы играет важную роль в патогенезе данного расстройства. В пери¬ од бодрствования активность мускулатуры ВДП у пациентов с СОАГС превы¬
838 НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯшает таковую в норме, что, возможно, является механизмом, компенсирующим сужение верхних дыхательных путей и формирование высокого сопротивления воздушному потоку [34, 51, 52]. У лиц, подверженных патологии, обычная сте* пень снижения активности мускулатуры ВДП при наступлении сна [7, 53, 54] уже оказывается достаточной для формирования критического давления во время вдоха, приводящего к коллапсу дыхательных путей [7, 34]. Кроме того, быстрые изменения уровня активности ЦНС, имеющие место при засыпании, приводят к преходящей нестабильности в поступлении дыхательных импульсов. Это сопро¬ вождается характерным воздействием на мускулатуру ВДП с развитием «перио¬ дического дыхания» [55, 56]. В результате наблюдаются преходящие эпизоды избыточного снижения активности мышц ВДП по сравнению с сократительной активностью диафрагмы [57-60]. В таких условиях формирующееся в процессе вдоха отрицательное давление в дыхательных путях оказывается достаточным для развития глоточного коллапса. Таким образом, сон оказывает провоцирующее влияние на функцию верхних дыхательных путей. Он способствует их спадению в тех случаях, когда пациенты имеют структурную предрасположенность, даже при незначительных изменениях анатомического просвета.Физиологически обусловленное уменьшение активности мускулатуры верх¬ них дыхательных пзп’ей наиболее выражено при наступлении быстрого сна, что, вероятно, является причиной максимального развития обструктивного апноэ сна именно в этот период. [4, 48]. Алкоголь и другие седативные средства, оказы¬ вающие избирательное подавляющее влияние на активность мускулатуры верхних дыхательных путей, могут способствовать их спадению у лиц, предрасположенных к таким нарушениям [61-64].Прекращение эпизодов обструктивного апноэ сна зависит от того, что произой¬ дёт — быстрое пробуждение или переход Б поверхностный сон. Это сопровожда¬ ется активацией мышц приводящей мускулатуры и мышц, расширяющих верхние дыхательные пути, в результате чего восстанавливается проходимость ВДП для воздушного потока [7, 35, 65]. В некоторых случаях происходит полное пробуж¬ дение ото сна. Специфическими факторами, которые обусловливают реакцию активации (пробуждения), являются химические стимулы, спровоцированные асфиксией, а также механические стимулы, обусловленные дыханием через сужен¬ ные воздухоносные пути [13, 66, 67]. Так, при повреждении каротидных синусов у экспериментальных животных наблюдалось значительное увеличение продол¬ жительности эпизодов обструктивного апноэ сна [68]. Было высказано предпо¬ ложение, что именно они играют ведущ)то роль в формировании гиперкапнии у пациентов с СОАГС [69]. Однако задержка в наступлении реакции активации может быть вызвана факторами, влияющими на ретикулярную формацию. Так, наступление быстрого сна удлиняет продолжительность и тяжесть эпизодов апноэ сна [13, 69]. Алкоголь, седативные средства, а также длительная депривация сна (лишение сна) приводят к нарушению способности ЦНС обеспечивать пробужде¬ ние, при этом увеличивается продолжительность эпизодов обструктивного апноэ сна [61,63,70,71].КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯГлавная последовательность событий, приводящих к развитию обструктив¬ ных апноэ сна, способствует возникновению производных физиологических реакций, которые обусловливают развитие характерных клинических прояв¬ лений и осложнений СОАГС (см, рис. 57-1). Клинические проявления подраз¬ деляются на две группы. В первую группу входят преимущественно симптомы, затрагивающие нейропсихологическую и поведенческую сферы. Как считают, они развиваются непосредственно вследствие повторных пробуждений, возни¬ кающих для прекращения каждого эпизода апноэ сна, хотя нельзя исключить
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВРЕМЯ СНА 839ИХ взаимосвязь с повторяющимися периодами церебральной гипоксии. Вторая группа включает кардиореспираторные симптомы, которые в значительной степени (но не исключительно) обусловлены эпизодами рецидивирующей ноч¬ ной асфиксии.Нейропсихологические и поведенческие реакцииНейропсихологические и поведенческие реакции СОАГС выражаются в виде избыточной дневной сонливости (ИДС), «снижения энергии», утомляемости, которые занимают центральное место среди жалоб пациента [72J. В ранних стадиях заболевания ИДС развивается преимущественно в пассивном состоянии, например во время просмотра телевизионных передач или в процессе чтения сидя. Однако по мере прогрессирования заболевания ИДС затрагивает все формы повседневной активности и приобретает характер выраженного инвалидизирующего фактора, сопряжённого с риском. В процессе проведения тестов с оценкой способности концентрировать внимание при вождении автотранспорта был установлен факт её значительного нарушения у пациентов с СОАГС. При этом основные показатели частоты дорожно-транспортных происшествий у пациентов с апноэ сна значитель¬ но превышали таковые в группе контроля [73-76]. Очень часто проявления ИДС взаимосвязаны с разнообразными интеллектуальными нарушениями, снижением памяти, расстройствами мышления, а также изменениями личности [72, 77-79], тем не менее, хотя все эти симптомы обусловлены фрагментацией сна, отсутствием стадий глубокого сна, при одинаковой тяжести дыхательных расстройств у таких пациентов в дневное время наблюдается различная степень выраженности ука¬ занных симптомов. Кроме того, пациент очень часто не осознаёт наличия у него избыточной дневной сонливости или нарушений высших мозговых функций. Бот почему в ходе сбора анамнеза болезни важную роль играет беседа с членами семьи больного.Наиболее частым симптомом, наблюдаемым в ночное время, является громкий храп, свидетельствующий о сужении верхних дыхательных путей. Как правило, храп существует у пациента на протяжении многих лет до момента развития других симптомов. Однако у многих пациентов лишь спустя годы он приобретает непо¬ стоянный характер и периодически прерывается эпизодами тишины (молчания), что соответствует периодам окклюзии (апноэ). Признаком завершения эпизода апноэ обычно является очень громкое всхрапывание на вдохе, что сопровождается движениями тела и порывистыми движениями конечносгей. Часто пациенты не знают о наличии у них таких особенностей, предъявляя жалобы только на бес¬ покойный сон или его расстройство. О таких симптомах чаще свидетельствуют те, кто спит с ними в одной комнате. Весьма редко пациент полностью пробуждается ночью с жалобами на удушье, нехватку воздуха или бессонницу. Чаще всего боль¬ ные предъявляют жалобы на отсутствие чувства «восстановления сил» после сна, на помрачение сознания и дезориентацию, а в ряде случаев — на головную боль, наблюдаемую по утрам или при пробуждении [72].Сердечно-сосудистые осложненияВсё большее число эпидемиологических исследований свидетельствует о нали¬ чии положительной корреляции между СОАГС и рядом сердечно-сосудистых осложнений, несмотря на то что наличие прямой причинно-следственной взаи¬ мосвязи не установлено [80, 81]. Наиболее достоверны выводы о взаимосвязи обструктивного апноэ сна с системной артериальной гипертензией. Они под¬ тверждаются результатами крупномасштабных поперечных и проспективных когортных исследований, свидетельствующих о достоверном повьппении риска распространённости и развития артериальной гипертензии у таких пациентов [82-84], В то же время в общей популяции больных с артериальной гипертензиейI
840 НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯприблизительно у 35% пациентов выявляется обструктивное апноэ сна [85-87]. У пациентов с «плохо контролируемой» лекарственными препаратами артериальной гипертензией показатель распространённости обструктивного апноэ сна составил 85% [88]. Результаты крупнейшего перекрёстного исследования Sleep Heart Health Study (2001), посвящённого изучению состояния здоровья, связанного с сердечной деятельностью и сном, свидетельствуют о налигчии взаимосвязи обструктивного апноэ сна с ишемической болезнью сердца, острым нарушением мозгового кро¬ вообращения и застойной сердечной недостаточностью, независимо от наличия других известных факторов риска [89].Интерес представляет исследование Marin и соавт. (2005), проведённое в испы¬ туемой группе численностью 1651 человек. Из них 264 являлись здоровыми добро¬ вольцами мужского пола, 377 мужчин были «привычными храпунами», 403 пациен¬ та страдали лёгкой или умеренной степенью СОАГС, а 607 мужчин (среди которых у 372 проводилась СРАР-терапия, а 235 участников отказались от лечения) имели тяжёлое течение заболевания [90]. СРАР-терапия рекомендовалась всем пациентам с индексом апноэ-гипопноэ сна более 30 эпизодов в час или тем, у кого избыточная дневная сонливость сочеталась с полицитемией, сердечной недостаточностью при индексе апноэ-гипопноэ от 5 до 20 эпизодов в час. Необходимо отметить, что 36% пациентов с тяжёлой формой СОАГС отказались от СРАР-терапии. Они находи¬ лись под наблюдением для оценки естественного течения заболевания, в отличие от испытуемых, согласившихся на лечение. Здоровых испытуемых сопоставляли с пациентами, страдающими тяжёлой формой СОАГС, по индексу массы тела и воз¬ расту. Конечной целью исследования являлось изучение частоты смертельных и не смертельных сердечно-сосудистых осложнений (ССО). к смертельным ССО относи¬ ли летальный исход, обусловленный инфарктом миокарда (ИМ) или инсультом. Не смертельные ССО включали случаи развития ИМ или инсульта, коронарную недо¬ статочность, требующие хирургического или чрескожного вмешательства.При анализе результатов 10-летнего динамического наблюдения установлено, что частота возникновения смертельных и не смертельных ССО выше у пациентов с тяжёлой формой СОАГС, которым терапия не проводилась (соответственно 1,05 и 2,13 на 100 человек в год), по сравнению со здоровыми добровольцами (0,3 и 0,45 на 100 человек в год); с пациентами, у которых отмечался только «привыч¬ ный» храп (0,34 и 0,58 на 100 человек в год); с пациентами с СОАГС, у которых проводилась СРАР-терапия (0,35 и 0,64 на 100 человек в год соответственно). Относительная вероятность сердечно-сосудистой смерти у пациентов с привыч¬ ным храпом составила 1,03; у не получавших терапию больных с СОАГС лёгкой или средней степени тяжести — 1,15; у не получавших терапию больных с СОАГС тяжёло¬ го течения — 2,87; у пациентов с СОАГС, получавших СРАР-терапию, — 1,05.Авторы пришли к заключению, что риск смертельных и не смертельных ослож¬ нений значительно выше у пациентов с тяжёлой формой СОАГС, не получавших лечения, чем у здоровых добровольцев. Проведение СРАР-терапии способствова¬ ло уменьшению такого риска. Привычный храп не коррелировал с достоверным повышением риска возникновения смертельных и не смертельных сердечно¬ сосудистых осложнений по сравнению со здоровыми лицами.Развитие сердечно-сосудистых расстройств при обструктивном апноэ сна обу¬ словлено несколькими физиологическими механизмами. Во-первых, в период обструктивного апноэ, в момент его возникновения или прекращения, наблюда¬ ется повышение системного артериального давления. Такое повышение является результатом активации симпатического звена нервной системы и рефлекторного сужения сосудов вследствие острой асфиксии, реакции активации и изменения внутригрудного давления [91-93] (рис. 57-4).После восстановления дыхания отмечается снижение артериального давления до исходного уровня. Однако, в отличие от здоровых лиц, у пациентов с СОАГС
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВРЕМЯ СНА 841EMG ^i.. V Ч.- ^1 «« II. -^.A-ywW^ À$mECG u<KiátiiUiii*in.ii»»iiiuiiniiiiimi<iiii>iJ«i4ii<iiti>mnniHH.mtmitt*uiui,»4timiiii>in>mtiiU4uin*itá>ttá»M SNA RESPOSA'OSA ' OSA-200 BP 100 020 сРис. 57-4. Запись активности симпатического звена нервной системы и динамики артериального давления у пациента с СОАГС. В начале эпизода апноэ (OSA) влияние симпатического звена нервной системы на мускулатуру подавляется. Оно увеличивается по мере того, как снижается насыщение артериальной крови кислородом (не показано), достигая максимума по окончании эпизода обструк¬ тивного апноэ сна, после чего такое влияние резко подавляется при раздувании лёгких. Подьёмы артериального давления (ВР) достигают максимума сразу после достижения точки наивысшего влияния симпатического звена нервной системы на мускулатуру с развитием реакции аіаивации (показано стрелками). По другим каналам сверху вниз: электроокулограмма (EOG), электроэнцефа- лограмма (EEG), электромиограмма (EMG), электрокардиограмма (ECG) и динамика дыхания (RESP). (Адаптировано из статьи: Somers V.K., Dyken М.E., Clary М.P. et a!. Sympathetic neural mechanisms in obstructive sleep apnea // J, Clin. Invest. —1995. — Vol. 96. — P. 1897-1904.)снижения показателя среднего кровяного давления в период сна не наблюдается [91-94]. Более чем у 50% больных с СОАГС в период сна наблюдается системная артериальная гипертензия, обусловленная высокой и продолжительной актив¬ ностью симпатического отдела нервной системы, повышенной концентрацией норадреналина в плазме крови [91, 93, 95-98], нарушением сосудорасширяющей реакции эндотелия [99-102]. Результаты экспериментальных исследований на животных с моделированием такого расстройства свидетельствуют о том, что обструктивное апноэ сна приводит к стабильному повышению показателей арте¬ риального давления при пробуждении [103].В последние годы поступает большое количество клинических и эксперимен¬ тальных данных, свидетельствующих о том, что в дополнение к системной гипер¬ тензии обструктивное апноэ сна оказывает как острое, так и хроническое отрица¬ тельное воздействие на функцию левого желудочка сердца. Острое воздействие заключается в том, что на фоне избыточного отрицательного внутригрудного давления, создаваемого во время эпизодов обструктивного апноэ сна. происходит уменьшение ударного объёма сердца и минутного сердечного выброса при возрас¬ тающей постнагрузке левого желудочка и снижении его преднагрузки [104,105]. Отрицательное внутригрудное давление в период апноэ сна способно достигать величины 90 см вод.ст. (65 мм рт.ст.), что вызывает увеличение трансмурального давления в левом желудочке сердца, способствуя развитию постнагрузки на этот отдел. Его повышение в результате влияния на взаимодействие левых и правых отделов сердца приводит к выраженному уменьшению преднагрз^зки левого желу¬ дочка [104,106-111]. Подобный механизм воздействия избыточного отрицатель¬
842 НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯного внутригрудного давления на ударный объём сердца и минутный сердечный выброс наиболее выражен у пациентов с нарушенной функцией левого желудочка [107, 112]. Остро развивающиеся гемодинамические расстройства, вызванные эпизодами обструктивного апноэ сна, могут способствовать развитию ночной стенокардии и кардиогенного отёка лёгких, которые были зафиксированы в ряде исследований у пациентов с СОАГС [113-116].Периодические эпизоды гипоксии, наблюдаемые во время эпизодов обстрзтстив- ного апноэ сна, оказывают отрицательное воздействие на работу левого желудочка, влияя на его сократимость, преднагрузку и постнагрузку. Повышение давления в лёгочной артерии, обусловленное гипоксией вследствие апноэ сна, препятствует опустошению правого желудочка и приводит к уменьшению скорости достижения диастолы обоими желудочками [117]. Подобные эффекты, как и последствия отри¬ цательного внутригрудного давления, могут приводить к нарушению наполнения левого желудочка [110,118,119]. Роль гипоксии заключается в резком повышении системного артериального давления через стимулирующее влияние на симпатиче¬ ский отдел нервной системы [120]. Важно, что такие эффекты наиболее выражены у пациентов, страдающих застойной сердечной недостаточностью [121]. В результате повышения постнагрузки левого желудочка и стимуляции симпатических влияний на сердце наблюдается увеличение потребности сердечной мышцы в кислороде, что может приводить к ишемии миокарда, ночной стенокардии, а также к сердечным аритмиям у пациентов с ишемической болезнью сердца и обструктивным апноэ сна [93, 113, 115, 116, 121-123]. С учётом причинно-следственных взаимоотношений была разработана концепция, согласно которой на фоне СОАГС может наступить внезапная смерть в период сна [115, 124]. Однако достоверные данные, подтверж¬ дающие эту концепцию, отсутствуют. Тем не менее Gula и соавт. (2004) провели ретроспективный анализ данных, полученных при обследовании 112 больных, прошедших полисомнографическое исследование и впоследствии перенёсших вне¬ запную смерть вследствие сердечно-сосудистых заболеваний. Больные исключались из исследования в том случае, если время летального исхода не было известно или причина внезапной смерти не была связана с сердечно-сосудистым заболеванием. Авторы провели сравнение частоты внезапной смерти в группе больных с СОАГС на протяжении четырёх 6-часовых суточных интервалов (с 6 до 12 ч, от 12 до 18 ч, с 18 до 24 ч, а также от 24 до 6 ч утра) с частотой внезапной сердечно-сосудистой смерти в среднем у населения. Сравнение проводилось также с ожидаемой частотой смерти в 25% случаев при допущении, что летальный исход с равной вероятностью может наступить в течение любого из четырёх временных интервалов. Показатели часто¬ ты внезапной смерти для всего населения были взяты из ранее опубликованных данных крупномасштабного исследования, в котором изучали внезапную смерть в результате сердечно-сосудистой патологии.Частота внезапной смерти, обусловленной болезнями сердца, оказалась выше у пациентов с СОАГС в течение временного интервала от 24 до 6 ч утра, чем у всего населения (46% против 21%), и выше ожидаемой частоты смерти (46% против 25%). Наоборот, частота случаев внезапной сердечно-сосудистой смерти у боль¬ ных с СОАГС оказалась ниже в течение временного интервала с 6 до 12 ч, чем у всего населения (20% против 41%), и значительно ниже во временном интервале от 12 до 18 ч (9% против 26%).У больных с тяжёлыми формами СОАГС, определяемыми на основе коэффициента апноэ-гипопноэ, более высок относительный риск внезапной смерти от сердечно¬ сосудистых заболеваний, чем у пациентов с лёгкой и средней степенью тяжести забо¬ левания, а также в сравнении со всем населением. Авторы допускают, что у пациентов с СОАГС на фоне повторных эпизодов апноэ могут действовать различные патофи¬ зиологические механизмы, способствующие увеличению риска внезапной сердечно¬ сосудистой смерти, а именно: гипоксемия, ишемия миокарда, аритмия, повышение
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВРЕМЯ СНА 843активности симпатического отдела нервной системы, артериальная гипертензия, факторы агрегации тромбоцитов. Они также предположили, что некоторые случаи внезапной ночной смерти по причине заболеваний сердца и сосудов у населения в целом могут представлять собой нераспознанный синдром СОАГС.Хотя в данном исследовании удалось продемонстрировать повышенную частот)? внезапной смерти в течение периода от 24 до 6 ч утра у пациентов с СОАГС, оно имеет свои недостатки, которые следует учитывать. Популяция участников этого исследования была представлена пожилыми лицами (средний возраст составил 70 лет), а в исследовании использовался только исторический контроль.В настоящее время всё большее количество исследований свидетельствует о взаимосвязи между обструктивным апноэ сна и хроническим нарушением функ¬ ции левого желудочка. Интерес к таким работам обусловлен тем, что способность обструктивного апноэ сна вызывать выраженную левожелудочковую недостаточ¬ ность при отсутствии длительно существующей артериальной гипертензии, коро¬ нарной болезни сердца или нарушения функции миокарда не была достоверно установлена [125-127J. Тем не менее у ряда пациентов с застойной сердечной недостаточностью (ЗСН) на фоне устранения обструктивного апноэ сна отмеча¬ лось значительное улучшение показателя фракции выброса левого желудочка, а также уменьшение выраженности одышки при физической нагрузке [106, 128, 129]. Необходимо отметить, что у пациентов с СОАГС наблюдается устойчивое повышение активности симпатического звена нервной системы, а также увеличе¬ ние концентрации норадреналина в плазме крови [91,93,97,98]. Однако известно, что выживаемость больных с ЗСН обратно пропорциональна активности симпа¬ тических влияний нервной системы на сердце и концентрации норадреналина в плазме крови [130, 131], что, возможно, объясняет отрицательное воздействие обструктивного апноэ сна на выживаемость таких пациентов при сочетании двух патологий.Обструктивное апноэ сна может оказывать влияние на сердечно-сосудистую систему через стимуляцию агрегационной способности тромбоцитов, через уси¬ ление коагуляции крови, повышение содержания медиаторов воспаления, а также реактивных форм кислорода. Все эти факторы принимают участие в процессе атерогенеза и формировании артериальных тромбов [132-137], При лечении СОАГС достоверно уменьшаются выработка реактивных форм кислорода, экс¬ прессия молекул адгезии и прилипания лейкоцитов к эндотелиальным клеткам, а также снижение уровня эндотелиального фактора роста [137,138]. Всё большее количество исследований свидетельствует о том, что обструктивное апноэ сна может являться независимым фактором риска развития метаболического син¬ дрома, повышения резистентности к инсулину. При лечении СОАГС отмечается повышение чувствительности к инсулину, не зависящей от снижения массы тела [139-142].У 10-15% пациентов с СОАГС развивается постоянная лёгочная гипертензия, которая приводит к недостаточности правых отделов сердца [143]. Было дока¬ зано, что во время эпизодов обструктивного апноэ сна происходит внезапный спазм лёгочных сосудов. В состоянии бодрствования у таких пациентов давление в лёгочной артерии, как правило, соответствует норме [15, 90]. При существующей постоянной ночной лёгочной гипертензии в дневное время отмечаются гипоксе¬ мия и гиперкапния, которые дополняют выраженное нарушение насыщения крови кислородом в ночной период [143-144]. Нарушения газового состава артериаль¬ ной крови в дневное время, как правило, обусловлены сочетанием ожирения с обструкцией дыхательных путей и замедлением передачи респираторных импуль¬ сов, тем не менее остаётся малопонятным, взаимосвязана ли изолированная ноч¬ ная гипоксемия с развитием недостаточности правых отделов сердца. У 10-15% пациентов с СОАГС развивается хроническая гиперкапния [145]. Сочетание недо¬
844 НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯстаточности правых отделов сердца, ожирения и дневной сонливости носит назва¬ ние «синдром Пиквика», или синдром ожирения-гиповентиляции, хронический избыток углекислого газа развивается вследствие ожирения, лёгкой или умерен¬ ной степени обструкции дыхательных путей, а также уменьшения чувствительно¬ сти хеморецепторов со снижением передачи респираторных импульсов [145-147]. Совокупность таких расстройств способствует уменьшению защитных механиз¬ мов гипервентиляции, развивающейся в промежутках между эпизодами ночной обструкции, тем самым препятствуя устранению нарушений газового состава арте¬ риальной крови, характерного для эпизодов обструктивного апноэ сна [146].ЛЕЧЕНИЕДля выбора стратегии лечения важно определить степень тяжести дыхательно¬ го расстройства на основе клинических проявлений болезни и данных обследова¬ ния, характеризующих степень расстройств дыхания и сна [148,153]. Существует единое мнение, что в активной терапии нуждаются пациенты, у которых наблю¬ даются нейропсихологические или кардиореспираторные осложнения СОАГС. К сожалению, в настоящее время нет стандартов лечения храпящих пациентов, не имеющих других симптомов заболевания. Подобная неопределённость терапев¬ тической тактики связана с тем, что естественное течение и исходы «бытового» храпа или очень лёгкой формы обструктивного апноэ сна не известны. Однако даже при отсутствии чёткой клинической картины таким пациентам необходимо назначать профилактическую программу, направленную на устранение храпа и отсрочивание очевидных апноэ сна. Целесообразность таких рекомендаций обу¬ словлена тем, что храп оказывает отрицательное воздействие на окружающих лиц, пребывающих с ними в одном помещении в период сна. Эти рекомендации ана¬ логичны профилактической программе, применяемой у пациентов с лёгким или среднетяжёлым течением СОАГС: снижение массы тела (если это уместно), отказ от алкоголя и седативных средств, избегание сна в положении «лёжа на спине» (по мере возможности) [151,154].Другая малоинвазивная лечебная тактика борьбы с бессимптомным храпом основана на использовании различных ротовых аппликаторов — приспособлений, которые помещаются в полость рта и либо помогают поддерживать язык в нор¬ мальном положении, препятствуя его движению кзади, либо смещают всю ниж¬ нюю челюсть вперёд. Эффективность таких методов устранения храпа составляет, по различным данным, от 55 до 100% [154-157], Неинвазивная респираторная поддержка постоянным положительным давлением в дыхательных путях (чрез¬ масочная СРАР-терапия, которая будет обсуждаться ниже) представляет собой высокоэффективный подход, направленный на устранение храпа. Однако СРАР- терапия непривлекательна для пациентов с бессимптомным храпом [158]. Кроме упомянутых консервативных мер, в настоящее время популярным инвазивным методом прекращения обычного храпа является хирургическое вмешательство на глотке, включающее как традиционную увулофарингопалатопластику, так и лазер¬ ную увулопалатопластику [159,160]. При хирургическом лечении явления храпа устраняются у 80% пациентов.Для терапии пациентов с клинически значимыми проявлениями СОАГС суще¬ ствуют различные современные методы терапии. Они включают ротовые аппли¬ каторы, хирургические методы, а также чрезмасочную СРАР-терапию во время сна. У таких пациентов ротовые аппликаторы предназначены для оттягивания нижней челюсти и языка вперёд, что способствует увеличению просвета верхних дыхательных путей. Имеются немногочисленные описания клинических случаев, подтверждающие положительный эффект их применения [155-157, 161, 162]. Хирургическое лечение включает увулофарингопалатопластику, которая расши¬ ряет просвет ротоглотки благодаря устранению избыточного количества мягких
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВРЕМЯ СНА 845тканей [163]. Однако частота отдалённых положительных результатов такого лечения составляет менее 50% [163]. Более высоких показателей успешного лече¬ ния можно достичь, только тщательно отбирая пациентов для хирургических манипуляций [163-165]. Другие методики хирургического лечения СОАГС, втом числе перемещение нижней челюсти вперёд, удаление подъязычной кости и т. п., имеют ограниченные показания. Положительный результат терапии при этих хирургических манипуляциях возможен только при условии самого тщательного отбора пациентов [164].Самым эффективным и широко используемым методом лечения СОАГС явля¬ ется чрезмасочная СРАР-терапия [152]. Она создаёт воздушную пневматическую подпорку мягким тканям ротоглотки и предотвращает развитие критического отрицательного давления, приводящего к коллапсу верхних дыхательных путей [166], СРАР-терапия является высокоэффективным методом, легко применимым в условиях сомнологической лаборатории. Она хорошо переносится большин¬ ством пациентов (от 60 до 85%) на протяжении десятков лет [167-169]. В ряде исследований достоверно установлено, что СРАР-терапия способствует улуч¬ шению качества сна, уменьшает дневную сонливость, сокращает вероятность дорожно-транспортных происшествий, а также значимо снижает степень арте¬ риальной гипертензии в ночное время [169]. Б некоторых медицинских центрах СРАР-терапию проводят немедленно в первую ночь после установления диагноза СОАГС. Однако необходимым условием успешного выполнения методики явля¬ ется обучение пациента правильному использованию аппаратов для проведения СРАР-терапии, что позволяет соблюдать предписанный режим лечения в течение продолжительного срока. Пациенты, не способные хорошо переносить стандарт¬ ную СРАР-терапию, несмотря на правильную методику её применения, могут позитивно реагировать на гибкие алгоритмы подбора давления в дыхательных путях автоматическими «интеллектуальными» аппаратами второго или третьего поколения [152,169].Единственным методом лечения СОАГС, который изучался при сочетании обструктивного апноэ сна с сердечно-сосудистыми заболеваниями, является чрез¬ масочная СРАР-терапия. У пациентов с сочетанием СОАГС и артериальной гипер¬ тензии такая терапия способствовала достоверному снижению как ночных, так и дневных показателей артериального давления [170]. Результаты других исследо¬ ваний свидетельствуют о такой же эффективности метода при терапии пациентов с рефрактерной артериальной гипертензией и обструктивным апноэ сна [171]. У пациентов с ишемической болезнью сердца и ночной стенокардией, получающих правильно подобранные антиангинальные средства, лечение обструктивного апноэ сна методом СРАР-терапии способствует значительному сокращению частоты приступов стенокардии в ночное время [116]. Аналогичным образом, у пациентов с сочетанием обструктивного апноэ сна и застойной сердечной недостаточности при проведении СРАР-терапии наблюдается быстрое развитие положительных эффектов. В их число входят улучшение оксигенации в ночное время, сокращение частоты пробуждений, консолидация сна, а также достоверное увеличение сердеч¬ ного выброса [106]. СРАР-терапия, проводимая длительно только в ночное время, имеет закономерные «дневные эффекты». Она способствует значительному улучше¬ нию фракции выброса левого желудочка, а также приводит к уменьшению тяжести одышки при физической нагрузке [106,128,129], В связи тем что СРАР-терапия «разгружает сердце» в ночное время, улучшая функцию левого желудочка, а также положительно воздействует на общее функциональное состояние сердца в течение всего дня, её можно считать предпочтительным методом лечения пациентов с сочетанием СОАГС и ИБС, СОАГС и застойной сердечной недостаточности.Пациентам, страдающим тяжёлой формой СОАГС, при лечении которых все остальные методы терапии не являются эффективными или переносимыми,
846 НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯпоказано проведение трахеостомии, которая способствует быстрому улучшению самочувствия, создавая обходной путь для воздушного потока, не зависящего от сужения ротоглотки во время сна [172,173]. В таких случаях трахеостому следует открывать только в ночное время, а в период бодрствования она должна быть закрыта. Однако в настоящее время к трахеостомии прибегают в очень редких случаях, поскольку преимущества СРАР-терапии бесспорны.Периодическое дыхание и центральное апноэ во снеЦентральное апноэ во сне определяется как остановка дыхания во время сна, которая обусловлена прекращением поступления нервных импульсов к дыха¬ тельной мускулатуре. Периодическое дыхание обозначает регулярное появление и исчезновение вентиляции в результате колебаний в поступлении центральных респираторных импульсов. У некоторых лиц фаза затухания в рамках периодиче¬ ского дыхания может включать короткий эпизод апноэ, которое имеет централь¬ ный генез. Б таких случаях центральное апноэ можно расценить как «осложнение» периодического дыхания. Поскольку оба этих вида патологического дыхания встречаются в клинической практике и характеризуются едиными основопола¬ гающими патогенетическими механизмами, то лз^ше всего рассматривать их в совокупности [57,174].ПАТОГЕНЕЗЦентральное апноэ сна (ЦАС) не является самостоятельным заболеванием, а, скорее, включает в себя несколько видов расстройств. Піавное, что происходит при этом, — это то, что прекращается поступление центральных эффекторных импульсов к дыхательной мускулатуре [174,175]. В результате этого уменьшается вентиляция лёгких, что запускает основную цепь событий, аналогичную описан¬ ным ранее. На основе теоретических, экспериментальных и клинических данных были установлены два основных механизма, под действием которых централь¬ ные респираторные импульсы прекращают поступать в момент наступления сна. Первый механизм подразумевает существование явных дефектов в системе кон¬ троля над функцией дыхания или нарушений нервно-мышечной передачи. Такие расстройства приводят к синдрому хронической альвеолярной гиповентиляции, который проявляется гиперкапнией в дневное время. Однако наиболее очевидным механизм таких нарушений становится при наступлении сна, когда отмечается минимальное стимулирующее воздействие со стороны поведенческих, корковых и ретикулярных факторов, посылающих импульсы в нейроны дыхательного центра в стволовой части головного мозга [176]. Б этот момент дыхательная функция становится крайне зависимой от повреждённой основным заболеванием метабо¬ лической системы дыхательного контроля [5,177].В отличие от ЦАС, которое развивается на фоне нарушений, происходящих в системе регуляции дыхательной функции и нервно-мышечной передачи, при¬ ступы периодического дыхания развиваются на фоне преходящих флюктуаций или нестабильности исходно сохранной системы респираторного контроля. Такие нарушения развиваются в состоянии дремоты или поверхностного сна. Поскольку очевидные нарушения дыхательного контроля над поступлением дыхательных импульсов отсутствуют, уровень РдСО^ в состоянии бодрствования или медленного сна обычно соответствует норме или несколько снижен [174, 175,178]. В разные годы было разработано несколько теоретических и экспериментальных моделей объяснения таких преходящих флюктуаций в поступлении центральных дыха¬ тельных импульсов [179-183]. Для всех этих моделей характерен уровень Р^С02 сна, периодически уменьшающийся ниже критического порогового значения под¬ держания нормального ритма дыхания.
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВРЕМЯ СНА 847Такие временные колебания уровня P^COj наиболее часто возникают при переходе из состояния бодрствования в состояние сна, В период бодрствования обычно поддерживается высокая степень вентиляции лёгких за счет регулярного поступления нервных дыхательных импульсов — вот почему уровень Р3СО2 ниже, чем в период глубокого сна [5]. Поскольку такие импульсы при переходе от бодр¬ ствования ко сну поступают нерегулярно, адекватное бодрствованию значение P^COj уменьшается и становится ниже допустимого уровня, необходимого для того, чтобы поддержать дыхание в состоянии сна (рис. 57-5). Если значение Р^СО^ в период бодрствования исходно ниже пороговой величины, необходимой для создания ритма дыхания в период сна, при переходе ко сну разовьётся апноэ. Оно будет существовать до тех пор, пока значение Р^СОзНе повысится до надлежащего порогового уровня. Если моменты повышения PjCO^ и момент наступления глубо¬ кого сна совпадут, дыхание приобретёт ритмичный характер без эпизодов апноэ или гипопноэ.Однако для состояния перехода от бодрствования ко сну характерны повторные флюктуации активности центральной нервной системы. При каждом быстром переходе из состояния сна к бодрствованию уровень P^COj повышается, приводя к «гиперкапнии бодрствования». В результате увеличивается вентиляция лёгких в соответствии с известной рецепторной реакцией в период бодрствования на повы¬ шение СО2, что приводит к развитию фазы гиперпноэ в рамках периодического дыхания. Изменения вентиляции лёгких при переходе от сна к бодрствованию зер¬ кально повторяют аналогичные изменения при переходе от бодрствования ко сну. Такой цикл, представляющий собой чередование гипопноэ (или апноэ) и гипер¬ пноэ, повторяется до тех пор. пока не установится стабильное состояние сна.СобственносонНервныйимпульсбодрствования0-Бодрство-ваниеСменасобытийМедленныйсонРис. 57-5. На рисунке показан предполагаемый механизм, лежащий в основе развития централь¬ ного апноэ в начальной стадии сна, а также механизм повышения порогового уровня Р^СО^ крови, поддерживающий нормальный ритм дыхания. Значение Р^СО^ во время бодрствования может быть ниже порогового значения Р^СО^ для сна, необходимого для создания ритма дыхания. Тогда уровень вентиляции (V) тоже снижается до нуля и наступает эпизод апноэ сна до тех пор, пока уровень Р^СО^ не поднимется выше порогового уровня для поддержания нормального ритма дыхания в период сна. После этого восстанавливается ритмичное дыхание. (Взято из статьи: Bradley T.D., Phillipson Е.А. Central sleep apnea // Clin. Chest. Med, — 1992. — Vol. 13. — P. 493-505.}
к-щ-і848 НАРУШЕНИЯ КОНТРОЛЯ ДЫХАНИЯв рамках такой схемы событий выраженность вентиляционных расстройств зависит от состояния центральной нервной системы, различий между показателя¬ ми Р3СО2 бодрствования и сна, а также от быстроты наступления компенсаторной дыхательной реакции в состоянии бодрствования на содержание COj в крови [183], Любой фактор, способствующий росту этих показателей, усиливает вероят¬ ность развития периодического дыхания и ЦАС: например, во время пребывания на значительной высоте альвеолярная гипервентиляция лёгких, обусловленная гипоксией, способствует уменьшению показателя Р^СОз- При этом его значение уменьшается значительно ниже пороговой величины, необходимой для поддер¬ жания ритма дыхания во сне [184,185], Гипоксия вызывает увеличение скорости рецепторной реакции на COj. Именно поэтому периодическое дыхание с корот¬ кими эпизодами центральных апноэ, чередующееся с интенсивными периодами гиперпноэ, типично для людей, пребывающих на значительной высоте [186], Аналогичным образом, при любом заболевании сердца или лёгких, которое при¬ водит к гипоксии и альвеолярной гипервентиляции в период бодрствования, суще¬ ствует высокая вероятность развития периодического дыхания и центрального апноэ у таких пациентов при наступлении сна.ПЕРИОДИЧЕСКОЕ ДЫХАНИЕ И ЦЕНТРАЛЬНОЕ АПНОЭ СНА У ПАЦИЕНТОВ С ЛЕВОЖЕЛУДОЧКОВОЙ НЕДОСТАТОЧНОСТЬЮНаиболее часто периодическое дыхание и ЦАС наблюдаются у пациентов, страдающих застойной сердечной недостаточностью (ЗСН). У таких больных периодическое дыхание характеризуется продолжительным циклом усиления — уменьшения дыхательного объёма, или так называемым дыханием Чейна-Стокса [187,188]. В отличие от обструктивного апноэ сна, дыхание Чейна-Стокса являет¬ ся следствием застойной сердечной недостаточности, но не является её причиной, однако в ряде случаев оно может быть взаимосвязано с другими патологическими процессами у таких больных.Ключевой фактор в патогенезе ЦАС при застойной сердечной недостаточности аналогичен обсуждавшемуся выше. Он представляет собой колебания Р3СО2 крови, уровень которого становится выше или ниже порогового значения ритмичного дыхания. [189,190]. Падение Р^СО^ ниже порогового значения способствует пре¬ кращению поступления центральных респираторных импульсов и является пуско¬ вым механизмом возникновения центрального апноэ сна. Продолжительность события пропорциональна предшествующей степени гипервентиляции и степени падения P^COj [184,191 j. При одной и той же степени систолической дисфункции левого желудочка, определяющей тяжесть ЗСН, у пациентов с дыханием Чейна- Стокса отмечаются более выраженная гипервентиляция и более низкий уровень P^COj как при бодрствовании, так и во время сна, чем у пациентов, не имеющих дыхания Чейна-Стокса [189,192]. На фоне значительной вентиляции и низкого уровня PgCCj у таких больных отмечено увеличение показателя конечного диа¬ столического объёма, давления наполнения левого желудочка, а также усиление чувствительности периферических и центральных хеморецепторов [193-195]. В таких случаях характерна длительная гипервентиляция лёгких, обусловленная преимущественной стимуляцией лёгочных рецепторов блуждающего нерва на фоне застоя крови в лёгких, при усилении реакций на химические стимулы [195, 196]. В результате хронической гипервентиляции показатели РдС02 у пациентов с ЦАС значительно приближаются к их пороговому значению. В таких условиях резкое усиление вентиляции в момент пробуждения способствует падению Р3СО2 ниже порогового значения, что ведёт к развитию центрального апноэ [189,191]. Основополагающая роль изменений уровня P^COj в возникновении центрально¬ го апноэ подтверждается обнаруженным феноменом, когда повышение Р^СО^ на величину 1-3 мм рт.ст. (например, в результате вдыхания газовой смеси, насы¬
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВРЕМЯ СНА 849щенной углекислым газом) способствовало прекращению центрального апноэ сна [190,197].И у пациентов с СОАГС, и у больных с центральным апноэ в сочетании с ЗСН главной причиной избьггочной дневной сонливости и утомляемости является фраг¬ ментация сна, обусловленная эпизодами активации в конце периодов апноэ [198]. На фоне гипоксии и частой активации отмечается стимуляция симпатического отдела нервной системы [11, 91,93,199]. У больных с ЗСН в сочетании с дыханием Чейна-Стокса и ЦАС наблюдаются значительно более высокие показатели концен¬ трации норадреналина крови в ночное и дневное время, чем у пациентов без апноэ.Такие показатели прямо пропорциональны частоте активации и степени гапок- сии, обусловленной апноэ, чего нельзя сказать о фракции выброса левого желу¬ дочка [200]. С уверенностью можно полагать, что центральное апноэ у пациентов с ЗСН способствует усилению симпатического влияния на сердце и тем самым оказывает вторичное отрицательное воздействие на основное заболевание.КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯУ ряда пациентов рецидивирующие эпизоды апноэ сна не сопряжены с какими- либо клиническими проявлениями или физиологическими расстройствами. Следовательно, они являются клинически незначимыми. У других больных последовательность событий, характеризующая центральное апноэ, приводит к развитию клинических симптомов и осложнений, аналогичных таковым при обструктивном апноэ сна (см. рис. 57-3). Поскольку несколько разных механиз¬ мов способны вызывать центральное апноэ сна, клинические проявления харак¬ теризуются разнообразием.В случаях, когда центральное апноэ является последствием заболевания, при¬ ведшего к нарушениям дыхательного контроля или нервно-мышечной передачи, в клинической картине доминируют повторяющиеся эпизоды сердечной недостаточ¬ ности и черты синдрома хронической альвеолярной гиповентиляции, такие, как задержка СО^, гипоксемия, лёгочная гипертензия, правожелудочковая недостаточ¬ ность и полицитемия [174,175]. Беспокойный сон, головная боль в утренние часы, хроническая усталость и избыточная дневная сонливость также часто встречаются у таких больных вследствие ночной гипоксемии, гиперкапнии, нарушений основных характеристик сна. Напротив, в случаях ЦАС, вызванного преходящими флюк¬ туациями поступления центральных дыхательных импульсов при наступлении сна, гиперкапния в дневное время отсутствует, как и осложнения со стороны сердечной и лёгочной системы [174,175]. У таких пациентов, скорее, имеют место признаки нарушенного сна, часгого пробуждения в ночное время, усталости в утренние часы, а также дневной сонливости [174,175]. У многих пациентов центральное апноэ вто¬ рично по отношению к застойной сердечной недостаточности [174,200]. Больные с сердечной недостаточностью и центральным апноэ во сне могут также жаловаться на бессонницу и пароксизмальную ночную одышку [187, 202-204].Усиление активности симпатического звена нервной системы в дневное и ноч¬ ное время на фоне ЦАС у больных с ЗСН может приводить к прогрессированию нарушений функции миокарда и способствует прогрессированию основного забо¬ левания [123, 200]. У таких пациентов чаще, чем у больных без ЦАС, отмечается желудочковая тахикардия. Развитие эктопических желудочковых сокращений взаимосвязано у таких пациентов как с дыхательным циклом, так и со сниже¬ нием SaOj [205]. Основная причина такой взаимосвязи остаётся неизвестной. Предположительно эктопические желудочковые сокращения являются следстви¬ ем гипоксии, повышенной активности симпатического отдела нервной системы, периодически повторяющихся резких подъёмов артериального давления, а также следствием значительного увеличения объёма левого желудочка [123, 193, 200]. Поскольку у одной трети больных с ЗСН наблюдается внезапная смерть от сердеч¬
850 НАРУШ EH ИЯ КОНТРОЛЯ ДЫХАНИЯных аритмий [206], такие причинно-следственные взаимоотношения нуждаются в дальнейшем изучении. Повышенная летальность среди пациентов с ЗСН в сочета¬ нии с центральным апноэ сна по фавнению с пациентами с ЗСН без апноэ может быть вызвана воздействием одного и более из указанных факторов [207].ЛЕЧЕНИЕЛечение синдрома центрального апноэ сна зависит от наличия или отсут¬ ствия нарушений проведения респираторных импульсов или расстройств нервно- мышечной передачи. Методы терапии пациентов с такими нарушениями анало¬ гичны таковым при синдроме хронической альвеолярной гиповентиляции. Важно отметить, что пациент должен быть предупреждён о недопустимости применения седативных средств, которые могут усугубить проявления центрального апноэ сна и вызвать острую дыхательную недостаточность. В ряде случаев улучшение насту¬ пает у больных на фоне применения лекарственных препаратов, оказывающих стимулирующее воздействие на функцию дыхания, особенно медроксипрогестеро- на [208], Ночная гипоксемия может быть купирована с помощью дополнительного назначения кислорода. Однако кислородотерапия может привести к выраженной степени гиповентиляции и удлинению эпизодов апноэ [209, 210]. Вот почему большинству пациентов с тяжёлой степенью гиповентиляции и центральным апноэ в ночное время требуется назначать другие методы, способствующие под¬ держанию дыхательной функции. При лечении больных с синдромом централь¬ ной альвеолярной гиповентиляции крайне эффективным может оказаться при¬ менение электростимуляции с раздражением диафрагмального нерва во время сна [211]. Если невозможно провести электростимуляцию диафрагмы или имеются противопоказания к её назначению, необходимо проводить искусственную вен¬ тиляцию лёгких методом чрезмасочной неинвазивной вентиляции лёгких (НВЛ) с положительным давлением в дыхательных путях либо НВЛ методом создания отрицательного давления, воздействующего на грудную стенку [212-214]. При использовании указанных методов удаётся достичь быстрого улучшения клиниче¬ ской картины заболевания, что сопровождается устранением симптомов, сниже¬ нием Р3СО2 крови в дневное время суток, а также регрессом сердечно-сосудистых осложнений [215-216].Методы лечения ЦАС, не связанного с гиперкапнией, чётко не определены [178]. Как правило, гипоксемию у таких пациентов удаётся успешно купировать кислородотерапией [217]. У некоторых пациентов улучшение наблюдается при назначении ацетазоламида [218]. В настоящее время для лечения этого патоло¬ гического состояния успешно применяют чрезмасочную СРАР-терапию, анало¬ гично лечению обструктивного апноэ сна [219, 220]. Механизмы, посредством которых при СРАР-терапии удаётся купировать центральное апноэ сна, остаются до конца не изученными. Предполагается, что в основе действия находится меха¬ низм поднятия P^COj выше порогового значения апноэ при нарастании механи¬ ческой нагрузки, сопряжённой с выдохом. Чрезмасочная СРАР-терапия наиболее эффективна при ЦАС, сочетающемся с застойной сердечной недостаточностью. При лечении таких пациентов повышается переносимость ими физической нагрузки днём, а также улучшаются функции сердца и качества сна [198, 221]. В рандомизированных клинических испытаниях длительностью от 1 до 3 мес было показано, что чрезмасочная СРАР-терапия оказывает положительное воз¬ действие на некоторые «суррогатные» маркёры у пациентов с застойной сердеч¬ ной недостаточностью, включая повышение фракции выброса левого желудоч¬ ка, уменьшение степени функциональной митральной регургитации, снижение содержания натрийуретического пептида, уменьшение концентрации норадрена¬ лина [198, 200, 222, 223],
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА ВО ВРЕМЯ СНА 851ЗАКЛЮЧЕНИЕРасстройства дыхания в период сна имеют разнообразные клинические сим¬ птомы. Наиболее распространёнными из них являются ощущение неосвежающего сна, избыточная дневная сонливость и утомляемость, когнитивные расстройства. В настоящее время существует всё больше доказательств того, что расстройства дыхания в период сна приводят к развитию часто встречающихся сердечно¬ сосудистых осложнений и метаболических расстройств, включая системную артериальную гипертензию, нарушения функции сердца, а также резистентность к инсулину. Самым распространённым дыхательным расстройством в период сна является обструктивное апноэ сна, для лечения которого назначается чрезмасоч¬ ная СРАР-терапия в период сна. Центральное апноэ сна может развиваться в виде самостоятельного расстройства или в сочетании с центральными нарушениями дыхания в период бодрствования, сопровождающимися гиповентиляцией. Чаще всего центральное апноэ сна сочетается с периодическим дыханием (дыхание Чейна-Стокса), особенно у пациентов с застойной сердечной недостаточностью. Центральное апноэ сна способно вызывать ухудшение функции миокарда и уси¬ ливать прогрессирование заболевания. Чрезмасочная СРАР-терапия является эффективным методом лечения центрального апноэ сна, в том числе она может оказывать положительное воздействие на функцию сердца у больных с синдромом Чейна-Стокса.СПИСОК ЛИТЕРАТУРЫ г
АЗДЕЛ XIIIРЕСПИРАТОРНЫЕ ПРОЯВЛЕНИЯ ВНЕЛЁГОЧНЫХ ЗАБОЛЕВАНИЙГлава 58. Трансплантация органов и первичные иммунодефициты 0Глава 59. Заболевания сердца @Г лава 60. Заболевания органов брюшной полости и почек @Глава 61. Гематологические заболевания ®Глава 62. Акушерская и гинекологическая патология 0Глава 63. Нейромышечные заболевания ®Глава 64. Патология грудной стенки @Глава 65. Синдром ожирения-гиповентиляции«
уРАЗДЕЛ XIVЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИГлава 66. Дыхательная недостаточность; определение, классификация, порды к диагностике и терапииГлава 67. Острая гипоксемическая дыхательная недостаточность, включая острый респираторный дистресс-синдромГлава 68. Острая вентиляционная дыхательная недостаточностьГлава 69. Искусственная вентиляция лёгкихГлава 70. Неинвазивная вентиляция лёгких при острой дыхательной недостаточностиГлава 71. Трансплантация лёгких
Глава 66 Дыхательная недостаточность; определение, классификация, подходы к диагностике и терапииОПРЕДЕЛЕНИЕДыхательная недостатогность (ДН) — неспособность системы дыхания обеспегить нормальный газовый состав артериальной крови.Другим более практичным является следующее определение: ДН — патологический синдром, при котором парциальное напряжение кис¬ лорода в артериальной крови (Р^з) меньше 60 мм рт.ст. и/или парци¬ альное напряжение углекислого газа (Р,СО^ больше 45 мм рт.ст.В литературе можно встретить другие сходные определения ДН, в которых количественные критерии газового состава крови несколь¬ ко различаются, например, уровень РРз, отвечающий критериям ДН, предлагают считать ниже 55 мм рт.ст., а уровень Р^СО^ — выше 50 мм рт.ст. Следует отметить, что напряжение газов крови для кон¬ кретного индивидуума может зависеть от разных факторов, таких, как барометрическое давление, фракция кислорода во вдыхаемом воздухе, положение и возраст пациента (зависимость Р^О^ от воз¬ раста выражается уравнением: Рр2=10^0^27хвозраст (лет) и др.КлассификацияСуществует несколько типов классификаций ДН:• по патогенезу;• по скорости развития;• по степени тяжести;• по анатомическому принципу.ПАТОГЕНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИРазличают две большие категории ДН: гипоксемическую (парен¬ химатозную, лёгочную или ДН 1 типа) и гиперкапническую (венти¬ ляционную, «насосную» или ДН 2 типа, рис. 66-1).Гипоксемическая ДН характеризуется гипоксемией, трудно корригируемой кислородотерапией. Обычно эта форма ДН возни¬ кает на фоне таких тяжёлых паренхиматозных заболеваний лёгких, как пневмония, острый респираторный синдром взрослых (ОРДС), отёк лёгких.Кардинальным признаком вентиляционной ДН является гиперкапния, гипоксемия также присутствует, но она обычно хоро-
858 ПЕЧЕНИЕ ДЬІХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИНедостаточностьгазообмена,проявляющаясягипоксемиейУгнетениедыхательногоцентраВентиляционнаянедостаточность,проявляющаясягиперкапниейМеханический дефект каркасаУтомление / слабость дыхательной мускулатурыРис. 66-1. Патогенетическая классификация дыхательной недостаточности.шо поддаётся терапии кислородом. Вентиляционная ДН может развиваться вследствие нарушений функции «дыхательной помпы» и дыхательного центра. Хроническая обструктивная болезнь лёгких (ХОБЛ) и дисфункция дыхательной мускулатуры — наиболее частые причины вентиляционной ДН, за ними следуют ожирение, кифосколиоз, заболевания, сопровождающиеся снижением активности дыхательного центра и др.КЛАССИФИКАЦИЯ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ ПО СКОРОСТИ РАЗВИТИЯПо скорости развития различают острую и хроническую ДН. Острая дыха¬ тельная недостаточность (ОДН) развивается в течение нескольких дней, часов или даже минут и требует проведения интенсивной терапии, так как может пред¬ ставлять непосредственную угрозу для жизни больного. При быстром развитии ДН не успевают включиться компенсаторные механизмы со стороны сисгем дыхания, кровообращения, кислотно-основного состояния (КОС) крови. Характерным при¬ знаком ОДН является нарушение КОС крови - респираторный ацидоз при вен¬ тиляционной ДН (рН<7,35) и респираторный алкалоз при паренхиматозной ДН (рН>7,45). ОДН практически всегда сопровождается нарушениями гемодинамики.Хроническая дыхательная недостаточность (ХДН) развивается в течение месяцев-лет. Начало хронической ДН может быть незаметным, постепенным, исподволь, или она может развиться при неполном восстановлении после острой ДН. Длительное существование хронической ДН способствует включению ком¬ пенсаторных механизмов — полицитемии, повышению сердечного выброса, нор¬ мализации респираторного ацидоза за счёт задержки почками бикарбонатов.Острая ДН может развиваться и у пациентов с уже существующей хронической ДН - так называемая ОДН на фоне ХДН. Синонимами этой формы ДН являются «обострение ХДН» или «декомпенсация ХДН».Классификация дыхательной недостаточности по скорости развития• Острая ДН:❖ развитие в течение минут-дней;❖ ассоциирована с гипоксемией и/или респираторным ацидозом или алкалозом;❖ непосредственно жизнеугрожающее состояние.• хроническая ДН:❖ развитие в течение месяцев-лет;❖ ассоциирована с гипоксемией и/или гиперкапнией;❖ потенциально жизнеугрожающее состояние.Классификация дыхательной недостаточности по степени тяжестиКлассификация дыхательной недостаточности по степени тяжести осно¬ вана на газометрических показателях (табл. 66-1). Данная классификация является
ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ: ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ, ПОДХОДЫ К ДИАГНОСТИКЕ... 857универсальной и имеет большое практическое значение, так, например, степень II предполагает обязательное назначение кислородотерапии, а степень III — чаще всего респираторной поддержки.Таблица 66-1. Классификация дыхательной недостаточности по степени тяжестиСтепеньНормаР^О^, мм рт.ст.>8060-7940-59<408.0„ %>9590-9475-89<75КЛАССИФИКАЦИЯ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ ПО АНАТОМИЧЕСКОМУ ПРИНЦИПУКроме заболеваний лёгких, к развитию ДН может приводить и большое коли¬ чество «внелёгочных» заболеваний. ДН может развиться при поражении любого отдела или звена системы внешнего дыхания. Условно среди причин ДН принято выделять поражение центральной нервной системы (ЦНС) и дыхательного цен¬ тра; нейромышечные заболевания, болезни грудной клетки, болезни дыхательных путей и альвеол (табл. 66-2).Таблица 66-2. Классификация дыхательной недостаточности по анатомическому принципуПоражение звена аппарата дыханияПример ДНЦентральная нервная система и дыхательный центрПередозировка наркотических средств: гипотиреоз, центральное апноэ; нарушение мозгового кровообращенияНейромышечная системаСиндром Гийена-Барре; ботулизм; миастения; болезнь Дюшенна; сла¬ бость и утомление дахательных мышцГрудная клеткаКифосколиоз; ожирение; состояние после торакопластики; пневмото¬ ракс; плевральный выпотДыхательные пу™Лариигоспазм; отёк гортани; бронхиальная астма; ХОБЛ; м^овисцидоз; облитерир^лощий бронхиолитАльвеолыПневмония; ОРДС; отёк лёгких; альвеолиты; лёгочные фиброзы; сар¬ коидозКлинические проявленияКлинические проявления ДН зависят от этиологии и типа ДН, её тяжести. Наиболее универсальными симптомами ДН являются диспноэ, признаки и сим¬ птомы гипоксемии, гиперкапнии, дисфункции дыхательной мускулатуры.Одним из наиболее универсальных симптомов ДН является диспноэ или одышка, т.е, некомфортное или неприятное ощущение собственного дыхания. Диспноэ при ДН чаще всего определяется больным как «ощущения дыхательного усилия» и очень тесно связано с активностью инспираторных мышц и активностью дыхательного центра. Гипоксемия и гиперкапния также вносят важный вклад в развитие диспноэ, однако корреляции между ?р^ и Р^СО^ и диспноэ довольно слабые, поэтому клас¬ сификации ДН не могут бьггь основаны на градациях диспноэ. У пациентов с венти¬ ляционной ДН респираторная поддержка является наиболее эффективным методом коррекции диспноэ, и если одышка не уменьшается, то должны исключаться другие её возможные причины, например эмболия лёгочной артерии, пневмоторакс и др.а-
858 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИКлинические проявления гипоксемии (РРз^бО мм рт.ст.) трудно отграничить от других проявлений ДН (например, гиперкапнии). Наиболее чувствительным органом-мишенью для гипоксемии является головной мозг, поражение которого наступает раньше других органов. При снижении до 55 мм рт.ст. у нормаль¬ ного индивидуума нарушается память на текущие события, а при уменьшении ДО 30 мм рт.ст. происходит потеря сознания. У пациентов с сосудистыми поражениями головного мозга клинические симптомы могут появляться и при менее выраженных значениях РРз- Важным клиническим признаком гипоксемии является цианоз. Цианоз отражает тяжесть гипоксемии, независимо от её при¬ чины, и появляется при повышении концентрации восстановленного гемоглобина в капиллярной крови более 5 г/дл, т.е. обычно при Рд02<60 мм рт.ст. и 8д02<90%, Для ДН характерен центральный цианоз, при котором артериальная кровь, поки¬ дающая левый желудочек, недостаточно оксигенирована.Характерными гемодинамическими эффектами гипоксемии являются тахикар¬ дия и умеренная артериальная гипотензия. Маркёрами хронической гипоксемии являются вторичная полицитемия и лёгочная гипертензия. Длительно существую¬ щая лёгочная гипертензия приводит к развитию лёгочного сердца и застойной сердечной недостаточности.Клинические эффекты гиперкапнии (Р^С02>45 мм рт.ст.) могут быть резуль¬ татом как повышенного ответа со стороны симпатической нервной системы, так и прямого действия избытка СО2 на ткани. Основными проявлениями повышения Р^СОз являются гемодинамические эффекты (тахикардия, повышение сердечного выброса, системная вазодилатация — у больных с гиперкапнией, как правило, тёплые конечности) и эффекты со стороны центральной нервной системы (хло¬ пающий тремор, бессонница, частые пробуждения ночью и сонливость в дневное время, утренние головные боли, тошнота), при быстром повышении Р3СО2 воз¬ можно развитие гиперкапнической комы, что связано с повышением мозгового кровотока, повышением внутричерепного давления и развитием отёка мозга. Как правило, гиперкапническая кома сопровождается отёком сосков дисков зритель¬ ных нервов. Толерантность к хронической гиперкапнии при условии адекватной оксигенации может быть значительной, некоторые больные адаптированы к Р^СО^ до 90-140 мм рт.ст.К физикальным признакам, характеризующим дисфункцию (утомление и сла¬ бость) дыхательной мускулатуры, относятся тахипноэ и изменение дыхатель¬ ного паттерна (стереотипа). Тахипноэ — частый признак лёгочных и сердечных заболеваний, повышение частоты дыхания >25 мин‘^ может являться признаком начинающегося утомления дыхательных мышц. Брадипноэ (ЧД<12 мин'^) явля¬ ется более серьёзным прогностическим признаком, чем тахипноэ. Постепенная смена частого дыхания редким может быть предвестником остановки дыхания. «Новый» паттерн дыхания характеризуется вовлечением дополнительных групп дыхательных мышц, и, возможно, является отражением попытки дыхательного центра выработать оптимальную стратегию во время стрессовых условий. Могут вовлекаться мышцы верхних дыхательных путей в виде активных раздуваний крыльев носа.При осмотре и пальпации надключичных областей может быть обнаружено синхронное с дыханием напряжение лестничных мышц. При быстро развившейся тяжёлой бронхиальной обструкции происходит активное вовлечение в процесс дыхания грудино-ключично-сосцевидных мышц, при пальпации также можно обнаружить активное сокращение брюшных мышц во время выдоха. Данный при¬ знак присутствует при тяжёлом ограничении воздушного потока и гиперинфляции лёгких.При высокой нагрузке на аппарат дыхания теряется мягкая и синхронная инспираторная экскурсия кнаружи груди и живота, что приводит к так называе-
ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ: ОПРЕДЕЛЕНИЕ. КЛАССИФИКАЦИЯ, ПОДХОДЫ К ДИАГНОСТИКЕ... 859МОЙ торакоабдоминальной асинхронии. В крайних случаях утомления и слабости дыхательных мышц может выявляться явное парадоксальное дыхание: во время вдоха живот втягивается вовнутрь, а грудная клетка движется кнаружи.Работа дыхания при ОДН может увеличиться в 10-20 раз. К сожалению, клинически очень трудно аккуратно оценить «избыточную» работу дыхания. Ориентировочными признаками избыточной работы дыхания являются такие сим¬ птомы, как тахикардия, потливость, парадоксальный пульс, ЧД выше 30-35 мин‘ использование в акте дыхания вспомогательной мускулатуры.ДиагностикаОсновным инструментальным методом оценки ДН является газовый анализ артериальной крови. Важнейшими показателями являются PPj, Р^СОз, pH и уровень бикарбонатов НСО^‘ артериальной крови, причем серийное, или дина¬ мическое исследование этих показателей имеет большее значение, чем однократ¬ ный анализ. Обязательным критерием ДН является гипоксемия. В зависимости от формы ДН возможно развитие как гиперкапнии (P^COj >45 мм рт.ст), так и гипокапнии (P^CO^ <35 мм рт.ст.). Для ОДН характерно развитие респираторного ацидоза (pH <7,35) или респираторного алкалоза (pH >7,45).Взаимоотношения между Р^С02 и pH можно представить в виде следующих правил:• при повышении Р^СОз на 20 мм рт.ст. происходргг снижение pH на 0,1;• при снижении Р^СО^ на 10 мм рт.ст. происходит повышение pH на 0,1;• изменения pH вне заданных пределов являются следствием метаболических расстройств.Повышенный уровень бикарбонатов (>26 ммоль/л) говорит о предшествующей хронической гиперкапнии, так как метаболическая компенсация респираторного ацидоза требует определённого времени — не менее 3-х суток.Большое практическое значение имеет оценка альвеолоартериального градиен¬ та по кислороду;= fío, X (Р^, - Р„J - (Р.О, + P.CoyR).При условии Fí02=0,21, Р,^^^ (атмосферное давление)=760 мм рт.ст., Р^^ц (парци¬ альное давление паров воды)=47 мм рт.ст. и R (респираторный коэффициент)=0,8, возможно использование упрощённой формулы:Р,л.А = 147-(Р.О,+ 1.25Р.СО,),В норме Р^^ ^^02=8-15 мм рт.ст. или рассчитывается по формуле Р(А-а) 02=2,5+0,21хвозраст(лет). При Р^д.^^О^ >15 мм рт.ст. предполагаются следующие причины нарушения газообмена: VyQ дисбаланс, снижение диффузионной спо¬ собности, увеличение истинного шунта.Для приблизительной оценки истинного шунта возможно использование пробы с ингаляцией 100% 0^ (что достаточно просто у интубированного больного и довольно сложно у больного со спонтанным дыханием, так как необходимо добиться полной герметизации дыхательных путей). Фракция шунта вычисля¬ ется по правилу: на каждые 100 мм рт.ст. Р^02 ниже 700 мм рт.ст. приходится 5% шунтового кровотока, т.е. при Р^02=700 мм рт.сг. шунт=0%, при Р^Оз^бОО мм рт.сг. шун1^5%, при Р^02=100 мм рт.ст. шунт=30%.Все изменения, выявленные при рентгенографии грудной клетки, у больных с ДН условно можно разделить на следующие группы:• «чистые» лёгкие;• диффузные затемнения;• лобарное затемнение;• затемнение одного лёгкого (табл. 66-3).
860 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИТаблица 66-3. Типы рентгенографических изменений лёгких у больных с ДН«Чистые» лёгкиеДиффузные 2-сторонние затемненияЛобарное затемнениеПолное затемнениеодного лёгкогоИнтракардиальмый шунт; Внутрилёгочный шунт; Бронхиальная астма; ХОБЛ;Пневмоторакс;ОжирениеМассивная пневмония; ОРДС;Отёк лёгкого; Аспирация;Лёгочное кровотечениеДолевая пневмония; Инфаркт лёгкого: АтелектазАспирация;Плевральный выпот; Инфаркг лёгкого;Ателектаз лёгхого; Интубация главного бронха; Контузия лёгкого; Пневмония;Контралатеральный пнев¬ мотораксНаряд}' с показателями газового состава крови, основные тесты ФВД позволяют не только оценивать тяжесть ДН и вести наблюдение за состоянием больного, но и определять возможные механизмы развития ДН, оценивать ответ больных на про¬ водимую терапию. Различные тесты ФВД позволяют охарактеризовать проходи¬ мость верхних и нижних дыхательных путей, состояние лёгочной паренхимы, сосу¬ дистой системы лёгких и дыхательных мышц. Использование простых показателей ФВД — ПСВ, ОФВ^, ЖЁЛ, ФЖЁЛ — может быть полезно для первичной оценки тяжести функциональных нарушений и динамического наблюдения за больными. При снижении общей ёмкости лёгких (TLC) менее 80% от должных значений, про¬ порциональном уменьшении всех лёгочных объёмов и нормальном соотношении ОФВуФЖЁЛ (>80%) говорят о рестриктивном сивдроме. Для обструктивного син- дрома характерно снижение отношения ОФВ^/ФЖЁЛ, снижение потоковых показа¬ телей, повышение бронхиального сопротивления и увеличение лёгочных объёмов. Возможно наличие комбинации рестриктивных и обструктивных нарушений. К сожалению, проведение функциональных лёгочных тестов часто неосуществимо из-за тяжести состояния, нарушения сознания и кооперации больных. У больных, находящихся на ИВЛ, при помощи функционального модуля респиратора возмож¬ на оценка таких параметров механики дыхания, как сопротивление дыхательных путей (R), общая податливость лёгких и грудной клетки (С), внутренний PEEP и работа дыхания.Большое значение в настоящее время придаётся оценке функции дыхатель¬ ных мышц. Наиболее простым методом является оценка максимального инспи- раторного (МІР) и экспираторного давлений (МЕР) в полости рта. Недостатками метода является его зависимость от кооперации с больным и «нефизиологичность» дыхательного маневра. Для больных, находящихся в критическом состоянии, для измерения МІР предложены специальные приёмы с использованием однонаправ¬ ленных клапанов. Оценка активности дыхательного центра (центрального драйва) довольно сложна, наиболее доступными и практичными являются тесты Р^^ и V.,./Tj (инспираторный поток).Общие принципы леченияВсе методы терапии ДН условно можно разделить на:• терапию, направленную на разрешение причины, приведшей к развитию ДН;• методы, обеспечивающие поддержание проходимости дыхательных путей;• нормализацию транспорта кислорода;• снижение нагрузки на аппарат дыхания.Этиотропная терапия, к сожалению, далеко не всегда возможна при ДН. В основном, устранить причину ДН можно при ОДН. Примером такой терапии являются антибиотики при инфекциях трахеобронхиального дерева, пневмони¬ ях, дренирование плевральной полости при развитии пневмоторакса, плеврита,
ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ: ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ, ПОДХОДЫ К ДИАГНОСТИКЕ... 861тромболитическая терапия при тромбоэмболии лёгочной артерии, удаление ино¬ родного тела при механической обструкции дыхательных путей и др. При ХДН очень редко удаётся радикально изменить течение ДН, хотя в последнее время и это стало возможным благодаря развитию трансплантации лёгких (при ХОБЛ, интерстициальном лёгочном фиброзе, муковисцидозе и др).ПОДДЕРЖАНИЕ ПРОХОДИМОСТИ ДЫХАТЕЛЬНЫХ ПУТЕЙДля обеспечения проходимости дыхательных путей применяются препараты разных классов — бронходилататоры и мукорегуляторы. Бронходилататоры (р^-агонисгы, антихолинергические препараты, теофиллины) являются препара¬ тами первой линии при бронхообструктивных заболеваниях (бронхиальная астма, ХОБЛ), однако они имеют определённое значение и при других заболеваниях, так как обструкция дыхательных путей за счёт развития бронхоспазма и нарушения отхождения мокроты являются универсальными осложнениями многих форм ДН.Мобилизация и удаление мокроты может быть успешно достигнуто при помо¬ щи методов кинезотерапии. Традиционным методом является постуральный дренаж с перкуссией и вибрацией грудной клетки. Однако метод довольно трудо¬ ёмкий, дорогой и, кроме того, может спровоцировать бронхоспазм и ухудшение респираторных функций (транзиторная гипоксемия). У больных с повышенной продукцией мокроты используется метод кашлевой техники — один-два форсиро¬ ванных выдоха от исходно низких лёгочных объёмов с последующей релаксацией и контролируемым дыханием,В ряде случаев проходимость дыхательных путей может быть обеспечена толь¬ ко при помощи эндотрахеальной интубации. Интубация трахеи (ИТ) является наиболее эффективным способом защиты дыхательных путей больного от аспи¬ рации, что особенно актуально для больного в бессознательном состоянии, кроме того, ИТ позволяет обеспечить клиренс бронхиального секрета из центральных дыхательных путей и устранить механическую обструкцию верхних дыхательных путей и, наконец, является способом связи больного с контуром респиратора при проведении респираторной поддержки. Однако проведение ИТ может сопрово¬ ждаться развитием серьёзных осложнений: манипуляции на верхних дыхательных путях могут спровоцировать развитие ларингоспазма или бронхоспазма, а начало вентиляции лёгких с положительным давлением может вызвать снижение веноз¬ ного возврата к сердцу, баротравму и остановку сердца. Подготовка к ИТ включает проведение максимальной оксигенации и регидратации больного.Проведение трахеостомии обычно показано больным, для которых высока вероятность проведения респираторной поддержки более 10-14 сут. Трахеостомия позволяет улучшить комфорт больного (возможен разговор, приём пищи), снижа¬ ет риск развития повреждения гортани, облегчает уход за дыхательными путями больного, кроме того, приводит к уменьшению сопротивления дыхательных путей. Однако данная процедура может приводить к развитию инфекционных осложнений, кровотечений и стенозу трахеи. Использование перкутанной дилата¬ ционной трахеостомии является более безопасной альтернативой традиционной трахеостомии.НОРМАЛИЗАЦИЯ ТРАНСПОРТА КИСЛОРОДАГлавной задачей лечения ДН является обеспечение нормальной оксигенации организма, так как выраженная гипоксия обладает потенциально летальными эффектами. Назначение кислорода является одним из основных методов тера¬ пии ДН. Кроме того, ул5!^шение транспорта О2 может быть достигнуто за счёт использования положительного давления в дыхательных путях, некоторых ЛС, изменения положения больного, оптимизации сердечного выброса и гематокрита, респираторной поддержки. Показания к ургентной (неотложной) и длитель¬ ной кислородотерапии представлены ниже (табл. 66-4)
862 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИПоказания к ургентной кислородотерапии• Документированная гипоксемия:у взрослых и детей старше 28 дней, мм рт.ст. или 5^02<90% (придыхании воздухом);❖ у новорождённых Рр2<50 мм рт.ст. и/или 5Р2‘^88%.• Неотложные ситуации, когда подозревается гипоксемия.• Тяжёлая травма.• Острый инфаркт миокарда.• Краткосрочная терапия (например, восстановление после анестезии).Таблица 66-4. Показания к длительной кислородотерапииПоказанияРА.мм рт.ст.5.0,Особые условияАбсолютные<88НетОтносительные (при наличии особых условий)55-5989Лёгочное сердце, отёки, полицитемия (гематокрит>55%)Нет показаний (за исключением особых условий)>60Десатурация при нагрузке;Десатурация во время сна;Болезнь лёгких с тяжёлым диспноэ, умень¬ шающимся на фоне О,Абсолютных противопоказаний к 02-терапии нет.Целью кислородотерапии является коррекция гипоксемии и достижение зна¬ чений Р^02 60-70 мм рт.ст. или сатурации артериальной крови (З^Оз) 90-93%. Благодаря сигмовидной форме кривой диссоциации оксигемоглобина, повыше¬ ние Р^2 более 60 мм рт.ст, приводит лишь к незначительному увеличению 5^2 и содержанию кислорода в артериальной крови (С^О^).Существует несколько систем для доставки кислорода в дыхательные пути пациента (рис. 66-2, табл. 66-5), Самой простой и удобной системой достав¬ ки О2 являются носовые канюли. Канюли позволяют создавать кислородно¬ воздушную смесь с РіОз до 24-40% при потоке О2 1-5 л/мин. Носовые канюли являются наиболее часто используемой системой при терапии ХДН и также нахо¬ дят широкое применение в острых ситуациях. Простая лицевая маска позволяет создавать РЮ2 от 35 до 50% при потоке кислорода 6-10 л/мин. Для обеспечения «вымывания» СО2 рекомендуется поток О2 более 5 л/мин. Маска предпочтительна для больных, которые дышат ртом, а также у пациентов с повышенной раздражи¬ тельностью слизистой носа. Маска Вентури — тип маски, способный обеспечи¬ вать довольно точные значения РЮ2 (например, 24%; 28%; 31%; 35%; 40%), не зависящие от минутной вентиляции больного. Принцип работы маски основан на эффекте Вентури: кислород, проходя через узкое отверстие, создаёт область пони¬ женного давления, что создаёт захват воздуха. Маска Вентури признана наиболее безопасным и эффективным способом доставки кислорода у больных с гиперкап¬ нической ДН.Однако при тяжёлой гипоксемии и потребности в Рі02 более 50% и канюли, и простая маска могут оказаться неэффективными методами доставки О2. В дан¬ ной ситуации используют маски с расходным мешком (нереверсивные маски), позволяющие при плотной подгонке маски к лицу достигать Рі02 до 90%, однако плотное крепление маски мало комфортно и плохо переносится. Если адекватная оксигенация не может бьггь достигнута при помощи повышения Рі02, следует рас¬ смотреть вопрос о респираторной поддержке.
ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ: ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ, ПОДХОДЫ К ДИАГНОСТИКЕ..863Рис. 66-2. Средства доставки О,.Таблица 66-5. Средства доставки кислородаСистемаПоток кислорода, л/минФракция Oj во вдыхаемой смеси (FiOj)Носовые канюли1;0,24;2;0,28:3;0,31;4;0,35;50,40Простая маска5-150,40-0,60Нереверсивная маска4-100,40-0,95Маска Вентури4-120,28-0,50Использование положительного давления в дыхательных путях возможно как при спонтанном дыхании больного - метод терапии постоянным положитель¬ ным давлением в дыхательных путях {continuous positive airway pressure — СРАР), так и при проведении респираторной поддержки — положительное давление в конце выдоха (positive end-expiratory pressure — PEEP). Отличием СРАР и PEEP является создание давления на вдохе и выдохе при СРАР и только на выдохе — при PEEP. СРАР проводится при помощи герметичной носовой маски (или лицевой маски) и генератора воздушного потока.СРАР находит применение в качестве самостоятельного метода при ДН у боль¬ ных с синдромом ночного апноэ, трахеомаляцией, рестриктивными заболева¬ ниями грудной клетки, отёком лёгких. Доказанными эффектами СРАР являются предотвращение и расправление ателектазов, повышение лёгочных объёмов, уменьшение vyQ дисбаланса и внутрилёгочного шунтового кровотока, повы¬ шение оксигенации, комплайенса лёгких, перераспределение жидкости в ткани лёгких. Важным механизмом СРАР является усиление клиренса бронхиального секрета за счёт повышения коллатеральной вентиляции между вентилируемыми и ателектазированными альвеолами, создания давления за областью обструкции и «выталкивания» секрета в более центральные дыхательные пути.Препаратом, улучшающим вентиляционно-перфузионный дисбаланс, является ингаляционный оксид азота (N0). N0 является селективным вазодилатато-
864 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИром, так как вызывает вазодилатацию только в хорошо вентилируемых отделах лёгких, приводя к уменьшению шунтового кровотока и улучшению оксигенации. Кроме того, N0 снижает давление в лёгочной артерии, и поэтому его использова¬ ние целесообразно у больных ДН с лёгочной гипертензией и недостаточностью правого желудочка. Ингаляционный N0 также обладает потенциалом уменьшения формирования интерстициального отёка лёгкого и снижает секвестрацию ней¬ трофилов в ткани лёгких. В настоящее время использование ингаляционного N0 рекомендовано у больных с рефрактерной гипоксемией и высо¬ким лёгочным сопротивлением (РУК>400 динхсекхсм'*), критерием ответа на N0 является повышение ?р^1сЮ2, как минимум, на 20%. Средние дозы N0 при ОРДС составляют 5-20 ррш.Препараты сурфактанта являются основой терапии респираторного дистресс- синдрома новорождённых (состояние, обусловленное дефицитом сурфактанта), поэтому предпринимались многократные попытки использования препаратов сурфактанта и у взрослых больных ОРДС. У больных ОРДС доказано нарушение функции и продукции эндогенного сурфактанта, а также уменьшение его количе¬ ства. Задачей терапии экзогенным сурфактантом является восстановление нор¬ мального поверхностного натяжения в альвеолах. Кроме того, препараты сурфак¬ танта, ввиду наличия у них антибактериальных свойств, способны уменьшить риск развития нозокомиальной пневмонии. Эффект терапии препаратами сурфактанта зависит от их природы, дозы, способа и времени назначения. Сурфактант назнача¬ ется эндотрахеально, либо в виде инстилляций, или через небулайзер. У взрослых больных требуется довольно большой объём раствора сурфактанта (150-200 мл), что может приводить к засорению фильтров респиратора.Улучшение оксигенации при некоторых формах ОДН (ОРДС) также может быть достигнуто за счёт прональной позиции, т.е. придания больному положения на животе. Механизм положительного эффекта прональной позиции связан с:• расправлением гравитационно-зависимых ателектазов;• улучшением Vд/Q баланса;• повышением функциональной остаточной ёмкости лёгких;• мобилизацией бронхиального секрета.Длительность «прональной позиции» пока чётко не установлена, есть рекоменда¬ ции её использования до 20 ч в сутки с перерывами для ухода, смены катетеров и т.д.Придание больному положения на здоровом боку приводит к улучшению баланса и улучшению оксигенации у больных с массивным односторонним поражением лёгких (пневмония, контузия и др.). Под воздействием эффекта гра¬ витации перфузия сдвигается в сторону здорового лёгкого, тем самым в «больном» лёгком (с плохой вентиляцией) перфузия снижается. Кроме того, за счёт компрес¬ сии «нижнего» здорового лёгкого и уменьшения в нём комплайенса происходит повышение вентиляции в поражённом лёгком. Данное положение хорошо пере¬ носится больными и не приводит к негативным явлениям со стороны системной гемодинамики и сердечного выброса.Задачей гемодииамической поддержки при ДН является поддержание адек¬ ватного сердечного выброса и доставки кислорода к тканям при минимально воз¬ можном окклюзионном давлении в лёгочной артерии. При наличии гипотензии назначают препараты для восполнения объёма циркулирующей жидкости (раство¬ ры) и/или вазопрессоры. При повышенном объёме внутрисосудистой жидкости и объёмной перегрузке правого желудочка показано использование диуретиков. Для поддержания гематокрита в пределах 40-45% и повышения кислородтранспорт- ной функции крови рекомендовано использование трансфузии эритроцитарной массы. Повышение гематокрита выше этого уровня приводит к повышению вяз¬ кости крови, снижает перфузию центральной нервной системы и может снизить сердечный выброс.
ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ; ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ, ПОДХОДЫ К ДИАГНОСТИКЕ.,. 865Снижение нагрузки на аппарат дыханияСнижение нагрузки на аппарат дыхания может быть достигнуто при помощи мероприятий, снижающих бронхиальное сопротивление (бронхолитики, гелиокс, трахеостомия, удаление бронхиального секрета) и повышающих комплайенс лёг¬ ких и грудной клетки (диуретики при отёке лёгких, эвакуация воздуха и жидкости из плевральной полости, расправление ателектазов).Респираторная поддержка (искусственная вентиляция лёгких — ИВЛ) явля¬ ется наиболее эффективным методом снижения нагрузки на аппарат дыхания и коррекции нарушений оксигенации. В зависимости от того, насколько респиратор выполняет работу дыхания за пациента, различают контролируемую (принуди¬ тельную, управляемую) вентиляцию: спонтанное дыхание отсутствует, и весь процесс дыхания осуществляется респиратором, и вспомогательную (триггерную) вентиляцию (ВИВЛ): респиратор поддерживает, усиливает каждое дыхательное усилие больного. Основные задачи респираторной поддержки:• выиграть время для разрешения причины, вызвавшей острую ДН;• коррекция нарушенного газообмена;• разгрузка и восстановление функции дыхательной мускулатуры,В зависимости от того, каким образом осуществляется связь между пациентом и респиратором, респираторная поддержка делится на инвазивную (связь пациент- респиратор обеспечивается при помощи интубационных и трахеостомических трубок) и неинвазивную (носовые и ротовые маски) (см. главы «Искусственная вентиляция лёгких» и «Неинвазивная вентиляция лёгких»),У больных с ДН на фоне обструктивных заболеваний лёгких эффективным методом уменьшения нагрузки на аппарат дыхания являются ингаляции гелиок- са (смесь гелия с кислородом с содержанием гелия от 60 до 80%). Достоинством такой смеси является более низкая плотность газа по сравнению с воздухом или кислородом (рис. бб’З), дыхание гелиоксом позволяет поддерживать ламинар- ность потока при значительном повышении его скорости. Турбулентный поток имеет значительно большее сопротивление по сравнению с ламинарным. Дыхание гелиоксом позволяет снизить сопротивление потоку в дыхательных путях, что0.21 0.25 0.30 0,35 0.40 0.45 0.50 0.55 0,60 0.65 0.70 0.75 0.80 0.85 0.90 0.95 1.00FÍO2Рис. 66-3. Зависимость плотности смесей воэдух-О^ и He-Oj от фракции О2 вдыхаемой смеси FiO^ [Jolliet Р. et al, 2001].
1 ' 866 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ'с' щ ведёт к снижению работы дыхания и уменьшению риска развития утомления г « дыхательной мускулатуры. Кроме того, снижение сопротивления дыханию ведёт ‘ § к уменьшению перепадов внутригрудного давления и к коррекции гемодинамиче- ■ >2' ских нарушений.' Кислородно-гелиевые смеси используют при ОДН у больных с обострением БА,ХОБЛ, при обструктивных заболеваниях гортани и трахеи.Показания и противопоказания к применению гелиокса Показания:• тяжёлое обострение БА и ХОБЛ, обструкция верхних дыхательных путей;• ЧД>25 мин'^;• выраженное диспноэ, ортопноэ;• признаки повышения работы дыхания, участие в дыхании вспомогательных мышц;• 5а02<90%, Ра02<60 мм рт.ст.Противопоказания:• признаки нарушения сознания;• остановка дыхания;• нестабильная гемодинамика, потребность в вазопрессорах;• Ра0^<40 мм рт.ст., потребность в 02-терапии с РЮ2>40%;• РаС02>75 мм рт.ст., рН<7,25Терапия гелиоксом у больных с ОДН приводит к снижению диспноэ, парадок¬ сального пульса, гиперкапнии, повышению пиковых инспираторного и экспира¬ торного потоков и уменьшению гиперинфляции лёгких. Таким образом, терапия гелиоксом может рассматриваться как метод, позволяющий «прикрыть» наиболее уязвимый период ОДН, в который ещё в полной мере не проявились свойства медикаментозной терапии.СПИСОК литературы;^
Глава 67Острая гипоксемическая дыхательная недостаточность, включая острый респираторный дистресс-синдромОПРЕДЕЛЕНИЕГипоксемическая форма ДН характеризуется артериальной гипоксемией. развивающейся, главным образом, в результате нару¬ шения регионарного вентиляционно-перфузионного баланса или внутрилёгочного шунтирования крови.Гипоксемическая ДН характеризуется глубокой гипоксемией, трудно корригируемой кислородотерапией. Обычно эта форма ДН возникает на фоне таких тяжёлых паренхиматозных заболеваний лёгких, как пневмония, ОРДС, отёк лёгких. Классическими клини¬ ческими признаками являются острое начало, диспноэ, тахипноэ, рентгенологические признаки диффузной альвеолярной инфиль¬ трации, крепитация. Ведущим механизмом нарушения газообмена является внутрилёгочный шунт справа налево, возникающий вслед¬ ствие «затопления» альвеол. На ранних стадиях гипоксемической ДН имеются гипоксемия и респираторный алкалоз, гиперкапния встречается редко и появляется лишь при дальнейшем прогресси¬ ровании патологического процесса. Например, РдС02 может повы¬ ситься при отёке лёгких, когда пена заполняет дыхательные пути, или если величина шунтового кровотока начинает превышать 60% от сердечного выброса. Учитывая, что основной причиной гипоксе¬ мической недостаточности является поражение паренхимы лёгких, также используются термины паренхиматозная или лёгочная недостаточность.Основные проявления гипоксемииОстрый дефицит О2 в тканях нарушает клеточный метаболизм и в тяжёлых случаях чреват необратимыми изменениями наиболее чувствительных органов (мозга, сердца), наступающими в течение нескольких минут. Последствия острой гипоксемии варьируют от нарушений сердечного ритма до комы (см. ниже). Хроническое сни¬ жение Р^2’ ^ общем, хорошо переносится больными с достаточны¬ ми гемодинамическими резервами, однако альвеолярная гипоксия может вызвать спазм лёгочных артериол и повышение лёгочного
868 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИаг сосудистого сопротивления. За несколько дней или недель этот процесс способен • е привести к лёгочной гипертензии, гипертрофии правого желудочка (лёгочное ‘ сердце) и даже к правожелудочковой сердечной недостаточности.^ Основные эффекты гипоксемии• Система органов дыхания:❖ диспноэ;; . ❖ тахипноэ — учащение дыхания;/ гиперпноэ - углубление дыхания.• Система органов кровообращения:<> тахи- или брадикардия;❖ аритмии;❖ артериальная гипер- или гипотензия;❖ цианоз видимых слизистых оболочек;❖ лёгочная гипертензия;❖ правожелудочковая сердечная недостаточность.• Центральная нервная система:❖ головная боль и бессонница;❖ снижение интеллектуальных функций;■0^ возбуждение и негативизм;<!■ нарушения координации движений и судороги;❖ психические расстройства (делирий);❖ нарушения сознания и кома.• Другие признаки;’О' общая слабость;❖ утомляемость;❖ увеличение уровня гемоглобина крови;❖ повышение гематокрита.Патофизилогические механизмы артериальной гипоксемииОсновными механизмами гипоксемии являются:• снижение парциального давления кислорода во вдыхаемом воздухе;• общая гиповентиляция лёгких;• нарушения диффузии газов через альвеолокапиллярную мембрану;• нарушение вентиляционно-перфузионных отношений;• шунт (прямой сброс венозной крови в артериальную систему кровообраще¬ ния);• снижение парциального напряжения кислорода в смешанной венозной крови.СНИЖЕНИЕ ПАРЦИАЛЬНОГО НАПРЯЖЕНИЯ КИСЛОРОДА ВО ВДЫХАЕМОМ ВОЗДУХЕНизкое парциальное давление кислорода во вдыхаемом воздухе может отме¬ чаться на больших высотах в результате уменьшения барометрического давления, при ингаляции отравляющих газов, а также вблизи огня из-за поглощения кисло¬ рода при горении.ОБЩАЯ ГИПОВЕНТИЛЯЦИЯ ЛЁГКИХПри гиповентиляции лёгких отмечается увеличение парциального давления СО2 в альвеолах. Поскольку общее давление газа в альвеолах должно оставаться постоянным, то чем больше в них будет уровень СО^, тем ниже будет парциальное напряжение О2 в альвеолярном воздухе (РдО^), известно, что каждый миллиметр давления СО2 в альвеолах фактически «вытесняет» 1,25 мм парциального давле¬ ния 0^. При уменьшении содержания кислорода в альвеолах снижается и Р^О^.
ОСТРАЯ ГИПОКСЕМИЧЕСКАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ, ВКЛЮЧАЯ ОРДС $69Между напряжениями кислорода и углекислого газа существуют реципрокные взаимоотношения, которые описываются «уравнением альвеолярного газа»:Р,Оз=РіОзХ(Рь,,-47)-Р,СО,:К, где FjOj ~ фракция кислорода во вдыхаемом воздухе, — барометрическое давление, РдСОз — парциальное напряжение углекислоты в альвеолах, R — дыха¬ тельный коэффициент.НАРУШЕНИЯ ДИФФУЗИИ ГАЗОВ ЧЕРЕЗ АЛЬВЕОЛОКАПИЛЛЯРНУЮ МЕМБРАНУПри нарушении диффузии газов через альвеолокапиллярную мембрану за время прохождения крови через лёгочные капилляры не достигается оптималь¬ ного равновесия в содержании газов в крови и альвеолах. Этот феномен получил название синдрома «альвеолярно-капиллярного блока». Данный механизм раз¬ вития гипоксемии имеет место при интерстициальных заболеваниях лёгких - альвеолитах, интерстициальных фиброзах, саркоидозе, асбестозе, альвеолярном карциноматозе. Однако нарушение диффузии не является ведущей причиной гипоксемии, за исключением выраженной физической нагрузки, когда происходит сокращение времени нахождения эритроцитов в лёгочных капиллярах и, соответ¬ ственно, времени, Б течение которого происходит процесс диффузии,НАРУШЕНИЯ ВЕНТИЛЯЦИОННО-ПЕРФУЗИОННОГО БАЛАНСАВентиляционно-перфузионный (Уд/О) дисбаланс является наиболее частым механизмом, ведущим к развитию гипоксемии. Среднее значение Уд/О.в нормаль¬ ных лёгких составляет 0,8-1,0. При заболеваниях лёгких значения отношения УуО могут колебаться от О (перфузируемые, но невентилируемые альвеолы, или шунт) до бесконечности (вентилируемые, но неперфузируемые альвеолы, или мёртвое пространство). Неравномерность вентиляционно-перфузионных отноше¬ ний может увеличиваться с возрастом, при изменении позиции тела, объёма лёг¬ ких, а также при заболеваниях дыхательных путей, альвеол или интерстициальной ткани лёгких.При различных заболеваниях соответствие процессов вентиляции и перфузии нарушается, и в этом случае в лёгких возможно появление двух патологических зон: с преобладанием участков с высоким (более 1,0) или низким (менее 1,0) вентиляционно-перфузионным соотношением, в первом случае (^high-pattem») альвеолы лёгких вентилируются при недостатке перфузии (рис. 67-1). Эти участки создают объём т.н. физиологического мёртвого пространства (У^). Для эффектив¬ ной вентиляции важна не сама величина У^, сколько отношение объёма мёртвого пространства к дыхательному объёму (У^.). Увеличение У^/У^ означает, что орга¬ низм в большей мере расходует энергию «вхолостую» и в меньшей мере — на альвеолярную вентиляцию. Гипоксемия при этом, как правило, не развивается, однако значительно возрастают энергетические затраты на дыхание. Примером вентиляционно-перфузионного дисбаланса с высоким соотношением Уд/О явля¬ ются больные ХОБЛ с преобладанием эмфиземы лёгких.Во втором случае («lowpattem^) в лёгких присутствуют регионы, где есть крово¬ ток, но практически нет вентиляции, а следовательно, и газообмена. Притекающая в эту зону венозная кровь оттекает от неё неартериализованной. Смешиваясь с кровью, оттекающей от вентилируемых участков, она создаёт т.н. венозное при¬ мешивание к артериальной крови и является причиной гипоксемии. Примером такого распределения вентиляции и перфузии в лёгких являются больные ХОБЛ с преобладанием бронхита.ШУНТИРОВАНИЕ КРОВИПри шунтирований бедная кислородом венозная кровь или полностью минует лёгочное циркуляторное русло — «анатомический шунт» (например, при внутри-
870 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИА Б^ Нет вентиляцииРА = 150>аСО2=0Низкое /./0Нормальное Уд/ОВысокое Уд/ОРис. 67-1. Вентиляционно-перфузионные отношения. Трёхкомпонентная модель для анализа воз¬ действия различных состояний на РО^ и РСОз- Сделаны следующие допущения: парциальное напряжение 0^ в выдыхаемом воздухе Р|02=150. А — крайне низкое Уд/О (т.е. ==0), шунт, Альвеола перфузируется, но не вентилируется. Давление альвеолярных газов равно таковому в смешанной венозной крови. Б — нормальное '^JQ {т.е. = 1,0). Вентиляция альвеолы соответствует перфузии. В — высокое Уд/О (т.е. - «=) мёртвое пространство. Альвеола вентилируется, но не перфузируется. Давление альвеолярных газов равно таковому во вдыхаемом воздухе.сердечных и внутрилёгочных сосудистых дефектах), или проходит через сосуды в участках лёгких, где не происходит газообмен — «альвеолярный» шунт (например, через сосуды, расположен¬ ные в зонах полного ателектаза). В этом случае отношение Vд/Q приближается к О (исгинный или абсолютный шунт: см. рис. 67-1). Величина лёгочного шунта в норме не превышает 5% сердечного выброса и обусловлена наличием брон¬ хиальной лёгочной циркуляции (сосу¬ дистой системы, питающей проводящие дыхательные пути — бронхи), благодаря существованию которой оксигенирован¬ ная в лёгких кровь возвращается в левые отделы сердца неоксигенированной (анатомически шунт). Лёгочный шунт несколько увеличивается с возрастом и не зависит от половых различий.Гипоксемия, причиной которой является внутрилёгочный шунт справа налево, плохо поддаётся кислородотерапии даже с высокой Р102 (рис. 67-2). Величина внутрилёгочного шунта обычно рассчитывается при дыхании 100% кислородом для элиминации нарушений оксигенации, связанных с нарушением диффузии и низкими (но более 0) Уд/О. несоответствиями. Шунтовой кровоток рассчитывается по уравнению:05/а1=(Сс’02-С Оз) : (Сс’0.-С^02), где Сс’02 — содержание кислорода в крови лёгочных капилляров; — содержа¬ ние кислорода в артериальной крови; СуО^ — содержание кислорода в смешанной венозной крови.Рис. 67-2. Ответ РД на 100% 0^ при различ¬ ных механизмах развития гипоксемии.
ОСТРАЯ ГИПОКСЕМИЧЕСКАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ, ВКЛЮЧАЯ ОРДС $71Для упрощения расчётов в этом уравнении парциальное напряжение О2 в крови лёгочных капилляров принимают равным напряжению в альвеолах {рассчиты¬ вается по уравнению альвеолярного газа — см. выше), СуО^ рассчитывают, вычи¬ тая 4,5 мл/дл из СаО^, при условии нормального сердечного выброса. Содержание кислорода в артериальной крови (Ср^) равняется сумме количества кислорода, связанного с гемоглобином (1,34 мл 0/гНЬхгНЬх5р^), и количества растворённого кислорода (Р^О^хО.ООЗІ мл/мм рт.ст.). Если превышает 150 мм рт.ст., т.е. весь гемоглобин насыщен кислородом, уравнение шунта можно представить как:(І8/Оі=0,0031хР^,_^^0,:0,0031хР^,^,02+С^^_,^0,,где С^^_^^02=4,5 мл оудл.Если при дыхании 100% кислородом Рр2 остаётся ниже ЮО мм рт.ст., то вели¬ чина шунта превышает 30%. Как правило, при быстром повышении шунтового кровотока выше 20% требуется проведение респираторной поддержки. При кар- диогенном отёке лёгких гиперкапния является довольно частым событием, в то время как при ОРДС гиперкапния наблюдается только на терминальных этапах развития заболевания. Элиминация СО^ происходит в основном через регионы, где обеспечивается нормальное отношение вентиляции и перфузии. При величине шунта до 50% от сердечного выброса Р^СО^ повышается в среднем лишь на 8 мм рт. ст. при отсутствии компенсаторного повышения общей вентиляции и совсем не повышается, если происходит даже незначительное увеличение вентиляции.СНИЖЕНИЕ ПАРЦИАЛЬНОГО НАПРЯЖЕНИЯ КИСЛОРОДА В СМЕШАННОЙ ВЕНОЗНОЙ КРОВИДесатурация венозной крови, или «венозная примесь», не является само¬ стоятельной причиной гипоксемии, если отсутствуют другие факторы развития нарушения газообмена. Однако этот фактор имеет важное значение для больных с уже существующими нарушениями газообмена и снижением сердечного выброса. Содержание кислорода в смешанной венозной крови зависит от нескольких фак¬ торов:5,.0-5Р2-[У„2:(НЬхО)]. где — потребление кислорода, ~ сатурация артериальной крови, 0. — сер¬ дечный выброс, НЬ — гемоглобин, 5^2 ~ сатурация смешанной венозной крови.Из данного уравнения становится ясно, что 5^2 баланса междудоставкой кислорода и потреблением кислорода, поэтому любой фактор, нару¬ шающий этот баланс, может привести к снижению Данный механизм играет важную роль в формировании гипоксемии при тромбоэмболии лёгочных артерий и при физической нагрузке у больных с многими формами хронических лёгочных заболеваний.Основные заболевания, приводящие к гипоксемической дыхательной недостаточностиНаиболее частыми клиническими ситуациями, приводящими к гипоксемиче¬ ской дыхательной недостаточности, являются: заболевания лёгочной паренхимы [пневмония, ателектаз, кардиогенный и некардиогенный отёк лёгких (ОРДС) и др.]; диффузные интерстициальные заболевания лёгких; массивная пневмония, ателектазы и др. (см. ниже),Причины острой гипоксемической дыхательной недостаточностиГомогенные повреждения лёгких• Кардиогенный отек лёгких;❖ левожелудочковая недостаточность; острая ишемия левого желудочка;
872 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ❖ гипертоничекии криз, злокачественная артериальная гипертензия;❖ митральная регургитация;❖ митральный стеноз;❖ перегрузка объёмом, особенно при сочетании с почечной или сердечной недостаточностью,? . • Отёк лёгких, связанный с повышенной проницаемостью альвеолокапилляр¬ной мембраны (ОРДС);❖ наиболее часто:- сепсис и синдром системной воспалительной реакции;- аспирация;- массивные гемотрансфузии; менее часто:- утопление;- панкреатит;- воздушная или жировая эмболия;- аортокоронарное шунтирование;- пневмония;- передозировка лекарств;- ингаляционное повреждение;- острая интерстициальная пневмония;- ишемия-реперфузия (например, посттромбэктомический период, пост¬ трансплантационный период).• Отёк лёгких неясного или смешанного генеза;реэкспансионный отёк лёгких;-о- нейрогенный отёк лёгких; отёк лёгких после токолиза.• Диффузные альвеолярные геморрагии:❖ микроскопический ангиит;❖ системные заболевания соединительной ткани;А синдром гудпасчера;❖ тяжёлая коагулопатия и трансплантация костного мозга.• Поражение лёгочного интерстиция:■Ф- экзогенный аллергический альвеолит;❖ вирусная или атипичная пневмония.• Поражение лёгочных сосудов: о тромбоэмболия;^ лёгочные васкулиты;о- интракардиальные или интрапульмональный шунты.Фокальные поражения лёгких:❖ долевая пневмония;❖ контузия лёгких;❖ ателектаз доли.Поражение плевры:❖ пневмоторакс;❖ массивный плевральный выпот.В настоящей главе мы более подробно остановимся на одном из самых сложных состояний из группы гипоксемической ОДН — остром респираторном дистресс- синдроме.Острый респираторный дистресс-синдромОРДС является клиническим синдромом, который в настоящее время довольно часто встречается у больных как хирургических, так и терапевтических отделений.
ОСТРАЯ ГИПОКСЕМИЧЕСКАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ, ВКЛЮЧАЯ ОРДС 873В основе развития ОРДС лежит повреждение эпителиального и эндотелиального барьеров лёгких, острый воспалительный процесс и отёк лёгких, приводящие к развитию ОДН,Американо-Европейской согласительной конференцией (1992) по ОРДС пред¬ ложено выделять две формы данного заболевания:• острое повреждение лёгких (ОПЛ), которое включает как начальный, более лёгкий этап заболевания, так и наиболее тяжёлые формы;• собственно ОРДС, являющийся наиболее тяжёлым заболеванием,ОПЛ/ОРДС определяется как воспалительный синдром, связанный с повы¬ шением проницаемости альвеолокапиллярной мембраны и ассоциированный с комплексом клинических, рентгенологических и физиологических нарушений, которые не могут быть объяснены наличием левопредсердной или лёгочной капиллярной гипертензии (но могут с ней сосуществовать).ОПЛ и ОРДС имеют острое начало, могут длиться несколько дней, а иногда и недель, связаны с одним или несколькими факторами риска и характеризуются артериальной гипоксемией, резистентной к оксигенотерапии, и диффузными рентгенологическими инфильтратами. Хронические заболевания лёгких, такие, как интерстициальный лёгочный фиброз или саркоидоз, которые технически соответствуют критериям определения ОПЛ, за исключением хронического тече¬ ния, исключаются из группы заболеваний ОПЛ и ОРДС. Рекомендованные крите¬ рии ОПЛ и ОРДС представлены в табл. 67-1.Таблица 67-1. Рекомендованные критерии ОПЛ и ОРДС.КритерииТечениеОксигенацияРентгенография грудной клеткиЗаклинивающее давление в лёгочной артерииОПЛостроеначалоPPj/no <300 мм рт.ст, (независимо от уров¬ ня PEEP)Двусторонние лёгочные инфильтраты на фронтальном рентгеновском снимке<18 мм рт.ст. или отсутствие клинических признаков лево- предсердной гипертензииОРДСостроеначалоP^02/Fi02<200 мм рт.ст. (независимо от уров¬ ня PEEP)Двусторонние лёгочные инфильтраты на фронтальном рентгеновском снимке¿18 мм рт.ст. или отсутствие клинических признаков лево¬ предсердной гипертензии~ парциатшное напряжение кислорода в артериальной крови, FiO^ - фракция кислорода во вдыхаемой смеси, PEEP - положительное давление в дыхательных путях в фазу выдоха.Следует отметить, что данное определение не является идеальным. Так, пред¬ лагается использование значений без учёта положительного давления в фазу выдоха (PEEP), хотя хорошо известно, что PEEP оказывает значительное влияние на показатели оксигенации. Наличие двусторонних лёгочных инфиль¬ тратов обязательно для определения ОРДС, однако характеристика инфильтратов плохо очерчена, многие эксперты признают, что данные изменения не являются ни симметричными, ни диффузными,ПРИЧИНЫ ОСТРОГО РЕСПИРАТОРНОГО ДИСТРЕСС-СИНДРОМАОРДС может быть следствием как «прямого», так и «непрямого» повреждения лёгких. «Непрямой» механизм ОПЛ/ОРДС связан с внелёгочными заболевания¬ ми, при которых повреждение лёгких является результатом системной воспали¬ тельной реакции организма, т.е. ассоциировано с повреждающими эффектами цитокинов и других биохимических и клеточных медиаторов. Наиболее часто встречающиеся клинические состояния, ассоциированные с развитием ОРДС, представлены в табл. 67-2.
874 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИТаблица 67-2. Клинические состояния, ассоциированные с развитием ОРДСПрямое повреждение лёгкихНепрямое повреждение легкихАспирация желудочного содержимогоТяжёлый сепсисТяжёлая торакальная травмаТяжёлая неторакальная травмаКонтузия лёгкихМножественные переломы длинных костейДиффузная лёгточная инфекцияГиповолемический шокбактериальнаяМассивная гемотрансфузиявируснаяОстрый панкреаштpneumocystis cariniiПередозировка наркотиковИнгаляция токсичных газовРеперфузионное повреждениеУтоплениеПосле трансплантации лёгкихПосле аортокоронарного шунтированияПАТОГЕНЕЗВ основе ОРДС лежит воспалительный процесс, что кардинальным способом отличает его от кардиогенного (гидростатического) отёка лёгких. В воспалительном ответе участвуют гуморальные и клеточные элементы. Гуморальное звено включает в себя повышение продукции и активацию различных систем, таких, как системы комплемента, коагуляции, кинины, цитокины, активные продукты кислорода, ней¬ ропептиды, вазоактивные пептиды, простагландины, оксид азота, тромбоцитарные факторы и др. Клеточное звено воспалительного процесса при ОРДС состоит из про¬ цессов адгезии, хемотаксиса и активации нейтрофилов, макрофагов и лимфоцитов.ГазообменОсновным механизмом гипоксемии при ОПЛ/ОРДС является внутрилёгочный шунт справа налево. Причиной формирования шунта является перфузия затоплен¬ ных экссудатом и спавшихся (ателектазироанных) альвеол. Нормальной компен¬ саторной реакцией на альвеолярную гипоксию является гипоксическая лёгочная вазоконстрикция, однако при ОПЛ/ОРДС данный механизм либо недостаточен, либо отсутствует. Пшоксемия, в основе которой лежит шунт, рефрактерна к окси- генотерапии даже с очень высокой р102, поэтому в данной ситуации основным методом улучшения оксигенации является создание положительного дополни¬ тельного давления в дыхательных путях, что позволяет восстановить вентиляцию в невентилируемых лёгочных регионах и уменьшить шунт.Механика дыханияДля больных с ОРДС характерны выраженные изменения механики дыхания (т.е. параметры, описывающие объёмы лёгких, потоки и давления в дыхатель¬ ных путях; табл. 67-3). Статический комплайнс (изменение лёгочного объёма на заданное изменение транспульмонального давления) респираторной системы С^^, у больных ОРДС практически всегда снижен. В исследованиях, в которых использо¬ вались пищеводные катетеры, было показано, что лёгочный комплайенс С^ также снижен до 32-72 мл/см водн.ст. (40-60% от нормы), комплайнс грудной клетки С^^ составляет 59-147 мл/см водн.ст. (50-80% от нормы). Снижение С^ вызвано нарушениями эластических свойств грудной клетки и стенок брюшной полости (повышение давления в брюшной полости и повышение ригидности стенок).
ОСТРАЯ ГИПОКСЕМИЧЕСКАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ, ВКЛЮЧАЯ ОРДС 875Таблица 67-3. Параметры механики респираторной системы в норме и при ОРДСПараметрыОРДСНормаСтатический комплайнс респираторной системы Crs, мл/см водн.ст.30-3457-85Статический комплайнс лёгких С., мл/см водн.ст.32-7274-122Статический комплайнс грудной клетки Ccw, мл/см водн.ст.59-147118-179Сопротивление респираторной системы Rrs, см водн.ст./л в секунду8-121-8Вязкостное сопротмвление респираторной системы Rrs-ve, см водн.ст./л в секунду5-71-2Постоянная времени t. с0,17-0,410,42-0,48Функциональная остаточная ёмкость FRC, л0,6-1,82,4Auto-PEEP, см водн.ст.2-5К сожалению, статический комплайнс не даёт информации о региональных особенностях лёгких у больных ОРДС, в данной ситуации большое значение при¬ обретает оценка кривой «давление-объём», которая обычно строится во время инфляции в дыхательные пути последовательных порций заданных объёмов с помощью большого шприца. Полученная кривая имеет два колена: нижнее коле¬ но и верхнее колено (рис. 67-3). Считается, что при уровне давления менее точки нижнего колена альвеолы находятся в спавшемся, коллабированном состоянии, а при давлении больше точки верхнего колена альвеолы перерастянуты. В идеале колебания положительного давления в дыхательных путях больного во время респираторной поддержки должны колебаться между точками верхнего и ниж¬ него колен.КЛИНИЧЕСКАЯ КАРТИНАРазвитие ОПЛ/ОРДС происходит чаще всего в первые 12-48 ч от начала раз¬ вития основного события (заболевания), хотя в ряде случаев возможно развитие ОПЛ/ОРДС и через 5 сут. Пациент с ОРДС часто жалуется на диспноэ, дискомфорт в грудной клетке, сухой кашель, причём данные симптомы могут на несколько часов опережать развитие диффузных инфильтратов лёгких по данным рентгено¬ графии грудной клетки.Осмотр больного выявляет цианоз, тахипноэ, тахикардию и признаки повы¬ шенной работы дыхания (участие в дыхании вспомогательных мышц). На ранних этапах развития заболевания больной часто возбуждён, ажитирован, при прогрес¬ сировании нарушений газообмена — заторможен, оглушён, возможно развитие гипоксемической комы. Частой клинической находкой у больных с ОРДС также является гипертермия и артериальная гипотензия. Характерными аускультатив-объём у больных ОРДС.
876 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИНЫМИ признаками ОРДС является диффузная крепитация, жёсткое, а иногда и бронхиальное, «амфорическое» дыхание.Облигатным признаком ОРДС является гипоксемия (З^О^ ниже 90%, часто ниже 75%). Больные с ОРДС практически всегда рефрактерны к терапии кислородом, что отражает основной механизм нарушения газообмена при ОРДС — разврггие внутрилёгочного шунта. Для ранних этапов ОРДС характерно наличие гипо¬ капнии (Р^С02<35 мм рт.ст.) и респираторного алкалоза (рН>7,45), связанных с высокой минутной вентиляцией, однако по мере прогрессирования заболевания, вследствие повышения альвеолярного мёртвого пространства, высокой продукции СО2 и развития усталости дыхательных мышц, происходит нарастание Р^СО^, и алкалоз сменяется ацидозом.Лабораторные признаки мало специфичны для ОРДС, большинство из них свя¬ заны с основным заболеванием. Так как ОПЛ/ОРДС часто сопутствует системной воспалительной реакции организма на инфекцию или другие факторы, лабора¬ торные параметры отражают данные изменения: лейкоцитоз или лейкопения, анемия. Так как ОРДС часто является проявлением полиорганной недостаточ¬ ности, то лабораторные тесты мог^т давать информацию о наличии недостаточ¬ ности функции печени (цитолитиз, холестаз) или почек (повышение креатинина, мочевины).РЕНТГЕНОГРАФИЯ И КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ ГРУДНОЙ КЛЕТКИХарактерными рентгенологическими находками при ОРДС является появле¬ ние картины «матового стекла» и диффузных мультифокальных инфильтратов довольно высокой плотности (консолидация) с хорошо очерченными воздуш¬ ными бронхограммами, т.е. развитие обширного поражения паренхимы лёгких (рис. 67-4). Кроме того, довольно часто может также наблюдаться небольшой плевральный выпот. Рентгенографическую картину ОРДС довольно непросто дифференцировать с кардиогенным отёком лёгких. В пользу ОРДС свидетель¬ ствует более периферическое расположение инфильтративных теней, нормаль¬ ные размеры сердечной тени и отсутствие или небольшое количество линий Керли В.КТ позволяет получить дoпoлн^ггeльнyю информацию о степени и протя¬ жённости поражения паренхимы лёгких, а также выявить наличие баротравмыили локализованной инфекции, т.е. те данные, которые не могут быть полу¬ чены при обычной рентгенографии. Ранние КТ исследования структуры лёг¬ ких отвергли концепцию гомогенного поражения лёгких у больных ОРДС. Было показано, что локализация лёгоч¬ ных инфильтратов носит пятнистый, негомогенный характер, причём суще¬ ствует вентрально-дорзальный гради¬ ент лёгочной плотности: нормальная аэрация лёгочной ткани в вентральных (т.н. независимых) отделах, картина «матового стекла» в промежуточных зонах и плотные очаги консолидации — в дорзальных (зависимых) отделах (рис. 67-5). Причиной развития плот-Рис. 67-4. Рентгенологическая картина при ных очагов в дорзальных отделах явля- ОРДС: двусторонние диффузные мультифокаль- зависимое от силы тяжести рас-ные инфильтраты. пределение отека легких и, в большей
ОСТРАЯ ГИПОКСЕМИЧЕСКАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ, ВКЛЮЧАЯ ОРДС 877степени, развитие «компрессионных ателектазов» зависимых зон вследствие их сдавления вышележащими отёчными лёгкими.ТЕРАПИЯПервым принципом терапии ОПЛ/ОРДС является диагностика и лечение заболевания, приведшего к развитию ОПЛ/ОРДС. Необходимо прекратить воздействие первичного повреждаю¬ щего фактора и предотвратить даль¬ нейшую стимуляцию воспалительного Рис. 67-5. КТ при ОРДС; плотные очаги консо- ответа организма. Так как инфекция лидации в дорзальных отделах, картина «мато- и сепсис являются наиболее частой вого аекла» в промежуточных зонах, нормаль- причиной ОПЛ/ОРДС, то в качестве ная аэрация лёгочной ткани в вентральных терапии первичного повреждающего отделах, фактора обычно рассматриваются анти¬ биотики. В некоторьк ситуациях, например, при абдоминальном сепсисе или при абсцессах любой локализации, может потребоваться проведение хирургических операций, направленных на ограничение локального воспалительного процесса. В тех ситуациях, когда терапия основного события или заболевания, вызвавшего ОРДС, невозможна (например, после массивных гемотрансфузий, аортокоро¬ нарного шунтирования и др.), возможно только проведение поддерживающей терапии ОПЛ/ОРДС. т.е. терапии, направленной на ограничение системного воспалительного ответа и обеспечение адекватной доставки Oj к тканям в тече¬ ние того времени, которое требуется для разрешения основной причины ОРДС, Поддерживающую терапию ОРДС условно можно разделить на респираторную поддержку и консервативную (фармакологическую) терапию.Респираторная поддержкаХотя некоторые больные ОРДС способны поддерживать адекватную оксиге¬ нацию тканей при спонтанном дыхании во время проведения О^-терапии или неинвазивной вентиляции лёгких через маску, большинство пациентов нужда¬ ются в проведении интубации трахеи и ИВЛ. Задачей респираторной поддержки является обеспечение нормального газообмена (Р О, в пределах 60-75 мм рт.ст., ~ 90-93%).Протективная вентиляция лёгкихНедавние исследования показали, что традиционная ИВЛ может приводить к развитию вентилятор-индуцированного повреждения лёгких (ВИПЛ, ventilator- induced lung injury). В течение последнего десятилетия знания о ВИПЛ значительно расширились: к традиционному осложнению ИВЛ, связанному с высоким уровнем давления в дыхательных путях (баротравма), прибавились данные о повреж¬ дающем действии больших дыхательных объёмов (волютравма), о возможности развтия ВИПЛ вследствие повторных, от цикла к циклу, расправлений и спадений альвеол (ателектравма) и о развитии во время ИВЛ воспалительного ответа со стороны лёгких вследствие высвобождения провоспалительных медиаторов (био¬ травма).При традиционной ИВЛ обычно применяют дыхательный объём (V^) 10-15 мл/кг веса больного. Такой намного выше, чем те объёмы, которые использует здо¬ ровый человек в условиях покоя (5-6 мл/кг веса), однако большие объёмы необ¬ ходимы для достижения нормальных значений Р3СО2 и pH артериальной крови и предотвращения развития ателектазов. В последние годы было опубликовано
878 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИшесть рандомизированных контролируемых исследований, в которых изучалась эффективность ИВЛ с использованием малых дыхательных объёмов (табл, 67-4). В самом крупном исследовании ARDS Network Study (включавшем 861 больного с ОРДС) было убедительно доказано, что использование равного 6 мл/кг веса, приводит к снижению летальности больных ОРДС на 22% по сравнению с исполь¬ зованием ИВЛ с обычным 12 мл/кг веса. Такой подход к ИВЛ при ОРДС полу¬ чил название «протективной вентиляции». При данном подходе акцент смещён не на достижение нормокапнии и нормального pH, а на поддержание небольших давлений в дыхательных путях (давление плато не должно превышать 30 см вод. ст.). Протокол ARDS Network Study представлен в табл. 67-5.Таблица 67-4. Рандомизированные контролируемые исследования, посвящённые изучению роли протективной вентиляции лёгких при ОРДСИсследо¬ваниеОбщеечислобольныхкОбычная» вентиляцияПротактивнаявентиляцияЛетальность в фуппе «обы>тойн ИВЛЛетальность в Фуппе протек* тивной ИВЛBrochard et ai., 1998116>10 мл/кг, нормаль¬ ное PaCOj<10 мл/кг, Pplato <25 см водн.ст.37,9%46,6%Stewartétat.,1998120V =10-15 мл/кг,Рреа1< <50 см водн.ст./^<мл/кг, Рреа1«30 см водн.ст.47%50%Brower et 3l., 199952V =10,2+0,1 мл/кг, Рреак=30,6±0,8 см водн.ст.V^=7,3±0,1 мл/кг, Рреак:=24,9±0,8 см еодн. ст.46%50%Amato et al., 199853V=12 мл/кг, PaCOj=4,7- 5,1 i(Pa. min PEEP для поддержания PaO^<6 мл/кг, PEEP выше UP по кривой P/V, Рреак <20 см водн.ст. над PEEP71%38%ARDSNetwork.2000861V^=12 мл/кг, Pplato <50 см водн.ст.Vy=6 мл/кг, Pplato <30 см водн.ст.39,8%31,0%Villar et ai., 2006103V^=9-11 мл/кг,PEEP >5 см водн.ст.V^=5-8 мл/кг, PEEP=i^lex+2 см водн.ст.55,5%34%Примечание: - дыхательный объём, Рреак - пиковое давление, PEEP - положительное дав¬ ление в конце выдоха, Pplato — давление плато, UP - нижняя точка сгиба (low inflection point), кртая P/V — кривая давление-объём.Таблица 67-5. Протокол респираторной поддержки при остром респираторном дистресс-синдроме (NIH ARDS Network)ПараметрыПротоколРежим вентиляцииVolume assist-controlДыхательный объём<6 мл/и- от должной массы телаДавление плато<30 см водн.ст.Частота респиратора / желаемый pH6-35/мин, регулировать для достижения pH >7,30, если возможноИнспираторный поток, 1/ЕРегулировать для достижения 1/Е 1/1-1/3Уровень желаемой оксигенации55 <PaOj ^0 мм рт.ст. или 88 <ЗД*<95%
ОСТРАЯ ГИПОКСЕМИЧЕСКАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ. ВКЛЮЧАЯ ОРДС 879Окончание табл. 67-5Комбинация FIOj/PEEP, мм рт.ст.0,3/5, 0,4/5, 0,4/8, 0,5/8, 0,5/10, 0,6/10, 0,7/10, 0,7/12, 0,7/14, 0,8/14. 0,9/14, 0,9/16, 0,9/18, 1,0/18, 1,0/22, 1,0/24Отлучение от респиратораПопытки отлучения при помощи pressure support при FrO^/PEEP < 0,40/8Должная масса тела для мужчин=50+{0,91х[рост в см-152,4]): должная масса тела для женщин^5+(0,91х[рост в см-152,4]).Постепенное повышение P^COj до 80-100 мм рт.ст. и снижение pH до 7,2 («пер- миссивная гиперкапния») обычно удовлетворительно переносится больными, однако, конечно, сопряжено с рядом потенциальных побочных явлений (вазо¬ дилатация, снижение сократимости миокарда, отёк головного мозга), что делает непригодным использование пермиссивной гиперкапнии у больных с коронарной болезнью сердца или с повышением внутричерепного давления.Выбор PEEPКроме проблемы выбора при ОРДС одним из важнейших параметров ИВЛ является выбор PEEP. Потенциальными достоинствами PEEP являются улучше¬ ние оксигенации и защита против развития ВИПЛ. Добавление PEEP обеспечивает рекрутирование и стабилизацию повреждённых альвеол, таким образом приводя к улучшению соотношений vyO. и комплайенса лёгких. В свою очередь, улучшение оксигенации снижает потребность в высокой РіОз и предотвращает дальнейшее повреждение альвеол высокими концентрациями О^. Кроме того, PEEP предохра¬ няет лёгкое от дальнейшего повреждения:• препятствует повторным, от цикла к циклу, расправлениям и спадениям аль¬ веол;• уменьшает действие «растягивающих сил» положительного давления, созда¬ ваемого при ИВЛ;• улучшает распределение вентиляции и предотвращает таким образом регио¬ нальное перерастяжение альвеол.Очень высокие значения PEEP могут привести к перерастяжению альвеол, сни¬ жению лёгочного комплайнса, снижению сердечного выброса. Такие наблюдения привели к развитию концепции «лучшего РЕЕР», т.е. такого уровня давления в фазу выдоха, которое балансирует между благоприятными и неблагоприятными эффектами PEEP. Точный уровень «лучшего РЕЕР» пока не известен, в настоя¬ щее время рекомендовано назначать PEEP от 5 см вод.сг, со ступенчатым повы¬ шением на 3-5 см (до максимальных цифр 20-25 см вод.ст.) для достижения Sa02>90%, минимальной FiO^ и удовлетворительного гемодинамического статуса. Рекомендуемые сочетания PEEP и FiOj представлены в табл. 67-5. Другими подхо¬ дами к выбору PEEP является титрация PEEP для достижения максимального ста¬ тического комплайенса респираторного аппарата или подбор PEEP на основании построения кривой давление-объём: значения PEEP выбирают с учётом кривой давление-объём, на 2 см водн.ст. выше нижнего «колена«» (lower inflection point), которое теоретически отражает уровень давления, необходимый для предотвра¬ щения спадения (дерекрутирования альвеол).Манёвры рекрутированияВ последнее время при проведении респираторной поддержки у больных ОРДС большое внимание уделяется проведению манёвров рекрутирования — приёмам, направленным на максимальное расправление коллабированных альвеол. Суть манёвров рекрутирования заключается в создании высокого положительного дав¬ ления в дыхательных путях в течение 30-120 с. Такая длительность необходима по двум причинам:• некоторые альвеолы для полного раскрытия требуют достаточно длительного времени;
880 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИШь-• ДЛЯ создания монослоя сурфактанта в заново раскрытых альвеолах также необходимо определённое время.В дальнейшем, для предотвращения дерекрутирования (спадения) альвеол достаточно поддержания более низкого транспульмонального давления, т.е. дав¬ ление закрытия меньше, чем давление открытия, и PEEP, необходимый для под¬ держания альвеол в «открытом» состоянии, гораздо меньше, чем уровень давле¬ ния во время рекрутирования. Основными методами рекрутирования являются:• постоянная инфляция лёгких (СРАР) для достижения давления в дыхатель¬ ных путях 45 см Н2О в течение 40-60 с;• ступенчатое повышение PEEP на 5 см водн.ст. (30 с/ступень) от исходного уровня PEEP до 35 см Н2О с одновременным уменьшением для ограниче¬ ния пикового инспираторного давления до 35 см водн.ст.;• вентиляция, контролируемая по давлению: пиковое давление 45 см водн.ст., в течение 2 мин (рис. 67-6);• добавление периодических раздуваний лёгких — «вздохов» с объёмами, достаточными для повышения давления в дыхательных путях до 30-45 см водн.ст., 1-2 раза/мин,В нескольких открытых исследованиях были показаны эффекты манёвров рекрутирования, которые обычно приводят к улучшению параметров газообмена и механики дыхания. Данные приёмы более эффективны у больных с «внелё- точными» причинами ОРДС. Потенциальным осложнением манёвров является снижение сердечного выброса/артериального давления вследствие повышения интраторакального давления, баротравмы.Прональная позицияУлучшение оксигенации больного с ОРДС может быть достигнуто за счёт про¬ нальной позиции, т.е. придания больному положения лёжа на животе. Данный приём приводит к улучшению оксигенации примерно у 65% больных ОРДС. Механизм положительного эффекта прональной позиции связан с:• расправлением гравитационно-зависимых ателектазов;• улучшением VVQ баланса;• повышением <^нкциональной остаточной ёмкости лёгких;• мобилизацией бронхиального секрета.Постоянная инфляция легких: СРАРjUII ишСтупенчатое повышение PEEPгтВентиляция контролируемая по давлениюРШ1М|ш1 шО 1 „ 3 4 5Время, МИНРис. 67-6. Методы рекрутирования [Lim et al,, 2004]. Вверху: постоянная инфляция лёгких: СРАР 45 см Нр в течение 40 с. В середине: ступенчатое повышение PEEP на5 см Н^О {30 с/ступень) от исходного уровня PEEP (здесь 8 cm Нр) до 35 см Н^О с одно¬ временным уменьшением для ограничения пикового инспираторного давления до 35 см HjO. После чего СРАР 35 см нр удерживает¬ ся в течение 30 с, и начинается ступенчатое снижение PEEP на 5 см Н^О/ступень. Внизу: вентиляция, контролируемая по давлению; пиковое давление 45 см нр, соотношение вдоха к выдоху 1:2, и уровень PEEP 16 см HgO в течение 2 мин.
ОСТРАЯ ГИПОКСЕМИЧЕСКАЯ ДЬІХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ, ВКЛЮЧАЯ ОРДС 881Потенциальными проблемами прональной позиции являются:• повышенное венозное давление головы (отёк лица);• повреждение глаз (кератиты, ишемия сетчатки и оптического нерва);• смещение эндотрахеальной трубки и сосудистых катетеров;• повышение внутрибрюшного давления.Длительность «прональной позиции» пока чётко не установлена, есть рекомен¬ дации её использования до 18 ч в сутки с перерывами для ухода, смены катетеров и т.д.Фармакологическая терапияИнгаляционный оксид азотаИнгаляционный оксид азота (iNO) является селективным вазодилататором, так как вызывает вазодилатацию только в хорошо вентилируемых отделах лёгких, при¬ водя к уменьшению шунтового кровотока и улучшению оксигенации. Кроме того, iNO снижает давление в лёгочной артерии, и поэтому его использование целесо¬ образно у больных ОРДС с недостаточностью правого желудочка. Ингаляционный N0 также обладает потенциалом уменьшения формирования интерстициального отёка лёгкого и снижает секвестрацию нейтрофилов в ткани лёгких.Клиническая эффективность iNO доказана во многих исследованиях: iNO зна¬ чительно улучшал показатели оксигенации у больных с ОРДС, однако не приво¬ дил к ул)гчшению других показателей — уменьшению длительности пребывания больных в отделении и повьппению выживаемости больных (табл. 67-6). Однако у больных ОРДС с тяжёлой рефрактерной гипоксемией и дисфункцией правого желудочка вследствие лёгочной гипертензии терапия iNO может иметь решаю¬ щее значение. В настоящее время использование iNO рекомендовано у больных с рефрактерной гипоксемией (Р^02/Рі0з <120) и высоким лёгочным сопротив¬ лением (PVR >400 динхсекхсм'^), критерием ответа на N0 является повышение PpypiOj, как минимум, на 20%. Около 40-70% всех больных являются «ответ¬ чиками» на iNO. Дозы iNO при ОРДС составляют 2-40 ррш, чаще всего 2-10 ррш. Эффективность iNO зависит от степени рекрутирования альвеол, выраженности воспалительного процесса.Таблица 67-6. Рандомизированные контролируемые исследования, посвящённые изучению роли iNO при ОРДСИоследо-вакиеОбщеечислобольныхДозаN0,ppmДлитепь- ностъ тера¬ пии, доиИсходыLundin et ai., 19992602-40до 30В группе N0 — меньше эпизодов тяжёлой ОДН (2,2% 10,3%), летальность схода<ая {44% уз 40% в фуппе контроля)Dellinger et а!.. 19981771,25-80до 28В группе N0 — повышение Р^0^20% в первые 4 ч у 60% больных (в фуппе контроля — у 24%), В тече¬ ние первых 4 дней уменыА1ение РЮ^ в фуппе N0. Летальность сходная {40% уз 32-38% в группе кон¬ троля)Michael et al., 1998405-203В фуппе N0 — повышение Р^02/П05>20% и снижение ПО^ на 0,15 — у большего числа больных, чем в груп¬ пе контроля, однако данное различие наблюдалось лишь в первые 24 чTroncy et al., 1998ЗО0,5-40до 30В группе N0 — улучшение показателей оксигенации у большего числа больных, чем в группе контроля в пер¬ вые 24 ч. Летальность сходная (60% уз 67% в группе контроля)
882 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИОкончание табл. 67-6Taylor et al., 2004В группе N0 — повышение РаО^ у большего числа больнык, чем в группе контроля а первые 48 ч. Летальность сходная (23% уз 20% в группе контроля)Препараты сурфактантаПрепараты сурфактанта являются основой терапии респираторного дистресс- синдрома новорождённых (состояние, обусловленное дефицитом сурфактанта), поэтому предпринимались многократные попытки использования препаратов сурфактанта и у больных ОРДС. У больных ОРДС доказано нарушение функции и продукции эндогенного сурфактанта, а также уменьшение его количества. Такие изменения повышают потенциал «затопления» альвеол и их спадения, приводя, таким образом, к снижению лёгочного комплайнса и усугублению вентиляционно-перфузионного дисбаланса. Задачей введения экзогенного сур¬ фактанта является восстановление нормального поверхностного натяжения в альвеолах. Кроме того, препараты сурфактанта способны уменьшить риск раз¬ вития нозокомиальной пневмонии ввиду наличия у них антибактериальных свойств. Сурфактант назначается эндотрахеально, либо в виде инстилляций при проведении бронхоскопии, либо через небулайзер. По данным Gregory и соавт., бронхоскопические инстилляции бычьего сурфактанта в дозе 100 мг/кг 4 раза/с значительно улучшают показатели оксигенации в течение 120 ч и, кроме того, могут улучшить выживаемость больных ОРДС. В крупном (более 700 больных) рандомизированном исследовании не было показано влияния ингаляционного синтетического сурфактанта на выживаемость больных ОРДС, поэтому изучение данной группы препаратов пока продолжается. Возможно, что эффект терапии препаратами сурфактанта зависит от их природы, дозы, способа и времени назначения. В настоящее время наиболее перспективными считаются препа¬ раты сурфактанта, имеющие в своём составе апопротеины (синтетические — SP-B или рекомбинантные — rSP-C), так как благодаря им препараты приоб¬ ретают поверхностно-активные свойства, близкие к нативным сурфактантам, и противовоспалительную активность.ГлюкокортикостероидыНесмотря на теоретическую роль ГКС при ОРДС (действие на воспалительные цитокины), их эффективность в ранней фазе ОРДС фактически равна нулю. Более того, в некоторых исследованиях был продемонстрирован повышенный риск развития инфекционных осложнений и даже повышение летальности больных ОРДС при назначении ГКС. Однако в ранних исследованиях ГКС назначались в относительно больших дозах (до 120 мг/кг/сут) и в течение относительно корот¬ кого времени (2-5 дней). Кроме того, роль ГКС может быть более значима на поздних стадиях ОРДС (позже 5-10 дня). В одном из исследований была показана эффективность метилпреднизолона в «стрессовых» дозах (начало от 2 мг/кг/сут с постепенным снижением дозы, длительность терапии 32 дня) у больных с фибропролиферативной фазой ОРДС: улучшение индекса повреждения лёгких, полиорганной недостаточности и улучшение выживаемости больных (88% про¬ тив 38% в контрольной группе). В другом недавно выполненном исследовании ARDS Network, в котором изучалась такая же схема ГКС у 180 больных ОРДС (7-14 дни), летальность больных оказалась сходной в группе ГКС и грзшпе срав¬ нения: 29,2% против 28,6%.АнтиоксидантыСуществуют веские доказательства роли свободных радикалов в патогенезе ОПЛ/ОРДС; доказано их повреждающее действие на протеины клеток и матрикса, липиды и нуклеиновые кислоты. Системы антиоксидантной защиты у больных
ОСТРАЯ ГИПОКСЕМИЧЕСКАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ, ВКЛЮЧАЯ ОРДС 883ОРДС истощены, так, концентрация и активность в БАЛ одного из наиболее актив¬ ных компонентов антиоксидантной защиты — глютатиона — значительно снижена у больных ОРДС. Назначение предшествеников глютатиона — Ы-ацетилцистеина и процистеина — усиливает синтез эндогенного глютатиона. В ряде рандомизирован¬ ных исследований было показано, что назначение средних доз Н-ацетилцистеина (70 мг/кг/сут) и процистеина (63 мг/кг/сут) ускоряет разрешение ОПЛ/ОРДС, повышает сердечный выброс, однако не влияет на выживаемость больных.ПРОГНОЗПрогноз при ОРДС неблагоприятный, летальность больных, как правило, составляет 40-60%. Чаще всего летальность больных ОРДС больше связана с последствиями сепсиса и полиорганной недостаточностью, чем с тяжестью дыха¬ тельной недостаточности, хотя данные последних работ по изучению протектив¬ ной вентиляции лёгких свидетельствуют о том, что в ряде случаев смерть больных ОРДС является прямым следствием повреждения лёгких.в течение последнего десятилетия появились обнадёживающие данные о сни¬ жении летальности от ОПЛ/ОРДС. Так, опубликованы данные об уменьшении летальности в крупном госпитале Сиэттла от 53-68% в 1983-1987 гг. до 36% в 1993 г. Сходные результаты получили специалисты из ведущего госпиталя Великобритании: снижение летальности от 66% в 1990-1993 гг. до 34% в 1994- 1997 гг. Возможным объяснением таких благоприятных перемен в прогнозе ОРДС может бьггь разработка и внедрение новых технологий респираторной поддержки, появление новых эффективных методов терапии сепсиса и улучшение общей под¬ держивающей терапии больных ОРДС.СПИСОК ЛИТЕРАТУРЫ
Глава 68 Острая вентиляционная дыхательная недостаточностьВентиляционная (гиперкапническая) дыхательная недостаточ¬ ность обусловлена первичным уменьшением эффективной лёгочной вентиляции (альвеолярная гиповентиляция), что нарушает выведе¬ ние СО2 и нередко приводит к серьёзным нарушениям кислотно¬ основного состояния. При этом уровень гиперкапнии прямо про¬ порционален степени уменьшения альвеолярной вентиляции.Кардинальным признаком вентиляционной ДН является гипер¬ капния (повышение РдС02 >45 мм рт.ст.), гипоксемия также при¬ сутствует, но она обычно хорошо поддаётся терапии кислородом. Вентиляционная ДН может развиваться вследствие нарушений функции «дыхательной помпы» или дыхательного центра.Основные проявления гиперкапнииПшеркапния приводит к увеличению мозгового кровотока, вызы¬ вая головную боль и иногда повышение внутричерепного давления. Возникающие вследствие этого нарушения проявляются в виде беспокойства, «хлопающего» тремора, спутанной речи, неустой¬ чивости поведения. Высокие уровни СО2 обладают наркотическим действием и приводят к нарушениям сознания — оглушению, сопо¬ ру и коме.Отсутствие специфических признаков гиперкапнии требует обя¬ зательного анализа газового состава крови при установлении диа¬ гноза вентиляционной ДН. Выраженность клинических проявлений зависит от степени сопутствующего ацидоза (определяемого по уровню снижения pH) и темпов его развития. Диапазон адаптации центральной нервной системы (ЦНС) к хронической гиперкапнии достаточно велик: например, Сошгое е1 а1. (1954) описали больного, который при РдС02, равном 140 мм рт.ст. (на фоне кислородотера¬ пии) отвечал на вопросы и не был заторможен.Основные проявления гиперкапнии:• симптомы, обусловленные поражением ЦНС:❖ головная боль;❖ беспокойство;^ тремор конечностей;❖ миоклонические судороги;❖ отёк диска зрительного нерва;<!► спутанная речь;❖ нарушения сознания (оглушение, сопор, кома);
ОСТРАЯ ВЕНТИЛЯЦИОННАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 885• другие признаки:❖ покраснение кожных покровов (багрово-синюшное лицо);❖ экзофтальм с гиперемией сосудов конъюнктивы:❖ повышенная потливость;❖ артериальная гипертензия и тахикардия;❖ одутловатость лица.Патофизиологические механизмы гиперкапнииВеличина р^СО^ зависит от метаболических и, главным образом, от респиратор¬ ных факторов:Р,СО,=КхУСО,/У„где к — коэффициент, УСО^ — продукция углекислоты, — альвеолярная венти¬ ляция. При этом альвеолярная вентиляция является разностью общей вентиляции лёгких (1^^) и вентиляции «мёртвого» пространства.Следовательно, основными механизмами гиперкапнии являются:• снижение минутной вентиляции лёгких (гиповентиляция);• увеличение физиологического <гмёртвого» пространства (Уу);• повышение продукции углекислоты.СИНДРОМ АЛЬВЕОЛЯРНОЙ ГИПОВЕНТИЛЯЦИИШповентиляция — снижение альвеолярной вентиляции лёгких, при котором она перестаёт соответствовать продукции углекислого газа. При гиповентиляции лёгких отмечается увеличение парциального давления СО^ в альвеолах (Р^СО^)- Поскольку общее давление газа в альвеолах остаётся постоянным, то чем боль¬ ше РдСО^, тем ниже будет парциальное напряжение в альвеолярном воздухе (Р^О^): прирост РдСО^ на 1 мм рт.ст. приводит к снижению на 1,25 мм рт.ст. При уменьшении содержания кислорода в альвеолах снижается и РО^ (рис. 68-1). Между напряжениями кислорода и углекислого газа существуют реципрокные взаимоотношения, которые описываются уравнением альвеолярного газа:Р,0,=Р10,х(Р,^-47>-Р,С0^К, где — фракция кислорода во вдыхаемом воздухе, Р^^^ — барометрическое дав¬ ление, К — дыхательный коэффициент.оofРис. 68-1. Взаимоотношения между Р^О^ и Р^СО^ при гипо- и гипервентиляции [Pierson D.J. Kacmarek R.M., 1992].
886 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИАльвеолярная гиповентиляция является следствием нарушения сложных взаи¬ моотношений между центральной регуляцией дыхания (центральным респира¬ торным драйвом) и механической работой по раздуванию лёгких, зависящей от функции дыхательной мускулатуры и податливости грудной клетки.УВЕЛИЧЕНИЕ ОБЪЁМА ФИЗИОЛОГИЧЕСКОГО ««МЁРТВОГО» ПРОСТРАНСТВАЕщё одним важным патофизиологическим нарушением при заболеваниях лёгких является увеличение Vj). Физиологическое «мёртвое» пространство скла¬ дывается из анатомического мёртвого пространства и альвеолярного мёртвого пространства — регионов лёгких с высоким вентиляционно-перфузионным (VyQ) отношением (с «холостой» вентиляцией). Для вычисления Vp используется урав¬ нение Бора:V,/V,=(PCO,-P,CO,)/P^CO,,где — дыхательный объём, Р^С02 — напряжение СО^ в конечной порции выды¬ хаемого воздуха. У нормальных индивидуумов почти всё функциональное мёртвое пространство представлено анатомическим мёртвым пространством и примерно соответствует (в мл) массе тела в фунтах. Например, у здорового человека при V^, равном 450 мл, и V^, равном 150 мл, vyv^=0,3. При обострении бронхиальной астмы или ХОБЛ V^/V^ может увеличиваться вдвое, а иногда достигает 0,8. При увеличении Vp для поддержания нормального уровня Р^СО^ требуется значительное повышение минутной и альвеолярной вентиляции, а если аппарат дыхания не в состоянии повысить вентиляцию до требуемого уровня, развивается гиперкапния.У больных с дыхательным объёмом, уменьшенным вследствие мышечной сла> бости или рестриктивного заболевания лёгких, газообмен может улучшиться после наложения трахеостомы, что связано с сокращением анатомического мёртвого пространства (часть верхних дыхательных путей выключается из газообмена).УВЕЛИЧЕНИЕ ПРОДУКЦИИ СО,Следует учитывать определённые ситуации, в которых повышается Veo,: лихо¬ радку (повышение температуры на 1 “С ведёт к повышению Vco^ на 9-14%), судороги, ажитацию (вследствие усиления мышечной активности), избыточное парентеральное питание, особенно с высоким содержанием углеводов.Основные заболевания, приводящие к вентиляционной дыхательной недостаточностик заболеваниям, которые могут быть ассоциированы с гиперкапнической ДН, относят нарушения центральной регуляции дыхания, нейромышечные заболева¬ ния, болезни грудной клетки и плевры, а также обструктивные заболевания дыха¬ тельных путей (табл. 68-1).Таблица 68-1. Клиническая классификация вентиляционной дыхательной недостаточностиЛокализация или тип пораженияМеханизмКлинический примерДыхательный центрФармакологическийПередозировка лекарственных и наркотиче¬ ских препаратов (седативные, опиаты, алко¬ голь), общая анестезияВрождённыйПервичная альвеолярная гиповентиляция (синдром «проклятий ундины»)ПриобретённыйИнсульт, опухоли мозга, резекция каротид¬ ного синуса
ОСТРАЯ ВЕНТИЛЯЦИОННАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 887Окончание табл. 68-1КомбинированныйСиндром ожирения-гиповентиляцииПроводящие нервные путиПовреждение спинного мозгаТравма, опухоль, сосудистая патологияДемиелинизирующие перифериче¬ ские нейропатииСиндром Гийена-БарреПоражение передних рогов спин¬ ного мозгаПолиомиелит, боковой амиотрофический склерозПоражение диафрагмального нерваТравма, операции на сердце, опухоли, идиопатическоеДыхательные мышцыФармакологическийМиорелаксантыПервичное поражение мышцМышечная дистрофия, полимиознт, дерма¬ томиозитНарушения нейромышечной пере¬ дачиМиастения, столбняк, ботулизмЭлектролитные и метаболические расстройстваГипофосфатемия, гипокапиемия, гипомаг- ниемия, микседемаГрудная клеткаРигидность грудной клеткиКифосколиоз, тяжёлое ожирение, травма¬ тическая асфиксия, тугие повязки грудной клеткиПлевраЭкстрапульмональная рестрикцияПневмоторакс, плевральный выпот, массив¬ ные швартыДыхательные путиОбструкция верхних дыхательных путейЭпиглоттит, инородное тело, паралич голо¬ совых связок, трахеомаляцияОбструкция нижних дыхательных путейХОБЛ, тяжёлое обострение БАПовышение вентиляции мёртвого пространстваВысокое Уд/О-отношениеХОБЛОчень низкое Уд/О'отношение, шунт справа налевоОстрый респираторный дистресс-синдромГенерализованная лёгочная гипо¬ перфузияГиповолемический или кардиогеный шок, гиперинфляций лёгких (чрезмерное PEEP*)Локализованная лёгочная гипопер- фузияТЗЛА, воздушная эмболияПовышение продукции СО^**Воспаление, усиление метабо¬ лизмаЛихорадка, сепсис, ожога, тяжёлая траамаУсиленная мышечная активностьСудороги, злокачественная гипертермияЧрезмерно калорийное питаниеПовышенный приём углеводовИнгаляция экзогенногоСОзПовышение содержания С02 во вдыхаемом воздухеНесчастные случаи•PEEP (positive end-expiratory pressure) — положительное давление в дыхательных путях в конце выдоха.** При отсутствии компенсаторного повышения альвеолярной вентиляции.
888 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИНаиболее частыми причинами «центрогенной» ДН являются; передозировка лекарственных препаратов (седативных, барбитуратов, наркотиков) и структур¬ ные повреждения ЦНС (травма, стволовой инсульт). Активность дыхательного центра также может быть снижена при хронической вентиляционной ДН — за счёт повышения уровня бикарбонатов и за счёт адаптации к хронической гипоксии. Другими причинами глубокой депрессии дыхательного центра могут быть высо¬ кие повреждения спинного мозга, а также центральная гиповентиляция (синдром «проклятия ундины»), в норме существует связь между активностью дыхательно¬ го центра и стимуляцией центральных и периферических хеморецепторов — при снижении р^2 и/или повышении Р3СО2 увеличивается эфферентная импульсация из дыхательного центра к дыхательной мускулатуре, что ведёт к повышению вентиляции и нормализации газового состава крови. При угнетении дыхательно¬ го центра происходит нарушение центральной регуляции дыхания, нарушается посылка стимулов к дыхательной мускулатуре. Характерными чертами ДН этого типа являются снижение альвеолярной вентиляции, минутной вентиляции, дыха¬ тельного объёма и/или частоты дыхания.Нейромышечные причины ДН условно можно разделить на поражения; мотонейронов передних рогов спинного мозга (боковой амиотрофический скле¬ роз, вирусный клещевой энцефалит), периферических нервов (синдром Гийена- Барре, послеоперационные и неопластические поражения диафрагмального нерва), нейромышечного синапса (миастения, синдром Итона-Ламберта) и дыха¬ тельной мускулатуры. При данных заболеваниях, несмотря на адекватную коман¬ ду из дыхательного центра, мышцы не создают достаточного трансторакального и трансдиафрагмального давления, необходимого для нормальной альвеолярной вентиляции. Нормальное дыхание возможно только при условии сохранной силы и выносливости дыхательной мускулатуры, при снижении которых развивается дисфункция и ДН. Условно дисфункцию дыхательной мускулатуры подразделяют на утомление и слабость.Утомление дыхательных мышц — это состояние, при котором происходит снижение их силы и скорости сокращения, связанное с чрезмерной работой. Утомление - процесс обратимый, и восстановление функции мышц возможно после отдыха. Явное утомление определяется как неспособность выполнять задан¬ ную нагрузку (создавать определенный уровень трансдиафрагмального давления во время каждого вдоха). Утомление дыхательной мускулатуры развивается в результате дисбаланса между потребностью дыхательной мускулатуры в энергии (работой дыхания) и доставкой энергии к ней. Увеличение нагрузки на аппарат дыхания (резистивная нагрузка, эластическая нагрузка лёгких и грудной клетки, пороговая инспираторная нагрузка, повышение минутной вентиляции) сдвига¬ ет баланс в сторону утомления. С другой стороны, развитию утомления может способствовать снижение доставки энергии: снижение содержания кислорода и энергетических субстратов в артериальной крови, неспособность мышц утилизи¬ ровать энергетические субстраты из крови, недостаточный кровоток в мышцах. При отсутствии адекватной терапии, направленной на обеспечение отдыха дыха¬ тельной мускулат^фы (респираторная поддержка), утомление дыхательных мышц может закончиться остановкой дыхания (рис. 68-2).Под слабостью дыхательной мускулатуры понимают состояние, при котором сила мускулатуры снижена и в условиях ее «отдыха». Кроме уже перечисленных нейромышечных заболеваний, мышечная слабость встречается у пациентов с экс¬ тренными состояниями, среди которых ацидоз, электролитный дисбаланс (гипо- кал иемия, гипомагниемия, гипофосфатемия), шок, сепсис, недостаточное питание, миопатии (стероидные, алкогольные и др.).При обструктивных болезнях лёгких снижение силы дыхательных мышц может бьггь связано не только со свойствами самой мышечной ткани, но и с функцио-
ОСТРАЯ ВЕНТИЛЯЦИОННАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 889Повншещ!^ на ашіаратд^)Ш№ШАльтернирующий ритм дыханияУтомление дыхательных лодшц (абдоминальный парадокс)ГиперкапнияБрадипноэОстановка дьіханияРис. 68-2. Физиологический каскад, вклю¬ чающий утомление дыхательных мышц [Cohen etal., 1982].пально невыгодным положением дыха¬ тельных мышц, что возникает, например, при гиперинфляции лёгких, у нормаль¬ ных индивидуумов при спокойном дыха¬ нии функциональная остаточная ёмкость (ФОЁ) — объём лёгких в конце спокой¬ ного выдоха равна объёму релаксации лёгочной системы (У^), т.е. объёму лёг¬ ких, при котором давление эластической отдачи респираторной системы равно нулю. Лёгочная гиперинфляция (гипер¬ воздушность) определяется как повыше¬ ние ФОЁ выше должных значений, что может быть результатом увеличения вследствие потери эластической тяги лёг¬ ких (эмфизема). Динамической лёгочной гиперинфляцией называется состояние, при котором ФОЁ становится больше вследствие того, что времени выдоха (до начала следующего вдоха) недостаточ¬ но для декомпрессии лёгкого до уровня У|.. Такое состояние возникает при выра¬ женном ограничении экспираторного воздушного потока (т.е. при повышении сопротивления дыхательных путей и сни¬ жении эластической отдачи лёгких) и приукорочении времени выдоха (например, при высокой частоте дыхания). Наиболее неблагоприятным эффектом динамической гиперинфляции лёгких служит её отрицательное влияние на дыхательную мускулатуру.Патология каркаса грудной клетки также является частой причиной венти¬ ляционной ДН. Кифосколиоз, ожирение (с массой тела >130 кг) могут быть само¬ стоятельными причинами ДН, другие же причины (пневмоторакс, экссудативный плеврит) чаще служат дополнительными факторами развития или усугубления ДН. Особо следует напомнить, что серьёзные изменения функции дыхательного аппара¬ та могут появиться после травмы грудной клетки или оперативных вмешательств.В настоящей главе мы рассмотрим два наиболее часто встречающихся состоя¬ ния, проявляющиеся острой вентиляционной ДН: ОДН у больных ХОБЛ и астма¬ тический статус.Тяжёлое обострение ХОБЛОпределение и классификацияОбострение ХОБЛ характеризуется усилением выраженности симптомов: одышки, кашля, нарастанием числа свистящих хрипов, увеличением продукции мокроты и повышением её гнойности, появлением заложенности в грудной клет¬ ке и периферических отёков. Рабочей группой специалистов по болезням лёгких США и Европы предложено следующее определение: «Обострение ХОБЛ — это относительно длительное (не менее 24 ч) ухудшение состояния больного^ по своей тяжести выходящее за пределы нормальной суточной вариабель¬ ности симптомов, характеризующееся острым началом и требующее изме¬ нения схемы обычной терапии».Тяжесть обострений у больных ХОБЛ может значительно различаться. Обычно более тяжёлые обострения развиваются у больных с более тяжёлым течением
890 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИзаболевания. Тяжёлым обострением ХОБЛ называется обострение, как правило, сопровождающееся ОДН и требующее госпитализации больного в отделение интенсивной терапии (ОИТ). Одна из недавно предложенных классификаций тяжести обострений ХОБЛ представлена в табл. 68-2.Таблица 68-2. Классификация тяжести обострений ХОБЛТяжесть обострениякритерииЛёгкоеТребуется терапия антибиотиками, но не системными ГКС; если газовый анализ крови не выполняется, то предполагается отсутствие ОДНСреднетяжёлоеТребуется терапия СГКС и антибиотиками; если газовый анализ крови не выполня¬ ется, предполагается отсутствие ОДНТяжёлоеОДН I типа: с гипоксемией, но без гиперкапнии: РД <60 мм рт.ст., Р СО. <45 мм рт.ст.Крайне тяжёлоеОДН II типа, компенсированная: с гилоксемией и гиперкапнией, но без респира¬ торного ацидоза: РД <60 мм рт.ст., Р^СО^ >45 мм рт.ст., pH >7,35ЖизнеугрожающееОДН II типа, декомпенсированная: с гипоксемией, гиперкапнией и респираторным ацидозом; Р^О^ <60 мм рт.ст., Р^СО^ >45 мм рт.ст., pH <7,35ПРИЧИНЫ ОБОСТРЕНИЯ ХОБЛИнфеюдии бронхиального дерева являются ведущей причиной тяжёлого обо¬ стрения ХОБЛ. Однако примерно в половине всех случаев причинами ОДН могут быть неинфекционные факторы:• атмосферные поллютанты;• ТЭЛА;• спонтанный пневмоторакс;• перелом рёбер или другая травма грудной клетки;• неадекватное использование седативных и наркотических препаратов, Р-блокаторов;• право- и левожелудочковая сердечная недостаточность, аритмии.Бактериальные патогены выявляются в дыхательных путях у 50-60% больныхс обострением ХОБЛ, наиболее часто — Haemophilus influenzae. Streptococcus pneu¬ moniae и Moraxella catarrhalis. Довольно часто в дыхательных путях у больных с ОДН на фоне ХОБЛ обнаруживаются грамотрицательные энтеробактерии (по разным данным, до 20-64%), причём особо пристального внимания заслуживает инфекция Pseudomonas spp., требующая специфической и более длительной анти¬ микробной терапии. Общая доля Mycoplasma pneumoniae среди всех возбудителей при обострении ХОБЛ составляет 6-9%, а Chlamydia pneumoniae — 5-7%. Вирусная инфекция может быть причиной 30% всех обострений ХОБЛ, из них на долю риновирусов приходится до 60% случаев.ТЭЛА служит частой причиной ОДН при ХОБЛ, а может стать осложнением обострения ХОБЛ. При аутопсии признаки ТЭЛА обнаруживают в 20-51% случа¬ ев обострения ХОБЛ.По данным крупного проспективного исследования, декомпенсация сердечной недостаточности явилась причиной развотия ОДН у больных ХОБЛ в 26% всех случаев обострений,ДИАГНОСТИКАК классическим проявлениям обострения ХОБЛ относятся: усиление одышки (диспноэ), увеличение количества и степени гнойности мокроты. Ощущение чрезмерного дыхательного усилия является основным среди всех ощущений диспноэ у больных ХОБЛ. Усиление кашля, увеличение количества и гнойности
ОСТРАЯ ВЕНТИЛЯЦИОННАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 891вмокроты наблюдается, как правило, при инфекциях трахеобронхиального дере¬ ва. Однако по мере утяжеления обструкции дыхательных путей клиренс мокроты может снижаться, поэтому снижение количества мокроты также может служить ^ ^ отражением обострения. Цвет мокроты имеет большее значение, чем её количе¬ ство. Гнойная (зелй'оъатая) мокрота служит надёжным индикатором бактери- альной инфекции трахеобронхиального дерева у больных с обострением ХОБЛ.К физикальньпй признакам, характерным для ОДН у больных ХОБЛ, относятся:• синхронное с дыханием напряжение мышц шеи;• активное сокращение брюшных мышц во время выдоха;• парадоксальное дыхание (во время вдоха живот втягивается вовнутрь, а груд¬ ная клетка движется кнаружи);• нарушения сознания;• артериальная гипотензия;• «хлопающий» тремор;• признаки правожелудочковой сердечной недостаточности.Наиболее важными показателями газового состава артериальной крови явля¬ ются Р^,02, Р^СО^, pH и уровень бикарбонатов артериальной крови, причём динамическое исследование этих показателей имеет большее значение, чем одно¬ кратный анализ. Для ОДН у больных ХОБЛ характерно развитие гипоксемии (Р^02<60 мм рт.ст), гиперкапнии (Р^С02>45 мм рт.ст) и респираторного ацидоза (pH <7,35). У не леченых больных с ОДН (до назначения О2) уровень Р^СО^ редко превышает 80 мм рт.ст. и почти никогда не превышает 90 мм рт.ст., так как более высокие значения Р^СОзПри дыхании атмосферным воздухом обычно ассоцииро¬ ваны с гипоксемией, несовместимой с жизнью. Однако при дыхании кислородно¬ воздушной смесью могут наблюдаться более высокие значения Р^СО^. Среди показателей газового состава артериальной крови наиболее важным параметром, отражающим остроту и тяжесть ОДН, является pH.Рентгенография грудной клетки у больных ХОБЛ при ОДН обычно не отличается от картины при стабильном состоянии. Чаще всего выявляют при¬ знаки эмфиземы лёгких (повышенную прозрачность лёгочных полей, уплощение диафрагмы, расширение ретростернального пространства, уменьшение числа и калибра лёгочных сосудов в периферических зонах) и хронического бронхита (усиление лёгочного рисунка, особенно в базальных отделах, симптом «трамвай¬ ных рельсов»). Однако при помощи рентгенографии можно выявить признаки пневмонии, ателектазов, застойных явлений в лёгких, которые не обнаруживают¬ ся при физикальном обследовании.К сожалению, проведение функциональных лёгочных тестов у больных ХОБЛ с ОДН часто неосуществимо из-за тяжести состояния, нарушений сознания и сни¬ жения кооперации, у тех больных, которые способны выполнить дыхательные манёвры, как правило, ОФВ^ <1 л (<35% должных величин). У больных, нахо¬ дящихся на ИВЛ, при помощи функционального модуля респиратора возможна оценка таких параметров механики дыхания, как общее сопротивление, общая податливость лёгких и грудной клетки, аиЮ-РЕЕР и работа дыхания.ЛЕЧЕНИЕЗадачами терапии служат: устранение причины обострения ХОБЛ, обеспече¬ ние адекватного газообмена, разгрузка дыхательной мускулатуры, профилактика осложнений.Показания для госпитализации больных с обострением ХОБЛ в ОИТ:• тяжёлое диспноэ, не поддающееся начальной экстренной терапии;• нарушения сознания (оглушение, сопор, кома);• персистирующая или прогрессирующая гипоксемия (Рр^ <50 мм рт.ст.), и/или выраженная/нарастающая гиперкапния (Р^СО^ >70 мм рт.ст.), и/или
892 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИвыраженный/нарастающий респираторный ацидоз (pH <7,30), несмотря на терапию О2 или неинвазивную вентиляцию лёгких (НВЛ).КИСЛОРОДОТЕРАПИЯШпоксемия представляет реальную угрозу для жизни больного, поэтому КИСЛО' родотерапия является приоритетным направлением терапии ОДН на фоне ХОБЛ. Целью кислородотерапии является достижение в пределах 60-65 мм рт.ст. и 5^2 - 90-93%.При ОДН у больных ХОБЛ для доставки 0^ чаще всего используются носовые канюли или маска Вентури. При назначении 0^ через канюли большинству боль¬ ных достаточно потока О^ 1-4 л/мин. Маска Вентури - более предпочтитель» ный способ доставки 0^, так как она позволяет обеспечивать довольно точные значения Р102, не зависящие от минутной вентиляции и инспираторного потока. Кроме того, маска Вентури более безопасна в условиях гиперкапнии. В среднем кислородотерапия с Р10, 24% повышает Р О, на 10 мм рт.ст., с Р10, 28% - на 20 мм рт.ст.Одним из хорошо известных осложнений кислородотерапии является гипер¬ капния (кислород-индуцированная гиперкапния). Риск развития гиперкапнии во время кислородотерапии значительно повышен у больных ХОБЛ с выраженной гипоксемией (Р3О2 <49 мм рт.ст.) и респираторным ацидозом (pH <7,35). Важно помнить, что при развитии кислород-индуцированной гиперкапнии грубой ошиб¬ кой является прекращение кислородотерапии, так как падение Р^О^ будет про¬ исходить быстрее, чем элиминация из организма СО2, и наступит момент, когда вследствие высокого парциального давления СО2 в альвеолах произойдет сниже¬ ние Рд02 и Р3О2 до значений, ниже исходных, В подобных ситуациях правильной тактикой является проведение мероприятий, направленных на улучшение механи¬ ки дыхания (бронходилататоры, мобилизация и удаление мокроты), и инициация респираторной поддержки.ЬРОИХОДИЛАТАТОРЫ И ГКСБронходилататоры являются препаратами первой линии в терапии тяжёлого обострения ХОБЛ. Даже небольшое улучшение проходимости дыхательных путей у больных ХОБЛ может привести к снижению их сопротивления и уменьшению работы дыхания, значительно улучшая клиническое состояние. Основными препа¬ ратами при обострении ХОБЛ являются ингаляционные р^-агонисты и антихоли¬ нергические препараты (ипратропия бромид), которые по сравнению с теофилли¬ ном являются более сильными бронходилататорами и обладают меньшим числом побочных эффектов. Эффективность [З^-агонистов и ипратропия при обострении ХОБЛ примерно одинакова, преимуществом рз'йгонисгов является более быстрое начало действия, а антихолинергических препаратов — высокая безопасность и хорошая переносимость. Многие эксперты считают, что при тяжёлом обострении ХОБЛ оптимальным является использование комбинированной терапии (ипра¬ тропия бромид + р^^агонист).Эффективной техникой доставки ингаляционных препаратов при обострении ХОБЛ являются дозированные аэрозольные ингаляторы (ДАИ) в комбинации со спейсером либо небулайзеры. Использование небулайзеров имеет большие преи¬ мущества при лечении тяжёлых больных с выраженным диспноэ, так как ингаля¬ ционная техника не зависит от усилия больного, не требует кооперации пациента и контроля медицинским персоналом.В настоящее время целесообразность применения препаратов теофиллина при обострении ХОБЛ оспаривается, что связано с его относительно слабым бронходилатирующим эффектом (по сравнению с р^-агонистами и ипратропия бромидом), небольшой широтой терапевтического коридора и выраженными
ОСТРАЯ ВЕНТИЛЯЦИОННАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 893побочными эффектами. Поэтому препараты теофиллина при обострении ХОБЛ рассматриваются как препараты второй или третьей линии.По данным ряда исследований, внутривенные и пероральные формы ГКС зна¬ чительно улучшают функциональные лёгочные показатели к 3-5-му дню терапии и снижают риск неудач терапии. Длительность назначения СГКС не должна пре¬ вышать 2 недель, средних доз ГКС (преднизолон 30-40 мг однократно per os или метил преднизолон 125 мг 4 раза в сутки в/в) достаточно для достижения клиниче¬ ского эффекта. Однако существуют определённые опасения при назначении СГКС больным ХОБЛ, среди которых очень высока доля пожилых людей с сопутствую¬ щими заболеваниями (сахарный диабет, артериальная гипертензия, язвенная болезнь желудка и двенадцатиперстной кишки), и терапия ГКС даже на протяже¬ нии короткого срока может привести к развитию серьёзных побочных эффектов. Альтернативой СГКС при обострении ХОБЛ может служить небулизированный будесонид, который более безопасен (средние дозы составляют 4-8 мг/сут).Рекомендуемые дозы препаратов, используемых для терапии тяжёлого обостре¬ ния ХОБЛ, представлены в табл. 68-3.Таблица 68-3. Препараты, используемые для терапии обострения ХОБЛПрепаратыСпособ доставкиРекомендуемая разовая дозаКратность введенияБронходилататорыPj-агонистыСальбутамолДАИНебулайзер100-400 мкг 2,5 мг4-8 раз в сутки 4-8 раз в суткиФенотеролДАИНебулайзер100-200 мкг 0,5-1,0 мг4-8 раз в сутки 4-8 раз в суткиАнтихолинергические препаратыИпрагропия бромидДАИНебулайзер20-80 мкг 0,5 мг4-5 раз в сутки 4-5 раз в суткиКомбинированные препаратыФенотерол/ипратропиябромидДАИНебулайзер50/20-100/40 мкг 1.0/0,5 мг (2 мл)4-6 раз в сутки 4-6 раз в суткиМетилксактиныАминофиллинВнуфивенноНагрузочная доза 5 мг/кг массы тела в течение 30 мин, затем поддержива¬ ющая доза 0,4-0,5 мг/кг/чПостоянная инфузияГКСМетилпреднизолонВнутривенно125 мг4 раза в суткиГидрокортизонВнутривенно200 мг4 раза в суткиПреднизолонPer os30-40 мг1 раз в суткиБудесонидНебулайзер2 мг2-4 раза в сутки
894 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИОкончант табл. 68-3АнтибиотикиАмоксициллин/клавуланатРеГ 05Внутривенно1,0 г1,2 г2 раза в сутки3 раза в суткиЦипрофлоксацинРег 05 Внутривенно500-750 мг 200-400 мг2 раза в сутки 2 раза в суткиМоксифлоксацинPerosВнутривенно400 мг 400 мг1 раз в сутки 1 раз в суткиЛевофлоксацинPerosВнутривенно500 мг 500 мг1 раз в сутки 1 раз в суткиГемифлоксацинРег 0$320 мг1 раз в суткиЦефотаксимВнутривенно1 г3 раза в суткиЦефтриаксонВнутривенно1-2 г1 раз в суткиЦефтазидимВнутривенно1 г3 раза в суткиЦефепимВнуфивенно1-2 г2 раза в суткиИмипенемВнутривенно0,5 г3'4 раза в суткиАНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯОснованием для назначения антибактериальных препаратов при ОДН у боль¬ ных ХОБЛ является ведущая роль бактериальной инфекции в генезе обострения. Использование антибиотиков при обострении ХОБЛ позволяет снизить бактери¬ альную нагрузку в дыхательных путях и предотвратить прогрессирование забо¬ левания в фазу паренхиматозной инфекции (пневмонию). Учитывая непосред¬ ственную угрозу жизни при развитии ОДН на фоне ХОБЛ, все больные должны получать антибиотики с целью улучшения прогноза.Антибиотики должны назначаться:1) больным с обострением ХОБЛ I типа по АшЬошзеп (наличие 3 признаков: усиление диспноэ, увеличение количества и гнойности мокроты);2) больным с обострением ХОБЛ II типа по Ап11юп15еп, когда усиление гнойно¬ го характера мокроты является одним из двух основных признаков;3) больным с тяжёлым обострением ХОБЛ, нуждающимся в ИВЛ или НВЛ.Антибиотикотерапия при обострении ХОБЛ чаще всего назначается эмпириче¬ ски, с учетом местных эпидемиологических данных о структуре возбудителей и их чувствительности к антимикробным препаратам.У госпитализированных больных с обострением ХОБЛ чаще всего используются амоксициллин/клавуланат калия и фторхинолоны. Амоксициллин/клавуланат калия активен в отношении З.рпешпотае и НлпАиепше. Однако этот антибиотик следует применять в высоких дозах (875/125 мг) для достижения в сьшоротке и бронхиаль¬ ном секрете высокой концентрации, превышающей минимальную подавляющую концентрацию (МПК) для большинства резистентных к пенициллину штаммов. Новые ^рхинолоны (лeвoфлoкcaцин^ моксифлоксацин и гемифлоксацин) активны в отношении большинства штаммов 8.рпеитотае и Я. 'ифиепте и достигают высоких концентраций в бронхиальном секрете, в несколько раз превышающих МПК; они также активны в отношении грамотрицательных бактерий (но не Р. ает^поза).^ Флорацид (левофлоксацин, 250 мг № 5 и 500 мг № 5) - «респираторный фторхинолон«>, обе¬ спечивающий эффективную и комплайентную монотерапию смешанных инфекций, а также забо¬ леваний, вызванных полирезистентными штаммами.
ОСТРАЯ ВЕНТИЛЯЦИОННАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 895РЕСПИРАТОРНАЯ ПОДДЕРЖКАУ больных ХОБЛ с ОДН основным методом респираторной поддержки является НВЛ (см. главу «Неинвазивная вентиляция лёгких?-). Важным достоинством НВЛ является возможность её быстрого прекращения, а также немедленного возобнов¬ ления при необходимости, при проведении НВЛ чаще всего используют режим под¬ держки давлением или близкий к нему режим ВІРАР. Средние значения давления на вдохе составляют 12-18 см вод.ст., на вьщохе — 4-6 см вод.ст. FÍO2 поддерживают на уровне, необходимом для 5^2 >90% (обычно FiOj составляет 0,3-0,5).ИВЛ показана больным ХОБЛ с ОДН, у которых медикаментозная и другая консервативная терапия (в т.ч. НВЛ) не приводит к дальнейшему улучшению состояния. Показания к проведению ИВЛ должны учитывать не только отсутствие эффекта консервативных методов терапии и тяжесть функциональных показате¬ лей, но также быстроту развития и потенциальную обратимость процесса, вызвав¬ шего ОДН. Как правило, при назначении респираторной поддержки проводится комплексная клиническая и функциональная оценка статуса больного.Показания к ИВЛ при ОДН на фоне обострения ХОБЛ:• абсолютные:<!' остановка дыхания;❖ выраженные нарушения сознания (сопор, кома);❖ нестабильная гемодинамика (систолическое АД <70 мм рт.ст., ЧСС <50/мин или >160/мин);утомление дыхательной мускулатуры;• относительные:^ ЧД >35/мин;❖ pH артериальной крови <7,25;❖ Р^2 <45 мм рт.ст., несмотря на проведение кислородотерапии.Однако основой для решения о проведении респираторной поддержки является клиническая характеристика пациента.Длительное использование традиционного контролируемого режима ИВЛ (при котором полностью отсутствует спонтанное дыхание) ведёт к атрофии дыхательной мускулатуры, поэтому данный режим рекомендовано использовать только в течение времени, необходимого для разрешения утомления дыхательных мышц, — около 24 ч, после чего показан перевод больного на вспомогательные режимы: вспомогательно-контролируемый или поддержки давлением.Особенностью подбора параметров вентиляции при ХОБЛ является использо¬ вание высоких инспираторных потоков (70-90 л/мин), что обеспечивает удлине¬ ние экспираторного времени, уменьшение динамической гиперинфляции лёгких и auto-PEEP. Однако чрезмерное повышение инспираторного потока во время вспомогательных режимов ИВЛ может вести к повышению ЧД с последующей гипокапнией и алкалозом.Наиболее доступным методом для оценки гиперинфляции лёгких служит давле¬ ние плато — безопасным уровнем считается его величина <30 см вод.ст. У больных ХОБЛ при выраженной гиперинфляции, проявляющейся нарушениями гемодина¬ мики, высоким риском баротравмы и чрезмерной работой дыхания, используются малые дыхательные объёмы (5-7 мл/кг) и аппаратная частота 8-10/мин. Ещё одним подходом, направленным на борьбу с auto-PEEP, является использование «внешнего» PEEP. При этом достигается не снижение, а уравновешивание auto- PEEP, т.е. снижается до минимума пороговая инспираторная нагрузка и работа дыхания. Для предотвращения дальнейшего роста auto-PEEP «внешнее» PEEP устанавливают на уровень, равный 80-90% измеренного auto-PEEP.Учитывая, что большинство пациентов с ХОБЛ до развития ОДН имели хро¬ ническую гиперкапнию, альвеолярная вентиляция контролируется не по уровню Р^СО^, а по уровню pH.
896 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИПРОГНОЗГоспитальная летальность у пациентов с ОДН на фоне обострения ХОБЛ высо¬ ка — от 10 до 30%, среди пациентов старше 65 лет — более 30%. На фоне ИВЛ летальность ещё выше — 32-57%. После выписки из стационара летальность больных ХОБЛ, перенёсших ОДН, в течение 1 года и 2 лет составляет 40-50% и 50-60%.Астматический статус. Определение, терминология и классификацияВ настоящее время существует несколько терминов, описывающих тяжёлое обострение БА.Под астматическим статусом (АС) понимают эпизод ОДН вследствие обостре' ния БА. Важно подчеркнуть, что скорость развития тяжёлого приступа не может служить диагностическим критерием АС, так как довольно часто тяжёлый приступ БА развивается настолько быстро» что летальный исход может наступить в тече^ ние нескольких часов или даже минут,В настоящее время большее распространение получил термин «тяжёлое обо' стрение БА» или «острая тяжёлая астма» . Использование этого термина является более обоснованным, так как он подчёркивает главное отличие данного состоя¬ ния — его тяжесть. Больных с уірозой остановки дыхания объединяют в группу жизнеугрожающей астмы. С другой стороны, во многих странах (США, Канаде и России) чаще всего употребляется термин «астматический статусів, однако в его определение вкладывается тот же смысл, т.е, не длительность развития приступа, а его необычная тяжесть и резистентность к обычной бронходилатирующей тера> пии.В ряде руководств по БА отдельно выделяют наиболее тяжёлый вид обострений БА — астму, близкую к фатальной, — эпизод тяжёлого обострения БА, который характеризуется развитием остановки дыхания, нарушением сознания и прогрес¬ сирующей гиперкапнией. Данное состояние требует экстренной госпитализации больных в ОИТ и проведения респираторной поддержки.Классификация тяжёлых обострений БА представлена в табл. 68-4.Таблица 68-4. Классификация тяжёлых обострений БАТяжёлое обострение 6АОдин из следующих критериев:ПСВ 33-50% лучших значений;ЧД ^ 25/мин;ЧСС > 110/мин;невозможность произнесли фразу на одном вьщохеЖизнеугрожающая 6АОдин из следующих кртериев:ПСВ <33% лучших значений;5Д <92%;РД <60 мм рт.ст.;нормокалния (Р^С02 35-45 мм рт.ст.);«немое» лёгкое;цианоз;слабое дыхательноебрадикардия;гипотензия;утомление;оглушение;комаБА, близкая к фатальнойГиперкапния (Р3СО2 >45 мм рт.ст.) и/или потребность в проведении ИВЛ
ОСТРАЯ ВЕНТИЛЯЦИОННАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 897ПРИЧИНЫ ОБОСТРЕНИЯ БАК обострению Б А могут привести различные триггеры, индуцирующие воспале¬ ние в дыхательных путях или провоцирующие острый бронхоспазм. Данные тригге¬ ры могут значительно различаться у разных больных. К основным триггерам отно¬ сятся бьгговые и внешние аллергены, аэрополлютанты, инфекции респираторного тракта (в основном, вирусные), физическая нагрузка, метеорологические факторы, лекарства, пищевые продукты, эмоциональные реакции и др. Другими факторами, которые способны привести к обострению БА, являются бактериальный синусит, ринит, гастроэзофагеальный рефлюкс, беременность, недостаточная терапия.ДИАГНОСТИКАКлиническая оценка больного с обострением БА, нарастающей одышкой и ухуд¬ шением газообмена должна бьггь проведена очень быстро. Она должна включать историю заболевания, определение его тяжести, потенциальных провоцирующих факторов, осложнений и ответа на терапию.У больных с развитием астмы, близкой к фатальной, в анамнезе часто упоми¬ наются эпизоды жизнеугрожающих обострений БА, проведение ИБЛ по поводу обострения БА, пневмоторакс или пневмомедиастинум, частые госпитализации по поводу обострений БА в течение последнего года, психологические и социоэконо- мические проблемы, а также снижение восприятия одышки,Физикальное обследование является наиболее важным шагом при обследо¬ вании больного с обострением БА. Классическими признаками АС являются: положение ортопноэ, профузная потливость, невозможность говорить из-за одышки (больной может лишь произносить отдельные фразы или слова), участие в дыхании вспомогательной мускулатуры шеи, втяжение над- и подключичных промежутков.Частота дыхания более 25/мин и ЧСС более 110/мин указывают на развитие тяжёлой бронхиальной обструкции. Величина парадоксального пульса более 12 мм рт.ст. является достоверным признаком тяжести БА и может быть исполь¬ зована для оценки ответа на терапию, однако парадоксальный пульс может уменьшиться или даже исчезнуть при развитии утомления дыхательных мышц. Интенсивность сухих свистящих хрипов не очень хорошо отражает тяжесть обо¬ стрения, так как при очень тяжёлом обострении возможно развитие «немого» лёгкого. При крайней тяжести процесса возможно брадипноэ.Объективная оценка тяжести обострения БА. Наиболее ценная объективная информация о тяжести процесса при АС может бьггь получена у кровати больного при измерении ПСВ, На развитие АС указывает снижение ПСВ до уровня <33% лучших индивидуальных значений (следует иметь в виду, что этот критерий менее надёжен у больных с необратимым компонентом бронхиальной обструкции).Цианоз у больных с АС возникает поздно, поэтому в условиях стационара необ¬ ходимо использование объективных показателей газового анализа артериальной крови (РРз’ ^ которые позволяют дать точную оценку газообмена.Насыщение крови кислородом может быть измерено неинвазивно при помощи пульсоксиметра и использовано для длительного мониторинга. У больных с при¬ знаками АС при 5^2 <92% необходимо проведение исследования газов крови.По мере нарастания тяжести обострения БА происходит прогрессирующее сни¬ жение Р^Оз, в то время как РаС02 сначала снижается, затем достигает нормальных значений, а при снижении ПСБ <30% появляется гиперкапния.Рентгенография грудной клетки у больных с обострением БА имеет небольшое диагностическое значение. Показаниями к проведению рентгенографии являются симптомы пневмоторакса (плевральные боли, подкожная эмфизема, асимметрич¬ ность аускультативной картины), подозрение на пневмонию, а также отсутствие ответа на проводимую терапию в течение 6-12 ч.
/V- 898 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ: Щ. ЛЕЧЕНИЕ'''§ Задачи терапии обострения БА:' 1) обеспечение адекватной оксигенации крови;2) быстрое разрешение бронхиальной обструкции;• V' • - 3) уменьшение воспаления дыхательных путей.Основными компонентами лечения больных с обострением БА обычно служат бронходилататоры, ГКС и кислород. В ряде случаев может потребоваться назначе¬ ние дополнительных бронхорасширяющих препаратов (препараты второй линии), а в особо тяжёлых ситуациях — респираторной поддержки.КислородотерапияУ ряда больных с АС развивается гипоксемия, требующая проведения кисло¬ родотерапии. Основными причинами гипоксемии при обострении БА являются Vд/Q-Диcбaлaнc и повышение потребления кислорода тканями вследствие чрез¬ мерной работы дыхательной мускулатуры.Длякоррекции гипоксемииу больныхс АСтребуется назначение небольших доз кис¬ лорода (1-4 л/мин через носовые канюли). Невозможность достичь ^60 мм рт.сг. при использовании таких доз кислорода может свидетельствовать о наличии истин¬ ного шунта и, следовательно, другой причины гипоксемии (чаще всего ателектаза доли или всего лёгкого вследствие полной закупорки соответствующего бронха густой вязкой мокротой, возможно также наличие пневмоторакса, пневмонии. ТЭЛА).Ингаляционные ^^'ЭгонистыИнгаляционные ^з'^гонисты являются наиболее эффективными препаратами при обострении БА, а быстрота развития и выраженность бронхорасширяюще¬ го эффекта ставит р2~агонисты в разряд препаратов первой линии. Необходимо подчеркнуть, что назначение р^'З^гонистов показано практически всем больным с тяжёлым обострением БА независимо от того, использовал ли больной брон¬ холитики до госпитализации и в каких дозах. Отсутствие эффекта от обычной бронхорасширяющей терапии в домашних условиях чаще всего можно объяснить недостаточными дозами препаратов для разрешения тяжёлого приступа БА или неправильной ингаляционной техникой.При терапии обострения БА очень трудно рекомендовать какие-либо точные дозы р^'^гонистов, дозирование часто осуществляют эмпирически, основываясь на ответе больного на лечение и развитии побочных эффектов (сердцебиение или непереносимый тремор). Тахикардия не является противопоказанием для назна¬ чения Зг-агонисгов, более того, часто на фоне их назначения по мере устранения бронхообструкции, снижения работы дыхания и диспноэ наблюдается и замедление пульса. Следует также учитывать, что гипоксемия значительно увеличивает риск сердечно-сосудистых осложнений при введении р2“ЭГ0НИСГ0В, поэтому их назначе¬ ние должно сопровождаться адекватной кислородотерапией, которая, по-видимому, обладает протективным действием при использовании высоких доз [^2'агонистов во время обострения БА. Схемы терапии Р2-агонисгами представлены в табл. 68-5.Табли1«а 68-5. Лекарственнь[е средства, используемые лри обострении БАКласс препаратовПрепаратСхема терапииИнгаляционныеР^-агонистыСальбутамолИнгаляции при помощи небулайзера по 2,5 мг (либо при помощи ДАИ и спейсера ло 400 мкг) 3 дозы каждые 20 мин, титровать дозу в зависимости от эффекта (в среднем 5-8 раэ/суг)ФенотеролТа же схема (дозы ниже в 2 раза по сравнению с сальбута¬ молом)
ОСТРАЯ ВЕНТИЛЯЦИОННАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 899Окончание табл. 68-5АнтихолинергическиепрепаратыИпратропия бромидИнгаляции через небулайзер по 500 мкг каждые 4-6 ч (воз¬ можно каждые 2-4 ч)МетилксантиныАминофиллинНагрузочная доза 5-6 мг/кг в течение 30 мин, поддержи¬ вающая доза 0,5-0,9 мг/кг/ч, титровать дозу для достижения сывороточного уровня 10-15 мг/лПарентеральныер^-агонистыАдреналинПодкожно 0,3 мл 0,1% раствора - 3 дозы через 20 мин, затем через 4-6 чСГКСМетилпреднизолон40-125 мг каждые 6 ч в/вГидрокортизон100-200 мг каждые 6 ч е/вПреднизолон40-60 мг 1 раз в сутки рег озМагния сульфатМагния сульфат2-2,4 г в течение 20 мин, введение до 6-8 раз в суткиАнтихолинергические лрепаратыЭффективность антихолйнергических препаратов при обострении БА уступает р2-агонистам, однако в ряде случаев использование их комбинации с ^2-агонистами может быть эффективно у больных, рефрактерных к монотерапии Р2-агонистами. В настоящее время практическое значение при обострении БА имеет единственный препарат - ипратропия бромид. Комбинированная терапия (Рз-агонист + ипратро¬ пия бромид) приводит к большему бронхорасширяющему эффекту по сравнению с монотерапией и может значительно увеличить его длительность. Достоинством комбинированной терапии является безопасность.По данным различных исследований, наибольший эффект комбинированная терапия может оказывать у больных с очень выраженной бронхиальной обструк¬ цией (ОФВ^ <1,0 л или ПСВ <140 л/мин) и с признаками вирусной инфекции верхних дыхательных путей. Безусловным показанием к назначению ипратропия является бронхоспазм, вызванный приёмом р-блокаторов.Теофиллинсреди всего арсенала противоастматических препаратов теофиллины относят¬ ся к препаратам с наибольшим числом побочных эффектов (тошнота, головная боль, бессонница, энцефалопатия, электролитные расстройства), в том числе и потенциально летальных (аритмии, судороги). В настоящее время использование теофиллинов может быть рекомендовано только больным с АС, рефрактерным к терапии первой линии в течение 4 ч. Теофиллины обладают не только бронхо- дилатирующими, но также противовоспалительными, иммуномодулирующими и бронхопротективными свойствами. Кроме того, теофиллин способен уменьшать утомление дыхательной мускулатуры, усиливать центральную инспираторную активность, снижать экссудацию плазмы в просвет дыхательных путей и усили¬ вать мукоцилиарный клиренс.ГлюкокортикостероидыГКС являются наиболее эффективными противовоспалительными препаратами для терапии БА и рассматриваются как обязательные препараты для терапии обо¬ стрений БА. Эффект СГКС наступает не ранее чем через 6-24 ч от начала терапии, поэтому рекомендовано как можно более раннее их назначение (на уровне первич¬ ной помощи, в машине скорой помощи, в приёмном отделении): такая стратегия существенно уменьшает риск госпитализации. Многочисленные рандомизирован¬ ные клинические исследования по использованию ГКС у больных с обострением
900 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИБА показали, что эта терапия приводит к более быстрому разрешению бронхи¬ альной обструкции и значительно снижает риск рецидивов обострения БА после выписки из стационара.Внутривенный и пероральный пути введения ГКС одинаково эффективны при АС. Однако предпочтение чаще отдаётся парентеральному введению ГКС, особен¬ но больным, неспособным принимать препараты рег os (выраженная одышка или проведение вентиляции лёгких). Внутривенная терапия ГКС необходима больным с нарушенной абсорбцией из желудочно-кишечного тракта (рвота),ГКС обычно применяют в течение 7-14 дней (см. табл. 68-5). Ингаляционные ГКС, назначаемые при помощи небулайзера или ДАИ и спейсера, по эффектив¬ ности не уступают СГКС и даже могут их превосходить по скорости наступления положительных эффектов и безопасности. Результаты клинических исследований свидетельствуют о более быстром действии ГКС при их ингаляционном назначе¬ нии (в течение 3 ч).Магния сульфатВнутривенный магния сульфат является эффективным бронхорасширяющим препаратом при лечении больных с обострением БА, рефрактерных к терапии ^2-агонистами. Точный механизм влияния препаратов магния на бронхиальный тонус неясен. Предполагается, что основное значение имеет блокада кальцие¬ вых каналов гладкой мускулатуры бронхов, кроме того, магний в экспериментах ш vitro предотвращает бронхоконстрикцию в ответ на гистамин и метахолин и пре¬ пятствует высвобождению ацетилхолина из нервных окончаний. По данным про¬ ведённых метаанализов, наиболее выраженный эффект внутривенного введения магния сульфата достигается у больных с тяжёлым обострением БА.Респираторная поддержкаПроведение респираторной поддержки требуется больным с АС в тех случа¬ ях, когда все другие виды консервативной терапии оказались неэффективными. Иногда показания к вентиляции лёгких очевидны уже при госпитализации боль¬ ного в стационар (остановка дыхания, кома), однако чаще всего к респираторной поддержке прибегают после неудачи интенсивной терапии. Нередко бывает очень трудно определить момент, когда больной нуждается в интубации трахеи (ИТ) и ИВЛ. Часто приходится наблюдать обратное развитие астматического кризиса после периода рефрактерности к терапии и даже клинического ухудшения, но в то же время излишне оптимистическая оценка состояния больного клиницистом (при высоком риске развития осложнений ИТ и ИВЛ) может вести к неадекватной задержке этой жизнеспасающей процедуры.Тяжёлая артериальная гипоксемия, рефрактерная к высоким потокам кислорода, является абсолютным показанием к ИВЛ. Несмотря на то, что повышение РаС02 коррелирует с тяжестью обострения БА, тем не менее не существует точного порога гиперкапнии, который требует назначения ИВЛ. Уровень pH артериальной крови является более важным признаком, чем PgCOj. Во время жизнеугрожающего обо¬ стрения БА пациенты часто имеют респираторный ацидоз вследствие повышения Р^СО^ и метаболический ацидоз вследствие гипоксемии или снижения сердечного выброса. Как правило, снижение pH до 7,2 является показанием к проведению ИВЛ. Важными ориентирами при назначении ИВЛ служат клинические симптомы: при¬ знаки чрезмерной работы дыхания и утомления дыхательной мускулатуры, резкое тахипноэ, общее истощение, усталость, сонливость больного (маркёры гипоксии головного мозга), так как при этом высок риск остановки дыхания.Абсолютные показания к респираторной поддержке при АС:• остановка дыхания;• нарушение сознания (сопор, кома);
ОСТРАЯ ВЕНТИЛЯЦИОННАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 901• нестабильная гемодинамика (систолическое АД <70 мм ртхт., ЧСС <50/мин или >160/мин);• общее утомление, истощение больного;• утомление дыхательных мышц;• рефрактерная гипоксемия (P^O^ <60 мм рт.ст. при FiO, >60%).Интубация трахеи может быть довольно сложной проадемой у больных с АС.Манипуляции на верхних дыхательных путях могут спровоцировать развитие ларингоспазма или бронхоспазма. Начало ИВЛ с положительным давлением может вызвать снижение венозного возврата к сердцу, баротравму и остановку сердца. При АС предпочтение отдаётся оротрахеальной интубации, которая позво¬ ляет использовать трубки большего размера (это сопровождается меньшим доба¬ вочным сопротивлением и облегчает удаление бронхиального секрета).Подготовка к ИТ включает проведение максимальной оксигенации и регидра¬ тации для снижения риска артериальной гипотензии. Гипотензия, развивающаяся сразу же после ИТ и начала ИВЛ, является мультифакторной по своему генезу. Дегидратация предрасполагает к развитию относительной гиповолемии, поло¬ жительное давление в дыхательных путях при начале ИВЛ ещё больше снижает венозный возврат к сердцу. При проведении ИТ необходимо быть готовым к быстрой инфузии больших количеств кристаллоидов. При отсутствии ответа со стороны АД на болюсное введение растворов необходим поиск других причин для артериальной гипотензии, таких, как пневмоторакс или сердечная дисфункция.Респираторная поддержка больных с жизнеугрожающим обострением БА очень сложна, так как пациенты, нуждающиеся в ИВЛ, характеризуются крайне выраженными степенями бронхиальной обструкции и лёгочной гиперинфляции и имеют очень высокий риск развития побочных эффектов вследствие высоко¬ го внутригрудного давления. К таким побочным эффектам относятся; снижение венозного возврата к сердцу и снижение сердечного выброса, баротравмы (пнев¬ моторакс, пневмомедиастинум, воздушная эмболия). Ведущими причинами смер¬ ти больных БА на фоне ИВЛ становятся баротравма и аноксическая энцефалопа¬ тия вследствие запоздалых реанимационных мероприятий.Безопасной альтернативой «обычной» ИВЛ (т.е. вентиляции, обеспечивающей нормокапнию) является подход с использованием низких дыхательных объёмов (6-8 мл/кг) и малой ЧД (10-12/мин), который направлен на минимизацию дина¬ мической гиперинфляции и связанных с ней баротравм, при этом допускается повышение Р3СО2 (табл. 68-6). Данный подход получил название контролируе¬ мой гиповентиляции или пермиссивной гиперкапнии. Задачей контролируемой гиповентиляции является поддержание давления плато в дыхательных путях <30 см вод.ст. и auto-PEEP <12 см вод.ст. Само по себе повышение Р^СО^ не пред¬ ставляет особой опасности для больных, находящихся на ИВЛ, а основное значе¬ ние придают поддержанию Рр2 мм рт.ст. и pH >7,2. При снижении pH <7,2 рекомендовано внутривенное введение бикарбоната натрия. Несколько исследо¬ ваний показали, что использование данного подхода приводит к значительному снижению летальности и частоты побочных эффектов у больных АС.При АС предпочтение отдают самому распространённому и хорошо изученному режиму ИВЛ - контролируемому по объёму. Рекомендуемые начальные параме¬ тры ИВЛ у больных АС представлены в табл. 68-6.Таблица 68-6. Рекомендуемые начальные параметры ИВЛ у больных АСПараметрыЗначенияРежимКонтролируемый по объёмуДыхательный объём6-8 мл/кг
902 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИОкончание табл. 68-6Частота дыхания10-12/минПрофиль потокаПрямоугольный (убывающий)Инспираторный лоток80-100 л/минСоотношение длительности вдоха и выдоха1:3R0.Исходно “ 100%, затем регулировать для поддержания >90%PEEPО см ВОД.СТ.Возможность успешного применения НВЛ у больных АС была продемонстри¬ рована в нескольких проспективных исследованиях (см. главу «Неинвазивная вентиляция лёгких»). В большинстве случаев больные, получавшие НВЛ. не тре¬ бовали немедленного проведения ИТ и ИВЛ и имели меньшую тяжесть ОДН по сравнению с больными, которым проводилась традиционная ИВЛ.ПРОГНОЗГоспитальная летальность при АС составляет в среднем 5-6%, а при проведении ИВЛ достигает 15%. Около 9% больных, перенёсших ИВЛ по поводу АС, в даль¬ нейшем повторно нуждаются в ИВЛ по той же причине. Длительные наблюдения за больными БА, которым проводилась ИВЛ, свидетельствуют* что эти пациенты имеют повышенный риск летальности — до 14% в течение 3 лет и до 23% в течение6 лет, что диктует необходимость пристального долговременного наблюдения за такими больными.СПИСОК ЛИТЕРАТУРЫ.-
Глава 69 Искусственная вентиляция лёгкихДревнегреческий врач и философ Клавдий Гален {129-210 гг.) был первым, кто описал ИВЛ у животных. В XVI веке эта техника применялась для восстановления человека к жизни. За исключени¬ ем этих исторических эпизодов, искусственная вентиляция лёгких не получила широкого распространения в качестве лечебного меро¬ приятия до 1940 и 1950 годов, когда по Европе и США прокатилась эпидемия полиомиелита. Начиная с середины XX века, было раз¬ работано множество методик ИВЛ для лечения пациентов с дыха¬ тельной недостаточностью (ДН).Клинические задачи искусственной вентиляции лёгкихОсновной целью ИВЛ является поддержание жизнедеятельно¬ сти у пациентов с нарушением функций дыхательной системы до адекватного восстановления её функций (табл. 69-1). Ликвидация острой тяжёлой гипоксемии или дыхательного ацидоза при помощи искусственной вентиляции лёгких может спасти жизнь пациенту, ИВЛ также может ослабить проявления респираторных нарушений у пациентов, которые не могут переносить работу, необходимую для осуществления дыхания. Кроме того, благодаря ИВЛ можно добиться профилактики или ликвидации ателектаза: ИВЛ также можно использовать при слабости дыхательной мускулатуры. Даже у пациентов со здоровыми лёгкими ИВЛ часто используется при необходимости в седации и нейромышечной блокады (например, при анестезии при оперативных вмешательствах). Снижая систем¬ ное потребление кислорода и потребление кислорода миокардом, ИВЛ также может применяться у пациентов с нарушением функции миокарда, когда работа дыхания становится избыточной. Другие задачи ИВЛ включают снижение внутричерепного давления за счёт контролируемой гипервентиляции у пациентов с закрытой черепно¬ мозговой травмой и стабилизацию грудной стенки при обширных переломах грудной клетки (при «окончатом» переломе рёбер).Обычно ИВЛ обеспечивает только симптоматическое облегчение, но не является истинным методом терапии ДН или острого повреж¬ дения лёгких. Важным исключением является состояние сердечной недостаточности, при котором применение ИВЛ может приводить
904 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИа.щ К увеличению сердечного выброса и, следовательно, оказывать терапевтический д эффект. Использование ИВЛ может стать причиной ятрогенного повреждения Щ лёгких, следовательно, требуется соблюдение профилактических мер.Таблица 69-1. Цели и задачи искусственной вентиляции лёгких Цел»Заменить полностью и частично газообменную функцию лёгких и фун(щии дыхательной помпы больных, у которых способность поддерживать данные функции временно ілт постоянно нарушеныОбеспечить поддержание данных функций ценой наименьшего нарушения гомеостаза и минимальных ослож¬ ненийФизиологические задачиУлучшить альвеолярную вентиляцию, отражением которой являются параметры РаСО^ и pHУлучшить артериальную оксигенацию, отражением которой являются РаОг, ВаО^ и содержание кислорода в артериальной крови СаО^Повысить конечно-инспираторную инфляцию лёгкихПовысить конечно-экспираторный объём лёгких (функциональную остаточную ёмкость)Уменьшить работу дыхания (т.е, разгрузить дыхательные мышцы)Клинические задачиРазрешение острого респираторного ацидоза — уменьшение жизнеугрожающей ацидемии, нормализация РаСО^ и pHРазрешение гипоксемии — повышение РаО^ (целевыми являются параметры ЗаОз >90%, РаО^ >60 мм рт.ст.) для устранения или предотвращения клинически важной тканевой гипоксииРазрешение респираторного дистресса — улучшение комфорта больного до момента разрешения или улуч¬ шения причины дыхательной недостаточностиПредотвращение и разрешение ателектазов — избежание или коррекция нежелательных эффектов неполной инфляции лёгкихРазрешение утомления дыхательных мышц — разгрузка дыхательных мышц и обеспечение их отдь(ха до момента разрешения или улучшения причин повышенной нагрузки на аппарат дыханияОбеспечение условий седации и/’или нейромьшечной блокады — полное замещение спонтанной вентиляции больного на период оперативного вмешательства или специальных процедур интенсивной терапииСнижение системного и миокардиального потребления кислорода при определённых условиях (например, при тяжёлом ОРДС, кардиогенном шоке), когда спонтанное дыхание или другая мышечная активность нарушает системную и миокардиальную оксигенациюСнижение внутричерепного давления — уменьшение внутричерепного объёма фови путем контролируемой гипервентиляции при острой внутричерепной гипертензииСтабилизаций грудной клетки, например, при резекции грудной клетки или при массивных «окончатых» пере¬ ломах рёберПоказания и противопоказания к искусственной вентиляции лёгкихПоказания и противопоказания представлены в таблицах 69-2 и 69-3.
ИСКУССТВЕННАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ 905 Таблица 69-2. Показания к искусственной вентиляции лёгких• Апноэ или угроза остановки дыхания• Обострение ХОБЛ*; одышка, тахипноэ, острый респираторный ацидоз (гиперкапния и снижение артери¬ ального pH), плюс, как минимум, один из признаков;острая нестабильность гемодинамикинарушение ментального статуса или персистирующая некооперативность пациента неспособность защиты нижних дыхательных путей обильный и необычно вязкий секретпатология лица или верхних дыхательных путей, что может быть препятствием к проведению НВЛ прогрессирующий респираторный ацидоз, несмотря на проводимую интенсивную терапию, в т.ч. и НВЛ• Острая вентиляционная недостаточность при нейромышечных заболеваниях, при наличии одного из сле¬ дующих признаков;острый респираторный ацидоз (гиперкапния и снижение артериального pH) прогрессирующее снижение жизненной ёмкости лёгких менее 10-15 мп/кг прогрессирующее снижение максимального инспираторного давления до 20-30 см вод.ст.• Острая гипоксемическая дыхательная недостаточность; тахипноэ, респираторный дистресс и персистирую¬ щая гипоксемия, несмотря на назначение кислорода с высокой FiOj через высокопоточные системы, или наличие одного из следующих признаков;острая нестабильность гемодинамикинарушение ментального статуса или персистирующая некооперативность пациента неспособность защиты нижних дыхательных путей• Необходимость эндотрахеальной интубации для поддержания проходимости дыхательных путей или защи¬ ты дыхательных путей, в следующих ситуациях;внутренний диаметр эндотрахеальной трубки <7,0 мм при минутной вентиляции >10 л/мин внутренний диаметр эндотрахеальной трубки 58,0 мм при минутной вентиляции >15 л/мин• При отсутствии вышеперечисленных состояний экстренная интубация трахеи и ИВЛ не являются необходи¬ мыми в следующих ситуациях, пока не были использованы другие виды терапии;одышка; острый респираторный дистрессобострение ХОБЛтяжёлое обострение астмыострая гипоксемическая дыхательная недостаточность у иммунокомпетент>ного пациента гипоксемия является изолированной находкой травматическое повреждение головного мозга «окончатый» перелом рёберТе же показания при тяжёлом обострении БА, если респираторный ацидоз и обструкция дыха¬ тельных путей ухудшаются, несмотря на проведение интенсивной терапии.
906 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ Таблица 69-3. Противопоказания к искусственной вентиляции лёгких Нет показаний к инвазивной респираторной поддержке {см. табл. 69-2)НВЛ более предпочтитеяьна, чем инвазивная респираторная подцержкаИнтубация трахеи и ИВЛ противоречат воле пациентаЖмзнеспасающив мероприятия, включая ИВЛ, не имеют смысла (инкурабельные опухоли и т.д.)Режимы искусственной вентиляции лёгкихРезультаты исследований свидетельствуют о том, что подавление спонтанного дыхания и полная зависимость от контролируемой ИВЛ ведёт к быстрой атрофии дыхательных мышц. Следовательно, по возможности, предпочтение следует отда¬ вать режимам ИВЛ, которые позволяют осуществлять спонтанное дыхание, или вспомогательным (триггерным) режимам, откликающимся на усилие пациента.ВСПОМОГАТЕЛЬНЫЙ/КОНТРОЛИРУЕМЫЙ РЕЖИМ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЁГКИХВспомогательно-контролируемая вентиляция [assisted-controlled ventilation (ACV)] является комбинированным режимом вентиляции лёгких. Респиратор подаёт на вдохе заданный дыхательный объём с положительным давлением в ответ на каждое инспираторное усилие пациента (обозначается как вспомогатель¬ ная вентиляция). Однако, если пациент не начинает вдох в течение определённого времени, респиратор автоматически осуществляет механический вдох для поддер¬ жания минимальной или «резервной» частоты дыхания (обозначается как контро¬ лируемая или управляемая вентиляция). Для индуцирования вспомогательного вдоха давление в дыхательных путях пациента должно снизиться на определённую величину, называемую триггером чувствительности. На рисунке 69-1 показаны примеры кривых давления и объёма во время ACV с переключением по объёму.ПЕРЕМЕЖАЮЩАЯСЯ ПРИНУДИТЕЛЬНАЯ ВЕНТИЛЯЦИЯПеремежающаяся принудительная вентиляция [intermittent mandatory ventilation (IMV)] представляет собой режим вентиляционной поддержки, при котором через определённые промежутки времени осуществляются принудительные вдохи с положительным давлением. Между этими вдохами пациент может дышать спон¬ танно через отдельный контур с постоянным потоком газа. IMV ассоциируется с1|зо ё §20 ■So 10 осЮООI 800 I 600л 400 о 200Управляемый вдохJВспомопэтвпьный у/вдох7/f Нет усилия пациентаУ»-Усилие пациента-6 8 10 Время, с12 14 16Рис. 69*1. Кривые давления и объёма во время вспомогательно-контролируемой ИВЛ. Первый вдох обеспечивается респиратором без стимула от пациента (управляемый вдох), а второй и третий вдох вызываются пациентом (вспомогательная вентиляция).
ИСКУССТВЕННАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ 907десинхронизацией пациента и аппарата, так как принудительные вдохи осущест¬ вляются несогласованно с инспираторными усилиями пациента. Следовательно, принудительный вдох может осуществляться во время спонтанного вдоха, что приводит к перерастяжению лёгких. IMV была практически полностью заме¬ нена на синхронизированную перемежающуюся принудительную вентиляцию [synchronized intermittent mandatory ventilation (57AiV)].СИНХРОНИЗИРОВАННАЯ ПЕРЕМЕЖАЮЩАЯСЯ ПРИНУДИТЕЛЬНАЯ ВЕНТИЛЯЦИЯПри SIMV пациент получает установленное число вдохов с положительным давлением за минуту, каждый из которых синхронизируется с усилиями пациента. Аппарат способен выявить начало спонтанного дыхания у пациента и не осущест¬ вляет автоматический вдох во время спонтанного дыхания. Однако между меха¬ ническими вдохами пациент может осуществлять любое количество дыхательных движений из резервуара. Спонтанные вдохи не вызывают ответа аппарата. На рисунке 69-2 показаны типичные кривые давления и объёма во время S1MV с пере¬ ключением по объёму.ПОДДЕРЖКА ДЫХАНИЯ ДАВЛЕНИЕМВентиляция с поддержкой дыхания давлением {pressure support ventilation (PSV)J является вспомогательным режимом респираторной поддержки. При проведении PSV каждый раз, когда пациент начинает спонтанный вдох, отрицательное дав¬ ление или поток в инспираторном контуре открывает клапан. Затем респиратор осуществляет подачу потока газа, достаточного для поддержания постоянного дав¬ ления наполнения. Если инспираторный поток у пациента падает ниже заданного порогового уровня (например, 25% от максимального), поток газа прекращается. При таком режиме ИВЛ пациент контролирует частоту дыхания (f), время вдоха (Т,) и инспираторный поток (V,). Дыхательный объём (V.J.) и минутная вентиля¬ ция лёгких (Vg) отчасти определяются пациентом, а отчасти респиратором. V.J,, который реально получает пациент, зависит от установленного уровня поддержки давлением, усилия пациента и комплайнса лёгких. Поддержка давлением также может применяться при спонтанном дыхании пациента во время проведения SIMV. На рисунке 69-3 показаны кривые давления и объёма при PSV.40Ф н'I 9 30 с 5S и 20Л 2о1000 I 800 I 600ё 400 ° 200Принудтвльный8 10 Время, сПринудительныйвдох12 14 16Рис. 69-2. Кривые давления и объёма во время синхронизированной перемежающейся прину¬ дительной вентиляции. Первый и четвёртый вдох являются принудительными, а второй и третий вдох — спонтанными.
908 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИВремя, сРис. 69-3. Кривые давления и объёма во время вентиляции с поодержкой давлением. Каждый вдох вызывается усилием пациента. Вдохи различаются по дыхательному объёму и промежутком времени.Параметры искусственной вентиляции лёгкихДЫХАТЕЛЬНЫЙ ОБЪЁМТрадиционно рекомендуется использовать начальный равный 10 мл/кг. Эта формула остаётся пригодной к применению для пациентов без повреждения лёгких. Однако недавно были проведены крупные клинические исследования, показавшие снижение летальности у пациентов с ОРДС при использовании малых V.J. (6 мл/кг веса) по сравнению с пациентами, у которых использовались более высокие значения (12 мл/кг). Таким образом, пациентов с ОРДС рекомендуется использовать V.J„ равный 6 мл/кг.По результатам исследований было сделано предположение, что перерастя¬ жение альвеол высоким может индуцировать повреждение лёгких (например, увеличение проницаемости микрососудов лёгких, отёк лёгких и разрыв лёгких). Избыточное растяжение лёгких является важной проблемой, однако непосред¬ ственно измерить реальный объём воздуха, достигающий отдельных альвеол, не представляется возможным. Однако величина объёма лёгких прямо связана с давлением, которое растягивает альвеолы. Это давление можно приблизительно определить при измерении конечного давления плато в конце выдоха. Плато дав¬ ления определяется при окклюзии контура респиратора в конце вдоха, В качестве безопасного уровня рекомендуется давление плато менее 30 см водн.ст. Для дости¬ жения этого целевого уровня может потребоваться снизить У^ ниже 5 мл/кг, что является физиологическим значением для спонтанного дыхания. Использование низких У.^ может привести к снижению вентиляции и увеличению артериального парциального давления углекислого газа (РаСОз). Такая стратегия вентиляции лёгких носит название пермиссивной гиперкапнии. При использовании пермис¬ сивной гиперкапнии клиницистам рекомендуется сфокусировать своё внимание на pH, а не на РаО,. Несмотря на то, что специалисты рекомендуют внутривенное назначение бикарбоната при pH менее 7,2, взгляды на такую практику остаются противоречивыми.ЧАСТОТА ДЫХАНИЯИдеальная частота дыхания (£) при ИВЛ зависит от специфического режима вентиляции. При применении АСУ f должна быть приблизительно на 4 вдоха в
ИСКУССТВЕННАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ 9Q9минуту меньше, чем частота дыхания у пациента при спонтанном дыхании, что обеспечивает адекватную вентиляцию при истощении самостоятельных усилий пациента. При использовании SIMV или при отсутствии у пациента спонтанного дыхания необходимо первоначально установить f 10 вдохов в минуту: f следу¬ ет увеличить, если требуется более высокий объём минутной вентиляции (как, например, при дыхательном ацидозе), и постепенно уменьшать её, насколько позволяет переносимость пациента. При PSVчастота дыхания не задаётся.ЧУВСТВИТЕЛЬНОСТЬ ТРИГГЕРАДля инициации вспомогательного дыхания при проведении ACV или осущест¬ влении вдоха с поддерживающим давлением при проведении PSV у пациента давление в дыхательных путях должно снизиться на определённую величину для открытия «клапана, работающего по требованию», который позволяет осущест¬ влять доставку газа. Необходимое изменение давления в дыхательных путях (т.е, чувствительность триггера) обычно устанавливают на 1-3 см водн,сг. Однако реальное отрицательное давление, которое должен создавать пациент, может быть значительно выше, если клапан, работающий по требованию, является мало чувствительным. Наоборот, если установлена слишком низкая чувствитель¬ ность триггера, респиратор может слишком часто осуществлять вдохи (что обыч¬ но называется аутоциклингом), что вызывает тяжёлый дыхательный алкалоз. Многие современные респираторы используют в качестве триггера изменение инспираторного потока, а не давления. Показано, что этот метод инициации вдоха требует меньше усилий пациента.ФРАКЦИЯ КИСЛОРОДА ВО ВДЫХАЕМОМ ВОЗДУХЕИнгаляция любой газовой смеси с фракцией кислорода во вдыхаемом воздухе (FiOj) выше, чем FiOj окружающего воздуха (21%), может бьггь потенциально токсичной. Однако порог токсической концентрации FiO^ был установлен как значение 60%. Для минимизации риска токсического эффекта 0^ необходимо использовать самый низкий уровень Pi02, при котором достигается адекватная оксигенация. Приемлемое насыщение кислородом артериальной крови обычно определяется как 90% или более, что обычно соответствует Рр^, составляющему 60 мм рт.ст. и более.ПОЛОЖИТЕЛЬНОЕ ДАВЛЕНИЕ В КОНЦЕ ВЫДОХАУ лиц со здоровыми лёгкими внутригрудное давление в конце вьщоха практи¬ чески приближается к атмосферному. Однако внутриплевральное давление слегка отрицательное. Благодаря этому отрицательному давлению в конце выдоха в лёг¬ ких сохраняется остаточный объём — функциональная остаточная ёмкость лёгких (ФОЕ). FRC представляет резервуар газа, который позволяет поддерживать посто¬ янный уровень РРз и — критические физиологические параметры. Однако у пациентов с ДН, которые нуждаются в ИВЛ, FRC обычно снижена вследствие потерь сурфактанта и нестабильности альвеол, что ведёт к спадению альвеол, В свою очередь, спадение альвеол приводит к тяжёлой и быстро развивающейся гипоксемии. Это состояние является обратимым при искусственном увеличении давления в дыхательных путях в конце выдоха, что форсирует открытие альвеол и способствует поддержанию большего объёма лёгких.Улучшение оксигенации коррелирует с величиной среднего давления в дыха¬ тельных путях, которая определяется как усреднённое за определённое время давление в дыхательных путях. Следовательно, методы, которые позволяют уве¬ личивать среднее давление в дыхательных путях, также улучшают оксигенацию. Создание положительного давления в конце выдоха (PEEP) является наиболее часто используемым методом для повышения среднего давления в дыхательных путях и улучшения оксигенации. PEEP и постоянное положительное давление
91 о ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИВ дыхательных путях, которое представляет собой PEEP, применяющееся при спонтанных вдохах, может улучшить оксигенацию и позволяет снизить FiOj и сопутствующий ему риск токсического эффекта. Избыточное PEEP, однако, может привести к снижению сердечного выброса и нарушению системной доставки кислорода, что может свести к нулю улучшение оксигенации. PEEP традиционно использовалось для улучшения оксигенации у пациентов с дыхательной недоста¬ точностью, связанной с различными состояниями, особенно при ОРДС.СКОРОСТЬ ИНСПИРАТОРНОГО ПОТОКАПри проведении АСУ и SIMV инспираторный поток (Vj) часто устанавливают на уровне 60 л/мин. Однако у пациентов с ХОБЛ лучшего газообмена можно добить¬ ся при скоростях потока до 100 л/мин. Более высокий Vj позволяет осуществить доставку V,, за более короткий период времени и оставить больший период време¬ ни для вьщоха, что способствует более полному опорожнению лёгких и меньшей «воздушной ловушке». Однако при более высоких Vj также увеличивается и пико¬ вое инспираторное давление, которое может превысить безопасные для респира¬ тора границы; при этом уменьшается доставляемый V.J,. Если V^ слишком низкий и не отвечает вентиляционным запросам больного, то пациент создаёт высокое отрицательное внутриплевральное давление во время вдоха против закрытого инспираторного клапана. Отрицательное внутриплевральное давление может при¬ водить к утомлению мышц и даже к отёку лёгких.Альтернативные режимы искусственной вентиляции лёгкихВЕНТИЛЯЦИЯ со СВОБОДНЫМ (СБРАСЫВАЕМЫМ) ДАВЛЕНИЕМ в ДЫХАТЕЛЬНЫХ ПУТЯХВентиляция со свободным (сбрасываемым) давлением в дыхательных путях [Airway pressure release ventilation (APBV)] является режимом ИВЛ, который изме¬ няет нормальный процесс дыхания. Для достижения растяжения альвеол и их вос¬ становления наполнение лёгких поддерживается при заданном уровне давления. Вьщох происходит только при циклическом сбросе постоянного давления в дыха¬ тельных путях, за которым следует быстрое восстановление. При APRV поддержи¬ вается адекватное среднее давление в дьгхательных путях; также поддерживается ФОЕ при отсутствии потребности в увеличении пикового давления в дыхательных путях. Хотя APRV представляется эффективным методом и теоретически должна оказывать благоприятный эффект как протективный метод респираторной под¬ держки, по сравнению с обычными режимами ИВЛ преимуществ показано не было.ПРИНУДИТЕЛЬНАЯ МИНУТНАЯ ВЕНТИЛЯЦИЯПри принудительной минутной вентиляции [mandatory minute ventilation (MMV)] врач устанавливает целевую минутную вентиляцию. Если у пациента спонтанное дыхание не адекватно и не отвечает текущим потребностям, респиратор определя¬ ет различия, производя механические вдохи. Если спонтанное дыхание отвечает целевой минутной вентиляции или превышает её, респиратор поддержки не осу¬ ществляет.ВЕНТИЛЯЦИЯ С УПРАВЛЯЕМЫМ ДАВЛЕНИЕМ С ИНВЕРТИРОВАННЫМ СООТНОШЕНИЕМ ВДОХА И ВЫДОХАПри нормальном спонтанном дыхании соотношение времени вдоха и выдоха составляет от 1:2 до 1:3. При проведении вентиляции с управляемым давлением с инвертированным соотношением вдоха и вьщоха [pressure controlled inverse ratio ventilation (PC-ilîV)] время вдоха продляется и увеличивается до 50-75% от дли¬ тельности дыхательного цикла, при этом соотношение времени вдоха и выдоха
ИСКУССТВЕННАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ 911становится равным от 1:1 до 3:1. Такая инверсия позволяет поддерживать в лёгких пиковое давление наполнения в течение более длительного периода времени, чем при обычной вентиляции лёгких, при которой среднее давление в дыхательных путях возрастает без увеличения пикового инспираторного давления. Так как оксигенация коррелирует с лёгочными объёмами, которые зависят от среднего давления в дыхательных путях, PC-IRV, подобно PEEP, позволяет улучшить окси¬ генацию. PC-IRV плохо переносится пациентами и может требовать глубокой седа¬ ции. Кроме того, этот способ вентиляции лёгких приводит к созданию auto-PEEP, усз^гублению гиперкапнии и способствует баротравме. Решение о применении PC-IRV должно быть взвешенным, и этот режим должен использоваться только опытными врачами.ВЫСОКОЧАСТОТНАЯ СТРУЙНАЯ ИСКУССТВЕННАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХПри проведении высокочастотной струйной ИВЛ для подачи в лёгкие струи газа с высокой частотой используется инжектор. Хотя проведение высокочастотной струйной ИВЛ считается целесообразным у пациентов с тяжёлым ОРДС и бронхо¬ плевральными фистулами, в проспективном сравнительном исследовании по срав¬ нению с обычной ИВЛ преимуществ показано не было. В исследовании, в котором проводилось сравнение «ультравысокочасготной» струйной ИВЛ (т.е. при частоте дыхания, равной или превышающей 180 мин‘^) и обычной ИВЛ у пациентов с ОРДС был сделан вывод об улучшении оксигенации при использовании ультравы- сокочастотного режима.ВЫСОКОЧАСТОТНАЯ ОСЦИЛЛЯТОРНАЯ ВЕНТИЛЯЦИЯВысокочастотные осцилляторы ритмически с очень высокой частотой оказы¬ вают давление на дыхательные пути за счёт поршней или микропроцессоров. При предварительной оценке было показано, что высокочастотная осцилляторная вентиляция позволяет безопасно и эффективно улучшать газообмен у взрослых мужчин с тяжёлым ОРДС, у которых обычная искусственная венргиляция лёгких оказалась неэффективной.ЧАСТИЧНАЯ ЖИДКОСТНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХПри проведении частичной жидкостной вентиляции лёгких применяются перфторуглеродные жидкости. Эти жидкости не смешиваются с сурфактантом, имеют низкое поверхностное натяжение и высокий коэффициент растворимо¬ сти для кислорода и диоксида углерода. При проведении частичной жидкостной искусственной вентиляции лёгких перфторуглеродная жидкость инстиллируется в лёгкие до тех пор, пока её объём приблизительно не достигнет ФОЕ; затем произ¬ водится стандартная ИВЛ. Предварительные результаты многоцентрового рандо¬ мизированного контролируемого исследования по эффективности и безопасности частичной жидкостной ИВЛ у пациентов с ОРДС свидетельствуют об отсутствии достоверных различий в смертности или числе дней, когда ИВЛ не требуется, по сравнению с обычной ИВЛ.Описание, преимущества и недостатки различных режимов ИВЛ представлены в таблице 69-4.Таблица 69-4. Режимы искусственной вентиляции лёгкихРежимОписаниеПреимущества/недостаткиКонтролируемая меха¬ ническая вентиляция {controlled mechanical ventilation — CMV)Задают параметры: f респиратора, инспираторное время и (и т.о. V^)Может быть использован у больных с седацией/нейромышечной блокадой; респиратор не отвечает на вентиляцион¬ ные потребности пациента
912 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИОкончание табл. 69-4Вспомогательная или вспомогательно¬ контролируемая вентиля¬ ция (assfefed mechanical ventiiation — AMV или ass/sfed-coftfroJ ventilation - ACV)Задают параметры; инспираторное время и Vp но пациент может повы¬ шать f (и т.о. Vj)Респиратор может отвечать на вентиляци¬ онные потребности пациента; респиратор может отвечать на все инспираторные усилия больного или, наоборот, отвечать слишком часто, в зависимости от чув¬ ствительности триггераПеремежающаяся при¬ нудительная вентиляция{intermittent mandatory ventilation — IMV}Задают параметры; f респиратора, инспираторное время и но паци¬ ент также может дашать спонтанноМожет уменьшить асинхронность дыхания и снизить потребность в седации; респи¬ ратор не отвечает на вентиляционные потребности пациентаСинхронизированная перемежающаяся при¬ нудительная вентиляция {syncfironaed intermittent mandatory ventilation — SimТо же, что и при IMV, но вдох респи¬ ратора подстраивается под очеред¬ ной вдох больногоТо же, что и при IMV, но не происходит избьп-очной гиперинфляции за счёт воз¬ никновения спонтанного вдоха и выдоха респиратора в одно и то же времяВысокочастотная вен¬ тиляция Ihigh-frequency ventilation — HFV)f респиратора высокая, а может быть меньше VqМожет снизить пиковое давление в дыхательных путях; может приводить к auto-PffiPПомержка давлением (p/'esst^лe-support venWa- ifon - PSV)Пациент сам задаёт f; является производным от инспираторного дав¬ ления и CRSПовышение комфорта больного и сниже¬ ние работы дыхания; респиратор может не отвечать на вентиляционные потреб¬ ности пациентаВентиляция, контро¬ лируемая по давле¬ нию {pressure-control ventilation - PCV)Задают параметры: пиковое давле¬ ние, f и респираторное времяМожет снизить пиковое давление в дыха¬ тельных путях; возможно развитие гипо- вентиляцииВентиляция с инверти¬ рованным соотношением вдох/выдох (inverse ratio ventilation — ЩИнспираторное время превышает экспираторное времяМожет улучшить газообмен путём увели¬ чения времени вдоха; может приводить к auto-PEEPВентиляция со свободным (сбрасываемым) давлени¬ ем (ainivay pressure release ventilation — APRV)Больной получает СРАР на высоких и низких уровнях для симуляцииМожет улучшить оксигенацию при более низких давлениях в дыхательных путях; возможно развитие гиповентиляцииПропорциональная вспо¬ могательная вентиля¬ ция {proportional assist ventilation — PAV)Пациент сам задает f, , давления и потокиМожет повысить спонтанное дыхание; полностью зависит от респираторного драйва пациентаСРАР ~ постоянное положительное давление в дыхательных путях; f — частота дыхания; C^S - комплайнс респираторной системы; PEEP - положительное давление в конце выдоха; - мёрт¬ вое пространство; - минутная вентиляция; — дьсхательный объём: auto-PEEP — «внутрен- нее*> положительное давление в конце выдоха.Осложнения искусственной вентиляции лёгкихИВЛ далеко не лишена осложнений, и одной из принципиальных задач ИВЛ является предупреждение развития осложнений (табл. 69-5). Для выявления пациентов, имеющих высокий риск развития ятрогенных осложнений, или опре¬ деления ятрогенных осложнений в ранней фазе необходим тщательный мони¬ торинг. Необходимо также постоянно контролировать состояние пациентов для определения момента, когда они станут способны обходиться без искусственной
ИСКУССТВЕННАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ 913вентиляционной поддержки, так как возникновение большинства проблем связа¬ но с длительностью ИВЛ.Осложнения могут быть связаны с эвдотрахеальной трубкой (т.е. повреждение гортани, стенозы трахеи, трахеомаляция, синусит). Ранее уже упоминалось о ток¬ сическом эффекте кислорода. Баротравмы, такие, как пневмоторакс, подкожная эмфизема, пневмомедиастинум, у пациентов, находящихся на ИВЛ, развиваются приблизительно в 10-20% случаев. Возникновение баротравмы, вероятно, свя¬ зано с асимметричным перерастяжением альвеол в дополнение к высокому дав¬ лению в дыхательных путях. В связи с тем, что пациенты, которым проводится ИВЛ, обычно находятся в горизонтальном положении, классическая картина верхушечного или верхушечно-латерального пневмоторакса наблюдается менее часто, чем у пациентов, которым ИВЛ не проводится, в результате диагноз часто не устанавливается. ИВЛ с положительным давлением может стать причиной умень¬ шения возврата венозной крови и, следовательно, снижения сердечного выброса у пациентов с нормальной функцией миокарда. Однако у пациентов с нарушенной сократительной способностью миокарда может произойти увеличение сердечного выброса в связи с уменьшением постнагрузки левого желудочка при увеличении внутригрудного давления, и, наоборот, трансмуральное аортальное давление уменьшается.Таблица 69-5. Основные побочные эффекты искусственной вентиляции лёгких Повышение среднего внутригрудного давления Снижение венозного возврата к сердцу и снижение сердечного выброса Повышение соотношения вентиляция/перфузияСнижение почечного кровотока и клубочковой фильтрации, с последующей задержкой жидкости Воздушная ловушка и внутреннее положительное давление в конце выдоха (аиЛ)-Р£НР)БаротравмаНозокомиальные инфекции лёгких и придаточных пазух носа Респираторный алкалозАжитация и усиление респираторного дастресса Повышение работы дыханияВЕНТИЛЯТОР-АССОЦИИРОВАННАЯ ПНЕВМОНИЯВентилятор-ассоциированная пневмония (ВАП) является грозным осложне¬ нием ИВЛ, при котором летальность достигает приблизительно 30%. Нефарма¬ кологические методы профилактики ВАП включают:• тщательное мытьё рук обслуживающего персонала;• полулежачее положение пациента для предотвращения аспирации;• адекватное питание;• предотвращение перерастяжения желудка;• раннее удаление эндотрахеальной трубки и назогастрального зонда;• использование постоянного отсоса под голосовыми складками;• использование неинвазивной вентиляции лёгких.Также рекомендуется поддерживать адекватное давление в манжетке эндотрахе¬ альной трубки, при давлении в манжетке, превышающем 25 мм рт.ст., может нару¬ шаться перфузия слизистой оболочки трахеи, что может привести к её поврежде¬ нию. Применение сукральфата вместо антагонистов Н2-рецепторов, гистамина или
914 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЩОСТАТОЧНОСТИантацидов для профилактики стрессовых язв ассоциируется с меньшей частотой развития ВАП, Другие фармакологические методы, которые рекомендуются для профилактики ВАП, включают: отказ от необоснованного применения антибио¬ тиков, проведение промывания ротовой полости хлоргексидином, профилакти¬ ческое применение антибиотиков и гранулоцитарного колониестимулирующего фактора у пациентов с нейтропенической лихорадкой, находящихся на ИВЛ. Однако рутинное применение антибиотикопрофилактики у пациентов без нейтро- пении не рекомендуется и может нанести вред.ОТЛУЧЕНИЕ ОТ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЁГКИХТермин «отлучение» часто используется для описания процесса снятия пациен¬ та с ИВЛ и восстановления спонтанного дыхания, В некоторых случаях (напри¬ мер, при восстановлении пациента после передозировки препаратами или после операционной анестезии) вентиляционная поддержка может просто отключаться, когда результаты клинического наблюдения свидетельствуют о том, что пациент способен возобновить самостоятельное дыхание. В других случаях, особенно у пациентов, восстанавливающихся после ОРДС или при тяжёлом течении ХОБЛ, отлучение может требовать интенсивного лабораторного контроля и значитель¬ ных временных затрат,ГОТОВНОСТЬ БОЛЬНОГО к ОТЛУЧЕНИЮ ОТ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЁГКИХпрекращение ИВЛ обычно не предполагается до тех пор, пока у пациента не удастся достигнуть гемодииамической и сердечно-лёгочной стабильности. Кроме того, многие авторы рекомендуют, чтобы у пациентов при дыхании было Р^О^ 60 мм рт.ст., FiO^ <40% или менее, а PEEP 5 см водн.ст. или менее. В идеа¬ ле пациент должен быть в полном сознании, иметь адекватный и стабильный уровень гемоглобина и адекватную и стабильную функцию почек; также должна отсутствовать потребность в использовании вазоактивных и седативных препа- ратов. Кроме того, у пациента должна быть нормальная температура, либо повы¬ шенная температура при стабильной гемодинамике; дыхательный центр должен быть сохранным. Пациент должен быть способным защитить дыхательные пути и должна присутствовать адекватная секреция с выделением прозрачного секре¬ та. В таблице 69-6 представлен перечень критериев для отлучения пациента от ИВЛ.Таблица 69*6. Критерии отлучения пациента от искусственной вентиляции лёгких Гемодинам/ческая стабильность>60 мм рт.ст., PiO^ <40%, положительное давление в конце выдоха ¿5 см водн.ст.Адекватное и стабильное содержание гемоглобина в крови Стабильная функция почек Наличие сознанияОтсутствие потребности 0 вазоконстрикторах и седативных препаратах или тревожность при применении ста¬ бильных доз зазоактивных или седативных агентовОтсутствие лихорадки или лихорадка при стабильном гемодинамичвском статусе Интактный дыхательный центрСпособность обеспечить защиту дыхательных путей и вццапение прозрачного секрета
ИСКУССТВЕННАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ 915ПРОГНОЗИРОВАНИЕ УСПЕШНОГО ОТЛУЧЕНИЯУспешное прекращение ИВЛ во многом определяется способностью дыха¬ тельной мускулатуры переносить нагрузку, которая обычно повышается при вос¬ становлении функционирования лёгких. Показатели, которые ассоциируются с успешным отлучением, включают минутную вентиляцию лёгких менее 10 мл/кг и уровень отрицательного инспираторного давления <15 см водн.ст. Рекомендуется также использование индекса частого поверхностного дыхания (т.е. отношение f/ V.J,), Высокое прогностическое значение f/V.^ для выявления пациентов, способных перенести прекращение ИВЛ, имеют значение менее 105 вдохов/мин на литр.МЕТОДЫ ОТЛУЧЕНИЯ ОТ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЁГКИХОтлучение производится в значительной мере эмпирическим способом, и для проведения этой процедуры существует мало стандартизированных методик. Некоторые клиницисты рекомендуют проводить сеансы спонтанного дыхания при полной вентиляционной поддержке, которые могут длиться от нескольких минут до нескольких часов. Проверка спонтанного дыхания может длиться до 2 ч, хотя недавно полученные доказательства свидетельствуют о том, что сеансы в течение 30 мин сопоставимы по эффективности для прогнозирования успешного отлучения от ИВЛ. Возникновения спонтанного дыхания можно добиться при отключении пациентов от респиратора и перевода их на открытый дыхательный контур, который обеспечивает постоянный приток кислородо-воздушной смеси (т.е. «Т-образная трубка»). Пациент также может спонтанно дышать, продолжая оставаться подключённым к респиратору и ползшая PSV от 5 до 7 см водн.ст. Если в конце сеанса спонтанного дыхания пациент остаётся клинически стабильным и сохраняется приемлемый уровень иа основании клинического заключения врача может быть произведена экстубация. Если пациент плохо переносит сеансы спонтанного дыхания, полная дыхательная поддержка возобновляется при воз¬ никновении первых признаков нарушений. Сеансы спонтанного дыхания могут вновь проводиться в более поздние сроки, обычно с частотой одна попытка в день.Другие методы отключения включают постепенное уменьшение числа вдохов при SIMV, в результате чего работа, необходимая для осуществления дыхания, постепенно переключается на пациента. Пациента также можно постепенно пере¬ водить с PSV', уровни поддерживающего давления до проведения экстубации должны достигать от 5 до 7 см водн.ст. У многих пациентов клиницисты комби¬ нируют SIMV и Р5У, Когда у такой группы пациентов предполагается проводить отлучение от ИВЛ, первоначально проводится уменьшение числа принудительных вдохов при SIMV до н}^ля, а затем уровень поддерживающего давления снижается до уровня от 5 до 7 см водн.ст. Если пациент переносит этот период дыхания при таком уровне поддержки, производится попытка экстубации.В исследованиях, в которых проводилось сравнение различных способов отлу¬ чения от искусственной вентиляции лёгких, были получены противоречивые результаты. Следовательно, оптимальный метод отлучения остаётся неизвестным. В независимости от метода попытку отлучения необходимо прекратить, и тре¬ буется возобновить искусственную вентиляционную поддержку при появлении признаков утомления, страдания, дыхательного ацидоза или гипоксемии. После экстубации необходим тщательный контроль пациентов на предмет развития дыхательных нарушений, слабости или стридора.СПИСОК ЛИТЕРАТУРЫ
Глава 70 Неинвазивная вентиляция лёгких при острой дыхательной недостаточностиВВЕДЕНИЕИнтубация трахеи (ИТ) и искусственная вентиляция лёгких (ИВЛ) в течение последних пяти десятилетий являются стандарт¬ ными процедурами при ведении больных с острой дыхательной недостаточностью (ОДН), Однако ИТ и ИВЛ связаны с развитием таких тяжёлых осложнений, как нозокомиальные пневмонии, сину¬ ситы, сепсис, травмы гортани и трахеи, стенозы и кровотечения из верхних дыхательных путей. Эти осложнения вносят существен¬ ный вклад в неблагоприятный исход больных с ОДН, кроме того, пациенты, успешно «пережившие» ИТ и ИВЛ, часто сталкиваются с новой проблемой — отлучением от респиратора.Однако у некоторых больных с ОДН обеспечение эффективной респираторной поддержки возможно без использования эндотра- хеальных или трахеостомических трубок, данный метод получил название неинвазивной вентиляции лёгких (НВЛ). Принципиально НВЛ делится на две большие группы: с отрицательным давлением на вдохе и с положительным давлением на вдохе. Вентиляция лёг¬ ких отрицательным давлением — то есть с наложением отрицатель¬ ного, субатмосферного давления на всё тело или на грудную клетку, живот пациента — практически отсутствует в нашей стране, поэтому в настоящем обзоре рассматривается только НВЛ с положительным давлением.При НВЛ положительным давлением в качестве интерфейса для взаимосвязи «пациент-респиратор» используются носовые или лицевые маски. Впервые НВЛ при помощи лицевых масок была предложена в 30-х годах XX века американскими врачами Poulton, Охоп и Barach для терапии кардиогенного отёка лёгких при помощи метода спонтанного дыхания с постоянным положительным давле¬ нием в дыхательных путях. Однако метод не получил широкого рас¬ пространения, и маски для обеспечения респираторной поддержки использовались крайне редко, хотя уже в 60-х годах некоторые авторы рекомендовали перед проведением ИТ попытку применения вентиляции через маску при ОДН у больных хроническим бронхи¬ том и эмфиземой.Новое развитие данное направление получило после внедрения Б практику удобных шіотноподгоняемьіх масок: в 1981 г. док> тор Sullivan из Австралии предложил носовую маску для терапии
НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТМ 917пациентов с синдромом апноэ сна, а в 1983 г. французский врач Rideau внедрил в клиническую практику носовые маски для проведения длительной респира¬ торной поддержки больных с нейромышечными заболеваниями. Эти удобные маски в дальнейшем и послужили прототипом для масок, используемых при НВЛ. Проведённые в середине 80-х годов исследования показали, что применение масочной НВЛ значительно улучшает состояние больных с хронической дыха¬ тельной недостаточностью на фоне нейромышечных заболеваний, кифосколиоза, идиопатической центральной гиповентиляции. Кроме того, в начале 90-х годов на медицинском рынке появились портативные, удобные и недорогие респираторы, специально предназначенные для НВЛ (BiPAP S/T и др). Новые исследования, посвящённые применению НВЛ с помощью лицевых масок при ОДН различной природы, проведённые в 1989-1990 гг. тремя независимыми группами Meduri, Robert и Brochard, продемонстрировали, что при помощи данного метода респира¬ торной поддержки у больных с ОДН удаётся добиться существенного улучшения клинической картины и коррекции параметров газообмена без использования ИТ и ИВЛ. Все эти факторы значительно стимулировали интерес к НВЛ и послужили предпосылками бурного развития масочной НВЛ в 90-е годы.Физиологические эффекты неинвазивной вентиляции лёгкихОсновными задачами респираторной поддержки являются улучшение газообмена (разрешение гипоксемии и острого респираторного ацидоза), разрешение респира¬ торного дистресса (снижение кислородной цены дыхания и предотвращение разви¬ тия утомления дыхательной мускулатуры). Больные ОДН, нуждающиеся в респира¬ торной поддержке, как правило, уже исчерпали свои компенсаторные механизмы, направленные на обеспечение адекватной вентиляции. Повышение резистентности дыхательных путей, снижение комплайнса лёгких, развитие динамической гипе¬ ринфляции ведут к повышению нагрузки на аппарат дыхания, повышению работы дыхания, превышающей возможности силы и выносливости дыхательных мышц.Одной из самых главных задач при терапии больных ОДН является достиже¬ ние адекватной оксигенации. В большинстве исследований, посвящённых НВЛ, показано значительное улучшение параметров оксигенации. В основе улучшения газообмена при гипоксемической ОДН во время НВЛ лежит вовлечение (рекру¬ тирование) в процесс вентиляции невентилируемых или плоховентилируемых альвеолярных единиц, приводя, таким образом, к повышению функциональной остаточной ёмкости, снижению вентиляционно-перфузионного (VyO) дисбалан¬ са и шунта. У больных с гиперкапнической ОДН (например, обострение ХОБЛ) НВЛ также приводит к значительному повышению уровней и S^^Oj, однако в данной ситуации основным механизмом улучшения газообмена является повыше¬ ние альвеолярной вентиляции, что также отражает наблюдаемое снижение уровня Р^СО^. Следует отметить, что разрешение гиперкапнии при НВЛ происходит более медленно, чем при обычной ИВЛ, и отсутствие уменьшения Р^С02 в первые мину¬ ты неинвазивной поддержки не означает неэффективность данной процедуры.Несколько исследований продемонстрировали способность НВЛ обеспечить частичную разгрузку дыхательной мускулатуры. Brochard и соавт. изучали влия¬ ние НВЛ в режиме поддержки давлением (12 и 20 см вод.ст,) на физиологические параметры у больных ХОБЛ с ОДН. Неинвазивная респираторная поддержка обеспечивала значительное увеличение дыхательного объёма и снижение частоты дыхания, улучшение параметров газообмена. Кроме того, авторы показали досто¬ верное снижение диафрагмальной активности: трансдиафрагмальное давление уменьшилось на 52%, средняя амплитуда электромиографического сигнала диа¬ фрагмы снизилась на 32-53% (рис. 70-1).В ряде работ показано, что у больных с острой и хронической сердечной недо¬ статочностью НВЛ приводит к повышению сердечного выброса, повышению
918 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИvC XV.Pdi (cm HjO)Рис. 70-1. Влияние неинвазивной вентиляции лёгких на трансдиафрагмальное давление (Pdi) у больных ХОБЛ с ОДН. Закрытые квадратики — IPAP 12 см водн.ст., открытые квадратики — IPAP 20 см водн.ст. [Brochard et al., 1990].фракции выброса, снижению митральной регургитации, снижению давления заклинивания в лёгочной артерии, уменьшению конечно-диастолического раз¬ мера левого желудочка. При нормальной функции левого желудочка (ЛЖ) сер¬ дечный выброс, в основном, зависит от преднагрузки, поэтому респираторная поддержка с созданием положительного давления в дыхательных путях обычно приводит к снижению сердечного выброса, у больных с тяжёлой систолической дисфункции ЛЖ ситуация прямо противоположная: сердечный выброс очень мало зависит от преднагрузки, но очень чувствителен к изменениям со стороны пост- нагрузки, основной детерминантой которой является трансмуральное давление в ЛЖ (разница между систолическим давлением в ЛЖ и внутригрудным давлением). Naughton и кол. показали, что НВЛ приводит к снижению амплитуды отрица¬ тельного инспираторного давления в грудной клетке (рис. 70-2), и т.о. снижению трансмурального давления ЛЖ (от 116 до 110 мм рт.ст.). Положительный эффект НВЛ при отёке лёгких наблюдается не только при систолической дисфункции ЛЖ, но и при диастолической дисфункции ЛЖ.Рис. 70-2. Влияние неинвазивной вентиляции лёгких на интратора- кальное (эзофагеальное) давле¬ ние (Рез) у больных с сердечной недостаточностью [МаидМоп et а1., 1995].
НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ 919Особенности неинвазивной вентиляции лёгкихПринципиальными различиями неинвазивной респираторной поддержки от вентиляции лёгких с использованием интубационной или трахеостомической трубок являются:• при проведении НВЛ всегда присутствует «утечка», и таким образом достав¬ ляемые дыхательный объём и минутная вентиляция превышают их «эффек¬ тивные» величины;• при НВЛ важное значение имеет дополнительное, динамично меняющееся сопротивление верхних дыхательных путей, прежде всего обусловленное гор¬ танью, которая расположена между респиратором и лёгкими.Чрезмерно высокая утечка может явиться причиной неэффективности НВЛ. Основными источниками утечки являются область контакта между маской и лицом больного, а также открытый рот больного. Утечка в области контакта маски чаще всего связана с высоким давлением под маской, причиной которого может явить¬ ся дискоординация дыхательных циклов пациента и респиратора. Утечка может происходить и при низком давлении под маской, когда имеет место несостоятель¬ ность сфинктеров губ, или вследствие высокого фарингеального давления, напри¬ мер, при полном смыкании гортани. Существует и так называемая «внутренняя утечка», когда часть воздуха попадает в пищевод или заполняет податливую часть верхних дыхательных путей (глотка) — так называемый шунтовой комплайенс,Delguste и соавт, в одном из наблюдений продемонстрировали возникновение эпизодов обструктивного апноэ, продолжительностью до 1-й минуты, у больных во время сна при использовании высокого минутного объёма дыхания во время НВЛ, природой апноэ явилось полное смыкание голосовых связок. Последующие исследования этой же группы авторов показали, что при проведении НВЛ гло¬ точная апертура является основным фактором, регулирующим эффективную вентиляцию лёгких. Все эти особенности существенно изменяют традиционные подходы к проведению неинвазивной респираторной поддержки, так, требуется подбор параметров вентиляции с учётом утечки, соотношения «доставляемой» и «эффективной» минутной вентиляции, фазы сна или бодрствования и др.РЕЖИМЫ ВЕНТИЛЯЦИИ ПРИ НЕИНВАЗИВНОЙ ВЕНТИЛЯЦИИ ЛЁГКИХНаиболее часто у больных ОДН применяются следующие режимы НВЛ:• спонтанное дыхание с положительным давлением в дыхательных путях (соп- tinuous positive airway pressure — CPAP);• поддержка давлением на вдохе (pressure support Ventilation — PSV);• режим с двумя уровнями положительного давления (bi-level positive airway pressure — BiPAP);• вспомогательно-контролируемый режим с регуляцией по объёму (volume- cycled assisted/controÜed Ventilation — ACV; используется редко);• пропорциональная вспомогательная вентиляция (proportional assist Ventila¬ tion — PAV; используется редко);• режим timed-adaptive (новый режим).При режиме СРАР пациент дышит самостоятельно (спонтанно), и при этом в его дыхательных путях на протяженю! всего дыхательного цикла поддерживается какое-то определённое положительное, по отношению к атмосферному, давление (рис. 70-3). Режим СРАР применяется в качестве основного режима для лечения больных с обструктивным апноэ во время сна, КОЛ, посттравматической ОДН, постоперационной ОДН.Режим BiPAP, по сути, не отличается от режима FSV: так называемое экспира¬ торное давление (ЕРАР) соответствует положительному давлению в конце выдо¬ ха (РЕЕР), а инспираторное давление (IPAP) соответствует сумме РЕЕР и PSV (рис. 70-4),
920ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИIЄsРис. 70-3. Кривые давления в дыхательных путях при спонтанном дыхании и при СРАР-терапии. PEEP ~ положительное давление в конце выдоха.BIPAP 1РАР = 22 см водн.ст.PS - 12 см водн.ст.ЕРАР = PEEP = 10 см водн.ст.XISф§2010PS12 см водн.ст.Нормачс.2О510 мгPEEP = 10 см водн.ст.іВремяРис. 70-4. Кривые давления в дыхательных путях при PSV и BiPAP. PS (поддержка давлением) IPAP-PEEP. На фоне кривой давления указаны значения дыхательного объёма (мл).В режиме РАУ респиратор генерирует поток и объем пропорционально инспи- раторному усилию пациента, а также обеспечивает синхронизацию окончания аппаратного инспираторного цикла и окончания инспираторного усилия боль¬ ного. Более того, уровень создаваемого давления в дыхательных путях пациента повышается или снижается соответственно вентиляционным запросам больного.Особо разительных преимуществ в эффективности каждого из этих режимов не выявлено, хотя каждый из режимов имеет свои достоинства. Режимы, контроли¬ руемые по давлению, позволяют лучше компенсировать утечку, а режимы, контро¬ лируемые по объёму, обеспечивают стабильную величину минутной вентиляции, несмотря на изменение импеданса бронхолёгочной системы (сопротивления и податливости). Преимущества и недостатки основных режимов НВЛ представле¬ ны в табл. 70-1.
НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ 921 Таблица 70-1. Преимущества и недостатки режимов неинвазивной вентиляции лёгкихХарактерисшкиРежимы, контролируемые по дав* пениюРежимы, контролируемые по объёмуВозможность компенсации утечкиВысокаяНизкаяЧувствительность триггераВысокаяНизкая/средняяПостоянство дыхательного объёмаСреднееВысокоеУровень пикового давленияНизкий/среднийВысокийКомфортВысокийНизкий/среднийУменьшение работы дыханияСреднееЗначительноеСовсем новым режимом, специально разработанным для проведения НВЛ, является режим timed-adaptive (ТА). Данный режим сочетает преимущества кон¬ тролируемых (более полная разгрузка респираторного аппарата) и вспомогатель¬ ных режимов (синхронизация дыхания больного с респиратором). При дыхании в режиме ТА респиратор сначала проводит анализ спонтанного дыхательного паттерна больного (в это время больной дышит в режиме СРАР), затем респи¬ ратор имитирует спонтанный дыхательный паттерн больного, т.е. происходит наложение «контролируемых» аппаратных циклов на спонтанные вдохи больного, В случае «борьбы» пациента с респиратором происходит прекращение вентиляции в данном режиме, аппарат вновь анализирует дыхательный паттерн больного и «подстраивается» к дыханию больного. Вентиляция в режиме ТА сопровождается более высоким комфортом пациента по сравнению со стандартными режимами, т.е. ощущения больного такие же, как при режиме PSV, а снижение работы дыхания — как при контролируемых режимах.Проведено несколько рандомизированных контролируемых исследований (РКИ), сравнивавших влияние режимов PSV и ACV на дыхательный комфорт, параметры газообмена, инспираторное усилие и работу дыхания. Исследование Girault и соавт. показало, что режимы PSV и АСУ способны значительно улуч¬ шить показатели газообмена, дыхательный паттерн и обеспечить парциальную разгрузку дыхательной мускулатуры, причём АСУ обеспечивает больший отдых дыхательной мускулатуры по сравнению с Р8У, однако данное преимущество достигается ценою снижения дыхательного комфорта. Так как дыхательный ком¬ форт является очень важным параметром, определяющим комплайнс пациента к процедуре НВЛ, то в ряде ситуаций приходится прибегать к режиму Р8У, даже жертвуя некоторым физиологическим преимуществом АСУ.типы РЕСПИРАТОРОВ ДЛЯ ПРОВЕДЕНИЯ НЕИНВАЗИВНОЙ ВЕНТИЛЯЦИИ ЛЁГКИХВыбор респиратора является важным компонентом для эффективного прове¬ дения НВЛ. НВЛ может быть осуществлена как при помощи «реанимационных» респираторов (с их помощью проводится обычная, «инвазивная» ИВЛ), так и с помощью портативных респираторов, специально предназначенных для НВЛ (рис, 70-5), «Реанимационный» респиратор позволяет точно контролировать фракцию кислорода во вдыхаемой смеси и предлагает возможности мониториро- вания параметров механики дыхания, снабжён многочисленными тревогами. При респираторной поддержке с данными типами респираторов используется полный контур (инспираторная и экспираторная трубки), благодаря чему порция выдо¬ хнутого газа (с большим содержанием СО^) не может быть вновь ингалирована. Основными проблемами «реанимационных» респираторов при проведении НВЛ
922 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИVPAP И (ResMed)1VENTIIogic (Weinmann)Synchrony (Respironics)BiPAP ST 30(Respironics)VPAP 1Я (ResMed)Рис. 70-5. Портативные респираторы, предназначенные для проведения неинвазивной вентиляции лёгких.является их низкая способность компенсации утечки и связанные с этим сложно¬ сти переключения с фазы вдоха на фазу выдоха.Общими чертами портативных респираторов является их малый размер, низ¬ кая стоимость, простота настройки, возможность эффективно компенсировать даже высокую утечку, однако данные аппараты, как правило, не обладают теми возможностями мониторинга и тревог, что у «реанимационных» респираторов. Большинство портативных респираторов используют одиночный контур (инспи- раторный), эвакуация вьщыхаемого дыхательного объёма осуществляется через клапан выдоха или специальные отверстия в маске или контуре. Одной из про¬ блем портативных респираторов является возможность обратного вдыхания СОз- Повышение РЮ^ осуществляется путём увеличения подаваемого потока О2 в кон¬ тур респиратора. Преимущества и недостатки «реанимационных» и портативных респираторов представлены в табл. 70-2.Таблица 70-2. Преимущества и недостатки респираторов для неинвазивной вентиляции лёгкихПо|»тативныв респираторы«Реанимационные»респираторыКомпенсация утечки-Н-++Проблемы с экспираторным порогомРедкоЧастоТревогиЖизненно необходимыеЧрезмерныеМониторинг механики дыханияНет (да)ДаО^-модульРедкоДаУправлениеПростоеСложноеПортативностьДаНетВозвратное вдыхание СО^ВозможноНет
НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ 923ТИПЫ МАСОКВо многих случаях неудачи применения НВЛ во время эпизодов ОДН были свя¬ заны не только с тяжестью состояния больных, но и с неспособностью пациентов переносить присутствие маски, т.е. с низкой толерантностью к ним, В настоящее время в качестве интерфейса НВЛ для связи «пациент-респиратор» используются носовые и лицевые маски (рис. 70-6). Каждый тип масок имеет свои преимущества и недостатки. Носовые маски менее обременительны, реже вызывают клаустрофо¬ бию (очень редкое осложнение), позволяют приём пищи, разговор и экспектора- цию мокроты без снятия интерфейса. Кроме того, носовые маски имеют меньшее мёртвое пространство (около 100 мл) по сравнению с лицевыми масками, и, следо¬ вательно, требуется меньшее инспираторное давление при PSV и меньший дыха¬ тельный объём при АСУ для обеспечения одинаковой альвеолярной вентиляции.Лицевые маски при ОДН имеют то преимущество, что многие больные с выра¬ женным диспноэ дышат ртом, поэтому такая маска позволит избежать большой утечки через рот. Действительно, в своём исследовании Carrey и кол. показали, что во время НВЛ при помощи носовых масок огромное значение имеет позиция рта, так, при открытии рта утечка значительно увеличивалась, и активность диафраг¬ мы, оценённая по величине амплитуды электромиографии, возвращалась от 15% до 98%, т.е. респираторная поддержка практически полностью сводилась на нет. Особенно часто открытый рот пациента является источником непреднамеренной утечки во время сна. Однако режимы вентиляции, регулируемые по давлению, способны компенсировать умеренную утечку, кроме того, снижение утечки во время сна обеспечивает использование подбородочных ремней. У пациентов с отсутствием зубов развитие утечки через рот является большой проблемой и при использовании носовых масок может явиться причиной неэффективности НВЛ.Некоторые авторы также отмечают, что нормализация параметров газообмена происходит несколько быстрее при использовании лицевой маски (около 30 мин) по сравнению с носовой маской (около 1 ч). Лицевые маски рекомендуется использовать у более тяжёлых больных, с более выраженными степенями нару-Breeze(Mallinckrodt)Ultra Mirage (ResMed)Рис. 70-6. Маски, предназначенные для проведения неиивазивной вентиляции лёгких. 1-3 — носо¬ вые маски; 4, 7 — лицевые маски; 5 — носовые «конусы»; 6 — «полная» лицевая маска.
'''"■'•’Ж'924 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИшения сознания и меньшей кооперацией, а также у тех больных, у кого носовая маска вызывает чрезмерно большую утечку. Преимущества и недостатки лицевых и носовых масок представлены в табл. 70-3,Таблица 70-3. Преимущества (+) и недостатки (-} лицевых и носовых масокРотовая утечкаДавление в дыхательных путяхАппаратное «мёртвое пространство»Возможность разговораПриём пищи, водыЭкспекторация секретаРиск аспирацииРиск аэрофобииКлаустрофобияКомфорт больногоЛицевая маскаНосовая масжаКлинические исследоваиия неинвазивной вентиляции лёгких при острой дыхательной недостаточностиНВЛ может с успехом применяться у больных с гиперкапнической и гипоксе¬ мической ОДН. Наилучшими кандидатами для НВЛ являются наиболее уязвимые больные, для которых обычная ИВЛ может оказаться опасной процедурой вслед¬ ствие многочисленных потенциально опасных для жизни осложнений: больные с ХОБЛ, с терминальными стадиями болезней лёгких, больные с иммунодефи- цитными состояниями, кроме того, очень важно учитывать скорость развития и разрешения патологического процесса в лёгких, например, при отёке лёгких ОДН развивается в течение минут, при эффективной терапии (НВЛ) обратное развитие ОДН также наблюдается довольно быстро (минуты-часы). Достаточно быстро наблюдается обратное развитие ОДН у больных с ХОБЛ, с астматическим статусом, с синдромом ожирения-гиповентиляции (1-5 сут), а процесс разреше¬ ния ОДН при паренхиматозных заболеваниях лёгких — при тяжёлой пневмонии, ОРДС — как правило, требует более длительного времени (часто более 7-14 сут). Поэтому эффективность НВЛ обычно ниже при заболеваниях с медленным типом разрешения ОДН. Показания и противопоказания к НВЛ представлены ниже.Показания к неинвазивиой вентиляции лёгких при острой дыхательной недостаточности• Симптомы и признаки ОДН:❖ выраженная одышка в покое;❖ ЧД>25 в минуту, участие в дыхании вспомогательной дыхательной мускула¬ туры, абдоминальный парадокс.• Признаки нарушения газообмена:❖ Р^С02>45 мм рт.ст., рН<7,35❖ Р^02/Р102<200 мм рт.ст.Критерии исключения для неинвазивной лёгочной вентиляции при острой дыхательной недостаточности
НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ 925• Остановка дыхания.• Нестабильная гемодинамика (гипотония, неконтролируемые аритмии или ишемия миокарда).• Невозможность обеспечить защиту дыхательных путей (нарушения кашля и глотания).• Избыгочная бронхиальная секреция.• Признаки нарушения сознания (ажитация или угнетение), неспособность пациента к сотрудничеству с медицинским персоналом.• Лицевая травма, ожоги, анатомические нарушения, препятствующие наложе¬ нию маски.НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНЬЮ ЛЁГКИХВ большинстве исследований, посвящённых НВЛ при ОДН у больных ХОБЛ являлась наиболее частым показанием для проведения масочной респираторной поддержки.НВЛ является единственно доказанным методом терапии, способным снизить летальность у больных ХОБЛ с ОДН. К настоящему времени известны резуль¬ таты нескольких РКИ, посвящённых изучению эффективности НВЛ у больных с тяжёлым обострением ХОБЛ. Суммируя выводы данных работ, можно говорить о следующих положительных эффектах НВЛ при ОДН на фоне ХОБЛ:• НВЛ снижает потребность в интубации трахеи на 41-66% по сравнению со стандартной терапией (О^, бронхолитики, антибиотики):• НВЛ снижает летальность больных по сравнению со стандартной терапией (8-9% против 29-31%);• НВЛ снижает длительность пребывания больных ОИТ (13 сут против 22 сут);• НВЛ снижает длительность пребывания больных в стационаре (23-26 сут против 34-35 сут).Достоинством НВЛ является возможность применения данного метода не только в условиях ОИТ, но и в условиях палаты нереанимационного отделения, конечно, при условии определённой подготовки врачей и среднего медицинского персонала.Снижение летальности больных ХОБЛ при использовании НВЛ, как было убедительно показано в нескольких исследованиях, связано со снижением риска развития нозокомиальных инфекций, особенно госпитальных пневмоний. Общий успех (т.е. предотвращение ИТ и летального исхода больных) при ОДН на фоне ХОБЛ составляет около 60-70%, т.е. существует небольшая группа больных (20-30%), у которых НВЛ не приносит успеха, так как даже на фоне масочной вентиляции у больных происходит прогрессивное ухудшение газообмена и общего состояния.НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ АСТМАТИЧЕСКОМ СТАТУСЕНВЛ при астматическом статусе впервые была использована Meduri и соавт. На фоне проведения НВЛ через 2 ч от инициации вентиляции были отмечены досто¬ верные положительные сдвиги показателей газового состава артериальной крови, ЧД, ЧСС, и эти изменения продолжали улучшаться в течение последующих суток. Продолжительность НВЛ составила в среднем 16 ч, переносимость респираторной поддержки была хорошей, лишь два пациента нуждались в интубации трахеи и ИВЛ.Возможность применения НВЛ у больных с тяжёлыми и жизнеугрожающими обострениями Б А была продемонстрирована в нескольких проспективных иссле-
926 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИfe дованиях. в большинстве случаев больные, получавшие НВЛ, не требовали немед- ^ ленного проведения ИТ и ИВЛ и характеризировались меньшей тяжестью ОДН по Ш сравнению с больными, которым проводилась традиционная ИВЛ. НаилучшимиS кандидатами для НВЛ являются больные с обострением БА, имеющие тяжёлое диспноэ, гиперкапнию, клинические признаки повышенной работы дыхательной мускулатуры, однако без признаков утомления, без нарушения уровня сознания (оглушение или кома).НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ГИПОКСЕМИЧЕСКОЙ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИВ группу больных с гипоксемической ОДН обычно включают больных с тяжё¬ лой гипоксемией (Pa02/Fi02<200 мм рт.ст.) и тахипноэ (ЧД>35/мин). Данная группа включает больных с разнообразной патологией: тяжёлой пневмонией, кардиогенным отёком лёгких, острым респираторным дистресс-синдромом, травмой грудной клетки, аспирацией. Результаты исследований, посвящённых применению НВЛ у больных с гипоксемической ОДН, достаточно противоре¬ чивы.Wysocki и кол. в одном из первых РКИ не выявили преимуществ НВЛ у больных с гипоксемической ОДН по таким показателям, как снижение числа ИТ и леталь¬ ности больных. В то же время, по данным крупного несравнительного исследова¬ ния Meduri и кол., успех НВЛ при гипоксемической ОДН составлял 66%. Высокая эффективность НВЛ у больных с гипоксемической ОДН была также показана в последующих РКИ. Различные результаты разных исследований можно объяснить гетерогенностью патологий больных, подпадающих под определение «гипоксеми¬ ческая ОДН». Как показали недавно Domenighetti и кол., эффективность НВЛ при гипоксемической ОДН зависит не столько от выраженности нарушений газообме¬ на, сколько от природы заболевания, приведшего к ОДН: число ИТ и выживаемость больных с кардиогенным отёком лёгких была много выше по сравнению с больны¬ ми с тяжёлой пневмонией, несмотря на то, что исходные показатели газообмена у данных пациентов были сходными. По данным проспективного мультицентрового когортного исследования Antonelli и кол., на фоне проведения НВЛ наибольшая потребность в ИТ была у больных с ОРДС (51%) и тяжёлой пневмонией (50%), и реже всего ИТ выполнялась у больных с кардиогенным отёком лёгких (10%) и контузией лёгких (18%). Всего к настоящему времени выполнено не менее 12 РКИ, посвящённых изучению эффективности НВЛ у больных с гипоксемической ОДН. Наилучшие результаты НВЛ были отмечены у больных с ОДН, возникшей на фоне кардиогенного отёка лёгких, в постоперационный период, у иммуноском- прометированных больных, у больных с травмой грудной клетки.НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ПРИ КАРДИОГЕННОМ ОТЁКЕ ЛЁГКИХРеспираторная поддержка при помощи масок, в частности СРАР-терапия, с успехом используется для терапии кардиогенного отёка лёгких (КОЛ) в течение многих десятилетий. Первые РКИ, изучавшие эффективность масочной СРАР у больных с тяжёлым КОЛ, привели к выводам, что данная терапия способна зна¬ чительно уменьшить число ИТ: 0% vs 35% (р <0,005) в исследовании Bersten и кол. и 18% V5 43% (р <0,01) в исследовании Lin и кол. Кроме того, практически все проведённые исследования показали, что СРАР-терапия у больных КОЛ более быстро, по сравнению с кислородотерапией, приводит к значимым положитель¬ ным клиническим и функциональным изменениям: улучшение тахипноэ, диспноэ и тахикардии, повышение ¥р^¥^, pH и снижение P^COj.Несмотря на то, что масочная СРАР-терапия признана золотым стандартом терапии больных с ОДН на фоне тяжёлого КОЛ, по-прежнему остаётся открытым вопрос о целесообразности использования других режимов, например PSV+PEEP
НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ 927ИЛИ BiPAP, при данной патологаи. В сравнительных исследованиях было показано, что данные режимы, по сравнению с СРАР, более эффективно уменьшают нагрузку ш на аппарат дыхания и снижают работу дыхания, и также повышают дыхательный ^ объём и минутную вентиляцию. Согласно совокупным данным мета-анализа Keenan и кол., СРАР и НВЛ (PSV или BiPAP) приводят к достоверному снижению числа ИТ на 20% и 24% и достоверному снижению летальности больных на 17% и 8%, соответственно.НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ЛРИ ТЯЖЁЛОЙ ПНЕВМОНИИВозможность использования НВЛ у больных с ОДН на фоне пневмонии была показана в нескольких неконтролируемых исследованиях. По данным Meduri и соавт., НВЛ улучшила газообмен у 75% и позволила избежать интубации трахеи у 62% больных с тяжёлой пневмонией. При назначении НВЛ 30 больным с гипок¬ семической ОДН Benhamou и кол. не обнаружили различий по частоте успеха НВЛ (60%) у больных с пневмонией и без пневмонии. Изучению эффективности НВЛ при тяжёлой внебольничной пневмонии было посвящено РКИ Confalonieri и кол., Б которое было включено 56 больных. Использование НВЛ хорошо пере¬ носилось данными больными, не затрудняло удаление бронхиального секрета и приводило к значимому уменьшению тахипноэ, частоты ИТ (21% vs 50%, р=0,03) и длительности пребывания больных в отделении интенсивной терапии (1,8 VS 6,0 дней, р=0,04). Последующий анализ показал, что максимальный положи¬ тельный эффект НВЛ достигался у больных ХОБЛ, более того, у больных ХОБЛ 2-месячная выживаемость оказалась значительно выше у пациентов, получавших НВЛ (88,9% VS 37,5%, р=0,05), В настоящее время применение НВЛ при тяжёлой пневмонии обосновано у больных с фоновым заболеванием ХОБЛ, больных с лёг¬ ким удалением бронхиального секрета и на ранних этапах развития ОДН.НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ОСТРОМ РЕСПИРАТОРНОМ ДИСТРЕСС-СИНДРОМЕОсновными режимами НВЛ у больных с ОРДС являются СРАР и PSV, чаще всего используются лицевые маски. PSV имеет большее предпочтение, чем СРАР, так как обеспечивает большую разгрузку дыхательной мускулатуре, более эффек¬ тивно снижает работу дыхания и уменьшает диспноэ. В течение первых суток НВЛ обычно проводится постоянно, с короткими перерывами длительностью 10-20 мин. Необходимо подчеркнуть, что для проведения НВЛ необходим стро¬ гий отбор больных, главными критериями являются сохранение сознания и коо- перативность больного, а также стабильная гемодинамика. На основе большого опыта использования НВЛ у 147 больных с ОРДС, Antonelli и соавт. рекомендуют избегать проведения НВЛ у больных с SAPS более 34 баллов. Кроме того, если после пробного сеанса НВЛ в течение 1 ч показатель P^O/FíO^ не превышает 175 мм рт.ст., то такие больные также считаются неподходящими кандидатами для НВЛ. По данным Rana и кол., предикторами плохого ответа на НВЛ больных ОРДС являются метаболический ацидоз и выраженная гипоксемия. Возможность использования НВЛ у таких хорошо отобранных больных с ОРДС была показана в нескольких исследованиях. Успех НВЛ, по сводным данным нескольких исследо¬ ваний, составляет около 50%.Преимущества иеинвазивной вентиляции лёгкихАвторы всех проведённых исследований, посвящённых НВЛ, единодушны в том, что количество осложнений значительно меньше при использовании НВЛ, чем при традиционной ИВЛ. Масочная вентиляция позволяет снизить до миниму¬ ма число инфекционных и «механических» осложнений.
928 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИПреимущества неинвазивной вентиляции лёгких:• предотвращение «механических» и инфекционньгх осложнений, связанных с интубацией;• сохранение естественных защитных механизмов верхних дыхательных путей;• сохранение физиологического кашля;V, • сохранение способности больного разговаривать, глотать, принимать пищу,откашливать мокроту;• повышение комфорта больного;• снижение потребности в миорелаксантах и транквилизаторах;• лёгкое отлучение от респиратора.Нозокомиальная пневмония является частым осложнением вентиляции лёгких и является важнейшим фактором, определяющим исход больного. При проведении НВЛ не происходит прямого контакта с трахеей (интубационная трубка, аспира- ционный катетер), пациент может сам экспекторировать мокроту после снятия маски. Кроме того, в отличие от ИВЛ, при проведении НВЛ голосовые связки сохраняют свою естественную подвижность, что снижает риск развития аспира¬ ции — ведущего фактора риска развития вентиляционной пневмонии. В наиболее крупном исследовании Meduri и соавт., включавшем 158 больных, получавших НВЛ, нозокомиальная пневмония была выявлена только у одного больного.При использовании НВЛ полностью отсутствуют осложнения, связанные с наличием в дыхательных путях интубационных и трахеостомических трубок, — ранние и поздние повреждения глотки, гортани и трахеи. Также практически не наблюдается развития другого частого осложнения назотрахеальной интубации — синуситов, которые часто являются причинами необъяснимой лихорадки и бакте¬ риемии у пациентов, получающих респираторную поддержку. По данным ретро¬ спективного анализа, проведённого Abou-Shala и Medml, ни в одном из 633 случа¬ ев НВЛ не было зарегистрировано развития нозокомиального синусита.Основная роль в снижении риска нозокомиальных инфекций принадлежит, безусловно, замене интубационной трубки на маску, хотя возможно, что и меньшая потребность в других инвазивных процедурах (катетеризация вен, мочевого пузыря, зондирование желудка) у неинтубированного больного и меньшая длительность нахождения больных в отделении интенсивной терапии также вносят свой вклад в уменьшение числа инфекционных осложнений респираторной поддержки.Недостатки неинвазивной вентиляции лёгкихОсложнения при проведении НВЛ встречаются намного реже, чем при тради¬ ционной, инвазивной вентиляции, и, как правило, не требуют прекращения респи¬ раторной поддержки. Наиболее частыми осложнениями НВЛ являются некрозы кожи лица, конъюнктивиты, раздражение носа, транзиторная гипоксемия, общий дискомфорт, аэрофагия, утечка (рис. 70-7).Эрозии и некрозы кожи образуются чаще всего в месте наибольшего давле¬ ния маски на кожу лица (обычно мостик носа). Данное осложнение, по данным различных исследований, встречается в 6-18% случаев. Эрозии и некрозы кожи не являются серьёзным осложнением, так как обычно очень быстро заживают (2-7 дней).Транзиторная гипоксемия обычно появляется лишь во время перерыва между сеансами НВЛ, когда пациент снимает маску. Данная проблема особенно актуальна для больных с гипоксемической ОДН. Использование постоянного мониторинга при помощи пульс-оксиметрии позволяет вовремя возобновить неинвазивную респираторн}!'ю поддержку и быстро устранить гипоксемию.Недостатками НВЛ являются необходимость кооперации с пациентом и его высокой мотивации. По данным метаанализа, проведённого Muir и соавт,, про-
НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЁГКИХ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ 929Дискомфорт ЦЩШ Аррозии кожи лицаЗаложенность носа Аэрофагия УтечкаHiШ mtn ■ max20 40 60 V-80100Рис. 70-7. Частота осложнений при неинвазивной вентиляции лёгких — минимальная и максималь¬ ная частота [Mehta & Hill, 2001].цедура НВЛ была прекращена из-за непереносимости пациентом присутствия маски в 37 из 747 случаев (5%) использования НВЛ при ОДН. Настоящий метод практически не используется у больных с выраженными нарушениями созна¬ ния (число баллов по шкале Глазго менее 9), так как эти больные нуждаются в защите дыхательных путей и требуют частых санационных мероприятий, что трудно выполнимо при использовании НВЛ. Однако кома в некоторых ситуациях (гаперкапническая кома, постоперационное состояние) не является абсолютным противопоказанием к неинвазивной респираторной поддержке, так как легко может разрешаться и при НВЛ.СЛИСОК ЛИТЕРАТУРЫ^«
Глава 71 Трансплантация лёгкихТрансплантация лёгких или комплекса «сердце-лёгкие» при¬ меняется при лечении терминальных стадий заболеваний лёгких и лёгочных сосудов. По данным Регистра международного общества сердечно-лёгочной трансплантации, к 2004 г, в мире было выпол¬ нено более 20 тыс. операций по пересадке лёгю^х и более 3000 — по пересадке комплекса «сердце-лёгкие».История трансплантации лёгких началась в России в 40-х гг. XX века и тесно связана с именем Владимира Петровича Демихова (рис, 71-1). В 1946 г., после Великой Отечественной войны, хирург и физиолог В.П. Демихов начал работу по пересадке органов грудной полости у животных и показал техническую возможность пересад¬ ки сердца, комплекса «сердце-лёгкие» и изолированного лёгкого у собак.В 1963 г. Харди впервые пересадил лёгкое человеку (трансплан¬ тат одного лёгкого) и обнаружил, что пересаженное лёгкое было способно участвовать в газообмене. К сожалению, реципиент вскоре умер от почечной недостаточности. В течение почти двух последую¬ щих десятилетий ни одна из более 40 попыток пересадки лёгкого не была успешной.После длительного периода экспериментов на животных и разработки циклоспори¬ на А — мощного ингибитора роста Т-клеток, группа учёных Стэнфордского университета под руководством Reitz впер¬ вые сумела добиться длитель¬ ного выживания реципиента, которому пересадили ком¬ плекс «сердце-лёгкие» (HLTx).Через два года, в 1983 г., группа по пересадке лёгких в Торонто под руководством Cooper доби¬ лась длительного выживания реципиента с идиопатическим лёгочным фиброзом (ИЛФ), которому было пересажено Владимир Петрович Дешхов
ТРАНСПЛАНТАЦИЯ ЛЁГКИХ 931Рис. 71-2. Число выполняемых в мире трансплантаций лёгких, по данным Международного обще¬ ства пересадки сердца и лёгких (International Society for Heart and Lung Transplantation — ISHLT).одно лёгкое (SLTx). Впоследствии эта группа из Торонто успешно провела пере¬ садку комплекса обоих лёгких (без сердца) в 1985 г. Эта процедура приводила к большой смертности, обусловленной расхождением трахеального анастомоза. Б 1989 г. одновременно в Торонто и Сан-Антонио эта процедура была модифици¬ рована до широко применяемой в настоящее время билатеральной последователь¬ ной пересадки (одного) лёгкого (BLTx),Б 1991 г. Starnes и сотрудники из Университета Южной Калифорнии сообщили о пересадке доли лёгкого от живого донора (LDLTx). Сначала в качестве донора выступали два близких родственника (обычно родители), каждый их которых донировал нижнюю долю, теперь всё чаще используют доноров, не являющихся родственниками.До 1990 г. было выполнено лишь небольшое число пересадок лёгких, при этом широко применяли HLTx. С1990 г. число сообщений о пересадках лёгких в разных странах мира быстро увеличивалось (рис, 71-2), Число проводимых процедур SLTx и BLTx почти одинаково, при этом проводится 1500 одиночных или билатераль¬ ных пересадок в год. В настоящее время HLTx проводят нечасто, обычно только пациентам с комбинированной болезнью лёгких и сердца в терминальной стадии. Очень редко делают повторную пересадку этих органов. Сообщения о комбини¬ рованных процедурах, таких, как пересадка лёгкого-печени и лёгкого-почек, всё ещё крайне редки. За последние 10 лет было опубликовано много работ, в которых описаны выживание, исходы и осложнения после пересадки лёгкого, и в настоя¬ щее время есть надёжные данные по периоду, охватывающему до 10 лет после пересадки.МЕТОДЫ ТРАНСПЛАНТАЦИИ ЛЁГКИХПри выборе процедуры пересадки необходимо учитывать преимущества и недо¬ статки той или иной процедуры для данного индивидуума, предпочтения и опыт хирурга, а также более общие факторы, такие, как крайний дефицит подходящих донорских органов для пересадки лёгкого и обеспечение доставки и распределения органов (табл. 71-1). Хотя интуитивно кажется, что BLTx обеспечивает больший резерв лёгкого, отчётливое преимущество в отношении выживания BLTx, по сравнению с SLTx, обнаружено только при хронической обструктивной болезни лёгких (ХОБЛ) у реципиентов моложе 60 лет. Таким образом, единственной раз¬ деляемой почти всеми точкой зрения является то, что при гнойных заболеваниях лёгких требуется BLTx или HLTx, а пациентам с тяжёлым заболеванием лёгких или сосудов лёгких, сопровождающимся необратимым поражением сердца, требуется
1Щдарй932 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИHLTx. В настоящее время имеется тенденция применять BLTx, в основном, при муковисцидозе/бронхоэктазах и ХОБЛ. В большинстве программ теперь предпо¬ читают проводить BLTx при тяжёлой лёгочной гипертензии, хотя это не является общим правилом. К немногочисленным показаниям для BLTx относятся интерсти¬ циальные лёгочные процессы (в особенности ИЛФ), саркоидоз, лимфангиолейо¬ миоматоз, облитерирующий бронхиолит. повторная пересадка лёгкого и другие редкие показания.Таблица 71-1. Сравнение стандартных методов трансплантации лёгкихКомплекс «сердце¬ лёгкие*Два лёлсихОдно лёгкоеДоля от живого донораДоступСрединная стернотомияГоризонтальный «clam shell»Латеральная тора¬ котомияГоризонтальный «clam shell*АнастомозыТрахея;правое предсердие; аортаЛевый и правый бронхи; двойной, левое пред¬ сердие;правая и левая лёгочные артерииБронх;левое предсердие; лёгочная артерияДолевой бронх; долевая вена к верхней лёгочной вене;долевая артерия к лёгочному стволуПреиму¬ществаВаскуляризация дыха¬ тельных путей;Бсе показанияДоступ к плевральной полости;нет сердечного алло- графтаНаиболее простая процедура; болыиее число реципиентовРасширяет число доноровНедостаткиСердечный аллографт; «расход» органовОсложнения со стороны дыхательных путей; постоперационные болиОсложнения со сто¬ роны дыхательных путей;недостаточныйрезервИнвалидизациядоноровОбщиепоказанияВрождённые заболева¬ ния сердца с лёгочной гипертензией; заболевания серл1(я и лёгких:первичная лёгочная гипертензияМуковисцидоз; буллёзная эмфизема; бронхоэктазы; первичная лёгочная гипертензияЭмфизема;ИЛФМуковисцидоз;ИЛФSLTx чаще всего применяют при ХОБЛ, хотя вначале считали, что это может вызвать гемодинамически значимую динамическую гиперинфляцию собственно лёгкого. Это мнение не нашло подтверждения, и ХОБЛ является самым частым показанием для SLTx. ИЛФ является следующим по частоте показанием для ЗЬТх, Пересадку доли лёгкого от живого донора можно применять при большинстве показаний, но на практике эту процедуру чаще всего применяют при муковисци¬ дозе.Пересадку лёгких широко применяли при многих редких заболеваниях, некото¬ рые из которых, как было показано, рецидивируют в пересаженных лёгких.Заболевания, которые с большой долей вероятности моїуг вновь развиться в лёгочном аллографте:• саркоидоз;• лимфангиолейомиоматоз;• бронхоальвеолярный рак;• гистиоцитоз X.С меньшей вероятностью можно ожидать также вновь развития:• идиопатического лёгочного гемосидероза;• недостаточности a^-антитрипсина.
ТРАНСПЛАНТАЦИЯ ЛЁГКИХ 933Часто рецидив имеет незначительное влияние на функцию (например, при саркоидозе), возможно, потому, что подавление иммунного ответа, применяемое после пересадки, изменяет течение основного заболевания. Бронхоальвеолярную карциному ранее считали единственным злокачественным заболеванием лёгких, поддающимся лечению путём BLTx, но недавно сообщили о высоком проценте рецидивов и смертности.ВЫЖИВАЕМОСТЬ БОЛЬНЫХ ПОСЛЕ ТРАНСПЛАНТАЦИИ ЛЁГКИХМеждународный реестр, ведущийся теперь при сотрудничестве Международного общества пересадки сердца и лёгких (ISHLT) и Единой сети по распределению органов (United Network for Organ Sharing - UNOS) в США (реестр ISHLT/ UNOS), сообщил, что за период с 1990 по 2000 гг. медиана продолжительности жизни составила 3,7 года при SLTx и 4,9 года при BLTx (рис. 71-3). Однако с 2000 г, выживаемость больных продолжает улучшаться. Это улучшение целиком обусловлено улучшением выживаемости на ранних стадиях (до 90 дней), без види¬ мого изменения смертности у выживших за первые 90 дней, которая составляет у них 6-8% в год. Важными факторами, влияющими на выживание, являются диагноз перед пересадкой (хуже у пациентов с ИЛФ и лёгочной гипертензией, чем у пациентов с ХОБЛ и кистозным фиброзом), потребность в искусственной вен¬ тиляции лёгких, молодой или старческий возраст (пациенты в возрасте младше 18 или старше 65 лет), а также опыт центра трансплантации (центры, в которых делается менее 10 пересадок лёгкого в год имеют худшие результаты). Центры с большим опытом получают лучшие результаты, несмотря на то, что у них более сложный состав пациентов. В центрах, имеющих большой опыт, при отсутствии других осложнений BLTx можно ожидать, что выживаемость реципиентов соста¬ вит 85% через год и 60-70% через 5 лет.Причина смерти после трансплантации лёгкихВ настоящее время реестр ISHLT/UNOS сообщает причину смерти для четырёх периодов после пересадки лёгкого (рис. 71-4), У пациентов, умерших в течение 30 дней после пересадки, самыми частыми причинами смерти являются: отторжение1ШГоды после ТЛРис. 71-3. Выживаемость больных после трансплантации лёгких. Кривые выживаемости 1990- 2000 гг., показывающие преимущество двусторонней трансплантации лёгких. Стрелками показана медиана выживаемости.
934 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ100о604020ы0-30 дней 31 день—1 год 1—3 года3-5 летОпухоли Хронр1ческое отторжениеОстрое отгоржение ш Сердечно-сосудистые событияИнфекции ДругиеНедостаточность трансплантата Рис. 71-4. Причины смерти больных после трансплантации лёгких, по данным 1SHLT и UNOS.трансплантата, инфекции и сердечно-сосудистые события. Острое отторжение (00) встречается редко. Однако эти данные следует интерпретировать с большой осторожностью, поскольку ранняя смерть часто определяется многими фактора¬ ми, и установление «удобной» причины смерти может исказить очень сложную последовательность событий.У выживших в течение длительного времени преобладают два осложнения аллотрансплантата лёгкого: инфекции и хроническое отторжение, которые про¬ текают под маской синдрома облитерирующего бронхиолита (СОБ). Оба эти осложнения часто встречаются одновременно и, скорее всего, имеют общую этиологию, у пациентов, проживших более 5 лет, частота смерти в результате СОВ, по-видимому, не снижается, а смертность вследствие злокачественных новообра¬ зований или почечной недостаточности возрастает.Физиологические и функциональные исходы после трансплантации лёгкихПосле успешной пересадки лёгкого любого типа (но особенно BLTx и HLTx), произведённой по любому показанию, чаще всего сообщают о чувстве усталости в ногах как об основном симптоме после физической нагрузки. Ограничения со стороны сердца и вентиляции редки.
тРАнсплАнтацйя ЛЁГКИХ 935Функция лёгких (показатели спирометрии и диффузионная способность лёг- ких) близка к норме при BLTx и HLTx. У реципиентов трансплантата доли лёгкого Mv от живого донора имеется стойкое умеренное нарушение вентиляции по рестрик- ’'Йй тивному типу и снижение диффузионной способности лёгких, у реципиентов SLTx обычно имеются нарушения параметров спирометрии, отражающие патологиче¬ ский процесс в оставшемся собственном лёгком (например, у пациентов, перенёс¬ ших SLTx по поводу ХОБЛ, сохраняются стойкие лёгкие/умеренные нарушения вентиляции по обструктивному типу, а у пациентов с ИЛФ — стойкие лёгкие/ умеренные рестриктивные нарушения). У реципиентов SLTx, у которых аллотран¬ сплантат лёгкого функционировал практически нормально, физическая нагрузка может вызывать умеренное снижение насыщения крови кислородом.У пациентов с любым видом трансплантата ограничение в стандартном тесте с физической нагрузкой почти всегда было связано с периферическими факторами.Быстрое достижение порога молочной кислоты и преобладание симптоматической усталости ног в конце нагрузки указывают на нарушение окислительной способно¬ сти работающих скелетных мышц. Повреждение мышц, скорее всего, обусловлено сочетанием тяжёлой детренированности до пересадки и токсическим действием лекарств, принимаемых после пересадки. При полном восстановлении максималь¬ ное потребление кислорода обычно составляет только 45-60% от должного зна¬ чения, независимо от вида трансплантата или показания. Несмотря на это, почти 90% реципиентов через год сообщали, что состояние здоровья не ограничивает их активносги, и их качество жизни существенно улучшилось.ОТБОР РЕЦИПИЕНТОВ ДЛЯ ТРАНСПЛАНТАЦИИ ЛЁГКИХОбщества по пересадке органов в разных странах недавно попытались раз¬ работать единые критерии отбора реципиентов. Это вызвало широкие дискуссии и отчасти сфокусировало внимание на том, какие именно критерии отбора они хотели получить. Эти критерии должны также выявить тех, для кого имеется при¬ емлемая вероятность увеличения продолжительности жизни при улучшении её качества. При этом они должны учитывать региональные и национальные взгляды на распределение ограниченных ресурсов и соблюдать соответствующие законы.Общепринятые показания к трансплантации лёгкихОбычно пациентов — потенциальных реципиентов оценивают и активно вносят в лист ожидания, когда ожидаемая продолжительность их жизни составляет 2 года или меньше. Однако время ожидания обычно велико (часто более 12-18 месяцев), так что высока вероятность того, что пациенты с очень плохим прогнозом (<6 месяцев) умрут, находясь в списке ожидания. Поэтому для точного определения времени оценки и включения в список необходимо учитывать факторы, относя¬ щиеся к пациенту, к списку ожидания, а также характер используемой системы распределения органов (например, приоритет только по времени или приоритет по клиническим показателям).Показания к трансплантации лёгких.1. ХОБЛ:❖ FEV^ <25%;❖ РдСОз >55 мм рт.ст.;❖ Т давления в лёгочной артерии.2. Муковисцидоз/бронхоэктазы:^ FEVj S30%;❖ FEVj >30% и наличие одного из следующих:- быстрое снижение FEV^;- массивное лёгочное кровотечение;- нарастание кахексии;
936 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ^ - частые госпитализации;& - Р^С02 >50 мм рт.ст.;Щ - Р3О2 мм рт.ст,' ^ 3. Идиопатический лёгочный фиброз;❖ прогрессирование заболевания, несмотря на 3 мес медикаментозной терапии;❖ десатурация в покое или при физических нагрузках:- УС <60-70;- 01^0 <50-60%.4. Лёгочная гипертензия:симптоматическое, прогрессирующее заболевание, несмотря на оптималь¬ ную медикаментозную терапию, включая эпопростенол или его аналоги в течение, как минимум, 3 мес (обычно МУНА 1П-1У);•О' сердечный индекс <2 л/мин/м^;❖ давление в правом предсердии >15 мм рт.ст.; среднее давление в лёгочной артерии > 55 мм рт.ст.Качество жизни также является важным показателем при определении вре¬ мени внесения в список. Например, у многих пациентов с ХОБЛ качество жизни очень низкое, и, несмотря на очевидное преимущество в отношении сроков жизни, они готовы принять существенные риски, связанные с пересадкой. Оценка, проведённая во время последнего тяжёлого обострения или без проведения соответствующей реабилитации, может создать у пациента неправильное пред¬ ставление относительно достижимого качества его жизни в это время. Перед при¬ нятием окончательного решения о пересадке лёгкого на основании низкого каче¬ ства жизни следует активизировать лечение (в том числе приём лекарственных средств, оксигенотерапию), дать психологическую оценку результатов лечения, а также провести реабилитационные мероприятия.Противопоказания к трансплантации лёгкихСуществующие противопоказания к пересадке опираются на мнение экспер¬ тов, а не основаны на доказательных данных. Они пытаются выявить пациентов с такими сопутствующими заболеваниями, которые ухудшают прогнозируемый исход пересадки, могут осложнить пересадку или могут обостриться при прове¬ дении пересадки или применении иммунодепрессантов.Некоторые противопока¬ зания являются относительными, но их сочетание может привести к недопустимо высокому риску. Такие решения требуют обстоятельной оценки, тщательного рас¬ смотрения и обсуждения, помимо врачей, группой специалистов разного профиля (например, диетологов, социальных работников, психологов и физиотерапевтов) для оценки пересадки.Противопоказания к трансплантации лёгких.1. Относительные противопоказания:❖ тяжёлый остеопороз;❖ тяжёлые мышечно-скелетные заболевания (в тл. кифосколиоз);❖ идеальная масса тела <70% или >130%; неразрешимые психосоциальные проблемы;❖ потребность в механической вентиляции лёгких;❖ колонизация грибами или атипичными микобактериями.2, Абсолютные противопоказания:❖ органная недостаточность (хроническая почечная недостаточность — ХПН: клиренс креатинина <50 мг/мл/мин, заболевание печени, подтверждённое биопсией);❖ ВИЧ-инфекция;❖ активное опухолевое заболевание (за исключением базальноклеточной и плоскоклеточной карциномы кожи);
ТРАНСПЛАНТАЦИЯ ЛЁГКИХ 937❖ положительный HBAg;❖ гепатит С, подтверждённый биопсией печени;❖ курение, приём алкоголя, наркотиков в последние 6 мес.Отбор доноровОбычно пересадка лёгкого возможна от доноров, у которых в результате ката¬ строфического неврологического происшествия наступила смерть мозга, но про¬ должает работать сердце. В анамнезе у них не должно быть заболеваний органов дыхания и клинически значимой инфекции дыхательных путей, необходимо, чтобы у них был нормальный газообмен, отсутствовали изменения ка рентгено¬ грамме органов грудной клетки. Доноры должны также соответствовать общим требованиям к донорам многих органов (например, отрицательная реакция в тесте на ВИЧ, отсутствие злокачественных новообразований) (табл. 71-2).Таблица 71-2. Критерии селекции доноровКритерииОбычныеРасширенныеВозраст<60 лет<65 лет (60-65 лет, если время ишемии <7 ч)Стаж курения<20 пачек/лет<30 пачек/летБолезни лёгкихНетБронхиальная астма, при условии её контроляРентгенограмма грудной клеткиНормаМинимальные измененияБронхиальный секретНетДопустим, если легко удаляется во время бронхоскопииГазы артериальной крови (ГАК) при уровне положительного давления в конце выдоха (positive end expiratory pressure — PEEP) 10 CM H^O + FIO2 100%PaO. >300 MM рт.ст.Респираторное пособие и повторения ГАК; PaOj >300 мм рт.ст.Крайняя нехватка донорских лёгких привела к неуклонному движению в сто¬ рону «расширенных показаний» или пограничных доноров. Это, по-видимому, не привело к ухудшению исходов, хотя постепенный характер этих изменений затрудняет обнаружение этих эффектов, если они не очень значительны. В про¬ граммах или регионах, использующих доноров по расширенным показаниям, число пересадок может увеличиться на величину до 50%, В недавнем сообщении из Швеции показана возможность взятия лёгких у донора вплоть до 3 ч после оста¬ новки сердца. Это может увеличить источник доноров в последующие несколько лет. в предстоящие десятилетия вероятными вариантами лечения моїут стать ксе- нотрансплантация, заселение лёгкого стволовыми клетками и даже выращивание работоспособных органов с использованием технологии стволовых клеток.Ведение доноровСмерть мозга не является статическим состоянием, и, несмотря на наилучшее ведение, через 24-48 ч происходит повреждение жизненно важных органов и, в конечном итоге, необратимая остановка сердца. Считается, что этот процесс уси¬ ливается в результате нейрогормональных изменений, вызванных смертью мозга. Для стабилизации донора после смерти мозга используют введение гормонов. Группы, принимающие органы, имеют различные точки зрения на процесс веде¬ ния донора многих органов, особенно в том, что касается применения инотропных средств или инфузии жидкостей при интенсивной терапии. Лёгкие подвержены
938 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИнейрогенному отёку, поэтому желательно избегать вливания больших объёмов жидкости. Бронхоскопическое удаление секрета, использование антибиотиков и применение положительного давления в конце выдоха часто могут помочь пре¬ вратить пограничных доноров в приемлемых доноров с хорошими исходами.Подбор пары донор-реципиентПодбор донора для реципиента для пересадки лёгкого проводится в основном по совместимости группы крови и соответствия размера лёгкого (табл. 71-3). Всегда, когда это возможно, реципиентам, не имевшим контакта с цитомегалови- русом (ЦМВ) и вирусом Эпштейна-Барр (ВЭБ), следует пересаживать органы от ЦМВ- и ВЭБ-негативных доноров, хотя это часто невыполнимо. Желательно про¬ вести тест на совместимость лимфоцитов, хотя это делается не всегда.Таблица 71-3. Критерии подбора донор-реципиентгруппа кровиРазмерВирусологический статусЛимфоцитарный cross-matchСовпадает• Окружность грудной клетки и размеры лёгких по данным рентгенографии ФУДНОЙ клетки.• TLC донора и TLC реципиента приблизительно равны (±10%)При возможности избегать;• положительный 1дС к цитомегапоаирусу у донора и отрицательный у реци¬ пиента;• положительный 1д6 к вирусу Эпштейна-Барр у донора и отрицательный у реципиентаТ-клетки отрицательные (обязательно) и В-клетки отрицательные (желательно)ПОСТОПЕРАЦИОННОЕ ЛЕЧЕНИЕ Интенсивная терапияв настоящее время смерть реципиентов на операционном столе при пересадке лёгкого является исключительным явлением. Начальное лечение почти всех паци¬ ентов проводят в отделении интенсивной терапии (ОИТ). К основным проблемам на ранних стадиях после операции относятся ранний реперфузионный отёк лёг¬ ких (синоним: первичная дисфункция аллографта), который дифференцируют со сверхострым отторжением, обструкция анастомоза лёгочной вены с левым предсердием (рис. 71-5). Состояние пациентов с этими проблемами продолжает ухудшаться в течение 24-48 ч после операции.Состояние пациентов в большинстве случае позволяет проводить раннюю экс- тубацию в ОИТ уже в первые сутки после операции, однако при развитии ранних осложнений требуется проведение искусственной вентиляции лёгких (ИВЛ) в тече¬ ние нескольких дней. Хотя на ранних стадиях функция аллотрансплантата может не вызывать проблем, прекращению ИВЛ могут препятствовать дисфункция диа¬ фрагмы (даже паралич), боль и потребность в сильных седативных средствах, и к этому часто присоединяется развитие сепсиса, связанного с аллотрансплантатом. Главными целями в это время являются:• тщательное наблюдение за балансом жидкости в организме;• поддержание низкого давления наполнения для ограничения отёка лёгких вследствие повышенной проницаемости альвеолярно-капиллярной мембра¬ ны, часто с применением умеренной инотропной поддержки;• обеспечение максимального снятия боли, которое часто дополняется установ¬ кой эпидурального катетера в грудной области;• тщательное наблюдение за функцией почек.Индукционная иммуносупрессия (табл. 71-4) обычно включает антилим- фоцитарный глобулин (АТОАМ, АТС, ОКТЗ) или антагонисты рецепторов
ТРАНСПЛАНТАЦИЯ ЛЁГКИХ 939Све{Обехос ірукц» ^гтрое отгорж 2ІЯ ЛЄГОЧНІIРепер!отекфузионнір ЛегкихСепсис!НИе X венвнебольничОстрое отторжениеная пневмония;госпи'Осложне ишемия стри грануляи бронхомальная пневмонияния анаст слизистой ктуДа:ИЯ: шяцияО П порту ^|[ и СТ и ческ I Хромоза:1е инфекциионическос отгорженио143060 90 365Дни после трансплантации Рис. 71-5. Хронология лёгочных осложнений после трансплантации лёгких.интерлейкина-2 (базиликсимаб, даклизумаб) и высокие дозы кортикостероидов (метилпреднизолон) парентерально. После этого обычно применяют режим, включающий антагонист кальциневрина (циклоспорин или такролимус) и цито- статики (азатиоприн, или микофенолата мофетил, или микофеноловая кислота) и кортикостероид (преднизолон или метилпреднизолон) Б снижающейся дозе.Таблица 71-4. Иммунос^рессивная терапия при трансплантации лёгкихПрепаратыОбычная дозаОсновные побочные эффектыИнплбиторы калщиневринаПоддерживающая доза:Почечная недостаточность. Артериальная гипертензия. Гиперхолестеринемия. Нарушение функции печени. Головные боли. Гипертрофия дёсен (циклоспорин). Гирсутиэм (циклоспорин). Диабет (такролимус)Циклоспорин5-10 мг/кг/с {регулируется по концентрации сыворотки крови)Такролимус0,2-0,5 мг/кг/с (регулируется по концентрации сыворотки крови)ГКСПоддерживающая доза:Колебание настроения.Прибавка веса.Нарушение толерантности к глю¬ козе.Остеопения.Мышечная атрофияПреднизолон0,2-0,5 мг/кг/с
940 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИОкончание табл. 71-4Повышение дозы при отторже¬ нии:МетилпреднизолонхПульс»-терапия 1-2 г 3 сутокЦитостатикиПоддерживающая доза:Супрессия костного мозга. Желудочно-кишечные осложнения (особенно микофенолат). Анафилаксия. Неинфекционный менингмт. Отёк лёгких. Сывороточная болезньАзатиоприн1-2 мг/кг/сМикофенолата мофетил2-3 г/с (взрослые)Микофеноловая кислота1440-2160 мг/с (взрослые)РапамицинПоддерживающая доза; регули¬ руется по концентрации е сыво¬ ротке кровиАнтагонисты рецепторов интерлейкина-2Индукция иммуносупрессии:Базиликсимаб20 мг/кг предоперационно и на 4 деньДаклизумаб1 кг/кг предоперационно и на 14, 28, 42, 56 дниАнтилимфоцитарные препаратыИндукция иммуносупрессии или острое отторжениеАтгам15 мг/кг/с в/в 14 дней, потом через день на протяжении 14 днейТяжёлая первичная дисфункция аллографта может потребовать продолжитель¬ ной ИВЛ или даже экстракорпоральной мембранной оксигенации крови. У пациен¬ тов с SLTx при эмфиземе динамическая гиперинфляция собственного лёгкого или необходимость приложения PEEP в пересаженном лёгком могут потребовать неза¬ висимой вентиляции каждого лёгкого с помощью двух отдельных респираторов.Может потребоваться внутривенное введение антибиотиков и профилактика вирусных инфекций, вызываемых ЦМВ. ВЭБ, и вирусом varicella zoster, а также инфекций, вызываемых грибками и простейшими. Необходимо также обращать особое внимание на функцию желудочно-кишечного тракта (особенно у пациен¬ тов с муковисцидозом), функцию нервной системы (особенно обращать внимание на судороги, вызванные ингибиторами кальциневрина, или лейкоэнцефалопатию) и алиментарный статус.Постоперационное восстановлениеКак только пациент покидает ОИТ, основное внимание смещается на оптимиза¬ цию режима иммуносупрессии и помощь в восстановлении после операции. Снятие боли остаётся трудной проблемой, особенно после прекращения эпидуральной анал- гезии (примерно через 5-7 дней после операции). Поощрение глубокого дыхания, откашливания и раннее прекращение постельного режима помогают восстановле¬ нию. После удаления эпидурального катетера трудно поддерживать баланс между
ТРАНСПЛАНТАЦИЯ ЛЁГКИХ 041достаточной аналгезией и избыточным потреблением седативных препаратов. Следует избегать применения нестероидных противовоспалительных препаратов, так как это часто приводит к значительному ухудшению функции почек.Дальнейшее восстановление позволяет проводить более активную реабили¬ тацию, просвещение и постепенно возложить на самого пациента обязанности по соблюдению сложного режима приёма лекарств. При раннем и подробном планировании выписки пациента можно вполне безопасно вьтисать домой или в реабилитационные центры.РеабилитацияПациенты часто находятся в плохом физическом состоянии перед транс¬ плантацией, имеют небольшую мышечную массу и сниженную окислительную способность скелетной мускулатуры. Радикальная операция, сепсис и лекарства (особенно антагонисты кальциневрина и глюкокортикоиды) часто усиливают дис¬ функцию скелетных мышц. В идеальном случае контролируемую реабилитацию следует начинать как можно раньше. Пациентам, которым требуется длительная механическая вентиляция, реабилитационные мероприятия следует проводить уже в ОИТ, пока они ещё подключены к респиратору. Реабилитацию других боль¬ ных можно начать в больнице перед выпиской и продолжать после этого в течение нескольких недель.ДОЛГОСРОЧНОЕ ЛЕЧЕНИЕОсновными целями лечащей группы при долгосрочном лечении реципиента трансплантата лёгкого являются:• достижение и поддержание оптимальной иммуносупрессии (см. табл. 71-5);• раннее выявление и лечение осложнений аллотрансплантата (в том числе инфекции и отторжения);• мониторинг и лечение внелёгочных осложнений иммуносупрессии;• оказание поддержки реципиентам и их семьям.В большинство программ включены; регулярное проведение рентгенографии грудной клетки, тесты функции лёгких и бронхоскопия с чрезбронхиальной биопси¬ ей (ЧББ) и бронхоальвеолярным лаважом (БАЛ) для контроля функции трансплан¬ тата. Протоколы контрольного наблюдения сильно варьируют в разных програм¬ мах. Стандартную бронхоскопию с БАЛ и ЧББ обычно проводят регулярно в течение первых 12 месяцев. Жидкость, полученную при БАЛ, исследуют на бактерии, гриб¬ ки, вирусы и простейшие. ЧББ может выявить характер инфекции и оценивается по стандартной системе количественной оценки 00, воспаления дыхательных путей, хронического отторжения дыхательных путей и хронического сосудистого отторже¬ ния (табл. 71-5). В целом, частота этих исследований уменьшается со временем, но может и увеличиться, если возникнут проблемы с аллотрансплантатом.Таблица 71-5. Классификация синдрома 00 (Уои$ет а1., 1996)СтепеньМорфологические измененияАО (нет 00)Нормальная паренхима лёгкихА1 (минимальное 00)Рассеянные немногочисленные периваскулярные мононуклеарные инфильтраты в паренхиме лёгких, не видимые при малом увеличенииА2 (лёгкое 00)Многочисленные периваскулярные мононуклеарные инфильтраты, окружающие венулы и артериолы, хорошо видимые при малом увеличенииАЗ (умеренное 00)Хорошо различимые «муфты» из плотных периваскулярных мононуклеарных инфильтратов вокруг венул и артериол, с распространением воспалительных клеток инфильтрата на периваскулярные и перибронхиолярные альвеолярные перегородки и воздушные пространства
942 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИОкончание табл. 71-5А4 (тяжёлое 00)Диффузные периваскулярные, интерстициальные и альвеолярные мононукле- арные инфильтраты и выраженное повреждение альвеолоцитов, обычно ассо¬ циированное с наличием внутри альвеол некротических клеток, макрофагов, гиалиновых мембран, кровоизлияний, нейтрофиловДля выявления внелёгочных осложнений обычно требуется проводить мони¬ торинг артериального давления, анализы крови (в том числе для определения функции печени, почек и уровня холестерина), а также регулярный врачебный осмотр. Следует поощрять желание пациентов и сотрудников сообщать о сим¬ птомах как можно раньше, поскольку из-за упущенного времени проблемы часто усложняются.ЛЁГОЧНЫЕ ОСЛОЖНЕНИЯЛёгочный аллотрансплантат особенно склонен к осложнениям из-за ряда осо¬ бенностей:• нарушения мукоцилиарного клиренса (отчасти вследствие анастомоза дыха¬ тельных путей);• склонности к альвеолярно-капиллярной утечке;• нарушения дренажа лимфы;• отсутствия реанастомозы бронхиальной артерии, что приводит к ишемиикрупных дыхательных путей.После трансплантации лёгких возможно развитие различных лёгочных ослож¬ нений. К ним относят:1) ранние осложнения:❖ реперфузионный отёк лёгких;❖ инфекции;❖ 00;❖ геморрагии;> недостаточность анастомоза;2) поздние осложнения:инфекции (бактериальные, вирусные, грибковые); хроническое отторжение;❖ бронхиальные осложнения; лимфопролиферативные заболевания;❖ карциномы.Самыми частыми проблемами являются: реперфузионный лёгочный отёк, пневмония, вызванная грамотрицательной или госпитальной микрофлорой, 00 и хроническое отторжение в форме СОБ.Реперфузионный лёгочный отёкРеперфузионный лёгочный отёк(или первичная дисфункция аллографта) явля¬ ется одним из наиболее частых осложнений, развивающихся в ранний постгран- сплантационный период. Чаще всего данное осложнение развивается немедленно после операции, но иногда может появиться через 24-72 ч. Реперфузионный лёгочный отёк встречается примерно у 10-25% реципиентов, хотя, по некоторым оценкам, его лёгкие субклинические формы могут быть выявлены примерно у 80% больных, к клиническим признакам реперфузионного отёка лёгких относятся:• появление новых альвеолярных/интерстициальных инфильтратов на рентге¬ нограмме грудной клетки;• гипоксемия;• повышение лёгочного сосудистого сопротивления;• снижение комплайенса респираторной системы (измеряется во время ИВЛ).
ТРАНСПЛАНТАЦИЯ ЛЁГКИХ 943Рис. 71-6. Рентгенография лёгких при репер- фузионном лёгочном отёке.Типичные рентгенологические при¬ знаки реперфузионного лёгочного отёка представлены пятнистыми очагами консолидации, часто в области корней и в нижних отделах лёгких, «воздуш¬ ными бронхограммами» (рис. 71-6).Гистологическая картина ткани лёгких представлена паттерном диффузного альвеолярного повреждения.Самыми важными факторами риска реперфузионного отёка лёгких являют¬ ся: искусственное кровообращение во время операции; лёгочная гипертензия до операции; время ишемии аллографта >330 мин. Клиническая картина ухуд¬ шается или остаётся стабильной на про¬ тяжении 2-4 дней и лишь затем при наличии адекватного лечения начинаетулучшаться. Тяжёлые формы реперфузионного лёгочного отёка приводят к уве¬ личению продолжительности ИВЛ, длительности пребывания больных в ОИТ и стационаре, а также к высокой летальности больных (около 44%),К диагностическим критериям тяжёлого реперфузионного лёгочного отёка (Christie et al., 1998) относят:• появление диффузных альвеолярных инфильтратов на рентгенограмме груд¬ ной клетки в течение 72 ч после трансплантации (при односторонней транс¬ плантации ~ на стороне аллографта);• <200 мм рт.ст. больше чем в течение первых 48 ч;• зависимость от респиратора более 5 дней, связанную с дыхательной недоста¬ точностью;• отсутствие других причин острой дыхательной недостаточности;• гистологическую картину диффузного альвеолярного повреждения в случае смерти больного в течение первых 6 дней.Терапия реперфузионного лёгочного отёка включает диуретики и респиратор¬ ную поддержку (используется протокол протективной вентиляции лёгких). Кроме того, в некоторых центрах протоколы ведения таких больных включают ингаля¬ ционный оксид азота, препараты простациклина, введение экзогенного сурфак¬ танта и экстракорпоральную мембранную оксигенацию (ЕСМО).Лёгочные инфекцииПациенты с лёгочными инфекциями представляют самую большую трудность в отношении диагностики и лечения после пересадки лёгкого. Основными при¬ знаками лёгочной инфекции являются: лихорадка, кашель, нарастающая одышка, выделение мокроты и присутствие инфильтрата на рентгенограмме грудной клет¬ ки. Лихорадка может не появляться в условиях значительной иммуносупрессии.Дифференциальная диагностика инфекционных и неинфекционных осложне¬ ний после трансплантации лёгких очень сложна. Рентгенографическая картина грудной клетки может дать важные сведения (например, диффузный или узло¬ вой инфильтрат, инфильтрат в собственном лёгком или в аллотрансплантате). Следующим шагом диагностики обычно является бронхоскопия с БАЛ и ЧББ. Патогенные организмы можно высеять из жидкости БАЛ и идентифицировать, а ЧББ может подтвердить, что инфекция является клинически значимой (напри¬ мер, наличие цитопатогенных эффектов, характерных для пневмонии, вызванной ЦМВ (рис. 71-7, см. также цветную вклейку). В редких случаях требуется торако-Ш.
944 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИРис. 71-7. трансбронхиальная биопсия лёгких: картина цитомегаловирусной пневмонии с ТИПИЧНЫМИ включениями в виде «совиного глаза».скопическая биопсия или биопсия на открытом лёгком для определения причины лёгочного инфильтрата. К сожалению, ни одно из этих исследований не является на 100% чувствительным или на 100% специфичным. Для принятия решения относительно лечения требуется объединить всю имеющуюся информацию.Большинство инфекций вызываются бытовыми, больничными или перси¬ стирующими патогенами реципиента. Истинные оппортунистические патогены тоже важны, но проведение антимикробной профилактики значительно снизило распространённость инфекций и смерти, вызванных ЦМВ и Pneumocystis carinii. Aspergillus fumigatus и другие грибки остаются сложной проблемой, но можно надеяться, что её решению поможет появление новых противогрибковых средств (липосомального амфотерицина, вориконазола, каспофунгана).Острое отторжениеСовременные стратегии иммуносупрессии делают 00 редкой причиной ранней смерти после пересадки. Многие случаи 00 теперь выявляются контрольной ЧББ, и их лечат даже при отсутствии симптомов у пациента. 00 может начаться вне¬ запно нарастающей одышкой, кашлем и стеснением грудной клетки (табл. 71-6). Уменьшение насыщения крови кислородом при физической нагрузке может ука¬ зывать на раннее нарушение функции трансплантата.Таблица 71-6. Сравнение 00 и синдрома облитерирующего бронхиолитаХарактеристики00Синдром облитерирующего бронхиолитаПик осложненийПервые 6 месБолее 3 месяцев-годыНачалоОстрое-подостроеНезаметноеСимптомыЗаложенность в грудной клетке (в ранний постоперационный период)Одышка при физической нафузкеКашель (обычно непродуктивный)Кашель (обычно продуктивный)ОдышкаФизиология дыханияРестриктивные нарушенияОбструктивные нарушенияСнижение сатурацииНормоксия до поздних стадийРентгенофафияДиффузные интерстициальные инфильтратыНет изменений до поздних стадийПлевральный выпотНа компьютерной томограмме признаки мозаичной олигемии и бронхоэктазов
ТРАНСПЛАНТАЦИЯ ЛЁГКИХ 945Окончание табл. 71-6Анализ кровиЛейкоцитозНормаМорфологияПериваскулярные мононуклеарные инфиль¬ тратыОблитерирующий бронхиолитВариабельное воспаление в дыхательных путяхАтеросклероз лёгочных и бронхиаль¬ ных артерийОтвет на терапиюВ большинстве случаев быстрое улучшение наступает быстро при в/в введении глюко- кортикоидных средств (ГКС)У большинства реципиентов наблю¬ дается прогрессирующее снижение функции внешнего дыхания (ФВД)Объём форсированного выдоха за 1 секунду (ОФВ^), жизненная ёмкость и диф¬ фузионная способность могут снизиться на 10% и более. Присутствие диффузных инфильтратов в лёгких на рентгенограммах грудной клетки обычно отражает более высокую степень 00 (АЗ или А4; см. табл. 71-5).Альвеолярные инфильтраты чаще всего локализованы в области корней и в нижних отделах, возможно наличие небольшого плеврального выпота (рис. 71-8).Но у 75-80% пащ^ентов с гистологически доказанным 00 нет никаких рент¬ генологических изменений. Даже компьютерная томография (КТ) лёгких имеет ограниченную диагностическую ценность (чувствительность 17% при А1, 50% — при А2 и 20% - при АЗ). К сожалению, довольно часто необходимо гистологиче¬ ское подтверждение 00, что требует проведения бронхоскопии с ЧББ (рис. 71-9, см. также цветную вклейку).Терапия 00 состоит из назначения высоких доз внутривенного метилпредни¬ золона (по 500-1000 мг/с в течение 3 дней). При 00, рефрактерном к терапии, возможно включение в схему терапии антитимоцитарного глобулина в течение 10-14 дней; замена циклоспорина на такролимус; терапия ингаляционным циклоспорином; метотрексат; тотальное облучение лимфоидных органов.Рис. 71-8. Рентгенография лёгких при синдроме острого отторжения.
946 ЛЕЧЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИГ5К*“'^■Рис. 71-9. Трансбронхиальная биопсия лёгких: острое оиоржение, лимфоцитарные инфильтраты вокруг артериолы. с распространением воспалительных клеток инфильтрата на апьвеолярные пере¬ городки и воздушные пространства (АЗ),Хроническое опоржениеСиндром облитерирующего бронхиолитаЗа последние два десятилетия существенно улучшилась выживаемость после пересадки лёгкого. Это улучшение обусловлено в основном снижением немед¬ ленной послеоперационной смертности, благодаря чему более 90% реципи¬ ентов трансплантата лёгкого теперь доживают, по крайней мере, до выписки из больницы. Хроническое отторжение, чаще всего проявляющееся в форме клинического синдрома прогрессирующей обструкции дыхательных путей при неизменённой рентгенограмме грудной клетки и отсутствии других причин (см. табл. 71-7), известно как СОБ, и в настоящее время оно является самой частой причиной смерти пациентов в отсроченный период после транспланта¬ ции (см. рис. 71-4).Патологические изменения при СОБ характеризуются пролиферативным пора¬ жением бронхиол с участием фибрина, миофибробластов и лимфоцитов, которое может привести к полной окклюзии малых дыхательных путей (рис. 71-10, см. также цветную вклейку). С морфологической точки зрения это повреждение пред¬ ставляет собой облитерирующий бронхиолит.Рис. 71-10. трансбронхиальная биопсия лёгких: облитерирующий бронхиолит. Асимметричное сужение просвета бронхиолы грубой рубцовой тканью {стрелка}.
СтадияСОБОСОБОр (потенциальный)СОБІС052СОБЗФВДОФВ/ >90% и МОС25-75 >75%ОФВ. 81-90% и/или МОС25-75 575%ОФВ, 66-fiОФВ, 51-65%ОФВ, <50%* исходный уровень OOBj определяется по двум лучшим результатам после трансплантации.Подразумевается, что СОБ обусловлен поздним проявлением аллоиммунного ответа. Стойкое 00 и лимфоцитарный бронхит и бронхиолит являются признан¬ ными факторами риска. Пневмония, вызванная ЦМВ, также является установлен¬ ным фактором риска, поскольку она прямо или косвенно может способствовать аллореактивности. Высокие уровни нейтрофилов и интерлейкина-8 в жидкости БАЛ у реципиентов трансплантата лёгкого с установленным СОБ привели к пред¬ положению о том, что в этом процессе могут играть важную роль первичные (врождённые) иммунные ответы.СОБ возникает примерно у 50% реципиентов трансплантата лёгкого через 3 года, часто после лёгкой вирусной инфекции верхних дыхательных путей. У паци¬ ентов может появиться прогрессирующая одышка или могут возникнуть реци¬ дивирующие бактериальные инфекции и стойкая продукция гнойной мокроты. Таким образом, в качестве причины смерти часто указывают инфекцию, тогда как основной причиной является СОБ.В диагностике СОБ большое значение имеет КТ лёгких. Прямыми признака¬ ми облитерирующего бронхиолита являются мелкие разветвлённые затемнения (branching opacities) и центролобулярные узелки, непрямыми — участки мозаич¬ ной олигемии (воздушная ловушки) и бронхоэктазы.В терапию облитерирующего бронхиолита входят: курсы пульс-терапии метил¬ преднизолоном (3 дня, затем высокие дозы per os); антитимоцитарный глобулин (курсы по 10-14 дней); азитромицин 250 мг через день постоянно; замена цикло¬ спорина на такролимус (при СОБІ); замена азатиоприна на микофенолата мофе¬ тил (при СОБІ); ингаляционный будесонид в дозе 1,6-4 мг/с через порошковый ингалятор или небулайзер; ингаляционный циклоспорин в дозе 100-300 мг/с и даже повторная трансплантация лёгких.Другие формы хронического отторженияСОБ является самой частой формой хронического отторжения аллотрансплан¬ тата. В редких случаях наблюдается хроническое сосудистое отторжение или про¬ грессирующий интерстициальный фиброз. Иногда наблюдается облитерирующий бронхиолит с организующейся пневмонией (ОБОП) — подострая форма оттор-ТРАНСПЛАНТАЦИЯ ЛЁГКИХ 947Существует значительная путаница вследствие слабой корреляции между пато¬ логической сущностью облитерирующего бронхиолита и клиническим СОБ. Например, облитерирующий бронхиолит может быть обнаружен у реципиентов трансплантата лёгкого с нормальной функцией лёгких. С другой стороны, он ’ может не обнаруживаться в образцах ЧББ и может с трудом обнаруживаться даже при биопсии на открытом лёгком, даже у пациентов с высокой степенью СОБ. Группа экспертов под эгидой ISHLT рекомендовала стандартизованный подход к описанию хронического отторжения, в котором акцент сделан на клиническом синдроме СОБ (табл. 71-7). Тяжесть СОБ определяют по процентному снижению ОФВ^ относительно наилучшего значения o6Bj после пересадки.Таблица 71-7. Классификация синдрома облитерирующего бронхиолита (Estenne et al., 2002)
948 ЛЕ4ЕНИЕ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИжения, проявляющаяся в форме нарастающей одышки и лёгочных инфильтратов. Хотя ОБОП часго улучшается под действием возрастающих доз глюкокортикои¬ дов, вводимых в течение от нескольких недель до нескольких месяцев, у некото¬ рых пациентов он может являться началом развития СОБ.ВНЕЛЁГОЧНЫЕ ОСЛОЖНЕНИЯПрепараты, включаемые в стандартный режим иммуносупрессии, обладают многими нежелательными эффектами (см. табл. 71-5). Многим пациентам могут потребоваться: изменение целевых уровней лекарств, режима приёма, замена одного из лекарств или лечение нежелательных действий того или иного лекар¬ ства. Циклоспорин и такролимус также обнаруживают большое число лекарствен¬ ных взаимодействий, и уровни этих двух лекарств существенно изменяются под действием других часто применяемых лекарств (табл. 71-8),Таблица 71-8. Препараты, влияющие на концентрации циклоспорина и такролимуса сыворотки кровиПовышают уровень препаратовСнижают уровень препаратовАнтагонисты кальция; верапамил, дилтиаземПротивосудорожные: фенитоин, карбамазепин. бар- б^ратыПротивогрибковые: кетоконазол, итраконазол, флу¬ коназолАнтибиотики: рифампицин, изониазид, сульфаниламид-сульфаметоксазол (высою^е дозы)Макролиды: эритромицин, кларитромицинХинолоны: ципрофлоксацинГрейпфруты и грейпфрутоаый сокДругие препараты: метоклопрамид, циметидинк наиболее часто встречающимся внелёгочным осложнениям после трансплан¬ тации лёгких относят:гиперкоагуляционное состояние крови; нефротоксичность; артериальную гипертензию; остеопороз; гиперлипидемию; сахарный диабет; нейротоксичность; анемию; панкреатит; миопатию;• гемолитико-уремический синдром;• лимфопролиферативные заболевания;• другие опухоли;• парез желудка;• гастроэзофагеальную рефлюксную болезнь;• диарею.Нарушение функции почекВажной проблемой является нарушение функции почек; у 50% реципиентов после трансплантации лёгкого уровень креатинина сыворотки удваивается, и у 5-10% в течение 5 лет после пересадки развивается терминальная почечная недо¬ статочность. С помощью более новых эффективных иммуносупрессоров, в том
ТРАНСПЛАНТАЦИЯ ЛЁГКИХ 949числе микофенолата мофетила и эверолимуса, возможно удастся существенно снизить существующие целевые уровни антагонистов кальциневрина.Неврологические нарушенияУ 5-8% пациентов, принимающих циклоспорин, бывает, по меньшей мере, один приступ судорог, применение противосудорожных препаратов (в особен¬ ности адифенина и барбитуратов) может значительно снизить уровни цикло¬ спорина и такролимуса, поэтому требуется соответствующая коррекция дозы и тщательный мониторинг. Повторные судороги или прогрессирующее ухудшение неврологического статуса требуют проведения немедленного обследования, в том числе с помощью КТ и магнитно-резонансной томографии (МРТ), для выявления вызванной антагонистом кальциневрина прогрессирующей многоочаговой лей- коэнцефалопатии, которая возникает редко, но обычно может быстро привести к летальному исходу.Сахарный диабетОпределённые заболевания (например, муковисцидоз) характеризуются частым развитием сахарного диабета. Кроме того, продолжительная терапия ГКС, в особенности в комбинации с такролимусом, может привести к вновь возникшему диабету. Если для предотвращения 00 проводится лечение короткими курсами высоких доз ГКС, то требуется тщательный мониторинг уровня сахара в крови.ОстеопорозОстеопороз часто обнаруживают во время обследования перед пересадкой лёгких, но комбинация ГКС и антагонистов кальциневрина может ускорить раз¬ витие остеопороза. Можно надеяться, что регулярное наблюдение за плотностью кости до и после пересадки позволит выявить пациентов, которым требуется более детальное обследование и лечение.Психологические проблемыПересадка лёгкого может быть эмоционально глубоко переживаемым событи¬ ем для пациентов и их семей. Это происходит на фоне приёма ГКС, седативных средств, бессонницы и упорной боли, и многие пациенты испытывают острый син¬ дром органического поражения мозга в течение нескольких дней и недель после пересадки. Более высокие дозы ГКС могут вызвать глубокую депрессию, а также манию и даже психоз. Однако чаще высокие дозы ГКС вызывают сонливость и раздражительность. Предупредив об этом заранее пациента и его семью, можно предотвратить серьёзный семейный кризис.Ухудшение функции трансплантата (часто после периода хорошего состояния здоровья после пересадки) может оказывать особенно удручающее психологиче¬ ское действие на больного. Некоторые семьи строятся на отношении зависимости, и полное восстановление здоровья после пересадки лёгкого может привести к существенным изменениям отношений, приводя иногда к распаду брака и длитель¬ ных отношений. Существенной частью любой программы пересадки должна быть сильная группа психологической поддержки.
АЗДЕЛ XVПРОФИЛАКТИКА И КОНТРОЛЬГлава 72. Курение @Глава 73. Обучение пациентов и комплайнс«
Предметный указательАбляция радиочастотная 506 Абсцесс гангренозный 256 Абсцесс- лёгкого 96, 256- - дифференциальная диагностика 266- - лечение 266- хронический 261 Агар- МакКонки 33- Эндо 33Агранулоцитоз 284, 286 Адгезия бактерий 315 Аденовирусные инфекции 213 Аденома 97Актиномикоз, диагностика 32 Аллергическая астма 152 Аллергия 152,381 Аллодиния 179 Альвеолит 76- аллергический 131 Альмитрина бисмезилат 161 Ангиография прямая 52 Ангиопульмонография 52 Ангиосаркома 489 Анемия 133, 217 AiiTHren Смитта 675 Антигенный-дрейф 195- шифт 194Антилейкотриеновые препараты 149 Антитела- антитопоизомеразные 678- антицентромные 678- к цитоплазме нейтрофилов 544- миозит-специфические 679 Антихолинергические препараты 160 Апноэ 205,321- обструктивное 833- - сна 835, 838,844- центральное сна 846, 849,850 Апоптоз 367Аппарат ренгенографический передвижной 43Апудомы 477 Артериит- гигантоклеточный 542,560 ~ Такаясу 542, 561 Артериография бронхиальная 52 Артрит- инфекционный 182- ревматоидный 132,184, 674, 762Артропатия 217 Асбестоз 77,82,134. 789 Аспергиллёз 32,257,282- аллергический бронхолёгочный 291,413- инвазивный 282- - лёгочный 34- некротизирующий хронический 288 Аспергиллома 289Аспирация простая 794 Астма сердечная 169 Асцит 123Ателектаз 84. 95, 204, 241 -дисковидный 676- обтурационный 229 Атопический кашель 171 Ахалазия пищевода 185 Ацетилцистеин 153 Ацинус 360 Аэрополлютанты 383Бактериологическая диагностика 33 Бензодиазепины 161 Биоплёнки 245 Биопсия- медиастинотомия 104- прескаленная 103- торакоскопия 104- трансгоракальная аспирационная 104- трансцервикальная 103 Биоптат лёгочной ткани 29 Бластома 494 Бластомикоз 36 Бодиплетизмография 127 Бойля закон 128 Бокавирусная инфекция 217 Болезни аорты 184 Болезнь- Бека 681- Бехчета 542, 544, 562- Гоше 599 -Дауна 360- Дюшенна 857- Кавасаки 543, 557, 704- Крона 532 -Лайма 183- Мондора 182- Такаясу 704- Ходжкина 485, 493- Шегрена 704- Шенлейна-Геноха 542- Эрдхайма-Честера 685
952 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬБоль, дифференциальная диагностика 186 Браш-биопсия 29, 94 Браш-биоптат 29Бронхиальная астма 96,117,131,375- кашлевой вариант 170■ " Бронхиолит 77, 205, 231, 362, 752- облитерирующий 133- лекарственный 758 Бронхит 169,205,751- хронический 96- эозинофильный 170 Бронхоальвеолярный смыв 29 Бронходилатационньт ответ 336 Бронхоскопия 92- диагностическая 94- лечебная 98- - NO-тepaпия 99- - осложнения 101- санационная 98- - терапия лазерным излучением 99-- удаление доброкачественных опухолей 100- - удаление инородных тел 100 Бронхостеноз 84 Бронхоэктазия 96Бронхоэктазы 76, 81,86,133,160,172, 291,406 Бронхоэктатическая болезнь 153,406 Буллэктомия 372 Бурая индурация лёгких 707ВВакцинация 240 Васкулит- геморрагический 556- лёгочный 541- мелких сосудов 557- эссенциальный криоглобулинемический 556 Вентиляционные нарушения- обструктивный тип 122- рестриктивный тип 124 Визуальная аналоговая шкала 158 Вирусы респираторные 191 Висцеральные боли 179 Внебольничная пневмония 27 Воксель 59Волчанка системная красная 132,184,231, 675, 789- лёгочная гипертензия 676 -тромбоэмболия 676 Воспаление- острое 258- хроническое 309Галактоманнан 32,284 Гангрена лёгкого 256Гастроэзофагеальный рефлюкс 171,185,394 Гемангиоперицитома 489 Гемобластоз 702 Гемоторакс 109, 802- ятрогенный 804 Гиалогифомикозы 298 Гипералгезия 179Гиперреактивность бронхиальная 392 П1перчувствительный пневмонит 72 Гипоальбуминемия 159 Гипотеза протеазно-антипротеазного дисба¬ ланса 363 Гистиоцитоз 81- Лангерганс-клеточный 696 Гистиоцитоз X 696 П1стиоцитома 490 Гистоплазмоз 36 Глаукома 146 Гпомерулонефрит 551,553 Глюкокортикостероиды ингаляционные 142 Гран>'лёма эозинофильная 696 Гранулематоз Вегенера 79,124, 219, 231, 542,551, 676, 704, 789 Гранулы Бирбека 701 Грибной шар 289 Грипп 193 ■' азиатский 194- птичий 192,198 Грудная симпатэктомия 116ДДавление трансмуральное 123 Д-димер 516Деконтаминация селективная 254 Дерматомиозит ювенильный 679 Детоксикация физиологическая 259 Диабет несахарный 699 Диагностика- аэробные актиномицеты 33- вирусы 35- грибь1 34- микобактерии 33- микоплазмы 35- серодиагностика 35- хламидии 34 Димеры 143 Диспноэ 155,170 Дистресс-синдром 80,198, 212 Дисфония 146Диффузионная способность лёгких 130 Диффузные заболевания лёгких 113 Диффузный спазм пищевода 185 Дренирование плевральной полости 795 Друзы 32 Дыхание -Биота 25- Куссмауля 25- Чейна-Стокса 25, 848 Дыхательная недостаточность 325 Дыхательный объём 126Ёмкость вдоха 126
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 053ЖЖелезное лёгкое 707 Живая гриппозная вакцина 200Заболевания соединительной ткани систем¬ ные 674 Закон Старлинга 566 Зигомикоз лёгких 297 Злокачественный плевральный выпот 110ИИдиопатический гемосидероз лёгких 707 Измерение- диффузионной способности лёгких 127- лёгочных объёмов 125 Иммунохроматографический тест 32 Импульсная осциллометрия 130 Индекс- BODE 323- курящего человека 333- одышки 334 Индукция плевродеза 111 Инородные тела бронхов 173 Инсульт 93Интервенционная радиология 67 Интерстициальные заболевания лёгких 172 Интоксикация кокаином 185 Инфаркт миокарда 93,118,142 Инфекции оппортунистические 674 Ирританты 750 Испанка 194 Исследование- крови на гемокультуру 30- мазки из носа и зева 31- моча 30- ПЦР 36- серодиагностика 35- сыворотка крови 31 Ишемия миокарда 179,183ККаверна туберкулёзная 266 Кандидоз 36- инвазивный 293- лёгочный 34- орофарингеальный 146 Капиллярит изолированный лёгочный 556 Капилляропатии 146Капсаицин 167 Карбоксигемоглобин 134 Кардиалгия 185 Кардиомиопатия 555 Кариес 257 Карциноид 477- метастазы 482 Карциноматоз 76,82Карциносаркома 485,494 Катаракта 146 Катепсины 367 Кашель 165,197. 205,263- атопический 171- идиопатический 176- кашлевая триада 170- провокационные кашлевые тесты 167- психогенный 173 Кашлевой рефлекс 165 Кератоконъюнктивит 215 Киста- воздушная 798- ретенционная 70, 413- эхинококковая 266 Кифосколиоз 131 Клетки- Лангерганса 700 -Мак-Кой 34- Пирогова-Лангханса 273- Штернберга 493 Коагулопатия 109 Коинфекция 225 Кокцидиоидомикоз 36 Коклюш 169 Колонизация 218 Комплекс криоплазменно-антиферментный 267 Комплексообразование 259 Коронавирусная инфекция 210 Кривая -епоток-объём» 120 Криоглобулинемия 556 Криптококкоз 32, 36,295 Критерии бронхиальной обструкции 335 Кровотечение лёгочное 286 Кровохарканье 290, 413 Круп 203 Ксифоидия 182ЛЛактатдегидрогеназа 677 Ларингит 205, 218 Ларинготрахеит 751 Латерография 39 Легионеллёз 28,32 Лёгкое амиодароновое 763 Лёгочная гипертензия 181 Лейкоцитоз 184 Лейомиоматоз 81 Лейомиосаркома 488 Лизосомальные ферменты 195 Лимфангиолейомиоматоз 133 Лимфангиомиоматоз 83 Лимфолейкоз 296 Лимфома 36, 296,493- ассоциироанная с пиотораксом 822- первичная в виде выпота 820 Лимфоузлы средостения 454 Линия Дамуазо 802 Липосаркома 491
954 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬЛобэктомия 114 Лучевая диагностика 38 Люпус-нефрит 675ММаксимальная вентиляция лёгких 125 Малиновое желе 459 Мальнутриция 244 Мальформация артериовенозная 70 Матрица томограммы 58 Медиастиноскопия 467 Мезаденит 215 Мезотелиома плевры 113- диффузная злокачественная 813,814,816, 817,819- локализованная злокачественная 820 Менингит 197 Менингоэнцефалит 197 Металлопротеиназы матриксные 366 Метапневмовирусная инфекция 207 Метастазирование опухолей 497 Метастазы лёгочные 498 Метастазэктомия 113Метод- вымывания азота 127- выявления антигенов 32- микроскопии 31- разведения газов 126- разведения гелия 127 Методики контрастирования 51 Метроррагии 685 Микобактериоз, патогенез 273 Микобактериозы 271- диагностика 279- клиническая картина 276- лечение 280 Микрогематурия 552 Микроиммунофлюоресценция 35 Миокардит 216Миопатии воспалительные идиопатические 679 Модуляция болевых ОШ)гщеНИЙ 180 Мозаичная плотность 81 Мокрота 28, 229Моноклональные антитела к IgE 151 Моча 30Муаровые структуры 490 Муковисцидоз 96,133,153,291, 415,949 Муколитики 153 Муфты периваскулярные 75 М-холиноблокаторы 150ННазофарингит 205 Невралгия межрёберная 182 Неврастения 185 Нейросаркома 490 Неходжкинская лимфома 493 Нитрофураны, поражение лёгких 764Новообразования, томографическая диагно- сгика 69,72,74 Ноцицепторы 165,181ООбструкция верхних дыхательных путей 123 Объём форсированного выдоха 322 Одышка 93,117,155,172,181, 205 Ожирение 131 Окно электронное- костное 61- лёгочное 60- плевральное 60 Окраска- поГ]раму 31- по Цилю-Нильсену 32 Оксиданты 311Операции комбинированные 470 Операция Тренделенбурга 528 Опоясывающий лишай 183 Опухоли- первичные злокачественные неэпителиаль¬ ные 484-плевры 812,825- метастазирование 497 Остаточный объём лёгких 126 Остеома лёгкого 492 Остеопороз 949 Остеосаркома 492Острое отторжение 944 Острые респираторные вирусные инфекции 191 Отёк- лёгких- - альвеолярный 80- лекарственный 759- - острый токсический 752- - реперфузионный 942- тканей 258 Отит 216ППалисадообразные структ^фы 490 Панкреатит 185 Папиллома 97 Параганглиома 485 Парагрипп 200 Пародонтит 257Переменная интраторакальная обструкция 124Периартериит 557Перикардит 184Периоциты Циммермана 489Перфузионная сцинтиграфия 519Перцепция 156Пиксель 59Пиопневмоторакс 261, 268 Плазмаферез 550Плазмоцитома солитарная 485,493
Плевральная жидкость 29 Плевральный выпот 131 Плеврит 110,181- ихорозный 261- при ревматоидном артрите 677 Плевродез химический 795 Плевропневмония 84 Плевроскопия 109 Пневмонит 231,485- гиперчувствительный 72- лекарственный 674- острый волчаночный 675- хронический 676 Пневмония 169, 205, 215,218,289- абсцедаруюшая 96- вентиляторассоциированная 241- внебольничная 223, 236, 240- гриппозная 240- затяжная 238- интерстициальная 80- инфарктная 182- казеозная 266,275- кандидозная 293- неонатальная 35- нозокомиальная 241,242- острая токсическая 752- при дерматомиозите 680- при полимиозите 680- псевдодесквамативная интерстициальная 698- ретенционная 95, 97 “ хламидийная 34Пневмосклероз склеродермический 678 Пневмоторакс 24,109,118,169,181,790- напряжённый 801- первичный спонтанный 796- спонтанный 112- - вторичный 798- ятрогенный 800Позитронно-эмиссионная томография 67 Полиангиит микроскопический 543, 553,676 Полиартериит узелковый 542,543, 554,557 Полимиалгия ревматическая 560 Полимиозит 679- интерстициальное заболевание лёгких 680 Полинейропатия периферическая 553 Полихондрит рецидивирующий 124 Полицитемия 117,133Понижение плотности лёгочной ткани 80 Поражение лёгких- лекарственного происхождения 131, 754, 756- радиационное 131Поражения дыхательных путей токсические острые 750 Признак глубокой борозды 793 Проба- Вальсальвы 41- Манту 277Пробы рентгенофункциональные 41 Проводимость дыхательных путей 129 Прокальцитонин 230ПРЕДМЕТНЬГЙ УКАЗАТЕЛЬ 955Промывные воды бронхов 28 Протеазы- сериновь(е 364- цистеиновые 366 Псевдохилоторакс 809 Пситтакоз 34 Пульпит 257 Пульсоксиметрия 834Пунктат инфильтрата или абсцесса лёгкого 29Пурпура Шенлейна-Геноха 542,704 Пятая болезнь 217Рабдомиосаркома 488 Рак- бронхогенный 129- колоректальный 505- лёгких 69, 94,103,183, 451- бронхоальвеолярный 454Реакции кратковременных пробуждений 833 Реакция прямой имк1унофлюоресцеиции 32 Резервный объём- вдоха 126- выдоха 123,126 Резистентность 226 Ремоделирование бронхов 314 Ренгеноскопия 48Рентгеновское исследование традиционое 39 Рентгенография- плёночная 39- показания 69- цифровая 44Респираторно-синцитиальная вирусная инфекция 203 Ринит 171, 218- язвенно-некротический 552 Риновирусная инфекция 208 Ринофарингит 205, 215 Ринофаринготонзиллит 215 Розовые пыхтельщики 326,369Саркоидоз 72,76,103,131,681 Саркома 486- ангиогенная 488- миогенная 488- остеогенная 504- синовиальная 491 Сахарный диабет 949 Свищ- бронхоплевральный 93- плевроторакальный 109 Секвестрация 257 -лёгкого 418 Семиномы 685Сепсис 221Сердце лёгочное хроническое 320 Серодиагностика 27,35
956 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬСерпины 364 Симпаталгии 183 Симптом- бабочки 568- барабанных палочек 411- воздушной бронхограммы 463,486,493- дерева в почках 77 -зубаакулы 369- кольца 292- лимфогенной дорожки 462- матового стекла 79, 284, 700,701, 757- ореола 284- Плеша 325-погремушки 284.290,413 ' полумесяца 284- пупковидного втяжения плевры 462- серпа 290- часовых стёкол 411 Синдром- Бернара-Горнера 183,460- бронхообструктивный 330.758- верхней апертуры грудной клетки 183- висцеральной гипестезии 184- гиповентиляционный 680- Горама 806- Горнера 116 -гриппоподобный 752- Гудпасчера 556, 676,703,704- диссеминированного внутрисосудистого свёртывания 259,267- Дресслера 181,184, 772, 789- жёлтых ногтей 772- Иценко-Кушинга 146- карциноидный 478- коклюшеподобный 215 -Лёффлера 554- МакЛеода 362,418- Мари-Бамбергера 460- Мейгса 789- Мелькерссона-Розенталя 685- мышечно-фасциальный 182- облитерирующего бронхита 946- обструктивных апноэ-гипопноэ сна 321,835- организующейся пневмонии 500- острый коронарный 183 -Панкоста 183,452 -перекреста 321,338- постнагрузочного бронхоспазма 394- правожелудочковой грудной жабы 181- проклятия ундины 888- раздражённого кишечника 179 -Рейно 116-Рея 198- системной воспалительной реакции 258- слизисто-кожный лимфонодулярный 557- Титце 182 -ТУретта 173- тяжёлый острый респираторный 210- усадки лёгких 675- фиброзирующего альвеолита 680 ' Целена-Геллерстедта 707- Черджа-Стросс 542,554- Шауманна 681 Синие одутловатики 326 Синусит 171,216Системная красная волчанка 674- лекарственная 759Системы флюорографические сканирующие 47 Сифилис 257Склеродермия системная 678 Склероз-нодулярный 493- системный 132 Скорость выдоха пиковая 336 Соли золота, поражение лёгких 763 Солитарные узлы ИЗСон 831Сопротивление дыхательных путей 129Сотовое лёгкое 81, 700СПИД 276, 296Спирометрия 117Спланхниэктомия 116Спондилит анкилозирующий 182Среда- Левенштейна-Йенсена 33- Миддлбрука 33Стабилизаторы мембран тучных клеток 153 Стеноз- гортани субглоточный 552 -трахеи 93Стент 68Стернотомия 502Стресс оксидативный 311Стридор 26,93,117Судороги клонико-тонические 197Сцинтилляция 55Сыворотка крови 31Тахипноэ 25 Тахифилаксия 346 Теофиллин 147 Терапия- антифунгальная 285- деэскалационная 251 Тест-вазореактивный 679-патергии 562Тимома 74Тимпанит 264Томография линейная 49Тонзиллит 215Торакоскопия 104Т^)ансмуральное давление 123Трансплантация лёгких 930Трансторакальная пункция 466Транстрахеальный аспират 29Трансфер-фактор для окиси углерода 130Трахеобронхит 169,182,196Трахеомаляция 124Треск целлофана 640
Тромбангиит 542 -облитерирующий 562 Тромбэндартерэктомия 538 Т^опонин 517Т^еркулёз 28. 72. 93,103,134, 257, 270, 289, 330,417- диагностика 277- диссеминированный 273- иммунитет 273- классификация 274- клинические проявления 275- лечение 280- патогенез 272Тромбоэмболия лёгочной артерии 511- лучевое исследование 88Уменьшение объёма лёгочной ткани хирурги¬ ческое 372 Уремия 184ФФагоциты макрофагальные 696 Фактор- антинуклеарный 675- ревматоидный 676Факторы риска 186, 235, 240, 242, 244,386 Фарингит 215,218Фарингоконъюнктивальная лихорадка 215 Феномен- взвинчивания 179- воздушной ловушки 156.161- гипералгезии 179- клетка в клетке 819- манжетки 568- обкрадывания 538- Рейно 678 Феогифомикозы 300 Фиброателектаз 84 Фибробронхоскопия 159, 465,480 Фиброз- дыхательных путей 698- кожи генерализованный 678 Фибромиалгия 182 Фиброоптическая бронхоскопия 230 Фибросаркома 490 Фиброторакс 810 Фиксированная обструкция 124 Флебография 52Флегмона 268 Флюорография 47 Формула Light 793Фотостимулируемая люминесценция 44ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 057Хирургическая редукция лёгких 163 Холецистит 185 Хондросаркома 491 Хорионэпителиома 498 Хроническая гранулематозная болезнь 283, 288Хроническая обсгруктивная болезнь лёгких 303ЦЦирроз печени 160 Цитомегаловирус 29,938 Цитомегаловирусная инфекция 283Числа Хаунсфидца 56 ШШваннома 490 Шкала- Борга (рейтинг категорий) 158- клинической оценки инфекции лёгких 249- одышки MRC 334- Хаунсфилда 59,371- CURB-65 233- PORT 233Эзофагит 185Экзантематозная болезнь 217 Эластаза нейтрофильная 364 Эластическая отдача лёгких 130 Электромиограмма 835 Эмболия лёгочная 132 Эмболы опухолевые 497 Эмболэктомия 528 Эмбриома 494 Эмпиема плевры 112,269 Эмфизема 109, 204, 304, 360- буллёзная 362- голодающих 368- сенильная 368 Эмфизема 80- базиллярная 160Эндартериит сосудов верхних конечностей 116Эндосонография 55 Эозинофилия 555 Эозинофильный бронхит 170 Эпидемии сезонные 195 Эписклерит 553 Эритема инфекционная 217Хилоторакс 805Язвы твёрдого нёба 675
о проекте «Наииональные руководства»«Национальные руководства» - серия практических руководств для непрерывного последипломного образования врачей по основным медицинским специальностям.Аудитория национальных руководств - врачи различных специальнос¬ тей, работающие как в учреждениях первичного звена, так и в стаци¬ онарах; интерны, ординаторы, аспиранты; студенты старших курсов медицинских вузов; преподаватели медицинских вузов и учреждений последипломного образования; руководители лечебных учреждений. К участию в подготовке национальных руководств приглашены веду¬ щие российские специалисты. В редакционный совет вошли главные специалисты-эксперты Минздравсоцразвития России, руководители профессиональных медицинских обществ, академики РАН и РАМН, руководители научно-исследовательских учреждений и медицинских вузов.Национальные руководства должны стать основой информационного обеспечения непрерывного профессионального образования врачей, проводимого под ЭГИДОЙ медицинских обществ.в данной книге освешены актуальные проблемы пульмонологии:• современные методы диагностики болезней органов дыха¬ ния;• клиническая фармакология лекарственных средств, использу¬ емых в пульмонологии;• схемы лечения основных инфекционных заболеваний лёгких;• диагностика и лечение опухолевых заболеваний лёгких и плевры;• терапия дыхательной недостаточности различной этиологии;• современные рекомендации по диагностике и лечению бронхи¬ альной астмы и хронической обструктивной болезни лёгких.15ВЫ 978-5-9704-1076-99 785970410769
Войти

Полноэкранный режим
Для цитирования:
Чучалин А.Г., Авдеев С.Н., Айсанов З.Р., Белевский А.С., Васильева О.С., Геппе Н.А., Игнатова Г.Л., Княжеская Н.П., Малахов А.Б., Мещерякова Н.Н., Ненашева Н.М., Фассахов Р.С., Хаитов Р.М., Ильина Н.И., Курбачева О.М., Астафьева Н.Г., Демко И.В., Фомина Д.С., Намазова-Баранова Л.С., Баранов А.А., Вишнева Е.А., Новик Г.А. Бронхиальная астма: федеральные клинические рекомендации по диагностике и лечению. Пульмонология. 2022;32(3):393-447. https://doi.org/10.18093/0869-0189-2022-32-3-393-447
For citation:
Chuchalin A.G., Avdeev S.N., Aisanov Z.R., Belevskiy A.S., Vasil’eva O.S., Geppe N.A., Ignatova G.L., Knyazheskaya N.P., Malakhov A.B., Meshcheryakova N.I., Nenasheva N.M., Fassakhov R.S., Khaitov R.M., Il’ina N.I., Kurbacheva O.M., Astafieva N.G., Demko I.V., Fomina D.S., Namazova-Baranova L.S., Baranov A.A., Vishneva E.A., Novik G.A. Federal guidelines on diagnosis and treatment of bronchial asthma. PULMONOLOGIYA. 2022;32(3):393-447.
(In Russ.)
https://doi.org/10.18093/0869-0189-2022-32-3-393-447
Просмотров: 4137












