Мероприятия
Фонд борьбы с лейкемией организует круглый стол ко Дню осведомленности об остром миелоидном лейкозе (ОМЛ)
Читать подробно
Артериальная гипертензия у взрослых
Версия: Клинические рекомендации РФ 2018-2020 (Россия)
Категории МКБ:
Вторичная гипертензия (I15), Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек (I13), Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек (I12), Гипертензивная болезнь сердца [гипертоническая болезнь сердца с преимущественным поражением сердца] (I11), Эссенциальная [первичная] гипертензия (I10)
Разделы медицины:
Кардиология
Общая информация
Краткое описание
Российское кардиологическое общество
Клинические рекомендации
Артериальная гипертензия у взрослых
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: I10/ I11/ I12/ I13/ I15
Возрастная группа: взрослые
Год утверждения: 2020
Определение заболевания или состояния (группы заболеваний, состояний)
Артериальная гипертензия (АГ) — синдром повышения систолического АД (далее — САД) ≥140 мм рт. ст. и/или диастолического АД (далее — ДАД) ≥90 мм рт. ст.
Гипертоническая болезнь (далее — ГБ) — хронически протекающее заболевание, основным проявлением которого является повышение АД, не связанное с выявлением явных причин, приводящих к развитию вторичных форм АГ (симптоматические АГ). Термин «гипертоническая болезнь», предложенный Г. Ф. Лангом в 1948 г., соответствует терминам «эссенциальная гипертензия» и «артериальная гипертензия», используемым за рубежом. ГБ преобладает среди всех форм АГ, ее распространенность превышает 90%.
Вторичная (симптоматическая) АГ — АГ, обусловленная известной причиной, которую можно устранить с помощью соответствующего вмешательства.
Гипертонический криз — cостояние, вызванное значительным повышением АД, ассоциирующееся с острым поражением органов-мишеней, нередко жизнеугрожающим, требующее немедленных квалифицированных действий, направленных на снижение АД, обычно с помощью внутривенной терапии
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Болезни, характеризующиеся повышенным кровяным давлением (I10, I11, I12, I13, I15):
I10 — Эссенциальная [первичная] гипертензия:
Высокое кровяное давление;
Гипертензия (артериальная) (доброкачественная) (эссенциальная) (злокачественная) (первичная) (системная).
I11 — Гипертензивная болезнь сердца [гипертоническая болезнь сердца с преимущественным поражением сердца];
I11.0 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца с (застойной) сердечной недостаточностью:
Гипертензивная [гипертоническая] сердечная недостаточность.
I11.9 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца без (застойной) сердечной недостаточности:
Гипертензивная болезнь сердца без дополнительных уточнений (БДУ).
I12 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек:
Артериосклероз почек
Артериосклеротический нефрит (хронический) (интерстициальный);
Гипертензивная нефропатия;
Нефросклероз.
I12.0 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек с почечной недостаточностью:
Гипертоническая почечная недостаточность.
I12.9 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек без почечной недостаточности:
Почечная форма гипертонической болезни БДУ.
I13 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек.
I13.0 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек с (застойной) сердечной недостаточностью.
I13.1 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек с почечной недостаточностью.
I13.2 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек с (застойной) сердечной недостаточностью и почечной недостаточностью.
I13.9 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек неуточненная.
I15 — Вторичная гипертензия.
I15.0 — Реноваскулярная гипертензия.
I15.1 — Гипертензия вторичная по отношению к другим поражениям почек.
I15.2 — Гипертензия вторичная по отношению к эндокринным нарушениям.
I15.8 — Другая вторичная гипертензия.
I15.9 — Вторичная гипертензия неуточненная.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация заболевания или состояния (группы заболеваний, состояний)
АГ классифицируют по степени, которая определяется уровнем АД у нелеченных пациентов; стадии, которая определяется наличием сахарного диабета (СД), поражения органов-мишеней (ПОМ) и ассоциированных клинических состояний (АКС); категории риска развития сердечно-сосудистых осложнений, которая учитывает уровень АД, сопутствующие факторы риска (ФР), наличие СД, ПОМ, АКС.
Классификация уровней АД у лиц старше 18 лет представлена в таблице П2, Приложение Г1. Категорию АД определяют по результатам его трехкратного измерения в положении пациента сидя. Используют средние значения САД и ДАД, определенных при двух последних измерениях. Изолированная систолическая гипертензия классифицируется на степени 1, 2 или 3 в зависимости от значения САД. Если значения САД и ДАД попадают в разные категории, то степень АГ оценивается по более высокой категории.
Выделение 3 стадий АГ (Таблица П1, Приложение Г3) основано на наличии поражения органов-мишеней (ПОМ), ассоциированных клинических состояний, сахарного диабета и хронической болезни почек. Стадия АГ не зависит от уровня АД.
Выделяются 3 стадии гипертонической болезни.
Стадия I — отсутствие ПОМ и АКС, возможное наличие факторов риска
Факторы СС риска у пациентов с АГ:
— Пол (мужчины > женщин);
— Возраст ≥55 лет у мужчин, ≥65 лет у женщин;
— Курение (в настоящем или прошлом; курение в прошлом следует рассматривать как фактор риска при отказе от курения в течение последнего года);
— Дислипидемия (принимается во внимание каждый из представленных показателей липидного обмена): ОХС >4,9 ммоль/л и/или ХС ЛПНП >3,0 ммоль/л и/или ХС ЛПВП у мужчин — <1,0 ммоль/л (40 мг/дл), у женщин — <1,2 ммоль/л (46 мг/дл) и/или триглицериды >1,7 ммоль/л;
— Мочевая кислота (≥360 мкмоль/л у женщин, ≥420 мкмоль/л у мужчин);
— Нарушение гликемии натощак: глюкоза плазмы натощак 5,6–6,9 ммоль/л;
— Нарушение толерантности к глюкозе;
— Избыточная масса тела (ИМТ 25-29,9 кг/м2) или ожирение (ИМТ ≥ 30 кг/м2);
— Семейный анамнез развития ССЗ в молодом возрасте (< 55 лет для мужчин и <65 лет для женщин);
— Развитие АГ в молодом возрасте у родителей или в семье;
— Ранняя менопауза;
— Малоподвижный образ жизни;
— Психологические и социально-экономические факторы;
— Частота сердечных сокращений в покое >80 ударов в минуту.
Стадия II подразумевает наличие бессимптомного поражения органов-мишеней, связанного с АГ и/или ХБП С3 (СКФ 30–59 мл/мин), и/или СД без поражения органов-мишеней и предполагает отсутствие АКС.
• Артериальная жесткость:
Пульсовое давление (ПД) (у пожилых пациентов) ≥60 мм рт. ст.
Каротидно-феморальная СПВ >10 м/с
• Электрокардиографические (ЭКГ) признаки ГЛЖ на (индекс Соколова–Лайона > 35 мм, или амплитуда зубца R в отведении aVL ≥11 мм, корнельское произведение >2440 мм x мс или корнельский вольтажный индекс >28 мм для мужчин и >20 мм для женщин);
• Эхокардиографические признаки ГЛЖ (индекс массы ЛЖ (масса ЛЖ, г/рост, м) формула ASE для пациентов с избыточной массой тела и ожирением: для мужчин >50 г/м2,7, для женщин >47 г/м2,7; индексация на площадь поверхности тела (масса ЛЖ/рост, м2) для пациентов с нормальной массой тела: >115 г/м2(мужчины) и > 95 г/м2 (женщины);
• Альбуминурия 30–300 мг/24 ч или отношения альбумин-креатинин 30–300 мг/г или 3,4-34 мг/ммоль (предпочтительно в утренней порции мочи);
• ХБП С3 стадии с СКФ >30–59 мл/мин/1,73 м2;
• Лодыжечно-плечевой индекс <0,9;
• Выраженная ретинопатия: наличие кровоизлияний, экссудатов или отека соска зрительного нерва.
Стадия III определяется наличием АКС, в том числе ХБП С4–С5 стадии, и/или СД с поражением органов-мишеней.
СД (рассматривается как дополнительное состояние, усугубляющее риск) [31]: глюкоза плазмы натощак ≥7,0 ммоль/л при двух последовательных измерениях и/или HbA1c ≥6,5%, и/или глюкоза плазмы после нагрузки или при случайном определении ≥11,1 ммоль/л.
Стадии АГ имеют уточняющий характер по поражениям органов-мишеней и сопутствующей патологии.
На основании уровня АД, наличия ФР, ПОМ, АКС, СД выделяют 4 категории риска СС осложнений: низкий (риск 1), умеренный (риск 2), высокий (риск 3) и очень высокий (риск 4) (Приложение Г2, таблица П12). Наиболее значимым является определение категории риска у пациентов с гипертонической болезнью I и II стадий.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний, состояний)
Предрасполагающие факторы Этиология АГ остается не до конца выясненной, но выявлен ряд факторов, тесно и независимо связанных с повышением АД:
• возраст — увеличение возраста ассоциировано с повышением частоты АГ и уровня АД (прежде всего систолического) [10];
• избыточная масса тела и ожирение способствуют повышению АД;
• наследственная предрасположенность — повышение АД встречается приблизительно в 2 раза чаще среди лиц, у которых один или оба родителя имели АГ. Эпидемиологические исследования показали, что около 30% вариаций АД в различных популяциях обусловлены генетическими факторами [11].
• избыточное потребление натрия (>5 г/день) [12];
• злоупотребление алкоголем;
• гиподинамия.
Стойкое и длительное повышение АД обусловлено изменением соотношения трех гемодинамических показателей:
• повышением общего периферического сосудистого сопротивления (ОПСС);
• увеличением сердечного выброса (минутного объема);
• увеличением объема циркулирующей крови (ОЦК).
Наиболее важными патогенетическими звеньями формирования и прогрессирования эссенциальной АГ (ГБ) являются [13-16]:
• активация симпатоадреналовой системы (САС) (реализуется преимущественно через альфа- и бета-адренорецепторы);
• активация ренин-ангиотензин-альдостероновой системы (РААС); в т.ч. повышение продукции минералокортикоидов (альдостерона и др.), инициируемое, в частности, гиперактивацией почечной РААС;
• нарушение мембранного транспорта катионов (Nа+, Са2+, К+);
• увеличение реабсорбции натрия в почках;
• дисфункция эндотелия с преобладанием продукции вазоконстрикторных субстанций (тканевого ангиотензина-II, эндотелина) и снижением выработки депрессорных соединений (брадикинина, NО, простациклина и др.);
• структурные изменения сосудистой стенки артерий мышечного (резистивного) и эластического типа, в том числе вследствие низкоинтенсивного неинфекционного воспаления;
• нарушение микроциркуляции (снижение плотности капилляров);
• нарушение барорецепторного звена системы центральной регуляции уровня АД;
• повышение жесткости крупных сосудов.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний, состояний)
Распространенность АГ среди взрослого населения составляет 30–45% [17]. Распространенность АГ не зависит от уровня дохода и одинакова в странах с низким, средним и высоким уровнями дохода [17]. В российской популяции среди мужчин в возрасте 25–65 лет распространенность АГ несколько выше (в некоторых регионах она достигает 47%), тогда как среди женщин распространенность АГ — около 40% [18]. Распространенность АГ увеличивается с возрастом, достигая 60% и выше у лиц старше 60 лет [17]. Поскольку наблюдаемое увеличение продолжительности жизни сопровождается постарением населения и, соответственно, увеличением количества малоподвижных пациентов с избыточной массой тела, прогнозируется, что распространенность АГ будет расти во всем мире. Согласно прогнозу, к 2025 году число пациентов АГ увеличится на 15–20% и достигнет почти 1,5 миллиардов [19].
АГ является ведущим фактором риска развития сердечно-сосудистых (СС) (инфаркт миокарда, инсульт, ишемическая болезнь сердца (ИБС), хроническая сердечная недостаточность), цереброваскулярных (ишемический или геморрагический инсульт, транзиторная ишемическая атака) и почечных (хроническая болезнь почек (ХБП)) заболеваний [20–22].
Взаимосвязь артериального давления с риском развития сердечно-сосудистых, цереброваскулярных и почечных осложнений
Повышенное АД является основным фактором развития преждевременной смерти и причиной почти 10 миллионов смертей и более чем 200 миллионов случаев инвалидности в мире [20–22]. Уровень САД ≥140 мм рт. ст. ассоциируется с повышением риска смертности и инвалидности в 70% случаев, при этом наибольшее число смертей в течение года, связанных с уровнем САД, возникают вследствие ИБС, ишемических и геморрагических инсультов [21].Между уровнем АД и риском сердечно-сосудистых заболеваний (ССЗ) существует прямая связь. Эта связь начинается с относительно низких значений — 110–115 мм рт. ст. для САД и 70–75 мм рт. ст. для ДАД [22].
Повышенные уровни АД, измеренные в медицинском учреждении или вне его, имеют прямую и независимую связь с частотой развития большинства СС событий (геморрагического инсульта, ишемического инсульта, инфаркта миокарда, внезапной смерти, сердечной недостаточности и заболеваний периферических артерий), а также терминальной почечной недостаточности [23]. Все больше данных свидетельствуют о тесной связи АГ с увеличением частоты развития фибрилляции предсердий [24], а также когнитивной дисфункции и деменции. Повышение АД в среднем возрасте ассоциируется с развитием когнитивных нарушений и деменции в пожилом возрасте, а интенсивная терапия артериальной гипертензии с достижением целевых цифр АД уменьшает риски развития умеренных когнитивных нарушений и возможной деменции [25, 26].
Прямая связь между повышенным уровнем АД и риском СС событий продемонстрирована для всех возрастных [27] и этнических групп [28]. У пациентов старше 50 лет САД является более сильным предиктором событий, чем ДАД [27, 29]. Высокое ДАД ассоциируется с увеличением риска СС событий и чаще является повышенным у более молодых (<50 лет) пациентов. ДАД имеет тенденцию к понижению во второй половине жизни вследствие увеличения артериальной жесткости, тогда как САД, как фактор риска, приобретает в этот период еще большее значение [29]. У пациентов среднего возраста и пожилых повышение пульсового давления (ПД) (которое представляет собой разницу между САД и ДАД) оказывает дополнительное негативное влияние на прогноз [20, 30].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний, состояний)
В большинстве случаев АД повышается бессимптомно, и АГ обнаруживают лишь в ходе объективного исследования пациента. В тех случаях, когда жалобы есть, они неспецифичны (головная боль, головокружение, сердцебиение и т.д.). При симптоматической гипертонии жалобы обусловлены основным заболеванием:
Синдром обструктивного апноэ во сне: храп, головная боль по утрам, сонливость в дневное время, нарушение памяти, внимания, неполноценный ночной сон;
Первичный гиперальдостеронизм: мышечная слабость, полиурия, полидипсия, запоры;
Феохромоцитома: пароксизмальная АГ, головная боль, профузная потливость, сердцебиение, лабильное повышение АД, ортостатическая гипотония;
Синдром Иценко–Кушинга: лунообразное лицо, плетора, жировой горбик, гирсутизм, центральное ожирение, атрофия кожи, багровые стрии, синяки, нарушения углеводного обмена;
Заболевания щитовидной железы: симптомы тиреотоксикоза или гипотиреоза;
Коарктация аорты: головная боль, холодные конечности, боль в ногах при физических нагрузках, носовые кровотечения.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
Диагноз АГ на основании СМАД устанавливается в соответствии с пороговыми значениями, указанными в таблице П9, Приложение Г2 [32]. Мониторинг АД в домашних условиях рекомендуется при недоступности метода СМАД или из-за предпочтений пациента. При этом диагноз АГ устанавливается в соответствии с пороговыми значениями, указанными в таблице П9, Приложение Г2 [32].
В случае если диагноз важен для экспертизы трудоспособности или определения годности к военной службе, а также годности к профессиональной деятельности, необходима объективизация с помощью постановки СМАД.
Диагностика АГ включает следующие этапы:
• выяснение жалоб и сбор анамнеза;
• повторные измерения АД;
• объективное обследование;
• лабораторно-инструментальные методы исследования: рутинные на первом этапе и сложные — на втором этапе обследования (по показаниям);
• исключение вторичных (симптоматических) АГ при необходимости;
• оценка общего сердечно-сосудистого риска.
• Всем пациентам при измерении уровня АД в медицинском учреждении рекомендуется классифицировать его на оптимальное, нормальное, высокое нормальное артериальное давление или артериальную гипертензию 1–3-й степени [21, 22].
ЕОК/ЕОАГ нет (УУР С, УУД 5)
Комментарий. Повышение АД, измеренного в медицинском учреждении выше 140 и/или 90 мм рт. ст. (таблица П2, Приложение Г1) на двух разных визитах, за исключением тяжелой АГ (АГ 3-й степени, особенно у пациентов высокого риска) и/или повышения АД при измерении вне медицинского учреждения (по данным СМАД и/или ДМАД) при условии экономической и логистической целесообразности [32–37] (таблица П7, Приложение Г2).
У всех пациентов с впервые диагностированным гипертоническим кризом, необходимо выявить причину повышения АД, в т.ч. симптоматическую АГ.
У всех пациентов при выявлении повышения АД в медицинском учреждении необходимо два измерения АД на двух разных визитах для постановки диагноза АГ (таблица П2, Приложение Г1) [21;32].
На каждом визите должно быть проведено не менее двух измерений АД с интервалом в 1-2 мин и еще одно дополнительное измерение при разнице между первыми двумя более 10 мм рт. ст. Уровень АД — это среднее из последних двух измерений.
- Проведение методов измерения АД вне медицинского учреждения (СМАД и ДМАД) рекомендуется в отдельных клинических ситуациях: при выявлении гипертонии белого халата и маскированной АГ с целью оценки эффективности лечения и выявлении возможных побочных эффектов [21, 32, 38].
ЕОК/ЕОАГ IA (УУР C, УДД 5)
- Рекомендуется при установлении диагноза учитывать возможность вторичной (симптоматической) формы АГ и проводить диагностические мероприятия, направленные на ее исключение при наличии следующих признаков [39, 138, 220] (таблица П3, Приложение Г2):
o АГ 2-й степени у пациентов моложе 40 лет или любое повышение АД у детей
o Внезапное острое развитие АГ у пациентов с ранее документированной стойкой нормотонией
o Резистентная АГ
o АГ 3-й степени или гипертонический криз
o Признаки значительных изменений в органах-мишенях
o Клинические или лабораторные признаки, позволяющие подозревать эндокринные причины АГ или ХБП
o Клинические симптомы СОАС
o Симптомы, позволяющие заподозрить феохромоцитому, или семейный анамнез данной опухоли
ЕОК/ЕОАГ нет (УУР A, УДД 1)
Комментарии. Вторичные АГ выявляются у 5–10% пациентов с АГ [39]. Для диагностики вторичных форм АГ важно детальное обследование пациента, начиная с рутинных методов: опроса, осмотра, лабораторной диагностики, до выполнения сложных инструментальных методов (Таблица П3, Приложение Г2).
Принципы формулировки диагноза при АГ
• Необходимо указать стадию гипертонической болезни (Таблица П1, Приложение Г3).
• Степень повышения АД (степень АГ (Таблица 2, Приложение Г1) обязательно указывается у пациентов с впервые диагностированной АГ. Если пациент принимает антигипертензивную терапию, то в диагнозе указывается наличие контроля АД (контролируемая/неконтролируемая АГ).
• При формулировании диагноза максимально полно должны быть отражены ФР, ПОМ, ССЗ, ХБП и категория сердечно-сосудистого риска (таблицы П1 и П2, Приложение Г3).
• Указание целевого уровня АД для данного пациента
Примеры формулировки диагноза:
1. ГБ I стадии. Степень АГ 1. Гиперлипидемия. Риск 2 (средний). Целевое АД <130/<80 мм рт. ст.
2. ГБ II стадии. Неконтролируемая АГ. Нарушенная гликемия натощак. Гиперлипидемия. ГЛЖ. Риск 3 (высокий) Целевое АД <130/<80 мм рт. ст.
3. ГБ II стадии. Неконтролируемая АГ. Гиперлипидемия. Ожирение II степени. Нарушение толерантности к глюкозе. ГЛЖ. Альбуминурия высокой степени. Риск 4 (очень высокий). Целевое АД 130-139/<80 мм рт. ст.
4. ИБС. Стенокардия напряжения III ФК. Постинфарктный кардиосклероз (2010г). ГБ III стадии. Неконтролируемая АГ. Риск 4 (очень высокий). Целевое АД <130/<80 мм рт. ст.
5. ГБ III стадии. Контролируемая АГ. Ожирение I степени. Сахарный диабет 2-го типа, целевой уровень гликированного гемоглобина ≤7,5%. ХБП С4 стадии, альбуминурия А2. Риск 4 (очень высокий). Целевое АД 130–139/< мм рт. ст.
Принципы измерения АД
- Скрининг АГ путем измерения АД в медицинском учреждении и регистрация полученных цифр АД в медицинской документации рекомендован всем пациентам с 18 лет [33, 40] (Таблица П1, Приложение Г2).
ЕОК/ЕОАГ IВ (УУР А, УДД 1)
- Для определения степени и стабильности повышения уровня АД рекомендовано проводить измерения АД в медицинском учреждении (таблица П2, Приложение Г1) у всех пациентов с повышением АД [33, 40, 42].
EОК/ЕОАГ IВ (УУР А, УДД 1)
Комментарии. Клиническое измерение АД имеет наибольшую доказательную базу для диагностики АГ и оценки эффективности антигипертензивной терапии (АГТ). Точность измерения АД и, соответственно, диагностика АГ, определение ее степени тяжести зависят от соблюдения правил по измерению АД (Таблица П1, Приложение Г1).
- Рекомендуется проводить измерения АД в медицинском учреждении на обеих руках, по крайней мере, во время первого визита пациента для выявления возможного поражения артерий (в первую очередь атеросклеротического), ассоциированного с более высоким СС риском [41].
EОК/ЕОАГ IА (УУР А, УДД 2)
Комментарии. При разнице показателей АД на правой и левой руке более 15 мм рт. ст. вероятно атеросклеротическое поражение сосудов. При выявленной разнице показателей между правой и левой руками в дальнейшем рекомендуется проводить измерения на руке с более высоким АД.
- Определение АД, измеренного вне медицинского учреждения (СМАД или ДМАД) для постановки диагноза или контроля эффективности АГТ рекомендуется в ряде клинических ситуаций, указанных в таблице П7, Приложение Г2 [40, 42–46].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
Комментарии. Преимущества и недостатки каждого метода измерения АД суммированы в таблице П8, Приложение Г2. Диагностические критерии АГ по данным СМАД приведены в таблице П9, Приложение Г2. Результаты СМАД и ДМАД могут помочь в диагностике АГ, но не заменяют повторные измерения АД в лечебном учреждении. Следует обратить внимание, что критерии диагностики АГ по результатам клинического измерения АД, СМАД и ДМАД (таблица П2, приложение Г1 и таблица П9 приложение Г2).
Оценка сердечно-сосудистого риска
- Базовый скрининг на наличие ПОМ рекомендовано проводить у всех пациентов с АГ. Расширенное обследование рекомендовано в том случае, когда выявление ПОМ повлияет на выбор терапевтической тактики [21, 22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Для выявления поражения сердца всем пациентам целесообразно проводить регистрацию электрокардиограммы (ЭКГ) с расчетом индексов гипертрофии ЛЖ, в случае расширенного обследования — ЭхоКГ с определением индекса массы миокарда левого желудочка. Для выявления поражения почек у всех оценивают протеинурию/альбуминурию, концентрационную функцию и мочевой осадок; при расширенном обследовании выполняется УЗИ почек и допплерография почечных артерий. Для выявления поражения сосудов рекомендовано выполнение фундоскопии, расчет пульсового давления (ПД) у пожилых, оценка лодыжочно-плечевого индекса (ЛПИ), скорость пульсовой волны (СПВ) и обследования для выявления атеросклеротических бляшек в брахиоцефальных, почечных и подвздошно-бедренных сосудах при расширенном обследовании (таблицы П4 и П5, приложение Г2).
- Всем пациентам с АГ рекомендуется оценка общего сердечно-сосудистого риска (ССР) — выявление ФР, ПОМ и АКС, СД, ХБП, которые влияют на прогноз (таблица П10, Приложение Г2). Для оценки степени риска развития ССО рекомендуется обследование с целью оценки состояния органов-мишеней в соответствии с действующими клиническими рекомендациями [47].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Величина АД является важнейшим, но не единственным фактором, определяющим тяжесть АГ, прогноз пациента и тактику лечения. Большое значение имеет оценка общего ССР, степень которого зависит от величины АД, наличия или отсутствия сопутствующих ФР, субклинического поражения органов-мишеней и наличия АКС и СД. Повышенный уровень АД, наличие ФР и ПОМ взаимно усиливают влияние друг на друга, что приводит к увеличению степени ССР, превышающего сумму отдельных его компонентов. Комплексный подход к оценке сердечно-сосудистого риска приведен в таблице П10 приложения Г2.
Оценка риска по шкале SCORE (Таблица П11, Приложение Г2) является одним из вариантов алгоритма оценки суммарного сердечно-сосудистого риска у пациентов с ГБ I–II стадии, т.е. не имеющих установленных ССЗ, ХБП и СД.
Пациенты с ГБ III стадии, имеющие документированное ССЗ атеросклеротического генеза (под атеросклеротическим ССЗ подразумевают ишемическую болезнь сердца, ишемический инсульт или транзиторное нарушение мозгового кровообращения, ишемию нижних конечностей), включая бессимптомный атеросклероз при визуализации, СД 1-го или 2-го типа, очень высокие значения по отдельным факторам риска (в том числе АГ 3-й степени) или ХБП 3–5-й стадий по умолчанию относятся к категории высокого или очень высокого риска по глобальной шкале 10-летнего риска сердечно-сосудистых осложнений (Таблица П12, Приложение Г2). Внутри категории очень высокого риска введена категория экстремального риска. К экстремальному риску следует относить:
сочетание клинически значимого сердечно-сосудистого заболевания, вызванного атеросклерозом, с СД 2 типа и/или СГХС;
сердечно-сосудистое осложнение у пациента с атеросклеротически сердечно-сосудистым заболеванием, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ХС ЛНП ≤1,5 ммоль/л;
2 и более сердечно-сосудистых осложнения в течение 2 лет.
Акцент на значимость выявления поражения ФР и органов-мишеней для корректной оценки сердечно-сосудистого риска — одна из ключевых особенностей современных рекомендаций. Бессимптомное ПОМ может существенно увеличивать риск у пациентов с АГ. Наибольшая польза от детальной оценки ПОМ может наблюдаться у пациентов среднего возраста, у молодых пациентов с АГ 1-й степени, пациентов с высоким нормальным АД. Необходимо подчеркнуть важность оценки функции почек по показателям скорости клубочковой фильтрации (СКФ), альбуминурии и количественной оценки гипертрофии левого желудочка (ГЛЖ). Основная цель выявления ПОМ — правильное определение категории риска [48]. Первостепенное значение оценка ПОМ имеет у больных с низким и умеренным риском, меньшее значение — при высоком и очень высоком риске. Характер органного поражения не играет решающей роли в выборе режима антигипертензивной терапии, но регресс ПОМ — суррогатный маркер среднесрочной эффективности АГТ [49].
Для выявления ПОМ целесообразно использовать дополнительные методы исследования (таблица П5, приложение Г2): сердца (ЭхоКГ с определением индекса массы миокарда левого желудочка), почек (количественное определение альбуминурии/протеинурии, определение скорости клубочковой фильтрации), сосудов (наличие атеросклеротических бляшек в брахиоцефальных, почечных и подвздошно-бедренных сосудах, определение лодыжечно-плечевого индекса (ЛПИ), каротидно-феморальной скорости пульсовой волны (СПВ).
Наличие ПОМ способствует дальнейшему прогрессированию ССЗ, что существенно увеличивает риск смерти у таких пациентов по сравнению с пациентами, у которых имеются только ФР (Таблица П2, Приложение Г3). Риск возрастает с увеличением числа органных поражений, ассоциированных с АГ. Уровень СС риска у ряда пациентов может быть выше, чем он определен по стандартной системе стратификации (Таблица П1, Приложение Г3):
— при малоподвижном образе жизни у пациентов с центральным ожирением (увеличение относительного риска, ассоциированного с ожирением, более выражено у молодых, чем у пожилых пациентов);
— у лиц с низким социальным статусом;
— у пациентов с повышенным уровнем аполипопротеина В, липопротеина (а) и уровня С-реактивного белка, определенного высокочувствительным методом.
Как в общей популяции, так и у пациентов АГ необходимо учитывать факторы, повышающие СС риск (таблица П13, Приложение Г2). Такие модифицирующие факторы приобретают особое значение у пациентов, относящихся к категории умеренного риска. Наличие модифицирующих факторов может привести к изменению категории риска на более высокую и, соответственно, повлиять на решение о старте и выборе терапии.
- Пациентам с АГ, которые не соответствуют категориям высокого или очень высокого риска при оценке по глобальной шкале 10-летнего СС риска (Таблица П12, Приложение Г2), рекомендуется проводить оценку СС риска по шкале SCORE (Приложение Г) [49, 50].
ЕОК/ЕОАГ IВ (УУР С, УДД 4)
Комментарии. Пациенты с АГ с диагностированным ССЗ, включая бессимптомные атеросклеротические бляшки со стенозом ≥50%, выявленные при визуализации, сахарным диабетом 1-го и 2-го типа, значимо повышенным единственным фактором риска (в том числе — с АГ 3-й степени) или хронической болезнью почек (ХБП, стадии 3–5) автоматически относятся к категориям очень высокого (риск СС смертности ≥10%) или высокого (СС смертность 5–10%) 10-летнего СС риска.
Жалобы и анамнез
Многие пациенты с повышенным АД могут не иметь никаких жалоб. Симптомы (головные боли, одышка, боль в груди, кровотечение из носа, субъективное головокружение, отеки, расстройство зрения, ощущение жара, потливость, приливы), встречающиеся при АГ неспецифичны и могут наблюдаться при других заболеваниях.
При наличии перечисленных симптомов у любого пациента необходимо в процессе его обследования учитывать возможность диагностированной АГ.
- Рекомендуется собирать полный медицинский и семейный анамнез для оценки семейной предрасположенности к АГ и ССЗ [51, 52].
ЕОК/ЕОАГ нет (УУР С, УДД 4)
Комментарии. Сбор анамнеза включает сбор сведений о наличии ФР, субклинических симптомов ПОМ, наличии в анамнезе ССЗ, ЦВБ, ХБП и вторичных форм АГ, образе жизни, предшествующем опыте лечения АГ (таблица П3, Приложение Г1).
Физикальное обследование
- Всем пациентам с АГ рекомендуется определение антропометрических данных для выявления избыточной массы тела/ожирения, оценка неврологического статуса и когнитивной функции, исследование глазного дна для выявления гипертонической ретинопатии, пальпация и аускультация сердца и сонных артерий, пальпация и аускультация периферических артерий для выявления патологических шумов, сравнение АД между руками хотя бы однократно [21].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Объективное исследование пациента с АГ направлено на выявление ФР, признаков вторичных форм АГ и ПОМ. В таблице П3, Приложение Г2 суммированы основные положения и требования к клиническому обследованию пациента.
- Всем пациентам с АГ рекомендуется пальпировать пульс в покое для измерения его частоты и ритмичности с целью выявления аритмий [21; 32; 43].
ЕОК/ЕОАГ IС (УУР В, УДД 2)
Лабораторная диагностика
Для установления диагноза АГ лабораторная диагностика не требуется, однако, она необходима с целью исключения вторичных форм АГ, выявления ПОМ, оценки СС риска, и сопутствующей патологии, влияющей на эффективность лечения и качество жизни пациента.
- Всем пациентам с АГ с целью исключения вторичной гипертензии рекомендуется проведение общего (клинического) анализа крови (гемоглобин/гематокрит, лейкоциты, тромбоциты) [21, 22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
- Для выявления предиабета, СД и оценки сердечно-сосудистого риска всем пациентам с АГ рекомендуется исследование уровня глюкозы в венозной крови [53,54,55,56,57, 302].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. При значениях глюкозы ≥ 6,1 ммоль/Л следует повторно определить ее уровень во всех случаях, кроме несомненной гипергликемии с острой метаболической декомпенсацией или очевидными симптомами. В качестве теста, подтверждающего гипергликемию, может быть определение гликированного гемоглобина (НвА1с). Диагноз СД устанавливают на основании двух цифр, находящихся в диабетическом диапазоне: дважды определенный HbA1c или однократное определение HbA1c и однократное определение уровня глюкозы крови. Значения перечисленных параметров оценки гликемии выше нормальных, но ниже диабетических, указывают на наличие предиабета. Пероральный глюкозотолерантный тест (ПГТТ) проводится в сомнительных случаях для уточнения диагноза СД, а также для выявления предиабета. Гликированный гемоглобин (НвА1с) может быть использован для диагностики СД и предиабета, если метод его определения сертифицирован в соответствии с National Glycohemoglobin Standartization Program (NGSP), или International Federation of Clinical Chemists (IFCC) и стандартизованного в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial (DCCT). При наличии СД рекомендуется стратификация пациента в категорию высокого или очень высокого сердечно-сосудистого риска.
- Всем пациентам с АГ для выявления нарушения функции почки оценки сердечно-сосудистого риска рекомендуются исследование уровня креатинина в сыворотке крови и расчет скорости клубочковой фильтрации (СКФ) в мл/мин/1,73м2 по формуле Chronic Kidney Disease Epidemiology (CKD-EPI) [58] в специальных калькуляторах (Таблица П3, Приложение Г3) [21, 22, 58].
ЕОК/ЕОАГ IВ (УУР B, УДД 2)
Комментарии. Выполняется у всех пациентов с АГ для выявления ХБП в связи с тем, что снижение СКФ <60 мл/мин/1,73м2 является значимым прогностическим фактором при АГ [60] и в связи с наличием доказанной связи между даже незначительным снижением СКФ и повышением сердечно-сосудистой смертности [61, 62]. Формула CKD-EPI включает те же 4 переменные, что и формула MDRD. Формула CKD-EPI дает меньше погрешностей, чем формула MDRD, особенно при СКФ≥60 мл/мин/1,73 м2, и характеризуется несколько меньшим разбросом данных и бόльшей точностью. Значительная часть (но не все) исследований в Северной Америке, Европе показали, что формула CKD-EPI дает более точные результаты, чем формула MDRD, особенно при высокой СКФ [63]. Меньшая погрешность формулы CKD-EPIпо сравнению с формулой MDRD отражает более высокую рСКФ в большей части возрастного диапазона и значений креатинина, особенно у лиц молодого возраста, женщин и представителей европеоидной расы [64].
- Всем пациентам с АГ для выявления заболеваний почек и оценки СС риска рекомендуется проводить общий (клинический) анализ мочи с микроскопическим исследованием осадка мочи, количественной оценкой альбуминурии или отношения альбумин/креатинин (оптимально) [64, 65].
ЕОК/ЕОАГ IВ (УУР В, УДД 2)
Комментарии. Выполняется у всех пациентов с АГ в связи с тем, что повреждение почек является значимым прогностическим фактором при АГ, наличием доказанной связи между выявлением альбуминурии и повышением середечно-сосудистой смертности [60, 61, 64, 66]. Суточная экскреция альбумина с мочой ≥30 мг/сут ассоциирована с повышенным риском осложнений ХБП [64]. В мета-анализе Консорциума по прогнозу ХБП обнаружены ассоциации между СЭА ≥30 мг/сут при исследовании тест-полосками, с риском общей смертности и смертности от ССЗ, почечной недостаточности прогрессирования ХБП в общей популяции и в популяциях с повышенным риском развития ССЗ. Соотношение альбумин/креатинин в моче (предпочтительно в утренней порции) 30–300 мг/г; 3,4–34 мг/ммоль является маркером повреждения почек [64].
- Всем пациентам с АГ для стратификации риска и выявления нарушений липидного обмена рекомендуется исследование уровня общего холестерина (ОХС), холестерина липопротеинов высокой плотности (ХС-ЛВП), холестерина липопротеинов низкой плотности (ХС-ЛНП) (прямое измерение или расчетно) и триглицеридов (ТГ) в крови [21, 67, 68].
ЕОК/ЕОАГ нет (УУР В, УДД 2)
Комментарии. Выполняется у всех пациентов с АГ для стратификации риска [67, 68], а также в связи с высокой распространенностью дислипидемии в популяции пациентов с АГ и положительным эффектом коррекции дислипидемии на СС риск у пациентов с АГ [21, 22].
- Всем пациентам с АГ для выявления электролитных нарушений и дифференциального диагноза с вторичной АГ рекомендуется исследование уровня калия и натрия в крови [21, 22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Выполняется у всех пациентов с АГ для выявления электролитных нарушений в связи с доказанной взаимосвязью между уровнем калия и натрия сыворотки крови и уровнем АД [69, 70].
- Всем пациентам с АГ для выявления гиперурикемии рекомендуется исследование уровня мочевой кислоты в крови [71].
ЕОК/ЕОАГ нет (УУР А, УДД 2)
Комментарии. Выполняется у всех пациентов с АГ в связи с тем, что уровень мочевой кислоты является значимым прогностическим фактором при АГ, а также наличием доказанной связи между гиперурикемией и повышением сердечно-сосудистой смертности [71-73].
Инструментальная диагностика
Проведение инструментальных методов диагностики является необходимым для исключения вторичных форм АГ, выявления поражения органов-мишеней, оценки сердечно-сосудистого риска, и сопутствующей патологии, влияющей на эффективность лечения и качество жизни пациента.
- Всем пациентам с АГ для выявления ГЛЖ и определения СС риска рекомендуется проведение 12-канальной ЭКГ [21, 22, 78, 297].
ЕОК/ЕОАГ IВ (УУР В, УДД 1)
Комментарии. Выполняется у всех пациентов с АГ для выявления гипертрофии левого желудочка (ГЛЖ) и определения сердечно-сосудистого риска [74–84]. ГЛЖ характеризуют индекс Соколова–Лайона (SV1+RV5-6 >35 мм); амплитуда зубца R в Корнельский показатель (RaVL+SV3) >20 мм для женщин, (RAVL+SV3) >28 мм для мужчин; Корнельское произведение (RAVL+SV5) мм х QRS мс> 2440 мм х мс [21, 22]. Несмотря на то, что ЭКГ является менее чувствительным методом диагностики ГЛЖ по сравнению с ЭхоКГ [80, 82, 84], она незаменима для документирования сердечного ритма, ЧСС и выявления аритмий.
- Пациентам с АГ при наличии изменений на ЭКГ или симптомов/признаков дисфункции левого желудочка рекомендуется проведение ЭхоКГ для выявления степени ГЛЖ [21, 22, 81].
ЕОК/ЕОАГ IВ (УУР B, УДД 2)
Комментарии. В таблице П6 (Приложение Г2) приведены эхокардиографические критерии для диагностики изменений левых отделов сердца [85].
- Пациентам с АГ в сочетании с ЦВБ или признаками атеросклеротического поражения сосудов других локализаций, при указании в анамнезе на преходящую слабость в конечностях с одной стороны или онемение половины тела, а также мужчинам старше 40 лет, женщинам старше 50 лет и пациентам с высоким общим сердечно-сосудистым риском (Таблица П12, Приложение Г2) рекомендуется дуплексное сканирование брахиоцефальных артерий для выявления атеросклеротических бляшек/стенозов внутренних сонных артерий [21, 298].
ЕОК/ЕОАГ IВ (УУР В, УДД 1)
Комментарии. О наличии бляшки говорит толщина комплекса интима-медиа (КИМ)>1,5 мм или локальное увеличение толщины на 0,5 мм или на 50%, по сравнению со значением КИМ в прилежащих участках сонной артерии [21].
- Рекомендуется определение ЛПИ в целях уточнения категории риска пациентам с симптомами значимого атеросклероза артерий нижних конечностей или пациентам умеренного риска, у которых положительные результаты данного исследованияприведут к изменению категории риска [86, 87].
ЕОК/ЕОАГ IIbВ (УУР B, УДД 2)
- Всем пациентам с нарушением функции почек, альбуминурией и при подозрении на вторичную АГ рекомендуется проведение УЗИ (ультразвукового исследования) почек и дуплексного сканирования артерий почек с целью оценки размеров, структуры, а также наличия врожденных аномалий почек или стеноза почечных артерий [60, 61, 64].
ЕОК/ЕОАГ IIaC (УУР В, УДД 1)
- Пациентам с АГ 2–3-й степеней, всем пациентам с сахарным диабетом и АГ рекомендуется проводить исследование глазного дна врачом-офтальмологом (геморрагии, экссудаты, отек соска зрительного нерва) для выявления гипертонической ретинопатии [21, 89].
ЕОК/ЕОАГ IС (УУР С, УДД 4)
Комментарии. Гипертоническая ретинопатия, выявленная с помощью фундоскопии (осмотра глазного дна), имеет высокую прогностическую значимость при АГ [88–90]. Обнаружение кровоизлияний в сетчатку, микроаневризм, твердых экссудатов, папиллоэдемы указывает на тяжелую гипертоническую ретинопатию и значимо коррелирует с плохим прогнозом. Изменения, характерные для ранних стадий ретинопатии, не имеют существенного прогностического значения и характеризуются низкой воспроизводимостью. Фундоскопия также показана, если диагноз важен для экспертизы трудоспособности или определения годности к военной службе.
- Пациентам с АГ при наличии неврологических симптомов и/или когнитивных нарушений рекомендуется выполнение КТ или МРТ головного мозга для исключения инфарктов мозга, микрокровоизлияний и повреждений белого вещества и других патологических образований [21, 91, 92].
ЕОК/ЕОАГ IIаВ (УУР А, УДД 1)
Комментарии. Гиперинтенсивные очаги в белом веществе головного мозга и бессимптомные инфаркты ассоциированы с прогрессированием когнитивной дисфункции и повышением риска инсульта в связи с дегенеративной и сосудистой деменцией.
Иные диагностические исследования
Иные диагностические исследования в рамках диагностики АГ не предусмотрены, возможно расширение диагностических исследований по решению врача в зависимости от клинической ситуации и состояния пациента.
- Когнитивные нарушения у пожилых пациентов частично ассоциированы с АГ, в связи с чем у пожилых пациентов с анамнезом, позволяющим предположить ранний когнитивный дефицит, рекомендована оценка когнитивной функции с использованием теста MMSE (MiniMentalStateExamination) [93, 94].
ЕОК/ЕОАГ нет (УУР A, УДД 1)
Лечение
Лечение, включая медикаментозную и немедикаментозную терапию, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Решение о тактике лечения рекомендуется принимать в зависимости от исходного уровня АД и общего сердечно-сосудистого риска. Показания к АГТ суммированы в таблице П1, Приложение Г4.
- Всем пациентам с АГ 1-й степени рекомендуется проводить мероприятия по изменению (оздоровлению) образа жизни с целью нормализации АД и коррекции факторов риска [21, 95, 96].
ЕОК/ЕОАГ IIаB (УУР B, УДД 1)
Комментарии. Подробный подход к изменению образа жизни с целью снижения СС риска представлен в разделе «Немедикаментозное лечение АГ».
Показания к антигипертензивной терапии
(Таблица П2, Приложение Г4)
- Пациентам с АГ 2-й или 3-й степени при любом уровне СС риска рекомендуется незамедлительное начало антигипертензивной лекарственной терапии для снижения риска развития сердечно-сосудистых осложнений, СС смерти одновременно с рекомендациями по изменению образа жизни [59, 110].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ 1-й степени, относящимся к категориям низкого/умеренного риска без признаков ПОМ (оценка риска по шкале SCORE (Таблица П11, Приложение Г2) рекомендуется начинать антигипертензивную лекарственную терапию в том случае, если у них сохраняется повышенное АД, несмотря на мероприятия по изменению образа жизни в течение 3 месяцев [21, 22, 97].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ 1-й степени, относящимся к категории высокого риска (оценка риска по шкале SCORE (Приложение Г3) при неосложненной АГ или при наличии ПОМ, рекомендуется незамедлительное начало антигипертензивной лекарственной терапии одновременно с рекомендациями по изменению образа жизни [21, 22, 97].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с высоким нормальным АД (130–139/85–89 мм рт. ст.) рекомендуется начало АГТ при очень высоком уровне СС риска вследствие наличия ССЗ (особенно ИБС) (Таблица П12, Приложение Г2) [21, 22, 99].
ЕОК/ЕОАГ IIbA (УУР А, УДД 1)
- Пожилым пациентам с АГ (даже в возрасте >80 лет), находящимся в удовлетворительном физическом состоянии, рекомендуется изменение образа жизни и АГТ при уровне САД ≥160 мм рт. ст. [21, 22, 100]. Пожилым пациентам (>65 лет, но не >80 лет), находящимся в удовлетворительном физическом состоянии (без синдрома старческой астении), если их САД соответствует показателям АГ 1-й степени (140–159 мм рт. ст.), рекомендуются изменение образа жизни и АГТ при хорошей переносимости [21, 22, 100, 101, 102, 235].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Рекомендуется рассмотреть возможность назначения АГТ пожилым пациентам с синдромом старческой астении при удовлетворительной переносимости [100, 101, 235].
ЕОК/ЕОАГ IIbB (УУР A, УДД 1)
- У пациентов старше 80 лет не рекомендуется отменять антигипертензивную лекарственную терапию, при условии, что эта терапия хорошо переносится, не сопровождается ортостатической гипотонией, развитием/усугублением гериатрических синдромов и снижением функционального статуса в связи с доказанными преимуществами в отношении СС смертности [21, 22, 101, 103, 104].
ЕОК/ЕОАГ IIIA (УУР А, УДД 1)
Целевые уровни артериального давления
- Всем пациентам с АГ, получающим лечение, независимо от возраста и степени риска, рекомендуется в качестве первого целевого уровня снижать АД до значений <140/90 мм рт. ст., а при условии хорошей переносимости — до целевого уровня 130/80 мм рт. ст. или ниже, в связи с доказанными преимуществами в плане снижения риска сердечно-сосудистых осложнений [59, 105, 107].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
- Пациентам моложе 65 лет и без ХБП, получающих антигипертензивную терапию, рекомендуется снижать САД до значений 120–130 мм рт. ст., в связи с доказанным влиянием вмешательства на СС риск [59, 103, 106, 107, 108].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
- Пациентам 65 лет и старше без старческой астении, получающим антигипертензивную терапию, вне зависимости от уровня СС риска и наличия ССЗ рекомендуется снижать САД до целевых значений 130–139 мм рт. ст., при условии хорошей переносимости. [59, 103, 107, 108].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
Комментарии. Всем пациентам в возрасте ≥65 лет, получающим антигипертензивную терапию, при каждом визите к врачу рекомендуется проводить оценку возможных нежелательных явлений.
- Всем пациентам с АГ вне зависимости от возраста, уровня риска и наличия сопутствующих заболеваний рекомендуется снижать ДАД до целевых значений 70–79 мм рт. ст. (таблица П3, Приложение Г4) [107, 109, 110].
ЕОК/ЕОАГ IIaB (УУР B, УДД 2)
Комментарии. Следует учитывать, что нижняя граница безопасности установлена в связи с результатами исследований, проведенных преимущественно в группах пациентов высокого и очень высокого риска (пожилые с коморбидностью, установленными ССЗ, в том числе — лица с ИБС, заболеванием периферических артерий. Таким образом, в общей популяции пациентов с АГ, верятно, нет необходимости в коррекции лечения при уровне САД <120 мм рт. ст. и ДАД <70 мм рт. ст. при его хорошей переносимости.
Немедикаментозное лечение АГ
Мероприятия по изменению образа жизни рекомендуются всем пациентам с АГ. Немедикаментозные методы лечения АГ способствуют снижению АД, уменьшают потребность в антигипертензивных препаратах (АГП) и повышают их эффективность, позволяют осуществлять коррекцию ФР, проводить первичную профилактику АГ у пациентов с высоким нормальным АД и имеющих ФР [114, 115].
- Всем пациентам с АГ для улучшения контроля заболевания рекомендуется ограничение употребления соли до <5 г в сутки [116–119].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
Комментарии. Избыточное потребление соли может играть существенную неблагоприятную роль в развитии рефрактерной АГ. Стандартное потребление соли во многих странах составляет от 9 до 12 г/сутки (80% потребляемой соли приходится на так называемую «скрытую соль»), уменьшение ее потребления до 5 г/сутки у пациентов АГ ведет к снижению САД на 4–5 мм рт. ст. Влияние ограничения натрия более выражено у пациентов пожилого и старческого возраста, у пациентов с СД, МС и ХБП.
- Всем пациентам с АГ для улучшения контроля заболевания рекомендуется ограничить употребления алкоголя (менее 14 единиц в неделю для мужчин, менее 8 единиц в неделю для женщин*) и избегать хронического злоупотребления алкоголем [21, 22, 120].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
Комментарии. Одной единицей употребления алкоголя следует считать 10 мл или 8 г чистого спирта, что соответствует 125 мл вина или 250 мл пива.
- Всем пациентам с АГ для улучшения метаболических показателей рекомендуется увеличить употребление овощей, свежих фруктов, рыбы, орехов и ненасыщенных жирных кислот (оливковое масло), молочных продуктов низкой жирности, уменьшить употребление мяса [121].
ЕОК/ЕОАГ IA (УУР А, УДД 1)
Комментарии. Необходимо увеличение потребления растительной пищи, содержания в рационе калия, кальция (в овощах, фруктах, зерновых) и магния (в молочных продуктах), а также уменьшение потребления жиров животного происхождения. Пациентам с АГ следует рекомендовать употребление рыбы не реже двух раз в неделю и 300–400 г в сутки свежих овощей и фруктов.
- Всем пациентам с АГ рекомендуется контролировать массу тела для предупреждения развития ожирения (индекс массы тела (ИМТ) ≥30 кг/м2 или окружность талии >102 см у мужчин и >88 см у женщин) и достижение ИМТ в пределах 20–25 кг/м2; окружности талии <94 см у мужчин и <80 см у женщин с целью снижения АД и уменьшения СС риска [122–124].
ЕОК/ЕОАГ IA (УУР А, УДД 1)
Комментарии. У лиц с ожирением уменьшение массы тела на 5–10% от исходной приводит к достоверному снижению риска развития ССО.
- Всем пациентам с АГ в связи с доказанным положительным эффектом на уровень СС смертности рекомендуются регулярные аэробные физические упражнения (не менее 30 минут динамических упражнений умеренной интенсивности 5–7 дней в неделю) [125, 126].
ЕОК/ЕОАГ IA (УУР А, УДД 2)
Комментарии. Пациентам с АГ следует рекомендовать умеренные аэробные нагрузки (ходьба, скандинавская ходьба, езда на велосипеде, плавание, фитнес). Влияние изометрической силовой нагрузки на уровень АД и СС риск до конца не ясно.
- Всем пациентам с АГ в связи с доказанным негативным эффектом курения на уровень смертности рекомендуются прекращение курения, психологическая поддержка и выполнение программ по прекращению курения [127–129].
ЕОК/ЕОАГ IB (УУР А, УДД 2)
Медикаментозная терапия АГ
Общие принципы медикаментозной терапии
Основой антигипертензивной терапии для снижения АД и уменьшения числа СС событий являются 5 классов антигипертензивных препаратов: ингибиторы АПФ (ИАПФ), блокаторы рецепторов ангиотензина-II (БРА), бета-адреноблокаторы (ББ), блокаторы кальциевых каналов (АК) и диуретики (тиазидные — гидрохлортиазид, и тиазидоподобные — хлорталидон и индапамид).
Противопоказания к назначению основных антигипертензивных препаратов суммированы в таблице П4, Приложение Г4.
- Всем пациентам с АГ (кроме пациентов низкого риска с АД<150/90 мм рт. ст., пациентов ≥80 лет, пациентов с синдромом старческой астении) в качестве стартовой терапии рекомендована комбинация антигипертензивных препаратов, предпочтительно фиксированная, для улучшения приверженности к терапии. Предпочтительные комбинации должны включать блокатор ренин-ангиотензиновой системы (РААС) (ингибитор АПФ или БРА) и дигидропиридиновый АК или диуретик (Приложение Б2) [130–134].
ЕОК/ЕОАГ IA (УУР А, УДД 1)
Комментарии. Многочисленными РКИ показано, что монотерапия эффективно снижает АД лишь у ограниченного числа пациентов АГ, большинству пациентов для контроля АД требуется комбинация как минимум из двух препаратов. Метаанализ более 40 исследований показал, что комбинация двух препаратов из любых двух классов антигипертензивных средств усиливает степень снижения АД намного сильнее, чем повышение дозы одного препарата. Еще одно преимущество комбинированной терапии — возможность физиологического и фармакологического синергизма между препаратами разных классов, что может не только лежать в основе более выраженного снижения АД и лучшей переносимости. Комбинированная терапия позволяет также подавить контррегуляторные механизмы повышения АД. Все преимущества комбинированной терапии присущи только рациональным комбинациям АГП. К ним относятся: ИАПФ + диуретик; БРА + диуретик; ИАПФ + АК; БРА + АК, дигидропиридиновый АК + ББ, АК + диуретик, ББ + диуретик. На практике могут быть использованы и другие комбинации пяти основных классов антигипертензивных средств при наличии индивидуальных показаний. При наличии клинической целесообразности, с учетом особенностей клинического течения заболевания, коморбидной патологии, переносимости лечения и профиля побочных эффектов, а также при наличии предпочтений пациента, связанных с его личным позитивным или негативным опытом, и, соответственно с учетом ожидаемой приверженности к лечению врач имеет право назначать любой антигипертензивный препарат, который зарегистрирован для лечения АГ в РФ, как в монотерапии, так и в комбинации. При этом отклонение от стандартных схем терапии требует соответствующего объяснения в истории болезни.
К запрещенным комбинациям относится комбинация двух блокаторов РААС.
Фиксированные комбинации повышают приверженность к лечению. Однако такие лекарственные формы не входят в формуляры многих учреждений и в списки жизненно важных лекарственных препаратов, что делает сложным их назначение пациентам в стационаре и льготным категориям пациентов, поэтому если у пациента достигнут целевой уровень АД в пределах установленных значений и наблюдается хорошая приверженность к лечению, то нет необходимости его перевода со свободной на фиксированные комбинации. Свободные комбинации могут быть использованы также по организационным соображениям, в частности с целью обеспечения доступности препаратов для пациента.
Шаги АГТ предполагают возможность или использования более высоких дозировок в комбинации, или сразу переход на 3-компонентную схему лечения. Оба подхода допустимы на этапе 2-компонентной схемы, но они должны обеспечить достижение целевого АД в течение 3 месяцев с шагом титрации дозы приблизительно 4 недели.
Следует подчеркнуть, что в реальной практике на 1 шаге терапии необходимо назначать препараты в оптимальных терапевтических дозах, которые могут обеспечить достижение целевого АД в указанные сроки. В этом случае при недостижении целевого АД рациональным будет переход на следующий шаг. До перехода на 4-компонентную схему необходимо использование трех препаратов в максимальных дозах при хорошей переносимости.
У 15–20% пациентов контроль АД может быть не достигнут при использовании 3 препаратов. В этом случае используется комбинация из 4 и более АГП. Однако в случаях резистентной АГ при добавлении каждого нового препарата необходимо контролировать их эффективность, и неэффективные АГП следует отменять, а не сохранять в рамках постепенного усиления многокомпонентной АГТ.
К рекомендуемым комбинациям трех антигипертензивных препаратов относятся: ИАПФ + АК + диуретик; БРА + АК + диуретик.
По показаниям, при наличии особых условий можно использовать и другие комбинации: ИАПФ + дигидропиридиновый АК + ББ; БРА + дигидропиридиновый АК + ББ; ИАПФ + диуретик + ББ; БРА + диуретик + ББ; дигидропиридиновый АК + диуретик + ББ.
Целевые уровни АД являются рекомендованными для достижения в каждой подгруппе пациентов, но важнейшим принципом их достижения является соблюдение безопасности и сохранения качества жизни пациента. Поэтому скорость достижения целевых значений и степень снижения АД может быть скорректирована у конкретного пациента в зависимости от конкретной клинической ситуации. При этом плохая переносимость снижения АД может быть основанием для более медленной титрации доз и числа назначаемых препаратов, равно как и при хорошей переносимости АД, может быть снижено до более низких значений, чем рекомендовано в среднем. Недостижение целевого АД в указанные сроки не является ошибочным, если это продиктовано клинической необходимостью. Если врач считает, что препятствием к достижению целевого АД является плохая приверженность пациента, это должно находить отражение в медицинской документации и должны быть предприняты и зафиксированы меры по повышению приверженности. В этих случаях недостижение целевого уровня не должно считаться дефектом оказания помощи.
- Пациентам, не достигшим целевого АД на фоне двойной комбинированной терапии, рекомендуется тройная комбинация, как правило, блокатора РААС с АК и тиазидовым/тиазидоподобным диуретиком, предпочтительно в форме фиксированной комбинации [135, 136].
ЕОК/ЕОАГ IА (УУР В, УДД 1)
- Пациентам с АГ, не достигшим целевого АД на фоне тройной комбинированной терапии, рекомендуется добавление спиронолактона (подробнее в разделе 3.6.11.) [106, 137, 138, 169].
ЕОК/ЕОАГ IB (УУР А, УДД 1)
Комментарии. При непереносимости спиронолактона рекомендуется назначение других диуретиков (эплеренона, хлорталидона, петлевых диуретиков, в т.ч в более высоких дозах), ББ, альфа-адреноблокаторов или препаратов центрального действия. [139].
- Всем пациентам с АГ не рекомендуется назначение комбинации двух блокаторов РААС вследствие повышенного риска развития гиперкалиемии, гипотензии и ухудшения функции почек [21, 139, 145, 146].
ЕОК/ЕОАГ IIIА (УУР A, УДД 1)
Основные классы препаратов для лечения артериальной гипертензии
Ингибиторы ангиотензинпревращающего фермента и антагонисты рецепторов ангиотензина II
ИАПФ и БРА — среди наиболее часто используемых классов антигипертензивных препаратов, обладающие сходной эффективностью в отношении сердечно-сосудистых осложнений и смертности по сравнению как друг с другом, так и с другими классами АГТ [59, 140–142]. БРА по сравнению с другими классами характеризуются более низкой частотой отмены из-за побочных эффектов, сопоставимой с плацебо [143, 144].
ИАПФ и БРА снижают альбуминурию в большей степени, чем другие антигипертензивные препараты, и эффективно замедляют прогрессирование диабетической и недиабетической ХБП [99]. По данным метаанализов, блокаторы РААС — единственные из всех антигипертензивных препаратов доказанно снижают риск терминальной ХБП.
ИАПФ и БРА эффективно предотвращают или приводят к обратному развитию ПОМ (ГЛЖ, ремоделирование мелких артерий) на фоне соответствующего снижения АД [140]. Оба препарата снижают риск пароксизмов ФП, что может быть обусловлено улучшением функции ЛЖ и более эффективным регрессом структурных изменений ЛЖ [140]. ИАПФ и БРА показаны пациентам с перенесенным ИМ, ХСНнФВ.
ИАПФ ассоциированы с умеренным повышением риска ангионевротического отека, особенно у представителей негроидной расы. У таких пациентов следует отдавать предпочтение БРА.
Для всех пациентов с АГ в связи с наличием абсолютных противопоказаний не рекомендуется назначение ИАПФ и БРА при беременности, высокой гиперкалиемии (≥5,5 ммоль/л), двухстороннем стенозе почечных артерий, стенозе почечной артерии единственной почки, у беременных и кормящих женщин и ангионевротическом отеке в анамнезе.
Блокаторы кальциевых каналов
Все АК метаболически нейтральны и не оказывают отрицательного действия на углеводный, липидный и пуриновый обмен. Помимо антигипертензивного, они оказывают антиангинальное и органопротективное действие, тормозят агрегацию тромбоцитов. В целом их влияние на СС риск схоже с другими классами антигипертензивных препаратов [59, 140]. При этом АК обладают большим эффектом в отношении профилактики инсультов, чем этого можно было ожидать только от антигипертензивного эффекта, однако они менее эффективны в отношении профилактики СНнФВ [59, 140].
Не рекомендуется (абсолютное противопоказание) назначение недигидропиридиновых АК при атриовентрикулярной блокаде 2–3-й степени, ХСН снизкой ФВ ЛЖ. Для дигидропиридиновых АК абсолютных противопоказаний нет.
Диуретики тиазидные и тиазидоподобные
Диуретики оказывают выраженный антигипертензивный эффект и остаются краеугольным камнем антигипертензивной терапии. Их эффективность в предотвращении всех вариантов СС осложнений и смертности подтверждена в РКИ и метаанализах [147]. Диуретики более эффективно предотвращают СН, чем другие классы препаратов [140]. В настоящее время ведутся дискуссии о том, следует ли предпочесть тиазидоподобные диуретики классическим тиазидным диуретикам, хотя их превосходство не было подтверждено в РКИ с прямым сравнением. Недавний метаанализ плацебо-контролируемых РКИ показал сходные эффекты трех типов диуретиков на СС исходы [147]. Таким образом, в отсутствие прямых сравнительных исследований и с учетом того, что гидрохлортиазид является компонентом многих фиксированных комбинаций, можно рекомендовать равноценное использование тиазидов, хлорталидона и индапамида.
И тиазидные, и тиазидоподобные диуретики снижают уровень сывороточного калия и имеют менее благоприятный профиль безопасности, чем блокаторы РААС [147, 148]. Они также могут способствовать повышению инсулинорезистентности и риска развития СД. Недавно проведенные исследования показали, что снизить негативное влияние тиазидов на метаболизм глюкозы можно добавлением калийсберегающего диуретика [149]. И тиазидные, и тиазидоподобные диуретики характеризуются снижением антигипертензивной эффективности при СКФ менее 45 мл/мин, а при СКФ менее 30 мл/мин препараты становятся неэффективными. В этом случае в качестве альтернативы следует использовать петлевые диуретики.
- У пациентов, не достигших целевого АД при приеме моно- или комбинированной АГТ, не включавшей диуретики, рекомендуется назначение низких доз тиазидных или тиазидоподобных диуретиков в составе комбинированной терапии с БРА, ИАПФ и АК для усиления АГЭ и достижения целевого АД [150–152].
ЕОК/ЕОАГ IB (УУР А, УДД 1)
Комментарии. Подагра и бессимптомная гиперурикемия являются абсолютным противопоказанием к назначению гидрохлортиазида и хлорталидона и относительным противопоказанием для индапамида.
Антагонисты минералокортикоидных рецепторов
АГЭ антагонистов минералокортикоидных рецепторов (АМКР) (спиронолактон, эплеренон) связан с тем, что они, имея стероидную структуру, конкурентно по отношению к альдостерону, связываются с его рецепторами, блокируя биологические эффекты альдостерона.
Cпиронолактон оказывает положительный эффект при сердечной недостаточности и резистентной АГ. Эплеренон также продемонстрировал положительный эффект при сердечной недостаточности и резистентной АГ и может использоваться как альтернатива спиронолактону. Для лечения АГ используются низкие суточные дозы АМКР (25–50 мг). Не рекомендуется (абсолютное противопоказание) назначение антагонистов альдостероновых рецепторов при нарушении функции почек с СКФ<30 мл/мин/1,73 м2 из-за повышения риска гиперкалиемии и ухудшения функции почек.
Бета-адреноблокаторы. АГЭ ББ обусловлена их способностью блокировать β1- и β2-адренорецепторы и уменьшать адренергическое влияние на сердце (снижение частоты и силы сердечных сокращений), а также снижать секрецию ренина (блокада β1-рецепторов юкстагломерулярного аппарата).
- ББ рекомендованы в качестве антигипертензивной терапии при наличии особых клинических ситуаций: например, стенокардии, перенесенного инфаркта миокарда, сердечной недостаточности [21, 22].
ЕОК ЕОАГ IA (УУР С, УДД 5)
Комментарии. ББ — один из пяти основных классов АГП. Предпочтительными ситуациями для их назначения являются симптомная стенокардия напряжения, перенесенный ИМ, ХСН с низкой фракцией выброса, ФП, аневризма аорты, контроль ЧСС, а также лечение АГ у женщин детородного возраста, особенно планирующих беременность. ББ — гетерогенный класс препаратов. В отдельных исследованиях продемонстрированы неодинаковые эффекты классических и вазодилатирующих ББ в отношении центрального АД, артериальной ригидности, риска развития СД, исходов при ХСН. РКИ по сопоставлению эффективности ББ с разными свойствами у пациентов с АГ не проводились. У физически активных пациентов и при наличии у них МС, НТГ рекомендованы ББ с вазодилатирующим эффектом, не оказывающие отрицательного влияния на инсулинорезистетность.
В многоцентровых исследованиях была показана несколько меньшая эффективность ББ по предупреждению инсульта в сравнении с другими АГП [153]. Однако все эти данные были получены при анализе исследований, где применялся атенолол. В отношении небиволола, карведилола и высокоселективных ББ (бисопролол и метопролол замедленного высвобождения) нет данных по влиянию на жесткие конечные точки [147].
Абсолютное противопоказание для назначения ББ — синоатриальная, атриовентрикулярная блокада 2–3-й степени, синдром слабости синусового узла и бронхиальная астма.
Другие (дополнительные) классы антигипертензивных препаратов
В целом антигипертензивные препараты, не относящиеся к пяти основным классам (например, препараты центрального действия, альфа-адреноблокаторы), не рекомендуются для рутинного применения при АГ, но остаются препаратами резерва, например, для применения при резистентной гипертензии при неэффективности остальных препаратов [21].
Агонисты имидазолиновых рецепторов (моксонидин) стимулируют имидазолиновые рецепторы, расположенные в вентролатеральном отделе продолговатого мозга. В отличие от других классов АГП, для моксонидина не проводились РКИ с использованием жестких конечных точек. С учетом результатов исследования ALMAZ [154], показавшего, что моксонидин повышает чувствительность тканей к инсулину у пациентов с избыточной массой тела, мягкой АГ и инсулинорезистентностью и нарушением углеводного обмена, назначение моксонидина возможно при ведении пациентов с АГ, ожирением и инсулинорезистентностью. Несмотря на отсутствие в рекомендациях данного класса препаратов среди основных, нет оснований для отмены такой терапии пациентам, которые уже получают данную группу препаратов при условии их хорошей эффективности и переносимости.
- Моксонидин для лечения АГ рекомендуется пациентам с МС или ожирением в комбинации с ИАПФ, БРА, АК и диуретиками при недостаточной эффективности классических комбинаций [154–156].
ЕОК/ЕОАГ нет (УУР B, УДД 3)
Комментарии. Не рекомендовано (абсолютное противопоказание) назначение агонистов имидазолиновых рецепторов при синдроме слабости синусового узла, синоатриальной, атриовентрикулярной блокаде 2–3-й степени, выраженной брадикардии с ЧСС менее 50 в минуту, ХСН (III–IV ФК).
Альфа-адреноблокаторы. Альфа-адреноблокаторы улучшают углеводный и липидный обмены, повышают чувствительность тканей к инсулину, улучшают почечную гемодинамику. Ввиду того, что эти препараты вызывают постуральную гипотензию, их с осторожностью применяют у пациентов с диабетической нейропатией и у пациентов старше 65 лет. Предпочтительным показанием для этого класса препаратов является наличие у пациентов с АГ доброкачественной гиперплазии предстательной железы.
- Альфа-адероноблокаторы рекомендуются при резистентной АГ (подробнее в разделе 3.6.11.), в качестве четвертого препарата к комбинации ИАПФ/БРА, АК, диуретика (при непереносимости спиронолактона**) [137].
ЕОК/ЕОАГ нет (УУР B, УДД 2)
Аппаратное лечение артериальной гипертензии
- Денервация почечных артерий (ренальная денервация) не рекомендована для лечения артериальной гипертензии в рутинной практике, пока не будет доступно больше данных относительно их эффективности и безопасности [157, 158].
ЕОК/ЕОАГ нет (УУР С, УДД 5)
Комментарии. Денервация почечных артерий может выполнятьсядля предотвращения эффектов симпатической нервной системы в отношении почечного сосудистого сопротивления, высвобождения ренина и реабсорбции натрия [159]. Для лечения пациентов с резистентной АГ были предложены минимально инвазивные методы катетерной денервации почек с помощью радиочастотной стимуляции, ультразвука или периваскулярной инъекции нейротоксичных веществ, например, этилового спирта [160]. Однако клинические данные относительно антигипертензивной эффективности ренальной денервации неоднозначны и требуют дальнейшего изучения.
Лечение артериальной гипертензии в отдельных клинических ситуациях
Артериальная гипертензия и сахарный диабет
- Пациентам с АГ в сочетании с СД рекомендуется начинать антигипертензивную терапию при значениях АД, измеренного в медицинском учреждении ≥140/90 мм рт. ст. [107, 157, 158]
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ в сочетании с СД, получающим АГП, в связи с доказанными преимуществами в снижении СС риска рекомендуется:
— в качестве целевого уровня снижать САД у пациентов моложе 65 лет до значений 130 мм рт. ст. и ниже при хорошей переносимости, но не ниже 120 мм рт. ст. [107, 157, 159]
ЕОК/ЕОАГ IА (УУР А, УДД 1)
— у пожилых пациентов (≥65 лет) с СД целевой уровень САД составляет 130–139 мм рт. ст. [107, 157, 160]
ЕОК/ЕОАГ IА (УУР А, УДД 1)
— целевой уровень ДАД у всех пациентов с АГ и СД составляет <80 мм рт. ст., но не ниже 70 мм рт. ст. [21, 22].
ЕОК/ЕОАГ IС (УУР С, УДД 5)
- Всем пациентам с АГ и СД рекомендуется начинать лечение с комбинации блокатора РААС с АК или тиазидным/тиазидоподобным диуретиком в связи с наилучшим влиянием этих комбинаций на частоту достижения целевого АД и снижение СС риска, а также нефропротективным потенциалом блокаторов РААС [106–107, 165].
ЕОК/ЕОАГ IА (УУР А, УДД 2)
Комментарии. Сочетание СД и АГ заслуживает особого внимания, поскольку оба заболевания существенно увеличивают риск развития микро- и макрососудистых поражений, включая диабетическую нефропатию, инсульт, ИБС, ИМ, ХСН, атеросклероз периферических артерий, и способствуют увеличению СС смертности. При лечении пациентов АГ с СД необходимо контролировать все имеющиеся у пациента ФР, включая дислипидемию (назначение гиполипидемической терапии). Развитие диабетической нефропатии сопровождается очень высоким риском развития ССО, при этом необходимы контроль АД и уменьшение протеинурии до минимально возможных значений.
Артериальная гипертензия и хроническая болезнь почек
- Пациентам с ХБП рекомендуется начинать лечение (изменение образа жизни и лекарственную терапию) вне зависимости от наличия сахарного диабета при уровне АД, измеренного в медицинском учреждении, ≥140/90 мм рт. ст. (Приложение Б3) [165, 166].
ЕОК/ЕОАГIА (УУР С, УДД 4)
- Пациентам с диабетической и недиабетической ХБП рекомендуется снижать САД до значений 130–139 мм рт. ст. в связи с доказанными преимуществами в снижении риска сердечно-сосудистых событий [168].
ЕОК/ЕОАГ IА (УУР С, УДД 4)
Комментарии. Следует назначать индивидуализированную терапию в зависимости от ее переносимости и влияния на функцию почек и уровень электролитов
- Блокаторы РААС рекомендуются в качестве компонента терапевтической стратегии при наличии альбуминурии высокой степени или протеинурии, как более эффективные препараты для уменьшения выраженности альбуминурии [167, 168].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Всем пациентам с АГ и ХБП в качестве начальной терапии рекомендуется комбинация блокатора РААС с АК или диуретиком в связи с наилучшим влиянием данных комбинаций на частоту достижения целевого АД и снижение СС риска [165].
ЕОК/ЕОАГ IА (УУР А, УДД 2)
Комментарии. АГ является важнейшим фактором риска развития и прогрессирования хронической болезни почек (ХБП) любой этиологии; адекватный контроль АД замедляет ее развитие. В свою очередь, ХБП является важным независимым фактором риска развития и прогрессирования ССЗ, в том числе фатальных. У пациентов, получающих почечную заместительную терапию гемодиализом, АГ существенно влияет на выживаемость. Для ведения таких пациентов крайне важно точное и правильное измерение АД, однако АД до сеанса гемодиализа может не отражать средний уровень АД, так как большие колебания натрия и воды в организме способствуют большей вариабельности АД. Доказано, что АД, измеренное методом ДМАД, более информативно, чем показатели АД перед сеансом гемодиализа.
У пациентов с терминальной стадией ХБП, находящихся на диализе, снижение САД и ДАД сопровождается уменьшением частоты СС осложнений и общей смертности. Пациентам, находящимся на гемодиализе, можно назначать все АГП, при этом их дозы зависят от стабильности гемодинамики и способности конкретного препарата проходить через диализные мембраны. Петлевые диуретики — препараты выбора среди диуретиков при терминальной ХБП.
При использовании АМКР, особенно в комбинации с блокатором РААС, необходим более тщательный контроль функции почек и уровня калия (опасность гиперкалиемии).
Артериальная гипертензия и ишемическая болезнь сердца
Пациентам с АГ в сочетании с ИБС рекомендуется:
- Пациентам моложе 65 лет, без ХБП, получающим антигипертензивную терапию, в связи с доказанными преимуществами в снижении риска СС событий рекомендуется снижать САД до целевого уровня ≤130 мм рт. ст. при хорошей переносимости, но не <120 мм рт. ст. (Приложение Б4) [157, 170].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- У пожилых пациентов (≥65 лет) и/или с наличием ХБП рекомендовано снижать САД до целевых значений 130–139 мм рт. ст. [157, 170].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Снижать ДАД до целевых значений <80 мм рт. ст., но не <70 мм рт. ст. [299]
ЕОК/ЕОАГ IА (УУР А, УДД 3)
- Пациентам с АГ с перенесенным инфарктом миокарда рекомендуется назначение ББ и блокаторов РААС в качестве составной части терапии для снижения риска СС смертности [171].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ и симптомами стенокардии рекомендуется назначение ББ и/или АК. [171].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
Артериальная гипертензия, гипертрофия левого желудочка и сердечная недостаточность
- Пациентам с АГ в сочетании с сердечной недостаточностью (СН) (с низкой или сохраненной фракцией выброса) рекомендуется назначение АГТ при уровне АД ≥140/90 мм рт. ст. в связи с доказанными преимуществами в отношении снижения СС смертности [172].
ЕОК/ЕОАГ IIaB (УУР C, УДД 5)
Комментарии. У пациентов с АГ и СН с сохранной функцией левого желудочка при назначении АГТ возможно использование всех основных лекарственных средств, поскольку ни один из препаратов не продемонстрировал свое превосходство над другими в отношении улучшения СС исходов [21, 22].
- Пациентам с АГ в сочетании с СН со сниженной ФВ в качестве АГТ рекомендуется использовать ИАПФ или БРА, а также ББ, диуретиков и/или АМКР при необходимости [171, 173] (Приложение Б5).
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- При недостаточном контроле АД пациентам с СН и АГ рекомендуется рассмотреть возможность добавления к терапии дигидропиридиновых АК для достижения целевого АД [21, 22].
ЕОК/ЕОАГ IIbC (УУР C, УДД 5)
- Пациентам с АГ и СН с сохраненной ФВ рекомендуется руководствоваться теми же пороговыми и целевыми значениями АД, что и при сниженной ФВ [174–176].
ЕОК/ЕОАГ IIaB (УУР С, УДД 5)
- Всем пациентам с ГЛЖ рекомендуется назначение блокаторов РААС в комбинации с АК или диуретиком в связи с доказанным влиянием на процессы ремоделирования ЛЖ [177].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- У пациентов с АГ и ГЛЖ моложе 65 лет и при отсутствии ХБП рекомендуется снижать САД до значений 120–130 мм рт. ст. в связи с доказанными преимуществами в отношении снижения СС исходов и смертности [107, 178–180].
ЕОК/ЕОАГ IIaB (УУР А, УДД 1)
Артериальная гипертензия, фибрилляция предсердий и другие аритмии
Ведение пациентов с АГ в сочетании с фибрилляцией предсердий проводится в соответствии с действующими клиническими рекомендациями.
- Всех пациентов с ФП рекомендуется обследовать для исключения АГ [181].
ЕОК/ЕОАГ IC (УУР C, УДД 5)
- Пациентам с АГ и ФП при необходимости контроля ЧСС в качестве компонента АГТ рекомендуется назначать ББ или недигидропиридиновые АК (Приложение Б6) [181].
ЕОК/ЕОАГ IIaB (УУР C, УДД 5)
Комментарии. Индивидуальный выбор доз ББ или недигидропиридиновых АК препаратов должен быть ориентирован на целевые значения ЧСС не выше 110 в минуту в состоянии покоя [182].
- Пациентам с АГ в сочетании с ФП при числе баллов по шкале CHA2DS2-Vasc ≥2 для мужчин и ≥3 для женщин рекомендуется проводить профилактику инсульта с помощью пероральных антикоагулянтов (шкала предсталена в Таблице 4, Приложение Г3) [183].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Назначение пероральных антикоагулянтов рекомендовано пациентам с ФП, имеющим 1 балл по шкале CHA2DS2-VASc, учитывая индивидуальные особенности и предпочтения пациента [182,184].
ЕОК/ЕОАГ IIaB (УУР C, УДД 5)
Комментарии. Развитие ФП у пациентов АГ ухудшает прогноз заболевания, значимо повышает риск развития инсульта (кардиоэмболического генеза) и сердечной недостаточности. АГ — самое распространенное сопутствующее заболевание у пациентов с ФП. В отсутствие противопоказаний пациенты ФП должны получать пероральные антикоагулянты для профилактики инсульта и других эмболий. Адекватный контроль АГ у пациентов, получающих антикоагулянты, способствует снижению частоты кровотечений. Оральные антикоагулянты следует применять с осторожностью у пациентов со значительно повышенным АД (САД ≥180 мм рт. ст. и/или ДАД ≥100 мм рт. ст.), при этом необходимо применить срочные меры для достижения контроля АД; целью является снижение САД как минимум <140 мм рт. ст., ДАД <90 мм рт. ст. Целесообразно оценить возможность снижения САД до <130 мм рт. ст. [181, 185].
Артериальная гипертензия и цереброваскулярная болезнь
- Пациентам с внутримозговой гематомой и САД < 200 мм рт. ст. не рекомендуется незамедлительное снижение АД для профилактики осложнений (в том числе гипоперфузии головного мозга или увеличения размеров очага поражения) [186-192].
ЕОК/ЕОАГ IIIA (УУР A, УДД 2)
- Пациентам с внутримозговой гематомой при САД ≥220 мм рт. ст. рекомендовано осторожное снижение АД до уровня <180 мм рт. ст. с помощью в/в терапии для профилактики осложнений (в том числе гипоперфузии головного мозга или увеличения размеров очага поражения) [191, 192].
ЕОК/ЕОАГ IIaB (УУР С, УДД 5)
- Пациентам c острым ишемическим инсультом рутинное снижение АД не рекомендуется для профилактики осложнений (в том числе гипоперфузии головного мозга) [190-195].
ЕОК/ЕОАГ IIIA (УУР A, УДД 1)
- Пациентам с острым ишемическим инсультом, которым планируется проведение внутривенной тромболитической терапии, АД рекомендуется осторожно снизить и поддерживать на <180/105 мм рт. ст. в течение как минимум 24 часов после тромболизиса в связи с доказанными преимуществами в отношении прогноза неврологического восстановления [193, 196, 197].
ЕОК/ЕОАГ IIaB (УУР С, УДД 3)
- Пациентам с САД ≥ 220 и/или ДАД ≥120 мм рт. ст., которым не проводился тромболизис, рекомендуется рассмотреть возможность целесообразности лекарственной терапии с целью снижения АД на 15% в течение первых суток после инсульта принимается на основании оценки клинической ситуации [21, 22, 193].
ЕОК/ЕОАГ IIbC (УУР C, УДД 5)
- Пациентам с АГ, перенесшим острое цереброваскулярное нарушение, с целью сокращения риска повторного острого нарушения мозгового кровообращения (ОНМК) назначение АГТ рекомендовано сразу после транзиторной ишемической атаки (ТИА) и через несколько дней после ишемического инсульта [185, 198, 199].
ЕОК/ЕОАГ IА (УУР С, УДД 4)
- Всем пациентам с АГ после ишемического инсульта или ТИА моложе 65 лет и без ХБП рекомендуется снижать САД до целевых значений 120–130 мм рт. ст. в связи с доказанными преимуществами в отношении снижения СС смертности [108, 185, 199, 200].
ЕОК/ЕОАГ IIaB (УУР B, УДД 2)
- АГТ, направленная на снижение риска инсульта и рекомендованная всем пациентам с ЦВБ, включает блокатор РААС в сочетании с АК или тиазидоподобным диуретиком [108, 153, 198].
ЕОК/ЕОАГ IA (УУР А, УДД 1)
Комментарии. У пациентов АГ с ЦВБ (дисциркуляторная энцефалопатия II–III степени и/или ТИА/инсульт в анамнезе, гемодинамически значимый стеноз магистральных брахиоцефальных артерий) не следует резко снижать АД, так как у части пациентов может быть плохая индивидуальная переносимость более низких уровней АД вследствие нарушения ауторегуляции сосудов головного мозга. У этих пациентов целесообразно применение этапной (ступенчатой) схемы снижения АД.
Артериальная гипертензия у пациентов с заболеванием периферических артерий
- Пациентам с АГ в сочетании с периферическим атеросклерозом, учитывая высокий риск инфаркта миокарда, инсульта, сердечной недостаточности и сердечно-сосудистой смерти, рекомендуется назначение АГТ с достижением целевого АД <140/90 мм рт. ст. [21, 22, 107, 171, 201–203].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Всем пациентам с АГ в сочетании с атеросклерозом периферических артерий в качестве начальной терапии рекомендуется назначать комбинацию блокатора РААС и АК или диуретика [21, 22, 201, 202].
ЕОК/ЕОАГ IIaВ (УУР А, УДД 1)
- Пациентам с атеросклерозом сонных артерий рекомендуется назначать АК и блокаторы РААС, так как препараты данных групп более эффективно замедляют прогрессирование атеросклероза, чем диуретики и ББ [21, 22, 201–205].
ЕОК/ЕОАГ нет (УУР А, УДД 1)
Комментарии. На основании данных РКИ установлено, что контроль АГ замедляет прогрессирование атеросклероза сонных артерий. АК, ИАПФ и их комбинация в этом случае более эффективны, чем диуретики и ББ [204, 205]. Следует учитывать, что пациенты с каротидным атеросклерозом имеют высокий риск атероэмболического инсульта и СС осложнений, в связи с чем АГТ должна сочетаться с назначением статинов и антитромбоцитарных препаратов. Снижение АД у пациентов с двусторонним стенозом сонных артерий следует проводить осторожно, начиная с монотерапии и тщательно отслеживая побочные эффекты [21, 22].
- У пациентов с периферическим атеросклерозом рекомендуется рассмотреть возможность назначения ББ в качестве АГТ, особенно при наличии показаний к их применению для снижения выраженности симптоматики [21, 22].
ЕОК/ЕОАГ IIbC (УУР С, УДД 5)
Артериальная гипертензия у пациентов с заболеваниями легких
- Пациентам с АГ в сочетании с бронхиальной астмой (БА) и/или ХОБЛ с целью достижения целевого уровня АД в качестве стартовой АГТ не рекомедовано назначение ББ, рекомендуется назначение блокаторов РААС и АК [206–211].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
Комментарии. Сочетание АГ с ХОБЛ и/или бронхиальной астмой обуславливает особенности проведения АГТ.
Пациентам с БА и/или ХОБЛ назначение петлевых и тиазидных диуретиков требует осторожности, в связи с высокой вероятностью развития гипокалиемии при их совместном применении с β2-агонистами и особенно — системными стероидами.
ББ могут стать причиной развития бронхоспазма, особенно неселективные, в связи с чем не должны рутинно назначаться пациентам с ХОБЛ и противопоказаны пациентам с БА. Ряд исследований, проведенных у ограниченного числа пациентов, показали, что применение небольших доз высокоселективных ББ не ухудшает и может даже несколько улучшать бронхиальную проходимость [210].
Применение АК у пациентов с ХОБЛ и/или БА безопасно и даже способствует снижению гиперреактивности бронхов и повышению бронходилатирующего эффекта β2-агонистов. Таким образом, наравне с изменением образа жизни (в первую очередь — отказом от курения) в качестве стартовой АГТ предопочтительно использование блокаторов РААС и АК. При недостижении целевого АД или наличии сопутствующих заболеваний с соответствующими показаниями можно рассмотреть добавление/назначение тиазидных или тиазидоподобных диуретиков и высокоселективных ББ [21, 22].
Пациенты с АГ с бронхообструктивной патологией часто применяют бронхолитические и глюкокортикостероидные (ГКС) препараты. Системное и длительное применение ГКС способствует повышению АД. При применении ингаляционных ГКС подобные эффекты незначительны.
Артериальная гипертензия и синдром обструктивного апноэ сна
- Для улучшения контроля АГ у пациентов с синдромом обструктивного апноэ во время сна (СОАС) рекомендуется применение CPAP (“сипап”) — терапии (от англ. Constant Positive Airway Pressure), заключающейся в создании непрерывного положительного давления в дыхательных путях аппаратным методом) [21].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. СОАС характеризуется периодическим спадением верхних дыхательных путей на уровне глотки и прекращением легочной вентиляции при сохраняющихся дыхательных усилиях во время сна с последовательным снижением насыщения кислородом крови, грубой фрагментацией сна и выраженной дневной сонливостью. При СОАС, особенно тяжелой степени (индекс апноэ/гипопноэ >30), происходит активация СНС, что приводит к повышению или недостаточному снижению АД в ночные часы, развитию эндотелиальной дисфункции, оксидативного стресса и увеличению риска развития ССО. На наличие СОАС должны быть обследованы пациенты с АГ с ожирением, резистентностью к АГТ, у которых по результатам СМАД имеется недостаточное снижение или повышение АД в ночные часы. Признаками, позволяющими заподозрить СОАС, являются: беспокойный, «неосвежающий» сон; учащенное ночное мочеиспускание; дневная сонливость; разбитость, утренние головные боли; хроническая усталость; снижение памяти и внимания; громкий, прерывистый храп; остановки дыхания во сне; увеличение массы тела и снижение потенции.
Для скрининга СОАС можно использовать опросник шкалы сонливости по Эпфорт (Epworth Sleepiness Scale) (Таблица П5, Приложение Г3), компьютерную пульсоксиметрию.
Для постановки диагноза и оценки степени тяжести СОАС проводится респираторное или кардиореспираторное мониторирование. Золотой стандарт выявления СОАС — полисомнографическое исследование.
Лечение пациентов с СОАС включает снижение веса у пациентов с ожирением, отказ от курения, приема транквилизаторов и снотворных препаратов, а также проведение мероприятий, направленных на обеспечение свободного носового дыхания. Основной метод лечения пациентов с СОАС — CPAP терапия (создание постоянного положительного давления воздуха в дыхательных путях — Continuous Positive Airways Pressure). При CPAP терапии поток нагнетаемого под давлением воздуха предотвращает спадение верхних дыхательных путей. Для СРАР терапии применяются аппараты с индивидуальными режимами вентиляции, обеспечивающими максимально эффективное их использование [212].
Артериальная гипертензия в периоперационном периоде
- При впервые выявленной АГ перед плановым хирургическим вмешательством рекомендуется провести обследование в объеме, предусмотренном п. 2 данных рекомендаций, с целью выявления ПОМ и оценки CC риска [21].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
- Всем пациентам с АГ рекомендуется избегать существенных колебаний АД (более 10%) в периоперационном периоде [21, 213, 214].
ЕОК/ЕОАГ IС (УУР B, УДД 2)
Комментарии. Можно не откладывать некардиохирургическое вмешательство у пациентов с АГ 1–2-й степени (САД<180 мм рт. ст. и ДАД <110 мм рт. ст.) [21].
- Пациентам с АГ, длительно получающим ББ, рекомендуется продолжить терапию в периоперационном периоде для контроля АД. [215, 216].
ЕОК/ЕОАГ IВ (УУР А, УДД 3)
- Резкая отмена ББ или препаратов центрального действия (например, клонидина) потенциально опасна и не рекомендуется [217, 218].
ЕОК/ЕОАГ IIIВ (УУР С, УДД 4)
- Пациентам с АГ перед некардиохирургическим вмешательством для снижения риска интраоперационной гипотензии рекомендуется временная отмена блокаторов РААС [21].
ЕОК/ЕОАГ IIaC (УУР С, УДД 5)
Резистентная артериальная гипертензия
Резистентная к терапии АГ (т.е. резистентная АГ) устанавливается на основании следующих критериев:
— соблюдение мероприятий по изменению образа жизни и лечение с использованием оптимальных (или максимальных переносимых) доз трех и более лекарственных препаратов, включая ингибитор АПФ или БРА, АК и диуретик не приводит к снижению САД и ДАД до значений <140 мм рт. ст. и/или <90 мм рт. ст. соответственно;
— неадекватность контроля АД подтверждена с помощью СМАД и/или ДМАД;
— подтверждена приверженность пациента к лечению
— исключены причины псевдорезистентности и причины вторичной АГ.
Прежде чем диагностировать резистентную АГ, необходимо исключить причины псевдорезистентности:
— низкая приверженность к назначенной терапии является частой причиной псевдорезистентности, она выявляется у ≤50% пациентов, которых обследовали с помощью методов прямого мониторинга контроля приема препаратов, этот показатель прямо зависит от количества назначенных таблеток [219].
— феномен «белого халата» (при котором АД, измеренное в медицинском учреждении, повышено, но по данным СМАД или ДМАД уровень АД контролируется) встречается нередко, в связи с чем рекомендуется подтвердить наличие АГ с помощью СМАД или ДМАД до установления диагноза резистентной АГ.
— нарушение правил измерения АД в медицинском учреждении, включая использование манжеты меньшего размера, может привести к ложному выявлению повышенного АД.
— выраженный кальциноз плечевой артерии, особенно у пожилых пациентов.
— клиническая инертность, приводящая к назначению нерациональных комбинаций и неадекватных доз АГП.
Другие причины резистентной гипертензии:
— образ жизни, включая ожирение или быструю прибавку веса, чрезмерное употребление алкоголя или поваренной соли.
— применение вазопрессоров или веществ, способствующих задержке натрия, препаратов, назначенных по поводу сопутствующих заболеваний, растительных препаратов, употребление наркотиков (кокаин и т.п.) или анаболических стероидов
— СОАС
— выраженное ПОМ, особенно ХБП или жесткость крупных артерий [21, 22].
Истинная резистентная АГ встречается, не более чем в 10% случаев среди всей популяции пациентов АГ, однако в отдельных группах пациентов, например, с ХБП, ее распространенность может доходить до 30% [21,220]. Истинная резистентная АГ часто наблюдается у пациентов с ожирением, метаболическим синлромом, СД, СОАС, множественным ПОМ, при вторичных формах АГ. Тяжелое ПОМ (выраженная ГЛЖ, снижение функции почек, атеросклеротическое поражение артерий) способствует развитию резистентности к лечению.
- Всем пациентам с резистентной АГ рекомендовано усиление мероприятий по изменению образа жизни, особенно ограничение употребления соли с целью достижения целевого уровня АД [221].
ЕОК/ЕОАГ IВ (УУР В, УДД 2)
- Всем пациентам с резистентной АГ рекомендовано добавление к проводимой терапии спиронолактона** в дозах 25-50 мг/сут для достижения целевого уровня АД [137, 222, 223].
ЕОК/ЕОАГ IВ (УУР А, УДД 1)
Комментарии. При непереносимости спиронолактона рекомендовано добавление других диуретиков, включающих эплеренон, более высокие дозы тиазидных/тиазидоподобных диуретиков, или петлевые диуретики, или добавление бисопролола или доксазозина. Применение спиронолактона, эплеренона противопоказано пациентам с СКФ ≤ 30 мл/мин и концентрацией калия в плазме ≥ 5 ммоль/л из-за риска гиперкалиемии. Петлевые диуретики следует использовать вместо тиазидных/тиазидоподобных при СКФ <30 мл/мин.
Артериальная гипертензия «белого халата»
- Пациентам с АГ «белого халата» рекомендуется проводить мероприятия по изменению образа жизни, направленные на уменьшение СС риска [21, 22].
ЕОК/ЕОАГ IС (УУР А, УДД3)
- Всем пациентам с АГ «белого халата» рекомендуется проводить регулярные обследования (не менее 1 раза в 2 года) с периодическим мониторированием АД, вне медицинского учреждения [21, 22, 224–230].
ЕОК/ЕОАГ IС (УУР B, УДД 2)
Комментарии. АГ «белого халата» диагностируется при выявлении повышенного АД, измеренного в медицинском учреждении и нормальных показателей АД, измеренного вне медицинского учреждения. АГ «белого халата» может иметь место у многих людей с повышением клинического АД, особенно с АГ 1-й степени, а также у очень пожилых пациентов (>50%) [21, 22]. По сравнению со здоровыми лицами АГ «белого халата» ассоциируется с более высокой распространенностью метаболических факторов риска и ПОМ. Она также ассоциирована с более высоким риском развития сахарного диабета типа 2 и устойчивой АГ, а также с повышенным сердечно-сосудистым риском [227–230]. Различают «эффект белого халата», являющийся дополнительным прессорным ответом (реакцией) у пациента с АГ на измерение АД (реакция тревоги), чаще наблюдаемый в условиях медицинской организации.
- Для пациентов с АГ «белого халата» рекомендуется рассмотреть возможность медикаментозной антигипертензивной терапии при наличии признаков ПОМ или высоком/очень высоком СС риске (раздел 2.3, Таблица П11, Приложение Г2 и Таблица П12, Приложение Г2) [21, 22].
ЕОК/ЕОАГ IIbC (УУР C, УДД 5)
Комментарии. Для остальных пациентов с АГ «белого халата» рутинная медикаментозная терапия не рекомендована [21, 22].
«Маскированная» артериальная гипертензия
«Маскированная» гипертензия (МГ) (скрытая гипертензия) диагностируется у пациентов с нормальными показателями АД, измеренного в медицинском учреждении, но с повышенными значениями АД, измеренного вне медицинского учреждения. У таких пациентов метаболические факторы риска и ПОМ, встречается чаще, чем у пациентов с истинной нормотензией [37, 228–231]. Проблему представляет диагностика «маскированной» АГ, поскольку большинство скрининговых программ основано на использовании показателей АД, измеренного в медицинском учреждении, которое является нормальным. «Маскированная» АГ чаще встречается у молодых пациентов, чем у пожилых, а также у тех, чьи показатели клинического АД находятся в пределах значений высокого нормального АД (130–139/80–89 мм рт. ст.). Она редко встречается у лиц с показателями клинического АД <130/80 мм рт. ст. «Маскированная» АГ ассоциируется с повышением риска прогрессирования заболевания до стойкой АГ, повышенной частотой развития СД типа 2 и наличием ПОМ [21, 22]. Уровень отдаленного риска развития фатальных и нефатальных СС событий приближается к значению этого показателя у пациентов с устойчивой АГ [37, 38, 98, 232–233].
- Всем пациентам с «маскированной» АГ рекомендуются мероприятия по изменению образа жизни с целью уменьшения СС риска [21, 22].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
- Всем пациентам с «маскированной» АГ рекомендуется регулярное наблюдение, включающее периодическое мониторирование показателей АД, измеренного вне медицинского учреждения [21, 22, 230, 232].
ЕОК/ЕОАГ IС (УУР C, УДД 4)
- Всем пациентам с «маскированной» АГ рекомендуется проведение антигипертензивной медикаментозной терапии, учитывая прогностическое значение высоких значений АД, измеренного вне медицинского учреждения [38, 228, 232].
ЕОК/ЕОАГ IIaC (УУР А, УДД 2)
- Пациентам с неконтролируемой «маскированной» АГ (не достигнут контроль АД, измеренного вне медицинского учреждения), получающим медикаментозное лечение, рекомендуется усиление АГТ с целью снижения СС риска [230, 232].
ЕОК/ЕОАГ IIaC (УУР А, УДД 2)
Артериальная гипертензия у молодых пациентов (<50 лет)
АГ у молодых пациентов характеризуется более высокой частотой повышения ДАД и изолированной диастолической АГ [97]. При обследовании пациентов этой возрастной группы, особенно при наличии тяжелой АГ, следует учитывать, что вероятность обнаружения вторичной гипертензии, может достигать 10% [21].
- Всем пациентам моложе 50 лет при наличии АГ 2 и 3 степени, а также АГ 1 степени в сочетании с множественными ФР, ПОМ, СД, сердечно-сосудистыми, цереброваскулярными или почечные заболеваниями следует назначать АГТ одновременно с рекомендациями по изменению образа жизни в соответствии с общими принципами[21].
ЕОК/ЕОАГ нет (УУР С, УДД 5)
Комментарии.В связи с тем, что ранее назначение АГТ может предотвратить более тяжелую АГ и развитие ПОМ в будущем, молодым пациентам с АГ 1 степени при отсутствии ФР, ПОМ и ССЗ можно обсуждать назначение АГТ наравне с изменениями образа жизни [21]. При этом целевой уровень АД составляет 120-130/70-79 мм рт. ст. (см. раздел 3.2). В случае, если принимается решение о немедикаментозной коррекции АД или пациент отказывается принимать АГТ, необходимо дать подробные рекомендации по изменению образа жизни и длительно наблюдать пациента, так как со временем АД неизбежно будет расти [21].
Артериальная гипертензия у пожилых пациентов (≥65 лет)
- У пациентов 65 лет и старше с АГ, обратившихся за медицинской помощью в учреждения амбулаторного или стационарного типа, рекомендуется проводить скрининг синдрома старческой астении с использованием опросника «Возраст не помеха» (Приложение Г3, таблица П6), поскольку выявление старческой астении может влиять на тактику АГТ и уровень целевого АД [9].
ЕОК/ЕОАГ нет (УУР А, УДД 1)
- Пациентам >65 лет с АГ рекомендуется назначение антигипертензивной терапии с использованием любого из основных классов АГП [238, 239].
ЕОК/ЕОАГ нет (УУР В, УДД 1)
Комментарии. Пациенты старше 65 лет должны получать АГТ в соответствии с общим алгоритмом, приведенном в Приложении Б2. У пациентов очень пожилого возраста (>80 лет) может быть целесообразно начинать лечение с монотерапии. У всех пожилых пациентов комбинированную терапию следует начинать с минимальных доз препаратов. При отсутствии дополнительных показаний следует избегать назначения петлевых диуретиков и альфа-адреноблокаторов, так как они увеличивают риск падений [240, 241]. При лечении пожилых пациентов целевое АД составляет 130-139/70-79 мм рт. ст. при переносимости [21].
До назначения и в процессе приема АГТ необходим тщательный мониторинг функции почек для выявления ее возможного ухудшения вследствие АД-обусловленного снижения почечной перфузии. Всех пациентов 65 лет и старше, особенно старше 80 лет, и пациентов со старческой астенией необходимо тщательно наблюдать на предмет возможного развития ортостатической гипотензии (при необходимости — использовать СМАД) и мониторировать переносимость и развитие возможных побочных эффектов [21]. Не рекомендуется отмена медикаментозной АГТ на основании возраста, даже при достижении 80 лет, при условии, что лечение хорошо переносится.
При лечении пациентов 65 лет и старше необходимо учитывать методические рекомендации МР 103 «Фармакотерапия у пациентов пожилого и старческого возраста».
Изолированная систолическая артериальная гипертензия
Изолированная систолическая АГ: повышение САД ≥140 мм рт. ст. при ДАД <90 мм рт. ст.
Наиболее распространена у пожилых пациентов (до 29,4%), может встречаться и у пациентов молодого (1,8% среди пациентов 18–39 лет) и среднего возраста (6% среди пациентов 40–60 лет) [242, 243]. В основе развития ИСАГ лежат артериолосклероз и повышение артериальной ригидности, эндотелиальная дисфункция, провоспалительная активность, кальцификация эластина. Наблюдается у пожилых, пациентов с СД, ХБП, остеопорозом с кальцификацией сосудов [244]. ИСАГ независимо ассоциирована с риском неблагоприятных СС исходов и смертности [245, 246].
Пороговым значением САД для начала АГТ является ≥140 мм рт. ст. Лечение пациентов с ИСАГ проводят в соответствии с алгоритмом антигипертензивной терапии, при этом необходимо ориентироваться на уровень САД, а нормальное значение ДАД не должно препятствовать назначению оптимального лечения для достижения целевого САД [21, 31].
Помимо истинной ИСАГ, у некоторых молодых здоровых людей, чаще у мужчин, может выявляться ложная ИСАГ 1-й степени, сопровождающаяся нормальными показателями центрального САД за счет чрезмерной амплификации периферического САД [247]. Показано, что у молодых пациентов с ИСАГ сердечно-сосудистый риск аналогичен риску пациентов с высоким нормальным АД, причем, риск развития ИСАГ ассоциирован с курением [248].
На основании имеющихся данных молодым пациентам с изолированной систолической АГ 1-й степени следует рекомендовать мероприятия по изменению образа жизни (особенно прекращение курения); необходимость назначения АГТ на настоящий момент не доказана; показано длительное наблюдение, поскольку у многих из них в дальнейшем возможно развитие стойкой АГ [21].
Артериальная гипертензия при беременности и лактации
Выделяют следующие клинические варианты АГ при беременности [21]:
— АГ, развившаяся до беременности (хроническая АГ — ХАГ) — АГ, определяемая до беременности или проявившаяся до 20 нед. беременности и персистирующая более 6 недель после родов. АГ, диагностированная после 20-й недели гестации и не исчезнувшая в течение 6 недель после родов, также классифицируется как существовавшая ранее АГ, но уже ретроспективно;
— Гестационная артериальная гипертензия (ГАГ) — состояние, индуцированное беременностью и проявляющееся повышением АД ≥140/90 мм рт. ст. впервые после 20 нед., со спонтанной нормализацией АД в течение 6 нед. после родов АД;
— Преэклампсия (ПЭ) — гестационная АГ с протеинурией >300 мг/сут или альбумин/креатинин в разовой порции мочи >30 мг/ммоль, в ряде случаев с проявлениями полиорганной недостаточности.
— ХАГ, осложненная преэклампсией.
- Беременным женщинам, имеющим ФР, ПОМ, СД или поражение почек, рекомендуется проведение СМАД для подтверждения АГ [43, 228].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
- Женщинам с гестационной АГ, преэклампсией или хронической АГ, сопровождающейся субклиническим ПОМ, рекомендуется начинать лекарственную терапию при САД ≥140 мм рт. ст. или ДАД ≥90 мм рт. ст. с целью снижения СС риска [21, 22].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
- Беременным женщинам с повышением АД без наличия признаков ПОМ, преэклампсии и АКС с целью снижения СС риска начало лекарственной терапии рекомендуется при САД ≥150 мм рт. ст. или ДАД ≥95 мм рт. ст. [21, 22].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
Комментарии. Цель лечения беременных с АГ — предупредить развитие осложнений, обусловленных высоким уровнем АД, обеспечить сохранение беременности, нормальное развитие плода и успешные роды. Целевой уровень АД для беременных <140/90 мм рт. ст. Следует не допускать развития эпизодов гипотонии, чтобы не ухудшить плацентарный кровоток.
- Беременных женщин с САД ≥ 170 и ДАД ≥ 110 мм рт. ст. рекомендуется срочно госпитализировать и расценивать данное состояние как гипертонический криз [21, 22].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
Комментарии. Главное правило при лечении гипертонического криза (ГК)у беременных — контролируемое снижение САД до <160 И ДАД до <105 мм рт. ст. Для пероральной терапии следует использовать метилдопу или нифедипин замедленного высвобождения. Для лечения преэклампсии с отеком легких препаратом выбора является нитроглицерин, длительность его применения не должна составлять более 4 часов, из-за отрицательного воздействия на плод и риска развития отека мозга у матери. Применение диуретиков не показано, т.к. при преэклампсии уменьшается объем циркулирующей крови. Для предотвращения эклампсии и лечения судорог рекомендовано в/в введение сульфата магния.
- Женщинам с высоким риском преэклампсии с целью ее профилактики рекомендуется назначать малые дозы (150 мг) аспирина с 12-й недели беременности и до 36-й недели, при условии низкого риска желудочно-кишечных кровотечений [236].
ЕОК IA (УУР В, УДД 2)
Комментарии. Высокий риск преэклампсии отмечается у женщин с АГ во время предыдущей беременности, ХБП, аутоиммунными заболеваниями (системной красной волчанкой или антифосфолипидным синдромом), СД 1-го или 2-го типа, хронической АГ; к умеренному — первая беременность, возраст ≥40 лет, интервал между беременностями более 10 лет, ИМТ ≥35 кг/ м2 на первом визите, семейный анамнез преэклампсии и многоплодная беременность.
- Беременным женщинам с АГ в качестве АГТ с целью контроля уровня АД рекомендуется назначение лекарственных препаратов с замедленным высвобождением лекарственного вещества (метилдопа**) [237, 250].
ЕОК/ЕОАГ IB (УУР А, УДД 2)
- Беременным женщинам с АГ в качестве АГТ с целью контроля уровня АД рекомендуется назначение лекарственных препаратов с замедленным высвобождением лекарственного вещества (нифедипин**) [237, 250].
ЕОК/ЕОАГ IC (УУР А, УДД 2)
Комментарии
. Резервными препаратами для плановой АГТ у беременных женщин с АГ являются верапамил и бисопролол. АГТ должна быть продолжена в течение 12 недель после родов, особенно у женщин с ПЭ и при рождении недоношенных детей. Можно использовать любые классы АГП, согласно алгоритму АГТ, с рациональным выбором препаратов при лактации и учитывая то, что метилдопа не рекомендована к назначению в связи с повышением риска послеродовой депрессии.
- Не рекомендовано назначение ИАПФ, БРА и прямых ингибиторов ренина при беременности в связи с риском развития врожденных уродств и гибели плода [237, 250, 251].
ЕОК/ЕОАГ IIIC (УУР C, УДД 5)
- Женщинам с АГ в репродуктивном возрасте с риском наступления незапланированной беременности не рекомендуется назначение блокаторов РААС в связи с риском развития врожденных уродств и гибели плода [21, 22, 237, 251].
ЕОК/ЕОАГ IIIC (УУР C, УДД 4)
Препараты для оральной контрацепции и заместительной гормональной терапии и артериальная гипертензия
- Не рекомендуется применять оральные контрацептивы (ОК) женщинам с неконтролируемой АГ [252, 253].
ЕОК/ЕОАГ нет (УУР B, УДД 3)
Комментарии. Комбинированные пероральные контрацептивные препараты, содержащие эстрогены и прогестины, могут приводить к повышению АД и развитию АГ приблизительно у 5% пациенток [254, 255]. При назначении оральных контрацептивов (ОК) следует оценивать риски и преимущества, наличие сопутствующих факторов СС риска (особенно курения) у конкретной пациентки. Необходимо тщательно контролировать уровень АД [256, 257]. Отмена ОК может улучшить контроль АД у женщин с АГ [252]. Прием ОК женщинами с АГ диктует необходимость их тщательного выбора и начала приема после сопоставления риска и пользы индивидуально у каждой пациентки.
Заместительная гормональная терапия не противопоказана женщинам с АГ при условии контроля АД с помощью АГП [21]. Не рекомендуется назначение гормональной заместительной терапии и селективных модуляторов рецепторов к эстрогенам с целью первичной или вторичной профилактики ССЗ.
Артериальная гипертензия и эректильная дисфункция
- Всем пациентам с АГ и наличием эректильной дисфункции (ЭД) для коррекции эндотелиальной дисфункции рекомендовано назначение ингибиторов фосфодиэстеразы-5, даже тем из них, которые получают несколько АГП (за исключением альфа-адреноблокаторов и нитратов в связи с опасностью ортостатической гипотонии) [258, 259].
ЕОК/ЕОАГ нет (УУР B, УДД 2)
Комментарии.ЭД у мужчин с АГ встречается чаще, чем у лиц с нормальным АД. ЭД считается независимым ФР сердечно-сосудистых событий и смертности, ассоциированным с ПОМ. Сбор анамнеза у пациентов АГ должен включать оценку половой функции. Изменение (оздоровление) образа жизни может уменьшить степень ЭД. Современные препараты (БРА, ИАПФ, АК и вазодилатирующие ББ) не влияют на эректильную функцию. Адекватный контроль АГ способствует ее улучшению.
Артериальная гипертензия и противоопухолевая терапия
АГ является наиболее частым сопутствующим ССЗ по данным онкологических регистров, при этом повышение АД выявляется более чем у трети пациентов [260]. Это может быть связано с высокой распространенностью АГ в той возрастной категории, в которой наиболее часто встречаются и онкологические заболевания. Однако это также обусловлено прессорным эффектом двух групп широко используемых противоопухолевых препаратов: ингибиторов фактора роста эндотелия сосудов (бевацизумаб, сорафениб, сунитиниб и пазопаниб) и ингибиторов протеасом (карфизомиб [261]).
Повышение АД выявлялось у большого числа пациентов (≤30%), получающих терапию вышеописанными противоопухолевыми препаратами. Этот эффект часто наблюдается в течение первого месяца после начала лечения.
- Рекомендовано контролировать офисное АД еженедельно в течение первого цикла терапии ингибиторами фактора роста эндотелия сосудов (бевацизумаб, сорафениб, сунитиниб и пазопаниб) или ингибиторами протеасом (карфизомиб) у пациентов со злокачественными новообразованиями и каждые 2–3 нед. в дальнейшем [262]. После завершения первого цикла лечения, при условии стабильных значений АД, его следует измерять во время рутинных посещений врача или с помощью ДМАД.
ЕОК/ЕОАГ нет (УУР С, УДД 5)
- В случае развития АГ (≥140/90 мм рт. ст.) или повышения ДАД на ≥20 мм рт. ст. по сравнению с исходным уровнем на фоне терапии ингибиторами фактора роста эндотелия сосудов (бевацизумаб, сорафениб, сунитиниб и пазопаниб) или ингибиторами протеасом (карфизомиб) у пациентов рекомендовано начать или оптимизировать антигипертензивную терапию. Предпочтительными являются блокаторы РААС и дигидропиридиновые АК[263, 264].
ЕОК/ЕОАГ нет (УУР С, УДД 5)
Комментарии
: Хотя противоопухолевая терапия имеет очевидный приоритет, следует рассмотреть возможность ее прерывания в случаях чрезмерно высоких показателей АД, несмотря на многокомпонентную терапию, при наличии симптомов, обусловленных АГ, или при развитии ССС, требующего немедленного снижения АД [263, 264].
Коррекция сопутствующих факторов сердечно-сосудистого риска
- Пациентам с АГ и очень высоким или экстремальным СС риском рекомендовано назначение статинов для достижения целевого ХС-ЛНП ≤1,4 ммоль/л или его снижение на ≥50% от исходного [265–267].
ЕОК/ЕОАГ IВ (УУР А, УДД 1)
- Пациентам с АГ и высоким СС риском рекомендовано назначение статинов для достижения целевого ХС-ЛНП ≤1,8 ммоль/л или его снижение на ≥50% от исходного [266, 267].
ЕОК/ЕОАГ IВ (УУР А, УДД 1)
Комментарии. У пациентов с низким риском можно рассмотреть назначение статинов для достижения целевого ХС-ЛНП ≤3,0 ммоль/л. У пациентов с умеренным риском можно рассмотреть назначение статинов для достижения целевого ХС-ЛНП ≤2,6 ммоль/л.
- Пациентам с АГ с целью вторичной профилактики СС событий рекомендуется назначение ацетилсалициловой кислоты в низких дозах [268].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ не рекомендуется назначение ацетилсалициловой кислоты с целью первичной профилактики при отсутствии ССЗ в связи с недоказанными преимуществами данного вмешательства в отношении снижения СС риска [268].
ЕОК/ЕОАГ IIIA (УУР A, УДД 1)
Неотложные состояния при артериальной гипертензии: гипертонический криз
Гипертонический криз (ГК) — cостояние, при котором значительное повышение АД (до 3 степени) ассоциируется с острым поражением органов-мишеней, нередко жизнеугрожающим, требующее немедленных квалифицированных действий, направленных на снижение АД, обычно с помощью внутривенной терапии [269]. При определении тяжести поражения органов скорость и степень повышения АД могут быть так же важны, как и абсолютный уровень АД [270]. Можно выделить следующие типичные проявления гипертонических кризов:
— Пациенты со злокачественной АГ: тяжелая АГ (чаще 3-й степени) ассоциируется с изменениями на глазном дне (кровоизлияния и/или отек соска зрительного нерва), микроангиопатией и диссеминированным внутрисусосудистым свертыванием. Может приводить к энцефалопатии (примерно в 15% случаев) [271], ОСН, острому ухудшению функции почек [272–275].
— Пациенты с тяжелой АГ, ассоциированной с другими клиническими состояниями, требующими неотложного снижения АД: расслоение аорты, острая ишемия миокарда, ОСН
— Пациенты с внезапным повышением АД на фоне феохромоцитомы, ассоциированным с ПОМ
— Беременные с тяжелой АГ или преэклампсией.
Ранее использовавшийся термин «неосложненный гипертонический криз», описывавший пациентов со значительным повышением АД, но без признаков острых изменений в органах-мишенях [276], в настоящее время не рекомендован к использованию. В данной группе пациентов снижение АД обычно может проводиться в амбулаторных условиях, чаще всего путем назначения пероральной терапии в соответствии со стандартным алгоритмом, представленным выше. У этих пациентов необходимо проводить строгий контроль цифр АД до достижения целевых значений.
- Лечение пациентов с ГК рекомендуется проводить в отделении неотложной кардиологии или палате интенсивной терапии [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. При наличии инсульта целесообразна безотлагательная госпитализация в палату интенсивной терапии неврологического отделения или нейрореанимацию сосудистого центра.
- Осмотр врачом-терапевтом или врачом-кардиологом рекомендуется проводить не позднее 10 минут от момента поступления в стационар [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
- ЭКГ рекомендуется проводить при ГК не позднее 15 минут от момента поступления в стационар [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Рутинное обследование при всех возможных вариантах криза включает фундоскопию, ЭКГ, общий анализ крови, определение фибриногена, креатинина, рСКФ, электролитов, ЛДГ, гаптоглобин, оценку альбуминурии и микроскопию осадка мочи, тест на беременность у женщин детородного возраста. Специфическое обследование по показаниям может включать определение тропонина, МВ-КФК, НУП, рентгенографию органов грудной клетки, ЭХО-КГ, КТ-ангиографию аорты и ее ветвей, КТ или МРТ головного мозга, УЗИ почек, исследование мочи на наркотики (метамфетамины, кокаин) [269].
- При ГК терапию антигипертензивными лекарственными препаратами внутривенно рекомендуется проводить не позднее 15 минут от момента поступления в стационар [22, 278].
ЕОК/ЕОАГ нет (УУР A, УДД 1)
Комментарии. При лечении гипертонического криза для своевременной коррекции терапии в соответствии с изменениями АД оптимальным представляется в/в назначение препарата с коротким периодом полувыведения. Быстрое неконтролируемое снижение АД не рекомендовано, так как может привести к осложнениям [277].
У пациентов со злокачественной АГ можно рассмотреть осторожное пероральное назначение иАПФ, БРА или ББ, так как почечная ишемия приводит к активации РААС. Лечение следует начинать с очень низких доз в условиях стационара, поскольку такие пациенты могут быть очень чувствительны к данным препаратам.
Для лечения ГК используются следующие парентеральные препараты:
— Вазодилататоры:
o нитроглицерин (предпочтителен при ОКС и острой левожелудочковой недостаточности);
o нитропруссид натрия (является препаратом выбора при острой гипертонической энцефалопатии).
— ИАПФ: эналаприлат (предпочтителен при острой левожелудочковой недостаточности);
— ББ (метопролол предпочтителен при расслаивающей аневризме аорты и ОКС);
— диуретики (фуросемид при острой левожелудочковой недостаточности);
— альфа-адреноблокаторы (урапидил);
— нейролептики (дроперидол).
- В остром периоде инсульта вопрос о необходимости снижения АД и его оптимальной величине рекомендуется решать совместно с врачом-неврологом, индивидуально для каждого пациента [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Пациенты с инсультом требуют особого подхода, т.к. избыточное и/или быстрое снижение АД может привести к нарастанию ишемии головного мозга.
- В большинстве других случаев врачам рекомендуется обеспечить быстрое, но не более чем на 25% от исходных значений, снижение АД за первые 2 часа от момента поступления в стационар [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Рекомендуются следующие сроки и выраженность снижения АД [270, 278]:
— У пациентов со злокачественной АГ с или без почечной недостаточности среднее давление должно быть снижено на 20–25% от исходного в течение нескольких часов
— У пациентов с гипертонической энцефалопатией рекомендовано немедленное снижение среднего АД на 20–25% от исходного
— У пациентов с ОКС рекомендовано немедленное снижение САД ниже 140 мм рт. ст.
— У пациентов с кардиогенным отеком легких рекомендовано немедленное снижение САД ниже 140 мм рт. ст.
— У пациентов с расслоением аорты рекомендовано немедленное снижение САД ниже 120 мм рт. ст. и ЧСС ниже 60 уд/мин.
— У пациенток с эклампсией и тяжелой преэклампсией или HELLP-синдромом рекомендовано немедленное снижение САД ниже 160 мм рт. ст. и ДАД ниже 105 мм рт. ст.
Пациенты с ГК являются группой высокого риска [279, 280] и должны быть скринированы на наличие вторичной АГ. Выписка из стационара осуществляется при достижении безопасного стабильного уровня АД на фоне перорального приема препаратов. Наблюдение в амбулаторных условиях следует проводить хотя бы раз в месяц до достижения целевого АД. Далее рекомендуется длительное регулярное наблюдение специалистом.
Медицинская реабилитация
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- Для всех пациентов с АГ рекомендована разработка индивидуального плана реабилитационных мероприятий, включающий в себя рекомендации по достижению целевого АД, самоконтролю АД, повышению приверженности к лечению, питанию, физической активности, контролю веса [287].
ЕОК/ЕОАГ нет (УУР B, УДД 2)
- С целью снижения риска сердечно-сосудистых осложнений всем пациентам с АГ рекомендованы, по крайней мере, 150 мин (2 часа 30 мин) в неделю аэробной физической активности умеренной интенсивности или 75 мин (1 час 15 мин) в неделю аэробной физической активности высокой интенсивности [281, 300-301].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
Комментарии. Умеренная физическая нагрузка — это такая нагрузка, которую можно выдержать в течение 1 часа, а интенсивная физическая нагрузка та, при которой через 30 минут появляется усталость [281]. Во время проведения физических нагрузок обязателен контроль АД.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Динамическое наблюдение — чрезвычайно важная составляющая медицинской помощи пациентам с АГ, задачами которого являются: поддержание целевых уровней АД, контроль выполнения врачебных рекомендаций по коррекции ФР, контроль за соблюдением режима приема АГП, оценка состояния органов-мишеней.
При стабильном течении АГ приемлемой альтернативой визитам в медицинское учреждение могут быть ДМАД [292, 294–296].
Все рекомендации, даваемые пациенту, должны быть ясными, четкими и соответствовать его интеллектуальному уровню.
С целью обеспечить осознанное участие пациента в лечебно-профилактическом процессе и повысить эффективность лечения целесообразно для ряда пациентов, для которых устных рекомендаций недостаточно, продублировать их в письменном виде.
- Всем пациентам с высоким нормальным АД (130–139/85–89 мм рт. ст.) рекомендуется изменение образа жизни [21, 22, 98].
ЕОК/ЕОАГ IА (УУР C, УДД 5)
- Рекомендуется всем пациентам с АГ в рамках диспансерного наблюдения проводить оценку факторов риска и ПОМ не реже, чем 1 раз в год [21].
ЕОК/ЕОАГ нет (УУР 5, УДД С)
Комментарии. У пациентов с высоким нормальным АД или АГ «белого халата» нередко выявляются дополнительные факторы риска, ПОМ, а также высокий риск развития устойчивой АГ [282–286], поэтому даже при отсутствии лечения пациентов необходимо регулярно наблюдать (по крайней мере, ежегодно) для оценки клинического АД, АД, измеренного вне медицинского учреждения и СС риска. При ежегодных визитах следует обращать внимание на рекомендации по изменению образа жизни, которые являются методом адекватной терапии таких пациентов.
- Всем пациентам с АГ, которым была назначена АГТ, рекомендуется проводить плановые визиты к врачу для оценки переносимости, эффективности и безопасности лечения, а также контроля выполнения врачебных рекомендаций [21, 289, 290].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
Комментарии. Визиты проводятся с интервалом в 3–4 недели до достижения целевого уровня АД (при отсутствии других причин более частых визитов). Целевое АД должно быть достигнуто в течение 3 месяцев.
- Всем пациентам с АГ, принимающим АГТ, при ее недостаточной эффективности рекомендуется производить замену ранее назначенного АГП или присоединять другой АГП. При отсутствии эффективного снижения АД на фоне 2-компонентной терапии рекомендуется присоединение третьего препарата (одним из трех препаратов, как правило, должен быть диуретик) с обязательным последующим контролем эффективности, безопасности и переносимости комбинированной терапии [21].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Целевые уровни АД являются рекомендованными для достижения в каждой подгруппе пациентов, но важнейшим принципом их достижения является соблюдение безопасности и сохранения качества жизни пациента. Поэтому скорость достижения целевых значений и степень снижения АД могут быть скорректированы у конкретного пациента в зависимости от конкретной клинической ситуации. При этом плохая переносимость снижения АД может быть основанием для более медленной титрации доз и числа назначаемых препаратов, равно как и при хорошей переносимости АД может быть снижено до более низких значений, чем рекомендовано в среднем. Недостижение целевого АД в указанные сроки не является ошибочным, если это продиктовано клинической необходимостью. Если врач считает, что препятствием к достижению целевого АД является плохая приверженность пациента, это должно находить отражение в медицинской документации и должны быть предприняты и зафиксированы меры по повышению приверженности. В этих случаях недостижение целевого уровня не должно считаться дефектом оказания помощи.
- Пациентам с высоким и очень высоким сердечно-сосудистым риском (таблица П10, Приложение Г2 и таблица П12, Приложение Г2), а также для пациентов, получающих только немедикаментозное лечение, и для лиц с низкой приверженностью к лечению после достижения целевого уровня АД на фоне проводимой терапии последующие визиты к врачу рекомендуется проводить не реже, чем один раз в 3 месяца; визиты для пациентов со средним и низким риском, которые регулярно измеряют АД дома, рекомендуется проводить с интервалом в 4–6 месяцев [288].
ЕОК/ЕОАГ нет (УУР С, УДД 2)
- Пациентам с АГ для повышения приверженности к проводимой АГТ рекомендуется проведение ДМАД и ведение дневников с указанием доз принимаемых препаратов и уровня АД [21, 289, 290].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
- Пациентам с АГ для повышения эффективности и приверженности к проводимой АГТ рекомендуется проведение телемониторинга показателей системной гемодинамики с телеметрической передачей результатов измерения АД непосредственно в лечебное учреждение для оперативной обработки информации и оперативного принятия решения [291–293].
ЕОК/ЕОАГ нет (УУР В, УДД 1)
- Рекомендуется при динамическом наблюдении особое внимание уделять показателям АД в ночные часы (особенно у пациентов с метаболическим синдромом (МС), сахарным диабетом (СД), синдромом обструктивного апноэ во время сна (СОАС), хронической болезнью почек (ХБП) 3–5-й ст.) и ранние утренние часы с целью снижения риска таких осложнений, как ИМ, инсульт [21, 34, 35].
ЕОК/ЕОАГ нет (УУР В, УДД 2)
Информация
Источники и литература
-
Клинические рекомендации Российского кардиологического общества
- 1. Rosenberg WM, Gray JA et al. Evidence based medicine: what it is and what it isn’t. BMJ 1996, January; 312 (7023): 71–72. 2. Федеральный закон от 21.11.2011 № 323-ФЗ (ред. от 03.04.2017) «Об основах охраны здоровья граждан в Российской Федерации». 3. Эпидемиологический словарь, 4-е издание. Под ред. Джона М. Ласта для Международной эпидемиологической ассоциации. М., 2009. 316 с.
4. Федеральное агентство по техническому регулированию и метрологии. Национальный стандарт Российской Федерации. ГОСТР 52379-2005. Надлежащая клиническая практика. Москва, 2005 5. Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 03.07.2016) «Об обращении лекарственных средств».
6. Jansen RW, Lipsitz LA. Postprandial hypotension: epidemiology, pathophysiology, and clinical management. Ann Int Med 1995;122(4):286–295. 7. Малая медицинская энциклопедия. М.: Медицинская энциклопедия, 1991—96 гг. [Электронный ресурс]. Режим доступа:http://dic.academic.ru/dic.nsf/enc_medicine/28878/Синдром 8. Андреева Н. С., Реброва О. Ю., Зорин Н. А. и др. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор. 2012. №. 4. С. 10–24.
9. Общероссийская общественная организация «Российская ассоциация геронтологов и гериатров». Клинические рекомендации «Старческая астения». 2018. 10. Rapsomaniki E et al. Blood pressure and incidence of twelve cardiovascular diseases: lifetime risks, healthy life-years lost, and age-specific associations in 1• 25 million people. The Lancet 383.9932 (2014):1899–1911. 11. Ehret GB, Caulfield MJ. Genes for blood pressure: an opportunity to understand hypertension. Eur Heart J 2013;34:951–961. 12. Elliott P, Stamler J, Nichols R, et al. Intersalt revisited: further analyses of 24 hour sodium excretion and blood . pressure within and across populations. Intersalt Cooperative Research Group. . BMJ 1996;312:1249–1253. 13. Кушаковский М. С. Эссенциальная гипертензия (гипертоническая болезнь). Причины, механизмы, клиника, лечение. СПб., 2002. 14. Ланг Г. Ф. Гипертоническая болезнь. М.: Медгиз, 1950. 459 с. 15. Постнов Ю. В., Орлов С. Н. Первичная гипертензия как патология клеточных мембран. М.: Медицина, 1987. 192 с. 16. Мясников А. Л. Гипертоническая болезнь. М.: Медгиз, 1954. 17. Распространенность факторов риска неинфекционных заболеваний в российской популяции в 2012–2013 гг. Результаты исследования ЭССЕ-РФ. Кардиоваскулярная терапия и профилактика 2014; 13(6):4–11. 18. Бойцов С. А., Баланова Ю. А., Шальнова С. А., Деев А. Д. и др. Артериальная гипертония среди лиц 25–64 лет: распространенность, осведомленность, лечение и контроль. По материалам исследования ЭССЕ. Кардиоваскулярная терапия и профилактика. 2014;4:4-14.do1.org/10.15829/1728-8800-2014-4-4-14. 19. Kearney PM, Whelton M, Reynolds K, et al. Global burden of hypertension: analysis of worldwide data. Lancet 2005;365:217–223. 20. Franklin SS, Lopez VA, Wong ND, et al. Single versus combined blood pressure components and risk for cardiovascular disease: the Framingham Heart Study. Circulation 2009;119:243–250. 21. Williams B, Mancia G, Spiering W et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. JHypertens 2018;36(10):1953–2041.
22. Чазова И. Е., Жернакова Ю. В. [от имени экспертов]. Клинические рекомендации. Диагностика и лечение артериальной гипертонии. Системные гипертензии. 2019;16 (1):6–31. 23. Lewington S, Clarke R, Qizilbash N et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903–1913. 24. Lip GYH, Coca A, Kahan T, et al. Hypertension and cardiac arrhythmias: executive summary of a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Eur Heart J Cardiovasc Pharmacother 2017;3:235–250. 25. Gottesman RF, Albert MS, Alonso A, et al. Associations between midlife vascular risk factors and 25-year incident dementia in the Atherosclerosis Risk in Communities (ARIC) cohort. JAMA Neurol 2017;74:1246–1254. 26. Rovio SP, Pahkala K, Nevalainen J et al. Cardiovascular risk factors from childhood and midlife cognitive performance: the Young Finns study. J Am Coll Cardiol 2017;69:2279–2289. 27. Vishram JK, Borglykke A, Andreasen AH, et al, MORGAM Project. Impact of age on the importance of systolic and diastolic blood pressures for stroke risk: the MOnica, Risk, Genetics, Archiving, and Monograph (MORGAM) project. Hypertension 2012;60:1117–1123. 28. Brown DW, Giles WH, Greenlund KJ. Blood pressure parameters and risk of fatal stroke, NHANES II mortality study. Am J Hypertens 2007;20:338–341. 29. Franklin SS, Khan SA, Wong ND, et al. Is pulse pressure useful in predicting risk for coronary heart disease? The Framingham heart study. Circulation 1999;100:354–360. 30. Domanski M, Mitchell G, Pfeffer M, Neaton JD, Norman J, Svendsen K, Grimm R, Cohen J, Stamler J, MRFIT Research Group. Pulse pressure and cardiovascular disease-related mortality: follow-up study of the Multiple Risk Factor Intervention Trial (MRFIT). JAMA 2002;287:2677–2683. 31. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Меморандум экспертов Российского кардиологического общества по рекомендациям Европейского общества кардиологов/Европейского общества по артериальной гипертензии по лечению артериальной гипертензии 2018 г. Российский кардиологический журнал. 2018;(12):131–42. 32. Lewington S, Clarke R, Qizilbash N, et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002; 360:1903–1913.
33. Reino-Gonzalez S. et al. How in-office and ambulatory BP monitoring compare: A systematic review and meta-analysis. – 2017. 34. Kollias A., Ntineri A., Stergiou G. S. Association of night-time home blood pressure with night-time ambulatory blood pressure and target-organ damage: a systematic review and meta-analysis //Journal of hypertension. – 2017. – Т. 35. – №. 3. – С. 442-452. 35. Fagard RH, Celis H, Thijs L, et al. Daytime and night-time blood pressure as predictors of death and cause-specific cardiovascular events in hypertension. Hypertension 2008; 51:55–61. 36. Ward AM, Takahashi O, Stevens R, Heneghan C. Home measurement of blood pressure and cardiovascular disease: systematic review and meta-analysis of prospective studies. J Hypertens 2012; 30:449–456. 37. Mancia G, Facchetti R, Bombelli M, et al. Long-term risk of mortality associated with selective and combined elevation in office, home and ambulatory blood pressure. Hypertension 2006; 47:846–853. 38. Fagard RH, Cornelissen VA. Incidence of cardiovascular events in white-coat, masked and sustained hypertension vs. true normotension: a meta-analysis. J Hypertens 2007; 25:2193–219. 39. Rimoldi SF, Scherrer U, Messerli FH. Secondary arterial hypertension: when, who, and how to screen? Eur Heart J 2014;35:1245–1254. 40. Albasri A. et al. A comparison of blood pressure in community pharmacies with ambulatory, home and general practitioner office readings: systematic review and meta-analysis //Journal of hypertension. – 2017. – Т. 35. – №. 10. – С. 1919. 41. Clark CE, Taylor RS, Shore AC, et al. Association of a difference in systolic blood pressure between arms with vascular disease and mortality: a systematic review and meta-analysis. Lancet 2012;379:905–914. 42. Sega R, Facchetti R, Bombelli M, et al.Prognostic value of ambulatory and home blood pressures compared with office blood pressure in the general population: follow-up results from the Pressioni Arteriose Monitorate e Loro Associazioni (PAMELA) study. Circulation 2005;111:1777–1783. 43. Shi Y. et al. Resting heart rate and the risk of hypertension and heart failure: a dose–response meta-analysis of prospective studies //Journal of hypertension. – 2018. – Т. 36. – №. 5. – С. 995-1004. 44. Salles GF, Reboldi G, Fagard RH, et al. Prognostic effect of the nocturnal blood pressure fall in hypertensive patients: the Ambulatory Blood pressure Collaboration in patients with Hypertension (ABC-H) meta-analysis. Hypertension 2016;67:693–700.
45. Ward AM, Takahashi O, Stevens R, Heneghan C. Home measurement of blood pressure and cardiovascular disease: systematic review and meta-analysis of prospective studies. J Hypertens 2012;30:449–56. 46. Tucker KL, Sheppard JP, Stevens R et al. Self-monitoring of blood pressure in hypertension: a systematic review and individual patient data meta-analysis. PLoS Med 2017;14:e1002389. 47. Parati G, Stergiou G, O’Brien E, et al, European Society of Hypertension Working Group on Blood Pressure Monitoring and Cardiovascular Variability. European Society of Hypertension practice guidelines for ambulatory blood pressure monitoring. J Hypertens 2014;32:1359–1366. 48. Sehestedt T, Jeppesen J, Hansen TW, et al. Risk prediction is improved by adding markers of subclinical organ damage to SCORE. Eur Heart J 2010;31:883–891. 49. Volpe M, Battistoni A, Tocci G, et al. Cardiovascular risk assessment beyond systemic coronary risk estimation: a role for organ damage markers. J Hypertens 2012;30:1056–1064. 50. Conroy, R. M., et al. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. European heart journal 24.11 (2003): 987–1003. 51. Hunt SC, Williams RR, Barlow GK. A comparison of positive family history definitions for defining risk of future disease. J Chronic Dis 1986; 39:809–821. 52. Friedman GD, Selby JV, Quesenberry CP Jr, et al Precursors of essential hypertension: body weight, alcohol and salt use and parental history of hypertension. Prev Med 1988;17:387–402. 53. Дедов И. И. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Сахарный диабет 1S (2019). 54. Cosentino F, Grant P, Aboyans V et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: The Task Force for diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD). Eur Heart J 2019, published online on 31 August 2019. 55. Emerging Risk Factors Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. The Lancet 375.9733 (2010): 2215–2222. 56. Wilson PW, Cupples CF, Kannel WB. Is hyperglycemia associated with cardiovascular disease? The Framingham Study. Amer. Heart J 1991;121:586–90. 57. Izzo R, de Simone G, Trimarco V. et al. Hypertensive target organ damage predicts incident diabetes mellitus. EurHeartJ. epub 27 June 2013. 58. Matsushita K. et al. Comparison of risk prediction using the CKD-EPI equation and the MDRD study equation for estimated glomerular filtration rate //Jama. – 2012. – Т. 307. – №. 18. – С. 1941-1951.
59. Ettehad D, Emdin CA, Kiran A, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet 2016;387:957–967. 60. De Haan M. W. et al. Renovascular disease in patients with hypertension: detection with duplex ultrasound //Journal of human hypertension. – 2002. – Т. 16. – №. 7. – С. 501. 61. Mahmoodi, Bakhtawar K., et al. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without hypertension: a meta-analysis. The Lancet 380.9854 (2012):1649–1661. 62. Van Der Velde M. et al. Lower estimated glomerular filtration rate and higher albuminuria are associated with all-cause and cardiovascular mortality. A collaborative meta-analysis of high-risk population cohorts. Kidney international 79.12 (2011): 1341–1352. 63. Earley A, Miskulin D, Lamb EJ et al. Estimating equations for glomerular filtration rate in the era of creatinine standardization: a systematic review. Ann Intern Med 2012; 156: 785–795. 64. Zachrisson K. et al. Duplex ultrasound for identifying renal artery stenosis: direct criteria re-evaluated //Acta Radiologica. – 2017. – Т. 58. – №. 2. – С. 176-182. 65. Matsushita K. et al. Kidney measures beyond traditional risk factors for cardiovascular prediction: A collaborative meta-analysis //The lancet. Diabetes & endocrinology. – 2015. – Т. 3. – №. 7. – С. 514. 66. Gerstein HC, Mann JF, Yi Q, Zinman B, et al. HOPE Study Investigators. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA 2001;286:421–426. 67. Boekholdt SM et al. Association of LDL cholesterol, non–HDL cholesterol, and apolipoprotein B levels with risk of cardiovascular events among patients treated with statins: a meta-analysis //Jama. — 2012. — Т. 307. — №. 12. — С. 1302-1309. 68. Guo X. et al. Prehypertension: a meta-analysis of the epidemiology, risk factors, and predictors of progression //Texas heart institute journal. – 2011. – Т. 38. – №. 6. – С. 643. 69. Geleijnse JM, Kok FJ, Grobbee DE. Blood pressure response to changes in sodium and potassium intake: a metaregression analysis of randomised trials. Journal of human hypertension 17.7(2003):471. 70. Macdonald JE, Struthers AD. hat is the optimal serum potassium level in cardiovascular patients? Journal of the American College of Cardiology 43.2 (2004):155–161. 71. Wang J. et al. Hyperuricemia and risk of incident hypertension: a systematic review and meta-analysis of observational studies //PloS one. – 2014. – Т. 9. – №. 12. – С. e114259. 72. Grayson PC et al. Hyperuricemia and incident hypertension: a systematic review and meta‐analysis.. Arthritis care & research 63.1 (2011):102–110.
73. Palmer TM et al. Association of plasma uric acid with ischaemic heart disease and blood pressure: mendelian randomisation analysis of two large cohorts. Bmj 347 (2013): f4262. 74. Schillaci, G., Battista, F., & Pucci, G. (2012). A review of the role of electrocardiography in the diagnosis of left ventricular hypertrophy in hypertension. Journal of electrocardiology, 45(6), 617–623. 75. Kahn S, Frishman WH, Weissman S et al. Left ventricular hypertrophy on electrocardiogram: prognostic implications from a 10-year cohort study of older subjects: a report from the Bronx Longitudinal Aging Study. J Am Geriatr Soc 1996;44:524–529. 76. Lonn E, Mathew J, Pogue J et al. Relationship of electrocardiographic left ventricular hypertrophy to mortality and cardiovascular morbidity in high-risk patients. Eur J Cardiovasc Prevent Rehab. 2003;10:420–428. 77. Bacharova L, Schocken D, Estes EH, Strauss D. The role of ECG in the diagnosis of left ventricular hypertrophy. Curr Cardiol Rev 2014;10:257–261. 78. Lehtonen AO, Puukka P, Varis J et al. Prevalence and prognosis of ECG abnormalities in normotensive and hypertensive individuals. J Hypertens 2016;34:959–966.
- 1. Rosenberg WM, Gray JA et al. Evidence based medicine: what it is and what it isn’t. BMJ 1996, January; 312 (7023): 71–72. 2. Федеральный закон от 21.11.2011 № 323-ФЗ (ред. от 03.04.2017) «Об основах охраны здоровья граждан в Российской Федерации». 3. Эпидемиологический словарь, 4-е издание. Под ред. Джона М. Ласта для Международной эпидемиологической ассоциации. М., 2009. 316 с.
Информация
Список сокращений
АГ — артериальная гипертензия
АГП — антигипертензивные препараты
АГТ — антигипертензивная лекарственная терапия
АГЭ — антигипертензивный эффект
АД — артериальное давление
АИР — агонисты имидазолиновых рецепторов
АК — антагонисты кальция (блокаторы кальциевых каналов)
АКС — ассоциированное клиническое состояние
АЛТ — аланинаминотрансфераза
АМКР — антагонисты минералокортикоидных рецепторов
АПФ — ангиотензинпревращающий фермент
АСТ — аспартатаминотрансфераза
БА — бронхиальная астма
ББ — бета-адреноблокатор
БРА — блокатор рецепторов ангиотензина
БСК — болезни системы кровообращения
ГБ — гипертоническая болезнь
ГК — гипертонический криз
ГКС — глюкокортикостероиды
ГЛЖ — гипертрофия левого желудочка
ДАД — диастолическое артериальное давление
ДМАД — домашнее мониторирование артериального давления
ЕОК/ЕОАГ — Европейское общество кардиологов/Европейское общество артериальной гипертонии
ИААГ — изолированная амбулаторная артериальная гипертензия
ИАПФ — ингибитор ангиотензинпревращающего фермента
ИБС — ишемическая болезнь сердца
ИММЛЖ — индекс массы миокарда левого желудочка
ИМТ — индекс массы тела
ИСАГ — изолированная систолическая артериальная гипертензия
КТ — компьютерная томография
ЛЖ — левый желудочек
ЛП — левое предсердие
ЛПИ — лодыжечно-плечевой индекс
МРТ — магнитно-резонансная томография
МС — метаболический синдром
НТГ — нарушенная толерантность к глюкозе
ОК — оральные контрацептивы
ОКС — острый коронарный синдром
ОПСС — общее периферическое сосудистое сопротивление
ОХС — общий холестерин
ОЦК — объем циркулирующей крови
ПД — пульсовое давление
ПОМ — поражение органов-мишеней
РААС — ренин-ангиотензин-альдостероновая система
РКИ — рандомизированные клинические исследования
РФ — Российская Федерация
САД — систолическое артериальное давление
САС — симпато-адреналовая система
СД — сахарный диабет
СКФ — скорость клубочковой фильтрации
СМАД — суточное мониторирование артериального давления
СНС — симпатическая нервная система
СОАС — синдром обструктивного апноэ во время сна
СПВ — скорость пульсовой волны
СС — сердечно-сосудистый
ССЗ — сердечно-сосудистые заболевания
ССО — сердечно-сосудистые осложнения
ТГ — триглицериды
ТИА — транзиторная ишемическая атака
УДД — уровень достоверности доказательств
УЗИ — ультразвуковое исследование
УУР — уровень убедительности рекомендаций
ФВ — фракция выброса
ФК — функциональный класс
ФП — фибрилляция предсердий
ФР — фактор риска
ХБП — хроническая болезнь почек
ХОБЛ — хроническая обструктивная болезнь легких
ХПН — хроническая почечная недостаточность
ХС ЛВП — холестерин липопротеинов высокой плотности
ХС ЛНП — холестерин липопротеинов низкой плотности
ХСН — хроническая сердечная недостаточность
ЦАД — центральное артериальное давление
ЦВБ — цереброваскулярная болезнь
ЧСС — частота сердечных сокращений
ЭД — эректильная дисфункция
ЭКГ — электрокардиограмма
ЭхоКГ — эхокардиография
CKD-EPI — ChronicKidneyDiseaseEpidemiology Collaboration
ESC/ESH — European society of cardiology/European society of hypertension
MDRD — Modification of Diet in Renal Disease
SCORE — Systemic coronary risk evaluation
Термины и определения
Артериальная гипертензия (АГ) — синдром повышения клинического артериального давления (АД) при гипертонической болезни и симптоматических АГ выше пороговых значений, определенных в результате эпидемиологических и рандомизированных контролируемых исследований, продемонстрировавших связь с повышением сердечно-сосудистого риска и целесообразность и пользу лечения, направленного на снижение АД ниже этих уровней АД.
АГ у молодых — повышение АД выше пороговых значений у лиц моложе 50 лет
Высокое нормальное АД — давление в диапазоне систолического АД (САД) от 130 до 139 мм рт. ст. и/или диастолического АД (ДАД) от 85 до 89 мм рт. ст.
Гипертония белого халата — форма АГ, при которой повышение АД ≥140 и/или ≥90 мм рт. ст. отмечается только на приеме у врача, а при измерении АД методом домашнего мониторирования АД (ДМАД) и/или суточного мониторирования АД (СМАД) показатели АД — в пределах нормальных значений. Доказательная медицина — надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в сочетании с индивидуальным клиническим опытом и c учетом ценностей и предпочтений пациента в процессе принятия решений о состоянии здоровья и лечении пациента [1].
Заболевание — состояние, возникающее в связи с воздействием патогенных факторов, нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма [2].
Изолированная систолическая АГ–повышение САД ≥140 мм рт. ст. при уровне ДАД <90 мм рт. ст.
Исход — любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства [3].
Клиническое исследование — любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов и/или выявления нежелательных реакций на исследуемые продукты, и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность [4].
Конфликт интересов — ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента [2].
Лекарственные препараты — лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности [5].
Маскированная (скрытая) АГ — форма гипертонии, особенностью которой являются нормальные показатели клинического АД (<140/90 мм рт. ст.) и повышенные — по данным СМАД и/или ДМАД.
Медицинское вмешательство — выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности [2].
Изменение образа жизни — мероприятия, направленные на нормализацию веса и характера питания, двигательной активности, целью которых является снижение сердечно-сосудистого риска.
Оптимальное АД — САД менее 120 ммрт. ст. и/или ДАД менее 80 мм рт. ст.
Очень пожилые пациенты — пациенты в возрасте ≥ 80 лет. Пациент — физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния [2].
Нормальное АД — давление в диапазоне САД 120–129 мм рт. ст. и/или ДАД 80–84 мм рт. ст.
Пожилые пациенты — пациенты, которым от 65 лет до 79 лет.
Постпрандиальная гипотензия — снижение систолического АД более, чем на 20 мм рт. ст. в течение двух часов после приема пищи при нахождении в положении лежа или сидя [6].
Постуральная гипотензия — снижение САД на 20 мм рт. ст. и более и/или ДАД — на 10 мм рт. ст. и более в первые 3 мин при переходе из горизонтального в вертикальное положение.
Псевдорезистентная АГ — случаи резистентной АГ, в которых не могут быть исключены причины плохого контроля АД: эффект «белого халата», плохая приверженность к лечению, неправильно подобранная терапия, неправильное измерениеАД, выраженная кальцификация артерий, регулярный прием препаратов, повышающих АД, факторы образа жизни, наличие синдрома обструктивного апноэ во время сна.
Пульсовое давление — разница между САД и ДАД.
Рабочая группа по разработке/актуализации клинических рекомендаций — коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций и несущих общую ответственность за результаты данной работы.
Резистентная АГ — диагностируется в случаях, когда назначение трех антигипертензивных препаратов (включая диуретик) в оптимальных или максимально переносимых дозах не приводит к достижению целевого АД ниже 140 и/или 90 мм рт. ст. у приверженных к лечению пациентов. При этом отсутствие контроля АД подтверждено измерением АД вне медицинского учреждения (СМАД или ДМАД), а вторичные причины АГ исключены.
Синдром — устойчивая совокупность ряда симптомов с единым патогенезом [7].
Состояние — изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи [2].
Уровень достоверности доказательств — степень уверенности в том, что полученный эффект от применения медицинского вмешательства является истинным [8].
Уровень убедительности рекомендаций — степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [8].
Фиксированная комбинация лекарственных препаратов — сочетание двух и более разных классов препаратов в одной таблетке.
Хроническая болезнь почек — наднозологическое понятие, объединяющее всех пациентов с признаками повреждения почек и/или снижением функции, оцениваемой по величине скорости клубочковой фильтрации, которые сохраняются в течение 3 и более месяцев.
Хроническая алкогольная интоксикация — комплекс физиологических, поведенческих и когнитивных явлений, при которых употребление алкогольных напитков начинает занимать более важное место в системе ценностей человека, чем другие формы поведения, которые ранее были более важными для него.
Синдром старческой астении — гериатрическийсиндром, характеризующийся возраст-ассоциированным снижением физиологического резерва и функций многих систем организма, приводящий к повышенной уязвимости организма пожилого человека к воздействию эндо- и экзогенных факторов и высокому риску развития неблагоприятных исходов для здоровья, потери автономности и смерти [9].
Целевой уровень АД — уровень АД, различный для разных групп пациентов с АГ, достижение которого в процессе лечения позволяет добиться наиболее благоприятного соотношения польза (снижение сердечно-сосудистого (СС) риска) — риск (неблагоприятные эффекты).
Организация оказания медицинской помощи
Показания для плановой госпитализации:
- неясность диагноза и необходимость в специальных методах исследования (использование диагностических процедур, проведение которых невозможно или нецелесообразно в условиях поликлиники) для уточнения причины повышения АД (исключение симптоматических АГ);
- трудности в подборе медикаментозной терапии (сочетанная патология, частые гипертонические кризы);
- рефрактерная АГ.
Показания для экстренной госпитализации:
- гипертонический криз, не купирующийся на догоспитальном этапе;
- гипертонический криз при феохромоцитоме;
- гипертонический криз с выраженными явлениями гипертонической энцефалопатии;
- осложнения АГ, требующие интенсивной терапии: инсульт, ОКС, субарахноидальное кровоизлияние, острые нарушения зрения, отек легких, расслоение аорты, почечная недостаточность, эклампсия.
Показания к выписке пациента из стационара:
- установленный диагноз симптоматической АГ или ГБ с использованием специальных методов исследования при уточнении причины повышения АД;
- подобранная медикаментозная терапия при сочетанной патологии и/или частых гипертонических кризах с достижением целевого уровня АД или снижение АД на 25–30% от исходных значений на момент выписки из стационара;
- купированный гипертонический криз, отсутствие осложнений, требующих интенсивной терапии, стабилизация уровня АД.
Иные организационные технологии
При анализе работы медицинской организации с пациентами с АГ целесообразно анализировать следующие показатели:
- процент пациентов, достигших целевого АД менее 140/90 мм рт. ст. и 130/80 мм рт. ст. через 3, 6 и 12 месяцев наблюдения;
- процент пациентов, получающих комбинированную антигипертензивную терапию.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Снижение АД, достижение и удержание его на целевом уровне является ключевым фактором, влияющим на прогноз и улучшающим сердечно-сосудистые исходы у пациентов с АГ.
Другими важными целями при лечении АГ являются:
— максимальное снижение риска развития ССО и смерти;
— коррекция всех модифицируемых ФР (курение, дислипидемия, гипергликемия, ожирение);
— предупреждение, замедление темпа прогрессирования и/или уменьшение ПОМ;
— лечение сопутствующих заболеваний (ИБС, ХСН, СД, ФП, ХБП).
Критерии оценки качества медицинской помощи
| № | Критерий качества |
EОК Класс и уровень |
Да/ нет |
| 1 | Установлен диагноз АГ согласно рекомендациям. Зафиксировано повышение офисного (клинического) АД выше 140 и/или 90 мм рт. ст. на повторных визитах, либо на основании СМАД (среднее за 24 часа ≥130 мм и/или ≥80 мм рт. ст.) | IA | Да/нет |
| 2 | Выполнен общий анализ крови | — | Да/нет |
| 3 | Выполнен биохимический анализ крови (креатинин, расчетная скорость клубочковой фильтрации, глюкоза, калий, натрий, мочевая кислота, ОХ, ЛПНП, ТГ, ЛПВП) | IB | Да/нет |
| 4 | Выполнен общий анализ мочи | IB | Да/нет |
| 5 | Выполнена качественная оценка протеинурии тест-полоской или количественное определение альбуминурии | IB | Да/нет |
| 6 | Выполнена ЭКГ в 12 отведениях | IB | Да/нет |
| 7 | Даны рекомендации по модификации образа жизни (ограничение потребления натрия, увеличение физической активности, снижение избыточной массы тела, отказ от курения, ограничение потребления алкоголя) | IA | Да/нет |
| 8 | Поставлен клинический диагноз с указанием стадии заболевания, степени повышения АД (при отсутствии терапии), категории риска, наличия ПОМ и АКС | — | Да/нет |
| 9 | У пациентов с АГ 1-й степени, относящимся к категориям низкого/среднего риска, начата антигипертензивная лекарственная терапия одним из препаратов рекомендованных классов после 3-го месяца модификации образа жизни | IA | Да/нет |
| 10 | Лицам с АГ второй степени и выше назначена комбинированная двухкомпонентная антигипертензивная терапия сразу после постановки диагноза и проведена ее интенсификация для достижения целевого АД. | IA | Да/нет |
| 11 | Достигнут целевой уровень САД<140 мм рт. ст. и ДАД < 90 мм рт. ст. через 3 месяца от начала лечения. При недостижении целевого АД приведено объяснение необходимости индивидуального уровня АД и скорости его снижения (плохая переносимость, побочные эффекты лекарственной терапии, низкая приверженность пациента к лечению, включая невыполнения рекомендаций врача, необходимость ревизии поставленного диагноза для исключения симптоматической АГ, наличие сопутствующей патологии или лекарственной терапии, затрудняющей контроль АД) | IA | Да/нет |
| 12 | Пациент взят под диспансерное наблюдение | — | Да/нет |
Типичными дефектами при оказании медицинской помощи пациентам с АГ являются:
при сборе анамнеза:
• не уточнены характер начала заболевания, продолжительность, особенности течения заболевания;
• отсутствуют сведения об эффективности ранее проводимой терапии, о возможном приеме пациентами других, помимо антигипертензивных, лекарственных препаратов: глюкокортикоидных гормонов, цитостатиков, нестероидных противовоспалительных препаратов, оральных контрацептивов и др.
• отсутствуют сведения о наличии менопаузы у женщин, характере питания, статусе курения, семейном анамнезе ранних сердечно-сосудистых заболеваний, осложнений АГ;
• отсутствие сведений о наличии предшествующих госпитализаций.
при обследовании пациентов:
• неполное физическое, лабораторное и инструментальное обследование, что приводит к недооценке возможности наличия симптоматической АГ, неверной оценке ПОМ и СС риска;
• отсутствие развернутого клинического диагноза, с указанием стадии гипертонической болезни, степени повышения АД (степени АГ при впервые выявленной АГ), с максимально полным отражением ФР, ПОМ, ССЗ, ХБП и категории сердечно-сосудистого риска;
• необоснованное и неверное установление стадии ГБ и степени АГ, категории риска;
• отсутствие сведений о наличии у пациента ПОМ, сопутствующих заболеваний и факторов риска;
при проведении лечения:
• измерение АД на высоте эффекта АГТ;
• назначение нерациональных комбинаций АГП, в неверном режиме и отсутствие интенсификации антигипертензивной терапии;
• недооценка наличия сопутствующей патологии, влияющей на выбор антигипертензивной терапии;
при обеспечении преемственности:
• отсутствие назначения повторных визитов для контроля АД;
• несвоевременная постановка на диспансерный учет;
• нерегулярность диспансерных осмотров.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Президиум рабочей группы:
- Кобалава Ж. Д.
- Конради А. О.
- Недогода С. В.
- Шляхто Е. В.
Другие члены рабочей группы:
- Арутюнов Г. П.,
- Баранова Е. И.,
- Барбараш О. Л.,
- Бойцов С. А.,
- Вавилова Т. В.,
- Виллевальде С. В.,
- Галявич А. С.,
- Глезер М. Г.,
- Гринева Е. Н.,
- Гринштейн Ю. И.,
- Драпкина О. М.,
- Жернакова Ю. В.,
- Звартау Н. Э.,
- Кисляк О. А.,
- Козиолова Н. А.,
- Космачева Е. Д.,
- Котовская Ю. В.,
- Либис Р. А.,
- Лопатин Ю. М.,
- Небиридзе Д. В.,
- Недошивин А. О.
- Остроумова О. Д.,
- Ощепкова Е. В.,
- Ратова Л. Г.,
- Скибицкий В. В.,
- Ткачева О. Н.,
- Чазова И. Е,
- Чесникова А. И.,
- Чумакова Г. А.,
- Шальнова С. А.,
- Шестакова М. В.,
- Якушин С. С.,
- Янишевский С. Н.
Члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов. В случае сообщения о наличии конфликта интересов член(ы) рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Представленные Рекомендации разработаны на основе Рекомендаций РМОАГ 2019 г. по диагностике и лечению артериальной гипертензии и Рекомендаций по лечению артериальной гипертензии Европейского общества кардиологов 2018 года [28, 29].
В Рекомендациях, основанных на результатах крупнейших эпидемиологических, рандомизированных клинических исследований и метаанализов, обобщены и изложены основные принципы лечения пациентов с АГ в целом и в особых клинических ситуациях. Основная цель Рекомендаций — облегчить принятие решения при выборе оптимальной стратегии лечения конкретного пациента с АГ. Тем не менее окончательное решение о лечении должно быть принято с учетом индивидуальных особенностей механизмов развития и течения заболевания (например, солечувствительность, вторичный гиперальдостеронизм, индивидуальная чувствительность к АГП).
Целевая аудитория данных клинических рекомендаций:
1. Врач-кардиолог.
2. Врач-терапевт.
3. Врач общей практики.
4. Врач-эндокринолог.
5. Врач-невролог
Вследствие того, что члены Российского кардиологического общества входят в состав Европейского общества кардиологов и также являются его членами, все рекомендации Европейского общества кардиологов (ЕОК) формируются с участием российских экспертов, которые являются соавторами европейских рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов. В связи с этим формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающие доступность медицинской помощи. По этой причине в тексте настоящих клинических рекомендаций, одновременно использованы две шкалы оценки достоверности доказательств тезисов рекомендаций: уровни достоверности доказательств ЕОК с УУР и УДД. Добавлены классы рекомендаций ЕОК, позволяющие оценить необходимость выполнения тезиса рекомендаций (Таблицы 1, 2, 3, 4,5 ).
Таблица 1/А2 — Шкала оценки классов рекомендаций Европейского общества кардиологов (ЕОК).
Таблица 2/А2 — Шкала оценки уровней достоверности доказательств Европейского общества кардиологов (ЕОК).
Таблица 3/А2 — Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
Уровни достоверности доказательств (УДД) Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» |
|
| 1 | Систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай–контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 4/А2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 5/А2. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
Уровень убедительности рекомендации (УРР), Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (Зарегистрирован 08.05.2019 № 54588) |
|
| А | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| В | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными). |
| С | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными). |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
1. Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 918н «Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями».
2. Стандарт медицинской помощи больным эссенциальной первичной артериальной гипертензией (при оказании специализированной помощи), утвержден приказом Министерства здравоохранения и социального развития Российской Федерации от 13 июня 2007г. № 419.
3. Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016 г. № 520н «Об утверждении критериев оценки качества медицинской помощи»
4. Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (Зарегистрирован 08.05.2019 № 54588)
Приложение Б. Алгоритмы действий врача
Приложение Б2. Алгоритм лечения АГ I–II стадий
Этот алгоритм подходит для большинства пациентов с ПОМ, а также может быть использован при лечении пациентов с цереброваскулярной болезнью, СД или заболеваниями периферических артерий.
Приложение Б3. Стратегия лекарственной терапии при сочетании АГ и ХБП
1У пациентов с ХБП, получающих антигипертензивную терапию, особенно ИАПФ или БРА, можно ожидать повышения уровня креатинина. Значительное повышение уровня креатинина на фоне назначения блокаторов РААС требует обследования пациента для исключения реноваскулярного заболевания.
2Диуретик — тиазидный или тиазидоподобный диуретик. Оценить целесообразность назначения петлевых диуретиков у пациентов с отеками.
3Риск гиперкалиемии при назначении спиронолактона, особенно при исходной СКФ <45 мл/мин/1,73 м2 и уровне калия 4,5 ммоль/л.
Приложение Б4. Стратегия лекарственной терапии при сочетании АГ и ИБС
Приложение Б5. Стратегия лекарственной терапии при сочетании АГ и ХСН со сниженной ФВ левого желудочка
Приложение Б6. Стратегия лекарственной терапии при сочетании АГ и ФП
Оральные антикоагулянты должны быть назначены по показаниям в соответствии с оценкой риска по CHA2DS2Vasc при отсутствии противопоказаний.
Приложение В. Информация для пациентов
Гипертоническая болезнь — заболевание, основным симптомом которого является повышение артериального давления выше 140/90 мм рт. ст., что приводит к поражению мозга, сердца, почек.
Только 50% людей̆ с повышенным артериальным давлением знают, что больны, из них систематически лечатся далеко не все. Нелеченная гипертоническая болезнь опасна осложнениями, главные из которых — инсульт, инфаркт миокарда, сердечная недостаточность, почечная недостаточность.
Главным фактором снижения риска смерти, инсульта и инфаркта миокарда является контроль АД и поддержание его на уровне как минимум <140/90 мм рт. ст., поэтому важен самоконтроль АД в домашних условиях с использованием сертифицированных аппаратов для измерения АД.
При этом необходимо выполнение следующих правил:
• перед измерением АД необходимы минимум 5 мин отдыха в положении сидя;
• сидеть во время измерения АД нужно с полной опорой стоп на пол, не перекрещивая и не поджимая ноги, положив руку на стол так, чтобы наложенная на плечо манжета была на уровне сердца, спина и рука с манжетой должны быть расслаблены;
• необходимо выполнять минимум 2 последовательных измерения АД утром и вечером ежедневно, хотя бы за 7 дней до планового визита к врачу или после изменения терапии; следует записывать результаты измерений в дневник самоконтроля;
• минимум за 30 мин до измерения АД не следует курить и употреблять кофеинсодержащие напитки;
• во время измерения АД одежда не должна плотно охватывать плечо, создавая складки и дополнительную компрессию.
Пациент и члены его семьи должны владеть методикой измерения АД, уметь вести дневник АД с записью цифр.
Если пациент получает антигипертензивные препараты, он должен быть осведомлен об ожидаемом эффекте, изменениях самочувствия и качестве жизни в ходе терапии, возможных побочных эффектах и способах их устранения.
Пациент должен знать об имеющихся у него и членов его семьи сердечно-сосудистых факторах риска — это курение, избыточная масса тела, психоэмоциональный стресс, малоподвижный образ жизни, повышенный уровень холестерина. Влияние указанных факторов риска может быть снижено. Особенно важна коррекция изменяемых факторов риска при наличии у пациента и членов его семьи некорригируемых факторов риска, к которым относятся: наличие в семейном анамнезе ранних мозговых инсультов, инфарктов ммммиокарда, сахарного диабета; мужской пол; пожилой возраст; физиологическая или хирургическая менопауза у женщин.
Коррекцию факторов риска требуется проводить не только пациенту, но и членам его семьи. Она осуществляется путем реализации программ семейной первичной профилактики и воспитания, составленных врачом.
• индекс массы тела (Кетле) = масса тела в килограммах/(рост в м2)
15–19,9 кг/м2 — недостаточная масса тела;
20–24,9 кг/м2 — нормальная масса тела (целевой уровень);
25–29,9 кг/м2- избыточная масса тела;
30–39,9 кг/м2 — ожирение;
40 кг/м2 — выраженное ожирение.
• индекс талия/бедра (ИТБ): ИТБ = ОТ/ОБ, где ОТ (окружность талии) — наименьшая окружность, измеренная над пупком; ОБ (окружность бедер) — наибольшая окружность, измеренная на уровне ягодиц.
0,8–0,9 — промежуточный тип распределения жировой ткани,
< 0,8 — гиноидный (бедренно-ягодичный),
>0,9 — андроидный (абдоминальный);
• Интерпретация уровня холестерина плазмы:
— целевой уровень ХС ЛНП для пациентов с очень высоким риском < 1,8 ммоль/л или его снижение не менее чем на 50% от исходного уровня, если он находился в диапазоне 1,8-3,5 ммоль/л (70–135 мг/дл)
— целевой уровень ХС ЛНП для пациентов с высоким риском < 2,6 ммоль/л или его снижение не менее чем на 50% от исходного уровня, если он находился в диапазоне 2,6–5,2 ммоль/л (100–200 мг/дл)
— целевой уровень ХС ЛНП для пациентов с низким и умеренным риском по шкале SCORE <3 ммоль/л
— ЛПВП >1,2 ммоль/л (у женщин), >1,0 ммоль/л (у мужчин),
— триглицеридов < 1,7 ммоль/л
• уровень глюкозы в плазме натощак не выше 6,1 ммоль/л;
• уровень мочевой кислоты сыворотки крови<420 мкмоль/л (у мужчин), < 360 мкмоль/л (у женщин).
Советы пациенту и его семье:
• Достаточным считается сон не менее 7 часов в сутки.
• Масса тела должна приближаться к идеальной (ИМТ менее 25 кг/м2). Для этого суточная калорийность пищи в зависимости от массы тела и характера работы должна составлять от 1500 до 2000 ккал. Потребление белка — 1 г/кг массы тела в сутки, углеводов — до 50г/сут, жиров — до 80 г/сут. Желательно вести дневник питания. Пациенту настоятельно рекомендуется избегать жирных, сладких блюд, отдавать предпочтение овощам, фруктам, злаковым и хлебу грубого помола.
• Потребление соли надо ограничить до 5 г/сут. Рекомендовано не подсаливать пищу, заменять соль другими веществами, улучшающими вкус пищи (соусы, небольшие количества перца, уксуса и др.) В соли содержится натрий, который приводит к задержке воды в организме, и как следствие, повышению артериального давления. Так же влияет большое содержание натрия в колбасах, консервах, солениях и копченых мясных продуктах.
• Следует увеличить потребление калия (его много в свежих фруктах, овощах, кураге, печеном картофеле). Соотношение К+/Nа+сдвигается в сторону К+ при преимущественно вегетарианской диете.
• Необходимо прекратить или ограничить курение.
• Потребление алкоголя следует ограничить до 30 мл/сут в пересчете на абсолютный этанол. Крепкие спиртные напитки лучше заменить красными сухими винами.
• При гиподинамии (сидячая работа > 5 ч/сут, физическая активность < 10 ч/нед) — регулярные физические тренировки не менее 4 раз в неделю продолжительностью 30–45 минут. Предпочтительны индивидуально приемлемые для пациента нагрузки: пешие прогулки, теннис, езда на велосипеде, ходьба на лыжах, работа в саду, плавание. При физической нагрузке число сердечных сокращений должно увеличиваться не более чем на 20–30 в 1 мин.
• Психоэмоциональный стресс на производстве и в быту контролируется правильным образом жизни. Следует ограничить продолжительность рабочего дня и домашних нагрузок, избегать ночных смен, командировок.
• Женщинам, больным гипертонической болезнью, надо отказаться от приема пероральных контрацептивов.
• Юношам, занимающимся спортом, нельзя злоупотреблять пищевыми добавками для наращивания мышечной массы и исключить прием анаболических стероидов.
Приложение Г1. Правила измерения АД, классификация уровней АД и основная информация, которая должна быть получена при сборе анамнеза
Таблица П1/Г1. Правила измерения АД
Измерение артериального давления в кабинете врача
АД — артериальное давление, САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление.
Таблица П2/Г1. Классификация АД, измеренного в медицинском учреждении, и определение степеней гипертензии
САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление.
Таблица П3/Г1. Основная информация, которая должна быть получена при сборе анамнеза
Приложение Г2. Принципы диагностики и оценки сердечно-сосудистого риска
Таблица П1/Г2. Скрининг и диагностика артериальной гипертензии
Таблица П2/Г2. Частые причины вторичных гипертензий
| Причина | Распространенность среди пациентов АГ | Возможные симптомы и признаки | Обследование |
| Синдром обструктивного апноэ во время сна | 5–10% | Храп; ожирение (но может встречаться при отсутствии ожирения); сонливость днем | Шкала Эпворта и полисомнография |
| Ренопаренхиматозные заболевания | 2–10% | Бессимптомное течение; сахарный диабет; гематурия, протеинурия, никтурия; анемия, образование почек при поликистозе у взрослых | Креатинин и электролиты плазмы, СКФ; анализ мочи на кровь и белок, отношение альбумин/креатинин мочи; ультразвуковое исследование почек |
| Реноваскулярные заболевания | |||
| Атеросклероз почечных артерий | 1–10% | Пожилые; диффузный атеросклероз (особенно периферических артерий); диабет; курение; рецидивирующий отек легких; шум в проекции почечных артерий. | Дуплексное сканирование почечных артерий или КТ-ангиография или МР-ангиография |
| Фибромускулярная дисплазия почечных артерий | Молодые; чаще у женщин; шум в проекции почечных артерия | ||
| Эндокринные причины | |||
| Первичный альдостеронизм | 5–15% |
Спонтанная или индуцированная диуретиками гипокалиемия, гипертензия в сочетании с надпочечниковой инсиденталомой, или синдромом сонного апноэ или семейным анамнезом гипертензии в раннем возрасте (до 40 лет), семейным анамнезом первичного гиперальдостеронизма (родственники 1-й линии родства) |
Ренин, альдостерон плазмы (исследование проводят на нормокалиемии и через 6 недель после отмены верошпирона); трактуют результаты с учетом антигипертензивой терапии, которую получает пациент |
| Феохромоцитома | <1% | Периодические симптомы: эпизоды повышения АД, головная боль, потливость, сердцебиения и бледность; лабильное АД; подъемы АД могут быть спровоцированы приемом препаратов (ББ, метоклопрамида, симпатомиметиков, опиоидов, трициклических антидепрессантов) | Метанефрины в плазме или суточной моче |
| Синдром Кушинга | <1% | Лунообразное лицо, центральное ожирение, атрофия кожи, стрии, диабет, длительный прием стероидов | Проба с 1 мг дексаметазона, и/или кортизол слюны в 23:00–00:00, и/или суточная экскреция свободного кортизола с мочой — исключить прием глюкокортикоидов! |
| Заболевания щитовидной железы (гипер- или гипотиреоз) | 1–2% | Признаки и симптомы гипер- или гипотиреоза | Оценка функции щитовидной железы (ТТГ, Т4, Т3) |
| Гиперапаратиреоз | <1% | Гиперкальциемия, гипофосфатемия | Паратгормон, уровень кальция |
| Акромегалия | Увеличение акральных частей тела, укрупнение и огрубление черт лица, потливость | Инсулиноподобный фактор роста (ИФР-1) сыворотки крови | |
| Другие причины | |||
| Коарктация аорты | <1% | Обычно выявляется у детей или подростков; разница АД (≥20/10 мм рт. ст.) между верхними и нижними конечностями и/или между правой и левой рукой и задержка радиально-феморальной пульсации; низкий ЛПИ; систолический шум в межлопаточной области; узурация ребер при рентгенографии | Эхокардиография |
Таблица П3/Г2. Основные требования к физическому обследованию
| Антропометрические показатели |
| Определение веса и роста с помощью калиброванных приборов, расчет ИМТ |
| Окружность талии |
| Признаки ПОМ |
| Неврологическое обследование и оценка когнитивного статуса |
| Фундоскопия для выявления гипертонической ретинопатии |
| Пальпация и аускультация сердца, сонных и почечных артерий |
| Пальпация периферических артерий |
| Определение АД на обеих руках (как минимум однократно) |
| Вторичные гипертензии |
| Осмотр кожных покровов: признаки нейрофиброматоза (феохромоцитома) |
| Пальпация почек для исключения их увеличения при поликистозе |
| Аускультация сердца и почечных артерий для выявления шумов, являющихся признаком коарктации аорты или реноваскулярной гипертензии |
| Сравнение пульсации на радиальных и бедренных артериях для выявления задержки пульсовой волны при коарктации аорты |
|
Признаки синдрома Кушинга (сочетание 2 или более симптомов): центральное ожирение, проксимальная мышечная слабость, подкожные кровоизлияния, широкие и глубокие стрии, необъяснимый остеопороз, гипокалиемия, вновь начавшийся СД, аменорея, инсиденталома надпочечника |
|
Признаки акромегалии увеличение акральных частей тела, укрупнение и огрубление черт лица, потливость |
|
Признаки заболеваний щитовидной железы (синдром гипотиреоза): склонность к брадикардии; плохая переносимость холода (зябкость); нарушения стула по типу запора; диффузная алопеция, раннее поседение волос, дистрофии ногтевых пластин (важен факт появления в недавнем анамнезе, возможен неудачный опыт лечения у дерматолога); нарушения менструальной функции у женщин (по типу олиго-, опсо-, аменореи), анамнез бесплодия, невынашивания беременности) |
|
Признаки заболеваний щитовидной железы (синдром тиреотоксикоза): • склонность к тахикардии (нарушения ритма в анамнезе — фибрилляция и трепетание предсердий, суправентрикулярные тахикардии, частые наджелудочковые и желудочковые экстрасистолии); • плохая переносимость тепла; • потливость, кожа влажная, горячая • потеря массы тела • диарея; • нарушения менструальной функции у женщин (по типу олиго-, опсо-, аменореи), анамнез бесплодия, невынашивания беременности); • глазные симптомы: Грефе — отставание верхнего века от края роговицы при движении глазного яблока вниз. Кохера — отставание движения глазного яблока от такового верхнего века при взгляде вверх, в связи с чем обнаруживается участок склеры между верхним веком и радужкой. Краузе — усиленный блеск глаз. Дальримпля — широкое раскрытие глазных щелей — «удивленный взгляд». Розенбаха — мелкое и быстрое дрожание опущенных или слегка сомкнутых век. Штельвага — редкие и неполные мигательные движения всочетании с ретракцией верхнего века. Мебиуса — нарушение конвергенции. Меланодермия в области век (симптом Еллинека) • эндокринная офтальмопатия — выраженный экзофтальм, нередко имеющий несимметричный характер, диплопия при взгляде в одну из сторон или вверх, слезотечение, ощущение песка в глазах, отечность век. • тремор пальцев вытянутых рук, иногда всего тела (симптом телеграфного столба). |
|
Признаки гиперпаратиреоза: • нефролитиаз, • вторичный остеопороз, • мышечная слабость, • боли в мышцах. |
Таблица П4/Г2. Рутинное обследование пациентов с АГ
| Гемоглобин и/или гематокрит |
| Глюкоза и гликозилированный гемоглобин |
| Липиды крови: ОХС, ХС ЛНП, ХС ЛВП |
| Триглицериды |
| Калий, натрий |
| Мочевая кислота |
| Креатинин и расчетная СКФ |
| Показатели функции печени |
| Анализ мочи: микроскопия осадка, качественная оценка протеинурии тест-полоской, отношение альбумин–креатинин в разовой порции мочи (оптимально) |
| ЭКГ в 12 отведениях |
Таблица П5/Г2.Обследование для выявления поражения органов-мишеней
| Показание и интерпретация | |
| Первичные тесты для выявления ПОМ | |
| ЭКГ в 12 отведениях | Скрининг для выявления ГЛЖ и других возможных аномалий, а также для документирования сердечного ритма и выявления аритмий |
| Отношение альбумин–креатинин в разовой порции мочи | Для выявления альбуминурии, что указывает на возможное поражение почек |
| Креатинин и расчетная СКФ | Для выявления поражения почек |
| Фундоскопия | Для выявления гипертонической ретинопатии, особенно у больных АГ 2-й или 3-й степеней |
| Детальное обследование для выявления ПОМ | |
| Эхокардиография | Для оценки структуры и функции сердца, если эта информация может повлиять на выбор тактики лечения |
| УЗИ сонных артерий | Для выявления наличия атеросклеротических бляшек или стенозов сонных артерий, особенно у пациентов с ЦВБ или признаками поражения сосудов других локализаций |
| Ультразвуковое и допплеровское исследование брюшной полости |
– Для оценки размеров и структуры почек (например, рубцовые изменения) и исключения обструктивного поражения мочевыводящих путей как причины ХБП и АГ – Оценить состояние брюшной аорты, исключить аневризму и поражение сосудов – Обследовать надпочечники для исключения аденомы или феохромоцитомы (для тщательного обследования предпочтительно выполнить КТ или МРТ); – Допплеровское исследование почечных артерий для исключения реноваскулярных заболеваний, особенно при выявлении асимметрии размеров почек |
| СПВ | Показатель аортальной жесткости и артериосклероза |
| ЛПИ | Скрининг для выявления атеросклероза нижних конечностей |
| Оценка когнитивных функций | Для оценки когнитивных функций у больных с признаками их нарушений |
| Визуализация головного мозга | Для оценки наличия ишемического или геморрагического повреждения головного мозга, особенно у пациентов с ЦВБ в анамнезе или признаками ухудшения когнитивных функций |
Сокращения: АГ — артериальная гипертензия, ГЛЖ — гипертрофия левого желудочка, КТ — компьютерная томография, ЛПИ — лодыжечно-плечевой индекс, МВП — мочевыводящие пути, МРТ — магнитно-резонансная томография, ПООГ — поражение органов-мишеней, опосредованное гипертензией, СКФ — скорость клубочковой фильтрации, СПВ — скорость пульсовой волны, ХБП — хроническая болезнь почек, ЦВБ — цереброваскулярная болезнь, ЭКГ — электрокардиограмма.
Таблица П6/Г2. Эхокардиографические критерии гипертрофии левого желудочка, концентрического ремоделирования, размеров полости левого желудочка и дилатации левого предсердия
ГЛЖ — гипертрофия левого желудочка, ЛЖ — левый желудочек, ЛП — левое предсердие, ОТС — относительная толщина стенок, ПТТ — площадь поверхности тела.
Таблица П7/Г2. Клинические показания для домашнего (ДМАД) и суточного мониторирования АД (СМАД)
СМАД — суточное мониторирование АД; ДМАД — домашнее мониторирование АД
Таблица П8/Г2. Сравнение методов суточного и домашнего мониторирования артериального давления
| СМАД | ДМАД |
|
Преимущества: Позволяет идентифицировать гипертензию «белого халата» и маскированную гипертензию Более существенная прогностическая значимость Ночные измерения Измерения проводятся в условиях реальной жизни Дополнительное прогностическое значение разных фенотипов АД Большой объем информации на основании одного исследования, включая краткосрочную вариабельность АД |
Преимущества: Позволяет идентифицировать гипертензию «белого халата» и маскированную гипертензию Дешевизна и широкая доступность Измерения в домашних условиях, которые предоставляют больший комфорт, чем кабинет врача Вовлечение пациента в процесс измерения АД Легко выполнимо, может быть использовано в течение длительного периода времени для оценки вариабельности АД от дня ко дню |
|
Недостатки: Дороговизна и иногда ограниченная доступность Может доставлять дискомфорт |
Недостатки: Возможно только статичное измерение АД Возможны ошибки измерений Отсутствие ночных измерений |
АД — артериальное давление, СМАД — суточное мониторирование артериального давления, ДМАД — домашнее мониторирование артериального давления.
Таблица П9/Г2. Определение артериальной гипертензии в зависимости от метода измерения АД: измеренного в медицинском учреждении, СМАД или ДМАД
Таблица П10/Г2. Этапы оценки сердечно-сосудистого риска
| Этапы обследования | Необходимые процедуры |
| Клиническая оценка | Выявление пациентов высокого и очень высокого риска на основании документированных ССЗ, СД, ХБП 3–5-й стадий, чрезмерного повышения отдельных факторов риска, семейной гиперхолестеринемии или высокого риска по SCORE |
| Оценка 10-летнего риска по шкале SCORE | Проводить оценку риска по SCORE рекомендовано у бессимптомных лиц старше 40 лет, без анамнеза ССЗ, СД, ХБП, семейной гиперхолестирнемии или повышения ХС-ЛНП >4,9 ммоль/л (>190 мг/дл) |
| Оценка факторов, изменяющих риск | У отдельных пациентов низкого или умеренного риска целесообразно оценвать дополнительные факторы, которые могут повлиять на стратификацию по риску и выбор тактики лечения: повышение аполипопротеина В, липопротеина (а) или С-реактивного белка, семейный анамнез ранних атеросклеротических ССЗ, выявление атеросклеротической бляшки |
| Стратификация риска сердечно-сосудистых осложнений у пациентов с АГ | На основании уровня АД, наличия ФР, ПОМ, АКС, ХБП 3–5-й стадий, СД |
АГ — артериальная гипертензия, АД — артериальное давление, АКС — ассоциированное клиническое состояние, ПОМ — поражение органов-мишеней, СД — сахарный диабет, ССЗ — сердечно-сосудистое заболевание, ХБП — хроническая болезнь почек, ХС-ЛНП — холестерин липопротеинов низкой плотности, ФР — факторы риска.
Приложение Г3. Шкала SCORE
Название на русском языке: Шкала SCORE
Оригинальное название (если есть): SCORE scale (Systematic COronary Risk Evaluation)
Источник (официальный сайт разработчиков, публикация с валидацией): http://www.heartscore.org/ru_RU
Тип (подчеркнуть):
— шкала оценки
— индекс
— вопросник
— другое (уточнить):
Назначение: клинический инструмент для оценки риска смертельного сердечно-сосудистого заболевания в течение 10 лет. Настоящая шкала разработана для стран с высоким уровнем смертности от ССЗ (включая Россию) на основании следующих факторов: возраст, пол, курение, уровень систолического АД и ОХС. Уровень ХС ЛВП не учитывается. Общая оценка риска с помощью SCORE рекомендуется у бессимптомных взрослых старше 40 лет, без ССЗ, СД, ХБП или СГХС.
Содержание (шаблон):
Ключ (интерпретация): Уровень суммарного СС риск по шкале SCORE: менее 1% — низкий. от 1 до 4% — средний или умеренно повышенный. от 5% до 9% — высокий. >10% — очень высокий.
Пояснения: нет
Таблица П12/Г2. Шкала глобальной оценки 10-летнего сердечно-сосудистого риска
1 ИБС: стенокардия напряжения 3-4 ФК, нестабильная стенокардия, перенесенный инфаркт миокарда, ишемический инсульт, ЧКВ, операция КШ, ангиопластика сонных артерий или артерий нижних конечностей, каротидная эндартерэктомия, подвздошно-бедренное, бедренно-подколенное шунтирование.
2 Инфаркт миокарда, нестабильная стенокардия, перемежающаяся хромота, транзиторная ишемическая атака/ишемический инсульт.
3 Назначение статинов в максимально переносимых дозах в сочетании с эзетимибом.
АГ — артериальная гипертензия, ХБП — хроническая болезнь почек, СКФ — скорость клубочковой фильтрации, ТИА — транзиторная ишемическая атака, CCЗ — сердечно-сосудистые заболевания, АСБ – атеросклеротическая бляшка, СГХС – семейная гиперхолестеринемия, ФР – фактор риска.
Таблица П13/Г2. Модифицирующие факторы, способствующие увеличению сердечно-сосудистого риска
Приложение Г3.1. Классификация стадий и стратификация риска при АГ
Таблица П1/Г3. Классификация стадий АГ в зависимости от уровней артериального давления, наличия факторов СС риска, поражения органов, обусловленного гипертензией, и наличия сопутствующих заболеваний
Таблица П2/Г3. Факторы, определяющие сердечно-сосудистый риск и стадию заболевания у пациентов с АГ
а — факторы риска, учтенные в шкале SCORE, b — Протеинурия и снижение СКФ являются независимыми факторами риска.
Таблица П3/Г3. Расчет СКФ по формуле CKD-EpidemiologyCollaboration 2009*
Калькулятор СКФ: https://www.kidney.org/professionals/KDOQI/gfr_calculator
Таблица П4/Г3. CHA2DS2-VASс. Шкала оценки риска тромбоэмболических осложнений у пациентов с фибрилляцией/трепетанием предсердий
Название на русском языке: CHA2DS2-VASс. Шкала оценки риска тромбоэмболических осложнений у пациентов с фибрилляцией/трепетанием предсердий
Оригинальное название (если есть): CHA2DS2-VASс
Источник (официальный сайт разработчиков, публикация с валидацией): Olesen, Jonas Bjerring, et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. Bmj 342 (2011): d124.
Тип (подчеркнуть):
— шкала оценки
— индекс
— вопросник
— другое (уточнить):
Назначение: клинический инструмент для прогнозирования риска ишемического инсульта и системного тромбоэмболизма при фибрилляции предсердий
Содержание (шаблон):
Ключ (интерпретация):
Пояснения: нет
Таблица П5/Г3. Шкала сонливости Эпворта (Epworth)
Название на русском языке: Шкала сонливости Эпворта
Оригинальное название (если есть): Epworth Sleepiness Scale
Источник (официальный сайт разработчиков, публикация с валидацией): https://epworthsleepinessscale.com/about-the-ess/
Тип (подчеркнуть):
— шкала оценки
— индекс
— вопросник
— другое (уточнить):
Назначение: серия вопросов, которые используют для изучения воздействия сна на дневной образ жизни.
Насколько вероятно то, что вы можете задремать или уснуть в ситуациях, описанных ниже, по сравнению с ощущением обычной усталости?
Речь идет об обычном вашем состоянии в последнее время. Даже если вы не были в подобных ситуациях в последнее время, то постарайтесь представить себе, как бы эти ситуации повлияли на вас. Используйте эту шкалу и выбирете наиболее подходящее число для каждой ситуации.
0 — никогда бы не заснул/не задремал
1 — очень небольшая вероятность заснуть или задремать
2 — вероятно, засну или задремлю
3 — большая вероятность заснуть или задремать
Ключ (интерпретация):
1 — 6 баллов: Нормальный сон
7 — 8 баллов: Умеренная сонливость
9 — 24 баллов: Аномальная (возможно, патологическая) сонливость
Пояснения: нет
Таблица П6/Г3. Опросник «Возраст не помеха»
Название на русском языке: Возраст не помеха
Оригинальное название (если есть):
Источник (официальный сайт разработчиков, публикация с валидацией): Общероссийская общественная организация «Российская ассоциация геронтологов и гериатров «Клинические рекомендации «Старческая астения» 2018 г.
Тип (подчеркнуть):
— шкала оценки
— индекс
— вопросник
— другое (уточнить):
Назначение: серия вопросов, которые используют для изучения воздействия сна на дневной образ жизни.
Содержание (шаблон):
Ключ (интерпретация):
за каждый положительный ответ начисляется 1 балл.
3 балла и более — высокая вероятность синдрома старческой астении, необходима консультация гериатра
1–2 балла — вероятен синдром старческой астении (преастения)
0 баллов — нет ССА
Пояснения: * имеется в виду непреднамеренное снижение веса. Если пациент похудел намеренно — за счет соблюдения специальной диеты или регулярной физической активности, балл не засчитывается.
Приложение Г4. принципы антигипертензивной терапии и диспансерное наблюдение больных с АГ
Таблица П1/Г4. Начало антигипертензивной терапии (изменение образа жизни и лекарственные препараты) при различных значениях АД, измеренного в медицинском учреждении
Таблица П2/Г4. Показания к началу антигипертензивной терапии в зависимости от возраста и сопутствующих заболеваний
Таблица П3/Г4. Целевые значения АД, измеренного в медицинском учреждении, в зависимости от возраста и сопутствующих заболеваний.
аОтносится к пациентам с инсультом в анамнезе, а не к показателям АД в остром периоде инсульта.
bЦелевые значения могут меняться у пожилых пациентов с синдромом старческой астении.
Таблица П4/Г4. Противопоказания к назначению отдельных классов антигипертензивных препаратов
Таблица П5/Г4. Алгоритм диспансерного наблюдения больных АГ с контролируемым артериальным давлением на фоне приема антигипертензивных лекарственных препаратов [292]
| Заболевание, состояние | Регулярность профилактических посещений | Рекомендуемые вмешательства и методы исследования во время профилактических посещений |
| АГ 1-й степени без ПОМ, ССЗ, ЦВБ и ХБП |
Не менее 1 раза в год при контроле АД на уровне целевых значений. При стабильном течении возможно наблюдение в отделении/кабинете медицинской профилактики При рефрактерной АГ I-II степени пациент наблюдается у врача-кардиолога; при отсутствии возможности наблюдения у врача-кардиолога — у врача-терапевта/участкового врача. |
— сбор жалоб и анамнеза, активный опрос на наличие, характер и выраженность боли в грудной клетке и одышки при физической нагрузке, эпизодов кратковременной слабости в конечностях, онемения половины лица или конечностей, об объеме диуреза — уточнение факта и характера приема антигипертензивных препаратов — уточнение факта приема гиполипидемических, антиагрегантных и гипогликемических препаратов при наличии показаний — опрос и краткое консультирование по поводу курения, характера питания, физической активности — измерение АД при каждом посещении — анализ данных ДМАД — общий осмотр и объективное обследование, включая пальпацию периферических сосудов и аускультацию подключичных, сонных, почечных и бедренных артерий, измерение индекса массы тела и окружности талии при каждом посещении — глюкоза плазмы крови натощак не реже 1 раза в год (допускается экспресс-метод) — общий холестерин не реже 1 раза в год (допускается экспресс-метод) — оценкасуммарного сердечно-сосудистого риска по шкале SCORE — холестерин липопротеинов низкой плотности, холестерин липопротеинов высокой плотности, триглицериды в сыворотке при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — калий и натрий сыворотки при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — креатинин сыворотки (с расчетом СКФ) при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — анализ мочи на микроальбуминурию при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года
— ЭКГ в 12 отведениях с расчетом индекса Соколова-Лайона и Корнельского показателя не реже 1 раза в год — ЭхоКГ с определением ИММЛЖ и диастолической функции при взятии под диспансерное наблюдение, в последующем по показаниям, но не менее 1 раза в 2 года при отсутствии достижения целевых значений АД и наличии признаков прогрессирования гипертрофии левого желудочка по данным расчета индекса Соколова–Лайона и Корнелльского показателя — дуплексное сканирование сонных артерий у мужчин старше 40 лет, женщин старше 50 лет при ИМТ>30 кг/м2 и более и общем холестерине >5 ммоль/л и более при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раз в 3 года с целью определения ТИМ и наличия атеросклеротических бляшек* — измерение скорости пульсовой волны на каротидно-феморальном участке артериального русла при взятии под диспансерное наблюдение, в последующем по показаниям, но не реже 1 раза в 3 года при отсутствии достижения целевых значений АД* — корректировка терапии (при необходимости) — объяснение пациенту и/или обеспечение его памяткой по алгоритму неотложных действий при жизнеугрожающем состоянии, вероятность развития которого у пациента наиболее высокая |
| АГ 2–3-й степени с ПОМ, но без ССЗ, ЦВБ и ХБП | Не менее 2 раз в год |
— сбор жалоб и анамнеза, активный опрос на наличие, характер и выраженность боли в грудной клетке и одышки при физической нагрузке, эпизодов кратковременной слабости в конечностях, онемения половины лица или конечностей, об объеме диуреза — уточнение факта и характера приема антигипертензивных препаратов — уточнение факта приема гиполипидемических, антиагрегантных и гипогликемических препаратов при наличии показаний — опрос и краткое консультирование по поводу курения, характера питания, физической активности — измерение АД при каждом посещении — анализ данных ДМАД — общий осмотр и объективное обследование, включая пальпацию периферических сосудов и аускультацию подключичных, сонных, почечных и бедренных артерий, измерение индекса массы тела и окружности талии при каждом посещении — гемоглобин и/или гематокрит при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — глюкоза плазмы натощак не реже 1 раза в год (допускается экспресс-метод) — общий холестерин не реже 1 раза в год (допускается экспресс-метод) — холестерин липопротеинов низкой плотности, холестерин липопротеинов высокой плотности, триглицериды в сыворотке при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — калий и натрий сыворотки при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — мочевая кислота сыворотки при взятии под диспансерное наблюдение, далее по показаниям — креатинин сыворотки (с расчетом СКФ) при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — анализ мочи на микроальбуминурию при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — ЭКГ в 12 отведениях с расчетом индекса Соколова–Лайона и Корнелльского показателя не реже 1 раза в год — ЭхоКГ с определением ИММЛЖ и диастолической функции при взятии под диспансерное наблюдение, в последующем по показаниям, но не реже 1 раза в год при отсутствии достижения целевых значений АД и наличии признаков прогрессирования гипертрофии левого желудочка по данным расчета индекса Соколова–Лайона и Корнельского показателя — дуплексное сканирование сонных артерий у мужчин старше 40 лет, женщин старше 50 лет при ИМТ>30 кг/м2 и более и общем холестерине >5 ммоль/л и более при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года с целью определения ТИМ и наличия атеросклеротических бляшек* — УЗИ почек и дуплексное сканирование почечных артерий при наличии обоснованного подозрения на их патологию* — лодыжечно-плечевой индекс при наличии обоснованного подозрения на стеноз сосудов нижних конечностей* — консультация окулиста на предмет наличия кровоизлияний или экссудата на глазном дне, отека соска зрительного нерва при взятии под ДН и по показаниям — оценка суммарного сердечно-сосудистого риска по таблице величины риска при АГ и по шкале SCORE (при интерпретации уровня риска приоритет отдается более высокому показателю) — корректировка терапии (при необходимости) — объяснение пациенту и/или обеспечение его памяткой по алгоритму неотложных действий при жизнеугрожающем состоянии, вероятность развития которого у пациента наиболее высокая |
| АГ 1–3-й степени с ССЗ, ЦВБ и ХБП | Не менее 2 раз в год |
— сбор жалоб и анамнеза, активный опрос на наличие, характер и выраженность боли в грудной клетке и одышки при физической нагрузке, эпизодов кратковременной слабости в конечностях, онемения половины лица или конечностей, об объеме диуреза — уточнение факта приема антигипертензивных препаратов — уточнение факта приема гиполипидемических, антиагрегантных и гипогликемических препаратов при наличии показаний — опрос и краткое консультирование по поводу курения, характера питания, физической активности — измерение АД при каждом посещении — анализ данных ДМАД — уточнение характера гипотензивной терапии и терапии по поводу других ССЗ, ЦВБ и ХБП — общий осмотр и объективное обследование, включая пальпацию периферических сосудов и аускультацию подключичных, сонных, почечных и бедренных артерий, измерение индекса массы тела и окружности талии при каждом посещении — гемоглобин и/или гематокрит при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — глюкоза плазмы натощак не реже 1 раза в год (допускается экспресс-метод) — общий холестерин не реже 1 раза в год (допускается экспресс-метод) — холестерин липопротеинов низкой плотности, холестерин липопротеинов высокой плотности, триглицериды в сыворотке при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — калий и натрий сыворотки при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в год -мочевая кислота сыворотки при взятии под диспансерное наблюдение, далее по показаниям — креатинин сыворотки (с расчетом СКФ) при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в год — анализ мочи с микроскопией осадка и определением белка в моче не реже 1 раза в год — анализ на микроальбуминурию при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в год — ЭКГ в 12 отведениях с расчетом индекса Соколова–Лайона и Корнелльского показателя не реже 2 раз в год — ЭхоКГ с определением ИММЛЖ и диастолической функции при взятии под диспансерное наблюдение, в последующем по показаниям, но не менее 1 раза в год при отсутствии достижения целевых значений АД и наличии признаков прогрессирования гипертрофии левого желудочка при расчете индекса Соколова–Лайона и Корнелльского показателя — дуплексное сканирование сонных артерий у мужчин старше 40 лет, женщин старше 50 лет не реже 1 раза в 2 года с целью определения ТИМ и наличия атеросклеротических бляшек* -УЗИ почек при взятии под диспансерное наблюдение, далее по показаниям при наличии обоснованного подозрения на развитие или прогрессирование ХБП* — дуплексное сканирование почечных артерий при наличии обоснованного подозрения на их патологию* — лодыжечно-плечевой индекс при наличии обоснованного подозрения на стеноз сосудов нижних конечностей* — дуплексное сканирование подвздошных и бедренных артерий при наличии обоснованного подозрения на их патологию* — консультация окулиста на предмет наличия кровоизлияний или экссудата на глазном дне, отека соска зрительного нерва при взятии под ДН и по показаниям — оценка суммарного сердечно-сосудистого риска по таблице величины риска при АГ и по шкале SCORE (при интерпретации уровня риска приоритет отдается более высокому показателю) — корректировка терапии (при необходимости) -объяснение пациенту и/или обеспечение его памяткой по алгоритму неотложных действий при жизнеугрожающем состоянии, вероятность развития которого у пациента наиболее высокая |
Приложение Г5. Иные
Таблица П1/Г5. Распространенность и типичные причины вторичных гипертензий в различных возрастных группах
| Возрастная группа | Частота (%) | Типичные причины |
| Дети (<12 лет) | 70–85 |
Ренопаренхиматозные заболевания Коарктация аорты Моногенные заболевания |
| Подростки (12–18 лет) | 10-15 |
Ренопаренхиматозные заболевания Коарктация аорты Моногенные заболевания |
| Молодые (19–40 лет) | 5-10 |
Ренопаренхиматозные заболевания Фибромускулярная дисплазия Недиагностированные моногенные заболевания |
| Средний возраст (41–65 лет) | 5-15 |
Первичный альдостеронизм Обструктивное ночное апноэ Синдром Кушинга Феохромоцитома Ренопаренхиматозные заболевания Атеросклероз почечных артерий |
| Пожилые(>65 лет) | 5-10 |
Атеросклероз почечных артерий Ренопаренхиматозные заболевания Заболевания щитовидной железы |
Таблица П2/Г5. Редкие генетические причины вторичных артериальных гипертензий
АРП активность ренина плазмы, КАП концентрация альдостерона плазмы, КРП концентрация ренина плазмы.
Таблица П3/Г5. Лекарственные препараты и другие субстанции, приводящие к повышению артериального давления
| Препарат/субстанция | |
| Оральные контрацептивы | Особенно с содержанием эстрогенов; вызывают АГ у 5% женщин, обычно легкую, но возможна и тяжелая |
| Препараты для снижения веса | Например, фенилпропаноламин и сибутрамин |
| Назальные противоотечные препараты | Например, фенилэфрина гидрохлорид и нафазолина гидрохлорид |
| Стимуляторы | Амфетамины, кокаин, экстази; обычно вызывают острый подъем АД, а не хроническую АГ |
| Лакрица | Хроническое избыточное употребление лакрицы приводит к проявлениям, похожим на гиперальдостеронизм за счет стимуляции минералокортикоидных рецепторов и угнетения метаболизма кортизола |
| Иммуносупрессанты | Например, циклоспорин А (такролимус оказывает меньшее действие на АД, а рапамицин практически его не имеет) и стероиды (например, кортикостероиды и гидрокортизон) |
| Нестероидные противовоспалительные препараты | |
| Антиангиогенные противоопухолевые препараты | Например, ингибиторы эндотелиального сосудистого фактора роста (бевацизумаб), ингибиторы тирозинкиназы (сунитиниб) и сорафениб |
| Другие препараты и субстанции, способные повышать АД | Анаболические стероиды, эритропоэтин, растительные препараты (эфедра и марихуана) |
Таблица П4/Г5. Мероприятия, которые могут повысить приверженность пациентов с артериальной гипертензией к лекарственной терапии
| На уровне врача |
| Предоставление пациенту информации о рисках при АГ и преимуществах терапии, согласование стратегии лечения, направленной на поддержание нормального АД с использованием рекомендаций по изменению образа жизни и назначения фиксированных комбинаций; использование информационных материалов, программ обучения, консультирование с помощью компьютерных технологий |
| Получение обратной связи в отношении соблюдения рекомендаций и наличия улучшения |
| Оценка и разрешение индивидуальных проблем, препятствующих высокой приверженности к лечению |
| Сотрудничество с другими медицинскими сотрудниками |
| На уровне пациента |
| Самоконтроль АД (в том числе телемониторирование) |
| Групповые занятия и тренинги |
| Рекомендации в сочетании с мотивационными стратегиями |
| Использование систем напоминания |
| Получение поддержки семьи и общества |
| Обеспечение лекарственными препаратами на рабочем месте |
| На уровне лекарственной терапии |
| Упрощение схем приема препарата, предпочтение — фиксированным комбинациям и стратегии «одной таблетки» |
| Упаковки с системой напоминаний |
| На уровне системы здравоохранения |
| Поддержка развития систем мониторирования (телефонные контакты, посещения на дому, телемониторинг результатов домашнего контроля АД) |
| Финансовая поддержка системы взаимодействия между различными представителями системы здравоохранения (например, фармацевты и медицинские сестры) |
| Система компенсации стратегии «одной таблетки» |
| Развитие национальных баз данных, включая данные о назначении лекарственных препаратов, доступных для врачей и фармацевтов |
| Доступность препаратов |
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
КЛИНИКО-ФАРМАКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ГРУПП ЛЕКАРСТВЕННЫХ СРЕДСТВ
β-Адреноблокаторы
β-Адреноблокаторы — препараты, действие которых обусловлено блокирующими эффектами на β-адренорецепторы в различных органах и тканях. В клинической практике их применяют с начала 60-х годов. Эти препараты обладают гипотензивным, антиангинальным, антиаритмическим и органопротективным эффектами.
ФАРМАКОДИНАМИКА β-АДРЕНОБЛОКАТОРОВ
Действие β-адреноблокаторов ограничивает β-адренорецепторы сердца от влияния эндогенных агонистов, обеспечивая отрицательные хроно-, дромо-, батмо- и инотропный эффекты.
Фармакодинамические эффекты преимущественной блокады β1-адренорецепторов:
-
уменьшение ЧСС (отрицательное хронотропное, брадикардитическое действие);
-
снижение АД (снижение постнагрузки, гипотензивное действие);
-
замедление атриовентрикулярной проводимости (отрицательное дромотропное действие);
-
снижение возбудимости миокарда (отрицательное батмотропное, антиаритмическое действие);
-
снижение сократительной способности миокарда (отрицательное инотропное, антиаритмическое действие);
-
снижение давления в системе воротной вены (благодаря уменьшению печёночного и мезентериального артериального кровотока);
-
уменьшение образования внутриглазной жидкости (снижение внутриглазного давления);
-
психотропные эффекты для β-адреноблокаторов, проникающих через ГЭБ (слабость, сонливость, депрессия, бессонница, кошмарные сновидения, галлюцинации и т.д.);
-
синдром отмены в случае внезапного прекращения приёма короткодействующих β-адреноблокаторов (гипертензивная реакция, обострение коронарной недостаточности, включая развитие нестабильной стенокардии, острого инфаркта миокарда или внезапной смерти).
Фармакодинамические эффекты частичной или полной блокады β2-адренорецепторов:
-
нарушение мобилизации глюкозы из печени в кровь вследствие торможения гликогенолиза и глюконеогенеза, потенцирующее гипогликемическое действие инсулина и гипогликемических препаратов;
-
повышение тонуса гладкой мускулатуры артерий — артериальная вазоконстрикция, вызывающая увеличение общего периферического сосудистого сопротивления (ОПСС), спазм коронарных сосудов, уменьшение почечного кровотока, снижение кровообращения в конечностях, гипертензивную реакцию на гиперкатехоламинемию при гипогликемии, феохромоцитоме, после отмены клонидина, во время операции или в послеоперационном периоде.
Определяющие фармакологические параметры β-адреноблокаторов — β1-селективность (кардиоселективность) и её степень, внутренняя симпатомиметическая активность, мембраностабилизирующее действие, дополнительные вазодилатирующие свойства, уровень липофильности и длительность действия препарата. При оценке кардиоселективности оценивают степень ингибирования препаратом β-адренорецепторов по данным ЧСС, АД, тремору пальцев, тонусу бронхов в сравнении с эффектами пропранолола, селективность которого принята за единицу. Степень селективности отражает интенсивность связи с β-адренорецептором, а также выраженность силы и длительность действия β-адреноблокатора. Преимущественная блокада β1-адренорецепторов определяет индекс селективности β-адреноблокаторов, уменьшение эффектов блокады β2-адренопрецепторов, снижая вероятность побочных эффектов (табл. 21-1).
Таблица 21-1. Индекс кардиоселективности β-адреноблокаторов
| Препарат | Отношение Ci/β1,/Ci/β2 |
|---|---|
|
Пропранолол |
1,8:1 (неселективный) |
|
Метопролол |
1:20 |
|
Атенолол |
1:35 |
|
Бетаксолол |
1:35 |
|
Бисопролол |
1:75 |
|
Небиволол |
1:300 |
Длительный приём β-адреноблокаторов способствует увеличению количества β-рецепторов. Это определяет постепенное нарастание эффектов блокады β-адренорецепторов и значительно выраженный синдром отмены в случае внезапной отмены, особенно короткодействующих β-адреноблокаторов. К I поколению этой группы препаратов относят β-адреноблокаторы, вызывающие в одинаковой степени блокаду β1— и β2-адренорецепторов (неселективные), — пропранолол, надолол. Определённое преимущество имеют неселективные β-адреноблокаторы без внутренней симпатомиметической активности.
Ко II поколению относят селективные β1-адреноблокаторы (кардиоселективные): атенолол, бисопролол, бетаксолол, метопролол, небиволол, талинолол, окспренолол*, ацебутолол*, целипролол*. В низких дозах β1-селективные препараты мало влияют на физиологические реакции, опосредуемые периферическими β2-адренорецепторами (тонус бронхов, тонус сосудов, матки, секрецию инсулина, глюконеогенез), поэтому они имеют преимущества по выраженности гипотензивного действия, меньшей частоте побочных эффектов по сравнению с неселективными β1-адреноблокаторами. Высокий уровень селективности блокады β1-адренорецепторов позволяет их применять у больных с бронхообструктивыми заболеваниями, у курильщиков за счёт менее выраженной реакции на катехоламины, пациентов с гиперлипидемией, сахарным диабетом 1-го и 2-го типа, нарушениями периферического кровообращения по сравнению с неселективными и менее селективными β-адреноблокаторами.
Уровень селективности β-адреноблокаторов определяет влияние на ОПСС как один из компонентов гипотензивного эффекта. Селективные β1-адреноблокаторы не оказывают существенного влияния на ОПСС; неселективные β-адреноблокаторы за счёт блокады β2-адренорецепторов сосудов могут усиливать вазоконстрикторный эффект и повышать ОПСС.
Состояние селективности β-адреноблокаторов зависит от их дозы. Увеличение дозы кардиоселективного препарата сопровождается уменьшением селективности действия, клиническими проявлениями блокады β2-адренорецепторов, в больших дозах β1-селективные препараты утрачивают селективность.
Выделяют β-адреноблокаторы, обладающие дополнительным вазодилатирующим действием (III поколение). Учитывая разные механизмы развития вазодилатирующего эффекта, эту группу β-адреноблокаторов относят к препаратам с комбинированным механизмом действия. К ним относят: лабеталол* (неселективный β-адреноблокатор) с дополнительным α1-адреноблокирующим действием; карведилол (неселективный β-адреноблокатор) с дополнительным α1 -адреноблокирующим действием, дилевалол* (неселективный β-адреноблокатор) с частичным агонизмом к β2 -адренорецепторам сосудов; небиволол (β1-адреноблокатор) с активацией эндотелиального оксида азота.
На основании степени селективности и наличия вазодилатирующих свойств М.Р. Бристоу (1998) предложил классификацию β-адреноблокаторов (табл. 21-2).
Таблица 21-2. Классификация β-адреноблокаторов (M.R. Bristow, 1998)
| Поколение | Свойства | Типичный представитель |
|---|---|---|
|
I поколение |
Неселективные: |
Пропранолол, тимолол |
|
II поколение |
Кардиоселективные: |
Метопролол, атенолол, бисопролол |
|
III поколение: |
Неселективные |
Карведилол |
Некоторые β-адреноблокаторы обладают способностью к частичной активации β-адренорецепторов, т.е. частичной агонистической активности. Эти β-адреноблокаторы называют препаратами с внутренней симпатомиметической активностью — алпренолол*, ацебуталол*, окспренолол*, пенбутолол*, пиндолол, талинолол, практолол*. Наиболее выражена собственная симпатомиметическая активность у пиндолола. Внутренняя симпатомиметическая активность β-адреноблокаторов ограничивает уменьшение ЧСС в покое. Это находит применение у пациентов с исходно низкой ЧСС.
Неселективные β-адреноблокаторы без внутренней симпатомиметической активности: пропранолол, надолол, соталол, тимолол, и с внутренней симпатомиметической активностью: алпренолол* , бопиндолол* , окспренолол* , пиндолол.
Препараты с мембраностабилизирующим эффектом — пропранолол, бетаксолол, бисопролол, окспренолол*, пиндолол, талинолол.
ФАРМАКОКИНЕТИКА β-АДРЕНОБЛОКАТОРОВ
Различия в продолжительности действия β-адреноблокаторов с невысоким индексом селективности зависят от особенностей химического строения, липофильности и путей элиминации. Выделяют гидрофильные, липофильные и амфофильные препараты.
Липофильные препараты, как правило, метаболизируются в печени и имеют сравнительно короткий период полувыведения (T1/2). Липофильность сочетается с печёночным путём элиминации. Липофильные препараты быстро и полностью (более 90%) всасываются в пищеварительном тракте, их метаболизм в печени составляет 80-100%, биодоступность большинства липофильных β-блокаторов (пропранолол, метопролол, алпренолол* и др.) в связи с эффектом «первого прохождения» через печень составляет немногим больше 10-40% (табл. 21-3).
Таблица 21-3. Фармакокинетические параметры липофильных β-адреноблокаторов
|
Препарат |
β1-Селективность |
Внутренняя симпатомиметическая активность/α-адреноблокада |
T1/2, ч |
Связывание с белками плазмы, % |
Элиминация |
|
|
печенью |
почками |
|||||
|
Алпренолол* |
0 |
+2/0 |
2-3 |
85 |
100 |
0 |
|
Небиволол |
+8 |
0/0 |
10-50 |
98 |
99,5 |
0,5 |
|
Бетаксолол |
+2 |
0/0 |
16-22 |
50 |
85 |
15 |
|
Карведилол |
+1 |
0/+1 |
6-7 |
— |
100 |
0 |
|
Лабетолол* |
0 |
+β2/+2 |
3-4 |
50 |
100 |
0 |
|
Метопролол |
+2 |
0/0 |
3-4 |
10 |
100 |
0 |
|
Окспренолол* |
0 |
+2β1=β2 |
1-4 |
80 |
100 |
0 |
|
Пропранолол |
0 |
0/0 |
2-5 |
93 |
100 |
0 |
|
Тимолол |
0 |
0/0 |
4-5 |
10 |
80 |
20 |
Состояние печёночного кровотока влияет на скорость метаболизма, на величины разовых доз и кратность приёма препаратов. Это необходимо учитывать при лечении пожилых пациентов, больных сердечной недостаточностью, циррозом печени. При тяжёлой печёночной недостаточности скорость элиминации снижается пропорционально снижению функции печени. Липофильные препараты при длительном применении могут сами уменьшать печёночный кровоток, замедлять свой собственный метаболизм и метаболизм других липофильных препаратов. Этим объясняют увеличение периода полувыведения и возможность уменьшения разовой (суточной) дозы и кратности приёма липофильных препаратов, нарастание эффекта, угрозы передозировки.
Влияние уровня микросомального окисления на метаболизм липофильных препаратов также имеет большое значение. Индукция микросомального окисления липофильных β-адреноблокаторов (при курении, приёме алкоголя, рифампицина, барбитуратов, дифенина*) значительно ускоряет их элиминацию, снижает выраженность эффекта. Противоположное влияние оказывают лекарственные препараты, замедляющие печёночный кровоток, уменьшающие скорость микросомального окисления в гепатоцитах (циметидин, хлорпромазин).
Среди липофильных β-адреноблокаторов применение бетаксолола не требует коррекции дозы при печёночной недостаточности, однако при применении бетаксолола требуется коррекция дозы препарата при тяжёлой почечной недостаточности и проведении диализа. Коррекцию дозы метопролола проводят при тяжёлых нарушениях функции печени.
Липофильность β-адреноблокаторов способствует их проникновению через гематоэнцефаличекий, гистероплацентарный барьеры, в камеры глаза.
Гидрофильные β-адреноблокаторы выводятся преимущественно почками в неизменённом виде и имеют более продолжительный T1/2. Гидрофильные препараты не полностью (30-70%) и неравномерно (0-20%) всасываются в пищеварительном тракте, экскретируются почками на 40-70% в неизменённом виде либо в виде метаболитов, имеют больший T1/2 (6-24 ч), чем липофильные β-адреноблокаторы (табл. 21-4).
Таблица 21-4. Фармакокинетические параметры гидрофильных β-адреноблокаторов
|
Препарат |
β1-Селективность |
Внутренняя симпатомиметическая активность/α-адреноблокада |
T1/2, ч |
Связывание с белками плазмы, % |
Элиминация |
|
|
печенью |
почками |
|||||
|
Атенолол |
+2 |
0/0 |
6-9 |
5 |
10 |
90 |
|
Надолол |
0 |
0/0 |
14-24 |
25 |
0 |
100 |
|
Пенбутолол* |
0 |
+ 1/0 |
24-27 |
98 |
5 |
95 |
|
Соталол |
0 |
0/0 |
7-18 |
0 |
20 |
80 |
|
Талинолол |
+2 |
+ 1/0 |
6-7 |
— |
10 |
90 |
|
Эсмолол* |
+2 |
0/0 |
9 мин |
55 |
0 |
0 |
Сниженная СКФ (у пожилых больных, при хронической почечной недостаточности) уменьшает скорость экскреции гидрофильных β-адреноблокаторов. Это требует уменьшения дозы и кратности приёма. Ориентироваться можно по сывороточной концентрации креатинина, уровень которой повышается при снижении СКФ ниже 50 мл/мин. В этом случае кратность назначения гидрофильного β-адреноблокатора должна быть через день. Из гидрофильных β-адреноблокаторов только пенбутолол* не требует коррекции дозы при нарушении функции почек. Надолол не снижает почечный кровоток и СКФ, оказывая вазодилатирующий эффект на почечные сосуды.
Влияние уровня микросомального окисления на метаболизм гидрофильных β-адреноблокаторов несущественно.
β-Адреноблокаторы сверхкороткого действия разрушаются эстеразами крови и используются исключительно для внутривенных инфузий. β-Адреноблокаторы, разрушающиеся эстеразами крови, имеют очень короткий T1/2; действие их прекращается через 30 мин после прекращения инфузии. Tакие препараты применяют для лечения острой ишемии, пароксизма наджелудочковой тахикардии в период операции или в послеоперационном периоде. Кратковременность действия делает более безопасным их применение у больных с гипотонией, при сердечной недостаточности, а β1 -селективность препарата (эсмолол*) — при бронхообструкции.
Амфофильные β-адреноблокаторы растворяются в жирах и в воде (ацебутолол*, бисопролол, пиндолол, целипролол*) и имеют два пути элиминации — печёночный метаболизм и почечную экскрецию (табл. 21-5).
Таблица 21-5. Фармакокинетические параметры амфофильных β-адреноблокаторов
|
Препарат |
β1-Селективность |
Внутренняя симпатомиметическая активность/α-адреноблокада |
T1/2, ч |
Связывание с белками плазмы, % |
Элиминация |
|
|
печенью |
почками |
|||||
|
Ацебутолол* |
+ 1 |
+β1/0 |
3-4 |
25 |
60 |
40 |
|
Бисопролол |
+3 |
0/0 |
10-12 |
30 |
50 |
50 |
|
Пиндолол |
0 |
+3β2 |
3-4 |
57 |
60 |
40 |
|
Целипролол* |
+2 |
+2β2/+1 |
5-6 |
30 |
40 |
60 |
Сбалансированный клиренс этих препаратов определяет безопасность их применения у больных с умеренной почечной и печёночной недостаточностью, низкую вероятность взаимодействия с другими лекарственными препаратами. Скорость элиминации препаратов снижается только при тяжёлой почечной и печёночной недостаточности (в этих случаях суточные дозы необходимо уменьшить в 1,5-2 раза).
Амфофильный β-адреноблокатор пиндолол при хронической почечной недостаточности (ХПН) может повысить почечный кровоток.
ДОЗИРОВАНИЕ β-АДРЕНОБЛОКАТОРОВ
Дозы β-адреноблокаторов необходимо подбирать индивидуально, ориентируясь на клинический эффект, уровни ЧСС, АД. Начальная доза β-адреноблокатора должна составлять 1/8-1/4 средней терапевтической разовой дозы, при недостаточном эффекте дозу увеличивают через каждые 3-7 дней до средней терапевтической разовой дозы. ЧСС в покое в вертикальном положении должна быть в пределах 55-60 в мин, систолическое АД — не ниже 100 мм рт.ст. Максимальную выраженность β-адреноблокирующего эффекта наблюдают через 4-6 нед регулярного приёма препарата, особенного контроля в эти сроки требуют липофильные β-адреноблокаторы, способные замедлять свой собственный метаболизм. Кратность приёма препарата зависит от частоты ангинозных приступов и длительности действия β-адреноблокатора.
Следует учитывать, что продолжительность брадикардитического и гипотензивного действия β-адреноблокаторов значительно превышает их T1/2, а продолжительность антиангинального действия меньше, чем продолжительность отрицательного хронотропного эффекта.
МЕХАНИЗМЫ АНТИАНГИНАЛЬНОГО ЭФФЕКТА β-АДРЕНОБЛОКАТОРОВ ПРИ ЛЕЧЕНИИ СТЕНОКАРДИИ
Улучшение баланса между потребностью миокарда в кислороде и доставкой его по коронарным артериям может быть достигнуто за счёт увеличения коронарного кровотока и путём снижения потребности миокарда в кислороде.
В основе антиишемического (антиангинального) действия β-адреноблокаторов лежит их способность влиять на гемодинамические параметры — снижать потребление кислорода миокардом за счёт уменьшения ЧСС, сократительной способности миокарда и системного АД.
По рекомендациям Российского комитета экспертов ВНОК (2004 г.), дозы и кратность приёма β-адреноблокаторов для достижения антиангинального эффекта у больных стабильной стенокардией и эквивалентные суточные дозы представлены в табл. 21-6.
Таблица 21-6. Препараты β-адреноблокаторов в лечении стенокардии
| Активное вещество | Селективность | Внутренняя симпатомиметическая активность | Препарат | Обычная дозировка при стенокардии |
|---|---|---|---|---|
|
Пропранолол |
нет |
нет |
Индералр# |
20-80 мг* 4 раза в сут |
|
Метопролол |
β1 |
нет |
Беталок* |
25-200 мг/сут |
|
Эгилок* |
50-200 мг* 2 раза в сут |
|||
|
Атенолол |
β1 |
нет |
Тенормин р* |
50-200 мг* 1-2 раза в сут |
|
Бисопролол |
β1 |
нет |
Конкор* |
10 мг/сут |
|
Бетаксолол |
β1 |
нет |
Локрен* |
10-20 мг/сут |
|
Ацебутолол* |
β1 |
да |
Сектраль** |
200-600 мг* 2 раза в сут |
|
Тимолол |
нет |
нет |
Блокарден** |
10 мг* 2 раза в сут |
|
Надолол |
нет |
нет |
Коргард* |
40-80 мг/сут |
|
Пиндолол |
нет |
да |
Вискен* |
2,5-7,5 мг* 3 раза в сут |
|
β-адреноблокаторы с дополнительными вазодилатирующими свойствами |
||||
|
Небиволол |
β1 |
нет |
Небилет* |
2,5-5 мг/сут |
|
Карведилол (αи β-блокатор) |
нет |
нет |
Дилатренд* |
25-50 мг* 2 раза в сут |
Примечание: β1 — селективный препарат; # — в настоящее время в России оригинальный препарат не зарегистрирован; * — разовая доза.
Липофильные β-адреноблокаторы, не имеющие внутренней симпатомиметической активности, вне зависимости от селективности в большей степени обладают кардиопротективным действием у перенёсших острый инфаркт миокарда больных при длительном применении, уменьшая риск повторного инфаркта миокарда, внезапной смерти и общей смертности этой группы пациентов. Tакие свойства отмечены у метопролола, пропранолола, тимолола. Липофильные β-адреноблокаторы с внутренней симпатомиметической активностью имеют меньшую профилактическую антиангинальную эффективность. Эффекты карведилола и бисопролола по кардиопротективным свойствам сопоставимы с эффектами ретардированной формы метопролола. Гидрофильные β-адреноблокаторы (атенолол, соталол) не влияли на общую летальность и частоту внезапной смерти у больных ИБС . Данные метаанализа 25 контролируемых клинических исследований (рандомизированных контролируемых испытаний) представлены в табл. 21-7.
Таблица 21-7. Кардиопротективная эффективность β-адреноблокаторов у больных, перенёсших инфаркт миокарда
| Суммированные группы β-блокаторов | Снижение риска смерти |
|---|---|
|
Гидрофильные β-адреноблокаторы (атенолол и соталол, 3 рандомизированных контролируемых испытания) |
10% |
|
β-адреноблокатор с внутренней симпатомиметической активностью (алпренолол*, оскспренолол*, пиндолол, практолол*; 11 рандомизированных контролируемых испытаний) |
11% |
|
β-адреноблокатор без внутренней симпатомиметической активности (14 рандомизованных контролируемых исследований) |
28% |
|
Неселективные β-адреноблокаторы (пропранолол, соталол, тимолол, 6 рандомизированных контролируемых испытаний) |
27% |
|
β1 -селективные β-адреноблокаторы (атенолол и метопролол, 8 рандомизированных контролируемых испытаний) |
31% |
|
Липофильные β-адреноблокаторы (метопролол, пропранолол, тимолол, 11 рандомизированных контролируемых испытаний) |
30% |
Для вторичной профилактики β-адреноблокаторы показаны всем пациентам, перенёсшим инфаркт миокарда с изменением Q-зубца в течение как минимум 3 лет при отсутствии абсолютных противопоказаний к назначению препаратов этого класса, особенно пациентам старше 50 лет, с инфарктом передней стенки левого желудочка, ранней постинфарктной стенокардией, высокой ЧСС, желудочковыми нарушениями ритма сердца, явлениями стабильной сердечной недостаточности.
ЭФФЕКТИВНОСТЬ β-БЛОКАТОРОВ ПРИ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Tерапевтический эффект β-адреноблокаторов при ХСН связан с прямым антиаритмическим действием, положительным влиянием на функцию левого желудочка, уменьшением хронической ишемии дилатированного желудочка даже при отсутствии ИБС, подавление процессов апоптоза миокардиоцитов, активируемых в условиях β1-адренергической стимуляции.
Tактика назначения β-адреноблокаторов у больных с ХСН представлена в табл. 21-9. В первые 2-3 мес применение даже малых доз β-адреноблокаторов вызывает повышение ОПСС, снижение систолической функции миокарда. Это требует титрования дозы назначаемого больному ХСН β-адреноблокатора, динамического наблюдения за симптоматикой заболевания. В этих случаях рекомендуют увеличение доз диуретиков, ингибиторов АПФ, применение положительных инотропных препаратов (малых доз сердечных гликозидов или левосимендана* ), более медленное титрование дозы β-адреноблокатора.
Противопоказания к назначению β-адреноблокаторов при ХСН:
-
бронхиальная астма или тяжёлая патология бронхов, сопровождающаяся нарастанием симптомов бронхообструкции при назначении β-адреноблокатора;
-
симптоматическая брадикардия (<50 ударов в минуту);
-
симптоматическая гипотония (<85 мм рт.ст.);
-
атриовентрикулярная блокада II степени и выше;
-
тяжёлый облитерирующий эндартериит.
Абсолютные показания для назначения β-адреноблокаторов — ХСН в сочетании с сахарным диабетом 2-го типа. Все положительные свойства препаратов этого класса полностью сохраняются при наличии сахарного диабета. Применение некардиоселективного β1— и β2-адреноблокатора с дополнительными свойствами α1-адреноблокатора карведилола у таких пациентов может быть средством выбора за счёт улучшения чувствительности периферических тканей к инсулину.
Результаты исследования SENIORS с применением β1-адреноблокатора небиволола показали небольшое, но достоверное суммарное снижение частоты госпитализации и смертей у больных ХСН старше 75 лет. Это позволило рекомендовать небиволол для лечения больных ХСН старше 70 лет.
Дозы β-адреноблокаторов для лечения больных ХСН, утверждённые Национальными рекомендациями ВНОК И ОССН, представлены в табл. 21-8.
Таблица 21-8. Дозы β-адреноблокаторов для лечения пациентов с хронической сердечной недостаточностью
|
Препарат |
Доза (мг) и кратность назначения |
||
|
стартовая |
средняя терапевтическая |
максимальная |
|
|
Бисопролол (конкор) |
1,25х1 |
10×1 |
10х1 |
|
Метопролола сукцинат (беталок ЗОК) |
12,5х1 |
100х1 |
20х1 |
|
Карведилол (дилатренд) |
3,125х1 |
25×1 |
25х2 |
|
Небиволол (небилет) у больных старше 70 лет |
1,25х1 |
10×1 |
10х1 |
Опубликованы первые результаты исследования BETACAR по изучению эффективности и безопасности бетаксолола в сравнении с карведилолом при лечении ХСН у пациентов с фракцией выброса левого желудочка менее 35%. Была выявлена одинаковая эффективность и переносимость бетаксолола и карведилола.
Применение неселективного β-адреноблокатора буциндолола*, обладающего умеренной внутренней симпатомиметической активностью и дополнительными вазодилатирующими свойствами, недостоверно снижало общую смертность и частоту госпитализаций в связи с ХСН, отмечалось ухудшение прогноза и рост риска смерти на 17% в группе пациентов чёрной расы.
Необходимо дальнейшее уточнение эффективности препаратов этой группы у отдельных демографических групп пациентов, у пожилых пациентов, больных с мерцательной аритмией.
Таблица 21-9. Начальные, целевые дозы и схема подбора доз β-адреноблокаторов при хронической сердечной недостаточности по результатам крупномасштабных плацебо-контролируемых исследований
|
β-Адреноблокатор |
Начальная доза, мг |
Схема подбора дозы (суммарная суточная доза, мг) |
Целевая доза (суммарная суточная доза, мг) |
|||||||
|
недели лечения |
||||||||||
|
1-я |
2-я |
3-я |
4-я |
5-я |
6-я |
7-я |
12-15-я |
|||
|
Метопролол (исследование MCD) |
5 |
10 |
15 |
30 |
50 |
75 |
100 |
150 |
— |
100-150 |
|
1-я |
2-я |
3-я |
4-7-я |
8-11-я |
12-15-я |
|||||
|
Бисопролол (CIBIS-II) |
1,25 |
1,25 |
2,5 |
3,75 |
5,0 |
7,5 |
10 |
10 |
||
|
1-я |
2-я |
3-я |
4-я |
5-я |
6-я |
7-я |
12-15-я |
|||
|
Карведилол (исследования в США) |
3,125 |
6,26 |
— |
12,5 |
— |
25 |
— |
50 |
— |
50 |
МЕХАНИЗМЫ ГИПОТЕНЗИВНОГО ДЕЙСТВИЯ β-АДРЕНОБЛОКАТОРОВ
β-адреноблокаторы — препараты стартовой терапии в лечении артериальной гипертензии и занимают первое место в лечении артериальной гипертензии у пациентов после перенесённого инфаркта миокарда, страдающих стабильной стенокардией, сердечной недостаточностью, у лиц с непереносимостью ингибиторов АПФ и/или блокаторов рецепторов ангиотензина II, у женщин детородного возраста, планирующих беременность.
В результате блокады β-адренорецепторов сердца снижается ЧСС и сократительная способность миокарда, уменьшается сердечный выброс. Блокада β-адренорецепторов в клетках юкстагломерулярного аппарата почек приводит к снижению секреции ренина, уменьшению образования ангиотензина, снижению ОПСС. Уменьшение продукции альдостерона способствует уменьшению задержки жидкости. Изменяется чувствительность барорецепторов дуги аорты и каротидного синуса, угнетается высвобождение норадреналина из окончаний постганглионарных симпатических нервных волокон. Происходит торможение центральных адренергических влияний (для β-адреноблокаторов, проникающих через ГЭБ).
Применение β-адреноблокаторов способствует снижению систолического и диастолического АД, контролю АД в ранние утренние часы, нормализации суточного профиля АД. β-адреноблокаторы в результате снижения активности симпатической и ренин-ангиотензиновой системы предотвращают и способствуют регрессу гипертрофии левого желудочка. Опосредованное снижение уровня альдостерона ограничивает стимуляцию фиброза миокарда, улучшая диастолическую функцию левого желудочка.
Уровень селективности β-адреноблокаторов определяет влияние на ОПСС. Селективные β1-адреноблокаторы не оказывают существенного влияния на ОПСС, неселективные, за счёт блокады β2-рецепторов сосудов, могут усиливать вазоконстрикторный эффект и повышать ОПСС.
β-Адреноблокаторы с дополнительным вазодилатирующим действием или α-, β-адреноблокатор лабетолол* — препараты выбора при угрозе расслаивания аневризмы аорты на фоне повышения АД. Лабетолол* — препарат выбора в лечении гипертонического криза, осложнённого острой коронарной недостаточностью, парентеральное введение неселективного β-адреноблокатора показано при развитии тахикардии или нарушениях ритма.
Лабетолол* и эсмолол* — препараты выбора ведения больных с черепномозговыми травмами, осложнёнными гипертоническими кризами.
Лабетолол* и окспренолол* — препараты выбора для контроля уровня АД у беременных, в случае непереносимости метилдопы. Эффективность пиндолола сравнима с окспренололом* и лабетололом*. При длительном применении атенолола было обнаружено снижение массы новорождённого и плаценты, что связано со снижением фетоплацентарного кровотока.
В табл. 21-10 представлены основные дозы и кратность приёма β-адреноблокаторов для лечения артериальной гипертензии.
Таблица 21-10. Суточные дозы и кратность приёма β-адреноблокаторов для лечения артериальной гипертензии
| Международное название | Средние дозы (мг/сутки) | Кратность приёма |
|---|---|---|
|
Атенолол |
25-100 |
1-2 |
|
Ацебутолол* |
200-800 |
1-2 |
|
Бетаксолол |
10-20 |
1 |
|
Бисопролол |
2,5-10 |
1 |
|
Карведилол |
25-75 |
2 |
|
Лабетолол* |
200-800 |
2-3 |
|
Метопролол |
50-200 |
2-3 |
|
Надолол |
40-160 |
1 |
|
Небиволол |
2,5-5 |
1 |
|
Окспренолол* |
60-200 |
2-3 |
|
Пиндолол |
10-40 |
2-3 |
|
Пропранолол |
60-160 |
2-3 |
|
Соталол |
80-160 |
1-2 |
|
Целипролол* |
200-500 |
1-2 |
КОНТРОЛЬ ТЕРАПИИ β-АДРЕНОБЛОКАТОРАМИ
Эффективная ЧСС на максимуме ожидаемого действия очередной дозы β-адреноблокатора (обычно через 2 ч после приёма) составляет 55-60 ударов в минуту. Стабильный гипотензивный эффект наступает через 3-4 нед регулярного приёма препарата. Учитывая возможность замедления атриовентрикулярной проводимости, необходим контроль ЭКГ, особенно в случаях более значительного снижения ЧСС. Tребуют внимания пациенты с явлениями скрытой недостаточности кровообращения, таким пациентам необходимо более длительное титрование дозы β-адреноблокатора из-за угрозы развития явлений декомпенсации (появление утомляемости, прибавки веса, одышки, хрипов в лёгких).
Возрастные особенности фармакодинамики β-адреноблокаторов обусловлены изменениями во взаимодействии между β-адренорецепторами и стимуляцией продукции АЛТ, связыванием рецептора с аденилатциклазой. Изменяется и извращается чувствительность β-адренорецепторов к β-адреноблокаторам. Это определяет разнонаправленность и труднопрогнозируемый характер фармакодинамического ответа на лекарственное средство.
Изменяются и фармакокинетические параметры: уменьшается белковая ёмкость крови, водная и мышечная масса тела, увеличивается объём жировой ткани, изменяется тканевая перфузия. Объём и скорость печёночного кровотока уменьшается на 35-45%. Снижается количество гепатоцитов, уровень их ферментативной активности — масса печени снижается на 18-25%. Уменьшается количество функционирующих клубочков почек, СКФ (на 35-50%) и канальцевой секреции.
ПРЕПАРАТЫ β-АДРЕНОБЛОКАТОРОВ
Неселективные β-адреноблокаторы
Пропранолол — неселективный β-адреноблокатор без внутренней симпатомиметической активности с непродолжительным действием. Биодоступность пропранолола после приёма внутрь составляет менее 30%, T1/2 — 2-3 ч. Из-за большой скорости метаболизма препарата при первом прохождении через печень концентрации его в плазме крови после приёма одной и той же дозы могут различаться у разных людей в 7-20 раз. С мочой в виде метаболитов элиминируется 90% принятой дозы. На распределение в организме пропранолола и, по-видимому, других β-адреноблокаторов оказывает влияние ряд препаратов. В то же время сами β-адреноблокаторы могут изменять метаболизм и фармакокинетику других ЛС. Пропранолол назначают внутрь, начиная с небольших доз — 10-20 мг, постепенно (особенно у пожилых людей и при подозрении на сердечную недостаточность) в течение 2-3 нед доводя суточную дозу до эффективной (160-180-240 мг). Учитывая короткий T1/2 препарата, для достижения постоянной терапевтической концентрации необходимо принимать пропранолол 3-4 раза в сутки. Лечение может быть длительным. Следует помнить, что высокие дозы пропранолола могут привести к учащению побочных эффектов. Для выбора оптимальной дозы необходимо регулярное измерение ЧСС и АД. Отменять препарат рекомендуют постепенно, особенно после длительного приёма либо после использования больших доз (уменьшать дозу на 50% в течение одной недели). Резкое прекращение его приёма может вызвать синдром отмены: учащение приступов стенокардии, развитие желудочковой тахикардии или инфаркта миокарда, а при артериальной гипертензии — резкий подъём АД.
Надолол — неселективный β-адреноблокатор без внутренней симпатомиметической активности и мембраностабилизирующей активности. Отличается от остальных препаратов этой группы длительным действием и способностью улучшать функцию почек. Надолол обладает антиангинальной активностью. Оказывает меньшее кардиодепрессивное действие, возможно, из-за отсутствия мембраностабилизирующей активности. При приёме внутрь абсорбируется около 30% препарата. Tолько 18-21% связывается с белками плазмы. Пик концентрации в крови после приёма внутрь достигается через 3-4 ч, T1/2 составляет от 14 до 24 ч. Это позволяет назначать препарат 1 раз в сутки при лечении больных как стенокардией, так и артериальной гипертензией. Надолол не метаболизируется в организме, выводится почками и кишечником в неизменённом виде. Полное выделение достигается только через 4 сут после однократной принятой дозы. Надолол назначают по 40-160 мг 1 раз в сутки. Стабильный уровень его концентрации в крови достигается после 6-9 дней приёма.
Пиндолол — неселективный β-адреноблокатор с внутренней симпатомиметической активностью. Он хорошо всасывается при приёме внутрь. Отличается высокой биодоступностью, T1/2 — 3-6 ч, β-блокирующий эффект сохраняется в течение 8 ч. С белком соединяется около 57% принятой дозы. С мочой выделяется 80% препарата (40% в неизменённом виде). Метаболиты его представлены в виде глюкуронидов и сульфатов. ХПН существенно не меняет константы элиминации и времени полувыведения. Скорость элиминации препарата снижается только при тяжёлой почечной и печёночной недостаточности. Препарат проникает через ГЭБ и плаценту. Совместим с диуретиками, антиадренергическими препаратами, метилдопой, резерпином, барбитуратами, наперстянкой. По β-адреноблокирующему действию 2 мг пиндолола эквивалентны 40 мг пропранолола. Пиндолол применяют по 5 мг 3-4 раза в сутки, а в тяжёлых случаях — по 10 мг 3 раза в сутки. При необходимости препарат можно вводить внутривенно капельно по 0,4 мг; максимальная доза при внутривенном введении составляет 1-2 мг. Препарат вызывает менее выраженный отрицательный инотропный эффект в покое, чем пропранолол. Он слабее, чем другие неселективные β-адреноблокаторы, влияет на β2 -адренорецепторы и поэтому в обычных дозах более безопасен при бронхоспазме и сахарном диабете. При артериальной гипертензии гипотензивный эффект пиндолола развивается медленнее, чем у пропранолола: начало действия — через неделю, а максимальный эффект — через 4-6 нед.
Селективные β-адреноблокаторы
Небиволол — высокоселективный β1-адреноблокатор III поколения. Активное вещество небиволола — рацемат, состоит из двух энантиомеров: D-небиволол — конкурентный и высокоселективный β1 -адреноблокатор, L-небиволол оказывает мягкое возодилатирующее действие за счёт модуляции высвобождения из эндотелия сосудов релаксирующего фактора (NO), который поддерживает нормальный базальный тонус сосудов. После приёма внутрь быстро всасывается. Высоколипофильный препарат, активно метаболизируется, частично с образованием активных гидроксиметаболитов. Стабильная равновесная концентрация у лиц с быстрым метаболизмом достигается в течение 24 ч, для гидроксиметаболитов — через несколько суток.
Уровень гипотензивного эффекта у отвечающих на терапию пациентов увеличивается пропорционально 2,5-5 мг суточной дозе препарата, поэтому средняя эффективная доза небиволола принята, соответственно, 5 мг в сутки. При почечной недостаточности, а также у лиц старше 65 лет начальная доза не должна превышать 2,5 мг.
Гипотензивное действие небиволола развивается после первой недели лечения, нарастает к 4-й нед регулярного применения, при длительном лечении вплоть до 12 мес эффект стабильно удерживается. АД после прекращения приёма небиволола медленно, в течение 1 мес, возвращается к исходному уровню, синдрома отмены в виде обострения гипертонии не наблюдают.
Благодаря наличию вазодилатирующих свойств небиволол не влияет на показатели почечной гемодинамики (сопротивление почечных артерий, почечный кровоток, клубочковую фильтрацию, фильтрационную фракцию) как у больных с нормальной, так и нарушенной почечной функцией на фоне артериальной гипертонии.
Несмотря на высокую липофильность, небиволол практически лишён побочных эффектов со стороны ЦНС: он не вызывал свойственных липофильным β-адреноблокаторам нарушений сна, кошмарных сновидений. Единственное неврологическое расстройство — парестезии (частота 2-6%). Сексуальные расстройства возникали с частотой, не отличающейся от плацебо (менее 2%).
Карведилол обладает β- и α1-адреноблокирующими, а также антиоксидантными свойствами. Он снижает постнагрузку на сердце благодаря артериолярной вазодилатации и тормозит нейрогуморальную вазоконстрикторную активацию сосудов и сердца. Карведилол обладает пролонгированным антигипертензивным эффектом.
Ему свойствен антиангинальный эффект. Он не обладает собственной симпатомиметической активностью. Карведилол тормозит пролиферацию и миграцию гладкомышечных клеток, по-видимому, действуя на специфические митогенные рецепторы. Карведилол обладает липофильными свойствами, при первом прохождении через печень подвергается метаболизму, экскретируется через печень. T1/2 составляет 6 ч. В плазме крови карведилол на 95% связан с белками. Применяют при артериальной гипертензии по 25-50 мг 1 раз в сутки; при стенокардии напряжения и при ХСН — по 25-50 мг 2 раза в сутки.
Бисопролол — высокоселективный длительно действующий β1-адреноблокатор без внутренней симпатомиметической активности, не вызывает мембраностабилизирующего эффекта. Обладает амфофильными свойствами. Благодаря пролонгированному действию его можно назначать один раз в сутки. Пик действия бисопролола наступает через 2-4 ч после приёма, антигипертензивный эффект продолжается 24 ч. Биодоступность составляет 65-75% для бисопролола гидрохлорида и 80% для бисопролола фумарата. Биодоступность препарата увеличена у пожилых пациентов. Приём пищи не влияет на биодоступность бисопролола. Малая связь с белками плазмы (30%) обеспечивает безопасность при совместном применении с большинством лекарственных препаратов. 20% бисопролола метаболизируется в три неактивных метаболита. Отмечают линейную зависимость фармакокинетики препарата от дозы в границах 2,5-20 мг. T1/2 составляет 7-15 ч для бисопролола фумарата и 4-10 ч для бисопролола гидрохлорида. С белками крови бисопролола фумарат связывается на 30%, бисопролола гидрохлорид — на 40-68%. Возможна кумуляция бисопролола в крови при нарушении функции печени и почек. В равной степени экскретируется печенью и почками. Скорость элиминации препарата снижается только при тяжёлой почечной и печёночной недостаточности, в связи с этим возможна кумуляция бисопролола в крови при нарушении функции печени и почек.
Проникает через ГЭБ. Применяется при артериальной гипертонии, стенокардии, сердечной недостаточности. Начальная доза при гипертонии составляет 5-10 мг в сутки, возможно увеличение дозы до 20 мг в день, при недостаточности функции печени и почек суточная доза не должна превышать 10 мг. Бисопролол не влияет на уровень глюкозы в крови у больных сахарным диабетом и на уровень тиреоидных гормонов, практически не влияет на потенцию у мужчин.
Бетаксолол — кардиоселективный β1-адреноблокатор без внутренней симпатомиметической активности и со слабовыраженными мембраностабилизирующими свойствами. Выраженность блокады β-адренорецепторов в 4 раза превышает эффекты пропранолола. Обладает высокой липофильностью. Хорошо (более 95%) всасывается в пищеварительном тракте. После однократного приёма достигает максимальных концентраций в плазме крови через 2-4 ч. Приём пищи не влияет на степень и скорость абсорбции. В отличие от других липофильных препаратов биодоступность при приёме внутрь бетаксолола составляет 80-89%. Это объясняется отсутствием эффекта «первого прохождения» через печень. Индивидуальные особенности метаболизма не влияют на вариабельность концентраций препарата в сыворотке крови. Это позволяет ожидать более стабильного ответа на действие препарата при его применении. Степень снижения ЧСС пропорциональна дозе бетаксолола. Отмечают корреляцию антигипертензивного эффекта с пиком концентрации бетаксолола в крови к 3-4 ч после приёма и далее в течение 24 ч, зависимость эффекта от дозы. При регулярном приёме бетаксолола антигипертензивный эффект достигает максимальной величины через 1-2 нед. Бетаксолол метаболизируется в печени путём микросомального окисления, однако циметидин не изменяет концентрации препарата при совместном применении и не приводит к удлинению T1/2. T1/2 составляет 14-22 ч, что позволяет принимать препарат 1 раз в сутки. У лиц старшего возраста T1/2 увеличивается до 27 ч.
Связывается с белками плазмы на 50-55%, из них с альбуминами — на 42%. Заболевания печени и почек не влияют на степень связывания с белками, она не изменяется при одновременном приёме дигоксина, аспирина* , диуретиков. Бетаксолол и его метаболиты выводятся с мочой. Скорость элиминации препарата снижается только при тяжёлой почечной и печёночной недостаточности. Особенности фармакокинетики бетаксолола не требуют изменения режима дозирования при тяжелой печёночной и умеренной почечной недостаточности. Коррекция дозы препарата необходима только в случае тяжёлой почечной недостаточности и у пациентов, находящихся на диализе. Больным со значительной почечной недостаточностью, требующим гемодиализа, начальная доза бетаксолола составляет 5 мг в сутки, дозу можно увеличивать на 5 мг каждые 14 дней, максимальная доза — 20 мг. Начальная доза при гипертонии и стенокардии составляет 10 мг 1 раз в сутки, при небходимости дозу можно удвоить через 7-14 дней. Для усиления эффекта бетаксолол можно комбинировать с тиазидными диуретиками, вазодилататорами, агонистами имдазолиновых рецепторов, α1-адреноблокаторами. Преимущество перед другими селективными β1 -адренорецепторами — отсутствие снижения концентрации липопротеина высокой плотности. Бетаксолол не оказывает влияния на процесс метаболизма глюкозы и компенсаторные механизмы при гипогликемии. По степени снижения ЧСС, АД, повышения толерантности к физической нагрузке у больных стенокардией эффекты бетаксолола не отличались от надолола.
Метопролол — селективный β1-адреноблокатор. Биодоступность метопролола составляет 50%, T1/2 — 3-4 ч для лекарственной формы обычного высвобождения. С белками крови связывается около 12% препарата. Метопролол быстро распределяется в тканях, проникает через ГЭБ, обнаруживается в грудном молоке в более высоких концентрациях, чем в плазме. Препарат подвергается интенсивному печёночному метаболизму в системе цитохрома Р450, имеет два активных метаболита — α-гидроксиметопролол и Ο-диметилметопролол. Возраст не влияет на концентрацию метопролола, цирроз увеличивает биодоступность до 84% и T1/2 до 7,2 ч. При ХПН аккумуляции препарата в организме не происходит. У больных гипертиреозом снижается уровень достигаемой максимальной концентрации и площади под кинетической кривой. Метопролол существует в виде метопролола тартрата (форм обычного и замедленного высвобождения), метопролола сукцината с длительным контролируемым высвобождением. Формы замедленного высвобождения имеют максимальную пиковую концентрацию активного вещества в 2,5 раза ниже форм обычного высвобождения, что имеет преимущество у пациентов с недостаточностью кровообращения. Фармакокинетические параметры для метопролола различного высвобождения в дозе 100 мг представлены в табл. 21-11.
Таблица 21-11. Фармакокинетика лекарственных форм метопролола
| Показатель/форма высвобождения | Метопролол тартрат/ обычная | Метопролол тартрат/ замедленная | Метопролол сукцинат/ контролируемая |
|---|---|---|---|
|
Cmax , нмоль/л |
722 |
207 |
136-143 |
|
AUC, нмоль/л в ч |
4645 |
2148 |
1994-3068 |
|
Тmax, ч |
1,3 |
2,8 |
2,2-7,3 |
Метопролол сукцинат в форме контролируемого высвобождения имеет постоянную скорость высвобождения активного вещества, всасывание в желудке не зависит от приёма пищи.
При артериальной гипертензии и стенокардии метопролол назначают 2 раза в день по 50-100-200 мг в сутки. Гипотензивный эффект наступает быстро, систолическое АД снижается через 15 мин, максимально — через 2 ч; диастолическое
АД снижается после нескольких недель регулярного приёма. Формы замедленного высвобождения являются препаратами выбора при лечении ХСН.
Атенолол — селективный β1-адреноблокатор, не обладающий внутренней симпатомиметической и мембраностабилизирующей активностью. Абсорбируется из пищеварительного тракта приблизительно на 50%. Пик плазменной концентрации наступает через 2-4 ч. Почти не метаболизируется в печени и элиминируется преимущественно почками. Около 6-16% связывается с белками плазмы. T1/2 составляет 6-7 ч как при разовом, так и при длительном назначении. После орального приёма снижение сердечного выброса наступает уже через час, максимальный эффект между 2 и 4 ч и продолжительность не менее 24 ч. Гипотензивный эффект, как и у всех β-адреноблокаторов, не коррелирует с уровнем в плазме и нарастает после постоянного приёма в течение нескольких недель. При артериальной гипертензии начальная доза составляет 25-50 мг, при отсутствии эффекта в течение 2-3 нед дозу увеличивают до 100-200 мг, разделённых на два приёма. У пожилых пациентов при наличии ХПН рекомендуют коррекцию дозы при клубочковой фильтрации ниже 35 мл/мин.
ПОБОЧНЫЕ ЭФФЕКТЫ β-АДРЕНОБЛОКАТОРОВ
Побочные эффекты β-адреноблокаторов определяются их преимущественным блокирующим влиянием на тот или иной вид рецепторов; уровень липофильности определяет наличие побочных эффектов со стороны ЦНС (табл. 21-12).
Таблица 21-12. Характеристика побочных эффектов β-адреноблокаторов
| Механизм развития | Описание |
|---|---|
|
β1-Блокада |
Клинические: похолодание конечностей, сердечная недостаточность, редко — бронхоспазм и брадикардия. |
|
β2-Блокада |
Клинические: слабость, похолодание конечностей, бронхоспазм, гипертензивные реакции. |
|
Липофильность |
Расстройства ЦНС (нарушение сна, депрессия, кошмарные сновидения) |
Основные побочные эффекты β-адреноблокаторов: синусовая брадикардия, развитие или нарастание степени атриовентрикулярной блокады, манифестация скрытой застойной сердечной недостаточности, обострение бронхиальной астмы или других обструктивных заболеваний лёгких, гипогликемия, нарушение половой функции у мужчин, различные проявления ангиоспазма, общая слабость, сонливость, депрессия, головокружения, снижение быстроты реакции, возможность развития синдрома отмены (преимущественно для препаратов короткой продолжительности действия).
ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ β-АДРЕНОБЛОКАТАРОВ
Препараты нельзя применять при выраженной брадикардии (менее 48 в минуту), артериальной гипотонии (систолическое АД ниже 100 мм рт.ст.), бронхиальной астме, синдроме слабости синусового узла, нарушениях атриовентрикулярной проводимости высокой степени. Относительными противопоказаниями являются сахарный диабет в стадии декомпенсации, выраженные нарушения периферического кровообращения, выраженная недостаточность кровообращения в состоянии декомпенсации, беременность (для β-адреноблокаторов, не обладающих вазодилатирующим эффектом).
МЕСТО β-АДРЕНОБЛОКАТОРОВ В КОМБИНИРОВАННОЙ ТЕРАПИИ
Монотерапия β-блокаторами эффективна для профилактики ангинозных приступов при стенокардии напряжения I-III функционального класса и у 30-50% больных мягкой и умеренной артериальной гипертензией для поддержания целевых цифр АД. Однако в ряде случаев β-адреноблокаторы используют в комбинации с препаратами других классов для терапии стенокардии, артериальной гипертензии и ХСН (табл. 21-13).
Эффективная комбинация в лечении артериальной гипертензии — сочетание β-адреноблокатора и диуретика. Мочегонный и вазодилатирующий эффекты диуретика ограничивают задержку натрия и повышение тонуса периферических сосудов, свойственных β-адреноблокаторам. β-адреноблокаторы, в свою очередь, подавляют активность симпатоадреналовой и ренин-ангиотензиновой системы, характерных для диуретика. Возможно сдерживание β-адреноблокатором развития диуретической гипокалиемии. Привлекательна невысокая стоимость таких комбинаций.
Существуют фиксированные комбинированные препараты: теноретик (50-100 мг атенолола и 25 мг хлорталидона), лопрессор HGT (50-100 мг метопролола и 25-50 мг гидрохлортиазида), корзоид (40-80 мг надолола и 5 мг бендрофлюметазида), вискальдикс (10 мг пиндолола и 5 мг клопамида), зиак (2,5-5-10 мг бисопролола и 6,25 мг гидрохлортиазида*).
При сочетании с дигидропиридиновыми антагонистами кальция β-адреноблокаторы оказывают аддитивный эффект, противодействуют развитию тахикардии и активации симпатической нервной системы, свойственных начальной терапии дигидропиридинами. Tакая комбинированная терапия показана пациентам с артериальной гипертензией и ИБС. Логимакс* — фиксированная комбинация метопролола 50-100 мг и фелодипина 5-10 мг, теночек* — фиксированная комбинация атенолола 50 мг и амлодипина 5 мг.
Благоприятно сочетание β-адреноблокаторов и α1-адреноблокаторов. β-адреноблокаторы тормозят развитие тахикардии, характерной при назначении α-адреноблокаторов. Блокаторы α1-адренорецепторов уменьшают такие эффекты β-адреноблокаторов, как повышение ОПСС, влияние на липидный и углеводный обмен.
Сочетание β-адреноблокаторов и ингибиторов АПФ, снижая активность ренин-ангиотензиновой системы, может оказывать синергический гипотензивный эффект. Назначение ингибиторов АПФ не подавляет полностью образование ангиотензина II, так как имеются альтернативные пути его образования. Гиперренинемия, возникающая вследствие ингибирования АПФ, может быть снижена с помощью прямого подавляющего действия β-адреноблокаторов на секрецию ренина юкстагломерулярным аппаратом почек. Подавление секреции ренина уменьшит продукцию ангиотензина I и, опосредованно, ангиотензина II. Вазодилатирующие свойства ингибиторов АПФ могут уменьшить вазоконстрикторные эффекты β-адреноблокаторов. Доказан органопротективный эффект такой комбинации у пациентов с застойной сердечной недостаточностью.
Комбинация β-адреноблокатора и агониста имидазолиновых рецепторов (препарата центрального действия) может быть рациональна в комбинированной терапии артериальной гипертензии для достижения целевых цифр АД у пациентов с метаболическими нарушениями (до 80% пациентов артериальной гипертонией страдают метаболическими нарушениями). Аддитивный гипотензивный эффект сочетается с коррекцией инсулинорезистентности, нарушения толерантности к глюкозе, дислипидемии, свойственных классу β-адреноблокаторов.
Таблица 21-13. Комбинированная антигипертензивная терапия с β-адреноблокаторами
|
Предпочтительные комбинации: |
|
β-адреноблокатор + диуретик |
|
β-адреноблокатор + антагонист кальция (дигидропиридинр) |
|
β-адреноблокатор + α1 -адреноблокатор |
|
Менее предпочтительные комбинации: |
|
β-адреноблокатор + ингибитор АПФ |
|
β-адреноблокатор + агонист имидазолиновых рецепторов |
|
Нерекомендуемые комбинации: |
|
β-адреноблокатор + верапамил или дилтиазем |
Таблица 21-14. Лекарственные взаимодействия с β-адреноблокаторами
| Препарат | Сущность взаимодействия |
|---|---|
|
Нитраты |
Потенцирование их антиангинального и антиишемического действия, при этом уменьшается выраженность побочного действия каждого из препаратов (сердцебиение и головная боль вследствие приёма нитратов, брадикардия и похолодание конечностей вследствие приёма β-адреноблокаторов) |
|
Сердечные гликозиды, клонидин |
Потенцируется влияние на проводимость и частоту сердечных сокращений (отрицательное хроно- и дромотропное действие β-адреноблокатора) |
|
Антагонисты кальция: верапамил, дилтиазем, антиаритмики |
Потенцируется влияние на проводимость, сократимость, сердечный ритм (опасность асистолии, атриовентрикулярной блокады высокой степени, брадикардии, коллапса, развития сердечной недостаточности) |
|
Диуретики, антагонисты кальция дигидропиридинового ряда, α-адреноблокаторы, ингибиторы АПФ, блокаторы АТ1 рецепторов ангиотензина |
Потенцируется гипотензивное действие |
|
Ингибиторы МАО |
Риск развития нарушений проводимости, коллапса, повышения АД (применение β-адреноблокаторов возможно только через 15 дней после отмены ингибиторов МАО) |
|
Инсулин, гипогликемические препараты |
Усиление действия, нивелирование симптомов гипогликемии (тахикардии, потливости, мышечного тремора) |
|
Йод-контрастные вещества |
Снижение сердечно-сосудистых компенсаторных реакций при гипотонии |
|
НПВС, глюкокортикоиды, симпатомиметики |
Уменьшение гипотензивного эффекта |
|
Нейролептики, антидепрессанты |
Усиление гипотензивного эффекта |
|
Индукторы печёночного метаболизма (курение, алкоголь, рифампицин, барбитураты, дифенин) |
Усиление метаболизма липофильных препаратов, снижение эффекта β-блокаторов |
|
Ингибиторы печёночного метаболизма (циметидин, хлорпромазин) |
Уменьшение скорости микросомального окисления в гепатоцитах, повышение эффекта β-блокаторов |
|
Средства для наркоза (кроме фторотана) |
Усиление β-блокирующего эффекта |
СПИСОК ЛИТЕРАТУРЫ
Гилман А.Г. Клиническая фармакология по Гудману и Гилману. — М.: Практика, 2006.
Информация о лекарственных средствах для специалистов здравоохранения. Вып. 2. Лекарственные средства, действующие на сердечно-сосудистую систему / Под ред. М.Д. Машковского. — М.: Фармединфо, 1997.
Метелица В.И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. — 3-е изд. — М.: МИА, 2005.
Chairperson J.L.-S., Swedberg K., McMurray J., Tamargo J. et al. Expert consensus document on β-adrenergic receptor blockers. The task Force on beta-blockers of the European Society of Cardiology // Eur. Heart J. — 2004. — Vol. 25. — P. 1341-1362.
α-Адреноблокаторы
Среди препаратов, влияющих на адренергическую регуляцию сосудистого тонуса, выделяют препараты центрального механизма действия (центральные α-агонисты, агонисты имидазолиновых рецепторов) и блокаторы периферических α-адренорецепторов.
Адренорецепторы, широко распространённые во многих органах и тканях, выполняют различные функции. В связи с этим выделяют α- и β-адренорецепторы, для каждого из которых идентифицированы два подтипа, различные по численному преобладанию в тех или иных органах, функциям, чувствительности к норадреналину и адреналину (табл. 21-15).
Таблица 21-15. Локализация и функции α1- и α2-адренорецепторов
| Ткань | Тип рецептора | Функция |
|---|---|---|
|
Постсинаптические α-адренорецепторы |
||
|
Гладкая мускулатура сосудов |
α1 |
Вазоконстрикция |
|
Гладкая мускулатура урогенитального тракта |
α1а * |
Сокращение |
|
Сердце |
α1 |
Инотропный эффект |
|
Печень |
α1 |
Гликогенолиз |
|
Жировая ткань |
α1 |
Синтез гликогена |
|
ЦНС |
α1 |
Стимуляция |
|
Эндокринные железы |
α1 |
Стимуляция секреции |
|
β-клетки поджелудочной железы |
α2-Постсинаптические |
Ингибирование секреции инсулина |
|
Энтероциты кишечника |
α1 |
Стимуляция транспорта жидкости и электролитов |
|
Тромбоциты |
α2-Постсинаптические |
Агрегация |
|
Пресинаптические α-адренорецепторы |
||
|
Норадренергические нейроны |
α2 |
Ингибирование высвобождения норадреналина |
|
Холинергические нейроны |
α2 |
Ингибирование высвобождения ацетилхолина |
|
Серотонинергические нейроны |
α2 |
Ингибирование высвобождения серотонина |
* α1а — уроселективные рецепторы.
В регуляции сосудистого тонуса участвуют α- и β-адренорецепторы, локализованные в окончаниях сосудосуживающих нервов. Их медиатор — норадреналин. В синаптической щели норадреналин, высвобождающийся из пресинаптического окончания, стимулирует постсинаптические α1-адренорецепторы сосудистой стенки, количество которых преобладает на постсинаптической мембране над β1-адренорецепторами, вследствие чего происходит вазоконстрикция. Пресинаптические α2— и β2-адренорецепторы осуществляют регуляцию норадренергических медиаторных механизмов обратной связи. При этом стимуляция α2-адренорецепторов приводит к усилению обратного депонирования медиатора из синаптической щели в везикулы пресинаптического окончания и ингибированию последующего высвобождения норадреналина (отрицательная обратная связь). β2-Адренорецепторы, наоборот, повышают высвобождение норадреналина в щель (положительная обратная связь).
Класс α-адреноблокаторов представлен препаратами, неселективно воздействующими на α1— и α2-адренорецепторы (фентоламин), и селективными α1-адреноблокаторами. Неселективная блокада α-адренорецепторов вызывает кратковременное снижение АД. Tакой препарат непригоден для длительной терапии (применяют только для купирования гипертонических кризов).
С 1980 г. в клиническую практику вошли селективные 1</sub>-адреноблокаторы. В настоящее время в группу селективных α1-адреноблокаторов входят несколько препаратов. Условно их разделяют на два поколения с учётом продолжительности действия:
I поколение (короткого действия ) — празозин;
II поколение (длительного действия) — доксазозин, теразозин.
В отдельную группу выделены уроселективные α1А-адреноблокаторы — альфузозин и тамсулозин, блокирующие α1А-адренорецепторы гладкой мускулатуры урогенитального тракта.
Блокада α1-адренорецепторов приводит к снижению сосудистого тонуса и АД. Вместе с тем чувствительность α-адренорецепторов к препаратам неодинакова: празозин, теразозин и доксазозин обладают наибольшим сродством к α1-адренорецепторам, а клонидин — к α2-адренорецепторам. Кроме того, теразозин и доксазозин имеют вполовину меньшее сродство к α1-адренорецепторам, чем празозин.
ФАРМАКОДИНАМИКА α1-АДРЕНОБЛОКАТОРОВ
Фармакодинамические эффекты α1-блокаторов: гипотензивный, гиполипидемический, улучшение оттока мочи. По механизму гипотензивного действия α1-адреноблокаторы представляют собой «чистые» вазодилататоры. В результате блокады α1-адренорецепторов происходит дилатация как резистивных (артериальных), так и ёмкостных (венозных) сосудов, уменьшение ОПСС и снижение АД. Следствие одновременной периферической вазодилатации артерий и вен — небольшая рефлекторная стимуляция сердечного выброса за счёт модуляции высвобождения норадреналина неблокированными α2-адренорецепторами. Эти гемодинамические эффекты можно обнаружить как в покое, так и при физических нагрузках, в отличие от β-адреноблокаторов (табл. 21-16). Наиболее благоприятным и физиологичным влиянием гипотензивного средства на гемодинамику считают падение АД вследствие значительного снижения ОПСС, обусловленного равномерным снижением тонуса артериол и венул на фоне сохранённого сердечнососудистого рефлекторного механизма и неизменного сердечного выброса. В связи с этим β-адреноблокаторы в большинстве случаев предпочтительнее для пациентов, нежели α-адреноблокаторы.
Есть данные, свидетельствующие о том, что центральные механизмы гипотензивного действия α1-адреноблокаторов связаны с понижением центрального симпатического тонуса. Снижение АД под действием α1-адреноблокаторов не сопровождается повышением активности ренина плазмы.
Таблица 21-16. Сравнение гемодинамических эффектов α- и β-адреноблокаторов
| Показатели гемодинамики | α-Адреноблокаторы | β-Адреноблокаторы |
|---|---|---|
|
Частота сердечных сокращений |
↑ |
↓↓ |
|
АД |
↓ |
↓ |
|
Атриовентрикулярная проводимость |
↔ |
↓↓ |
|
Сократимость миокарда |
↔↑ |
↓↓ |
|
ОПСС |
↓↓ |
↓ |
|
Почечный кровоток |
↑ |
↓ |
Примечание: ↑ — увеличение; ↓ — уменьшение; ↔ — нет влияния.
Наиболее значимое снижение АД происходит после приёма первой дозы препарата, особенно в положении стоя. Эквивалентные дозы ЛС, вызывающие одинаковое снижение АД, следующие: 2,4 мг празозина, 4,5 мг доксазозина или 4,8 мг теразозина.
Гипотензивный эффект α1-адреноблокаторов может сопровождаться развитием рефлекторной тахикардии вследствие того, что пресинаптические α2-рецепторы не блокированы, либо по причине антагонизма к центральным α1-адренорецепторам, подавляющим рефлекторную тахикардию. Достоверное увеличение ЧСС происходит после приёма первой дозы, особенно в положении стоя; при длительном применении препаратов ЧСС существенных изменений не претерпевает.
Основной недостаток гипотензивного действия α1-адреноблокаторов — быстрое развитие толерантности, клиническое значение которой неизвестно.
α1 -Адреноблокаторы не изменяют почечный кровоток и экскрецию электролитов. Вместе с тем доксазозин уменьшает микроальбуминурию, что расценивают как нефропротективное действие при артериальной гипертензии.
α1-Адреноблокаторы способны вызывать регресс гипертрофии левого желудочка при длительной монотерапии больных с артериальной гипертензией. Tем не менее, по данным метаанализа клинических исследований, в этом качестве они уступают антагонистам кальция и ингибиторам АПФ: степень уменьшения массы миокарда α1-адреноблокаторами составляет в среднем не более 10%.
α1-Адреноблокаторы благоприятно влияют на липидный и углеводный профиль, вызывая небольшое, но достоверное снижение содержания общего холестерина, липопротеидов низкой плотности и триглицеридов (до 30%), повышая содержание липопротеидов высокой плотности. Данные изменения связаны с антагонизмом к α1-адренорецепторам, участвующим в метаболизме холестерина и триглицеридов, вследствие чего возникают следующие эффекты:
-
уменьшение активности 3-гидрокси-3-метил-глутарил КоА-редуктазы, участвующей в биосинтезе холестерина в печени;
-
повышение функциональной активности рецепторов для связывания липопротеидов низкой плотности вследствие снижения синтеза холестерина почти на 40%;
-
снижение активности эндотелиальной липопротеинлипазы, участвующей в катаболизме триглицеридов;
-
стимуляция синтеза аполипопротеина А1 (основного компонента липопротеида высокой плотности).
При длительном применении α1-адреноблокаторов происходит снижение гликемии и содержания инсулина вследствие повышения чувствительности тканей к глюкозе и стимуляции инсулинзависимой утилизации глюкозы тканями. Данные изменения связаны как со снижением АД, так и с увеличением кровотока через мышечную ткань.
Сравнение эффектов разных классов гипотензивных препаратов приведено в табл. 21-17.
Таблица 21-17. Метаболические эффекты гипотензивных препаратов у больных с артериальной гипертензией
| Показатели | α1-Адреноблокаторы | β-Адреноблокаторы | Диуретики | Антагонисты кальция | Ингибиторы АПФ |
|---|---|---|---|---|---|
|
Общий холестерин |
↔↓ |
↔ |
↔↑ |
↔↑ |
↔ |
|
Липопротеины высокой плотности |
↑ |
↓ |
↓ |
↔ |
↔ |
|
Триглицериды |
↓ |
↑ |
↑ |
↔ |
↔ |
|
Гипергликемия |
↓ |
↑ |
↑ |
↔ |
↓ |
|
Толерантность к глюкозе |
↑ |
↓ |
↓ |
↔ |
↑ |
|
Чувствительность к инсулину |
↑ |
↓ |
↓ |
↔ |
↑ |
Примечание: ↑ — увеличение; ↓ — уменьшение; ↔ — нет влияния.
Дополнительный эффект α1-адреноблокаторов — расслабление мышечного слоя уретры в области простаты, регулируемого α1С-адренорецепторами. Снижение мышечного тонуса уретры способствует уменьшению сопротивления току мочи, облегчает мочеиспускание у пациентов с доброкачественной гиперплазией простаты. Кроме того, неспецифическая блокада α1С-адренорецепторов вызывает дозозависимое расслабление гладких мышц простаты, что уменьшает гиперплазию органа.
ФАРМАКОКИНЕТИКА
α1-Адреноблокаторы — липофильные препараты. Данные о сравнительной фармакокинетике α1 -адреноблокаторов представлены в табл. 21-18.
Таблица 21-18. Сравнительная фармакокинетика α1-адреноблокаторов
| Препарат | Биодоступность, % | Связь с белками, % | Тmax, ч | Время максимального действия, ч | Длительность действия, ч | Биотрансформация в печени | Т1/2, ч | Элиминация жёлчь/почки, % в неизменённом виде |
|---|---|---|---|---|---|---|---|---|
|
Празозин |
50-85 |
97 |
1-3 |
2-4 |
7-10 |
+*(активные метаболиты) |
2-3 |
90 (5-11%)/6-10 |
|
Теразозин |
90 |
90-94 |
1 |
2-3 |
24 |
+ (активный метаболит) |
12 |
60 (20%)/40(10%) |
|
Доксазозин |
65 |
98-99 |
1,5-3,6 |
5-6 |
24 |
+ (активные метаболиты) |
19-22 |
63-65 (5%)/9 |
* — есть пресистемный метаболизм.
α1-Адреноблокаторы хорошо и полностью всасываются после приёма внутрь, биодоступность составляет 50-90%. Время достижения максимальной концентрации (Tmax) составляет от 1 ч у празозина до 3 ч у доксазозина, что влияет на скорость развития гипотензивного эффекта и его переносимость. Максимальная концентрация (Cmax) дозозависима в широком диапазоне.
α1-Адреноблокаторы хорошо связываются с белками плазмы (98-99%), преимущественно с альбуминами, имеют значительный объём распределения. Препараты подвержены активной печёночной биотрансформации с участием микросомальных ферментов (цитохром Р450 ). Празозин имеет высокий печёночный клиренс (в том числе пресистемный); печёночный клиренс доксазозина и теразозина не коррелирует со скоростью печёночного кровотока и значительно меньше, чем у празозина.
Экскреция α1-адреноблокаторов происходит преимущественно с жёлчью (более 60%) в неактивном виде; почечный клиренс имеет меньшее значение. T1/2 наиболее длителен у теразозина и доксазозина.
К настоящему времени в клиническую практику внедрена лекарственная форма доксазозина с контролируемым высвобождением. Особенности фармакокинетики данной лекарственной формы: увеличение Tmax до 8-9 ч (4 ч у обычной лекарственной формы), уменьшение Cmax в 2-2,5 раза при сопоставимом уровне Cmin, колебание Cmax/Cmin — 50-60% (140-200% для обычной лекарственной формы).
Возраст пациента, функция почек не влияют на фармакокинетику α1-адреноблокаторов.
ПОКАЗАНИЯ
α1-Адреноблокаторы назначают при артериальной гипертензии в качестве препаратов второго ряда.
ПРОТИВОПОКАЗАНИЯ
Гиперчувствительность, гипотония, беременность (препараты категории С), кормление грудным молоком, детский возраст.
ПОБОЧНЫЕ ЭФФЕКТЫ
Большинство побочных эффектов α1-адреноблокаторов связано с их фармакодинамическим (гемодинамическим) действием и зависит от скорости наступления эффекта.
Наиболее значимые побочные эффекты α1-адреноблокаторов — гипотензия и ортостатический коллапс — чаще наблюдают после приёма первой дозы празозина, чем теразозина и доксазозина, которые действуют медленнее. Данный гемодинамический эффект называют «феноменом (эффектом) первой дозы». Феномен первой дозы дозозависим и возникает в момент максимального гипотензивного эффекта (через 2-6 ч). При приёме повторных доз α1-адреноблокаторов постуральных явлений не бывает (за исключением коллапсов, вызванных нахождением пожилых пациентов в душном помещении либо на открытом солнце в жару). Однако описанные побочные эффекты могут возобновиться во время длительного лечения при увеличении дозы препарата.
Ортостатический коллапс описан у 2-10% больных, получавших α1 -адреноблокаторы. Коллапса можно избежать, если первую дозу празозина уменьшить до 0,5 мг и назначить на ночь. Другими проявлениями постуральных эффектов считают головокружение, головную боль, сонливость и усталость, встречающиеся у 20% больных. Резкий вазодилатирующий эффект может привести к обострению ИБС и стенокардии. Осторожность необходима в случае применения α1-адреноблокаторов у пожилых, а также у больных, получающих сопутствующую гипотензивную терапию (особенно диуретики), — в этих группах возрастает риск постуральных явлений.
Доксазозин в виде формы с пролонгированным высвобождением реже вызывает эффект первой дозы вследствие замедленной фармакокинетики.
Отёки менее характерны для действия α1-адреноблокаторов (около 4%), однако типичное проявление вазодилатации, вызванной α1-адреноблокаторами, — отёк слизистой носа (заложенность носа, явления ринита). Сердцебиение при приёме α1-адреноблокаторов возникает редко (2%).
У 5-10% больных описано развитие синдрома отмены при прекращении приёма α1-адреноблокаторов.
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ
Фармакодинамические взаимодействия α1-адреноблокаторов в основном связаны с выраженностью гипотензивного эффекта: другие гипотензивные препараты и диуретики его усиливают, а НПВС, эстрогены, симпатомиметики — ослабляют.
ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ПРЕПАРАТОВ
Празозин
Празозин — селективный блокатор постсинаптических α1-адренорецепторов. Гипотензивный эффект празозина не приводит к повышению активности ренина. Рефлекторная тахикардия выражена незначительно, в основном при первом приёме препарата. Празозин расширяет венозное русло, уменьшает преднагрузку, а также понижает ОПСС, поэтому его можно использовать при застойной сердечной недостаточности. Празозин практически не влияет на функцию почек и электролитный метаболизм, поэтому показан при почечной недостаточности. Гипотензивный эффект препарата возрастает в комбинации с тиазидными диуретиками. Препарат обладает значительным гиполипидемическим действием.
Абсорбция празозина зависит от приёма пищи и других индивидуальных особенностей. Средняя биодоступность составляет около 60%. T1/2 составляет 3 ч, однако гипотензивный эффект не связан с содержанием препарата в плазме (продолжается дольше). Празозин начинает действовать через 0,5-3 ч после приёма внутрь. Препарат активно метаболизируется; 90% экскретируется с калом, 10% — с мочой и только 5% — в неизменённом виде. Метаболиты празозина также обладают гипотензивным действием и способны накапливаться в организме.
Препарат назначают, начиная с небольших доз (0,5-1 мг) для того, чтобы избежать развития побочных эффектов (тахикардия, гипотензия), связанных с первым приёмом. Дозу постепенно увеличивают до 3-20 мг в день в 2-3 приёма. Полный гипотензивный эффект наступает через 4-6 нед. Поддерживающая доза составляет 5-7,5 мг/сут.
Побочные эффекты: постуральная гипотония, головокружение, слабость, усталость, головная боль. Незначительно выражена сонливость, сухость во рту, импотенция. В целом препарат обладает хорошей переносимостью.
Доксазозин
Доксазозин — длительнодействующий α1-адреноблокатор. Вазодилатация и снижение ОПСС приводят к уменьшению АД как в покое, так и при физической нагрузке. При этом не происходит увеличения ЧСС и сердечного выброса. При лечении доксазозином содержание норадреналина не меняется или слегка возрастает, а концентрация адреналина, ренина, дофамина и серотонина остаётся прежней.
Снижает сопротивление току мочи. Обладает гиполипидемическим действием, благодаря чему показан пациентам с артериальной гипертензией в сочетании с гиперлипидемией, курящим, больным сахарным диабетом 2-го типа. Опубликованы данные о благоприятном влиянии доксазозина на фибринолиз, наличии антиагрегационных свойств у препарата.
Биодоступность доксазозина составляет 62-69%, пик концентрации в крови — через 1,7-3,6 ч после приёма внутрь. Препарат подвержен в организме О-деметилированию и гидроксилированию; метаболиты малоактивны. Препарат кумулирует при длительном приёме, в связи с чем конечный T1/2 возрастает с 16 до 22 ч. Доза препарата, состояние почек и возраст пациента не влияют на T1/2.
Доксазозин применяют в дозе 1-16 мг один раз в сутки; ввиду развития эффекта первой дозы проводят титрование дозы препарата, начиная с 0,5-1 мг. Создана лекарственная форма доксазозина с контролируемым высвобождением по 4 и 8 мг. Преимущества данной формы — медленное развитие гипотензивного эффекта при сопоставимой степени снижения систолического и диастолического АД, не требующее титрования дозы, уменьшение частоты возникновения эффекта первой дозы, хорошая переносимость.
Побочные эффекты: головокружение, тошнота, головная боль.
Теразозин
Tеразозин также обладает сосудорасширяющим, антидизурическим и гиполипидемическим действием. Препарат расширяет крупные резистивные сосуды и снижает ОПСС, избирательно блокирует α1-адренорецепторы гладкой мускулатуры чревных сосудов, простаты и шейки мочевого пузыря. Нормализует липидный профиль плазмы.
После приёма препарата внутрь происходит быстрое и полное всасывание, биодоступность превышает 90%, пресистемной биотрансформации почти не бывает. Максимальная концентрация в крови достигается в течение 1 ч. В плазме препарат на 90-94% связан с белками. В печени из теразозина образуется ряд неактивных метаболитов. Время полувыведения составляет около 12 ч, однако терапевтический эффект сохраняется не менее 24 ч. 60% препарата экскретируется печенью; при патологии печени происходит снижение клиренса препарата и пролонгирование его терапевтического действия.
Побочные эффекты: слабость, утомляемость, сонливость, беспокойство, головная боль, головокружение, парестезии, снижение либидо, нарушение зрения, шум в ушах, эффект первой дозы, гипотония, тахикардия, аритмии, периферические отёки, кашель, бронхит, ксеростомия, фарингит, тошнота, рвота, артралгия, миалгия, аллергические реакции.
Tеразозин усиливает гипотензивную активность мочегонных средств, адреноблокаторов, антагонистов кальция, ингибиторов АПФ. Препарат назначают внутрь по 1 мг однократно перед сном в положении лёжа (во избежание ортостатической гипотензии); при необходимости дозу постепенно увеличивают до 10-20 мг 1 раз в сутки.
СПИСОК ЛИТЕРАТУРЫ
Гилман А.Г. Клиническая фармакология по Гудману и Гилману. — М.: Практика, 2006.
Информация о лекарственных средствах для специалистов здравоохранения. Вып. 2. Лекарственные средства, действующие на сердечно-сосудистую систему / Под общ. ред. Машковского М.Д. — М.: Фармединфо, 1997.
Метелица В.И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. — 3-е изд. — М.: МИА, 2005.
Сергеев П.В., Шимановский Н.Л. Рецепторы. — М.: Медицина, 1987. — С. 83-92.
Fulton В., Wagstaff A., Sorkin E. Doxazosin: an update of its clinical pharmacology and therapeutic applications in the treatment of hypertension and BPH // Drugs. — 1995. — Vol. 49. — P. 295-320.
Диуретики
Различные классификации диуретических препаратов основаны на химической структуре и механизме действия. Выраженность натрийуретического эффекта определяется местом приложения действия диуретика в нефроне и выражается в процентах экскретируемого натрия от общего количества натрия, профильтрованного в почечных клубочках. В зависимости от данного показателя выделяют три группы диуретиков.
-
Сильнодействующие диуретики, вызывающие экскрецию более 15-20% профильтрованного натрия.
-
Производные сульфамонлантраниловой кислоты (фуросемид, буметанид, пиретанид P, торасемид).
-
Производные феноксиуксусной кислоты (этакриновая кислота, индакринонP).
-
-
Диуретики с умеренно выраженным натрийуретическим действием, вызывающие экскрецию 5-10% профильтрованного натрия.
-
Производные бензотиадиазина (тиазиды и гидротиазиды) — хлоротиазидP, гидрохлоротиазид.
-
Сходные по механизму канальцевого действия с тиазидными диуретиками гетероциклические соединения — хлорталидон, клопамид, индапамид, ксипамидP.
-
-
Слабодействующие диуретики, вызывающие экскрецию менее 5% профильтрованного натрия.
-
Калийсберегающие диуретики — амилорид*, триамтерен, спиронолактон.
-
Ингибиторы карбоангидразы — ацетазоламид и др.
-
При лечении артериальной гипертензии не применяют.
-
-
Осмотические диуретики — маннитол, мочевина, глицерин.
-
При лечении артериальной гипертензии не применяют.
-
-
Наиболее часто используют смешанную классификацию диуретиков.
КЛАССИФИКАЦИЯ
-
Петлевые диуретики.
-
Осмотические диуретики.
-
Тиазидные диуретики.
-
Тиазидоподобные диуретики.
-
Калийсберегающие диуретики.
-
Ингибиторы карбоангидразы.
МЕХАНИЗМ ДЕЙСТВИЯ И ОСНОВНЫЕ ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ
Действие на проксимальный отдел канальцев нефрона оказывают ингибиторы карбоангидразы (ацетазоламид и бензоламид) благодаря наличию в химической структуре незамещённой сульфонамидной группы. Эта группа препаратов ингибирует реабсорбцию натрия, хлоридов и фосфатов и обладает ограниченной диуретической способностью, так как под их действием с мочой экскретируется только 3-5% профильтрованного натрия, значительно большее количество реабсорбируется в более дистальных отделах канальцев. Только небольшая часть транспортируемого натрия в проксимальном отделе канальцев подвержена действию этих препаратов. Кроме того, диуретический эффект ограничен способностью снижать СКФ. Вторичным эффектом на проксимальный отдел канальцев обладают этакриновая кислота, фуросемид, буметанид, маннитол, хлоротиазид* , индапамид, но основное действие они оказывают на другие отделы канальцев.
Основное действие на восходящее колено петли Генле, где происходит реабсорбция около 15-25% профильтрованного в просвет канальцев натрия из провизорной мочи, оказывают наиболее мощные натрийуретические средства из различных по биохимическому строению соединений:
-
фуросемид, буметанид и торасемид;
-
производное феноксиацетиловой кислоты — этакриновая кислота.
Все эти препараты оказывают первичный ингибирующий эффект на электронейтральный взаимосвязанный транспорт ионов натрия, калия и хлора. Кроме того, фуросемид и буметанид оказывают дополнительное действие на проксимальный отдел канальцев, причём у фуросемида он более выражен, чем у ингибиторов карбоангидразы. Петлевые диуретики вызывают экскрецию с мочой более чем 15-20% профильтрованного натрия из провизорной мочи.
Основное действие на начальную часть дистальных извитых канальцев, где реабсорбируется около 5-8% профильтрованного натрия, оказывают тиазидные и тиазидоподбные диуретики: хлоротиазид*, гидрохлоротиазид, индапамид и др. Tранспортный механизм в этом участке нефрона ввиду совместного транспорта ионов натрия и хлора электронейтрален. Хлоротиазид* и индапамид обладают также дополнительным действием на проксимальный отдел канальцев.
Основное действие на конечную часть дистальных извитых канальцев и кортикальный отдел собирательных трубок, где реабсорбируется только 2-3% профильтрованного натрия, и обмен на ионы калия и водорода оказывают так называемые калийсберегающие диуретики, такие как спиронолактон, амилорид* и триамтерен. Спиронолактон — антагонист альдостерона, конкурирует с последним за места связывания. Амилорид* оказывает основной эффект на натриевые каналы, блокируя их или вызывая закрытие этих каналов. Действие триамтерена подобно действию амилорида*. Эти препараты обладают слабым натрийуретическим эффектом, поэтому их чаще всего применяют в комбинации с тиазидовыми диуретиками для уменьшения потерь калия с мочой.
Петлевые диуретики
Механизм действия и основные фармакологические эффекты
ЛС этой группы обладают способностью блокировать активный транспорт натрия. Эффект реализуется через ингибирование транспортного белка, обеспечивающего перенос ионов натрия, калия и хлора через эпителиальные клетки канальцев. Петлевые диуретики в разной степени повышают почечный кровоток. Возможно, этот эффект обеспечивается за счёт простациклина, синтез которого диуретики увеличивают. Препараты не изменяют СКФ. Фуросемид и другие петлевые диуретики выраженно стимулируют образование ренина, а при снижении объёма циркулирующей крови вызывают рефлекторную активацию симпатической нервной системы и стимулируют процессы внутрипочечной барорецепции. Повышение синтеза простациклина приводит к расширению венозного русла и снижению давления наполнения в левом желудочке сердца. Этот эффект особенно выражен у фуросемида и проявляется при отёке лёгких ещё до начала диуретического действия.
Данная группа диуретиков даёт выраженный, но кратковременный диуретический эффект. В период действия петлевых диуретиков экскреция ионов натрия с мочой значительно возрастает, однако после прекращения диуретического эффекта препаратов скорость экскреции ионов натрия уменьшается до уровня ниже исходного. Это явление получило название «феномен рикошета». Предполагают, что в его основе лежит резкая активация ренин-ангиотензиновой и других антинатрийуретических нейрогуморальных систем в ответ на массивный диурез, вызываемый петлевыми диуретиками. Выраженная экскреция ионов натрия во время диуретического эффекта короткодействующих петлевых диуретиков (например, фуросемида и буметанида) компенсируется чрезмерной задержкой ионов натрия по окончании диуретического действия. Петлевые диуретики длительного действия не дают эффекта рикошета и потому более эффективны при лечении гипертонической болезни, чем фуросемид и буметанид. Недавние исследования показали, что петлевой диуретик длительного действия торасемид, назначаемый в дозе 2,5 мг 1 раз в сутки, не вызывая значительного диуреза, приводит к столь же существенному снижению АД, как и гидрохлоротиазид, хлорталидон и индапамид. Диуретический эффект петлевых диуретиков значительно возрастает по мере повышения дозы, и в отличие от тиазидных диуретиков петлевые препараты имеют более высокую эффективную дозу. Петлевые диуретики сохраняют свою эффективность при низкой СКФ, что позволяет использовать их для лечения артериальной гипертензии у больных с почечной недостаточностью. Петлевые диуретики (особенно фуросемид) можно вводить внутривенно, благодаря чему их широко используют при лечении гипертонических кризов.
БУМЕТАНИД
Фармакологическое действие
Буметанид вызывает расширение периферических вен, уменьшает преднагрузку на сердце, снижает давление заполнения левого желудочка и давление в лёгочной артерии, снижает системное АД. Диуретический эффект после внутривенного введения начинается через несколько минут, достигая максимума через 15-30 мин. После приёма внутрь диуретический эффект развивается в течение первого часа, достигает максимума через 1-2 ч и длится в зависимости от дозы 4-6 ч.
Фармакокинетика
После приёма внутрь препарат быстро абсорбируется из пищеварительного тракта. Возможно замедление абсорбции у пациентов с асцитом на фоне ХСН или нефротического синдрома. Связывание с белками плазмы составляет 95-97%. Метаболизируется в печени (метаболизм ограничен, в результате образуются неактивные метаболиты). T1/2 составляет 1,2-1,5 ч. 64% препарата экскретируется почками в неизменённом виде, остальное выделяется с калом.
Показания
Отёчный синдром различного генеза (при ХСН, синдроме портальной гипертензии, нефротическом синдроме). Отёк лёгких, отёк мозга. Артериальная гипертензия. С целью форсирования диуреза. Поздний гестоз (эклампсия).
Режим дозирования
Внутрь назначают в дозе 0,5-2 мг однократно утром натощак. По достижении клинического эффекта переходят на поддерживающую терапию. Максимальная суточная доза равна 10 мг. Разовая доза при внутривенном введении составляет 0,5-1 мг, при внутримышечном введении — 0,5-1,5 мг. Кратность введения зависит от показаний и клинической ситуации.
Противопоказания
Острая почечная недостаточность (анурия), тяжёлая почечная недостаточность, I триместр беременности, возраст до 18 лет (эффективность и безопасность не определены), период лактации, повышенная чувствительность к буметаниду.
Побочное действие
Гипонатриемия, гипокалиемия, гипохлоремический алкалоз. Повышенная утомляемость, слабость; ортостатическая гипотензия, аритмии; сухость во рту, жажда, диарея, анорексия, нарушение функции печени (желтуха), панкреатит. Гиперурикемия, обострение подагры; головная боль, головокружение; мышечные спазмы, миалгия, тетания. Возможны боли в суставах. При применении в высоких дозах у больных с выраженными нарушениями выделительной функции почек возможно ототоксическое действие; нечёткость зрения; редко зуд. Аллергические реакции редки и выражены в виде сыпи.
Среди редких побочных эффектов отмечают ускорение эякуляции, нарушение эрекции, лейкопению или агранулоцитоз, тромбоцитопению, гиперемию или болезненность в месте инъекции.
Особые указания
C осторожностью следует применять при сахарном диабете, гиперурикемии (подагра в анамнезе, уратный нефроуролитиаз), нарушении слуха, печёночной недостаточности (гипокалиемия способствует развитию печёночной энцефалопатии), инфаркте миокарда, панкреатите в анамнезе, гипокалиемии (при заболеваниях, способствующих гипокалиемии), одновременно с препаратами, токсичность которых повышается при гипокалиемии, у пациентов пожилого возраста.
У пациентов с почечной недостаточностью повышен риск развития нарушений водно-электролитного обмена. Для профилактики гипокалиемии лечение необходимо проводить на фоне диеты, богатой калием.
Больным, получающим буметанид в высоких дозах, во избежание развития гипонатриемии и гипохлоремического алкалоза нецелесообразно рекомендовать ограничение поваренной соли. В период лечения необходимо контролировать содержание электролитов плазмы, кислотно-основное равновесие, содержание остаточного азота. При появлении или усилении азотемии и олигурии (более 24 ч) у пациентов с тяжёлыми прогрессирующими заболеваниями почек рекомендуют приостановить применение буметанида.
На фоне применения буметанида возможен риск развития ортостатической гипотензии при жаркой погоде и при резком переходе в вертикальное положение из положения лёжа или сидя. Пациент должен соблюдать осторожность при длительном положении стоя или выполнении физических упражнений.
В период лечения не рекомендуют употребление этанола.
Лекарственное взаимодействие
Одновременный приём буметанида и некоторых препаратов приводит к лекарственному взаимодействию.
-
Сочетание буметанида с аминогликозидами повышает риск усиления нефрои ототоксического действия последних.
-
При одновременном применении с β-адреномиметиками (фенотеролом, тербуталином* , сальбутамолом) или с глюкокортикоидами возможно усиление гипокалиемии.
-
При одновременном применении с НПВС (ацетилсалициловой кислотой) возможно уменьшение диуретического эффекта. Это обусловлено угнетением синтеза простагландинов в почках и задержкой натрия в организме неспецифическими ингибиторами ЦОГ и антигипертензивного действия.
-
При совместном приёме с астемизолом повышен риск развития аритмии.
-
Сочетание препаратов лития и буметанида приводит к интоксикации литием.
-
Совместный приём буметанида с сердечными гликозидами повышает риск передозировки последними.
-
При одновременном применении буметанида с сукцинилхолином* ослабляется действие сукцинилхолина*.
-
Буметанид усиливает действие тубокурарина хлорида*.
-
При одновременном применении с цизапридом* возможно усиление гипокалиемии.
Беременность и лактация
Буметанид противопоказан к применению в I триместре беременности.
Применение буметанида во II и III триместрах возможно только в том случае, когда ожидаемый терапевтический эффект для матери превышает потенциальный риск для плода.
ЭТАКРИНОВАЯ КИСЛОТА
Фармакодинамика
Обладает выраженным салуретическим и диуретическим эффектом с быстрым началом и коротким периодом действия. Этакриновая кислота уменьшает pH мочи; не влияет на экскрецию бикарбонатов и фосфатов, увеличивает экскрецию кальция и магния, оказывает умеренное гипотензивное действие. Обладает ототоксичностью. Начало действия при приёме внутрь через 30 мин; при внутривенном введении через 5 мин. Cmax после приёма внутрь достигается через 2 ч; после внутривенного введения — через 15-20 мин. Продолжительность эффекта при приёме внутрь — 6-8 ч, после внутривенного введения — 2-3 ч. У пожилых больных имеется риск развития постуральной гипотензии, циркуляторного коллапса, тромбоэмболических осложнений, ухудшения функционального состояния почек, что требует индивидуального подбора дозы и интервала между приёмами. При почечной недостаточности этакриновая кислота может быть эффективна, когда другие препараты не действуют или их применение не показано. При нарушенной функции печени применение этакриновой кислоты может привести к нарушению электролитного баланса, а в случаях прогрессирующего цирроза печени может ускорить летальный исход.
Фармакокинетика
Биодоступность составляет около 100%. Этакриновая кислота практически полностью связывается с белками плазмы крови. T1/2 составляет 1 ч, у пожилых больных этот период удлиняется. Глутатионовые конъюгаты этакриновой кислоты метаболизируются в цистеин и меркаптопурин в печени и почках. Экскреция на 67% осуществляется почками, 33% выделяется с жёлчью, в том числе 20% в неизменённом виде. При недостаточной функции почек или печени этакриновая кислота может накапливаться в организме.
Показания
Сердечная недостаточность, асцит, в том числе при злокачественных новообразованиях, гиперкальциемия.
Применение
В качестве диуретического средства при приёме внутрь начинают с дозы 50-100 мг/сут в один или два приёма, затем при необходимости дозу увеличивают на 25-50 мг/сут. Максимальная доза составляет 400 мг/сут. Поддерживающая доза равна 50-200 мг/сут. Пожилым лицам следует назначать более низкие дозы. При внутривенном введении назначают в качестве диуретического средства раствор в дозе 50 мг или 0,5-1 мг на кг массы тела; повторно вводят через 2-4 ч, затем через каждые 4-6 ч. Запрещается внутримышечное или подкожное введение. При повторных внутривенных введениях следует менять места пункции во избежание развития тромбофлебита. Мощный натрийуретический эффект этакриновой кислоты позволяет не ограничивать поваренную соль.
Противопоказания
Анурия, гипокалиемия, недостаточность функции печени, дигидратация с гипонатриемией, тяжёлая почечная недостаточность, диарея. С осторожностью следует назначать при гипотензии, панкреатитах, при совместном приёме с фуросемидом, при необходимости любого оперативного вмешательства.
Побочные эффекты
См. «Фуросемид».
Взаимодействия
См. «Фуросемид».
ФУРОСЕМИД
Фармакологическое действие
При сердечной недостаточности быстро приводит к снижению преднагрузки на сердце посредством расширения крупных вен. Оказывает гипотензивное действие вследствие увеличения выведения натрия и снижения реакции гладкой мускулатуры сосудов на вазоконстрикторные воздействия и в результате уменьшения объёма циркулирующей крови. Действие фуросемида после внутривенного введения наступает через 5-10 мин; после приёма внутрь — через 30-60 мин, максимум действия достигается через 1-2 ч, продолжительность эффекта составляет 2-3 ч (при сниженной функции почек — до 8 ч). В период действия препарата выведение ионов натрия значительно возрастает, однако после его прекращения скорость выведения уменьшается ниже исходного уровня («феномен рикошета»). Фуросемид уменьшает уровень предсердного натрийуретического фактора в плазме, вызывает вазоконстрикцию. При внутривенном введении вызывает дилатацию периферических вен, уменьшает преднагрузку, снижает давление наполнения левого желудочка и давление в лёгочной артерии, а также системное АД.
Диуретическое действие развивается через 3-4 мин после внутривенного введения и продолжается 1-2 ч; после приёма внутрь — через 20-30 мин, продолжается до 4 ч.
Фармакокинетика
После приёма внутрь абсорбция составляет 60-70%. При тяжёлых заболеваниях почек или ХСН степень абсорбции уменьшается.
Связывание с белками плазмы (преимущественно с альбуминами) равно 95-99%. Метаболизируется в печени. Выводится почками 88%, с жёлчью 12%. T1/2 у пациентов с нормальной функцией почек и печени составляет 0,5-1,5 ч. При анурии T1/2 может возрастать до 1,5-2,5 ч, при сочетанной почечной и печёночной недостаточности — до 11-20 ч.
Показания
Отёчный синдром различного генеза (при ХСН II-III стадии, циррозе печени, нефротическом синдроме). Отёк лёгких, сердечная астма, отёк мозга, эклампсия, проведение форсированного диуреза, артериальная гипертензия тяжёлого течения, некоторые формы гипертонического криза, гиперкальциемия.
Применение
Режим дозирования устанавливают индивидуально, в зависимости от показаний, клинической ситуации, возраста пациента. В процессе лечения корректируют в зависимости от величины диуретического ответа и динамики состояния пациента.
При приёме внутрь начальная доза для взрослых составляет 20-80 мг/сут, при необходимости дозу постепенно увеличивают до 600 мг/сут. Для детей разовая доза составляет 1-2 мг/кг. Максимальная доза при приёме внутрь для детей равна 6 мг/кг.
При внутривенном струйном или внутримышечном введении доза для взрослых составляет 20-40 мг/сут, в отдельных случаях 2 раза в сутки Для детей начальная суточная доза для парентерального применения равна 1 мг/кг.
Противопоказания
Острый гломерулонефрит, стеноз мочеиспускательного канала, обструкция мочевыводящих путей камнем, острая почечная недостаточность с анурией. Гипокалиемия, алкалоз, прекоматозные состояния, тяжёлая печёночная недостаточность, печёночная кома и прекома, диабетическая кома, гиперурикемия, подагра. Декомпенсированный митральный или аортальный стеноз, гипертрофическая обструктивная кардиомиопатия, повышение центрального венозного давления (более 10 мм рт.ст.), артериальная гипотензия, острый инфаркт миокарда, панкреатит, нарушение водно-электролитного обмена (гиповолемия, гипонатриемия, гипохлоремия, гипокальциемия, гипомагниемия), интоксикация сердечными гликозидами, повышенная чувствительность к фуросемиду.
Побочное действие
Снижение АД, ортостатическая гипотензия, коллапс, тахикардия, аритмии, снижение объёма циркулирующей крови; головокружение, головная боль. Миастения, судороги икроножных мышц, парестезии, апатия, адинамия, слабость, вялость, сонливость, спутанность сознания. Нарушения зрения и слуха; снижение аппетита, сухость во рту, жажда, тошнота, рвота, запоры или диарея, холестатическая желтуха, панкреатит (обострение); олигурия, острая задержка мочи (у больных с гипертрофией предстательной железы), интерстициальный нефрит, гематурия, снижение потенции; лейкопения, тромбоцитопения, агранулоцитоз, апластическая анемия; гиповолемия, дегидратация (риск развития тромбоза и тромбоэмболии). Гипокалиемия, гипонатриемия, гипохлоремия, гипокальциемия, гипомагниемия, метаболический алкалоз, гиповолемия, гипокалиемия, гипонатриемия, гипохлоремия. Артериальная гипотензия, головокружение, сухость во рту, жажда, аритмия, мышечная слабость, судороги. Гиперурикемия (с возможным обострением подагры), гипергликемия.
Аллергические реакции: пурпура, крапивница, эксфолиативный дерматит, мультиформная экссудативная эритема, васкулит, некротизирующий ангиит, кожный зуд, озноб, лихорадка, фотосенсибилизация, анафилактический шок.
При внутривенном применении возможно развитие тромбофлебита, кальциноза почек у недоношенных детей.
Особые указания
C осторожностью применяют при гиперплазии предстательной железы, системной красной волчанке, гипопротеинемии (риск развития ототоксичности), сахарном диабете (снижение толерантности к глюкозе), при стенозирующем атеросклерозе церебральных артерий, на фоне продолжительной терапии сердечными гликозидами, у пациентов пожилого возраста с выраженным атеросклерозом.
До начала лечения следует компенсировать электролитные нарушения. В период лечения фуросемидом необходимо контролировать АД, уровень электролитов и глюкозы в сыворотке крови, функцию печени и почек.
Для профилактики гипокалиемии целесообразно комбинировать фуросемид с калийсберегающими диуретиками. При одновременном применении фуросемида и гипогликемических препаратов может потребоваться коррекция дозы последних.
Не рекомендуют смешивать раствор фуросемида в одном шприце с любыми другими препаратами.
Влияние на способность к вождению автотранспорта и управлению механизмами
При применении фуросемида нельзя исключить вероятность снижения способности к концентрации внимания, что важно для лиц, управляющих транспортными средствами и работающих с механизмами.
Лекарственное взаимодействие
Совместное применение фуросемида с некоторыми препаратами приводит к лекарственному взаимодействию.
-
При одновременном применении с антибиотиками группы аминогликозидов (гентамицином, тобрамицином) возможно усиление нефро- и ототоксического действия.
-
Фуросемид уменьшает клиренс гентамицина и повышает концентрации в плазме крови гентамицина, а также тобрамицина.
-
-
При одновременном применении с антибиотиками группы цефалоспоринов повышен риск усиления нефротоксичности.
-
При одновременном применении с β2-адреномиметиками (фенотеролом, тербуталиномP, сальбутамолом) и с глюкокортикоидами возможно усиление гипокалиемии.
-
Одновременное применение с гипогликемическими средствами, инсулином уменьшает эффективность последних, так как фуросемид обладает способностью повышать содержание глюкозы в плазме крови.
-
При одновременном приёме фуросемида и ингибиторов АПФ антигипертензивное действие последних возрастает.
-
Возможна выраженная артериальная гипотензия, особенно после приёма первой дозы фуросемида за счёт гиповолемии, которая приводит к транзиторному усилению гипотензивного эффекта ингибиторов АПФ. Отмечено повышение риска нарушений функции почек. Возможно развитие гипокалиемии.
-
-
Одновременное назначение недеполяризующих миорелаксантов с фуросемидом усиливает их эффекты.
-
При одновременном применении с индометацином и другими НПВС возможно уменьшение диуретического эффекта вследствие угнетения синтеза простагландинов в почках и задержки натрия в организме под влиянием индометацина.
-
При одновременном применении с селективными ингибиторами ЦОГ-2 данное взаимодействие выражено в значительно меньшей степени или практически отсутствует.
-
-
При одновременном применении с астемизолом повышается риск развития аритмии.
-
При одновременном применении с ванкомицином возможно усиление ото- и нефротоксичности.
-
Одновременное применение с дигоксином, дигитоксином повышает токсичность сердечных гликозидов, что связанно с риском развития гипокалиемии на фоне приёма фуросемида.
-
Получены сведения о развитии гипонатриемии при одновременном применении с карбамазепином.
-
При одновременном применении с холестирамином*, колестиполом* уменьшается абсорбция и диуретический эффект фуросемида.
-
При одновременном применении с препаратами лития возможно усиление их эффектов вследствие повышения концентрации в плазме крови.
-
При одновременном применении с пробенецидом* уменьшается почечный клиренс фуросемида.
-
При одновременном применении с соталолом возможна гипокалиемия и развитие желудочковой аритмии типа «пируэт».
-
При одновременном применении с теофиллином возможно изменение концентрации теофиллина в плазме крови.
-
Одновременный приём с фенитоином значительно снижает диуретическое действие фуросемида.
-
После внутривенного введения фуросемида на фоне терапии хлоралгидратом возможно повышение потоотделения, чувство жара, нестабильность АД, тахикардия.
-
При одновременном применении с цизапридом* возможно усиление гипокалиемии.
-
Фуросемид может уменьшать нефротоксическое действие циклоспорина.
-
При одновременном применении с цисплатином возможно усиление ототоксического действия.
Беременность и лактация
При беременности применение фуросемида возможно только в течение короткого времени и лишь в том случае, когда предполагаемая польза для матери превышает возможный риск для плода. Поскольку фуросемид может выделяться с грудным молоком, а также подавлять лактацию, при необходимости применения в период лактации грудное вскармливание следует прекратить.
ТОРАСЕМИД
Фармакологическое действие
Основной механизм действия препарата обусловлен обратимым связыванием торасемида с ионным насосом, расположенным в апикальной мембране толстого сегмента восходящего отдела петли Генле. Торасемид снижает или полностью ингибирует реабсорбцию ионов натрия и уменьшает осмотическое давление внутриклеточной жидкости и реабсорбцию воды. Торасемид в меньшей степени, чем фуросемид, вызывает гипокалиемию, при этом проявляет большую активность и его действие более продолжительно.
Фармакокинетика
После приёма внутрь торасемид быстро и практически полностью абсорбируется из пищеварительного тракта. Cmax торасемида в плазме достигается через 1-2 ч после приёма препарата внутрь после еды. Биодоступность около 80% с незначительными индивидуальными вариациями.
Связывание с белками плазмы более 99%. Метаболизм в печени с участием ферментов системы цитохрома Р450 с образованием трёх метаболитов (M 1, М 3 и М 5). T1/2 торасемида и его метаболитов у здоровых лиц составляет 3-4 ч. Около 83% от принятой дозы выводится через почечные канальца в неизменённом виде 24%, остальное составляют неактивные метаболиты.
При почечной недостаточности T1/2 торасемида не изменяется.
Показания
Отёки, вызванные сердечной недостаточностью, заболеваниями печени, почек и лёгких.
Применение
Таблетки принимают один раз в сутки после еды. Средняя терапевтическая доза составляет 5 мг/сут. При необходимости возможно повышение дозы до 20 мг/сут, а в отдельных случаях — до 40 мг/сут.
Пациентам пожилого возраста специального подбора дозы не требуется.
Противопоказания
Печёночная кома и прекоматозное состояние, почечная недостаточность с нарастающей азотемией, артериальная гипотензия, аритмии, беременность, период лактации (нет данных о применении препарата в период лактации). Возраст до 18 лет (эффективность и безопасность не установлены), анурия, повышенная чувствительность к торасемиду и сульфонамидам. С осторожностью следует назначать пациентам с предрасположенностью к гиперурикемии, подагре, при латентном и выраженном сахарном диабете.
Побочное действие
В отдельных случаях отмечают эритропению, лейкопению, тромбоцитопению. Возможны тромбозы, тромбоэмболии, снижение АД, явления диспепсии, потеря аппетита, сухость во рту, повышение активности печёночных ферментов. Редко наблюдают панкреатит, у пациентов с обструкцией мочевыводящих путей возможна задержка мочи, иногда повышение уровней мочевины и креатинина. Среди прочих побочных эффектов возможна головная боль, головокружение, слабость, сонливость, нарушения зрения, шум в ушах, глухота, спутанность сознания, судороги, парестезии конечностей; гиповолемия, нарушения водноэлектролитного баланса, гипокалиемия, повышение уровня мочевой кислоты в сыворотке крови, гипергликемия, гиперлипидемия, кожный зуд, сыпь, фотосенсибилизация.
Особые указания
До назначения торасемида следует провести коррекцию водно-электролитного баланса.
С осторожностью принимать при подагре или склонности к повышению уровня мочевой кислоты.
При длительном лечении торасемидом рекомендуют проводить контроль электролитного баланса, уровня глюкозы, мочевой кислоты, креатинина и липидов в крови.
У больных сахарным диабетом 1-го или 2-го типа необходимо регулярно контролировать уровень глюкозы в плазме крови.
Влияние на способность к вождению автотранспорта и управлению механизмами
В период лечения пациентам следует избегать вождения автотранспорта и другой деятельности, требующей высокой концентрации внимания и скорости психомоторных реакций.
Лекарственное взаимодействие
При совместном применении торасемид увеличивает:
-
чувствительность миокарда к сердечным гликозидам (за счёт развития гипокалиемии и гипомагниемии);
-
выведение калия при приёме минерало- и глюкокортикоидов, слабительных средств;
-
действие гипотензивных средств;
-
нефро- и ототоксические эффекты антибиотиков группы аминогликозидов, токсичность цисплатина, нефротоксические эффекты цефалоспоринов и кардио- и нейротоксические эффекты препаратов лития;
-
действие периферических миорелаксантов (производных кумарина) и теофиллина;
-
токсическое действие салицилатов (в высоких дозах).
При совместном применении торасемид снижает эффективность гипогликемических средств.
При последовательном или одновременном приёме торасемида с ингибиторами АПФ возможно преходящее падение АД. При необходимости применения такой комбинации следует или уменьшить начальную дозу ингибитора АПФ, или снизить дозу торасемида. Одновременный приём НПВС и пробенецида* может уменьшать диуретическое и гипотензивное действие торасемида. Холестирамин* может уменьшать всасывание торасемида из пищеварительного тракта (по данным доклинического изучения у животных).
Беременность и лактация
Препарат противопоказан при беременности и в период лактации.
Осмотические диуретики
МАННИТОЛ
Механизм действия и основные фармакологические эффекты
Повышает осмотическое давление плазмы и фильтрации без последующей канальцевой реабсорбции, приводит к удерживанию воды в канальцах и увеличению объёма мочи. Повышает осмолярность плазмы, вызывает перемещение жидкости из тканей (в частности, глазного яблока, головного мозга) в сосудистое русло. Вызывает выраженный диуретический эффект, при котором наблюдают выведение большого количества осмотически свободной воды, а также натрия и хлора без существенного выведения калия. Вызывает повышение объёма циркулирующей крови.
Фармакокинетика
Объём распределения соответствует объёму внеклеточной жидкости. Маннитол может подвергаться незначительному метаболизму в печени с образованием гликогена.
Выведение маннитола регулируется клубочковой фильтрацией без существенной канальцевой реабсорбции.
T1/2 составляет около 100 мин. Выводится почками.
При почечной недостаточности T1/2 увеличивается до 36 ч.
Показания
Отёк мозга. Внутричерепная гипертензия. Эпилептический статус. Внутриглазная гипертензия, острый приступ глаукомы. Олигурия при острой почечной недостаточности. Для определения скорости гломерулярной фильтрации при острой олигурии. Острая печёночная недостаточность. Острая печёночная недостаточность у пациентов с сохранённой фильтрационной способностью почек и других состояниях, требующих повышения диуреза.
Отравление барбитуратами, салицилатами, бромидами, препаратами лития, форсированный диурез при других отравлениях.
Посттрансфузионные осложнения после введения несовместимой крови.
Для профилактики гемолиза и гемоглобинемии при трансуретральной резекции предстательной железы или при выполнении хирургических манипуляций типа шунтирования на сердечно-лёгочной системе, при операциях с экстракорпоральным кровообращением.
Применение
Вводят внутривенно (медленно струйно или капельно). Профилактическая доза составляет 500 мг/кг массы тела, лечебная 1-1,5 г/кг. Суточная доза не должна превышать 140-180 г. При операциях с экстракорпоральным кровообращением вводят в дозе 20-40 г непосредственно перед операцией.
Пациентам с олигурией следует предварительно ввести внутривенно капельно пробную дозу маннитола (200 мг/кг) в течение 3-5 мин. Если после этого в течение 2-3 ч не будет отмечено повышения скорости диуреза до 30-50 мл/г, то от дальнейшего введения маннитола следует воздержаться.
Противопоказания
ХПН, нарушение фильтрационной функции почек, левожелудочковая недостаточность (особенно сопровождающаяся отёком легких), геморрагический инсульт, субарахноидальное кровоизлияние (кроме кровотечений во время трепанации черепа), тяжёлые формы дегидратации, гипонатриемия, гипохлоремия, гипокалиемия, повышенная чувствительность к маннитолу.
Побочное действие
Нарушения водно-электролитного баланса (повышение объёма циркулирующей крови, гипонатриемия разведения, гиперкалиемия) и их проявления (мышечная слабость, судороги, сухость во рту, жажда, нарушение сознания).
Tахикардия, боли за грудиной, тромбофлебит, кожная сыпь.
Особые указания
С осторожностью применяют у пациентов с тяжёлыми формами ХСН, гиповолемией, нарушениями функции почек.
В случае появления при введении маннитола таких симптомов, как головная боль, рвота, головокружение, нарушения зрения, следует прекратить введение и исключить развитие такого осложнения, как субдуральное и субарахноидальное кровотечение.
При применении маннитола необходимо контролировать АД, диурез, концентрацию электролитов в сыворотке крови (калий, натрий).
Лекарственное взаимодействие
При одновременном применении маннитола с сердечными гликозидами возможно увеличение их токсического действия, связанного с гипокалиемией.
Беременность и лактация
Адекватных и строго контролируемых исследований у человека не проводилось.
Применение маннитола при беременности и в период лактации возможно в случаях, когда предполагаемая польза для матери превышает возможный риск для плода или грудного ребёнка.
Тиазидные и тиазидоподобные диуретики
Механизм действия и основные фармакологические эффекты
Tиазидные и тиазидоподобные диуретики ингибируют транспортный белок, обеспечивающий перенос ионов натрия и хлора в клетки канальцевого эпителия, и снижают их реабсорбцию в дистальных отделах канальцев. Повышение концентрации натрия в системе собирательных трубочек стимулирует его обмен на калий, что приводит к повышению потерь калия. Однократный приём повышает, а регулярный понижает экскрецию мочевой кислоты. Вызывают слабую магнийурию, которая при длительном приёме может иметь клиническое значение. При регулярном приёме препаратов наблюдают снижение экскреции кальция.
Диуретики этой группы не изменяют почечный кровоток и только вариабельно снижают СКФ в определённых условиях.
В отличие от тиазидных диуретиков первого поколения индапамид увеличивает СКФ и оказывает антигипертензивное действие у больных артериальной гипертензией как с нормальной, так и нарушенной функцией почек.
Для этой группы диуретиков характерно более умеренное натрийуретическое и диуретическое и более продолжительное действие, чем у петлевых диуретиков, что объяснимо локализацией их действия в нефроне. Локализация почечных эффектов тиазидных диуретиков определяет и другие их особенности. Наибольшего диуретического эффекта достигают при назначении сравнительно низких доз тиазидных диуретиков. Это характерно не только для диуретического, но и для антигипертензивного эффекта тиазидных и тиазидоподобных диуретиков. Сравнительно низкие дозы диуретиков (12,5-25 мг гидрохлоротиазида в сутки или эквивалентные дозы других тиазидных диуретиков) вызывают значительное снижение АД. При дальнейшем увеличении дозы тиазидных диуретиков антигипертензивный эффект возрастает лишь в небольшой степени, зато значительно увеличивается частота гипокалиемии и других серьёзных побочных эффектов. Кроме того, диуретическое, а следовательно, и антигипертензивное действие тиазидных диуретиков значительно ослабевает у больных с почечной недостаточностью (уровень креатинина в сыворотке выше 2,0 мг/дл; СКФ <30 мл/мин). По этой причине тиазидные и тиазидоподобные диуретики не рекомендуют использовать для лечения артериальной гипертензии у больных с нарушенной функцией почек.
Наиболее часто при использовании тиазидных диуретиков наблюдают гипокалиемию, гипомагниемию и гиперурикемию. Чрезмерной потерей ионов калия и магния при лечении высокими дозами тиазидных диуретиков объясняют другие известные побочные явления (возникновение желудочковых аритмий и нарушения углеводного обмена).
Доказательная база
Тиазидные и тиазидоподобные диуретики наиболее часто применяют в качестве антигипертензивных средств у больных с мягкой и умеренной артериальной гипертензией. В большом контролируемом исследовании HDFP (1979 г.) у больных с артериальной гипертензией тиазидные диуретики приводили к снижению общей смертности на 17%, смертности от цереброваскулярных заболеваний на 45% и смертности от заболеваний сердца на 20%. В исследовании, проведённом в Осло (1986 г.), летальность от инфаркта миокарда больных с артериальной гипертензией при лечении тиазидными диуретиками в течение 10 лет оказалась выше, чем в контрольной группе. Исследование MRC (1985 г.), проводимое у больных с мягкой артериальной гипертензией, показало благоприятный эффект этой группы диуретиков только в отношении предупреждения развития инсультов, но не инфаркта миокарда. Частота возникновения инфаркта миокарда даже возрастала в подгруппе больных с артериальной гипертензией, перенёсших до начала исследования болевой или безболевой приступ (с зубцом Q на ЭКГ). В этой подгруппе больных была выше частота внезапной смерти. Эти данные нашли подтверждение в другом большом исследовании по многофакторной профилактике — MRFIT (1985 г.). Было показано, что лечение тиазидными диуретиками (12,5-25 мг хлорталидона в сутки) пожилых больных с изолированной систолической артериальной гипертензией привело к значительному снижению частоты возникновения инсульта и сердечных осложнений (SHEP, 1991 г.). Исследование STOP-HT (1991 г.) показало, что использование тиазидных диуретиков приводит к достоверному снижению частоты фатальных и нефатальных инсультов, смертности от сердечно-сосудистых заболеваний и общей смертности у лиц пожилого возраста. У той же группы пациентов в исследовании Syst-Eur (1997 г.) применение гидрохлоротиазида наряду со снижением фатальных и нефатальных инсультов и кардиальных осложнений приводило к достоверному снижению частоты сосудистой деменции. Исследование ALLHAT (2002 г.) показало, что применение хлорталидона в течение длительного времени по сравнению с другими антигипертензивными средствами имело более выраженное снижение систолического АД и более благоприятное влияние на частоту развития вторичных конечных точек. При изучении влияния ретардной формы индапамида (арифон ретард*) на больных с артериальной гипертензией и сахарным диабетом 2-го типа в исследовании NESTOR (2003 г.) было выявлено, что индапамид имеет существенный антипротеинурический эффект, что расширяет терапевтический потенциал для лечения пациентов с артериальной гипертензией и диабетической нефропатией. Индапамид в исследовании X-CELLENt (2005 г.) зарекомендовал себя как препарат выбора при изолированной систолической артериальной гипертензии, так как наряду со значительным снижением систолического АД этот тиазидоподобный диуретик более выраженно снижал пульсовое давление по сравнению с другими анитигипертензивными препаратами.
Фармакокинетика
Разница между различными тиазидными диуретиками выражена в сроке начала, продолжительности действия и переносимости. Большая их растворимость в липидах связана с более значительным кажущимся объёмом распределения, меньшим почечным клиренсом и с большим связыванием с тканями.
Показания
Детям назначают с учётом массы тела, при этом следует осторожно применять у детей с желтухой. Пожилым лицам показаны тиазидные диуретики, однако у них относительно чаще возникают побочные эффекты, в частности постуральная гипотония после приёма пищи. Эти препараты можно применять только при небольшой или умеренной почечной недостаточности, так как они могут ускорить развитие азотемии. Препараты назначают с осторожностью при функциональной недостаточности печени (возможно нарушение электролитного баланса и ускорение развития печёночной комы). Беременным не рекомендуют длительно назначать тиазидные диуретики, так как снижение объёма плазмы может привести к относительному снижению перфузии плаценты. Препараты применяют только в случаях, когда потенциальная польза для матери превышает потенциальный риск для плода. У больных при обструктивных кардиомиопатиях с тяжёлым митральным или аортальным стенозом тиазидные диуретики могут усилить выраженность гипотонии, вызвать ишемию миокарда. Эту группу диуретиков с осторожностью назначают больным панкреатитом, системной красной волчанкой, сахарным диабетом, после симпатектомии.
Противопоказания
Tяжёлая почечная недостаточность, анурия, гиперчувствительность к сульфонамидам, прекоматозное состояние у больных с циррозом печени, тяжёлая функциональная недостаточность печени, печёночная кома, приём препаратов лития, выраженная гипотония, гипокалиемия, гиперкальциемия, гиперурекемия и подагра, гипонатриемия. Кормящим грудью матерям тиазидные диуретики противопоказаны вследствие их способности переходить в грудное молоко; при необходимости их назначения следует прекратить грудное кормление.
Побочные эффекты
Гипонатриемия, гипокалиемия, гипогликемия, гипомагниемия, гипофосфатемия, гиперкальциемия, гиперхолестеринемия, гипертриглециридемия. Судороги, головокружения, нарушения функции пищеварительного тракта, нарушение толерантности к углеводам, гиперурикемия, головная боль. Импотенция, тошнота, фотосенсибилизация, постуральная гипотензия, сыпь, нарушение зрения, внутрипечёночный холестаз, желтуха. Боли в грудной клетке.
Лекарственное взаимодействие
При совместном приёме с наркотическими препаратами может развиться ортостатическая гипотония. В сочетании с сердечными гликозидами вызывают гипокалиемию или гипомагниемию, могут способствовать появлению дигиталисных аритмий. При приёме препаратов лития приводят к снижению клиренса лития; амантадина — к снижению клиренса и повышению токсичности препарата. Уменьшают эффект антикоагулянтов. ХолестираминP и колестиполP снижают реабсорбцию тиазидных диуретиков.
ГИДРОХЛОРОТИАЗИД
Фармакологическое действие
Нарушает реабсорбцию ионов натрия, хлора, калия, магния, воды в дистальном отделе нефрона. Диуретический эффект наступает через 2 ч, достигает максимума через 4 ч и продолжается 6-12 ч. Гипотензивный эффект развивается за счёт расширения артериол.
Антигипертензивное действие наступает через 3-4 дня, но для достижения оптимального терапевтического эффекта может потребоваться 3-4 нед. Гипотензивное действие сохраняется в течение недели после отмены препарата.
Тиазидные диуретики снижают выведение кальция с мочой и тем самым уменьшают образование почечных камней.
Фармакокинетика
После приёма внутрь гидрохлоротиазид быстро, но неполностью всасывается из пищеварительного тракта (60-80%). Сmax составляет 2 мкг/мл. Связывание с белками составляет 40%. Гидрохлоротиазид накапливается в эритроцитах в отношении 3,5:1 к содержанию в плазме. Гидрохлоротиазид проникает через плацентарный барьер и проникает в грудное молоко.
Гидрохлоротиазид не подвержен существенному метаболизму в организме. Первичный путь его выведения — почечная экскреция (фильтрация и секреция) в неизменённом виде. Выведение гидрохлоротиазида с мочой сопровождает падение концентрации в плазме. После приёма внутрь 70% от принятой дозы выделяется с мочой в течение 4 дней, в основном в течение первых 12 ч. При приёме внутрь около 11,4%-24,5% выводится с калом, при внутривенном введении свыше 90% с мочой и только 1-4,3% с калом. Выведение с жёлчью незначительно. Почечный клиренс гидрохлоротиазида составляет около 335 мл/мин (после приёма внутрь препарата в дозе 12,5-75 мг). T1/2 в начальной фазе составляет около 3-4 ч, T1/2 в терминальной фазе около — 12 ч (от 2 до 15 ч). При нарушении функции почек T1/2 возрастает.
Показания
Артериальная гипертензия, отёчный синдром различного генеза (при ХСН, нефротическом синдроме, при почечной недостаточности, задержке жидкости при ожирении); несахарный диабет; профилактика камнеобразования в мочевыводящих путях у предрасположенных пациентов.
Применение
Режим дозирования устанавливают индивидуально.
Взрослым при отёчном синдроме препарат назначают в дозе 25-75 мг/сут. Максимальная суточная доза составляет 100 мг. Возможно ежедневное применение препарата, однако чаще его назначают через 1-2 дня.
Для профилактики образования камней назначают по 50 мг два раза в сутки.
При артериальной гипертензии рекомендуемая доза варьирует от 25 до 100 мг/сут, кратность приёма 1-2 раза/сут в виде монотерапии или в составе комбинированной антигипертензивной терапии. В отдельных случаях эффективно применение препарата в начальной дозе 12,5 мг, при необходимости возможно повышение дозы. Препарат следует использовать в минимальной эффективной дозе. Максимальная суточная доза равна 100 мг.
При сахарном диабете рекомендуемая начальная доза препарата составляет 50-100 мг/сут в 2-4 приёма, в дальнейшем её можно снизить.
При назначении препарата лицам пожилого возраста следует учитывать, что пациенты этой возрастной категории могут быть более чувствительны к диуретику, применяемому в средней рекомендованной дозе.
Среднюю суточную дозу для детей определяют из расчёта 1-2 мг/кг массы тела или 30-60 мг/м2 поверхности тела; кратность приёма 1-2 раза в сутки. Детям в возрасте до 2 лет препарат назначают в дозе 12,5-25 мг/сут, детям в возрасте от 2 до 12 лет 25-100 мг/сут.
Противопоказания
Анурия; тяжёлые формы подагры; сахарный диабет тяжёлого течения; беременность, лактация, повышенная чувствительность к препарату и другим производным сульфонамидов.
Побочное действие
Возможно развитие гипокалиемии и гипохлоремического алкалоза (сухость во рту, усиление жажды, нарушения ритма сердца, изменение настроения и психики, судороги или боли в мышцах, тошнота, рвота, необычная усталость и слабость; развитие печёночной энцефалопатии или печёночной комы). Возможно развитие гипонатриемии (спутанность сознания, судороги, апатия, замедление процесса мышления, усталость, раздражительность), гипомагниемии (аритмии). Возможен агранулоцитоз, тромбоцитопения, гемолитическая и апластическая анемия, лейкоцитопения; аритмия, ортостатическая гипотензия, тахикардия. Иногда наблюдают холецистит, панкреатит, желтуху, диарею, сиаладенит, запор, анорексию, боли в эпигастрии. Возможны гипергликемия, глюкозурия, гиперурикемия, обострение подагры. Из аллергических реакций возможна кожная сыпь, пурпура, некротический васкулит, синдром Стивенса-Джонсона, респираторный дистресс (пневмонит, некардиогенный отёк лёгкого), фотосенсибилизация, анафилактические реакции (вплоть до угрожающего жизни анафилактического шока). Возможно снижение потенции.
Особые указания
С осторожностью назначают препарат при выраженных нарушениях функции почек. У этой категории пациентов возможно развитие кумулятивного эффекта препарата и возникновение азотемии. Если прогрессирование заболеваний почек не вызывает сомнений, следует приостановить или прервать терапию диуретиками. При клиренсе креатинина менее 30 мл/мин тиазидные диуретики теряют свою терапевтическую эффективность, в этих случаях препаратами выбора считают петлевые диуретики.
Тиазиды следует с осторожностью применять у пациентов с нарушениями функции печени или с прогрессирующими заболеваниями печени, так как небольшие изменения водно-электролитного баланса могут вызвать печёночную кому.
Аллергические реакции более вероятны у пациентов с аллергическими реакциями или бронхиальной астмой в анамнезе.
На фоне применения препарата возможно обострение течения заболеваний соединительной ткани (особенно системной красной волчанки).
В период применения препарата пациентам следует рекомендовать соблюдение диеты, обогащённой калием. При появлении признаков дефицита калия, а также при одновременном применении сердечных гликозидов, глюкокортикоидов и препаратов АКТГ показано назначение препаратов калия или калийсберегающих диуретиков.
Антигипертензивное действие препарата может быть усилено после симпатэктомии.
Показано, что тиазиды усиливают выведение магния с мочой, что может вызывать гипомагниемию.
Тиазиды снижают выведение кальция. У некоторых больных при длительном лечении тиазидами наблюдали патологические изменения паращитовидной железы с гиперкальциемией и гипофосфатемией. Общих осложнений гиперпаратиреоза (нефролитиаз, костная резорбция и пептическая язва) не наблюдали.
Применение препарата следует прекратить перед проведением анализа функции паращитовидной железы.
При применении гипотиазида концентрация билирубина в сыворотке может повышаться из-за вытеснения из мест связывания с альбумином. Возможно повышение уровня холестерина, липопротеида низкой плотности и триглицеридов.
При длительном применении препарата необходимо регулярно контролировать уровень электролитов крови и клиренс креатинина.
Влияние на способность к вождению автотранспорта и управлению механизмами
На фоне применения препарата способность к занятиям видами деятельности, требующими повышенного внимания, может нарушаться.
Лекарственное взаимодействие
При одновременном применении препаратов наперстянки с тиазидными диуретиками возрастает вероятность проявления токсических эффектов гликозидов (повышенная возбудимость желудочков) из-за вероятного развития гипокалиемии и гипомагниемии.
При одновременном применении гидрохлоротиазид усиливает действие недеполяризующих миорелаксантов и повышает чувствительность к тубокурарина хлориду*.
При совместном применении амиодарона и тиазидных диуретиков повышается риск развития аритмий, связанных с гипокалиемией.
При совместном применении c глюкокортикоидами, препаратами АКТГ или кальцитонина повышена вероятность развития гипокалиемии.
НПВС (особенно индометацин) снижают антигипертензивный эффект тиазидов.
Гидрохлоротиазид уменьшает эффективность гипогликемических препаратов.
При одновременном назначении с дифлунисалом возрастает концентрация гидрохлоротиазида в плазме и уменьшается его гиперурикемическое действие.
Тиазидные диуретики уменьшают влияние норэпинефрина на АД, могут повышать чувствительность к тубокурарина хлориду*.
Этанол, фенобарбитал и диазепам могут усиливать антигипертензивное действие тиазидных диуретиков.
Холестирамин* снижает абсорбцию тиазидных диуретиков на 85%.
Гидрохлоротиазид может повысить концентрацию солей лития в плазме до токсического уровня. Назначение такого сочетания не рекомендовано.
Беременность и лактация
Препарат противопоказан к применению при беременности, так как повышает риск развития тромбоцитопении и желтухи у новорождённых. Гидрохлоротиазид ухудшает кровоснабжение плаценты и проникает через плацентарный барьер. При необходимости назначения препарата в период лактации следует прекратить грудное вскармливание.
Тиазидоподобные диуретики
ХЛОРТАЛИДОН
Фармакодинамика
Оказывает продолжительный эффект, так как связывается с альбумином плазмы и эритроцитами. Начало действия через 2 ч после приёма. Продолжительность действия 48-72 ч.
Применение
Начальная суточная доза составляет 25-100 мг или даже до 200 мг ежедневно до завтрака либо один раз в сутки три дня в неделю. Пожилые люди более чувствительны к препарату.
КЛОПАМИД
Фармакологическое действие
Клопамид увеличивает выведение ионов калия и магния, нарушает реабсорбцию ионов натрия и хлора в кортикальном сегменте петли Генле. Ингибирует карбоангидразу в проксимальном отделе извитых канальцев, приводит к усилению секреции калия, карбонатов и фосфатов.
Незначительно влияет на кислотно-основное равновесие. Снижает исходно повышенное АД. Повышает тонус вен.
Диуретическое действие начинается через 1-2 ч после приёма и продолжается в течение 10-24 ч. Оказывает гипотензивное действие.
Фармакокинетика
Клопамид быстро абсорбируется из пищеварительного тракта, Cmax достигается в течение 1,4 ч. Связывание с белками плазмы составляет 46%.
T1/2 равна 5,8-7,2 ч. Выводится почками в виде глюкуронидов (1/3) и в неизменённом виде (2/3).
Показания
Артериальная гипертензия, отёчный синдром различного генеза (ХСН, синдром портальной гипертензии, нефротический синдром).
Применение
Режим дозирования устанавливают индивидуально. При артериальной гипертензии начальная доза составляет 20 мг один раз в сутки утром в течение 7 дней. При достижении желаемого гипотензивного эффекта дозу уменьшают до 10 мг/сут. При отёчном синдроме доза составляет 40-60 мг один раз в сутки.
Побочное действие
Tошнота, рвота, аритмии, снижение АД, мышечная слабость, гиперемия кожи, аллергические реакции.
При применении в высоких дозах возможны гипокалиемия, гипомагниемия, гипонатриемия, гипохлоремия.
Противопоказания
Выраженные нарушения функции почек, печёночная недостаточность, повышенная чувствительность к клопамиду.
Особые указания
С осторожностью применяют у больных сахарным диабетом (следует регулярно определять концентрацию глюкозы в крови и моче), при подагре.
Данные об эффективности и безопасности применения клопамида у детей отсутствуют.
Лекарственное взаимодействие
При одновременном применении с глюкокортикоидами возрастает риск развития гипокалиемии.
Возможно повышение концентрации лития в плазме крови и риска развития интоксикации при совместном применении с препаратами лития.
Беременность и лактация
При беременности и в период лактации клопамид применяют с осторожностью — только в том случае, когда ожидаемый терапевтический эффект превышает потенциальный риск для плода или ребёнка.
ИНДАПАМИД
Фармакологическое действие
Вызывает умеренный салурический и диуретический эффект, связанный с ингибированием реабсорбции ионов натрия, хлора, водорода и в меньшей степени ионов калия в проксимальных канальцах и в кортикальном сегменте петли Генле.
Наряду с диуретическим эффектом оказывает прямое сосудорасширяющее действие на системные и почечные артерии. Сосудорасширяющее действие индапамида объясняют тем, что он — слабый антагонист кальция. При такой же, как у других тиазидных и тиазидоподобных диуретиков, антигипертензивной эффективности индапамид не оказывает существенного влияния на липидный состав крови и углеводный обмен. В отличие от других диуретиков индапамид не нарушает чувствительности периферических тканей к действию инсулина. При длительном применении у больных с умеренной гипертензией и нарушением функции почек индапамид увеличивает СКФ, тогда как гидрохлоротиазид уменьшает её. Частота гипокалиемии при лечении индапамидом не ниже, чем при применении других тиазидных диуретиков.
Антигипертензивный эффект препарата проявляется только при исходно повышенном АД, как правило, развивается к концу первой недели от начала приёма и достигает максимума через 3 мес систематического приёма.
Показания
Артериальная гипертензия.
Применение
В виде монотерапии индапамид назначают по 2,5 мг в сутки утром. Максимальная суточная доза не должна превышать 2,5 мг.
Побочное действие
Гипокалиемия, гипохлоремия, гипонатриемия, гиперкальциемия; повышение в крови уровня мочевой кислоты, глюкозы, азота мочевины и креатинина крови.
Астения, головная боль, головокружение, вялость, сонливость, бессонница, слабость, апатия.
Tошнота, анорексия, сухость во рту, боли в области желудка, диарея, запор.
Ортостатическая гипотензия, тахикардия, изменения ЭКГ (неспецифические изменения сегмента ST-T, U-волны).
Сыпь, зуд, фотосенсибилизация вплоть до появления буллёзных элементов, эритродермия, пурпура.
Противопоказания
Сахарный диабет в стадии декомпенсации, подагра, анурия, гипокалиемия. Выраженные нарушения функции почек, острое нарушение мозгового кровообращения, повышенная чувствительность к компонентам препарата или другим производным сульфонамидов.
Лекарственное взаимодействие
При одновременном применении индапамида с астемизолом, эритромицином, пентаминидином, сультопридом, терфенадином, антиаритмическими препаратами I класса (хинидин, гидрохинидин, дизопирамид), амиодароном, бретилия тозилатом, соталолом возрастает вероятность возникновения нарушений сердечного ритма типа «пируэт».
НПВС системного действия снижают антигипертензивное действие индапамида.
При одновременном применении с препаратами, которые могут вызывать гипокалиемию (амфотерицином B, глюко- и минералокортикоидами, тетракозактидом, слабительными средствами, сердечными гликозидами) повышен риск развития гипокалиемии.
Tрициклические антидепрессанты, антипсихотические средства усиливают антигипертензивное действие индапамида и увеличивают риск ортостатической гипотензии.
При совместном применении индапамида с циклоспорином возможно увеличение содержания креатинина в плазме крови.
Сочетание индапамида с ингибиторами АПФ повышает риск развития артериальной гипотензии и/или почечной недостаточности.
При использовании йодсодержащих контрастных веществ в высоких дозах на фоне приёма индапамида возрастает риск развития почечной недостаточности.
Антигипертензивные препараты других групп усиливают влияние индапамида на АД.
При одновременном применении индапамида с препаратами лития возможно повышение концентрации лития в плазме крови.
Особые указания
С осторожностью и под тщательным контролем следует назначать препарат пациентам с нарушением функции почек (выведение индапамида из организма осуществляется преимущественно почками). При увеличении азотемии и возникновении олигурии во время лечения приём препарата следует прекратить.
С осторожностью необходимо назначать больным с заболеваниями печени, так как на фоне возможного развития гипокалиемии препарат может вызывать метаболический алкалоз, усиливающий проявления печёночной энцефалопатии.
При применении индапамида возможно возникновение гиперурикемии. Необходим контроль уровня мочевой кислоты в крови, особенно у больных с подагрой в анамнезе.
Во время приёма индапамида возможно развитие гипокалиемии. Следует контролировать уровень калия в крови и при необходимости назначать препараты калия. Особенно это касается больных, получающих сердечные гликозиды. Опасность развития гипокалиемии возрастает при сопутствующем приёме глюкокортикоидов, приёме препаратов АКТГ и при недостаточном поступлении электролитов в организм.
В период приёма индапамида необходимо также проведение контроля уровня электролитов в сыворотке крови, остаточного азота крови и уровня глюкозы крови.
На фоне приёма препарата возможно развитие ортостатической гипотензии, что может быть спровоцировано приёмом алкоголя, барбитуратов, опиоидных анальгетиков и одновременным приёмом других гипотензивных средств.
Редко при лечении индапамидом могут проявиться побочные реакции со стороны кожных покровов. В большинстве случаев они проходят полностью в течение 14 дней после отмены препарата.
Индапамид оказывает минимальное действие на метаболизм глюкозы, но у больных с инсулинзависимым сахарным диабетом возможно повышение необходимой дозы инсулина, а у больных с латентным сахарным диабетом могут возникнуть гипергликемия и глюкозурия.
Из-за отсутствия достаточного количества клинических данных препарат не рекомендуют применять у детей и подростков до 18 лет.
Беременность и лактация
Препарат не рекомендуют применять при беременности. Диуретики могут способствовать развитию фетоплацентарной недостаточности и приводить к нарушению развития плода.
В связи с тем, что индапамид проникает в грудное молоко, не рекомендовано назначение препарата в период грудного вскармливания. Если необходимо проведение терапии, кормление ребёнка грудью следует прекратить.
Калийсберегающие диуретики
Механизм действия и фармакологические эффекты
По механизму действия калийсберегающие диуретики делят на две подгруппы:
-
блокирующие натриевые каналы эпителиальных клеток почек (триамтерен и амилорид*);
-
предотвращающие потерю калия с мочой антагонисты альдостерона (спиронолактон).
Диуретический эффект выражен слабо, реабсорбционная способность собирательных трубочек ограничена. Длительный приём может привести к снижению экскреции мочевой кислоты.
Tриамтерен и амилоридP не оказывают клинически значимого действия на гемодинамику почек.
В качестве монотерапии спиронолактон используют при лечении так называемого «идиопатического гиперальдостеронизма», когда гиперсекреция альдостерона обусловлена двусторонней гиперплазией коркового слоя надпочечников. Во всех других случаях артериальной гипертензии назначают как спиронолактон, так и амилорид* и триамтерен, обычно в комбинации с тиазидными или петлевыми диуретиками в качестве калийсберегающих препаратов. Все калийсберегающие диуретики противопоказаны при наличии гиперкалиемии. С большой осторожностью следует назначать эти препараты больным с повышенным риском развития гиперкалиемии. К этой категории больных относят:
-
больных с сопутствующим заболеванием почек;
-
больных сахарным диабетом;
-
пациентов пожилого возраста или получающих ингибиторы АПФ.
При беременности противопоказано применение спиронолактона в связи с тем, что этот препарат обладает антитестостероновой активностью.
Доказательная база
В исследовании EWPHE (1985 г.) было показано, что у пожилых больных с артериальной гипертензией комбинация тиазидных диуретиков (гидрохлотиазида) и триамтерена приводит к значительному снижению смертности от сердечнососудистых заболеваний и к тенденции снижения частоты заболевания инсультом. Комбинация гидрохлоротиазида и амилорида* вызывает значительное снижение заболеваемости инсультом и инфарктом миокарда (MRC, 1992 г.).
АМИЛОРИД
Фармакологическое действие
Действует главным образом на дистальную часть почечных канальцев. Повышает выведение ионов натрия и хлора и уменьшает выведение ионов калия. Вызывает менее выраженный диуретический эффект, чем тиазидные диуретики. При сочетании с калийвыводящими диуретиками уменьшает риск возникновения гипокалиемии и гипомагниемии.
Показания
Отёчный синдром различного генеза (при ХСН, нефротическом синдроме, циррозе печени), артериальная гипертензия.
Применение
Режим дозирования индивидуальный. Для приёма внутрь суточная доза составляет 2,5-20 мг.
Максимальная суточная доза равна 40 мг.
Побочное действие
Возможны тошнота, рвота, головная боль, гиперкалиемия.
Противопоказания
Выраженные нарушения функции почек, гиперкалиемия, печёночная кома, повышенная чувствительность к амилориду*.
Лекарственное взаимодействие
При одновременном применении ингибиторов АПФ (в т.ч. каптоприла, эналаприла) повышен риск развития гиперкалиемии, так как ингибиторы АПФ уменьшают уровень альдостерона, что приводит к задержке калия в организме.
При одновременном применении амилорида* и петлевых и тиазидных диуретиков (гидрохлоротиазида) и других диуретических средств, вызывающих гипокалиемию, уменьшается выведение калия.
При одновременном применении препаратов калия, других калийсберегающих диуретиков, заменителей поваренной соли и биологически активных добавок к пище, содержащих калий, возможно развитие тяжёлой, угрожающей жизни гиперкалиемии.
При одновременном применении амилорида* и амоксициллина возможно незначительное снижение абсорбции амоксициллина из пищеварительного тракта.
У здоровых добровольцев амилорид* не оказывает существенного влияния на концентрацию дигоксина в плазме крови, но уменьшает его положительный инотропный эффект. У пациентов с нарушением функции почек возможно повышение концентрации дигоксина в плазме крови.
При одновременном применении амилорида* и кандесартана, эпросартана, лозартана, телмисартана, валсартана повышен риск развития гиперкалиемии.
При одновременном применении комбинации амилорида* с гидрохлоротиазидом и триметопримом возможно развитие гипонатриемии, что обусловлено суммацией эффектов диуретиков и триметоприма.
Одновременный приём амилорида* и хинидина снижает эффективность хинидина.
Особые указания
Амилорид* обычно применяют в сочетании с другими мочегонными средствами, вызывающими гипокалиемию (с гидрохлоротиазидом).
СПИРОНОЛАКТОН
Фармакологическое действие
В дистальных отделах нефрона спиронолактон препятствует задержке альдостероном натрия и воды и подавляет калийвыводящий эффект альдостерона, снижает синтез пермеаз в альдостерон-зависимом участке собирательных трубочек и дистальных канальцев. Связываясь с рецепторами альдостерона, спиронолактон увеличивает экскрецию ионов натрия, хлора и воды с мочой, уменьшает выведение ионов калия и мочевины, снижает кислотность мочи.
Усиление диуреза вызывает непостоянный гипотензивный эффект.
Максимальный эффект наблюдают через 7 ч после приёма капсул внутрь. Эффект сохраняется не менее 24 ч.
Диуретический эффект проявляется на 2-5-й день лечения.
Фармакокинетика
После приёма внутрь быстро и полностью всасывается из пищеварительного тракта, биодоступность составляет 100%. После ежедневного приёма 100 мг спиронолактона в течение 15 дней Cmax составляет 80 нг/мл, время достижения Сmax после очередного утреннего приёма равно 2-6 ч. Связывается с белками плазмы крови на 98%.
Спиронолактон плохо проникает в органы и ткани, при этом проникает через плацентарный барьер. Метаболит канренон проникает в грудное молоко.
В процессе биотрансформации в печени образуются активные серосодержащие метаболиты (7-альфа-тиометилспиронолактон и канренон). Канренон достигает своей Сmax через 2-4 ч, его связь с белками плазмы крови составляет 90%.
T1/2 препарата равна 13-24 ч. Выводится преимущественно с мочой (50% в виде метаболитов, 10% в неизменённом виде) и частично с калом. Выведение канренона (главным образом с мочой) двухфазное, T1/2 в первой фазе составляет 2-3 ч, во второй 12-96 ч.
Показания
Эссенциальная гипертензия (в составе комбинированной терапии), отёчный синдром при ХСН (можно применять в виде монотерапии и в комбинации со стандартной терапией). Состояния, при которых возможно развитие вторичного гиперальдостеронизма, в том числе цирроз печени, сопровождаемый асцитом и/ или отёками, нефротический синдром и другие состояния, сопровождаемые отёками. Гипокалиемия/гипомагниемия (в качестве вспомогательного средства для её профилактики во время лечения диуретиками и при невозможности применения других способов коррекции уровня калия); первичный гиперальдостеронизм (для короткого предоперационного курса лечения), для установления диагноза первичного гиперальдостеронизма.
Применение
При эссенциальной гипертензии суточная доза для взрослых обычно составляет 50-100 мг однократно и может быть увеличена до 200 мг. При этом увеличивать дозу следует постепенно, один раз в две недели. Чтобы добиться адекватного ответа на терапию, препарат необходимо принимать не менее двух недель. При необходимости проводят коррекцию дозы.
При идиопатическом гиперальдостеронизме препарат назначают в дозе 100400 мг/сут.
При выраженном гиперальдостеронизме и гипокалиемии суточная доза составляет 300 мг (максимально 400 мг) за 2-3 приёма, при улучшении состояния дозу постепенно снижают до 25 мг/сут.
При гипокалиемии и/или гипомагниемии, вызванной терапией диуретиками, спиронолактон назначают в дозе 25-100 мг/сут, однократно или в несколько приёмов. Максимальная суточная доза составляет 400 мг, если пероральные препараты калия или другие методы восполнения его дефицита неэффективны.
При диагностике и лечении первичного гиперальдостеронизма в качестве диагностического средства при коротком диагностическом тесте спиронолактон назначают в течение 4 дней по 400 мг/сут, распределив суточную дозу на несколько приёмов в день. При увеличении концентрации калия в крови во время приёма препарата и снижении после отмены можно предполагать наличие первичного гиперальдостеронизма. При длительном диагностическом тесте препарат назначают в той же дозе в течение 3-4 недель. При достижении коррекции гипокалиемии и артериальной гипертензии можно предполагать наличие первичного гиперальдостеронизма.
После того как диагноз гиперальдостеронизма установлен с помощью более точных диагностических методов, в качестве короткого курса предоперационной терапии первичного гиперальдостеронизма спиронолактон следует назначать в суточной дозе 100-400 мг, разделив её на 1-4 приёма в течение всего периода подготовки к хирургической операции. Если операция не показана, то спиронолактон применяют для проведения длительной поддерживающей терапии, при этом используют наименьшую эффективную дозу, которую подбирают индивидуально для каждого пациента.
При лечении отёков на фоне нефротического синдрома суточная доза для взрослых обычно составляет 100-200 мг. Не выявлено влияния спиронолактона на основной патологический процесс, и потому применение данного препарата рекомендуют только в тех случаях, когда другие виды лечения неэффективны.
При отёчном синдроме на фоне ХСН препарат назначают ежедневно, в течение 5 дней, по 100-200 мг/сут в 2-3 приёма в комбинации с петлевым или тиазидным диуретиком. При хорошем ответе на лечение суточную дозу уменьшают до 25 мг. Поддерживающую дозу подбирают индивидуально. Максимальная суточная доза составляет 200 мг.
При отёках на фоне цирроза печени суточная доза спиронолактона для взрослых обычно составляет 100 мг.
При отёках у детей начальная доза составляет 1,0-3,3 мг/кг массы тела в 1-4 приёма. Через 5 дней проводят коррекцию дозы и при необходимости её увеличивают в три раза по сравнению с первоначальной.
Побочное действие
Tошнота, рвота, диарея, изъязвления и кровотечения из пищеварительного тракта, гастрит, кишечная колика, боль в животе, запор, нарушение функции печени. Атаксия, заторможенность, головокружение, головная боль, сонливость, летаргия, спутанность сознания, мышечный спазм, судороги икроножных мышц. Агранулоцитоз, тромбоцитопения, мегалобластоз. Гиперурикемия, гиперкреатининемия, повышение концентрации мочевины, гиперкалиемия, гипонатриемия, метаболический гиперхлоремический ацидоз или алкалоз.
Огрубение голоса, у мужчин — гинекомастия (вероятность развития зависит от дозы, длительности лечения и обычно носит обратимый характер), снижение потенции и эрекции; у женщин — нарушения менструального цикла, дисменорея, аменорея, метроррагия в климактерическом периоде, гирсутизм, боли в области молочных желёз, карцинома молочной железы (наличие связи с приёмом препарата не доказано).
Среди аллергических реакций возможны крапивница, макуло-папулёзная и эритематозная сыпь, лекарственная лихорадка, зуд. Редко — алопеция, гипертрихоз.
Возможно развитие острой почечной недостаточности.
Противопоказания
Болезнь Аддисона-Бирмера; гиперкалиемия; гипонатриемия. Почечная недостаточность тяжёлой степени (клиренс креатинина >10 мл/мин), анурия. Беременность, период лактации. Повышенная чувствительность к препарату. С осторожностью следует назначать препарат при гиперкальциемии, метаболическом ацидозе, атриовентрикулярной блокаде, сахарном диабете (при подтверждённой или предполагаемой ХПН), диабетической нефропатии. Осторожно назначают при хирургических вмешательствах, приёме ЛС, вызывающих гинекомастию, проведении местной и общей анестезии, нарушениях менструального цикла, печёночной недостаточности, циррозе печени, у пациентов пожилого возраста.
Лекарственное взаимодействие
Спиронолактон при одновременном применении снижает эффект антикоагулянтов (гепарина натрия, производных кумарина, индандиона) и митотана; усиливает действие диуретиков и антигипертензивных препаратов, усиливает эффект трипторелина, бусерелина, гонадорелина* .
При приёме спиронолактона одновременно с препаратами калия, калиевыми добавками и калийсберегающими диуретиками, ингибиторами АПФ, антагонистами ангиотензина II возрастает риск развития гиперкалиемии.
На фоне применения спиронолактона уменьшается токсичность сердечных гликозидов (нормализация уровня калия в крови препятствует развитию токсичности).
Спиронолактон снижает чувствительность сосудов к норэпинефрину (необходимо соблюдение осторожности при проведении анестезии).
Петлевые и тиазидные диуретики усиливают и ускоряют диуретический и натрийуретический эффекты спиронолактона.
Глюкокортикоиды усиливают диуретический и натрийуретический эффект спиронолактона при гипоальбуминемии и/или гипонатриемии.
Салицилаты и индометацин снижают диуретический эффект спиронолактона.
Хлорид аммония, холестирамин3* при одновременном применении со спиронолактоном способствуют развитию гиперкалиемического метаболического ацидоза, а флудрокортизон вызывает парадоксальное усиление канальцевой секреции калия.
Спиронолактон усиливает токсическое действие лития из-за снижения его клиренса, усиливает метаболизм феназона (антипирина), увеличивает T1/2 дигоксина (возможна интоксикация дигоксином), ускоряет метаболизм и выведение карбеноксолона3*. Карбеноксолон3* способствует задержке натрия спиронолактоном.
Беременность и лактация
Применение спиронолактона противопоказано при беременности и лактации.
Особые указания
При применении спиронолактона возможно временное повышение уровня азота мочевины в сыворотке крови, особенно при сниженной функции почек и гиперкалиемии. Tакже возможно развитие гиперхлоремического метаболического ацидоза. При назначении пациентам с нарушениями функции почек и печени и пациентам пожилого возраста необходим регулярный контроль электролитов сыворотки крови и функции почек.
Приём спиронолактона затрудняет определение концентрации дигоксина, кортизола и адреналина в крови.
Несмотря на отсутствие прямого воздействия на углеводный обмен, наличие сахарного диабета, особенно с диабетической нефропатией, требует особой осторожности при назначении спиронолактона из-за возможности развития гиперкалиемии.
При лечении НПВС на фоне приёма спиронолактона следует контролировать функцию почек и уровень электролитов крови.
Во время лечения спиронолактоном употребление алкоголя противопоказано, следует избегать употребления пищи, богатой калием.
При циррозе печени и сердечной недостаточности продолжительность T1/2 увеличивается без признаков кумуляции, вероятность которой выше при ХПН и гиперкалиемии.
ТРИАМТЕРЕН
Фармакологическое действие
Уменьшает проницаемость клеточных мембран дистальных канальцев для ионов натрия и усиливает их выведение с мочой без увеличения выделения ионов калия. Снижает секрецию калия в дистальных канальцах. Уменьшает гипокалемию, вызываемую тиазидными диуретиками, и усиливает диуретический эффект последних. Диуретическое действие после приёма внутрь отмечается через 15-20 мин. Максимальный эффект через 2-3 ч, длительность действия 12 ч.
Фармакокинетика
После приёма внутрь триамтерен очень быстро абсорбируется из пищеварительного тракта. Степень всасывания вариабельна. Tриамтерен проникает через плацентарный барьер в грудное молоко. Биодоступность около 50%. Связывание с белками плазмы около 60%. Метаболизм главным образом с мочой в виде метаболитов и в небольшом количестве в неизменённом виде. T1/2 около 2 ч.
Показания
Отёчный синдром различного генеза (ХСН, нефротический синдром, цирроз печени), артериальная гипертензия, профилактика гипокалиемии на фоне применения салуретиков.
Применение
Внутрь взрослым по 150-250 мг/сут или по 100 мг два раза в сутки после еды в первой половине дня. Максимальная суточная доза 300 мг. Для детей начальная доза — 1-2 мг/кг два раза в сутки.
Побочное действие
Диспептические явления, сухость во рту. Гиперкалиемия, гипонатриемия.
Увеличение концентрации мочевой кислоты в крови, образование камней в почках (триамтерен плохо растворим и может давать осадок в моче), редко — обратимая почечная недостаточность, обусловленная острым интерстициальным нефритом.
Артериальная гипотензия.
Противопоказания
Печёночная и/или почечная недостаточность, период лактации, повышенная чувствительность к триамтерену.
Лекарственное взаимодействие
При одновременном применении с антигипертензивными препаратами потенцируется антигипертензивное действие триамтерена.
При одновременном применении с ингибиторами АПФ возможно развитие гиперкалиемии (особенно у пациентов с нарушениями функции почек), так как ингибиторы АПФ уменьшают содержание альдостерона, что приводит к задержке калия в организме на фоне ограничения выведения калия.
При одновременном применении с препаратами калия, другими калийсберегающими диуретиками, заменителями поваренной соли возможно развитие гиперкалиемии.
При одновременном применении с диклофенаком описан случай нарушения функции почек.
При одновременном применении с индометацином возможно развитие острой почечной недостаточности; с кандесартаном, лозартаном, эпросартаном — возникает риск развития гиперкалиемии; с ранитидином — возможно уменьшение абсорбции и диуретического эффекта триамтерена.
Беременность и лактация
При необходимости применения при беременности следует тщательно оценить ожидаемую пользу терапии для матери и возможный риск для плода или ребёнка. Применение в период лактации противопоказано.
Особые указания
Не рекомендуют применять при гиперкалиемии, одновременно с другими калийсберегающими диуретиками (в т.ч. с амилоридом* , спиронолактоном, комбинированными препаратами, содержащими триамтерен), заменителями соли, содержащими калий.
С осторожностью следует применять у пациентов с подагрой, указаниями в анамнезе на мочекаменную болезнь.
При применении у пациентов с циррозом печени возможно развитие мегалобластной анемии.
Ингибиторы карбоангидразы
АЦЕТАЗОЛАМИД
Фармакологическое действие
Вызывает слабый диуретический эффект. Ингибирует фермент карбоангидразу в проксимальном извитом канальце нефрона, увеличивает экскрецию с мочой ионов натрия, калия, бикарбоната, не влияет на экскрецию ионов хлора; вызывает повышение рН мочи. Нарушает кислотно-основное равновесие (вызывает метаболический ацидоз). Угнетение карбоангидразы реснитчатого тела глазного яблока приводит к уменьшению секреции водянистой влаги и снижению внутриглазного давления. Подавление активности карбоангидразы в головном мозге обусловливает противосудорожную активность препарата.
Применение препарата при повышенном внутричерепном давлении связано с подавлением карбоангидразы в сплетениях желудочков головного мозга и снижением продукции СМЖ.
Длительность действия — до 12 ч.
Фармакокинетика
Ацетазоламид хорошо всасывается из пищеварительного тракта. Через 1-3 ч после приёма в дозе 500 мг Стaх активного вещества составляет 12-27 мкг/мл. Определяемая концентрация ацетазоламида в плазме сохраняется в течение 24 ч после приёма препарата.
Распределяется главным образом в эритроцитах, почках, мышцах, тканях глазного яблока и ЦНС. Связывается с белками плазмы в высокой степени. Проникает через плацентарный барьер.
Ацетазоламид не подвергается метаболизму в организме.
Выводится почками в неизменённом виде. Около 90% дозы выводится с мочой в течение 24 ч.
Показания
Отёчный синдром (слабой и умеренной степени выраженности, в сочетании с алкалозом); глаукома (первичная и вторичная, при остром приступе); эпилепсия (в составе комбинированной терапии); внутричерепная гипертензия; острая высотная болезнь.
Применение
При отёчном синдроме в начале лечения препарат назначают в дозе 250-375 мг (1-1,5 таблетки) один раз в сутки утром. Максимального диуретического эффекта достигают при приёме препарата через день или принимая два дня подряд с однодневным перерывом. При применении ацетазоламида следует продолжать терапию недостаточности кровообращения, включая сердечные гликозиды, соблюдать диету с ограничением потребления соли и восполнять недостаток калия.
Взрослым при открытоугольной глаукоме препарат назначают в разовой дозе 250 мг 1-4 раза в сут. Дозы, превышающие 1 г, не увеличивают терапевтический эффект. При вторичной глаукоме препарат назначают в разовой дозе 250 мг каждые 4 ч. У некоторых пациентов терапевтический эффект проявляется после приёма препарата в дозе 250 мг два раза в сут. При острых приступах глаукомы препарат назначают по 250 мг 4 раза в сут.
Детям при приступах глаукомы ацетазоламид назначают из расчёта 10-15 мг/кг в сутки в 3-4 приёма.
При эпилепсии взрослым назначают курсами по 250-500 мг/сут в один приём в течение трёх дней. Детям в возрасте от 4 до 12 мес назначают 50 мг/сут в 1-2 приёма. Детям в возрасте 2-3 лет назначают 50-125 мг/сут в 1-2 приёма; от 4 до 18 лет по 125-250 мг один раз в сутки утром.
При горной болезни препарат назначают в дозе 500-1000 мг в сутки; в случае быстрого восхождения — по 1000 мг/сут. Суточную дозу делят на несколько приёмов в равных дозах. Препарат следует применять за 24-48 ч перед восхождением, а в случае появления симптомов болезни продолжать лечение в течение следующих 48 ч или более, если это необходимо.
При пропуске приёма препарата не следует увеличивать дозу при очередном приёме.
Побочное действие
Судороги, парестезии, анорексия, шум в ушах, близорукость. При длительном приёме возможны дезориентация, нарушение осязания, сонливость.
В отдельных случаях при длительном применении возможно развитие гемолитической анемии, лейкопении, агранулоцитоза.
Со стороны водно-электролитного баланса и кислотно-основного равновесия возможно развитие гипокалиемии, метаболического ацидоза.
В отдельных случаях при длительном применении наблюдают нефролитиаз, преходящую гематурию и глюкозурию.
Среди редких побочных действий возможны покраснение кожных покровов, зуд, мышечная слабость, аллергические реакции.
Противопоказания
Острая почечная недостаточность, печёночная недостаточность, цирроз печени. Гипокалиемия, ацидоз, гипокортицизм, болезнь Аддисона, уремия. Сахарный диабет, беременность, лактация, повышенная чувствительность к компонентам препарата.
Лекарственное взаимодействие
При совместном применении с противоэпилептическими препаратами ацетазоламид усиливает проявления остеомаляции.
Ацетазоламид усиливает эффект других диуретиков и теофиллина.
Кислотообразующие диуретики уменьшают эффект ацетазоламида.
Ацетазоламид повышает риск проявления токсических эффектов салицилатов, препаратов наперстянки, карбамазепина, эфедрина, недеполяризующих миорелаксантов.
Беременность и лактация
Ацетазоламид противопоказан при беременности и в период лактации.
Особые указания
С осторожностью назначают препарат при отёках печёночного и почечного генеза и при совместном приёме с ацетилсалициловой кислотой.
При назначении препарата более 5 дней подряд повышается риск развития метаболического ацидоза.
С осторожностью следует применять препарат у пожилых пациентов и/или у больных с нарушениями функции почек из-за повышенного риска развития метаболического ацидоза.
При длительном применении препарата следует контролировать показатели периферической крови, водно-электролитного баланса и кислотно-основного обмена.
Блокаторы медленных кальциевых каналов
История блокаторов медленных кальциевых каналов (антагонистов кальция) берёт начало с работ А. Флекенштейна. Он доказал снижение сократительной способности кардиомиоцитов и гладких миоцитов сосудистой стенки при блокаде поступления в них ионов кальция. Кроме того, было выяснено, что различные химические соединения могут уменьшать вход Ca2+ через медленные кальциевые каналы и вызывать разобщение электромеханического сопряжения в кардиомиоцитах и гладкомышечных клетках, тем самым подавляя их сокращение. В дальнейшем эти препараты были названы «антагонистами кальция».
Классификация
Классификация основных антагонистов кальция построена на особенностях химической структуры и специфичности действия отдельных препаратов (см. табл. 21-19).
Таблица 21-19. Классификация антагонистов кальция
|
Группа (специфичность действия) |
Первое поколение |
Второе поколение |
Третье поколение |
|
|
2 a |
2 b |
|||
|
Дигидропиридины (артерии > сердце) |
Нифедипин |
Нифедипин SR/GITS р |
Бенидипинр |
Амлодипин |
|
Бензотиазепины |
Дилтиазем |
Дилтиазем SRр |
Клентиаземр |
Примечание. SR — sustained release; GITS — gastrointestinal therapeutic system; ER — extended release; SRO — sustained release oral (ретардные формы лекарственных препаратов).
Механизм действия и основные фармакологические эффекты
Механизм действия антагонистов кальция связан с торможением входа ионов кальция внутрь клеток через потенциал-зависимые медленные кальциевые каналы L-типа. Эти каналы локализованы на поверхности цитоплазматической мембраны кардиомиоцитов, клеток синусового и атриовентрикулярного узлов, клеток гладкой и поперечно-полосатой мускулатуры. Они образованы крупной α1 -субъединицей, формирующей собственно канал, а также более мелкими дополнительными субъединицами — α2 β, γ, δ. Каждая α1-субъединица состоит из четырёх гомологичных доменов (I, II, III, IV), каждый домен — из шести трансмембранных сегментов (S1-S6). Антагонисты кальция взаимодействуют с α1-субъединицей канала L-типа. Блокада производными фенилалкиламина кальциевых каналов миокарда приводит к уменьшению использования энергии фосфатных связей для механической работы сердца и вызывает угнетение сократимости миокарда — отрицательный инотропный эффект. Блокада производными фенилалкиламина кальциевых каналов L-типа синусового и атриовентрикулярного узлов приводит к угнетению пейсмекерной активности синусового узла — отрицательный батмотропный эффект, а также проводимости атриовентрикулярного узла — отрицательный дромотропный эффект. Производные бензотиазепина имеют сходный механизм отрицательного ино-, батмо- и дромотропного действия. Все антагонисты кальция блокируют кальциевые каналы L-типа гладкой мускулатуры сосудов, что приводит к нарушению фосфорилирования лёгких цепей миозина и вазодилатации. Дигидропиридиновые антагонисты кальция, оказывая более выраженное вазодилатирующее действие, вызывают барорефлекторное повышение симпатического тонуса, в результате чего их отрицательный инотропный эффект нивелируется. Антагонисты кальция вызывают расслабление периферических и коронарных артерий и почти не влияют на тонус вен.
Фармакокинетика
Особенности всасывания
Антагонисты кальция имеют высокую липофильность, хорошо всасываются при приёме внутрь и начинают действовать через 30-60 мин. При внутривенном введении эффект верапамила проявляется через 1-2 мин. Ретардные формы антагонистов кальция медленно всасываются, и действие их более длительно. Биодоступность антагонистов кальция связана с наличием эффекта первого прохождения через печень. Невысокая биодоступность характерна для верапамила, исрадипинаP, фелодипина, нимодипина, нисолдипинаP. Наибольшую биодоступность имеет амлодипин (60-90%).
Особенности распределения
Антагонисты кальция в значительной степени связываются с белками плазмы крови (70-98%). Это необходимо учитывать при лечении больных с гипопротеинемией, а также при совместном применении с препаратами, способными конкурировать за связь с плазменными альбуминами.
Особенности биотрансформации
Антагонисты кальция метаболизируются в печени и стенке кишечника при участии изоферментов цитохрома P450 CYP IIIA — цитохрома 3A4. В метаболизм верапамила определённый вклад вносят также изоферменты цитохром 1А2 и 3А5, в метаболизм дилтиазема — цитохром 2D6. В результате метаболизма верапамила образуются активные метаболиты норверапамил и деметилированный метаболит, дилтиазема — деацетилдилтиазем, менее активный, чем исходный препарат. Метаболиты дигидропиридиновых антагонистов кальция малоактивны или вообще неактивны.
Особенности выведения
Антагонисты кальция выделяются через почки и кишечник. Период полувыведения (T1/2) у антагонистов кальция первого поколения составляет 2-7 ч, второго поколения — 7-15 ч, амлодипина — 35-60 ч. Выведение препаратов замедляется при циррозе печени, тяжёлой почечной недостаточности и в пожилом возрасте.
Возможности применения терапевтического лекарственного мониторинга для выбора режима дозирования
Выраженность влияний антагонистов кальция на электрофизиологические и гемодинамические показатели находится в прямой зависимости от их концентрации в плазме, относительно антиангинального эффекта подобной корреляции не обнаружено. При использовании антагонистов кальция у больных с ХПН следует проводить инструментальные и фармакокинетические исследования с целью индивидуальной коррекции доз.
Фармакогенетика
Известна внутривидовая вариабельность метаболизма антагонистов кальция цитохромом 3А4, вероятная причина которой — нарушение экспрессии факторов транскрипции гена цитохрома 3А4. Есть данные о генетической основе полиморфизма цитохрома 3А5. Идентифицированы мутации этого гена, приводящие к снижению активности метаболизма верапамила. Обладает полиморфизмом и ген CYP2D6, участвующий в метаболизме дилтиазема.
Показания и доказательная база. «Перспективные показания»
Ишемическая болезнь сердца
Антагонисты кальция обладают антиангинальным действием, уменьшая потребность миокарда в кислороде, что позволяет использовать их для лечения ИБС. Однако в последние два десятилетия появились многочисленные данные о неблагоприятных эффектах антагонистов кальция I поколения у пациентов с ИБС. Было показано, что нифедипин короткого действия ухудшает течение нестабильной стенокардии, повышает риск возникновения инфаркта миокарда, а также увеличивает смертность больных в первые недели после развития инфаркта миокарда. Кроме того, до настоящего времени нет достоверных доказательств положительного влияния пролонгированных антагонистов кальция дигидропиридинового ряда на выживаемость больных нестабильной стенокардией и острым инфарктом миокарда. В то же время недигидропиридиновые антагонисты кальция верапамил и дилтиазем используют при нестабильной стенокардии, а также остром инфаркте миокарда без патологических зубцов Q при наличии противопоказаний к β-адреноблокаторам.
У больных со стабильной стенокардией антагонисты кальция II и III поколений используют при наличии противопоказаний к назначению β-адреноблокаторов или при развитии НЛР при приёме β-адреноблокаторов. Возможно добавление дигидропиридиновых антагонистов кальция пролонгированного действия при отсутствии эффективности монотерапии β-адреноблокаторами. В исследовании ACTION применение пролонгированного нифедипина у пациентов со стабильной стенокардией приводило к достоверному снижению суммарной частоты инфаркта миокарда, рефрактерной стенокардии, сердечной недостаточности, инсульта, реваскуляризации периферических артерий и смерти от любых причин. В исследовании PREVENT терапия амлодипином у больных коронарным атеросклерозом привела к достоверному снижению относительного риска развития нестабильной стенокардии и реваскуляризации коронарных артерий. В исследовании CAMELOT амлодипин по сравнению с плацебо замедлял развитие коронарного атеросклероза и снижал риск неблагоприятных исходов.
Вазоспастическая стенокардия
Эффективность антагонистов кальция при вазоспастической стенокардии показана в контролируемых клинических исследованиях. Дигидропиридины в большей степени устраняют спазм коронарных артерий и поэтому приоритетны при данной форме стенокардии.
Нарушения ритма сердца
Верапамил и дилтиазем уменьшают ЧСС, вызывают замедление атриовентрикулярного проведения и увеличение рефрактерности атриовентрикулярного узла, что позволяет использовать их при реципрокных аритмиях с вовлечением атриовентрикулярного узла, а также для снижения частоты сокращений желудочков при мерцательной аритмии и трепетании предсердий.
Артериальная гипертония
Антагонисты кальция — средства выбора в лечении артериальной гипертензии, что подтверждено многочисленными клиническими исследованиями (STOP-2, INSIGHT, INVEST, NORDIL, SYST-Eur, ELSA, ALLHAT и др.). Эти препараты наиболее эффективны при изолированной систолической гипертензии, гипертрофии левого желудочка, а также при наличии атеросклеротических изменений в сонных или коронарных артериях. Метаболическая нейтральность позволяет использовать антагонисты кальция при метаболическом синдроме.
Другие возможные показания для использования верапамила — гипертрофическая кардиомиопатия, а также профилактика приступов мигрени. Производные дигидропиридина эффективны при первичной и вторичной лёгочной гипертензии, а также уменьшают симптомы болезни Рейно. Нимодипин используют при неврологических нарушениях, обусловленных вторичным спазмом церебральных артерий на фоне субарахноидального кровоизлияния. Блокаторы медленных кальциевых каналов можно использовать при некоторых функциональных заболеваниях пищеварительного тракта.
Попытки клинического применения мибефрадила13, который блокирует «быстрые» кальциевые каналы T-типа, закончились неудачно в связи с выявлением опасных лекарственных взаимодействий, связанных с угнетением изоферментов цитохрома Р450 3A4, 2D6 и 1А2, которые участвуют в метаболизме многих лекарственных препаратов, в том числе блокаторов «медленных» кальциевых каналов L-типа. Tем не менее дальнейший поиск эффективных и безопасных блокаторов кальциевых каналов T-типа с перспективными фармакодинамическими преимуществами перед существующими антагонистами кальция L-типа представляет несомненный интерес.
Принципы выбора отдельных лекарственных средств данной группы в различных клинических ситуациях
Выбор антагонистов кальция основан на особенностях их фармакодинамики. Tак, при брадикардии и атриовентрикулярной блокаде I степени предпочтительно назначать дигидропиридиновые антагонисты кальция. Недигидропиридиновые антагонисты кальция верапамил и дилтиазем предпочтительны при сочетании артериальной гипертонии со стенокардией и суправентрикулярной тахикардией. При сердечной недостаточности наиболее предпочтителен амлодипин. Больным с диабетической и гипертонической нефропатией наиболее показан верапамил в связи с тем, что он увеличивает почечный кровоток и уменьшает протеинурию. Для длительной терапии ИБС и артериальной гипертензии целесообразно использовать блокаторы медленных кальциевых каналов пролонгированного действия: ретардные формы верапамила, дилтиазема, нифедипина или амлодипин. Коррекцию режимов дозирования антагонистов кальция проводят у пациентов с гипопротеинемией, ХПН, нарушением функции печени, с учётом возраста, а также возможного взаимодействия при их комбинации с другими лекарственными средствами.
Противопоказания
Противопоказания для назначения дигидропиридиновых антагонистов кальция — тяжёлый аортальный стеноз, обструктивная форма гипертрофической кардиомиопатии. Для использования недигидропиридиновых антагонистов кальция — синдром слабости синусового узла, синоатриальная и атриовентрикулярная блокады степени, синдром Вольфа-Паркинсона-Уайта с антероградным проведением по дополнительным путям. Все антагонисты кальция противопоказаны при артериальной гипотонии (систолическое АД менее 90 мм рт.ст.), а также при кардиогенном шоке и выраженной дисфункции левого желудочка.
Нежелательные лекарственные реакции и методы контроля за безопасностью
Основные побочные эффекты антагонистов кальция, особенно дигидропиридинов, обусловлены чрезмерным расширением сосудов. Они проявляются артериальной гипотонией, головной болью, головокружением, гиперемией кожных покровов, тахикардией, развитием пастозности на лодыжках и голенях. Имеются данные о развитии ишемии миокарда после приёма нифедипина, возможная причина которой — чрезмерное снижение АД и, как следствие, перфузионного давления в коронарных артериях, синдром «обкрадывания», а также повышение потребности в кислороде вследствие рефлекторной тахикардии. Верапамил и дилтиазем могут вызывать нарушение атриовентрикулярной проводимости и развитие атриовентрикулярной блокады, брадикардию и асистолию, снижение сократимости миокарда, одышку, отёк лёгких. Верапамил может вызвать желудочковую тахикардию при синдроме Вольфа-Паркинсона-Уайта. Реже возникает сыпь, бессонница, повышение активности печёночных ферментов, запор, гиперплазия слизистой дёсен. В высоких дозах антагонисты кальция могут тормозить сокращение матки и затруднять родовую деятельность.
Для контроля за безопасностью применения антагонистов кальция используют мониторирование АД, контроль ЭКГ, включая холтеровское мониторирование, пробы с дозированной физической нагрузкой. Для выявления нежелательных гемодинамических реакций возможно проведение острых фармакологических проб с оценкой центральной и церебральной гемодинамики.
Взаимодействия
Фармакокинетическое
Совместное назначение антагонистов кальция с ингибиторами или индукторами изофермента 3А4 приводит к изменению фармакокинетики антагонистов кальция. Например, циметидин увеличивает плазменные концентрации антагонистов кальция, фенобарбитал и фенитоин усиливают метаболизм верапамила и дилтиазема, снижают их эффективность. Антагонисты кальция повышают плазменные концентрации дигоксина, в связи с чем увеличивается вероятность развития атриовентрикулярной блокады и брадикардии. Дилтиазем и верапамил повышают плазменные концентрации и усиливают эффект теофиллина, карбамазепина.
Фармакодинамическое
Сочетание верапамила и дилтиазема с β-адреноблокаторами, амиодароном, дизопирамидомP повышает риск возникновения атриовентрикулярной блокады, кардиодепрессивного действия, брадикардии и асистолии. При одновременном использовании нифедипина с β-адреноблокаторами возможно развитие выраженной гипотонии и сердечной недостаточности. Применение антагонистов кальция во время наркоза увеличивает риск развития гипотонии.
Возможное взаимодействие с алкоголем, пищей, витаминами и лекарственными растениями
Алкоголь усиливает гипотензивный эффект антагонистов кальция. Грейпфрутовый сок может повышать плазменные концентрации антагонистов кальция за счёт ингибирования изоферментов цитохрома Р450.
Применение в особых ситуациях (беременность, лактация, в детском и пожилом возрасте, при сопутствующих заболеваниях, в т.ч. печени и почек)
Антагонисты кальция используют для лечения артериальной гипертензии у беременных. Но эти препараты проникают в грудное молоко, что ограничивает их применение в период грудного вскармливания. У пожилых пациентов увеличивается T1/2 и снижается их клиренс вследствие замедления скорости биотрансформации и выведения, поэтому необходимо уменьшение дозы препаратов.
СПИСОК ЛИТЕРАТУРЫ
Клиническая фармакология по Гудману и Гилману: в 4 т. / Под общ. ред. А.Г. Гилмана. — М.: Практика. — T. 2. — 2006. — 336 с.
Кукес В.Г., Фисенко В.П., Стародубцев А.К. и др. Клиническая фармакология блокаторов медленных кальциевых каналов. — 2-е изд., перераб. — М.: ИАА Ремедиум, 2003. — 88 с.
Метелица В.И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. — 3-е изд., перераб. и доп. — М.: Медицинское информационное агентство, 2005. — 1528 с.
Сидоренкова Н.Б., Манукян А.В. Артериальная гипертония и антагонисты кальция. — М.: МАКС Пресс, 2005. — 428 с.
Guidelines Committee for the Management of Arterial Hypertension / The Task Force for the Management of General Hypertension (ESH) and the European Society of Cardiology (ESC) // J. of Hypertension. — 2007. — Vol. 25. — P. 1105-1187.
ACC/AHA/ACP-ACIM Guidelines for the management of patients with chronic stable angina. A report of the American College of Cardiology / American Heart Association Task Force on Practice Guideline’s — JACC. — 2003. — Vol. 41. — P. 159-168.
Basile J. The role of existing and newer calcium channel blockers in the treatment of hypertension // J. Clin. Hypertens. — 2004. — Vol. 6 (1). — P. 521-631.
Epsteim M. Calcium antagonists in clinical medicine / Hanley & Belfus, 1998. — P. 590.
Neal B., Mac Mahon S., Chapman N. Blood pressure Lowering Treatment Trialists Collaboration. Effects of ACE inhibitors, calcium antagonists, and other blood-pressure-lowering drugs: results of prospectively designed overviews of randomized trials / Blood Pressure Lowering Treatment Trialists Collaboration // Lancet. — 2000. — Vol. 356. — P. 1955-1964.
Zanchetti A. Evidence-based medicine in hypertension: What type of evidence? // J. Hypertens. — 2005. — Vol. 23. — P. 1113-1120.
Ингибиторы ангиотензинпревращающего фермента
СТРОЕНИЕ И ФУНКЦИИ РЕНИН-АНГИОТЕНЗИН-АЛЬДОСТЕРОНОВОЙ СИСТЕМЫ
РААС оказывает выраженное гуморальное влияние на сердечно-сосудистую систему и участвует в регуляции АД. Центральное звено РААС — ангиотензин II (рис. 21-1), который обладает мощным прямым вазоконстрикторным действием на артерии (преимущественно) и опосредованным действием на ЦНС (на компоненты РААС мозга). Ангиотензин II способствует высвобождению катехоламинов из надпочечников и вызывает увеличение ОПСС, стимулирует секрецию альдостерона и приводит к задержке жидкости и повышению объёма циркулирующей крови, стимулирует выброс катехоламинов (норадреналина) и других нейрогормонов из симпатических окончаний (табл. 21-20). Ангиотензин II — фактор роста (или модулятор роста) для кардиомиоцитов и гладкомышечных клеток сосудов.
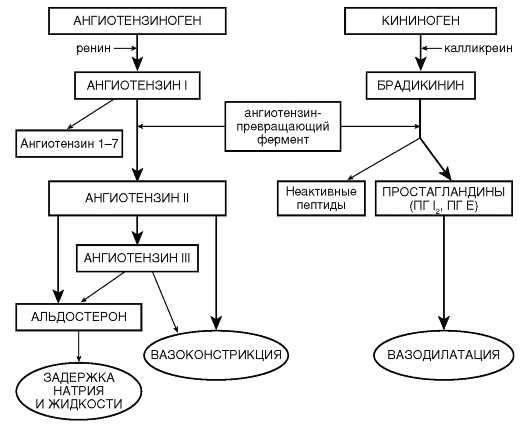
Рис. 21-1. Строение ренин-ангиотензин-альдостероновой системы (схема).
Функции других форм ангиотензина
Ангиотензин I малозначим в системе РААС, так как быстро превращается в ангиотензин II. Кроме того, его активность в 100 раз меньше активности ангиотензина II. Ангиотензин III действует подобно ангиотензину II, но его прессорная активность в 4 раза слабее ангиотензина II. Ангиотензин 1-7 образуется вследствие превращения ангиотензина I. По функциям он значительно отличается от ангиотензина II. Он не вызывает прессорного действия, а, наоборот, приводит к снижению АД благодаря секреции антидиуретического гормона, стимуляции синтеза простагландинов, натрийуреза.
Таблица 21-20. Эффекты ангиотензина II
| Органы и ткани | Эффекты |
|---|---|
|
Сосуды |
Вазоконстрикция (выброс норадреналиина, вазопрессина, эндотелина I). |
|
Сердце |
Инотропное и хронотропное действие. Спазм коронарных артерий |
|
Почки |
Спазм почечных сосудов (больше эфферентных артериол). Сокращение и пролиферация мезангиальных клеток. Реабсорбция натрия, экскреция калия. Снижение секреции ренина |
|
Надпочечники |
Секреция альдостерона и адреналина |
|
Головной мозг |
Секреция вазопрессина, антидиуретического гормона. |
|
Тромбоциты |
Стимуляция адгезии и агрегации |
|
Воспаление |
Активация и миграция макрофагов. |
|
Трофические факторы |
Гипертрофия кардиомиоцитов, гладкомышечных клеток сосудов. Стимуляция проонкогенов, факторов роста. |
РААС регулирует функции почек. Ангиотензин II вызывает мощный спазм приносящей артериолы, уменьшение давления в капиллярах клубочка и снижение фильтрации в нефроне. В результате снижения фильтрации уменьшается реабсорбция натрия в проксимальном отделе нефрона, что приводит к увеличению концентрации натрия в дистальных канальцах и активации Na-чувствительных рецепторов плотного пятна в нефроне. По механизму обратной связи это сопровождается торможением выделения ренина и увеличением СКФ.
Функционирование РААС связано и с альдостероном посредством механизма обратной связи. Альдостерон — важнейший регулятор объёма внеклеточной жидкости и гомеостаза калия. Прямого действия на секрецию ренина и ангиотензина II альдостерон не оказывает, но возможно косвенное влияние через задержку натрия в организме. В регуляции секреции альдостерона участвуют ангиотензин II и электролиты, причём ангиотензин II стимулирует, а натрий и калий уменьшают его образование.
Гомеостаз электролитов тесно связан с активностью РААС. Натрий и калий не только влияют на активность ренина, но и изменяют чувствительность тканей к ангиотензину II. В регуляции активности ренина основная роль принадлежит натрию, а в регуляции секреции альдостерона калий и натрий оказывают одинаковое влияние.
Физиологическую активацию РААС наблюдают при потере натрия и жидкости, значительном снижении АД (которое сопровождается падением фильтрационного давления в почках), повышении активности симпатической нервной системы, а также под воздействием многих гуморальных агентов (вазопрессина, предсердного натрийуретического гормона, антидиуретического гормона).
Целый ряд сердечно-сосудистых заболеваний может способствовать патологической стимуляции РААС (например, при артериальной гипертензии, застойной сердечной недостаточности, остром инфаркте миокарда).
Известно, что РААС функционирует не только в плазме крови (эндокринная функция), но и во многих других тканях организма (головном мозге, сосудистой стенке, сердце, почках, надпочечниках, лёгких). Эти тканевые фракции системы могут работать на клеточном уровне независимо от плазменной фракции компонентов РААС (аутокринная, паракринная и интракринная регуляция). Поэтому различают краткосрочные эффекты ангиотензина II, обусловленные свободно циркулирующей его фракцией в системном кровотоке, и отсроченные эффекты, регулируемые через тканевые фракции РААС и влияющие на структурноадаптационные механизмы перестройки органов (табл. 21-21).
Таблица 21-21. Разные фракции ренин-ангиотензин-альдостероновой системы и их эффекты
| Органы | Циркулирующая фракция РААС (краткосрочные эффекты) | Тканевые фракции РААС (отсроченные эффекты) |
|---|---|---|
|
Почки |
Стимуляция альдостерона, задержка натрия и жидкости |
Интрагломерулярная гипертензия, артериолонефросклероз |
|
Сосуды |
Вазоконстрикция |
Гипертрофия сосудистой стенки, ремоделирование сосудов |
|
Сердце |
Аритмогенный эффект |
Гипертрофия миокарда, ремоделирование сердца |
Основное количество АПФ присутствует в плазме крови, что способствует образованию свободно циркулирующего ангиотензина II и краткосрочным гемодинамическим эффектам. В тканях (помимо АПФ) присутствуют другие ферменты (химазы, эндопероксиды, катепсин G и др.), способные превращать ангиотензин I в ангиотензин II; им принадлежит ведущая роль в функционировании тканевых РААС и развитии отсроченных эффектов моделирования функции и структуры органов-мишеней.
Образование ангиотензина II происходит из ангиотензина I под действием АПФ. Этот фермент присутствует не только в РААС. АПФ идентичен ферменту кининазе II, участвующему в деградации кининов (брадикинина) (см. рис. 21-1).
Кинины — мощные вазодилататоры, которые участвуют в регуляции АД, микроциркуляции и ионном транспорте. Кинины имеют очень короткий период жизни и присутствуют в кровотоке в низких концентрациях. Именно поэтому они проявляют свои эффекты как местные гормоны (паракринно). Основное биологически активное вещество кининовой системы — брадикинин. Брадикинин способствует увеличению внутриклеточного Са2+, являющегося кофактором для NO-синтазы, которая участвует в образовании эндотелиального релаксирующего фактора (оксида азота). Эндотелиальный релаксирующий фактор блокирует сокращение сосудов и агрегацию тромбоцитов, а также ингибирует митоз и пролиферацию гладкой мускулатуры сосудов, что обеспечивает антиатеросклеротическое действие. Брадикинин стимулирует синтез в эндотелии сосудов простагландинов Е2 и I2 (простациклина) — мощного вазодилататора и тромбоцитарного антиагреганта.
Tаким образом, брадикинин влияет на выработку эндотелиального релаксирующего фактора и оказывает противоположное ангиотензину II действие. Блокирование АПФ потенциально повышает концентрацию кининов в тканях сердца и сосудистой стенки, что обеспечивает антипролиферативный, антиишемический, антиатерогенный и антиагрегантный эффекты. Кинины способствуют увеличению кровотока, диуреза и натрийуреза без существенного изменения СКФ. Простагландины Е2 и I2 тоже обладают диуретическим и натрийуретическим действием и увеличивают почечный кровоток.
МЕХАНИЗМ ДЕЙСТВИЯ И ФАРМАКОЛОГИЯ ИНГИБИТОРОВ АНГИОТЕНЗИНПРЕВРАЩАЮЩЕГО ФЕРМЕНТА
Фармакодинамические эффекты ингибиторов АПФ обусловлены блокированием АПФ и уменьшением образования ангиотензина II в крови и тканях, устраняя таким образом прессорные и другие нейрогуморальные эффекты ангиотензина II. При этом по механизму обратной связи может увеличиваться концентрация ренина плазмы и ангиотензина I, а также транзиторно снижаться концентрация альдостерона. Ингибиторы АПФ предупреждают разрушение брадикинина, что дополняет и усиливает их сосудорасширяющий эффект.
-
Ингибиторы АПФ различают по следующим характеристикам (табл. 21-22):
-
химическое строение (наличие SH-группы, карбоксильной группы, фосфорсодержащие);
-
лекарственная активность (лекарство или пролекарство);
-
влияние на тканевые РААС;
-
фармакокинетические свойства (липофильность).
-
Таблица 21-22. Характеристика ингибиторов ангиотензинпревращающего фермента
| Препарат | Химическая группа | Лекарственная активность | Влияние на тканевые РААС |
|---|---|---|---|
|
Каптоприл |
SH-группы |
Лекарство |
Слабо |
|
Эналаприл |
Карбоксильная |
Пролекарство |
Умеренно |
|
Беназеприл |
Карбоксильная |
Пролекарство |
Умеренно |
|
Квинаприл |
Карбоксильная |
Пролекарство |
Сильно |
|
Лизиноприл |
Карбоксильная |
Лекарство |
Умеренно |
|
Моэксиприл |
Карбоксильная |
Пролекарство |
Сильно |
|
Периндоприл |
Карбоксильная |
Пролекарство |
Сильно |
|
Рамиприл |
Карбоксильная |
Пролекарство |
Сильно |
|
Трандолаприл |
Карбоксильная |
Пролекарство |
Сильно |
|
Фозиноприл |
Фосфорная |
Пролекарство |
Слабо |
|
Цилазаприл |
Карбоксильная |
Пролекарство |
Сильно |
Характер распределения в тканях (тканевая специфичность) ингибиторов АПФ зависит от степени липофильности, обусловливающей пенетрацию в разные ткани, и от силы связывания с тканевыми АПФ. Относительная сила действия (аффинность) ингибиторов АПФ исследована in vitro.
-
Данные о сравнительной силе действия разных ингибиторов АПФ представлены ниже:
-
квинаприл ± беназеприл ± трандолаприл ± цилазаприл ± рамиприл ± периндоприл ≥ лизиноприл ≥ эналаприл ≥ фозиноприл ≥ каптоприл.
-
Несмотря на различия в силе связывания с АПФ in vitro, использование эквивалентных доз препаратов позволяет добиться полного ингибирования АПФ. Сила связывания с АПФ определяет не только силу действия ингибиторов АПФ, но и продолжительность их действия.
Фармакодинамика ингибиторов ангиотензинпревращающего фермента
Основной фармакодинамический эффект ингибиторов АПФ — гемодинамический, обусловленный периферической артериальной и венозной вазодилатацией. Данный эффект развивается в результате сложных изменений нейрогуморальной регуляции сердечно-сосудистой системы (подавление активности РААС и симпатоадреналовая система). По механизму действия они принципиально отличаются как от прямых вазодилататоров и антагонистов кальция, действующих непосредственно на сосудистую стенку, так и от вазодилататоров рецепторного действия (αи β-адреноблокаторов). Они уменьшают ОПСС, увеличивают сердечный выброс и не влияют на ЧСС вследствие устранения стимулирующего действия ангиотензина II на симпатоадреналовую систему. Гемодинамический эффект ингибиторов АПФ наблюдают независимо от активности ренина в крови. Вазодилатирующее действие ингибиторов АПФ проявляется улучшением регионального кровотока в органах и тканях мозга, сердца, почек. В ткани почек ингибиторы АПФ оказывают расширяющее действие на эфферентные (выносящие) артериолы клубочков и снижают внутриклубочковую гипертонию. Они вызывают также натрийурез и задержку калия в результате уменьшения секреции альдостерона.
Гемодинамические эффекты ингибиторов АПФ обусловливают их гипотензивное действие. Гипотензивный эффект обусловлен не только снижением образования ангиотензина II, но и предупреждением деградации брадикинина, который потенцирует эндотелийзависимую релаксацию гладкой мускулатуры сосудов, через образование вазодилатирующих простагландинов и эндотелиального релаксирующего фактора (NO).
Для большинства ингибиторов АПФ гипотензивное действие начинается через 1-2 ч, максимальный эффект развивается в среднем через 2-6 ч, продолжительность действия достигает 24 ч (кроме наиболее короткодействующих — каптоприла и эналаприла, действие которых продолжается 6-12 ч) (табл. 21-23). Скорость наступления гемодинамического эффекта ингибиторов прямо влияет на переносимость и выраженность гипотонии «первой дозы».
Таблица 21-23. Продолжительность гипотензивного действия ингибиторов ангиотензинпревращающего фермента
| Препарат | Время начала действия, ч | Время максимального действия, ч | Длительность действия, ч |
|---|---|---|---|
|
Беназеприл |
≤1 |
2-4 |
16-24 |
|
Каптоприл |
≤0,5 |
1 |
4-12 |
|
Квинаприл |
≤1 |
2-4 |
24 |
|
Лизиноприл |
≤1 |
4-6 |
>24 |
|
Моэксиприл |
1 |
3-6 |
24 |
|
Периндоприл |
1 |
4-6 |
24 |
|
Рамиприл |
1-2 |
4-8 |
>24 |
|
Спираприл |
1 |
4 |
24 |
|
Трандолаприл |
1 |
6 |
до 48 |
|
Фозиноприл |
1 |
2-6 |
24 |
|
Эналаприл |
≤1 |
6-8 |
24 |
Распределение гипотензивного эффекта ингибиторов АПФ во времени не всегда точно зависит от фармакокинетики, при этом не все препараты, даже продолжительного действия, характеризуются высоким индексом T/p (табл. 21-24).
Таблица 21-24. Отношение T/p ингибиторов ангиотензинпревращающего фермента
| Препарат | Отношение Т/р, % |
|---|---|
|
Каптоприл |
25 |
|
Эналаприл |
51 (40-64) |
|
Лизиноприл |
48 (30-70) |
|
Фозиноприл |
64 |
|
Цилазаприл |
51 (10-80) |
|
Моэксиприл |
0-9 |
|
Рамиприл |
56 (50-63) |
|
Трандолаприл |
84 |
Ингибиторы АПФ уменьшают высвобождение норадреналина и реактивность сосудистой стенки на симпатическую активацию, что используют у больных ИБС, при остром инфаркте миокарда и угрозе реперфузионных аритмий. У больных с застойной сердечной недостаточностью снижение периферической системной резистентности (постнагрузки), лёгочной сосудистой резистентности и капиллярного давления (преднагрузки) ведёт к снижению дилатации полостей сердца, улучшению диастолического наполнения, повышению сердечного выброса и увеличению толерантности к физической нагрузке. Кроме того, нейрогуморальные эффекты ингибиторов АПФ замедляют ремоделирование сердца и сосудов.
Благодаря блокированию нейрогуморальных эффектов ангиотензина II ингибиторы АПФ оказывают выраженное органопротективное действие: кардиопротективное, вазопротективное и нефропротективное. Ингибиторы АПФ вызывают ряд благоприятных метаболических эффектов, улучшая углеводный и липидный обмен. Потенциальные эффекты ингибиторов АПФ представлены в табл. 21-25.
Таблица 21-25. Фармакодинамические эффекты ингибиторов ангиотензинпревращающего фермента
| Группа эффектов | Эффекты | |
|---|---|---|
|
Сердечно-сосудистые эффекты |
Артериальная вазодилатация (↓, постнагрузки, гипотензивный эффект). |
|
|
Почечные эффекты |
Дилатация афферентных и эфферентных артериол (уменьшение внутриклубочковой гипертонии). |
|
|
Метаболические эффекты |
Уменьшение инсулинорезистентности, повышение чувствительности тканей к инсулину. |
|
|
Нейрогуморальные эффекты |
Уменьшение образования ангиотензина II, альдостерона, норадреналина, антидиуретического гормона, вазопрессина, эндотелина I |
Повышение концентрации брадикинина, простагландинов I2 и E2 , оксида азота |
Ингибиторы АПФ проявляют кардиопротективное действие, вызывая регресс гипертрофии левого желудочка, препятствуя ремоделированию, ишемическому и реперфузионному повреждению миокарда. Кардиопротективный эффект специфичен для всего класса ингибиторов АПФ. Он обусловлен устранением трофического действия ангиотензина II на миокард и модуляцией симпатической активности (так как ангиотензин II — важный регулятор высвобождения катехоламинов, а ингибирование ангиотензина II приводит к снижению симпатического влияния на сердце и сосуды). В осуществлении кардиопротективных эффектов ингибиторов АПФ определённое место принадлежит кининам. Брадикинин и простагландины (благодаря антиишемическому действию, дилатации капилляров и увеличению доставки кислорода миокарду) способствуют усилению микроциркуляции, восстановлению метаболизма и насосной функции миокарда на фоне регресса гипертрофии левого желудочка и в постинфарктном периоде.
Доказана преобладающая роль ингибиторов АПФ в уменьшении гипертрофии левого желудочка по сравнению с другими классами гипотензивных препаратов, причём отсутствует связь между выраженностью гипотензивного эффекта и регрессией гипертрофии левого желудочка (они могут предотвращать развитие гипертрофии левого желудочка и миокардиального фиброза даже при отсутствии снижения АД).
Ингибиторы АПФ проявляют вазопротективное действие, что обусловлено блокированием эффектов ангиотензина II на АT1 -рецепторы сосудов, активированием брадикининовой системы, улучшением эндотелиальной функции, антипролиферативным действием на гладкую мускулатуру сосудов.
Ингибиторы АПФ обладают антиатерогенным действием, обусловленным:
-
антипролиферативным и антимиграционным эффектами на гладкомышечные клетки сосудов и моноциты;
-
уменьшением образования коллагенового матрикса;
-
антиоксидантным и противовоспалительным действием;
-
потенцированием эндогенного фибринолиза;
-
антиагрегантным действием (торможение агрегации тромбоцитов);
-
снижением атерогенности плазмы (уменьшение липопротеида низкой плотности, триглицеридов и повышение липопротеида высокой плотности);
-
предупреждением развития атеротромбоза и разрыва атеросклеротической бляшки.
Антиатерогенные свойства в клинических исследованиях показаны для рамиприла, квинаприлаP.
Ингибиторы АПФ обладают важным нефропротективным эффектом, предотвращая прогрессирование почечной недостаточности и уменьшая протеинурию. Нефропротективный эффект специфичен для всего класса препаратов. Дилатация преимущественно эфферентных артериол почечного клубочка сопровождается снижением интрагломерулярного фильтрационного давления, фильтрационной фракции и гиперфильтрации, в результате чего уменьшается протеинурия (преимущественно низкомолекулярных белков) у больных с диабетической и гипертонической нефропатией. Ренальные эффекты, ввиду высокой чувствительности почечных сосудов к вазодилатирующему действию ингибиторов АПФ, проявляются раньше, чем снижение ОПСС, и лишь частично опосредованы гипотензивным действием. Антипротеинурический эффект ингибиторов АПФ обусловлен противовоспалительным действием на базальную мембрану клубочка и антипролиферативным действием на мезангиальные клетки клубочка, что уменьшает проницаемость базальной мембраны для среднемолекулярных и высокомолекулярных белков. Кроме того, ингибиторы АПФ устраняют трофические эффекты ангиотензина II, который за счёт стимуляции роста мезангиальных клеток, продукции ими коллагена и эпидермального фактора роста почечных канальцев ускоряет развитие нефросклероза.
Фармакокинетика ингибиторов ангиотензинпревращающего фермента
Современная классификация ингибиторов АПФ основана на их фармакокинетических свойствах (табл. 21-26). Выделяют липофильные и гидрофильные препараты, использующие разные пути элиминации.
Таблица 21-26. Классификация ингибиторов ангиотензинпревращающего фермента (Opie, 1999)
|
Класс I |
Липофильные лекарства: каптоприл, алацеприлP</sup> |
|
Класс II |
Липофильные пролекарства: |
|
Подкласс IIA |
Препараты, активные метаболиты которых выводятся преимущественно через почки: эналаприл, беназеприл, квинаприлP, периндоприл, цилазаприл |
|
Подкласс IIB |
Препараты, активные метаболиты которых имеют два основных пути элиминации: моэксиприл, рамиприл, спираприл, трандолаприл, фозиноприл |
|
Класс III |
Гидрофильные лекарства: лизиноприл, либензаприлP</sup> |
Установлено, что липофильность ингибиторов АПФ обусловливает влияние на тканевые ренин-ангиотензиновые системы и, возможно, органопротективные эффекты (табл. 21-27).
Таблица 21-27. Индекс липофильности активных форм основных ингибиторов ангиотензинпревращающего фермента
| Препарат | Индекс липофильности |
|---|---|
|
Фозиноприл |
≥2,00 |
|
Трандолаприл |
1,46 |
|
КвинаприлP |
1,42 |
|
Рамиприл |
0,92 |
|
Периндоприл |
0,87 |
|
Эналаприл |
0,11 |
|
Каптоприл |
0,08 |
|
Лизиноприл |
-2,44 |
Примечание: отрицательное значение указывает на гидрофильность.
Сравнительная фармакокинетика ингибиторов АПФ представлена в табл. 21-28.
Отличительная фармакокинетическая особенность большинства ингибиторов АПФ (кроме каптоприла и лизиноприла) — выраженный метаболизм в печени (в том числе пресистемный), приводящий к образованию активных метаболитов и сопровождающийся значительной индивидуальной вариабельностью. Tакая фармакокинетика делает ингибиторы АПФ похожими на «пролекарства», фармакологическое действие которых после приёма внутрь осуществляется благодаря образованию в печени активных метаболитов. В России зарегистрирована парентеральная форма эналаприла — синтетический аналог эналаприлата, который используется для купирования гипертонических кризов.
Максимальная концентрация ингибиторов АПФ достигается в плазме крови через 1-2 ч и влияет на скорость развития гипотонии. Ингибиторы АПФ отличаются высокой степенью связи с белками плазмы (70-90%). Период полувыведения вариабельный: от 3 до 24 ч и более, хотя фармакокинетика меньше влияет на продолжительность гемодинамического эффекта.
-
Выделяют три фазы T1/2 :
-
быстрое раннее снижение, отражающее фазу распределения (T1/2α);
-
начальная фаза элиминации, отражающая элиминацию несвязанной с тканевыми АПФ фракции (T1/2β);
-
длительная терминальная фаза элиминации, отражающая элиминацию диссоциированной фракции активных метаболитов из комплекса с АПФ, которая может достигать 50 ч (у рамиприла) и определяет интервал дозирования.
-
Препараты в дальнейшем метаболизируются с образованием глюкуронидов (кроме лизиноприла и цилазаприла).
-
Наибольшее клиническое значение имеют пути элиминации ингибиторов АПФ:
-
преимущественно почечный (более 60%) — лизиноприл, цилазаприл, эналаприл, квинаприлP, периндоприл;
-
билиарный — спираприл, трандолаприл;
-
смешанный.
-
Билиарная экскреция — важная альтернатива почечной элиминации, особенно при наличии ХПН.
Таблица 21-28. Фармакокинетика ингибиторов ангиотензинпревращающего фермента
| Препарат | Всасывание, % | Биодоступность, % | Связь с белками, % | T1/2, ч | Метаболизм/активные метаболиты | Преимущественная элиминация (почки или печень) |
|---|---|---|---|---|---|---|
|
Беназеприл |
37 |
37 |
95 |
10-11 |
/ |
Почки (более 70%) |
|
Каптоприл |
75 (30-55 после еды) |
75 (↓, после еды) |
25-30 |
2 |
+/- |
Почки (до 50% — в неизменённом виде) |
|
Квинаприл |
60 |
38 |
97 |
2 |
/ |
Почечно-печёночная (60/40%) |
|
Лизиноприл |
25 (6-60) |
25-60 |
≤10 |
12 |
— |
Почечная (100%) |
|
Моэксиприл |
— |
22 (↓, после еды) |
50-70 |
2-9 |
/ |
Почечно-печёночная (50/50%) |
|
Периндоприл |
60-80 |
65-75 |
20-30 |
3-10 |
/ |
Почки (более 70% в виде активного метаболита) |
|
Рамиприл |
50-60 |
50-60 |
56 |
9-17 |
/ |
Почечно-печёночная (60/40%) |
|
Спираприл |
45 |
50 |
90 |
2-40 |
/ |
Почечно-печёночная (40/60%) |
|
Трандолаприл |
40-60 |
10 |
80-95 |
10 |
/ |
Почечно-печёночная (33/66%) |
|
Фозиноприл |
25-36 |
25-30 |
97-98 |
11,5 |
/ |
Почечно-печёночная (50/50%) |
|
Цилазаприл |
— |
45 |
— |
7-11 |
/ |
Почки (100%) |
|
Эналаприл (эналаприлат) |
60 |
60 |
50-60 |
11 |
/ |
Почки (70%) (в неизменённом виде и активным метаболитом) |
Показания к назначению ингибиторов ангиотензинпревращающего фермента
Артериальная гипертония
Ингибиторы АПФ оказывают гипотензивный эффект практически при всех формах артериальной гипертензии, вне зависимости от активности ренина плазмы. Барорефлекс и другие кардиоваскулярные рефлексы не изменяются, отсутствует ортостатическая гипотония. Этот класс препаратов относят к препаратам первого ряда в лечении артериальной гипертензии. Монотерапия эффективна у 50% больных с артериальной гипертензией. Помимо гипотензивного действия ингибиторы АПФ у больных с артериальной гипертензией снижают риск развития сердечно-сосудистых осложнений (возможно, больше, чем другие гипотензивные препараты). Ингибиторы АПФ — препараты выбора при сочетании артериальной гипертензии и сахарного диабета ввиду значимого снижения риска развития сердечно-сосудистых осложнений.
Систолическая дисфункция левого желудочка и хроническая сердечная недостаточность
Ингибиторы АПФ следует назначать всем больным с дисфункцией левого желудочка независимо от присутствия симптомов сердечной недостаточности. Ингибиторы АПФ предупреждают и замедляют развитие ХСН, снижают риск развития острого инфаркта миокарда и внезапной смерти, уменьшают потребность в госпитализации. Ингибиторы АПФ уменьшают дилатацию левого желудочка и препятствуют ремоделированию миокарда, уменьшают кардиосклероз. Эффективность ингибиторов АПФ усиливается с тяжестью дисфункции левого желудочка.
Острый инфаркт миокарда
Применение ингибиторов АПФ в ранние сроки при остром инфаркте миокарда снижает смертность больных. Особенно эффективны ингибиторы АПФ на фоне артериальной гипертензии, сахарного диабета и пациентов высокого риска.
Сахарный диабет и диабетическая нефропатия
Все ингибиторы АПФ замедляют прогрессирование поражения почек при сахарном диабете типа 1 и 2 вне зависимости от величины АД. Ингибиторы АПФ замедляют прогрессирование ХПН и при других нефропатиях. Длительное применение ингибиторов АПФ сопровождается снижением частоты осложнений сахарного диабета и сердечно-сосудистых осложнений. Применение ингибиторов АПФ сопровождается меньшей частотой возникновения новых случаев сахарного диабета, чем другие гипотензивные препараты (диуретики, β-адреноблокаторы, антагонисты кальция) (табл. 21-29).
Таблица 21-29. Показания к назначению ингибиторов ангиотензинпревращающего фермента
| Показания | Уровень доказательности |
|---|---|
|
Артериальная гипертония |
А |
|
Хроническая сердечная недостаточность |
А |
|
Систолическая дисфункция левого желудочка |
А |
|
Острый инфаркт миокарда |
А |
|
Сахарный диабет, диабетическая нефропатия |
А |
|
Ишемическая болезнь сердца без симптомов ХСН, наличие высокого риска сердечно-сосудистых осложнений (периндоприл, рамиприл) |
В |
Противопоказания к назначению ингибиторов ангиотензинпревращающего фермента
-
Ингибиторы АПФ противопоказаны больным:
-
с билатеральным стенозом почечных артерий или стенозом в единственной почке, а также после трансплантации почки (риск развития почечной недостаточности);
-
с выраженной почечной недостаточностью;
-
с гиперкалиемией;
-
с выраженным аортальным стенозом (с нарушением гемодинамики);
-
с ангионевротическим отёком, в том числе и после применения любого из ингибиторов АПФ.
-
-
С осторожностью следует применять:
-
при аутоиммунных заболеваниях, коллагенозах, особенно системной красной волчанке или склеродермии (увеличивается риск развития нейтропении или агранулоцитоза);
-
на фоне угнетения функций костного мозга.
-
Ингибиторы АПФ противопоказаны при беременности. Применение ингибиторов АПФ во время беременности приводит к эмбриотоксическим эффектам: в I триместре описаны мальформации сердца, сосудов, почек, мозга, пищеварительного тракта, во II и III триместрах приводит к гипотензии плода, гипоплазии костей черепа, почечной недостаточности, анурии и даже смерти плода, поэтому ингибиторы АПФ нужно отменить сразу же после установления беременности.
Принципы дозирования ингибиторов ангиотензинпревращающего фермента
Дозирование ингибиторов АПФ имеет свои особенности, связанные с риском выраженного гемодинамического (гипотензивного) эффекта и предполагает применение метода титрования дозы — использование начальной дозы препарата с последующим наращиванием дозы с интервалами 2 нед до достижения средней терапевтической (целевой) дозы. Важно достичь целевой дозы как для лечения артериальной гипертензии, ХСН, так и нефропатий, так как именно в этих дозах наблюдается максимальный органопротективный эффект ингибиторов АПФ (табл. 21-30).
Таблица 21-30. Дозирование ингибиторов ангиотензинпревращающего фермента
| Препарат | Начальная доза, мг/сут | Поддерживающая доза, мг/сут |
|---|---|---|
|
Беназеприл |
5-10 |
10-40 |
|
Каптоприл |
6,25-12,5 |
25-50 |
|
КвинаприлP |
5-10 |
10-40 |
|
Лизиноприл |
2,5-10 |
10-40 |
|
Моэксиприл |
7,5 |
15-30 |
|
Периндоприл |
2 |
4-8 |
|
Рамиприл |
1,25-2,5 |
5-10 |
|
Спираприл |
3 |
6 |
|
Трандолаприл |
0,5-1 |
2-4 |
|
Цилазаприл |
1,25 |
5 |
|
Фозиноприл |
5-10 |
10-40 |
|
Эналаприл |
5-10 |
10-40 |
Побочные эффекты ингибиторов ангиотензинпревращающего фермента
Ингибиторы АПФ, ввиду общего механизма действия, связанного с неселективным блокированием протеаз, имеют одинаковые класс-специфические побочные эффекты.
-
К класс-специфическим побочным эффектам ингибиторов АПФ относят:
-
наиболее частые — гипотензия, кашель, сыпь, гиперкалиемия;
-
менее частые — ангионевротический отёк, расстройства кроветворения, вкуса и нарушение функции почек (в частности, у больных с билатеральным стенозом почечных артерий и с застойной сердечной недостаточностью, получающих диуретики).
-
Различия в частоте развития побочных эффектов для ингибиторов АПФ связаны с неодинаковой тканевой специфичностью.
Гипотония «первой дозы» и связанные с ней головокружения свойственны всем ингибиторам АПФ. Головокружения считают проявлением гемодинамического эффекта (частота до 2%, при сердечной недостаточности — до 10%). Особенно часты после приёма первой дозы, у пожилых больных, у больных с высокой активностью ренина плазмы, с ХСН, при гипонатриемии и сочетанном приёме диуретиков. Для уменьшения выраженности гипотонии «первой дозы» рекомендуют медленное титрование доз препаратов с интервалами 2 нед до средней терапевтической (целевой) дозы.
Кашель — класс-специфичный побочный эффект ингибиторов АПФ. Частота его возникновения колеблется от 5 до 20%, чаще встречается у женщин и не зависит от дозы препаратов. Механизм развития кашля связан с активацией кинин-калликреиновой системы вследствие блокирования АПФ. При этом накапливающийся в стенке бронхов брадикинин может активировать другие провоспалительные пептиды (например, субстанцию Р, нейропептид Y), а также гистамин, влияющие на бронхомоторику и провоцирующие кашель. Отмена ингибиторов АПФ полностью прекращает кашель.
Гиперкалиемия (выше 5,5 ммоль/л) — результат уменьшения секреции альдостерона, возникающего при блокировании образования ангиотензина II. Может наблюдаться у больных с ХПН, на фоне совместного приёма калийсберегающих диуретиков, препаратов калия.
Кожная сыпь и ангионевротический отёк (отёк Квинке) связаны с увеличением концентрации брадикинина.
Нарушение функции почек (повышение креатинина и остаточного азота в плазме крови) может наблюдаться в начале лечения ингибиторами АПФ, носит транзиторный характер. Значительное повышение креатинина в плазме крови может наблюдаться у больных с застойной сердечной недостаточностью и стенозом почечных артерий, сопровождающихся высокой активностью ренина плазмы и спазмом эфферентных артериол. В этих случаях необходима отмена препаратов.
Лейкопения, тромбоцитопения и агранулоцитоз возникают крайне редко (менее 0,5%).
Лекарственные взаимодействия ингибиторов ангиотензинпревращающего фермента
Для ингибиторов АПФ не описаны фармакокинетические взаимодействия; все лекарственные взаимодействия с ними — фармакодинамические.
-
Ингибиторы АПФ имеют специфические лекарственные взаимодействия:
-
с НПВС;
-
с диуретиками;
-
с препаратами калия;
-
с гипотензивными средствами (табл. 21-31).
-
Комбинация ингибиторов АПФ с диуретиками и другими гипотензивными средствами может приводить к усилению гипотензивного эффекта. Лекарственные взаимодействия с НПВС (в том числе с аспирином*) могут приводить к ослаблению гипотензивного действия ингибиторов АПФ вследствие задержки жидкости и блокирования синтеза простагландинов в сосудистой стенке. Калийсберегающие диуретики и другие калий-содержащие средства могут увеличивать риск развития гиперкалиемии.
Таблица 21-31. Лекарственные взаимодействия ингибиторов ангиотензинпревращающего фермента
| Взаимодействующие препараты | Механизм взаимодействия | Результат взаимодействия |
|---|---|---|
|
Тиазидные, петлевые диуретики |
Дефицит натрия и жидкости |
Резкая гипотония, риск почечной недостаточности |
|
Калийсберегающие диуретики |
Снижение образования альдостерона |
Гиперкалиемия |
|
Антигипертензивные средства |
Повышение активности ренина или симпатической активности |
Усиление гипотензивного действия |
|
НПВС (особенно индометацин) |
Подавление синтеза простагландинов в почках и задержка жидкости |
Снижение гипотензивного действия |
|
Препараты калия, пищевые добавки, содержащие калий |
Фармакодинамическое |
Гиперкалиемия |
|
Средства, угнетающие кроветворение |
Фармакодинамическое |
Риск нейтропении и агранулоцитоза |
|
Эстрогены |
Задержка жидкости |
Снижение гипотензивного действия |
СПИСОК ЛИТЕРАТУРЫ
Клиническая фармакология по Гудману и Гилману: в 4 т. / Под общ. ред. А.Г. Гилмана. — М.: Практика. — 2006.
Информация о лекарственных средствах для специалистов здравоохранения. — Вып. 2.: Лекарственные средства, действующие на сердечно-сосудистую систему / Под ред. М.Д. Машковского. — М.: Фармединфо, 1997.
Метелица В.И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. — 3-е изд. — М.: МИА, 2005.
Рабочая группа по ингибиторам АПФ Европейского общества кардиологов. Заключение экспертов Европейского общества кардиологов по применению ингибиторов ангиотензинпревращающего фермента при сердечно-сосудистых заболеваниях // Рациональная фармакотерапия в кардиологии. — 2005. — № 1. — С. 49-69.
Aguilar D., Solomon S.D. ACE inhibitors and angiotensin receptor antagonists and the incidence of new-onset diabetes mellitus // Drugs. — 2006. — Vol. 66. — Р. 1169-1177.
Cooper W.O., Hernandez-Diaz S., Arbogast P.G. et al. Major congenital malformations after first-trimester exposure to ACE inhibitors // N. Engl. J. Med. — 2006. — Vol. 354. — Р. 24432451.
Dzau V.A. The relevance of tissue angiotensin-converting-enzyme: manifestation in mechanistic and endpoint data // Am. J. Cardiol. — 2001. — Vol. 88. — Р. 1-20.
Fabris B., Chen B., Pupic V. et al. Inhibition of angiotensin-converting enzyme (ACE) in plasma and tissue // J. Cardiovasc. Pharmacol. — 1990. — Vol. 15.
Israili Z.H., Hall W.D. Cough and angioneurotic oedema associated with therapy // Ann. Intern. Med. — 1992. — Vol. 117. — Р. 234-242.
Opie L.H. Angiotensin-converting-enzyme inhibitors. The advance continues. — 3-d ed. // New-York.: Authors’ Publishing House, 1999. — 275 p.
Shionori H. Pharmacokinetic drug interactions with ACE inhibitors // Clin. Pharmacokinetics. — 1993. — Vol. 25 (1). — Р. 20-58.
Антагонисты рецепторов ангиотензина II
МЕХАНИЗМ ДЕЙСТВИЯ
Несмотря на широкое использование ингибиторов АПФ в качестве гипотензивных средств, с их помощью далеко не всегда возможно полностью заблокировать синтез ангиотензина II. Установлено, что в превращении данного субстрата могут участвовать и другие ферменты, не связанные с АПФ (химазы, эндотелиальная и почечная пептидаза и др.), на которые действие ингибиторов АПФ не распространяется. Кроме того, применение ингибиторов АПФ может активировать альтернативные пути образования ангиотензина II. В результате ингибиторы АПФ не могут полностью устранить эффекты ангиотензина II, т.е. недостаточно эффективны.
Поиск другого подхода к блокированию РААС привёл к открытию в организме специфических рецепторов, через которые ангиотензин II реализует свои эффекты, и созданию новой группы препаратов, блокирующих эти рецепторы, — антагонистов рецепторов ангиотензина II.
Наиболее хорошо изучены два типа рецепторов к ангиотензину II, выполняющих разные функции: AT1 и AT2 (табл. 21-32).
Таблица 21-32. Функции рецепторов к ангиотензину II
| Рецепторы | Функции |
|---|---|
|
АТ1 -рецепторы |
Сужение сосудов. |
|
АТ2 -рецепторы |
Расширение сосудов. |
В отличие от ингибиторов АПФ антагонисты рецепторов ангиотензина II обладают специфичным действием и препятствуют развитию лишь биологических эффектов ангиотензина II, не вмешиваясь в кининовую систему, что улучшает их переносимость.
Ингибиторы АПФ, влияя на образование ангиотензина II, снимают эффекты стимуляции как с АT1, так и АT2-рецепторов. При этом оказываются заблокированными не только «вредные», но и потенциально «полезные» эффекты ангиотензина II, опосредованные через АT2-рецепторы; в частности, репарация, регенерация, антипролиферативное действие и дополнительная вазодилатация. Антагонисты рецепторов ангиотензина II обладают селективным действием на АT1-рецепторы, тем самым препятствуют реализации «вредных» эффектов ангиотензина II, а также стимулируют АT2 -рецепторы, увеличивая содержание ангиотензина II и других сходных продуктов (ангиотензин III, ангиотензин IV, ангиотензин 1-7) вследствие остановки отрицательной обратной связи (табл. 21-33).
Таблица 21-33. Сравнение влияния антагонистов АТ1-рецепторов и ингибиторов ангиотензинпревращающего фермента на ренин-ангиотензин-альдостероновую систему
| Компоненты РААС | Антагонисты АТ1-рецепторов | Ингибиторы АПФ |
|---|---|---|
|
Ренин |
↑ |
↑ |
|
Ангиотензиноген |
↑ |
↓ |
|
АПФ (кининаза) |
↔ |
↓ |
|
Химазы |
↓ |
↔ |
|
Ангиотензин I, 1-7 |
↑ |
↑ |
|
Ангиотензин II |
↑ |
↓ |
|
Ангиотензин III и IV |
↑ |
↓ |
|
Альдостерон |
↓ |
↓ |
|
Брадикинин |
↔ |
↑ |
ФАРМАКОЛОГИЯ АНТАГОНИСТОВ РЕЦЕПТОРОВ АНГИОТЕНЗИНА II
Первым неселективным антагонистом рецепторов ангиотензина II был препарат пептидной природы — саралазин, не нашедший широкого клинического применения ввиду быстрого распада в организме и внутривенного способа введения. К настоящему времени созданы непептидные антагонисты рецепторов ангиотензина II.
По химическому строению антагонисты рецепторов ангиотензина II относят к трём группам:
-
бифениловые производные тетразола (лозартан, кандесартан, ирбесартан);
-
небифениловые производные тетразола (телмисартан);
-
небифениловые нететразолы (эпросартан);
-
негетероциклические производные (валсартан).
Некоторые антагонисты рецепторов ангиотензина II фармакологически активны (телмисартан, ирбесартан, эпросартан); другие представляют собой пролекарства, например лозартан и кандесартан (табл. 21-34).
Таблица 21-34. Классификация антагонистов рецепторов ангиотензина II
| Препараты | Химическая группа | Фармакологическая активность (метаболит) | Характер связи с рецептором | Аффинность к рецепторам ангиотензина II |
|---|---|---|---|---|
|
Лозартан |
Бифенилтетразол |
Пролекарство (Е3174) |
Неконкурентная |
1,9 (3,7) |
|
Валсартан |
Бифенилтетразол |
+ |
Неконкурентная |
2,4 |
|
Ирбесартан |
Бифенилтетразол |
Пролекарство (CV11974) |
Неконкурентная |
1,2 |
|
Кандесартан |
Бифенилтетразол |
+ |
Неконкурентная |
0,7 (7,4) |
|
Телмисартан |
Небифенилтетразол |
— |
Неконкурентная |
1,2 |
|
Эпросартан |
Небифенилнететразол |
— |
Конкурентная |
1,5 |
Антагонисты рецепторов ангиотензина II отличает бо льшая селективность к АT1-рецепторам, чем к АT2-рецепторам (показатель селективности составляет 10000-30000:1).
Фармакология антагонистов рецепторов ангиотензина II различна по силе связывания с рецепторами (аффинности) и характеру связи (конкурентная или неконкурентная). Первый антагонист рецепторов ангиотензина II лозартан обладает наиболее слабой аффинностью к АT1-рецепторам, но его активный метаболит (E3174) в 10 раз сильнее лозартана. В связи с этим лозартан стали рассматривать как пролекарство, активность которого связана с метаболизацией в E3174. Новые антагонисты рецепторов ангиотензина II отличаются большей аффинностью (см. табл. 21-34) и более выраженным клиническим эффектом. По силе аффиннитета к АT1-рецепторам препараты расположены следующим образом: кандесартан > ирбесартан > лозартан = валсартан = телмисартан. Различия в силе связывания с рецепторами влияют и на прочность связи, характеризующуюся продолжительностью связывания с рецепторами ангиотензина (t1/2) и длительностью эффекта. Сравнительные характеристики силы и продолжительности связи с АT1-рецепторами представлены в табл. 21-35.
Таблица 21-35. Характеристика связывания бифениловых производных с АТ1 -рецепторами
| Препарат | Сила связи с АТ1 -рецепторами | Продолжительность связи с АТ1-рецепторами (t1/2) |
|---|---|---|
|
Кандесартан |
1 |
120 мин |
|
Валсартан |
0,17 |
17 мин |
|
Ирбесартан |
0,15 |
7 мин |
|
Лосартан |
0,014 |
быстро |
Подавляющее большинство антагонистов рецепторов ангиотензина II — неконкурентные, что в совокупности с высокой силой связывания с рецептором делает их фармакологическую кинетику необратимой (ирбесартан, кандесартан, телмисартан). Лозартан — слабый конкурентный антагонист, но благодаря наличию активного метаболита, проявляющего свойства неконкурентного антагониста, его тоже относят к группе неконкурентных антагонистов. Эпросартан — единственный конкурентный антагонист, действие которого преодолимо высокими концентрациями ангиотензина II.
ФАРМАКОДИНАМИКА АНТАГОНИСТОВ РЕЦЕПТОРОВ АНГИОТЕНЗИНА II
Антагонисты АT1-рецепторов имеют сложный нейрогуморальный механизм действия, включающий влияние на наиболее важные регуляторные системы организма — РААС и симпатоадреналовую систему, участвующие в патогенезе многих сердечно-сосудистых заболеваний (табл. 21-36).
Таблица 21-36. Роль ангиотензина II в регуляции артериального давления
| Органы | Механизм | Результат |
|---|---|---|
|
Сосудистая стенка |
Сужение сосудов. Гипертрофия |
— |
|
ЦНС |
Выброс адреналина. Высвобождение вазопрессина. Выброс антидиуретического гормона. Стимуляция жажды |
Повышение общего периферического сопротивления сосудов |
|
Почки |
Реабсорбция натрия и воды в канальцах |
— |
|
Кишечник |
Недостаточно изучен |
Повышение объёма циркулирующей крови |
|
Кора надпочечников |
Секреция альдостерона |
— |
|
Сердце |
Гипертрофия миокарда. Улучшение сократимости миокарда |
Повышение ударного объёма |
Прямой механизм действия антагонистов АT1-рецепторов связан с блокированием эффектов ангиотензина II, опосредуемых через АT1-рецепторы, таких как сужение артериальных сосудов, задержка натрия и воды, ремоделирование сосудистой стенки и миокарда. Кроме того, препараты обладают центральным (активация высвобождения норадреналина в ЦНС) и периферическим (уменьшение высвобождения норадреналина в синаптическую щель) симпатолитическим действием, что предотвращает сужение сосудов под влиянием симпатической нервной системы. Tаким образом, антагонисты АT1-рецепторов приводят к системному расширению сосудов и снижению ОПСС без увеличения ЧСС, натрийуретическому эффекту. Кроме того, антагонисты АT1-рецепторов оказывают антипролиферативное действие, преимущественно в сердечно-сосудистой системе.
Гемодинамические и нейрогуморальные фармакодинамические эффекты блокаторов рецепторов ангиотензина II обусловливают их применение при артериальной гипертонии и сердечной недостаточности.
Механизм гипотензивного действия антагонистов АT1-рецепторов состоит из устранения вазоконстрикции, вызванной ангиотензином II, снижения тонуса симпатоадреналовой системы, натрийуретического действия. Выраженность гипотензивного действия препаратов различается незначительно.
Почти все антагонисты рецепторов ангиотензина II проявляют гипотензивный эффект при приёме один раз в сутки и способствуют сохранению контроля над уровнем АД на протяжении 24 ч. Антипролиферативное действие антагонистов рецепторов ангиотензина II обусловливает кардиопротективный (вследствие регресса гипертрофии и гиперплазии миокарда и мускулатуры сосудистой стенки) и ренопротективный эффекты.
Почечные эффекты антагонистов АT1-рецепторов близки к влиянию ингибиторов АПФ, но имеют некоторые серьёзные отличия (табл. 21-37).
Таблица 21-37. Почечные эффекты ингибиторов ангиотензинпревращающего фермента и антагонистов рецепторов ангиотензина II
| Параметры | Блокаторы АТ1-рецепторов | Ингибиторы АПФ |
|---|---|---|
|
Тонус приносящих артериол |
↓ (минимально) |
↓ (минимально) |
|
Тонус выносящих артериол |
↓ |
↓↓ |
|
Скорость клубочковой фильтрации |
↓ |
↓ |
|
Фильтрационная фракция |
↓ |
↓↓ |
|
Уровень калия |
↑ |
↑↑ |
Наиболее важным считают отсутствие влияния антагонистов АT1 -рецепторов на концентрацию брадикинина, мощного фактора, влияющего на почечную микроциркуляцию. В исследованиях показано, что накопление брадикинина в результате действия ингибиторов АПФ приводит к выраженному снижению тонуса выносящих почечных артериол, уменьшению интрагломерулярного давления, фильтрационной фракции и СКФ, что нежелательно.
В отличие от ингибиторов АПФ, антагонисты рецепторов ангиотензина II меньше влияют на тонус выносящих артериол, увеличивают эффективный почечный кровоток и существенно не меняют СКФ. Происходит уменьшение гломерулярного давления и фильтрационной фракции, чем и объясняют ренопротективный эффект. Низкосолевая диета потенцирует почечные и нейрогуморальные эффекты антагонистов АT1-рецепторов: сильнее снижается содержание альдостерона, возрастает активность ренина плазмы, происходит стимуляция натрийуреза, не страдает скорость клубочковой фильтрации. Эти эффекты обусловлены блокадой АT1-рецепторов, регулирующих реабсорбцию натрия в дистальных канальцах почек. При солевой нагрузке эти эффекты ослабевают.
У больных с артериальной гипертензией и ХПН антагонисты рецепторов ангиотензина II поддерживают эффективный почечный кровоток, не угнетая и без того сниженную скорость клубочковой фильтрации.
Ренопротективным действием антагонистов АT1-рецепторов объясняют также уменьшение микроальбуминурии у больных с артериальной гипертензией и диабетической нефропатией.
Почечные эффекты антагонистов АT1-рецепторов можно обнаружить раньше, чем гипотензивный эффект. Это важно для больных с тяжёлой хронической почечной или сердечной недостаточностью: ингибиторы АПФ даже в малых дозах усиливают азотемию и вызывают резкую гипотонию.
Главные отличия фармакодинамических эффектов антагонистов рецепторов ангиотензина II от ингибиторов АПФ:
-
устранение биологических эффектов ангиотензина II в тканях, опосредованное блокированием АT1-рецепторов (заблокированы неблагоприятные эффекты ангиотензина II);
-
усиление влияния ангиотензина II на АT2-рецепторы, что дополняет вазодилатирующий и антипролиферативный эффект;
-
мягкое влияние на почечную гемодинамику (отсутствие изменений активности внутрипочечной кининовой системы);
-
отсутствие антиишемического действия вследствие отсутствия влияния на активность кининовой системы;
-
отсутствие нежелательных эффектов, связанных с активацией брадикининовой системы.
ФАРМАКОКИНЕТИКА АНТАГОНИСТОВ РЕЦЕПТОРОВ АНГИОТЕНЗИНА II
Фармакокинетика антагонистов рецепторов ангиотензина II связана с их липофильностью (табл. 21-38). Липофильность антагонистов АT1 -рецепторов определяет также степень тканевого распределения и влияния на тканевую РААС. Лозартан — самый гидрофильный препарат, телмисартан — наиболее липофильный.
Таблица 21-38. Сравнение липофильности антагонистов рецепторов ангиотензина II
| Препарат | Коэффициент липофильности (октанол/вода) |
|---|---|
|
Лозартан (Е3174) |
-2,45 |
|
Валсартан |
-0,95 |
|
Кандесартан (CV11974) |
-0,96 |
|
Эпросартан |
0,047 |
|
Ирбесартан |
1,48 |
|
Телмисартан |
3,20 |
Примечание. Отрицательные значения указывают на гидрофильность.
Антагонисты рецепторов ангиотензина II различны по следующим фармакокинетическим характеристикам: биодоступность, период полувыведения (T1/2), метаболизм. Клиническое значение этих различий не изучено до конца.
Первые антагонисты АT1-рецепторов обладали низкой и вариабельной биодоступностью; этот показатель у новых препаратов улучшен и стабилен (табл. 21-39). После приёма внутрь максимальная плазменная концентрация (Tmax) достижима через 1-2 ч; при длительном регулярном применении стационарную концентрацию (С~steady state~) можно зарегистрировать через 5-7 дней.
Таблица 21-39. Сравнительная фармакокинетика антагонистов рецепторов АТII
|
Препараты |
Биодоступность, % |
Связь с белками плазмы, % |
Tmax, ч |
T1/2, ч |
Метаболизм, % |
Экскреция, % |
|
|
печёночная |
почечная |
||||||
|
Лосартан (Е3174) |
30-40 |
99,8 |
1-2 |
1-3 (5-10) |
14 с участием цитохрома Р450(Е3174) |
65 |
35 |
|
Валсартан |
10-35 |
95 |
2-4 |
6-7 |
20 |
80 |
20 |
|
Ирбесартан |
60-80 |
90-92 |
1,5-2 |
11-18 |
9 с участием цитохрома Р450 |
80 |
20 |
|
Эпросартан |
13 |
98 |
1-2 |
5-9 |
10 |
90 |
10 |
|
Кандесартан |
15 |
>99 |
4 |
5-13 |
минимально |
67 |
33 |
|
Телмисартан |
30-60 |
>99 |
0,5-1 |
21-38 |
15 |
98 |
2 |
Антагонисты АT1-рецепторов обладают высоким связыванием с белками плазмы (более 90%), преимущественно с альбуминами, частично с α1-кислым гликопротеином, γ-глобулином и липопротеинами. Однако высокая связь с белком не ограничивает плазменный клиренс и объём распределения препаратов, в связи с чем потенциальный риск взаимодействия с другими лекарственными средствами на уровне связи с белком невелик.
Объём распределения (Vd) антагонистов рецепторов ангиотензина II различен в зависимости от их липофильности: наибольший объём распределения у телмисартана, с этим связана хорошая мембранная проницаемость и высокое тканевое распределение препарата.
У всех антагонистов АT1-рецепторов значительна величина показателя T1/2— 9-24 ч. Однако данные цифры лишь приблизительно отражают продолжительность действия: фармакодинамический T1/2 превышает фармакокинетический T1/2 . На продолжительность действия влияет также характер и сила взаимодействия с рецепторами. Благодаря этим особенностям принимать антагонисты рецепторов ангиотензина II можно один раз в сутки.
Антагонисты АT1-рецепторов отличны от ингибиторов АПФ путями элиминации, что имеет большое клиническое значение. Путь элиминации антагонистов рецепторов ангиотензина II преимущественно внепочечный (более 70% элиминирует через печень и менее 30% — почками). Антагонисты рецепторов ангиотензина II частично метаболизирует печень, их элиминация происходит преимущественно в активном виде. Метаболизм осуществляет глюкуронил трансфераза или микросомальная система печени (цитохромом Р450). Tак, цитохром Р450 участвует в метаболизме лозартана, ирбесартана и кандесартана, этим можно объяснить взаимодействие данных ЛС с другими препаратами.
У больных с тяжёлой печёночной недостаточностью возможно увеличение биодоступности, Cmax и AUC лозартана, валсартана и телмисартана, снижение клиренса препаратов. С этим связан запрет на применение данных препаратов у пациентов с билиарной обструкцией или тяжёлой печёночной недостаточностью, однако возможно осторожное назначение пациентам с лёгкой или среднетяжёлой печёночной недостаточностью. Пациенты с лёгкой или среднетяжёлой почечной недостаточностью в коррекции режима дозирования антагонистов рецепторов ангиотензина II не нуждаются; однако при тяжёлой ХПН не исключено увеличение C max и AUC.
У пожилых больных возможно увеличение биодоступности препаратов, приводящее к удвоению максимальной плазменной концентрации, а также замедление всасывания, приводящее к увеличению Tmax и T1/2. Вместе с тем, учитывая большую широту терапевтического индекса препарата, нет необходимости в снижении доз у пожилых лиц.
ПОКАЗАНИЯ
Применение антагонистов показано при артериальной гипертонии, сердечной недостаточности, диабетической нефропатии. В настоящее время применение данных препаратов при артериальной гипертензии ограничено случаями непереносимости ингибиторов АПФ.
Изучение свойств антагонистов рецепторов ангиотензина II активно идёт в крупных клинических исследованиях с целью обнаружения и уточнения преимуществ перед другими классами препаратов в лечении ряда сердечно-сосудистых заболеваний. Опубликованы результаты первого метаанализа эффективности антагонистов рецепторов ангиотензина II по основным конечным точкам в клинических исследованиях у пациентов с артериальной гипертензией (табл. 21-40). Эти данные свидетельствуют о наличии определённых преимуществ по всем главным исходам перед другими классами гипотензивных препаратов.
Таблица 21-40. Результаты метаанализа отдалённой эффективности антагонистов рецепторов ангиотензина II у пациентов с артериальной гипертензией (относительный риск)
| Исход | Антагонисты кальция против β-адреноблокаторов/диуретиков | Ингибиторы АПФ против β-адреноблокаторов/диуретиков | Ингибиторы АПФ против антагонистов кальция | Антагонисты рецепторов ангиотензина II против других гипотензивных препаратов |
|---|---|---|---|---|
|
Инсульт |
0,93 |
1,09 |
1,12 |
0,79 |
|
Острый инфаркт миокарда |
1,01 |
0,98 |
0,96 |
0,96 |
|
Хроническая сердечная недостаточность |
1,34 |
1,07 |
0,82 |
0,83 |
|
Все сердечно-сосудистые исходы |
1,04 |
1,02 |
0,97 |
0,90 |
ПРОТИВОПОКАЗАНИЯ
Гиперчувствительность к препаратам, гипотония, гиперкалиемия, дегидратация, стеноз почечных артерий, беременность (I триместр — категория С, II-III триместры — категория D), кормление грудным молоком, детский возраст.
КОНТРОЛЬ ЛЕЧЕНИЯ
При лечении антагонистами рецепторов ангиотензина II необходимо контролировать уровень АД, особенно у пожилых пациентов либо при нарушении функции почек; проводят контроль функции почек (уровень калия, креатинин).
ПОБОЧНЫЕ ЭФФЕКТЫ
Антагонисты рецепторов ангиотензина II обладают благоприятным профилем побочных эффектов, близким по уровню к плацебо. Наибольшее клиническое значение имеет частота возникновения кашля, связанного с влиянием брадикинина на мукоцилиарный клиренс. Антагонисты рецепторов ангиотензина II, в отличие от ингибиторов АПФ, не влияют на метаболизм кининов, однако могут вызывать кашель с частотой, не отличающейся от плацебо (1,5-4%). Частота других побочных эффектов, связанных с активностью кининовой системы (ангионевротический отёк, сыпь), не превышает 1%.
Гипотония, возникающая при приёме первой дозы ингибиторов АПФ и обусловленная резким гемодинамическим эффектом, менее выражена у блокаторов рецепторов ангиотензина II (частота гипотонии менее 1%). Синдром отмены не отмечен.
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ
Антагонисты рецепторов ангиотензина II могут вступать в фармакодинамические взаимодействия с изменением выраженности гипотензивного эффекта, усилением гиперкалиемии при сочетании с калийсберегающими диуретиками и калийсодержащими препаратами. Фармакокинетические взаимодействия возможны также с варфарином, дигоксином (табл. 21-41).
Таблица 21-41. Лекарственные взаимодействия антагонистов рецепторов ангиотензина II
| Взаимодействующий препарат | Антагонисты рецепторов ангиотензина II | Результат взаимодействия |
|---|---|---|
|
Фармакодинамические взаимодействия |
||
|
Алкоголь |
Лозартан, валсартан, эпросартан |
Усиление гипотензивного эффекта |
|
Гипотензивные препараты, диуретики |
Все |
|
|
Нестероидные противовоспалительные средства, эстрогены, симпатомиметики |
Все |
Ослабление гипотензивного эффекта |
|
К+ -сберегающие диуретики, |
Все |
Гиперкалиемия |
|
Фармакокинетические взаимодействия |
||
|
Варфарин |
Валсартан, телмисартан |
Уменьшение Cmax , увеличение протромбинового времени |
|
Дигоксин |
Телмисартан |
Увеличение Cmax |
СПИСОК ЛИТЕРАТУРЫ
Клиническая фармакология по Гудману и Гилману: в 4 т. / Под общ. ред. А.Г. Гилмана. — М.: Практика. — 2006.
Метелица В.И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств.- 3-е изд. — М.: МИА, 2005.
Csaica C., Buclin Т., Brunner H.R., Biollaz J. Pharmacokinetic-pharmacodynamic profile of angiotensin II receptor antagonists // Clin. Pharmacokinet. — 1997. — Vol. 32. — P. 1-29.
Elmfeldt D., Olofsson B., Meredith P. The relationship between dose and antihypertensive effect of four AT1 -receptor blockers. Differevces in potency and efficacy // Blood Press. — 2002. — Vol. 11. — P. 293-301.
Israili Z.H. Clinical pharmacokinetics of angiotensin II (AT1 ) receptor blockers in hypertension // J. Hum. Hypertens. — 2000. — Vol. 14 (suppl. 1). — P. 73-86.
Timmermans P.B., Smith R.D. Angiotensin II receptor subtypes: selective antagonists and functional correlates // Eur. Heart J. — 1994. — Vol. 15 (suppl. D). — P. 79-87.
Органические нитраты
Открытие нитроглицерина принадлежит итальянскому химику А. Собреро. Шведский предприниматель А. Нобель открыл производство взрывчатого вещества, основой которого был нитроглицерин. Его применение для купирования приступов стенокардии, а также для их профилактики перед физической нагрузкой началось в 1879 г. после опубликования в журнале Lancet работы Уильяма Маррела. Доказано, что механизм действия нитратов связан с оксидом азота, который считают одним из факторов расслабления сосудов. Открытие оксида азота в качестве сигнальной молекулы сердечно-сосудистой и других систем стало основанием для присуждения Фёрчготту, Игнарро и Мьюрэду в 1998 г. Нобелевской премии. Органические нитраты и другие соединения, действие которых основано на использовании оксида азота, называют нитровазодилататорами.
КЛАССИФИКАЦИЯ
Классификация нитровазодилататоров основана на особенностях химической структуры препаратов. В группе нитратов выделяют три препарата: нитроглицерин (глицерола тринитрат), изосорбида динитрат и изосорбида-5-мононитрат.
Нитроглицерин — низкомолекулярное соединение в виде умеренно летучей маслянистой жидкости. Динитрат и мононитрат — высокомолекулярные твёрдые соединения.
Нитроглицерин и изосорбида динитрат выпускают в виде таблеток (для приёма сублингвально и внутрь), аэрозолей, трансдермальных форм (мази, пластыри, диски), буккальных форм (пластинки, таблетки-букклеты), а также специальные формы для внутривенного введения. Изосорбида-5-мононитрат производят только в виде таблеток и капсул для приёма внутрь (табл. 21-42).
МЕХАНИЗМ ДЕЙСТВИЯ И ОСНОВНЫЕ ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ
Нарушение коронарного кровотока и сопротивления коронарных артерий зависит от органических изменений в стенке сосудов, приводящих к стенозированию или окклюзии отдельных ветвей, а также нейрогуморальных воздействий и механизмов ауторегуляции. В работающем миокарде образуются локальные вазодилатирующие метаболиты, которые стимулируют расширение сосудов и запускают противодействующую системную нейрогуморальную регуляцию, контролирующую АД и ЧСС. Например, сосудистый тонус регулируется эндотелиальными факторами, в том числе endothelium derived relaxing factor — эндогенным нитратом, который подобен оксиду азота и способствует повышению внутриклеточной концентрации циклического гуанозинмонофосфата, в результате происходит расслабление гладкомышечных клеток сосудов. Нормальный эндотелий сосудов занимает важное место в предупреждении и развитии коронарного атеросклероза благодаря ингибирующему воздействию на механизмы воспаления, агрегацию тромбоцитов и пролиферацию гладкомышечных клеток. При атеросклерозе коронарная метаболическая вазодилатация может измениться, так как нарушается образование оксида азота и вазодилатирующих простагландинов. Органические нитраты (кроме изосорбида мононитрата) считают пролекарствами, которые вызывают вазодилатацию только после денитрозирования с образованием оксида азота. Оксид азота стимулирует гуанилатциклазу, что приводит к увеличению содержания циклического гуанозинмонофосфата и к активации протеинкиназы G. В гладкомышечных клетках протеинкиназа G приводит к дефосфорилированию лёгких цепей миозина, в результате уменьшается образование актомиозиновых мостиков и содержание кальция в цитозоле, происходит релаксация гладкомышечных клеток сосудов (рис. 21-2). Другой промежуточный метаболит нитратов — S-нитрозотиол — тоже способен активировать гуанилатциклазу и вызывать вазодилатацию.
Рис. 21-2. Механизм действия органических нитратов (цитируется по Нил М. Дж., 2001, с изменениями).
Более тонкие биохимические механизмы действия органических нитратов считают дискуссионными.
-
Вместе с глутатион-S-редуктазой, связанной с клеточной мембраной, в биотрансформации нитратов могут принимать участие и другие ферменты (5-нуклеотидаза и паранитрофенилфосфатаза).
-
Превращение нитратов в оксид азота не всегда идёт по ферментативному пути (с участием глутатион-S-редуктазы и других ферментов), а может происходить благодаря химической связи нитратов с тиолами.
-
Недостаточно изучены медиаторы ферментативного превращения органических нитратов, а также их локализация.
-
От нитроглицерина отщепляется группа NO2-, образующая с внутриклеточным водородом азотистую кислоту, которая в кислой среде расщепляется с образованием оксида азота. NO2 — слабый генератор образования оксида азота.
Нитраты обладают гемодинамической эффективностью из-за расслабления почти всех гладких мышц, в большей степени венул и вен. Предполагают, что гладкомышечные клетки вен содержат больше фермента, метаболизирующего органические нитраты в оксид азота. После приёма низких доз нитратов в первую очередь расширяются венулы, что сопровождается уменьшением венозного возврата, конечно-диастолического давления и объёма правого и левого желудочков, в результате чего уменьшается потребность миокарда в кислороде. ОПСС не меняется. АД может несколько уменьшиться, ЧСС не меняется или немного повышается. Уменьшаются лёгочное сосудистое сопротивление и сердечный выброс. С увеличением дозы нитратов ёмкость венозного русла возрастает и уменьшается ОПСС. В результате уменьшается систолическое и диастолическое АД и сердечный выброс. Рефлекторно повышается симпатический тонус, развивается тахикардия и суживаются артериолы. В связи с расширением коронарных артерий временно возрастает кровоток, по мере уменьшения сердечного выброса он способен уменьшаться.
При вегетативных расстройствах, сопровождающихся периферической вегетативной недостаточностью, артериальная гипотония после приёма органических нитратов не компенсируется рефлекторным повышением симпатического тонуса. У этих больных нитраты могут снижать артериальное и перфузионное давление в коронарных артериях, что приводит к усугублению стенокардии и угрожающей жизни гипотонии.
Для коронарных артерий ишемия — сильнейший сосудорасширяющий стимул. При тяжёлом стенозе максимального расширения артерий хватает только для обеспечения кровотока в покое, но не в условиях повышенной потребности миокарда в кислороде. Считают, что при ишемии нитраты перераспределяют внутрисердечный кровоток, благодаря чему улучшается перфузия субэндокардиальных отделов сердца.
Органические нитраты не обладают прямым инотропным или хронотропным действием. Известно, что они оказывают положительный лузитропный эффект (повышают скорость диастолического расслабления миокарда), в результате чего происходит ускорение раннего диастолического наполнения желудочков.
Нитраты увеличивают содержание циклического гуанозинмонофосфата тромбоцитов и блокируют их агрегацию, что имеет большое значение в их антиангинальном действии.
Главное в механизме действия нитратов — уменьшение потребности миокарда в кислороде, а также увеличение его доставки во время диастолы, что способствует перераспределению части коронарного кровотока от здоровых участков сердца к очагам ишемии. При вазоспастической стенокардии очень важно их прямое расширяющее действие на коронарные артерии.
Кроме того, нитраты расслабляют гладкую мускулатуру и других органов. Например, расширяют бронхи независимо от их исходного тонуса. Под действием нитратов уменьшается тонус гладких мышц желчевыводящих путей, матки и мочеточников.
Таблица 21-42. Некоторые фармакодинамические показатели органических нитратов
|
Пути введения |
Форма выпуска |
Рекомендуемая разовая доза |
Действие |
|
|
Начало действия |
Длительность действия |
|||
|
Нитроглицерин |
||||
|
Сублингвально |
Таблетка |
0,3-0,6 мг, при необходимости повторить через 5 мин, не более трёх доз в течение 15 мин |
1-3 мин |
10-30 мин |
|
Спрей |
Аэрозоль |
0,4-0,8 мг, при необходимости повторить через 5 мин, не более трёх доз в течение 15 мин |
30 с |
10-25 мин |
|
Буккально |
Полимерная пластинка |
1-3 мг |
2-3 мин |
3-5 ч |
|
Внутрь |
Таблетка |
2,5-5,0 мг |
20-45 мин |
2-6 ч |
|
Трансдермально |
Мазь |
7,5-30 мг |
15-60 мин |
4-6 ч |
|
Трансдермально |
Пластырь |
25-50 мг |
30-60 мин |
24 ч |
|
Внутривенно капельно |
Раствор |
5-100 мкг/мин, увеличивая каждые 3-5 мин до 300-400 мкг/мин |
Немедленно |
30 мин |
|
Изосорбида динитрат |
||||
|
Сублингвально |
Таблетка |
5-10 мг |
5-15 мин |
1,5-2 ч |
|
Спрей |
Аэрозоль |
1,25-3,75 мг |
2-5 мин |
0,5-1 ч |
|
Внутрь |
Таблетка |
5-20 мг |
15-20 мин |
6-8 ч |
|
Трансдермально |
Мазь |
50-100 мг |
30-45 мин |
12 ч |
|
Трансдермально |
Пластырь |
30-60 мг |
30-60 мин |
24 ч |
|
Внутривенно капельно |
Раствор |
2-10 мг/ч |
3-5 мин |
— |
|
Изосорбида мононитрат |
||||
|
Внутрь |
Таблетка обычная |
10-40 мг |
30-45 мин |
12 ч |
|
Внутрь |
Таблетка-ретард |
60-120 мг |
60-90 мин |
До 24 ч |
ФАРМАКОКИНЕТИКА
Благодаря небольшой молекулярной массе и липофильности нитроглицерин быстро и достаточно полно всасывается через слизистую оболочку полости рта, органы пищеварительной системы, а также через кожу. Максимальная сывороточная концентрация нитроглицерина при приёме под язык достигается через 4 мин, связь с белками крови 60%. Период полувыведения (T1/2) нитроглицерина составляет 1-3 мин. При сублингвальном, буккальном, аэрозольном применении или внутривенном введении нитроглицерин сразу попадает в системный кровоток, достигая системных и коронарных сосудов. После приёма внутрь нитроглицерин значительно метаболизируется в печени при первом прохождении, а затем биотрансформируется с образованием оксида азота в гладкомышечных клетках. Промежуточные метаболиты нитроглицерина — ди- и мононитраты, а конечный метаболит — глицерин. Период полувыведения метаболитов нитроглицерина составляет 4-6 ч. Значительная часть ди- и мононитрата глицерина образует конъюгаты с глюкуроновой кислотой. Выведение метаболитов нитроглицерина происходит в основном через почки (до 50% в неизменённом виде без связи с глюкуроновой кислотой), часть метаболитов — через лёгкие. Изосорбида динитрат после абсорбции из органов пищеварительной системы подвергается интенсивному метаболизму при первом прохождении через печень. Биодоступность при сублингвальном приёме равна 31-59%, при приёме внутрь — 20-25%, при трансдермальном введении — 10-30%. Связь с белками плазмы около 30%. Основные метаболиты изосорбида динитрата — изосорбида-2-мононитрат и изосорбида-5мононитрат. T1/2 для изосорбида динитрата составляет в среднем 1,1-1,3 ч, для изосорбида-2 мононитрата — 1,8 ч, для изосорбида-5 мононитрата — 4,2 ч.
Изосорбида-5 мононитрат — активный метаболит изосорбида динитрата. Абсорбция изосорбида мононитрата не зависит от приёма пищи. При приёме внутрь обладает высокой биодоступностью — около 100% в связи с отсутствием первичного прохождения через печень. Это обеспечивает практическое отсутствие колебаний концентрации препарата в плазме. Изосорбида-5 мононитрат имеет более длительный период полувыведения — 4-6 ч. Фармакокинетические параметры нитратов зависят от способа введения препарата и его лекарственной формы (табл. 21-43, табл. 21-44).
Таблица 21-43. Некоторые фармакокинетические показатели органических нитратов
|
Показатель |
Способ применения нитроглицерина |
|||
|
сублингвально |
аэрозоль |
внутрь |
внутривенно |
|
|
Максимальная концентрация (Cmax) основных метаболитов |
0,2-0,3 нг/мл через 120-150 с |
14,6 нг/мл через 5, 3 мин |
0,2-0,3 нг/мл через 20-60 мин |
— |
|
Кажущийся объём распределения (V) |
3 л/кг |
— |
— |
— |
|
Общий клиренс |
0,3-1,0 л/(мин х кг) |
— |
— |
30-78 мл/мин |
|
Период полувыведения (Т1/2) |
1-3 мин |
20 мин |
4 ч |
1-3 мин |
|
Терапевтическая концентрация |
0,5-1,0 нг/мл |
— |
— |
— |
|
Биодоступность |
— |
76% |
10-15% |
— |
|
Показатель |
Способ применения изосорбида динитрата |
|||
|
сублингвально |
аэрозоль |
внутрь |
трансдермально |
|
|
Биодоступность |
31-59% |
— |
20-25% |
10-30% |
|
С |
17,2 нг/мл |
16,2 нг/мл |
7,4 нг/мл через 2 ч |
— |
|
Период полувыведения (Т1/2) |
60 мин |
1,1 мин |
1 ч (4 ч для метаболитов) |
— |
|
Общий клиренс |
— |
— |
13,84 л/мин |
— |
Таблица 21-44. Некоторые фармакокинетические показатели органических нитратов
| Показатель | Изосорбид мононитрат (внутрь) |
|---|---|
|
Биодоступность |
100% |
|
Сmax |
через 30-60 мин (через 5 ч для препаратов с замедленным высвобождением) |
|
Объём распределения |
600 л |
|
Минимальная терапевтическая концентрация |
100 нг/мл |
|
Связь с белками плазмы |
менее 4% |
|
Период полувыведения (Т1/2) |
4-6 ч |
|
Почечный клиренс |
1,8 л/мин |
При использовании органических нитратов целесообразно проведение терапевтического лекарственного мониторинга, что позволит регулировать эффективность выбранных форм, доз и режимов дозирования. Анализ корреляционной связи между площадью под кривой «концентрация-время» и клинической эффективностью поможет выявить клинически значимую толерантность к антиангинальному и антиишемическому эффектам органических нитратов.
ФАРМАКОГЕНЕТИКА
Данных по фармакогенетике органических нитратов нет.
ПОКАЗАНИЯ И ДОКАЗАТЕЛЬНАЯ БАЗА. ПЕРСПЕКТИВНЫЕ ПОКАЗАНИЯ
Органические нитраты применяют для купирования и профилактики приступов стабильной и нестабильной стенокардии. Нитраты используют при остром инфаркте миокарда, в том числе осложнённом острой левожелудочковой недостаточностью, отёке лёгких без падения АД (в сочетании с фуросемидом), лёгочной гипертензии, лёгочном сердце (в составе комбинированной терапии). Доказана эффективность их применения для профилактики и лечения спазма коронарных артерий при использовании сердечного катетера, например во время селективной коронарографии и для лечения облитерирующего эндартериита.
В связи с тем, что в кардиологической практике нитраты практически не используют в виде монотерапии, самостоятельное прогностическое влияние этой группы препаратов на выживаемость окончательно не установлено.
При лечении ИБС обратили внимание на генотерапию. Большой интерес вызывают факторы ангиогенеза, стволовые клетки и предшественники эндотелиальных клеток, с помощью которых предполагают стимулировать появление новых сосудов в очагах ишемии. Научные исследования в этой области развиваются, и, возможно, в будущем генотерапию начнут использовать для лечения ИБС.
ПРИНЦИПЫ ВЫБОРА ОТДЕЛЬНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДАННОЙ ГРУППЫ В РАЗЛИЧНЫХ КЛИНИЧЕСКИХ СИТУАЦИЯХ
Одним из быстрых и эффективных методов купирования приступа стенокардии и острых проявлений левожелудочковой недостаточности считают приём нитроглицерина сублингвально или в форме аэрозоля. При этом действие препарата продолжается 10-30 мин. Если повторные приёмы нитроглицерина не оказывают необходимого действия (при инфаркте миокарда, острой левожелудочковой недостаточности), назначают внутривенную инфузию. Лекарственные формы нитроглицерина для приёма внутрь не дают клинически значимого антиангинального эффекта. Буккальные формы применяют для купирования и профилактики приступов стенокардии, трансдермальные формы используют только с профилактической целью. Изосорбида динитрат назначают по тем же показаниям, что и нитроглицерин, для купирования и профилактики приступов стенокардии. При использовании аэрозоля изосорбида динитрата или приёме его под язык эффект наступает позже, чем у аналогичных лекарственных форм нитроглицерина, но его считают более длительным (см. табл. 21-43). Изосорбида мононитрат из-за фармакокинетических особенностей используют только для профилактики приступов стенокардии.
ПРОТИВОПОКАЗАНИЯ
Противопоказания для назначения нитратов: плохая индивидуальная переносимость органических нитратов, повышенная чувствительность и аллергические реакции на нитраты, шок (в том числе кардиогенный, кроме случаев с высоким давлением наполнения левого желудочка, или обеспеченным внутриаортальной контрпульсацией, препаратами с положительным инотропным действием).
Противопоказаниями считают резко выраженную артериальную гипотонию, коллапс, геморрагический инсульт, травмы головы, острые расстройства церебрального кровообращения, острый инфаркт миокарда с низким давлением наполнения левого желудочка, тампонаду сердца, гипертрофическую кардиомиопатию, выраженный аортальный стеноз, констриктивный перикардит, закрытоугольную глаукому с высоким внутриглазным давлением, тяжёлую анемию и гипертиреоз. Пролонгированные лекарственные формы для приёма внутрь не назначают при повышенной перистальтике органов пищеварительной системы и синдроме мальабсорбции, так как может нарушаться их всасывание.
НЕЖЕЛАТЕЛЬНЫЕ ЛЕКАРСТВЕННЫЕ РЕАКЦИИ И МЕТОДЫ КОНТРОЛЯ БЕЗОПАСНОСТИ
Основная часть нежелательных эффектов нитратов связана с их влиянием на сердечно-сосудистую систему. В начале лечения может возникать головная боль, которая проходит в течение нескольких дней и уменьшается при снижении дозы, преходящее головокружение, слабость и другие симптомы ортостатической гипотонии (до обморока). Гипотония при внутривенном введении зависит от скорости введения препарата, возможно ухудшение коронарного кровотока, появление симптомов церебральной недостаточности. Во время назначения нитратов возникает рефлекторная тахикардия, которая в сочетании с гипотонией может ухудшать коронарное кровообращение и увеличивать потребность миокарда в кислороде, покраснение лица, ощущение прилива крови к лицу и шее. При частом и длительном приёме пролонгированных нитратов или инфузии может развиваться метгемоглобинемия. При трансдермальном применении нитратов возможно развитие контактного дерматита, местное жжение под языком при использовании таблеток, онемение слизистой полости рта при использовании аэрозолей. Возможно появление сухости во рту, тошноты, рвоты, диареи, нечёткости зрения, обострения симптомов глаукомы.
При передозировке нитратов отмечают головокружение, обморок, ощущение давления в голове, чувство усталости, слабость, одышку, цианоз губ, ногтей, ладоней, повышение температуры, судороги.
После внезапной отмены ранее эффективной терапии нитратами может наступить обострение ИБС в виде учащения приступов стенокардии, возникновения инфаркта миокарда и внезапной смерти (синдром отмены). Отмену нитратов при длительном лечении необходимо проводить постепенно.
Одной из главных проблем при лечении считают развитие толерантности, которая, несмотря на высокую концентрацию препарата в крови, выражается в уменьшении продолжительности и выраженности антиангинального и антиишемического эффекта, что приводит к необходимости увеличения дозы нитрата для достижения прежнего эффекта. В настоящее время существует несколько гипотез механизмов развития толерантности к нитратам. Метаболическая гипотеза включает теорию истощения сульфгидрильных групп, угнетения превращения нитратов в оксид азота, изменения, связанные с гуанилатциклазой, повышение активности фосфодиэстеразы циклическим гуанозинмонофосфатом. Нейрогуморальная гипотеза предусматривает активацию рефлекторных вазоконстрикторных реакций организма. Медиаторами этих реакций считают такие нейрогуморальные факторы, как ренин, ангиотензин, катехоламины, эндотелин и др. Этот физиологический антагонизм приводит к уменьшению эффекта нитратов, и его расценивают как «псевдотолерантность». Истинная сосудистая толерантность развивается при изменении плотности рецепторов на мембране гладкомышечных клеток сосудов и их сродства к нитратам, т.е. в связывании рецептора с нитратами. Вызываемое уменьшение почечного кровотока или его перераспределение может привести к активации нейрогуморальных факторов, включая увеличение высвобождения ренина, а также задержку натрия и жидкости для поддержания перфузии почек. Быстрое перемещение жидкости из внесосудистого во внутрисосудистое пространство приводит к увеличению объёма, что может способствовать развитию истинной сосудистой толерантности к нитратам. Существует гипотеза о значении окислительного стресса в развитии толерантности к нитратам в результате повышенной продукции супероксида. До настоящего времени ни одна из имеющихся гипотез не объясняет полностью причины развития толерантности к нитратам.
Различают несколько подходов к профилактике толерантности к нитратам:
-
прагматические, связанные с дозированием нитратов;
-
фармакодинамические, влияющие на механизмы развития толерантности с использованием корректоров.
Восстановление эффекта при развитии толерантности к нитратам может наступить при увеличении разовой дозы того же препарата, либо при полной отмене нитратов или при прерывистом приёме нитратов в течение суток. Корректоры применяют вместе с нитратами при появлении признаков развития толерантности. К ним относят донаторы SH-групп, ингибиторы АПФ, антагонисты рецепторов ангиотензина II, гидралазин, диуретики и антиоксиданты.
Для предупреждения НЛР и контроля безопасности использования нитратов рекомендуют проведение терапевтического мониторинга, определение гемодинамических показателей и метгемоглобина в крови.
ВЗАИМОДЕЙСТВИЯ
Сочетание органических нитратов с другими препаратами, влияющими на биотрансформацию, может привести к фармакокинетическому взаимодействию с угнетением или активацией метаболизма нитратов. Одновременное назначение барбитуратов и нитроглицерина активирует биотрансформацию последнего.
Фармакодинамическое взаимодействие возникает при одновременном приёме нитратов и антигипертензивных или других сосудорасширяющих ЛС, опиоидных анальгетиков. При одновременном введении гепарина, альтеплазы и нитратов снижается антикоагулянтный эффект. Внутривенное введение нитроглицерина может противодействовать антикоагулянтному действию низкомолекулярных гепаринов. Симпатомиметики уменьшают антиангинальный эффект нитратов. Усиление гипотензивного эффекта развивается при одновременном приёме нитратов с трициклическими антидепрессантами и алкоголем. Назначение силденафила, варденафила и тадалафила на фоне применения органических нитратов сопровождается выраженной стойкой артериальной гипотонией. Приём органических нитратов возможен не ранее чем через 24-48 ч после использование средств, регулирующих потенцию, механизм действия которых связан с воздействием на активность циклической гуанозинмонофосфат-специфической фосфодиэстеразы типа 5.
ПРИМЕНЕНИЕ В ОСОБЫХ СИТУАЦИЯХ
Органические нитраты противопоказаны в первые 3 мес беременности и во время кормления грудью. Во II и III триместрах беременности назначение нитратов возможно по строгим показаниям и при постоянном гемодинамическом контроле. Безопасность и эффективность использования органических нитратов в педиатрической практике не изучена. Пожилой возраст, а также тяжёлая печёночная и почечная недостаточность усугубляют риск развития побочных эффектов нитратов.
ЛИТЕРАТУРА
Клиническая фармакология по Гудману и Гилману / Под общ. ред. А.Г. Гилмана, ред. Дж. Хардман, Л. Либерман: В 4 т. — М.: Практика. — T. 2. — 2006. — 336 с.
Метелица В.И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. — 3-е изд., перераб. и доп. — М.: ООО «Медицинское информационное агентство», 2005. — 1528 с.
Нил М. Дж. Наглядная фармакология / Пер. с англ. / Под ред. М.А. Демидовой. — 2-е изд., перераб. — М.: Гэотар-Медиа, 2001. — 104 с.
Руководство по рациональному использованию лекарственных средств / Под ред. А.Г. Чучалина, Ю.Б. Белоусова, Р.У. Хабриева, Л.Е. Зиганшиной. — М.: ГЭОTАР-Медиа, 2007. — 768 с.
Antman E.M., Anbe S.C., AlpertJ.S. et al. ACC/AHA Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction — Executive Summary: A Report of the American College of Cardiology // American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction). Circulation 2004. — Vol. 110. — Р. 588-636.
Bertram G. Katzung. Basic and Clinical Pharmacology. — 10-th ed. — 2006. — Р. 1179.
Braunwald E., Antman E.M., Beasley J.W. et al. ACC/AHA 2002 Guideline Update for the Management of Patients With Unstable Angina and Non-ST-Segment Elevation Myocardial Infarction — Summary Article: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Unstable Angina) // J. Am. Coll. Cardiol. — 2002. — Vol. 40. — Р. 1366-1374.
Chen Z., ZhangJ., Stamler J.S. Identification of the enzymatic mechanism of nitroglycerin bioactivation // Proc. Natl. Acad. Sci. USA. — 2002. — Vol. 99. — Р. 8306.
Gibbons R.J., Abrams J., Chatterjee K. et al. ACC/AHA 2002 Guideline Update for the Management of Patients With Chronic Stable Angina — Summary Article: A Report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Chronic Stable Angina) // J. Am. Coll. Cardiol. — 2003. — Vol. 41. — Р. 159-168.
Hunt S.A., Abraham W.T., Chin M.H. et al. ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult-Summary Article A Report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure) // J. Am. Coll. Cardiol. — 2005. — Vol. 46. — Р. 1116.
Li Y., Zhang D., Jin W. et al. Mitochondrial aldehyde dehydrogenase-2 (ALDH2) Glu504 Lys polymorphism contributes to the variation in efficacy of sublingual nitroglycerin // J. Clin. Invest. — 2006. — Vol. 116. — Р. 506.
Миокардиальные цитопротекторы
Различные заболевания и состояния, вызывающие повреждение и/или гибель миокардиоцитов (прежде всего ИБС, артериальная гипертензия и ХСН, а также различные непосредственные токсические и механические воздействия на миокард), предполагают назначение ЛС, оказывающих прямое или опосредованное защитное действие на миокардиоциты — миокардиальную цитопротекцию, или кардиопротекцию.
Кардиопротективные свойства представителей основных классов сердечнососудистых препаратов (β-адреноблокаторов, ингибиторов АПФ, агониста рецепторов ангиотензина, статины и др.) хорошо обоснованы, подтверждены многочисленными клиническими испытаниями и признаются подавляющим большинством исследователей. Эти свойства обусловлены как прямыми или опосредованными гемодинамическими эффектами, так и принципиально другими механизмами. Например, β-адреноблокаторы подавляют прямое кардиотоксическое действие катехоламинов, снижая их выброс из нейронов вследствие блокады пресинаптических β-адренорецепторов. Способность тех же β-адреноблокаторов уменьшать периоперационный риск сердечно-сосудистых осложнений при некардиальных операциях — также одно из кардиопротективных свойств этой группы ЛС.
В настоящее время необходимым и чрезвычайно важным условием для включения ЛС в национальные рекомендации по лечению ряда сердечно-сосудистых заболеваний стало наличие кардиопротективных свойств, проявляющихся замедлением или обратным развитием гипертрофии и ремоделирования левого желудочка сердца во время лечения этим ЛС.
Кардиопротекция — не класс-специфическое свойство всех ЛС, применяемых для лечения сердечно-сосудистых заболеваний. Пример этому — вышеупомянутое кардиопротективное действие β-адреноблокаторов. До сих пор, прилагая значительные усилия и проводя рандомизованные контролируемые исследования, не удалось доказать способности некоторых β-адреноблокаторов уменьшать смертность или риск развития инфаркта миокарда ни у больных с артериальной гипертензией или ХСН, ни после перенесённого инфаркта миокарда. По данным литературы, лишь кардиоселективные блокаторы медленных кальциевых каналов (в отличие от вазоселективных) обладают кардиопротективными свойствами, независимо от их антигипертензивного эффекта.
Tем не менее существуют ЛС, для которых кардиопротективный эффект считается основным. Именно они в обзорах называются «миокардиальными цитопротекторами».
Существует фармакологическая группа по АTK C01EB «Прочие препараты для лечения заболеваний сердца», некоторые из них часто называют «метаболическими препаратами» или «препаратами метаболического действия». Несмотря на большое количество литературы, эта область лечения как сердечно-сосудистых, так и ряда других заболеваний достаточно скромно представлена современной доказательной базой. Хотя данное направление терапии, очевидно, весьма привлекательно по ряду позиций, в отношении большинства этих ЛС существует лишь экспериментальная доказательная база, количество же рандомизованных контролируемых исследований незначительно либо полностью отсутствует, что не позволяет этим ЛС быть рекомендованными для широкого применения с позиций доказательной медицины.
В качестве иллюстрации приведем результат поиска кардиопротектора в справочной базе «Гарант-Инфарм»; дата поиска — октябрь 2007 г. (рис. 21-3).
Рис. 21-3. Результат поиска кардиопротектора в справочной базе «Гарант-Инфарм».
Tем не менее в реальной клинической практике эти ЛС, особенно в нашей стране, используются очень широко, что требует особого внимания как представителей науки, так и государственных органов, регулирующих закупки ЛС.
Классификация
Существует ряд фармакологических классификаций миокардиоцитопротекторов, с точки зрения доказательной медицины выделяют три группы:
-
препараты с доказанным цитопротективным эффектом: триметазидин;
-
препараты с недостаточно высоким уровнем доказательств цитопротективного эффекта, собравшие клиническую доказательную базу (в т.ч. активно применяемые в РФ): мельдоний, таурин, отдельные препараты ω-3-полиненасыщенных жирных кислот;
-
препараты, не имеющие весомых клинических доказательств цитопротективного эффекта, — участники метаболизма (витамины и витаминоподобные вещества, янтарная кислота, инозие-Ф*, другие антиоксиданты и антигипоксанты).
ТРИМЕТАЗИДИН
Фармакологическим стандартом миокардиальной цитопротекции метаболического действия с доказательной базой (уровень А, В) принято считать триметазидин. Анализ крупных рандомизованных контролируемых исследований подтверждает безопасность применения триметазидина у больных ИБС, в том числе страдающих сахарным диабетом и у пожилых (исследования TRIMPOL-I, TRIMEP, TIGER). У больных стенокардией триметазидин как при монотерапии (TEMS, VASCO), так и в составе базисной терапии ИБС (TRIMPOL-II, TACT, TРИУМФ) уменьшает частоту приступов стенокардии, увеличивает толерантность к физической нагрузке, приводит к существенному снижению потребности в нитроглицерине, улучшает сократительную функцию левого желудочка у пациентов с диастолической дисфункцией левого желудочка. Применение препарата для лечения стабильной стенокардии было одобрено и рекомендовано Европейским обществом кардиологов в 1999 г.
Tриметазидин выпускают в таблетках, покрытых оболочкой, по 20 мг (у оригинального препарата — с модифицированным высвобождением).
Механизм действия и основные фармакологические эффекты
Tриметазидин оказывает антиагрегантное, антиангинальное, антигипоксантное, вазодилатирующее, коронародилатирующее и церебровазодилатирующее действие, непосредственно влияет на кардиомиоциты и нейроны головного мозга, оптимизируя их метаболизм и функцию. Цитопротективный эффект обусловлен повышением энергетического потенциала, активацией окислительного декарбоксилирования и рационализацией потребления кислорода (усиление аэробного гликолиза и блокада окисления жирных кислот).
Препарат поддерживает сократимость миокарда, предотвращает внутриклеточное истощение аденозинтрифосфата и фосфокреатинина. В условиях ацидоза нормализует работу ионных каналов мембран, препятствует накоплению Ca2+ и Na+ в кардиомиоцитах, нормализует внутриклеточную концентрацию K+ .
Tриметазидин уменьшает внутриклеточный ацидоз и концентрацию фосфатов, обусловленные ишемией миокарда и реперфузией. Препятствует повреждающему действию свободных радикалов, сохраняет целостность клеточных мембран, предотвращает активацию нейтрофилов в зоне ишемии, увеличивает продолжительность электрического потенциала, уменьшает выход креатининфосфокиназы из клеток и выраженность ишемических повреждений миокарда.
Фармакокинетика
Tриметазидин быстро и практически полностью абсорбируется в пищеварительном тракте. Биодоступность — 90%. TCmax — 2 ч. Cmax (после однократного приёма внутрь 20 мг триметазидина) — около 55 нг/мл. Объём распределения — 4,8 л/кг.
Легко проходит через гистогематические барьеры. Связь с белками плазмы — 16%. T1/2 — 4,5-5 ч. Выводится почками (около 60% — в неизменённом виде).
Показания
Длительное лечение ИБС, профилактика приступов стенокардии (монотерапия или в составе комбинированной терапии), ишемическая кардиомиопатия (при комплексной терапии), хориоретинальные сосудистые нарушения, головокружение сосудистого происхождения, головокружение при болезни Меньера, шум в ушах.
Противопоказания
Гиперчувствительность, беременность, период лактации.
Режим дозирования
Внутрь, по 20 мг 2-3 раза в день (40-60 мг в сутки) во время еды. Продолжительность лечения устанавливается индивидуально, обычно не менее 2 мес.
Нежелательные лекарственные реакции и методы контроля безопасности
Аллергические реакции (кожный зуд), редко — слабая диспепсия (тошнота, рвота, гастралгия).
Применение в особых ситуациях (беременность, лактация, в детском и пожилом возрасте, при сопутствующих заболеваниях в т.ч. печени и почек)
Из-за отсутствия данных не рекомендуется пациентам с почечной недостаточностью (с клиренсом креатинина менее 15 мл/мин), а также пациентам с тяжёлыми нарушениями функции печени.
Tриметазидин не влияет на способность к вождению автомобиля и выполнению работ, требующих высокой скорости психомоторных реакций.
МЕЛЬДОНИЙ
Механизм действия и основные фармакологические эффекты
Фармакологическое действие включает: анаболическое, антигипоксантное, метаболическое, стимулирующее репарацию тканей. Препарат представляет собой аналог гамма-бутиробетаина (синтетический карнитин). Он подавляет гамма-бутиробетаингидроксиназу, снижает синтез карнитина и транспорт длинноцепочечных жирных кислот через оболочки клеток, препятствует накоплению в клетках активированных форм неокисленных жирных кислот — производных ацилкарнитина и ацилкоэнзима-А. В условиях ишемии восстанавливает равновесие процессов доставки кислорода и его потребления в клетках, предупреждает нарушение транспорта аденозинтрифосфата; одновременно с этим активирует гликолиз, протекающий без дополнительного потребления кислорода.
Механизм действия определяет многообразие его фармакологических эффектов: повышение работоспособности, уменьшение симптомов психического и физического перенапряжения, кардиопротективное действие. В случае острого ишемического повреждения миокарда препарат замедляет образование некротической зоны, укорачивает период реабилитации. При ХСН — повышает сократимость миокарда, увеличивает толерантность к физической нагрузке, снижает частоту приступов стенокардии.
Фармакокинетика
После приёма внутрь быстро всасывается, биодоступность — 78%. Cmax в плазме достигается через 1-2 ч после приёма.
Метаболизируется в организме с образованием двух основных метаболитов, которые выводятся почками. T1/2 при приёме внутрь зависит от дозы, составляет 3-6 ч.
Показания
ИБС (стенокардия, инфаркт миокарда), ХСН.
Противопоказания
Гиперчувствительность, повышение внутричерепного давления (нарушения венозного оттока, внутричерепные опухоли.
Режим дозирования
Стабильная стенокардия (возможно включение в состав комбинированной терапии) — внутрь, по 250 мг 3 раза в сут в течение первых 3-4 дней, далее 2 раза в нед, по 250 мг 3 раза в сут в течение 1-1,5 мес.
Нестабильная стенокардия и инфаркт миокарда — внутривенно струйно, по 0,5-1 г 1 раз в сут, далее — внутрь, по 250 мг 2 раза в сут первые 3-4 дня, после чего — 2 раза в нед по 250 мг 3 раза в сут.
Нежелательные лекарственные реакции и методы контроля безопасности
Редко — аллергические реакции (покраснение, высыпания, зуд, отёк), а также диспепсия, тахикардия, изменение АД, возбуждение.
Взаимодействия
Усиливает действие коронародилатирующих средств, некоторых антигипертензивных препаратов, сердечных гликозидов.
Можно сочетать с антиангинальными средствами, антикоагулянтами, антиагрегантами, антиаритмическими средствами, диуретиками, бронхолитиками.
Ввиду возможного развития умеренной тахикардии и артериальной гипотензии следует соблюдать осторожность при комбинации с нитроглицерином, нифедипином, α-адреноблокаторами, гипотензивными средствами и периферическими вазодилататорами.
Применение в особых ситуациях (беременность, лактация, в детском и пожилом возрасте, при сопутствующих заболеваниях, в том числе печени и почек)
Безопасность применения препарата во время беременности не доказана. Не выяснено, выделяется ли препарат с молоком матери. На время лечения следует прекратить грудное вскармливание.
Пациентам с хроническими заболеваниями печени и почек при длительном применении следует соблюдать осторожность.
Данных о безопасности и эффективности применения сиропа мельдония у детей младше 12 лет и в капсулах у детей и подростков до 18 лет недостаточно.
Следует иметь в виду, что 1 мерная ложка (5 мл) сиропа содержит 2,75 г сорбита и 0,25 г глицерина.
ТАУРИН
Несколько десятилетий назад в ряде фундаментальных работ было показано, что таурин благоприятно влияет на структуру и функции эндотелия. Важнейшим среди его фармакологических эффектов считался кардиотропный, в частности, положительный инотропный эффект, что объяснялось подтверждённым в экспериментах усилением вхождения ионов кальция внутрь кардиомиоцитов. Современный интерес к синтетическим производным таурина обусловлен перспективами использования их влияния на ЦНС.
Механизм действия и основные фармакологические эффекты
Tаурин — естественный продукт обмена серосодержащих аминокислот (цистеина, цистеамина, метионина) и компонент невегетарианской диеты, входит в состав молока млекопитающих. Препарат оказывает метаболическое, кардиотропное, гипогликемическое действие, обладает осморегуляторным и мембранопротективным свойствами, благоприятно влияет на фосфолипидный состав клеточных мембран, нормализует обмен ионов кальция и калия в клетках. Имеет свойства тормозного нейромедиатора, обладает антистрессорным действием, регулирует высвобождение ГАМК, адреналина, пролактина (и других гормонов) и ответные реакции на них. Улучшает метаболические процессы в сердце, печени и в других органах и тканях.
При сердечно-сосудистой недостаточности уменьшает застой в малом и большом круге кровообращения, снижает внутрисердечное диастолическое давление, улучшает сократимость миокарда (повышает максимальную скорость сокращения и расслабления, индексы сократимости и релаксации). Умеренно снижает АД у пациентов с артериальной гипертензией, но практически не изменяет его при сердечно-сосудистой недостаточности.
Устраняет побочные эффекты при передозировке сердечных гликозидов и блокаторов медленных кальциевых каналов, повышает работоспособность при тяжёлых физических нагрузках.
Фармакокинетика
После однократного приёма в дозе 0,5 г активное вещество (таурин) определяется в крови через 15-20 мин, Cmax достигается через 1,5-2 ч. Полностью выводится из организма в течение суток.
Показания
Сердечно-сосудистая недостаточность, интоксикация сердечными гликозидами, сахарный диабет 1-го и 2-го типа.
Противопоказания
Гиперчувствительность.
Нежелательные лекарственные реакции и методы контроля безопасности
Аллергические реакции на компоненты препарата.
Взаимодействия
Совместим с другими препаратами, усиливает инотропный эффект сердечных гликозидов. Во время лечения следует уменьшить дозу сердечных гликозидов и блокаторов медленных кальциевых каналов (иногда до 50%).
Режим дозирования
Принимают внутрь, за 20 мин до еды.
При сердечной недостаточности — 0,25-0,5 г 2 раза в сутки (доза может быть увеличена до 2-3 г в сутки или уменьшена до 0,125 г на приём), курс — 30 дней, количество курсов определяется индивидуально, обычно 2-3 в год.
При гликозидной интоксикации назначают по 0,5-1 г в сутки при отмене основного препарата, длительность назначения в этом случае индивидуальна.
Применение в особых ситуациях (беременность, лактация, в детском и пожилом возрасте, при сопутствующих заболеваниях, в том числе печени и почек)
Клинические исследования безопасности и эффективности препарата у детей не проводились.
ПРЕПАРАТЫ ω-3 ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
Механизм действия и основные фармакологические эффекты
Задерживают синтез триглицеридов в печени, поскольку эйкозапентоеновая и докозагексаеновая кислоты угнетают этерификацию других жирных кислот. Снижению уровня триглицеридов способствует также уменьшение количества свободных жирных кислот, участвующих в синтезе триглицеридов. Ингибирование их синтеза понижает уровень липопротеидов очень низкой плотности. Повышение липопротеидов высокой плотности незначительно и непостоянно, при этом меньше, чем после приёма фибратов.
Фармакокинетика
ω-3 полиненасыщенные жирные кислоты имеют три главных пути метаболизма:
-
сначала доставляются в печень, где включаются в состав различных категорий липопротеидов и направляются к периферийным запасам липидов;
-
фосфолипиды клеточных мембран заменяются фосфолипидами липопротеидов, после чего ω-3 полиненасыщенные жирные кислоты выступают в качестве предшественников различных эйкозаноидов;
-
большая часть ω-3 полиненасыщенных жирных кислот окисляется с целью обеспечения энергетических потребностей.
Показания и доказательная база
Доказательную базу (уровень 2А) из зарегистрированных в РФ ЛС этой группы имеет только омакор*. По данным исследования GISSI-P, его назначение позволило снизить риск фатального инфаркта и инсульта на 15%, смертности от нефатального инфаркта и инсульта на 20%, от сердечно-сосудистых заболеваний — на 30%. При этом риск внезапной смерти уменьшился на 45%.
Препараты применяются с целью вторичной профилактики инфаркта миокарда (в сочетании с другими стандартными методами лечения — статинами, антитромбоцитарными средствами, β-адреноблокаторами, ингибиторами АПФ).
Противопоказания
Повышенная чувствительность к компонентам препарата, экзогенная гипертриглицеридемия (гиперхиломикронемия, тип 1), беременность и период грудного вскармливания. С осторожностью — возраст до 18 лет (эффективность и безопасность не установлены), возраст старше 70 лет, выраженные нарушения функции печени, одновременное применение с фибратами или пероральными антикоагулянтами, тяжёлые травмы, хирургические операции (риск увеличения времени кровотечения).
Нежелательные лекарственные реакции и методы контроля безопасности
Со стороны пищеварительного тракта: возможно возникновение рефлюкса или отрыжки с запахом или привкусом рыбы, тошнота, рвота, вздутие живота, диарея или запор.
Со стороны кожных покровов: редко — экзема, акне.
Лабораторные показатели: у пациентов с гипертриглицеридемией возможно умеренное повышение активности печёночных трансаминаз.
Взаимодействия
При одновременном применении с пероральными антикоагулянтами — риск увеличения времени кровотечения.
Не рекомендуется одновременное применение с фибратами.
Режим дозирования
Принимают внутрь вместе с пищей.
Для вторичной профилактики инфаркта миокарда рекомендуется принимать по 1 капсуле в сутки. Продолжительность лечения — по рекомендации врача.
Применение в особых ситуациях (беременность, лактация, в детском и пожилом возрасте, при сопутствующих заболеваниях, в том числе печени и почек)
В связи с умеренным увеличением времени кровотечения (при приёме высокой дозы — 4 капсулы) требуется наблюдение за пациентами, проходящими антикоагулянтную терапию, а при необходимости — соответствующая коррекция дозы антикоагулянта. Проведение этой терапии не исключает необходимости обычного при лечении таких пациентов контроля. Следует принимать в расчёт увеличение времени кровотечения у пациентов с повышенным риском кровотечений (в результате тяжёлой травмы, хирургической операции и т.д.).
Возможно умеренное повышение активности печёночных трансаминаз. У пациентов с нарушением функции печени (особенно при приёме высокой дозы — 4 капсулы) необходим регулярный контроль функции печени.
СПИСОК ЛИТЕРАТУРЫ
Бойцов С.Л., Овчинников О.В., Захарова А.И. Применение милдроната при лечении хронической недостаточности кровообращения I стадии // Прогресс и проблемы в лечении заболеваний сердца и сосудов: Материалы конф. — СПб.: 1997. — С. 43.
Заволовская Л.И., Елизарова Е.П., Орлов В.А. Клиническая эффективность тауфона в комбинированном лечении больных с хронической недостаточностью кровообращения // Экспериментальная и клиническая фармакология. — 1995. — С. 29-32.
Палеев Н.Р., Джанашия П.Х., Шуганов Е.Г. и др. Применение триметазидина в комплексной терапии сердечной недостаточности // Российский кардиологический журнал. — 2001. — T. 28. — № 2. — С. 29-31.
Сыркин А.Л., Добровольский А.В. Антиишемические препараты метаболического действия // Consilium Medicum. — 2002. — T. 11. — № 4.
Cross H.R. Trimetazidine for stable angina pectoris // Expert Opin Pharmacopher. — 2001. — Vol. 2 (5). — Р. 857-875.
Detry J., Sellier P., Pennaforte S. et al. Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol with stable angina // Br. J. Clin. Pharmac. — 1994. — Vol. 37. — Р. 279-288.
GISSI-Prevenzione Investigators // Lancet. — 1999. — Vol. 354. — P. 447-455.
Harpey C., Clauser P., Labrid C. et al. Trimetazidine: a cellular anti-ischemic agent // Cardiovasc. Drug. Rev. — 1989. — Vol. 6 (4). — P. 292-312.
Pornin M., Harpey C., Allal J. et al. Lack of effects of trimetazidine on systemic heamodynamics in patients with coronary artery disease: a placebocontrolled study // Clinical trials and metaanalysis. — 1994. — Vol. 29. — P. 49-56.
Сердечные гликозиды
Основные препараты сердечных гликозидов: дигоксин, дигитоксин, десланозид8 (применяют в США, изоланид8*), ланатозид Ц (целанид*) строфантин К. Кроме них, известны другие препараты: уабаин (строфантин Г*), метилдигоксин, коргликон* и ацетилдигитоксин8 .
Все сердечные гликозиды — комбинация агликона (генина) с одной-четырьмя молекулами сахара (гликона). Фармакологическими свойствами обладают в основном агликоны. Агликоны высвобождаются из сердечных гликозидов при гидролизе. Агликон — циклопентанопергидрофенантреновое ядро, к которому присоединено ненасыщенное лактоновое кольцо, а также метильные, гидроксильные и альдегидные группы. От количества и положения свободных гидроксильных групп зависит полярность сердечных гликозидов (водорастворимость или липофильность), связывание с белками в плазме крови, проницаемость через клеточные мембраны, их метаболизм и продолжительность действия. Чем больше свободных гидроксильных групп в молекуле агликона, тем более выражена полярность препарата.
КЛАССИФИКАЦИЯ
-
Полярные (гидрофильные) — строфантин К, коргликон, уабаин. Они плохо всасываются из пищеварительного тракта, выделяют их почки, связывание с белками низкое. При ХПН необходимо снижение дозы. Tолько для внутривенного введения.
-
Неполярные (липофильные) — дигитоксин, ацетилдигитоксин. Хорошо всасываются в кишечнике, быстро связываются с белками (альбуминами). Поступают в печень, экскретируются с жёлчью и подвергаются реабсорбции из пищеварительного тракта. В плазме, в основном в связанном с альбумином состоянии. Эти препараты используют для приёма внутрь.
-
Относительно полярные (частично гидрофильные и частично липофильные) — дигоксин, ланатозид Ц, метилдигоксин. Из пищеварительного тракта всасываются на 40-80%. Частично экскретируются с мочой в неизменённом виде и частично метаболизируются в печени. Эти сердечные гликозиды применяют как внутривенно, так и внутрь.
МЕХАНИЗМ ДЕЙСТВИЯ И ОСНОВНЫЕ ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ
Основной эффект сердечных гликозидов — положительный инотропный, который состоит в торможении зависимого от АTФазы натрий-калиевого насоса в миокарде, что приводит к увеличению внутриклеточного содержания натрия, возрастанию обмена между натрием и кальцием. Повышение концентрации внутриклеточного кальция в кардиомиоците приводит к повышению сократимости и, соответственно, к увеличению фракции выброса. Гемодинамические эффекты сердечных гликозидов на систолическую функцию миокарда левого желудочка при сердечной недостаточности проявляются увеличением сердечного индекса, ударного индекса, фракции выброса, особенно у лиц с выраженными нарушениями функции левого желудочка. Антиаритмический эффект сердечных гликозидов обусловлен уменьшением скорости проведения через атриовентрикулярный узел и удлинением эффективного рефрактерного периода вследствие активности блуждающего нерва либо путём прямого действия на атриовентрикулярный узел, либо из-за симпатолитического эффекта. В терапевтических дозах сердечные гликозиды прямо не влияют на проведение и рефрактерность в системе Гиса-Пуркинье. Однако благодаря рефлекторному увеличению тонуса блуждающего нерва и прямому действию на предсердие они укорачивают эффективный рефрактерный период в предсердиях и снижают в них скорость проведения. В терапевтических дозах вне зависимости от степени дигитализации отмечают удлинение интервала PR и укорочение интервала Q-T, а также типичную депрессию сегмента ST. У больных с синдромом Вольфа-Паркинсона-Уайта сердечные гликозиды повышают скорость проведения по дополнительному пути, что может привести к желудочковой тахикардии и даже к фибрилляции предсердий. У больных с мерцательной аритмией антиаритмический эффект сердечных гликозидов ограничен. В большинстве случаев сердечные гликозиды контролируют ЧСС в покое, а при физической нагрузке для контроля ЧСС к сердечным гликозидам добавляют β-адреноблокатор или антагонисты медленных кальциевых каналов (верапамил либо дилтиазем).
Основные эффекты сердечных гликозидов.
-
Положительный инотропный эффект.
-
Отрицательный хронотропный эффект.
-
Нейромодуляторный эффект.
В настоящее время в клинической практике в большинстве случаев используют дигоксин, обладающий оптимальными фармакодинамическими свойствами и доказанной клинической эффективностью. Применение других сердечных гликозидов для длительного лечения больных ХСН (ланатозид Ц) не имеет преимуществ. Он хуже всасывается из пищеварительного тракта, в связи с чем затруднён подбор дозы и, кроме того, отсутствует соответствующая доказательная база по его эффективности. Дигитоксин имеет преимущество перед дигоксином только при почечной недостаточности. Применение короткодействующих сердечных гликозидов для внутривенного введения (строфантин К) также ограничено: только в случае декомпенсации сердечной недостаточности на фоне тахисистолии при постоянной форме фибрилляции предсердий.
ФАРМАКОДИНАМИКА
Дигоксин. Начало действия через 5-30 мин, после внутривенного введения, после приёма внутрь — 0,5-2 ч; максимальный эффект развивается через 1-4 ч после внутривенного введения и через 6-8 ч после приёма внутрь. Продолжительность действия при внутривенном введении около 5 ч, при приёме внутрь 6-8 ч. У пациентов с ХСН II-III стадии (фракция выброса 35% и ниже) резкая отмена дигоксина после 12 нед регулярного приёма может приводить к синдрому отмены.
Дигитоксин — сердечный гликозид наиболее продолжительного действия. Начало действия через 1-4 ч, пик действия наступает через 8-14 ч после приёма внутрь. Продолжительность действия 14 дней.
Строфантин К. После внутривенного введения начало эффекта через 2-10 мин; максимум эффекта через 15-30 мин. Строфантин К в меньшей степени, чем другие гликозиды, влияет на ЧСС и атриовентрикулярную проводимость. Не обладает кумулятивным эффектом. Возможно, что при введении в вечернее время строфантин К действует сильнее, чем в другое время суток. При выраженной гипоксии вероятность развития токсического эффекта выше при введении строфантина К. При быстром внутривенном введении у больных ИБС возможно развитие тяжёлой ишемии миокарда.
ФАРМАКОКИНЕТИКА
Дигоксин. Биодоступность при приёме внутрь составляет 60-85%, после внутримышечной инъекции — 70-85%, после приёма капсул — 90-100%. Невсосавшаяся часть препарата инактивируется бактериальной флорой в дистальном отделе толстой кишки. Дигоксин не связывается с белками в сыворотке крови. Tерапевтическая концентрация дигоксина — 1-2 нг/мл. Период полувыведения составляет 32-48 часов. Дигоксин связывается с рецепторами в сердце и в скелетных мышцах. Выделение происходит преимущественно почками в неизменённом виде. Внепочечным путём экскретируется около 25% препарата. При ХПН происходит снижение объёма распределения препарата. При низкой массе тела уменьшено общее связывание дигоксина в скелетных мышцах. Благодаря своей липофильности может проникать через ГЭБ.
Дигитоксин. Биодоступность при приёме внутрь составляет 100%. В плазме крови более чем на 90% связан с белками. 10% не связанного с белками дигитоксина метаболизирует печень с образованием небольшого количества активного метаболита в виде дигоксина, большую же часть составляют инертные метаболиты, которые, возможно, экскретируются с мочой. Большая часть дигитоксина остаётся в неизменённом виде и экскретируется с жёлчью в кишечник и реабсорбируется, поступая заново в печень. Tакие циклы кишечно-печёночной рециркуляции происходят до тех пор, пока весь свободный дигитоксин полностью не подвергнется метаболизму в печени, что обусловливает длительность действия препарата (14 дней). Период полувыведения — 6-7 дней.
Ланатозид Ц. Абсорбция из пищеварительного тракта хуже, чем у дигоксина, и составляет около 40%.
Строфантин К. Используют только для парентерального введения, так как он быстро разрушается. Период полувыведения составляет 24 часа. Экскретируется с мочой за сутки на 37-42% от введённой дозы.
ПОКАЗАНИЯ И ДОКАЗАТЕЛЬНАЯ БАЗА
-
Сердечная недостаточность и фибрилляция или трепетание предсердий.
-
Сердечная недостаточность при синусовом ритме.
-
Постоянная форма фибрилляции предсердий (контроль ЧСС).
Сердечные гликозиды — группа препаратов, снижающих заболеваемость и не изменяющих смертность больных с декомпенсацией. При фибрилляции предсердий — это средства первой линии, а при синусовом ритме их применяют наравне с другими базисными препаратами, используемыми для лечения сердечной недостаточности [исследования PROVED (1997 г.), RADIANCE (1997 г.), DIG (1996 г.)].
ПРОТИВОПОКАЗАНИЯ
-
Гипертрофическая обструктивная кардиомиопатия (гипертрофический субаортальный стеноз) при отсутствии фибрилляции предсердий и тяжёлой миокардиальной недостаточности — положительные инотропные средства усиливают обструкцию выносящего тракта.
-
Гиперчувствительность к сердечным гликозидам и предрасположенность к дигиталисной интоксикации — пожилой возраст с тяжёлой сердечной недостаточностью и фибрилляцией предсердий; нарушение функции почек; не следует назначать высокие дозы, особенно при низкой концентрации калия и магния в сыворотке крови.
-
Синдром Вольфа-Паркинсона-Уайта.
-
Выраженная атриовентрикулярная блокада (перемежающаяся полная блокада II степени, указание в анамнезе на приступы Морганьи-Адамса-Стокса).
-
Желудочковая тахикардия, фибрилляция желудочков.
-
Рестриктивная кардиомиопатия; амилоидоз почек.
-
Изолированная недостаточность правого желудочка (лёгочное сердце, стеноз клапана лёгочной артерии).
Относительные противопоказания
-
Ожидаемая низкая эффективность — при резком снижении сердечного выброса в случаях клапанного стеноза, хронического перикардита, лёгочного сердца; при высоком сердечном выбросе; при фибрилляции предсердий, обусловленной тиреотоксикозом.
-
Условия, способствующие повышению чувствительности к сердечным гликозидам, в том числе гипокалиемия, хронические заболевания лёгких, микседема, острая гипоксия.
-
Ранний период инфаркта миокарда и постинфарктный период при отсутствии фибрилляции предсердий и без значительного снижения фракции выброса (35% и выше).
-
Почечная недостаточность — необходимо снижение дозы, мониторинг концентрации препарата в плазме крови.
-
Синусовая брадикардия или слабость синусового узла.
-
Комбинация с другими препаратами, вызывающими синусовую брадикардию, замедление атриовентрикулярной проводимости.
-
Сердечная недостаточность с сопутствующим острым гломерулонефритом.
-
Tяжёлый миокардит.
-
Кардиоверсия.
ПОБОЧНЫЕ ЭФФЕКТЫ И МЕТОДЫ ИХ КОРРЕКЦИИ
-
Проаритмогенное действие (наджелудочковые аритмии — предсердная тахикардия с блокадой и без блокады, узловая тахикардия; желудочковые аритмии — моноили политопные желудочковые экстрасистолы, по типу бигеминии или тригеминии, фибрилляция желудочков; синусовая брадикардия без нарушения атриовентрикулярной проводимости); атриовентрикулярная блокада; изменения ЭКГ (удлинения интервала P-Q, депрессия сегмента ST); обмороки; сердцебиение.
-
Желудочно-кишечные — анорексия, тошнота, рвота, поносы (как ранние симптомы передозировки), абдоминальные боли (редко), геморрагический некроз кишечника или пищевода (редко).
-
Неврологические — нарушение зрения (двоение в глазах, жёлтые или зелёные кольца вокруг источника света), головная боль, общая слабость, головокружение, апатия; психозы.
-
Прочие — гинекомастия (редко), кожные реакции (макулопапулярная сыпь и др.), тромбоцитопения.
Сердечные гликозиды имеют низкий терапевтический индекс, что обусловливает необходимость тщательного индивидуального дозирования препаратов. Большинство негативных свойств сердечных гликозидов, а именно проаритмическое и опасность увеличения риска внезапной смерти, тесно связаны с его высокими концентрациями и выраженным инотропным действием. В то же время положительные эффекты сердечных гликозидов в большей степени зависят от нейрогуморальных эффектов, которые наблюдают уже при невысоких дозах препарата. Определение концентрации дигоксина в плазме крови — стандартный метод мониторирования эффективности и безопасности терапии. Рекомендуемая терапевтическая концентрация дигоксина в сыворотке крови колеблется в пределах 1-2 нг/мл (1 таблетка — 0,25 мг/сут). В связи с этим на сегодняшний день насыщение организма больного сердечными гликозидами (дигитализация) не применяют. В исследовании DIG была подтверждена прямая взаимосвязь между дозой и концентрацией дигоксина в крови и риском смерти больных. Смертность была ниже средней при концентрации дигоксина менее 1 нг/мл, при концентрации 1-1,5 нг/мл смертность была выше средней, а дальнейший рост концентрации приводил к неуклонному повышению смертности. Достигая 63,8% при превышении концентрации выше 2 нг/мл (что в прошлом соответствовало оптимальной дигитализации). Однако следует помнить, что у пациентов с ХСН и синусовым ритмом, особенно при ИБС, возможно развитие гликозидной интоксикации и снижение выживаемости даже при использовании невысоких доз, что диктует необходимость их применения (до 0,25 мг/сут). Для своевременной диагностики дигиталисной интоксикации необходимо следить за появлением таких признаков, как анорексия, тошнота, рвота, усталость, нарушение зрения, возникновение аритмий. Tакже возможен мониторинг концентрации сердечных гликозидов и калия в сыворотке крови.
Факторы, способствующие развитию нежелательных явлений
-
Почечная недостаточность — снижение объёма распределения и уменьшение экскреции; хронические заболевания лёгких — гипоксия и нарушение кислотно-щелочного равновесия; миксидема — удлинение периода полувыведения; острая гипоксия — риск аритмий; снижение массы тела — уменьшение связывания дигиталиса в скелетных мышцах.
-
Электролитные нарушения — при гипокалиемии и гипомагниемии повышен риск токсических эффектов; при гиперкальциемии повышена чувствительность к дигиталису.
-
Сопутствующая лекарственная терапия: диуретики — гипокалиемия, препараты, оказывающие влияние на синусовый и атриовентрикулярный узел (верапамил, дилтиазем, β-адреноблокаторы, клонидин, метилдопа, амиодарон).
-
Пожилой возраст — с возрастом возможны изменения фармакокинетики дигоксина (удлинение периода полувыведения за счёт замедления абсорбции и снижения скорости клубочковой фильтрации).
-
При лёгочном сердце и развитии правожелудочковой недостаточности сердечные гликозиды не только неэффективны, но и опасны из-за возможности развития дигиталисной интоксикации, за исключением правожелудочковой недостаточности, возникшей вследствие недостаточности левого желудочка.
-
При передозировке рекомендуют следующее: гипокалиемия — препараты калия при сохранной функции почек; брадиаритмии — атропин или временный искусственный водитель ритма; желудочковые аритмии — лидокаин или фенитоин; высокая концентрация дигоксина в крови (для ускорения клиренса) — активированный уголь, колестирамин8 или колестипол8.
ВЗАИМОДЕЙСТВИЯ
-
Повышение риска дигиталисной интоксикации на фоне применения петлевых, тиазидных диуретиков и глюкокортикоидов вследствие развития гипокалиемии.
-
Препараты кальция при быстром внутривенном введении при приёме сердечных гликозидов могут привести к развитию серьёзных аритмий вплоть до остановки сердца.
-
Хинидин уменьшает клиренс дигоксина с жёлчью.
-
Верапамил, нифедипин повышают концентрацию дигоксина в крови.
-
Амиодарон и пропафенон повышают концентрацию дигоксина с риском развития дигиталисной интоксикации.
-
Антацидные средства, пектин*, сульфасалазин, неомицин, колестирамин8, колестипол8, некоторые противоопухолевые препараты уменьшают абсорбцию дигоксина, что приводит к снижению концентрации в крови.
-
T/иреоидные гормоны — снижение эффективности дигиталиса.
-
Симпатомиметики — развитие аритмий.
-
β-Адреноблокаторы, верапамил — аддитивное влияние на проводимость атриовентрикулярного узла с развитием полной блокады.
-
Нифедипин, празозин — аддитивный положительный эффект при лечении сердечной недостаточности.
-
Спиронолактон и другие калийсберегающие диуретики, ингибиторы АПФ — препятствуют развитию гипокалиемии, тем самым уменьшают риск аритмий.
ОСОБЕННОСТИ ПРИМЕНЕНИЯ Дигоксин
-
При неотложных состояниях и для достижения немедленного эффекта — в зависимости от возраста, массы тела и выраженности почечной недостаточности внутривенно вводят нагрузочную дозу 0,4-0,6 мг, а затем по 0,1-0,3 мг каждые 4-8 ч до достижения хорошего клинического эффекта; поддерживающая доза — 0,125-0,5 мг/сут, в зависимости от состояния почек. Внутривенно препарат вводят в неразведённом виде или в разведении 1:4 в дистиллированной воде или 0,9% растворе хлорида натрия, либо 5% глюкозе*.
-
Мощное положительное инотропное действие сердечных гликозидов проявляется при применении больших доз (для дигоксина больше 0,375 мг/сут). Однако применение таких доз чревато развитием дигиталисной интоксикации и отрицательно влияет на выживаемость больных ХСН.
-
Дигоксин следует принимать в малых дозах до 0,25 мг/сут — для больных с массой тела более 85 кг до 0,375 мг/сут, а при массе тела менее 55 кг — до 0,125 мг/сут, тогда он действует как нейрогормональный модулятор, оказывает слабое положительное инотропное действие и не стимулирует нарушение ритма.
-
При фибрилляции предсердий дигоксин можно использовать в качестве средства первой линии благодаря его способности замедлять атриовентрикулярную проводимость, а не снижать ЧСС.
-
При синусовом ритме дигоксин — лишь пятый препарат после ингибиторов АПФ, β-адреноблокаторов, антагонистов альдостерона и мочегонных. Осторожно применять у пациентов с ИБС.
-
У пожилых больных суточные дозы дигоксина должны быть снижены до 0,0625-0,125 мг/сут.
-
При ХПН дозу дигоксина уменьшают пропорционально снижению клиренса креатинина или возможно применение дигитоксина, который экскретирует печень.
-
При нарушении функции почек вместо дигоксина можно использовать дигитоксин.
Дигитоксин
Препарат выбора при ХПН, но противопоказан при печёночной недостаточности. Назначают по 0,2 мг 2 раза в день в течение 4 дней, далее — поддерживающая доза от 0,5 до 0,3 мг один раз в день.
Ланатозид Ц
-
При неотложных состояниях — внутривенно вводят начальную дозу 0,20,4 мг в виде 0,02% раствора 1-2 раза в сут в течение 1-3 дней (максимальная суточная доза — 0,8 мг — 4 ампулы); поддерживающая доза с 3-5-го дня — приём таблеток внутрь, 0,25 мг в сут.
-
Внутрь 0,25 мг в таблетках или 10-25 капель в виде 0,05% раствора 3-4 раза в сут. Поддерживающая доза 0,125 мг 1-2 раза в день.
Строфантин К
Особенности применения: внутривенно вводят в течение 5-6 минут — предварительно разбавив 0,5-1 мг (1-2 мл 0,05% раствора) 10-20 мл 5 или 20% раствором глюкозы* либо изотоническим раствором хлорида натрия. Внутривенно капельно вводят ту же дозу после предварительного разбавления в 100 мл изотонического раствора хлорида натрия или 5% глюкозы*. Внутривенное введение рекомендуют проводить в вечернее время или 2 раза в день (утром и вечером). Возможно внутримышечное введение, однако из-за выраженной локальной болезненности предварительно следует ввести 5 мл 2% раствора прокаина, а дозу строфантина К также разводят в 1 мл 2% раствора прокаина. Если больной до этого уже получал сердечные гликозиды, то введение строфантина К возможно только через 12-24 ч после приёма последней дозы дигоксина или 7-14 дней после приёма дигитоксина. У пожилых пациентов и с нарушением функции почек дозу строфантина К следует уменьшить.
Антиаритмические лекарственные средства
Основной механизм действия антиаритмических препаратов определяется их способностью связываться с ионными каналами или рецепторами клеток миокарда, модулировать трансмембранный ионный транспорт и электрофизиологические процессы в миокарде. Антиаритмические препараты способны влиять на электрофизиологические механизмы развития аритмий или на условия, необходимые для возникновения нарушений ритма.
Наиболее популярная классификация Вогана Уильямса (1969) подразделяет антиаритмические препараты на четыре класса.
-
I класс — мембраностабилизирующие препараты (блокаторы натриевых каналов).
-
II класс — β-адреноблокаторы.
-
III класс — препараты, замедляющие реполяризацию (блокаторы калиевых каналов).
-
IV класс — блокаторы медленных кальциевых каналов.
Ниже приведены сведения об антиаритмических препаратах, зарегистрированных в России, применение которых согласовано с современными рекомендациями по лечению аритмий.
Антиаритмические препараты I класса (блокаторы натриевых каналов)
Общие свойства антиаритмических препаратов I класса — блокада натриевых каналов, замедление натриевого тока, уменьшение максимальной скорости деполяризации, увеличение порога возбудимости и снижение скорости распространения возбуждения в миокарде. По влиянию на кинетику взаимодействия с натриевыми каналами и процесс реполяризации антиаритмические препараты I класса подразделяют на три подкласса:
-
антиаритмические препараты IA класса блокируют калиевые каналы, увеличивают ППД и эффективный рефрактерный период клеток проводящей системы, миокарда предсердий и желудочков;
-
антиаритмические препараты IB класса характеризуются «быстрой» кинетикой взаимодействия с натриевыми каналами и укорачивают ППД и эффективный рефрактерный период, в основном, миокарда желудочков;
-
антиаритмические препараты IC класса обладают «медленной» кинетикой взаимодействия с натриевыми каналами и практически не влияют на ППД и эффективный рефрактерный период.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ IA КЛАССА
Хинидин
Механизм действия
Обладает всеми электрофизиологическими свойствами антиаритмических препаратов IA класса. Другие фармакологические эффекты хинидина: блокада α-адренорецепторов, блокада холинэргических рецепторов, отрицательный инотропный эффект.
Фармакокинетика
Абсорбция хинидина составляет 80-90%. Время наступления максимальной концентрации препарата в плазме (TCmax ) 3-4 ч. Tерапевтическая концентрация препарата в крови 3-6 мкг/мл, токсические эффекты развиваются при концентрациях выше 8 мкг/мл. Хинидин связывается с белками плазмы на 70-90%, обладает большим объёмом распределения. Проницаемость через ГЭБ и плацентарный барьер низкая. Период полувыведения (T1/2 ) препарата 5-8 ч. Выводится почками, 10-50% в неизменённом виде.
Показания
Хинидин рекомендуют применять для восстановления синусового ритма у пациентов с фибрилляцией предсердий или для поддержания синусового ритма при рецидивирующей фибрилляции предсердий у пациентов без органических заболеваний сердца, а также у пациентов с артериальной гипертензией и ИБС. При этом хинидин рассматривают как препарат второй линии, применяемый при неэффективности других, более активных и безопасных препаратов.
Для купирования пароксизма фибрилляции предсердий используют нагрузочную дозу 0,2-0,4 г, с последующим приёмом 0,2 г каждый час до достижения суммарной дозы 1 г. Для длительного лечения применяют пролонгированные формы — 0,3-0,6 г через 8-12 ч.
Противопоказания
Атриовентрикулярная-блокада II-III степени, гликозидная интоксикация, нарушения внутрижелудочковой проводимости. Особую осторожность следует соблюдать при бронхиальной астме, нарушениях функций печени или почек, гипертиреозе, гипокалиемии, миастении, псориазе, тромбоцитопении.
Нежелательные лекарственные реакции
НЛР отмечают у 30-50% пациентов. К ним относят желудочковые тахиаритмии и системные токсические и аллергические эффекты (желудочно-кишечные расстройства, неврологические нарушения, реакции гиперчувствительности в виде гемолитической анемии и тромбоцитопении). Относительно редко наблюдают развитие волчаночного синдрома и гепатита.
Для контроля за безопасностью лечения хинидином проводят мониторирование АД, ЭКГ, функций печени и почек, определение концентрации калия, а также хинидина в сыворотке крови.
Взаимодействия
Хинидин увеличивает эффект непрямых антикоагулянтов, миорелаксантов, сердечных гликозидов. Риск аритмогенных эффектов хинидина возрастает при применении с трициклическими антидепрессантами, галоперидолом и эритромицином. Антациды и противодиарейные препараты замедляют абсорбцию и выведение хинидина. Препараты, стимулирующие печёночный метаболизм, укорачивают T1/2 хинидина.
Применение в особых ситуациях
Исследований применения во время беременности нет (близкий по структуре хинин тератогенен и ототоксичен). Хинидин проникает в грудное молоко, однако связанных с этим осложнений не зарегистрировано. У пожилых пациентов исследования не проводили, но каких-либо специфических реакций, обусловленных приёмом хинидина, не зафиксировано.
Прокаинамид
Механизм действия
Прокаинамид обладает свойствами антиаритмических препаратов IA класса. Другие фармакологические эффекты: ганглиоблокирующая активность, умеренная блокада холинорецепторов, умеренный отрицательный инотропный эффект.
Фармакокинетика
При внутривенном введении прокаинамид начинает действовать почти немедленно. После приёма внутрь абсорбция составляет 70-90%. TCmax 1-2 ч. Tерапевтическая концентрация 4-10 мг/л. Связь с плазменными белками низкая (10-20%). Проникает через ГЭБ и плацентарный барьер. T1/2 2,5-4,5 ч, при нарушениях функций почек — 11-20 ч. Прокаинамид подвергается печёночной трансформации с образованием N-ацетилпрокаинамида (до 25%) — активного метаболита со свойствами антиаритмических препаратов III класса. Прокаинамид выводится почками (до 50-60% в неизменённом виде).
Показания
Согласно существующим рекомендациям, прокаинамид показан для купирования пароксизмальных аритмий (вводят внутривенно со скоростью не более 50 мг/мин до прекращения пароксизма аритмии или достижения суммарной дозы 1000 мг).
Показания для внутривенного введения прокаинамида:
-
лечение резистентной к электроимпульсной терапии желудочковой тахикардии и фибрилляции желудочков;
-
купирование устойчивой желудочковой аритмии без существенных гемодинамических нарушений;
-
лечение непрерывно рецидивирующей желудочковой тахикардии в комбинации с β-адреноблокаторами у пациентов с острым коронарным синдромом/ инфарктом миокарда;
-
купирование мономорфной устойчивой или рецидивирующей желудочковой тахикардии;
-
купирование тахикардии с широкими комплексами QRS с неизвестным источником возбуждения — либо желудочковой, либо суправентрикулярной тахикардии с участием дополнительных путей проведения;
-
купирование пароксизмов фибрилляции предсердий.
Противопоказания
Атриовентрикулярная-блокада (II-III степени). Особую осторожность следует соблюдать в случае использования прокаинамида при блокадах ножек пучка Гиса, передозировке сердечных гликозидов, бронхиальной астме, ХСН, нарушениях функций печени или почек, красной волчанке, миастении.
Нежелательные лекарственные реакции
ЖА, фибрилляция желудочков или асистолия при быстром внутривенном введении или передозировке, токсическое влияние на кроветворение (агранулоцитоз, нейтропения, тромбоцитопения, апластическая анемия), гипотония (особенно при быстром внутривенном введении), аллергические реакции, волчаночноподобный синдром, токсическое действие на ЦНС (спутанность сознания, галлюцинации, депрессия). Контроль за безопасностью: мониторирование АД и ритма сердца (ЭКГ), оценка общего анализа крови, определение сывороточной концентрации прокаинамида и N-ацетилпрокаинамида, титров антиядерных антител.
Взаимодействие
Применение прокаинамида с другими антиаритмическими препаратами увеличивает риск развития аритмий, усиливает эффект гипотензивных, антигистаминных, холиноблокирующих и цитостатических средств, миорелаксантов. Снижает активность антимиастенических препаратов.
Применение в особых ситуациях
Прокаинамид проникает через плацентарный барьер, однако какого-либо неблагоприятного действия на плод и новорождённого не отмечено. Существует потенциальный риск развития гипотензии у матери, возможны нарушения маточноплацентарного кровотока. В педиатрической практике каких-либо специфических осложнений, ограничивающих применение прокаинамида, не выявлено. Для достижения терапевтического эффекта могут быть необходимы более высокие дозы, чем у взрослых.
У пожилых пациентов более вероятно развитие гипотензии. При возрастных изменениях функций почек может быть необходимо применение меньших доз прокаинамида.
Дизопирамид
Дизопирамид обладает электрофизиологическими свойствами антиаритмических препаратов IA класса. Другие фармакологические эффекты: блокада холинорецепторов, отрицательный инотропный эффект.
Фармакокинетика
Всасывание быстрое и почти полное (95%). Связывание с белками умеренное (50%), зависит от концентрации препарата и может колебаться от 35 до 95%. Проницаемость через ГЭБ и плацентарный барьер низкая. TCmax 0,5-3 ч. Tерапевтическая концентрация в сыворотке крови 2-4 мкг/мл. Биотрансформация в печени, метаболиты дизопирамида обладают антиаритмической и антихолинергической активностью. T1/2 4-10 ч. Выведение преимущественно с мочой, около 50% в неизменённом виде и 30% в виде метаболитов, с жёлчью — около 15%.
Показания
По данным существующих рекомендаций, дизопирамид показан лишь для лечения рецидивирующей предсердной очаговой тахикардии и только в комбинации с препаратами, замедляющими атриовентрикулярную проводимость. Дизопирамид используют в нагрузочной дозе 300 мг с последующим приёмом 100-200 мг 4 раза в сутки.
Противопоказания
Атриовентрикулярная блокада II-III степени. Осторожность следует соблюдать при кардиомиопатиях, ХСН, сахарном диабете, закрытоугольной глаукоме, нарушениях функций печени или почек, гиперили гипокалиемии, миастении, гипертрофии предстательной железы.
Нежелательные лекарственные реакции
Желудочковые тахиаритмии, антихолинэргические эффекты — сухость во рту, запоры, задержка мочи, развитие или прогрессирование симптомов сердечной недостаточности, гипотензия, мышечная слабость, агранулоцитоз, обострение глаукомы, холестаз, гипогликемия, депрессия. Контроль за безопасностью: определение АД, мониторирование ЭКГ (увеличение продолжительности QRS, удлинение Q-T), оценка функций печени и почек, уровня калия в сыворотке крови, внутриглазного давления.
Взаимодействие
С алкоголем — развитие гипотензии и гипогликемии, с другими антиаритмическими препаратами — повышение риска развития аритмий, с β-адреноблокаторами — усугубление симптомов ХСН, с антикоагулянтами — усиление действия, с пероральными противодиабетическими средствами и инсулином, с индукторами ферментов печени — снижение концентрации.
Применение в особых ситуациях
Дизопирамид обнаруживают в крови плода, однако какого-либо неблагоприятного действия на плод и новорождённого не отмечено. В грудное молоко проникает в низких концентрациях. Каких-либо специфических осложнений, связанных с применением дизопирамида в педиатрии, не выявлено. У пожилых пациентов возможна повышенная чувствительность к антихолинергическим эффектам дизопирамида. При наличии возрастных изменений функций почек может быть необходима коррекция дозы.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ IB КЛАССА Лидокаин
Механизм действия
Лидокаин обладает свойствами антиаритмических препаратов IB класса.
Фармакокинетика
В качестве антиаритмического препарата лидокаин применяют внутривенно. Связывание с белками плазмы 60-80%, зависит от концентрации. Tерапевтическая концентрация в плазме 1,5-5 мкг/мл. Проникает через ГЭБ, плацентарный барьер и в грудное молоко. Лидокаин в основном подвергается печёночной трансформации (до 90%), преимущественно с участием микросомальных ферментов. Активные метаболиты могут способствовать проявлению терапевтического и токсического эффектов. T1/2 лидокаина после болюсного введения 1,5-2 ч, при длительной инфузии T1/2 возрастает до 3 ч. На период полувыведения также влияет концентрация плазменных белков, особенно белков острой фазы. Лидокаин выводится почками (до 10% в неизменённом виде) и печенью. При ХСН возможна кумуляция метаболитов.
Показания
Лидокаин используют для купирования желудочковых аритмий — мономорфной и полиморфной желудочковой тахикардии, ассоциированной с острым инфарктом миокарда или острым коронарным синдромом, устойчивой и рецидивирующей мономорфной желудочковой тахикардии и желудочковой тахикардии типа «пируэт», а также тахикардии неуточнённого генеза с широкими комплексами QRS.
Лидокаин применяют внутривенно в виде болюса 1 мг/кг (50-120 г) со скоростью 25-50 мг/мин, при необходимости введение дозы повторяют через 5 мин. При заболеваниях печени и ХСН дозу снижают на 30-40%.
Противопоказания
Выраженная атриовентрикулярная и внутрижелудочковая блокада. С осторожностью лидокаин следует применять при ХСН, нарушениях функций печени и почек, гиповолемии или шоке, синусовой брадикардии, синдроме ВольфаПаркинсона-Уайта, повышенной чувствительности к лидокаину.
Нежелательные лекарственные реакции
Гипотония, брадикардия, риск развития асистолии, остановки дыхания при передозировке, симптомы нейротоксичности, аллергические реакции. Методы контроля за безопасностью: мониторирование АД и ЭКГ, определение концентрации калия и лидокаина в сыворотке крови.
Взаимодействие
С β-адреноблокаторами возможно развитие брадикардии; при применении с другими антиаритмическими препаратами — негативное влияние на проводимость и сократимость. При совместном внутривенном применении с барбитуратами возрастает риск остановки дыхания. Индукторы микросомальных ферментов печени могут уменьшать T1/2 лидокаина.
Применение в особых ситуациях
Специфических осложнений в педиатрической практике не зарегистрировано. У пожилых пациентов НЛР лидокаина отмечают несколько чаще. При наличии возрастных изменений функций почек у пожилых может быть необходима коррекция дозы лидокаина.
МексилетинP
Механизм действия
МексилетинP обладает свойствами антиаритмических препаратов IB класса. Фармакокинетика
МексилетинP хорошо всасывается (до 90%) из верхних отделов пищеварительного тракта. Связывается с белками плазмы умеренно (60-75%). Проникает через плацентарный барьер и в грудное молоко. Биотрансформация преимущественно в печени (до 85%) при участии ферментной системы CYP1A2 с образованием неактивных метаболитов. Начало действия препарата через 0,5-2 ч, TCmax 2-3 ч. Tерапевтическая концентрация 0,5-2,0 мкг/кг. T1/2 10-12 ч, может увеличиваться до 25 ч при заболеваниях печени и почек, снижении минутного объёма крови. Выводится с жёлчью и мочой (до 10% в неизменённом виде).
Показания
Лечение желудочковой тахикардии типа «пируэт» у пациентов с синдромом удлинённого Q-T (LQ-T3). Режим дозирования: нагрузочная доза 400 мг внутрь с последующим назначением 200 мг через 8 ч.
Противопоказания
Мексилетин* противопоказан при атриовентрикулярных блокадах высокой степени и кардиогенном шоке. С осторожностью используют при ХСН, нарушениях функций печени, гипотензии, синдроме слабости синусового узла, эпилепсии, повышенной чувствительности к мексилетину*.
Нежелательные лекарственные реакции
Боль в грудной клетке, одышка, лейкопения, агранулоцитоз, тромбоцитопения, судороги, симптомы нейротоксичности, нарушения со стороны пищеварительного тракта — нарушения вкуса, тошнота, запоры или диарея. Контроль за безопасностью: мониторирование ЭКГ, определение активности трансаминаз, концентрации мексилетина* в крови.
Взаимодействия
Хинидин, β-адреноблокаторы и амиодарон усиливают антиаритмический эффект мексилетина*. Активаторы печёночного метаболизма могут снижать плазменную концентрацию мексилетина^* . Стимуляторы моторики пищеварительного тракта, наркотические анальгетики, блокаторы Н2-рецепторов снижают всасывание мексилетина*. Метоклопрамид усиливает абсорбцию мексилетина*. Гидрокарбонат натрия и диуретики, ощелачивающие мочу, снижают выведение мексилетина*.
Применение в особых ситуациях
Влияние мексилетина* на плод у человека не изучено. Мексилетин* проникает в грудное молоко, принимать препарат при грудном вскармливании не рекомендуют. Специальных исследований применения мексилетина* у детей и пациентов пожилого возраста не было.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ IC КЛАССА
Пропафенон
Механизм действия
Пропафенон обладает электрофизиологическими эффектами антиаритмических препаратов IC класса. Другие фармакологические эффекты: умеренная блокада β-адренорецепторов, а также медленных кальциевых каналов, отрицательный инотропный эффект.
Фармакокинетика
Пропафенон быстро и хорошо всасывается в пищеварительном тракте (до 90%). Есть эффект первичного прохождения через печень, что определяет системную биодоступность 5-50% (последняя нарастает при увеличении дозы и совместном приёме препарата с пищей). Связывание препарата с белками плазмы очень высокое (до 97%). Проницаемость через ГЭБ и плацентарный барьер низкая. TCmax 1-3,5 ч. Плазменная концентрация 500-1500 мкг/л. Пропафенон метаболизируется преимущественно в печени ферментной системой CYP2D6 с образованием двух метаболитов, обладающих антиаритмической активностью. T1/2 у «быстрых» метаболитов 2-10 ч, у «медленных» — 10-32 ч. Препарат выводится с мочой (до 38%) в виде метаболитов и с жёлчью (до 53%) в виде глюкуронидов и сульфатов.
Показания
-
Купирование гемодинамически стабильной предсердной очаговой тахикардии и профилактика рецидивов предсердной очаговой тахикардии.
-
Купирование гемодинамически нестабильной атриовентрикулярной узловой реципрокной тахикардии.
-
Длительное лечение атриовентрикулярной узловой реципрокной тахикардии, резистентной к терапии β-адреноблокаторами и верапамилом, и невозможности выполнения абляции.
-
Лечение β-адреноблокаторами у пациентов с дополнительными путями проведения.
-
Лечение эктопической атриовентрикулярной узловой тахикардии.
-
Купирование пароксизма фибрилляции предсердий давностью до 7 дней.
-
Препарат выбора для поддержания синусового ритма у пациентов с идиопатической фибрилляцией предсердий или у пациентов с артериальной гипертензией без выраженной гипертрофии левого желудочка.
Для купирования аритмий нагрузочная доза 600 мг внутрь или 1,5-3,0 мг/кг внутривенно в течение 10-20 мин. При длительном приёме стартовая доза 150 мг через 8 ч (450 мг/сут) с постепенным увеличением дозы до 300 мг через 8 часов (900 мг/сут).
Противопоказания
Атриовентрикулярная блокада высокой степени или двухпучковые внутрижелудочковые блокады у пациентов без электрокардиостимуляции. Применение пропафенона требует осторожности при бронхообструктивных заболеваниях, синусовой брадикардии и синдроме слабости синусового узла, ХСН, нарушениях функций печени и почек, гипоили гиперкалиемии, гипотензии, повышенной чувствительности к пропафенону.
Нежелательные лекарственные реакции
Аритмии, в том числе развитие атриовентрикулярной блокады, прогрессирование ХСН, гипотония, агранулоцитоз, тромбоцитопения, появление антинуклеарных антител, нейротоксичность (головокружение, атаксия), аллергические реакции, артралгии, бронхоспазм. Методы контроля за безопасностью — ЭКГ (аритмогенное действие пропафенона).
Взаимодействие
Повышает концентрации дигоксина, варфарина, пропранолола и метопролола в плазме крови, усиливает антиаритмический эффект β-адреноблокаторов.
Применение в особых ситуациях
Контролируемых исследований приёма пропафенона во время беременности у человека не проводилось. Пропафенон проникает в грудное молоко, однако связанных с этим осложнений не зарегистрировано. Рекомендовано осторожное применение пропафенона в педиатрической практике, ПЭ у детей сходны с таковыми у взрослых. Специфических осложнений, связанных с применением пропафенона у пожилых пациентов, не отмечено (при возрастных нарушениях функций печени и почек может быть необходима коррекция дозы).
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ II КЛАССА (β-АДРЕНОБЛОКАТОРЫ)
Механизм действия
Антиаритмические препараты II класса (β-адреноблокаторы) способны подавлять воздействие катехоламинов на скорость спонтанной диастолической деполяризации клеток-водителей ритма синусового узла, что приводит к снижению ЧСС. β-Адреноблокаторы замедляют проведение импульса и увеличивают рефрактерный период атриовентрикулярного узла. β-Адреноблокаторы уменьшают патологический автоматизм и следовые деполяризации.
Эффективность β-адреноблокаторов при желудочковых аритмиях обусловлена их способностью устранять и предотвращать ишемию — важный фактор индукции данных нарушений ритма. β-Адреноблокаторы активно изменяют базовые патологические процессы, лежащие в основе структурно-функционального ремоделирования миокарда. Некоторые β-адреноблокаторы (карведилол) обладают свойствами антиоксиданта. β-Адреноблокаторы предотвращают апоптоз кардиомиоцитов, опосредованный катехоламинами. Tаким образом, β-адреноблокаторы способны модифицировать процессы, влияющие на формирование кругов re-entry в ткани желудочков, а также блокировать механизмы, которые могут приводить к их активации. В отличие от антиаритмических препаратов других классов, у β-адреноблокаторов отсутствует проаритмогенное действие. β-Адреноблокаторы обладают антиангинальной и гипотензивной активностью.
Фармакокинетика
Особенности фармакокинетики отдельных β-адреноблокаторов представлены в табл. 21-45.
Таблица 21-45. Особенности фармакокинетики отдельных β-адреноблокаторов
| Название | Абсорбция | Связь с белками | ТСmax | T1/2 | ГЭБ | Метаболизм | Выведение |
|---|---|---|---|---|---|---|---|
|
Пропранолол |
90% |
90-95% |
1-1,5 ч |
3-5 ч |
++ |
в печени |
почками до 90% |
|
Атенолол |
50-60% |
6-16% |
2-4 ч |
6-9 ч |
-+ |
не метаболизируется |
почками 85-100% |
|
Метопролол |
95% |
10% |
1,5-2 ч |
3,5-7 ч |
++ |
в печени |
почками 95% |
|
Бисопролол |
80-90% |
26-33% |
2-4 ч |
9-12 ч |
-+ |
в печени |
почками 50%, печенью 50% |
|
Карведилол |
100% |
98-99% |
— |
6-10 ч |
++ |
в печени |
печенью 100% |
|
ЭсмололP |
— |
55% |
— |
9 мин |
— |
в эритроцитах |
почками 100% |
Показания
Эффективность и безопасность β-адреноблокаторов делает их препаратами выбора при различных типах аритмий, как суправентрикулярных, так и желудочковых.
Согласно существующим рекомендациям, β-адреноблокаторы показаны при следующих нарушениях ритма сердца:
-
симптоматическая синусовая тахикардия на фоне психо-эмоционального стресса, тревожности или панических атак, а также при тиреотоксикозе;
-
пароксизмальная синоатриальная реципрокная тахикардия, предсердная очаговая тахикардия, атриовентрикулярная узловая реципрокная тахикардия, реципрокные аритмии у пациентов с дополнительными путями проведения (при отсутствии аномально быстрых путей), эктопическая атриовентрикулярная узловая тахикардия, контроль ЧСС у пациентов с постоянной формой фибрилляции предсердий;
-
желудочковая экстрасистолия и суправентрикулярная тахикардия у пациентов с острым коронарным синдромом или острым инфарктом миокарда (профилактический приём β-адреноблокаторов);
-
желудочковая тахикардия, не связанная с острым коронарным синдромом, — рецидивирующая мономорфная желудочковая тахикардия, полиморфная желудочковая тахикардия, желудочковая тахикардия типа «пируэт» — совместно с электрокардиостимуляцией, непрерывно рецидивирующая желудочковая тахикардия;
-
первичная профилактика внезапной сердечной смерти у пациентов, перенёсших инфаркт миокарда (метопролол, бисопролол, карведилол), в том числе тем, у которых были эпизоды фибрилляции желудочков, устойчивой желудочковой тахикардии с выраженными нарушениями гемодинамики или эпизоды устойчивой желудочковой тахикардии без значимых гемодинамических нарушений;
-
профилактика внезапной сердечной смерти у пациентов с дилатационной кардиомиопатией, особенно при наличии факторов риска — перенесённой фибрилляции желудочков или эпизода устойчивой желудочковой тахикардии;
-
врождённый синдром удлинённого Q-T (для профилактики желудочковых аритмий как при бессимптомном течении заболевания, так и при наличии эпизодов тахикардии типа «пируэт» в анамнезе);
-
первичная и вторичная профилактика у пациентов с катехолзависимой полиморфной желудочковой тахикардией;
-
желудочковые аритмии у пациентов без органического поражения миокарда (идиопатическая левожелудочковая тахикардия или желудочковая тахикардия из выносящего тракта правого желудочка).
Режимы дозирования β-адреноблокаторов представлены в табл. 21-46.
Таблица 21-46. Режимы дозирования β-адреноблокаторов
| Название | Внутривенное применение | Приём внутрь |
|---|---|---|
|
Пропранолол |
Внутривенно 1 мг медленно, с повторением дозы через 2-3 мин до суммарной дозы 10 мг |
10-80 мг 4 раза в сутки |
|
Атенолол |
Внутривенно 2-5 мг медленно, с повторением дозы через 5 мин до суммарной дозы 15 мг |
12,5-100 мг 2 раза в сутки |
|
Метопролол |
Внутривенно 2-5 мг медленно, с повторением дозы через 5 мин до суммарной дозы 15 мг |
12,5-100 мг 2-3 раза в сутки |
|
Бисопролол |
— |
1,25-10 мг 1 раз в сутки |
|
Карведилол |
— |
6,25-25 мг 2 раза в сутки |
|
ЭсмололP |
Нагрузочная доза 500 мкг/кг, инфузия 50 мг/кг/мин в течение 4-5 мин, поддерживающая доза для длительного введения 25 мкг/кг/мин |
— |
Противопоказания
Синдром слабости синусового узла, атриовентрикулярная блокада II-III степени, бронхиальная астма тяжёлого течения. Применение β-адреноблокаторов требует осторожности при бронхообструктивных заболеваниях, декомпенсации ХСН, сахарном диабете, заболеваниях периферических артерий.
Побочные эффекты
К наиболее частым побочным эффектам β-адреноблокаторов следует отнести брадиаритмии и нарушения атриовентрикулярного проведения, бронхоспазм, обострение периферических артериопатий, сексуальную дисфункцию, депрессию.
Взаимодействия
Совместное применение с блокаторами медленных кальциевых каналов, амиодароном, дигоксином увеличивает риск развития брадиаритмий и нарушений атриовентрикулярного проведения.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ III КЛАССА
Основное электрофизиологическое свойство антиаритмических препаратов III класса — блокада калиевых каналов и замедление калиевого тока, что приводит к увеличению ППД, и эффективный рефрактерный период в ткани предсердий и желудочков. Антиаритмические препараты III класса подавляют автоматизм.
Амиодарон
Механизм действия
Амиодарон обладает эффектами антиаритмических препаратов III класса. Кроме того, амиодарон незначительно блокирует натриевые каналы, медленные кальциевые каналы, а также проявляет умеренно выраженные свойства блокатора β- и α-адренорецепторов. Амиодарон влияет на метаболизм гормонов щитовидной железы.
Фармакокинетика
Всасывание амиодарона из пищеварительного тракта медленное и вариабельное (20-55%). Значительная часть препарата связывается с белками (до 96%). Проникает через ГЭБ и плаценту, секретируется с грудным молоком. Для амиодарона характерен большой и вариабельный объём распределения в результате интенсивного накопления в жировой ткани и в органах с хорошим кровоснабжением. Особенности фармакокинетики препарата требуют применения высоких нагрузочных доз. Время достижения максимальной концентрации в плазме крови 3-7 ч. Начало действия колеблется от 2-3 сут до 2-3 мес даже при использовании нагрузочных доз. Tерапевтическая концентрация 1-2,5 мкг/мл. Амиодарон метаболизируется в печени, возможно, путем дейодирования с образованием активного метаболита. T1/2 амиодарона составляет от 30 до 110 дней (в среднем около 40). Выводится в основном с жёлчью (80-95%), с мочой выделяется менее 1%.
Показания
-
Амиодарон показан пациентам с атриовентрикулярной узловой реципрокной тахикардией, особенно при плохо переносимых пароксизмах с нарушениями гемодинамики.
-
Амиодарон рекомендуют для лечения суправентрикулярных аритмий у пациентов с дополнительными путями проведения — атриовентрикулярная узловая реципрокная тахикардия или фибрилляция предсердий, также его назначают при предсердной очаговой тахикардии и эктопической атриовентрикулярной узловой тахикардии.
-
Амиодарон рекомендуют использовать для восстановления синусового ритма при персистирующей фибрилляции предсердий; для поддержания синусового ритма у пациентов с ХСН, ИБС, выраженной гипертрофии левого желудочка, а также при отсутствии органического поражения сердца в случае неэффективности флекаинидаP, пропафенона или соталола.
-
Амиодарон применяют для неотложной терапии желудочковых аритмий:
-
желудочковая тахикардия/фибрилляции желудочков при неэффективности кардиоверсии, устойчивой желудочковой тахикардии без нарушений гемодинамики у пациентов с острым коронарным синдромом/острым инфарктом миокарда;
-
при желудочковых аритмиях, не связанных с острым коронарным синдромом/острым инфарктом миокарда — желудочковой тахикардии/фибрилляции желудочков при неэффективности кардиоверсии, устойчивой желудочковой тахикардии c гемодинамическими нарушениями, желудочковой тахикардий, резистентной к другим антиаритмическим препаратам, рецидивирующей мономорфной желудочковой тахикардией, полиморфной желудочковой тахикардией (при отсутствии удлинённого Q-T), непрерывно рецидивирующей желудочковой тахикардией.
-
-
Амиодарон назначают пациентам с инфарктом миокарда в анамнезе для первичной профилактики внезапной сердечной смерти, а также пациентам с эпизодами желудочковой тахикардии/фибрилляции желудочков в анамнезе, при рецидивах желудочковой тахикардии на фоне лечения β-адреноблокаторами, пациентам с дилатационной кардиомиопатией, перенёсшим желудочковую тахикардию/фибрилляцию желудочков, пациентам с гипертрофической кардиомиопатией для первичной профилактики, а также после перенесённого эпизода желудочковой тахикардии/фибрилляции желудочков при невозможности применения имплантируемого кардиовертера/дефибриллятора; пациентам с аритмогенной дисплазией правого желудочка после эпизода желудочковой тахикардии/фибрилляции желудочков при невозможности применения имплантируемого кардиовертера/дефибриллятора.
Дозы амиодарона во время стационарного лечения при пероральном насыщении: 1200-1800 мг/сут до суммарной дозы 10 г и последующий приём поддерживающей дозы 200-400 мг/сут. При комбинированном насыщении стартовая доза составляет 75 мг/кг внутривенно в течение 30-60 мин, затем 1200-1800 мг/сут внутривенно в виде постоянной инфузии или внутрь до достижения дозы 10 г и последующий приём поддерживающей дозы 200-400 мг/сут. При назначении амиодарона амбулаторно: 600-800 мг/сут внутрь до суммарной дозы 10 г и последующий приём поддерживающей дозы 200-400 мг/сут.
Противопоказания
Атриовентрикулярная блокада II-III степени, эпизоды синусовой брадикардии с развитием синкопальных состояний, синдром слабости синусового узла при отсутствии электрокардиостимуляции. Применение амиодарона требует осторожности при ХСН, нарушениях функций печени, гипокалиемии, повышенной чувствительности к амиодарону, нарушениях функций щитовидной железы, изменениях морфологии щитовидной железы при УЗИ.
Нежелательные лекарственные реакции
Симптоматическая брадикардия, проаритмогенный эффект, симптомы нейротоксичности, фотосенсибилизация, фиброз лёгких или интерстициальный пневмонит/альвеолит, нарушения функций щитовидной железы, кератопатия, аллергические реакции, гепатит. Методы контроля за безопасностью: определение активности АСТ и АЛT, рентгенография грудной клетки, спирография, ЭКГ, офтальмологическое обследование, оценка функций щитовидной железы, определение концентрации амиодарона в плазме крови.
Взаимодействие
С другими антиаритмическими препаратами — риск развития желудочковых аритмий, с антикоагулянтами — торможение метаболизма и усиление эффекта антикоагулянтов, препараты дигиталиса — увеличение концентрации дигоксина, угнетение синусового и атриовентрикулярного узлов β-адреноблокаторами — повышенный риск брадиаритмий и атриовентрикулярной блокады, с петлевыми диуретиками — риск аритмий, связанный с гипокалиемией.
Применение в особых ситуациях
Амиодарон проникает через плацентарный барьер, препарат обнаруживают в плазме крови новорождённых в умеренных концентрациях. Специальных исследований безопасности приёма во время беременности не проводили, ряд сообщений показали отсутствие НЭ при назначении в поздние сроки беременности. Потенциально неблагоприятные эффекты амиодарона у новорождённых — брадикардия и дисфункция щитовидной железы. Специальных исследований применения амиодарона у детей нет, однако препарат может начинать действовать раньше, но длительность действия будет меньше. У детей отмечено более выраженное взаимодействие амиодарона с препаратами дигиталиса. У пожилых пациентов амиодарон может сильнее влиять на функции щитовидной железы; кроме того, повышается частота атаксии и других нейротоксических эффектов.
Соталол
Механизм действия
Соталол обладает электрофизиологическими эффектами антиаритмических препаратов III класса, а также антиангинальным и гипотензивным действием.
Фармакокинетика
Соталол хорошо всасывается из пищеварительного тракта (до 80%). Практически не связывается с белками плазмы. Проницаемость через ГЭБ и плацентарный барьер низкая. Метаболизируется в печени. T1/2 препарата составляет 7-18 ч, увеличивается при ХПН. Выводится почками, до 75% в неизменённом виде.
Показания
-
Купирование рецидивирующей мономорфной желудочковой тахикардии.
-
Лечение рецидивирующей желудочковой тахикардии, резистентной к β-адреноблокаторам, у пациентов, перенёсших инфаркт миокарда.
-
Лечение и профилактика устойчивой желудочковой тахикардии у пациентов с аритмогенной дисплазией правого желудочка при невозможности имплантации кардиовертера/дефибриллятора или первичной профилактики внезапной сердечной смерти.
-
Купирование пароксизма ФПТ, лечение и профилактика рецидивирующей ФПТ.
-
Лечение рецидивирующей атриовентрикулярной узловой реципрокной тахикардии, резистентной к β-адреноблокаторам и блокаторам медленных кальциевых каналов, лечение/профилактика атриовентрикулярной узловой реципрокной тахикардии у пациентов с дополнительными путями проведения.
-
Лечение эктопической атриовентрикулярной узловой тахикардии.
-
В качестве препарата первого ряда для поддержания синусового ритма у пациентов с фибрилляцией предсердий, не имеющих органического поражения сердца, у пациентов с артериальной гипертензией без выраженной гипертрофии левого желудочка, у пациентов с ИБС.
Соталол назначают в стартовой дозе 80 мг 2 раза в сутки, максимальная суточная доза 320 мг/сут (дальнейшее увеличение дозы существенно увеличивает риск проаритмий). При внутривенном применении максимальная общая доза 1,5 мг/кг, рекомендовано медленное введение (5-15 мин), под контролем ЭКГ и АД.
Противопоказания
Атриовентрикулярная блокада II-III степени, синоатриальная блокада и синдром слабости синусового узла, артериальная гипотензия и другие противопоказания, свойственные β-адреноблокаторам. Применение соталола требует осторожности при ХСН, почечной недостаточности, гипокалиемии, повышенной чувствительности к препарату, депрессии.
Нежелательные лекарственные реакции
Аритмогенный эффект (желудочковая тахикардия типа «пируэт»), симптомы нейротоксичности, НЛР, характерные для β-адреноблокаторов, тромбоцитопения, агранулоцитоз, лейкопения, аллергические реакции. Методы контроля за безопасностью: регистрация ЭКГ, определение концентрации глюкозы в плазме крови у пациентов с сахарным диабетом, оценка функций почек, особенно у пожилых пациентов.
Взаимодействие
Повышение риска аритмий при совместном назначении с антиаритмическими препаратами I класса; с йодсодержащими контрастными веществами — увеличение риска анафилактических реакций; с ингаляционными анестетиками — риск гипотонии и угнетения сердечной деятельности; при сочетании с гипотензивными препаратами — риск гипотонии; с петлевыми диуретиками — повышение риска развития аритмий.
Применение в особых ситуациях
Соталол плохо проникает через плацентарный барьер, вероятность неблагоприятного влияния на плод и новорождённого, очевидно, низка. Соталол обнаруживают в грудном молоке, однако данные о НЛР соталола при лактации отсутствуют. У детей применение соталола не связано с какими-либо специфическими осложнениями. Пожилые пациенты могут быть более чувствительны к некоторым неблагоприятным эффектам соталола, которые связаны с его β-адреноблокирующей активностью.
ИбутилидP
Механизм действия
ИбутилидP блокирует выходящий калиевый ток и медленный входящий натриевый ток. Увеличивает продолжительность потенциала действия и эффективный рефрактерный период кардиомиоцитов предсердий, желудочков, атриовентрикулярного узла, пучка Гиса и волокон Пуркинье, дополнительных путей проведения. ИбутилидP подавляет автоматизм.
Фармакокинетика
ИбутилидP применяют внутривенно. Связь с белками низкая (около 40%). Препарат активно метаболизируется в печени, около 80% выводится почками в виде метаболитов, около 10% в неизменённом виде. T1/2 варьирует от 2 до 12 ч.
Показания
Купирование пароксизмальной и персистирующей фибрилляции предсердий продолжительностью до 7 сут и более 7 сут.
Вводят в дозе 1 мг внутривенно в течение 10 мин, при необходимости дозу можно увеличить до 1 мг.
Противопоказания
Беременность, период лактации. С осторожностью следует применять при синдроме слабости синусового узла, синоатриальной и атриовентрикулярной блокадах, коллапсе, гипокалиемии, ХСН, печёночной недостаточности.
Нежелательные лекарственные реакции
Полиморфная желудочковая тахикардия или тахикардия типа «пируэт», брадиаритмии, атриовентрикулярная блокада, тошнота, головная боль, почечная недостаточность. Методы контроля за безопасностью: мониторирование ЭКГ и АД.
Взаимодействие
С другими антиаритмическими препаратами — повышение риска развития желудочковых аритмий, с β-адреноблокаторами и блокаторами медленных кальциевых каналов — повышение риска брадикардии и атриовентрикулярной блокады.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ IV КЛАССА
Механизм действия
Антиаритмические препараты IV класса — верапамил и дилтиазем — блокируют медленные кальциевые каналы, которые в основном определяют скорость деполяризации синусового и атриовентрикулярного узлов. Верапамил и дилтиазем подавляют автоматизм, замедляют проведение и увеличивают рефрактерность данных отделов проводящей системы сердца. В некоторых случаях медленные кальциевые токи — необходимый компонент развития следовых деполяризаций. Блокаторы медленных кальциевых каналов способны подавлять следовые деполяризации и могут быть эффективными при триггерных аритмиях. Препараты данной группы также обладают антиангинальным и гипотензивным эффектами.
Фармакокинетика
Верапамил хорошо абсорбируется в пищеварительном тракте (до 90%). Печёночный метаболизм первого прохождения снижает биодоступность до 20-35%. До 90% верапамила связывается с плазменными белками. Препарат метаболизируется в печени с участием ферментных систем CYP3A4, CYP3A5 и CYP3A7, известно до 11 метаболитов, наиболее значимый — норверапамил, обладающий умеренной гипотензивной активностью. T1/2 верапамила составляет 5-12 ч. Выводится в основном почками (до 70%).
Дилтиазем хорошо реабсорбируется в пищеварительном тракте (до 90%), но метаболизм первого прохождения снижает его биодоступность до 40%. С плазменными белками связывается до 70-80% препарата. Дилтиазем метаболизируется в печени с участием ферментных систем цитохрома CYP3A4, CYP3A5 и CYP3A7, T1/2 составляет около 3,5 ч. Выводится печенью (около 65%) и почками (около 35%).
Показания
Согласно существующим рекомендациям, блокаторы медленных кальциевых каналов показаны для лечения симптоматической синусовой тахикардии, для купирования и профилактического лечения атриовентрикулярной узловой реципрокной тахикардии, для купирования и профилактики ФПТ Препараты IV класса рекомендуют использовать для контроля ЧСС у пациентов с постоянной формой фибрилляции предсердий. Кроме того, блокаторы медленных кальциевых каналов могут быть эффективны при лечении идиопатических (верапамилчувствительных) желудочковых тахикардий.
Для экстренного контроля ЧСС или купирования суправентрикулярной тахикардии верапамил вводят внутривенно 0,075-0,150 мг/кг в течение 2 мин, дилтиазем 0,25 мг/кг в течение 2 мин. При приёме внутрь доза верапамила составляет 120-480 мг/сут, дилтиазема — 60-360 мг/сут.
Противопоказания
Гипотония, синоатриальная или атриовентрикулярная блокада, синдром слабости синусового узла, фибрилляция предсердий и трепетание предсердий у пациентов с дополнительными путями проведения, ХСН, обусловленная систолической дисфункцией левого желудочка. С осторожностью блокаторы медленных кальциевых каналов следует использовать при атриовентрикулярной блокаде I степени, брадикардии, печёночной или почечной недостаточности, у пациентов пожилого возраста.
Нежелательные лекарственные реакции
Брадикардия, гипотония, нарушения атриовентрикулярной проводимости, симптомы нейротоксичности, запоры, гиперплазия дёсен, аллергические реакции, претибиальные отёки. Методы контроля за безопасностью: мониторирование АД и ЭКГ, определение активности трансаминаз.
Взаимодействие
С β-адреноблокаторами — увеличение вероятности развития брадикардии и нарушений проводимости, с антиаритмическими препаратами IA и III классов — риск существенного удлинения Q-T, с препаратами дигиталиса — нарушения атриовентрикулярной проводимости, c индукторами печёночного метаболизма — ослабление эффектов блокаторов медленных кальциевых каналов из-за снижения их концентрации в плазме крови.
Применение в особых ситуациях
Блокаторы медленных кальциевых каналов проходят через плаценту, однако влияние на развитие плода не определено. Гипотония, вызываемая у матери быстрым внутривенным введением препаратов IV класса, может вызывать дисстресс плода. Блокаторы медленных кальциевых каналов проникают в грудное молоко. Исследований применения этих препаратов в педиатрии не проведено, специфических осложнений, ограничивающих применение блокаторов медленных кальциевых каналов у детей, не предполагают. Есть сообщения о существенных гемодинамических нарушениях у новорождённых и грудных детей при внутривенном введении верапамила. У пожилых может увеличиваться T1/2 (из-за снижения почечного клиренса).
ПРЕПАРАТЫ ДРУГИХ ГРУПП, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКИМИ СВОЙСТВАМИ
Существуют ЛС, не вошедшие в классификацию, но применяемые для лечения нарушений ритма.
-
м-Холиноблокаторы (атропин) используют для увеличения ЧСС при брадикардиях.
-
Сердечные гликозиды (дигоксин) назначают для контроля частоты желудочковых сокращений при суправентрикулярных аритмиях с высокой частотой сокращений предсердий, так как дигоксин замедляет проводимость в атриовентрикулярном узле.
-
Электролиты (растворы калия и магния, пероральные препараты калия и магния). Препараты магния используют для лечения желудочковой тахикардии типа «пируэт», возникающей по триггерному механизму. Кроме того, препараты магния назначают внутрь для симптоматического лечения желудочковой экстрасистолии у пациентов без органических заболеваний сердца.
-
Аденозина фосфат применяют преимущественно для купирования пароксизмальной суправентрикулярной тахикардии.
-
Препараты, не обладающие прямыми электрофизиологическими свойствами:
-
ингибиторы АПФ способны снизить риск фатальных желудочковых аритмий и внезапной сердечной смерти у пациентов с инфарктом миокарда и дилатационной кардиомиопатией;
-
у пациентов, перенёсших инфаркт миокарда, применение блокаторов альдостероновых рецепторов и статинов снижает риск фатальных желудочковых аритмий и внезапной сердечной смерти.
-
-
По-видимому, препараты, не обладающие прямыми электрофизиологическими свойствами, способны влиять на ремоделирование миокарда. Эти ЛС снижают вероятность образования субстрата для re-entry аритмий либо препятствуют активации существующих.
Антиагреганты
Антиагреганты — ЛС, препятствующие тромбообразованию за счёт уменьшения функциональной активности тромбоцитов.
Существует около 20 препаратов, которые, действуя различным образом, подавляют агрегацию тромбоцитов. К основным антиагрегантным препаратам, доказавшим свою эффективность в рандомизированных клинических испытаниях и широко применяемым в клинической практике, относят ацетилсалициловую кислоту (аспирин*), клопидогрел, тиклопидин, а также блокаторы гликопротеиновых IIb/IIIa рецепторов тромбоцитов для внутривенного введения (абциксимаб, тирофибан8, эптифибатид18). Значительно реже в качестве антиагреганта используют дипиридамол. Другие ЛС, обладающие недостаточно выраженными антитромбоцитарными свойствами, не имеют зарегистрированных показаний к своему применению в качестве антиагрегантов.
Отличительные признаки основных антиагрегантных препаратов приведены в табл. 21-47.
Таблица 21-47. Отличительные признаки основных антиагрегантов
| Признак | Ацетилсалициловая кислота | Клопидогрел | Антагонисты гликопротеиновых IIb/IIIa рецепторов |
|---|---|---|---|
|
Воздействие на белок тромбоцита |
ЦОГ-1 |
P2Y12 |
αII bβ3 |
|
Обратимость эффекта |
Необратим |
Необратим |
Обратим |
|
Период полувыведения препарата или активного метаболита |
Минуты |
Минуты |
Часы |
|
Необходимость мониторирования эффекта |
Нет |
Нет |
Не определена |
|
Необходимость титрования дозы |
Нет |
Нет |
Есть |
АЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА
Наиболее часто применяемый в клинической практике антиагрегант, который подавляет синтез тромбоксана (тромбоксана А2) в тромбоцитах, а также синтез простациклина (простагландин I2) в эндотелиальных клетках сосудов. Ацетилсалициловая кислота селективно и необратимо инактивирует ключевой фермент метаболизма арахидоновой кислоты в тромбоцитах — простагландин Н-синтазу (последняя отвечает за образование простагландина Н2, предшественника тромбоксана А2, стимулятора агрегации тромбоцитов и мощного вазоконстриктора). Препарат действует путём ковалентного ацетилирования остатка серина 529 вблизи активного центра ЦОГ, фермента, катализирующего этап биосинтеза простаноидов из арахидоновой кислоты. Иными словами, ацетилсалициловая кислота конкурирует с арахидоновой кислотой за связывание с активными центрами фермента ЦОГ тромбоцитов и соответственно тормозит зависимую от этого фермента агрегацию тромбоцитов. В низких дозах ацетилсалициловая кислота влияет преимущественно на изофермент ЦОГ — ЦОГ-1. В итоге тромбоциты теряют способность к ресинтезу белка, прекращают образовывать тромбоксан А2, а в клетках эндотелия происходит уменьшение синтеза простагландина I2 , обладающего антиагрегационной активностью и вазодилатирующими свойствами. В клетках эндотелия, в отличие от тромбоцитов, присутствуют ядра, а значит, есть возможность для возобновления синтеза ЦОГ, прерванного после приёма ацетилсалициловой кислоты. Угнетение синтеза тромбоксана А2 происходит на весь оставшийся период жизни тромбоцита.
Поскольку ежедневно происходит обновление пула тромбоцитов на 10% (период жизни клеток составляет 7-10 дней), то через 5-6 дней после однократного приёма ацетилсалициловой кислоты в крови будет около 50% нормально функционирующих тромбоцитов. Ацетилсалициловая кислота не влияет на длительность жизни тромбоцитов. Анализ применения ацетилсалициловой кислоты в дозах от 30 до 1500 мг свидетельствует об эффекте насыщения малыми дозами препарата (75-100 мг) на ЦОГ тромбоцитов.
Ацетилсалициловая кислота, наряду с профилактикой образования тромбов, повышает риск кровотечений. Можно выделить, по крайней мере, два механизма, связанных с действием препарата на ЦОГ-1:
-
подавление функции тромбоцитов (ингибирование синтеза тромбоксана А2);
-
нарушение цитопротекции в слизистой оболочке пищеварительного тракта (ингибирование синтеза простагландина Е2).
Первый эффект не зависит от дозы ацетилсалициловой кислоты, в то время как второй носит дозозависимый характер (при дозе ацетилсалициловой кислоты 75-100 мг риск кровотечения из верхних отделов пищеварительного тракта увеличен в два раза).
Фармакокинетика
Ацетилсалициловая кислота быстро и полностью всасывается из желудка и верхних отделов кишечника (за 5-16 мин). Приём пищи не влияет на биодоступность ацетилсалициловой кислоты, однако при этом скорость всасывания препарата замедлена. В тонком кишечнике и в печени ацетилсалициловая кислота подвергается пресистемному гидролизу эстеразами слизистой оболочки кишечника, плазмы крови, эритроцитов и печени. Биодоступность ацетилсалициловой кислоты при приёме внутрь составляет 50-68%. Антитромбоцитарное действие ацетилсалициловой кислоты мало зависит от системной биодоступности, поскольку ацетилирование ЦОГ-1 в тромбоцитах происходит при их циркуляции в портальной системе печени. Максимальной концентрации ацетилсалициловая кислота в плазме крови достигает через 30-40 мин, период полувыведения препарата равен 15-20 мин.
Показания к применению ацетилсалициловой кислоты.
-
Первичная профилактика инфаркта миокарда у больных, относимых к группе высокого риска сердечно-сосудистых осложнений.
-
Вторичная профилактика и лечение тромботических осложнений у больных с клиническими проявлениями атеросклероза (инфаркт миокарда; нестабильная и стабильная стенокардия; послеоперационный период после коронарного шунтирования, чрезкожной коронарной ангиопластики или пластики периферических артерий, в том числе со стентированием; ишемический инсульт и транзиторная ишемическая атака; периферический атеросклероз).
-
Фибрилляция предсердий у больных с умеренным риском тромбоэмболических осложнений или у пациентов высокого риска при наличии противопоказаний для назначения варфарина.
-
Стеноз митрального клапана ревматической этиологии, если не назначены антикоагулянты непрямого действия.
-
В комбинации с варфарином у больных с искусственными клапанами сердца.
Противопоказания к применению ацетилсалициловой кислоты.
-
Непереносимость ацетилсалициловой кислоты.
-
Эрозивно-язвенное поражение пищеварительного тракта в фазе обострения.
-
Продолжающееся кровотечение.
-
Геморрагический диатез.
-
Tяжёлое заболевание печени.
-
Кормление грудью.
-
Бронхиальная астма.
-
Tяжёлые аллергические реакции на другие НПВС.
В большинстве рандомизированных клинических испытаний ацетилсалициловую кислоту в качестве антиагреганта применяли в диапазоне доз от 75 до 1500 мг. Установлено, что для профилактики и лечения тромботических осложнений показано использование 75-325 мг препарата в сутки. Назначение более высоких доз ацетилсалициловой кислоты не приводит к повышению эффективности, однако при этом увеличивается риск развития побочных реакций (со стороны пищеварительного тракта). В целях уменьшения прямого побочного действия ацетилсалициловой кислоты на желудок разработаны лекарственные формы, покрытые кишечно-растворимой оболочкой. Для достижения быстрого начала действия ацетилсалициловой кислоты у больных, ранее её не принимавших, рекомендуют разжевать и проглотить таблетку (160-325 мг). Внутривенное введение ацетилсалициловой кислоты не имеет преимуществ перед таблетированными формами препарата.
Известно, что у больных высокого риска ацетилсалициловая кислота снижает вероятность развития тяжёлых артериальных тромбозов приблизительно на 25%. Вместе с тем, несмотря на отчётливую клиническую эффективность и прекрасное соотношение цена/качество, у 10-20% пациентов, принимающих ацетилсалициловую кислоту, возникают повторные артериальные тромбозы. В связи с этим возник термин «резистентность к ацетилсалициловой кислоте». Необходимо изучение распространённости, механизмов развития, а также поиска оптимальных методов диагностики и лечения данного состояния. Tак, в настоящее время ни один из методов оценки функции тромбоцитов не рекомендован для контроля антитромбоцитарных эффектов ацетилсалициловой кислоты у больных, имеющих показания к применению данного лекарственного средства. Несмотря на то, что этиология артериальных тромбозов разнообразна, при выяснении причин резистентности к ацетилсалициловой кислоте в первую очередь надо выяснить, принимает ли в принципе препарат больной и соблюдает ли предписанный режим приёма препарата. Tакже уточняют факт приёма других НПВС.
Основные побочные эффекты ацетилсалициловой кислоты.
-
Желудочно-кишечные расстройства (тошнота, рвота, диспепсия).
-
Кровотечения (тяжёлые до 1-2% случаев).
Реже встречают аллергические реакции, бронхоспазм, метаболический алкалоз, нарушение функции печени и почек, синдром Рея у детей, обострение подагры, учащение приступов вазоспастической стенокардии, головокружение, головную боль, сыпь, отёки и повышение АД.
Установлено, что при совместном применении ацетилсалициловой кислоты с антитромботическими лекарственными средствами, растениями, обладающими антитромбоцитарной активностью (чеснок, женьшень, гингко и др.), а также алкоголем, глюкокортикоидами, НПВС повышен риск кровотечений. Кроме того, сочетание ацетилсалициловой кислоты с глюкокортикоидами и НПВС увеличивает риск образования язв в пищеварительном тракте. В настоящее время в целях профилактики образования язв нет оснований рекомендовать ингибиторы протонного насоса или цитопротекторы для рутинного применения у больных, получающих ацетилсалициловую кислоту в дозе 75-100 мг/сут.
Сочетанное применение ацетилсалициловой кислоты и НПВС (в силу конкуренции за связывание с участком ЦОГ-1) может вызвать ослабление антитромбоцитарного действия ацетилсалициловой кислоты.
Обсуждают вопросы ослабления антигипертензивных эффектов ряда ЛС (в частности, ингибиторов АПФ), хотя клиническое значение такого взаимодействия ещё предстоит уточнить.
ПРОИЗВОДНЫЕ ТИЕНОПИРИДИНА
Производные тиенопиридина клопидогрел и тиклопидин проявляют свои антитромбоцитарные свойства путём подавления агрегации тромбоцитов, индуцируемой аденозиндифосфатом. В основе механизма действия препаратов лежит необратимая блокада рецепторов к аденозиндифосфату типа P2Y12 на мембране тромбоцитов (предполагают, что при первом прохождении тиенопиридинов через печень происходит образование активных метаболитов, которые при участии цитохрома Р450 модифицируют этот тип рецепторов, при этом уменьшается количество мест связывания аденозиндифосфата). К влиянию тиенопиридинов чувствительны только 60-70% рецепторов к аденозиндифосфату. Препараты способны также подавлять агрегацию тромбоцитов, запускаемую коллагеном и тромбином. На метаболизм арахидоновой кислоты тиенопиридины не действуют.
Фармакокинетика. Основные фармакокинетические характеристики клопидогрела и тиклопидина приведены в табл. 21-48.
Таблица 21-48. Основные фармакокинетические характеристики производных тиенопиридина клопидогрела и тиклопидина
| Характеристика | Клопидогрел | Тиклопидин |
|---|---|---|
|
Биодоступность, % |
>50 |
80-90 |
|
Связывание с белками, % |
94-98 |
>98 |
|
Период полувыведения в плазме крови |
7-8 ч |
8-12 ч при однократном приёме |
|
Начало заметного угнетения агрегации тромбоцитов |
Первые 2 ч после нагрузочной дозы 300-600 мг |
2-е сутки |
|
Максимальное угнетение агрегации тромбоцитов |
2-5 ч после нагрузочной дозы 400-600 мг 3-7-е сут при применении в дозе 75 мг/сут |
3-7-е сутки |
Биодоступность тиклопидина увеличивается на 20% после приёма пищи и снижается на 20% после назначения антацидов. На абсорбцию клопидогрела приём пищи и антацидов не влияет. Начало действия и максимальный эффект производных тиенопиридина можно ускорить путём применения ударных доз препаратов. Содержание в крови тиклопидина увеличивается примерно в три раза при его применении в суточной дозе 500 мг на протяжении 2-3 нед. Нормализация агрегации тромбоцитов наступает после отмены клопидогрела в пределах 7 дней, а тиклопидина — 7-10 дней.
Показания к применению производных тиенопиридина клопидогрела и тиклопидина.
-
Вторичная профилактика тромботических осложнений у больных ИБС, ишемическим инсультом и транзиторной ишемической атакой, облитерирующим атеросклерозом нижних конечностей (в качестве альтернативы ацетилсалициловой кислоте).
-
Профилактика тромботических осложнений у больных ИБС при проведении коронарной ангиопластки и стентировании коронарных артерий (в сочетании с ацетилсалициловой кислотой).
-
В сочетании с ацетилсалициловой кислотой (для клопидогрела) у больных нестабильной стенокардией, инфарктом миокарда без подъёма и с подъёмом сегмента ST.
При обозначении показаний к применению производных тиенопиридина следует помнить о том, что во многих клинических ситуациях клопидогрел изучен в большей степени, чем тиклопидин. В согласительном документе экспертов Европейского общества кардиологов (2004) по применению антитромбоцитарных препаратов подчёркивается, что в настоящее время отсутствуют длительные крупные рандомизированные клинические испытания по прямому сравнению двух тиенопиридинов, однако непрямые сравнения свидетельствуют о меньшей частоте развития побочных эффектов при назначении клопидогрела по сравнению с тиклопидином. Tакже указано, что у тиклопидина нет таких утверждённых показаний, как недавно перенесённый инфаркт миокарда (в отличие от клопидогрела). Примечательно, что для такого показания, как профилактика тромботических осложнений при выполнении коронарной ангиопластики и стентировании коронарных артерий, в Рекомендациях по выполнению чрезкожных коронарных вмешательств (2005) упоминается режим дозирования и продолжительность лечения именно клопидогрелом, а не тиклопидином. Более того, назначение двух антиагрегантов (ацетилсалициловая кислота и клопидогрел) стандартно не только для больных стабильной ИБС, подвергаемых чрезкожным коронарным вмешательствам с имплантацией стента или без такового, но и для пациентов с острым коронарным синдромом с подъёмом и без подъёма сегмента ST.
Противопоказания к применению производных тиенопиридина клопидогрела и тиклопидина.
-
Активное кровотечение.
-
Гиперчувствительность.
-
Геморрагический диатез.
-
Нейтропения, тромбоцитопения.
-
Tромботическая тромбоцитопеническая пурпура (в анамнезе).
-
Tяжёлая печёночная недостаточность.
Особенности дозирования производных тиенопиридина состоят в необходимости назначения нагрузочной дозы препаратов (более высокая доза обеспечивает более быстрое начало действия): одномоментно для клопидогрела — 300-600 мг, а тиклопидина — 500 мг. Для длительного приёма препаратов рекомендуют следующие дозы производных тиенопиридина — для клопидогрела 75 мг один раз в сутки, а для тиклопидина — 250 мг два раза в сутки. Длительность терапии определяет клиническая ситуация, в том числе и характеристика имплантированного стента. Tак, клопидогрел назначают на 3-4 нед при имплантации металлического стента и на 6-12 мес при использовании стента с лекарственным покрытием.
Как и в случае с ацетилсалициловой кислотой, имеются сообщения о недостаточном угнетении агрегации тромбоцитов у ряда больных, получающих клопидогрел (резистентность к клопидогрелу). Клиническое значение резистентности к клопидогрелу остаётся неясным. В качестве возможных механизмов этого явления выдвигают позиции, связанные с биодоступностью, всасыванием клопидогрела, взаимодействием с другими препаратами и др.
В начале терапии производными тиенопиридина необходимо контролировать содержание тромбоцитов в крови, при снижении менее 80х109 /л препараты следует отменить. В первые три месяца лечения тиклопидином следует определять лейкоцитарную формулу крови (раз в две недели). При содержании нейтрофилов ниже 1,2х109/л препарат необходимо отменить.
Основные побочные эффекты производных тиенопиридина.
-
Кровотечения.
-
Нейтропения, тромбоцитопения, редко агранулоцитоз и апластическая анемия.
-
Tромбоцитопения и тромбоцитопеническая пурпура.
Установлены различия в частоте развития побочных эффектов при применении клопидогрела и тиклопидина. Например, при назначении тиклопидина у больных, подвергнутых коронарной ангиопластике со стентированием, в два раза чаще встречались такие побочные эффекты, как крупные кровотечения, тромбоцитопения и нейтропения, чем у пациентов, получавших клопидогрел (исследование CLASSICS, 2000). Кроме того, при назначении чаще отмечают аллергические реакции, кожную сыпь, зуд, боль в животе, тошноту, рвоту, диарею, холестатическую желтуху и повышение активности печёночных ферментов.
При сочетании производных тиенопиридина с другими антитромбоцитарными лекарственными средствами повышен риск развития кровотечений. Появившееся утверждение о способности аторвастатина снижать активность клопидогрела in vitro посредством конкурентного подавления цитохрома P450 3A4 в последующем не было подтверждено в специальных анализах (CREDO, 2002; регистр MITRA PLUS, 2003). Доказано, что тиклопидин взаимодействует с дигоксином, циклоспорином (уменьшение их концентрации) и теофиллином (увеличение концентрации). При сочетании с циметидином концентрация тиклопидина увеличивается.
Данных об экскреции производных тиенопиридина с грудным молоком нет, однако их использование при кормлении грудью не рекомендовано.
В случае планируемого крупного хирургического вмешательства, связанного с высоким риском кровотечения, клопидогрел следует отменить за 5-7 дней, а тиклопидин — за 10-14 дней до операции.
БЛОКАТОРЫ ГЛИКОПРОТЕИНОВЫХ IIB/IIIA РЕЦЕПТОРОВ ТРОМБОЦИТОВ
Для данной группы препаратов характерно торможение конечного этапа агрегации тромбоцитов, а именно процесса построения тромбоцитарного тромба посредством образования мостиков между соседними активированными тромбоцитами. Препараты блокируют участок взаимодействия активированных гликопротеинов IIb/IIIa на поверхности тромбоцитов с фибриногеном, фактором фон Виллебранда и другими адгезивными молекулами.
Абциксимаб стал первым представителем группы блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов, применённым в терапевтических целях у больных с острым коронарным синдромом. Препарат изготовлен на основе моноклональных антител к IIb/IIIa гликопротеинам мембраны тромбоцитов. Абциксимаб обладает сродством не только к гликопротеиновым IIb/IIIa рецепторам на мембране тромбоцитов (αII bβ3), но и к рецепторам к витронектину на поверхности эндотелия (αν β3) и рецепторам МАС-1 лейкоцитов (αm β3 ). После внутривенного введения в виде болюса абциксимаб быстро и прочно связывается гликопротеинами IIb/IIIa на поверхности тромбоцитов (приблизительно 2/3 лекарственного вещества в течение нескольких минут связываются с рецепторами, а свободный препарат элиминируется из плазмы). Абциксимаб отличает от других блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов (тирофибана8 и эптифибатида8) больший размер молекулы, более продолжительное и прочное связывание с рецепторами тромбоцитов и короткий период циркуляции в плазме. Период полувыведения из плазмы составляет 26 мин, для поддержания постоянной концентрации препарата в крови необходима внутривенная инфузия. После прекращения инфузии абциксимаба концентрация препарата снижается в течение первых 6 ч, при этом агрегация тромбоцитов нормализуется через 48 ч, а время кровотечения — через 24 ч. Молекулы абциксимаба, находящиеся в связанном состоянии, могут переходить на гликопротеины IIb/IIIa новых тромбоцитов, поступающих в кровоток. Связанный с тромбоцитами абциксимаб определяют в плазме крови в течение более 14 дней после прекращения внутривенной инфузии препарата.
Тирофибан 8 — производное тирозина, непептидный селективный антагонист гликопротеиновых IIb/IIIa рецепторов тромбоцитов. Препарат начинает действовать в первые минуты внутривенного введения. В плазме крови определяют 35% препарата, не связанного с белками (фармакологически активная часть препарата). Период полувыведения тирофибана8 составляет около 2 ч. Обратимость действия препарата равна 4-8 ч. Экскреция препарата происходит через почки (65%), остальная часть (35%) через пищеварительный тракт.
Эптифибатид 8 — синтетический пептид (циклический гептапептид), который высокоселективен в отношении гликопротеиновых IIb/IIIa рецепторов тромбоцитов. После внутривенной инфузии болюсом максимальная концентрация эптифибатида8 в плазме крови достигается в течение 5 мин, а затем снижается (для поддержания концентрации препарата необходима последующая инфузия). 25% лекарственного вещества связывают белки крови. Эптифибатид8 начинает действовать в первые минуты внутривенного введения. Период полувыведения в плазме крови составляет 2,5 ч. Как и у тирофибана8, обратимость действия эптифибатида8 равна 4-8 ч. Препарат выводят преимущественно почки.
Показания к применению блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов.
-
Раннее лечение острого коронарного синдрома без подъёма сегмента ST на ЭКГ у больных высокого риска (особенно при повышенной активности тропонинов, депрессии сегмента ST, наличии сахарного диабета) — эптифибатид8 или тирофибан8 (в добавление к пероральным антитромбоцитарным средствам).
-
Чрескожные коронарные вмешательства (ангиопластика, стентирование).
Если выполнение чрескожного коронарного вмешательства возможно в ближайшие 2,5 ч с момента поступления больного с острым коронарным синдромом в стационар, то оправданным считают использование абциксимаба (12 ч) или эптифибатида 8 (16 ч) прямо в ангиографической операционной. Если вмешательство у больных острым коронарным синдромом высокого риска возможно, но в более поздние сроки (2,5-48 ч), следует назначить инфузию тирофибана8 или эптифибатида8 с момента госпитализации до ангиографии с продолжением введения этих средств после вмешательства. В случае отсроченного выполнения вмешательства (позднее 48 ч) у больных высокого риска препарат выбора — абциксимаб, вводимый в ангиографической операционной. У больных острым коронарным синдромом с подъёмом сегмента ST на ЭКГ применение блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов в рамках консервативного лечения (включающего тромболитическую терапию) не показано. В случае проведения чрезкожного коронарного вмешательства показана инфузия абциксимаба.
Рутинное использование блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов у больных стабильной ИБС, подвергаемых чрескожным коронарным вмешательствам, не показано. Исключение могут составить пациенты с угрозой или острым закрытием просвета артерии, комплексным повреждением, выявляемыми тромбами, феноменом no slow-reflow.
В качестве альтернативы блокаторам гликопротеиновых IIb/IIIa рецепторов тромбоцитов у больных с острым коронарным синдромом можно рассмотреть ингибитор тромбина прямого действия бивалирудинP.
Позитивные результаты, которые были получены в рандомизированных клинических испытаниях при внутривенном введении блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов больным с острым коронарным синдромом, способствовали созданию препаратов для перорального применения (ксемилофибанP, орбофибанP, сибрафибанP, лотрафибанP). Однако надежды на получение положительных эффектов при долгосрочном приёме препаратов у больных с острым коронарным синдромом не оправдались — они не оказались более эффективны, чем ацетилсалициловая кислота, при сочетании с ней не превосходили плацебо и могли повышать смертность.
Противопоказания к применению блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов.
-
Гиперчувствительность.
-
Продолжающееся кровотечение или кровоточивость в предшествующий месяц, крупное хирургическое вмешательство или травма в предшествующие 6 нед.
-
Острое нарушение мозгового кровообращения (в предшествующие 30 сут для тирофибана8 и эптифибатида8 и 2 года для абциксимаба), остаточные неврологические нарушения, геморрагический инсульт в анамнезе.
-
Геморрагический диатез.
-
Использование антикоагулянтов непрямого действия в предшествующие 7 сут (за исключением случаев, когда МНО не превышает 1,2).
-
Количество тромбоцитов менее 100х109/л.
-
Внутричерепные новообразования, пороки развития артериовенозной системы, аневризмы.
-
Tяжёлая неконтролируемая артериальная гипертензия.
-
Tяжёлая почечная недостаточность (тирофибан8, эптифибатид8).
-
Одновременное использование другого блокатора гликопротеиновых IIb/IIIa рецепторов тромбоцитов.
В проведённых рандомизированных клинических испытаниях с блокаторами гликопротеиновых IIb/IIIa рецепторов тромбоцитов использовались одинаковые дозы препаратов. Рекомендаций относительно индивидуального подбора дозы при использовании этих препаратов пока нет. При внутривенном введении блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов необходимо контролировать содержание тромбоцитов, уровень гемоглобина, гематокрит, а также искать признаки кровотечения.
Основные побочные эффекты: кровотечения (риск снижается при отказе от избыточных доз гепарина натрия, быстром выполнении инвазивных процедур и удалении проводника), тромбоцитопения (может появиться в первые часы после начала введения препаратов и обычно исчезает после их отмены), а также артериальная гипотония, тошнота, рвота, боль в животе, головная боль, головокружение и боль в спине.
При необходимости быстрого устранения антитромбоцитарного действия блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов обычно достаточно отмены препаратов (тирофибан8, эптифибатид8), при использовании абциксимаба возможно переливание свежих тромбоцитов.
Данных об экскреции блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов с грудным молоком нет, их использование при кормлении грудью не рекомендовано.
Блокаторы гликопротеиновых IIb/IIIa рецепторов тромбоцитов можно комбинировать с антитромбоцитарными препаратами и антикоагулянтами, при этом выбор комбинации должен учитывать не только угрозу развития тромботических событий, но и риск развития кровотечений. Препараты оказывают своё положительное действие у больных, подготовленных к чрескожным коронарным вмешательствам с помощью комбинированной антитромбоцитарной терапии (ацетилсалициловая кислота и клопидогрел, в том числе при использовании последнего в удвоенной нагрузочной дозе).
Несмотря на то, что отличительная особенность блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов — способность воздействовать на общий конечный этап агрегации тромбоцитов (что позволяет рассчитывать на универсальность антиагрегантного действия препаратов), как и в случае с ацетилсалициловой кислотой и клопидогрелом, возник термин «резистентность к антагонистам гликопротеиновых IIb/IIIa рецепторов тромбоцитов» (на основании вариабельности степени подавления агрегации тромбоцитов у различных больных). Клиническое значение такой резистентности ещё предстоит уточнить.
ДИПИРИДАМОЛ
Хотя дипиридамол традиционно и упоминают в качестве антиагрегантного средства (препарат ингибирует фосфодиэстеразу и повышает содержание цАМФ в тромбоцитах, кроме того, стимулирует высвобождение простациклина эндотелиальными клетками, угнетает образование тромбоксана А2), его сочетание с ацетилсалициловой кислотой не обеспечивает дополнительного снижения частоты развития неблагоприятных сердечно-сосудистых событий (Antithrombotic Trialists Collaboration, 2002). Установлено, что комбинация дипиридамола (форма с замедленным высвобождением, 200 мг 2 раза в день) в сочетании с низкой дозой ацетилсалициловой кислоты снижает риск повторных инсультов у больных, перенёсших ишемический инсульт и транзиторную ишемическую атаку (не кардиоэмбологенного происхождения). Дипиридамол не рекомендован для применения у больных ИБС.
СПИСОК ЛИТЕРАТУРЫ
Лечение острого коронарного синдрома без стойких подъёмов сегмента ST на ЭКГ. Российские рекомендации // Кардиология. — 2004. — № 4. — С. 1-28.
Antithrombotic Trialists’ Collaboration. Prevention of Death, Myocardial infarction and stroke by antiplatelet therapy in high-risk patients // BMJ. — 2002. — Vol. 324. — P. 71-86.
Expert Consensus Document on the Use of Antiplatelet Agents // Eur. Heart J. — 2004. — Vol. 25. — P. 166-181.
Guidelines for Percutaneous Coronary Interventions // Eur. Heart J. — 2005. — Vol. 26. — P. 804-847.
Guidelines for the diagnosis and treatment of non-ST -segment elevation acute coronary syndromes // Eur. Heart J. — 2007.
Patrono C., Coller B., Dalen J.E. et al. Platelet-Active Drugs: The relationships among dose, effectiveness, and side effects // Chest. — 2001. — Vol. 119. — P. 39-63.
Антикоагулянты
Антикоагулянты — ЛС, препятствующие тромбообразованию путём воздействия на плазменные факторы свёртывания крови.
Антикоагулянты в основном тормозят появление нитей фибрина и способствуют прекращению роста уже возникших тромбов, противодействуя влиянию тромбина на фибрин. Антикоагулянты также усиливают воздействие на тромбы эндогенных фибринолитических ферментов.
Антикоагулянты делят на две группы:
-
антикоагулянты прямого действия — взаимодействуют непосредственно с факторами свёртывания крови, эффективны in vitro и in vivo;
-
антиакоагулянты непрямого действия (антагонисты витамина K*) — длительного действия, действуют только in vivo и после латентного периода.
Антикоагулянты прямого действия применяют парентерально при необходимости в быстром наступлении эффекта.
Антикоагулянты непрямого действия нарушают синтез в печени факторов свёртывания крови, действуют длительно и назначают их внутрь.
АНТИКОАГУЛЯНТЫ ПРЯМОГО ДЕЙСТВИЯ
К антикоагулянтам прямого действия относят гепарин*, который бывает нефракционированным и фракционированным (низкомолекулярным), а также селективные ингибиторы тромбина прямого действия, которые, однако, в клинической практике в РФ ещё не применяют. Кроме того, к прямым антикоагулянтам относят фондапаринукс натрия — синтетический препарат, обладающий сходным с гепарином* действием.
Нефракционированный (стандартный) гепарин* (гепарин натрия)
Получают из лёгких крупного рогатого скота и слизистой оболочки кишечника свиней. Гепарин* связывается антитромбином III, вызывает конформационные изменения в его молекуле и ускоряет комплексирование антитромбина III с серинпротеазами системы коагуляции; в результате блокируется тромбин, ферментативная активность активированных факторов IX, X, XI, XII, плазмина и калликреина.
Наиболее высокую биодоступность отмечают при внутривенном введении. После внутривенного введения действие начинается немедленно, период полувыведения (T1/2) составляет 1 ч. При подкожном введении биодоступность низкая (10-40%), T1/2 составляет 1-2 ч.
Гепарин* в плазме находится в основном в связанном с белками состоянии, интенсивно захватывается эндотелиальными клетками и клетками мононуклеарномакрофагальной системы, что служит причиной изменчивого антикоагулянтного действия препарата.
Экскреция гепарина* происходит через почки в виде метаболитов, и только при введении высоких доз возможна экскреция в неизменённом виде.
Гепарин* снижает вязкость крови, уменьшает проницаемость сосудов, стимулированную брадикинином, гистамином и другими эндогенными факторами, и препятствует развитию стаза.
Показания
Нестабильная стенокардия, острый инфаркт миокарда; тромбоэмболические осложнения при инфаркте миокарда, операциях на сердце и кровеносных сосудах; тромбоэмболия лёгочных и мозговых сосудов, тромбофлебиты (профилактика и лечение); ДВС-синдром, профилактика микротромбообразования и нарушения микроциркуляции; тромбоз почечных вен; мерцательная аритмия, митральные пороки сердца (профилактика тромбообразования); бактериальный эндокардит; гломерулонефрит; волчаночный нефрит; ревматизм; бронхиальная астма; проведение экстракорпоральных методов (экстракорпоральное кровообращение при операции на сердце, гемосорбция, гемодиализ, перитонеальный диализ), форсированного диуреза; промывание венозных катетеров.
Противопоказания
Геморрагический диатез, лейкозы, анемии, повышенная проницаемость сосудов, полипы, злокачественные новообразования и язвенные поражения пищеварительного тракта, тяжёлые нарушения функции печени и почек, операции на мозге и позвоночнике.
Побочные действия
Головокружение, головные боли, тошнота, анорексия, рвота, диарея, алопеция; ранние и поздние (аутоиммунные) тромбоцитопении; геморрагические осложнения — кровотечения в пищеварительном или мочевом тракте, ретроперитонеальные кровоизлияния в яичники, надпочечники (с развитием острой надпочечниковой недостаточности); остеопороз, кальцификация мягких тканей, угнетение синтеза альдостерона, повышение уровня трансаминаз в крови, аллергические реакции (лихорадка, высыпания, бронхиальная астма, анафилактоидная реакция), местное раздражение, гематома, болезненность при введении.
Взаимодействие
Эффективность усиливается ацетилсалициловой кислотой, декстраном, тетрациклинами, фенилбутазоном, ибупрофеном, индометацином, варфарином, этил бискумацетатом (возрастает риск кровотечений); ослабляется — сердечными гликозидами, антигистаминными препаратами, этакриновой кислотой.
Меры предосторожности
При применении нефракционированного гепарина необходимо определение активированного частичного тромбопластинового времени. Учитывают относительное увеличение активированного частичного тромбопластинового времени по отношению к контрольным значениям для данной лаборатории.
Низкомолекулярные (фракционированные) гепарины
Гепарины с низкой молекулярной массой, или низкомолекулярные гепарины, получают путём химической или ферментативной деполимеризации нефракционированного гепарина. Они составляют примерно 1/3 размера его молекулы. Низкомолекулярные гепарины состоят из смеси полисахаридов со средней молекулярной массой 4000-6000 Да. Механизм влияния нефракционированного и низкомолекулярного гепарина* на факторы свёртывания крови сходен, однако есть различия в антикоагулянтных свойствах, биодоступности, фармакокинетике и действии на тромбоциты.
Низкомолекулярные гепарины* в отличие от нефракционированных гепаринов* обладают преимущественно анти-Xa-фактором активностью, в меньшей степени блокируя непосредственно тромбин. Соотношение: антитромбин/анти-Xaфактор активности у нефракционированного гепарина составляет 1/1, а у разных низкомолекулярных гепаринов — от 1/1,5 до 1/4.
Низкомолекулярные гепарины меньше связываются с белками плазмы, макрофагами и эндотелиальными клетками, что обеспечивает лучшую биодоступность его небольших доз и быструю всасываемость из подкожных депо. При подкожном введении биодоступность низкомолекулярных гепаринов достигает 90%. Анти-Xa активность низкомолекулярных гепаринов сохраняется 12 ч и более, следовательно, необходимый уровень антикоагуляции можно поддерживать 1-2 подкожными инъекциями препарата в сутки.
Низкомолекулярные гепарины меньше влияют на тромбоциты и реже вызывают развитие тромбоцитопений, а следовательно, и геморрагических осложнений при его применении. В общем, антикоагуляционное действие низкомолекулярных гепаринов более предсказуемо и стабильно, чем действие нефракционированного гепарина.
В настоящее время известно множество низкомолекулярных гепаринов, из которых в нашей стране чаще применяют: надропарин кальция (фраксипарин*), эноксапарин натрия (клексан*), далтепарин натрия (фрагмин*), ревипарин натрия8 (кливарин8).
Необходимо отметить, что различные низкомолекулярные гепарины отличаются друг от друга по физико-химическим, биологическим и фармакокинетическим свойствам, что обусловлено различной технологией их производства. В связи с этим недопустимо переносить данные по показаниям, эффективности и безопасности с одного низкомолекулярного гепарина на другие. С позиций доказательной медицины существуют различия в показаниях к применению отдельных низкомолекулярных гепаринов. Так, если применение надропарина кальция, эноксапарина натрия и дальтепарина натрия показано практически при всех клинических ситуация, когда необходимо снижение коагуляционной активности плазмы, то эффективность ревипарина натрия8 доказана только при лечении тромбоэмболии лёгочной артерии, тромбоза глубоких вен нижних конечностей и при профилактике венозного тромбоза у хирургических больных.
Контроль за терапией низкомолекулярных гепаринов можно осуществлять по определению анти-Xa-фактора активности. Определение активированного частичного тромбопластинового времени не полностью характеризует антитромботическую активность низкомолекулярных гепаринов. Однако, учитывая достаточно предсказуемую фармакокинетику низкомолекулярных гепаринов, при дозировании препарата достаточно ориентироваться только на массу тела больного.
Низкомолекулярные гепарины вводят в подкожную клетчатку живота каждые 12 ч.
Показания и противопоказания
Tакие же, как для нефракционированного гепарина.
Фондапаринукс натрия
Фондапаринукс натрия — синтетический пентасахарид, который так же, как и гепарин*, связывается с антитромбином III и многократно усиливает способность последнего связывать активированный Х фактор свёртывания крови. При этом в отличие от препаратов гепарина* влияние фондапаринукса натрия не затрагивает другие ферменты, участвующие в процессе коагуляции.
Препарат практически полностью всасывается из подкожной клетчатки, мало взаимодействует с белками и клетками крови, а также обладает длительным периодом полувыведения, который составляет около 17 и 21 ч у молодых и пожилых здоровых лиц соответственно.
Всё это обусловливает достаточно предсказуемое действие и возможность обеспечить достаточное влияние на свёртывающую систему крови при подкожных инъекциях не чаще 1 раза в сутки.
При применении фондапаринукса натрия не описано случаев иммунной тромбоцитопении. Имеются сообщения о возможности использования этого препарата у больных с эпизодами иммунной тромбоцитопении, вызванной гепаринотерапией и даже при лечении этого опасного осложнения.
Фондапаринукс натрия выводится почками, и его период полувыведения заметно возрастает по мере снижения клиренса креатинина, что способствует кумуляции.
Эффективность фондапаринукса натрия была показана при лечении больных острым коронарным синдромом без стойких подъёмов сегмента ST на ЭКГ, где препарат показал большую геморрагическую безопасность по сравнению с эноксапарином натрия. У больных инфарктом миокарда со стойкими подъёмами сегмента ST использование фондапаринукса натрия способствовало снижению частоты неблагоприятных исходов, особенно при проведении тромболитической терапии стрептокиназой, а также отсутствии реперфузионного лечения. Изучение препарата продолжается.
АНТИКОАГУЛЯНТЫ НЕПРЯМОГО ДЕЙСТВИЯ
Антикоагулянты непрямого действия не влияют на кровь вне организма, эффективны при приёме внутрь, их действие реализуется через белки протромбинового комплекса, у них имеется общий антагонист — витамин K*. Общее также и время появления противотромботического эффекта — в среднем через 3-5 дней.
Xaрактеризуя механизм действия оральных антикоагулянтов, необходимо отметить, что в отличие от других ЛС, тормозящих формирование фибрина (гепарина* , дефибринаторов), антикоагулянты непрямого действия препятствуют образованию в гепатоците полноценных в коагуляционном плане II, VII, IX и Х факторов свёртывания крови, вызывая состояние гипокоагуляции.
По химической структуре антикоагулянты непрямого действия можно подразделить на три подгруппы:
-
производные монокумарина (варфарин, аценокумарол);
-
кумарина (этил бискумацетат);
-
индандиона (фениндион).
С клинической же точки зрения эти препараты отличаются друг от друга по способности адсорбироваться в пищеварительном тракте, продолжительности периода полувыведения, частоте вызываемых побочных проявлений.
Варфарин — препарат выбора, так как обеспечивает наиболее стабильное антикоагуляционное действие, кроме того, он имеет лучшую доказательную базу в отношении эффективности и безопасности применения. Аценокумарол уступает варфарину по эффективности и безопасности. Производные индандиона обладают подобным кумаринам антикоагулянтным действием, но часто вызывают побочные эффекты (токсическое влияние на печень и многообразные кожные проявления). Производные индандиона можно назначать больным, имевшим аллергические реакции на производные кумарина или хорошо переносящим длительный приём препарата.
Варфарин
Ингибирует синтез витамин К-зависимых факторов свёртывания крови (II, VII, IX X) в печени, снижает их концентрацию в плазме и замедляет процесс свёртывания крови.
Фармакокинетика
Всасывается из пищеварительного тракта практически полностью. Связывание с белками плазмы — 97-99%, терапевтическая концентрация в плазме — 1-5 мкг/мл. Метаболизируется в печени с образованием неактивных или малоактивных соединений, которые реабсорбируются из жёлчи. Выводится почками, Т1/2 — 40 ч.
Фармакодинамика
Действие проявляется на 3-5-й день от начала применения и прекращается через 3-5 дней после отмены.
Показания
Профилактика тромбозов и тромбоэмболии. Кратковременно — при остром тромбозе вен и тромбоэмболии лёгких (в комбинации с гепарином*), постоперационном тромбозе, остром инфаркте миокарда, хирургическом и тромболитическом лечении тромбозов, проведении кардиоверсии в случае трепетания предсердий. Длительно — при рецидивирующем тромбозе вен и тромбоэмболии лёгочной артерии, протезировании клапанов сердца и сосудов (возможно, в комбинации с ацетилсалициловой кислотой), ИБС, транзиторных приступах ишемии, вторичной профилактике сердечного приступа, хроническом мерцании предсердий, тромбозе периферических артерий.
Противопоказания
Острое кровотечение, выраженные нарушения функции печени и почек, тяжёлая артериальная гипертензия, беременность.
Побочные действия
Кровоизлияния (не более 1%), редко — васкулит, диарея, повышение активности печёночных ферментов, экзема, некроз кожи, выпадение волос.
Способ применения и дозы
Внутрь, в одно и то же время суток. Начальная доза 2,5-5 мг. В дальнейшем дозу подбирают в соответствии с МНО, которое должно достигать 2,2-4,4 в зависимости от заболевания и индивидуальных особенностей больного. При длительном назначении контроль свёртываемости крови следует проводить каждые 4-8 нед по показателю МНО.
Следует соблюдать особую осторожность у больных с эндогенными нарушениями свёртываемости крови, тромбоцитопении, выраженной гипертензией, язвенной болезнью желудка и двенадцатиперстной кишки в стадии обострения, нарушением функций печени и почек, кровоизлияниями в мозг, алкоголизмом. Потребление алкоголя увеличивает опасность гипопротромбинемических кровотечений. К особенности диеты относится исключение зелёного чая, шпината, салата.
ПРИМЕНЕНИЕ АНТИКОАГУЛЯНТОВ ПРИ ОСТРОМ КОРОНАРНОМ СИНДРОМЕ
Нефракционированный гепарин*
Изначально применение нефракционированного гепарина показано всем больным с острым коронарным синдромом без стойкого подъёма сегмента ST (нестабильной стенокардией и инфарктом миокарда, не сопровождающимся подъёмами сегмента ST), не имеющим противопоказаний. Через 6-12 ч терапию продолжают только у больных из группы с высоким риском, а у больных с низким риском достаточно дальнейшего применения антитромбоцитарных средств. Схема применения нефракционированного гепарина: внутривенно — болюс 60-80 ЕД/кг (но не более 5000 ЕД), затем инфузия 12-18 ЕД/кг в час (но не более 1250 ЕД/ч) в течение 48 ч. Скорость введения гепарина* определяют по величине активированного частичного тромбопластинового времени, которая должна быть увеличена в 1,5-2,5 раза по сравнению с нормальным значением этого показателя для лаборатории данного лечебного учреждения. Активированное частичное тромбопластиновое время рекомендуют определять через каждые 6 ч. Если при двух последовательных определениях активированного частичного тромбопластинового времени данный показатель сохраняется в терапевтических пределах, анализ проводят 1 раз в сутки.
При остром коронарном синдроме со стойким подъёмом сегмента ST (инфаркт миокарда с подъёмом сегмента ST) гепарин* показан больным с повышенным риском тромбоэмболических осложнений (обширный инфаркт миокарда, передняя локализация инфаркта миокарда, мерцательная аритмия, тромбоэмболии в анамнезе, документированный тромб в левом желудочке) по схеме: внутривенно — болюс 60 ЕД/кг (но не более 4000 ЕД), затем инфузия 12 ЕД/кг в час (но не более 1000 ЕД/ч) в течение 48 ч, с подбором дозы, поддерживающей значение активированного частичного тромбопластинового времени в 1,5-2,5 раза выше по сравнению с нормальным значением этого показателя для лаборатории данного лечебного учреждения. При наличии у больного факторов риска развития тромбоза глубоких вен нижних конечностей и тромбоэмболии лёгочной артерии нефракционированный гепарин применяют подкожно 7500 ЕД 2 раза в сутки без контроля активированного частичного тромбопластинового времени (в случаях когда более высокие дозы нефракционированного гепарина не назначены по другим показаниям).
В отношении применения гепарина* при проведении тромболититической терапии при инфаркте миокарда однозначного мнения на сегодняшний день нет, прежде всего, из-за увеличения риска геморрагических инсультов (особенно у больных артериальной гипертензией и при использовании в качестве тромболитика тканевого активатора плазминогена). В рекомендациях Европейского общества кардиологов по лечению инфаркта миокарда указано, что гепарин* не способствует более быстрому лизису тромба, но при его назначении улучшается проходимость поражённой инфарктсвязанной артерии. Tем не менее гепарин* не предотвращает реокклюзию инфарктсвязанной артерии после успешного тромболизиса.
Низкомолекулярные гепарины
Низкомолекулярные гепарины не имеют преимуществ перед нефракционированным гепарином по способности снижать риск развития инфаркта миокарда и смерти у больных с НС и инфарктом миокарда без зубца Q. В то же время низкомолекулярные гепарины отличает простота применения: их вводят подкожно в фиксированной дозе, не требуя применения инфузионного насоса и лабораторного контроля. Tолько для эноксапарина натрия было показано преимущество перед нефракционированным гепарином по уменьшению риска развития суммы «коронарных событий» (смерть, инфаркт миокарда, рецидив стенокардии) и частоты экстренных операций реваскуляризации миокарда. Однако длительное применение низкомолекулярных гепаринов увеличивает риск кровотечений.
Несмотря на более высокую стоимость низкомолекулярных гепаринов, их применение особенно оправдано в медицинских учреждениях, не имеющих возможности обеспечить эффективный контроль при использовании нефракционированного гепарина (регулярное исследование активированного частичного тромбопластинового времени).
В отношении антикоагулянтов непрямого действия имеются сведения о том, что прогноз больных, перенёсших острый коронарный синдром, возможно существенно улучшить за счёт включения в состав комплексной терапии непрямого антикоагулянта варфарина. Однако широкое применение варфарина во вторичной профилактике ИБС ограничивает необходимость регулярного контроля антикоагуляционного эффекта по величине МНО.
ПРИМЕНЕНИЕ АНТИКОАГУЛЯНТОВ ПРИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
При фибрилляции предсердий антикоагулянты назначают с целью профилактики системных тромбоэмболий, особенно «нормализационных» эмболий, возникающих после нормализации ритма сердца.
Профилактически применяют антикоагулянты непрямого действия у больных старше 65 лет с пароксизмами фибрилляции предсердий, длительностью более 48 ч или постоянной формой фибрилляции предсердий. Больным моложе 65 лет — при наличии в анамнезе ишемического инсульта, инфаркта миокарда, сахарного диабета, дилатации левого предсердия, застойной сердечной недостаточности и других факторов риска системных тромбоэмболий. Рекомендуют назначать варфарин внутрь 5-10 мг/сут 2-4 дня до достижения МНО 2,0-3,0 при отсутствии и 3,0-4,0 при наличии ревматического поражения сердца. Затем назначают поддерживающую дозу (2-10 мг/сут) под контролем МНО не реже 1 раза в месяц.
Для профилактики «нормализационных» эмболий антикоагулянты назначают не менее чем на 3 нед до кардиоверсии и на 4 нед после неё по схеме, описанной выше.
ПРИМЕНЕНИЕ АНТИКОАГУЛЯНТОВ ПРИ ТРОМБОЗЕ ГЛУБОКИХ ВЕН И ТРОМБОЭМБОЛИИ ЛЁГОЧНОЙ АРТЕРИИ У ТЕРАПЕВТИЧЕСКИХ БОЛЬНЫХ
Показания к профилактическому применению антикоагулянтов у терапевтических больных изучены недостаточно. Рекомендуют профилактическое назначение гепарина* у больных с ишемическим инсультом и при наличии таких факторов риска, как инфаркт миокарда, тяжёлая сердечная и дыхательная недостаточность, злокачественные опухоли и т.д. Назначают нефракционированный гепарин подкожно по 5000 ЕД 2-3 раза в сут в течение 1-2 нед или низкомолекулярные гепарины на тот же срок.
В терапии тромбоза глубоких вен и тромбоэмболии лёгочной артерии применение антикоагулянтов обязательно. Лечение начинают с назначения нефракционированного гепарина по схеме: внутривенно — болюс 80 ЕД/кг, затем инфузия 18 ЕД/кг в час (но не менее 1250 ЕД/ч) в течение 48 ч, с подбором дозы, поддерживающей значение активированного частичного тромбопластинового времени в 1,5-2,5 раза выше по сравнению с нормальным значением этого показателя для лаборатории данного лечебного учреждения. Если проведение постоянной инфузионной терапии гепарином обеспечить невозможно, допустимо применение гепарина* в виде подкожных инъекций по схеме: внутривенно — болюс 30005000 ЕД, затем подкожно 250 ЕД/кг, затем по 250 ЕД/кг 2 раза в сут с подбором дозы по значению активированного частичного тромбопластинового времени. Продолжительность гепаринотерапии должна быть не менее 7 сут. При тромбозе глубоких вен и тромбоэмболии лёгочной артерии (кроме тяжёлой формы) допустимо применение вместо нефракционированного гепарина низкомолекулярного гепарина в виде подкожных инъекций.
Антикоагулянты непрямого действия назначают одновременно с гепарином за 3-4 дня до его отмены, начиная с минимальных терапевтических доз. Tак, варфарин назначают в начальной дозе 2,5-5 мг/сут. Гепарин* отменяют при достижении уровня МНО 2,0-3,0, сохраняющегося в течение двух дней подряд.
Продолжительность терапии антикоагулянтами непрямого действия после эпизода тромбоза глубоких вен и тромбоэмболии лёгочной артерии зависит от сохранения факторов риска и причин возникновения тромбозов и должна составлять от 3 мес до пожизненного приёма препарата.
СПИСОК ЛИТЕРАТУРЫ
Баркаган З.С., Мамот А.П., Тараненко И.А. и др. Основы пролонгированной профилактики и терапии тромбоэмболий антикоагулянтами непрямого действия (показания, подбор доз, лабораторный мониторинг). — М., 2004.
Рациональная фармакотерапия сердечно-сосудистых заболеваний: Руководство для практикующих врачей / Под общ. ред. Е.И. Чазова, Ю.Н. Беленкова. — М.: Литтерра, 2006. — 971 с.
ACC/AHA Guidelines for the Management of Patients With Unstable Angina and Non-STSegment Elevation Myocardial Infarction. A Report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Unstable Angina) // JACC. — 2000. — Vol. 36. — P. 970-1062.
Albers G., Dalen J., Laupacis A. et. al. Antithrombotic Therapy in Atrial Fibrillation // Chest. — 2001. — Vol. 119. — P. 194-206.
Camm A. Atrial fibrillation: is there a role for low-molecular-weight heparin? // Clin. Cardiol. — 2001. — Vol. 24 (Suppl. 3). — P. 115-119.
Hirsh J., Anand S., Halperin J., Fuster V. Guide to Anticoagulant Therapy: Heparin. A Statement for Healthcare Professionals From the American Heart Association // Circulation. — 2001. — Vol. 103. — P. 2994-3018.
Hirsh J., Fuster V., Ansell J., Halperin J. AHH/ACC Foundation Guide to Warfarin Therapy // Circulation. — 2003. — Vol. 107. — P. 1692.
Hurlen M., Abdelnoor M., Smith P. et al. Warfarin, aspirin or both after myocardial infarction // N. Engl. J. Med. — 2002. — Vol. 347. — P. 969-974.
The OASIS-6 Trial Group. Effects of Fondaparinux on Mortality and Reinfarction in Patients With Acute ST-Segment Elevation Myocardial Infarction. The OASIS-6 Randomized Trial // J.A.M.A. — 2006. — Vol. 295. — P. 1519-1530.
The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST -segment elevation // Eur. Heart J. — 2003. — Vol. 24. — P. 28-66.
Фибринолитики
Фибринолитики — ЛС, разрушающие фибрин, который входит в состав недавно возникшего тромба. Фибринолитики — активаторы плазминогена переводят неактивный белок крови плазминоген в активный фермент плазмин, который вызывает лизис фибрина и разрушение тромба. Препараты не предупреждают дальнейшего тромбообразования, а также могут привести к увеличению образования тромбина и усилению агрегации тромбоцитов.
К основным фибринолитическим препаратам (часто применяют и другой термин — тромболитические препараты) относят стрептокиназу, тканевой активатор плазминогена, урокиназу и близкие к ней соединения.
Стрептокиназа — фермент, полученный из культуры β-гемолитического стрептококка. Осуществляет своё действие как непрямой активатор плазминогена. Первоначально происходит связывание молекулы стрептокиназы с молекулой плазминогена с образованием активного комплекса плазминогена, который активирует другие молекулы плазминогена. В результате развивается системная плазминемия, сопровождаемая снижением концентрации фибриногена, плазминогена, факторов свёртывания крови V и VIII, повышением содержания в крови продуктов деградации фибрина и фибриногена. Перечисленные процессы приводят к системной гипокоагуляции, сохраняющейся некоторое время после прекращения введения препарата. Из фибринолитических средств стрептокиназа наименее селективна в отношении тромба. Как белковое соединение, стрептокиназа обладает антигенными свойствами. После однократного введения препарата в течение первых 5 дней можно обнаружить антитела, титр которых остаётся повышенным продолжительное время (как минимум 10 лет). Поэтому при необходимости повторного проведения тромболитической терапии уже через 5 дней и в последующем в течение 6-12 мес после первого применения стрептокиназы необходимо использовать другие фибринолитики. Впрочем, у многих больных, получавших стрептокиназу, повторно не отмечено тяжёлых аллергических реакций.
Тканевой активатор плазминогена — сериновая протеаза, физиологический активатор плазминогена. Тканевой активатор плазминогена синтезируют эндотелиальные клетки сосудов. В отсутствие фибрина слабо активирует плазминоген, однако после соединения тканевого активатора плазминогена с фибрином скорость активации связанного плазминогена возрастает, превышая в сотни раз скорость активации свободного плазминогена. Действию тканевого активатора плазминогена препятствуют ингибиторы активатора плазминогена. В настоящее время преимущественно используют препарат, полученный с помощью рекомбинантной технологии ДНК в культуре клеток, — одноцепочечную рекомбинантную молекулу тканевого активатора плазминогена (алтеплаза). Алтеплаза обладает повышенным сродством к фибрину. На его поверхности она значительно более активна и избирательно воздействует на находящийся рядом связанный с фибрином плазминоген, превращая его в плазмин. Действие тканевого активатора плазминогена специфично в отношении тромба, поскольку в условиях, когда нет образования тромба, активация циркулирующего плазмина происходит медленно и он почти полностью нейтрализуется циркулирующими в крови антиплазминами. Поэтому естественный плазмин не вызывает значительного системного лизиса. По сравнению со стрептокиназой алтеплаза способна разрушать фибрин с выраженными перекрёстными связями, входящий в состав более длительно существующих тромбов. Разработаны мутантные формы альтеплазы: ретеплазаP (создана за счёт отщепления части исходной молекулы; период полувыведения препарата в 2 раза больше, чем у алтеплазы, но обладает меньшей фибриноспецифичностью) и тенектеплаза (создана с помощью генной инженерии за счёт замены аминокислотных остатков в трёх участках исходной молекулы; это привело к увеличению периода полувыведения, более выраженной фибриноспецифичности и появлению устойчивости к влиянию ингибитора активатора плазминогена I типа).
Более высокую (по сравнению со стрептокиназой) стоимость тканевого активатора плазминогена традиционно упоминают как недостаток препарата.
Урокиназа 8 — сериновая протеаза, прямой активатор плазминогена. Для её действия не требуется предварительное образование комплекса с плазминогеном. Урокиназу8 выделяют из культуры почечных клеток человека. По фибринолитическим свойствам урокиназа8 подобна стрептокиназе, однако в отличие от стрептокиназы для неё нехарактерны антигенные свойства. Основной недостаток — высокая стоимость препарата. Проурокиназа — одноцепочечный предшественник урокиназы. Относительно селективное по отношению к тромбу соединение, которое в присутствии фибрина превращается в урокиназу. Имеет очень короткий период полувыведения и по фибриноспецифичности аналогична тканевому активатору плазминогена.
Фармакокинетические характеристики наиболее распространённых фибринолитических препаратов приведены в табл. 21-49.
Таблица 21-49. Фармакокинетические характеристики наиболее распространённых фибринолитических препаратов
| Препарат | Фибринспецифичность | Метаболизм | Период полувыведения, мин | Антигенность | Способ введения |
|---|---|---|---|---|---|
|
Стрептокиназа |
— |
Печень |
18-23 |
+ |
Внутривенная инфузия |
|
Тканевой активатор плазминогена |
++ |
Печень |
3-8 |
— |
Внутривенная болюс и инфузия |
|
Ретеплаза* |
+ |
Почки |
15-18 |
— |
Внутривенный двойной болюс |
|
Тенектеплаза |
+++ |
Печень |
18-20 |
— |
Внутривенный болюс |
|
Урокиназа |
— |
Печень |
14-20 |
— |
Внутривенная инфузия |
|
Пуролаза* (модифицированная проурокиназа) |
+ |
Печень Почки |
20 |
— |
Внутривенная болюс и инфузия |
Показания к назначению фибринолитиков.
-
Острый инфаркт миокарда с подъёмом сегмента ST на ЭКГ.
-
Массивная тромбоэмболия лёгочной артерии.
-
Тяжёлый проксимальный тромбоз глубоких вен.
-
Тромбоз и тромбоэмболия периферических артерий.
-
Тромбоз центральной артерии или вены сетчатки.
-
Тромбоз артериовенозных шунтов.
Противопоказания к назначению фибринолитиков.
-
Геморрагический инсульт или инсульт неизвестной этиологии в анамнезе.
-
Ишемический инсульт в предшествующие 6 мес.
-
Повреждение или новообразования ЦНС.
-
Недавняя крупная травма, или операция, или повреждение головы (в ближайшие 3 нед).
-
Желудочно-кишечное кровотечение в ближайший месяц.
-
Геморрагический диатез.
-
Расслоение аорты.
-
Преходящее нарушение мозгового кровообращения в предшествующий месяц.
-
Лечение непрямыми антикоагулянтами.
-
Беременность и 1-я неделя послеродового периода.
-
Пункция сосудов, не поддающихся прижатию.
-
Травматичные реанимационные мероприятия.
-
Рефрактерная артериальная гипертензия (систолическое АД >180 мм рт.ст.).
-
Тяжёлое заболевание печени.
-
ИЭ.
-
Активная пептическая язва.
Продолжающееся менструальное кровотечение и наличие диабетической ретинопатии не считают противопоказаниями для назначения фибринолитиков.
Фибринолитики следует вводить как можно раньше после появления первых симптомов заболевания. Особенности дозирования фибринолитиков зависят от показаний и используемого препарата. Наиболее часто проводят системную тромболитическую терапию с внутривенным введением фибринолитика. В отдельных случаях лекарственное средство подводят непосредственно к тромбу (при инфаркте миокарда путём катетеризации коронарной артерии).
Например, для практического применения по показанию «острый инфаркт миокарда с подъёмом сегмента ST» эксперты Европейского общества кардиологов (2003) рекомендуют следующие дозы фибринолитиков.
-
Стрептокиназа — внутривенно 1,5 млн ЕД в 100 мл 5% раствора декстрозы или 0,9% растворе натрия хлорида в течение 30-60 мин.
-
Алтеплаза — внутривенно болюс 15 мг, затем инфузия 0,75 мг/кг в течение 30 мин, затем 0,5 мг/кг в течение 60 мин. Общая доза не более 100 мг.
-
Ретеплаза* — внутривенно болюсы по 10 ЕД с интервалами в 30 мин.
-
Tенектеплаза — один болюс внутривенно 30 мг при массе тела менее 60 кг; 35 мг при 60-69 кг; 40 мг при 70-79 кг; 45 мг при 80-89 кг; 50 мг при массе тела более 90 кг.
На практике выбор фибринолитика зависит от индивидуальной оценки соотношения пользы и риска от использования конкретного препарата, а также его доступности и стоимости. При этом учитывают и сравнительную эффективность фибринолитиков. Tак, у больных с острым инфарктом миокарда тканевой активатор плазминогена алтеплаза эффективнее стрептокиназы (при общем недостатке времени и при необходимости достаточно длительной внутривенной инфузии), а производные алтеплазы — ретеплаза* и тенектеплаза равны ей по эффективности, но гораздо проще в применении (введение в вену болюсом). Кроме того, целесообразно учитывать и сроки заболевания: по мнению экспертов Европейского общества кардиологов (2003), для поздно поступивших больных (более 4 ч от момента появления первых симптомов) предпочтительнее использовать более фибринспецифичный препарат, такой как тенектеплаза или алтеплаза.
При принятии решения о проведении тромболитической терапии в каждом конкретном случае необходимо сопоставить ожидаемую пользу от такого лечения и риск развития серьёзных побочных эффектов.
Осложнения фибринолитической терапии: внутричерепное кровоизлияние; системное кровотечение; иммунологические нарушения; артериальная гипотензия и разрыв миокарда.
Внутричерепные кровоизлияния возникают в 0,2-1,0% случаев тромболитической терапии. По данным метаанализа FTT Collaborative Group (1994), в первые сутки терапии фибринолитиками (в основном стрептокиназой и тканевым активатором плазминогена) число геморрагических инсультов составило в среднем 3,9:1000 больных, получавших лечение (из них у 1,9:1000 пациентов, получавших лечение, возникал смертельный исход, а один из двух не смертельных инсультов вызвал умеренную или тяжёлую инвалидизацию). Риск развития внутричерепных кровоизлияний особенно высок, если фибринолитики назначают пациентам с диагностированной опухолью мозга перед нейрохирургической операцией, в течение 6 мес после инсульта и в течение месяца после травмы головы (абсолютные противопоказания). Значительно повышен риск возникновения внутричерепного кровоизлияния при высокой артериальной гипертензии, перенесённом ранее ишемическом инсульте, транзиторной ишемической атаке. К факторам риска этого осложнения тромболитической терапии относят: пожилой возраст (старше 65 и особенно 75 лет), малую массу тела (менее 65-70 кг), женский пол, цереброваскулярное заболевание или артериальную гипертензию в анамнезе, уровень систолического (более 175 мм рт.ст.) или диастолического (более 110 мм рт.ст.) АД при госпитализации, а также введение тканевого активатора плазминогена или его производных. С большей частотой внутричерепные кровоизлияния можно наблюдать при некоторых режимах введения фибринолитиков.
Системные кровотечения возникают чаще всего при проведении инвазивных манипуляций (до 12-15% случаев) и лишь в 1% случаев без таковых. Помимо инвазивных вмешательств риск развития кровотечения увеличен при венепункции, любом наружном сдавлении грудной клетки, беременности, аневризме брюшного отдела аорты, применении антикоагулянтов на момент назначения тромболитика.
Иммунологические нарушения могут возникать как анафилаксия (менее 0,2% случаев), причём профилактическое назначение стероидов неэффективно для предупреждения тяжёлых аллергических реакций. Кроме того, аллергические реакции могут проявляться в виде лихорадки, артралгий, кожной сыпи, васкулитов и почечной недостаточности.
Артериальная гипотензия — транзиторное снижение систолического АД ниже 90 мм рт.ст. При развитии данного осложнения менее чем у 5% пациентов необходимо введение вазопрессорных средств. Развитие артериальной гипотензии при введении стрептокиназы связывают с образованием брадикинина. При наличии исходной артериальной гипотензии предпочтение должно быть отдано тканевому активатору плазминогена.
Разрыв миокарда возникает вследствие повреждения сердечной мышцы не только из-за острого инфаркта миокарда, но и из-за реперфузионного синдрома, возникшего после реканализации коронарной артерии в результате применения фибринолитика. Риск разрыва миокарда снижается при раннем применении фибринолитиков и возрастает, если тромболитическая терапия проведена через 12 ч и более от начала заболевания.
Другие побочные эффекты тромболитической терапии — тромбоэмболические осложнения (при наличии тромбов в левых отделах сердца или при клапанных поражениях сердца), реперфузионные аритмии, брадикардия, повторные инфаркты, бронхоспазм, полинейропатия, головная боль, тошнота, рвота, боль в спине.
Отмечено повышение риска осложнений при проведении тромболитической терапии у больных с геморрагическим панкреатитом, старческой деменцией, кавернозным туберкулёзом, тяжёлым поражением печени с портальной гипертензией и расширением вен пищевода.
Резистентность к фибринолитикам может возникать у 10-15% пациентов с артериальными тромбозами. При существующих стратегиях тромболитической терапии острого инфаркта миокарда реперфузии достигают лишь у 50-60% больных, причём более чем в 20% случаев успешного тромболизиса в последующем отмечают реокклюзию коронарной артерии. Особенно этому способствуют морфологические изменения стенки сосуда (трещины, разрывы атеросклеротических бляшек). Кроме того, под влиянием фибринолитиков происходит активизация тромбоцитов, что также снижает эффективность реперфузии и повышает риск реокклюзии.
Повысить эффективность тромболитической терапии можно за счёт выбора более активного фибринолитика, а также за счёт более раннего начала лечения и совершенствования сопутствующего антитромботического лечения.
Ускорение начала тромболитической терапии возможно за счёт более быстрой доставки больного в стационар, а также введения фибринолитика на догоспитальном этапе. При инфаркте миокарда рекомендуют начинать тромболитическую терапию соответственно в пределах 90 мин после обращения за помощью и 30 мин после госпитализации. При этом частота осложнений при догоспитальном тромболизисе не отличается от таковой при выполнении в стационаре (однако при тромболитической терапии вне стационара не исключено более частое возникновение фибрилляции желудочков). Обязательным условием проведения догоспитального тромболизиса при инфаркте миокарда с подъёмом сегмента ST является не только наличие несомненных показаний, но и квалифицированного персонала и соответствующего оснащения. Такой подход представляется особенно оправданным в случаях, когда потенциальное время транспортировки больного в стационар достаточно велико (превышает 30 и особенно 60 мин). Для проведения догоспитального тромболизиса более предпочтительным выглядит выбор фибринолитиков, вводимых внутривенно болюсом. Это упрощает и ускоряет проведение тромболитической терапии, повышает вероятность того, что препарат будет введён полностью, а также уменьшает вероятность ошибок при его применении.
Эффективность тромболитической терапии может быть повышена при сочетании фибринолитика с ацетилсалициловой кислотой, тиенопиридином, клопидогрелом, а также препаратами с антитромбиновой активностью (из них наиболее широко используют внутривенную инфузию нефракционированного гепарина). Проводят попытки улучшения результатов тромболитической терапии путём сочетания фибринолитика с блокаторами гликопротеиновых IIb/IIIa рецепторов тромбоцитов и более активными, чем нефракционированный гепарин, антитромбинами. На роль последних претендуют прямые ингибиторы тромбина (гирудинP, бивалирудинP), низкомолекулярные гепарины и прямой ингибитор фактора свёртывания Xa (фондапаринукс натрия). Однако при любом увеличении активности и агрессивности проводимой терапии (за счёт внедрения более эффективных фибринолитиков, добавления к фибринолитикам одного или нескольких антитромботических средств) можно ожидать увеличения частоты геморрагических осложнений
С практической точки зрения более перспективно сочетание тромболитической терапии с механическими способами реканализации артерий. При таком подходе догоспитально или в стационаре общего профиля предварительно вводят фибринолитик, а затем пациента транспортируют в лечебное учреждение, специализирующееся на выполнении ангиопластики и стентирования. Tакая тактика лечения позволит преодолеть основное ограничение, присущее механическому подходу к реперфузии, — задержку во времени, связанную с необходимостью транспортировки в соответствующий стационар.
СПИСОК ЛИТЕРАТУРЫ
Maggioni A. et al. The Gruppo Italiano per lo Studio della Sopravvivenza nell Infarcto Miocardico II (GISSI-2) and the International Study Group. The risk of stroke in patients with acute myocardial infarction after thrombolytic and antithrombotic treatment // N. Engl. J. Med. — 1992. — N 1 -Vol. 6.
Fibrinolytic Therapy Trialists’ (FTT) Collaborative Group. Indications for fibrinolytic therapy in suspected acute myocardial infarction: collaborative overview of early mortality and major morbidity results from all randomized trials of more than 1000 patients // Lancet. — 1994. — Vol. 22.
ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17,187 cases of suspected acute myocardial infarction: ISIS-2 // Lancet. — 1988. — Vol. 60.
ISIS-3 (Third International Study of Infarct Survival) Collaborative Group. ISIS-3: a randomised comparison of streptokinase vs tissue plasminogen activator vs anistreplase and of aspirin plus heparin vs aspirin alone among 41 299 cases of suspected acute myocardial infarction // Lancet. — 1992.
The GUSTO Investigators. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction // N. Engl. J. Med. — 1993.
The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Management of acute myocardial infarction syndromes in patients presenting with St-segment elevation // Eur. Heart. J. — 2003. — Vol. 24. — P. 28-66.
Лекарственные средства, влияющие на мозговое кровообращение, и церебропротекторы
Различные заболевания и состояния, ведущие к повреждению и/или гибели органных, тканевых и клеточных структур головного мозга (прежде всего, это острые и хронические нарушения мозгового кровотока различного генеза, а также различные непосредственные токсические и механические воздействия на ЦНС), предполагают выбор и назначение ЛС, оказывающих влияние на интенсивность мозгового кровотока и/или прямое или опосредованное защитное действие на головной мозг — церебропротекцию.
Ситуация, сложившаяся в современной клинической практике с церебропротекцией и применением ЛС, влияющих на мозговое кровообращение, — часть общей проблемы, связанной с цитопротекцией и так называемой метаболической терапией. Кстати, сама идея — защитить мозг введением одного-двух химических соединений, и сопутствующие ей логические и биохимические обоснования признаны далеко не всеми специалистами, поскольку механизмы повреждения (в частности, при инсульте) многогранны. Кроме того, процессы, происходящие в очаге поражения, выступают и в качестве физиологических, имея реактивный характер. Именно поэтому предотвращение какого-либо, на первый взгляд патологического, процесса (как и улучшение суррогатных критериев оценки эффекта) может оказаться в конечном счёте вредным, ухудшив результаты лечения; и описываемая в этом разделе группа ЛС в клинических рекомендациях многих развитых стран не представлена совсем.
Сложившиеся, в частности в нашей стране, стереотипы лечения (и рейтинги продаж соответствующих ЛС) существуют отдельно от доказательной базы их применения. В ряде случаев последняя включает в себя только экспериментальные исследования, в то время как рандомизованные контролируемые исследования не проводят по ряду причин. В отличие от более активного и более широко представленного в научном мире кардиологического сообщества, исследователиневрологи, возможно, находятся в некотором меньшинстве, не так быстро создавая пресловутую доказательную базу.
Кроме того, дополнительную сложность создаёт отсутствие обоснованных и общепринятых критериев оценки, конечных точек, согласованных сроков оценки и тому подобное для метаболических и/или цитопротекторных эффектов при ряде заболеваний ЦНС.
Благодаря многочисленным рандомизованным контролируемым исследованиям, в которых изучали эффективность основных классов ЛС для лечения артериальной гипертензии и ИБС , убедительно доказаны церебропротективные свойства и способность предотвращать вазоцеребральные осложнения ряда представителей основных классов сердечно-сосудистых препаратов — блокаторов медленных кальциевых каналов, диуретиков, β-адреноблокаторов, ингибиторов АПФ, антагонистов рецепторов альдостерона, статинов, антиагрегантов и некоторых других. Механизмы этих воздействий — проявления как прямых гемодинамических эффектов, так и непосредственно их метаболической активности.
Существуют также препараты, для которых церебропротективный эффект и/ или свойство улучшать мозговой кровоток выступает в качестве основного (или одного из основных). Все отечественные руководства, фармакологические справочники, даже «Перечень жизненно необходимых и важнейших лекарственных средств» включают разнородный по своей химической структуре и особенностям применения класс ЛС, «усиливающих мозговое кровообращение, микроциркуляцию и метаболизм», а также пересекающуюся с ними группу ноотропов (нейрометаболических стимуляторов). Они значительно более широко представлены, чем миокардиальные цитопротекторы, что может проиллюстрировать проведённый поиск в отечественной фармакологической информационной базе (рис. 21-4).
Рис. 21-4. Результат поиска средств, улучшающих мозговой кровоток, в справочной базе «ГарантИнфарм» (дата поиска — октябрь 2007 г.).
К сожалению, результаты крупномасштабных полноценных рандомизованных контролируемых исследований пока не представлены ни по одному из этих ЛС. В одном из систематических обзоров (по применению нейропротекторов при ишемическом инсульте) положительный эффект показан для глицина (1 рандомизованное контролируемое исследование, 200 пациентов) и цитихолина (4 рандомизованных контролируемых исследования, 1372 пациента). Для остальных ЛС либо нет качественных исследований, либо — разницы с плацебо, либо даже выявились неблагоприятные эффекты, в частности увеличение смертности и инвалидизации. Как следствие, в европейских и американских рекомендациях не рекомендуют использование нейропротекторов при ишемическом инсульте.
В то же время это не означает полного отказа мировой науки от идеи церебропротекции. В настоящее время перспективными считают новые препараты с нейропротективным действием, проходящие оценку в ряде рандомизованных контролируемых исследований. Это и новые антагонисты NMDA рецепторов, а также ЛС: ламотриджин (ламиктал*), лубелузол, цитихолин и некоторые другие.
КЛАССИФИКАЦИЯ
Существует ряд фармакологических классификаций указанных препаратов, и ни одна из них не является ни полностью логичной, ни общепринятой. В качестве исторически и клинически важной группы выступают ноотропы. Ноотропы — вещества, улучшающие когнитивные (познавательные) функции, стимулирующие мыслительную деятельность, повышающие устойчивость мозга к повреждающим факторам, улучшающие кортикально-субкортикальные связи. Перечисленные свойства препаратов реализуются как при различных заболеваниях, так и у здоровых людей.
К ноотропным препаратам относят:
-
пирацетам, его гомологи и аналоги;
-
производные диметиламиноэтанола: деанола ацеглюмат, меклофеноксат (центрофеноксин*);
-
препараты нейроаминокислот: гамма-аминомасляная кислота (ГАМК) и её производные [аминофенилмасляная кислота (фенибут*), никотиноил гаммааминомасляная кислота], гопантеновая кислота, глицин, глутамин;
-
производные пиридоксина: пиритинол;
-
холиномиметик центрального действия: холина альфосцерат;
-
препараты Гинкго Билоба*;
-
соединения другой химической структуры, относящиеся к различным классам и группам химических веществ, сходные по механизму действия с пирацетамом и обладающие способностью облегчать процессы обучения и улучшать память.
Механизмы ноотропного действия могут быть обусловлены как прямой активацией энергозависимых процессов в нейронах, так и реализовываться опосредованно, путём улучшения мозгового кровообращения и микроциркуляции, а также изменения функционирования нейромедиаторных систем. Именно поэтому различные авторы, наряду с собственно ноотропными препаратами (с доминирующим действием на мнестические функции), относят к группе ноотропных средств также:
-
препараты, усиливающие мозговое кровообращение, микроциркуляцию и метаболизм: винпоцетин, ницерголин, циннаризин, флунаризин, нимодипин, ксантиновые производные пентоксифиллина, мельдоний, фосфатидилсерин; витамины и их производные: пиридоксин, пантотеновая кислота, фолиевая кислота, витамин Е;
-
промежуточные продукты метаболизма клетки: оротовая и янтарная кислоты;
-
энергодающие субстраты: инозин, трифосаденин (АТФ*), рибонуклеиновая кислота*, глюкозо-1- и глюкозо-6-фосфат;
-
комбинированные препараты: инстенон*.
Несмотря на разницу в реализуемых эффектах, у перечисленных ЛС отсутствуют ярко выраженные эффекты традиционных психотропных и кардиотропных препаратов. Для большинства из них также свойственны низкая токсичность и отсутствие выраженных побочных эффектов даже в субтоксических дозах.
Выбор препарата. В существующих условиях выбор препарата зависит от ряда причин, идентичных таковым при назначении большинства сердечно-сосудистых средств (за исключением важной детали — нам неизвестно конечное влияние большинства рассматриваемых ЛС на результаты лечения): характеристик самого ЛС — наличия разрешённых показаний, направленности гемодинамической активности (если таковая присутствует), рода и выраженности НЛР; особенностей пациента — основного диагноза, возраста, стабильности гемодинамики (системной и церебральной), сопутствующих заболеваний, функции элиминирующих органов, лекарственного анамнеза; а также соображений доступности и экономических характеристик лечения.
ВИНПОЦЕТИН
Механизм действия и основные фармакологические эффекты
Расслабляет гладкую мускулатуру сосудов головного мозга, усиливает кровоснабжение ишемизированных участков. Облегчает транспорт кислорода и энергетических субстратов к тканям. Усиливает поглощение и обмен глюкозы, переключает метаболизм на аэробное направление, улучшает переносимость гипоксии клетками головного мозга. Обладает нейропротекторной активностью. Оказывает сосудорасширяющий, антиагрегационный, улучшающий мозговое кровообращение, антигипоксический эффекты.
Фармакокинетика
Быстро и полностью абсорбируется из пищеварительного тракта. Биодоступность — 50-70%. Связывается с белками плазмы на 66%. Cmax достигается через 1 ч. Терапевтическая концентрация в плазме — 10-20 нг/мл. При парентеральном введении объём распределения достигает 5,3 л/кг. Проходит через плаценту и проникает в грудное молоко. Подвергается биотрансформации в печени. Выводится с мочой в неизменённом виде (незначительно) и в виде метаболитов. T1/2 — 4,8-5 ч.
Показания и доказательная база. Перспективные показания
Нарушение мозгового кровообращения (в том числе инсульт, вертебробазилярная недостаточность, мозговая травма, атеросклеротические изменения сосудов головного мозга, сосудистая деменция, гипертоническая и посттравматическая энцефалопатия), перемежающаяся недостаточность и спазм сосудов головного мозга; частичная окклюзия артерий, головная боль, головокружение (в том числе лабиринтного происхождения), нарушение памяти, двигательные расстройства, в том числе апраксия, афазия, артериолосклеротические и ангиоспастические изменения сетчатки и сосудистой оболочки глаза.
Способ применения и дозы: внутрь, после еды, по 5-10 мг 3 раза в сут. Поддерживающая доза — по 5 мг 3 раза в сут. Курс лечения — 2 мес. Внутривенно капельно, медленно (максимальная скорость инфузии — 80 капель/мин), по 10-20 мг в 500-1000 мл изотонического раствора натрия хлорида. При необходимости в течение 3-4 дней дозу увеличивают до максимальной — 1 мг/кг в сут. Курс лечения — 10-14 дней. Затем переходят на приём препарата внутрь (по 10 мг 3 раза в сут) с постепенным уменьшением дозы перед отменой.
Противопоказания
Гиперчувствительность, тяжёлые формы ИБС и аритмий, первые дни после церебрального геморрагического инсульта, повышенное внутричерепное давление; беременность, кормление грудью.
Нежелательные лекарственные реакции
Со стороны нервной системы и органов чувств: головокружение, головная боль, бессонница, сонливость, слабость.
Со стороны сердечно-сосудистой системы: замедление внутрижелудочковой проводимости; депрессия сегмента ST и удлинение интервала Q-T, гипотензия, тахикардия, экстрасистолия.
Другое: сухость во рту, тошнота, изжога, потливость, тромбофлебит в месте введения.
Взаимодействия
Повышает риск геморрагических осложнений на фоне гепаринотерапии. Усиливает действие гипотензивных средств.
Применение в особых ситуациях
Противопоказано при беременности. Прекратить грудное вскармливание. Нет достаточного опыта в детской практике. При парентеральном введении больным сахарным диабетом необходим контроль содержания глюкозы в крови (в растворе содержится сорбит). При наличии синдрома удлинённого интервала Q-T или при одновременном применении препаратов, провоцирующих удлинение интервала Q-T, необходим контроль ЭКГ. При геморрагическом инсульте парентеральное применение препарата допустимо только после исчезновения острых явлений (через 5-7 дней). С осторожностью при печёночной недостаточности.
Меры предосторожности: не рекомендуют назначать при лабильном АД и низком сосудистом тонусе. Недопустимо подкожное, внутримышечное и внутривенное струйное введение. Не следует применять во время работы водителям транспорта и людям, профессия которых связана с повышенной концентрацией внимания.
ГИНКГО БИЛОБА*
Механизм действия и основные фармакологические эффекты
Улучшает мозговое кровообращение и снабжение мозга кислородом и глюкозой. Оказывает дозозависимое вазорегулирующее действие, стимулирует выработку эндотелиального релаксирующего фактора, расширяет мелкие артерии, повышает тонус вен, регулируя кровенаполнение сосудов. Уменьшает проницаемость сосудистой стенки, оказывает выраженное противоотёчное действие (головной мозг, периферические ткани). Обладает антигипоксическими, антиоксидантными свойствами.
Оказывает следующие эффекты: ноотропный, психостимулирующий, улучшающий мозговое кровообращение, антигипоксический, улучшающий микроциркуляцию, антиагрегационный, снижающий проницаемость капилляров.
Фармакокинетика
При приёме внутрь хорошо всасывается, Cmax достигается через 1,5 ч, T1/2 составляет 4,5 ч. Малотоксичен.
Показания и доказательная база. Перспективные показания
Дисциркуляторная энцефалопатия (последствия инсульта, черепно-мозговой травмы, старческий возраст), проявляющаяся расстройствами внимания и/или памяти, снижением интеллектуальных способностей, тревогой, страхом, нарушением сна; деменция, в том числе при болезни Альцгеймера; для улучшения памяти и внимания у лиц молодого возраста; нейросенсорные нарушения (головокружение, шум в ушах, гипоакузия), старческая дегенерация жёлтого пятна, диабетическая ретинопатия; астенические состояния: психогенные, невротические, обусловленные травматическим поражением головного мозга.
Способ применения и дозы: внутрь, во время еды. Деменция: 40-80 мг 3 раза в сут (120-240 мг/сут). Астеническое расстройство: 240 мг/сут. В других случаях: 40 мг 3 раза в сут или 80 мг 2 раза в сут. Курс лечения — не менее 8 нед (в среднем — 3 мес).
Противопоказания
Гиперчувствительность.
Нежелательные лекарственные реакции
Диспепсия, головная боль, головокружение, аллергические реакции.
Применение в особых ситуациях
Не рекомендуют применять при беременности и лактации (отсутствует достаточный клинический опыт).
ИНСТЕНОН*
Комбинированный препарат, содержащий этамиван, гексобендин и этофиллин.
Механизм действия и основные фармакологические эффекты
Предполагают, что все компоненты действуют совместно и однонаправленно на различные звенья патогенеза ишемического и гипоксического поражения ЦНС.
Этамиван способствует адекватному функционированию нейронных комплексов коры и подкорково-стволовых структур и, соответственно, регрессии неврологического дефицита и активации вегетативной сферы. Гексобендин стабилизирует механизмы ауторегуляции церебрального и кардиального кровотока, умеренно расширяет церебральные сосуды, стимулирует нейрональный метаболизм, активирует анаэробный гликолиз, восстанавливает синаптическую передачу. Этофиллин способствует увеличению перфузионного давления в сосудах краевой зоны ишемии, стимулирует подкорковые образования среднего мозга, центры — дыхательный, сосудодвигательный, вегетативной регуляции, ядра черепных нервов, в первую очередь блуждающего.
Оказывает эффекты: улучшающий мозговое и коронарное кровообращение, спазмолитический, аналептический, стимулирующий метаболизм мозга.
Показания и доказательная база. Перспективные показания
Заболевания головного мозга сосудистого и возрастного характера; последствия недостаточности кровоснабжения мозга; постинсультные состояния; головокружения, вызванные функциональными расстройствами головного мозга.
Способ применения и дозы. Таблетки: внутрь, не разжёвывая, вместе с небольшим количеством жидкости во время или после еды, по 1-2 таблетки 3 раза в сут или по 1 таблетке форте 3 раза в сут. Курс — не менее 6 нед. Раствор для инъекций: предпочтительно — внутривенно капельно, путём медленной инфузии (2 мл препарата предварительно разводят 250 мл 5% раствора фруктозы). В зависимости от тяжести состояния — 1-2 раза в сут по 2 мл внутримышечно или внутривенно медленно или 1-2 раза в сут по 2 мл в виде капельной инфузии до клинического улучшения.
Противопоказания
Гиперчувствительность, эпилептиформные синдромы (состояние сильного возбуждения, судороги и др.), повышенное внутричерепное давление (длительная головная боль, рвота, нарушение зрения), внутримозговые кровоизлияния.
Нежелательные лекарственные реакции
При быстром внутривенном введении — понижение АД, кратковременная тахикардия, неприятные ощущения в области сердца, гиперемия лица, незначительная головная боль (явления проходят при уменьшении дозы или прекращении введения препарата).
Взаимодействия
Усиливает торможение агрегации тромбоцитов (за счёт гексобендина) ацетилсалициловой кислотой. Кофеин (в очень высоких дозах) может ослабить эффект.
Применение в особых ситуациях
Применение при беременности и кормлении грудью допустимо только по строгим показаниям.
Меры предосторожности: во время лечения рекомендуют избегать употребления больших количеств кофе и чая. При внутривенном применении допустимо только медленное капельное введение, в случае внутривенного вливания введение 1 ампулы с 2 мл раствора должно длиться не менее 3 мин.
КСАНТИНОЛА НИКОТИНАТ
Механизм действия и основные фармакологические эффекты
Блокирует аденозиновые рецепторы и фосфодиэстеразу, увеличивая уровень цАМФ в клетке, стимулирует синтез НАД и НАДФ. Оказывает вазодилатирующее действие, снижает общее периферическое сопротивление сосудов, тормозит агрегацию тромбоцитов, улучшает микроциркуляцию, оксигенацию и питание тканей, усиливает мозговое кровообращение, уменьшает вязкость крови, активирует фибринолиз.
Оказывает сосудорасширяющее, антиагрегационное действие.
Показания и доказательная база. Перспективные показания
Нарушения мозгового кровообращения, атеросклероз сосудов мозга, диабетическая ангиопатия, ретинопатия.
Способ применения и дозы: внутрь (после еды), начинают со 150 мг 3 раза в день, при необходимости дозу увеличивают до 300-600 мг 3 раза в день. Внутримышечно вводят по 2-6 мл 15% раствора в течение 2-3 нед.
Противопоказания
Гиперчувствительность, тяжёлая застойная сердечная недостаточность, острое кровотечение, острый инфаркт миокарда, язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения.
Нежелательные лекарственные реакции
Артериальная гипотензия, преходящее ощущение тепла, покраснение кожных покровов, слабость, головокружение, тошнота, диарея, анорексия, гастралгия.
Взаимодействия
Усиливает (взаимно) эффект гипотензивных препаратов (β-адреноблокаторов, алкалоидов спорыньи, α-адреноблокаторов, симпатолитиков, ганглиоблокаторов).
Применение в особых ситуациях
Ограничения к применению: артериальная гипотензия, беременность (особенно в I триместре).
Меры предосторожности: следует соблюдать осторожность при одновременном назначении с антигипертензивными средствами и строфантином К.
МЕЛЬДОНИЙ (МИЛДРОНАТ*)
При острых и хронических ишемических нарушениях мозгового кровообращения улучшает циркуляцию крови в очаге ишемии, способствует перераспределению крови в пользу ишемизированного участка. Эффективен в случае васкулярной и дистрофической патологии глазного дна. Подробно — см. раздел «Миокардиальные цитопротекторы».
НИМОДИПИН
Механизм действия и основные фармакологические эффекты
Специфически связывается с расположенными на клеточных мембранах рецепторами, регулирующими функцию кальциевых каналов L-типа. Преимущественно влияет на сосуды головного мозга, нормализует мозговое кровоснабжение, увеличивает толерантность нейронов к ишемии. Оказывает нейропротективное действие, стабилизирует функции нервных клеток. У пациентов с острым нарушением мозгового кровообращения улучшает перфузию повреждённых и ишемизированных участков мозга. Внутривенное введение в начальной фазе инсульта сопровождается уменьшением числа осложнений и летальности. Улучшает мозговой кровоток у больных с гипертоническим кризом, ослабляет возрастную (при старении) неврологическую симптоматику, в том числе нарушение памяти, эмоциональную лабильность, уменьшение инициативы.
Эффекты: нейропротективный, вазодилатирующий, антиагрегационный.
Фармакокинетика
Быстро всасывается из пищеварительного тракта. Cmax достигается через 1 ч после приёма внутрь и через 3 мин при внутривенном введении. В связи с эффектом «первого прохождения» через печень биодоступность составляет около 13% (у пациентов с субарахноидальным кровоизлиянием — до 16%). Связывается с белками плазмы до 95%. T1/2 составляет 8-9 ч (увеличивается при заболеваниях почек и выраженной печёночной недостаточности). Биотрансформируется в печени с образованием неактивных метаболитов. Выводится с фекалиями в виде метаболитов (более 99%) и в неизменённом виде с мочой (менее 1%).
Показания и доказательная база. Перспективные показания
Ишемическое нарушение мозгового кровообращения (в том числе при гипертоническом кризе), неврологические расстройства вследствие спазма сосудов головного мозга, обусловленного субарахноидальным кровоизлиянием, сенильная деменция.
Способ применения и дозы: внутрь, натощак (таблетки не разжёвывают), с небольшим количеством жидкости, внутривенно капельно, интрацистернально. Острая церебральная ишемия: по 30 мг 4 раза в сут в течение 1 мес (не более). Профилактика и лечение ишемических неврологических нарушений при церебральном вазоспазме вследствие субарахноидального кровоизлияния: внутривенно в виде постоянной инфузии — в начальной дозе 1 мг/ч (5 мл/ч) в течение 2 ч [приблизительно 15 мкг/(кг×ч)], затем (при хорошей переносимости и отсутствии гипотензии) — 2 мг/ч (10 мл/ч), что составляет около 30 мкг/(кгхч). У больных с массой тела менее 70 кг или нестабильном АД — в начальной дозе 0,5 мг/ч (2,5 мл/ч). Внутривенную профилактику начинают не позднее чем через 4 дня и продолжают в течение 10-14 дней после кровоизлияния. Лечение уже развившихся неврологических расстройств следует начинать как можно раньше и проводить не менее 5 и не более 14 дней. Инфузионный раствор вводят непрерывно внутривенно через центральный катетер с использованием инфузионного насоса и трёхканального запорного крана одновременно с одним из следующих растворов: 5% раствор глюкозы, 0,9% раствор натрия хлорида, раствор Рингера, раствор Рингера с магния сульфатом, раствор декстрана 40 или 6% раствор поли0-2-гидроксиэтилкрахмала в соотношении 1:4 (раствор нимодипина и другой раствор соответственно). В качестве сопутствующей инфузии можно использовать маннитол, кровь или человеческий альбумин. Для адекватного разведения раствора нимодипина необходимо, чтобы вводимое в течение 1 сут количество жидкости было не менее 1000 мл. По окончании инфузионной терапии препарат назначают внутрь в дозе 60 мг 6 раз в сутки с интервалами 4 ч в течение 7 дней. При оперативном лечении субарахноидального кровоизлияния возможно интрацистернальное введение 20 мл разведённого раствора (1 мл раствора нимодипина для инфузий и 19 мл раствора Рингера). Сенильная деменция: внутрь, по 30 мг 3 раза в сут.
Противопоказания
Гиперчувствительность, выраженная артериальная гипотензия, отёк мозга, повышенное внутричерепное давление, тяжёлые нарушения функции печени, цирроз печени, беременность, кормление грудью.
Ограничения к применению: артериальная гипотензия (лёгкая или умеренная), сердечная недостаточность, кардиогенный шок, инфаркт миокарда с застойными явлениями в лёгких, нерезко выраженные нарушения функции печени.
Нежелательные лекарственные реакции
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): 1-9% — артериальная гипотензия; <1% — тахикардия или брадикардия, сердечная недостаточность, изменения на ЭКГ, спазм периферических сосудов, артериальная гипертензия, анемия и тромбоцитопения, склонность к тромбозам, флебит (при внутривенном введении).
Со стороны нервной системы и органов чувств: 1-9% — головная боль; <1% — головокружение и депрессия; возможно — возбуждение, агрессивность, нарушение сна.
Со стороны опорно-двигательного аппарата: 1-9% — мышечные спазмы.
Со стороны мочеполовой системы: 1-9% — периферические отёки; <1% — гипонатриемия; возможно — ухудшение функции почек с повышением концентрации мочевины или креатинина в сыворотке крови.
Со стороны органов пищеварения: 1-9% — диспепсия, желудочные спазмы, диарея; <1% — тошнота, рвота, гепатит, желтуха, повышение активности лактатдегидрогеназы, ЩФ и трансаминаз в сыворотке крови.
Со стороны кожных покровов: 1-9% — покраснение кожи лица, экзантема; <1% — зуд, потливость, геморрагии.
Аллергические реакции: дерматит (1-9%).
Прочие: одышка (<1%).
Взаимодействия
Индометацин, циметидин, фенобарбитал и симпатомиметики ослабляют эффект. Усиливает активность гипотензивных препаратов. Повышает вероятность развития побочных эффектов сердечных гликозидов (и других средств, вызывающих гипокалиемию), хинидина, карбамазепина, циклоспорина, теофиллина, вальпроатов, солей лития, β-адреноблокаторов. На фоне потенциально нефротоксичных препаратов (аминогликозиды, цефалоспорины, фуросемид) возможно нарушение функции почек. Не рекомендуют комбинировать с другими блокаторами медленных кальциевых каналов (амлодипин, нифедипин, дилтиазем, верапамил), метилдопой и с внутривенным введением β-адреноблокаторов (возможно значительное понижение АД, усиление отрицательного инотропного действия и развитие декомпенсации сердечной деятельности). Инфузионный раствор (содержит 23,7% спирта по объёму) не следует сочетать с препаратами, не совместимыми с алкоголем.
Применение в особых ситуациях
У пациентов с нарушением функции почек возможно прогрессирование почечной недостаточности, требующее отмены терапии. С осторожностью назначать при заболеваниях печени, алкоголизме, эпилепсии и в детском возрасте. Не следует применять во время работы водителям транспортных средств и людям, профессия которых связана с повышенной концентрацией внимания. При нарушении функции печени (замедляется метаболизм) необходимо уменьшить дозу в соответствии с выраженностью артериальной гипотензии или отменить препарат.
Особые указания: резкое понижение АД или возникновение выраженной головной боли обусловливают необходимость прекращения терапии. Не рекомендовано прерывать лечение при проведении анестезии, хирургических вмешательств и ангиографии. Не рекомендуют введение раствора после прямого попадания на него солнечного света, добавление раствора непосредственно в инфузионную бутыль или смешивание с другими препаратами. При рассеянном дневном свете или искусственном освещении инъекционные формы можно использовать в течение 10 ч без защитных мероприятий (т.е. без стеклянных шприцев и соединительных трубок тёмного цвета).
НИЦЕРГОЛИН
Механизм действия и основные фармакологические эффекты
Оказывает как α-адреноблокирующее действие, так и миотропное спазмолитическое действие на резистивные сосуды (особенно активен в отношении сосудов головного мозга и конечностей), повышает их проницаемость для глюкозы. Блокирует сосудосуживающие реакции мозговых сосудов, вызванные серотонином. Ингибирует агрегацию тромбоцитов. Улучшает мозговой кровоток.
Эффекты: α-адренолитический, вазодилатирующий, улучшающий мозговое кровообращение.
Фармакокинетика
Быстро и почти полностью (90-100%) всасывается. Биодоступность — около 60%. Cmax определяют через 1-1,5 ч. 90% препарата метаболизируется путём гидролиза, деметилирования и глюкуронизации. Почками выводится 70-80% препарата и метаболитов в течение 70-100 ч после приёма. С калом выводится 20%. T1/2 препарата — 2,5 ч.
Показания и доказательная база. Перспективные показания
Нарушения мозгового кровообращения (в том числе при атеросклерозе сосудов головного мозга, инсульте, ишемии головного мозга, последствиях тромбоза и тромбоэмболии сосудов головного мозга, посттравматической энцефалопатии, психоорганическом синдроме).
Способ применения и дозы: внутрь, перед или во время еды, не разжёвывая, запивая достаточным количеством жидкости, по 5-10 мг 3 раза в сут. При ограниченной функции почек (уровень сывороточного креатинина более 2 мг/мл) — по 5 мг 2-3 раза в сут. Внутривенно капельно — по 4-8 мг на 100 мл изотонического раствора натрия хлорида; внутримышечно — по 2-4 мг 2 раза в сут; внутриартериально — по 4 мг в 10 мл изотонического раствора натрия хлорида, в течение 2 мин. Курс лечения — от 2-3 нед до нескольких месяцев.
Противопоказания
Гиперчувствительность, артериальная гипотензия, выраженный атеросклероз периферических сосудов, органические поражения сердца, недавно перенесённый инфаркт миокарда, стенокардия напряжения, брадикардия, острое кровотечение, беременность, кормление грудью.
Нежелательные лекарственные реакции
Со стороны нервной системы и органов чувств: головная боль, головокружение, сонливость, ощущение усталости, бессонница, возбуждение, беспокойство, обморок.
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): ортостатическая гипотензия, приступ стенокардии, уменьшение вязкости крови, похолодание конечностей.
Со стороны органов пищеварения: тошнота, рвота, понижение аппетита, диарея, абдоминальные боли, увеличение кислотности желудочного сока.
Со стороны мочеполовой системы: нарушение эякуляции.
Со стороны кожных покровов: потливость.
Аллергические реакции: зуд и гиперемия лица и верхней половины туловища, эритема, крапивница.
Прочие: боль в конечностях, жар.
Взаимодействия
Усиливает эффекты гипотензивных средств, анксиолитиков и антипсихотических средств. Антациды замедляют всасывание. Следует избегать совместного применения с препаратами, возбуждающими ЦНС, α- и β-адреномиметиками.
Применение в особых ситуациях
При стойкой брадикардии (ЧСС в покое — менее 50 в минуту) приём препарата возможен только при тщательном врачебном контроле. При одновременном применении с антикоагулянтами и антиагрегантами необходим контроль параметров свёртываемости крови. С осторожностью применяют с гипотензивными препаратами. После парентерального введения для предупреждения ортостатического эффекта или при возникновении выраженной артериальной гипотензии рекомендуют принять горизонтальное положение на 10-15 мин. Больным с почечной недостаточностью, а также пожилым пациентам суточная доза должна быть уменьшена. Не следует применять во время работы водителям транспортных средств и людям, профессия которых связана с повышенной концентрацией внимания. На время лечения необходимо воздержаться от употребления алкоголя.
НИКОТИНОИЛ ГАММА-АМИНОМАСЛЯНАЯ КИСЛОТА (ПИКАМИЛОН*)
Механизм действия и основные фармакологические эффекты
Улучшает кровоснабжение и функциональное состояние головного мозга. Уменьшает сосудистое сопротивление и увеличивает скорость кровотока в сосудах головного мозга, улучшает микроциркуляцию, ингибирует агрегацию тромбоцитов. Воздействует на центральные процессы вазомоторной регуляции, опосредованные ГАМК. Стимулирует метаболизм в нервной ткани, обладает антигипоксической активностью. Повышает устойчивость ЦНС к воздействию неблагоприятных факторов. Обладает психостимулирующим действием, уменьшает угнетающее действие этанола на ЦНС.
Эффекты: ноотропный, улучшающий мозговое кровообращение.
Фармакокинетика
Быстро всасывается из пищеварительного тракта, легко проникает через ГЭБ, биодоступность составляет 50-80%. Распределяется в головном мозге, почках, мышцах и жировой ткани, длительно удерживается в тканях организма. Практически не метаболизируется, выводится с мочой в неизменённом виде, T1/2 — 0,51 ч.
Показания и доказательная база. Перспективные показания
Острое нарушение мозгового кровообращения по ишемическому типу лёгкой и средней степени тяжести в подостром и восстановительном периоде, цереброваскулярная недостаточность, дисциркуляторная энцефалопатия, вегето-сосудистая дистония, астенический синдром, депрессия, сенильный психоз, состояние после перенёсенной черепно-мозговой травмы и нейроинфекции.
Способ применения и дозы: внутрь, независимо от приёма пищи. При цереброваскулярных заболеваниях: 0,02-0,05 г 2-3 раза в сут, суточная доза — 0,06-0,15 г, курс лечения — 1-2 мес, повторный курс рекомендован через 5-6 мес. Парентерально: внутривенно струйно (медленно) или капельно (содержимое ампулы предварительно разводят в 200 мл изотонического раствора натрия хлорида); внутримышечно. Острое и хроническое нарушение мозгового кровообращения: внутривенно или внутримышечно 0,1-0,2 г (2 мл 5-10% раствора) 1-2 раза в сутки в суточной дозе 0,2-0,4 г по схеме: утром внутривенно капельно, вечером внутримышечно; или 10 дней внутривенно, затем внутримышечно, курс — 15-30 дней.
Противопоказания
Гиперчувствительность, заболевание почек (острое, хроническое).
Ограничения к применению: не рекомендуют при тяжёлой степени острого нарушения мозгового кровообращения.
Нежелательные лекарственные реакции
Tошнота, головная боль, головокружение, раздражительность, возбуждение, тревога, аллергические реакции (сыпь, зуд); приливы крови к лицу, покраснение лица, парестезии (при быстром внутривенном введении).
Взаимодействия
Укорачивает действие барбитуратов.
ПИРАЦЕТАМ (НООТРОПИЛ*, ЛУЦЕТАМ*)
Механизм действия и основные фармакологические эффекты
Оказывает разностороннее влияние на ЦНС: изменяет скорость распространения возбуждения в головном мозге, улучшает нейрональную пластичность и метаболические процессы. Улучшает мозговой кровоток. Улучшает микроциркуляцию в головном мозге, воздействуя на реологические характеристики крови, не вызывая сосудорасширяющего действия. Оказывает протекторное и восстанавливающее действие при нарушении функции головного мозга вследствие гипоксии, интоксикации или травмы.
Эффект: ноотропный.
Фармакокинетика
При приёме внутрь быстро и практически полностью всасывается из пищеварительного тракта. Cmax достигается через 1 ч после приёма. После приёма внутрь однократной дозы 2 г Cmaix составляет 40-60 мкг/мл и достигается в крови через 30 мин и в СМЖ через 5 ч. Кажущийся объём распределения пирацетама составляет около 0,6 л/кг. T1/2 из плазмы крови — 4-5 ч, из СМЖ — 8,5 ч, T1/2 удлиняется при почечной недостаточности. Фармакокинетика пирацетама не изменяется у больных с печёночной недостаточностью. Пирацетам проникает через ГЭБ, плацентарный барьер и мембраны, используемые при гемодиализе. Не связывается с белками плазмы крови, не метаболизируется в организме и выводится почками (80-100%) в неизменённом виде путём почечной фильтрации.
Показания и доказательная база. Перспективные показания
Симптоматическое лечение психоорганического синдрома. Лечение последствий ишемического инсульта, травм и интоксикаций головного мозга.
Способ применения и дозы: внутрь, во время приёма пищи или натощак, запивая жидкостью (вода, сок). Суточная доза — 30-160 мг/кг, кратность приёма — 2-4 раза в сут. Внутривенно или внутримышечно: суточная доза — 30-160 мг/кг (3-12 г/сут), кратность введения — 2-4 раза в сут. При симптоматическом лечении хронического психоорганического синдрома в зависимости от выраженности симптомов назначают 1,2-2,4 г, а в течение первой недели — 4,8 г в день. При лечении последствий инсульта назначают 4,8 г/сут. При лечении коматозных состояний, а также трудностей восприятия у людей с травмами головного мозга начальная доза составляет 9-12 г/сут, поддерживающая — 2,4 г/сут. Длительность лечения — не менее 3 нед.
Противопоказания
Гиперчувствительность к пирацетаму или производным пирролидона, а также к другим компонентам препарата; геморрагический инсульт; конечная стадия почечной недостаточности (Cl креатинина <20 мл/мин); детский возраст до 1 года.
Нежелательные лекарственные реакции
Существуют единичные сообщения о следующих побочных эффектах: со стороны пищеварительного тракта — тошнота, рвота, диарея, боли в животе и в желудке; со стороны нервной системы — головокружение, головные боли, атаксия, нарушение равновесия, обострение течения эпилепсии, бессонница; со стороны психики — замешательство, возбуждение, тревога, галлюцинации, повышение сексуальности; со стороны кожных покровов — дерматит, зуд, высыпания, отёк. НЛР возникают чаще у пожилых пациентов, получающих дозы свыше 2,4 г/сут. В большинстве случаев удаётся добиться регресса подобных симптомов, снизив дозу препарата.
Взаимодействия
При совместном применении с экстрактом щитовидной железы (T3+T4) возможны повышенная раздражительность, дезориентация и нарушения сна. Не отмечено взаимодействия с клоназепамом, фенитоином, фенобарбиталом, вальпроевой кислотой.
Возможность изменения фармакодинамики пирацетама под воздействием других ЛС низка, так как 90% препарата выводится в неизменённом виде с мочой.
Применение в особых ситуациях
Исследования у беременных не проводились. При назначении женщине пирацетама следует воздержаться от грудного вскармливания. В связи с влиянием на агрегацию тромбоцитов необходимо с осторожностью назначать больным с нарушением гемостаза, во время больших хирургических операций или больным с симптомами тяжёлого кровотечения. Поскольку пирацетам выводится из организма почками, следует соблюдать осторожность при лечении больных с почечной недостаточностью. Пожилым больным доза корректируется при наличии почечной недостаточности, и при длительной терапии необходим контроль функционального состояния почек. Больные с нарушением функции печени в коррекции дозы не нуждаются. Учитывая возможные побочные эффекты, следует соблюдать осторожность при выполнении работы с механизмами и вождении автомобиля.
ФЕНИЛПИРАЦЕТАМ (ФЕНОТРОПИЛ*)
Механизм действия и основные фармакологические эффекты
Обладает антиамнестическим действием, способствует консолидации памяти, улучшает концентрацию внимания и умственную деятельность, повышает устойчивость тканей мозга к гипоксии и токсическим воздействиям, обладает противосудорожным действием и анксиолитической активностью, регулирует процессы активации и торможения ЦНС. Оказывает положительное влияние на обменные процессы и кровообращение мозга, улучшает регионарный кровоток в ишемизированных участках мозга.
Эффекты: ноотропный, анксиолитический, антиастенический, противосудорожный.
Фармакокинетика
Быстро всасывается, проникает в различные органы и ткани, легко проходит через ГЭБ. Абсолютная биодоступность при приёме внутрь составляет 100%. Cmax в крови достигается через 1 ч, T1/2 составляет 3-5 ч. Не метаболизируется. Выводится в неизменённом виде: примерно 40% — с мочой и 60% — с жёлчью и потом.
Показания и доказательная база. Перспективные показания
Заболевания ЦНС различного генеза, особенно связанные с сосудистыми заболеваниями и нарушениями обменных процессов в мозге, интоксикацией (в частности, при посттравматических состояниях и явлениях хронической цереброваскулярной недостаточности), сопровождающиеся ухудшением интеллектуальномнестических функций, снижением двигательной активности. Психоорганические синдромы, проявляющиеся интеллектуально-мнестическими нарушениями и апатико-абулическими явлениями, а также вялоапатические состояния при шизофрении. Судорожные состояния.
Способ применения и дозы: внутрь, сразу после еды. Дозы варьируют в зависимости от особенностей состояния больного. Средняя разовая доза составляет 150 мг (от 100 до 250 мг); средняя суточная доза — 250 мг (от 200 до 300 мг). Максимальная допустимая доза — 750 мг/сут. Рекомендуют суточную дозу до 100 мг принимать однократно в утренние часы, а свыше 100 мг разделять на два приёма. Продолжительность лечения может варьировать от 2 нед до 3 мес, в среднем — 30 дней. При необходимости курс можно повторить через 1 мес. Не рекомендуется принимать препарат позднее 15 ч.
Противопоказания
Гиперчувствительность.
Нежелательные лекарственные реакции
Бессонница (в случае приёма препарата позднее 15 ч). У некоторых больных в первые 1-3 дня приёма возможны психомоторное возбуждение, гиперемия кожных покровов, ощущение тепла, повышение АД.
Взаимодействия
Фенотропил* может усиливать действие препаратов, стимулирующих ЦНС, антидепрессантов и других ноотропных препаратов.
Применение в особых ситуациях
Не следует назначать при беременности, кормлении грудью, а также детям из-за отсутствия данных клинических исследований. С осторожностью применяют у больных с тяжёлыми органическими поражениями печени и почек, тяжёлым течением артериальной гипертензии, у больных атеросклерозом, у больных, перенёсших ранее панические атаки, острые психотические состояния, протекавшие с психомоторным возбуждением, — вследствие возможности обострения тревоги, паники, галлюцинаций и бреда, а также у больных, склонных к аллергическим реакциям на ноотропные препараты группы пирролидона. При чрезмерном психоэмоциональном истощении на фоне хронического стресса и утомления, хронической бессонницы однократный приём фенотропила* в первые сутки может вызвать резкую потребность в сне. Таким больным в амбулаторных условиях следует рекомендовать начинать курсовой приём препарата в нерабочие дни.
ЦИННАРИЗИН
Механизм действия и основные фармакологические эффекты
Блокирует кальциевые каналы L-типа. Имеет высокую тропность к сосудам головного мозга, улучшает мозговое кровообращение. Подавляет реакции на биогенные вазоконстрикторы (адреналин, норадреналин, брадикинин). Повышает эластичность эритроцитов и понижает вязкость крови. Повышает резистентность к гипоксии.
Эффекты: сосудорасширяющий, улучшение мозгового и периферического кровообращения.
Фармакокинетика
При приёме внутрь быстро всасывается. С белками плазмы связывается на 91%. Cmax определяется через 1-3 ч. Полностью метаболизируется в печени. 1/3 метаболитов выводится с мочой, 2/3 — с фекалиями. T1/2 — 4 ч. Не обладает тератогенностью.
Показания и доказательная база. Перспективные показания
Нарушения мозгового кровообращения: атеросклероз сосудов мозга, ишемический инсульт, период после геморрагического инсульта и черепно-мозговых травм, дисциркуляторная энцефалопатия; головокружение, сенильная деменция, снижение и потеря памяти, нарушение мышления и невозможность концентрации внимания.
Способ применения и дозы: внутрь, желательно после еды. Нарушение мозгового кровообращения: по 25-50 мг 3 раза в сут. Детям назначают половину дозы для взрослых. При высокой чувствительности к циннаризину лечение начинают с 1/2 дозы, увеличивая её постепенно.
Противопоказания
Гиперчувствительность, кормление грудью.
Ограничения к применению: беременность, болезнь Паркинсона.
Нежелательные лекарственные реакции
Со стороны нервной системы и органов чувств: сонливость, утомляемость, головная боль.
Со стороны органов пищеварения: сухость во рту, диспептические явления, боль в эпигастральной области, холестатическая желтуха.
Со стороны кожных покровов: повышенное потоотделение, проявления красной волчанки или красного плоского лишая.
Прочие: аллергические кожные реакции, увеличение массы тела; очень редко — тремор конечностей, повышенный мышечный тонус.
Взаимодействия
Химическая несовместимость неизвестна. Усиливает действие алкоголя, седативных средств, антигипертензивных и сосудорасширяющих препаратов. Усиливает эффект ноотропных средств. Уменьшает эффект средств для лечения артериальной гипотензии.
Применение в особых ситуациях
При беременности применение возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода. На время лечения следует прекратить грудное вскармливание.
Меры предосторожности: с осторожностью применять во время работы водителям транспортных средств и людям, профессия которых связана с повышенной концентрацией внимания (возможна сонливость, особенно в начале лечения). Пациентам с болезнью Паркинсона можно назначать, только если ожидаемый эффект терапии превышает риск ухудшения основного заболевания. При длительном применении рекомендован контроль функции печени, почек и картины периферической крови.
СПИСОК ЛИТЕРАТУРЫ
Ковалёв Г.В. Ноотропные средства. — Волгоград, 1990. — 368 с.
Кругликова-Львова Р.П. Пикамилон — новый вазоактивный и ноотропный препарат / Р.П. Кругликова-Львова, М.А. Ковлер, Р.С. Мирзоян // Хим. фарм. журн. — 1989. — № 2. — С. 252-255.
Barradell L.B. Oral naftidrofuryl / L.B. Barradell, R.N. Brogden // Drugs Aging. — 1996. — № 8. — P. 299-322.
Bath P.M.W. Pentoxifylline, propentofylline and pentifylline for acute ischaemic stroke, 2004 / P.M.W. Bath, F.J. Bath-Hextall // The Cochrane Database of Systematic Reviews. — 2007.
De Schryver ELLM. Dipyridamole for preventing stroke and other vascular events in patients with vascular disease, 2006 / ELLM De Schryver, A. Algra, J. van Gijn // The Cochrane Database of Systematic Reviews. — 2007.
Ginkgo biloba for acute ischaemic stroke, 2005 / X. Zeng, M. Liu, Y. Yang, Y. Li // The Cochrane Database of Systematic Reviews. — 2007.
Horn J. Calcium antagonists for acute ischemic stroke, 1999 / J. Horn, M. Limburg // The Cochrane Database of Systematic Reviews. — 2007.
Muir K.W. Excitatory amino acid antagonists for acute stroke, 2003 / K.W. Muir, K.R. Lees // The Cochrane Database of Systematic Reviews. — 2007.
Piracetam for acute ischaemic stroke, 2005 / S. Ricci, M.G. Celani, A.T. Cantisani, E. Righetti // The Cochrane Database of Systematic Reviews. — 2007.
Венотонические средства. Клинико-фармакологические подходы к выбору и применению лекарственных средств при хронической венозной недостаточности
Хроническая венозная недостаточность (ХВН) — синдром нарушения оттока крови из вен нижних конечностей вследствие дисфункции венозного клапанного аппарата и физиологической трансформации просвета сосуда, проявляющийся отёком, болью и трофическими расстройствами мягких тканей разной степени выраженности. Перегрузка венозной системы также ведёт к нарушению лимфатического оттока, из-за чего часть лимфы через анастомозы поступает в венозное русло.
Нозологические формы ХВН:
-
варикозная болезнь;
-
посттромбофлебитический синдром;
-
венозные дисплазии;
-
флебопатии.
Выделяют следующие причины развития ХВН:
-
тромбофлебит поверхностных вен;
-
тромбоз глубоких вен нижних конечностей;
-
варикозная болезнь вен нижних конечностей.
В настоящий момент не существует данных о том, что варикозное расширение вен служит фактором риска спонтанного тромбоза глубоких вен, для развития которого необходимы определённые условия.
Среди методов лечения начальных стадий ХВН основное значение имеют консервативные: эластическая компрессия (дополнительный каркас для вен) и фармакотерапия (флеботропные препараты). При необходимости у части больных проводят склеротерапию и оперативное лечение.
ЦЕЛИ ЛЕЧЕНИЯ
-
Купирование симптомов заболевания.
-
Предотвращение осложнений.
-
Предоперационная подготовка и послеоперационная реабилитация больных с ХВН.
-
Повышение качества жизни пациентов.
-
Профилактика болезней вен.
ОБЗОР СОВРЕМЕННЫХ РЕКОМЕНДАЦИЙ
Согласно современным воззрениям, ЛС, используемые в лечении варикозной болезни, должны отвечать следующим требованиям:
-
повышать венозный тонус;
-
нормализовать проницаемость и резистентность капилляров;
-
оказывать противовоспалительное действие;
-
улучшать реологические свойства крови;
-
усиливать лимфатический дренаж.
Несмотря на присутствие в лечебном арсенале местнодействующих средств, в настоящее время им придают лишь второстепенное значение (в качестве аддитивной симптоматической терапии). Основное же внимание уделяют препаратам системного действия, обладающим максимальными выраженностью и числом перечисленных эффектов.
Классификация венотропных лекарственных средств
Приведённая ниже классификация условна, так как практически у всех ЛС есть венотонический компонент.
Средства, преимущественно оказывающие констрикторное (тонизирующее) влияние на гладкую мускулатуру стенки вен. Эффект этой подгруппы обусловлен прежде всего изменением соотношения пре- и посткапиллярного сопротивления, смещением так называемого равновесия Старлинга, при котором создаются физиологические предпосылки к преобладанию фильтрации над абсорбцией (либо наоборот). В то же время данные исследований свидетельствуют о наличии у них самостоятельного, дополнительного эффекта, уменьшающего проницаемость стенки вен.
-
Нативные и восстановленные алкалоиды спорыньи, их метаболиты и производные (дигидроэрговалин, дигидроэрготамин, дигидроэргостин, 8-гидроксидигидроэрготамин, амид дигидролизергиновой кислоты, алкалоиды группы дигидроэрготоксина).
-
Симпатомиметики [d,1,N-этил-норфенилэфрин-этил-эфрин, эффонтил, эффортил, этил-адрианол, этафедрин; 1-(2’5′-диметоксифенил)-2-глицинамидоэтанол — мидодрин (гутрон*)].
-
Препараты растительного происхождения (дикорастущая европейская иглица шиповатая, виргинский орех и др.).
Венотропные средства, преимущественно оказывающие влияние на функцию обмена жидкости (уменьшающие сосудистую проницаемость). Основное действие, направленное на уменьшение проницаемости сосудистой стенки, у этих препаратов сочетается с дополнительным венотонизирующим эффектом, проявляющимся при определённых условиях, в частности при исходно низком тонусе вен и венозном застое.
-
Экстракты семян конского каштана (эсцин, эскулин, венен*).
-
Вещества с Р-витаминной активностью (гидроксиэтилрутозид).
-
Производное глюкофуранозида [трибенозид (гливенол*)].
Дополнительного улучшения лимфодренажной функции можно добиться назначением препаратов из группы бензопиронов (троксерутин, рутозид и др.), а также препаратов с поливалентным механизмом действия.
Для нормализации микроциркуляции и реологических свойств крови применяют низкомолекулярные декстраны, пентоксифиллин, ацетилсалициловую кислоту, тиклопидин, клопидогрел. Эту же задачу решает назначение таких препаратов, как детралекс*, гинкор форт*, цикло-3 форт*, эндотелон*, трибенозид.
Для купирования воспаления применяют НПВС (диклофенак, индометацин, кетопрофен и др.), различные мазевые формы (содержащие НПВС, глюкокортикоиды, гепарин и др.), а также препараты нового поколения с поливалентным механизмом действия (детралекс*, флебодиа 600*).
Доказательная база венотонических средств (по данным on-line-библиотеки Cochrane Collaboration, 2007).
Флеботоники при ХВН. 44 исследования с 4413 пациентами, достойные анализа: 23 of rutosides (рутозиды), 10 hidrosmine and diosmine (гидросмин и диосмин), 6 calcium dobesilate (кальция добезилат), 2 centella asiatica (щитолистник азиатский), 1 french maritime pine bark extract (экстракт коры приморской французской сосны), 1 aminaftone (аминафтон), 1 grape seed extract (экстракт косточек винограда).
Выводы авторов: доказательных данных для глобального обоснования флеботоников при ХВН недостаточно; существует мнение о некотором эффекте флеботоников при отёках, но клиническая значимость этого неясна. Нужны новые исследования с особым вниманием к качеству их методологии.
Экстракт зёрен конского каштана при ХВН. Достойными анализа оказались исследования: 7 — боль в ногах, 6 — значительное снижение боли в ногах (placebo contr.), 7 — объём ног.
Выводы авторов: метаанализ 6 исследований (n=502) — лекарство лучше плацебо; лечение также эффективно, как лечение компрессионными чулками.
Вмешательства при варикозе и отёке ног при беременности. 3 подходящих исследования (115 женщин) достойны для анализа. Капсулы с рутозидами в третьем триместре показали улучшение симптомов (placebo contr.). Снижалась окружность лодыжки на сроке 36 нед беременности после 8 нед лечения. Плацебо снижало меньше.
Выводы авторов: рутозиды способны уменьшать симптомы венозной недостаточности при поздней беременности; в то же время их безопасность при беременности неизвестна.
Консервативное лечение симптомов и/или осложнений геморроя у беременных и родильниц. 10 подходящих исследований, но только 2 из них (150 женщин) достойны для анализа: оба сравнивали рутозиды per os и плацебо; рутозиды были более эффективны в уменьшении симптомов и по мнению медиков, и по мнению пациенток.
Выводы авторов: несмотря на показанный эффект гидроксиэтилрутозидов для уменьшения симптомов геморроя I-II степени, их применение при беременности не рекомендуют до установления их безопасности; наиболее часто используемая тактика — изменения в диете и местное лечение — недостаточно оценены у беременных и родильниц.
Какой же из представленных данных следует вывод? Отказаться от флеботоников, если их эффект лишь частично доказан? Ответ подсказало волевое решение на уменьшение дотаций (покрытие страховой компенсацией) флеботропных препаратов. После отказа от дотаций на флеботропные препараты в Италии и последующего снижения потребления этих ЛС:
-
увеличились ежегодные затраты на лечение на 23,6 млн евро (благодаря увеличению затрат на госпитализацию);
-
существенно перераспределились финансовые затраты с амбулаторного звена на госпитальное.
Tак реальная клиническая практика указала на вредность поспешных выводов в вопросах лечения десятков тысяч человек. В настоящее время осуществляют клинические исследования данной группы ЛС, продолжают собирать доказательную базу.
ПРИНЦИПЫ ВЫБОРА ЛЕКАРСТВЕННЫХ СРЕДСТВ И РЕЖИМОВ ИХ ДОЗИРОВАНИЯ
Детралекс* (микронизированный диосмин) — флеботропный препарат, имеющий комплексное венопротекторное и лимфотонизирующее действие. Это очищенная микронизированная фракция флавоноидов. Детралекс* увеличивает тонус венозной стенки, улучшает лимфатический дренаж, уменьшает проницаемость капилляров, подавляет аутоагрессивность лейкоцитов и макрофагов, снижает адгезию нейтрофилов к стенке капилляров, блокирует синтез местных медиаторов воспаления и предотвращает повреждение ими тканей. Детралекс* показан для лечения всех форм ХВН нижних конечностей, проявляющихся судорожным, болевым и отёчным синдромами, а также при наличии трофических расстройств кожи и венозных язв. Кроме того, препарат показан для профилактического приёма при воздействии факторов риска ХВН (длительные статические нагрузки, подъём тяжестей, длительные поездки в транспорте, приём гормональных препаратов, избыточная масса тела и т.д.). Суточная дозировка детралекса* составляет 500 мг (1 таблетка) 2 раза в сут в течение 2 нед, затем по 2 таблетки 1 раз в сут во время еды. Длительность приёма прямо пропорциональна тяжести заболевания: при начальных формах ХВН («тяжёлые ноги») — курсами по 2 мес 2 раза в год; при более тяжёлых случаях (болевой, судорожный и отёчный синдромы) — курсами по 3-4 мес, при трофических язвах — курсами по 6 мес и более, а после перенесённого тромбоза глубоких вен рекомендован постоянный приём препарата (см. табл. 21-50).
Флебодиа 600* — препарат из группы полусинтетических диосминов, оказывающий венотоническое и ангиопротекторное действие благодаря вазоконстрикции вен, устранению микроциркуляторных расстройств и повышению оксигенации тканей. Препарат обладает также противовоспалительной и связанной с ней обезболивающей активностью. При хронической лимфовенозной недостаточности Флебодиа 600* применяют по 1 таблетке (600 мг) в день, утром, за 30 мин до еды. Разовый утренний приём одной таблетки значительно повышает комплаентность лечения, учитывая длительные, от 1 мес, курсы терапии препаратами этого класса.
Цикло-3 форт — препарат растительного происхождения, включающий экстракт иглицы, экстракт мяты и аскорбиновую кислоту. Цикло-3 форт обладает флеботоническим действием, снижает проницаемость и увеличивает резистентность капилляров. Назначают по 1 капсуле после еды. Суточная доза препарата составляет 3 капсулы.
Производные алкалоидов спорыньи (дигидроэрготамин, дитамин*, клавигренин*, эрготамин*). Активное вещество — дигидроэрготамин мезилат. Препараты обладают выраженной α1— и α2-адреноблокирующей активностью. Алкалоиды спорыньи расширяют периферические сосуды, повышают тонус вен. Обычная дозировка для взрослых и подростков с массой тела более 50 кг — 5 мг (1 таблетка или 10-20 капель) дигидроэрготамина 3 раза в день. При тяжёлых формах ХВН их следует применять под строгим врачебным контролем. Противопоказания: ИБС (инфаркт миокарда, стенокардия), артериальная гипертензия, сепсис, выраженные нарушения функции печени и почек, первый триместр беременности, период лактации.
Вазобрал* (α-дигидроэргокриптина мезилат и триметилксантин). Препарат снижает агрегацию тромбоцитов и эритроцитов, повышает периферический венозный тонус, уменьшает сосудистую проницаемость. Назначают по 2-4 мл (1-2 мерных пипетки) 2 раза в сут. Разбавляют большим количеством воды, принимают во время еды. Безопасность применения препарата в период беременности не доказана, назначение препарата кормящим матерям может привести к уменьшению лактации.
Производные эсцина получают путём переработки семян конского каштана. Препараты, наряду с флавоноидами и другими субстанциями, содержат эсцин. Обладают выраженной капилляропротективной активностью, оказывают антиэкссудативное и противовоспалительное действие, повышают тонус венозных сосудов, улучшают гемореологические показатели, обладают умеренным антикоагулянтным эффектом. Производные эсцина применяют по 15-20 капель (1 таблетке) 4 раза в день. Необходимо помнить, что в жидкой форме препарат всасывается в полости рта, в связи с чем необходимо инструктировать пациента. Производные эсцина следует применять в сочетании с аскорутином* (1 таблетка 4 раза в день), потенцирующим их терапевтический эффект.
Аэсцин* — венотропное средство растительного происхождения из экстракта семян конского каштана с содержанием эсцина 20 мг. Его применяют при варикозном расширении вен, так как он обладает капилляроукрепляющими свойствами. 1 таблетка содержит 200 мг экстракта. Суточная доза для взрослых составляет 60-120 мг эсцина.
Эскузан* — растительный венотоник. Оказывает противоотёчное действие, препятствует экссудации, повышает устойчивость капилляров, нормализует состояние сосудистой стенки, повышает тонус венозных сосудов. Показания к применению: посттромбофлебитический синдром, отдельные симптомы ХВН различного происхождения — отёки, судороги икроножных мышц, боли и чувство тяжести в ногах, варикозное расширение вен, трофические нарушения. 1 драже содержит 250 мг густого экстракта семян конского каштана, что соответствует 5 мг эсцина. Назначают по 1-3 драже 3 раза в сут.
Рутозид — препарат из группы гидроксиэтилрутозидов, обладает доказанным флеботонизирующим и ангиопротективным действием, нормализует проницаемость капилляров, укрепляет сосудистую стенку, уменьшает агрегацию тромбоцитов, обладает противовоспалительным эффектом, уменьшает отёчный и болевой синдромы. Его производят в виде капсул по 0,3 г (назначают по 1 капсуле 3 раза в сут) и таблеток по 0,5 г (назначают по 1 таблетке 2 раза в сут, утром и вечером, во время еды). Препарат противопоказан при повышенной чувствительности к рутозидам, а также в первом триместре беременности.
Троксерутин — уменьшает проницаемость и ломкость капилляров, оказывает противовоспалительное действие. Препарат выпускают в виде капсул по 0,3 г и 10% раствора для инъекций по 5 мл в ампуле. Вначале назначают парентерально (внутримышечно или внутривенно) по 5 мл через день (не менее 5 инъекций), затем переводят на пероральную терапию с применением 2-3 капсул в день во время еды. Побочные эффекты: аллергические реакции, лекарственный гастрит.
Гинкор форт* — комбинированный препарат, содержащий 300 мг троксерутина, 14 мг экстракта гинкго двудольного и 300 мг гептаминола хлорида. Он обеспечивает повышение тонуса вен, оказывает противовоспалительный и антиэкссудативный эффекты. Обладает антиоксидантной активностью, подавляя образование медиаторов воспаления (гистамина, серотонина, лейкотриенов) и свободных радикалов, оказывает положительный гемореологический эффект.
Трибенозид — венотропный препарат на основе глюкофуранозидов. Оказывает капилляропротекторное действие, улучшает микроциркуляцию, повышает тонус вен, обладает антиаллергической и противовоспалительной активностью. Tрибенозид целесообразно использовать при ХВН в стадии трофических расстройств. Tерапевтическая доза препарата — 800 мг в сут. Курс лечения глюкофуранозидами составляет не менее 1,5-2 мес. Tрибенозид целесообразно применять в комплексе с пентоксифиллином.
Мадекассол* — экстракт Centella asiatica. Улучшает трофику тканей, стимулирует биосинтез коллагена, повышает пластичность сосудистой стенки. Назначают по 6 таблеток в сутки в течение недели с последующим переходом на 3 таблетки ежедневно.
Пайлекс — экстракты различных растений. Повышает тонус вен, снижает отёчный синдром, уменьшает проницаемость венозной стенки. Вначале принимают по 2-3 таблетки 3 раза в день после еды в течение недели, затем переходят на приём 2 таблеток 2 раза ежедневно.
Кальция добезилат нормализует сосудистую проницаемость, увеличивает резистентность капилляров, улучшает микроциркуляцию, снижает агрегацию тромбоцитов и вязкость крови, уменьшает отёчный и геморрагический синдромы. Назначают по 250 мг 4 раза в день или по 500 мг 1-2 раза в день во время еды в течение 2-3 нед, затем снижают дозу до 250-500 мг в сут.
Актовегин* — депротеинезированный гемодериват из телячьей крови с низкомолекулярными пептидами и производными нуклеиновых кислот. Препарат обеспечивает улучшение снабжения тканей кислородом и глюкозой, стимулирует активность ферментов окислительного фосфорилирования, повышает обмен аденозинтрифосфата и аденозиндифосфата, ускоряет распад лактатов и пируватов, улучшает микроциркуляцию.
Препараты для системной энзимотерапии (вобэнзим*, флогэнзим*) — смесь ферментов растительного и животного происхождения, которые, попадая в кровоток, предположительно оказывают противовоспалительный, противоотёчный, фибринолитический и антиагрегантный эффекты. Как правило, препараты хорошо переносятся, их можно применять в течение длительного времени. Вобэнзим* принимают по 5-10 таблеток 3 раза в день за 40 мин до еды, запивая большим количеством воды. Флогэнзим* принимают по 2 таблетки 3 раза в день за 30 мин до еды, запивая большим количеством воды.
Куриозин* (основное действующее вещество — цинка гиалуронат) оказывает противомикробное действие, усиливает клеточную пролиферацию и заживление тканей. Применяют при трофических язвах в стадиях грануляции и эпителизации.
Гепаринсодержащие мази и гели (гепариновая мазь*, гепароид*, эссавенгель*, лиотон-1000 гель*). Их отличие между собой — доза гепарина. 1 г гепариновой мази* содержит 100 МЕ натриевой соли гепарина, а лиотон-1000* — 1000 МЕ. Остальные препараты группы содержат 400-500 МЕ гепарина натрия в 1 г. Применяют их местно 3-4 раза в день.
Таблица 21-50. Сравнительная фармакологическая активность некоторых флеботоников
| Препараты | Тонус вен | Лимфодренаж | Микроциркуляция | Гемореология крови | Купирование воспаления |
|---|---|---|---|---|---|
|
Флебодиа 600* |
++ |
++ |
++ |
+ |
+ |
|
Детралекс* |
++ |
++ |
++ |
+ |
+ |
|
Гинкор форт* |
++ |
+ |
+ |
+ |
+ |
При остро возникших тромбозах глубоких вен также применяют антикоагулянты прямого действия. У больных с очевидными симптомами тромбоза глубоких вен нижних конечностей внутривенно вводят 5000-10 000 ЕД гепарина натрия под контролем активированного частичного тромбопластинового времени, позволяющего оценить начальную стадию коагуляции (образование тромбопластина) и составить представление о внутреннем пути плазменного гемостаза. С целью профилактики тромбоза глубоких вен прибегают к подкожному введению гепарина натрия в низких дозах (500-1000 ЕД) короткими курсами также под контролем активированного частичного тромбопластинового времени через 6 ч после введения препарата. У гепарина имеется доказанное снижение риска тромбозов глубоких вен и тромбоэмболии лёгочной артерии после хирургических вмешательств. Также препарат хорошо зарекомендовал себя для предупреждения и лечения острых тромбозов. Однако у гепарина натрия, как антикоагулянта прямого действия, отсутствует достоверная прямая связь между величиной дозы и выраженностью эффекта, не отмечено клинически значимого действия на тромбин, связанный с тромбом. Гепарин может вызывать реакцию повышенной чувствительности, где он играет роль аллергена.
Для лечения и профилактики ХВН можно также использовать низкомолекулярные гепарины. Это препараты короткоцепочечных мукополисахаридов с молекулярной массой 400-7000 дальтон. Их достоинство заключено в способности тормозить свёртывание крови на более высокой ступени. Принципиальное значение имеет то обстоятельство, что лечение низкомолекулярными гепаринами может быть длительным и его можно осуществлять не только в стационаре, но и в амбулаторных условиях.
Далтепарин натрия (фрагмин*) при остром тромбозе глубоких вен назначают внутривенно или подкожно 100 МЕ/кг каждые 12 ч. Продолжительность курса лечения составляет 5-7 дней. При передозировке в случае необходимости используют протамина сульфат из расчёта, что 1 мг протамина нейтрализует 100 МЕ фрагмина*.
Надропарин кальция* (фраксипарин*) вводят подкожно в переднебоковую поверхность живота каждые 12 ч в течение 10 дней. Дозу определяют в зависимости от массы тела пациента. При массе тела 45 кг она составляет 0,4 мл, до 55 кг — 0,5 мл, до 70 кг — 0,6 мл, до 80 кг — 0,7 мл, до 90 кг — 0,8 мл, при массе тела 100 кг и более — 0,9 мл. При передозировке используют протамина сульфат из расчёта, что 0,6 мг протамина нейтрализует 0,1 мл фраксипарина*.
Энокспарин натрия (клексан*) назначают подкожно в переднеили заднелатеральную поверхность брюшной стенки на уровне поясничной области. Инъекцию осуществляют перпендикулярно кожной складке. Для лечения венозных тромбозов глубоких вен клексан* применяют по 1 мг/кг каждые 12 ч в течение 10 дней с одновременным назначением непрямых антикоагулянтов. Для профилактики венозных тромбозов у пациентов с умеренным риском развития тромбоэмболий препарат вводят по 20 мг (0,2 мл) 1 раз в сутки, при высоком риске доза удваивается (40 мг 1 раз в сутки). Препарат нельзя вводить внутримышечно. При передозировке можно использовать протамина сульфат из расчёта, что 1 мг протамина нейтрализует 1 мг клексана*.
ПРОФИЛАКТИКА ХРОНИЧЕСКОЙ ВЕНОЗНОЙ НЕДОСТАТОЧНОСТИ
Успешность борьбы с ХВН зависит от ряда взаимосвязанных факторов. Первичную профилактику ХВН следует проводить у всех больных. При наличии клинических проявлений к немедикаментозным методам профилактики необходимо добавлять флеботропные препараты, при трофических расстройствах в ряде случаев необходима консультация хирурга. Всё перечисленное улучшит профилактику, диагностику и позволит проводить адекватное лечение данного заболевания, сохраняя качество жизни больных с этой распространённой патологией.
СПИСОК ЛИТЕРАТУРЫ
Амосова Е.Н., Дыкун Я.В., Мишалов В.Г. Руководство по тромболитической терапии. — К.: IT-studio, 1998. — C. 125-130.
Пангенко Е.П., Добровольский А.Б. Tромбозы в кардиологии. Механизмы развития и возможности терапии. — М., 1999. — 464 с.
Профилактика послеоперационных венозных тромбоэмболических осложнений // Российский консенсус. — 2000.
Руксин В.В. Неотложная кардиология. — СПб.: Невский диалект, 2000. — 503 с.
Rehn D. et al. Comparative clinical efficacy and tolerability of oxerutins and horse chestnut extract in patients with chronic venous insufficiency // Arzneimittelforschung. — 1996.
Siebert U. et al. Efficacy, routine effectiveness, and safety of horsechestnut seed extract in the treatment of chronic venous insufficiency. A meta-analysis of randomized controlled trials and large observational studies // Int. Angiol. — 2002.
MacLennan W.J. et al. Hydroxyethylrutosides in elderly patients with chronic venous insufficiency: Its efficacy and tolerability // Gerontology. — 1994.
Pittler M.H. Ernst E. Horse chestnut seed extract for chronic venous insufficiency // Cochrane Database Syst. Rev. — 2006.
The Cochrane Database of Systematic Reviews 2007. — Part 1. (CD). — Cochrane Collaboration, 2007.
Гиполипидемические препараты
-
Ингибиторы редуктазы ГМГ-КоА или статины.
-
Производные фиброевой кислоты или фибраты.
-
Секвестранты жёлчных кислот.
-
Препараты никотиновой кислоты.
-
Селективные ингибиторы абсорбции холестерина.
-
Омега-3-полиненасыщенные жирные кислоты.
-
Антиоксиданты липопротеидов.
СТАТИНЫ
Ингибиторы ГМГ-КоА-редуктазы или статины — наиболее эффективные препараты среди гиполипидемических средств.
Классификация
Классификация ингибиторов ГМГ-КоА-редуктазы основана как на различиях в химической структуре (ЛС, полученные путём ферментации грибов, и синтетические статины), так и по времени начала использования в клинической практике (статины I-IV поколений). К статинам, полученным путём ферментации грибов Aspergillus terreus, «естественным статинам», относят ловастатин, симвастатин (полусинтетический статин) и правастатин. Полностью синтетическими статинами являются флувастатин, аторвастатин, розувастатин и питавастатин*. Ловастатин и симвастатин имеют в своей структуре закрытое лактоновое кольцо, эти статины — пролекарства. Синтетические статины поступают в организм в активной форме. Лактоновое кольцо у синтетичеких статинов открыто, в нём метильный радикал замещён либо атомом водорода (правастатин), либо натриевой (флувастатин) или кальциевой (аторвастатин и розувастатин) солью. Классификация статинов по поколениям:
-
I поколение: ловастатин, симвастатин, правастатин;
-
II поколение: флувастатин;
-
III поколение: аторвастатин;
-
IV поколение: розувастатин.
Механизм действия и основные фармакологические эффекты
Лактоновое кольцо в составе молекулы статинов по своей структуре подобно части фермента редуктазы ГМГ-КоА. По принципу конкурентного антагонизма молекула статина связывается с той частью рецептора кофермента А, к которой прикрепляется этот фермент. Другая часть молекулы статина ингибирует процесс превращения гидрометилглутарата в мевалонат (промежуточная субстанция в синтезе молекулы холестерина). Ингибирование активности редуктазы ГМГ-КоА приводит к серии последовательных реакций, в результате которых снижается внутриклеточное содержание холестерина и происходит компенсаторное повышение активности рецепторов липопротеидов низкой плотности и, соответственно, катаболизма холестерина липопротеинов низкой плотности.
Главные эффекты статинов — антиатерогенное действие, в частности гиполипидемическое, и достоверное снижение основных сердечно-сосудистых осложнений в первичной и вторичной профилактике, подтверждённое в крупных многоцентровых проспективных рандомизированных плацебо-контролируемых исследованиях. Такие изучения проведены для правастатина, симвастатина, ловастатина, флувастатина, аторвастатина и розувастатина. Статины обладают также множеством дополнительных свойств, не связанных с воздействием на уровень липидов.
Гиполипидемический эффект вызван снижением на 25-50% липопротеинов низкой плотности путём ингибирования синтеза холестерина. Выраженность гиполипидемического эффекта имеет дозозависимый характер, причём каждое удвоение дозы приводит к дополнительному снижению уровня холестерина липопротеинов низкой плотности на 6% («правило шести»). Статины различают по выраженности гиполипидемического эффекта. В международных рекомендациях не упоминают о преимуществах одних препаратов перед другими. По данным исследований MERCURY I и STELLAR 2003, по выраженности гиполипидемического эффекта статины можно расположить следующим образом (в порядке ослабления действия): розувастатин, аторвастатин, симвастатин, правастатин. В настоящее время наиболее мощный гиполипидемический эффект даёт розувастатин (снижение липопротеинов низкой плотности на 65% в дозе 80 мг/сут), при этом исследование STELLAR продемонстрировало, что доза розувастатина в 10 мг на 3-4% эффективнее в снижении холестерина липопротеинов низкой плотности, чем доза аторвастатина в 20 мг. Лечение розувастатином в дозе 10-40 мг приводило к снижению холестерина липопротеинов низкой плотности на 46-55%, аторвастатином в дозе 10-80 мг — к снижению холестерина липопротеинов низкой плотности на 37-51%.
Сравнительный анализ показал, что розувастатин позволил достичь целевого уровня липидов в 82-89% случаев, аторвастатин — в 69-85%. По данным исследования CURVE, действие 10 мг аторвастатина эквивалентно действию 20 мг симвастатина, 40 мг ловастатина и правастатина и 80 мг флувастатина. Влияние статинов на уровни триглицеридов и липопротеинов высокой плотности зависит от исходных их значений, отличается у разных статинов и не зависит от дозы препаратов. Наиболее прогностически значимо повышение антиатерогенной фракции липопротеинов высокой плотности у пациентов с дислипидемией. При использовании начальных и средних доз статинов возможно повышение уровня липопротеинов высокой плотности на 6-10%. По некоторым данным, новая форма флувастатина с замедленным высвобождением (80 мг) способна повышать уровень липопротеинов высокой плотности на 20%. Новый статин — розувастатин — повышает содержание липопротеинов высокой плотности на 7,7-9,6% в диапазоне доз 10-40 мг.
По влиянию на уровень триглицеридов статины также имеют умеренно выраженный эффект, наиболее целесообразно их применение при уровне триглицеридов не более 4,5 ммоль/л. На фоне лечения аторвастатином и розувастатином гиполипидемический эффект на эту фракцию наиболее выражен (примерно на 23-30%).
Нелипидные (плейотропные) эффекты статинов не связаны с их гиполипидемическим действием. Основные дополнительные эффекты статинов рассмотрены ниже.
-
Влияние лечения статинами на размер атеросклеротической бляшки и сосудистую жёсткость (толщину «интимы-медиа»).
Наиболее выраженное влияние у розувастатина: исследование ASTEROID, доказанный регресс атеросклеротической бляшки во всех группах пациентов, получавших лечение.
-
Достоверное уменьшение сосудистой жёсткости (толщины «интимымедиа»сонной артерии).
Эффект был показан на фоне лечения статинами в следующих исследованиях: ACAPS (ловастатин 20-40 мг); MARS (ловастатин 80 мг); субисследование REGRESS (правастатин 40 мг). В исследовании ASAP (Atorvastatin vs. Simvastatin on Atherosclerosis progression): толщина интимы-медиа каротидной артерии существенно снизилась в группе аторвастатина и повысилась в группе симвастатина; эти результаты, а также исследование ARBITER демонстрируют преимущества агрессивного гиполипидемического лечения по сравнению со стандартным в перспективе влияния на прогрессирование атеросклероза.
-
Снижение активности медиаторов воспаления и проатерогенных медиаторов.
Статины снижают концентрацию ингибитора активатора плазминогена типа 1, молекул сосудистой адгезии типа 1, белка хемоаттрактанта моноцитов, интерлейкина-8, CD 40L, ингибитора активатора плазминогена типа 1, тканевого фактора, миграцию и пролиферацию гладких мышечных клеток, кроме того, уменьшается уровень С-реактивного белка в плазме на 30-49%. Исследования REVERSAL и PROVE IT-TIMI 22 подтвердили наличие противовоспалительных свойств статинов и стабилизацию процесса атеросклероза, не зависящих от гиполипидемического эффекта, у больных с ангиографически подтверждённой коронарной болезнью сердца, доказаны преимущества лечения аторвастатином в дозе 80 мг/сут.
-
Улучшение функции эндотелия, показателя потокзависимой (эндотелийзависимой) вазодилатации плечевой артерии.
Ловастатин и симвастатин индуцируют транскрипцию генов NO-синтазы.
-
Антиоксидантные свойства.
Снижение способности к окислению фосфолипидов и липопротеинов низкой плотности.
-
Иммуномодулирующие свойства. Происходит увеличение количества T-лимфоцитов.
-
Снижение выработки фактора некроза опухоли.
-
Повышение минерализации кости.
-
Уменьшение литогенности жёлчи.
В настоящее время проводят дополнительное исследование других эффектов статинов: дилатация коронарных артерий, стимуляция коронарного ангиогенеза; уменьшение альбуминурии при сахарном диабете; уменьшение гипертрофии левого желудочка; антиаритмическое действие; замедление прогрессирования болезни Альцгеймера и деменции.
Фармакокинетика
Все статины различают по абсорбции в пищеварительном тракте, показатель варьирует от 31% (ловастатин) до 99% (аторвастатин). В печени препараты метаболизируются при «первом прохождении», степень экстракции варьирует от 46% у правастатина до 90% у розувастатина. Степень селективности действия в печени также различна у разных представителей: у флувастатина составляет более 90%, 6% активного вещества присутствует в тканях, у правастатинов — 53%, у аторвастатина — 30% активного вещества в периферической циркуляции. Все статины связываются с белками плазмы очень интенсивно (более 95%), кроме правастатина (48%). Период полувыведения для симвастатина составляет 2 ч; для ловастатина и правастатина — 3 ч; для флувастатина — 2,3 ч (капсулы) и до 7 ч (таблетки-ретард); для аторвастатина — 14 ч и для розувастатина — 19 ч. Особенности биотрансформации: метаболизм системой Р450 — ловастатин, симвастатин, аторвастатин; флувастатин, правастатин, розувастатин не метаболизируются через системы цитохрома Р450. Статины экскретируются в основном с жёлчью (70-90%), только правастатин — до 60% — экскретируется почками, повышения концентрации правастатина при ХПН не происходит. При применении ловастатина отмечено повышение его концентрации у больных с уремией. Розувастатин (около 90% дозы) выводится в неизменённом виде с калом, остальное — с мочой.
Возможности применения терапевтического лекарственного мониторинга для выбора режима дозирования
Критерий эффективности лечения статинами и главная мишень — уровень липопротеинов низкой плотности. Основная цель лечения — достижение целевых уровней общего холестерина и липопротеинов низкой плотности в зависимости от индивидуального риска, особенность современной концепции — агрессивное гиполипидемическое лечение. Тактика применения статинов основана на их дозозависимом эффекте, соответственно, обязательно титрование доз препаратов (удвоение) до максимально эффективных и безопасных. Целевыми уровнями (по действующим Российским и Европейским рекомендациям) для пациентов с ИБС/ эквивалентами ИБС: для общего холестерина — менее 4,5 ммоль/л, для липопротеинов низкой плотности — менее 2,5 ммоль/л; для пациентов с дислипидепротеидемией и факторами риска: общего холестерина — менее 5 ммоль/л, и липопротеинов низкой плотности — менее 3 ммоль/л. Начальные дозы и максимально эффективные и безопасные суточные дозы статинов: ловастатин 10-20-80 мг, симвастатин 10-20-80 мг, флувастатин 20-80 мг, правастатин 10-40 мг, аторвастатин 10-80 мг, розувастатин 5-40 мг.
Показания и доказательная база
Показания к лечению статинами с учётом действующих Российских рекомендаций «Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза», ВНОК, 2004 г:
-
дислипидемия IIA/IIB типа, рефрактерная к диетотерапии в течение 3 мес;
-
первичная профилактика ИБС;
-
вторичная профилактика ИБС;
-
профилактика цереброваскулярных событий;
-
сахарный диабет (первичная профилактика макрососудистых осложнений).
Доказательная база эффективности статинов очень убедительна: проведено большое количество многоцентровых плацебо-контролируемых рандомизованных контролируемых исследований (4S, HPS, IDEAL, ASCOT LLA, WOSCOPS, LIPID, CARE, PPP, TNT, ALLHAT-LLT, REVERSAL, PROVE-IT, исследования программы GALAXY).
Перспективные показания
Другие заболевания и состояния, при которых статины могут оказывать своё положительное действие (аритмии, желчнокаменная болезнь, остеопороз), с учётом дополнительных эффектов статинов. В настоящее время достаточной доказательной базы по данным показаниям нет, необходимы дополнительные многоцентровые исследования.
Принципы выбора отдельных статинов в различных клинических ситуациях
Симвастатин
На фоне лечения симвастатином в дозе 20 мг/сут, по данным многоцентрового плацебо-контролируемого рандомизованного контролируемого исследования (4S, 1994), выявлено снижение относительного риска смерти от ИБС на 42%, риска сердечно-сосудистых осложнений на 34%, потребности в аорто-коронарном шунтировании на 37% на фоне снижения общего холестерина, липопротеинов низкой плотности и триглицеридов на 25, 35 и 10% соответственно, и увеличения уровня липопротеинов высокой плотности на 8%. Tакже в многочисленных исследованиях (HPS, MERCURY I) подтверждён гиполипидемический эффект симвастатина, по выраженности на третьем месте после розувастатина и аторвастатина, также умеренно выраженное влияние на фракцию триглицеридов и липопротеинов высокой плотности, незначительное влияние на показатели сосудистой жёсткости. У пациентов с сахарным диабетом применение симвастатина приводит к снижению риска ИБС на 32% (4S).
Ловастатин
По результатам исследования The AFCAPS/TexCAPS PRIMARY PREVENTION TRIAL (1998) на фоне лечения ловастатином (20-40 мг/сут) выявлено умеренное снижение уровня общего холестерина крови на 18,4%, холестерина липопротеинов низкой плотности на 25%, триглицеридов на 15%, холестерина липопротеинов высокой плотности увеличился на 6%. За время лечения частота сердечно-сосудистых осложнений снизилась на 36%, а также уменьшилась частота конечных точек второго ряда. В сравнительных исследованиях (CURVE) препарат также подтвердил недостаточно выраженный гиполипидемический эффект.
Флувастатин
Только применение максимальной дозы флувастатина (80 мг) приводит к умеренному снижению общего холестерина на 23%, холестерина липопротеинов низкой плотности на 34%, триглицеридов на 19%, к повышению концентрации холестерина липопротеинов высокой плотности на 9%. Показана эффективность флувастатина у пациентов с ИБС (исследование FLARE) при различных исходных показателях холестерина в отношении снижения на 31% риска сердечной смерти, нефатального инфаркта миокарда, необходимости реваскуляризации и коронарного шунтирования на протяжении длительного времени наблюдения. Эти положительные эффекты особенно выражены у пациентов с сахарным диабетом и поражением сосудов. Флувастатин не катаболизируется через систему цитохрома Р450, поэтому предпочтение данному ЛС отдают при необходимости комбинации с препаратами, катаболизируемыми через данную систему (например, макролиды, верапамил, амиодарон, тетрациклин).
Аторвастатин
Препарат имеет выраженный гиполипидемический эффект на общий холестерин, липопротеинов низкой плотности, триглицеридов и приводит к достоверному снижению сердечно-сосудистых осложнений на фоне лечения при первичной и вторичной профилактике ИБС (по данным IDEAL, ASCOT LLA, TNT) и риска ишемического инсульта (исследование MIRACL) как при сахарном диабете, так и без него. У пациентов с сахарным диабетом применение аторвастатина приводит к снижению риска ИБС на 51% (GREACE), инсульта на 48% (CARDS), острого коронарного синдрома на 36% (CARDS). Исследования REVERSAL и PROVE-IT подтвердили эффект замедления атеросклероза на фоне лечения. Аторвастатин улучшает вазомоторную функцию эндотелия артерий. С учётом выраженного влияния на триглицериды ЛС можно рассматривать в качестве препарата выбора у пациентов с метаболическим синдромом, сахарным диабетом, ожирением, при высоком или очень высоком риске сердечно-сосудистых осложнений.
Розувастатин
Препарат наиболее мощный среди всех представителей статинов. Гиполипидемический эффект наблюдают при дозе 10-40 мг, снижение холестерина липопротеинов низкой плотности на 46-55%; в дозе 80 мг/сут — снижение липопротеинов низкой плотности на 65%. Доказанный процесс регрессирования атеросклероза, сосудистого ремоделирования на фоне выраженного гиполипидемического эффекта. Доказательная база — исследования программы GALAXY, часть исследований ещё не завершена. После приёма в течение 4 нед дозы, превышающей рекомендуемую начальную (5 мг), последующее её повышение до 40 мг можно проводить только у пациентов с тяжёлой гиперхолестеринемией и с высоким риском сердечно-сосудистых осложнений (особенно при семейной гиперхолестеринемии) в случае неэффективности препарата в дозе 20 мг и под контролем врача в специализированных клиниках. Пациентам с почечной недостаточностью лёгкой или средней степени тяжести коррекции дозы не требуется. Розувастатин не является ни ингибитором, ни индуктором изоферментов системы цитохрома Р450. Не было отмечено клинически значимого взаимодействия между розувастатином и флуконазолом, кетоконазолом.
Побочные эффекты
Побочные эффекты при лечении статинами редки.
Со стороны пищеварительного тракта
Основная НЛР связана с превышением верхней границы нормы активности сывороточных ферментов более чем в 3 раза, встречают в 0,2-2,3% случаев в зависимости от применяемой дозы ЛС (10-80 мг/сут). Другие НЛР (запор, метеоризм, диспепсия, диарея, тошнота, панкреатит, гепатит, холестаз) обычно носят временный характер и их встречают крайне редко.
Со стороны костно-мышечной системы
Десятикратное превышение верхней границы нормы активности креатинфосфокиназы на фоне лечения статинами встречают крайне редко, менее чем в 0,1% случаев. Не описано ни одного случая рабдомиолиза при применении флувастатина. Чаще всего рабдомиолиз (острый некроз скелетных мышц) регистрировали при лечении церивастатином8, данный препарат перестали применять в клинике.
Прогностические факторы риска миопатии и рабдомиолиза: острая инфекция и антибиотикотерапия, тяжёлая травма, большая полостная операция, эндокринные и электролитные нарушения.
Со стороны других органов и систем
-
Со стороны ЦНС: головная боль, бессонница, судороги.
-
Аллергические реакции: крапивница, сыпь, васкулит, ангионевротический отёк, токсический эпидермальный некролиз.
-
Протеинурия.
-
Анемия, тромбоцитопения.
Методы контроля безопасности
Исходно необходимо определять активность АЛТ, АСТ, креатинфосфокиназы, креатинин. Через 4-6 нед необходимо проводить контрольный анализ параметров безопасности. При выявлении повышения печёночных трансаминаз более чем в 3 раза верхнего предела нормы необходимо повторить анализ, исключить другие причины гиперферментемии: приём алкоголя или сока грейпфрута накануне, восходящий холангит, холелитиаз, вирусный гепатит, переливание крови. Причиной повышения креатинфосфокиназы может быть интенсивная физическая нагрузка накануне, внутримышечные инъекции.
Противопоказания
-
Повышение печёночных трансаминаз более чем в 3 раза от нормального значения, активный гепатит.
-
Повышение креатининфосфокиназы более чем в 5 раз от верхнего предела нормального значения.
-
Беременность и лактация.
-
Индивидуальная непереносимость.
-
Детский возраст.
Предостережения: с осторожностью назначать лицам с активными заболеваниями печени в анамнезе, жировым гепатозом с небольшой гиперферментемией, при выраженных метаболических заболеваниях (сахарный диабет, гипотиреоз), при повышении уровня креатинина более 300 мкмоль/л.
Взаимодействие с лекарственными препаратами и продуктами, комбинация с которыми может увеличить риск развития миопатии:
-
антибиотики группы макролидов;
-
амиодарон;
-
верапамил;
-
варфарин;
-
грейпфруты и грейпфрутовый сок;
-
фибраты (нежелательная, но допустимая комбинация);
-
препараты для лечения ВИЧ-инфекции — ингибиторы протеазы;
-
никотиновая кислота;
-
противогрибковые препараты группы азолов (флуконазол);
-
циклоспорин.
Секвестранты жёлчных кислот — снижение абсорбции правастатина и флувастатина.
Ранитидин, омепразол — небольшое увеличение биодоступности флувастатина.
Рифампицин — снижение биодоступности флувастатина.
Варфарин и другие антикоагулянты — увеличение протромбинового времени.
Дигоксин — небольшое увеличение концентрации дигоксина в крови.
Одновременное применение статинов и антацидов, содержащих алюминия и магния гидроксид, приводит к снижению плазменной концентрации розувастатина примерно на 50%. Данный эффект выражен слабее, если антациды применяются через 2 ч после приёма розувастатина.
Одновременное применение розувастатина и пероральных контрацептивов увеличивает концентрации этинилэстрадиола и норгестрела на 26% и 34% соответственно.
Применение в особых ситуациях
Особенности фармакокинетики статинов в пожилом возрасте
Для правастатина и флувастатина у пожилых фармакокинетика не изменена. На фоне ловастатина и симвастатина у пациентов старше 70 лет площадь под фармакокинетической кривой больше на 40-60% у женщин и на 20-50% у мужчин; на фоне лечения аторвастатином — на 42% выше, чем у молодых пациентов. Исследования аторвастатина доказали безопасность применения доз аторвастатина от 10 до 80 мг.
Особенности применения статинов больными с хронической почечной недостаточностью и пересаженными органами
С учётом того, что ловастатин, симвастатин и аторвастатин катаболизируются через изоформу цитохрома Р450, препараты нельзя назначать больным с пересаженными органами, получающим цитостатики.
У пациентов с выраженной почечной недостаточностью (клиренс креатинина <30 мл/мин) концентрация розувастатина в плазме крови в 3 раза выше. Концентрация розувастатина в плазме крови у пациентов на гемодиализе была примерно на 50% выше, чем у здоровых добровольцев.
У пациентов с различными стадиями печёночной недостаточности не выявлено увеличения T1/2 розувастатина (пациенты с баллом 7 и ниже по шкале Чайльда-Пью).
ФИБРАТЫ
Механизм действия и основные фармакологические эффекты
Действие через активацию факторов транскрипции генов, пероксисомальные пролифератор-активированные рецепторы, экспрессия преимущественно в печени, влияние на многие звенья метаболизма триглицеридов: повышение активности эндотелиальной и печёночной липазы, снижение концентрации аполипопротеида (апо)С-Ш, повышение активности синтетазы ацетилКоА, которая ускоряет внутриклеточный транспорт холестерина и снижение концентрации жирных кислот. Важный механизм фибратов — воздействие на уровень алиментарных липидов. Безафибрат8 обладает механизмами повышения инсулинорезистентности. Уменьшение общего количества липопротеидов, обогащённых триглицеридов снижает переход на них эфиров холестерина с липопротеинами высокой плотности, поэтому уровень липопротеинов высокой плотности повышается.
Гиполипидемический эффект
На фоне лечения фибратами отмечают выраженное снижение уровня триглицеридов до 20-50%, увеличение содержания липопротеинов высокой плотности до 25-30%. Фибраты третьего поколения (фенофибрат и ципрофибрат) способствуют также снижению липопротеинов низкой плотности до 25%. Подобное влияние фибратов на липиды обнаруживают не только у больных с нормальной толерантностью к глюкозе, но и у больных с инсулинорезистентностью, типичной для пациентов с метаболическим синдромом. Фибраты эффективно снижают остатки хиломикронов и липопротеинов очень низкой плотности, хорошие результаты при дислипидепротеидемии III типа.
Плейотропные эффекты
Противовоспалительное, антиоксидантное действие, улучшение функции эндотелия.
Выраженное влияние на реологические свойства крови и фибринолиз, больше, чем у статинов: снижение фибриногена (под влиянием всех фибратов, кроме гемфиброзила), агрегация тромбоцитов и активация фибринолиза выше 5,2 ммоль/л. Фенофибрат уменьшает агрегацию тромбоцитов, снижает повышенный уровень фибриногена в плазме на 3% у пациентов с нормальным холестерином и на 23% у пациентов с дислипидепротеидемией.
Фибраты улучшают углеводный и пуриновый обмены. Фенофибрат может несколько понизить уровень глюкозы в крови у больных сахарным диабетом, снизить уровень мочевой кислоты в крови и проявления жирового гепатоза, а также уровни ЩФ и гаммаглутамилтрансферазы. Потенциально неблагоприятный плейотропный эффект — повышение уровня гомоцистеина (для фенофибрата и безафибрата8).
Фармакокинетика
Метаболизм всех фибратов, кроме гемфиброзила, происходит в почках (ограничения при ХПН).
Безафибрат18: быстро и почти полностью абсорбируется в кишечнике. Биодоступность 90%. Период полувыведения капсулы 300 мг самый короткий среди фибратов — 1,5-2 ч. С этим связана низкая гиполипидемическая активность, но возможность применять со статинами.
Гемфиброзил: биодоступность 97%. Период полувыведения — 1,5-2,5 ч. Около 97% препарата связывается с белками. Метаболизируется в печени. Единственный фибрат, который с осторожностью можно назначать при нарушении функции почек.
Фенофибрат: главный метаболит — фенофиброевая кислота. Cmax в плазме крови достигается через 5 ч после приёма препарата внутрь. Средняя концентрация в плазме — около 15 мкг/мл при дозе 200 мг. Уровень концентрации в плазме устойчив. Связывание с белками 99%. T1/2 фенофиброевой кислоты из плазмы составляет около 20 ч. По сравнению с другими фибратами эффективность фенофибрата в меньшей степени зависит от приёма жирной пищи. Практически весь препарат выводится с мочой через 6 сут преимущественно в виде фенофиброевой кислоты и глюкуронидов. Препарат не кумулирует при приёме однократной дозы и продолжительном применении. Фенофиброевая кислота не выводится при гемодиализе.
Ципрофибрат: наибольший период полувыведения из плазмы (до 80 ч), разовая суточная доза — 100 мг.
Показания и доказательная база
Достаточная доказательная база есть по гиполипидемическому эффекту и влиянию на конечные точки у фибратов. Гемфиброзил (1200 мг/сут): доказанный гиполипидемический эффект по снижению триглицеридов (на 25-38%), повышению липопротеинов высокой плотности на 9% и снижению риска сердечно-сосудистых осложнений и смерти на 34% в исследованиях HHS и VA-HIT. В результате трёхлетнего приёма гемфиброзила было снижено число смертельных и несмертельных исходов ИБС на 22% на фоне повышения концентрации холестерина липопротеинов высокой плотности на 6% и снижения триглицеридов на 31%; содержание холестерина липопротеинов низкой плотности практически не менялось (VaHIT). В подгруппе пациентов с низким содержанием липопротеинов высокой плотности, у лиц с ожирением и метаболическим синдромом лечение более эффективное. Влияние фибратов на прогрессирование атеросклероза: исследование BECAIT в течение 5 лет лечение безафибратом8 сопровождало достоверное снижение общего холестерина на 14%, триглицеридов на 31%, липопротеинов очень низкой плотности на 35%, фибриногена на 13%, уровень липопротеинов высокой плотности повысился на 9%, отмечено уменьшение степени прогрессирования атеросклероза по минимальному диаметру просвета коронарной артерии (на 0,13 мм). В исследовании DAIS динамика коронарного атеросклероза при коррекции дислипопротеидемии с помощью микронизированного фенофибрата (200 мг/сут) 3 года лечения у больных сахарным диабетом 2-го типа отмечено увеличение холестерина липопротеинов высокой плотности на 7,5%, снижение общего холестерина на 9,9%, холестерина липопротеинов низкой плотности на 6,2% и триглицеридов на 28%. Наблюдали также замедление прогрессирования атеросклероза в группе больных, получавших фенофибрат, на 42% меньше скорость прогрессирования стеноза по сравнению с плацебо.
Показания
-
Гиперхолестеринемия (тип IIa по классификации Фредриксона).
-
Эндогенная гипертриглицеридемия (тип IV по классификации Фредриксона).
-
Смешанная гиперлипидемия (тип IIb и III по классификации Фредриксона).
-
Дислипидемия при метаболическом синдроме, сахарном диабете, при неэффективности монотерапии статинами в комбинации со статинами — только фенофибрат.
-
Противопоказания к статинам.
Режим дозирования
Наиболее перспективное ЛС среди фибратов — фенофибрат в микрогранулах 200М. Фенофибрат 200М назначают по 1 капс/сут во время одного из основных приёмов пищи.
Побочное действие
Со стороны костно-мышечной системы: диффузная миалгия, болезненность, слабость; редко рабдомиолиз (в некоторых случаях достаточно тяжёлого течения). При прекращении лечения эти явления, как правило, обратимы.
Со стороны пищеварительной системы: диспепсия, транзиторное повышение активности печёночных трансаминаз.
Аллергические реакции : кожная сыпь, зуд, крапивница, фотосенсибилизация.
В некоторых случаях после нескольких месяцев применения препарата могут возникать реакции фоточувствительности в виде эритемы, папул, пузырьков, экземы.
Противопоказания
-
Выраженные нарушения функции печени.
-
Выраженные нарушения функции почек.
-
Наличие в анамнезе фототоксичных или фотоаллергических реакций при лечении фенофибратами или другими аналогичными препаратами (кетопрофен).
-
Комбинация с другими фибратами.
-
Врождённая галактоземия.
-
Дефицит лактазы.
-
Детский и подростковый возраст до 18 лет.
-
Беременность.
-
Лактация (грудное вскармливание).
Особые указания
При отсутствии эффекта после 3-6 мес приёма препарата может быть назначено сопутствующее или альтернативное лечение. Получены данные о влиянии фибратов на мышечную ткань, включая редкие случаи некроза. Эти процессы происходят чаще при сниженном уровне альбумина плазмы крови. При развитии у пациента диффузной миалгии, повышении уровня креатинфосфокиназы (в 5 раз выше нормы) лечение препаратом фенофибрата 200М следует прекратить. Кроме того, риск развития рабдомиолиза увеличивается при одновременном приёме препарата с ингибиторами ГМГ-КоА-редуктазы.
При совместном применении фенофибрата 200М и антикоагулянтов необходим более частый контроль протромбинового времени во время подбора дозы непрямого антикоагулянта при лечении фибратами и в течение 8 дней после их отмены.
Контроль лабораторных показателей
При длительном лечении необходим контроль активности печёночных трансаминаз каждые 3 мес в первый год лечения. В случаях повышения активности ферментов АСТ или АЛT более чем в 3 раза по сравнению с верхней границей нормы приём препарата прекращают.
Лекарственное взаимодействие
Противопоказано одновременное назначение фенофибрата 200М с другими фибратами, так как возрастает риск развития рабдомиолиза. По этой же причине фенофибрат 200М назначают с осторожностью в комбинации с ингибиторами ГМГ-КоА-редуктазы.
При совместном применении фенофибрата 200М и непрямых антикоагулянтов возможно усиление их эффекта и повышение риска возникновения кровотечений, что связано с вытеснением антикоагулянта из мест связывания с белками плазмы (необходим контроль протромбинового времени).
Не следует назначать одновременно с фенофибратом ингибиторы МАО.
Особенности фармакокинетики фибратов в пожилом возрасте
Период полувыведения возрастает в 3-4 раза, необходимо снижать суточную дозу.
Особенности фармакокинетики фибратов при хронической почечной недостаточности
Период полувыведения коррелирует с клиренсом креатинина, необходимо снижать дозу при ХПН.
СЕКВЕСТРАНТЫ ЖЁЛЧНЫХ КИСЛОТ
Механизм действия и фармакологические эффекты
Секвестранты жёлчных кислот или ионно-обменные смолы — достаточно разные по своей структуре, но имеют общий механизм — прерывание нормальной циркуляции богатого холестерином пула жёлчных кислот. Секвестранты жёлчных кислот связывают жёлчные кислоты в кишечнике. Истощение пула жёлчных кислот в печени ведёт к повышению синтеза холестерина гепатоцитов, таким образом, содержание холестерина в гепатоцитах снижается. Также секвестранты жёлчных кислот незначительно абсорбируют холестерин из пищи, как результат — повышение экспрессии рецепторов липопротеинов низкой плотности в гепатоцитах, снижение уровня холестерина в плазме. Секвестранты жёлчных кислот при длительном применении стимулируют активность редуктазы ГМГ-КоА, поэтому их часто комбинируют со статинами.
По данным исследования LRC-CPTT, снижение уровня общего холестерина на фоне длительного лечения колестирамином8 в дозе 24 г/сут может достигать 20%, уровень липопротеинов высокой плотности статистически значимо возрастает на 1,6%, уровень триглицеридов повышается незначительно — через год на 4,3%. Существует риск увеличения триглицеридов только при исходно повышенном уровне. Комбинированное лечение секвестрантами жёлчных кислот со статинами позволяет добиться снижения уровня липопротеинов низкой плотности на 45-60%.
Фармакокинетика
Секвестранты жёлчных кислот действуют в дистальном отделе тонкой кишки, не всасываются и не оказывают системного действия.
Показания и доказательная база
-
Неэффективность немедикаментозных методов лечения.
-
Комбинированное лечение со статинами при выраженной дислипидемии IIa.
-
В педиатрии при наследственной дислипидемии и неэффективности диеты.
В исследовании LRC-CPTT (наблюдение 7,4 года) выявлено: колестирамин8 24 г/сут — снижение риска развития фатального и нефатального инфаркта миокарда на 19%, снижения общей смертности не достигнуто.
Побочное действие
Со стороны пищеварительного тракта: сильные запоры, изжога, стеаторея, обострения язвенной болезни, желудочно-кишечное кровотечение, способствуют образованию камней в жёлчном пузыре, усилению желудочно-пищеводного рефлюкса.
Новый секвестрант жёлчных кислот — колестирамин 8 редко даёт такие побочные действия (миалгия, фарингит, очень редко гриппоподобные симптомы).
Противопоказания
Основные протипопоказания: билиарный цирроз печени, полная билиарная обструкция, семейная дисбеталипиопротеидемия, выраженная гипертриглицеридемия и запоры.
С осторожностью: при болезнях почек, желчнокаменной болезни, расстройствах органов пищеварения, синдроме мальабсорбции, язвенной болезни желудка и двенадцатиперстной кишки, геморрое, нарушение коагуляции, гипотиреоидизме.
При беременности и лактации — данных нет.
Лекарственные взаимодействия
Секвестранты жёлчных кислот действуют в просвете кишечника и могут влиять на процесс всасывания и фармакокинетику многих ЛС: гидрокортизона, сердечных гликозидов, тиазидных диуретиков, тироксина, варфарина, антибиотиков, флувастатина, правастатина. Секвестранты жёлчных кислот могут влиять на всасывание жирорастворимых витаминов. Приём секвестрантов жёлчных кислот за час до или через 4-6 ч после приёма основных ЛС существенно снижает лекарственное взаимодействие с другими лекарственными средствами.
НИКОТИНОВАЯ КИСЛОТА
Механизм действия и фармакологические эффекты
Гиполипидемический эффект
Никотиновая кислота ингибирует липолиз в адипоцитах, снижает поступление в печень свободных жирных кислот, ингибирует в печени продукцию липопротеинов очень низкой плотности, что приводит к снижению уровня липопротеинов низкой плотности. Повышение уровня липопротеинов высокой плотности на фоне применения никотиновой кислоты максимально. Снижает синтез липопротеинов очень низкой плотности в печени и частично блокирует высвобождение жирных кислот из жировой ткани, таким образом создавая их дефицит в плазме. В организме никотиновая кислота превращается в никотинамид, который связывается с коэнзимами кодегидрогеназы I и II (НАД и НАДФ), переносящими водород, участвует в метаболизме жиров, протеинов, аминокислот, пуринов, тканевом дыхании, гликогенолизе, синтетических процессах. Гипохолестеринемический эффект отмечают через несколько дней, снижение триглицеридов — через несколько часов после приёма. В суточной дозе 3,0-6,0 г никотиновая кислота приводит к снижению уровня триглицеридов на 20-80%, холестерина липопротеинов низкой плотности на 10-20%, повышает уровень холестерина липопротеинов высокой плотности на 25-50%. Повышение содержания липопротеинов высокой плотности зависит от исходного уровня, при нормальном исходном уровне наблюдают максимальный прирост.
Нелипидные механизмы
Никотиновая кислота оказывает вазодилатирующее действие на уровне мелких сосудов (в том числе головного мозга), улучшает микроциркуляцию, оказывает слабое антикоагулянтное действие (повышает фибринолитическую активность крови). Восполняет дефицит витамина РР (витамина В3), является специфическим противопеллагрическим средством (авитаминоз витамина РР).
Фармакокинетика
Примерно 60-76% от принятой дозы никотиновой кислоты абсорбируется. Максимальная концентрация в плазме достигается через 4-5 ч после приёма форм с замедленным высвобождением. До 90% принятого препарата внутрь выводится с мочой как в неизменённом виде, так и в виде метаболитов. Получены данные по отличию метаболизма никотиновой кислоты у разных полов: у женщин эффект никотиновой кислоты более выраженный. Доза для гиполипидемического эффекта — 1-5 мг/сут. Для минимизации побочного действия рекомендуют перед употреблением препарат измельчить и принимать только с пищей.
Показания и доказательная база
Основные показания для назначения никотиновой кислоты:
-
комбинированная гиперлипопротеидемия (фенотип IIb), а также гипертриглицеридемия в сочетании с низким содержанием холестерина липопротеинов высокой плотности и дислипидепротеидемией I, III, IV и V типов;
-
дислипидемия и атеросклероз нижних конечностей.
В исследовании CDP в группе больных, принимавших никотиновую кислоту, в отдалённом периоде смертность от всех причин была на 11% ниже по сравнению с группой плацебо.
Другие показания
Гипо- и авитаминоз РР: пеллагра, неполноценное и несбалансированное питание (в том числе парентеральное), синдром мальабсорбции (в том числе на фоне нарушения функции поджелудочной железы), быстрое похудание, гастрэктомия, болезнь Хартнупа (наследственное заболевание, сопровождающееся нарушением усвоения некоторых аминокислот, в том числе триптофана), заболевания органов пищеварения (глютеновая энтеропатия, персистирующая диарея, тропическая спру, болезнь Крона), а также состояния повышенной потребности организма в витамине РР: длительная лихорадка, заболевания гепатобилиарной области (острые и хронические гепатиты, цирроз печени), гипертиреоз, хронические инфекции, злокачественные опухоли, длительный стресс, беременность (особенно на фоне никотиновой и лекарственной зависимости, многоплодная беременность), период лактации.
Ишемические нарушения мозгового кровообращения, облитерирующие заболевания сосудов конечностей (облитерирующий эндартериит, болезнь Рейно), спазм сосудов конечностей, желче- и мочевыводящих путей; диабетическая полиневропатия, микроангиопатия.
Неврит лицевого нерва, гипоацидный гастрит, энтероколит, колит, длительно не заживающие раны и трофические язвы.
Режим дозирования
Никотиновую кислоту назначают в дозе 1-2-4-6 г в день в 2-3 приёма. Для повышения уровня липопротеинов высокой плотности достаточно 1 г/сут. Для воздействия на другие фракции липопротеидов требуются более высокие дозы — до 4-6 г/сут. Рекомендуют медленное титрование дозы для улучшения переносимости — с 0,25-0,5 г до 4-6 г с интервалом 1 нед.
Побочные действия
Со стороны сердечно-сосудистой системы: гиперемия кожи лица и верхней половины туловища с ощущением покалывания и жжения, при быстром введении — снижение АД, ортостатическая гипотензия, коллапс, суправентрикулярные аритмии. Со стороны ЦНС и периферической нервной системы: парестезии, головокружение и головная боль (у 4-11% пациентов), мигрень, астения, повышенная нервная возбудимость, панические эпизоды. Также могут быть выявлены следующие нежелательные явления: токсическая амблиопия, двоение в глазах, ослабление или потеря центрального зрения, импотенция. Со стороны пищеварительной системы: повышение активности трансаминаз (у 3-5%), в отдельных случаях развитие печёночной недостаточности. Другие побочные реакции: обострение язвенной болезни желудка, абдоминальный дискомфорт у 20% пациентов, также может быть тошнота, рвота, холестаз. Со стороны обмена веществ: при длительном применении гиперурикемия (у 5-10%), снижение толерантности к глюкозе (у 10%). Миопатию на фоне монотерапии встречают нечасто; значительно учащается при комбинации со статинами и фибратами. Кожные побочные реакции: сухость, ихтиоз, acantosis nigricans — нередкие НЛР.
В лабораторных анализах иногда выявляют: повышение протромбинового времени, снижение количества тромбоцитов, повышение концентрации амилазы.
Для улучшения переносимости рекомендовано за 30 мин до приёма никотиновой кислоты принимать 125-250 мг ацетилсалициловой кислоты или ибупрофена для нивелирования эффекта гиперемии и жара.
Противопоказания
Повышенная чувствительность к никотиновой кислоте.
Для приёма внутрь: язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, наличие желудочных кровотечений в анамнезе, детский возраст до 16 лет (в качестве гиполипидемического средства).
Для парентерального применения: тяжёлая артериальная гипертензия, атеросклероз, подагра, гиперурикемия, детский возраст.
Относительные противопоказания: глаукома, подагра, гиперурикемия, печёночная недостаточность, артериальная гипотензия, гиперацидный гастрит, язвенная болезнь желудка и двенадцатиперстной кишки (в фазе ремиссии), сахарный диабет 2-го типа.
Особые указания
C осторожностью применять перорально у пациентов с геморрагическим диатезом, указаниями на рабдомиолиз, болезнях печени, при нестабильной стенокардии.
Для предупреждения осложнений со стороны печени рекомендуют включать в диету продукты, богатые метионином (творог) или применять метионин, липоевую кислоту и другие липотропные средства.
Не рекомендуют применять беременным и кормящим.
Лекарственное взаимодействие
Во время лечения никотиновой кислотой нельзя принимать горячие напитки, алкоголь, горячий душ с целью уменьшения выраженности побочных явлений.
Необходимо соблюдать осторожность при комбинировании с гипотензивными средствами, антикоагулянтами и ацетилсалициловой кислотой. Никотиновая кислота снижает токсичность неомицина и предотвращает индуцируемое им уменьшение концентрации холестерина и липопротеинов высокой плотности.
Статины: при комбинации возрастает риск миопатий и рабдомиолиза, если доза никотиновой кислоты более 1 г/сут.
Антикоагулянты: при комбинации отмечено увеличение протромбинового времени и снижение количества тромбоцитов.
Секвестранты жёлчных кислот: колестирамин8 и колестипол8 снижают биодоступность никотиновой кислоты от 10-30% до 98%, так как она может связываться со свободными жирными кислотами; совместный приём с интервалом 4-6 ч.
СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ АБСОРБЦИИ ХОЛЕСТЕРИНА. ЭЗЕТИМИБ
Механизм действия и фармакологический эффект
Гиполипидемический препарат для приёма внутрь. Снижает абсорбцию холестерина в кишечнике, в том числе холестерина растительных жиров.
При поступлении в тонкий кишечник эзетимиб локализуется в щёточной каёмке тонкой кишки и препятствует всасыванию холестерина, что приводит к уменьшению поступления холестерина из кишечника в печень, за счёт чего снижаются запасы холестерина в печени и увеличивается его выведение из крови. Эзетимиб не повышает экскрецию жёлчных кислот (в отличие от препаратов, связывающих жёлчные кислоты) и не ингибирует синтез холестерина в печени (в отличие от статинов). В двухнедельном клиническом исследовании, в которое были включены 18 пациентов с гиперхолестеринемией, эзетимиб уменьшал абсорбцию холестерина в кишечнике на 54% по сравнению с плацебо.
За счёт снижения абсорбции холестерина в кишечнике эзетимиб уменьшает поступление холестерина в печень. Статины снижают синтез холестерина в печени. За счёт двух различных механизмов действия препараты этих двух классов при совместном назначении обеспечивают дополнительное снижение уровня холестерина. Эзетимиб, назначаемый в комбинации со статинами, снижает уровень общего холестерина и холестерина липопротеинов низкой плотности, аполипопротеина-В и триглицеридов и повышает уровень холестерина липопротеинов высокой плотности у пациентов с гиперхолестеринемией в большей степени, чем эзетимиб или симвастатин, назначаемые раздельно.
Клинические исследования показали, что повышенный уровень общего холестерина, холестерина липопротеинов низкой плотности и аполипопротеина-В — главного белкового компонента липопротеинов низкой плотности — способствует развитию атеросклероза. Кроме того, пониженный уровень холестерина липопротеинов высокой плотности ассоциируется с развитием атеросклероза. В эпидемиологических исследованиях установлено, что сердечно-сосудистая заболеваемость и смертность находятся в прямой зависимости от уровня общего холестерина и холестерина липопротеинов низкой плотности и в обратной зависимости от уровня холестерина липопротеинов высокой плотности. Как и липопротеины низкой плотности, липопротеины, богатые холестерином и триглицеридами, включая липопротеины очень низкой плотности, липопротеины промежуточной плотности и ремнанты, также могут способствовать развитию атеросклероза.
Для определения избирательности эзетимиба в отношении ингибирования всасывания холестерина была проведена серия доклинических исследований. Эзетимиб ингибировал всасывание 14C-холестерина и не оказывал влияния на всасывание триглицеридов, жирных кислот, жёлчных кислот, прогестерона, этинилэстрадиола, жирорастворимых витаминов А и D.
Фармакокинетика
После приёма внутрь эзетимиб быстро всасывается и интенсивно конъюгирует в тонкой кишке и печени с фармакологически активным фенольным глюкуронидом с образованием эзетимиб-глюкуронида. Сmax эзетимиб-глюкуронида достигается через 1-2 ч, эзетимиба — через 4-12 ч. Одновременный приём пищи (как с высоким содержанием жира, так и нежирной) не оказывает влияния на биодоступность эзетимиба при приёме внутрь в дозе 10 мг. Связывание с белками плазмы крови эзетимиба и эзетимиб-глюкуронида составляет 99,7% и 88-92% соответственно. Эзетимиб метаболизируется главным образом в тонкой кишке и печени путём конъюгации с глюкуронидом (реакция II фазы) с последующим выведением с жёлчью. Эзетимиб и эзетимиб-глюкуронид — основные вещества, выявляемые в плазме крови и составляющие примерно 10-20% и 80-90% от общего содержания препарата в плазме соответственно. Т1/2 эзетимиба и эзетимиб-глюкуронида составляет около 22 ч. В течение 10 дней от общего количества принятой дозы с калом выводится 78%, с мочой — 11%.
Фармакокинетика в особых клинических случаях
Фармакокинетические данные для детей в возрасте до 10 лет отсутствуют. Абсорбция и метаболизм эзетимиба у детей, подростков в возрасте 10-18 лет и взрослых одинаковы. По данным измерения концентрации суммарного эзетимиба фармакокинетические показатели у подростков и взрослых не отличались.
У пожилых пациентов в возрасте старше 65 лет концентрация в плазме суммарного эзетимиба примерно в 2 раза выше, чем у молодых (от 18 до 45 лет). Снижение холестерина липопротеинов низкой плотности и профиль безопасности у пожилых и молодых испытуемых, получавших препарат эзетимиб, сопоставимы.
Подбора дозы для пациентов с лёгкой печёночной недостаточностью не требуется. В связи с недостаточно исследованным действием повышенных доз эзетимиба у больных с умеренной (7-9 баллов по шкале Чайлда-Пью) и тяжёлой (более 9 баллов по шкале Чайлда-Пью) печёночной недостаточностью применение эзетимиба у данной категории пациентов не рекомендуют.
После однократного приёма эзетимиба в дозе 10 мг у пациентов с тяжёлыми заболеваниями почек (креатинин не более 30 мл/мин/1,73 м2 ) AUC для общего эзетимиба увеличилась примерно в 1,5 раза по сравнению со здоровыми добровольцами. Данный результат не является клинически значимым.
Концентрация эзетимиба в плазме крови несколько выше (менее 20%) у женщин, чем у мужчин. Снижение уровня холестерина липопротеинов низкой плотности и профиль безопасности сравним у лиц обоего пола, поэтому коррекции дозы препарата для мужчин или женщин не требуется.
Показания
-
Первичная гиперхолестеринемия (эзетимиб назначают в комбинации с ингибиторами ГМГ-КоА-редуктазы/статинами или в качестве монотерапии в дополнение к диете для снижения повышенного уровня общего холестерина, холестерина липопротеинов низкой плотности, аполипопротеина В и триглицеридов, а также для повышения уровня холестерина липопротеинов высокой плотности у пациентов с первичной /гетерозиготной семейной и несемейной гиперхолестеринемией).
-
Гомозиготная семейная гиперхолестеринемия (эзетимиб в комбинации со статинами рекомендуют для снижения повышенного уровня общего холестерина, холестерина липопротеинов низкой плотности; пациенты могут также получать дополнительное лечение, например аферез липопротеинов низкой плотности).
-
Гомозиготная ситостеролемия (или фитостеролемия) — повышенный уровень растительных стеролов в плазме при повышенном или нормальном уровне холестерина и нормальном содержании триглицеридов (эзетимиб рекомендуют для снижения повышенного уровня ситостерола и кампестерола).
Режим дозирования
Перед началом лечения и во время всего периода лечения эзетимибом пациенты должны соблюдать липидопонижающую диету. Препарат принимают внутрь в любое время дня, независимо от приёма пищи. Рекомендуемая доза эзетимиба в качестве монотерапии или в комбинации со статинами составляет 10 мг 1 раз/сут. При сопутствующем лечении секвестрантами жёлчных кислот препарат назначают по 10 мг 1 раз/сут не позднее чем за 2 ч до приёма секвестрантов жёлчных кислот или не ранее чем через 4 ч после их приёма.
У пожилых и пациентов с нарушениями функции почек подбора дозы не требуется.
Подбора дозы для пациентов с лёгкой печёночной недостаточностью (5-6 баллов по шкале Чайлда-Пью) не требуется.
Побочное действие
В клинических исследованиях длительностью от 8 до 14 нед, в которые было включено 3366 пациентов, эзетимиб, назначаемый в суточной дозе 10 мг в качестве монотерапии или в комбинации со статинами, показал хорошую переносимость.
НЛР были лёгкими и преходящими; общая частота побочных эффектов и частота случаев отмены препарата не отличались от показателей при приёме плацебо.
НЛР выявлены в 1-10% случаев при приёме эзетимиба в виде монотерапии или одновременно со статином.
При монотерапии: головная боль, боль в животе, диарея.
При комбинированном лечении со статином: головная боль, утомляемость, боль в животе, запор, диарея, вздутие живота, тошнота, повышение активности АСТ и АЛT
Лабораторные показатели: при монотерапии частота клинически значимого повышения печёночных трансаминаз (АЛT и/или ACT в три или более раз превышает верхнюю границу нормы после приёма) была одинаковой для препарата эзетимиб (0,5%) и плацебо (0,3%). При комбинированном лечении со статинами частота клинически значимого повышения трансаминаз сыворотки крови составляет 1,3% для больных, принимавших эзетимиб вместе со статином, и 0,4% — для принимавших только статин. Повышение трансаминаз обычно бессимптомное, не сопровождается развитием холестаза и проходит как при продолжении лечения, так и после отмены препарата.
Частота возникновения клинически значимого повышения креатинфосфокиназы (превышает верхнюю границу нормы в ≥10) у пациентов, получавших препарат эзетимиб в монотерапии, была сходна с данным показателем у больных, получавших плацебо или статин в монотерапии.
При применении эзетимиба в клинической практике отмечали следующие НЛР: ангионевротический отёк, кожная сыпь, повышение креатинфосфокиназы, печёночных ферментов, гепатиты, тромбоцитопения, панкреатит, тошнота, миалгия; очень редко миопатия, рабдомиолиз.
Противопоказания
-
Повышенная чувствительность к компонентам препарата.
-
Умеренная (7-9 баллов по шкале Чайлда-Пью) и тяжёлая (более 9 баллов по шкале Чайлда-Пью) степень печёночной недостаточности.
-
Одновременное применение с фибратами (в настоящее время эффективность и безопасность не установлены).
С осторожностью следует назначать препарат пациентам, получающим циклоспорин.
Применение эзетимиба при беременности не рекомендуют. В случае наступления беременности приём эзетимиба следует прекратить, не рекомендуют применять препарат кормящим матерям.
Особые указания
Следует учитывать, что если эзетимиб назначают совместно с гиполипидемическими средствами класса статинов, необходимо внимательно ознакомиться с инструкцией по медицинскому применению данного статина.
При назначении эзетимиба вместе со статином контроль функции печени следует проводить в начале лечения, в дальнейшем — в соответствии с рекомендациями для данного статина.
При необходимости одновременного назначения эзетимиба с циклоспорином следует контролировать концентрацию последнего.
В клинических исследованиях частота возникновения миопатии или рабдомиолиза, связанных с применением эзетимиба, не превышала таковую в сравнении с соответствующей контрольной группой (плацебо или статин). В клинических исследованиях частота повышения креатинфосфокиназы (превышает верхнюю границу нормы в >10х) составила 0,2% в группе эзетимиба в сравнении с 0,1% в группе плацебо и 0,1% в группе комбинированного назначения эзетимиба со статином в сравнении с 0,4% в группе монотерапии статином.
Использование в педиатрии
Клинический опыт применения эзетимиба у детей и подростков в возрасте 9-17 лет ограничен, поэтому не рекомендуют назначать препарат данной категории пациентов.
Лекарственное взаимодействие
Эзетимиб не индуцирует изоферменты цитохрома Р450. Между эзетимибом и лекарственными средствами, которые метаболизируются изоферментами цитохрома P450 1А2, 2D6, 2С8, 2С9 и 3А4 или NAT, клинически значимых фармакокинетических взаимодействий не наблюдали.
Эзетимиб не влияет на фармакокинетику дапсона, декстрометорфана, дигоксина, пероральных контрацептивов (этинилэстрадиола и левоноргестрела), глипизида, толбутамида, мидазолама и варфарина.
При одновременном применении с антацидами скорость всасывания эзетимиба снижается, но не оказывает влияния на его биодоступность и, следовательно, не является клинически значимой.
При одновременном применении с колестирамином8 AUC для суммарного эзетимиба (эзетимиб + эзетимиб-глюкуронид) уменьшается приблизительно на 55%. Дополнительное снижение холестерина липопротеинов низкой плотности за счёт присоединения эзетимиба к колестирамину8 может быть уменьшено данным взаимодействием.
Безопасность и эффективность эзетимиба при применении с фибратами не установлена. Фибраты могут повышать выделение холестерина в жёлчь, что приводит к желчнокаменной болезни. Одновременный приём фенофибрата или гемфиброзила повышает суммарную концентрацию эзетимиба приблизительно в 1,5 и 1,7 раза соответственно. Однако данное повышение не рассматривают как клинически значимое. В доклинических исследованиях на собаках эзетимиб повышал уровень холестерина в жёлчном пузыре. Хотя значение этих данных для человека неизвестно, одновременное назначение эзетимиба с фибратами до проведения клинических исследований не рекомендуют.
Аторвастатин, симвастатин, правастатин, ловастатин или флувастатин при одновременном применении с эзетимибом не вызывают клинически значимых фармакокинетических изменений.
У пациентов, перенёсших трансплантацию почки, с креатинином более 50 мл/мин, постоянно получающих циклоспорин, однократный приём эзетимиба в дозе 10 мг сопровождается в среднем 3,4-кратным (с разбросом от 2,3 до 7,9 раза) увеличением AUC для эзетимиба.
ОМЕГА-3-ПОЛИНЕНАСЫЩЕННЫЕ ЖИРНЫЕ КИСЛОТЫ. ОМАКОР*
Активные вещества: концентрат К85 ω-3-кислот эфиров этиловых 1000 мг (этиловый эфир ω-3-кислот, состоящий из этилового эфира эйкозапентоеновой кислоты — 46% и этилового эфира докозагексаеновой кислоты — 38%); альфатокоферол 4 мг.
Фармакологический эффект
По результатам многоцентрового исследования GISSI-Prevenzione, омакор* рекомендован в качестве вторичной профилактики инфаркта миокарда (1 г в сутки). При применении высокоочищенных ω-3-полиненасыщенных жирных кислот риск внезапной смерти снижался на 45%. Риск смерти от сердечнососудистых осложнений уменьшился на 20% в сравнении с контрольной группой. В исследованиях GISSI-Р, DART выявлено снижение риска сердечно-сосудистой смерти после 6-9 мес приёма высокоочищенных ω-3-полиненасыщенных жирных кислот. Tакже есть данные об уменьшении на 48% количества желудочковых экстрасистол после 16-недельного курса ω-3-полиненасыщенных жирных кислот по сравнению с плацебо. Существенного положительного влияния на уровень холестерина в дозе 1 г/сут препарат не оказывает, не менялись также показатели глюкозы крови и количество фибриногена. Отмечена хорошая переносимость препарата.
Показания и доказательная база
Препарат применяют для вторичной профилактики инфаркта миокарда — GISSI-Р, DART — в сочетании с другими стандартными методами лечения статинами, антитромбоцитарными средствами, бета-адреноблокаторами, ингибиторами АПФ. При эндогенной гипертриглицеридемии — в качестве дополнения к диете при её недостаточной эффективности:
-
тип IV (в качестве монотерапии);
-
типы IIb/III (в комбинации со статинами в случае, когда концентрация триглицеридов остаётся высокой).
Наблюдения в течение 3,5 лет пациентов, принимавших по 1 г препарата омакор* в сутки, показали значительное сокращение комбинированного показателя, включающего смертность от всех причин, а также нефатальные инфаркты миокарда и инсульты.
Противопоказания
Повышенная чувствительность к компонентам препарата. Экзогенная гипертриглицеридемия (гиперхиломикронемии типа I). Беременность и период лактации.
Меры предосторожности
Препарат следует применять с осторожностью лицам:
-
в возрасте до 18 лет (эффективность и безопасность лечения не установлены);
-
пожилого возраста (старше 70 лет);
-
с выраженными нарушениями функций печени;
-
принимающим фибраты и/или пероральные антикоагулянты;
-
с тяжёлыми травмами;
-
перенёсшим хирургические операции (в связи с риском увеличения времени кровотечения).
Способ применения
Препарат принимают внутрь во время еды. Для вторичной профилактики инфаркта миокарда рекомендуют принимать по 1 капсуле в сутки. Продолжительность лечения — по рекомендации врача. При гипертриглицеридемии начальная доза составляет 2 капсулы в сутки. В случае отсутствия терапевтического эффекта возможно увеличение дозы до 4 капсул в сутки.
Побочное действие
Со стороны пищеварительного тракта: возможно появление рефлюкса или отрыжки с запахом или привкусом рыбы, тошнота, рвота, вздутие живота, диарея или запор.
Со стороны кожных покровов: редко — экзема, акне.
Несмотря на то, что случаев аллергических реакций при приёме омакора* не описано, полностью исключить их вероятность нельзя.
Лабораторные показатели: при приёме омакора* у пациентов с гипертриглицеридемией возможно умеренное повышение активности «печёночных» трансаминаз.
АНТИОКСИДАНТЫ ЛИПОПРОТЕИДОВ. ПРОБУКОЛ
Механизм действия и фармакологический эффекты
Увеличивает катаболизм липопротеинов низкой плотности, снижает уровень липопротеинов низкой плотности на 8-15%, но одновременно снижает также уровень липопротеинов высокой плотности (антиатерогенный фактор) — максимально на 25%, что неблагоприятно изменяет соотношение липопротеинов низкой плотности и липопротеинов высокой плотности. Пробукол тормозит раннюю стадию синтеза холестерина. Tакже препарат имеет антиоксидантное действие на липопротеиды, то есть способность тормозить перекисное окисление липидов. Считают, что положительное действие пробукола в меньшей степени связано с его способностью снижать содержание липопротеинов низкой плотности в сыворотке, а в основном с его антиоксидантным действием на липиды. Начало гипохолестеринемического действия пробукола — через 2-4 ч после приёма, пик действия — через 3-6 нед, эффект сохраняется после приёма 20 дней.
Фармакокинетика
Биодоступность — 2-8%, зависит от приёма пищи. В плазме крови на 95% связан с липопротеидами крови. Период полувыведения — 12 ч и более, сохраняется в жировой ткани до 6 мес, в связи с высокой липофильностью. Метаболизм до конца не изучен. Экскреция в основном с жёлчью, 2% с мочой. При нарушенной функций печени и у пожилых пациентов может наблюдаться кумуляция препарата.
Показания
Как гипохолестеринемическое средство второго ряда при неэффективности других препаратов, но только при условии, что не будет прогностически значимого снижения липопротеинов высокой плотности.
Применение
Приём 500 мг 2 раза в день вместе с приёмом пищи утром и вечером.
Противопоказания
Острый инфаркт миокарда, нестабильная стенокардия, аритмии, брадикардия, удлинения интервала Q-T, нарушение атриовентрикулярной проводимости при приёме дигоксина, гипокалиемия, гипомагниемия, первичный билиарный цирроз печени, воспалительный процесс.
Побочные эффекты
-
Сердечно-сосудистые: желудочковая аритмия (желудочковая тахикардия, фибрилляция желудочковая), удлинение интервала Q-T, тахикардия, боли в грудной клетке, внезапная смерть.
-
Гематологические: эозинофилия, тромбоцитопения, снижение уровня гемоглобина и гематокрита, гиперурикемия.
-
Желудочно-кишечные: изменение вкусовых ощущений, ощущения запаха сероводорода, желудочно-кишечные кровотечения, диарея, метеоризм, боли в животе, нарушение функций печени.
-
Неврологические: головокружение, головная боль, парестезии, бессонница, нарушения зрения.
-
Кожные: сыпь, петехии, гипергидроз.
-
Прочие: ангионевротический отёк, увеличение щитовидной железы, конъюнктивит, импотенция.
ЛЕКАРСТВЕННОЕ ВЗАИМОДЕЙСТВИЕ
-
Препараты, способные вызвать удлинение Q-T, в том числе трициклические антидепрессанты.
-
β-Адреноблокаторы, дигоксин, антиаритмики, фенотиазиновые производные.
-
Производные фиброевой кислоты, усиление эффекта снижения липопротеинов высокой плотности.
-
Гормональные антикоагулянты и гипогликемические средства.
КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ К ВЫБОРУ И ПРИМЕНЕНИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЯХ
Артериальная гипертензия
В основу главы положены Российские рекомендации, разработанные Комитетом экспертов Всероссийского научного общества кардиологов в 2004 г.
КЛАССИФИКАЦИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ И СТРАТИФИКАЦИЯ ПАЦИЕНТОВ ПО СТЕПЕНИ РИСКА
Артериальная гипертензия — заболевание сердечно-сосудистой системы, сопровождающееся повышением АД выше 140/90 мм рт.ст. и структурными изменениями органов-мишеней. Современная классификация артериальной гипертензии и стратификация риска развития осложнений основана на определении уровня АД (учитывает уровень систолического и диастолического артериального давления) и наличии факторов риска, органных нарушений и ассоциированных с артериальной гипертензией заболеваний.
Для определения тактики лечения рекомендуют проводить стратификацию — качественную и количественную оценку индивидуального риска сердечнососудистых осложнений. В стратификации риска учитывают уровень АД (степень повышения АД), наличие факторов риска, поражения органов-мишеней и ассоциированных клинических состояний (табл. 21-51). Уровень риска определяют согласно Европейским критериям SCORE (риск смерти от заболеваний, связанных с атеросклерозом, в течение 10 лет), учитывающим пол, возраст, фактор курения, уровень систолического АД и общего холестерина. По критериям SCORE низкому риску соответствует величина <4%, умеренному — 4-5%, высокому — 5-8%, очень высокому — >8%.
Таблица 21-51. Стратификация риска у пациентов с артериальной гипертензией
|
Факторы риска |
Категории АД |
|||
|
Высокое нормальное АД (130-139/85-89 мм рт.ст.) |
Степень 1 (140-159/9099 мм рт.ст.) |
Степень 2 (160-179/100109 мм рт.ст.) |
Степень 3 (≥180/110 мм рт.ст.) |
|
|
Нет факторов риска |
незначимый |
низкий риск |
умеренный риск |
высокий риск |
|
1-2 фактора риска |
низкий риск |
умеренный риск |
умеренный риск |
очень высокий риск |
|
3 и более факторов риска или поражение органов-мишеней |
высокий риск |
высокий риск |
высокий риск |
очень высокий риск |
|
Ассоциированные клинические состояния или сахарный диабет |
очень высокий риск |
очень высокий риск |
очень высокий риск |
очень высокий риск |
НЕМЕДИКАМЕНТОЗНЫЕ МЕТОДЫ ЛЕЧЕНИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Лечение артериальной гипертензии объединяет немедикаментозные методы и фармакотерапию, которые взаимно дополняют и усиливают эффективность лечения.
Немедикаментозные методы лечения направлены на снижение уровня АД, оздоровление образа жизни и устранение модифицируемых факторов риска:
-
борьба с гиподинамией (рекомендуют умеренную аэробную физическую нагрузку, быструю ходьбу пешком, плавание в течение 30-40 мин 4 раза в неделю; избегать изометрических нагрузок);
-
нормализация массы тела — достижение индекса массы тела менее 25 кг/м2 (снижение веса увеличивает сердечный выброс, уменьшает объём циркулирующей крови, ОПСС, уровень катехоламинов, инсулина, снижает активность ренина, альдостерона, препятствует задержке жидкости);
-
ограничение потребления поваренной соли (до 5 г/сут, у пожилых лиц до 2 г/сут);
-
комплексная модификация диеты (ограничение потребления жиров животного происхождения; адекватное потребление калия — 80-100 мэкв/сут, кальция — до 1000 мг/сут, магния);
-
прекращение курения (уменьшает симпатическую активность);
-
ограничение приёма алкогольных напитков (до 20-30 г/сут чистого этанола для мужчин, что соответствует 50-60 мл водки, 200-250 мл сухого вина, 500600 мл пива, и до 10-20 г/сут для женщин; превышение этих норм алкоголя приводит к повышению активности ренина, альдостерона и кортизола).
КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ПОДХОДЫ К ВЫБОРУ И ПРИМЕНЕНИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Цель лечения
Цель лечения: максимальное снижение риска развития сердечно-сосудистых осложнений.
Задачи лечения: коррекция модифицируемых факторов риска, достижение целевого уровня АД, органопротективное действие (предупреждение, стабилизация или обратное развитие поражения органов-мишеней), лечение ассоциированных клинических состояний (ИБС), цереброваскулярных заболеваний, ХПН, атеросклероза и др.).
Принципы выбора лекарственных средств и их режимов дозирования
Tактика лечения больных артериальной гипертензией зависит от степени риска развития сердечно-сосудистых осложнений (табл. 21-52).
Таблица 21-52. Тактика лечения больных с артериальной гипертензией
| Степень артериальной гипертензии | Группа низкого риска | Группа умеренного риска | Группа высокого и очень высокого риска |
|---|---|---|---|
|
Высокое нормальное АД (130-139/85-89 мм рт.ст.) |
Изменение образа жизни |
Изменение образа жизни |
Медикаментозная терапия** |
|
Степень 1 (140-159/9099 мм рт.ст.) |
Изменение образа жизни (в течение 12 мес.); при неэффективности — медикаментозная терапия |
Изменение образа жизни (в течение 3 мес.)*; при неэффективности — медикаментозная терапия |
Медикаментозная терапия |
|
Степень 2 и 3 (≥160/100 мм рт.ст.) |
Медикаментозная терапия |
Медикаментозная терапия |
Медикаментозная терапия |
Примечание: * — при наличии нескольких факторов риска уже на начальном этапе возможна медикаментозная терапия; ** — при наличии сахарного диабета, сердечной или почечной недостаточности.
Общие принципы
-
Необходимо добиваться постепенного снижения АД до целевого уровня.
-
Начало лечения с монотерапии в минимальных дозах или низкодозовой комбинированной терапии.
-
При отсутствии полного гипотензивного эффекта (достижение целевого уровня АД) необходимо увеличение дозы стартового препарата, переход к другому препарату или увеличение доз комбинируемых препаратов.
-
Переход к комбинированной терапии целесообразен при отсутствии эффекта от монотерапии.
-
Пациентам с АД >160/100 мм рт.ст. при ассоциации с сахарным диабетом, протеинурией, ХПН сразу можно назначить полнодозовую комбинированную терапию.
-
Использование оптимальных комбинаций антигипертензивных препаратов с различными механизмами действия для наиболее эффективного снижения АД и улучшения переносимости терапии.
-
Применение фиксированных комбинаций антигипертензивных препаратов в одной таблетке повышает комплаентность больных.
-
Использование препаратов пролонгированного действия, обеспечивающих контроль АД в течение 24 ч при однократном приёме.
Медикаментозную терапию в группах высокого и очень высокого риска рекомендуют начинать безотлагательно; в группах с умеренным и низким риском медикаментозной терапии предшествует программа немедикаментозного воздействия (рис. 21-5). При наличии сахарного диабета, почечной или сердечной недостаточности даже при высоком нормальном уровне АД требуется ранняя активная медикаментозная терапия.
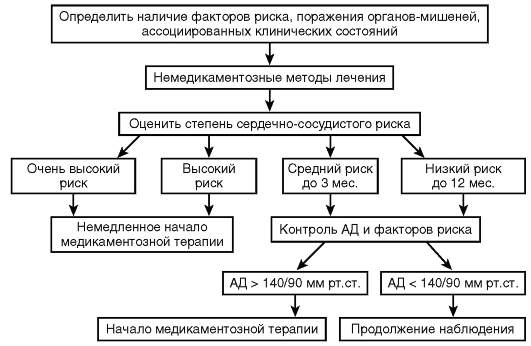
Рис. 21-5. Тактика ведения больных с артериальной гипертензией (рекомендации Всероссийского научного общества кардиологов, 2004).
Смену тактики гипотензивной терапии (титрование доз, замена препарата, добавление второго препарата и др.) рекомендуют не ранее чем через 4-6 нед от начала лечения.
Общие рекомендации по выбору антигипертензивных препаратов
Рекомендации Всероссийского научного общества кардиологов (2004 г.) предлагают использовать 7 классов антигипертензивных препаратов: диуретики, β-адреноблокаторы, блокаторы медленных кальциевых каналов, ингибиторы АПФ, блокаторы рецепторов к ангиотензину II, α-адреноблокаторы, агонисты имидазолиновых рецепторов. Основой для этого послужил ряд метаанализов рандомизированных клинических исследований, составляющих основу «доказательной» медицины в области артериальной гипертензии.
При выборе антигипертензивных препаратов необходимо учитывать наличие факторов риска, поражения органов-мишеней, ассоциированных клинических состояний, поражения почек, сахарного диабета, других сопутствующих заболеваний и сопутствующей терапии, индивидуального ответа больного на антигипертензивные препараты разных классов, вероятность взаимодействий с ЛС, которые больной принимает по другому поводу, а также стоимость терапии.
Крупные клинические исследования последних лет, посвящённые изучению сравнительной эффективности антигипертензивных препаратов у разных категорий пациентов (например, у пожилых больных, в сочетании с другими заболеваниями — сахарным диабетом, ИБС, ХПН), при исследовании суррогатных точек (динамики гипертрофии левого желудочка, толщины комплекса интима-медиа сосудов, микропротеинурии) позволили выявить дополнительные показания к дифференцированному применению отдельных классов препаратов (табл. 21-53).
Таблица 21-53. Рекомендации к дифференцированному выбору антигипертензивных препаратов
| Классы препаратов | Дополнительные показания | Противопоказания |
|---|---|---|
|
Тиазидные диуретики |
Систолическая артериальная гипертензия, артериальная гипертензия у пожилых больных, сопутствующая ХСН, артериальная гипертензия на фоне сахарного диабета |
Подагра, дислипидемия, беременность |
|
β-Адреноблокаторы |
Артериальная гипертензия в сочетании с ИБС (стенокардия, перенесённый инфаркт миокарда), тахиаритмиями, хронической сердечной недостаточностью. Возможно при беременности |
Бронхиальная астма и хроническая обструктивная болезнь лёгких, блокада проводящих путей сердца, дислипидемия, заболевания периферических артерий, нарушение толерантности к глюкозе |
|
Блокаторы медленных кальциевых каналов |
Артериальная гипертензия в сочетании с ИБС (стенокардия), артериальная гипертензия у пожилых больных, изолированная систолическая артериальная гипертензия, сопутствующие заболевания периферических артерий, каротидный атеросклероз, хроническая обструктивная болезнь лёгких, диабетическая нефропатия, беременность |
Блокада проводящих путей сердца (для верапамила и дилтиазема), застойная сердечная недостаточность |
|
Ингибиторы ангиотензинпревращающего фермента |
Сопутствующая ХСН или дисфункция левого желудочка, перенесённый инфаркт миокарда, диабетическая и недиабетическая нефропатия |
Двусторонний стеноз почечных артерий (или артерии единственной почки), гиперкалиемия, ХПН, беременность |
|
Блокаторы рецепторов к АТ II |
Непереносимость ингибиторов АПФ, сопутствующая ХСН, перенесённый инфаркт миокарда, диабетическая нефропатия |
Двусторонний стеноз почечных артерий (или артерии единственной почки), беременность |
|
α-Адреноблокаторы |
Сопутствующая доброкачественная гиперплазия предстательной железы, нарушение толерантности к глюкозе, дислипидемия |
Ортостатическая гипотензия, ХСН |
|
Агонисты имидазолиновых рецепторов |
Артериальная гипертензия на фоне метаболического синдрома, у больных с сахарным диабетом, сопутствующая микроальбуминурия |
Блокада проводящих путей сердца, ХСН |
Кроме того, необходимо учитывать гемодинамические особенности разных классов антигипертензивных препаратов, влияние на региональный кровоток, функциональное состояние почек (табл. 21-54).
Таблица 21-54. Гемодинамические эффекты антигипертензивных препаратов
|
Параметр |
Диуретики |
β-Адреноблокаторы |
Блокаторы медленных кальциевых каналов |
|
|
Без внутренней симпатической активности |
С внутренней симпатомиметической активностью |
|||
|
Общее периферическое сопротивление сосудов |
↓→ |
↑→ |
↓ |
↓ |
|
Сердечный выброс |
↓→ |
↓ |
↓→ |
↑→ |
|
Фракция выброса |
↓ |
↓ |
↓→ |
↑→ |
|
Частота сердечных сокращений |
↑ |
↓ |
→↑ |
→↓ |
|
Почечный кровоток |
↓→ |
↓ |
→ |
↑ |
|
Резистентность почечных артерий |
↑ |
↑ |
↓→ |
↓ |
|
Скорость клубочковой фильтрации |
↓ |
↓ |
→ |
↓→ |
|
Мозговой кровоток |
↓ |
↓ |
→ |
↑ |
|
Коронарный кровоток |
↓ |
↓ |
→ |
↑ |
|
Объём циркулирующей крови |
↓ |
↓→ |
→ |
↓ |
|
Эластичность артерий |
↓ |
↓ |
↓ |
↑ |
|
Перфузия органов |
↓ |
↓ |
↑→ |
↑ |
|
Гипертрофия левого желудочка |
↓→ |
↓→ |
↑ |
↓ |
|
Гипертрофия стенки артерий |
↑ |
→ |
↑ |
↓ |
|
Нагрузки |
→↓ |
↓ |
→↓ |
→ |
|
Параметры |
Ингибиторы АПФ, антагонисты рецепторов АТ II |
α-Адреноблокаторы |
Центральные α-агонисты |
|
|
Общее периферическое сопротивление сосудов |
↓ |
↓ |
↓ |
|
|
Сердечный выброс |
↑→ |
→↑ |
→ |
|
|
Фракция выброса |
↑ |
→↑ |
→ |
|
|
Частота сердечных сокращений |
→ |
→↑ |
↓→ |
|
|
Почечный кровоток |
↑ |
↑ |
↑ |
|
|
Резистентность почечных артерий |
↓ |
↓ |
↓ |
|
|
Скорость клубочковой фильтрации |
↓ |
↑ |
↑→ |
|
|
Мозговой кровоток |
↑ |
↑ |
↑→ |
|
|
Коронарный кровоток |
↑ |
→↑ |
↑→ |
|
|
Объём циркулирующей крови |
↓ |
→↓ |
↑ |
|
|
Эластичность артерий |
↑ |
? |
? |
|
|
Перфузия органов |
↑ |
↑ |
↑ |
|
|
Гипертрофия левого желудочка |
↓ |
↓ |
↓ |
|
|
Гипертрофия стенки артерий |
↓ |
↓ |
↓ |
|
|
Нагрузки |
→ |
→ |
→ |
Примечание: ↓ — снижение; ↑ — увеличение; → — нет влияния.
Комбинированная гипотензивная терапия
Комбинированная терапия показана в следующих случаях:
-
при повышении уровня АД >160/100 мм рт.ст. (II-III степень артериальной гипертензии);
-
при поражении органов-мишеней;
-
при наличии ассоциированных клинических состояний (ИБС, ХСН, сахарный диабет) вне зависимости от уровня АД;
-
при необходимости достижения более низкого уровня целевого АД (например, при сахарном диабете, ХПН);
-
при плохой переносимости монотерапии и необходимости применения более низких доз антигипертензивных препаратов.
Для выбора рациональных комбинаций антигипертензивных препаратов необходимо учитывать механизм гипотензивного действия, особенности фармакодинамики и фармакокинетики, спектр побочного действия.
Рациональная комбинация подразумевает применение антигипертензивных препаратов с различным механизмом действия с целью получения дополнительного гипотензивного эффекта и уменьшения побочных реакций. При использовании рациональной комбинации усиливается не только гипотензивный эффект, но и органопротективное действие. Важно отметить, что зачастую при использовании комбинации антигипертензивных препаратов происходит пролонгирование их гипотензивного действия. Нерациональным считают комбинирование препаратов с одинаковым механизмом действия (усиление компенсаторных механизмов повышения АД) и сходным спектром побочных эффектов.
Рациональные комбинации:
-
диуретик + β-адреноблокатор;
-
диуретик + ингибитор АПФ;
-
диуретик + антагонист рецепторов АТ II;
-
блокатор медленных кальциевых каналов (дигидропиридин) + β-адреноблокатор;
-
блокатор медленных кальциевых каналов + ингибитор АПФ;
-
α-адреноблокатор + β-адреноблокатор;
-
антагонист кальция + диуретик;
-
агонист имидазолиновых рецепторов + диуретик.
Нерациональные комбинации:
-
β-адреноблокатор + верапамил / дилтиазем;
-
блокатор медленных кальциевых каналов + α-адреноблокатор.
Оценка эффективности гипотензивной терапии
Основным результатом гипотензивной терапии является достижение целевого уровня АД, который обеспечивает максимальное снижение риска сердечнососудистых осложнений. Определение целевого уровня АД зависит от категории риска больных: чем выше сердечно-сосудистый риск, тем важнее строгое достижение целевого АД и тем ниже должен быть его уровень.
По рекомендациям Всероссийского научного общества кардиологов (2004 г.) целевой уровень АД для больных с артериальной гипертензией составляет <140/90 мм рт.ст., а для пациентов с сахарным диабетом, протеинурией или ХПН — <130/80 мм рт.ст.
Учитывая клинико-фармакологические особенности современных антигипертензивных препаратов (длительный период полувыведения, медленное накопление в тканях, сложные механизмы гипотензивного действия), рекомендуют медленный темп снижения АД до целевого уровня — в течение 3-6 мес. Помимо основного критерия эффективности гипотензивной терапии (снижения АД), необходимо оценивать и другие факторы риска, динамику органных нарушений и ассоциированных клинических состояний.
Резистентность к терапии
Резистентность к терапии (АД остаётся >140/90 мм рт.ст.) может быть результатом неадекватного режима дозирования препаратов (неадекватые дозы препаратов, нерациональные комбинации), применения препаратов, повышающих АД или препятствующих его снижению, низкой комплаентности больных, нарушения рекомендаций по изменению образа жизни (увеличение массы тела, приём алкоголя, продолжение курения), перегрузки объёмом (неадекватная терапия диуретиками, прогрессирование ХПН, высокое потребление соли), а также вторичной формы артериальной гипертензии или псевдорезистентности («гипертония белого халата»).
ЛЕЧЕНИЕ ГИПЕРТОНИЧЕСКИХ КРИЗОВ
Принципы выбора лекарственных средств и их режимов дозирования
Гипертонический криз — внезапное значительное повышение АД, сопровождающееся клиническими симптомами и требующее быстрого его снижения для предупреждения повреждения органов-мишеней. Главный принцип лечения гипертонического криза — соблюдение баланса между немедленным снижением АД для предупреждения необратимых органных повреждений и риском значимого снижения перфузии жизненно важных органов, особенно головного мозга, миокарда, почек. При состояниях, требующих неотложной терапии (появление или усугубление симптомов повреждения органов-мишеней или осложнённый криз), необходимо парентеральное введение антигипертензивных препаратов (табл. 21-55). В течение первых двух часов должно быть достигнуто снижение АД на 25%, в течение последующих 2-6 ч — до 160/100 мм рт.ст.
Таблица 21-55. Антигипертензивные препараты для парентерального применения при гипертонических кризах
| Препараты | Путь введения | Начало действия | Максимальное действие | Продолжительность действия | Дозы |
|---|---|---|---|---|---|
|
Нитропруссид натрия |
Внутривенная инфузия |
секунды |
1-2 мин |
3-5 мин |
0,25-10 мкг/кг/мин |
|
Нитроглицерин |
Внутривенная инфузия |
1-2 мин |
— |
2-3 мин |
5-100 мкг/мин |
|
Эналаприлат |
Внутривенная инфузия |
15-30 мин |
1-4 ч |
2-6 ч |
1,25-5 мг каждые 6 ч |
|
Гидралазин |
Внутривенная инфузия внутримышечно |
10-20 мин 20-30 мин |
20-40 мин 1 ч |
3-8 ч |
10-20 мг 10-50 мг |
|
Диазоксидр |
Внутривенный болюс Внутривенная инфузия |
1-5 мин |
2-3 мин |
6-12 ч |
50-300 мг 15-30 мг/мин |
|
Фентоламин |
Внутривенно |
1-2 мин |
3-10 мин |
5-15 мин |
|
|
Пентамин* |
Внутривенно Внутримышечно |
5-15 мин |
15 мин |
3-4 ч |
0,2-0,75 мл в 20 мл р-ра 0,3-1 мл 5% р-ра |
|
Фуросемид |
Внутривенно, внутримышечно |
5 мин |
30-40 мин |
2-3 ч |
20-40 мг |
|
Клонидин |
Внутривенно внутримышечно |
1-2 мин |
30 мин |
2-8 ч |
0,1-0,2 мг 0,1 мг |
При состояниях, не сопровождающихся появлением симптомов повреждения органов-мишеней (неосложнённый криз), АД можно снижать в течение нескольких часов с помощью перорального приёма антигипертензивных прерапатов (табл. 21-56).
Таблица 21-56. Антигипертензивные препараты для перорального применения при гипертонических кризах
| Препараты | Путь введения | Начало действия | Максимальное действие | Продолжительность действия | Дозы |
|---|---|---|---|---|---|
|
Клонидин |
внутрь |
30 мин |
1-2 ч |
8-12 ч |
0,15-0,3 мг |
|
Нифедипин |
Внутрь |
15 мин |
30 мин |
4-6 ч |
10-20 мг |
|
Каптоприл |
внутрь |
15 мин |
1-2 ч |
4-6 ч |
6,25-50 мг |
|
Празозин |
внутрь |
15-30 мин |
1-2 ч |
8 ч |
1-2 мг |
|
Лабетололр |
внутрь |
2 ч |
3 ч |
12 ч |
10 мг |
|
Нитроглицерин |
сублингв. |
1 мин |
15 мин |
1 ч |
1 мг |
СПИСОК ЛИТЕРАТУРЫ
Профилактика, диагностика и лечение артериальной гипертензии: Российские рекомендации ВНОК (второй пересмотр) // Секция артериальной гипертонии ВНОК. — М., 2004. — 20 с.
Профилактика, диагностика и лечение первичной артериальной гипертонии в Российской Федерации // Клиническая фармакология и терапия. — 2000. — № 3. — С. 5-30.
Рекомендации по профилактике, диагностике и лечению артериальной гипертензии: Российские рекомендации ВНОК // Артериальная гипертония. — 2001. — № 1. — 20 с.
Casas J.P. et al. Effect of inhibitors of the rennin-angiotensin system and other antihypertensive drugs on renal outcomes: systematic review and meta-analysis // Lancet. — 2005. — Vol. 366. — P. 2026-2033.
Chalmers J. WHO-ISH Hypertension guidelines Committee: 1999 World Health Organization, International Society of Hypertension guidelines for the management of hypertension / J. Chalmers et al. // J. Hypertens. — 1999. — Vol. 17. — P. 151-185.
Elliott W.J. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis / W.J. Elliott, P.M. Meyer // Lancet. — 2007. — Vol. 369. — P. 201-207.
European Society of Hypertension. European Society of Cardiology guidelines for the management of arterial hypertension. Guidelines Committee // J. Hypertens. — 2003. — N 21. — P. 1011-1053.
Houston M.C. Handbook of antihypertensive therapy / M.C. Houston, B.P. Meador, L.M. Schipani. — 10-th ed. // Philadelphia: Hanley & Belfus Inc., 2000. — 176 p.
Lindholm L.H. β-blockers remain first choice in the treatment of primary hypertension?: a meta-analysis / L.H. Lindholm, B.C. Samuelsson, O. Should // Lancet. — 2005. — Vol. 366. — P. 1545-1553.
Magee L.A. Treating hypertension in women of child-bearing age and during pregnancy / L.A. Magee // Drug Safety. — 2001. — Vol. 24. — P. 457-474.
McMahon S. Blood Pressure Lowering Treatment Trialist’s Collaboration. Second cycle of analysis / S. McMahon // www.medscape.com.
Neal B. Blood Pressure Lowering Treatment Trialist’s Collaboration. Effects of ACE inhibitors, calcium antagonists and other blood-pressure-lowering drugs: results of prospectively designed overviews of randomised trials / B. Neal, S. McMahon, N. Chapman // Lancet. — 2000. — Vol. 356. — N 9246. — P. 1955-1964.
Psaty B.M. Health outcomes associated with various antihypertensive therapies used as first-line agents (a network meta-analysis) / B.M. Psaty et al. // J.A.M.A. — 2003. — Vol. 289. — P. 25342544.
Staessen J.A. Cardiovascular protection and blood pressure reduction: a meta-analysis / J.A. Staessen, J.G. Wang, L. Thijs // Lancet. — 2001. — Vol. 358. — P. 1305-1315.
Wing L.M. et al. A comparison of outcomes with angiotensin-converting-enzyme inhibitors and diuretics for hypertension in the elderly // N. Engl. J. Med. — 2003. — Vol. 348. — P. 583-592.
Ишемическая болезнь сердца
СТЕНОКАРДИЯ НАПРЯЖЕНИЯ
Цель лечения
Уменьшить или устранить проявления ишемии миокарда и предотвратить неблагоприятные исходы заболевания.
Принципы выбора лекарственных средств и их режимов дозирования
β*-Адреноблокаторы* — основа лечения стенокардии. Их применяют во всех случаях при отсутствии противопоказаний. Предпочтение обычно отдают длительно действующим кардиоселективным препаратам. У больных с сердечной недостаточностью и низкой фракцией выброса левого желудочка следует применять бисопролол, карведилол или метопролола сукцината пролонгированного действия. Дозу β-адреноблокаторов подбирают таким образом, чтобы уменьшить ЧСС и поддерживать её в интервале 50-60 в минуту. При тяжёлой стенокардии допустимы более низкие значения ЧСС, если больной хорошо переносит брадикардию. У больных с сердечной недостаточностью и низкой фракцией выброса дозу препарата ступенчато увеличивают до целевой дозы или до максимальной переносимой, если целевой дозы достичь не удаётся (см. «Хроническая сердечная недостаточность»).
Блокаторы медленных кальциевых каналов обычно применяют для предупреждения эпизодов ишемии миокарда в случаях, когда нельзя использовать β-адреноблокаторы или они недостаточно эффективны. Особое показание к применению блокаторов медленных кальциевых каналов — вазоспастическая стенокардия. Короткодействующие производные дигидропиридина не следует использовать без одновременного приёма β-адреноблокаторов. Блокаторы медленных кальциевых каналов (за исключением амлодипина и фелодипина) противопоказаны при сердечной недостаточности.
Органические нитраты необходимы для неотложного устранения и предупреждения ишемии миокарда. В последнем случае их можно использовать в качестве монотерапии (у больных с нетяжёлой стенокардией или при наличии противопоказаний к применению β-адреноблокаторов и блокаторов кальциевых каналов), а также в сочетании с антиангинальными препаратами других групп. Для устранения ишемии миокарда применяют быстро- и короткодействующие препараты. Для профилактики приступов стенокардии рекомендуют приём длительнодействующих препаратов за некоторое время до ожидаемой физической нагрузки или регулярный приём нитратов.
Антиангинальные средства других групп не являются препаратами первого ряда. Для предупреждения приступов стенокардии можно назначить триметазидин. При непереносимости β-адреноблокаторов не исключено применение ивабрадина.
Лекарственные средства, не обладающие антиангинальным действием, применяют для лечения осложнений, сопутствующих заболеваний и улучшения долгосрочного прогноза. Для улучшения прогноза помимо бета-адреноблокаторов применяют ацетилсалициловую кислоту, а также устраняют модифицируемые факторы риска сердечно-сосудистых осложнений. Препараты выбора для снижения уровня холестерина — статины. Больным с артериальной гипертензией, сердечной недостаточностью, сократительной дисфункцией левого желудочка, инфарктом миокарда в анамнезе, сахарным диабетом показаны ингибиторы АПФ. У лиц с высоким риском сердечно-сосудистых осложнений, не имеющих выраженной сократительной дисфункции левого желудочка, в схему лечения целесообразно включить рамиприл в целевой дозе 10 мг/сут или периндоприл в дозе 8 мг/сут.
Алгоритм медикаментозного лечения больных стабильной стенокардией представлен на рис. 21-6.
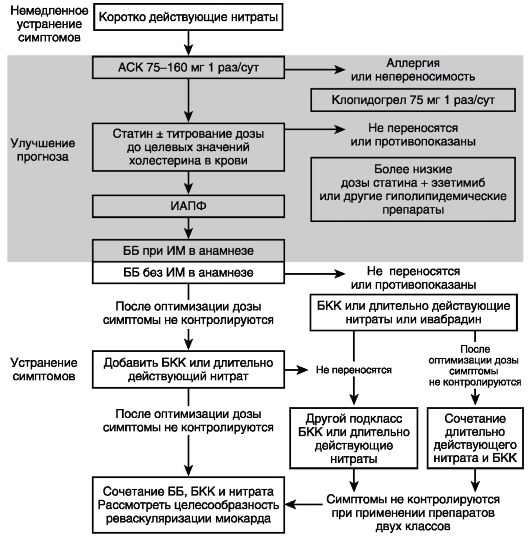
Рис. 21-6. Медикаментозное лечение стабильной стенокардии. АСК — ацетилсалициловая кислота; БКК — блокаторы медленных кальциевых каналов; АПФ — ангиотензинпревращающий фермент; ИМ — инфаркт миокарда.
ОСТРЫЙ КОРОНАРНЫЙ СИНДРОМ (НЕСТАБИЛЬНАЯ СТЕНОКАРДИЯ, ИНФАРКТ МИОКАРДА)
Цели лечения
Предотвратить неблагоприятные исходы заболевания, ограничить зону некроза миокарда (при инфаркте миокарда), устранить ишемию миокарда и осложнения.
Принципы выбора лекарственных средств и режимов их дозирования
Устранение болевого приступа. Необходимо добиться полного и быстрого устранения болевого синдрома. Если болевой синдром сохраняется после прекращения физической нагрузки и трёхкратного приёма нитроглицерина под язык в дозе 0,4 мг с интервалом в 5 мин, методом выбора является внутривенное дробное введение морфина.
Антитромботические препараты — основа лечения острого коронарного синдрома, связанного с изъязвлением или разрывом атеросклеротической бляшки в коронарной артерии. При подозрении на острый коронарный синдром следует применять ацетилсалициловую кислоту. Начать лечение нужно как можно раньше. При непереносимости ацетилсалициловой кислоты применяют клопидогрел. С ранних сроков заболевания показано совместное использование ацетилсалициловой кислоты и клопидогрела. У больных с острым коронарным синдромом без стойких подъёмов сегмента ST на ЭКГ оно должно продолжаться до 1 года, у больных с острым коронарным синдромом с подъёмом сегмента ST — до 1 мес., после установки металлического стента без покрытия — до 1 года и как минимум 1 год после установки стента, выделяющего антипролиферативные препараты.
Антикоагулянты непрямого действия не являются средством раннего лечения острого коронарного синдрома из-за медленного наступления эффекта. Их можно использовать для вторичной профилактики в качестве монотерапии или в сочетании с ацетилсалициловой кислотой. Кроме того, препараты этой группы показаны для предупреждения тромбоэмболических осложнений при наличии тромба в полости левого желудочка, больших участков акинезии в миокарде левого желудочка, мерцательной аритмии.
Особенности антитромботического лечения острого коронарного синдрома без стойких подъёмов сегмента ST на ЭКГ.
Антикоагулянты прямого действия назначают лицам с повышенным риском коронарной смерти и инфаркта миокарда, когда после эпизода ишемии миокарда прошло не более 48 ч. При высоком риске неблагоприятного исхода эноксапарин натрия превосходит по эффективности нефракционированный гепарин. Фондапаринукс натрия по сравнению с эноксапарином натрия даёт меньше кровотечений, в результате чего можно ожидать более низкую смертность. Это преимущество реализуется прежде всего при продолжительном введении препаратов и у больных с нарушенной функцией почек. Дальтепарин натрия и надропарин кальция по эффективности аналогичны нефракционированному гепарину. Длительность введения нефракционированного гепарина и эноксапарина натрия определяют по клиническому течению заболевания. Обычно она составляет 2-8 сут. Изученная длительность применения фондапаринукса натрия — до 8 сут (в среднем 5-6 сут), далтепарина натрия и надропарина кальция — 5-6 сут. Чрескожные коронарные вмешательства в ранние сроки заболевания выполняют на фоне болюсного введения нефракционированного гепарина или продолжающегося применения эноксапарина натрия. При лечении фондапаринуксом натрия во время процедуры надо дополнительно вводить нефракционированный гепарин.
Блокаторы гликопротеидов IIb/IIIa тромбоцитов обычно применяют при чрескожных коронарных вмешательствах. Внутривенное введение препаратов этой группы у больных с высоким риском неблагоприятного исхода можно осуществлять с самого начала лечения (тирофибанаP, эптифибатидP) или начинать непосредственно перед чрескожными коронарными вмешательствами (абциксимаб). Абциксимаб следует применять заранее только у больных с известной коронарной анатомией, когда в ближайшие сутки будет выполнено чрескожное коронарное вмешательство.
Особенности антитромботического лечения острого коронарного синдрома с подъёмами сегмента ST на ЭКГ.
Тромболитическая терапия является основой лечения этой формы острого коронарного синдрома. Она показана больным, у которых боль (дискомфорт) в грудной клетке длительностью до 12 ч сопровождается подъёмом сегмента ST на ЭКГ как минимум на 0,1 мВ в двух смежных отведениях или остро возникшей блокадой левой ножки пучка Гиса.
Внутривенная инфузия нефракционированного гепарина в течение 48 ч является стандартным дополнением к алтеплазе13, тенектеплазе и проурокиназе. При применении стрептокиназы введение нефракционированного гепарина необязательно. У больных без выраженного нарушения функции почек эффективность лечения можно повысить за счёт применения фондапаринукса натрия или эноксапарина натрия в течение 1 нед. При первичном чрескожном коронарном вмешательстве используют внутривенные болюсы нефракционированного гепарина. В более поздние сроки заболевания чрескожное коронарное вмешательство можно проводить на фоне продолжающегося применения эноксапарина натрия. При лечении фондапаринуксом натрия во время процедуры надо дополнительно вводить нефракционированный гепарин.
Если ни тромболитическую терапию, ни первичное чрескожное коронарное вмешательство не проводят, положительное воздействие на исход заболевания может оказать фондапаринукс натрия при применении в течение 1 нед. Другие показания для использования антикоагулянтов связаны с необходимостью профилактики артериальных или венозных тромбозов и эмболий.
Блокаторы гликопротеидов IIb/IIIa тромбоцитов применяют при чрескожном коронарном вмешательстве.
β-Адреноблокаторы целесообразно использовать у всех больных, не имеющих противопоказаний. Внутривенное введение оправдано при сохраняющейся тахикардии у больных без сердечной недостаточности, ишемии миокарда, артериальной гипертензии, суправентрикулярных и желудочковых тахиаритмиях. Лечение нужно начать как можно раньше или отсрочить до исчезновения противопоказаний, имеющихся в остром периоде заболевания. Целевые значения ЧСС при использовании β-адреноблокаторов составляют 50-60 в минуту. Этих показателей достигают за счёт постепенного увеличения дозы β-адреноблокаторов без внутренней симпатомиметической активности. При выборе препарата надо учитывать, что доказательства благоприятного влияния на смертность после инфаркта миокарда были получены при применении карведилола, метопролола и пропранолола.
Органические нитраты в ранние сроки острого коронарного синдрома применяют при острых проявлениях сердечной недостаточности, сохраняющейся ишемии миокарда или артериальной гипертензии. Целесообразность более широкого использования не установлена. Как правило, осуществляют внутривенную инфузию нитроглицерина. В последующем нитраты рекомендуют использовать только при сохранении признаков ишемии миокарда.
Ингибиторы АПФ в ранние сроки инфаркта миокарда необходимы больным с передним инфарктом миокарда, застоем в лёгких, фракцией выброса левого желудочка менее 40%. Кроме того, ингибиторы АПФ можно использовать у всех больных, не имеющих противопоказаний. Как правило, лечение начинают с приёма внутрь небольшой дозы, которую постепенно увеличивают, стремясь достичь рекомендуемой (или максимально переносимой) дозы в ближайшие 24-48 ч.
В крупных клинических исследованиях доказана эффективность применения с первых суток инфаркта миокарда каптоприла, лизиноприла и зофеноприла; при более длительном лечении у больных с выраженной сократительной дисфункцией левого желудочка использовали каптоприл, рамиприл, трандолаприл и эналаприл.
Блокаторы рецепторов ангиотензина II можно использовать при непереносимости ингибиторов АПФ у больных с инфарктом миокарда, сочетающимся с сердечной недостаточностью, застоем в лёгких (по данным рентгенографии грудной клетки), фракцией выброса не выше 40%. Проведённые исследования доказали эффективность применения валсартана в целевой дозе 320 мг в сутки.
Антагонисты альдостерона применяют в дополнение к терапевтическим дозам ингибиторов АПФ после перенесённого инфаркта миокарда у больных с фракцией выброса не выше 40% в сочетании с сердечной недостаточностью или сахарным диабетом. Обязательным условием является отсутствие выраженного повышения уровня креатинина в крови и гиперкалиемии.
Блокаторы медленных кальциевых каналов. В отдельных случаях возможно применение верапамила или дилтиазема. Длительно действующие производные дигидропиридина можно использовать в дополнение к β-адреноблокаторам у больных с тяжёлой стенокардией, рефрактерной к медикаментозному лечению, а также при стойкой артериальной гипертензии.
Статины. Есть данные о наличии положительного эффекта от раннего начала использования статинов. Наиболее убедительные данные получены для аторвастатина в суточной дозе 80 мг.
Другие лекарственные средства применяют для лечения осложнений, сопутствующих заболеваний и с целью улучшения долгосрочного прогноза основного заболевания (см. раздел «Стабильная стенокардия»).
СПИСОК ЛИТЕРАТУРЫ
Рекомендации ВНОК по лечению острого коронарного синдрома без стойкого подъёма сегмента ST на ЭКГ / Кардиология. — 2006. — Приложение.
Рекомендации Всероссийского научного общества кардиологов (ВНОК) по диагностике и лечению стабильной стенокардии / Кардиоваскулярная терапия и профилактика. — 2004. — № 4. — Приложение 1.
Федеральное руководство по использованию лекарственных средств (формулярная система): ежегодно обновляемое издание / Под ред. А.Г. Чучалина, Ю.Б. Белоусова, В.В. Яснецова. — М.: Здоровье человека.
ACC/AHA 2002 Guideline Update for the Management of Patients With Chronic Stable Angina: A Report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines (Committee to Update the 1999 Guidelines for the Management of Patients With Chronic Stable Angina) // Circulation. — 2003. — N 107. — P. 149-158.
ACC/AHA/SCAI 2005 Guideline Update for Percutaneous Coronary Intervention: A Report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines (ACC/AHA/SCAI Writing Committee to Update the 2001 Guidelines for Percutaneous Coronary Intervention) // J.A.C.C. — 2004. — N 44. — P. 671-719.
Smith S.C., AllenJ, Blair S.N. AHA/ACC Guidelines for Secondary Prevention for Patients With Coronary and Other Atherosclerotic Vascular Disease: 2006 Update // Circulation. — 2006. — N 113. — P. 2363-2372.
The Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology: Guidelines for Percutaneous Coronary Interventions // Eur. Heart J. — 2005. — N 26. — P. 804847.
The Task Force for the Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of the European Society of Cardiology: Guidelines for the diagnosis and treatment of non-ST -segment elevation acute coronary syndromes // Eur. Heart J. — 2007. — N 28. — P. 1598-1660.
The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology: Management of acute myocardial infarction in patients presenting with ST-segment elevation // Eur. Heart J. — 2003. — N 24. — P. 28-66.
The Task Force on the management of stable angina pectoris for the Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of the European Society of Cardiology: Guidelines on the management of stable angina pectoris // Eur. Heart J. — 2006. — N 27. — P. 1341-1381.
Острая сердечная недостаточность
Острая сердечная недостаточность (ОСН) — неотложное состояние, возникающее вследствие нарушения сократительной способности миокарда вместе со снижением систолического и минутного объёма сердца.
ОСН возникает при острых патологических состояниях, когда компенсаторные механизмы не успевают уменьшить последствия появившихся нарушений. У одного больного возможно сочетание нескольких причин, взаимно усугубляющих друг друга. Часто ОСН вызвана сниженной сократительной способностью миокарда левого желудочка. Также наблюдают ситуации, при которых причина ОСН — поражение правого желудочка (инфаркт миокарда правого желудочка или тромбоэмболия лёгочной артерии, приводящие к снижению давления заполнения левого желудочка и падению сердечного выброса) или при отсутствии нарушений сократимости миокарда (при тахиаритмии у больных с выраженной гипертрофией миокарда левого желудочка или митральным стенозом). Исход ОСН зависит от характера основного заболевания и причин, вызывающих декомпенсацию. Выделяют следующие клинические варианты ОСН:
-
отёк лёгких — тяжёлое проявление ОСН, сопровождающееся дыхательной недостаточностью и снижением насыщения артериальной крови кислородом <90% до начала лечения. В основе отёка лежит увеличение давления в капиллярах лёгких, что приводит к выходу крови в интерстициальное пространство (кардиальная астма) и альвеолы;
-
кардиогенный шок — крайнее проявление ОСН, возникающее при критическом снижении сократительной способности миокарда. При этом кроме снижения систолического АД до 90-100 мм рт.ст. и менее возникают признаки сниженной перфузии органов и тканей (холодные кожные покровы, олигоанурия, заторможенность). Давление заклинивания лёгочной артерии повышается, а сердечный выброс, не компенсируемый периферической вазоконстрикцией, уменьшается, приводя к снижению АД.
ОСНОВНЫЕ ПРИНЦИПЫ ЛЕЧЕНИЯ ОСТРОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
-
При ОСН необходимы неотложные и действенные вмешательства, поэтому предпочтение отдают внутривенному введению препаратов, что в сравнении с другими способами обеспечивает наиболее быстрый, предсказуемый и управляемый эффект.
-
ОСН приводит к прогрессивному ухудшению оксигенации крови в лёгких, артериальной гипоксемии и гипоксии периферических тканей. Метод борьбы с вышеназванными проявлениями — вдыхание 95% кислородо-воздушной смеси для поддержания насыщения артериальной крови кислородом >90%. Оптимально использовать маску с «увлажнённым» кислородом. Иногда больным необходимо провести ИВЛ.
-
Важно нормализовать АД и устранить нарушения, способные снизить сократимость миокарда (гипоксия, ишемия миокарда, гиперили гипогликемия, электролитные нарушения, передозировка ЛС). Необходимо поддерживать адекватную вентиляцию лёгочных альвеол и как можно быстрее восстановить достаточную перфузию периферических тканей.
-
При наличии артериальной гипотензии и до назначения вазодилататоров важно убедиться в отсутствии гиповолемии, приводящей к недостаточному заполнению камер сердца (что само по себе уменьшает сердечный выброс и вызывает артериальную гипотензию и шок). При оценке адекватности заполнения левого желудочка в клинических условиях часто ориентируются на физикальные признаки застоя в лёгких.
-
Эффективным средством повышения АД, уменьшения постнагрузки левого желудочка и увеличения перфузионного давления в коронарных артериях служит внутриаортальная баллонная контрапульсация. Внутриаортальная баллонная контрапульсация эффективна при наличии митральной регургитации и при дефектах межжелудочковой перегородки. В отличие от медикаментозного лечения внутриаортальной баллонной контрапульсации не увеличивает потребности миокарда в кислороде, не угнетает сократимость миокарда и не снижает АД. Однако внутриаортальная баллонная контрапульсация — временная мера, позволяющая выиграть время и устранить причины ОСН.
-
Важно устранить тахиили брадикардию, если они вызывают или усугубляют ОСН. При наличии признаков остро возникшей стойкой окклюзии коронарной артерии с появлением стойких подъёмов сегмента ST на ЭКГ необходимо как можно быстрее восстановить проходимость коронарной артерии посредством операции по шунтированию либо провести тромболитическую терапию.
-
При наличии обострения ИБС необходимо как можно быстрее подавить ишемию миокарда и предотвратить её повторное возникновение. Симптомы ОСН у таких больных служат показаниями к антитромботическому лечению и скорейшему выполнению коронарной ангиографии с последующей реваскуляризацией миокарда (чрескожная ангиопластика/стентирование или операция шунтирования коронарных артерий). При тяжёлом течении острого миокардита часть больных нуждается в трансплантации сердца.
ПРИНЦИПЫ ВЫБОРА ЛЕКАРСТВЕННЫХ СРЕДСТВ И ИХ РЕЖИМОВ ДОЗИРОВАНИЯ
Положительные инотропные агенты
Данные препараты используют при ОСН для увеличения сократимости миокарда, и их действие, как правило, сопровождается повышением потребности миокарда в кислороде.
-
Прессорные (симпатомиметические) амины (норадреналин, допамин, добутамин) помимо увеличения сократительной способности миокарда способны вызвать периферическую вазоконстрикцию, что вместе с повышением АД приводит к ухудшению оксигенации периферических тканей. Лечение обычно начинают с малых доз, которые при необходимости постепенно увеличивают (титруют) до получения оптимального эффекта. В большинстве случаев для подбора дозы требуется инвазивный контроль параметров гемодинамики с определением сердечного выброса и давления заклинивания лёгочной артерии. Общий недостаток препаратов этой группы — способность вызывать или усугублять тахикардию, нарушения ритма сердца, ишемию миокарда, тошноту и рвоту. Эти влияния дозозависимы и часто препятствуют дальнейшему увеличению дозы.
Норадреналин вызывает периферическую вазоконстрикцию за счёт стимуляции α-адренорецепторов. При этом сердечный выброс может как увеличиться, так и уменьшиться в зависимости от исходного периферического сосудистого сопротивления, функционального состояния левого желудочка и рефлекторных влияний, опосредованных через каротидные барорецепторы. Он показан больным с тяжёлой артериальной гипотензией (систолическое АД ниже 70 мм рт.ст.), при низком периферическом сосудистом сопротивлении. Обычная начальная доза норадреналина составляет 0,5-1 мкг/мин; в дальнейшем она титруется до достижения эффекта и при рефрактерном шоке может составить 8-30 мкг/мин.
Допамин стимулирует α- и β-адренорецепторы, а также допаминергические рецепторы, находящиеся в сосудах почек и брыжейки. Его влияние зависит от дозы. При внутривенном введении в дозе 2-4 мкг/кг в мин ЛС в основном влияет на допаминергические рецепторы, что приводит к расширению чревных артериол и сосудов почек. Допамин может способствовать увеличению темпа диуреза и преодолению рефрактерности к диуретикам, вызванных сниженной перфузией почек. Препарат также воздействует на почечные канальцы, стимулируя натрийурез. Допамин, изолированно или в сочетании с другими прессорными аминами, используют для устранения артериальной гипотензии, увеличения сократительной способности миокарда, а также увеличения ЧСС у больных с брадикардией, нуждающейся в коррекции.
Добутамин — синтетический катехоламин, стимулирующий в основном β-адренорецепторы. При этом происходит улучшение сократительной способности миокарда с увеличением сердечного выброса и снижением давления заполнения желудочков сердца. Из-за снижения периферического сосудистого сопротивления АД может не измениться. Поскольку цель лечения добутамином — нормализация сердечного выброса, для подбора оптимальной дозы препарата необходимо мониторирование данного показателя. Обычно используют дозы 5-20 мкг/кг в мин. Добутамин можно сочетать с допамином; препарат способен уменьшить сопротивление лёгочных сосудов и служит средством выбора при лечении правожелудочковой недостаточности. Вместе с тем уже через 12 ч после начала инфузии возможно развитие тахифилаксии.
-
Ингибиторы фосфодиэстеразы III (амринонP, милринонP) обладают положительным инотропным и вазодилатирующими свойствами, вызывая преимущественно венодилатацию и уменьшение тонуса лёгочных сосудов. Как прессорные амины, они способны усугубить ишемию миокарда и спровоцировать желудочковые нарушения ритма сердца. Для их оптимального использования необходимо мониторирование параметров гемодинамики, давление заклинивания лёгочной артерии не должно быть ниже 16-18 мм рт.ст. В/в инфузию ингибиторов фосфодиэстеразы III обычно назначают при тяжёлой сердечной недостаточности или кардиогенном шоке, адекватно не отвечающих на стандартное лечение прессорными аминами.
-
Средства, повышающие сродство сократительных миофибрилл кардиомиоцитов к кальцию (левосимендан).
Левосимендан — единственный препарат из группы, применяемый при лечении ОСН. Его положительное инотропное действие не сопровождается ощутимым повышением потребности миокарда в кислороде и увеличением симпатических влияний на миокард. Другие возможные механизмы действия — селективное угнетение фосфодиэстеразы III, активация калиевых каналов. Левосимендан обладает сосудорасширяющим и антиишемическим действием. Из-за наличия длительно действующего активного метаболита эффект сохраняется некоторое время после прекращения введения препарата. Эффективность и безопасность 6-часовой внутривенной инфузии левосимендана показана у больных с левожелудочковой недостаточностью после недавно перенесённого инфаркта миокарда. Левосимендан разрешён к клиническому применению в Европе и России.
Вазодилататоры
Вазодилататоры способны быстро уменьшить пред- и постнагрузку за счёт расширения вен и артериол, что приводит к уменьшению давления в капиллярах лёгких, снижению ОПСС и АД. Их нельзя использовать при артериальной гипотензии. Перед назначением вазодилататоров необходимо обеспечить достаточное давление заполнения желудочков (устранить гиповолемию).
-
Нитраты уменьшают венозный застой в лёгких без повышения потребности миокарда в кислороде. Дозу нитратов уменьшают, если систолическое АД снижается до 90-100 мм рт.ст. и полностью прекращают их введение при дальнейшем падении АД.
Нитроглицерин вызывает расслабление гладкомышечных клеток стенки сосудов, что приводит к дилатации артериол и вен, включая сосуды сердца. При приёме препарата под язык эффект возникает через 1-2 мин и может продолжаться вплоть до 30 мин. При ОСН это наиболее быстрый и доступный способ уменьшить острые проявления заболевания. Если систолическое АД выше 100 мм рт.ст., необходимо начать принимать нитроглицерин под язык (по 1 таблетке, содержащей 0,3-0,4 мг лекарственного вещества, каждые 5-10 мин) до появления возможности проводить его внутривенную инфузию. Внутривенную инфузию нитроглицерина обычно начинают с 10-20 мкг/мин и увеличивают на 5-10 мкг/мин каждые 5-10 мин до получения желаемого гемодинамического или клинического эффекта. Низкие дозы препарата (30-40 мкг/мин) в основном вызывают дилатацию вен, более высокие (150-500 мкг/мин) приводят также к расширению артериол.
Нитраты наиболее эффективны при ишемии миокарда, неотложных состояниях, возникших в связи с артериальной гипертензией, или при застойной сердечной недостаточности. Применение нитратов может способствовать усугублению тахикардии, брадикардии, нарушению вентиляционно-перфузионных отношений в лёгких.
При поддержании постоянной концентрации нитратов в крови более 16-24 ч к ним развивается толерантность.
Натрия нитропруссид. По влиянию на артериолы и вены похож на нитроглицерин, при этом в большей степени, чем нитроглицерин, расширяет артерии. Обычно ЛС вводят в дозах 0,1-5,0 мкг/кг в мин (в отдельных случаях вплоть до 10 мкг/кг в минуту). Препарат долгое время не должен находиться на свету. Используют для лечения неотложных состояний, возникающих при тяжёлой сердечной недостаточности (особенно связанной с аортальной или митральной регургитацией) и артериальной гипертензии.
Нитропруссид натрия не стоит использовать при сохраняющейся ишемии миокарда, поскольку он способен ухудшить кровообращение в зонах стенозированных эпикардиальных коронарных артерий. При гиповолемии нитропруссид натрия вызывает значительное снижение АД с рефлекторной тахикардией, поэтому давление заполнения левого желудочка должно составлять не менее 16-18 мм рт.ст. Другие побочные эффекты включают усугубление гипоксемии при заболеваниях лёгких за счёт устранения гипоксической констрикции лёгочных артериол — головную боль, тошноту, рвоту. При печёночной или почечной недостаточности и при введении натрия нитропруссида в дозе более 3 мкг/кг в минуту в течение более 72 ч в крови возможно накопление цианида или тиоцианата, что сопровождается развитием метаболического ацидоза с заторможенностью, гиперрефлексией и судорогами. Лечение заключается в немедленном прекращении инфузии препарата и введении тиосульфата натрия.
-
Антагонисты рецептора эндотелина и натрийуретических пептидов.
Новая группа вазодилататоров, эффективность которой в настоящее время активно изучается при лечении декомпенсированной сердечной недостаточности.
Незиритид P у больных с острой декомпенсированной сердечной недостаточностью по влиянию на параметры гемодинамики и клинические симптомы в сравнении с нитратами имеет меньшее число побочных эффектов, но по силе действия уступает нитроглицерину.
-
Наркотические анальгетики.
Морфин — опиоидный анальгетик, который помимо седативного действия и увеличения вагусного тонуса вызывает венозную и небольшую артериальную дилатацию, а также уменьшает ЧСС. Его рассматривают как средство выбора для купирования отёка лёгких и устранения боли в грудной клетке, связанной с ишемией миокарда и не проходящей после повторного приёма нитроглицерина под язык. Помимо венозной вазодилатации и уменьшения преднагрузки на миокард уже через 5-10 мин после введения морфин снижает работу дыхательных мышц, подавляя дыхательный центр, что обеспечивает дополнительное уменьшение нагрузки на сердце. Определённую роль играет способность препарата уменьшать психомоторное возбуждение и симпатоадреналовую активность. Морфин вводят внутривенно дробно по 2-5 мг. Берут 1 мл 1% раствора, который доводят до 20 мл изотоническим раствором натрия хлорида и вводят полученный раствор по 4-10 мл каждые 10-15 мин до получения эффекта или появления нежелательных действий. Противопоказания — нарушение ритма дыхания (дыхание ЧейнаСтокса), угнетение дыхательного центра, острая обструкция дыхательных путей, хроническое лёгочное сердце.
-
Диуретики.
Фуросемид, торасемид — петлевые диуретики, вызывающие гемодинамическую разгрузку миокарда уже через 5-15 мин после введения за счёт венозной вазодилатации; позже присоединяется диуретическое действие. Их вводят внутривенно болюсно без разведения в дозе от 40 мг при минимальных признаках застоя до 240 мг при крайне тяжёлых отёках лёгких.
-
β-Адреноблокаторы.
Противопоказано использование препаратов этой группы при ОСН, связанной с нарушением сократительной способности миокарда. Однако, когда отёк лёгких возникает у больного с субаортальным или изолированным митральным стенозом и связан с возникновением тахисистолии в сочетании с повышенным АД, введение бета-адреноблокаторов способствует купированию симптомов заболевания.
Для внутривенного применения в России доступно три препарата — пропранолол, метопролол и эсмолол. Первые два вводят небольшими дозами с интервалами, достаточными для оценки эффективности и безопасности предыдущей дозы (изменения АД, ЧСС, внутрисердечной проводимости, проявление ОСН). Эсмолол обладает очень коротким периодом полувыведения (2-9 мин), поэтому у острых больных с высоким риском осложнений его использование считают предпочтительным.
Тактика лечения отдельных проявлений острой сердечной недостаточности и методы контроля эффективности лечения
ОТЁК ЛЁГКИХ
Цели лечения
Уменьшить давление в лёгочных капиллярах. Оптимально добиться уменьшения давления заклинивания лёгочной артерии до 16-20 мм рт.ст. и подъёма сердечного выброса более 2 л/мин.
Обзор современных рекомендаций
Отёк лёгких, гипертонический криз и острая декомпенсация ХСН во многих случаях связаны с возникновением выраженной периферической вазоконстрикции у больных со сниженным сократительным резервом левого желудочка. Увеличение постнагрузки приводит к снижению сердечного выброса и увеличению диастолического давления в левом желудочке. Неотложное лечение этих вариантов ОСН основано на использовании мощных, быстродействующих вазодилататоров. После первоначальной стабилизации лечение должно быть направлено на предупреждение повторных эпизодов выраженной вазоконстрикции в сочетании с оптимизацией функций сердца.
Принципы выбора лекарственных средств и их режимов дозирования
Вмешательства первой ступени направлены на быстрое снижение давления в капиллярах лёгких и устранение гипоксии. Помимо внутривенного введения морфина и мочегонных препаратов (фуросемид) необходимо придать больному положение полусидя с опущенными ногами и обеспечить дыхание 95% кислородом. При систолическом АД выше 100 мм рт.ст. следует начать принимать нитроглицерин под язык (по 1 таблетке каждые 5-10 мин) или использовать нитраты в виде аэрозоля до появления возможности проводить внутривенно инфузию нитроглицерина или снижения систолического АД менее 90 мм рт.ст. Если ответ на первую дозу фуросемида отсутствует в течение 20 мин, рекомендуют ввести удвоенную дозу препарата. Тиазидные диуретики и спиронолактон здесь иногда используются в сочетании с петлевыми диуретиками.
Средствами непосредственной борьбы с пенообразованием при отёке лёгких служат так называемые пеногасители — вещества, обеспечивающие разрушение пены за счёт снижения поверхностного натяжения. Простейшее из них — пары спирта (спирт наливают в увлажнитель, пропуская через него кислород, пары подают больному через носовой катетер или дыхательную маску с начальной скоростью 2-3 л, а спустя несколько минут — со скоростью 6-8 л в минуту). Исчезновение клокочущего дыхания наблюдают в сроки от 10-15 мин до 2-3 ч.
Показаниями к переводу на ИВЛ служит частота дыхания свыше 30 в минуту, активное участие в дыхании вспомогательной мускулатуры, падение рO2 ниже 50 мм рт.ст., тяжёлый респираторный ацидоз.
Вмешательства второй ступени начинают несколько позже и продолжают от нескольких часов до нескольких суток. В/в инфузия нитроглицерина или натрия нитропруссида — вмешательства второй ступени. Отмечено, что эффективность вазодилататоров уменьшается как при слишком низких, так и при слишком высоких дозах препаратов. При их использовании необходимо тщательно контролировать АД. Доза титруется до снижения систолического АД на 10-15%, но не ниже 90 мм рт.ст., а также до достижения оптимального гемодинамического эффекта. При этом клиническое улучшение может быть отсрочено. При рефрактерных или возобновляющихся симптомах ОСН, связанных с низкой сократительной способностью миокарда, показано введение положительных инотропных агентов (добутамина или/и допамина). Показание к длительному использованию нитратов — необходимость контролировать ишемию миокарда. При выраженном бронхоспазме необходим аминофиллин (вводят внутривенно в нагрузочной дозе 5 мг/кг за 20 мин с последующей инфузией 0,5-0,7 мг/кг в час), его применение нежелательно при суправентрикулярных тахиаритмиях.
Методы контроля эффективности
Необходимо помнить о признаках передозировки аминофиллина, включающих тошноту, рвоту, тахикардию, тахиаритмии, тремор, беспокойство, раздражительность и судороги. Эффективным средством, позволяющим контролировать ишемию миокарда при недостаточной эффективности медикаментозного лечения, а также связанные с ней проявления ОСН и тяжёлые аритмии, служит внутриаортальная баллонная контрапульсация.
КАРДИОГЕННЫЙ ШОК И АРТЕРИАЛЬНАЯ ГИПОТЕНЗИЯ
Цели лечения
Оптимизация давления заполнения желудочков сердца, нормализация АД и устранение снижения сердечного выброса.
Принципы выбора лекарственных средств и режимов их дозирования
Артериальную гипотонию диагностируют, если систолическое АД не превышает 80-90 мм рт.ст. При артериальной гипотензии или кардиогенном шоке первоначально надо убедиться в достаточном давлении заполнения желудочков сердца (отсутствии абсолютной или относительной гиповолемии). В неотложной ситуации, если нет отёка лёгких, целесообразно быстро ввести внутривенно 250-500 мл жидкости, контролируя степень застоя в лёгких и центральное венозное давление. Если достаточного повышения АД не достигнуто, следует начать инфузию прессорного агента в постепенно увеличивающейся дозе, выбор которого зависит от уровня АД. Применяют норадреналин (при систолическом АД <70 мм рт.ст), допамин (при систолическом АД от 70 до 90 мм рт.ст.), добутамин (при систолическом АД >90 мм рт.ст); ингибиторы фосфодиэстеразы. Поддержанию достаточного уровня АД помогает использование внутриаортальной баллонной контрапульсации.
При тяжёлой правожелудочковой недостаточности (распространении некроза на правый желудочек при инфаркте миокарда, массивной тромбоэмболии лёгочной артерии) надо исключить применение вазодилататоров (нитраты, ингибиторы АПФ и др.) и мочегонных. Важно также добиться сохранения синхронной сократительной активности правого предсердия и желудочка (устраняя пароксизмы наджелудочковых аритмий и при необходимости используя последовательную атриовентрикулярную электрическую стимуляцию сердца). При сократительной дисфункции левого желудочка может потребоваться снижение его постнагрузки с помощью натрия нитропруссида или внутриаортальной баллонной контрапульсации. Тромбоэмболия лёгочной артерии с артериальной гипотензией или шоком — показания к неотложной тромболитической терапии.
Согласно последним данным, при кардиогенном шоке, рефрактерном к стандартному лечению, высокоэффективно применение ингибитора синтазы оксида азота L-NMMA.
Восстановлению нормальной текучести крови способствует переливание плазмы крови, альбумина, низкомолекулярных декстранов (декстран), растворов гидроксиэтилкрахмала (инфукол*, рефортан*), глюкозы. В лечении также используют п/к введение низкомолекулярных гепаринов (эноксапарин натрия 40 мг 1 раз в сутки, далтепарин натрия 5000 МЕ 1 раз в сутки) и антиагрегантов, а также препаратов, обладающих противоферментной активностью (апротинин), аминокапроновой кислоты, активаторов спонтанного фибринолиза (никотиновая кислота, ксантинола никотинат), глюкокортикоидов (4-12 мг дексаметазона) с целью уменьшения проницаемости мембран.
Перечисленные мероприятия проводят на фоне коррекции водно-солевого баланса и кислотно-основного состояния с использованием солей калия и магния.
СПИСОК ЛИТЕРАТУРЫ
Верткин А.Л., Тополянский А.В. Алгоритм догоспитального этапа ведения больных острой сердечной недостаточностью // Consilium Medicum. — № 5. — 2005. — С. 44-51.
Диагностика и лечение острой сердечной недостаточности. Российские рекомендации // Комитет экспертов Всероссийского научного общества кардиологов. — 2007. — www. cardiosite.ru.
Явелов И.С. Принципы лечения острой сердечной недостаточности // Сердце. — № 1. — 2003. — С. 28-42.
ACC/AHA Guideline Update for the Management of Patients With Unstable Angina and NonST-Segment Elevation Myocardial Infarction-2002: Summary Article A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Unstable Angina) // Circulation. — 2002. — October 1. — P. 1893-1900.
ACC/AHA /ESC Guidelines for the management of patients with atrial fibrillation. A Report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients With Atrial Fibrillation). Developed in Collaboration With the North American Society of Pacing and Electrophysiology // Eur. Heart. J. — 2001. — Vol. 22. — P. 1852-1923.
Bristow M., Port D., Kelly R. Treatment of Heart Failure: Pharmacological Methods // Heart Disease: A Textbook of Cardiovascular Medicine / Ed. E. Braunwald, D. Zipes, P. Libby. — 6-th ed. — W.B. Saunders Co. — 2001. — P. 562-599.
Cotter G., Kaluski E., Blatt A. et al. L-NMMA (a nitric oxide synthase inhibitor) is effective in the treatment of cardiogenic shock // Circulation. — 2000. — N 101. — P. 1358-1361.
Hogg K., Swedberg K., McMurray J. Heart Failure with preserved left ventricular systolic function. Epidemiology, Clinical Characteristics, and Prognosis // J. Am. Coll. Cardiol. — 2004. — N 43. — P. 317-327.
Lee T. Management of Heart Failure. Guidelines // Heart Disease: A Textbook of Cardiovascular Medicine / Ed. E. Braunwald, D. Zipes, P. Libby. — 6-th ed. — W.B. Saunders Co. — 2001. — P. 652-658.
Menon V., Hochman J. Management of cardiogenic shock complicating acute myocardial infarction // Heart. — 2002. — N 88. — P. 531-537.
Moiseyev V., Poder P., Andrejevs N. et al. On behalf of RUSSLAN Study Investigators. Safety and efficacy of a novel calcium sensitizer, levosimendan, in patients with left ventricular failure due to an acute myocardial infarction. A randomized, placebo-controlled, double-blind study (RUSSLAN) // Eur. Heart. J. — 2002. — N 23. — P. 1422-1932.
Publication Committee for the VMAC Investigators. Intravenous nesiritide vs nitroglycerin for treatment of decompensated congestive heart failure: A randomized controlled trial // J.A.M.A. — 2002. — N 287. — P. 1531-1540.
Richenbacher W., Pierce W. Treatment of Heart Failure: Assisted Circulation // Heart Disease: A Textbook of Cardiovascular Medicine / Ed. E. Braunwald, D. Zipes, P. Libby. — 6-th ed. — W.B. Saunders Co. — 2001.- P. 600-614.
The Task Force on the Management of Acute Coronary Syndromes of the European society of Cardiology. Management of acute coronary syndromes in patients presenting without persistent ST-segment elevation // Eur. Heart. J. — 2002. — N 23. — P. 1809-1840.
The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Management of acute myocardial infarction in patient presenting with St-segment elevation // Eur. Heart. J. — 2003. — N 24. — P. 28-66.
Хроническая сердечная недостаточность
КЛАССИФИКАЦИЯ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
В классификации ХСН, предложенной Американской коллегией кардиологов и Американской ассоциацией сердца (2005 г.), выделены 4 стадии ХСН. Стадия А: ещё нет дисфункции сердца и не наступило развитие клинически выраженной декомпенсации сердечной деятельности. Стадия В — бессимптомная дисфункция левого желудочка — соответствует I стадии ХСН по классификации общества специалистов по сердечной недостаточности (2002 г.), стадия С — клинически выраженная ХСН — соответствует II стадии по классификации общества специалистов по сердечной недостаточности 2002 г. В российской классификации выделены периоды IIA и ИБ (начальная и клинически выраженная ХСН). Стадию D в Американской классификации относят к финальной стадии ХСН (соответствует III стадии болезни по классификации общества специалистов по сердечной недостаточности 2002 г.). Важно отметить, что классификация ХСН по стадиям лишь дополняет, но не заменяет классификацию, предложенную Нью-Йоркской кардиологической ассоциацией (NYHA). Классы (по классификации NYHA) могут меняться у каждого пациента как в сторону повышения, так и снижения (в зависимости от реакции на лечение или при прогрессировании заболевания). Стадии, в отличие от классов, могут меняться только в одном направлении — прогрессировать в зависимости от ремоделирования миокарда. Выделение стадий сердечной недостаточности позволяет показать возможность профилактики ХСН, а также подчёркнуть значимость диагностики прогрессирования дисфункции левого желудочка.
ЦЕЛИ ЛЕЧЕНИЯ
В настоящее время в международных и национальных российских рекомендациях по лечению ХСН выделяют шесть основных целей лечения данного заболевания:
-
предотвращение развития симптомной ХСН (для I стадии ХСН);
-
устранение симптомов ХСН (для стадий ПА-Ш);
-
замедление прогрессирования болезни путём защиты сердца и других органовмишеней (головного мозга, почек, сосудов) (для стадий I-III);
-
улучшение качества жизни (для стадий IIA-III);
-
уменьшение количества госпитализаций (и расходов) (для стадий
-
улучшение прогноза (для стадий I-III).
При наличии бессимптомной дисфункции левого желудочка, характерной для I стадии ХСН, необходимо предотвратить появление её выраженных симптомов.
Главная задача фармакотерапии при ХСН на любой её стадии — замедление прогрессирования болезни путём защиты органов-мишеней (сердца, сосудов, почек и др.). Предотвращение и замедление ремоделирования сердца и сосудов — не менее важная задача, чем устранение симптомов ХСН. Естественно, что при симптомной ХСН на начальном этапе лечения важно избавить больного от одышки, удушья, отёков и улучшить качество его жизни (например, нормализовать сон). Достичь этого можно уже через несколько суток лечения (максимум — через 1-2 нед).
Уменьшение числа госпитализаций косвенно свидетельствует о стабильном течении ХСН и существенно снижает затраты на лечение.
ПРИНЦИПЫ ВЫБОРА ЛЕКАРСТВЕННЫХ СРЕДСТВ И РЕЖИМОВ ИХ ДОЗИРОВАНИЯ
Медикаментозное лечение — важнейшая составляющая комплексного лечения ХСН (комплексное лечение включает также немедикаментозные и хирургические методы).
По степени доказанности каждого из методов лечения Европейским обществом кардиологов предложена трёхбалльная шкала: степень доказанности А — применение предлагаемого метода абсолютно доказано, по меньшей мере, в двух независимых крупных контролируемых исследованиях; степень доказанности В (более низкая) — эффективность предлагаемого лечения уже получила подтверждение в одном крупном исследовании или результаты исследований противоречивы и требуются дополнительные исследования; степень доказанности С (самая низкая) — рекомендации по лечению основаны на результатах отдельных исследований и полагаться на них трудно. Кроме того, выделяют классы рекомендаций: I класс — лечение показано всем, На — лечение скорее показано, Нб — лечение скорее противопоказано, III — лечение строго противопоказано.
Общие принципы лечения ХСН подразумевают назначение только тех препаратов, эффективность и безопасность которых доказана в длительных многоцентровых двойных слепых, плацебо-контролируемых исследованиях. Все рекомендации по дозам ЛС и кратности их приёма также основаны на данных контролируемых исследований, в которых была доказана эффективность того или иного препарата. Тактика лечения ХСН представлена на рис. 21-7.
Схема лечения сердечной недостаточности
Рис. 21-7. Стратегия лечения хронической сердечной недостаточности.
Профилактику ХСН (лечение стадии А) проводят в соответствии с существующими рекомендациями по лечению артериальной гипертензии, ИБС, сахарного диабета, клапанных пороков сердца.
Все ЛС для лечения ХСН по степени доказанности их эффективности можно разделить на три группы: основные, дополнительные и вспомогательные.
Основные лекарственные средства
К этой группе относят препараты, эффект которых доказан, сомнений не вызывает и которые рекомендованы именно для лечения ХСН.
-
Ингибиторы АПФ показаны всем больным с ХСН вне зависимости от этиологии, стадии процесса и типа декомпенсации.
-
β-Адреноблокаторы применяют дополнительно к ингибиторам АПФ.
-
Антагонисты альдостерона применяют вместе с ингибиторами АПФ и β-адреноблокаторами у больных с тяжёлой ХСН.
-
Диуретики показаны всем больным при наличии клинических симптомов ХСН, связанных с избыточной задержкой натрия и воды в организме.
-
Сердечные гликозиды — препараты выбора при мерцательной аритмии. При синусовом ритме их назначают с осторожностью (особенно у женщин) и в малых дозах.
-
Блокаторы ангиотензиновых рецепторов применяют не только в случаях непереносимости ингибиторов АПФ, но и вместе с ингибиторами АПФ в качестве средств первого ряда у больных с клинически выраженной декомпенсацией.
Дополнительные лекарственные средства
Эффективность и/или безопасность данных препаратов показана в отдельных крупных исследованиях, но требует уточнения.
-
Статины рекомендованы всем больным с ишемической этиологией ХСН, так как они способны предотвращать развитие ХСН при разных формах ИБС.
-
Непрямые антикоагулянты показаны при сочетании ХСН и мерцательной аритмии. Эта группа препаратов меняется наиболее быстро, так как многие препараты, подтвердив свою эффективность и безопасность, становятся основными (при отсутствии подтверждения — вспомогательными) средствами лечения ХСН.
Вспомогательные лекарственные средства
-
Периферические вазодилататоры, в частности нитраты, применяют только при сопутствующей стенокардии.
-
Блокаторы медленных кальциевых каналов — длительно действующие дигидропиридины — применяют при упорной стенокардии и стойкой артериальной гипертензии.
-
Антиаритмические средства (в основном III класса) используют при опасных для жизни желудочковых аритмиях.
-
Ацетилсалициловую кислоту (аспирин*) и другие антиагреганты применяют для вторичной профилактики после перенесённого инфаркта миокарда.
-
Негликозидные инотропные стимуляторы используют при обострении ХСН, протекающем с низким сердечным выбросом и упорной гипотонией.
В литературе есть данные двух исследований возможности улучшения прогноза больных при применении вазодилататоров — нитратов (изосорбида динитрат) — с гидралазином (апрессином*). Однако побочные эффекты (тахикардия, гипотония, головная боль) при таком варианте лечения очень выражены, поэтому при использовании ингибиторов АПФ рекомендовать такое лечение нецелесообразно. Указанную комбинацию препаратов можно использовать только при непереносимости ингибиторов АПФ.
ОСНОВНЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Ингибиторы ангиотензинпревращающего фермента
Данные препараты в настоящее время считают средствами первого ряда при лечении ХСН. Более 10 лет назад в классическом метаанализе была убедительно продемонстрирована их способность к снижению риска смерти больных с ХСН почти на 25%, причём в первые 90 сут от начала лечения этот эффект ещё более выражен (снижение риска смерти почти в 2 раза). Положительные эффекты ингибиторов АПФ не зависят от возраста и тяжести ХСН. Эффективность использования ингибиторов АПФ может несколько снижаться при ишемической этиологии ХСН, а также у женщин. Кроме того, эффект ингибиторов АПФ может быть ослаблен при одновременном применении НПВС (вследствие конкурентной блокады синтеза простациклина, стимулируемого кининовой системой). Меньшее снижение эффективности ингибиторов АПФ наблюдают при применении малых доз ацетилсалициловой кислоты (аспирина*). В целом при ХСН применение ингибиторов АПФ имеет самый высокий уровень доказанности (класс рекомендаций I, уровень доказанности А).
В России зарегистрировано много ингибиторов АПФ, имеющих в качестве показания ХСН: зофеноприл, каптоприл, лизиноприл, периндоприл, спираприл, рамиприл, фозиноприл, цилазаприл, эналаприл. Считают, что при использовании ингибиторов АПФ при ХСН развивается так называемый класс-эффект, т. е. то, что свойственно всему этому классу лекарств. Однако степень доказанности эффективности каждого из них при лечении ХСН (табл. 21-57).
Таблица 21-57. Доказательная база применения ингибиторов ангиотензинпревращающего фермента для предотвращения развития хронической сердечной недостаточности и/или её лечения*
| Препараты | Профилактика ХСН | I функциональный класс начальная ХСН | II функциональный класс клинически выраженная ХСН | III-IV функциональные классы тяжёлая ХСН |
|---|---|---|---|---|
|
Эналаприл |
— |
SOLVD prev |
SOLVD treat, V-HeFT II, RESOLVD |
CONSENSUS |
|
Каптоприл |
SAVE, VALIANT, OPTIMAAL |
Munich MHF |
Captopril-Degoxin, ELITE-II |
— |
|
Фозиноприл |
FAMIS |
— |
FEST, SHF без глик, Fosinopril-Enalapril |
— |
|
Периндоприл |
PROGRESS, EUROPA |
— |
PEP-CHF, PREAMI |
— |
|
Лизиноприл |
GISSI-III |
— |
ATLAS |
— |
|
Рамиприл |
AIRE, HOPE |
— |
— |
— |
|
Зофеноприл |
SMILE |
— |
— |
— |
|
Спираприл |
— |
— |
CASSIS |
— |
* Без исследований по подбору доз и оценки гемодинамики.
Максимальную степень доказанности в лечении ХСН всех стадий имеют только классические ингибиторы АПФ — эналаприл и каптоприл, поэтому именно их необходимо наиболее широко использовать для лечения ХСН. Для профилактики ХСН у больных, перенёсших инфаркт миокарда, можно применять каптоприл, рамиприл и фозиноприл. В исследовании PRE-AMI было показано, что периндоприл блокирует постинфарктное ремоделирование левого желудочка у лиц пожилого возраста. Трандолаприл и зофеноприл исследованы только на пациентах с инфарктом миокарда. Трандолаприл не предотвращает развитие ХСН у больных с ИБС и сохранной функцией сердца.
Для профилактики ХСН у пациентов с хроническими заболеваниями сердечнососудистой системы, в частности ИБС, можно использовать только периндоприл и рамиприл (наиболее эффективен периндоприл). Рамиприл может предотвращать развитие декомпенсации у смешанной группы больных с ИБС, артериальной гипертензией, сахарным диабетом, периферическим атеросклерозом и перенесённым инсультом.
В дополнение к перечисленным препаратам в Российских рекомендациях общества специалистов по сердечной недостаточности по лечению больных с ХСН указан спираприл, эффективность которого при лечении ХСН доказана в отечественных исследованиях.
В табл. 21-58 приведены дозы наиболее исследованных ингибиторов АПФ, применяемых для лечения и профилактики ХСН (препараты, эффективность которых доказана только у больных с инфарктом миокарда, а также препараты, эффективность которых доказана только в национальных исследованиях, в табл. 21-58 не представлены).
Таблица 21-58. Дозирование ингибиторов ангиотензинпревращающего фермента при лечении хронической сердечной недостаточности (мгхкратность приёма в сутки)
| Препарат | Стартовая доза | Терапевтическая доза | Максимальная доза | Стартовая доза при гипотонии |
|---|---|---|---|---|
|
Эналаприл |
2,5×2 |
10×2 |
20×2 |
1,25×2 |
|
Каптоприл |
6,25х3(2)[8] |
25×3(2) |
50×3(2) |
3,125×3(2) |
|
Фозиноприл |
5×1(2) |
10-20×1(2) |
20×1(2) |
2,5×1(2) |
|
Периндоприл |
2×1 |
4×1 |
8×1 |
1×1 |
|
Лизиноприл |
2,5×1 |
10×1 |
20×1[9] |
1,25×1 |
|
Рамиприл |
2,5×1 |
5×2 |
5×2 |
1,25×1 |
Все ингибиторы АПФ необходимо начинать назначать с небольших доз. В дальнейшем дозы нужно постепенно (не чаще 1 раза в 2-3 сут, а при системной гипотонии — не чаще 1 раза в нед) увеличивать до индивидуальных «целевых» доз (которые часто существенно выше, чем стандартные дозы, используемые в клинической практике). Ингибиторы АПФ можно назначать больным с ХСН при уровне систолического АД выше 85 мм рт. ст. При исходном систолическом АД ниже 85-100 мм рт. ст. ингибиторы АПФ эффективны, однако стартовая доза в таком случае должна быть ниже в 2 раза (для всех ингибиторов АПФ).
При применении ингибиторов АПФ для лечения ХСН могут развиваться различные побочные эффекты (ниже перечислены наиболее клинически значимые из них).
-
Повышение концентрации креатинина. Наблюдают у 5-15% больных. Оно связано с возможным снижением скорости почечной фильтрации вследствие блокады рецепторов ангиотензина II и развитием функциональной почечной недостаточности. Риск повышен у больных с исходной гипонатриемией (может возникнуть опасная ситуация). При медленном увеличении доз ингибиторов АПФ повышение концентрации креатинина более чем в 2 раза выше нормы и усугубление почечной недостаточности встречается максимум у 1-2% пациентов. В этих случаях оправдан переход на ингибиторы АПФ, имеющие два пути выведения из организма — фозиноприл и спираприл. Назначение лизиноприла в таких случаях противопоказано.
-
Сухой кашель — типичный побочный эффект всех ингибиторов АПФ. Встречается у 2-3% больных и связан с блокадой деградации брадикинина. При развитии упорного кашля ингибитор АПФ нужно заменить блокатором ангиотензиновых рецепторов (при применении препарата данной группы частота возникновения сухого кашля значительно меньше).
-
Симптомная гипотония развивается, как правило, в начале лечения. Она характерна для пациентов с высоким уровнем активности ренина в плазме крови. Риск гипотонии возрастает у больных с ХСН IV функциональный класс, при сочетании ингибиторов АПФ с периферическими вазодилататорами и при назначении ингибиторов АПФ после обильного диуреза. Ингибиторы АПФ рекомендуют назначать не ранее чем через 24 ч после обильного диуреза, предварительно отменив вазодилататоры. Реже гипотония первой дозы развивается на фоне применения периндоприла. У 3-4% пациентов симптомная гипотония может стать причиной прекращения приёма ингибиторов АПФ. При развитии гипотонии на фоне лечения ингибиторами АПФ нужно уменьшить дозу данных препаратов. Важно отметить, что применение ингибиторов АПФ в таких случаях необходимо продолжить.
При лечении ингибиторами АПФ необходимо контролировать АД и уровень электролитов крови (исследование выполняют через 2 нед после каждого последующего увеличения дозы).
β-Адреноблокаторы
При ХСН симпатико-адреналовая система у больных с декомпенсацией находится в состоянии хронической гиперактивации и предопределяет плохой прогноз. Основная цель применения β-адреноблокаторов — снижение смертности и улучшение прогноза. В настоящее время доказано, что β-адреноблокаторы не только блокируют влияние катехоламинов на β-адренергические рецепторы, но оказывают комплексное нейрогормональное воздействие, а также дополняют эффекты ингибиторов АПФ.
Эффекты β-адреноблокаторов при ХСН:
-
уменьшение гибели (некроза и апоптоза) и дисфункции кардиомиоцитов;
-
уменьшение выраженности гибернации кардиомиоцитов;
-
улучшение показателей гемодинамики;
-
повышение плотности и аффинности β-адренорецепторов (их аффинность при ХСН снижена);
-
уменьшение гипертрофии миокарда;
-
снижение ЧСС;
-
уменьшение степени ишемии миокарда в покое и при физических нагрузках;
-
уменьшение частоты желудочковых аритмий;
-
антифибрилляторное действие, снижение риска внезапной смерти.
К настоящему времени проведено более 30 плацебо-контролируемых исследований, которые показали способность β-адреноблокаторов снижать смертность больных с декомпенсацией почти на 30%, причём в большинстве случаев β-адреноблокаторы назначают на фоне приёма ингибиторов АПФ. Доказано, что два типа β-адреноблокаторов — β1-селективные (кардиоселективные) (бисопролол и метопролол с замедленным высвобождением препарата), а также некардиоселективный β1— и β2-блокатор с дополнительными свойствами α1-блокатора, антиоксиданта и антипролиферативного средства (карведилол) — эффективны, безопасны и способны улучшать прогноз больных с ХСН, а также уменьшать число госпитализаций. Кроме трёх рекомендованных β-адреноблокаторов для лечения пожилых больных с ХСН (старше 70 лет) можно применять небиволол, который достоверно не снижает смертность, но уменьшает заболеваемость пациентов и число повторных госпитализаций. Другие β-адреноблокаторы, такие как атенолол, метопролол, не улучшают прогноз больных ХСН. Применение атенолола и метопролола для лечения больных ХСН противопоказано.
В табл. 21-59 перечислены исследования β-адреноблокаторов (доказательная база применения данных препаратов).
Таблица 21-59. Доказательная база применения β-адреноблокаторов при хронической сердечной недостаточности
| Препарат | Начальная ХСН | Клинически выраженная ХСН |
|---|---|---|
|
Метопролол |
SOLV prev |
MERIT-HF |
|
Бисопролол |
CIBIS-III |
CIBIS-I и II, BEST |
|
Карведилол |
— |
US Carvedilol HF COPERNICUS, COMET, CAPRICORN |
β-Адреноблокаторы необходимо применять у всех больных с ХСН (если нет противопоказаний), поскольку эффективность данной группы препаратов не зависит от тяжести декомпенсации, пола, возраста, уровня исходного давления и ЧСС. В обычных клинических ситуациях β-адреноблокаторы нужно назначать только дополнительно к ингибиторам АПФ (в том числе больным, у которых достигнута стабилизация состояния).
В табл. 21-60 представлены оптимальные дозы β-адреноблокаторов, применяющиеся для лечения ХСН.
Таблица 21-60. Дозы β-адреноблокаторов, используемые при лечении хронической сердечной недостаточности (по рекомендациям Российского общества специалистов по сердечной недостаточности)
| Препарат | Стартовая доза | Терапевтическая доза | Максимальная доза |
|---|---|---|---|
|
Бисопролол |
1,25 1 |
101 |
101 |
|
Метопролол |
12,51 |
1001 |
2001 |
|
Карведилол |
3,1251 |
251 |
251 |
|
Небиволол[10] |
1,251 |
101 |
101 |
Использовать β-адреноблокаторы при ХСН надо осторожно, начинать нужно с 1/8 терапевтической дозы (стартовая доза). В дальнейшем дозу увеличивают очень медленно (не чаще 1 раза в 2 нед, а при плохой переносимости и чрезмерном снижении АД — 1 раз в месяц) до достижения оптимальной терапевтической дозы. Необходимо помнить, что оптимальную терапевтическую дозу для каждого пациента нужно подбирать индивидуально.
В рекомендациях Российского общества специалистов по сердечной недостаточности указаны следующие наиболее оптимальные схемы лечения:
-
бисопролол применяют в первые 2 нед лечения по 1,25 мг, на 3-й и 4-й нед — по 2,5 мг, на 5-й и 6-й нед — по 3,75 мг, на 7-й и 8-й нед — по 5 мг, на 9-й и 10-й нед — по 7,5 мг, на 11-й и 12-й нед — по 10 мг (при сомнительной переносимости периоды увеличения дозы нужно увеличить до 4 нед, оптимальная доза будет достигнута к 24 нед);
-
дозы метопролола сукцината также увеличивают постепенно: в первые 2 нед лечения по 12,5 мг, на 3-4-й нед — по 25 мг, на 5-6-й недпо 50 мг, на 7-8-й нед по 75 мг, на 9-10-й нед — по 100 мг, на 11-12-й нед — по 200 мг;
-
для карведилола: начальная доза составляет 3,125 мг 2 раза, затем через 2 недели 2 раза в сутки по 6,25 мг, затем ещё через 2 недели по 12,5 мг 2 раза в сутки и далее по 25 мг 2 раза в сутки;
-
для небиволола (у больных старше 70 лет): 1,25 мг-2,5 мг-5 мг-7,5 мг10 мг. Увеличение дозы раз в 2 недели, при чрезмерном снижении АД 1 раз в месяц.
В Российских рекомендациях ВНОК и ОССН (общество специалистов по сердечной недостаточности) даны указания по тактике ведения пациентов с ХСН, уже получающих лечение не рекомендованными β-адреноблокаторами (табл. 21-61): «Если больные получают очень малые дозы атенолола (≤25 мг/сут) или метопролола тартрата (≤25 мг/сут), то титрование доз рекомендованных β-адреноблокаторов необходимо начать с общепринятых стартовых доз. При условии, если пациенты принимали средние дозы атенолола (25-75 мг/сут) или метопролола тартрата (25-75 мг/сут), то титрование рекомендованных β-адреноблокаторов можно начать сразу со второй ступени. Наконец, если пациенты успешно принимали высокие дозы атенолола (≥75 мг/сут) или метопролола тартрата (≥75 мг/сут), то титрование бисопролола, карведилола или метопролола сукцината можно начать с третьей ступени. Между последним приёмом атенолола или метопролола сукцината и первым приёмом рекомендованного β-адреноблокатора, на который переводится больной, должно пройти 12 ч. В дальнейшем титрование доз рекомендованных β-адреноблокаторов проходит по обычным принципам — увеличение доз каждые 2 нед, а при гипотонии и нестабильном состоянии 1 раз в 4 нед».
Таблица 21-61. Перевод больных с хронической сердечной недостаточностью с атенолола и метопролола тартрата на рекомендованные β-адреноблокаторы (по рекомендациям Российского общества специалистов по сердечной недостаточности)
|
Принимаемые β-адреноблокаторы |
Рекомендованные β-адреноблокаторы (стартовая доза) |
||
|
Бисопролол |
Метопролол |
Карведилол |
|
|
Атенолол ≤25 мг/сут |
1,25 мг |
12,5 мг |
3,125 мг x 2 раза в сутки |
|
Атенолол 25-75 мг/сут |
2,5 мг |
25 мг |
6,25 мг x 2 раза в сутки |
|
Атенолол ≥75 мг/сут |
5 мг |
50 мг |
12,5 мг x 2 раза в сутки |
|
Метопролол ≤25 мг/сут |
1,25 мг |
12,5 мг |
3,125 мг x 2 раза в сутки |
|
Метопролол 25-75 мг/сут |
2,5 мг |
25 мг |
6,25 мг x 2 раза в сутки |
|
Метопролол ≥75 мг/сут |
1,25 мг |
12,5 мг |
3,125 мг x 2 раза в сутки |
В первые 2 нед лечения β-адреноблокаторами возможно снижение сердечного выброса и обострение ХСН, что требует постоянного наблюдения за состоянием пациента. В таких случаях необходимо:
-
увеличить дозы диуретиков;
-
увеличить (если возможно) дозы ингибиторов АПФ;
-
назначить сердечные гликозиды;
-
замедлить увеличение дозы β-адреноблокаторов.
Противопоказания для назначения β-адреноблокаторов хорошо известны. При наличии ХОБЛ, осложняющей течение ХСН, β-адреноблокаторы нужно назначать осторожно, начинать с малых доз и увеличивать их постепенно. Однако при обострении симптомов бронхообструкции на фоне лечения β-адреноблокаторами от их применения необходимо отказаться. Препарат выбора в такой ситуации — высокоселективный β1-адреноблокатор бисопролол.
При сочетании ХСН и сахарного диабета 2-го типа назначение β-адреноблокаторов необходимо. Препарат выбора — карведилол, который, в отличие от всех других β-адреноблокаторов, улучшает чувствительность периферических тканей к инсулину. При невозможности использовать β-адреноблокаторы у больных ИБС на фоне ХСН рекомендуют применять блокаторы If-каналов (ивабрадин), изолированно снижающие ЧСС.
Для безопасного и эффективного применения β-адреноблокаторов при ХСН необходимо соблюдать следующие правила:
-
использовать только рекомендованные для лечения ХСН β-адреноблокаторы;
-
назначать β-адреноблокаторы дополнительно к ингибиторам АПФ (пациенты должны получать ингибиторы АПФ или блокаторы ангиотензиновых рецепторов);
-
пациенты должны находиться в стабильном состоянии без внутривенной инотропной поддержки, без признаков выраженных застойных явлений и на правильно подобранных дозах диуретиков;
-
лечение следует начинать с небольших доз β-адреноблокаторов с последующим медленным их повышением до целевых терапевтических доз;
-
уменьшение ЧСС минимум на 15% от исходной величины свидетельствует о правильно подобранной схеме лечения.
Антагонисты альдостерона
Спиронолактон в дозе 100-300 мг/сут применяют в комплексной терапии тяжёлой ХСН как калийсберегающий диуретик. При наличии декомпенсации спиронолактон используют в высоких дозах (100-300 мг, или 4-12 таблеток, назначают однократно утром или в 2 приёма — утром и в обед) на 1-3-й нед до достижения компенсации. После этого дозу спиронолактона нужно уменьшить. При таком варианте лечения необходим тщательный контроль концентрации калия и креатинина в плазме крови.
Критерии эффективности применения спиронолактона в комплексном лечении упорного отёчного синдрома:
-
увеличение диуреза на 20-25% (это особенно важно при упорных, рефрактерных отёках);
-
уменьшение жажды, сухости во рту и исчезновение специфического «печёночного» запаха изо рта;
-
стабильная концентрация калия и магния в плазме крови (отсутствие снижения), несмотря на достижение положительного диуреза.
После достижения компенсации высокие дозы спиронолактона отменяют. В дальнейшем решают вопрос о длительном назначении невысоких доз препарата в качестве нейрогормонального модулятора.
В настоящее время наиболее популярной и клинически оправданной стала концепция длительного лечения больных ИБС III-IV функциональных классов с выраженной декомпенсацией с использованием малых (25-50 мг) доз спиронолактона дополнительно к ингибиторам АПФ и β-адреноблокаторам в качестве нейрогуморального модулятора. Это позволяет более полно блокировать РААС, улучшать течение и прогноз больных с ХСН. Считают, что именно сочетание трёх нейрогормональных модуляторов (ингибитор АПФ с β-адреноблокатором и антагонистом альдостерона) наиболее эффективно для лечения больных с тяжёлой ХСН.
Из основных побочных реакций спиронолактона следует отметить развитие гинекомастии (до 10% пациентов), связанное со способностью препарата повышать уровень пролактина в крови.
При наличии повышенного уровня креатинина сыворотки (≥130 мкмоль/л), почечной недостаточности в анамнезе, гиперкалиемии, причём даже умеренной (>5,2 мкмоль/л), и сочетании антагонистов альдостерона с ингибитором АПФ
необходим постоянный мониторинг клинико-лабораторных данных пациента. Необходимо определять уровень калия и креатинина плазмы через 2 и 4 нед после начала лечения, затем через 2 и 3 мес, а потом 1 раз в 6 мес.
Диуретики
Диуретическая терапия при ХСН имеет две фазы: активную (при декомпенсации ХСН) и поддерживающую (при стабильном состоянии пациента). В активной фазе превышение количества выделенной мочи над количеством принятой жидкости должно составлять 1-2 л/сут, но при этом ежедневное снижение веса не должно быть больше 1 кг. Более интенсивная терапия может спровоцировать гиперактивацию РААС и симпатоадреналовой системы и привести к задержке жидкости. В поддерживающей фазе диурез должен быть сбалансированным, а масса тела стабильной при ежедневном приёме диуретиков (не допустим дискретный прием диуретиков 1-2 раза/нед).
Российское общество специалистов по сердечной недостаточности предлагает следующий алгоритм назначения диуретиков в зависимости от тяжести ХСН:
-
при I и II (без застоя) функциональных классах — диуретики не использовать;
-
при II функциональном классе (с застоем) назначить тиазидные диуретики (только при их неэффективности можно назначать петлевые);
-
при III функциональном классе (декомпенсация) — петлевые (тиазидные) и антагонисты альдостерона;
-
при III функциональном классе для поддерживающего лечения — тиазидные (петлевые) диуретики в сочетании со спиронолактоном (в малых дозах) и ацетазоламидом (по 0,25 мг 3 раза/сут в течение 3-4 сут, 1 раз в неделю);
-
при IV функциональном классе — петлевые и тиазидные диуретики (иногда сочетание двух петлевых диуретиков, фуросемида и этакриновой кислоты) вместе с антагонистами альдостерона и ингибиторами карбоангидразы (ацетазоламид по 0,25 мг 3 раза в сутки в течение 3-4 сут, 1 раз в неделю).
В настоящее время диуретики рассматривают всего лишь как один из компонентов дегидратационной терапии наряду с ингибиторами АПФ и антагонистами альдостерона. Поэтому монотерапия ХСН диуретиками недопустима. Диуретики, используемые для лечения ХСН, относятся к различным фармакологическим группам и отличаются по уровню воздействия на нефрон. На проксимальные канальцы действуют слабейшие из диуретиков — ингибиторы карбоангидразы (ацетазоламид), на кортикальный участок восходящей части петли Генле и начальную часть дистальных канальцев — тиазидные и тиазидоподобные диуретики (гидрохлоротиазид, индапамид, хлорталидон); на всю восходящую часть петли Генле — самые мощные петлевые диуретики (фуросемид, этакриновая кислота, буметанид, торасемид); на дистальные канальцы — конкурентные (спиронолактон) и неконкурентные (триамтерен) антагонисты альдостерона, относящиеся к группе калийсберегающих диуретиков (диуретический эффект у них очень незначителен, а при лечении ХСН используют их нейрогуморальные свойства). В табл. 21-62 представлен режим дозирования диуретиков при ХСН.
Основные принципы диуретической терапии при ХСН
-
Диуретики следует назначать только при наличии клинических признаков застоя крови (со НА стадии, II функционального класса по классификации общества специалистов по сердечной недостаточности).
-
Лечение нужно начинать с малых доз.
-
Важно использовать «ступенчатое» назначение диуретиков: от слабейшего из возможно эффективных у конкретного больного до комбинаций диуретиков (от тиазидных диуретиков, например гидрохлоротиазида, к мощным петлевым диуретикам — фуросемиду, этакриновой кислоте, буметаниду, торасемиду). Кроме того, вначале препарат назначают внутрь, в дальнейшем при необходимости переходят от приёма внутрь к парентеральному введению.
-
Нельзя назначать ударные дозы 1 раз в 3-7 сут, так как это не только приводит к ухудшению качества жизни, но и повышает риск развития нарушений ритма.
Таблица 21-62. Режимы дозирования диуретиков при лечении хронической сердечной недостаточности и длительность их действия (по рекомендациям Российского общества специалистов по сердечной недостаточности)
| Диуретики | Показания | Стартовая доза | Максимальная доза | Длительность действия | |
|---|---|---|---|---|---|
|
Тиазидные |
Гидрохлоротиазид |
функциональные классы, скорость клубочковой фильтрации ≥30 мл/мин |
25 мг, 1-2 раза в сутки |
200 мг/сут |
6-12 ч |
|
Индапамид |
II функциональный класс (СКФ≥30 мл/мин) |
1,5 мг/сут |
4,5 мг/сут |
36 ч |
|
|
Хлорталидон |
II функциональный класс (СКФ≥30 мл/мин) |
12,5 мг/сут |
100 мг/сут |
24-72 ч |
|
|
Петлевые |
Фуросемид |
II-IV функциональные классы (СКФ≥5 мл/мин |
20 мг, 1-2 раза в сутки |
600 мг/сут |
6-8 ч |
|
Буметанид |
II-IV функциональные классы (СКФ≥5 мл/мин) |
0,5 мг, 1-2 раза в сутки |
10 мг/сут |
4-6 ч |
|
|
Этакриновая кислота |
II-IV функциональные классы (СКФ≥5 мл/мин) |
25 мг, 1-2 раза в сутки |
200 мг/сут |
6-8 ч |
|
|
Торасемид |
II-IV функциональные классы (СКФ≥5 мл/мин) |
10 мг/сут |
200 мг/сут |
12-16 ч |
|
|
Ингибиторы карбоксиангидразы |
Ацетазоламид |
Сердечно-лёгочная недостаточность, синдром ночного апноэ, устойчивость к активным диуретикам (вследствие алкалоза) |
250 мг, 3-4 сут с перерывами 10-14 сут[11] |
750 мг/сут |
12 ч |
|
Калийсберегающие |
Спиронолактон[12] |
Декомпенсация ХСН |
50 мг 2 раза в сутки |
300 мг/сут |
До 72 ч |
|
Триамтерен[13] |
Гипокалиемия |
50 мг 2 раза в сутки |
200 мг/сут |
8-10 ч |
Типичное последствие применения диуретиков при ХСН — гиперактивация РААС, сопровождающаяся задержкой жидкости. Именно поэтому при лечении тиазидными и петлевыми диуретиками необходимо подавлять гиперактивацию РААС с помощью ингибиторов АПФ, блокаторов ангиотензиновых рецепторов и антагонистов альдостерона. Кроме того, электролитные нарушения при лечении диуретиками менее выражены, если вместе с диуретиками применять ингибиторы АПФ и антагонисты альдостерона. Возможное негативное влияние на углеводный и липидный обмен при терапии тиазидными диуретиками (в меньшей степени петлевыми диуретиками) для больных с ХСН имеет меньшее прогностически неблагоприятное значение, чем эти же изменения у пациентов с артериальной гипертензией.
Традиционно наиболее широко для лечения отёчного синдрома применяют фуросемид. Его стартовая доза обычно составляет 20-40 мг, но может быть и выше (до 500-1800 мг/сут). Длительность диуретического эффекта — 6-8 ч, поэтому при тяжёлом состоянии пациента рекомендуют двукратное (а в отдельных случаях и троекратное) применение фуросемида в течение суток.
Этакриновую кислоту используют для временного лечения пациентов при привыкании к фуросемиду и снижении его эффективности, а также при рефрактерном отёчном синдроме в дополнение к фуросемиду.
Наиболее сложная клиническая проблема при терапии ХСН диуретиками связана с развитием рефрактерности к ним. Выделяют раннюю (развивается в первые часы или дни после назначения диуретиков и обусловлена гиперактивацией РААС) и позднюю (развивается спустя недели и месяцы постоянной диуретической терапии) рефрактерность, которая связана с гипертрофией апикальных клеток почечных канальцев, где как раз и действуют диуретики. Бороться с этим видом рефрактерности сложнее. Требуется периодическая (раз в 3-4 недели) смена активных диуретиков и их комбинация с иАПФ. Для преодоления ранней рефрактерности необходима полноценная блокада РААС комбинацией ингибитора АПФ и спиронолактона. Для преодоления поздней рефрактерности можно использовать торасемид. Кроме того, у некоторых пациентов хороший результат даёт внутривенное введение удвоенной (по сравнению с предыдущей неэффективной дозой) дозы диуретика. При наличии гипоальбуминемии эффективность диуретиков повышается при введении альбумина. Очень важно обеспечить нормальное перфузионное давление. С этой целью можно использовать средства с положительным инотропным эффектом — добутамин и допамин.
В настоящее время в России зарегистрирован самый эффективный и безопасный петлевой диуретик — торасемид. Данный препарат — типичный петлевой диуретик, блокирующий реабсорбцию натрия и воды в восходящей части петли Генле, но по своим фармакокинетическим свойствам он лучше фуросемида, так как имеет лучшую всасываемость и биодоступность. При почечной недостаточности период полувыведения торасемида не изменяется, так как он на 80% метаболизируется в печени. Главное отличие торасемида от других петлевых диуретиков — его способность уменьшать активность РААС путём дозозависимой блокады (стимулированного ангиотензином II) входа кальция в клетки, а также с помощью антиальдостеронового действия. В сравнительных контролируемых исследованиях торасемид оказался гораздо эффективнее и безопаснее фуросемида. Более того, в исследовании T0RIC торасемид улучшал прогноз больных с ХСН. Данный препарат можно считать наиболее близким по своим свойствам к гипотетическому «идеальному диуретику» для лечения ХСН.
Ингибиторы карбоангидразы
Ингибиторы карбоангидразы для лечения ХСН практически не применяют из-за их слабого диуретического эффекта, однако эти препараты потенцируют эффективность более сильных диуретиков (путём усиления «загрузки» натрием нижележащих отделов канальцев).
Схема назначения одного из ингибиторов карбоангидразы — ацетазоламида: по 0,25 мг трижды в сутки в течение 3-4 сут с двухнедельным перерывом. Применение препарата по такой схеме позволяет восстановить диуретическую активность тиазидных и петлевых диуретиков, при длительном применении которых развивается алкалоз. Также известно, что применение ацетазоламида на ночь в дозе 0,25 мг позволяет уменьшить выраженность и частоту синдрома обструктивного ночного апноэ (СОНА) при ХСН.
Сердечные гликозиды
Сердечные гликозиды продолжают считать одними из основных средств для лечения ХСН, несмотря на то, что они не замедляют её прогрессирование и не улучшают прогноз. Однако препараты этой группы улучшают клиническую симптоматику и качество жизни, а также снижают частоту госпитализаций по поводу развития или усиления декомпенсации (причём как при мерцательной аритмии, так и при синусовом ритме).
В клинической практике используют три фармакодинамических эффекта сердечных гликозидов: положительный инотропный, отрицательный хронотропный и нейромодуляторный. Наиболее эффективно применение сердечных гликозидов у пациентов с низкой фракцией выброса (<25%), с выраженной кардиомегалией (кардиоторакальный индекс >55%) и при неишемической этиологии ХСН.
С позиций доказательной медицины в настоящее время для лечения ХСН допустимо использование только дигоксина, так как применение других гликозидов не имеет оснований. Парентеральное применение сердечных гликозидов ограничено только случаями декомпенсации ХСН на фоне тахисистолической формы мерцательной аритмии.
Положительный инотропный эффект сердечных гликозидов в полной мере реализуется только при применении высоких доз (для дигоксина ≥0,375 мг/сут), однако в таком случае очень высок риск развития интоксикации и ухудшения прогноза. Именно поэтому в настоящее время дигоксин при ХСН применяют в малых дозах (обычно <0,25 мг/сут), но при этом используют его нейромодуляторные свойства, а не положительный инотропный эффект. При таком режиме дозирования риск побочных эффектов минимален. У пожилых пациентов и у женщин суточные дозы дигоксина должны быть снижены до 0,0625-0,125 мг. Именно у этих групп пациентов чаще возникает интоксикация и развиваются смертельные осложнения (что обусловлено более высокими концентрациями гликозидов в крови у женщин и у пожилых пациентов по сравнению с мужчинами среднего возраста при приёме одинаковых доз). Кроме того, дигоксин необходимо с осторожностью применять при ИБС.
Сочетание сердечных гликозидов с β-адреноблокаторами считают одним из оптимальных, поскольку в этом случае можно лучше контролировать ЧСС, снизить риск опасных для жизни желудочковых аритмий и уменьшить опасность обострения коронарной недостаточности.
Блокаторы ангиотензиновых рецепторов I
Препараты этой группы, как и ингибиторы АПФ, блокируют РААС, однако их действие направлено на другой компонент этой системы. Таким образом, указанные препараты позволяют использовать ещё один механизм блокады РААС. В настоящее время принято считать, что по своей клинической эффективности при ХСН блокаторы ангиотензиновых рецепторов эквивалентны ингибиторам АПФ. Так, исследование CHARM продемонстрировало достоверное снижение риска смерти на 33% после первого года наблюдения, на 20% — после второго и на 12% — после третьего. Эти данные сопоставимы с результатами классического исследования ингибиторов АПФ — SOLVD (в котором было показано, что эналаприл снижает риск смерти на 23% через год, на 23% через два и на 16% через три года лечения). В исследованиях лозартана и валсартана было показано, что применение указанных препаратов может положительно повлиять на прогноз, снизить риск смерти (а также риск смерти и частоту повторных госпитализаций у декомпенсированных больных с ХСН).
В табл. 21-63 приведены данные о рекомендованных режимах применения блокаторов ангиотензиновых рецепторов при ХСН. Не случайно в ней приведены данные только по трём таким препаратам, так как остальные представители этого класса лекарственных препаратов не имеют достаточной доказательной базы для применения при ХСН (но не при артериальной гипертензии!).
Таблица 21-63. Показания к применению и дозировки блокаторов ангиотензиновых рецепторов, рекомендуемых для профилактики и лечения хронической сердечной недостаточности (приводится по рекомендациям Российского общества специалистов по сердечной недостаточности)
| Препарат | Показания | Стартовая доза | Терапевтическая доза | Максимальная доза |
|---|---|---|---|---|
|
Кандесартан |
ХСН I-IV функциональных классов, диаст. ХСН |
4 мгс×1 раз в сутки |
16 мгс×1 раз в сутки |
32 мгс×1 раз в сутки |
|
Валсартан |
ХСН II-IV функциональных классов, после инфаркта миокарда |
20 мг×2 раза в сутки |
80 мг×1 раз в сутки |
160 мг×1 раз в сутки |
|
Лозартан |
Непереносимость ингибиторов АПФ, профилактика ХСН |
25 мгс×1 раз в сутки |
50 мг×1 раз в сутки |
100 мг×1 раз в сутки |
В исследовании Val-HeFT была доказана способность валсартана в сочетании с ингибиторами АПФ уменьшать число госпитализаций больных с ХСН, однако при этом данных о положительном влиянии на прогноз получено не было.
Дальнейшие исследования подтвердили клиническую обоснованность комбинации блокаторов ангиотензиновых рецепторов и ингибиторов АПФ. Однако комбинацию ингибиторов АПФ с β-адреноблокаторами и блокаторами ангиотензиновых рецепторов нельзя считать оптимальной, так как она может приводить к гипотонии и даже повторной гиперактивации РААС.
Таким образом, блокаторы ангиотензиновых рецепторов можно назначать дополнительно к ингибиторам АПФ и вместо ингибиторов АПФ при их непереносимости у пациентов с ХСН.
ДОПОЛНИТЕЛЬНЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Статины
Два крупных проспективных исследования (CORONA, GISSI-HF), проводимых для доказательства возможности включения статинов в комплекс терапии больных с ХСН ишемической этиологии, ещё не завершены. Пока доказательства эффективности статинов в лечении больных с ишемической этиологией ХСН получены только в ретроспективных анализах контролируемых протоколов, в популяционных и когортных (случай-контроль) исследованиях. Однако современные данные позволяют предположить, что статины могут снижать риск развития ХСН и улучшать прогноз пациентов с декомпенсацией ХСН. Наиболее значимы для больных с ХСН не гиполипидемические, а плейотропные эффекты статинов. В первые 3 мес лечения статинами у больных ХСН необходим регулярный контроль активности печёночных трансаминаз и креатинфосфокиназы. При повышении активности АСТ и АЛТ более чем в 3 раза или креатинфосфокиназы в 10 раз выше нормы, а также при появлении мышечных болей приём статинов необходимо немедленно прекратить. Учитывая частую сопутствующую ХСН патологию печени, следует избегать высоких доз статинов. При наличии кардиального цирроза применение статинов необходимо прекратить.
Антитромботические средства
При ХСН часто повышен риск тромбоэмболий, поэтому в таких случаях показаны антикоагулянты.
По современным данным, наиболее безопасно применение низкомолекулярных гепаринов. Их используют для предотвращения тромбозов и эмболий у пациентов с ХСН, находящихся на постельном режиме (эноксапарин натрия по 40 мг/сут в течение 2-3 нед).
Непрямые антикоагулянты (аценокумарол, варфарин) обязательны для применения у больных с мерцательной аритмией и повышенным риском тромбоэмболий. Для уменьшения риска геморрагических осложнений антикоагулянты необходимо применять при тщательном контроле (1 раз в месяц) МНО. Доказательств эффективности антикоагулянтов у больных с ХСН и синусовым ритмом в настоящее время нет.
ДРУГИЕ ПРЕПАРАТЫ, ПРИМЕНЯЕМЫЕ У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
Пациентам с ХСН (особенно при декомпенсации) нужно все лекарственные препараты назначать крайне осторожно. В частности, это касается НПВС (селективных и неселективных, в том числе дозы аспирина >325 мг), глюкокортикоидов, трициклических антидепрессантов, антиаритмических средств I класса и антагонистов кальция (верапамил, дилтиазем, дигидроперидины короткого действия), метформина, тиаглитазонов.
Для России очень актуально выделение группы препаратов, не рекомендованных (!) к применению при ХСН, но, несмотря на это, всё же используемых для её лечения (триметазидин, таурин, карнитин, коэнзим композитум* и милдронат*).
МЕТОДЫ КОНТРОЛЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
В условиях клинической практики кроме обычного клинико-лабораторного контроля состояния пациента с ХСН необходим контроль величины фракции выброса (с помощью эхокардиографии) и переносимости физических нагрузок (6-минутный тест с ходьбой). Последний метод отличается доступностью и низкой стоимостью. Техника выполнения теста проста: необходимо измерить дистанцию, которую в состоянии пройти пациент в течение 6 мин (при этом темп ходьбы и количество остановок регулирует сам пациент). Оценка этого показателя при каждом визите пациента к врачу даёт абсолютно объективную информацию об эффективности фармакотерапии ХСН.
Данные о соответствии пройденной дистанции тяжести ХСН представлены в табл. 21-64.
Таблица 21-64. Соотношение тяжести хронической сердечной недостаточности и пройденной дистанции во время 6-минутного теста с ходьбой
| Выраженность ХСН | Дистанция, пройденная за 6 мин, м |
|---|---|
|
Нет ХСН |
≥551 |
|
I функциональный класс ХСН |
426-550 |
|
II функциональный класс ХСН |
301-425 |
|
III функциональный класс ХСН |
151-300 |
|
IV функциональный класс ХСН |
≤150 |
СПИСОК ЛИТЕРАТУРЫ
Агеев Ф.Т., Даниелян М.О., Мареев В.Ю. и др. Больные с хронической сердечной недостаточностью в российской амбулаторной практике: особенности контингента, диагностики и лечения (по материалам исследования ЭПОХА-О-ХСН) // Сердечная недостаточность. — 2004. — № 5 (1). — С. 4-7.
Даниелян М.О. Прогноз и лечение хронической сердечной недостаточности (данные 20-тилетнего наблюдения): Автореф. дис. … канд. мед. наук. — Москва, 2001.
Мареев В.Ю., Даниелян М.О., Беленков Ю.Н. От имени рабочей группы исследования ЭПОХА-О-ХСН. Сравнительная характеристика больных с ХСН в зависимости от величины ФВ по результатам Российского многоцентрового исследования ЭПОХА-О-ХСН // Сердечная недостаточность. — 2006. — Vol. 7 (4). — P. 164-171.
Национальные рекомендации по диагностике и лечению ХСН (Утверждены съездом кардиологов РФ в октябре 2003 г.) // Там же. — 2003. — № 4 (6). — С. 276-297.
ACC / AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult A Report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines (writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure) // http:www.acc.org/qualityandscience/clinical/guidelines/failure/update/index.pdf.
Cleland J.G., Swedberg K., Follath F. et al. The EuroHeart Failure survey programme a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis // Eur. Heart J. — 2003. — Vol. 24 (5). — P. 442-463.
Guidelines for the diagnosis and treatment of Chronic Heart Failure: full text The Task Force for the diagnosis and treatment of CHF of the European Society of Cardiology // Eur. Heart J. — 2005. — Vol. 26 (22). — 2472 p.
HFSA 2006 Comprehensive Heart Failure Practice Guideline // J. of Cardiac Failure. — 2006. — Vol. 12. — e1-e122.
Hogg K., Swedberg K., McMurray J. Heart Failure with preserved left ventricular systolic function. Epidemiology, Clinical Characteristics, and Prognosis // J. Am. Coll. Cardiol. — 2004. — Vol. 43 (3). — P. 317-327.
Owan T.E., Hodge D.O., Herges R.M. et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction // N. Engl. J. Med. — 2006. — Vol. 355 (3). — P. 251-259.
Нарушения ритма сердца
Полноценное лечение желудочковых аритмий (желудочковой экстрасистолии, неустойчивой желудочковой тахикардии, устойчивой мономорфной или полиморфной желудочковой тахикардии, фибрилляции желудочков) требует понимания механизмов развития и этиологии нарушений ритма, оценки сопутствующих заболеваний (состояний), которые могут вносить вклад в развитие или провоцирование аритмии, риска, обусловленного аритмией, и соотношения «польза-риск» планируемого антиаритмического лечения.
Основной механизм развития желудочковых аритмий у пациентов со структурными поражениями сердца — повторный вход и циркуляция возбуждения. Круги циркуляции импульса, как правило, формируются в пограничных зонах между нормальной и патологически изменённой тканью в миокарде желудочков.
Триггерная активность — основной механизм развития нарушений ритма у пациентов без органического поражения миокарда (синдромы удлинённого Q-T, катехолзависимая полиморфная желудочковая тахикардия, идиопатическая желудочковая тахикардия из выносящего тракта правого желудочка).
Желудочковые аритмии при острой ишемии миокарда и, возможно, идиопатическая левожелудочковая тахикардия могут быть обусловлены наличием патологического автоматизма.
Желудочковая экстрасистолия и неустойчивая желудочковая тахикардия у пациентов без органических заболеваний сердца не связаны с повышенным риском внезапной сердечной смерти и при отсутствии симптомов не требуют лечения. Лечение показано только при наличии выраженных симптомов, существенно снижающих качество жизни. При этом к препаратам выбора относят β-адреноблокаторы; при их неэффективности возможно использование амиодарона, соталола или флекаинидаP.
Основной задачей лечения желудочковых нарушений ритма у пациентов с органическими заболеваниями сердца, а также при генетически детерминированных электрических аномалиях (синдромы удлинённого Q-T) считают снижение риска внезапной сердечной смерти, в основном, обусловленной фатальной желудочковой тахикардией/фибрилляцией желудочков. Первичная профилактика включает методы лечения, направленные на предотвращение фатальных аритмических эпизодов у пациентов без желудочковых аритмий и внезапной сердечной смерти в анамнезе, но имеющих признаки высокого риска. Вторичную профилактику используют у пациентов, перенёсших эпизод желудочковой тахикардии или внезапной сердечной смерти.
Ведение пациентов с желудочковыми нарушениями ритма включает применение антиаритмических препаратов, имплантируемых устройств (имплантируемого кардиовертера/дефибриллятора), различных вариантов абляции и хирургических вмешательств.
Основу фармакотерапии желудочковых аритмий составляют β-адреноблокаторы. Препараты данной группы эффективно подавляют желудочковые нарушения ритма и снижают риск внезапной сердечной смерти как у пациентов с органическими поражениями сердца, так и при отсутствии структурных изменений миокарда. Данные об эффективности амиодарона противоречивы, хотя существуют доказательства подавления желудочковых нарушений ритма и снижения риска внезапной сердечной смерти у пациентов с дилатационной кардиомиопатией и перенесённым инфарктом миокарда. Длительное использование амиодарона может быть ограничено выраженной системной токсичностью. Другие антиаритмические препараты оказались малоэффективными для профилактики внезапной сердечной смерти и увеличения выживаемости. Доступные в настоящее время антиаритмические препараты используют в определённых клинических ситуациях, чаще всего для неотложной терапии желудочковых нарушений ритма, однако их следует применять с осторожностью в связи с риском развития проаритмий.
Для профилактики внезапной сердечной смерти у пациентов с органическим поражением сердца также эффективны ЛС, не обладающие антиаритмической активностью. Эти препараты способны влиять на процессы, определяющие формирование субстрата для развития желудочковых аритмий — ишемию и патологическое ремоделирование миокарда желудочков. Так, способность снижать риск внезапной сердечной смерти доказана для дезагрегантов, статинов, ингибиторов АПФ, блокаторов альдостероновых рецепторов.
Ниже представлены рекомендации по использованию антиаритмических препаратов для неотложной терапии желудочковых аритмий (табл. 21-65).
Таблица 21-65. Применение антиаритмических препаратов для неотложной терапии желудочковых аритмий
| Состояния (заболевания) | Класс рекомендаций | Уровень доказательности |
|---|---|---|
|
Желудочковые аритмии у пациентов с острым инфарктом миокарда и острым коронарным синдромом |
||
|
Резистентная желудочковая тахикардия/фибрилляции желудочков |
||
|
Амиодарон 300 мг внутривенно болюсно в дополнение к электроимпульсной терапии |
IIA |
В |
|
Прокаинамид болюс внутривенно в дополнение к электроимпульсной терапии |
IB |
C |
|
Устойчивая желудочковая тахикардия без гемодинамических нарушений и/или гипотонии |
||
|
Амиодарон, повторные болюсы 150 мг внутривенно до кумулятивной дозы 2,2 г/сут |
I |
В |
|
Прокаинамид болюс внутривенно |
IIB |
C |
|
Лидокаин внутривенно |
IIB |
C |
|
Неустойчивая желудочковая тахикардия, желудочковая экстрасистолия |
||
|
Профилактическое использование β-адреноблокаторов |
I |
А |
|
Профилактическое использование антиаритмических препаратов для подавления желудочковой экстрасистолии и неустойчивой желудочковой тахикардии |
III |
В |
|
Непрерывно рецидивирующая желудочковая тахикардия |
||
|
Прокаинамид или амиодарон внутривенно с последующим назначением β-адреноблокаторов |
I |
C |
|
Полиморфная желудочковая тахикардия |
||
|
Лидокаин внутривенно |
IIB |
C |
|
Желудочковые аритмии, не ассоциированные с острым инфарктом миокарда |
||
|
Остановка сердца, обусловленная резистентной желудочковой тахикардией/фибрилляцией желудочков |
||
|
Амиодарон в дополнение к электроимпульсной терапии при её неэффективности |
I |
B |
|
Устойчивая мономорфная желудочковая тахикардия |
||
|
Прокаинамид внутривенно |
IIA |
B |
|
Амиодарон внутривенно (при наличии гемодинамической нестабильности или резистентности к другим антиаритмическим препаратам и электроимпульсной терапии) |
IIA |
C |
|
Лидокаин внутривенно |
IIB |
C |
|
Рецидивирующая мономорфная желудочковая тахикардия |
||
|
Амиодарон внутривенно |
IIA |
С |
|
β-Адреноблокаторы внутривенно |
IIA |
С |
|
Прокаинамид внутривенно |
IIA |
С |
|
Соталол внутривенно |
IIA |
С |
|
Аймалин внутривенно |
IIA |
С |
|
Полиморфная желудочковая тахикардия |
||
|
β-Адреноблокаторы внутривенно |
I |
B |
|
Амиодарон внутривенно (при отсутствии врождённого или приобретённого удлинения Q-T) |
I |
C |
|
Лидокаин внутривенно |
IIB |
C |
|
Желудочковая тахикардия типа «пируэт» |
||
|
Магния сульфат (при синдроме удлинённого Q-T) |
I |
B |
|
β-Адреноблокаторы внутривенно в сочетании с временным пейсмекером |
I |
B |
|
Инфузия изопротеренолар (при отсутствии врождённого удлинения Q-T) |
I |
В |
|
Лидокаин внутривенно |
IIB |
C |
|
Мексилетинр внутрь (у пациентов с синдромом LQ-T3) |
IIB |
С |
|
Непрерывно рецидивирующая желудочковая тахикардия |
||
|
β-Адреноблокаторы и/или амиодарон внутривенно и/или учащающая желудочковая стимуляция |
IIB |
C |
Градации рекомендаций: класс I — существуют доказательства или общее мнение экспертов о полезности/эффективности метода лечения; класс II — есть противоречивые свидетельства или расхождения мнений экспертов о полезности/эффективности метода лечения; класс IIA — превалируют доказательства/мнения в пользу полезности/эффективности; класс IIB — недостаточно данных для обоснования полезности/эффективности; класс III — существуют доказательства или общее мнение экспертов о неэффективности/бесполезности метода лечения.
Уровни доказательности: A- данные получены из нескольких рандомизированных исследований или метаанализа; B — данные получены из одного рандомизированного или нерандомизированных исследований; С — согласованная точка зрения экспертов или описательные исследования.
В табл. 21-66 представлены рекомендации по лечению желудочковых аритмий у пациентов с наиболее распространёнными заболеваниями сердца.
Таблица 21-66. Применение антиаритмических препаратов для длительного лечения желудочковых нарушений ритма
| Состояния (заболевания) | Класс рекомендаций | Уровень доказательности |
|---|---|---|
|
Первичная профилактика внезапной сердечной смерти у пациентов, перенёсших инфаркт миокарда |
||
|
β-Адреноблокаторы (в том числе при наличии ХСН) |
I |
А |
|
Ингибиторы АПФ (в том числе при наличии ХСН) |
I |
В |
|
Блокаторы альдостероновых рецепторов (при наличии ХСН) |
I |
В |
|
Статины |
I |
А |
|
Амиодарон (в том числе при наличии ХСН) |
IIA |
A |
|
Антиаритмические препараты I класса, соталол, дофетилидр |
III |
А-В |
|
Пациенты, перенёсшие инфаркт миокарда и реанимационные мероприятия по поводу желудочковой тахикардии/фибрилляции желудочков или имеющие эпизоды желудочковой тахикардии |
||
|
β-Адреноблокаторы |
IIA |
C |
|
Амиодарон |
IIA |
С |
|
Амиодарон + β-адреноблокаторы при рецидивах желудочковой тахикардии на фоне лечения β-адреноблокаторами |
IIA |
В |
|
Соталол для устранения симптомов при рецидивах желудочковой тахикардии на фоне лечения β-адреноблокаторами |
IIA |
C |
|
Антиаритмические препараты I, III и IV классов |
III |
С |
|
Лечение желудочковых аритмий и профилактика внезапной сердечной смерти у пациентов с дилатационной кардиомиопатией |
||
|
β-Адреноблокаторы |
I |
B |
|
Ингибиторы АПФ |
I |
B |
|
Блокаторы альдостероновых рецепторов |
IIA |
B |
|
Амиодарон у пациентов с желудочковой тахикардией/фибрилляцией желудочков |
IIB |
B |
|
Лечение желудочковых аритмий и профилактика внезапной сердечной смерти у пациентов с гипертрофической кардиомиопатией |
||
|
Амиодарон для первичной профилактики внезапной сердечной смерти |
IIB |
B |
|
β-Адреноблокаторы для первичной профилактики внезапной сердечной смерти |
III |
C |
|
Верапамил для первичной профилактики внезапной сердечной смерти |
III |
С |
|
Амиодарон у пациентов с желудочковой тахикардией/фибрилляцией желудочков в анамнезе при отсутствии возможности имплантации кардиовертера/дефибриллятора |
IIA |
C |
|
Лечение желудочковых аритмий и профилактика внезапной сердечной смерти у пациентов с аритмогенной дисплазией правого желудочка |
||
|
Амиодарон или соталол для лечения устойчивой желудочковой тахикардии/фибрилляции желудочков при невозможности имплантации кардиовертера/дефибриллятора |
IIA |
C |
|
Антиаритмические препараты (соталол) для первичной профилактики внезапной сердечной смерти |
IIB |
C |
|
Антиаритмические препараты для вторичной профилактики внезапной сердечной смерти |
III |
C |
|
Лечение желудочковых аритмий и профилактика внезапной сердечной смерти при синдромах удлинённого Q-T |
||
|
Модификация образа жизни (отказ от видов деятельности, связанных с интенсивными физическими нагрузками) |
IIA |
B-C |
|
Запрет приёма препаратов, удлиняющих Q-T или снижающих уровень калия |
I-IIA |
C |
|
β-Адреноблокаторы при наличии симптомов желудочковых аритмий |
I |
B |
|
β-Адреноблокаторы у бессимптомных пациентов |
IIA |
C |
|
β-Адреноблокаторы + имплантируемый кардиовертер/дефибриллятор при рецидивах желудочковых аритмий на фоне лечения β-адреноблокаторами или для вторичной профилактики после эпизода желудочковой тахикардии/фибрилляции желудочков |
I-IIA |
C |
|
Лечение катехоламинергической полиморфной желудочковой тахикардии |
||
|
β-Адреноблокаторы для первичной профилактики внезапной сердечной смерти |
I |
C |
|
β-Адреноблокаторы + имплантируемый кардиовертер/дефибриллятор для вторичной профилактики внезапной сердечной смерти |
I |
C |
|
β-Адреноблокаторы для вторичной профилактики |
IIA |
C |
|
Желудочковые аритмии у пациентов без органического поражения миокарда (идиопатическая левожелудочковая тахикардия или желудочковая тахикардия из выносящего тракта правого желудочка) |
||
|
β-Адреноблокаторы |
IIA |
C |
|
Блокаторы медленных кальциевых каналов |
IIA |
C |
|
Препараты IC класса для лечения желудочковой тахикардии из выносящего тракта правого желудочка |
IIA |
C |
В отличие от желудочковых нарушений ритма, суправентрикулярные аритмии (суправентрикулярная экстрасистолия, синоатриальная реципрокная тахикардия, атриовентрикулярная узловая реципрокная тахикардия, реципрокная тахикардия с участием дополнительных путей проведения, предсердная очаговая тахикардия и многофокусная предсердная тахикардия, эктопическая атриовентрикулярная узловая тахикардия) в подавляющем большинстве случаев не представляют угрозы для жизни. Значение суправентрикулярных аритмий определяется их достаточно широкой распространённостью, наличием симптомов, требующих экстренной госпитализации, а также снижением качества жизни в результате ограничения физической активности или развития симптомов сердечной недостаточности.
К наиболее значимым механизмам развития реципрокных суправентрикулярных аритмий относят повторный вход и циркуляцию возбуждения. Наиболее вероятный механизм развития очаговых суправентрикулярных аритмий — патологический автоматизм.
В большинстве случаев основной задачей лечения суправентрикулярных аритмий считают улучшение качества жизни пациента. Бессимптомная ПЭ не требует коррекции. Лечение показано только при наличии выраженных симптомов, существенно снижающих качество жизни. При этом к препаратам выбора относят β-адреноблокаторы или блокаторы медленных кальциевых каналов, при их неэффективности можно использовать амиодарон, соталол или флекаинид*. Лечение суправентрикулярных аритмий предусматривает купирование пароксизма и применение профилактической антиаритмической терапии для предотвращения рецидивов.
Основу современного лечения суправентрикулярных нарушений ритма составляют антиаритмические препараты различных классов и многочисленные варианты абляции. В качестве препаратов первого ряда, как правило, используют ЛС с низким аритмогенным потенциалом и низкой системной токсичностью — β-адреноблокаторы и блокаторы медленных кальциевых каналов.
Ниже представлены рекомендации по использованию антиаритмических препаратов для неотложной терапии суправентрикулярной тахикардии (табл. 21-67).
Таблица 21-67. Применение антиаритмических препаратов для неотложной терапии суправентрикулярных аритмий
| Состояния (заболевания) | Класс рекомендаций | Уровень доказательности |
|---|---|---|
|
Тахикардия с суправентрикулярными комплексами (с узкими комплексами QRS) |
||
|
Вагусные приёмы |
I |
В |
|
Аденозин |
I |
А |
|
Верапамил, дилтиазем |
I |
А |
|
β-Адреноблокаторы |
IIB |
C |
|
Амиодарон |
IIB |
C |
|
Дигоксин |
IIB |
C |
|
Суправентрикулярная тахикардия с широкими комплексами QRS (суправентрикулярная тахикардия + блокада правой ножки пучка Гиса), суправентрикулярная тахикардия с проведением по дополнительным путям проведения |
||
|
Все вышеперечисленные препараты |
||
|
Суправентрикулярная тахикардия с широкими комплексами QRS (суправентрикулярная тахикардия с проведением по дополнительным путям проведения) |
||
|
Флекаинидр |
I |
B |
|
Ибутилидр |
I |
B |
|
Прокаинамид |
I |
B |
|
Тахикардия неуточнённого происхождения с широкими комплексами QRS |
||
|
Прокаинамид |
I |
B |
|
Соталол |
I |
B |
|
Амиодарон (в том числе у пациентов с дисфункцией левого желудочка) |
I |
В |
|
Лидокаин |
IIB |
B |
|
β-Адреноблокаторы |
III |
C |
|
Верапамил |
III |
B |
Примечание. На стандартной ЭКГ в 12 отведениях суправентрикулярная тахикардия может проявляться как в виде регулярной тахикардии с узкими (суправентрикулярными) комплексами, так и в виде регулярной тахикардии с широкими комплексами QRS. Регулярная тахикардия с широкими комплексами QRS может быть суправентрикулярной (при наличии блокады правой ножки пучка Гиса или дополнительных путей проведения) или желудочковой. В ряде случаев установление источника тахикардии не представляется возможным и её рассматривают как тахикардию неизвестного происхождения с широкими комплексами QRS.
В табл. 21-68 представлены рекомендации по лечению отдельных форм суправентрикулярной тахикардии.
Фибрилляция и трепетание предсердий — широко распространённые нарушения ритма. Фибрилляция предсердий ассоциируется с повышенным риском сердечно-сосудистых осложнений. Частично это может быть обусловлено тяжестью фоновых (сопутствующих) заболеваний. Основные задачи лечения фибрилляции предсердий — профилактика системных эмболических осложнений, предупреждение гемодинамических нарушений, вызываемых неадекватно высокой ЧСС, и контроль симптомов
В настоящее время существуют две тактики лечения фибрилляции предсердий — восстановление и поддержание синусового ритма (тактика контроля ритма) и сохранение фибрилляции предсердий с контролем частоты желудочковых сокращений (тактика контроля ЧСС). Проведённые исследования показали, что контроль ритма не имеет преимуществ перед контролем ЧСС с точки зрения снижения риска сердечно-сосудистых осложнений и смерти. Более того, для некоторых групп тактика контроля ЧСС, по-видимому, предпочтительна, например для пожилых пациентов с артериальной гипертензией и другими сердечно-сосудистыми заболеваниями в качестве начальной терапии. Для молодых пациентов, особенно с идиопатической фибрилляцией предсердий, показано восстановление и поддержание синусового ритма.
Таблица 21-68. Применение антиаритмических препаратов для лечения суправентрикулярных аритмий
| Состояния (заболевания) | Класс рекомендаций | Уровень доказательности |
|---|---|---|
|
Пароксизмальная синоатриальная реципрокная тахикардия* |
||
|
Вагусные приёмы |
— |
С |
|
β-Адреноблокаторы |
— |
С |
|
Верапамил, дилтиазем |
— |
С |
|
Амиодарон |
— |
С |
|
Дигоксин |
— |
С |
|
Предсердная очаговая тахикардия |
||
|
Предсердная очаговая тахикардия, купирование при наличии гемодинамической нестабильности |
||
|
Кардиоверсия |
I |
А |
|
Купирование гемодинамически стабильной предсердной очаговой тахикардии |
||
|
Аденозин |
IIA |
С |
|
Верапамил, дилтиазем |
IIA |
С |
|
β-Адреноблокаторы |
IIA |
С |
|
Прокаинамид |
IIA |
С |
|
Флекаинидр, пропафенон |
IIA |
С |
|
Амиодарон, соталол |
IIA |
С |
|
Рецидивирующая предсердная очаговая тахикардия с наличием симптомов, профилактическое лечение |
||
|
Катетерная абляция |
I |
B |
|
Верапамил, дилтиазем |
I |
C |
|
β-Адреноблокаторы |
I |
C |
|
Дизопирамид |
IIA |
C |
|
Флекаинидр, пропафенон |
IIA |
C |
|
Соталол, амиодарон |
IIA |
C |
|
Пароксизмальная атриовентрикулярная узловая реципрокная тахикардия |
||
|
Атриовентрикулярная узловая реципрокная тахикардия с гемодинамической нестабильностью |
||
|
Катетерная абляция |
I |
В |
|
β-Адреноблокаторы |
IIA |
C |
|
Верапамил, дилтиазем |
IIA |
C |
|
Амиодарон |
IIA |
C |
|
Пропафенон |
IIA |
C |
|
Флекаинидр |
IIA |
C |
|
Рецидивирующая атриовентрикулярная узловая реципрокная тахикардия с наличием симптомов |
||
|
Катетерная абляция |
I |
B |
|
β-Адреноблокаторы |
I |
C |
|
Верапамил, дилтиазем |
I |
B |
|
Дигоксин |
IIB |
B |
|
Рецидивирующая атриовентрикулярная узловая реципрокная тахикардия, резистентная к терапии β-адреноблокаторами и верапамилом, не предусматривающая проведение катетерной абляции |
||
|
Пропафенон |
IIA |
B |
|
Соталол |
IIA |
B |
|
Флекаинид^ |
IIA |
B |
|
Амиодарон |
IIB |
C |
|
Нечастая, хорошо переносимая атриовентрикулярная узловая реципрокная тахикардия |
||
|
Отсутствие профилактической антиаритмической терапии |
I |
B |
|
Вагусные приёмы |
I |
C |
|
Применение антиаритмических препаратов по требованию (только для купирования пароксизмов) |
I |
B |
|
β-Адреноблокаторы |
I |
B |
|
Верапамил, дилтиазем |
I |
B |
|
Катетерная абляция |
I |
B |
|
Атриовентрикулярная узловая реципрокная тахикардия у пациентов с дополнительными путями проведения |
||
|
Гемодинамически стабильная, хорошо переносимая атриовентрикулярная узловая реципрокная тахикардия или с наличием плохо переносимых симптомов |
||
|
Катетерная абляция |
I |
B |
|
Пропафенон |
IIA |
C |
|
Соталол |
IIA |
C |
|
Флекаинид^ |
IIA |
C |
|
Амиодарон |
IIA |
C |
|
β-Адреноблокаторы |
IIA |
C |
|
Верапамил, дилтиазем, дигоксин |
III |
C |
|
Эктопическая атриовентрикулярная узловая тахикардия |
||
|
β-Адреноблокаторы |
IIA |
C |
|
Флекаинид^ |
IIA |
C |
|
Пропафенон |
IIA |
C |
|
Соталол |
IIA |
C |
|
Амиодарон |
IIA |
C |
|
Катетерная абляция |
IIA |
C |
* Контролируемых клинических исследований нет, в связи с чем определить уровень рекомендаций затруднительно.
В табл. 21-69 представлены рекомендации по фармакологической кардиоверсии фибрилляции предсердий.
Рекомендации по выбору антиаритмического препарата для поддержания синусового ритма при рецидивирующей пароксизмальной или персистирующей фибрилляции предсердий представлены в табл. 21-70.
Рекомендации по контролю ЧСС представлены в табл. 21-71.
Таблица 21-69. Рекомендации по фармакологической кардиоверсии фибрилляции предсердий
| Состояния (заболевания) | Класс рекомендаций | Уровень доказательности |
|---|---|---|
|
Эпизод фибрилляции предсердий длительностью до 7 сут |
||
|
Дофетилидр, внутрь |
I |
А |
|
Флекаинидр, внутрь или внутривенно |
I |
A |
|
Ибутилидр, внутривенно |
I |
A |
|
Пропафенон, внутрь или внутривенно |
I |
А |
|
Амиодарон, внутрь или внутривенно |
IIA |
A |
|
Дизопирамид,внутривенно |
IIB |
B |
|
Сотатол, внутривенно или внутрь |
III |
А |
|
Эпизод фибрилляции предсердий длительностью более 7 сут |
||
|
Дофетилидр, внутрь |
I |
A |
|
Амиодарон, внутрь или внутривенно |
IIA |
A |
|
Ибутилидр, внутривенно |
IIA |
A |
|
Дизопирамид (внутривенно), прокаинамид (внутривенно), хинидин (внутрь) |
IIB |
В-С |
|
Пропафенон, внутрь или внутривенно |
IIB |
B |
|
Сотатол (внутривенно или внутрь) |
III |
В |
Таблица 21-70. Рекомендации по выбору антиаритмического препарата для поддержания синусового ритма
| Состояния (заболевания) | Препараты выбора | Препараты резерва |
|---|---|---|
|
Идиопатическая фибрилляция предсердий |
Пропафенон |
Амиодарон |
|
Фибрилляция предсердий у пациентов с артериальной гипертензией без выраженной гипертрофии левого желудочка |
Пропафенон |
Амиодарон |
|
Фибрилляция предсердий у пациентов с артериальной гипертензией с выраженной гипертрофией левого желудочка |
Амиодарон |
— |
|
Фибрилляция предсердий у пациентов с ИБС |
Дофетилидр |
Амиодарон |
|
Фибрилляция предсердий у пациентов с ХСН |
Амиодарон |
— |
Таблица 21-71. Рекомендации по контролю частоты сердечных сокращений у пациентов с фибрилляцией предсердий
| Состояния (заболевания) | Класс рекомендаций | Уровень доказательности |
|---|---|---|
|
Контроль ЧСС в экстренных ситуациях |
||
|
Пациенты без дополнительных путей проведения |
||
|
β -Адреноблокаторы внутривенно — пропранолол, эсмололр, метопролол |
I |
С |
|
Блокаторы медленных кальциевых каналов внутривенно — верапамил, дилтиазем |
I |
В |
|
Пациенты с ХСН |
||
|
Дигоксин внутривенно |
I |
B |
|
Амиодарон внутривенно |
IIA |
C |
|
Пациенты с наличием дополнительных путей проведения |
||
|
Амиодарон внутривенно |
IIA |
C |
|
Длительный контроль ЧСС |
||
|
β-Адреноблокаторы внутрь (метопролол, пропранолол, атенолол, бисопролол, карведилол) |
I |
C |
|
Дилтиазем, верапамил внутрь |
I |
В |
|
Длительный контроль ритма у пациентов с ХСН |
||
|
Дигоксин внутрь |
I |
С |
|
β-Адреноблокаторы (метопролол, бисопролол, карведилол) внутрь |
I |
C |
|
β-Адреноблокаторы + дигоксин |
I |
C |
|
Амиодарон внутрь |
IIB |
C |
Ишемический инсульт и транзиторные ишемические атаки
ПЕРВИЧНАЯ ПРОФИЛАКТИКА
Первичная профилактика инсульта сводится к устранению или ослаблению влияния модифицируемых факторов риска, к основным из которых относится артериальная гипертензия, фибрилляция предсердий, гиперхолестеринемия, курение. Помимо общих мероприятий, направленных на нормализацию образа жизни (отказ от курения, адекватная физическая нагрузка, диетические рекомендации для нормализации массы тела и ограничения употребления богатых холестерином продуктов и др.), важное значение имеет лекарственная профилактика, в первую очередь антигипертензивная терапия. Кроме того, некоторым категориям пациентов показаны антиагреганты, антикоагулянты и гиполипидемические средства (статины).
Антигипертензивные препараты
Артериальная гипертензия (АГ) — один из наиболее частых и практически важных факторов риска цереброваскулярной патологии. Значимым в плане повышения риска инсульта считают любое повышение АД выше оптимального (110-120/70-80 мм рт.ст.). Адекватная терапия артериальной гипертензии позволяет снизить риск развития инсульта приблизительно на 40%. Подбор лекарственных препаратов проводят в индивидуальном порядке, учитывая возраст пациента, сопутствующие заболевания, переносимость и другие факторы (см. Российские рекомендации «Профилактика, диагностика и лечение артериальной гипертензии», второй пересмотр, М., 2004). Тем не менее существуют данные о том, что угнетение активности ренин-ангиотензиновой системы оказывает дополнительный эффект на снижение риска инсульта (не связанный со снижением АД). С учётом этого препаратами выбора следует считать ингибиторы АПФ, а также блокаторы ангиотензиновых рецепторов (например, эпросартан). Обычные дозы ингибиторов АПФ: эналаприл — 2,5-5 мг/сут, затем дозу увеличивают до 10-20 мг/сут; периндоприл — 2 мг/сут, затем дозу увеличивают до 4-8 мг/сут; рамиприл -1,25 мг/сут, затем дозу увеличивают до 5 мг/сут.
Антиагреганты
Доказан положительный эффект ацетилсалициловой кислоты для предотвращения инфаркта миокарда, однако в плане первичной профилактики инсульта её роль окончательно не установлена и рутинное назначение с этой целью не рекомендуется. Возможно, терапия ацетилсалициловой кислотой (1 мг/кг) оправдана у женщин с высоким риском цереброваскулярной патологии (старше 65 лет, с артериальной гипертензией, сахарным диабетом, гиперлипидемией). Кроме того, ацетилсалициловая кислота показана для первичной профилактики инсульта у пациентов с асимптомным каротидным стенозом (при отсутствии показаний к оперативному лечению), а также некоторым пациентам с фибрилляцией предсердий (см. следующий раздел).
Непрямые антикоагулянты
Для профилактики кардиоэмболии у пациентов с фибрилляцией предсердий на фоне клапанной патологии сердца (особенно при наличии механического протеза клапана) показан варфарин. Пациентам с фибрилляцией предсердий неклапанной этиологии варфарин назначают при высоком и умеренном риске развития инсульта (табл. 21-72). Начальная доза варфарина — 2,5 мг, в дальнейшем её титруют для достижения целевого МНО (обычно 2-3, у пациентов старше 75 лет — 1,6-2,5). Необходим периодический контроль протромбинового времени/МНО (обычно каждые 2-4 нед). Пациентам с низким риском инсульта, а также при невозможности назначения варфарина (плохая приверженность к лечению, высокий риск кровотечения, невозможность регулярного определения МНО) назначают ацетилсалициловую кислоту в дозе 325 мг.
Таблица 21-72. Стратификация риска больных фибрилляцией предсердий
| Категория риска Характеристика пациента | Высокий | Умеренный | Низкий |
|---|---|---|---|
|
Систолическое АД выше 160 мм рт.ст. Дисфункция левого желудочка Инсульт или транзиторная ишемическая атака в анамнезе Женщины старше 75 лет |
Умеренная артериальная гипертензия без факторов риска в анамнезе |
Отсутствие факторов риска или артериальной гипертензии в анамнезе |
|
|
Риск развития инсульта в течение 1 года |
8% |
3,5% |
1% |
Статины
Терапия статинами (например, симвастатин 20 мг/сут, аторвастатин 10 мг/сут длительно) показана при наличии у пациента ишемической болезни сердца (ИБС), атеросклеротических поражений периферических артерий, сахарного диабета, а также артериальной гипертензии с высоким риском сердечно-сосудистых осложнений [три и более следующих факторов риска: мужской пол, возраст 55 лет и старше, поражение почек (микроальбуминурия или протеинурия), отклонения на ЭКГ, курение, семейный анамнез ИБС, концентрация холестерина в крови 6 ммоль/л и выше]; это позволяет снизить риск инсульта приблизительно на 30%.
ЛЕЧЕНИЕ И ВТОРИЧНАЯ ПРОФИЛАКТИКА
Лечение ишемического инсульта включает поддержание жизненно важных функций, ограничение размера ишемического поражения (в период «терапевтического окна»), предупреждение и купирование осложнений, вторичную профилактику, реабилитационные мероприятия и симптоматическую терапию. В острейшем и остром периоде лечение проводят в стационарных условиях, лучше всего — в специализированном ангионеврологическом отделении многопрофильного стационара, в котором реализован мультидисциплинарный подход к ведению больного.
Тромболитическая терапия
В течение первых 3 ч от развития ишемического инсульта, при наличии соответствующих технических и организационных условий (обученный персонал, разработанный протокол, возможность проведения экстренной КТ и др.), следует решить вопрос о целесообразности тромболитической терапии. Последняя эффективна при всех подтипах ишемического инсульта и позволяет увеличить количество благоприятных исходов ишемического инсульта (полное функциональное восстановление) с 35 до 50%. Проведение тромболитической терапии возможно при соблюдении следующих условий.
-
Наличие информированного согласия пациента.
-
Возраст пациента 18 лет и старше.
-
Подтверждённый диагноз ишемического инсульта.
-
Период времени от появления симптоматики до начала тромболитической терапии не более 3 ч.
-
Наличие у пациента очевидного неврологического дефицита.
Для тромболитической терапии используют тканевой активатор плазминогена алтеплазу в дозе 0,9 мг/кг (но не более 90 мг). 10% рассчитанной дозы вводят внутривенно болюсно, оставшуюся часть — внутривенно капельно. Проведение тромболитической терапии за пределами 3-часового «терапевтического окна» в рутинной практике не рекомендовано.
Существует множество противопоказаний к тромболитической терапии, основные из которых включают наличие на КТ признаков внутричерепного кровоизлияния, опухоли мозга, абсцесса, артериовенозной мальформации, крупной аневризмы, а также обширного инфаркта; тяжёлую черепно-мозговую травму или инсульт в течение последних 3 мес; некупируемое повышение АД выше 185/110 мм рт.ст.; гипокоагуляцию (МНО более 1,7; увеличение активированного частичного тромбопластинового времени более 40 с), бактериальный эндокардит и др.
Подробную информацию о процедуре проведения тромболитической терапии можно найти в соответствующих регламентирующих протоколах [например, см. (4)].
Средства для купирования осложнений в остром периоде инсульта
-
Для устранения ишемического отёка головного мозга, помимо общих мероприятий (правильное позиционирование, устранение, адекватная инфузионная терапия и др.), используют осмотические диуретики, например маннитол (25-50 г внутривенно каждые 3-6 ч). Применение с этой целью глюкокортикоидов неэффективно.
-
Для купирования эпилептических припадков используют диазепам (внутривенно 10-20 мг).
Антигипертензивные препараты
В острейшем периоде инсульта антигипертензивные препараты назначают в следующих случаях.
-
АД более 200/130 мм рт.ст.
-
Наличие острой коронарной или почечной недостаточности, кровоизлияния в сетчатку.
-
Подозрение на расслаивающую аневризму аорты.
-
Планируемая тромболитическая терапия.
Целесообразность раннего снижения АД в прочих случаях окончательно не доказана. Следует использовать легко титруемые препараты (например, β-адреноблокаторы, ингибиторы АПФ). АД целесообразно снижать ступенчато (на 10-15 мм рт.ст.), тщательно наблюдая при этом за общим состоянием и неврологическим статусом. У лиц с артериальной гипертензией в анамнезе АД обычно снижают до 180/100-105 мм рт.ст., в остальных случаях — до 160-180/90100 мм рт.ст.
В дальнейшем всем пациентам с артериальной гипертензией (а также с нормальным высоким АД) подбирают адекватную антигипертензивную терапию. Доказано, что нормализация АД позволяет снижать риск повторных церебральных ишемий. Как и при первичной профилактике, целесообразно использовать средства, снижающие активность ренин-ангиотензиновой системы.
Антикоагулянты
Гепарины в рутинном порядке при ишемическом инсульте не назначают (за исключением низких доз гепарина натрия для профилактики тромбоза глубоких вен у обездвиженных пациентов как альтернативы пневмокомпрессии нижних конечностей). Лечение гепарином натрия (либо низкомолекулярными гепаринами) показано только в следующих случаях.
-
Коагулопатии (например, дефицит протеинов C и S и др.).
-
Подозрение на тромбоз мозговых вен или синусов.
-
Аневризма экстракраниальных артерий, сопровождающаяся клинической симптоматикой.
-
Стенозы экстраили интракраниальных артерий, сопровождающиеся клинической симптоматикой, рецидивирующей на фоне терапии антиагрегантами.
Непрямые антикоагулянты показаны для вторичной профилактики у больных с кардиоэмболическим инсультом на фоне фибрилляции предсердий. Используют варфарин, дозу титруют до достижения целевого МНО (2-3, при протезированных клапанах — 3-4). При транзиторных ишемических атаках терапию начинают немедленно, при небольших инфарктах — через 2-4 дня, при обширных инфарктах — через 2-4 недели. Во время лечения необходим периодический контроль МНО.
Антиагреганты
Всем пациентам, перенёсшим ишемический инсульт, назначают вторичную профилактику антиагрегантами сразу же, как будет исключено внутричерепное кровоизлияние (при проведении тромболитической терапии — через 1 сут после её окончания). Препарат выбора — ацетилсалициловая кислота в дозе 1 мг/кг. При постоянном приёме препарат снижает риск повторного инсульта на 10-20%. Альтернативные препараты — дипиридамол или клопидогрел, их обычно используют при плохой переносимости ацетилсалициловой кислоты, а также в тех случаях, когда острая церебральная ишемия развилась на фоне её приёма. Дипиридамол назначают по 300-450 мг/сут в 3-6 приёмов либо по 200 мг 2 раза в сут (при использовании ретардных форм), клопидогрел — по 75 мг 1 раз в сут. Комбинация ацетилсалициловой кислоты (25 мг 2 раза в день) и дипиридамола (ретардные формы по 200 мг 2 раза в день) более эффективна, чем ацетилсалициловая кислота, и позволяет снизить риск инсульта на 30%.
Статины
Всем пациентам (при отсутствии противопоказаний) следует рекомендовать терапию статинами (например, симвастатином, аторвастатином), установлено, что она позволяет снизить риск повторного инсульта или транзиторной ишемической атаки более чем на 20%.
Средства симптоматической терапии
-
Для уменьшения спастичности (помимо методов физиотерапии) можно использовать центральные миорелаксанты (баклофен, толперизон, тизанидин), а также инъекции ботулотоксина.
-
Для лечения депрессии, часто возникающей у пациентов, перенёсших инсульт, обычно используют селективные ингибиторы обратного захвата серотонина сбалансированного действия или амитриптилин.
-
Для улучшения когнитивных функций при лёгкой или умеренной сосудистой деменции можно использовать центральные антихолинэстеразные препараты (галантамин — 16 мг/сут, ривастигмин — 9 мг/сут), мемантин (20 мг/сут), гинкго двулопастного листьев экстракт (120 мг/сут).
СПИСОК ЛИТЕРАТУРЫ
Кузнецов А.Н., Скворцова В.И., Суслина З.А. Инсульт и транзиторная ишемическая атака / Клинические рекомендации по неврологии. — М.: ГЭОТАР-Медиа, 2007.
Парфенов В.А. Статины в профилактике ишемического инсульта и других сердечнососудистых заболеваний // Неврол. журн. — 2006. — № 6. — С. 30-36.
Скворцова В.И., Соколов К.В., Шамалов Н.А. Артериальная гипертония и цереброваскулярные нарушения // Журн. неврол. и психиатр. — 2006. — № 11. — С. 57-65.
Яворская В.А., Фломин Ю.В., Дьолог Н.В., Гребенюк А.В. Тромболитическая терапия: становление и современная практика внутривенного тромболизиса при остром ишемическом инсульте // Инсульт. Приложение к журналу невр. и псих. — 2005. — № 15. — С. 13-27.
Guidelines for Prevention of Stroke in Patients With Ischemic Stroke or Transient Ischemic Attack: AHA/ASA Guideline // Stroke. — 2006. — Vol. 37. — P. 577-617.
James C. Grotta. PIER. Clinical guidance from ACP. Stroke and transient ischemic attack // http://www.pier.acponline.org/.
Management of Adult Stroke Rehabilitation Care: AHA/ASA Guideline // Stroke — 2005. — Vol. 36. — P. 100-143.
Management of patients with stroke: national clinical guideline — Royal College of Physicians, 2002 // http://www.sign.ac.uk/.
Primary Prevention of Ischemic Stroke: AHA/ASA Guideline // Stroke — 2006. — Vol. 37. — P. 1583-1633.
Тромбоэмболия лёгочной артерии
Тромбоэмболия лёгочной артерии — внезапная закупорка сгустком крови (эмболом) ветви лёгочной артерии с последующим прекращением кровоснабжения лёгочной паренхимы. Тромбоэмболия лёгочной артерии — осложнение венозного тромбоза. Тромбоз глубоких вен нижних конечностей наиболее часто вызывает тромбоэмболию лёгочной артерии (третья по частоте причина смерти населения от сердечно-сосудистых заболеваний после инфаркта миокарда и инсульта). Ежегодно от тромбоэмболии лёгочной артерии погибает 0,1% населения земного шара. Массивная тромбоэмболия лёгочной артерии заканчивается летально в 70% случаев, смерть наступает в течение первых двух часов. Среди пациентов терапевтического профиля наиболее часто венозные тромбозы регистрируют при инсультах (56%) и инфарктах миокарда (22%). Тромбоэмболия лёгочной артерии может стать осложнением любого венозного тромбоза. Наиболее эмболоопасная локализация тромбоза — бассейн нижней полой вены, с которым связано около 90% всех случаев тромбоэмболии лёгочной артерии. Флотирующие тромбы вен нижних конечностей значительно более опасны. Тромбы, полностью обтурирующие вены, вызывают тромбоэмболию лёгочной артерии значительно реже флотирующих.
ПРИНЦИПЫ ВЫБОРА ЛЕКАРСТВЕННЫХ СРЕДСТВ И РЕЖИМОВ ИХ ДОЗИРОВАНИЯ
Антитромботическая терапия при тромбоэмболии лёгочной артерии — высокоэффективный метод лечения, позволяющий снизить летальность с 30 до 2-8%.
Стандарт антитромботической терапии при венозных тромбоэмболиях — назначение гепарина (нефракционированного или низкомолекулярного) и оральных антикоагулянтов при условии стабильного состояния пациентов. Исключение составляют нестабильные больные, требующие немедленного проведения тромболизиса с дальнейшей терапией нефракционированным гепарином и оральными антикоагулянтами (варфарином) или постановки кава-фильтра.
Гепаринотерапия
Гепарин, включая низкомолекуляные формы, служит непрямым антикоагулянтом и не оказывает прямого воздействия на уже образовавшийся тромб. Цель проведения гепаринотерапии состоит в предотвращении возникновения тромбов, а в случае их наличия — в предотвращении дальнейшего увеличения тромба и уменьшения вторичных тромбоэмболических осложнений.
Гепаринотерапию необходимо начать немедленно, как только заподозрен диагноз «тромбоэмболия лёгочной артерии» у всех больных с высокой и средней клинической вероятностью немассивной тромбоэмболии лёгочной артерии. У больных с низкой клинической вероятностью немассивной тромбоэмболии лёгочной артерии необходимо сначала подтвердить диагноз объективными методами обследования и только после этого начинать гепаринотерапию.
Стандарт проведения гепаринотерапии при тромбоэмболии лёгочной артерии — введение первоначальной дозы 5000 МЕ внутривенно болюсно с последующей внутривенной инфузией из расчёта 1680 МЕ/ч.
Подбор адекватной дозы нефракционированного гепарина осуществляют на основании активированного частичного тромбопластинового времени, которое должно быть в 1,5-2,5 раза выше нормальных значений, что соответствует концентрации гепарина в плазме в диапазоне 0,2-0,4 МЕ/мл. Первое определение активированного частичного тромбопластинового времени проводят через 4-6 ч после начала терапии, после достижения терапевтического диапазона — 1 раз в сут. Исключение составляют пациенты после недавних хирургических вмешательств, больные язвенной болезнью, с желудочно-кишечным кровотечением в анамнезе, с тромбоцитопенией. В этих ситуациях терапию нефракционированным гепарином проводят по схеме 1250 МЕ/ч.
К основным недостаткам нефракционированного гепарина относят необходимость индивидуального подбора дозы под контролем активированного частичного тромбопластинового времени и связанные с этим практические сложности, необходимость длительного (несколько суток) внутривенного введения, «реактивацию» болезни после прекращения инфузии, возможность развития иммунной тромбоцитопении с парадоксальным повышением опасности тромбозов. В связи с этим при венозных тромбозах всё шире применяют низкомолекулярные гепарины: эноксапарин натрия, надропарин кальция и дальтепаринP.
Основное преимущество низкомолекулярного гепарина перед нефракционированным гепарином — отсутствие необходимости контроля активированного частичного тромбопластинового времени, возможность подкожного введения и длительного применения (до нескольких месяцев), обеспечение более равномерного терапевтического эффекта.
Низкомолекулярные гепарины — невзаимозаменяемая группа ЛС: каждое ЛС — самостоятельный препарат с уникальным спектром антитромботического действия и профилем клинической эффективности.
Лечебные дозы низкомолекулярных гепаринов назначают из расчёта:
-
эноксапарин натрия- 1 мг/кг (100 МЕ/кг) через 12 ч подкожно;
-
надропарин кальция — 86 МЕ/кг болюс, затем 86 МЕ/кг через 12 ч подкожно;
-
дальтепаринP — 120 МЕ/кг через 12 ч подкожно.
Продолжительность гепаринотерапии при венозных тромбозах — не менее 4-5 дней при одновременном назначении с гепарином (нефракционированным или низкомолекулярным) оральных антикоагулянтов. Через 5 дней определяют содержание тромбоцитов. Если оно составляет менее 150х109 /л, исследование повторяют. Если результат подтверждают, необходимо лечение гепарининдуцированной тромбоцитопении.
Отмена гепарина возможна после подбора адекватной дозы оральных антикоагулянтов (достижение MHO в терапевтическом диапазоне на протяжении двух дней подряд). Более длительные периоды начальной терапии гепарина можно рассматривать в случае массивной лёгочной эмболии или илеофеморального тромбоза.
Противопоказания к назначению гепарина (нефракционированного или низкомолекулярного):
-
геморрагический синдром любой этиологии;
-
неконтролируемая тяжёлая артериальная гипертензия;
-
язвенная болезнь или опухоль пищеварительного тракта с высоким риском развития кровотечения;
-
ИЭ;
-
ретиноангиопатия;
-
тромбоцитопения (менее 100 000/мкл);
-
заболевания, сопровождающиеся нарушениями процессов свёртывания крови;
-
операции на головном мозге и позвоночнике;
-
гиперчувствительность к гепарину.
Оральные (непрямые) антикоагулянты
Оральные (непрямые) антикоагулянты — высокоэффективные препараты для лечения венозных тромбозов. У пациентов с проксимальными тромбозами длительная терапия оральными антикоагулянтами (варфарин) снижает частоту рецидивов венозных тромбоэмболий с 47 до 2%.
Оральные антикоагулянты не оказывают прямого воздействия на уже образовавшийся тромб. Цель назначения оральных антикоагулянтов — предотвращение возникновения тромбов и дальнейшего их увеличения, а также уменьшение риска рецидивов тромбоэмболии.
Есть две различные химические группы оральных антикоагулянтов: производные индандиона (фенилинP) и кумарина (варфарин). Производные кумарина обладают рядом существенных преимуществ перед фенилиномP, связанных с более ранним началом действия, большей предсказуемостью эффекта и меньшей токсичностью. Наиболее широко в мире применяют варфарин, так как время его нахождения в организме обеспечивает наиболее стабильное воздействие на процессы свёртывания крови.
Существуют значительные различия у пациентов в отношении «доза-ответ», что требует индивидуального подбора дозы препаратов. Стартовая доза варфарина — 5,0 мг/сут. Для пожилых пациентов начальную дозу варфарина целесообразно уменьшить до 2,5 мг/сут.
При лечении оральных антикоагулянтов венозных тромбоэмболий и профилактики их рецидивов терапевтический диапазон MHO соответствует 2,0-3,0. При выявлении антифосфолипидного синдрома значения MHO следует увеличить до 2,5-3,5. В случае развития венозной тромбоэмболии при МНО, равном 2,0-3,0, следует довести этот показатель до 3,0-4,5.
В течение периода подбора терапевтической дозы оральных антикоагулянтов рекомендуют ежедневное определение MHO. Дозу считают подобранной при получении MHO в «терапевтическом интервале» в течение двух дней подряд.
При достижении терапевтического диапазона рекомендуют следующий алгоритм контроля MHO: первое определение MHO — через 5-10 дней, второе — через 2 нед, третье — через 3 нед, четвёртое и все последующие — через 4 нед.
Продолжительность антикоагулянтной терапии при венозных тромбоэмболиях зависит от клинической ситуации:
-
при первом эпизоде венозной тромбоэмболии и наличии транзиторных факторов риска (иммобилизация, хирургическое вмешательство, травма, использование эстрогена) — от 6 нед до 3-6 мес (до устранения факторов риска);
-
при первом эпизоде идеопатической венозной тромбоэмболии терапию оральными антикоагулянтами проводят в течение 3-6 мес;
-
при повторном эпизоде идеопатической венозной тромбоэмболии или при первичном эпизоде тромбоэмболии у пациента с тромбофилией продолжительность терапии оральными антикоагулянтами на сегодняшний день не определена, но она должна составлять не менее 12 мес (постоянно);
-
при наличии постоянных факторов риска, например рак или паралич ноги, — от 6 мес;
-
при рецидивирующей венозной тромбоэмболии — постоянно.
Основное серьёзное осложнение при проведении терапии оральными антикоагулянтами — кровотечение, риск которого значительно возрастает и начинает превышать пользу от проводимой терапии при МНО >5,0-6,0.
Тромболитические препараты
Тромболитическая терапия показана с целью максимально быстрого восстановления окклюзированной лёгочной артерии, уменьшения лёгочной гипертензии и постнагрузки на правый желудочек. Убедительных данных о положительном влиянии тромболитической терапии на исходы тромбоэмболии лёгочной артерии нет. Проведение тромболитической терапии сопряжено с повышенным риском кровотечений. Показанием к проведению тромболитической терапии служит развитие массивных тромбоэмболий лёгочной артерии с артериальной гипотонией (систолическое АД менее 90 мм рт.ст. или снижение АД на 40 мм рт.ст. более 15 мин, не вызванное вновь возникшими нарушениями ритма сердца, гиповолемией или сепсисом) или шоком.
При развитии субмассивной тромбоэмболии лёгочной артерии, сопровождающейся острой правожелудочковой недостаточностью, вопрос о проведении тромболитической терапии решают в индивидуальном порядке. Наличие перфузионного дефицита, по данным сцинтиграфии, более 30% или повышение систолического АД в лёгочной артерии более 60 мм рт.ст. — дополнительные аргументы в пользу проведения тромболитической терапии. Пациентам без признаков перегрузки правых отделов сердца тромболитическая терапия не показана.
Проведение ангиографии при тромболизисе необязательно, так как требует дополнительных временных затрат и увеличивает риск кровотечения. Однако перед проведением тромболитической терапии обязательно подтверждение развития массивной или субмассивной тромбоэмболии лёгочной артерии объективными методами исследования.
Не существует общепринятой схемы проведения тромболитической терапии при тромбоэмболии лёгочной артерии. Она более эффективна в ранние сроки возникновения тромбоэмболии лёгочной артерии — в первые 3-7 сут заболевания.
Тромболитические препараты вводят в периферическую вену, что обеспечивает такую же эффективность, как и при введении непосредственно в лёгочную артерию.
В настоящее время тромболизис всё чаще проводят тканевым активатором плазминогена (альтеплазой), что связано с удобством его введения (длительность инфузии всего 2 ч) и более низким риском возникновения гипотензии и системных признаков (озноб, лихорадка). Альтеплазу вводят из расчёта 10 мг внутривенно в течение 1-2 мин, после чего вводят 90 мг внутривенно в течение 2 ч (у пациентов с массой тела менее 65 кг максимальная доза 1,5 мг/кг).
Стрептокиназу обычно вводят болюсом внутривенно 250 000 ЕД на 100 мл 0,9% раствора натрия хлорида (в течение 30 мин), затем проводят постоянную инфузию со скоростью 100 000 ЕД/час в течение 12-72 ч.
Абсолютное противопоказание к тромболитической терапии — продолжающееся внутреннее кровотечение и интракраниальное кровоизлияние в течение последнего месяца.
В отличие от гепаринов антикоагулянты непрямого действия не применяют при остром и подостром синдроме ДВС любого происхождения (особенно при инфекционно-септическом), поскольку происходит снижение в плазме уровней белков С и S, синтез которых ингибируется непрямыми антикоагулянтами.
Назначение варфарина противопоказано при перенесённом (за 6 мес до начала лечения) геморрагическом инсульте, при недавних желудочно-кишечных кровотечениях (особенно повторяющихся) и при гематурии. Противопоказан варфарин и при тяжёлых заболеваниях печени — острых гепатитах и циррозах. С осторожностью и в меньших дозах препарат необходимо применять у лиц старше 70-75 лет. Лабораторный контроль действия препарата у лиц преклонного возраста необходимо производить чаще, чем при аналогичных ситуациях у молодых людей.
ПРОФИЛАКТИКА ТРОМБОЭМБОЛИИ ЛЁГОЧНОЙ АРТЕРИИ
В целях профилактики венозных тромбозов у хирургических больных используются низкомолекулярные гепарины в следующих дозах:
-
эноксапарин натрия — 40 мг (4000 МЕ/0,4 мл) в сутки подкожно для группы высокого риска и 20 мг (2000 МЕ/0,2 мл) в сутки подкожно для группы умеренного и низкого риска;
-
надропарин кальция- 0,4 мл (3800 ME) первые 3 дня, затем по 5700 ME (0,6 мл) в сутки подкожно;
-
дальтепаринP — 5000 ME (0,4 мл) 1 раз в сутки подкожно.
Гепаринотерапию начинают за 2 ч до операции и продолжают минимум 5-7 сут после операции до активизации больного. В ургентной хирургии и в случаях высокого риска интероперационного кровотечения гепаринотерапию можно начать через 12 ч после завершения операции. В таких ситуациях целесообразно применять более высокие дозы низкомолекулярных гепаринов.
СПИСОК ЛИТЕРАТУРЫ
Яковлев В.Б., Яковлева М.В. Тромбоэмболия лёгочной артерии: патофизиология, диагностика, лечебная тактика // Consilium Medicum. — 2005. — № 6. — C. 493-499.
Nicolaides A., Breddin H., Fareed J. Prevention of venous thromboembolism: international Consensus Statement Guidelines compiled in accordance with the scientific evidence // Int. Angiol. — 2001. — Vol. 20. — P. 1-37.
Pulmonary embolism — new paradigms in diagnosis and therapy // Chest. — 2001. — Vol. 120. — P. 1556-1561.
The Sixth (2000) ACCP Guidelines of Antithrombolitic Therapy for Prevention and Treatment of Thrombosis // Chest. — 2001. — Vol. 119 (Suppl. 1). — 370 p.
Гиперлипидемии
ЦЕЛИ ЛЕЧЕНИЯ
Коррекция нарушений липидного обмена — важный фактор первичной и вторичной профилактики атеросклероза. В настоящее время в клинической практике используют классификацию гиперлипидемий ВОЗ (табл. 21-73).
Таблица 21-73. Классификация гиперлипидемий ВОЗ
| Фенотип | Общий холестерин | Холестерин липопротеинов низкой плотности | Триглицериды | Изменения ЛП | Атерогенность |
|---|---|---|---|---|---|
|
I |
Повышен |
Понижен или в норме |
Повышены или в норме |
↑ХМ |
Неатерогенен |
|
II a |
Повышен |
Повышен |
В норме |
↑липопротеины низкой плотности |
Высокая |
|
II b |
Повышен |
Повышен |
Повышены |
↑липопротеины низкой плотности и липопротеины очень низкой плотности |
Высокая |
|
III |
Повышен |
Понижен или в норме |
Повышены |
↑ЛПП |
Высокая |
|
IV |
Чаще в норме |
В норме |
Повышены |
↑липопротеины очень низкой плотности |
Умеренная* |
|
V |
Повышен |
В норме |
Повышены |
↑ХМ и липопротеины очень низкой плотности |
Низкая |
↑ — повышение концентрации; * — IV фенотип атерогенный, если ему сопутствует низкая концентрация холестерина липопротеинов высокой плотности, а также другие метаболические нарушения (гипергликемия, инсулинорезистентность, нарушенная толерантность к глюкозе)
Необходимо обратить внимание на то, что для диагностики типа гиперлипидемий и выработки оптимальной стратегии и тактики фармакотерапии определения только уровня общего холестерина недостаточно. При ИБС, атеросклерозе мозговых и периферических артерий чаще всего имеют место фенотипы IIa и IIb. При метаболическом синдроме и сахарном диабете 2-го типа чаще выявляют повышение концентрации триглицеридов на фоне высокого уровня общего холестерина. Поэтому у них часто выявляют фенотипы IIb и/или IV. Все эти фенотипы требуют немедленной медикаментозной терапии.
Помимо идентификации типа гиперлипидемии практический врач должен оценить наличие других факторов риска у пациента (табл. 21-74 и табл. 21-75).
Таблица 21-74. Факторы риска развития и прогрессирования ИБС*
| Фактор риска | Интерпретация |
|---|---|
|
Возраст |
Мужчины >45 лет |
|
Раннее начало ИБС у ближайших родственников |
инфаркт миокарда или ВС |
|
Курение |
Вне зависимости от количества |
|
Артериальная гипертензия |
АД>140/90 мм рт.ст. |
|
Гиперхолистеринемия |
Общий холестерин >5 ммоль/л (190 мг/дл) |
|
Гипертриглицеридемия, низкий уровень холестерина липопротеинов высокой плотности |
Триглицериды ≥2 ммоль/л (180 мг/дл) |
|
Сахарный диабет |
Глюкоза натощак ≥7 ммоль/л (125 мг/дл) |
|
Абдоминальное ожирение |
Окружность талии: |
Примечание: * — Европейские рекомендации 1988 г.
Категории риска развития фатальных осложнений.
-
1-я категория — высокого риска. Больные с любыми клиническими проявлениями ИБС, периферического атеросклероза и атеросклероза мозговых артерий; лица без клинических проявлений перечисленных выше заболеваний, но имеющие несколько факторов риска, при оценке которых по таблице SCORE десятилетний риск фатального исхода заболевания ≥5%. Больные, страдающие сахарным диабетом 1-2-го типов в особенности в комбинации с микроальбуминурией
-
2-я категория — умеренного риска. Лица, у которых отсутствуют клинические проявления ССЗ, но у которых существует риск развития атеросклероза сосудов вследствие: наличия нескольких факторов риска (≥2), даже если при оценке по таблице SCORE десятилетний риск фатального исхода заболевания не <5%; выраженного повышения одного из факторов риска, например общий холестерин ≥8 ммоль/л (320 мг/дл), или холестерин липопротеинов низкой плотности ≥6 моль/л (240 мг/дл), или АД ≥180/110 мм рт. ст.
-
3-я категория — низкого риска. Лица без клинических проявлений ССЗ с одним умеренно выраженным фактором риска, например общий холестерин >5 ммоль/л (190 мг/дл), но <8 ммоль/л (320 мг/дл) или ХСЛНП ≥3 ммоль/л (115 мг/дл), но <6 ммоль/л (240 мг/дл) в пределах 140/90-160/100 мм рт.ст.; лица с отягощённым семейным анамнезом; начало ИБС или другого сосудистого заболевания у ближайших родственников больного по мужской линии <5 лет, по женской <65 лет.
Обследование пациента с гиперлипидемией следует закончить определением индивидуального фатального риска развития ССЗ по таблицам SCORE (Systemic Coronary Risk Evaluation). Эта таблица была разработана и проверена на российской популяции. Риск считают очень высоким при проекции в зону более 10%, высоким — 5-10% и низким — <5% (рис. 21-8). Чем выше риск, тем агрессивнее должна быть терапия.
Клинически важным считают определение оптимальных значений липидных параметров. Европейские рекомендации по профилактике ССЗ I от 2003 г. дают оптимальные значения концентраций липидов, определение которых более доступно в условиях реальной клинической практики (табл. 21-75) . Национальные Российские рекомендации ориентированы на достижение целевой концентрации липидов в зависимости от показателя SCORE у пациента (табл. 21-76).
На практике достижение целевого уровня липидов часто является трудно выполнимой, даже при использовании комбинированной терапии, задачей. В этом случае необходимо добиться снижения холестерина липопротеинов низкой плотности на 30-40% от исходного значения.
В последнее время появилась достаточно солидная доказательная база по возможности снижения риска развития инсульта, сосудистой деменции, хронической сердечной и почечной недостаточности при назначении статинов благодаря наличию у них плейотропных эффектов, и прежде всего способности уменьшать воспаление.
Таблица 21-75. Оптимальные значения липидов крови (Европейские рекомендации)
| Липидные параметры | ммоль/л | мг/дл |
|---|---|---|
|
Общий холестерин |
<5,0 |
<190 |
|
Холестерин липопротеинов низкой плотности |
<3,0 |
<115 |
|
Холестерин липопротеинов высокой плотности |
≥1,0 (у муж.), 1,2 (у жен.) |
≥40 (у муж.), 46 (у жен.) |
|
Триглицериды |
<1,7 |
<150 |
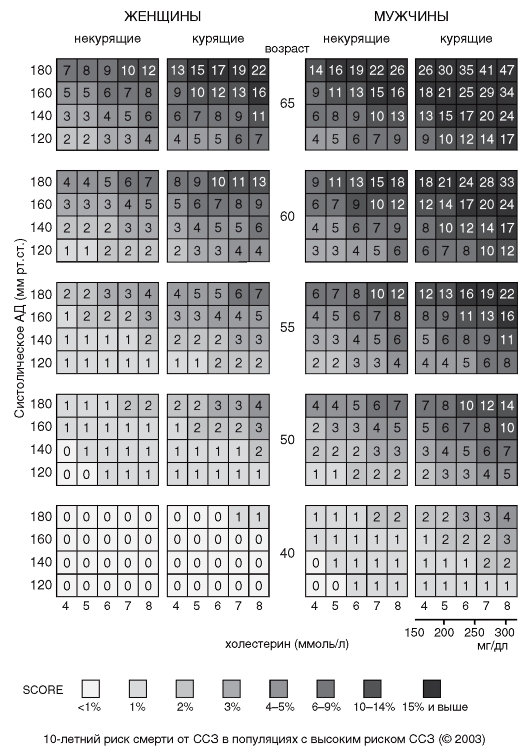
Рис. 21-8. Таблица расчёта индивидуального риска развития сердечно-сосудистых осложнений по SCORE.
Примечание: таблица разработана с учётом данных ФГУ «Государственный научноисследовательский центр профилактической медицины» Росздрава.
Таблица 21-76. Целевые уровни липидов в зависимости от риска по SCORE
| Категория риска | Целевой холестерин липопротеинов низкой плотности, ммоль/л (мг/дл) | Уровень холестерина липопротеинов низкой плотности для начала немедикаментозной терапии | Уровень холестерина липопротеинов низкой плотности для начала применения лекарств |
|---|---|---|---|
|
ИБС или её эквиваленты, или десятилетний фатальный риск, очень высокий (>10%) |
<2,5 (100) |
≥2,5 (100) |
≥3,0 (116) |
|
2 и более факторов риска, десятилетний фатальный риск, высокий (5-10%) |
<3,0 (115) |
≥3,0 (115) |
≥3,5 (135) |
|
1 фактор риска, десятилетний риск, низкий (<5%) |
<3,0 |
≥3,5 (135) |
≥4,0 (155) |
ПРИНЦИПЫ ВЫБОРА ЛЕКАРСТВЕННЫХ СРЕДСТВ И ИХ РЕЖИМОВ ДОЗИРОВАНИЯ
Даже на фоне активной медикаментозной терапии у пациента с нарушениями липидного обмена необходимо использовать весь комплекс немедикаментозных методов лечения: диету, снижение веса, повышение физической активности.
Для нормализации липидного обмена в настоящее время используют следующие группы ЛС:
-
ингибиторы фермента ГМК-КоА редуктазы (статины);
-
производные фиброевой кислоты (фибраты);
-
никотиновая кислота;
-
полиненасыщенные жирные кислоты — ω-3 триглицериды (омакор*);
-
секвестранты жёлчных кислот (смолы);
-
ингибитор абсорбции холестерина в кишечнике (эзетимиб).
Приведённая выше последовательность соответствует существующей доказательной базе применения этих групп лекарственных препаратов, лидируют в которой статины.
Ингибиторы фермента ГМГ-КоА редуктазы (статины)
Статины наиболее эффективны при лечении гиперлипидемий фенотипов IIa и IIb. Они наиболее эффективно снижают общий холестерин и холестерин липопротеинов низкой плотности, что сопровождается снижением общей смертности и различных сердечно-сосудистых заболеваний на 25-40%.
В настоящее время в России в клинической практике используют симвастатин, аторвастатин, розувастатин, правастатин, флувастатин, ловастатин. Симвастатин, правастатин и ловастатин были выделены из культуры пенициллиновых грибов и грибов Aspergillus terreus, а флувастатин и аторвастатин — полностью синтетические препараты. Существует два возможных объяснения различной клинической эффективности статинов:
-
длительность действия — период полувыведения аторвастатина и розувастатина более 14 ч, а всех других статинов — не более 2 ч;
-
различия по гидрофильности: симвастатин и ловастатин — липофильны, аторвастатин, розувастатин и правастатин — гидрофильны, флувастатин — относительно гидрофилен.
Отличительной особенностью статинов является наличие доказанных плейотропных эффектов (способности улучшать функцию эндотелия, снижать содержание С-реактивного белка и гомоцистеина, подавлять агрегацию тромбоцитов и пролиферацию гладкомышечных клеток).
Необходимо обратить внимание на то, что статины назначают однократно, в вечернее время, после ужина, так как синтез холестерина наиболее интенсивно происходит в ночные часы.
Среднетерапевтические дозы статинов представлены в табл. 21-77.
Таблица 21-77. Среднетерапевтические дозы статинов
| Международное название | Средняя терапевтическая доза, позволяющая снизить уровень холестерина липопротеинов низкой плотности на 30-40%, мг/сут |
|---|---|
|
Симвастатин |
20-40 |
|
Аторвастатин |
10-20 |
|
Правастатин |
20-40 |
|
Флувастатин |
20-40 |
|
Розувастатин |
5-10 |
|
Ловастатин |
40 |
Вполне очевидно, что начальные дозы статинов существенно различаются между собой по гиполипидемической активности. Это было подтверждено в исследовании CURVES и в клинике Maйо (рис. 21-9).
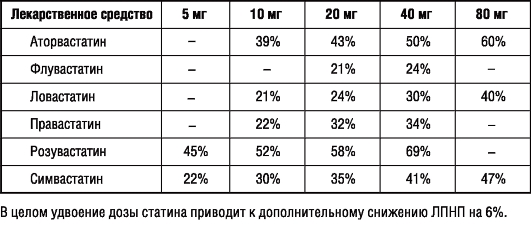
Рис. 21-9. Эффективность различных доз статинов.
Поэтому сегодня у практического врача стоит проблема выбора конкретного препарата среди них.
Несомненно, что алгоритм выбора должен быть максимально объективным. Поэтому он должен учитывать следующие характеристики препаратов:
-
эффективность;
-
доказательная база;
-
безопасность;
-
наличие клинически значимых лекарственных взаимодействий;
-
стоимость.
Для воспроизведённых (генерических) препаратов также необходимо принимать во внимание данные об их клинической эффективности в российских исследованиях и соотношении цена/эффективность в сравнении с другими генериками.
Сравнительная эффективность статинов
В крупных эпидемиологических исследованиях (Фремингемское, MRFIT) была выявлена прямая корреляция между уровнем холестерина и липопротеинов низкой плотности в крови и уровнем смертности от ИБС. Основная цель гиполи-
пидемической терапии — снижение именно холестерина липопротеинов низкой плотности. В настоящее время для достижения этой цели наиболее эффективными считают ингибиторы ГМГ-КоА-редуктазы (статины). Важным их свойством является то, что они не только эффективно снижают уровень общего холестерина и холестерина липопротеинов низкой плотности, но и повышают уровень липопротеинов высокой плотности, обладающих выраженным антиатеросклеротическим действием. Кроме этого, некоторые из статинов могут достаточно выраженно снижать и уровень триглицеридов.
Последние метаанализы показывают, что наиболее эффективные препараты для лечения выраженных нарушений липидного обмена — синтетические статины (аторвастатин в суточной дозе 10 мг снижает уровень липопротеинов низкой плотности в среднем на 39%, ловастатин и правастатин в дозе 40 мг — на 31%, симвастатин 40 мг — на 35-41%, флувастатин 40-80 мг — на 25-35%, розувастатин 10 мг — 39-45%), а именно аторвастатин, клиническое изучение которого началось с 1995 г. Сегодня это один из немногих препаратов, который позволяет добиться выраженного снижения общего холестерина и холестерина липопротеинов низкой плотности у больных с семейной гиперхолестеринемией. Применение 10 мг аторвастатина эквивалентно 20 мг симвастатина, 40 мг ловастатина и правастатина, 80 мг флувастатина. В этих дозах сравниваемые статины снижают концентрацию холестерина липопротеинов низкой плотности в среднем на 34%, а общего холестерина — на 27%, в то время как аторвастатин снижает их на 55% (а по данным ряда исследований — на 61%) и на 46% соответственно. Отличительная черта аторвастатина — его способность эффективно снижать уровень триглицеридов (на 23-45%). Причём по этому показателю он не уступает розувастатину. Кроме этого, аторвастатин — единственный среди статинов, который показал высокую эффективность в широком диапазоне дозировок (от 5 до 80 мг/сут), что чрезвычайно важно при проведении «агрессивной» гиполипидемической терапии.
Сравнение результатов крупных клинических исследований (рис. 21-10) позволяет сделать вывод о том, что именно его применение в наибольшей степени способствует достижению целевого уровня липидов.
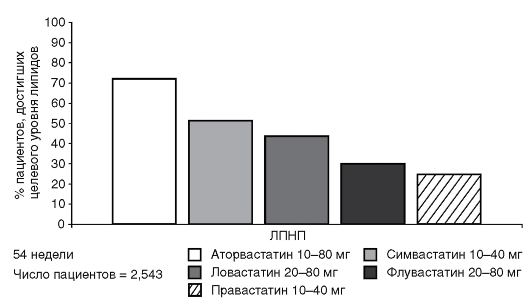
Рис. 21-10. Достижение целевого уровня липопротеидов низкой плотности при использовании различных статинов.
Итак, аторвастатин обладает уникально широким спектром действия на липидный профиль, даёт возможность широкого терапевтического манёвра с использованием разных доз и обеспечивает быстрое достижения целевого уровня липидов.
Доказательная база применения статинов
По выражению Грэхэма Джексона, мир подошёл вплотную к порогу «великой войны между статинами». В качестве критериев предпочтительности того или иного статина, как правило, аппелируют либо к лабораторно-биохимической эффективности, либо к способности снижать общую и сердечно-сосудистую летальность. Причём если по первой позиции признают бесспорное лидерство аторвастатина, то по второму параметру лидерство приписывается симвастатину и правастатину. Опираясь на результаты крупных многоцентровых рандомизированных исследований (CARE и WOSCOPS — правастатин, 4S — симвастатин), констатируют снижение риска «коронарной» летальности на 20-42%, частоту развития инфаркта миокарда — на 25-37%, частоту развития инсульта — на 28-31%. Однако необходимо отметить, что режим дозирования и исходный уровень холестерина в этих исследованиях были принципиально различными (в исследованиях CARE и WOSCOPS правастатин назначали пациентам с уровнем суммарного холестерина в крови 4,0-6,2 ммоль/л в дозе 40 мг/сут, а в исследовании 4S симвастатин назначали при гиперхолестеринемии 5,5-8,0 ммоль/л и в суточной дозе 20-40 мг). Такой подход опосредованного сравнения эффективности препаратов не соответствует принципам доказательной медицины. А кроме этого, игнорируются данные о влиянии статинов на другие клинически важные суррогатные точки и при другой сопутствующей гиперлипидемии патологии. Если сравнить результаты исследований GREACE и 4S, то оказывается, что аторвастатин более выраженно по сравнению с симвастатином снижает общую смертность, смертность от ИБС, количество инфарктов и инсультов (рис. 21-11).
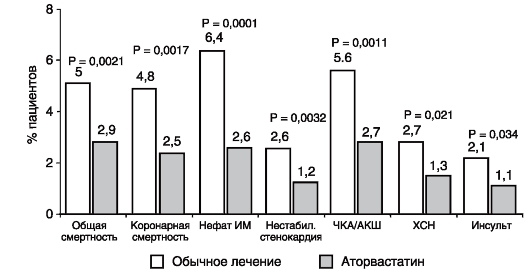
Рис. 21-11. Влияние аторвастатина и других статинов на конечные точки.
Более того, выявляют явное преимущество аторвастатина перед симвастатином по скорости снижения риска развития сердечно-сосудистых осложнений: аторвастатин снижает риск их развития уже через три месяца приёма препарата, а симвастатин — только через 1,5 года.
Не вдаваясь в дискуссию о целесообразности использования более высоких доз статинов с самого начала лечения, важно иметь в виду результаты исследования GREACE, в котором начальная доза аторвастатина составляла 20 мг/сут (средняя доза — 24 мг/сут). 95% на этой дозе аторвастатина достигли целевого уровня холестерина липопротеинов низкой плотности, в то время как в группе обычного лечения это было сделано только у 3% больных.
Особый интерес для клиницистов представляет возможность статинов не только предотвращать или замедлять развитие, но и уменьшать размер уже существующей атеросклеротической бляшки. Аторвастатин доказал возможность замедления и регресса атеросклеротической бляшки как минимум в двух крупных исследованиях с использованием внутрисосудистой ультразвуковой методики REVERSAL и ESTABLISH. При этом очень интересно сравнение результатов исследований ESTABLISH (аторвастатин) и ASTEROID (розувастатин). Шестимесячная терапия аторвастатином в дозе 20 мг/сут приводила к уменьшению размера атеромы на 13,1%, в то время как терапию розувастатином в течение 24 мес в дозе 40 мг/сут сопровождало уменьшение размера атеромы на 6,8%.
Если проанализировать количество исследований по статинам с «твёрдыми» конечными точками (общая смертность, сердечно-сосудистая смертность, инфаркт миокарда, инсульт) и по количеству включённых в них пациентов, то аторвастатин уверенно находится в тройке «лидеров» наряду с симвастатином и правастатином, несмотря на то, что появился на рынке значительно позже них. Розувастатин по этим показателям выглядит хуже, хотя в настоящее время близится завершение целого ряда крупных исследований с этим препаратом.
Аторвастатин позволяет не только добиться выраженного и стойкого снижения атерогенных фракций липидов и улучшить липидный профиль в целом, но и, как следствие, существенно замедлить и даже остановить прогрессирование атеросклероза. При этом именно аторвастатин в наибольшей степени соответствует принципу лечения атеросклероза: лечим не высокий холестерин, а пациента с высоким риском развития сердечно-сосудистых осложнений.
Безопасность статинов
Необходимо отметить хорошую переносимость аторвастатина как при применении стандартных дозировок, так и высоких (до 80 мг/сут).
Клинически значимое взаимодействие статинов и других лекарственных средств
С момента появления статинов активно обсуждают вопрос о возможном положительном синергизме их влияния на конечные точки при комбинации с антигипертензивными препаратами. Разочарование после опубликования результатов субисследования ALLHAT-LLA (к проводимой антигипертензивной терапии добавляли правастатин) было развеяно только после окончания исследования ASCOT-LLA. В исследовании ASCOT-LLA на фоне терапии амлодипин + периндоприл было выявлено снижение частоты возникновения первичной конечной точки на 36%, а также вторичных конечных точек (фатального и нефатального инсульта — на 27%, всех сердечно-сосудистых событий и процедур — на 21%, всех коронарных событий — на 29%). В то же время в группе больных, у которых применяли схему лечения амлодипин + периндоприл + аторвастатин, относительный риск снижения развития нефатального инфаркта миокарда и фатальной ИБС составлял 48%, а фатального и нефатального инсульта — 44%.
По-видимому, именно сочетание амлодипина и аторвастатина наиболее оптимально для реализации синергетического взаимодействия. В одном из исследований было показано, что именно комбинация амлодипина и аторвастатина в наибольшей степени обеспечивает не только достижение целевого уровня липидов, но и АД.
Этому факту есть несколько объяснений. Прежде всего, амлодипин и аторвастатин — несомненные лидеры в своих классах препаратов. Кроме этого, комбинация амлодипин + аторвастатин оказывает благоприятное влияние на уровень интерлейкина (ИЛ-6), фактор некроза опухоли-α и чувствительность к инсулину. Очевидно, что комбинация амлодипин + аторвастатин не только обладает более выраженным антигипертензивным эффектом, но и значительно сильнее уменьшает проявления инсулинорезистентности и воспаления.
Многие авторы считают, что возможно взаимодействие между амлодипином и статинами на молекулярном уровне, которое приводит к стабилизации атеросклеротической бляшки и обусловливает более выраженное снижение риска коронарных событий.
Фармакоэкономика статинов
Большой практический интерес представляет соотношение эффективность/стоимость при гиполипидемической терапии. В масштабном исследовании CURVES показано, что высокая эффективность аторвастатина по влиянию на уровень холестерина липопротеинов низкой плотности предопределяет его лучшие фармакоэкономические показатели по сравнению с другими статинами. Так, снижение уровня холестерина липопротеинов низкой плотности на 1% с ипользованием аторвастатина в дозе 10 мг/сут обходится в 17,96 долларов США в год. К этой ценовой отметке (20 долларов США в год) приближается только флувастатин в дозе 40 мг/сут. Стоимость использования других статинов существенно выше.
Высокая стоимость оригинальных препаратов и необходимость применения статинов в высоких дозах для достижения целевых уровней липидов делают необходимым широкое применение их генерических препаратов в условиях реальной клинической практики.
В настоящее время на российском рынке присутствует очень большое число генериков статинов, что делает возможным их назначение практически всем пациентам, нуждающимся в нём. Однако важно быть уверенным в фармакокинетической и терапевтической эквивалентности воспроизведённых и оригинальных статинов.
В настоящее время доказана целесообразность применения статинов у женщин, лиц пожилого возраста, пациентов с метаболическим синдромом, сахарным диабетом, артериальной гипертензией (аторвастатин) и острым коронарным синдромом. Выявлены их положительные эффекты при ХСН и снижении функции почек.
Производные фиброевой кислоты (фибраты)
Группа фибратов в настоящее время представлена ципрофибратом, фенофибратом и гемфиброзилом. Они наиболее эффективны при лечении изолированной гипертриглицеридемии (фенотип IV) в сочетании с низким уровнем холестерина липопротеинов высокой плотности и при комбинированной гиперлипопротеидемии (фенотип IIb, III). Кроме этого, они достаточно широко используются в комбинированной терапии гиперлипидемий.
Наряду со снижением уровня липопротеинов низкой плотности, липопротеинов очень низкой плотности и триглицеридов фибраты повышают уровень липопротеинов высокой плотности. Положительное влияние фибратов на снижение сердечно-сосудистой заболеваемости и смертности доказано в ходе крупных рандомизированных исследований. Однако, в отличие от статинов, спектр плейотропных эффектов у них уже, а значит, область их применения ограничена лечением гиперлипидемий. Вместе с тем в клинической практике используют способность фибратов усиливать действие гипогликемических средств, что актуально для пациентов с сахарным диабетом и метаболическим синдромом. Результаты клинических исследований показывают, что применение фибратов сопровождается снижением общего холестерина на 20-25%, липопротеинов низкой плотности — на 10-15%, триглицеридов на 40-50% и повышением липопротеинов высокой плотности на 10-20%. В исследовании у пациентов с нарушенной толерантностью к глюкозе и ИБС было показано, что применение безафибрата на 30% снижает риск развития сахарного диабета, а при ожирении — на 41%. Фибраты способны снижать уровень липопротеина А и фибриногена, которые считают независимыми предикторами риска развития сердечно-сосудистых осложнений.
В отличие от статинов фибраты рекомендуется принимать в утренние часы во время приёма пищи, так как в это время синтез триглицеридов максимально интенсивен. Режим дозирования фибратов следующий: ципрофибрат 100 мг 1-2 раза/сут, безафибрат 200 мг 2-3 раза/сут, фенофибрат М 200 мг 1 раз/сут, гемфиброзил 600 мг 2 раза/сут.
Фибраты хорошо переносятся. Частота развития побочных эффектов не превышает 5-10%. Наиболее типичными из них являются боли в животе, запоры, диарея, метеоризм. Реже возникают головные боли и бессонница. Все эти явления имеют преходящий характер и не требуют отмены фибратов. Назначение фибратов не рекомендуется пациентам с желчнокаменной болезнью, так как при длительном приёме они могут повышать литогенность жёлчи. При сочетании фибратов со статинами существенно увеличивается риск повышения печёночных ферментов и развития миалгии, миопатии. В связи с этим необходим их контроль и креатинин фосфокиназы не реже 1 раза в месяц.
Никотиновая кислота
Никотиновая кислота, будучи одним из витаминов группы В, в дозах 2-4 г/сут оказывает выраженное гиполипидемическое действие. По своему спектру эффектов (выраженное снижение холестерина на 20-30% и триглицеридов — на 30-40% на фоне повышения липопротеинов высокой плотности на 20-30%) она могла бы быть почти «идеальным» гиполипидемическим средством, но обычные формы никотиновой кислоты больные переносят плохо. Данное ЛС используют в комбинированной терапии гиперлипидемий фенотипа IIb (необходима большая осторожность при её комбинировании со статинами или фибратами) и при необходимости повысить уровень липопротеинов высокой плотности.
Считают, что никотиновая кислота может снижать общую смертность, однако такие исследования единичны.
Никотиновую кислоту назначают в дозе 2-4 г/сут 2-3 раза в сут вместе с приёмом пищи, но переносимость такого варианта лечения плохая. Лучшую переносимость имеет пролонгированная форма никотиновой кислоты — эндурацинP, в которой активное вещество фиксировано на восковой матрице, обеспечивающей медленное высвобождение препарата в кровь. Препарат не вызывает ощущения «приливов» и в меньшей степени оказывает раздражающее действие на слизистые оболочки.
Помимо указанных выше побочных эффектов, наиболее серьёзное осложнение при её приёме -печёночная недостаточность. Клинически она проявляется симптомами печёночной комы, выраженным повышением активности печёночных ферментов на фоне резкого и внезапного снижения уровня общего холестерина. В связи с этим необходим ежемесячный контроль функций печени. Также не рекомендуют переводить пациента без перерыва с кристаллической формы никотиновой кислоты на форму замедленного высвобождения и наоборот. Никотиновая кислота может повышать уровень мочевой кислоты, в связи с чем у пациентов с нарушением пуринового обмена и подагрой её использование проблематично.
Полиненасыщенные ω-3 жирные кислоты
ω-3-полиненасыщенные жирные кислоты в дозах 2-4 г/сут эффективны при фенотипах гиперлипидемии IIb-V. Они снижают уровень триглицеридов на 40-45% и рекомендованы также для вторичной профилактики инфаркта миокарда, так как в исследовании GISSI Prevenzione было показано, что на фоне стандартной терапии использование высокоочищенных ω-3-полиненасыщенных жирных кислот (омакор*) в дозе 1000 мг приводит к снижению общей смертности и внезапной смерти соответственно на 21% и 45% у постинфарктных пациентов при сравнении с плацебо.
В состав многих биологически активных добавок входят ω-3-полиненасыщенные жирные кислоты, однако количественный и качественный их состав существенно отличается от омакора* и часто не стандартизирован. Кроме этого, омакор* должен назначать врач, так как есть «проблемные» с точки зрения безопасности группы пациентов (пациенты со стеатогепатозом или на терапии дезагрегантами и пероральными антикоагулянтами).
Ингибитор абсорбции холестерина — эзетимиб
Эзетимиб (эзетрол*) — представитель нового класса гиполипидемических средств, избирательно блокирующих процесс абсорбции холестерина в эпителии тонкого кишечника. Для монотерапи практически не применяют, а широко используют в комбинации с невысокими дозами статинов у пациентов с фенотипами IIa, IIb. Эффективность такой комбинации сопоставима с эффективностью монотерапии с использованием статинов в высоких дозах, но её безопасность выше. В настоящее время проводят несколько длительных клинических исследований по изучению влияния препарата на жёсткие конечные точки.
Эзетимиб назначают в дозе 10 мг один раз в сутки вне зависимости от приёма пищи.
При сочетании со статинами необходим контроль активности трансаминаз. При исходном их повышении в 3 раза и более от верхней границы нормы от применения препарата необходимо воздержаться.
Секвестранты жёлчных кислот
Секвестранты жёлчных кислот (ионообменные смолы) в качестве гиполипидемических средств начали использовать очень давно. Они хорошо снижают уровень общего холестерина и липопротеинов низкой плотности, но при этом могут существенно повышать уровень триглицеридов. В настоящее время в реальной клинической практике их не используют, хотя и доказано их положительное влияние на конечные точки. Имеют многочисленные побочные эффекты и при одновременном приёме с дигоксином, варфарином, тиазидными диуретиками и β-адреноблокаторами существенно снижают их эффективность.
Комбинированная гиполипидемическая терапия
Сегодня стало очевидным, что для достижения целевого уровня липидов многим пациентам необходима комбинированная терапия (табл. 21-78).
Таблица 21-78. Выбор гиполипидемических препаратов и комбинированная терапия в зависимости от вида гиперлипопротеидемии (приводится по рекомендациям ВНОК)
| Гиперлипопротеидемия | Препараты первого ряда | Препараты второго ряда | Комбинации препаратов |
|---|---|---|---|
|
Гиперхолистеринемия |
Статины |
Фибраты, Эзетимиб, Эндурацин |
Статин + эзетимиб |
|
Комбинированная гиперлипопротеидемия (холестерин ↑, триглицериды↑) |
Статины, фибраты |
Эндурацин |
Статин + фибрат |
|
Гипертриглицеридемия |
Фибраты, эндурацин |
Статины |
Фибрат + статин |
Примечание: * — комбинация статинов с фибратами повышает риск миопатии; 1 — комбинация статинов с эндурацином повышает риск миопатии и печёночной недостаточности; 2 — комбинация фибрата и эндурацина может вызвать выраженное нарушение печёночной функции.
МЕТОДЫ КОНТРОЛЯ ЗА ЭФФЕКТИВНОСТЬЮ
Помимо контроля за уровнем липидов необходим мониторинг за активностью печёночных ферментов и креатинин фосфокиназы. Если при двух последовательных измерениях уровень хотя бы одной из трансаминаз превышает в 3 раза верхние пределы нормальных значений, то статины необходимо отменить. При более умеренном их повышении целесообразно снижение дозы препарата или переход на аторвастатин. При повышении уровня креатинин фосфокиназы более чем в 5 раз также необходима отмена статинов. При монотерапии первый контроль активности ферментов назначают через 3 мес от начала лечения, а затем каждые 6 мес.
При появлении миопатии и миалгии необходимо исключить рабдомиолиз с поражением почек, о котором будет свидетельствовать повышение уровня креатинин фосфокиназы более чем в 10 раз и потемнение мочи (миоглобинурия). В этих случаях гиполипидемическую терапию отменяют. Риск рабдомиолиза повышен при одновременном назначении статинов с фибратами, цитостатиками и макролидными антибиотиками.
Инфекционный эндокардит
ИЭ — заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде (реже на эндотелии аорты и крупных артерий) или внутрисердечных инородных телах (искусственных клапанах, водителях ритма), ведущее к нарушению функций и деструкции клапанного аппарата.
В зависимости от характера течения различают острый и подострый ИЭ. По спектру основных возбудителей и, следовательно, особенностям антимикробной терапии выделяют также следующие варианты ИЭ:
-
ИЭ естественных клапанов;
-
ИЭ у наркоманов, использующих внутривенный путь введения наркотических веществ;
-
ИЭ искусственных (протезированных) клапанов:
-
ранний (развивается в течение 60 сут после операции);
-
поздний (развивается через 2 мес и позднее после операции).
-
ЦЕЛИ ЛЕЧЕНИЯ
-
Элиминация возбудителя через стерилизацию крови и клапанных структур.
-
Профилактика осложнений как со стороны сердечно-сосудистой системы, так и со стороны других органов и систем.
ОБЗОР СОВРЕМЕННЫХ РЕКОМЕНДАЦИЙ
Клинические и микробиологические данные должны лежать в основе начальной терапии. Для оптимизации диагностики и лечения пациентов с ИЭ необходимо выполнение двух основных условий:
-
постоянно функционирующая микробиологическая служба, проводящая идентификацию возбудителя и определяющая его чувствительность к антимикробным лекарственным средствам; контакт с микробиологом возможен в течение 24 ч, 7 дней в неделю;
-
возможность неотложной консультации кардиолога и/или кардиохирурга, а также постоянный доступ к дополнительным диагностическим методикам, в частности эхокардиографии.
Если эти условия не выполнены, необходимо в срочном порядке транспортировать пациента в соответствующую клинику.
ПРИНЦИПЫ ВЫБОРА ЛЕКАРСТВЕННЫХ СРЕДСТВИ РЕЖИМОВ ИХ ДОЗИРОВАНИЯ
При острой ИЭ необходима немедленная антибиотикотерапия, при этом лечение подострого эндокардита можно отложить на 24-48 ч, пока проводят диагностическое обследование. Необходимость безотлагательного лечения острого эндокардита продиктована одним из его наиболее вероятных возбудителей — S. aureus, вызывающим токсический шок, септические метастазы и быстрое разрушение сердечных клапанов. До первого введения антимикробных лекарственных средств проводят забор крови для микробиологической диагностики.
Подострый ИЭ обычно вызван менее вирулентными микроорганизмами и достаточно редко сопровождается септицемией или шоком. Некоторая отсрочка начала лечения даёт возможность в течение 1-2 сут получить предварительные данные микробиологического исследования крови и провести этиотропную терапию, при этом недопустимо откладывать начало применения антимикробных лекарственных средств более чем на 48 ч.
До получения результатов микробиологического исследования крови эмпирическая антимикробная терапия должна быть направлена на основных возбудителей с учётом индивидуальных особенностей пациента (табл. 21-79).
Наиболее частые возбудители подострого ИЭ — зеленящие стрептококки (S. mitis, S. sanguis, S. mutans и др.) и S. bovis, поэтому при подостром ИЭ нативных клапанов терапию ориентируют на стрептококки. При неэффективности лечения следует предположить другие патогенные микроорганизмы, прежде всего энтерококки.
При остром ИЭ препараты выбора — активные в отношении S. aureus антимикробные лекарственные средства.
У «внутривенных наркоманов» антибиотикотерапия должна включать антимикробные лекарственные средства, активные против S. aureus (с учётом высокой частоты MRSA) и грамотрицательных бактерий.
При ИЭ искусственных клапанов препараты выбора — ванкомицин и гентамицин ввиду высокой распространённости MRSE.
После получения результатов микробиологического исследования крови необходимо скорректировать лечение. При отрицательных культурах следует продолжить проводимую терапию (если она была эффективной). Рекомендуемые режимы терапии ИЭ в зависимости от этиологии приведены в табл. 21-80.
Таблица 21-79. Эмпирическая антимикробная терапия инфекционного эндокардита
| Режим | Курс | Примечания |
|---|---|---|
|
Подострый инфекционный эндокардит |
||
|
Бензилпенициллин 3-4 млн ЕД в/в каждые 4 ч или ампициллин 2 г в/в каждые 4 ч + |
4 нед |
— |
|
Цефтриаксон 2 г в/в или в/м каждые 24 ч |
4 нед |
— |
|
Цефтриаксон 2 г в/в или в/м каждые 24 ч |
2 нед |
— |
|
Ванкомицин 15 мг/кг в/в каждые 12 ч |
4-6 нед |
При аллергии на β-лактамы |
|
Острый инфекционный эндокардит |
||
|
Оксациллин 2 г в/в каждые 4 ч или |
4-6 нед |
Цефазолин при не IgЕ-опосредованной аллергии на пенициллины |
|
Ванкомицин 15 мг/кг в/в каждые 12 ч |
4-6 нед |
При аллергии на β-лактамы |
|
Инфекционный эндокардит у «внутривенных наркоманов» |
||
|
Оксациллин 2 г в/в каждые 4 ч или цефазолин 2 г в/в каждые 8 ч |
4-6 нед |
Цефазолин при не IgЕ-опосредованной аллергии на пенициллины |
|
Ванкомицин 15 мг/кг в/в каждые 12 ч |
4-6 нед |
При аллергии на β-лактамы |
|
Инфекционный эндокардит искусственных клапанов |
||
|
Ванкомицин 15 мг/кг в/в каждые 12 ч |
4-6 нед |
Высокий риск MRSA и MRSE |
|
Оксациллин 2 г в/в каждые 4 ч или цефазолин 2 г в/в каждые 8 ч |
6-8 нед |
— |
Особенности лечения инфекционного эндокардита у детей
Существенных различий в этиологии ИЭ у детей и взрослых нет. Данные об оптимальной антимикробной терапии у детей ограничены. Большинство режимов заимствовано у взрослых, в целом терапия в равной степени эффективна и безопасна.
Таблица 21-80. Антимикробная терапия инфекционного эндокардита установленной этиологии
| Режим | Курс | Примечания |
|---|---|---|
|
Зеленящие стрептококки и S. bovis с минимальной подавляющей концентрацией пенициллина ≤0,1 мг/л |
||
|
||
|
Бензилпенициллин 2-3 млн ЕД в/в каждые 4 ч |
4-6 нед |
Перевод на амбулаторную терапию через 7 сут лечения в стационаре |
|
||
|
Бензилпенициллин (коррекция дозы в соответствии с функцией почек) |
4 нед |
Цефтриаксон при аллергии на пенициллин |
|
||
|
Ванкомицин 15 мг/кг в/в каждые 12 ч |
4 нед |
— |
|
Зеленящие стрептококки и S. bovis с минимальной подавляющей концентрацией пенициллина 0,1-0,5 мг/мл |
||
|
Бензилпенициллин 3-4 млн ЕД в/в каждые 4 ч или цефтриаксон 2 г в/в или в/м каждые 24 ч |
4 нед 2 нед 4 нед |
Ванкомицин при аллергии на пенициллин |
|
Зеленящие стрептококки и S. bovis с минимальной подавляющей концентрацией >0,5 мг/л или энтерококки |
||
|
Ванкомицин 15 мг/кг в/в каждые 12 ч |
6 нед |
При выделении энтерококков, резистентных к ванкомицину — линезолид |
|
Метициллиночувствительные стафилококки |
||
|
Оксациллин 2 г в/в каждые 4 ч или цефазолин 2 г в/в каждые 8 ч |
4-6 нед |
При искусственных клапанах длительность терапии 6-8 нед (гентамицин первые 2 нед и рифампицин 0,3 г внутрь 2 раза в сут в течение всего курса) Ванкомицин при аллергии на β-лактамы |
|
Ванкомицин 15 мг/кг в/в каждые 12 ч |
4-6 нед |
|
|
Метициллинорезистентные стафилококки |
||
|
Ванкомицин 15 мг/кг в/в каждые 12 ч |
6 нед |
— |
|
Бактерии группы НАСЕК |
||
|
Цефтриаксон 2 г в/в или в/м каждые 24 ч |
4 нед |
— |
|
Грамотрицательные бактерии |
||
|
Цефотаксим 2 г в/в каждые 4-6 ч или цефтазидим 2 г в/в каждые 8 ч |
4 нед |
В зависимости от активности in vitro |
Особенности лечения инфекционного эндокардита у людей пожилого возраста
У лиц старше 60 лет частота встречаемости ИЭ несколько выше, что связано с наличием осложняющих факторов (заболевания сердечно-сосудистой системы). Возрастное снижение функции почек может потребовать изменения доз и/или кратности применения антимикробных лекарственных средств.
МЕТОДЫ КОНТРОЛЯ ЭФФЕКТИВНОСТИ
Эффективность терапии ИЭ отслеживают с момента её начала. Проводят осмотр пациента, мониторинг температуры тела, исследование клинических и биохимических показателей крови. При подозрении на инфекционные осложнения необходим повторный забор крови для культурального исследования, проведение эхокардиографии и ЭКГ (холтеровское мониторирование, компьютерная томография/магнитно-резонансная томография брюшной полости, исследование глазного дна). Регулярные общеклинические обследования направлены на выявление новых сердечных шумов, признаков сердечной недостаточности, изменений АД, симптомов тромбоэмболических осложнений. Важно помнить, что сердечнососудистые и системные осложнения более вероятны в первые дни антимикробной терапии.
Лихорадка — очень важный критерий оценки состояния пациентов с ИЭ. При неосложнённом течении ИЭ нормализация температуры тела должна произойти на 5-10-й день терапии. При ИЭ, вызванном зеленящими стрептококками, обычно отмечают более быстрый ответ на терапию по сравнению со стафилококковым или энтерококковым эндокардитом. Персистирующая лихорадка после первой недели лечения обычно свидетельствует о наличии осложнений — прогрессирующей деструкции клапана, распространении инфекции за клапанное кольцо и/или формировании абсцессов. Рецидивирующую лихорадку у клинически и гемодинамически стабильных пациентов после афебрильного периода наиболее часто наблюдают на 3-4-й неделе лечения, что может быть связано как с проявлением реакций на антимикробные лекарственные средства, так и с поздними сердечнососудистыми осложнениями и эмболией.
Среди лабораторных показателей степень ответа на проводимую терапию наиболее чётко отражает С-реактивный белок. Его величины обычно снижаются в течение 1-2 нед адекватной терапии, но могут оставаться повышенными до 4-6 нед и более. Удержание высоких уровней С-реактивного белка следует интерпретировать как неадекватно контролируемый инфекционный процесс и/или наличие кардиальных или экстракардиальных осложнений ИЭ.
Нормализация числа лейкоцитов периферической крови происходит, как правило, в течение 1-2 нед. Персистирующий лейкоцитоз также свидетельствует о наличии активного инфекционного процесса, при этом следует контролировать уровень эритроцитов и тромбоцитов.
Повторные определения сывороточного уровня креатинина важны для выявления осложнений ИЭ со стороны почек и контроля их состояния у пациентов, получающих аминогликозиды и/или ванкомицин.
Динамическое наблюдение за пациентом после выписки из стационара осуществляет кардиолог поликлиники с ежемесячным осмотром на протяжении 6 мес и проведением эхокардиографии через 3 и 6 мес после выписки. Лабораторные исследования (общий анализ крови, биохимический анализ крови, общий анализ мочи) проводят 1 раз в 3 мес на протяжении года.
СПИСОК ЛИТЕРАТУРЫ
Белоусов Ю.Б. и др. Инфекции сердечно-сосудистой системы: Практическое руководство по антиинфекционной химиотерапии. — Смоленск: МАКМАХ, 2007. — С. 311-316.
Демин А.А., Дробышева В.П. Диагностика и лечение инфекционного эндокардита // Клин. микробиол. антимикроб. химиотер. — 2000. — № 2. — С. 19-30.
Baddour L.M., Wilson W.R., Bayer A.S. et al. Infective endocarditis: diagnosis, antimicrobial therapy, and management of complications: a statement for healthcare professionals from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, and the Councils on Clinical Cardiology, Stroke, and Cardiovascular Surgery and Anesthesia, American Heart Association: endorsed by the Infectious Diseases Society of America // Circulation. — 2005. — Vol. 14. — N 11. — P. 394-434.
Delahaye F., Wong J., Mills P.G. Infective endocarditis: a comparison of international guidelines // Heart. — 2007. — N 93. — P. 524-527.
Horstkotte D., Follath F., Gutschik E. et al. Guidelines on prevention, diagnosis and treatment of infective endocarditis executive summary; the task force on infective endocarditis of the European society of cardiology // Eur. Heart J. — 2004. — N 25. — P. 267-276.
Paul-Ehrlich-Gesellschaft fur Chemotherapie (PEG; Paul-Ehrlich-Society for Chemotherapy); Deutsche Gesellschaft fur Kardiologie, Herzund Kreislaufforschung (DGK; German Society for Cardiology, Heart, and Circulatory Research). German guidelines for the diagnosis and management of infective endocarditis // Int. J. Antimicrob Agents. — 2007. — N 29. — P. 643-657.
Wilson W.R., Karchmer A.W., Dajani A.S. et al. Antibiotic treatment of adults with infective endocarditis due to streptococci, enterococci, staphylococci, and HACEK microorganisms // J.A.M.A. — 1995. — N 274. — P. 1706-1713.









































