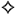1 таблетка содержит 80 мг или 160 мг валсартана;
вспомогательные вещества:
САРТВАЛ 80 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172).
САРТВАЛ 160 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172), железа оксид черный (Е172).
Антагонисты рецепторов ангиотензина II.
Код АТХ: С09СА03.
— Артериальная гипертензия у взрослых и детей от 6 до 18 лет (см. разделы «Противопоказания», «Меры предосторожности», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Фармакодинамика»).
— Сердечная недостаточность: лечение сердечной недостаточности с клинической симптоматикой у взрослых пациентов, не получающих ингибиторы ангиотензинпревращающего фермента (иАПФ), или в качестве дополнительной терапии к иАПФ у пациентов, не получающих бета-блокаторы, если нельзя использовать антагонисты минералокортикоидных рецепторов (см. разделы «Способ применения и дозы», «Меры предосторожности», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Фармакодинамика»).
— Недавно перенесенный инфаркт миокарда (у клинически стабильных взрослых пациентов с клиническими проявлениями сердечной недостаточности или бессимптомной систолической дисфункцией левого желудочка после перенесенного (12 часов – 10 дней) инфаркта миокарда).
— Повышенная чувствительность к валсартану или к любому из компонентов препарата.
— Беременность.
— Тяжелая печеночная недостаточность, билиарный цирроз печени и обструкция желчных путей.
— Одновременное применение иАПФ или блокаторов (антагонистов) рецепторов ангиотензина II (БРА) с препаратами, содержащими алискирен, у пациентов с сахарным диабетом или умеренной/тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Способ применения
САРТВАЛ принимают внутрь независимо от приема пищи, запивая водой.
Риска способствует разламыванию для облегчения глотания и не обеспечивает деления таблетки 80 мг и 160 мг на две равные дозы.
Артериальная гипертензия
Рекомендуемая стартовая доза препарата САРТВАЛ для взрослых составляет 80 мг или 160 мг один раз в сутки. Антигипертензивный эффект достигается в течение двух недель, а максимальный эффект наступает через четыре недели. Пациентам, у которых не удается достичь адекватного снижения артериального давления, суточную дозу можно повысить до 160 мг, или, максимально, до 320 мг; возможно дополнительное назначение диуретиков.
САРТВАЛ можно назначать также совместно с другими антигипертензивными средствами (см. разделы «Противопоказания», «Меры предосторожности», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Фармакодинамика»).
Сердечная недостаточность
Рекомендуемая начальная доза САРТВАЛа составляет 40 мг два раза в сутки. Повышение дозы до 80 мг и 160 мг два раза в сутки должно осуществляться с интервалом не менее 2 недель, с учетом переносимости препарата пациентом. Максимальная суточная доза, которая применялась в клинических исследованиях, составила 320 мг, распределенная на несколько приемов. При сопутствующем лечении диуретиком следует рассмотреть вопрос о снижении дозы последнего.
Поскольку наличие риски не обеспечивает возможность деления таблетки 80 мг на две равные части, данная лекарственная форма не может обеспечить дозировку 40 мг. При необходимости назначения валсартана в дозе 40 мг следует воспользоваться лекарственным средством, которое обеспечивает требуемую разовую дозу.
САРТВАЛ может назначаться совместно с другими лекарственными средствами, применяемыми для лечения сердечной недостаточности. Не рекомендуется одновременный прием тройной комбинации иАПФ, валсартана и бета-блокатора или калийсберегающего диуретика (см. разделы «Меры предосторожности», «Фармакодинамика»).
Оценка состояния пациентов с сердечной недостаточностью всегда должна включать мониторинг функции почек.
Постинфарктное состояние
У клинически стабильных пациентов лечение можно начать уже через 12 часов после инфаркта миокарда. После начальной дозы 20 мг два раза в сутки дозу валсартана необходимо увеличивать до 40 мг, 80 мг и 160 мг два раза в сутки в течение следующих нескольких недель.
Данная лекарственная форма не может обеспечить дозировку 20 мг. При необходимости назначения валсартана в дозе 20 мг необходимо воспользоваться лекарственным средством, которое обеспечивает требуемую разовую дозу. Максимальная доза – 160 мг два раза в сутки. В целом рекомендуется, чтобы доза 80 мг два раза в сутки достигалась в течение двух недель после начала лечения, а целевая максимальная доза – в течение трех месяцев, исходя из переносимости пациентом валсартана в период титрования дозы. Если возникает симптоматическая артериальная гипотензия или почечная дисфункция, следует рассмотреть вопрос о снижении дозы.
Валсартан можно назначать пациентам, которые лечились другими препаратами, рекомендованными после инфаркта миокарда (например, тромболитиками, ацетилсалициловой кислотой, бета-блокаторами и статинами). Не рекомендуется одновременный прием тройной комбинации иАПФ, бета-блокаторов и валсартана.
Оценка состояния пациентов после инфаркта миокарда всегда должна включать мониторинг функции почек.
САРТВАЛ может применяться для лечения гипертензии у пациентов с нарушенной толерантностью к глюкозе и риском сердечно-сосудистой недостаточности. Рекомендации по дозированию см. в разделе «Артериальная гипертензия».
Препарат можно принимать независимо от приема пищи, запивая небольшим количеством воды.
Отдельные группы пациентов
Артериальная гипертензия у детей и подростков
Дети от 6 до 18 лет
Для детей c массой тела менее 35 кг начальная доза составляет 40 мг один раз в день.
Поскольку наличие риски не обеспечивает возможность деления таблетки 80 мг на две равные части, данная лекарственная форма не может обеспечить дозировку 40 мг. При необходимости назначения валсартана в дозе 40 мг следует воспользоваться лекарственным средством, которое обеспечивает требуемую разовую дозу.
Для детей с массой тела 35 кг и более начальная доза составляет 80 мг один раз в день. Дозу следует корректировать в зависимости от действия на артериальное давление. Максимальные дозы, изученные в клинических испытаниях, приведены в таблице ниже. Дозы, превышающие указанные, не были изучены и поэтому не рекомендуются.
| Масса тела | Максимальные дозы, изученные в клинических испытаниях |
| ≥ 18 кг … < 35 кг | 80 мг |
| ≥ 35 кг … < 80 кг | 160 мг |
| ≥ 80 кг … ≤ 160 кг | 320 мг |
Дети до 6 лет
Безопасность и эффективность препарата САРТВАЛ у детей младше 6 лет не установлена.
Сердечная недостаточность и недавно перенесенный инфаркт миокарда у детей и подростков
САРТВАЛ не рекомендуется для лечения сердечной недостаточности или недавно перенесенного инфаркта миокарда у детей и подростков в возрасте до 18 лет в связи с отсутствием данных о безопасности и эффективности.
Пациенты пожилого возраста
Нет необходимости в коррекции дозы у пациентов пожилого возраста.
Пациенты с нарушением функции почек
Дети от 6 до 18 лет
Применение у детей с клиренсом креатинина <30 мл/мин или находящихся на диализе не изучалось, поэтому таким пациентам валсартан не рекомендуется. Не требуется коррекции дозы у детей с клиренсом креатинина более 30 мл/мин. Следует тщательно контролировать функцию почек и уровень калия в сыворотке крови (см. разделы «Меры предосторожности» и «Фармакокинетика»).
Взрослые
Нет необходимости коррекции дозы у взрослых пациентов с клиренсом креатинина более 10 мл/мин.
Пациенты с нарушением функции печени
Валсартан противопоказан пациентам с тяжелой печеночной недостаточностью, билиарным циррозом печени или обструкцией желчных путей. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза доза валсартана не должна превышать 80 мг (см. раздел «Меры предосторожности»).
Частота возникновения побочных реакций оценивается следующим образом: очень часто ≥ 1/10, часто – от ≥ 1/100, <1/10, нечасто — от ≥ 1/1000, < 1/100, редко — от ≥ 1/10000, <1/1000, очень редко — < 1/10000.
Со стороны крови и лимфатической системы: частота неизвестна – *снижение гемоглобина, *снижение гематокрита, *нейтропения, *#тромбоцитопения.
Со стороны иммунной системы: частота неизвестна – *#реакции гиперчувствительности, включая сывороточную болезнь.
Нарушение обмена веществ: частота неизвестна – *#увеличение содержания калия в крови, *#гипонатриемия; нечасто — #гиперкалиемия.
Нарушения со стороны нервной системы: часто – #головокружение, #постуральное головокружение; нечасто – #обмороки, #головная боль.
Со стороны органов слуха: нечасто – *#вертиго.
Со стороны сердечно-сосудистой системы: частота неизвестна – *#васкулит, часто — #ортостатическая гипотензия, #гипотензия; нечасто – #сердечная недостаточность.
Со стороны дыхательной системы: нечасто – *#кашель.
Со стороны пищеварительной системы: нечасто – *боль в животе, #диарея, #тошнота.
Со стороны гепатобилиарной системы: частота неизвестна – #повышение уровня печеночных ферментов, *повышение уровня печеночных ферментов, включая повышение уровня билирубина в крови.
Со стороны кожи и подкожно-жировой клетчатки: частота неизвестна – *ангионевротический отек, *#буллезный дерматит, *#сыпь, *#зуд; нечасто – #ангионевротический отек.
Со стороны скелетно-мышечной системы: частота неизвестна – *#миалгия.
Со стороны мочеполовой системы: частота неизвестна — *нарушение функции почек, *почечная недостаточность, *повышение уровня креатинина в сыворотке крови, #увеличение содержания мочевины крови; часто – #нарушение функции почек, #почечная недостаточность, нечасто – #острая почечная недостаточность, #повышение уровня креатинина в крови.
Общие нарушения: нечасто – *#слабость; #астения.
Следующие побочные эффекты наблюдались в ходе клинических исследований независимо от их причинной связи с исследуемым препаратом: *#артралгия, #абдоминальная боль, *астения, *#боль в спине, *диарея, *головокружение, *головная боль, *#бессонница, *#снижение либидо, #нейтропения, *тошнота, *#отеки, *#фарингит, *#ринит, *#синусит, *#инфекции верхних дыхательных путей, *#вирусные инфекции.
Примечание
Сообщалось при: *гипертензии; #сердечной недостаточности и/или постинфарктном состоянии.
Педиатрические пациенты (гипертензия)
Антигипертензивный эффект валсартана оценивался в двух рандомизированных, двойных слепых клинических исследованиях у 561 детей от 6 до 18 лет. Не было выявлено значимых отличий по типу, частоте и тяжести побочных эффектов между профилем безопасности для детей в возрасте от 6 до 18 лет и ранее известным профилем безопасности у взрослых пациентов.
Оценка нейрокогнитивной функции и развития у детей в возрасте от 6 до 16 лет не выявила клинически значимого отрицательного влияния после лечения САРТВАЛом продолжительностью до одного года.
В двойном слепом рандомизированном исследовании у 90 детей в возрасте от 1 года до 6 лет, за которым последовало открытое продление на один год, два человека умерли и наблюдалось отдельные случаи выраженного повышения печеночных трансаминаз. Во втором исследовании, в котором были рандомизированы 75 детей в возрасте от 1 года до 6 лет, не было ни одного случая смерти и отмечался один случай выраженного повышения печеночных трансаминаз в течение открытого продления на один год. Эти случаи имели место в популяции пациентов со значительными сопутствующими заболеваниями. Не было установлено причинно-следственной связи с приемом САРТВАЛа.
У детей в возрасте от 6 до 18 лет с хроническими заболеваниями почек наблюдалась гиперкалиемия.
Вследствие передозировки САРТВАЛа может развиться выраженная артериальная гипотензия, что может привести к угнетению сознания, коллапсу и/или шоку. Если препарат был принят недавно, следует вызвать рвоту. При артериальной гипотензии обычным методом терапии является внутривенное введение солевого раствора.
Выведение валсартана из организма путем гемодиализа маловероятно.
Как и другие препараты, напрямую воздействующие на ренин-ангиотензин-альдостероновую систему (РААС), САРТВАЛ нельзя применять при беременности (см. раздел «Противопоказания»).
Пациенткам, планирующим беременность, в случае необходимости должно быть назначено альтернативное антигипертензивное лечение, которое имеет установленный профиль безопасности для применения во время беременности. Когда беременность обнаружена, лечение блокаторами рецепторов ангиотензина II (БРА) должно быть немедленно прекращено и, при необходимости, должно быть назначено альтернативное лечение.
Эпидемиологические данные показали повышенный риск тератогенного воздействия при применении иАПФ в первом триместре беременности. Подобный риск может существовать также при приеме БРА.
Известно, что прием БРА во втором и третьем триместрах беременности вызывает фетотоксичность (снижение функции почек, маловодие, задержка окостенения черепа) и неонатальную токсичность (почечная недостаточность, артериальная гипотензия, гиперкалиемия).
Если женщина принимала БРА во втором триместре беременности, необходим УЗИ контроль функции почек и черепа плода. Новорожденные, матери которых принимали БРА, должны внимательно наблюдаться из-за возможной артериальной гипотензии.
Не рекомендуется применять САРТВАЛ во время грудного вскармливания, так как отсутствует информация о применении валсартана во время кормления грудью. Предпочтительно использовать альтернативные методы лечения с установленным профилем безопасности, особенно если ребенок новорожденный или недоношенный.
Пациенты с дефицитом в организме натрия и/или объема циркулирующей крови (ОЦК). У пациентов с тяжелой степенью дефицита натрия и/или объема циркулирующей крови в организме, например, у тех, которые получают высокие дозы диуретиков, в отдельных случаях после начала терапии может наблюдаться симптоматическая гипотензия. Перед началом лечения следует провести коррекцию содержания в организме натрия и/или объема циркулирующей крови, например, путем снижения дозы диуретика.
При гипотензии пациента следует уложить и, если необходимо, провести внутривенную инфузию солевого раствора. Лечение можно продолжить сразу после стабилизации артериального давления.
Гиперкалиемия. Следует соблюдать осторожность при совместном применении САРТВАЛа с препаратами калия, калийсберегающими диуретиками, препаратами, содержащими калий в виде солей, или другими препаратами, которые могут повысить уровень калия (гепарин и др.). Рекомендуется контролировать содержание калия в крови.
Стеноз почечной артерии. Кратковременное применение САРТВАЛа у 12 пациентов с вазоренальной гипертензией, являющейся вторичной вследствие одностороннего стеноза почечной артерии, не вызвало никаких существенных изменений гемодинамических параметров почек, креатинина сыворотки или азота мочевины крови. Поскольку другие лекарственные средства, влияющие на ренин-ангиотензин-альдостероновую систему (РAAС), могут повышать уровень мочевины крови и креатинина сыворотки у пациентов с односторонним или двусторонним стенозом почечной артерии, как мера безопасности рекомендуется мониторинг этих показателей.
Нарушение функции почек. У пациентов с нарушением функции почек коррекция дозы не требуется. Однако в тяжелых случаях (клиренс креатинина <10 мл/мин) следует соблюдать осторожность, поскольку опыт применения препарата в этих случаях отсутствует. С осторожностью применять у пациентов, находящихся на гемодиализе.
В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов, находящихся на гемодиализе. Однако валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно. Опыт применения препарата САРТВАЛ у пациентов с трансплантацией почки отсутствует.
Нарушение функции печени. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза САРТВАЛ должен применяться с осторожностью (см. разделы «Противопоказания» и «Фармакокинетика»).
Сердечная недостаточность/Постинфарктное состояние. У пациентов с сердечной недостаточностью или постинфарктным состоянием, принимающих САРТВАЛ в обычных дозах, наблюдается незначительное снижение артериального давления, но прекращение терапии из-за длительной симптоматической гипотензии, как правило, не требуется, если соблюдать инструкции по дозированию препарата. Необходимо соблюдать осторожность у пациентов с сердечной недостаточностью или в постинфарктном состоянии, начинающих терапию.
Как следствие угнетения ренин-ангиотензин-альдостероновой системы (РAAС), у лиц с повышенной чувствительностью могут наблюдаться нарушения функции почек. У пациентов с тяжелой сердечной недостаточностью, у которых функция почек зависит от активности РААС, лечение иАПФ или БРА могло стать причиной олигурии и/или прогрессирующей азотемии, острой почечной недостаточности (редко) и/или летального исхода. Оценка состояния пациентов с сердечной недостаточностью или в постинфарктном состоянии всегда должна включать мониторинг функции почек.
Не рекомендуется одновременный прием тройной комбинации иАПФ, бета-блокаторов и валсартана.
Стеноз аортального и митрального клапанов, гипертрофическая кардиомиопатия. Как и при применении других вазодилататоров, следует соблюдать особую осторожность при назначении препарата пациентам с аортальным или митральным стенозом, а также гипертрофической кардиомиопатией.
Ангионевротический отек.
Сообщалось о случаях ангионевротического отека, в том числе отека гортани и голосовой щели, что приводит к обструкции дыхательных путей и/или отеку лица, губ, глотки и/или языка у пациентов, получавших валсартан; у некоторых из этих пациентов ранее развивался отек Квинке при приеме других лекарственных препаратов, в том числе иАПФ. Следует немедленно прекратить прием препарата САРТВАЛ пациентам, у которых развивается ангионевротический отек, и препарат не должен назначаться снова.
Первичный гиперальдостеронизм. Не рекомендовано назначать САРТВАЛ пациентам с первичным гиперальдостеронизмом.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС)
Двойная блокада РААС ассоциируется с повышенным риском развития гипотонии, гиперкалиемии и нарушениями функции почек (включая острую почечную недостаточность) в сравнении с монотерапией. Двойная блокада РААС с применением иАПФ, БРА или препаратов, содержащих алискирен, не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией.
В отдельных случаях, когда совместное применение иАПФ и БРА абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции почек, водно-электролитного баланса, артериального давления. Это относится к назначению кандесартана или валсартана в качестве дополнительной терапии к ингибиторам АПФ у пациентов с хронической сердечной недостаточностью. Проведение двойной блокады РААС под тщательным наблюдением специалиста с обязательным мониторингом функции почек, водно-электролитного баланса и артериального давления возможно у пациентов с хронической сердечной недостаточностью при непереносимости антагонистов альдостерона (спиронолактона), у которых наблюдается персистирование симптомов хронической сердечной недостаточности, несмотря на проведение иной адекватной терапии.
Детский возраст
Применение у детей с нарушением функции почек
Применение у детей с клиренсом креатинина <30 мл/мин и у детей на диализе не изучалось, поэтому у таких пациентов валсартан применять не рекомендуется. Не требуется коррекции дозы у детей с клиренсом креатинина > 30 мл/мин. Следует тщательно контролировать функцию почек и содержание калия в сыворотке. Это особенно касается случаев, когда валсартан применяется при наличии других состояний (напр., лихорадка, обезвоживание), способных вызвать нарушение функции почек.
Противопоказано одновременное применение блокаторов рецепторов ангиотензина II (в т.ч. САРТВАЛа) или иАПФ с препаратами, содержащими алискирен, у пациентов с умеренной/тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Применение у детей с нарушением функции печени
Как и у взрослых, САРТВАЛ противопоказан у детей при тяжелой печеночной недостаточности, билиарном циррозе печени и при холестазе. Существует ограничеснный клинический опыт применения САРТВАЛа у детей с легкой и умеренной печеночной недостаточностью. У таких пациентов доза валсартана не должна превышать 80 мг.
Исследований по оценке влияния препарата САРТВАЛ на способность управлять автомобилем и работать с механизмами не проводилось. При управлении транспортными средствами или работе с механизмами следует учитывать возможность возникновения головокружения или слабости. Как и при назначении других антигипертензивных средств, необходимо соблюдать осторожность при управлении автомобилем и работе с движущимися механизмами.
В клинических исследованиях не обнаружено имеющих клиническое значение взаимодействий валсартана со следующими лекарственными средствами: циметидин, варфарин, фуросемид, дигоксин, атенолол, индометацин, гидрохлоротиазид, амлодипин, глибенкламид.
Литий.
При одновременном применении иАПФ или БРА с препаратами лития наблюдалось обратимое повышение концентрации лития в сыворотке крови и появление токсических эффектов. Если существует необходимость совместного приема данных лекарственных средств, необходим тщательный мониторинг сывороточных концентраций лития. Если мочегонное средство также используется, можно предположить увеличение риска токсичности лития при применении САРТВАЛ.
Препараты, влияющие на CYP 450.
Поскольку САРТВАЛ не подвергается существенному метаболизму, клинически значимого взаимодействия с другими лекарственными препаратами в виде метаболической индукции или угнетения системы цитохрома Р450 при совместном применении с валсартаном не наблюдалось. Несмотря на то, что валсартан имеет высокую степень связывания с белками плазмы, исследования in vitro не продемонстрировали никакого взаимодействия на этом уровне с рядом молекул, которые также имеют высокую степень связывания с белками, а именно – диклофенаком, фуросемидом и варфарином.
Калийсберегающие диуретики, препараты калия, препараты, содержащие калий в виде солей и другие препараты, способные повысить уровень калия.
Совместное применение с калийсберегающими диуретиками (например, спиронолактон, триамтерен, амилорид), препаратами калия, калийсодержащими заменителями поваренной соли, либо с другими препаратами, которые могут увеличить уровень калия (напр., гепарин), может привести к повышению уровня калия в сыворотке крови, а у пациентов с сердечной недостаточностью может повышать уровень сывороточного креатинина. Следует контролировать уровень калия в случае необходимости совместного введения данных препаратов.
Нестероидные противовоспалительные препараты (НПВП), включая селективные ингибиторы ЦОГ-2, ацетилсалициловой кислоты (> 3 г/сут) и неселективные НПВП.
Одновременное применение НПВП и БРА может привести к ослаблению антигипертензивного эффекта. Кроме того, одновременный прием БРА и НПВП может привести к повышению риска ухудшения функции почек и увеличение уровня калия в сыворотке крови. В связи с этим рекомендуется контроль функции почек в начале лечения и адекватная гидратация пациента.
Транспортеры.
Одновременный прием ингибиторов переноса (напр., рифампин, циклоспорин) или эффлюксных транспортеров (напр., ритонавир) может усиливать действие валсартана.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС).
На основе имеющихся данных, двойная блокада РААС с применением иАПФ, БРА или препаратов, содержащих алискирен, не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией.
У пациентов с сахарным диабетом или умеренной/тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2) одновременное применение препаратов, содержащих алискирен, с иАПФ или БРА противопоказано.
В отдельных случаях, когда совместное применение иАПФ и БРА абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции почек, водно-электролитного баланса, артериального давления.
Валсартан является активным специфическим блокатором (антагонистом) рецепторов ангиотензина II (БРА), предназначенным для приема внутрь. Он действует избирательно на рецепторы подтипа AT1, которые ответственны за действие ангиотензина II. Повышенные уровни ангиотензина II в плазме вследствие блокады АТ1-рецепторов валсартаном могут стимулировать незаблокированные АТ2-рецепторы, которые уравновешивают эффект АТ1-рецепторов. Валсартан не проявляет какой-либо активности агониста в отношении АТ1-рецепторов, но обладает большим (примерно в 20000 раз) сродством к АТ1-рецепторам, чем к АТ2-рецепторам.
Валсартан не угнетает ангиотензинпревращающий фермент (АПФ), известный также под названием кининазы II, который превращает ангиотензин I в ангиотензин II и влияет на систему брадикинина. В клинических испытаниях, в которых валсартан сравнивали с ингибитором АПФ, частота развития сухого кашля была значительно ниже (р<0,05) у пациентов, получавших валсартан, чем у пациентов, получавших ингибитор АПФ (2,6% против 7,9% соответственно). Применение препарата у пациентов с артериальной гипертензией приводит в итоге к снижению артериального давления без влияния на частоту пульса.
Начало гипотензивного действия отмечается в пределах 2 часов, максимум — в пределах 4-6 часов после приема внутрь; продолжительность действия – свыше 24 часов. Максимальный терапевтический эффект развивается через 2-4 недели от начала лечения и сохраняется при длительной терапии. При применении с гидрохлоротиазидом достигается достоверное дополнительное снижение артериального давления.
Внезапная отмена препарата не сопровождается развитием синдрома отмены.
Применение препарата приводит к уменьшению случаев госпитализации по поводу сердечной недостаточности, замедлению прогрессирования сердечной недостаточности, улучшению функционального класса по классификации NYHA, увеличению фракции выброса, а также к уменьшению признаков и симптомов сердечной недостаточности и улучшению качества жизни по сравнению с плацебо.
Применение комбинации иАПФ и БРА изучалось в двух крупных рандомизированных контролируемых исследованиях (ONTARGET и VA NEPHRON-D). Исследование ONTARGET проводилось у пациентов с сердечным или сердечно-сосудистым заболеванием или с сахарным диабетом 2 типа с наличием поражения органов-мишеней. Исследование VA NEPHRON-D включало пациентов с сахарным диабетом 2 типа и диабетической нефропатией. Эти исследования не продемонстрировали достоверного благоприятного эффекта в отношении почек и/или сердечно-сосудистой системы, а также смертности, при этом наблюдалось увеличение риска гиперкалиемии, острой почечной недостаточности и/или гипотензии по сравнению с монотерапией. С учетом схожих свойств фармакодинамики результаты этих исследований также актуальны для других иАПФ и БРА. Поэтому не следует одновременно применять иАПФ и БРА у пациентов с диабетической нефропатией.
В исследовании ALTITUDE изучалась возможная польза от добавления алискирена к стандартной терапии иАПФ или БРА у пациентов с сахарным диабетом 2 типа и хроническим заболеванием почек и/или сердечно-сосудистым заболеванием. Исследование было прекращено досрочно и-за повышенного риска неблагоприятных исходов. Сердечно-сосудистая смерть и инсульт в группе алискирена наблюдались чаще, чем в группе плацебо, и сообщения о нежелательных явлениях и изучаемых серьезных нежелательные явлениях (гиперкалиемия, гипотензия и нарушение функции почек) чаще возникали в группе алискирена, чем в группе плацебо.
Фармакокинетика
После приема препарата внутрь натощак максимальная концентрация валсартана в плазме достигается через 2-4 часа. Средняя величина биодоступности препарата составляет 23%. При назначении валсартана с пищей площадь под кривой «концентрация-время» (AUC) уменьшается на 48%, хотя, начиная примерно с 8 часов после приема препарата, концентрации в плазме как в случае приема его натощак, так и в случае приема с пищей одинаковы. Уменьшение площади под кривой AUC, однако, не сопровождается значительным снижением терапевтического эффекта.
Значительная часть валсартана не подвергается биотрансформации, только около 20% дозы выводится в виде метаболитов. Гидроксиметаболит обнаруживается в плазме крови в низких концентрациях (менее 10% от AUC валсартана). Этот метаболит фармакологически неактивен.
Кинетика элиминации валсартана имеет мультиэкспоненциальный характер (t1/2α< 1 ч и t1/2β около 9 ч.).
При приеме препарата один раз в сутки кумуляция незначительна. Концентрации препарата в плазме крови у женщин и мужчин были одинаковы.
Валсартан в значительной степени связывается с белками плазмы крови (94-97 %), преимущественно с альбумином. Объем распределения в период равновесного состояния низкий (около 17 л). После внутривенного введения плазменный клиренс валсартана составляет около 2 л/ч и его почечный клиренс составляет 0,62 л/ч (около 30% от общего клиренса). Период полураспада составляет 6 часов. Количество валсартана, выводимого с калом, составляет 83% (от величины принятой внутрь дозы), примерно 13% выводится с мочой, преимущественно в неизмененном виде.
Среднее время достижения максимальной концентрации и период полувыведения валсартана у пациентов с сердечной недостаточностью и здоровых добровольцев одинаковы. Величины площади под кривой «концентрация-время» и максимальной концентрации валсартана увеличиваются линейно и почти пропорционально повышению дозы в пределах диапазона доз 40-160 мг два раза в сутки. Коэффициент кумуляции в среднем равен 1,7. Клиренс валсартана после приема внутрь составляет примерно 4,5 л/час. Возраст не влияет на клиренс препарата у пациентов с сердечной недостаточностью.
Фармакокинетика у отдельных групп пациентов
Пожилые пациенты
У некоторых пациентов пожилого возраста системное воздействие валсартана было несколько более выражено, чем у пациентов молодого возраста; однако не было показано какой-либо клинической значимости этого.
Пациенты с нарушением функции почек
Для соединений, почечный клиренс которых составляет менее 30% общего плазменного клиренса, отсутствует корреляция между функцией почек и системным воздействием. Поэтому у пациентов с нарушением функции почек (клиренс креатинина > 10 мл/мин) коррекция дозы препарата не требуется. В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов с клиренсом креатинина <10 мл/мин и у пациентов, находящихся на гемодиализе, поэтому валсартан следует применять с осторожностью у этих пациентов. Однако валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно.
Пациенты с нарушением функции печени
Около 70% от величины всосавшейся дозы препарата экскретируется с желчью, преимущественно в неизмененном виде. У пациентов с легкой и умеренной печеночной недостаточностью наблюдается увеличение в два раза AUC по сравнению со здоровыми людьми. Тем не менее, корреляция между концентрацией валсартана в плазме и степенью нарушения функции печени не обнаружена. Применение валсартана не изучалось у пациентов с тяжелым нарушением функции печени (см. разделы «Противопоказания», «Способ применения и дозы», «Меры предосторожности»).
Педиатрические пациенты
В исследовании у 26 детей с артериальной гипертензией (в возрасте от 1 до 16 лет), получавших однократную дозу суспензии валсартана (в среднем 0,9-2 мг/кг, максимальная доза 80 мг), клиренс (л/час/кг) валсартана был сопоставим у детей разного возраста внутри возрастной группы 1-16 лет и аналогичен таковому у взрослых, получавших препарат в той же лекарственной форме.
САРТВАЛ 80 мг: бледно-красные круглые таблетки, покрытые оболочкой, со скошенными краями, с риской на одной стороне таблетки; с надписями «D» с одной стороны риски и «V» — с другой; и надписью «NVR» с обратной стороны таблетки.
САРТВАЛ 160 мг: серо-оранжевые овальные таблетки, покрытые оболочкой, слегка выпуклые, с риской на одной стороне таблетки; с надписями «DX» с одной стороны риски и «DX» — с другой, и с надписью «NVR» с обратной стороны таблетки.
Хранить при температуре не выше 30 °С, в защищенном от влаги месте.
Хранить в недоступном для детей месте.
По 14 таблеток в блистере. По 2 блистера вместе с инструкцией по применению в картонной пачке.
По рецепту.
Производитель
Лек д.д., Веровшкова 57, Любляна, Словения.
- Описание препарата Сартвал
- Состав препарата Сартвал
- Показания препарата Сартвал
- Условия хранения препарата Сартвал
- Срок годности препарата Сартвал
Код ATX:
Сердечно-сосудистая система (C) > Препараты, влияющие на ренин-ангиотензиновую систему (C09) > Антагонисты ангиотензина II (C09C) > Антагонисты ангиотензина II (C09CA) > Valsartan (C09CA03)
Форма выпуска, состав и упаковка
таб., покр. оболочкой, 80 мг: 28 шт.
Рег. №: 9940/12/17/18 от 16.09.2017 — Срок действия рег. уд. не ограничен
Таблетки, покрытые оболочкой бледно-красные, круглые, со скошенными краями, с риской на одной стороне, с надписями «D» с одной стороны риски и «V» — с другой, и надписью «NVR» с обратной стороны таблетки.
Вспомогательные вещества: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172).
14 шт. — блистеры (2) — пачки картонные.
таб., покр. оболочкой, 160 мг: 28 шт.
Рег. №: 9940/12/17/18 от 06.09.2017 — Срок действия рег. уд. не ограничен
Таблетки, покрытые оболочкой бледно-красные, круглые, со скошенными краями, с риской на одной стороне, с надписями «D» с одной стороны риски и «V» — с другой, и надписью «NVR» с обратной стороны таблетки.
Вспомогательные вещества: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172).
14 шт. — блистеры (2) — пачки картонные.
Описание активных компонентов препарата САРТВАЛ . Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата. Дата обновления: 14.01.2006 г.
Фармакологическое действие
Антигипертензивное средство. Является специфическим антагонистом рецепторов ангиотензина II. Оказывает избирательное антагонистическое действие на AT1-рецепторы, которые ответственны за реализацию эффектов ангиотензина II.
Вследствие блокады AT1-рецепторов повышается плазменная концентрация ангиотензина II, который может стимулировать незаблокированные AT2-рецепторы. Не обладает агонистической активностью в отношении AT1-рецепторов. Сродство валсартана к AT1-рецепторам примерно в 20 000 раз выше, чем к AT2-рецепторам.
Не ингибирует АПФ. Не взаимодействует и не блокирует рецепторы других гормонов или ионные каналы, имеющие важное значение для регуляции функций сердечно-сосудистой системы. Не оказывает влияния на уровень общего холестерина, ТГ, глюкозы и мочевой кислоты в плазме крови.
Начало антигипертензивного действия валсартана после его применения внутрь в однократной дозе наблюдается в течение 2 ч после приема, максимальный эффект достигается в течение 4-6 ч.
Фармакокинетика
После приема внутрь валсартан быстро абсорбируется из ЖКТ, степень всасывания характеризуется индивидуальными различиями. Абсолютная биодоступность в среднем составляет 23%. Фармакокинетическая кривая валсартана имеет мультиэкспоненциальный характер (T1/2 в α-фазе < 1 ч и T1/2 в β-фазе — около 9 ч), кинетика линейная.
При курсовом применении изменений фармакокинетических параметров не отмечалось.
При приеме валсартана с пищей AUC уменьшается на 48%, при этом примерно через 8 ч после приема концентрации валсартана в плазме одинаковы у пациентов, принимавших его с пищей и натощак. Уменьшение AUC не сопровождается клинически значимым уменьшением терапевтического эффекта.
При приеме валсартана 1 раз/сут кумуляция выражена незначительно. Концентрации валсартана в плазме крови у женщин и мужчин были одинаковы.
Связывание с белками плазмы, преимущественно с альбуминами, составляет 94-97%. Vd в равновесном состоянии составляет около 17 л.
Плазменный клиренс валсартана составляет около 2 л/ч. Выводится с калом — 70% и с мочой — 30%, преимущественно в неизмененном виде.
При билиарном циррозе или обструкции желчевыводящих путей AUC валсартана увеличивается приблизительно в 2 раза.
Показания к применению
Лечение артериальной гипертензии.
Лечение хронической сердечной недостаточности (II-IV функциональный класс по классификации NYHA) у пациентов, получающих традиционную терапию диуретиками, препаратами наперстянки, а также ингибиторами АПФ или бета-адреноблокаторами.
Реклама
Режим дозирования
Принимают внутрь в дозе 80 мг 1 раз/сут или по 40 мг 2 раза/сут, ежедневно. При отсутствии адекватного эффекта суточная доза может быть постепенно увеличена.
Максимальная суточная доза составляет 320 мг в 2 приема.
Побочные действия
Со стороны сердечно-сосудистой системы: артериальная гипотензия, постуральное головокружение, постуральная гипотензия.
Со стороны ЦНС: головокружение, головная боль.
Со стороны пищеварительной системы: диарея, тошнота, повышение уровня билирубина.
Со стороны мочевыделительной системы: редко — нарушение функции почек, повышение уровня креатинина и азота мочевины (особенно при хронической сердечной недостаточности).
Со стороны обмена веществ: гиперкалиемия.
Со стороны системы кроветворения: нейтропения, уменьшение гемоглобина и гематокрита.
Аллергические реакции: редко — ангионевротический отек, сыпь, зуд, сывороточная болезнь, васкулит.
Прочие: утомляемость, общая слабость, кашель, фарингит, повышение риска развития вирусных инфекций.
Применение при беременности и кормлении грудью
Валсартан противопоказан к применению при беременности.
Неизвестно, выделяется ли валсартан с грудным молоком у человека. Применение в период лактации (грудного вскармливания) не рекомендуется.
В экспериментальных исследованиях показано, что валсартан выделяется с грудным молоком у крыс.
Применение при нарушениях функции почек
У пациентов с реноваскулярной гипертензией, развившейся вторично вследствие стеноза почечной артерии, в период лечения следует регулярно контролировать уровень мочевины и креатинина в сыворотке. Данные о безопасности применения у пациентов с КК менее 10 мл/мин отсутствуют.
Вследствие ингибирования РААС у предрасположенных пациентов возможны изменения функции почек.
Применение у детей
Безопасность и эффективность применения валсартана у детей не установлена.
Особые указания
При гипонатриемии и/или уменьшении ОЦК, а также на фоне терапии высокими дозами диуретиков в редких случаях валсартан может вызвать выраженную артериальную гипотензию. Перед началом лечения следует провести коррекцию нарушений водно-солевого обмена.
У пациентов с реноваскулярной гипертензией, развившейся вторично вследствие стеноза почечной артерии, в период лечения следует регулярно контролировать уровень мочевины и креатинина в сыворотке. Данные о безопасности применения у пациентов с КК менее 10 мл/мин отсутствуют.
С особой осторожностью применяют у пациентов с нарушениями проходимости желчных путей.
Вследствие ингибирования РААС у предрасположенных пациентов возможны изменения функции почек. При применении ингибиторов АПФ и антагонистов ангиотензиновых рецепторов у пациентов с хронической сердечной недостаточностью тяжелого течения наблюдались олигурия и/или нарастание азотемии, редко развивалась острая почечная недостаточность с риском летального исхода.
Безопасность и эффективность применения валсартана у детей не установлена.
Влияние на способность к вождению автотранспорта и управлению механизмами
При применении валсартана рекомендуется соблюдать осторожность при вождении автомобиля и управлении механизмами.
Лекарственное взаимодействие
При одновременном применении диуретиков в высоких дозах возможно развитие артериальной гипотензии.
При одновременном применении калийсберегающих диуретиков, гепарина, биологически активных добавок или заменителей соли, содержащих калий, возможно развитие гиперкалиемии.
При одновременном применении с индометацином возможно уменьшение антигипертензивного действия валсартана.
При одновременном применении с лития карбонатом описан случай развития интоксикации литием.

Все аналоги
Аналоги препарата
ВАЛЬСАКОР® (KRKA, d.d., Novo mesto, Словения)
ВАЛЗАН (Pharmacare Int. Co./German Palestinian Joint Venture, Палестина)
ДИОВАН® (NOVARTIS PHARMA, AG, Швейцария)
ВАЛСАРТАН-НАН (АКАДЕМФАРМ, Государственное предприятие, Республика Беларусь)
ВАЛЗ (ACTAVIS, Ltd., Мальта)
ВАЛСАРТАН-ЛФ (ЛЕКФАРМ, СООО, Республика Беларусь)
Аналоги КФУ
ТЕЛМИСТА® (KRKA, d.d., Novo mesto, Словения)
СЕНТОР® (GEDEON RICHTER, Plc., Венгрия)
ЛОЗАРТАН (ФАРМЛЭНД, СП ООО, Республика Беларусь)
ТИРЕГИС® (EGIS Pharmaceuticals, PLC, Венгрия)
КАНДЕСАРТАН-НАН (АКАДЕМФАРМ, Государственное предприятие, Республика Беларусь)
ВАЛЬСАКОР® (KRKA, d.d., Novo mesto, Словения)
ЭДАРБИ (TAKEDA PHARMA, A/S, Дания)
ТЕЛСАРТАН® (Dr. REDDY`s LABORATORIES, Ltd., Индия)
ЛОРИСТА® (KRKA, d.d., Novo mesto, Словения)
АПРОВЕЛЬ (SANOFI WINTHROP INDUSTRIE, Франция)
Другие препараты этого производителя
ПИРАМИЛ® ЭКСТРА ПЛЮС (Sandoz Pharmaceuticals, d.d., Словения)
ДЕЛАНИ (Sandoz Pharmaceuticals, d.d., Словения)
КАНВЕРС (Sandoz Pharmaceuticals, d.d., Словения)
СОРЕЛЬ (Sandoz Pharmaceuticals, d.d., Словения)
БЕНКОМ (Sandoz Pharmaceuticals, d.d., Словения)
ЭЛИТАРЕН (Sandoz Pharmaceuticals, d.d., Словения)
МОРИС (Sandoz Pharmaceuticals, d.d., Словения)
ТЕЙКОПЛАНИН САНДОЗ (Sandoz Pharmaceuticals, d.d., Словения)
СОРЕЛЬ ПЛЮС (Sandoz Pharmaceuticals, d.d., Словения)
ПРИЛАМ ДИУРЕТИК (Sandoz Pharmaceuticals, d.d., Словения)

Наименование
Сартвал (Валсартан Сандоз) табл 160мг №28
Основное действующее вещество
Валсартан
Форма выпуска
таблетки
Состав
1 таблетка содержит 80 мг или 160 м г валсартана; вспомогательные вещества:
Валсартан Сандоз 80 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172).
Валсартан Сандоз 160 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172), железа оксид черный (Е172).
Описание
Валсартан Сандоз 80 мг: бледно-красные круглые таблетки, покрытые оболочкой, со скошенными краями, с риской на одной стороне таблетки; с надписями «D» с одной стороны риски и «V» — с другой; и надписью «NVR» с обратной стороны таблетки. Валсартан Сандоз 160 мг: серо-оранжевые овальные таблетки, покрытые оболочкой, слегка выпуклые, с риской на одной стороне таблетки; с надписями «DX» с одной стороны риски и «DX» — с другой, и с надписью «NVR» с обратной стороны таблетки.
Фармакологическое действие
Валсартан является активным специфическим антагонистом рецепторов ангиотензина II, предназначенным для приема внутрь. Он действует избирательно на рецепторы подтипа АТ), которые ответственны за действие ангиотензина II. Повышенные уровни ангиотензина II в плазме вследствие блокады ATi-рецепторов валсартаном могут стимулировать незаблокированные АТг-рецепторы, которые уравновешивают эффект АТ-рецепторов. Валсартан не проявляет какой-либо активности агониста в отношении АТ-рецепторов, но обладает гораздо большим (примерно в 20 ООО раз) сродством к АТр рецепторам, чем к АТг-рецепторам.
Валсартан не угнетает ангиотензинпревращающий фермент (АПФ), известный также под названием кининазы II, который превращает ангиотензин I в ангиотензин II и влияет на систему брадикинина. В клинических испытаниях, в которых валсартан сравнивали с ингибитором АПФ, частота развития сухого кашля была значительно ниже (р<0,05) у пациентов, получавших валсартан, чем у пациентов, получавших ингибитор АПФ (2,6% против 7,9% соответственно). Применение препарата у пациентов с артериальной гипертензией приводит в итоге к снижению артериального давления без влияния на частоту пульса.
Начало гипотензивного действия отмечается в пределах 2 часов, максимум — в пределах 4- 6 часов после приема внутрь; продолжительность действия — свыше 24 часов. Максимальный терапевтический эффект развивается через 2-4 недели от начала лечения и сохраняется при длительной терапии. При применении с гидрохлоротиазидом достигается достоверное дополнительное снижение артериального давления.
Внезапная отмена препарата не сопровождается развитием синдрома отмены.
Применение препарата приводит к уменьшению случаев госпитализации по поводу сердечной недостаточности, замедлению прогрессирования сердечной недостаточности, улучшению функционального класса по классификации NYHA, увеличению фракции выброса, а также к уменьшению признаков и симптомов сердечной недостаточности и улучшению качества жизни по сравнению с плацебо.
Фармакокинетика
После приема препарата внутрь натощак максимальная концентрация валсартана в плазме достигается через 2-4 часа. Средняя величина биодоступности препарата составляет 23%. При назначении валсартана с пищей площадь под кривой «концентрация-время» (AUC) уменьшается на 48%, хотя, начиная примерно с 8 часов после приема препарата, концентрация в плазме как в случае приема его натощак, так и в случае приема с пищей одинаковы. Уменьшение площади под кривой AUC, однако, не сопровождается значительным снижением терапевтического эффекта.
Значительная часть валсартана не подвергается биотрансформации, только около 20% дозы выводится в виде метаболитов. Гидроксиметаболит обнаруживается в плазме крови в низких концентрациях (менее 10% от AUC валсартана). Этот метаболит фармакологически неактивен.
Кинетика элиминации валсартана имеет мультиэкспоненциальный характер (tl/2a< 1 ч и tl/2|3 около 9 ч.).
При приеме препарата один раз в сутки кумуляция незначительна. Концентрации препарата в плазме крови у женщин и мужчин были одинаковы.
Валсартан в значительной степени связывается с белками плазмы крови (94-97 %), преимущественно с альбумином. Объем распределения в период равновесного состояния низкий (около 17 л). После внутривенного введения плазменный клиренс валсартана составляет около 2 л/ч и его почечный клиренс составляет 0,62 л/ч (около 30% от общего клиренса). Период полураспада составляет 6 часов. Количество валсартана, выводимого с калом, составляет 83% (от величины принятой внутрь дозы), примерно 13% выводится с мочой, преимущественно в неизмененном виде.
Среднее время достижения максимальной концентрации и период полувыведения валсартана у пациентов с сердечной недостаточностью и здоровых добровольцев одинаковы. Величины площади под кривой «концентрация-время» и максимальной концентрации валсартана увеличиваются линейно и почти пропорционально повышению дозы в пределах диапазона доз 40-160 мг два раза в сутки. Коэффициент кумуляции в среднем равен 1,7. Клиренс валсартана после приема внутрь составляет примерно 4,5 л/час. Возраст не влияет на клиренс препарата у пациентов с сердечной недостаточностью.
Фармакокинетика у отдельных групп пациентов.
Пожилые пациенты. У некоторых пациентов пожилого возраста системное воздействие валсартана было несколько более выражено, чем у пациентов молодого возраста; однако не было показано какой-либо клинической значимости этого.
Пациенты с нарушением функции почек. Для соединений, почечный клиренс которых составляет менее 30% общего плазменного клиренса, отсутствует корреляция между функцией почек и системным воздействием. Поэтому у пациентов с нарушением функции почек (клиренс креатинина > 10 мл/мин) коррекция дозы препарата не требуется. В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов с клиренсом креатинина <10 мл/мин и у пациентов, находящихся на гемодиализе. Однако, валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно.
Пациенты с нарушением функции печени. Около 70% от величины всосавшейся дозы препарата экскретируется с желчью, преимущественно в неизмененном виде. У пациентов с легкой и умеренной печеночной недостаточностью наблюдается увеличение в два раза AUC по сравнению со здоровыми людьми. Тем не менее, корреляция между концентрацией валсартана в плазме и степенью нарушения функции печени не обнаружена. Применение валсартана не изучалось у пациентов с тяжелым нарушением функции печени (см. разделы «Противопоказания», «Способ применения и дозы», «Особенности применения»).
Показания к применению
Артериальная гипертензия.
Сердечная недостаточность (лечение сердечной недостаточности с клинической симптоматикой у пациентов, не получающих ингибиторы ангиотензинпревращающего фермента (АПФ), или в качестве дополнительной терапии к ингибиторам АПФ у пациентов, не получающих бета-блокаторы).
Недавно перенесенный инфаркт миокарда (у клинически стабильных пациентов с клиническими проявлениями сердечной недостаточности или бессимптомной систолической дисфункцией левого желудочка после перенесенного (12 часов — 10 дней) инфаркта миокарда).
Противопоказания
• Повышенная чувствительность к валсартану или к любому из компонентов препарата.
• Беременность, кормление грудью.
• Детский возраст.
• Тяжелая печеночная недостаточность, билиарный цирроз печени и холестаз.
• Одновременное применение антагонистов рецепторов ангиотензина, в том числе валсартана, или ингибиторов ангиотензин-превращающего фермента (АПФ) с алискиреном у пациентов с сахарным диабетом 2 типа или умеренной/ тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Применение при беременности и в период лактации
Прием антагонистов рецепторов ангиотензина II не рекомендуется в течение первого триместра беременности. Прием антагонистов рецепторов ангиотензина II противопоказан во втором и третьем триместрах беременности.
Эпидемиологические данные показали повышенный риск тератогенного воздействия при применении ингибиторов АПФ в первом триместре беременности. Подобный риск может существовать также при приеме антагонистов рецепторов ангиотензина II.
У пациенток, планирующих беременность, в случае необходимости должно быть назначено альтернативное антигипертензивное лечение, которое имеет установленный профиль безопасности для применения во время беременности. Когда беременность обнаружена, лечение антагонистами рецепторов ангиотензина II должно быть немедленно прекращено и, при необходимости, должно быть назначено альтернативное лечение. Известно, что прием антагонистов рецепторов ангиотензина II во втором и третьем триместрах беременности вызывает фетотоксичность (снижение функции почек, маловодие, задержка окостенения черепа) и неонатальную токсичность (почечная недостаточность, артериальная гипотензия, гиперкалиемия).
Если женщина принимала антагонисты рецепторов ангиотензина II во втором триместре беременности, необходим УЗИ контроль функции почек и черепа плода. Новорожденные, матери которых принимали антагонисты рецепторов ангиотензина II, должны внимательно наблюдаться из-за возможной артериальной гипотензии.
Не рекомендуется применять Валсартан Сандоз во время лактации, так как отсутствует информация о применении валсартана во время кормления грудью. Предпочтительно использовать альтернативные методы лечения с установленным профилем безопасности, особенно если ребенок новорожденный или недоношенный.
Дети.
Безопасность и эффективность применения Валсартана Сандоз у детей в возрасте до 18 лет не установлены.
Способ применения и дозы
Артериальная гипертензия. Рекомендуемая стартовая доза Валсартана Сандоз для взрослых составляет 80 мг или 160 мг один раз в сутки. Антигипертензивный эффект достигается в течение двух недель, а максимальный эффект наступает через четыре недели. Пациентам, у которых не удается достичь адекватного снижения артериального давления, суточную дозу можно повысить до 320 мг; возможно дополнительное назначение диуретиков.
Валсартан Сандоз можно назначать также совместно с другими антигипертензивными средствами.
Сердечная недостаточность. Рекомендуемая начальная доза Валсартана Сандоз составляет 40 мг два раза в сутки. Повышение дозы до 80 мг и 160 мг два раза в сутки должно осуществляться с интервалом не менее 2 недель, с учетом переносимости препарата пациентом. Максимальная суточная доза, которая применялась в клинических исследованиях, составила 320 мг, распределенная на несколько приемов. При сопутствующем лечении диуретиком следует рассмотреть вопрос о снижении дозы последнего.
Валсартан может применяться совместно с другими лекарственными средствами, применяемыми для лечения сердечной недостаточности. Не рекомендуется одновременный прием тройной комбинации ингибиторов АПФ, бета-блокаторов и валсартана.
Оценка состояния пациентов с сердечной недостаточностью всегда должна включать мониторинг функции почек.
Постинфарктное состояние. У клинически стабильных пациентов лечение можно начать уже через 12 часов после инфаркта миокарда. После начальной дозы 20 мг два раза в сутки дозу валсартана необходимо увеличивать до 40 мг, 80 мг и 160 мг два раза в сутки в течение следующих нескольких недель.
Максимальная доза — 160 мг два раза в сутки. В целом рекомендуется, чтобы доза 80 мг два раза в сутки была достигнута в течение двух недель после начала лечения, а целевая максимальная доза — в течение трех месяцев, исходя из переносимости пациентом валсартана в период титрования дозы. Если возникает симптоматическая артериальная гипотензия или почечная дисфункция, следует рассмотреть вопрос о снижении дозы. Валсартан можно назначать пациентам, которые лечились другими препаратами, рекомендованными после инфаркта миокарда (например, тромболитиками, ацетилсалициловой кислотой, Р-блокаторами и статинами). Не рекомендуется одновременный прием тройной комбинации ингибиторов АПФ, бета-блокаторов и валсартана.
Оценка состояния пациентов после инфаркта миокарда всегда должна включать мониторинг функции почек.
Валсартан Сандоз может применяться для лечения гипертензии у пациентов с нарушенной толерантностью к глюкозе и риском сердечно-сосудистой недостаточности. Рекомендации по дозированию см. в разделе «Артериальная гипертензия».
Препарат можно принимать независимо от приема пищи, запивая небольшим количеством воды.
Дозирование в особых группах пациентов.
Пациенты пожилого возраста. Нет необходимости в коррекции дозы у пациентов пожилого возраста.
Пациенты с нарушением функции почек. Нет необходимости в коррекции дозы у пациентов с клиренсом креатинина более 10 мл/мин.
Пациенты с нарушением функции печени. Валсартан противопоказан пациентам с тяжелой печеночной недостаточностью, билиарным циррозом печени и у пациентов с холестазом. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза доза валсартана не должна превышать 80 мг.
Особую осторожность следует соблюдать при назначении валсартана пациентам с обструкцией желчевыводящих путей.
Побочное действие
Частота возникновения побочных реакций оценивается следующим образом: очень часто — > 1/10, часто — от > 1/100, <1/10, нечасто — от > 1/1000, < 1/100, редко — от > 1/10000, <1/1000, очень редко — < 1/100000.
Со стороны системы крови и лимфатической системы: частота неизвестна — *снижение гемоглобина, *снижение гематокрита, *нейтропения, *#тромбоцитопения.
Со стороны иммунной системы: частота неизвестна — *#реакции гиперчувствительности, включая сывороточную болезнь.
Нарушение обмена веществ: частота неизвестна — *#увеличение содержания калия в сыворотке крови, *#гипонатриемия; нечасто — #гиперкалиемия.
Нарушения со стороны нервной системы: часто — ^головокружение, #постуральное головокружение; нечасто — #обмороки, #головная боль.
Со стороны органов слуха: нечасто — *#вертиго.
Со стороны сердечно-сосудистой системы: частота неизвестна — *#васкулит, часто — #ортостатическая гипотензия, #гипотензия; нечасто — #сердечная недостаточность.
Со стороны дыхательной системы: нечасто — *#кашель.
Со стороны пищеварительной системы: нечасто — *боль в животе, # диарея, #тошнота.
Со стороны гепатобилиарной системы: частота неизвестна — ^повышение уровня печеночных ферментов, *повышение уровня печеночных ферментов, включая повышение уровня билирубина в сыворотке крови.
Со стороны кожи и подкожно-жировой клетчатки: частота неизвестна
*ангионевротический отек, *#буллезный дерматит, *#сыпь, *#зуд; нечасто — #ангионевротический отек.
Со стороны скелетно-мышечной системы: частота неизвестна — *#миалгия.
Со стороны мочеполовой системы: частота неизвестна — *нарушение функции почек, * почечная недостаточность, * повышение уровня креатинина в сыворотке крови, #увеличение содержания мочевины крови; часто — Нарушение функции почек, #почечная недостаточность, нечасто — #острая почечная недостаточность, Повышение уровня креатинина в сыворотке крови.
Общие нарушения: нечасто — *#слабость; #астения.
Следующие побочные эффекты наблюдались в ходе клинических исследований независимо от их причинной связи с исследуемым препаратом: *#артралгия,
Абдоминальная боль, *астения, *#боль в спине, *диарея, * головокружение, *головная
м U II ^ Ji
боль, * бессонница, * снижение либидо, нейтропения, *тошнота, * отеки, * фарингит, *#ринит, *#синусит, *#инфекции верхних дыхательных путей, *#вирусные инфекции.
ПРИМЕЧАНИЕ
Сообщалось при: *гипертензии; #сердечной недостаточности и/или постинфарктном состоянии.
Передозировка
Вследствие передозировки Валсартаном Сандоз может развиться выраженная артериальная гипотензия, что может привести к угнетению сознания, коллапсу и/или шоку. Если препарат был принят недавно, следует вызвать рвоту. При артериальной гипотензии обычным методом терапии является внутривенное введение солевого раствора.
Выведение валсартана из организма путем гемодиализа маловероятно.
Взаимодействие с другими препаратами
В клинических исследованиях не обнаружено взаимодействий, имеющих клиническое значение, валсартана со следующими лекарственными средствами: циметидин, варфарин, фуросемид, дигоксин, атенолол, индометацин, гидрохлоротиазид, амлодипин, глибенкламид.
Литий.
При одновременном применении ингибиторов АПФ или антагонистов рецепторов ангиотензина II с препаратами лития наблюдалось обратимое повышение концентрации лития в сыворотке крови и появление токсических эффектов. Если существует необходимость совместного приема данных лекарственных средств, необходим тщательный мониторинг сывороточных концентраций лития. Если мочегонное средство также используется, можно предположить увеличение риска токсичности лития при применении Валсартана Сандоз.
Препараты, влияющие на CYP 450.
Поскольку Валсартан Сандоз не подвергается существенному метаболизму, клинически значимого взаимодействия с другими лекарственными препаратами в виде метаболической индукции или угнетения системы цитохрома Р450 при совместном применении с валсартаном не наблюдалось. Несмотря на то, что валсартан имеет высокую степень связывания с белками плазмы, исследования in vitro не продемонстрировали никакого взаимодействия на этом уровне с рядом молекул, которые также имеют высокую степень связывания с белками, а именно — диклофенаком, фуросемидом и варфарином. Калийсберегающие диуретики, препараты калия, препараты, содержащие калий в виде солей и другие препараты, способные повысить уровень калия.
Совместное применение с калийсберегающими диуретиками (например, спиронолактон, триамтерен, амилорид), препаратами калия или препаратами, содержащими калий в виде солей, может привести к повышению уровня калия в сыворотке крови. Следует контролировать уровень калия в случае необходимости совместного введения данных препаратов.
Нестероидные противовоспалительные препараты (НПВП’), включая селективные ингибиторы ЦОГ-2, ацетилсалициловая кислота (> 3 г/сут) и неселективные НПВП. Одновременное применение НПВП и антагонистов рецептора ангиотензина II может привести к ослаблению антигипертензивного эффекта. Кроме того, одновременный прием антагонистов ангиотензина II и НПВП может привести к повышенному риску ухудшения функции почек и увеличение уровня калия в сыворотке крови. В связи с этим,
Транспортеры.
Одновременный прием ингибиторов переноса (рифампин, циклоспорин) или эффлюксных транспортеров (ритонавир) может усиливать действие валсартана.
Двойная блокада ренин-ангиотензиновой-системы (РАС) антагонистами рецепторов ангиотензина, ингибиторами АПФ или алискиреном.
Одновременное применение антагонистов рецепторов ангиотензина, в том числе валсартана, с другими веществами, действующими на РАС связано с увеличением количества случаев гипотензий, гиперкалиемий, и изменений в функции почек по сравнению с монотерапией. Рекомендуется контролировать артериальное давление, функцию почек и уровень электролитов у больных применяющих Валсартан Сандоз и другие вещества, влияющие на РАС.
На основе имеющихся данных, двойная блокада РААС с применением ингибиторов АПФ, антагонистов рецепторов ангиотензина или алискирена не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией. Противопоказано одновременное применение антагонистов рецепторов ангиотензина, в том числе валсартана или ингибиторов АПФ с алискиреном у пациентов с сахарным диабетом или умеренной/ тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Меры предосторожности
Пациенты с дефицитом в организме натрия и/или объема циркулирующей крови (ОЦК). У пациентов с тяжелой степенью дефицита натрия и/или ОЦК, например, у тех, которые получают высокие дозы диуретиков, в отдельных случаях после начала терапии Валсартаном Сандоз может наблюдаться симптоматическая гипотензия. Перед началом лечения следует провести коррекцию содержания в организме натрия и/или ОЦК, например, путем снижения дозы диуретика.
При гипотензии пациента следует уложить и, если необходимо, провести внутривенную инфузию солевого раствора. Лечение можно продолжить сразу после стабилизации артериального давления.
Гиперкалиемия. Следует соблюдать осторожность при совместном применении Валсартана Сандоз с препаратами калия, калийсберегающими диуретиками, препаратами, содержащими калий в виде солей, или другими препаратами, которые могут повысить уровень калия (гепарин и др.). Рекомендуется контролировать содержание калия в крови. Стеноз почечной артерии. Кратковременное применение Валсартана Сандоз у 12 пациентов с вазоренальной гипертензией, являющейся вторичной вследствие одностороннего стеноза почечной артерии, не вызвало никаких существенных изменений гемодинамических параметров почек, креатинина сыворотки или азота мочевины крови. Поскольку другие лекарственные средства, влияющие на ренин-ангиотензин- альдостероновую систему (РААС), могут повышать уровень мочевины крови и креатинина сыворотки у пациентов с односторонним или двусторонним стенозом почечной артерии, как мера безопасности рекомендуется мониторинг этих показателей.
Нарушение функции почек. У пациентов с нарушением функции почек коррекция дозы не требуется. Однако в тяжелых случаях (клиренс креатинина < 10 мл/мин) следует соблюдать осторожность, поскольку опыт применения препарата в этих случаях отсутствует. С осторожностью применять у пациентов, находящихся на гемодиализе.
В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов, находящихся на гемодиализе. Однако валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно. Опыт применения препарата Валсартан Сандоз у пациентов с трансплантацией почки отсутствует.
Следует избегать одновременного применения антагонистов рецепторов ангиотензина, в том числе валсартана, или ингибиторов АПФ с алискиреном у пациентов с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл / мин).
Нарушение функции печени. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза Валсартан Сандоз должен применяться с осторожностью (см. разделы «Противопоказания» и «Фармакокинетика»).
Сердечная недостаточность / Постинфарктное состояние. У пациентов с сердечной недостаточностью или постинфарктным состоянием, принимающих Валсартан Сандоз в обычных дозах, наблюдается незначительное снижение артериального давления, но прекращение терапии из-за длительной симптоматической гипотензии, как правило, не требуется, если соблюдать инструкции по дозировке препарата. Необходимо соблюдать осторожность пациентам с сердечной недостаточностью или в постинфарктном состоянии, начинающим терапию.
Как следствие угнетения ренин-ангиотензин-альдостероновой системы (РААС), у лиц с повышенной чувствительностью могут наблюдаться нарушения функции почек. У пациентов с тяжелой сердечной недостаточностью, у которых функция почек зависит от активности ренин-ангиотензин-альдостероновой системы, лечение ингибиторами АПФ или антагонистами рецепторов ангиотензина могло стать причиной олигурии и/или прогрессирующей азотемии, острой почечной недостаточности (редко) и/или летального исхода. Оценка состояния пациентов с сердечной недостаточностью или в постинфарктном состоянии всегда должна включать мониторинг функции почек.
Не рекомендуется одновременный прием тройной комбинации ингибиторов АПФ, (3- блокаторов и валсартана.
Стеноз аортального и митрального клапанов, гипертрофическая кардиомиопатия. Как и при применении других вазодилататоров следует соблюдать особую осторожность при назначении препарата пациентам с аортальным или митральным стенозом, а также гипертрофической кардиомиопатией.
Ангионевротический отек.
Сообщалось о случаях ангионевротического отека, в том числе отека гортани и голосовых связок, что приводит к обструкции дыхательных путей и/или отеку лица, губ, глотки и/или языка у пациентов, получавших валсартан; у некоторых из этих пациентов ранее развивался отек Квинке при приеме других лекарственных препаратов, в том числе ингибиторов АПФ. Следует немедленно прекратить прием Валсартана Сандоз пациентам, у которых развивается ангионевротичекий отек, и препарат не должен назначаться снова. Первичный гиперальдостеронизм. Не рекомендовано назначать Валсартан Сандоз пациентам с первичным гиперальдостеронизмом.
Двойная блокада ренин-ангиотензиновой системы (РАС)
Следует избегать совместного применения антагонистов рецепторов ангиотензина, в том числе валсартана, с ингибиторами АПФ или алискиреном, особенно у пациентов с диабетической нефропатией. В отдельных случаях, когда совместное применение ингибиторов АПФ и антагонистов рецепторов ангиотензина абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции
почек, водно-электролитного баланса, артериального давления. Это относится к назначению валсартана в качестве дополнительной терапии к ингибиторам АПФ у пациентов с хронической сердечной недостаточностью при непереносимости антагонистов альдостерона (спиронолактона), у которых наблюдается сохранение симптомов хронической сердечной недостаточности, несмотря на проведение иной адекватной терапии.
Условия хранения
Хранить при температуре не выше 30°С, предохранять от воздействия влаги. Хранить в недоступном для детей месте.
Купить Сартвал таблетки п/о 160мг №14х2
Цена на Сартвал таблетки п/о 160мг №14х2
Инструкция по применению для Сартвал таблетки п/о 160мг №14х2
Сартавель — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-002327
Торговое название препарата:
Сартавель®
Международное непатентованное название (МНН):
валсартан
Лекарственная форма:
капсулы
Состав на одну капсулу:
Активное вещество:
Валсартан 20,0 мг 40,0 мг 80,0 мг 160,0 мг
Вспомогательные вещества:
Целлюлоза микрокристаллическая 152,7 мг 131,5 мг 89,1 мг 178,2 мг
Кроскармеллоза натрия 3,6 мг 3,6 мг 3,6 мг 7,2 мг
Повидон-К17 0,75 мг 1,5 мг 3,0 мг 6,0 мг
Кремния диоксид коллоидный 1,35 мг 1,8 мг 2,7 мг 5,4 мг
Магния стеарат 1,6 мг 1,6 мг 1,6 мг 3,2 мг
Капсулы твердые желатиновые №2, №0
Состав капсул:
Корпус:
Краситель железа оксид черный — 0,01%
Краситель железа оксид красный 0,008% 0,01%
Краситель железа оксид желтый 0,1763% 0,2727% 0,1763% 0,1714%
Титана диоксид 0,9744% 2% 0,9744% 3%
Желатин до 100% до 100% до 100% до 100%
Крышечка:
Краситель железа оксид черный — 0,01%
Описание:
Дозировка 20 мг. Капсулы твердые желатиновые № 2. Корпус светло-желтого цвета с бежевым оттенком, крышечка светло-желтого цвета с кремовым оттенком непрозрачные.
Дозировка 40 мг. Капсулы твердые желатиновые № 2. Корпус и крышечка светло-желтого цвета с кремовым оттенком непрозрачные.
Дозировка 80 мг. Капсулы твердые желатиновые № 2. Корпус и крышечка светло-желтого цвета с бежевым оттенком непрозрачные.
Дозировка 160 мг. Капсулы твердые желатиновые № 0. Корпус и крышечка светло-коричневого цвета непрозрачные.
Содержимое капсул — смесь порошка и гранул белого или почти белого цвета. Допускается уплотнение содержимого капсул в комки по форме капсулы, легко разрушаемые при надавливании.
Фармакотерапевтическая группа:
ангиотензина II рецепторов антагонист.
Код ATX: С09СА03
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
Валсартан — активный специфический антагонист рецепторов ангиотензина II, предназначенный для приема внутрь. Избирательно блокирует рецепторы подтипа AT1, которые ответственны за эффекты ангиотензина II. Следствием блокады АТ1 рецепторов является повышение плазменной концентрации ангиотензина II, который может стимулировать незаблокированные АТ2— рецепторы. Валсартан не имеет сколько-нибудь выраженной агонистической активности в отношении AT1-рецепторов. Сродство валсартана к рецепторам подтипа AT1 примерно в 20 000 раз выше, чем к рецепторам подтипа АТ2. Вероятность возникновения кашля при применении валсартана очень низкая, что связано с отсутствием влияния на ангиотензинпревращающий фермент (АПФ), который отвечает за деградацию брадикинина.
Сравнение валсартана с ингибитором АПФ, показало, что частота развития сухого кашля была достоверно (р < 0.05) ниже у пациентов, получавших валсартан, чем у пациентов, получавших ингибитор АПФ (2.6% против 7.9%, соответственно). В группе пациентов, у которых ранее при лечении ингибитором АПФ развивался сухой кашель, при лечении валсартаном это осложнение было отмечено в 19.5% случаев, а при лечении тиазидным диуретиком — в 19.0% случаев, в то время как в группе пациентов, получавших лечение ингибитором АПФ, кашель наблюдался в 68.5% случаев (р < 0.05). Валсартан не вступает во взаимодействие и не блокирует рецепторы других гормонов или ионные каналы, имеющие важное значение для регуляции функций сердечно-сосудистой системы. При лечении валсартаном пациентов с артериальной гипертензией отмечается снижение артериального давления (АД), не сопровождающееся изменением частоты сердечных сокращений (ЧСС).
После приема внутрь разовой дозы препарата у большинства пациентов начало антигипертензивного действия отмечается в пределах 2 часов, а максимальное снижение АД достигается в пределах 4-6 часов. После приема препарата антигипертензивное действие сохраняется более 24 часов. При повторных назначениях препарата максимальное снижение АД, вне зависимости от принятой дозы, обычно достигается в пределах 2-4 недель и поддерживается на достигнутом уровне в ходе длительной терапии. В случае комбинации препарата с гидрохлоротиазидом достигается достоверное дополнительное снижение АД. Резкое прекращение приема валсартана не сопровождается резким повышением АД или другими нежелательными последствиями.
Механизм действия валсартана при хронической сердечной недостаточности основан на его способности устранять отрицательные последствия хронической гиперактивации ренин-ангиотензин-альдостероновой системы (РААС) и ее главного эффектора — ангиотензина II, а именно, — вазоконстрикцию; задержку жидкости в организме; пролиферацию клеток, ведущую к ремодели-рованию органов-мишеней (сердце, почки, сосуды); стимуляцию избыточного синтеза гормонов, действующих синергично с РААС (катехоламинов, альдо-стерона, вазопрессина, эндотелина и др.). На фоне применения валсартана при хронической сердечной недостаточности (ХСН) уменьшается предна-грузка, снижается давление заклинивания в легочных капиллярах (ДЗЛК) и диастолическое давление в легочной артерии, повышается сердечный выброс. Наряду с гемодинамическими эффектами, валсартан за счет опосредованной блокады синтеза альдостерона уменьшает задержку натрия и воды в организме.
Установлено, что препарат не оказывал существенного влияния на концентрацию общего холестерина, мочевой кислоты, а также при исследовании натощак — на концентрацию триглицеридов и глюкозы в сыворотке крови.
Фармакокинетика
Валсартан быстро всасывается после приема внутрь, однако степень абсорбции варьирует в широких пределах. Средняя величина абсолютной биодоступности валсартана составляет 23%. Время, необходимое для достижения максимальной концентрации (ТCmax) — 2 часа. После регулярного применения максимальное снижение АД развивается через 4 недели. При применении препарата однократно в сутки кумуляция его незначительная. Концентрация валсартана в плазме крови одинакова у мужчин и женщин.
Валсартан активно связывается с белками сыворотки крови (94-97%), преимущественно с альбумином. Объем распределения валсартана небольшой, около 17 л. Плазменный клиренс относительно низкий (примерно 2 л/час) при сравнении с печеночным кровотоком (примерно 30 л/час). Валсартан не подвергается выраженному метаболизму (около 20% принятой дозы определяется в виде метаболитов). Гидроксильный метаболит определяется в плазме крови в низких концентрациях (менее чем 10% от площади под кривой «концентрация-время» (AUC) валсартана). Этот метаболит фармакологически неактивен. Валсартан выводится двухфазно: альфа-фаза с периодом полувыведения менее 1 часа и бета-фаза с периодом полувыведения – около 9 часов.
Выводится валсартан в основном в неизмененном виде через кишечник (около 83%) и почками (около 13%). Период полувыведения (Т1/2) валсартана составляет 6 часов.
При применении валсартана с пищей уменьшается площадь под кривой «концентрация-время» (AUC) на 48%. Тем не менее, через 8 часов после применения препарата концентрация валсартана в плазме крови, принятого натощак и с пищей, одинакова. Уменьшение AUC не сопровождается клинически значимым уменьшением терапевтического эффекта валсартана, поэтому препарат можно применять как до, так и после приема пищи.
Фармакокинетика у особых групп пациентов
Пациенты с ХСН
У данной категории пациентов TCmax и Т1/2 сходны с таковыми у здоровых добровольцев. Повышение AUC и Cmax прямо пропорционально увеличению дозы препарата (с 40 мг до 160 мг 2 раза/сутки). Фактор кумуляции со-80,0 мг 160,0 мг ставляет в среднем 1,7. При приеме внутрь клиренс валсартана составил приблизительно 4,4 л/час. Возраст пациентов с ХСН не оказывал влияния на клиренс валсартана.
Пациенты в возрасте старше 65 лет
У некоторых пациентов в возрасте старше 65 лет системная биодоступность валсартана выше таковой у пациентов молодого возраста, однако, какая-либо клиническая значимость отсутствует.
Пациенты с нарушением функции почек
Корреляция между функцией почек и системной биодоступностью валсартана отсутствует. У пациентов с нарушениями функции почек и клиренсом 0,01% креатинина (КК) более 10 мл/мин коррекции дозы не требуется. В настоящее время отсутствуют данные о применении у пациентов, находящихся на гемодиализе. Валсартан имеет высокую степень связывания с белками плазмы крови, поэтому его выведение с помощью гемодиализа маловероятно.
Пациенты с нарушением функции печени
У пациентов с легкими и умеренными нарушениями функции печени отме-0,01% чается повышение биодоступности (AUC) валсартана в 2 раза по сравнению со здоровыми добровольцами. Однако не наблюдается корреляции значений AUC валсартана со степенью нарушений функции печени. Применение у пациентов с тяжелыми нарушениями функции печени не изучалось.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
- артериальная гипертензия.
- хроническая сердечная недостаточность у пациентов, получающих стандартную терапию одним или несколькими препаратами: диуретиками, сердечными гликозидами, ингибиторами АПФ или бета-адреноблокаторами. Применение каждого из перечисленных препаратов не является обязательным.
- для повышения выживаемости пациентов после перенесенного острого инфаркта миокарда, осложненного левожелудочковой недостаточностью и/или систолической дисфункцией левого желудочка, при наличии стабильных показателей гемодинамики.
ПРОТИВОПОКАЗАНИЯ
- повышенная чувствительность к любому компоненту препарата;
- беременность, планирование беременности; период лактации;
- возраст до 18 лет;
- тяжелые нарушения функции печени (более 9 баллов по шкале Чайлд-Пью), билиарный цирроз и холестаз;
- одновременное применение антагонистов рецепторов ангиотензина II включая валсартан, или ингибиторов АПФ с алискиреном у пациентов с сахарным диабетом.
С ОСТОРОЖНОСТЬЮ
При двустороннем стенозе почечных артерий, стенозе артерии единственной почки, первичном гиперальдостеронизме, при соблюдении диеты с ограничением потребления поваренной соли, при состояниях, сопровождающихся снижением объема циркулирующей крови (ОЦК) (в том числе диарея, рвота), при печеночной недостаточности легкой и умеренной степени тяжести небилиарного генеза без явлений холестаза, при почечной недостаточности (клиренс креатинина менее 10 мл/мин), в том числе пациентов, находящихся на гемодиализе (клинические данные отсутствуют), валсартан следует назначать с осторожностью; митральный или аортальный стеноз, гипертрофическая обструктивная кардиомиопатия, у пациентов после трансплантации почки. Хроническая сердечная недостаточность II-IV функционального класса по классификации NYHA; одновременное применение антагонистов рецепторов ангиотензина II, включая валсартан, с другими средствами, ингибирующими РААС, такими как ингибиторы АПФ и др.
Не рекомендуется применять валсартан одновременно с ингибиторами АПФ, поскольку данная комбинированная терапия не имеет преимуществ перед монотерапией валсартаном или ингибитором АПФ в отношении показателей общей смертности по любой причине.
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ
Применение препарата Сартавель® противопоказано во время беременности.
Учитывая механизм действия антагонистов рецепторов ангиотензина II нельзя исключить риск для плода. Действие ингибиторов АПФ (препаратов, оказывающих влияние на РААС) на плод, в случае их назначения во втором и третьем триместрах беременности, приводит к его повреждению и гибели. По ретроспективным данным при применении ингибиторов АПФ в первом триместре беременности повышается риск рождения детей с врожденными дефектами. Имеются сообщения о самопроизвольных абортах, олигогидрам-нионе и нарушениях функции почек у новорожденных, матери которых в период беременности неумышленно получали валсартан. Сартавель®, как и любой другой препарат, оказывающий непосредственное влияние на РААС, не следует применять при беременности, а также у женщин, планирующих беременность. При применении средств, воздействующих на РААС, врачу следует проинформировать женщин детородного возраста о потенциальном риске отрицательного влияния данных препаратов на плод во время беременности.
Если беременность выявлена в период лечения препаратом Сартавель® препарат следует отменить как можно скорее.
Неизвестно, выделяется ли валсартан в грудное молоко. Поэтому не следует применять препарат Сартавель® в период кормления грудью.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Капсулы принимать внутрь, не разжевывая.
Артериальная гипертензия
Рекомендуемая начальная доза препарата Сартавель® составляет 80 мг 1 раз в сутки ежедневно, вне зависимости от расовой принадлежности, возраста и пола пациента. Антигипертензивный эффект развивается в первые 2 недели лечения; максимальный эффект отмечается через 4 недели. Тем пациентам, у которых не удается достичь адекватного терапевтического ответа, суточная доза препарата Сартавель® может быть увеличена до максимальной суточной дозы 320 мг или необходимо дополнительно применять диуретические средства.
Хроническая сердечная недостаточность
Рекомендуемая начальная доза препарата Сартавель® составляет 40 мг 2 раза в сутки ежедневно. Дозу препарата Сартавель® следует постепенно увеличить в течение как минимум 2 недель до 80 мг 2 раза в сутки, а при хорошей переносимости — до 160 мг 2 раза в сутки. При этом может потребоваться снижение доз одновременно принимаемых диуретиков. Максимальная суточная доза препарата Сартавель® составляет 320 мг в 2 приема.
Для повышения выживаемости после перенесенного инфаркта миокарда
Лечение следует начинать в течение 12 часов после перенесенного инфаркта миокарда. Начальная доза составляет 20 мг 2 раза в сутки. Повышение дозы проводится методом титрования (40 мг, 80 мг, 160 мг 2 раза в сутки) в течение нескольких последующих недель, до достижения целевой дозы 160 мг 2 раза в сутки. Максимальная суточная доза составляет 320 мг в 2 приема. Как правило, рекомендуется достижение дозы до 80 мг 2 раза в сутки к концу второй недели лечения. Достижение максимальной целевой дозы по 160 мг 2 раза в сутки рекомендуется к концу третьего месяца терапии препаратом Сартавель®. Увеличение дозы зависит от переносимости препарата в период титрования.
В случае развития артериальной гипотензии, сопровождающейся клиническими проявлениями, или нарушения функции почек следует рассмотреть возможность снижения дозы. Оценка состояния пациентов в период после перенесенного инфаркта миокарда должна включать оценку функции почек.
Применение у пациентов в возрасте старше 65 лет
У пожилых пациентов коррекции дозы не требуется.
Пациенты с нарушениями функции почек
У пациентов с нарушениями функции почек коррекции дозы не требуется. В настоящее время отсутствуют клинические данные о применении препарата у пациентов с КК менее 10 мл/мин.
Пациенты с нарушениями функции печени
Пациенты с легкими или умеренными нарушениями функции печени небили-арного генеза без явлений холестаза препарат следует применять с осторожностью, суточная доза не должна превышать 80 мг.
ПОБОЧНОЕ ДЕЙСТВИЕ
Частота побочных эффектов: «очень часто» (1/10 и более); «часто» (1/100 и более, менее 1/10); «нечасто» (1/1000 и более, менее 1/100); «редко» (1/10000 и более, менее 1/1000), «очень редко» (менее 1/10000). Для всех нежелательных явлений, выявленных в клинической практике и при анализе лабораторных показателей (частоту развития которых установить невозможно) использовалась градация «частота неизвестна».
Пациенты с артериальной гипертензией
Со стороны системы кроветворения: частота неизвестна – снижение гемоглобина, гематокрита, нейтропения, тромбоцитопения.
Со стороны иммунной системы: частота неизвестна – реакции повышенной чувствительности, включая сывороточную болезнь.
Нарушения метаболизма: частота неизвестна – повышение содержания калия в сыворотке крови.
Со стороны гепатобилиарной системы: частота неизвестна – нарушение функции печени, включая повышение концентрации билирубина в плазме крови.
Со стороны органа слуха и лабиринтные расстройства: нечасто — вертиго.
Со стороны сердечно-сосудистой системы: частота неизвестна – васкулит.
Со стороны дыхательной системы: нечасто — кашель.
Со стороны желудочно-кишечного тракта: нечасто — боли в животе.
Со стороны кожи и подкожной клетчатки: очень редко – ангионевротический отек; кожная сыпь, зуд; частота неизвестна — буллезный дерматит.
Со стороны костно-мышечной системы: частота неизвестна – миалгия.
Со стороны почек: частота неизвестна – нарушения функции почек, повышение концентрации креатинина в сыворотке крови.
Прочие: нечасто — повышенная утомляемость.
Также в ходе клинических исследований у пациентов с артериальной ги-пертензией, наблюдались следующие нежелательные явления, причинно-следственная связь с приемом препарата не установлена: артралгия, астения, боль в спине, диарея, головокружение, бессонница, снижение либидо, тошнота, периферические отеки, фарингит, ринит, синусит, инфекции верхних дыхательных путей, вирусные инфекции.
Пациенты, которые получали препарат после перенесенного инфаркта миокарда и/или ХСН
Со стороны системы кроветворения: частота неизвестна – тромбоцитопения.
Со стороны иммунной системы: частота неизвестна – реакции повышенной чувствительности, включая сывороточную болезнь. Нарушения метаболизма: нечасто – гиперкалиемия.
Со стороны нервной системы: часто – головокружение, постуральное головокружение; нечасто – обморок, головная боль.
Со стороны органа слуха и лабиринтные расстройства: нечасто — вертиго.
Со стороны сердечно-сосудистой системы: часто – выраженное снижение АД, ортостатическая гипотензия; нечасто – усиление симптомов течения ХСН; частота неизвестна – васкулит.
Со стороны дыхательной системы: нечасто — кашель.
Со стороны желудочно-кишечного тракта: нечасто – тошнота, диарея.
Со стороны костно-мышечной системы: редко – рабдомиолиз, частота неизвестна – миалгия.
Со стороны почек: часто – нарушения функции почек; нечасто – острая почечная недостаточность, повышение концентрации креатинина в сыворотке крови; частота неизвестна – повышение содержания азота мочевины в плазме крови.
Общие нарушения: нечасто – астения, повышенная утомляемость.
Со стороны гепатобилиарной системы: частота неизвестна – нарушение функции печени.
ПЕРЕДОЗИРОВКА
Симптомы: при передозировке препарата Сартавель® основным проявлением является выраженное снижение АД, которое может привести к угнетению сознания, коллапсу и/или шоку.
Лечение: симптоматическое, характер которого зависит от времени, прошедшего с момента приема препарата, и от степени тяжести симптомов. При случайной передозировке следует вызвать рвоту (если препарат принят недавно) или провести промывание желудка. При выраженном снижении АД обычным методом терапии является внутривенное введение 0.9% раствора натрия хлорида, пациента следует уложить, приподняв ноги, на необходимый для терапии период времени, принять активные меры по поддержанию деятельности сердечно-сосудистой системы, включая регулярный контроль деятельности сердца и дыхательной систем, объема ОЦК и количества выделяемой мочи.
Маловероятно, что валсартан можно вывести из организма при помощи гемодиализа.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ
Двойная блокада РААС при применении антагонистов рецепторов ан—гиотензина II, ингибиторов АПФ или алискирена
Одновременное применение антагонистов рецепторов ангиотензина II, включая валсартан, с другими препаратами, оказывающими влияние на РААС, связано с повышенной частотой развития артериальной гипотензии, гиперкалиемии и нарушений функции почек по сравнению с монотерапией. Рекомендуется контроль артериального давления, функции почек и содержания электролитов у пациентов, принимающих препарат Сартавель® и другие лекарственные средства, оказывающие влияние на РААС. Установлено, что при монотерапии валсартаном отсутствуют клинически значимые взаимодействия со следующими лекарственными препаратами: циметидин, варфарин, фуросемид, дигоксин, атенолол, индометацин, ги-дрохлоротиазид, амлодипин и глибенкламид.
Нестероидные противовоспалительные препараты (НПВП):
при одновременном применении с НПВП (включая селективные ингибиторы циклооксигеназы-2 (ЦОГ-2)) возможно снижение антигипертензивного действия валсартана. При применении антагонистов рецепторов ангиотензина II одновременно с НПВП возможно ухудшение функции почек и повышение содержания калия в плазме крови. При необходимости одновременного применения валсартана и НПВП до начала терапии необходимо провести оценку функции почек и коррекцию нарушений водно-электролитного баланса.
Препараты лития:
при одновременном применении ингибиторов АПФ и антагонистов рецепторов ангиотензина II одновременно с препаратами лития отмечается повышение содержания лития в плазме крови и усиление его токсического действия. Сартавель® не рекомендуется применять одновременно с препаратами лития (опыт применения ограничен). При необходимости одновременного применения препарата Сартавель® и препаратов лития необходимо обеспечить контроль содержания лития в плазме крови.
Препараты калия:
одновременное применение калийсберегающих диуретиков (в т.ч. спиронолактона, триамтерена, амилорида), препаратов калия или солей, содержащих калий, может привести к увеличению содержания калия в сыворотке крови и у пациентов с сердечной недостаточностью к увеличению концентрации креатинина сыворотки крови. Если такое комбинированное лечение признано необходимым, следует соблюдать осторожность.
Белки—переносчики
По результатам исследования in vitro на культурах печени валсартан является субстратом для белков-переносчиков ОАТЗ1В1 и MRP2. Одновременное назначение валсартана с ингибиторами белка-переносчика ОАТР1В1 (рифампицин, циклоспорин) и с ингибитором белка-переносчика MRP2 (ритонавир) может увеличить системную экспозицию Сартавеля® (Cmax и AUC).
ОСОБЫЕ УКАЗАНИЯ
Дефицит в организме натрия и/или снижение объема циркулирующей крови (ОЦК)
У пациентов с выраженным дефицитом в организме натрия и/или сниженным ОЦК, например, получающих высокие дозы диуретиков, в редких случаях в начале лечения препаратом Сартавель® может возникать артериальная гипотензия, сопровождающаяся клиническими проявлениями. Перед началом лечения препаратом Сартавель® следует провести коррекцию содержания в организме натрия и/или ОЦК, в том числе, путем уменьшения дозы диуретика.
В случае развития артериальной гипотензии пациента следует уложить, ноги приподнять. При необходимости провести внутривенную инфузию 0,9% раствором натрия хлорида. После того, как АД стабилизируется, лечение препаратом Сартавель® можно продолжать.
Гиперкалиемия
При одновременном применении с биологически активными добавками, содержащими калий, калийсберегающими диуретиками, калийсодержащими заменителями соли, или с другими лекарственными препаратами, которые могут вызывать гиперкалиемию (например, с гепарином), следует соблюдать осторожность и проводить регулярный контроль содержания калия в крови.
Стеноз почечной артерии
Применение препарата Сартавель® коротким курсом у пациентов с ренова-скулярной гипертензией, развившейся вторично вследствие одностороннего стеноза почечной артерии, не привело к сколько-нибудь существенным изменениям почечной гемодинамики, концентрации креатинина сыворотки крови или азота мочевины крови. Однако, учитывая, что другие лекарственные средства, влияющие на РААС, могут вызвать повышение концентрации мочевины и креатинина в сыворотке крови у пациентов с двусторонним или односторонним стенозом почечной артерии, в качестве меры предосторожности рекомендуется контроль этих показателей.
Нарушения функции почек
Пациентам с нарушением функции почек не требуется коррекции дозы препарата. Однако, при выраженных нарушениях функции почек (когда клиренс креатинина составляет менее 10 мл/мин) рекомендуется соблюдать осторожность. Следует избегать одновременного применения антагонистов рецепторов ангиотензина II, включая валсартан, или ингибиторов АПФ с алискиреном у пациентов с тяжелыми нарушениями функции почек (КК менее 30 мл/мин).
Трансплантация почки
Данных о безопасности применения препарата Сартавель® у пациентов, перенесших трансплантацию почки, нет.
Нарушение функции печени
У пациентов с печеночной недостаточностью не требуется коррекции дозы препарата, за исключением случаев холестаза. Валсартан выводится главным образом в неизмененном виде с желчью через кишечник, и было показано, что у пациентов с обструкцией желчевыводящих путей клиренс валсарта-на снижен. При назначении препарата Сартавель® этим пациентам следует соблюдать особую осторожность.
Отек Квинке
Отек Квинке, в том числе гортани и голосовых складок, приводящих к обструкции дыхательных путей, и/или отек лица, губ, глотки и/или отек языка, встречался у пациентов, получавших валсартан, у некоторых из этих пациентов ранее возникал отек Квинке на фоне приема других препаратов, в том числе ингибиторов АПФ. Прием препарата Сартавель® в случае развития отека Квинке должен быть немедленно отменен, возобновление приема препарата Сартавель® запрещено.
Первичный гиперальдостеронизм
Препарат неэффективен для терапии артериальной гипертензии у пациентов с первичным гиперальдостеронизмом, поскольку у данной категории пациентов не отмечается активация РААС. ХСН/период после перенесенного инфаркта миокарда У пациентов с ХСН или после перенесенного инфаркта миокарда, начинающих лечение препаратом Сартавель®, часто отмечается некоторое снижение АД, в связи с чем, рекомендуется контролировать АД в начале терапии. При условии соблюдения рекомендаций по режиму дозирования обычно не возникает необходимости отмены Сартавель® по причине артериальной гипотензии. Оценка состояния пациентов с ХСН должна включать оценку функции почек.
Вследствие ингибирования РААС у некоторых пациентов возможны нарушения функции почек. У пациентов с ХСН II-IV функционального класса по классификации NYHA лечение ингибиторами АПФ и антагонистами рецепторов ангиотензина II может сопровождаться олигурией и/или нарастанием азотемии и (редко) острой почечной недостаточностью и/или смертельным исходом. Поэтому у данных категорий пациентов перед применением препарата Сартавель®, а также периодически во время терапии препаратом, необходимо проводить оценку функции почек. Комбинированная терапия при артериальной гипертензии При артериальной гипертензии препарат Сартавель® может применяться в монотерапии, а так же одновременно с другими гипотензивными препаратами.
Комбинированная терапия в период после перенесенного инфаркта миокарда
Возможно применение препарата Сартавель® в комбинации с другими препаратами, применяемыми после перенесенного инфаркта миокарда, а именно: тромболитиками, ацетилсалициловой кислотой в качестве антиагрегантного средства, бета-адреноблокаторами и ингибиторами ГМГ-КоА-редуктазы (статинами).
У данной категории пациентов не рекомендуется применять препарат Сартавель® одновременно с ингибиторами АПФ, поскольку данная комбинированная терапия не имеет преимуществ перед монотерапией валсартаном или ингибитором АПФ в отношении показателей общей смертности по любой причине.
Комбинированная терапия при ХСН
При ХСН препарат Сартавель® может применяться как в монотерапии, так и одновременно с другими препаратами – диуретиками, сердечными гликози-дами, а также ингибиторами АПФ или бета-адреноблокаторами. У данной категории пациентов не рекомендуется применение тройной комбинированной терапии ингибиторов АПФ, бета-адреноблокатором и препаратом Сартавель®.
Влияние на способность управлять автотранспортом и работать с механизмами
С осторожностью применяют у пациентов, управляющих автотранспортными средствами и занимающихся деятельностью, требующей повышенного внимания и быстроты двигательных и психических реакций (риск развития головокружения или обморока).
Форма выпуска
Капсулы 20 мг, 40 мг, 80 мг и 160 мг.
По 10, 20, 30 капсул в контурную ячейковую упаковку из пленки поливинилх-лоридной и фольги алюминиевой печатной лакированной. По 10, 20, 30, 40, 50 или 100 капсул в банки полимерные для лекарственных средств.
Одну банку или 1, 2, 3, 4, 5, 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную упаковку (пачку).
Условия хранения
В защищенном от света месте при температуре не выше 25 °С Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать после истечения срока годности.
Условия отпуска
По рецепту.
Юридический адрес: 445351, Россия, Самарская обл., г. Жигулевск, ул. Песочная, д. 11
Адрес места производства (адрес для переписки, в том числе для приема претензий):
445351, Россия, Самарская обл., г. Жигулевск, ул. Гидростроителей, д. 6
ПРОИЗВОДИТЕЛЬ
ООО «Озон»
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Обобщенные научные материалы по действующему веществу препарата Сартавель® (капсулы, 20 мг)
Дата последней актуализации: 18.08.2021
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Владелец РУ
- Условия хранения
- Срок годности
- Источники информации
- Фармакологическая группа
- Характеристика
- Фармакология
- Показания к применению
- Нозологическая классификация (МКБ-10)
- Противопоказания
- Применение при беременности и кормлении грудью
- Побочные действия
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Отзывы
Действующее вещество
ATX
Владелец РУ
Атолл ООО
Условия хранения
В защищенном от света месте, при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Источники информации
www.rxlist.com, 2021.
Фармакологическая группа
Характеристика
Валсартан — непептидный специфический АРА II, действующий на подтип рецепторов AT1.
Мелкий порошок белого или почти белого цвета, растворим в этаноле и метаноле, мало растворим в воде. Молекулярная масса 435,5.
Фармакология
Механизм действия
Ангиотензин II образуется из ангиотензина I в реакции, катализируемой АПФ (кининаза II). Ангиотензин II является основным прессорным агентом РААС, его эффекты включают вазоконстрикцию, стимуляцию синтеза и высвобождения альдостерона, сердечную стимуляцию и реабсорбцию натрия в почках. Валсартан блокирует сосудосуживающие и альдостеронсекретирующие эффекты ангиотензина II, избирательно блокируя связывание ангиотензина II с рецепторами AT1 во многих тканях, таких как гладкие мышцы сосудов и надпочечники. Его действие, таким образом, не зависит от путей синтеза ангиотензина II.
Во многих тканях обнаружены также рецепторы AT2, но их связь с сердечно-сосудистым гомеостазом не установлена. Валсартан имеет гораздо большее сродство (примерно в 20000 раз) к рецепторам AT1, чем к рецепторам AT2. Повышенные уровни ангиотензина II в плазме после блокады рецепторов AT1 валсартаном могут стимулировать незаблокированные рецепторы AT2. Основной метаболит валсартана не имеет существенной активности, его сродство к рецепторам AT1 примерно в 200 раз меньше, чем валсартана.
Блокада РААС ингибиторами АПФ, ингибирующими биосинтез ангиотензина II из ангиотензина I, широко применяется при лечении гипертензии. Ингибиторы АПФ, кроме того, ингибируют деградацию брадикинина, реакцию, также катализируемую АПФ. Поскольку валсартан не ингибирует АПФ (кининаза II), он не влияет на реакцию на брадикинин. Пока неизвестно, имеет ли это различие клиническое значение. Валсартан не связывает и не блокирует рецепторы других гормонов или ионные каналы, которые, как известно, играют важную роль в регуляции функций ССС.
Блокада рецепторов ангиотензина II подавляет отрицательную регуляторную обратную связь ангиотензина II на секрецию ренина, но повышенная в результате активность ренина плазмы и уровни циркулирующего ангиотензина II не препятствуют эффекту валсартана на АД.
Фармакодинамика
Валсартан подавляет прессорный эффект инфузий ангиотензина II. Пероральная доза 80 мг подавляет прессорный эффект примерно на 80% на пике, при этом ингибирование примерно на 30% сохраняется в течение 24 ч. Информация о влиянии бóльших доз отсутствует.
Устранение отрицательной обратной связи ангиотензина II вызывает 2–3-кратное повышение уровня ренина в плазме и, как следствие, повышение концентрации ангиотензина II в плазме у пациентов с гипертензией. После приема валсартана наблюдалось минимальное снижение уровня альдостерона в плазме и очень небольшое влияние на уровень калия в сыворотке.
В исследованиях множественных доз у пациентов с гипертензией со стабильной почечной недостаточностью и пациентов с реноваскулярной гипертензией валсартан не оказывал клинически значимого влияния на СКФ, фракцию фильтрации, клиренс креатинина или почечный плазмоток.
В исследованиях множественных доз у пациентов с гипертензией валсартан не оказывал заметного влияния на уровни общего Хс, триглицеридов натощак, глюкозы в сыворотке натощак или мочевой кислоты.
Фармакокинетика
Cmax валсартана в плазме крови достигается через 2–4 ч после приема. Валсартан демонстрирует биэкспоненциальную кинетику распада после в/в введения со средним Т1/2 около 6 ч. Абсолютная биодоступность — около 25% (от 10 до 35%). Биодоступность в виде суспензии в 1,6 раза больше, чем в виде таблеток. При приеме в виде таблеток пища снижает экспозицию (измеренную по AUC) валсартана примерно на 40% и Cmax в плазме примерно на 50%. Значения AUC и Cmax валсартана увеличиваются приблизительно линейно с увеличением дозы в пределах клинического диапазона доз. Валсартан не кумулирует в плазме крови после многократного применения.
Метаболизм и выведение
Валсартан при приеме внутрь в виде раствора преимущественно выводится с фекалиями (около 83% дозы) и мочой (около 13% дозы). Выведение осуществляется в основном в неизмененном виде, только около 20% дозы — в виде метаболитов. Основным метаболитом, составляющим около 9% дозы, является валерил-4-гидроксивалсартан. Исследования метаболизма in vitro с участием рекомбинантных изоферментов CYP цитохрома Р450 показали, что за образование валерил-4-гидроксивалсартана отвечает изофермент CYP2C9. Валсартан не ингибирует изоферменты CYP цитохрома Р450 в клинически значимых концентрациях. Взаимодействие, опосредованное CYP 450, валсартана и ЛС, принимаемых одновременно, маловероятно из-за низкой степени метаболизма.
После в/в введения плазменный клиренс валсартана составляет около 2 л/ч, почечный клиренс — 0,62 л/ч (около 30% общего клиренса).
Распределение
Vd валсартана после в/в введения в равновесном состоянии небольшой (17 л), что указывает на то, что валсартан не распределяется в тканях широко. Связывание валсартана с белками сыворотки крови высокое (95%), в основном с альбумином сыворотки.
Зависимость параметров фармакокинетики от некоторых факторов
Педиатрические пациенты. В исследовании у педиатрических пациентов с гипертензией (n=26, от 1 года до 16 лет), получавших однократные дозы суспензии валсартана (в среднем от 0,9 до 2 мг/кг), значения клиренса (л/ч/кг) валсартана у детей были сходными с таковыми у взрослых.
Гериатрические пациенты. Экспозиция валсартана (измеренная по AUC) у пожилых людей выше на 70%, а Т1/2 больше на 35%, чем у молодых. Корректировка дозы не требуется.
Пол. Фармакокинетика валсартана существенно не различается у мужчин и женщин.
Сердечная недостаточность. Среднее время достижения Cmax и Т1/2 валсартана у пациентов с сердечной недостаточностью схожи с теми, которые наблюдаются у здоровых добровольцев. Значения AUC и Cmax валсартана линейно увеличиваются и почти пропорциональны увеличению дозы в пределах клинического диапазона доз (от 40 до 160 мг 2 раза в день). Средний коэффициент кумуляции составляет около 1,7. Кажущийся клиренс валсартана после перорального приема составляет примерно 4,5 л/ч. Возраст не влияет на кажущийся клиренс у пациентов с сердечной недостаточностью.
Почечная недостаточность. Нет очевидной корреляции между функцией почек (измеренной по клиренсу креатинина) и экспозицией валсартана (измеренной по AUC) у пациентов с различной степенью почечной недостаточности. Следовательно, коррекция дозы не требуется у пациентов с нарушением функции почек легкой и средней степени тяжести. Исследования у пациентов с тяжелым нарушением функции почек (Cl креатинина <10 мл/мин) не проводили. Валсартан не выводится из плазмы при гемодиализе. При тяжелой почечной недостаточности необходимо соблюдать осторожность при дозировании валсартана.
Печеночная недостаточность. В среднем у пациентов с хроническим заболеванием печени от легкой до умеренной степени экспозиция валсартана (оцененная по значениям AUC) вдвое выше по сравнению с экспозицией у здоровых добровольцев (с учетом возраста, пола и массы тела). Как правило, у пациентов с заболеванием печени легкой и средней степени тяжести коррекция дозы не требуется. Следует проявлять осторожность у пациентов с заболеванием печени.
Доклиническая токсикология
Канцерогенность, мутагенность, влияние на фертильность
Не обнаружено доказательств канцерогенности при приеме валсартана с пищей в дозах до 160 и 200 мг/кг/сут у мышей и крыс соответственно в период до 2 лет. Эти дозы для мышей и крыс примерно в 2,6 и 6 раз соответственно превышают МРДЧ из расчета на мг/м2 (в расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг).
В исследовании мутагенности не выявлено каких-либо эффектов, связанных с валсартаном, ни на генном уровне, ни на уровне хромосом. Эти анализы включали тесты на бактериальную мутагенность с Salmonella (Ames) и E.coli; тест генных мутаций на клетках китайского хомячка линии V79; цитогенетический тест на клетках яичника китайского хомячка и микроядерный тест у крыс.
Валсартан не оказывал неблагоприятного воздействия на репродуктивную функцию самцов или самок крыс при пероральных дозах до 200 мг/кг/сут. Эта доза в 6 раз превышает МРДЧ из расчета мг/м2 (в расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг).
Фармакология и токсикология у животных
Исследования репродуктивной токсикологии
При пероральном применении валсартана в дозах до 600 мг/кг/сут у беременных мышей и крыс и в дозах до 10 мг/кг/сут у крольчих тератогенных эффектов не наблюдалось. Однако в исследованиях, в которых беременные крысы получали валсартан в пероральных дозах 600 мг/кг/сут, токсичных для матери (снижение прибавки массы тела и потребления пищи), во время органогенеза или поздних сроков беременности и лактации, наблюдались значительное снижение массы тела плодов, массы тела детенышей при рождении, выживаемости детенышей и небольшие задержки этапов развития. У крольчих фетотоксичность (т.е. резорбция, потеря помета, выкидыши и низкая масса тела), ассоциированные с материнской токсичностью (смертностью), наблюдалась при дозах 5 и 10 мг/кг/сут. Не наблюдалось побочных эффектов при дозах 600, 200 и 2 мг/кг/сут у мышей, крыс и кроликов, что составляет 9, 6 и 0,1 МРДЧ соответственно из расчета на мг/м2. В расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг.
Клинические исследования
Гипертензия
Гипертензия у взрослых
Антигипертензивный эффект валсартана был продемонстрирован в основном в 7 плацебо- контролируемых испытаниях продолжительностью от 4 до 12 нед (1 — у пациентов старше 65 лет) при применении в дозах от 10 до 320 мг/сут у пациентов с исходным дАД 95–115 мм рт. ст. Исследования позволили сравнить режимы приема 160 мг/сут 1 раз в день и 2 раза в день; сравнить максимальный и минимальный эффект; сравнить (в объединенных данных) ответ в зависимости от пола, возраста и расы; и оценить дополнительные эффекты гидрохлоротиазида.
Применение валсартана у пациентов с эссенциальной гипертензией приводит к значительному снижению сАД и дАД в положении сидя, лежа и стоя, обычно с незначительными ортостатическими реакциями или без них.
У большинства пациентов после приема однократной пероральной дозы начало антигипертензивного действия наблюдается примерно в течение 2 ч, а максимальное снижение АД достигается в течение 6 ч. Антигипертензивный эффект сохраняется в течение 24 ч после приема, но наблюдается снижение по сравнению с максимальным эффектом при более низких дозах (40 мг), предположительно отражающее утрату ингибирования действия ангиотензина II. Однако при более высоких дозах (160 мг) разница в максимальном и минимальном эффекте незначительна. При повторных приемах снижение АД при любой дозе в основном наблюдается в течение 2 нед, а максимальное снижение обычно достигается через 4 нед. В долгосрочных исследованиях (без контроля плацебо) эффект валсартана поддерживался до 2 лет. Антигипертензивный эффект не зависит от возраста, пола или расы. Вывод относительно расы основан на объединенных данных и должен рассматриваться с осторожностью, потому что антигипертензивные ЛС, влияющие на РААС (такие как ингибиторы АПФ и АРА II), как правило, менее эффективны при низком уровне активности ренина плазмы (часто у чернокожих), чем при высокой активности ренина плазмы (часто у белокожих). В объединенных рандомизированных контролируемых испытаниях валсартана, в которых участвовали в общей сложности 140 чернокожих и 830 белокожих пациентов, валсартан и ингибитор АПФ в качестве контроля были, по крайней мере, столь же эффективны у чернокожих, как и у белокожих. Объяснение этого отличия от предыдущих результатов неясно.
Резкая отмена валсартана не была ассоциирована с быстрым повышением АД.
При применении валсартана и диуретиков тиазидного ряда отмечается аддитивный гипотензивный эффект.
В 7 исследований монотерапии валсартаном было включено более 2000 пациентов, рандомизированных для получения различных доз валсартана, и около 800 пациентов, рандомизированных в группу плацебо. Минимальный эффект при дозах ниже 80 мг не всегда отличался от наблюдаемого при приеме плацебо, но дозы 80, 160 и 320 мг вызывали дозозависимое снижение сАД и дАД с отличием от плацебо примерно на 6–9/3–5 мм рт. ст. при дозах от 80 до 160 мг и 9/6 мм рт. ст. при дозе 320 мг. В контролируемом исследовании добавление гидрохлоротиазида к валсартану в дозе 80 мг приводило к дополнительному снижению сАД и дАД примерно на 6/3 и 12/5 мм рт.ст. для доз гидрохлоротиазида 12,5 и 25 мг соответственно по сравнению с приемом только валсартана в дозе 80 мг.
У пациентов с неадекватным контролем АД при дозе 80 мг 1 раз в сутки дозу титровали до 160 мг 1 раз в сутки или 80 мг 2 раза в сутки, что привело к сопоставимому ответу в обеих группах.
В контролируемых исследованиях антигипертензивный эффект валсартана в дозе 80 мг 1 раз в сутки был аналогичен эффекту эналаприла в дозе 20 мг 1 раз в сутки или лизиноприла в дозе 10 мг 1 раз в сутки.
Нет испытаний валсартана, демонстрирующих снижение риска сердечно-сосудистых заболеваний у пациентов с гипертензией, но по крайней мере один фармакологически подобный препарат продемонстрировал такие преимущества.
В контролируемых исследованиях практически не наблюдалось изменений ЧСС у пациентов, получавших валсартан.
Гипертензия у педиатрических пациентов
Антигипертензивные эффекты валсартана оценивали в двух рандомизированных двойных слепых клинических исследованиях.
В клиническом исследовании с участием 261 педиатрического пациента с гипертензией в возрасте от 6 до 16 лет пациенты с массой тела <35 кг получали 10, 40 или 80 мг валсартана в сутки (низкие, средние и высокие дозы), а пациенты с массой тела ≥35 кг — 20, 80 и 160 мг валсартана в сутки (низкие, средние и высокие дозы). Нарушения со стороны почек и мочевыводящих путей, а также эссенциальная гипертензия с ожирением или без него были наиболее частыми первопричинами гипертензии у детей, включенных в это исследование. По истечении 2 нед валсартан дозозависимо снижал как сАД, так и дАД. В целом три уровня доз валсартана (низкий, средний и высокий) значимо снижали сАД на −8, −10, −12 мм рт. ст. от исходного уровня соответственно. Пациенты были повторно рандомизированы для продолжения приема той же дозы валсартана или были переведены на прием плацебо. У пациентов, которые продолжали получать средние и высокие дозы валсартана, минимальное сАД было на −4 и −7 мм рт. ст. ниже, чем у пациентов, получавших плацебо. У пациентов, получавших низкую дозу валсартана, минимальное сАД было таким же, как у пациентов, получавших плацебо. В целом дозозависимый антигипертензивный эффект валсартана был стойким во всех демографических подгруппах.
В клиническом исследовании с участием 90 педиатрических пациентов с гипертензией в возрасте от 1 до 5 лет с аналогичным дизайном исследования были получены некоторые доказательства эффективности, но результаты безопасности, для которых нельзя было исключить связь с лечением, не позволяют дать рекомендации по применению в этой возрастной группе (см. «Побочные действия»).
Сердечная недостаточность
Valsartan Heart Failure Trial (Val-HeFT) было многонациональным двойным слепым исследованием, в котором участвовали 5010 пациентов с сердечной недостаточностью II (62%)–IV (2%) классов по классификации NYHA и ФВЛЖ <40%, получавших исходную терапию, выбранную им врачами. Пациенты были рандомизированы в группы плацебо или валсартана (с титрованием дозы от 40 мг 2 раза в день до максимальной переносимой дозы или 160 мг 2 раза в день) и наблюдались в среднем около 2 лет. Хотя основной целью Val-HeFT было изучение эффекта валсартана при добавлении к ингибитору АПФ, около 7% пациентов не получали ингибитор АПФ. Другая традиционная терапия включала диуретики (86%), дигоксин (67%) и бета-адреноблокаторы (36%). В исследованной популяции 80% составляли мужчины, 46% пациентов были в возрасте 65 лет и старше и 89% — европеоиды. В конце исследования у пациентов в группе, получавшей валсартан, сАД было на 4 мм рт. ст., а дАД — на 2 мм рт. ст. ниже, чем в группе плацебо. Две первичные конечные точки, которые были определены как время до первого события, включали смертность от всех причин и заболеваемость, связанную с сердечной недостаточностью, последняя определялась как смертность от всех причин, внезапная смерть при реанимации, госпитализация по поводу сердечной недостаточности и необходимость в/в введения ЛС с инотропным или сосудорасширяющим действием не менее 4 ч. Эти результаты приведены в следующей таблице.
Таблица 1
| Плацебо (n=2499) | Валсартан (n=2511) | Отношение рисков (95% ДИ) | Номинальное p-значение | |
| Смертность от всех причин | 484 (19,4%) | 495 (19,7%) | 1,02 (0,9–1,15) | 0,8 |
| Заболеваемость, связанная с сердечной недостаточностью | 801 (32,1%) | 723 (28,8%) | 0,87 (0,79–0,97) | 0,009 |
Хотя общий результат заболеваемости говорил о преимуществе валсартана, этот результат во многом был обусловлен тем, что 7% пациентов не получали ингибитор АПФ, как показано в следующей таблице.
Таблица 2
| Без ингибитора АПФ | С ингибитором АПФ | |||
| Плацебо (n=181) | Валсартан (n=185) | Плацебо (n=2318) | Валсартан (n=2326) | |
| События (%) | 77 (42,5%) | 46 (24,9%) | 724 (31,2%) | 677 (29,1%) |
| Отношение рисков (95% ДИ) | 0,51 (0,35; 0,73) | 0,92 (0,82; 1,02) | ||
| p-значение | 0,0002 | 0,0965 |
Умеренный положительный результат в группе, получавшей ингибитор АПФ, был в значительной степени связан с пациентами, получавшими ингибитор АПФ в дозе, меньше рекомендованной. Таким образом, имеется мало доказательств дальнейшей клинической пользы при добавлении валсартана к терапии ингибитором АПФ в адекватной дозе.
Вторичные конечные точки в подгруппе, не получавшей ингибиторы АПФ, были следующими.
Таблица 3
| Плацебо (n=181) | Валсартан (n=185) | Отношение рисков (95% ДИ) | |
| Компоненты заболеваемости, связанной с сердечной недостаточностью | |||
| Смертность от всех причин | 49 (27,1%) | 32 (17,3%) | 0,59 (0,37; 0,91) |
| Внезапная смерть при реанимации | 2 (1,1%) | 1 (0,5%) | 0,47 (0,04; 5,2) |
| Лечение ХСН | 1 (0,6%) | 0 (0%) | − |
| Госпитализация при ХСН | 48 (26,5%) | 24 (13%) | 0,43 (0,27; 0,71) |
| Смертность от срдечно-сосудистых заболеваний | 40 (22,1%) | 29 (15,7%) | 0,65 (0,4; 1,05) |
| Заболеваемость без летального исхода | 49 (27,1%) | 24 (13%) | 0,42 (0,26; 0,69) |
У пациентов, не получавших ингибитор АПФ, но получавших валсартан, наблюдалось увеличение ФВЛЖ и уменьшение внутреннего конечно-диастолического диаметра левого желудочка.
Эффекты в целом были одинаковыми для подгрупп, подобранных по возрасту и полу, в популяции пациентов, не получавших ингибитор АПФ. Количество чернокожих пациентов было небольшим и не позволяет провести значимую оценку в этой подгруппе пациентов.
Применение после инфаркта миокарда
VALsartan In Аcute myocardial iNfarcTion trial (VALIANT) — рандомизированное контролируемое многонациональное двойное слепое исследование с участием 14703 пациентов с острым инфарктом миокарда, осложненным сердечной недостаточностью (признаки, симптомы или рентгенологические данные) или систолической дисфункцией левого желудочка (фракция выброса ≤40% при радиовентрикулографии или ≤35% при эхокардиографии или желудочковой контрастной ангиографии). Пациенты были рандомизированы в период от 12 ч до 10 дней после появления симптомов инфаркта миокарда в одну из трех групп лечения: валсартан (от 20 или 40 мг 2 раза в день до наивысшей переносимой дозы вплоть до максимальной 160 мг 2 раза в день), ингибитор АПФ, каптоприл (от 6,25 мг 3 раза в день до наивысшей переносимой дозы вплоть до максимальной 50 мг 3 раза в день) или сочетание валсартана и каптоприла. В группе комбинированной терапии доза валсартана была увеличена с 20 мг 2 раза в день до наивысшей переносимой дозы вплоть до максимальной 80 мг 2 раза в день; доза каптоприла была такой же, как при монотерапии. В исследуемой популяции было 69% мужчин, 94% европеоидов и 53% пациента были в возрасте 65 лет и старше. Исходная терапия включала аспирин (91%), бета-адреноблокаторы (70%), ингибиторы АПФ (40%), тромболитики (35%) и статины (34%). Средняя продолжительность лечения составила 2 года. Средняя суточная доза валсартана в группе монотерапии составляла 217 мг.
Первичной конечной точкой было время до смертности от всех причин. Вторичные конечные точки включали (1) время до сердечно-сосудистой смертности и (2) время до первого события сердечно-сосудистой смертности, повторного инфаркта или госпитализации по поводу сердечной недостаточности. Результаты представлены в следующей таблице.
Таблица 4
| Валсартан vs. каптоприл (n=4909) (n=4909) | Валсартан + каптоприл vs. каптоприл (n=4885) (n=4909) | |||||
| Количество смертей валсартан/каптоприл | Отношение рисков (ДИ) | р-значение | Количество смертей комбинация/каптоприл | Отношение рисков (ДИ) | р-значение | |
| Смертность от всех причин | 979 (19,9%)/958 (19,5%) | 1,001 (0,902; 1,111) | 0,98 | 941 (19,3%)/958 (19,5%) | 0,984 (0,886; 1,093) | 0,73 |
| Смертность от сердечно-сосудистых заболеваний | 827 (16,8%)/830 (16,9%) | 0,976 (0,875; 1,09) | ||||
| Смертность от сердечно-сосудистых заболеваний, госпитализация по поводу сердечной недостаточности, повторный несмертельный инфаркт миокарда | 1529 (31,1%)/1567 (31,9%) | 0,955 (0,881; 1,035) |
Не было различий в общей смертности между тремя группами лечения. Таким образом, не было доказательств того, что сочетание ингибитора АПФ каптоприла и АРА II валсартана было полезным.
Была проведена оценка данных, чтобы посмотреть, проявляет ли валсартан не меньшую эффективность и сохраняет ли он часть эффекта каптоприла, препарата с продемонстрированным влиянием на выживаемость в этих условиях. Традиционная оценка эффекта каптоприла (основанная на объединенном анализе 3 постинфарктных исследований каптоприла и 2 других ингибиторов АПФ) показала снижение смертности на 14–16% по сравнению с плацебо. Валсартан можно было бы считать эффективным, если бы он сохранял значительную часть этого эффекта и однозначно сохранял часть этого эффекта. Как показано в таблице, верхняя граница ДИ для ОР (валсартан/каптоприл) для общей смертности или смертности от сердечно-сосудистых заболеваний составляет от 1,09 до 1,11, разница примерно от 9 до 11%, таким образом, валсартан четко демонстрирует свою эффективность. Другие вторичные конечные точки соответствовали этому выводу.
Влияние на смертность среди подгрупп в исследовании VALIANT
Не было явных различий в смертности от всех причин в зависимости от возраста, пола, расы или исходного лечения.
Показания к применению
Гипертензия
Валсартан показан при лечении гипертензии для снижения АД. Снижение АД уменьшает риск смертельных и нефатальных сердечно-сосудистых событий, в первую очередь инсультов и инфарктов миокарда. Эти преимущества были отмечены в контролируемых испытаниях антигипертензивных ЛС из широкого спектра фармакологических классов, включая класс, к которому принадлежит валсартан. Контролируемых исследований, демонстрирующих снижение риска при применении валсартана, с участием пациентов с гипертензией, не проводилось.
Контроль высокого АД должен быть частью комплексного управления риском сердечно-сосудистых заболеваний, включая при необходимости контроль уровня липидов, контроль диабета, антитромботическую терапию, отказ от курения, физические упражнения и ограниченное потребление натрия. Многим пациентам для достижения целевого АД может потребоваться более одного ЛС.
В рандомизированных контролируемых исследованиях было показано, что многочисленные антигипертензивные ЛС из различных фармакологических классов и с различными механизмами действия снижают сердечно-сосудистую заболеваемость и смертность, и можно заключить, что именно снижение АД, а не какое-либо другое фармакологическое свойство ЛС, в значительной степени ответственно за это преимущество. Самым большим и наиболее стойким преимуществом в отношении сердечно-сосудистых заболеваний было снижение риска инсульта, но также регулярно наблюдалось снижение риска инфаркта миокарда и смертности от сердечно-сосудистых заболеваний.
Повышенное сАД или дАД вызывает повышение риска сердечно-сосудистых заболеваний, а абсолютное увеличение риска в мм рт. ст. больше при более высоком АД, так что даже умеренное снижение тяжелой гипертензии может дать существенную пользу. Снижение ОР при снижении АД одинаково для разных групп населения с различным абсолютным риском, поэтому абсолютная польза больше у пациентов с повышенным риском, независимо от их гипертензии (например, пациенты с диабетом или гиперлипидемией), и у таких пациентов можно ожидать получить пользу от более агрессивного лечения для снижения АД.
Некоторые антигипертензивные ЛС оказывают меньшее влияние на АД (при монотерапии) у чернокожих пациентов, а многие антигипертензивные ЛС имеют дополнительные одобренные показания и эффекты (например, при стенокардии, сердечной недостаточности или диабетической болезни почек). Эти соображения могут определять выбор терапии.
Валсартан можно применять отдельно или в комбинации с другими антигипертензивными ЛС.
Сердечная недостаточность
Валсартан показан для лечения сердечной недостаточности (класс II–IV по классификации NYHA). В контролируемых клинических испытаниях валсартан значительно сокращал количество госпитализаций по поводу сердечной недостаточности. Нет каких-либо доказательств того, что валсартан обеспечивает дополнительные преимущества при использовании с адекватной дозой ингибитора АПФ (см. Клинические исследования).
Постинфарктное состояние
У клинически стабильных пациентов с левожелудочковой недостаточностью или дисфункцией левого желудочка после инфаркта миокарда валсартан показан для снижения смертности от сердечно-сосудистых заболеваний (см. Клинические исследования).
Противопоказания
Гиперчувствительность, одновременное применение алискирена у пациентов с диабетом (см. «Взаимодействие»).
Применение при беременности и кормлении грудью
Беременность
Категория действия на плод по FDA — D.
Применение ЛС, влияющих на РААС, во II и III триместрах беременности снижает функцию почек плода и увеличивает заболеваемость и смертность плода и новорожденного. Возникающее в результате маловодие может быть ассоциировано с гипоплазией легких плода и деформациями скелета. Возможные побочные эффекты у новорожденных включают гипоплазию черепа, анурию, гипотензию, почечную недостаточность и смерть. Эти неблагоприятные исходы обычно связаны с применением этих ЛС во II и III триместрах беременности. При установлении беременности необходимо как можно скорее прекратить прием валсартана. В большинстве эпидемиологических исследований, посвященных изучению аномалий плода после экспозиции антигипертензивных средств в I триместре, не обнаружено отличий эффектов ЛС, влияющих на РААС, и других антигипертензивных средств. Надлежащее управление материнской гипертензией во время беременности важно для оптимизации исходов как для матери, так и для плода.
В случае отсутствия подходящей альтернативы терапии ЛС, влияющими на РААС, у конкретной пациентки, женщина должна быть предупреждена о потенциальном риске для плода. Необходимо выполнять серийные УЗИ для оценки внутриамниотической среды. При возникновении маловодия следует прекратить прием валсартана, если эта терапия не является спасением жизни матери. В зависимости от срока беременности, может потребоваться тестирование плода. Однако следует иметь в виду, что маловодие может появиться только после того, как плод получит необратимое повреждение. Необходимо тщательное наблюдение за состоянием младенцев, которые in utero подверглись экспозиции валсартана, на предмет развития гипертензии, олигурии и гиперкалиемии (см. «Меры предосторожности»).
Грудное вскармливание
Неизвестно, экскретируется ли валсартан в грудное молоко. Валсартан обнаруживается в молоке лактирующих крыс, однако уровни ЛС в грудном молоке животных могут не точно отражать уровни в грудном молоке женщин. Поскольку многие ЛС экскретируются в грудное молоко и из-за возможности побочных реакций у грудных младенцев, следует принять решение о прекращении кормления грудью или прекращении приема валсартана, принимая во внимание его важность для матери.
Побочные действия
Опыт клинических испытаний
Поскольку клинические испытания проводятся в разных условиях, частота побочных эффектов, наблюдаемых в клинических испытаниях ЛС, не может быть непосредственно сравнена с частотой неблагоприятных эффектов, полученных в других клинических испытаниях, и может не отражать частоту встречаемости этих эффектов в клинической практике.
Гипертензия у взрослых
Безопасность валсартана оценивали более чем у 4000 пациентов, включая более 400, которые лечились более 6 мес, и более 160 — более 1 года. Побочные реакции, как правило, были легкими и преходящими и лишь в редких случаях требовали прекращения терапии. Общая частота побочных реакций при приеме валсартана и плацебо была сходна.
Общая частота побочных реакций не зависела от дозы и пола, возраста, расы или режима лечения. Прекращение терапии из-за побочных эффектов потребовалось у 2,3% пациентов при приеме валсартана и 2% пациентов, получавших плацебо. Наиболее частыми причинами прекращения терапии валсартаном были головная боль и головокружение.
Побочные реакции, которые наблюдались в плацебо-контролируемых клинических испытаниях по крайней мере у 1% пациентов, получавших валсартан, и с большей частотой у пациентов, принимавших валсартан (n=2316), чем у пациентов, получавших плацебо (n=888), включали вирусную инфекцию (3% против 2%), усталость (2% против 1%) и боль в животе (2% против 1%). Головная боль, головокружение, инфекции верхних дыхательных путей, кашель, диарея, ринит, синусит, тошнота, фарингит, отек и артралгия возникали с частотой более 1%, но примерно с одинаковой частотой у пациентов, получавших плацебо и валсартан.
В исследованиях, в которых валсартан сравнивали с ингибитором АПФ с плацебо или без него, частота сухого кашля была значительно выше в группе ингибитора АПФ (7,9%), чем в группах, получавших валсартан (2,6%) или плацебо (1,5%). В исследовании с участием 129 пациентов, ограниченного пациентами, у которых был сухой кашель после того, как они получали ингибиторы АПФ, частота кашля у пациентов, получавших валсартан, гидрохлоротиазид или лизиноприл, составила 20, 19 и 69% соответственно (p <0,001).
Дозозависимые ортостатические эффекты наблюдались менее чем у 1% пациентов. Увеличение частоты головокружения наблюдалось у пациентов, получавших валсартан 320 мг (8%) по сравнению с этими показателями у пациентов, получавших 10–160 мг (от 2 до 4%).
Валсартан применяли одновременно с гидрохлоротиазидом без очевидных клинически значимых побочных эффектов.
Другие побочные реакции, возникшие в контролируемых клинических испытаниях у пациентов, получавших валсартан (>0,2% пациентов), перечислены ниже. Невозможно определить, были ли эти события связаны с валсартаном.
Организм в целом: аллергическая реакция и астения.
Со стороны ССС: пальпитация.
Дерматологические: зуд и сыпь.
Со стороны пищеварительной системы: запор, сухость во рту, диспепсия и метеоризм.
Со стороны скелетно-мышечной системы: боль в спине, мышечные спазмы и миалгия.
Неврология и психиатрия: беспокойство, бессонница, парестезия и сонливость.
Со стороны респираторной системы: одышка.
Со стороны органов чувств: головокружение.
Со стороны мочеполовой системы: импотенция.
Другие зарегистрированные явления, которые реже наблюдались в клинических испытаниях, включали боль в груди, обморок, анорексию, рвоту и ангионевротический отек.
Гипертензия у детей
Безопасность валсартана оценивалась более чем у 400 педиатрических пациентов в возрасте от 6 до 17 лет и более чем у 160 педиатрических пациентов в возрасте от 6 мес до 5 лет. Не было выявлено значимых различий между профилем неблагоприятных реакций у педиатрических пациентов в возрасте от 6 до 16 лет и взрослых пациентов. Головная боль и гиперкалиемия были наиболее частыми нежелательными явлениями, которые предположительно были связаны с ЛС, у детей старшего возраста (от 6 до 17 лет) и детей младшего возраста (от 6 мес до 5 лет). Гиперкалиемия в основном наблюдалась у детей с предшествующим заболеванием почек. Нейрокогнитивная оценка и оценка развития педиатрических пациентов в возрасте от 6 до 16 лет не выявили общего клинически значимого неблагоприятного воздействия после лечения валсартаном в течение периода до 1 года.
Валсартан не рекомендуется детям младше 6 лет. В исследовании (n=90) педиатрических пациентов (от 1 до 5 лет) в течение 1 года открытой расширенной фазы наблюдались две смерти и три случая повышения уровня трансаминаз во время лечения. Эти 5 событий произошли в исследуемой популяции, в которой пациенты часто имели серьезные сопутствующие заболевания. Причинно-следственная связь с валсартаном не установлена. Во втором исследовании, в котором были рандомизированы 75 детей в возрасте от 1 до 6 лет, на протяжении 1 года расширенного исследования не было зарегистрировано ни одного случая смерти и один случай заметного повышения уровня печеночных трансаминаз.
Сердечная недостаточность
Профиль неблагоприятного воздействия валсартана у пациентов с сердечной недостаточностью соответствовал фармакологии препарата и состоянию здоровья пациентов. В исследовании Valsartan Heart Failure Trial, при сравнении валсартана в общих суточных дозах до 320 мг (n=2506) с плацебо (n=2494), 10% пациентов прекратили прием валсартана из-за побочных реакций по сравнению с 7% пациентов, получавших плацебо.
В таблице показаны побочные реакции в двойных слепых краткосрочных испытаниях сердечной недостаточности, включая первые 4 мес Valsartan Heart Failure Trial, наблюдавшиеся с частотой не менее 2%, которые были более частыми у пациентов, получавших валсартан, чем у пациентов, получавших плацебо. Все пациенты получали стандартную лекарственную терапию сердечной недостаточности, часто в виде нескольких препаратов, включая диуретики, дигиталис, бета-адреноблокатор. Около 93% пациентов получали сопутствующую терапию ингибиторами АПФ.
Таблица 5
| Валсартан, % (n=3282) | Плацебо, % (n=2740) | |
| Головокружение | 17 | 9 |
| Гипотензия | 7 | 2 |
| Диарея | 5 | 4 |
| Артралгия | 3 | 2 |
| Усталость | 3 | 2 |
| Боль в спине | 3 | 2 |
| Постуральное головокружение | 2 | 1 |
| Гиперкалиемия | 2 | 1 |
| Постуральная гипотензия | 2 | 1 |
Прекращение приема произошло у 0,5% пациентов, получавших валсартан, и у 0,1% пациентов, получавших плацебо, в связи со следующими факторами: повышение уровня креатинина и повышение уровня калия. Другие побочные реакции при приеме валсартана с частотой более 1% и более высокой, чем плацебо, включали головную боль БДУ (БДУ = без дополнительного уточнения), тошноту, почечную недостаточность БДУ (БДУ = без дополнительного уточнения), обморок, нечеткость зрения, боль в верхней части живота и головокружение.
По долгосрочным данным Valsartan Heart Failure Trial, не было выявлено каких-либо значительных побочных реакций, не отмеченных ранее.
Применение после инфаркта миокарда
Профиль безопасности валсартана соответствовал фармакологии препарата и фоновым заболеваниям, факторам риска сердечно-сосудистых заболеваний и клиническому течению у пациентов, получавших лечение после инфаркта миокарда. В таблице показан процент пациентов, прекративших прием в группах валсартана и каптоприла в испытании VALsartan In Acute myocardial iNfarcTion trial (VALIANT) с частотой не менее 0,5% в любой из групп лечения.
Прекращение приема из-за нарушения функции почек было отмечено у 1,1% пациентов, получавших валсартан, и у 0,8% пациентов, получавших каптоприл.
Таблица 6
| Валсартан, % (n=4885) | Каптоприл, % (n=4879) | |
| Прекращение приема из-за неблагоприятных реакций | 5,8 | 7,7 |
| Неблагоприятные реакции | ||
| Гипотензия БДУ | 1,4 | 0,8 |
| Кашель | 0,6 | 2,5 |
| Повышение креатинина в крови | 0,6 | 0,4 |
| Сыпь БДУ | 0,2 | 0,6 |
Постмаркетинговый опыт
В постмаркетинговом периоде сообщалось о следующих дополнительных побочных реакциях.
Гиперчувствительность: имеются редкие сообщения об ангионевротическом отеке. У некоторых из этих пациентов ранее был ангионевротический отек при приеме других ЛС, включая ингибиторы АПФ. Валсартан не следует назначать повторно пациентам, перенесшим ангионевротический отек.
Со стороны пищеварительной системы: повышение уровня ферментов печени и очень редкие сообщения о гепатите.
Со стороны почек: нарушение функции почек, почечная недостаточность.
Клинические лабораторные исследования: гиперкалиемия.
Дерматологические: алопеция, буллезный дерматит.
Со стороны крови и лимфатической системы: очень редкие сообщения о тромбоцитопении.
Сосудистые: васкулит.
Сообщалось о редких случаях рабдомиолиза у пациентов, получавших АРА II.
Поскольку сообщения об этих реакциях поступают добровольно от популяции неопределенного размера, не всегда можно достоверно оценить их частоту и установить причинно-следственную связь с экспозицией ЛС.
Взаимодействие
При одновременном применении валсартана с амлодипином, атенололом, циметидином, дигоксином, фуросемидом, глибенкламидом, гидрохлоротиазидом или индометацином клинически значимого ФКВ не наблюдалось. Совместное применение валсартана и атенолола имело больший антигипертензивный эффект, чем любое из этих ЛС, но оно не снижало ЧСС больше, чем один атенолол.
Совместное применение валсартана и варфарина не изменяло фармакокинетику валсартана или продолжительность антикоагулянтного эффекта варфарина.
CYP450
Исследования метаболизма in vitro показывают, что взаимодействие, опосредованное CYP450, валсартана и одновременно принимаемого ЛС маловероятно из-за низкой степени метаболизма.
Транспортеры
Результаты in vitro исследования на ткани печени человека показывают, что валсартан является субстратом OATP1B1 и MRP2. Совместное применение ингибиторов OATP1B1 (рифампицин, циклоспорин) или MRP2 (ритонавир) может увеличить системную экспозицию валсартана.
Калий
Одновременное применение валсартана с другими ЛС, блокирующими РААС, калийсберегающими диуретиками (например, спиронолактон, триамтерен, амилорид), добавками калия, заменителями соли, содержащими калий, или другими ЛС, которые могут повышать уровень калия (например, гепарин), может привести к повышению сывороточного калия, а у пациентов с сердечной недостаточностью — к повышению сывороточного креатинина. Если совместное применение считается необходимым, рекомендуется контролировать уровень калия в сыворотке крови.
НПВС, включая селективные ингибиторы ЦОГ-2
У пожилых пациентов, пациентов с обезвоживанием (включая тех, кто принимает диуретики) или с нарушенной функцией почек совместное применение НПВС, включая селективные ингибиторы ЦОГ-2, с АРА II, в т.ч. валсартаном, может привести к ухудшению функции почек, включая возможную острую почечную недостаточность. Эти эффекты обычно обратимы. Следует периодически контролировать функцию почек у пациентов, получающих валсартан и НПВС.
Антигипертензивный эффект АРА II, в т.ч. валсартана, может быть ослаблен НПВС, включая селективные ингибиторы ЦОГ-2.
Двойная блокада РААС
Двойная блокада РААС АРА II, ингибиторами АПФ или алискиреном ассоциирована с повышенным риском развития гипотензии, гиперкалиемии и изменений функции почек (включая острую почечную недостаточность) по сравнению с монотерапией. У большинства пациентов применение комбинации двух ингибиторов РААС не дает каких-либо дополнительных преимуществ по сравнению с монотерапией (см. Клинические исследования). В целом следует избегать сочетанного применения ингибиторов РААС. Необходим тщательный мониторинг АД, функции почек и электролитов у пациентов, принимающих валсартан и другие ЛС, влияющие на РААС.
Не следует принимать алискирен одновременно с валсартаном пациентам с диабетом. Необходимо избегать применения алискирена с валсартаном у пациентов с почечной недостаточностью (СКФ <60 мл/мин).
Литий
Сообщалось об увеличении концентрации лития в сыворотке и токсичности лития при одновременном применении препаратов лития с АРА II, включая валсартан. При одновременном применении необходим мониторинг уровня лития в сыворотке крови.
Результаты клинических лабораторных исследований
В контролируемых клинических исследованиях клинически важные изменения стандартных лабораторных параметров редко были связаны с приемом валсартана.
Креатинин. В контролируемых клинических испытаниях у пациентов с гипертензией незначительное повышение уровня креатинина было отмечено у 0,8% пациентов, принимавших валсартан, и у 0,6% пациентов, получавших плацебо. В исследованиях сердечной недостаточности повышение уровня креатинина более чем на 50% наблюдалось у 3,9% пациентов, получавших валсартан, по сравнению с 0,9% пациентов, получавших плацебо. У пациентов, перенесших инфаркт миокарда, удвоение сывороточного креатинина наблюдалось у 4,2% пациентов, получавших валсартан, и у 3,4% пациентов, получавших каптоприл.
Hb и гематокрит. Более чем 20% снижение Hb и гематокрита наблюдалось у 0,4 и 0,8% соответственно пациентов, получавших валсартан, по сравнению этими показателями у 0,1 и 0,1% у пациентов, получавших плацебо. Один пациент при приеме валсартана прекратил лечение в связи с развитием микроцитарной анемии.
Функциональные тесты печени. У пациентов, получавших валсартан, наблюдались эпизодические повышения (более 150%) лабораторных показателей печени. Три пациента (<0,1%), получавшие валсартан, прекратили лечение из-за повышения лабораторных показателей печени.
Нейтропения. Нейтропения наблюдалась у 1,9% пациентов, получавших валсартан, и 0,8% пациентов, получавших плацебо.
Калий сыворотки. У пациентов с гипертензией повышение уровня калия в сыворотке крови более чем на 20% наблюдалось у 4,4% пациентов, получавших валсартан, и у 2,9% пациентов, получавших плацебо. У пациентов с сердечной недостаточностью повышение уровня калия в сыворотке крови более чем на 20% наблюдалось у 10% пациентов, получавших валсартан, и у 5,1% пациентов, получавших плацебо.
Азот мочевины крови. В исследованиях сердечной недостаточности более чем 50% увеличение азота мочевины крови наблюдалось у 16,6% пациентов, получавших валсартан, по сравнению с этим показателем у 6,3% пациентов, получавших плацебо.
Передозировка
Симптомы: имеются ограниченные данные о передозировке у человека. Наиболее вероятными проявлениями передозировки могут быть гипотензия и тахикардия, брадикардия может возникнуть из-за парасимпатической (вагусной) стимуляции. Сообщалось о снижении уровня сознания, сосудистой недостаточности и шоке.
Лечение: при возникновении симптоматической гипотензии следует назначить поддерживающую терапию.
Валсартан не удаляется из плазмы при гемодиализе.
Валсартан не проявлял явно наблюдаемых побочных эффектов при однократном пероральном применении доз до 2000 мг/кг у крыс и до 1000 мг/кг у мартышек, за исключением повышенного слюноотделения и диареи у крыс и рвоты у мартышек при максимальной дозе (в 60 и 31 раз соответственно выше МРДЧ на основе мг/м2 (в расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг).
Способ применения и дозы
Внутрь. Доза зависит от заболевания, возраста, состояния пациента, в т.ч. функции почек и печени, переносимости и сопутствующей терапии. У взрослых обычно начальная доза — 20–160 мг, 1–2 раза в сутки, максимальная суточная доза — 320 мг. У детей в возрасте от 6 до 16 лет, обычно начальная доза — 1,3 мг/кг 1 раз в сутки (всего до 40 мг).
Меры предосторожности
Фетальная токсичность — см. «Применение при беременности и кормлении грудью».
Гипотензия
Чрезмерная гипотензия редко наблюдалась (0,1%) у пациентов с неосложненной гипертензией, получавших только валсартан. У пациентов с активированной РААС, таких как пациенты с уменьшением ОЦК и/или пониженным содержанием натрия, получающие высокие дозы диуретиков, может возникнуть симптоматическая гипотензия. Это состояние следует скорректировать до начала приема валсартана или начать лечение под тщательным медицинским наблюдением.
Следует соблюдать осторожность при начале терапии у пациентов с сердечной недостаточностью или пациентов, перенесших инфаркт миокарда. У пациентов с сердечной недостаточностью или после инфаркта миокарда, получающих валсартан, обычно наблюдается некоторое снижение АД, но прекращение терапии из-за продолжающейся симптоматической гипотензии обычно не требуется при соблюдении инструкций по дозированию. В контролируемых исследованиях у пациентов с сердечной недостаточностью частота гипотензии у пациентов, получавших валсартан, составляла 5,5% по сравнению с этими показателями у 1,8% у пациентов, получавших плацебо. В исследовании VALsartan In Acute myocardial iNfarcTion trial (VALIANT) гипотензия у пациентов, перенесших инфаркт миокарда, привела к окончательному прекращению терапии у 1,4% пациентов, получавших валсартан, и 0,8% пациентов, получавших каптоприл.
При возникновении чрезмерной гипотензии пациенту следует придать положение лежа на спине, при необходимости — в/в инфузия физиологического раствора. Транзиторная гипотензия не является противопоказанием для дальнейшего лечения, которое обычно можно без труда продолжить после стабилизации АД.
Нарушение функции почек
Изменения функции почек, включая острую почечную недостаточность, могут быть вызваны ЛС, ингибирующими РААС, и диуретиками. Пациенты, функция почек которых может частично зависеть от активности РААС (например, пациенты со стенозом почечной артерии, хроническим заболеванием почек, тяжелой застойной сердечной недостаточностью или снижением ОЦК), могут подвергаться особому риску развития острой почечной недостаточности при приеме валсартана. У этих пациентов необходим периодический мониторинг функции почек. Необходимо рассмотреть возможность приостановки или прекращения терапии у пациентов, у которых при приеме валсартана развивается клинически значимое снижение функции почек (см. «Взаимодействие»).
Гиперкалиемия
У некоторых пациентов с сердечной недостаточностью наблюдается повышение уровня калия. Этот эффект обычно незначителен и преходящ, и он более вероятен у пациентов с уже существующей почечной недостаточностью. Может потребоваться уменьшение дозы и/или прекращение приема валсартана (см. «Побочные действия»).
Применение в педиатрии
Антигипертензивные эффекты валсартана были оценены в двух рандомизированных двойных слепых клинических исследованиях с участием педиатрических пациентов в возрасте 1–5 и 6–16 лет (см. Клинические исследования). Фармакокинетика валсартана была оценена у детей в возрасте от 1 года до 16 лет (см. Фармакокинетика, Педиатрические пациенты). Валсартан в целом хорошо переносился детьми 6–16 лет, и профиль неблагоприятных эффектов был аналогичен описанному для взрослых.
У детей и подростков с гипертензией, у которых могут быть более распространены лежащие в основе почечные аномалии, следует тщательно контролировать функцию почек и уровень калия в сыворотке в соответствии с клиническими показаниями.
Валсартан не рекомендуется для приема педиатрическими пациентами в возрасте до 6 лет из-за результатов по безопасности, исходя из которых нельзя исключить связь с лечением (см. «Побочные действия», Гипертензия у детей).
Нет данных о педиатрических пациентах, находящихся на диализе или при СКФ <30 мл/мин/1,73 м2.
Имеется ограниченный клинический опыт применения валсартана у педиатрических пациентов с печеночной недостаточностью легкой и средней степени тяжести.
Ежедневное пероральное введение неонатальным/молодым крысам валсартана в таких низких дозах, как 1 мг/кг/сут (около 10% максимальной рекомендованной педиатрической дозы на основе мг/м2), с 7-го до 70-го дня постнатального периода приводило к стойкому и необратимому поражению почек. Эти почечные эффекты у новорожденных крыс представляют собой ожидаемые преувеличенные фармакологические эффекты, которые наблюдаются при приеме ЛС в течение первых 13 дней жизни. Поскольку этот период у людей совпадает с 44 нед после зачатия, считается, что указанный эффект не вызывает повышенных опасений по поводу безопасности у детей в возрасте от 6 до 16 лет.
Новорожденные с экспозицией валсартана in utero в анамнезе. При возникновении олигурии или гипотензии необходимо обратить внимание на поддержание АД и почечной перфузии. Могут потребоваться обменное переливание крови или диализ как средства устранения гипотензии и/или замещения нарушенной функции почек.
Применение в гериатрии
В контролируемых клинических испытаниях возраст 1214 (36,2%) пациентов с гипертензией, получавших валсартан, составлял ≥65 лет, а возраст 265 (7,9%) пациентов — ≥75 лет. В общем в этой популяции пациентов не наблюдалось разницы в эффективности или безопасности валсартана, но нельзя исключать более высокую чувствительность некоторых пожилых людей.
Из 2511 пациентов с сердечной недостаточностью, рандомизированных для приема валсартана в исследовании Valsartan Heart Failure Trial 45% (1141) были в возрасте 65 лет и старше. В испытании VALsartan In Acute myocardial iNfarction trial (VALIANT) 53% (2596) из 4909 пациентов, получавших валсартан, и 51% (2515) из 4885 пациентов, получавших валсартан + каптоприл, были в возрасте 65 лет и старше. В обоих испытаниях не было заметных различий в эффективности или безопасности у пожилых и более молодых пациентов.
Почечная недостаточность
Безопасность и эффективность валсартана у пациентов с тяжелой почечной недостаточностью (Cl креатинина ≤30 мл/мин) не установлены. У пациентов с легким (Cl креатинина 60–90 мл/мин) или умеренным (Cl креатинина 30–60 мл/мин) нарушением функции почек коррекция дозы не требуется.
Печеночная недостаточность
Для пациентов с заболеванием печени легкой и средней степени тяжести коррекция дозы не требуется. Для пациентов с тяжелым заболеванием печени не могут быть даны рекомендации по дозированию.