Дата публикации 8 февраля 2018Обновлено 1 декабря 2022
Определение болезни. Причины заболевания
Шизофрения — это хроническое психическое расстройство, при котором развиваются фундаментальные нарушения восприятия, мышления и эмоциональных реакций. Наиболее частыми признаками шизофрении являются бред, галлюцинации, апатия, нарушение мышления и др. Это заболевание влияет как на социальную, так и на профессиональную сферу жизни самого больного и его близких.
Масштабы заболеваемости
Шизофрения — это одно из наиболее распространённых (в среднем болеет около 1 % населения) и тяжёлых психических расстройств, которые известны на сегодняшний день. Современные исследования показывают, что женщины и мужчины одинаково часто болеют шизофренией, но у мужчин это заболевание, как правило, начинается раньше (в 18-25 лет) и протекает тяжелее. Манифестация шизофрении у женщин обычно приходится на возраст 25-30 лет. По данным Американской психиатрической ассоциации, эти показатели одинаковы во всём мире [12].
Этиология
До сих пор нет единого мнения по поводу причин возникновения и механизма развития этого заболевания [4][15][16].
Актуальные на данный момент теории возникновения шизофрении:
- Инфекционная теория. Одна из теорий возникновения шизофрении утверждает, что основной причиной некоторых случаев заболевания является взаимодействие развивающегося плода с патогенами (такими как вирусы) или с антителами матери, которые образовались в ответ на эти патогены (в частности, интерлейкин-8) [7]. Согласно некоторым исследованиям, воздействие определённых вирусов на плод (например, гриппа), особенно в конце второго триместра, вызывает дефекты в развитии нервной системы, которые могут предрасполагать к развитию шизофрении [15]. Инфекционную теорию можно считать разновидностью дизонтогенетической теории, предполагающей связь между развитием шизофрении и нарушениями на ранних этапах развития плода.
- Генетическая теория (теория наследственной предрасположенности). Родственная связь с больными шизофренией значительно увеличивает риск развития заболевания (около 10 %, если болен один из родителей и около 40 % — если больны оба). В настоящее время обнаружено более 100 генов-кандидатов развития шизофрении, большинство из них отвечают за регуляцию аутоиммунного ответа.
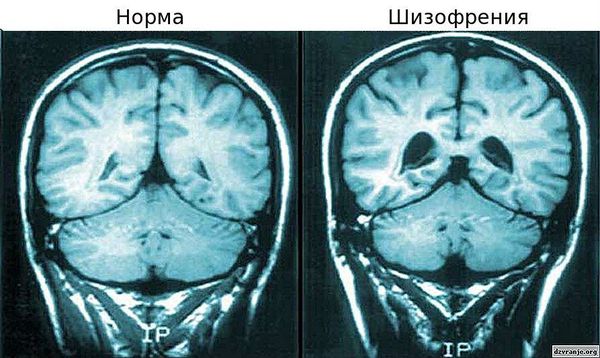
- Нейрофизиологическая теория. Для больных шизофренией характерны выраженные функциональные и структурные изменения: гиперактивность дофаминовой мезолимбической системы, гипофронтальность, снижение объёма серого вещества, расширение желудочков. Эти нарушения могут быть связаны с нарушениями закладки и развития нервной ткани.
- Нейромедиаторная (нейротрансмиттерная) теория. Нарушение нейротрансмиссии в дофаминергических и глутаматергических синапсах, которое, видимо, связаны с пресинаптическим нарушением.
- Психологические теории. В семьях больных шизофренией могут быть особые способы воспитания в условиях когнитивной неопределённости (ребёнок не знает наверняка взглядов и установок родителя, не может предугадать его поведение). Согласно психоаналитической теории, к развитию шизофрении приводит расщепление между истинным и социальным эго и нарушение отделения от материнской фигуры.
Теория аутоинтоксикации и аутоиммунизации, когнитивная теория развития шизофрении на данный момент не применяются.
Факторы риска
На сегодняшний день известно, что генетический фактор играет важнейшую роль в возникновении и развитии шизофрении. Показатель наследуемости колеблется от 70 до 85 %. Однако всё ещё не до конца изучен вопрос способа наследования этого заболевания. Сейчас известно более 100 генов-претендентов на роль в развитии шизофрении, причём большинство из них ответственны за регуляцию аутоиммунных процессов. Большинство генетиков сходятся во мнении, что это заболевание многофакторное по своей природе, т. е. вряд ли будет найдет один ген шизофрении.
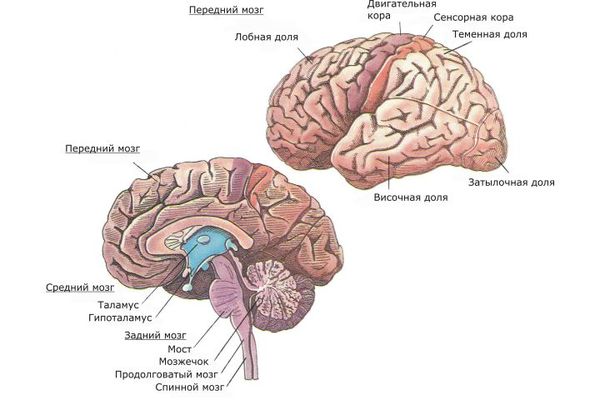
Также исследуется влияние экологических факторов на развитие шизофрении [8]. До начала 21 века большая часть исследований в этих вопросах была основана на эпидемиологических данных, и только благодаря современным нейронаукам и возможностям нейровизуализации и нейрохимии были выдвинуты новые модели возникновения и развития шизофрении. Стало известно, что префронтальная область лобной и височной доли головного мозга наиболее затронуты патологическим процессом. Также вовлечены подкорковые структуры, такие как таламус, гиппокамп и мозжечок [5][17].
Также много данных свидетельствует о том, что для начала шизофрении необходимо наличие предрасположенности к развитию данного заболевания (шизофренический диатез), а также конкретный стрессовый пусковой фактор. Шизофренический диатез могут иметь до 40 % людей. Эта теория получила название стресс-диатеза.
Что может спровоцировать возникновение шизофрении
Между началом и манифестацией заболевания может пройти как неделя, так и несколько месяцев или лет. Спровоцировать манифестацию заболевания может:
- злоупотребление психоактивными веществами, в частности каннабиноидами («спайсами») и катинонами («солями»);
- хронический стресс;
- тяжёлый острый стресс (распад семьи, смерть родственников и т. д.);
- беременность, роды.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы шизофрении
Шизофрения отличается огромным разнообразием клинических проявлений.
Категории симптомов шизофрении
Для шизофрении характерны:
- Позитивные симптомы — отсутствуют у здорового человека и возникают в результате болезни:
- бред;
- галлюцинации;
- резонёрство — пустое, бесплодное многословие с отсутствием конкретных идей и целенаправленности мыслительного процесса.
- Негативные симптомы — уменьшение или выпадение психических функций:
- снижение социального функционирования;
- апатия;
- снижение эмоциональной экспрессивности;
- нарушения в когнитивной сфере (нарушение мышления, планирования, специфические нарушения памяти, скорости мыслительных процессов, синтаксических правил речи и т. д.);
- нарушение социальных взаимодействий, что, в свою очередь, может видоизменять проявления других симптомов [3][4][14].
Несмотря на большую гетерогенность проявлений этого заболевания, обычно шизофрения характеризуется бредовыми идеями, галлюцинациями, дезорганизованной речью и поведением и другими симптомами, которые вызывают социальную или профессиональную дисфункцию.
Мышление и восприятие шизофреника
Проявления шизофрении могут различаться, но обычно они связаны с бредом и галлюцинациями:
- Бред — это ложные убеждения, не основанные на реальных событиях. Пациент с шизофренией может думать:
- что ему причиняют вред или преследуют;
- ему адресованы определённые жесты или комментарии;
- у него есть исключительные способности;
- другой человек влюблён в него;
- в ближайшее время произойдет крупная катастрофа.
- Галлюцинации — больной шизофренией видит или слышит то, чего не существует. Галлюцинации могут затрагивать различные органов чувств, но самая распространённая галлюцинация при шизофрении — слуховая (слышать «голоса») [20].
Чтобы установить диагноз, симптомы шизофрении должны присутствовать в течение полугода, а также необходимо наличие обострения длительностью не менее одного месяца [3][6].
Патогенез шизофрении
Активно исследуются процессы, которые регулируют процессы передачи информации от одного нейрона другому (нейротрансмиттерной регуляции) в головном мозге у больных с этим заболеванием. Традиционные модели шизофрении берут за основу длительный повышенный или длительный пониженный уровень нейротрансмиттера дофамина.
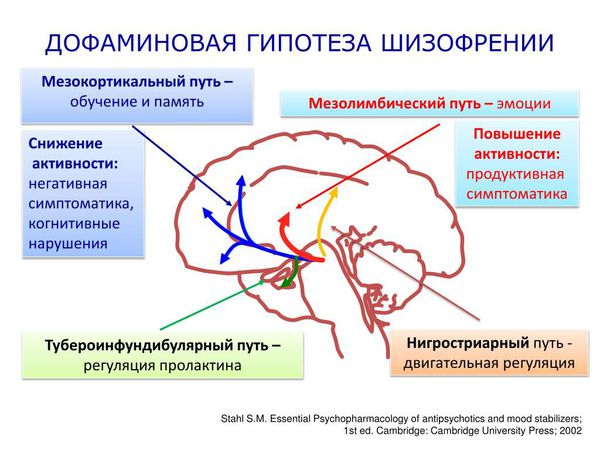
Дофаминовая гипотеза шизофрении была впервые предложена в 1960-х годах, когда обнаружили, что антипсихотический эффект хлорпромазина успешно лечит положительные симптомы у пациентов с шизофренией. Именно тогда началось исследование новых антипсихотических препаратов, механизм действия которых предполагал угнетение повышенной дофаминергической активности.
Такие препараты являлись антагонистами (блокаторами) рецептора допамина D2. Дофаминовый D2-рецептор связан с белком G, который является общей целью для антипсихотических препаратов. При лечении психотических симптомов считалось, что антагонизм рецептора допамина D2 наступает в основном в мезолимбическом пути. Однако антагонист рецептора допамина не является клинически эффективным при лечении негативных симптомов при шизофрении. Хотя точный механизм, лежащий в основе этих когнитивных дефицитов, остаётся в значительной степени неизвестным, такие факторы, как дефицит функции кортикального дофамина, дисфункция в NMDA-рецепторах или нарушение синаптической элиминации, вероятно, играют важную роль в патогенезе заболевания.
Молекулярные исследования подтвердили связь повышенного уровня подкоркового дофамина с возникновением положительных симптомов шизофрении, но с оговоркой, что это не является отличительным признаком шизофрении из-за нейрохимической гетерогенности (неоднородности) популяций пациентов с шизофренией.
Хотя гиперактивность в подкорковой дофаминергической системе в значительной степени является важным условием, объясняющим появление продуктивной симптоматики, дофаминовая гипотеза требует дальнейшего изучения и расширения. Необходимо исследовать роль других нейромедиаторных систем в патофизиологии заболевания [1][13].
Дофаминовая гипотеза шизофрении подтвердилась в ноябре 2022 года. Посмертный анализ мозга пациентов с шизофренией показал, что у них были изменены дофаминовые рецепторы в хвостатом ядре — структуре, расположенной спереди от таламуса. Такие рецепторы регулируют количество дофамина, высвобождаемого из нейронов. Если рецепторы работают неправильно, дофамина становится слишком много [21].
За последние 20 лет стало понятно, что эта теория не до конца объясняет патогенез шизофрении, поэтому потребовались разработки альтернативных моделей. Глутаматергические модели шизофрении основаны на том наблюдении, что психотомиметики (отравляющие психоделические галлюциногенные вещества), например фенциклидин (PCP) и кетамин, провоцируют психотические симптомы и нейрокогнитивные нарушения, сходные с симптомами шизофрении, блокируя нейротрансмиссию в рецепторах глутамата N-метил-D-аспартата (NMDA).
Поскольку глутаматные NMDA-рецепторы расположены во всем мозге, глутаматергические модели объясняют распространённую кортикальную дисфункцию с участием NMDA-рецепторов. Кроме того, NMDA-рецепторы расположены на мозговых структурах, которые регулируют высвобождение дофамина, что свидетельствует о том, что дофаминергический дефицит при шизофрении может также быть вторичным по отношению к основной глутаматергической дисфункции. Лекарственные препараты, которые стимулируют нейропередачу, опосредованную NMDA-рецепторами, включая ингибиторы транспорта глицина, показали обнадёживающие результаты в доклинических исследованиях и в настоящее время проходят клинические испытания. В целом, эти данные свидетельствуют о том, что глутаматергические теории могут привести к новым подходам в лечении, которые были бы невозможны только на основе дофаминергических моделей [10].
Классификация и стадии развития шизофрении
В психиатрии используется две классификационные системы:
- Международная классификация болезней 1-го пересмотра (МКБ-10). Больше распространена в Евразии.
- Диагностическое и статистическое руководство по психическим расстройствам 5-го издания (DSM-V). Чаще используется в Америке.
Несмотря на исключение клинических форм из классификации DSM-V [6], в отечественной психиатрии и в МКБ-10 сохранено правило подразделения заболевания по формам, которые отличаются друг от друга некоторыми особенностями течения и проявления. Однако есть мнение, что при следующем пересмотре МКБ деление шизофрении на формы будет убрано, так как на практике различия форм нечёткие.
Формы шизофрении
1. Параноидная форма. Встречается чаще всего. Основным проявлением является относительно стабильный, обычно параноидный, бред, который часто сопровождается слуховыми галлюцинациями и другими нарушениями восприятия. Патологий в сфере эмоций, воли, речи и кататонических симптомов чаще всего нет или они относительно слабо выражены.
2. Гебефреническая шизофрения. При этой форме заболевания на первый план в клинике выходят аффективные нарушения в виде вычурного и непредсказуемого поведения и манеризма (манерничанья). При этом бред и галлюцинации выражены слабо. Настроение у больных лабильное (неустойчивое), неадекватное, мышление грубо разорвано. У больных гебефренической формой шизофрении серьёзно страдает уровень социального функционирования. Вследствие быстрого нарастания дефекта в эмоционально-волевой сфере прогноз для пациентов неблагоприятный.
3. Кататоническая шизофрения. Проявляется ярко выраженными чередующимися приступами психомоторных нарушений: колебаниями между гиперкинезом (психомоторным возбуждением) и ступором или пассивным подчинением и негативизмом. На фоне длительно сохраняющейся скованной позы случаются внезапные состояния психомоторного возбуждения, что очень характерно для данной формы заболевания.
4. Простая форма шизофрении. Характеризуется отсутствием бреда и галлюцинаций при ярко выраженной неспособности к функционированию в социуме, аутизации, эмоциональной неадекватности, амбивалентности. Как правило, такой вариант заболевания протекает очень медленно, злокачественное течение наблюдается крайне редко [2][3].
Подтипы шизофрении
Шизофрению разделяют на дефицитарный и недефицитарный подтип в зависимости от наличия негативных симптомов: отсутствия мотивации, эмоциональной холодности и снижения стремления к достижению целей.
У пациентов сдефицитарным типом преобладает негативная симптоматика со стёртым проявлением других симптомов, например депрессии или тревожности.
Для пациентов снедефицитарным подтипом характерны галлюцинации, бредовые состояния, расстройства мышления, негативная симптоматика встречается редко.
Манифестация шизофрении
Типичные признаки болезни, которые проявляются до развития шизофрении:
- отсутствие близких дружеских или романтических отношений;
- сниженный интерес к командным видам спорта и предпочтение одиночных активностей (прослушивание музыки, увлечение компьютерными играми) ;
- у некоторых людей могут внезапно развиваться обсессивно-компульсивные черты;
- пассивность, интровертированность;
- необычные увлечения философией и религией;
- странности в поведении, необычные идеи и увлечения.
Заболевание, как правило, начинается задолго до первой госпитализации и проявляется неспецифическими жалобами:
- головными болями;
- болями в спине или мышцах;
- слабостью;
- утомляемостью;
- проблемами с пищеварением.
Члены семьи и близкие друзья могут отметить, что человек справляется с бытовыми, социальными и профессиональными делами хуже, чем раньше.
В настоящее время активно разрабатываются способы диагностики и вмешательства, которые могли бы предотвратить дебют шизофрении, но на данный момент показано только симптоматическое лечение имеющихся симптомов.
Фазы шизофрении
В зависимости от типа течения шизофрении выделяют несколько фаз (стадий) заболевания:
- Преморбидная стадия — ещё до развития заболевания люди с риском шизофрении имеют типичные личностные черты (эти пациенты тихие, спокойные, интровертированные).
- Продромальная стадия — период неспецифических жалоб.
- Манифестная стадия (стадия психоза) — обострение заболевания с развитием острого психотического расстройства.
- Межприступный период (остаточная стадия). В результате лечения может быть достигнута полная или частичная ремиссия со стабильным/нарастающим дефектом или без него. При непрерывном течении заболевания возможно отсутствие ремиссии.
- Рецидив (возвращение симптомов).
Особые формы шизофрении
- Фебрильная шизофрения (смертельная кататония) — неотложное состояние с развитием кататонической симптоматики (ступором, повторением слов и действий окружающих, хаотичным возбуждением с агрессией и др.), повышением температуры тела, общемозговыми и менингеальными синдромами вследствие отёка головного мозга. Является осложнением шизофрении и шизоаффективного расстройства. Встречается сравнительно редко.
- Шизофрения в форме затяжного пубертатного приступа — клиническая форма шизофрении, развивающаяся в подростковом периоде. Проявляется неврозоподобной и психопатоподобной симптоматикой, сверхценными или бредовыми идеями, философской и метафизической интоксикацией. Характерно стремление к самоутверждению и поведенческие нарушения. Не выделяется отдельно в МКБ-10, кодируется как психопатоподобная шизофрения.
Детская шизофрения
Формы детской шизофрении группируются по возрастному критерию:
- Шизофрения дошкольного возраста характеризуется преобладанием в дебюте негативной симптоматики заболевания. У ребёнка быстро угасает психическая активность, уменьшается интерес к играм и общению. Нарастает аутизация, пассивность, стремление к уединению. По мере взросления появляется разнообразная продуктивная симптоматика. Выражена тенденция к быстрому развитию тяжёлых состояний.
- Шизофрения детей младшего школьного возраста. Характеризуется медленными и незаметными изменениями личности. Дети отгораживаются от своего окружения, не интересуются играми и общением со сверстниками. Могут возникать сверхценные страхи и ипохондрические переживания. Часто встречается патологическое фантазирование. Дети играют и живут в своих выдуманных мирах, перевоплощаются в объекты своих выдумок.
- Подростковая шизофрения клинически схожа с шизофренией взрослого возраста. Для этого возраста характерны излишняя обеспокоенность незначительными дефектами своего тела, философская интоксикация, гебефренический синдром (дурашливость, проявление детских черт). Заболевание начинается как резкий «надлом» в психике: общительные дети становятся замкнутыми и наоборот; подросток полностью меняет сферу интересов и круг общения.
Осложнения шизофрении
Возможные нарушения при шизофрении:
- Нарушении физиологических функций, в связи с чем возникают трудности с выполнением ежедневных бытовых нужд (приёма пищи, сна).
- Нарушения функций головного мозга, как следствие возникают головные боли, бессонница, агрессия и раздражительность.
Чем опасно заболевание
- Сокращение продолжительности жизни на 20 %.
- Возникновение навязчивых мыслей и идей, которые могут навредить как самому больному, так и окружающим его людям.
- Повышенный риск смертности. Среди пациентов с шизофренией более высокий уровень смертности, чем среди населения в целом, преобладают естественные причины смерти (сердечно-сосудистые заболевания, рак и др.) и самоубийства. Известно, что 9-13 % лиц с диагнозом шизофрения кончают жизнь самоубийством [19]. Также среди причин летального исхода выделяют фебрильную шизофрению (приступ заболевания с центральной лихорадкой и полиорганной недостаточностью).
- Снижение социальной активности и уровня личностного функционирования, что приводит к инвалидизации [11].
Диагностика шизофрении
Диагностические критерии шизофрении в DSM-V[6]:
- бредовые идеи (преследования, величия, самоуничижения, религиозный бред, эротоманический, нигилистический и т. д.);
- галлюцинации (тактильные, слуховые, зрительные, ольфакторные и т. д.);
- разорванность речи (мышления);
- нарушение поведения, кататония (двигательные нарушения в виде ступора или возбуждения);
- негативные симптомы.
Для постановки диагноза необходимо наличие не менее двух симптомов, и хотя бы один симптом должен быть одним из первых трёх (бред, галлюцинации, разорванность речи/мышления).
Негативные симптомы:
- снижение эмоциональной экспрессивности: гипомимия или амимия (ослабление или отсутствие мимики), отсутствие зрительного контакта, отсутствие выразительности речи;
- снижение мотивации и целенаправленности деятельности;
- алогия (снижение речевой продукции и другие речевые нарушения);
- ангедония (снижение способности испытывать удовольствие от положительных стимулов или невозможность вспоминать об удовольствии, которое ранее испытывалось);
- асоциальность (отсутствие интереса к социальным взаимодействиям).
Критерии шизофрении из исследовательской версии МКБ-10:
1. Критерии первого ранга:
- «эхо» мысли (звучание мыслей);
- бред воздействия, влияния или другие бредовые восприятия;
- слуховые галлюцинации (голоса) комментирующего характера;
- стойкие бредовые идеи, неадекватные и невозможные по содержанию: идентификация себя с религиозными или политическими фигурами, заявления о сверхчеловеческих способностях (например, о возможности управлять погодой или об общении с инопланетянами).
2. Критерии второго ранга:
- ежедневные хронические галлюцинации любого вида на протяжении минимум одного месяца, которые сопровождаются бредом (может быть нестойким и полуоформленным) без отчётливого аффективного содержания;
- неологизмы, перерывы в мышлении, приводящие к разорванности или несообразности в речи;
- кататоническое поведение: возбуждение, застывание или восковая гибкость, негативизм (поведение противоположное ожидаемому), мутизм (отсутствие речи) и ступор;
- «негативные» симптомы, такие как выраженная апатия, речевое обеднение и сглаженность или неадекватность эмоциональных реакций (должно быть очевидным, что они не обусловлены депрессией или нейролептической терапией.
На протяжении большей части психотического эпизода длительностью не менее одного месяца (или в течение какого-либо времени в большинстве дней) должен отмечаться минимум один из признаков, перечисленных в первом перечне или минимум два признака из второго перечня.
Обычно дифференциальную диагностику шизофрении проводят со следующими психическими расстройствами:
- Шизофреноподобное расстройство и кратковременное психотическое расстройство — длятся меньше, чем шизофрения. При шизофреноподобном расстройстве нарушение присутствует менее 6 месяцев, а в кратковременном психотическом расстройстве симптомы присутствуют как минимум один день, но менее одного месяца.
- Хроническое бредовое расстройство — протекает при отсутствии других симптомов, характерных для шизофрении (например, слуховых или зрительных галлюцинаций, дезорганизованной речи, негативных симптомов). Есть только стойкий бред.
Шизотипическое расстройство — выраженность нарушения личности не такая сильная, как при шизофрении. Например, не происходит глубокого эмоционального опустошения [3][6].
Когда следует обратиться к врачу
Чем раньше начато лечение шизофрении, тем выше шансы на благоприятный прогноз. Поэтому при появлении симптомов шизофрении, затрудняющих социальное и профессиональное функционирование, следует как можно скорее обратиться за медицинской помощью.
Подготовка к посещению психиатра
Вопросы, которые может задать психиатр:
- что привело на приём;
- попросить рассказать о произошедших событиях и о том, какие чувства и мысли они вызвали;
- врач может задавать как прямые вопросы: «Как часто Вы слышите голоса?», так и вопросы о быте, работе, семье.
Для диагностики может быть полезна информация, полученная не только от самого пациента, но и от его близких.
Диагностические тесты и шкалы
Врачи-психиатры применяют различные диагностические шкалы. Среди них:
- Шкала оценки позитивных и негативных симптомов (PANNS).
- Шкала краткой оценки негативных симптомов (BNNS).
- Шкала депрессии Калгари у пациентов с шизофренией.
- Шкала личностного и социального функционирования (PSP).
Помимо беседы, в процессе исследования психиатром используются диагностические тесты и методики, такие как MMPI, таблицы Шульте, пробы на запоминание, «четвертый – лишний», метод пиктограмм. Но все они имеют дополнительное значение, т. к. диагноз шизофрении ставится на основании клинических симптомов.
Тест Люшера не специфичен для диагностики шизофрении, но может применяться как дополнительный.
Лечение шизофрении
Цели терапии больных шизофренией:
- повышение уровня социального функционирования;
- повышение комплайентности (приверженности) пациентов и обеспечение безопасности терапии;
- повышение качества жизни;
- снижение частоты обострений и увеличение длительности улучшения психического состояния при этом заболевании.
При выборе лечения необходимо учитывать фармакогеномику (генетическую склонность пациентов к тем или иным препаратам), побочные эффекты, стоимость препаратов, готовность пациента к терапии, а также оценку риска терапии при учёте коморбидных состояний (когда у пациента протекает одновременно несколько заболеваний) [14].
Современный подход к лечению шизофрении как биопсихосоциального заболевания предполагает комплексную терапию с применением как биологических (медикаментозных и нелекарственных), так и психосоциальных методов.
Психофармакотерапия
- Первый этап терапии шизофрении направлен на то, чтобы снять обострение заболевания и в дальнейшем стабилизировать психическое состояние больного.
- На втором этапе лекарственные препараты применяются для поддержания достигнутого улучшения и профилактики возможных приступов (противорецидивное действие препаратов).
В первую очередь используются антипсихотические препараты.
- Первое поколение: хлорпромазин, флуфеназин, галоперидол, перфеназин.
- Второе поколение: антипсихотиков: клозапин, оланзапин, палиперидон, кветиапин, рисперидон, зипрасидон и др.
Выбор препарата зависит от симптомов. Возможные побочные эффекты и осложнения терапии:
- экстрапирамидная симптоматика (острые мышечные спазмы, потребность постоянно двигаться, лекарственный паркинсонизм, позднее расстройство кишечника);
- злокачественный нейролептический синдром (мышечная скованность, лихорадка);
- метаболический синдром (нарушение обмена жиров и углеводов, повышением артериального давления) и др.
Наряду с антипсихотиками, в лечении шизофрении довольно широко применяются транквилизаторы и нормотимики.
Нелекарственные методы лечения
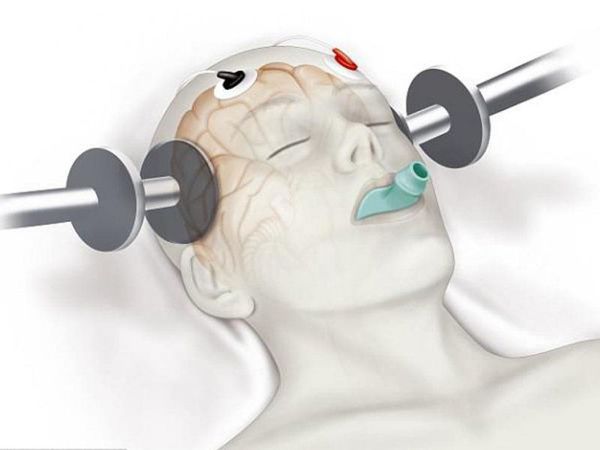
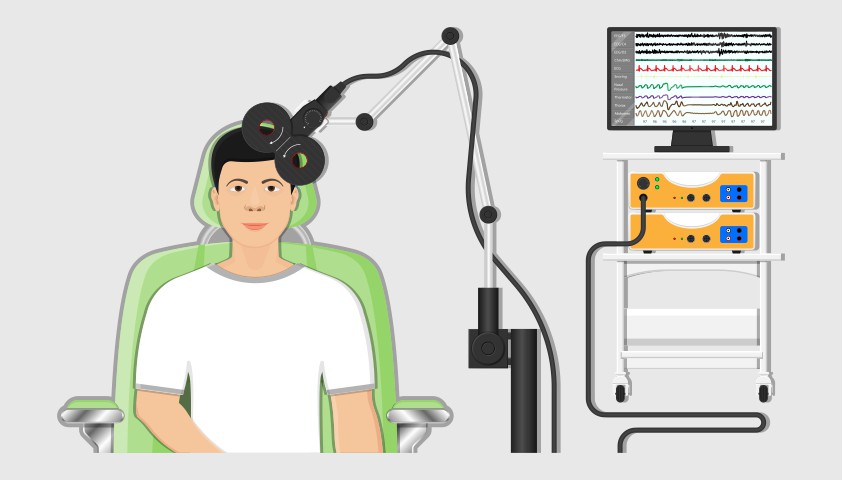
К нелекарственным методам лечения можно отнести электросудорожную терапию (ЭСТ) и транскраниальную магнитную стимуляцию (ТМС). Эти методы применяются в тех случаях, когда заболевание не поддаётся консервативному медикаментозному лечению. Обычно после ЭСТ и ТМС у пациентов наступает значительное улучшение и длительный период без обострений психотической симптоматики. Необходимо отметить, что эффективность ТМС еще не доказана полностью.
Реабилитация и поддерживающие групповые занятия
Важное место занимают психосоциальная реабилитация и поддерживающие занятия для больных шизофренией. Их цель — восстановление социальных и коммуникативных навыков пациентов и повышение их уровня функционирования [4].
Прогноз. Профилактика
Прогноз. Научные исследования показали, что существуют некоторые факторы, которые улучшают прогноз при шизофрении. К ним относятся:
- женский пол;
- острое начало заболевания по сравнению с длительно текущим процессом;
- более поздний возраст манифестации;
- преобладание продуктивной, а не негативной симптоматики в клинике заболевания;
- высокий уровень социального функционирования и личностной автономии в преморбидном периоде (предшествующем заболеванию).
Однако установить чёткую причинно-следственную связь сложно. Также доказано, что негативное отношение общества к людям с шизофренией может оказать значительное неблагоприятное влияние на этих пациентов. В частности, было обнаружено, что критические высказывания, враждебное отношение, авторитарность членов семьи больных шизофренией взаимосвязано с более высоким риском рецидива заболевания в разных культурах [9][18].
Что нужно делать, чтобы избежать шизофрении
Так как точная причина развития шизофрении не известна, то и меры профилактики разработать сложно. В качестве первичной профилактики можно рекомендовать медико-генетические консультации. Больных шизофренией и их супругов необходимо предупредить о повышенном риске возникновения психического расстройства у их потомков.
Вторичная и третичная профилактика заключается в ранней диагностике шизофрении. Раннее выявление заболевания позволяет эффективно пролечить первый психотический эпизод и установить длительную ремиссию.
Как вести себя с больным шизофренией
Людям, чей близкий человек болен шизофренией, рекомендовано:
- следить за своевременным приёмом лекарств и мотивировать пациента к лечению;
- отмечать изменения в поведении и при необходимости обращаться за медицинской помощью;
- помочь организовать быт и распорядок дня, следить, чтобы пациент хорошо высыпался;
- следить за тем, чтобы больной избегал алкоголя и других психоактивных веществ;
- найти адекватные способы справляться со стрессом, в том числе с помощью психосоциальных методик.
Лекция для врачей «Шизофрения». Введение. Лекцию для врачей проводит Игнатий Владимирович Журавлев — практикующий психолог, психотерапевт, кандидат психологических наук, специалист в области общей и клинической психологии, психологии общения, индивидуального и семейного консультирования. Автор лекционных курсов по проблемам развития ребенка, межличностного взаимодействия, коммуникации в семье, психической патологии
Шизофрения. Часть 1. Общая характеристика шизофреника
Шизофрения. Часть 2. Когнитивные нарушения
Шизофрения. Часть 3. Социальные когнитивные функции
Шизофрения. Часть 4. Когнитивно-поведенческая психотерапия
Дополнительный материал
Общие положения
Клинические рекомендации определяют основные правила ведения больных шизофренией на последовательных этапах оказания психиатрической помощи в соответствии с требованиями медицины, основанной на доказательствах. Рекомендуются те методы и препараты, которые имеют убедительные доказательства преимуществ в безопасности, эффективности перед другими, что улучшает соотношение «затраты- эффективность» лечебно-профилактических мероприятий.
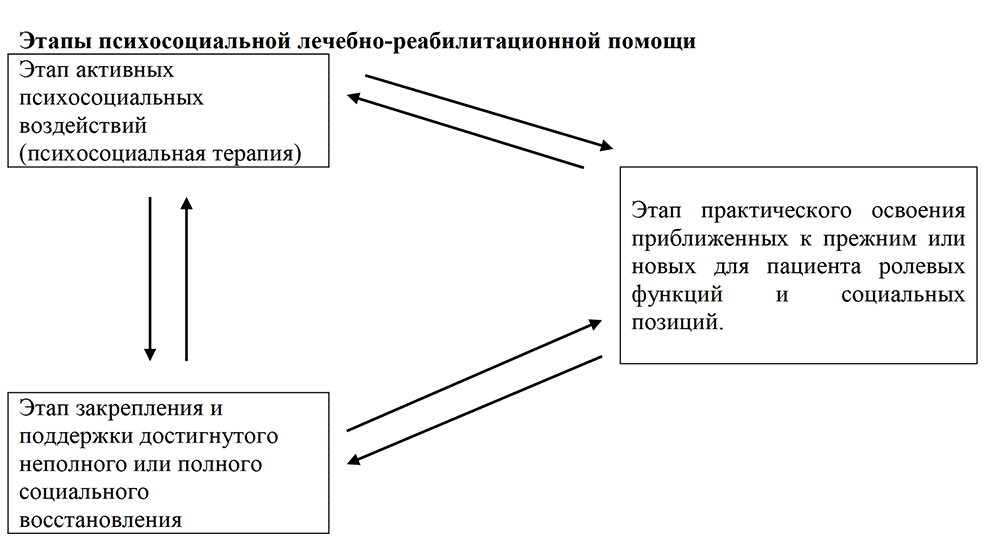
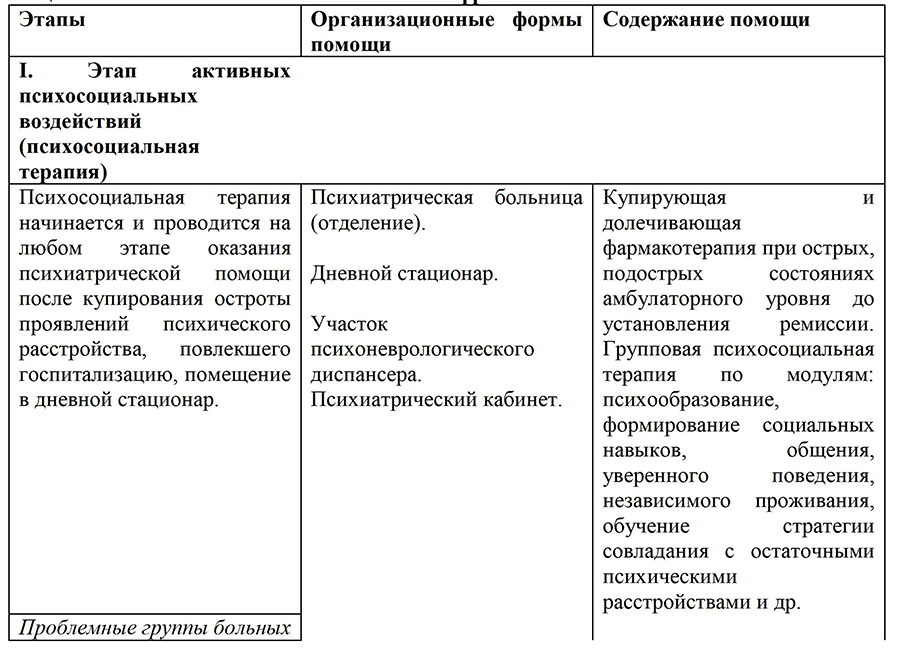
Шизофрения — заболевание, в отношении которого помощь не может ограничиваться только биологической терапией. Она, безусловно, должна включать психосоциальную терапию и психосоциальную реабилитацию, психотерапию, клинико¬социальные мероприятия и использование различных организационных форм помощи. Это соответствует современным положениям о бригадном подходе в работе с больными и приближению оказания помощи к общественно ориентированной психиатрии.
Актуальность разработки клинических рекомендаций объясняется следующими принципами:
— -медико-социальным и экономическим бременем шизофрении;
— различиями качества и организации психиатрической помощи в различных регионах страны и отдельных лечебно-профилактических учреждений;
— разным уровнем подготовки медицинских и социальных работников;
— недостаточной осведомленностью врачей-психиатров о результатах клинических исследований и рекомендациях по применению отдельных методов терапевтического вмешательства, полученных на основе методологии доказательной медицины;
— существенными отличиями рекомендованной («надлежащей») и реальной (повседневной) практики диагностики и лечения больных шизофренией;
— низким уровнем правовой защиты потребителей психиатрической помощи (пациентов и их близких);
— ограниченными возможностями финансирования психиатрических служб.
Цель настоящих рекомендаций — повышение качества обслуживания больных шизофренией в специализированных лечебно-профилактических учреждениях при обеспечении надлежащего объема психиатрической помощи.
Настоящее издание ограничивается освещением помощи только больным шизофренией (Б20 по МКБ-10). Помощь больным с остальными расстройствами шизофренического спектра, в том числе шизоаффективным и шизотипическим, а также другими психотическими и бредовыми расстройствами, требует отдельного рассмотрения.
Уровни доказательности
Руководство снабжено четырехуровневой системой оценки доказательности, согласно иерархии достоверности научных данных (при этом следует иметь в виду, что невысокий уровень доказательности — не всегда свидетельство ненадежности данных):
A) Доказательства убедительны: есть веские доказательства предлагаемому утверждению, которые получены на основании одного, хорошо спланированного, или нескольких рандомизированных клинических исследований (РКИ) или большого систематического обзора (мета-анализа) РКИ.
B) Относительная убедительность доказательств: есть достаточно доказательств в пользу того, чтобы рекомендовать данное предположение. Доказательства получены на основании по крайней мере одного контролируемого исследования или систематического обзора когортных исследований или РКИ.
C) Доказательства из неконтролируемых исследований или описание случаев/мнений экспертов
С1 Неконтролируемые исследования
С2 Описания случаев
С3 Мнение экспертов или клинический опыт
О) Неоднородные результаты
Положительные РКИ перевешиваются примерно равным количеством исследований с отрицательным результатом
Е) Отрицательные доказательства
Достаточно отрицательных доказательств: имеется достаточно доказательств, чтобы рекомендовать отказаться от применения данного лекарственного средства или метода лечения в определенной ситуации.
Б) Недостаточно доказательств
Эпидемиология, этиопатогенез и диагностика
Шизофрения — одно из наиболее распространенных психических расстройств, характеризующееся сочетанием продуктивной (галлюцинаторно-бредовой, кататоно- гебефренной, аффективной и др.) и негативной (апатия, абулия, алогия, эмоциональная и социальная отгороженность и др.) симптоматики, поведенческих и когнитивных нарушений (памяти, внимания, мышления и др.) и приводящее к неблагоприятным социальным и экономическим последствиям.
По данным эпидемиологических исследований распространенность шизофрении в мире оценивается в пределах О,8-1,0%.
Заболеваемость в РФ в 2011г. составила 12,2 на 100 тыс. чел. населения; болезненность — 379,7 на 100 тыс. чел. населения. Модальный возраст начала болезни для мужчин 18-25 лет, для женщин 25-30 лет. Характерны хронический (в большей части случаев) характер заболевания или течение с частыми обострениями, нарастающими изменениями личности и высоким уровнем инвалидизации (до 40% больных шизофренией). Вместе с тем, около 20-30% больных при адекватной терапии достигают степени «социального выздоровления» или ремиссии с минимальной симптоматикой. Социальные издержки связаны более чем на 90% с инвалидностью лиц трудоспособного возраста. Соотношение (2,6:1) медицинских и социальных потерь подчеркивает общественную значимость шизофрении и необходимость повышения ресурсосберегающего потенциала биопсихосоциальной терапии и реабилитации.
Сопутствующие соматические заболевания (сердечно-сосудистые, диабет II типа и т.д.) и суициды являются ведущими причинами преждевременной смертности и сокращают продолжительность жизни больных шизофренией в среднем на 10 лет по сравнению с популяцией.
В настоящее время общепринятой является стресс-диатезная модель происхождения шизофрении, в которой находит отражение представление о значении в развитии болезни не только наследственного, но и средовых, в том числе социальных факторов. В случае наличия болезни у одного из родителей риск заболевания шизофренией у пробандов составляет 10%, при болезни у обоих родителей — до 40%. Придается значение отклонениям в развитии головного мозга, явлениям диатеза с личностной уязвимостью, при наличии которых сверхпороговые внешние раздражители (психосоциальные стрессовые факторы) приводят к прогрессирующему процессу, проявляющемуся психопатологической (позитивной и негативной) симптоматикой.
В основе наиболее принятой нейрохимической концепции патогенеза шизофрении — нарушение обмена нейромедиаторов, в частности дофамина, в головном мозге. В последнее время специальное внимание уделяется глутаматергической системе. Специфических тестов (биологических маркеров) для диагностики шизофрении не существует, однако накапливаются нейровизуализационные данные в пользу т.н. гипофронтальности — снижения функциональной активности и обмеченных процессов в передних отделах головного мозга у больных шизофренией (эти явления усугубляются по мере течения заболевания).
Диагноз шизофрении устанавливается на основании критериев Международной классификации болезней 10-го пересмотра (МКБ-10) (Психические и поведенческие расстройства).
Для диагностики шизофрении необходимо наличие, как минимум, одного четкого симптома (или 2 менее отчетливых симптомов), принадлежащего к перечисленным ниже признакам 1-4, или 2 симптомов, относящихся к признакам 5-9, которые должны отмечаться на протяжении не менее одного месяца.
1. Эхо мыслей, вкладывание или отнятие мыслей, их трансляция (открытость);
2. Бред воздействия, влияния или овладения, относящийся к движениям тела или конечностей или к мыслям, действиям или ощущениям; бредовое восприятие;
3. Галлюцинаторные голоса, комментирующие поведение больного или обсуждающие его между собой; другие типы галлюцинаторных голосов, исходящих из какой-либо части тела;
4. Стойкие бредовые идеи другого рода, которые не адекватны для данной социальной культуры и не имеют рационального объяснения по своему содержанию;
5. Постоянные галлюцинации любой сферы, которые сопровождаются нестойкими или не полностью сформированными бредовыми идеями без четкого эмоционального содержания, или постоянные сверхценные идеи, которые могут появляться ежедневно в течение нескольких недель;
6. Прерывание мыслительных процессов или вмешивающиеся мысли, которые могут привести к разорванности или разноплановости в речи; или неологизмы;
7. Кататонические расстройства, такие как недифференцированное, иногда стереотипное возбуждение, импульсивные действия, застывания или восковая гибкость, негативизм, мутизм и ступор; возможны утрированная манерность, гримасничанье;
8. «Негативные» симптомы, такие как выраженная апатия, бедность речи, сглаженность или неадекватность эмоциональных реакций, что обычно приводит к социальной отгороженности и снижению социальной продуктивности; эти признаки не обусловлены депрессией или лекарственной нейролепсией;
9. Значительное последовательное качественное изменение поведения, что проявляется утратой интересов, нецеленаправленностью, бездеятельностью, самопоглощенностью и социальной аутизацией.
Состояния, соответствующие приведенным критериям, но продолжающиеся менее месяца (независимо от того находился больной на лечении или нет), должны быть квалифицированы как острое шизофреноподобное психотическое расстройство или перекодироваться, если симптомы продолжаются в течение более длительного периода. Диагноз шизофрении не должен ставиться при наличии выраженных депрессивных или маниакальных симптомов, если указанные выше шизофренические симптомы не предшествовали аффективным расстройствам. Не следует диагностировать шизофрению при наличии явных признаков болезней мозга или при наличии состояний лекарственной интоксикации или отмены.
Продромальные явления могут предшествовать острому психотическому эпизоду на протяжении недель или даже месяцев. К продромальным симптомам относятся: не сильно выраженные когнитивные нарушения, изменения моторики, отдельные расстройства восприятия, утрата интереса к работе, к социальной деятельности, к своей внешности, к гигиеническим привычкам, что может сочетается с тревогой и легкой степенью депрессии или другой неспецифической психопатологической симптоматикой. Критерий наличия расстройств в течение одного месяца имеет отношение только к вышеупомянутым специфическим симптомам, а не к продромальному непсихотическому этапу. У большинства больных (около 75%) продромальный этап длится более 5 лет.
Согласно МКБ-10, выделяют несколько форм шизофрении: параноидная, гебефреническая (гебефренная), кататоническая, недифференцированная и простая. Для диагностики определенной формы заболевания должны выявляться общие критерии шизофрении и кроме того:
— для параноидной формы должны быть выраженными галлюцинации и/или бред: галлюцинаторные голоса угрожающего или императивного характера или слуховые галлюцинации без вербального оформления, обонятельные или вкусовые галлюцинации, сексуальные или другие телесные ощущения; бред преследования, воздействия, отношения, значения, высокого происхождения, особого предназначения, телесных изменений или ревности. Эмоциональная сглаженность или неадекватность, кататонические симптомы или разорванная речь не должны доминировать в клинической картине, хотя они могут присутствовать в легкой степени выраженности;
— гебефреническая (гебефренная) форма обычно должна быть впервые диагностирована в подростковом или юношеском возрасте. Должны отмечаться: отчетливая и продолжительная эмоциональная сглаженность или неадекватность; поведение, которое характеризуется больше дурашливостью, нежели нецеленаправленностью; отчетливые расстройства мышления в виде разорванной речи. В клинической картине не должны доминировать галлюцинации или бред, хотя они могут присутствовать в легкой степени выраженности;
— при кататонической шизофрении в течение минимум двух недель отчетливо определяется один или более из следующих кататонических симптомов: ступор или мутизм; возбуждение; застывания; негативизм; ригидность; восковая гибкость; подчиняемость (автоматическое выполнение инструкций);
— при недифференцированной шизофрении симптоматика или недостаточна для выявления другой формы шизофрении, или симптомов так много, что выявляются критерии более одной формы шизофрении;
— при простой форме отмечается медленное развитие на протяжении не менее года
всех трех признаков:
1) отчетливое изменение преморбидной личности, проявляющееся потерей влечений и интересов, бездеятельностью и бесцельным поведением, самопоглощенностью и социальной аутизацией, 2) постепенное появление и углубление негативных симптомов, таких как выраженная апатия, обеднение речи, гипоактивность, эмоциональная сглаженность, пассивность и отсутствие инициативы, бедность невербального общения, 3) отчетливое снижение социальной, учебной или профессиональной продуктивности. Отсутствие галлюцинаций или достаточно полно сформировавшихся бредовых идей любого вида, то есть клинический случай не должен отвечать критериям любой другой формы шизофрении или любого другого психического расстройства. Отсутствие данных за деменцию или другое органическое психическое расстройство.
Выделяют следующие типы течения заболевания: непрерывный, эпизодический с нарастающим дефектом, эпизодический со стабильным дефектом, эпизодический ремиттирующий.
Приступы (обострения) заболевания могут характеризоваться различной выраженностью симптоматики и не всегда требовать госпитализации больных. Например, первый психотический эпизод может быть купирован во внебольничных условиях в 50% случаев.
Клинические проявления обострения (приступа) шизофрении: манифестация или усиление продуктивной психопатологической симптоматики в виде бреда, галлюцинаций, нарушений мышления, часто сопровождающихся страхом, тревогой, нарастающими изменениями поведения, различными видами психомоторного возбуждения, кататонической и гебефренической симптоматикой, зачастую — суицидальными мыслями и поступками.
В зависимости от выраженности нарушений, обострения (приступы) могут купироваться во внебольничных (при сохранении относительно упорядоченного поведения и отсутствии опасных для самого больного и окружающих тенденций) или стационарных условиях (при выраженности и остроте психопатологических расстройств, грубом нарушении социально приемлемых форм поведения, опасности для себя или окружающих).
Первичный осмотр врача-психиатра проводится с целью уточнения диагноза шизофрении, определения ее формы, типа течения, необходимости стационарного лечения и наблюдения. Осмотр осуществляется также психотерапевтом, психологом, специалистом по социальной работе, социальным работником и другими членами полипрофессиональной бригады (в зависимости от состояния пациента). Осуществляется комплексная диагностика, строится план лечения, назначается фармакотерапия и психосоциальное лечение.
Проводится беседа с пациентом и, по возможности, его родственниками. Выясняются:
— наследственная отягощенность психическими заболеваниями;
— преморбидные особенности личности, в том числе относящиеся или к акцентуациям, или к особенностям психопатического уровня;
— возраст, в котором впервые возникли первые признаки заболевания; продромальные явления, когда заболевание впервые было диагностировано (неврозо- и психопатоподобные расстройства, аффективные колебания, сверхценные образования, нарушения социального функционирования, транзиторные субпсихотические эпизоды);
— психический статус на момент осмотра (поведение больного, ориентировка в месте, времени, собственной личности, доступность в отношении болезненных переживаний, описание выявленных психопатологических расстройств, наличие или отсутствие критики к ним, своему положению и болезни в целом);
— соматический и неврологический статус;
— социальный статус (образование, семейное положение, трудовой статус, особенности социального функционирования, круг и стиль общения — обособленность, неразборчивость в контактах, склонность к агрессии либо пассивная подчиняемость и т.п.);
— особенности динамики заболевания (характер течения заболевания и его прогредиентность).
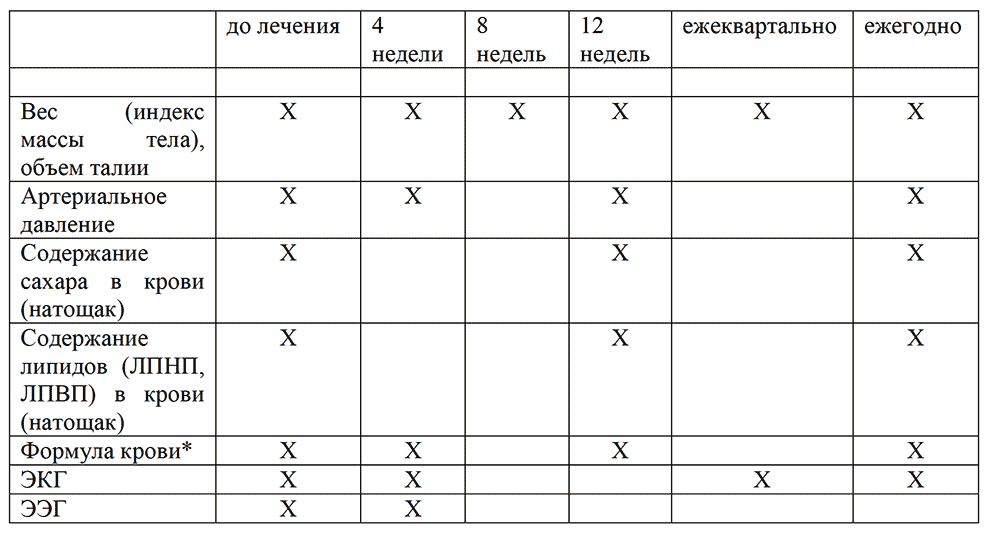
Следует исключить любое соматическое, неврологическое и органическое психическое расстройство или употребление токсических веществ, которые могут вызвать острое психотическое состояние с шизофреноформной симптоматикой. С этой целью обязательно проводят общий и биохимический анализ крови, анализ мочи, ЭКГ, при необходимости — ЭЭГ, М-ЭХОЭГ, магнито-резонансную томографию (МРТ) и другие лабораторные и инструментальные исследования, токсикологические тесты в крови и моче.
Дифференциальный диагноз с другими психическими заболеваниями требует изучения анамнеза, выделения ведущего синдрома и катамнестического наблюдения с целью уточнения характера течения заболевания.
Специалист по социальной работе (социальный работник) с момента первичного обращения (поступления) пациента в учреждение, оказывающее психиатрическую помощь, и на всем протяжении дальнейшего ведения случая оценивает особенности его социального положения и социального функционирования. Следует отмечать не только проблемы и трудности, но и благоприятные и положительные особенности. Сведения фиксируются как на настоящий момент, так и по данным истории жизни пациента.
Данные группируются по следующим категориям: семейное положение и особенности семьи; ближайшее (личностно-значимое) окружение; характеристика периода обучения (в прошлом или в настоящем) и уровень полученного образования; профессиональная занятость; материальное положение; самообслуживание; жилищные условия; досуг; проблемы медицинского обслуживания; юридические проблемы и проблемы, связанные с взаимодействием с государственными (в том числе правоохранительными) органами; другие психосоциальные проблемы.
На основании выявленных данных разрабатывается план психосоциальных мероприятий и поэтапного ведения случая с выделением целей и форм вмешательства.
Повторный прием врача-психиатра проводится для окончательной диагностики заболевания (шизофрении) и определения динамики психического состояния, контроля эффективности лечебных мероприятий. Обращается внимание на наличие характера сохранившихся или впервые появившихся жалоб и изменение психического состояния больного после проведенной терапии, отношение пациента к ней, соблюдение предписанного режима лечения, наличие побочных эффектов.
Оценивается выраженность психопатологических расстройств и степень их редукции. Обращается внимание на темп редукции симптоматики, равномерность уменьшения выраженности отдельных компонентов синдрома, исчезновение расстройств, определяющих опасность для больного и его окружения, упорядоченность поведения, контакт с врачом, появление критики к болезненным переживаниям. В стационаре (дневном стационаре) осмотр врачом-психиатром с наблюдением и уходом среднего и младшего медицинского персонала проводится ежедневно (с записями в истории болезни в течение первых 5 дней ежедневно, далее — не реже 1 раза в 3 дня; ухудшение состояния больного должно отражаться в истории болезни в тот же день); в амбулаторных условиях — 1 раз в 3-10 дней.
После достижения ремиссии повторные осмотры проводятся для определения ее стойкости, упорядоченности поведения, готовности к контакту с врачом, констатации изменения в критике к болезненным расстройствам и своему положению. Назначаются поддерживающая фармакотерапия, поддерживающее психосоциальное лечение, проводятся реабилитационные мероприятия, групповые и/или индивидуальные психосоциальные интервенции, мероприятия по социально-трудовой реабилитации, активизации больного в социальной среде, осуществляется контроль эффективности проводимых мероприятий. При этом обращается внимание на наличие и характер сохраняющихся или впервые появившихся жалоб и на изменения психического состояния больного, на соблюдение предписанного режима лечения, появление побочных эффектов и выраженность их.
Повторные осмотры проводятся при изменении состояния больного, а в дальнейшем — в зависимости от стойкости достигнутой ремиссии обычно 1 раз в 1-3 месяца, при длительных ремиссиях — не реже 1 раза в год. При затяжном, хроническом или с частыми обострениями течении комиссионно определяется диспансерное наблюдение.
Шизофрения — заболевание, в отношении которого необходимо комплексное применение биологических методов терапии (медикаментозных и нелекарственных) вместе с психосоциальными, включая психосоциальную реабилитацию, психотерапию, клинико-социальные мероприятия, психообразование и использование различных организационных форм помощи. Это соответствует современным положениям о бригадном подходе в работе с больными и приближению оказания помощи к общественно ориентированной психиатрии.
Психофармакотерапия
Цели и стратегии лекарственной терапии определяются фазой и тяжестью заболевания. Базовым фармакологическим классом для лечения как острых симптомов шизофрении, так и для длительной противорецидивной терапии являются антипсихотические препараты (нейролептики). Несмотря на то, что все современные стандарты рекомендуют придерживаться монотерапии, многообразие клинических проявлений шизофрении и многочисленные сопутствующие заболевания в реальности нередко требуют применения комбинаций различных препаратов, что существенно увеличивает риск развития лекарственных взаимодействий, побочных эффектов и общую преждевременную смертность больных. В этих случаях побочные эффекты и клиническая эффективность должны оцениваться более часто.
В проведении медикаментозной терапии шизофрении выделяют 3 этапа.
Первый этап — купирующая терапия начинается сразу же после постановки предварительного диагноза и заканчивается установлением клинической ремиссии, то есть продолжается до существенной или полной редукции психоза. При адекватной антипсихотической фармакотерапии этот этап может продолжаться от нескольких недель до нескольких месяцев (для достижения полного терапевтического контроля за состоянием обычно требуется 6-8 недель). Основными задачами являются редукция тяжести психоза, коррекция нарушений поведения и сопутствующих симптомов (возбуждения, агрессии, суицидальных тенденций, кататонических и аффективных симптомов). Эффективность фармакотерапии тем выше, чем больше выражены признаки остроты психоза (острое начало, психомоторное возбуждение, напряженные аффекты — тревога, страх, экстаз, растерянность, депрессия, агрессивность, яркие галлюцинаторнобредовые переживания, острый чувственный бред, нарушения сна, негативизм, расстройства сознания, грубые нарушения социальной адаптации), изменчивость, калейдоскопичность симптоматики и динамическая нестабильность состояния в целом. Эффективность ниже при постепенном развитии заболевания, наличии в преморбидном периоде личностных изменений, негативной симптоматики и когнитивных нарушений, при систематизированном интерпретативном бреде, гебефренической симптоматике, отсутствии признаков критического отношения к болезни, пассивности поведения, при застывших, малоподвижных формах с редукцией динамического потенциала и снижением реактивности.
Второй этап — долечивание или стабилизация заключается в продолжении эффективной антипсихотической терапии вплоть до достижения ремиссии с полной или значительной редукцией продуктивной симптоматики, воздействие на негативную симптоматику и когнитивные нарушения, восстановление, по возможности, прежнего уровня социальной адаптации больного. Этап может продолжаться от 3 до 9 месяцев (в среднем около 6 месяцев) от начала острой фазы заболевания. Обычная схема предполагает постепенное уменьшение дозы антипсихотика после установления ремиссии. Важно раннее выявление возможного рецидива и своевременное усиление антипсихотической терапии. При персистировании резидуальной негативной симптоматики необходимо ослабление седативного влияния препаратов, применявшихся в остром периоде, и подключение антипсихотических средств с дезингибирующей активностью с целью создания оптимального лекарственного режима для проведения психотерапии, налаживания интерперсональных связей и социально-трудовой реабилитации.
С учетом того, что шизофрения обычно характеризуется хроническим и рецидивирующим течением, у большинства больных требуется переход к следующему третьему этапу — длительной амбулаторной или противорецидивной терапии, которая направлена на удержание стабильной ремиссии, предотвращение развития новых психотических эпизодов (приступов) и замедление темпа прогредиентности заболевания. Этот этап прежде всего определяется спонтанными тенденциями течения процесса и частотой приступообразования. Обычно после двух и более психотических эпизодов терапия проводится неопределенно долго, но не менее 1 — 2 лет, чтобы можно было оценить ее эффективность. Этап включает в себя сохранение достигнутой редукции позитивной симптоматики, влияние на негативные и когнитивные расстройства, обеспечение противорецидивного эффекта, а также поддержание высокого уровня социального функционирования пациента.
Первый эпизод шизофрении (манифестный приступ)
Антипсихотическая терапия должна проводиться с большой осторожностью ввиду высокого риска развития экстрапирамидной симптоматики (ЭПС). В связи с этим оптимальным является постепенная титрация дозы антипсихотика, со стремлением использовать минимально возможную эффективную дозировку. Пациенты с первым эпизодом шизофрении должны получать терапию антипсихотиками в более низких дозировках в сравнении с хроническими больными (Категория доказательности А). Препаратами первого выбора могут быть как антипсихотические препараты первого поколения (АПП), так и антипсихотические препараты второго поколения (АВП) (Категория доказательности А). В связи с меньшим риском развития экстрапирамидных симптомов в случае первого эпизода шизофрении, предпочтение, в первую очередь, должно быть отдано АВП (Категория доказательности С3). Особое внимание на этом этапе заболевания должно уделяться созданию оптимального лекарственного режима для проведения психотерапевтических и социально-реабилитационных мероприятий, а также для формирования приверженности к терапии.
Шизофрения с повторными эпизодами (рецидив)
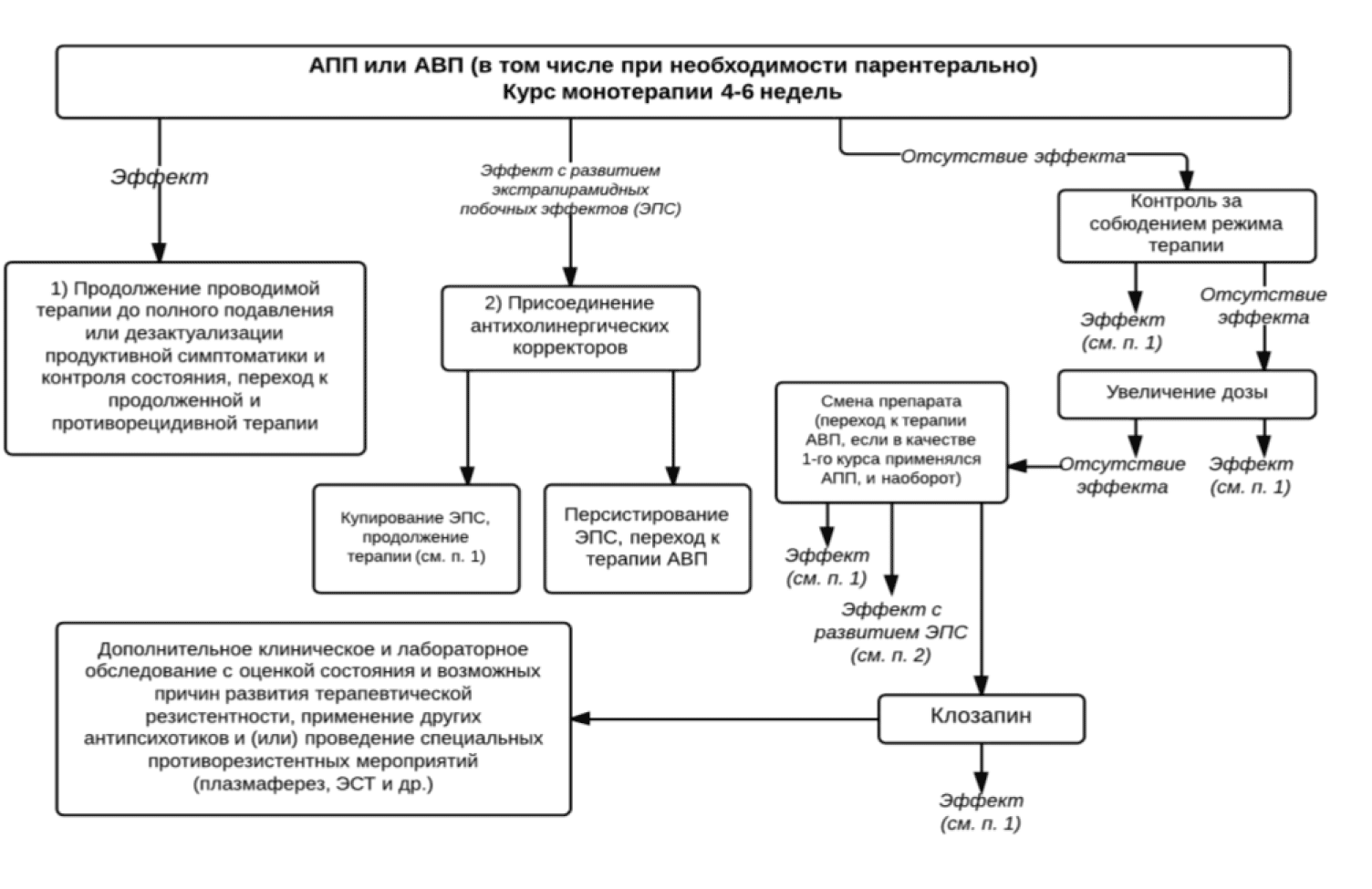
Выбор антипсихотической терапии должен основываться на предыдущем опыте лечения с учетом эффективности и переносимости прежних методов терапии, лекарственной формы препарата, наличия коморбидных психических и соматических расстройств, а также потенциальных лекарственных взаимодействий с сопутствующей терапией. К сожалению, доказательных исследований по изучению дифференцированного воздействия различных антипсихотиков на отдельные клинические синдромы и формы течения шизофрении не проводилось. Большая часть их была проведена на пациентах параноидной формой шизофрении. Однако имеются отдельные доказательные данные по лечению больных с кататонией (кататонической формой шизофрении), большим удельным весом депрессивной, негативной симптоматики (резидуальная и простая форма шизофрении), а также при терапевтической резистентности (см. соответствующие разделы рекомендаций). Доказательных исследований по терапии гебефренной и других рано начавшихся (ядерных) формах шизофрении не проводилось. Тем не менее имеется экспертное мнение о преимуществе в данных случаях АПП и АВП, обладающих более мощным глобальным антипсихотическим эффектом (галоперидол, зуклопентиксол, пипотиазин, клозапин, оланзапин, рисперидон). В целом, все АВП и АПП могут быть терапией выбора у пациентов с острым психотическим эпизодом (рис.1) (Категория доказательности Л). АВП характеризуются меньшим риском развития неврологических (экстрапирамидных) побочных эффектов, в особенности поздней дискинезии и злокачественного нейролептического синдрома (ЗНС). Более того, у АВП существуют определенные преимущества в отношении лучшей комплаентности и преждевременного прекращения терапии (Категория доказательности В/С3). Некоторые АВП могут иметь преимущество над другими АВП и АПП в отношении общей эффективности и в отдельных клинических ситуациях (рис.2)(Категория доказательности В/С3).
Необходимость смены препарата рассматривается только после того, как терапия настоящим антипсихотиком, в случае отсутствия противопоказаний и хорошей переносимости, была проведена в течение как минимум 4-6 недель в оптимальной терапевтической дозировке (Категория доказательности С). В качестве промежуточного шага при отсутствии терапевтического эффекта целесообразно повышение дозы антипсихотика до максимально разрешенной в действующей на территории РФ инструкции по препарату (рис.1). Достаточно часто проведение антипсихотической терапии сопровождается развитием экстрапирамидной симптоматики (ЭПС). В этом случае необходимо применение терапевтических мероприятий по её купированию (см. раздел «Ведение побочных эффектов» и табл.3). При персистировании ЭПС в дальнейшем, несмотря на её коррекцию, целесообразен перевод на другой антипсихотик с более благоприятным профилем неврологической переносимости (рис. 1).
В случае достижения терапевтического эффекта при приеме АПП без развития выраженных побочных явлений не рекомендуется смена АПП на АВП (Категория доказательности С). В то же время при неэффективности АПП целесообразен перевод на терапию АВП (Категория доказательности В)(рис.1). При неэффективности второго курса антипсихотического препарата психотическая симптоматика расценивается как терапевтически резистентная с необходимостью проведения специальных лечебных мероприятий (см. раздел «терапевтически резистентная шизофрения» и рис.1).
Рис. 1. Алгоритм фармакотерапии обострения шизофрении
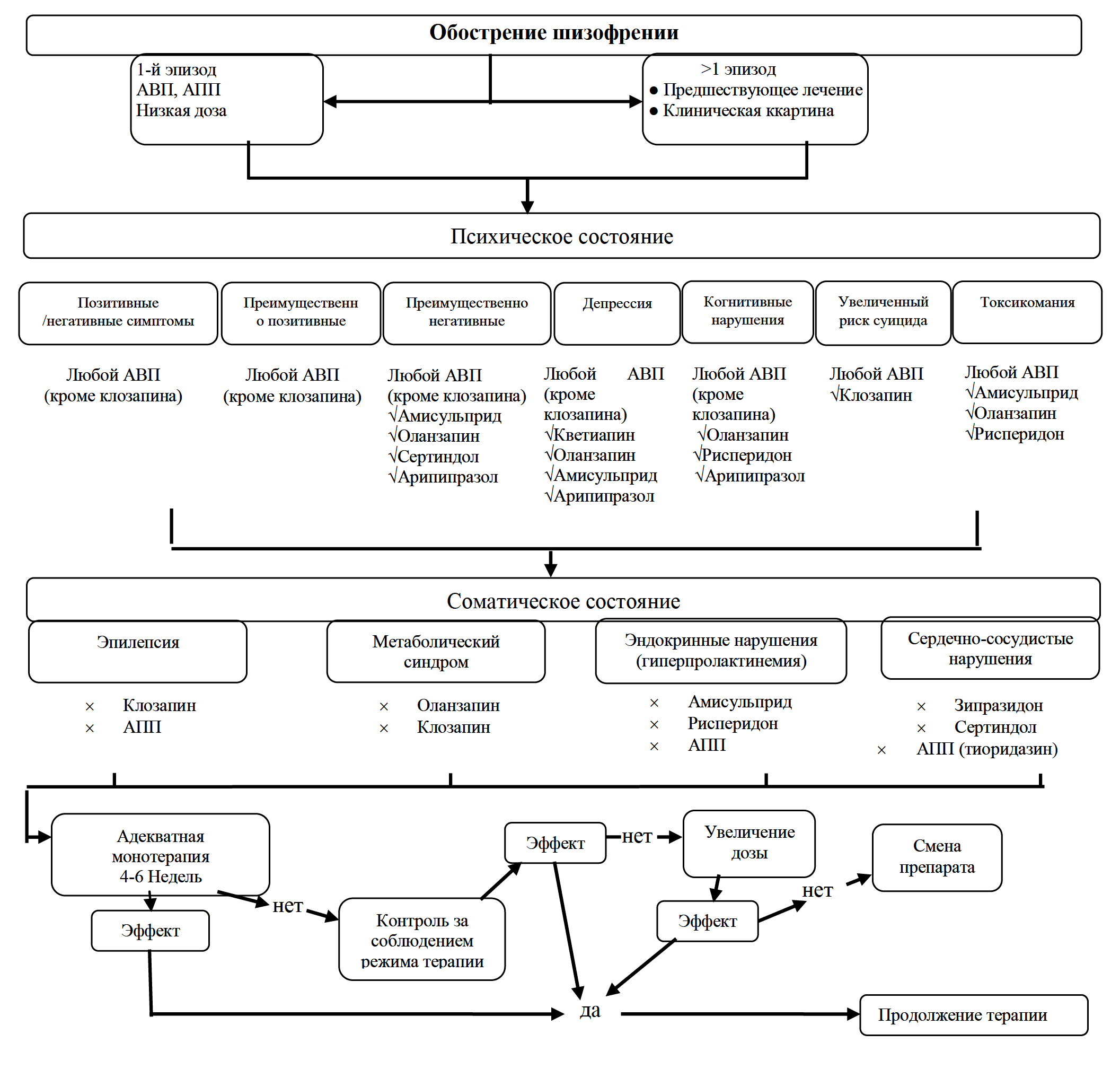
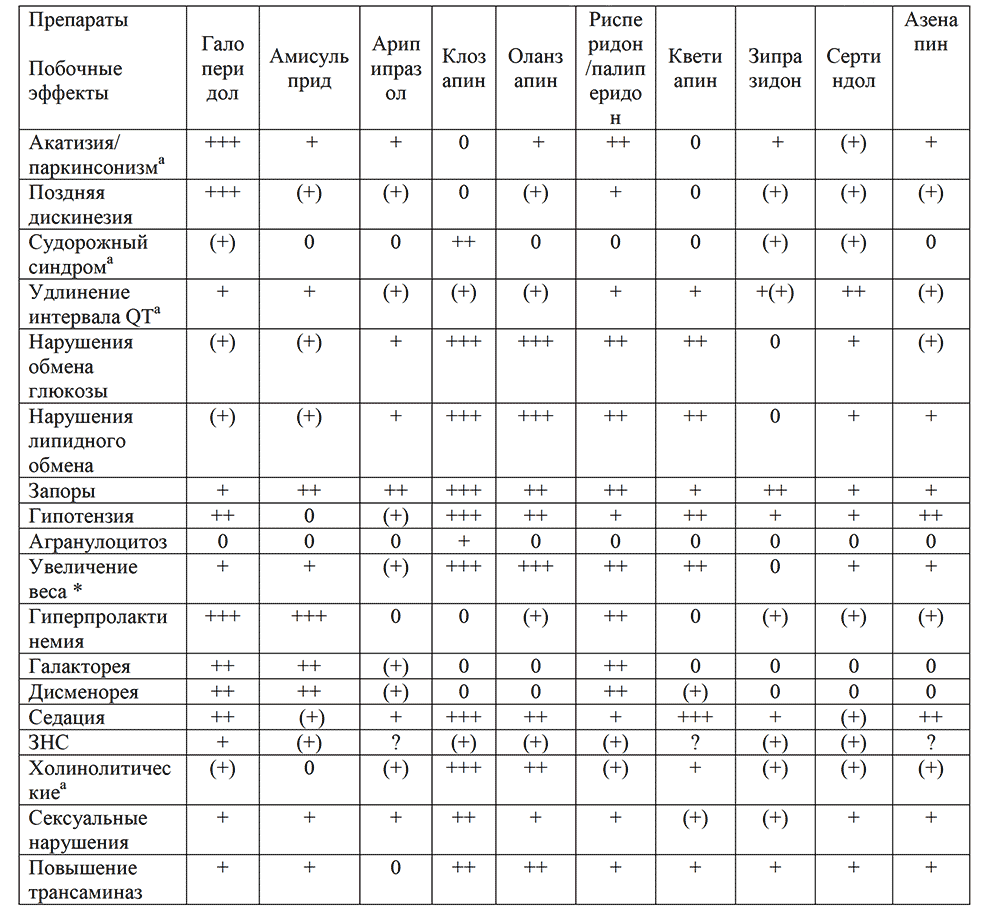
Важнейшим параметром, определяющим выбор антипсихотика, является предполагаемое соотношение эффективности и переносимости препарата у конкретного пациента. В отдельных клинических ситуациях имеются доказательства преимущества тех или иных антипсихотических препаратов. Эти данные для АВП суммированы на рис. 2. Например, клозапин в качестве препарата первого выбора рекомендуется только в двух случаях: при терапевтической резистентности (категория доказательности В) и увеличении суицидального риска (категория доказательности В). При преобладании первичной негативной симптоматики убедительные данные имеются в отношении амисульприда и в меньшей степени — ряда других антипсихотиков (см. Раздел «терапия негативных симптомов и рис.2). При большом удельном весе депрессивной симптоматики целесообразен выбор кветиапина и арипипразола (см. Раздел «терапия депрессии» и рис.2). Кроме того, при первичном выборе антипсихотика следует учитывать индивидуальные особенности соматического и неврологического состояния пациента. Например, при повышенной массе тела, диабете 2 типа и метаболическом синдроме не рекомендуется назначать оланзапин и клозапин (категория доказательности В/С3), при нейроэндокринных нарушениях, связанных с гиперпролактинемией, — АПП, амисульприд и рисперидон (категория доказательности С3), при нарушениях сердечного ритма — сертиндол, зипразидон и тиоридазин (категория доказательности С3), а при судорожном синдроме или снижении порога судорожной готовности — клозапин и некоторые АПП (категория доказательности В/С3).
Рисунок 2. Рекомендации по выбору атипичных антипсихотиков клинических ситуациях при лечении шизофрении
Примечание:
АВП — антипсихотик второго поколения
АПП — антипсихотик первого поколения
х — препарат не рекомендуется
V — предпочтительный препарат (имеется больше убедительных данных в РКИ)
Далеко не во всех психотических эпизодах можно рассчитывать на достижение полной редукции симптоматики. Это относится лишь к терапии острых психозов, в структуре которых наиболее полно представлены проявления чувственного бреда и циркулярный аффект. При большом удельном весе параноидной симптоматики и признаках непрерывного течения можно рассчитывать лишь на редукцию психоза. В случаях неустойчивости достигнутой ремиссии при проведении долечивающей или стабилизирующей антипсихотической терапии дозы эффективного антипсихотика остаются прежними или снижаются незначительно. В этом случае также возможен перевод на антипсихотики пролонгированного действия (см. раздел «пролонгированные антипсихотики»).
Дозы препаратов
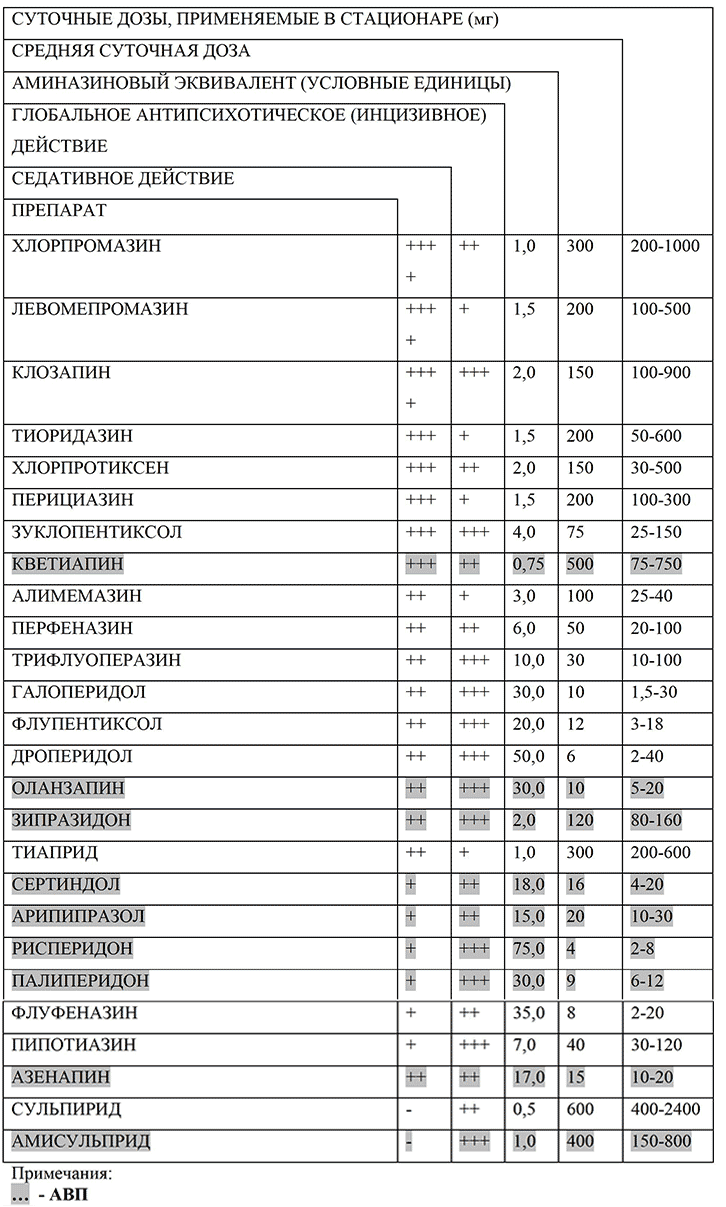
При первичном назначении АП необходим тщательный сбор аллергического анамнеза и при возможности применение пробной (небольшой) тестовой дозы. При терапии А1П1 и АВП, терапевтическая дозировка препарата может быть достигнута достаточно быстро. Во многих случаях повышение дозы не должно быть быстрым в целях превенции потенциально опасных побочных эффектов. В целом, в терапии острого эпизода шизофрении, желательно стремиться использовать более низкие терапевтические дозировки препаратов (Категория доказательности С). Стратегии быстрого наращивания дозировок, использование высоких ударных доз и дозировок, превосходящих рекомендуемые, не продемонстрировали большей терапевтической эффективности, но сопряжены с увеличением числа побочных эффектов. Суточные дозировки ниже 300 мг хлопромазинового эквивалента (ХПЭ) в большинстве случаев недостаточны для обеспечения оптимального терапевтического эффекта, а дозировки выше 900 мг хлорпромазинового эквивалента не обеспечивают прироста эффекта в сравнении с использованием препаратов в дозировках в диапазоне 500-900 мг ХПЭ (Категория доказательности А).
Следующие дозировки могут быть рекомендованы в отношении нижеприведенных препаратов (табл. 1).
Таблица 1. Спектр психотропной активности, дозы и хлорпромазиновые (аминазиновые) эквиваленты основных антипсихотических средств
Терапевтически резистентная шизофрения
Терапевтически резистентная шизофрения диагностируется при отсутствии уменьшения выраженности психопатологической симптоматики и/или иных ключевых симптомов на фоне терапии двумя антипсихотиками различных химических классов (как минимум, один из антипсихотиков должен быть АВП) в рекомендуемых терапевтических дозировках на протяжении, как минимум, 6-8 недель каждым препаратом.
Первым шагом при указании на терапевтическую резистентность должен быть контроль приема терапии, в том числе при возможности путем определения концентрации лекарственных средств в плазме крови.
У пациентов с терапевтически резистентной шизофренией клозапин должен быть рассмотрен в качестве средства первой линии выбора (Категория доказательности В) (рис.1). Целевая дозировка клозапина распределяется в диапазоне 100-900 мг/сут (Категория доказательности В/С3). Пациенты, получающие терапию клозапином, требуют контроля гематологических и кардиологических побочных эффектов, а также изменений на ЭЭГ (снижение порога судорожной активности). Комбинирование клозапина с другим АВП (предпочтительно рисперидоном) может иметь преимущества в сравнении с монотерапией (Категория доказательности С).
В определенных случаях при отсутствии эффекта терапии могут быть использованы другие терапевтические альтернативы, такие как иные АВП, стратегии аугментации (антидепрессанты, нормотимики) с учетом ключевых симптомов, комбинированная терапия антипсихотиками с ЭСТ, а также применение ТМС. Однако доказательства эффективности данных стратегий ограничены.
Негативные симптомы
При терапии негативных симптомов шизофрении следует дифференцировать первичные и вторичные негативные симптомы. Невозможно сделать выводы об общем превосходстве АВП над АПП в отношении терапии вторичных негативных симптомов, однако некоторые АВП имеют преимущество в отношении терапии первичных негативных симптомов (Категория доказательности В). Имеются достаточные данные об эффективности амисульприда/оланзапина (Категория доказательности А) и некоторые данные об эффективности кветиапина/зипрасидона (Категория доказательности В) в терапии больных шизофренией с преимущественно негативной (первичной) симптоматикой.
А1П1 также эффективны в терапии вторичных негативных симптомов, за исключением связанных с ЭПС (Категория доказательности А), при этом нет достаточных данных об их эффективности у больных с преобладанием первичной негативной симптоматики (Категория доказательности К).
Имеются ограниченные и, в целом, противоречивые данные об эффективности некоторых антидепрессантов (преимущественно СИОЗС) при их комбинированном назначении с антипсихотиками (Категория доказательности К). Более убедительные результаты получены при применении миртазапина как в комбинации с АПП так и с АВП (Категория доказательности В).
Терапия когнитивных симптомов
Наличие когнитивных нарушений является основной преградой для социальной и профессиональной реабилитации больных шизофренией. Когнитивный дефицит наиболее выражен у пациентов с отчетливой дефицитарной симптоматикой и при поздних дискинезиях. Антипсихотические препараты обладают небольшой либо умеренной эффективностью в отношении когнитивных нарушений (Категория доказательности В). Результаты сравнения АПП и АВП являются противоречивыми. В некоторых исследованиях приводятся данные о превосходстве АВП, в то время как в других — об отсутствие отличий. Тем не менее, ни в одном из исследований не приводятся данные о преимуществе АПП, в связи с чем, может быть рекомендовано преимущественное назначение АВП с некоторыми ограничениями доказательных данных (Категория доказательности С3). Имеются данные об эффективности некоторых ингибиторов холинэстеразы (донепезил и галантамин) при их присоединении к антипсихотику (Категория доказательности С3).
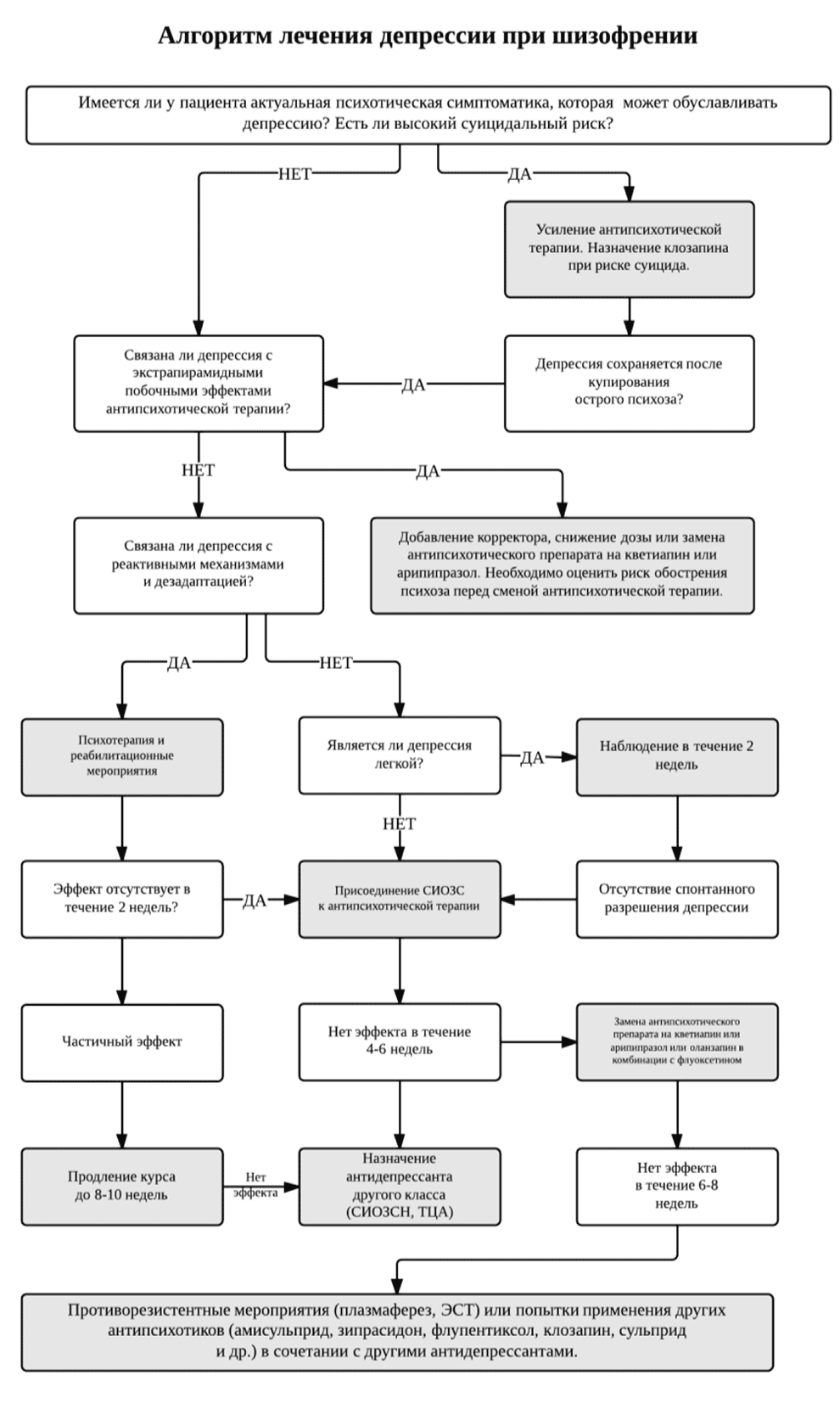
Диагностика и терапия депрессивных симптомов, оценка риска суицида
Депрессивные симптомы могут встречаться на всех этапах шизофрении, а именно, в продромальной фазе, в структуре психоза и после наступления ремиссии, в виде резидуальных симптомов шизофрении. Депрессивные симптомы необходимо дифференцировать от побочных эффектов антипсихотической терапии (в первую очередь от нейролептической дисфории, акинезии и акатизии) и первичных негативных симптомов шизофрении (рис.3). Однако первым диагностическим шагом в данном случае является выявление возможных проявлений психоза, которые могут обуславливать депрессию (рис.3). В этом случае единственным терапевтическим выбором должно быть усиление антипсихотической терапии. Ещё одним первостепенным диагностическим
шагом является определение суицидального риска. Оно включает в себя направленное клиническо-анамнестическое обследование с последующим выявлением и динамической оценкой факторов риска суицида (например, по Колумбийской шкале суицидального риска). При выявлении факторов риска суицидального поведения, особенно при сопряженности их с имеющейся психотической симптоматикой целесообразна замена антипсихотика на клозапин (Категория доказательности В).
Рис. 3. Алгоритм диагностики и терапии депрессии при шизофрении
Также необходимо выявить возможную связь депрессии с реактивными механизмами и дезадаптацией. В данном случае показано проведение психотерапии и реабилитационных мероприятий (рис.3). Показанием к коррекции терапии, в первую очередь, является длительность и тяжесть депрессивных симптомов (рис.3). Преимущественно может быть рекомендован перевод на некоторые АВП, в большей степени обладающие эффективностью по отношению к депрессивной симптоматике (рис.3) (Категория доказательности В/С3). Назначение антидепрессантов ограничивается преимущественно так называемыми постпсихотическими депрессиями при неэффективности других терапевтических мероприятий. Предпочтительно назначение СИОЗС, а при их неэффективности — СИОЗСН и ТЦА (Категория доказательности В/С3). При терапевтической рефрактерности депрессивной симптоматики необходимо проведение противорезистентных мероприятий (категория доказательности В/С3) (рис.3).
Терапия возбуждения и агрессии
Терапевтические подходы при возбуждении и агрессии должны быть дифференцированными. Проявления агрессии, а также состояния с высоким риском её развития требуют проведения ургентных терапевтических мероприятий. Они включают применение быстрой транквилизации (БТ), а при необходимости — фиксации или изоляции. Наряду с этим необходимо применение методик поведенческой терапии. В случае нетяжелых проявлений агрессии (вербальная агрессия и т.д.) и быстрым успокоением пациента проведение БТ может быть нецелесообразно. При проведении БТ необходимы навыки по оценке рисков, сопряженных с возможным достижением глубокой седации (развитие артериальной гипотонии и угнетения дыхания). Также желательно обеспечение техническими средствами, необходимыми для ургентной помощи при развитии побочных эффектов, в том числе возможность назначения флумазенила (антагониста бензодиазепиновых рецепторов).
При нетяжелом возбуждении и комплаентности пациента пероральные формы лекарственных средств с седативным компонентом действия могут быть более предпочтительны. В начале терапии препараты должны быть назначены в наиболее низких эффективных дозировках, которые в случае необходимости, могут быть постепенно повышены. Более тяжелые формы возбуждения требуют применения парентеральной терапии (рис.4). При купировании возбуждения желательно, чтобы терапевтический эффект был достигнут на уровне успокоения или легкой седации. При необходимости допускается достижение глубокой седации или даже анестезии. Применение для контроля возбуждения быстрой транквилизации (БТ) рассматривается как средство последней линии. Однако при крайне тяжелом возбуждении, сопряженным с рисками агрессии, её следует применять незамедлительно.
Бензодиазепины (лоразепам) и АПП демонстрируют сравнимую эффективность в терапии возбуждения и агрессии (Категория доказательности С). Назначение диазепама и других бензодиазепинов (кроме лоразепама), а также низкопотентных антипсихотиков (хлорпромазин, левомепромазин и хлорпротиксен) для терапии возбуждения рекомендуется с осторожностью в связи с худшей переносимостью и более длительным периодом полувыведения (Категория доказательности С). Парентеральные формы АВП не уступают в эффективности внутримышечной форме галоперидола (Категория доказательности А), но вызывают меньшее число неврологических побочных эффектов (Категория доказательности А). Комбинированное назначение лоразепама и антипсихотика может быть рекомендовано у пациентов с выраженным возбуждением и агрессией (Категория доказательности С). При этом необходимо учитывать повышенный риск развития побочных эффектов.
- АВП с седативным компонентом действия: оланзапин 10 -20 мг/сут, кветиапин 400800 мг/сут, клозапин 200-600 мг/сут. В случае сложностей с приемом таблеток применение пероральных форм АВП с быстрой абсорбцией: рисперидон в каплях 4-8 мг/сут, лингвальные таблетки оланзапина 10-20 мг/сут и др.
- назначение инъекционных форм АВП: оланзапин 10-30 мг/сут, зипразидон 80-160 мг/сут
- применение инъекционных форм традиционных нейролептиков: галоперидол 10-40 мг/сут, клопиксол-акуфаз 50-200 мг однократно в 1-3 дня; при необходимости совместно с антихолинергическими препаратами: акинетон 3-12 мг/сут, циклодол 3-12 мг/сут
- дополнительное назначение малых доз традиционных нейролептиков-седатиков (низкопотентных нейролептиков): хлорпромазин 50-200 мг/сут, левомепромазин 50-150 мг/сут, хлорпротиксен 30-150 мг/сут
- «быстрая транквилизация (нейролептизация)»: галоперидол 5-10 мг или галоперидол 5-10 мг + лоразепам 2 мг парентерально каждые 30-120 минут до прекращения возбуждения
- Электросудорожная терапия (ЭСТ)
- Барбитуратный наркоз или дроперидол в/м до 40 -60 мг/сут
В связи с риском развития дыхательной недостаточности необходимо избегать комбинированного назначения внутримышечной формы бензодиазепинов с клозапином,. Ввиду риска развития внезапной смерти следует избегать комбинированного назначения внутримышечной формы оланзапина и бензодиазепинов.
Фиксация и изоляция могут применяться только в кризисных ситуациях.
Необходимость их назначения должна быть тщательно документирована и объяснена пациенту.
Терапия кататонических симптомов
Применение АПН может сопровождаться утяжелением кататонической симптоматики, а также развитием ЗНС. Для лечения кататонических симптомов предпочтительно применение АВП с благоприятным профилем неврологической переносимости, а также сульпирида (Категория доказательности С). Препаратами выбора являются также бензодиазепины (диазепам, лоразепам) (Категория доказательности С). Вместе с тем, доказательных исследований в этом отношении не проводилось. При наличии кататонических симптомов и недостаточного эффекта терапии, а также при необходимости быстрой редукции симптомов (например, злокачественной кататонии) необходимо рассмотрение возможности более раннего применения ЭСТ (Категория доказательности С).
Длительная (противорецидивная) терапия
Антипсихотики являются эффективными препаратами для профилактики рецидивов (категория доказательности А). При этом вероятность развития рецидива по сравнению с плацебо сокращается в несколько раз. АПП и АВП не отличаются между собой по степени редукции симптоматики при длительной терапии (категория доказательности А). Имеется ряд данных в пользу отдельных АВП по показателям частоты прекращения терапии и профилактике рецидивов (категория доказательности В). Снижение риска развития неврологических побочных эффектов (в частности поздней дискинезии) является преимуществом АВП (рис.3)(категория доказательности С3). При длительной терапии, когда вторичная негативная симптоматика становится менее выраженной, некоторые АВП обладают рядом преимуществ в отношении коррекции негативной симптоматики (рис.3) (категория доказательности С3).
При длительной терапии поздняя дискинезия и метаболические побочные эффекты оказывают наибольшее влияние на состояние здоровья пациента. Необходим непрерывный мониторинг, раннее выявление и лечение этих побочных эффектов (категория доказательности С3).
При проведении длительной противорецидивной терапии необходимо использовать тот антипсихотический препарат, который обладал наилучшим эффектом и переносимостью у данного пациента в ходе купирования эпизода обострения и в процессе стабилизации состояния, т.е. на первых этапах терапии. Подбор антипсихотического препарата у каждого пациента необходимо проводить индивидуально с учетом предшествующего применения определенных групп препаратов и профиля побочных эффектов.
Длительность терапии
В случае прекращения терапии в течение 1-2 лет после острого психоза наблюдается высокий риск рецидива. У пациентов с первым эпизодом рекомендуется непрерывная антипсихотическая терапия в течение, по крайней мере, одного года (категория доказательности С). У пациентов с несколькими эпизодами следует решить вопрос о поддерживающей терапии на протяжении 2-5 лет (при сохраняющейся симптоматике и частых рецидивах — пожизненная терапия) (категория доказательности С). Прежде всего, многолетняя терапия показана при непрерывном течении шизофрении, при злокачественных и рано начавшихся формах. При приступообразном течении длительность противорецидивной терапии определяется принципом разумной достаточности. Тем не менее, длительность лечения необходимо определять индивидуально с учетом мотивации пациента, психосоциальной ситуации и некоторых других факторов. У пациентов с попытками суицида или грубым агрессивным поведением и частыми рецидивами также рекомендуется продолжение антипсихотической терапии на протяжении неопределенно долгого срока.
Во всех случаях для профилактики рецидива рекомендуется непрерывная антипсихотическая терапия (категория доказательности А). Стратегии прерывистой терапии могут подходить только пациентам с шизофренией, которые отказываются от непрерывного поддерживающего режима, или имеются противопоказания к непрерывной поддерживающей терапии.
При проведении длительной противорецидивной терапии у больных с низкой комплаентностью рекомендуются антипсихотические препараты пролонгированного действия, которые имеют ряд преимуществ:
- Обеспечивают максимальную непрерывность терапевтического воздействия и надежный контроль за приемом антипсихотика, что снижает необходимость контролировать врачом соблюдение режима терапии;
- Более стабильная и низкая концентрация нейролептика в крови (уменьшение риска развития «пиковых» побочных эффектов);
- Более безопасное достижение принципа минимальной эффективной дозы (поэтапное снижение);
- Более удобный для больных лекарственный режим, что имеет важное психотерапевтическое значение, поскольку сглаживает ощущение привязанности к лекарственным средствам;
- Избегание проблем с абсорбцией в желудочно-кишечном тракте и эффектов, связанных с метаболизмом при первом прохождении через печень (более предсказуемый метаболизм и редкие лекарственные взаимодействия);
- Уменьшение риска случайной или преднамеренной передозировки.
К недостаткам антипсихотических препаратов длительного действия следует отнести уменьшение гибкости терапии, длительный период подбора оптимальной дозы, длительный период выведения препарата из организма в случае развития побочных эффектов, местные реакции в области инъекции.
В настоящее время имеются достаточные данные в поддержку использования антипсихотических препаратов-депо первого поколения для профилактики рецидивов шизофрении (категория доказательности А), тем не менее, невозможно выявить достоверных различий в эффективности между пероральными препаратами и лекарственными формами-депо (категория доказательности А). Имеется достаточный объем данных в поддержку использования инъекционной формы рисперидона и палиперидона длительного действия для лечения шизофрении (категория доказательности А). Существует также ряд данных в поддержку превосходства клинической эффективности лекарственной формы-депо в сравнении с пероральным препаратом (категория доказательности С).
Качество жизни
Антипсихотики улучшают качество жизни пациентов с шизофренией, однако нет доказательств в поддержку какого-либо конкретного препарата или группы (Категория доказательств А). Существуют некоторые доказательства того, что на фоне приёма отдельных АВП улучшаются показатели субъективного самочувствия (Категория доказательств В). Кроме того, значимым фактором является наличие побочных эффектов, а их снижение и контроль важны для улучшения качества жизни пациентов (Категория доказательств С).
Побочные эффекты антипсихотической фармакотерапии
Экстрапирамидные побочные эффекты (ЭПС)
ЭПС наиболее часто развиваются при применении АВП, у некоторых АВП могут также отмечаться дозозависимые ЭПС (табл. 3). К ЭПС относятся острая дистония, акатизия, псевдопаркинсонизм и поздняя дискинезия. Добавление антихолинергического препарата, снижение дозы типичного антипсихотика или перевод на лечение АВП (в настоящее время предпочтение отдаётся такой замене) составляют возможности выбора при возникновении нежелательных эффектов. Риск развития ЭПС выше при лечении нейролептиками из группы пиперазиновых фенотиазинов и бутирофенонов. ЭПС легко распознаются, однако, их возникновение весьма трудно предвидеть, так как оно связано отчасти с дозировкой, отчасти с особенностями самого препарата, отчасти с индивидуальной чувствительностью пациента.
Паркинсоническая симптоматика исчезает после отмены препарата или может быть уменьшена присоединением центральных антихолинергических средств, так называемых корректоров нейролептической терапии (см. табл. 2). Назначение этих препаратов для профилактики экстрапирамидных расстройств при антипсихотической терапии необоснованно и не рекомендуется, так как они развиваются не у каждого больного. Кроме того, антипаркинсонические препараты могут способствовать развитию поздней дискинезии и ухудшать ее течение, а также вызывать лекарственную зависимость и когнитивные нарушения.
Таблица 2. Купирование побочных явлений нейролептической терапии
Таблица 3 Частота развития побочных эффектов при применении АВП и галоперидола
Примечание:
++++ сильное (максимально выраженное) действие;
+++ выраженное;
++ умеренное;
+ слабое;
— отсутствует.
Побочные эффекты со стороны нервной системы
Примечание
0 — отсутствуют
(+) — отдельные случаи (нет разницы с плацебо)
+ — очень редкие (менее 1%)
++ — редкие (менее 10%)
+++ — частые (более 10%)
? — данные отсутствуют
* — увеличение веса в течение 6-10 недель: + = незначительное (0-1,5 кг), ++ = среднее (1,5-3 кг), +++ = сильное (более 3 кг).
а — дозозависимые побочные эффекты
Нейроэндокринные побочные эффекты
Наиболее часто гиперпролактинемию (И!) вызывают АНН, но также амисульприд, рисперидон и палиперидон. Нри наличии клинических проявлений ГН: галакторея, нарушения менструального цикла, сексуальные дисфункции, гинекомастия рекомендуется (по возможности) проводить исследование уровня пролактина. Кроме того, с целью минимизации развития ГН необходимо учитывать следующие факторы риска: женщины репродуктивного возраста, дети, подростки, наличие ГН при предшествующей терапии. К дополнительным факторам риска относятся проблемы с фертильностью и вынашиванием у женщин и наличие гинекомастии, эректильной дисфункции, снижения полового влечения, уменьшением роста волос у мужчин.
При применении АВН чаще наблюдаются метаболические побочные эффекты …
С целью профилактики развития побочных явлений при проведении антипсихотической фармакотерапии рекомендуется регулярно проводить следующие лабораторные и клинические исследования (табл. 4).
Таблица 4. График мониторирования некоторых соматических показателей при применении антипсихотической фармакотерапии
Примечание: * — при применении клозапина — первые 18 недель еженедельно, а затем 1 раз в месяц.
В заключение необходимо отметить, что фармакотерапия шизофрении должна быть дифференцированной, динамичной и максимально индивидуализированной. Выбор препаратов, тактика терапии должна исходить из соотнесения доказательных данных, здравого клинического смысла, принципов индивидуальной необходимости и разумной достаточности. Ещё один важный аспект, позволяющий оптимизировать лечение и минимизировать врачебные ошибки, заключается в обсуждении клинических случаев во врачебном коллективе, с привлечением мнений более опытных коллег с последующим анализом предлагаемых подходов. И, наконец, фармакотерапия шизофрении является базовой, но не единственной составляющей лечения пациентов. Успех терапии определяется её комплексностью, сочетанием фармакотерапии, психосоциальных вмешательств и психотерапии.
Психосоциальная терапия и психосоциальная реабилитация больных шизофренией
Психосоциальная терапия и психосоциальная реабилитация, наряду с фармакотерапией, представляют собой необходимые и дополняющие друг друга терапевтические стратегии.
Психосоциальная терапия и реабилитация — формирование или восстановление недостаточных или утраченных (в условиях нарушенных в результате болезни когнитивных, мотивационных, эмоциональных ресурсов личности), навыков, знаний, умений взаимодействовать, решать проблемы, использовать стратегии совладения у психически больных с изъянами социальной адаптации, обеспечивающих их интеграцию в общество.
Применяется комплекс психосоциальных воздействий, направленных на восстановление потенциала самого пациента, участие в реабилитационном процессе с постоянным освоением прежних социальных, в том числе ролевых функций в условиях усложняющегося социального контекста для достижения возможно более полного или равного с другими положения в обществе.
Этапы психосоциальной реабилитации больных шизофренией
- 1.Этап активных психосоциальных воздействий (психосоциальная терапия)
- 2.Этап практического освоения приближенных к прежним или новых для пациента ролевый функций и социальный позиций
- 3.Этап закрепления и поддержки в той или иной степени неполного или полного социального восстановления
Психосоциальная работа с больным может начаться в любом периоде оказания психиатрической помощи. Необходимо, прежде всего, определение характера и степени социальной дезадаптации, нуждаемости в той или иной конкретной форме психосоциального воздействия. При этом пациент может участвовать в двух группах параллельно, а тем более последовательно. Чаще используются групповые формы работы, однако при невозможности включения пациента в группу (например, в случае его отказа и др.) допустимы индивидуальные формы работы, основанные на различных многочисленных программах («модулях»): тренинги социальных навыков, общения, уверенного поведения, независимого проживания, психообразовательные программы, обучение стратегии совладания с остаточными психотическими расстройствами, семейная терапия, когнитивный тренинг. Категория доказательности «А», если программы (модули) структурированы, направлены на четко определенные задачи, ситуации и проблемы.
Психосоциальные воздействия не сдвигаются к концу процесса реабилитации; напротив, они могут быть наиболее интенсивными, возможно ближе к началу оказания психиатрической помощи после купирования остроты состояния, все в большей степени становясь почти параллельным процессом биологического лечения.
В основном, это функция всего комплекса «промежуточных» (между психиатрическим учреждениями и обществом) звеньев реабилитационной направленности, приближающих пациента (с помощью ступенчатого практического освоения социальных ролей и позиций) к жизни непосредственно среди населения. Одновременно это процесс «генерализации» восстанавливаемых навыков, умений, знаний (полученных с помощью различных форм психосоциальных воздействий и использующих, естественно, более узкий круг моделей) применительно ко все более сложным социальным отношениям и требованиям, то есть к тому, что ожидает пациента при возвращении в жизнь.
В системе социальной поддержки и продолжении социальной работы в сообществе значительная часть пациентов нуждается постоянно. Кроме того, эффект психосоциальных воздействий сохраняется лишь определенное время, после чего требуется их повторение.
К мероприятиям этого этапа относится также социальная (инструментальная и эмоциональная) поддержка; многие больные нуждаются в ней постоянно (категория доказательности С3).
Кроме такой поддержки, осуществляемой социальными специалистами, в отношении некоторых пациентов проводится работа по активизации их социальной сети. Наконец часто оказывается важным поощрение включения больных в группы самопомощи — общественные организации больных и их родственников.
Однако, не все этапы обязательны. При относительной сохранности личности этап с использованием промежуточных форм психиатрической помощи оказывается излишним. Например, направление больного в общежития (отделения для формирования навыков самостоятельного проживания), трудовые или лечебно-производственные мастерские целесообразно лишь при более выраженных личностных изменениях, а также соответственно при бытовой неустроенности или трудовой дезадаптации.
В значительной части случаев III этап является непосредственным продолжением I этапа. Так же, как и при биологической терапии после купирования приступов или обострений переходят к поддерживающей фармакотерапии, так и после интенсивных психосоциальных воздействий переходят к поддерживающей психосоциальной терапии и другим психосоциальным мероприятиям, направленным на поддержание и закрепление достигнутых результатов.
При проведении психосоциальных мероприятий необходимо учитывать ряд принципиальных положений:
- 1.Процесс психосоциальной реабилитации может быть начат на любом этапе оказания психиатрической помощи — вне острых состояний (обострений), но возможно более рано после купирования острых проявлений психического расстройства. Чем раньше по отношению к началу заболевания начинаются психосоциальные мероприятия, тем скорее можно рассчитывать на благоприятный исход.
- 2.Необходимо формулировать цель каждого вмешательства с определением временного периода, в течение которого указанную цель предполагается достигнуть. Психосоциальные вмешательства должны быть, во-первых, дифференцированы и направлены на достижение определенной цели (или целей), и, во-вторых, ограничены во времени.
- 3.Выбор формы вмешательства для конкретного больного должен осуществляться в соответствии с особенностями у него психосоциального дефицита (социальной дезадаптации).
- 4.Последовательность психосоциальных воздействий осуществляется с учетом все большего приближения к обычным жизненным требованиям и достижению социальной компетентности.
- 5.При завершении каждого этапа или всей программы психосоциальной реабилитации необходимы поддерживающие психосоциальные воздействия.
Этапность и закрепление достигнутых результатов путем неоднократных повторений — обычное требование к психосоциальной реабилитации.
Выбор методики зависит от особенностей состояния и социальной дезадаптации, этапа психиатрической помощи и задач, которые ставятся на данном этапе его социального восстановления. Предпочтительным является использование психообразовательного подхода с элементами проблемно-разрешающей техники и тренинга социальных навыков.
- Iэтап
- IIэтап
- IIIэтап
В начальном периоде заболевания (в том числе в клиниках первого психического эпизода) используется психообразовательная методика с целью повысить осведомленность о заболевании, с акцентом также на следующих задачах: улучшение комплаенса, выполнение режима терапии, восстановление уровня социального функционирования, распознавание ранних проявлений рецидивов. Близкие к этим задачи при использовании психообразовательного подхода ставятся также при работе с семьями этих пациентов, включая также совладание со стрессом вследствие возникновения болезни у члена семьи и налаживание внутрисемейных отношений.
На последующих этапах болезни выбор программ (модулей) психосоциальной, в том числе когнитивной реабилитации может быть более широким с акцентом на задачах, которые так же, как и отдельные из указанных, могут становиться доминирующими (проблема общения, уверенного поведения, наиболее часто — улучшение комплаенса, совладание с остаточной психотической симптоматикой и др.). Категория доказательности «А», если программы (модули структурированы, нацелены на четко определённые задачи, ситуации и проблемы.
Специальные задачи становятся доминирующими в психосоциальной работе с пациентами, относящимися к той или иной «проблемной» группе:
- для больных шизофренией с частыми госпитализациями программа обычно включает проблемы комплаенса и выполнение режима фармакотерапии, распознавание начальных проявлений рецидивов, исключение факторов, способствующих обострению, а также изменение стиля внутрисемейного взаимодействия для семей этих больных;
- для одиноких больных — проблемы общения и других социальных навыков, комплаенса, независимого проживания, а кроме пациент-центрированных вмешательств, работа по активизации социальной сети;
- для больных шизофренией с длительным пребыванием в стационаре в условиях социальной депривации — независимого проживания, социальных навыков;
- для больных с неустойчивой трудовой адаптацией — комплаенс и выполнение режимов фармакотерапии, взаимодействие в трудовом коллективе, самоконтроль болезненного поведения, помощь в адекватном трудоустройстве.
- для больных, направленных в лечебно-трудовые мастерские или при оказании помощи в трудоустройстве — формирование мотивации на труд, на овладение новой профессией, взаимодействие в трудовом коллективе, продвижение к трудоустройству на обычных предприятиях;
- для больных медико-реабилитационных отделений, утративших социальные связи — модуль независимого проживания, тренинг социальных навыков, помощь в активизации, трудоустройстве, психосоциальная (инструментальная и эмоциональная) поддержка.
Особое внимание следует уделять психосоциальной терапии больных с впервые возникшими психотическими состояниями: развитие шизофрении, как правило, сопровождается, с одной стороны, серьезными нарушениями социальных и коммуникативных навыков, а с другой — стигматизацией и дискриминацией, существующей в общественном сознании по отношению к людям, страдающим этим заболеванием; осознание факта болезни отражается на эмоциональном состоянии заболевшего, изменяет его самовосприятие, самооценку, поведение, взаимоотношения с окружающими, вносит коррективы в планы на будущее. Работа над этими проблемами включает следующие компоненты:
1) помощь в преодолении стресса вследствие перенесенного психотического эпизода и смягчение социальных факторов риска его возникновения и повторения;
2) предоставление адекватной информации о психических расстройствах, соответствующих формах и службах помощи больному, членам его семьи и другим значимым членам ближайшего окружения;
3) разъяснение связи улучшения состояния с принимаемым лечением;
4) достижение комплаенса и профилактика повторных обострений;
5) раннее распознавание повторного обострения и быстрое вмешательство при его наступлении;
6) уменьшение риска суицида;
7) включение в психосоциальную программу когнитивной ремедиации.
Целесообразно первые три компонента психосоциального вмешательства включать в программу лечения уже на стадии выхода из первого острого состояния, тогда как остальные являются предметом долгосрочного ведения пациента по достижении терапевтической ремиссии (категория доказательности С3).
Психосоциальные программы для больных, получающих помощь в «промежуточных» реабилитационных звеньях психиатрической службы имеют отличия, связанные с задачами данного реабилитационного этапа, в частности:
Поддерживающая психосоциальная терапия (наряду с поддерживающей фармакотерапией) с более редким проведением занятий, являющихся продолжением программ, используемых на этапе интенсивных психосоциальных воздействий и направленных на поддержание комплаенса и соблюдения режима терапии. Интервалы между занятиями могут варьироваться в зависимости от стойкости достигнутых результатов (1 раз в месяц, в два месяца, раз в полгода). Оказание социальной (инструментальной и эмоциональной) поддержки осуществляется в зависимости от нуждаемости в ней, особенно при отсутствии естественной социальной поддержки у одиноких. Активизация социальной сети пациентов. Поощрение включения в деградированную за время болезни социальную сеть других пациентов, участвующих в работе групп. Поощрение участия пациентов в общественных организациях больных и их родственников. Помощь в трудоустройстве.
Соотношение психосоциальной терапии и психосоциальной (в том числе когнитивной) реабилитации с биологической терапией в различных организационных формах психиатрической помощи на последовательных этапах социального восстановления больных шизофренией
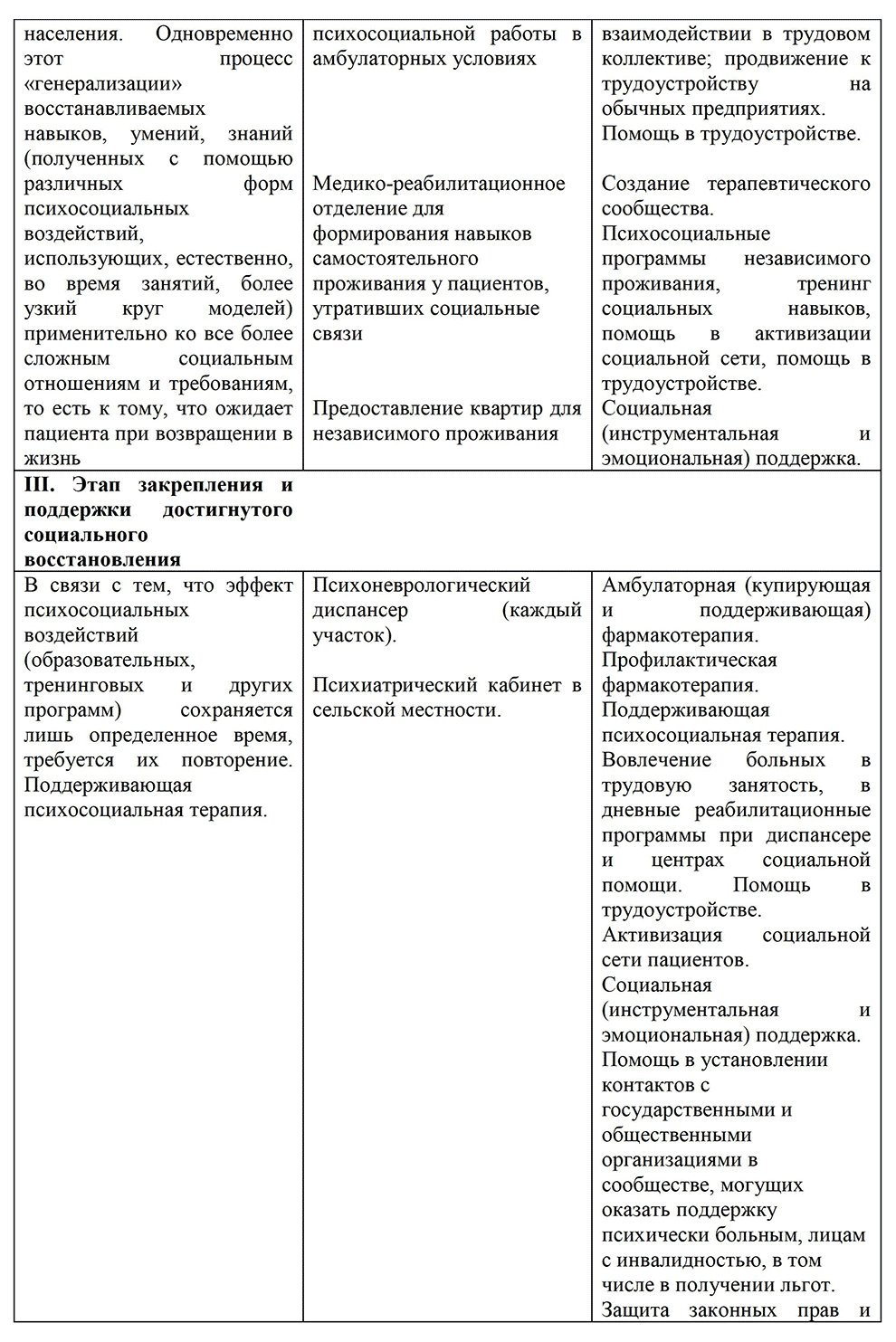
Определенная стратегия терапии требуется не только для пациентов в острый период шизофрении, но также в период стабилизации и в стабильную фазу заболевания. Период стабилизации начинается после острой фазы и представляет собой ограниченный по времени период перехода на длительную терапию в стабильной фазе. Стабильная фаза — это продолжительный период лечения и реабилитации, на протяжении которого обеспечивается адекватный контроль симптоматики, и основное внимание уделяется улучшению функционирования и восстановлению. Задачи длительной терапии необходимо обсуждать с пациентом в контексте имеющейся информации, а также его (ее) личных целей. Это позволит найти общие интересы, служащие стимулом для эффективной стратегии длительной терапии (принятие совместного решения). С этой позиции будет сформирован и принят план лечения.
Таблица 1. Категории доказательств и рекомендаций (Bandelow et al., 2008 a,b)
На протяжении фазы стабилизации основные цели терапии заключаются в обеспечении продолжения терапии, уменьшения выраженности симптоматики, консолидации ремиссии и стимулировании процесса выздоровления. Задачи лечения в стабильную фазу заключаются в сохранении ремиссии или контроля имеющейся симптоматики, в поддержании или улучшении уровня функционирования и качества жизни пациентов, в продолжении мониторинга побочных эффектов терапии, а также в профилактике рецидивов. Антипсихотическая лекарственная терапия должна быть дополнена психосоциальными вмешательствами.
Эффективность в стабильную фазу была продемонстрирована для ряда вариантов психосоциальной терапии, включая семейную терапию, помощь в трудоустройстве, активную амбулаторную терапию, профессиональное обучение и когнитивно-поведенческую психотерапию. Выбор подходящих видов психосоциальной терапии должен быть основан на потребностях конкретного пациента и социальном контексте. Аналогичным образом, необходим индивидуальный подбор психофармакотерапии. При этом основное внимание должно уделяться профилактике рецидивов, уменьшению выраженности симптоматики, улучшению самочувствия и качества жизни пациента.
Длительную терапию необходимо проводить у всех пациентов с шизофренией. Если при применении определенного режима лечения у больного будет зафиксировано улучшение, рекомендуется продолжать использование данного режима с дальнейшим мониторингом в течение по крайней мере шести месяцев фазы стабилизации. Преждевременное снижение дозы препарата может привести к повторному возникновению симптомов и рецидиву, хотя по данному вопросу существуют разные точки зрения (Takeuchi et al., 2012). Кроме того, необходимо наблюдать за развитием побочных эффектов и корректировать терапию при возникновении такой необходимости. Антипсихотические препараты значимо снижают риск рецидива в стабильную фазу заболевания, и их настоятельно рекомендуется применять в течение одного-двух лет у пациентов с первым эпизодом, двух-пяти лет у пациентов с одним рецидивом и на протяжении более пяти лет (иногда даже на всем протяжении жизни) у больных с несколькими эпизодами.
Предпочтительным подходом к лечению является антипсихотическая монотерапия. Стратегия непрерывной терапии превосходит по своей эффективности подходы с периодическим (прерывистым) приемом препарата. Принятие решения о дозе антипсихотического препарата в стабильную фазу затрудняет тот факт, что в настоящее время отсутствует надежная стратегия определения минимальной эффективной дозы для профилактики рецидива.
В настоящее время нет сведений, подтверждающих большую эффективность высоких поддерживающих доз(например, более 600 мг хлорпромазинового эквивалента для антипсихотических препаратов первого поколения) при профилактике рецидива по сравнению со стандартными дозами. Таким образом, рекомендуется поддерживающая дозировка ниже 600 мг хлорпромазинового эквивалента. У пациентов с первым эпизодом шизофрении могут потребоваться меньшие дозы для профилактики рецидива по сравнению с пациентами с несколькими эпизодами.
Препараты-депо (антипсихотические препараты первого или второго поколения длительного действия) должны быть вариантом выбора, если пациент предпочтет такой метод лечения как более удобный, или в рамках плана лечения, при котором приоритетным является предотвращение скрытого несоблюдения больным режима антипсихотической терапии. В определенных случаях необходима активная мотивация пациентов и ознакомление их с преимуществами препаратов-депо.
Антипсихотические препараты характеризуются различным уровнем риска развития разных побочных эффектов, включая неврологические, метаболические, сексуальные, эндокринные, седативные и сердечно-сосудистые (более подробное описание приведено в части 1 этого руководства). Данные побочные эффекты могут обладать даже большим влиянием на выбор препарата для длительной терапии по сравнению с лечением в острую фазу. Мониторирование сомато-неврологического состояния и лабораторных показателей больных определяется профилем побочных эффектов конкретного антипсихотического препарата. На протяжении стабильной фазы у всех больных важным элементом мониторинга является общепринятый контроль развития экстрапирамидных симптомов (ЭПС), увеличения массы тела, а также сердечно-сосудистых и метаболических побочных эффектов. При необходимости рекомендуется проводить мониторинг связанных с ожирением проблем (например, повышенное артериальное давление, нарушения липидных показателей и клиническая симптоматика диабета), а также принимать решения о необходимых вмешательствах (см. табл. 2 в части 1 руководства). Поскольку у пациентов часто наблюдаются несколько факторов риска сахарного диабета, особенно у больных с ожирением, врачи могут принять решение о регулярном мониторинге уровня глюкозы натощак или гликированного гемоглобина (HbA1c) с целью выявления сахарного диабета (De Hert et al., 2006, 2011). Антипсихотические препараты первого (АПП) и второго (АВП) поколений характеризуются специфичными профилями побочных эффектов, которые необходимо учитывать при планировании длительной терапии. АВП обладают явными преимуществами в отношении риска развития ЭПС (в особенности поздней дискинезии). Тем не менее ценность этого преимущества необходимо сравнивать с прочими потенциально опасными побочными эффектами, например, метаболическими или сердечно-сосудистыми побочными эффектами (см. табл. 3 в части 1 руководства).
Таблица 2. Некоторые побочные эффекты антипсихотиков. Оценка частоты и тяжести побочных эффектов основана на информации, полученной фармацевтическими компаниями, Federal Drug Administration, из данных литературы и других рекомендаций по терапии
Таблица 3. Мониторинг пациентов при лечении антипсихотиками второго поколения. Наиболее частые обследования могут назначаться в зависимости от клинического статуса
ИМТ — индекс массы тела, ЭКГ — электрокардиограмма, ЭЭГ — электроэнцефалограмма. В соответствии с APA (2004) с поправками.
Важно определить, действительно ли резидуальные негативные симптомы являются вторичными и связаны с паркинсоническим синдромом или с депрессией, поскольку имеются возможности их коррекции. Варианты лечения первичных негативных симптомов включают переход на АВП или стратегию аугментации терапии. Имеется лишь ограниченный объем доказательств по эффективности этих стратегий (см. часть 1 руководства). Для лечения коморбидных психических расстройств при проведении длительной антипсихотической терапии могут применяться дополнительные препараты. В отношении депрессии и обсессивно-компульсивного расстройства могут быть эффективны антидепрессанты, при выраженной лабильности настроения могут быть полезны нормотимики, а при тревоге и инсомнии — бензодиазепины. Тем не менее имеется лишь минимальный объем доказательств эффективности этих стратегий лечения; кроме того, в настоящее время обсуждается вопрос увеличения смертности пациентов при комбинированной терапии антипсихотическими препаратами и бензодиазепинами с длительным периодом полувыведения (Baandrup et al., 2010) (см. часть 1 руководства).
Ниже приведено подробное обсуждение прочих стратегий терапии, включая ведение пациентов с побочными эффектами.
Шизофрения является гетерогенным расстройством, различающимся по своему течению и исходам, влияющим на многие аспекты жизни пациента. Лечение большинства больных шизофренией включает множество направлений, при этом необходим мультидисциплинарный бригадный подход, направленный на снижение частоты, длительности и тяжести эпизодов, уменьшение общего уровня осложнений и смертности вследствие этого заболевания, улучшение психосоциального функционирования и качества жизни пациентов.
Антипсихотическую терапию необходимо продолжать в период стабилизации и в стабильную фазу шизофрении; для всех пациентов с хроническим течением шизофрении показана долговременная терапия. Ее клинические аспекты включают профилактику рецидивов, уменьшение выраженности психопатологических симптомов и деморализующих эффектов персистирующей психотической симптоматики, лечение депрессии и профилактику суицидов, снижение уровня злоупотребления психоактивными веществами (ПАВ) и табакокурения, усиление семейных связей и профессиональную реабилитацию.
Период стабилизации (обычно продолжающийся 3-6 месяцев) следует после острой фазы и представляет собой ограниченный по времени переход на длительную терапию в стабильной фазе заболевания. Основные задачи фазы стабилизации включают консолидацию терапевтических взаимоотношений, уменьшение выраженности позитивной симптоматики, редукцию когнитивной и негативной симптоматики, уменьшение стресса для пациента, уменьшение дефицита общения, консолидацию ремиссии, формирование критического отношения к болезни и приверженности терапии, помощь в выработке компенсаторных психологических механизмов и стратегий борьбы с заболеванием, предоставление поддержки для снижения вероятности рецидива, улучшение адаптации пациента в обществе и стимуляция процессов восстановления. Если у пациента будет зафиксировано улучшение на фоне определенного режима терапии, данный режим рекомендуется продолжать в течение не менее шести месяцев (Lehman et al., 2004; Falkai et al., 2006). Кроме того, крайне важно продолжать наблюдение за побочными эффектами, которые могли присутствовать в острую фазу, и корректировать лекарственную терапию с целью минимизации побочных эффектов, которые, в свою очередь, могут привести к несоблюдению режима терапии и рецидиву.
Стабильная фаза (продолжительностью от нескольких месяцев до нескольких лет) представляет собой длительный период лечения и реабилитации, на протяжении которого обеспечивается контроль симптоматики и основное внимание уделяется улучшению функционирования или полному его восстановлению (социальному выздоровлению). Основные задачи терапии в стабильную фазу заключаются в обеспечении сохраняющейся ремиссии или адекватного контроля симптоматики, в поддержании или улучшении уровня функционирования и качества жизни пациента, эффективном лечении любого усиления выраженности симптоматики или развивающегося рецидива, а также в продолжающемся мониторинге побочных эффектов. Для большинства пациентов шизофренией в стабильной фазе в качестве полезного дополнения к лекарственной терапии рекомендуется использовать психосоциальные вмешательства. Основные задачи фармакологического лечения в стабильную фазу заключаются в профилактике рецидивов, помощи в поддержании максимальной стабильности, позволяющей сохранять привычный образ жизни пациента, а также в стимуляции процесса восстановления (в плане поддерживающей или продолжающейся терапии).
Задачи длительной терапии необходимо обсудить с самим пациентом и, в случае его (ее) согласия, с членами семьи, родственниками, лицами, осуществляющими уход за пациентом, а также в ряде случаев с адвокатами. Задача этого обсуждения заключается в предоставлении надлежащей информации с учетом понимания целей самого пациента. После достижения согласия о совместном принятии решения необходимо сформировать план лечения. Психофармакологическую терапию необходимо индивидуально подбирать с учетом нужд и предпочтений конкретного пациента; при этом основное внимание должно уделяться профилактике рецидивов, уменьшению выраженности симптоматики и повышению благополучия и качества жизни пациента. Психотерапевтическое вмешательство сохраняет свою поддерживающую функцию, хотя становится менее директивным и активным по сравнению с острой фазой. Была продемонстрирована эффективность психообразовательных программ для обучения широкого диапазона пациентов с шизофренией таким вопросам, как организация лечения (т. е. преимущества продолжения антипсихотической терапии, борьба с побочными эффектами), самоконтроль симптоматики (т. е. идентификация ранних признаков рецидива, формирование плана профилактики рецидивов, отказ от злоупотребления ПАВ), а также основные социальные навыки (APA, 1997; Lehman et al., 2004; Falkai et al., 2006).
Антипсихотическая терапия
Общие аспекты
Эффективность АПП в отношении профилактики рецидивов была продемонстрирована в 1970-х годах (Davis, 1975; 1985) и подтверждена позднее для большинства АВП (Davis and Chen, 2003; Leucht et al., 2009a, 2012a, 2012b; NICE, 2010). Эти эффекты были продемонстрированы как у пациентов с первым эпизодом шизофрении (Kane et al., 1982; Crow et al., 1986; Bradford et al., 2003; Schooler et al., 2005; Gaebel et al., 2007), так и у больных с несколькими эпизодами (Davis, 1975, 1985, 1993; Jeste et al., 1993; Gilbert et al., 1995; Leucht et al., 2003). Антипсихотическую терапию следует продолжать в составе комплексного лечения, направленного на решение клинических, эмоциональных и социальных проблем пациента (NICE, 2002). Антипсихотические препараты являются обязательным компонентом лечения большинства пациентов в восстановительную и стабильную фазы шизофрении. Основная задача этого вида лечения заключается в профилактике рецидивов и в поддержании достаточно стабильного состояния пациента для продолжения нормальной жизни в максимально возможном объеме (NICE, 2002) с минимальными побочными эффектами. Антипсихотические препараты также необходимы для эффективного психологического лечения, и психосоциальные вмешательства всегда являются важным дополнением к фармакотерапии (RANZCP, 2005).
Задачи длительной терапии включают поддерживающее лечение для стабилизации ремиссии, профилактики рецидивов и обеспечения контроля над сохраняющимися симптомами или даже дальнейшей их редукции. Для определения эффективности изменениий программы лечения необходимо проводить текущий мониторинг и обследования в ходе стабильной фазы (Lehman et al., 2004); кроме того, эти меры необходимы для выявления потенциально опасных побочных эффектов. Тем не менее частота проводимых психиатром или другими специалистами оценок должна зависеть от характера лечения и предполагаемых флюктуаций в течении заболевания, а также от особенностей системы здравоохранения в конкретной стране. Так, у пациентов, получающих определенные антипсихотические препараты (например, клозапин) требуется более часто проводить мониторинг по сравнению с больными, которые получают другие препараты.
Выбор антипсихотического препарата должен осуществляться совместно пациентом и ответственным за лечение врачом на основании обсуждения относительных преимуществ препаратов и профилей их побочных эффектов, а также собственного опыта пациента и врача. Антипсихотические препараты не следует назначать одновременно, нужно выбирать монотерапию. На протяжении коротких периодов в случае перехода с одного препарата на другой при резистентности к терапии или с целью получения сочетания различных фармакологических эффектов (например, комбинированная терапия со слабоактивным АПП в седативных целях) допускается применять комбинированную терапию (NICE, 2002; Lehman et al., 2004; RANZCP, 2005; DGPPN, 2006; Falkai et al., 2006) . Психиатры, применяющие для лечения пациентов одновременно более одного антипсихотического препарата, должны быть осведомлены о взаимодействиях между лекарственными средствами, а также о практически полном отсутствии исследований по изучению безопасности таких комбинаций.
Методологические аспекты
В отличие от острой и кратковременной терапии шизофрении проведено лишь небольшое количество исследований по оценке поддерживающей терапии, а также исследований, в которых сравнивались бы АПП и АВП. Как уже обсуждалось в части 1 этого руководства и в других публикациях (Leucht et al., 2009b; Glick et al., 2011), разделение антипсихотических препаратов на первое и второе поколение служит причиной для возникновения ряда проблем («псевдоклассификация»), поскольку каждый антипсихотический препарат обладает своим индивидуальным профилем побочных эффектов. Другая проблема заключается в недостаточном числе качественных мета-анализов, в которых изучаются проблемы длительной антипсихотической терапии. Эта ситуация может быть объяснена небольшим количеством длительных клинических исследований с надлежащим дизайном. Кроме того, основные проблемы метаанализов заключаются в сравнимости включенных в них исследований (например, диагностические различия, различные периоды наблюдения и дозировки), а также в меньшей частоте публикации отрицательных результатов по сравнению с положительными (предвзятость публикаций) (Leucht et al., 2009c). Кроме того, при длительной терапии помимо психопатологических симптомов необходимо оценивать другие клинические переменные (например, когнитивные функции, приемлемость препарата, соблюдение режима терапии, подпороговые эпизоды, злоупотребление ПАВ и др.), при этом во многих долгосрочных исследованиях все равно предусмотрен слишком короткий период наблюдения, который не позволяет сделать окончательных выводов о длительной терапии пациентов с шизофренией (Altamura and Glick, 2010). Эти методологические аспекты являются крайне значимыми для понимания исходных публикаций и рекомендаций, сделанных в настоящем руководстве.
АПП и АВП
Различия между АПП и АВП необходимо рассматривать в контексте их эффекта или эффективности, побочных эффектов, симптоматики и опыта применения у пациента. Современная антипсихотическая терапия позволяет индивидуально подобрать режим лечения, при этом большое внимание уделяется побочным эффектам. В случае долговременной поддерживающей терапии непереносимые побочные эффекты являются важным фактором, связанным с низкой приверженностью лечению (Goff etal., 2010).
В двух сводных рандомизированных многоцентровых 52-недельных исследованиях (со схожими протоколами) сравнивалась эффективность арипипразола и галоперидола при длительном применении у 1294 пациентов с шизофренией (Kasper et al., 2003). В этом исследовании была зафиксирована сравнимая эффективность арипипразола и галоперидола в отношении позитивной симптоматики; тем не менее арипипразол превосходил галоперидол по редукции негативной и аффективной симптоматики. Кроме того, терапия галоперидолом сопровождалась большим количеством ЭПС (Kasper et al., 2003).
В крупном двойном слепом проспективном длительном исследовании у амбулаторных пациентов со стабильным течением шизофрении (средняя продолжительность заболевания более 15 лет) было выявлено превосходство рисперидона (модальная суточная доза 4,9 мг) по таким параметрам, как частота прекращения терапии, уменьшение выраженности симптоматики и ЭПС при сравнении с галоперидолом (модальная суточная доза 11,7 мг) (Csernansky et al., 2002).
В крупном (n = 555) двойном слепом контролируемом исследовании с гибким подбором дозы рисперидон (средняя модальная доза 3,3 мг/сут) и галоперидол (средняя модальная доза 2,9 мг/сут) обеспечивали значимое улучшение общей психопатологической симптоматики без различий между группами (Schooler et al., 2005). Тем не менее у пациентов с клиническим улучшением при применении рисперидона регистрировалось значительно более продолжительное время до рецидива. На фоне терапии галоперидолом наблюдалась большая частота ЭПС, в то время как у больных из группы рисперидона наблюдалось более выраженное повышение уровня пролактина. Терапия галоперидолом приводила к меньшему первоначальному увеличению массы тела по сравнению с терапией рисперидоном, однако эти различия не достигали значимости в конечной точке исследования (Schooler et al., 2005).
В двойном слепом исследовании с участием 159 пациентов с ремиссией после первого эпизода шизофрении не зафиксировано никаких различий по частоте рецидивирования между галоперидолом (4,1 мг/сут) и рисперидоном (4,2 мг/сут) (Gaebel et al., 2007). Оба препарата обладали одинаковой эффективностью по вторичным критериям, касающимся редукции симптоматики и улучшения качества жизни. Тем не менее в группе галоперидола чаще встречались ЭПС. Хотя в этом исследовании наблюдалась систематическая ошибка, обусловленная высокой частотой выбывания (68 %), значимых различий в частоте выбывания между группами не отмечено (Gaebel et al., 2007).
В двойном слепом сравнительном исследовании оланзапин (средняя доза 10,2 мг/сут) и галоперидол (средняя доза 4,82 мг/сут) обладали сопоставимой эффективностью в отношении редукции симптоматики (Green et al., 2006). Тем не менее у пациентов, получавших оланзапин, была меньше вероятность выбывания из исследования и наблюдалась более высокая частота достижения ремиссии. Отметим, что при интерпретации этих результатов должна учитываться значительно большая продолжительность заболевания в группе галоперидола (Green et al., 2006).
Еще в одном длительном двухлетнем двойном слепом исследовании сравнивалась терапия галоперидолом и рисперидоном у 63 пациентов со стабильным течением шизофрении. Помимо антипсихотической терапии у участников исследования проводилось «обучение стандартным поведенческим навыкам или более интенсивное обучение с индивидуальным специалистом, который стимулировал использование навыков пациентов в общественной жизни» (Marder et al., 2003). В этом исследовании не зафиксировано никаких различий между препаратами в отношении редукции симптоматики по шкале BPRS (Brief Psychiatric Rating Scale — Краткая Шкала Психиатрической Оценки). Тем не менее для вторичных показателей эффективности, включающих кластер тревоги и депрессии и самостоятельно заполняемого опросника SCL-90-R, рисперидон превосходил галоперидол. Кроме того, рисперидон вызывал меньшее количество ЭПС, и пациенты из группы галоперидола получали больше антихолинергических препаратов и пропранолола (в связи с акатизией) (Marder et al., 2003).
В одном 12-месячном двойном слепом исследовании в медицинских центрах по делам ветеранов (Rosenheck et al., 2003) сравнивалась терапия оланзапином и галоперидолом (в сочетании с профилактическим приемом бензтропина для коррекции ЭПС), при этом не было выявлено никаких значимых различий между этими препаратами по таким параметрам, как продолжение участия в исследовании, оценка симптоматики по PANSS, качество жизни и ЭПС. Тем не менее у получавших галоперидол с бензтропином больных чаще наблюдались когнитивные нарушения. Оланзапин вызывал меньше ЭПС, однако при его применении чаще наблюдалось увеличение массы тела по сравнению с применением галоперидола (Rosenheck et al., 2003). Важными факторами, затрудняющими интерпретацию результатов этого исследования, являются длительное течение заболевания (примерно 20 лет), гибкая схема терапии и профилактическое применение бензтропина (Moller, 2008). Последний служит причиной систематической ошибки в этом исследовании в пользу галоперидола, при этом данная комбинация не должна использоваться в обычной практике, поскольку при терапии антихолинергическими препаратами возможны когнитивные нарушения.
В двойном слепом 52-недельном исследовании с гибким подбором доз не было выявлено никаких различий между хлорпромазином и клозапином при оценке с помощью шкал тяжести симптоматики. Тем не менее у больных, получавших клозапин, значительно быстрее наступала ремиссия и наблюдалась ее большая продолжительность по сравнению с больными, получавшими хлорпромазин (Lieberman et al., 2003).
По результатам исследования CATIE (за исключением части 3 этого исследования) (Lieberman et al., 2005; Essock et al., 2006; Stroup et al., 2006; Stroup et al., 2007) был получен ряд сведений, позволяющих предположить, что оланзапин может превосходить АПП перфенанзин, а также другие АВП при поддерживающей терапии шизофрении. В исследовании CUtLASS с наблюдением до 52-й недели не было выявлено никаких различий между группами АВП и АПП (преимущественно сульпирид) при длительной терапии шизофрении (Jones et al., 2006). Тем не менее оба исследования обладали значимыми методологическими ограничениями, которые обсуждались в части 1 этого руководства и в других источниках (Moller, 2008; Naber and Lambert, 2009).
По данным одного проспективного наблюдательного исследования у 374 пациентов с шизофренией / шизоаффективным расстройством и периодом наблюдения длительностью 24 месяца оланзапин (средняя суточная доза 15 мг) в некоторой степени превосходил рисперидон (средняя суточная доза 4,9 мг) и кветиапин (средняя суточная доза 588 мг) по числу повторных госпитализаций (Kilian et al., 2012).
В исследовании EUFEST (Kahn et al., 2008) участвовали пациенты с первым эпизодом шизофрении, при этом сравнивался галоперидол с четырьмя различными АВП (амисульприд, оланзапин, кветиапин и зипрасидон). Частота прерывания терапии независимо от причины была значительно выше при применении галоперидола. Прерывание терапии вследствие недостаточной эффективности также чаще встречалось в группе галоперидола, тем не менее различия между галоперидолом и кветиапином были статистически незначимыми (Kahn et al., 2008).
В наблюдательном исследовании SOHO при применении АВП наблюдалась меньшая частота прекращения терапии и большая частота ремиссий по сравнению с АПП, при этом на фоне терапии АВП пациенты сообщали об улучшении субъективного чувства благополучия (Lambert et al., 2006; Haro et al., 2006).
В проведенном в 2003 г. мета-анализе рандомизированных краткосрочных исследований клозапин, амисульприд, рисперидон и оланзапин превосходили по эффективности АПП. Для других АВП явного превосходства обнаружено не было (Davis et al., 2003). При сравнении амисульприда, рисперидона и оланзапина различий в их эффективности не обнаружено. В более позднем мета-анализе (Leucht et al., 2009b, 2011b) только рисперидон, оланзапин и сертиндол (по результатам только одного исследования) превосходили АПП в отношении профилактики рецидивов. Для амисульприда, арипипразола и клозапина никаких значимых различий по сравнению с АПП не отмечено. Для других АВП данные отсутствовали (Leucht et al., 2009b). Необходимо учесть, что эти мета-анализы (Davis et al., 2003; Leucht et al., 2009b) преимущественно включали краткосрочные исследования, поэтому интерпретировать их результаты по отношению к долгосрочным исследованиям нужно с осторожностью.
В мета-анализе (Leucht et al., 2003), включающем только исследования с минимальной длительностью 6 месяцев, было зафиксировано превосходство АВП (в совокупности) по сравнению с плацебо, превосходство отдельных АВП (рисперидон, оланзапин и сертиндол), а также количественное, но статистически незначимое превосходство амисульприда и клозапина при сравнении с АПП. Кроме того, зафиксировано превосходство пула АВП по сравнению с АПП. Различий в частоте выбывания вследствие побочных эффектов между АПП и АВП не отмечено. Авторы также обсуждали ряд факторов, влияющих на результаты этого мета-анализа (например, сложности в определении рецидива, режим с фиксированной дозировкой в исследованиях), и пришли к выводу, что «имеющиеся данные не позволяют сделать какие-либо выводы относительно того, связано ли это умеренное превосходство новых антипсихотических препаратов в отношении профилактики рецидивов с их большей эффективностью, лучшим соблюдением режима терапии или комбинацией этих факторов» (Leucht et al., 2003). В более позднем мета-анализе рандомизированных исследований длительностью 6 месяцев и дольше, в котором сравнивались АВП и АПП при длительной терапии шизофрении (Kishimoto et al., 2011), АВП в совокупности значительно превосходили АПП по профилактике рецидивов. Ни в одном из исследований не было выявлено превосходства используемых для сравнения АПП. Кроме того, результаты этого мета-анализа не позволили провести статистически корректное сравнение между отдельными АВП. Тем не менее авторы обсуждают возможность объединения АВП в единую группу препаратов с особыми свойствами а также отличия средне- и низкопотентных АПП от галоперидола (Kishimoto et al., 2011).
В недавнем анализе средних и долгосрочных результатов применения новых антипсихотических препаратов обсуждается ряд преимуществ АВП при длительной терапии шизофрении (Glick et al., 2011). Авторы освещают проблемы сопоставимости различных антипсихотических препаратов, а также тот факт, что в ходе поддерживающего лечения пациенты и родственники обращают внимание на другие аспекты (например, уменьшение выраженности симптомов, являющихся причиной нетрудоспособности, возобновление работы, восстановление личностных взаимоотношений) по сравнению с терапией острой фазы (Glick et al., 2011). Кроме того, согласно консенсусной статье, опубликованной европейской коллегией нейропсихофармакологии (ECNP), в контролируемых долгосрочных исследованиях, в которых вторичные негативные симптомы становились менее выраженными, определенные АВП могут обладать рядом преимуществ с точки зрения уменьшения негативной симптоматики (Montgomery and van Zwieten-Boot, 2007).
Другим важным аспектом поддерживающего лечения шизофрении является терапия суицидальных проявлений, при этом существуют некоторые сведения о превосходстве определенных антипсихотических препаратов над другими препаратами в отношении уменьшения суицидального поведения при шизофрении (Meltzer et al., 2003; Crocq et al., 2010).
По аналогии с терапией острой фазы шизофрении в рекомендациях по длительной терапии необходимо ответить на вопрос о побочных эффектах. При длительном лечении риск развития поздней дискинезии (ПД) ниже при применении АВП (Kasper et al., 2006; Naber and Lambert, 2009; Leucht et al., 2011b). Не следует недооценивать профиль метаболических побочных эффектов определенных антипсихотических препаратов (см. часть 1 данного руководства), тем не менее отсутствуют долговременные исследования, направленные на разрешение этого вопроса. Поскольку увеличение частоты сердечно-сосудистых заболеваний в результате метаболического синдрома является основной причиной смертности у пациентов с шизофренией, необходимо уделять особое внимание этим побочным эффектам (Newcomer, 2007; De Hert et al., 2009; Laursen et al., 2009; De Hert et al., 2011).
Таким образом, при поддерживающем лечении необходимо соблюдать общие правила терапии острой фазы: поддерживающая антипсихотическая терапия должна быть сбалансирована с точки зрения эффективности, соблюдения режима лечения, профиля побочных эффектов у конкретного пациента и предшествующего применения определенных антипсихотических препаратов.
Риск развития ПД при применении АПП хорошо изучен, но в отношении поздних побочных эффектов и осложнений терапии определенными АВП нужны дополнительные исследования. По результатам текущих исследований невозможно исключить риск развития метаболического синдрома, сахарного диабета и ишемической болезни сердца при применении отдельных АВП (см. часть 1 руководства).
Даже после получения результатов исследований CATIE и CUtLASS не следует недооценивать риск развития ПД, поскольку широко обсуждаются ограничения этих двух исследований, которые могли привести к снижению частоты ПД (Moller, 2008; Naber and Lambert, 2009). В исследовании CATIE пациентов с ПД исключали из рандомизации в группу АПП (систематическая ошибка при отборе), в то время как в исследовании CUtLASS наиболее часто выбираемым АПП был сульпирид. Сульпирид является «атипичным» АПП и сопоставим по некоторым своим характеристикам с АВП. Кроме того, ни в одном из этих исследований в качестве препарата сравнения не использовался галоперидол (наиболее часто применяемый АПП в большинстве развитых стран) (Naber and Lambert, 2009). Результаты масштабного европейского исследования у пациентов с первым эпизодом (EUFEST) подтверждают, что терапия галоперидолом может приводить к значительному увеличению частоты ЭПС и значимо более высокому уровню выбывания из исследования (Kahn et al., 2007).
С учетом этих противоречивых точек зрения, основанная на принципах доказательной медицины длительная терапия шизофрении должна представлять собой индивидуально подобранную стратегию лечения, в которой особое внимание уделяется поздней дискинезии и метаболическим побочным эффектам.
Резюме
• Антипсихотические препараты (АПП и АВП) являются эффективными препаратами для профилактики рецидивов (категория доказательств А, уровень рекомендаций 1).
• АПП и АВП не различаются по редукции симптоматики при длительной терапии (категория доказательств А, уровень рекомендаций 1).
• Имеется ряд данных в поддержку превосходства определенных АВП по показателям частоты прерывания терапии и предотвращению рецидивов (категория доказательств В, уровень рекомендаций 3).
• Уменьшение риска развития двигательных побочных эффектов (в частности, ПД) может являться преимуществом определенных АВП (категория доказательств С3, уровень рекомендаций 4).
• При длительной терапии, когда вторичная негативная симптоматика становится менее выраженной, определенные АВП могут обладать рядом преимуществ по влиянию на негативную симптоматику (категория доказательств С3, уровень рекомендаций 4).
• ПД и метаболические побочные эффекты при длительной терапии, по-видимому, оказывают наибольшее влияние на благополучие и состояние здоровья пациента. Таким образом, необходим непрерывный мониторинг и как можно более быстрое лечение этих побочных эффектов (помимо прочих явлений, см. часть 1 данного руководства) (категория доказательств С3, уровень рекомендаций 4).
• При выборе антипсихотических препаратов необходимо руководствоваться теми же критериями, что и при начале лечения (надлежащая клиническая практика).
• При поддерживающей терапии необходимо использовать антипсихотический препарат, характеризующийся наилучшей эффективностью и оптимальным профилем побочных эффектов у данного пациента в ходе эпизода обострения (надлежащая клиническая практика).
• Подбор антипсихотического препарата для каждого пациента необходимо проводить индивидуально с учетом предшествующего применения определенных классов препаратов и профиля побочных эффектов.
Дозировки для длительной терапии
В настоящее время имеется недостаточно доказательных исследований по снижению дозы эффективного в острой фазе антипсихотического препарата для проведения длительной поддерживающей терапии. При улучшении у пациента с первым эпизодом шизофрении рекомендуется продолжение режима лечения эффективным препаратом в сочетании с мониторингом (при наличии такой возможности) на протяжении минимум шести месяцев в фазу стабилизации и на протяжении минимум одного года после назначения сниженной дозы (Lehman et al., 2004; DGPPN, 2006; Falkai et al., 2006). Преждевременное снижение дозы может привести к усилению симптоматики и развитию рецидива. Тем не менее некоторые считают это утверждение спорным (Takeuchi et al., 2012). В целом у пациентов с первым эпизодом требуются меньшие поддерживающие дозировки по сравнению с пациентами с несколькими эпизодами (категория доказательств C, уровень рекомендаций 4). Эта рекомендация основана на наблюдениях, согласно которым у пациентов с первым эпизодом шизофрении наблюдается более высокий риск развития побочных эффектов, и требуется меньшая дозировка для достижения эффекта антипсихотической терапии (см. часть 1 данного руководства).
В ряде исследований изучались режимы терапии, в которых в качестве поддерживающего лечения использовались значительно меньшие дозировки АПП (пероральных и депонированных форм препаратов) по сравнению с острой фазой терапии. Согласно этим результатам, в большинстве исследований наблюдалось увеличение частоты рецидивов, особенно при низких дозах (например, снижение на 25 или 50 % стандартной дозы (Johnson et al., 1987; Schooler et al., 1997) по сравнению с непрерывной терапией в полноценных дозах. Тем не менее полученные значения находились в приемлемом диапазоне (Kane et al., 1982,1983; Marder et al., 1984; Johnson et al., 1987; Hogarty et al., 1988; Dixon et al., 1995; Schooler et al., 1997). При использовании меньших дозировок наблюдался более благоприятный профиль побочных эффектов и боле высокий уровень соблюдения режима терапии. По результатам других исследований было установлено, что высокие дозировки поддерживающего лечения (т. е. более 600 мг хлорпромазинового эквивалента для АПП) не превосходят меньшие дозировки; кроме того, по данным одного исследования дозировки ниже 375 мг/сут хлорпромазинового эквивалента оказались приемлемы для профилактики рецидивов (Bollini et al., 1994). В одном недавно опубликованном клиническом исследовании с надлежащим дизайном снижение дозы во время поддерживающей терапии рисперидоном привело к значительному увеличению частоты рецидивов по сравнению с продолжением лечения в первоначальной стабилизирующей дозировке (Wang et al., 2010). Необходимы новые исследования, направленные на установление оптимальной дозы поддерживающей терапии (особенно для АВП).
С учетом необходимости уравновесить такие факторы, как профилактика рецидивов и развитие побочных эффектов, при поддерживающей терапии необходимо использовать стабилизирующую дозу до тех пор, пока наблюдается хороший контроль рецидивов и отсутствуют серьезные побочные эффекты (категория доказательств C, уровень рекомендаций 4) в течение, по крайней мере, одного года (в табл. 4 приведена более подробная информация о пациентах с первым эпизодом шизофрении и с повторными эпизодами).
Таблица 4. Рекомендуемые дозировки (при пероральном приеме) выбранных антипсихотиков при долгосрочном лечении
|
Антипсихотические препараты |
Начальная доза (мг/сут) |
Интервал дозирования1 |
Целевая доза при первом эпизоде (мг/сут) |
Целевая доза при множественных эпизодах (мг/сут) |
Максимальная дозировка (мг/сут)2 |
|
Антипсихотические препараты второго поколения |
|||||
|
Азенаприн3 |
5 |
1 |
5-10 |
5-20 |
20 |
|
Амисульпирид |
200 |
(1)-2 |
100-300 |
400-800 |
1200 |
|
Арипипразол |
5-15 |
1 |
15-(30) |
15-30 |
30 |
|
Зипразидон |
40 |
2 |
40-80 |
80-160 |
160 |
|
Кветиапин IR/XR |
50 |
2/1 |
300-600 |
400-750 |
750 |
|
Клозапин4 |
25 |
2-(4) |
100-250 |
300-800 |
900 |
|
Оланзапин |
5-10 |
1 |
5-15 |
5-20 |
20 |
|
Палиперидон3 |
3-6 |
1 |
3-9 |
3-12 |
12 |
|
Рисперидон |
1-2 |
1-2 |
1-4 |
3-10 |
16 |
|
Сертиндол |
4 |
1 |
12-20 |
12-24 |
24 |
|
Антипсихотические препараты первого поколения |
|||||
|
Галоперидол |
1-10 |
(1)-2 |
1-4 |
3-15 |
100 |
|
Зуклопентиксол |
2-50 |
1-3 |
2-10 |
25-50 |
75 |
|
Перфеназин |
4-24 |
1-3 |
6-36 |
12-42 |
56 |
|
1-4 |
2 |
1-4 |
2-12 |
16 |
|
|
Флупентиксол |
2-10 |
1-3 |
2-10 |
10-20 |
60 |
|
0,4-10 |
2-3 |
2,4-10 |
10-20 |
20-(40) |
|
|
Хлорпромазин |
50-150 |
2-4 |
300-500 |
300-1000 |
1000 |
1 Интервал дозирования (рекомендуемое распределение суточной дозы): один раз — 1, два раза — 2 и т. д.
2 Максимальная одобренная доза во многих странах (одобренная национальными комитетами; эти дозировки могут варьироваться в различных странах). В клинической практике некоторые антипсихотические препараты первого и второго поколения назначаются даже в больших дозах без достаточных показаний. Увеличение дозы, особенно при долгосрочной терапии, может привести к развитию большего числа побочных эффектов и к уменьшению комплаентности.
3 Эти антипсихотические препараты не были исследованы у пациентов с первым эпизодом шизофрении.
4 Клозапин обычно не применяется у пациентов с первым эпизодом шизофрении в качестве первой линии лечения.
Продолжительность длительного лечения
Шизофрения в большинстве случаев является хроническим заболеванием с рецидивирующим течением. Поэтому основная задача долговременного поддерживающего лечения заключается в профилактике рецидивов. Адекватная продолжительность терапии до настоящего времени не установлена, при этом различия в определении рецидива в исследованиях затрудняют возможность сравнения результатов. Согласно данным плацебо-контролируемых исследований и исследований отмены терапии, антипсихотические препараты (как АПП, так и АВП) позволяют с высокой эффективностью предотвращать рецидивы (см. выше).
У пациентов с первым эпизодом шизофрении может потребоваться более короткая продолжительность поддерживающего лечения по сравнению с пациентами с несколькими эпизодами. По данным Leucht с коллегами (2010), продолжительность исследований у пациентов с первым эпизодом ограничено двумя годами; при этом отмена антипсихотических препаратов в этой группе больных приводит к значимому увеличению частоты рецидивов по сравнению с продолжением лечения (Kane et al., 1982; Crow et al., 1986; Hogarty and Ulrich, 1998; Chen et al., 2010). У пациентов с хроническим течением заболевания, у которых наблюдалось стабильное состояние на протяжении многих лет, после отмены терапии значимо увеличивалась частота рецидивов по сравнению с больными, продолжавшими антипсихотическую терапию (Johnson, 1976; Cheung, 1981; Odejide and Aderounmu, 1982; Sampath et al., 1992; Leucht et al., 2011b). Кроме того, у подавляющего большинства больных, не получающих никакой антипсихотической терапии, в течение трех-пяти лет развивался рецидив. Таким образом, в различных публикациях для пациентов с несколькими эпизодами шизофрении рекомендуется применять непрерывную антипсихотическую терапию (Kissling, 1991; DGPPN, 2006; Falkai et al., 2006). Примерно у 20 % больных шизофренией наблюдается только один эпизод, и у такого же или большего числа, несмотря на продолжающуюся антипсихотическую терапию, развиваются рецидивы (Muller, van Zerssen, 1995; Robinson et al., 1999; Moller, 2004; Falkai et al., 2006). Согласно данным наблюдательного исследования, у амбулаторных пациентов с шизофренией в десяти европейских странах наблюдалась постоянная частота рецидивов на всем протяжении периода наблюдения, что указывает на наличие зависимости частоты рецидивов от течения заболевания (Haro et al., 2007). Пациенты и члены их семей могут настаивать на отмене антипсихотической терапии после разрешения эпизода шизофрении, тем не менее результаты исследований показывают, что после острого психотического эпизода наблюдается относительно высокая частота рецидивов. Учитывая тот факт, что в настоящее время достоверные прогностические факторы эффекта терапии отсутствуют, всем пациентам с диагнозом «шизофрения» следует назначать фармакологическую профилактику рецидивов. Возможными исключениями являются пациенты с очень непродолжительными психотическими эпизодами без отрицательных психосоциальных последствий, а также редкие пациенты, у которых все имеющиеся антипсихотические препараты представляют значительный риск для здоровья (Fleischhacker, Hummer, 1997; NICE, 2002, 2010).
Резюме
Для рекомендаций по продолжительности терапии шизофрении отсутствуют достаточные эмпирические основания, поэтому для предоставления более доказательных рекомендаций необходимо проводить дальнейшие исследования. Большинство рекомендаций основано на небольших исследованиях, мнениях экспертов и клиническом опыте. Тем не менее в случае прекращения терапии в течение одного-двух лет после острого психоза наблюдается высокий риск рецидива.
• У пациентов с первым эпизодом рекомендуется непрерывная антипсихотическая терапия в течение, по крайней мере, одного года (категория доказательств С, уровень рекомендаций 4).
• У пациентов с несколькими эпизодами следует решить вопрос о поддерживающей терапии на протяжении двух-пяти лет (в тяжелых случаях — пожизненная терапия) (категория доказательств С, уровень рекомендаций 4).
Длительность лечения необходимо определять на индивидуальной основе с учетом мотивации пациента, психосоциальной ситуации и проводимого дополнительного лечения. У пациентов с серьезными попытками суицида или грубым агрессивным поведением и очень частыми рецидивами в анамнезе рекомендуется продолжать антипсихотическую терапию на протяжении неопределенно долгого срока (категория доказательств С, уровень рекомендаций 4).
Стратегии лечения (непрерывная или периодическая терапия)
Была продемонстрирована меньшая эффективность периодического назначения терапии нейролептиками и постепенного снижения дозы до полной отмены с последующим тщательным наблюдением и ранним повторным повышением дозы при первых симптомах заболевания по сравнению с непрерывным лечением, поскольку показано, что при использовании такой стратегии наблюдается более высокая частота рецидивов и госпитализаций и у пациентов с первым эпизодом, и у пациентов с повторными эпизодами шизофрении (Schooler, 1993; Schooler et al., 1997; Gaebel et al., 2002, 2011; Wunderink et al., 2007; Takeuchi et al., 2012).
Таким образом, настоятельно рекомендуется проводить непрерывную антипсихотическую терапию для профилактики рецидивов (категория доказательств A, уровень рекомендаций 1). Прерывистая терапия может подходить только больным, которые отказываются от непрерывного поддерживающего режима или имеют противопоказания к непрерывной поддерживающей терапии (NICE, 2010).
Раннее вмешательство
Раннее вмешательство при появлении продромальных симптомов рецидива может быть эффективным способом его предотвращения и является одним из элементов ведения больных шизофренией. Рецидиву обычно предшествует появление продромальных симптомов, которые могут продолжаться несколько дней, недель или даже более длительный период времени. Продромальная фаза рецидива обычно включает умеренно выраженные или тяжелые симптомы, например, чувство напряжения и нервозности, снижение аппетита, затруднения, связанные с концентрацией и памятью, проблемы с засыпанием и депрессию. При этом возможно появление новых симптомов или увеличение тяжести уже имевшихся симптомов. Кроме того, могут появиться нерезко выраженные психотические симптомы и идиосинкратическое поведение, которое обычно замечают родственники больного. Примеры включают социальное отчуждение, избыточный или причудливый макияж, потерю интереса к своему внешнему виду (APA, 1997).
Согласно данным контролируемых исследований, специальные программы, разработанные для обучения больных и членов их семьи вопросам, связанным с продромальными симптомами и ранним вмешательством при появлении симптомов, могут быть полезны для снижения частоты рецидивов (APA, 1997; Lehman et al., 2004) (категория доказательств B, уровень рекомендаций 3). Одним из аспектов раннего вмешательства также может быть возобновление фармакологической терапии, которая была ранее отменена, либо повышение дозы применяемого настоящее время антипсихотического препарата. Для снижения тревожности и напряжения, часто наблюдаемого в начале рецидива, могут быть полезны бензодиазепины (Carpenter et al., 1999; Lehman et al., 2004) (категория доказательств C, уровень рекомендаций 4).
Препараты-депо пролонгированного действия (см. таблицу рекомендаций I)
Несоблюдение и частичное соблюдение перорального режима антипсихотической терапии наблюдается более чем у 40 % больных шизофренией (Cramer, Rosenheck, 1998) и является основной проблемой длительной терапии. Имеется прямая связь между неполным соблюдением режима терапии и риском госпитализации (Weiden et al., 2004). Разработка депонированных форм антипсихотических препаратов длительного действия расширила возможности терапии, особенно у пациентов с недостаточным комплаенсом.
Таблица рекомендаций I. Рекомендации, касающиеся антипсихотического лечения пациентов с шизофренией c помощью инъекционных препаратов длительного действия
|
Антипсихотические препараты с медленным высвобождением |
Категория доказательств’ |
Рекомендации1‘ |
|
АПП |
A |
1 |
|
Рисперидон |
A |
1 |
|
Палиперидон |
A |
1 |
a Категория доказательств, где A — полный объем объективных данных по результатам контролируемых исследований (см. табл. 1).
b Количественная оценка безопасности — уровень рекомендаций, полученный на основе категории доказательств и дополнительных аспектов безопасности, переносимости и потенциального взаимодействия.
Антипсихотические средства длительного действия преимущественно состоят из эфира нейролептического препарата в масляном растворе, который вводится с помощью глубоких внутримышечных инъекций. После инъекции препарат медленно высвобождается из места введения (за исключением рисперидона). Это приводит к установлению относительно стабильного уровня препарата в плазме на протяжении длительного периода времени, что позволяет вводить препарат один раз в 2-4 недели. Преимущества антипсихотических препаратов-депо необходимо соотносить с рядом их недостатков (Nasrallah, 2007).
Преимущества антипсихотических препаратов длительного действия:
— улучшенное соблюдение режима терапии;
— меньшая необходимость напоминать пациентам о приеме препарата;
— более безопасное достижение принципа минимальной эффективной дозы (поэтапное снижение);
— избегание проблем с абсорбцией в желудочно-кишечном тракте;
— исключение проблемы, связанной с метаболизмом при первом прохождении через печень;
— уменьшение риска случайной или преднамеренной передозировки.
Недостатки антипсихотических препаратов длительного действия:
— уменьшение гибкости терапии;
— коррекция оптимальной дозировки носит длительный характер, и этот процесс не вполне очевиден;
— замедленное исчезновение побочных эффектов после отмены препарата;
— редкие местные реакции в области инъекции (риск боли, отека, зуда и иногда — пальпируемого образования).
Тем не менее некоторые пациенты, уже получающие антипсихотические препараты-депо, предпочитают данный метод терапии, поскольку они считают его более удобным в сравнении с пероральными антипсихотическими препаратами (Walburn et al., 2001).
Депо-формы антипсихотипических препаратов первого поколения
Имеется очень небольшое количество исследований, в которых сравниваются антипсихотические препараты-депо с плацебо. Наиболее достоверные данные получают на основании мета-анализов, с выполнением которых связан ряд методологических проблем (Leucht et al., 2009c). Исследования со сравнением препаратов-депо и плацебо удалось обнаружить только для бромперидола, флуфеназина, флушпирилена и галоперидола. По результатам одного обзора Cochrane получен ограниченный объем данных по превосходству бромперидола деканоата над плацебо, но не над флуфеназином или галоперидолом-депо (Purgato, Adams, 2011). Для галоперидола деканоата существуют лишь разрозненные данные, тем не менее можно предположить, что этот препарат значительно более эффективно редуцирует симптоматику шизофрении по сравнению с плацебо, и для него отсутствуют явные различия между пероральной лекарственной формой и препаратом-депо (Quaraishi et al., 1999). Флуфеназин-депо (деканоат или энантат) был подвергнут тщательному изучению, и обзор Cochrane включает в общей сложности 70 исследований. Согласно этому мета-анализу флуфеназин-депо превосходит плацебо по снижению числа рецидивов за длительный период наблюдения, тем не менее данный эффект отсутствовал в исследованиях средней продолжительности (6 месяцев — 1 год). Кроме того, флуфеназина деканоат, по-видимому, превосходит флуфеназина энантат, но явных различий между пероральной формой и флуфеназином-депо не выявлено (David et al., 2005). В целом имеются ограниченные данные, указывающие на эффективность депонированных антипсихотиков при профилактике рецидивов шизофрении, и этот результат подтверждается значительным количеством исследований, в которых один антипсихотический препарат-депо сравнивался с другим. В соответствии с данными мета-анализа имеется лишь незначительное превосходство препаратов-депо над пероральными лекарственными формами, и невозможно выявить явное преимущество одного препарата — депо над другим (Adams et al., 2001). Это согласуется с результатами обзоров Cochrane, но противоречит результатам более раннего мета-анализа, в котором превосходство депонированных лекарственных форм объяснялось обеспечением приверженности терапии (Davis et al., 1994). В другом мета-анализе (10 рандомизированных клинических исследований) с включением долговременных исследований (1 год и выше), в которых сравнивались препараты-депо (8 препаратов первого поколения и 2 второго поколения) с пероральными лекарственными формами у амбулаторных пациентов депонированные препараты превосходили пероральные по предотвращению рецидивов, но не по числу повторных госпитализаций вследствие обострения психопатологической симптоматики, частоте выбывания или по несоблюдению режима терапии (Leucht et al., 2011a). Кроме того, в руководстве PORT для поддерживающей терапии шизофрении рекомендуется использовать галоперидола деканоат и флуфеназина деканоат (Buchanan et al., 2010).
Резюме
• В настоящее время имеются достаточные данные в поддержку использования депонированных форм АПП для профилактики рецидивов шизофрении (категория доказательств A, уровень рекомендаций 1), тем не менее невозможно выявить достоверные различия в эффективности между пероральными и депонированными лекарственными формами (категория доказательств A, уровень рекомендаций 1).
Депо-формы антипсихотических препаратов второго поколения
К настоящему моменту имеется три депонированных препарата АВП: рисперидон в микросферах, палиперидона пальмитат и оланзапина памоат1.
Рисперидон в микросферах (рисперидон-депо)
Препарат представляет собой водную суспензию микросфер, содержащих рисперидон в биорасщепляемой полимерной матрице. Интервал между его инъекциями составляет 2 недели. Перед переходом на монотерапию депо-препаратом необходим дополнительный пероральный прием рисперидона в течение первых трех недель. При использовании данной лекарственной формы высвобождение значимого количества рисперидона начинается через 3 недели после первой инъекции, после чего происходит постепенное длительное высвобождение препарата в течение 4-6 недель после первой инъекции (Harrison and Goa, 2004). В 12-недельном многоцентровом двойном слепом контролируемом исследовании рисперидон пролонгированного действия превосходил по эффективности плацебо по результатам оценки по шкале PANSS (Kane et al., 2003). Эти данные были подтверждены результатами двух других 12-недельных двойных слепых плацебо-контролируемых исследований, в которых было зафиксировано превосходство рисперидона длительного действия по влиянию на психопатологическую симптоматику и эффекту терапии по сравнению с плацебо (Ciliberto et al., 2005; Lauriello et al., 2005). В двух исследованиях (Harrison and Goa, 2004; Chue et al., 2005) не выявлено никаких различий в эффективности между рисперидоном для перорального приема и рисперидоном в микросферах; кроме того, по результатам одного 12-недельного рандомизированного контролируемого исследования рисперидон пролонгированного действия в инъекциях превосходил рисперидон для перорального приема по подшкале позитивных симптомов PANSS и меньшей выраженности побочных эффектов (Bai et al., 2006).
В открытом исследовании III фазы CATIE не зафиксировано никаких различий в эффективности между разными АВП, перфеназином, флуфеназином и рисперидоном в инъекционной форме длительного действия (Stroup et al., 2009). Кроме того, после 13 недель терапии и 12-месячного последующего наблюдения (было рандомизировано в две терапевтические группы 618 пациентов, завершили участие в исследовании 347 пациентов) не зафиксировано превосходства инъекционного рисперидона длительного действия (25-50 мг) над оланзапином для перорального приема (5-20 мг/сут) (Keks et al., 2007). В натуралистическом двухлетнем проспективном исследовании (e-STAR) инъекционная форма рисперидона длительного действия превосходила пероральные АВП (рисперидон или оланзапин) по шкале Общего клинического впечатления (CGI-S) и количеству госпитализаций (Olivares et al., 2009). В двухлетнем исследовании длительной открытой терапии оценивался переход со стабильного лечения пероральными препаратами рисперидона, оланзапина или традиционными нейролептиками на лечение инъекционным рисперидоном длительного действия или пероральным препаратом кветиапина. При оценке по методу Kaplan-Meier время до рецидива было значительно более продолжительным у пациентов, получающих инъекционную форму рисперидона длительного действия, по сравнению с больными, принимающими кветиапин перорально (Gaebel et al., 2010). Тем не менее у пациентов с нестабильным течением заболевания (что определялось как госпитализация в течение предшествующих двух лет или явный риск госпитализации), по-видимому, наблюдается другая ситуация. Эту популяцию больных исследовали в обширном недавно опубликованном рандомизированном исследовании Клинического центра по делам ветеранов (Rosenheck et al., 2011). У пациентов с нестабильным течением заболевания применялась либо инъекционная форма рисперидона длительного действия (каждые 2 недели), либо пероральный антипсихотический препарат по выбору психиатра. По результатам анализа значимого снижения частоты рецидивов после рандомизации у пациентов, получающих инъекционную форму рисперидона длительного действия, по сравнению с больными, получавшими пероральные антипсихотические препараты, не наблюдалось. Тем не менее у больных, получавщих депонированную лекарственную форму, наблюдались реакции раздражения в месте инъекции и больше двигательных побочных эффектов (Rosenheck et al., 2011). В одном наблюдательном исследовании «Когорта общего изучения шизофрении» (CGS) рисперидон длительного действия особенно часто назначался молодым пациентам и больным с более частыми госпитализациями (независимо от тяжести заболевания). Тем не менее даже после коррекции данных с исключением влияния этих факторов рисперидон длительного действия характеризовался значимым снижением риска госпитализации по сравнению с другими вариантами терапии (отсутствие лечения, другие лекарственные формы-депо или пероральные лекарственные формы АПП или АВП) (Grimaldi-Bensouda et al., 2011).
Были проведены три исследования инъекционной лекарственной формы рисперидона длительного действия в особых группах больных шизофренией: 1) пациенты с первым эпизодом; 2) пожилые пациенты; 3) пациенты с сопутствующим синдромом зависимости. В проспективном рандомизированном контролируемом исследовании у пациентов с первым эпизодом шизофрении инъекционная форма рисперидона длительного действия характеризовалась хорошей переносимостью и обеспечивала большую приверженность терапии по сравнению с пероральным приемом рисперидона (Weiden et al., 2009). В другом длительном открытом исследовании у пациентов с первым эпизодом шизофрении ремиссия достигалась у 64 % больных, а у 97 % пациентов данный статус сохранялся до завершения исследования (Emsley et al., 2008). По материалам публикации, касающейся пациентов, которые участвовали в вышеупомянутом 12-недельном исследовании, инъекционная форма рисперидона длительного действия являлась безопасным и хорошо переносимым препаратом (Lindenmayer et al., 2007). Безопасность этого препарата также была продемонстрирована у пожилых пациентов (65 лет и старше) (Kissling et al., 2007). В субпопуляции больных шизофренией с сопутствующим синдромом зависимости пролонгированная лекарственная форма рисперидона в открытом рандомизированном 6-месячном исследовании превосходила по эффективности АПП зуклопентиксола-депо (Rubio et al., 2006). В 52-недельном двойном слепом рандомизированном исследовании у больных шизофренией было зафиксировано отсутствие превосходства комбинации галантамина с инъекционной формой рисперидона длительного действия над комбинацией плацебо с рисперидоном-депо при оценке различных когнитивных доменов (Lindenmayer and Khan, 2011).
1 Препарат пока не зарегистрирован в России и поэтому далее не упоминается в тексте рекомендаций.
Резюме
• Имеется достаточный объем данных в поддержку использования инъекционной формы рисперидона длительного действия для лечения шизофрении (категория доказательств A, уровень рекомендаций 1).
• Существует ряд данных в поддержку превосходства депонированной лекарственной формы по сравнению с пероральным препаратом (категория доказательств C, уровень рекомендаций 4).
• Существует ряд данных в пользу применения инъекционной формы рисперидона длительного действия у пациентов с первым эпизодом шизофрении, пожилых больных с шизофренией и пациентов с шизофренией и сопутствующим синдромом зависимости (категория доказательств B, уровень рекомендаций 3).
• В настоящее время отсутствуют сведения в поддержку комбинированной терапии галантамином и рисперидоном-депо для лечения когнитивной симптоматики шизофрении (категория доказательств E).
Палиперидона пальмитат (палиперидон-депо)
Палиперидона пальмитат представляет собой лекарственную форму-депо палиперидона. Этот препарат обладает низкой растворимостью в воде и после инъекции медленно высвобождается в системное кровеносное русло. Терапия палиперидона пальмитатом не требует дополнительного приема пероральной лекарственной формы в начале лечения (Hough et al., 2009). Этот препарат был зарегистрирован на основании его эффективности в четырех краткосрочных (от 9 до 13 недель) исследованиях, в которых он сравнивался с плацебо (20 % интралипид 200 мг/мл для инъекций) (Citrome, 2010). Согласно результатам одного двойного — слепого контролируемого исследования, пациенты с шизофренией были рандомизированы для получения инъекций плацебо, инъекций палиперидона пальмитата в дозе 50 мг или 100 мг в 1-й, 8-й и 36-й дни (Kramer et al., 2010). Обе дозировки активного препарата превосходили плацебо по снижению суммарного балла PANSS, оценок по шкале CGI и частоте «отмены терапии». Кроме того, палиперидона пальмитат характеризовался хорошей переносимостью и не вызывал увеличения количества экстрапирамидных побочных симптомов (ЭПС), в то время как процент больных, принимавших корректоры по поводу ЭПС, был выше в группе больных, получавших дозу 100 мг. Однако при применении палиперидона пальмитата наблюдалось значительно большее увеличение массы тела, чем при применении плацебо (Kramer et al., 2010). В 9-недельной открытой фазе другого исследования пациентов переводили со стабильной антипсихотической терапии на терапию палиперидона пальмитатом. Пациенты получали две внутримышечные инъекции препарата (50 мг) с интервалом в одну неделю с последующими ежемесячными инъекциями (25, 50 или 100 мг с гибким подбором дозы). Далее в ходе двойной слепой фазы исследования достигшие стабилизации состояния пациенты были рандомизированы для терапии палиперидона пальмитатом (в стабильной дозе) или плацебо. Палиперидона пальмитат превосходил плацебо при запланированном промежуточном и итоговом анализе по времени до развития рецидива (Hough et al., 2010).
В 13-недельном двойном слепом исследовании с участием 388 пациентов сравнивались три различные дозировки палиперидона пальмитата (50, 100, 150 мг) с плацебо. В этом исследовании только палиперидона пальмитат в дозе 100 мг обладал значимым эффектом в отношении снижения оценок PANSS (Gopal et al., 2010b). В другом 13-недельном исследовании со сравнимым дизайном (палиперидона пальмитат в дозах 25, 100 и 150 мг по сравнению с плацебо) превосходство в отношении редукции показателей PANSS зафиксировано для всех терапевтических групп по сравнению с плацебо в популяции пациентов с обострением шизофрении (Pandina et al., 2010). Еще в одном 13-недельном исследовании сравнивался палиперидона пальмитат в дозах 25, 50 и 100 мг с плацебо, при этом зафиксировано значимое улучшение во всех терапевтических группах по сравнению с плацебо (Nasrallah et al., 2010). В открытой фазе двойного слепого исследования Hough et al., (2010) продолжительностью 1 год наблюдалась значимая редукция психопатологической симптоматики, при этом наиболее частой применяемой дозировкой палиперидона пальмитата было 100 мг (Gopal et al., 2011). Тем не менее авторы не сравнивали частоту рецидивов при использовании различных дозировок палиперидона пальмитата.
В сравнительных исследованиях (одно двойное слепое 12-недельное контролируемое исследование и одно открытое исследование) зафиксирована не меньшая эффективность палиперидона пальмитата по сравнению с инъекционной формой рисперидона длительного действия, при этом оба препарата характеризовались схожим профилем побочных эффектов (Li et al., 2011; Pandina et al., 2011). В 53-недельном двойном слепом исследовании III фазы у пациентов с острой симптоматикой подтверждена по крайней мере равная эффективность палиперидона пальмитата по сравнению с инъекционной лекарственной формой рисперидона длительного действия (Fleischhacker et al., 2011). По результатам анализа субпопуляции тяжелых больных шизофренией (согласно оценке по шкале CGI) палиперидона пальмитат превосходил плацебо уже к четвертому дню терапии (Alphs et al., 2011). По данным дополнительного анализа результатов 13-недельного двойного слепого плацебо-контролируемого исследования у принимавших перорально рисперидон пациентов с сохраняющейся симптоматикой применение палиперидона пальмитата по сравнению с плацебо приводило к улучшению общей оценки PANSS, оценкам CGI, а также по шкале личностного и социального функционирования (PSP) (Sliwa et al., 2011).
Резюме
• Получен достаточный объем данных в поддержку использования инъекционной лекарственной формы палиперидона длительного действия для лечения шизофрении (категория доказательств A, уровень рекомендаций 1).
• В настоящее время отсутствуют данные, позволяющие подтвердить превосходство лекарственной формы-депо по сравнению с палиперидоном для перорального приема (категория доказательств A, уровень рекомендаций 1).
• Палиперидон-депо, по-видимому, равен по эффективности рисперидону-депо (категория доказательств A, уровень рекомендаций 1).
Дозировки депо-нейролептиков (см. табл. 5)
Таблица 5. Рекомендуемые дозировки антипсихотиков медленного высвобождения при долгосрочном лечении
|
Антипсихотический препарат |
Интервал дозирования (недели) |
Пациенты с первым эпизодом (мг) |
Пациенты с множественными эпизодами (мг) |
|
Антипсихотические препараты второго поколения |
|||
|
Рисперидон — микросферы |
2 |
25 |
25-50 |
|
Рисперидона пальмитат |
4 |
25-75 |
25-150 |
|
Антипсихотические препараты первого поколения |
|||
|
Галоперидола деканоат |
4 |
50-100 |
100-200 |
|
Зуклопентиксола деканоат |
2-4 |
100-200 |
200-400 |
|
Флупентиксола деканоат |
2-3 |
20-40 |
20-100 |
|
Флуфеназина деканоат |
2-4 |
6,25-37,5 |
12,5-50 |
Согласно руководству PORT, рекомендуемая дозировка флуфеназина деканоата составляет от 6,25 мг раз в 2 недели до 25 мг рах в 2 недели, а дозировка галоперидола деканоата — от 50 до 200 мг раз в 4 недели (Dixon et al., 1995; Kane et al., 2002).
В одном из исследований отмечалась замена перорального рисперидона пролонгированного действия в эквивалентной дозе у госпитализированных пациентов. Согласно полученным результатам, переход рекомендуется выполнять следующим образом: пациенты, получавшие пероральный рисперидон в дозах менее или равных 3 мг в день, должны получать 25 мг рисперидона пролонгированного действия; пациенты, получавшие 3-5 мг рисперидона перорально, должны получать 37,5 мг; пациенты, получавшие более 5 мг рисперидона в день, должны получать 50 мг рисперидона пролонгированного действия в виде инъекции (Bai et al., 2007). В ходе двойного слепого рандомизированного клинического исследования продолжительностью 1 год проводилось сравнение рисперидона длительного действия в дозировках 25 и 50 мг у стабильных пациентов с шизофренией; отмечалось некоторое количественное (но не статистически значимое) преимущество более высокой дозировки. В целом рисперидон в форме микросфер в дозировках 25 и 50 мг является адекватным препаратом для долгосрочного лечения шизофрении и шизоаффективного расстройства (Simpson et al., 2006).
Лечение палиперидона пальмитатом может начинаться после отмены перорального антипсихотика (дополнительное назначение пероральных препаратов не требуется) либо у пациентов, получавших депо-нейролептики (в том числе рисперидон пролонгированного действия), в день запланированной следующей инъекции, а затем ежемесячно (Gopal et al., 2010a). Начальная доза палиперидона пальмитата составляет 150 мг в первый день, а затем 100 мг в восьмой день (± 2 дня). Обе инъекции выполняются в одну и ту же мышцу с целью быстрого достижения адекватной концентрации препарата. После второй инъекции палиперидона пальмитат следует вводить один раз в месяц (± 7 дней) в дозах от 25 до 150 мг (Gopal et al., 2010a).
Сводные рекомендации по длительному лечению
У больных шизофренией, перенесших один или несколько эпизодов, прием антипсихотиков в фазе ремиссии существенно снижает риск обострения и потому настоятельно рекомендован. Выбор препарата для длительного лечения должен быть сделан пациентом и врачом совместно с учетом адекватной информации о пользе препарата и его побочных эффектах (Lehman et al., 2004; Leucht et al., 2011b; NICE, 2010); при этом особое внимание следует уделять ПД и метаболическим нарушениям. При возможности в процессе принятия решения должны участвовать члены семьи или опекуны, а в некоторых случаях, если необходимо, адвокат. Для длительного поддерживающего лечения следует выбрать антипсихотик, позволяющий достичь ремиссии и обладающий наиболее благоприятным профилем побочных эффектов. Выбор целевой дозы антипсихотика в стабильную фазу заболевания затрудняется тем, что не существует надежной стратегии определения минимальной дозы, которая предотвратит обострение. Нет доказательств того, что высокие дозы (более 600 мг хлорпромазина или эквивалентные дозы других АПП) более эффективны в предотвращении обострения, чем стандартные дозы (Bollini et al., 1994). Однако пациентам, перенесшим первый эпизод шизофрении, для поддержания ремиссии могут потребоваться меньшие дозы, чем пациентам с множественными эпизодами. Следует выбирать наименьшую дозу, при которой не развиваются побочные эффекты, а риск обострения существенно снижается и подавляются имеющиеся симптомы. При необходимости коррекции терапии вследствие развития побочных явлений желательно избегать слишком быстрого и резкого снижения доз. В целях снижения риска ПД у пациентов, получавших АПП, их можно перевести на АВП, учитывая при этом риск развития сердечно-сосудистых и метаболических побочных эффектов. Для длительной терапии следует выбирать препарат, характеризующийся наилучшим соотношением эффективности и профиля побочных эффектов, а также обладающий наилучшей индивидуальной переносимостью, поскольку это способствует приверженности пациента лечению. Рядом преимуществ обладают антипсихотики с низкой частотой ЭПС и метаболических побочных эффектов, однако в настоящее время нет достаточных доказательств, чтобы рекомендовать какой-то конкретный препарат. Стратегии замены препаратов и ведение лекарственной резистентности описано в части 1 данного руководства.
Поскольку известно, что постоянный прием антипсихотиков дает лучшие результаты, чем прерывистый, предпочтительной стратегией лечения является продолжительное применение пероральных или внутримышечных препаратов.
Во всех случаях следует наблюдать за продромальными признаками обострения и корректировать дозы соответствующим образом. В стабильной ремиссии, если есть разумные причины причины отказа от приема лекарственных препаратов (к примеру, недостаточная приверженность), можно рассмотреть стратегию прерывистого лечения антипсихотиками под контролем продромальных признаков, особенно у пациентов с благоприятным прогнозом, перенесших первый эпизод шизофрении. При этом очень важно, чтобы пациент самостоятельно мог распознать ранние настораживающие признаки и принять соответствующие меры.
Депонированные препараты являются средством выбора, особенно если пациент предпочитает такой вид терапии, поскольку это позволяет улучшить приверженность. При наличии побочных эффектов, а также после обсуждения с пациентом можно рекомендовать введение низких доз депо-препаратов с добавлением пероральных нейролептиков при появлении ранних продромальных признаков обострения. Для достижения оптимальной эффективности в предотвращении обострения пролонги должны назначаться в стандартных дозировках и со стандартными интервалами введения. До начала введения антипсихотика длительного действия можно также назначить пациенту несколько пробных доз пероральной формы препарата, чтобы избежать неожиданных тяжелых побочных эффектов.
Качество жизни
Наряду с воздействием на психопатологическую симптоматику и мероприятиями по сохранению социальных функций одной из важнейших задач в долгосрочном лечении шизофрении является улучшение субъективного благополучия пациента и качества жизни.
Для оценки аспектов качества жизни существует ряд инструментов, в том числе Шкала качества жизни (QLS), Профиль влияния заболевания (SIP), опросник Исследования медицинских результатов из 36 пунктов (SF-36). Некоторые опросники были разработаны специально для пациентов, получающих антипсихотики (например, Шкала субъективного благополучия пациента при лечении нейролептиками — SWN). Качество жизни редко является первичным критерием оценки эффективности в клинических исследованиях, поэтому обычно бывает трудно установить различия между препаратами по этому параметру.
В предыдущей версии данного руководства было сказано, что благодаря амисульприду (Carriere et al., 2000; Colonna et al., 2000; Saleem et al., 2002), клозапину (Essock et al., 1996; Rosenheck et al., 1997; Rosenheck et al., 1998; Rosenheck et al., 1999), оланзапину (Hamilton et al., 1998; Revicki et al., 1999; Hamilton et al., 2000), кветиапину (Awad and Voruganti, 2004), рисперидону (Mahmoud et al., 1999; Voruganti et al., 2000) и зотепину (Voruganti et al., 2000) наметилась тенденция к преимуществу АВП по сравнению с АПП. Тем не менее даже в 2006 г имелись неоднородные результаты исследований, не позволявшие сделать однозначные выводы (Falkai et al., 2006). Кроме того, результаты исследований CATIE и CUtLASS поставили под сомнение превосходство АВП перед АПП по показателям улучшения качества жизни. Ситуация еще более затрудняется, если учитывать, что побочные эффекты, особенно моторные и метаболические, обладают значительным влиянием на качество жизни пациента. Согласно трем публикациям по итогам анализа CATIE не наблюдалось различий между АВП и АПП перфеназином по таким показателям, как трудоустройство и психологическая реабилитация (Resnick et al., 2008), качество жизни (Swartz et al., 2007) и число лет качественной жизни (Rosenheck et al., 2006), однако эти параметры не были первичными при оценке результатов исследования. Эти данные были подтверждены исследованием CUtLASS, согласно которому не наблюдалось значительных различий в улучшении качества жизни между АВП и АПП (преимущественно сульпиридом) (Jones et al., 2006). Однако ограничения данных исследований хорошо известны и должны учитываться при обсуждении их результатов (Moller, 2008; Naber and Lambert, 2009). В ходе небольшого двухлетнего исследования по сравнению галоперидола и рисперидона, а также в годовом исследовании по сравнению оланзапина и галоперидола не было выявлено различий между АПП и АВП по показателям улучшения качества жизни (Marder et al., 2003; Rosenheck et al., 2003). Однако, согласно результатам, полученным Marder et al. (2003), пациенты субъективно чувствовали себя лучше в группе рисперидона. Это согласуется с данными других исследований, в которых отмечалось улучшение субъективного самочувствия на фоне лечения АВП (Wehmeier et al., 2008; Naber and Lambert, 2009).
В исследовании EUFEST не отмечалось различий между галоперидолом и АВП по Манчестерской краткой шкале качества жизни (Kahn et al., 2008). В других исследованиях, проведенных у пациентов с первым эпизодом шизофрении, не было выявлено различий по показателю качества жизни при приеме галоперидола и рисперидона (Gaebel et al., 2007) или галоперидола и оланзапина (Strakowski et al., 2005). В исследовании по сравнению трех АВП (оланзапина, кветиапина и рисперидона) в течение 52 недель не отмечалось превосходства какого-либо из данных препаратов по показателю качества жизни (McEvoy et al., 2007). При анализе результатов различных исследований, касающихся качества жизни, необходимо принимать во внимание, что самоопросники по качеству жизни могут быть недостаточно чувствительным для дифференцировки различных терапевтических подходов (Moller, 2008).
Резюме
• Антипсихотики улучшают качество жизни больных шизофренией, однако нет сведений о преимуществах какого-либо одного или группы препаратов (категория доказательств A, уровень рекомендаций 1).
• Следует учитывать, что на качество жизни также влияют побочные эффекты, для улучшения качества жизни пациентов одинаково важны и уменьшение их проявлений, и их тщательная коррекция (категория доказательств C, уровень рекомендаций 4).
• Существуют некоторые доказательства того, что субъективное благополучие улучшается в большей степени при приеме определенных АВП, как отмечено выше (категория доказательств B, уровень рекомендаций 3).
Коррекция побочных эффектов
В первой части данного руководства подробно описаны значимые побочные эффекты антипсихотиков. Отметим, что АПП и АВП, в зависимости от индивидуального профиля связывания с рецепторами, могут вызывать неврологические побочные эффекты (например, острые и хронические ЭПС, злокачественный нейролитический синдром), седацию, эффекты со стороны сердечно-сосудистой системы, набор лишней массы тела и метаболические нарушения, холинолитические, адренолитические и антигистаминовые эффекты, гиперпролактинемию и сексуальную дисфункцию.
Мониторинг сомато-неврологического состояния больного и лабораторных показателей зависит от специфического профиля побочных эффектов назначенного антипсихотика. В стабильную фазу заболевания очень важно проводить регулярный контроль за массой тела, ЭПС, побочных эффектов со стороны сердечно-сосудистой системы и метаболических нарушений. Особое внимание следует уделять нарушениям, связанным с ожирением (повышению АД, нарушениям липидного обмена, клиническим признакам диабета). В связи с этим в клинической практике следует регулярно проверять уровень глюкозы натощак или гликированного гемоглобина (HbA1c) в целях ранней диагностики метаболического синдрома и сахарного диабета, поскольку у пациентов, особенно страдающих ожирением, обычно имеются многочисленные факторы риска развития этих состояний. В отношении ЭПС АВП обладают явными преимуществами перед АПП. Эти преимущества следует иметь в виду при учете других побочных эффектов, например, более высокого риска ожирения и сахарного диабета на фоне приема некоторых препаратов. Адекватное лечение побочных эффектов может способствовать приверженности пациента терапии и более благоприятным ее результатам. В следующем разделе описаны стратегии и рекомендации по коррекции побочных эффектов.
Следует отметить, что исследования высокого научного качества остаются редкостью в данной сфере, а лечению побочных эффектов уделяется меньше внимания, чем контролю психопатологической симптоматики.
Побочные эффекты со стороны нервной системы
Неврологические побочные эффекты являются серьезным бременем для пациента; настоятельно рекомендуется проводить частый скрининг для их выявления. В более ранних исследованиях указывалось, что неврологические побочные эффекты часто остаются не диагностированными и, следовательно, их не лечат (Weiden et al., 1987). Практикующий психиатр должен уметь вовремя распознать эти потенциально тяжелые симптомы. Неврологические побочные эффекты обычно связывают с применением АПП, однако и прием АВП сопровождается определенным риском их развития.
Экстрапирамидные симптомы (ЭПС) (см. табл. 6)
Таблица 6. Терапевтические возможности ведения пациентов с неврологическими побочными эффектами антипсихотиков (ЭПС и ЗНС) (категории доказательств представлены в тексте)
|
Побочный эффект |
Профилактика |
Лечение |
|
Острые дистонические реакции |
|
• Пероральное или внутривенное применение антихолинергических препаратов, например, 2,5-5 мг биперидена, при необходимости повторить процедуру через 30 минут, продолжить пероральный прием биперидена (максимально 12 мг/сут) |
|
Паркинсонизм |
|
|
|
Акатизия |
|
|
|
Поздняя дискинезия (ПД) |
|
|
|
Злокачественный нейролептический синдром (ЗНС) |
• Выбор антипсихотиков с низким риском развития ЗНС |
|
ЭПС можно разделить на острые (острые дистонические реакции, паркинсонизм, акатизия) и хронические (ПД). Острые ЭПС развиваются в первые дни или недели приема антипсихотика; они зависят от дозы и являются обратимыми при снижении дозы препарата или его отмене (APA, 1997).
Острая дистоническая реакция
Данный побочный эффект обычно возникает либо в начале лечения антипсихотиками, либо при повышении дозы. Острые дистонические реакции более характерны для молодых пациентов и связаны с применением высоких доз антипсихотиков (Singh et al., 1990). Острые дистонические реакции хорошо купируются введением антихолинергических или антигистаминных средств (APA, 1997) (категория доказательств C, уровень рекомендаций 4). Препараты для парентерального введения действуют быстрее, чем пероральные. Если при введении первой дозы антихолинергического или антигистаминного средства острую дистоническую реакцию прервать не удалось, следует повторить введение препарата.
Паркинсонизм
Паркинсонизм обычно развивается через несколько дней или недель после начала лечения антипсихотиками и разрешается самостоятельно после отмены препарата (категория доказательств C, уровень рекомендаций 4), хотя сообщалось о некоторых случаях стойкой симптоматики (Melamed et al., 1991). Первичное лечение паркинсонизма, обусловленного приемом антипсихотических средств, заключается в снижении дозы или в назначении АВП (категория доказательств C, уровень рекомендаций 4). Если это не представляется возможным, следует рассмотреть назначение антихолинергических препаратов (например, бипериден, бензтропин или тригексифенидил) или агонистов дофаминовых рецепторов (напимер, бромокриптин, амантадин). Тем не менее агонисты дофаминовых рецепторов могут привести к обострению психоза, а прием антихолинергических средств может сопровождаться характерными для них нежелательными эффектами. Таким образом, следует избегать длительного приема или высоких доз этих препаратов.
Акатизия
Акатизия обычно развивается в начале лечения антипсихотиками или при переходе с одного препарата на другой. Важно не спутать акатизию с психотическим возбуждением, поскольку для купирования последнего назначают антипсихотики, которые могут дополнительно усилить акатизию. Считается, что акатизия реже возникает при лечении АВП, чем АПП, но она может развиться на фоне приема любых антипсихотиков (Kumar and Sachdev, 2009). В связи с этим психиатр должен проводить скрининг на выявление акатизии у всех пациентов, получающих нейролептики.
В целях борьбы с акатизией применяют несколько стратегий, которые, однако, до настоящего времени не подтверждены достаточным числом доказательных исследований. Первым шагом в лечении акатизии является снижение дозы. Также при назначении для лечения акатизии бета-блокаторов центрального действия (например, пропранолола в дозах 30-90 мг в день) наблюдались хорошие результаты, однако выборка больных в исследованиях была очень маленькой, и данные результаты следует интерпретировать с осторожностью (Dupuis et al., 1987; Fleischhacker et al., 1990). Обзор Cochrane, включающий данные трех исследований, не подтверждает эффективность бета-блокаторов в лечении акатизии (Lima et al., 2004a). Таким образом, доказательства в поддержку применения бета-блокаторов центрального действия для лечения акатизии весьма ограничены (категория доказательств C, уровень рекомендаций 4). При назначении и изменении дозы этих препаратов следует вести наблюдение за артериальным давлением и частотой сердечных сокращений.
В обзор Cochrane были включены два небольших рандомизированных контролируемых исследования, в которых приняли участие всего 27 пациентов. Согласно результатам проведенного анализа, клоназепам более эффективно, чем плацебо, приводил к уменьшению выраженности акатизии в коротком (7-14 дней) периоде наблюдения (Kutcher et al., 1989; Pujalte et al., 1994; APA, 1997; Lima et al., 2002). Таким образом, имеются некоторые доказательства эффективности бензодиазепинов в лечении акатизии (категория доказательств В, уровень рекомендаций 3), однако известно, что длительный прием бензодиазепинов сопровождается риском развития лекарственной толерантности и зависимости, что должно учитываться при назначении лечения. Кроме того, возможно повышение летальности у пациентов, страдающих шизофренией, при одновременном назначении нейролептиков и некоторых бензодиазепинов с длительным временем полувыведения (Baandrup et al., 2010).
Рандомизированных контролируемых исследований, доказывающих эффективность антихолинергических препаратов для лечения акатизии, не проводилось (Rathbone and Soares-Weiser, 2011). Однако если пациент страдает от акатизии, несмотря на применение различных стратегий лечения, можно попробовать применить антихолинергические или антигистаминные средства (Vinson and Drotts, 2001; Lima et al., 2004b) (категория доказательств C, уровень рекомендаций 4).
В ходе небольшого плацебо-контролируемого исследования изучался витамин В6 как средство для лечения острой акатизии, вызванной приемом нейролептиков. Согласно оценке по шкале акатизии Барнса, витамин В6 снижал акатизию более эффективно, чем плацебо (Lerner et al., 2004). В другом небольшом рандомизированном клиническом исследовании у пациентов с акатизией, вызванной приемом антипсихотиков, витамин В6 и миансерин более эффективно, чем плацебо, уменьшали субъективный дискомфорт; однако при оценке объективных показателей акатизии различия достигли лишь уровня тенденции (Miodownik et al., 2006). Таким образом, имеются некоторые доказательства эффективности витамина В6 для лечения акатизии (категория доказательств C, уровень рекомендаций 4).
В небольшом (13 пациентов) плацебо-контролируемом двойном слепом перекрестном исследовании были получены данные о возможной эффективности тразодона в лечении акатизии, вызванной приемом антипсихотиков (Stryjer et al., 2010) (категория доказательств C, уровень рекомендаций 4).
Поздняя дискинезия (ПД)
ПД — это тяжелый неврологический побочный эффект, который обычно развивается на фоне длительного приема антипсихотиков, но может возникнуть и при кратковременном лечении. АВП по сравнению с АПП имеют меньший риск развития ПД (Tenback et al., 2005; Kasper et al., 2006; Correll and Schenk, 2008; Tenback et al., 2010). В руководстве PORT сообщалось о возможности развития ПД при приеме любых АВП без каких-либо различий в частоте этого побочного эффекта (Buchanan et al., 2010). В настоящий момент доказано, что назначение АВП сопровождается меньшим риском развития ПД по сравнению с АПП (категория доказательств А, уровень рекомендаций 1).
Во многих учебниках и руководствах в качестве терапии первого выбора в лечении ПД рекомендуется отмена антипсихотиков, однако, согласно результатам мета-анализа, проведенного группой Cochrane по шизофрении, нет каких-либо доказательств того, что отмена или снижение дозы антипсихотика может быть эффективным специфическим лечением ПД (Soares-Weiser and Rathbone, 2006). В то же время снижение дозы антипсихотика сопровождалось улучшением симптоматики у пациентов с ПД в исследованиях с небольшим размером выборок (Kane et al., 1983; Cookson, 1987). Снижение дозы антипсихотиков связано с высоким риском обострения основного заболевания, который следует учитывать, принимая во внимание слабые доказательства в пользу данного терапевтического подхода.
Перевод с одного антипсихотика (обычно АПП) на другой (обычно АВП) также неоднократно предлагался для лечения ПД. В руководстве PORT обсуждаются потенциальные преимущества атипичных антипсихотиков с точки зрения уменьшения симптомов ПД и указывается на отсутствие доказательств, позволяющих рекомендовать АВП для этой цели (Buchanan et al., 2010). Однако в том же руководстве PORT упоминаются исследования, в которых были получены некоторые данные в поддержку перехода на АВП. В ходе небольшого двойного слепого плацебо-контролируемого исследования продолжительностью 12 недель изучался переход с АПП на рисперидон или плацебо после 4-недельного периода отмывки у больных шизофренией с ПД (Bai et al., 2003). В данном исследовании рисперидон эффективно (68 % респондеров) по сравнению с плацебо (30 %) уменьшал симптоматику ПД (Bai et al., 2003). Той же группой было проведено проспективное наблюдательное исследование продолжительностью 48 недель (открытая продолженная фаза длительностью 36 недель), в ходе которого определялись признаки долгосрочного улучшения у пациентов, переведенных на рисперидон (Bai et al., 2005). В неконтролируемом слепом исследовании со снижением доз и периодом наблюдения 8 месяцев переход на оланзапин приводил к уменьшению явлений ПД даже после снижения дозы оланзапина (Kinon et al., 2004). В небольшом ослепленном для исследователей рандомизированном исследовании продолжительностью 12 месяцев пациентам с шизофренией на протяжении двух недель постепенно снижали дозы антипсихотиков, а затем назначали гибкие дозы кветиапина или галоперидола. У пациентов, получавших кветиапин, отмечалось значительно более выраженная редукция симптоматики ПД и моторных побочных эффектов (Emsley et al., 2004). Этот положительный эффект кветиапина был воспроизведен в другом небольшом исследовании (Cortese et al., 2008). В ходе анализа данных исследования CATIE у больных шизофренией было проведено сравнение 200 пациентов с ПД и 997 пациентов без ПД, которым в случайном порядке назначался один из АВП (оланзапин, кветиапин, рисперидон или зипрасидон). Согласно полученным результатам, не отмечалось значительных различий между препаратами с точки зрения снижения признаков ПД; у большинства пациентов симптомы сохранялись либо флюктуировали (Caroff et al., 2011). Хотя при замене АПП на АВП наблюдается некоторая тенденция к улучшению картины ПД, доказательства остаются ограниченными (категория доказательств C, уровень рекомендаций 4). Это можно объяснить отсутствием больших двойных слепых исследований и очень маленьким размером выборки больных в проведенных исследованиях. Более того, известно, что смена антипсихотика может привести к утяжелению симптоматики ПД.
Переход на клозапин — наиболее часто обсуждаемая стратегия лечения ПД. В ходе небольшого открытого исследования семи больным шизофренией с тяжелой ПД были на одну неделю отменены антипсихотики, а затем в течение 24 недель проводилось лечение клозапином. Данная стратегия привела к значительной редукции симптомов ПД (Bassitt and Louza Neto, 1998). Эти результаты были подтверждены итогами 5-летнего наблюдательного исследования (Louza and Bassitt, 2005). В обзоре восьми опубликованных исследований говорится, что ПД хорошо реагирует на клозапин, однако методологические ограничения проведенных исследований снижают качество имеющихся данных (Lieberman et al., 1991). Это согласуется с результатами еще одного короткого исследования, в котором отмечалась эффективность клозапина для лечения ПД (Spivak et al., 1997). Пациенты с уже имеющейся ПД отвечали на длительное лечение клозапином (Tamminga et al., 1994). Итак, имеются ограниченные данные в пользу положительного эффекта клозапина при ПД, однако не хватает доказательств, полученных в двойных слепых рандомизированных исследованиях (категория доказательств C, уровень рекомендаций 4).
Для лечения ПД изучалась эффективность и ряда других препаратов. Возможно, некоторым положительным эффектом обладает витамин Е (Soares- Weiser et al., 2011) (категория доказательств C, уровень рекомендаций 4), в то время как назначение антихолинергических препаратов не рекомендовано в связи с отсутствием доказательств их пользы и нежелательными эффектами (Soares, McGrath, 2000; Tammenmaa et al., 2002) (категория доказательств F). Также нет убедительных доказательств того, что бензодиазепины могут значительно снижать проявления ПД (Bhoopathi, Soares-Weiser, 2006), но при этом их прием сопровождается риском развития лекарственной толерантности и зависимости (категория доказательств F). В одном из обзоров Cochrane, обновленном в 2010 г. без внесения изменений в заключение, изучались эффекты смешанной группы веществ (токсина ботулизма, эндорфина, эссенциальных жирных кислот, EX11582A, ганглиозида, инсулина, лития, налоксона, эстрогена, периактина, фенилаланина, пирацетама, стефолидина и триптофана), а также нейрохирургического вмешательства и электросудорожной терапии (ЭСТ) при ПД. Ни одно из перечисленных веществ или вмешательств не было эффективным (Soares-Weiser and Joy, 2003) (категория доказательств F). В отсутствие надежных доказательств возможную пользу блокаторов кальциевых каналов при ПД следует противопоставлять потенциальным нежелательным эффектам, например, снижению артериального давления и даже ухудшению симптоматики ПД (Soares-Weiser and Rathbone, 2004) (категория доказательств F). Эффективность ГАМК-ергических агонистов (баклофена, гамма-винил-ГАМК, гамма-ацетиленовой ГАМК, прогабида, мусцимола, вальпроата и тетрагидроизоксазолопиридина) при ПД не доказана, и их использование не может быть рекомендовано (Alabed et al., 2011) (категория доказательств F).
По результатам обзора, включавшего 3 проспективных исследования, 8 дополнительных исследований, 1 серию клинических случаев и 8 сообщений о клинических случаях, сообщалось, что тетрабеназин может быть эффективен при ПД (Leung and Breden, 2011) (категория доказательств C, уровень рекомендаций 4). В натуралистическом длительном наблюдательном исследовании, проведенном у шести пациентов, комбинация тетрабеназина, клоназепама и клозапина приводила к быстрому уменьшению симптомов ПД (Kimiagar et al., 2011). Однако для тетрабеназина также отсутствуют доказательства, полученные в исследованиях с надлежащим дизайном.
Бензамидное производное тиаприд, возможно, обладает некоторым действием на симптомы ПД, однако исследований с хорошим дизайном недостаточно, чтобы сделать выводы, основанные на доказательствах (El-Sayeh et al., 2006) (категория доказательств F).
Помимо фармакологической терапии при ПД изучались и другие виды терапевтических вмешательств. Согласно описанию серии клинических случаев, ЭСТ была эффективна при лечении ПД (Hay et al., 1990; Ucok, Ucok, 1996) (категория доказательств C, уровень рекомендаций 4). Глубокая стимуляция головного мозга (ГСМ), зарекомендовавший себя метод лечения ряда моторных неврологических расстройств (например, болезни Паркинсона и дистонии), обладает потенциалом для лечения тяжелой ПД (Lyons, 2011). На сегодняшний момент исследования ГСМ для лечения ПД не проводились, однако сообщения о клинических случаях и сериях случаев (Trottenberg et al., 2005; Sako et al., 2008) и опыт лечения моторных нарушений позволяют предположить, что ГСМ теоретически может в некоторых случаях облегчать симптоматику поздней дискинезии (категория доказательств C, уровень рекомендаций 4).
При крайне тяжелой, резистентной к терапии ПД, вызванной антипсихотиками, в качестве «терапии отчаяния» может рассматриваться нейрохирургическое вмешательство — паллидотомия (Wang et al., 1997; Thobois et al., 2011) (категория доказательств C, уровень рекомендаций 4).
Итак, лечение ПД является сложной задачей. В настоящий момент нет данных, однозначно доказывающих эффективность какой-либо из существующих терапевтических стратегий. В тяжелых случаях, когда переход на клозапин или другие АВП не приводит к улучшению, могут рассматриваться подходы, описанные выше. При этом психиатры должны принимать во внимание относительно небольшое число доказательств эффективности данных методов.
Злокачественный нейролептический синдром (ЗНС)
ЗНС характеризуется дистонией, ригидностью, лихорадкой (> 38 °C, как минимум, при двух измерениях), такими проявлениями нестабильности вегетативной нервной системы, как тахикардия (> 25 % от исходного уровня), тахипное (> 50 % относительно исходного уровня), повышение артериального давления (> 25 % от исходного уровня) и его колебания (> 20 ммНд (диастолическое) или > 25 ммНд (систолическое)в течение 24 часов), делирий, миоглобинурия, повышение уровней креатинкиназы (как минимум, 4-кратное повышение относительно верхнего предела нормы) (Gurrera et al., 2011), лейкоцитов и ферментов печени (лактат дегидрогиназы и аспартат трансаминазы) и низкий уровень железа в плазме. В то же время специфические лабораторные параметры для диагностики ЗНС отсутствуют. ЭЭГ может иметь такие признаки метаболической энцефалопатии, как генерализованное торможение (Caroff, Mann, 1988; Strawn et al., 2007). Биологические показатели могут быть опорой для дифференциальной диагностики ЗНС и серотонинового синдрома, который имеет схожую клиническую картину и в редких случаях развивается у пациентов, получающих одновременно нейролептики и агонисты серотонина. В принципе, данный синдром может развиться на фоне лечения любым антипсихотиком (см. часть 1). В случае развития ЗНС нейролептики следует немедленно отменить. Наряду с общими терапевтическими подходами необходимо проводить специфические фармакологические или соматические лечебные мероприятия.
Пациенты с ЗНС должны быть помещены в отделение интенсивной терапии с целью неотлучного наблюдения, стабилизации жизненно важных функций и адекватного лечения таких симптомов, как гипертермия. Любые препараты, которые могут вызвать подобную симптоматику (к примеру, литий или антидепрессанты), следует также отменить. Доказательства эффективности каких-либо специфических методов лечения до настоящего времени остаются весьма ограниченными. Введение миорелаксанта дантролена (2,5/10 мг/кг в день в/в) показало многообещающие результаты (Sakkas et al., 1991). Однако, согласно результатам мета-анализа, включавшего 271 клинический случай, произошедший с 1980 по 2006 г, комбинация дантролена и других препаратов сопровождалась пролонгацией клинического восстановления, а монотерапия дантроленом была связана повышением общей смертности (Reulbach et al.,2007). Поэтому с этим авторы пришли к выводу, что ни одна схема лечения, включающая дантролен, не основана на научных доказательствах (Reulbach et al., 2007). Результаты изучения эффективности дантролена при ЗНС противоречивы, поэтому лечение ЗНС дантроленом пока не может быть рекомендовано (категория доказательств F). В то же время в некоторых случаях использование дантролена может обсуждаться (например, при крайне высокой температуре, ригидности и истинном гиперметаболизме) (Strawn et al., 2007) (категория доказательств C).
ЭСТ в обычном режиме от 6 до 10 процедур приводила к некоторым положительным результатам, но рандомизированные контролируемые исследования ограничены (Trollor, Sachdev, 1999; Supprian, 2004) (категория доказательств C, уровень рекомендаций 4).
Невозможно дать основанные на доказательствах рекомендации по возобновлению терапии антипсихотиками после перенесенного ЗНС, поскольку число методологически выдержанных исследований по этому вопросу невелико. Противоречие состоит в том, что возобновление терапии антипсихотиками после перенесенного ЗНС связано с высоким риском (до 30%) повторения ЗНС (Caroff, Mann, 1988; Pope et al., 1991; Strawn et al., 2007), однако большинство пациентов нуждаются в длительной антипсихотической терапии. В одной из публикаций излагаются некоторые общие правила по предупреждению повторного развития ЗНС (Strawn et al., 2007):
— сообщения о предшествующих эпизодах должны тщательно анализироваться;
— показания для назначения антипсихотика должны быть точно документированы;
— должны рассматриваться альтернативные варианты медикаментозной терапии;
— факторы риска (например, быстрая титрация дозы, использование очень высоких дозировок антипсихотика) должны быть сведены к минимуму;
— не менее двух недель должно пройти после выздоровления перед возобновлением нейролептической терапии любые антипсихотики должны назначаться в низких дозах с медленной титрацией после тестовой дозы;
— пациенты должны находиться под тщательным контролем для выявления ранних признаков ЗНС;
— пациент и члены его семьи должны дать информированное (письменное) согласие на возобновление антипсихотической терапии, в котором изложены преимущества возобновления терапии и риски развития нового эпизода ЗНС.
В одном обзоре (анализ литературы 1972-2011 гг.) утверждается, что клозапин может быть с осторожностью назначен повторно после ЗНС и нейтропении, но не после агранулоцитоза или миокардита (Manu et al., 2011). Однако это утверждение основано только на пяти клинических наблюдениях, и в них среднее время повторного введения клозапина после ЗНС составляло 8,5 недель (Manu et al., 2011). Описания клинических случаев (Mendhekar et al., 2002; Norgard, Stark, 2006) указывают, что антипсихотики могут быть назначены повторно после ЗНС. Основываясь на этих весьма ограниченных доказательствах (обзор клинических случаев см. Wells et al., 1988; Strawn et al., 2007) можно заключить, что осторожное возобновление антипсихотической терапии после ЗНС возможно (категория доказательств C3, уровень рекомендаций 4).
Судорожный синдром
У пациентов, страдающих шизофренией, повышен риск возникновения эпилептических судорог, которые усиливаются на фоне приёма антипсихотиков (Alper et al., 2007). Судорожный синдром встречается у 0,5-0,9 % больных, получающих нейролептики, при этом наибольший риск его развития связан приемом клозапина (около 3 %) и кумулятивным риском (около 10 %) после четырех лет лечения (Devinsky et al., 1991; Pacia, Devinsky, 1994; Buchanan, 1995).
Клиническое ведение больных с судорожным синдромом включает назначение бензодиазепинов и противосудорожных средств (например, фенитоина, леветирацетама, вальпроевой кислоты) и наблюдение за параметрами сердечно-сосудистой системы. Карбамазепин не следует назначать в комбинации с клозапином в связи с повышением риска развития нейтропении и агранулоцитоза. В целом при возникновении судорог рекомендуется снижать дозу или переходить с клозапина на другой антипсихотик, если его назначение не обусловлено строгими клиническими показаниями.
Ожирение, прибавка массы тела и метаболические параметры
Пациентов следует информировать о возможном наборе массы на фоне лечения антипсихотиками. Ведение больных шизофренией с избыточной массой тела, обусловленной приемом лекарственных средств, должно быть направлено на многофакторную патофизиологию этого феномена. Важными элементами, способствующими набору избыточной массы тела у психически больных, являются особенности их поведения и образа жизни. Врачу следует поощрять постепенное повышение физической активности пациентов в сочетании с пищевыми ограничениями с целью достижения отрицательного энергетического баланса (Ananth et al., 2004) (см. табл. 7 и таблицу рекомендаций 2).
Таблица 7. Терапевтические возможности ведения пациентов с метаболическими побочными эффектами антипсихотиков (категории доказательств представлены в тексте)
|
Побочный эффект |
Профилактика |
Лечение |
|
Увеличение массы тела |
• Выбор антипсихотиков с более низким риском увеличения массы тела |
|
|
Гиперлипидемия |
• Выбор антипсихотиков с низким риском возникновения гиперлипидемии • Скрининг факторов риска, определение уровня холестерина и триглицеридов |
• Психосоциальное вмешательство (программы контроля массы тела, диетические программы, поведенческая терапия) • Переход на применение другого антипсихотика с лучшим метаболическим профилем побочных эффектов |
|
Диабет |
• Скрининг факторов риска диабета, определение уровня глюкозы крови натощак, в некоторых случаях — определение уровня гликированного гемоглобина (НвА1с) • Выбор антипсихотиков с низким риском возникновения диабета |
• Психосоциальное вмешательство (программы контроля массы тела, диетические программы, поведенческая терапия) • Переход на применение другого антипсихотика с лучшим метаболическим профилем побочных эффектов • Направление к эндокринологу для назначения специального медикаментозного лечения диабета |
Психосоциальные вмешательства с целью снижения массы тела и улучшения метаболических параметров
Психосоциальные вмешательства могут обладать некоторым положительным эффектом и способствовать снижению массы тела у пациентов с шизофренией, хотя научные доказательства этого ограничены (Birt, 2003; Faulkneretal, 2007a, 2007b).
В рандомизированных клинических исследованиях изучалась существующая программа контроля лишней массы тела, модифицированная для пациентов с шизофренией. Она включает программу замены пищевых продуктов и использование пищевых добавок, а также коллективное обучение покупкам и приготовлению здоровой пищи. Согласно полученным результатам, такая программа может остановить набор лишнего веса или даже привести к его снижению у пациентов с шизофренией (Jean- Baptiste et al., 2007). Кроме того, в исследованиях поведенческой терапии и психообразовательных методов было показано, что эти методы могут приводить к снижению массы тела у пациентов с шизофренией, получавших антипсихотики (Mauri et al., 2006; Ganguli, 2007). В предыдущей версии руководства мы рассматривали исследования, в которых были получены данные в поддержку диетических ограничений (Heimberg et al., 1995), программ контроля массы тела (Menza et al., 2004; Centorrino et al., 2006) и поведенческих вмешательств (Umbricht et al., 2001; Littrell et al., 2003; Werneke et al., 2003). Мы упоминали исследования, в которых были получены негативные результаты (Wirshing et al., 2002), а также тот факт, что имеющихся доказательств недостаточно для формулировки четких рекомендаций (Falkai et al., 2006).
Итак, психологические вмешательства (программы контроля массы тела, диетические программы, поведенческая терапия) могут быть рекомендованы для лечения набора массы тела и метаболических нарушений у пациентов с шизофренией (категория доказательств C, уровень рекомендаций 4), однако на сегодняшний день отсутствуют доказательства их эффективности, полученные в исследованиях, отвечающих стандартам доказательной медицины. Тем не менее врачам следует поощрять участие пациентов, страдающих ожирением, в психологических программах, направленных на коррекцию питания, физическую нагрузку и самостоятельное наблюдение за результатами (категория доказательств C, уровень рекомендаций 4).
Фармакологические вмешательства, направленные на снижение массы тела
В руководстве PORT 2010 г. описаны три возможных типа фармакологического вмешательства при наборе массы тела, обусловленном приемом нейролептиков: 1) замена одного препарата другим; 2) назначение дополнительного препарата (см. ниже) до начала лечения антипсихотиками; 3) назначение дополнительного препарата (см. ниже) на фоне лечения антипсихотиками (Buchanan et al., 2010). Хотя некоторые стратегии кажутся многообещающими, доказательства их эффективности ограничены (Buchanan et al., 2010). Кроме того, каждая из этих стратегий может привести к ухудшению состояния пациента (Falkai et al., 2006).
Таблица рекомендаций II. Рекомендации, касающиеся психосоциального и фармакологического вмешательства при прибавке веса и других метаболических побочных эффектах, связанных с антипсихотической терапией
|
Вмешательство / препарат |
Категория доказательств’ |
Рекомендации1‘ |
|
Агонисты Н2-рецептора |
C |
4 |
|
Амантадин |
C |
4 |
|
Метформин |
D |
5 |
|
Орлистат |
F |
— |
|
Перевод на арипипразол |
A |
22 |
|
Перевод на зипрасидон |
B |
32 |
|
Психосоциальное вмешательство |
C |
41 |
|
Розаглитазон |
F |
— |
|
Розаглитазон + клозапин |
C |
4 |
|
Сибутрамин |
F |
— |
|
Сибутрамин + оланзапин |
C |
4 |
|
Топирамат |
C |
4 |
|
Топирамат + оланзапин |
B |
3 |
a Категория доказательств, где A — полный объем объективных данных по результатам контролируемых исследований (см. табл. 1).
b Количественная оценка безопасности — уровень рекомендаций, полученный на основе категории доказательств и дополнительных аспектов безопасности, переносимости и потенциального взаимодействия.
1 В связи с недостаточным количеством исследований категория доказательств для психосоциального вмешательства только С, однако его следует рекомендовать в связи с хорошей переносимостью.
2 Замена антипсихотиков несет риск утяжеления симптоматики и рецидива. Пожалуйста, обратитесь к тексту для получения информации о специфической стратегии замены препаратов.
Замена антипсихотиков
В ходе многоцентрового двойного слепого исследования 173 больных шизофренией с избыточной массой тела случайным образом переводились с оланзапина на арипипразол или продолжали прием оланзапина. Переход на арипипразол приводил к улучшению метаболических параметров и уменьшению массы тела (Newcomer et al., 2008). В другом рандомизированном исследовании при переводе больных с оланзапина, кветиапина или рисперидона на арипипразол (n = 89) отмечалось значительное снижение массы тела и улучшение метаболических параметров по сравнению с пациентами, продолжавшими принимать тот же самый нейролептик (n = 98) (Stroup et al., 2011). В коротких открытых исследованиях переход с различных антипсихотиков на арипипразол приводил к замедлению набора массы тела или к ее значительному снижению (Casey et al., 2003; Ganguli et al., 2011). Переход с оланзапина на кветиапин приводил к снижению среднего набора массы тела; переход с оланзапина/рисперидона на зипрасидон в открытых исследованиях также дал положительный результат (Weiden et al., 2003a; 2003b; Gupta et al., 2004). В длительном наблюдательном исследовании переход с оланзапина/рисперидона на зипрасидон сопровождался стойкими улучшениями параметров массы тела и метаболизма (Weiden et al., 2007) . Однако переход с АПП на зипрасидон не приводил к изменению каких-либо метаболических параметров (Weiden et al., 2008). Согласно результатам I фазы исследования CATIE, переход с оланзапина на любой другой антипсихотик приводил к прекращению набора массы тела или к ее снижению, а продолжение приема оланзапина сопровождалось увеличением массы тела (Rosenheck et al., 2009). Согласно данным обзора Cochrain, переход на антипсихотик с меньшим количеством метаболических побочных эффектов может приводить к улучшению значений этих параметров (Mukundan et al., 2010).
Согласно недавно опубликованным результатам, переход на арипипразол — это многообещающий подход к лечению ожирения, обусловленного приемом антипсихотиков (категория доказательств A, уровень рекомендаций 2). Переход на зипрасидон, возможно, обладает некоторыми преимуществами по сравнению с продолжением приема рисперидона /оланзапина, однако доказательства ограничены (категория доказательств В, уровень рекомендаций 3). До замены препарата следует учесть, что переход с одного антипсихотика на другой сопровождается риском ухудшения симптоматики, что наблюдалось, к примеру, в исследовании CATIE (Essock et al., 2006; Rosenheck et al., 2009).
Фармакологическая терапия ожирения
В популяции, не страдающей психическими заболеваниями, фармакологическая терапия ожирения рекомендуется исключительно в рамках комплексного плана лечения у пациентов с индексом массы тела (ИМТ) более 30 кг/м2, либо у пациентов с ИМТ более 27 кг/м2, у которых имеются факторы риска или заболевания, связанные с ожирением. У пациентов с шизофренией изучались различные препараты, действие которых направлено на уменьшение набора массы тела и улучшение метаболических параметров, однако в большинстве исследований положительных эффектов не наблюдалось.
Амантадин
Прием амантадина, агониста дофаминовых рецепторов, сопровождается риском обострения психоза (Ananth et al., 2004). Сообщалось о снижении массы тела после двух недель приема амантадина в открытом режиме у 10 больных, получавших АПП (Correa et al., 1987). Эффект снижения массы тела был также получен у 12 пациентов с прибавкой массы тела на фоне приема оланзапина. Эти пациенты получали 100-300 мг амантадина в день на протяжении 3-6 месяцев (Floris et al., 2001). В небольшом двойном слепом плацебо-контролируемом исследовании амантадин, принимавшийся одновременно с оланзапином, был более эффективен, чем плацебо, по влиянию на снижение массы тела (Graham et al., 2005). Данный результат подтвержден в ходе двойного слепого плацебо-контролируемого исследования, в котором приняли участие 60 пациентов с шизофренией, шизофреноформными или биполярными расстройствами. Тем не менее через 24 недели эффект не сохранялся (Deberdt et al., 2005).
Таким образом, имеются минимальные доказательства в поддержку того, что амантадин может снижать набор массы тела, обусловленный приемом антипсихотиков (категория доказательств C, уровень рекомендаций 4).
Антагонисты Н2-гистаминовых рецепторов
Механизм действия низатидина, блокатора периферических Н2-гистаминовых рецепторов, вероятно, основан на раннем появлении чувства сытости в связи с повышением уровня холецистокинина и снижением выработки соляной кислоты в желудке. Сообщалось, что данный препарат в дозе 300 мг в день приводит к снижению набора массы тела у пациентов, принимающих оланзапин (Sacchetti et al., 2000). В двойных слепых плацебо-контролируемых исследованиях продолжительностью 8 недель был подтвержден эффект низатидина по снижению массы тела у пациентов, получавших оланзапин; среднее снижение массы тела составило 1,0 кг (Atmaca et al., 2003). Кроме того, низатидин приводил к прекращению набора массы тела у пациентов, получавших кветиапин (Atmaca et al., 2004). Согласно результатам двойного слепого рандомизированного исследования, у пациентов, получавших оланзапин в дозах от 5 до 20 мг в день, отмечался значительно меньший набор массы тела после четырех недель дополнительного приема низатидина (300 мг, прием 2 раза в день), при этом серьезных различий со стороны нежелательных явлений не наблюдалось. Однако через 16 недель эффект уже не был статистически значимым (Cavaz- zoni et al., 2003). В рандомизированном открытом исследовании продолжительностью 16 недель у пациентов, получавших ранитидин (300-600 мг в день) одновременно с оланзапином, отмечался меньший набор массы тела (Lopez-Mato et al., 2003). В двойном слепом плацебо-контролируемом исследовании фамотидина не отмечалось существенных эффектов этого препарата (Poyurovsky et al., 2004).
Таким образом, имеются ограниченные доказательства в поддержку назначения антагонистов Н2-гистаминовых рецепторов в целях лечения ожирения, обусловленного приемом антипсихотиков (категория доказательств C, уровень рекомендаций 4).
Метформин
Метформин — это препарат для лечения сахарного диабета II типа, который повышает чувствительность к инсулину и, следовательно, может приводить к снижению массы тела у людей, не страдающих диабетом (Desilets et al., 2008; Buchanan et al., 2010). Комбинированный прием метформина и оланзапина в различных исследованиях был как более эффективен, так и менее эффективен, чем прием оланзапина и плацебо, по влиянию на прибавку массы тела и метаболические показатели (Baptista et al., 2006; 2007; Chen et al., 2008; Wu et al., 2008). Однако можно ожидать более высокой эффективности комбинации метформина и оланзапина у пациентов с первым эпизодом шизофрении, поскольку они более восприимчивы к побочным эффектам (Wu et al., 2008). В другом исследовании не отмечалось каких-либо эффектов метформина у пяти пациентов, проходящих длительный курс лечения галоперидолом, флуфеназином, трифтазином или рисперидоном (Baptista et al., 2001). Согласно результатам мета-анализа 12 исследований, прием метформина одновременно с оланзапином оказывал слабое или умеренное действие на набор массы тела и метаболические параметры (Praharaj et al., 2011). Прием метформина в комбинации с пероральным средством для снижения аппетита сибутрамином не оказывал эффекта на метаболические показатели по сравнению с плацебо, за исключением предотвращения повышения уровня триглицеридов (Baptista et al., 2008). В ходе рандомизированного открытого исследования сравнивались метаболические показатели у пациентов, получавших либо оланзапин в виде монотерапии, либо оланзапин в сочетании другими препаратами в одном из двух режимов (А: оланзапин + амантадин 200 мг в день, с возможным переходом на метформин в дозе 1000-1500 мг в день, а затем на зонисамид в дозе 100-400 мг в день; В: оланзапин + метформин в дозе 1000-1500 мг в день, с возможным переходом на амантадин в дозе 200 мг в день, а затем на зонисамид в дозе 100-400 мг в день) (Hoffmann et al., 2011). Наиболее благоприятные эффекты отмечались у пациентов, следующих режиму В. В двойном слепом плацебо-контролируемом исследовании продолжительностью 12 недель, проведенном у детей и подростков с шизофренией, не отмечалось положительного эффекта комбинации рисперидона и метформина (Arman et al., 2008). Назначение метформина одновременно с рисперидоном у одной пациентки 20 лет привело к ухудшению психотических симптомов («звучание мыслей») (Venkatasubramanian et al., 2010).
Таким образом, имеющиеся для метформина данные в отношении влияния на метаболические нарушения при антипсихотической терапии противоречивы; нельзя дать какие-либо убедительные рекомендации касательно назначения метформина в комбинации с антипсихотиками (категория доказательств D, уровень рекомендаций 5).
Орлистат
Орлистат — ингибитор липазы, предотвращает всасывание жиров в кишечнике, не влияя на аппетит. В двойном слепом плацебо-контролируемом исследовании продолжительностью 16 недель прием орлистата был в отношении влияния на метаболические нарушения при антипсихотической терапии противоречивы; нельзя дать какие-либо убедительные рекомендации касательно назначения метформина в комбинации с антипсихотиками (категория доказательств D, уровень рекомендаций 5).
В настоящее время недостаточно данных, позволяющих рекомендовать орлистат для снижения массы тела, вызванного антипсихотиками (категория доказательств F).
Росиглитазон
В небольшом двойном слепом плацебо-контролируемом исследовании продолжительностью 12 недель при приеме росиглитазона (средство для лечения диабета) в комбинации с оланзапином не наблюдалось эффекта влияния на метаболические показатели (Baptista et al., 2009). Однако в другом небольшом двойном слепом плацебо-контролируемом исследовании продолжительностью 8 недель при добавлении росиглитазона к клозапину отмечались положительное действие с точки зрения резистентности к инсулину и других метаболических параметров (Henderson et al., 2009). Имеются лишь минимальные доказательства того, что комбинация клозапина и росиглитазона может обладать положительными эффектами по отношению к метаболическим параметрам (категория доказательств C, уровень рекомендаций 4), однако данных недостаточно для того, чтобы сделать однозначные выводы (категория доказательств F).
Сибутрамин
Сибутрамин — препарат, одобренный для лечения ожирения, изучался в ходе двойных слепых плацебо-контролируемых исследований в комбинации с оланзапином (Henderson et al., 2005a) и клозапином (Henderson et al., 2007). В комбинации с оланзапином отмечалось снижение массы тела и улучшение метаболических параметров, в то время как в сочетании с клозапином положительных эффектов не наблюдалось (Henderson et al., 2005a, 2007; Barinas-Mitchell et al., 2006). Имеются некоторые доказательства того, что комбинация оланзапина и сибутрамина может обладать положительными эффектами в отношении метаболических показателей (категория доказательств C, уровень рекомендаций 4), однако имеющихся данных недостаточно, чтобы дать однозначные рекомендации (категория доказательств F). Следует учитывать, что сибутрамин может индуцировать психотические симптомы, поэтому его применение при шизофрении ограничено.
Топирамат
Противосудорожный препарат топирамат более эффективно, чем плацебо, приводил к снижению набора массы тела, обусловленного приемом антипсихотиков, и улучшению метаболических параметров в 12-недельном рандомизированном плацебо-контролируемом исследовании, в котором приняли участие 66 госпитализированных пациентов с шизофренией. Эффект зависел от дозы. У пациентов, получавших 200 мг топирамата в день, он был более выражен, чем у пациентов, получавших 100 мг в день (Ko et al., 2005). В другом двойном слепом плацебо-контролируемом исследовании топирамат по сравнению с плацебо способствовал контролю набора массы тела, связанного с приемом антипсихотиков (Afshar et al., 2009). В 12-недельном рандомизированном открытом исследовании, проведенном в параллельных группах у амбулаторных пациентов с шизофренией, топирамат снижал набор массы тела, вызванный оланзапином (Kim et al., 2006). Эти результаты были подтверждены в 12-недельном двойном слепом исследовании у больных с первым эпизодом шизофрении, ранее не получавших лечение. Топирамат в дозе 100 мг в день в комбинации с оланзапином значительно более эффективно улучшал метаболические параметры и снижал набор массы тела по сравнению с присоединением плацебо (Narula et al., 2010). Назначение топирамата в дополнение к клозапину не приводило к снижению массы тела в ходе двойного слепого плацебо-контролируемого исследования (Muscatello et al., 2011). В небольшом исследовании у пациентов, принимавших клозапин, отмечалось снижение массы тела после приема топирамата в дозе 125 мг/сут в течение более 5 месяцев (Dursun and Devarajan, 2000). Однако в другом 12-недельном рандомизированном исследовании не отмечалось различий между топираматом и плацебо с точки зрения этих параметров (Tiihonen et al., 2005). Таким образом, имеются некоторые доказательства в пользу того, что топирамат улучшает метаболические параметры и предотвращает набор массы тела, обусловленный антипсихотиками (категория доказательств C, уровень рекомендаций 4). Наиболее благоприятной представляется комбинация топирамата с оланзапином (категория доказательств В, уровень рекомендаций 3).
Другие препараты
Флуоксетин не был эффективен по сравнению с плацебо в снижении набора массы тела, вызванного приемом оланзапина (Poyurovsky et al., 2002; Bustillo et al., 2003), однако у пациентов, получавших флувоксамин, отмечалось предотвращение набора веса на фоне приема клозапина (Lu et al., 2004). У обоих селективных ингибиторов обратного захвата серотонина имеется высокий потенциал лекарственного взаимодействия с антипсихотическими средствами, поэтому они не могут быть рекомендованы для назначения по данным показаниям.
Общие аспекты
Прием таких препаратов, как фентермин, хлорфентермин, сибутрамин или фенилпропаноламин, у больных шизофренией не показан, поскольку данные лекарственные средства могут вызывать обострения психотических симптомов. Как отмечено в руководстве PORT за 2010 г. (Buchanan et al., 2010) и в обзоре научной группы по шизофрении (Faulkner et al., 2007a), нельзя дать какие-либо общие рекомендации по фармакологической терапии набора массы тела, вызванного приемом антипсихотиков. Кроме того, риск усиления психотической симптоматики после добавления одного или двух препаратов к текущей схеме лечения нейролептиками должен быть изучен в дополнительных исследованиях. Тем не менее переход с антипсихотиков, обладающих неблагоприятным метаболическим профилем, на препараты с лучшей переносимостью (арипипразол, зипрасидон) у больных с предрасположенностью к метаболическим нарушениям является обоснованной терапевтической альтернативой.
Несмотря на наличие лишь ограниченных доказательств в пользу значительного снижения массы тела при использовании программ по снижению массы тела (включающих когнитивно-поведенческую терапию), врачам следует поощрять пациентов с ожирением к участию в психологических программах, направленных на здоровое питание, повышение физической активности и самостоятельное отслеживание результатов (категория доказательств В, уровень рекомендаций 4).
Мониторинг метаболических побочных эффектов
Мониторинг метаболических побочных эффектов на фоне лечения антипсихотиками имеет особое значение. В совместной публикации Европейской психиатрической ассоциации, Европейского кардиологического общества и Европейской ассоциации по изучению диабета представлен алгоритм контроля риска сердечно-сосудистых заболеваний у пациентов с тяжелыми нарушениями психики (De Hert et al., 2007. Согласно этой публикации, до начала терапии нейролептиками нужно предпринять следующие шаги: оценить семейный анамнез сердечно-сосудистых и метаболических нарушений, анамнез курения, диетические привычки и физическую активность пациента с точки зрения факторов риска. Затем необходимо измерить артериальное давление, массу тела, окружность талии, рассчитать индекс массы тела. После этого следует собрать информацию об уровне глюкозы и липидов натощак, уровнях общего холестерина, липопротеинов низкой и высокой плотности, триглицеридов (De Hert et al., 2009). Измерения необходимо повторно провести на 6-й и 12-й неделях после начала лечения, а затем повторять ежегодно. Эта информация совпадает с рекомендациями Американской психиатрический и диабетической ассоциаций (APA/ADA), согласно которым перед началом и во время лечения антипсихотиками необходимо проводить мониторинг метаболических параметров до начала лечения, через 4, 8 и 12 недель, а затем один раз в год (APA, 2004). Врачам следует также поощрять пациентов вести письменные наблюдения за собственной массой тела. Особенно важно отслеживать любые изменения массы тела после смены препарата. Наличие у пациента психического заболевания не означает, что не нужно наблюдать за метаболическими осложнениями, риск которых у этой группы пациентов повышен (APA, 2004). Пациенты и их семьи/опекуны должны быть информированы о метаболическом синдроме и симптоматике сахарного диабета (Alberti et al., 2009). При необходимости смены препарата риски и возможные последствия метаболического синдрома и сахарного диабета необходимо взвешивать по сравнению с возможностью обострения психотических симптомов.
Другие побочные эффекты
Побочные эффекты со стороны сердечнососудистой системы (см. табл. 
Стратегии ведения ортостатической гипотензии включают снижение дозы антипсихотика или ее разделение на несколько приемов, а также переход на антипсихотик без антиадренергических эффектов. Пациентов, страдающих тяжелой постуральной гипертензией, следует предупреждать о том, что резкое вставание без поддержки может привести к падению и к переломам шейки бедра (особенно у пожилых пациентов) или другим последствиям. Постепенное увеличение дозы, начиная с самой низкой, и наблюдение за признаками ортостатической гипотензии позволяет свести к минимуму риск, связанный с этим побочным эффектом. Поддерживающие меры включают использование компрессионного белья, повышение потребления соли, а также избегание резких подъемов и использование опоры при подъеме. Тахикардию, связанную с антихолинергическими эффектами и не сопровождающуюся гипотензией, можно корректировать низкими дозами бета-блокаторов периферического действия, к примеру, атенолола (Miller, 2000).
Таблица 8. Терапевтические возможности ведения пациентов с сердечно-сосудистыми и гематологическими побочными эффектами антипсихотиков (категории доказательств представлены в основном тексте)
|
Побочный эффект |
Профилактика |
Лечение |
|
Ортостатическая гипотензия |
|
|
|
Удлинение интервала QTc |
|
|
|
Лейкопения |
|
|
Все антипсихотики могут с различной частотой вызывать дозозависимые побочные эффекты со стороны сердца. Среди АПП это прежде всего относится к трициклическим препаратам фенотиазинового ряда (хлорпромазин, прометазин,и особенно тиоридазин), а также к пимозиду. Среди АВП при применении сертиндола и зипрасидона отмечалось значительное удлинение интервала QT. Удлинение QTc (длительность интервала выше 450/470 (до 500) мс или увеличение более чем на 30-60 мс по сравнению с исходным) связано с повышением риска пируэтной желудочковой тахикардии и перехода к желудочковой фибрилляции (Glassman, Bigger, 2001; Roden, 2004; Sumic et al., 2007; Semple, Smyth, 2009; Nielsen et al., 2011). Если такой нежелательный эффект развивается на фоне лечения нейролептиком, препарат следует отменить и перевести пациента на препарат, прием которого сопровождается меньшим риском нарушения сердечной проводимости (Glassman, Bigger, 2001; Marder et al., 2004; Nielsen et al., 2011). Для большинства антипсихотиков выявлена дозозависимая связь с удлинением интервала QTc. Следует избегать комбинаций с препаратами, увеличивающими длительность интервала QTc (подробные списки этих препаратов приводятся в учебниках по терапии, а также на сайте http://www.qtdrugs.org/).
Клозапин связывают с риском миокардита у одного из 500-10000 пациентов. К типичным симптомам миокардита относятся боль в груди, сердцебиение, ухудшение общего состояния, лихорадка, симптомы перегрузки правой половины сердца, например, отеки или респираторный дистресс. В случаях, когда вероятен диагноз миокардита, клозапин следует немедленно отменить, а пациента направить к терапевту или кардиологу (Marder et al., 2004).
Гематологические побочные эффекты (см. табл. 9)
Агранулоцитоз является самым тяжелым побочным эффектом клозапина и некоторых АПП (например, хлорпротиксена). Но осложнение может развиться и на фоне приема других антипсихотиков. Снижение числа лейкоцитов до 2000/мм3 или числа нейтрофилов до 1000/мм3 свидетельствует о высоком риске агранулоцитоза; в таком случае следует немедленного отменить клозапин, ежедневно контролировать число лейкоцитов с дифференцированным подсчетом, вести наблюдение на предмет возможных признаков инфекции. В случае нарушений гранулопоэза можно рассмотреть вариант аспирации костного мозга и защитной изоляции. В дальнейшем при повышении числа лейкоцитов до 3000-3500/мм3 и числа нейтрофилов до более чем 1500/мм3, следует контролировать число лейкоцитов 2 раза в неделю до достижения их числа более 3500/мм3.
Таблица 9. Терапевтические возможности ведения пациентов с другими побочными эффектами антипсихотиков
|
Побочный эффект |
Профилактика |
Лечение |
|
Сухость во рту |
|
|
|
Сиалорея (слюнотечение) |
|
|
|
Сексуальная дисфункция |
|
|
|
Запор |
|
|
|
Задержка мочи |
• Выбор антипсихотиков с меньшими антихолинергическими эффектами |
|
Гиперпролактинемия и сексуальная дисфункция (см. табл. 9)
Если возникло подозрение на гиперпролактинемию, следует измерить уровень пролактина и установить причину (к примеру, исключить опухоль гипофиза), особенно если концентрация пролактина более чем в 5 раз превышает нормальную (Marder et al., 2004). Если гиперпролактинемия, вызванная приемом антипсихотика, сопровождается нарушениями менструального цикла и сексуальной дисфункцией, следует рассмотреть замену препарата на другой, с меньшим риском данного побочного эффекта. Если симптоматика исчезает, а уровень пролактина снижается, то можно обойтись без дополнительного эндокринологического обследования. Следует иметь в виду, что одним из важных долгосрочных последствий гиперпролактинемии является остеопороз (Holt, Peveler, 2011).
Переход с антипсихотика, способствующего повышению уровня пролактина (рисперидон, сульпирид), на антипсихотик, не обладающий данным эффектом (арипипразол, кветиапин, оланзапин), рекомендуется во многих исследованиях (Kim et al., 2002; Casey et al., 2003; Kaneda et al., 2004; Kinon et al., 2006; Lee et al., 2006; Potkin et al., 2006; Shim et al., 2007; Lu et al., 2008). Однако мы не нашли ни одного исследования, в котором бы изучался переход с амисульприда, повышающего уровень пролактина, на другие препараты. Смена антипсихотика при развитии гиперпролактинемии является адекватной стратегией (категория доказательств C, уровень рекомендаций 4), однако необходимо учитывать известные риски обострения и (или) ухудшения симптомов при переходе с одного препарата на другой. Другой вариант лечения — присоединение к антипсихотической терапии агониста дофаминовых рецепторов бромокриптина (Matsuoka et al., 1986; Bliesener et al., 2004; Miller, Sebastian, 2005; Lee et al., 2010) (категория доказательств C, уровень рекомендаций 4), хотя данному методу недостает доказательств, полученных в двойных слепых исследованиях. Следует также учитывать риск обострения психического заболевания. Доказательства эффективности агониста дофаминовых рецепторов каберголина ограничены данными одного исследования, проведенного у 19 пациентов (Cavallaro et al., 2004). В ходе одного рандомизированного перекрестного сравнения эффекты по снижению уровня пролактина растительного препарата «Отвар пиона и солодки» был не меньшим, чем эффект бромокриптина (Yuan et al., 2008).
Комбинация арипипразола с рисперидоном или кветиапином изучалась в многоцентровом двойном слепом плацебо-контролируемом исследовании продолжительностью 16 недель, в котором приняли участие 323 пациента с шизофренией или шизоаффективным расстройством. Комбинированное лечение не приводило к значительной редукции психопатологической симптоматики по сравнению с плацебо, однако хорошо переносилось, а в группе рисперидона отмечалось снижение уровня пролактина в крови (Kane et al., 2009a).
Авторы руководства PORT провели обзор различных методов лечения сексуальной дисфункции, обусловленной приемом антипсихотиков, и не выявили достаточного количества доказательств для формулирования каких-либо рекомендаций (Buchanan et al., 2010). Однако имеются минимальные (полученные в открытых или небольших двойных слепых клинических исследованиях) доказательства того, что препараты для лечения эректильной дисфункции (силденафил, варденафил) могут быть эффективны в лечении сексуальной дисфункции, обусловленной приемом антипсихотиков. Тем не менее данных в настоящее время недостаточно (Buchanan et al., 2010) (категория доказательств C, уровень рекомендаций 4).
Другие побочные эффекты (см. табл. 9)
Усиленное слюноотделение и слюнотечение относительно часто встречаются при приеме клозапина и, вероятнее всего, обусловлены снижением клиренса слюны из полости рта в результате затрудненного глотания, или, возможно, антагонистическим действием по отношению к М4-мускариновым рецепторам либо агонистическим — по отношению к альфа-адренергическим рецепторам (Rabinowitz et al., 2001). В целях лечения повышенного слюноотделения назначают пирензепин в дозе 25-50 мг/сут и, по возможности, снижают дозу клозапина.
Аллергические и дерматологические побочные эффекты, в том числе развитие фоточувствительности, возникают нечасто, в основном на фоне приема низкопотентных фенотиазиновых производных. Пациентам следует рекомендовать избегать чрезмерного воздействия солнечных лучей и пользоваться солнцезащитными средствами (Lehman et al., 2004).
Нежелательные эффекты со стороны печени (например, повышение уровня печеночных ферментов) могут возникать при приеме ряда антипсихотиков, хотя протекают они по большей части бессимптомно. Прямая гепатотоксичность или холестатическая желтуха развиваются крайне редко и связаны со низкопотентными препаратами фенотиазинового ряда (APA, 2004; Lehman et al., 2004).
В качестве побочных эффектов антипсихотиков также были описаны такие офтальмологические явления, как накопление пигмента в хрусталике и роговице, ретинопатии, отек роговицы, нарушения аккомодации, глаукома. В целях предотвращения пигментной ретинопатии, помутнения роговицы и катаракты пациенты, принимающие тиоридазин и хлорпромазин, должны регулярно проходить осмотр офтальмолога (приблизительно 1 раз в 2 года для пациентов, общий стаж лечения у которых превышает 10 лет). Рекомендуется, чтобы доза тиоридазина не превышала 800 мг/сут (Lehman et al., 2004). Поскольку у собак, получавших кветиапин, отмечалось развитие катаракты, психиатру следует спрашивать пациентов о состоянии их зрения «вдаль» и о четкости зрения, а также направлять пациента к офтальмологу ежегодно или 1 раз в 2 года (Marder et al., 2004).
Такие нарушения со стороны мочевыводящих путей, как задержка или недержание мочи, могут быть отчасти спровоцированы приемом антипсихотиков с выраженным антихолинергическим компонентом (например, фенотиазинов), а также препаратами с холинергическими эффектами. В случае острой задержки мочи назначается лечение низкими дозами карбахола.
В связи с адренергической и антихолинергической стимуляцией может возникать сухость слизистых полости рта и глаз, а также запоры; эти явления многократно описаны как побочные эффекты АПП. При симптомах сухости полости рта пациентам можно рекомендовать использовать жевательную резинку без сахара или специальные капли. Обычно пациенты страдают от этих эффектов со стороны вегетативной нервной системы в начале лечения антипсихотиками или сразу после смены препарата.
Пациентам, страдающим запорами, рекомендуется пить больше жидкости; в некоторых случаях хороший эффект оказывает прием лактулозы. Запор — частый побочный эффект (см. часть 1 данного руководства); в тяжелых случаях следует рассмотреть возможность замены нейролептика. Запоры должны быть вовремя диагностированы в целях предотвращения паралитической непроходимости, обструкции кишечника, уплотнения его содержимого, перфорации и других тяжелых осложнений (De Hert et al., 2010).
Заключение
В настоящем обновленном руководстве WFSBP по долгосрочному биологическому лечению шизофрении и контролю побочных эффектов обобщены данные доступных публикаций и представлены рекомендации, основанные на доказательствах.
Для практикующего психиатра огромное значение имеют сведения об эффективности различных антипсихотиков при их длительном применении, а также умение контролировать побочные эффекты этих препаратов. Большинству больных шизофренией требуется пожизненное лечение, а это означает, что стратегия должна быть направлена на достижение необходимого баланса между эффективностью, переносимостью и приверженностью терапии. Как АПП, так и АВП эффективно предотвращают обострения шизофрении. При этом АВП обладают рядом преимуществ с точки зрения профилактики обострений и ЭПС. Это может сделать некоторые АВП приоритетными при выборе препарата для проведения длительного лечения шизофрении.
Коррекция ЭПС (особенно поздней дискинезии) и нарушений метаболизма является важнейшей задачей. До появления АВП пациенты с шизофренией страдали от тяжелых неврологических нарушений, и никому не хотелось бы, чтобы эти времена вернулись. Однако никто не хочет и будущего, в котором молодые больные шизофренией страдают от ожирения, метаболического синдрома, сахарного диабета и коронарной недостаточности. Перед наукой будущего стоит задача решения этих проблем.
Антипсихотики с оптимальным соотношением эффективности и переносимости могут обладать преимуществами при долгосрочном лечении, однако в настоящее время недостаточно доказательств для того, чтобы сделать однозначные выводы. По-прежнему остается много вопросов, связанных с длительным лечением шизофрении, для однозначного ответа на которые недостаточно исследований, выполненных в соответствии с современной методологией. В последние годы опубликованы данные ряда важных клинических исследований, однако все они характеризуются определенными методологическими ограничениями. Тем не менее необходимо разрабатывать национальные и международные рекомендации, основанные на принципах доказательной медицины, а практикующим психиатрам следует регулярно повышать уровень своей информированности, обновлять свои знания и быть в курсе актуальных терапевтических стратегий, чтобы предоставлять пациентам наиболее качественное и современное лечение.
31.05.2022
Статьи
Видео-лекция подготовлена при поддержке Клиники неотложной психиатрии sch.clinic в Москве (режим работы: круглосуточно) +7 (495) 741-94-64
Перевод: Филиппов Д.С. Редакция и озвучка: Касьянов Е.Д.
Проект диагностического руководства МКБ-11 по шизофрении (обновите страницу, если не появляется):
Скачать (PDF, 614KB)
Презентация из видео (обновите страницу, если не появляется):
Скачать (PDF, 340KB)
Что такое шизофрения
Шизофрения — это психическое заболевание, при котором изменяются мышление и поведение, появляются галлюцинации и бред, а также апатия, безвольность, обедняются эмоции.
Некоторые психические особенности, свойственные здоровому человеку, пациент с шизофренией утрачивает частично или полностью. Например, он может осознавать, что нужно выполнить какое-то действие, но не может совершить необходимое для этого усилие. Такое состояние называют абулией — патологической утратой воли.
Абулию и другие симптомы шизофрении, связанные с потерей привычных способностей, называют негативными.
Человек, страдающий шизофренией, может целыми днями лежать в постели. Это следствие абулии — болезненного безволия
Постепенно абулия приводит к тому, что человек перестаёт следить за личной гигиеной (например, не чистит зубы) и порядком в доме
Другие особенности шизофрении, несвойственные здоровому человеку, пациент, напротив, приобретает. Их называют продуктивными, или позитивными, симптомами. «Продуктивный», «позитивный» в этом контексте означает «приобретённый», а не «хороший». К продуктивным симптомам шизофрении относят, например, галлюцинации.
Человек, который страдает шизофренией, может слышать голоса, приказывающие что-то сделать
Помимо негативных и продуктивных симптомов, болезнь приносит с собой когнитивные нарушения: пациенту становится трудно запоминать и анализировать информацию, концентрироваться на задаче.
В результате человек не может поддерживать привычную жизнь: становится замкнутым и апатичным или, напротив, навязчивым, агрессивным, теряет отношения с близкими и работу. Нередко у людей, страдающих шизофренией, появляются суицидальные мысли и намерения.
Чтобы не допустить негативного развития событий при шизофрении, важно как можно скорее обратиться за медицинской помощью.
Историческая справка
Впервые о шизофрении как отдельном заболевании заговорил русский психиатр Виктор Хрисанфович Кандинский. Правда, термин «шизофрения» тогда ещё не использовался, поэтому в своей работе «О псевдогаллюцинациях» (1890 год) Кандинский называет описываемое состояние идеофренией.
В. Х. Кандинский сам страдал шизофренией. В изучении болезни он опирался в том числе на самонаблюдение, например подробно описал псевдогаллюцинации.
Позже, в 1893 году, шизофрению как самостоятельную патологию выделил немецкий психиатр Эмиль Крепелин. Он тоже называл болезнь иначе — деменция прекокс (от лат. dementia praecox — «раннее слабоумие»).
Эмиль Крепелин создал классификацию психических заболеваний, а также разработал доступный метод психодиагностики, получивший название «счёт по Крепелину»
А привычное название болезни «шизофрения» (от греч. schizo — «расщепляю, раскалываю» и phren — «душа, разум») впервые использовал в своих работах швейцарский психиатр Эйген Блейлер в 1908 году.
Эйген Блейлер ввёл в научный обиход ныне привычные термины «шизофрения» и «аутизм». Фото: статья «Шизофрения» («Википедия»)
Паулина Анна Блейлер (на фото) — родная сестра Эйгена Блейлера — страдала шизофренией. Её болезнь повлияла на решение брата стать психиатром
Он описал болезнь и выделил её диагностические критерии — так называемые «четыре А»:
- Аффект: неадекватное проявление и восприятие эмоций, снижение их интенсивности, подавленность.
- Аутизм: замкнутость, отрыв от реальности.
- Ассоциации: нарушение ассоциативного мышления.
- Амбивалентность: сосуществование противоположных чувств (например, любви и ненависти), идей или решений.
Сейчас представления о шизофрении скорректированы, однако эти врачи заложили базу для понимания природы патологии.
Распространённость болезни
По данным клинических рекомендаций по лечению шизофрении у взрослых, которые подготовило Российское общество психиатров в 2021 году, в среднем на 100 тысяч человек приходится примерно 15 случаев шизофрении.
При этом в России, по сведениям за 2016 год, число впервые диагностированных случаев шизофрении составило 7,83 на 100 тысяч человек, а общая заболеваемость — более 321 случая на 100 тысяч человек, или 0,32% (данные за 2018 год).
Чем опасна шизофрения
Шизофрения приводит к существенному снижению качества жизни как самого пациента, страдающего от этой болезни, так и его близких.
Из-за развития негативных симптомов, как правило, сильно меняется личность. Например, прежде открытый и душевный человек становится холодным, эмоционально отстранённым, замыкается в себе. Его круг общения сужается, пропадает интерес к привычным любимым занятиям, учёбе или работе. Постепенно пациент с шизофренией может полностью утратить способность работать и обслуживать себя в быту.
Негативные симптомы шизофрении очень стойкие, могут сохраняться даже в период ремиссии и прогрессировать по мере развития болезни. Зачастую это приводит к инвалидности.
В 2016 году шизофрения стала причиной инвалидности в 240 случаях на 100 тысяч человек, причём в 89,4% случаев люди получили инвалидность I и II группы.
Продуктивные симптомы болезни могут привести к тому, что пациент с шизофренией причинит вред самому себе или окружающим. Например, слуховые галлюцинации (голоса в голове) и навязчивые идеи могут подтолкнуть такого человека к потенциально опасному поведению. Также при шизофрении люди могут отказываться от еды, что представляет угрозу их жизни.
Кроме того, в период обострения болезни и в фазе восстановления после острого эпизода пациентов, страдающих шизофренией, могут посещать суицидальные мысли и намерения: в среднем от 4 до 13% таких людей совершают суицид. Самоубийство — одна из ведущих причин преждевременной смерти людей с шизофренией.
Причиной смерти В. Х. Кандинского, одного из первых исследователей шизофрении, также стало самоубийство, совершённое в период после обострения болезни
При шизофрении нередко развиваются и сопутствующие соматические (телесные) заболевания. Например, риск развития сахарного диабета 2-го типа у пациентов с шизофренией составляет 11–23%, а у людей без шизофрении — 8,5%. Риск сердечно-сосудистых заболеваний при шизофрении также возрастает.
По описанным причинам продолжительность жизни людей, страдающих шизофренией, зачастую на 10–20 лет меньше, чем у людей без такого диагноза.
Почему и как развивается шизофрения
Несмотря на более чем вековую историю изучения шизофрении, её точные причины и механизм развития по-прежнему неизвестны.
Чтобы объяснить природу болезни, создано немало различных теорий. Они сходятся в одном: возникновение шизофрении связано с наследственностью. По результатам генеалогических и близнецовых исследований можно с уверенностью говорить о генетической природе шизофрении.
Учёными были определены следующие наследственные риски шизофрении:
- 41–65% — вероятность развития шизофрении у монозиготного близнеца человека, больного шизофренией;
- 27–46% — вероятность развития шизофрении у ребёнка, оба родителя которого больны шизофренией;
- 17% — вероятность развития шизофрении у гетерозиготного близнеца человека, больного шизофренией;
- 7–13% — вероятность развития шизофрении у ребёнка, один из родителей которого болен шизофренией;
- 9% — вероятность развития шизофрении у родных братьев или сестёр человека, больного шизофренией;
- 6% — вероятность развития шизофрении у одного из родителей ребёнка, больного шизофренией;
- 5% — вероятность развития шизофрении у внука человека с шизофренией;
- 4% — вероятность развития шизофрении у племянников человека, больного шизофренией;
- 3–8% — вероятность развития шизофрении у сводных братьев или сестёр человека, больного шизофренией;
- 2% — вероятность развития шизофрении у двоюродных братьев или сестёр, дядей или тёть человека, больного шизофренией.
Монозиготные близнецы генетически идентичны. Именно поэтому близнецовые исследования очень важны при изучении наследственных болезней
В то же время, по всей видимости, генетические мутации, вызывающие болезнь, сперва накапливаются у нескольких поколений семьи, прежде чем достичь критической величины, которая приводит к развитию шизофрении.
В американской семье Гэлвин 6 из 12 детей заболели шизофренией. Их история описана в книге Р. Колкера «Что-то не так с Гэлвинами».
Помимо наследственных, примерно в половине случаев к развитию патологии приводят случайные мутации, которых нет в геноме родителей человека, заболевшего шизофренией.
Шизофрению как генетическую патологию рассматривает дофаминовая (катехоламиновая) теория развития болезни. Она была сформулирована в связи с изучением антипсихотического действия, которое оказывают нейролептики .
В ходе исследований учёные обнаружили, что у людей, страдающих шизофренией, разные области мозга по-разному реагируют на дофамин. Так, в мезолимбической системе головного мозга чувствительность к дофамину превышает нормальную. Из-за этого у пациента развивается шизофренический психоз, например галлюцинации. А в мезокортикальной системе головного мозга чувствительность к дофамину, наоборот, снижена, что приводит к развитию негативных симптомов шизофрении (подавленность, апатия и другие). Такие изменения в реакции на дофамин, по-видимому, обусловлены генетическими мутациями.
У пациентов с шизофренией нарушается не только дофаминовая регуляция, но и реакция мозга на другие нейромедиаторы , или, как их иначе называют, нейротрансмиттеры: глутаминовую кислоту (глутамат), гамма-аминомасляную кислоту (ГАМК), серотонин, ацетилхолин. Поэтому в современной психиатрии дофаминовая теория выступает частью более широкой нейротрансмиттерной теории развития шизофрении.
Ещё одна теория развития шизофрении, которая рассматривается учёными, — аутоиммунная. Так, в крови пациентов с шизофренией повышена концентрация провоспалительных цитокинов — белков иммунной системы, которые вырабатываются при воспалении в организме. Это указывает на аутоиммунный воспалительный процесс в мозге таких людей. И действительно, у людей с шизофренией было выявлено повреждение некоторых структур мозга.
Кроме того, немаловажную роль в развитии шизофрении играет негативное влияние окружающей среды.
Нервно-психическая восприимчивость
Многофакторную модель развития болезни называют стресс-диатезной.
«Диатез» в медицине — это наследственная предрасположенность к какому-либо заболеванию.
Стресс-диатезная модель предполагает, что шизофрения развивается у генетически предрасположенных к ней людей (у людей с шизофреническим диатезом) под действием конкретного пускового события или переживания, которое выступает серьёзным стрессом для организма.
Внешние стрессогенные факторы
Учёные исследовали ряд факторов, которые потенциально могут быть связаны с развитием шизофрении.
Это, например, социальные (бедность, потеря работы или значимых отношений),
экологические стрессогенные факторы, а также употребление алкоголя и психоактивных веществ.
Тем не менее установить прямую причинно-следственную связь какого-то конкретного фактора с болезнью не удалось.
Факторы риска: что может спровоцировать развитие шизофрении
Некоторые факторы, хотя и не служат прямой причиной развития шизофрении, могут повышать риск её развития.
Факторы риска шизофрении:
- осложнения в период внутриутробного развития плода и во время родов: недостаточное питание матери в I и начале II триместра беременности; перенесённые матерью во время беременности инфекции (грипп, краснуха, токсоплазмоз, герпес); преждевременные роды; гипоксия плода;
- психологическая травма в раннем детском возрасте;
- проживание в городе;
- эмиграция;
- употребление каннабиноидов (марихуана).
Манифестация: как проявляется шизофрения
Манифестацией называют проявление выраженных симптомов болезни. Примерно в половине случаев патология манифестирует у людей в возрасте до 30 лет.
Пик заболеваемости шизофренией приходится на период 18–25 лет.
Ещё примерно у трети пациентов болезнь впервые проявилась, когда им было 31–45 лет. Оставшиеся 20% случаев шизофрении приходятся на детей, а также зрелых и пожилых людей.
Кроме того, возраст манифестации зависит от формы шизофрении. Например, гебефреническая (гебефренная) форма болезни обычно дебютирует в подростковом или юношеском возрасте.
Важно понимать, что манифестация шизофрении — неслучайное событие. Началу болезни всегда предшествует многолетний патологический процесс в головном мозге. Это подтверждается данными исследований, которые выявили уменьшение объёма мозга у людей, недавно заболевших шизофренией.
Классификация шизофрении
В Международной статистической классификации болезней и проблем, связанных со здоровьем, десятого пересмотра (МКБ-10) шизофрению классифицируют по клиническим формам, то есть набору симптомов, отличающих одну разновидность заболевания от другой.
По формам болезни:
- параноидная;
- гебефреническая (гебефренная);
- кататоническая;
- недифференцированная;
- простая;
- резидуальная.
Другая классификация шизофрении в МКБ-10 различает типы течения заболевания.
По типам течения болезни:
- первый психотический эпизод;
- эпизодическое течение;
- эпизодическое течение с нарастающим дефектом;
- непрерывное течение;
- малопрогредиентное течение (вялотекущая шизофрения).
Подтипы шизофрении
Международная статистическая классификация болезней и проблем, связанных со здоровьем, десятого пересмотра выделяет следующие подтипы шизофрении.
Коды по МКБ-10:
- F20.0 — параноидная шизофрения;
- F20.1 — гебефренная шизофрения;
- F20.2 — кататоническая шизофрения;
- F20.3 — недифференцированная шизофрения;
- F20.4 — постшизофреническая депрессия;
- F20.5 — резидуальная шизофрения;
- F20.6 — простая шизофрения;
- F20.8 — другие формы шизофрении;
- F20.9 — шизофрения неуточнённая.
Особые формы шизофрении
Специфика шизофрении состоит в том, что конкретные случаи заболевания могут сильно отличаться друг от друга по степени тяжести и выраженности симптомов. Поэтому не всегда болезнь можно чётко классифицировать по форме.
Одна из редких нетипичных форм болезни — фебрильная шизофрения. Это опасное для жизни состояние, при котором, помимо кататонических симптомов вроде ступора, также развивается лихорадка и отёк головного мозга.
Шизофрения: симптомы
Симптомы шизофрении многообразны, а их количество и выраженность зависят от стадии и формы болезни.
Стадии и формы шизофрении
Как правило, болезнь начинается с продромальной стадии, которая может продолжаться довольно долго — от нескольких недель до нескольких лет. В этот период болезнь проявляется неспецифическими симптомами, напоминающими признаки других психических расстройств, например депрессии.
Продромальные симптомы шизофрении:
- утрата интереса к работе, общественной деятельности;
- изменения в отношении к своей внешности (человек перестаёт следить за личной гигиеной, становится равнодушен к внешнему виду, опрятности одежды);
- когнитивные нарушения (например, трудности с концентрацией внимания);
- изменения моторики;
- тревога.
Следующая стадия болезни — активная. Она длится на протяжении 5 лет после манифестации шизофрении. Именно в этот период наиболее ярко проявляются специфические симптомы болезни. Какие именно признаки шизофрении проявятся на активной стадии, зависит от формы заболевания (параноидная, гебефреническая, кататоническая, недифференцированная, простая). Кроме того, переход болезни из активной формы в хроническую рассматривают как отдельную, резидуальную, форму шизофрении.
Симптомы параноидной шизофрении:
- галлюцинации. Человек может слышать голоса, которые угрожают ему или приказывают что-то сделать. Бывают и слуховые галлюцинации, когда пациент слышит не слова, а звуки. Также могут появляться обонятельные, вкусовые, осязательные галлюцинации (например, сексуальные или другие телесные ощущения);
- бред. Пациент, например, может жаловаться на то, что его преследуют, или верить в свою исключительность, величие;
- изменения эмоциональной сферы: «сглаженные» или неадекватные ситуации эмоции.
Симптомы гебефренической (гебефренной) шизофрении:
- изменения эмоциональной сферы: «сглаженные» или неадекватные ситуации эмоции;
- изменения поведения, например дурашливость;
- расстройства мышления, например разорванная речь.
Симптомы кататонической шизофрении:
- ступор: человек почти не двигается и не реагирует на раздражители, даже на боль;
- мутизм: пациент перестаёт разговаривать и отвечать на вопросы, несмотря на то что способность говорить не утрачена;
- нервное возбуждение;
- негативизм: человек с такой формой болезни сопротивляется просьбам, отказывается выполнять требуемые действия;
- ригидность: пациент утрачивает способность меняться и адаптироваться к ситуации;
- восковая гибкость: человек напоминает восковую фигуру — может долго сохранять ту позу, которую ему придали другие люди, например продолжает держать поднятыми руки;
- подчиняемость: пациент автоматически выполняет данные ему инструкции.
При недифференцированной шизофрении симптомов либо слишком мало, чтобы отнести их к какой-то из охарактеризованных выше форм болезни, либо, наоборот, так много, что они подпадают под описание разных форм шизофрении.
Простая шизофрения: признаки
- отчётливое изменение личности с началом болезни: утрата увлечений и интересов, бездеятельность, бесцельное или аутичное поведение (углубление в себя и избегание социальных контактов);
- постепенное появление и усиление негативных симптомов: апатии, обеднения речи, снижения активности, сглаживания эмоций, пассивности и безынициативности, утраты активной мимики и жестикулирования при разговоре;
- выраженное снижение продуктивности в учёбе или работе.
При простой форме шизофрении в течение года постепенно усиливаются симптомы всех трёх описанных групп.
Резидуальная (остаточная) форма шизофрении представляет собой переход болезни от активной стадии к хронической. При этом яркие психотические симптомы вроде галлюцинаций сменяются стойкими негативными симптомами.
Негативные симптомы резидуальной шизофрении:
- заторможенность,
- снижение активности,
- сглаженность эмоций,
- пассивность и безынициативность,
- бедность речи,
- утрата навыков самообслуживания,
- выпадение из социума.
Категории симптомов при шизофрении
Все симптомы шизофрении принято объединять в четыре основные группы.
Категории симптомов шизофрении:
- Негативные симптомы. В эту категорию включают признаки болезни, связанные с утратой качеств, свойственных здоровому человеку. Часто такие симптомы обозначают словами с греческой приставкой а-, обозначающей отсутствие чего-либо. Например, абулия — утрата воли, апатия — утрата интереса к жизни, безразличие.
- Продуктивные (позитивные) симптомы. К этой категории относят симптомы, которые несвойственны здоровому человеку, например бред, галлюцинации.
- Когнитивные симптомы. В эту категорию включают нарушения когнитивных функций — связанных с познанием мира, восприятием и обработкой информации. Например, человеку с шизофренией может стать трудно концентрироваться и запоминать новое.
- Поведенческие симптомы. К этой категории относят, например, несоблюдение пациентом личной гигиены, нарушение социальных норм, попытки суицида.
Фазы шизофрении
Течение шизофрении может быть непрерывным. В таком случае фазы болезни не выделяют. Однако чаще фаза обострения сменяется фазой ремиссии.
Обострение, или приступ, шизофрении сопровождается манифестацией или усилением продуктивных симптомов болезни: бреда, галлюцинаций, нарушений мышления. Очень часто при обострении заболевания появляется страх, тревога, возбуждение или, напротив, заторможенность. Кроме того, могут появляться суицидальные мысли, нередко человек предпринимает попытку самоубийства.
В фазу ремиссии происходит ослабление психопатологических симптомов.
Разновидности ремиссии при шизофрении:
- полная;
- неполная;
- спонтанная (происходит самостоятельно, независимо от фармакологической терапии);
- фармакозависимая (продолжается только до тех пор, пока проводится активное лечение).
Полная ремиссия отличается от неполной степенью изменения личности человека после перенесённого приступа. В первом случае личностные изменения неглубокие, человек начинает осознавать, что был болен, но теперь поправился. Во втором — изменения личности существенные, но не проявляются ярко и не влияют на поступки человека, позволяя ему сохранять социально приемлемое поведение: это личная проблема пациента, не представляющая опасности для окружающих.
В целом о ремиссии говорят, когда за 6 месяцев психотические симптомы у пациента не проявились ни разу или проявились в лёгкой степени.
Психотические симптомы, которые полностью отсутствуют или слабо выражены в период ремиссии:
- бред;
- необычное содержание мыслей;
- галлюцинации;
- концептуальная (понятийная) дезорганизация — нарушение последовательного потока мыслей;
- манерность и позирование;
- притуплённый аффект — выражение эмоций значительно слабее, чем должно быть в норме;
- пассивно-апатическая социальная отгороженность — проявление меньшего, чем обычно, интереса к общению с людьми;
- нарушение спонтанности и плавности речи.
Шизофрения у детей
Ни международный классификатор (МКБ-10), ни руководства отдельных стран (DSM-5 ) не рассматривают шизофрению у детей и подростков отдельно от шизофрении у взрослых.
Симптомы и фазы болезни у детей и у взрослых одинаковы, поэтому в России шизофрению у детей обозначают кодом F20.8xx3, что соответствует общему разделу F20.8 в МКБ-10 («Другие формы шизофрении»).
Также как шизофрению рассматривают случаи психического расстройства, которые развиваются в раннем детстве и сопровождаются выраженным олигофреноподобным дефектом, то есть серьёзной задержкой психического развития.
Кроме того, одна из «взрослых» форм шизофрении — гебефреническая, или гебефренная, — обычно впервые проявляется в подростковом возрасте.
Диагностика шизофрении
Диагностика и лечение шизофрении проводится врачом-психиатром.
Когда следует обратиться к врачу
Очень важно обратиться к врачу как можно раньше — при появлении первых тревожных изменений в поведении.
В европейских странах ранний подход к лечению шизофрении строится на том, чтобы выявить болезнь ещё на продромальной стадии и начать лечение до первого психотического эпизода. Это позволит предотвратить последующие обострения болезни и улучшить качество жизни человека.
Однако превентивный подход работает далеко не всегда: чаще диагноз выставляется уже после того, как проявились социально опасные симптомы болезни или случился первый психотический эпизод.
Как подготовиться к посещению психиатра
Специальная подготовка к посещению психиатра не нужна. Однако самому человеку и его близким полезно предварительно восстановить в памяти обстоятельства, связанные с проявлением необычных симптомов. Это важно для того, чтобы врач смог собрать подробный анамнез.
Как определить по поведению, что человек болен шизофренией
Проявления шизофрении многообразны, зависят от разновидности и фазы болезни и могут напоминать симптомы других психических и соматических патологий. Поэтому определить по поведению, что человек болен шизофренией, вряд ли получится.
Диагностировать шизофрению может только врач-психиатр после тщательного обследования и на основании результатов проведённой ранее дифференциальной диагностики.
Дифференциальная диагностика
Дифференциальной диагностикой называют лабораторные и инструментальные исследования, которые проводят при подозрении на шизофрению, чтобы исключить соматические (телесные) причины необычного поведения пациента.
Поведение, напоминающее шизофрению, могут вызвать повреждения мозга, эндокринные заболевания, эпилепсия или психоактивные вещества и алкоголь.
Врач может порекомендовать сдать общий и биохимический анализ крови, тест для оценки липидного обмена, пройти исследование уровня тиреотропного гормона (ТТГ) и общий анализ мочи. Это позволит подтвердить или исключить соматические патологии, которые могут проявляться похожими на шизофрению симптомами или повлиять на эффективность лечения в дальнейшем.
3.9.1. Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) 1 день

28.558. Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) 1 день

27.3. Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) 1 день

2.5. Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) 1 день

9.1. 
1 день

Также психоз может развиваться на фоне передозировки или отмены психоактивных веществ и алкоголя, дефицита тиамина (витамина B1). Чтобы исключить подобные причины изменения поведения, назначают лабораторные исследования.
1.91.1 
Кач. 6 дней

50.2.2144. Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) Колич. 5 дней

4.18. Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) Колич. 7 дней

Кроме того, могут посоветовать пройти следующие инструментальные исследования:
- электрокардиограмму,
- холтеровское мониторирование сердечного ритма,
- электроэнцефалограмму,
- эхоэнцефалограмму,
- магнитно-резонансную томографию головного мозга.
Диагностическая беседа
Шизофрению нельзя определить по данным лабораторных или инструментальных исследований: специфических изменений значимых показателей при этой болезни не происходит. Главный диагностический инструмент при выявлении шизофрении — беседа. Врач-психиатр собирает анамнез, причём общается не только с человеком, у которого подозревают шизофрению, но и с его родственниками. Полученные сведения нельзя считать вполне достоверными из-за их субъективности, но они помогают врачу полнее оценить состояние человека.
Важно понимать, что постановка диагноза «шизофрения» не происходит произвольно: в соответствии с МКБ-10 разработаны чёткие критерии для выявления каждой из форм шизофрении.
Критерии для диагностики параноидной, гебефренической, кататонической и недифференцированной шизофрении
На протяжении месяца или дольше отмечается как минимум один признак первой группы или два признака второй группы:
Первая группа признаков:
- «эхо» мысли, вкладывание или отнятие мыслей — человеку кажется, что мысли в его голове повторяются эхом или что кто-то посторонний вкладывает ему в голову мысли и управляет ими;
- бред воздействия — человеку кажется, что его действия, движения его тела управляются кем-то извне и происходят по чужой воле;
- слуховые галлюцинации — чаще всего представляют собой голоса в голове, которые комментируют действия человека или обсуждают его;
- стойкие бредовые идеи — человек считает, что он влиятельная фигура, может отождествлять себя с уже умершими знаменитостями вроде Наполеона или приписывать себе необыкновенные способности, например умение общаться с инопланетным разумом.
Вторая группа признаков:
- хронические ежедневные галлюцинации в сочетании с бредом;
- изменения речи: неологизмы, разорванная или бессмысленная речь;
- кататоническое поведение: возбуждение, застывание, восковая гибкость, негативизм, мутизм и ступор;
- негативные симптомы: апатия, бедность речи, сглаженность эмоций (не вызванные депрессией или приёмом нейролептиков).
Мартобрь — несуществующий месяц года, упомянутый героем повести «Записки сумасшедшего» Н. В. Гоголя. Это яркий пример шизофренического неологизма.
Дополнительно для параноидной шизофрении должны быть ярко выраженными бред и галлюцинации, для гебефренической — изменения эмоциональной сферы и разорванность речи, для кататонической — ступор, мутизм, возбуждение, застывание, негативизм, ригидность, восковая гибкость, автоматическая подчиняемость.
При недифференцированной шизофрении должны наблюдаться общие диагностические признаки шизофрении. Однако дополнительных симптомов либо слишком мало, либо слишком много, что не позволяет отнести состояние к какой-то конкретной форме.
О постшизофренической депрессии говорят, если в течение последних 12 месяцев у пациента наблюдались общие для всех форм шизофрении симптомы, однако на момент диагностики они больше не проявляются. Тем не менее у человека длительное время сохраняются симптомы депрессии.
При резидуальной шизофрении на момент диагностики также больше не проявляются общие симптомы шизофрении, однако в течение предшествующего года отмечались как минимум четыре негативных симптома из списка.
Негативные симптомы резидуальной шизофрении:
- психомоторная заторможенность, снижение активности;
- выраженная сглаженность эмоций;
- пассивность и безынициативность;
- оскудение речи;
- бедная мимика, жестикуляция, однообразные интонации голоса;
- невовлечённость в социальное взаимодействие, равнодушие к уходу за собой.
При простой шизофрении описанные выше три основных признака болезни (изменение личности человека, негативные симптомы, снижение продуктивности в социуме) медленно прогрессируют в течение как минимум года.
Диагностические тесты и шкалы
Для постановки диагноза шизофрении какие-либо тесты не используются: врач делает вывод о заболевании на основании анамнеза и проведения диагностической беседы.
Однако для оценки степени выраженности отдельных симптомов и личностных изменений при шизофрении психиатр может пользоваться специально разработанными шкалами.
Некоторые диагностические шкалы, которые используют психиатры:
- шкала оценки позитивных и негативных симптомов (PANSS — Positive and Negative Syndrome Scale);
- шкала депрессии Калгари у больных шизофренией (Calgary depression schizophrenia scale);
- шкала краткой оценки негативных симптомов (BNSS — Brief Negative Symptom Scale).
Лечение шизофрении
Лечение шизофрении, как правило, осуществляется добровольно: пациент даёт своё письменное согласие, чтобы начать терапию. Если пациент — ребёнок до 15 лет, то учитывается согласие на лечение, данное родственниками (законными представителями) ребёнка. Недобровольное лечение может проводиться только по решению суда в установленном законом порядке.
Фармакологическая терапия
Терапия первого выбора при диагностированной шизофрении — это антипсихотические лекарственные средства, или, как их ещё называют, нейролептики. Такие препараты помогают не только смягчить острые симптомы во время обострения шизофрении, но и предотвратить рецидивы болезни.
Различают нейролептики первого и второго поколения. Конкретный препарат подбирает врач в зависимости от выраженности симптомов болезни.
К сожалению, антипсихотические препараты могут оказывать серьёзное побочное действие на организм. Поэтому при подборе препарата для лечения шизофрении врач также учитывает общее состояние здоровья человека, чтобы взвесить пользу и риски от лечения.
Возможное побочное действие нейролептиков:
- экстрапирамидные симптомы: двигательные нарушения, например тремор рук;
- злокачественный нейролептический синдром: комплекс неврологических, психических и соматических нарушений, например скованность мышц в сочетании с лихорадкой;
- заторможенность, сонливость, замедление реакции и психических процессов;
- метаболический синдром: нарушение обмена жиров и углеводов, а также повышенное артериальное давление.
Чтобы не допустить возникновения побочных эффектов нейролептиков или минимизировать их, врач тщательно подбирает препарат для лечения и постепенно увеличивает дозу нейролептика.
В подборе подходящего препарата могут помочь генетические исследования крови. Такие тесты позволяют сократить время подбора препарата и дозировки до минимума благодаря индивидуально рассчитанному риску проявления побочных эффектов.
GNP227 Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) 30 дней

GNP228 Вен. кровь (+230 ₽) 
Вен. кровь (+230 ₽) 30 дней

Нелекарственные методы лечения
Также шизофрению могут лечить такими методами, как электросудорожная терапия, плазмаферез (лечение собственной плазмой крови), транскраниальная магнитная стимуляция, лазеротерапия (лечение лазерным излучением малой интенсивности). Нет данных, что они эффективнее, чем нейролептики. Однако нелекарственные методы лечения могут применяться при терапевтически резистентной шизофрении .
Электросудорожная терапия — метод лечения, когда через мозг человека, находящегося под общим наркозом, пропускают электрический ток
Транскраниальная магнитная стимуляция — метод стимуляции коры головного мозга с помощью коротких магнитных импульсов
Реабилитация и поддерживающие групповые занятия
Задача реабилитационных мероприятий — помочь пациенту с шизофренией восстановить утраченные социальные навыки и таким образом повысить качество жизни. Для этого проводят разного рода тренинги, краткосрочные курсы психотерапии (например, семейной терапии) и организуют программы по трудоустройству людей, страдающих шизофренией.
Как вести себя с больным шизофренией
Поддержка семьи и близких очень важна. Родственникам и друзьям пациента с таким диагнозом полезно знать, что это за расстройство и как действовать при проявлении симптомов болезни. Поэтому для обучения близких пациента при психиатрических больницах и других медицинских учреждениях организуют психообразовательные группы. Занятия в таких группах проводит врач-психиатр или клинический психолог. Как правило, образовательный курс состоит из 11–15 занятий по 45–60 минут каждое.
Помощь родных позволяет добиться значительного прогресса в лечении: снизить выраженность симптомов шизофрении и частоту рецидивов болезни.
В то же время членам семьи пациента с шизофренией важно помнить, что его не следует опекать чрезмерно. Так, для человека с шизофренией полезно, чтобы за ним сохранились привычные ему домашние обязанности, например уборка, приготовление еды или оплата счетов.
Прогноз при шизофрении
Поскольку степень выраженности психотических симптомов значительно различается у конкретных пациентов, предсказать, как будет протекать шизофрения, сложно.
Есть мнение, что прогноз лучше у женщин, а также у тех пациентов, у которых заболевание манифестировало в более позднем возрасте и началось остро, с продуктивными симптомами вроде галлюцинаций.
В то же время однозначной причинной связи между спецификой течения болезни и её исходом установить нельзя. Большое внимание уделяется профилактике самоубийств.
Профилактика шизофрении
Специфической профилактики шизофрении не существует. Стоит учитывать, что риск заболеть выше у тех, чьи родственники страдали от шизофрении. Однако наследственная предрасположенность ещё не означает, что человек непременно заболеет: считается, что к развитию заболевания приводит сочетание биологических (генетические мутации) и психосоциальных (например, острый стресс) факторов. Также известно, что употребление психоактивных веществ и алкоголя повышает риск развития болезни, поэтому в качестве меры профилактики можно назвать отказ от употребления веществ с психотропным действием и чрезмерного употребления алкоголя.
Источники
- Салокангас Р. Шизофрения / АЛГОМ. 2022.
- Шизофрения (возрастная категория: взрослые) : клинические рекомендации / Российское общество психиатров. 2021.
- Шизофрения (возрастная категория: дети) : клинические рекомендации / Российское общество психиатров. 2021.