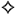1 таблетка содержит 80 мг или 160 мг валсартана;
вспомогательные вещества:
САРТВАЛ 80 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172).
САРТВАЛ 160 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172), железа оксид черный (Е172).
Антагонисты рецепторов ангиотензина II.
Код АТХ: С09СА03.
— Артериальная гипертензия у взрослых и детей от 6 до 18 лет (см. разделы «Противопоказания», «Меры предосторожности», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Фармакодинамика»).
— Сердечная недостаточность: лечение сердечной недостаточности с клинической симптоматикой у взрослых пациентов, не получающих ингибиторы ангиотензинпревращающего фермента (иАПФ), или в качестве дополнительной терапии к иАПФ у пациентов, не получающих бета-блокаторы, если нельзя использовать антагонисты минералокортикоидных рецепторов (см. разделы «Способ применения и дозы», «Меры предосторожности», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Фармакодинамика»).
— Недавно перенесенный инфаркт миокарда (у клинически стабильных взрослых пациентов с клиническими проявлениями сердечной недостаточности или бессимптомной систолической дисфункцией левого желудочка после перенесенного (12 часов – 10 дней) инфаркта миокарда).
— Повышенная чувствительность к валсартану или к любому из компонентов препарата.
— Беременность.
— Тяжелая печеночная недостаточность, билиарный цирроз печени и обструкция желчных путей.
— Одновременное применение иАПФ или блокаторов (антагонистов) рецепторов ангиотензина II (БРА) с препаратами, содержащими алискирен, у пациентов с сахарным диабетом или умеренной/тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Способ применения
САРТВАЛ принимают внутрь независимо от приема пищи, запивая водой.
Риска способствует разламыванию для облегчения глотания и не обеспечивает деления таблетки 80 мг и 160 мг на две равные дозы.
Артериальная гипертензия
Рекомендуемая стартовая доза препарата САРТВАЛ для взрослых составляет 80 мг или 160 мг один раз в сутки. Антигипертензивный эффект достигается в течение двух недель, а максимальный эффект наступает через четыре недели. Пациентам, у которых не удается достичь адекватного снижения артериального давления, суточную дозу можно повысить до 160 мг, или, максимально, до 320 мг; возможно дополнительное назначение диуретиков.
САРТВАЛ можно назначать также совместно с другими антигипертензивными средствами (см. разделы «Противопоказания», «Меры предосторожности», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Фармакодинамика»).
Сердечная недостаточность
Рекомендуемая начальная доза САРТВАЛа составляет 40 мг два раза в сутки. Повышение дозы до 80 мг и 160 мг два раза в сутки должно осуществляться с интервалом не менее 2 недель, с учетом переносимости препарата пациентом. Максимальная суточная доза, которая применялась в клинических исследованиях, составила 320 мг, распределенная на несколько приемов. При сопутствующем лечении диуретиком следует рассмотреть вопрос о снижении дозы последнего.
Поскольку наличие риски не обеспечивает возможность деления таблетки 80 мг на две равные части, данная лекарственная форма не может обеспечить дозировку 40 мг. При необходимости назначения валсартана в дозе 40 мг следует воспользоваться лекарственным средством, которое обеспечивает требуемую разовую дозу.
САРТВАЛ может назначаться совместно с другими лекарственными средствами, применяемыми для лечения сердечной недостаточности. Не рекомендуется одновременный прием тройной комбинации иАПФ, валсартана и бета-блокатора или калийсберегающего диуретика (см. разделы «Меры предосторожности», «Фармакодинамика»).
Оценка состояния пациентов с сердечной недостаточностью всегда должна включать мониторинг функции почек.
Постинфарктное состояние
У клинически стабильных пациентов лечение можно начать уже через 12 часов после инфаркта миокарда. После начальной дозы 20 мг два раза в сутки дозу валсартана необходимо увеличивать до 40 мг, 80 мг и 160 мг два раза в сутки в течение следующих нескольких недель.
Данная лекарственная форма не может обеспечить дозировку 20 мг. При необходимости назначения валсартана в дозе 20 мг необходимо воспользоваться лекарственным средством, которое обеспечивает требуемую разовую дозу. Максимальная доза – 160 мг два раза в сутки. В целом рекомендуется, чтобы доза 80 мг два раза в сутки достигалась в течение двух недель после начала лечения, а целевая максимальная доза – в течение трех месяцев, исходя из переносимости пациентом валсартана в период титрования дозы. Если возникает симптоматическая артериальная гипотензия или почечная дисфункция, следует рассмотреть вопрос о снижении дозы.
Валсартан можно назначать пациентам, которые лечились другими препаратами, рекомендованными после инфаркта миокарда (например, тромболитиками, ацетилсалициловой кислотой, бета-блокаторами и статинами). Не рекомендуется одновременный прием тройной комбинации иАПФ, бета-блокаторов и валсартана.
Оценка состояния пациентов после инфаркта миокарда всегда должна включать мониторинг функции почек.
САРТВАЛ может применяться для лечения гипертензии у пациентов с нарушенной толерантностью к глюкозе и риском сердечно-сосудистой недостаточности. Рекомендации по дозированию см. в разделе «Артериальная гипертензия».
Препарат можно принимать независимо от приема пищи, запивая небольшим количеством воды.
Отдельные группы пациентов
Артериальная гипертензия у детей и подростков
Дети от 6 до 18 лет
Для детей c массой тела менее 35 кг начальная доза составляет 40 мг один раз в день.
Поскольку наличие риски не обеспечивает возможность деления таблетки 80 мг на две равные части, данная лекарственная форма не может обеспечить дозировку 40 мг. При необходимости назначения валсартана в дозе 40 мг следует воспользоваться лекарственным средством, которое обеспечивает требуемую разовую дозу.
Для детей с массой тела 35 кг и более начальная доза составляет 80 мг один раз в день. Дозу следует корректировать в зависимости от действия на артериальное давление. Максимальные дозы, изученные в клинических испытаниях, приведены в таблице ниже. Дозы, превышающие указанные, не были изучены и поэтому не рекомендуются.
| Масса тела | Максимальные дозы, изученные в клинических испытаниях |
| ≥ 18 кг … < 35 кг | 80 мг |
| ≥ 35 кг … < 80 кг | 160 мг |
| ≥ 80 кг … ≤ 160 кг | 320 мг |
Дети до 6 лет
Безопасность и эффективность препарата САРТВАЛ у детей младше 6 лет не установлена.
Сердечная недостаточность и недавно перенесенный инфаркт миокарда у детей и подростков
САРТВАЛ не рекомендуется для лечения сердечной недостаточности или недавно перенесенного инфаркта миокарда у детей и подростков в возрасте до 18 лет в связи с отсутствием данных о безопасности и эффективности.
Пациенты пожилого возраста
Нет необходимости в коррекции дозы у пациентов пожилого возраста.
Пациенты с нарушением функции почек
Дети от 6 до 18 лет
Применение у детей с клиренсом креатинина <30 мл/мин или находящихся на диализе не изучалось, поэтому таким пациентам валсартан не рекомендуется. Не требуется коррекции дозы у детей с клиренсом креатинина более 30 мл/мин. Следует тщательно контролировать функцию почек и уровень калия в сыворотке крови (см. разделы «Меры предосторожности» и «Фармакокинетика»).
Взрослые
Нет необходимости коррекции дозы у взрослых пациентов с клиренсом креатинина более 10 мл/мин.
Пациенты с нарушением функции печени
Валсартан противопоказан пациентам с тяжелой печеночной недостаточностью, билиарным циррозом печени или обструкцией желчных путей. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза доза валсартана не должна превышать 80 мг (см. раздел «Меры предосторожности»).
Частота возникновения побочных реакций оценивается следующим образом: очень часто ≥ 1/10, часто – от ≥ 1/100, <1/10, нечасто — от ≥ 1/1000, < 1/100, редко — от ≥ 1/10000, <1/1000, очень редко — < 1/10000.
Со стороны крови и лимфатической системы: частота неизвестна – *снижение гемоглобина, *снижение гематокрита, *нейтропения, *#тромбоцитопения.
Со стороны иммунной системы: частота неизвестна – *#реакции гиперчувствительности, включая сывороточную болезнь.
Нарушение обмена веществ: частота неизвестна – *#увеличение содержания калия в крови, *#гипонатриемия; нечасто — #гиперкалиемия.
Нарушения со стороны нервной системы: часто – #головокружение, #постуральное головокружение; нечасто – #обмороки, #головная боль.
Со стороны органов слуха: нечасто – *#вертиго.
Со стороны сердечно-сосудистой системы: частота неизвестна – *#васкулит, часто — #ортостатическая гипотензия, #гипотензия; нечасто – #сердечная недостаточность.
Со стороны дыхательной системы: нечасто – *#кашель.
Со стороны пищеварительной системы: нечасто – *боль в животе, #диарея, #тошнота.
Со стороны гепатобилиарной системы: частота неизвестна – #повышение уровня печеночных ферментов, *повышение уровня печеночных ферментов, включая повышение уровня билирубина в крови.
Со стороны кожи и подкожно-жировой клетчатки: частота неизвестна – *ангионевротический отек, *#буллезный дерматит, *#сыпь, *#зуд; нечасто – #ангионевротический отек.
Со стороны скелетно-мышечной системы: частота неизвестна – *#миалгия.
Со стороны мочеполовой системы: частота неизвестна — *нарушение функции почек, *почечная недостаточность, *повышение уровня креатинина в сыворотке крови, #увеличение содержания мочевины крови; часто – #нарушение функции почек, #почечная недостаточность, нечасто – #острая почечная недостаточность, #повышение уровня креатинина в крови.
Общие нарушения: нечасто – *#слабость; #астения.
Следующие побочные эффекты наблюдались в ходе клинических исследований независимо от их причинной связи с исследуемым препаратом: *#артралгия, #абдоминальная боль, *астения, *#боль в спине, *диарея, *головокружение, *головная боль, *#бессонница, *#снижение либидо, #нейтропения, *тошнота, *#отеки, *#фарингит, *#ринит, *#синусит, *#инфекции верхних дыхательных путей, *#вирусные инфекции.
Примечание
Сообщалось при: *гипертензии; #сердечной недостаточности и/или постинфарктном состоянии.
Педиатрические пациенты (гипертензия)
Антигипертензивный эффект валсартана оценивался в двух рандомизированных, двойных слепых клинических исследованиях у 561 детей от 6 до 18 лет. Не было выявлено значимых отличий по типу, частоте и тяжести побочных эффектов между профилем безопасности для детей в возрасте от 6 до 18 лет и ранее известным профилем безопасности у взрослых пациентов.
Оценка нейрокогнитивной функции и развития у детей в возрасте от 6 до 16 лет не выявила клинически значимого отрицательного влияния после лечения САРТВАЛом продолжительностью до одного года.
В двойном слепом рандомизированном исследовании у 90 детей в возрасте от 1 года до 6 лет, за которым последовало открытое продление на один год, два человека умерли и наблюдалось отдельные случаи выраженного повышения печеночных трансаминаз. Во втором исследовании, в котором были рандомизированы 75 детей в возрасте от 1 года до 6 лет, не было ни одного случая смерти и отмечался один случай выраженного повышения печеночных трансаминаз в течение открытого продления на один год. Эти случаи имели место в популяции пациентов со значительными сопутствующими заболеваниями. Не было установлено причинно-следственной связи с приемом САРТВАЛа.
У детей в возрасте от 6 до 18 лет с хроническими заболеваниями почек наблюдалась гиперкалиемия.
Вследствие передозировки САРТВАЛа может развиться выраженная артериальная гипотензия, что может привести к угнетению сознания, коллапсу и/или шоку. Если препарат был принят недавно, следует вызвать рвоту. При артериальной гипотензии обычным методом терапии является внутривенное введение солевого раствора.
Выведение валсартана из организма путем гемодиализа маловероятно.
Как и другие препараты, напрямую воздействующие на ренин-ангиотензин-альдостероновую систему (РААС), САРТВАЛ нельзя применять при беременности (см. раздел «Противопоказания»).
Пациенткам, планирующим беременность, в случае необходимости должно быть назначено альтернативное антигипертензивное лечение, которое имеет установленный профиль безопасности для применения во время беременности. Когда беременность обнаружена, лечение блокаторами рецепторов ангиотензина II (БРА) должно быть немедленно прекращено и, при необходимости, должно быть назначено альтернативное лечение.
Эпидемиологические данные показали повышенный риск тератогенного воздействия при применении иАПФ в первом триместре беременности. Подобный риск может существовать также при приеме БРА.
Известно, что прием БРА во втором и третьем триместрах беременности вызывает фетотоксичность (снижение функции почек, маловодие, задержка окостенения черепа) и неонатальную токсичность (почечная недостаточность, артериальная гипотензия, гиперкалиемия).
Если женщина принимала БРА во втором триместре беременности, необходим УЗИ контроль функции почек и черепа плода. Новорожденные, матери которых принимали БРА, должны внимательно наблюдаться из-за возможной артериальной гипотензии.
Не рекомендуется применять САРТВАЛ во время грудного вскармливания, так как отсутствует информация о применении валсартана во время кормления грудью. Предпочтительно использовать альтернативные методы лечения с установленным профилем безопасности, особенно если ребенок новорожденный или недоношенный.
Пациенты с дефицитом в организме натрия и/или объема циркулирующей крови (ОЦК). У пациентов с тяжелой степенью дефицита натрия и/или объема циркулирующей крови в организме, например, у тех, которые получают высокие дозы диуретиков, в отдельных случаях после начала терапии может наблюдаться симптоматическая гипотензия. Перед началом лечения следует провести коррекцию содержания в организме натрия и/или объема циркулирующей крови, например, путем снижения дозы диуретика.
При гипотензии пациента следует уложить и, если необходимо, провести внутривенную инфузию солевого раствора. Лечение можно продолжить сразу после стабилизации артериального давления.
Гиперкалиемия. Следует соблюдать осторожность при совместном применении САРТВАЛа с препаратами калия, калийсберегающими диуретиками, препаратами, содержащими калий в виде солей, или другими препаратами, которые могут повысить уровень калия (гепарин и др.). Рекомендуется контролировать содержание калия в крови.
Стеноз почечной артерии. Кратковременное применение САРТВАЛа у 12 пациентов с вазоренальной гипертензией, являющейся вторичной вследствие одностороннего стеноза почечной артерии, не вызвало никаких существенных изменений гемодинамических параметров почек, креатинина сыворотки или азота мочевины крови. Поскольку другие лекарственные средства, влияющие на ренин-ангиотензин-альдостероновую систему (РAAС), могут повышать уровень мочевины крови и креатинина сыворотки у пациентов с односторонним или двусторонним стенозом почечной артерии, как мера безопасности рекомендуется мониторинг этих показателей.
Нарушение функции почек. У пациентов с нарушением функции почек коррекция дозы не требуется. Однако в тяжелых случаях (клиренс креатинина <10 мл/мин) следует соблюдать осторожность, поскольку опыт применения препарата в этих случаях отсутствует. С осторожностью применять у пациентов, находящихся на гемодиализе.
В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов, находящихся на гемодиализе. Однако валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно. Опыт применения препарата САРТВАЛ у пациентов с трансплантацией почки отсутствует.
Нарушение функции печени. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза САРТВАЛ должен применяться с осторожностью (см. разделы «Противопоказания» и «Фармакокинетика»).
Сердечная недостаточность/Постинфарктное состояние. У пациентов с сердечной недостаточностью или постинфарктным состоянием, принимающих САРТВАЛ в обычных дозах, наблюдается незначительное снижение артериального давления, но прекращение терапии из-за длительной симптоматической гипотензии, как правило, не требуется, если соблюдать инструкции по дозированию препарата. Необходимо соблюдать осторожность у пациентов с сердечной недостаточностью или в постинфарктном состоянии, начинающих терапию.
Как следствие угнетения ренин-ангиотензин-альдостероновой системы (РAAС), у лиц с повышенной чувствительностью могут наблюдаться нарушения функции почек. У пациентов с тяжелой сердечной недостаточностью, у которых функция почек зависит от активности РААС, лечение иАПФ или БРА могло стать причиной олигурии и/или прогрессирующей азотемии, острой почечной недостаточности (редко) и/или летального исхода. Оценка состояния пациентов с сердечной недостаточностью или в постинфарктном состоянии всегда должна включать мониторинг функции почек.
Не рекомендуется одновременный прием тройной комбинации иАПФ, бета-блокаторов и валсартана.
Стеноз аортального и митрального клапанов, гипертрофическая кардиомиопатия. Как и при применении других вазодилататоров, следует соблюдать особую осторожность при назначении препарата пациентам с аортальным или митральным стенозом, а также гипертрофической кардиомиопатией.
Ангионевротический отек.
Сообщалось о случаях ангионевротического отека, в том числе отека гортани и голосовой щели, что приводит к обструкции дыхательных путей и/или отеку лица, губ, глотки и/или языка у пациентов, получавших валсартан; у некоторых из этих пациентов ранее развивался отек Квинке при приеме других лекарственных препаратов, в том числе иАПФ. Следует немедленно прекратить прием препарата САРТВАЛ пациентам, у которых развивается ангионевротический отек, и препарат не должен назначаться снова.
Первичный гиперальдостеронизм. Не рекомендовано назначать САРТВАЛ пациентам с первичным гиперальдостеронизмом.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС)
Двойная блокада РААС ассоциируется с повышенным риском развития гипотонии, гиперкалиемии и нарушениями функции почек (включая острую почечную недостаточность) в сравнении с монотерапией. Двойная блокада РААС с применением иАПФ, БРА или препаратов, содержащих алискирен, не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией.
В отдельных случаях, когда совместное применение иАПФ и БРА абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции почек, водно-электролитного баланса, артериального давления. Это относится к назначению кандесартана или валсартана в качестве дополнительной терапии к ингибиторам АПФ у пациентов с хронической сердечной недостаточностью. Проведение двойной блокады РААС под тщательным наблюдением специалиста с обязательным мониторингом функции почек, водно-электролитного баланса и артериального давления возможно у пациентов с хронической сердечной недостаточностью при непереносимости антагонистов альдостерона (спиронолактона), у которых наблюдается персистирование симптомов хронической сердечной недостаточности, несмотря на проведение иной адекватной терапии.
Детский возраст
Применение у детей с нарушением функции почек
Применение у детей с клиренсом креатинина <30 мл/мин и у детей на диализе не изучалось, поэтому у таких пациентов валсартан применять не рекомендуется. Не требуется коррекции дозы у детей с клиренсом креатинина > 30 мл/мин. Следует тщательно контролировать функцию почек и содержание калия в сыворотке. Это особенно касается случаев, когда валсартан применяется при наличии других состояний (напр., лихорадка, обезвоживание), способных вызвать нарушение функции почек.
Противопоказано одновременное применение блокаторов рецепторов ангиотензина II (в т.ч. САРТВАЛа) или иАПФ с препаратами, содержащими алискирен, у пациентов с умеренной/тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Применение у детей с нарушением функции печени
Как и у взрослых, САРТВАЛ противопоказан у детей при тяжелой печеночной недостаточности, билиарном циррозе печени и при холестазе. Существует ограничеснный клинический опыт применения САРТВАЛа у детей с легкой и умеренной печеночной недостаточностью. У таких пациентов доза валсартана не должна превышать 80 мг.
Исследований по оценке влияния препарата САРТВАЛ на способность управлять автомобилем и работать с механизмами не проводилось. При управлении транспортными средствами или работе с механизмами следует учитывать возможность возникновения головокружения или слабости. Как и при назначении других антигипертензивных средств, необходимо соблюдать осторожность при управлении автомобилем и работе с движущимися механизмами.
В клинических исследованиях не обнаружено имеющих клиническое значение взаимодействий валсартана со следующими лекарственными средствами: циметидин, варфарин, фуросемид, дигоксин, атенолол, индометацин, гидрохлоротиазид, амлодипин, глибенкламид.
Литий.
При одновременном применении иАПФ или БРА с препаратами лития наблюдалось обратимое повышение концентрации лития в сыворотке крови и появление токсических эффектов. Если существует необходимость совместного приема данных лекарственных средств, необходим тщательный мониторинг сывороточных концентраций лития. Если мочегонное средство также используется, можно предположить увеличение риска токсичности лития при применении САРТВАЛ.
Препараты, влияющие на CYP 450.
Поскольку САРТВАЛ не подвергается существенному метаболизму, клинически значимого взаимодействия с другими лекарственными препаратами в виде метаболической индукции или угнетения системы цитохрома Р450 при совместном применении с валсартаном не наблюдалось. Несмотря на то, что валсартан имеет высокую степень связывания с белками плазмы, исследования in vitro не продемонстрировали никакого взаимодействия на этом уровне с рядом молекул, которые также имеют высокую степень связывания с белками, а именно – диклофенаком, фуросемидом и варфарином.
Калийсберегающие диуретики, препараты калия, препараты, содержащие калий в виде солей и другие препараты, способные повысить уровень калия.
Совместное применение с калийсберегающими диуретиками (например, спиронолактон, триамтерен, амилорид), препаратами калия, калийсодержащими заменителями поваренной соли, либо с другими препаратами, которые могут увеличить уровень калия (напр., гепарин), может привести к повышению уровня калия в сыворотке крови, а у пациентов с сердечной недостаточностью может повышать уровень сывороточного креатинина. Следует контролировать уровень калия в случае необходимости совместного введения данных препаратов.
Нестероидные противовоспалительные препараты (НПВП), включая селективные ингибиторы ЦОГ-2, ацетилсалициловой кислоты (> 3 г/сут) и неселективные НПВП.
Одновременное применение НПВП и БРА может привести к ослаблению антигипертензивного эффекта. Кроме того, одновременный прием БРА и НПВП может привести к повышению риска ухудшения функции почек и увеличение уровня калия в сыворотке крови. В связи с этим рекомендуется контроль функции почек в начале лечения и адекватная гидратация пациента.
Транспортеры.
Одновременный прием ингибиторов переноса (напр., рифампин, циклоспорин) или эффлюксных транспортеров (напр., ритонавир) может усиливать действие валсартана.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС).
На основе имеющихся данных, двойная блокада РААС с применением иАПФ, БРА или препаратов, содержащих алискирен, не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией.
У пациентов с сахарным диабетом или умеренной/тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2) одновременное применение препаратов, содержащих алискирен, с иАПФ или БРА противопоказано.
В отдельных случаях, когда совместное применение иАПФ и БРА абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции почек, водно-электролитного баланса, артериального давления.
Валсартан является активным специфическим блокатором (антагонистом) рецепторов ангиотензина II (БРА), предназначенным для приема внутрь. Он действует избирательно на рецепторы подтипа AT1, которые ответственны за действие ангиотензина II. Повышенные уровни ангиотензина II в плазме вследствие блокады АТ1-рецепторов валсартаном могут стимулировать незаблокированные АТ2-рецепторы, которые уравновешивают эффект АТ1-рецепторов. Валсартан не проявляет какой-либо активности агониста в отношении АТ1-рецепторов, но обладает большим (примерно в 20000 раз) сродством к АТ1-рецепторам, чем к АТ2-рецепторам.
Валсартан не угнетает ангиотензинпревращающий фермент (АПФ), известный также под названием кининазы II, который превращает ангиотензин I в ангиотензин II и влияет на систему брадикинина. В клинических испытаниях, в которых валсартан сравнивали с ингибитором АПФ, частота развития сухого кашля была значительно ниже (р<0,05) у пациентов, получавших валсартан, чем у пациентов, получавших ингибитор АПФ (2,6% против 7,9% соответственно). Применение препарата у пациентов с артериальной гипертензией приводит в итоге к снижению артериального давления без влияния на частоту пульса.
Начало гипотензивного действия отмечается в пределах 2 часов, максимум — в пределах 4-6 часов после приема внутрь; продолжительность действия – свыше 24 часов. Максимальный терапевтический эффект развивается через 2-4 недели от начала лечения и сохраняется при длительной терапии. При применении с гидрохлоротиазидом достигается достоверное дополнительное снижение артериального давления.
Внезапная отмена препарата не сопровождается развитием синдрома отмены.
Применение препарата приводит к уменьшению случаев госпитализации по поводу сердечной недостаточности, замедлению прогрессирования сердечной недостаточности, улучшению функционального класса по классификации NYHA, увеличению фракции выброса, а также к уменьшению признаков и симптомов сердечной недостаточности и улучшению качества жизни по сравнению с плацебо.
Применение комбинации иАПФ и БРА изучалось в двух крупных рандомизированных контролируемых исследованиях (ONTARGET и VA NEPHRON-D). Исследование ONTARGET проводилось у пациентов с сердечным или сердечно-сосудистым заболеванием или с сахарным диабетом 2 типа с наличием поражения органов-мишеней. Исследование VA NEPHRON-D включало пациентов с сахарным диабетом 2 типа и диабетической нефропатией. Эти исследования не продемонстрировали достоверного благоприятного эффекта в отношении почек и/или сердечно-сосудистой системы, а также смертности, при этом наблюдалось увеличение риска гиперкалиемии, острой почечной недостаточности и/или гипотензии по сравнению с монотерапией. С учетом схожих свойств фармакодинамики результаты этих исследований также актуальны для других иАПФ и БРА. Поэтому не следует одновременно применять иАПФ и БРА у пациентов с диабетической нефропатией.
В исследовании ALTITUDE изучалась возможная польза от добавления алискирена к стандартной терапии иАПФ или БРА у пациентов с сахарным диабетом 2 типа и хроническим заболеванием почек и/или сердечно-сосудистым заболеванием. Исследование было прекращено досрочно и-за повышенного риска неблагоприятных исходов. Сердечно-сосудистая смерть и инсульт в группе алискирена наблюдались чаще, чем в группе плацебо, и сообщения о нежелательных явлениях и изучаемых серьезных нежелательные явлениях (гиперкалиемия, гипотензия и нарушение функции почек) чаще возникали в группе алискирена, чем в группе плацебо.
Фармакокинетика
После приема препарата внутрь натощак максимальная концентрация валсартана в плазме достигается через 2-4 часа. Средняя величина биодоступности препарата составляет 23%. При назначении валсартана с пищей площадь под кривой «концентрация-время» (AUC) уменьшается на 48%, хотя, начиная примерно с 8 часов после приема препарата, концентрации в плазме как в случае приема его натощак, так и в случае приема с пищей одинаковы. Уменьшение площади под кривой AUC, однако, не сопровождается значительным снижением терапевтического эффекта.
Значительная часть валсартана не подвергается биотрансформации, только около 20% дозы выводится в виде метаболитов. Гидроксиметаболит обнаруживается в плазме крови в низких концентрациях (менее 10% от AUC валсартана). Этот метаболит фармакологически неактивен.
Кинетика элиминации валсартана имеет мультиэкспоненциальный характер (t1/2α< 1 ч и t1/2β около 9 ч.).
При приеме препарата один раз в сутки кумуляция незначительна. Концентрации препарата в плазме крови у женщин и мужчин были одинаковы.
Валсартан в значительной степени связывается с белками плазмы крови (94-97 %), преимущественно с альбумином. Объем распределения в период равновесного состояния низкий (около 17 л). После внутривенного введения плазменный клиренс валсартана составляет около 2 л/ч и его почечный клиренс составляет 0,62 л/ч (около 30% от общего клиренса). Период полураспада составляет 6 часов. Количество валсартана, выводимого с калом, составляет 83% (от величины принятой внутрь дозы), примерно 13% выводится с мочой, преимущественно в неизмененном виде.
Среднее время достижения максимальной концентрации и период полувыведения валсартана у пациентов с сердечной недостаточностью и здоровых добровольцев одинаковы. Величины площади под кривой «концентрация-время» и максимальной концентрации валсартана увеличиваются линейно и почти пропорционально повышению дозы в пределах диапазона доз 40-160 мг два раза в сутки. Коэффициент кумуляции в среднем равен 1,7. Клиренс валсартана после приема внутрь составляет примерно 4,5 л/час. Возраст не влияет на клиренс препарата у пациентов с сердечной недостаточностью.
Фармакокинетика у отдельных групп пациентов
Пожилые пациенты
У некоторых пациентов пожилого возраста системное воздействие валсартана было несколько более выражено, чем у пациентов молодого возраста; однако не было показано какой-либо клинической значимости этого.
Пациенты с нарушением функции почек
Для соединений, почечный клиренс которых составляет менее 30% общего плазменного клиренса, отсутствует корреляция между функцией почек и системным воздействием. Поэтому у пациентов с нарушением функции почек (клиренс креатинина > 10 мл/мин) коррекция дозы препарата не требуется. В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов с клиренсом креатинина <10 мл/мин и у пациентов, находящихся на гемодиализе, поэтому валсартан следует применять с осторожностью у этих пациентов. Однако валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно.
Пациенты с нарушением функции печени
Около 70% от величины всосавшейся дозы препарата экскретируется с желчью, преимущественно в неизмененном виде. У пациентов с легкой и умеренной печеночной недостаточностью наблюдается увеличение в два раза AUC по сравнению со здоровыми людьми. Тем не менее, корреляция между концентрацией валсартана в плазме и степенью нарушения функции печени не обнаружена. Применение валсартана не изучалось у пациентов с тяжелым нарушением функции печени (см. разделы «Противопоказания», «Способ применения и дозы», «Меры предосторожности»).
Педиатрические пациенты
В исследовании у 26 детей с артериальной гипертензией (в возрасте от 1 до 16 лет), получавших однократную дозу суспензии валсартана (в среднем 0,9-2 мг/кг, максимальная доза 80 мг), клиренс (л/час/кг) валсартана был сопоставим у детей разного возраста внутри возрастной группы 1-16 лет и аналогичен таковому у взрослых, получавших препарат в той же лекарственной форме.
САРТВАЛ 80 мг: бледно-красные круглые таблетки, покрытые оболочкой, со скошенными краями, с риской на одной стороне таблетки; с надписями «D» с одной стороны риски и «V» — с другой; и надписью «NVR» с обратной стороны таблетки.
САРТВАЛ 160 мг: серо-оранжевые овальные таблетки, покрытые оболочкой, слегка выпуклые, с риской на одной стороне таблетки; с надписями «DX» с одной стороны риски и «DX» — с другой, и с надписью «NVR» с обратной стороны таблетки.
Хранить при температуре не выше 30 °С, в защищенном от влаги месте.
Хранить в недоступном для детей месте.
По 14 таблеток в блистере. По 2 блистера вместе с инструкцией по применению в картонной пачке.
По рецепту.
Производитель
Лек д.д., Веровшкова 57, Любляна, Словения.
- Описание препарата Сартвал
- Состав препарата Сартвал
- Показания препарата Сартвал
- Условия хранения препарата Сартвал
- Срок годности препарата Сартвал
Код ATX:
Сердечно-сосудистая система (C) > Препараты, влияющие на ренин-ангиотензиновую систему (C09) > Антагонисты ангиотензина II (C09C) > Антагонисты ангиотензина II (C09CA) > Valsartan (C09CA03)
Форма выпуска, состав и упаковка
таб., покр. оболочкой, 80 мг: 28 шт.
Рег. №: 9940/12/17/18 от 16.09.2017 — Срок действия рег. уд. не ограничен
Таблетки, покрытые оболочкой бледно-красные, круглые, со скошенными краями, с риской на одной стороне, с надписями «D» с одной стороны риски и «V» — с другой, и надписью «NVR» с обратной стороны таблетки.
Вспомогательные вещества: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172).
14 шт. — блистеры (2) — пачки картонные.
таб., покр. оболочкой, 160 мг: 28 шт.
Рег. №: 9940/12/17/18 от 06.09.2017 — Срок действия рег. уд. не ограничен
Таблетки, покрытые оболочкой бледно-красные, круглые, со скошенными краями, с риской на одной стороне, с надписями «D» с одной стороны риски и «V» — с другой, и надписью «NVR» с обратной стороны таблетки.
Вспомогательные вещества: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172).
14 шт. — блистеры (2) — пачки картонные.
Описание активных компонентов препарата САРТВАЛ . Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата. Дата обновления: 14.01.2006 г.
Фармакологическое действие
Антигипертензивное средство. Является специфическим антагонистом рецепторов ангиотензина II. Оказывает избирательное антагонистическое действие на AT1-рецепторы, которые ответственны за реализацию эффектов ангиотензина II.
Вследствие блокады AT1-рецепторов повышается плазменная концентрация ангиотензина II, который может стимулировать незаблокированные AT2-рецепторы. Не обладает агонистической активностью в отношении AT1-рецепторов. Сродство валсартана к AT1-рецепторам примерно в 20 000 раз выше, чем к AT2-рецепторам.
Не ингибирует АПФ. Не взаимодействует и не блокирует рецепторы других гормонов или ионные каналы, имеющие важное значение для регуляции функций сердечно-сосудистой системы. Не оказывает влияния на уровень общего холестерина, ТГ, глюкозы и мочевой кислоты в плазме крови.
Начало антигипертензивного действия валсартана после его применения внутрь в однократной дозе наблюдается в течение 2 ч после приема, максимальный эффект достигается в течение 4-6 ч.
Фармакокинетика
После приема внутрь валсартан быстро абсорбируется из ЖКТ, степень всасывания характеризуется индивидуальными различиями. Абсолютная биодоступность в среднем составляет 23%. Фармакокинетическая кривая валсартана имеет мультиэкспоненциальный характер (T1/2 в α-фазе < 1 ч и T1/2 в β-фазе — около 9 ч), кинетика линейная.
При курсовом применении изменений фармакокинетических параметров не отмечалось.
При приеме валсартана с пищей AUC уменьшается на 48%, при этом примерно через 8 ч после приема концентрации валсартана в плазме одинаковы у пациентов, принимавших его с пищей и натощак. Уменьшение AUC не сопровождается клинически значимым уменьшением терапевтического эффекта.
При приеме валсартана 1 раз/сут кумуляция выражена незначительно. Концентрации валсартана в плазме крови у женщин и мужчин были одинаковы.
Связывание с белками плазмы, преимущественно с альбуминами, составляет 94-97%. Vd в равновесном состоянии составляет около 17 л.
Плазменный клиренс валсартана составляет около 2 л/ч. Выводится с калом — 70% и с мочой — 30%, преимущественно в неизмененном виде.
При билиарном циррозе или обструкции желчевыводящих путей AUC валсартана увеличивается приблизительно в 2 раза.
Показания к применению
Лечение артериальной гипертензии.
Лечение хронической сердечной недостаточности (II-IV функциональный класс по классификации NYHA) у пациентов, получающих традиционную терапию диуретиками, препаратами наперстянки, а также ингибиторами АПФ или бета-адреноблокаторами.
Реклама
Режим дозирования
Принимают внутрь в дозе 80 мг 1 раз/сут или по 40 мг 2 раза/сут, ежедневно. При отсутствии адекватного эффекта суточная доза может быть постепенно увеличена.
Максимальная суточная доза составляет 320 мг в 2 приема.
Побочные действия
Со стороны сердечно-сосудистой системы: артериальная гипотензия, постуральное головокружение, постуральная гипотензия.
Со стороны ЦНС: головокружение, головная боль.
Со стороны пищеварительной системы: диарея, тошнота, повышение уровня билирубина.
Со стороны мочевыделительной системы: редко — нарушение функции почек, повышение уровня креатинина и азота мочевины (особенно при хронической сердечной недостаточности).
Со стороны обмена веществ: гиперкалиемия.
Со стороны системы кроветворения: нейтропения, уменьшение гемоглобина и гематокрита.
Аллергические реакции: редко — ангионевротический отек, сыпь, зуд, сывороточная болезнь, васкулит.
Прочие: утомляемость, общая слабость, кашель, фарингит, повышение риска развития вирусных инфекций.
Применение при беременности и кормлении грудью
Валсартан противопоказан к применению при беременности.
Неизвестно, выделяется ли валсартан с грудным молоком у человека. Применение в период лактации (грудного вскармливания) не рекомендуется.
В экспериментальных исследованиях показано, что валсартан выделяется с грудным молоком у крыс.
Применение при нарушениях функции почек
У пациентов с реноваскулярной гипертензией, развившейся вторично вследствие стеноза почечной артерии, в период лечения следует регулярно контролировать уровень мочевины и креатинина в сыворотке. Данные о безопасности применения у пациентов с КК менее 10 мл/мин отсутствуют.
Вследствие ингибирования РААС у предрасположенных пациентов возможны изменения функции почек.
Применение у детей
Безопасность и эффективность применения валсартана у детей не установлена.
Особые указания
При гипонатриемии и/или уменьшении ОЦК, а также на фоне терапии высокими дозами диуретиков в редких случаях валсартан может вызвать выраженную артериальную гипотензию. Перед началом лечения следует провести коррекцию нарушений водно-солевого обмена.
У пациентов с реноваскулярной гипертензией, развившейся вторично вследствие стеноза почечной артерии, в период лечения следует регулярно контролировать уровень мочевины и креатинина в сыворотке. Данные о безопасности применения у пациентов с КК менее 10 мл/мин отсутствуют.
С особой осторожностью применяют у пациентов с нарушениями проходимости желчных путей.
Вследствие ингибирования РААС у предрасположенных пациентов возможны изменения функции почек. При применении ингибиторов АПФ и антагонистов ангиотензиновых рецепторов у пациентов с хронической сердечной недостаточностью тяжелого течения наблюдались олигурия и/или нарастание азотемии, редко развивалась острая почечная недостаточность с риском летального исхода.
Безопасность и эффективность применения валсартана у детей не установлена.
Влияние на способность к вождению автотранспорта и управлению механизмами
При применении валсартана рекомендуется соблюдать осторожность при вождении автомобиля и управлении механизмами.
Лекарственное взаимодействие
При одновременном применении диуретиков в высоких дозах возможно развитие артериальной гипотензии.
При одновременном применении калийсберегающих диуретиков, гепарина, биологически активных добавок или заменителей соли, содержащих калий, возможно развитие гиперкалиемии.
При одновременном применении с индометацином возможно уменьшение антигипертензивного действия валсартана.
При одновременном применении с лития карбонатом описан случай развития интоксикации литием.

Все аналоги
Аналоги препарата
ВАЛЬСАКОР® (KRKA, d.d., Novo mesto, Словения)
ВАЛЗАН (Pharmacare Int. Co./German Palestinian Joint Venture, Палестина)
ДИОВАН® (NOVARTIS PHARMA, AG, Швейцария)
ВАЛСАРТАН-НАН (АКАДЕМФАРМ, Государственное предприятие, Республика Беларусь)
ВАЛЗ (ACTAVIS, Ltd., Мальта)
ВАЛСАРТАН-ЛФ (ЛЕКФАРМ, СООО, Республика Беларусь)
Аналоги КФУ
ТЕЛМИСТА® (KRKA, d.d., Novo mesto, Словения)
СЕНТОР® (GEDEON RICHTER, Plc., Венгрия)
ЛОЗАРТАН (ФАРМЛЭНД, СП ООО, Республика Беларусь)
ТИРЕГИС® (EGIS Pharmaceuticals, PLC, Венгрия)
КАНДЕСАРТАН-НАН (АКАДЕМФАРМ, Государственное предприятие, Республика Беларусь)
ВАЛЬСАКОР® (KRKA, d.d., Novo mesto, Словения)
ЭДАРБИ (TAKEDA PHARMA, A/S, Дания)
ТЕЛСАРТАН® (Dr. REDDY`s LABORATORIES, Ltd., Индия)
ЛОРИСТА® (KRKA, d.d., Novo mesto, Словения)
АПРОВЕЛЬ (SANOFI WINTHROP INDUSTRIE, Франция)
Другие препараты этого производителя
ПИРАМИЛ® ЭКСТРА ПЛЮС (Sandoz Pharmaceuticals, d.d., Словения)
ДЕЛАНИ (Sandoz Pharmaceuticals, d.d., Словения)
КАНВЕРС (Sandoz Pharmaceuticals, d.d., Словения)
СОРЕЛЬ (Sandoz Pharmaceuticals, d.d., Словения)
БЕНКОМ (Sandoz Pharmaceuticals, d.d., Словения)
ЭЛИТАРЕН (Sandoz Pharmaceuticals, d.d., Словения)
МОРИС (Sandoz Pharmaceuticals, d.d., Словения)
ТЕЙКОПЛАНИН САНДОЗ (Sandoz Pharmaceuticals, d.d., Словения)
СОРЕЛЬ ПЛЮС (Sandoz Pharmaceuticals, d.d., Словения)
ПРИЛАМ ДИУРЕТИК (Sandoz Pharmaceuticals, d.d., Словения)

Наименование
Сартвал (Валсартан Сандоз) табл 160мг №28
Основное действующее вещество
Валсартан
Форма выпуска
таблетки
Состав
1 таблетка содержит 80 мг или 160 м г валсартана; вспомогательные вещества:
Валсартан Сандоз 80 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172).
Валсартан Сандоз 160 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172), железа оксид черный (Е172).
Описание
Валсартан Сандоз 80 мг: бледно-красные круглые таблетки, покрытые оболочкой, со скошенными краями, с риской на одной стороне таблетки; с надписями «D» с одной стороны риски и «V» — с другой; и надписью «NVR» с обратной стороны таблетки. Валсартан Сандоз 160 мг: серо-оранжевые овальные таблетки, покрытые оболочкой, слегка выпуклые, с риской на одной стороне таблетки; с надписями «DX» с одной стороны риски и «DX» — с другой, и с надписью «NVR» с обратной стороны таблетки.
Фармакологическое действие
Валсартан является активным специфическим антагонистом рецепторов ангиотензина II, предназначенным для приема внутрь. Он действует избирательно на рецепторы подтипа АТ), которые ответственны за действие ангиотензина II. Повышенные уровни ангиотензина II в плазме вследствие блокады ATi-рецепторов валсартаном могут стимулировать незаблокированные АТг-рецепторы, которые уравновешивают эффект АТ-рецепторов. Валсартан не проявляет какой-либо активности агониста в отношении АТ-рецепторов, но обладает гораздо большим (примерно в 20 ООО раз) сродством к АТр рецепторам, чем к АТг-рецепторам.
Валсартан не угнетает ангиотензинпревращающий фермент (АПФ), известный также под названием кининазы II, который превращает ангиотензин I в ангиотензин II и влияет на систему брадикинина. В клинических испытаниях, в которых валсартан сравнивали с ингибитором АПФ, частота развития сухого кашля была значительно ниже (р<0,05) у пациентов, получавших валсартан, чем у пациентов, получавших ингибитор АПФ (2,6% против 7,9% соответственно). Применение препарата у пациентов с артериальной гипертензией приводит в итоге к снижению артериального давления без влияния на частоту пульса.
Начало гипотензивного действия отмечается в пределах 2 часов, максимум — в пределах 4- 6 часов после приема внутрь; продолжительность действия — свыше 24 часов. Максимальный терапевтический эффект развивается через 2-4 недели от начала лечения и сохраняется при длительной терапии. При применении с гидрохлоротиазидом достигается достоверное дополнительное снижение артериального давления.
Внезапная отмена препарата не сопровождается развитием синдрома отмены.
Применение препарата приводит к уменьшению случаев госпитализации по поводу сердечной недостаточности, замедлению прогрессирования сердечной недостаточности, улучшению функционального класса по классификации NYHA, увеличению фракции выброса, а также к уменьшению признаков и симптомов сердечной недостаточности и улучшению качества жизни по сравнению с плацебо.
Фармакокинетика
После приема препарата внутрь натощак максимальная концентрация валсартана в плазме достигается через 2-4 часа. Средняя величина биодоступности препарата составляет 23%. При назначении валсартана с пищей площадь под кривой «концентрация-время» (AUC) уменьшается на 48%, хотя, начиная примерно с 8 часов после приема препарата, концентрация в плазме как в случае приема его натощак, так и в случае приема с пищей одинаковы. Уменьшение площади под кривой AUC, однако, не сопровождается значительным снижением терапевтического эффекта.
Значительная часть валсартана не подвергается биотрансформации, только около 20% дозы выводится в виде метаболитов. Гидроксиметаболит обнаруживается в плазме крови в низких концентрациях (менее 10% от AUC валсартана). Этот метаболит фармакологически неактивен.
Кинетика элиминации валсартана имеет мультиэкспоненциальный характер (tl/2a< 1 ч и tl/2|3 около 9 ч.).
При приеме препарата один раз в сутки кумуляция незначительна. Концентрации препарата в плазме крови у женщин и мужчин были одинаковы.
Валсартан в значительной степени связывается с белками плазмы крови (94-97 %), преимущественно с альбумином. Объем распределения в период равновесного состояния низкий (около 17 л). После внутривенного введения плазменный клиренс валсартана составляет около 2 л/ч и его почечный клиренс составляет 0,62 л/ч (около 30% от общего клиренса). Период полураспада составляет 6 часов. Количество валсартана, выводимого с калом, составляет 83% (от величины принятой внутрь дозы), примерно 13% выводится с мочой, преимущественно в неизмененном виде.
Среднее время достижения максимальной концентрации и период полувыведения валсартана у пациентов с сердечной недостаточностью и здоровых добровольцев одинаковы. Величины площади под кривой «концентрация-время» и максимальной концентрации валсартана увеличиваются линейно и почти пропорционально повышению дозы в пределах диапазона доз 40-160 мг два раза в сутки. Коэффициент кумуляции в среднем равен 1,7. Клиренс валсартана после приема внутрь составляет примерно 4,5 л/час. Возраст не влияет на клиренс препарата у пациентов с сердечной недостаточностью.
Фармакокинетика у отдельных групп пациентов.
Пожилые пациенты. У некоторых пациентов пожилого возраста системное воздействие валсартана было несколько более выражено, чем у пациентов молодого возраста; однако не было показано какой-либо клинической значимости этого.
Пациенты с нарушением функции почек. Для соединений, почечный клиренс которых составляет менее 30% общего плазменного клиренса, отсутствует корреляция между функцией почек и системным воздействием. Поэтому у пациентов с нарушением функции почек (клиренс креатинина > 10 мл/мин) коррекция дозы препарата не требуется. В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов с клиренсом креатинина <10 мл/мин и у пациентов, находящихся на гемодиализе. Однако, валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно.
Пациенты с нарушением функции печени. Около 70% от величины всосавшейся дозы препарата экскретируется с желчью, преимущественно в неизмененном виде. У пациентов с легкой и умеренной печеночной недостаточностью наблюдается увеличение в два раза AUC по сравнению со здоровыми людьми. Тем не менее, корреляция между концентрацией валсартана в плазме и степенью нарушения функции печени не обнаружена. Применение валсартана не изучалось у пациентов с тяжелым нарушением функции печени (см. разделы «Противопоказания», «Способ применения и дозы», «Особенности применения»).
Показания к применению
Артериальная гипертензия.
Сердечная недостаточность (лечение сердечной недостаточности с клинической симптоматикой у пациентов, не получающих ингибиторы ангиотензинпревращающего фермента (АПФ), или в качестве дополнительной терапии к ингибиторам АПФ у пациентов, не получающих бета-блокаторы).
Недавно перенесенный инфаркт миокарда (у клинически стабильных пациентов с клиническими проявлениями сердечной недостаточности или бессимптомной систолической дисфункцией левого желудочка после перенесенного (12 часов — 10 дней) инфаркта миокарда).
Противопоказания
• Повышенная чувствительность к валсартану или к любому из компонентов препарата.
• Беременность, кормление грудью.
• Детский возраст.
• Тяжелая печеночная недостаточность, билиарный цирроз печени и холестаз.
• Одновременное применение антагонистов рецепторов ангиотензина, в том числе валсартана, или ингибиторов ангиотензин-превращающего фермента (АПФ) с алискиреном у пациентов с сахарным диабетом 2 типа или умеренной/ тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Применение при беременности и в период лактации
Прием антагонистов рецепторов ангиотензина II не рекомендуется в течение первого триместра беременности. Прием антагонистов рецепторов ангиотензина II противопоказан во втором и третьем триместрах беременности.
Эпидемиологические данные показали повышенный риск тератогенного воздействия при применении ингибиторов АПФ в первом триместре беременности. Подобный риск может существовать также при приеме антагонистов рецепторов ангиотензина II.
У пациенток, планирующих беременность, в случае необходимости должно быть назначено альтернативное антигипертензивное лечение, которое имеет установленный профиль безопасности для применения во время беременности. Когда беременность обнаружена, лечение антагонистами рецепторов ангиотензина II должно быть немедленно прекращено и, при необходимости, должно быть назначено альтернативное лечение. Известно, что прием антагонистов рецепторов ангиотензина II во втором и третьем триместрах беременности вызывает фетотоксичность (снижение функции почек, маловодие, задержка окостенения черепа) и неонатальную токсичность (почечная недостаточность, артериальная гипотензия, гиперкалиемия).
Если женщина принимала антагонисты рецепторов ангиотензина II во втором триместре беременности, необходим УЗИ контроль функции почек и черепа плода. Новорожденные, матери которых принимали антагонисты рецепторов ангиотензина II, должны внимательно наблюдаться из-за возможной артериальной гипотензии.
Не рекомендуется применять Валсартан Сандоз во время лактации, так как отсутствует информация о применении валсартана во время кормления грудью. Предпочтительно использовать альтернативные методы лечения с установленным профилем безопасности, особенно если ребенок новорожденный или недоношенный.
Дети.
Безопасность и эффективность применения Валсартана Сандоз у детей в возрасте до 18 лет не установлены.
Способ применения и дозы
Артериальная гипертензия. Рекомендуемая стартовая доза Валсартана Сандоз для взрослых составляет 80 мг или 160 мг один раз в сутки. Антигипертензивный эффект достигается в течение двух недель, а максимальный эффект наступает через четыре недели. Пациентам, у которых не удается достичь адекватного снижения артериального давления, суточную дозу можно повысить до 320 мг; возможно дополнительное назначение диуретиков.
Валсартан Сандоз можно назначать также совместно с другими антигипертензивными средствами.
Сердечная недостаточность. Рекомендуемая начальная доза Валсартана Сандоз составляет 40 мг два раза в сутки. Повышение дозы до 80 мг и 160 мг два раза в сутки должно осуществляться с интервалом не менее 2 недель, с учетом переносимости препарата пациентом. Максимальная суточная доза, которая применялась в клинических исследованиях, составила 320 мг, распределенная на несколько приемов. При сопутствующем лечении диуретиком следует рассмотреть вопрос о снижении дозы последнего.
Валсартан может применяться совместно с другими лекарственными средствами, применяемыми для лечения сердечной недостаточности. Не рекомендуется одновременный прием тройной комбинации ингибиторов АПФ, бета-блокаторов и валсартана.
Оценка состояния пациентов с сердечной недостаточностью всегда должна включать мониторинг функции почек.
Постинфарктное состояние. У клинически стабильных пациентов лечение можно начать уже через 12 часов после инфаркта миокарда. После начальной дозы 20 мг два раза в сутки дозу валсартана необходимо увеличивать до 40 мг, 80 мг и 160 мг два раза в сутки в течение следующих нескольких недель.
Максимальная доза — 160 мг два раза в сутки. В целом рекомендуется, чтобы доза 80 мг два раза в сутки была достигнута в течение двух недель после начала лечения, а целевая максимальная доза — в течение трех месяцев, исходя из переносимости пациентом валсартана в период титрования дозы. Если возникает симптоматическая артериальная гипотензия или почечная дисфункция, следует рассмотреть вопрос о снижении дозы. Валсартан можно назначать пациентам, которые лечились другими препаратами, рекомендованными после инфаркта миокарда (например, тромболитиками, ацетилсалициловой кислотой, Р-блокаторами и статинами). Не рекомендуется одновременный прием тройной комбинации ингибиторов АПФ, бета-блокаторов и валсартана.
Оценка состояния пациентов после инфаркта миокарда всегда должна включать мониторинг функции почек.
Валсартан Сандоз может применяться для лечения гипертензии у пациентов с нарушенной толерантностью к глюкозе и риском сердечно-сосудистой недостаточности. Рекомендации по дозированию см. в разделе «Артериальная гипертензия».
Препарат можно принимать независимо от приема пищи, запивая небольшим количеством воды.
Дозирование в особых группах пациентов.
Пациенты пожилого возраста. Нет необходимости в коррекции дозы у пациентов пожилого возраста.
Пациенты с нарушением функции почек. Нет необходимости в коррекции дозы у пациентов с клиренсом креатинина более 10 мл/мин.
Пациенты с нарушением функции печени. Валсартан противопоказан пациентам с тяжелой печеночной недостаточностью, билиарным циррозом печени и у пациентов с холестазом. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза доза валсартана не должна превышать 80 мг.
Особую осторожность следует соблюдать при назначении валсартана пациентам с обструкцией желчевыводящих путей.
Побочное действие
Частота возникновения побочных реакций оценивается следующим образом: очень часто — > 1/10, часто — от > 1/100, <1/10, нечасто — от > 1/1000, < 1/100, редко — от > 1/10000, <1/1000, очень редко — < 1/100000.
Со стороны системы крови и лимфатической системы: частота неизвестна — *снижение гемоглобина, *снижение гематокрита, *нейтропения, *#тромбоцитопения.
Со стороны иммунной системы: частота неизвестна — *#реакции гиперчувствительности, включая сывороточную болезнь.
Нарушение обмена веществ: частота неизвестна — *#увеличение содержания калия в сыворотке крови, *#гипонатриемия; нечасто — #гиперкалиемия.
Нарушения со стороны нервной системы: часто — ^головокружение, #постуральное головокружение; нечасто — #обмороки, #головная боль.
Со стороны органов слуха: нечасто — *#вертиго.
Со стороны сердечно-сосудистой системы: частота неизвестна — *#васкулит, часто — #ортостатическая гипотензия, #гипотензия; нечасто — #сердечная недостаточность.
Со стороны дыхательной системы: нечасто — *#кашель.
Со стороны пищеварительной системы: нечасто — *боль в животе, # диарея, #тошнота.
Со стороны гепатобилиарной системы: частота неизвестна — ^повышение уровня печеночных ферментов, *повышение уровня печеночных ферментов, включая повышение уровня билирубина в сыворотке крови.
Со стороны кожи и подкожно-жировой клетчатки: частота неизвестна
*ангионевротический отек, *#буллезный дерматит, *#сыпь, *#зуд; нечасто — #ангионевротический отек.
Со стороны скелетно-мышечной системы: частота неизвестна — *#миалгия.
Со стороны мочеполовой системы: частота неизвестна — *нарушение функции почек, * почечная недостаточность, * повышение уровня креатинина в сыворотке крови, #увеличение содержания мочевины крови; часто — Нарушение функции почек, #почечная недостаточность, нечасто — #острая почечная недостаточность, Повышение уровня креатинина в сыворотке крови.
Общие нарушения: нечасто — *#слабость; #астения.
Следующие побочные эффекты наблюдались в ходе клинических исследований независимо от их причинной связи с исследуемым препаратом: *#артралгия,
Абдоминальная боль, *астения, *#боль в спине, *диарея, * головокружение, *головная
м U II ^ Ji
боль, * бессонница, * снижение либидо, нейтропения, *тошнота, * отеки, * фарингит, *#ринит, *#синусит, *#инфекции верхних дыхательных путей, *#вирусные инфекции.
ПРИМЕЧАНИЕ
Сообщалось при: *гипертензии; #сердечной недостаточности и/или постинфарктном состоянии.
Передозировка
Вследствие передозировки Валсартаном Сандоз может развиться выраженная артериальная гипотензия, что может привести к угнетению сознания, коллапсу и/или шоку. Если препарат был принят недавно, следует вызвать рвоту. При артериальной гипотензии обычным методом терапии является внутривенное введение солевого раствора.
Выведение валсартана из организма путем гемодиализа маловероятно.
Взаимодействие с другими препаратами
В клинических исследованиях не обнаружено взаимодействий, имеющих клиническое значение, валсартана со следующими лекарственными средствами: циметидин, варфарин, фуросемид, дигоксин, атенолол, индометацин, гидрохлоротиазид, амлодипин, глибенкламид.
Литий.
При одновременном применении ингибиторов АПФ или антагонистов рецепторов ангиотензина II с препаратами лития наблюдалось обратимое повышение концентрации лития в сыворотке крови и появление токсических эффектов. Если существует необходимость совместного приема данных лекарственных средств, необходим тщательный мониторинг сывороточных концентраций лития. Если мочегонное средство также используется, можно предположить увеличение риска токсичности лития при применении Валсартана Сандоз.
Препараты, влияющие на CYP 450.
Поскольку Валсартан Сандоз не подвергается существенному метаболизму, клинически значимого взаимодействия с другими лекарственными препаратами в виде метаболической индукции или угнетения системы цитохрома Р450 при совместном применении с валсартаном не наблюдалось. Несмотря на то, что валсартан имеет высокую степень связывания с белками плазмы, исследования in vitro не продемонстрировали никакого взаимодействия на этом уровне с рядом молекул, которые также имеют высокую степень связывания с белками, а именно — диклофенаком, фуросемидом и варфарином. Калийсберегающие диуретики, препараты калия, препараты, содержащие калий в виде солей и другие препараты, способные повысить уровень калия.
Совместное применение с калийсберегающими диуретиками (например, спиронолактон, триамтерен, амилорид), препаратами калия или препаратами, содержащими калий в виде солей, может привести к повышению уровня калия в сыворотке крови. Следует контролировать уровень калия в случае необходимости совместного введения данных препаратов.
Нестероидные противовоспалительные препараты (НПВП’), включая селективные ингибиторы ЦОГ-2, ацетилсалициловая кислота (> 3 г/сут) и неселективные НПВП. Одновременное применение НПВП и антагонистов рецептора ангиотензина II может привести к ослаблению антигипертензивного эффекта. Кроме того, одновременный прием антагонистов ангиотензина II и НПВП может привести к повышенному риску ухудшения функции почек и увеличение уровня калия в сыворотке крови. В связи с этим,
Транспортеры.
Одновременный прием ингибиторов переноса (рифампин, циклоспорин) или эффлюксных транспортеров (ритонавир) может усиливать действие валсартана.
Двойная блокада ренин-ангиотензиновой-системы (РАС) антагонистами рецепторов ангиотензина, ингибиторами АПФ или алискиреном.
Одновременное применение антагонистов рецепторов ангиотензина, в том числе валсартана, с другими веществами, действующими на РАС связано с увеличением количества случаев гипотензий, гиперкалиемий, и изменений в функции почек по сравнению с монотерапией. Рекомендуется контролировать артериальное давление, функцию почек и уровень электролитов у больных применяющих Валсартан Сандоз и другие вещества, влияющие на РАС.
На основе имеющихся данных, двойная блокада РААС с применением ингибиторов АПФ, антагонистов рецепторов ангиотензина или алискирена не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией. Противопоказано одновременное применение антагонистов рецепторов ангиотензина, в том числе валсартана или ингибиторов АПФ с алискиреном у пациентов с сахарным диабетом или умеренной/ тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Меры предосторожности
Пациенты с дефицитом в организме натрия и/или объема циркулирующей крови (ОЦК). У пациентов с тяжелой степенью дефицита натрия и/или ОЦК, например, у тех, которые получают высокие дозы диуретиков, в отдельных случаях после начала терапии Валсартаном Сандоз может наблюдаться симптоматическая гипотензия. Перед началом лечения следует провести коррекцию содержания в организме натрия и/или ОЦК, например, путем снижения дозы диуретика.
При гипотензии пациента следует уложить и, если необходимо, провести внутривенную инфузию солевого раствора. Лечение можно продолжить сразу после стабилизации артериального давления.
Гиперкалиемия. Следует соблюдать осторожность при совместном применении Валсартана Сандоз с препаратами калия, калийсберегающими диуретиками, препаратами, содержащими калий в виде солей, или другими препаратами, которые могут повысить уровень калия (гепарин и др.). Рекомендуется контролировать содержание калия в крови. Стеноз почечной артерии. Кратковременное применение Валсартана Сандоз у 12 пациентов с вазоренальной гипертензией, являющейся вторичной вследствие одностороннего стеноза почечной артерии, не вызвало никаких существенных изменений гемодинамических параметров почек, креатинина сыворотки или азота мочевины крови. Поскольку другие лекарственные средства, влияющие на ренин-ангиотензин- альдостероновую систему (РААС), могут повышать уровень мочевины крови и креатинина сыворотки у пациентов с односторонним или двусторонним стенозом почечной артерии, как мера безопасности рекомендуется мониторинг этих показателей.
Нарушение функции почек. У пациентов с нарушением функции почек коррекция дозы не требуется. Однако в тяжелых случаях (клиренс креатинина < 10 мл/мин) следует соблюдать осторожность, поскольку опыт применения препарата в этих случаях отсутствует. С осторожностью применять у пациентов, находящихся на гемодиализе.
В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов, находящихся на гемодиализе. Однако валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно. Опыт применения препарата Валсартан Сандоз у пациентов с трансплантацией почки отсутствует.
Следует избегать одновременного применения антагонистов рецепторов ангиотензина, в том числе валсартана, или ингибиторов АПФ с алискиреном у пациентов с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл / мин).
Нарушение функции печени. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза Валсартан Сандоз должен применяться с осторожностью (см. разделы «Противопоказания» и «Фармакокинетика»).
Сердечная недостаточность / Постинфарктное состояние. У пациентов с сердечной недостаточностью или постинфарктным состоянием, принимающих Валсартан Сандоз в обычных дозах, наблюдается незначительное снижение артериального давления, но прекращение терапии из-за длительной симптоматической гипотензии, как правило, не требуется, если соблюдать инструкции по дозировке препарата. Необходимо соблюдать осторожность пациентам с сердечной недостаточностью или в постинфарктном состоянии, начинающим терапию.
Как следствие угнетения ренин-ангиотензин-альдостероновой системы (РААС), у лиц с повышенной чувствительностью могут наблюдаться нарушения функции почек. У пациентов с тяжелой сердечной недостаточностью, у которых функция почек зависит от активности ренин-ангиотензин-альдостероновой системы, лечение ингибиторами АПФ или антагонистами рецепторов ангиотензина могло стать причиной олигурии и/или прогрессирующей азотемии, острой почечной недостаточности (редко) и/или летального исхода. Оценка состояния пациентов с сердечной недостаточностью или в постинфарктном состоянии всегда должна включать мониторинг функции почек.
Не рекомендуется одновременный прием тройной комбинации ингибиторов АПФ, (3- блокаторов и валсартана.
Стеноз аортального и митрального клапанов, гипертрофическая кардиомиопатия. Как и при применении других вазодилататоров следует соблюдать особую осторожность при назначении препарата пациентам с аортальным или митральным стенозом, а также гипертрофической кардиомиопатией.
Ангионевротический отек.
Сообщалось о случаях ангионевротического отека, в том числе отека гортани и голосовых связок, что приводит к обструкции дыхательных путей и/или отеку лица, губ, глотки и/или языка у пациентов, получавших валсартан; у некоторых из этих пациентов ранее развивался отек Квинке при приеме других лекарственных препаратов, в том числе ингибиторов АПФ. Следует немедленно прекратить прием Валсартана Сандоз пациентам, у которых развивается ангионевротичекий отек, и препарат не должен назначаться снова. Первичный гиперальдостеронизм. Не рекомендовано назначать Валсартан Сандоз пациентам с первичным гиперальдостеронизмом.
Двойная блокада ренин-ангиотензиновой системы (РАС)
Следует избегать совместного применения антагонистов рецепторов ангиотензина, в том числе валсартана, с ингибиторами АПФ или алискиреном, особенно у пациентов с диабетической нефропатией. В отдельных случаях, когда совместное применение ингибиторов АПФ и антагонистов рецепторов ангиотензина абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции
почек, водно-электролитного баланса, артериального давления. Это относится к назначению валсартана в качестве дополнительной терапии к ингибиторам АПФ у пациентов с хронической сердечной недостаточностью при непереносимости антагонистов альдостерона (спиронолактона), у которых наблюдается сохранение симптомов хронической сердечной недостаточности, несмотря на проведение иной адекватной терапии.
Условия хранения
Хранить при температуре не выше 30°С, предохранять от воздействия влаги. Хранить в недоступном для детей месте.
Купить Сартвал таблетки п/о 160мг №14х2
Цена на Сартвал таблетки п/о 160мг №14х2
Инструкция по применению для Сартвал таблетки п/о 160мг №14х2
Сартавель — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-002327
Торговое название препарата:
Сартавель®
Международное непатентованное название (МНН):
валсартан
Лекарственная форма:
капсулы
Состав на одну капсулу:
Активное вещество:
Валсартан 20,0 мг 40,0 мг 80,0 мг 160,0 мг
Вспомогательные вещества:
Целлюлоза микрокристаллическая 152,7 мг 131,5 мг 89,1 мг 178,2 мг
Кроскармеллоза натрия 3,6 мг 3,6 мг 3,6 мг 7,2 мг
Повидон-К17 0,75 мг 1,5 мг 3,0 мг 6,0 мг
Кремния диоксид коллоидный 1,35 мг 1,8 мг 2,7 мг 5,4 мг
Магния стеарат 1,6 мг 1,6 мг 1,6 мг 3,2 мг
Капсулы твердые желатиновые №2, №0
Состав капсул:
Корпус:
Краситель железа оксид черный — 0,01%
Краситель железа оксид красный 0,008% 0,01%
Краситель железа оксид желтый 0,1763% 0,2727% 0,1763% 0,1714%
Титана диоксид 0,9744% 2% 0,9744% 3%
Желатин до 100% до 100% до 100% до 100%
Крышечка:
Краситель железа оксид черный — 0,01%
Описание:
Дозировка 20 мг. Капсулы твердые желатиновые № 2. Корпус светло-желтого цвета с бежевым оттенком, крышечка светло-желтого цвета с кремовым оттенком непрозрачные.
Дозировка 40 мг. Капсулы твердые желатиновые № 2. Корпус и крышечка светло-желтого цвета с кремовым оттенком непрозрачные.
Дозировка 80 мг. Капсулы твердые желатиновые № 2. Корпус и крышечка светло-желтого цвета с бежевым оттенком непрозрачные.
Дозировка 160 мг. Капсулы твердые желатиновые № 0. Корпус и крышечка светло-коричневого цвета непрозрачные.
Содержимое капсул — смесь порошка и гранул белого или почти белого цвета. Допускается уплотнение содержимого капсул в комки по форме капсулы, легко разрушаемые при надавливании.
Фармакотерапевтическая группа:
ангиотензина II рецепторов антагонист.
Код ATX: С09СА03
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
Валсартан — активный специфический антагонист рецепторов ангиотензина II, предназначенный для приема внутрь. Избирательно блокирует рецепторы подтипа AT1, которые ответственны за эффекты ангиотензина II. Следствием блокады АТ1 рецепторов является повышение плазменной концентрации ангиотензина II, который может стимулировать незаблокированные АТ2— рецепторы. Валсартан не имеет сколько-нибудь выраженной агонистической активности в отношении AT1-рецепторов. Сродство валсартана к рецепторам подтипа AT1 примерно в 20 000 раз выше, чем к рецепторам подтипа АТ2. Вероятность возникновения кашля при применении валсартана очень низкая, что связано с отсутствием влияния на ангиотензинпревращающий фермент (АПФ), который отвечает за деградацию брадикинина.
Сравнение валсартана с ингибитором АПФ, показало, что частота развития сухого кашля была достоверно (р < 0.05) ниже у пациентов, получавших валсартан, чем у пациентов, получавших ингибитор АПФ (2.6% против 7.9%, соответственно). В группе пациентов, у которых ранее при лечении ингибитором АПФ развивался сухой кашель, при лечении валсартаном это осложнение было отмечено в 19.5% случаев, а при лечении тиазидным диуретиком — в 19.0% случаев, в то время как в группе пациентов, получавших лечение ингибитором АПФ, кашель наблюдался в 68.5% случаев (р < 0.05). Валсартан не вступает во взаимодействие и не блокирует рецепторы других гормонов или ионные каналы, имеющие важное значение для регуляции функций сердечно-сосудистой системы. При лечении валсартаном пациентов с артериальной гипертензией отмечается снижение артериального давления (АД), не сопровождающееся изменением частоты сердечных сокращений (ЧСС).
После приема внутрь разовой дозы препарата у большинства пациентов начало антигипертензивного действия отмечается в пределах 2 часов, а максимальное снижение АД достигается в пределах 4-6 часов. После приема препарата антигипертензивное действие сохраняется более 24 часов. При повторных назначениях препарата максимальное снижение АД, вне зависимости от принятой дозы, обычно достигается в пределах 2-4 недель и поддерживается на достигнутом уровне в ходе длительной терапии. В случае комбинации препарата с гидрохлоротиазидом достигается достоверное дополнительное снижение АД. Резкое прекращение приема валсартана не сопровождается резким повышением АД или другими нежелательными последствиями.
Механизм действия валсартана при хронической сердечной недостаточности основан на его способности устранять отрицательные последствия хронической гиперактивации ренин-ангиотензин-альдостероновой системы (РААС) и ее главного эффектора — ангиотензина II, а именно, — вазоконстрикцию; задержку жидкости в организме; пролиферацию клеток, ведущую к ремодели-рованию органов-мишеней (сердце, почки, сосуды); стимуляцию избыточного синтеза гормонов, действующих синергично с РААС (катехоламинов, альдо-стерона, вазопрессина, эндотелина и др.). На фоне применения валсартана при хронической сердечной недостаточности (ХСН) уменьшается предна-грузка, снижается давление заклинивания в легочных капиллярах (ДЗЛК) и диастолическое давление в легочной артерии, повышается сердечный выброс. Наряду с гемодинамическими эффектами, валсартан за счет опосредованной блокады синтеза альдостерона уменьшает задержку натрия и воды в организме.
Установлено, что препарат не оказывал существенного влияния на концентрацию общего холестерина, мочевой кислоты, а также при исследовании натощак — на концентрацию триглицеридов и глюкозы в сыворотке крови.
Фармакокинетика
Валсартан быстро всасывается после приема внутрь, однако степень абсорбции варьирует в широких пределах. Средняя величина абсолютной биодоступности валсартана составляет 23%. Время, необходимое для достижения максимальной концентрации (ТCmax) — 2 часа. После регулярного применения максимальное снижение АД развивается через 4 недели. При применении препарата однократно в сутки кумуляция его незначительная. Концентрация валсартана в плазме крови одинакова у мужчин и женщин.
Валсартан активно связывается с белками сыворотки крови (94-97%), преимущественно с альбумином. Объем распределения валсартана небольшой, около 17 л. Плазменный клиренс относительно низкий (примерно 2 л/час) при сравнении с печеночным кровотоком (примерно 30 л/час). Валсартан не подвергается выраженному метаболизму (около 20% принятой дозы определяется в виде метаболитов). Гидроксильный метаболит определяется в плазме крови в низких концентрациях (менее чем 10% от площади под кривой «концентрация-время» (AUC) валсартана). Этот метаболит фармакологически неактивен. Валсартан выводится двухфазно: альфа-фаза с периодом полувыведения менее 1 часа и бета-фаза с периодом полувыведения – около 9 часов.
Выводится валсартан в основном в неизмененном виде через кишечник (около 83%) и почками (около 13%). Период полувыведения (Т1/2) валсартана составляет 6 часов.
При применении валсартана с пищей уменьшается площадь под кривой «концентрация-время» (AUC) на 48%. Тем не менее, через 8 часов после применения препарата концентрация валсартана в плазме крови, принятого натощак и с пищей, одинакова. Уменьшение AUC не сопровождается клинически значимым уменьшением терапевтического эффекта валсартана, поэтому препарат можно применять как до, так и после приема пищи.
Фармакокинетика у особых групп пациентов
Пациенты с ХСН
У данной категории пациентов TCmax и Т1/2 сходны с таковыми у здоровых добровольцев. Повышение AUC и Cmax прямо пропорционально увеличению дозы препарата (с 40 мг до 160 мг 2 раза/сутки). Фактор кумуляции со-80,0 мг 160,0 мг ставляет в среднем 1,7. При приеме внутрь клиренс валсартана составил приблизительно 4,4 л/час. Возраст пациентов с ХСН не оказывал влияния на клиренс валсартана.
Пациенты в возрасте старше 65 лет
У некоторых пациентов в возрасте старше 65 лет системная биодоступность валсартана выше таковой у пациентов молодого возраста, однако, какая-либо клиническая значимость отсутствует.
Пациенты с нарушением функции почек
Корреляция между функцией почек и системной биодоступностью валсартана отсутствует. У пациентов с нарушениями функции почек и клиренсом 0,01% креатинина (КК) более 10 мл/мин коррекции дозы не требуется. В настоящее время отсутствуют данные о применении у пациентов, находящихся на гемодиализе. Валсартан имеет высокую степень связывания с белками плазмы крови, поэтому его выведение с помощью гемодиализа маловероятно.
Пациенты с нарушением функции печени
У пациентов с легкими и умеренными нарушениями функции печени отме-0,01% чается повышение биодоступности (AUC) валсартана в 2 раза по сравнению со здоровыми добровольцами. Однако не наблюдается корреляции значений AUC валсартана со степенью нарушений функции печени. Применение у пациентов с тяжелыми нарушениями функции печени не изучалось.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
- артериальная гипертензия.
- хроническая сердечная недостаточность у пациентов, получающих стандартную терапию одним или несколькими препаратами: диуретиками, сердечными гликозидами, ингибиторами АПФ или бета-адреноблокаторами. Применение каждого из перечисленных препаратов не является обязательным.
- для повышения выживаемости пациентов после перенесенного острого инфаркта миокарда, осложненного левожелудочковой недостаточностью и/или систолической дисфункцией левого желудочка, при наличии стабильных показателей гемодинамики.
ПРОТИВОПОКАЗАНИЯ
- повышенная чувствительность к любому компоненту препарата;
- беременность, планирование беременности; период лактации;
- возраст до 18 лет;
- тяжелые нарушения функции печени (более 9 баллов по шкале Чайлд-Пью), билиарный цирроз и холестаз;
- одновременное применение антагонистов рецепторов ангиотензина II включая валсартан, или ингибиторов АПФ с алискиреном у пациентов с сахарным диабетом.
С ОСТОРОЖНОСТЬЮ
При двустороннем стенозе почечных артерий, стенозе артерии единственной почки, первичном гиперальдостеронизме, при соблюдении диеты с ограничением потребления поваренной соли, при состояниях, сопровождающихся снижением объема циркулирующей крови (ОЦК) (в том числе диарея, рвота), при печеночной недостаточности легкой и умеренной степени тяжести небилиарного генеза без явлений холестаза, при почечной недостаточности (клиренс креатинина менее 10 мл/мин), в том числе пациентов, находящихся на гемодиализе (клинические данные отсутствуют), валсартан следует назначать с осторожностью; митральный или аортальный стеноз, гипертрофическая обструктивная кардиомиопатия, у пациентов после трансплантации почки. Хроническая сердечная недостаточность II-IV функционального класса по классификации NYHA; одновременное применение антагонистов рецепторов ангиотензина II, включая валсартан, с другими средствами, ингибирующими РААС, такими как ингибиторы АПФ и др.
Не рекомендуется применять валсартан одновременно с ингибиторами АПФ, поскольку данная комбинированная терапия не имеет преимуществ перед монотерапией валсартаном или ингибитором АПФ в отношении показателей общей смертности по любой причине.
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ
Применение препарата Сартавель® противопоказано во время беременности.
Учитывая механизм действия антагонистов рецепторов ангиотензина II нельзя исключить риск для плода. Действие ингибиторов АПФ (препаратов, оказывающих влияние на РААС) на плод, в случае их назначения во втором и третьем триместрах беременности, приводит к его повреждению и гибели. По ретроспективным данным при применении ингибиторов АПФ в первом триместре беременности повышается риск рождения детей с врожденными дефектами. Имеются сообщения о самопроизвольных абортах, олигогидрам-нионе и нарушениях функции почек у новорожденных, матери которых в период беременности неумышленно получали валсартан. Сартавель®, как и любой другой препарат, оказывающий непосредственное влияние на РААС, не следует применять при беременности, а также у женщин, планирующих беременность. При применении средств, воздействующих на РААС, врачу следует проинформировать женщин детородного возраста о потенциальном риске отрицательного влияния данных препаратов на плод во время беременности.
Если беременность выявлена в период лечения препаратом Сартавель® препарат следует отменить как можно скорее.
Неизвестно, выделяется ли валсартан в грудное молоко. Поэтому не следует применять препарат Сартавель® в период кормления грудью.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Капсулы принимать внутрь, не разжевывая.
Артериальная гипертензия
Рекомендуемая начальная доза препарата Сартавель® составляет 80 мг 1 раз в сутки ежедневно, вне зависимости от расовой принадлежности, возраста и пола пациента. Антигипертензивный эффект развивается в первые 2 недели лечения; максимальный эффект отмечается через 4 недели. Тем пациентам, у которых не удается достичь адекватного терапевтического ответа, суточная доза препарата Сартавель® может быть увеличена до максимальной суточной дозы 320 мг или необходимо дополнительно применять диуретические средства.
Хроническая сердечная недостаточность
Рекомендуемая начальная доза препарата Сартавель® составляет 40 мг 2 раза в сутки ежедневно. Дозу препарата Сартавель® следует постепенно увеличить в течение как минимум 2 недель до 80 мг 2 раза в сутки, а при хорошей переносимости — до 160 мг 2 раза в сутки. При этом может потребоваться снижение доз одновременно принимаемых диуретиков. Максимальная суточная доза препарата Сартавель® составляет 320 мг в 2 приема.
Для повышения выживаемости после перенесенного инфаркта миокарда
Лечение следует начинать в течение 12 часов после перенесенного инфаркта миокарда. Начальная доза составляет 20 мг 2 раза в сутки. Повышение дозы проводится методом титрования (40 мг, 80 мг, 160 мг 2 раза в сутки) в течение нескольких последующих недель, до достижения целевой дозы 160 мг 2 раза в сутки. Максимальная суточная доза составляет 320 мг в 2 приема. Как правило, рекомендуется достижение дозы до 80 мг 2 раза в сутки к концу второй недели лечения. Достижение максимальной целевой дозы по 160 мг 2 раза в сутки рекомендуется к концу третьего месяца терапии препаратом Сартавель®. Увеличение дозы зависит от переносимости препарата в период титрования.
В случае развития артериальной гипотензии, сопровождающейся клиническими проявлениями, или нарушения функции почек следует рассмотреть возможность снижения дозы. Оценка состояния пациентов в период после перенесенного инфаркта миокарда должна включать оценку функции почек.
Применение у пациентов в возрасте старше 65 лет
У пожилых пациентов коррекции дозы не требуется.
Пациенты с нарушениями функции почек
У пациентов с нарушениями функции почек коррекции дозы не требуется. В настоящее время отсутствуют клинические данные о применении препарата у пациентов с КК менее 10 мл/мин.
Пациенты с нарушениями функции печени
Пациенты с легкими или умеренными нарушениями функции печени небили-арного генеза без явлений холестаза препарат следует применять с осторожностью, суточная доза не должна превышать 80 мг.
ПОБОЧНОЕ ДЕЙСТВИЕ
Частота побочных эффектов: «очень часто» (1/10 и более); «часто» (1/100 и более, менее 1/10); «нечасто» (1/1000 и более, менее 1/100); «редко» (1/10000 и более, менее 1/1000), «очень редко» (менее 1/10000). Для всех нежелательных явлений, выявленных в клинической практике и при анализе лабораторных показателей (частоту развития которых установить невозможно) использовалась градация «частота неизвестна».
Пациенты с артериальной гипертензией
Со стороны системы кроветворения: частота неизвестна – снижение гемоглобина, гематокрита, нейтропения, тромбоцитопения.
Со стороны иммунной системы: частота неизвестна – реакции повышенной чувствительности, включая сывороточную болезнь.
Нарушения метаболизма: частота неизвестна – повышение содержания калия в сыворотке крови.
Со стороны гепатобилиарной системы: частота неизвестна – нарушение функции печени, включая повышение концентрации билирубина в плазме крови.
Со стороны органа слуха и лабиринтные расстройства: нечасто — вертиго.
Со стороны сердечно-сосудистой системы: частота неизвестна – васкулит.
Со стороны дыхательной системы: нечасто — кашель.
Со стороны желудочно-кишечного тракта: нечасто — боли в животе.
Со стороны кожи и подкожной клетчатки: очень редко – ангионевротический отек; кожная сыпь, зуд; частота неизвестна — буллезный дерматит.
Со стороны костно-мышечной системы: частота неизвестна – миалгия.
Со стороны почек: частота неизвестна – нарушения функции почек, повышение концентрации креатинина в сыворотке крови.
Прочие: нечасто — повышенная утомляемость.
Также в ходе клинических исследований у пациентов с артериальной ги-пертензией, наблюдались следующие нежелательные явления, причинно-следственная связь с приемом препарата не установлена: артралгия, астения, боль в спине, диарея, головокружение, бессонница, снижение либидо, тошнота, периферические отеки, фарингит, ринит, синусит, инфекции верхних дыхательных путей, вирусные инфекции.
Пациенты, которые получали препарат после перенесенного инфаркта миокарда и/или ХСН
Со стороны системы кроветворения: частота неизвестна – тромбоцитопения.
Со стороны иммунной системы: частота неизвестна – реакции повышенной чувствительности, включая сывороточную болезнь. Нарушения метаболизма: нечасто – гиперкалиемия.
Со стороны нервной системы: часто – головокружение, постуральное головокружение; нечасто – обморок, головная боль.
Со стороны органа слуха и лабиринтные расстройства: нечасто — вертиго.
Со стороны сердечно-сосудистой системы: часто – выраженное снижение АД, ортостатическая гипотензия; нечасто – усиление симптомов течения ХСН; частота неизвестна – васкулит.
Со стороны дыхательной системы: нечасто — кашель.
Со стороны желудочно-кишечного тракта: нечасто – тошнота, диарея.
Со стороны костно-мышечной системы: редко – рабдомиолиз, частота неизвестна – миалгия.
Со стороны почек: часто – нарушения функции почек; нечасто – острая почечная недостаточность, повышение концентрации креатинина в сыворотке крови; частота неизвестна – повышение содержания азота мочевины в плазме крови.
Общие нарушения: нечасто – астения, повышенная утомляемость.
Со стороны гепатобилиарной системы: частота неизвестна – нарушение функции печени.
ПЕРЕДОЗИРОВКА
Симптомы: при передозировке препарата Сартавель® основным проявлением является выраженное снижение АД, которое может привести к угнетению сознания, коллапсу и/или шоку.
Лечение: симптоматическое, характер которого зависит от времени, прошедшего с момента приема препарата, и от степени тяжести симптомов. При случайной передозировке следует вызвать рвоту (если препарат принят недавно) или провести промывание желудка. При выраженном снижении АД обычным методом терапии является внутривенное введение 0.9% раствора натрия хлорида, пациента следует уложить, приподняв ноги, на необходимый для терапии период времени, принять активные меры по поддержанию деятельности сердечно-сосудистой системы, включая регулярный контроль деятельности сердца и дыхательной систем, объема ОЦК и количества выделяемой мочи.
Маловероятно, что валсартан можно вывести из организма при помощи гемодиализа.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ
Двойная блокада РААС при применении антагонистов рецепторов ан—гиотензина II, ингибиторов АПФ или алискирена
Одновременное применение антагонистов рецепторов ангиотензина II, включая валсартан, с другими препаратами, оказывающими влияние на РААС, связано с повышенной частотой развития артериальной гипотензии, гиперкалиемии и нарушений функции почек по сравнению с монотерапией. Рекомендуется контроль артериального давления, функции почек и содержания электролитов у пациентов, принимающих препарат Сартавель® и другие лекарственные средства, оказывающие влияние на РААС. Установлено, что при монотерапии валсартаном отсутствуют клинически значимые взаимодействия со следующими лекарственными препаратами: циметидин, варфарин, фуросемид, дигоксин, атенолол, индометацин, ги-дрохлоротиазид, амлодипин и глибенкламид.
Нестероидные противовоспалительные препараты (НПВП):
при одновременном применении с НПВП (включая селективные ингибиторы циклооксигеназы-2 (ЦОГ-2)) возможно снижение антигипертензивного действия валсартана. При применении антагонистов рецепторов ангиотензина II одновременно с НПВП возможно ухудшение функции почек и повышение содержания калия в плазме крови. При необходимости одновременного применения валсартана и НПВП до начала терапии необходимо провести оценку функции почек и коррекцию нарушений водно-электролитного баланса.
Препараты лития:
при одновременном применении ингибиторов АПФ и антагонистов рецепторов ангиотензина II одновременно с препаратами лития отмечается повышение содержания лития в плазме крови и усиление его токсического действия. Сартавель® не рекомендуется применять одновременно с препаратами лития (опыт применения ограничен). При необходимости одновременного применения препарата Сартавель® и препаратов лития необходимо обеспечить контроль содержания лития в плазме крови.
Препараты калия:
одновременное применение калийсберегающих диуретиков (в т.ч. спиронолактона, триамтерена, амилорида), препаратов калия или солей, содержащих калий, может привести к увеличению содержания калия в сыворотке крови и у пациентов с сердечной недостаточностью к увеличению концентрации креатинина сыворотки крови. Если такое комбинированное лечение признано необходимым, следует соблюдать осторожность.
Белки—переносчики
По результатам исследования in vitro на культурах печени валсартан является субстратом для белков-переносчиков ОАТЗ1В1 и MRP2. Одновременное назначение валсартана с ингибиторами белка-переносчика ОАТР1В1 (рифампицин, циклоспорин) и с ингибитором белка-переносчика MRP2 (ритонавир) может увеличить системную экспозицию Сартавеля® (Cmax и AUC).
ОСОБЫЕ УКАЗАНИЯ
Дефицит в организме натрия и/или снижение объема циркулирующей крови (ОЦК)
У пациентов с выраженным дефицитом в организме натрия и/или сниженным ОЦК, например, получающих высокие дозы диуретиков, в редких случаях в начале лечения препаратом Сартавель® может возникать артериальная гипотензия, сопровождающаяся клиническими проявлениями. Перед началом лечения препаратом Сартавель® следует провести коррекцию содержания в организме натрия и/или ОЦК, в том числе, путем уменьшения дозы диуретика.
В случае развития артериальной гипотензии пациента следует уложить, ноги приподнять. При необходимости провести внутривенную инфузию 0,9% раствором натрия хлорида. После того, как АД стабилизируется, лечение препаратом Сартавель® можно продолжать.
Гиперкалиемия
При одновременном применении с биологически активными добавками, содержащими калий, калийсберегающими диуретиками, калийсодержащими заменителями соли, или с другими лекарственными препаратами, которые могут вызывать гиперкалиемию (например, с гепарином), следует соблюдать осторожность и проводить регулярный контроль содержания калия в крови.
Стеноз почечной артерии
Применение препарата Сартавель® коротким курсом у пациентов с ренова-скулярной гипертензией, развившейся вторично вследствие одностороннего стеноза почечной артерии, не привело к сколько-нибудь существенным изменениям почечной гемодинамики, концентрации креатинина сыворотки крови или азота мочевины крови. Однако, учитывая, что другие лекарственные средства, влияющие на РААС, могут вызвать повышение концентрации мочевины и креатинина в сыворотке крови у пациентов с двусторонним или односторонним стенозом почечной артерии, в качестве меры предосторожности рекомендуется контроль этих показателей.
Нарушения функции почек
Пациентам с нарушением функции почек не требуется коррекции дозы препарата. Однако, при выраженных нарушениях функции почек (когда клиренс креатинина составляет менее 10 мл/мин) рекомендуется соблюдать осторожность. Следует избегать одновременного применения антагонистов рецепторов ангиотензина II, включая валсартан, или ингибиторов АПФ с алискиреном у пациентов с тяжелыми нарушениями функции почек (КК менее 30 мл/мин).
Трансплантация почки
Данных о безопасности применения препарата Сартавель® у пациентов, перенесших трансплантацию почки, нет.
Нарушение функции печени
У пациентов с печеночной недостаточностью не требуется коррекции дозы препарата, за исключением случаев холестаза. Валсартан выводится главным образом в неизмененном виде с желчью через кишечник, и было показано, что у пациентов с обструкцией желчевыводящих путей клиренс валсарта-на снижен. При назначении препарата Сартавель® этим пациентам следует соблюдать особую осторожность.
Отек Квинке
Отек Квинке, в том числе гортани и голосовых складок, приводящих к обструкции дыхательных путей, и/или отек лица, губ, глотки и/или отек языка, встречался у пациентов, получавших валсартан, у некоторых из этих пациентов ранее возникал отек Квинке на фоне приема других препаратов, в том числе ингибиторов АПФ. Прием препарата Сартавель® в случае развития отека Квинке должен быть немедленно отменен, возобновление приема препарата Сартавель® запрещено.
Первичный гиперальдостеронизм
Препарат неэффективен для терапии артериальной гипертензии у пациентов с первичным гиперальдостеронизмом, поскольку у данной категории пациентов не отмечается активация РААС. ХСН/период после перенесенного инфаркта миокарда У пациентов с ХСН или после перенесенного инфаркта миокарда, начинающих лечение препаратом Сартавель®, часто отмечается некоторое снижение АД, в связи с чем, рекомендуется контролировать АД в начале терапии. При условии соблюдения рекомендаций по режиму дозирования обычно не возникает необходимости отмены Сартавель® по причине артериальной гипотензии. Оценка состояния пациентов с ХСН должна включать оценку функции почек.
Вследствие ингибирования РААС у некоторых пациентов возможны нарушения функции почек. У пациентов с ХСН II-IV функционального класса по классификации NYHA лечение ингибиторами АПФ и антагонистами рецепторов ангиотензина II может сопровождаться олигурией и/или нарастанием азотемии и (редко) острой почечной недостаточностью и/или смертельным исходом. Поэтому у данных категорий пациентов перед применением препарата Сартавель®, а также периодически во время терапии препаратом, необходимо проводить оценку функции почек. Комбинированная терапия при артериальной гипертензии При артериальной гипертензии препарат Сартавель® может применяться в монотерапии, а так же одновременно с другими гипотензивными препаратами.
Комбинированная терапия в период после перенесенного инфаркта миокарда
Возможно применение препарата Сартавель® в комбинации с другими препаратами, применяемыми после перенесенного инфаркта миокарда, а именно: тромболитиками, ацетилсалициловой кислотой в качестве антиагрегантного средства, бета-адреноблокаторами и ингибиторами ГМГ-КоА-редуктазы (статинами).
У данной категории пациентов не рекомендуется применять препарат Сартавель® одновременно с ингибиторами АПФ, поскольку данная комбинированная терапия не имеет преимуществ перед монотерапией валсартаном или ингибитором АПФ в отношении показателей общей смертности по любой причине.
Комбинированная терапия при ХСН
При ХСН препарат Сартавель® может применяться как в монотерапии, так и одновременно с другими препаратами – диуретиками, сердечными гликози-дами, а также ингибиторами АПФ или бета-адреноблокаторами. У данной категории пациентов не рекомендуется применение тройной комбинированной терапии ингибиторов АПФ, бета-адреноблокатором и препаратом Сартавель®.
Влияние на способность управлять автотранспортом и работать с механизмами
С осторожностью применяют у пациентов, управляющих автотранспортными средствами и занимающихся деятельностью, требующей повышенного внимания и быстроты двигательных и психических реакций (риск развития головокружения или обморока).
Форма выпуска
Капсулы 20 мг, 40 мг, 80 мг и 160 мг.
По 10, 20, 30 капсул в контурную ячейковую упаковку из пленки поливинилх-лоридной и фольги алюминиевой печатной лакированной. По 10, 20, 30, 40, 50 или 100 капсул в банки полимерные для лекарственных средств.
Одну банку или 1, 2, 3, 4, 5, 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную упаковку (пачку).
Условия хранения
В защищенном от света месте при температуре не выше 25 °С Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать после истечения срока годности.
Условия отпуска
По рецепту.
Юридический адрес: 445351, Россия, Самарская обл., г. Жигулевск, ул. Песочная, д. 11
Адрес места производства (адрес для переписки, в том числе для приема претензий):
445351, Россия, Самарская обл., г. Жигулевск, ул. Гидростроителей, д. 6
ПРОИЗВОДИТЕЛЬ
ООО «Озон»
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Сартвал инструкция по применению
Официальная инструкция лекарственного препарата Сартвал таблетки 80 мг, 160 мг. Описание и применение Sartval, аналоги и отзывы. Инструкция Сартвал таблетки утвержденная компанией производителем.
Общая характеристика
Международное непатентованное наименование
Valsartan.
Описание
САРТВАЛ 80 мг: бледно-красные круглые таблетки, покрытые оболочкой, со скошенными краями, с риской на одной стороне таблетки; с надписями «D» с одной стороны риски и «V» — с другой; и надписью «NVR» с обратной стороны таблетки.
САРТВАЛ 160 мг: серо-оранжевые овальные таблетки, покрытые оболочкой, слегка выпуклые, с риской на одной стороне таблетки; с надписями «DX» с одной стороны риски и «DX» — с другой, и с надписью «NVR» с обратной стороны таблетки.
Состав лекарственного средства
1 таблетка содержит 80 мг или 160 мг валсартана;
вспомогательные вещества:
САРТВАЛ 80 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172).
САРТВАЛ 160 мг: целлюлоза микрокристаллическая, кросповидон, кремния диоксид коллоидный безводный, магния стеарат, гипромеллоза, титана диоксид (Е171), макрогол 8000, железа оксид красный (Е172), железа оксид желтый (Е172), железа оксид черный (Е172).
Форма выпуска
Таблетки, покрытые оболочкой.
Фармакотерапевтическая группа
Антагонисты рецепторов ангиотензина II.
Код АТХ: С09СА03.
Фармакологические свойства
Фармакодинамика
Валсартан является активным специфическим блокатором (антагонистом) рецепторов ангиотензина II (БРА), предназначенным для приема внутрь. Он действует избирательно на рецепторы подтипа AT1, которые ответственны за действие ангиотензина II. Повышенные уровни ангиотензина II в плазме вследствие блокады АТ1-рецепторов валсартаном могут стимулировать незаблокированные АТ2-рецепторы, которые уравновешивают эффект АТ1-рецепторов. Валсартан не проявляет какой-либо активности агониста в отношении АТ1-рецепторов, но обладает большим (примерно в 20000 раз) сродством к АТ1-рецепторам, чем к АТ2-рецепторам.
Валсартан не угнетает ангиотензинпревращающий фермент (АПФ), известный также под названием кининазы II, который превращает ангиотензин I в ангиотензин II и влияет на систему брадикинина. В клинических испытаниях, в которых валсартан сравнивали с ингибитором АПФ, частота развития сухого кашля была значительно ниже (р<0,05) у пациентов, получавших валсартан, чем у пациентов, получавших ингибитор АПФ (2,6% против 7,9% соответственно). Применение препарата у пациентов с артериальной гипертензией приводит в итоге к снижению артериального давления без влияния на частоту пульса.
Начало гипотензивного действия отмечается в пределах 2 часов, максимум — в пределах 4-6 часов после приема внутрь; продолжительность действия — свыше 24 часов. Максимальный терапевтический эффект развивается через 2-4 недели от начала лечения и сохраняется при длительной терапии. При применении с гидрохлоротиазидом достигается достоверное дополнительное снижение артериального давления.
Внезапная отмена препарата не сопровождается развитием синдрома отмены.
Применение препарата приводит к уменьшению случаев госпитализации по поводу сердечной недостаточности, замедлению прогрессирования сердечной недостаточности, улучшению функционального класса по классификации NYHA, увеличению фракции выброса, а также к уменьшению признаков и симптомов сердечной недостаточности и улучшению качества жизни по сравнению с плацебо.
Применение комбинации иАПФ и БРА изучалось в двух крупных рандомизированных контролируемых исследованиях (ONTARGET и VA NEPHRON-D). Исследование ONTARGET проводилось у пациентов с сердечным или сердечно-сосудистым заболеванием или с сахарным диабетом 2 типа с наличием поражения органов-мишеней. Исследование VA NEPHRON-D включало пациентов с сахарным диабетом 2 типа и диабетической нефропатией. Эти исследования не продемонстрировали достоверного благоприятного эффекта в отношении почек и/или сердечно-сосудистой системы, а также смертности, при этом наблюдалось увеличение риска гиперкалиемии, острой почечной недостаточности и/или гипотензии по сравнению с монотерапией. С учетом схожих свойств фармакодинамики результаты этих исследований также актуальны для других иАПФ и БРА. Поэтому не следует одновременно применять иАПФ и БРА у пациентов с диабетической нефропатией.
В исследовании ALTITUDE изучалась возможная польза от добавления алискирена к стандартной терапии иАПФ или БРА у пациентов с сахарным диабетом 2 типа и хроническим заболеванием почек и/или сердечно-сосудистым заболеванием. Исследование было прекращено досрочно и-за повышенного риска неблагоприятных исходов. Сердечно-сосудистая смерть и инсульт в группе алискирена наблюдались чаще, чем в группе плацебо, и сообщения о нежелательных явлениях и изучаемых серьезных нежелательные явлениях (гиперкалиемия, гипотензия и нарушение функции почек) чаще возникали в группе алискирена, чем в группе плацебо.
Фармакокинетика
После приема препарата внутрь натощак максимальная концентрация валсартана в плазме достигается через 2-4 часа. Средняя величина биодоступности препарата составляет 23%. При назначении валсартана с пищей площадь под кривой «концентрация-время» (AUC) уменьшается на 48%, хотя, начиная примерно с 8 часов после приема препарата, концентрации в плазме как в случае приема его натощак, так и в случае приема с пищей одинаковы. Уменьшение площади под кривой AUC, однако, не сопровождается значительным снижением терапевтического эффекта.
Значительная часть валсартана не подвергается биотрансформации, только около 20% дозы выводится в виде метаболитов. Гидроксиметаболит обнаруживается в плазме крови в низких концентрациях (менее 10% от AUC валсартана). Этот метаболит фармакологически неактивен.
Кинетика элиминации валсартана имеет мультиэкспоненциальный характер (t1/2α< 1 ч и t1/2β около 9 ч.).
При приеме препарата один раз в сутки кумуляция незначительна. Концентрации препарата в плазме крови у женщин и мужчин были одинаковы.
Валсартан в значительной степени связывается с белками плазмы крови (94-97 %), преимущественно с альбумином. Объем распределения в период равновесного состояния низкий (около 17 л). После внутривенного введения плазменный клиренс валсартана составляет около 2 л/ч и его почечный клиренс составляет 0,62 л/ч (около 30% от общего клиренса). Период полураспада составляет 6 часов. Количество валсартана, выводимого с калом, составляет 83% (от величины принятой внутрь дозы), примерно 13% выводится с мочой, преимущественно в неизмененном виде.
Среднее время достижения максимальной концентрации и период полувыведения валсартана у пациентов с сердечной недостаточностью и здоровых добровольцев одинаковы. Величины площади под кривой «концентрация-время» и максимальной концентрации валсартана увеличиваются линейно и почти пропорционально повышению дозы в пределах диапазона доз 40-160 мг два раза в сутки. Коэффициент кумуляции в среднем равен 1,7. Клиренс валсартана после приема внутрь составляет примерно 4,5 л/час. Возраст не влияет на клиренс препарата у пациентов с сердечной недостаточностью.
Фармакокинетика у отдельных групп пациентов
Пожилые пациенты
У некоторых пациентов пожилого возраста системное воздействие валсартана было несколько более выражено, чем у пациентов молодого возраста; однако не было показано какой-либо клинической значимости этого.
Пациенты с нарушением функции почек
Для соединений, почечный клиренс которых составляет менее 30% общего плазменного клиренса, отсутствует корреляция между функцией почек и системным воздействием. Поэтому у пациентов с нарушением функции почек (клиренс креатинина > 10 мл/мин) коррекция дозы препарата не требуется. В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов с клиренсом креатинина <10 мл/мин и у пациентов, находящихся на гемодиализе, поэтому валсартан следует применять с осторожностью у этих пациентов. Однако валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно.
Пациенты с нарушением функции печени
Около 70% от величины всосавшейся дозы препарата экскретируется с желчью, преимущественно в неизмененном виде. У пациентов с легкой и умеренной печеночной недостаточностью наблюдается увеличение в два раза AUC по сравнению со здоровыми людьми. Тем не менее, корреляция между концентрацией валсартана в плазме и степенью нарушения функции печени не обнаружена. Применение валсартана не изучалось у пациентов с тяжелым нарушением функции печени (см. разделы «Противопоказания», «Способ применения и дозы», «Меры предосторожности»).
Педиатрические пациенты
В исследовании у 26 детей с артериальной гипертензией (в возрасте от 1 до 16 лет), получавших однократную дозу суспензии валсартана (в среднем 0,9-2 мг/кг, максимальная доза 80 мг), клиренс (л/час/кг) валсартана был сопоставим у детей разного возраста внутри возрастной группы 1-16 лет и аналогичен таковому у взрослых, получавших препарат в той же лекарственной форме.
Сартвал Показания к применению
— Артериальная гипертензия у взрослых и детей от 6 до 18 лет (см. разделы «Противопоказания», «Меры предосторожности», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Фармакодинамика»).
— Сердечная недостаточность: лечение сердечной недостаточности с клинической симптоматикой у взрослых пациентов, не получающих ингибиторы ангиотензинпревращающего фермента (иАПФ), или в качестве дополнительной терапии к иАПФ у пациентов, не получающих бета-блокаторы, если нельзя использовать антагонисты минералокортикоидных рецепторов (см. разделы «Способ применения и дозы», «Меры предосторожности», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Фармакодинамика»).
— Недавно перенесенный инфаркт миокарда (у клинически стабильных взрослых пациентов с клиническими проявлениями сердечной недостаточности или бессимптомной систолической дисфункцией левого желудочка после перенесенного (12 часов — 10 дней) инфаркта миокарда).
Способ применения Сартвал и дозировка
Способ применения
САРТВАЛ принимают внутрь независимо от приема пищи, запивая водой.
Риска способствует разламыванию для облегчения глотания и не обеспечивает деления таблетки 80 мг и 160 мг на две равные дозы.
Артериальная гипертензия
Рекомендуемая стартовая доза препарата САРТВАЛ для взрослых составляет 80 мг или 160 мг один раз в сутки. Антигипертензивный эффект достигается в течение двух недель, а максимальный эффект наступает через четыре недели. Пациентам, у которых не удается достичь адекватного снижения артериального давления, суточную дозу можно повысить до 160 мг, или, максимально, до 320 мг; возможно дополнительное назначение диуретиков.
САРТВАЛ можно назначать также совместно с другими антигипертензивными средствами (см. разделы «Противопоказания», «Меры предосторожности», «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий», «Фармакодинамика»).
Сердечная недостаточность
Рекомендуемая начальная доза САРТВАЛа составляет 40 мг два раза в сутки. Повышение дозы до 80 мг и 160 мг два раза в сутки должно осуществляться с интервалом не менее 2 недель, с учетом переносимости препарата пациентом. Максимальная суточная доза, которая применялась в клинических исследованиях, составила 320 мг, распределенная на несколько приемов. При сопутствующем лечении диуретиком следует рассмотреть вопрос о снижении дозы последнего.
Поскольку наличие риски не обеспечивает возможность деления таблетки 80 мг на две равные части, данная лекарственная форма не может обеспечить дозировку 40 мг. При необходимости назначения валсартана в дозе 40 мг следует воспользоваться лекарственным средством, которое обеспечивает требуемую разовую дозу.
САРТВАЛ может назначаться совместно с другими лекарственными средствами, применяемыми для лечения сердечной недостаточности. Не рекомендуется одновременный прием тройной комбинации иАПФ, валсартана и бета-блокатора или калийсберегающего диуретика (см. разделы «Меры предосторожности», «Фармакодинамика»).
Оценка состояния пациентов с сердечной недостаточностью всегда должна включать мониторинг функции почек.
Постинфарктное состояние
У клинически стабильных пациентов лечение можно начать уже через 12 часов после инфаркта миокарда. После начальной дозы 20 мг два раза в сутки дозу валсартана необходимо увеличивать до 40 мг, 80 мг и 160 мг два раза в сутки в течение следующих нескольких недель.
Данная лекарственная форма не может обеспечить дозировку 20 мг. При необходимости назначения валсартана в дозе 20 мг необходимо воспользоваться лекарственным средством, которое обеспечивает требуемую разовую дозу. Максимальная доза — 160 мг два раза в сутки. В целом рекомендуется, чтобы доза 80 мг два раза в сутки достигалась в течение двух недель после начала лечения, а целевая максимальная доза — в течение трех месяцев, исходя из переносимости пациентом валсартана в период титрования дозы. Если возникает симптоматическая артериальная гипотензия или почечная дисфункция, следует рассмотреть вопрос о снижении дозы.
Валсартан можно назначать пациентам, которые лечились другими препаратами, рекомендованными после инфаркта миокарда (например, тромболитиками, ацетилсалициловой кислотой, бета-блокаторами и статинами). Не рекомендуется одновременный прием тройной комбинации иАПФ, бета-блокаторов и валсартана.
Оценка состояния пациентов после инфаркта миокарда всегда должна включать мониторинг функции почек.
САРТВАЛ может применяться для лечения гипертензии у пациентов с нарушенной толерантностью к глюкозе и риском сердечно-сосудистой недостаточности. Рекомендации по дозированию см. в разделе «Артериальная гипертензия».
Препарат можно принимать независимо от приема пищи, запивая небольшим количеством воды.
Отдельные группы пациентов
Артериальная гипертензия у детей и подростков
Дети от 6 до 18 лет
Для детей c массой тела менее 35 кг начальная доза составляет 40 мг один раз в день.
Поскольку наличие риски не обеспечивает возможность деления таблетки 80 мг на две равные части, данная лекарственная форма не может обеспечить дозировку 40 мг. При необходимости назначения валсартана в дозе 40 мг следует воспользоваться лекарственным средством, которое обеспечивает требуемую разовую дозу.
Для детей с массой тела 35 кг и более начальная доза составляет 80 мг один раз в день. Дозу следует корректировать в зависимости от действия на артериальное давление. Максимальные дозы, изученные в клинических испытаниях, приведены в таблице ниже. Дозы, превышающие указанные, не были изучены и поэтому не рекомендуются.
| Масса тела | Максимальные дозы, изученные в клинических испытаниях |
| ≥ 18 кг … < 35 кг | 80 мг |
| ≥ 35 кг … < 80 кг | 160 мг |
| ≥ 80 кг … ≤ 160 кг | 320 мг |
Дети до 6 лет
Безопасность и эффективность препарата САРТВАЛ у детей младше 6 лет не установлена.
Сердечная недостаточность и недавно перенесенный инфаркт миокарда у детей и подростков
САРТВАЛ не рекомендуется для лечения сердечной недостаточности или недавно перенесенного инфаркта миокарда у детей и подростков в возрасте до 18 лет в связи с отсутствием данных о безопасности и эффективности.
Пациенты пожилого возраста
Нет необходимости в коррекции дозы у пациентов пожилого возраста.
Пациенты с нарушением функции почек
Дети от 6 до 18 лет
Применение у детей с клиренсом креатинина <30 мл/мин или находящихся на диализе не изучалось, поэтому таким пациентам валсартан не рекомендуется. Не требуется коррекции дозы у детей с клиренсом креатинина более 30 мл/мин. Следует тщательно контролировать функцию почек и уровень калия в сыворотке крови (см. разделы «Меры предосторожности» и «Фармакокинетика»).
Взрослые
Нет необходимости коррекции дозы у взрослых пациентов с клиренсом креатинина более 10 мл/мин.
Пациенты с нарушением функции печени
Валсартан противопоказан пациентам с тяжелой печеночной недостаточностью, билиарным циррозом печени или обструкцией желчных путей. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза доза валсартана не должна превышать 80 мг (см. раздел «Меры предосторожности»).
Побочные действия
Частота возникновения побочных реакций оценивается следующим образом: очень часто ≥ 1/10, часто — от ≥ 1/100, <1/10, нечасто — от ≥ 1/1000, < 1/100, редко — от ≥ 1/10000, <1/1000, очень редко — < 1/10000.
Со стороны крови и лимфатической системы: частота неизвестна — *снижение гемоглобина, *снижение гематокрита, *нейтропения, *#тромбоцитопения.
Со стороны иммунной системы: частота неизвестна — *#реакции гиперчувствительности, включая сывороточную болезнь.
Нарушение обмена веществ: частота неизвестна — *#увеличение содержания калия в крови, *#гипонатриемия; нечасто — #гиперкалиемия.
Нарушения со стороны нервной системы: часто — #головокружение, #постуральное головокружение; нечасто — #обмороки, #головная боль.
Со стороны органов слуха: нечасто — *#вертиго.
Со стороны сердечно-сосудистой системы: частота неизвестна — *#васкулит, часто — #ортостатическая гипотензия, #гипотензия; нечасто — #сердечная недостаточность.
Со стороны дыхательной системы: нечасто — *#кашель.
Со стороны пищеварительной системы: нечасто — *боль в животе, #диарея, #тошнота.
Со стороны гепатобилиарной системы: частота неизвестна — #повышение уровня печеночных ферментов, *повышение уровня печеночных ферментов, включая повышение уровня билирубина в крови.
Со стороны кожи и подкожно-жировой клетчатки: частота неизвестна — *ангионевротический отек, *#буллезный дерматит, *#сыпь, *#зуд; нечасто — #ангионевротический отек.
Со стороны скелетно-мышечной системы: частота неизвестна — *#миалгия.
Со стороны мочеполовой системы: частота неизвестна — *нарушение функции почек, *почечная недостаточность, *повышение уровня креатинина в сыворотке крови, #увеличение содержания мочевины крови; часто — #нарушение функции почек, #почечная недостаточность, нечасто — #острая почечная недостаточность, #повышение уровня креатинина в крови.
Общие нарушения: нечасто — *#слабость; #астения.
Следующие побочные эффекты наблюдались в ходе клинических исследований независимо от их причинной связи с исследуемым препаратом: *#артралгия, #абдоминальная боль, *астения, *#боль в спине, *диарея, *головокружение, *головная боль, *#бессонница, *#снижение либидо, #нейтропения, *тошнота, *#отеки, *#фарингит, *#ринит, *#синусит, *#инфекции верхних дыхательных путей, *#вирусные инфекции.
Примечание
Сообщалось при: *гипертензии; #сердечной недостаточности и/или постинфарктном состоянии.
Педиатрические пациенты (гипертензия)
Антигипертензивный эффект валсартана оценивался в двух рандомизированных, двойных слепых клинических исследованиях у 561 детей от 6 до 18 лет. Не было выявлено значимых отличий по типу, частоте и тяжести побочных эффектов между профилем безопасности для детей в возрасте от 6 до 18 лет и ранее известным профилем безопасности у взрослых пациентов.
Оценка нейрокогнитивной функции и развития у детей в возрасте от 6 до 16 лет не выявила клинически значимого отрицательного влияния после лечения САРТВАЛом продолжительностью до одного года.
В двойном слепом рандомизированном исследовании у 90 детей в возрасте от 1 года до 6 лет, за которым последовало открытое продление на один год, два человека умерли и наблюдалось отдельные случаи выраженного повышения печеночных трансаминаз. Во втором исследовании, в котором были рандомизированы 75 детей в возрасте от 1 года до 6 лет, не было ни одного случая смерти и отмечался один случай выраженного повышения печеночных трансаминаз в течение открытого продления на один год. Эти случаи имели место в популяции пациентов со значительными сопутствующими заболеваниями. Не было установлено причинно-следственной связи с приемом САРТВАЛа.
У детей в возрасте от 6 до 18 лет с хроническими заболеваниями почек наблюдалась гиперкалиемия.
Противопоказания Сартвал
— Повышенная чувствительность к валсартану или к любому из компонентов препарата.
— Беременность.
— Тяжелая печеночная недостаточность, билиарный цирроз печени и обструкция желчных путей.
— Одновременное применение иАПФ или блокаторов (антагонистов) рецепторов ангиотензина II (БРА) с препаратами, содержащими алискирен, у пациентов с сахарным диабетом или умеренной/тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Передозировка
Вследствие передозировки САРТВАЛа может развиться выраженная артериальная гипотензия, что может привести к угнетению сознания, коллапсу и/или шоку. Если препарат был принят недавно, следует вызвать рвоту. При артериальной гипотензии обычным методом терапии является внутривенное введение солевого раствора.
Выведение валсартана из организма путем гемодиализа маловероятно.
Меры предосторожности
Пациенты с дефицитом в организме натрия и/или объема циркулирующей крови (ОЦК). У пациентов с тяжелой степенью дефицита натрия и/или объема циркулирующей крови в организме, например, у тех, которые получают высокие дозы диуретиков, в отдельных случаях после начала терапии может наблюдаться симптоматическая гипотензия. Перед началом лечения следует провести коррекцию содержания в организме натрия и/или объема циркулирующей крови, например, путем снижения дозы диуретика.
При гипотензии пациента следует уложить и, если необходимо, провести внутривенную инфузию солевого раствора. Лечение можно продолжить сразу после стабилизации артериального давления.
Гиперкалиемия. Следует соблюдать осторожность при совместном применении САРТВАЛа с препаратами калия, калийсберегающими диуретиками, препаратами, содержащими калий в виде солей, или другими препаратами, которые могут повысить уровень калия (гепарин и др.). Рекомендуется контролировать содержание калия в крови.
Стеноз почечной артерии. Кратковременное применение САРТВАЛа у 12 пациентов с вазоренальной гипертензией, являющейся вторичной вследствие одностороннего стеноза почечной артерии, не вызвало никаких существенных изменений гемодинамических параметров почек, креатинина сыворотки или азота мочевины крови. Поскольку другие лекарственные средства, влияющие на ренин-ангиотензин-альдостероновую систему (РAAС), могут повышать уровень мочевины крови и креатинина сыворотки у пациентов с односторонним или двусторонним стенозом почечной артерии, как мера безопасности рекомендуется мониторинг этих показателей.
Нарушение функции почек. У пациентов с нарушением функции почек коррекция дозы не требуется. Однако в тяжелых случаях (клиренс креатинина <10 мл/мин) следует соблюдать осторожность, поскольку опыт применения препарата в этих случаях отсутствует. С осторожностью применять у пациентов, находящихся на гемодиализе.
В настоящее время отсутствует опыт по безопасному применению валсартана у пациентов, находящихся на гемодиализе. Однако валсартан имеет высокую степень связывания с белками плазмы, поэтому его выведение при гемодиализе маловероятно. Опыт применения препарата САРТВАЛ у пациентов с трансплантацией почки отсутствует.
Нарушение функции печени. У пациентов с легкой и умеренной печеночной недостаточностью без холестаза САРТВАЛ должен применяться с осторожностью (см. разделы «Противопоказания» и «Фармакокинетика»).
Сердечная недостаточность/Постинфарктное состояние. У пациентов с сердечной недостаточностью или постинфарктным состоянием, принимающих САРТВАЛ в обычных дозах, наблюдается незначительное снижение артериального давления, но прекращение терапии из-за длительной симптоматической гипотензии, как правило, не требуется, если соблюдать инструкции по дозированию препарата. Необходимо соблюдать осторожность у пациентов с сердечной недостаточностью или в постинфарктном состоянии, начинающих терапию.
Как следствие угнетения ренин-ангиотензин-альдостероновой системы (РAAС), у лиц с повышенной чувствительностью могут наблюдаться нарушения функции почек. У пациентов с тяжелой сердечной недостаточностью, у которых функция почек зависит от активности РААС, лечение иАПФ или БРА могло стать причиной олигурии и/или прогрессирующей азотемии, острой почечной недостаточности (редко) и/или летального исхода. Оценка состояния пациентов с сердечной недостаточностью или в постинфарктном состоянии всегда должна включать мониторинг функции почек.
Не рекомендуется одновременный прием тройной комбинации иАПФ, бета-блокаторов и валсартана.
Стеноз аортального и митрального клапанов, гипертрофическая кардиомиопатия. Как и при применении других вазодилататоров, следует соблюдать особую осторожность при назначении препарата пациентам с аортальным или митральным стенозом, а также гипертрофической кардиомиопатией.
Ангионевротический отек.
Сообщалось о случаях ангионевротического отека, в том числе отека гортани и голосовой щели, что приводит к обструкции дыхательных путей и/или отеку лица, губ, глотки и/или языка у пациентов, получавших валсартан; у некоторых из этих пациентов ранее развивался отек Квинке при приеме других лекарственных препаратов, в том числе иАПФ. Следует немедленно прекратить прием препарата САРТВАЛ пациентам, у которых развивается ангионевротический отек, и препарат не должен назначаться снова.
Первичный гиперальдостеронизм. Не рекомендовано назначать САРТВАЛ пациентам с первичным гиперальдостеронизмом.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС)
Двойная блокада РААС ассоциируется с повышенным риском развития гипотонии, гиперкалиемии и нарушениями функции почек (включая острую почечную недостаточность) в сравнении с монотерапией. Двойная блокада РААС с применением иАПФ, БРА или препаратов, содержащих алискирен, не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией.
В отдельных случаях, когда совместное применение иАПФ и БРА абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции почек, водно-электролитного баланса, артериального давления. Это относится к назначению кандесартана или валсартана в качестве дополнительной терапии к ингибиторам АПФ у пациентов с хронической сердечной недостаточностью. Проведение двойной блокады РААС под тщательным наблюдением специалиста с обязательным мониторингом функции почек, водно-электролитного баланса и артериального давления возможно у пациентов с хронической сердечной недостаточностью при непереносимости антагонистов альдостерона (спиронолактона), у которых наблюдается персистирование симптомов хронической сердечной недостаточности, несмотря на проведение иной адекватной терапии.
Дети
Применение у детей с нарушением функции почек
Применение у детей с клиренсом креатинина <30 мл/мин и у детей на диализе не изучалось, поэтому у таких пациентов валсартан применять не рекомендуется. Не требуется коррекции дозы у детей с клиренсом креатинина > 30 мл/мин. Следует тщательно контролировать функцию почек и содержание калия в сыворотке. Это особенно касается случаев, когда валсартан применяется при наличии других состояний (напр., лихорадка, обезвоживание), способных вызвать нарушение функции почек.
Противопоказано одновременное применение блокаторов рецепторов ангиотензина II (в т.ч. САРТВАЛа) или иАПФ с препаратами, содержащими алискирен, у пациентов с умеренной/тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2).
Применение у детей с нарушением функции печени
Как и у взрослых, САРТВАЛ противопоказан у детей при тяжелой печеночной недостаточности, билиарном циррозе печени и при холестазе. Существует ограничеснный клинический опыт применения САРТВАЛа у детей с легкой и умеренной печеночной недостаточностью. У таких пациентов доза валсартана не должна превышать 80 мг.
Применение в период беременности и кормления грудью
Как и другие препараты, напрямую воздействующие на ренин-ангиотензин-альдостероновую систему (РААС), САРТВАЛ нельзя применять при беременности (см. раздел «Противопоказания»).
Пациенткам, планирующим беременность, в случае необходимости должно быть назначено альтернативное антигипертензивное лечение, которое имеет установленный профиль безопасности для применения во время беременности. Когда беременность обнаружена, лечение блокаторами рецепторов ангиотензина II (БРА) должно быть немедленно прекращено и, при необходимости, должно быть назначено альтернативное лечение.
Эпидемиологические данные показали повышенный риск тератогенного воздействия при применении иАПФ в первом триместре беременности. Подобный риск может существовать также при приеме БРА.
Известно, что прием БРА во втором и третьем триместрах беременности вызывает фетотоксичность (снижение функции почек, маловодие, задержка окостенения черепа) и неонатальную токсичность (почечная недостаточность, артериальная гипотензия, гиперкалиемия).
Если женщина принимала БРА во втором триместре беременности, необходим УЗИ контроль функции почек и черепа плода. Новорожденные, матери которых принимали БРА, должны внимательно наблюдаться из-за возможной артериальной гипотензии.
Не рекомендуется применять САРТВАЛ во время грудного вскармливания, так как отсутствует информация о применении валсартана во время кормления грудью. Предпочтительно использовать альтернативные методы лечения с установленным профилем безопасности, особенно если ребенок новорожденный или недоношенный.
Способность влиять на скорость реакции при управлении транспортом
Исследований по оценке влияния препарата САРТВАЛ на способность управлять автомобилем и работать с механизмами не проводилось. При управлении транспортными средствами или работе с механизмами следует учитывать возможность возникновения головокружения или слабости. Как и при назначении других антигипертензивных средств, необходимо соблюдать осторожность при управлении автомобилем и работе с движущимися механизмами.
Взаимодействие с другими лекарственными средствами
В клинических исследованиях не обнаружено имеющих клиническое значение взаимодействий валсартана со следующими лекарственными средствами: циметидин, варфарин, фуросемид, дигоксин, атенолол, индометацин, гидрохлоротиазид, амлодипин, глибенкламид.
Литий.
При одновременном применении иАПФ или БРА с препаратами лития наблюдалось обратимое повышение концентрации лития в сыворотке крови и появление токсических эффектов. Если существует необходимость совместного приема данных лекарственных средств, необходим тщательный мониторинг сывороточных концентраций лития. Если мочегонное средство также используется, можно предположить увеличение риска токсичности лития при применении САРТВАЛ.
Препараты, влияющие на CYP 450.
Поскольку САРТВАЛ не подвергается существенному метаболизму, клинически значимого взаимодействия с другими лекарственными препаратами в виде метаболической индукции или угнетения системы цитохрома Р450 при совместном применении с валсартаном не наблюдалось. Несмотря на то, что валсартан имеет высокую степень связывания с белками плазмы, исследования in vitro не продемонстрировали никакого взаимодействия на этом уровне с рядом молекул, которые также имеют высокую степень связывания с белками, а именно — диклофенаком, фуросемидом и варфарином.
Калийсберегающие диуретики, препараты калия, препараты, содержащие калий в виде солей и другие препараты, способные повысить уровень калия.
Совместное применение с калийсберегающими диуретиками (например, спиронолактон, триамтерен, амилорид), препаратами калия, калийсодержащими заменителями поваренной соли, либо с другими препаратами, которые могут увеличить уровень калия (напр., гепарин), может привести к повышению уровня калия в сыворотке крови, а у пациентов с сердечной недостаточностью может повышать уровень сывороточного креатинина. Следует контролировать уровень калия в случае необходимости совместного введения данных препаратов.
Нестероидные противовоспалительные препараты (НПВП), включая селективные ингибиторы ЦОГ-2, ацетилсалициловой кислоты (> 3 г/сут) и неселективные НПВП.
Одновременное применение НПВП и БРА может привести к ослаблению антигипертензивного эффекта. Кроме того, одновременный прием БРА и НПВП может привести к повышению риска ухудшения функции почек и увеличение уровня калия в сыворотке крови. В связи с этим рекомендуется контроль функции почек в начале лечения и адекватная гидратация пациента.
Транспортеры.
Одновременный прием ингибиторов переноса (напр., рифампин, циклоспорин) или эффлюксных транспортеров (напр., ритонавир) может усиливать действие валсартана.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС).
На основе имеющихся данных, двойная блокада РААС с применением иАПФ, БРА или препаратов, содержащих алискирен, не может быть рекомендована любому пациенту, особенно пациентам с диабетической нефропатией.
У пациентов с сахарным диабетом или умеренной/тяжелой почечной недостаточностью (СКФ < 60 мл/мин/1,73 м2) одновременное применение препаратов, содержащих алискирен, с иАПФ или БРА противопоказано.
В отдельных случаях, когда совместное применение иАПФ и БРА абсолютно показано, необходимо тщательное наблюдение специалиста и обязательный мониторинг функции почек, водно-электролитного баланса, артериального давления.
Условия и срок хранения Сартвал
3 года.
Хранить при температуре не выше 30 °С, в защищенном от влаги месте.
Хранить в недоступном для детей месте.
Упаковка
По 14 таблеток в блистере. По 2 блистера вместе с инструкцией по применению в картонной пачке.
Правила отпуска
По рецепту.
Информация о производителе
Лек д.д., Веровшкова 57, Любляна, Словения.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Сартвал только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание! Эта инструкция по применению лекарственного средства является официальной инструкцией производителя Novartis Farmaceutica S.A..
Авторское право:
- Novartis Farmaceutica S.A.
- https://www.rceth.by — Государственный реестр ЛС Республики Беларусь
| Тип данных | Сведения из реестра |
| Торговое наименование: | Сартвал |
| Форма выпуска: | таблетки, покрытые оболочкой, 80 мг, 160 мг в блистерах в упаковке №14х2 |
| Международное наименование: | Valsartan |
| Производитель: | Novartis Farmaceutica S.A., Испания |
| Заявитель: | Sandoz Pharmaceuticals d.d., Словения |
| Номер регистрации: | 9940/12/17/18/22 |
| Дата регистрации: | 06.09.2017 |
| Срок действия: | бессрочно |
| Дата переоформления: | 11.06.2018 |
| Тип: | Лекарственное средство |
| Оригинальное: | оригинальное |
| Состав лекарственного средства: | Valsartan |
| Код АТХ: | C09CA03 |
| Производитель готовой лекарственной формы: | Novartis Farmaceutica S.A., Испания |
| Производитель, осуществляющий фасовку/упаковку: | Novartis Farmaceutica S.A., Испания |
| Контроль качества: | |
| Выдача разрешения на выпуск лекарственного средства: | Novartis Farmaceutica S.A., Испания |
| Другие участники производства: | выпуск серии — Lek d.d., Словения |
| Заявленная цена: | 9,51EUR |
| Порядок отпуска: | по рецепту |
| Список хранения: | |
| Срок годности лекарства: | 3 года |
| Нормативная документация: | РБ 8543-2017 (DP_3755246 010 R 02) |
| Дата утверждения нормативной документации: | 6 сентября 2017 г. 0:00 |
| Срок действия нормативной документации: | |
| Изменение в нормативной документации: |
Изменение по разделу «НД по контролю качества активной фармацевтической субстанции» (пр. №1495 от 13.12.2019) Изменение по разделу «Спецификация активной фармацевтической субстанции» (пр. №1495 от 13.12.2019) Изменение по разделу «Маркировка» (альтернативный дизайн первичной упаковки для дозировки 80мг) (пр. №1107 от 12.09.2019) Изменение по разделу «Маркировка» (дизайн вторичных упаковок) (пр. №1133 от 06.11.2018) Изменение по разделу «Производитель» (пр. №1133 от 06.11.2018) Изменение названия лекарственного средства (ком. №10 от 06.09.2017) Изменение по разделу «Маркировка» (уточнение нанесения теснения на первичную упаковку для дозировки 80мг) (ком. №10 от 06.09.2017) Изменение по разделу «Состав» (производители АФИ) (ком. №10 от 06.09.2017) |
| Номер разрешения НД: | 9903/1 |