- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Бурляева В.В.
1
1 МГМСУ им. А.И. Евдокимова
На основе литературных данных в работе был рассмотрен метод скрининга почвенных микроорганизмов при помощи изолирующих камер (iChip) и открытый с помощью него антибиотик из нового класса. В работе ставится задача обосновать рациональность будущего использования тейксобактина. Тейксобактин является циклическим депсипептидом, содержащим необычную аминокислоту эндурацидин. Это первый представитель нового класса антибиотиков, который действует на уникальные мишени в пути синтеза клеточной стенки, что в дальнейшем приводит к лизису клетки. В отличие от других антибиотиков, ингибирующих синтез клеточной стенки, он действует не на белковые мишени, которые могут легко развить мутационную резистентность при воздействии лекарств. Он связывается с высококонсервативным непептидным участком предшественника пептидогликана (липид II) и предшественника тейхоевой кислоты (липид III). Он продемонстрировал превосходную активность против широкого спектра грамположительных бактерий, в том числе организмов с множественной лекарственной устойчивостью, таких как метициллин-устойчивый золотистый стафилококк (MRSA), ванкомицин-промежуточный S. aureus (VISA), ванкомицин-резистентный энтерококк (VRE), Clostridium difficile, Streptococcus pneumoniae и Mycobacterium tuberculosis. Тем не менее, он не имеет активности против грамотрицательных бактерий. Фактическое отсутствие устойчивых мутантов Staphylococcus aureus и M. tuberculosis после длительного воздействия тейксобактина в сублетальной концентрации вызвало огромный интерес к его разработке и внедрению для клинического применения.
тейксобактин
антибиотики
технология ichip
пептидогликан
резистентность
1. Arias CA, Murray BE. / A new antibiotic and the evolution of resistance. // N Engl J Med, 2015.
2. Breukink E., B. de Kruijff, / Lipid II as a target for antibiotics, // Nat. Rev. Drug Discov, 2006.
3. Brown S, Xia G, Luhachack LG, Campbell J, Meredith TC, Winstel V, Gekeler C, Walker S. / Methicillin resistance in Staphylococcus aureus requires glycosylated wall teichoic acids, 2012.
4. Bugg, T. D. et al./ Biosynthesis of a depsipeptide peptidoglycan precursor by vancomycin resistance proteins VanH and VanA. // Biochemistry, 1991.
5. Carl Oster, Grzegorz P. Walkowiak,ab Dallas E. Hughes,c Amy L. Spoering / Structural studies suggest aggregation as one of the modes of action for teixobactin, 2018.
6. Lazarides L., J. Y. C. Chiva, M. Jones, V. F. Steadman The discovery of teixobactin / Antibiotic Drug Discovery: New Targets and Molecular Entities, 2017.
7. Ling LL, Schneider T, Peoples AJ, Spoering AL, Engels I, Conlon BP et al. / A new antibiotic kills pathogens without detectable resistance. //Nature, 2015.
8. Nichols D, Cahoon N, Trakhtenberg EM, Pham L, Mehta A, Belanger A et al. / Use of iChip for high-throughput in situ cultivation of ‘uncultivable’ microbial species, 2010.
9. Pasquina LW, Santa Maria JP, Walker S./Teichoic acid biosynthesis as an antibiotic target, 2013.
10. Pham VH, Kim J. / Cultivation of unculturable soil bacteria.// Trends Biotechnol, 2012.
11. Po-Chao Wen, a Juan M. Vanegas,b Susan B. Rempe b and Emad Tajkhorshid / a Probing key elements of teixobactin–lipid II interactions in membranes, 2018.
12. Pootoolal, J. Neu, Wright G.D.,/ Glycopeptide antibiotic resistance, 2002.
13. Sabine F. Oppedijk a, Nathaniel I.Martin, Eefjan Breukink The growing and structurally diverse family of peptides that target lipid-I I, 2015.
14. Sandra Sagar, Ezhilarasan.D and Sagar Moses/ iChip and teixobactin – a review, 2017.
15. Schlag M, Biswas R, Krismer B, Kohler T, Zoll S, Yu W, Schwarz H, Peschel A, Gotz F.. / Role of staphylococcal wall teichoic acid in targeting the major autolysin Atl, 2010.
16. Shimaa A. H. Abdel Monaim, Yahya E. Jad, Estelle J. Ramchuran / Lysine Scanning of Arg10−Teixobactin: Deciphering the Role of Hydrophobic and Hydrophilic Residues, 2016.
17. Theuretzbacher U., / Clin. Microbiol. // Infect., 2017.
18. Vollmer W, Blanot D, de Pedro MA../ Peptidoglycan structure and architecture, 2008.
19. Williamson, R. T.; Shen, B.; Graziani, E. I.; Yang, H. Y.; Petersen, P. J.; Carter, G. T. J. Am. Mannopeptimycins, novel antibacterial glycopeptides from Streptomyces hygroscopicus, 2002.
20. Wright G.D. The antibiotic resistome: the nexus of chemical and genetic diversity, 2007.
Введение
Антибиотики произвели революцию в современной медицине, позволив добиться значительного прогресса в качестве и продолжительности жизни. Всемирная организация здравоохранения в 2014 году предупредила, что мы вступаем в «эру после антибиотиков». Новый кризис, с которым сегодня сталкивается мир — это устойчивость к антибиотикам. Генетические модификации в бактериях привели к состоянию, при котором патогенные микроорганизмы стали устойчивыми к доступным антимикробным агентам. Риск резистентности также был ускорен из-за нерационального приема антибиотиков. Наиболее распространенным примером тому являются люди, страдающие простудой и кашлем.
В последнее время не было разработано ни одного нового класса антибиотиков, а с 1962 года было создано только два класса. Антибиотики были открыты ранее путем скрининга почвенных микроорганизмов, которые являются основным источником потенциальных новых веществ с антимикробной активностью, однако 99% бактерий не могут быть выращены при современных методах. Исследователи из лаборатории Льюиса и Раба Эпштейна разработали новую технику под названием iChip, которая позволяет исследовать некультивируемые бактерии, поскольку они растут в естественной для них среде и выделять производимый ими антибиотик, а затем идентифицировать его.
В пресс-релизе от 7 января 2015 года NovoBiotic Pharmaceuticals объявила об открытии тейксобактина, нового антибиотика из ранее некультивированной и неописанной почвенной бактерии, принадлежащей к β-протеобактериям, названной Eleftheria terra. Тейксобактин оказался первым представителем нового класса антибиотиков со значительной активностью в отношении патогенных штаммов, таких как ванкомицин устойчивых энтерококков (VRE) и метициллин устойчивых Staphylococcus aureus (MRSA). Тейксобактин связывается с предшественником пептидогликана и тейхоевых кислот, являющиеся компонентами клеточной стенки и, следовательно, ингибирует биосинтез клеточной стенки бактерий.
Цели работы: обосновать рациональность будущего использования тейксобактина.
Задачи:
1. Описать возможности технологии iChip.
2. Обосновать высокую антибактериальную активность тейксобактина исходя из структуры молекулы и механизма действия.
3. Обозначить спектр активности и потенциал развития резистентности.
1. Историческая справка
В 1943 году Сельман Ваксман и Альберт Штатц сооткрыли аминогликозидный антибиотик стрептомицин. Это был первый эффективный антибиотик для лечения туберкулеза, используемый по сей день. Вслед за этим знаменательным событием Ваксман получил в 1952 году Нобелевскую премию за «гениальные, систематические и успешные исследования почвенных микробов, которые привели к открытию стрептомицина». В отличии от ранее случайного открытия пенициллина Александром Флемингом, который заметил, что загрязнение плесенью в культуре чашки Петри препятствовало росту патогенных бактерий. Ваксман и его команда разработали платформу для выявления новых антибиотиков: она позволила проводить скрининг полученных из почвы актиномицетов на антибактериальную активность против микроорганизмов в чашках с агаром. Используя этот метод в 1940-х годах, Ваксман и его ученики выделили более пятнадцати антибиотиков, в том числе стрептомицин и неомицин [6].
В течение следующих десятилетий на основании метода скрининга почвенных микроорганизмов были открыты основные классы антибиотиков, например макролиды, тетрациклины и рифамицины. К сожалению, этот метод прекратил давать результаты в середине шестидесятых годов, поскольку область исследования была ограничена лишь 1% разнообразия микробов во внешней среде, так как остальные 99% до недавних лет были некультивируемыми и недоступными для изучения, так как они не способны расти в лабораторных условиях [10].
В настоящее время микробиологические культуры выращиваются преимущественно в твердом или жидком агаре. В течение многих лет техника выращивания бактерий в лаборатории оставалась неизменной. Подавляющее большинство микробов, видимых в микроскопе, в настоящее время не может быть выращено в лабораториях, поскольку некоторые бактерии могут фактически быть нежизнеспособными в этих условиях, так как микроорганизмы приспособились к процветанию в условиях их собственной родной среды.
В целях расширения доступа к большему разнообразию микроорганизмов был разработан новый метод культивирования в собственной среде обитания под названием iChip (изолирующий чип), который уже выделил множество новых организмов, а также тейксобактин — антибиотик со значительной активностью против грамположительных бактерий, в том числе, обладающих резистентностью к современным антибиотикам. Однако этот антибиотик все еще нуждается в клинических испытаниях. Сообщалось, что тейксобактин не эффективен в отношении грамотрицательных бактерий, что обусловлено строением их клеточной стенки и механизмом действия тейксобактина.
2. Принцип работы устройства iChip
Исследователи из Северо-Восточного университета и Novobiotic Pharmaceuticals разработали революционную технологию, в которой используется многоканальное устройство, называемое iChip, для выделения и выращивания некультурных бактерий в их естественной среде. Эта техника позволила выращивать большее количество микроорганизмов по сравнению с традиционной чашкой Петри (50% против 1%) [8].
IChip представляет собой сборку пластиковых пластин и мембран для захвата микроорганизмов окружающей среды (Приложение 1) [14]. По сути, он состоит из пластиковых пластин, которые содержат около сотни отверстий, каждое из которых образует очень маленькую диффузионную камеру, в которую помещается только один микроорганизм. Чип содержит 96 миниатюрных диффузионных камер, которые обеспечивают прохождение питательных веществ и метаболитов через полупроницаемую мембрану, удерживая при этом внутри камер бактериальные клетки.
Для выделения микроорганизмов образцы собираются из, например, почвы или морской воды, и смешиваются с жидким агаром. Предварительно образец почвы разбавляется до такой степени, что бы в каждую из камер iChip попадала примерно одна бактериальная клетка. Когда центральная пластина погружена в суспензию клеток в расплавленном агаре, сквозные отверстия заполняются небольшим объемом этой суспензии, которая затвердевает в виде небольших агаровых пробок.
Затем устройство покрывают двумя полупроницаемыми мембранами (размер пор 0,03 мкм) для обеспечения диффузии питательных веществ и факторов роста, и помещают обратно в почву, из которой была взята проба. Через некоторое время, выросшую колонию можно перенести в лабораторию и исследовать.
Этот метод скрининга значительно облегчит обнаружение новых антибиотиков, поскольку он позволяет соединения из микроорганизмов окружающей среды, которые не растут в нормальных лабораторных условиях [1]. Устройство позволило вырастить значительное количество бактериальных колоний по сравнению с чашкой с агаром.
Экстракты из 10000 изолятов, полученных в результате роста в iChip бактерий, были подвергнуты скринингу на антимикробную активность на пластинках покрытых S. aureus. Это привело к обнаружению нового вида грамотрицательного микроорганизма, условно названного Eleftheria terrae из вида b-протеобактерий, который продуцировал соединение, проявившее высокую антибактериальную активность [14].
3. Структура молекулы тейксобактина
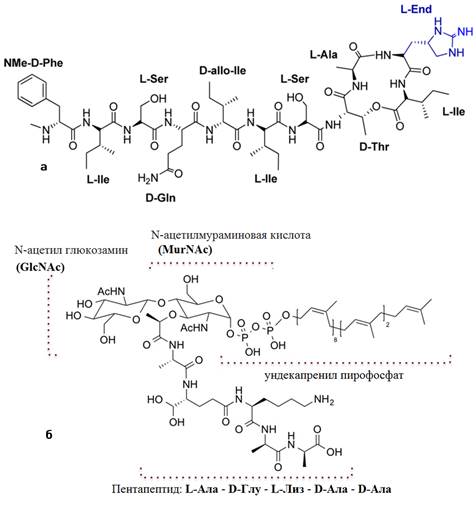
Структура была определена посредством обширного анализа методами жидкостной хроматографии, масс-спектрометрии и методами ядерного магнитного резонанса (ЯМР). Эти анализы выявили необычный депсипептид, содержащий 11 аминокислот, связаные примерно 10 пептидными связями (Приложение 2-а) [6].
Молекулу можно условно разделить на головную и боковую цепи. Боковая цепь состоит из 7 аминокислот: N-метил-D-фенилаланин, D-глутамин, два L-изолейцина и один D-изолейцин, два L-серина [16]. Головная цепь представляет собой макролактоновое кольцо, состоящее из четырех аминокислот: D-треонина, L-аланина, L-изолейцина и L-алло-эндурацидина — непротеиногенной аминокислоты, которая была впервые идентифицирована как аминокислотный компонент сильнодействующих депсипептидных антибиотиков, выделенных из Streptomyces hygroscopicus LL-AC98 в 2002 году [19].
4. Биосинтез пептидогликана
Бактериальная клеточная стенка жизненно необходима для бактерий, поскольку она противодействует осмотическому давлению, которое возникает между цитозолем клетки и ее окружающей средой. Стенка состоит из слоев пептидогликана, сшитых линейными гликановыми цепями [18]. Пептидогликан, основной компонент клеточной стенки грамположительных бактерий, синтезируется из липида II — строительного блока, уникального для бактериальных клеток. Ферменты, сшивающие пептидогликана являются мишенью для β-лактамных и гликопептидных антибиотиков.
Липид II — предшественник пептидогликана, кроме липидного компонента и пирофосфата, содержит основные строительные блоки пептидогликана: N-ацетилмураминовую кислоту, N-ацетилглюкозамин и пентапептид (L-Ala-D-Glu-L-Lys / DAP-D-Ala-D-Ala) (Приложение 3) [13].
У грамположительных бактерий тейхоевая кислота (ТА) также является основным компонентом клеточной стенки. TA включает стеночную тейхоевую кислоту (WTA), связанную с пептидогликаном, или липотейхоевую кислоту (LTA), закрепленную в цитоплазматической мембране. TA играет важную роль в физиологии бактерий [18], а ферменты биосинтеза тейхоевой кислоты являются важной мишенью для антибиотиков. Недавно было показано, что ингибирование биосинтеза тейхоевой кислоты может восстановить чувствительность к метициллину у метициллин-резистентного золотистого стафилококка (MRSA) [9].
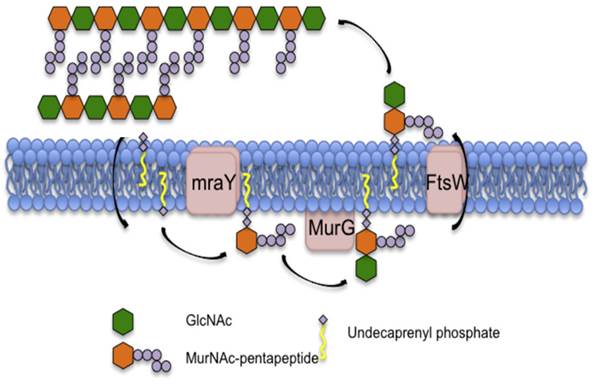
Синтез липида II начинается на цитозольной стороне мембраны, где встроенный в мембрану фермент MraY связывает пентапептид UDP-N-ацетил-мураминовой кислоты (UDP-MurNAc-pp) с липидом-ундекапренилфосфатом, образующим липид I. Затем трансфераза MurG связывает UDP-N-ацетилглюкозамин (UDP-GlcNAc) с мурамоильной частью липида I с образованием липида II. Затем FtsW «переворачивает» липид II на другую сторону бактериальной мембраны, после чего белки, связывающие пенициллин (PBP), включают липид II в растущую сеть пептидогликана. Остаточный ундекапренилпирофосфат затем дефосфорилируется до монофосфата и переворачивается обратно в цитозольный сайт для повторного использования в цикле синтеза липида II(Приложение 2-б) [7].
MurNAc-пентапептид связан с ундекапренилфосфатом с помощью mraY. Затем GlcNAc связывается с липидом I с помощью MurG с образованием липида II. Затем предшественник пептидогликана переворачивается в периплазматическое пространство с помощью ftsW и включается в пептидогликан пептидами, связывающими пенициллин (PBP).
Жизнеспособность липида II как мишени для гликопептидных антибиотиков была ясно продемонстрирована ванкомицином, который впервые был выделен из почвенных бактерий Streptomyces orientalis в 1953 году Эли Лили. Начиная с его введения в клинику, ванкомицин остается единственным антибиотиком, мишенью которого является липид II, и, к тому же, является последним средством лечения против многих устойчивых к пенициллину и метициллину грамположительных бактерий. На ранних испытаниях ванкомицина исследователи не смогли выделить бактерии, устойчивые к ванкомицину [13]. Однако после более чем 30 лет клинического применения резистентность к ванкомицину все же возникла.
В настоящее время известно шесть различных генотипов резистентных к ванкомицину бактерий, обозначаемых как кластеры генов VanA-VanG. Бактерии с резистентностью к VanA-, VanB- и VanD-типам обладают измененной формой липида, где связывающий ванкомицин мотив D-Ala-D-Ala заменен на D-Ala-D-Lac [4]. Другие устойчивые к ванкомицину микроорганизмы вместо этого используют D-Ala-D-Ser, хотя это приводит к менее серьезной устойчивости. Связывание ванкомицина с D-Ala-D-Ala фрагментом липида II хорошо изучено и обусловлено образованием пяти водородных связей. Замена терминального D-аланина на D-Lac или D-Ser позволяет ванкомицину образовывать только четыре водородные связи, что приводит к почти 1000-кратной потере сродства к его цели [12]. Этот способ обхода связывания липида II, вероятно, основан на механизме самоиммунитета штамма-продуцента или бактерий, которые естественным образом несут этот фрагмент, таких как Lactobacillus Casei и Lactobacillus Plantarum.
5. Особенности связывания тейксобактина с предшественником пептидогликана
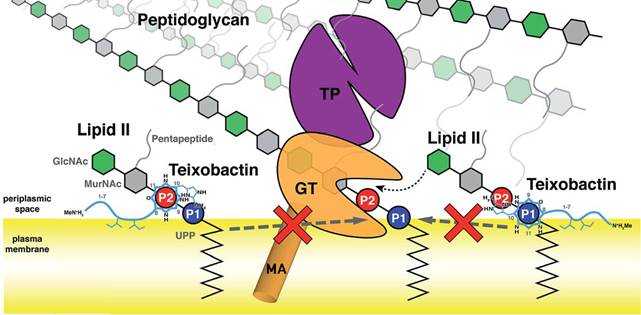
Были обнаружены две основные конформации связи липид II-тейксобактин, каждая из которых демонстрирует характерное связывание пирофосфата липида II амидами головной цепи тейксобактина (Txb) вблизи С-концевого циклодепсипептидного (D-Thr8-Ile11) кольца (Приложение 4) [11]. Кроме того, в связывании также участвует гидроксильная группа боковой цепи Ser7 и вторичное фосфатное связывание, обеспечиваемое головной цепью (L-алло-эндурацидин). Интересно, что эти конформации различаются заменой двух групп доноров водородных связей, которые координируют две фосфатные группы липида II, что приводит к противоположным ориентациям связывания липида II [5].
Кроме того, остатки D-allo-Ile5 и Ile6 служат в качестве мембранных якорей в обеих конформациях Txb, независимо от детальных фосфат-связывающих взаимодействий вблизи депсипептидного кольца. Роль гидрофобных остатков в активности Txb, в первую очередь, заключается в его мембранном закреплении и, кроме того, в обеспечении неполярных взаимодействий с хвостом липида II.
В обеих конформациях связывание липида II достигается в основном за счет координации фосфатов вблизи С-концевого циклодепсипептидного кольца, в то время как два гидрофобных остатка в середине пептидной цепи служат в качестве якоря мембраны. Не наблюдается значительного взаимодействия между Txb и дисахаридом или пентапептидом липида II. Хотя гидрофобные остатки в Txb необходимы для его активности, это требование важно для закрепления Txb на поверхности мембраны, а не для стимулирования специфического связывания с липидом II, включающего гидрофобные взаимодействия. Таким образом, существенными для активности Txb представляются как специфическое связывание с фосфатом липида II, так и неспецифическое связывание с поверхностью мембраны.
6. Механизм действия
Способность тейксобактина одновременно ингибировать биосинтез пептидогликана и тейхоевой кислоты вызывает синергические эффекты, приводящие к повреждению клеточной стенки, делокализации аутолизинов и последующему лизису и гибели клеток. Кроме того, тейксобактин не связывает зрелый пептидогликан и, следовательно, способен эффективно воздействовать на штаммы ванкомицина-промежуточного S. aureus (VISA), которые имеют повышенную плотность клеточной стенки.
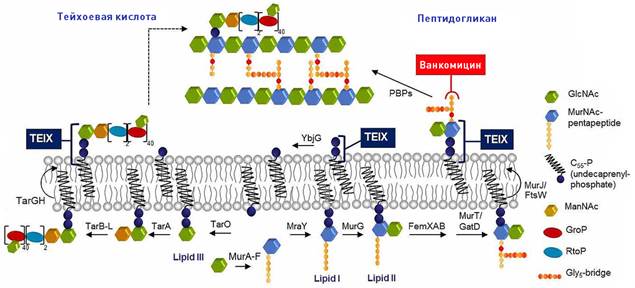
Было показано, что механизм действия тейксобактина основан на связывании двух важных строительных блоков бактериальной клеточной стенки: липид II (основной предшественник пептидогликана), и липид III (предшественник тейхоевых кислот) [7]. Тейхоевые кислоты играют важную роль в предотвращении неконтролируемого гидролиза пептидогликана, поэтому ингибирование синтеза тейхоевых кислот может способствовать делокализации аутолизинов. Липид II также является мишенью для гликопептидного антибиотика ванкомицина, но тейксобактин связывается с другой его областью и поэтому активен против устойчивых к ванкомицину энтерококков (VRE), которые имеют модифицированный липид II. Таким образом, он одновременно ингибирует биосинтез пептидогликана и тейхоевой кислоты, вызывая синергетический эффект, приводящий к повреждению клеточной стенки.
Липид II, предшественник пептидогликана, синтезируется в цитоплазме и переворачивается на поверхность внутренней мембраны с помощью MurJ48 или FtsW49 (Приложени 5) [7]. Липид III, предшественник тейхоевой кислоты в стенке (WTA), аналогичным образом образуется внутри клетки, и липид-связанные предшественники WTA транслоцируются через цитоплазматическую мембрану с помощью ABC-транспортера TarGH50 [7].
Биосинтез липида II варьируется внутри пентапептида в третьем положении между грамположительными бактериями (лизин) и грамотрицательными бактериями (диаминопимелиновая кислота (DAP)) [2]. Mикoбактерии spp. обладают DAP и могут дополнительно модифицировать N-ацетил- в N-гликолилмурамовую кислоту. Было обнаружено и несколько других модификаций пептидного стебля или гликановых цепей. Предполагается, что тейксобактин взаимодействует с пирофосфатом липида II и, таким образом, может связывать как грамположительные, так и грамотрицательные варианты липида II, независимо от модификаций сахаров или пептидов.
Ванкомицин также нацелен на липид II. Однако, принимая во внимание то, что тейксобактин проявил активность против ванкомицин-резистентного энтерококка (VRE), его связывание происходит через другую область по сравнению с таковой у ванкомицина. В этом отношении биохимические анализы показали, что тейксобактин связывает пирофосфат и первый сахарный фрагмент, присутствующий как в липиде II, так и в липиде III [7]. Кроме того, тейксобактин, в отличие от ванкомицина, не связывает зрелый пептидогликан, что обеспечивает эффективное уничтожение бактерий с повышенной плотностью клеточной стенки, таких как ванкомицин-промежуточный Staphylococcus aureus (VISA), против которого ванкомицин неэффективен.
Ингибирование биосинтеза тейхоевой кислоты клеточной стенки приводит к делокализации аутолизинов и лизису клеток. Было высказано предположение, что тейхоевые кислоты контролируют связывание аутолизина с пептидогликаном по принципу исключения, при котором взаимодействие тейхоевой кислоты клеточной стенки с пептидогликаном ингибирует связывание аутолизина [15]. Следовательно, отсутствие тейхоевой кислоты в перегородке способствует соответствующей делокализации аутолизинов [3].
Тейксобактин-индуцированный лизис зависит от аутолизина Atl. Известно, что индуцированный β-лактамом лизис опосредуется Atl, основным аутолизином клеточной стенки S. aureus. Обработка тейксобактином приводила к делокализации Atl вследствие ингибирования биосинтеза WTA клетки, что объясняет интенсивную литическую способность тейксобактина [15].
7. Спектр активности
Тейксобактин обладает активностью против грамположительных микробов, включая ванкомицин-устойчивые энтерококки (VRE) и метициллин-устойчивый Staphylococcus aureus (MRSA) [6]. Тейксобактин также был эффективен в качестве однократной дозы для значительного снижения количества бактерий на мышиной модели сепсиса MRSA и пневмококковой пневмонии. На мышах он продемонстрировал активность против нескольких устойчивых штаммов бактерий, таких как Streptococcus pneumonia и Mycobacterium tuberculosis. Он также эффективен против Clostridium difficile, M. tuberculosis и потенциально может использоваться для лечения туберкулеза.
Линг и соавт. в своих исследованиях in vitro показали, что тейксобактин был высокоэффективен против Bacillus anthracis и C. difficile при минимальной ингибирующей концентрации (MIC) 5 и 20 мг / мл [7]. Следует заметить, что в случае M. tuberculosis или S. aureus резистентные штаммы не были обнаружены при посеве с низкой дозой тейксобактина.
При исследовании на лабораторных животных, соединение сохранило свою активность в присутствии сыворотки крови, имело хорошую микросомальную стабильность и низкую токсичность. Фармакокинетические параметры, определенные после внутривенных инъекций одной дозы 20 мг на кг у мышей были благоприятными, поскольку уровень соединения в сыворотке поддерживали выше значения MIC в течение 4 ч. Затем проводили исследование эффективности на мышах: они были внутрибрюшинно инфицированы устойчивым к метициллину S. aureus (MRSA) в дозе, приводящей к 90% смерти. Через час после заражения вводили тейксобактин внутривенно в однократных дозах от 1 до 20 мг на кг. Все животные выжили, и в последующем эксперименте было определено, что PD50 (защитная доза, при которой выживает половина животных) составляет 0,2 мг/кг, что выгодно отличается от 2,75 мг/кг PD50 ванкомицина — основного антибиотика, используемого для лечения MRSA [7].
8. Пути развития резистентности
Мутанты S. aureus или M. tuberculosis, устойчивые к тейксобактину, не продуцировались даже при посеве на среду с низкой дозой соединения. Последовательный пассаж S. aureus в присутствии сублетальной дозы тейксобактина в течение 27 дней также не давал устойчивых мутантов. Обычно это означает, что вещество обладает неспецифическим механизмом действия с сопутствующей токсичностью [7]. Однако тейксобактин не обладал токсичностью в отношении клеток млекопитающих, не проявлял гемолитической активности и не связывал ни ДНК, ни белок. Он связывается с консервативной областью ундекапренил-PP-сахара, которая, как известно, не модифицируется. Мишенями большинства других антибиотиков являются белки, и бактерии становятся устойчивыми в результате мутаций генов, кодирующих эти белки. Но нацеливаясь на липиды вместо белков, бактериям может потребоваться больше времени для развития резистентности. Ванкомицин обладает схожим механизмом действия, и для развития резистентности потребовалось 30 лет.
Микроорганизмы, производящие антибиотик, а иногда и его близкие микробные соседи, устойчивы к антибиотику, так как не имеют для него мишеней либо обладают генами, обуславливающими устойчивость к нему. Для продуцирующего микроорганизма это необходимо, иначе собственно произведенный антибиотик будет действовать на него самого. Eleftheria terrae является грамотрицательной бактерией и, следовательно, не имеет мишени для тейксобактина, который вызывает лизис грамположительных бактерий. Живущие по соседству в той же среде микроорганизмы могут быть устойчивыми, поскольку имеют соответствующие гены устойчивости так, что обуславливает их выживаемость в той же нише, что и продуцирующий микроорганизм.
«Естественные» гены устойчивости к антибиотикам могут быть переданы в патогенные бактерии. Например, ген, кодирующий один из наиболее распространенных механизмов устойчивости к антибиотикам — бета-лактамаза расширенного спектра (ESBL), был получен от бактерии из внешней среды [20]. Таков наиболее вероятный путь развития устойчивости, если это произойдет с тейксобактином. Однако это маловероятно, поскольку патогенные бактерии должны были бы смешиваться с устойчивыми к тейксобактину почвенными бактериями. Тем не менее, чтобы быть уверенным в том, что резистентность к тейксобактину маловероятна при применении в медицине, бактерии, выделенные из той же среды, что и Eleftheria terrae, должны быть подвергнуты скринингу на выявление генов, обеспечивающих устойчивость к тейксобактину.
Выводы
1. Новая методика культивирования с использованием изолирующего чипа (iChip) может обеспечить доступ к неиспользованному резервуару антибиотиков, вырабатываемых некультивируемыми бактериями, поскольку они могут расти в естественных для них условиях.
2. Тейксобактин представляет собой депсипептид, состоящий из 11 аминокислот, четверо из которых образуют макролактоновое кольцо. Механизм действия тейксобактина основан на ингибировании синтеза клеточной стенки путем связывания предшественников пептидогликана и тейхоевых кислот (липид II и липид III соответственно) и дальнейшем лизисе клетки.
3. Тейксобактин активен в отношении грамположительных бактерий, включая ванкомицин-устойчивые энтерококки и метициллин-устойчивый золотистый стафилококк. Так как мишенью тейксобактина являются не ферменты, а несколько высококонсервативных фрагментов предшественников компонентов клеточной стенки, для возникновения мутаций, из-за которых может возникнуть устойчивость к тейксобактину понадобится довольно долгое время.
Заключение
Чтобы тейксобактин (как и любое новое соединение с антимикробной активностью) стал лекарством для лечения инфекций у людей, необходимо провести клинические испытания, чтобы убедиться, что препарат безопасен, хорошо переносится и эффективен у пациентов. Для этого необходимо будет провести полные токсикологические тесты, чтобы убедиться, что после введения тейксобактина нет побочных реакций или взаимодействий между лекарственными средствами. Также необходимо подобрать лекарственную форму так, чтобы антибиотик оставался активным in vivo в клинически значимых местах инфекции. Будет ли он полностью разработан в качестве нового препарата, еще неизвестно, не в последнюю очередь потому, что сомнительно, требуется ли больше лекарств против грамположительных бактерий. Однако, поскольку тейксобактин активен в отношении M. tuberculosis, он может предложить вариант нового лечения для пациентов с туберкулезом. Тейксобактин также может ответить требованиям для одобрения FDA в рамках системы квалифицированных продуктов для инфекционных заболеваний (QIDP), как это предусмотрено в Законе США о создании стимулов для антибиотиков (GAIN), поэтому он может быть быстро лицензирован. Даже если сам тейксобактин не появится на полках аптек, он является первым из серии новых антибиотиков в своем классе.
Приложение 1. iChip: a – центральная пластина, погруженная в суспензию клеток в расплавленном агаре; б – отдельные микроорганизмы в каждой из диффузионных камер; в – полупроницаемые мембраны, отделяющие пластину от окружающей среды и расположенные сверху и снизу от нее, и две опорные боковые панели, которые имеют с центральной пластиной соответствующие сквозные отверстия. [14]
Приложение 2. Химическая структура тейксобактина (а) и липида II (б) [6], [7].
Приложение 3. Схематический обзор пути биосинтеза пептидогликана [13].
Приложение 4. Схематическое изображение двух ориентаций комплексов тейксобактин-липид II на поверхности мембраны и механизм ингибирования биосинтеза пептидогликана. Прототип пенициллинсвязывающего белка показан как комбинация мембранного якоря (MA, оранжевый цилиндр), гликозилтрансферазного домена (GT, оранжевый) и транспептидазного домена (TP, фиолетовый) [11].
Приложение 5. Модель механизма действия тейксобактина, ингибирование синтеза клеточной стенки тейксобактином. Тейксобактин (TEIX) образует стехиометрический комплекс с липидом II и липидом III. Связывание этих строительных блоков одновременно прерывает биосинтез пептидогликана (справа) и тейхоевой кислоты (слева). Связывание с несколькими мишенями в клеточных стенках препятствует образованию функциональной клеточной оболочки. [7]
Библиографическая ссылка
Бурляева В.В. ТЕЙКСОБАКТИН, ПЕРВЫЙ ИЗ НОВОГО КЛАССА АНТИБИОТИКОВ, ОТКРЫТЫЙ ПО ТЕХНОЛОГИИ ICHIP // Международный студенческий научный вестник. – 2019. – № 5-2.
;
URL: https://eduherald.ru/ru/article/view?id=19796 (дата обращения: 19.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Нинларо — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер :
ЛП-004500
Действующее вещество :
Иксазомиб
Лекарственная форма :
капсулы
Состав :
Одна капсула дозировкой 2,3 мг содержит:
действующее вещество: иксазомиба цитрата 3,29 мг соответствует иксазомибу 2,3 мг; вспомогательные вещества: целлюлоза микрокристаллическая 65,66 мг, тальк 0,70 мг, магния стеарат 0,35 мг;
оболочка капсулы: желатин 36,83 мг, титана диоксид 1.14 мг, краситель железа оксид красный 0.03 мг, чернила черные 10А21 следовые количества.
Одна капсула дозировкой 3 мг содержит:
действующее вещество: иксазомиба цитрата 4,3 мг соответствует иксазомибу 3 мг; вспомогательные вещества: целлюлоза микрокристаллическая 64,65 мг, тальк 0.70 мг, магния стеарат 0,35 мг;
оболочка капсулы: желатин 37,07 мг, титана диоксид 0,89 мг, краситель железа оксид черный 0,05 мг, чернила черные 10А21 следовые количества.
Одна капсула дозировкой 4 мг содержит:
действующее вещество: иксазомиба цитрата 5,7 мг соответствует иксазомибу 4 мг; вспомогательные вещества: целлюлоза микрокристаллическая 107,5 мг, тальк 1,20 мг, магния стеарат 0,60 мг;
оболочка капсулы: желатин 46,53 мг, титана диоксид 1,13 мг, краситель железа оксид красный 0.03 мг, краситель железа оксид желтый 0,32 мг, чернила черные 10А21 следовые количества.
1 Чернила черные 10А2 содержат: шеллак, пропиленгликоль, калия гидроксид, краситель оксид железа черный.
Описание :
Дозировка 2,3 мг: твердые желатиновые капсулы № 4, корпус капсулы светло-розового цвета, крышечка капсулы светло-розового цвета, с надписями «Takeda» на крышечке капсулы и «2.3 mg» на корпусе капсулы, нанесенными черными чернилами:
Дозировка 3 мг: твердые желатиновые капсулы № 4. корпус капсулы светло-серого цвета, крышечка капсулы светло-серого цвета, с надписями «Takeda» на крышечке капсулы и «3 mg» на корпусе капсулы, нанесенными черными чернилами:
Дозировка 4 мг: твердые желатиновые капсулы № 3, корпус капсулы светло-оранжевого цвета, крышечка капсулы светло-оранжевого цвета, с надписями «Takeda» на крышечке капсулы и «4 mg» на корпусе капсулы, нанесенными черными чернилами.
Содержимое капсул — порошок от белого до желтовато-белого цвета.
Фармакотерапевтическая группа :
Противоопухолевое средство
АТХ :
L.01.X.X.50
Фармакодинамика :
Иксазомиб является обратимым ингибитором протеасом.
Иксазомиб преимущественно связывается и подавляет химотрипсиноподобную активность субъединицы бета-5 20S протеасомы.
Иксазомиб вызывает апоптоз культивируемых in vitro клеточных линий множественной миеломы.
Иксазомиб проявлял цитотоксичность in vitro в отношении клеток миеломы, взятых у пациентов с развившимися рецидивами после многократных циклов терапии, включавших
бортезомиб.
леналидомид и
дексаметазон. Комбинация иксазомиба и леналидомида демонстрировала синергическое цитотоксическое действие на клеточные линии множественной миеломы. В условиях in vivo иксазомиб проявлял противоопухолевое действие на модели опухолевого ксенотрансплантата множественной миеломы мышей.
Кардиоэлектрофизиология
Нинларо® не удлинял интервал QTc при воздействиях, соответствующих клиническим, по результатам фармакокинетическо-фармакодинамического анализа данных 245 пациентов.
Фармакокинетика:
Всасывание
После приема внутрь медиана времени достижения максимальной концентрации иксазомиба в плазме составляла один час. Значение абсолютной биодоступности после перорального приема составляло 58 % по результатам популяционного анализа фармакокинетики. AUC иксазомиба увеличивается дозозависимым образом в диапазоне доз от 0,2 до 10,6 мг. Исследование влияния приема пищи, проведенное у пациентов, получавших однократную дозу 4 мг иксазомиба, показало, что пища с высоким содержанием жиров понижала AUC иксазомиба на 28 % и Смакс (максимальную концентрацию) на 69 %.
Распределение
Иксазомиб на 99 % связывается с белками плазмы и распределяется в эритроциты с соотношением «кровь-плазма», составляющем 10. Объем распределения в равновесном состоянии составляет 543 л.
Выведение
По результатам популяционного анализа фармакокинетики системный клиренс составлял около 1,9 л/ч с изменчивостью индивидуальных значений величиной 44 %. Период полувыведения в конечной фазе (Т1/2) иксазомиба составлял 9,5 дня. После еженедельного перорального применения отношение накопления было определено как двукратное.
Метаболизм
После перорального приема дозы с радиоизотопной меткой
иксазомиб представлял 70 % всего связанного с препаратом радиоактивного материала в плазме. Основным механизмом выведения иксазомиба считают метаболизм под действием множественных ферментов CYP и не-CYP белков. При клинически значимых уровнях концентрации иксазомиба исследования in vitro с использованием изоферментов цитохрома Р450, полученных на основе человеческой комплементарной ДНК, показали, что не существует специфического изофермента CYP, преимущественно участвующего в метаболизме иксазомиба. При концентрациях более высоких, чем клинические,
иксазомиб подвергался метаболизму под действием многих изоформ CYP с оценочными долями участия: 3А4 (42 %), 1А2 (26 %), 2В6 (16 %), 2С8 (6 %), 2D6 (5 %), 2С19 (5 %) и 2С9 (< 1 %).
Выделение
После перорального приема однократной дозы 14С-иксазомиба у 5 пациентов с распространённой злокачественной опухолью 62 % поступившей радиоактивности было выведено с мочой и 22 % с калом. Неизмененный
иксазомиб, выведенный с мочой, составлял < 3,5 % введенной дозы.
Особые группы пациентов
Возраст, пол, этническая принадлежность
Не наблюдалось клинически значимого влияния возраста (в диапазоне 23-91 года), пола, площади поверхности тела (диапазон 1,2-2,7 м2) или расовой принадлежности на клиренс иксазомиба на основании популяционного анализа фармакокинетики.
Нарушения функции печени
Фармакокинетика иксазомиба была сходной у пациентов с нормальной функцией печени и у пациентов с нарушениями функции печени легкой степени (общий билирубин ? ВПН [верхний предел нормы] и ACT > ВПН, или общий билирубин > 1-1,5 х ВПН и любое значение ACT) на основании популяционного анализа фармакокинетики. Фармакокинетические данные были описаны у пациентов с нормальной функцией печени при приеме иксазомиба в дозе 4 мг (N=12), с умеренными нарушениями функции печени при дозе 2,3 мг (общий билирубин > 1,5-3 х ВПН, N=13) или тяжелыми нарушениями функции печени при дозе 1,5 мг (общий билирубин > 3 х ВПН, N=18). Нормализованные по дозе средние значения AUC были на 20% выше у пациентов с умеренными или тяжелыми нарушениями функции печени по сравнению с пациентами с нормальной функцией печени.
Нарушения функции почек
Фармакокинетика иксазомиба была сходной у пациентов с нормальной функцией почек и у пациентов с нарушениями функции ночек легкой или умеренной степени тяжести (клиренс креатинина ? 30 мл/мин) на основании популяционного анализа фармакокинетики. Фармакокинетические данные были описаны при дозе иксазомиба 3 мг у пациентов с нормальной функцией почек (клиренс креатинина ? 90 мл/мин, N=18), тяжелыми нарушениями функции почек (клиренс креатинина < 30 мл/мин, N=14) или с заболеваниями почек в терминальной стадии, требующими диализа (N=6). Средние значения AUC были на 39 % выше у пациентов с тяжелыми нарушениями функции почек или с заболеваниями почек в терминальной стадии, требующими диализа, по сравнению с пациентами с нормальной функцией почек. Концентрации иксазомиба перед диализом, во время его проведения и после проведения диализа были сходными, что свидетельствовало о том, что
иксазомиб не выводится при проведении диализа.
Показания к применению
Препарат Нинларо® показан в комбинации с леналидомидом и дексаметазоном для лечения пациентов с множественной миеломой, получивших ранее как минимум одну линию предшествующей терапии.
Противопоказания
Повышенная чувствительность к компонентам препарата, беременность, период грудного вскармливания, детский возраст до 18 лет.
С осторожностью :
Меры предосторожности при применении
Тромбоцитопения, желудочно-кишечная токсичность, периферическая нейропатия, периферические отеки, кожные реакции, гепатотоксичность, эмбриофетотоксичность.
Беременность и лактация :
Беременность
Краткое описание риска
Механизм действия Нинларо® и данные, полученные в ходе исследований репродуктивной токсичности у животных, указывают на то, что Нинларо® может оказывать вредное влияние на плод при применении у беременных женщин. Клинические данные относительно потенциального влияния Нинларо® на беременность или на развитие эмбриона или плода отсутствуют.
Иксазомиб обусловливал эмбриофетотоксичность у беременных крыс и кроликов в дозах, приводящих к воздействию, слегка превышающему то, которое наблюдается у пациентов, получающих рекомендуемые дозы. Женщина должна быть проинформирована о потенциальной опасности для плода и избегать беременности в период применения Нинларо®.
В общей популяции США оцениваемый риск выраженных врожденных дефектов или невынашивания при клинически установленной беременности составляет 2-4 % и 15-20 %, соответственно.
Данные
Данные, полученные в исследованиях на животных
При исследовании эмбриофетального развития на беременных кроликах у плода наблюдалось повышение частоты неправильного развития/изменений скелета (сращение хвостовых позвонков, изменение числа поясничных позвонков и полноценные добавочные ребра) при дозах, которые являлись токсичными и для самки (? 0,3 мг/кг). Уровни воздействия дозой 0,3 мг/кг у кроликов были в 1,9 раза выше, чем средняя доза воздействия у человека при применении рекомендуемых доз 4 мг. В исследовании по определению диапазона доз, влияющих на эмбриофетальное развитие крыс, при дозах, которые являлись токсичными для самки, наблюдалось снижение массы тела плода, тенденция к понижению жизнеспособности плода и увеличению частоты постимплантационной гибели плода при дозах 0.6 мг/кг. Уровни воздействия у крыс при дозах 0,6 мг/кг были в 2,5 раза выше, чем средний уровень воздействия у человека при применении рекомендуемых доз 4 мг.
Лактация
Краткое описание риска
Нет данных о выделении Нинларо® или его метаболитов с грудным молоком и влиянии препарата на детей, находящихся на грудном вскармливании, или на образование грудного молока. Ввиду того, что степень риска развития серьезных нежелательных реакций у ребенка при применении Нинларо® неизвестна, следует рекомендовать женщине прекратить грудное вскармливание в период лечения и в течение 90 дней после приема последней дозы.
Женщины и мужчины, способные к деторождению
Контрацепция
Пациенты мужского и женского пола, способные к деторождению, должны применять надежные средства контрацепции в период лечения и в течение 90 дней после него.
Известно, что
дексаметазон оказывает слабое или средней силы индуцирующее действие на изофермент CYP3A4, а также на другие ферменты и белки-переносчики. Поскольку Нинларо® применяется совместно с дексаметазоном, следует учитывать риск снижения эффективности противозачаточных средств. Женщинам, использующим гормональные контрацептивы, следует также дополнительно применять барьерный метод контрацепции.
Способ применения и дозы
Нинларо® в комбинации с леналидомидом и дексаметазоном
Нинларо® предназначен для приема внутрь.
Нинларо® следует принимать один раз в неделю, в один и тот же день недели и приблизительно в одно и то же время, в течение первых трех недель четырехнедельного цикла. Нинларо® следует принимать, по крайней мере, за один час до или, по крайней мере, через два часа после приема пищи. Капсулу проглатывают целиком, запивая водой. Капсулу не следует раздавливать, жевать или открывать.
Режим дозирования
Рекомендуемые начальные дозы Нинларо® составляют 4 мг, принимаемые внутрь один раз в неделю в 1, 8 и 15 дни 28-дневного цикла лечения.
Рекомендуемые начальные дозы леналидомида составляют 25 мг, принимаемые внутрь ежедневно с 1 по 21 дни 28-дневного цикла лечения.
Рекомендуемые начальные дозы дексаметазона составляют 40 мг, применяемые в 1, 8, 15 и 22 дни 28-дневного цикла лечения.
Табл. 1. Схема применения Нинларо в комбинации с леналидомидом и дексаметазоном
|
28-дневный цикл (4-недельный цикл) |
||||||||
|
1 неделя |
2 неделя |
3 неделя |
4 неделя |
|||||
|
1 день |
2-7 дни |
8 день |
9-14 дни |
15 день |
16-21 дни |
22 день |
23-28 дни |
|
|
Нинларо |
V |
V |
V |
|||||
|
Леналидомид |
V |
V ежедневно |
V |
V ежедневно |
V |
V ежедневно |
||
|
Дексаметазон |
V |
V |
V |
V |
V — прием лекарственного препарата
Для получения дополнительной информации по леналидомиду и дексаметазону следует обратиться к инструкциям по их медицинскому применению.
Перед началом нового цикла терапии:
— Абсолютное количество нейтрофилов должно быть, по крайней мере, 1000 /мм3
— Количество тромбоцитов должно быть, по крайней мере, 75000 /мм3
— Негематологическая токсичность должна в целом восстановиться до исходного состояния пациента или до 1 степени или ниже, по усмотрению врача.
Лечение следует продолжать до прогрессирования заболевания или развития неприемлемой токсичности.
Сопутствующая терапия
Следует оцепить необходимость профилактического назначения противовирусных препаратов у пациентов, получающих Нинларо®, с целью снизить риск реактивации вируса опоясывающего герпеса (см. раздел «Побочное действие»).
Задержка приема или пропущенные дозы
В случае задержки или пропуска приема очередной капсулы Нинларо® препарат следует принять только если до приема следующей запланированной дозы осталось ? 72 часов. Пропущенную дозу не следует принимать менее, чем за 72 часа перед приемом следующей запланированной дозы. Не следует принимать двойную дозу препарата вместо пропущенной дозы.
В случае возникновения рвоты после приема препарата не следует принимать дополнительную дозу. Пациент должен продолжить лечение препаратом со следующей запланированной дозы.
Указания по изменению дозы
Последовательность уменьшения дозы Нинларо® представлена в таблице 2. рекомендации по коррекции дозы приведены в таблице 3.
Табл. 2. Снижение дозы Нинларо® вследствие нежелательных реакций
|
Рекомендуемая начальная доза* |
Первое уменьшение дозы до |
Второе уменьшение дозы до |
Отмена препарата |
|
4 мг |
3 мг |
2,3 мг |
* Рекомендуемая начальная доза 3 мг у пациентов с умеренными или тяжелыми нарушениями функции печени, тяжелыми нарушениями функции почек или заболеваниями почек терминальной стадии, требующими диализа.
Рекомендуется чередующийся подход к изменению дозы Нинларо® и леналидомида при тромбоцитопении, нейтропении и сыпи, как описано в таблице 3. Следует обратиться к инструкции по медицинскому применению леналидомида, если требуется снижение дозы леналидомида.
Таблица 3. Указания но изменению дозы Нинларо® при применении в комбинации с леналидомидом и дексаметазоном
|
Гематологическая токсичность |
Рекомендуемые действия |
|
Тромбоцитопения (количество тромбоцитов) |
|
|
Количество тромбоцитов менее чем 30 000 /мм3 |
— Не применять Нинларо® и — После нормализации продолжают применение леналидомида в следующей более низкой дозе согласно инструкции по его применению и продолжают применение Нинларо® в его последней дозе. — Если количество тромбоцитов снова падает ниже чем 30 000/мм3, не применять Нинларо® и — После нормализации продолжают применение Нинларо® в следующей более низкой дозе и продолжают применение леналидомида в его последней дозе.* |
|
Нейтропения (абсолютное количество нейтрофилов) |
|
|
Абсолютное количество нейтрофилов менее чем 500 /мм3 |
— Не применять Нинларо® и — После нормализации продолжают применение леналидомида в следующей более низкой дозе согласно инструкции по его применению и продолжают применение Нинларо® в его последней дозе. — Если абсолютное количество нейтрофилов снова падает ниже чем 500/мм3, не применять Нинларо® и — После нормализации продолжают применение Нинларо® в следующей более низкой дозе и продолжают применение леналидомида в его последней дозе.* |
| Негематологическая токсичность |
Рекомендуемые действия |
|
Сыпь |
|
|
Степеньt 2 или 3 |
— Не применять — После нормализации продолжают применение леналидомида в следующей более низкой дозе согласно инструкции по его применению. — Если появляется сыпь степени 2 или 3, не применять Нинларо® и — После нормализации продолжают применение Нинларо® в следующей более низкой дозе и продолжают применение леналидомида в его последней дозе.* |
|
Степень 4 |
Отменить схему лечения |
|
Периферическая нейропатия |
|
|
Периферическая нейропатия степени 1 с болью или периферическая нейропатия степени 2 |
— Не применять Нинларо®, пока периферическая нейропатия не уменьшится до степени 1 или ниже без боли или до исходного состояния пациента. — После нормализации продолжают применение Нинларо® в его последней дозе. |
|
Периферическая нейропатия степени 2 с болью или периферическая нейропатия степени 3 |
— Не применять Нинларо®. Явления токсичности, на усмотрение врача, в целом, должны уменьшиться до исходного состояния пациента или степени 1 или ниже перед возобновлением приема Нинларо®. — После нормализации продолжают применение Нинларо® в следующей более низкой дозе |
|
Периферическая нейропатия степени 4 |
Отменить схему лечения |
|
Другие виды негематологической токсичности |
|
| Другие виды негематологической токсичности степени 3 или 4 |
— Не применять Нинларо®. Явления токсичности, на усмотрение врача, в целом, должны уменьшиться до исходного состояния пациента или степени 1 или ниже перед возобновлением приема Нинларо®. — Если явление связано с Нинларо®, после нормализации продолжают применение Нинларо® в следующей более низкой дозе |
* При повторных проявлениях токсичности рекомендуется использовать схему последовательного приема леналидомида и Нинларо*.
t Градация основана на Общих терминологических критериях нежелательных явлений Национального института онкологии США (СТСАЕ, версия 4.03)
Особые группы пациентов
Пациенты пожилого возраста (65 лет и старше)
Результаты популяционного фармакокинетического (ФК) анализа у пациентов старше 65 лет показали отсутствие необходимости в коррекции дозы иксазомиба.
В исследованиях иксазомиба не выявлено клинически значимых различий безопасности и эффективности препарата у пациентов моложе 65 лет и пациентов в возрасте 65 лет и старше.
Нарушение функции печени
Начальную дозу Нинларо® снижают до 3 мг у пациентов с умеренными (общий билирубин выше чем 1,5-3 х ВПН [верхний предел нормы]) или тяжелыми (общий билирубин выше чем 3 х ВПН) нарушениями функции печени.
Нарушение функции почек
Начальную дозу Нинларо® снижают до 3 мг у пациентов с тяжелыми нарушениями функции почек (клиренс креатинина ниже чем 30 мл/мин) или с заболеваниями почек в терминальной стадии, требующих диализа. Нинларо® не может быть выведен путем проведения диализа. Относительно рекомендаций но дозированию леналидомида у пациентов с нарушениями функции почек следует обратиться к инструкции по его медицинскому применению.
Дети и подростки
Безопасность и эффективность применения иксазомиба у детей в возрасте до 18 лет не установлены. Данные отсутствуют.
Побочное действие
Следующие нежелательные реакции подробно описаны в разделе «Особые указания»:
— Тромбоцитопения
— Желудочно-кишечная токсичность
— Периферическая нейропатия
— Периферические отеки
— Кожные реакции
— Гепатотоксичность
Опыт применения в клинических исследованиях
Поскольку Нинларо® применяется в комбинации с леналидомидом и дексаметазоном, следует ознакомиться с информацией о нежелательных реакциях этих препаратов в инструкции по медицинскому применению.
Популяция оценки безопасности в базисном исследовании 3 фазы включала 720 пациентов с рецидивирующей и/или устойчивой к лечению множественной миеломой, получавших Нинларо® в комбинации с леналидомидом и дексаметазоном (схема с Нинларо*; N=360) или плацебо в комбинации с леналидомидом и дексаметазоном (схема с плацебо; N=360) и 115 пациентов из двойного слепого плацебо-контролируемого исследования.
Наиболее частыми нежелательными реакциями (? 20 %), которые были зарегистрированы у 417 пациентов, получавших Нинларо и 418 пациентов, получавших плацебо, являлись диарея (39 % по сравнению с 32 %), тромбоцитопения (33 % по сравнению с 21 %), нейтропения (33 % по сравнению с 30 %), запор (30 % по сравнению с 22 %), периферическая нейропатия (25 % по сравнению с 20 %), тошнота (23 % по сравнению с 18 %), периферические отеки (23 % по сравнению с 17 %), рвота (20 % по сравнению с 10 %) и инфекции верхних дыхательных путей (21 % по сравнению с 16 %). Серьезные нежелательные реакции, зарегистрированные у ? 2 % пациентов, включали тромбоцитопению (2 %) и диарею (2 %).
Нежелательные реакции на препарат упорядочены по системно-органному классу и согласуются с терминами предпочтительного употребления (в соответствии с Медицинским словарем для нормативно-правовой деятельности — MedDRA) (см. табл. 4). Для описания частоты нежелательных реакций (HP) используется классификация, основанная на рекомендациях Совета международных научно-медицинских организаций — CIOMS: очень часто (? 1/10); часто (? 1/100 до < 1/10); нечасто (? 1/1000 до < 1/100); редко (? 1/10 000 до < 1/1000); очень редко (< 1/10 000); неизвестно (не может быть рассчитана на основе доступных данных).
Табл. 4. Нежелательные реакции при применении Нинларо в комбинации с леналидомидом и дексаметазоном (все степени тяжести, 3 степени и 4 степени)
|
Класс системы органов/ Нежелательные реакции |
Нежелательные реакции (все степени тяжести) |
Нежелательные реакции 3 степени тяжести |
Нежелательные реакции 4 степени тяжести |
|
Инфекционные и паразитарные заболевания |
|||
|
Инфекция верхних дыхательных путей |
Очень часто |
Нечасто |
|
|
Опоясывающий герпес |
Часто |
Часто |
|
|
Нарушения со стороны системы крови и лимфатической системы |
|||
|
Тромбоцитопения* |
Очень часто |
Очень часто |
Часто |
|
Нейтропения* |
Очень часто |
Очень часто |
Часто |
|
Нарушения со стороны нервной системы |
|||
|
Периферические нейропатии* |
Очень часто |
Часто |
|
|
Нарушения со стороны желудочно-кишечного тракта |
|||
|
Диарея |
Очень часто |
Часто |
|
|
Запор |
Очень часто |
Нечасто |
|
|
Тошнота |
Очень часто |
Часто |
|
|
Рвота |
Очень часто |
Нечасто |
|
|
Нарушения со стороны кожи и подкожных тканей |
|||
|
Сыпь* |
Очень часто |
Часто |
|
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
|||
|
Боль в спине |
Очень часто |
Нечасто |
|
|
Общие расстройства и нарушения в месте введения |
|||
|
Периферические отеки |
Очень часто |
Часто |
* Представляет группу предпочтительных терминов.
Описание отдельных нежелательных реакций
Прекращение лечения
Развитие каждой из перечисленных нежелательных реакций потребовало отмены одного или более из трех лекарственных препаратов у ? 1% пациентов в группе Нинларо®.
Тромбоцитопения
У 3 % пациентов, принимавших Нинларо® и 1 % пациентов, получавших плацебо, во время лечения количество тромбоцитов составило ? 10000/мм3. У менее 1 % пациентов в обеих группах количество тромбоцитов во время лечения снизилось до ? 5000/мм3. Развитие тромбоцитопении привело к отмене одного или более из трех препаратов у < 1 % пациентов в группе Нинларо® и у 1 % пациентов в группе плацебо. Тромбоцитопения не сопровождалась увеличением частоты геморрагических проявлений или количества переливаний тромбоцитарной массы.
Токсические эффекты со стороны желудочно-кишечного тракта
Диарея приводила к отмене одного или более из трех препаратов у 1 % пациентов в группе Нинларо® и < 1 % пациентов в группе плацебо.
Сыпь
Сыпь наблюдались у 18 % пациентов в группе Нинларо® по сравнению с 10 % пациентов в группе плацебо. Чаще всего в обеих группах выявлялись пятнисто-папулезные и макулезные высыпания. Сыпь 3 степени зарегистрирована у 2 % пациентов в группе Нинларо® по сравнению с 1 % в группе плацебо. Появление высыпаний привело к отмене одного или более из трех лекарственных препаратов у < 1 % пациентов в обеих группах.
Периферическая нейропатия
Периферическая нейропатия возникла у 25 % пациентов в группе Нинларо® по сравнению с 20 % пациентов в группе плацебо. Периферическая нейропатия 3 степени зарегистрирована у 2 % пациентов в обеих группах. Наиболее часто развивалась периферическая сенсорная нейропатия (16 % и 12 % в группе Нинларо® и плацебо, соответственно). Периферическая моторная нейропатия встречалась нечасто в обеих группах (< 1 %). Развитие периферической нейропатии привело к отмене одного или более из трех лекарственных препаратов у 1 % пациентов в группе Нинларо® по сравнению с < 1 % пациентов в группе плацебо.
Расстройства зрения
Расстройства зрения описывали многими различными терминами предпочтительного употребления, суммарно их частота составляла 24 % у пациентов, получавших схему с Нинларо®, и 15 % у пациентов, получавших схему с плацебо. Наиболее частыми нежелательными реакциями были нечеткость зрения (5 % при схеме с Нинларо® и 4 % при схеме с плацебо), сухость глаз (4 % при схеме с Нинларо® и 1 % при схеме с плацебо), конъюнктивит (5 % при схеме с Нинларо® и 1 % при схеме с плацебо) и катаракта (4 % при схеме с Нинларо® и 5 % при схеме с плацебо). Нежелательные реакции степени 3 наблюдались у 2 % пациентов в обеих группах.
Другие нежелательные реакции
Но доступным данным, полученным за рамками исследования 3 фазы, в редких случаях сообщалось о следующих серьезных нежелательных реакциях: острый лихорадочный иейтрофильный дерматоз (синдром Свита), синдром Стивенса-Джонсона, поперечный миелит, синдром задней обратимой энцефалопатии, синдром лизиса опухоли и тромботическая тромбоцитопеническая пурпура.
В базисном исследовании 3 фазы (N=720) и двойном слепом плацебо-контролируемом исследовании (N=115) перечисленные ниже нежелательные реакции встречались с одинаковой частотой в группе Нинларо® и группе плацебо: усталость (26 % против 24 %), снижение аппетита (12 % против 9 %), артериальная гипотензия (4 % в каждой группе), сердечная недостаточность (3 % в каждой группе), аритмия (12 % против 11 %), а также нарушение функции печени, в том числе изменение уровня печеночных ферментов (8 % против 6 %).
Частота возникновения тяжелых (3-4 степени) форм гипокалиемии была выше в группе Нинларо® (5 %), чем в группе плацебо (< 1 %).
Развитие грибковой и вирусной пневмонии с летальным исходом регистрировалось у пациентов, получавших комбинацию Нинларо®,
леналидомид и
дексаметазон, редко.
Пациент должен быть проинформирован о необходимости сообщить врачу обо всех случаях нежелательных реакций, в том числе не перечисленных в данной инструкции по медицинскому применению.
Передозировка :
Специфического антидота для применения при передозировке Нинларо® не существует. В случае передозировки необходим мониторинг за состоянием пациента, наличием нежелательных реакций (см. раздел «Побочное действие»), а также проведение симптоматической терапии.
Взаимодействие
Фармакокинетические взаимодействия
Мощные индукторы CYP3A
Следует избегать одновременного применения Нинларо® с мощными индукторами CYP3A (таких, как рифампин,
фенитоин,
карбамазепин и зверобой). Совместное применение Нинларо с рифампином понижает Смакс иксазомиба на 54 % и AUC на 74 %.
Мощные ингибиторы CYP3A
Совместное применение Нинларо с кларитромицином, мощным ингибитором CYP3A, не привело к клинически значимому изменению наличия иксазомиба в системном кровотоке.
Мощные ингибиторы CYP1A2
По данным популяционного анализа фармакокинетики одновременное применение иксазомиба с мощными ингибиторами СYР1А2 не привело к клинически значимому изменению системного воздействия иксазомиба.
Влияние Нинларо® на другие лекарственные средства
Нинларо® не является ни обратимым, ни зависящим от длительности применения ингибитором изоформ CYP — 1А2, 2В6, 2С8, 2С9, 2С19. 2D6 или 3А4/5.
Иксазомиб не индуцировал активности CYP1A2, CYP2B6 и CYP3A4/5 или уровней соответствующих иммунореактивных белков. При применении Нинларо® не ожидается развития лекарственных взаимодействий путем подавления или индукции CYP.
Взаимодействия, связанные с переносчиками
Иксазомиб является низкоаффинным субстратом гликопротеина-Р.
Иксазомиб не является субстратом BCRP (белка резистентности рака молочной железы), MRP2 (белка 2 множественной лекарственной резистентности) или печеночных ОАТР (транспортных полипептидов органических анионов).
Иксазомиб не является ингибитором гликопротеина-Р, BCRP, MRP2, ОАТР1В1, ОАТР1В3, ОСТ (переносчика органических катионов) 2 типа, ОАТ (переносчика органических анионов) 1 и 3 типа, МАТЕ (белков экструзии лекарственных препаратов и токсинов) 1 или 2-К. При применении Нинларо® не ожидается развития лекарственных взаимодействий, связанных с переносчиками.
Пероральные контрацептивы
При одновременном применении Нинларо® с дексаметазоном, который является слабым или умеренным индуктором CYP3A4, а также других ферментов и белков переносчиков, необходимо учитывать риск снижения эффективности пероральных контрацептивов. Женщинам, принимающим гормональные контрацептивы, следует дополнительно использовать барьерный метод контрацепции.
Особые указания :
Тромбоцитопения
Имеются сообщения о тромбоцитопении при применении Нинларо® с максимальным снижением числа тромбоцитов, наблюдаемым между 14-21 днями каждого 28-дневного цикла, и восстановлением до исходного уровня к началу следующего цикла терапии. В ходе лечения у 3 % пациентов при схеме применения с Нинларо® и 1 % пациентов при схеме применения с плацебо отмечалось количество тромбоцитов ? 10 000/мм3. У менее чем 1 % пациентов на фоне использования обеих схем отмечалось количество тромбоцитов ? 5000/мм3. Отмена лечения из-за тромбоцитопении встречалась со сходной частотой при обеих схемах лечения (< 1 % пациентов при применении Нинларо® и 2 % пациентов при применении плацебо отменяли одно или более из трех применяемых лекарственных средств). Частота переливания тромбоцитарной массы составляла 6 % при схеме применения с Нинларо® и 5 % пациентов при схеме применения с плацебо.
Количество тромбоцитов контролируют как минимум ежемесячно в ходе лечения препаратом Нинларо®. Рекомендуется рассмотреть более частый контроль в течение первых трех циклов терапии. Тромбоцитопения коррегируется с помощью изменений дозы (см. раздел «Способ применения и дозы») и переливания тромбоцитарной массы согласно стандартным медицинским рекомендациям.
Желудочно-кишечная токсичность
На фоне применения Нинларо® отмечались диарея, запор, тошнота и рвота, эпизодически требовавшие применения противодиарейных, противорвотных средств и поддерживающего лечения. Диарея описана у 42 % пациентов при схеме применения с Нинларо® и у 36 % пациентов при схеме применения с плацебо, запор у 34 % и 25 % пациентов соответственно, тошнота у 26 % и 21 % пациентов соответственно, и рвота у 22 % и 11 % пациентов соответственно. Диарея приводила к отмене одного или более из трех применяемых лекарственных средств у 1 % пациентов при применении Нинларо® и < 1 % пациентов при применении плацебо. При симптомах степени 3 или 4 модифицируют дозу (см. раздел «Способ применения и дозы»).
Периферическая нейропатия
Большинство случаев нежелательных реакций в виде периферической нейропатии имели степень 1 (18 % при схеме применения с Нинларо® и 14 % при схеме применения с плацебо) и степень 2 (8 % при схеме применения с Нинларо® и 5 % при схеме применения с плацебо). Нежелательные реакции в виде периферической нейропатии степени 3 наблюдались у 2 % пациентов при обеих схемах; нежелательных реакций степени 4 или серьезных нежелательных реакций не отмечено.
Наиболее часто наблюдающейся реакцией оказалась периферическая сенсорная нейропатия (19 % и 14 % при схеме с Нинларо® и плацебо соответственно). Периферическая моторная нейропатия наблюдалась при обеих схемах нечасто (< 1 %). Периферическая нейропатия приводила к отмене одного или более из трех применяемых лекарственных средств у 1 % пациентов при обеих схемах. Пациентов следует регулярно обследовать на наличие симптомов нейропатии. Пациентам с вновь выявленной периферической нейропатией или ухудшением имеющейся может требоваться изменение дозы (см. раздел «Способ применения и дозы»).
Периферические отеки
Периферические отеки были описаны у 25 % и 18 % пациентов при схеме применения с Нинларо® и плацебо соответственно. Большинство случаев нежелательных реакций в виде периферических отеков имели степень 1 (16 % при схеме применения с Нинларо® и 13 % при схеме применения с плацебо) и степень 2 (7 % при схеме применения с Нинларо® и 4 % при схеме применения с плацебо).
Периферические отеки степени 3 наблюдались у 2 % и 1 % пациентов при схеме применения с Нинларо® и плацебо соответственно. Периферических отеков степени 4 не отмечено. Случаев отмены лечения из-за периферических отеков не было. Следует оценить основную причину и проводить поддерживающее лечение согласно необходимости. При симптомах степени 3 или 4 коррегируют дозу дексаметазона согласно инструкции по его медицинскому применению или дозу Нинларо® (см. раздел «Способ применения и дозы»).
Кожные реакции
Сыпь описана у 19 % пациентов при схеме применения с Нинларо® и у 11 % пациентов при схеме применения с плацебо. Большинство случаев нежелательных реакций в виде сыпи имели степень 1 (10 % при схеме применения с Нинларо® и 7 % при схеме применения с плацебо) или степень 2 (6 % при схеме применения с Нинларо® 3 % при схеме применения с плацебо). Сыпь степени 3 отмечена у 3 % пациентов при схеме применения с Нинларо® и у 1 % пациентов при схеме применения с плацебо. Нежелательных реакций в виде сыпи степени 4 или серьезных нежелательных реакций в виде сыпи не отмечено. Наиболее частым видом сыпи при обеих схемах являлись макулопапулезная и макулезная сыпь. Сыпь приводила к отмене одного или более из трех применяемых лекарственных средств у < 1 % пациентов при обеих схемах. Сыпь контролируют с помощью поддерживающего лечения или изменений дозы в случае степени 2 или выше (см. раздел «Способ применения и дозы»).
Гепатотоксичность
Лекарственное поражение печени, гепатоцеллюлярные повреждения, стеатоз печени, холестатический гепатит и гепатотоксичность были описаны у < 1 % пациентов в каждой из перечисленных реакций, получавших Нинларо®. Были отмечены нарушения функции печени (6 % при схеме применения с Нинларо® и 5 % пациентов при схеме применения с плацебо).
Следует регулярно контролировать уровень печеночных ферментов и коррегировать дозу при симптомах степени 3 или 4 (см. раздел «Способ применения и дозы»).
Эмбриофетотоксичность
На основании знаний о механизме действия и результатов исследований на животных Нинларо® может оказывать вредное влияние на плод при применении у беременных женщин. Адекватные и строго контролируемые исследования применения Нинларо® у беременных женщин отсутствуют.
Иксазомиб обусловливал эмбриофетотоксичность у беременных крыс и кроликов в дозах, приводящих к воздействию, слегка превышающему то, которое наблюдается у пациентов, получающих рекомендуемые дозы.
Женщинам, способным к деторождению, следует рекомендовать избегать беременности в период применения Нинларо®. Если Нинларо® применяется в период беременности или женщина забеременела во время применения Нинларо®, ее следует проинформировать о потенциальной опасности для плода. Следует рекомендовать способным к деторождению женщинам применение надежных средств контрацепции в период применения Нинларо® и в течение 90 дней после приема последней дозы. Женщинам, использующим гормональные контрацептивы, следует также дополнительно применять барьерный метод контрацепции (см. раздел «Применение при беременности и в период грудного вскармливания»).
Нинларо® является цитотоксическим препаратом. Следует соблюдать правила обращения и утилизации цитотоксических препаратов. Не следует открывать или разрушать капсулы. Следует избегать непосредственного контакта с содержимым капсулы. В случае разрушения капсулы избегать непосредственного контакта содержимого капсулы с кожей или глазами. Если произошел контакт с кожей, тщательно промыть водой с мылом. Если произошел контакт с глазами, тщательно промыть водой.
Любое неиспользованное количество лекарственного препарата или отходов следует уничтожать в соответствии с местными требованиями.
Влияние на способность управлять транспортным средством :
Препарат Нинларо® оказывает незначительное влияние на способность управлять транспортными средствами и механизмами. В клинических исследованиях наблюдались усталость и головокружение. Пациентам следует рекомендовать воздержаться от вождения автомобиля и управления механизмами при наличии данных симптомов.
Форма выпуска :
Капсулы 2,3 мг, 3 мг и 4 мг.
Упаковка :
По 1 капсуле в блистере ПВХ Алюминий/ Алюминий, вклеенном в складывающуюся картонную обложку. По 1 картонной обложке вместе с инструкцией но применению помещают в пачку картонную (промежуточную упаковку). 3 картонные пачки (промежуточные упаковки) помещают в общую картонную пачку. На защитной наклейке голографическим способом указывают логотип «Takeda». и/Will
По 1 капсуле в блистере ПВХ Алюминий/ Алюминий, вклеенном в складывающуюся картонную обложку. По 1 картонной обложке вместе с инструкцией по применению помещают в пачку картонную.
Условия хранения :
Хранить при температуре не выше 25 °С. Не замораживать. Хранить в оригинальной упаковке непосредственно до приема каждой капсулы. Хранить в недоступном для детей месте.
Срок годности :
2 года. Не применять по истечении срока годности.
Условия отпуска из аптек :
По рецепту
Владелец регистрационного удостоверения :
Владелец Регистрационного удостоверения:Миллениум Фармасьютикалз Инкорпорэйтед
Производитель
HAUPT PHARMA AMAREG, GmbH Германия
Представительство: Такеда Фармасьютикалс ООО
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Химическое название
5-Хлор-6′-метил-3-[4-(метилсульфонил)фенил]-2,3′-бипиридин
Химические свойства
Эторикоксиб – нестероидное противовоспалительное средство. Относится к группе коксибов.
Фармакологическое действие
Обезболивающее, противовоспалительное, жаропонижающее.
Фармакодинамика и фармакокинетика
Эторикоксиб угнетает активность ЦОГ-2 по избирательному механизму, препятствует биосинтезу медиаторов воспаления простагландинов. Происходит уменьшение выраженность симптомов воспалительного процесса. При этом вещество не оказывает влияния на функциональную активность тромбоцитов и не повреждает слизистую оболочку пищеварительного тракта. Степень угнетения циклооксигеназы-2 носит дозозависимый характер. Средство не влияет на ЦОГ-1 (если суточная дозировка не превышает 150 мг).
Данное вещество значительно снижает степень проницаемости сосудов, улучшает микроциркуляцию крови и интенсивность выработки простагландинов, кининов и лейкотриенов. Происходит блокировка энергообеспечения воспалительного процесса.
Обезболивание осуществляется за счет снижения интенсивности воспаления, уменьшения количества вырабатываемого в процессе брадикинина. Благодаря способности лекарства снижать возбудимость центра теплорегуляции в промежуточном мозге, оно оказывает жаропонижающее действие.
После перорального приема средства, вещество быстро усваивается в пищеварительном тракте и проникает в кровь. Лекарство обладает практически 100%-ой биодоступностью. После приема 120 мг Эторикоксиба, максимальная его концентрация в крови наблюдается через 60 минут. Прием пищи снижает максимальную концентрацию на 35%, а время ее достижения увеличивает до 2 часов.
Степень связывания с белками плазмы крови = 92%. Средство преодолевает гематоэнцефалический и плацентарный барьеры. Метаболизм протекает с участием микросомальных ферментов печени, образует неактивные метаболиты: 6-гидроксиметил-эторикоксиб, 6-карбокси-ацетил-эторикоксиб и прочие.
Ежедневный прием лекарства в дозировке 120 мг приводит к установлению равновесной концентрации в течение недели. Период полувыведения составляет порядка 22 часов. Выводится лекарство с помощью почек и с каловыми массами, в виде метаболитов и в неизмененном виде (меньше 2%).
Установлено, что возраст, почечная и печеночная недостаточность незначительно изменяют фармакокинетические параметры вещества. Исследования не проводились у пациентов младше 12 лет и с тяжелой степенью печеночной недостаточности.
Показания к применению
Эторикоксиб применяют:
- для устранения симптомов ревматоидного артрита, остеоартроза, анкилозирующего спондилита;
- при подагрическом артрите;
- для купирования краткосрочной боли при проведении стоматологических манипуляций.
Противопоказания
Лекарство противопоказано к применению:
- при аллергии на действующее вещество либо группу веществ;
- если у пациента бронхиальная астма, рецидивирующий полипоз носа либо пазух и непереносимость НПВС либо Аспирина (наблюдалась ранее);
- при язвах и эрозиях в желудке и 12-перстной кишке;
- у пациентов с воспалительными заболеваниями кишечника, при болезни Крона, неспецифическом язвенном колите, при кровотечении в ЖКТ;
- у больных гемофилией, с нарушением процессов свертывания крови;
- при цереброваскулярном либо другом виде кровотечения;
- если у пациента выраженная хроническая либо острая сердечная недостаточность (2-4 класса);
- при серьезных заболеваниях печени;
- у больных с тяжелой почечной недостаточностью, гиперкалиемией, с прогрессирующими заболеваниями почек;
- при болезнях периферических артерий;
- у больных с ишемией;
- у беременных женщин на любом сроке;
- если пациент недавно перенес аортокоронарное шунтирование;
- при повышенном АД, если гипертензия достигает более 140 мм рт. ст. на 90 мм рт. ст.;
- у детей в возрасте до 16 лет;
- при кормлении грудью.
Побочные действия
Во время лечения Эторикоксибом могут проявиться следующие побочные реакции:
- головокружение, ощущение сердцебиения, общая слабость, головная боль, повышенное артериальное давление;
- понос, кашель, тошнота, несварение желудка, повышенное газообразование;
- болезненные ощущения в эпигастральной области;
- экхимоз, повышение уровня печеночных ферментов;
- отечность, симптомы гриппа.
Редко (у менее 1% больных) наблюдаются:
- искажение вкусовых ощущений и запахов, сонливость, парестезии, бессонница, гиперстезия, нарушения кровоснабжения мозга;
- депрессивные расстройства, тревожность, снижение концентрации внимания, приливы;
- лейкопения, нарушение зрения, шум в ушах, вертиго, конъюнктивит;
- сердечная недостаточность, фибрилляция предсердий;
- одышка, кровь из носа, кашель, развитие инфекций верхних дыхательных путей;
- гастрит, эзофагит, снижение уровня гемоглобина и гематокрита, инфаркт миокарда, тромбоцитопения;
- запор, тяжесть в животе, икота, сухость слизистой ротовой полости;
- снижение либо повышение аппетита, язва 12-перстной кишки и желудка, рвота;
- гастроэнтерит, инфекции мочевыводящих путей, протеинурия, миалгия;
- снижение судорожного порога, артралгия, высыпания на коже, зуд, аллергический отек лица;
- увеличение веса, болезненные ощущения в груди и за грудиной, гиперкалиемия;
- гиперурикемия, повышения уровня мочевины в крови.
Очень редко возникают:
- почечная недостаточность (состояние нормализуется при отмене препарата);
- гипернатриемия, шок, анафилактические реакции;
- синдром Стивенса-Джонсона, крапивница;
- перфорация и кровотечения в ЖКТ;
- синдром Лайелла, гепатит, бронхоспазм;
- гипертонический криз, спутанность сознания и галлюцинации.
Эторикоксиб, инструкция по применению (Способ и дозировка)
Лекарство предназначено для приема внутрь. Дозировка и схема лечения зависит от болезни и рекомендаций врача.
Обычно принимают от 0,06 до 0,12 г один раз в день. При печеночной недостаточности не рекомендуется принимать более 60 мг средства в сутки.
Передозировка
При передозировке данным веществом могут значительно усилиться побочные реакции, в особенности со стороны сердца, сосудов, почек и пищеварительного тракта.
Лечение направлено на устранение опасных симптомов передозировки. Лекарство не выводится из организма при перитонеальном диализе и гемодиализе.
Взаимодействие
С осторожностью сочетают лечение данным веществом с приемом пероральных контрацептивов (норэтиндрон и этинилэстрадиол) в течение длительного времени (от 3 недель). Такая комбинация значительно повышает риск развития тромбоэмболии.
Если пациент принимает Ацетилсалициловую кислоту в небольшой дозировке для профилактики сердечно-сосудистых заболеваний, то проводить лечение Эторикоксибом следует с осторожностью. Увеличивается вероятность развития язв и эрозий пищеварительного тракта.
У пациентов, которые принимают Варфарин, препарат может увеличить протромбиновый индекс и МНО. Поэтому рекомендуется перед началом терапии и во время лечения контролировать данные показатели. Также можно скорректировать суточную дозировку (не выше 60 мг), особенно в начале лечения.
Лекарственные средства, входящие в группы неселективных НПВС и селективных ингибиторов циклооксигеназы-2 снижают эффективность ингибиторов АПФ. У больных с почечной недостаточностью такая комбинация крайне нежелательна и может привести к функциональной недостаточности почек и повышению АД.
Сочетанный прием Эторикоксиба, Циклоспорина и Такролимуса усиливает нагрузку на почки.
Данное лекарственное средство может повысить уровень лития в плазме крови при сочетании с препаратами лития.
Эторикоксиб повышает плазменную концентрацию Метотрексата и снижает его почечный клиренс.
Сочетание препарата с Дигоксином допустимо. Лекарство не оказывает влияния на величину AUC и процесс выведения Дигоксина. Однако, повышается максимальная концентрация кардиотоника в крови, это может вызвать передозировку препаратом.
Не рекомендуется комбинация Эторикоксиба и Рифампицина.
Условия продажи
При покупке лекарства нужен рецепт от врача.
Срок годности
Препараты Эторикоксиба хранят в течение 3 лет.
Особые указания
Во время лечения данным средством следует учитывать все риски и ограничения, связанные с приемом НПВС (кровотечения в ЖКТ, цереброваскулярные нарушения).
Рекомендуется назначать вещество с осторожностью:
- при сахарном диабете или курении;
- пожилым пациентам;
- больным, которые ранее длительно лечились НПВС;
- в сочетании с антикоагулянтами, глюкокортикостероидами, антиагрегантами, селективными ингибиторами обратного захвата серотонина;
- при алкоголизме (хроническом, в сочетании с печеночной недостаточностью).
В течение первых 14 дней терапии рекомендуется контролировать артериальное давление и работу печени.
Средство лучше не сочетать с другими нестероидными противовоспалительными препаратами.
Требуется с осторожностью водить автомобиль и выполнять потенциально опасные, требующие высокой концентрации внимания действия.
Пожилым
Пациентам преклонного возраста препарат назначают с особой осторожностью и в минимальной дозировке.
При беременности и лактации
Средство противопоказано к приему во время беременности и при кормлении грудью. Женщинам, которые принимают лекарство, рекомендуется использовать надежные методы контрацепции.
Препараты, в которых содержится (Аналоги Эторикоксиба)
Совпадения по коду АТХ 4-го уровня:
- Аркоксиа
- Аторика табс
- Бикситор
- Костарокс
- Эторелекс
- Долококс
- Эториакс
- Риксия
- Рикотиб
- Этория
Отзывы
Отзывов о применении лекарства множество. В основном оно помогает снять боль и воспаление при длительном использовании. Также можно обнаружить много сообщений о развитии побочных реакций, со стороны пищеварительной системы. Некоторые пациенты предпочли перейти на более безопасные аналоги и заменители этого лекарства.
Некоторые отзывы о Эторикоксибе:
- “… Принимала этот препарат 3 недели, мне его назначили после операции по поводу межпозвоночной грыжи. У меня от него эрозия желудка появилась. Сейчас грыжа не беспокоит, но пришлось лечить эрозию”;
- “… Частный платный врач мне назначил этот препарат. Должна отметить, что он достаточно дорогой и мне совершенно не помог. Боль ушла только после приема другого лекарства, проверенного временем”.
Цена Эторикоксиба, где купить
Цена таблеток с Эторикоксибом дозировкой 120 мг составляет около 500 рублей за упаковку.
Описание препарата Табекс® (таблетки, покрытые пленочной оболочкой, 1.5 мг) основано на официальной инструкции, утверждено компанией-производителем в 2017 году
Дата согласования: 11.08.2017
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| активное вещество: | |
| цитизин | 1,5 мг |
| вспомогательные вещества: лактозы моногидрат — 28 мг; МКЦ — 67,5 мг; тальк — 2 мг; магния стеарат — 1 мг | |
| оболочка пленочная: Опадрай II коричневый 8 F 26948 — 3 мг: поливиниловый спирт частично гидролизованный — 1,2 мг; титана диоксид (Е171) — 0,654 мг; макрогол 3350 — 0,606 мг; тальк — 0,444 мг; железа оксид желтый (Е172) — 0,062 мг, железа оксид красный (Е172) — 0,018 мг, железа оксид черный (Е172) — 0,016 мг |
Описание лекарственной формы
Таблетки: круглые, двояковыпуклые, покрытые пленочной оболочкой светло-коричневого цвета.
Вид на изломе — от белого до бежевого цвета.
Фармакологическое действие
Фармакологическое действие
—
н-холиномиметическое.
Фармакодинамика
Алкалоид цитизин, являющийся активным веществом препарата, обладает н-холиномиметическим действием; возбуждает ганглии вегетативной нервной системы, рефлекторно стимулирует дыхательный центр, вызывает выделение адреналина из мозгового вещества надпочечников, повышает АД.
При близком сходстве с механизмом действия никотина, цитизин обладает гораздо более низкой токсичностью и бóльшим терапевтическим индексом.
Цитизин конкурентно подавляет взаимодействие никотина с соответствующими рецепторами, что ведет к постепенному уменьшению и исчезновению никотиновой зависимости.
Фармакокинетика
Фармакокинетические исследования на людях не проводились.
Показания
Никотиновая зависимость (для облегчения отказа от курения).
Физическая и психологическая зависимость от никотина считается определенным типом заболевания, которое приводит к неспособности воздержания от курения, даже при понимании его негативных эффектов.
Противопоказания
гиперчувствительность к активному или любому из вспомогательных веществ препарата;
острый инфаркт миокарда;
нестабильная стенокардия;
аритмия сердца;
недавно перенесенное нарушение мозгового кровообращения;
атеросклероз;
тяжелая артериальная гипертензия;
недостаточность лактазы, галактоземия, синдром мальабсорбции глюкозы-галактозы (в состав препарата входит лактоза);
беременность;
период грудного вскармливания;
возраст до 18 и после 65 лет.
С осторожностью: другие формы ишемической болезни сердца (стабильная стенокардия, бессимптомная (тихая) ишемия миокарда, вазоспастическая стенокардия, синдром «X» (микрососудистая стенокардия); сердечная недостаточность, повышенное АД; заболевания сосудов головного мозга; облитерирующие артериальные заболевания, гипертиреоидизм, язвенная болезнь желудка, сахарный диабет, почечная или печеночная недостаточность, некоторые формы шизофрении, наличие хромаффинных опухолей надпочечников; гастроэзофагеальная рефлюксная болезнь; лица с длительным стажем курения и лица старше 40–45 лет (см. «Особые указания»). Применение препарата у пациентов с заболеваниями, указанными в разделе «С осторожностью», возможно только после консультации врача.
Применение при беременности и кормлении грудью
Табекс® не следует применять женщинам во время беременности и в период грудного вскармливания.
Способ применения и дозы
Внутрь, целиком, запивая достаточным количеством жидкости. Не следует превышать рекомендованные дозы. Прием препарата желательно начинать после установки пациента на полный отказ от курения.
Препарат следует применять по следующей схеме: c 1-го по 3-й день — по 1 табл. 6 раз в день (каждые 2 ч), постепенно уменьшая число выкуренных сигарет. Таблетку следует принимать между эпизодами курения для удлинения интервалов между выкуриванием сигарет, чтобы максимально снизить их потребление. Интервал приема каждые 2 ч должен соблюдаться. Если результат неудовлетворительный, лечение следует прекратить и через 2–3 мес можно начать его снова.
При хорошем эффекте лечение продолжают по следующей схеме: с 4-го по 12-й день — по 1 табл. каждые 2,5 ч; с 13-го по 16-й день — по 1 табл. каждые 3 ч; с 17-го по 20-й день — по 1 табл. каждые 5 ч; с 21-го по 25-й день — по 1–2 табл. в день.
Настоятельно рекомендуется отказаться от курения не позднее 5-го дня от начала лечения. Сочетание медикаментозной терапии с консультациями, в т.ч. с мерами психологической поддержки пациента, достоверно повышает эффективность лечения.
Побочные действия
Препарат обычно хорошо переносится, наблюдаемые побочные явления выражены слабо или умеренно. Большинство из них появляются в начале лечения и проходят самостоятельно. Чаще всего они связаны с отказом от табакокурения и проявляются головокружением, головной болью и бессонницей.
В рекомендованных дозах препарат Табекс® не вызывает серьезных неблагоприятных эффектов.
Возможны следующие побочные действия:
Со стороны ССС: тахикардия, незначительное повышение АД, ощущение сердцебиения.
Со стороны ЦНС: головная боль, головокружение, бессонница или сонливость, повышенная раздражительность.
Со стороны дыхательной системы: одышка.
Со стороны ЖКТ: сухость во рту, тошнота, боли в животе, запоры, диарея, изменения вкуса и аппетита.
Со стороны скелетно-мышечной и соединительной ткани: боли в мышцах.
Со стороны обмена веществ и питания: снижение массы тела, повышенное потоотделение.
Прочие: боли в грудной клетке.
Взаимодействие
После прекращения табакокурения могут усиливаться побочные действия теофиллина, ропинирола, клозапина и оланзапина.
При одновременном применении препарата Табекс® с ацетилхолином, карбахолом, галантамином, пиридостигмином, ривастигмином, дистигмином возможно усиление холиномиметических побочных действий (слюнотечение, слезотечение, бронхиальная секреция с кашлем и риск возникновения приступа астмы, сужение зрачка, колики, тошнота, рвота, частое мочеиспускание, повышенный тонус мышц или внезапные сокращения мышц).
Применение препарата Табекс® одновременно с ловастатином, симвастатином, флувастатином, правастатином и др. повышает риск появления болей в мышцах.
Одновременное применение препарата Табекс® с гипотензивными средствами (пропранолол и др.) может ослабить их эффект.
Передозировка
Симптомы: тошнота, рвота, расширение зрачков, общая слабость, тахикардия, клонические судороги, паралич дыхания. Наступают в случае, когда пациент не соблюдает режим дозирования и принимает препарат в дозах, в несколько раз превышающих терапевтические.
Лечение: промывание желудка, назначение активированного угля, инфузионное введение водно-солевых растворов, а также 5 или 10% раствора глюкозы, назначение противосудорожных средств, кардиотоников, дыхательных аналептиков и других симптоматических средств. Следует отслеживать работу органов дыхания, АД и ЧСС.
Особые указания
Прием препарата следует начать только тогда, когда пациент имеет серьезное намерение отказаться от курения.
Лицам с длительным стажем курения и лицам старше 40–45 лет препарат Табекс® следует применять только после консультации с врачом. При применении препарата не следует превышать рекомендованные дозы. Лечение препаратом и продолжение курения может привести к усилению побочных действий никотина (никотиновая интоксикация). Лекарственный препарат содержит вспомогательное вещество лактозу. Пациентам с редкими наследственными проблемами непереносимости галактозы, с лактазным дефицитом (тип Лапп) или глюкозо-галактозной мальабсорбцией не следует применять лекарственный препарат.
Влияние на способность управлять транспортными средствами и работать с механизмами. Хотя на фоне применения препарата какого-либо отрицательного влияния на способность управлять автотранспортом и работу с механизмами не наблюдалось, однако вследствие возможного возникновения сонливости и других побочных реакций следует соблюдать осторожность в перечисленных ситуациях.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 1,5 мг. В бл. из ПВХ-пленки/фольги алюминиевой, 50 шт. 2 бл. в картонном вкладыше с календарем приема в пачке картонной.
Производитель
«Софарма» АО. Болгария, 1220, София, ул. Илиенское шоссе, 16.
Тел.: (+359 2) 813-42-00; факс: (+359 2) 936-02-86.
Претензии потребителей и информацию о нежелательных явлениях следует направлять по адресу: 109429, Москва, МКАД 14-й км, 10.
Тел./факс: (495) 786-22-26.
Условия отпуска из аптек
Без рецепта.
Условия хранения
Хранить в оригинальной упаковке для защиты от света и влаги, при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Исследователи Мельбурнского университета ищут пути борьбы с опасными возбудителями с помощью антибиотиков, преодолевающих резистентность патогенов, что может помочь в борьбе не только с нозокомиальными инфекциями, но и с осложнениями новой коронавирусной инфекции (COVID-19).
По мере эволюционирования микроорганизмов они вырабатывают механизмы, которые позволяют им противостоять имеющимся антибактериальным препаратам и превращают их в «супербактерии», с которыми не может справиться большинство доступных методов лечения. Нередко такие возбудители становится причиной развития опасных и потенциально жизнеугрожающих инфекций.
Исследователи из Мельбурна установили, что недавно открытый природный антибиотик тейксобактин может быть эффективен при лечении бактериальных заболеваний лёгких, вызванных полирезистентными возбудителями, туберкулёза и бактериальных осложнений COVID-19.
Тейксобактин был открыт в 2015 г. командой во главе с профессором Кимом Льюисом (Kim Lewis) из Северо-Восточного университета (Бостон, США). В настоящее время компания-производитель разрабатывает его как средство для лечения инфекционных заболеваний учеловека.
Новая работа учёных из Мельбурнского университета, результаты которой были опубликованы в Systems, стала первым доклиническим исследованием, призванным объяснить, как работает тейксобактин в отношении метициллинорезистентных штаммов Staphylococcus aureus (MRSA).
MRSA относится к числу возбудителей, вызывающих целый ряд инфекций, трудно поддающихся лечению, в частности, вторичных бактериальных осложнений после перенесённых вирусных инфекций, таких как тяжёлая пневмония, возникающая после COVID-19 и гриппа.
Научные сотрудники Университета Мельбурна синтезировали новый вариант тейксобактина. Полученное ими соединение продемонстрировало высокую активность против MRSA. Как оказалось, тейксобактин эффективно подавляет механизмы, участвующие в развитии резистентности к антибиотикам из группы гликопептидов (в частности, ванкомицину), которые рекомендуются для лечения осложненных инфекций кожи и мягких тканей, инфекций кровотока, инфекционного эндокардита, инфекций костей и суставов и менингита, вызванного MRSA.
Устойчивость к антибиотикам у микроорганизмов нередко возникает в первые 48 часов после воздействия препарата. В ходе нового исследования бактерии не смогли развить устойчивость к тейксобактину в течение 48 часов.
Эти новые результаты, возможно, откроют новое перспективное направление разработки антибактериальных препаратов для лечения грамположительных инфекций, вызванных возбудители с множественной лекарственной устойчивостью.
Источник: http://antibiotic.ru/
Опубликовано: https://medicalxpress.com/