Описание препарата Тилкотил® (суппозитории ректальные, 20 мг) основано на официальной инструкции, утверждено компанией-производителем в 2000 году
Дата согласования: 31.07.2000
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав и форма выпускa
- Фармакологическое действие
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Меры предосторожности
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав и форма выпускa
1 таблетка, покрытая оболочкой, содержит теноксикама 20 мг; в коробке 3 блистера по 10 шт.
1 ректальный суппозиторий — 20 мг; в блистере 5 шт., в коробке 2 блистера.
Фармакологическое действие
Фармакологическое действие
—
анальгезирующее, противовоспалительное, жаропонижающее.
Ингибирует синтез ПГ (угнетает активность циклооксигеназы 1 и циклооксигеназы 2), снижает накопление лейкоцитов в очаге воспаления.
Ингибирует синтез ПГ (угнетает активность циклооксигеназы 1 и циклооксигеназы 2), снижает накопление лейкоцитов в очаге воспаления.
Фармакодинамика
Оказывает мощное и длительное болеутоляющее (наступает через 30 мин) и противовоспалительное действие при менее выраженном жаропонижающем. При ревматических заболеваниях ослабляет боль в суставах в покое и при движении, уменьшает утреннюю скованность и припухлость, улучшает функции и увеличивает объем движений суставов.
Фармакокинетика
Быстро и полно всасывается в ЖКТ. Биодоступность 100%. Cmax достигается через 2 ч. Связывается с белками плазмы на 99%. Объем распределения — 0,15 л/кг. T1/2 — 60–75 ч. В печени гидроксилируется. Легко проходит гистогематические барьеры. Основная часть выводится в виде неактивных метаболитов с мочой, остальная — с желчью.
Показания
Воспалительно-дегенеративные заболевания опорно-двигательного аппарата, сопровождающиеся болевым синдромом: суставной синдром при подагре, ревматоидный артрит, остеоартроз, анкилозирующий спондилоартрит, остеохондроз, суставной ревматизм (тендиниты, бурситы, миозиты), боли в позвоночнике, невралгии, миалгии, травмы.
Противопоказания
Гиперчувствительность, активная пептическая язва, выраженные нарушения функции печени в активной стадии, почечная недостаточность, сахарный диабет, артериальная гипертензия, сердечная недостаточность, детский возраст.
Применение при беременности и кормлении грудью
Противопоказано.
Способ применения и дозы
Внутрь, ректально. По 1 табл. или 1 супп. 1 раз в день (желательно в одно и то же время).
При острых приступах подагры по 2 табл. или 2 супп. 1 раз в сутки в течение первых двух дней, затем по 1 табл. или 1 супп. 1 раз в день в течение 5 дней.
Побочные действия
Тошнота, изжога, боли в животе, диарея, метеоризм, стоматит, анорексия, эрозивно-язвенные поражения, кровотечения, головная боль, головокружение, бессонница, депрессия, повышенная возбудимость, отек в области глаз, раздражение глаз, нарушение зрения, периферические отеки, повышение концентрации в плазме креатинина, мочевины азота, билирубина и активности печеночных трансаминаз, аллергические реакции (крапивница, зуд); при применении суппозиториев возможно местное раздражение, болезненная дефекация.
Взаимодействие
Усиливает эффект препаратов лития (в т.ч. токсичность), непрямых антикоагулянтов, пероральных гипогликемизирующих средств (производные сульфонилмочевины). Антациды снижают скорость всасывания. Одновременное применение др. НПВС увеличивает риск побочных явлений (особенно со стороны ЖКТ).
Меры предосторожности
С осторожностью назначают лицам пожилого возраста, на фоне диуретиков, нефротоксических препаратов, непосредственно после хирургических вмешательств. За несколько дней до хирургического вмешательства препарат следует отменить. В процессе длительного лечения необходим контроль функции печени и почек, протромбинового индекса (на фоне непрямых антикоагулянтов), глюкозы в крови (если пациент получает пероральные гипогликемизирующие средства).
Условия хранения
При температуре 15–25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Медикамент запрещен для реализации в аптеках.
 |
Международное непатентованное название? Теноксикам |
 |
Действующее вещество — Теноксикам. |
 |
Нестероидный противовоспалительный препарат (НПВП) |
 |
Показания к применению Тилкотил таблетки 20мгВоспалительно-дегенеративные заболевания опорно-двигательного аппарата, сопровождающиеся болевым синдромом: суставной синдром при подагре, ревматоидный артрит, остеоартроз, анкилозирующий спондилит, остеохондроз, суставной ревматизм (тендиниты, бурситы, миозиты); боль в позвоночнике, невралгия, миалгия, травмы. |
 |
Способ применения и дозировка Тилкотил таблетки 20мгВнутрь, в одно и тоже время суток, запивая водой или другой жидкостью, в дозе 20 мг 1 раз в сутки; поддерживающая доза — 10 мг/сут. При острых приступах подагры — по 40 мг 1 раз в сутки в течение первых 2-х дней, затем — 20 мг 1 раз в сутки в течение 5 дней. Пациентам пожилого возраста назначают в дозе 20 мг/сут. |
 |
Противопоказания Тилкотил таблетки 20мгГиперчувствительность, эрозивно-язвенные поражения ЖКТ (в т.ч. в анамнезе), желудочно-кишечное кровотечение (в т.ч. в анамнезе), гастрит тяжелого течения, «аспириновая» триада, выраженные нарушения функции печени и почек, почечная недостаточность, сахарный диабет, артериальная гипертензия, сердечная недостаточность, беременность, кормление грудью (на время лечения прекращают), детский возраст. |
 |
Фармакологическое действиеПротивовоспалительное, жаропонижающее, анальгезирующее. Противовоспалительный эффект обусловлен уменьшением проницаемости капилляров (ограничивает экссудацию), стабилизацией лизосомальных мембран (препятствует выходу ферментов лизосом, вызывающих повреждение тканей), торможением выработки макроэргов, в т.ч. АТФ, угнетением синтеза или инактивацией медиаторов воспаления (ПГ, гистамина, брадикинина, лимфокинов, факторов комлемента). Уменьшает количество свободных радикалов в очаге воспаления, угнетает хемотаксис и фагоцитоз. Снижает болевую чувствительность в очаге воспаления и действует на таламические центры боли. Оказывает десенсибилизирующее действие (при длительном применении). Быстро и полностью всасывается в ЖКТ; прием пищи замедляет скорость абсорбции. Биодоступность полная. Легко проходит через гистогематические барьеры. Основная часть выводится в виде неактивных метаболитов с мочой, остальная — с желчью. При ревматических заболеваниях ослабляет боль в суставах в покое и при движении, уменьшает утреннюю скованность и припухлость суставов, улучшает функции и увеличивает объем движений суставов. Противовоспалительный эффект развивается к концу первой недели лечения. |
 |
Побочное действие Тилкотил таблетки 20мгТошнота, изжога, боли и неприятные ощущения в животе, диарея, метеоризм, стоматит, анорексия, эрозивно-язвенные поражения, кровотечения, перфорация, головная боль, головокружение, бессонница, депрессия, повышенная возбудимость, отек или раздражение глаз, нарушения зрения, периферические отеки, повышение концентрации в плазме креатинина, мочевины азота, билирубина и активности печеночных трансаминаз, удлинение времени кровотечения, аллергические реакции в виде крапивницы, зуда, эритемы, синдрома Стивенса-Джонсона и Лайелла. При применении свечей возможно местное раздражение, болезненная дефракция. |
 |
ПередозировкаДанных нет. |
 |
Взаимодействие Тилкотил таблетки 20мгУсиливает эффект препаратов лития (в т.ч. токсичность), непрямых антикоагулянтов, пероральных гипогликемизирующих средств (производные сульфанилмочевины). Антациды снижают скорость всасывания. Другие НПВС повышают риск развития побочных проявлений, особенно со стороны ЖКТ. |
 |
Особые указанияС осторожностью используют для лечения пожилых, на фоне диуретиков, нефротоксических препаратов, непосредственно после хирургических вмешательств. За несколько дней до хирургического вмешательства теноксикам следует отменить. В процессе длительного лечения необходим контроль функции печени и почек, протромбинового индекса, глюкозы в крови. Развитие на фоне лечения эрозивно-язвенного поражения или кровотечения из ЖКТ требует отмены препарата и назначение соответствующей терапии. При применении с диуретиками и больным с артериальной гипертензией и сердечной недостаточностью следует учитывать возможность задержки натрия и воды в организме. |
 |
Условия храненияСписок Б. В сухом защищенном от света месте при комнатной температуре. |
Теноксикам
Теноксикам – эффективный, надежный, проверенный временем представитель группы нестероидных противовоспалительных препаратов (НПВП), который активно используется в мировой медицинской практике уже более 35 лет. С момента своего появления на фармакологическом рынке теноксикам прошел жесткую проверку в многочисленных сравнительных клинических исследованиях, выполненных по всем требованиям медицины, основанной на доказательствах, а также оценку длительного применения в реальной клинической практике в ходе серии национальных наблюдательных исследований. Его лечебный потенциал доказан при широком спектре ревматических заболеваний – остеоартрите, ревматоидном артрите, анкилозирующем спондилите, подагре, неспецифической боли в спине. Он также с успехом используется в хирургической практике для контроля послеоперационной боли и как компонент мультимодальной периоперационной анальгезии. Удобство применения (один раз в день), наличие различных лекарственных форм и хорошая переносимость (по сравнению с другими традиционными НПВП) делают теноксикам удачным инструментом обезболивающей терапии в самых разных отраслях медицины.
Нестероидные противовоспалительные препараты (НПВП) были и остаются незаменимым инструментом анальгетической и противовоспалительной терапии, востребованным в самых разных областях медицины. Лечение заболеваний суставов и позвоночника, купирование головной боли напряжения и мигрени, острой висцеральной боли («колики»), контроль болевого синдрома после травм и оперативных вмешательств, комплексная симптоматическая терапия онкологических больных и многое другое – области успешного использования этого класса фармакологических средств [1,3]. Это одна из наиболее обширных фармакологических групп: сегодня спектр НПВП, доступных российскому врачу, насчитывает более 20 международных непатентованных наименований, а число коммерческих препаратов (за счет генериков) превышает две сотни.
Такое разнообразие ставит врача перед непростым выбором – какой препарат назначить конкретному пациенту в той или иной клинической ситуации?
Формально, все НПВП обладают сходным обезболивающим и противовоспалительным потенциалом, разумеется, при условии, что они используются в максимальных терапевтических дозах в течение достаточно длительного времени. Это положение подтверждается обширным опытом «правильно организованных» с точки зрения медицины, основанной на доказательствах, рандомизированных контролируемых исследований (РКИ) [1,2]. Однако в реальной клинической практике на результат применения лекарства влияет множество факторов, связанных с характером заболевания, индивидуальной чувствительностью пациента и наличием коморбидной патологии. И, конечно, огромное значение имеют фармакологические особенности препарата, определяющие его быстродействие, стойкость эффекта и риск развития нежелательных реакций (НР) [3].
Одним из наиболее интересных биохимических семейств НПВП являются оксикамы. Они представляют собой производные эноликовой кислоты, которые, в отличие от большинства других НПВП, не содержат в своей структуре карбоксильную группу [4].
Общеизвестно, что главной фармакологической мишенью всех НПВП, независимо от химической структуры, является индуцируемый (т.е. появляющийся под воздействием провоспалительных цитокинов) фермент циклооксигеназа (ЦОГ)-2. Подавление активности этого фермента блокирует синтез простагландина (ПГ) Н2, который представляет собой субстрат для образования ПГЕ2, одного из наиболее важных медиаторов боли и воспаления [5,6]. ЦОГ – это последовательный гомодимер, белковая структура, объединяющая две взаимосвязанные зеркальные субъединицы, образующие при соприкосновении тонкий извитой гидрофобный канал, по которому происходит перемещение субстрата (полиненасыщенных жирных кислот, ПЖК) и где проходит его биохимическая трансформация. Оба мономера ЦОГ содержат N-терминальную зону (фактор роста подобную зону) – четырехспиральный участок, связанный с клеточной мембраной, и энзимный участок. В данной области ЦОГ имеются два участка: циклооксигеназный, где осуществляется окисление ПЖК и «замыкание» типичного для простаноидов циклопентанового кольца, и область пероксидазы, которая катализирует присоединение дополнительной OH- группы. Действие всех НПВП – от аспирина до коксибов, заключается в связывании циклооксигеназной области активной зоны ЦОГ, что нарушает ее взаимодействие с субстратом. Но пероксидазная активность фермента при этом не меняется [6,7].
Хотя все НПВП имеют общий механизм действия, разная биохимическая структура этих препаратов определяет важные отличия в их взаимодействии с ЦОГ. От этого зависит длительность их фармакологического эффекта и селективность в отношении ЦОГ-1/ЦОГ-2. Последнее имеет принципиальное значение: ведь именно с подавлением активности ЦОГ-2 связано анальгетическое, противовоспалительное и жаропонижающее действие НПВП. А неизбирательная блокада биохимического «двойника» этого фермента – ЦОГ-1, который постоянно присутствует в тканях организма и отвечает за синтез цитопротективных ПГ, приводит к развитию многих НР, таких как повреждение слизистой желудочно-кишечного тракта (ЖКТ) [4].
В чем особенность действия оксикамов? Они связываются с активной зоной ферментативного канала ЦОГ, образуя множественные гидрофобные связи и единственную непосредственную водородную связь между 4-гидроксильной группой молекулы препарата и аминокислотой Ser-530 ЦОГ. Фиксация двух молекул Н2О в активной зоне фермента обеспечивает дополнительные полярные связи между действующим веществом и структурами ЦОГ в каталитической вершине и области сужения ферментативного канала. Связь боковой цепи оксикама с аминокислотой Leu-531 ЦОГ формирует особую пространственную конформацию комплекса и появление гидрофобного «кармана», представленного 8 аминокислотными остатками фермента: Met-113, Val116, Leu-117, Ile-345, Val-349, Leu-531, Leu-534 и Me535. Согласно компьютерной модели взаимодействия оксикамов и ЦОГ, именно образование данной структуры определяет большую селективность в отношении ЦОГ-2 и более длительный противовоспалительный эффект этих препаратов [4].
Ценным свойством оксикамов представляется их способность влиять не только на активность ЦОГ-2, но и на матриксную ПГЕ2-синтетазу – фермент, благодаря которому происходит конечный синтез основного медиатора воспаления – ПГЕ2. Матриксная ПГЕ2-синтетаза является очень перспективной «мишенью» для противовоспалительной терапии, однако разработать пригодный для клинического применения ингибитор этого фермента («супер-НПВП») пока не удалось. В то же время оксикамы обладают структурным сходством с бензотиопиран S-диоксидами, а эти соединения могут связывать матриксную ПГЕ2-синтетазу и стали основой для создания экспериментального препарата PF-9184, показавшего свойство селективного ингибитора фермента [4].
Теноксикам – это надежный, проверенный временем лекарственный препарат, который широко используется во многих странах мира [8]. Впервые на фармакологическом рынке он появился в 1982 г. во Франции под торговым наименованием Тилкотил. В настоящее время, по данным сайта www.drugs.com, на глобальном фармакологическом рынке, кроме оригинального препарата, представлены еще 83 генерика теноксикама [9]. На 2016 г. теноксикам зарегистрирован и используется в 14 странах Евросоюза, таких как Бельгия, Болгария, Великобритания, Греция, Дания, Исландия, Испания, Италия, Кипр, Люксембург, Португалия, Румыния, Франция и Швеция [10].
Теноксикам относится к «традиционным» НПВП – неселективным ингибиторам ЦОГ-2. Соотношение ингибирующих концентраций ЦОГ-2/ЦОГ-1 для него составляет 1,34 (для примера, для индометацина – более 10) [11]. Имеются данные, что теноксикам, помимо своего основного фармакологического действия (блокада ЦОГ-2), способен проявлять свойства антиоксиданта, подавляя образование реактивных форм кислорода, супероксид-анионов, а также снижать синтез окиси азота [12-14].
Теноксикам обладает устойчивой стабильной фармакодинамикой. Он практически полностью всасывается из ЖКТ (биодоступность составляет 99%) и обнаруживается в крови уже через 30 мин после перорального приема. Достаточно быстро – в среднем через 1,9 ч (1,0-5,0 ч) после приема 20 мг теноксикама достигается пиковая концентрация препарата в плазме – 2,7 мг/л (2,3-3,0 мг/л). Теноксикам практически полностью связывается белками плазмы (на 99%), при этом, за счет низкой липофильности и высокой ионизации, его проникновение в ткани происходит плавно и постепенно: пиковая концентрация в синовиальной жидкости составляет 1/3 от содержания в плазме и достигается примерно через 20 ч. Препарат метаболизируется в печени с образованием 5′-гидрокси- и 6-O-глюкуронированной формы, которые выводятся с мочой и желчью. Особенностью теноксикама является линейная фармакодинамика (которая отмечается при использовании в дозах от 10 до 100 мг) и весьма медленная элиминация. Период полувыведения этого лекарства составляет 67 ч (49-81 ч) [8].
Теноксикам при хронических заболеваниях суставов и позвоночника
С момента появления на фармакологическом рынке теноксикам проходил жесткую проверку, прежде всего, как препарат, предназначенный для длительного использования у больных с хроническими ревматическими заболеваниями, такими как остеоартрит (ОА), ревматоидный
артрит (РА) и анкилозирующий спондилит.
С целью изучения эффективности и безопасности теноксикама была проведена серия масштабных и хорошо организованных РКИ. Так, в 12-недельной работе британских ученых теноксикам 20 мг/сут сравнивали с пироксикамом 20 мг/сут у 1328 больных ОА и РА [15]. Параллельно в Швейцарии было проведено РКИ, в котором оценивали действие теноксикама 20 мг/сут, пироксикама 20 мг/сут и диклофенака 100 мг/сут у пациентов с ОА и ревматической патологией околосуставных мягких тканей [16]. Третьей работой со сходным планом было 12-недельное РКИ датских исследователей, которые сопоставляли эффект теноксикама 20 мг/сут и кетопрофена 200 мг/сут у 307 больных ОА [17]. Во всех трех исследованиях был получен сходный результат: анальгетическое и противовоспалительное действие теноксикама не уступало препаратам контроля, но при этом суммарная частота НР, особенно со стороны ЖКТ, была ниже. Например, при сравнении теноксикама с кетопрофеном суммарная частота НР составила 29,0% и 47,3%, соответственно (p<0,05). Показательны данные N. Bellamy и соавт., которые сравнили результаты использования теноксикама 20 мг/сут и диклофенака 150 мг/сут у 98 больных ОА. Через 12 недель терапии не было отмечено существенного различия в динамике индекса WOMAC. Однако переносимость теноксикама была достоверно лучше таковой диклофенака: суммарная частота НР составила 43,8% и 66,0%, соответственно (p<0,05) [18].
Р. Riedemann и соавт. провели мета-анализ 18 РКИ, в 12 из которых теноксикам сравнивали с его ближайшим «родственником» пироксикамом, в 3 – с диклофенаком и в 2 – с индометацином. Согласно полученным данным, теноксикам был более эффективен и лучше переносился, чем пироксикам; он не уступал индометацину по эффективности и вызывал меньше НР; не отличался по лечебному потенциалу от диклофенака, но реже вызывал НР [19].
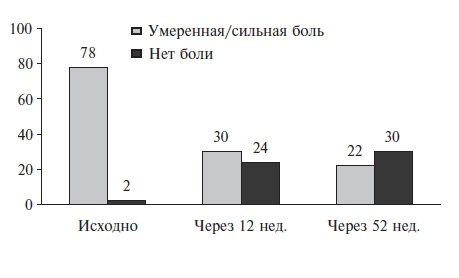
Для оценки клинических достоинств теноксикама, помимо РКИ, была проведена серия национальных наблюдательных исследований, в которых этот препарат изучали в реальной клинической практике. Например, в работе британских исследователей теноксикам применяли в течение 12 недель у 2963 больных ОА и РА. Препарат позволил успешно контролировать основные симптомы артрита (рис. 1). При этом около 60% пациентов продолжили использовать теноксикам более 3 мес, а 31% продлили его прием до 1 года [20].
Рис. 1. Динамика боли (% пациентов) в суставах на фоне применения теноксикама 20 мг/сутки у 2963 больных ОА и РА (наблюдение 12 мес).
Адаптировано из [20]
Канадские ученые G. Kraag и соавт. провели масштабное наблюдательное исследование, в котором оценивали результаты использования теноксикама у 1809 амбулаторных больных с заболеваниями суставов и позвоночника, из которых большинство (84,3%) страдали ОА.
Средний курс терапии составил 4 недели. Теноксикам оказался эффективным и относительно безопасным лекарством. Так, 81,1% пациентов сообщили о существенном улучшении состояния после курса терапии, при этом лишь у 12,6% были отмечены те или иные
НР [21].
Итальянские ученые R. Marcolongo и A. Fioravanti оценили результаты применения теноксикама 20 мг/сут, диклофенака 100 мг/сут и пироксикама 20 мг/сут у 625 больных с ОА и ревматической патологией околосуставных мягких тканей. Теноксикам не уступал препаратам
контроля по эффективности, но превосходил по переносимости – частота НР при его применении оказалось самой низкой (7,4%) [22].
K. Ibrahima и соавт. изучали эффективность теноксикама 20 мг/сут (от 15 до 30 дней) у 736 африканских пациентов с ревматическими заболеваниями. Пода вляющее большинство больных (более 90%) оценили результат лечения как хороший или отличный [23].
Эффективность, хорошая переносимость и удобство применения сделали теноксикам удачным средством для длительного лечения больных с ревматическими заболеваниями. Это подтверждает опыт нескольких исследований, в которых лечебное действие теноксикама оценивали
в течение продолжительного периода времени. В частности, О. Nived и соавт. сравнивали теноксикам с напроксеном в течение 6 месяцев [24], а В. Lund и соавт. применяли теноксикам и пироксикам у больных ОА в течение 12 месяцев [25]. А в небольшом
исследовании J. Lalos и соавт. успешно использовали теноксикам в течение 4 лет (!) у 20 больных РА. При этом переносимость препарата была оценена как хорошая или отличная [26].
В плане оценки безопасности теноксикама очень важны результаты его сравнения с ацеклофенаком, который характеризуется хорошей переносимостью и низким риском серьезных НР. Испанские ученые провели два таких исследования. В работе F. Perez-Ruiz и соавт.
292 больных РА получали теноксикам 20 мг/сут или ацеклофенак 200 мг/сут в течение 3 мес. Эффективность препаратов через 2 недели и в конце исследования не различалась. Частота НР также была практически равной: 4,1% – в группе ацеклофенака и 6,2%
– в группе теноксикама. Число осложнений со стороны ЖКТ также достоверно не отличалось [27]. L. Villa Alcаzar и соавт. оценивали эффективность этих препаратов в аналогичных дозах при анкилозирующем спондилите (n=273). Через 3 мес лечения эффект
препаратов не отличался ни в отношении боли, ни в отношении улучшения функции позвоночника. При этом частота НР при лечении ацеклофенаком была несколько выше, чем при приеме теноксикама: они развились у 42 и 37 больных, соответственно. Частота
отмены двух препаратов из-за НР составила 2,2% и 1,4%, соответственно. Таким образом, в обоих исследованиях теноксикам не уступал по переносимости ацеклофенаку [28].
Эффективность теноксикама для купирования острой боли
Теноксикам представляет собой эффективное и удобное средство для длительного контроля основных симптомов при наиболее распространенных хронических заболеваниях суставов и позвоночника. Однако он может использоваться не только в этой ситуации. Теноксикам
оказался весьма удачным препаратом и для купирования острой боли при самой различной ургентной патологии.
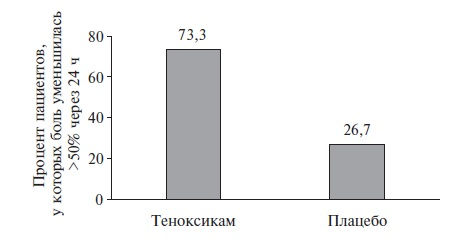
Так, имеется успешный опыт применения теноксикама для лечения острого подагрического артрита [29,30]. Любопытно отметить, что теноксикам, согласно анализу Cochrane Collaboration, стал единственным НПВП, который сравнивали с плацебо для купирования острого
приступа подагры (de la Torre G., 1987). В этом РКИ 30 больных (по 15 в каждой группе) получали теноксикам 40 мг/сут или плацебо. По эффективности теноксикам значительно превосходил плацебо (рис.2). Очень важно, что в группе теноксикама не было
зафиксировано ни одной НР, в то время как в группе плацебо было 2 осложнения [31].
Рис. 2. Сравнение эффективности теноксикама и плацебо для купирования острого подагрического артрита.
Адаптировано из [31]
Теноксикам показал себя действенным средством для лечения острой неспецифической боли в спине. В работе бельгийских ученых М. Szpalski и J. Hayez 2-недельный курс лечения теноксикамом в дозе 20 мг у 78 пациентов с этой патологией привел к существенному
уменьшению боли и улучшению функции позвоночника [32].
Классической моделью для проверки терапевтического потенциала анальгетиков в ургентных ситуациях служит купирование острой боли после удаления зуба. Такую проверку прошел и теноксикам, причем очень успешно. Была проведена серия исследований, показавших
его эффективность в данной клинической ситуации [33-35]. При этом по уровню обезболивающего действия он не уступал большим дозам глюкокортикоидов [36] и превосходил мягкие опиоидные препараты (в частности, комбинацию парацетамола 500 мг и кодеина
8 мг) [37].
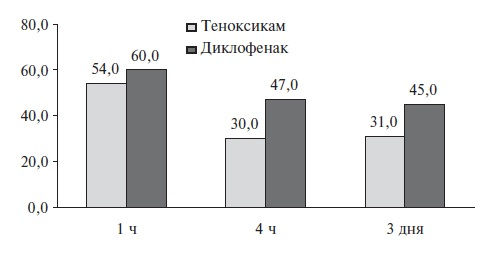
В качестве примера удачного использования теноксикама в стоматологической практике можно привести РКИ J. Roelofse и соавт., в которое были включены 35 пациентов, перенесших удаление 3-го моляра. Теноксикам сравнивали с диклофенаком: оба препарата вводили
непосредственно перед операцией (теноксикам 40 мг внутривенно, диклофенак 75 мг внутримышечно), а затем назначали внутрь (теноксикам 20 мг один раз в день, диклофенак 50 мг три раза в день) на 7 дней. Эффективность теноксикама оказалась достоверно
выше как в первые послеоперационные часы, так и через 3 дня (рис. 3) [38].
Рис. 3. Сравнение эффективности тенкосикама и диклофенака при купировани боли после экстракции зуба (выраженность боли в мм ВАШ).
Адаптировано из [38]
Эффективность теноксикама для купирования боли после экстракции зуба подтверждает также недавнее исследование V. Kaplan и соавт. у 90 больных, перенесших удаление зуба мудрости. В качестве анальгетика они в течение 7 дней получали теноксикам 20 мг, флурбипрофен
200 мг или диклофенак 100 мг, причем первую доза каждого препарата назначали за 2 ч до операции. Теноксикам оказывал более выраженное обезболивающее действие по сравнению с препаратами сравнения как в первые послеоперационные часы, так и последующие
дни наблюдения [39].
Важнейшая область ургентного применения НПВП – купирование острой почечной и билиарной колики. Здесь теноксикам также показал себя эффективным препаратом: внутривенное или внутримышечное введение препарата быстро и существенно снижало выраженность болевых
ощущений и частоту осложнений, связанных с этой патологией [40-44].
Теноксикам применяется в анестезиологической практике как элемент мультимодального обезболивания при «больших» хирургических операциях. Его эффективность была подтверждена результатами серии РКИ. Так, в работе W. Chang и соавт. предоперационное введение
этого препарата обеспечивало снижение потребности в применении опиоидов в послеоперационном периоде у больных, перенесших хирургическое вмешательство на позвоночнике [45]. Очень важные данные были получены I. Gunusen и соавт., которые сравнили
выраженность боли и потребность в морфине у 120 больных, которые после абдоминальной гистерэктомии получали внутривенно теноксикам 20 мг, парацетамол 1 г или плацебо. В группе теноксикама послеоперационная боль была достоверно менее выражена,
а суммарная потребность в морфине в трех группах составила 44,8±17,4 мг, 64,6±19,6 мг и 69,2±22,1 мг, соответственно (p<0,05) [46]. Снижение потребности в морфине при использовании теноксикама после холецистэктомии было также показано в исследовании
F. Munro и соавт [47].
T. Akca и соавт. сравнили эффекты предоперационного введения 20 мг теноксикама или физиологического раствора у 80 больных, которым была проведена лапароскопическая холецистэктомия или пластика паховой грыжи. В группе теноксикама выраженность боли через
4 и 8 ч после операции, а также потребность в дополнительных анальгетиках оказалась достоверно ниже, чем в контрольной группе [48].
А. Merry и соавт. оценивали влияние интраоперационного внутривенного введения теноксикама 20 и 40 мг или плацебо на выраженность послеоперационной боли у 45 больных, перенесших торакотомию. Выраженность боли оказалась достоверно меньше при использовании
обеих доз теноксикама: 17,4±14,8, 16,5±13,3 и 25,8±12,5 мм по визуальной аналоговой шкале, соответственно (p<0,05) [49].
Нельзя обойти вниманием еще одну область клинического применения теноксикама – его локальное внутри- и околосуставное введение при патологии суставов или околосуставных мягких тканей. Хотя такое применение теноксикама не зарегистрировано, тем не менее,
оно активно практикуется в ряде стран мира [50]. Так, Z. Unlu и соавт. сравнили эффект внутрисуставного введения теноксикама 20 мг (три еженедельные инъекции) и постоянного перорального приеме этого препарата в течение 3 недель у 69 больных ОА
коленного сустава. Оба метода применения позволили добиться существенного улучшения состояния больных, причем выраженность боли в обеих группах достоверно не различалась через 1, 3 и 6 мес [51]. Недавно были представлены данные аналогичного по
плану исследования, выполненного М. Erbas и соавт. В нем также сравнивали результаты 3-недельного внутрисуставного и перорального применения теноксикама у 60 больных ОА. Как и в предыдущем исследовании, эффективность лечения не отличалась [52].
В исследовании Н. Çift и соавт. 40 больных с тендинитом ротаторов плеча и/или субакромиальным бурситом получали внутрисуставные инъекции метилпреднизолона 40 мг (однократно) или теноксикама 20 мг (3 инъекции еженедельно). Эффект двух препаратов был сходным:
через 6 недель в группе метилпреднизолона интенсивность боли снизилась с 6,2 до 3,6 см (по визуальной аналоговой шкале длиной 10 см), в группе теноксикама – с 7,8 до 2,6 см [53].
S. Guner и соавт. сравнили результаты локального введения теноксикама 20 мг и метилпреднизолона 40 мг (оба препарата в комбинации с 2% лидокаином) у 61 пациента с плантарным фасциитом. Оба препарата были эффективными и вызывали сопоставимое уменьшение
боли через 6 и 12 ч после инъекции [54]. С другой стороны, в работе S. Karthikeyan и соавт. было показано преимущество однократной субакромиальной инъекции метилпреднизолона перед однократным субакромиальным введением теноксикама 20 мг при синдроме
столкновения ротаторов плеча [55].
Некоторые хирурги-ортопеды активно практикуют внутрисуставное введение теноксикама с опиоидами и локальными анестетиками после артроскопических вмешательств на суставах (например, после менискэктомии). Имеются четкие данные, что использование теноксикама
в этой ситуации позволяет существенно уменьшить послеоперационную боль [56-58]. Напри мер, R. Jawish и соавт. выявлили значительное уменьшение воспалительного отека и боли у 134 больных, которым в конце артроскопии коленного сустава внутрисуставно
вводили теноксикам 20 мг [59].
Очень интересные данные были получены S. Sanel и соавт. в ходе двойного слепого РКИ, в котором были сопоставлены эффекты теноксикама 20 мг и морфина (оба препарата применяли в комбинации с 0,5% бупивокаином) у 240 больных, перенесших артроскопическое
вмешательство на коленном суставе. Применение теноксикама позволило добиться меньшего уровня послеоперационной боли и снижения потребности в дополнительных анальгетиках по сравнению с применением опиоида [60].
Безопасность
Как было отмечено выше, теноксикам относится к «традиционным» НПВП, т.е. неселективным ингибиторам ЦОГ-2, поэтому на фоне приема этого препарата могут отмечаться НР, свойственные всем другим представителям этой лекарственной группы. Прежде всего, речь
идет о возможности развития осложнений со стороны ЖКТ [61]. Тем не менее, согласно данным многочисленных РКИ и наблюдательных исследований, приведенных выше, по переносимости он в целом превосходит многие другие популярные НПВП [19].
Было проведено несколько исследований, в которых изучалось действие теноксикама на слизистую оболочку верхних отделов ЖКТ. Так, Р. Müller и соавт. сравнили частоту эндоскопических изменений после 14-дневного приема теноксикама 20 мг/сут и диклофенака
100 мг/сут у 36 здоровых добровольцев. Теноксикам достоверно реже вызывал повреждения слизистой оболочки. Так, счет Lanza, отражающий выраженность изменений, составил 1,3±0,7 и 2,2±1,1 в двух группах, соответственно (р=0,014) [62]. А. al-Quorain
и соавт. сравнивали частоту изменений слизистой оболочки желудка у 36 больных, получавших теноксикам 20 мг и диклофенак 100 мг в течение 4 недель. Повреждение слизистой оболочки было отмечено у 21% и 41% больных, соответственно. При этом множественные
геморрагии и эрозии (>10) были выявлены лишь у 5% больных, получавших теноксикам, и 18% пациентов группы диклофенака [63].
G. Perpignano и соавт. оценили частоту и характер эндоскопических изменений ЖКТ у 60 больных ОА, которые в течение 8 недель получали теноксикам 20 мг/сут или умеренно селективный НПВП с хорошей переносимостью этодолак 600 мг/сут. Частота минимальных изменений
слизистой желудка оказалась выше в группе теноксикама, однако язвы желудка встречались с одинаковой частотой (по 2 в каждой группе) [64].
Важные данные о сравнительной частоте НР при использовании теноксикама в реальной клинической практике были получены специалистами французской системы фармаконадзора, которые оценили 42389 спонтанных сообщений о серьезных НР, зарегистрированных за период
с 2002 по 2006, и построили «рейтинг» для наиболее популярных НПВП в зависимости от частоты лекарственных осложнений. При лечении теноксимамом частота НР была низкой (0,42 случая на 1 млн принятых доз), сопоставимой с таковой при применении мелоксикама
(0,41) и существенно ниже, чем при лечении диклофенаком (0,58) и особенно кетопрофеном (0,78) [65].
Данные по осложнениям со стороны сердечнососудистой системы при применении теноксикама ограничены, однако другие представители семейства оксикамов (мелоксикам и пироксикам) характеризуются средним риском их развития [66,67]. Недавно А. Arfе и соавт. провели
анализ взаимосвязи между приемом НПВП и развитием сердечной недостаточности у 92163 больных, госпитализированных в связи с этой патологией в Нидерландах, Германии, Велико британии и Италии за период с 2000 по 2010 гг. Соответствующую по полу и
возрасту контрольную группу составили 8 246 403 пациента без сердечной недостаточности. В среднем, прием НПВП ассоциировался с умеренным нарастанием риска сердечной недостаточности: показатель относительного риска (ОР) составил 1,19 (95% доверительный
интервал [ДИ] 1,17-1,22). Теноксикам практически не повышал риск развития сердечной недостаточности (ОР 1,06; 95% ДИ 0,80-1,41). Для диклофенака этот показатель составил 1,19 (95% ДИ 1,151,24) [67].
Разумеется, при использовании теноксикама следует учитывать все противопоказания и тщательно оценивать наличие факторов риска класс-специфических осложнений, свойственных НПВП.
Заключение
Теноксикам – универсальный НПВП, который может использоваться как для купирования острой боли (в том числе в хирургической практике), так и и для длительного контроля болевых ощущений при хронических заболеваниях суставов и позвоночника. Имеется обширная
доказательная база, основанная на данных хорошо организованных клинических испытаний и многолетнем опыте реальной практической работы, подтверждающая эффективность и хорошую переносимость этого препарата. Он удобен в применении (назначают один
раз в день) и имеет различные лекарственные формы, в том числе для парентерального введения. Эти достоинства определяют целесообразность активного использования теноксикама в российской медицинской практике.
Используемые источники
- Brune K, Patrignani P. New insights into the use of currently available nonsteroidal anti-inflammatory drugs. J Pain Res 2015;8:105-18.
- Conaghan PG. A turbulent decade for NSAIDs: update on current concepts of classification, epidemiology, comparative efficacy, and toxicity. Rheumatol Int 2012;32(6):1491-502.
- Hunter TS, Robison C, Gerbino PP. Emerging evidence in NSAID pharmacology: important considerations for product selection. Am J Manag Care 2015;21(7 Suppl):S139-47.
- Xu S, Rouzer CA, Marnett LJ. Oxicams, a class of nonsteroidal anti-inflammatory drugs and beyond. IUBMB Life 2014;66(12):803-11.
- Díaz-González F, Sаnchez-Madrid F. NSAIDs: learning new tricks from old drugs. Eur J Immunol 2015;45(3):679-86.
- Vecchio AJ, Malkowski MG. The structural basis of endocannabinoid oxygenation by cyclooxygenase-2. J Biol Chem 2011;286(23):20736-45.
- Vecchio AJ, Simmons DM, Malkowski MG. Structural basis of fatty acid substrate binding to cyclooxygenase-2. J Biol Chem 2010;285(29):22152-63.
- Nilsen OG. Clinical pharmacokinetics of tenoxicam. Clin Pharmacokinet 1994;26(1):16-43.
- https://www.drugs.com/international/tenoxicam.html.
- http://www.ema.europa.eu/docs/en_GB/document_library/Periodic_safety_update_single_assessment/2016/10/WC500214741.pdf.
- Lora M, Morisset S, Mеnard HA, et al. Expression of recombinant human cyclooxygenase isoenzymes in transfected COS-7 cells in vitro and inhibition by tenoxicam, indomethacin and aspirin. Prostaglandins Leukot Essent Fatty Acids 199;56(5):361-7.
- Van Antwerpen P, N ève J. In vitro comparative assessment of the scavenging activity against three reactive oxygen species of non-steroidal anti-inflammatory drugs from the oxicam and sulfoanilide families. Eur J Pharmacol 2004;496(13):55-61.
- Ferrari GV, Natera J, Paulina Monta ña M Scavenging of photogenerated ROS by Oxicams. Possible biological and environmental implications. J Photochem Photobiol B 2015;153:233-9.
- Ozgocmen S, Ardicoglu O, Erdogan H, et al. In vivo effect of celecoxib and tenoxicam on oxidant/ anti-oxidant status of patients with knee osteoarthritis. Ann Clin Lab Sci 2005;35(2):137-43.
- Simpson J, Golding DN, Freeman AM, et al. A large multicentre, parallel group, double-blind study comparing tenoxicam and piroxicam in the treatment of osteoarthritis and rheumatoid arthritis. Br J Clin Pract 1989;43(9):328-33.
- Moser U, Waldburger H, Schwarz HA, Gobelet CA. A double-blind randomised multicentre study with tenoxicam, piroxicam and diclofenac sodium retard in the treatment of ambulant patients with osteoarthritis and extra-articular rheumatism. Scand J Rheumatol Suppl 1989;80:71-80.
- Ejstrup L, Knudsen JV, Petersen L. A randomised double-blind multicentre trial comparing tenoxicam and ketoprofen in osteoarthritis. Scand J Rheumatol Suppl 1989;80:48-53.
- Bellamy N, Buchanan WW, Chalmers A, et al. A multicenter study of tenoxicam and diclofenac in patients with osteoarthritis of the knee. J Rheumatol 1993;20(6):999-1004.
- Riedemann PJ, Bersinic S, Cuddy LJ, et al. A study to determine the efficacy and safety of tenoxicam versus piroxicam, diclofenac and indomethacin in patients with osteoarthritis: a meta-analysis. J Rheumatol 1993;20(12):2095-103.
- Langdon CG, Moran DG, Jamieson V, et al. A multicentre study of tenoxicam review5_Layout 1 18.11.17 19:47 Page 49
- Kraag GR, Gordon DA, M énard HA, et al. Patient compliance with tenoxicam in family practice. Clin Ther 1994;16(3):581-93.
- Marcolongo R, Fioravanti A. Clinical experiences with tenoxicam. Preliminary results of a multicenter study. Recenti Prog Med 1991;82(4):242-9.
- Ibrahima K, Kodjo G, Issa S, et al. Clinical efficacy and tolerability of tenoxicam in African patients with osteoarthritis, rheumatoid arthritis, tendinitis and/or bursitis: an open study. Curr Med Res Opin 1991;12(7):471-8.
- Nived O, Sturfelt G, Eckern äs SA, Singer P. A comparison of 6 months’ compliance of patients with rheumatoid arthritis treated with tenoxicam and naproxen. Use of patient computer data to assess response to treatment. J Rheumatol 1994;21(8):1537-41.
- Lund B, Andersen RB, Fossgreen J, et al. A long-term randomised trial on tenoxicam and piroxicam in osteoarthritis of the hip or knee: a 24-month interim report focusing on the 12-24 month interval. Eur J Rheumatol Inflamm 1987;9(2):58-67.
- Lalos J, Tsachalos P, Gallis L. Long-term (four year) clinical trial with tenoxicam and basis therapy in patients suffering from rheumatoid arthritis. Scand J Rheumatol Suppl 1989;80:67-70.
- Perez-Ruiz F, Alonso-Ruiz A, Ansoleaga JJ. Comparative study of the efficacy and safety of aceclofenac and tenoxicam in rheumatoid arthritis. Clin Rheumatol 1996;15(5):473-7.
- Villa Alc ázar LF, de Buergo M, Rico Lenza H, Montull Fruit ós E. Aceclofenac is as safe and effective as tenoxicam in the treatment of ankylosing spondylitis: a 3 month multicenter comparative trial. Spanish Study Group on Aceclofenac in Ankylosing Spondylitis. J Rheumatol 1996;23(7):1194-9.
- Vald és EF. Use of tenoxicam in patients with acute gouty arthritis. Eur J Rheumatol Inflamm 1987;9(2):133-6.
- Waterworth RF, Waterworth SM. An open assessment of tenoxicam (Tilcotil) in the treatment of acute gout in general practice. N Z Med J 1987;100(837):744-5.
- van Durme CM, Wechalekar MD, Buchbinder R, et al. Non-steroidal antiinflammatory drugs for acute gout. Cochrane Database Syst Rev 2014;(9):CD010120.
- Szpalski M, Hayez JP. Objective functional assessment of the efficacy of tenoxicam in the treatment of acute low back pain. A double-blind placebo-controlled study. Br J Rheumatol 1994;33(1):74-8.
- Cheung LK, Rodrigo C. Tenoxicam for pain relief following third molar surgery. Anesth Pain Control Dent 1992;1(4):229-33.
- Zacharias M, De Silva RK, Herbison P, Templer P. A randomized crossover trial of tenoxicam compared with rofecoxib for postoperative dental pain control. Anaesth Intensive Care 2004;32(6):770-4.
- Arslan H, Topcuoglu HS, Aladag H. Effectiveness of tenoxicam and ibuprofen for pain prevention following endodontic therapy in comparison to placebo: a randomized double-blind clinical trial. J Oral Sci 2011;53(2):157-61.
- Ilhan O, Agacayak KS, Gulsun B, et al. A comparison of the effects of methylprednisolone and tenoxicam on pain, edema, and trismus after impacted lower third molar extraction. Med Sci Monit 2014;20:147-52.
- Merry AF, Swinburn PF, Middleton NG, et al. Tenoxicam and paracetamolcodeine combination after oral surgery: a prospective, randomized, double-blind, placebo-controlled study. Br J Anaesth 1998;81(6):875-80.
- Roelofse JA, Van der Bijl P, Joubert JJ. Analgesic and anti-inflammatory efficacy of tenoxicam and diclofenac sodium after third molar surgery. Anesth Prog 1996;43(4):103-7.
- Kaplan V, Ero ğlu CN. Comparison of the effects of daily single-dose use of flurbiprofen, diclofenac sodium, and tenoxicam on postoperative pain, swelling, and trismus: a randomized double-blind study. J Oral Maxillofac Surg 2016;74(10):1946.e1-6.
- Cevik E, Cinar O, Salman N, et al. Comparing the efficacy of intravenous tenoxicam, lornoxicam, and dexketoprofen trometamol for the treatment of renal colic. Am J Emerg Med 2012;30(8):1486-90.
- Keke çZ, Yilmaz U, S özüer E. The effectiveness of tenoxicam vs isosorbide dinitrate plus tenoxicam in the treatment of acute renal colic. BJU Int 2000;85(7):783-5.
- al-Waili NS, Saloom KY. Intravenous tenoxicam to treat acute renal colic: comparison with buscopan compositum. J Pak Med Assoc 1998;48(12):370-2.
- Al-Waili NS. Intramuscular tenoxicam to treat acute renal colic. Br J Urol 1996;77(1):15-6.
- Masudi T, Capitelli-McMahon H, Anwar S. Acute pain management in symptomatic cholelithiasis. World J Gastrointest Surg 2016;8(10):713-8.
- Chang WK, Wu HL, Yang CS, et al. Effect on pain relief and inflammatory response following addition of tenoxicam to intravenous patient-controlled morphine analgesia: a double-blind, randomized, controlled study in patients undergoing spine fusion surgery. Pain Med 2013;14(5):736-48.
- Gunusen I, Karaman S, Acar A, et al. The efficacy of paracetamol versus tenoxicam on postoperative pain and morphine consumption after abdominal hysterectomy: a placebo-controlled, randomized study. Clin Exp Obstet Gynecol 2012;39(1):49-52.
- Munro FJ, Young SJ, Broome IJ, et al. Intravenous tenoxicam for analgesia following laparoscopic cholecystectomy. Anaesth Intensive Care 1998;26(1):56-60.
- Akca T, Colak T, Kanik A, et al. The effect of preoperative intravenous use of tenoxicam: a prospective, double-blind, placebo-controlled study. J Invest Surg 2004;17(6):333-8.
- Merry AF, Sidebotham DA, Middleton NG, et al. Tenoxicam 20 mg or 40 mg after thoracotomy: a prospective, randomized, double-blind, placebo-controlled study. Anaesth Intensive Care 2002;30(2):160-6.
- Papathanassiou NP. Intra-articular use of tenoxicam in degenerative osteoarthritis of the knee joint. J Int Med Res 1994;22(6):332-7.
- Unlu Z, Ay K, Tuzun C. Comparison of intra-articular tenoxicam and oral tenoxicam for pain and physical functioning in osteoarthritis of the knee. Clin Rheumatol 2006;25(1):54-61.
- Erbas M, Simsek T, Kiraz HA et al. Comparison of the effectivity of oral and intra-articular administration of tenoxicam in patients with knee osteoarthritis. Braz J Anesthesiol 2015;65(5):333-7.
- Çift H, Özkan F Ü, Tolu S, et al. Comparison of subacromial tenoxicam and steroid injections in the treatment of impingement syndrome. Eklem Hastalik Cerrahisi 2015;26(1):16-20.
- Guner S, Onder H, Guner SI et al. Effectiveness of local tenoxicam versus corticosteroid injection for plantar fasciitis treatment. Orthopedics 2013;36:e1322-6.
- Karthikeyan S, Kwong HT, Upadhyay PK, et al. A double-blind randomised controlled study comparing subacromial injection of tenoxicam or methylprednisolone in patients with subacromial impingement. J Bone Joint Surg Br 2010;92(1):77-82.
- Cook TM, Tuckey JP, Nolan JP. Analgesia after day-case knee arthroscopy: double-blind study of intra-articular tenoxicam, intra-articular bupivacaine and placebo. Br J Anaesth 1997;78(2):163-8.
- Talu GK, Ozyal çin S, Koltka K, et al. Comparison of efficacy of intraarticular application of tenoxicam, bupivacaine and tenoxicam: bupivacaine combination in arthroscopic knee surgery. Knee Surg Sports Traumatol Arthrosc 2002;10:355-60.
- Oral EG, Hanci A, Ulufer Sivrikaya G et al. The analgesic effects of morphine and tramadol added to intra-articular levobupivacaine-tenoxicam combination for arthroscopic knee surgery on postoperative pain; a randomized clinical trial. Anesth Pain Med 2015;5(3):e24047.
- Jawish R, Najdi H, Abi Safi C, Chameseddine A. The effect of intra-articular Tenoxicam on knee effusion after arthroscopy. Int Orthop 2015;39(7):1423-6.
- Sanel S, Arpaz O, Unay K, et al. Comparison of intra-articular bupivacaine-morphine with bupivacaine-tenoxicam combinations on post-operative analgesia in patients with arthroscopic meniscectomy: a prospective, randomised study. Int Orthop 2016;40(3):601-5.
- Castellsague J, Riera-Guardia N, Calingaert B, et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project). Drug Saf 2012;35(12):1127-46.
- Müller P, Dammann HG, Marinis E, Simon B. Gastroduodenal tolerance of tenoxicam versus diclofenac-Na: an endoscopy double-blind controlled study in healthy probands. Z Rheumatol 1989;48(5):243-5.
- al-Quorain AA1, Satti MB, Marwah S, et al. Non-steroidal anti-inflammatory drug-induced gastropathy: a comparative endoscopic and histopathological evaluation of the effects of tenoxicam and diclofenac. J Int Med Res 1993;21(2):89-97.
- Perpignano G, Bogliolo A, Puccetti L. Double-blind comparison of the efficacy and safety of etodolac SR 600 mg u.i.d. and of tenoxicam 20 mg u.i.d. in elderly patients with osteoarthritis of the hip and of the knee. Int J Clin Pharmacol Res 1994;14(5-6):203-16.
- Lapeyre-Mestre M, Grolleau S, Montastruc JL. Adverse drug reactions associated with the use of NSAIDs: a case/noncase analysis of spontaneous reports from the French pharmacovigilance database 2002-2006. Fundam Clin Pharmacol 2013; 27(2):223-30.
- McGettigan P, Henry D. Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2. JAMA 2006;296(13):1633-44.
- Varas-Lorenzo С, Riera-Guardia N, Calingaert B, et al. Myocardial infarction and individual nonsteroidal anti-inflammatory drugs meta-analysis of observational studies. Pharmacoepidemiol Drug Saf 2013;22:559–70.
- Arfe A, Scotti L, Varas-Lorenzo C, et al. Non-steroidal anti-inflammatory drugs and risk of heart failure in four European countries: nested case-control study. BMJ 2016;354:i4857
Версия на английском языке
Флакон с лиофилизатом: лиофилизированная масса или порошок от желтого до зеленовато-желтого цвета; ампула с растворителем: прозрачная и бесцветная жидкость.
1 флакон с лиофилизатом содержит:
активное вещество: теноксикам — 20 мг;
вспомогательные вещества: маннитол, натрия метабисульфит, динатрия эдетат, трометамол, натрия гидроксид.
1 ампула с растворителем содержит: вода для инъекций — 2 мл.
Нестероидные противовоспалительные и противоревматические средства. Оксикамы.
Код ATX: М01АС02.
Фармакодинамика
Препарат Теноксикам — нестероидный противовоспалительный препарат (НПВП), который оказывает выраженное и длительное анальгезирующее, противовоспалительное, а также жаропонижающее действие. Как и для других НПВП точный механизм действия не известен, возможно, он является многофакторным и включает ингибирование синтеза простагландинов и снижает аккумулирование лейкоцитов в очаге воспаления.
Фармакокинетика
Теноксикам обладает длительным действием, однократная суточная доза является эффективной.
Теноксикам хорошо проникает в синовиальную жидкость, при этом достигаются концентрации примерно вдвое меньше, чем в плазме. Средний период полувыведения из плазмы составляет около 72 часов. При внутривенном введении 20 мг теноксикама в первые два часа наблюдается быстрое снижение концентрации препарата в плазме в основном вследствие процесса распределения. При внутримышечном введении концентрации выше 90% максимально возможных достигаются не позднее чем через 15 минут после введения. При применении рекомендованной дозы — 20 мг один раз в сутки равновесная концентрация в плазме сохраняется в течение 10-15 дней, при этом не наблюдается непредвиденного аккумулирования. Теноксикам прочно связывается с белками плазмы. Выводится из организма теноксикам преимущественно метаболическим путём. Около 2/3 введенной дозы выводится с мочой (в форме неактивного 5-гидроксипиридил метаболита), а остальное с желчью (в форме глюкуронового конъюгата гидрокси-метаболита). Никаких изменений фармакокинетики теноксикама в зависимости от возраста пациентов не наблюдалось, несмотря на индивидуальные изменения тенденций к повышению подобных характеристик у более пожилых пациентов.
Препарат Теноксикам показан для облегчения боли и воспаления при остеоартрите и ревматоидном артрите. Также препарат Теноксикам применяется для кратковременного лечения острых заболеваний опорно-двигательного аппарата, включая растяжения, вывихи и другие повреждения мягких тканей. При указанных показаниях возможно использование внутривенного и внутримышечного введения теноксикама пациентами, которые не могут принимать теноксикам внутрь.
Препарат Теноксикам предназначен для внутримышечного или внутривенного введения.
Взрослые
Рекомендуемая доза составляет 20 мг в сутки в течение первых одного-двух дней лечения, затем переходят на прием таблеток, которые должны приниматься каждый день в одно и то же время. Лиофилизированный порошок растворяется в 2 мл воды для инъекций, которая включена в комплект. После полного растворения порошка раствор должен быть использован немедленно. Не следует применять более высокие дозы, так как при этом не всегда достигается значительно более выраженный терапевтический эффект, а риск возникновения неблагоприятных явлений повышается.
Продолжительность терапии
Лечение острых расстройств опорно-двигательного аппарата обычно не превышает 7 дней. В исключительных случаях продолжительность терапии может быть продлена до 14 дней.
Пожилые пациенты
Назначать с осторожностью, т.к. на фоне сопутствующего лечения или нарушений функций почек, печени или сердечно-сосудистой системы повышается вероятность проявления побочных эффектов в сравнении с более молодыми пациентами. При необходимости применения теноксикама следует назначать наименьшую эффективную дозу и минимальный возможный период лечения. Во время лечения необходимо проводить регулярный контроль пациентов на предмет желудочно-кишечного кровотечения.
Дети
Нет достаточной информации о применении теноксикама у детей.
Почечная и печеночная недостаточность
При почечной недостаточности пациентам с клиренсом креатинина более 25 мл/мин необходим тщательный контроль врача без коррекции режима дозирования. У пациентов с клиренсом креатинина менее 25 мл/мин применяется с осторожностью в виду отсутствия достаточной информации об использовании теноксикама у таких пациентов.
При достаточно низких концентрациях альбумина в плазме крови (например, нефротический синдром) или при высоких концентрациях билирубина применять с осторожностью, в связи с высоким сродством теноксикама к белкам плазмы крови. У пациентов с нарушениями функции печени применяется с осторожностью в виду отсутствия достаточной информации об использовании теноксикама у таких пациентов.
Для большинства пациентов любые побочные эффекты являются временными и разрешаются без прекращения лечения. Наиболее часто наблюдаемыми побочными реакциями являются желудочно-кишечные.
Сердечно-сосудистые и церебрально-васкулярные эффекты. Сообщалось о возникновении отека, гипертонии и сердечной недостаточность, в связи с применением НПВП. Редко наблюдались учащённое сердцебиение и одышка. Клинические испытания и эпидемиологические данные свидетельствуют о том, что использование некоторых НПВП (особенно при высоких дозах и при длительном лечении) может быть связано с повышенным риском развития артериальных тромботических явлений (например, инфаркта миокарда или инсульта).
Дерматологические эффекты: Сообщалось об очень редких тяжелых кожных нежелательных реакциях, таких как синдром Стивенса-Джонсона (SJS) и токсический эпидермальный некролиз (TEN).
Желудочно-кишечные эффекты: Наиболее распространенные побочные эффекты могут наблюдаться со стороны желудочно-кишечного тракта. К ним относятся диспепсия, тошнота, рвота, боль и дискомфорт в животе, запор, диарея, метеоризм, мелена, рвота кровью, язвенный стоматит, анорексия, обострение колита и болезнь Крона. Как и в случае применения других НПВП, существует риск возникновения пептической язвы, перфорации или желудочно- кишечного кровотечения, которое может быть фатальным, особенно у пожилых пациентов. Менее часто отмечалось возникновение гастрита. Очень редко сообщалось о развитии панкреатита.
Гематологические эффекты: при применении НПВП возможно снижение гемоглобина, не связанное с желудочно-кишечными кровотечениями. Сообщалось о возникновении анемии, апластической и гемолитической анемии, тромбоцитопении и нетромбоцитопенической пурпуры, лейкопении, нейтропении и эозинофилии. Редко сообщалось о появление носового кровотечения. Сообщалось о редких случаях агранулоцитоза.
Нарушения со стороны печени: Дисфункция печени. Как и в случае применения большинства других НПВП, наблюдались изменения различных параметров функции печени. У некоторых пациентов возможно повышение уровней сывороточных трансаминаз. Несмотря на низкую частоту возникновения подобных реакций, при значительном или устойчивом отклонении результатов анализа функции печени от нормы, развития признаков и симптомов заболевания печени или возникновения систематических проявлений (например, эозинофилии, сыпи) следует прекратить применение препарата. Сообщалось о возникновении гепатита и желтухи.
Повышенная чувствительность: Сообщалось о следующих реакциях
гиперчувствительности при лечении НПВП:
a) Неспецифические аллергические реакции и анафилаксия;
b) Повышенная реактивность дыхательных путей, включающие астму, обострение астмы, бронхоспазм или одышку;
c) Кожные заболевания, включая различные типы сыпи. Сообщалось об ангионевротическом отеке, зуде и пурпуре. Сообщалось о редких случаях поражения ногтей, алопеции, эритеме, крапивнице и реакции светочувствительности. Как и в случае применения других НПВП, сообщалось об эксфолиативных и буллезных дерматозах, включая эпидермальный некролиз, полиформную эритему и синдром Стивенса-Джонсона. Редко сообщалось о возникновении везикулобуллезных реакций и васкулитов.
Нарушения метаболизма: сообщалось о редких метаболических расстройствах, таких как снижение или увеличение массы тела и гипергликемия.
Неврологические нарушения и нарушения со стороны органов чувств: Сообщалось о возникновении нарушений зрения, неврита зрительного нерва, отека глаз, помутнения зрения и раздражения глаз. Офтальмоскопия и исследование с помощью щелевой лампы не выявили изменений в глазах. Может возникать общее недомогание и шум в ушах. Сообщения о других, менее распространённых эффектах, включая парестезию и асептический менингит (в особенности у пациентов с существующими аутоиммунными заболеваниями, такими как системная красная волчанка и смешанное заболевание соединительной ткани) с такими симптомами как ригидность затылочных мышц, головная боль, тошнота, рвота, жар или потеря ориентации. Головокружение, недомогание, утомление и гиперсомния. Редко сообщалось о возникновении головной боли, сонливости, бессонницы, депрессии, нервозности, нарушений сна, помутнения сознания, парестезий и вертиго.
Нарушения со стороны почек: Сообщалось о развитии нефротоксичности в различных формах, включая интерстициальный нефрит, нефротический синдром и почечную недостаточность. Сообщалось о реверсивных подъемах азота мочевины и креатинина в крови.
Сообщение о нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного средства с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного средства.
В случае возникновения нежелательных реакций, в том числе, не указанных в инструкции по медицинскому применению, пациентам следует обратиться к врачу. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного средства через национальную систему сообщения о нежелательных реакциях.
Повышенная чувствительность к действующему веществу или вспомогательным компонентам препарата; наличие в анамнезе симптомов повышенной чувствительности (включая симптомы астмы, ринит, ангионевротический отек, крапивницу) к ацетилсалициловой кислоте или другим НПВП; наличие в анамнезе желудочно-кишечных кровотечений и перфораций, связанных с предшествующей терапией НПВП; активная пептическая язва/кровотечение или наличие в анамнезе рецидивирующей язвы/кровотечения (2 или более подтвержденных эпизода язвы или кровотечения); тяжелый гастрит, язвенный колит, болезнь Крона; тяжелая сердечная недостаточность, состояние после аорто-коронарного шунтирования; тяжелая печеночная и/или почечная недостаточность, заболевания крови; беременность, период лактации.
Симптомы:
Не сообщалось о случаях серьезной передозировки теноксикамом. Симптомы передозировки с НПВП включают в себя головную боль, тошноту, рвоту, боль в эпигастральной области, желудочно-кишечные кровотечения, редко — диарею, дезориентацию, возбуждение, кому, сонливость, головокружение, шум в ушах, обморок, иногда судороги. В случаях серьезного отравления возможны острая почечная недостаточность и повреждение печени.
Лечение: В случае передозировки следует применить симптоматическое лечение. Должен быть обеспечен достаточный диурез. Следует тщательно контролировать функцию почек и печени. Пациенты должны наблюдаться в течение как минимум четырех часов после потенциально токсичной дозы. При частых или продолжительных судорогах применяется диазепам (внутривенно). Может являться целесообразным применение блокаторов Н2-гистаминовых рецепторов. Также возможно применение других мер в зависимости от клинического состояния пациента.
Безопасность применения препарата в период беременности и лактации не установлена, по этой причине применение препарата при беременности и лактации не рекомендовано.
Беременность
Сообщалось о возникновении врождённых аномалий, вызванных применением НПВП, однако их частота является невысокой, а определённой закономерности их возникновения обнаружено не было. Принимая во внимание известные эффекты НПВП на сердечно-сосудистую систему плода (риск закрытия артериального протока), применение НПВП в третьем триместре беременности противопоказано. Начало родов может запаздывать, а их продолжительность — увеличиваться; также отмечается тенденция к усилению кровотечения у матери и ребенка. Применение НПВП в первых двух триместрах беременности и при родах возможно только в случаях, когда потенциальная польза для пациентки превышает потенциальный риск для плода.
Лактация
В ходе немногочисленных исследований было установлено, что НПВП проникают в грудное молоко в очень низких концентрациях. По возможности следует избегать применения НПВП в период грудного вскармливания. Информация о проникновении теноксикама в женское молоко отсутствует; исследования на животных указывают на возможность его проникновения в значительных количествах.
Не следует применять теноксикам с другими НПВП, включая селективные ингибиторы циклооксигеназы-2.
Нежелательные эффекты могут быть минимизированы путём применения наиболее низкой эффективной дозы в течение минимального периода времени.
Сердечно-сосудистые и цереброваскулярные эффекты
Рекомендуется проведение надлежащего мониторинга и консультирования пациентов с гипертензией и/или застойной сердечной недостаточностью слабой или умеренной степени, т.к. при применении НПВП отмечалась задержка жидкости и возникновение отека.
Результаты клинических исследований и эпидемиологические данные указывают на то, что применение некоторых НПВП (в особенности при высоких дозах и продолжительном лечении) может быть связано с небольшим повышением риска возникновения артериальных тромботических явлений (например, инфаркт миокарда или инсульт). Имеющиеся данные являются недостаточными для исключения подобного риска при применении теноксикама. Поэтому продолжительное лечение теноксикамом пациентов, имеющих факторы риска возникновения сердечно-сосудистых заболеваний, а также пациентов с неконтролируемой гипертензией, застойной сердечной недостаточностью, установленной ишемической болезнью сердца, заболеваниями периферических артериальных сосудов и/или цереброваскулярным заболеванием возможно только после тщательного рассмотрения случая.
Аналогичные рекомендации должны быть приняты во внимание перед началом длительного лечения пациентов с факторами риска сердечно-сосудистых заболеваний (такие как гипертензия, гиперлипидемия, сахарный диабет, курение).
Сердечно-сосудистая, почечная и печеночная недостаточность
Применение НПВП может вызвать дозозависимое снижение образования простагландина и возникновение спровоцированной почечной недостаточности. Большему риску возникновения данной реакции подвержены пациенты, принимающие диуретики, и лица пожилого возраста. Такие пациенты подвергаться мониторингу функции почек.
Сообщалось об отдельных случаях повышения уровней сывороточных трансаминаз или иных индикаторов функции печени. В большинстве случаев данные превышения нормального диапазона значений являлись слабыми и преходящими. При значительном или устойчивом отклонении следует прекратить применение препарата и провести повторные анализы. Необходимо соблюдать особую осторожность при лечении пациентов с существующим заболеванием печени. В редких случаях НПВП могут вызвать интерстициальный нефрит, гломерулонефрит, папиллярный некроз и нефротический синдром. Такие вещества ингибируют синтез почечного простагландина, что играет вспомогательную роль в поддержании почечной перфузии у пациентов со сниженным кровотоком и объемом крови. Применение НПВП у данных пациентов может вызвать клиническую почечную декомпенсацию с возвращением к состоянию, наблюдавшемуся до начала терапии, после прекращения лечения. Наибольшему риску возникновения подобной реакции подвержены пациенты с существующим заболеванием почек (включая пациентов с диабетом и нарушением функции почек), нефротическим синдромом, увеличением объема межклеточной жидкости, заболеванием печени, сердечной недостаточностью, а также пациенты, подвергающиеся параллельному лечению диуретиками или потенциально нефротоксическими средствами. У таких пациентов должен быть установлен тщательный контроль функции почек, печени и сердца. Применяемая дозировка должна быть минимальной. Следует применять НПВП с осторожностью у пациентов с сердечной недостаточностью или гипертензией в анамнезе.
Дерматологические эффекты
При применении НПВП очень редко сообщалось о возникновении серьёзных кожных реакций, включающих эксфолиативный дерматит, синдром Стивенса-Джонсона и токсический эпидермальный некролиз.
Риск развития подобных реакций является наиболее высоким в начале лечения: первое проявление отмечалось в течение первого месяца терапии. При первых признаках кожной сыпи, поражений слизистых оболочек или иных признаках гиперчувствительности следует прекратить применение препарата.
Пожилые пациенты
У пациентов пожилого возраста повышается частота возникновения неблагоприятных реакций на НПВП, в особенности желудочно-кишечного кровотечения и перфорации. Следует соблюдать особую осторожность и проводить регулярный мониторинг пожилых пациентов для обнаружения возможных взаимодействий с применяемыми параллельно лекарственными средствами и наблюдением за функциями почек, печени и сердечно-сосудистой системы, которые могут подвергаться воздействию НПВП.
Нарушение фертильности у женщин
Применение препарата может нарушить фертильность женщин, поэтому его применение не рекомендовано женщинам, планирующим беременность.
Желудочно-кишечное кровотечение, изъязвление и перфорации
Необходимо соблюдать осторожность при применении НПВП у пациентов с заболеванием ЖКТ в анамнезе. При применении всех НПВП сообщалось о возникновении желудочно- кишечного кровотечения, изъязвления и перфорации в любое время периода лечения при наличии или отсутствии предупреждающих симптомов или перенесенных ранее серьёзных явлений со стороны ЖКТ. Риск желудочно-кишечного кровотечения, изъязвления или перфорации повышается при увеличении доз НПВП у пациентов с язвой в анамнезе, особенно осложненной кровотечением или перфорацией, и у пациентов пожилого возраста. Лечение таких пациентов следует начинать с минимальной возможной дозы. Для таких пациентов следует рассматривать возможность лечения в сочетании с защитными веществами (например, мизопростолом или ингибиторами протонного насоса), как и для пациентов, параллельно принимающих низкие дозы аспирина или иные препараты, способные повышать риск поражения ЖКТ.
Пациенты с наличием токсичности в отношении ЖКТ в анамнезе, особенно пожилые пациенты, должны сообщать о возникновении необычных симптомов со стороны органов брюшной полости (в особенности желудочно-кишечного кровотечения), прежде всего на начальных этапах лечения.
Необходимо соблюдать осторожность при лечении пациентов, параллельно принимающих лекарственные средства, способные усиливать риск возникновения язвы или кровотечения, такие как пероральные кортикостероиды, антикоагулянты (такие как варфарин), селективные ингибиторы обратного захвата серотонина или антиагрегантные средства (такие как аспирин). Пациенты, принимающие теноксикам и, имеющие симптомы заболеваний ЖКТ, должны подвергаться тщательному мониторингу. При возникновении пептической язвы или желудочно-кишечного кровотечения необходимо незамедлительно прекратить применение препарата. Следует с осторожностью применять НПВП у пациентов с заболеваниями ЖКТ (язвенный колит, болезнь Крона) в анамнезе, так как возможно обострение данных заболеваний.
Гематологический эффект
Теноксикам снижает агрегацию тромбоцитов и может увеличивать время кровотечения. Это следует учитывать при лечении пациентов, подвергающихся обширному оперативному вмешательству (например, при замене сустава), и при необходимости определения времени кровотечения.
Офтальмологический эффект
Сообщалось о возникновении неблагоприятных явлений со стороны глаз при применении НПВП. По этой причине пациентам, у которых при лечении теноксикамом возникают нарушения зрения, следует проходить офтальмологическое обследование.
Нарушения дыхания
Следует соблюдать осторожность при лечении пациентов, страдающих бронхиальной астмой или имеющих данное заболевание в анамнезе, поскольку сообщалось, что НПВП вызывают у таких пациентов бронхоспазм.
Системная красная волчанка и смешанное заболевание соединительной ткани
У пациентов с системной красной волчанкой и смешанными заболеваниями соединительной ткани может повышаться риск развития асептического менингита.
Пациентам, испытывающим такие неблагоприятные явления, как вертиго, головокружение, сонливость, утомление или нарушения зрения, следует воздержаться от вождения автомобиля или управления механизмами.
Антикоагулянты
У здоровых субъектов не наблюдалось клинически значимого взаимодействия между теноксикамом и гепарином с низкой молекулярной массой.
Теноксикам в высокой степени связывается с альбумином сыворотки крови и, как и все НПВП, может усиливать антикоагулянтное действие варфарина и других антикоагулянтов. Рекомендуется осуществлять тщательный мониторинг эффектов антикоагулянтов и пероральных гликемических средств, особенно на начальных этапах лечения теноксикамом.
Антиагрегантные средства и селективные ингибиторы обратного захвата серотонина (СИОЗС)
Повышение риска желудочно-кишечного кровотечения.
Антигипертензивные средства
Теноксикам и другие НПВП могут ослаблять эффект антигипертензивных средств.
Сердечные гликозиды
НПВП способны обострять сердечную недостаточность, снижать скорость клубочковой фильтрации и повышать уровень сердечных гликозидов в плазме крови при параллельном их применении.
Циклоспорин
Как и при применении других НПВП, следует соблюдать осторожность при параллельном приеме циклоспорина, поскольку в таком случае повышается риск нефротоксичности.
Циметидин
При параллельном применении циметидина взаимодействий не наблюдалось. Кортикостероиды
Как и при применении других НПВП, следует соблюдать осторожность при параллельном приеме кортикостероидов, поскольку в таком случае повышается риск возникновения язв или желудочно-кишечного кровотечения.
Диуретики
Эффект диуретиков снижается. НПВП могут вызывать задержку натрия, калия и жидкости и способны нарушать натрийуретическое действие диуретиков, что может повышать риск нефротоксичности НПВП. Следует учитывать данные особенности при лечении пациентов с нарушением функций сердца или гипертензией, так как указанные эффекты могут вызывать ухудшение состояния пациентов.
Литий
Сообщалось, что НПВП снижают выведение лития. При применении теноксикама пациенту, принимающему литий, следует чаще контролировать уровень лития, а также предупредить пациента о достаточном поступлении жидкости в организм и симптомах интоксикации литием.
Метотрексат
Следует соблюдать осторожность при параллельном приеме метотрексата, так как повышается риск усиления его токсичности, поскольку НПВП ослабляет выведение метотрексата.
Мифепристон
Не следует применять НПВП в течении 8-12 дней после приема мифепристона, так как НПВП могут снизить эффективность последнего.
НПВП, селективные ингибиторы циклооксигеназы-2, салицилаты
Следует избегать совместного применения двух или более НПВП (включая аспирин), так как это может усиливать риск возникновения неблагоприятных эффектов. Салицилаты способны вытеснять теноксикам из мест связывания с белками и таким образом повышать клиренс и объем распределения препарата. Следует избегать параллельного лечения салицилатами или другими НПВП по причине повышения риска неблагоприятных реакций (в частности, желудочно-кишечных).
Пеницилламин и золото для парентерального применения
У небольшого количества пациентов, принимавших пеницилламин или золото для парентерального применения, клинически значимого взаимодействия не наблюдалось.
Хинолоны
Данные, полученные в исследовании на животных, показывают, что НПВП могут усиливать риск возникновения судорог, вызванных хинолоновыми антибиотиками. Пациенты, получающие НПВП и хинолоны могут подвергаться повышенному риску возникновения судорог.
Такролимус
При применении НПВП совместно с такролимусом возможно повышение риска нефротоксичности.
Зидовудин
При применении НПВП совместно с зидовудином повышается риск гематологической токсичности. Имеются свидетельства усиления риска возникновения гемартроза и гематомы у ВИЧ-положительных пациентов с гемофилией, принимающих одновременно зидовудин и ибупрофен.
В оригинальной упаковке для защиты от света, при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
3 года
Не использовать по истечении срока годности, указанного на упаковке.
Флакон
Лиофилизат для приготовления раствора, содержащий 20 мг теноксикама, во флаконе из бесцветного стекла с резиновой пробкой из бромбутилкаучука и алюминиевым колпачком с пластиковым диском белого цвета. На флакон наклеивают этикетку.
Ампула
По 2 мл воды для инъекций в ампулы из бесцветного стекла с кольцом излома. На ампулы наклеивают этикетку.
Комплектация 1
По одному флакону и одной ампуле в ячейковой упаковке. По одной, три, пять или десять ячейковых упаковок вместе с инструкцией по медицинскому применению помещают в пачку из картона.
Комплектация 2
По одной ячейковой упаковке с одним флаконом и одной ячейковой упаковке с одной ампулой; по одной ячейковой упаковке с тремя флаконами и одной ячейковой упаковке с тремя ампулами; по одной ячейковой упаковке с пятью флаконами и одной ячейковой упаковке с пятью ампулами; по две ячейковые упаковки с пятью флаконами и две ячейковые упаковки с пятью ампулами вместе с инструкцией по медицинскому применению помещают в пачку из картона.
По рецепту.
Информация о производителе
«К.О. Ромфарм Компани С.Р.Л.», Румыния, Илфов, 075100 г. Отопень, ул. Друмул Гэрий Отопень, №52 и ул. Ероилор, №1А / СООО «Лекфарм», Республика Беларусь, 223141, г. Логойск, ул. Минская, д. 2а, 2а/4
Владелец регистрационного удостоверения
СООО «Лекфарм», Республика Беларусь, 223141, г. Логойск, ул. Минская, д. 2а, к. 301, тел./факс: (01774)-53801, www.lekpharm.by
Итилокт — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-007401
Торговое наименование:
Итилокт
Международное непатентованное или группировочное наименование:
тиоктовая кислота
Лекарственная форма:
концентрат для приготовления раствора для инфузий
Состав
1 мл препарата содержит:
| Действующее вещество: | для дозировки 25 мг/мл | для дозировки 30 мг/мл |
| Трометамоловая соль тиоктовой кислоты, | 39,7 мг | 47,6 мг |
| в пересчете на тиоктовую кислоту | 25 мг | 30 мг |
| Вспомогательные вещества: | ||
| Трометамол | до pH 8,2-8,5 | |
| Вода для инъекций | до 1 мл |
Теоретическая осмолярность:
25 мг/мл: 356 мОсм/л
30 мг/мл: 427 мОсм/л
Описание
Прозрачный или слегка опалесцирующий раствор желтого или зеленовато-желтого цвета.
Фармакотерапевтическая группа
Метаболическое средство.
Код ATX:
А16АХ01
Фармакологические свойства
Фармакодинамика
Тиоктовая (альфа-липоевая) кислота – эндогенный антиоксидант прямого (связывает свободные радикалы) и непрямого (способствует восстановлению внутриклеточного уровня глутатиона и повышению активности супероксиддисмутазы) действия. В качестве кофермента митохондриальных мультиферментных комплексов участвует в окислительном декарбоксилировании пировиноградной кислоты и альфа-кетокислот. Способствует снижению концентрации глюкозы в плазме крови и увеличению концентрации гликогена в печени, а также преодолению инсулинорезистентности. По характеру биохимического действия близка к витаминам группы В. Участвует в регулировании углеводного и липидного обменов, стимулирует обмен холестерина. Оказывает гепатопротекторное, гиполипидемическое, гипохолестеринемическое, гипогликемическое действие. Улучшает трофику нейронов. При сахарном диабете тиоктовая кислота уменьшает образование конечных продуктов гликирования, улучшает эндоневральный кровоток, повышает содержание глутатиона до физиологического значения, что в результате приводит к улучшению функционального состояния периферических нервных волокон при диабетической полинейропатии.
Благодаря участию в метаболизме жиров, тиоктовая кислота увеличивает биосинтез фосфолипидов, в частности, фосфоинозитидов, восстанавливая повреждения клеточных мембран; нормализует энергетический обмен и проведение нервных импульсов.
Тиоктовая кислота устраняет токсическое влияние метаболитов алкоголя (ацетальдегида, пировиноградной кислоты), уменьшает избыточное образование молекул свободных кислородных радикалов, уменьшает эндоневральную гипоксию и ишемию, ослабляя проявления полинейропатии в виде парестезии, ощущения жжения, боли и онемения конечностей.
Таким образом, тиоктовая кислота оказывает антиоксидантное, нейротрофическое действие, улучшает метаболизм липидов.
Фармакокинетика
При внутривенном введении тиоктовой кислоты в дозе 600 мг максимальная концентрация в плазме крови через 30 мин составляет около 20 мкг/мл. Площадь под кривой «концентрация-время» составляет около 5 мкг/ч/мл. Биодоступность – 30%.
Тиоктовая кислота обладает эффектом «первого прохождения» через печень. Образование метаболитов происходит в результате окисления боковой цепи и конъюгирования. Объем распределения – около 450 мл/кг.
Тиоктовая кислота и ее метаболиты выводятся почками преимущественно в виде метаболитов (80-90%), в небольшом количестве – в неизмененном виде. Период полувыведения составляет 25 мин. Общий плазменный клиренс – 10-15 мл/мин/кг.
Показания к применению
- Диабетическая полинейропатия;
- алкогольная полинейропатия.
Противопоказания
- Повышенная чувствительность к тиоктовой кислоте или другим компонентам препарата;
- беременность, период грудного вскармливания (отсутствует достаточный опыт применения препарата);
- возраст до 18 лет (эффективность и безопасность применения препарата не установлены).
С осторожностью
Внутривенное введение препарата следует проводить с осторожностью у пациентов пожилого возраста (старше 75 лет).
Применение при беременности и в период грудного вскармливания
Применение тиоктовой кислоты во время беременности противопоказано в связи с отсутствием достаточного опыта применения.
Неизвестно, проникает ли тиоктовая кислота в материнское молоко. При необходимости применения препарата в период грудного вскармливания грудное вскармливание необходимо прекратить.
Способ применения и дозы
Внутривенно капельно.
В начале лечения препарат назначают в суточной дозе 600 мг.
Перед применением содержимое 1-2 ампул/флаконов (10-24 мл препарата) разводят в 250 мл 0,9% раствора натрия хлорида и вводят внутривенно капельно, медленно, со скоростью не более 2 мл/мин. Поскольку действующее вещество чувствительно к свету, раствор для инфузии готовят непосредственно перед применением. Приготовленный раствор необходимо защищать от воздействия света, например, с помощью алюминиевой фольги. Защищенный от света раствор может храниться в течение 6 часов.
Курс лечения составляет 2-4 недели. Затем переходят на поддерживающую терапию пероральной формой препарата тиоктовой кислоты в дозе 600 мг в сутки.
Продолжительность курса лечения и необходимость его повторения определяется врачом.
Побочное действие
Нежелательные реакции классифицированы согласно классификации ВОЗ (Всемирной организации здравоохранения): очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000) и частота неизвестна (невозможно оценить на основании имеющихся данных). Корреляции частоты возникновения побочных эффектов с пожилым возрастом пациентов не наблюдается.
Нарушения со стороны крови и лимфатической системы: очень редко – петехиальные кровоизлияния в слизистые оболочки, кожу; геморрагическая сыпь (пурпура), тромбоцитопатия, гипокоагуляция.
Нарушения со стороны иммунной системы: очень редко – аллергические реакции (кожная сыпь, экзема, крапивница, кожный зуд); частота неизвестна – анафилактический шок; аутоиммунный инсулиновый синдром у пациентов с сахарным диабетом, который характеризуется частыми гипогликемиями в условиях наличия аутоантител к инсулину.
Нарушения со стороны обмена веществ и питания: очень редко – гипогликемия (из-за улучшения усвоения глюкозы), симптомы которой включают головокружение, повышенное потоотделение, головную боль и нарушение зрения.
Нарушения со стороны нервной системы: очень редко – изменение или нарушение вкусовых ощущений, «приливы», судороги.
Нарушения со стороны желудочно-кишечного тракта: часто – тошнота, рвота; очень редко – боль в животе, диарея.
Нарушения со стороны печени и желчевыводящих путей: очень редко – повышение активности «печеночных» ферментов.
Нарушения со стороны сердца: частота неизвестна – боль в области сердца, тахикардия при быстром введении препарата.
Нарушения со стороны сосудов: очень редко – тромбофлебит.
Нарушения со стороны органа зрения: очень редко – диплопия, нечеткость зрения.
Общие расстройства и нарушения в месте введения: очень редко – чувство жжения в месте введения, частота неизвестна – аллергические реакции в месте введения (раздражение, гиперемия или припухлость).
Прочие: очень редко – при быстром внутривенном введении наблюдались самостоятельно проходящие повышение внутричерепного давления (чувство тяжести в голове) и затруднение дыхания, слабость.
Передозировка
Симптомы: головная боль, тошнота, рвота.
В тяжелых случаях (при применении тиоктовой кислоты в дозе 10-40 г): психомоторное возбуждение или нарушение сознания, генерализованные судороги, выраженное нарушение кислотно-щелочного равновесия с лактоацидозом, гипогликемия (вплоть до развития комы), острый некроз скелетных мышц, синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром), гемолиз, супрессия костного мозга, полиорганная недостаточность.
Лечение: при подозрении на передозировку тиоктовой кислотой (например, введение более 80 мг на 1 кг массы тела) рекомендуется экстренная госпитализация и немедленное принятие мер в соответствии с общими принципами, принятыми при случайном отравлении. Терапия симптоматическая. Лечение генерализованных судорог, лактоацидоза и других угрожающих жизни последствий передозировки должно проводиться в соответствии с принципами современной интенсивной терапии. Специфического антидота нет. Гемодиализ, гемоперфузия или методы фильтрации с принудительным выведением тиоктовой кислоты не эффективны.
Взаимодействие с другими лекарственными средствами
В связи с тем, что тиоктовая кислота способна образовывать хелатные комплексы с металлами, следует избегать совместного назначения с препаратами железа, магния, кальция. Одновременное применение тиоктовой кислоты с цисплатином снижает эффективность последнего.
С молекулами сахаров тиоктовая кислота образует плохо растворимые комплексные соединения. Тиоктовая кислота несовместима с растворами декстрозы (глюкозы), фруктозы, Рингера, а также с растворами, реагирующими с дисульфидными или SH-группами.
Тиоктовая кислота усиливает гипогликемическое действие инсулина и гипогликемических препаратов для перорального применения при одновременном применении.
Тиоктовая кислота усиливает противовоспалительное действие глюкокортикостероидов. Этанол и его метаболиты снижают терапевтическую эффективность тиоктовой кислоты.
Особые указания
У пациентов с сахарным диабетом необходим постоянный контроль концентрации глюкозы в плазме крови, особенно на начальной стадии терапии препаратом. В некоторых случаях может возникнуть необходимость уменьшения дозы инсулина или гипогликемических препаратов для перорального применения во избежание развития гипогликемии. При возникновении симптомов гипогликемии (головокружение, повышенное потоотделение, головная боль, расстройство зрения, тошнота) следует немедленно прекратить введение препарата. При парентеральном применении возможно возникновение реакций гиперчувствительности. При появлении симптомов, таких как зуд, недомогание, лечение препаратом следует немедленно прекратить. Прием алкоголя снижает эффективность лечения препаратом, поэтому пациентам в период терапии следует воздержаться от употребления алкоголя в течение всего курса лечения, а также, по возможности, в перерывах между курсами. Употребление алкоголя во время лечения тиоктовой кислотой также является фактором риска развития и прогрессирования нейропатии. Растворителем для препарата может быть только 0,9% раствор натрия хлорида. Приготовленный раствор препарата следует защищать от воздействия света.
Описано несколько случаев развития аутоиммунного инсулинового синдрома у пациентов с сахарным диабетом на фоне лечения тиоктовой кислотой, который характеризовался частыми гипогликемиями в условиях наличия аутоантител к инсулину. Возможность развития аутоиммунного инсулинового синдрома определяется наличием у пациентов гаплотипов HLA-DRB1*0406 и HLA-DRB1*0403.
Влияние на способность управлять транспортными средствами и механизмами
Влияние применения тиоктовой кислоты на способность управлять транспортными средствами и механизмами не изучалось. Учитывая возможные нежелательные реакции (головокружение и развитие симптомов гипогликемии), необходимо соблюдать осторожность при управлении транспортными средствами и механизмами, а также занятии потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска
Концентрат для приготовления раствора для инфузий 25 мг/мл, 30 мг/мл.
Для дозировки 25 мг/мл:
По 12 или 24 мл во флаконы из окрашенного стекла, герметично укупоренные резиновыми пробками, обжатые комбинированными колпачками типа «flip-off».
По 5 или 10 флаконов в контурной ячейковой упаковке из пленки поливинилхлоридной или полиэтилентерефталатной с пленкой полимерной или фольгой алюминиевой лакированной, или без пленки полимерной и фольги алюминиевой лакированной, или в форме из картона с ячейками для укладки флаконов, или без контурной ячейковой упаковки или формы из картона.
По 1 контурной ячейковой упаковке или форме из картона с 5 или 10 флаконами или 2 контурные ячейковые упаковки или формы из картона с 5 флаконами, или по 5 или 10 флаконов вместе с инструкцией по применению в пачке из картона.
Для дозировки 30 мг/мл:
По 10 или 20 мл в ампулы из окрашенного стекла с цветным кольцом разлома или с цветной точкой и насечкой или без кольца разлома, цветной точки и насечки.
По 5 или 10 ампул в контурной ячейковой упаковке из пленки поливинилхлоридной или полиэтилентерефталатной с пленкой полимерной или фольгой алюминиевой лакированной, или без пленки полимерной и фольги алюминиевой лакированной, или в форме из картона с ячейками для укладки ампул.
По 1 контурной ячейковой упаковке или форме из картона с 5 или 10 ампулами или 2 контурные ячейковые упаковки или формы из картона с 5 ампулами вместе с инструкцией по применению и скарификатором ампульным или без него в пачке из картона.
Условия хранения
Хранить в оригинальной упаковке (пачке) при температуре не выше 25 °С.
Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять после окончания срока годности!
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
ООО «Гротекс»
Россия, 195279, г. Санкт-Петербург
Индустриальный проспект, д. 71, корп. 2, лит. А
Производитель/Организация, принимающая претензии
ООО «Гротекс»
Россия, 195279, г. Санкт-Петербург
Индустриальный проспект, д. 71, корп. 2, лит. А
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)