Обобщенные научные материалы по действующему веществу препарата Тивикай® (таблетки, покрытые пленочной оболочкой, 50 мг)
Дата последней актуализации: 21.11.2016
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Владелец РУ
- Условия хранения
- Срок годности
- Источники информации
- Фармакологическая группа
- Характеристика
- Фармакология
- Показания к применению
- Нозологическая классификация (МКБ-10)
- Противопоказания
- Ограничения к применению
- Применение при беременности и кормлении грудью
- Побочные действия
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Владелец РУ
ВииВ Хелскер ЮК Лимитед
Условия хранения
При температуре не выше 30 °C.
Хранить в недоступном для детей месте.
Срок годности
5 лет.
Не применять по истечении срока годности, указанного на упаковке.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2015 и www.rxlist.com, 2016.
Фармакологическая группа
Характеристика
Противовирусное средство — ингибитор интегразы ВИЧ.
RxList.com
Долутегравир в виде долутегравира натрия имеет молекулярную массу 441,36 г/моль и представляет собой порошок от белого до слегка желтого цвета, малорастворимый в воде.
Фармакология
Фармакодинамика
Долутегравир ингибирует интегразу ВИЧ, связываясь с активным участком интегразы и блокируя этап переноса цепей во время интеграции ретровирусной ДНК, который необходим для цикла репликации ВИЧ. При проведении двух биохимических анализов переноса цепи с использованием очищенной интегразы ВИЧ-1 и предварительно обработанного субстрата ДНК были получены значения IC50, составляющие 2,7 и 12,6 нмоля. In vitro долутегравир медленно диссоциирует от активного центра комплекса ДНК-интеграза дикого типа (T1/2 — 71 ч).
Фармакодинамические эффекты
В рандомизированном исследовании с целью определения оптимальной дозы у инфицированных ВИЧ-1 пациентов, которые получали монотерапию долутегравиром (ING111521), отмечалось быстрое и дозозависимое противовирусное действие со средним снижением РНК ВИЧ-1 на 11-й день, составляющим 1,5; 2 и 2,5 log10 по сравнению с исходным уровнем для 2; 10 и 50 мг долутегравира соответственно при приеме 1 раз в сутки. Данный противовирусный ответ поддерживался в течение 3–4 дней с момента приема последней дозы в группе пациентов, получавших 50 мг долутегравира.
Противовирусная активность в клеточной культуре
В мононуклеарных клетках периферической крови (МКПК), инфицированных штаммом BaL ВИЧ-1 или NL432 ВИЧ-1, IC50 долутегравира составила 0,51 и 0,53 нмоля соответственно. В клетках МТ-4, инфицированных штаммом IIIB ВИЧ-1 и инкубированных с долутегравиром в течение 4 или 5 дней, были получены IC50 0,71 и 2,1 нмоля.
В анализе чувствительности вирусной интегразы с использованием участка кодирования интегразы из 13 клинически различающихся изолятов субтипа В долутегравир продемонстрировал противовирусную активность, сходную с активностью в отношении лабораторных штаммов, со средней IC50 0,52 нмоля. В анализе МКПК-панели, состоящей из 24 клинических изолятов ВИЧ-1 (группа М, субтипы А, В, С, D, Е, F и G и группа О), а также 3 клинических изолятов ВИЧ-2 среднее геометрическое IC50 составило 0,2 нмоля, а значения IC50 варьировали от 0,02 до 2,14 нмоля для изолятов ВИЧ-1, в то время как для изолятов ВИЧ-2 среднее геометрическое IC50 составило 0,18 нмоля, а значения IC50 варьировали от 39 до 0,61 нмоля.
Противовирусная активность в сочетании с другими противовирусными ЛС
Ни одно из ЛС с типичной противовирусной активностью в отношении ВИЧ не проявляло антагонизма к долутегравиру (in vitro оценку проводили в сочетании со ставудином, абакавиром, эфавирензом, невирапином, лопинавиром, ампренавиром, энфувиртидом, маравироком, адефовиром и ралтегравиром, выбранными в шахматном порядке). Кроме того противовирусные ЛС без типичной активности в отношении ВИЧ (рибавирин) не оказывали видимый эффект на активность долутегравира.
Влияние сыворотки крови и белков сыворотки крови человека
Исследования in vitro подтвердили 75-кратное изменение IC50 (КИ) долутегравира в присутствии 100% сыворотки крови человека (методом экстраполяции), а IC90, скорректированная с учетом связывания белками (PA-IC90), в МКПК составила 64 нг/мл. Минимальная концентрация долутегравира после применения разовой дозы 50 мг у пациентов, ранее не получавших ингибиторы интегразы, составила 1,2 мкг/мл, в 9 раз превышая установленную РА-IС90.
Устойчивость in vitro
Изоляты дикого типа ВИЧ-1. В течение 112-дневного пассажа штамма IIIB не выявлялись вирусы с высокой устойчивостью к долутегравиру, максимальное 4,1-кратное изменение наблюдалось у полученных при пассажах групп устойчивых вирусов с заменами S153Y и S153F в консервативных позициях гена интегразы. Пассаж штамма NL432 дикого типа ВИЧ-1 в присутствии долутегравира приводил к селекции замены E92Q (пересеваемая группа вируса с КИ 3,1) и G193E (пересеваемая группа вируса с КИ 3,2) на 56-й день. Дополнительный пассаж субтипов В, С и А/G дикого типа вируса в присутствии долутегравира приводил к селекции R263K, G118R и S153T.
Противовирусная активность в отношении устойчивых штаммов
Штаммы, устойчивые к ингибиторам обратной транскриптазы (ИОТ) и ингибиторам протеазы (ИП). Долутегравир продемонстрировал одинаковую активность против 2 ненуклеозидных ИОТ-устойчивых, 3 нуклеозидных ИОТ-устойчивых и 2 ИП-устойчивых мутантных клонов ВИЧ-1 (один с 3- и один с 6-кратной резистентностью) по сравнению с диким штаммом.
Штаммы ВИЧ-1, устойчивые к ингибиторам интегразы. 60 мутантных изолятов ВИЧ-1, устойчивых к ингибиторам интегразы (28 с одной и 32 с двумя или более заменами), были получены из вируса дикого типа NL432 путем сайтнаправленного мутагенеза. Долутегравир продемонстрировал противовирусную активность (чувствительность) против ВИЧ с КИ <5 в отношении 27 из 28 мутантных вирусов, устойчивых к ингибиторам интегразы с одной заменой, в т.ч. Т66А/1/К, E92Q/V, Y143C/H/R, Q148H/K/R и N155H, в то время как ралтегравир и элвитегравир проявили активность в отношении 17 из 28 и 11 из 21 тестируемых мутантных вирусов с КИ <5 соответственно. Кроме того, из 32 мутантных вирусов, устойчивых к ингибиторам интегразы с двумя или более заменами, 23 из 32 продемонстрировали КИ <5 для долутегравира по сравнению с КИ <5 в отношении 4 из 32 для ралтегравира и 2 из 25 тестируемых вирусов для элвитегравира.
Штаммы ВИЧ-2, устойчивые к ингибиторам интегразы. Вирусы были получены путем сайтнаправленного мутагенеза изолятов ВИЧ-2, выделенных у инфицированных ВИЧ-2 пациентов, которые получали ралтегравир и у которых отмечалась вирусологическая неэффективность лечения. В целом, КИ у ВИЧ-2 были схожи с КИ ВИЧ-1, наблюдавшимися при аналогичном наборе мутаций. КИ долутегравира составила <5 против 4 вирусов ВИЧ-2 (S163D, G140A/Q148R, A153G/N155H/S163G и E92Q/T97A/N155H/S163D); для E92Q/N155H КИ долутегравира составила 8,5, а для G140S/Q148R — 17. Долутегравир, ралтегравир и элвитегравир проявили одинаковую активность против ВИЧ-2 с сайтнаправленной мутацией S163D, как и в отношении дикого типа, а для остальных мутантных вирусов ВИЧ-2 диапазоны КИ ралтегравира составили 6,4–420, элвитегравира — 22–640.
Клинические изоляты у пациентов с вирусологической неэффективностью лечения ралтегравиром
30 клинических изолятов с генотипической и фенотипической устойчивостью к ралтегравиру (медиана КИ >81) исследовали на чувствительность к долутегравиру (медиана КИ 1,5) путем анализа с помощью Monogram Biosciences PhenoSense. Медиана КИ долутегравира для изолятов с заменами в позициях C140S + Q148H составила 3,75; G140S + Q148R — 13,3; Т97А + Y143R — 1,05 и N155H — 1,37.
705 устойчивых к ралтегравиру изолятов, выделенных у пациентов, получавших ралтегравир, были проанализированы на чувствительность к долутегравиру путем анализа с помощью Monogram Biosciences PhenoSense. Долутегравир проявил КИ <10 в отношении 93,9% из 705 клинических изолятов при этом у 16 (9%) из 184 изолятов с заменой Q148 + 1 с резистентностью к ингибиторам интегразы и 25 (27%) из 92 клинических изолятов с заменой Q148+ >2 с резистентностью к ингибиторам интегразы наблюдалось более чем 10-кратное изменение.
Устойчивость in vivo: пациенты, не получавшие ингибиторы интегразы
Не отмечалось мутаций резистентности к ингибитору интегразы или связанной с лечением устойчивости к нуклеозидным ИОТ основной терапии у ранее не получавших лечение пациентов, которые получали 50 мг долутегравира 1 раз в сутки (исследования SPRING-1, SPRING-2, SINGLE и FLAMINGO). В исследовании SAILING у пациентов, получавших долутегравир и ранее не получавших ингибиторы интегразы (N=354 в группе долутегравира), связанные с лечением замены в интегразе наблюдались на 48-й нед у 4 из 17 пациентов с вирусологической неэффективностью, получавших долутегравир. У 2 из 4 пациентов наблюдалась уникальная замена R263K в гене интегразы с максимальной КИ 1,93, у 1 пациента наблюдалась полиморфная замена V151V/I интегразы с максимальной КИ 0,92, и у 1 пациента были уже изначально мутации интегразы, и, как предполагается, он ранее получал ингибитор интегразы или был инфицирован устойчивым к ингибитору интегразы вирусом.
Устойчивость in vivo: пациенты с устойчивостью к ингибиторам интегразы
В исследовании VIKING-3 изучали долутегравир (плюс оптимизированная базовая терапия) у пациентов с имеющейся устойчивостью к ингибиторам интегразы. До 24-й нед у 36 из 183 пациентов отмечалась установленная протоколом вирусологическая неэффективность (PDVF). Из них у 32 пациентов для анализа имелись парные данные по исходной и PDVF-устойчивости, и у 17 из этих 32 (53%) отмечались мутации, связанные с лечением.
Наблюдались следующие связанные с лечением мутации или сочетания мутаций: L74L/M (N=1), E92Q (N=2), T97А (N=9), Е138К/А/Т (N=8), G140S (N=2), YI43H (N=1), S147G (N=1), Q148H/K/R (N=4), N155H (N=1) и EI57E/Q (N=1). У 14 из 17 пациентов с мутациями вируса, связанными с лечением, исходно или в анамнезе имелась мутация Q148. У 5 других пациентов в период между неделями 24 и 48 была отмечена PDVF, и у 2 из этих 5 пациентов имелись возникшие во время лечения мутации. Отмеченными мутациями, возникшими во время лечения, или сочетаниями мутаций были L74I (N=1), Т155Н (N=2).
В исследовании VIKING-4 изучали долутегравир (плюс оптимизированная базовая терапия) у 30 пациентов с первичной генотипической устойчивостью к ингибиторам интегразы, выявленной при скрининге. Возникшие во время лечения мутации соответствовали мутациям, наблюдавшимся в исследовании VIKING-3.
Влияние на показатели ЭКГ
В рандомизированном перекрестном плацебо-контролируемом клиническом исследовании 42 здоровых добровольца получили разовую дозу плацебо, суспензии долутегравира (250 мг) (воздействие приблизительно в 3 раза превышает воздействие дозы 50 мг 1 раз в сутки в равновесном состоянии) и моксифлоксацина (400 мг, активный контроль) в случайном порядке. Долутегравир не вызывал удлинение корригированного интервала (QTc) в течение 24 ч после приема. После коррекции по исходным показателям ЭКГ и приема плацебо максимальное среднее изменение QTc, основанное на коррекции по формуле Фредерика (QTcF), составило 1,99 мс (верхняя граница 1-стороннего 95% ДИ — 4,53 мс).
Влияние на функцию почек
Влияние долутегравира на клиренс креатинина сыворотки крови, СКФ в пробе с йогексолом и эффективный почечный плазмоток (ЭПП) в пробе с парааминогиппуратом оценивались в открытом рандомизированном плацебо-контролируемом исследовании в 3 группах с участием 37 здоровых добровольцев, которые получали 50 мг долутегравира 1 раз в сутки (N=12), 50 мг — 2 раза в сутки (N=13) или плацебо — 1 раз в сутки (N=12) в течение 14 дней. Отмечалось умеренное снижение клиренса креатинина при применении долутегравира в течение первой недели лечения, соответствующее снижению, которое наблюдалось в клинических исследованиях. При приеме в обеих дозах долутегравир не оказал значительное влияние на СКФ и ЭПП. Эти данные подтверждают исследования in vitro, которые позволяют предположить, что небольшое повышение уровня креатинина, наблюдаемое в клинических исследованиях, вызвано непатологическим ингибированием переносчика органических катионов 2 (ОСТ2) в проксимальных почечных канальцах, что обусловливает канальцевую секрецию креатинина.
Фармакокинетика
Фармакокинетика долутегравира у здоровых добровольцев и ВИЧ-инфицированных пациентов одинакова. Вариабельность фармакокинетики долутегравира была от низкой до умеренной. В исследованиях фазы I с участием здоровых добровольцев коэффициент вариации (КВ) среди участников для AUC и Сmах варьировал от приблизительно 20 до 40%, а концентрация в конце интервала дозирования (Сτ) — от 30 до 65%.
Вариабельность фармакокинетики долутегравира между участниками была выше у ВИЧ-инфицированных пациентов, чем у здоровых добровольцев. Индивидуальная вариабельность показателей фармакокинетики была ниже вариабельности между индивидуумами.
Всасывание. Долутегравир быстро всасывается после приема внутрь, медиана Тmах после перорального приема составляет 2–3 ч. Линейность фармакокинетики долутегравира зависит от дозы и лекарственной формы. После приема внутрь долутегравир в виде таблеток в целом проявляет нелинейную фармакокинетику с менее чем дозозависимым повышением плазменной экспозиции в интервале доз от 2 до 100 мг, однако повышение экспозиции долутегравира пропорционально дозе от 25 до 50 мг.
Долутегравир можно принимать независимо от приема пищи. Пища повышает степень и снижает скорость всасывания долутегравира. Биодоступность долутегравира зависит от содержания жира в пище: при приеме пищи с низким, умеренным и высоким содержанием жиров AUC0-∞ долутегравира увеличивалась на 33, 41 и 66%, Сmах повышалась на 46, 52 и 67%, Тmах удлинялось до 3, 4 и 5 ч по сравнению с 2 ч при приеме натощак соответственно. Данные изменения не имеют клинического значения.
Абсолютная биодоступность долутегравира не установлена.
Распределение. По данным in vitro, долутегравир в значительной степени (приблизительно на 99,3%) связывается с белками плазмы крови человека. Кажущийся Vd (после приема внутрь в виде суспензии, Vd/F) составляет приблизительно 12,5 л. Связывание долутегравира с белками плазмы крови не зависит от концентрации. Соотношение общей концентрации долутегравира с радиоактивной меткой в крови и плазме составляет 0,441–0,535, что указывает на минимальную связь радиоактивно меченого долутегравира с клеточными компонентами крови. Свободная фракция долутегравира в плазме крови — приблизительно 0,2–1,1% у здоровых добровольцев, приблизительно 0,4–0,5% у пациентов с печеночной недостаточностью средней степени тяжести, 0,8–1% у пациентов с тяжелой почечной недостаточностью и 0,5% у пациентов, инфицированных ВИЧ-1.
Долутегравир проникает в цереброспинальную жидкость (ЦСЖ). У 12 ранее не получавших лечение пациентов, которые получали долутегравир и абакавир/ламивудин в течение 16 нед, средняя концентрация долутегравира в ЦСЖ составила 15,4 нг/мл на 2-й нед и 12,6 нг/мл на 16-й нед с диапазоном от 3,7 до 23,2 нг/мл (сопоставимо с концентрацией несвязанного долутегравира в плазме). Соотношение концентрации долутегравира в ЦСЖ к концентрации в плазме крови варьировало от 0,11 до 2,04%. Концентрации долутегравира в ЦСЖ превысили IC50, что подтверждает медианное снижение концентрации РНК ВИЧ-1 в ЦСЖ по сравнению с исходной концентрацией на 2,2 log после 2 нед терапии и на 3,4 log после 16 нед терапии (см. «Фармакодинамика»).
Долутегравир обнаруживается в мужских и женских половых путях. AUC в цервико-вагинальной жидкости, цервикальной и вагинальных тканях составляет 6–10% от таковой в плазме крови в равновесном состоянии. AUC в семенной жидкости составляет 7%, а в тканях прямой кишки — 17% от таковой в плазме крови в равновесном состоянии.
Метаболизм. Долутегравир главным образом метаболизируется УДФ-ГТ1А1 с некоторым участием изофермента CYP3A (9,7% обшей принятой дозы в исследовании баланса массы у людей). Долутегравир является основным соединением, циркулирующим в плазме крови, в неизмененном виде незначительно выводится через почки (<1% дозы). 53% общей дозы, принятой внутрь, выводится в неизмененном виде через кишечник. Неизвестно, объясняется это неполным всасыванием ЛС или выведением с желчью глюкуронидного конъюгата, который дальше может распадаться до образования родственных соединений в просвете кишечника. 31% общей дозы, принятой внутрь, выводится через почки в форме эфира глюкуронида долутегравира (18,9% общей дозы), N-деалкилированного метаболита (3,6% общей дозы) и метаболита, образованного путем окисления бензилового углерода (3% общей дозы).
Выведение. Конечный T1/2 долутегравира составляет около 14 ч, а кажущийся клиренс (CL/F) — 0,56 л/ч.
Особые группы пациентов
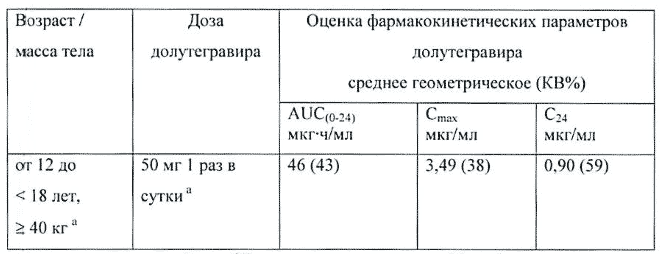
Дети. В педиатрическом исследовании, включавшем 23 ВИЧ-1-инфицированных ребенка и подростка в возрасте от 12 до 18 лет, ранее получавших антиретровирусное лечение, данные фармакокинетики долутегравира у 10 пациентов с массой тела больше или равной 40 кг показали, что суточная доза 50 мг долутегравира (1 пациент с массой тела 37 кг получал 35 мг долутегравира 1 раз в сутки) приводила к такой же экспозиции у детей и подростков, как и у взрослых, которые получали 50 мг долутегравира 1 раз в сутки. Средние геометрические значения фармакокинетических параметров у этих 10 пациентов в возрасте от 12 до 18 лет составили (в скобках КВ, %): AUC0-24 — 46 мкг·ч/мл (43%), Cmax — 3,49 мкг/мл (38%) и C24 — 0,9 мкг/мл (59%).
Пожилой возраст. Популяционный фармакокинетический анализ долутегравира с использованием данных, полученных у взрослых, инфицированных ВИЧ-1, показал отсутствие клинически значимого влияния возраста на экспозицию долутегравира.
Данные фармакокинетики долутегравира у пациентов старше 65 лет ограничены.
Нарушение функции почек. Почечный клиренс неизмененного ЛС является второстепенным путем выведения долутегравира. Было проведено исследование фармакокинетики долутегравира у пациентов с нарушением функции почек тяжелой степени (Cl креатинина <30 мл/мин). Не наблюдалось клинически значимых фармакокинетических различий между пациентами с нарушением функции почек тяжелой степени (Cl креатинина <30 мл/мин) и здоровыми добровольцами. Пациентам с нарушением функции почек коррекция дозы не требуется. Долутегравир не исследовался в группе пациентов, находящихся на диализе, тем не менее различия в фармакокинетике не ожидаются.
Нарушение функции печени. Долутегравир метаболизируется и выводится главным образом печенью. В исследовании, в котором сравнивали 8 пациентов с нарушением функции печени средней степени тяжести (класс В по шкале Чайлд-Пью) и 8 здоровых взрослых добровольцев, воздействие разовой дозы 50 мг долутегравира было одинаковым в обеих группах. Пациентам с нарушением функции печени легкой или средней степени тяжести не требуется коррекция дозы. Влияние нарушения функции печени тяжелой степени на фармакокинетику долутегравира не исследовалось.
Полиморфизм ферментов, метаболизирующих ЛС. Нет доказательств того, что часто встречающийся полиморфизм ферментов, метаболизирующих ЛС, изменяет фармакокинетику долутегравира в клинически значимой степени. В метаанализе с использованием фармакогеномных образцов, полученных в клинических исследованиях с участием здоровых добровольцев, у пациентов с генотипами УДФ-ГТ1А1 (N=7), у которых отмечался слабый метаболизм долутегравира, клиренс долутегравира был снижен на 32%, a AUC была на 46% выше по сравнению с пациентами с генотипами, которые ассоциировались с нормальным метаболизмом через УДФ-ГТ1А1 (N=41). Полиморфизм изоферментов CYP3A4, CYP3A5 и NR112 не был связан с различиями фармакокинетики долутегравира.
Пол. На основании данных, полученных в исследовании с участием здоровых добровольцев (мужчины N=17, женщины N=24), обнаружено, что воздействие долутегравира несколько выше у женщин (примерно на 20%), чем у мужчин. Популяционный фармакокинетический анализ с использованием совокупных фармакокинетических данных, полученных в клинических исследованиях фазы IIb и III с участием взрослых пациентов, не показал клинически значимое влияние пола на экспозицию долутегравира.
Раса. Популяционный фармакокинетический анализ с использованием совокупных фармакокинетических данных, полученных в клинических исследованиях фазы IIb и III с участием взрослых пациентов, не показал клинически значимое влияние расы на экспозицию долутегравира. Доказано, что фармакокинетика долутегравира после однократного приема внутрь представителями Японии аналогична фармакокинетике у западных народностей (представители США).
Коинфекция ВИЧ и вирусного гепатита В или С. Популяционный фармакокинетический анализ показал, что коинфекция вируса гепатита С не оказывает клинически значимый эффект на воздействие долутегравира. Данные о пациентах с коинфекцией гепатита В ограничены.
Фертильность. Отсутствуют данные о влиянии долутегравира на способность к зачатию у мужчин или женщин. Исследования на животных показали отсутствие влияния долутегравира на способность к зачатию у самцов или самок.
Показания к применению
Лечение ВИЧ-1-инфекции у взрослых и детей с 12 лет и массой тела 40 кг и более в составе комбинированной антиретровирусной терапии.
Противопоказания
Повышенная чувствительность к долутегравиру; одновременный прием с дофетилидом или пилсикаинидом; детский возраст до 12 лет и масса тела менее 40 кг.
Ограничения к применению
Печеночная недостаточность тяжелой степени (класс С по шкале Чайлд-Пью); одновременное применение с ЛС, которые могут изменить действие долутегравира, или ЛС, действие которых может измениться под действием долутегравира.
Применение при беременности и кормлении грудью
Категория действия на плод по FDA — B.
Соответствующие и хорошо контролируемые исследования долутегравира с участием беременных женщин не проводились. Влияние долутегравира на беременность у женщин неизвестно. В исследованиях репродуктивной токсичности на животных было показано, что долутегравир проникает через плаценту. Долутегравир можно применять во время беременности только в том случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
ВИЧ-инфицированным пациенткам рекомендован отказ от грудного вскармливания детей, чтобы избежать вертикальной передачи ВИЧ-инфекции.
На основании данных, полученных у животных, ожидается, что долутегравир будет выделяться у женщин с грудным молоком, хотя это и не было подтверждено у людей.
Побочные действия
Нежелательные реакции, представленные ниже, установлены во время анализа совокупных данных клинических исследований фаз IIb и III, перечислены в соответствии с системно-органной классификацией и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100); редко (≥1/10000 и <1/1000); очень редко (<1/10000, включая отдельные случаи).
Частота встречаемости нежелательных реакций
Со стороны иммунной системы: нечасто — реакция гиперчувствительности, синдром восстановления иммунитета (см. «Меры предосторожности»).
Нарушения психики: часто — бессонница, необычные сновидения, депрессия; нечасто — суицидальное мышление или попытка суицида (особенно у пациентов с депрессией или психическими заболеваниями в анамнезе).
Со стороны нервной системы: очень часто — головная боль; часто — головокружение.
Со стороны ЖКТ: очень часто — тошнота, диарея; часто — рвота, метеоризм, боль в верхних отделах живота, боль в области живота, дискомфорт в области живота.
Со стороны печени и желчевыводящих путей: нечасто — гепатит.
Со стороны кожи и подкожных тканей: часто — сыпь, зуд.
Общие расстройства и нарушения в месте введения: часто — повышенная утомляемость.
Лабораторные и инструментальные данные: часто — повышение активности АЛТ и/или АСТ, КФК.
Профиль безопасности был одинаковым в популяциях пациентов, ранее не получавших лечение; пациентов, получавших лечение (за исключением ингибиторов интегразы), и пациентов с устойчивостью к ингибиторам интегразы.
Изменения лабораторных показателей
В течение первой недели лечения долутегравиром отмечалось повышение концентрации креатинина сыворотки крови, которое сохранялось в течение 48 нед. При лечении пациентов, которые ранее не получали терапию, среднее изменение 9,96 мкмоль/л по сравнению с исходной концентрацией (диапазон от −53 до 54,8 мкмоль/л) наблюдалось через 48 нед лечения. Повышение концентрации креатинина было сопоставимо с концентрацией, которая отмечается при применении основных нуклеозидных ИОТ, и не отличалось от концентрации, которая наблюдалась у пациентов, ранее получавших лечение. Данное изменение не считается клинически значимым, поскольку оно не отражает изменения СКФ (см. «Фармакология»).
В клинических исследованиях в группах долутегравира и ралтегравира (но не эфавиренза) отмечались незначительные повышения концентрации общего билирубина (без клинической желтухи). Данные изменения не считаются клинически значимыми, поскольку они вероятно отражают конкурентный клиренс долутегравира и неконъюгированного билирубина посредством УДФ-ГТ1А1 (см. «Фармакология»).
Также во время терапии долутегравиром регистрировались бессимптомные повышения активности КФК, которые в основном были связаны с физической нагрузкой.
Применение у детей
На основании ограниченных данных, доступных у детей и подростков в возрасте от 12 до 18 лет, можно сделать заключение об отсутствии дополнительных типов нежелательных реакций, кроме тех, которые наблюдались у взрослых.
Коинфекция ВИЧ и гепатита В или С
В исследования III фазы было разрешено включать пациентов с коинфекцией гепатита В и/или С при условии, что результаты исходных лабораторных показателей функции печени не превышали ВГН в 5 раз. В целом, профиль безопасности у пациентов с коинфекций гепатита В и/или С был таким же, как у пациентов без коинфекции гепатита В или С, несмотря на то что частота отклонений концентрации ACT и AЛT была выше в подгруппе пациентов с коинфекций гепатита В и/или С во всех группах лечения. Повышение активности печеночных ферментов, соответствующее синдрому восстановления иммунитета, наблюдалось у нескольких пациентов с коинфекцией гепатита В и/или С в начале терапии долутегравиром, особенно у тех, у кого было отменено лечение гепатита В (см. «Меры предосторожности»).
Пострегистрационные данные: отсутствуют.
RxList.com
Следующие серьезные побочные реакции обсуждаются в других разделах описания:
— реакции гиперчувствительности (см. «Меры предосторожности»);
— влияние на сывороточные биохимические показатели функции печени у пациентов с коинфекций гепатита В или С (см. «Меры предосторожности»);
— перераспределение жира (см. «Меры предосторожности»);
— синдром восстановления иммунитета (см. «Меры предосторожности»).
Опыт клинических иследований
Так как клинические исследования проведены с различным набором условий, частота встречаемости побочных реакций, наблюдавшихся в этих исследованиях, может не совпадать с полученной в других исследованиях и наблюдаемой в клинической практике.
Опыт клинических исследований у взрослых субъектов
Субъекты, ранее не получавшие лечение. Оценка безопасности применения долутегравира у ВИЧ-1-инфицированных пациентов, ранее не получавших лечение, основана на анализе данных двух международных многоцентровых двойных слепых исследований SPRING-2 (ING113086) и SINGLE (ING114467) и данных международного многоцентрового открытого исследования FLAMINGO (ING114915).
В исследовании SPRING-2 были рандомизированы 822 пациента, которые получали по крайней мере 1 дозу долутегравира 50 мг 1 раз в сутки или ралтегравира 400 мг 2 раза в сутки, в обоих случаях в комбинации с парой нуклеозидных ИОТ в фиксированной дозе (абакавира сульфат и ламивудин или эмтрицитабин/тенофовир). В популяцию оценки эффективности и безопасности включили 808 пациентов. В течение 96 нед доля побочных реакций, приведших к отмене лечения, составила 2% в обеих группах лечения.
В исследовании SINGLE были рандомизированы 833 пациента, которые получали по крайней мере 1 дозу долутегравира 50 мг 1 раз в сутки и фиксированную дозу абакавира сульфата и ламивудина 1 раз в сутки или фиксированную дозу комбинации эфавиренз/эмтрицитабин/тенофовир 1 раз в сутки (исследование было слепым в течение 96 нед и открытым с 96-й по 144-ю нед). В течение 144 нед доля побочных реакций, приведших к отмене лечения, составила 4% у пациентов, получавших долутегравир 50 мг 1 раз в сутки плюс комбинацию абакавира сульфат/ламивудин, и 14% у пациентов, получавших комбинацию эфавиренз/эмтрицитабин/тенофовир 1 раз в сутки.
Ниже перечислены побочные реакции умеренной и серьезной степени тяжести (степени тяжести 2–4), возникавшие в ходе лечения по крайней мере у 2% пациентов в любой из групп лечения в исследованиях SPRING-2 и SINGLE. Побочные реакции указаны в предпочтительных терминах системно-органной классификации. Данные приведены параллельно для простоты представления, прямое сравнение между исследованиями невозможно из-за различий в их дизайне. Частота побочных реакций приведена в процентах от числа участников в следующей последовательности: долутегравир 50 мг 1 раз в сутки + два нуклеозидных ИОТ (N=403), ралтегравир 400 мг 2 раза в сутки + два нуклеозидных ИОТ (N=405) (исследование SPRING-2), долутегравир 50 мг + абакавира сульфат и ламивудин 1 раз в сутки (N=414) и эфавиренз/эмтрицитабин/тенофовир 1 раз в сутки (N=419) (исследование SINGLE).
Нарушения психики: бессонница — <1%, <1%, 3% и 3%; депрессия — <1%, <1%, 1% и 2%; аномальные сновидения — <1%, <1%, <1% и 2%.
Со стороны нервной системы: головокружение — <1%, <1%, <1% и 5%; головная боль — <1%, <1%, 2% и 2%.
Со стороны ЖКТ: тошнота — 1%, 1%, <1%, 3%; диарея — <1%, <1%, <1% и 2%.
Со стороны кожи и подкожных тканей: сыпь (объединяет сыпь, генерализованную сыпь, макулярную сыпь, макулопапулезную сыпь, зудящую сыпь и токсидермию) — 0%, <1%, <1% и 6%.
Общие нарушения: повышенная утомляемость — <1%, <1%, 2% и 2%.
Со стороны уха и лабиринтные нарушения: вертиго — 0%, <1%, 0% и 2%.
В дополнение к этому бессонница 1-й степени тяжести отмечалась у 1% и <1% пациентов, получавших долутегравир и ралтегравир соответственно в исследовании SPRING-2, в то время как в исследовании SINGLE частота этого побочного действия составила 7 и 4% для групп, получавших долутегравир и эфавиренз/эмтрицитабин/тенофовир соответственно. Эти случаи не являлись ограничением для лечения.
В многоцентровом открытом исследовании (FLAMINGO) 243 пациента получали долутегравир 50 мг 1 раз в сутки в сравнении с 242 пациентами, которые получали дарунавир 800 мг/ритонавир 100 мг 1 раз в сутки, в обоих случаях в комбинации с выбранным исследователями режимом фоновой терапии нуклеозидными ИОТ (либо абакавира сульфат/ламивудин, либо эмтрицитабин/тенофовир). В популяцию оценки эффективности и безопасности включили 484 пациента. В течение 96 нед применения доля побочных реакций, приведших к отмене лечения, составила 3% у пациентов, получавших долутегравир, и 6% у пациентов, получавших дарунавир/ритонавир. Спектр побочных действий, наблюдавшихся в исследовании FLAMINGO в основном был схожим с отмеченным в исследованиях SPRING-2 и SINGLE.
Опыт применения у пациентов, ранее получавших лечение, но не получавших ингибитор переноса цепей интегразой. В международном многоцентровом двойном слепом исследовании (ING111762, SAILING) 719 ВИЧ-1-инфицированных взрослых пациентов с опытом антиретровирусной терапии были рандомизированы и получали либо долутегравир 50 мг 1 раз в сутки, либо ралтегравир 400 мг 2 раза в сутки совместно с выбранным исследователями режимом фоновой терапии, состоящей из 2 ЛС, включая по крайней мере один активный ингредиент. За 48 нед доля побочных реакций, приведших к отмене лечения составила 3% у пациентов, получавших долутегравир 50 мг 1 раз в сутки + фоновую терапию и 4% у пациентов, получавших ралтегравир 400 мг 2 раза в сутки + фоновую терапию. Единственным связанным с лечением побочным действием от умеренной до серьезной степени тяжести, встречавшимся с частотой по крайней мере 2% в каждой исследуемой группе, была диарея — 2% (6 из 354 пациентов) в группе получавших долутегравир 50 мг 1 раз в сутки + фоновую терапию, и 1% (5 из 361 пациентов) в группе получавших ралтегравир 400 мг 2 раза в сутки + фоновую терапию.
Опыт применения у пациентов, ранее получавших лечение и ингибитор переноса цепей интегразой. В международном многоцентровом открытом исследовании без контрольной группы (ING112574, VIKING-3) 183 ВИЧ-1-инфицированных взрослых пациента с опытом антиретровирусной терапии c вирусологической недостаточностью и текущими или в анамнезе случаями устойчивости к терапии ралтегравиром и/или элвитегравиром получали долутегравир 50 мг 2 раза в сутки совместно с неудавшейся фоновой терапией в течение 7 дней и совместно с оптимизированной фоновой терапией с 8-го дня. Доля побочных реакций, приведших к отмене лечения, составила 4% за 48 нед.
Спектр побочных реакций, связанных с лечением, в исследовании VIKING-3 был в целом схожим с наблюдавшимся при использовании долутегравира в дозе 50 мг 1 раз в сутки у взрослых в III фазе исследований.
Менее распространенные побочные реакции, наблюдавшиеся у пациентов, ранее не получавших и получавших антиретровирусную терапию. Следующие побочные реакции отмечались менее чем у 2% пациентов, ранее не получавших или получавших антиретровирусную терапию, при применении долутегравира в режиме комбинированной терапии в любом одном исследовании. Эти случаи были включены в рассмотрение вследствие их серьезности и оценки потенциальной связи с применением лекарств.
Со стороны ЖКТ: боль в животе, дискомфорт в животе, метеоризм, боль в верхней части живота, рвота.
Со стороны гепатобилиарной системы: гепатит.
Со стороны скелетно-мышечной системы: миозит.
Нарушения психики: суицидальные мысли, попытки, поведение или удавшаяся попытка. Эти случаи наблюдались главным образом у пациентов с предшествующей депрессией или другими психическими заболеваниями в анамнезе.
Со стороны почек и мочевых путей: нарушение функции почек.
Со стороны кожи и подкожных тканей: зуд.
Отклонения лабораторных показателей
Пациенты, ранее не получавшие лечение. Ниже приведены серьезные отклонения отдельных лабораторных показателей (степени тяжести 2–4) от исходного уровня, свидетельствующие о токсичности, которые наблюдались по крайней мере у 2% пациентов, а также средние изменения от исходного уровня, наблюдавшиеся для отдельных липидов. Данные приведены параллельно для простоты представления, прямое сравнение между исследованиями невозможно из-за различий в их дизайне. Данные приведены в предпочтительных терминах в процентах от числа участников в следующей последовательности: долутегравир 50 мг 1 раз в сутки + два нуклеозидных ИОТ (N=403), ралтегравир 400 мг 2 раза в сутки + два нуклеозидных ИОТ (N=405) (исследование SPRING-2, за 96 нед), долутегравир 50 мг + абакавира сульфат и ламивудин 1 раз в сутки (N=414) и эфавиренз/эмтрицитабин/тенофовир 1 раз в сутки (N=419) (исследование SINGLE, за 144 нед).
АЛТ: степень тяжести 2 (>2,5–5×ВГН) — 4%, 4%, 3% и 5%; степени тяжести 3–4 (>5×ВГН) — 2%, 2%, 1% и <1%.
АСТ: степень тяжести 2 (>2,5–5×ВГН) — 5%, 3%, 3% и 4%; степени тяжести 3–4 (>5×ВГН) — 3%, 2%, 1% и 3%.
Общий билирубин: степень тяжести 2 (1,6–2,5×ВГН) — 3%, 2%, <1% и <1%; степени тяжести 3–4 (>2,5×ВГН) — <1%, <1%, <1% и <1%.
КФК: степень тяжести 2 (6–9,9×ВГН) — 2%, 5%, 5% и 3%; степени тяжести 3–4 (≥10×ВГН) — 7%, 4%, 7% и 8%.
Гипергликемия: степень тяжести 2 (126–250 мг/дл) — 6%, 6%, 9% и 6%; степень тяжести 3 (>250 мг/дл) — <1%, 2%, 2% и <1%.
Липаза: степень тяжести 2 (>1,5–3×ВГН) — 7%, 7%, 11% и 11%; степени тяжести 3–4 (>3×ВГН) — 2%, 5%, 5% и 4%.
Всего нейтрофилов: степень тяжести 2 (0,75–0,99×109) — 4%, 3%, 4% и 5%; степени тяжести 3–4 (<0,75×109) — 2%, 2%, 3% и 3%.
Хс, мг/дл: 8,1; 10,1; 24 и 26,7.
Хс ЛПВП, мг/дл: 2; 2,3; 5,4 и 7,2.
Хс ЛПНП, мг/дл: 5,1; 6,1; 16 и 14,6.
Триглицеиды, мг/дл: 6,7; 6,6; 136 и 31,9.
При оценке изменений уровня липидов из анализа были исключены пациенты, получавшие в начале лечения липидопонижаюшие ЛС (по 19 человек в каждой группе исследования SPRING-2 и в исследовании SINGLE 30 человек, получавших долутегравир + абакавира сульфат/ламивудин, и 27 — получавших эфавиренз/эмтрицитабин/тенофовир). 94 пациента получали липидопонижающие ЛС уже после начала лечения, их последние результаты анализа натощак (до начала применения липидопонижающего ЛС) учитывались независимо от того, прекратили ли они прием этого ЛС (в исследовании SPRING N=9 в группе долутегравира и N=13 в группе ралтегравира, в исследовании SINGLE N=36 в группе долутегравир + абакавира сульфат/ламивудин и N=36 — в группе эфавиренз/эмтрицитабин/тенофовир).
Отклонения лабораторных показателей, наблюдавшиеся в исследовании FLAMINGO, в целом были схожими с полученными в исследованиях SPRING-2 и SINGLE.
Опыт применения у пациентов, ранее получавших лечение, но не получавших ингибитор переноса цепей интегразой. Отклонения лабораторных показателей, наблюдавшиеся в исследовании SAILING, были в целом схожими с наблюдавшимися в исследованиях с участием пациентов, ранее не получавших лечение (SPRING-2 и SINGLE).
Опыт применения у пациентов, ранее получавших лечение и получавших ингибитор переноса цепей интегразой. В исследовании VIKING-3 за 48 нед наиболее часто (в сумме с частотой >5% для степеней тяжести 2–4) отмечались отклонения таких лабораторных показателей, как АЛТ (9%), АСТ (8%), Хс (10%), КФК (6%), гипергликемия (14%) и липаза (10%). У 2% пациентов (4 из 183) наблюдались отклонения гематологических показателей, связанные с лечением, среди которых чаще всего отмечалась нейтропения (2%, 3 из 183 пациентов).
Коинфекция вируса гепатита В и/или С. В III фазе исследований допускалось участие пациентов с коинфекцией вирусом гепатита В и/или С при условии, что у них исходный уровень почечных тестов не превышал 5×ВГН. В целом профиль безопасности у таких пациентов был схожим с наблюдавшимся у пациентов без коинфекции вирусом гепатита В или С, хотя степень отклонения АСТ и АЛТ была выше в подгруппе с коинфекцией вирусом гепатита В и/или С во всех группах лечения. Отклонения от нормального уровня степени тяжести 2–4 у пациентов с коинфекцией гепатита В и/или С по сравнению с пациентами с моноинфекцией ВИЧ, получавшими долутегравир, наблюдались у 18 против 3% пациентов при дозе долутегравира 50 мг 1 раз в сутки и 13 против 8% — при дозе 50 мг 2 раза в сутки. У некоторых пациентов с гепатитом В и/или С в начале лечения долутегравиром наблюдалось увеличение показателей печеночных тестов, согласующееся с синдромом восстановления иммунитета, в частности в условиях, когда терапия против гепатита была отменена (см. «Меры предосторожности»).
Изменение уровня сывороточного креатинина. Показано, что долутегравир увеличивал уровень сывороточного креатинина вследствие ингибирования канальцевой секреции без влияния на гломерулярную функцию почек. Повышение уровня сывороточного креатинина возникало в первые 4 нед лечения и оставалось стабильным в течение 96 нед. У пациентов, ранее не получавших лечение, среднее изменение от исходного уровня в 0,15 мг/дл (диапазон от −0,32 до 0,65 мг/дл) наблюдалось после 96 нед лечения. Увеличение уровня креатинина было сопоставимо с наблюдавшимся при фоновой терапии нуклеозидными ИОТ и схожим с уровнем, отмеченным у пациентов, получавших лечение.
Опыт клинических исследований у детей
В продолжающемся многоцентровом открытом несравнительном исследовании IMPAACT P1093 участвовали 160 ВИЧ-1-инфицированных пациента в возрасте от 4 нед до менее 18 лет, из которых 46 пациентов в возрасте от 6 до менее 18 лет ранее получали антиретровирусное лечение, но не получали лечение ингибиторами переноса цепей интегразой.
Профиль побочных реакций у этих пациентов был схожим с наблюдавшимся у взрослых. Побочными реакциями степени тяжести 2, отмеченными более чем у одного пациента, были уменьшение числа нейтрофилов (N=3) и диарея (N=2). Не отмечались побочные реакции 3-й или 4-й степени тяжести, связанные с применением лечения. Не было побочных реакций, приведших к отмене лечения.
Отклонения лабораторных показателей степени тяжести 3 или 4, отмеченные более чем у одного пациента, включали повышение общего билирубина (N=3) и уменьшение числа нейтрофилов (N=2). Изменения уровня сывороточного креатинина были схожими с наблюдавшимися у взрослых пациентов.
Взаимодействие
Влияние долутегравира на фармакокинетику других ЛС
In vitro долутегравир демонстрировал отсутствие прямого ингибирования либо слабое ингибирование (IC50 >50 мкмоль) изоферментов системы цитохрома Р450 CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 и CYP3A, УДФ-ГТ1А1 или УДФ-ГТ2В7, либо переносчиков P-gp, BCRP, BSEP, ОАТР1В1, ОАТР1В3, ОСT1, MRP2 или MRP4. In vitro долутегравир не индуцировал изоферменты CYP1A2, CYP2B6 или CYP3A4. In vivo долутегравир не оказывал влияние на мидазолам, показатель активности CYP3A4. На основании этих данных не ожидается, что долутегравир может повлиять на фармакокинетику ЛС, которые являются субстратами данных ферментов или переносчиков (например ИОТ или ИП, абакавир, зидовудин, маравирок, опиоидные анальгетики, антидепрессанты, статины, азольные фунгициды, ингибиторы протонного насоса, ЛС для лечения эректильной дисфункции, ацикловир, валацикловир, ситаглиптин, адефовир).
В исследованиях взаимодействия с ЛС долутегравир не оказывал клинически значимый эффект на фармакокинетику тенофовира, ритонавира, метадона, эфавиренза, лопинавира, атазанавира, дарунавира, этравирина, фосампренавира, рилпивирина, боцепревира, телапревира, даклатасвира и пероральных контрацептивов, содержащих норгестимат и этинилэстрадиол.
In vitro долутегравир ингибировал почечный переносчик органических катионов 2 (ОСТ2) (IС50 1,93 мкмоля), выводящий переносчик различных лекарственных веществ и токсинов MATE1 (IC50 6,34 мкмоля) и МАТЕ2-К (IC50 24,8 мкмоля). С учетом экспозиции долутегравира in vivo маловероятно потенциальное влияние на транспорт субстратов MАТЕ2-К in vivo. In vivo долутегравир может повышать концентрации в плазме крови ЛС, выведение которых зависит от ОСТ2 или MATE1 (дофетилид, пилсикаинид или метформин).
In vitro долутегравир ингибировал базолатеральные переносчики в почках: переносчик органических анионов OAT1 (IC50 2,12 мкмоля) и ОАТ3 (IC50 1,97 мкмоля). Однако долутегравир не оказывал выраженное влияние на фармакокинетику in vivo субстратов OАТ тенофовира и парааминогиппурата и таким образом обладал слабой способностью вызывать взаимодействие ЛС за счет ингибирования переносчиков OАТ.
Влияние других ЛС на фармакокинетику долутегравира
Долутегравир выводится главным образом путем метаболизма с участием УДФ-ГТ1А1. Долутегравир также является субстратом УДФ-ГТ1А3, УДФ-ГТ1А9, CYP3A4, P-gp и BCRP, поэтому ЛС, которые индуцируют данные ферменты или переносчики, теоретически могут снижать концентрацию долутегравира в плазме крови и уменьшать его терапевтический эффект.
Одновременное применение долутегравира и других ЛС, которые ингибируют УДФ-ГТ1А1, УДФ-ГТА3, УДФ-ГТ1А9, CYP3A4 и/или P-gp, может повысить концентрацию долутегравира в плазме крови.
In vitro долутегравир не является субстратом человеческого транспортного полипептида органических анионов OATP1B1, ОАТР1В3 или ОСТ1, поэтому не ожидается, что ЛС, модулирующие исключительно активность этих переносчиков, будут влиять на концентрацию долутегравира в плазме крови.
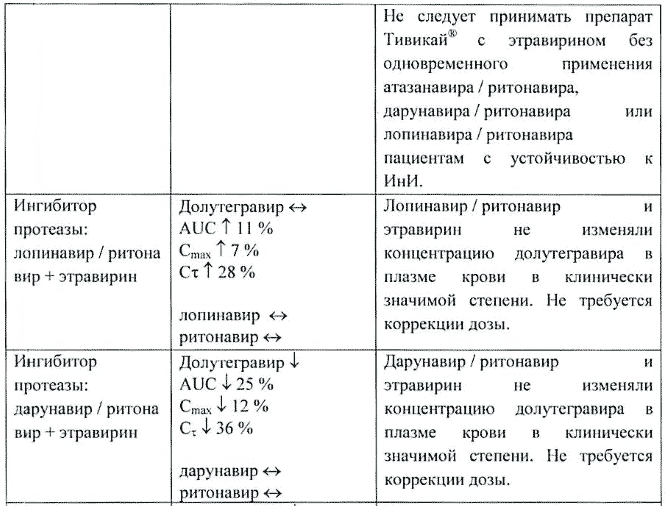
Эфавиренз, этравирин, невирапин, рифампицин, карбамазепин и типранавир в сочетании с ритонавиром значительно снижали концентрации долутегравира в плазме крови, и поэтому необходима коррекция дозы долутегравира до 50 мг 2 раза в сутки. Эффект этравирина ослаблялся одновременным применением ингибиторов CYP3A4 лопинавира/ритонавира, дарунавира/ритонавира, и ожидается, что он ослабляется атазанавиром/ритонавиром. Таким образом, при одновременном применении долутегравира с этравирином либо лопинавиром/ритонавиром, дарунавиром/ритонавиром, либо атазанавиром/ритонавиром коррекция дозы долутегравира не требуется.
Другой индуктор, фосампренавир, в сочетании с ритонавиром снижал концентрацию долутегравира в плазме крови, но коррекция дозы долутегравира не требуется. Исследование взаимодействия с ингибитором УДФ-ГТ1А1, атазанавиром, не показало клинически значимое повышение концентрации долутегравира в плазме крови. Тенофовир, лопинавир/ритонавир, дарунавир/ритонавир, рилпивирин, боцепревир, телапревир, преднизон, рифабутин, даклатасвир и омепразол не оказали никакого эффекта либо оказали минимальный эффект на фармакокинетику долутегравира, поэтому при одновременном применении с данными ЛС коррекция дозы долутегравира не требуется.
Ниже перечислены взаимодействия долутегравира с отдельными ЛС и приведены рекомендации по их совместному применению. Рекомендации основаны либо на исследованиях взаимодействия с другими ЛС, либо на прогнозируемых взаимодействиях ввиду ожидаемой амплитуды взаимодействий и вероятности развития серьезных нежелательных явлений либо утраты эффективности.
Противовирусные ЛС для лечения ВИЧ-1
Этравирин (ненуклеозидный ИОТ) без усиления ингибиторами протеазы. Долутегравир — снижение AUC на 71%, Cmax на 52% и Cτ на 88%. Этравирин — отсутствие значительных изменений.
Этравирин без усиления ингибиторами протеазы снижал концентрацию долутегравира в плазме крови. Рекомендуемая доза долутегравира составляла 50 мг 2 раза в сутки при совместном применении с этравирином без усиления ингибиторами протеазы. Не следует применять долутегравир с этравирином без одновременного применения атазанавира/ритонавира, дарунавира/ритонавира или лопинавира/ритонавира пациентам с устойчивостью к ингибиторам интегразы.
Лопинавир/ритонавир (ингибитор протеазы) + этравирин. Долутегравир — без значительных изменений (повышение AUC на 11%, Cmax на 7% и Cτ на 28%). Лопинавир и ритонавир — отсутствие значительных изменений.
Лопинавир/ритонавир и этравирин не изменяли концентрацию долутегравира в плазме крови в клинически значимой степени. Не требуется коррекция дозы.
Дарунавир/ритонавир (ингибитор протеазы) + этравирин. Долутегравир — снижение AUC на 25%, Cmax на 12% и Cτ на 36%. Дарунавир и ритонавир — отсутствие значительных изменений.
Дарунавир/ритонавир и этравирин не изменяли концентрацию долутегравира в плазме крови в клинически значимой степени. Не требуется коррекция дозы.
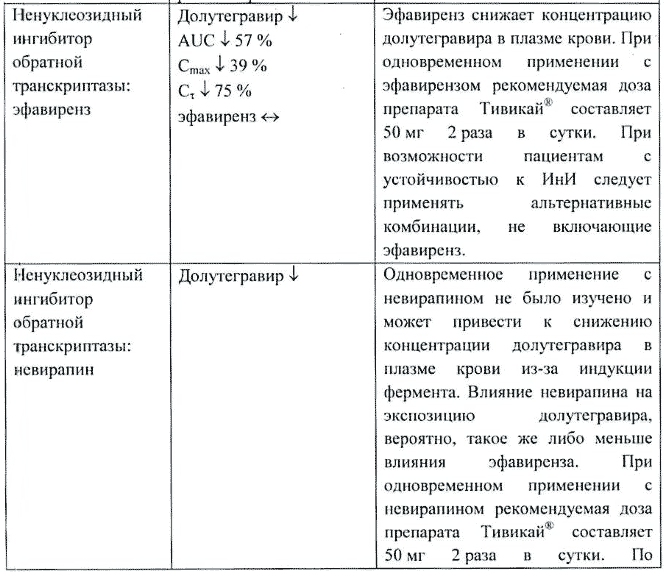
Эфавиренз (ненуклеозидный ИОТ). Долутегравир — снижение AUC на 57%, Cmax на 39% и Cτ на 75%. Эфавиренз — отсутствие значительных изменений.
Эфавиренз снижал концентрацию долутегравира в плазме крови. При одновременном применении с эфавирензом рекомендуемая доза долутегравира составляла 50 мг 2 раза в сутки. При возможности пациентам с устойчивостью к ингибиторам интегразы следует назначать альтернативные комбинации, не включающие эфавиренз.
Невирапин (ненуклеозидный ИОТ). Одновременное применение с невирапином не было изучено и может привести к снижению концентрации долутегравира в плазме крови из-за индукции фермента. Влияние невирапина на экспозицию долутегравира вероятно такое же либо меньше влияния эфавиренза. При одновременном применении с невирапином рекомендуемая доза долутегравира составляет 50 мг 2 раза в сутки. По возможности следует применять альтернативные комбинации, не включающие невирапин, у пациентов с устойчивостью к ингибиторам интегразы.
Атазанавир (ИП). Долутегравир — повышение AUC на 91%, Cmax на 50% и Cτ на 180%. Атазанавир — отсутствие значительных изменений.
Атазанавир повышал концентрацию долутегравира в плазме крови. Не требуется коррекция дозы.
Атазанавир/ритонавир (ИП). Долутегравир — повышение AUC на 62%, Cmax на 34% и Cτ на 121%. Атазанавир и ритонавир — отсутствие значительных изменений.
Атазанавир/ритонавир повышал концентрацию долутегравира в плазме крови. Не требуется коррекция дозы.
Рилпивирин. Долутегравир — отсутствие значительных изменений (повышение AUC на 12%, Cmax на 13% и Cτ на 22%). Рилпивирин — отсутствие значительных изменений.
Не требуется коррекция дозы.
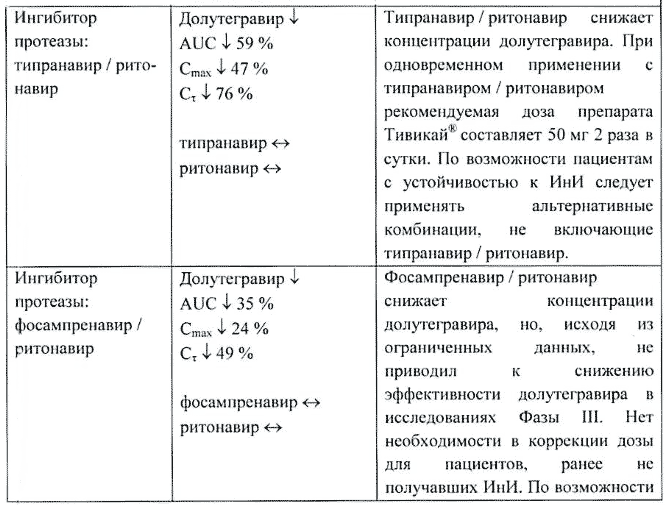
Типранавир/ритонавир (ИП). Долутегравир — снижение AUC на 59%, Cmax на 47% и Cτ на 76%.
Типранавир/ритонавир снижал концентрации долутегравира. При одновременном применении с типранавиром/ритонавиром рекомендуемая доза долутегравира составляет 50 мг 2 раза в сутки. По возможности пациентам с устойчивостью к ингибиторам интегразы следует применять альтернативные комбинации, не включающие типранавир/ритонавир.
Фосампренавир/ритонавир (ИП). Долутегравир — снижение AUC на 35%, Cmax на 24% и Cτ на 49%.
Фосампренавир/ритонавир снижал конценрации долутегравира, но исходя из ограниченных данных не приводил к снижению эффективности долутегравира в исследованиях фазы III. Нет необходимости в коррекции дозы для пациентов, ранее не получавших ингибиторы интегразы. По возможности следует применять альтернативные комбинации, не включающие фосампренавир/ритонавир, пациентам с устойчивостью к ингибиторам интегразы.
Нелфинавир (ИП). Долутегравир — отсутствие значительных изменений.
Данное взаимодействие не исследовалось. Несмотря на то что он является ингибитором CYP3A4, исходя из данных, полученных для других ингибиторов, повышения не ожидается. Не требуется коррекция дозы.
Лопинавир/ритонавир (ИП). Долутегравир — отсутствие значительных изменений (снижение AUC на 4%, Cmax — отсутствие значительных изменений, снижение Cτ на 6%). Лопинавир и ритонавир — отсутствие значительных изменений.
Лопинавир/ритонавир не изменяли концентрацию долутегравира в плазме крови в клинически значимой степени. Не требуется коррекция дозы.
Дарунавир/ритонавир (ИП). Долутегравир — снижение AUC на 22%, Cmax на 11% и Cτ на 38%.
Дарунавир/ритонавир не изменяли концентрацию долутегравира в плазме крови в клинически значимой степени. Не требуется коррекция дозы.
Тенофовир (нуклеозидный ИОТ). Долутегравир — отсутствие значительных изменений (AUC — отсутствие значительных изменений, снижение Cmax на 3% и Cτ на 8%. Тенофовир — отсутствие значительных изменений (повышение AUC на 12%, Cmax на 9% и Cτ на 19%).
Тенофовир не изменял концентрацию долутегравира в плазме крови в клинически значимой степени. Не требуется коррекция дозы.
Другие ЛС
Дофетилид, пилсикаинид. Повышение фармакокинетических показателей дофетилида и пилсикаинида.
Одновременное применение с долутегравиром может повысить концентрацию дофетилида или пилсикаинида в плазме крови путем ингибирования переносчика OCT2; одновременное применение не исследовалось. Одновременное применение дофетилида или пилсикаинида с долутегравиром противопоказано из-за возможной жизнеугрожающей токсичности, вызываемой высокой концентрацией дофетилида или пилсикаинида.
Карбамазепин. Долутегравир — снижение AUC на 49%, Cmax на 33% и Cτ на 73%.
Карбамазепин снижал концентрацию долутегравира в плазме крови. Рекомендуемая доза долутегравира составляла 50 мг 2 раза в сутки при совместном применении с карбамазепином. По возможности у пациентов с устойчивостью к ингибиторам интегразы следует применять альтернативные ЛС вместо карбамазепина.
Фенитоин, фенобарбитал, препараты зверобоя продырявленного. Снижение фармакокинетических показателей долутегравира.
Одновременное применение с данными индукторами метаболизма не было изучено, и возможно снижение концентрации долутегравира в плазме крови вследствие индукции ферментов. Влияние этих индукторов метаболизма на экспозицию долутегравира, по-видимому, сходно с влиянием карбамазепина. Рекомендуемая доза долутегравира составляла 50 мг 2 раза в сутки при применении с данными индукторами метаболизма. По возможности у пациентов с устойчивостью к ингибиторам интегразы следует применять альтернативные комбинации, не включающие эти индукторы метаболизма.
Окскарбазепин. Снижение фармакокинетических показателей долутегравира.
Это взаимодействие не было изучено. Несмотря на то что окскарбазепин является индуктором CYP3A4, на основании данных, полученных для других индукторов, не ожидается клинически значимого снижения концентрации долутегравира. Не требуется корректировка дозы.
Кетоконазол, флуконазол, итраконазол, позаконазол, вориконазол (азольные противогрибковые ЛС). Долутегравир — отсутствие значительных изменений (не изучено).
Не требуется коррекция дозы. На основании данных, полученных при применении других ингибиторов CYP3A4, выраженное повышение концентрации не ожидается.
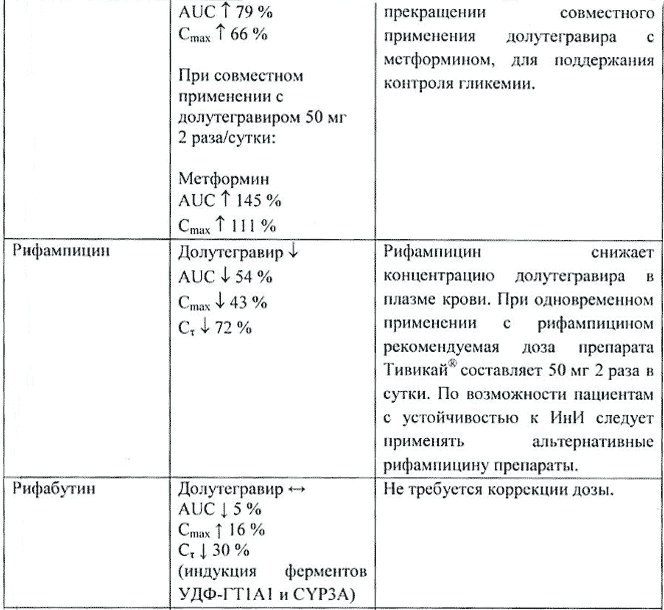
Антациды, содержащие поливалентные катионы (например Mg, Al). Долутегравир — снижение AUC на 74%, Cmax на 72% и C24 на 74%.
Одновременное применение антацидов, содержащих поливалентные катионы, может снизить концентрацию долутегравира в плазме крови. Рекомендуется применять долутегравир за 2 ч до или через 6 ч после применения антацидных ЛС, содержащих поливалентные катионы.
Препараты кальция. Долутегравир — снижение AUC на 39%, Cmax на 37% и C24 на 39%.
Долутегравир рекомендуется принимать за 2 ч до или через 6 ч после приема препаратов, содержащих кальций. При приеме с пищей долутегравир можно применять одновременно с препаратами кальция.
Препараты железа. Долутегравир — снижение AUC на 54%, Cmax на 57% и C24 на 56%.
Долутегравир рекомендуется принимать за 2 ч до или через 6 ч после приема препаратов, содержащих железо. При приеме с пищей долутегравир можно применять одновременно с препаратами железа.
Поливитаминные ЛС. Долутегравир — снижение AUC на 33%, Cmax на 35% и C24 на 56% (комплексное связывание с поливалентными ионами).
Долутегравир рекомендуется принимать за 2 ч до или через 6 ч после приема поливитаминных ЛС.
Преднизон (кортикостероид). Долутегравир — отсутствие значительных изменений (повышение AUC на 11%, Cmax на 6% и Cτ на 17%).
Не требуется коррекция дозы.
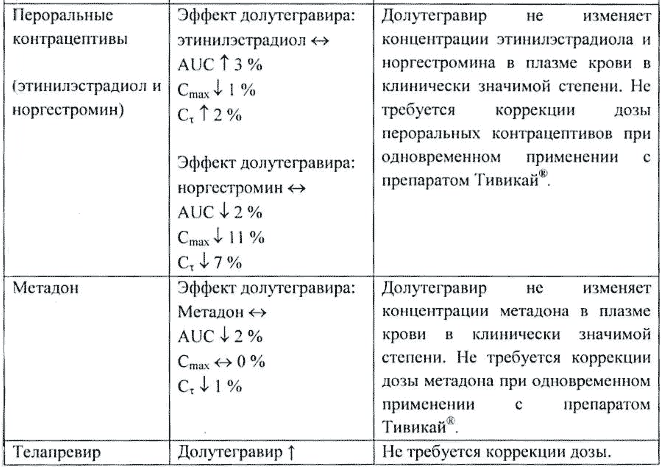
Метформин. Повышение фармакокинетических показателей метформина при совместном применении с долутегравиром 50 мг 1 раз в сутки (AUC на 79%, Cmax на 66%) и 50 мг 2 раза в сутки (AUC на 145%, Cmax на 111%).
Одновременное применение долутегравира может повысить концентрацию метформина в плазме крови. Необходимо рассмотреть возможность коррекции дозы метформина в начале и при прекращении совместного применения долутегравира с метформином для поддержания контроля гликемии.
Рифампицин. Долутегравир — снижение AUC на 54%, Cmax на 43% и Cτ на 72%.
Рифампицин снижал концентрацию долутегравира в плазме крови. При одновременном применении с рифампицином рекомендуемая доза долутегравира составляла 50 мг 2 раза в сутки. По возможности пациентам с устойчивостью к ингибиторам интегразы следует применять альтернативные рифампицину ЛС.
Рифабутин. Долутегравир — отсутствие значительных изменений (снижение AUC на 5%, повышение Cmax на 15%, снижение Cτ на 30%; индукция ферментов УДФ-ГТ1A1 и CYP3A).
Не требуется коррекция дозы.
Этинилэстрадиол + норгестромин (пероральные контрацептивы). Этинилэстрадиол — отсутствие значительных изменений (повышение AUC на 3%, снижение Cmax на 1%, повышение Cτ на 2%). Норгестромин — отсутствие значительных изменений (снижение AUC на 2%, Cmax на 11% и Cτ на 7%).
Долутегравир не изменял концентрацию этинилэстрадиола и норгестромина в плазме крови в клинически значимой степени. Не требуется коррекция дозы пероральных контрацептивов при одновременном применении с долутегравиром.
Метадон. Метадон — отсутствие значительных изменений (снижение AUC на 2%, Cmax без изменений, снижение Cτ на 1%).
Долутегравир не изменял концентрацию метадона в плазме крови в клинически значимой степени. Не требуется коррекция дозы метадона при одновременном применении с долутегравиром.
Телапревир. Долутегравир — повышение AUC на 25%, Cmax на 19% и Cτ на 37%. Телапревир — отсутствие значительных изменений (исторический контроль; ингибирование фермента CYP3A).
Не требуется коррекция дозы.
Боцепревир. Долутегравир — отсутствие значительных изменений (повышение AUC на 7%, Cmax на 5% и Cτ на 8%).
Не требуется коррекция дозы.
Даклатасвир. Долутегравир — отсутствие значительных изменений (повышение AUC на 33%, Cmax на 29% и Cτ на 45%). Даклатасвир — отсутствие значительных изменений.
Даклатасвир не изменял концентрацию долутегравира в плазме крови в клинически значимой степени. Долутегравир не изменял концентрацию даклатасвира в плазме крови. Не требуется коррекция дозы.
Передозировка
Симпомы: данные о передозировке долутегравира ограничены.
Ограниченный опыт применения более высоких разовых доз (до 250 мг у здоровых добровольцев) не выявил никаких особых симптомов или признаков, кроме описанных в разделе «Побочные действия».
Лечение: должно проводиться в соответствии с клиническими показаниями либо рекомендациями национального токсикологического центра. Отсутствует специфическое лечение передозировки долутегравира. В случае передозировки необходимо проводить поддерживающую терапию и соответствующее наблюдение. По причине высокого связывания долутегравира с белками плазмы крови, маловероятно, что его значительное количество может быть выведено при помощи диализа.
Способ применения и дозы
Внутрь, независимо от приема пищи. Рекомендованная доза составляет 50 мг 1 или 2 раза в сутки в зависимости от схемы терапии.
Меры предосторожности
Реакции гиперчувствительности
При применении ингибиторов интегразы, в т.ч. долутегравира, регистрировались реакции гиперчувствительности, которые характеризовались сыпью, нарушением системных показателей и иногда нарушением функции органов, в т.ч. поражением печени.
При возникновении признаков или симптомов гиперчувствительности (включая, но не ограничиваясь, сыпь тяжелой степени или сыпь, сопровождающуюся повышением температуры тела, общее недомогание, повышенную утомляемость, боль в мышцах или суставах, буллезные поражения, поражения слизистой оболочки полости рта, конъюнктивит, отек лица, гепатит, эозинофилию, ангионевротический отек) необходимо немедленно отменить применение долутегравира и других ЛС, которые могли бы вызвать подобные реакции. Необходимо контролировать клиническое состояние, в т.ч. показатели печеночных аминотрансфераз, и провести соответствующую терапию.
Задержка прекращения лечения долутегравиром либо другими ЛС, которые могли бы вызвать подобные реакции, после развития реакций гиперчувствительности может привести к жизнеугрожающим реакциям.
Синдром восстановления иммунитета
У ВИЧ-инфицированных пациентов с тяжелым иммунодефицитом во время начала антиретровирусной терапии может возникнуть воспалительная реакция на бессимптомные или остаточные оппортунистические инфекции, которая может вызвать серьезные клинические состояния либо усугубление симптомов. Как правило, такие реакции наблюдались в течение первых нескольких недель или месяцев после начала антиретровирусной терапии. Типичными примерами таких состояний являются цитомегаловирусный ретинит, генерализованные и/или очаговые микобактериальные инфекции и пневмония, вызванная Pneumocystis jiroveci (P.carinii).
Небходимо без промедления оценивать любые воспалительные симптомы и при необходимости начинать лечение. Аутоиммунные заболевания (такие как болезнь Грейвса, полимиозит и синдром Гийена-Барре) наблюдались на фоне восстановления иммунитета, однако время первичных проявлений варьировало, и заболевание могло возникать через много месяцев после начала терапии и иметь атипичное течение.
В начале терапии долутегравиром у некоторых пациентов с коинфекцией гепатита В и/или С наблюдалось повышение активности ферментов печени, отражающее синдром восстановления иммунитета.
Рекомендуется контролировать активность ферментов печени у пациентов с коинфекцией гепатита В и/или С. Необходим особенный контроль за началом или продолжением терапии гепатита В (согласно действующим руководствам) у пациентов, которым назначается лечение долутегравиром (см. «Побочные действия»).
Оппортунистические инфекции
У пациентов, получающих долутегравир или другую антиретровирусную терапию, могут развиться оппортунистические инфекции либо другие осложнения ВИЧ-инфекции. Поэтому пациенты должны быть под тщательным клиническим наблюдением врача с опытом лечения заболеваний, связанных с ВИЧ.
Передача инфекции
Пациентов необходимо уведомить о том, что не доказано предотвращение риска передачи ВИЧ другим лицам половым путем или через кровь при получении доступной в настоящее время антиретровирусной терапии, в т.ч. долутегравира. Необходимо продолжать предпринимать необходимые меры предосторожности.
Взаимодействие с другими ЛС
Необходимо соблюдать осторожность при одновременном применении с ЛС (рецептурными и безрецептурными), которые могут изменить экспозицию долутегравира, либо ЛС, экспозиция которых может измениться под действием долутегравира (см. «Взаимодействие»).
Рекомендованная доза долутегравира составляет 50 мг 2 раза в сутки при одновременном применении с этравирином (без усиления ингибиторами протеазы), эфавирензом, невирапином, типранавиром/ритонавиром, рифампицином, карбамазепином, фенитоином, фенобарбиталом и зверобоем продырявленным (см. «Взаимодействие»).
Долутегравир не следует назначать вместе с антацидами, содержащими поливалентные катионы. Рекомендуется применять долутегравир за 2 ч до или через 6 ч после применения данных ЛС (см. «Взаимодействие»).
Долутегравир рекомендуется принимать за 2 ч до или через 6 ч после приема кальцийсодержащих или железосодержащих добавок к пище или (в качестве альтернативного варианта) принимать с пищей (см. «Взаимодействие»).
Долутегравир повышает концентрацию метформина. Необходимо рассмотреть возможность коррекции дозы метформина в начале и при прекращении совместного применения долутегравира с метформином для поддержания контроля гликемии (cм. «Взаимодействие»).
Резистентность к ингибиторам интегразы, имеющая особое значение
При принятии решения о применении долутегравира при наличии резистентности к ингибиторам интегразы следует учитывать, что при этом значительно уменьшается активность долутегравира в отношении вирусных штаммов, несущих вторичные мутации Q148 + >2 в участках G140A/C/S, Е138А/К/Т, L741. Степень, в которой долутегравир обеспечивает дополнительную эффективность при наличии такой резистентности к ингибиторам интегразы, остается неясной.
Остеонекроз
Несмотря на то что этиология данного заболевания является многофакторной (включая применение кортикостероидов, бифосфонатов, употребление алкоголя, тяжелую иммуносупрессию, высокий ИМТ), случаи остеонекроза чаще всего встречались у пациентов на поздней стадии ВИЧ-инфекции и/или длительно получавших комбинированную антиретровирусную терапию. Пациентам следует обратиться к врачу, если они испытывают боли и скованность в суставах или трудности при движении.
Влияние на способность управлять транспортными средствами и работать с механизмами. Не проводились исследования влияния долутегравира на способность к управлению транспортными средствами и работе с механизмами. Необходимо учитывать клиническое состояние пациента и профиль нежелательных явлений долутегравира при рассмотрении способности пациента к вождению либо управлению механизмами.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Тивикай — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП 002536 — 210617
Торговое название:
Тивикай® / Tivicay®
Международное непатентованное наименование:
долутегравир / dolutegravir.
Лекарственная форма:
таблетки, покрытые пленочной оболочкой.
CОСТАВ
Каждая таблетка содержит:
|
Компонент |
Количество (мг) |
|
Ядро таблетки |
|
|
Действующее вещество |
|
|
Долутегравир натрия (в пересчете на долутегравир) |
52,6 (50,0) |
|
Вспомогательные вещества |
|
|
Маннитол |
145,4 |
|
Целлюлоза микрокристаллическая |
60,0 |
|
Повидон-К29/32 |
15,0 |
|
Карбоксиметил крахмал натрия |
21,0 |
|
Натрия стеарилфумарат |
6,0 |
|
Масса ядра таблетки |
300,0 |
|
Пленочная оболочка |
|
|
Опадрай II желтый |
9,0 |
|
Номинальная масса таблетки |
309,0 |
|
Состав Опадрая II желтого |
|
|
Наименование компонентов |
Количество (% вес / вес) |
|
Поливиниловый спирт гидролизованный |
40.00 |
|
Титана диоксид |
23.45 |
|
Макрогол / полиэтиленгликоль |
20.20 |
|
Тальк |
14.80 |
|
Краситель железа оксид желтый |
1.55 |
ОПИСАНИЕ
Круглые двояковыпуклые таблетки желтого цвета с выгравированной надписью «SV 572» с одной стороны и «50» — с другой стороны.
ФАРМАКОТЕРАПЕВТИЧЕСКАЯ ГРУППА
Противовирусное (ВИЧ) средство.
КодАТХ: J05AX12.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодннамика
Механизм действия
Долутегравир ингибирует интегразу ВИЧ, связываясь с активным участком интегразы и блокируя этап переноса цепей во время интеграции ретровирусной дезоксирибонуклеиновой кислоты (ДНК), который необходим для цикла репликации ВИЧ. При проведении биохимического анализа переноса цепи с использованием очищенной интегразы ВИЧ-1 и предварительно обработанного субстрата ДНК были получены значения IC50 (концентрация, ингибирующая репликацию на 50%), составляющие 2,7 нМ и 12.6 нМ. In vitro долутегравир медленно диссоциирует от активного центра комплекса ДНК-интегразы дикого типа (t1/2 71 час).
Фармакодинамичечкие эффекты
В рандомизированном исследовании с целью определения оптимальной дозы у инфицированных ВИЧ-1 пациентов, которые получали монотерапию долутегравиром (ING111521), отмечалось быстрое и дозозависимое противовирусное действие, со средним снижением РНК ВИЧ-1 на 11 день по сравнению с исходным уровнем, составляющим 1,5, 2,0 и 2.5 log10 для 2мг, 10мг и 50мг долутегравира при приеме 1 раз в сутки, соответственно. Данный противовирусный ответ поддерживался в течение 3-4дней с момента приема последней дозы в группе пациентов, принимавших 50 мг долутегравира.
Противовирусная активность в клеточной культуре
В мононуклеарных клетках периферической крови (МКПК), инфицированных штаммом Bal ВИЧ-1 либо штаммом NL432 ВИЧ-1, для долутегравира были получены IC50 0,51 нМ 0.53 нМ. соответственно. В клетках МТ-4, инфицированных штаммом 1MB ВИЧ-1 и инкубированных с долутегравиром в течение 4 или 5 дней, были получены IC50 0,71 и 2.1 нМ.
В анализе чувствительности вирусной интегразы с использованием участка кодирования интегразы из 13 клинически различающихся изолятов субтипа В долутегравир продемонстрировал противовирусную активность, сходную с активностью в отношении лабораторных штаммов, со средней IC50 0,52 нМ. В анализе МКПК панели, состоящей из 24 клинических изолятов ВИЧ-1 [группа М (субтипы А, В. С, D, Е, F и G) и группа О], а также 3 клинических изолятов ВИЧ-2 среднее геометрическое IC50 составило 0.20 нМ, а значения IC50 варьировались от 0,02 до 2,14 нМ для ВИЧ-1, в то время как для изолятов ВИЧ-2 среднее геометрическое IC50 составило 0.18 нМ. а значения IC50 варьировались от 0,09 до 0,61 нМ.
Противовирусная активность в сочетании с другими противовирусными препаратами
Hи один из лекарственных препаратов с типичной противовирусной акгнвностью в отношении ВИЧ не проявлял антагонизма к долутегравиру [in vitroоценки проводились в сочетании со ставудином, абакавиром, эфавирензом, невирапином, лопинавиром, ампренавиром, энфувиртидом, маравироком, адефовиром и ралтегравиром, выбранных в шахматном порядке). Кроме того, противовирусные препараты без типичной активности в отношении ВИЧ (рибавирин) не оказывали видимого эффекта на активность долутегравира
Влиянue сыворотки крови и белков сыворотки крови человека
Исследования in vitroподтвердили 75-кратное изменение (КИ) IC50 долутегравира в присутствии 100% сыворотки крови человека (методом экстраполяции), a IC90, скорректированная с учетом связывания белками (PA-IC90), в МКПК составила 64 нг/мл.
Минимальная концентрация долутегравира после применения разовой дозы 50 мг у пациентов, ранее не принимавших ингибиторы имтегразы (ИнИ), составила 1,20 мкг/мл, в 9 раз превышая установленную PA-IC90.
Устойчивость in vitro
Изоляты дикого типа ВИЧ-1: в течение 112-дневного пассажа штамма IIIB не выявлялись вирусы с высокой устойчивостью к долутегравиру. максимальное 4.1-кратное изменение наблюдалось у полученных при пассажах групп устойчивых вирусов с заменами SI53Y и S153F в консервативных позициях гена интегразы. Пассаж штамма HL432 дикого типа ВИЧ-1 в присутствии долутегравира приводил к селекции замены 92Q (пересеваемая группа вируса с КИ = 3,1) и G193B (пересеваемая группа вируса с КИ 3.2) на 56 день. Дополнительный пассаж субтипов В. С и A/G дикого типа вируса в Присутствии долутегравира приводил к селекции R263K. Gl 18R и S153T.
Противовирусная активность в отношении устойчивых штаммов: штаммы, устойчивые к ингибиторам обратной транскриптазы (ИОТ) и ингибиторам протеазы (ИИ): Аолутегравир продемонстрировал одинаковую активность против 2 ненуклеозидных (НН)-ИОТ-устойчивых, 3 нуклеозидных (Н)-ИОТ-устойчивых и 2 ИП-устойчивых мутантных клонов ВИЧ-1 (1 с тройной и 1 с шестикратной резистентностью) по сравнению с диким штаммом.
Штаммы ВИЧ-1, устойчивые к ИнИ: 60 мутантпых изолятов ВИЧ-1, устойчивых к ИнИ (28 с одной заменой и 32 с 2 или более заменами), были получены из вируса дикого типа ВL432 путем сайт-направленного мутагенеза. Долутегравир продемонстрировал противовирусную активность (чувствительность) против ВИЧ с КИ < 5 в отношении 27 из 8 мутантпых вирусов, устойчивых к ИнИ с одной заменой, в том числе T66A/I/K. E92Q/V, 43C/M/R. Q148H/K/R и N15511, в то время как для ралтегравира и элвитегравира сгивность проявилась в отношении 17/28 и 11/21 тестируемых мутантпых вирусов с КИ < 5. соответственно. Кроме того, из 32 мутантных вирусов, устойчивых к ИнИ с 2 или олее заменами, 23 из 32 продемонстрировали КИ < 5 для долутегравира по сравнению с И < 5 для 4 из 32 для ралтегравира и КИ < 5 для 2 из 25 тестируемых вирусов для титегравира.
Штаммы ВИЧ-2, устойчивые к ИнИ: вирусы были получены путем сайт-направленного мутагенеза изолятов ВИЧ-2, выделенных у инфицированных ВИЧ-2 пациентов, которые получали ралтегравир и у которых отмечалась вирусологическая неэффективность лечения. В целом, КИ у ВИЧ-2 были схожи с КИ ВИЧ-1, которые наблюдались при аналогичном наборе мутаций. КИ долутегравира составило < 5 против 4 вирусов ВИЧ-2 (S163D, G140A/Q148R, A153G/N155H/S163G и I292Q/T97A/N155H/S163D); для Е92Q/N155II КИ долутегравира составило 8,5, а для G140S/QI48R КИ долутегравира составило 17. Долутегравир, ралтегравир и элвитегравир проявили одинаковую активность против ВИЧ-2 с сайт-направленной мутацией с SI63D, как и в отношении дикого типа, а для остальных мутантных вирусов ВИЧ-2 диапазоны КИ ралтегравира составили 6,4-420, а диапазоны КИ элвитегравира составили 22-640.
Клинические изоляты у пациентов с вирусологической неэффективностью лечения ралтегравиром: 30 клинических изолятов с генотипической и фенотипической устойчивостыо к ралтегравиру (медиана КИ >81) исследовали на чувствительность к олутегравиру (медиана КИ 1.5) путем анализа с помощью Monogram Biosciences PlienoSense. Медиана КИ долутегравира для изолятов с заменами в позициях 140S-I-Q148II составила 3.75: G140S + Q148R — 13.3: Т97А + Y143R — 1,05 и 15511 — 1,37. 705 устойчивых к ралтегравиру изолятов, полученных у пациентов, получавших ралтегравир, были проанализированы на чувствительность к долутегравиру путем анализа помощью Monogram Biosciences PhenoSense. Долутегравир проявил КИ<10 в отношении 93.9% из 705 клинических изолятов, при этом у 16 (9%) из 184 изолятов с заменой QI48 + 1 с резистентностью к ИнИ и 25 (27%) из 92 клинических изолятов с заменой Q148 + > 2 с резистентностью к ИнИ наблюдалось более чем 10-кратное изменение.
Устойчивость in vivo: пациенты, не принимавшие ИнИ
Не отмечалось мутаций резистентности к ИнИ или связанной с лечением устойчивости к нуклеозидным ингибиторам обратной транскриптазы (НИОТ) основы терапии у ранее не получавших лечение пациентов, которые принимали 50 мг долутегравира 1 раз в сутки ( исследования SPRING-1, SPRING-2, SINGLE и FLAMINGO). В исследовании SAILINGy пациентов, получавших долутегравир и ранее не получавших ИнИ (n = 354 в группе дэлутегравира), связанные с лечением замены в интегразе наблюдались на 48 неделе у 4 из 17 пациентов с вирусологической неэффективностью, получающих долутегравир. У 2 из 4 пациентов наблюдалась уникальная замена R263K в гене интегразы с максимальным К И 1,93, у 1 пациента наблюдалась полиморфная замена V151V/I интегразы с максимальной FC 0.92, и у 1 пациента были уже изначально мутации интегразы и, как предполагается, он ранее получал ИнИ или был инфицирован устойчивым к ИнИ вирусом.
Устойчивостьin vivo: пациенты с устойчивостью к ИнИ
В исследовании VIKING-3 изучали долутегравир (плюс оптимизированная базовая терапия) у пациентов с имеющейся устойчивостью к ИнИ. До 24 педели у 36 из 183 пациентов отмечалась установленная протоколом вирусологическая неэффективность (РDVF). Из них, у 32 пациентов для анализа имелись парные данные по исходной и PDVF-устойчивости. и у 17/32 (53%) отмечались мутации, связанные с лечением, наблюдались следующие связанные с лечением мутации или сочетания мутаций: L74L/M (n =1), E92Q (n = 2), Т97А (n = 9), Е138К/А/Т (n = 8), G140S (n = 2), Y143H (n = 1). S147G (n=l), Q148H/K/R (n = 4). N155II (n=1) и E157E/Q (n=1). У 14 из 17 пациентов с мутациями вируса, связанными с лечением, исходно или в анамнезе имелась мутация С 148. У 5 других пациентов в период между педелями 24 и 48 была отмечена PDVF и у 2 из этих 5 пациентов имелись возникшие во время лечения мутации. Отмеченными мутациями, возникшими во время лечения, или сочетаниями мутаций были L74I (n = 1), М55Н(n = 2).
В исследовании VIKING-4 изучали долутегравир (плюс оптимизированная базовая терапия) у 30 пациентов с первичной генотипической устойчивостью к ИнИ, выявленной при скрининге. Возникшие во время лечения мутации соответствовали мутациям наблюдавшимся в исследовании VIKING-3.
Влияние на показатели электрокардиограммы (ЭКГ)
В рандомизированном перекрестном плацебо-контролируемом клиническом исследовании 42 здоровых добровольца получили разовую дозу плацебо, суспензии долутегравира 250 мг (воздействие приблизительно в 3 раза превышает воздействие дозы 50 мг 1 раз в сутки в равновесном состоянии) и моксифлоксацина (400 мг, активный контроль) в случайном порядке. Долутегравир не вызывал удлинения корригированного интервала (QTc) в течение 24 часов после приема препарата. После коррекции по исходным показателям ЭКГ и приему плацебо, максимальное среднее изменение QTc основанное на коррекции по формуле Фредерика (QTcF), составило 1,99 мсск (верхняя граница 1-стороннего 95 % доверительного интервала — 4.53 мсек).
Влияние на функцию почек
Влияние долутегравира на клиренс креатинина сыворотки крови (КК), скорость кгубочковой фильтрации (СКФ) в пробе с йогсксолом и эффективный почечный плазмоток (ЭПП) в пробе с парааминогипиуратом оценивались в открытом рандомизированном плацебо-контролируемом исследовании в 3 группах с участием 37 здоровых добровольцев, которые принимали 50 мг долутегравира I раз в сутки (n = 12), 50 мг — 2 раза в сутки (n = 13) или плацебо 1 раз в сутки (n=12) в течение 14 дней. Отмечалось умеренное снижение КК при применении долутегравира в течение первой недели лечения, соответствующее снижению, которое наблюдалось в клинических исследованиях. При приеме в обеих дозах долутегравир не оказал значительного влияния на СКФ либо ЭПП эти данные подтверждают исследования in vitro, которые позволяют предположить, что небольшие повышения уровня креатинина, наблюдаемые в клинических исследованиях, вызваны непатологическим ингибированием переносчика органических катионов (ОСТ2) в проксимальных почечных канальцах, что обуславливает канальцевую секрецию креатинина.
Фармакокинетика
Фармакокинетика долутегравира у здоровых добровольцев и ВИЧ-инфицированных пациентов одинакова. Вариабельность фармакокинетики долутегравира была от низкой до умеренной. В исследованиях Фазы 1 с участием здоровых добровольцев коэффициент вариации (KB) среди участников для площади под фармакокинетической кривой «концентрация-время» (AUC) и для максимальной концентрации (С mах) варьировал от 20 до 40%, а концентрация в конце интервала дозирования (Сmax) — от 30 до 65%. Индивидуальная вариабельность фармакокинетики долутегравира между участниками была выше у ВИЧ-инфицированных пациентов, чем у здоровых добровольцев. Индивидуальная вариабельность показателей фармакокинетики была ниже вариабельности между индивидуумами.
Всасывание
Долутегравир быстро всасывается после приема внутрь, медиана времени до достижения максимальной концентрации (Тmах) после приема дозы в форме таблеток составляет 2-3 чaca. Линейность фармакокинетики долутегравира зависит от дозы и лекарственной фЬрмы. После приема внутрь долугегравир в форме таблеток в целом проявлял нелинейную фармакокинстику, с менее чем дозозависимым повышением плазменной экспозиции с 2 до 100 мг, однако повышение экспозиции долутегравира пропорционально дозе с 25 мг до 50 мг.
Долутегравир можно принимать независимо от приема пищи. Пища повышает степень и снижает скорость всасывания долутегравира. Биодоступность долутегравира зависит от содержания нищи: при приеме пищи с низким, умеренным и высоким содержанием жиров AUQ0-∞) долутегравира повышалась на 33 %, 41 % и 66 %, Сmaх повышалась на 46 %, 52 % и 67 %, Тmax удлинялось до 3, 4 и 5 часов по сравнению с 2 часами при приеме натощак, сoответственно. Данные увеличения не имеют клинического значения. Абсолютная биодоступность долутегравира не установлена.
Распределение
Согласно данным, полученным in vitro, долутегравир в значительной степени ( фиблизителыю на 99,3 %) связывается с белками плазмы крови человека. Кажущийся объем распределения (после приема внутрь в форме суспензии, Vd/F) составляет приблизительно 12,5 л. Связывание долутегравира с белками плазмы крови не зависело от концентрации. Соотношения общей концентрации радиоактивно меченого препарата в крови и плазме составили 0.441-0,535, что указывает на минимальную связь радиоактивно леченого препарата с клеточными компонентами крови. Свободная фракция долутегравира в плазме крови составляет приблизительно 0.2-1.1% у здоровых добровольцев, приблизительно 0.4-0.5 % у пациентов с печеночной недостаточностью средней степени тяжести, 0.8-1,0% у пациентов с почечной недостаточностью тяжелой степени, и 0.5 % у пациентов, инфицированных ВИЧ-1.
Долутегравир проникает в цереброспинальную жидкость (ЦСЖ). У 12 ранее не получавших лечение пациентов, которые принимали долутегравир и абакавир / ламивудин II течение 16 недель, средняя концентрация долутегравира в ЦСЖ составила 15.4 нг/мл на 2-й неделе и 12.6 нг/мл на 16-й неделе, с диапазоном от 3,7 до 23,2 нг/мл (сопоставимо с
довязанной концентрацией в плазме). Соотношение концентрации долутегравира в ЦСЖ к концентрации в плазме крови варьировалось от 0,11 до 2,04 %. Концентрации долугегравира в ЦСЖ превысили IC50, что подтверждает медианное снижение концентрации РНК ВИЧ-1 в ЦСЖ по сравнению с исходной концентрацией на 2.2 log тккле 2 недель терапии и 3,4 log после 16-иеделыюй терапии (см. подраздел Фармакодинамика»).
Дэлутегравир обнаруживается в мужских и женских половых путях. AUC в цервико-вагинальной жидкости, цервикальной и вагинальных тканях составила 6-10 % от таковой в плазме крови в равновесном состоянии. AUC в семенной жидкости составила 7 %, а в тканях прямой кишки — 17 % от таковой в плазме крови в равновесной концентрации.
Метаболизм
Долутегравир главным образом метаболизируется уридиндифосфат-глюкоронозилтрансферазой УДФ-ГТ1А1 с незначительным компонентом изоферменга CYP3A (9,7% общей принятой дозы в исследовании баланса массы у людей). Долутегравир является основным соединением, циркулирующим в плазме крови, в неизмененном виде незначительно выводится через ночки (< 1 % дозы). 53 % общей дозы, принятой внугрь, выводится в неизмененном виде через кишечник. Неизвестно, объясняется это неполным всасыванием лекарственного препарата или выведением с желчью глюкуронидного конъюгата, который дальше может распадаться до образования родственных соединений в просвете кишечника. 31 % общей дозы, принятой внутрь, выводится через почки в форме эфира глюкуронида долугегравира (18.9% общей дозы). N-деалкилированного метаболита (3,6 % общей дозы) и метаболита, образованного путем с кисления бензилового углерода (3.0 % общей дозы).
Bыведение
Конечный период полувыведения долугегравира составляет около 14 часов, а видимый клиренс (CL/F) — 0,56 л/ч.
Особые группы пациентов
Дети
В педиатрическом исследовании, включавшем 23 ВИЧ-1-инфицированных ребенка и подростка в возрасте от 12 до 18 лет, ранее получавших антиретровирусное лечение, данные фармакокннетики долугегравира у 10 детей показали, что суточная доза 50 мг долутегравира приводила к такой же экспозиции долугегравира у детей и подростков, как у взрослых, которые получали 50 мг долугегравира 1 раз в сутки.
Фармакокинетические параметры у детей (n=10)
a — Один пациент с массой тела 37 кг получал долутегравир 35 мг 1 раз в сутки.
Пациенты пожилого возраста
Популяционный фармакокинетический анализ долутсгравира с использованием данных, полученных у взрослых, инфицированных ВИЧ-1, показал отсутствие клинически значимого влияния возраста на экспозицию долутегравира.
Данные фармакокинетики долутегравира у пациентов старше 65 лет ограничены.
Пациенты с нарушением функции почек
Почечный клиренс неизмененного лекарственного препарата является второстепенным путем выведения долутегравира. Было проведено исследование фармакокинетики долутегравира у пациентов с нарушением функции почек тяжелой степени (КК < 30 мл/мин). Не наблюдалось клинически значимых фармакокинетических различий между пациентами с нарушением функции почек тяжелой степени (КК < 30 мл/мин) и з хоровыми добровольцами. Пациентам с нарушением функции почек коррекции дозы не тэебуется. Долутегравир не исследовался в группе пациентов, находящихся на диализе, тгм не менее, различия в фармакокинетике не ожидаются.
Пациенты с нарушением функции печени
Долутегравир мстаболизирустся и выводится, главным образом, печенью. В исследовании, в котором сравнивали 8 пациентов с нарушением функции печени средней степени тяжести (класс В по шкале Чайлд-Пыо) и 8 здоровых взрослых добровольцев, воздействие вазовой дозы 50 мг долутегравира было одинаковым в двух группах. Пациентам с нарушением функции печени легкой или средней степени тяжести не требуется коррекции юзы. Влияние нарушения функции печени тяжелой степени на фармакокинетику долутегравира не исследовалось.
Полиморфизм ферментов, метаболизирующих лекарственные препараты
Нет доказательств того, что часто встречающиеся полиморфизмы ферментов, метабодизирующих лекарственные препараты, изменяют фармакокинетику долутегравира в клинически значимой степени. В мета-анализе с использованием фармакогеномных ос разцов. полученных в клинических исследованиях с участием здоровых добровольцев, у шциентов с генотипами УДФ-ГТ1А1 (n = 7). у которых отмечался слабый метаболизм дoлутегравира, клиренс долутегравира был снижен на 32 %. a AUC была на 46 % выше по сравнению с пациентами с генотипами, которые ассоциировались с нормальным метаболизмом через УДФ-ГТ1А1 (n = 41). Полиморфизм изоферментов CYP3A4, CYP3A5 и NR112 не был связан с различиями фармакокинетики долутсфавира.
Пол
На основании данных, полученных в исследовании с участием здоровых добровольцев (мужчины n = 17, женщины n = 24). обнаружено, что воздействие долутегравира нисколько выше у женщин (примерно на 20%), чем у мужчин. Популяциониый ф фмакокинетический анализ с использованием совокупных фармакокинетических данных, полученных в клинических исследованиях Фазы IIb и Фазы III с участием взрослых пациентов, не показал клинически значимого влияния пола на экспозицию долутегравира.
Раса
Популяционный фармакокинетический анализ с использованием совокупных фармакокинетических данных, полученных в клинических исследованиях Фазы IIb и Фазы III с участием взрослых пациентов, не показал клинически значимого влияния расы на экспозицию долутегравира. Доказано, что фармакокинетика долутегравира после однократного приема внутрь представителями Японии аналогична фармакокинетике у западных народностей (представители США).
Коинфекция ВИЧ и вирусного гепатита В или С
Популяционный фармакокинетический анализ показал, что коинфекция вируса гепатита С не оказывает клинически значимого эффекта па воздействие долутегравира. Данные о гациентах с коинфекцией гепатита В ограничены.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Лечение ВИЧ-1 инфекции у взрослых и детей с 12 лет и массой тела 40 кг и более в составе комбинированной антиретровирусной терапии (APT).
ПРОТИВОПОКАЗАНИЯ
Повышенная чувствительность к долутегравиру или любому другому компоненту, вводящему в состав препарата. Одновременный прием с дофетилидом или пелсикаинидом, детский возраст до 12 лет и массой тела менее 40 кг.
С ОСТОРОЖНОСТЬЮ
Печеночная недостаточность тяжелой степени (класс С по шкале Чайлд-Пью);
При одновременном применении с лекарственными препаратами (рецептурными и безрецептурными), которые могут изменить действие препарата Тивикай®, либо лекарственными препаратами, действие которых может измениться под действием чрепарата Тивикай®.
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ, ВЛИЯНИЕ НА ФЕРТИЛЬНОСТЬ
Фертильность
Отсутствуют данные о влиянии препарата Тивикай на способность к зачатию у мужчин и ти женщин. Исследования на животных показали отсутствие влияния долутегравира на способность к зачатию у самцов или самок.
Беременность
Соответствующие и хорошо контролируемые исследования препарата Тивикай с участием беременных женщин не проводились. Влияние препарата Тивикай на беременность у женщин неизвестно. В исследованиях репродуктивной токсичности на животных было показано, что долутегравир проникает через плаценту. Препарат Тивикай® можно применять во время беременности только в том случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
Период грудного вскармливания
ВИЧ-инфицированным пациенткам рекомендован отказ от грудного вскармливания детей, чтобы избежать вертикальной передачи ВИЧ-инфекции.
На основании данных, полученных у животных, ожидается, что долутегравир будет выделяться у женщин с грудным молоком, хотя это и не было подтверждено у людей.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Терапию препаратом Тивикай должен проводить врач с опытом лечения ВИЧ-инфекции
Препарат Тивикай можно принимать независимо от приема пищи.
Взрослые
Пациенты, инфицированные ВИЧ-1, без резистентности к ИнИ
Рекомендованная доза препарата Тивикай составляет 50 мг 1 раз в сутки.
При одновременном применении с эфавирензом, невирапином, рифампицином или тмпранавиром в сочетании с ритонавиром рекомендуемая доза препарата Тивикай у дшной категории пациентов должна составлять 50 мг 2 раза в сутки.
Пациенты, инфицированные ВИЧ-1, с резистентностью к ИнИ (документированной или подозреваемой клинически)
Рекомендованная доза препарата Тивикай* составляет 50 мг 2 раза в сутки. Решение о применении препарата Тивикаи у таких пациентов должно приниматься с учетом лекарственной устойчивости к ИнИ.
У данной категории пациентов следует избегать одновременного применения с эфавирензом, невирапином, рифампицином или типранавиром в сочетании с ритонавиром.
Пропуск приема препарата
Если пациент пропустил прием препарата Тивикай*, ему следует принять пропущенную дозу как можно скорее, если до приема следующей дозы осталось не менее 4 часов. Если до приема следующей дозы осталось менее 4 часов, пациенту не следует принимать пропущенную дозу, и при этом необходимо возобновить прием препарата согласно схеме приема.
Дети в возрасте от 12 до 18 лет и с массой тела 40 кг и более
Рекомендованная доза препарата Тивикай для пациентов, которые ранее не получали лечение ИнИ (возраст — от 12 до 18 лет, масса тела 40 кг и более) составляет 50 мг 1 раз в сутки.
Недостаточно данных для рекомендации дозы препарата Тивикай детям в возрасте от 12 до 18 лет с резистентностью к ИнИ.
Особые группы пациентов
Дети в возрасте до 12 лет и с массой тела менее 40 кг
Недостаточно данных о безопасности и эффективности для рекомендации дозы препарата Тивикаи детям младше 12 лет или с массой тела менее 40 кг.
Пациенты пожилого возраста
Данные о применении препарата Тивикай у пациентов в возрасте 65 лет и старше ограничены. Однако отсутствуют данные о необходимости коррекции дозы пожилым щиентам (см. раздел «Фармакокинетика» — «Особые группы пациентов»).
Пациенты с нарушением функции почек
Пациентам с нарушением функции почек легкой, средней или тяжелой степени тяжести (КК <30 мл/мин, не на диализе) не требуется коррекция дозы. Отсутствуют данные для пациентов, находящихся на диализе, но различий в фармакокинетике в данной популяции не ожидается (см. раздел «Фармакокинетика» — «Особые группы пациентов»).
Пациенты с нарушением функции печени
Пациентам с нарушением функции печени легкой или средней степени тяжести (класс А или В по шкале Чайлд-Пью) не требуется коррекции дозы. Отсутствуют данные относительно пациентов с нарушением функции печени тяжелой степени (класс С по шкале Чайлд-Пьо) (см. раздел «Фармакокинетика» — «Особые группы пациентов»).
ПОБОЧНОЕ ДЕЙСТВИЕ
Нежелательные реакции, представленные ниже, установлены в ходе анализа совокупных данных клинических исследований Фаз IIb и III и перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥ 1/10), часто (≥ 1/100 и < 1/10), нечасто (≥ 1/1 000 и < 1/100), редко (≥ 1/10 000 и < 1/1 000) и очень редко (< 1/10 000, включая отдельные случаи).
Частота встречаемости нежелательных реакций
Нарушения со стороны иммунной системы
Нечасто: реакция гиперчувствительности, синдром восстановления иммунитета.
Нарушения психики
Часто: бессонница, необычные сновидения, депрессия.
Нечасто: суицидальное мышление или попытка суицида (особенно у пациентов с депрессией или психическими заболеваниями в анамнезе).
Нарушения со стороны нервной системы
Очень часто: головная боль, часто: головокружение.
Нарушения со стороны желудочно-кишечного тракта
Очень часто: тошнота, диарея,
Часто: рвота, метеоризм, боль в верхних отделах живота, боль в области живота, дискомфорт в области живота.
Нарушения со стороны печени и желчевыводящих путей
Нечасто: гепатит.
Нарушения со стороны кожи и подкожных тканей
Часто: сыпь, зуд.
Общие расстройства и нарушения в месте введения
Часто: утомляемость.
Лабораторные и инструментальные данные
Часто: повышение активности аланинаминотрансферазы (АЛТ) и/или аспартатаминотрансферазы (ACT), креатинфосфокиназы (КФК).
Профиль безопасности был одинаковым в популяциях пациентов, ранее не получавших лечение, пациентов, получавших лечение (и не принимавших ингибиторы интегразы), и пациентов с устойчивостью к ингибиторам интегразы.
Описание отдельных побочных эффектов
Изменения лабораторных показателей
В течение первой недели лечения препаратом Тивикай® отмечалось повышение концентрации креатинина в сыворотке крови, которое сохранялось в течение 48 недель. Среднее изменение концентрации креатинина на момент 48 недели терапии составляло 9,96 мкмоль/л. Повышение концентрации креатинина было сопоставимо для различных фоновых режимов терапии. Данные изменения не считаются клинически значимыми, поскольку они не отражают изменения скорости клубочковой фильтрации.
Синдром восстановления иммунитета
На момент начала комбинированной антиретровирусной терапии (кАРТ) у ВИЧ-инфицированных пациентов с тяжелым иммунодефицитом возможно развитие воспалительной реакции на фоне бессимптомных оппортунистических инфекций или их остаточных явлений. Также были зарегистрированы случаи развития аутоиммунных заболеваний (например, болезнь Грейвса) на фоне восстановления иммунитета, однако время первичных проявлений варьировало, и заболевание могло возникать через много месяцев после начала терапии.
Применение у детей
На основании ограниченных данных о применении у детей и подростков в возрасте от 12 до 18 лет можно сделать заключение об отсутствии дополнительных типов нежелательных реакций, помимо реакций, которые наблюдались у взрослых.
Коинфекция ВИЧ и вирусом гепатита В или С
В исследования Фазы III было разрешено включать пациентов с коинфекцией вирусом гепатита В и/или С при условии, что результаты исходных лабораторных показателей функции печени не превышали верхнюю границу нормы (ВГН) более чем в 5 раз. В целом, профиль безопасности у пациентов с коинфекцией вирусом гепатита В и/или С был таким же, как у пациентов без коинфекций вирусом гепатита В или С, несмотря на то, что частота встречаемости отклонений активности ACT и АЛТ была выше в подгруппе пациентов с коинфекцией вирусом гепатита В и/или С во всех группах лечения. Повышение активности печеночных ферментов, соответствующее синдрому восстановления иммунитета, наблюдалось у некоторых пациентов с коинфекцией вирусом гепатита В и/или С в начале терапии препаратом Тивикай®, особенно у тех, у кого было отменено лечение гепатита В.
Пострегистрационные данные
Нарушения со стороны скелетно-мышечной и соединительной ткани
Нечасто: артралгия, миалгия.
ПЕРЕДОЗИРОВКА
Симптомы
Данные о передозировке препарата Тивикай ограничены.
Ограниченпый опыт применения более высоких разовых доз (до 250 мг у здоровых добровольцев) не выявил никаких особых симптомов или признаков, кроме описанных в рг зделе «Побочное действие».
Лечение
Дальнейшее лечение должно проводиться в соответствии с клиническими показаниями либо рекомендациями национального токсикологического центра, где это применимо. Отсутствует специфическое лечение передозировки препаратом Тивикай. В случае передозировки необходимо проводить поддерживающую терапию и соответствующее наблюдение. По причине высокого связывания долутегравира с белками плазмы крови, маловероятно, что его значительное количество может быть выведено при помощи диализа.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ
Влияние долутегравира на фармакокинетику других препаратов
In vitro долутегравир демонстрирует отсутствие прямого ингибироваиия либо слабое ингибирование (IC50>50 μМ) изоферментов системы цитохрома Р450 (CYP)А2. CYP2A6, CYP2B6. CYP2C8, CYP2C9, CYP2C19. CYP2D6 CYP3A, УДФ-ГТ1А1 или УДФ-ГТ2В7, либо переносчиков Pgp. BCRP, BSEP, OATPIB1, ОАТР1ВЗ, ОСП, MRP2 или MRP4. In vitro долутегравир не индуцирует изоферменты CYP1A2, CYP2B6 или CYP3A4. In vivo долутегравир не оказывает влияния на мидазолам, показатель активности CYP3A4. На основании этих данных не ожидается, что препарат Тивикай может повлиять на фармакокипетику лекарственных препаратов, которые являются субстратами данных оерментов или переносчиков (например, ингибиторы обратной транскриптазы или протеазы, абакавир, зидовудин, маравирок, опиоидные анальгетики, антидепрессанты, статины, азольные фунгициды, ингибиторы протонной помпы, препараты для лечения эректильной дисфункции, ацикловир, валацикловир, ситаглиптин, адефовир).
В исследованиях взаимодействия с лекарственными препаратами долутегравир не оказывал клинически значимого эффекта на фармакокинстику следующих препаратов: тенофовир, ритонавир, метадон, эфавиренз, лопинавир, атазанавир, дарунавир, этравирин, фосампренавир, рилпивирин, боцепревир, телапрсвир, даклатасвир и пероральные контрацептивы, содержащие норгестимат и этинилэстрадиол.
In vitro долутегравир ингибировал почечный переносчик органических катионов 2 (ОСТ2) IC50 = 1.93 мкМ), выводящий переносчик различных лекарственных веществ и токсинов (МАТЕ) 1 (1С 50 = 6,34 мкМ) и МАТЕ2-К (1С50 = 24,8 мкМ). С учетом экспозиции долутегравира in vivo, маловероятно, потенциальное влияние на транспорт субстратов МATE2-K in vivo. In vivo долутегравир может повышать концентрации лекарственных средств в плазме крови, выведение которых зависит от ОСТ2 или МАТЕ1 (дофетилид, пилсикаинид или метформин) (см. таблицу 1). In vitro долутегравир ингибировал базолатеральные переносчики в почках: переносчик органических анионов (OAT) 1 (IC50 = 2,12 мкМ) и ОАТ3 (IC50= 1,97 мкМ). Однако долутегравир не оказывал выраженного влияния на фармакокинетику in vivo субстратов ОАТтенофовира и пара-аминогиппурата, и, таким образом, обладал слабой способностью вызывать взаимодействия лекарственных препаратов за счет ингибирования переносчиков CAT.
Влияние других средств на фармакокинетику долутегравира
Долутегравир выводится, главным образом, путем метаболизма УДФ-ГТ1А1. Долутегравир также является субстратом УДФ-ГТ1АЗ, УДФ-ГТ1А9, CYP3A4, Pgp и ВCRP; поэтому лекарственные препараты, которые индуцируют данные ферменты или переносчики, теоретически могут снижать концентрацию долутегравнра в плазме крови и уменьшать терапевтический эффект препарата Тивикай.
Одновременное применение препарата Tивикай и других лекарственных препаратов, которые иигибируют УДФ-ГТ1А1, УДФ-ГТ1АЗ. УДФ-ГТ1А9, CYP3A4 и/или Pgp, может повысить концентрацию долутегравира в плазме крови (см. таблицу 1).
in vitro долутегравир не является субстратом человеческого транспортного полипептида органических анионов (OATP)lBl. ОАТР1ВЗ или ОСТ1, поэтому не ожидается, что препараты, модулирующие исключительно активность этих переносчиков, будут влиять нa концентрацию долутгравира в плазме крови.
Эфавиренз, этравирин, невирапин, рифампицин, карбамазепин и типранавир в сочетании с ритонавиром значительно снижали концентрации долутегравира в плазме крови и поэтому необходима коррекция дозы препарата Тивикай до 50 мг 2 раза в сутки. Эффект этравирина ослаблялся одновременным применением ингибиторов CYP3A4 лопинавира / ритоиавира, дарунавира / ритонавира, и ожидается, что он ослабляется атазанавиром/ритонавиром. Таким образом, при одновременном применении допутегравира с этравирином и либо лопинавиром /ритонавиром, дагунавиром /ритонавиром, либо атазанавиром / ритонавиром коррекции дозы препарата Тивикай не требуется.
Другой индуктор, фосампрснавир. в сочетании с ритонавиром. снижал концентрации дс лутегравира в плазме крови, но коррекции дозы препарата Тивикаи не требуется (см. таблицу 1). Исследование взаимодействия с ингибитором УДФ-ГТ1А1. атазанавиром, не показало клинически значимого повышения концентраций долутегравира в плазме крови. Тенофовир, лопинавир/ритонавир, дарунавир / ритонавир, рилпивирин, боцепревир, телапревир, преднизон, рифабутин, даклатасвир и омепразол не оказали никакого эффекта либо оказали минимальный эффект на фармакокинетику долутегравира, поэтому при одновременном применении с данными лекарственными препаратами коррекции дозы препарата Тивикай не требуется.
Взаимодействия с отдельными лекарственными препаратами представлены в таблице 1. Рекомендации основаны либо на исследованиях взаимодействия с другими лекарственными препаратами, либо на прогнозируемых взаимодействиях ввиду ожидаемой амплитуды взаимодействий и вероятности развития серьезных нежелательных явлений либо утраты эффективности.
Таблица 1. Взаимодействия с другими лекарственными препаратами
Сокращения: ↑— повышение; ↓- снижение; ↔ — отсутствие значительных изменений; AUС — площадь под кривой зависимости «концентрация-время», Сmaх — максимальная концентрация, Сτ— концентрация в конце интервала между приемами лекарственного препарата.
OСОБЫЕ УКАЗАНИЯ
Реакции гиперчувствительности
При применении ИнИ, в том числе препарата Тивикай, регистрировались реакции гиперчувствительности, которые характеризовались сыпью, нарушением системных показателей и, иногда, нарушением функции органов, в том числе поражением печени.
При возникновении признаков или симптомов гиперчувствительности (включая, но не ограничиваясь, сыпь тяжелой степени или сыпь, сопровождающуюся повышением температуры тела, общее недомогание, утомляемость, боль в мышцах или суставах.
Буллезные поражения, поражения слизистой оболочки полости рта, конъюнктивит, отек лица, гепатит, эозинофилию, ангионевротический отек) необходимо немедленно отменить применение препарата Тивикай и других лекарственных препаратов, которые могли бы вызвать подобные реакции. Необходимо контролировать клиническое состояние, в том числе, показатели печеночных аминотрансфераз и провести соответствующую терапию.
Задержка в прекращении лечения препаратом Тивикай* либо другими лекарственными препаратами, которые могли бы вызвать подобные реакции, после развития реакций гиперчувствителыюсти может привести к жизнеугрожающим реакциям.
Синдром восстановления иммунитета
У ВИЧ-инфицированных пациентов с тяжелым иммунодефицитом по время начала APT может возникнуть воспалительная реакция на бессимптомные или остаточные оппортунистические инфекции, которая может вызвать серьезные клинические состояния либо усугубление симптомов. Как правило, такие реакции наблюдались в течение первых нескольких недель или месяцев после начала APT. Типичными примерами таких ее стояний являются цитомегаловирусный ретинит, генерализованные и/или очаговые микобактериальные инфекции и пневмония, вызванная Pneumocystis jiroveci (P. carinii). Hеобходимо без промедления оценивать любые воспалительные симптомы и, при необходимосги, начинать лечение. Аутоиммунные заболевания (такие как болезнь Грейвса, полимиозит и синдром Гийена-Барре) наблюдались на фоне восстановления иммунитета, однако время первичных проявлений варьировало, и заболевание могло возникать через много месяцев после начала терапии и иметь атипичное течение. В начале терапии препаратом Тивикай у некоторых пациентов с коинфекцией гепатита В и или С наблюдалось повышение активности ферментов печени, отражающие синдром восстановления иммунитета. Рекомендуется контролировать активность ферментов п:чени у пациентов с коинфекцией гепатита В и/или С. Необходим особенный контроль за началом или продолжением терапии гепатита В (согласно действующим руководствам) у пациентов, которым назначается лечение долутегравиром (см. раздел «Побочное действие»).
Оппортунистические инфекции
У пациентов, получающих препарат Тивикай или другую APT, могут развиться оппортунистические инфекции либо другие осложнения ВИЧ-инфекции. Таким образом, гациенты должны быть под тщательным клиническим наблюдением врача, с опытом j ечения заболеваний, связанных с ВИЧ.
Передача инфекции
Пациентов необходимо уведомить о том, что не доказано предотвращение риска передачи ВИЧ другим лицам половым путем или через кровь при приеме доступной в настоящее гремя APT. в том числе препарата Тивикай . Необходимо продолжать предпринимать необходимые меры предосторожности.
Взаимодействие с другими лекарственными средствами
Необходимо соблюдать осторожность при одновременном применении с лекарственными препаратами (рецептурными и безрецептурными), которые могут изменить экспозицию долутегравира, либо лекарственными препаратами, экспозиция которых может измениться под действием долутегравира (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Рекомендованная доза препарата Тивикай составляет 50 мг 2 раза в сутки при одновременном применении с этравирином (без усиления ингибиторами протеазы), эфавирензом, невирапином, типранавиром / ритонавиром. рифампицином, карбамазепином, фенитоином, фенобарбиталом и зверобоем продырявленным (см. раздел заимодействие с другими лекарственными препаратами»).
Препарат Тивикай не следует назначать вместе с антацидами, содержащими пеливалентные катионы. Рекомендуется применять препарат Тивикай за 2 часа до или через 6 часов после применения данных средств (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Тивикай рекомендуется принимать за 2 часа до или через 6 часов после приема кальцийсодержащих или железосодержащих пищевых добавок, или, в качестве альтернативного варианта, принимать с пищей (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Тивикай повышает концентрации мстформина. Необходимо рассмотреть возможность коррекции дозы метформина в начале и при прекращении совместного применения долутегравира с метформином, для поддержания контроля гликемии (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Резистентиость к ингибиторам интегразы, имеющий особое значение
При принятии решения о применении долутегравира при наличии резистентности к ИиИ следует учитывать, что при этом значительно уменьшается активность долутегравира в отношении вирусных штаммов, несущих вторичные мутации Q148 + >2 в участках G140A/C/S, Е138А/К/Т, L74I. Степень, в которой долутегравир обеспечивает дополнительную эффективность при наличии такой резистентности к ИнИ, остается неясной.
Остеонекроз
Несмотря на то, что этиология данного заболевания является многофакторной (включая применение кортикостсроидов, дифосфонатов, употребление алкоголя, тяжелую иммуносупрессию, высокий индекс массы тела), случаи остеонекроза чаще всего встречались у пациентов на поздней стадии ВИЧ-инфекции и/или длительно принимавших комбинированную APT. Пациентам следует обратиться к врачу, если они испытывают боли и скованность в суставах или трудности при движении.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Не проводились исследования влияния препарата Тивикай на способность к управлению трпнспортными средствами и работе с механизмами. Необходимо учитывать клиническое состояние пациента и профиль нежелательных явлений препарата Тивикай® при рассмотрении способности пациента к вождению либо управлению механизмами.
ФОРМА ВЫПУСКА
Таблетки, покрытые пленочной оболочкой, 50 мг.
По 30 таблеток, покрытых пленочной оболочкой во флаконе из полиэтилена высокой плотности, снабженным полиэтиленовой термозапечатываемой пленкой и навинчивающейся крышкой. По 1 флакону вместе с инструкцией по применению в картонной пачке.
СРОК годности
2 года.
Не применять после истечения срока годности, указанного на упаковке.
УСЛОВИЯ ХРАНЕНИЯ
Хранить при температуре не выше 30°С. Хранить в недоступном для детей месте.
УСЛОВИЯ ОТПУСКА
По рецепту.
Производитель
«Глаксо Вэллком С.A.»/Glaxo Wellcome S.A.
Авда. де Экстремадура 3, 09400 Аранда де Дуэро. Бургос. Испания /
Avda. de Extremadura 3, 09400 Aranda de Ducro, Burgos, Spain
НАИМЕНОВАНИЕ И АДРЕС ЮРИДИЧЕСКОГО ЛИЦА, НА ИМЯ КОТОРОГО ВЫДАНО РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ
«ВииВ Хелскер Великобритания Лимитсд»/ ViiV Healthcare UK Limited Великобритания. TW8 9GS Миддлсекс. Брентфорд. Грейт Вест Роуд 980 / 980 Great West Road, Brentford, Middlesex TW8 9GS. United Kingdom
За дополнительной информацией обращаться:
ЗАО «ГлаксоСмнтКляйн Трейдинг»
121614. г. Москва, ул. Крылатская, д. 17. корп. 3. эт. 5
Бизнec-Парк «Крылатские холмы»
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Тивикай® (Tivicay®) инструкция по применению
📜 Инструкция по применению Тивикай®
💊 Состав препарата Тивикай®
✅ Применение препарата Тивикай®
📅 Условия хранения Тивикай®
⏳ Срок годности Тивикай®
Описание лекарственного препарата
Тивикай®
(Tivicay®)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2014 года, дата обновления: 2022.07.14
Владелец регистрационного удостоверения:
Код ATX:
J05AJ03
(Долутегравир)
Лекарственная форма
| Тивикай® |
Таб., покр. пленочной оболочкой, 50 мг: 30 шт. рег. №: ЛП-002536 |
Форма выпуска, упаковка и состав
препарата Тивикай®
Таблетки, покрытые пленочной оболочкой желтого цвета, круглые, двояковыпуклые, с выгравированной надписью «SV 572» с одной стороны и «50» — с другой стороны.
Вспомогательные вещества: маннитол 145.4 мг, целлюлоза микрокристаллическая 60 мг, повидон-К29/32 15 мг, карбоксиметилкрахмал натрия 21 мг, натрия стеарилфумарат 6 мг.
Состав пленочной оболочки: Опадрай II желтый 9 мг, в т. ч. поливиниловый спирт гидролизованный 40%, титана диоксид 23.45%, макрогол 20.2%, тальк 14.8%, краситель железа оксид желтый 1.55%.
30 шт. — флаконы полиэтиленовые (1) — пачки картонные.
Фармакологическое действие
Механизм действия
Долутегравир ингибирует интегразу ВИЧ, связываясь с активным участком интегразы и блокируя этап переноса цепей во время интеграции ретровирусной дезоксирибонуклеиновой кислоты (ДНК), который необходим для цикла репликации ВИЧ. In vitro долутегравир медленно отделяется от активного участка комплекса ДНК-интегразы дикого типа (T1/2 71 час).
Фармакодинамические эффекты
В рандомизированном исследовании с целью определения оптимальной дозы у инфицированных ВИЧ-1 пациентов, которые получали монотерапию долутегравиром, отмечалось быстрое и дозозависимое противовирусное действие. Средние снижения РНК ВИЧ-1 на 11 день по сравнению с исходной концентрацией составили 1,5, 2.0 и 2,5 log10 для 2 мг, 10 мг и 50 мг долутегравира при приеме 1 раз в сутки, соответственно. Данный противовирусный ответ поддерживался в течение 3-4 дней с момента приема последней дозы в группе пациентов, принимавших 50 мг долутегравира.
Противовирусная активность в клеточной культуре
В мононуклеарных клетках периферической крови (МКПК), инфицированных штаммом BaL ВИЧ-1 либо штаммом NL432 ВИЧ-1, для долутегравира были получены IC50 (концентрация, ингибирующая репликацию на 50%) 0,51 нМ и 0,53 нМ, соответственно. В клетках МТ-4, инфицированных штаммом IIIВ ВИЧ-1 и инкубированных с долутегравиром в течение 4 или 5 дней, были получены IC50 0,71 и 2,1 нМ. В двух биохимических тестах in vitro по переносу цепей ДНК с использованием очищенной интегразы ВИЧ-1 и предварительно обработанного субстрата ДНК были получены IC50 2,7 нМ и 12,6 нМ.
В анализе чувствительности вирусной интегразы с использованием участка кодирования интегразы из 13 клинически различающихся изолятов субтипа В долутегравир продемонстрировал противовирусную активность, сходную с активностью в отношении лабораторных штаммов, со средней IC50 0,52 нМ. В анализе на МКПК панели, состоящей из 24 клинических изолятов ВИЧ-1 [группа М (субтипы А, В, С, D, Е, F и G) и группа О], а также 3 клинических изолятов ВИЧ-2 среднее геометрическое IC50 составило 0,20 нМ, а значения IC50 варьировались от 0,02 до 2,14 нМ для ВИЧ-1, в то время как для изолятов ВИЧ-2 среднее геометрическое 1С50 составило 0,18 нМ, а значения IC50 варьировались от 0,09 до 0,61 нМ.
Противовирусная активность в сочетании с другими противовирусными препаратами
Ни один из лекарственных препаратов с типичной противовирусной активностью в отношении ВИЧ не проявлял антагонизма к долутегравиру (in vitro оценка проводилась в сочетании со ставудином, абакавиром, эфавирензем, невирапином, лопинавиром, ампренавиром, энфувиртидом, маравироком, адефовиром и ралтегравиром, выбранных в шахматном порядке). Кроме того, противовирусные препараты без типичной активности в отношении ВИЧ (рибавирин) не оказывали видимого эффекта на активность долутегравира.
Влияние на сыворотку крови и белки сыворотки крови человека
Исследования in vitro подтвердили 75-кратное изменение (КИ) 1С50 долутегравира в присутствии 100% сыворотки крови человека (методом экстраполяции), a IC90, скорректированная с учетом связывания белками (PA-IC90), в МКПК составила 64 нг/мл. Устойчивая концентрация долутегравира после применения разовой дозы 50 мг у пациентов, ранее не принимавших ингибиторы интегразы (ИнИ), составила 1,20 мкг/мл и, таким образом, была в 19 раз выше установленной PA-IC90.
Устойчивость in vitro
Изоляты дикого типа ВИЧ-1: в течение 112-дневного пассажа штамма IIIB не выявлялись вирусы с высокой устойчивостью к долутегравиру, максимальное 4,1-кратное изменение наблюдалось у полученных при пассажах групп устойчивых вирусов с заменами S153Y и S153F в консервативных позициях гена интегразы. Пассаж штамма NL-432 дикого типа ВИЧ-1 в присутствии долутегравира приводил к селекции замены E92Q (пересеваемая группа вируса с КИ =3,1) и G193E (пересеваемая группа вируса с КИ = 3,2) на 56 день. Дополнительный пассаж субтипов В, С и A/G дикого типа вируса в присутствии долутегравира приводил к селекции R263K, G118R и S153T.
Противовирусная активность в отношении устойчивых штаммов: штаммы, устойчивые к ингибиторам обратной транскриптазы (ИОТ) и ингибиторам протеазы (ИП): долутегравир продемонстрировал одинаковую активность против 2 ненуклеозидных (НН)-ИОТ-устойчивых, 3 нуклеозидных (Н)-ИОТ-устойчивых и 2 ИП-устойчивых мутантных клонов ВИЧ-1 (1 с тройной и 1 с шестикратной резистентностью) по сравнению с диким штаммом.
Штаммы ВИЧ-1, устойчивые к ингибиторам интегразы: 60 мутантных изолятов ВИЧ-1, устойчивых к ИнИ (28 с одной заменой и 32 с 2 или более заменами), были получены из вируса дикого типа NL432 путем направленного мутагенеза. Долутегравир продемонстрировал противовирусную активность (чувствительность) против ВИЧ с КИ < 5 в отношении 27 из 28 мутантных вирусов, устойчивых к ИнИ с одной заменой, в том числе T66A/I/K, E92Q/V, Y143C/H/R, Q148H/K/R и N155H, в то время как для ралтегравира и элвитегравира она проявилась в отношении 17/28 и 11/21 тестируемых мутантных вирусов с КИ < 5, соответственно. Кроме того, из 32 мутантных вирусов, устойчивых к ингибиторам интегразы с 2 или более заменами, 23 из 32 продемонстрировали КИ < 5 для долутегравира по сравнению с КИ < 5 для 4 из 32 для ралтегравира и КИ < 5 для 2 из 25 тестируемых вирусов для элвитегравира.
Штаммы ВИЧ-2, устойчивые к ИнИ: вирусы были получены путем направленного мутагенеза изолятов ВИЧ-2, выделенных у инфицированных ВИЧ-2 пациентов, которые получали ралтегравир и у которых отмечалась вирусологическая неэффективность лечения. В целом, КИ у ВИЧ-2 были схожи с КИ ВИЧ-1, которые наблюдались при аналогичном наборе мутаций. КИ долутегравира составило < 5 против 4 вирусов ВИЧ-2 (S163D, G140A/Q148R, A153G/N155H/S163G и E92Q/T97A/N155H/S163D); для E92Q/N155H КИ долутегравира составило 8,5, а для G140S/Q148R КИ долутегравира составило 17. Долутегравир, ралтегравир и элвитегравир проявили одинаковую активность против ВИЧ-2 с направленной мутацией с S163D как и в отношении дикого типа, а для остальных мутантных вирусов ВИЧ-2 диапазоны КИ ралтегравира составили 6,4-20, а диапазоны КИ элвитегравира составили 22-640.
Клинические изоляты у пациентов с вирусологической неэффективностью лечения ралтегравиром: 30 клинических изолятов с генотипической и фенотипической устойчивостью к ралтегравиру (медиана КИ >81) исследовали на чувствительность к долутегравиру (медиана КИ 1,5) путем анализа с помощью Monogram Biosciences PhenoSense. Медиана КИ долутегравира для изолятов с заменами в позициях G140S + Q148H составила 3,75; G140S + Q148R— 13,3; Т97А + Y143R — 1,05 и N155H — 1,37. 705 устойчивых к ралтегравиру изолятов, полученных у пациентов, получавших ралтегравир, были проанализированы на чувствительность к долутегравиру путем анализа с помощью Monogram Biosciences PhenoSense. Долутегравир проявил КИ < 10 в отношении 93,9 % из 705 клинических изолятов.
Устойчивость in vivo: пациенты, не принимавшие ИнИ
Не отмечалось мутаций резистентности к ИнИ или связанной с лечением устойчивости к нуклеозидным ингибиторам обратной транскриптазы (НИОТ) основной терапии у ранее не получавших лечение пациентов, которые принимали 50 мг препарата Тивикай 1 раз в сутки (исследования SPRING-1, SPRPNG-2 и SINGLE). В исследовании SAILING у пациентов, получавших препарат Тивикай и ранее не получавших ИнИ (п = 354 в группе долутегравира), связанная с лечением устойчивость к ИнИ наблюдалась на 48 неделе у 4 из 17 пациентов с вирусологической неэффективностью, получающих долутегравир. У 2 из 4 пациентов наблюдалась уникальная замена R263K в гене интегразы с максимальным КИ 1,93, у 1 пациента наблюдалась полиморфная замена V151V/I интегразы с максимальной FC 0,92, и у 1 пациента были уже изначально мутации интегразы и, как предполагается, он ранее получал ИнИ или был инфицирован устойчивым к ИнИ вирусом.
Устойчивость invivo: пациенты с устойчивостью к ИнИ
В исследовании VIKING-3 изучали препарат Тивикай (плюс оптимизированная базовая терапия) у пациентов с имеющейся устойчивостью к ИнИ. До 24 недели у 36 из 183 пациентов отмечалась установленная протоколом вирусологическая неэффективность (PDVF). Из них, у 31 пациента для анализа имелись парные данные по исходной и PDVF-устойчивости, и у 16/31 (52%) отмечались мутации, связанные с лечением. Наблюдались следующие связанные с лечением мутации или сочетания мутаций: L74L/M (n = 1), E92Q (n = 2), Т97А (п = 8), Е138К/А (n = 7), G140S (п = 2), Y143H (n=l), S147G (n=l), Q148H/K/R (n = 4), N155H (п = 1) и E157E/Q (п=1). У 14 из 16 пациентов с мутациями вируса, связанными с лечением, исходно или в анамнезе имелась мутация Q148.
Влияние на показатели ЭКГ
В рандомизированном перекрестном плацебо-контролируемом клиническом исследовании 42 здоровых добровольца получили разовую дозу плацебо, суспензии долутегравира 250 мг (воздействие приблизительно в 3 раза превышает воздействие дозы 50 мг 1 раз в сутки в равновесном состоянии) и моксифлоксацина (400 мг, активный контроль) в случайном порядке. Долутегравир не вызывал удлинения интервала QT в течение 24 часов после приема препарата. После коррекции по исходным показателям ЭКГ и приему плацебо максимальное среднее изменение QT, основанное на коррекции по формуле Fridericia (QTcF), составило 1,99 мс (верхняя граница 1 -стороннего 95 % доверительного интервала — 4,53 мс).
Влияние на функцию почек
Влияние препарата Тивикай на клиренс креатинина сыворотки крови (КК), скорость клубочковой фильтрации (СКФ) в пробе с йогексолом и эффективный почечный плазмоток (ЭПП) в пробе с пара-аминогиппуратом оценивались в открытом рандомизированном плацебо-контролируемом исследовании в 3 группах с участием 37 здоровых добровольцев, которые принимали 50 мг препарата Тивикай 1 раз в сутки (п= 12), 50 мг — 2 раза в сутки (п = 13) или плацебо 1 раз в сутки (п = 12) в течение 14 дней. Отмечалось умеренное снижение КК при применении долутегравира в течение первой недели лечения, соответствующее снижению, которое наблюдалось в клинических исследованиях. При приеме в обеих дозах долутегравир не оказал значительного влияния на СКФ либо ЭПП. Эти данные подтверждают исследования in vitro, которые позволяют предположить, что небольшие повышения креатинина, наблюдаемые в клинических исследованиях, вызваны непатологическим ингибированием переносчика органических катионов 2 (ОСТ2) в проксимальных почечных канальцах, что обуславливает канальцевую секрецию креатинина.
Фармакокинетика
Фармакокинетика долутегравира у здоровых добровольцев и ВИЧ-инфицированных пациентов одинакова. Вариабельность фармакокинетики долутегравира была от низкой до умеренной. В исследованиях Фазы 1 с участием здоровых добровольцев коэффициент вариации (KB) среди участников для площади под фармакокинетической кривой «концентрация — время» (AUC) и для Cmax варьировал от ~ 20 до 40 %, а концентрация в конце интервала дозирования (Сt) — от 30 до 65 %. Вариабельность фармакокинетики долутегравира между участниками была выше у ВИЧ-инфицированных пациентов, чем у здоровых добровольцев. Индивидуальная вариабельность показателей фармакокинетики была ниже вариабельности между индивидуумами.
Всасывание
Долутегравир быстро абсорбируется после приема внутрь, медиана ТCmax достигается через 2-3 часа после приема дозы в форме таблеток, покрытых пленочной оболочкой. Линейность фармакокинетики долутегравира зависит от дозы и лекарственной формы. После приема внутрь препарат Тивикай в таблетках в целом проявлял нелинейную фармакокинетику, с менее чем дозозависимым повышением плазменной экспозиции с 2 до 100 мг, однако повышение экспозиции долутегравира пропорционально дозе в интервале с 25 мг до 50 мг.
Препарат Тивикай можно принимать независимо от приема пищи. Пища повышает степень и снижает скорость абсорбции долутегравира. Биодоступность долутегравира зависит от содержания пищи: при приеме пищи с низким, умеренным и высоким содержанием жиров AUC (0-∞) долутегравира повышалась на 33%, 41 % и 66%, Cmax снижалась на 46 %, 52 % и 67 %, ТCmax удлинялось до 3, 4 и 5 часов по сравнению с 2 часами при приеме натощак, соответственно. Данные увеличения не имеют клинического значения.
Абсолютная биодоступность долутегравира не установлена.
Распределение
Согласно данным, полученным in vitro, долутегравир в значительной степени (приблизительно на 99,3 %) связывается с белками плазмы крови человека. Кажущийся объем распределения (Vd/F) после приема внутрь суспензии составляет приблизительно 12,5 л. Связывание долутегравира с белками плазмы крови не зависело от концентрации. Соотношения общей концентрации радиоактивно меченого препарата в крови и плазме составили 0,441-0,535, что указывает на минимальную связь радиоактивно меченого препарата с клеточными компонентами крови. Свободная фракция долутегравира в плазме крови составляет приблизительно 0,2-1,1 % у здоровых добровольцев, 0,4-0,5 % у пациентов с печеночной недостаточностью средней степени тяжести, 0,8-1,0 % у пациентов с печеночной недостаточностью тяжелой степени, и 0,5 % у пациентов, инфицированных ВИЧ-1.
Долутегравир проникает в цереброспинальную жидкость (ЦСЖ). У 12 ранее не получавших лечение пациентов, получавших схему долутегравир и абакавир / ламивудин в течение 16 недель, средняя концентрация долутегравира в ЦСЖ составила 15,4 нг/мл на 2-й неделе и 12,6 нг/мл на 16-й неделе, с диапазоном от 3,7 до 23,2 нг/мл (сопоставимо с несвязанной концентрацией в плазме). Соотношение концентрации долутегравира в ЦСЖ к плазме крови варьировалось от 0,11 до 2,04%. Концентрации долутегравира в ЦСЖ превысили IC50, что подтверждает медианное снижение концентрации РНК ВИЧ-1 в ЦСЖ по сравнению с исходной концентрацией на 2,2 log после 2 недель терапии и 3,4 log после 16-недельной терапии (см. подраздел «Фармакодинамика»).
Долутегравир обнаруживается в мужских и женских половых путях. AUC в цервико-вагинальной жидкости, цервикальной и вагинальных тканях составила 6-10 % от таковой в плазме крови в равновесном состоянии. AUC в семенной жидкости составила 7 %, а в тканях прямой кишки — 17 % от таковой в плазме крови в равновесной концентрации.
Метаболизм
Долутегравир главным образом метаболизируется уридиндифосфат-глюкуронозилтрансферазой (УДФ-ГТ)1А1 с незначительным компонентом изофермента CYP3A (9,7 % общей принятой дозы в исследовании баланса массы у людей). Долутегравир является основным соединением, циркулирующим в плазме крови. Долутегравир незначительно выводится через почки в неизмененном виде (< 1 % дозы). 53 % общей дозы, принятой внутрь, выводится в неизмененном виде через кишечник. Неизвестно, объясняется это полным или частично неполным всасыванием лекарственного препарата или выведением с желчью глюкуронидного конъюгата, который дальше может распадаться до образования родственных соединений в просвете кишечника. 31 % общей дозы, принятой внутрь, выводится через почки в форме эфира глюкуронида долутегравира (18.9% общей дозы), N-деалкилированного метаболита (3,6 % общей дозы) и метаболита, образованного путем окисления бензилового углерода (3,0 % общей дозы).
Выведение
Конечный период полувыведения долутегравира составляет около 14 часов, а видимый клиренс (CL/F) — 0,56 л/ч.
Особые группы пациентов
Дети
В педиатрическом исследовании, включавшем 23 ВИЧ-1-инфицированных подростка в возрасте от 12 до 18 лет, ранее получавших антиретровирусное лечение, данные фармакокинетики долутегравира у 10 детей показали, что суточная доза 50 мг долутегравира приводила к такой же экспозиции долутегравира у детей и подростков, как и у взрослых, которые получали 50 мг долутегравира 1 раз в сутки.
Фармакокинетические параметры у детей (n=10)
1Один пациент с массой тела 37 кг получал долутегравир 35 мг 1 раз в сутки.
Пациенты пожилого возраста
Групповой фармакокинетический анализ долутегравира с использованием данных, полученных у взрослых, инфицированных ВИЧ-1, показал отсутствие клинически значимого влияния возраста на параметры фармакокинетики долутегравира. Данные фармакокинетики долутегравира у пациентов старше 65 лет ограничены.
Пациенты с почечной недостаточностью
Почечный клиренс неизмененного лекарственного препарата является второстепенным путем выведения долутегравира. Было проведено исследование фармакокинетики долутегравира у пациентов с почечной недостаточностью тяжелой степени (КК < 30 мл/мин). Не наблюдалось клинически значимых фармакокинетических различий между пациентами с почечной недостаточностью тяжелой степени (КК < 30 мл/мин) и здоровыми добровольцами. Пациентам с почечной недостаточностью коррекции дозы не требуется. Долутегравир не исследовался в группе пациентов, находящихся на диализе, тем не менее, различия в фармакокинетике не ожидаются.
Пациенты с печеночной недостаточностью
Долутегравир метаболизируется и выводится, главным образом, печенью. В исследовании, в котором сравнивали 8 пациентов с печеночной недостаточностью средней степени тяжести (класс В по шкале Чайлд-Пью) и 8 здоровых взрослых добровольцев, воздействие разовой дозы 50 мг долутегравира было одинаковым в двух группах. Пациентам с печеночной недостаточностью легкой или средней степени тяжести не требуется коррекции дозы. Влияние печеночной недостаточности тяжелой степени на фармакокинетику долутегравира не исследовалось.
Полиморфизм ферментов, метаболизирующих лекарственные препараты
Нет доказательств того, что часто встречающиеся полиморфизмы ферментов, метаболизирующих лекарственные препараты, изменяют фармакокинетику долутегравира в клинически значимой степени. В мета-анализе с использованием фармакогеномных образцов, полученных в клинических исследованиях с участием здоровых добровольцев, у пациентов с генотипами УДФ-ГТ1А1 (n = 7), у которых отмечался слабый метаболизм долутегравира, клиренс долутегравира был снижен на 32 %, a AUC была на 46 % выше по сравнению с пациентами с генотипами, которые ассоциировались с нормальным метаболизмом через УДФ-ГТ1А1 (n = 41). Полиморфизм изоферментов CYP3A4, CYP3A5 и NR1I2 не был связан с различиями фармакокинетики долутегравира.
Показания препарата
Тивикай®
- лечение ВИЧ-1 инфекции у взрослых и детей с 12 лет и массой тела 40 кг и более в составе комбинированной антиретровирусной терапии (APT).
Режим дозирования
Терапию препаратом Тивикай должен проводить врач с опытом лечения ВИЧ-инфекции. Препарат Тивикай можно принимать независимо от приема пищи.
Взрослые
Пациенты, инфицированные ВИЧ-1, без резистентности к ИнИ
Рекомендованная доза препарата Тивикай составляет 50 мг 1 раз в сутки.
При одновременном применении с эфавирензом, невирапином, рифампицином и типранавиром в сочетании с ритонавиром рекомендуемая доза препарата Тивикай у данной категории пациентов должна составлять 50 мг 2 раза в сутки.
Пациенты, инфицированные ВИЧ-1, с резистентностью к ИнИ (документированной или подозреваемой клинически)
Рекомендованная доза препарата Тивикай составляет 50 мг 2 раза в сутки. Решение о применении препарата Тивикай у таких пациентов должно приниматься с учетом лекарственной устойчивости к ИнИ.
У данной категории пациентов следует избегать одновременного применения с эфавирензом, невирапином, рифампицином и типранавиром в сочетании с ритонавиром.
Пропуск приема препарата
Если пациент пропустил прием препарата Тивикай, ему следует принять пропущенную дозу как можно скорее, если до приема следующей дозы осталось не менее 4 часов. Если до приема следующей дозы осталось менее 4 часов, пациенту не следует принимать пропущенную дозу, и при этом необходимо возобновить прием препарата согласно графику.
Дети в возрасте от 12 до 18 лет и массой тела 40 кг и более
Рекомендованная доза препарата Тивикай для пациентов, которые ранее не получали лечение ИнИ (возраст — от 12 до 18 лет, масса тела 40 кг и более) составляет 50 мг 1 раз в сутки.
Недостаточно данных для рекомендации дозы препарата Тивикай детям в возрасте от 12 до 18 лет с резистентностью к ИнИ.
Особые группы пациентов
Дети в возрасте до 12 лет и массой тела менее 40 кг
Недостаточно данных о безопасности и эффективности для рекомендации дозы препарата Тивикай® детям младше 12 лет или массой тела менее 40 кг.
Пациенты пожилого возраста
Данные о применении препарата Тивикай у пациентов в возрасте 65 лет и старше ограничены. Однако отсутствуют данные о необходимости коррекции дозы пожилым пациентам (см. раздел «Фармакокинетика» — «Особые группы пациентов»).
Пациенты с нарушением функции почек
Пациентам с почечной недостаточностью легкой, средней или тяжелой степени тяжести (КК <30 мл/мин, не на диализе) не требуется коррекция дозы. Отсутствуют данные для пациентов, находящихся на диализе, но различий в фармакокинетике в данной популяции не ожидается (см. раздел «Фармакокинетика» — «Особые группы пациентов»).
Пациенты с нарушением функции печени
Пациентам с печеночной недостаточностью легкой или средней степени тяжести (класс А или В по шкале Чайлд-Пью) не требуется коррекции дозы. Отсутствуют данные относительно пациентов с тяжелой степенью печеночной недостаточности (класс С по шкале Чайлд-Пью) (см. раздел «Фармакокинетика» — «Особые группы пациентов»).
Побочное действие
Нежелательные явления, представленные ниже, перечислены в соответствии с системно-органной классификацией и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥ 1/10), часто (≥ 1/100 и < 1/10), нечасто (≥ 1/1 000 и < 1/100), редко (≥ 1/10 000 и < 1/1 000), очень редко (< 1/10 000, включая отдельные случаи). Категории частоты были сформированы на основании клинических исследований препарата.
Частота встречаемости побочных действий
Нарушения со стороны иммунной системы
Нечасто: реакция гиперчувствительности, синдром восстановления иммунитета (см. раздел «Особые указания»).
Нарушения со стороны психики
Часто: бессонница.
Нарушения со стороны нервной системы
Очень часто: головная боль.
Часто: головокружение, необычные сновидения.
Нарушения со стороны ЖКТ
Очень часто: тошнота, диарея.
Часто: рвота, метеоризм, боль в верхних отделах живота.
Нечасто: боль в области живота, дискомфорт в области живота.
Нарушения со стороны печени и желчевыводящих путей
Нечасто: гепатит.
Нарушения со стороны кожи и подкожных тканей
Часто: сыпь, зуд.
Общие расстройства и нарушения в месте введения
Часто: утомляемость.
Лабораторные показатели
Часто: повышение активности АЛТ (АЛТ) и/или АСТ (ACT), креатинфосфокиназы (КФК).
Профиль безопасности был одинаковым в популяциях пациентов, ранее не получавших лечение; пациентов, получавших лечение (за исключением ИнИ), и пациентов с устойчивостью к ИнИ.
Изменения лабораторных показателей
В течение первой недели лечения препаратом Тивикай отмечалось повышение концентрации креатинина сыворотки крови, которое сохранялось в течение 48 недель. При лечении пациентов, которые ранее не получали терапию, среднее изменение 9,96 мкмоль/л по сравнению с исходной концентрацией (диапазон: от -53 мкмоль/л до 54,8 мкмоль/л) наблюдалось через 48 недель лечения. Повышение концентрации креатинина было сопоставимо с концентрацией, которая отмечается при применении основных НИОТ. Данное изменение не считается клинически значимым, поскольку оно не отражает изменения скорости клубочковой фильтрации (см. раздел «Фармакодинамика» — «Влияние на функцию почек»).
В программе по изучению препарата в группах долутегравира и ралтегравира отмечались незначительные повышения концентрации общего билирубина (без клинической желтухи). Данные изменения не считаются клинически значимыми, поскольку они, вероятно, отражают конкурентный клиренс долутегравира и неконъюгированного билирубина через УДФ-ГТ1А1 (см. раздел «Фармакокинетика» — «Метаболизм»). Также во время терапии долутегравиром регистрировались асимптоматические повышения активности КФК.
Применение у детей
На основании ограниченных данных, доступных у детей в возрасте от 12 до 18 лет, можно сделать заключение об отсутствии дополнительных типов нежелательных реакций, кроме реакций, которые наблюдались у взрослых.
Ко-инфекция ВИЧ и гепатита В или С
В исследования фазы 3 пациентов с конфекцией гепатита В и/или С включали, при условии, что результаты исходных лабораторных показателей функции печени не превышали верхней границы нормы (ВГН) в 5 раз. В целом, профиль безопасности у пациентов с коинфекций гепатита В и/или С был таким же, как у пациентов без ко-инфекции гепатита В или С, несмотря на то, что частота отклонений концентрации ACTи АЛТ была выше в подгруппе пациентов с коинфекций гепатита В и/или С во всех группах лечения. Повышение активности печеночных ферментов, соответствующее синдрому восстановления иммунитета наблюдалось у нескольких пациентов с ко-инфекцией гепатита В и/или С в начале терапии препаратом Тивикай, особенно у тех, у кого было отменено лечение гепатита В (см. раздел «Особые указания»).
Пострегистрационные данные
Данные отсутствуют.
Противопоказания к применению
- повышенная чувствительность к долутегравиру или любому другому компоненту препарата;
- одновременный прием с дофетилидом;
- детский возраст до 12 лет и массой тела менее 40 кг.
С осторожностью:
- печеночная недостаточность тяжелой степени (класс С по шкале Чайлд-Пью);
- при одновременном применении с лекарственными препаратами (рецептурными и безрецептурными), которые могут изменить действие препарата Тивикай, либо лекарственными препаратами, действие которых может измениться под действием препарата Тивикай.
Применение при беременности и кормлении грудью
Фертильность
Отсутствуют данные о влиянии препарата Тивикай на способность к зачатию у мужчин или женщин. Исследования на животных показали отсутствие влияния долутегравира на способность к зачатию у самцов или самок.
Беременность
Соответствующие и хорошо контролируемые исследования препарата Тивикай с участием беременных женщин не проводились. Влияние препарата Тивикай на беременность у женщин неизвестно. В исследованиях репродуктивной токсичности на животных было показано, что долутегравир проникает через плаценту. Препарат Тивикай можно применять во время беременности только в том случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
Период грудного вскармливания
ВИЧ-инфицированным пациенткам рекомендован отказ от грудного вскармливания детей, чтобы избежать вертикальной передачи ВИЧ-инфекции.
На основании данных, полученных у животных, ожидается, что долутегравир будет выделяться у женщин с грудным молоком, хотя это и не было подтверждено у людей.
Применение при нарушениях функции печени
Пациентам с печеночной недостаточностью легкой или средней степени тяжести (класс А или В по шкале Чайлд-Пью) не требуется коррекции дозы. Отсутствуют данные относительно пациентов с тяжелой степенью печеночной недостаточности (класс С по шкале Чайлд-Пью) (см. раздел «Фармакокинетика» — «Особые группы пациентов»).
Применение при нарушениях функции почек
Пациентам с почечной недостаточностью легкой, средней или тяжелой степени тяжести (КК <30 мл/мин, не на диализе) не требуется коррекция дозы. Отсутствуют данные для пациентов, находящихся на диализе, но различий в фармакокинетике в данной популяции не ожидается (см. раздел «Фармакокинетика» — «Особые группы пациентов»).
Применение у детей
Недостаточно данных о безопасности и эффективности для рекомендации дозы препарата Тивикай® детям младше 12 лет или массой тела менее 40 кг.
Применение у пожилых пациентов
Данные о применении препарата Тивикай у пациентов в возрасте 65 лет и старше ограничены. Однако отсутствуют данные о необходимости коррекции дозы пожилым пациентам (см. раздел «Фармакокинетика» — «Особые группы пациентов»).
Особые указания
Реакции гиперчувствительности
При применении ИнИ, в том числе препарата Тивикай, регистрировались реакции гиперчувствительности, которые характеризовались сыпью, нарушением системных показателей и, иногда, нарушением функции органов, в том числе поражением печени. При возникновении признаков или симптомов гиперчувствительности (включая, но не ограничиваясь, сыпь тяжелой степени или сыпь, сопровождающуюся повышением температуры, общее недомогание, утомляемость, боль в мышцах или суставах, буллезные поражения, поражения слизистой оболочки полости рта, конъюнктивит, отек лица, гепатит, эозинофилию, ангионевротический отек) необходимо немедленно отменить применение препарата Тивикай и других лекарственных препаратов, которые могли бы вызвать подобные реакции. Необходимо контролировать клиническое состояние, в том числе показатели печеночных аминотрансфераз и провести соответствующую терапию. Промедление в прекращении лечения препаратом Тивикай* либо другими лекарственными препаратами, которые могли бы вызвать подобные реакции, после развития реакций гиперчувствительности может привести к состояниям, опасным для жизни.
Синдром восстановления иммунитета
У ВИЧ-инфицированных пациентов с тяжелым иммунодефицитом во время начала APTможет возникнуть воспалительная реакция на асимптоматические или остаточные оппортунистические инфекции, которая может вызвать серьезные клинические состояния либо усугубление симптомов. Как правило, такие реакции наблюдались в течение первых нескольких недель или месяцев после начала APT. Типичными примерами таких состояний являются цитомегаловирусный ретинит, генерализованные и/или очаговые микобактериальные инфекции и пневмония, вызванная Pneumocystis jiroveci (P. carinii). Необходимо без промедления оценивать любые воспалительные симптомы и, при необходимости, начинать лечение. Аутоиммунные заболевания (такие как болезнь Грейвса, полимиозит и синдром Гийена-Барре) наблюдались на фоне восстановления иммунитета, однако время первичных проявлений варьировало, и заболевание могло возникать через много месяцев после начала терапии и иметь атипичное течение. В начале терапии препаратом Тивикай у некоторых пациентов с ко-инфекцией гепатита В и/или С наблюдалось повышение активности ферментов печени, отражающие синдром восстановления иммунитета. Рекомендуется контролировать активность ферментов печени у пациентов с ко-инфекцией гепатита В и/или С. Необходим особенный контроль за началом или продолжением терапии гепатита В (согласно действующим руководствам) у пациентов, которым назначается лечение долутегравиром (см. раздел «Побочное действие»).
Оппортунистические инфекции
У пациентов, получающих препарат Тивикай или другую APT, могут развиться оппортунистические инфекции либо другие осложнения ВИЧ-инфекции. Таким образом, пациенты должны быть под тщательным клиническим наблюдением врача, с опытом лечения заболеваний, связанных с ВИЧ.
Передача инфекции
Пациентов необходимо уведомить о том, что не доказано предотвращение риска передачи ВИЧ другим лицам половым путем или через кровь при приеме доступной в настоящее время APT, в том числе препарата Тивикай. Необходимо продолжать предпринимать необходимые меры предосторожности.
Взаимодействие с другими лекарственными средствами
Не рекомендуется одновременное применение препарата Тивикай и этравирина, если пациент не получает одновременно атазанавир / ритонавир, лопинавир / ритонавир или дарунавир / ритонавир (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Рекомендованная доза препарата Тивикай составляет 50 мг 2 раза в сутки при одновременном применении с эфавирензем, невирапином, типранавиром / ритонавиром или рифампицином (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Тивикай не следует назначать вместе с антацидами, содержащими поливалентные катионы. Рекомендуется применять препарат Тивикай за 2 часа до или через 6 часов после применения данных средств (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Тивикай может повышать концентрации метформина. Необходимо осуществлять наблюдение за пациентами во время терапии, и может потребоваться коррекция доз метформина (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Резистентность к ингибиторам интегразы, имеющая особое значение
При принятии решения о применении долутегравира при наличии резистентности к ИнИ следует учитывать, что при этом значительно уменьшается активность долутегравира в отношении вирусных штаммов, несущих вторичные мутации Q148 + ≥2 в участках G140A/C/S, Е138А/К/Т, L74I. Степень, в которой долутегравир обеспечивает дополнительную эффективность при наличии такой резистентности к ИнИ, остается неясной.
Остеонекроз
Несмотря на то, что этиология данного заболевания является многофакторной (включая применение кортикостероидов, дифосфонатов, употребление алкоголя, тяжелую иммуносупрессию, высокий индекс массы тела), случаи остеонекроза чаще всего встречались у пациентов на поздней стадии ВИЧ-инфекции и/или длительно принимавших комбинированную APT. Пациентам следует обратиться к врачу, если они испытывают боли и скованность в суставах или трудности при движении.
Влияние на способность к управлению транспортными средствами и механизмами
Не проводились исследования влияния препарата Тивикай на способность к управлению транспортными средствами и работе с механизмами. Необходимо учитывать клиническое состояние пациента и профиль нежелательных явлений препарата Тивикай при рассмотрении способности пациента к вождению либо управлению механизмами.
Передозировка
Симптомы
Данные о передозировке препарата Тивикай ограничены.
Ограниченный опыт применения более высоких разовых доз (до 250 мг у здоровых добровольцев) не выявил никаких особых симптомов или признаков, кроме описанных в разделе «Побочное действие».
Лечение
Дальнейшее лечение должно проводиться в соответствии с клиническими показаниями либо рекомендациями национальных токсикологических центров, где это применимо. Отсутствует специфическое лечение передозировки препаратом Тивикай. В случае передозировки необходимо проводить поддерживающую терапию и соответствующее наблюдение. По причине высокого связывания долутегравира с белками плазмы крови, маловероятно, что его значительное количество может быть выведено при помощи диализа.
Лекарственное взаимодействие
Влияние долутегравира на фармакокинетику других препаратов
In vitro долутегравир демонстрирует отсутствие прямого ингибирования либо слабое ингибирование (IC50 > 50 цМ) изоферментов системы цитохрома Р450 CYP1A2, CYP2A6. CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 CYP3A, УДФ-ГТ1А1 или УДФ-ГТ2В7, либо переносчиков Pgp, BCRP, ОАТР1В1, ОАТР1ВЗ, ОСТ1 или MRP2. In vitro долутегравир не индуцирует изоферменты CYP1A2, CYP2B6 или CYP3A4. In vivo долутегравир не оказывает влияния на мидазолам, показатель активности CYP3A4. На основании этих данных не ожидается, что препарат Тивикай может повлиять на фармакокинетику лекарственных препаратов, которые являются субстратами данных ферментов или переносчиков (например, ингибиторы обратной транскриптазы или протеазы. абакавир, зидовудин, маравирок, опиоидные анальгетики, антидепрессанты, статины, азольные фунгициды, ингибиторы протонной помпы, препараты для лечения эректильной дисфункции, ацикловир, валацикловир, ситаглиптин, адефовир). В исследованиях взаимодействия с лекарственными препаратами долутегравир не оказывал клинически значимого эффекта на фармакокинетику следующих препаратов: тенофовир, метадон, эфавиренз, лопинавир, атазанавир, дарунавир, этравирин. фосампренавир, рилпивирин, телапревир и пероральных контрацептивов, содержащих норгестимат и этинилэстрадиол.
In vitro долутегравир ингибировал почечный ОСТ2. На основании этих наблюдений сделано заключение, что долутегравир может повышать концентрации лекарственных средств в плазме крови, выведение которых зависит от ОСТ2 (дофетилид, метформин) (см. таблицу 1).
Влияние других средств на фармакокинетику долутегравира
Долутегравир выводится, главным образом, путем метаболизма УДФ-ГТ1А1. Долутегравир также является субстратом УДФ-ГТ1АЗ, УДФ-ГТ1А9. CYP3A4, Pgp и BCRP; поэтому лекарственные препараты, которые индуцируют данные ферменты, теоретически могут снижать концентрацию долутегравира в плазме крови и уменьшать терапевтический эффект препарата Тивикай.
Одновременное применение препарата Тивикай и других лекарственных препаратов, которые ингибируют УДФ-ГТ1А1. УДФ-ГТ1 A3, УДФ-ГТ1А9, CYP3A4 и/или Pgp, может повысить концентрацию долутегравира в плазме крови (см. таблицу 1). Эфавиренз, невирапин, рифампицин и типранавир в сочетании с ритонавиром значительно снижали концентрации долутегравира в плазме крови и. поэтому необходима коррекция дозы препарата Тивикай до 50 мг 2 раза в сутки. Этравирин также снижал концентрации долутегравира в плазме крови, но эффект этравирина ослаблялся одновременным применением ингибиторов CYP3A4 лопинавира / ритонавира, дарунавира / ритонавира, и ожидается, что он ослабляется атазанавиром / ритонавиром. Таким образом, при одновременном применении долутегравира с этравирином и лопинавиром / ритонавиром, дарунавиром / ритонавиром, либо атазанавиром / ритонавиром коррекции дозы долутегравира не требуется. Другой индуктор, фосампренавир, в сочетании с ритонавиром, снижал концентрации долутегравира в плазме крови, но коррекции дозы препарата Тивикай не требуется. Необходимо соблюдать осторожность и осуществлять клиническое наблюдение при назначении данных комбинаций пациентам с устойчивостью к ингибиторам интегразы (см. таблицу 1). Исследование взаимодействия с ингибитором УДФ-ГТ1А1, атазанавиром, не показало клинически значимого повышения концентраций долутегравира в плазме крови. Тенофовир, ритонавир, лопинавир / ритонавир, дарунавир / ритонавир, рилпивирин, боцепревир, телапревир, преднизон, рифабутин и омепразол не оказали никакого эффекта либо оказали минимальный эффект на фармакокинетику долутегравира, поэтому при одновременном применении с данными лекарственными препаратами коррекции дозы препарата Тивикай не требуется.
Ряд взаимодействий с другими лекарственными препаратами представлен в таблице 1. Рекомендации основаны либо на исследованиях взаимодействия с другими лекарственными препаратами, либо на прогнозируемых взаимодействиях ввиду ожидаемой амплитуды взаимодействий и вероятности развития серьезных нежелательных явлений либо утраты эффективности.
Таблица 1. Взаимодействия с другими лекарственными препаратами
Сокращения: ↑ — повышение; ↓ — снижение; ↔ — отсутствие значительных изменений; Cmax — наблюдаемый максимум концентрации, Сt — концентрация в конце интервала между приемами лекарственного препарата.
Условия хранения препарата Тивикай®
Хранить при температуре не выше 30°С. Хранить в недоступном для детей месте.
Срок годности препарата Тивикай®
Условия реализации
По рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой желтого цвета; на одной стороне таблетки выдавлена надпись «SV 572», на другой стороне – «50».
Фармакотерапевтическая группа
Противовирусные средства для системного применения, прочие антивирусные средства.
Код ATX: J05AX12.
Фармакологические свойства
Фармакодинамика
Механизм действия
Долутегравир ингибирует интегразу ВИЧ, связываясь с активным участком интегразы и блокируя этап переноса цепей во время интеграции ретровирусной дезоксирибонуклеиновой кислоты (ДНК), который необходим для цикла репликации ВИЧ.
Фармакодинамические эффекты Противовирусная активность в клеточной культуре
Показатель IC50 (концентрация, ингибирующая репликацию на 50 %) долутегравира применительно к различным лабораторным штаммам с использованием мононуклеарных клеток периферической крови (МКПК) составил 0,5 нмоль, а при использовании клеток МТ-4 он находился в пределах 0,7–2 нмоль. Схожие показатели IC50 были получены применительно к клиническим изолятам без существенных различий между подтипами; применительно к панели из 24 ВИЧ-1 изолятов клад А, В, С, D, Е, F, G и группы О среднее значение IC50 составило 0,2 нмоль (диапазон 0,02–2,14). Для 3 изолятов ВИЧ-2 среднее значение IC50 составило 0,18 нмоль (диапазон от 0,09 до 0,61).
Противовирусная активность в сочетании с другими противовирусными препаратами
Антагонистические эффекты in vitro не отмечались при применении долутегравира и других тестированных антиретровирусных препаратов, таких как ставудин, абакавир, эфавиренз, невирапин, лопинавир, ампренавир, энфувиртид, маравирок и ралтегравир. Кроме этого, адефовир не проявлял антагонизма к долутегравиру, а рибавирин не влиял на эффективность долутегравира.
Влияние сыворотки крови человека
В присутствии 100 % сыворотки крови человека было продемонстрировано среднее обусловленное белком 75-кратное изменение, и откорректированное по связыванию с белком значение IC90 (концентрация, ингибирующая репликацию на 90 %) составило 0,064 мкг/мл.
Резистентность
Резистентность in vitro
Серийный пассаж применяется для изучения развития резистентности in vitro. В течение 112-дневного пассажа лабораторного штамма ВИЧ-1 IIIB мутации появлялись медленно с заменами в позициях S153Y и S153F, что в результате привело к максимальному 4-кратному изменению чувствительности (диапазон 2–4). Селекции мутаций не было у пациентов, получавших долутегравир в ходе клинических исследований. С использованием штамма NL432 были получены мутации E92Q (КИ [кратность изменения] 3) и G193E (также КИ 3). Мутация E92Q была получена у пациентов с уже существовавшей резистентностью к ралтегравиру, которые затем получали долутегравир (данная мутация указана как вторичная мутация применительно к долутегравиру).
В дальнейших экспериментах с селекцией с использованием клинических изолятов подтипа В мутация R263K наблюдалась во всех пяти изолятах (начиная с 20-й недели). В изолятах подтипов С (n = 2) и А/G (n = 2) замена интегразы R263K была получена в одном изоляте, a G118R – в двух изолятах. Мутация R263K отмечалась у двух ранее получавших APT (антиретровирусная терапия) и не получавших ИИ (ингибиторы интегразы) пациентов с подтипами В и С в рамках клинической программы без какого-либо влияния на чувствительность долутегравира in vitro. Мутация G118R снижает восприимчивость к долутегравиру в сайт-направленных мутантах (КИ 10), но у пациентов, получающих долутегравир в рамках программы Фазы III, она не была выявлена.
Первичные мутации применительно к ралтегравиру/элвитегравиру (Q148H/R/K, N155H, Y143R/H/C, E92Q и T66I) как одиночные мутации не влияют in vitro на чувствительность долутегравира. Добавление мутаций, указанных в качестве вторичных и связанных с применением ингибиторов интегразы (ралтегравир/элвитегравир), к данным первичным мутациям в экспериментах с сайт-направленными мутантами, не влияет на чувствительность долутегравира (КИ < 2 в сравнении с вирусом дикого типа), за исключением случая с мутациями Q148, в котором КИ составляет 5–10 или выше при комбинациях определенных вторичных мутаций. Влияние мутаций Q148 (H/R/K) было проверено в экспериментах с пассажем с сайт-направленными мутантами. В серийном пассаже с использованием штамма NL432, начиная с сайт-направленных мутантов, содержащих мутации N155H или E92Q, дальнейшая селекция резистентности не отмечалась (КИ около 1, без изменений). В отличие от этого, начиная с мутантов, содержащих мутацию Q148H (КИ 1), отмечался ряд вторичных мутаций с последующим увеличением КИ до показателей >10.
Значимое с клинической точки зрения фенотипическое пороговое значение (КИ в сравнении с вирусом дикого типа) не было определено; лучшим прогностическим фактором была генотипическая резистентность.
Семьсот пять резистентных к ралтегравиру изолятов от принимающих ралтегравир пациентов были проанализированы на предмет чувствительности к долутегравиру. Долутегнавир проявил КИ ≤ 10 в отношении 94 % клинических изолятов из 705.
Резистентность in vivo
У ранее не леченных пациентов, получавших долутегравир + 2 НИОТ (нуклеозидный ингибитор обратной транскриптазы) в рамках исследований Фазы IIb и Фазы III, развитие резистентности к препаратам класса ингибиторов интегразы или НИОТ не отмечалось (n = 1118, последующее наблюдение в течение 48–96 недель).
У пациентов с предшествующей неэффективной терапией, не получавших ранее терапии ингибиторами интегразы (исследование SAILING), замены ингибиторов интегразы имели место у 4 пациентов из 354, получавших долутегравир (последующее наблюдение в течение 48 недель), который применялся в комбинации с назначенным исследователем режимом фоновой терапии (РФТ). Из 4 пациентов у 2 наблюдалась уникальная замена R263K в гене интегразы с максимальным КИ 1.93, у 1 пациента наблюдалась полиморфная замена V151V/I интегразы с максимальным КИ 0.92, еще у 1 пациента мутации интегразы имели место изначально, в связи с чем предполагается, что он ранее получал ингибиторы интегразы или был инфицирован устойчивым к ингибиторам интегразы вирусом. Мутация R263K была также получена in vitro (см. выше).
При наличии резистентности к препаратам класса ингибиторов интегразы (исследование VIKING-3) следующие мутации были получены у 32 пациентов с установленной протоколом вирусологической неэффективностью (УПВН) за 24 недели и с парными генотипами (все получали долутегравир 50 мг два раза в сутки + оптимизированная фоновая терапия): L74L/M (n = 1), E92Q (n = 2), Т97А (n = 9), Е138К/А/Т (n = 8), G140S (n = 2), Y143H (n = 1), S147G (n = 1), Q148H/K/R (n = 4), N155H (n = 1) и E157E/Q (n = 1). Возникающая во время лечения резистентность к ингибиторам интегразы, как правило, имела место у пациентов с мутацией Q148 на исходном уровне или в анамнезе. Еще у пяти испытуемых УПВН была отмечена на отрезке времени между 24-й и 48-й неделями, при этом у 2 испытуемых из этих 5 имели место мутации, возникшие во время лечения. Наблюдавшиеся связанные с лечением мутации или сочетания мутаций были следующие: L74I (n = 1), N155H (n = 2).
В исследовании VIKING-4 изучалось применение долутегравира (совместно с оптимизированной фоновой терапией) у 30 пациентов с первичной генотипической резистентностью к ингибиторам интегразы на этапе скрининга. Мутации, наблюдаемые во время лечения, были сопоставимы с таковым в исследовании VIKING-3.
Влияние на показатели электрокардиограммы
Существенное влияние на интервал QTc при применении доз, превышающих клиническую дозу примерно в три раза, не наблюдалось.
Клиническая эффективность и безопасность
Ранее не леченные пациенты
Оценка эффективности применения долутегравира у ВИЧ-инфицированных «наивных» испытуемых основана на анализе данных за 96 недель, полученных в ходе двух рандомизированных международных двойных слепых исследований с активным контролем SPRING-2 (ING113086) и SINGLE (ING114467). Эта оценка была подтверждена данными за 96 недель, полученными в ходе открытого рандомизированного исследования с активным контролем без контроля плацебо FLAMINGO (ING114915), а также дополнительными данными из открытой фазы исследования SINGLE продолжительностью до 144 недель.
В исследовании SPRING-2 822 взрослых испытуемых были рандомизированы для получения минимум одной дозы либо долутегравира 50 мг один раз в сутки, либо ралтегравира (RAL) 400 мг два раза в сутки, оба препарата принимались совместно с АВС/3ТС (абакавир/ламивудин) или TDF/FTC (тенофовир/эмтрицитабин). Исходно медиана возраста участников составляла 36 лет, 14 % пациентов были женского пола, 15 % испытуемых не принадлежали к европеоидной расе, у 11 % участников было зафиксировано коинфицирование гепатитом В и/или С и у 2 % участников исследования отмечено наличие CDC (комплементзависимая цитотоксичность) класса С, указанные характеристики в группах терапии были схожими.
В исследовании SINGLE 833 участника были рандомизированы для получения минимум одной дозы либо долутегравира 50 мг один раз в сутки в сочетании с комбинацией с фиксированной дозой абакавир–ламивудин (DTG + АВС/3ТС), либо с комбинацией с фиксированной дозой эфавиренз–тенофовир–эмтрицитабин (EFV/TDF/FTC). Исходно медиана возраста участников составила 35 лет, 16 % пациентов были женского пола, 32 % испытуемых не принадлежали к европеоидной расе, у 7 % участников было зафиксировано коинфицирование гепатитом С, и у 4 % участников исследования отмечено наличие CDC класса С, указанные характеристики в группах терапии были схожими.
Первичная конечная точка и другие исходы в отметке времени 48-я неделя (включая исходы по ключевым исходным ковариатам) по материалам исследований SPRING-2 и SINGLE представлены в Таблице 1.
Таблица 1 Ответ в исследованиях SPRING-2 и SINGLE в отметке времени 48-я неделя (алгоритм моментального снимка , <50 копий /мл)
| SPRING-2 | SINGLE | |||
| Долутегравир 50 мгодин раз в сутки + 2 НИОТN = 411 | RAL 400 мгдва раза в сутки + 2 НИОТN = 411 | Долутегравир 50 мг + АВС/3ТСодин раз в суткиN = 414 | EFV/TDF/FTCодин раз в суткиN = 419 | |
| РНК ВИЧ-1 < 50 копий/мл | 88 % | 85 % | 88 % | 81 % |
| Расхождение в зависимости от вида терапии * | 2,5 % (95 % ДИ: –2,2 %, 7,1 %) | 7,4 % (95 % ДИ: 2,5 %, 12,3 %) | ||
| Отсутствие вирусологического отклика † | 5 % | 8 % | 5 % | 6 % |
| РНК ВИЧ-1 < 50 копий /мл по исходным ковариатам | ||||
| Вирусная нагрузка на исходном уровне (копий/мл) | ||||
| ≤100000≥100000 | 267/297 (90 %)94/114 (82 %) | 264/295 (89 %)87/ 116(75 %) | 253/280 (90 %)111/134 (83 %) | 238/288 (83 %)100/ 131 (76 %) |
| CD4+ (клеток/мм3) на исходном уровне | ||||
| <200От 200 до <350≥350 | 43/55 (78 %)128/144 (89 %)190/212(90 %) | 34/50 (68 %)118/139 (85 %)199/222 (90 %) | 45/57 (79 %)143/163 (88 %)176/194(91 %) | 48/62 (77 %)126/159 (79 %)164/198 (83 %) |
| НИОТ основа | ||||
| АВС/3ТС | 145/169 (86 %) | 142/164 (87 %) | Н/П | Н/П |
| TDF/FTC | 216/242 (89 %) | 209/247 (85 %) | Н/П | Н/П |
| Пол участников исследования | ||||
| Мужской | 308/348 (89 %) | 305/355 (86 %) | 307/347 (88 %) | 291/356 (82 %) |
| Женский | 53/63 (84 %) | 46/56 (82 %) | 57/67 (85 %) | 47/63 (75 %) |
| Расовая принадлежность | ||||
| Европеоидная раса | 306/346 (88 %) | 301/352 (86 %) | 255/284 (90 %) | 238/285 (84 %) |
| Афро-американцы/Другие | 55/65 (85 %) | 50/59 (85 %) | 109/130(84 %) | 99/133 (74 %) |
| Возраст (лет) | ||||
| <50 | 324/370 (88 %) | 312/365 (85 %) | 319/361 (88 %) | 302/375 (81 %) |
| ≥50 | 37/41 (90 %) | 39/46 (85 %) | 45/53 (85 %) | 36/44 (82 %) |
| Медиана изменения CD4 от исходного уровня | 230 | 230 | 246‡ | 187‡ |
| _________________________________________НИОТ = нуклеозидные ингибиторы обратной транскриптазыН/П = не применимо* Показатель откорректирован по исходным факторам стратификации.† Включая испытуемых, у которых РФТ был изменен на другой класс или измененный РФТ не разрешен протоколом или в связи с отсутствием эффективности в период до Недели 18 (только в исследовании SPRING-2), а также испытуемые, которые прекратили участие в исследовании до Недели 48 в связи с отсутствием или ослаблением эффективности, и испытуемые, у которых отмечено ≥50 копий в течение 48 недель.‡ Откорректированный показатель среднего расхождения в зависимости от вида терапии был статистически значимым (р < 0,001). |
В отметке времени Неделя 48 долутегравир продемонстрировал не меньшую эффективность в сравнении с ралтегравиром в исследовании SPRING-2, а в исследовании SINGLE терапия долутегравир + АВС/3ТС показала лучшие результаты в сравнении с терапией эфавиренз/TDF/FTC (р = 0,003), смотрите Таблицу 1 выше. В исследовании SINGLE медиана времени до наступления вирусной супрессии была короче у пациентов, получавших долутегравир (28 дней в сравнении с 84 днями (р < 0,0001).
В отметке времени Неделя 96 результаты были сопоставимыми с данными, полученными в отметке времени Неделя 48. В исследовании SPRING-2 долутегравир по-прежнему демонстрировал не меньшую эффективность в сравнении с ралтегравиром (вирусная супрессия у 81 % пациентов в сравнении с 76 % пациентов), при медиане изменения числа CD4: 276 клеток/мм3 в сравнении с 264 клеток/мм3, соответственно. В исследовании SINGLE терапия долутегравир + АВС/3ТС по-прежнему демонстрировала лучшие результаты в сравнении с терапией EFV/TDF/FTC (вирусная супрессия у 80 % пациентов в сравнении с 72 % пациентов, расхождение в зависимости от вида терапии 8,0 % (2,3, 13,8), р = 0,006, при медиане изменения числа CD4: 325 клеток/мм3 в сравнении с 281 клеток/мм3, соответственно. В отметке времени неделя 144 в открытой фазе исследования SINGLE сохранялась вирусная супрессия, при этом результаты в группе долутегравир + АВС/3ТС (71 %) были лучше, по сравнению с группой терапии EFV/TDF/FTC (63 %), показатель разницы в методах лечения составил 8,3 % (2,0, 14,6).
В исследовании FLAMINGO (ING114915), открытом рандомизированном исследовании с активным контролем, 484 взрослых испытуемых, инфицированных ВИЧ-1, не проходивших ранее антиретровирусной терапии, получали либо долутегравир 50 мг один раз в сутки (n = 242) либо дарунавир/ритонавир (DRV/r) 800 мг/100 мг один раз в сутки (n = 242), оба препарата принимались совместно с АВС/3ТС или TDF/FTC. Исходно медиана возраста участников составляла 34 года, 15 % пациентов были женского пола, 28 % испытуемых не принадлежали к европеоидной расе, у 10 % участников было зафиксировано коинфицирование гепатитом В и/или С и у 3 % участников исследования отмечено наличие CDC класса С, указанные характеристики в группах терапии были схожими. Вирусная супрессия (РНК ВИЧ-1 < 50 копий/мл) в группе долутегравира (90 %) была лучше в сравнении с группой DRV/r (83 %) в отметке времени 48-я неделя. Откорректированное пропорциональное различие и 95 % ДИ составили 7,1 % (0,9, 13,2), р = 0,025. В отметке времени неделя 96 вирусная супрессия в группе долутегравира (80 %) превышала таковую в группе DRV/r (68 %) (скорректированный показатель разницы в методах лечения [DGT-(DRV+RTV)] составил 12.4 %; 95 % доверительный интервал: [4,7, 20,2]).
Резистентность, развившаяся в ходе терапии у ранее не леченных пациентов, и отсутствие эффективности терапии
На протяжении 96 недель в исследованиях SPRING-2 и FLAMINGO и 144 недель в исследовании SINGLE не было отмечено случаев появления в ходе лечения первичной резистентности к ингибиторам интегразы или НИОТ в группах терапии долутегравиром. Что касается групп терапии, получавших препарат сравнения, отсутствие связанной с лечением резистентности было также отмечено у пациентов, получавших дарунавир/r, в исследовании FLAMINGO. В исследовании SPRING-2 терапия оказалась неэффективной для четырех пациентов в группе RAL с мутациями применительно к НИОТ и для одного пациента – с резистентностью к ралтегравиру; в исследовании SINGLE терапия оказалась неэффективной для шестерых участников в группе EFV/TDF/FTC с мутациями, связанными с резистентностью к ННИОТ (ненуклеозидные ингибиторы обратной транскриптазы), также у одного испытуемого появилась мутация применительно к НИОТ.
Пациенты с предшествующей неэффективностью лечения, не принимавшие ингибиторы интегразы
В международном многоцентровом двойном слепом исследовании SAILING (ING111762), 719 взрослых пациентов, инфицированных ВИЧ-1, ранее получавших антиретровирусную терапию (АРВТ), были рандомизированы для получения долутегравира 50 мг один раз в сутки или ралтегравира 400 мг два раза в сутки, в качестве режима фоновой терапии исследователи выбрали терапию с применением не более 2 веществ (включая минимум одно в полной мере активное вещество). Исходно медиана возраста участников составляла 43 года, 32 % пациентов были женского пола, 50 % испытуемых не принадлежали к европеоидной расе, у 16 % участников было зафиксировано коинфицирование гепатитом В и/или С, и у 46 % участников исследования отмечено наличие CDC класса С. Исходно у всех пациентов была устойчивость минимум к двум классам АРВТ, а у 49 % испытуемых – устойчивость минимум к трем классам АРВТ.
Исходы в отметке времени Неделя 48 (включая исходы по ключевым исходным ковариатам) по материалам исследования SAILING представлены в Таблице 2.
Таблица 2 Ответ в исследовании SAILING в отметке времени Неделя 48 (алгоритм моментального снимка, <50 копий /мл)
| Долутегравир 50 мгодин раз в сутки,N=354§ | RAL 400 мгдва раза в сутки + РФТ,N=361 § | |
| РНК ВИЧ-1 <50 копий/мл | 71 % | 64 % |
| Откорректированное расхождение в зависимости от вида терапии ‡ | 7,4 % (95 % ДИ: 0,7 %, 14,2 %) | |
| Отсутствие вирусологического отклика | 20 % | 28 % |
| РНК ВИЧ-1 < 50 копий /мл по исходным ковариатам | ||
| Вирусная нагрузка на исходном уровне (копий/мл) | ||
| ≤ 50000 копий/мл | 186/249 (75 %) | 180/254 (71 %) |
| > 50000 копий/мл | 65/105 (62 %) | 50/107 (47 %) |
| CD4+ (клеток/ мм3) на исходном уровне | ||
| <50 | 33/62 (53 %) | 30/59 (51 %) |
| От 50 до < 200 | 77/111 (69 %) | 76/ 125 (61 %) |
| От 200 до < 350 | 64/82 (78 %) | 53/79 (67 %) |
| ≥350 | 77/99 (78 %) | 71/98 (72 %) |
| Режим фоновой терапии | ||
| Генотипический индекс чувствительности *<2 | 155/216 (72 %) | 129/192 (67 %) |
| Генотипический индекс чувствительности *=2 | 96/138 (70 %) | 101/169 (60 %) |
| Применение DRV (дарунавир) в режиме фоновой терапии | ||
| DRV не применяется | 143/214 (67 %) | 126/209 (60 %) |
| Применение DRV с первичными мутациями применительно к ИП | 58/68 (85 %) | 50/75 (67 %) |
| Применение DRV без первичных мутаций применительно к ИП | 50/72 (69 %) | 54/77 (70 %) |
| Пол участников исследования | ||
| Мужской | 172/247 (70 %) | 156/238 (66 %) |
| Женский | 79/ 107 (74 %) | 74/ 123 (60 %) |
| Расовая принадлежность | ||
| Европеоидная раса | 133/178 (75 %) | 125/175 (71 %) |
| Афро-американцы/Другие | 118/ 175 (67 %) | 105/185 (57 %) |
| Возраст (лет) | ||
| <50 | 196/269 (73 %) | 172/277 (62 %) |
| >50 | 55/85 (65 %) | 58/84 (69 %) |
| Подтип ВИЧ | ||
| Клада В | 173/241 (72 %) | 159/246 (65 %) |
| Клада С | 34/55 (62 %) | 29/48 (60 %) |
| Другие† | 43/57 (75 %) | 42/67 (63 %) |
| Среднее увеличение числа CD4+ Т клеток (клетки/мм3) | 162 | 153 |
| ‡ Показатель откорректирован по исходным факторам стратификации.§ 4 участника были исключены из анализа эффективности по причине наличия расхождений в данных в одном исследовательском центре.* Генотипический индекс чувствительности (ГИЧ) определялся как общее число видов АРВТ в РФТ, к которым вирусный изолят пациента проявлял чувствительность на исходном уровне на основании тестов на генотипическую резистентность.† Другие клады включали: Complex (43). F1 (32), А1 (18), BF (14), все прочие < 10. |
В исследовании SAILING показатель вирусной супрессии (РНК ВИЧ-1 < 50 копий /мл) в группе, получавшей препарат Тивикай (71 %), был статистически выше, чем в группе, получавшей ралтегравир (64 %), в отметке времени Неделя 48 (р = 0,03).
В группе, получавшей препарат Тивикай, для меньшего числа испытуемых терапия была неэффективной при наличии связанной с лечением резистентности к ингибиторам интегразы (4/354, 1 %), в сравнении с группой, получавшей ралтегравир (17/361, 5 %) (р = 0,003) (более подробно смотрите выше раздел «Резистентность in vivo»).
Пациенты с опытом предшествующей неэффективной терапии, которая включала применение ингибитора интегразы (и резистентность к препаратам класса ингибиторов интегразы)
В многоцентровом открытом несравнительном исследовании VIKING-3 (ING112574) взрослые участники, инфицированные ВИЧ-1, которые ранее получали АРВТ и у которых отмечалась вирусологическая неэффективность лечения и резистентность к ралтегравиру и/или элвитегравиру на момент проведения исследования или в анамнезе, получали препарат Тивикай 50 мг два раза в сутки, при этом в течение 7 дней применялся режим текущей неэффективной фоновой терапии, с последующей, начиная с Дня 8, оптимизацией фоновой АРВТ. В исследование было включено 183 пациента: 133 участника с резистентностью к ИИ (ингибиторам интегразы) на этапе скрининга и 50 участников – только с информацией о резистентности в анамнезе (не на этапе скрининга). Применение ралтегравира/элвитегравира было частью режима текущей неэффективной терапии у 98/183 пациентов (частью предшествующей неэффективной терапии у других пациентов). Исходно медиана возраста участников составила 48 лет, 23 % испытуемых были женского пола, 29 % испытуемых не принадлежали к европеоидной расе и у 20 % участников исследования было зафиксировано коинфицирование гепатитом В и/или С. Исходно медиана CD4+ составила 140 клеток/мм3, медиана продолжительности предшествующей АРВТ равнялась 14 годам, у 56 % участников исследования было отмечено наличие CDC класса С. У испытуемых отмечалась множественная резистентность к разным классам АРВТ на исходном уровне: у 79 % пациентов – резистентность к ≥2 НИОТ, у 75 % пациентов – резистентность к ≥1 ННИОТ и у 71 % пациентов отмечалось ≥2 мутаций применительно к ИП (ингибиторам протеазы); у 62 % пациентов был обнаружен вирус, отличный от R5. Среднее изменение показателей РНК ВИЧ в сравнении с исходным уровнем в отметке времени День 8 (первичная конечная точка) составило –1,4 log10 копий/мл (95 % ДИ –1,3 – –1,5 log10, p < 0,001). Ответ был связан с типом мутации применительно к ИИ на исходном уровне, как показано в Таблице 3.
Таблица 3 Вирусологический ответ (День 
| Исходные параметры | Долутегравир (DTG) 50 мгдва раза в сутки N=88* | ||
| n | Среднее (стандартное отклонение) содержание РНК ВИЧ-1 в плазме log10 копий/мл | Медиана | |
| Группа пациентов с полученной мутацией применительно к ИИ на исходном уровне с продолжающейся терапией RAL/EVG (ралтегравир/элвитегравир) | |||
| Первичная мутация отличная от Q148H/K/Ra | 48 | –1,59 (0,47) | –1,64 |
| Q148+1 вторичная мутацияb | 26 | –1,14(0,61) | –1,08 |
| Q148+ ≥2 вторичные мутацииb | 14 | –0,75 (0,84) | –0,45 |
| * Из 98 участников исследования, получавших RAL/EVG в составе режима текущей неэффективной терапии, у 88 человек отмечены поддающиеся обнаружению первичные мутации применительно к ИИ на исходном уровне, а также в отметке времени День 8 определено содержание РНК ВИЧ-1 в плазме в качестве исхода для проведения оценки.а Включая первичные мутации применительно к резистентности к ИИ: N155H, Y143C/H/R, Т66А, E92Q.b Вторичные мутации от G140A/C/S, Е138А/К/Т, L74I. |
У пациентов, у которых не были выявлены поддающиеся обнаружению первичные мутации на исходном уровне (N=60) (то есть применение RAL/EVG не было частью текущей неэффективной терапии) отмечено 1,63 log10 снижение вирусной нагрузки в отметке День 8.
По окончании фазы функциональной монотерапии фоновая терапия была оптимизирована у тех участников исследования, у которых это было возможно. Общая частота ответа, зафиксированная на протяжении 24 недель терапии, 69 % (126/183), в целом оставалась устойчивой и в течение 48 недель, при том, что у 116/183 (63 %) пациентов отмечался уровень РНК ВИЧ-1 < 50 копии/мл (ITT-E, алгоритм моментального снимка). После исключения пациентов, которые прекратили терапию, поскольку она была неэффективной, а также тех участников исследования, которые допустили значительные отклонения от протокола (прием неточной дозы долутегравира, одновременное применение запрещённых препаратов), вошедших в «Популяцию вирусологического исхода (ВИ)», соответствующие показатели частоты отклика составили 75 % (120/161, Неделя 24) и 69 % (111/160, Неделя 48).
Показатель частоты ответа был ниже в случае наличия мутации Q148 исходно и в особенности при наличии ≥2 вторичных мутаций, смотрите Таблицу 4. Общий индекс чувствительности (ОИЧ) при оптимизированном режиме фоновой терапии (ОРФТ) не был связан с ответом на лечение ни в отметке Неделя 24, ни в отметке Неделя 48.
Таблица 4 Ответ с учетом резистентности на исходном уровне, исследование VIKING— 3. Популяция ВИ (РНК ВИЧ-1 < 50 копий/мл, алгоритм моментального снимка)
| Неделя 24(N=161) | Неделя 18(N=160) | |||||
| Группа с полученной мутацией применительно к ИИ | ОИЧ = 0 | ОИЧ = 1 | ОИЧ = 2 | ОИЧ > 2 | Всего | Всего |
| Без первичной мутации применительно к ИИ1 | 2/2(100 %) | 15/20(75 %) | 19/21(90 %) | 9/12(75 %) | 45/55(82 %) | 38/55(69 %) |
| Первичная мутация отличная от Q148H/K/R2 | 2/2(100 %) | 20/20(100 %) | 21/27(78 %) | 8/10(80 %) | 51/59(86 %) | 50/58(86 %) |
| Q148H + 1 вторичная мутация3 | 2/2(100 %) | 8/12(67 %) | 10/17(59 %) | – | 20/31(65 %) | 19/31(61 %) |
| Q148H + ≥2 вторичных мутаций3 | 1/2(50 %) | 2/11(18 %) | 1/3(33 %) | – | 4/16(25 %) | 4/16(25 %) |
| 1 Резистентность только к ИИ, фенотипическая или в анамнезе.2 N155H, Y143C/H/R, Т66А, E92Q.3 Вторичные мутации от G140A/C/S, Е138А/К/Т, L74I.ОИЧ: комбинированный показатель генотипической и фенотипической резистентности (оценка базы данных Monogram Biosciences). |
Медиана изменения числа CD4+ Т клеток от исходного уровня в исследовании VIKING-3 составила 61 клеток/мм3 в отметке времени Неделя 24 и 110 клеток/мм3 в отметке времени Неделя 48.
В двойном слепом исследовании с контролем плацебо VIKING-4 (ING116529) 30 взрослых участников, инфицированных ВИЧ-1, с первичной генотипической резистентностью к ИИ, выявленной на этапе скрининга, которым ранее проводилась АРВТ, были рандомизированы для приема долутегравира 50 мг два раза в сутки или плацебо при текущем режиме неэффективной терапии в течение 7 дней, за которыми следовала немаскированная фаза, в течение которой все участники получали долутегравир. На исходном уровне медиана возраста участников составила 49 лет, 20 % испытуемых были женщины, 58 % испытуемых не принадлежали к европеоидной расе и у 23 % участников исследования было зафиксировано коинфицирование гепатитом В и/или С. Исходно медиана CD4+ составила 160 клеток/мм3, медиана продолжительности предшествующей АРВТ равнялась 13 годам, у 63 % участников исследования было отмечено наличие CDC класса С. У пациентов отмечалась множественная резистентность к разным классам АРВТ на исходном уровне: у 80 % пациентов – резистентность к ≥2 НИОТ, у 73 % пациентов – резистентность к ≥1 ННИОТ и у 67 % пациентов отмечалось ≥2 мутаций применительно к ИП (ингибиторам протеазы); у 83 % пациентов был обнаружен вирус, отличный от R5. У 16 из 30 пациентов (53 %) исходно имелся вирус Q148. Первичная конечная точка в отметке времени День 8 свидетельствовала, что применение долутегравира 50 мг два раза в сутки было более эффективным в сравнении с плацебо; откорректированный показатель среднего расхождения в зависимости от вида терапии в отношении изменения содержания РНК ВИЧ-1 в плазме в сравнении с исходным уровнем составил –1,2 log10 копий/мл (95 % ДИ –1,5 – –0,8 log10 копий/мл, р < 0,001). Ответы в отметке День 8 в исследовании с контролем плацебо полностью соответствовали результатам, полученным в исследовании VIKING-3 (без контроля плацебо), включая данные по категориям резистентности к ингибиторам интегразы на исходном уровне. На неделе 48 у 12 из 30 (40 %) пациентов наблюдался уровень РНК ВИЧ-1 < 50 копий/мл (ITT-E, алгоритм моментального снимка).
В объединенном анализе результатов исследований VIKING-3 и VIKING-4 (n = 186, популяция ВИ) соотношение пациентов с РНК ВИЧ-1 < 50 копий/мл на неделе 48 составило 123/186 (66 %). РНК ВИЧ-1 < 50 копий/мл наблюдалось у 96/126 (76 %) пациентов с отсутствием мутации Q148, 22/41 (54 %) – у пациентов с мутацией Q148 + 1 вторичной мутацией и 5/19 (26 %) – у пациентов с мутацией Q148 + ≥2 вторичными мутациями.
Пациенты детского возраста
В многоцентровом открытом исследовании Фазы I/II продолжительностью 48 недель (P1093/ING112578) будет проводиться изучение фармакокинетических параметров, безопасности, переносимости и эффективности препарата Тивикай в режимах комбинированной терапии у подростков, инфицированных ВИЧ-1.
В отметке времени Неделя 24 16 подростков из 23 (70 %) (12 – <18 лет), получавшие терапию препаратом Тивикай один раз в сутки (35 мг n =4, 50 мг n =19) плюс ОРФТ, достигли вирусной нагрузки < 50 копий/мл.
У четырех участников исследования отмечена вирусологическая неэффективность, ни у одного из указанных пациентов не было резистентности к ИИ ко времени установления вирусологической неэффективности.
Европейское агентство по контролю за оборотом лекарственных средств отсрочило обязательство предоставлять результаты исследований применения препарата Тивикай у педиатрических пациентов в возрасте от 4 недель до менее 12 лет с ВИЧ инфекцией (информацию о применении у педиатрических пациентов смотрите в разделе «Способ применения и дозировка»).
Фармакокинетика
Фармакокинетика долутегравира схожа у здоровых добровольцев и ВИЧ-инфицированных пациентов. Вариабельность фармакокинетики (ФК) долутегравира классифицируется от низкой до умеренной. В исследованиях Фазы I с участием здоровых добровольцев коэффициент вариации среди участников CVb % для AUC и Сmах изменялся от ~20 до 40 %, а Сτ (концентрация в конце интервала между приемами лекарственного средств) – от 30 до 65 % во всех исследованиях. Вариабельность ФК долутегравира между участниками была выше у ВИЧ-инфицированных пациентов, чем у здоровых добровольцев. Индивидуальная вариабельность (CVw %) ниже вариабельности между индивидуумами.
Всасывание
Долутегравир быстро абсорбируется после приема внутрь препарата в форме таблетки, медиана Тmах составляет 2–3 час.
Пища повышает степень всасывания долутегравира и снижает его скорость. Биодоступность долутегравира зависит от содержания пищи: при приеме пищи с низким, умеренным и высоким содержанием жиров показатель AUС(0–∞) долутегравира увеличивался на 33 %, 41 % и 66 %, значение Сmах увеличивалось на 46 %, 52 % и 67 %, Тmах удлинялось до 3, 4 и 5 часов по сравнению с 2 часами при приеме препарата натощак, соответственно. Указанные увеличения показателей могут иметь клиническое значение в случае наличия резистентности к определенному ингибитору интегразы. Ввиду этого ВИЧ- инфицированным пациентам с резистентностью к препаратам класса ингибиторов интегразы рекомендуется принимать препарат Тивикай с пищей (смотрите раздел «Способ применения и дозировка»).
Абсолютная биодоступность долутегравира не установлена.
Распределение
Согласно данным, полученным in vitro, долутегравир в значительной степени (>99 %) связывается с белками плазмы крови человека. По материалам популяционного анализа фармакокинетики, у пациентов, инфицированных ВИЧ, кажущийся объем распределения составляет от 17 л до 20 л. Связывание долутегравира с белками плазмы крови не зависит от концентрации долутегравира. Соотношения общей концентрации радиоактивно меченого препарата в крови и плазме составили от 0,441 до 0,535, что указывает на минимальную связь радиоактивности с клеточными компонентами крови. Свободная фракция долутегравира в плазме крови увеличивается при низких уровнях сывороточного альбумина (<35 г/л), что наблюдается у пациентов с печеночной недостаточностью умеренной степени тяжести.
Долутегравир проникает в спинномозговую жидкость (СМЖ). У 13 ранее не леченных пациентов, получавших по неизменяемой схеме долутегравир плюс абакавир/ламивудин, концентрация долутегравира в СМЖ составила в среднем 18 нг/мл (сопоставимо с концентрацией свободного препарата в плазме и выше IC 50).
Долутегравир присутствует в мужских и женских половых органах. Показатель AUC в цервико-вагинальной жидкости, цервикальной и вагинальной тканях составил 6–10 % от аналогичного показателя в плазме крови в равновесном состоянии. Показатель AUC в семенной жидкости составил 7 %, а в тканях прямой кишки – 17 % от аналогичного показателя в плазме крови при равновесной концентрации.
Биотрансформация
Долутегравир главным образом метаболизируется путем глюкуронидации через UGT1А1 с незначительным компонентом CYP3A. Долутегравир является основным соединением, циркулирующим в плазме крови; выведение активной субстанции в неизмененном виде через почки незначительное (<1 % дозы). 53 % общей дозы, принятой перорально, выводится в неизмененном виде через кишечник. Неизвестно, полностью или частично это связано с неполным всасыванием лекарственного препарата или с выведением с желчью глюкуронидного конъюгата, который дальше может распадаться до образования родственных соединений в просвете кишечника. 32 % общей дозы, принятой перорально, выводится с мочой в форме эфира глюкуронида долутегравира (18,9 % от общей дозы), N-деалкилированного метаболита (3,6 % от общей дозы) и метаболита, образованного путем окисления бензилового углерода (3,0 % от общей дозы).
Взаимодействие с другими лекарственными препаратами
In vitro долутегравир демонстрирует отсутствие прямого ингибирования либо слабое ингибирование (IC50 > 50 мкмоль) изоферментов системы цитохрома Р450 (CYP)1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 CYP3A, уридиндифосфат-глюкуронозилтрансферазы (UGT)lAl или UGT2B7, либо переносчиков Pgp, BCRP, BSEP, ОАТР1В1, ОАТР1В3, ОСТ1, МАТЕ2-К, MRP2 или MRP4. In vitro долутегравир не индуцировал изоферменты CYP1А2, CYP2B6 или CYP3A4. На основании этих данных не ожидается, что, долутегравир может повлиять на фармакокинетику лекарственных препаратов, которые являются субстратами основных ферментов или переносчиков (смотрите раздел «Взаимодействие с другими лекарственными средствами»).
In vitro долутегравир не являлся субстратом ОАТР1В1, ОАТР1В3 или ОСТ1 человека.
Выведение
Конечный период полувыведения долутегравира составляет ~14 часов. Кажущийся общий клиренс (CL/F) приблизительно 1 л/час у пациентов, инфицированных ВИЧ, по данным популяционного анализа фармакокинетики.
Линейность/нелинейность
Линейность фармакокинетики долутегравира зависит от дозировки и лекарственной формы. После приема внутрь таблетки долутегравир, как правило, проявлял нелинейную фармакокинетику, с менее чем дозозависимым повышением плазменной экспозиции с 2 до 100 мг, однако в интервале от 25 мг до 50 мг повышение экспозиции долутегравира является дозопропорциональным для лекарственной формы таблетка. При приеме 50 мг препарата два раза в сутки экспозиция на протяжении 24 часов увеличивалась примерно вдвое в сравнении с применением 50 мг один раз в сутки.
Фармакокинетические/фармакодинамические взаимодействия
В рандомизированном исследовании с целью определения оптимальной дозы у инфицированных ВИЧ-1 пациентов, которые получали монотерапию долутегравиром (ING111521), отмечалось быстрое и дозозависимое противовирусное действие, среднее снижение РНК ВИЧ-1 на 11 день составило 2,5 log10 при приеме 50 мг долутегравира. Данный противовирусный ответ поддерживался в течение 3–4 дней после приема последней дозы в группе пациентов, принимавших 50 мг долутегравира.
Моделирование фармакокинетики/фармакодинамики с использованием объединенных данных клинических исследований у пациентов с резистентностью к ингибиторам интегразы указывает на то, что увеличение дозы долутеравира с 50 мг 2 раза в сутки до 100 мг 2 раза в сутки может повысить эффективность долутегравира у пациентов с резистентностью к ингибиторам интегразы и ограниченными опциями лечения в связи с наличием распространенной множественной резистентности к различным классам. Предполагалось, что пропорциональное число ответов на лечение (РНК ВИЧ-1 < 50 копий/мл) на неделе 24 увеличится на 4–18 % у пациентов с мутацией Q148 + ≥2 вторичными мутациями из G140A/C/S, Е138А/К/Т, L74I. Несмотря на то, что данные результаты не были подтверждены в клинических исследованиях, назначение данной увеличенной дозы может рассматриваться у пациентов с наличием мутации Q148 + ≥2 вторичных мутаций из G140A/C/S, Е138А/К/Т, L74I, для которых ограничено количество возможных вариантов лечения в связи с наличием распространенной множественной резистентности к различным классам. Клинические данные по безопасности или эффективности приема долутегравира в дозе 100 мг 2 раза в сутки отсутствуют. Сопутствующее лечение атазанавиром значительно увеличивает экспозицию долутегравира. Атазанавир не следует применять с указанной высокой дозой долутегравира в связи с отсутствием данных по безопасности.
Особые группы пациентов
Дети
Данные фармакокинетики долутегравира у 10 ВИЧ-1-инфицированных подростков (в возрасте от 12 лет до < 18 лет), ранее получавших антиретровирусное лечение, показали, что при приеме 50 мг препарата Тивикай внутрь один раз в сутки экспозиция долутегравира была сопоставима с аналогичным показателем у взрослых пациентов, которые получали 50 мг препарата Тивикай внутрь один раз в сутки.
Пациенты пожилого возраста
Популяционный фармакокинетический анализ применения долутегравира с использованием данных, полученных у взрослых пациентов, инфицированных ВИЧ-1, показал отсутствие клинически значимого влияния возраста на экспозицию долутегравира.
Данные о фармакокинетике долутегравира при применении у пациентов старше 65 лет ограничены.
Пациенты с почечной недостаточностью
Почечный клиренс неизмененного активного вещества является второстепенным путем выведения долутегравира. Было проведено исследование фармакокинетики долутегравира у пациентов с почечной недостаточностью тяжелой степени (CLcr < 30 мл/мин) и в подобранной контрольной группе здоровых добровольцев. Экспозиция долутегравира у испытуемых с почечной недостаточностью тяжелой степени снижается приблизительно на 40 %. Механизм указанного снижения неизвестен. У пациентов с почечной недостаточностью коррекция дозы не требуется. Исследования препарата Тивикай в группе пациентов, находящихся на диализе, не проводились.
Пациенты с печеночной недостаточностью
Долутегравир метаболизируется и выводится, главным образом, печенью. Однократная доза 50 мг долутегравира вводилась 8 пациентам с печеночной недостаточностью умеренной степени (класс В по шкале Чайлд–Пью) и 8 подобранным здоровым добровольцам из контрольной группы. В то время как общая концентрация долутегравира в плазме была одинаковой, экспозиция несвязанного долутегравира увеличилась в 1,5–2 раза у испытуемых с печеночной недостаточностью умеренной степени в сравнении со здоровыми добровольцами из контрольной группы. У пациентов с печеночной недостаточностью легкой или умеренной степени коррекции дозы не требуется. Влияние печеночной недостаточности тяжелой степени на фармакокинетику препарата Тивикай не исследовалось.
Полиморфизм ферментов, метаболизирующих лекарственные препараты
Нет доказательств того, что часто встречающиеся полиморфизмы ферментов, метаболизирующих лекарственные препараты, изменяют фармакокинетику долутегравира в степени, имеющей клиническое значение. В мета-анализе с использованием фармакогеномных образцов, полученных в клинических исследованиях с участием здоровых добровольцев, у пациентов с генотипами UGT1A1 (n = 7), у которых отмечался слабый метаболизм долутегравира, клиренс долутегравира был снижен на 32 %, а показатель AUC был на 46 % выше в сравнении с пациентами с генотипами, которые ассоциировались с нормальным метаболизмом через UGT1А1 (n = 41).
Пол
Популяционный ФК анализ с использованием совокупных фармакокинетических данных, полученных в клинических исследованиях Фазы IIb и Фазы III с участием взрослых пациентов, не выявил клинически значимого влияния половой принадлежности пациента на экспозицию долутегравира.
Раса
Популяционный ФК анализ с использованием совокупных фармакокинетических данных, полученных в клинических исследованиях Фазы IIb и Фазы III с участием взрослых пациентов, не выявил клинически значимого влияния расовой принадлежности пациента на экспозицию долутегравира. Фармакокинетические параметры долутегравира после однократного приема внутрь испытуемыми японцами аналогичны соответствующим параметрам, отмеченным у испытуемых из западных стран (США).
Коинфицирование гепатитом В или С
Популяционный фармакокинетический анализ показал, что коинфицирование вирусом гепатита С не оказывает клинически значимого эффекта на экспозицию долутегравира. Данные о пациентах с коинфекцией гепатита В ограничены.

Товары из категории — Противовирусные препараты
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 7 714
Описание препарата
Тивикай относится к противовирусным медицинским препаратам. Разработан для замедления прогрессирования заболевания, спровоцированного вирусом иммунодефицита человека. Радикальных способов, позволяющих избавиться от ВИЧ-инфекции, ученые еще не изобрели. Все существующие лекарства помогают облегчить состояние пациента, а также предотвратить серьезное поражение многих систем организма.
Существует несколько направлений лечения ВИЧ. По решению врача, пациенту назначают АРВ терапию; препараты для лечения заболеваний, вызванных различными возбудителями, в большинстве случаев представителями условно-патогенной микрофлоры организма человека и являющиеся следствием значительного снижения функциональной активности иммунитета; средства для блокирования механизмов развития болезни.
Успешность применения антиретровирусной терапии зависит от соблюдения нескольких правил. Прием препаратов следует начать до выявления признаков серьезного нарушения защитной функции организма. Лечение медикаментами указанной группы необходимо продолжать пожизненно.
ВААРТ предусматривает комбинированное назначение нескольких препаратов – не менее трех. Пациент обязательно должен проходить регулярное обследование для контроля показателя Т-лимфоцитов, а также общего состояния организма. По решению врача, может быть назначена химиотерапия или дополнительные лекарственные средства против повреждений, спровоцированных ВИЧ. Купить Тивикай можно в сети аптек по рецепту врача.
Воздействие активного вещества на способность к управлению сложными механизмами и транспортными средствами не доказано. Соответствующие исследования с участием здоровых добровольцев или пациентов не проводились. При рассмотрении возможности управления устройствами, требующими повышенной концентрации, должен учитываться анамнез пациента, а также текущее клиническое состояние.
Форма выпуска, состав и упаковка
Tivicay, как и большинство его аналогов, производят в таблетированной форме. Сверху круглые таблетки покрыты оболочкой из пленки, имеют желтый окрас и несколько отличительных символов – SV 572 и 50. В качестве действующего компонента производитель использует долутегравир натрия в дозировке 50 мг. Также в состав входят и другие ингредиенты, такие как маннит, МКЦ, crospovidone, натрия крахмалгликолят.
При производстве оболочки используются следующие вещества – E1203, пищевой краситель E171, Е1521, стабилизатор Е553b, Е172. Таблетки упакованы во флаконы из полиэтилена, а также картонные пачки. Средняя цена на Тивикай составляет 9600 рублей.
Фармакологическое действие
Результаты клинических исследований показали, что химические и биологические процессы, происходящие с действующим веществом, в организме человека с ВИЧ-инфекцией не отличаются от фармакокинетики у здоровых добровольцев. Максимальная концентрация долутегравира зафиксирована в среднем через 2,5 часа после приема лекарства.
Эффективность терапии, как указывает производитель в официальном описании, не зависит от приема пищи. Полученные результаты испытаний, показывающие влияние препарата на биодоступность, максимальную концентрацию и Tmax, клинического значения не имеют. Отсутствует информация относительно части неизменного препарата, достигшего системного кровотока.
Доказана способность активного вещества связываться с белками плазмы крови в независимости от концентрации препарата. Результаты анализов показали, что dolutegravir проникает в цереброспинальную жидкость, вагинальные и цервикальные ткани. Более пятидесяти процентов препарата выводится через кишечник в неизменном виде. Т1/2 Тивикай занимает около 14 часов.
Показания
Препарат назначают при диагностировании заражения организма наиболее распространенным и патогенным видом ретровируса – ВИЧ-1. Используется в терапии у детей старше двенадцати лет, если их масса составляет больше 40 кг, а также для лечения взрослых пациентов.
Противопоказания
Запрещено использовать медикамент в следующих случаях:
1. При доказанной гиперчувствительности к dolutegravir или одному из вспомогательных компонентов.
2. При употреблении препарата Dofetilidum.
3. Пациентам младшей возрастной категории (до достижения двенадцатилетнего возраста).
4. Если вес пациента меньше 40 кг.
Tivicay может использоваться для лечения пациентов с нарушением функций печени и почек, но только по решению ответственного врача. Запрещено принимать Тивикай с алкоголем.
Дозировка
Назначать препарат должен специалист, имеющий опыт лечения инфекции, вызванной ретровирусом. Дозировку, а также схему лечения определяют в каждом индивидуальном случае. Стандартно производитель рекомендует принимать взрослым пациентам около пятидесяти миллиграммов препарата в течение суток.
При комбинированном лечении, с применением Efavirenz, Nevirapinum, Rifampicinum, Tipranavirum, дозу Tivicay необходимо увеличить в два раза. При подозрении на невосприимчивость организма к ингибитору интегразы препарат назначают дважды в сутки по пятьдесят миллиграммов.
Выпить пропущенную таблетку можно, если по схеме лечения осталось более четырех часов до следующего приема препарата. Пациентам в возрасте от двенадцати до восемнадцати лет назначают Tivicay в дозировке 50 мг. Принимать медикамент необходимо один раз в сутки.
Побочные действия
Клинические исследования показали, что прием Tivicay может спровоцировать развитие нескольких нежелательных реакций. Защитная функция организма зачастую реагирует развитием повышенной чувствительности к действию активного компонента. Со стороны нервной системы и органов чувствительности диагностируют нарушение сна, депрессивное состояние, головокружение.
Пищеварительный тракт, по результатам исследований и отзывам пациентов, отзывается нарушением микрофлоры, позывами к рвоте, болью в эпигастральной области. На коже могут появиться высыпания и неприятные ощущения в виде зуда. Среди общих системных нарушений исследования также показали повышенную утомляемость.
Как указано в инструкции по применению Тивикай, существует вероятность развития воспалительной реакции у пациентов, инфицированных вирусом иммунодефицита, в особенности, если они принимают другие препараты антиретровирусной терапии. Допускается появление симптомов Базедовой болезни в период исправления повреждений, нанесенных иммунной системе вирусом. Известны случаи, когда заболевание также проявлялось и спустя несколько месяцев после начала лечения.
Зарегистрированных случаев других нетипичных реакций в организме пациентов младшей возрастной группы (от 12 до 18 лет) на прием препарата не зафиксировано.
Допускается применение медикамента при комбинированном заражении одной клетки различными вирусами, в том числе гепатитом В или С, несмотря на незначительное отклонение показателей аспартатаминотрансфераза и аланинаминотрансфераза. После отмены лечения гепатита B у некоторых пациентов наблюдалось повышение уровня печеночных ферментов.
После регистрации подтверждались и другие побочные эффекты Тивикай, в частности, были зафиксированы несколько случаев возникновения выраженной боли в суставах и мышцах.
Лекарственное взаимодействие
Перед началом терапии нужно сообщить врачу о приеме каких-либо других медикаментов. Некоторые действующие вещества могут изменить концентрацию долутегравира в плазме крови. При комбинированном лечении с применением таких препаратов как Etravirinum, Nevirapinum, Rifampicinum, Phenytoinum, Phenobarbital понадобится коррекция дозировки. В течение суток следует принять 100 мг Тивикай.
Производитель не рекомендует использовать медикамент в сочетании с группой лекарственных средств, нейтрализующих соляную кислоту в желудке. Принимать препарат, содержащий долутегравир, можно за 120 минут до или через шесть часов после использования антацидов. Аналогичный перерыв между приемом лекарств следует выдержать при комбинированном лечении с пищевыми добавками, содержащими кальций или железо.
Эффективность лечения пациентов с диагностированной устойчивостью к долутегравиру не доказана. Исследования показали, что при использовании препарата в таком случае снижается эффективность воздействия активного компонента на штаммы вирусов с вторичными мутациями.
Tivicay имеет свойство повышать концентрацию таблетированного сахароснижающего лекарственного средства класса бигуанидов (Metforminum). При комбинированном приеме понадобится коррекция дозировки препарата, предназначенного для уменьшения содержания глюкозы в крови. В Москве Тивикай можно приобрести с доставкой на дом. Проверить наличие препарата достаточно просто на сайте или по номеру телефона, указанному в разделе «Контакты».
Беременность и лактация
Доказательств эффективности и безопасности применения Tivicay среди женщин в период вынашивания ребенка нет. Испытания в соответствующей группе риска не проводились. Исследование с участием животных показали, что действующее вещество имеет свойство проникать через плацентарный барьер. В связи с тем, что существует риск проявления репродуктивной токсичности использовать медикамент можно лишь в том случае, когда предполагаемая польза для организма матери выше потенциальной опасности для плода.
Во избежание передачи вируса иммунодефицита ребенку, женщинам необходимо отказаться от естественного вскармливания. Подтвержденные результаты таких опытов среди людей отсутствуют. Выводы сделаны на основании исследований с участием животных.
Нет информации относительно влияния препарата на фертильность. У животных, принимающих Tivicay, способность к зачатию не изменилась. Всеми перечисленными свойствами обладает и известный аналог (дженерик) препарата – Долувир (Doluvir).
Условия и сроки хранения
Препарат сохраняет свои лечебные свойства в течение 24 месяцев с момента изготовления. Дата производства нанесена на упаковку. Запрещено применять медикамент по истечению срока годности. Оптимальные условия для хранения Тивикай – температура воздуха не выше +30 градусов и контролируемый уровень влажности воздуха.
Цены на Тивикай в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 7 714 руб.