Облучатели Ультрамиг-311Р (расчески) – домашнее лечение кожных заболеваний!
Российские облучатели Ультрамиг 311Р (расчески) представляют собой ручные приборы для лечения кожных заболеваний ультрафиолетом. Относятся к портативному медицинскому оборудованию, работающему по методу узкополосной фототерапии. Предназначены для самостоятельного облучения волосистой части головы и других участков тела. Наиболее эффективны в лечении кожных заболеваний с хроническим течением. Чаще всего ручные облучатели используются как антипсориазные расчески. Широко применяются и в лечении витилиго, нейродермита, экземы, разноцветного лишая, грибовидного микоза и очагового выпадения волос (алопеции). Позволяют проводить курсы фототерапии в домашних условиях.
Общее терапевтическое действие ультрафиолета основано на повышении синтеза и усвоения витамина D, на активизации обменных и регенерационных процессов в коже. Локальное воздействие УФ-облучателя направлено на уменьшение покраснения и очагов воспаления, снятие зуда, замедление распространения бляшек и восстановление пигментации. Благодаря купированию патологических процессов (воспалительных, аутоиммунных, аллергических) достигается стойкая продолжительная ремиссия. Максимальный терапевтический эффект с минимальными побочными последствиями был обнаружен на длине волны 311 нанометров. Лампами с таким излучением и комплектуются ультрафиолетовые облучатели Ультрамиг 311Р.
Российское производство облучателей Ультрамиг
Выпускаются облучатели компанией «Хронос» на собственной производственной базе (Санкт-Петербург). Является ведущим российским разработчиком медицинских фототерапевтических приборов. Специалисты компании досконально изучили все методы лечения кожных заболеваний ультрафиолетом. За основу было взято самое безопасное, эффективное и передовое направление фототерапии – узкополосное UVB-облучение с длиной волны 311 нанометров. Доказало свою эффективность в лечении псориаза, парапсориаза, витилиго, атопического и себорейного дерматита, экземы, грибовидного микоза, отрубевидного лишая и гнездовой алопеции. По этому принципу работают все модели Ультрамиг. Собственное производство облучателей для лечения кожных заболеваний оснащено высокотехнологичным оборудованием с компьютерным управлением. Используются импортные комплектующие – высококачественные, надежные и безопасные УФ-лампы PL-S 9W/01/2P 1CT с пиком 311 нм.
Применение облучателя в лечении кожных заболеваний
Узкополосный ультрафиолет с пиком эмиссии на 311 нанометров проникает только до плотного шиповатого слоя эпидермиса. Не затрагивает более глубокие слои кожи и предотвращает разрушение их структуры, что происходит при длинноволновом облучении. Благодаря узконаправленному воздействию УФ-лучи практически не захватывают здоровые участки кожи и не вызывают сильные эритемы (покраснения), как при селективной широкополосной фототерапии. Узкополосное UVB-облучение 311 нанометров считается безвредным и легко контролируемым. Поэтому облучатели-расчески Ультрамиг допущены к свободной продаже и проведению самостоятельных курсов фототерапии. При правильном использовании прибора риски минимальные. Под действием ультрафиолета на коже могут появиться локальные покраснения, но они проходят самостоятельно и без последствий.
Показания к применению облучателя-расчески
● Псориаз. При этом заболевании узкополосная фототерапия признана методом первого выбора. Пользователи расчески Ультрамиг подтверждают уменьшение псориатических проявлений, зуда и воспаления после полного курса. Прибор можно использовать как для лечения псориаза в прогрессирующей стадии, так и для длительной поддерживающей терапии.
● Парапсориаз. Под этим названием объединены дерматозы разной этиологии, но схожей симптоматики. Это хронические воспалительные заболевания кожи, которые также поддаются воздействию ультрафиолета 311 нанометров. Применять облучатели для лечения кожи можно по той же схеме, что и при псориазе (особенно при мелко- или крупнобляшечной форме).
● Витилиго. Воздействие ультрафиолета на кожу активизирует обменные процессы и местное кровообращение. Восстанавливает функции меланоцитов, которые отвечают за пигментацию. При витилиго ультрафиолет 311 нм также считается приоритетным методом фототерапии. Облучатели уменьшают выраженность депигментации и количество очагов поражения.
● Атопический дерматит. При нейродермите узкополосное УФ-облучение признано терапией второй линии. Облучатели для лечения кожных заболеваний могут применяться вместе с медикаментами или самостоятельно (если лекарства неэффективны). Облучение проводится и в качестве поддерживающей терапии для увеличения продолжительности ремиссии.
● Себорейный дерматит. Облучатели для лечения кожи применяются на стадии себореи (расстройства салообразования) и при развитии дерматита, а также в случае его осложнений и перехода в себорейную экзему. На всех этих этапах ультрафиолет позволяет приостановить патологические процессы в коже и добиться ремиссии минимум на 12-14 месяцев.
● Отрубевидный лишай. При этом заболевании поражается верхний слой кожи, поэтому применение облучателя 311 нм полностью оправдано. Разноцветный (отрубевидный) лишай хорошо поддается фототерапии в комбинации с медикаментозным лечением. Пятна могут локализоваться и на голове, поэтому расчески очень удобны для самостоятельного облучения.
● Грибовидный микоз. Опасное кожное заболевание с онкологическим потенциалом, предвестником которого считают крупнобляшечную форму парапсориаза. Лечение ультрафиолетом 311 выполняется на доопухолевой стадии, когда болезнь можно приостановить. При микозе перед прохождением курса нужно проконсультироваться с врачом!
● Очаговое выпадение волос. Гнездовая алопеция – одно из самых сложных в лечении кожных заболеваний. Причины выпадения волос до конца не выяснены. Но отмечено, что облучатель помогает активизировать фолликулы и восстановить естественный рост волос. Результативность терапии разная, но УФ-расческа дает реальный шанс остановить их потерю.
Абсолютные противопоказания к фототерапии:
– Доброкачественные и злокачественные новообразования кожи.
– Гипертония и заболевания щитовидной железы (гипертиреоз).
– Инфекционные и воспалительные заболевания в острой форме.
– Сахарный диабет, сердечная и почечная недостаточность.
– Красная волчанка и повышенная светочувствительность кожи.
При хронических заболеваниях крови и внутренних органов также нужно проконсультироваться с врачом перед прохождением фототерапии. Бывают и временные противопоказания – например, прием отдельных лекарственных препаратов (антибиотики, фотосенсибилизаторы). Применение негормональных мазей и кремов противопоказанием к фототерапии не является.
Описание облучателя для лечения кожи Ультрамиг 311Р
● Прибор выполнен в удлиненном корпусе с ручкой и насадкой-гребнем. Материал корпуса – белый ударопрочный пластик. Габаритные размеры: 52х50х324 мм, вес – не более 650 г.
● Установлена одна лампа PL-S 9W/01/2P 1CT с узкополосным излучением 311 нанометров. Полезная мощность – 9 Ватт. Паспортный срок службы лампы –1000 часов.
● Работают облучатели-расчески от сети 220 В. Включаются и выключаются тумблером, расположенным на ручке. Используются в диапазоне температур от +5°C до +45°C.
● Гарантийный срок производителя на облучатели Ультрамиг – 12 месяцев (распространяется только на прибор). Ультрафиолетовые лампы Philips рекомендуется менять каждые 2-3 года.
● Не допускается самостоятельная разборка и ремонт прибора, использование его не по назначению и несоблюдение других правил, приведенных в инструкции по эксплуатации.
Рекомендации по использованию облучателей Ультрамиг
1) До начала процедуры необходимо позаботиться о защите здоровой кожи. Открытые участки тела можно прикрыть одеждой или помазать защитным кремом. Обязательно надеть очки, поставляемые в комплекте с прибором!
2) После включения в сеть нужно выждать не менее 30 секунд, чтобы лампа пришла в рабочее состояние и начала давать равномерное УФ-излучение. Во время подготовки к работе не следует направлять прибор на кожу.
3) Во время облучения расческу нужно держать в руке, последовательно перемещая на разные участки. Можно наклонять ее в любую сторону. Благодаря легкому весу и эргономичному корпусу прибор не утомляет руки во время работы.
4) Начинать лечение кожных заболеваний облучателем следует с 20-25 секунд. Если облучаются ладони, кисти или стопы, то продолжительность можно увеличить до 30-40 секунд из-за более плотного и толстого кожного покрова.
5) В среднем участки кожи облучают по 60 секунд. Максимальное время облучения – 3-4 мин. Облучение всей кожи головы можно проводить по 5-6 мин.
6) Длительность первой обработки головы зависит от плотности волосяного покрова и толщины волос. Лучше разделять локоны для легкого доступа и во время облучения расчесывать волосы на правую или левую сторону.
7) При лечении кожи ультрафиолетом 311 нм рекомендуемая начальная доза – 0,1 Дж/см2. На каждом последующем сеансе экспозиция увеличивается на 20-30%. Индивидуальная доза облучения определяется с учетом типа кожи.

9) После 2000-3000 часов работы лампы интенсивность ее излучения начинает снижаться. Нужно будет увеличить длительность сеанса на 10-20%. При замене лампы в облучателе, наоборот, время нужно будет сократить.
10) Если во время лечения кожных заболеваний ультрафиолетом появились сильные покраснения, то время облучения следует уменьшить на 15-20 сек. Вернуться к прежнему режиму можно после двух последующих сеансов.
11) Рекомендуемая регулярность облучения при псориазе, витилиго и дерматитах – 4-5 раз в неделю. Полный курс фототерапии облучателем-расческой может включать в себя 20-35 процедур в зависимости от состояния кожи.
Преимущества облучателя-расчески Ультрамиг 311Р
УФ-облучатели собственного производства Хронос позволяют проводить лечение кожных заболеваний в домашних условиях. Используются при болезнях кожи аллергической, воспалительной, аутоиммунной и грибковой природы. Самостоятельные курсы фототерапии облучателем 311 нм абсолютно безопасны, что подтверждено их многолетним практическим применением. Процедуры не доставляют никакого психологического или физического дискомфорта. При отсутствии противопоказаний проводить курсы фототерапии можно без постоянного контроля врача! Выраженный терапевтический эффект будет заметен уже через несколько процедур. Уменьшатся покраснения и воспаление, перестанет беспокоить зуд и начнется постепенная регенерация поврежденных тканей. При прохождении полного курса ультрафиолетовые облучатели-расчески обеспечивают продолжительную ремиссию.
Российское производство облучателей для лечения кожных заболеваний позволило продавать приборы по низким ценам и обеспечивать техническую поддержку. Антипсориазные расчески Ультрамиг-311Р всегда имеются в наличии на складе, как и их основные запчасти. При необходимости замены лампы Philips можно заказать ее на официальном сайте Хронос. Компания оказывает квалифицированную консультационную помощь всем пользователям и предлагает подробную инструкцию по использованию прибора. Купить облучатели для лечения заболеваний кожи Ультрамиф-311Р можно в офисе компании (Санкт-Петербург) или в интернет-магазине по ценам производителя. При покупке с сайта облучатель-расческа в полной комплектации бесплатно доставляется в любой регион РФ в течение 7 дней. Приборы доступны для заказа и на всех крупных маркетплейсах (Wildberries, Ozon, Яндекс.Маркет).
УЛЬТРАМИГ UVB 311 nm — это линейка аппаратов для проведения фототерапии в домашних условиях.
Предназначенные для лечения витилиго, псориаза, парапсориаза, атопического дерматита,
грибовидного микоза, алопеции, красном плоском лишае и других хронических заболеваний кожного покрова, реагирующих на физиотерпапию.
Описание
Прибор сертифицирован и зарегистрирован Росздравнадзором и разрешен к реализации и
лечебному применению на всей территории Российской Федерации
Регистрационный номер: РЗН 2017/5337 от 08.02.2017г.
УЛЬТРАМИГ UVB 311 nm — это линейка аппаратов для проведения фототерапии в домашних условиях.
Предназначенные для лечения витилиго, псориаза, парапсориаза, атопического дерматита,
грибовидного микоза, алопеции, красном плоском лишае и других хронических заболеваний кожного покрова, реагирующих на физиотерпапию.
- СОВРЕМЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ КОЖНЫХ ЗАБОЛЕВАНИЙ.
- ЧТО ЛЕЖИТ В ОСНОВЕ УЛЬТРАМИГ?
воздействует на поверхность кожи ультрафиолетом определенной длиной волны 311 нанометров.
Улучшается состояние эпидермиса, уменьшается зуд, шелушения;
УФ-терапия 311 нм способстует снижению количества и исчезновению высыпаний, повышает местный иммунитет.
Данный вид излучения стимулирует важные процессы в клетках, улучшает их питание, ускоряет регенерацию И восстанавливает обмен вещестВ.
Аппарат воздействует локально ультрафиолетовой лампой на участки тела, причем решает не только проблемы кожи, но и недостаток витамина D.
Регулярное применение способствует исчезновению проявлений заболеваний и стойкой ремиссии,
которую можно легко поддерживать имея данный аппарат в личном пользовании.
При помощи аппаратов серии УЛЬТРАМИГ UVB 311 nm можно легко контролировать состояние своей кожи.
В сердце прибора — оригинальная лампа Philips 9w/01/2 с лучшей в своем классе эффективностью,
которая достигается за счет очень узкого диапазона излучения: от 305 до 315 нм с пиком на 311нм.
Высокая доказанная эффективность и безопастность
Данная длина волны обладает максимальным лечебным действием при отсутствии негативного воздействия на организм.
Большая безопасность ультрафиолетовых лучей 311 нанометров объясняется тем, что воздействует только
на самый верхний и тонкий слой кожи эпидермис, где и протекают патогенные процессы.
Более 400 независимых клинических исследований показали, что данные лампы являются более эффективными и безопасными
по сравнению с остальными лампами в своем классе.
При исполизовании специального ультрафиолетового излучения UVB 311 nm значительно сокращается время и доза облучения,
это обуславливает его большую безопасность для пациента, позволяет свести к минимуму побочные эффекты, такие как покраснение и зуд кожи.
Она не проникает глубже поверхностного слоя кожи, не провоцирует развития новообразований.
Идеальное решения против витилиго и псориаза
Все это делает лампы идеальным решением для фототерапии различных хронических заболеваний кожного покрова.
Более того, поскольку общую дозу узкополосного излучения можно контролировать с высокой точностью, эти лампы подходят для домашней терапии.
Экономически выгодно
Лампы УЛЬТРАМИГ UVB 311 nm – современное решение актуальной проблемы.
Солнечные лучи, стационарные аппараты на основе данных ламп доказали свое благотворное влияние на кожу,
однако стоимость терапии такими передовыми методами в стационарных условиях медицинских учреждений довольно высока. Человек,
страдающий заболеванием кожи, должен был 2-3 раза в неделю приходить на процедуры, а посещения растягивались на несколько месяцев.
Но теперь лечение можно проводить в комфортных домашних условиях по доступной цене, заказав портативный и удобный аппарат Ультрамиг.
ПРИНЦИП ДЕЙСТВИЯ
Как прибор помогает лечить кожные заболевания
В начале 90-х годов прошлого века, благодаря научным разработкам компании Philips, был произведен источник света, позволяющий получить ультрафиолетовое излучение с пиком волны 311нм.
Данная длина волны обладает максимальным лечебным действием при минимальном негативном воздействии на организм, она не проникает глубже
поверхностного слоя кожи, не провоцирует развития новообразований и практически не имеет противопоказаний к применению
(в т.ч. и у детей с 3 лет). Метод лечения псориаза с помощью ультрафиолетового облучения длинной волны 311нм (UVB -терапия) в настоящее
время достаточно изучен, по нему имеется масса научных публикаций, он активно применяется в лечебных учреждениях и помогает достаточно быстро и
без побочных эффектов бороться с обострениями псориаза, витилиго и рядом других кожных заболеваний (экзема, гнездная алопеция, атопический дерматит и пр).
Одним из механизмов действия ультрафиолетового излучения 311 нанометров, ученые считают воздействие непосредственно на молекулы ДНК и активацию
передачи генетической информации с ДНК на РНК. В результате этого останавливается деление клеток и восстанавливается нормальный обмен веществ в клетках.
Принцип действия аппаратов УЛЬТРАМИГ основан на воздействии лучей узкого спектра UVB 311 nm, которые обеспечивают хороший терапевтический результат,
при этом сводя риски возникновения осложнений практически к нулю.
Обычный ультрафиолетовый свет состоит из волн различной длины, в том числе двух спектров, которые используются в световой терапии — UVA и UVB.
• UVA — мало влияет на лечение воспаленных заболеваний, основная его функция вызывать постепенную пигментацию кожи (загар). Этот метод лечения,
чаще всего, используется для восполнения в организме витамина D, в осеннее-зимний период, и имеет достаточное количество осложнений и противопоказаний.
• UVB — включает широкополосный и узкополосный спектр ультрафиолетового излучения. Облучение небольших участков тела, с минимальным временем воздействия,
снижает риск возможных осложнений и сохраняет длительный терапевтический эффект.
Действие ультрафиолетовой лампы УЛЬТРАМИГ UVB 311 nm основано именно на методе UVB терапии,
поэтому, он практически не имеет противопоказаний и может применяться как у взрослых, так и для лечения детей и беременных женщин.
Несмотря на многообразие терапевтических методов, лечение хронических кожных заболеваний,
до настоящего времени представляет сложную задачу, а лечение ультрафиолетовым излучение UVB с пиком излучения 311 нанометров,
считается одним из самых эффективных, безопасных и перспективных поскольку так же снижается потребность в приеме специальных препаратов
и необходима меньшая доза ультафиолетового облучения.
Приборы для лечения псориаза, витилиго и других заболеваний кожи специальным медицинским ультрафиолетовым излучением UVB 311 нанометров
широко практикуется во всем мире и в лечебных центрах Российской Федерации.
Технические характеристики облучателя для лечения псориаза УЛЬТРАМИГ 311 nm
|
Пиковая длина волны |
311 нанометров |
|
Тип лампы |
PHILIPS PL-S 9W/01/2P 1CT, срок |
|
Полезная мощность |
9 Ватт |
|
Питание облучателя для |
220 В 50 Гц |
|
Потребляемая мощность |
40 Ватт |
|
Габаритные размеры облучателя |
52х50х324 мм |
|
Вес облучателя для лечения с |
650 г |
|
Рабочая температура |
5-45° C |
|
Класс защиты |
2а |
ОБЛАСТЬ ПРИМЕНЕНИЯ
Показания к применению ультрафиолетовой лампы Ультрамиг
Псориаз
Обыкновенный (вульгарный), себорейный, эритродермический, каплевидный, ладонно-подошвенный, пустулезный
Витилиго
Генерализованная форма, локализованная форма; стабильный, нестабильный вид; прогрессирующий вид
Алопеция
Очаговая, диффузная формы; рубцовая; андрогенетическая • Угревая болезнь • Нейродермит • Атопический дерматит • Крапивница и другие кожные заболевания аллергического генеза • Склеродермия
Другие заболевания
Угревая болезнь • Нейродермит • Атопический дерматит • Крапивница и другие кожные заболевания аллергического генеза • Склеродермия,
себорейный дерматит, розовый лишай, экзема, фунгоидный микоз, прурит, раздражения фоточувствительной кожи
РЕКОМЕНДАЦИИ ПО ИСПОЛЬЗОВАНИЮ
Прибор доказал свою безопасность и эффективность многолетним использованием.
Мы так же рекомендуем проконсультироваться с врачом, чтобы получить у него возможные индивидуальные рекомендации по использованию и длительности курса.
Курс как правило состоит из 12-30 процедур, проводимых от 3 до 4 раз в неделю.
Общие рекомендации
После включения аппарата проводить процедуру можно через 30 секунд.
Расположить прибор примерно в 3-4 сантиметрах от очага воздействия.
Кожа должна быть чистая, сухая, максимально очищена от чешуек.
Важно помнить, что при лечении очагов заболеваний на лице обязательно нужно использовать специальные защитные очки.
Время проведения процедуры стоит начинать с 20 секунд на лице, 40 секунд в местах с более толстой кожей.
Сеансы рекомендуется проводить через день, увеличивая время на лице по 10 секунд каждый раз, а где толще по 20 секунд.
Необходимо достигнуть уровня лёгкого покраснения и светить с этим же временем 3050 сеансов, затем время также постепенно снижать.
Следующую процедуру проводят при условях отсутсвии выраженного покраснения, эритемы кожи.
Максимальное время процедуры для каждого участка кожи за один сеанс при указанном расстоянии не должно превышать 5 минут.
Для удобства участки поражения лучше разбить примерно пополам и облучать их через день, постоянно меняя.
Зачастую возникает вопрос о возможности использования традиционного солярия для лечения кожных заболеваний, в т.ч. псориказ и витилиго.
Дело в том, что лампы, использующиеся для оснащения соляриев,
излучают широкий спектр UVА лучей, что может приводить к интенсивным побочным эффектам, покраснению кожи, оказывая весьма малое терапевтическое воздействие.
Расческу для лечения псориаза Ультрамиг 311Р можно использовать не только для воздействия на область головы, но и для облучения разных зон тела,
где преобладают признаки болезни. Во время сеансов важно следовать инструкции и не превышать допустимое время.
После курса с применением ультрафиолетового излучением 311 нанометров, пациенты с витилиго получают более однородную и косметически привлекательную
пигментацию кожного покрова.
При лечении псориаза ультрафиолетовым излучением 311 нанометров эффект заметен сразу, снижается зуд, устраняется покраснение кожи.
Применение расчески для лечения псориаза заметно улучшает состояние кожи, уменьшается количество высыпаний, а затем высыпания полностью исчезают.
Регулярное применение расчески для способствует стойкой ремиссии, которую можно легко поддерживать имея расческу в личном пользовании.
Медицинское устройство легко в обращении и не вызывает затруднений при эксплуатации.
Противопоказания к использованию ультрафиолетовой лампы
Патологическая светочувствительность, злокачественные онкологические заболевания в анамнезе, некоторые аутоиммунные заболевания (красная волчанка)
УЛЬТРАМИГ-311Р – популярная ультрафиолетовая лампа, купить которую следует, если вы страдаете от дерматологических заболеваний, поражающих волосистую часть головы. Она является доступным аналогом дорогой лампы Dermalight 80, ничуть не уступая ей по качеству и эффективности. Поскольку лечение псориаза под волосами с помощью мазей и кремов весьма затруднительно, лампа бактерицидная ультрафиолетовая в форме расчески идеально подходит для обработки псориатических бляшек в домашних условиях. Плюс, УЛЬТРАМИГ-311Р – это не только удобная ультрафиолетовая лампа для дома, но и компактный доктор в поездках, командировках и на отдыхе, где с ним нет нужды прерывать лечение.
Преимущества
Расческа УЛЬТРАМИГ-311Р работает с длиной волны 311 нм, считающейся наиболее подходящей для лечебного облучения кожи ультрафиолетом без ожогов и покраснений. Регулярное и дозированное использование прибора обеззараживает пораженные участки кожи под волосами, не затрагивая здоровые, быстро уменьшает выраженность зуда, раздражений и шелушений эпидермиса. Также УЛЬТРАМИГ-311Р можно применять на других участках тела – достаточно снять специальный чехол, оснащенный зубчиками для прочесывания головы.
Использование ультрафиолетовых ламп Philips в данном приборе обеспечивает наилучшее качество и максимально эффективное лечение псориаза. Форма расчески с зубчиками не только обеспечивает прибору полный доступ к псориатическим бляшкам под волосами, но еще и предотвращает запутывание волос при обработке волосистой части головы. На сегодняшний день это лучшая ультрафиолетовая лампа, цена которой доступна почти всем.
Показания
Лампа УЛЬТРАМИГ-311Р показана к применению при наличии псориаза, витилиго, себореи, различных дерматитов, экземы, чесотки, полиморфного солнечного дерматоза, перхоти, зуда, шелушения и раздражения, вызванных кожными заболеваниями различного происхождения.
Противопоказания
УЛЬТРАМИГ-311 нельзя применять при наличии гипертонической болезни, доброкачественных и злокачественных опухолей, меланомы, беременности, обострении хронических заболеваний, синдрома Блума, туберкулеза, глаукомы и катаракты.
Способ применения
Наденьте защитные очки и перчатки (идут в комплекте с прибором) и держите включенную лампу на расстоянии 2 см от пораженных участков под волосами. На протяжении 30 секунд прочесывайте эти участки против роста волос и в разных направлениях. Если после процедуры не возникнет побочных эффектов в виде покраснения, повторяйте ее через 1-2 дня, каждый раз увеличивая время воздействия на 20 секунд. Курс лечения – 1 месяц.
УЛЬТРАМИГ-311Р Ультрафиолетовая лампа UV-B 311 нм портативная
Технические характеристики расчески для лечения псориаза:
- Пиковая длина волны ультрафиолетового излучения — 311 нанометров.
- Тип лампы — PHILIPS PL-S 9W/01/2P 1CT, срок службы лампы по паспорту 1000 часов.
- Полезная мощность ультрафиолетового излучения 9 Ватт.
- Питание расчески для лечения псориаза от сети — 220 В 50 Гц.
- Потребляемая мощность расчески для лечения псориаза не более — 40 Ватт.
- Габаритные размеры расчески для лечения псориаза (ВхШхД) — 52х50х324 мм.
- Вес расчески для лечения псориаза с кабелем питания не более — 650 г.
- Рабочая температура — 5-45° C.
- Класс защиты — 2а.
| Прочие | ||
| Наши предложения | Рекомендуем | |
| Производитель | Хронос | |
| Код ОКП | 944430 | |
| Гарантия | 1 год | |
| Цвет | Белый |
Псориаз — один из самых распространенных хронических дерматозов. По
данным разных авторов, псориазом страдает от 3 до 7% населения планеты.
В последнее время все чаще о псориазе говорят как о системном
заболевании, называя его «псориатической болезнью» из-за вовлечения в
процесс не только кожи, но и суставов, почек, печени. Несмотря на
большое количество исследований, посвященных изучению псориаза, причина
заболевания до конца не выяснена. В настоящее время «эту загадочную
болезнь» рассматривают как заболевание мультифакториальной природы с
участием генетических, иммунных и средовых факторов.
Являясь генетически детерминированным заболеванием, псориаз
характеризуется гиперпролиферацией эпидермальных клеток, нарушением
дифференцировки кератиноцитов, нарушением функционирования иммунной
системы, сопровождающимся образованием иммунозависимых цитокинов и
медиаторов, индуцирующих воспалительную реакцию в дерме. Одним из
основных патогенетических звеньев в иммунных изменениях является
девиация цитокинового профиля по пути Th1-типа, при этом, наряду с
повышением уровня Il-1α, 2, 6, 7, 8, INFγ, ведущую роль играет
повышение уровня фактора некроза опухоли альфа (ФНОα).
Из пусковых механизмов псориаза прежде всего имеют значение
эмоциональный стресс и психоэмоциональный статус пациента. Однако
наличие инфекционных заболеваний, очагов хронической инфекции, таких,
как тонзиллит, гайморит, мочеполовые заболевания, также может
спровоцировать появление первых признаков псориаза. Достаточно часто
псориаз возникает в местах механического повреждения кожи, а именно в
области порезов, царапин, уколов, расчесывания, потертостей, ожогов,
или после приема лекарственных препаратов (β-блокаторов, нестероидных
противовоспалительных средств, интерферона). Нельзя не учитывать также
влияние климатических факторов.
Несмотря на то что сегодня существует большое количество методов и
лекарственных средств для лечения псориаза, остается определенный
процент больных, резистентных к любой проводимой терапии. В связи с
этим постоянно продолжается поиск новых эффективных способов лечения
этого недуга. Практически все больные отмечают благотворное влияние
солнца на течение псориаза. Причиной этого служит воздействие
ультрафиолета, который составляет часть спектра солнечного излучения.
Светотерапия, основанная на использовании ультрафиолетового излучения
спектра А и Б, широко применяется для лечения целого ряда
дерматологических заболеваний, среди которых на первом месте стоит
псориаз.
Для лечения псориаза применяются: фотохимиотерапия (ПУВА) —
сочетание длинноволнового ультрафиолетового облучения и
фотосенсибилизатора внутрь; селективная фототерапия — комбинация
средневолнового излучения (295–330 нм) и длинноволнового
ультрафиолетового облучения; узковолновая УФБ-терапия с пиком эмиссии
на длине волны 311 нм. Фотоиммунологический эффект светолечения
обусловлен глубиной проникновения ультрафиолетовых лучей. УФБ-лучи
воздействуют в основном на эпидермальные кератиноциты и клетки
Лангерганса, а УФА-лучи проникают в более глубокие слои кожи и
оказывают воздействие на дермальные фибробласты, дентритные клетки и
клетки воспалительного инфильтрата. Ультрафиолетовые лучи влияют на
продукцию цитокинов, обладающих иммуносупрессивным действием,
экспрессию молекул на клеточной поверхности и индукцию апоптоза клеток,
чем, возможно, и объясняется терапевтический эффект ультрафиолетового
излучения.
Наибольшая эффективность в лечении псориаза отмечена у
фотохимиотерапии: по нашим наблюдениям и на основании данных других
авторов, она составляет от 90 до 97%. Механизм воздействия
фотохимиотерапии сложный и еще до конца не выяснен, но непрекращающиеся
исследования в этом направлении позволили выявить тормозящее влияние
фотосенсибилизатора и УФА на синтез ДНК в клетках эпидермиса.
Считается, что кванты длинноволнового УФ-излучения нарушают целостность
нуклеиновых кислот, свободные радикалы которых вступают в ковалентную
связь с препаратами псораленового ряда. Образующиеся соединения
значительно тормозят репликацию ДНК и, следовательно, пролиферацию
эпидермальных клеток.
Чаще всего ПУВА-терапия применяется при лечении распространенного
вульгарного и экссудативного псориаза, в том числе при
ладонно-подошвенной локализации и поражении волосистой части головы,
для чего используются специальные установки для локального облучения.
Вместе с тем этот метод успешно применяется при тяжелых формах псориаза
— эритродермической и пустулезной. В качестве фотосенсибилизатора
используются оксорален ультра (метоксален), выпускающийся в капсулах, и
аммифурин («Вилар», Россия) в виде таблеток и 0,3% раствора. Лечение
проводится по методике трех- или четырехразового облучения в неделю —
до полного исчезновения всех высыпаний. Начальная доза облучения
определяется с учетом типа кожи и составляет 0,25–1 Дж/смІ. Постепенно
доза УФА увеличивается через каждые две процедуры на 0,5–1 Дж/смІ. В
среднем для достижения клинического излечения требуется около 15–25
процедур. При замедленном разрешении высыпаний на нижних конечностях
после 7–10 процедур дополнительно назначают локальное облучение на эти
места (25–50% от разовой дозы).
Селективная фототерапия (СФТ) применяется в основном при вульгарном
и экссудативном псориазе при умеренно инфильтрированных высыпаниях,
причем прогрессирующая стадия заболевания не является
противопоказанием. Проводят СФТ 5 раз в неделю, начиная с дозы УФБ,
равной 0,05–0,1 Дж/смІ. При отсутствии эритемы дозу УФБ постоянно
увеличивают при каждой последующей процедуре на 0,05–0,1 Дж/смІ. Курс
лечения составляет 20–30 процедур, при этом их терапевтическая
эффективность достигает 85–90%. При СФТ нет необходимости в приеме
фотосенсибилизатора, который может вызывать нежелательные побочные
эффекты в виде тошноты, рвоты, головокружения и чувства дискомфорта.
Работы последних лет показали, что фототерапия УФБ-лучами спектра
311 нм обладает выраженной терапевтической эффективностью и сопоставима
по результатам лечения с ПУВА-терапией. Показания к проведению подобной
терапии те же, что и при СФТ. К сожалению, этот метод лечения из-за
недостаточной оснащенности кабинами с таким спектром в нашей стране
распространен не очень широко, а ведь именно он в скором времени, по
прогнозам ученых, заменит селективную терапию, так как по скорости
достижения ремиссии превосходит таковую. Фототерапия УФБ-лучами узкого
спектра 311 нм проводится 3–5 раз в неделю, начальная доза составляет
0,1 Дж/смІ. Следующая процедура проводится при отсутствии эритемы дозой
на 0,1–0,2 Дж/смІ больше, чем предшествующая. Курс лечения состоит
обычно из 20–30 процедур.
Как и при любом методе лечения, светолечение имеет нежелательные
побочные эффекты, которые можно условно разделить на ранние и
отдаленные. Ранние осложнения возникают во время проведения процедур и
к ним относятся фототоксическая эритема, кожный зуд и сухость кожных
покровов. Отдаленные побочные явления появляются гораздо позже — в виде
актинических повреждений (фотостарения) и стойких пигментных изменений
кожи. Кроме того, псоралены в состоянии проникать в хрусталик и
образовывать под воздействием УФА фотоаддитивные продукты с
аминокислотами протеина хрусталика. Так как эти продукты представляют
собой прочные соединения и не подлежат репарации, часто повторяющиеся
экспозиции ПУВА могут привести к накоплению измененного белка
хрусталика. Однако это происходит в том случае, если больные не
пользуются специальными фотозащитными очками. Наконец, нельзя не
считаться с мнением о том, что светолечение способно повышать риск
возникновения злокачественных заболеваний кожи, хотя мутагенное влияние
фотохимиовоздействия в виде увеличения случаев хромосомных аббераций
доказано только в опытах. По-видимому, следует согласиться с тем, что
ПУВА может играть роль псевдостимулятора, т. е. фактора, подавляющего
механизмы иммунологического надзора, тем самым позволяющего проявиться
эффектам, вызванным более сильными факторами риска (рентгеновское
облучение, инсоляция, лечение в прошлом дегтем и т. д.).
В последние годы в научной литературе стали появляться работы о
новом методе лечения псориаза — фототерапии УФБ-лучами узкого спектра
308 нм с помощью эксимерного лазера. В 1997 г. B. Bonis и соавторы
впервые сообщили об эффективности ксенон-хлоридного (XeCl) эксимерного
лазера для лечения псориаза, определив, что суммарная доза, необходимая
для полного очищения от псориатических бляшек, при применении узкого
спектра (308 нм) в 6 раз меньше, чем при СФТ [1]. Затем стали
появляться другие работы об успешном применении фототерапии УФБ-лучами
узкого спектра (308 нм) при лечении псориаза [2, 3, 4, 5]. Научные
исследования показали, что волны длиной 308 нм обладают максимальным
терапевтическим эффектом при минимальных побочных воздействиях.
Под нашим наблюдением находились 236 больных: 157 (66,5%) человек с
вульгарным псориазом, 40 (16,9%) — с экссудативным, 35 (14,8%) — с
ладонно-подошвенным и 4 (1,7%) — с псориатической эритродермией.
Возраст больных составлял от 16 до 72 лет. Мужчин было 124 (52,5%),
женщин — 112 (47,5%). Давность заболевания варьировала от 1 года до 48
лет.
У всех 197 пациентов с вульгарным и экссудативным псориазом была
диагностирована стационарная стадия. У большинства из этих больных
(83,2%) высыпания были представлены бляшками и носили ограниченный
характер. У всех пациентов отмечалось поражение волосистой части
головы.
Сопутствующие заболевания были выявлены у 123 больных (52,1%). Среди
них: хронический гастрит — у 32 (26%), хронический холецистит — у 14
(11,4%), желчнокаменная болезнь — у 6 (4,9%), язвенная болезнь желудка
и двенадцатиперстной кишки — у 9 (7,3%), хронический колит — у 6
(4,9%), хронический тонзиллит — у 15 (12,2%), хронический трахеит — у 4
(3,3%), сахарный диабет — у 7 (5,7%), гипертоническая болезнь — у 8
(6,5%), хронический пиелонефрит — у 6 (4,9%), хронический простатит — у
9 (7,3%), дерматологические заболевания — у 7 (5,7%).
С помощью индекса PASI (Psoriasis Area and Severity Index)
определяли площадь пораженной поверхности тела и интенсивность основных
симптомов псориаза. Выраженность кожных проявлений оценивалась в баллах
по трем показателям — эритемы (покраснения), инфильтрации и шелушения.
Критерием клинической эффективности назначенного лечения являлось
уменьшение показателей индекса PASI:
1) на 75% и более от исходного показателя — выраженное улучшение
клинической картины (этот показатель соответствует регрессивной
стадии); 2) на 74 — 50% — удовлетворительное улучшение (соответствует
стационарной стадии); 3) на 49–25% — незначительное улучшение; 4) менее
25% — без видимого улучшения.
Облучение псориатических высыпаний проводилось с помощью эксимерного
ХеСl-лазера XTRAC «PhotoMedix» (CША), обладающего следующими
характеристиками: длина волны — 308 нм, частота импульсов — до143 Гц,
длительность импульса на уровне половины амплитуды — 30 нс,
максимальная плотность энергии за время экспозиции — 2100 мДж/смІ,
диаметр светового пятна — 18х18 мм, в качестве доставки излучения —
оптоволоконный кабель со сменными наконечниками.
Противопоказанием для назначения данного лечения являлись случаи
келоидных образований в анамнезе, а также наличие в прошлом у больных
злокачественных новообразований кожи. Кроме того, не рекомендовано было
применять метод у тех пациентов, у которых отсутствовал эффект от ПУВА
и СФТ.
Лечение проводили в виде монотерапии по методике двух- и
трехразового облучения в неделю после определения минимальной
фотоэритемной дозы (МЭД) в области спины вне очагов поражения. Облучали
шесть областей с помощью насадки 3х3 смІ. Результат оценивали через
24–48 ч.
В результате проведенного лечения у 28 больных ладонно-подошвенным
псориазом было достигнуто клиническое излечение, у 7 — значительное
улучшение.
У 3 больных псориатической эритродермией по окончании курса
фототерапии отмечалось значительное улучшение и у одного больного —
улучшение (редукция PASI составляла от 45 до 60%). Клиническое
излечение наблюдалось у подавляющего большинства больных (181 больной —
92%) вульгарным и экссудативным псориазом (редукция PASI — 80–97%), у
остальных — значительное улучшение (редукция PASI составляла от 66 до
74%).
В среднем для достижения терапевтического эффекта требовалось от 4
до 15 процедур в течение 2–5,5 нед с суммарной дозой 308 UVB от 1,2 до
9,6 Дж/смІ, при этом выявлялась обратная связь между дозой UVB и
количеством процедур (чем выше была разовая доза, тем меньшее
количество сеансов проводилось).
В процессе лечения у 10 больных ладонно-подошвенным псориазом
отмечались небольшое покраснение и зуд. В наблюдениях у 17 больных
бляшечным псориазом и у 2 пациентов с псориатической эритродермией
наблюдалась локальная реакция по типу фотодерматита без образования
пузырей, которая самопроизвольно разрешалась после окончания процедуры,
причем при развитии явлений фотодерматита регрессирование очагов
поражения протекало гораздо быстрее.
Таким образом, наилучшие результаты были получены при лечении
ограниченных форм вульгарного и экссудативного псориаза. Очень
эффективным и обнадеживающим представляется этот метод терапии в
отношении лечения ладонно-подошвенного псориаза, который отличается
выраженной резистентностью к различным способам лечения. Что касается
эритродермии, то, несмотря на полученный терапевтический эффект,
фототерапия УФБ-лучами с помощью лазера из-за большой площади поражения
была сопряжена с определенными трудностями, связанными с проведением
процедур.
Преимуществом метода можно считать хорошую переносимость, отсутствие
серьезных побочных эффектов, возможность не облучать неповрежденную
кожу, минимальный риск канцерогенеза благодаря локальному воздействию и
относительно низкой суммарной дозе облучения.
К сожалению, фототерапия с помощью эксимерного лазера из-за
объективных причин не проводится при поражении псориазом волосистой
части головы. Для этой цели у 60 больных мы применяли весьма
эффективный комплекс Нодэ К («Биодерма», Франция), разработанный
специально для подобной локализации псориатического процесса. Комплекс
состоит из эмульсии и шампуня с кератолитическими и кераторегулирующими
свойствами. В состав эмульсии помимо 2% салициловой кислоты, 10%
гликолевой кислоты, масла каритэ и вазелина входит зантален — активная
субстанция экстракта растения Zanthoxylum bungeanum, используемого в
китайской медицине с давних пор для лечения экземы. Зантален ингибирует
выработку медиатора воспаления — оксида азота (в активированных
макрофагах), содержание которого при псориазе повышено в 10 раз (по
сравнению со здоровой кожей), и таким образом уменьшает зуд.
Противовоспалительное действие шампуня связано с наличием в его составе
форсколина — экстракта гималайского растения Coleus barbatus,
известного своей «успокаивающей способностью для кожных покровов».
Действие форсколина in vitro продемонстрировало активацию
аденилатциклазы и накопление циркулирующего аденозинмонофосфата в
клетке. Кроме того, форсколин снижает активность протеинкиназы и
угнетает Т-клеточную аттракцию (притяжение), способствуя уменьшению
лейкотриена С4, уровень которого повышен при псориазе. Кератолитический
и редуцирующий эффект шампуня обусловлен включением в его состав 10%
салициловой кислоты и масла красного можжевельника. Курс лечения до
достижения хороших результатов (исчезновение покраснения, инфильтрации,
шелушения, зуда) составлял в среднем около 8 нед, при этом эмульсия
наносилась 3 раза в неделю на 15 мин, после чего эмульсию с головы
смывали шампунем, предварительно оставив его на 3–4 мин. Применение
Нодэ К по такой схеме привело к клиническому излечению у 44 (73,3%) и
значительному улучшению у 16 (26,7%) больных, что позволяет сделать
вывод о высокой терапевтической эффективности данного средства.
Каких-либо нежелательных побочных явлений во время лечения не
отмечалось. Таким образом, преимуществами данного метода лечения
являются его действенность, отсутствие побочных проявлений, удобство в
применении и возможность достичь выраженного косметического эффекта.
По вопросам литературы обращайтесь в редакцию.
О. Ю. Олисова, И. Я. Пинсон
ММА им. И. М. Сеченова, Медицинский центр УД Президента РФ, Москва
Себорейный дерматит (СД) является мультифакториальным хроническим рецидивирующим воспалительным заболеванием кожи. Высыпания СД локализуются, как правило, в 88% случаев в области лица, в 70% – на волосистой части головы, в 27% – в области груди, в 10% – в области спины, на паховых и подмышечных складках, т. е. на тех местах, где наиболее развиты сальные железы [1]. Для СД характерны эритематозно-сквамозные очаги на коже, нередко сопровождающиеся зудом [2–4].
В настоящее время существуют разночтения в терминологии: многие авторы смешивают понятия «себорея» и «себорейный дерматит». Себорея — это состояние кожи, обусловленное расстройством салообразования, которое может являться фоном для развития угревой болезни. СД — это самостоятельное заболевание, которое некоторые дерматологи называют «себорейной экземой» и «себореидом» [5–9].
СД — распространенное заболевание; по данным различных авторов, частота его распространения составляет 1–5% [2, 5, 10–12]. На долю СД приходится около 10% среди всех дерматозов [5, 13].
Мужчины болеют чаще, чем женщины. Заболевание наблюдают и у грудных детей («себорейный чепчик»), оно возникает на 12-й нед. жизни ребенка и самостоятельно исчезает к 8–9 мес. СД развивается у 20–25% мальчиков в пубертатном периоде и у молодых людей в возрасте 19–20 лет; последующий пик заболеваемости приходится на 50 лет.
Клинические проявления и частое рецидивирующее течение СД приводят к психоэмоциональным переживаниям больных, снижают их социальную активность и качество жизни, способствуют развитию у них комплекса неполноценности [5, 9, 12, 14–16]. Представление о собственной внешней непривлекательности приводит к развитию дисморфофобии — болезненного состояния психики, сопровождающегося опасениями или убеждениями по поводу мнимого внешнего уродства. Пациенты становятся замкнутыми, легко раздражаются, у них появляются сложности адаптации в социальной и интимной сферах [2].
Несмотря на большой выбор терапевтических методов, СД характеризуется склонностью к рецидивированию и резистентностью к проводимому лечению.
В настоящее время методом выбора при многих дерматозах является фототерапия, а поскольку многие пациенты с СД отмечают улучшение в летний период, применение этого вида лечение вполне обоснованно.
В мировой литературе имеются единичные работы, посвященные применению УФБ-терапии при СД.
Несмотря на накопленный опыт применения узковолновой УФВ-терапии, механизм ее действия до сих пор окончательно не выяснен. T. Wrone-Smith, B. J. Nickoloff (1996) определили, что узкополосное УФБ-излучение больше способствует апоптозу Т-клеток, чем широкополосная СФТ [17]. J. С. Viac и соавт. считают, что узкополосная УФБ-терапия на длине волны 311 нм оказывает избирательное действие на иммунитет кожи [18]. Другими исследователями убедительно показано иммуносупрессивное действие узкополосной УФБ на фактор некроза опухоли (TNFα), концентрация которого в сыворотке крови больных псориазом до лечения превышала контрольные показатели (1,89±0,3 нг/мл при норме 1,48±0,43 нг/мл, р<0,05), при этом PASI коррелировало с показателями TNFα (r=0,52, р<0,05). Снижение концентрации TNFα в результате фототерапии 311 нм сопровождалось также снижением PASI [19].
H. Sigmundsdottir и соавт. (2005) наблюдали у больных псориазом, получавших лечение узкополосной УФБ, значительное снижение продукции IL, 1β, IL2, IL5 и IL6 в сыворотке крови по сравнению с этими показателями до лечения. Кроме того, концентрация INFγ, IL 8 и IL12p70 также уменьшалась, но не достигала статистического значения [20].
D. Pirkhammer и соавт. (2000) изучали эффективность терапии УФБ (311 нм). В открытом исследовании участвовали 18 пациентов с поражением кожи лица, волосистой части головы, межлопаточной области и области груди. Лечение проводили 3 раза в неделю (в среднем 23 процедуры) со средней кумулятивной дозой 9,8 Дж/см2. Побочных явлений авторы не наблюдали. Клиническая ремиссия была достигнута максимум за 8 нед. [21]. Авторы отметили высокую эффективность этого метода при СД.
T. Gambichler и соавт. (2005) в 28 статьях, включающих 6 рандомизированных контролируемых, 16 открытых проспективных и 6 ретроспективных исследований, в которые вошли 719 больных атопическим дерматитом, 305 больных распространенным витилиго, 25 больных полиморфным фотодерматозом, 108 больных с ранней стадией Т-клеточной лимфомы, 88 больных хронической крапивницей, 15 больных красным плоским лишаем, 10 больных пруриго, ассоциированным с полицитемией, 18 больных себорейным дерматитом, 6 больных пруриго и 5 больных перфорирущим дерматитом, показали, что наилучший результат УФБ-терапии узкого спектра отмечен при лечении атопического дерматита и витилиго [22].
Учитывая все вышесказанное, нами было проведено собственное исследование по изучению эффективности и безопасности фототерапии УФБ-лучами 311 нм у 40 больных СД. В качестве примера мы приводим наше клиническое наблюдение.
Пациент М., 50 лет, в декабре 2013 г. обратился в Клинику кожных и венерических болезней Первого МГМУ имени И. М. Сеченова с жалобами на высыпания на волосистой части головы, лице, в области груди и спины. Субъективно беспокоил зуд. Аллергологический анамнез не отягощен.
Анамнез жизни: рос и развивался соответственно возрасту, в благополучной семье. В детстве перенес ветряную оспу, часто болел ОРВИ. В настоящее время не работает, женат, имеет здорового ребенка. Аллергологический анамнез не отягощен. Вредные привычки: не курит, алкоголем не злоупотребляет.
История болезни: болен в течение 10 лет. Первые высыпания появились на волосистой части головы. Самостоятельно периодически применял противосеборейные шампуни. Постепенно сыпь распространилась на лицо и туловище. К врачу обратился в 2010 г., был поставлен диагноз «себорейный дерматит». Применял антигистаминные препараты, витамины, мази с глюкокортикостероидами и противосеборейные шампуни с временным положительным эффектом. Получал системные и местные противогрибковые препараты, но улучшения не было. Настоящее обострение в течение 1 мес., развилось после стрессовой ситуации. Обратился в нашу клинику для подбора терапии.
При осмотре: высыпания хронического воспалительного характера, локализуются на волосистой части головы, лице, в области груди и спины. Сыпь мономорфна, представлена эритематозно-сквамозными очагами розовато-желтого цвета диаметром около 2–4 см, с четкими границами неправильных очертаний. На волосистой части головы имеются чешуйкокорки серовато-желтого цвета на эритематозном фоне. Волосы и ногти не изменены. Лимфатические узлы не увеличены. Субъективно высыпания сопровождаются периодическим зудом (рис. 1).
Клинически был выставлен диагноз «себорейный дерматит».
Сопутствующие заболевания: хронический гастрит и дискинезия желчевыводящих путей.
При обследовании в клиническом и биохимическом анализе крови изменений не выявлено, за исключением повышенного содержания АЛТ — 53 Ед/л.
Проведен курс фототерапии УФБ-лучами 311 нм, состоящий из 11 процедур с режимом 4-разового облучения в неделю с начальной дозой 0,05 Дж/см2 и постепенным ее увеличением на 0,1 Дж/см2 каждые две процедуры. Максимальная разовая доза составила 0,6 Дж/см2, суммарная — 4,1 Дж/см2. На фоне проведенной терапии отмечался регресс высыпаний уже после 5-й процедуры, зуд купировался после 3-й процедуры. Побочных эффектов отмечено не было. Местно мы применяли только шампунь «Нодэ DS» с частотой 2–3 раза в неделю.
В результате фототерапии УФБ-лучами 311 нм была достигнута клиническая ремиссия (рис. 2). По поводу сопутствующей патологии была рекомендована консультация и обследование у гастроэнтеролога.
После проведенной терапии пациент находился под наблюдением в течение 12 мес. За данный период клиническая ремиссия сохранялась.
Таким образом, фототерапия в настоящее время по праву занимает достойное место в лечении дерматозов. Применение УФБ 311 нм при СД дает быстрый и стойкий эффект, а также увеличивает длительность ремиссии.
Эта статья завершает наш спецпроект по псориазу. Теперь, когда мы уже знакомы с особенностями развития этой патологии, пришло время разобраться с ее лечением. Поиски лекарства для полной и безоговорочной победы над этой болезнью пока не увенчались успехом, но привели к появлению множества терапевтических подходов, позволяющих держать ее в узде. Познакомимся с преимуществами и недостатками основных способов лечения псориаза и попытаемся разобраться, как они работают.
Псориаз
Спецпроект посвящен генетическому кожному заболеванию, от которого страдает около 1% россиян. В статьях спецпроекта мы стараемся подробно, достоверно и интересно осветить это заболевание со всех возможных сторон. В этом нам помогают наши рецензенты: специалист по псориазу, кандидат биологических наук Алёна Золотаренко и врач-дерматовенеролог, кандидат медицинских наук Михаил Бетехтин.
Предыдущие статьи нашего цикла о псориазе («Псориаз: на войне с собственной кожей» [1], «Псориаз: Т-хелперы, цитокины и молекулярные шрамы» [2], «Генетика псориаза: иммунитет, барьерная функция кожи и GWAS» [3], «Эпигенетика псориаза: молекулярные отметины судьбы» [4]) очень подробно объяснили, насколько сложна этиология этого заболевания: она связана и с особенностями генома, и с эпигенетическими модификациями, и с провоцирующими факторами внешней среды. Вычленить из этого коктейля конкретные причины заболевания еще не удалось, поэтому и его лечение до сих пор не этиотропное (позволяющее повлиять на причину болезни), а патогенетическое — направленное на то или иное звено патогенеза псориаза. К сожалению, о полном излечении пока речи нет, но современные терапевтические подходы позволяют приостановить развитие заболевания и достичь ремиссии.
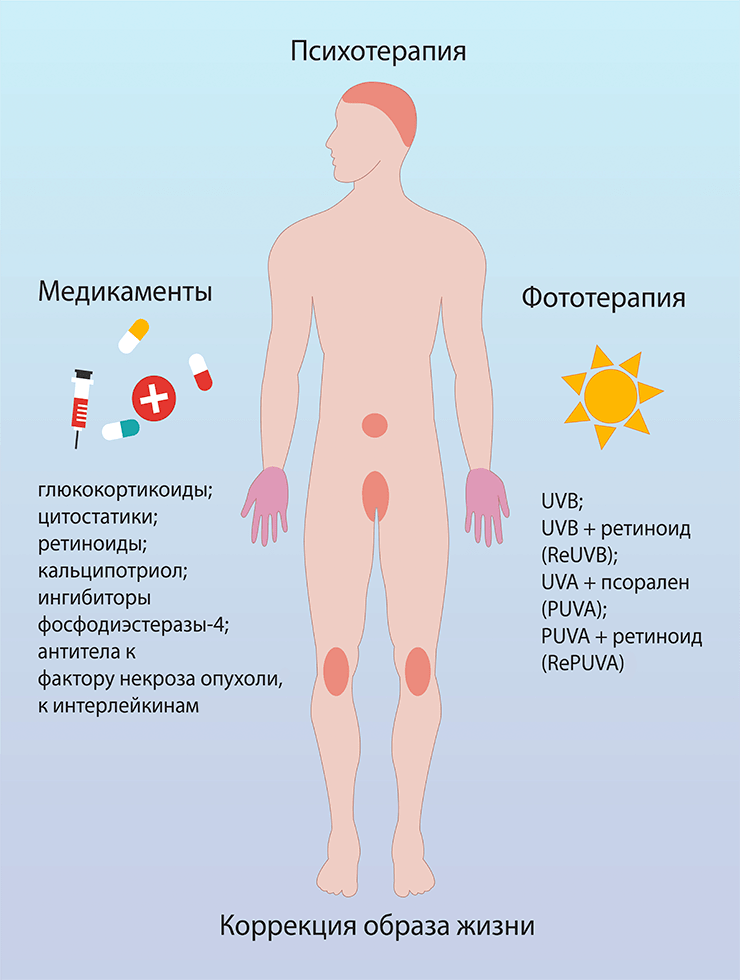
Чаще всего псориаз контролируют с помощью следующих подходов (рис. 1):
- лекарственной терапии (глюкокортикоиды, аналоги витаминов D и А, цитостатики, антитела к цитокинам, ингибиторы провоспалительных ферментов);
- фототерапии (УФ-лучи самостоятельно или в сочетании с молекулами, повышающими их эффективность).
Рисунок 1. Лечение псориаза
Глюкокортикоиды
Гормоны из группы глюкокортикостероидов входят в число антипсориатических препаратов первой линии, то есть тех, с которых лечение начинают. Эти гормоны сокращенно называют глюкокортикоидами, кортикостероидами или даже просто стероидами, хотя последнее не совсем корректно. Название этой группы гормонов отражает их принадлежность к стероидам — веществам, главной и системообразующей молекулой которых является циклопентанопергидрофенантрен. Знаменитые «стероиды» бодибилдеров тоже содержат эту молекулу. К глюкокортикоидам относят лишь те стероиды, что способны повышать уровень глюкозы в крови. Термин же «кортикостероиды» очерчивает круг стероидов, происходящих исключительно из коркового слоя, или кортекса, надпочечников.
Природные гормоны из надпочечников животных — кортизон и гидрокортизон (кортизол) — были выделены еще в первой половине XX века. Благодаря широкому спектру действия на разные процессы в организме (общий обмен веществ, водно-электролитный обмен и др.) их применяли для лечения различных заболеваний. Затем появилась возможность усовершенствовать их путем химического синтеза — чтобы они действовали сильнее и прицельнее. Так появились:
- преднизолон, в четыре раза превосходящий кортизол по глюкокортикоидной (влияющей на обмен глюкозы) активности;
- флудрокортизон, превосходящий кортизол не только по глюкокортикоидной, но и по минералокортикоидной активности;
- бетаметазон, в 25 раз превосходящий кортизол по глюкокортикоидной активности и не влияющий на водно-солевой обмен; структура вещества позволяет применять его местно на коже и слизистых.
Хотя эти гормоны давно известны, ученые лишь приоткрыли завесу тайны над молекулярными основами их действия. Известно, что они проникают внутрь клетки и соединяются со специальными внутриклеточными глюкокортикоидными рецепторами. Комплекс гормон—рецептор транспортируется в ядро, где взаимодействует с участками ДНК GRE (glucocorticoid response elements) в промоторах ряда генов, регулируя таким образом их активность. Стероиды, в частности, контролируют экспрессию генов таких факторов транскрипции, как активаторный белок 1 (AP-1) и ядерный фактор каппа-би (NF-kB). А они, в свою очередь, регулируют работу генов цитокинов, молекул адгезии, протеиназ и других веществ, участвующих в иммунном ответе и воспалении [5].
Глюкокортикоиды — мощные иммуносупрессоры и регуляторы воспаления. На иммунную систему они действуют неизбирательно, вмешиваясь в работу чуть ли не всех ее звеньев. В частности, они влияют на дифференцировку и/или функции макрофагов, нейтрофилов, моноцитов, Т- и В-лимфоцитов. При псориазе глюкокортикоиды оказывают противовоспалительное действие за счет угнетения синтеза простагландинов, лейкотриенов и цитокинов, уменьшения проницаемости кровеносных сосудов для клеток и жидкости, снижения хемотаксиса иммунокомпетентных клеток и их активности, а также подавления активности фибробластов.
Для лечения псориаза кортикостероиды назначают как наружно (мази, кремы, лосьоны, крело — что-то среднее между кремом и лосьоном), так и внутрь (таблетки, растворы и суспензии для инъекций); выбор препарата и его лекарственной формы зависит от стадии и степени тяжести заболевания. Из-за побочных действий этих препаратов их назначение внутрь стараются отложить настолько, насколько это возможно.
Парацельс, известный врач эпохи Ренессанса, утверждал, что лекарство и яд различает лишь доза. Справедливо это и для глюкокортикоидов: при длительном и/или неадекватном их применении повышается риск побочных эффектов. В связи с тем, что эти гормоны влияют на все виды обмена — углеводный, белковый, жировой и минеральный, — злоупотребление ими серьезно нарушает множество процессов в организме. Например, они стимулируют глюконеогенез (образование глюкозы из неуглеводных веществ) в печени, увеличивают концентрацию глюкозы в крови, что может вести к «стероидному» сахарному диабету. По симптомам он схож с сахарным диабетом II типа: постепенное развитие мышечной слабости и зуда кожи, нарушение зрения, изменения нервов и сосудов. Влияние на белковый обмен характеризуется угнетением синтеза и ускорением распада белков, что особенно выражено в коже, мышцах и костях и ведет к атрофии кожи и мышц, замедлению заживления ран. Влияние на обмен жиров заключается в расщеплении жира в тканях конечностей и его накоплении в туловище и лице: формируется так называемое лунообразное лицо.
Однако перечисленные нежелательные эффекты проявляются при применении глюкокортикоидов внутрь. Их нанесение на небольшие участки кожи позволяет избежать системных реакций, хотя и не делает местное применение абсолютно безопасным. Чаще всего при длительном наружном использовании сильных глюкокортикоидов могут наблюдаться телеангиэктазии (расширенные мелкие сосуды), атрофия (истончение) кожи, стероидное акне (прыщи на лице и теле), стрии (растяжки кожи) и кожные инфекции. Если переусердствовать с нанесением сильных гормональных мазей на большие участки кожи, то можно получить и системные побочные эффекты [6].
При всех несомненных преимуществах глюкокортикоидов перед другими лекарствами по части эффективности и доступности, их можно сравнить с дубиной, которой мы лупим по иммунной системе и обмену веществ. Ниже мы обсудим лекарства, более тонко регулирующие иммунные механизмы.
Производные витаминов
Витамины А и D, включая их синтетические варианты, способны подавлять проявления псориаза. Эти вещества связываются с ядерными рецепторами (и по совместительству транскрипционными факторами) RARγ/RXR и VDR/RXR, активируя экспрессию ряда генов, ответственных за дифференцировку и пролиферацию клеток. Один из таких генов кодирует особый цитокин — тимический стромальный лимфопоэтин (TSLP, thymic stromal lymphopoietin), который заставляет антигенпредставляющие дендритные клетки воспитывать Th2- и регуляторные (Treg) клетки в ущерб Th1-клеткам. Мы помним из статьи [2], что для псориаза характерна повышенная активность Th1 и Th17 при сниженной активности Th2 и Treg. Соответственно, предполагалось, что А/D-витаминные средства, активируя синтез TSLP в кератиноцитах и других клетках, могут корректировать этот дисбаланс и уменьшать Th1/Th17-опосредованное аутоиммунное воспаление. Но всё оказалось сложнее: TSLP модулирует иммунные реакции по-разному в зависимости от условий. Гомеостатическую и, вероятно, терапевтическую роли играет короткая изоформа TSLP, в то время как длинная образуется в патологических условиях, включая псориатические бляшки. Активный синтез TSLP с последующим «иммунным перекосом» в сторону Th2-звена провоцирует аллергическое воспаление, характерное для атопического дерматита и астмы. А в воспалительной среде, характерной для псориаза, TSLP (по косвенным данным, длинная форма) с помощью CD40L запускает патологическую IL-23/IL-17-сигнализацию [7], [8]. Поэтому в лечении можно было бы использовать ингибиторы длинной формы TSLP и стимуляторы синтеза короткой (либо ее саму).
Роль TSLP в патогенезе и терапии псориаза еще предстоит уточнить, но в то же время очевидно, что антипсориатические эффекты витаминов A и D обусловлены изменением транскрипции многих других генов — регуляторов дифференцировки и пролиферации клеток [1]. (Здесь я должен принести извинения читателю за весьма скудное понимание исследователями как причин, так и механизмов действия лекарств от некоторых кожных болезней.)
Ретиноиды
К ретиноидам в широком смысле слова причисляют витамин А (ретинол) и его биологически активные производные. Но в медицине так принято называть группу синтетических производных витамина А, служащих для лечения определенных болезней, а не восполнения витаминодефицита. Кожные заболевания с их помощью успешно лечат уже более 40 лет.
Чаще других для лечения псориаза используют ацитретин — ретиноид второго поколения. Как и любой другой препарат этой группы, он подавляет избыточный клеточный рост и кератинизацию — главные характеристики псориатической кожи.
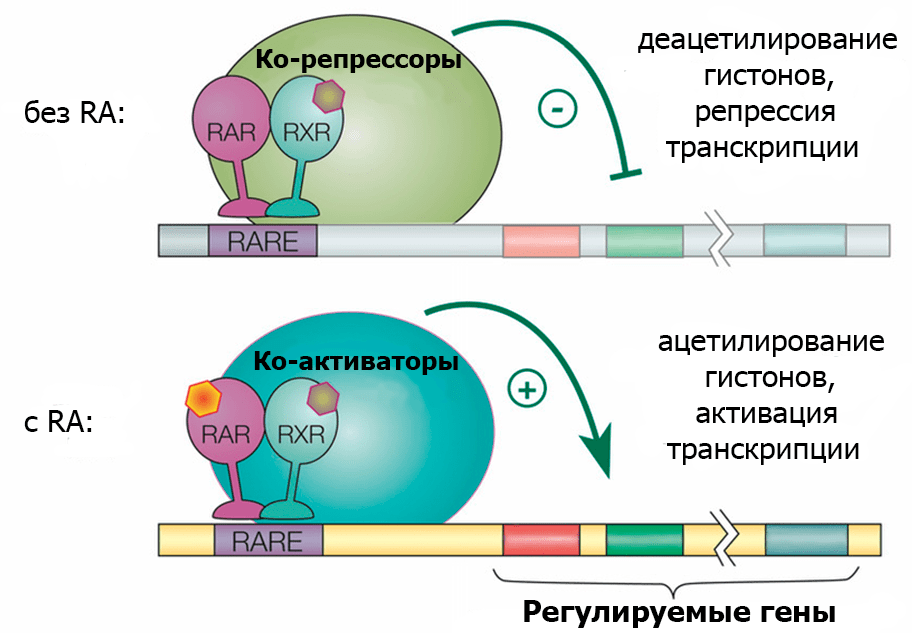
Точный механизм действия ацитретина неизвестен. Судя по всему, ацитретин связывается с рецепторами ретиноевой кислоты — активного метаболита витамина А, образующегося в кератиноцитах, — и запускает характерную для нее сигнализацию [9]. Как это происходит, и почему влияет на течение псориаза, показано на рисунке 2.
Рисунок 2. Принцип работы ретиноидных рецепторов (на примере связывания ретиноевой кислоты). За восприятие ретиноидных сигналов в клетке отвечают ядерные рецепторы семейства RAR (retinoic acid receptors, RARα–γ). RAR образует пару с другой рецепторной молекулой, RXR (retinoid X receptors, RXRα–γ), и этот комплекс взаимодействует с особыми нуклеотидными последовательностями — RARE (RA response elements) — в регуляторных областях ряда генов. Это взаимодействие модулирует активность многих генов, контролирующих рост, деление и дифференцировку клеток. Несвязанная с ретиноевой кислотой (RA) или другим лигандом пара RAR—RXR, взаимодействуя с RARE, чаще всего подавляет экспрессию близлежащих генов, потому что привлекает ко-репрессоры: они конденсируют хроматин так, что считывание наследственной информации в этом участке становится невозможным. Если же с RAR связана RA, то к такому RARE устремляются активаторы экспрессии генов, «расслабляющие» хроматин для посадки компонентов транскрипционной машины. Ретиноидная сигнализация нормализует структуру эпидермиса путем стимуляции клеточной дифференцировки и эксфолиации.
Хотя ацитретин демонстрирует высокую эффективность при псориазе, заранее сложно сказать, как долго пациенту нужно будет принимать препарат и насколько стойкую ремиссию он даст. Прием ацитретина может сопровождаться нежелательными реакциями, порой непереносимыми: фоточувствительностью, истончением и шелушением кожи по всему телу, хрупкостью ногтей, болями в костях и мышцах, тошнотой и др. Препарат противопоказан при нарушениях работы почек и печени, а из-за тератогенного эффекта — и при беременности. Более того, планировать беременность или становиться донором крови можно не менее чем через три года после завершения терапии. Из-за всех этих ограничений вопрос о назначении системных ретиноидов и их преимуществах перед другими лечебными подходами решается строго индивидуально [10].
Кальципотриол (кальципотриен)
Под таким мудреным названием скрывается синтетический аналог витамина D, а именно — его активной формы, кальцитриола. Эффективность кальципотриола была случайно обнаружена при лечении больных остеопорозом, которые также страдали и от псориаза [11]. Точный механизм действия препарата при псориазе не установлен. Известно, что благодаря своему химическому строению кальципотриол взаимодействует с рецепторами витамина D (VDR), но, в отличие от последнего, на обмен кальция влияет незначительно. Рецептор витамина D представлен в различных клетках, включая лимфоциты и кератиноциты; он относится к семейству стероидных рецепторов и работает чаще в виде гетеродимера с уже знакомым нам RXR. Одна часть VDR взаимодействует с лигандом, другая — с участками VDRE (vitamin D response elements) в промоторах регулируемых генов [12]. Далее события развиваются по аналогичному с ретиноидной регуляцией сценарию. Некоторые мутации VDR связаны с предрасположенностью к псориазу, да и дефицит VDR-сигнализации любой природы может иметь патогенетическое значение при этом заболевании.
При местном использовании кальципотриола у мышей и людей выявили дозозависимое повышение секреции кератиноцитами иммуномодулятора TSLP, причем у людей — его короткой формы (у мышей она не синтезируется) [8], [13].
Вообще, эффекты витамина D множественны, связаны не только с TSLP-сигнализацией и не до конца объяснены. При псориазе же важнее всего то, что в терапевтических дозах он:
- смещает баланс Th1+Th17/Th2-влияний в пользу последних, подавляя синтез Th1/Th17- и ряда других провоспалительных цитокинов, в числе которых IL-2, IFN-γ, TNF, IL-17, IL1β. В то же время активнее размножаются и вырабатывают цитокины клетки Th2, повышается уровень противовоспалительного IL-10, который подавляет активность Th1 и дендритных клеток;
- способствует дифференцировке и иммуносупрессивной активности регуляторных Т-клеток. Витамин D здесь может действовать через посредников — дендритные клетки;
- ограничивает избыточную пролиферацию Т-клеток и кератиноцитов, провоцируя их дифференцировку и апоптоз, а также снижает избыточную продукцию псориазина, которая нарушает дифференцировку кератиноцитов [14], [15];
- предохраняет от вторичных инфекций, стимулируя макрофагальный фагоцитоз [16].
При использовании мази, крема или раствора кальципотриола лечебный эффект появляется в течение двух недель. Существуют препараты, содержащие и кальципотриол, и глюкокортикоид: такая комбинация действует сильнее. Несмотря на все положительные стороны кальципотриола, его не стόит наносить на обширные участки пораженной кожи (более 30%), так как через нее в кровь может проникнуть избыточное количество лекарства, а это грозит повышением содержания кальция в крови и отложением его солей в почках [17].
Цитостатические препараты
Или просто цитостатики. Это противоопухолевые препараты, нарушающие процессы роста и размножения клеток, особенно быстро делящихся. Очевидно, что чаще всего их применяют для уничтожения злокачественных опухолей. Но поскольку при псориазе кератиноциты, подстегиваемые большим количеством иммунных клеток и цитокинов, делятся как угорелые, для его лечения тоже предложили использовать цитостатики, а точнее — метотрексат, циклоспорин и такролимус. Последние два препарата к этой группе относят не всегда, так как они всё же больше влияют на функции, чем на деление чувствительных клеток. Зато все три препарата можно назвать иммуносупрессорами.
Метотрексат относится к группе антиметаболитов — молекул, которые похожи по химической структуре на вещества, родные для нашего организма, и потому могут занять их место в биохимических процессах и привести к нарушению клеточных функций. Это всё равно что заменить одно из автомобильных колес колесом того же диаметра, но от велосипеда: вроде, всё то же, но далеко не уедешь.
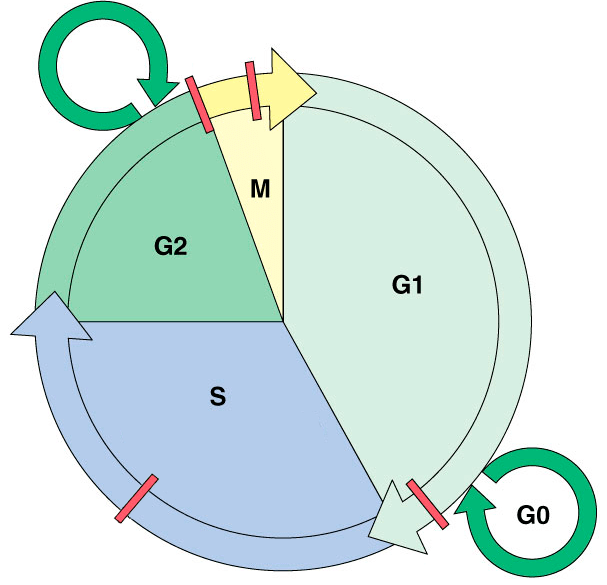
Метотрексат активен в отношении быстро пролиферирующих клеток (в том числе клеток кожи), находящихся в S-фазе клеточного цикла (рис. 3). Но с этим связано и его губительное действие на костный мозг, слизистые оболочки желудочно-кишечного тракта и мочевыводящих путей [6], [18]. Универсальный механизм его работы таков. Для синтеза ДНК организму необходима тетрагидрофолиевая кислота, которая образуется с помощью фермента дигидрофолатредуктазы. Метотрексат блокирует работу этого фермента, притворяясь его субстратом, дигидрофолатом. Кроме того, он ингибирует и другие ферменты, необходимые для синтеза нуклеотидов. В результате подавляются синтез и репарация ДНК, нарушается митоз. Описаны и более специфические механизмы влияния метотрексата на активность лимфоцитов [19].
Деликатнее работает иммуносупрессор циклоспорин. Более 40 лет назад его выделили из почвенных грибков и чуть позже дали на вооружение врачам, которые начали его применять для лечения псориаза. Циклоспорин избирательно блокирует фосфатазную активность кальциневрина в фазах G0 или G1 клеточного цикла T-лимфоцитов. Этот фермент активирует (дефосфорилирует) транскрипционные факторы NFAT, необходимые для синтеза IL-2, IFN-γ и других цитокинов — факторов роста и созревания Т-лимфоцитов [20]. Циклоспорин также мешает экспрессии генов IL-3, IL-4, IL-5, гранулоцитарно-макрофагального колониестимулирующего фактора и TNF. Говоря проще, этот препарат борется с воспалением, обусловленным активацией Т-клеток. Но важно отметить, что он не блокирует синтез цитокинов лимфоцитами раз и навсегда. При снижении его концентрации всё возвращается на круги своя. Более того, в отличие от метотрексата, циклоспорин не подавляет гемопоэз, а в отличие от глюкокортикоидов, не парализует сразу большинство иммунных процессов. Тем не менее его иммуносупрессивного действия хватает для повышения у пациентов риска развития инфекций, паразитарных инвазий и опухолей (особенно лимфом и злокачественных новообразований кожи).
Рисунок 3. Клеточный цикл. M — митоз (деление клетки); S — синтетическая фаза (репликация ДНК); G1 и G2 (Gap 1/2) — пре- и постсинтетическая фазы; G0 — выход из клеточного цикла (временный/постоянный). Красные прямоугольники — контрольные точки (checkpoints) клеточного цикла.
Другой ингибитор кальциневрина — такролимус — можно применять местно. Этот макролид, производимый стрептомицетами, подавляет активность Т-лимфоцитов так же, как и циклоспорин. Помимо этого такролимус тормозит высвобождение медиаторов воспаления из эозинофилов, базофилов и тучных клеток (тканевых базофилов). Клетки Лангерганса под его влиянием меньше экспрессируют FcεRI (высокоаффинный поверхностный рецептор иммуноглобулина Е), что подавляет их активность и презентацию антигенов Т-лимфоцитам. Такролимус — хорошая альтернатива местным глюкокортикоидам, поскольку он не нарушает синтез коллагена и не вызывает атрофии кожи. К побочным эффектам препарата можно отнести повышение вероятности возникновения кожных инфекций, зуд, отеки и фоточувствительность. Однозначных данных о повышении риска злокачественных новообразований кожи на фоне применения такролимуса пока нет [21], [22].
Ингибиторы фактора некроза опухоли
Фактор некроза опухоли альфа (TNF-α, или просто TNF) считают главным инициатором воспаления. В пораженной псориазом коже TNF секретируют Т-клетки и дендритные клетки. Он стимулирует синтез провоспалительных цитокинов IL-1, IL-2, IL-6, IL-8 и IFN-γ, вызывает экспрессию молекул адгезии на стенках кровеносных сосудов, способствуя привлечению иммуноцитов из кровяного русла в кожу, стимулирует производство кератиноцитами других медиаторов воспаления, активирует макрофаги, дендритные и Т-клетки.
Для ингибирования TNF применяют моноклональные антитела (инфликсимаб, адалимумаб) и гибридные белки (этанерцепт) [5], [23].
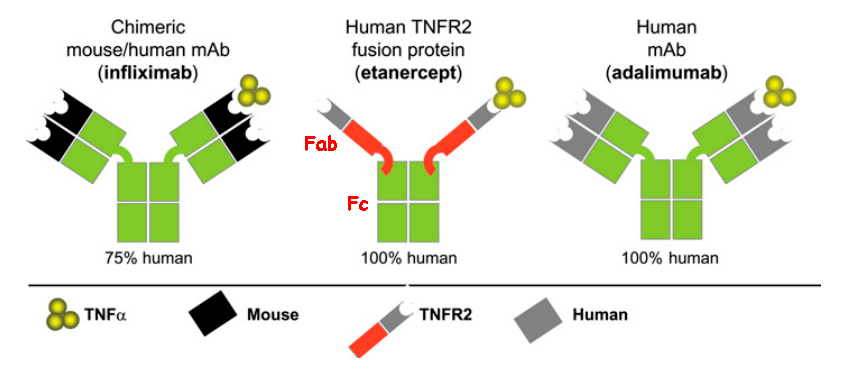
Моноклональные антитела — антитела, произведенные одним клоном клеток, берущим свое начало от одной плазматической клетки. Соединяясь с белком или другим антигеном, к которому они имеют сродство, антитела мешают ему выполнять свои функции. Лекарства из этой группы носят очень странные названия, оканчивающиеся на «-маб» (monoclonal antibody). А буквы перед «-маб» позволяют понять происхождение этих молекул: «-омабы» — полностью мышиные, «-ксимабы» — химерные, «-зумабы» — гуманизированные, «-умабы» — полностью человеческие антитела . Моноклональные антитела к TNF (рис. 4) влияют на иммунные реакции, которые изменяют уровень молекул адгезии, ответственных за миграцию лейкоцитов к очагам воспаления. Инфликсимаб вводится внутривенно, адалимумаб — подкожно.
Для препаратов, зарегистрированных после июня 2017 года, этот принцип упразднили, потому что с развитием биотехнологии появилось много комбинированных вариантов антител и возникла проблема выбора более подходящего названия [45]. — Ред.
Среди новых (применительно к обыкновенному псориазу) молекул можно выделить цертолизумаб пэгол. Это гуманизированный ПЭГилированный Fab-фрагмент антитела к TNF. Связывание с ПЭГ снижает иммуногенность, улучшает распределение в пораженных тканях и продляет жизнь молекулы в кровяном русле, а отсутствие Fc-фрагмента человеческого IgG1 меняет ее профиль цитотоксичности и затрудняет проникновение через плаценту, что может дать цертолизумабу преимущество перед одногруппниками в лечении беременных [24]. В фазе III клинических исследований препарат в дозировке 200 мг не уступил по эффективности этанерцепту, а в дозировке 400 мг — превзошел его, причем без ухудшения переносимости [25].
Гибридный белок этанерцепт действует немного иначе — как ловушка для TNF. Дело в том, что существуют два типа рецепторов TNF: рецепторы на лейкоцитах, соединение TNF с которыми запускает иммунный ответ, и растворимые рецепторы, циркулирующие в кровяном русле, которые оттягивают на себя TNF и тем самым уменьшают иммунный ответ. Как раз под последние и «подделывается» этанерцепт (рис. 4), но, благодаря Fc-фрагменту человеческого IgG1, он может дольше находиться в кровяном русле и дольше оставаться эффективным.
Рисунок 4. Примеры блокаторов TNF. Инфликсимаб — химерное (мышино-человеческое) моноклональное антитело к TNF. Адалимумаб — полностью человеческое моноклональное антитело. Этанерцепт — гибрид, состоящий из двух растворимых рецепторов TNF (p75) и Fc-фрагмента человеческого IgG1. Fab — антигенсвязывающий фрагмент антитела.
Одним из молекулярных механизмов терапевтического действия TNF-ингибиторов может быть перестройка эпигенетических процессов. Например, в ходе лечения этанерцептом или адалимумабом в крови частично корректируются метильные профили ДНК, меняется продукция десятков типов микроРНК [4].
Поскольку TNF участвует во множестве биологических процессов, подавление его сигнализации не может быть безобидным. Ингибиторы TNF иммуногенны (их эффективность со временем падает из-за выработки антител к ним), противопоказаны в случае тяжелых инфекций (например, туберкулеза) и могут провоцировать частые инфекции кожи и слизистых, хотя по этому пункту ученые ведут споры, ежегодно публикуя обширные статистические работы как в поддержку [26], так и в опровержение этого [27].
Ингибиторы интерлейкинов
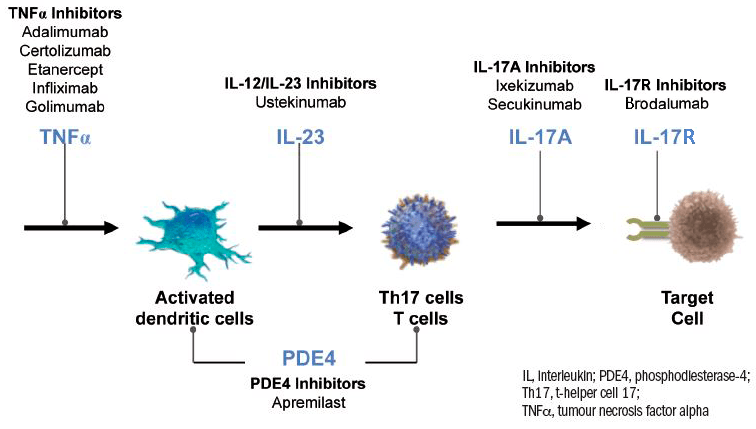
Ингибиторы интерлейкинов фактически действуют так же, как и ингибиторы TNF, и тоже представляют собой моноклональные антитела, но связываются они уже с интерлейкинами. Поскольку популяция клеток Тh17 играет ключевую роль в возникновении псориаза, а цитокин IL-17 специфичен для иммуноопосредованных воспалительных заболеваний (псориаза, болезни Крона, ревматоидного артрита и др.), моноклональные антитела к IL-17 бьют по цели точнее, чем ингибиторы TNF. С IL-17А взаимодействуют секукинумаб и иксекизумаб, а с рецептором IL-17 — бродалумаб.
Моноклональные антитела к субъединицам IL-12 и/или IL-23 тоже эффективно подавляют деятельность Тh17 и Тh1. В эту группу препаратов входят широко известный устекинумаб и относительно недавно одобренная к применению в США и Евросоюзе молекула гуселькумаб [28].
Поскольку ингибиторов интерлейкинов появляется всё больше, приходится регулярно сравнивать их эффективность. Так, одно из исследований 2018 года выстроило препараты по мере снижения эффективности в таком порядке: иксекизумаб и бродалумаб → секукинумаб → устекинумаб [29]. Однако препараты могут проявлять разную эффективность при разных исходных данных, таких как возраст, форма и тяжесть псориаза, сопутствующие болезни и др. А эти исследования им только предстоит пройти.
Моноклональные антитела к интерлейкинам произвели революцию в лечении псориаза, но, к сожалению, эти лекарства отличает очень высокая цена. Поэтому, несмотря на высокую эффективность в клинических исследованиях, они пока остаются малодоступными для широкого круга больных. Нежелательные реакции при применении этой группы препаратов и ингибиторов TNF схожи [27], [30].
Исследователи не ограничились существующим набором молекул и продолжают поиск более эффективных и при этом не менее безопасных. Или не менее эффективных, но более безопасных и/или экономически выгодных. Недавно завершилась фаза 2b клинических исследований новой гуманизированной молекулы — бимекизумаба [31]. Она блокирует сразу две разновидности интерлейкина-17 — IL-17A и IL-17F. Если сравнивать с традиционной блокировкой IL-17A, такая двойная нейтрализация сильнее подавляет экспрессию провоспалительных генов и миграцию иммунных клеток. К 2020 году должна завершиться III фаза клинических исследований бимекизумаба, с бóльшим числом участников, продленным сроком лечения и секукинумабом в качестве контрольного препарата.
Ингибиторы фосфодиэстеразы-4
Фосфодиэстераза-4 (PDE4) — это основная фосфодиэстераза, регулирующая обмен циклического аденозинмонофосфата (цАМФ) в иммунных клетках. Высокая концентрация цАМФ в клетках приводит к депонированию кальция, направлению активности ферментов и цитокиновой сигнализации в сторону подавления воспаления: выработка TNF, IL-23, IL-17 снижается, а IL-10 — повышается. PDE4 разрушает цАМФ, чем стимулирует воспаление, а потому служит одной из терапевтических мишеней при псориазе.
Показано, что апремиласт ингибирует PDE4, что в конечном счете ведет к ослаблению воспалительной реакции. Преимуществом апремиласта считают то, что он подавляет воспаление на более раннем этапе, чем моноклональные антитела к TNF (инфликсимаб, адалимумаб), IL-12/23 (устекинумаб) или IL-17A (секукинумаб, иксекизумаб) [32].
Из нежелательных реакций при приеме апремиласта чаще всего фиксируют расстройства пищеварения и инфекции дыхательных путей [33]. Эффективность апремиласта оценивают лишь к концу первого полугодия лечения, что в сочетании с его высокой стоимостью и доступностью более дешевых противопсориатических препаратов говорит не в пользу его назначения.
Сводная схема таргетированных терапевтических воздействий на основные звенья патогенеза псориаза приведена на рисунке 5. Если говорить о сравнительной эффективности ингибиторов TNF, интерлейкинов и PDE4, то крупное исследование 2018 года показало, что с помощью ингибиторов интерлейкинов или инфликсимаба можно избавиться от псориатических бляшек быстрее, чем с помощью этанерцепта, адалимумаба или апремиласта. Инфликсимаб проигрывает ингибиторам интерлейкинов по двум параметрам: его нужно вводить внутривенно, и на фоне его применения чаще развиваются инфекционные заболевания [29].
Рисунок 5. Патогенетическая терапия псориаза. Объяснения даны в тексте.
Фототерапия
В борьбе с псориазом часто задействуют и физические факторы, а именно — ультрафиолетовое (УФ) излучение. Облучение пораженных участков кожи УФ определенной длины волны (UVА, UVB) называют фототерапией. UVB-терапия может быть широкополосной (280–320 нм) и узкополосной средневолновой (NB-UVB, 311 нм). Второму варианту практически идентична UVB-терапия, проводимая эксимерным лазером (308 нм). Эта группа методов не требует применения каких-либо специальных медикаментов и не противопоказана даже детям.
UVА-терапию чаще используют в виде модификации PUVA — облучения длинноволновым УФ (320–400 нм) с применением фотосенсибилизаторов из группы псораленов. Фотосенсибилизаторы — это вещества, повышающие чувствительность клеток к воздействию УФ. Они могут применяться перорально или наружно, в том числе в виде псораленовых ванн. Из-за повышенной (относительно UVB-терапии) канцерогенности к PUVA прибегают при тяжелых формах псориаза, его прогрессии и в случае неэффективности других средств.
Фототерапия может действовать на течение псориаза несколькими способами, которые обычно делят на четыре категории: индукция апоптоза, изменение цитокиновой сигнализации, иммуносупрессия, прочие механизмы (см. врезку) [34]. Однако эти эффекты во многом взаимосвязаны и взаимообусловлены.
Выбор лечебного подхода
Любой лечебный подход преследует три главных цели: уменьшение баллов PASI (индекса охвата и тяжести псориаза), повышение качества жизни и максимальная продолжительность ремиссии. Достичь этих целей можно только под руководством грамотного врача, который обязан учитывать многообразие эффектов лечебного агента, особенности его метаболизма [3] и возможное взаимодействие с другими лекарственными средствами.
В лечении псориаза, как и большинства заболеваний, всё очень и очень индивидуально. То, что работает у одного, другому может абсолютно не подойти. Тем не менее врачи разработали общую стратегию ведения пациентов с псориазом (рис. 7).
Рисунок 7. Стандартный алгоритм ведения пациента с подтвержденным диагнозом «псориаз»
Выбор того или иного лечебного подхода определяется степенью тяжести псориаза. А объективным критерием тяжести псориаза, принятым в большинстве стран мира, служит PASI. При значении индекса до 10 псориаз считается легким, от 10 до 20 — средней тяжести, более 20 — тяжелым. У большинства пациентов PASI не превышает 10, и в таких случаях ограничиваются наружным лечением. Превышение 10 баллов служит показанием для назначения метотрексата, циклоспорина и ацитретина [40]. В некоторых случаях целесообразно комбинировать метотрексат или ацитретин с фототерапией (UVВ, PUVA), что позволяет одновременно снизить дозировку препаратов, частоту побочных эффектов и канцерогенный потенциал фототерапии [41], [42]. В случае неэффективности, непереносимости побочных эффектов или при противопоказаниях к применению перечисленных подходов прибегают к биологическим препаратам (моноклональным антителам).
Вносить свою лепту в тяжесть болезни и длительность ремиссии могут и вспомогательные, немедикаментозные подходы. Обычно врачи рекомендуют снижение уровня стресса, соблюдение диеты, климатотерапию (курорты с сероводородными, кремнистыми и радоновыми водами) и применение увлажняющих средств.
Заключение
Даже если просто просмотреть заголовки в этой статье, станет ясно: разнообразие видов терапии псориаза настолько велико, что позволяет более-менее индивидуализировать лечение. Но ни один из существующих подходов не лишен недостатков, порой весьма серьезных.
Псориаз — одна из самых распространенных кожных болезней, которая до сих пор окружена множеством загадок и сильно влияет на жизнь больных. Поэтому пациенты с этим диагнозом больше, чем многие другие страдающие хроническими воспалительными заболеваниями, могут рассчитывать на изобретение той самой «волшебной таблетки» (а скорее, нескольких), которая наконец заставит забыть о недуге навсегда. В последние годы новая информация о патогенезе, генетике и эпигенетике псориаза появляется особенно быстро. Это позволяет постепенно переходить от неизбирательной «тяжелой артиллерии» к специфичным средствам, бьющим по конкретным звеньям патогенеза. Каждый год в мире синтезируются новые молекулы, но лишь единицы из них, пройдя длинный путь проверок безопасности и эффективности, достигают организма больного. При этом каждый новый одобренный препарат хоть в чём-то превосходит старые, приближая нас к моменту, когда псориаз станет очередной побежденной болезнью в истории медицины.
- Псориаз: на войне с собственной кожей;
- Псориаз: Т-хелперы, цитокины и молекулярные шрамы;
- Генетика псориаза: иммунитет, барьерная функция кожи и GWAS;
- Эпигенетика псориаза: молекулярные отметины судьбы;
- Karow T. Allgemeine und Spezielle Pharmakologie und Toxikologie. Verlag: Dr. med. Thomas Karow, 2012. — 1275 p.;
- Кубанова А.А., Кисина В.И., Блатун Л.А., Вавилов А.М. и др. Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем: Рук. для практикующих врачей / под общ. ред. Кубановой А.А., Кисиной В.И. М.: «ЛитТерра», 2005. — 890 с.;
- Elisabetta Volpe, Lucia Pattarini, Carolina Martinez-Cingolani, Stephan Meller, Marie-Helene Donnadieu, et. al.. (2014). Thymic stromal lymphopoietin links keratinocytes and dendritic cell–derived IL-23 in patients with psoriasis. Journal of Allergy and Clinical Immunology. 134, 373-381.e4;
- Katerina Tsilingiri, Giulia Fornasa, Maria Rescigno. (2017). Thymic Stromal Lymphopoietin: To Cut a Long Story Short. Cellular and Molecular Gastroenterology and Hepatology. 3, 174-182;
- Ferdinand Marlétaz, Linda Z. Holland, Vincent Laudet, Michael Schubert. (2006). Retinoic acid signaling and the evolution of chordates. Int. J. Biol. Sci.. 38-47;
- United States pharmacopeia dispensing information. Drug information for the health care professional. 24th ed. V. 1.plus updates. Thomson/Micromedex. Greenwood Village, CO, 2004. — p. 21;
- Morimoto S. and Kumahara Y. (1985). A patient with psoriasis cured by 1-α-hydroxyvitamin D3. Med. J. Osaka Univ. 35 (3–4), 51–54;
- Igor Orlov, Natacha Rochel, Dino Moras, Bruno P Klaholz. (2012). Structure of the full human RXR/VDR nuclear receptor heterodimer complex with its DR3 target DNA. The EMBO Journal. 31, 291-300;
- M. Li, P. Hener, Z. Zhang, S. Kato, D. Metzger, P. Chambon. (2006). Topical vitamin D3 and low-calcemic analogs induce thymic stromal lymphopoietin in mouse keratinocytes and trigger an atopic dermatitis. Proceedings of the National Academy of Sciences. 103, 11736-11741;
- Ananya Datta-Mitra, Suravi Raychaudhuri, Anupam Mitra. (2014). Immunomodulatory mechanisms of action of calcitriol in psoriasis. Indian J Dermatol. 59, 116;
- A Ekman, J Vegfors, C Eding, C Enerbäck. (2017). Overexpression of Psoriasin (S100A7) Contributes to Dysregulated Differentiation in Psoriasis. Acta Derm Venerol. 97, 441-448;
- Luigi Barrea, Maria Cristina Savanelli, Carolina Di Somma, Maddalena Napolitano, Matteo Megna, et. al.. (2017). Vitamin D and its role in psoriasis: An overview of the dermatologist and nutritionist. Rev Endocr Metab Disord. 18, 195-205;
- Дерматовенерология. Клинические рекомендации / под ред. Кубановой А.А. М.: «ДЭКС-Пресс», 2010. — 428 с.;
- Биохимия: Учеб. для вузов / под ред. Северина Е.С. М.: «ГЭОТАР-Медиа», 2003. — 779 с.;
- J. A. M. Wessels, T. W. J. Huizinga, H.-J. Guchelaar. (2007). Recent insights in the pharmacological actions of methotrexate in the treatment of rheumatoid arthritis. Rheumatology. 47, 249-255;
- Satoshi Matsuda, Shigeo Koyasu. (2000). Mechanisms of action of cyclosporine. Immunopharmacology. 47, 119-125;
- T.C. Lucka, D. Pathirana, A. Sammain, F. Bachmann, S. Rosumeck, et. al.. (2012). Efficacy of systemic therapies for moderate-to-severe psoriasis: a systematic review and meta-analysis of long-term treatment. Journal of the European Academy of Dermatology and Venereology. 26, 1331-1344;
- Alan Menter, Neil J. Korman, Craig A. Elmets, Steven R. Feldman, Joel M. Gelfand, et. al.. (2009). Guidelines of care for the management of psoriasis and psoriatic arthritis. Journal of the American Academy of Dermatology. 61, 451-485;
- Róbert Kui, Brigitta Gál, Magdolna Gaál, Mária Kiss, Lajos Kemény, Rolland Gyulai. (2016). Presence of antidrug antibodies correlates inversely with the plasma tumor necrosis factor (TNF)-α level and the efficacy of TNF-inhibitor therapy in psoriasis. J Dermatol. 43, 1018-1023;
- Enrique Soriano, Maria Laura Acosta Felquer, Javier Rosa. (2016). An evidence-based review of certolizumab pegol in the treatment of active psoriatic arthritis: place in therapy. OARRR. 37;
- Mark Lebwohl, Andrew Blauvelt, Carle Paul, Howard Sofen, Jolanta Węgłowska, et. al.. (2018). Certolizumab pegol for the treatment of chronic plaque psoriasis: Results through 48 weeks of a phase 3, multicenter, randomized, double-blind, etanercept- and placebo-controlled study (CIMPACT). Journal of the American Academy of Dermatology. 79, 266-276.e5;
- Allison S. Dobry, Charles P. Quesenberry, G. Thomas Ray, Jamie L. Geier, Maryam M. Asgari. (2017). Serious infections among a large cohort of subjects with systemically treated psoriasis. Journal of the American Academy of Dermatology. 77, 838-844;
- André Vicente Esteves de Carvalho, Rodrigo Pereira Duquia, Bernardo Lessa Horta, Renan Rangel Bonamigo. (2017). Efficacy of Immunobiologic and Small Molecule Inhibitor Drugs for Psoriasis: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Drugs R D. 17, 29-51;
- Kristian Reich, April W. Armstrong, Peter Foley, Michael Song, Yasmine Wasfi, et. al.. (2017). Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the treatment of patients with moderate to severe psoriasis with randomized withdrawal and retreatment: Results from the phase III, double-blind, placebo- and active comparator–controlled VOYAGE 2 trial. Journal of the American Academy of Dermatology. 76, 418-431;
- Anne M. Loos, Shanshan Liu, Celia Segel, Daniel A. Ollendorf, Steven D. Pearson, Jeffrey A. Linder. (2018). Comparative effectiveness of targeted immunomodulators for the treatment of moderate-to-severe plaque psoriasis: A systematic review and network meta-analysis. Journal of the American Academy of Dermatology. 79, 135-144.e7;
- Agnieszka Wasilewska, Marta Winiarska, Małgorzata Olszewska, Lidia Rudnicka. (2016). Interleukin-17 inhibitors. A new era in treatment of psoriasis and other skin diseases. pdia. 4, 247-252;
- Kim A. Papp, Joseph F. Merola, Alice B. Gottlieb, Christopher E.M. Griffiths, Nancy Cross, et. al.. (2018). Dual neutralization of both interleukin 17A and interleukin 17F with bimekizumab in patients with psoriasis: Results from BE ABLE 1, a 12-week randomized, double-blinded, placebo-controlled phase 2b trial. Journal of the American Academy of Dermatology. 79, 277-286.e10;
- Stacy L. Haber, Sarah Hamilton, Mark Bank, Shi Yun Leong, Evelyn Pierce. (2016). Apremilast. Ann Pharmacother. 50, 282-290;
- Kim Papp, Jennifer C Cather, Les Rosoph, Howard Sofen, Richard G Langley, et. al.. (2012). Efficacy of apremilast in the treatment of moderate to severe psoriasis: a randomised controlled trial. The Lancet. 380, 738-746;
- Tami Wong, Leon Hsu, Wilson Liao. (2013). Phototherapy in Psoriasis: A Review of Mechanisms of Action. J Cutan Med Surg. 17, 6-12;
- S. Haupt. (2003). Apoptosis — the p53 network. Journal of Cell Science. 116, 4077-4085;
- Terrence C. Keaney, Robert S. Kirsner. (2010). New Insights into the Mechanism of Narrow-Band UVB Therapy for Psoriasis. Journal of Investigative Dermatology. 130, 2534;
- Chih-Hung Lee, Shi-Bei Wu, Chien-Hui Hong, Hsin-Su Yu, Yau-Huei Wei. (2013). Molecular Mechanisms of UV-Induced Apoptosis and Its Effects on Skin Residential Cells: The Implication in UV-Based Phototherapy. IJMS. 14, 6414-6435;
- Olga María Palomino. (2015). Current knowledge in Polypodium leucotomos effect on skin protection. Arch Dermatol Res. 307, 199-209;
- Chih-Hung Lee, Shi-Bei Wu, Chien-Hui Hong, Hsin-Su Yu, Yau-Huei Wei. (2013). Molecular Mechanisms of UV-Induced Apoptosis and Its Effects on Skin Residential Cells: The Implication in UV-Based Phototherapy. IJMS. 14, 6414-6435;
- U. Mrowietz, E.M.G.J. de Jong, K. Kragballe, R. Langley, A. Nast, et. al.. (2014). A consensus report on appropriate treatment optimization and transitioning in the management of moderate-to-severe plaque psoriasis. J Eur Acad Dermatol Venereol. 28, 438-453;
- John Koo, Mio Nakamura. (2017). Combing Phototherapy with Acitretin: Re-PUVA and Re-UVB. Clinical Cases in Phototherapy. 113-118;
- Heba M. Mashaly, Marwa F. Hussein, Shaimaa Hamdy, Olfat Shaker. (2017). Evaluation of carcinogenic risk of PUVA versus Re-PUVA in psoriatic patients. Journal of the Egyptian Womenʼs Dermatologic Society. 14, 106-110;
- Jacquelyn J. Bower, Leah D. Vance, Matthew Psioda, Stephanie L. Smith-Roe, Dennis A. Simpson, et. al.. (2017). Patterns of cell cycle checkpoint deregulation associated with intrinsic molecular subtypes of human breast cancer cells. npj Breast Cancer. 3;
- Cristina Russo, Riccardo Polosa. (2005). TNF-α as a promising therapeutic target in chronic asthma: a lesson from rheumatoid arthritis. Clin. Sci.. 109, 135-142;
- Paul W. H. I. Parren, Paul J. Carter, Andreas Plückthun. (2017). Changes to International Nonproprietary Names for antibody therapeutics 2017 and beyond: of mice, men and more. mAbs. 9, 898-906.
Владимиров В.В.
Институт повышения квалификации ФМБА России, Москва
Фототерапия хронических дерматозов узкополосным ультрафиолетовым излучением 311 нм
Авторы:
Владимирова Е.В., Владимиров В.В.
Как цитировать:
Владимирова Е.В., Владимиров В.В. Фототерапия хронических дерматозов узкополосным ультрафиолетовым излучением 311 нм. Клиническая дерматология и венерология.
2010;8(3):82‑86.
Vladimirova EV, Vladimirov VV. Phototherapy of chronic dermatoses by narrow-band ultraviolet radiation at 311 nm wavelength. Klinicheskaya Dermatologiya i Venerologiya. 2010;8(3):82‑86. (In Russ.)

Настоящая статья является продолжением ряда публикаций помощи практикующему врачу, посвященных фототерапии хронических дерматозов с применением ультрафиолетового излучения (УФИ). Предыдущие работы опубликованы в ряде журналов, которые были посвящены определению фототипа кожи при проведении фототерапии [1], фотохимиотерапии — ПУВА [2] и средневолновой широкополосной ультрафиолетовой фототерапии [3].
Первой реакцией на УФИ является эритема, развивающаяся спустя 4—6 ч после облучения, которую с клинической точки зрения можно трактовать как фотодерматит. Он возникает под воздействием ультрафиолетовых лучей с длиной волны более 300 нм [4].
УФИ как в средневолновом (УФБ), так и длинноволновом (УФА) спектре при попадании на кожу вызывает ряд биологических эффектов; следствием последних являются эритема (покраснение), гиперпигментация (загар) и в более поздние сроки, особенно при избыточном воздействии на кожу УФИ — старение и появление новообразований.
Научные исследования, выполненные в последние годы и направленные на изыскание более безопасных спектров УФИ, привели к созданию ламп, дающих излучение длиной волны 311 нм (рис. 1).
Эта длина волны, в отличие от широкополосного УФИ, вызывает меньшую эритему. На рис. 2
Несмотря на большой опыт применения узкополосной 311-нанометровой УФБ-терапии, механизм ее действия до сих пор окончательно не выяснен. J. Viac и соавт. [5] считают, что узковолновая УФБ-терапия на длине волны 311 нм оказывает избирательное воздействие на иммунитет кожи. У здоровых добровольцев экспрессия клеток CD1+ уменьшается, HLA-DR+ отростчатых клеток увеличивается в отсутствие дермоэпидермальной инфильтрации макрофагами CD11b. В верхних слоях эпидермиса отмечается более активное связывание биотинилированного вещества Р, в дерме повышаются экспрессия ICAM-1 и индукция Е-селектина клетками эндотелия.
По мнению A. el-Ghorr и соавт. [6], УФБ-излучение 311 нм оказывает более выраженное, чем широковолновое УФБ-излучение, действие на системный иммунный ответ, что выражается в активности натуральных киллеров, лимфопролиферации и ответе цитокинов.
В настоящее время считают, что основным механизмом разрешения псориатических бляшек под воздействием узкополосного УФБ-излучения 311 нм является индукция последним Т-клеточного апоптоза [7].
В ходе последующих исследований выявлена высокая эффективность узковолновой 311-нанометровой фототерапии при минимальных побочных эффектах [8—10].
Методика лечения узкополосной 311-нанометровой фототерапией. Эффективность фототерапии и безопасность ее применения зависят от следующих факторов: 1) определения реакции кожи на солнечное (УФИ), т.е. определения фототипа кожи; 2) контроля интенсивности излучения ультрафиолетовых ламп в аппаратах для фототерапии; 3) контроля за дозой УФИ; 4) методики лечения.
Определение фототипа кожи, т.е. реагирования ее на солнечное (ультрафиолетовое) облучение по эритеме и гиперпигментации с выделением 3 фототипов с уточняющими характеристиками по цвету глаз, волос и других параметров [1]:
1-й фототип — возникновение эритемы без пигментации (наблюдается у людей со светлыми и рыжими волосами, белой кожей с веснушками, голубыми глазами);
2-й фототип — возникновение эритемы с последующей пигментацией (наблюдается у людей с русыми или каштановыми волосами, смуглой кожей, карими глазами;
3-й фототип — возникновение пигментации без эритемы (наблюдается у людей с каштановыми или черными волосами, смуглой кожей, карими или черными глазами).
Контроль за интенсивностью излучения ультрафиолетовых ламп проводится с целью обеспечения должного эффекта терапии, а также для профилактики побочных эффектов. Интенсивность УФИ измеряется в мВт/см2. Этот контроль осуществляется УФ-метрами, измеряющими интенсивность излучения ламп УФИ (рис. 4).
Для учета отпускаемых процедур введена единица, носящая название «доза облучения», обозначаемая в Дж/см2. Она зависит от интенсивности излучения и времени облучения.
Режим дозирования УФБ определяется двумя методами:
1) с определением минимальной эритемной дозы (МЭД);
2) без определения МЭД.
Методики лечения. При первой методике в качестве критерия начальной дозы облучения используется минимальная МЭД, т.е. такая доза УФБ-лучей, которая вызвала минимальное покраснение или гиперпигментацию кожи после облучения на испытательных полях. Для определения МЭД испытательные поля облучают возрастающими дозами УФБ-лучей.
Определив МЭД, лечение начинают с дозы, меньшей на 50% МЭД, и каждую последующую процедуру увеличивают на 25—50% от МЭД (в зависимости от реакции кожи и переносимости лечения).
По второй методике лечения, без определения МЭД, при 1-м фототипе кожи лечение начинают с дозы 0,05 Дж/см2, при 2-м и 3-м фототипах кожи — с дозы 0,05—0,1 Дж/см2.
Реакция кожи на УФИ развивается, как правило, спустя 4—6 ч после облучения и выражается в появлении эритемы и чувства легкого зуда. Обычно спустя 2—3 ч эти явления исчезают. Однако, если воспалительная реакция кожи остается на более длительный срок, рекомендуется дождаться ее исчезновения и после этого продолжить лечение.
В процессе лечения у всех больных появляется легкий загар. Следует отметить, что образование пигментации при терапии УФБ-лучами 311 нм занимает среднее положение между ПУВА и широкополосной средневолновой (селективной) фототерапией. Пигментация более интенсивная, чем при широкополосной средневолновой фототерапии, но менее интенсивная, чем при ПУВА.
Фотохимиотерапия (ПУВА) остается наиболее эффективной методикой фототерапии. Наши данные свидетельствуют, что клиническое излечение при ПУВА наблюдается в 96% случаев, тогда как при узкополосной 311-нанометровой фототерапии — в 80—83%. Однако по переносимости и безопасности узкополосная 311-нанометровая фототерапия превосходит ПУВА.
Противопоказания к фототерапии. Перед началом фототерапии больные должны быть обследованы для исключения патологии внутренних органов, поскольку лечение ультрафиолетовыми лучами имеет ряд противопоказаний. Применение фототерапии противопоказано при заболеваниях глаз (глаукома, катаракта), гипертонической болезни (II, III стадии), эндокринопатиях, наличии доброкачественных и злокачественных опухолей. С этой целью перед началом лечения больной должен быть обследован терапевтом, хирургом, офтальмологом, гинекологом, эндокринологом.
Показания к узкополосной 311-нанометровой фототерапии: псориаз, атопический дерматит, почесуха, парапсориаз, красный плоский лишай, солнечная крапивница, полиморфный солнечный дерматоз.
Особенности лечения псориаза. При методике 3- или 4-разовых облучений в неделю в случае регресса высыпаний нет необходимости постоянно увеличивать дозу УФБ-лучей. Например, на 2-й неделе при дозе УФБ-излучения 0,5 Дж/см2 наблюдается исчезновение клинических проявлений на коже, поэтому доза УФБ-излучения 0,5 Дж/см2 может быть сохранена в последующие дни лечения. В отсутствие регресса требуется увеличение дозы. В последующем, например на 3-й неделе, на фоне дозы 0, Дж/см2 наблюдается регресс высыпаний, и эта доза должна оставаться прежней.
Особенности лечения парапсориаза. Средневолновым УФИ узкого спектра 311 нм проводится лечение бляшечной и каплевидной форм парапсориаза. Режим облучений может быть от 3 до 4 раз в неделю. Во время лечения у больного с бляшечной формой парапсориаза могут появляться новые, ранее не видимые высыпания на коже туловища и конечностей. При их появлении отмена назначенного курса лечения не требуется. Лечение проводится до полного исчезновения клинических проявлений на коже.
Особенности лечения красного плоского лишая. Лечение проводится, как правило, по методике 3-разовых облучений в неделю. Рекомендуется применять эритемные дозы УФБ-излучения на весь период лечения.
Сроки окончания лечения определяются клиническим эффектом — до полного регресса высыпаний.
Особенности лечения атопического дерматита и почесухи. Поскольку эти заболевания имеют общую природу и порой сходную клиническую картину, подход к лечению средневолновым 311-нанометровым УФИ идентичен методике лечения широковолнового спектра, однако режим облучений может быть от 3 до 4 раз в неделю. Лечение начинают с минимальной (субэритемной) дозы УФБ-лучей и осуществляют до полного исчезновения клинических проявлений на коже. Курс лечения может составлять от 20 до 30 процедур.
Особенности лечения витилиго. Лечение при витилиго средневолновым УФИ широкого спектра основывается на тех же принципах, которые были разработаны для лечения витилиго УФИ, т.е. проводится на эритемных дозах, когда на депигментированных участках возникает эритема и появляются очажки пигментации.
На курс лечения рекомендуется не более 20 процедур. Для достижения положительного эффекта терапии необходимо нескольких курсов с перерывом между ними 20—30 дней.
Особенности лечения облысения. Лечение как тотальной, так и очаговой формы облысения проводится на эритемных дозах. Режим облучений может быть от 2 до 3 процедур в неделю. На курс лечения рекомендуется не более 10—15 процедур. Для достижения положительного эффекта терапии необходимо нескольких курсов лечения с перерывом между ними 20—30 дней.