Описание препарата Спирива® Респимат® (раствор для ингаляций, 2.5 мкг/доза) основано на официальной инструкции, утверждено компанией-производителем в 2021 году
Дата согласования: 24.09.2021
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок
24.09.2021
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для ингаляций | 1 доза |
| активное вещество: | |
| тиотропий | 2,5 мкг |
| соответственно тиотропия бромида моногидрат — 3,1235 мкг | |
| вспомогательные вещества: бензалкония хлорид — 1,105 мкг; динатрия эдетат — 1,105 мкг; хлористоводородная кислота 1М — до рН 2,8–3,0; вода — до 11,05 мг |
Описание лекарственной формы
Прозрачный бесцветный или почти бесцветный раствор в картридже вместимостью 4,5 мл, помещенном в алюминиевый цилиндр.
Фармакологическое действие
Фармакологическое действие
—
м-холиноблокирующее, бронходилатирующее.
Фармакодинамика
Тиотропия бромид — антимускариновый препарат длительного действия, в клинической практике часто называемый м-холиноблокирующим средством. Препарат обладает одинаковым сродством к M1–M5 подтипам мускариновых рецепторов. Результатом ингибирования M3-рецепторов в дыхательных путях является расслабление гладкой мускулатуры. Бронходилатирующий эффект зависит от дозы и сохраняется не менее 24 часов. Значительная продолжительность действия связана вероятно с очень медленной диссоциацией препарата от M3-рецепторов; период полудиссоциации существенно более длительный, чем у ипратропия бромида. При ингаляционном способе введения тиотропий бромид, как N-четвертичное производное аммония, оказывает местный избирательный эффект (на бронхи), при этом в терапевтических дозах не вызывает системных м-холиноблокирующих побочных эффектов. Диссоциация от M2-рецепторов происходит быстрее, чем от M3-рецепторов, что свидетельствует о преобладании селективности в отношении M3 подтипа рецепторов над M2-рецепторами. Высокое сродство к рецепторам и медленная диссоциация препарата из связи с рецепторами обусловливают выраженный и продолжительный бронходилатирующий эффект у пациентов с хронической обструктивной болезнью легких (ХОБЛ).
Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена, в первую очередь, местным (на дыхательные пути), а не системным действием.
В клинических исследованиях было показано, что применение препарата СПИРИВА РЕСПИМАТ 1 раз в день приводит к значительному улучшению (по сравнению с плацебо) функции легких — объем форсированного воздуха за 1 секунду (ОФВ1) и форсированная жизненная емкость легких (ФЖЕЛ) в течение 30 минут после использования первой дозы. Улучшение функции легких сохраняется в течение 24 часов при равновесной концентрации.
Фармакодинамическое равновесие достигалось в течение одной недели. СПИРИВА РЕСПИМАТ значительно улучшал утреннюю и вечернюю пиковую объемную скорость выдоха (ПОСВ), измеренную больными. Применение препарата СПИРИВА РЕСПИМАТ приводило к уменьшению (по сравнению с плацебо) использования бронходилататора в качестве средства скорой помощи.
Бронходилатирующий эффект препарата сохраняется на протяжении 48 недель применения препарата; признаков привыкания не отмечается.
Анализ комбинированных данных двух рандомизированных, плацебо-контролируемых, перекрестных клинических исследований показал, что бронходилатирующий эффект препарата СПИРИВА РЕСПИМАТ (5 мкг) после 4-недельного периода лечения был в количественном отношении выше, чем эффект препарата СПИРИВА (18 мкг).
В долгосрочных (12-месячных) исследованиях было установлено, что СПИРИВА РЕСПИМАТ значительно уменьшает одышку; улучшает качество жизни; снижает психосоциальное воздействие ХОБЛ и увеличивает активность.
Препарат СПИРИВА РЕСПИМАТ достоверно улучшал общее состояние здоровья (общий балл) по сравнению с плацебо к концу двух 12-месячных исследований, это различие сохранялось на протяжении всего периода лечения; препарат СПИРИВА РЕСПИМАТ значительно уменьшал число обострений ХОБЛ, и увеличивал период до момента первого обострения по сравнению с плацебо.
Доказано, что СПИРИВА РЕСПИМАТ уменьшает риск обострения ХОБЛ и значительно снижает количество случаев госпитализации.
При ретроспективном анализе отдельных клинических исследований было замечено статистически недостоверное увеличение по сравнению с плацебо, количества случаев смерти у пациентов с нарушениями ритма сердца. Однако эти данные статистически не подтверждены и могут быть связаны с заболеванием сердца.
В клинических исследованиях у пациентов, страдающих бронхиальной астмой и продолжающих испытывать симптомы заболевания, несмотря на поддерживающую терапию ингаляционным кортикостероидом, в том числе в комбинации с длительно действующим агонистом бета2-адренорецепторов, было установлено, что добавление препарата СПИРИВА РЕСПИМАТ к поддерживающей терапии приводило к достоверному улучшению функции легких по сравнению с плацебо, значительно уменьшало число серьезных обострений и периодов ухудшения симптомов бронхиальной астмы и увеличивало период до первого их наступления, приводило к достоверному улучшению качества жизни и увеличению числа пациентов с положительным ответом на поддерживающую терапию. Бронходилатирующий эффект препарата сохранялся на протяжении 1 года применения, признаков привыкания не отмечалось.
Фармакокинетика
Тиотропия бромид — четвертичное производное аммония, умеренно растворимое в воде. Тиотропия бромид выпускается в виде раствора для ингаляций, который применяется с помощью ингалятора РЕСПИМАТ. Приблизительно 40% от величины ингаляционной дозы осаждается в легких, остальное количество поступает в желудочно-кишечный тракт (ЖКТ). Некоторые фармакокинетические данные, описанные ниже, были получены при использовании доз, превышающих рекомендуемые для лечения.
Всасывание
После ингаляции раствора молодыми здоровыми добровольцами установлено, что в системную циркуляцию поступает около 33% от величины ингаляционной дозы. Прием пищи не влияет на всасывание тиотропия бромида в связи с тем, что он плохо всасывается из желудочно-кишечного тракта. Абсолютная биодоступность при приеме внутрь составляет 2–3%. Максимальная концентрация в плазме наблюдается через 5–7 мин после ингаляции. На стадии динамического равновесия пиковая концентрация тиотропия в плазме крови у пациентов с ХОБЛ составляет 10,5 пг/мл и быстро снижается. Это указывает на мультикомпартментный тип распределения препарата. На стадии динамического равновесия базальная концентрация тиотропия в плазме крови составляет 1,6 пг/мл. На стадии динамического равновесия пиковая концентрация тиотропия в плазме крови у пациентов с бронхиальной астмой составляла 5,15 пг/мл и достигалась через 5 мин.
Распределение
Связывание препарата с белками плазмы составляет 72%; объем распределения — 32 л/кг. Исследования показали, что тиотропия бромид не проникает через гематоэнцефалический барьер.
Биотрансформация
Степень биотрансформации незначительна. Это подтверждается тем, что после внутривенного введения препарата молодым здоровым добровольцам в моче обнаруживается 74% субстанции тиотропия бромида в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-N-метилскопин и дитиенилгликолиевую кислоту; эти соединения не связываются с мускариновыми рецепторами.
В исследованиях in vitro показано, что некоторая часть препарата (<20% от дозы после внутривенного введения) метаболизируется путем окисления цитохромом P450 с последующей конъюгацией с глютатионом и образованием различных метаболитов. Данный механизм может тормозиться ингибиторами изоферментов CYP450 2D6 и 3A4, хинидин, кетоконазол и гестоден. Таким образом, CYP450 2D6 и 3A4 участвуют в метаболизме препарата. Тиотропия бромид даже в сверхтерапевтических концентрациях не ингибирует цитохром P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 или 3A в микросомах печени человека.
Выведение
Терминальный период полувыведения тиотропия бромида после ингаляции составляет от 27 до 45 часов у пациентов с ХОБЛ. У пациентов с астмой эффективный период полувыведения после ингаляции составляет 34 ч.
Общий клиренс после внутривенного введения препарата молодым здоровым добровольцам составлял 880 мл/мин. Тиотропия бромид после внутривенного введения в основном выводится почками в неизмененном виде (74%). После ингаляции раствора у пациентов с ХОБЛ почечная экскреция составляет 18,6% (0,93 мкг), оставшаяся неабсорбировавшаяся часть выводится через кишечник. В стадии фармакокинетического равновесия у пациентов с астмой 11,9% (0,595 мкг) дозы выводится в неизмененном виде с мочой через 24 часа после приема препарата. Почечный клиренс тиотропия бромида превышает клиренс креатинина, что свидетельствует о его канальцевой секреции. После длительного ингаляционного приема препарата 1 раз в день пациентами с ХОБЛ фармакокинетическое равновесие достигается на 7-й день; при этом в дальнейшем не наблюдается аккумуляции.
Тиотропия бромид имеет линейную фармакокинетику в терапевтических пределах после внутривенного применения, ингаляции сухого порошка и ингаляции раствора.
Фармакокинетика у пациентов пожилого возраста
В пожилом возрасте отмечается снижение почечного клиренса тиотропия (347 мл/мин у пациентов с ХОБЛ в возрасте до 65 лет и 275 мл/мин у пациентов с ХОБЛ и астмой старше 65 лет). Установлено, что у пациентов с бронхиальной астмой воздействие тиотропия бромида не зависит от возраста пациентов.
Пациенты с нарушениями функции почек
После ингаляционного применения тиотропия один раз в день в период устойчивого состояния фармакокинетики у пациентов с ХОБЛ и небольшими нарушениями функции почек (клиренс креатинина 50–80 мл/мин) отмечалось небольшое увеличение величин AUC0–6,ss на 1,8–30% и Cmax,ss по сравнению с пациентами с нормальной функцией почек (клиренс креатинина >80 мл/мин). У пациентов с ХОБЛ и умеренными или значительными нарушениями функции почек (клиренс креатинина <50 мл/мин) внутривенное применение тиотропия бромида приводило к двукратному увеличению общего воздействия (площадь под кривой «концентрация-время» AUC0–4 увеличивалась на 82%, а величина Cmax увеличилась на 52%) по сравнению с пациентами с ХОБЛ и нормальной функцией почек. Аналогичное повышение концентрации в плазме отмечалось и после ингаляции сухого порошка.
У пациентов с бронхиальной астмой и небольшими нарушениями функции почек (клиренс креатинина 50–80 мл/мин) ингаляционное применение тиотропия бромида не приводило к значительному увеличению воздействия в сравнении с пациентами с нормальной функцией почек.
Пациенты с нарушениями функции печени. Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокинетику тиотропия бромида, так как тиотропия бромид преимущественно выводится почками и с помощью неферментативного расщепления эфирной связи с образованием производных, которые не обладают фармакологической активностью.
Показания
поддерживающее лечение пациентов с ХОБЛ, хроническим бронхитом, эмфиземой легких; поддерживающая терапия при сохраняющейся одышке; улучшение качества жизни, нарушенного вследствие ХОБЛ, и снижение частоты обострений;
дополнительная поддерживающая терапия у пациентов с 6 лет с бронхиальной астмой, с сохраняющимися симптомами заболевания на фоне приема, по крайней мере, ингаляционных глюкокортикостероидов для уменьшения симптомов бронхиальной астмы, улучшения качества жизни и снижения частоты обострений.
Противопоказания
Гиперчувствительность к любому компоненту этого препарата, к атропину или к его производным, например, ипратропию бромиду, окситропию бромиду.
С осторожностью: закрытоугольная глаукома, гиперплазия предстательной железы, обструкция шейки мочевого пузыря.
Применение при беременности и кормлении грудью
Данные о влиянии препарата СПИРИВА РЕСПИМАТ на беременность ограничены. В доклинических исследованиях при изучении репродуктивной токсичности не получено указаний на прямые или опосредованные неблагоприятные влияния препарата. В качестве меры предосторожности предпочтительнее воздержаться от использования препарата СПИРИВА РЕСПИМАТ во время беременности.
Клинических данных о влияния тиотропия бромида у женщин, кормящих грудью, нет. Препарат не должен применяться у беременных или кормящих грудью женщин, если потенциальная польза для матери не превышает потенциальный риск для плода и ребенка. На период применения препарата необходимо прекратить кормление грудью ребенка.
Способ применения и дозы
Рекомендуемая терапевтическая доза составляет две ингаляции спрея из ингалятора РЕСПИМАТ (5 мкг/терапевтическая доза) 1 раз в день, в одно и то же время суток (см. Инструкции по применению).
При лечении бронхиальной астмы полный терапевтический эффект наступает через несколько дней.
У пожилых пациентов, пациентов с нарушениями функции печени и пациентов с небольшими нарушениями функции почек (клиренс креатинина 50–80 мл/мин) можно использовать препарат СПИРИВА РЕСПИМАТ в рекомендуемой дозе.
Однако использование препарата у пациентов с умеренными или значительными нарушениями функции почек (клиренс креатинина <50 мл/мин) должно тщательно мониторироваться.
ХОБЛ обычно не встречается у детей. Безопасность и эффективность препарата СПИРИВА РЕСПИМАТ у детей до одного года не изучены.
Инструкция по применению
Следует прочитать эту инструкцию перед началом приемы препарата СПИРИВА РЕСПИМАТ .
Внешний вид СПИРИВА РЕСПИМАТ
Использовать этот ингалятор только 1 раз в день. Каждый раз при применении его следует делать 2 ингаляции.
Как хранить ингалятор СПИРИВА РЕСПИМАТ
— в недоступном для детей месте;
— не замораживать;
— если ингалятор СПИРИВА РЕСПИМАТ не использовался более 7 дней, направить его перед применением вниз и нажать 1 раз на кнопку подачи дозы;
— если ингалятор СПИРИВА РЕСПИМАТ не использовался более 21 дня, повторить шаги 4–6 из Подготовка к первому использованию до появления облачка аэрозоля. Затем повторить шаги 4–6 еще 3 раза.
— не использовать ингалятор СПИРИВА РЕСПИМАТ после окончания срока годности;
— не трогать прокалывающий элемент внутри прозрачной гильзы.
Как ухаживать за ингалятором СПИРИВА РЕСПИМАТ
— очищать мундштук, включая металлическую часть мундштука, влажной тряпочкой или тканью, по меньшей мере 1 раз в неделю;
— любое незначительное изменение цвета мундштука не влияет на работу ингалятора СПИРИВА РЕСПИМАТ.
Как определить, когда нужен новый ингалятор СПИРИВА РЕСПИМАТ.
Ингалятор СПИРИВА РЕСПИМАТ содержит 60 ингаляционных доз (т.е. 30 терапевтических доз) при условии применения в соответствии с указаниями (2 ингаляционные дозы 1 раз в день).
Индикатор доз показывает, сколько примерно доз еще осталось.
Когда индикатор доз покажет на красную область шкалы, это означает, что лекарства осталось примерно на 7 дней (14 ингаляционных доз).
Когда индикатор доз ингалятора достигнет конца красной шкалы, ингалятор СПИРИВА РЕСПИМАТ автоматически заблокируется — больше не может быть получено ни одной ингаляционной дозы (поворот прозрачной гильзы будет невозможен).
Через 3 месяца после первого использования СПИРИВА РЕСПИМАТ следует выбросить, даже если он полностью не использован.
Подготовка к первому использованию
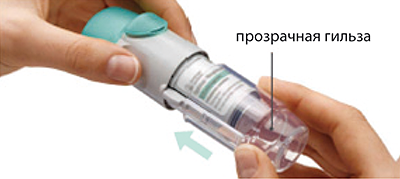
1. Снять прозрачную гильзу:
— держать колпачок закрытым;
— нажать стопорную кнопку и сильно потянуть при этом другой рукой за прозрачную гильзу.
2. Вставить картридж: вставить узким концом в ингалятор; поставить ингалятор дном картриджа на твердую поверхность и сильно нажать на него, пока картридж не встанет на место со щелчком.
3. Установить на место прозрачную гильзу до щелчка.
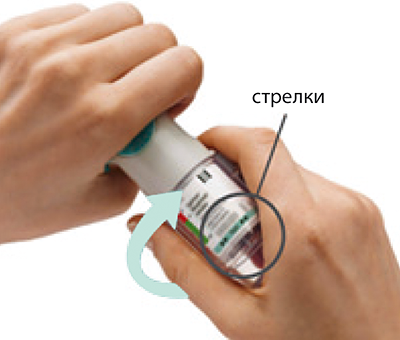
4. Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (полоборота), держа колпачок закрытым.
5. Открыть колпачок до упора.
6. Нажать кнопку подачи дозы, предварительно направив ингалятор вниз; закрыть колпачок. Повторить шаги 4–6 до появления облачка аэрозоля, после появления которого повторить шаги 4–6 еще 3 раза.
Ежедневное применение
Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (пол-оборота), держа колпачок закрытым.
Открыть колпачок до упора.
Сделать медленный полный выдох.
Обхватить мундштук губами, не перекрывая воздухозаборники.
Делая медленный, глубокий вдох через рот, нажать кнопку подачи дозы и продолжать делать вдох.
Задержать дыхание примерно на 10 секунд или так долго, как пациент может.
Для получения второй ингаляционной дозы повторить: Повернуть, Открыть, Нажать.
Ответы на часто задаваемые вопросы
1. Сложно установить картридж на необходимую глубину.
Пациент случайно повернул прозрачную гильзу до установки картриджа? Открыть колпачок, нажать на кнопку подачи дозы, затем вставить картридж.
Пациент вставляет картридж широким концом? Вставить картридж узким концом в ингалятор.
2. Невозможно нажать на кнопку подачи дозы.
Повернул ли пациент прозрачную гильзу? Если нет, повернуть прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
Индикатор доз ингалятора СПИРИВА РЕСПИМАТ указывает на ноль? Ингалятор СПИРИВА РЕСПИМАТ блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовить и использовать новый ингалятор СПИРИВА РЕСПИМАТ.
3. Невозможно повернуть прозрачную гильзу.
Пациент уже повернул прозрачную гильзу? Если прозрачная гильза уже повернута, необходимо следовать по шагам Открыть и Нажать в разделе Ежедневное применение для получения ингаляционной дозы.
Индикатор доз ингалятора СПИРИВА РЕСПИМАТ указывает на ноль? Ингалятор СПИРИВА РЕСПИМАТ блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовить и использовать новый ингалятор СПИРИВА РЕСПИМАТ.
4. Индикатор доз ингалятора СПИРИВА РЕСПИМАТ достигает нуля слишком быстро.
Использовал ли пациент СПИРИВА РЕСПИМАТ в соответствии с указаниями (2 ингаляционные дозы 1 раз в день)? Препарата СПИРИВА РЕСПИМАТ хватает на 30 дней при использовании 2 ингаляций 1 раз в день.
Поворачивал ли пациент прозрачную гильзу до установки картриджа? Индикатор доз считает каждый поворот прозрачной гильзы вне зависимости от того, установлен картридж или нет.
Выпускал ли пациент ингаляционные дозы в воздух для проверки работы СПИРИВА РЕСПИМАТ ? После подготовки ингалятора к использованию не требуется ежедневной проверки ингаляции.
Пациент установил картридж в использованный ингалятор СПИРИВА РЕСПИМАТ? Всегда устанавливать новый картридж в новый ингалятор СПИРИВА РЕСПИМАТ.
5. Ингалятор СПИРИВА РЕСПИМАТ выпускает ингаляционные дозы автоматически.
Был ли открыт колпачок когда пациент поворачивал прозрачную гильзу? Закрыть колпачок, затем повернуть прозрачную гильзу.
Нажимал ли пациент кнопку подачи дозы во время поворота прозрачной гильзы? Закрыть колпачок так, чтобы кнопка подачи дозы была закрыта, затем поворачивать прозрачную гильзу.
Останавливался ли пациент во время поворота прозрачной гильзы, до звука щелчка? Поворачивать прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
6. Ингалятор СПИРИВА РЕСПИМАТ не выпускает ингаляционную дозу.
Установлен ли картридж? Если нет, установить картридж.
Пациент повторил шаги Повернуть, Открыть, Нажать менее 3 раз после установки картриджа? Повторить шаги Повернуть, Открыть, Нажать 3 раза после установки картриджа как описано в разделе Подготовка к первому использованию, шаги 4–6.
Индикатор доз ингалятора СПИРИВА РЕСПИМАТ указывает на ноль? Если индикатор доз указывает на ноль, значит ингалятор СПИРИВА РЕСПИМАТ пуст и заблокирован. Не снимать прозрачную гильзу и не вынимать картридж после подготовки ингалятора к использованию.
Всегда устанавливать новый картридж в новый ингалятор СПИРИВА РЕСПИМАТ.
Побочные действия
Многие из перечисленных ниже нежелательных реакций могут быть обусловлены м-холиноблокирующими свойствами препарата.
Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований и отдельных сообщений в течение пострегистрационного использования препарата.
Частота побочных реакций, которые могут возникать во время терапии, приведена в виде следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); неуточненной частоты (частота не может быть оценена по доступным данным).
Нарушения со стороны обмена веществ и питания: неуточненной частоты — дегидратация.
Нарушения со стороны нервной системы: нечасто — головокружение; редко — бессонница.
Нарушения со стороны органа зрения: редко — повышение внутриглазного давления, глаукома; нечеткость зрения.
Нарушения со стороны сердечно-сосудистой системы: редко — мерцательная аритмия; тахикардия (включая суправентрикулярную тахикардию), ощущение сердцебиения.
Нарушения со стороны органов дыхания, органов грудной клетки и средостения: нечасто — кашель, фарингит, дисфония; редко — носовое кровотечение, бронхоспазм, ларингит; неуточненной частоты — синусит.
Нарушения со стороны желудочно-кишечного тракта: часто — незначительная преходящая сухость слизистой оболочки глотки; нечасто — запор, кандидоз полости рта; редко — дисфагия, гастроэзофагеальный рефлюкс, гингивит, глоссит; неуточненной частоты — стоматит, кишечная непроходимость, включая паралитическую кишечную непроходимость.
Нарушения со стороны кожи и подкожных тканей: редко — кожные инфекции и язвы на коже, сухость кожи.
Аллергические реакции: нечасто — сыпь, зуд; редко — ангионевротический отек, крапивница; неуточненной частоты — гиперчувствительность, включая реакции немедленного типа.
Нарушения со стороны скелетно-мышечной системы и соединительной ткани: неуточненной частоты — припухлость суставов.
Нарушения со стороны почек и мочевыделительной системы: нечасто — дизурия, задержка мочи (чаще у мужчин с наличием предрасполагающих факторов); редко — инфекции мочевыводящих путей.
Взаимодействие
Хотя специальных исследований лекарственных взаимодействий не проводилось, тиотропия бромид применялся совместно с другими препаратами для лечении ХОБЛ, включая симпатомиметические бронходилататоры, метилксантины, стероиды для приема внутрь и ингаляционного применения, антигистаминные препараты, муколитики, модификаторы лейкотриенов (ЛТ), кромоны, анти-IgE-препараты, при этом клинических признаков лекарственных взаимодействий не отмечалось.
Совместное применение с длительнодействующими бета2-агонистами, ингаляционными глюкокортикостероидами и их комбинациями не влияет на действие тиотропия.
Длительное совместное применение тиотропия бромида с другими м-холиноблокирующими препаратами не изучалось. Поэтому долгосрочное совместное применение препарата СПИРИВА РЕСПИМАТ с другими м-холиноблокирующими препаратами не рекомендуется.
Передозировка
При применении высоких доз препарата возможны проявления м-холиноблокирующего действия.
После 14-дневного ингаляционного применения тиотропия бромида в дозах, достигавших 40 мкг, у здоровых лиц не наблюдалось значимых неблагоприятных явлений, кроме чувства сухости слизистых оболочек носа и ротоглотки, частота которых зависела от величины дозы (10–40 мкг в день). Исключение составляло отчетливое снижение саливации начиная с 7-го дня применения препарата. В 6 долгосрочных исследованиях у пациентов с ХОБЛ при ингаляционном применении раствора тиотропия бромида в суточной дозе 10 мкг в течение 4–48 недель не наблюдалось существенных нежелательных явлений.
Особые указания
Препарат СПИРИВА РЕСПИМАТ как бронходилататор, применяемый 1 раз в день для поддерживающего лечения, не должен применяться в качестве начальной терапии при острых приступах бронхоспазма или для устранения остро возникающих симптомов. В случае развития острого приступа используются быстродействующие β2-агонисты.
Препарат СПИРИВА РЕСПИМАТ не должен использоваться для лечения бронхиальной астмы в качестве терапии первой линии. Пациентам следует рекомендовать на фоне приема препарата СПИРИВА РЕСПИМАТ продолжать противовоспалительную терапию (например, ингаляционными глюкокортикостероидами), даже если симптомы уменьшатся.
После применения препарата могут развиваться немедленные реакции повышенной чувствительности.
Ингаляция препарата может вызывать бронхоспазм.
При умеренной или выраженной почечной недостаточности (клиренс креатинина ≤50 мл/мин) прием препарата следует вести под тщательным наблюдением, как и при приеме всех лекарственных препаратов, экскретируемых преимущественно почками.
Пациенты должны быть ознакомлены с инструкцией по применению. Не следует допускать попадания раствора или аэрозоля в глаза. Боль или дискомфорт в глазах, нечеткое зрение, зрительные ореолы в сочетании с покраснением глаз, отек конъюнктивы и роговицы могут быть симптомами острой закрытоугольной глаукомы. При развитии любой комбинации этих симптомов следует немедленно обратиться к специалисту. Глазные капли, обладающие миотическим действием, не считаются эффективным лечением.
Препарат СПИРИВА РЕСПИМАТ не должен использоваться чаще чем 1 раз в день. Картриджи препарата СПИРИВА должны использоваться только с ингалятором РЕСПИМАТ.
Влияние препарата на способность управлять транспортными средствами и механизмами. Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились. Следует соблюдать осторожность при выполнении данных видов деятельности, так как возможно развитие головокружения или нечеткости зрения.
Форма выпуска
Раствор для ингаляций, 2,5 мкг/доза. Ингалятор Респимат® в комплекте с картриджем вместимостью 4,5 мл, помещенным в алюминиевый цилиндр. Ингалятор и цилиндр с картриджем вместе с инструкцией по применению в картонную пачку.
Производитель
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ. Бингер Штрассе, 173, 55216 Ингельхайм-на-Рейне, Германия.
Владелец регистрационного удостоверения. Берингер Ингельхайм Интернешнл ГмбХ, Бингер Штрассе, 173, 55216 Ингельхайм-на-Рейне, Германия.
Получить дополнительную информацию о препарате, а также направить свои претензии и информацию о нежелательных явлениях можно по следующему адресу в России. ООО «Берингер Ингельхайм». 125171, Москва, Ленинградское ш., 16А, стр. 3.
Тел.: (495) 544-50-44; факс: (495) 544-56-20.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Использовать в течение 3 мес после первой ингаляции.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Фармакологическое действие
Тиотропия бромид — м-холиноблокатор длительного действия. Препарат обладает одинаковым сродством к M1-М5 подтипам мускариновых рецепторов. Результатом ингибирования М3-холинорецепторов в дыхательных путях является расслабление гладкой мускулатуры. Бронходилатирующий эффект зависит от дозы и сохраняется не менее 24 ч. Значительная продолжительность действия связана, вероятно, с очень медленной диссоциацией препарата от М3-холинорецепторов; период полудиссоциации существенно более длительный, чем у ипратропия бромида.
При ингаляционном способе введения тиотропия бромид, как N-четвертичное производное аммония, оказывает местный избирательный эффект (на бронхи), при этом в терапевтических дозах не вызывает системных м-холиноблокирующих побочных эффектов. Диссоциация от М2-холинорецепторов происходит быстрее, чем от М3-холинорецепторов, что свидетельствует о преобладании селективности в отношении М3 подтипа рецепторов над М2-холинорецепторами. Высокое сродство к рецепторам и медленная диссоциация препарата из связи с рецепторами обусловливают выраженный и продолжительный бронходилатирующий эффект у пациентов с ХОБЛ.
Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена, в первую очередь, местным (на дыхательные пути), а не системным действием.
В клинических исследованиях было показано, что применение препарата Спирива® Респимат® 1 раз/сут приводит к значительному улучшению (по сравнению с плацебо) функции легких (ОФВ1 и ФЖЕЛ) в течение 30 мин после использования первой дозы. Улучшение функции легких сохраняется в течение 24 ч при равновесной концентрации.
Фармакодинамическое равновесие достигалось в течение одной недели. Спирива® Респимат® значительно улучшал утреннюю и вечернюю пиковую объемную скорость выдоха (ПОСВ), измеренную больными. Применение препарата Спирива® Респимат® приводило к уменьшению (по сравнению с плацебо) использования бронходилататора в качестве средства скорой помощи. Бронходилатирующий эффект препарата сохраняется на протяжении 48 недель применения препарата; признаков привыкания не отмечается.
Анализ комбинированных данных двух рандомизированных, плацебо-контролируемых, перекрестных клинических исследований показал, что бронходилатирующий эффект препарата Спирива® Респимат® (5 мкг) после 4-недельного периода лечения был в количественном отношении выше, чем эффект препарата Спирива® (18 мкг).
В долгосрочных (12-месячных) исследованиях было установлено, что Спирива® Респимат® значительно уменьшает одышку; улучшает качество жизни; снижает психосоциальное воздействие ХОБЛ и увеличивает активность.
Препарат Спирива® Респимат® достоверно улучшал общее состояние здоровья (общий балл) по сравнению с плацебо к концу двух 12-месячных исследований, это различие сохранялось на протяжении всего периода лечения; препарат Спирива® Респимат® значительно уменьшал число обострений ХОБЛ, и увеличивал период до момента первого обострения по сравнению с плацебо.
Доказано, что Спирива® Респимат® уменьшает риск обострения ХОБЛ и значительно снижает количество случаев госпитализации.
При ретроспективном анализе отдельных клинических исследований было замечено статистически недостоверное увеличение, по сравнению с плацебо, количества случаев смерти у пациентов с нарушениями ритма сердца. Однако эти данные статистически не подтверждены и могут быть связаны с заболеванием сердца.
В клинических исследованиях у пациентов, страдающих бронхиальной астмой и продолжающих испытывать симптомы заболевания, несмотря на поддерживающую терапию ингаляционным ГКС, в т.ч. в комбинации с длительно действующим агонистом бета2-адренорецепторов, было установлено, что добавление препарата Спирива® Респимат® к поддерживающей терапии приводило к достоверному улучшению функции легких по сравнению с плацебо, значительно уменьшало число серьезных обострений и периодов ухудшения симптомов бронхиальной астмы, увеличивало период до первого их наступления, приводило к достоверному улучшению качества жизни и увеличению числа пациентов с положительным ответом на поддерживающую терапию.
Бронходилатирующий эффект препарата сохранялся на протяжении 1 года применения, признаков привыкания не отмечалось.
Фармакокинетика
Тиотропия бромид — четвертичное производное аммония, умеренно растворимое в воде. Тиотропия бромид выпускается в виде раствора для ингаляций, который применяется с помощью ингалятора Респимат®. Приблизительно 40% от величины ингаляционной дозы осаждается в легких, остальное количество поступает в ЖКТ. Некоторые фармакокинетические данные, описанные ниже, были получены при использовании доз, превышающих рекомендуемые для лечения.
Всасывание
После ингаляции раствора молодыми здоровыми добровольцами установлено, что в системный кровоток поступает около 33% от величины ингаляционной дозы. Прием пищи не влияет на всасывание тиотропия бромида, в связи с тем, что он плохо всасывается из ЖКТ. Абсолютная биодоступность при приеме внутрь составляет 2-3%. Cmax в плазме наблюдается через 5-7 мин после ингаляции.
Распределение
Связывание препарата с белками плазмы составляет 72%; Vd — 32 л/кг. В равновесном состоянии Cmax тиотропия в плазме у пациентов с ХОБЛ составляет 10.5 пг/мл и быстро снижается. Это указывает на мультикомпартментный тип распределения препарата. В равновесном состоянии базальная концентрация тиотропия в плазме крови составляет 1.6 пг/мл. В равновесном состоянии Cmax тиотропия в плазме крови у пациентов с бронхиальной астмой составляла 5.15 пг/мл и достигалась через 5 мин.
Исследования показали, что тиотропия бромид не проникает через ГЭБ.
Метаболизм
Степень биотрансформации незначительна. Это подтверждается тем, что после в/в введения препарата молодым здоровым добровольцам в моче обнаруживается 74% субстанции тиотропия бромида в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-N-метилскопин, и дитиенилгликолевую кислоту; эти соединения не связываются с мускариновыми рецепторами.
В исследованиях in vitro показано, что некоторая часть препарата (< 20% от дозы после в/в введения) метаболизируется путем окисления цитохромом Р450 с последующей конъюгацией с глутатионом и образованием различных метаболитов. Данный механизм может тормозиться ингибиторами изоферментов CYP2D6 и 3А4 (хинидин, кетоконазол и гестоден). Таким образом, CYP2D6 и 3А4 участвуют в метаболизме препарата. Тиотропия бромид даже в сверхтерапевтических концентрациях не ингибирует цитохромом Р450 1А1, 1А2, 2В6, 2С9, 2С19, 2D6, 2Е1 или 3А в микросомах печени человека.
Выведение
Терминальный T1/2 тиотропия бромида после ингаляции составляет от 27 до 45 ч у пациентов с ХОБЛ. У пациентов с бронхиальной астмой эффективный Т1/2 после ингаляции составляет 34 ч.
Общий клиренс после в/в введения препарата молодым здоровым добровольцам составлял 880 мл/мин. Тиотропия бромид после в/в введения в основном выводится почками в неизмененном виде (74%). После ингаляции раствора у пациентов с ХОБЛ почечная экскреция составляет 18.6% (0.93 мкг), оставшаяся неабсорбировавшаяся часть выводится через кишечник. В равновесном состоянии у пациентов с бронхиальной астмой 11.9% (0.595 мкг) дозы выводится в неизмененном виде с мочой через 24 ч после приема препарата. Почечный клиренс тиотропия бромида превышает КК, что свидетельствует о его канальцевой секреции. После длительного ингаляционного приема препарата 1 раз/сут пациентами с ХОБЛ равновесное состояние достигается на 7 день; при этом в дальнейшем не наблюдается кумуляции.
Тиотропия бромид имеет линейную фармакокинетику в терапевтических пределах после в/в применения, ингаляции сухого порошка и ингаляции раствора.
Фармакокинетика в особых клинических случаях
У пациентов пожилого возраста отмечается снижение почечного клиренса тиотропия бромида (347 мл/мин у пациентов с ХОБЛ в возрасте до 65 лет и 275 мл/мин у пациентов с ХОБЛ и бронхиальной астмой старше 65 лет). Установлено, что у пациентов с бронхиальной астмой воздействие тиотропия бромида не зависит от возраста пациентов.
После ингаляционного применения тиотропия 1 раз/сут в равновесном состоянии у пациентов с ХОБЛ и легкими нарушениями функции почек (КК 50-80 мл/мин) отмечалось небольшое увеличение AUC0-6,ss на 1.8-30% и Cmax, ss по сравнению с пациентами с нормальной функцией почек (КК>80 мл/мин). У пациентов с ХОБЛ и умеренными или значительными нарушениями функции почек (КК<50 мл/мин) в/в применение тиотропия бромида приводило к двукратному увеличению общего воздействия (AUC0-4 ч увеличивалась на 82%, а величина Cmax увеличивалась на 52%) по сравнению с пациентами с ХОБЛ и нормальной функцией почек. Аналогичное повышение концентрации в плазме отмечалось и после ингаляции сухого порошка.
У пациентов с бронхиальной астмой и небольшими нарушениями функции почек (КК 50-80 мл/мин) ингаляционное применение тиотропия бромида не приводило к значительному увеличению воздействия в сравнении с пациентами с нормальной функцией почек.
Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокинетику тиотропия бромида, т.к. тиотропия бромид преимущественно выводится почками и с помощью неферментативного расщепления эфирной связи с образованием производных, которые не обладают фармакологической активностью.
Показания препарата
Спирива® Респимат®
- для поддерживающего лечения пациентов с ХОБЛ, хроническим бронхитом, эмфиземой легких; поддерживающей терапии при сохраняющейся одышке; улучшения качества жизни, нарушенного вследствие ХОБЛ, и снижения частоты обострений;
- в качестве дополнительной поддерживающей терапии у пациентов с 6 лет с бронхиальной астмой, с сохраняющимися симптомами заболевания на фоне приема, по крайней мере, ингаляционных ГКС, для уменьшения симптомов бронхиальной астмы, улучшения качества жизни и снижения частоты обострений.
Режим дозирования
Рекомендуемая терапевтическая доза составляет 2 ингаляции спрея из ингалятора Респимат® (5 мкг/терапевтическая доза) 1 раз/сут, в одно и то же время суток.
При лечении бронхиальной астмы полный терапевтический эффект наступает через несколько дней.
У пациентов пожилого возраста, пациентов с нарушениями функции печени и пациентов с незначительными нарушениями функции почек (КК 50-80 мл/мин) можно использовать препарат Спирива® Респимат® в рекомендуемой дозе.
Однако использование препарата у пациентов с умеренными или значительными нарушениями функции почек (КК <50 мл/мин) следует проводить под тщательным контролем.
ХОБЛ обычно не встречается у детей. Безопасность и эффективность применения препарата Спирива® Респимат® у детей до 1 года не изучены.
Правила применения ингалятора Спирива® Респимат®
Перед началом использования препарата следует изучить правила применения ингалятора Спирива® Респимат®.
Ингалятор предназначен для использования 1 раз/сут. Каждый раз при его применении следует делать 2 ингаляции.
Как хранить ингалятор Спирива® Респимат®
Хранить Спирива® Респимат® в недоступном для детей месте.
Не замораживать Спирива® Респимат®.
Если ингалятор Спирива® Респимат® не использовался более 7 дней, следует направить его перед применением вниз и нажать один раз на кнопку подачи дозы.
Если ингалятор Спирива® Респимат® не использовался более 21 дня, следует повторить шаги 4-6 из раздела «Подготовка к первому использованию» до появления облачка аэрозоля. Затем повторить шаги 4-6 еще три раза.
Не использовать ингалятор Спирива® Респимат® после окончания срока годности.
Не трогать прокалывающий элемент внутри прозрачной гильзы.
Уход за ингалятором Спирива® Респимат®
Мундштук и металлическую часть внутри мундштука необходимо чистить влажной тряпочкой или тканью, как минимум, 1 раз в неделю.
Любое незначительное изменение цвета мундштука не влияет на работу ингалятора Спирива® Респимат®.
Определение момента, когда нужно начать пользоваться новым ингалятором
Ингалятор Спирива® Респимат® содержит 60 ингаляционных доз (т.е. 30 терапевтических доз) при условии применения в соответствии с режимом дозирования (2 ингаляционные дозы 1 раз/сут).
Индикатор доз показывает, сколько примерно доз еще осталось. Когда индикатор покажет на красную область шкалы, это означает, что лекарства осталось примерно на 7 дней (14 ингаляционных доз).
Когда индикатор доз ингалятора достигнет конца красной шкалы, ингалятор Спирива® Респимат® автоматически заблокируется — больше не может быть получено ни одной ингаляционной дозы (поворот прозрачной гильзы будет невозможен).
Через 3 месяца после первого использования ингалятор Спирива® Респимат® следует выбросить, даже если он не полностью использован.
Подготовка к первому использованию
1. Снять прозрачную гильзу
- Держать колпачок закрытым.
- Нажать стопорную кнопку и сильно потянуть при этом другой рукой за прозрачную гильзу.
2. Вставить картридж
- Вставить картридж узким концом в ингалятор.
- Поставить ингалятор дном картриджа на твердую поверхность и сильно нажать на него, пока картридж не встанет на место со щелчком.
3. Установить на место прозрачную гильзу
- Установить прозрачную гильзу на место до щелчка.
4. Повернуть
- Держать колпачок закрытым.
- Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (пол-оборота).
5. Открыть
- Открыть колпачок до упора.
6. Нажать
- Направить ингалятор вниз.
- Нажать кнопку подачи дозы.
- Закрыть колпачок.
- Повторить шаги 4-6 до появления облачка аэрозоля.
- После появления облачка аэрозоля повторить шаги 4-6 еще 3 раза.
Ежедневное применение
Повернуть
- Держать колпачок закрытым.
- Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, до щелчка (пол-оборота).
Открыть
- Открыть колпачок до упора.
Нажать
Сделать медленный полный выдох.
Обхватить мундштук губами, не перекрывая воздухозаборники.
Делая медленный, глубокий вдох через рот, нажать кнопку подачи дозы и продолжать делать вдох.
Задержите дыхание примерно на 10 сек или насколько возможно долго.
Для получения второй ингаляционной дозы повторить операции: Повернуть, Открыть, Нажать.
Ответы на часто задаваемые вопросы
1. Сложно установить картридж на необходимую глубину
Вы случайно повернули прозрачную гильзу до установки картриджа? Откройте колпачок, нажмите на кнопку подачи дозы, затем вставьте картридж.
Вы вставляете картридж широким концом? Вставьте картридж узким концом в ингалятор.
2. Невозможно нажать на кнопку подачи дозы
Повернули ли Вы прозрачную гильзу? Если нет, поверните прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
Индикатор доз ингалятора Спирива® Респимат® указывает на ноль? Ингалятор Спирива® Респимат® блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спирива® Респимат®.
3. Невозможно повернуть прозрачную гильзу
Вы уже повернули прозрачную гильзу? Если прозрачная гильза уже повернута, следуйте по шагам «Открыть» и «Нажать» в разделе «Ежедневное применение» для получения ингаляционной дозы.
Индикатор доз ингалятора Спирива® Респимат® указывает на ноль? Ингалятор Спирива® Респимат® блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спирива® Респимат®.
4. Индикатор доз ингалятора Спирива® Респимат® достигает нуля слишком быстро
Использовали ли Вы Спирива® Респимат® в соответствии с Режимом дозирования (две ингаляционные дозы 1 раз/сут)? Препарата Спирива® Респимат® хватает на 30 дней при использовании двух ингаляций 1 раз/сут.
Поворачивали ли Вы прозрачную гильзу до установки картриджа? Индикатор доз считает каждый поворот прозрачной гильзы вне зависимости от того, установлен картридж или нет.
Выпускали ли Вы ингаляционные дозы в воздух для проверки работы Спирива® Респимат®. После подготовки ингалятора к использованию не требуется ежедневной проверки ингаляции.
Вы установили картридж в использованный ингалятор Спирива® Респимат®?
Всегда устанавливайте новый картридж в новый ингалятор Спирива® Респимат®.
5. Ингалятор Спиолто® Респимат® выпускает ингаляционные дозы автоматически
Был ли открыт колпачок, когда Вы поворачивали прозрачную гильзу? Закройте колпачок, затем поверните прозрачную гильзу.
Нажимали ли Вы кнопку подачи дозы во время поворота прозрачной гильзы? Закройте колпачок так, чтобы кнопка подачи дозы была закрыта, затем поверните прозрачную гильзу.
Останавливались ли Вы во время поворота прозрачной гильзы, до звука щелчка? Поверните прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
6. Ингалятор Спирива® Респимат® не выпускает ингаляционную дозу
Установили ли Вы картридж? Если нет, установите картридж.
Вы повторили шаги «Повернуть», «Открыть», «Нажать» менее трех раз после установки картриджа? Повторите шаги «Повернуть», «Открыть», «Нажать» три раза после установки картриджа, как описано в разделе «Подготовка к первому использованию», шаги 4-6.
Индикатор доз ингалятора Спирива® Респимат® указывает на ноль? Если индикатор доз указывает на ноль, значит ингалятор пуст и заблокирован.
Не снимайте прозрачную гильзу и не вынимайте картридж после подготовки ингалятора к использованию. Всегда устанавливайте новый картридж в новый ингалятор Спирива® Респимат®.
Побочное действие
Многие из перечисленных ниже нежелательных реакций могут быть обусловлены м-холиноблокирующими свойствами препарата.
Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований и отдельных сообщений в течение пострегистрационного использования препарата.
Определений категорий частоты побочных реакций: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (от ≥1/1000, <1/100), редко (≥1/10 000, <1/1000), очень редко (<1/10 000), частота неизвестна (частота не может быть оценена на основании имеющихся данных).
Со стороны обмена веществ: частота неизвестна — дегидратация.
Со стороны нервной системы: нечасто — головокружение; редко — бессонница.
Со стороны органа зрения: редко — повышение внутриглазного давления, глаукома, нечеткое зрение.
Со стороны сердечно-сосудистой системы: редко — мерцательная аритмия, тахикардия (включая суправентрикулярную тахикардию), ощущение сердцебиения.
Со стороны дыхательной системы: нечасто — кашель, фарингит, дисфония; редко — носовое кровотечение, бронхоспазм, ларингит; частота неизвестна — синусит.
Со стороны пищеварительной системы: часто — незначительная преходящая сухость слизистой оболочки глотки; нечасто — запор, кандидоз полости рта; редко — дисфагия; редко, гастроэзофагеальный рефлюкс, гингивит, глоссит; частота неизвестна — стоматит; кишечная непроходимость, включая паралитическую кишечную непроходимость.
Со стороны кожи и подкожных тканей: редко — кожные инфекции и язвы на коже, сухость кожи.
Аллергические реакции: нечасто — сыпь, зуд; редко — ангионевротический отек, крапивница; частота неизвестна — гиперчувствительность, включая реакции немедленного типа.
Со стороны костно-мышечной системы: частота неизвестна — отечность суставов.
Со стороны почек и мочевыделительной системы: нечасто — дизурия, задержка мочи (чаще у мужчин с наличием предрасполагающих факторов); редко — инфекция мочевыводящих путей.
Противопоказания к применению
- гиперчувствительность к компонентам препарата, к атропину или его производным: к ипратропия бромиду, окситропия бромиду.
С осторожностью препарат следует применять при закрытоугольной глаукоме, гиперплазии предстательной железы, обструкции шейки мочевого пузыря.
Применение при беременности и кормлении грудью
Данные о влиянии препарата Спирива® Респимат® на беременность ограничены. В доклинических исследованиях при изучении репродуктивной токсичности не получено указаний на прямое или опосредованное неблагоприятное влияние препарата. В качестве меры предосторожности предпочтительно воздержаться от применения препарата Спирива® Респимат® при беременности.
Клинических данных о влиянии тиотропия бромида в период грудного вскармливания нет.
Препарат не следует применять у беременных или кормящих грудью женщин, если потенциальная польза для матери не превышает потенциальный риск для плода и ребенка. На период применения препарата необходимо прекратить грудное вскармливание.
Применение при нарушениях функции печени
У пациентов с нарушениями функции печени можно использовать препарат Спирива® Респимат® в рекомендуемой дозе.
Применение при нарушениях функции почек
У пациентов с незначительными нарушениями функции почек (КК 50-80 мл/мин) можно использовать препарат Спирива® Респимат® в рекомендуемой дозе.
Однако, использование препарата у пациентов с умеренными или значительными нарушениями функции почек (КК <50 мл/мин) должно тщательно мониторироваться.
Применение у детей
Противопоказано назначение детям и подросткам в возрасте до 18 лет (ввиду отсутствия данных по эффективности и безопасности).
Применение у пожилых пациентов
У пациентов пожилого возраста можно использовать препарат Спирива® Респимат® в рекомендуемой дозе.
Особые указания
Препарат Спирива® Респимат®, как бронходилататор, применяемый 1 раз/сут для поддерживающего лечения, не следует применять в качестве начальной терапии при острых приступах бронхоспазма или для устранения остро возникающих симптомов. В случае развития острого приступа используются быстродействующие бета2-агонисты.
Препарат Спирива® Респимат® не следует применять для лечения бронхиальной астмы в качестве терапии первой линии. Пациентам следует рекомендовать на фоне приема препарата Спирива® Респимат® продолжать противовоспалительную терапию (например, ингаляционными ГКС), даже если симптомы уменьшатся.
После применения препарата могут развиваться немедленные реакции повышенной чувствительности.
Ингаляция препарата может вызывать бронхоспазм.
При умеренной или выраженной почечной недостаточности (КК ≤50 мл/мин) прием препарата следует вести под тщательным наблюдением, как и при приеме всех лекарственных препаратов, экскретируемых преимущественно почками.
Перед началом применения пациенты должны быть ознакомлены с инструкцией по применению.
Не следует допускать попадания раствора или аэрозоля в глаза. Боль или дискомфорт в глазах, нечеткое зрение, зрительные ореолы в сочетании с покраснением глаз, отек конъюнктивы и роговицы могут быть симптомами острой закрытоугольной глаукомы. При развитии любой комбинации этих симптомов следует немедленно обратиться к специалисту. Глазные капли, обладающие миотическим действием, не считаются эффективным лечением.
Спирива® Респимат® не следует использовать чаще чем 1 раз/сут.
Картриджи Спирива® следует использовать только с ингалятором Респимат®.
Влияние на способность к управлять транспортными средствами и механизмами
Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились. Следует соблюдать осторожность при выполнении данных видов деятельности, т.к. возможно развитие головокружения или нечеткости зрения.
Передозировка
При применении препарата в высоких дозах возможны проявления м-холиноблокирующего действия. После 14-дневного ингаляционного применения тиотропия бромида в дозах, достигавших 40 мкг, у здоровых лиц не наблюдалось значимых неблагоприятных явлений, кроме чувства сухости слизистых оболочек носа и ротоглотки, частота которых зависела от величины дозы (10-40 мкг/сут). Исключение составляло отчетливое снижение саливации, начиная с 7 дня применения препарата. В шести долгосрочных исследованиях у пациентов с ХОБЛ при ингаляционном применении раствора тиотропия бромида в суточной дозе 10 мкг в течение 4-48 недель не наблюдалось существенных нежелательных явлений.
Лекарственное взаимодействие
Хотя специальных исследований лекарственного взаимодействия не проводилось, тиотропия бромид использовали совместно с другими препаратами, применяющимися для лечении ХОБЛ, включая симпатомиметические бронходилататоры, метилксантины, ГКС для приема внутрь и ингаляционного применения, антигистаминные препараты, муколитики, модификаторы лейкотриенов, кромоны, анти-IgE препараты; при этом клинических признаков лекарственного взаимодействия не отмечалось.
Совместное применение с длительнодействующими бета2-агонистами, ингаляционными ГКС и их комбинациями не влияет на действие тиотропия
Длительное совместное применение тиотропия бромида с другими м-холиноблокирующими препаратами не изучалось. Поэтому долгосрочное совместное применение препарата Спирива® Респимат® с другими м-холиноблокирующими препаратами не рекомендуется.
Условия хранения препарата Спирива® Респимат®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С. Не замораживать.
Срок годности препарата Спирива® Респимат®
Срок годности — 3 года.
Использовать в течение 3 месяцев после первой ингаляции.
Условия реализации
Препарат отпускается по рецепту.
Спирива® Респимат®
МНН: Тиотропия бромид
Производитель: Берингер Ингельхайм Фарма ГмбХ и Ко. КГ
Анатомо-терапевтическо-химическая классификация: Tiotropium bromide
Номер регистрации в РК:
№ РК-ЛС-5№014869
Информация о регистрации в РК:
10.04.2020 — бессрочно
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
13 123.92 KZT
- Скачать инструкцию медикамента
Торговое название
СПИРИВА РЕСПИМАТ
Международное непатентованное название
Тиотропия бромид
Лекарственная форма
Раствор для ингаляций в комплекте с ингалятором РЕСПИМАТ, 2,5 мкг/ингаляция
Состав
1 ингаляция содержит
активное вещество – тиотропия бромид 2,5 мкг
(эквивалентно 3,124 мкг тиотропия бромида моногидрата)
2 ингаляции соответствуют 1 терапевтической дозе
вспомогательные вещества: бензалкония хлорид, динатрия эдетат, 1М кислота хлороводородная, вода очищенная.
Описание
Прозрачная, бесцветная жидкость.
Фармакотерапевтическая группа
Другие ингаляционные препараты для лечения обструктивных заболеваний дыхательных путей. Холиноблокаторы.
Тиотропия бромид.
Код АТХ R03ВВ04
Фармакологическое действие
Фармакокинетика
Тиотропия бромид — нехиральное соединение четвертичного аммония, умеренно растворимое в воде. Около 40 % ингаляционной дозы осаждается в легких, оставшееся количество – в желудочно-кишечном тракте (ЖКТ).
Всасывание. После ингаляции около 33 % ингаляционной дозы поступает в системный кровоток. Абсолютная биодоступность растворов тиотропия бромида для приема внутрь составляет 2-3 %. Прием пищи не влияет на абсорбцию тиотропия бромида.
Пиковые концентрации тиотропия бромида в плазме крови наблюдаются через 5-7 мин после ингаляции.
На стадии динамического равновесия пиковая концентрация тиотропия в плазме у пациентов с хронической обструктивной болезнью легких (ХОБЛ) достигает 10,5 пг/мл и медленно снижается в соответствии с мультикомпонентной моделью. На стадии динамического равновесия минимальная концентрация тиотропия бромида в плазме составляет 1,6 пг/мл.
На стадии динамического равновесия пиковая концентрация тиотропия в плазме, равная 5,15 пг/мл, достигается через 5 минут после применения препарата в такой же терапевтической дозе у больных с бронхиальной астмой.
Распределение. Связывание препарата с белками плазмы составляет 72 %, а объем распределения равен 32 л/кг. Очаг концентрации в легких неизвестен, но способ введения позволяет предположить, что они значительно выше. Доклинические исследования показали, что тиотропия бромид не проникает через гематоэнцефалический барьер в каком-либо значимом объеме.
Биотрансформация. После внутривенного введения 74 % вещества в неизменном виде выводится с мочой, что свидетельствует о низкой степени биотрансформации. Эфир тиотропия бромид неферментативно расщепляется на спирт (N-метилскопин) и дитиенилгликолиевую кислоту, которые не действуют на мускариновые рецепторы.
Исследования in vitro показали, что некоторое количество препарата (<20 % дозы после внутривенного введения) метаболизируется за счет цитохром-Р450 (CYP)-зависимого окисления и последующего конъюгирования с глутатионом с образованием различных метаболитов II фазы.
Данный ферментативный механизм может замедляться ингибиторами CYP 2D6 (и 3A4), хинидином, кетоконазолом и гестодином. Таким образом, CYP 2D6 и 3A4 участвуют в метаболическом пути, через который выводится меньшая часть дозы. Тиотропия бромид даже в сверхтерапевтических концентрациях не ингибирует CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 или 3A в микросомах печени человека.
Выведение. Период полураспада тиотропия бромида после ингаляционного применения варьируется между 27 – 45 часами у здоровых добровольцев и у пациентов с ХОБЛ, у пациентов с бронхиальной астмой составляет 34 часа. Общий клиренс после внутривенного введения составляет 880 мл/мин. При внутривенном введении тиотропий выводится преимущественно в неизменном виде с мочой (74 %).
После ингаляции выведение с мочой составляет 18.6% (0.93 мкг) дозы у пациентов с ХОБЛ, 20.1-29.4 % дозы — у здоровых добровольцев, у пациентов с бронхиальной астмой в течение 24 часов – 11.9 % (0.595 мкг) дозы. Оставшаяся часть неабсорбируемого в кишечнике препарата выводится через ЖКТ. Почечный клиренс тиотропия бромида превышает клиренс креатинина, что указывает на выделение с мочой.
После длительного лечения пациентов с ХОБЛ с применением ингаляций один раз в день, фармакокинетическое равновесное состояние достигается на 7-й день без накопления в последующий период.
Линейность/нелинейность. Тиотропия бромид имеет линейную фармакокинетику в терапевтическом диапазоне в зависимости от лекарственной формы.
Пациенты пожилого возраста.В пожилом возрасте отмечается снижение почечного клиренса тиотропия бромида (от 347 мл/мин у пациентов с ХОБЛ в возрасте < 65 лет и до 275 мл/мин у пациентов с ХОБЛ в возрасте ≥ 65 лет). Это не привело к соответствующему увеличению значений AUC0-6,ss или Cmax,ss.
Возрастных различий воздействия тиотропия бромида у пациентов с бронхиальной астмой не обнаружено.
Пациенты с нарушениями функции почек. Ингаляционное введение тиотропия один раз в день до достижения равновесного состояния у пациентов с ХОБЛ и легким нарушением функции почек (CLCR 50–80 мл/мин) привело к незначительному повышению AUC0-6,ss (на 1,8–30 % выше) и аналогичному повышению Cmax,ss по сравнению с пациентами с нормальной функцией почек (CLCR > 80 мл/мин).
У пациентов с ХОБЛ c умеренными или тяжелыми нарушениями функции почек (клиренс креатинина < 50мл/мин) внутривенное введение разовой дозы тиотропия бромида приводило к удвоению общего воздействия (на 82 % выше AUC0-4ч и на 52 % выше Сmаx), по сравнению с пациентами с ХОБЛ с нормальной функцией почек, которое подтверждалось концентрацией в плазме после ингаляции сухого порошка.
У пациентов с бронхиальной астмой и незначительными нарушениями функции почек (клиренс креатинина 50-80 мл/мин) ингаляция тиотропия бромида не приводила к существенному увеличению концентрации препарата в сравнении с пациентами с нормальной функцией почек.
Пациенты с нарушениями функции печени. Нарушение функции печени не оказывает существенного влияния на фармакокинетику тиотропия бромида. Тиотропия бромид преимущественно выводится почками (до 74 % у молодых здоровых добровольцев) и путем простого неферментативного расщепления эфира на фармакологически неактивные производные.
Пациенты детского возраста. Пациенты детского возраста не участвовали в программах по ХОБЛ, но исследовались в рамках клинической программы по муковисцидозу (МВ) вместе со взрослыми пациентами. Через 5 мин после ингаляции 5 мкг тиотропия бромида, равновесная концентрация тиотропия бромида в плазме у пациентов с МВ в возрасте ≥ 5 лет составляла 10,1 пг/мл и быстро снижалась. Уровень у пациентов с МВ в возрасте < 5 лет, использовавших маску и переходник, был ниже в 3-4 раза, чем у пациентов с МВ в возрасте 5 лет и старше. Воздействие тиотропия бромида у пациентов с МВ в возрасте <5 лет зависело от массы тела.
Фармакокинетические/фармакодинамические взаимодействия. Прямая взаимосвязь между фармакокинетикой и фармакодинамикой отсутствует.
Фармакодинамика
Механизм действия
Тиотропия бромид является специфическим антагонистом мускариновых рецепторов длительного действия. Обладает аналогичным сродством к M1-M5 подтипам мускариновых рецепторов. В дыхательных путях тиотропия бромид конкурентно и обратимо связывается с М3-рецепторами гладкой мускулатуры бронхов, противодействуя холинергическому (бронхосуживающему) эффекту ацетилхолина, что приводит к расслаблению гладкой мускулатуры бронхов. Данный эффект зависит от величины дозы и сохраняется более 24 часов. Тиотропия бромид, являясь N-четвертичным антихолинергическим средством, при ингаляционном применении оказывает местное селективное действие (на бронхи) в приемлемом диапазоне терапевтических доз до появления системных антихолинергических эффектов.
Фармакодинамические эффекты
Диссоциация тиотропия от M3-рецепторов происходит очень медленно, что указывает на значительно более длительный период полудиссоциации, чем у ипратропия. Диссоциация тиотропия от M2-рецепторов происходит быстрее, чем от M3-рецепторов, что обуславливает большую селективность (кинетически контролируемую) к рецепторам подтипа М3 по сравнению с М2-рецепторами. Высокая активность, медленная рецепторная диссоциация препарата и селективность при местном ингаляционном введении препарата обуславливают выраженный и долговременный бронходилятирующий эффект у пациентов с ХОБЛ и бронхиальной астмой.
Клиническая эффективность и безопасность при ХОБЛ
Программа клинических исследований в рамках III фазы включала следующие показатели клинических результатов при ХОБЛ: измерения функции легких, одышку, качество жизни, связанное со здоровьем, и влияние на обострения.
Функция легких
В ходе клинических исследований препарат СПИРИВА РЕСПИМАТ, вводимый 1 раз в день, обеспечивал значительное улучшение функции легких (объема форсированного выдоха за одну секунду и форсированной жизненной емкости) в течение 30 мин после приема первой дозы (среднее улучшение ОФВ1 в момент времени 30 мин: 0,113 л; 95 % доверительный интервал (ДИ): 0,102 – 0,125 л, р < 0,0001) по сравнению с плацебо. Улучшение функции легких поддерживалось в течение 24 часов в стабильном состоянии (среднее улучшение ОФВ1: 0,122 л; 95 % ДИ: 0,106 – 0,138 л, р < 0,0001) по сравнению с плацебо, фармакодинамическое равновесное состояние достигалось в течение одной недели.
Препарат значительно улучшал утреннюю и вечернюю МОСВ (максимально объемная скорость выдоха), измеряемую по ежедневным записям пациента, по сравнению с плацебо (среднее улучшение МОСВ: среднее улучшение утром 22 л/мин; 95 % ДИ: 18–55 л/мин, p < 0,0001; вечером 26 л/мин; 95 % ДИ: 23–30 л/мин, p < 0,0001), и приводил к снижению применения бронходилататоров экстренной помощи по сравнению с плацебо (среднее снижение применения средств экстренной помощи составило 0,66 раза в день, 95 % ДИ: 0,51–0,81 раза в день, p < 0,0001).
Бронхолитическое действие СПИРИВА РЕСПИМАТ поддерживалось в течение одного года без каких-либо признаков привыкания.
Одышка, качество жизни, связанное со здоровьем, обострения ХОБЛ
Одышка
Раствор для ингаляций СПИРИВА РЕСПИМАТ значительно улучшал состояние при одышке по сравнению с плацебо (среднее улучшение 1,05 единицы; 95 % ДИ: 0,73–1,38 единицы, p < 0,0001). Улучшение сохранялось на протяжении всего периода лечения.
Качество жизни, связанное со здоровьем
Улучшение средней общей балльной оценки качества жизни согласно оценке пациента при приеме препарата СПИРИВА РЕСПИМАТ по сравнению с плацебо составило 3,5 единицы (95 % ДИ: 2,1–4,9, p < 0,0001). Снижение на 4 единицы считается клинически значимым.
Обострения ХОБЛ
Лечение раствором для ингаляций СПИРИВА РЕСПИМАТ привело к значительному снижению риска обострения ХОБЛ по сравнению с плацебо. Лечение раствором для ингаляций СПИРИВА РЕСПИМАТ привело к снижению риска госпитализации из-за обострения ХОБЛ.
Клиническая эффективность и безопасность при астме
Согласно результатам клинических исследований у пациентов с симптомами астмы, получавших поддерживающее лечение с применением по меньшей мере интраназальных кортикостероидов (≥ 800 мкг будесонида/день или эквивалентное лечение) в комбинации с ß2-агонистами длительного действия, раствор для ингаляций СПИРИВА РЕСПИМАТ продемонстрировал клинически значимое улучшение функции легких по сравнению с плацебо при применении в качестве дополнения к фоновому лечению.
На 24-й неделе среднее улучшение пикового и минимального ОФВ1 составило 0,110 л (95 % ДИ: 0,063–0,158 л, p < 0,0001) и 0,093 л (95 % ДИ: 0,050–0,137 л, p < 0,0001) соответственно. Улучшение функции легких по сравнению с плацебо сохранялось в течение 24 часов.
Лечение пациентов с симптомами астмы с применением комбинации интраназальных кортикостероидов и ß2-агонистами длительного действия, добавление тиотропия бромида снизило риск тяжелых обострений астмы.
Пациенты детского возраста
Нет данных по применению у пациентов детского возраста с ХОБЛ и бронхиальной астмой.
Клиническая эффективность и безопасность при муковисцидозе (МВ)
Программа клинических исследований при МВ включала исследования с участием пациентов в возрасте от 5 месяцев и старше. Результаты показали, что признаки и симптомы, считавшиеся проявлениями МВ, численно (но статистически не значимо), возрастали при приеме тиотропия бромида, особенно у пациентов в возрасте ≤ 11 лет.
Показания к применению
— поддерживающее лечение пациентов с хронической обструктивной болезнью легких (ХОБЛ) для облегчения симптомов
— дополнительное поддерживающее лечение взрослых пациентов с бронхиальной астмой (перенесших одно или несколько тяжелых обострений в течение последнего года при комбинированном лечении ингаляционными кортикостероидами и β2-агонистами длительного действия).
Способ применения и дозы
Препарат СПИРИВА РЕСПИМАТ предназначен только для ингаляций и только через ингалятор РЕСПИМАТ.
Взрослые — рекомендуемая доза составляет две ингаляционные дозы спрея из ингалятора РЕСПИМАТ, что соответствует 5 мкг тиотропия бромида, один раз в день, в одно и то же время дня.
Не следует превышать рекомендуемую дозу.
При лечении бронхиальной астмы максимальная польза будет достигнута после применения нескольких доз препарата СПИРИВА РЕСПИМАТ.
Пожилым пациентам необходимо использовать препарат СПИРИВА РЕСПИМАТ в рекомендуемой дозе.
Пациентам с нарушениями функции почек необходимо использовать препарат СПИРИВА РЕСПИМАТ в рекомендуемой дозе. Однако пациентам с умеренной или острой почечной недостаточностью (клиренс креатинина ≤ 50 мл/мин) СПИРИВА РЕСПИМАТ следует применять только в том случае, если ожидаемая польза превышает потенциальный риск (см. раздел Особые указания).
Пациентам с нарушениями функции печени можно использовать СПИРИВУ РЕСПИМАТ в рекомендуемой дозе.
Пациенты детского возраста. Данных о применении препарата при ХОБЛ и бронхиальной астме у детей и подростков до 18 лет нет. Эффективность и безопасность препарата не установлены.
Муковисцидоз. Эффективность и безопасность препарата не установлены.
Для обеспечения правильного применения препарата пациенты должны быть инструктированы о том, как использовать ингалятор.
Инструкция по применению препарата СПИРИВА РЕСПИМАТ
Пожалуйста, внимательно прочитайте инструкцию и тщательно ей следуйте.
Необходимо использовать ингалятор только ОДИН РАЗ В ДЕНЬ.
Каждый раз при использовании делайте ДВЕ ИНГАЛЯЦИИ.
-
Если ингалятор СПИРИВА РЕСПИМАТ не использовался более 7 дней, выпустите одну ингаляцию вниз.
-
Если ингалятор СПИРИВА РЕСПИМАТ не использовался более 21 дня, повторите шаги с 4-го по 6-й «Подготовка к первому использованию» до появления видимого облака аэрозоля. Затем трижды повторите шаги с 4-го по 6-й.
• Не прикасайтесь к прокалывающему элементу внутри прозрачного основания.
Уход за ингалятором СПИРИВА РЕСПИМАТ
Необходимо чистить мундштук, в том числе металлическую часть внутри мундштука, только влажной салфеткой или тканью не менее одного раза в неделю.
Незначительное обесцвечивание мундштука не влияет на производительность ингалятора. При необходимости ингалятор протирают снаружи влажной тканью.
Когда необходимо приобрести новый ингалятор СПИРИВА РЕСПИМАТ
• Ингалятор содержит 60 ингаляций (30 доз) при условии его использования согласно указаниям (две ингаляции/один раз в день).
• Индикатор доз показывает приблизительное количество оставшихся доз.
• Когда индикатор доз войдет в красную область шкалы, необходимо будет получить новый рецепт; лекарства останется примерно на 7 дней (14 ингаляций).
• Как только индикатор доз достигнет конца красной области шкалы, ингалятор СПИРИВА РЕСПИМАТ заблокируется автоматически и подача доз станет невозможной. С этого момента прозрачное основание вращать нельзя.
• Ингалятор СПИРИВА РЕСПИМАТ следует выбросить через три месяца после первого использования независимо от того, закончился препарат или нет.
Подготовка к первому использованию
|
1. Снять прозрачное основание • Колпачок должен быть закрыт. • Нажать на предохранитель и одновременно с усилием снять прозрачное основание другой рукой. |
|
|
2. Вставить картридж • Вставить картридж узким концом в ингалятор. • Поставить ингалятор на твердую поверхность и с усилием надавить на него, пока он не встанет на место со щелчком. |
|
|
3. Установить прозрачное основание на место • Вернуть прозрачное основание обратно на место до щелчка. |
|
|
4. Повернуть • Колпачок должен быть закрыт. • Поворачивать прозрачное основание в направлении стрелок на этикетке до щелчка (половина оборота). |
|
|
5. Открыть • Открыть колпачок, пока он полностью не откроется. |
|
|
6. Нажать • Направить ингалятор вниз. • Нажать кнопку подачи дозы. • Закрыть колпачок. • Повторить шаги с 4-го по 6-й до появления видимого облака аэрозоля. • После появления видимого облака повторить шаги с 4-го по 6-й еще три раза. |
Теперь ингалятор готов к использованию. Эти шаги не влияют на количество имеющихся доз. После подготовки ингалятора хватит на 60 ингаляций (30 доз лекарства).
Ежедневное использование
|
ПОВЕРНУТЬ • Колпачок должен быть закрыт. • ПОВОРАЧИВАТЬ прозрачное основание в направлении стрелок на этикетке до щелчка (половина оборота). |
|
|
ОТКРЫТЬ • ОТКРЫТЬ колпачок, пока он полностью не откроется. |
|
|
НАЖАТЬ • Сделать полный медленный выдох. • Плотно охватить губами мундштук, не закрывая вентиляционных отверстий. Направить ингалятор к задней стенке глотки. • Во время выполнения медленного глубокого вдоха через рот необходимо НАЖАТЬ кнопку подачи дозы и продолжать медленно вдыхать как можно дольше. • Задержать дыхание на 10 секунд или настолько, насколько это будет комфортно. • Повторить этапы ПОВЕРНУТЬ, ОТКРЫТЬ и НАЖАТЬ два раза, чтобы в общей сложности получилось 2 ингаляции. • Закрыть колпачок до следующего применения ингалятора СПИРИВА РЕСПИМАТ. |
Ответы на часто задаваемые вопросы
Сложно установить картридж глубоко вовнутрь
Вы случайно повернули прозрачное основание до того, как установить картридж?
Откройте колпачок, нажмите на кнопку подачи дозы, а затем вставьте картридж.
Вы установили картридж широким концом вперед?
Установите картридж узким концом вперед.
Я не могу нажать кнопку подачи дозы.
Вы поворачивали прозрачное основание?
Если нет, непрерывно поворачивайте прозрачное основание до щелчка (половина оборота).
Индикатор дозы СПИРИВА РЕСПИМАТ показывает ноль?
Ингалятор блокируется после 60 ингаляций (30 доз лекарства). Подготовьте и используйте свой новый ингалятор СПИРИВА РЕСПИМАТ.
Я не могу повернуть прозрачное основание.
Вы поворачивали прозрачное основание до этого?
Если вы уже повернули прозрачное основание, выполните этапы ОТКРЫТЬ и НАЖАТЬ из раздела «Ежедневное использование» для получения лекарственного средства.
Индикатор дозы СПИРИВА РЕСПИМАТ показывает ноль?
Ингалятор СПИРИВА РЕСПИМАТ блокируется после 60 ингаляций (30 доз лекарства). Подготовьте и используйте свой новый ингалятор СПИРИВА РЕСПИМАТ.
Индикатор доз ингалятора СПИРИВА РЕСПИМАТ достиг ноля преждевременно.
Вы использовали СПИРИВА РЕСПИМАТ согласно рекомендации (две ингаляций/один раз в день)?
Ингалятор СПИРИВА РЕСПИМАТ закончится через 30 дней при условии его использования по две ингаляции/один раз в день.
Вы повернули прозрачное основание до того, как установили картридж?
Индикатор доз считает каждый поворот прозрачного основания независимо от того, был установлен картридж или нет.
Вы часто распыляли препарат для того, чтобы убедиться, работает ли СПИРИВА РЕСПИМАТ?
Если СПИРИВА РЕСПИМАТ уже подготовлен к работе, то нет необходимости повторять проверку распыления каждый день.
Вы установили картридж в уже использованный ингалятор СПИРИВА РЕСПИМАТ?
Всегда устанавливайте новый картридж в НОВЫЙ ингалятор СПИРИВА РЕСПИМАТ.
Мой «Спирива Респимат» распыляет препарат автоматически.
Колпачок был открыт в то время, когда вы поворачивали прозрачное основание?
Закройте колпачок, а затем поверните прозрачное основание.
Вы нажали на кнопку подачи дозы, когда поворачивали прозрачное основание?
Закройте колпачок, таким образом кнопка подачи дозы будет закрыта, а затем поверните прозрачное основание.
Вы прекратили поворачивать прозрачное основание до того, как услышали щелчок?
Непрерывно поворачивайте прозрачное основание до тех пор, пока не услышите щелчок (половина оборота).
Мой «Спирива Респимат» не распыляет препарат.
Вы установили картридж?
Если нет, установите картридж.
Вы повторяли этапы ПОВЕРНУТЬ, ОТКРЫТЬ и НАЖАТЬ не менее трех раз после того, как установили картридж?
Повторите этапы ПОВЕРНУТЬ, ОТКРЫТЬ и НАЖАТЬ три раза после установки картриджа, как указано в пунктах 4–6 в разделе «Подготовка к первому использованию».
Индикатор доз СПИРИВА РЕСПИМАТ показывает ноль?
Если индикатор доз указывает на ноль, это значит, что вы использовали весь препарат и ингалятор заблокировался.
После сборки ингалятора не удаляйте прозрачное основание или картридж. Всегда устанавливайте новый картридж в НОВЫЙ ингалятор СПИРИВА РЕСПИМАТ.
Побочные действия
Многие из нижеперечисленных нежелательных явлений могут быть следствием антихолинергических свойств тиотропия бромида.
Побочные действия определены со следующей частотой: очень часто: ≥ 1/10; часто: ≥ 1/100 < 1/10; нечасто: ≥ 1/1,000 < 1/100; редко: ≥ 1/10,000 < 1/1,000; очень редко: < 1/10,000; неизвестно: невозможно оценить на основании доступных данных.
|
Класс системы органов |
Частота при ХОБЛ |
Частота при бронхиальной астме |
|
Нарушения со стороны обмена веществ и питания |
||
|
Обезвоживание |
Неизвестно |
Неизвестно |
|
Нарушения со стороны нервной системы |
||
|
Головокружение |
Нечасто |
Нечасто |
|
Головная боль |
Нечасто |
Нечасто |
|
Бессонница |
Редко |
Нечасто |
|
Нарушения со стороны органов зрения |
||
|
Глаукома |
Редко |
Неизвестно |
|
Повышение внутриглазного давления |
Редко |
Неизвестно |
|
Нечеткое зрение |
Редко |
Неизвестно |
|
Нарушения со стороны сердечно-сосудистой системы |
||
|
Фибрилляция предсердий |
Редко |
Неизвестно |
|
Учащенное сердцебиение |
Редко |
Нечасто |
|
Суправентрикулярная тахикардия |
Редко |
Неизвестно |
|
Тахикардия |
Редко |
Неизвестно |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
||
|
Кашель |
Нечасто |
Нечасто |
|
Носовое кровотечение |
Редко |
Неизвестно |
|
Фарингит |
Нечасто |
Нечасто |
|
Дисфония |
Нечасто |
Нечасто |
|
Бронхоспазм |
Редко |
Нечасто |
|
Ларингит |
Редко |
Неизвестно |
|
Синусит |
Неизвестно |
Неизвестно |
|
Нарушения со стороны ЖКТ |
||
|
Сухость во рту |
Часто |
Часто |
|
Запор |
Нечасто |
Редко |
|
Кандидоз полости рта |
Нечасто |
Нечасто |
|
Дисфагия |
Редко |
Неизвестно |
|
Гастроэзофагеальная рефлюксная болезнь |
Редко |
Неизвестно |
|
Кариес зубов |
Редко |
Неизвестно |
|
Гингивит |
Редко |
Редко |
|
Глоссит |
Редко |
Неизвестно |
|
Стоматит |
Неизвестно |
Редко |
|
Кишечная непроходимость, включая паралитическую кишечную непроходимость |
Неизвестно |
Неизвестно |
|
Тошнота |
Неизвестно |
Неизвестно |
|
Нарушения со стороны кожи и подкожных тканей, со стороны иммунной системы |
||
|
Сыпь |
Нечасто |
Редко |
|
Зуд |
Нечасто |
Редко |
|
Ангионевротический отек |
Редко |
Редко |
|
Крапивница |
Редко |
Редко |
|
Инфекции/язвы кожи |
Редко |
Неизвестно |
|
Сухость кожи |
Редко |
Неизвестно |
|
Гиперчувствительность (в том числе реакции немедленного типа) |
Неизвестно |
Редко |
|
Анафилактическая реакция |
Неизвестно |
Неизвестно |
|
Нарушения со стороны опорно-двигательного аппарата и соединительных тканей |
||
|
Отек сустава |
Неизвестно |
Неизвестно |
|
Нарушения со стороны почек и мочевыводящих путей |
||
|
Задержка мочеиспускания |
Нечасто |
Неизвестно |
|
Дизурия |
Нечасто |
Неизвестно |
|
Инфекция мочевыводящих путей |
Редко |
Неизвестно |
Антихолинергические эффекты могут усиливаться с возрастом пациента.
Противопоказания
-
гиперчувствительность к тиотропия бромиду, атропину или его производным (ипратропию, окситропию) или к любому компоненту этого препарата
-
детский и подростковый возраст до 18 лет
Лекарственные взаимодействия
Допускается применение тиотропия бромида совместно с другими препаратами, обычно применяемыми в лечении ХОБЛ и астмы, включая лечение симпатомиметическими бронходилататорами, метилксантинами, пероральными и ингаляционными стероидами, антигистаминными средствами, муколитиками, модификаторами лейкотриенов, кромонами и анти-IgE антителами без клинических признаков лекарственного взаимодействия.
Изменений воздействия тиотропия за счет β2-агонистов длительного действия) или ингаляционных кортикостероидов (ИКС) не обнаружено.
Не рекомендуется совместное применение СПИРИВА РЕСПИМАТ с другими антихолинергическими препаратами.
Особые указания
Препарат СПИРИВА РЕСПИМАТ, являющийся бронходилатирующим поддерживающим средством для приема один раз в день, не следует применять в качестве стартовой терапии острых приступов бронхоспазма или для облегчения острых симптомов.
В случае возникновения острых приступов следует использовать быстродействующие β2-агонисты.
СПИРИВА РЕСПИМАТ не следует использовать в качестве монотерапии (препарата первой линии) для лечения бронхиальной астмы. Пациентам, страдающим от бронхиальной астмы, настоятельно рекомендуется продолжать противовоспалительную терапию ингаляционными кортикостероидами без изменений после начала приема препарата СПИРИВА РЕСПИМАТ даже в случае облегчения симптомов.
После приема СПИРИВА РЕСПИМАТ могут возникать реакции гиперчувствительности немедленного типа.
В связи с его антихолинергической активностью СПИРИВА РЕСПИМАТ должен использоваться с осторожностью у больных с закрытоугольной глаукомой, гиперплазией предстательной железы или обструкцией шейки мочевого пузыря.
Применение ингаляционных препаратов может вызывать бронхоспазм, индуцированный ингаляцией.
СПИРИВА РЕСПИМАТ следует с осторожностью применять у пациентов с известными нарушениями сердечного ритма: у пациентов с недавно (менее 6 месяцев назад) перенесенным инфарктом миокарда; нестабильной или опасной для жизни сердечной аритмией или сердечной аритмией, требовавшей вмешательства или изменения медикаментозной терапии за последний год; госпитализацией по причине сердечной недостаточности (III или IV класса по NYHA) в течение последнего года. Антихолинергический механизм действия препарата может влиять на эти состояния.
Поскольку концентрация в плазме крови увеличивается со снижением функции почек прием препарата СПИРИВА РЕСПИМАТ у пациентов с умеренной или тяжелой степенью почечной недостаточности (клиренс креатинина ≤ 50 мл/мин) следует начинать только в том случае, если польза превышает потенциальный риск. Длительный опыт применения СПИРИВА РЕСПИМАТ у пациентов с тяжелой степенью почечной недостаточности отсутствует.
Пациентов следует проинструктировать относительно правильного приема СПИРИВА РЕСПИМАТ и избегать попадания препарата в глаза. Пациенты должны быть предупреждены о том, что это может привести к ухудшению острой закрытоугольной глаукомы, появлению боли или дискомфорта в глазах, временной нечеткости зрения, наличию в поле зрения радужных кругов или цветных пятен в сочетании с покраснением глаз вследствие конъюктивальной гиперемии и отека роговицы. В случае возникновения любой комбинации этих симптомов следует незамедлительно прекратить прием препарата и проконсультироваться у специалиста.
Сухость во рту, наблюдаемая при антихолинергическом лечении, при длительном применении может сопровождаться кариесом зубов.
Препарат СПИРИВА РЕСПИМАТ не должен использоваться чаще, чем один раз в день.
Муковисцидоз: СПИРИВА РЕСПИМАТ не рекомендуется применять при муковисцидозе (МВ), так как тиотропия бромид может усилить признаки и симптомы МВ (например, серьезные нежелательные явления, легочные обострения, инфекции дыхательных путей)
Фертильность, беременность и период грудного вскармливания:
Беременность. Имеется ограниченное количество данных применения тиотропия бромида у беременных женщин. Доклинические исследования не указывают на прямое или косвенное токсическое воздействие на репродуктивную функцию при клинически значимых дозах. В качестве меры предосторожности следует избегать приема препарата во время беременности.
Период грудного вскармливания. Нет достаточных данных о том, проникает ли тиотропия бромид в грудное молоко. Несмотря на результаты доклинических исследований, которые показали, что выделение тиотропия бромида с молоком происходит лишь в небольших количествах, применение СПИРИВА РЕСПИМАТ у кормящих грудью женщин не рекомендуется. Тиотропия бромид – соединение длительного действия. Решение о целесообразности продолжения/прекращения кормления грудью или продолжения/прекращения лечения с применением препарата СПИРИВА РЕСПИМАТ следует принимать с учетом преимущества грудного вскармливания для ребенка и благоприятного терапевтического действия СПИРИВА РЕСПИМАТ для женщины.
Фертильность. Данных о воздействии тиотропия на фертильность нет. Доклинические исследования не выявили каких-либо нежелательных воздействий на репродуктивную функцию.
Особенности влияния лекарственного средства на способность управлять
транспортным средством или потенциально опасными механизмами. Исследований о влиянии препарата на способность управлять транспортными средствами и механизмами не проводилось. Возникновение головокружения или нечеткости зрения может влиять на эти виды деятельности.
Передозировка
Симптомы: высокие дозы тиотропия бромида могут вызывать признаки и симптомы, характерные для антихолинергических препаратов. В то же время не отмечалось системных антихолинергических нежелательных эффектов после приема однократной ингаляционной дозы до 340 мкг и не наблюдалось значимых нежелательных эффектов после 14-дневного приема до 40 мкг ингаляционных доз ипратропия бромида, помимо сухости во рту/глотке и слизистой носа, а также выраженного снижения слюноотделения начиная с 7-го дня. Возникновение острой интоксикации в случае непреднамеренного проглатывания раствора тиотропия для ингаляций из картриджа маловероятно, вследствие низкой пероральной биодоступности.
Лечение: симптоматическая терапия.
Форма выпуска и упаковка
По 4 мл препарата разливают в картриджи, вложенные в алюминиевые патроны для системы РЕСПИМАТ. На картридж наклеивают этикетку самоклеющуюся.
По 1 картриджу в комплекте с 1 ингалятором РЕСПИМАТ вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в пачку картонную.
Условия хранения
Хранить при температуре не выше 25оС, не замораживать!
Хранить в недоступном для детей месте!
Срок хранения
3 года
Период применения после вскрытия картриджа 3 месяца.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Наименование и страна организации-производителя
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ, Ингельхайм, Германия
Владелец регистрационного удостоверения
Берингер Ингельхайм Интернешнл ГмбХ, Ингельхайм, Германия
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара) и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства:
Филиал «Берингер Ингельхайм Фарма Геселлшафт мбХ» в РК
Адрес: г. Алматы, 050008, пр-т Абая, 52, БЦ«Innova Tower», 7-й этаж
Тел: + 7(727) 250 00 77; факс:+7 (727) 244 51 77
e-mail: PV_local_Kazakhstan@boehringer-ingelheim.com
| 173156921477976508_ru.doc | 966.5 кб |
| 173211931477977663_kz.doc | 1032.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Спирива Респимат — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-000890
Торговое название:
Спирива® Респимат®
Международное название:
тиотропия бромид
Химическое название:
(1R, 2R, 4S, 5S, 7S)-7-[2-Гидрокси-2,2-ди-(2-тиенил)ацетокси]-9,9-диметил-3-окса-9- азониатрицикло [3.3.1.02,4] нонан бромид моногидрат
Лекарственная форма:
раствор для ингаляций
Состав:
Одна ингаляционная доза содержит
Активное вещество: тиотропий — 2,5 мкг (соответственно тиотропия бромид моногидрат -3,1235 мкг).
Вспомогательные вещества: бензалкония хлорид — 1,105 мкг, динатрия эдетат — 1,105 мкг, хлористоводородная кислота 1М до рН 2,8 — 3,0, вода — до 11,05 мг.
Описание:
прозрачный бесцветный или почти бесцветный раствор в картридже вместимостью 4,5 мл, помещенном в алюминиевый цилиндр.
Фармакотерапевтическая группа:
М-холиноблокатор
Код АТХ:
R03BB04
Фармакологические свойства
Тиотропия бромид — антимускариновый препарат длительного действия, в клинической практике часто называемый м-холиноблокирующим средством. Препарат обладает одинаковым сродством к Ml — M5 подтипам мускариновых рецепторов. Результатом ингибирования M3-рецепторов в дыхательных путях является расслабление гладкой мускулатуры. Бронходилатирующий эффект зависит от дозы и сохраняется не менее 24 часов. Значительная продолжительность действия связана, вероятно, с очень медленной диссоциацией препарата от M3-рецепторов; период полудиссоциации существенно более длительный, чем у ипратропия бромида. При ингаляционном способе введения тиотропий бромид, как N-четвертичное производное аммония, оказывает местный избирательный эффект (на бронхи), при этом в терапевтических дозах не вызывает системных м-холиноблокирующих побочных эффектов. Диссоциация от M2-рецепторов происходит быстрее, чем от M3-рецепторов, что свидетельствует о преобладании селективности в отношении M3 подтипа рецепторов над M2-рецепторами. Высокое сродство к рецепторам и медленная диссоциация препарата из связи с рецепторами обусловливают выраженный и продолжительный бронходилатирующий эффект у пациентов с хронической обструктивной болезнью легких (ХОБЛ).
Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена, в первую очередь, местным (на дыхательные пути), а не системным действием.
В клинических исследованиях было показано, что применение препарата Спирива Респимат один раз в день приводит к значительному улучшению (по сравнению с плацебо) функции легких (объем форсированного выдоха за 1 секунду ОФВ1 и форсированная жизненная емкость легких ФЖЕЛ) в течение 30 минут после использования первой дозы. Улучшение функции легких сохраняется в течение 24 часов при равновесной концентрации.
Фармакодинамическое равновесие достигалось в течение одной недели. Спирива Респимат значительно улучшал утреннюю и вечернюю пиковую объемную скорость выдоха (ПОСВ), измеренную больными. Применение препарата Спирива Респимат приводило к уменьшению (по сравнению с плацебо) использования бронходилататора в качестве средства скорой помощи. Бронходилатирующий эффект препарата сохраняется на протяжении 48 недель применения препарата; признаков привыкания не отмечается.
Анализ комбинированных данных двух рандомизированных, плацебо-контролируемых, перекрестных клинических исследований показал, что бронходилатирующий эффект препарата Спирива Респимат (5 мкг) после 4-недельного периода лечения был в количественном отношении выше, чем эффект препарата СПИРИВА (18 мкг).
В долгосрочных (12-месячных) исследованиях было установлено, что Спирива Респимат значительно уменьшает одышку; улучшает качество жизни; снижает психосоциальное воздействие ХОБЛ и увеличивает активность.
Препарат Спирива Респимат достоверно улучшал общее состояние здоровья (общий балл) по сравнению с плацебо к концу двух 12-месячных исследований, это различие сохранялось на протяжении всего периода лечения; препарат Спирива Респимат значительно уменьшал число обострений ХОБЛ, и увеличивал период до момента первого обострения по сравнению с плацебо.
Доказано, что Спирива Респимат уменьшает риск обострения ХОБЛ и значительно снижает количество случаев госпитализации.
При ретроспективном анализе отдельных клинических исследований было замечено статистически недостоверное увеличение, по сравнению с плацебо, количества случаев смерти у пациентов с нарушениями ритма сердца. Однако эти данные статистически не подтверждены и могут быть связаны с заболеванием сердца.
В клинических исследованиях у пациентов, страдающих бронхиальной астмой и продолжающих испытывать симптомы заболевания, несмотря на поддерживающую терапию ингаляционным кортикостероидом, в том числе в комбинации с длительно-действующим агонистом бета2— адренорецепторов, было установлено, что добавление препарата Спирива Респимат к поддерживающей терапии приводило к достоверному улучшению функции легких по сравнению с плацебо, значительно уменьшало число серьезных обострений и периодов ухудшения симптомов бронхиальной астмы, и увеличивало период до первого их наступления, приводило к достоверному улучшению качества жизни и увеличению числа пациентов с положительным ответом на поддерживающую терапию. Бронходилатирующий эффект препарата сохранялся на протяжении 1 года применения, признаков привыкания не отмечалось.
Фармакокинетика
Тиотропия бромид — четвертичное производное аммония, умеренно растворимое в воде. Тиотропия бромид выпускается в виде раствора для ингаляций, который применяется с помощью ингалятора РЕСПИМАТ. Приблизительно 40 % от величины ингаляционной дозы осаждается в легких, остальное количество поступает в желудочно-кишечный тракт. Некоторые фармакокинетические данные, описанные ниже, были получены при использовании доз, превышающих рекомендуемые для лечения.
Всасывание
После ингаляции раствора молодыми здоровыми добровольцами установлено, что в системную циркуляцию поступает около 33 % от величины ингаляционной дозы. Прием пищи не влияет на всасывание тиотропия бромида, в связи с тем, что он плохо всасывается из желудочно-кишечного тракта. Абсолютная биодоступность при приеме внутрь составляет 2-3 %. Максимальная концентрация в плазме наблюдается через 5-7 минут после ингаляции. На стадии динамического равновесия пиковая концентрация тиотропия в плазме крови у пациентов с ХОБЛ составляет 10,5 пг/мл и быстро снижается. Это указывает на мультикомпартментный тип распределения препарата. На стадии динамического равновесия базальная концентрация тиотропия в плазме крови составляет 1,6 пг/мл. На стадии динамического равновесия пиковая концентрация тиотропия в плазме крови у пациентов с бронхиальной астмой составляла 5,15 пг/мл и достигалась через 5 мин.
Распределение
Связывание препарата с белками плазмы составляет 72 %; объем распределения — 32 л/кг. Исследования показали, что тиотропия бромид не проникает через гематоэнцефалический барьер.
Биотрансформация
Степень биотрансформации незначительна. Это подтверждается тем, что после внутривенного введения препарата молодым здоровым добровольцам в моче обнаруживается 74 % субстанции тиотропия бромида в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-N-метилскопин, и дитиенилгликолиевую кислоту; эти соединения не связываются с мускариновыми рецепторами.
В исследованиях in vitro показано, что некоторая часть препарата (<20 % от дозы после внутривенного введения) метаболизируется путем окисления цитохромом P450 с последующей конъюгацией с глютатионом и образованием различных метаболитов. Данный механизм может тормозиться ингибиторами изоферментов CYP450 2D6 и 3A4, хинидин, кетоконазол и гестоден. Таким образом, CYP450 2D6 и 3A4 участвуют в метаболизме препарата. Тиотропия бромид даже в сверхтерапевтических концентрациях не ингибирует цитохром P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 или 3A в микросомах печени человека.
Выведение
Терминальный период полувыведения тиотропия бромида после ингаляции составляет от 27 до 45 часов у пациентов с ХОБЛ. У пациентов с астмой эффективный период полувыведения после ингаляции составляет 34 ч.
Общий клиренс после внутривенного введения препарата молодым здоровым добровольцам составлял 880 мл/мин. Тиотропия бромид после внутривенного введения в основном выводится почками в неизмененном виде (74 %). После ингаляции раствора у пациентов с ХОБЛ почечная экскреция составляет 18,6% (0,93 мкг), оставшаяся неабсорбировавшаяся часть выводится через кишечник. В стадии фармакокинетического равновесия у пациентов с астмой 11,9% (0,595 мкг) дозы выводится в неизменном виде с мочой через 24 часа после приема препарата. Почечный клиренс тиотропия бромида превышает клиренс креатинина, что свидетельствует о его канальцевой секреции. После длительного ингаляционного приема препарата один раз в день пациентами с ХОБЛ фармакокинетическое равновесие достигается на 7 день; при этом в дальнейшем не наблюдается аккумуляции.
Тиотропия бромид имеет линейную фармакокинетику в терапевтических пределах после внутривенного применения, ингаляции сухого порошка и ингаляции раствора.
Фармакокинетика у пациентов пожилого возраста
В пожилом возрасте отмечается снижение почечного клиренса тиотропия (347 мл/мин у пациентов с ХОБЛ в возрасте до 65 лет и 275 мл/мин у пациентов с ХОБЛ и астмой старше 65 лет). Установлено, что у пациентов с бронхиальной астмой воздействие тиотропия бромида не зависит от возраста пациентов.
Пациенты с нарушениями функции почек
После ингаляционного применения тиотропия один раз в день в период устойчивого состояния фармакокинетики у пациентов с ХОБЛ и небольшими нарушениями функции почек (клиренс креатинина 50-80 мл/мин) отмечалось небольшое увеличение величин AUCo-6,ss на 1,8-30 % и Cmax,ss по сравнению с пациентами с нормальной функцией почек(клиренс креатинина >80 мл/мин). У пациентов с ХОБЛ и умеренными или значительными нарушениями функции почек (клиренс креатинина <50 мл/мин) внутривенное применение тиотропия бромида приводило к двукратному увеличению общего воздействия (площадь под кривой «концентрация/время» AUC0-4ч увеличивалась на 82 %, а величина Cmax увеличилась на 52 %) по сравнению с пациентами с ХОБЛ и нормальной функцией почек. Аналогичное повышение концентрации в плазме отмечалось и после ингаляции сухого порошка.
У пациентов с бронхиальной астмой и небольшими нарушениями функции почек (клиренс креатинина 50-80 мл/мин) ингаляционное применение тиотропия бромида не приводило к значительному увеличению воздействия в сравнении с пациентами с нормальной функцией почек.
Пациенты с нарушениями функции печени
Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокинетику тиотропия бромида, так как тиотропия бромид преимущественно выводится почками и с помощью неферментативного расщепления эфирной связи с образованием производных, которые не обладают фармакологической активностью.
Показания
Препарат Спирива Респимат показан:
— для поддерживающего лечения пациентов с ХОБЛ, хроническим бронхитом, эмфиземой легких; поддерживающей терапии при сохраняющейся одышке; улучшения качества жизни, нарушенного вследствие ХОБЛ, и снижения частоты обострений.
— в качестве дополнительной поддерживающей терапии у пациентов с 6 лет с бронхиальной астмой, с сохраняющимися симптомами заболевания на фоне приема, по крайней мере, ингаляционных глюкокортикостероидов; для уменьшения симптомов бронхиальной астмы, улучшения качества жизни и снижения частоты обострений.
С осторожностью
Закрытоугольная глаукома, гиперплазия предстательной железы, обструкция шейки мочевого пузыря.
Противопоказания
Препарат Спирива Респимат противопоказан больным, у которых ранее отмечалась гиперчувствительность к любому компоненту этого препарата, к атропину или его производным, например, ипратропию бромиду, окситропию бромиду.
Применение при беременности и в период грудного вскармливания
Данные о влиянии препарата Спирива Респимат на беременность ограничены. В доклинических исследованиях при изучении репродуктивной токсичности не получено указаний на прямые или опосредованные неблагоприятные влияния препарата. В качестве меры предосторожности предпочтительнее воздержаться от использования препарата Спирива Респимат во время беременности.
Клинических данных о влияния тиотропия бромида у женщин, кормящих грудью, нет. Препарат не должен применяться у беременных или кормящих грудью женщин, если потенциальная польза для матери не превышает потенциальный риск для плода и ребенка. На период применения препарата необходимо прекратить кормление грудью ребенка.
Способ применения и дозы
Рекомендуемая терапевтическая доза составляет две ингаляции спрея из ингалятора РЕСПИМАТ (5 мкг/терапевтическая доза) один раз в день, в одно и то же время суток (см. «Инструкции по применению»).
При лечении бронхиальной астмы полный терапевтический эффект наступает через несколько дней.
У пожилых пациентов, пациентов с нарушениями функции печени и пациентов с небольшими нарушениями функции почек (клиренс креатинина 50 — 80 мл/мин) можно использовать препарат Спирива Респимат в рекомендуемой дозе.
Однако, использование препарата у пациентов с умеренными или значительными нарушениями функции почек (клиренс креатинина менее 50 мл/мин) должно тщательно мониторироваться. ХОБЛ обычно не встречается у детей. Безопасность и эффективность препарата Спирива Респимат у детей до одного года не изучены.
Побочное действие
Многие из перечисленных ниже нежелательных реакций могут быть обусловлены м-холиноблокирующими свойствами препарата.
Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований и отдельных сообщений в течение пострегистрационного использования препарата.
Частота побочных реакций, которые могут возникать во время терапии, приведена в виде следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1 000, <1/100); редко (≥1/10 000, <1/1 000); очень редко (<1/10 000); неуточненной частоты (частота не может быть оценена по доступным данным).
Нарушения со стороны обмена веществ и питания
Неуточненной частоты: дегидратация.
Нарушения со стороны нервной системы
Нечасто: головокружение.
Редко: бессонница.
Нарушения со стороны органа зрения
Редко: повышение внутриглазного давления, глаукома; нечеткость зрения.
Нарушения со стороны сердечно-сосудистой системы
Редко: мерцательная аритмия; тахикардия (включая суправентрикулярную тахикардию), ощущение сердцебиения.
Нарушения со стороны органов дыхания, органов грудной клетки и средостения
Нечасто: кашель, фарингит, дисфония.
Редко: носовое кровотечение, бронхоспазм, ларингит.
Неуточненной частоты: синусит.
Нарушения со стороны желудочно-кишечного тракта
Часто: незначительная преходящая сухость слизистой оболочки глотки.
Нечасто: запор, кандидоз полости рта.
Редко: дисфагия, гастроэзофагеальный рефлюкс, гингивит, глоссит.
Неуточненной частоты: стоматит, кишечная непроходимость, включая паралитическую кишечную непроходимость.
Нарушения со стороны кожи и подкожных тканей
Редко: кожные инфекции и язвы на коже, сухость кожи.
Аллергические реакции
Нечасто: сыпь, зуд.
Редко: ангионевротический отек, крапивница.
Неуточненной частоты: гиперчувствительность, включая реакции немедленного типа.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Неуточненной частоты: припухлость суставов.
Нарушения со стороны почек и мочевыделительной системы
Нечасто: дизурия, задержка мочи (чаще у мужчин с наличием предрасполагающих факторов).
Редко: инфекции мочевыводящих путей.
Передозировка
При применении высоких доз препарата возможны проявления м-холиноблокирующего действия. После 14-дневного ингаляционного применения тиотропия бромида в дозах, достигавших 40 мкг, у здоровых лиц не наблюдалось значимых неблагоприятных явлений, кроме чувства сухости слизистых оболочек носа и ротоглотки, частота которых зависела от величины дозы (10 — 40 мкг в день). Исключение составляло отчетливое снижение саливации, начиная с 7 дня применения препарата. В шести долгосрочных исследованиях у пациентов с ХОБЛ при ингаляционном применении раствора тиотропия бромида в суточной дозе 10 мкг в течение 4 — 48 недель не наблюдалось существенных нежелательных явлений.
Взаимодействие с другими лекарственными средствами
Хотя специальных исследований лекарственных взаимодействий не проводилось, тиотропия бромид применялся совместно с другими препаратами для лечении ХОБЛ, включая симпатомиметические бронходилататоры, метилксантины, стероиды для приема внутрь и ингаляционного применения, антигистаминные препараты, муколитики, модификаторы лейкотриенов, кромоны, анти-IgE препараты, при этом клинических признаков лекарственных взаимодействий не отмечалось.
Совместное применение с длительнодействующими бета2-агонистами, ингаляционными глюкокортикостероидами и их комбинациями не влияет на действие тиотропия.
Длительное совместное применение тиотропия бромида с другими м-холиноблокирующими препаратами не изучалось. Поэтому долгосрочное совместное применение препарата Спирива Респимат с другими м-холиноблокирующими препаратами не рекомендуется.
Особые указания
Препарат Спирива Респимат, как бронходилататор, применяемый один раз в день для поддерживающего лечения, не должен применяться в качестве начальной терапии при острых приступах бронхоспазма или для устранения остро возникающих симптомов. В случае развития острого приступа используются быстродействующие Р2-агонисты.
Препарат Спирива Респимат не должен использоваться для лечения бронхиальной астмы в качестве терапии первой линии. Пациентам следует рекомендовать на фоне приема препарата Спирива Респимат продолжать противовоспалительную терапию (например, ингаляционными глюкокортикостероидами), даже если симптомы уменьшатся.
После применения препарата могут развиваться немедленные реакции повышенной чувствительности.
Ингаляция препарата может вызывать бронхоспазм.
При умеренной или выраженной почечной недостаточности (клиренс креатинина ≤ 50 мл/мин) прием препарата следует вести под тщательным наблюдением, как и при приеме всех лекарственных препаратов, экскретируемых преимущественно почками.
Пациенты должны быть ознакомлены с инструкцией по применению. Не следует допускать попадания раствора или аэрозоля в глаза. Боль или дискомфорт в глазах, нечеткое зрение, зрительные ореолы в сочетании с покраснением глаз, отек конъюнктивы и роговицы могут быть симптомами острой закрытоугольной глаукомы. При развитии любой комбинации этих симптомов следует немедленно обратиться к специалисту. Глазные капли, обладающие миотическим действием, не считаются эффективным лечением.
Препарат Спирива Респимат не должен использоваться чаще, чем один раз в день.
Картриджи Спиривы должны использоваться только с ингалятором Респимат.
Влияние препарата на способность управлять транспортными средствами и механизмами
Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились. Следует соблюдать осторожность при выполнении данных видов деятельности, так как возможно развитие головокружения или нечеткости зрения.
Форма выпуска
Раствор для ингаляций 2,5 мкг/доза
Ингалятор Респимат® в комплекте с картриджем вместимостью 4,5 мл, помещенным в алюминиевый цилиндр. Ингалятор и цилиндр с картриджем с инструкцией по применению в картонную пачку.
Условия хранения
При температуре не выше 25 °С. Не замораживать.
Использовать в течение 3 месяцев после первой ингаляции.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту врача.
Владелец Регистрационного удостоверения:
Берингер Ингельхайм Интернешнл ГмбХ
Бингер штрассе 173, 55216 Ингельхайм-на-Рейне, Германия
Производитель:
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ
Бингер штрассе 173, 55216 Ингельхайм-на-Рейне, Германия
Получить дополнительную информацию о препарате, а также направить свои претензии и информацию о нежелательных явлениях можно по следующему адресу в России
ООО «Берингер Ингельхайм»
125171, Москва, Ленинградское шоссе, 16А стр.3
Инструкция по применению
Введение
Прочитайте эти Инструкции по применению перед началом использования препарата Спирива Респимат.
Вам нужно будет использовать этот ингалятор только ОДИН РАЗ В ДЕНЬ. Каждый раз при применении его делайте ДВЕ ИНГАЛЯЦИИ.
Как хранить ингалятор Спирива Респимат
- Храните Спирива Респимат в недоступном для детей месте
- Не замораживайте Спирива Респимат
- Если ингалятор Спирива Респимат не использовался более 7 дней, направьте его перед применением вниз и нажмите один раз на кнопку подачи дозы
- Если ингалятор Спирива Респимат не использовался более 21 дня, повторите шаги 4-6 из раздела «Подготовка к первому использованию» до появления облачка аэрозоля. Затем повторите шаги 4-6 еще три раза.
- Не используйте ингалятор Спирива Респимат после окончания срока годности.
- Не трогайте прокалывающий элемент внутри прозрачной гильзы.
Как ухаживать за Вашим ингалятором Спирива Респимат
Очищайте мундштук, включая металлическую часть мундштука, влажной тряпочкой или тканью, по меньшей мере один раз в неделю.
Любое незначительное изменение цвета мундштука не влияет на работу Вашего ингалятора Спирива Респимат.
Как определить, когда нужен новый ингалятор Спирива Респимат
- Ваш ингалятор Спирива Респимат содержит 60 ингаляционных доз (т.е. 30 терапевтических доз) при условии применения в соответствии с указаниями (две ингаляционные дозы один раз в день).
- Индикатор доз показывает, сколько примерно доз еще осталось.
- Когда индикатор доз покажет на красную область шкалы, это означает, что лекарства осталось примерно на 7 дней (14 ингаляционных доз).
- Когда индикатор доз ингалятора достигнет конца красной шкалы, ингалятор Спирива Респимат автоматически заблокируется — больше не может быть получено ни одной ингаляционной дозы (поворот прозрачной гильзы будет невозможен).
- Через три месяца после первого использования Спирива Респимат следует выбросить, даже если он полностью не использован.
Подготовка к первому использованию
1. Снимите прозрачную гильзу
- Держите колпачок закрытым.
- Нажмите стопорную кнопку и сильно потяните при этом другой рукой за прозрачную гильзу.
2. Вставьте картридж
- Вставьте картридж узким концом в ингалятор.
- Поставьте ингалятор дном картриджа на твердую поверхность и сильно нажмите на него, пока картридж не встанет на место со щелчком.
3. Установите на местопрозрачную гильзу
- Установите прозрачную гильзу на место до щелчка.
4. Поверните
- Держите колпачок закрытым.
- Поверните прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (пол-оборота).
5. Откройте
- Откройте колпачок до упора.
6. Нажмите
- Направьте ингалятор вниз.
- Нажмите кнопку подачи дозы.
- Закройте колпачок.
- Повторите шаги 4-6 до появления облачка аэрозоля.
- После появления облачка аэрозоля повторите шаги 4-6 еще три раза.
Ежедневное применение
Поверните
- Держите колпачок закрытым.
- Поверните прозрачную гильзу в направлении, указанном стрелками на этикетке, до щелчка (пол-оборота).
Откройте
- Откройте колпачок до упора.
Нажмите
- Сделайте медленный полный выдох.
- Обхватите мундштук губами, не перекрывая воздухозаборники.
- Делая медленный, глубокий вдох через рот, нажмите кнопку подачи дозы и продолжайте делать вдох.
- Задержите дыхание примерно на 10 секунд или так долго, как Вы можете.
- Для получения второй ингаляционной дозы повторите: Поверните, Откройте, Нажмите.
Ответы на часто задаваемые вопросы
1. Сложно установить картридж на необходимую глубину.
Вы случайно повернули прозрачную гильзу до установки картриджа? Откройте колпачок, нажмите на кнопку подачи дозы, затем вставьте картридж.
Вы вставляете картридж широким концом? Вставьте картридж узким концом в ингалятор.
2. Не могу нажать на кнопку подачи дозы.
Повернули ли Вы прозрачную гильзу? Если нет, поверните прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
Индикатор доз ингалятора Спирива Респимат указывает на ноль? Ингалятор Спирива Респимат блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спирива Респимат.
3. Не могу повернуть прозрачную гильзу.
Вы уже повернули прозрачную гильзу? Если прозрачная гильза уже повернута, следуйте по шагам «Откройте» и «Нажмите» в разделе «Ежедневное применение» для получения ингаляционной дозы.
Индикатор доз ингалятора Спирива Респимат указывает на ноль? Ингалятор Спирива Респимат блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спирива Респимат.
4. Индикатор доз ингалятора Спирива Респимат достигает нуля слишком быстро.
Использовали ли Вы Спирива Респимат в соответствии с указаниями (две ингаляционные дозы один раз в день)? Препарата Спирива Респимат хватает на 30 дней при использовании двух ингаляций один раз в день.
Поворачивали ли Вы прозрачную гильзу до установки картриджа? Индикатор доз считает каждый поворот прозрачной гильзы вне зависимости от того, установлен картридж или нет.
Выпускали ли Вы ингаляционные дозы в воздух для проверки работы Спирива Респимат? После подготовки ингалятора к использованию не требуется ежедневной проверки ингаляции.
Вы установили картридж в использованный ингалятор Спирива Респимат? Всегда устанавливайте новый картридж в новый ингалятор Спирива Респимат.
5. Ингалятор Спирива Респимат выпускает ингаляционные дозы автоматически.
Был ли открыт колпачок когда Вы поворачивали прозрачную гильзу? Закройте колпачок, затем поверните прозрачную гильзу.
Нажимали ли Вы кнопку подачи дозы во время поворота прозрачной гильзы? Закройте колпачок так, чтобы кнопка подачи дозы была закрыта, затем поворачивайте прозрачную гильзу.
Останавливались ли Вы во время поворота прозрачной гильзы, до звука щелчка? Поворачивайте прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
6. Ингалятор Спирива Респимат не выпускает ингаляционную дозу.
Установили ли Вы картридж? Если нет, установите картридж.
Вы повторили шаги Поверните, Откройте, Нажмите менее трех раз после установки картриджа? Повторите шаги Поверните, Откройте, Нажмите три раза после установки картриджа как описано в разделе «Подготовка к первому использованию», шаги 4-6.
Индикатор доз ингалятора Спирива Респимат указывает на ноль? Если индикатор доз указывает на ноль, значит ингалятор Спирива Респимат пуст и заблокирован.
Не снимайте прозрачную гильзу и не вынимайте картридж после подготовки ингалятора к использованию. Всегда устанавливайте новый картридж в новый ингалятор Спирива Респимат.
Купить Спирива Респимат в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Средства для лечения обструктивных заболеваний дыхательных путей. Антихолинергические средства.
Код ATX: R03BB04.
Фармакологические свойства
Фармакодинамика
Механизм действия
Тиотропий — специфический антагонист мускариновых рецепторов длительного действия. Он обладает сходным сродством к М1-М5 подтипам рецепторов. В дыхательных путях тиотропия бромид конкурентно и обратимо связывается с М3-рецепторами гладкой мускулатуры бронхов, блокируя бронхокостриктивный эффект ацетилхолина, что приводит к снижению тонуса гладкой мускулатуры и бронходилатации. Эффект является дозозависимым и сохраняется более 24 часов. Являясь N-четвертичным холиноблокатором, тиотропия бромид при ингаляционном введении оказывает местное селективное действие на бронхи, демонстрируя приемлемый терапевтический диапазон доз без возникновения системных антихолинергических эффектов.
Фармакодинамические эффекты
Высвобождение тиотропия из связи с М3-рецепторами происходит очень медленно, что приводит к достоверно более длительному периоду полувыведения по сравнению с ипратропием. В исследовании in vitro установлено более быстрое высвобождение тиотропия из связи с М2-рецепторами, чем из связи с М3-рецепторами, что приводит к фармакокинетически обусловленному селективному действию препарата в отношении М3 подтипа рецепторов по сравнению с Мг подтипом. Высокая активность, очень медленное высвобождение из связи с рецептором и местное селективное действие при ингаляционном введении приводит к клинически достоверному длительному бронходилатирующему действию тиотропия у пациентов с ХОБЛ и бронхиальной астмой.
Клиническая эффективность и безопасность при ХОБЛ
Программа клинических исследований III фазы включала два одногодичных, два 12-недельных и два 4-недельных рандомизированных двойных слепых исследования с участием 2901 пациента с ХОБЛ (из них 1038 пациентов получали тиотропий в дозе 5 мкг). 1-летняя программа состояла из двух плацебо-контролируемых исследований. Два 12-недельных исследования проводили с активным контролем (ипратропий) и с плацебо контролем. Все шесть исследований включали исследование функции легких. Кроме того, два 1-годичных исследования включали изучение влияния на выраженность одышки, качество жизни и развитие обострений.
Плацебо-контролируемые исследования
Функция легких Применение тиотропия раствора для ингаляций один раз в сутки приводило к достоверному улучшению функции легких (объема форсированного выдоха за первую секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ)) в течение 30 минут после ингаляции первой дозы по сравнению с плацебо (среднее значение повышения ОФВ1 на 30 минуте: 0,113 литра; 95% доверительный интервал (ДИ): 0,102-0,125 литра, р <0,0001). Улучшение функции легких сохранялось в течение 24 часов по сравнению с плацебо (среднее значение повышения ОФВ1: 0,122 литра, 95% ДИ: 0,106-0,138 литра, р <0,0001).
Фармакодинамически стабильное состояние достигалось в течение одной недели.
При использовании СПИРИВА РЕСПИМАТ достоверно повышалась пиковая скорость выдоха (ПСВ), измеренная у пациентов ежедневно утром и вечером, по сравнению с плацебо (среднее значение улучшения ПСВ: утром — 22 л/мин.; 95% ДИ: 18-55 л/мин., р <0,0001; вечером — 26 л/мин.; 95% ДИ: 23-30 л/мин., р <0,0001). Применение СПИРИВА РЕСПИМАТ приводило к уменьшению необходимости использования средств для купирования бронхоспазма по сравнению с плацебо (среднее снижение использования средств для купирования бронхоспазма — 0,66 случая в сутки, 95% ДИ: 0,51-0,81 случая в сутки, р <0,0001).
Бронхолитический эффект СПИРИВА РЕСПИМАТ сохранялся на протяжении года применения без появления признаков развития толерантности.
Одышка, качество жизни, связанное со здоровьем, обострения ХОБЛ в исследованиях продолжительностью 1 год
Одышка
СПИРИВА РЕСПИМАТ достоверно уменьшал выраженность одышки (при оценке с использованием индекса транзиторной одышки) по сравнению с плацебо (улучшение составило в среднем 1,05 единиц, 95% ДИ: 0,73-1,38 единиц, р <0,0001). Улучшение сохранялось на протяжении всего периода лечения.
Качество жизни, связанное со здоровьем
Улучшение среднего общего балла оценки пациентом качества жизни (по оценке с помощью Респираторного опросника больницы Святого Георгия) при приеме СПИРИВА РЕСПИМАТ по сравнению с плацебо к концу 1-го года обоих исследований составило 3,5 единицы (95% ДИ: 2,1-4,9, р <0,0001). Снижение значения на 4 единицы считается клинически значимым.
Обострения ХОБЛ
В трех одногодичных рандомизированных двойных слепых плацебо-контролируемых клинических исследованиях терапия СПИРИВА РЕСПИМАТ привела к достоверному снижению риска обострений ХОБЛ по сравнению с плацебо. Обострением ХОБЛ считали «комплекс по крайней мере двух событий/симптомов со стороны дыхательной системы продолжительностью три дня или более, требующих коррекции терапии (назначение антибиотиков и/или системных кортикостероидов и/или значительному изменению дозирования принимаемых лекарственных средств)». Терапия СПИРИВА РЕСПИМАТ привела к достоверному снижению риска госпитализации в связи с обострением ХОБЛ (значительное снижение риска в крупномасштабном исследовании среди пациентов с обострением).
Объединенный анализ двух исследований III фазы и отдельный анализ дополнительного исследования влияния на частоту обострений представлены в таблице 1. В указанных исследованиях разрешалось применение лекарственных препаратов, влияющих на дыхательную систему (быстродействующие бета- агонисты, ингаляционные глюкокортикостероиды, ксантины), кроме антихолинергических средств и бета-агонистов длительного действия. Применение бета-агонистов длительного действия допускалось дополнительно при обострении.
Таблица 1 Статистический анализ обострений и госпитализаций в связи с обострением у пациентов с ХОБЛ от средней до тяжелой степени
| Исследование (Nспирива, Nплацебо) | Конечная точка | СПИРИВА РЕСПИМАТ | Плацебо | % снижения риска (95% ДИ)а | р-значение |
| 1-годичное исследование III фазы, объединенный анализd (670, 653) | Количество дней до развития первого обострения ХОБЛ | 160а | 86а | 29 (16-40)b | <0,0001b |
| Среднее количество случаев обострения на пациента в год | 0,78c | 1,00c | 22 (8-33)c | 0,002c | |
| Время до первой госпитализации в связи с обострением ХОБЛ | 25 (-16-51)b | 0,20b | |||
| Среднее количество госпитализаций в связи с обострением на пациента в год | 0,09c | 0,11c | 20 (-4-38)° | 0,096c | |
| 1-годичное исследование влияния на частоту обострений, IIIb фаза (1939,1953) | Количество дней до развития первого обострения ХОБЛ | 169а | 119а | 31 (23-37)b | <0,0001b |
| Среднее количество случаев обострения на пациента в год | 0,69c | 0,87c | 21 (13-28)c | <0,0001c | |
| Время до первой госпитализации в связи с обострением ХОБЛ | 27 (10-41)b | 0,003b | |||
| Среднее количество госпитализаций в связи с обострением на пациента в год | 0,12c | 0,15c | 19 (7-30)c | 0,004c |
а Время до первого явления: количество дней терапии до развития не менее одного обострения ХОБЛ/госпитализации в связи с обострением ХОБЛ у 25% пациентов. В исследовании А обострение у 25% пациентов в группе плацебо зарегистрировано на 112 день от начала терапии, в то время как в группе СПИРИВА РЕСПИМАТ развитие обострения у 25% пациентов зарегистрировано на 173 день (р =0,09); в исследовании В обострение зарегистрировано у 25% пациентов в группе плацебо на 74 день, в то время как в группе СПИРИВА РЕСПИМАТ обострение у 25% пациентов зарегистрировано на 149 день (р <0,0001).
b Отношение рисков оценивали по модели пропорциональных рисков Кокса. Процент снижения риска =100(1 — отношение рисков).
с Регрессия Пуассона. Снижение риска =100(1 — относительный риск).
d Объединение проведено после разработки дизайна исследований. Конечная точка (обострение ХОБЛ) была достоверно выше в отдельных анализах обоих исследований продолжительностью 1 год.
Продолжительные исследования тиотропия с активным контролем
Долгосрочное крупномасштабное рандомизированное двойное слепое исследование с активным контролем и периодом наблюдения до 3 лет было проведено с целью сравнения эффективности и безопасности СПИРИВА с ингалятором РЕСПИМАТ и СПИРИВА с ингалятором ХандиХалер (5711 пациентов получали СПИРИВА РЕСПИМАТ, 5694 пациентов получали СПИРИВА ХандиХалер). Первичными конечными точками были время до первого обострения ХОБЛ, время до наступления смертности от любых причин и, в субисследовании (906 пациентов), минимального ОФВ1 (перед введением дозы).
Время до наступления первого обострения ХОБЛ в ходе исследования было численно сопоставимо в группах СПИРИВА РЕСПИМАТ и СПИРИВА ХандиХалер (отношение рисков (СПИРИВА РЕСПИМАТ/СПИРИВА ХандиХалер) 0,98; 95% ДИ 0,93-1,03). Среднее количество дней до первого обострения ХОБЛ составило 756 дней для СПИРИВА РЕСПИМАТ и 719 дней для СПИРИВА ХандиХалер.
Бронхолитическое действие СПИРИВА РЕСПИМАТ продолжалось более 120 недель и было сходным с действием СПИРИВА ХандиХалер. Средняя разница в минимальном ОФВ1 для СПИРИВА РЕСПИМАТ в сравнении со СПИРИВА ХандиХалер составила -0,010 л (95% ДИ -0,038-0,018 л).
В пострегистрационном сравнительном исследовании TIOSPIR между СПИРИВА РЕСПИМАТ и СПИРИВА ХандиХалер продемонстрированы сходные показатели смертности от любых причин, включая отслеживаемое состояние здоровья, между исследуемыми группами (отношение рисков (СПИРИВА РЕСПИМАТ/СПИРИВА ХандиХалер) 0,96 с 95% ДИ 0,84-1,09). Экспозиция терапии соответственно составила 13135 и 13050 пациенто-лет.
В плацебо-контролируемых исследованиях с отслеживанием состояния здоровья до конца запланированного периода лечения у пациентов, получавших СПИРИВА РЕСПИМАТ, зарегистрировано цифровое увеличение смертности от всех причин в сравнении с плацебо (относительный риск (95% доверительный интервал) -1,33 (0,93, 1,92) при экспозиции терапии препаратом СПИРИВА РЕСПИМАТ, составляющей 2574 пациенто-лет; повышенное увеличение смертности наблюдалось у пациентов с известными нарушениями сердечного ритма. У пациентов, получавших СПИРИВА ХандиХалер, наблюдалось снижение риска смертности на 13% (отношение рисков, включая отслеживание состояние здоровья (тиотропий/плацебо) =0,87; 95% ДИ, 0,76-0,99). Экспозиция терапии препаратом СПИРИВА ХандиХалер составляла 10927 пациeнто-лет. Повышение риска смертности не наблюдалось у пациентов с известными нарушениями сердечного ритма в плацебо-контролируемом исследовании СПИРИВА ХандиХалер, а также в исследовании TIOSPIR по сравнению СПИРИВА РЕСПИМАТ и ХандиХалер.
Клиническая эффективность и безопасность при бронхиальной астме
Клиническая программа исследований III фазы у взрослых пациентов с персистирующей бронхиальной астмой включала два рандомизированных двойных слепых плацебо-контролируемых исследования продолжительностью 1 год с участием 907 пациентов с бронхиальной астмой (из них 453 пациента получали СПИРИВА РЕСПИМАТ) в комбинации с ингаляционными глюкокортикостероидами (ИГКС) (≥ 800 мкг будесонида/сутки или эквивалентная доза другого лекарственного препарата) с бета-агонистами длительного действия. Данные исследования включали оценку функции легких и тяжести приступов в качестве первичных точек.
PrimoTinA-исследования бронхиальной астмы
В двух исследованиях продолжительностью 1 год у пациентов с недостаточным контролем бронхиальной астмы на фоне базовой терапии ИГКС (≥ 800 мкг будесонида/сутки или эквивалентная доза другого лекарственного препарата) и бета-агониста длительного действия дополнительное назначение СПИРИВА РЕСПИМАТ приводило к клинически достоверному улучшению легочной функции по сравнению с плацебо.
На 24 неделе среднее повышение пиковой скорости выдоха и глубины ОФВ1 составило 0,110 л (95% ДИ: 0,063-0,158 л, р <0,0001) и 0,093 литра (95% ДИ: 0,050-0,137 л, р <0,0001) соответственно. Улучшение функции легких по сравнению с плацебо сохранялось в течение 24 часов.
В PrimoTinA-исследованиях бронхиальной астмы лечение пациентов с симптомами (N =453) ИГКС совместно с бета-агонистом длительного действия и тиотропием снижает риск развития тяжелых обострений астмы на 21% по сравнению с лечением пациентов (N =454) ИГКС совместно с бета-агонистом длительного действия и плацебо. Снижение числа тяжелых обострений астмы/пациент/год в среднем составило 20%.
Описанная терапия привела также к сокращению риска ухудшения течения бронхиальной астмы на 31% и снижению числа ухудшений течения астмы/пациент/год в среднем на 24% (см. таблицу 2).
Таблица 2 Обострения у пациентов с симптомами бронхиальной астмы на фоне приема ИГКС (≥ 800 мкг будесонида/сутки или эквивалентная доза другого лекарственного препарата) и бета-агониста длительного действия (PrimoTinA — исследования бронхиальной астмы)
| Исследование | Конечная точка | СПИРИВА РЕСПИМАТ дополнительно к ИГКСа и бета-агонисту длительного действия (N =453) | Плацебо дополнительно к ИГКСа и бета-агонисту длительного действия (N =454) | Снижение риска, % (95% ДИ) | Р-значение |
| Два исследования III | Количество дней до | 282c | 226c | 21b (0, 38) | 0,0343 |
| фазы продолжительностью 1 год, объединенный анализ | первого тяжелого обострения астмы | ||||
| Среднее количество тяжелых обострений астмы/ пациента/год | 0,530 | 0,663 | 20d (0, 36) | 0,0458 | |
| Количество дней до первого ухудшения течения астмы | 315c | 181c | 31b (18, 42) | <0,0001 | |
| Среднее количество ухудшений течения астмы/пациента/год | 2,145 | 2,835 | 24d (9, 37) | 0,0031 |
а ≥ 800 мкг будесонида/сутки или эквивалентная доза другого лекарственного препарата
b Отношение рисков, доверительный интервал и p-значение получены в модели пропорциональных рисков Кокса с учетом терапии в качестве эффекта. Процент снижения риска =100 (1 — отношение рисков).
с Время до первого явления: количество дней терапии до появления у 25%/50% пациентов по крайней мере одного тяжелого обострения бронхиальной астмы/ухудшения течения бронхиальной астмы.
d Относительный риск получен при использовании регрессии Пуассона с LOG экспозицией (в годах) в качестве смещения. Процент снижения риска =100(1 — относительный риск).
Дети
Бронхиальная астма
Все исследования программы клинических исследований III фазы в отношении персистирующей астмы у пациентов детского возраста (1-17 лет) являлись рандомизироваными, двойными слепыми и плацебо-контролируемыми. Все пациенты получали фоновую терапию, включающую применение ИГКС.
Тяжелая бронхиальная астма
Подростки (12-17 лет)
В 12-недельном исследовании PensieTinA-asthma принимали участие 392 пациента (130 пациентов получали СПИРИВА РЕСПИМАТ), у которых сохранялись симптомы на фоне приема высоких доз ИГКС в комбинации с одним препаратом базисной терапии или средних доз ИГКС в комбинации с двумя препаратами базисной терапии.
Для пациентов в возрасте 12-17 лет высокая доза ИГКС определялась как доза > 800-1600 мкг будесонида/сутки или эквивалентные дозы другого лекарственного препарата; средняя доза ИГКС — как 400-800 мкг будесонида/сутки или эквивалентные дозы другого лекарственного препарата. Кроме того, пациенты в возрасте 12-14 лет могли получать дозу ИГКС > 400 мкг будесонида/сутки или эквивалентные дозы другого лекарственного препарата и минимально один препарат базисной терапии или 200 мкг будесонида/сутки или эквивалентные дозы другого лекарственного препарата и минимально два препарата базисной терапии.
В данном исследовании применение СПИРИВА РЕСПИМАТ привело к улучшению легочной функции по сравнению с плацебо при использовании в качестве дополнения к фоновой терапии, однако различия между пиковым и минимальным ОФВ1 не были статистически достоверными.
На 12 неделе среднее повышение пикового и минимального ОФВ1 составило 0,090 литра (95% ДИ: -0,019-0,198 литра, р =0,1039) и 0,054 литра (95% ДИ: — 0,061-0,168 литра, р =0,3605) соответственно.
На 12 неделе лекарственный препарат СПИРИВА РЕСПИМАТ значительно улучшал максимальную скорость выдоха, измеряемую в утреннее и вечернее время (утром — 17,4 л/мин.; 95% ДИ: 5,1-29,6 л/мин.; вечером — 17,6 л/мин.; 95% ДИ: 5,9-29,6 л/мин.).
Дети (6-11 лет)
В 12-недельном исследовании VivaTinA-asthma принимали участие 400 пациентов (130 пациентов получали СПИРИВА РЕСПИМАТ), у которых сохранялись симптомы на фоне приема высоких доз ИГКС в комбинации с одним препаратом базисной терапии или средних доз ИГКС в комбинации с двумя препаратами базисной терапии. Высокая доза ИГКС определялась как доза > 400 мкг будесонида/сутки или эквивалентные дозы другого лекарственного препарата, средняя доза ИГКС — как 200-400 мкг будесонида/сутки или эквивалентные дозы другого лекарственного препарата.
В данном исследовании применение СПИРИВА РЕСПИМАТ привело к значительному улучшению легочной функции по сравнению с плацебо при использовании в качестве дополнения к фоновой терапии.
На 12 неделе среднее повышение пикового и минимального ОФВ1 составило 0,139 литра (95% ДИ: 0,075-0,203 литра, р <0,0001) и 0,087 литра (95% ДИ: 0,019-0,154 литра, р =0,0117) соответственно.
Бронхиальная астма средней тяжести
Подростки (12-17 лет)
В 1-летнем исследовании RubaTinA-asthma принимали участие 397 пациентов (134 пациента получали СПИРИВА РЕСПИМАТ), у которых сохранялись симптомы на фоне приема средних доз ИГКС (200-800 мкг будесонида/сутки или эквивалентные дозы другого лекарственного препарата для пациентов в возрасте 12-14 лет или 400-800 мкг будесонида/сутки или эквивалентные дозы другого лекарственного препарата для пациентов в возрасте 15-17 лет). Применение СПИРИВА РЕСПИМАТ привело к значительному улучшению легочной функции по сравнению с плацебо при использовании в качестве дополнения к фоновой терапии.
Дети (6-11 лет)
В 1-летнем исследовании CanoTinA-asthma принимали участие 401 пациент (135 пациентов получали СПИРИВА РЕСПИМАТ), у которых сохранялись симптомы на фоне приема средних доз ИГКС (200-400 мкг будесонида/сутки или эквивалентные дозы другого лекарственного препарата). Применение СПИРИВА РЕСПИМАТ привело к значительному улучшению легочной функции по сравнению с плацебо при использовании в качестве дополнения к фоновой терапии.
Дети (1-5 лет)
Одно 12-недельное рандомизированное двойное слепое плацебо-контролируемое клиническое исследование II/III фазы (NinoTinA-asthma) было проведено с участием 101 ребенка (31 получал СПИРИВА РЕСПИМАТ) с бронхиальной астмой на фоне терапии ИГКС. У 98 пациентов для введения исследуемого лекарственного препарата использовался ингалятор с лицевой маской Aerochamber Plus Flow-Vu®.
Основная задача исследования заключалась в оценке безопасности; оценка эффективности носила экспериментальный характер.
Количество и процентное содержание пациентов, сообщивших о нежелательных явлениях, независимо от наличия взаимосвязи, представлены в таблице 3. Количество нежелательных явлений при бронхиальной астме в группе СПИРИВА РЕСПИМАТ было ниже по сравнению с группой плацебо. Экспериментальная оценка эффективности не показала различий между лекарственным препаратом СПИРИВА РЕСПИМАТ и плацебо.
Таблица 3 Количество пациентов с нежелательными явлениями, сообщенными для ≥ 5 пациентов в исследовании NinoTinA-asthma (дети в возрасте от 1 до 5 лет)
| N, группа плацебо (%) | N, СПИРИВА РЕСПИМАТ (%) | |
| Количество пациентов | 34(100,0) | 31 (100,0) |
| Пациенты, у которых выявлено любое нежелательное явление | 25 (73,5) | 18(58,1) |
| Назофарингит | 5 (14,7) | 2 (6,5) |
| Инфекция верхних дыхательных путей | 1 (2,9) | 5(16,1) |
| Бронхиальная астма* | 10 (29,4) | 2 (6,5) |
| Лихорадка | 6(17,6) | 3 (9,7) |
* Термины низкого уровня словаря MedDRA под предпочтительным термином «Бронхиальная астма» включали либо «Обострившаяся астма», либо «Обострение астмы».
Клиническая эффективность и безопасность при муковисцидозе
Программа клинических исследований при муковисцидозе включала 3 многоцентровых исследования с участием 959 пациентов в возрасте от 5 месяцев и старше. Для пациентов младше 5 лет использовался ингалятор с лицевой маской (AeroChamber Plus®). Эти пациенты были включены в исследование только для оценки безопасности. В двух базовых исследованиях (исследование выбора оптимального режима дозирования II фазы и подтверждающее исследование III фазы) сравнивался эффект на функцию легких (процент предполагаемого ОФВ1 AUC0-4ч и минимального ОФВ1) СПИРИВА РЕСПИМАТ (тиотропий 5 мкг: 469 пациентов) по сравнению с плацебо (315 пациентов) в рандомизированных двойных слепых периодах продолжительностью 12 недель. Исследование III фазы также включало долгосрочное немаскированное продление терапии до 12 месяцев приема препарата. В этих исследованиях в качестве сопутствующей терапии были разрешены все препараты, влияющие на дыхательную систему, за исключением антихолинергических, например, бета-агонисты длительного действия, муколитики и антибиотики.
Эффект на функцию легких представлен в таблице 4. Не выявлено достоверного улучшения симптомов и состояния здоровья (оценка обострений проводилась по опроснику респираторных и системных симптомов и качества жизни — по опроснику для муковисцидоза).
Таблица 4 Скорректированная средняя разница с плацебо для абсолютных изменений от исходного уровня после 12 недель
| II фаза | III фаза | |||||
| Все пациенты (Nспирива= 176,Nплацебо= 168) | Все пациенты(Nспирива= 293,Nплацебо= 147) | ≤ 11 лет(Nспирива= 95, Nплацебо= 47) | ≥ 12 лет(Nспирива= 198, Nплацебо= 100) | |||
| Среднее (95% ДИ) | р- значение | Среднее (95% ДИ) | р- значение | Среднее (95% ДИ) | Среднее (95% ДИ) | |
| ОФВ1 AUC0-4ч (предполагаемый %)а абсолютные изменения | 3,39 (1,67; 5,12) | <0,001 | 1,64 (-0,27; 3,55) | 0,092 | -0,63 (-4,53; 3,32) | 2,58 (0,50; 4,65) |
| ОФВ1 AUC0-4ч (литры) абсолютные изменения | 0,09 (0,05; 0,14) | <0,001 | 0,07 (0,02; 0,12) | 0,010 | 0,01 (-0,07; 0,08) | 0,10 (0,03; 0,17) |
| МинимальныйОФВ1 (предполагаемый%)а абсолютные изменения | 2,22 (0,38; 4,06) | 0,018 | 1,40 (-0,50; 3,30) | 0,150 | -1,24 (-5,20; -271) | 2,56 (0,49; 4,62) |
| МинимальныйОФВ1 (литры) абсолютные изменения | 0,06 (0,01; 0,11) | 0,028 | 0,07 (0,02; 0,12) | 0,012 | -0,01 (-0,08; 0,06) | 0,10 (0,03; 0,17) |
а Составные первичные конечные точки.
Все нежелательные явления, наблюдавшиеся в исследованиях у пациентов с муковисцидозом, являются известными нежелательными реакциями тиотропия (см. раздел «Побочное действие»). Наиболее часто наблюдаемыми нежелательными реакциями в течение 12 недель двойного слепого периода были кашель (4,1%) и сухость во рту (2,8%).
Количество и процент пациентов, у которых зарегистрированы нежелательные явления, представляющие особый интерес при муковисцидозе, независимо от их взаимосвязи с приемом препарата, представлены в таблице 5. При использовании тиотропия наблюдалось усиление, хотя и не достоверное, признаков и симптомов, относящихся к проявлениям муковисцидоза, особенно у пациентов 211 лет.
Таблица 5 Процентное содержание пациентов с нежелательными явлениями, представляющих особый интерес при муковисцидозе, по возрастным группам, при приеме в течение более 12 недель, независимо от оценки взаимосвязи с приемом препарата (объединенные данные II и III фаз исследования)
| ≤ 11 лет | ≥ 12 лет | |||
| Nплацебо = 96 | Nспирива = 158 | Nплацебо = 215 | Nспирива = 307 | |
| Боль в животе | 7,3 | 7,0 | 5,1 | 6,2 |
| Запор | 1,0 | 1,9 | 2,3 | 2,6 |
| Синдром обструкции дистальных отделов кишечника | 0,0 | 0,0 | 1,4 | 1,3 |
| Инфекции дыхательных путей | 34,4 | 36,7 | 28,4 | 28,3 |
| Повышение вязкости мокроты | 1,0 | 5,1 | 5,6 | 6,2 |
| Обострение | 10,4 | 14,6 | 18,6 | 17,9 |
«Синдром обструкции дистальных отделов кишечника» и «Повышение вязкости мокроты» являются предпочтительными терминами согласно MedDRA. «Инфекции дыхательных путей» является MedDRA групповым термином высокого уровня. «Боль в животе», «Запор» и «Обострение» являются собирательными предпочтительными терминами MedDRA.
У 34 (10,9%) пациентов, рандомизированных в группу плацебо, и 56 (12,0%) пациентов, рандомизированных в группу СПИРИВА РЕСПИМАТ, были зарегистрированы серьезные нежелательные явления.
Фармакокинетика
Общие сведения
Тиотропия бромид является нехиральным четвертичным аммониевым соединением, плохо растворимым в воде. Тиотропия бромид может применяться в виде раствора для ингаляций, вводимого при помощи ингалятора РЕСПИМАТ. Примерно 40% ингалируемой дозы достигает легких, которые являются органом-мишенью; оставшееся количество попадает в желудочно-кишечный тракт. Некоторые из фармакокинетических данных, описанных ниже, были получены при использовании более высоких доз, чем рекомендуемые для лечения.
Общие характеристики действующего вещества после применения лекарственного препарата
Абсорбция
После ингаляции у молодых здоровых добровольцев данные экскреции с мочой показывают, что примерно 33% ингалируемой дозы достигает системного кровотока. Абсолютная биодоступность пероральных растворов тиотропия бромида составляет 2-3%. Не ожидается, что прием пищи повлияет на абсорбцию этого четвертичного аммониевого соединения.
Максимальные концентрации тиотропия в плазме крови наблюдаются через 5-7 минут после ингаляции.
В равновесном состоянии максимальная концентрация тиотропия в плазме крови у пациентов с ХОБЛ составила 10,5 пг/мл с быстрым снижением в соответствии с многокамерной моделью. Равновесная остаточная концентрация в плазме крови составила 1,60 пг/мл.
Равновесная максимальная концентрация тиотропия в плазме крови 5,15 пг/мл достигалась через 5 минут после введения такой же дозы пациентам с бронхиальной астмой.
Системная экспозиция тиотропия после ингаляции через ингалятор РЕСПИМАТ была сходна с экспозицией после ингаляции через ингалятор ХандиХалер.
Распределение
Препарат связывается с белками плазмы крови на 72%, объем распределения составляет 32 л/кг. Локальная концентрация в легких неизвестна, но путь введения предполагает существенно более высокие концентрации препарата в легких. Исследования на крысах показали, что тиотропия бромид не проникает через гематоэнцефалический барьер даже в минимальных количествах.
Биотрансформация
Степень биотрансформации незначительна. Это подтверждается тем, что после внутривенного введения препарата молодым здоровым добровольцам в моче обнаруживается 74% тиотропия бромида в неизмененном виде. Тиотропия бромид является эфиром, который неферментативно распадается до спирта (N-метилскопин) и дитиенилгликолиевой кислоты; эти соединения не оказывают влияния на мускариновые рецепторы. В исследованиях in vitro на культуре клеток гепатоцитов человека и микросомах печени человека показано, что некоторая часть препарата (< 20% дозы после внутривенного введения) метаболизируется путем окисления цитохромом Р450 с последующей конъюгацией с глютатионом и образованием различных метаболитов во II фазе биотрансформации. Исследования in vitro на микросомах печени человека свидетельствует о том, что ферментативный путь метаболизма может тормозиться ингибиторами изоферментов CYP 2D6 (и 3А4), хинидином, кетоконазолом и гестоденом. Таким образом, CYP 2D6 и 3А4 участвуют в метаболизме тиотропия бромида и отвечают за элиминацию небольшой части препарата. Тиотропия бромид даже в сверхтерапевтических концентрациях не ингибирует изоферменты цитохрома Р450 1А1, 1А2, 2В6, 2С9, 2С19, 2D6, 2Е1 или 3А в микросомах печени человека.
Элиминация
Эффективный период полувыведения тиотропия составляет 27-45 часов после ингаляции у здоровых добровольцев и пациентов с ХОБЛ. У пациентов с бронхиальной астмой эффективный период полувыведения после ингаляции составляет 34 часа.
Общий клиренс после внутривенного введения препарата молодым здоровым добровольцам составлял 880 мл/мин. Внутривенно введенный тиотропий выводится, в основном, почками в неизмененном виде (74%).
После ингаляции раствора у пациентов с ХОБЛ почечная экскреция в стационарном состоянии составляет 18,6% (0,93 мкг) дозы, оставшаяся неабсорбировавшаяся часть выводится через кишечник. После ингаляции раствора у здоровых добровольцев почечная экскреция составляет 20,1-29,4% дозы, оставшаяся неабсорбировавшаяся часть выводится через кишечник. В стадии фармакокинетического равновесия у пациентов с бронхиальной астмой 11,9% (0,595 мкг) дозы выводится в неизмененном виде с мочой через 24 часа после приема препарата. Почечный клиренс тиотропия превышает клиренс креатинина, что подтверждает выведение препарата с мочой.
При регулярном ингаляционном применении тиотропия один раз в сутки у пациентов с ХОБЛ фармакокинетическое стационарное состояние достигалось на 7-й день без признаков кумуляции в последующий период.
Линейность/нелинейность фармакокинетики
Тиотропия бромид демонстрирует линейную фармакокинетику в терапевтических дозах независимо от лекарственной формы.
Характеристика отдельных групп пациентов
Пожилые пациенты
Как и для всех других лекарственных препаратов с преимущественно почечной экскрецией препарата увеличение возраста пациента ассоциировалось со снижением почечного клиренса тиотропия (с 347 мл/мин. у пациентов с ХОБЛ в возрасте <65 до 275 мл/мин. у пациентов с ХОБЛ £65 лет). Это не вызывало соответствующих повышений значений AUC0-6,ss или Cmax,ss. У пациентов с бронхиальной астмой экспозиция тиотропия не зависела от возраста.
Нарушения функции почек
После ингаляционного применения тиотропия один раз в сутки в период стационарного состояния фармакокинетики у пациентов с ХОБЛ и легким нарушением функции почек (КК 50-80 мл/мин.) наблюдалось незначительное увеличение AUC0-6,ss (на 1,8-30%) и аналогично значений Cmax,ss по сравнению с пациентами с нормальной функцией почек (КК >80 мл/мин.).
У пациентов с ХОБЛ и средним или тяжелым нарушением функции почек (КК < 50 мл/мин.) внутривенное введение тиотропия привело к двукратному увеличению общей экспозиции (значение AUC0-4ч увеличивалось на 82%, а Cmax на 52%) по сравнению с пациентами с ХОБЛ и нормальной функцией почек, что подтверждалось концентрацией в плазме крови после ингаляции сухого порошка. У пациентов с бронхиальной астмой и легким нарушением функции почек (КК 50-80 мл/мин.) ингаляционное введение тиотропия не приводило к соответствующему увеличению экспозиции в сравнении с пациентами с нормальной функцией почек.
Нарушения функции печени
Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокинетику тиотропия. Тиотропий выводится преимущественно почками (74% у молодых здоровых добровольцев) и метаболизируется простым неферментативным расщеплением эфира до фармакологически неактивных метаболитов.
Пациенты японской национальности с ХОБЛ
В перекрестном сравнительном исследовании средние пиковые концентрации тиотропия в плазме крови через 10 минут после ингаляционного введения препарата в стационарном состоянии были от 20% до 70% выше у пациентов с ХОБЛ в японской популяции по сравнению с европеоидной расой, однако признаков более высокой смертности или кардиологического риска у пациентов японской национальности по сравнению с европеоидными пациентами не выявлено. Данных по фармакокинетике для других народов или рас недостаточно.
Дети
Бронхиальная астма
Максимальная и общая (AUC и выведение с мочой) экспозиция тиотропия у пациентов с бронхиальной астмой в возрасте 6-11 лет, 12-17 лет и ≥ 18 лет является сопоставимой. Исходя из значений выведения с мочой общая экспозиция тиотропия у пациентов в возрасте 1-5 лет была на 52-60% ниже, чем в других более старших возрастных группах. Было установлено, что общая экспозиция, скорректированная с учетом площади поверхности тела, была сопоставима во всех возрастных группах. СПИРИВА РЕСПИМАТ у пациентов в возрасте 1-5 лет вводился с использованием ингалятора с лицевой маской.
ХОБЛ
Исследования с участием детей с ХОБЛ не проводились.
Муковисцидоз
После ингаляции 5 мкг тиотропия его концентрация в плазме крови у пациентов с муковисцидозом в возрасте 5 лет и старше в равновесном состоянии через 5 минут после введения дозы составила 10,1 пг/мл с последующим быстрым снижением. Биодоступность препарата у пациентов с муковисцидозом в возрасте менее 5 лет, у которых использовался ингалятор с маской, была примерно в 3-4 раза ниже, чем у пациентов с муковисцидозом в возрасте 5 лет и старше. Экспозиция тиотропия у пациентов с муковисцидозом в возрасте менее 5 лет зависела от массы тела.
Фармакокинетические/фармакодинамические взаимосвязи
Прямая зависимость между фармакокинетикой и фармакодинамикой отсутствует.

Аналоги Спирива респимат
Товары из категории — Препараты от болезней легких
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 2 021
Немного фактов
Бронхиальная астма и хроническая обструктивная болезнь легких являются одними из самых тяжелых заболеваний дыхательных путей.
Бронхиальная астма – хронический воспалительный процесс, который проявляется приступообразным кашлем, одышкой и возможными приступами удушья.
Хронический воспалительный процесс приводит чрезмерной реакции дыхательных путей на различные раздражители, сосуды бронхов сужаются, спазмируются и производят большое количество слизи, это не дает возможности для нормального тока воздуха при вдохе.
Причинами возникновения бронхиальной астмы в первую очередь считаются различные аллергены в среде, окружающей нас. Это и различные пищевые добавки, парфюмерия и моющие средства, строительная пыль, различные лекарственные вещества.
Однако кроме аллергических компонентов бронхиальную астму
могут вызывать и неврологические раздражители: стресс, умственное перенапряжение, физическая перезагрузка. А также различные вирусные и бактериальные инфекции, которые вызывают хронические воспалительные процессы в бронхах.
Хроническая обструктивная болезнь легких имеет воспалительный характер и возникает обычно при длительном воздействии неблагоприятных факторов на организм человека. Чаще всего таким фактором является табакокурение. При долговременном течении воспалительного процесса в бронхах и бронхиолах происходят патологические изменения, что приводит к затрудненному дыханию, кашлю, одышке.
Чаще всего, хроническое обструктивное заболевание легких представляет собой сочетание двух болезней: хронического бронхита — воспаления слизистых оболочек бронхов, при котором сужаются просветы дыхательных путей. И эмфиземы, вследствие которой альвеолярные стенки становятся неэластичными, и происходит уменьшение площади легких.
Из-за того, что объем легких уменьшен и дыхательные пути обладают меньшей пропускной способностью, нарушается процесс газообмена. Организм не может получить нужное количество кислорода и избавиться от лишнего углекислого газа. Это приводит к утяжелению негативных проявлений болезни.
Основной целью лечения этих двух заболеваний является достижение стойкой клинической ремиссии, которое достигается с помощью лекарственных средств. Одним из таких лекарств является Спирива респимат.
Фармакологические свойства
Основным действующим веществом медицинского средства Спирива респимат является бромид тиотропия, относящийся к группе м-холиноблокаторов, оказывающих длительное положительное воздействие при лечении патологий проводимости в бронхах при хроническом обструктивном заболевании легких. Данное вещество обладает свойством ингибирования ацетилхолиновых мускариновых рецепторов, осуществляющих нервно-мышечную передачу, что обуславливает быстрый сосудорасширяющий эффект после ингаляционного использования медицинского средства. Длительность положительной динамики у пациентов с заболеваниями хронической обструкции легких сохраняется на протяжении двадцати четырех часов с момента проведения ингаляции. Поскольку действие активного вещества является местным, негативные проявления побочных эффектов минимальны.
Положительный эффект от воздействия лекарственного средства Спирива респимат достигается на протяжении семи дней и значительно улучшает скорость выдыхаемого воздуха, а также остается неизменным на протяжении двенадцати месяцев, не вызывая привыкания. За этот период у пациентов уменьшается проявление одышки, значительно повышается физическая активность и улучшается качество жизни. Также использование описываемого активного вещества снижает количество возможных острых приступов хронической обструктивной болезни легких, и в связи с этим значительно уменьшает количество госпитализаций в медицинские учреждения.
Показания к использованию
Лекарственное средство Спирива респимат применяется в следующих случаях:
• При проведении длительной поддерживающей терапии лиц, имеющих в анамнезе хроническую обструктивную болезнь легких, хроническое воспаление слизистой бронхов, а также заболевания дыхательной системы, при которых расширяются пространства дистальных альвеол и возникают патологические изменения стенок альвеол (эмфизема легких).
• Как поддерживающая и улучшающая качество жизни терапия при заболевании бронхиальная астма, в случае сохранения негативных проявлений, несмотря на проводимое лечение другими средствами.
Противопоказания
Противопоказаниями для проведения терапевтического курса ингаляций средством Спирива респимат являются:
— Наличие у пациента индивидуальной непереносимости или чувствительности к веществам, входящим в состав лекарства.
— Детский возраст пациента (до восемнадцати лет). Поскольку не проводились клинические исследования, указывающие на безопасность и эффективность активного вещества, применительно к детскому возрасту.
С осторожностью необходимо использовать процедуры ингаляции у пациентов имеющих гиперплазические патологии простаты, непроходимость мочевого пузыря и при глаукоме закрытоугольного типа.
Способ использования и дозировка
Медицинское средство Спирива респимат предназначается исключительно для проведения ингаляционных процедур в устройстве респимат. Одной порцией (дозой) введения лекарства считается два вдоха через ингалятор.
Стандартной дозировкой является количество активного вещества, равное 5 мкг.
В случае заболевания бронхиальной астмой эффективность лекарства ощущается после нескольких процедур.
До начала проведения терапевтического курса лекарственным раствором Спирива респимат необходимо внимательное изучение правил использования механизма для введения активного вещества. Аппарат подлежит к применению один раз в день, по две процедуры, и рассчитан на шестьдесят использований, то есть на 30 суток работы. Показания индикатора изменяются с количеством использованных доз, при указании на красную область, индикатор сообщает, что оставшееся количество активного вещества около четырнадцати доз. При достижении окончания шкалы вещество в ингаляторе заканчивается это значит, что следует брать новый аппарат.
В случае если вещество в ингаляторе не было израсходовано в трехмесячный промежуток времени, дальнейшее использование механизма запрещено и подлежит утилизации.
Стандартная дозировка препарата – двухразовая ингаляционная процедура один раз в день, желательно проведение ровно через 24 часа.
Передозировка
Поскольку маловероятно проглатывание большого количества активного вещества, возможность возникновения передозировки исключена. Однако если медицинское средство использовалось более чем один раз в день, возможно усиление побочных эффектов, описанных ниже. В этом случае следует обратиться за консультацией к лечащему врачу.
Симптомы эффектов побочного действия
При использовании лекарственного средства Спирива респимат возможно возникновение следующих негативных проявлений.
Обмен веществ.
— Возможно обезвоживание организма.
Нервная система.
— Редко: состояние головокружения и расстройства сна.
Зрительный аппарат.
— Редко: увеличение давления внутри глаз, возникновение глаукомы, расстройства четкости зрения.
Сердце и сосудистая система.
— Редко: нарушение сердечного ритма (включая мерцательную аритмию), учащение сердцебиения.
Дыхательная система.
— Редко: возникновение кашля, кровотечение из носа, воспалительные процессы на слизистых оболочках верхних дыхательных путей и горла, расстройства голосовой функции, проявление парадоксального бронхоспазма.
Пищеварительная система.
— Часто: ощущение сухости слизистой оболочки горла и ротовой полости.
— Редко: воспалительные процессы на деснах, расстройства пищеварения (включая дисфагию), возникновение кишечной непроходимости (включая паралитическую).
Кожные покровы.
— Редко: возможно возникновение различных кожных инфекций и изъязвления, состояние сухости кожных покровов.
Иммунная система.
— Редко: сыпные реакции, зуд, покраснение кожных покровов, отек Квинке. Возникновение аллергических проявлений немедленного типа.
Опорно-двигательный аппарат.
— Возможно возникновение отечности в суставной области.
Мочевыделительная система.
— Возникновение расстройств мочеиспускания, инфекционные заболевания мочеполовой системы
Данная инструкция по применению не может описать все негативные симптомы, которые могут возникать при использовании лекарственного средства Спирива респимат. Поэтому при любом дискомфортном ощущении следует сообщать лечащему врачу.
Особенности использования
Лекарственное средство Спирива респимат используется для бронходилатирующего эффекта один раз в день.
Не рекомендуется употребление лекарства для купирования острых бронхоспазматических приступов.
Для терапевтического применения при бронхиальной астме не рекомендуется употреблять описываемое вещество как препарат первой линии. Обычное использование происходит на фоне терапевтического курса противовоспалительными средствами.
Пациент должен быть предупрежден о возможном развитии немедленных аллергических реакций во время произведения процедуры ингаляции. Также в редких случаях возможно проявление симптомов острого бронхоспазма.
В случае патологических изменений почек, при клиренсе креатинина менее 50 мл/мин, проведение процедуры требует тщательного наблюдения.
Для назначения лекарственного вещества лицам, не достигшим сорокалетнего возраста, требуется подтвердить наличие в анамнезе хронической обструктивной болезни.
Если в анамнезе присутствует закрытоугольная глаукома, необходимо назначать описываемое активное вещество с большой осторожностью. Больной должен быть предупрежден о возможности проявления возможных острых приступов этой болезни при проведении процедур описываемым лекарством. При негативных проявлениях зрительных расстройств требуется немедленно сообщить о них лечащему врачу.
С особой осторожностью требуется назначать лекарство, и проводить ингаляции при наличии у больного симптомов расстройств мочевыведения и задержки мочеиспускания.
При проявлении негативных симптомов со стороны сердца и сосудистой системы необходимо прекратить процедуру и сообщить о своих ощущениях лечащему врачу.
Нет рекомендаций по уменьшению или увеличению дозировки лекарственного средства для пациентов пожилого возраста.
Лекарственное взаимодействие
Не рекомендовано одновременное использование лекарственного средства Спирива респимат с веществами, обладающими ингибирующими свойствами по отношению к м-холинам.
Комбинированная терапия совместно с бронходилаторными средствами, глюкокортикостероидами, муколитическими веществами и другими лекарствами возможна.
Использование лекарства в период вынашивания плода и грудного вскармливания
Клинических испытаний медицинского средства Спирива респимат в период беременности не проводилось. Поэтому не рекомендуется использовать описываемое вещество для терапии во время вынашивания плода. Если существует серьезная необходимость проведения процедур, решение об использовании средства принимает врач.
Поскольку на сегодняшний день не существуют данные об испытаниях лекарства во время грудного вскармливания, не рекомендуется использовать в этот период ингаляционный раствор Спирива респимат.
Управление различными видами транспорта в период проведения терапевтического курса
Поскольку во время использования описываемого медицинского средства могут проявляться негативные симптомы в виде головокружения и нарушения зрения, следует с особой осторожностью управлять автомобилем и другими видами транспорта. А также проводить работы, требующие особого внимания на концентрации.
Взаимодействие с алкоголем
На сегодняшний день нет данных о возможности употребления напитков, содержащих в своем составе алкоголь, во время проведения терапевтического курса лекарством Спирива респимат. В связи с этим желательно ограничить употребление таких напитков.
Инструкция по хранению
Требования к хранению медицинского средства Спирива респимат предписывают температурный режим до двадцати пяти градусов тепла. Средство необходимо сохранять в производственной упаковке в местах, недоступных детям и животным. При соблюдении инструкции хранения, срок годности составляет тридцать шесть месяцев. По истечению этого периода лекарство нельзя использовать и необходимо утилизировать.
Продажа в аптечной сети
Лекарственное средство Спирива респимат можно приобрести в аптечных магазинах по предъявлению рецепта от врача.
Цены на Спирива респимат в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 2 021 руб.
Сертификаты и лицензии
Фармакологические .
Механизм действия
Тиотропия бромид является специфическим антагонистом мускариновых рецепторов длительного действия. Тиотропий имеет подобную родство с подтипами рецепторов от М 1 до М 5 . В дыхательных путях тиотропия бромид конкурентно и обратимо связывается с М 3 рецепторами бронхиальной гладкой мускулатуры, противодействуя холинергическая (бронхозвужувальному) влияния ацетилхолина, что приводит к расслаблению бронхиальных гладких мышц. Эффект был дозозависимым и длился более 24 часов. Поскольку тиотропий является бронхоселективним N-четвертичным антихолинергиком, при ингаляционном применении он демонстрирует приемлемый терапевтический диапазон до появления системных антихолинергических эффектов.
фармакодинамические эффекты
Диссоциация тиотропия бромида, особенно с М 3 рецепторов, является медленной. При этом период полувыведения значительно длиннее чем в ипратропия. Диссоциация с M 2 рецепторов является быстрой, чем с M 3, что в функциональных исследованиях in vitro выявило большую селективность (кинетически контролируемую) до субтипа рецептора М 3 , чем М 2 . Было обнаружено, что высокая мощность и медленная диссоциация рецепторов клинически коррелировали со значительной и длительной бронходилатацией у пациентов с ХОЗЛта астмой.
Бронходилатация после ингаляции тиотропия, в первую очередь, является местным эффектом (в дыхательных путях) и не системным.
Клиническая эффективность и безопасность для пациентов с ХОБЛ
Программа клинической разработки III фазы включала два однолетние, два 12-недельные и два 4-недельные рандомизированные двойные слепые исследования с участием 2901 пациента с ХОБЛ (1038 пациентов получали по 5 мкг тиотропия). Однолетняя программа включала два плацебо-контролируемые испытания. Два 12-недельные испытания предусматривали контроль как активным препаратом (ипратропий), так и плацебо. Все шесть исследований предусматривали измерения легочной функции. Кроме того, два однолетние исследования включали определение частоты одышки, оценку качества жизни, связанной со здоровьем, и оценку влияния на частоту обострений.
Плацебо-контролируемые исследования. легочная функция
Тиотропия раствор для ингаляции, который вводили 1 раз в сутки, обеспечил существенное улучшение легочной функции (объем форсированного выдоха за одну секунду и форсированная жизненная емкость легких) в течение 30 минут после первой дозы по сравнению с плацебо (среднее улучшение ОФВ 1 через 30 минут: 0,113 литра; 95% доверительный интервал (ДИ) от 0,102 до 0,125 литра, p <0,0001). Улучшение легочной функции сохранялось в течение 24 часов в стабильном состоянии по сравнению с плацебо (среднее улучшение ОФВ 1 : 0,122 литра; 95% ДИ: от 0,106 до 0,138 литра, p <0,0001).
Фармакодинамически стабильное состояние был достигнут за одну неделю.
Спиривы РЕСПИМАТ существенно улучшила показатель утренней и вечерней максимальной объемной скорости выдоха в соответствии с ежедневных измерений пациентом по сравнению с плацебо (среднее улучшение максимальной объемной скорости выдоха: среднее улучшение утром на 22 л / мин; 95% ДИ: от 18 до 55 л / мин, p <0,0001; вечером на 26 л / мин; 95% ДИ от 23 до 30 л / мин, p <0,0001). Применение препарата Спиривы РЕСПИМАТ привело к снижению частоты применения бронходилататоров для неотложной помощи по сравнению с плацебо (среднее снижение частоты применения препаратов для неотложной помощи на 0,66 случае в сутки, 95% ДИ: от 0,51 до 0,81 случая на сутки, p <0,0001).
Бронходилатирующим эффект препарата Спиривы РЕСПИМАТ сохранялся на протяжении всего периода в применение без признаков непереносимости.
Одышка, качество жизни связана со здоровьем, обострение ХОБЛ в долгосрочных 1 годовых исследованиях.
Одышка. Спиривы РЕСПИМАТ существенно снизила частоту возникновения одышки (по оценке на основе индекса транзиторной одышки) по сравнению с плацебо (среднее улучшение на 1,05 балла; 95% ДИ от 0,73 до 1,38 балла, p <0,0001). Улучшение продолжалось в течение всего периода лечения.
Качество жизни, связанное со здоровьем Улучшение средней общей оценки пациентами качества жизни (измеренной на основе анкеты Госпиталя Святого Георгия для оценки дыхательной функции) при приеме препарата Спиривы РЕСПИМАТ сравнению с плацебо по результатам двух однолетних исследований на 3,5 балла (95 % ДИ от 2,1 до 4,9, p <0,0001). Снижение на 4 балла считается клинически значимым.
обострения ХОБЛ
Результаты трех годовалых рандомизированных двойных слепых плацебо-контролируемых клинических испытаний лечения Спиривы РЕСПИМАТ продемонстрировали существенное снижение риска обострения ХОБЛ по сравнению с плацебо. Обострения ХОБЛ определяли как комплекс менее двух явлений / симптомов в органах дыхания продолжительностью три дня или более, для которых требуется изменение лечения (назначение антибиотиков и / или системных кортикостероидов и / или существенное изменение назначенных лекарственных средств для лечения органов дыхания). Лечение препаратом Спиривы РЕСПИМАТ привело к снижению риска госпитализации из-за обострения ХОБЛ (значительное снижение риска в крупномасштабном исследовании среди пациентов с обострением).
Результаты совокупного анализа результатов двух испытаний фазы III и отдельного анализа дополнительного исследования среди пациентов с обострением представлены в таблице 1. Все лекарственные средства для органов дыхания, за исключением антихолинергических средств и β-агонистов длительного действия, допускались как сопутствующая терапия, то есть β-агонисты скорой действия, ингаляционные кортикостероиды и ксантини. В исследовании влияния на обострение у пациентов с обострением также допускался прием β-агонистов длительного действия.
Таблица 1
Статистический анализ случаев обострения ХОБЛ и случаев госпитализации из-за обострения ХОБЛ среди пациентов с ХОБЛ от умеренного до очень тяжелой степени
| Исследования (N Спиривы , N плацебо ) | Конечная точка | Спиривы Респимат | плацебо | % Снижения риска (95% ДИ) a |
|
| 1-летние исследования фазы III, совокупный анализ d (670, 653) | Количество дней до первого обострения ХОБЛ | 160 a | 86 a | 29 (от 16 до 40) b | <0,0001 b |
| Средняя частота обострений за один пациенто-год | 0,78 c | 1,00 c | 22 (от 8 до 33) c | 0,002 c | |
| Время до первой госпитализации из-за обострения ХОБЛ | 25 (от -16 до 51) b | 0,20 b | |||
| Средняя частота случаев госпитализации из-за обострения за один пациенто-год | 0,09 c | 0,11 c | 20 (от -4 до +38) c | 0,096 c | |
| 1-летнее исследование фазы IIIb среди пациентов с обострением (1939, 1953) | Дней до первого обострения ХОБЛ | 169 a | 119 a | 31 (от 23 до 37) b | <0,0001 b |
| Средняя частота обострений за один пациенто-год | 0,69 c | 0,87 c | 21 (от 13 до 28) c | <0,0001 c | |
| Время до первой госпитализации из-за обострения ХОБЛ | 27 (от 10 до 41) b | 0,003 b | |||
| Средняя частота случаев госпитализации из-за обострения за один пациенто-год | 0,12 c | 0,15 c | 19 (от 7 до 30) c | 0,004 c |
a Время до первого события: количество дней лечения до того момента, как у 25% пациентов возникнет, по меньшей мере одно обострение ХОБЛ / случай госпитализации из-за обострения ХОБЛ. В исследовании A у 25% пациентов, получавших плацебо, наблюдалось обострение ко дню 112, тогда как у 25% пациентов, получавших препарат Спиривы РЕСПИМАТ, отмечалось обострение ко дню 173 (p = 0,09) в исследовании B у 25% пациентов, получавших плацебо, наблюдалось обострение ко дню 74, тогда как у 25% пациентов, получавших Спиривы РЕСПИМАТ, отмечалось обострение ко дню 149 (p <0,0001).
b Соотношение рисков оценивали на основе модели пропорциональных рисков Кокса. Процентное соотношение снижения риска составляет 100 (1 — соотношение рисков).
c пуассоновский регрессия. Снижение риска составляет 100 (1 — относительный риск).
d Объединение результатов было отмечено при разработке дизайна исследований. Конечные точки оценки обострения значительно улучшились в отдельных анализах результатов двух однолетних исследований.
Клиническая эффективность и безопасность у пациентов с астмой
Клиническая программа III фазы у пациентов с персистирующей астмой включала два 1-летние рандомизированные двойные слепые плацебо-контролируемые исследования с участием 907 пациентов с астмой (453 пациенты, которые получали препарат Спиривы РЕСПИМАТ), которым применяли комбинированное лечение ингаляционным ГКС (ИКС) (≥800 мкг будесонида / сутки или эквивалент) и β-агонистов длительного действия. Исследования включали измерения легочной функции и оценку тяжелых обострений как первичных конечных точек.
Исследование PrimoTinA с участием пациентов с астмой
В двух годовалых исследованиях у пациентов, у которых отмечались симптомы при получении поддерживающего лечения, включавшего крайней мере ИКС (≥800 мкг будесонида / сут или эквивалент) в комбинации с β-агонистов длительного действия, Спиривы РЕСПИМАТ демонстрировала клинически значимое улучшение легочной функции по сравнению с плацебо при применении в комбинации с основным лечением.
На 24 неделе среднее улучшение показателей пикового и минимального ОФВ 1 составляло 0,110 литра (95% ДИ: от 0,063 до 0,158 литра, p <0,0001) и 0,093 литра (95% ДИ: от 0,050 до 0,137 литра, p <0,0001 ) в соответствии. Улучшение функции легких по сравнению с плацебо сохранялось в течение 24 часов.
В исследованиях PrimoTinA у больных с астмой лечение пациентов (N = 453) комбинацией ИКС с β-агонистов длительного действия и тиотропия снизило риск развития тяжелых обострений астмы на 21% по сравнению с лечением пациентов (N = 454) комбинацией ИКС с β-агонистов длительного действия и плацебо. Снижение риска с точки зрения средней частоты тяжелых обострений астмы за один пациенто-год составляло 20%.
Эти результаты подтверждались снижением риска ухудшения астмы на 31% и снижением риска на 24% с точки зрения средней частоты ухудшение астмы за один пациенто-год (см. Таблицу 2).
Таблица 2
Обострение у пациентов, в которых отмечаются симптомы и получавших ИКС (≥800 мкг будесонида / сут или эквивалент) в комбинации с β-агонистов длительного действия (исследование PrimoTinA с участием больных астмой)
| исследование | Конечная точка | Спиривы Респимат, в сочетании с не менее ИКС a / β-агонистов длительного действия (N = 453) | Плацебо в комбинации с по меньшей мере ИКС a / β-агонистов длительного действия (N = 454) | % Снижения риска (95% ДИ) |
|
| Два однолетних исследования фазы III, совокупный анализ | Количество дней до первого серьезного обострения астмы | 282 c | 226 c | 21 b (0, 38) | 0,0343 |
| Среднее количество случаев тяжелых обострений астмы за один пациенто-год | 0,530 | 0,663 | 20 d (0, 36) | 0,0458 | |
| Количество дней до первого ухудшение астмы | 315 c | 181 c | 31 b (18, 42) | <0,0001 | |
| Среднее количество случаев ухудшения астмы за один пациенто-год | 2,145 | 2,835 | 24 d (9, 37) | 0,0031 |
a ≥800 мкг будесонида / сутки или эквивалент.
b Соотношение рисков, доверительный интервал и p-значения, полученные на основе модели пропорциональных рисков Кокса, при учете только лечение как эффекта. Процентное соотношение снижения риска составляет 100 (1 — соотношение рисков).
c Время до первого события: количество дней до лечения до того момента, как в 25% / 50% пациентов возникло по крайней мере одно серьезное обострение астмы / ухудшение астмы.
d Относительный риск был установлен на основе паусонивськои регрессии с использованием логарифмической экспозиции (в годах) как коррекции. Процентное снижение риска составляет 100 (1 — относительный риск).
Пациенты детского возраста
Эффективность и безопасность препарата Спиривы РЕСПИМАТ для детей не устанавливались.
Фармакокинетика.
Тиотропия бромид является нехиральною четвертичным аммониевым соединением, умеренно растворяется в воде. Тиотропия бромид доступен в виде раствора для ингаляций, применяемый с помощью ингалятора РЕСПИМАТ. Примерно 40% дозы ингалюеться, накапливается в легких, а та часть дозы, которая осталась, оседает в желудочно-кишечном тракте. Некоторые фармакокинетические данные, описанные ниже, были получены с помощью высоких доз, чем рекомендовано для терапии.
Абсорбция. Данные мочеиспускания после ингаляции раствора здоровым добровольцам дают возможность предположить, что примерно 33% ингальованои дозы попадает в системный кровоток. Не ожидается влияния пищи на абсорбцию этой четвертичной аммониевой соединения. Биодоступность раствора тиотропия для перорального применения составляет 2-3%. Максимальные концентрации тиотропия в плазме наблюдались через 5-7 минут после ингаляции. При стабильном состоянии максимальный уровень тиотропия в плазме у пациентов с ХОБЛ составил 10,5 и быстро снизился многостадийным образом. Стабильное состояние из-за концентрации в плазме составлял 1,60 пг / мл. Стабильное состояние максимальной концентрации тиотропия в плазме 5,15 пг / мл устанавливался через 5 минут после ингаляционного введения тиотропия с помощью устройства ХендиХейлера.
Системное действие тиотропия после ингаляционного введения последнего с помощью ингалятора РЕСПИМАТ была подобная системной действия тиотропия после ингаляционного введения с помощью устройства ХендиХейлера.
Распределение. Препарат на 72% связывается с белками плазмы, объем распределения составляет 32 л / кг. Локальная концентрация в легких неизвестна, но, исходя из способа применения, допускается высокая концентрация в легких.
Метаболизм. Степень биотрансформации мал. Это видно по выделению с мочой 74% неизмененной субстанции после внутривенного введения здоровым молодым добровольцам. Эфир тиотропия бромида неферментативно распадается до спирта (N-метилскопину) и кислоты (дитиенилгликолевои кислоты), которые не связываются с мускариновыми рецепторами.
Выведение. Величина эффективного периода полураспада тиотропия находится в пределах 27-45 ч после ингаляции у здоровых добровольцев и пациентов с ХОБЛ. Величина эффективного периода полураспада тиотропия составила 34 ч после ингаляции у пациентов с астмой После введения здоровым молодым добровольцам общий клиренс был 880 мл / мин. Тиотропий, введенный внутривенно, выделяется преимущественно с мочой (74%). После ингаляции раствором у пациентов с ХОБЛ к установлению состояния равновесия выделение с мочой составляет 18,6% дозы (0,93 мкг), остаток не абсорбируется кишечником и выводится с калом.
После ингаляции раствором у здоровых добровольцев выделение с мочой составляет 20,1- 29,4% дозы, остаток не абсорбируется кишечником и выводится с калом.
У пациентов с астмой 11,9% (0,595 мкг) дозы выводится в неизмененном виде с мочой в течение более 24 часов после дозы в состоянии равновесия.
Почечный клиренс тиотропия превышает клиренс креатинина, что указывает на выделение в мочу.
После длительного применения ингаляции один раз в день у пациентов с ХОБЛ фармакокинетический состояние равновесия достигался на 7 день без дальнейшей кумуляции.
Линейность / нелинейность. Тиотропий демонстрирует линейные фармакокинетические свойства в терапевтическом диапазоне независимо от фармацевтической формы.
Пациенты пожилого возраста. Как и для всех других лекарственных средств, которые в основном выводятся почками, применение тиотропия у пациентов пожилого возраста связано со снижением его почечного клиренса (347 мл / мин у пациентов с ХОБЛ <65 лет по сравнению с 275 мл / мин у пациентов с ХОБЛ> 65 лет). Это не приводило к соответствующему увеличению величин AUC 0-4год или C max, ss .
У пациентов с астмой не было определено различий влияния тиотропия в зависимости от возраста пациента.
Пациенты с нарушениями функции почек.
После введения тиотропия (один раз в день путем ингаляций) у пациентов с ХОБЛ до получения состояния равновесия незначительная почечная недостаточность (клиренс креатинина 50 — 80 мл / мин) обусловила некоторое повышение показателя AUC 0-6, ss (на 1,8 — 30% ) и подобные показатели C max, ss сравнению с пациентами с нормальной функцией почек (клиренс креатинина> 80 мл / мин).
У пациентов с ХОБЛ с нарушениями функции почек от умеренных до тяжелых (клиренс креатинина <50 мл / мин) введение разовой дозы тиотропия привело к удвоению общего воздействия (AUC 0-4год выше на 82% и C max выше на 52%) по сравнению с пациентами с ХОБЛ и нормальной функцией почек, подтверждалось концентрацией в плазме крови после ингаляций сухого порошка. У пациентов с астмой со слабым нарушением функции почек (клиренс креатинина 50-80 мл / мин) тиотропий в виде ингаляций приводил к соответствующему увеличению экспозиции по сравнению с пациентами с нормальной функцией почек.
Пациенты с нарушениями функции печени. Печеночная недостаточность не имеет существенного влияния на фармакокинетику тиотропия. Тиотропий основном выделяется путем почечной элиминации (до 74% у молодых здоровых добровольцев) и путем простого неферментативного расщепления эфира до фармакологически неактивных продуктов.
Пациенты с ХОБЛ Японской нации Во время перекрестного сравнения средние максимальные концентрации тиотропия в плазме крови через 10 мин. после введения дозы в состоянии равновесия были на 20% — 70% выше в японских пациентов по сравнению с европейцами после ингаляций тиотропия, но признаков повышенной смертности или риска осложнений сердечных состояний в японских пациентов по сравнению с европейцами не было. Что касается других рас или этнических групп существует недостаточно фармакокинетических данных.
Взаимосвязь фармакокинетика / фармакодинамика . Нет прямого взаимосвязи между фармакокинетикой и фармакодинамики.