Визкью — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-006598
Торговое наименование:
Визкью
Международное непатентованное наименование (МНН):
бролуцизумаб
Лекарственная форма:
раствор для внутриглазного введения
Состав
1 мл раствора содержит:
действующее вещество – бролуцизумаб – 120 мг;
вспомогательные вещества – сахароза, натрия цитрат, полисорбат 80, натрия гидроксид, вода для инъекций.
Описание
От бесцветного до слегка коричневато-желтого цвета, от прозрачного до слегка опалесцирующего раствор.
Фармакотерапевтическая группа:
средства, препятствующие новообразованию сосудов.
Код ATX:
S01LA06
Фармакологические свойства
Механизм действия
Патологический ангиогенез в глазу и отек сетчатки связан с повышенной активизацией сигнального пути фактора роста эндотелия сосудов A (VEGF-A). Бролуцизумаб с высокой аффинностью связывается с различными изоформами VEGF-A (в частности с VEGF110, VEGF121 и VEGF165), тем самым препятствуя связыванию VEGF-A с его рецепторами VEGFR-1 и VEGFR-2. Подавляя связывание VEGF-A, бролуцизумаб угнетает пролиферацию эндотелиальных клеток, тем самым уменьшая патологическую неоваскуляризацию и снижая проницаемость сосудов.
Фармакодинамика
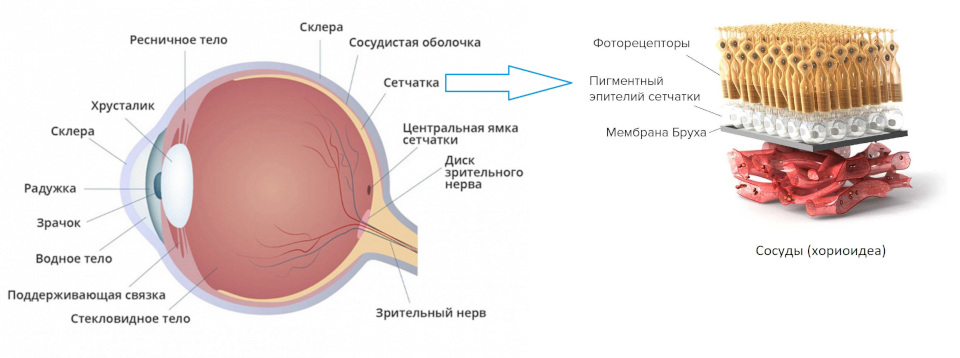
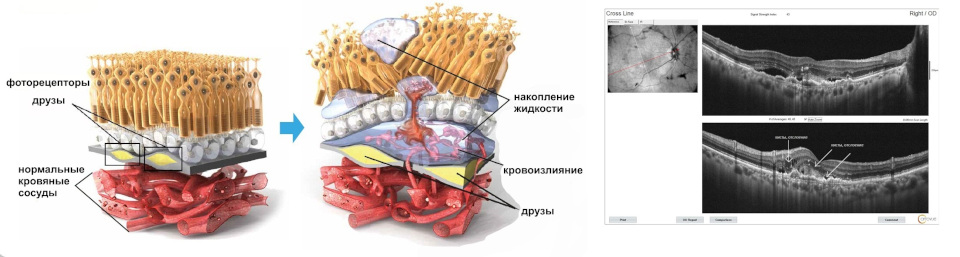
Неоваскулярная (влажная) форма возрастной макулодистрофии (нВМД) характеризуется наличием патологической хориоидальной неоваскуляризации (ХНВ). Экссудация крови и жидкости из хориоидальных неоваскулярных мембран (ХНМ) может вызывать утолщение или отек сетчатки и (или) суб/интраретинальное кровоизлияние, приводящие к снижению остроты зрения.
В исследованиях HAWK и HARRIER решение о лечении принималось на основании оценки активности заболевания, включающей оценку соответствующих анатомических параметров. У пациентов, получавших бролуцизумаб, уже через 4 недели после начала лечения и вплоть до 48 и 96 недель наблюдалось снижение толщины центральной зоны сетчатки (ТЦЗС) и количества интраретинальной/субретинальной жидкости (ИРЖ/СРЖ) или жидкости, находящейся под пигментным эпителием сетчатки (ПЭС). Снижение ТЦЗС и количества ИРЖ/СРЖ на 16 и 48 неделях в случае применения бролуцизумаба статистически значимо превышало соответствующее снижение в случае применения афлиберцепта (см. подраздел «Клиническая эффективность и безопасность»).
В этих исследованиях уменьшение размера очага ХНВ, у пациентов, получавших бролуцизумаб, наблюдалось уже через 12 недель и сохранялось через 48 и 96 недель после начала лечения.
Клиническая эффективность и безопасность
Безопасность и эффективность бролуцизумаба оценивали в 2 рандомизированных многоцентровых двойных слепых исследованиях III фазы с активным контролем (HAWK и HARRIER) у пациентов с нВМД. В этих исследованиях лечение в течение 2 лет получали в общей сложности 1817 пациентов (1088 – бролуцизумаб; 729 – афлиберцепт). Возраст пациентов варьировал от 50 до 97 лет; средний возраст составил 76 лет.
В исследовании HAWK пациентов рандомизировали в отношении 1:1:1 в группы со следующими схемами лечения:
- бролуцизумаб 3 мг, применяемый каждые 12 или 8 недель (1 раз/12 нед/ 1 раз/8 нед) после 3 первых ежемесячных инъекций;
- бролуцизумаб 6 мг, применяемый каждые 12 или 8 недель (1 раз/12 нед/ 1 раз/8 нед) после 3 первых ежемесячных инъекций;
- афлиберцепт 2 мг, применяемый каждые 8 недель (1 раз/8 нед) после 3 первых ежемесячных инъекций.
В исследовании HARRIER пациентов рандомизировали в отношении 1:1 в группы со следующими схемами лечения:
- бролуцизумаб 6 мг, применяемый каждые 12 или 8 недель (1 раз/12 нед/ 1 раз/8 нед) после 3 первых ежемесячных инъекций;
- афлиберцепт 2 мг, применяемый каждые 8 недель (1 раз/8 нед) после 3 первых ежемесячных инъекций.
В обоих исследованиях пациенты из групп бролуцизумаба после 3 первых ежемесячных инъекций (0, 4 и 8 неделя), получали препарат каждые 12 недель с возможностью изменения интервала дозирования до 1 раза в 8 недель в зависимости от активности заболевания. Активность заболевания оценивал врач в первый 12-недельный интервал (на 16 и 20 неделях) и в каждый из последующих плановых визитов, в рамках которых проводились инъекции с интервалом 12 недель. Пациентам, у которых в какой-либо из этих визитов выявляли активность заболевания (например, снижение остроты зрения, увеличение толщины центральной зоны сетчатки (ТЦЗС) и (или) наличие жидкости в сетчатке (ИРЖ/СРЖ, жидкость под ПЭС)), интервал между инъекциями уменьшали до 1 раза в 8 недель.
Результаты
Первичной конечной точкой эффективности в обоих исследованиях являлось изменение относительно исходного уровня максимальной корригированной остроты зрения (МКОЗ) к 48 неделе, которую оценивали по буквенной шкале ETDRS (исследование «Лечение диабетической ретинопатии на ранней стадии»). Основная цель заключалась в демонстрации не меньшей эффективности бролуцизумаба по сравнению с афлиберцептом. В обоих исследованиях было показано, что бролуцизумаб (применяемый по схеме 1 раз/12 нед/ 1 раз/8 нед) по своей эффективности не уступает афлиберцепту 2 мг (применяемому по схеме 1 раз/8 нед). Увеличение остроты зрения, достигнутое в течение первого года, сохранялось и в течение второго года.
Результаты обоих исследований представлены в табл. 1 и на рисунке 1 ниже.
Таблица 1 Результаты оценки остроты зрения на 48 и 96 неделях в исследованиях III фазы – исследования НАWK HARRIER
| Показатель эффектив- ности |
На неделе |
HAWK | HARRIER | ||||
| бролуцизу- маб 6 мг (n=360) |
Афлибер- цепт 2 мг (n=360) |
Разность (95% ДИ) бролуцизумаб-афлиберцепт |
бролуцизу- маб 6 мг (n=370) |
Афлибер- цепт 2 мг (n=369) |
Разность (95% ДИ) бролуцизумаб-афлиберцепт |
||
| Среднее изменение МКОЗ (по шкале ETDRS) относительно исходного значения | 48 | 6,6 (СО = 0,71) |
6,8 (СО = 0,71) |
-0,2 (-2,1, 1,8) Р <0,0001a) |
6,9 (СО = 0,61) |
7,6 (СО = 0,61) |
-0,7 (-2,4, 1,0) Р <0,0001a) |
| 36-48b) | 6.7 ((СО = 0,68) |
6,7 (СО = 0,68) |
0,0 (-1,9, 1,9) Р <0,0001a) |
6,5 (СО = 0,58) |
7,7 (СО = 0,58) |
-1,2 (-2,8, 0,4) Р = 0,0003a) |
|
| 96 | 5,9 (СО = 0,78) |
5,3 (СО = 0,78) |
0,5 (-1,6, 2,7) |
6,1 (СО = 0,73) |
6,6 (СО = 0,73) |
-0,4 (-2,5, 1,6) |
|
| Доля пациентов, у которых острота зрения улучшилась не менее чем на 15 букв, % | 48 | 33,6 | 25,4 | 8,2 (2,2, 15,0) |
29,3 | 29,9 | -0,6 (-7,1, 5,8) |
| 96 | 34,2 | 27,0 | 7,2 0,4, 13,8) |
29,1 | 31,5 | -2,4 (-8,8, 4,1) |
|
| Доля пациентов, у которых острота зрения снизилась, % (потеря МКОЗ на ≥15 букв) | 48 | 6,4 | 5,5 | 0,9 (-2,7, 4,3) |
3,8 | 4,8 | -1,0 (-3,9, 2,2) |
| 96 | 8,1 | 7,4 | 0,7 (-3,6, 4,6) |
7,1 | 7,5 | -0,4 (-3,8, 3,3) |
МКОЗ: Острота зрения при максимальной коррекции; отсутствующие данные вменялись по методу переноса вперед последнего доступного наблюдения (LOCF)
ETDRS: Early Treatment of Diabetic Retinopathy Study / Исследование «Лечение диабетической ретинопатии на ранней стадии»
СО – стандартная ошибка, ДИ – доверительный интервал
a) Р-значение, относящееся к гипотезе о неменьшей эффективности с границей неменьшей эффективности 4,0 буквы
b) Ключевая вторичная конечная точка, учитывающая различия в схемах терапии бролуцизумабом и афлиберцептом
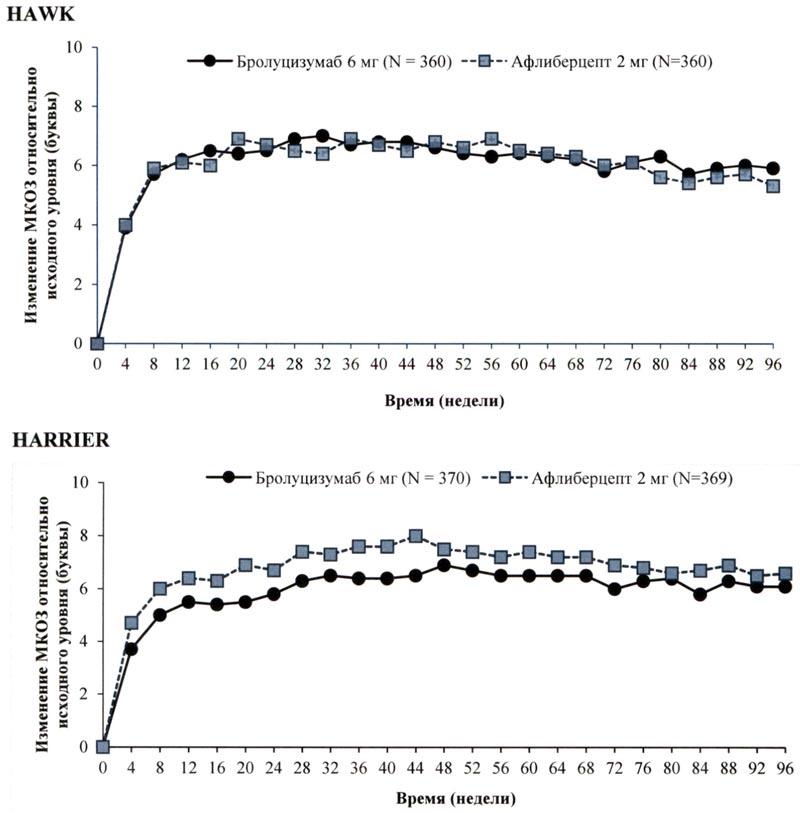
На 48 неделе такое увеличение остроты зрения в исследованиях HAWK и HARRIER было достигнуто у 56% и 51% пациентов, получавших бролуцизумаб 6 мг каждые 12 недель соответственно, а на неделе 96 – у 45% и 39% пациентов. Среди пациентов, которые по результатам оценки, проведенной в первом 12-недельном интервале, соответствовали критериям продолжения инъекций с интервалом 1 раз/ 12 недель, 85% и 82% пациентов продолжали получать препарат каждые 12 недель вплоть до 48 недели. Из числа пациентов, получавших препарат с интервалом 12 недель на 48 неделе, 82% и 75% пациентов продолжали получать препарат каждые 12 недель вплоть до 96 недели.
Терапевтические эффекты в изученных подгруппах (например, различающихся по возрасту, полу, расе, исходной остроте зрения, исходной толщине сетчатки, типу и размеру очага ХНВ, статусу жидкости), в обоих исследованиях в целом соответствовали эффектам, наблюдаемым в общей популяции пациентов, включенных в данные исследования.
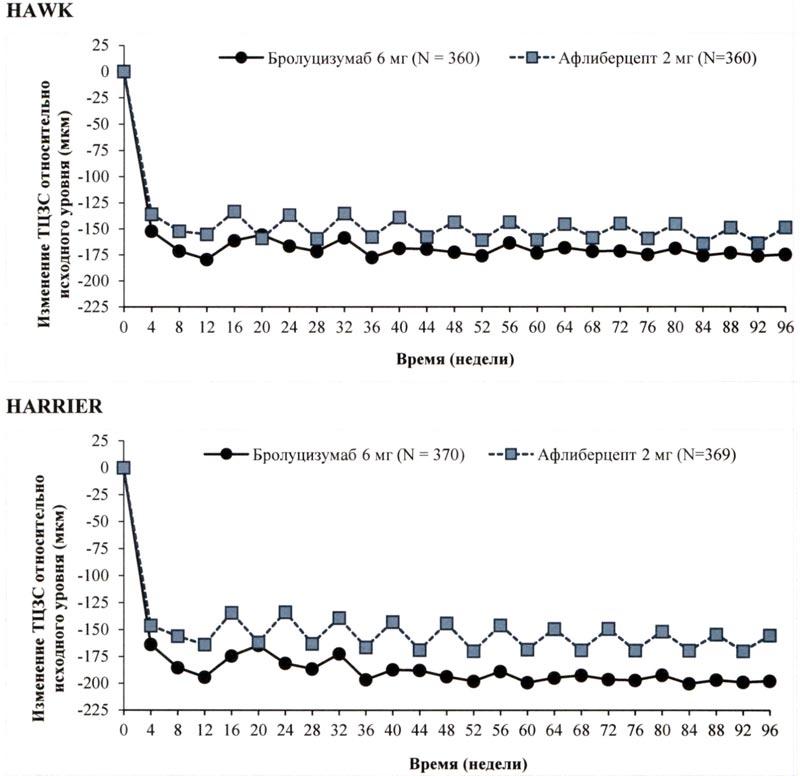
Активность заболевания оценивали по изменениям остроты зрения и (или) анатомических параметров, включающих ТЦЗС и (или) наличие жидкости в сетчатке (ИРЖ/СРЖ, жидкость под ПЭС). На 16 неделе, когда проводили первую оценку активности заболевания для определения интервала между инъекциями, доля пациентов с активным заболеванием в группе бролуцизумаба 6 мг оказалась статистически значимо ниже, чем в группе афлиберцепта 2 мг. В обоих исследованиях активность заболевания оценивали в течение всего исследования. Значения анатомических параметров, свидетельствующих об активности заболевания, на 48 неделе и на 96 неделе в группе бролуцизумаба были ниже, чем в группе афлиберцепта 2 мг (табл. 2).
Таблица 2 Оценка активности заболевания в исследованиях НАWK и HARRIER вплоть до 96 недели
| Показатель эффектив- ности (заранее определенные вторичные конечные точки) |
На неделе |
HAWK | HARRIER | ||||
| бролуцизу- маб 6 мг (N=360) |
Афлибер- цепт 2 мг (N=360) |
Разность (95% ДИ) бролуцизумаб-афлиберцепт |
бролуцизу- маб 6 мг (N=370) |
Афлибер- цепт 2 мг (N=369) |
Разность (95% ДИ) бролуцизумаб-афлиберцепт |
||
| Доля пациентов с активным заболеванием, %с) | 16d) | 24,0 | 34,5 | -10,5 (-17,1,-3,5) Р = 0,0013a) |
22,7 | 32,2 | -9,5 (-15,8, -3,1) Р = 0,0021a) |
| Среднее изменение ТЦЗС относительно исходного уровня (мкм) | 16d) | -161,4 (СО = 6,2) |
-133,6 (СО = 6,2) |
-27,8 (-45,1,-10,5) Р = 0,0008a) |
-174,4 (СО = 6,7) |
-134,2 (СО = 6,7) |
-40,2 (-58,9,-21,6) Р <0,0001a) |
| 48 | -172,8 (СО = 6,7) |
-143,7 (СО = 6,7) |
-29,0 (-47,6,-10,4) Р = 0,0012a) |
-193,8 (СО = 6,8) |
-143,9 (СО = 6,8) |
-49,9 (-68,9, -30,9) Р <0,0001a) |
|
| 96 | -174,8 (СО = 7,3) |
-148,7 (СО = 7,3) |
-26,0 (-46,2, -5,9) Р=0,0115b) |
-197,7 (СО = 7,0) |
-155,1 (СО = 7,0) |
-42,6 (-62,0, -23,3) Р<0,0001b) |
|
| Доля пациентов с жидкостью (ИРЖ и/или СРЖ), % | 16d) | 33,9 | 52,2 | -18,2 (-25,3, -10,9) Р< 0,0001a) |
29,4 | 45,1 | -15,7 (-22,9, -9,0) Р < 0,0001a) |
| 48 | 31,2 | 44,6 | -13,5 (-20,7, -6,1) Р = 0,0001a) |
25,8 | 43,9 | -18,1 (-24,9,-11,8) Р<0,0001a) |
|
| 96 | 24,0 | 36,9 | -12,9 (-19,7,-6,6) Р=0,0002b) |
24,4 | 38,5 | -14,1 (-21,3,-7,2) Р<0,0001b) |
|
| Доля пациентов с жидкостью под ПЭС, % | 16d) | 18,7 | 27,3 | -8,6 (-14,4, -2,9) Р = 0,0030b) |
16,0 | 23,8 | -7,8 (-13,0, -2,7) Р = 0,0041b) |
| 48 | 13,5 | 21,6 | -8,1 (-13,6,-2,7) Р = 0,0035b) |
12,9 | 22,0 | -9,1 (-13,8,-3,9) Р = 0,0007b) |
|
| 96 | 10,9 | 14,7 | -3,8 (-8,5,0,8) Р=0,1213b) |
16,5 | 22,4 | -5,9 (-11,5,-0,3) Р=0,0371b) |
ТЦЗС: Толщина центрального зоны сетчатки; ИРЖ/СРЖ: интраретинальная/субретинальная жидкость; ПЭС: пигментный эпителий сетчатки; СО: стандартная ошибка; ДИ – доверительный интервал.
a) Вторичная конечная точка в исследовании HARRIER, подтверждающий анализ в исследовании НАWK; 1-сторонние p-значения для оценки превосходства бролуцизумаба
b) Вторичные конечные точки в исследовании НАWK и HARRIER; 2-сторонние р-значения
c) Оценки активности заболевания были основаны на суждениях врача на 16 неделе, опирающихся на указания протокола: Снижение МКОЗ на ≥5 букв относительно исходного уровня, снижение МКОЗ на ≥3 буквы и увеличение ТЦЗС на ≥75 мкм по сравнению с неделей 12, снижение МКОЗ на ≥5 букв, обусловленное активностью неоваскулярной ВМД по сравнению с неделей 12 или вновь выявленные либо усугубившиеся интраретинальные кисты (ИРК)/ интраретинальная жидкость (ИРЖ) по сравнению с 12 неделей
d) До 16 недели оба препарата применяли с одинаковой частотой, что позволяет провести прямое сравнение бролуцизумаба и афлиберцепта
В обоих исследованиях применение бролуцизумаба приводило к клинически значимому улучшению относительно исходного уровня заранее определенной вторичной конечной точки эффективности, а именно исходов, оцениваемых самими пациентами по опроснику Национального института глаза для оценки зрительной функции (NEI VFQ-25). По величине эти изменения были примерно такими же, что и в ранее опубликованных исследованиях: МКОЗ увеличивалась на 15 букв. Улучшения, отмеченные пациентами, сохранялись и в течение второго года.
Клинически значимых различий между группами бролуцизумаба и афлиберцепта ни в изменениях общего показателя по шкале NEI VFQ-25, ни в изменениях показателей по отдельным подшкалам (зрение в целом, боль в глазу, зрение вблизь, зрение вдаль, социальное функционирование, психическое здоровье, ролевые трудности, зависимость, вождение автомобиля, цветное зрение и периферическое зрение) к 48 неделе относительно исходного уровня выявлено не было.
Фармакокинетика
Бролуцизумаб вводят непосредственно в стекловидное тело с тем, чтобы он оказывал местное воздействие в тканях глаза.
Всасывание/распределение
После интравитреального введения бролуцизумаба в дозе 6 мг в глаз пациентам с нВМД среднее значение Сmax свободного бролуцизумаба в плазме крови составляло 49,0 нг/мл (диапазон: 8,97-548 нг/мл); при этом Сmax достигалась через 1 день.
Метаболизм/выведение
Бролуцизумаб – это фрагмент моноклонального антитела, поэтому исследований метаболизма лекарственного препарата не проводили. Свободный бролуцизумаб представляет собой одноцепочечный фрагмент антитела и ожидается, что его выведение будет происходить за счет мишень-опосредованного распределения через связывание со свободным эндогенным VEGF, пассивного выведения через почки и метаболизма, опосредованного протеолизом.
После интравитреальных инъекций бролуцизумаб выводился из крови с кажущимся периодом полувыведения, составлявшим 4,3 дня. Приблизительно через 4 недели после введения, системные концентрации у большинства пациентов находились на нижней границе предела количественного определения или ниже (<0,5 нг/мл). При применении бролуцизумаба в виде интравитреальных инъекций каждые 4 недели не наблюдалось накопления препарата в сыворотке крови.
Особые группы пациентов
Пожилые пациенты (65 лет или старше)
В клинических исследованиях HAWK и HARRIER приблизительно 90% (978/1088) пациентов, рандомизированных в группу бролуцизумаба, находились в возрасте ≥65 лет, а приблизительно 60% (648/1088) – в возрасте ≥75 лет. Статистически значимых различий в эффективности и безопасности между подгруппами пациентов разного возраста в этих исследованиях не наблюдалось.
Раса / этническая принадлежность
В исследовании, в котором участвовали 24 пациента европеоидной расы и 26 пациентов-японцев, никаких различий в системной фармакокинетике после интравитреальной инъекции, связанных с этнической принадлежностью, выявлено не было.
Нарушения функции почек
Нарушения функции почек различной степени тяжести (от легких до тяжелых) не должны влиять на общую системную экспозицию бролуцизумаба, поскольку его системная концентрация определяется не столько скоростью его выведения, сколько скоростью его поступления в кровь из тканей глаза, а также в связи с низкой системной экспозицией свободного бролуцизумаба.
Системный клиренс бролуцизумаба оценивали у пациентов с нВМД, для которых имелись данные по фармакокинетическим параметрам бролуцизумаба в плазме крови и данные по клиренсу креатинина (КК). У пациентов с нарушением функции почек легкой степени (КК = 50-79 мл/мин (n=13)) средние значения системного клиренса бролуцизумаба отличались не более чем на 15% от соответствующих значений у лиц с нормальной функцией почек (КК ≥80 мл/мин (n=25)). У пациентов с нарушением функции почек средней степени (КК = 30-49 мл/мин (n=3)) средние значения системного клиренса бролуцизумаба были ниже, чем у пациентов с нормальной функцией почек, однако число таких пациентов было недостаточным для формирования заключения. Пациенты с нарушением функции почек тяжелой степени (КК <30 мл/мин) в исследованиях не участвовали.
Нарушения функции печени
У пациентов с нарушениями функции печени применение бролуцизумаба не изучалось. Нарушения функции печени различной степени тяжести (от легких до тяжелых) не должны влиять на общую системную экспозицию бролуцизумаба, поскольку его метаболизм происходит за счет протеолиза и не зависит от функции печени.
Показания к применению
Лечение неоваскулярной (влажной) формы возрастной макулярной дегенерации (нВМД).
Противопоказания
- Гиперчувствительность к бролуцизумабу или любому другому компоненту препарата.
- Активные или предполагаемые инфекционные заболевания глаза или окологлазничной области.
- Активное внутриглазное воспаление.
Применение при беременности и в период грудного вскармливания
Женщины с сохраненным репродуктивным потенциалом
Женщин с сохраненным репродуктивным потенциалом следует предупреждать о необходимости применять эффективные методы контрацепции (методы, обеспечивающие частоту беременности менее 1%) во время лечения препаратом и в течение по крайней мере одного месяца после последней инъекции при прекращении лечения бролуцизумабом.
Беременность
Адекватных и хорошо контролируемых исследований с применением бролуцизумаба у беременных женщин не проводили. Исследования репродуктивной токсичности на животных являются недостаточными. Хотя системное воздействие после введения препарата в глаз очень незначительное, бролуцизумаб не следует применять во время беременности, если потенциальная польза не превышает потенциальный риск для плода.
Период грудного вскармливания
Неизвестно проникает ли бролуцизумаб в грудное молоко человека. Риск для ребенка на грудном вскармливании исключить нельзя. Не рекомендуется применять бролуцизумаб во время кормления грудью. Не следует начинать кормление грудью в течение, по крайней мере, одного месяца после последней дозы при прекращении лечения бролуцизумабом. Решение о прекращении грудного вскармливания или воздержании от терапии бролуцизумабом следует принимать с учетом пользы грудного вскармливания для ребенка и пользы терапии для женщины.
Фертильность
Исследования влияния на репродуктивную функцию и фертильность не проводились. Было показано, что подавление активности VEGF влияет на развитие фолликулов, функцию желтого тела и фертильность. Исходя из механизма действия ингибиторов VEGF, препарат может неблагоприятно влиять на репродуктивную функцию у женщин, а также на ранний и поздний эмбриогенез.
Способ применения и дозы
Режим дозирования
Флакон для однократного применения предназначен исключительно для интравитреального введения. Каждый флакон следует использовать для введения только в один глаз.
Бролуцизумаб может вводить только врач, имеющий соответствующую квалификацию.
Целевая популяция
Рекомендуемая доза препарата составляет 6 мг (0,05 мл раствора); первые 3 дозы вводят в виде интравитреальной инъекции с интервалом 4 недели (ежемесячно).
Затем врач может подбирать интервалы между инъекциями в индивидуальном порядке, основываясь на активности заболевания, которая оценивается по остроте зрения и (или) анатомическим параметрам.
Через 16 недель (4 месяца) после начала терапии следует провести оценку активности заболевания. У пациентов без признаков активности заболевания интравитреальное введение препарата осуществляется каждые 12 недель (3 месяца). У пациентов с признаками активности заболевания введение препарата осуществляется каждые 8 недель (2 месяца). Впоследствии врач может корректировать интервалы инъекций индивидуально для каждого пациента, основываясь на активности заболевания.
Если по результатам оценки анатомических параметров или остроты зрения можно сделать вывод, что пациент не получает пользы от проводимой терапии, следует прекратить инъекции.
Особые группы пациентов
Нарушения функции почек
У пациентов с нарушением функции почек корректировать схему дозирования не требуется (см. раздел «Фармакологические свойства»).
Нарушения функции печени
У пациентов с нарушениями функции печени применение бролуцизумаба не изучалось. У пациентов с нарушением функции печени корректировать схему дозирования не требуется (см. раздел «Фармакологические свойства»).
Дети и подростки (младше 18 лет)
Безопасность и эффективность бролуцизумаба у детей и подростков не установлены.
Пожилые пациенты (65 лет или старше)
У пациентов 65 лет или старше корректировать схему дозирования не требуется.
Способ применения
Препарат предназначен только для интравитреальных инъекций.
Как и в случае любого лекарственного препарата для интравитреального введения, перед тем как вводить бролуцизумаб, следует провести его визуальный осмотр (см. раздел «Указания по применению»).
Инъекцию препарата следует проводить в асептических условиях, что подразумевает хирургическую обработку рук медицинского персонала, использование стерильных перчаток, стерильной салфетки и стерильного векорасширителя (или его аналога). В качестве меры предосторожности следует держать наготове стерильные инструменты для парацентеза. До проведения интравитреальной инъекции следует внимательно изучить анамнез пациента на предмет наличия у него аллергических реакций (см. раздел «Противопоказания»). Перед введением препарата необходимо провести надлежащую анестезию, а также продезинфицировать область вокруг глаз, кожу век и поверхности глаза местным бактерицидным средством широкого спектра действия.
Информация по подготовке препарата к введению приведена в разделе «Указания по применению».
Инъекционную иглу следует ввести в стекловидную камеру глаза на 3,5-4 мм кзади от лимба, избегая горизонтального меридиана и направляя иглу к центру глазного яблока. После этого медленно вводят 0,05 мл препарата; следующую инъекцию препарата проводят в другую половину склеры.
Безопасность и эффективность препарата при его введении в оба глаза одновременно не изучали.
Побочное действие
Выборку для оценки безопасности в двух исследованиях III фазы HAWK и HARRIER составили 1088 пациентов, которые получали бролуцизумаб в общей сложности 96 недель; 730 пациентов получали препарат в рекомендованной дозе 6 мг.
К числу наиболее частых нежелательных лекарственных реакций, которые отмечались у >5%, получавших бролуцизумаб в дозе 6 мг, относились снижение остроты зрения (7,3%), катаракта (7,0%), конъюнктивальное кровоизлияние (6,3%) и плавающие помутнения стекловидного тела (5,1%).
К числу менее частых нежелательных лекарственных реакций, которые отмечались у <1% пациентов, получавших бролуцизумаб в дозе 6 мг, относились эндофтальмит, слепота, окклюзия артерии сетчатки и отслойка сетчатки.
Сводная таблица нежелательных лекарственных реакций, отмечавшихся в клинических исследованиях и полученные путем спонтанных сообщений и обзора литературы
Нежелательные реакции, отмечавшиеся в клинических исследованиях и полученные путем спонтанных сообщений и обзора литературы (табл. 3), представлены по системно-органным классам словаря MedDRA. Внутри каждого системно-органного класса нежелательные лекарственные реакции приведены в порядке уменьшения их частоты. Внутри каждой категории частоты нежелательные лекарственные реакции представлены в порядке уменьшения степени их серьезности. Кроме того, для каждой нежелательной лекарственной реакции приведена соответствующая ей категория частоты в соответствии со следующими обозначениями (CIOMS III): очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); неизвестно (невозможно установить частоту по имеющимся данным).
Таблица 3. Частота нежелательных лекарственных реакций в клинических исследованиях и полученных путем спонтанных сообщений и обзора литературы
| Нежелательные реакции | Бролуцизумаб (N=730) |
Афлиберцепт (N=729) |
Категория частоты |
| Нарушения со стороны органа зрения | |||
| Снижение остроты зрения | 7,3 | 7,5 | Часто |
| Кровоизлияние в сетчатку | 4,1 | 3,2 | Часто |
| Увеит | 1,6 | 0,1 | Часто |
| Ирит | 1,2 | 0,3 | Часто |
| Отслойка стекловидного тела | 4,0 | 3,3 | Часто |
| Разрыв сетчатки | 1,2 | 0,7 | Часто |
| Катаракта | 7,0 | 11,1 | Часто |
| Конъюнктивальное кровоизлияние | 6,3 | 7,0 | Часто |
| Плавающие помутнения стекловидного тела | 5,1 | 2,9 | Часто |
| Боль в глазу | 4,9 | 6,2 | Часто |
| Повышение внутриглазного давления | 3,8 | 4,5 | Часто |
| Конъюнктивит | 3,3 | 1,6 | Часто |
| Разрыв пигментного эпителия сетчатки | 2,7 | 1,1 | Часто |
| Затуманивание зрения | 1,9 | 1,6 | Часто |
| Эрозия роговицы | 1,5 | 2,2 | Часто |
| Точечный кератит | 1,4 | 2,3 | Часто |
| Эндофтальмит | 0,7 | 0,1 | Нечасто |
| Слепота | 0,8 | 0,3 | Нечасто |
| Окклюзия артерии сетчатки | 0.8 | 0,1 | Нечасто |
| Отслойка сетчатки | 0,7 | 0,4 | Нечасто |
| Конъюнктивальная инъекция | 1,0 | 1,1 | Нечасто |
| Слезотечение | 1,0 | 1,1 | Нечасто |
| Атипичные ощущения в глазу | 0,8 | 1,8 | Нечасто |
| Отслойка пигментного эпителия сетчатки | 0,5 | 0,4 | Нечасто |
| Витрит | 0,4 | 0,4 | Нечасто |
| Воспалительная реакция во влаге передней камеры | 0,4 | 0 | Нечасто |
| Иридоциклит | 0,4 | 0,1 | Нечасто |
| Опалесценция влаги передней камеры | 0,3 | 0 | Нечасто |
| Отек роговицы | 0,3 | 0 | Нечасто |
| Кровоизлияние в стекловидное тело | 0,1 | 0,4 | Нечасто |
| Окклюзия сосудов сетчатки | – | – | Неизвестно |
| Васкулит сетчатки | – | – | Неизвестно |
| Нарушения со стороны иммунной системы | |||
| Гиперчувствительностьa) | 1,8 | 1,4 | Часто |
a) Включая крапивницу, кожную сыпь, кожный зуд, эритему
Иммуногенность
Как и любой терапевтический белок, бролуцизумаб может вызывать у пациентов иммунный ответ. Иммуногенность бролуцизумаба оценивали, изучая образцы плазмы крови. Данные по иммуногенности отражают процент пациентов, в образцах сыворотки которых иммуноанализ выявил антитела к бролуцизумабу. Обнаружение антител (иммунного ответа) в значительной степени зависит от чувствительности и специфичности используемого метода анализа, обращения с образцом, времени сбора образца, сопутствующих лекарственных препаратов и имеющегося у пациента заболевания. По названным причинам сравнение частот образования антител к бролуцизумабу и к другим терапевтическим белкам может привести к неверным выводам.
Антитела к ряду терапевтических белков, получаемых биотехнологическими методами, в том числе к одноцепочечным антителам, обнаруживались у лиц, ни разу не получавших такие белки, то есть еще до начала лечения. Частота обнаружения антител к бролуцизумабу до начала лечения составляла 35-52%. После применения препарата в течение 88 недель антитела к бролуцизумабу, возникшие на фоне лечения, обнаруживались у 23-25% пациентов.
Антитела к бролуцизумабу не влияли на клиническую эффективность препарата. У пациентов, у которых на фоне лечения образовались антитела, наблюдалась повышенная частота внутриглазного воспаления. В настоящее время неясно, каким образом антитела к бролуцизумабу влияют на безопасность клинического применения препарата.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
В случае передозировки, то есть введения препарата в объеме выше рекомендованного, может повышаться внутриглазное давление. В связи с этим, при передозировке следует контролировать внутриглазное давление и начинать надлежащее лечение, если лечащий врач сочтет это необходимым.
Взаимодействие с другими лекарственными средствами
Специальные исследования лекарственных взаимодействий не проводились.
Особые указания
Прослеживаемость
Следует четко обозначать наименование и серию вводимого препарата с целью обеспечения прослеживаемости биологических препаратов.
Эндофталъмит, внутриглазное воспаление, травматическая катаракта, отслойка сетчатки, васкулит сетчатки и/или окклюзия сосудов сетчатки
На фоне проведения интравитреальных инъекций, в том числе бролуцизумаба, отмечались случаи эндофтальмита, внутриглазного воспаления, травматической катаракты и отслойки сетчатки (см. раздел «Побочное действие»). Инъекции препарата всегда следует проводить с соблюдением правил асептики.
При терапии бролуцизумабом были отмечены случаи васкулита сетчатки и/или окклюзии сосудов сетчатки, сопровождающиеся, как правило, внутриглазным воспалением (см. разделы «Противопоказания» и «Побочное действие»). При возникновении таких явлений лечение препаратом следует прекратить и незамедлительно обеспечить пациенту соответствующее лечение и наблюдение.
Пациентов следует предупреждать о необходимости незамедлительно сообщать врачу о любых симптомах, указывающих на явления, упомянутые выше.
Повышение внутриглазного давления
Как и в случае интравитреального введения других ингибиторов VEGF, в течение 30 минут после инъекции бролуцизумаба отмечалось преходящее повышение внутриглазного давления (см. раздел «Побочное действие»). Особую осторожность следует соблюдать у пациентов с неконтролируемой глаукомой (не следует вводить бролуцизумаб, если внутриглазное давление ≥30 мм рт. ст.). Следует контролировать внутриглазное давление и перфузию диска зрительного нерва и при необходимости проводить надлежащее лечение.
Двустороннее применение
Эффективность и безопасность инъекций бролуцизумаба одновременно в оба глаза не изучали.
Иммуногенность
Как и любой терапевтический белок, бролуцизумаб может вызывать у пациентов иммунный ответ (см. раздел «Побочное действие»). Врачу следует предупредить пациента о необходимости незамедлительно сообщать о появлении таких симптомов как боль в области глаза или дискомфорт, усиление красноты глаза, затуманивание или снижение зрения, увеличение количества плавающих частиц или повышенную чувствительность к свету (см. раздел «Побочное действие»).
Одновременное применение с другими анти-VEGFпрепаратами
Нет данных об одновременном применении бролуцизумаба с другими ингибиторами VEGF в одном глазу. Бролуцизумаб не следует применять одновременно с другими ингибиторами VEGF (системными и внутриглазными).
Приостановление применения:
Очередную инъекцию ингибитора VEGF следует отменить и не производить до следующей запланированной инъекции в следующих случаях:
- снижение МКОЗ на ≥30 букв по сравнению с последним определением;
- разрыв сетчатки;
- субретинальные кровоизлияния, затрагивающие центральную часть фовеа или если площадь кровоизлияния составляет ≥50% площади поражения;
- в течение 28 дней до или после внутриглазного хирургического вмешательства.
Разрыв пигментного эпителия сетчатки
Пациенты с выявленной обширной и/или высокой отслойкой пигментного эпителия сетчатки входят в группу риска развития разрыва пигментного эпителия сетчатки при применении анти-VEGF препаратов у пациентов с нВМД.
Регматогенная отслойка сетчатки ши макулярное отверстие
У пациентов с регматогенной отслойкой сетчатки или макулярным отверстием 3, 4 стадии лечение препаратом следует прекратить.
Системное действие препарата при интравитреальном введении
При интравитреальном введении ингибиторов VEGF возможно развитие системных побочных эффектов, включая кровотечения внеглазной локализации и артериальные тромбоэмболии. Существует вероятная теоретическая связь этих явлений с ингибированием VEGF.
Данные по безопасности применения препарата у пациентов с ВМД с инсультом, транзиторной ишемической атакой или инфарктом миокарда в анамнезе за последние 3 месяца ограничены. У таких пациентов препарат следует применять с осторожностью.
Содержание натрия
В одной дозе препарата содержится менее 1 ммоль натрия (23 мг), то есть фактически относится к препаратам, не содержащим натрий.
Влияние на способность управлять транспортными средствами и механизмами
После интравитреальной инъекции бролуцизумаба и связанного с ней исследования глаза у пациентов могут возникать временные нарушения зрения, в связи с чем им рекомендуется воздерживаться от управления транспортным средством и работы с механизмами до тех пор, пока зрительная функция не восстановится в достаточной степени.
Форма выпуска
Раствор для внутриглазного введения, 120 мг/мл.
По 0,23 мл раствора для внутриглазного введения 120 мг/мл во флакон из стекла класса I вместимостью 2 мл, укупоренный пробкой из хлорбутилового каучука, покрытого этилентетрафторэтиленом, обкатанной алюминиевым колпачком с полипропиленовой отщелкивающейся крышкой.
По 1 флакону в комплекте с иглой, снабженной фильтром, для извлечения препарата из флакона, вместе с инструкцией по медицинскому применению в пачку картонную.
Допускается наличие контроля первичного вскрытия на картонной пачке.
Срок годности
2 года.
Препарат не следует применять по истечении срока годности.
Условия хранения
Хранить в защищенном от света месте при температуре от 2 до 8 °С. Не замораживать.
Хранить в недоступном для детей месте.
Условия отпуска
Отпускают по рецепту.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
«Новартис Оверсиз Инвестментс АГ», Лихтштрассе 35, 4056 Базель, Швейцария / Novartis Overseas Investments AG, Lichtstrasse 35, 4056 Basel, Switzerland.
Производитель
«Новартис Фарма Штейн АГ», Шаффхаузерштрассе, Штейн, 4332, Швейцария / Novartis Pharma Stein AG, Schaffhauserstrasse, 4332 Stein, Switzerland
Организация, принимающая претензии потребителя:
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 72, корпус 3
Указания по применению
Несовместимость
Данный лекарственный препарат не следует смешивать с другими лекарственными препаратами, поскольку исследования совместимости не проводились.
Особые меры предосторожности при хранении
Хранить в холодильнике при температуре 2-8 °С.
Невскрытый флакон можно хранить при комнатной температуре (25 °С) в течение 24 часов до использования.
Не замораживать.
Флакон следует хранить в картонной пачке во избежание попадания света.
Срок годности указан на флаконе.
Хранить в недоступном для детей месте.
В разных странах информация может различаться.
Указания по применению набора, включающего флакон с препаратом Визкью
Хранение и проверка
Хранить в холодильнике при температуре 2-8 °С; не замораживать. Флакон следует хранить в картонной пачке во избежание попадания света.
Невскрытый флакон можно хранить при комнатной температуре (25 °С) в течение 24 часов до использования. После вскрытия флакона следует соблюдать правила асептики.
Визкью представляет собой раствор от бесцветного до слегка коричневато-желтого цвета, от прозрачного до слегка опалесцирующего.
После извлечения препарата из холодильника и до проведения инъекции необходимо провести визуальный осмотр раствора. Не допускается использовать флакон при обнаружении видимых частиц или помутнений; в этом случае следует произвести надлежащую замену препарата.
Содержимое флакона и фильтрующая игла являются стерильными и предназначены исключительно для одноразового применения. Не использовать, если упаковка, флакон или фильтрующая игла повреждены либо истек их срок годности.
Как подготовить Визкью к введению
Интравитреальную инъекцию следует проводить в асептических условиях, что подразумевает хирургическую обработку рук медицинского персонала, использование стерильных перчаток, стерильной салфетки, стерильного векорасширителя (или его аналога) и, при необходимости, стерильных инструментов для парацентеза. Перед введением препарата необходимо провести надлежащую анестезию, а также продезинфицировать область вокруг глаз, кожу век и поверхность глаза местным бактерицидным средством широкого спектра действия.
Для приготовления раствора и проведения интравитреальной инъекции требуются следующие медицинские изделия одноразового применения:
- Инъекционная игла калибра 30G х ½», стерильная;
- Шприц объемом 1 мл с отметкой 0,05 мл, стерильный;
- Тупая фильтрующая игла на 5 мкм (18G х 1½», 1,2 мм х 40 мм), стерильная.
Инъекционная игла и шприц не включены в комплект поставки препарата Визкью.
Примечание: Доза должна быть установлена на 0,05 мл.
Инъекцию следует проводить сразу после приготовления препарата к введению (этап 8).
Процедура инъекции
1. Снимите с флакона крышку и протрите пробку флакона, например с помощью спиртовой салфетки.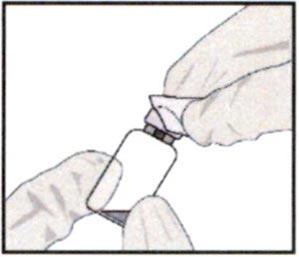
2. В асептических условиях наденьте фильтрующую иглу на шприц объемом 1 мл.
3. Проткните центр пробки флакона фильтрующей иглой и протолкните ее вниз до тех пор, пока игла не коснется дна флакона.
4. Держите флакон в слегка наклонном положении и медленно наберите всю жидкость из флакона и фильтрующей иглы.
При извлечении жидкости убедитесь, что поршень шприца вытянут на достаточное расстояние, чтобы в игле не осталось жидкости.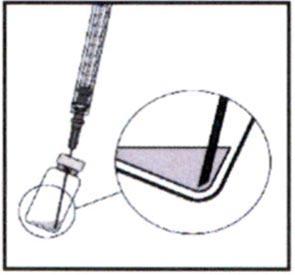
5. С соблюдением правил асептики отсоедините фильтрующую иглу от шприца и утилизируйте ее надлежащим образом.
Фильтрующая игла не предназначена для проведения интравитреальной инъекции.
6. В асептических условиях плотно соедините шприц с инъекционной иглой 30G х ½».
7. Возьмите шприц и поверните его иглой вверх, чтобы проверить на наличие пузырьков с воздухом. Если пузырьки с воздухом присутствуют, аккуратно постучите по шприцу пальцем, чтобы пузырьки поднялись вверх.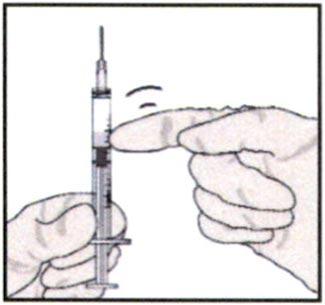
8. Тщательно удалите из шприца весь воздух и подведите поршень к отметке «0,05 мл». Шприц готов для инъекции.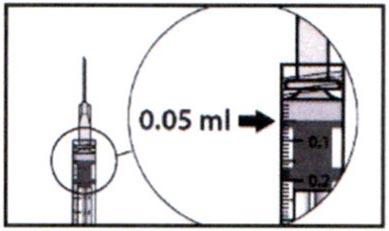
9. Для введения раствора объемом 0,05 мл медленно проведите инъекцию до тех пор, пока резиновая пробка не достигнет края шприца. Убедитесь в введении полной дозы, для чего проверьте, что резиновая пробка достигла края цилиндра шприца.
Примечание: Неиспользованный лекарственный препарат и использованный материал подлежат утилизации в соответствии с требованиями местного законодательства.
Часто задаваемые вопросы (В) и ответы (О) на них
В: Что делать, если из флакона трудно набрать достаточное количество жидкости?
О: Не встряхивайте флакон перед тем, как набрать жидкость; дайте жидкости стечь на дно флакона. Убедитесь в том, что флакон находится в вертикальном положении и слегка наклонен. Медленно оттяните поршень и подождите, пока жидкость не появится в цилиндре шприца. Продолжайте медленно оттягивать поршень до полного опорожнения флакона и фильтрующей иглы.
В: Что делать, если из жидкости не удается удалить все пузырьки с воздухом?
О: Важно, чтобы в растворе не было пузырьков воздуха. Однако мельчайшие пузырьки воздуха, связанные с пробкой, обычно не отделяются от нее во время инъекции, поэтому они не влияют на вводимый объем.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Визкью® (Vizk’yu)
💊 Состав препарата Визкью®
✅ Применение препарата Визкью®
Описание активных компонентов препарата
Визкью®
(Vizk’yu)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.02.07
Владелец регистрационного удостоверения:
Код ATX:
S01LA06
(Бролуцизумаб)
Лекарственная форма
| Визкью® |
Р-р д/внутриглазного введения 120 мг/1 мл: фл. 0.23 мл рег. №: ЛП-006598 |
Форма выпуска, упаковка и состав
препарата Визкью®
Раствор для внутриглазного введения от бесцветного до слегка коричневато-желтого цвета, от прозрачного до слегка опалесцирующего.
Вспомогательные вещества: сахароза, натрия цитрат, полисорбат 80, натрия гидроксид, вода д/и.
0.23 мл — флаконы из стекла класса I вместимостью 2 мл (1) в комплекте с иглой, снабженной фильтром — пачки картонные×.
× допускается наличие контроля первичного вскрытия на пачке картонной.
Фармакологическое действие
Средство для внутриглазного введения. Патологический ангиогенез в глазу и отек сетчатки связан с повышенной активизацией сигнального пути фактора роста эндотелия сосудов A (VEGF-A). Бролуцизумаб с высокой аффинностью связывается с различными изоформами VEGF-A (в частности с VEGF110, VEGF121 и VEGF165), тем самым препятствуя связыванию VEGF-А с его рецепторами VEGF-1 и VEGF-2. Подавляя связывание VEGF-А, бролуцизумаб угнетает пролиферацию эндотелиальных клеток, тем самым уменьшая патологическую неоваскуляризацию и снижая проницаемость сосудов.
Неоваскулярная (влажная) форма возрастной макулодистрофии (нВМД) характеризуется наличием патологической хориоидальной неоваскуляризации (ХНВ). Экссудация крови и жидкости из хориоидальных неоваскулярных мембран (ХНМ) может вызывать утолщение или отек сетчатки и (или) суб/интраретинальное кровоизлияние, приводящие к снижению остроты зрения.
В клинических исследованиях у пациентов, получавших бролуцизумаб, уже через 4 недели после начала лечения и вплоть до 48 и 96 недель наблюдалось снижение толщины центральной зоны сетчатки и количества интраретинальной/субретинальной жидкости или жидкости, находящейся под пигментным эпителием сетчатки.
Фармакокинетика
Бролуцизумаб вводят непосредственно в стекловидное тело с тем, чтобы он оказывал местное воздействие в тканях глаза. После интравитреального введения бролуцизумаба в дозе 6 мг в глаз пациентам с нВМД среднее значение Cmax свободного бролуцизумаба в плазме крови составляло 49.0 нг/мл (диапазон: 8.97-548 нг/мл); при этом Cmax достигалась через 1 сут. Бролуцизумаб — фрагмент моноклонального антитела, поэтому исследований метаболизма бролуцизумаба не проводили. Свободный бролуцизумаб представляет собой одноцепочечный фрагмент антитела и ожидается, что его выведение будет происходить за счет мишень-опосредованного распределения через связывание со свободным эндогенным VEGF, пассивного выведения почками и метаболизма, опосредованного протеолизом. После интравитреальных инъекций бролуцизумаб выводился из крови с кажущимся T1/2, составлявшим 4.3 сут. Приблизительно через 4 недели после введения системные концентрации у большинства пациентов находились на нижней границе предела количественного определения или ниже (<0.5 нг/мл).
Показания активных веществ препарата
Визкью®
Лечение неоваскулярной (влажной) формы возрастной макулярной дегенерации (нВМД).
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Рекомендуемая доза составляет 6 мг; первые 3 дозы вводят в виде интравитреальной инъекции с интервалом 4 недели (ежемесячно). Затем врач может подбирать интервалы между инъекциями в индивидуальном порядке, основываясь на активности заболевания, которая оценивается по остроте зрения и (или) анатомическим параметрам.
Побочное действие
Со стороны органа зрения: часто — снижение остроты зрения, кровоизлияние в сетчатку, увеит, ирит, отслойка стекловидного тела, разрыв сетчатки, катаракта, конъюнктивальное кровоизлияние, плавающие помутнения стекловидного тела, боль в глазу, повышение внутриглазного давления, конъюнктивит, разрыв пигментного эпителия сетчатки, затуманивание зрения, эрозия роговицы, точечный кератит; нечасто — эндофтальмит, слепота, окклюзия артерии сетчатки, конъюнктивальная инъекция, слезотечение, атипичные ощущения в глазу, отслойка пигментного эпителия сетчатки, витрит, воспалительная реакция во влаге передней камеры, иридоциклит, опалесценция влаги передней камеры, отек роговицы, кровоизлияние в стекловидное тело; неизвестно — окклюзия сосудов сетчатки, васкулит сетчатки. У пациентов, у которых на фоне лечения образовались антитела, наблюдалась повышенная частота внутриглазного воспаления.
Со стороны иммунной системы: часто — кожная сыпь, кожный зуд, эритема.
Противопоказания к применению
Повышенная чувствительность к бролуцизумабу; активные или предполагаемые инфекционные заболевания глаза или окологлазничной области, активное внутриглазное воспаление.
Применение при беременности и кормлении грудью
Женщин с сохраненным репродуктивным потенциалом следует предупреждать о необходимости применять эффективные методы контрацепции (методы, обеспечивающие частоту беременности менее 1%) во время лечения бролуцизумабом и в течение по крайней мере одного месяца после последней инъекции при прекращении лечения бролуцизумабом.
Адекватных и хорошо контролируемых исследований с применением бролуцизумаба у беременных женщин не проводили. Исследования репродуктивной токсичности на животных являются недостаточными. Хотя системное воздействие после введения препарата в глаз очень незначительное, бролуцизумаб не следует применять во время беременности, если потенциальная польза не превышает потенциальный риск для плода.
Неизвестно проникает ли бролуцизумаб в грудное молоко человека. Риск для ребенка на грудном вскармливании исключить нельзя. Не рекомендуется применять бролуцизумаб во время кормления грудью. Не следует начинать кормление грудью в течение, по крайней мере, одного месяца после последней дозы при прекращении лечения бролуцизумабом. Решение о прекращении грудного вскармливания или воздержании от терапии бролуцизумабом следует принимать с учетом пользы грудного вскармливания для ребенка и пользы терапии.
Исследования влияния на репродуктивную функцию и фертильность не проводились. Было показано, что подавление активности VEGF влияет на развитие фолликулов, функцию желтого тела и фертильность. Исходя из механизма действия ингибиторов VEGF, данное средство может неблагоприятно влиять на репродуктивную функцию у женщин, а также на ранний и поздний эмбриогенез.
Применение при нарушениях функции печени
Коррекция дозы не требуется.
Применение при нарушениях функции почек
Коррекция дозы не требуется.
Применение у детей
Безопасность и эффективность применения у детей и подростков в возрасте до 18 лет не установлены.
Применение у пожилых пациентов
Препарат разрешен для применения у пожилых пациентов.
Особые указания
При возникновении васкулита сетчатки и/или окклюзии сосудов сетчатки, сопровождающиеся, как правило, внутриглазным воспалением лечение бролуцизумабом следует прекратить и незамедлительно обеспечить пациенту соответствующее лечение и наблюдение.
Особую осторожность следует соблюдать у пациентов с неконтролируемой глаукомой (не следует вводить бролуцизумаб, если внутриглазное давление >30 мм рт. ст.). Следует контролировать внутриглазное давление и перфузию диска зрительного нерва и при необходимости проводить надлежащее лечение.
Эффективность и безопасность инъекций бролуцизумаба одновременно в оба глаза не изучали
Очередную инъекцию ингибитора VEGF следует отменить и не производить до следующей запланированной инъекции в следующих случаях:
- снижение МКОЗ на ≥30 букв по сравнению с последним определением;
- разрыв сетчатки;
- субретинальные кровоизлияния, затрагивающие центральную часть фовеа или если площадь кровоизлияния составляет >50% площади поражения;
- в течение 28 дней до или после внутриглазного хирургического вмешательства.
Пациенты с выявленной обширной и/или высокой отслойкой пигментного эпителия сетчатки входят в группу риска развития разрыва пигментного эпителия сетчатки при применении анти-VEGF препаратов у пациентов с нВМД.
У пациентов с регматогенной отслойкой сетчатки или макулярным отверстием 3, 4 стадии лечение препаратом следует прекратить.
При интравитреальном введении ингибиторов VEGF возможно развитие системных побочных эффектов, включая кровотечения внеглазной локализации и артериальные тромбоэмболии. Существует вероятная теоретическая связь этих явлений с ингибированием VEGF.
Данные по безопасности применения бролуцизумаба у пациентов с ВМД с инсультом, транзиторной ишемической атакой или инфарктом миокарда в анамнезе за последние 3 месяца ограничены. У таких пациентов бролуцизумаб следует применять с осторожностью
Влияние на способность к управлению транспортными средствами и механизмами
После интравитреальной инъекции бролуцизумаба и связанного с ней исследования глаза у пациентов могут возникать временные нарушения зрения, в связи с чем им рекомендуется воздерживаться от управления транспортным средством и работы с механизмами до тех пор, пока зрительная функция не восстановится в достаточной степени.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
1 мл раствора для инъекций содержит 120 мг бролуцизумаба;
вспомогательные вещества: сахароза, натрия цитрат, полисорбат 80, натрия гидроксид, вода для инъекций.
Прозрачный или слегка опалесцирующий, бесцветный или слегка коричневато-желтый водный раствор.
Средства, применяемые при сосудистых заболеваниях глаз. Антинеоваскулярные средства. Код ATX: S01LA06.
Фармакодинамика
Механизм действия
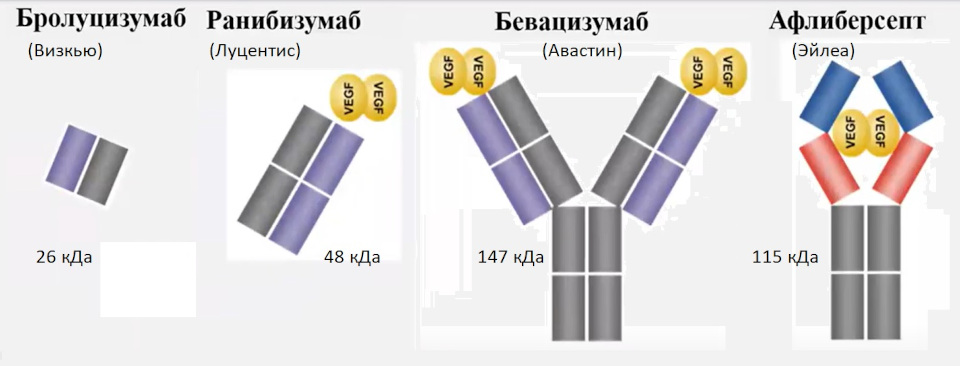
Бролуцизумаб представляет собой фрагмент гуманизированного моноклонального одноцепочечного антитела Fv (scFv) с молекулярной массой ~26 кДа.
Повышенные уровни передачи сигналов через путь фактора роста эндотелия сосудов A (VEGF А) связаны с патологическим ангиогенезом в глазу и отеком сетчатки. Бролуцизумаб связывается с высокой аффинностью с изоформами VEGF А (например, VEGF по, VEGF 121 и VEGFies), таким образом предотвращая связывание VEGF А с его рецепторами VEGFR 1 и VEGFR 2. За счет ингибирования связывания VEGF А бролуцизумаб подавляет пролиферацию эндотелиальных клеток, тем самым снижая патологическую неоваскуляризацию и уменьшая проницаемость сосудов.
Фармакодинамические эффекты
Неоваскулярная (влажная) возрастная макулярная дегенерация (ВМД) характеризуется патологической хориоидальной неоваскуляризацией (ХНВ). Излияние крови и жидкости при ХНВ может вызвать утолщение сетчатки или отек и/или внутриретинальное/субретинальное кровоизлияние, что приводит к потере остроты зрения.
В исследованиях HAWK и HARRIER анатомические параметры были частью оценки активности заболевания, определяющей терапевтические решения. Уменьшение толщины фовеальной зоны сетчатки (ФЗС) в присутствии внутриретинальной/субретинальной жидкости (ВРЖ /СРЖ) или субретинального пигментного эпителия (суб-РПЭ) наблюдалось у пациентов, получавших Визкью™, уже через 4 недели после начала терапии и вплоть до 48 и 96 недели.
На 16 неделе уменьшение толщины ФЗС было статистически значимым при применении Визкью™ по сравнению с афлиберцептом в обоих исследованиях (HAWK: 161 против 134 микрон; HARRIER: 174 против 134 микрон). Это уменьшение по сравнению с исходной Т1ДЗС также было статистически значимым на 48 неделе (HAWK: 173 против 144 микрон; HARRIER: 194 против 144 микрон) и сохранялось до окончания каждого исследования на 96 неделе (HAWK: 175 против 149 микрон) HARRIER: 198 против 155 микрон).
На 16 неделе относительная разница у пациентов с ВРЖ и/или СРЖ было статистически значимой при применении Визкью™ и афлиберцепта в обоих исследованиях (HAWK: 34% против 52%; HARRIER: 29% против 45%). Эта разница была также статистически значимой на 48 неделе (HAWK: 31% против 45%; HARRIER: 26% против 44%) и сохранялась до окончания каждого исследования на 96 неделе (HAWK: 24% против 37%; HARRIER: 24% против 39%).
На 16 неделе относительная разница у пациентов с суб-РПЭ было статистически значимой при применении Визкью™ и афлиберцепта в обоих исследованиях (HAWK: 19% против 27%; HARRIER: 16% против 24%). Эта разница была также статистически значимой на 48 неделе (HAWK: 14% против 22%; HARRIER: 13% против 22%) и сохранялась до окончания каждого исследования на 96 неделе (HAWK: 11% против 15%; HARRIER: 17% против 22%).
В этих исследованиях у пациентов, получавших Визкью™, уменьшение размеров поражения ХНВ наблюдалось уже через 12 недель, а также на 48 и 96 неделе после начала лечения.
Клиническая эффективность и безопасность
Эффективность и безопасность Визкью™ оценивали в двух рандомизированных многоцентровых двойных слепых активно контролируемых исследованиях фазы III (HAWK и HARRIER) у пациентов с неоваскулярной (влажной) ВМД. Всего в этих исследованиях за 2 года лечение получили 1817 пациентов (1088 — Визкью™ и 729 — препаратом сравнения афлиберцептом). Возраст пациентов варьировался от 50 до 97 лет, средний возраст составлял 76 лет.
В обоих исследованиях после первых 3 ежемесячных доз (0, 4 и 8 неделя) пациенты в группе бролуцизумаба получали лечение каждые 12 недель с возможностью корректировки интервала дозирования каждые 8 недель в зависимости от активности заболевания. Активность заболевания оценивалась врачом в течение первых 12 недель (16 и 20 неделя) и при каждом последующем запланированном визите через 12 недель. У пациентов с активным заболеванием (например, снижение остроты зрения, увеличение толщины ФЗС и/или присутствие ВРЖ/СРЖ или суб-РПЭ) во время любого из этих визитов схему корректировали на 8-недельный интервал лечения. Препарат сравнения афлиберцепт вводили каждые 8 недель после первых 3-х ежемесячных доз.
Результаты
Первичной конечной точкой эффективности в исследованиях было изменение наилучшей скорректированной остроты зрения (НСОЗ) от исходного уровня до 48 недели, что измерялось по буквенному показателю исследования раннего лечения диабетической ретинопатии (РЛДР). При этом основной целью было продемонстрировать не меньшую эффективность Визкью™ по сравнению с афлиберцептом. В обоих исследованиях Визкью™ (вводимый каждые 12 недель или каждые 8 недель) продемонстрировал не меньшую эффективность, чем афлиберцепт 2 мг (вводимый каждые 8 недель). Наблюдаемое в первый год улучшение остроты зрения сохранялось на второй год.
Детальные результаты обоих исследований приведены ниже в Таблице 1 и на Рис. 1.
Таблица 1. Результаты для остроты зрения на 48 и 96 неделе в исследованиях III фазы HAWK и HARRIER
| HAWK | HARRIER | ||||||
| Результат по эффективности | Неделя |
Визкью™ 6 мг (n=360) |
Афлиберцепт 2 мг (n=360) |
Разница (95% ДИ) бролуцизумаб — афлиберцепт |
Визкью™ 6 мг (n=370) |
Афлиберцепт 2 мг (n=369) |
Разница (95% ДИ) бролуцизумаб — афлиберцепт |
| Среднее изменение НСОЗ от исходного уровня (измеряется по буквенному показателю РЛДР) | 48 |
6.6 (СО=0.71) |
6.8 (СО=0.71) |
-0.2 (-2.1, 1.8) Р<0.0001 а) |
6.9 (СО=0.61) |
7.6 (СО=0.61) |
-0.7 (-2.4, 1.0) Р <0.0001а) |
| 36 — 48b) |
6.7 (СО=0.68) |
6.7 (СО=0.68) |
0.0 (-1.9, 1.9) Р<0.0001 а) |
6.5 (СО=0.58) |
7.7 (СО=0.58) |
-1.2 (-2.8, 0.4) Р=0.0003 а) |
|
| 96 |
5.9 (СО=0.78) |
5.3 (СО=0.78) |
0.5 (-1.6, 2.7) |
6.1 (СО=0.73) |
6.6 (СО=0.73) |
-0.4 (-2.5, 1.6) |
|
| % пациентов с улучшением зрения мин. на 15 букв | 48 | 33.6 | 25.4 |
8.2 (2.2, 15.0) |
29.3 | 29.9 |
-0.6 (-7.1, 5.8) |
| 96 | 34.2 | 27.0 |
7.2 (1.4, 13.8) |
29.1 | 31.5 |
-2.4 (-8.8, 4.1) |
|
| % пациентов со снижением остроты зрения (%) (потеря НСОЗ на ≥15 букв) | 48 | 6.4 | 5.5 |
0.9 (-2.7, 4.3) |
3.8 | 4.8 |
-1.0 (-3.9, 2.2) |
| 96 | 8.1 | 7.4 |
0.7 (-3.6, 4.6) |
7.1 | 7.5 |
-0.4 (-3.8, 3.3) |
|
|
НСОЗ: наилучшая скорректированная острота зрения; отсутствующие данные рассчитаны с использованием метода переноса вперед данных последнего наблюдения (LOCF) РЛДР: исследование раннего лечения диабетической ретинопатии a) P-значение, связанное с гипотезой не меньшей эффективности с допустимым запасом 4,0 буквы. b) Ключевая вторичная конечная точка, учитывающая разницу во времени терапии Визкью™ и афлиберцептом. СО — стандартная ошибка |
Рис. 1 Среднее изменение остроты зрения от исходного уровня до 96 недели в исследованиях HAWK и HARRIER


Эти улучшения остроты зрения были достигнуты у 56% и 51% пациентов, получавших Визкью™ 6 мг с 12-недельным интервалом дозирования на 48 неделе, и у 45% и 39% пациентов на 96 неделе в исследованиях HAWK и HARRIER соответственно. Среди пациентов, определенных как подходящие для 12-недельного режима в течение первого 12-недельного интервала, у 85% и 82% 12-недельный интервал сохранялся вплоть до 48 недели. Среди пациентов, которым был определен 12-недельный интервал на 48 неделе, у 82% и 75% 12-недельный интервал сохранялся вплоть до 96 недели.
Влияние лечения в оцениваемых подгруппах (например, возраст, пол, раса, острота зрения на исходном уровне, толщина сетчатки на исходном уровне, тип повреждения, размер повреждения, жидкостный статус) в каждом исследовании в целом соответствовало результатам для общей популяции.
Активность заболевания оценивали по изменениям остроты зрения и/или анатомических параметров, включая толщину ФЗС и/или наличие ВРЖ/СРЖ или суб-РПЭ. Активность заболевания оценивали на протяжении всей длительности исследований. Анатомические параметры активности заболевания снизились на 48 и 96 неделе в группе Визкью™ по сравнению с афлиберцептом (см. раздел «Фармакодинамические эффекты»).
Относительная разница у пациентов с активностью заболевания на 16 неделе была статистически значимой в группе Визкью™ по сравнению с афлиберцептом (24% против 35% в исследовании HAWK, р=0.0013; 23% против 32% в исследовании HARRIER, р=0.0021).
В обоих исследованиях Визкью™ продемонстрировал клинически значимое улучшение предварительно определенной вторичной конечной точки эффективности — результатов, основанных на опросе пациентов с использованием Опросника по оценке зрительной функции Национального офтальмологического института (NEI VFQ 25), по сравнению с исходным уровнем. Величина этих изменений была аналогична установленной в опубликованных исследованиях, что соответствовало увеличению НСОЗ на 15 букв. Польза согласно результатам, основанным на опросе пациентов, сохранялась на второй год.
Клинически значимые различия между Визкью™ и афлиберцептом с точки зрения изменений общего балла по шкале NEI VFQ 25 и подшкалах (общее качество зрения, боль в глазах, зрение вблизи, зрение вдали, социальное функционирование, психическое здоровье, ролевые трудности, зависимость, вождение, цветное зрение и периферическое зрение) от исходного уровня до 48 недели отсутствовали.
Дети
Европейское агентство по лекарственным средствам отменило требование обязательного представления результатов исследований Визкью™ у детей всех категорий (информацию об использовании у детей см. в разделе «Дозировка и способ применения»).
Фармакокинетика
Визкью™ вводят непосредственно в стекловидное тело для местного действия в глазу.
Поглощение и распределение
После интравитреального введения 6 мг/глаз бролуцизумаба пациентам с нВМД, средняя геометрическая Сmax свободного бролуцизумаба в плазме составляла 49,0 нг/мл (диапазон: от 8,97 до 548 нг/мл) и достигалась через 1 день.
Биотрансформация и выведение
Бролуцизумаб является фрагментом моноклонального антитела; исследования метаболизма не проводились. Будучи одноцепочечным фрагментом антитела. свободный бролуцизумаб должен выводиться путем целевой опосредованной элиминации путем связывания со свободным эндогенным VEGF, а также пассивной элиминации с мочой. Метаболизм бролуцизумаба происходит через протеолиз.
После интравитреальных инъекций бролуцизумаб выводился с установленным системным периодом полувыведения 4,4 дня. Концентрации, как правило, были близки или ниже предела количественного определения (<0,5 нг/мл) приблизительно через 4 недели после введения дозы у большинства пациентов. Бролуцизумаб не накапливался в сыворотке крове при интравитреальном введении каждые 4 недели.
Особые категории пациентов
Пожилые пациенты
Значимых различий в системной фармакокинетике после интравитреального введения в исследовании 22 пациентов в возрасте от 65 до 74 лет, 18 пациентов в возрасте от 75 до 84 лет и 3 пациентов в возрасте ≥85 лет не было.
Почечная недостаточность
Системную фармакокинетику бролуцизумаба оценивали у пациентов с нВМД и нормальной функцией почек (≥90 мл/мин [n = 21]), легкой (от 60 до <90 мл/мин [n = 22]) или умеренной (от 30 до <60 мл)/мин [n = 7]) почечной недостаточностью. В то время как средние значения системного клиренса у пациентов с легкой или умеренной почечной недостаточностью были в целом ниже, чем у пациентов с нормальной функцией почек, значительное влияние легкой и умеренной почечной недостаточности на общее системное воздействие бролуцизумаба не наблюдалось. Бролуцизумаб не изучался у пациентов с тяжелой (<30 мл/мин) почечной недостаточностью.
Печеночная недостаточность
Бролуцизумаб не изучался у пациентов печеночной недостаточностью. Печеночная недостаточность от легкой до тяжелой степени не должна влиять на общее системное воздействие бролуцизумаба, поскольку метаболизм происходит через протеолиз и не зависит от функции печени.
Доклинические данные о безопасности
Исследования канцерогенного или мутагенного потенциала бролуцизумаба не проводились.
Исследования репродуктивной функции у животных не проводились.
• Визкью™ показан для лечения неоваскулярной (влажной) возрастной макулярной дегенерации (ВМД) у взрослых.
Визкью™ должен вводиться квалифицированным офтальмологом, имеющим опыт интравитреальных инъекций.
Дозировка
Рекомендуемая доза составляет 6 мг бролуцизумаба (0,05 мл раствора), вводимого путем интравитреальных инъекций каждые 4 недели (ежемесячно) для первых 3 доз. После этого врач может индивидуально подобрать интервалы лечения исходя из активности заболевания, оцениваемой по остроте зрения и/или анатомическим параметрам. Оценку активности заболевания предлагается проводить через 16 недель (4 месяца) после начала лечения. У пациентов с неактивным заболеванием необходимость лечения следует рассматривать каждые 12 недель (3 месяца). У пациентов с активным заболеванием необходимость лечения следует рассматривать каждые 8 недель (2 месяца). Врач может дополнительно индивидуально подбирать интервалы лечения в зависимости от активности заболевания.
Если оценка качества зрения и анатомических параметров указывает на то, что пациент не извлекает пользу от лечения, применение Визкью™ следует прекратить.
Особые категории пациентов
Пожилые пациенты
Корректировка дозы у пациентов в возрасте от 65 лет не требуется (см. подраздел «Фармакокинетика»).
Почечная недостаточность
Корректировка дозы у пациентов с почечной недостаточностью не требуется (см. подраздел «Фармакокинетика»).
Печеночная недостаточность
Бролуцизумаб не изучался у пациентов с печеночной недостаточностью. Корректировка дозы у пациентов с печеночной недостаточностью не требуется (см. подраздел «Фармакокинетика»).
Дети
Безопасность и эффективность бролуцизумаба у детей и подростков младше 18 лет не установлены. Данные отсутствуют.
Способ применения
Визкью™ предназначен только для интравитреального применения.
Раствор для инъекций необходимо проверять визуально до введения (см. ниже подраздел «Инструкция по применению флакона»).
Процедуру интравитреальной инъекции следует проводить в асептических условиях, что включает использование хирургического дезинфектора рук, стерильных перчаток, стерильной салфетки и стерильного зеркала для век (или эквивалента). Стерильное оборудование для парацентеза должно быть доступно в качестве меры предосторожности. Следует тщательно оценить историю болезни пациента на предмет реакций гиперчувствительности до проведения интравитреальной инъекции (см. раздел «Противопоказания»), Перед инъекцией необходимо обеспечить достаточную анестезию и использовать местный антисептик широкого спектра действия для дезинфекции периокулярной кожи, века и поверхности глаза.
Инъекционную иглу следует вводить на 3,5-4,0 мм позади лимба в полость стекловидного тела, избегая горизонтального меридиана и направляясь к центру глазного яблока. Затем медленно доставляется вводимый объем 0,05 мл; для последующих инъекций следует использовать другую область склеры.
Сразу после интравитреальной инъекции пациентам следует обеспечить контроль на предмет повышения внутриглазного давления. Соответствующий контроль может состоять из проверки перфузии диска зрительного нерва или тонометрии. При необходимости должно быть доступно стерильное оборудование для парацентеза.
После интравитреальной инъекции пациенты должны немедленно сообщать о любых симптомах, свидетельствующих об эндофтальмите (например, боль в глазах, покраснение глаз, фотофобия, нарушение зрения).
Флакон предназначен только для одноразового использования. Каждый флакон следует использовать только для лечения одного глаза.
Объем, содержащийся во флаконе, превышает рекомендованную дозу 6 мг. Извлекаемый объем флакона (0,23 мл) не должен использоваться полностью. Излишек следует удалить до инъекции. Введение всего объема флакона может привести к передозировке. Вводимая доза должна быть установлена на отметке 0,05 мл, т.е. 6 мг бролуцизумаба.
Раствор следует визуально осмотреть после извлечения из холодильника и до введения. В случае присутствия видимых частиц или помутнения флакон не следует использовать. Необходимо выполнить соответствующие процедуры замены.
Содержимое флакона и фильтровальная игла стерильны и предназначены только для одноразового использования. Не следует применять препарат, если упаковка, флакон и/или фильтровальная игла повреждены или их срок годности истек. Подробные инструкции по применению приведены в Инструкции по медицинскому применению лекарственного средства.
Неиспользованное лекарственное средство или отходы следует утилизировать в соответствии с требованиями местного законодательства.
Следующая информация предназначена только для медицинских работников:
Инструкция по применению флакона
Хранение и осмотр

Перед использованием запечатанный флакон Визкью™ можно хранить при комнатной температуре (ниже 25 ° С) в течение макс. 24 часов. После вскрытия флакона необходимо работать в асептических условиях.
Визкью™ представляет собой прозрачный, слегка опалесцирующий, бесцветный или слегка коричневато-желтый водный раствор.
Раствор следует визуально осмотреть после изъятия из холодильника и до введения. В случае присутствия видимых частиц или помутнения флакон не следует использовать. Необходимо выполнить соответствующие процедуры замены.
Содержимое флакона и фильтровальная игла стерильны и предназначены только для одноразового использования. Не следует применять препарат, если упаковка, флакон и/или фильтровальная игла повреждены или их срок годности истек.
Порядок приготовления и введения Визкью™
Объем, содержащийся во флаконе, превышает рекомендованную дозу 6 мг. Извлекаемый объем флакона (0,23 мл) не должен использоваться полностью. Излишек следует удалить до инъекции. Введение всего объема флакона может привести к передозировке.
Процедуру интравитреальной инъекции следует проводить в асептических условиях, что включает использование хирургического дезинфектора рук. стерильных перчаток, стерильной салфетки и стерильного зеркала для век (или их эквивалента), а также наличие стерильного оборудования для парацентеза (при необходимости).
Перед инъекцией необходимо обеспечить достаточную анестезию и использовать местный антисептик широкого спектра действия для дезинфекции периокулярной кожи, века и поверхности глаза.
Для подготовки и интравитреального введения необходимы следующие одноразовые медицинские устройства:
• Стерильная инъекционная игла 30G × ½ д.
• Стерильный 1 мл шприц со шкалой деления 0,05 мл.
• Стерильная тупоконечная фильтровальная игла 5 мкм (18G × 1½д, 1.2 мм × 40 мм).
Инъекционная игла и шприц не входят в комплект поставки Визкью™.
Инъекция должна вводиться сразу после приготовления дозы (шаг 8).
Примечание: доза должна быть установлена на 0,05 мл.
Порядок введения
1. 
|
Снять крышку флакона и протереть перегородку флакона (например, тампоном с 70% спиртом). |
| 2. | Установить фильтровальную иглу на шприц 1 мл в асептических условиях. |
| 3. | Протолкнуть фильтровальную иглу в центр перегородки флакона, пока игла не коснется дна флакона. |
4. 
|
Для извлечения жидкости держать флакон слегка наклоненным и медленно извлечь всю жидкость из флакона и фильтровальной иглы. Для полного опорожнения фильтровальной иглы необходимо убедиться, что шток поршня достаточно вытянут назад при опорожнении флакона. |
| 5. | Асептически отсоединить фильтровальную иглу от шприца и утилизировать ее. Фильтровальная игла не должна использоваться для интравитреального введения. |
| 6. | Надежно установить иглу 30G × ½ д на шприц в асептических условиях. |
7. 
|
Чтобы проверить препарат на наличие пузырьков воздуха, держать шприц иглой вверх. При наличии пузырьков воздуха осторожно постучать пальцем по шприцу, пока пузырьки не поднимутся наверх. |
8. 
|
Держа шприц на уровне глаз, осторожно нажать на поршень для удаления воздуха вместе с излишком раствора из шприца, скорректировать дозу до отметки 0,05 мл. Шприц готов к введению. |
| 9. | Медленно вводить препарат, пока наконечник поршня не достигнет конца цилиндра шприца, что соответствует доставленному объему 0,05 мл. Введение полной дозы подтверждают, проверив, что наконечник поршня достиг конца цилиндра шприца. |
Примечание: неиспользованное лекарственное средство или отходы следует утилизировать в соответствии с местными требованиями.
Частые вопросы и ответы
В: Что делать, если у меня не получается извлечь достаточное количества жидкости из флакона?
О: Не встряхивайте флакон перед извлечением. Дайте жидкости осесть на дно флакона. Убедитесь, что флакон находится в вертикальном, слегка наклонном положении. Медленно извлеките поршень и подождите, пока жидкость не появится в цилиндре шприца. Продолжайте медленно извлекать препарат до полного опорожнения флакона и фильтровальной иглы.
В: Что делать, если у меня не получается удалить все пузырьки воздуха из жидкости?
О: Важно, чтобы жидкость не содержала воздуха. Однако крошечные пузырьки воздуха на пробке обычно не отсоединяются от нее во время введения и, следовательно, не влияют на объем дозы.
• Гиперчувствительность к действующему веществу или любому из вспомогательных веществ, указанных в разделе «Состав».
• Пациенты с активными или подозреваемыми глазными или периокулярными инфекциями.
• Пациенты с активным внутриглазным воспалением.
Отслеживаемость
Для улучшения отслеживаемости биологических лекарственных средств, торговое наименование и номер серии введенного продукта должны четко документироваться.
Эндофтальмит, внутриглазное воспаление, травматическая катаракта, отслоение сетчатки, васкулит сетчатки и/или окключия сосудов сетчатки
Интравитреальные инъекции, в том числе Визкью™, связаны с эндофтальмитом, внутриглазным воспалением, травматической катарактой и отслоением сетчатки (см. раздел «Побочные реакции»). Надлежащие методы асептического введения всегда должны использоваться при применении Визкью™.
При применении Визкью™ сообщалось о васкулите сетчатки и/или окклюзии сосудов сетчатки, как правило с внутриглазным воспалением (см. разделы «Противопоказания» и «Побочные реакции»). Пациенты должны немедленно сообщать о любых симптомах, указывающих на описанные выше явления.
Повышение внутриглазного давления
Временное повышение внутриглазного давления отмечалось в течение 30 минут после интравитреального введения ингибиторов фактора роста эндотелия сосудов (VEGF), включая бролуцизумаб (см. раздел «Побочные реакции»). Особые меры предосторожности требуются у пациентов с плохо контролируемой глаукомой (Визкью™ не следует применять при внутриглазном давлении ≥30 мм рт. ст.). Необходимо обеспечивать надлежащий контроль и корректировку как внутриглазного давления, так и перфузии диска зрительного нерва.
Двустороннее лечение
Безопасность и эффективность бролуцизумаба при одновременном введении в оба глаза не изучались.
Иммуногенность
Поскольку бролуцизумаб является терапевтическим белком, его применение подразумевает вероятность иммуногенности (см. раздел «Побочные реакции»). Пациенты должны сообщать своему врачу в случае возникновения таких симптомов, как боль в глазах или усиление дискомфорта, ухудшающееся покраснение глаз, помутнение или снижение зрения, увеличение количества мелких частиц в поле зрения или повышенная светочувствительность (см. раздел «Побочные реакции»).
Сопутствующее применение других анти—VEGF
Данные о сопутствующем применении Визкью™ с другими ингибиторами VEGF в одном глазу отсутствуют. Бролуцизумаб не следует вводить одновременно с другими ингибиторами VEGF (системными или местными).
Отсрочка лечения
При интравитреальном введении ингибиторов VEGF дозу следует отсрочить и лечение не следует возобновлять раньше, чем следующая запланированная процедура в следующих случаях:
• снижение наилучшей скорректированной остроты зрения (НСОЗ) на > 30 букв по сравнению с последней оценкой;
• разрыв сетчатки;
• субретинальное кровоизлияние в центре ямки или если размер кровоизлияния составляет ≥50% от общей площади пораженной области;
• проведенная или запланированная внутриглазная хирургическая операция в течение предыдущих или следующих 28 дней.
Разрыв пигментного эпителия сетчатки
Факторы риска, связанные с разрывом пигментного эпителия сетчатки после терапии влажной ВМД ингибиторами VEGF, включают обширное и/или высокое отслоение пигментного эпителия сетчатки. При начале терапии бролуцизумабом следует соблюдать осторожность у пациентов с факторами риска разрыва пигментного эпителия сетчатки.
Регматогенное отслоение сетчатки или макулярная перфорация
Лечение следует прекратить у пациентов с регматогенным отслоением сетчатки или макулярной перфорацией 3 или 4 стадии.
Системные эффекты после интравитреального применения
Сообщалось о системных побочных эффектах, включая неглазные кровоизлияния и артериальные тромбоэмболические явления, после интравитреального введения ингибиторов VEGF. Существует теоретический риск того, что эти явления могут быть связаны с ингибированием VEGF. Данные о безопасности лечения пациентов с ВМД, перенесших инсульт, транзиторные ишемические приступы или инфаркт миокарда в течение последних 3 месяцев, ограничены. При лечении таких пациентов следует соблюдать осторожность.
Содержание натрия
Данный лекарственный препарат содержит менее 1 ммоль натрия (23 мг) на дозу, то есть фактически не содержит натрий.
Исследования взаимодействия не проводились.
Женщины репродуктивного возраста
Женщинам репродуктивного возраста следует использовать эффективную контрацепцию во время лечения бролуцизумабом и в течение минимум одного месяца после введения последней дозы при прекращении лечения бролуцизумабом.
Беременность
Данные об использовании бролуцизумаба у беременных отсутствуют или ограничены. Количество исследований репродуктивной токсичности у животных недостаточно (см. раздел «Доклинические данные о безопасности»). Хотя системное воздействие после интравитреального введения очень низкое, бролуцизумаб не следует использовать во время беременности, если только потенциальная польза не превышает потенциальный риск для плода.
Кормление грудью
Неизвестно, проникает ли бролуцизумаб в грудное молоко. Риск для новорожденного/младенца на грудном вскармливании не может быть исключен. Бролуцизумаб не рекомендуется во время кормления грудью. Грудное вскармливание не следует начинать в течение минимум одного месяца после введения последней дозы при прекращении лечения бролуцизумабом. Необходимо принять решение о том, следует ли прекратить грудное вскармливание или воздержаться от терапии бролуцизумабом, учитывая пользу грудного вскармливания для ребенка и пользу терапии для матери.
Репродуктивная функция
Исследования репродуктивной функции и фертильности не проводились. Было установлено, что ингибирование VEGF влияет на развитие фолликула, функции желтого тела и фертильность. Основываясь на механизме действия ингибиторов VEGF, существует потенциальный риск для репродуктивной функции женщины и эмбриофетального развития.
Визкью™ оказывает незначительное влияние на способность управлять транспортными средствами или работать с другими автоматизированными системами вследствие возможных временных нарушений зрения после интравитреального введения и, связанного с этим, осмотра. Пациентам не следует управлять транспортными средствами или работать с другими автоматизированными системами, пока зрительная функция не восстановится.
Резюме профиля безопасности
Наиболее частыми побочными реакциями были снижение остроты зрения (7,3%), катаракта (7,0%), кровоизлияние в конъюнктиву (6,3%) и плавающие помутнения стекловидного тела (5,1%).
Наиболее серьезными побочными реакциями были слепота (0,8%), эндофтальмит (0,7%), окклюзия артерии сетчатки (0,8%) и отслоение сетчатки (0,7%).
Табличный перечень побочных реакций
Побочные реакции (Таблица 2) перечислены в соответствии с классом системы органов MedDRA. В каждом классе системы органа побочные реакции расположены по частоте, т.е. наиболее частые реакции указаны первыми. Категории частоты для каждой побочной реакции основаны на следующих условных обозначениях: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (≥1/10000 до <1/1000), очень редко (<1/10000), неизвестно (невозможно оценить на основании имеющихся данных). В каждой группе частоты побочные реакции представлены в порядке уменьшения серьезности.
Таблица 2 Частота побочных реакций в клинических исследованиях и на основании опыта пострегистрационного применения
| Класс системы органов MedDRA | Категория частоты |
| Нарушения со стороны иммунной системы | |
| Гиперчувствительность (в том числе крапивница, сыпь, зуд, эритема) | Часто |
| Нарушения со стороны органа зрения | |
| Снижение остроты зрения | Часто |
| Кровоизлияние в сетчатку | Часто |
| Увеит | Часто |
| Ирит | Часто |
| Отслоение стекловидного тела | Часто |
| Разрыв сетчатки | Часто |
| Катаракта | Часто |
| Конъюнктивальное кровоизлияние | Часто |
| Плавающие помутнения стекловидного тела | Часто |
| Боль в глазу | Часто |
| Повышение внутриглазного давления | Часто |
| Конъюнктивит | Часто |
| Разрыв пигментного эпителия сетчатки | Часто |
| Помутнение зрения | Часто |
| Истирание роговицы | Часто |
| Точечный кератит | Часто |
| Слепота | Нечасто |
| Эндофтальмит | Нечасто |
| Окклюзия артерии сетчатки | Нечасто |
| Отслоение сетчатки | Нечасто |
| Конъюнктивальная гиперемия | Нечасто |
| Повышенное слезотечение | Нечасто |
| Ощущение инородного тела в глазу | Нечасто |
| Отслоение пигментного эпителия сетчатки | Нечасто |
| Витрит | Нечасто |
| Воспаление передней камеры глаза | Нечасто |
| Иридоциклит | Нечасто |
| Обострение воспаления передней камеры глаза | Нечасто |
| Отек роговицы | Нечасто |
| Кровоизлияние в стекловидное тело | Нечасто |
| Окклюзия сосудов сетчатки | Неизвестно |
| Васкулит сетчатки | Неизвестно |
Описание некоторых побочных реакций
Иммуногенность
У пациентов, которым проводится терапия Визкью™, существует потенциал иммунного отклика. После применения Визкью™ в течение 88 недель лечения повышение уровня антител к бролуцизумабу было выявлено у 23-25% пациентов. Среди пациентов с повышением уровня антител наблюдалось увеличение частоты внутриглазного воспаления. Клиническое значение антител к бролуцизумабу для безопасности в настоящее время не установлено. Антитела к бролуцизумабу не влияли на клиническую эффективность.
Побочные реакции, связанные с классом препарата
Существует теоретический риск артериальных тромбоэмболических явлений, включая инсульт и инфаркт миокарда, после интравитреального применения ингибиторов VEGF. Низкая частота артериальных тромбоэмболических явлений наблюдалась в клинических исследованиях бролуцизумаба у пациентов с ВМД. Значительных или заметных различий между группами, получавшими бролуцизумаб и препарат сравнения, не было.
Информирование о подозреваемых побочных реакциях
Информирование о подозрениях на побочные реакции после регистрации лекарственного средства имеет важное значение. Это позволяет вести непрерывный мониторинг соотношения польза/риск препарата. Специалисты в области здравоохранения обязаны сообщать о любых случаях подозреваемых побочных реакций через национальную систему сбора информации.
При возникновении нежелательных явлений и/или наличии претензий к качеству, пожалуйста, сообщите об этом по тел. +375 (17) 3600365 (для Республики Беларусь) или по электронной почте на адрес drugsafety.cis@novartis.com.
Передозировка при введении объема препарата, превышающего рекомендуемый, может повысить внутриглазное давление. Следовательно, в случае передозировки необходимо контролировать внутриглазное давление и, если лечащий врач посчитает целесообразным, начать соответствующее лечение.
0,23 мл стерильного раствора для инъекций в стеклянном флаконе, закрытом резиновой пробкой, обжатой алюминиевым колпачком с отрывной пластиковой накладкой фиолетового цвета.
1 флакон и 1 фильтровальная игла в картонной пачке.
Хранить в недоступном для детей месте.
Хранить в холодильнике (при температуре от 2°С до 8°С).
Не замораживать.
Хранить в защищенном от света месте.
Перед использованием невскрытый флакон можно хранить при комнатной температуре (ниже 25°С) не более 24 часов.
По рецепту врача.
Производитель:
Novartis Pharma Stein AG, Schaflhauserstrasse, 4332 Stein, Switzerland/
Новартис Фарма Штейн АГ, Шаффхаусерштрассе, 4332 Штейн, Швейцария.
Держатель регистрационного удостоверения:
Novartis Overseas Investments AG, Lichtstrasse 35, 4056 Basel, Switzerland.
Новартис Оверсиз Инвестментс АГ, Лихтштрассе 35, 4056 Базель, Швейцария.
Визкью
МНН: Бролуцизумаб
Производитель: Новартис Фарма Штейн АГ
Анатомо-терапевтическо-химическая классификация: Бролуцизумаб
Номер регистрации в РК:
№ РК-ЛС-5№024790
Информация о регистрации в РК:
21.10.2020 — 21.10.2025
- Скачать инструкцию медикамента
Торговое наименование
Визкью
Международное непатентованное название
Бролуцизумаб
Лекарственная
форма, дозировка
Раствор
для внутриглазного введения, 120 мг/мл
Фармакотерапевтическая группа
Органы
чувств. Офтальмологические препараты. Средства для лечения
сосудистых расстройств окологлазного пространства. Антинеоваскулярные
средства. Бролуцизумаб
Код
АТХ S01LA06
Показания к применению
Препарат
Визкью показан для лечения неоваскулярной (экссудативной) формы
возрастной макулярной дегенерации (ВМД) у взрослых пациентов.
Перечень
сведений, необходимых до начала применения
Противопоказания
—
гиперчувствительность к действующему веществу или к любому из
вспомогательных веществ
—
подтвержденные или предполагаемые инфекции глаза или инфекционные
процессы периокулярной локализации
—
пациенты с внутриглазным воспалением в активной стадии.
Необходимые
меры предосторожности при применении
Прослеживаемость
Чтобы
улучшить прослеживаемость биологических медицинских препаратов,
наименование и номер серии введенного препарата должны быть четким
образом указаны.
Эндофтальмиты,
отслойка сетчатки, васкулит сетчатки и/или окклюзия сосудов сетчатки
Интравитреальные
инъекции, в том числе инъекции препарата Визкью, были связаны с
эндофтальмитом, интраокулярным воспалением, травматической катарактой
и отслоением сетчатки. Всегда должны практиковаться правильные методы
асептической инъекции при введении Визкью. Во время использования
препарата Визкью были зарегистрированы случаи
васкулита сетчатки и/или окклюзии
сосудов сетчатки, как правило, в присутствии внутриглазного
воспаления. Пациенты должны быть проинструктированы незамедлительно
сообщать врачу обо всех симптомах, которые могут свидетельствовать
о развитии
вышеперечисленных состояний.
Повышение
внутриглазного давления
В
течение 30 минут после интравитреальной инъекции ингибиторов
фактора роста сосудистого эндотелия (VEGF),
включая бролуцизумаба, отмечалось временное увеличение внутриглазного
давления. С особой осторожностью нужно использовать препарат
пациентам с плохо
контролируемой глаукомой (не вводите препарат Визкью, если
внутриглазное давление ≥30 мм рт. ст). Необходимо
обеспечить надлежащий мониторинг и коррекцию внутриглазного давления
и перфузии головки зрительного нерва.
Билатеральное
лечение
Безопасность
и эффективность препарата бролуцизумаб, вводимого одновременно в оба
глаза, не изучалась.
Иммуногенность
Так
как это терапевтический белок, существует вероятность развития
иммуногенности при использовании бролуцизумаба. Пациенты должны быть
проинструктированы сообщать врачу при развитии таких симптомов, как
боль в глазах или повышенный дискомфорт, усиление покраснения глаз,
нечеткое или ослабленное зрение, увеличение числа мелких точек перед
глазами или повышенная чувствительность к свету.
Совместное
применение других препаратов анти-VEGF
Данные
по сопутствующему применению препарата Визкью с другими анти-VEGF
препаратами в один и тот же глаз отсутствуют. Бролуцизумаб не следует
применять одновременно с другими анти-VEGF средствами (системными или
глазными).
Приостановка
лечения
При
использовании интравитреальных анти-VEGF лекарственных препаратов
лечение необходимо временно прекратить и не следует возобновлять
раньше следующего запланированного курса лечения в случае:
• снижения
максимальной корригированной остроты зрения (МКОЗ) на ≥30 букв по
сравнению с последней оценкой остроты зрения;
• разрыва
сетчатки;
• субретинального
кровоизлияния, затрагивающего центральную ямку, или если размер
кровоизлияния составляет ≥50 % от общей площади поражения;
• выполненного
или запланированного проведения в течение предыдущих или последующих
28 дней интраокулярного хирургического вмешательства.
Разрыв
пигментного эпителия сетчатки
Факторы
риска, связанные с возникновением разрыва пигментного эпителия
сетчатки после анти-VEGF терапии при экссудативной ВМД представляют
собой обширную и/ или значительную отслойку пигментного эпителия
сетчатки. Следует соблюдать осторожность перед началом лечения
бролуцизумабом пациентов с описанными факторами риска разрыва
пигментного эпителия сетчатки.
Регматогенная
отслойка сетчатки или макулярные отверстия
У
пациентов с регматогенной отслойкой или макулярными отверстиями
сетчатки 3 или 4 степени лечение должно быть прекращено.
Системное
воздействие после интравитреального введения
После
интравитреальной инъекции ингибиторов VEGF сообщалось о системных
побочных эффектах, в том числе о неофтальмологических кровоизлияниях
и артериальных тромбоэмболических осложнениях, и существует
теоретический риск их возможной связи с ингибированием VEGF. Данные
касательно безопасности при лечении ВМД у пациентов с инсультом или
транзиторными ишемическими атаками в анамнезе за последние 3 месяца,
ограничены. Следует с осторожностью применять препарат у пациентов с
соответствующими состояниями.
Взаимодействия
с другими лекарственными препаратами
Исследования
по взаимодействиям не проводились.
Специальные
предупреждения
Содержание
натрия
Данный
лекарственный препарат содержит менее, чем 1 ммоль натрия (23 мг) на
дозу, т.е. практически «безнатриевый».
Применение
в педиатрии
Безопасность
и эффективность применения препарата Визкью у детей и подростков
в возрасте
младше 18 лет не установлена. Доступные данные отсутствуют.
Пациенты
пожилого возраста
У
пациентов в возрасте от 65 лет и старше корректировка дозы не
требуется.
Пациенты
с печеночной недостаточностью
Применение
препарата для пациентов с нарушением функции печени не изучалось. У
пациентов с нарушениями
функции печени корректировка дозы не требуется.
Пациенты
с почечной недостаточностью
У
пациентов с нарушением функции почек корректировка дозы не требуется.
Женщины
детородного возраста
Женщинам
детородного возраста во время лечения следует использовать
эффективные средства контрацепции в период лечения бролуцизумабом и в
течение не менее одного месяца после приема последней дозы, когда
лечение бролуцизумабом было прекращено.
Во
время беременности и лактации
Данные
о применении бролуцизумаба у беременных женщин отсутствуют или
ограничены. Исследования на животных недостаточны в отношении
репродуктивной токсичности. Хотя системное воздействие после
внутриглазного введения препарата очень мало, бролуцизумаб не следует
применять во время беременности, если только потенциальная польза не
превышает потенциальный риск для плода.
Неизвестно,
выделяется ли бролуцизумаб с грудным молоком. Нельзя исключать риск
для новорожденных детей/младенцев, находящихся на грудном
вскармливании. Бролуцизумаб не рекомендуется принимать в период
грудного вскармливания, а грудное вскармливание не следует начинать
ранее, чем через один месяц после приема последней дозы, когда
лечение бролуцизумабом было прекращено. Решение о прерывании грудного
вскармливания или воздержании от лечения бролуцизумабом, должно
приниматься с учетом пользы грудного вскармливания для ребенка и
пользы терапии для матери.
Особенности
влияния препарата на способность управлять транспортным средством или
потенциально опасными механизмами
Препарат
Визкью оказывает незначительное влияние на способность управлять
транспортными средствами и/или механизмами из-за возможного
временного нарушения зрения после интравитреальной инъекции и
связанной с этим обследованием глаз. Пациентам не следует управлять
транспортным средством или работать с механизмами, пока зрительная
функция не восстановится в полной мере.
Рекомендации
по применению
Режим
дозирования
Рекомендованная
доза составляет 6 мг бролуцизумаба (0,05 мл раствор),
вводится путем инъекции в стекловидное тело каждые 4 недели
(ежемесячно) для первых трех доз.
Метод
и путь введения
Препарат
Визкью предназначен только для интравитреального введения.
Перед
введением раствор для инъекций подлежит проверке.
Процедуру
инъекции в стекловидное тело следует проводить в асептических
условиях, что предполагает выполнение хирургической дезинфекции рук,
использование стерильных перчаток, стерильной салфетки и стерильного
векорасширителя (или эквивалентного прибора). Оборудование для
проведения стерильного парацентеза должно быть доступно в качестве
меры предосторожности. Перед выполнением интравитреальной процедуры
необходимо тщательно изучить анамнез пациента на предмет
возникновения реакций гиперчувствительности. Перед инъекцией
необходимо провести надлежащее обезболивание, а также
продезинфицировать кожу окологлазной области, века и поверхностные
ткани глаза с применением
соответствующих бактерицидных средств широкого спектра действия.
Инъекционную
иглу следует вводить на 3,5–4,0 мм позади лимба роговицы в
полость стекловидного тела, избегая горизонтального меридиана и
направляя иглу к центру глазного яблока. Затем препарат медленно
вводится в объеме 0,05 мл. Для последующих инъекций следует
использовать другой участок склеры.
Сразу
после интравитреального введения пациентов следует контролировать на
предмет повышения внутриглазного давления. Надлежащий контроль может
включать проверку перфузии зрительного нерва или тонометрию. При
необходимости должно быть доступно оборудование для проведения
стерильного парацентеза.
После
проведения процедуры интравитреальной инъекции пациенты должны быть
проинструктированы незамедлительно сообщать врачу обо всех симптомах,
которые могут свидетельствовать о развитии эндофтальмита (боль в
глазу, покраснение глаза, фотофобия, неясность зрения).
Внимание:
Следующая
информация предназначена только для работников здравоохранения!
Инструкции
по применению флакона
Хранение
и осмотр
Хранить Визкью при
температуре от 2 ºС до 8 ºС, в защищённом от света месте.
Не замораживать.
Перед
использованием невскрытый флакон Визкью можно хранить при комнатной
температуре (ниже 25 °С) до 24 часов. После вскрытия флакона
соблюдать асептические условия.
Визкью
представляет из себя прозрачный или слегка
опалесцирующий раствор от бесцветного до светлого коричневато-желтого
цвета.
После
извлечения из холодильника и перед введением раствор для инъекций
подлежит визуальной проверке. Если различимы частицы или имеет место
помутнение запрещается использоваться флакон, необходимо следовать
соответствующим процедурам замены.
Содержимое флакона и игла с фильтром
стерильны и предназначены только для однократного применения. Если
упаковка, флакон или игла с фильтром повреждены, или истек срок
годности, не используйте данный препарат.
Подготовка
и применение Визкью
Флакон
содержит больше, чем рекомендованная доза, равная 6 мг.
Извлекаемый объем флакона (0,23 мл) не должен использоваться
полностью. Избыточный объем должен быть удален перед инъекцией.
Введение полного объема содержимого флакона может привести к
передозировке.
Процедуру
интравитреальной инъекции необходимо проводить в асептических
условиях, что предполагает выполнение хирургической дезинфекции рук,
использование стерильных перчаток, стерильной салфетки и стерильного
векорасширителя (или эквивалентного прибора), а также возможность
выполнения парацентеза в стерильных условиях (при необходимости).
Перед
инъекцией необходимо провести надлежащее обезболивание, а также
продезинфицировать кожу окологлазной области, века и поверхностные
ткани глаза с применением соответствующих бактерицидных средств
широкого спектра действия.
Для
подготовки к процедуре и интравитреальной инъекции необходимы
следующие одноразовые медицинские изделия:
-
Стерильная инъекционная игла (30G х
½″). -
Стерильный шприц объемом 1 мл с
отметкой дозы 0,05 мл. -
Стерильная тупая игла с 5 мкм
фильтром (18G x 1½″, 1,2 мм x 40 мм).
Игла для инъекций и шприц не входят в
комплект поставки Визкью.
Инъекцию
необходимо делать сразу после подготовки дозы (шаг 8).
Примечание:
Доза для инъекции должна быть установлена на отметке 0,05 мл.
Процедура
инъекции:
|
1. |
Удалить |
|
2. |
В |
|
3. |
Ввести |
|
4. |
Чтобы |
|
5. |
Отсоединить |
|
6. |
В |
|
7. |
Убедиться |
|
8. |
Удерживая |
|
9. |
Ввести |
Примечание:
Любой неиспользованный продукт или отходы должны быть утилизированы в
соответствии с локальными требованиями.
Часто задаваемые
вопросы и ответы на них:
В:
Что если будет затруднительно набрать достаточный объем жидкости из
флакона?
О:
Не встряхивайте флакон перед набором жидкости, позвольте ей стечь по
стенкам на дно флакона. Убедитесь, что флакон лишь немного наклонен
при наборе жидкости. Медленно потяните поршень и подождите, пока
жидкость не появится в корпусе шприца. Продолжайте медленно набирать
жидкость, пока флакон и игла с фильтром полностью не опустеют.
В:
Что если не получится удалить пузырьки воздуха из жидкости?
О:
Необходимо освободить жидкость от пузырьков. В то же время, крошечные
пузырьки, прилипшие к пробке, обычно остаются на ней и, таким
образом, не влияют на объем вводимой дозы.
Частота
применения с указанием времени приема
Каждые
4 недели (ежемесячно) для первых трех доз.
Длительность
лечения
Впоследствии
врач может индивидуализировать интервалы лечения в зависимости от
проявлений активности заболевания в соответствии с оценкой остроты
зрения и (или) анатомических параметров. Оценку активности
заболевания предполагается проводить через 16 недель (4 месяца)
после начала лечения. У пациентов с отсутствием активности
заболевания лечение следует рассматривать каждые 12 недель
(3 месяца). У пациентов с активностью заболевания лечение
следует рассматривать каждые 8 недель (2 месяца).
Впоследствии врач может индивидуализировать интервалы лечения в
зависимости от проявлений активности заболевания.
Меры,
которые необходимо принять в случае передозировки
Передозировка
большим, чем рекомендованный, объемом инъекции может повысить
внутриглазное давление. В случае передозировки препарата, если
лечащий врач сочтет это необходимым, следует контролировать
внутриглазное давление и начать соответствующее лечение.
Рекомендации
по обращению за консультацией к медицинскому работнику для
разъяснения способа применения лекарственного препарата
Вводить
препарат Визкью должен только офтальмолог, имеющий опыт выполнения
интравитреальных инъекций.
Описание
нежелательных реакций, которые
проявляются при стандартном применении ЛП и меры, которые следует
принять в этом случае
Определение
частоты побочных явлений проводится в соответствии со следующими
критериями: очень часто (≥ 1/10), часто (от ≥1/100 до <
1/10), нечасто (от ≥ 1/1000 до < 1/100), редко (от ≥ 1/10000
до < 1/1000), очень редко (< 1/10000),
неизвестно (невозможно оценить на основании имеющихся данных).
Часто
—
гиперчувствительность (включая крапивницу, сыпь, зуд, эритему)
—
снижение остроты зрения
—
кровоизлияние в сетчатку
—
увеит
—
ирит
—
отслойка стекловидного тела
—
разрыв сетчатки
—
катаракта
—
кровоизлияние в конъюнктиву
—
плавающие помутнения в стекловидном теле
—
боль в глазах
—
повышенное внутриглазное давление
—
конъюнктивит
—
разрыв пигментного эпителия клетчатки
—
нечеткое зрение
—
ссадина роговицы
—
точечный кератит
Нечасто
—
слепота
—
эндофтальмит
—
окклюзия артерии сетчатки
—
отслоение сетчатки
—
конъюнктивальная гиперемия
—
повышенное слезотечение
—
аномальные ощущения в глазу
—
отслойка пигментного эпителия сетчатки
—
витрит
—
воспаления в передней камере
—
иридоциклит
—
блики в передней камере
—
отек роговицы
—
кровоизлияние в стекловидное тело
Неизвестно
(невозможно оценить на основании имеющихся данных)
—
окклюзия сосудов сетчатки
—
васкулит сетчатки.
При
возникновении нежелательных лекарственных реакций обращаться к
медицинскому работнику, фармацевтическому работнику или напрямую в
информационную базу данных по нежелательным реакциям (действиям) на
лекарственные препараты, включая сообщения о неэффективности
лекарственных препаратов
РГП
на ПХВ «Национальный Центр экспертизы лекарственных средств и
медицинских изделий» Комитета контроля качества и безопасности
товаров и услуг Министерства здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные
сведения
Состав
лекарственного препарата
Один
флакон (0,23 мл) содержит
активное
вещество — бролуцизумаб,
27,6 мг.
Таким
образом обеспечивается необходимое количество для доставки
однократной дозы 0,05 мл раствора, содержащей 6 мг
бролуцизумаба.
вспомогательные
вещества – сахароза,
натрия цитрат, полисорбат 80, натрия гидроксид, вода для инъекций.
Описание
внешнего вида, запаха, вкуса
Прозрачный
или слегка опалесцирующий раствор от бесцветного до светлого
коричневато-желтого цвета.
Форма выпуска и упаковка
Препарат
помещают в бесцветный стеклянный флакон (тип I) вместимостью 2 мл,
укупоренный серой хлорбутиловой резиновой пробкой, покрытой ETFE
(этилен/тетра-фторэтиленовой) пленкой, обжатый алюминиевой обкаткой с
крышечкой «flip-off».
Одну
иглу, снабженную фильтром, помещают в защитную упаковку (мягкий
блистер).
По
1 флакону в комплекте с иглой, снабженной фильтром, вместе с
инструкцией по медицинскому применению на казахском и русском языках
помещают в пачку из картона.
Срок хранения
2
года.
Не
применять по истечении срока годности!
Условия хранения
Хранить
при температуре от 2 ºС до 8 ºС, в защищённом от света
месте.
Не
замораживать.
Хранить
в недоступном для детей месте!
Условия отпуска из аптек
По
рецепту
Сведения
о производителе
Новартис
Фарма Штейн АГ, Швейцария
Шаффхаузерштрассе,
4332
Штейн
Держатель
регистрационного удостоверения
Новартис
Оверсиз Инвестментс АГ, Швейцария
Лихтштрассе
35, 4056 Базель
Наименование,
адрес и контактные данные (телефон, факс, электронная почта)
организации на
территории Республики Казахстан, принимающей претензии (предложения)
по качеству лекарственных средств от потребителей и
ответственной
за пострегистрационное наблюдение за безопасностью лекарственного
средства
Филиал
Компании «Новартис Фарма Сервисэз АГ» в Республике
Казахстан
050022
г. Алматы, ул. Курмангазы, 95
тел.:
+ 7 (727) 258-24-47
факс:
+ 7 (727) 244-26-51
e-mail:
drugsafety.cis@novartis.com
| визкью_ЛВ_кз.docx | 0.12 кб |
| Визкью_ЛВ_авг_2020.docx | 0.12 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Препарат «Визкью» или бролуцизумаб (за пределами России больше известный как «Беовью» (Beovu) – для чего и как применяется, его сравнительная характеристика с Луцентисом и Эйлеа, и риски для пациента — в этой статье.
Рис.1 Два варианта названия бролуцизумаба
Сначала немного анатомии – для того, чтобы пациентам было понятно, о чем говорят доктора, показывая им снимки ОКТ или результаты других исследований. Ведь это совсем не похоже на то, как выглядит наш глаз снаружи.
Изнутри наш глаз покрывает тонкая световоспринимающая внутренняя оболочка — сетчатка, это как обои внутри комнаты, приклеенные к штукатурке.
«Штукатурка» – это средняя оболочка глаза, образованная сосудами, которые достаточно рыхлые и склонны к протечкам. Но между штукатуркой и обоями есть слой, называемый мембраной Бруха, который служит барьером и предохраняет наш глаз от таких протечек.
Рис.2 Анатомия глаза и сетчатки
Макула – это центральная часть сетчатки, которая и обеспечивает центральное цветовое зрение в высоком разрешении, благодаря расположенным там клеткам – колбочкам.
Если отдаляться от макулы, в сетчатке начинают преобладать другие клетки – палочки, ответственные за периферическое и ночное зрение.
Если развивается какое-либо заболевание центральной зоны, например отек или дистрофия, то страдает острота зрения, линии становятся изогнутыми, теряется контрастная чувствительность. Например, это заметно на тесте «сетка Амслера».[1]
Рис.3 Норма (слева) и патология (справа) на решётке Амслера
В норме в сетчатке происходит постоянный обмен веществ, необходимым для обеспечения работы световоспринимающих клеток. Но со временем не все продукты обмена утилизируются (в первую очередь это — липофусцин), они начинают накапливаться и откладываться в слоях сетчатки, вызывая состояние, называемое «сухая форма возрастной макулодистрофии» (ВМД).
Примерно 80% людей с этим диагнозом остаются в сухой форме, но остальные 20% переходят во влажную форму – когда из-за разрушения барьера жидкость из капилляров сетчатки начинает под неё просачиваться, а сами сосуды – прорастать внутрь.
Рис. 4 Сетчатка при влажной форме ВМД – схематично и на ОКТ
Причина этого прорастания – выделение фактора роста эндотелия сосудов (англ. VEGF — Vascular endothelial growth factor), обусловленное кислородным голоданием сетчатки.
Визкью на ряду с Луцентисом и Эйлеа относится к блокаторам фактора роста эндотелия сосудов (англ. – antiVEGF).
Появление этой группы препаратом было настоящим прорывом в лечении влажной ВМД, их применение уменьшило случаев слепоты на треть.[2]
- Луцентис (ранибизумаб) – широко используется с 2008 года
- Эйлеа (афлиберцепт) – используется c 2013 года
- Беовью (бролуцизумаб) – в мировой клинической практике с 2020 года, в России под названием Визкью – с начала 2022 года
Авастин (бевацизумаб) не разрешен для применения в России для внутриглазного введения, хотя и применяется в некоторых клиниках «Off Label», т.е. по показаниями, не указанным в инструкции.[3]
Ингибиторы ангиогенеза имеют одинаковый механизм действия – они работают как «рецептор-ловушка», который связывается с фактором роста эндотелия сосудов и блокируют его. Благодаря этому рост новых сосудов останавливается, уменьшается отёк. У пациента улучшается зрение.
Главное отличие этих препаратов – разный размер и строение молекул, что обеспечивает силу и продолжительность действия.
Рис.5 Размеры молекул различных ингибиторов ангиогенеза
Так Визкью имеет наименьший размер молекулы (26 килодальтон) и содержит только фрагмент, связывающийся с белками фактора роста. Это дает ряд преимуществ:
1. Высокая степень связываемости (афинности)
2. Быстрое и более глубокое проникновение в стекловидное тело и ткани сетчатки
3. Большая концентрация препарата в дозе
4. Длительность выраженного клинического эффекта
5. Высокая безопасность
Так, чтобы попасть в сетчатку Визкью требуется от одного до 6 часов, Луцентису – от 6 до 12, Элеа – 24 часа.[4]
Рис.6 Путь anti-VEGF препарата после укола в стекловидное тело глаза
Если говорить о концентрации, то нужно понимать, что в стекловидное тело для введения объём рекомендуемой дозы составляет 0.05 мл любого из этих препаратов. И если сравнивать его концентрацию, то в том же объёме Визкью будет 3 раза больше молекул, чем в Луцентисе и в 12 раз больше молекул, нежели в Эйлеа.
Если говорить о длительности действия, согласно стандартному протоколу, все препараты имеют три загрузочные дозы с перерывом в 4 недели. Но дальше рекомендации сильно отличаются. Если для Луцентиса интервал составляет также 4 недели, то для Эйлеа это уже 8 недель, а для Визкью – уже 12 недель.[5]
| Препарат | Масса молекулы (кДа) | Количество действующего вещества в дозе 0.05 мл (мг) |
Скорость проникновения (часы) |
Загрузочные дозы (шт). | Интервал между последующими введениями (нед.) |
| Визкью (бролуцизумаб) | 26 | 6 | 1-6 | 3 | 4 |
| Луцентис (ранибизумаб) | 48 | 0,5 | 6-12 | 3 | 8 |
| Эйлеа (афлиберцепт) | 115 | 2 | 24 | 3 | 12 |
Риски и осложнения
Негативные последстви введения Визкью можно разделить на две группы: первая – это потенциальные проблемы, связанные с интравитреальной инъекцией вне зависимости от препарата. К ним относится воспаления глаза (увеит, эндофтальмит), отслойка сетчатки, помутнение хрусталика и повышение внутриглазного давления.
Anti-VEGF препараты имеют свои специфические осложнения, к ним относятся кровоизлияния и нарушения кровообращения в сосудах сетчатки.
Как показывают исследования, при инъекциях Визкью сосудистые осложнения наблюдаются в 14 случаях на 10 000 инъекций, при этом в 4 случаях осложнения приводят к серьёзному ухудшению зрения.[6]
Из специфических осложнений Визкью можно назвать больший риск разрыва пигментного эпителия сетчатки, по сравнению с другими блокаторами фактора роста эндотелия сосудов.
Бролуцизумаб нельзя применять при воспалении глаз, а также у беременных и кормящих женщин. С осторожностью – у людей с сахарным диабетом, системными заболеваниями и тромбозами сосудов сетчатой оболочки, фиброваскулярной отслойкой пигментного эпителия сетчатки.
Видео нашего специалиста о препарате
Стоимость укола
Цена интравитреальной инъекции Визкью (в условиях стерильной операционной) — 96 000 рублей.
Заключение
Основное преимущество препарата Визкью это больший интервал между введениями и возможность получить эффект, если предшествующее лечение Луцентисом или Эйлеа не были эффективны.
Список использованных источников
- Tripathy K, Salini B. Amsler Grid. 2022 Feb 21. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. PMID: 30844168.
- GBD 2019 Blindness and Vision Impairment Collaborators; Vision Loss Expert Group of the Global Burden of Disease Study. Causes of blindness and vision impairment in 2020 and trends over 30 years, and prevalence of avoidable blindness in relation to VISION 2020: the Right to Sight: an analysis for the Global Burden of Disease Study. Lancet Glob Health. 2021 Feb;9(2):e144-e160. doi: 10.1016/S2214-109X(20)30489-7. Epub 2020 Dec 1. Erratum in: Lancet Glob Health. 2021 Apr;9(4):e408. PMID: 33275949; PMCID: PMC7820391.
- Официальная инструкция Авастин® (концентрат для приготовления раствора для инфузий, 100 мг/4 мл)
- Erik L. Nimz; Clinton W. Van’t Land; Jaime A. Yáñez; James E. Chastain Intraocular and systemic pharmacokinetics of brolucizumab (RTH258) in nonhuman primates. ARVO Annual Meeting Abstract, 2016
- Dugel PU, Koh A, Ogura Y, Jaffe GJ, Schmidt-Erfurth U, Brown DM, Gomes AV, Warburton J, Weichselberger A, Holz FG; HAWK and HARRIER Study Investigators. HAWK and HARRIER: Phase 3, Multicenter, Randomized, Double-Masked Trials of Brolucizumab for Neovascular Age-Related Macular Degeneration. Ophthalmology. 2020 Jan;127(1):72-84. doi: 10.1016/j.ophtha.2019.04.017. Epub 2019 Apr 12. PMID: 30986442.
- Post-marketing data in patients with wet AMD. Информация с официального сайта компании Novartis www.brolucizumab.info Дата обращения: 20.09.2022