Воспалительные заболевания кишечника
Воспалительные заболевания кишечника – это хронические иммунопатологические болезни неизвестной этиологии, которые поражают разные отделы ЖКТ. Они возникают на фоне генетической предрасположенности, нарушения микробиоты тонкой и толстой кишки, действия экзогенных факторов. Патология вызывает кишечные симптомы (боли в животе, расстройства стула, появление слизи и крови в кале), сопровождающиеся разнообразными внекишечными проявлениями. Для диагностики используют данные УЗИ, рентгенографии и КТ органов живота, эндоскопии (ЭФГДС, колоноскопия), лабораторных анализов. Лечение консервативное, при осложнениях требуется хирургическое вмешательство.
Общие сведения
Группу воспалительных заболеваний кишечника (ВЗК) составляют две основные нозологические единицы: язвенный колит (ЯК) и болезнь Крона (БК). Суммарная частота встречаемости патологий составляет 60-300 случаев на 100 тыс. населения. Некоторые исследователи выделяют третью форму ВЗК – недифференцированный неспецифический колит. Несмотря на относительно низкую распространенность, воспалительные заболевания кишечника имеют высокую медико-социальную значимость, не теряют актуальности в практической гастроэнтерологии.
Воспалительные заболевания кишечника
Причины
Этиологические факторы воспалительных заболеваний пока точно не установлены. Большое значение уделяется генетическим изменениям. Описан полиморфизм Ala893 – гена множественной лекарственной резистентности (MDR1), полигенные мутации главного комплекса гистосовместимости, мутации IBD5 и CARD15 (NOD2) на 16-ой хромосоме. Гены участвуют в формировании эпителиального защитного барьера, регулируют иммунный ответ. Другие возможные причины ВЗК:
- Дисбиоз кишечника. Патология возникает при снижении числа полезных бифидобактерий, возрастании количества болезнетворных энтеробактерий и анаэробных микроорганизмов. Дисбаланс микрофлоры оказывает токсическое и аллергизирующее действие, нарушает естественную иммунную защиту в кишечнике.
- Внешние факторы. Риск развития заболевания повышают вирусы (герпесвирус, возбудитель кори), бактерии (хламидии, листерии, микобактерии). Определенную роль в формировании ВЗК играет хронический стресс, проживание в регионе с плохой экологией, употребление рафинированных продуктов и пищи с большим количеством консервантов.
Патогенез
Под действием генетических факторов и внешних агентов развиваются повреждения кишечной стенки и сопутствующие нарушения иммунного ответа. Эпителиальный барьер кишечника становится проницаемым для антигенов, в ответ на которые в организме активно формируются антитела. Постепенно у 60-75% пациентов образуются противотолстокишечные аутоантитела, реже встречаются антинейтрофильные аутоантитела (ANSA).
При болезни Крона иммунные комплексы атакуют любые отделы ЖКТ – от ротовой полости до ануса, вызывая характерное гранулематозное воспаление с трансмуральным поражением стенки пищеварительного канала. При неспецифическом язвенном колите наблюдается поверхностное воспаление толстой кишки без отдельных гранулем. При ВЗК нарушается всасывательная, секреторная и эвакуаторная функция кишечника, с чем связаны различные гастроэнтерологические симптомы.
Большое значение в патогенезе воспалительных заболеваний имеют провоспалительные цитокины, которые синтезируются макрофагами, Т-лимфоцитами и эндотелиальными клетками. К ним относят фактор некроза опухолей, интерлейкины 1 и 6, гамма-интерферон. Со временем в крови появляются иммунные комплексы, которые поражают другие органы и ткани: кожу, орган зрения опорно-двигательный аппарат, систему кроветворения.
Боль в животе при ВЗК
Симптомы
Манифестация воспалительных заболеваний кишечника чаще всего происходит в возрасте 20-40 лет. При ВЗК развиваются типичные признаки поражения ЖКТ: хроническая диарея, боли в животе различной локализации, примеси крови и слизи в каловых массах. Для язвенного колита характерны ложные позывы на дефекацию (тенезмы), выделение малых объемов кала («ректальный плевок»). У 25-35% пациентов наблюдаются трещины и свищи в перианальной зоне, которые более характерны для БК.
Вторую группу симптомов ВЗК составляют внекишечные проявления, вызванные системным действием иммунопатологических механизмов. Они в 3 раза чаще встречаются при язвенном колите и болезни Крона с поражением толстого кишечника, чем при изолированном терминальном илеите, типичном для БК. Внекишечные признаки отягощают течение воспалительного заболевания, снижают качество жизни и могут стать причиной инвалидизации.
Поражение опорно-двигательной системы представлено артритом крупных суставов, остеопорозом, сакроилеитом и анкилозирующим спондилитом (болезнью Бехтерева). Нарушения зрения возникают в результате эписклерита и увеита. Вовлечение в процесс кожи и слизистых оболочек проявляется узловатой эритемой, афтозным стоматитом, гангренозной пиодермией.
У 3-5% больных с ВЗК возникают патологии гепатобилиарной системы: первичный склерозирующий холангит, аутоиммунный гепатит, желчнокаменная болезнь. При длительном существовании заболевания и значительном поражении кишечника развивается синдром мальабсорбции, который сопровождается железодефицитной или В12-дефицитной анемией, полигиповитаминозами, признаками недостатка микроэлементов.
Осложнения
Вероятность тяжелого обострения ВЗК составляет 15% на протяжении жизни. При проведении адекватного лечения рецидивы возникают у 50% пациентов в первые 5 лет от начала терапии, у 80% больных – в течение 10 лет. Серьезной проблемой остается зависимость от системных стероидов, которые применяются для купирования обострений – в организме снижается синтез собственных гормонов, поэтому после отмены лекарств возможна надпочечниковая недостаточность.
К жизнеугрожающим последствиям воспалительных заболеваний относят токсическую дилатацию кишечника, перфорацию стенки с массивным кровотечением. Для БК характерно образование свищей, которые открываются в перианальной области. При заживлении язв зачастую формируются рубцовые стриктуры, которые нарушают пассаж каловых масс и со временем приводят к острой кишечной непроходимости.
ВЗК относят к факультативным предраковым заболеваниям. Риск развития колоректального рака возрастает в 20 раз по сравнению со среднепопуляционным значением. От манифестации воспалительного заболевания кишечника до формирования злокачественной опухоли проходит более 10 лет. Если человек болеет дольше 30 лет, вероятность развития рака составляет свыше 18%.
Диагностика
При подозрении на ВЗК пациенту необходима консультация врача-гастроэнтеролога. Первый этап диагностики – уточнение жалоб и детальный сбор анамнеза, чтобы уточнить время и очередность появления симптомов, количество внекишечных проявлений, результативность проводимого ранее лечения. Второй этап – физикальное обследование с пальпацией живота и осмотром перианальной зоны. На третьем этапе назначаются такие методы исследования:
- Неинвазивные методы визуализации. Базовое обследование при гастроэнтерологических жалобах включает УЗИ и обзорную рентгенографию органов брюшной полости, рентгенологическое исследование с контрастированием. В спорных случаях для уточнения диагноза назначают КТ или МРТ органов живота.
- Эндоскопическая диагностика. При синдроме колита проводится колоноскопия, чтобы оценить степень и распространенность поражения стенки кишечника, выполнить биопсию пораженных участков для гистологического анализа. При болезни Крона с вовлечением в процесс верхних отделов ЖКТ потребуется ЭФГДС, по показаниям назначают капсульную эндоскопию.
- Биопсия стенки кишечника. К патогномоничным признакам воспалительных заболеваний кишечника относят поверхностные (при НЯК) или глубокие щелевидные язвы (при БК), лимфоплазмоцитарную инфильтрацию, структурные изменения ворсин. При язвенном колите определяются нарушения секреции слизи и крипт-абсцессы.
- Лабораторные исследования. В стандартный комплекс входит клинический и биохимический анализ крови, определение острофазовых показателей, коагулограмма. Также проводится копрограмма, бактериологический посев кала, анализ каловых масс на яйца гельминтов.
Дифференциальная диагностика
При постановке диагноза исключают более распространенные причины абдоминальных болей и диспепсических нарушений. ВЗК дифференцируют с инфекционными болезнями (сальмонеллез, дизентерия, амебиаз, паразитозы), антибиотик-ассоциированной диареей, туберкулезом кишечника, ишемическим колитом. Выделение крови с калом требует дифференциальной диагностики с геморроем, анальной трещиной, колоректальным раком.
Эндоскопическое исследование ЖКТ
Лечение воспалительных заболеваний кишечника
Консервативная терапия
При болезни Крона и язвенном колите требуется комплексное медикаментозное лечение для индукции и длительного поддержания ремиссии, профилактики осложнений. Терапевтическая программа подбирается с учетом степени тяжести заболевания, выраженности клинических проявлений, наличия внекишечной симптоматики. Используемые препараты подразделяются на 3 категории:
- Средства для индукции ремиссии. В первую линию терапии входят системные глюкокортикостероиды и иммуносупрессоры, по показаниям их дополняют антибиотиками и салицилатами. Высокую эффективность показывают генно-инженерные препараты – моноклональные антитела к провоспалительным цитокинам.
- Противорецидивные средства. После ликвидации острых проявлений назначаются поддерживающие курсы иммуносупрессоров, препаратов 5-аминосалициловой кислоты и моноклональных антител. Основная задача этого этапа – стойкий контроль симптомов без применения гормонов.
- Вспомогательные медикаменты. Используется фармакотерапия для коррекции осложнений ВЗК: препараты железа при анемии, средства с кальцием при остеопорозе, парентеральные растворы для устранения белково-электролитных нарушений.
Хирургическое лечение
Операцию назначают при осложненной форме воспалительного заболевания, отсутствии эффекта от консервативной терапии. По возможности ограничиваются минимально травматичными вмешательствами: стриктуропластикой, дилатацией стриктур, эндоскопической остановкой кровотечения, чтобы сохранить целостность кишечника. Глубокое поражение стенки кишки требует резекции отдельных участков с наложением анастомозов или выведением стомы.
Прогноз и профилактика
Правильно подобранное лечение позволяет контролировать симптоматику воспалительных заболеваний кишечника и поддерживать удовлетворительное качество жизни пациента. При развитии осложнений и потребности в радикальных операциях прогноз сомнительный. Поскольку причины и факторы риска точно не определены, эффективные превентивные меры отсутствуют. Вторичная профилактика заключается в ранней диагностике и своевременном начале терапии.
|
Литература 1. Клинические рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению язвенного колита. – 2020. 2. Воспалительные заболевания кишечника. Клиническое руководство/ под ред. И.П. Халифа. – 2018. 3. Воспалительная болезнь кишечника. Глобальные практические рекомендации Всемирной гастроэнтерологической ассоциации. – 2015. 4. Воспалительные заболевания кишечника/ И.П. Павлова и соавт. – 2014. |
Код МКБ-10 К50-К52 |
Воспалительные заболевания кишечника — лечение в Москве
Настоящий обзор имеет своей целью анализ данных мировой литературы по терапии воспалительных заболеваний кишечника (ВЗК) иммунобиологическими препаратами и лечению ВЗК в педиатрической практике.
К ВЗК относятся язвенный колит (ЯК) и болезнь Крона (БК) — идиопатические хронические рецидивирующие заболевания ЖКТ, которые имеют как наслаивающиеся друг на друга, так и самостоятельные клинические и патологические черты[1].
В настоящее время распространенность ВЗК среди общего населения в мире составляет до 0,3%[2], что создает огромную экономическую нагрузку на общество[3]. По существующим оценкам, только в США прямые затраты, связанные с ВЗК, в 2014 г. находились в пределах от 14,6 до 31,6 млрд долларов[4].
Этиология и патогенез ВЗК остаются в значительной степени неизвестными. В настоящее время эти заболевания считаются многофакторными, развивающимися под влиянием отдельных генетических и экологических факторов, количественных и качественных изменений кишечной флоры и нарушений иммунного ответа. Сочетание этих факторов приводит к неадекватной иммунной реакции на комменсальную флору у генетически предрасположенных субъектов и вызывает нарушения барьерной функции слизистой оболочки ЖКТ[5].
К факторам риска развития ВЗК относятся семейная предрасположенность, социальные и географические факторы, стресс, прием некоторых лекарственных средств, оральных контрацептивов, ожирение и диета с повышенным содержанием углеводов[5].
Течение ВЗК носит прогрессирующий деструктивный характер и сопровождается различными кишечными осложнениями, включая стенозы, абсцессы и свищи, а также внекишечными проявлениями и связанными с колитом неоплазиями и раком[1].
Лечение ВЗК требует индивидуального подхода в зависимости от формы и тяжести заболевания, локализации процесса и наличия кишечных и внекишечных осложнений. Терапия обычно разделяется на две стадии: стадию лечения обострения для достижения ремиссии (индукционная терапия) и стадию поддерживающей терапии.
В течение длительного времени фармакотерапия ВЗК ограничивалась применением глюкокортикостероидов (ГКС) для индукции ремиссии и иммунодепрессантов (таких как азатиоприн, меркаптопурин и метотрексат) для ее поддержания[5].
ПРИМЕНЕНИЕ ИНГИБИТОРОВ ФАКТОРА НЕКРОЗА ОПУХОЛИ
В 1997 г. парадигма терапии ВЗК с неселективного подавления иммунного ответа с помощью традиционных классов лекарственных препаратов сменилась высокоселективным подавлением воспалительного процесса за счет ингибирования ключевого провоспалительного цитокина — фактора некроза опухоли альфа (ФНО-α). S.R. Targan и соавт. опубликовали результаты первого рандомизированного клинического исследования (РКИ), подтвердившие эффективность инфликсимаба (ИФМ) — современного препарата моноклональных антител к ФНО-α — в лечении БК[6].
Помимо ИФМ, современными представителями моноклональных антител к ФНО-α являются адалимумаб (АДБ), голимумаб и цетролизумаба пэгол (табл.).
Таблица
Показания и режимы дозирования иммунопрепаратов при воспалительных заболеваниях кишечника[7]
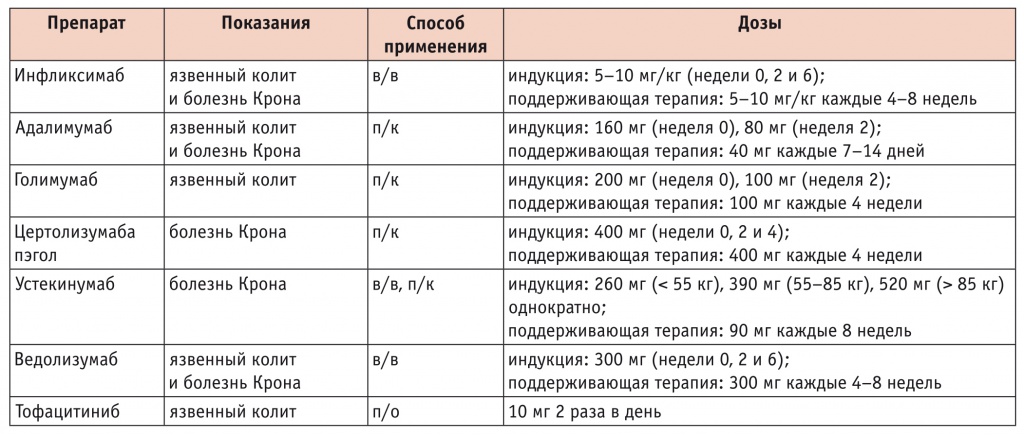
Примечание: в/в — внутривенно; п/к — подкожно; п/о — перорально.
Анти-ФНО-терапия при язвенном колите
В настоящее время имеются убедительные доказательства того, что анти-ФНО-терапия позволяет добиться клинической ремиссии при гормонозависимых и гормонорезистентных формах ЯК средней и тяжелой степени.
Систематический обзор с сетевым метаанализом, включавший 506 РКИ, показал, что у пациентов с ЯК ингибиторы ФНО эффективны не только при индукции, но и при поддержании ремиссии заболевания[8]. Однако у 60% пациентов с ЯК в течение 5 лет после начала терапии ингибиторами ФНО развивалась вторичная резистентность[9].
Анти-ФНО-терапия при болезни Крона
В систематическом обзоре с сетевым метаанализом десяти РКИ, в котором изучалась эффективность ИФМ, АДБ и цертолизумаба пэгола у пациентов с БК, показано, что все эти ингибиторы ФНО эффективнее плацебо как при индукции, так и при поддержании ремиссии заболевания [8].
Положительные результаты получены в многоцентровом РКИ с участием 52 медицинских организаций, где изучалась эффективность АДБ в индукции ремиссии у больных БК, ранее лечившихся ИФМ[10].
У пациентов с БК тяжелой и средней степени, гормонозависимых либо не отвечавших на большие дозы месалазина или ГКС, комбинированная терапия ИФМ и азатиоприном оказалась значительно эффективнее, чем изолированное применение ИФМ, в достижении клинической ремиссии к 26-й неделе после начала лечения[11]. Однако неизвестно, как долго должна продолжаться данная комбинированная терапия.
Имеются также подтверждения того, что ингибиторы ФНО являются эффективными средствами лечения параректальных свищей при БК[12].
Таким образом, в настоящее время ингибиторы ФНО можно считать эффективными при лечении ЯК тяжелой и средней степени (ИФМ, АДБ, голимумаб) и БК (ИФМ, АДБ, цертолизумаба пэгол).
Побочные эффекты ингибиторов фактора некроза опухоли
Анти-ФНО-терапия может вызывать реактивацию таких инфекций, как туберкулез и вирусный гепатит В[13]. Ввиду этого перед ее назначением необходимо провести скрининг на вышеуказанные инфекции.
Согласно ретроспективному когортному исследованию, в течение 3,5 года наблюдения примерно у 30% пациентов, получавших ингибиторы ФНО, развилось поражение кожи[14]. Сообщалось также о развитии демиелинизирующей и периферической нейропатии при применении анти-ФНО-препаратов[15].
Проспективное когортное исследование, проведенное в Северной Америке и включавшее 6000 больных БК, показало, что ИФМ не ассоциируется с тяжелыми инфекционными осложнениями[16]. Кроме того, согласно проспективному обсервационному исследованию, монотерапия ИФМ не имеет статистически значимой связи с развитием злокачественных новообразований[17]. Однако применение ИФМ в комбинации с тиопуринами является фактором риска развития неходжкинской лимфомы[18] и гепатоспленической лимфомы[19].
Отмечены более частые, по сравнению с плацебо, случаи воспалительных реакций в месте инъекции и лейкоцитопении при лечении АДБ[20].
ИНГИБИТОРЫ ИНТЕРЛЕЙКИНОВ 12 И 23
IL-12 и IL-23 являются гетеродимерными провоспалительными цитокинами, участвующими в формировании воспаления в слизистой оболочке кишечника при БК[21].
Каждый из этих цитокинов состоит из двух субъединиц — р35/р40 (IL-12) и р19/р40 (IL-23). Наличие у IL-12 и IL-23 общей субъединицы р40 позволяло предположить, что ее блокада приведет к эффективному подавлению воспалительного процесса в слизистой оболочке кишечника. Это нашло подтверждение в экспериментальной модели[22] и послужило рациональным основанием для создания устекинумаба — препарата моноклональных антител к р40-субъединице IL-12 и IL-23 (см. табл).
В исследовании IM-UNITI устекинумаб показал свою эффективность в качестве поддерживающей терапии. Различия в частоте побочных эффектов в группах устекинумаба и плацебо отсутствовали[23].
В обсервационном исследовании почти две трети пациентов с БК, резистентной к анти-ФНО-терапии, на фоне лечения устекинумабом в течение около года достигли бесстероидной ремиссии[24].
В 2016 г. устекинумаб был одобрен для лечения БК в Европе и США [23]. В настоящее время проводится РКИ III фазы UNIFI, в котором изучаются безопасность и эффективность индукционной и поддерживающей терапии устекинумабом у пациентов с умеренно активным ЯК (NCT02407236).
БЛОКАТОРЫ ТРАФИКА ЛЕЙКОЦИТОВ
С целью блокады трафика (активация, адгезия, миграция и инфильтрация) лейкоцитов из крови в воспалительный очаг в слизистой оболочке кишечника разработаны моноклональные антитела, получившие название антиинтегринов, или антиадгезивных препаратов. Они блокируют действия интегринов — молекул межклеточной адгезии, которые присутствуют на поверхности лейкоцитов и обеспечивают их адгезию и трансэндотелиальную миграцию. Соответственно, блокада интегринов избирательно предотвращает миграцию лейкоцитов и инфильтрацию ими очага воспаления[25].
Натализумаб
Натализумаб является рекомбинантным гуманизированным моноклональным антителом IgG4, направленным против субъединицы α4 в интегринах α4β7 и α4β1 лейкоцитов. Блокада этих интегринов предотвращает миграцию лимфоцитов в большинство тканей, включая кишечник, кожу и головной мозг.
Натализумаб был первым антиадгезивным средством, одобренным в США для лечения БК средней тяжести при резистентности или непереносимости ингибиторов ФНО. Кокрановский систематический обзор с метаанализом, проведенный в 2018 г., подтвердил, что натализумаб превосходит плацебо в индукции ремиссии у больных БК[25].
Однако из-за ингибирования миграции лейкоцитов в центральной нервной системе натализумаб в редких случаях способствовал реактивации вируса Джона Каннингема (JCV) в головном мозге и развитию прогрессирующей многоочаговой лейкоэнцефалопатии[25].
В связи с этим в настоящее время применение натализумаба одобрено только в США и Швейцарии, где он может использоваться при отсутствии инфекции JCV для краткосрочного (до 2 лет) лечения с мониторингом антител к JCV[25].
Ведолизумаб
Ведолизумаб (см. табл) — это гуманизированное моноклональное антитело IgGl, которое избирательно блокирует интегрин α4β7. Его воздействие направлено в основном на лейкоциты в стенке кишечника, он не проникает через гематоэнцефалический барьер и не вызывает прогрессирующую многоочаговую лейкоэнцефалопатию.
Ведолизумаб одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. Food and Drug Administration) и Европейским агентством по лекарственным средствам (англ. European Medicines Agency) для лечения ЯК и БК средней тяжести [26]. Его эффективность подтверждена в РКИ III фазы GEMINI. При применении ведолизумаба, в сравнении
с плацебо, статистически значимо чаще достигались клинический ответ на 6-й неделе лечения (39,2% против 22,3%; р = 0,001) и клиническая ремиссия на 10-й неделе (26,6% против 12,1%; р = 0,001). Побочные эффекты в группах были одинаковыми[27].
Данные недавних систематических обзоров, метаанализов и постмаркетинговых исследований показали, что ведолизумаб является безопасным средством для лечения пациентов с тяжелыми и средней тяжести формами БК и ЯК, включая больных, не поддающихся анти-ФНО-терапии[28, 29]. Однако его эффект проявляется лишь через 10 и более недель лечения.
ИНГИБИТОРЫ ЯНУС-КИНАЗ
Янус-киназы (JAK) относятся к классу нерецепторных тирозинкиназ, которые экспрессируются в иммунокомпетентных клетках, в том числе лейкоцитах. Их функция заключается в передаче сигналов от факторов роста и рецепторов цитокинов (IL-2, IL-6, IL-12, IL-21, IL-23 и др.), которые участвуют в поддержании воспаления в слизистой кишечника при ВЗК, внутрь клетки, что обеспечивает реализацию эффектов данных цитокинов[30]. Идея блокирования JAK с целью предотвращения патогенного действия этих цитокинов послужила рациональной основой для создания ингибиторов JAK.
Тофацитиниб
Среди ингибиторов JAK к настоящему времени наиболее многообещающие клинические результаты при ВЗК, в основном при ЯК, продемонстрированы первым ингибитором JAK — тофацитинибом (см. табл).
В РКИ II фазы участвовали пациенты с активным тяжелым или средней тяжести ЯК. Из них 598 и 541 человек до этого не отвечали на стандартное лечение (OCTAVE 1) и на анти-ФНО-терапию (OCTAVE 2) соответственно[31]. В каждом из этих двух субисследований пациенты были рандомизированы на группы индукционной терапии тофацитинибом и плацебо в течение 8 недель. В обоих субисследованиях в группах тофацитиниба к 8-й неделе лечения частота клинических ремиссий была статистически значимо выше, чем в группах плацебо (18,5% и 8,2% соответственно, p = 0,007). В исследовании OCTAVE Sustain была показана эффективность поддерживающей терапии тофацитинибом при сравнении с плацебо[31].
Во всех трех исследованиях OCTAVE лечение тофацитинибом сопровождалось повышением уровней липидов крови. В РКИ OCTAVE 1 и 2 инфекционная заболеваемость была выше при лечении тофацитинибом, чем в группах плацебо[31].
Основываясь на результатах серии РКИ OCTAVE, в августе 2018 г. Европейская комиссия одобрила тофацитиниб (Xeljanz, Pfizer) для лечения ЯК средней тяжести у взрослых пациентов, не отвечающих либо не переносящих традиционную терапию или биологические препараты[32].
Следует заметить, что тофацитиниб стал первым пероральным препаратом, предназначенным для долгосрочного применения при ЯК.
В отличие от результатов лечения ЯК, результаты применения тофацитиниба при БК оказались разочаровывающими. В нескольких РКИ после лечения больных БК не было никаких различий в частоте клинического ответа в группах тофацитиниба и плацебо[33]. Последующие клинические испытания по изучению эффективности и безопасности тофацитиниба при БК были прекращены.
ПОДХОДЫ К ЛЕЧЕНИЮ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА У ДЕТЕЙ
Лечение ВЗК у детей основано на комплексном подходе, подборе наиболее эффективной тактики: консервативной или хирургической — и нацелено на достижение и поддержание бесстероидной ремиссии, предотвращение прогрессирования заболевания, профилактику ранних и поздних осложнений, в том числе злокачественного перерождения, улучшение качества жизни пациентов и их социализацию.
Выбор консервативного или хирургического лечения определяется тяжестью атаки, протяженностью поражения, наличием внекишечных проявлений, временем от дебюта заболевания до верификации диагноза, эффективностью и наличием осложнений при ранее проведенном лечении, а также риском развития осложнений[34].
Важным является взаимодействие специалистов различного педиатрического профиля: гастроэнтерологов, хирургов, ревматологов, дерматологов, иммунологов, психологов, диетологов.
Пероральные и ректальные препараты 5-аминосалициловой кислоты
Согласно клиническим рекомендациям Союза педиатров России пероральное применение препаратов 5-аминосалициловой кислоты (5-АСК) является терапией первой линии для индукции и поддержания ремиссии у детей с ЯК при легкой и среднетяжелой активности воспалительного процесса. Доза перорального месалазина должна составлять от 60 до 80 мг/кг/сут (не > 4,8 г/сут); сульфасалазина — от 70 до 100 мг/кг/сут (максимальная доза — 4 г/сут). Ректальные препараты 5-АСК назначаются в дозе 25 мг/кг (до 1 г/сут)[35].
Рекомендована комбинация пероральных и местных препаратов 5-АСК, так как она более эффективна, чем применение каждого препарата в отдельности[35, 36]. Важно использовать адекватные дозы препаратов 5-АСК при индукции и поддержании ремиссии ЯК.
Обострение колита может имитироваться острой непереносимостью салазопрепаратов. Улучшение самочувствия после отмены 5-АСК и появление симптомов после ее повторного назначения позволяют верифицировать причину состояния и являются противопоказанием к назначению любых препаратов, содержащих 5-АСК.
При отсутствии ответа на прием салазопрепаратов в течение 2 недель рекомендовано применение альтернативного лечения — подключение местной терапии или назначение пероральных ГКС[35].
Системные глюкокортикостероиды
ГКС рекомендовано использовать для индукции ремиссии ВЗК, но не для ее поддержания, ввиду развития осложнений и гормональной резистентности[37].
Пероральные ГКС целесообразно применять при среднетяжелой атаке с системными проявлениями и у отдельных пациентов детского возраста с тяжелой атакой без системных проявлений или у пациентов, не достигших ремиссии на фоне терапии адекватной дозой 5-АСК. При тяжелой атаке проводится внутривенная терапия ГКС[35].
Доза перорального преднизолона — 1–2 мг/кг/сут с ее постепенным снижением и отменой к 12-й неделе (рис.), доза для внутреннего введения при тяжелой атаке — до 3–5 мг/кг/сут. Применение ГКС обеспечивает значительное подавление воспаления и быстрое исчезновение симптомов[35].
Рис. Схема снижения дозы глюкокортикостероидов у детей с язвенным колитом в зависимости от индукционной дозы[35]
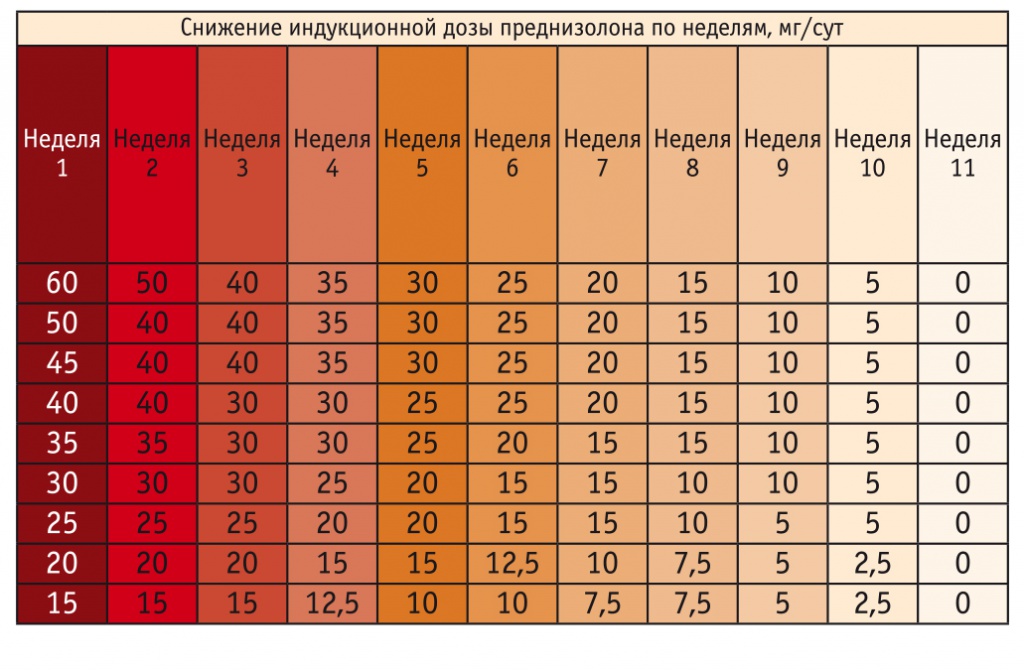
Однако системные побочные эффекты ГКС часто осложняют ведение больных, что приводит к досрочной отмене препаратов и/или к самостоятельному прекращению лечения больными. Удлинение курса гормональной терапии не приносит пользы[38].
Топические глюкокортикостероиды
В отличие от классических ГКС, только около 10% будесонида достигают системного кровотока. В связи с этим для него в меньшей степени характерны побочные эффекты стероидной терапии[38].
Согласно рекомендациям Европейской организации по изучению язвенного колита и болезни Крона (англ. European Crohn´s and Colitis Organisation) 2017 г., применение будесонида возможно при БК илеоцекальной локализации при легкой и среднетяжелой атаке[38]. Дозирование будесонида: 8 недель — 9 мг/сут, 2 недели — 6 мг/сут, 2 недели — 3 мг/сут, далее отмена. Средняя продолжительность терапии — 12 недель.
Иммуносупрессоры
Назначение тиопуринов обосновано для поддержания ремиссии у детей с непереносимостью препаратов 5-АСК и/или с часто рецидивирующим ВЗК (2–3 обострения в год), а также с развитием гормонозависимой формы заболевания на фоне проведения терапии 5-АСК в максимальных дозах[35, 39].
Терапевтический эффект тиопуринов достигается через 10–14 недель от начала лечения. Доза может корректироваться приблизительно до 2,5 мг/кг для азатиоприна или 1–1,5 мг/кг для 6-меркаптопурина и приниматься однократно.
Метотрексат угнетает дигидрофолатредуктазу и синтез ДНК, подавляет активность IL-1 и пролиферацию Т-лимфоцитов. Применение метотрексата при ЯК у детей в настоящее время не рекомендуется[35, 36].
Действие иммуносупрессоров развивается медленно (через 2–3 месяца от начала терапии), поэтому данные препараты более пригодны для поддержания ремиссии[36].
Биологические препараты
В настоящее время у детей рекомендовано назначать ИФМ в качестве препарата первой линии биологической терапии ЯК и БК[35, 40].
Учитывая потенциальное благоприятное действие и высокую безопасность 5-АСК, представляется рациональным комбинированное применение 5-АСК и биологических препаратов.
Показано, что ИФМ эффективен в индукции клинической ремиссии, обеспечивает заживление слизистой оболочки и снижает потребность в проведении колэктомии у детей с активным ЯК, не ответивших на стандартную терапию[41].
Согласно данным проведенного у детей РКИ Т-72, через 8 недель применения ИФМ 73% больных ЯК ответили на лечение и 40% достигли клинической ремиссии, у 68% пациентов отмечалось заживление слизистой оболочки по данным эндоскопического исследования. При продолжении терапии в течение года в режиме регулярных инфузий по 5 мг/кг каждые 8 недель стойкая клиническая ремиссия без применения ГКС наблюдалась практически у 40% пациентов[35, 42, 43].
Метаанализ исследований о применении ИФМ у детей с ЯК показал, что накопленная долгосрочная эффективность ИФМ при остром тяжелом колите составляет 64%[44]. Избежать колэктомии в течение 2 лет удалось у 61% больных.
ИФМ рекомендовано назначать при гормонорезистентной форме ЯК. Если ИФМ был назначен при острой атаке у пациента, ранее не получавшего тиопурины, биологическая терапия может использоваться как вспомогательная для перехода на применение тиопуринов. В этом случае терапию ИФМ можно прекратить спустя приблизительно 4–8 месяцев[42].
АДБ рекомендовано применять только у пациентов с потерей ответа на ИФМ или с его непереносимостью[35, 36]. Терапию АДБ показано проводить по схеме: индукционная доза на 0-й и 2-й неделе — 120 мг и 80 мг соответственно при массе тела ≥ 40 кг или 80 мг и 40 мг соответственно при массе тела менее 40 кг; затем поддерживающая терапия по 40 мг 1 раз в 2 недели. Препарат вводится подкожно. Может потребоваться индивидуальный подбор дозы[35, 36].
В настоящее время зарегистрированы биосимиляры (биоаналоги) анти-ФНО-препаратов, которые эквивалентны им по строению и схожи с ними по эффективности, однако возможность перехода с оригинальных препаратов на биоаналоги или обратно на сегодняшний день не доказана [45].
ЗАКЛЮЧЕНИЕ
Подробный анализ литературы позволяет сделать вывод о положительных сдвигах в терапии воспалительных заболеваний кишечника (ВЗК). Можно отметить развившийся в кратчайшие сроки тренд перехода от неселективного лечения (глюкокортикостероиды и препараты 5-аминосалициловой кислоты) к таргетной терапии: ингибиторам фактора некроза опухоли (ФНО) и ведолизумабу. Более того, многие новые биологические препараты в фазе разработки и тестирования показывают обнадеживающие результаты.
Другая многообещающая тенденция — выход на рынок биосимиляров анти-ФНО-препаратов, которые продемонстрировали эквивалентную эффективность в лечении ВЗК, однако дальнейшие исследования должны подтвердить возможность замены оригинальных средств.
При всех положительных результатах биологические препараты неидеальны: необходимо решить проблему развития вторичной резистентности к терапии, проблему реактивации вторичных инфекций, таких как туберкулез и гепатит В.
Вопрос терапии ВЗК особенно остро стоит в педиатрии, так как у детей эти заболевания протекают намного тяжелее, сопряжены с отставанием в росте и развитии и с более высоким риском злокачественных новообразований кишечника. В связи с этим необходимо с самого начала определиться с тактикой терапии и назначить наиболее эффективный препарат с минимальным количеством побочных эффектов.
Статья в формате PDF
В 2018 г. Японское гастроэнтерологическое общество (Japanese Society of Gastroenterology) обновило положения клинического практического руководства, основанного на данных доказательной медицины, по лечению пациентов с язвенным колитом (ЯК) и болезнью Крона (БК). Новая версия этого документа содержит 59 клинических вопросов, которые представлены в 9 категориях. Ниже приведено содержание разделов, описывающих современные методы лечения воспалительных заболеваний кишечника (ВЗК).
3. Общие рекомендации по лечению
3-1. Следует ли больным ВЗК бросать курить?
- Ввиду негативного влияния курения на тяжесть заболевания у больных ЯК при формулировании пожеланий по отказу от курения с учетом его комплексного влияния на здоровье рекомендуется не поощрять эту вредную привычку, принимая во внимание степень тяжести заболевания.
- Среди пациентов с БК также рекомендуется политика, не поддерживающуя курение.
3-2. Следует ли больным ВЗК отказаться от алкоголя?
- Рекомендуется грамотно советовать больным ВЗК воздерживаться от избыточного употребления алкоголя, учитывая их состояние (тяжесть заболевания, наличие осложнений); нет данных доказательной медицины, поддерживающих полный отказ от употребления алкоголя.
4. Терапевтические вмешательства при ВЗК
4-1. Показания, риски/преимущества применения 5-аминосалициловой кислоты (5-АСК) при лечении пациента с ВЗК
- Препараты 5-АСК эффективны для индукции и поддержания ремиссии при ЯК.
- Эффективность препаратов 5-АСК при БК, как правило, несколько ниже, чем при ЯК. Они успешно уменьшают тяжесть БК, однако их эффективность в поддержании ремиссии не доказана.
- Эффективность препаратов 5-АСК для профилактики ЯК, ассоциированного с колоректальной карциномой, не доказана.
4-2. Показания, риски/преимущества применения кортикостероидов при лечении пациента с ВЗК
- Кортикостероиды обладают выраженными противовоспалительными свойствами, они эффективны в индукции ремиссии при ЯК и БК.
- Кортикостероиды неэффективны в поддержании ремиссии, их длительное применение может привести к возникновению неблагоприятных побочных действий, поэтому кортикостероиды не следует применять в целях поддержания ремиссии.
4-3. Показания, риски/преимущества применения иммуномодуляторов при лечении пациента с ВЗК
- Азатиоприн/6-меркаптопурин являются эффективными препаратами для профилактики рецидивов у пациентов с ЯК, находящихся в фазе ремиссии, они также эффективно поддерживают ремиссию у стероидзависимых пациентов и пациентов, у которых было невозможно достичь ремиссии при применении 5-АСК.
- Азатиоприн/6-меркаптопурин являются эффективными препаратами для поддержания ремиссии при БК. Прием азатиоприна/6-меркаптопурина позволяет предотвратить проведение хирургического вмешательства. Также эти препараты успешно уменьшают вероятность возникновения постоперационного клинического и эндоскопического рецидивов. Их комбинация с инфликсимабом повышает результативность действий по индукции ремиссии по сравнению с монотерапией инфликсимабом.
- Терапия азатиоприном/6-меркаптопурином повышает риск развития лимфомы. К другим распространенным побочным действиям относятся симптомы поражения пищеварительной системы: тошнота, миелосупрессия, алопеция, панкреатит.
- Такролимус эффективен в индукции ремиссии при тяжелом ЯК, однако недостаточно данных, подтверждающих эффективность и безопасность его длительного применения.
- Циклоспорин эффективен в индукции ремиссии при тяжелом и рефрактерном течении ЯК; его эффективность сопоставима с таковой инфликсимаба.
4-4. Показания, риски/преимущества применения антибиотиков и пробиотиков при лечении пациента с ВЗК
- Антибиотики могут быть эффективны в индукции ремиссии при БК.
- Антибиотики могут уменьшить количество выделений из анальной фистулы при БК.
- Антибиотики могут быть эффективны в индукции ремиссии при ЯК, но тип и длительность приема антибактериальных препаратов не определена.
- Антибиотики также эффективны в лечении резервуарного илеита, возникшего после колэктомии по поводу ЯК.
4-5. Эффективность ингибиторов фактора некроза опухоли (ФНО) при лечении пациента с ВЗК
- Ингибиторы ФНО эффективны в индукции ремиссии при стероидрефрактерном или стероидзависимом ЯК со среднетяжелым/тяжелым течением заболевания.
- Ингибиторы ФНО эффективны в индукции и поддержании ремиссии у больных БК с тяжелым воспалительным процессом.
4-6. Показания, риски/преимущества применения нутритивной терапии при ведении пациента с ВЗК
- Эффективность изолированного применения нутритивной терапии, включающей энтеральное или полное парентеральное питание в индукции ремиссии при ЯК, не доказана. Поэтому больных ЯК не следует принуждать ограничивать диету; лечение должно основываться на медикаментозной терапии и/или цитоферезе.
- Энтеральная нутритивная терапия эффективна в индукции ремиссии у пациентов с тяжелым БК. Энтеральное питание имеет хороший профиль безопасности, но такой подход тяжело применим у пациентов с ВЗК.
- Питание элементными смесями эффективно для поддержания ремиссии при БК.
4-7. Показания, риски/преимущества проведения цитофереза при лечении пациента с ВЗК
- Проведение цитофереза целесообразно для индукции ремиссии при среднетяжелом/тяжелом течении ЯК; цитоферез имеет высокий профиль безопасности. Интенсивная терапия (2 сеанса в неделю) позволяет быстрее достичь ремиссии у большего количества пациентов, чем еженедельное выполнение процедуры.
- Следует рассмотреть целесообразность проведения моноцитофереза у больных БК с тяжелым поражением толстого кишечника в том случае, если фармакологическое лечение или нутритивная терапия оказались неэффективными.
4-8. Показания, риски/преимущества хирургического вмешательства при лечении пациента с ВЗК
- Хирургическое вмешательство может улучшить прогноз для жизни у пациентов с тяжелым течением заболевания или ВЗК на фоне дисплазии/рака. Оно может повысить качество жизни у пациентов с рефрактерными к медикаментозной терапии клиническими проявлениями ВЗК, со значимыми побочными эффектами на фоне приема лекарственных средств, при внекишечных проявлениях заболевания.
- Хирургическое лечение может осложниться возникновением таких постоперационных осложнений, как несостоятельность анастомоза, интестинальная обструкция, резервуарный илеит (при ЯК), недостаточность тонкого кишечника у больных БК.
5. Лечение ЯК
1) Лечение пациента при легком/среднетяжелом течении дистального ЯК (рис. 1)
5-1. Показания для назначения 5-АСК при легком/среднетяжелом течении активного дистального ЯК
- Применение клизм с 5-АСК рассматривается в качестве терапии первой линии для индукции ремиссии.
- Монотерапия пероральными препаратами 5-АСК также эффективна и рекомендована для индукции ремиссии.
- Комбинация пероральных и топических форм 5-АСК рекомендуется больным, нуждающимся в более сильном лечении, чем монотерапия пероральными или топическими препаратами, содержащими 5-АСК.
- Клизмы с 5-АСК рекомендуются в качестве препаратов первого выбора для проведения топической терапии, т.к. их эффективность как минимум сопоставима или превосходит таковую клизм с кортикостероидами.
5-2. Показания для назначения кортикостероидов при легком/среднетяжелом течении активного дистального ЯК
- Рекомендуется не применять ни пероральные, ни топические кортикостероиды в качестве терапии первой линии, несмотря на то, что эти препараты эффективны в индукции ремиссии.
- Рекомендуется не использовать клизмы с кортикостероидами в качестве терапии первой линии, потому что их эффективность сопоставима или несколько ниже таковой клизм с 5-АСК.
- Пациентам, не ответившим на терапию пероральными препаратами 5-АСК в оптимальной дозе в комбинации с топическими средствами, содержащими 5-АСК/стероиды, рекомендуется назначить ежедневный пероральный прием преднизолона в стартовой дозе 30-40 мг.
5-3. Показания для комбинированного лечения легкого/среднетяжелого течения активного дистального ЯК
- Рекомендуется рассмотреть целесообразность назначения проведения цитофереза или применения инфликсимаба/адалимумаба больным ЯК, не ответившим на терапию препаратами 5-АСК или стероидами.
- Антибиотики могут быть эффективны в индукции ремиссии, однако наиболее целесообразные группы антибиотиков, их комбинации и длительность терапии еще не определены.
5-4. Терапия, рекомендованная при легком/среднетяжелом течении активного проктита
- Суппозитории 5-АСК рекомендуются для индукции ремиссии у больных проктитом.
- Если пациенты не отвечают на применение суппозиториев с 5-АСК, рекомендуется рассмотреть целесообразность комбинированной терапии пероральными препаратами 5-АСК или переход на топическую терапию кортикостероидами.
2) Терапия при легком/среднетяжелом течении обширного ЯК (рис. 2)
5-5. Показания для применения пероральной 5-АСК при легком/среднетяжелом течении обширного ЯК
- Рекомендуется применять пероральные препараты 5-АСК в качестве терапии первой линии.
- Рекомендуется применять клизмы с 5-АСК при левостороннем колите.
5-6. Показания для назначения кортикостероидов при легком/среднетяжелом течении обширного ЯК
- Рекомендуется назначать преднизолон (30-40 мг/сут), если пациент не отвечает на достаточную дозу 5-АСК.
- Рекомендуется рассмотреть целесообразность отмены кортикостероида при достижении клинического ответа с целью предотвращения его длительного применения.
5-7. Показания для назначения комбинированной терапии при легком/среднетяжелом течении обширного ЯК
- Рекомендуется назначать цитоферез пациентам со стероидрефрактерным, стероидзависимым ЯК, а также больным, не переносящим кортикостероиды.
- Рекомендуется рассмотреть целесообразность назначения такролимуса или ингибитора ФНО пациентам со стероидрефрактерным/стероидзависимым и среднетяжелым/тяжелым течением заболевания.
3) Лечение тяжелого ЯК (рис. 3)
5-8. Показания для назначения кортикостероидов при тяжелом ЯК
- Рекомендуется применять кортикостероиды в качестве терапии первой линии.
- Рекомендуется назначать преднизолон в суточной дозе 1-1,5 мг/кг (или эквивалентной дозе) в/в при лечении тяжелого ЯК.
5-9. Показания для применения иммуномодуляторов при тяжелом ЯК
- Рекомендуется рассмотреть целесообразность в/в введения циклоспорина при лечении стероидрефрактерного тяжелого ЯК.
- Рекомендуется рассмотреть целесообразность назначения такролимуса при стероидрефрактерном тяжелом ЯК.
5-10. Показания для назначения ингибиторов ФНО при тяжелом ЯК
- Ингибиторы ФНО рекомендуются пациентам, рефрактерным к стандартной терапии.
- Сравнительное исследование продемонстрировало сопоставимую эффективность инфликсимаба с таковой циклоспорина в лечении больных, рефрактерных к назначению кортикостероидов.
5-11. Показания для проведения цитофереза при тяжелом течении ЯК
- Рекомендуется рассмотреть целесообразность назначения цитофереза в качестве одного из методов выбора для облегчения достижения ремиссии, т.к. у пациентов с чрезвычайно тяжелым течением ЯК описан стероидсберегающий эффект при проведении цитофереза.
- Цитоферез рекомендуется проводить 2 р/нед или чаще для более быстрого достижения ремиссии.
4) Поддерживающая терапия ЯК в фазе ремиссии (рис. 4)
5-12. Показания для назначения 5-АСК при ЯК в фазе ремиссии
- Пероральная 5-АСК в дозе 2 г/сут или более рекомендуется для поддержания клинической/эндоскопической ремиссии.
- Клизмы с 5-АСК рекомендуются для поддержания ремиссии при дистальном колите.
5-13. Показания для назначения иммуномодуляторов при ЯК в фазе ремиссии
- Иммуномодуляторы (азатиоприн, 6-меркаптопурин) рекомендованы пациентам со стероидзависящим ЯК или при возникновении трудностей в связи с отменой кортикостероидов.
5-14. Показания для назначения ингибиторов ФНО при ЯК в фазе ремиссии
- Длительный прием ингибиторов ФНО рекомендован для поддержания ремиссии при среднетяжелом/тяжелом течении ЯК тем пациентам, которые достигли ремиссии при помощи этих препаратов.
- Поддержание ремиссии при помощи ингибиторов ФНО сопряжено с низкой вероятностью проведения колэктомии.
5-15. Показания для назначения смешанной терапии при ЯК в фазе ремиссии и как она применяется
- Любая другая терапия, отличная от 5-АСК, тиопуринов, ингибиторов ФНО, не способствует поддержанию ремиссии, поэтому ее не следует для этого использовать.
5) Оперативное лечение пациента с ЯК
5-16. Показания для хирургического вмешательства при ЯК
- Оперативное лечение рекомендуется, если возникла перфорация кишечника, массивное кровотечение, токсический мегаколон, колоректальный рак или высокодифференцированная дисплазия, а также при тяжелом течении заболевания, которое не отвечает на медикаментозную терапию.
- Хирургическое вмешательство рекомендовано при неэффективности адекватной медикаментозной терапии, наличии внекишечных осложнений или побочных эффектов, вызванных приемом лекарственных средств, а также больным, у которых повседневный образ жизни значительно изменился под влиянием заболевания.
5-17. Какие хирургические вмешательства выполняются при ЯК?
- Рекомендуется выполнять тотальную проктоколэктомию с илеоанальным резервуарным анастомозом или подвздошно-резервуарно-анальной реконструкцией в качестве стандартной хирургической техники планового оперативного вмешательства.
5-18. Постоперационные осложнения, характерные для ЯК, и подходы к лечению таких пациентов
- В постоперационном периоде могут возникнуть несостоятельность анастомоза или обструкция кишечника, в этом случае рекомендовано повторное хирургическое вмешательство.
Рекомендуется назначить антибиотики при резервуарном илеите.
6. Лечение пациента с БК
1) Лечение пациента при легком/среднетяжелом течении БК (рис. 5)
6-1. Терапия выбора при легком/среднетяжелом течении активной БК
- Салазосульфопиридин или кортикостероиды рекомендованы при легком/среднетяжелом течении активной БК с поражением толстого кишечника.
- Рекомендуется отдать предпочтение энтеральному питанию / системным кортикостероидам при поражении тонкого кишечника.
- Следует рассмотреть целесообразность назначения ингибитора ФНО при стероидзависимом или стероидрефрактерном течении болезни.
2) Лечение пациента со среднетяжелой или тяжелой активной БК (рис. 5)
6-2. Терапия выбора при среднетяжелом или очень тяжелом течении БК
- Рекомендован пероральный прием кортикостероидов (преднизолон ≈40 мг/сут).
- Рекомендуется рассмотреть целесообразность энтеральной нутритивной терапии, хотя ее эффективность в индукции ремиссии сопоставима или несколько ниже таковой при применении кортикостероидов.
- Рекомендуется рассмотреть целесообразность назначения ингибиторов ФНО стероидрефрактерным больным.
- Рекомендуется рассмотреть целесообразность гранулоцитофереза у пациентов с активным поражением толстого кишечника, не отвечающих или не переносящих лекарственную/нутритивную терапию.
3) Лечение пациента с тяжелой/фульминантной БК (рис. 5)
6-3. Терапия выбора при очень тяжелом/фульминантном течении активной БК
- Рекомендуется госпитализировать пациентов, перевести их на энтеральное питание, назначить инфузионную терапию и переливание крови (при необходимости), антибиотики (если имеются симптомы, позволяющие заподозрить инфекцию).
- Рекомендуется назначить в/в введение кортикостероидов (преднизолон 40-60 мг/сут) после исключения инфекции.
- Рекомендуется рассмотреть целесообразность назначения ингибиторов ФНО стероидрефрактерным пациентам.
- Рекомендуется раннее проведение консультации хирурга, если пациент находится в тяжелом состоянии или не отвечает на терапию ингибиторами ФНО.
4) Перианальные повреждения
6-4. Медикаментозная терапия пациента с перианальными повреждениями при БК
- Рекомендуется определить наличие показаний для проведения хирургического лечения перианальных повреждений в ходе объективного осмотра, выполненного опытным хирургом/проктологом и специалистами, проводящими визуализирующие исследования.
- Рекомендуется применять иммуномодуляторы для медикаментозной терапии анальных фистул.
- В случае если абсцессы плохо поддаются лечению, рекомендуется рассмотреть целесообразность назначения иммуномодуляторов в качестве медикаментозной терапии анальных фистул.
5) Кишечные осложнения (фистула, стриктуры, абсцессы, кровотечение) (рис. 6)
6-5. Кишечные осложнения при БК: терапия выбора при наличии фистул
- Рекомендуется рассмотреть целесообразность назначения антибиотиков, иммуномодуляторов, ингибиторов ФНО в качестве медикаментозной терапии перианальных фистул.
- Рекомендуется рассмотреть целесообразность назначения ингибиторов ФНО для лечения наружных тонкокишечных свищей при условии отсутствия интестинального стеноза и сложных свищей.
- Хирургическое вмешательство рекомендуется для лечения свищей, сопровождающихся формированием абсцессов, или внутренних свищей, ассоциированных с тяжелой мальабсорбцией.
6-6. Кишечные осложнения при БК: терапия выбора при наличии стриктур
- Рекомендуется кратковременный прием кортикостероидов / ингибиторов ФНО при лечении стриктур воспалительного генеза.
- Если симптомы обструкции не уменьшаются при проведении монотерапии лекарственными средствами, то рекомендуется выполнить эндоскопическую дилатацию или хирургическое вмешательство.
6-7. Кишечные осложнения при БК: терапия выбора при кровотечении
- Рекомендуется попытаться добиться гемостаза эндоскопическими или интервенционными радиологическими методами наряду с оказанием общей медицинской помощи.
- В качестве медикаментозной терапии рекомендуется инфликсимаб.
- В случае, если гемостаз не может быть достигнут проведением консервативной терапии, показано хирургическое вмешательство.
6-8. Кишечные осложнения при БК: терапия выбора при абсцессе
- Прием антибиотиков, чрескожный дренаж и/или вскрытие абсцесса рекомендуется после проведения таких визуализирующих методов исследования, как компьютерная томография, ультразвуковое исследование и магнитно-резонансная томография.
- Назначение ингибиторов ФНО после лечения абсцесса уменьшает риск его рецидива.
6) Другие гастроинтестинальные повреждения
6-9. Терапия выбора при вовлечении в патологический процесс верхних отделов пищеварительного тракта при БК
- Несмотря на недостаточность доказательной базы, рекомендуется рассмотреть целесообразность назначения ингибиторов протонной помпы, кортикостероидов, тиопуринов и инфликсимаба для лечения активных поражений верхних отделов пищеварительного тракта.
- Рекомендуется назначить кортикостероиды и/или тиопурины при стенозе отечного генеза и рассмотреть целесообразность эндоскопической баллонной дилатации фиброзных стриктур.
7) Поддерживающая терапия при БК в фазе ремиссии (рис. 7)
6-10. Рекомендации по предотвращению рецидива БК в фазе ремиссии заболевания
- Рекомендуется информировать курильщиков о целесообразности отказа от курения.
- Рекомендуется избегать длительного приема нестероидных противовоспалительных препаратов.
6-11. Терапия выбора для предотвращения рецидива БК во время ремиссии заболевания
- Рекомендуется назначать тиопурин (азатиоприн/6-меркаптопурин) для поддержания ремиссии.
- Рекомендуется плановый профилактический прием ингибиторов ФНО, если ремиссия была достигнута при помощи этих препаратов.
- Рекомендуется рассмотреть целесообразность проведения энтеральной нутритивной терапии и назначения препаратов 5-АСК для поддержания ремиссии.

6-12. Показания к оперативному лечению пациента с БК
- Хирургическое вмешательство рекомендовано при перфорации, массивном кровотечении, раке, обструкции кишечника, рефрактерной к медикаментозной терапии, абсцессах.
- Хирургическое вмешательство рекомендовано при рефрактерном стенозе, внутренних и наружных свищах, неподдающихся медикаментозной терапии, рефрактерных внекишечных осложнениях (задержке роста, гангренозной пиодермии), перианальных повреждениях, устойчивых к консервативному лечению.
6-13. Хирургические вмешательства, рекомендованные при БК
- Лечение стриктур или формирующихся свищей рекомендуется проводить посредством резекции пораженного участка тонкого кишечника или пластики стриктуры (если это возможно).
- Перианальные повреждения, рефрактерные к медикаментозной терапии, рекомендуется лечить посредством локальных вмешательств, таких как дренирование свища с проведением лигатуры, формирование стомы, ампутация прямой кишки.
6-14. Постоперационные осложнения при БК и подходы к лечению таких пациентов
- К осложнениям, возникающим в ранний постоперационный период, относят несостоятельность анастомоза, абдоминальный абсцесс, обструкцию толстого кишечника; рекомендуется их лечить консервативно или оперативно.
- К осложнениям, возникающим в поздний постоперационный период, относят недостаточность тонкого кишечника; для ее коррекции рекомендуется использовать нутритивную терапию.
7. Внекишечные осложнения
7-1. Внекишечные осложнения ВЗК и подходы к лечению таких пациентов
- Выделяют два типа внекишечных осложнений при ВЗК: ассоциированные с тяжестью поражения тонкого кишечника (периферические артриты, нодозная эритема, пероральные афты) и осложнения не связанные с тяжестью поражения тонкого кишечника (гангренозная пиодермия, увеит, анкилозирующий спондилит, первичный склерозирующий холангит).
- При вовлечении в патологический процесс тонкого кишечника сначала рекомендуется купировать его воспаление.
- Локальные и системные кортикостероиды рекомендуются в качестве терапии первой линии при гангренозной пиодермии.
- Рекомендуется рассмотреть целесообразность назначения ингибиторов ФНО для лечения внекишечных осложнений.
Статья печатается в сокращении.
Matsuoka К. Evidence-based clinical practice guidelines for inflammatory bowel disease. J Gastroenterol (2018) 53: 305-353.
Перевела с англ. Татьяна Можина
Медична газета «Здоров’я України 21 сторіччя» № 21 (442), листопад 2018 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
03.05.2023
Гастроентерологія
Виразкова хвороба шлунка: оптимальні стратегії лікування
Значна розповсюдженість кислотозалежних захворювань органів травлення в клініці внутрішніх хвороб робить актуальним питання пошуку ефективного інгібітора протонної помпи (ІПП), який мав би високий потенціал кислотосупресії, передбачуваний терапевтичний ефект та належний профіль безпеки. Безперечно, таким представником у класі ІПП є пантопразол, який зарекомендував себе як ефективний та безпечний засіб при терапії виразкової хвороби (ВХ) шлунка і дванадцятипалої кишки (ДПК)….
02.05.2023
Гастроентерологія
Сучасні стандарти профілактики та лікування НПЗП-асоційованих ушкоджень шлунка і кишечнику
Щороку в світі стрімко підвищується кількість пацієнтів, котрі отримують нестероїдні протизапальні препарати (НПЗП), отже, зростають проблеми, асоційовані з використанням цих засобів, у т. ч. ушкодження шлунково-кишкового тракту (ШКТ). Безумовно, це потребує формування нових і зваженіших та раціональніших підходів до профілактики й лікування таких станів, тому над вирішенням цієї задачі працюють провідні світові, в т. ч. українські, фахівці в галузі гастроентерології, фармакології, а також інших сфер медицини.
Про алгоритми ведення хворих із НПЗП-асоційованими ушкодженнями шлунка та кишечнику кореспонденту нашої редакції розповів член-кореспондент НАМН України, директор ДУ «Інститут гастроентерології НАМН України» (м. Дніпро), доктор медичних наук, професор Юрій Миронович Степанов….
по материалам международных издании
УДК 616.34
Clmjcjl Nutrition (2020}632-6И
Contants lists, available at ScienceDlioet
Clinical Nutrition
L LSEV1ER journal homepage: http://wuvw.alsovi0r.com/locaia/clnu
CLINICAL NUTRITION
и ■ —
ESPE M Guideline
ESPEN practical guideline: Clinical Nutrition in inflammatory bowel (Ц)
disease
warn
Stephan С. Bischoff*1-‘, Johanna Escherь, Xavier Hébuterne cf Stanistaw Klçk d, Zeljko KrznaricStéphane Schneiderc, Raanan Shamir Kalina Stardelova Nicolette Wierdsma , Anthony E. Wiskiiî Alastair ForbesJ
Практическое руководство ESPEN: клиническое питание
при воспалительных заболеваниях кишечника
По материалам ESPEN practical guideline: Clinical Nutrition in inflammatory bowel disease
Stephan C. Bischoff, Johanna Escher, Xavier H^uterne, Stanislaw Klçk, Zeljko Krznaric, Stéphane Schneider, Raanan Shamir, Kalina Stardelova, Nicolette Wierdsma, Anthony E. Wiskin, Alastair Forbes
Clinical Nutrition 39 (2020) 632-653
Адаптированный перевод подготовили для публикации:
А.А. КАМАлОВА, Э.Р. сАФиНА, Г.А. ГАРиНА, А.Р. ГАЙФУТДиНОВА
Казанский государственный медицинский университет МЗ РФ, г. Казань
Контактная информация:
Камалова Аэлита Асхатовна — доктор медицинских наук, профессор кафедры госпитальной педиатрии Адрес: 420012, г. Казань, ул. Бутлерова, д. 49, тел.: +7 (843) 237-30-37, e-mail: aelitakamalova@gmail.com
В статье представлен адаптированный перевод современного практического руководства Европейской ассоциации клинического питания и метаболизма (ESPEN) по клиническому питанию при воспалительных заболеваниях кишечника (2020).
Ключевые слова: болезнь Крона, язвенный колит, энтеральное питание, парентеральное питание, воспалительные заболевания кишечника, диетотерапия.
(Для цитирования: Камалова А.А., Сафина Э.Р., Гарина Г.А., Гайфутдинова А.Р. Практическое руководство ESPEN: клиническое питание при воспалительных заболеваниях кишечника. Практическая медицина. 2021. Т. 19, № 5, С. 67-74) DOI: 10.32000/2072-1757-2021-5-67-74
A.A. KAMALOVA, E.R. SAFINA, G.A. GARINA, A.R. GAYFUTDINOVA
Kazan State Medical University, Kazan
ESPEN practical guideline:
Clinical Nutrition in inflammatory bowel disease
Contact details:
Kamalova A.A. — MD, Professor of the Department of Hospital Pediatrics
Address: 49 Butlerov St., Kazan, Russian Federation, 420012, tel.: +7 (843) 237-30-37, e-mail: aelitakamalova@gmail.com
The article presents an adapted translation of the current ESPEN (European Society for Clinical Nutrition and Metabolism) practical guideline: Clinical Nutrition in inflammatory bowel disease (2020).
Key words: Crohn’s disease, ulcerative colitis, enteral nutrition, parenteral nutrition, inflammatory bowel disease, diet therapy.
(For citation: Kamalova A.A., Safina E.R., Garina G.A., Gayfutdinova A.R. ESPEN practical guideline: Clinical Nutrition in inflammatory bowel disease. Practical medicine. 2021. Vol. 19, № 5, P. 67-74)
Воспалительные заболевания кишечника (ВЗК), язвенный колит (ЯК) и болезнь Крона (БК) в настоящее время имеют высокую распространенность во всех развитых странах. Недостаточность питания (НП) может наблюдаться как при ЯК, так и при БК. НП значительно более выражена при БК вследствие возможного поражения любого отдела желудочно-кишечного тракта (ЖКТ), в отличие от ЯК, при котором заболевание ограничено толстой кишкой. Кроме того, ЯК нечасто сопровождается синдромом мальабсорбции. НП наблюдается в основном в активную фазу заболевания. Поскольку пациенты с ВЗК входят в группу риска по развитию нутритивной недостаточности, они нуждаются в соответствующем скрининге с последующей оценкой и лечением. Диетологическая помощь при ВЗК включает профилактику развития НП, дефицита микроэлементов и остеопороза, а также обеспечение оптимального роста и развития детей.
Методология
Настоящее практическое руководство состоит из 40 рекомендаций и основано на Руководстве
ESPEN: «Клиническое питание при воспалительных заболеваниях кишечника»: практическая версия [1] и научная версия [2]. Более подробную информацию о методологии смотрите в полной версии руководства ESPEN [1] и ESPENSOP [3].
Практическое руководство ESPEN «Клиническое питание при воспалительных заболеваниях кишечника» было структурировано в соответствии с блок-схемой, охватывающей все аспекты ВЗК, связанные с питанием (рис. 1).
Результаты
I. Профилактика ВЗК
Курение, прием антибиотиков и диета являются потенциально обратимыми факторами риска развития ВЗК. Согласно данным систематического обзора «Питание и риск развития ВЗК», повышенный риск развития ЯК и БК связан с высоким потреблением ПНЖК, омега-6 жирных кислот и мяса, а высокое потребление клетчатки (> 22 г/сут.) и фруктов снижает риск БК, но не ЯК [4]. Кумулятивное потребление общего жира, насыщенных жиров,
Рисунок 1. Блок-схема, характеризующая анализ всех аспектов ВЗК, представленных в практическом руководстве
Figure 1. The chart characterizing the analysis of all aspects of inflammatory bowel disease showed in the manual
ненасыщенных жиров, омега-6 и омега-3 ПНЖК не было связано с риском развития БК или ЯК [5]. Тем не менее при увеличении потребления омега-3 ДПНЖК наблюдалась тенденция к снижению риска ЯК. Напротив, при длительном потреблении большого количества транс-ненасыщенных жирных кислот была выявлена тенденция к увеличению частоты развития ЯК.
Диета, богатая фруктами и овощами, оме-га-3 жирными кислотами и низким содержанием омега-6 жирных кислот, снижает риск развития БК или ЯК._
Убедительно продемонстрирована польза грудного вскармливания [6, 7], поэтому необходимо рекомендовать грудное вскармливание, так как оно оптимально для питания младенцев и снижает риск развития ВЗК.
II. Общие диетологические аспекты
Взрослые с ВЗК подвержены повышенному риску развития НП, причем дефицит чаще встречается при БК, чем при ЯК [8]. Пациенты с ожирением могут иметь скрытый дефицит мышечной массы, который может быть обнаружен путем измерения толщины кожных складок. Пациенты с активным ВЗК, особенно те, у кого заболевание плохо отвечает на терапию, имеют самый высокий риск развития НП. У взрослых риск ее развития можно оценить с помощью валидизированных инструментов скрининга [9]. НП часто встречается у детей с болезнью Крона при постановке диагноза и может сохраняться, несмотря на лечение заболевания [10]. Дети с яК также подвержены риску развития НП, но дефицит питательных веществ не всегда очевиден при оценке только роста и массы тела [11].
Эксперты ESPEN считают, что энергетические потребности пациентов с ВЗК аналогичны таковым у здорового населения, а потребность в белке повышается в активной стадии ВЗК, следовательно, потребление должно быть увеличено, до 1,2-1,5 г/кг/сут. у взрослых, по сравнению с рекомендованным в общей популяции. Потребность в белке в период ремиссии, как правило, остается на прежнем уровне, и обеспечение должно быть сопоставимым, около 1 г/кг /сут. у взрослых, по сравнению с рекомендуемым для общей популяции. У детей с БК оценка энергетических затрат в состоянии покоя не показала существенных различий. Измерение энергии основного обмена с помощью непрямой калориметрии может применяться в сложных клинических случаях.
Пациенты с ВЗК относятся к группе риска развития микронутриентной недостаточности вследствие диареи, НП и анорексии, сопровождающих активное заболевание. Поэтому при назначении нутритивной поддержки следует рекомендовать поливитаминные и пищевые добавки. При интерпретации результатов исследования важно учитывать, что многие показатели сыворотки крови являются
положительными или отрицательными маркерами острой фазы. Например, уровни ферритина и меди увеличиваются при воспалении, а показатели фолата, селена и цинка уменьшаются [12]. Более того, дефицит может быть даже у пациентов с адекватным питанием [13].
Таким образом, пациентов с ВЗК следует регулярно обследовать (ежегодно) на наличие дефицита микронутриентов, а дефицит определенных веществ должен быть скорректирован соответствующим образом.
Анемия является наиболее частым внекишечным проявлением ВЗК, обычно осложняющим течение как ЯК, так и БК. Все пациенты с ВЗК независимо от их возраста должны быть обследованы на наличие анемии [14]. Основными формами анемии при ВЗК являются железодефицитная анемия (ЖДА), анемия хронического заболевания и анемия смешанного генеза [14]. Для лабораторного скрининга проводят полный анализ крови, определение сывороточного ферритина и С-реактивного белка [14]. Для пациентов с ремиссией или с ВЗК легкой степени тяжести анализы должны проводиться каждые 6-12 месяцев. У амбулаторных больных с активным заболеванием такие измерения должны проводиться не реже одного раза в 3 месяца [14]. У пациентов без клинических, эндоскопических или биохимических изменений, характерных для активной стадии заболевания, уровень сывороточного ферритина < 30 мкг/л является диагностическим критерием ЖДА. При воспалении сывороточный ферритин до 100 мкг/л все еще может быть показателем дефицита железа [14]. При наличии биохимических или клинических признаков воспаления диагностическими критериями анемии хронического заболевания являются сывороточный ферритин > 100 мкг/л и насыщение трансферрина < 20%. Если уровень ферритина в сыворотке составляет от 30 до 100 мкг/л, вероятна комбинация истинного дефицита железа и анемии хронического заболевания [14].
Следовательно, препараты железа рекомендуются всем пациентам с ВЗК при ЖДА.
Пероральный прием препаратов железа следует рассматривать в качестве терапии первой линии у пациентов с легкой ЖДА и клинически неактивной фазой заболевания, с хорошей переносимостью пе-роральных форм препаратов железа. Внутривенное введение препаратов железа, как терапия первой линии, рекомендуется пациентам с клинически активным ВЗК, предшествующей непереносимостью пероральных препаратов железа, уровнем гемоглобина ниже 100 г/л и больным, нуждающимся в препаратах, стимулирующих эритропоэз. Оценка потребности в железе обычно базируется на исходном содержании гемоглобина и массе тела (табл. 1) .
После успешного лечения ЖДА с использованием внутривенного введения железа следует повторить внутривенное лечение препаратами железа, как только ферритин в сыворотке крови снизится до уровня менее 100 мкг/л или уровень гемоглобина составит 12 или 13 г/л в зависимости от пола [14].
III. Диетологические рекомендации в активной фазе ВЗК
Данные рандомизированных контролируемых исследований, касающихся эффективности экспериментальных диет, таких как специфическая
Пациенты с ВЗК находятся в группе риска и поэтому должны быть обследованы на предмет недостаточного питания при постановке диагноза и затем на регулярной основе. Подтвержденную НП у пациентов с ВЗК следует лечить, поскольку она ухудшает прогнози качество жизни, увеличивает частоту осложнений и смертность.
Таблица 1. Простая схема для оценки общей потребности в железе [15]
Table 1. A pattern for assessing the overall demand of iron [15]
Гемоглобин г/л Вес тела < 70 kg Вес тела > 70 kg
100-120 (женщины) 1000 mg 1500 mg
100-130 (мужчины) 1000 mg 1500 mg
70-100 1500 mg 2000 mg
углеводная, палеолитная, безглютеновая, с исключением низкоферментируемых олиго-, ди- и моносахаридов и полиолов (FODMAP) или диеты, обогащенные омега-3-ПНЖК, в настоящее время все еще отсутствуют.
Не существует «диеты при ВЗК», которая бы способствовала ремиссии у пациентов с клинически активным ВЗК, и могла бы быть рекомендована.
Эта рекомендация не исключает потребности всех пациентов с ВЗК в индивидуальном диетологическом подходе, основанном на их конкретной персональной ситуации, предпочтительно при активном участии специального диетолога или диетолога в рамках междисциплинарного подхода.
Постоянная и тяжелая диарея или высокие потери через стомы могут привести к кишечной недостаточности [16] с мальабсорбцией, непреднамеренной потерей веса, недостаточностью питания, дефицитом питательных веществ и/или обезвоживанием.
У пациентов с ВЗК с тяжелой диареей или еюностомой или илеостомой с высокими потерями следует контролировать потери жидкости и содержание натрия в моче, а также адаптировать введение жидкости — уменьшить введение гипотонических растворов и увеличить количество солевых растворов с учетом пищевой непереносимости, которая может увеличить потери жидкости.
В случае продолжающихся высоких потерь через стомы могут потребоваться парентеральные инфу-зии водно-электролитных растворов.
В зависимости от тяжести / степени обструкции и локализации кишечных стриктур может потребоваться нутритивная поддержка, пока ожидается эффект от лечения. Кишечный фиброз является особенностью БК и может проявляться стриктурой, стенозом или кишечной непроходимостью. Стено-зирование при БК приводит к значительному ухудшению качества жизни больных и представляет собой сложную задачу в лечении. Лечение может быть консервативным, с применением препаратов, когда сужение обусловлено, в основном, воспалением, или механическим, с помощью баллонной дилатации или хирургического вмешательства, когда имеется фиброзное рубцевание. У пациентов с рентгенологически идентифицированным, но бессимптомным стенозом обычно рекомендуется модифицированная диета с низким содержанием нерастворимой клетчатки, но надежных доказательств, подтверждающих этот, по-видимому, логичный подход, в настоящее время нет. При наличии симптомов может возникнуть необходимость в адаптации диеты — рекомендуются продукты с мягкой консистенцией, возможно, преимущественно в жидкой форме.
Пациентам с БК с кишечными стриктурами и стенозом в сочетании с симптомами обструкции может быть рекомендована диета с адаптированной текстурой или дистальное (постстенотическое) энтеральное питание.
В настоящее время не существует единого мнения о статусе витамина D и необходимых действиях при его дефиците у детей и подростков с ВЗК. Факторами риска, развития низкой минеральной плотности кости детей и подростков являются кумулятивная доза кортикостероидов, показатели Z-скор роста к возрасту и Z-скор ИМТ [17].
У взрослых и детей с активным ВЗК и у больных, получающих стероидную терапию, следует контролировать и восполнять дефицит сывороточного кальция и 25(ОН) витамина D.
Распространенными причинами мальабсорбции желчных кислот при БК являются резекция подвздошной кишки и терминальный илеит. Снижение реабсорбции конъюгированных желчных кислот приводит к их избыточному поступлению в толстую кишку, где происходит деконъюгация бактериями. Последствиями могут быть осмотическая диарея и мальабсорбция жира при тяжелой мальабсорбции желчных кислот [18]. В легких случаях диарею, обусловленную мальабсорбцией желчных кислот, можно контролировать секвестрантами, такими как холестирамин [19, 20]. Вторичная кишечная гипероксалурия с повышенным риском образования камней в почках возникает при тяжелой БК тонкой кишки и связана с мальабсорбцией жира и последующим повышением абсорбции оксалатов в кишечнике. После резекции подвздошной кишки может развиться кишечная гипероксалурия. Увеличение потребления жира в рационе у этих пациентов еще больше увеличивает экскрецию оксалатов с мочой [21]. Пациентам с гипероксалурией следует рекомендовать диету с низким содержанием жиров и оксалатов и высоким содержанием кальция. Ограничение оксалатов в диете, в основном, чая и фруктов, представляется оправданным только у тех пациентов, у кого периодически выявляются камни мочевыводящих путей.
Пациенты с БК, получающие секвестран-ты, такие как холестирамин, имеют минимальный дополнительный риск мальабсорб-ции жира и, следовательно, не нуждаются в модификации диеты по сравнению с другими пациентами с БК. У пациентов с ВЗК с гипероксалурией часто также наблюдается ма-льабсорбция жира, и эти пациенты должны быть проконсультированы по этому поводу.
На сегодня имеется недостаточно доказательств, чтобы дать четкие рекомендации относительно эли-
минационных диет для индукционной терапии при ВЗК. Было показано, что элиминационные диеты облегчают симптомы [22], но лишь в нескольких неконтролируемых исследованиях отмечалась индукция ремиссии [23, 24].
Согласно рекомендациям, терапия с использованием пробиотиков Lactobacillus reuteri или «VSL # 3» может рассматриваться у пациентов с ЯК легкой и умеренной степени тяжести для индукции ремиссии, но не для лечения активной БК.
IV. Лечебное питание при активном ВЗК
Решение об оптимальном пути введения лечебного питания при ВЗК может быть сложным и определяется несколькими аспектами, в том числе, способностьюпациентаесть, функциейЖКТ,состоя-нием питания пациента и целями лечения. Используя лечебное пероральное питание, можно достичь дополнительного потребления до 600 ккал/день без ущерба для обычного приема пищи у взрослых. Если пероральное питание невозможно, следует рассмотреть кормление пациента через на-зогастральный или назоинтестинальный зонд. Энтеральное питание (ЭП) можно назначить пациентам с функционирующим ЖКТ, при безопасном кормлении [25, 26].
Назначение дополнительного лечебного перорального питания является первым этапом, но, как правило, вспомогательной терапией, применяемой в дополнение к обычному рациону.
Если недостаточно перорального питания, для поддерживающей терапии следует рассмотреть ЭП. ЭП с использованием формул или напитков всегда должно иметь преимущество перед парентеральным питанием (Пп), если нет абсолютных противопоказаний. ПП показано при ВЗК, когда пероральное питание или ЭП недостаточно возможны, например при дисфункции ЖКТ или у пациентов с Бк с короткой кишкой; когда имеется кишечная непроходимость, где нет возможности размещения зонда за препятствием, или если не удалось установить зонд, или при возникновении других осложнений, таких как несостоятельность анастомоза или интестинальный свищ с высокими потерями.
Стартовая диетотерапия в форме эксклюзивного ЭП должна рассматриваться у всех пациентов с острой активной БК. Это первый выбор у больных с высоким риском назначения альтернативной терапии, такой как стероиды. Аргументы в пользу эксклюзивного ЭП весомее в педиатрической практике. ЭП предпочтительнее, поскольку было показано, что ПП не дает каких-либо преимуществ при БК и должно использоваться только для улучшения нутритивного статуса во время операции и когда другие способы питания невозможны [27].
Эксклюзивное ЭП эффективно и рекомендуется в качестве терапии первой линии для индукции ремиссии у детей и подростков с острой активной БК.
Для стартовой и поддерживающей диетотерапии при активном ВЗК может применяться стандартное ЭП — полимерное, с умеренным содержанием жира, без особых добавок. Конкретные составы или субстраты, например глютамин, омега-3-жирные кислоты, не рекомендуются для ЭП или ПП пациентов с ВЗК.
Пациенты с Бк склонны к образованию свищей между двумя участками кишечника или между кишечником и другим органом, в особенности кожей, мочевым пузырем и влагалищем. В большинстве случаев это происходит после оперативного вмешательства. Установлено, что у прооперированных пациентов ранняя нутритивная поддержка, независимо от пути введения, снижает частоту возникновения и тяжесть свищей [28-30]. БЭН с ИМТ < 20 является независимым фактором риска развития свищей [31]. Лечение кишечных свищей обычно является комплексным, зависит от локализации, распространенности и характера симптомов и требует участия междисциплинарной команды, включая гастроэнтеролога, хирурга и диетолога [32].
Пациенты с БК с дистальной-подвздошной или ободочно-кишечной фистулой и низкой коло- или илеостомой могут обычно получать всю нутритивную поддержку энтерально, а больные с БК с проксимальной фистулой и/ или очень высокой стомой должны получать нутритивную поддержку в виде частичного или полного ПП частично или полностью.
У пациентов с БК, у которых было длительное вынужденное голодание / недоедание, необходимо предупредить развитие рефидинг-синдрома, особенно в отношении фосфатов и тиамина. Синдром возобновления питания, или рефидинг-синдром, — это жизнеугрожающее состояние, которое возникает при возобновлении питания у пациентов с исходной ну-тритивной недостаточностью. В патогенезе данного синдрома лежат выраженные водно-электролитные и метаболические нарушения, провоцируемые возобновлением питания, на фоне истощения запасов калия, магния, фосфора, приводящие к полиорганной недостаточности.
В отличие от БК, вопросы диетологического сопровождения больных с ЯК недостаточно изучены. Тем не менее считается, что энтеральное питание является безопасным и может быть рекомендовано в качестве поддерживающей терапии в соответствии со стандартной диетологической практикой у пациентов с тяжелым активным ЯК [33]. Парентеральное питание не должно применяться у пациентов с ЯК, если нет признаков кишечной недостаточности.
V. Хирургические аспекты питания при ВЗК
Ключевые аспекты питания в периоперационный период включают в себя: избегание длительных периодов предоперационного голодания; восстановление ЭП, как можно раньше после хирургического вмешательства; интеграция вопросов питания в общий протокол лечения пациента; контроль биохимических анализов крови; сокращение факторов, усугубляющих стресс-ассоциированный катаболизм или нарушение функции ЖКТ; ранняя мобилизация пациента для облегчения синтеза белка и стимуляции мышечной функции.
Элиминационные диеты не могут быть рекомендованы для достижения ремиссии при активной БК, даже если пациент имеет индивидуальную непереносимость.
Перспективным представляется применение пробиотиков в лечении ВЗК.
В большинстве случаев плановых хирургических вмешательств нет необходимости в соблюдении предоперационного голодания с полуночи — вместо этого можно использовать протокол ускоренного восстановления (ERAS — enhanced recovery after surgery).
При необходимости в неотложном хирургическом вмешательстве, лечебное питание — ЭП и ПП — следует начинать сразу при наличии белково-энер-гетической недостаточности (БЭН) на момент вмешательства либо при невозможности перорального приема пищи в течение 7 дней после операции.
БЭН оказывает негативное влияние на течение болезни, частоту послеоперационных осложнений и смертность.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Пациентам, которым невозможно удовлетворить энергетические потребности и/или потребности в белке обычным рационом, следует рекомендовать дополнительное пероральное питание в течение всего периоперационного периода. Пациенты, которые не могут удовлетворить свои энергетические потребности и/или потребности в белке обычным рационом совместно с пероральным дополнительным питанием, должны получать ЭП в течение периопера-ционного периода.
Рабочая группа ESPEN (2006) определила нутри-тивный риск как «серьезный» при наличии хотя бы одного из следующих критериев: потеря веса > 10-15% в течение шести месяцев; ИМТ < 18,5 кг/ м2; сывороточный альбумин < 30 г/л (без признаков печеночной или почечной дисфункции).
Если у пациента имеется высокий нутри-тивный риск и диагностирована БЭН, то хирургическое лечение ВЗК следует отложить по возможности на 7-14 дней и это время использовать для организации интенсивного лечебного питания.
Энтеральный путь введения пищи всегда должен быть предпочтительным, кроме случаев, когда имеется одно или несколько из следующих противопоказаний: тонкокишечная / толстокишечная непроходимость, шок, ишемия кишечника, свищ верхних отделов ЖКТ, тяжелое кишечное кровотечение. В этих случаях возможно назначение ПП в течение нескольких дней или недель, пока не восстановится функция ЖКТ [34].
ЭП всегда предпочтительнее ПП, но назначение комбинации ЭП и ПП следует рассматривать у пациентов, у которых > 60% потребности в энергии не может быть удовлетворено энтеральным путем.
ПП в периоперационном периоде у пациентов с ВЗК обычно следует назначать в качестве дополнения к ЭП. ПП рекомендуется как единственный вид питания, если ЭП невозможно (невозможность естественного приема пищи, сильная рвота или диарея) или противопоказано при непроходимости толстой и тонкой кишки, тяжелом шоке и ишемии кишечника.
У пациентов с БК, имеющих желудочно-кишечную недостаточность в течение длительного времени, например пациентов с синдромом короткой
кишки после резекции кишечника, ПП является обязательным и жизнесохраняющим лечением, по крайней мере на ранних стадиях кишечной недостаточности. У большинства пациентов с ВЗК в послеоперационном периоде возможно обычное питание или ЭП сразу после операции. На ранней стадии после проктоколэктомии или колэктомии следует назначать водно-электролитные растворы для обеспечения стабильной гемодинамики.
VI. Диетологические рекомендации во время ремиссии при ВЗК
Согласно рекомендациям, всем пациентам с ВЗК в стадии ремиссии необходима консультация диетолога в рамках междисциплинарного подхода с целью коррекции диетотерапии, профилактики развития БЭН и расстройств, связанных с питанием. При этом в стадии ремиссии ВЗК не требуется соблюдение специальной диеты, в том числе с высоким содержанием клетчатки. Также на основании данных последнего обзора Кокрейн [35] не рекомендуется применение добавок с омега-3 жирными кислотами для поддержки ремиссии у пациентов с ВЗК.
Результаты метаанализа подтвердили эффективность применения штамма E. coli Nissle 1917 и мультиштаммового пробиотика VSL#3 для поддержания ремиссии у пациентов, включая детей, с легким — умеренным ЯК, по сравнению с препаратами 5-аминосалициловой кислоты [36]. Также после колэктомии с наложением колостомы и с паучитом рекомендовано лечить пациентов пробиотической смесью (VSL#3) при неэффективности антибактериальной терапии. VSL #3 может использоваться для первичной и вторичной профилактики паучита у пациентов с ЯК, перенесших колэктомию и наложение пауч-анального анастомоза. В отличие от ЯК, про-биотики не рекомендуется применять для поддержания ремиссии при БК ввиду их неэффективности.
Нутритивная поддержка не была оценена как поддерживающая терапия при ЯК, так же как и ПП при БК. По данным недавно проведенного систематического обзора двенадцати рандомизированных клинических исследований и нерандомизированных когортных исследований [37] (1169 пациентов, включая 95 детей), было показано, что поддерживающее ЭП оказывало такой же эффект или даже больший, чем лечение сравнения (стандартная диета, 5-аСк или азатиоприн) на профилактику рецидивов БК в течение периода от 6 месяцев до 4 лет. Европейские организации по изучению ВЗК, общество детских гастроэнтерологов и диетологов, ECCO и ESPGHAN дают рекомендации о возможном использовании частичного ЭП для поддержания ремиссии у пациентов с очень легким заболеванием или низким риском рецидивов, при этом предпочтительно использовать полимерные смеси, а элементные смеси рекомендуется применять только в случае непереносимости белка коровьего молока [38].
Пациентам с ВЗК в стадии ремиссии следует соблюдать стандартную диету или принимать дополнительное пероральное питание, уделяя внимание нутритивному скринингу и назначению нутритивной поддержки при необходимости.
Ни ЭП, ни ПП не рекомендуется в качестве основной терапии для поддержания ремиссии при ВЗК. Дополнительное пероральное питание или ЭП могут быть рекомендованы пациентам с БК в стадии ремиссии, при невозможности коррекции БЭН после консультации диетолога. Пациенты с клиническим
дефицитом В12 должны получать 1000 мкг витамина В12 внутримышечно через день в течение недели, а затем каждый месяц в течение жизни [39]. На данный момент рекомендован парентеральный путь введения, но пероральные добавки могут стать стандартом в ближайшие годы. При резекции более 20 см дистального отдела подвздошной кишки, независимо от того, сохраняется ли илеоцекальный клапан или нет, пациентам с БК должен назначаться витамин В12.
Существует несколько причин дефицита фолатов при ВЗК: низкое потребление, мальабсорбция, избыточное потребление фолатов из-за воспаления слизистой оболочки и лекарственные препараты. Применение препаратов — наиболее значимая причина дефицита фолиевой кислоты из-за ингибирования дигидрофолатредуктазы — фермента, который катализирует восстановление дигидрофолиевой кислоты до тетрагидрофолиевой кислоты (метотрексат) или мальабсорбции фолата (сульфасалазин).
Отдельные пациенты с ВЗК, которые находятся на терапии сульфасалазином и ме-тотрексатом, должны получать витамин В9 / фолиевую кислоту.
Руководства ECCO, ESPGHAN по ведению детей с БК рекомендуют пероральный прием фолата пациентам, принимающим метотрексат, по 5 мг один раз в неделю через 24-72 ч после введения метотрек-сата или по 1 мг ежедневно в течение пяти дней в неделю [29]. Эта группа рекомендует такую же схему для взрослых.
Важными являются рекомендации для беременных и кормящих женщин, имеющих ВЗК. Так, у беременных с ВЗК необходимо регулярно контролировать состояние обмена железа и уровень фолатов, а в случае дефицита — дополнительно принимать железо и/или витамин B9 / фолиевую кислоту. Женщинам с ВЗК в период лактации следует регулярно контролировать нутритивный статус, в случае выявления дефицитного состояния — устранять дефицит.
Одним из проявлений нутритивной недостаточности является саркопения. Эталонным лечением саркопении, наряду с поддержанием адекватного потребления белка, является силовые тренировки с использованием специального оборудования — резиновых амортизаторов. Поэтому группа экспертов рекомендует проводить силовые упражнения (упражнения с нагрузкой пациентам с ВЗК с сарко-пенией или проявлениями саркопении — снижение мышечной массы, силы и/или работоспособности).
Избыточный вес и ожирение в настоящее время также являются частым нарушением питания у пациентов с ВЗК. Пациентам с ожирением, страдающим ВЗК, следует рекомендовать снижать вес только в фазе стабильной ремиссии и в соответствии с действующими рекомендациями по ожирению. Поэтому эксперты рекомендуют избегать применения низкокалорийных диет у пациентов с активной стадией заболевания и рекомендуют силовые тренировки на выносливость в качестве первого шага при любой попытке снижения веса.
ЛИТЕРАТУРА
1. Bischoff S.C., Escher J., Hebuterne X., Kt^k S., Krznaric Z., Schneider S. et al. ESPEN practical guideline: Clinical nutrition in inflammatory bowel disease // ClinNutr. — 2020. — Vol. 39. — P. 632-653
2. Forbes A., Escher J., Hebuterne X., Kt^k S., Krznaric Z., Schneider S. et al. ESPEN guideline: Clinical nutrition in inflammatory bowel disease // Clin Nutr. — 2017. — Vol. 36. — P. 321-347.
3. Bischoff S.C., Singer P., Koller M., Barazzoni R., Cederholm T., van Gossum A. Standard operating pro-cedures for ESPEN guidelines and consensus papers // Clin Nutr. — 2015. — Vol. 34. — P. 10431051.
4. Hou J.K., Abraham B., El-Serag H. Dietary Intake and Risk of Developing Inflammatory Bowel Disease: A Systematic Review of the Literature // Am J Gastroenterol. — 2011. — Vol. 106. — P. 563-573.
5. Ananthakrishnan A.N., Khalili H., Konijeti G.G., Higuchi L.M., de Silva P., Fuchs C.S. et al. Long-term intake of dietary fat and risk of ulcerative colitis and Crohn’s disease // Gut. — 2014. — Vol. 63. — P. 776-784.
6. Klement E., Cohen R.V., Boxman J., Joseph A., Reif S. Breastfeeding and risk of inflammatory bowel disease: a systematic review with meta-analysis // Am J Clin Nutr. — 2004. — Vol. 80. — P. 1342-1352.
7. Barclay A.R., Russell R.K., Wilson M.L., Gilmour W.H., Satsangi J., Wilson D.C. Systematic review: the role of breastfeeding in the development of pediatric inflammatory bowel disease // J Pediatr. —
2009. — Vol. 155. — P. 421-426.
8. Nguyen G.C., Munsell M., Harris M.L. Nationwide prevalence and prognostic significance of clinically diagnosa-ble protein-calorie malnutrition in hospitalized inflammatory bowel disease patients // Inflamm Bowel Dis. — 2008. — Vol. 14. — P. 1105-1111.
9. Sandhu A., Mosli M., Yan B., Wu T., Gregor J., Chande N. et al. Self-Screening for Malnutrition Risk in Outpatient Inflammatory Bowel Disease Patients Using the Malnutrition Universal Screening Tool (MUST) // JPEN J Parenter Enteral Nutr. — 2016. — Vol. 40. — P. 507-510.
10. Vasseur F., Gower-Rousseau C., Vernier-Massouille G., Dupas J.L., Merle V., Merlin B. et al. Nutritional Status and Growth in Pediatric Crohn’s Disease: A Population-Based Study // Am J Gastroenterol. —
2010. — Vol. 105. — P. 1893-1900.
11. Hill R.J., Davies P.S. You look all right to me: compromised nutritional status in paediatric patients with ulcerative colitis // J Pediatr Gastroenterol Nutr. — 2013. — Vol. 56. — P. 385-389.
12. Gerasimidis K., Edwards C., Stefanowicz F., Galloway P., McGrogan P., Duncan A. et al. Micronutrient status in children with IBD: true deficiencies or epiphenomenon of the systemic inflammatory response // J Pediatr Gastroenterol Nutr. — 2013. — Vol. 56. — P. e50-51.
13. Vagianos K., Bector S., McConnell J., Bernstein C.N. Nutrition assessment of patients with inflammatory bowel disease // JPEN. Jour Jarenter Enteral Nutr. — 2007. — Vol. 31. — P. 311-319.
14. Dignass A.U., Gasche C., Bettenworth D., Birgegard G., Danese S., Gisbert J.P. et al. European Crohn’s and Colitis Organisation [ECCO]. European consensus on the diagnosis and management of iron deficiency and anaemia in inflammatory bowel diseases // J Crohns Colitis. — 2015. — Vol. 9. — P. 211-222.
15. Dignass A.U., Gasche C., Bettenworth D., Birgegard G., Danese S., Gisbert J.P. et al. European Crohn’s and Colitis Organisation [ECCO]. European consensus on the diagnosis and management of iron deficiency and anaemia in inflammatory bowel diseases // J Crohns Colitis. — 2015. — Vol. 9. — P. 211-222.
16. Evstatiev R., Marteau P., Iqbal T., Khalif I.L., Stein J., Bokemeyer B. et al. FERGIcor, a randomized con-trolled trial on ferric carboxymaltose for iron deficiency anemia in inflammatory bowel disease // Gastroen-terology. — 2011. — Vol. 141. — P. 846-853, e1-2.
17. Pironi L., Arends J., Baxter J., Bozzetti F., Pelaez R.B., Cuerda C. et al. Home Artificial Nutrition & Chronic Intestinal Failure; Acute Intestinal Failure Special Interest Groups of ESPEN. ESPEN endorsed recommendations. Definition and classification of intestinal failure in adults // Clin Nutr. — 2015. — Vol. 34. — P. 171-180.
18. Lopes L.H., Sdepanian V.L., Szejnfeld V.L., de Morais M.B., Fagundes-Neto U. Risk factors for low bone mineral density in children and adolescents with inflammatory bowel disease // Dig Dis Sci. — 2008. — Vol. 53. — P. 2746-2753.
19. Hebuterne X., Filippi J., Al-Jaouni R., Schneider S. Nutritional consequences and nutrition therapy in Crohn’s disease // Gastroenterol Clin Biol. — 2009. — Vol. 33 (3). — P. S235-244.
20. Jacobsen O., H0jgaard L., Hylander M0ller E., Wielandt T.O., Thale M. et al. Effect of enterocoated cholestyramine on bowel habit after ileal resection: a double blind crossover study // Br Med J (Clin Res Ed). — 1985. — Vol. 290. — P. 1315-1318.
21. Little K.H., Schiller L.R., Bilhartz L.E., Fordtran J.S. Treatment of severe steatorrhea with ox bile in an ileectomy patient with residual colon // Dig Dis Sci. — 1992. — Vol. 37. — P. 929-933.
22. Andersson H., Filipsson S., Hulten L. Urinary oxalate excretion related to ileocolic surgery in patients with Crohn’s disease // Scand J Gastroenterol. — 1978. — Vol. 13. — P. 465-469.
23. Charlebois A., Rosenfeld G., Bressler B. The Impact of Dietary Interventions on the Symptoms of Inflammatory Bowel Disease: A Systematic Review // Crit Rev Food Sci Nutr. — 2016. — Vol. 56. — P. 1370-1378.
24. Sigall-Boneh R., Pfeffer-Gik T., Segal I., Zangen T., Boaz M., Levine A. Partial enteral nutrition with a Crohn’s disease exclusion diet is effective for induction of remission in children and young adults with Crohn’s disease // Inflamm Bowel Dis. — 2014. — Vol. 20. — P. 1353-1360.
25. Rajendran N., Kumar D. Food-specific IgG4-guided exclusion diets improve symptoms in Crohn’s disease: a pilot study // Colorectal Dis. — 2011. — Vol. 13. — P. 1009-1013.
26. Carter M.J., Lobo A.J., Travis S.P. Guidelines for the management of inflammatory bowel disease in adults // Gut. — 2004. — Vol. 53 (5). — P. V1-16.
27. Valentini L., Schaper L., Buning C., Hengstermann S., Koernicke T., Tillinger W. et al. Malnutrition and impaired muscle strength in patients with Crohn’s disease and ulcerative colitis in remission // Nutrition. — 2008. — Vol. 24. — P. 694-702.
28. Smith M.A., Smith T., Trebble T. Nutritional management of adults with inflammatory bowel disease: practical lessons from the available evidence // Frontline Gastroenterology. — 2012. — Vol. 3. — P. 172-179.
29. Li G., Ren J., Wang G., Hu D., Gu G., Liu S. et al. Preoperative exclusive enteral nutrition reduces the postoperative septic complications of fistulizing Crohn’s disease // Eur J Clin Nutr. — 2014. — Vol. 68. — P. 441-446.
30. Yan D., Ren J., Wang G., Liu S., Li J. Predictors of response to enteral nutrition in abdominal enterocutaneous fistula patients with Crohn’s disease // Eur J Clin Nutr. — 2014. — Vol. 68. — P. 959-963.
31. Visschers R.G., Olde Damink S.W., Winkens B., Soeters P., van Gemert W.G. Treatment strategies in 135 consecutive patients with enterocutaneous fistulas // World J Surg. — 2008. — Vol. 32. — P. 445-453.
32. Llop J.M., Cobo S., Padulles A., Farran L., Jodar R., Badia M.B. Nutritional support and risk factors of appearance of enterocutaneous fistulas // Nutr Hosp. — 2012. — Vol. 27. — P. 213-218.
33. Visschers R.G., Olde Damink S.W., Winkens B., Soeters P., van Gemert W.G. Treatment strategies in 135 consecutive patients with enterocutaneous fistulas // World J Surg. — 2008. — Vol. 32. — P. 445-453.
34. Dignass A., Lindsay J.O., Sturm A., Windsor A., Colombel J.F., Allez M. et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis Part 2: Current management // J Crohn Colitis. — 2012. — Vol. 6. — P. 991-1030.
35. Weimann A., Braga M., Carli F., Higashiguchi T., Hübner M., Klek S. et al. ESPEN guideline: Clinical nutrition in surgery // Clin Nutr. — 2017. — Vol. 6. — P. 623-650.
36. Lev-Tzion R., Griffiths A.M., Leder O., Turner D. Omega 3 fatty acids (fish oil) for maintenance of remission in Crohn’s disease // Cochrane Database Syst Rev. — 2014. — Vol. 2. CD006320.
37. Fujiya M., Ueno N., Kohgo Y. Probiotic treatments for induction and maintenance of remission in inflammatory bowel diseases: a meta-analysis of randomized controlled trials // Clin J Gastroenterol. — 2014. — Vol. 7. — P. 1-13.
38. El-Matary W., Otley A., Critch J., Abou-Setta A.M. Enteral Feeding Therapy for Maintaining Remission in Crohn’s Disease: A Systematic Review // JPEN J Parenter Enteral Nutr. — 2015. — Vol. 41. — P. 550-561.
39. Ruemmele F.M., Veres G., Kolho K.L., Griffiths A., Levine A., Escher J.C. et al. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease // J Crohns Colitis. — 2014. — Vol. 8. — P. 1179-1207.
40. Stabler S.P. Clinical practice. Vitamin B12 deficiency // N Engl J Med. — 2013. — Vol. 368. — P. 149-160.
Воспалительные заболевания кишечника (ВЗК) являются многофакторными заболеваниями неясной этиологии с доказанным влиянием окружающей среды на генетическую предрасположенность [1]. Выявленные генетические ассоциации ВЗК, нетипичная реакция иммунной системы организма на определенные виды микроорганизмов кишечника, триггерная роль вирусной инфекции, стрессов, этническая принадлежность, курение, особенности питания являются предметом пристального изучения, влияющего на развитие ВЗК. Сегодня большинство исследователей понимают, что воздействие на один или несколько из этих компонентов сложного механизма ВЗК не может удовлетворить потребности врача и пациента в излечении заболевания. Несомненно, возможности современных фармакологических препаратов значительно улучшают качество жизни пациентов, даже изменяют естественное течение болезни, однако совершенно очевидно, что требуются дальнейшие серьезные разработки для эффективного контроля над течением ВЗК.
Распространенность язвенного колита (ЯК) в мире составляет 21,0–505,0 случаев на 100 тыс. населения, болезни Крона (БК) — 9,0–322,0 случая на 100 тыс. населения. Заболеваемость ЯК регистрируется в диапазоне 0–24,3 случая, а БК — 0–20,2 случая на 100 тыс. населения, в зависимости от географического расположения [2, 3]. В последние десятилетия в России, как и во всем мире, отмечается неуклонный рост заболеваемости ВЗК. По данным Министерства здравоохранения РФ прирост ЯК с 2012 по 2015 гг. составил 31,7%, а БК — 20,4%. По данным отдельных эпидемиологических исследований распространенность ВЗК в России составляет 19,3–29,8 на 100 тыс. населения для ЯК и 3,0–4,5 на 100 тыс. населения для БК. Однако, по данным региональных регистров, распространенность ВЗК в РФ гораздо выше. В Московской области, например, этот показатель составляет 58,0 случаев на 100 тысяч населения; 40,0 случаев в Республике Татарстан, 49,0 — на 100 тысяч в Новосибирской области [4]; по данным регистра Иркутской области, распространенность ВЗК составила 74,9 случая на 100 тысяч населения. В следующие десятилетия ряд авторов прогнозируют рост первичной заболеваемости ВЗК в странах Восточной Европы, в том числе в России, и в Азии [3, 4].
Лечебные мероприятия при ВЗК включают в себя назначение лекарственных препаратов, хирургическое лечение, психосоциальную поддержку и диетические рекомендации. Выбор вида консервативного или хирургического лечения определяется тяжестью атаки, протяженностью поражения толстой кишки, наличием внекишечных проявлений, длительностью анамнеза, эффективностью и безопасностью ранее проводившейся терапии, а также риском развития осложнений ВЗК.
Лекарственная (консервативная) терапия ЯК и БК проводится не только для того, чтобы устранить симптомы заболевания, с которыми человек обратился к врачу. Цель лечения — сократить частоту и тяжесть обострений, предотвратить развитие осложнений, поскольку они могут потребовать серьезной хирургической операции, достижение бесстероидной ремиссии. Зачастую пациентам требуется применение комбинации нескольких препаратов. Основные группы препаратов для лечения ВЗК:
- моноклональные антитела (инфликсимаб, адалимумаб, цертолизумаб, голимумаб, ведолизумаб);
- рекомбинантные цитокины;
- малые молекулы (такролимус и др.);
- ингибиторы киназ (тофацитиниб);
- иммуносупрессоры, цитостатики — азатиоприн, 6-меркаптопурин, метотрексат, циклоспорин;
- глюкокортикостероиды — системные (преднизолон, гидрокортизон), топические (будесонид);
- 5-аминосалициловая кислота — месалазин, сульфасалазин;
- энтеро- и колосептики, антибиотики — метронидазол, ципрофлоксацин, рифаксимин.
Одним из препаратов в лечении ВЗК является месалазин, противовоспалительный эффект которого обусловливается нейтрализацией свободных радикалов, угнетением хемотаксиса лейкоцитов, уменьшением продукции цитокинов и лейкотриенов в воспаленной слизистой оболочке кишечника. Рассмотрим данные клинических исследований препарата Пентаса. Это препарат для перорального применения, с контролируемым высвобождением аминосалицилатного компонента, химически представляющего собой 5-амино-2-гидроксибензойную кислоту. Эффективность изучена в течение нескольких десятилетий в ряде серьезных рандомизированных, мультицентровых плацебо-контролируемых исследований. Согласно инструкции, Пентаса назначается для лечения легких и умеренных форм ВЗК, а также широко используется в качестве поддерживающей терапии для снижения риска повторных рецидивов. Таблетки Пентаса (250 мг, 500 мг и 1 г) одобрены для лечения ВЗК в более чем 100 странах, а гранулы Пентаса (250 мг, 500 мг, 1 г, 2 г и 4 г) — более чем в 80 странах мира. Пероральная форма препарата Пентаса имеет состав с пролонгированным высвобождением активного месалазина по всей длине кишечника от двенадцатиперстной кишки до прямой. Лекарственные формы для местного применения (суппозитории и клизмы) предназначены для введения через прямую кишку, что позволяет добиваться высокой концентрации и длительной экспозиции (несколько часов) лекарственного средства в дистальной части толстой кишки.
P. Miner и соавт. в 12-месячном двойном слепом плацебо-контролируемом исследовании рандомизировали 205 пациентов с ЯК в ремиссии на плацебо или месалазин с контролируемым высвобождением (Пентаса) в дозе 4 г/сут в течение 12 месяцев. Поддержание ремиссии определялось по следующим показателям: эндоскопический индекс < 5, менее пяти дефекаций в день и отсутствие ректального кровотечения. Значительно большее число пациентов сохраняли ремиссию при приеме месалазина 4 г/сут по сравнению с плацебо при каждом из пяти посещений исследования после первого посещения в течение одного месяца (p < 0,05). 12-месячные показатели ремиссии для группы месалазина составили 64% и 38% для плацебо (p = 0,0004). Побочные эффекты, связанные с лечением, были редкими. Месалазин с контролируемым высвобождением был признан безопасным и эффективным средством для поддержания ремиссии ЯК [5].
M. Vecchi и соавт. в 15 исследовательских центрах сравнивали эффективность перорального приема месалазина (Пентаса) в сравнении с комбинированным пероральным и местным приемом месалазина (Пентаса) при легком и умеренно активном ЯК. В результате частота клинической ремиссии составила 82% для перорального лечения и 87% для комбинированного лечения (p = 0,56); среднее время до ремиссии 22,2 и 20,2 дня соответственно (р = 0,29); частота клинической ремиссии/улучшения и частота эндоскопической ремиссии составляли 85% и 91% (p = 0,503) и 58% и 71% (p = 0,21) соответственно. Таким образом, у пациентов с легким активным ЯК месалазин 4 г перорально или 2 г перорально плюс 2 г в клизме были одинаково эффективны в индукции ремиссии заболевания [6].
Основная цель 12-месячного многоцентрового рандомизированного слепого контролируемого исследования PODIUM заключалась в том, чтобы продемонстрировать одинаковую эффективность одного 2-граммового саше месалазина, принимаемого один раз в день, по сравнению с двумя отдельными 1-граммовыми саше в день. Однако из 362 пациентов с ЯК в стадии ремиссии, которые рецидивировали в течение предыдущего года, 73,8% пациентов, принимавших саше один раз в день, находились в клинической и эндоскопической ремиссии по сравнению с 63,6% в группе, принимавших саше два раза в день (p = 0,024). Впервые режим дозирования месалазина (гранул Пентаса) один раз в день оказался статистически превосходящим дозирование два раза в день для эффективного поддержания ремиссии у пациентов, страдающих ЯК легкой и средней степени тяжести [7].
B. Flourié и соавт. изучали эффективность и безопасность однократного применения против двукратного ежедневного приема пролонгированного высвобождения месалазина (Пентаса) при активном легком или умеренном течении ЯК. Все пациенты (n = 206) были рандомизированы на 8 недель приема месалазина (4 г/сут), либо однократно два саше по 2 г месалазиновых гранул утром (n = 102), либо двукратно по одному саше 2 г утром и вечером (n = 104). Пациенты также получали в течение 4 недель клизмы с месалазином по 1 г/сут. Активность заболевания оценивали через 4, 8 и 12 недель, используя индекс активности ЯК (UC-DAI). Клиническая и эндоскопическая ремиссия (первичная конечная точка) была оценена через 8 недель. Пациенты регистрировали частоту стула и ректальных кровотечений в ежедневном дневнике. В сочетании с клизмами, месалазин пролонгированного действия 4 г один раз в день столь же эффективен и хорошо переносился, как 2 г два раза в день, для индукции ремиссии у пациентов с легким или умеренно активным ЯК [8].
В европейском многоцентровом рандомизированном исследовании PINCE авторы сравнивали терапию комбинированным пероральным (4 г/сут) месалазином (Пентаса) с ректальной суспензией (1 г/сут) и пероральным месалазином (Пентаса) (4 г/сут) плюс плацебо-суспензия у пациентов с обширным умеренно активным ЯК. Частота ремиссии, основанная на клинических и эндоскопических критериях, была выше в группе комбинированной терапии месалазином, чем в группе пероральной терапии на 4-й и 8-й неделе; значительно чаще ремиссия констатирована на 8-й неделе — 64% при комбинированном лечении по сравнению с пероральным приемом месалазина — 43% (р = 0,030) [9].
Японские ученые исследовали 180 пациентов с активным ЯК, а затем 115 пациентов, у которых имелось клиническое улучшение или была достигнута клиническая ремиссия после лечения месалазином (Пентаса) в дозе 4,0 г/сут. Все пациенты были разделены на две подгруппы в соответствии с медианой продолжительности лечения: группа краткосрочного лечения (≤ 105 дней, n = 58) и группа длительного лечения (> 105 дней, n = 57). В целом у 45 (39,1%) пациентов случился рецидив: у 28 (48,3%) в группе краткосрочного лечения и у 17 (29,8%) в группе длительного лечения (р < 0,05). Частота рецидивов в группе долгосрочного лечения оказалась значимо меньше, чем в группе краткосрочного лечения (р < 0,05). Среднее время ремиссии в группе длительного лечения также было значительно дольше, чем в группе краткосрочного лечения (425,6 ± 243,8 дня против 277,4 ± 224,5 дня; р < 0,05). Длительное непрерывное лечение месалазином в высоких дозах (4,0 г/сут) было более эффективным, чем краткосрочное лечение для поддержания ремиссии у пациентов с ЯК [10].
В японском исследовании OPTIMUM авторы изучали несколько вариантов применения пероральных месалазинов разных коммерческих наименований, в том числе и препарат Пентаса; оценивали эффективность лечения пациентов с легкой и умеренной тяжестью течения язвенного колита. Препарат Пентаса по 4 г/сут в 2 приема вводили 480 (21,0%) пациентам с ремиссией и 341 (46,6%) пациенту в активной стадии ЯК. Показатель поддержания ремиссии на 52-й неделе на фоне приема препарата Пентаса 4 г/сут в 2 приема составил 76,5%, этот показатель не отличался достоверно от результатов лечения другими препаратами месалазинов [11].
В еще одном японском исследовании авторы проспективно проанализировали 2 группы пациентов, страдающих ЯК. Пациенты в каждой группе принимали 4 г таблетированного препарата или гранул месалазина с длительным высвобождением (Пентаса) в течение 6–9 недель, а затем переходили на 4 г другой формы препарата в течение еще 6–9 недель. Эффективность лечения оценивали с помощью опросников, а приверженность — с использованием визуальной аналоговой шкалы. Значительно больше пациентов обнаружили, что таблетки менее приемлемы, чем гранулы (76% против 33%, p = 0,0005). Гранулы оказались предпочтительнее таблеток, когда сравнивали 2 препарата непосредственно (73% против 21%, p = 0,004) по их переносимости, размеру и количеству таблеток. Уровень приверженности был немного выше среди пациентов, принимавших гранулы (94% против 91%) в течение периода наблюдения, но разница не была статистически значимой (p = 0,139). Таким образом, гранулы препарата Пентаса продемонстрировали более высокую приемлемость, чем таблетки, и, следовательно, могут быть лучшим вариантом для длительного лечения [12].
Большое количество клинических исследований посвящено применению месалазина при ЯК. Известно, что применение месалазинов при БК носит ограниченный характер. S. B. Hanauer и U. Strömberg представили метаанализ трех крупных двойных слепых рандомизированных исследований по лечению активной БК и подтвердили, что Пентаса в дозе 4 г/сут превосходила плацебо в снижении индекса активности БК (CDAI) [13]. Пероральная форма препарата Пентаса достигает всех участков воспаления благодаря ее уникальной системе высвобождения, которая обеспечивает прогнозируемое и надежное пролонгированное воздействие месалазина от двенадцатиперстной до прямой кишки. О. Б. Щукина и соавт. провели 5-летнее проспективное наблюдение 210 пациентов с БК, получающих базисную терапию. Ответ на лечение определяли в условиях реальной жизни, согласно рекомендациям Европейского общества по изучению БК и ЯК (European Crohn’s Colitis Organisation, ЕCCO). Оценивали благоприятные и неблагоприятные исходы, а также влияние на них различных видов медикаментозного лечения. Авторы считают, что поддерживающая терапия месалазином возможна только у больных с воспалительной формой БК без системной активности под динамическим контролем лечащего врача [14]. Согласно третьему европейскому консенсусу ЕССО 2016 г. [15], препараты 5-аминосалициловой кислоты (5-АСК) не рекомендуются в качестве поддерживающей терапии, хотя результаты некоторых метаанализов представляют доказательную базу об эффективности месалазина как у пациентов с легким течением БК, так и в профилактике послеоперационного рецидива и отдаленной ремиссии. Так, например, в 1995 г. в журнале Gastroenterology опубликованы данные двойного слепого, плацебо-контролируемого многоцентрового исследования С. Brignola и соавт., об эффективности месалазина для снижения вероятности эндоскопического рецидива БК после хирургического вмешательства (резекции кишки) по поводу БК [16]. Наблюдали группу пациентов, получающих препарат Пентаса по 1 г три раза в день (n = 44), вторая группа пациентов с плацебо (n = 43) в течение 12 месяцев. Оценивали результаты через 1 месяц после хирургического вмешательства и по истечении 12 месяцев исследования. Состояние клинической ремиссии сохранил 31 (70%) пациент в группе приема препарата Пентаса и 29 пациентов (67%) в группе приема плацебо. Из общего числа пациентов частота тяжелых эндоскопических рецидивов (оценка 3–4 балла) через 1 год составила 14% в группе препарата Пентаса и 50% в группе плацебо. Общая частота тяжелых рецидивов через 1 год составила 24% в группе препарата Пентаса и 56% в группе плацебо. Лечение, получаемое во время исследования, было единственным фактором, который оказывал достоверный эффект на общую частоту рецидивов (отношение шансов [ОШ] 4,1; 95% ДИ 2,7–6,3), и частота рецидивов была выше у пациентов, которые в прошлом подвергались более чем одному хирургическому вмешательству (ОШ 4,1; нет данных). Среди всех пациентов, которые подвергались более чем 1 операции, у 3 из 11 пациентов, получавших препарат Пентаса, по сравнению с 6 из 7 пациентов, получавших плацебо, произошел рецидив, по данным эндоскопического исследования (ОШ 16; 95% ДИ 13,4–19,0; χ2: 5,5; p < 0,05). Среди пациентов, которые подвергались только одной операции, эндоскопические рецидивы были зафиксированы у 5 из 25 пациентов, принимавших препарат Пентаса, по сравнению с 16 из 31 пациента, получавшего плацебо (ОШ 4,2; 95% ДИ 2,3–7,7χ2: 5,9; p < 0,05). Исследование показало, что Пентаса в дозе 3 г/день эффективно снижает частоту и тяжесть эндоскопических рецидивов у пациентов с БК подвздошной или подвздошной и ободочной кишки после хирургического вмешательства.
Рекомендации Американской гастроэнтерологической ассоциации (American Gastroenterological Association, AGA) не рассматривают прием 5-АСК, месалазина у пациентов с хирургически индуцированной ремиссией БК в силу низкого уровня доказательности [17]. Проведенный Jin-Shan Feng и соавт. метаанализ 14 рандомизированных клинических исследований, включающий 877 пациентов, показал, что месалазины в любых дозах неэффективны для профилактики раннего послеоперационного рецидива БК [18]. Необходимо отметить, что проведенные исследования демонстрировали относительную безопасность препарата Пентаса — во всех одобренных дозах побочные эффекты препарата сопоставимы с таковыми в группах плацебо [19.
Выбор тактики ведения пациентов с БК в послеоперационном периоде представляет серьезную проблему как для гастроэнтеролога, так и для колопроктолога не только в силу тяжести самого заболевания, но и в связи с достаточно часто встречающейся коморбидностью или развитием нежелательных явлений на прием базисных препаратов. Несмотря на противоречивые данные о применении месалазина в поддерживающей терапии БК, в реальной клинической практике препарат занимает свою определенную нишу, что демонстрирует следующий пример.
Пациент К., 1986 г. р., поступил в хирургическое отделение по экстренным показаниям с клиникой перитонита. 28.10.2006 г. выполнена лапаротомия, разобщение тонко-толстокишечных свищей, ушивание перфорации терминального отдела подвздошной кишки, наложение илеотрансверзоанастомоза. 31.10.2006 г. — релапаротомия, резекция терминального отдела тонкой кишки, правосторонняя гемиколэктомия. По гистологическому заключению исследования резецированного материала выявлена БК. 11.02.2011 г. — диагностирован абсцесс брюшной полости, выполнена лапаротомия, иссечение участка брыжейки тонкой кишки, содержащего лигатуру и гнойник. В январе 2012 г. по экстренным показаниям вновь госпитализирован в хирургическое отделение с нарушением кишечного пассажа. 08.01.2012 г. — лапаротомия, энтеролиз, вскрытие абсцесса брюшной полости, резекция тонкой кишки (объем неизвестен), энтеростомия. На 12-е сутки после операции развилась клиника острой кишечной непроходимости. Выполнена релапаротомия, с техническими трудностями проведен энтеролиз, резекция тонкокишечного конгломерата, вскрытие и дренирование межкишечных абсцессов, формирование петлевой энтеростомы. Из-за выраженного рубцового изменения брыжейки тонкой кишки и ограниченной мобильности кишки энтеростома наложена в нижнем углу лапаротомной раны. На фоне проводимой терапии выписан с положительной динамикой и направлен для восстановительной операции в клинику ФГБУ НЦРВХ г. Иркутска. При поступлении состояние пациента средней тяжести, рост 178 см, вес 48 кг, ИМТ = 15, бледный кожный покров с желтушным оттенком, ангулярный стоматит. В верхнем правом квадранте живота под реберной дугой — трубчатый кишечный свищ с минимальным отделяемым. В нижней трети послеоперационной раны — тонкокишечный свищ. Слизистая оболочка стомированной кишки ярко-багрового цвета, плотная, кишечное отделяемое жидкое. При приеме через рот контрастное вещество поступает через 20 минут в калоприемник. Слизистая оболочка прямой кишки отечная, ранимая, на высоте пальца пальпируется болезненный инфильтрат. Ректороманоскопия (осмотр до 18 см): слизистая оболочка розовая, отечная, от ануса до 10 см без сосудистого рисунка, выше — слизистая оболочка обычной окраски, сосудистый рисунок четко прослеживается. Продолжение осмотра невозможно из-за выраженного болевого синдрома. Диагноз при поступлении: «Болезнь Крона, илеоколит, тяжелое непрерывное течение, свищевая форма, осложненная инфильтратом и абсцессами брюшной полости. Энтеростома. Сформированный тонкокишечный свищ. Ангулярный стоматит. Сопутствующий диагноз: невралгия седалищного нерва справа. Трофические нарушения, умеренный болевой синдром с нейропатическим компонентом». Проведена инфузионно-корригирующая терапия, преднизолон в стартовой дозе 150 мг внутривенно (в/в) (из расчета 2,5 мг на 1 кг веса), далее по снижающей схеме. Начат индукционный курс биологической терапии — инфликсимабом (Ремикейд) в дозе 300 мг в/в по стандартной схеме. По данным МСКТ-энтерографии — обнаружен высокий сформированный тонкокишечный свищ (в 40 см от дуоденоеюнального перехода), утолщение стенок всей тонкой кишки от 4 до 10 мм. Выполнена резекция 20 см тонкой кишки, включая энтеростомальный сегмент, наложен илеотрансверзоанастомоз по типу «конец в бок» однорядным непрерывным внеслизистым швом. Гистологическое заключение: резецированная тонкая кишка с картиной хронического продуктивного гранулематозного воспаления.
В послеоперационном периоде — серия релапаротомий в связи с перфорациями тонкой кишки, развитием диффузного фибринозного перитонита. Через три месяца пациент выписан в удовлетворительном состоянии, вес 55 кг, ИМТ 17, с восстановлением пассажа по желудочно-кишечному тракту, количество дефекаций уменьшилось с 7–8 раз до 3 эпизодов в сутки, каловые массы кашицеобразной консистенции, без видимых патологических примесей. Назначен азатиоприн 100 мг (2 мг/кг веса в сутки), продолжен инфликсимаб 5 мг/кг. Перед 4-й инфузией инфликсимаба 18.05.2012 г. развилась лихорадка. Дополнительное обследование выявило диссеминированный туберкулез легких, инфликсимаб отменен. Назначена полихимиотерапия из 6 противотуберкулезных препаратов. В декабре 2012 г. развилась панцитопения — азатиоприн отменен, назначен препарат с учетом локализации поражения — месалазин с контролируемым высвобождением (Пентаса) 3,0 г/сут. Стационарное лечение в противотуберкулезном диспансере с мая 2012 по апрель 2013 г. Выписан в удовлетворительном состоянии. В мае 2013 г. — гемоглобин снизился до 46 г/л, сывороточное железо — 1,2 мкг/л, панцитопения тяжелой степени. Госпитализирован в тяжелом состоянии в отделение реанимации по месту жительства. Лечение: гемотрансфузии, препарат железа внутривенно в течение нескольких недель. Противотуберкулезные средства отменены. С июня 2013 г. по настоящее время: получает 2 г месалазина с контролируемым высвобождением (Пентаса), состояние удовлетворительное, стул 2–3 раза в сутки, кал кашицеобразный, без крови и слизи. Кальпротектин в пределах 12–37 мкг/г (норма: до 50 мкг/г). По МРТ-энтерографии органов брюшной полости (один раз в 1–2 года) — признаков активности БК нет. МСКТ органов грудной клетки — активного специфического процесса нет, заключение фтизиатра: «Излечение». На визите 09.01.2019 г. — пациент чувствует себя хорошо, вес 78 кг, повторно женился, родился второй ребенок, работает.
Приведенный клинический случай [20] представляет типичный пример естественного прогрессирующего течения БК с развитием хирургических осложнений. Дебют болезни у пациента произошел в возрасте 13 лет, когда возникали немотивированные подъемы температуры тела до фебрильных цифр, слабость. Пациент лечился у невролога с диагнозом «аутоиммунный энцефаломиелополирадикулоневрит» с нарушением фагоцитарного звена. Позднее с учета снят. В 2004 г. в возрасте 17 лет вновь отметил повышение температуры тела до фебрильной, тогда же появились боли в животе. В ноябре 2006 г. впервые появился частый стул с примесью крови и появилось разжижение каловых масс.
К сожалению, от момента первых проявлений БК до постановки диагноза прошло 6 лет, когда пациент поступил в хирургический стационар уже с осложненным течением болезни. Однако базисной терапии назначено не было, несмотря на патоморфологическое и интраоперационное подтверждение диагноза. Доказано, что резекция пораженных отделов пищеварительной трубки в пределах здоровых тканей не означает излечения БК и предполагает обязательное продолжение медикаментозной терапии ввиду высокого риска рецидивов [18]. Назначенная в феврале 2012 г. биологическая терапия блокаторами ФНО-α позволила стабилизировать состояние больного, однако, несмотря на предварительно проведенное обследование у фтизиатра, у пациента после индукционного курса инфликсимаба развилась туберкулезная инфекция, в связи с чем антицитокиновую терапию прекратили. Азатиоприн также отменили в связи с тяжелой анемией и панцитопений. Что в такой ситуации назначать пациенту, учитывая агрессивное течение болезни, многократные оперативные вмешательства и резекции кишечника? Несмотря на существующее мнение многих исследователей о неэффективности месалазина для поддерживающей терапии в случае тяжелого осложненного течения БК, у данного пациента применение монотерапии месалазином в течение нескольких лет позволяет удерживать стабильное состояние пациента в ремиссии. Подобные клинические ситуации встречаются в практике специалистов, занимающихся ВЗК, нередко выходя за рамки клинических рекомендаций, стандартов и данных рандомизированных исследований, когда месалазины оказываются единственными препаратами, возможными для назначения даже в случаях тяжелого течения болезни [18].
Второй препарат для лечения ВЗК — Кортимент (Cortiment) MMX. Показан взрослым пациентам для индукции ремиссии при активном язвенном колите с легкой и умеренной активностью, когда лечение препаратами 5-ASA (аминосалицилатом) недостаточно. Кортимент MMX содержит будесонид, локально действующий глюкокортикостероид, запатентованный оральный препарат в виде таблеток с использованием технологии мультиматриксной доставки (MMX), которая предназначена для контролируемого высвобождения и распределения будесонида по всей длине толстой кишки.
Будесонид является кортикостероидом второго поколения, который обладает минимальной системной активностью благодаря метаболизму печени первого прохода. В настоящее время доступны две композиции будесонида: композиция с зависимым от рН высвобождением и таблетка с пролонгированным высвобождением, в которой используется MMX для доставки в толстую кишку. Многочисленные рандомизированные клинические исследования на сегодняшний день продемонстрировали, что 3–9 мг будесонида MMX хорошо переносятся, вызывают значительное улучшение у пациентов по сравнению с плацебо и имеют профиль безопасности, аналогичный плацебо, связанный с кортикостероидами [21].
Композиция MMX была разработана для перорально вводимых лекарств с таргетным воздействием на дистальный отдел толстой кишки [22]. Эта система доставки использует внешнее pH-зависимое покрытие, состоящее из гидрофильной и инертной полимерной матрицы, которая позволяет проходить активное лекарственное средство через желудочно-кишечный тракт в подвздошную кишку, где внешний слой капсулы начинает растворяться при pH > 7,0. Таким образом, активное лекарственное средство доставляется равномерно по всей длине ободочной кишки, что сводит к минимуму системную абсорбцию, в отличие от обычной абсорбции кортикостероидов (рис. 1) [23]. В фармакокинетических исследованиях с будесонидом MMX 9 мг средняя относительная абсорбция будесонида в области между восходящей ободочной кишкой и нисходящей/сигмовидной ободочной кишкой составила 95,9%, обнаруженным между 4 и > 24 часами после введения лекарственного средства (рис. 2) [24].
Два спонсируемых производителем многоцентровых двойных слепых плацебо-контролируемых рандомизированных исследования: CORE I (n = 510) и CORE II (n = 512) оценивали эффективность и безопасность применения препарата Кортимент (будесонид) MMX 9 мг у взрослых пациентов с активным легким и умеренным ЯК. Исследование CORE I также включало группу лечения месалазином (Асакол 2,400 мг), в то время как исследование CORE II включало группу лечения будесонидом (Энтокорт EC 9 мг). Хотя в исследованиях не было возможности сравнить эти препараты с плацебо или препаратом Кортимент, они были включены в качестве контрольного сравнения. Авторы исследования представили сетевой метаанализ сравнения препарата Кортимент 9 мг с другими лекарственными средствами для индукции полной клинической ремиссии у пациентов с активным ЯК от легкой до умеренной степени тяжести. Кортимент был связан со статистически значимым улучшением в индукции полной клинической ремиссии по сравнению с плацебо и высокими дозами месалазина [25, 26].
В 2015 г. опубликованы данные пяти клинических исследований, в том числе двойных слепых, рандомизированных и открытых исследований, которые показали, что частота побочных эффектов была одинаковой для будесонида MMX (Кортимент) 9 мг и 6 мг (54,5% и 60,6% соответственно) и плацебо (50,5%) у пациентов с легким и умеренным течением ЯК. Кроме того, открытые исследования показали меньшую частоту побочных эффектов с будесонидом MMX (3 мг или 9 мг) по сравнению с плацебо. Наиболее частыми побочными эффектами в этих исследованиях регистрировали головную боль, тошноту и инфекции мочевыводящих путей, демонстрирующие, что топические кортикостероиды второго поколения не только имеют меньше побочных эффектов, но и эти эффекты менее серьезны по сравнению с побочными эффектами системных глюкокортикостероидов [27].
M. E. Sherlock и соавт. провели поиск в MEDLINE, EMBASE, CENTRAL и в специализированном регистре Cochrane IBD Group с момента его создания до апреля 2015 г. и выбрали шесть исследований с участием 1808 человек, страдающих ЯК. В четырех исследованиях сравнивался будесонид MMX (Кортимент) с плацебо, в одном небольшом пилотном исследовании изучалась клиническая ремиссия на четвертой неделе, а затем следовали три крупных исследования, в которых оценивались комбинированная клиническая и эндоскопическая ремиссия на восьмой неделе. Данные исследования подтвердили использование перорального приема будесонида MMX в дневной дозе 9 мг для индукции ремиссии при активном ЯК, особенно у пациентов с левосторонним колитом. Будесонид MMX 9 мг в день был эффективен для индукции ремиссии при наличии или отсутствии одновременной терапии 5-АСК. Кроме того, будесонид MMX был безопасным и не приводил к значительному ухудшению функции надпочечников по сравнению с плацебо [28].
В нескольких исследованиях оценивалось использование пероральных составов будесонида MMX в качестве поддерживающей терапии у пациентов с БК, и он обеспечил поддержку долгосрочной (≥ 1 года) ремиссии заболевания. Будесонид MMX (Кортимент) может также предложить фармакоэкономические преимущества, потенциально повышая приверженность к лечению с помощью дозирования один раз в день и снижая риск возникновения побочных эффектов по сравнению с обычными оральными кортикостероидами [29].
Обзор W. J. Sandborn, S. Travis с соавт. (2014 г.) плацебо-контролируемого исследования показал, что более высокая доля пациентов с ЯК легкой и умеренной активности, получавших будесонид MMX (Кортимент) (9 мг), достигла клинической ремиссии и разрешения симптомов по сравнению с плацебо. Напротив, более низкие дозы будесонида MMX (6 мг) и месалазина (2,4 г/сут) не улучшили существенно ни один из параметров заболевания. Кроме того, более высокая доза будесонида MMX была эффективной в индукции ремиссии у пациентов с легкой и умеренной формами ЯК, которые не достигли ремиссии при лечении месалазином или сульфасалазином [30]. В настоящее время врачи назначают будесонид MMX пациентам с ЯК, которые не реагируют на традиционную поддерживающую терапию до лечения азатиоприном/6-меркаптопурином [31].
D. T. Rubin и соавт. (2017) провели рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое исследование, в котором оценили эффективность и безопасность будесонида MMX (Кортимент) для индукции ремиссии ЯК (индекс активности ЯК ≥ 4 и ≤ 10) у 510 взрослых пациентов, которые принимали будесонид MMX 9 мг один раз в день или плацебо в течение 8 недель. Пациенты продолжали базовое лечение пероральным месалазином ≥ 2,4 г/день. Будесонид MMX оказался безопасным и эффективным для индукции клинической и эндоскопической ремиссии при ЯК легкой и средней степени, резистентном к пероральной терапии месалазином [32].
Мы в своей повседневной практике широко применяем Кортимент как у пациентов с болезнью Крона толстой кишки, так и у пациентов, страдающих язвенным колитом. Относительная безопасность препарата позволяет назначать его в ситуациях, когда, несмотря на потребность в стероидах, системные глюкокортикостероидные препараты крайне нежелательны. Представляем вниманию тактику ведения пациента 1983 г. р., социально благополучного, без вредных привычек молодого человека с высшим образованием. Из анамнеза болезни известно, что в 2014 г. выставлен диагноз сахарного диабета 1 типа, инсулинозависимый, средней степени тяжести. В 2015 г. — дебют язвенного колита с тотальным поражением толстой кишки, потребовавшего госпитализации и назначения внутривенного преднизолона. Поддерживающая терапия — месалазин таблетированный 3,0 г/сут и ректально два раза в неделю по 4,0 г. В течение следующих 10 месяцев наблюдалась клинико-эндоскопическая ремиссия, однако в течение этого периода выявили трудно корригируемые уровни глюкозы крови. Через 10 месяцев обострение ЯК — 8 баллов по индексу Мейо. Учитывая сопутствующую патологию, риск развития инсулинорезистентности при назначении системных стероидов, решено назначить Кортимент 9 мг/сут, согласно инструкции, с постепенной отменой и азатиоприн в дозе 2 мг/кг. Препараты месалазина пациент продолжал принимать в прежних дозах. Получен положительный ответ на лечение, клинико-эндоскопическая ремиссия в течение 8,5 месяцев, стабилизация состояния по течению диабета. Однако весной 2018 г. случилось очередное обострение, расцененное как 8 баллов по индексу Мейо. К лечению назначен Кортимент 9 мг/сут и начат индукционный курс биологической терапии (Ремикейд) с выраженным положительным ответом. В настоящее время пациент чувствует себя хорошо, уровень глюкозы крови нормализовался, со слов пациента — снизилась дозировка инсулина. В приведенном случае, с нашей точки зрения, назначение топического стероидного препарата позволило минимизировать риски применения системных стероидов у пациента с сопутствующей тяжелой патологией. Назначение препарата Кортимент перед биологической терапией и в период индукционного курса послужило своеобразным «мостиком» для достижения ремиссии.
Таким образом, при выборе лечения пациентов с воспалительными заболеваниями кишечника лечащий врач принимает во внимание клинические симптомы, течение и тяжесть заболевания, а также наличие и характер осложнений. ВЗК — хронические заболевания, контроль которых в большинстве случаев возможен. Препараты Пентаса и Кортимент оказывают доказанную эффективность для достижения ремиссии и ее поддержания у пациентов с ВЗК в реальной клинической практике.
Литература
- Shanahan F. The gut microbiota — a clinical perspective on lessons learned // Nat. Rev. Gastroenterol. Hepatol. 2012; 9: 609–614.
- Molodecky N. A., Soon I. S., Rabi D. M., Ghali W. A., Ferris M., Chernoff G., Benchimol E. I., Panaccione R., Ghosh S., Barkema H. W., Kaplan G. G. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review // Gastroenterology. 2012; 142 (1): 46–54. e42; quiz e30.
- Burisch J., Pedersen N., Cukovic-Cavka S. et al. East–West gradient in the incidence of inflammatory bowel disease in Europe: the ECCO-EpiCom inception cohort // Gut. 2013; 0: 1–10. DOI: 10.1136/gutjnl-2013–304636.
- Князев О. В., Шкурко Т. В., Фадеева Н. А., Бакулин И. Г., Бордин Д. С. Эпидемиология хронических воспалительных заболеваний кишечника. Вчера, сегодня, завтра // Экспериментальная и клиническая гастроэнтерология. 2017; 3: 4–12.
- Miner P., Hanauer S., Robinson M., Schwartz J., Arora S. Safety and efficacy of controlled-release mesalamine for maintenance of remission in ulcerative colitis. Pentasa UC Maintenance Study Group // Dig Dis Sci. 1995; 40 (2): 296–304.
- Vecchi M., Meucci G., Gionchetti P., Beltrami M., Di Maurizio P., Beretta L., Ganio E., Usai P., Campieri M., Fornaciari G., DeFranchis R. Oral versus combination mesalazine therapy in active ulcerative colitis: a double-blind, double-dummy, randomized multicentre study // Alimentary Pharmacology & Therapeutics. 2001; 15 (2): 251–256.
- Bokemeyer B., Hommes D., Gill I., Broberg P., Dignass A. Mesalazine in left-sided ulcerative colitis: efficacy analyses from the PODIUM trial on maintenance of remission and mucosal healing // J Crohns Colitis. 2012; 6 (4): 476–482.
- Flourié, Hagège B., Tucat H., Maetz G., Hébuterne D., Dewit X., Olivier [UCL], Aoucheta D. et al. Randomised clinical trial: once- vs. twice-daily prolonged-release mesalazine for active ulcerative colitis // Alimentary Pharmacologyand Therapeutics. 2013; 37 (8): 767–775.
- Proberta C. S. J., Dignass A. U., Lindgren S., Pool M. O., Marteau P. Combined oral and rectal mesalazine for the treatment of mild-to-moderately active ulcerative colitis: Rapid symptom resolution and improvements in quality of life. Author links openoverlay panel // Journal of Crohn’sand Colitis. 2014; 8 (3): 200–207.
- Takeshima F., Matsumura M., Makiyama K. et al. Efficacy of long-term 4.0 g/day mesalazine (Pentasa) for maintenance therapy in ulcerative colitis // Med Sci Monit. 2014; 20: 1314–1318.
- Nagahori M., Kochi S., Hanai H., Yamamoto, Nakamura S., Omuro S., Watanabe M., Hibi T. Real life results in using 5-ASA-for maintaining mild to moderate UC patients in Japan, amulti-center study, OPTIMUM Study // BMC Gastroenterol. 2017; 17: 47.
- Yagisawa K., Kobayashi T., Ozaki R., Okabayashi S., Toyonaga T., Miura M., Hayashida M., Saito E., Nakano M., Matsubara H., Hisamatsu T., Hibi T. Randomized, crossover questionnaire survey of acceptabilityes of controlled-release mesalazine tablets and granules in ulcerative colitis patients // Intest Res. 2018. Dec 14. DOI: 10.5217/ir.2018.00078.
- Hanauer S. B., Strömberg U. Oral Pentasa in the treatment of active Crohn’s disease: A meta-analysis of double-blind, placebo-controll edtrials // Clin Gastroenterol Hepatol. 2004; 2 (5): 379–388.
- Щукина О. Б., Кондрашина Э. А., Вепрева Е. Г., Харитонов А. Г., Барановский А. Ю. Влияние базисной терапии на клинические исходы болезни Крона // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016; 26 (2): 112–119.
- Gomollón F., Dignass A., Annese V., Tilg H., van Assche G., J. O. Lindsay, Peyrin-Biroulet L., Garret J., Daperno M., Kucharzik T. et al. // Journal of Crohn’s and Colitis. 2017, 1 January, vol. 11, Issue 1, p. 3–25. https://doi. org/10.1093/ecco-jcc/jjw168.
- Corrado Brignola et al., Mesalamine in the Prevention of Endoscopic Recurrence After Intestinal Resectionfor Crohn’s Disease / Gastroenterology 1995; 108: 345–349.
- Ngyuen G. C. et al. Summary of Recommendations of the AGA. Clinical Guidelines for the Management of Crohn’s Disease After Surgical Resection AGA // Gastroenterology. 2017; 152: 271–275.
- Головенко А. О., Халиф И. Л., Головенко О. В. Профилактика послеоперационных рецидивов болезни Крона // Колопроктология. 2012; 4: 40–48.
- Ardizzone S, et al. Azathioprine and mesalamine for prevention of relapse after conservative surgery for Crohn’s Disease / Gastroenterology 2004; 127(3): 730–740.
- Григорьев Е. Г., Чашкова Е. Ю., Капорский В. И., Гельфанд С. А., Шедоева Л. Р., Чхенкели Л. Г. Многоэтапное хирургическое лечение пациента с осложненной формой болезни Крона // Колопроктология. 2014; № 1 (47): 37–42.
- Weisshof R., Jurdi K. E., Zmeter N., Rubin D. T. Emerging Therapies for Inflammatory Bowel Disease // Adv Ther. 2018; 35 (11): 1746–1762.
- Prantera C., Viscido A., Biancone L., Francavilla A., Giglio L., Campieri M. A new oral delivery system for 5-ASA: preliminary clinical findings for MMx // Inflamm Bowel Dis. 2005; 11: 421–427.
- Fiorino G., Fries W., de La Rue S. A., Malesci A. C., Repici A., Danese S. New drug delivery systems in inflammatory bowel disease: MMX™ and tailored delivery to the gut // Curr Med Chem. 2010; 17: 1851–1857.
- Brunner M., Ziegler S., Di Stefano A. F. et al. Gastrointestinal transit, release and plasma pharmacokinetics of a new oral budesonide formulation // Br J Clin Pharmacol. 2006; 61: 31–38.
- Lichtenstein G. R. Budesonide multi-matrix for the treatment of patients with Ul cerative Colitis // Dig Dis Sci. 2016; 61: 358–370.
- Huang M., Yeung P., Ballard E. D. Once-daily budesonide MMX® extended-release tablets induce remission in patients with mild to moderate ulcerative colitis: results from the CORE I study // Gastroenterology. 2012; 143: 1218–1226.
- Travis S. P. L., Danese S., Kupcinskas L., Alexeeva O., D’Haens G., Gibson P. R., Moro L., Jones R., Ballard E. D., Masure J., Rossini M., Sandborn W. J. Once-daily budesonide MMX in active, mild-to-moderate ulcerative colitis: results from the randomised CORE II study // Gut. 2014, Mar; 63 (3): 433–441.
- Lichtenstein G. R., Travis S., Danese S., D’Haens G., Moro L., Jones R., Huang M., Ballard E. D., Bagin R., Hardiman Y. et al. Budesonide MMX for the Induction of Remission of Mild to Moderate Ulcerative Colitis: A Pooled Safety Analysis // J Crohns Colitis. 2015; 9: 738–746.
- Sherlock M. E., MacDonald J. K., Griffiths A. M., Steinhart A. H., Seow C. H. Oral budesonide for induction of remission in ulcerative colitis // Cochrane Database Syst Rev. 2015, Oct 26; (10): CD007698.
- Sandborn W. J., Travis S., Moro L., Jones R., Gautille T., Bagin R., Danese S., Siegel C. A., Peyrin-Biroulet L. Review article: integrating budesonide-MMX into treatment algorithms for mild-to-moderate ulcerative colitis // Aliment Pharmacol Ther. 2014; 39: 1095–1103.
- Dubois-Camacho K., Ottum P. A., Franco-Muñoz D., De la Fuente M., Torres-Riquelme A., Díaz-Jiménez D., Olivares-Morales M., Astudillo G., Quera R., Hermoso M. A. Glucocorticosteroid therapy in inflammatory bowel diseases: From clinical practice to molecular biology // World J Gastroenterol. 2017, Sep 28; 23 (36): 6628–6638.
- Rubin D. T., Cohen R. D., Sandborn W. J., Lichtenstein G. R., Axler J., Riddell R. H., Zhu C., Barrett A. C., Bortey E., Forbes W. P. Budesonide Multimatrix Is Efficacious for Mesalamine-refractory, Mild to Moderate Ulcerative Colitis: A Randomised, Placebo-controlled Trial // J Crohns Colitis. 2017 Jul; 11 (7): 785–791.
Е. Ю. Плотникова*, 1, доктор медицинских наук, профессор
Е. Ю. Чашкова**, кандидат медицинских наук
* ГБОУ ВПО КемГМУ Минздрава России, Кемерово
** ФГБНУ ИНЦХТ, Иркутск
1 Контактная информация: eka-pl@rambler.ru
DOI: 10.26295/OS.2019.62.53.002
Некоторые аспекты лечения воспалительных заболеваний кишечника/ Е. Ю. Плотникова, Е. Ю. Чашкова
Для цитирования: Лечащий врач № 8/2019; Номера страниц в выпуске: 14-21
Теги: желудочно-кишечный тракт, воспаление, осложнения