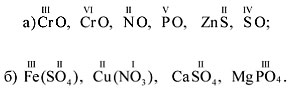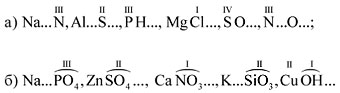САМОУЧИТЕЛЬ ПО ХИМИИ
Предлагаемый вашему вниманию Самоучитель — не обычный учебник по химии. В нём не просто излагаются какие-то факты, не просто описываются свойства веществ, как в обычном пособии. Этот курс по изучению химии объясняет и учит, особенно в тех случаях, если вы не можете или стесняетесь обратиться за разъяснениями к учителю. Данный самоучитель в виде рукописи использовался с 1991 г. школьниками, и не было ни одного ученика, который бы «провалился» на экзамене по химии и в школе, и в вузах. Большинство из них начинало с «нуля»!
Курс рассчитан на самостоятельную работу ученика. Главное, чтобы вы отвечали по ходу чтения на те вопросы, которые встречаются в тексте. Если вы не смогли ответить на вопрос, — читайте внимательнее ещё раз: все ответы имеются рядом. Желательно также выполнять все задания которые встречаются по ходу объяснения нового материала, а также задания ЕГЭ, которые взяты из реальных сборников ФИПИ разных лет издания. В этом вам помогут многочисленные обучающие алгоритмы, которые есть в каждой части Самоучителя по химии.
В интерактивном учебнике приведены, в основном, схемы химических реакций. Коэффициенты нужно расставлять самим, даже если об этом не сказано в задании. В конце каждого урока имеются упражнения, вопросы и задачи, которые проверяют степень усвоения предложенного материала. Если вы смогли, не подглядывая в текст урока, ответить на эти вопросы, сделать все упражнения, решить все задачи — замечательно. В противном случае ещё раз перечитайте урок.
В последних уроках самоучителя приведены также способы решения базовых задач по химии. В случае затруднений при решении задачи, условие которой имеется в конце главы, найдите эту задачу среди задач для самостоятельного решения в уроках 29–32, а потом посмотрите, как решается такая задача.
Изучив данный Самоучитель, вы сможете легко ответить на многие вопросы ЕГЭ и просто понять и, возможно, полюбить этот непростой, но очень интересный предмет ХИМИЯ.
Если ты готов, то дерзай! И да прибудет с тобой химия 🙂
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Часть I. Элементы общей химии
(первый уровень сложности)
От автора
Я, Френкель Евгения Николаевна, заслуженный
работник высшей школы РФ, выпускница химического
факультета МГУ 1972 г., педагогический стаж 34 года.
Кроме того, я мать троих детей и бабушка четырех
внуков, старший из которых школьник.Меня волнует проблема школьных учебников.
Главная беда многих из них – тяжелый язык,
который требует дополнительного «перевода» на
понятный школьнику язык изложения учебного
материала. Ко мне часто обращаются ученики
средней школы с такой просьбой: «Переведите
текст учебника, чтобы понятно было». Поэтому я
написала «Самоучитель по химии», в котором
многие сложные вопросы изложены вполне доступно
и в то же время научно. На основе этого
«Самоучителя», который был написан в 1991 г., я
разработала программу и содержание
подготовительных курсов. На них обучались сотни
школьников. Многие из них начинали с нуля и за 40
занятий понимали предмет настолько, что сдавали
экзамены на «4» и «5». Поэтому в нашем городе мои
пособия-самоучители расходятся как горячие
пирожки.Может, и другим пригодятся мои наработки?
Статья подготовлена при поддержке учебного центра «МакарОФФ». Учебный центр предлагает Вам пройти курсы маникюра в Москве недорого. Профессиональная школа маникюра проводит обучение по маникюру, педикюру, наращиванию и дизайну ногтей, а также курсы мастеров-универсалов ногтевого сервиса, наращивание ресниц, микроблейдинг, шугаринг и эпиляция воском. Центр выдаёт дипломы после обучения и гарантированное трудоустройство. Подробная информация обо всех программах обучения, цены, расписание, акции и скидки, контакты на сайте: www.akademiyauspeha.ru .
Предисловие
Уважаемые читатели! Предлагаемый вашему
вниманию «Самоучитель по химии» – не обычный
учебник. В нем не просто излагаются какие-то
факты или описываются свойства веществ.
«Самоучитель» объясняет и учит даже в том случае,
если вы, к сожалению, не знаете и не понимаете
химии, а к учителю обратиться за разъяснениями не
можете или стесняетесь. В виде рукописи эта книга
используется школьниками с 1991 г., и не было ни
одного ученика, который бы провалился на
экзамене по химии и в школе, и в вузах. Причем
многие из них совсем не знали химии.
«Самоучитель» рассчитан на самостоятельную
работу ученика. Главное – отвечать по ходу
чтения на те вопросы, которые встречаются в
тексте. Если вы не смогли ответить на вопрос, то
читайте внимательнее текст еще раз – все ответы
имеются рядом. Желательно также выполнять все
упражнения, которые встречаются по ходу
объяснения нового материала. В этом помогут
многочисленные обучающие алгоритмы, которые
практически не встречаются в других учебниках. С
их помощью вы научитесь:
составлять химические
формулы по валентности;
составлять уравнения
химических реакций, расставлять в них
коэффициенты, в том числе в уравнениях
окислительно-восстановительных процессов;
составлять электронные
формулы (в том числе краткие электронные формулы)
атомов и определять свойства соответствующих
химических элементов;
предсказывать свойства
некоторых соединений и определять, возможен
данный процесс или нет.
В пособии два уровня сложности. Самоучитель первого
уровня сложности состоит из трех частей.
I часть. Элементы общей химии (публикуемая).
II часть. Элементы неорганической химии.
III часть. Элементы органической химии.
Книг второго уровня сложности тоже три.
Теоретические основы общей химии.
Теоретические основы неорганической химии.
Теоретические основы органической химии.
СОДЕРЖАНИЕ
Глава 1. Основные понятия химии.
Упражнения к главе 1.
Глава 2. Важнейшие классы неорганических
соединений.
2.1. Оксиды.
2.2. Кислоты.
2.3. Основания.
2.4. Соли.
Упражнения к главе 2.
Глава 3. Элементарные сведения о строении
атома. Периодический закон Д.И.Менделеева.
Упражнения к главе 3.
Глава 4. Понятие о химической связи.
Глава 5. Растворы.
Глава 6. Электролитическая диссоциация.
6.1. Понятие о рН (водородном показателе).
6.2. Гидролиз солей.
Упражнения к главе 6.
Глава 7. Понятие об
окислительно-восстановительных реакциях.
Глава 8. Расчеты по химическим формулам и
уравнениям.
8.1. Основные расчетные понятия.
8.2. Задачи, решаемые по стандартным формулам.
8.2.1. Задачи по теме «Газы».
8.2.2. Задачи по теме «Способы выражения
концентрации растворов».8.2.3. Задачи по теме «Количественный состав
вещества».8.3. Задачи, решаемые по уравнениям реакций.
8.3.1. Оформление расчетов по уравнениям реакций.
8.3.2. Задачи по теме «Количественный состав
растворов и смесей».8.3.3. Задачи на установление формулы вещества.
8.4. Задачи для самостоятельного решения.
Приложение.
Глава 1. Основные понятия химии
Что такое химия? Где мы встречаемся с
химическими явлениями?
Химия – везде. Сама жизнь – это бесчисленное
множество разнообразных химических реакций,
благодаря которым мы дышим, видим голубое небо,
ощущаем изумительный запах цветов.
Что изучает химия?
Химия изучает вещества, а также химические
процессы, в которых участвуют эти вещества.
Что такое вещество?
Вещество – это то, из чего состоит окружающий
нас мир и мы сами.
Что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в
результате которых изменяется состав или
строение молекул, образующих данное вещество*. Изменились молекулы –
изменилось вещество (оно стало другим),
изменились его свойства. Например, свежее молоко
стало кислым, зеленые листья стали желтыми, сырое
мясо при обжаривании изменило запах.
Все эти изменения – следствие сложных и
многообразных химических процессов. Однако
признаки простых химических реакций, в
результате которых изменяется состав и строение
молекул, такие же: изменение цвета, вкуса или
запаха, выделение газа, света или тепла,
появление осадка.
Что же такое молекулы, изменение которых влечет
за собой столь разнообразные проявления?
Молекулы – это мельчайшие частицы вещества,
отражающие его качественный и количественный
состав и его химические свойства.
Изучая состав и строение одной молекулы, можно
предсказать многие свойства данного вещества в
целом. Такие исследования – одна из главных
задач химии.
Как устроены молекулы? Из чего они состоят?
Молекулы состоят из атомов. Атомы в
молекуле соединены при помощи химических связей.
Каждый атом обозначается при помощи символа
(химического знака). Например, Н – атом водорода,
О – атом кислорода.
Число атомов в молекуле обозначают при помощи индекса
– цифры внизу справа после символа.
Например:
Примеры молекул:
О2 – это молекула вещества кислорода,
состоящая из двух атомов кислорода;
Н2О – это молекула вещества воды,
состоящая из двух атомов водорода и одного атома
кислорода.
Если атомы не связаны химической связью, то их
число обозначают при помощи коэффициента –
цифры перед символом:
Аналогично изображают число молекул:
2Н2 – две молекулы водорода;
3Н2О – три молекулы воды.
Почему атомы водорода и кислорода имеют разные
названия и разные символы? Потому что это атомы
разных химических элементов.
Химический элемент – это вид атомов с
одинаковым зарядом ядер.
Что такое ядро атома? Почему заряд ядра
является признаком принадлежности атома к
данному химическому элементу? Чтобы ответить на
эти вопросы, следует уточнить: изменяются ли
атомы в химических реакциях, из чего состоит
атом?
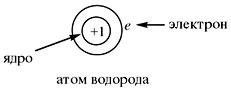
Нейтральный атом не имеет заряда, хотя и
состоит из положительно заряженного ядра и
отрицательно заряженных электронов:
В ходе химических реакций число электронов
любого атома может изменяться, а вот заряд ядра
атома не меняется. Поэтому заряд ядра
атома – своеобразный «паспорт» химического
элемента. Все атомы с зарядом ядра +1 принадлежат
химическому элементу под названием водород.
Атомы с зарядом ядра +8 относятся к химическому
элементу кислороду.
Каждому химическому элементу присвоен
химический символ (знак), порядковый номер в
таблице Д.И.Менделеева (порядковый номер равен
заряду ядра атома), определенное название, а для
некоторых химических элементов – особое
прочтение символа в химической формуле (табл. 1).
Таблица 1
Символы (знаки) химических элементов
| № п/п | № в таблице Д.И.Менделеева |
Символ | Прочтение в формуле | Название |
| 1 | 1 | H | аш | Водород |
| 2 | 6 | C | це | Углерод |
| 3 | 7 | N | эн | Азот |
| 4 | 8 | O | о | Кислород |
| 5 | 9 | F | фтор | Фтор |
| 6 | 11 | Na | натрий | Натрий |
| 7 | 12 | Mg | магний | Магний |
| 8 | 13 | Al | алюминий | Алюминий |
| 9 | 14 | Si | силициум | Кремний |
| 10 | 15 | P | пэ | Фосфор |
| 11 | 16 | S | эс | Сера |
| 12 | 17 | Cl | хлор | Хлор |
| 13 | 19 | K | калий | Калий |
| 14 | 20 | Ca | кальций | Кальций |
| 15 | 23 | V | ванадий | Ванадий |
| 16 | 24 | Cr | хром | Хром |
| 17 | 25 | Mn | марганец | Марганец |
| 18 | 26 | Fe | феррум | Железо |
| 19 | 29 | Cu | купрум | Медь |
| 20 | 30 | Zn | цинк | Цинк |
| 21 | 35 | Br | бром | Бром |
| 22 | 47 | Ag | аргентум | Серебро |
| 23 | 50 | Sn | станнум | Олово |
| 24 | 53 | I | йод | Йод |
| 25 | 56 | Ba | барий | Барий |
| 26 | 79 | Au | аурум | Золото |
| 27 | 80 | Hg | гидраргирум | Ртуть |
| 28 | 82 | Pb | плюмбум | Cвинец |
Вещества бывают простые и сложные.
Если молекула состоит из атомов одного
химического элемента, это простое вещество. Простые
вещества – Са, Сl2, О3, S8 и т. д.
Молекулы сложных веществ состоят из атомов
разных химических элементов. Сложные
вещества – H2O, NO, H3PO4, C12H22O11
и т. д.
Задание 1.1. Укажите число атомов в молекулах
сложных веществ H2O, NO, H3PO4, C12H22O11,
назовите эти атомы.
Возникает вопрос: почему для воды всегда
записывается формула Н2О, а не НО или НО2?
Опыт доказывает, что состав воды, полученной
любым способом или взятой из любого источника,
всегда соответствует формуле Н2О (речь идет
о чистой воде).
Дело в том, что атомы в молекуле воды и в
молекуле любого другого вещества соединены при
помощи химических связей. Химическая связь
соединяет как минимум два атома. Поэтому, если
молекула состоит из двух атомов и один из них
образует три химические связи, то другой также
образует три химические связи.
Число химических связей, образуемых атомом,
называют его валентностью.
Если обозначить каждую химическую связь
черточкой, то для молекулы из двух атомов АБ
получим АБ, где тремя
черточками показаны три связи, образуемые
элементами А и Б между собой.
В данной молекуле атомы А и Б трехвалентны.
Известно, что атом кислорода двухвалентен, атом
водорода одновалентен.
В о п р о с. Сколько атомов водорода может
присоединиться к одному атому кислорода?
О т в е т. Два атома. Состав воды описывают
формулой Н–О–Н, или Н2О.
П о м н и т е! В устойчивой молекуле не может быть
«свободных», «лишних» валентностей. Поэтому для
двухэлементной молекулы число химических связей
(валентностей) атомов одного элемента равно
общему числу химических связей атомов другого
элемента.
Валентность атомов некоторых химических
элементов постоянна (табл. 2).
Таблица 2
Значение постоянных валентностей
некоторых элементов
|
Валентность |
Символы элементов |
| I | H, F, Ag, Na, K |
| II | O, Ca, Мg, Ba, Zn |
| III | Аl |
Для других атомов валентность** можно определить (вычислить)
из химической формулы вещества. При этом нужно
учитывать изложенное выше правило о химической
связи. Например, определим валентность x
марганца Mn по формуле вещества MnO2:
Общее число химических связей, образуемых
одним и другим элементом (Mn и О), одинаково:
x · 1 = 4; II · 2 = 4. Отсюда х = 4, т.е. в этой
химической формуле марганец четырехвалентен.
П р а к т и ч е с к и е в ы в о д ы
1. Если один из атомов в молекуле одновалентен,
то валентность второго атома равна числу атомов
первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то
валентность первого атома равна валентности
второго атома:
3. Если у одного из атомов индекс отсутствует, то
его валентность равна произведению валентности
второго атома на его индекс:
4. В остальных случаях ставьте валентности
«крест-накрест», т.е. валентность одного элемента
равна индексу другого элемента:
Задание 1.2. Определите валентности
элементов в соединениях:
CO2, CO, Mn2O7, Cl2O, P2O3,
AlP, Na2S, NH3, Mg3N2.
П о д с к а з к а. Сначала укажите валентность
атомов, у которых она постоянная. Аналогично
определяется валентность атомных групп ОН, РО4,
SО4 и др.
Задание 1.3. Определите валентности атомных
групп (в формулах подчеркнуты):
H3PO4, Ca(OH)2, Ca3(PO4)2,
H2SO4, CuSO4.
(Обратите внимание! Одинаковые группы атомов
имеют одинаковые валентности во всех
соединениях.)
Зная валентности атома или группы атомов, можно
составить формулу соединения. Для этого
пользуются следующими правилами.
• Если валентности атомов одинаковы, то и число
атомов одинаково, т.е. индексы не ставим:
• Если валентности кратны (обе делятся на одно
и то же число), то число атомов элемента с меньшей
валентностью определяем делением:
• В остальных случаях индексы определяют
«крест-накрест»:
Задание 1.4. Составьте химические формулы
соединений:
Вещества, состав которых отражают химические
формулы, могут участвовать в химических
процессах (реакциях). Графическая запись,
соответствующая данной химической реакции,
называется уравнением реакции. Например, при
сгорании (взаимодействии с кислородом) угля
происходит химическая реакция:
С + O2 = CO2.
Запись показывает, что один атом углерода С,
соединяясь с одной молекулой кислорода O2,
образует одну молекулу углекислого газа СО2.
Число атомов каждого химического элемента до и
после реакции должно быть одинаково. Это
правило – следствие закона сохранения массы
вещества. Закон сохранения массы: масса
исходных веществ равна массе продуктов реакции.
Закон был открыт в XVIII в. М.В.Ломоносовым и,
независимо от него, А.Л.Лавуазье.
Выполняя этот закон, необходимо в уравнениях
химических реакций расставлять коэффициенты
так, чтобы число атомов каждого химического
элемента не изменялось в результате реакции.
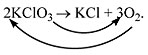
Например, при разложении бертолетовой соли KClO3
получается соль KСl и кислород О2:
KClO3 KСl + О2.
Число атомов калия и хлора одинаково, а
кислорода – разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до
реакции. Уравняем их:
Наконец, между правой и левой частями уравнения
можно поставить знак равенства:
2KClO3 = 2KСl + 3О2.
Полученная запись показывает, что при
разложении сложного вещества KClO3
получаются два новых вещества – сложное KСl и
простое – кислород O2. Числа перед
формулами веществ в уравнениях химических
реакций называют коэффициентами.
При подборе коэффициентов необязательно
считать отдельные атомы. Если в ходе реакции не
изменился состав некоторых атомных групп, то
можно учитывать число этих групп, считая их
единым целым. Составим уравнение реакции веществ
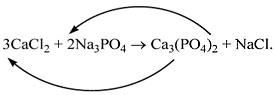
CaCl2 и Na3PO4:
CaCl2 + Na3PO4 ……………… .
П о с л е д о в а т е л ь н о с т ь д е й с т в и й
1) Определим валентность исходных атомов и
группы PO4:
2) Напишем правую часть уравнения (пока без
индексов, формулы веществ в скобках надо
уточнить):
3) Составим химические формулы полученных
веществ по валентностям составных частей:
4) Обратим внимание на состав самого сложного
соединения Ca3(PO4)2 и уравняем
число атомов кальция (их три) и число групп РО4
(их две):
5) Число атомов натрия и хлора до реакции теперь
стало равным шести. Поставим соответствующий
коэффициент в правую часть схемы перед формулой
NaCl:
3CaCl2 + 2Na3PO4 = Ca3(PO4)2
+ 6NaCl.
Пользуясь такой последовательностью, можно
уравнять схемы многих химических реакций (за
исключением более сложных
окислительно-восстановительных реакций, см.
главу 7).
Типы химических реакций. Химические
реакции бывают разных типов. Основными являются
четыре типа – соединение, разложение, замещение
и обмен.
1. Реакции соединения – из двух и более
веществ образуется одно вещество:
А + В АВ.
Например:
Са + Сl2 = CaCl2.
2. Реакции разложения – из одного вещества
получаются два вещества или более:
АВ А + В.
Например:
Ca(HCO3)2 CaCO3 + CO2 + H2O.
3. Реакции замещения – реагируют простое и
сложное вещества, образуются также простое и
сложное вещества, причем простое вещество
замещает часть атомов сложного вещества:
А + ВХ АХ + В.
Например:
Fe + CuSO4 = Cu + FeSO4.
4. Реакции обмена – здесь реагируют два
сложных вещества и получаются два сложных
вещества. В ходе реакции сложные вещества
обмениваются своими составными частями:
АВ + XY АY + XВ.
Например:
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в
схемах реакций:
Na + Cl2 NaCl,
NaHCO3 Na2CO3
+ CO2 + H2O,
Fe + AgNO3 Fe(NO3)2
+ Ag,
Fe(OH)3 + HCl
FeСl3 + H2O.
Задание 1.6. Расставьте коэффициенты и
определите типы химических реакций:
Fe(OH)3 Fe2O3
+ H2O,
Al + H2SO4 Al2(SO4)3 + H2,
HNO3 + Cu(OH)2 Cu(NO3)2 + H2O,
P + O2 P2O5.
Выводы по главе 1. Вещества состоят из
молекул, молекулы состоят из атомов, атомы с
одинаковым зарядом ядра относятся к одному и
тому же химическому элементу.
Вещества бывают простые и сложные. Состав
веществ показывают при помощи химических формул.
Формулы веществ составляют, учитывая
валентности составных частей. Запись
химического процесса при помощи формул
называется уравнением химической реакции.
Химические реакции бывают разных типов: обмена,
замещения, разложения, соединения и др.
Упражнения к главе 1
1. Выучите табл. 1. Проверьте себя, напишите
химические символы: серы, цинка, олова, магния,
марганца, калия, кальция, свинца, железа и фтора.
2. Напишите символы химических элементов,
которые в формулах произносятся как: «аш», «о»,
«купрум», «эс», «пэ», «гидраргирум», «станнум»,
«плюмбум», «эн», «феррум», «це», «аргентум».
Назовите эти элементы.
3. Укажите число атомов каждого химического
элемента в формулах соединений:
Al2S3, СаS, МnО2, NH3,
Mg3P2, SO3.
4. Определите, какие из веществ – простые, а
какие – сложные:
Na2O, Na, O2, CaCl2, Cl2.
Прочитайте формулы этих веществ.
5. Выучите табл. 2. Составьте химические
формулы веществ по известной валентности
элементов и атомных групп:
6. Определите валентность химических
элементов в соединениях:
N2O, Fe2O3, PbO2, N2O5,
HBr, SiH4, H2S, MnO, Al2S3.
7. Расставьте коэффициенты и укажите типы
химических реакций:
а) Mg + O2 MgO;
б) Al + CuCl2 AlCl3
+ Cu;
в) NaNO3 NaNO2 + O2;
г) AgNO3 + BaCl2
AgCl + Ba(NO3)2;
д) Al + HCl AlCl3 + H2;
е) KOH + H3PO4 K3PO4
+ H2O;
ж) CH4 C2H2
+ H2.
* Существуют вещества,
построенные не из молекул. Но об этих веществах
речь пойдет позже (см. главу 4).
** Строго говоря, по
нижеизложенным правилам определяют не
валентность, а степень окисления (см. главу 7).
Однако во многих соединениях числовые значения
этих понятий совпадают, поэтому по формуле
вещества можно определять и валентность.
Печатается с продолжением
Химия
Рекомендации
- Новинки
- Рекомендации
только полные версии книг
полная версия
В справочнике представлен в обобщенном виде теоретический материал по предметам школьного курса. Табличная форма позволяет наглядно представить основные положения школьной программы, способствует…
Подробнее
полная версия
Горст Август Георгиевич
Книга содержит краткие сведения о теории взрывчатых веществ, о взрывчатых веществах (бризантных и инициирующих), средствах воспламенения и инициирования, порохах и пиротехнике в объеме,…
Подробнее
полная версия
Кондрашов Анатолий Павлович
Любознательность – вот то качество, которое присуще подавляющему большинству потомков Адама и Евы, любопытство – главная движущая сила великих научных открытий и выдающихся культурных достижений,…
Подробнее
полная версия
Матвейчук Валерий Витальевич
Учебно-практическое пособие. Изложены все разделы курса «Взрывное дело». Подробно описано хранение, применение и обезвреживание взрывчатых веществ.
Рекомендовано для широкого круга специалистов,…
Подробнее
полная версия
Марголина А. А.Эрнандес Е. И.
«Новая косметология» в доступной и занимательной форме описывает об основных научных концепциях, на которых строятся сегодняшняя практическая косметология и изготовление косметических средств. В…
Подробнее
полная версия
Новых Анастасия
Доклад «ИСКОННАЯ ФИЗИКА АЛЛАТРА» подготовлен интернациональной научно-исследовательской группой ALLATRA SCIENCE Международного общественного движения «АЛЛАТРА» под редакцией Анастасии Новых. В…
Подробнее
Рюмин Владимир Владимирович
В книге знаменитого ученого-химика Владимира Владимировича Рюмина вы найдете крайне занимательные опыты и превращения химических веществ, каждое из которых можно найти в специализированных магазинах….
Подробнее
полная версия
Айзек Азимов
Из этой замечательной книги вы узнаете о строении и тайнах центральной нервной системы человека, об анатомии, физиологии и сложнейших биохимических процессах, протекающих в головном мозге. В книге…
Подробнее
полная версия
Фасхутдинова Раиля
Если среди читателей «Самоучителя» окажутся учителя по химии, автор будет особенно рада, потому что среди них обязательно будут те, которые захотят усовершенствовать предложенный учебный материал….
Подробнее
полная версия
Одноралов Николай Васильевич
В пособии изложены способы и приемы выполнения всевозможных гальванопластических покрытий серебрение, никелирование, хромирование и др. Много внимания уделено изготовлению для школы декоративных…
Подробнее
полная версия
Чувурин Александр Викторович
Книга рассчитана на широкий круг читателей, неравнодушных к спичкам, кострам. ракетам и фейерверкам.
В первой части книги подробно описано более 1400 составов и индивидуальных химических…
Подробнее
полная версия
Чувурин Александр Викторович
Вторая часть книги представляет собой подробное практическое руководство по изготовлению фейерверков в кустарных условиях. В том числе низовых, верховых, водных, театральных и даже комнатных….
Подробнее
полная версия
Лев Дионисович Мирошниченко
Словарь содержит более 1000 статей, отражающих клинические, биологические, психологические и социальные явления, сопряжённые с употреблением наркотических и других психоактивных веществ и болезненной…
Подробнее
полная версия
Иванов Александр Александрович
Книга об истории развития человеческой цивилизации с точки зрения химии.
В книге последовательно описываются химические элементы в порядке, в котором они были открыты, и какой вклад они внесли в…
Подробнее
полная версия
Эрнандес Е. И.
В книжке проанализированы такие темы: аппаратные методы в косметологии, волосы и уход за волосами, вопросы испытания косметологических средств на плодотворность и безопасность, инъекционные…
Подробнее
полная версия
Шкурко Д.
Книга представляет собой сборник занимательных химических опытов. Автор знакомит школьников со свойствами химических элементов, предлагая разгадать маленькие химические тайны и попутно повторить…
Подробнее
полная версия
полная версия
Менделеев Дмитрий Иванович
IX том работ Д. И. Менделеева посвящен деятельности его в области химии и технологии бездымных порохов. Этой отрасли химической технологии Д. И. уделил всего несколько лет (1890 – 1894), но за такой…
Подробнее
полная версия
Популярные авторы
Название: Справочное руководство по химии
Автор: Артеменко А.И.
Издательство: Высшая школа
Год: 1990
Страниц: 303
Формат: pdf
Размер: 41 mb
Руководство включает основные теоретические положения неорганической , органической, физической и аналитической химии, электрохимии, термодинамики, сведения по техническому анализу, общей химической технологии, примеры решения типовых задач. Приведен обширный справочный материал по продуктам основного неорганического и органического синтеза, по строительным материалам, удобрениям, лекарственным веществам и т.д.
Справочное руководство рассчитано на студентов нехимических специальностей вузов, лаборантов вузов и заводских лабораторий.
Цель настоящего пособия — помочь студентам нехимических специальностей ориентироваться в большом объеме теоретического материала по различным разделам неорганической, органической и аналитической химии, электрохимии, общей химической технологии.
Загрузить книгу «Справочное руководство по химии»

ОтложитьЧитал
00
добавлено 2023-04-18 11:59:07
В учебном пособии описаны основные понятия в области нанонауки, дана классификация наноматериалов и методов их получения…
ОтложитьЧитал
00
добавлено 2023-02-03 16:15:18
В сборнике представлены краткие сведения теоретического курса по биохимии, включая основные термины, формулы биоорганиче…
ОтложитьЧитал
00
добавлено 2023-01-30 15:15:00
В сборнике собраны тематические задания различного уровня сложности по 12 темам биохимии, включая ситуационные, расчетны…
ОтложитьЧитал
00
добавлено 2022-10-10 15:12:58
В настоящем издании для химико-технологических и других вузов, в которых курс аналитической химии является частью общехи…
ОтложитьЧитал
00
добавлено 2022-10-10 15:10:16
Новое издание известного учебника по органической химии отражает последние достижения в теории и изучении механизмов орг…
ОтложитьЧитал
00
добавлено 2022-09-16 16:01:29
Учебник соответствует программе по химии для средних профессиональных учебных заведений на базе основного общего образов…
ОтложитьЧитал
00
добавлено 2022-08-04 09:31:38
В учебном издании, написанном преподавателями Института тонких химических технологий имени М. В. Ломоносова РТУ МИРЭА и …
ОтложитьЧитал
00
добавлено 2022-05-28 22:43:05
Данное учебное пособие является руководством для самостоятельной работы студентов по аналитической химии для направления…
ОтложитьЧитал
00
добавлено 2022-05-28 22:43:51
Данное учебное пособие является руководством для самостоятельной работы студентов по аналитической химии для направления…
ОтложитьЧитал
00
добавлено 2022-05-28 22:44:06
Данное учебное пособие является руководством для самостоятельной работы студентов по аналитической химии для направления…
ОтложитьЧитал
00
добавлено 2022-05-28 23:20:47
Данное учебное пособие является руководством для самостоятельной работы студентов по аналитической химии для направления…
ОтложитьЧитал
00
добавлено 2022-05-28 22:43:36
Данное учебное пособие является руководством для самостоятельной работы студентов по аналитической химии для направления…
ОтложитьЧитал
00
добавлено 2022-05-28 22:43:21
Данное учебное пособие является руководством для самостоятельной работы студентов по аналитической химии для направления…
ОтложитьЧитал
00
добавлено 2022-05-23 11:07:32
В учебнике описаны методы качественного и количественного анализа, а также физико-химические (инструментальные) исследов…
ОтложитьЧитал
00
добавлено 2022-05-11 08:38:19
Учебник состоит из трех разделов: «Теоретические основы химии», «Химия элементов и их соединений», «Практические работы …
ОтложитьЧитал
00
добавлено 2021-12-10 13:19:18
Учебное пособие содержит основные положения современных теорий, описывающих химическую связь координационных соединений,…
ОтложитьЧитал
00
добавлено 2021-09-16 14:46:57
В пособии излагается материал по химии белков: переваривание, пути распада аминокислот, пути обезвреживания аммиака, зна…
ОтложитьЧитал
00
добавлено 2021-05-24 10:02:38
В издании приводится основной теоретический материал школьного курса химии, представленный в виде логических схем и инфо…
ОтложитьЧитал
00
добавлено 2021-03-24 16:02:16
Содержит полное и систематическое изложение материала, входящего в учебную программу курса по дисциплинам «методы синтез…
ОтложитьЧитал
00
добавлено 2021-03-24 15:35:28
Учебник содержит полное и систематическое изложение материала, входящего в учебную программу курса «Химия», изучаемого с…
ОтложитьЧитал
00
добавлено 2021-01-06 17:16:09
Методическое пособие «Ферменты» отражает свойства ферментов как биологических катализаторов. В нём даётся понятие активн…
ОтложитьЧитал
00
добавлено 2020-10-01 09:49:36
Данный учебник написан в соответствии с типовой программой изучения курса неорганической химии студентами фармацевтическ…
ОтложитьЧитал
00
добавлено 2020-08-25 21:05:12
Учебное пособие направлено на формирование представлений о методах измерений основных физико-химических величин, которые…
ОтложитьЧитал
00
добавлено 2020-05-04 01:20:22
В монографии рассмотрены проблемы механизмов неорганических реакций железа в процессах выплавки чугуна и стали, проблемы…
ОтложитьЧитал
00
добавлено 2020-02-10 14:05:05
Кристаллохимия как основа учения об атомно-молекулярном строении вещества и взаимосвязи кристаллической структуры и свой…
ОтложитьЧитал
00
добавлено 2019-05-14 16:27:11
Учебник соответствует базовой части программы по дисциплине «Введение в специальность» направления подготовки 04.05.01 –…
ОтложитьЧитал
00
добавлено 2019-05-15 12:58:24
Учебное пособие «Основы химии гетероциклических соединений» нацелено на оптимизацию учебного процесса в ЮФУ, быстрого и …
ОтложитьЧитал
00
добавлено 2019-04-30 11:01:17
Предназначено для студентов-иностранцев, готовящихся к поступлению в вуз и студентов, давно закончивших школу, испытываю…
ОтложитьЧитал
00
добавлено 2019-04-30 11:00:46
Рассмотрены теория окислительно-восстановительных процессов и правила составления уравнений окислительно-восстановительн…
ОтложитьЧитал
00
добавлено 2019-01-10 13:19:16
Пособие является практическим руководством к лабораторным занятиям по химии. Приведены краткие теоретические сведения и …
ОтложитьЧитал
00
добавлено 2019-01-15 17:07:55
Учебное пособие составлено на основе многолетнего опыта преподавания органической химии на химическом факультете Южного …
ОтложитьЧитал
00
добавлено 2019-02-06 11:52:58
Во второй части цикла лекций представлен материал по химии алканов, алкенов, алкинов и диенов.
ОтложитьЧитал
00
добавлено 2019-02-06 11:50:52
Учебное пособие знакомит читателя с «языком» стереохимии, то есть с основными понятиями и терминами, которыми оперирует …
ОтложитьЧитал
00
добавлено 2018-12-10 17:15:01
Учебник предназначен в помощь студентам и аспирантам вузов России при освоении ими теоретических курсов Радиохимия и Те…
ОтложитьЧитал
00
добавлено 2017-10-06 14:02:56
В настоящем издании для химико-технологических и других вузов, в которых курс аналитической химии является частью общехи…
ОтложитьЧитал
00
добавлено 2017-10-06 14:04:29
В учебнике, написанном в соответствии с учебной программой непрофильных специальностей вузов, изложены основы химической…
ОтложитьЧитал
00
добавлено 2017-05-01 10:01:30
Рассмотрены избранные разделы физической, коллоидной и общей химии, которые необходимы при изучении физико-химической су…
ОтложитьЧитал
00
добавлено 2017-02-01 21:02:32
Предлагаемая книга — первый в отечественной литературе учебник, предназначенный для студентов фармацевтических высших уч…
ОтложитьЧитал
00
добавлено 2016-10-27 11:40:22
Новый учебник химической термодинамики написан в соответствии с современными университетскими программами для химиков и …
ОтложитьЧитал
00
добавлено 2016-10-27 11:03:57
Данное учебное пособие подготовлено с учетом новых требований, предъявляемых к содержанию учебных изданий двухуровневой …