Что такое синдром раздраженного кишечника?
Синдром раздраженного кишечника (СРК) — это функциональное расстройство кишечника, основным симптомом которого является боль в животе, связанная с актом дефекации и изменением частоты и формы стула. Данные симптомы возникают как минимум раз в неделю в течение не менее последних 3 месяцев.
СРК является широко распространенным заболеванием. По данным мировой статистики, от 30 до 50% больных, обратившихся к гастроэнтерологу, составляют пациенты с СРК. Симптомы СРК чаще всего наблюдаются у лиц молодого возраста (от 24 лет до 41 года). У женщин СРК выявляют в 3–4 раза чаще, чем у мужчин.
Причины СРК до конца не выяснены. В развитии СРК важную роль играют нервно-психологическое перенапряжение, стрессовые ситуации, тревожные, депрессивные расстройства, а также неправильный режим и характер питания, пищевая аллергия и непереносимость определенных видов продуктов, перенесенные кишечные инфекции (постинфекционный СРК), длительная антибиотикотерапия, нарушения микрофлоры толстого кишечника.
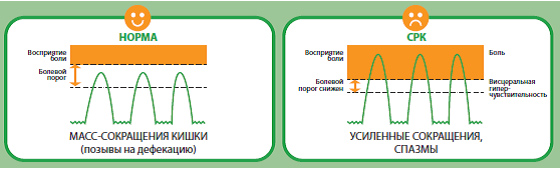
Многие исследователи считают СРК биопсихосоциальным заболеванием с генетической предрасположенностью, при котором возникают расстройства взаимодействия в системе «головной мозг–кишечник», нарушения вегетативного и гормонального баланса, проявляющиеся изменением моторной функции кишечника и нарушением восприятия боли как чувствительными рецепторами кишечника, так и аномальной их оценкой центрами головного мозга. Этот феномен, характерный для СРК носит название висцеральной гиперчувствительности.
Что такое висцеральная гиперчувствительность при СРК?
У пациентов СРК либо снижен порог восприятия боли, либо при нормальном пороге восприятия боль ощущается более интенсивно, чем у здоровых лиц. Например, один и тот же объем газа, образующегося в кишечнике, у здоровых лиц не будет вызывать болевых ощущений, а пациенты СРК будут воспринимать его как источник боли в животе.
На сегодняшний день ведущей причиной развития феномена висцеральной гиперчувствительности является недавно открытое минимальное, так называемое субклиническое воспаление, которое выявляется на микроскопическом уровне при исследовании слизистой толстой кишки. Вследствие ряда факторов – питание, нарушение микрофлоры толстой кишки, перенесенные кишечные инфекции – гиперактивируются иммунные клетки кишечника, которые выделяют факторы воспаления, что приводит к нарушению целостности кишечного барьера, воспалению и повреждению чувствительных нервных окончаний кишечника. В результате поврежденные чувствительные кишечные рецепторы воспринимают минимальные стимулы (химические, механические, термические) как интенсивные и передают «неправильный» «гиперинтенсивный» сигнал, который воспринимается структурами головного мозга как боль.
Большинством исследователей висцеральная гиперчувствительность в настоящее время рассматривается в качестве первичного механизма, который обуславливает возникновение и интенсивность абдоминальной боли и моторных нарушений кишечника при СРК. В исследованиях показано, что висцеральная гиперчувствительность у пациентов СРК коррелирует с выраженностью боли в животе: чем выше гиперчувствительность – тем интенсивнее боли.
Какие бывают варианты синдрома раздраженного кишечника?
Ведущий симптом СРК – это боль в животе, которая обычно носит колющий, спастический характер разной интенсивности, не беспокоит в ночное время и связана с изменением стула.
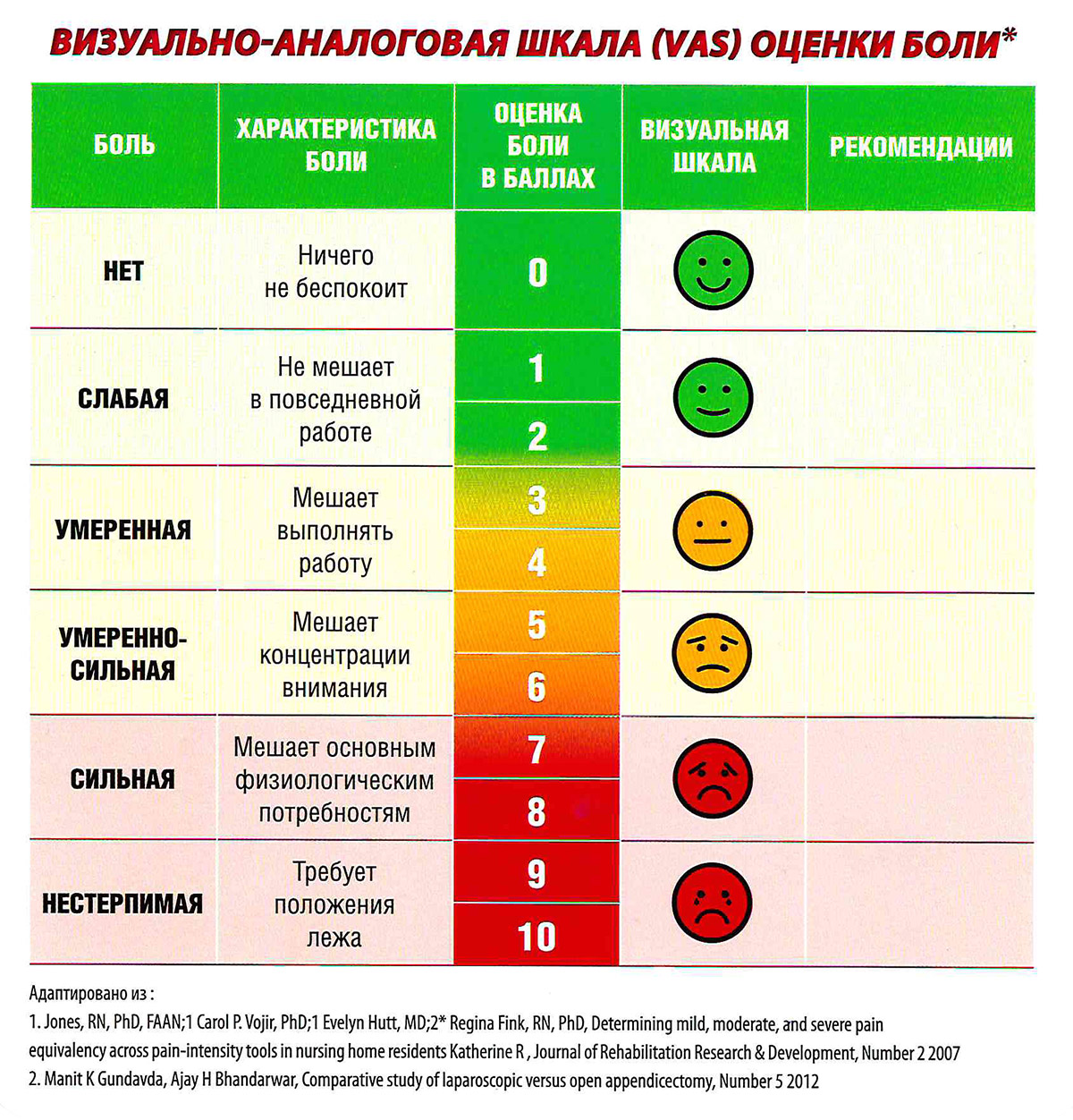
Для субъективной оценки боли используется визуально-аналоговая шкала (ВАШ), позволяющая оценить интенсивность боли.
ВИЗИУАЛЬНО-АНАЛОГОВАЯ ШКАЛА ОЦЕНКИ БОЛИ (ВАШ)
Для оценки характера стула используется Бристольская шкала форм кала.
В зависимости от изменения частоты и консистенции стула выделяют:
— синдром раздраженной кишки с запором, при котором боль в животе связана с нарушением частоты дефекаций (менее 3 раз в неделю). Также характерно ощущение неполного опорожнения кишечника, необходимость натуживания во время дефекации. Консистенция кала твердая, комковатая (1-2 тип по Бристольской шкале).
— синдром раздраженной кишки с диареей, при котором боль в животе связана с частыми (иногда срочными, безотлагательными) позывами на дефекацию более 3 раз в день. Каловые массы неоформленные (водянистые или жидкие – 6-7 тип по Бристольской шкале), могут содержать небольшое количество слизи.
— синдром раздраженной кишки смешанного типа, при котором боль в животе связана с чередованием поносов и запоров.
Отмечено, что наибольшая интенсивность боли в животе чаще встречается при синдроме раздраженной кишки с диареей и смешанного типа.
Выраженность симптомов, характер течения заболевания и прогноз во многом зависят от личностных характерологических особенностей и психологического статуса пациента. Более половины пациентов отмечают такие внекишечные проявления СРК, как головная боль по типу «стягивающего обруча», неудовлетворенность вдохом, ощущение кома в горле, колющая боль в области сердца, боль в поясничной области, учащенное мочеиспускание. Возможны нарушения менструального цикла, снижение потенции. У трети больных с СРК могут возникать различные психоневрологические расстройства (депрессия, тревожный синдром, различные фобии, истерия).
Если у Вас имеются вышеперечисленные симптомы, длительность которых превышает 3 мес за последние полгода, необходимо как можно быстрее обратиться к врачу для установления диагноза и проведения своевременного лечения.
Как диагностируют синдром раздраженного кишечника?
Диагноз СРК основывается на наличие симптомов, соответствующим критериям СРК (см. рисунок 1). Подобные симптомы могут наблюдаться при заболеваниях поджелудочной железы, печени и желчного пузыря, атрофическом гастрите, кишечных инфекциях, воспалительных заболеваниях кишечника, а также нарушениях функции щитовидной железы и других состояниях. Поэтому диагноз СРК — это диагноз исключения. Он правомочен только при наличии нарушения функции кишечника и отсутствии его органических заболеваний или болезни других органов и систем, которые могут вызывать подобную клиническую картину, что подтверждено достоверными результатами других методов исследования (назначенными Вашим врачом).
Что такое «симптомы тревоги»?
Если на фоне вышеперечисленных симптомов Вы отметили немотивированное уменьшение массы тела, повышение температуры тела, боль в животе носит постоянный характер и беспокоит в ночное время, наличие примеси крови в кале, Вам более 60 лет и у Ваших родственников выявляли опухоль толстого кишечника, Вам следует срочно обратиться к врачу для уточнения диагноза и назначения лечения. Это так называемые «симптомы тревоги», требующие обязательного исключения у пациента с симптомами СРК органического заболевания. Своевременная диагностика и систематическое адекватное лечение позволят предупредить прогрессирование заболевания и развитие осложнений, а также улучшить качество жизни.
Важным диагностическим исследованием при СРК является эндоскопия толстой кишки (колоноскопия). Колоноскопию рекомендуется проводить лицам старше 50 лет, при наличии «симптомов тревоги», при наличии онкологического заболевания кишечника у родственников, а также при упорной, постоянной, хронической диарее (поносе), не проходящей от проводимого лечения.
Более подробно об эндоскопическом исследовании толстой кишки – колоноскопии и о том, как правильно к ней подготовиться можно узнать на специальных интернет-сайтах: www.colonoscopy.ru, www.endofalk.ru
Как лечат синдром раздраженного кишечника?
Лечение СРК — процесс длительный, его необходимо проводить под постоянным наблюдением врача. Все лекарственные препараты для лечения СРК должен назначать только лечащий врач в индивидуальном порядке, с учетом преобладающих симптомов. Если Вам установили диагноз СРК, Вы должны четко выполнять рекомендации врача по приему назначенных препаратов, придерживаться соответствующего образа жизни и соблюдать диету.
Рекомендации в отношении образа жизни
1. На протяжении 2–4 нед ведите пищевой дневник, чтобы определить продукты питания, употребление которых приводит к появлению симптомов СРК и обострению заболевания. Обратите внимание на связь возникновения симптомов СРК с употреблением продуктов, которые наиболее часто их вызывают (жирная пища, молочные продукты, шоколад, алкоголь, содержащие кофеин напитки — кофе, чай, кола, энергетики, сорбитные подсластители), а также обусловливают газообразование (бобовые и некоторые другие овощи).
2. Соблюдайте режим труда и отдыха, не переутомляйтесь, старайтесь не нервничать и не допускайте негативных эмоций. Если у Вас нередко возникают нервно-психологическое перенапряжение, состояние тревоги или депрессии, обратитесь за помощью к психологу или психотерапевту.
3. Больше двигайтесь, занимайтесь гимнастикой, йогой, плаванием, ходьбой.
4. Если СРК сопровождается запором, не игнорируйте позывы на дефекацию, обеспечьте комфортные условия для дефекации, лучше в одно и то же время (утром после завтрака).
5. Следите за массой тела (избыточная масса тела приводит к запорам).
Регулярно посещайте врача (не реже одного раза в 6 мес) для проведения необходимых исследований. Это будет способствовать правильному подбору препаратов, эффективному лечению и предупреждению осложнений.
Не пытайтесь лечиться самостоятельно, а также по совету родственников или знакомых.
Лекарственные препараты для лечения СРК
Лечение СРК – симптоматическое, т.е. применяются лекарства, воздействующие на симптомы заболевания – боль в животе, и преобладающее нарушение стула – запор или диарею. Таким образом, это всегда будет комбинация нескольких препаратов.
Для лечения запора при СРК рекомендуется на первом этапе изменение образа жизни (активный образ жизни), прием достаточного количества жидкости и увеличение в рационе пищевых волокон. Стоит отметить, что не все пищевые волокна можно применять у пациентов СРК. Так грубая клетчатка (отруби) не эффективны при СРК. Мягкие пищевые волокна (псиллиум) не раздражает слизистую оболочку кишечника и эффективно воздействует при запоре. Эффективность псиллиума была подтверждена в большом количестве исследований, что позволило включить псиллиум в рекомендации по лечению СРК с азпором в качестве средства первой линии. Более подробно о препарате псиллиума (Мукофальк) и его применении как при запорах, СРК и других заболеваниях можно ознакомиться на интернет сайте www.mucofalk.ru.
При неэффективности псиллиума рекомендуется добавить к лечению слабительные препараты.
Для лечения диареи при СРК рекомендуются препараты, обладающие антидиарейным действием (лоперамид, кишечные антибиотики, препараты, сорбирующие желчные кислоты, пробиотики).
Для лечения боли в животе при СРК согласно современным рекомендациям применяются спазмолитики и регуляторы моторики кишечника и в тяжелых случаях антидепрессанты. Их цель – купировать спазм и нормализовать моторику кишечника. Эффективность этих препаратов при СРК по данным исследований составляет 53-61%. К сожалению, не всегда удается добиться полного купирования боли, приходится менять один спазмолитик на другой.
Как повысить эффективность лечения боли при синдроме раздраженного кишечника?
Повысить эффективность спазмолитиков можно с помощью препаратов, влияющих на нарушенное восприятие рецепторов кишечника болевых стимулов — висцеральную гиперчувствительность. К сожалению, арсенал таких препаратов крайне мал, некоторые из них не зарегистрированы в России, другие имеют серьезные побочные эффекты и не подходят для длительного применения.
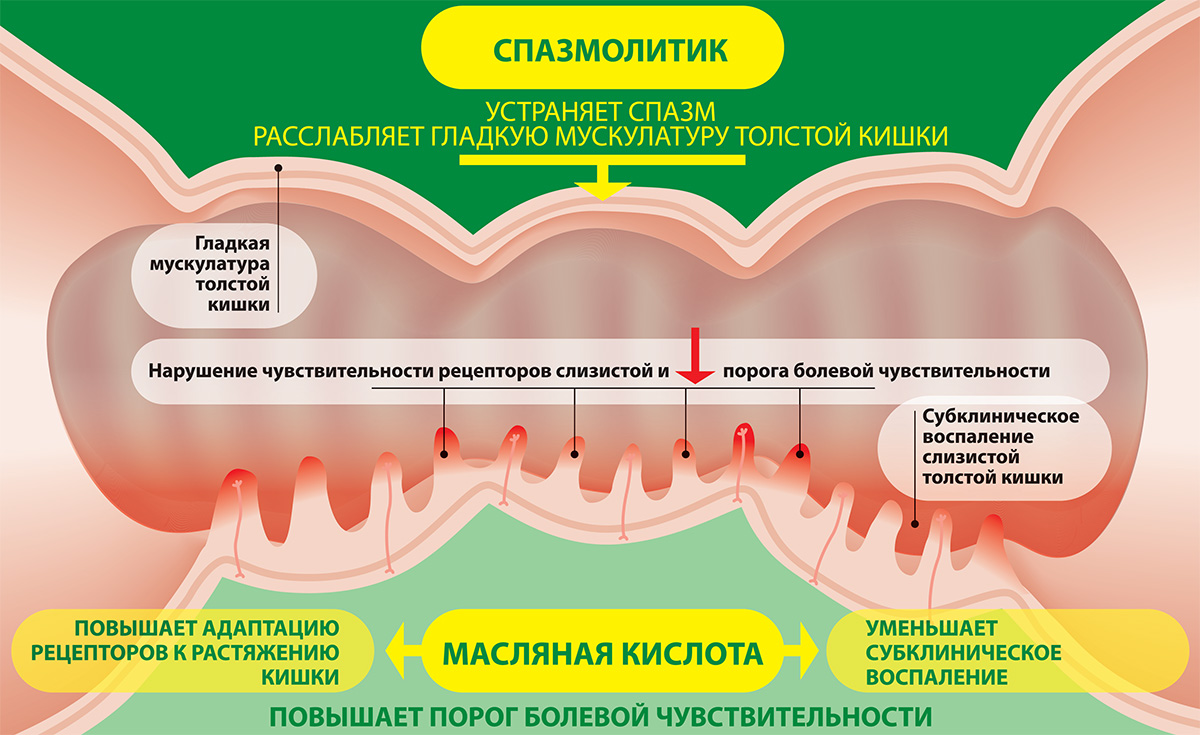
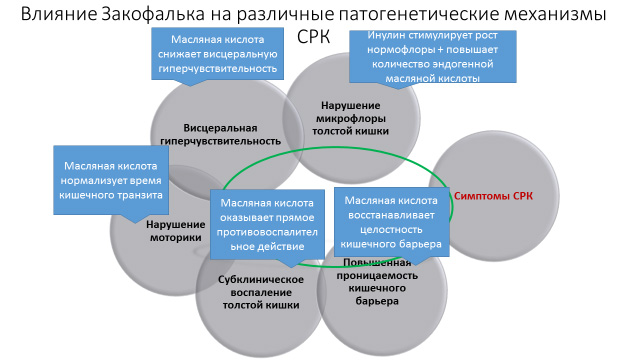
В настоящее время одним из перспективных методов снижения висцеральной чувствительности является применение масляной кислоты. Масляная кислота за счет противоспалительного действия и ряда других механизмов снижает висцеральную чувствительность, что было продемонстрировано как в экспериментальных, так и клинических исследованиях. Масляная кислота запатентована в странах Евросоюза как «медикаментозное средство для снижения висцеральной гиперчувствительности у пациентов с СРК».
Применение такой комбинации спазмолитиков с масляной кислотой (Закофальком) является оправданным, т.к. препараты действуют на разные механизмы формирования ощущения боли у пациента с СРК – спазмолитик снимает спазм кишечной стенки, масляная кислота – снижает висцеральную гиперчувствительность.
Такая комбинация препаратов позволяет повысить эффективность полного купирования боли в среднем в 2,8 раза!
Применение масляной кислоты при синдроме раздраженного кишечника
Эффективность включения в Закофалька в схему лечения СРК в комбинации со спазмолитиками была продемонстрирована во многих зарубежных и российских исследованиях.
Комбинированная терапия Закофалька со спазмолитиками по сравнению с одними спазмолитиками у пациентов СРК обеспечивает:
- большую частоту (в 2,8 раз) полного купирования (0 по ВАШ боли) абдоминальной боли;
- более быстрый эффект (уже на второй неделе пациенты не ощущали боль в животе) в отношении полного купирования боли;
- более выраженное снижение интенсивности абдоминальной боли с сильной (7,3 балла по ВАШ) до минимальной – 1,94 балла по ВАШ, по сравнению с только стандартной терапией спазмолитиками по ВАШ (умеренная боль).
Кроме того, масляная кислота стимулирует всасывание излишков воды и электролитов в просвете толстой кишки и оказывает антидиарейное действие у пациентов с СРК с преобладанием диареи и с функциональной диареей, снижая потребность в приеме лоперамида.
В каких случаях Закофальк следует применять сразу со спазмолитиками для лечения СРК?
- при выраженном болевом синдроме (сильная и умеренно-сильная боль по ВАШ) независимо от типа СРК;
- для более быстрого (к концу 1-2 недели терапии) купирования боли независимо от ее интенсивности;
- у пациентов с СРК с диареей.
В качестве усиления терапии Закофальк добавляется в схему лечения при неэффективности одних спазмолитиков (недостижение полного купирования боли).
Закофальк при СРК применяется по 3–4 таблетки в день до еды в течение не менее 30 дней. При достижении эффекта, возможна длительная (6-10 месяцев) поддерживающая терапия 2 таблетки, раздельно или однократно в день.
Пройдите тест! Определите нужно ли Вам сразу начать принимать Закофальк для лечения СРК в составе комплексной терапии.
Калькулятор риска — пройти тест
Среди функциональных заболеваний желудочно-кишечного тракта в последние годы наибольший интерес исследователей вызывает синдром раздраженного кишечника (СРК). Распространенность СРК в различных географических регионах значительно варьирует от 10% до 25%, составляя в среднем около 11% [1].
Пациенты с СРК составляют значимую долю на приеме у врача общей практики и гастроэнтеролога (от 30% до 50%) [1]. В основном обращаются к врачам тяжелые и средней степени тяжести пациенты с СРК, которые проходят многочисленные обследования для исключения органической патологии, характеризуются отчетливым снижением качества жизни и психоэмоциональными расстройствами.
Согласно критериям Римского консенсуса ΙΙΙ пересмотра (2006 г.) синдром раздраженного кишечника определялся как функциональное кишечное расстройство, при котором дискомфорт или боль в животе уменьшаются после дефекации, связаны с изменением частоты и консистенции стула, возникают не менее 3 дней в месяц на протяжении 3 месяцев при общей продолжительности жалоб не менее 6 месяцев [2].
На Американской гастроэнтерологической неделе, проходившей в Сан-Диего с 22 по 24 мая 2016 г., были озвучены новые критерии функциональных нарушений (Римские критерии ІV) [3, 4]. Из диагностических критериев СРК удалено такое понятие, как «дискомфорт». В новых критериях фраза «улучшение после дефекации» изменена на «абдоминальная боль, связанная с дефекацией». Кроме того, в определении СРК изменена частота абдоминальной боли — для постановки диагноза СРК пациент должен испытывать абдоминальную боль по меньшей мере 1 день в неделю в течение 3 последних месяцев [3, 4].
Истинная природа СРК остается до конца неясной. Целый ряд факторов самостоятельно или в сочетании друг с другом приводят к развитию СРК. Наибольшее число исследователей сходятся во мнении о важной роли психоэмоционального стресса в развитии СРК. В Римских критериях ІV предложен новый термин «нарушения цереброинтестинального взаимодействия» [3, 4].
В патогенезе СРК одним из ключевых звеньев является формирование висцеральной гиперчувствительности (ВГЧ). В развитии ВГЧ и восприятии боли участвуют многочисленные молекулярные медиаторы и рецепторы [5]. Недавно были описаны новые рецепторы, участвующие в формировании реакций ВГЧ — N-метил-D-аспартат-рецепторы (NMDA) в головном мозге, спинном мозге и энтеральной нервной системе. Показано значительное усиление активности NMDA слизистых оболочек кишечника у пациентов с СРК по сравнению с контролем, а также статистически значимая корреляция с выраженностью абдоминальной боли [6].
Результаты последних экспериментальных и клинических исследований свидетельствуют о роли слабовыраженного воспаления в патогенезе СРК.
Показано снижение плотности и активности энтероэндокринных клеток, выделяющих различные сигнальные вещества, такие как серотонин, мелатонин, а также цитокины, что может приводить к нарушению моторики кишечника и формированию повышенной висцеральной чувствительности [7].
Кроме того, у пациентов с СРК отмечается сдвиг в сторону повышения продукции провоспалительных цитокинов: фактора некроза опухоли-альфа (ФНО-α), интерлейкинов — ИЛ-6, ИЛ-8, ИЛ-1β и снижение уровня противовоспалительного цитокина — ИЛ-10 в системном кровотоке [8].
В последнее время авторы придают значение окислительному стрессу в развитии СРК. При СРК показано снижение концентрации ферментов-антиоксидантов, в том числе ферментов системы глутатиона, и, напротив, повышение показателей перекисного окисления липидов [9].
Микробиоценоз кишечника играет важную роль в развитии СРК. Показана взаимосвязь микрофлоры, иммунной системы и ноцицептивной системы кишечника [10]. В связи с нарушением процессов кишечной ферментации дисбиоз кишечника рассматривается как потенциальный этиологический механизм при СРК [11].
Медикаментозная терапия СРК складывается из назначения препаратов, применяемых для купирования: болевого абдоминального синдрома, метеоризма, cиндрома диареи и запора, и назначается с учетом преобладания тех или иных синдромов. Патогенетически оправданным, необходимым условием купирования боли является назначение спазмолитических лекарственных средств [12]. В то же время удовлетворенность пациентов с СРК лечением недостаточна.
В последние годы появились принципиально новые группы лекарственных средств, активно воздействующие на ключевые звенья патогенеза СРК. В частности, экспериментально и клинически был показан эффект масляной кислоты.
В настоящее время применение масляной кислоты в качестве лекарственного средства для снижения висцеральной чувствительности запатентовано в Евросоюзе. В России зарегистрирован препарат Закофальк, содержащий 250 мг бутирата с таргетной доставкой в толстую кишку путем использования специальной технологии замедленного высвобождения (мультиматриксная основа), а также 250 мг инулина — водорастворимого пищевого волокна, подвергающегося бактериальному гидролизу толстокишечной микрофлорой с высвобождением дополнительного количества бутирата [13].
Масляная кислота в норме образуется в толстой кишке в результате расщепления нормальной микрофлорой кишки неперевариваемых углеводов, поступающих вместе с пищей. Основная функция масляной кислоты — снабжение энергией клеток слизистой оболочки толстой кишки и поддержание их в здоровом функциональном состоянии. Масляная, уксусная и пропионовая кислоты составляют приблизительно 83% от короткоцепочечных жирных кислот (КЦЖК) в толстой кишке [14]. Концентрация этих кислот в просвете кишечника колеблется от 60 ммоль/кг до 150 ммоль/кг [15]. Предпочтительным источником бутирата является хорошо сбалансированная диета, богатая пробиотиками, пребиотиками и клетчаткой. В производстве бутирата участвуют следующие виды бактерий: Eubacterium spp., Fusobacterium spp., Butyrivibrio spp., Megasphaera elsdenii, Mitsuokella multiacida, Roseburia intestinalis, и Faecalibacterium prausnitzii, а также непатогенные виды клостридий [16].
Нами проведено проспективное интервенционное исследование с целью оценки клинической эффективности препарата Закофальк в составе комплексной терапии различных вариантов СРК.
Задачами исследования были оценка эффективности препарата Закофальк по влиянию на основные синдромы (болевой, синдром диареи/запора, синдром метеоризма), а также переносимости и безопасности препарата.
Материалы и методы исследования
Проспективное интервенционное исследование проведено в двух медицинских центрах г. Иркутска: поликлиническое отделение Клиник ГБОУ ВПО Иркутский Государственный медицинский университет Минздрава России и ООО Медицинский центр «Виктория». В исследование было включено 63 амбулаторных пациента с СРК.
Диагноз СРК ставили согласно Римским критериям ІІІ (2006 г.) при исключении органической патологии органов желудочно-кишечного тракта. Кроме того, критериями исключения являлись тяжелая соматическая патология (сердечно-сосудистая патология, дыхательная недостаточность и др.); онкологическая патология любой локализации.
Все пациенты с СРК были разделены на две основные группы в зависимости от проводимой терапии: 1-я группа — 31 пациент с различными вариантами СРК на фоне стандартной терапии в комбинации с приемом препарата Закофальк и 2-я группа — 32 пациента с различными вариантами СРК на фоне стандартной терапии (рис. 1). Стандартная терапия включала: при CРК с преобладанием запора — миотропные спазмолитики в терапевтических дозах, препарат Мукофальк 2–6 пакетиков в сутки (в зависимости от тяжести запора); при CРК с преобладанием диареи — миотропные спазмолитики и лоперамид в терапевтических дозах. По данным Кохрановсого обзора наиболее эффективными спазмолитическими препаратами для купирования боли являются пинаверия бромид и тримебутин [17].
Из спазмолитических препаратов пациенты получали пинаверия бромид 200 мг в сутки или тримебутин 600 мг в сутки. Пациенты с СРК в первой группе в дополнение к стандартной терапии получали препарат Закофальк по 1 таблетке 3 раза в сутки. Длительность курса терапии составила 1 месяц. Больные дважды посещали врача — до начала лечения и после его окончания. До начала лечения и в конце лечения оценивали выраженность клинических проявлений (выраженность болевого синдрома в брюшной полости и метеоризма оценивали по шкале ВАШ, консистенцию стула по Бристольской шкале кала). Статистическую обработку проводили, используя программу Statistica 8 for Windows. Достоверность различий определяли по критерию Манна–Уитни. Качественные показатели сравнивались с помощью критерия χ2.
Результаты исследования
Из исследования выбыли 3 пациента: 2 из 1-й группы (прекратили прием препаратов) и 1 пациент из 2-й (не явился на второй визит). Таким образом, оценка эффективности препарата Закофальк в составе комплексной терапии проведена у 29 пациентов с СРК 1-й группы (из них у 14 диагностирован вариант СРК с запором, у 15 — СРК с диареей) в сравнительном аспекте с 31 пациентом 2-й группы на фоне стандартной терапии (из них у 16 — вариант СРК с запором, у 15 — СРК с диареей) (рис. 1).
После проведенного лечения в обеих группах пациентов с СРК с диареей отмечено уменьшение болевого синдрома, урежение стула, уменьшение метеоризма и чувства неполного опорожнения. В 1-й группе болевой синдром был полностью купирован у 12 пациентов (80%), в то время как во второй группе полное исчезновение болевого синдрома отметили 6 пациентов (40%) (p < 0,05), что свидетельствует об эффективности комбинации спазмолитиков и препарата Закофальк в купировании болевого синдрома у пациентов с СРК с преобладанием диареи, p < 0,05 (рис. 2).
В результате лечения у пациентов с СРК, вариант с преобладанием запоров, как в 1-й, так и во 2-й группах отмечено уменьшение интенсивности болевого синдрома, нормализация консистенции и частоты стула. В 1-й группе болевой синдром был полностью купирован у 12 пациентов (86%), во 2-й лишь 5 пациентов (31%) отметили отсутствие абдоминальных болей после проведенного лечения, p < 0,05 (рис. 3).
У 2 пациентов в 1-й группе болевой синдром в животе сохранялся, но был слабой степени интенсивности и возникал 1 раз в 5–6 дней.
После проведенного лечения в 1-й группе с преобладанием диареи у всех пациентов частота стула нормализовалась: стул был в среднем 1 раз в сутки (у 10 пациентов 1 раз в сутки, у 5 — 2 раза), причем преобладал 3–4 тип стула по Бристольской шкале кала; во 2-й же группе пациенты отмечали частоту стула 3 раза (у 12 пациентов стул был 3 раза в сутки, у 3 — 4 раза) (p < 0,05), сохранялся 5-й тип по шкале.
У большинства пациентов с СРК с запором в обеих группах частота стула нормализовалась (в то время как различия не были статистически достоверны, p > 0,05), стул после проведенного лечения соответствовал 3–4 типу по Бристольской шкале кала.
На первом приеме вздутие живота отмечено у 10 пациентов (67%) с СРК 1-й группы с преобладанием диареи, из них после лечения метеоризм прошел у 8 (80%). Во 2-й группе симптом вздутия живота отмечали 9 (60%) пациентов с СРК с преобладанием диареи, из них метеоризм купирован у 7 (78%), что статистически незначимо.
После лечения вздутие живота прошло у пациентов с СРК с запором: в 1-й группе — у 8 из 14 пациентов (57%), во 2-й группе — у 8 из 16 (50%) (p > 0,05). В обеих группах у пациентов с СРК с запором чувство неполного опорожнения прошло после лечения: в 1-й группе — у 11 пациентов (79%), во 2-й группе — у 12 (75%) (p > 0,05).
Побочных действий препарата Закофальк не было отмечено ни у одного пациента.
Таким образом, полученные результаты свидетельствуют, что препарат Закофальк является эффективным препаратом в комплексной терапии пациентов с СРК: эффективно купирует болевой синдром при различных вариантах СРК; при СРК с диареей нормализует стул (уменьшает частоту и нормализует консистенцию); побочные действия при применении препарата Закофальк отсутствовали.
Обсуждение результатов исследования
Эффективное купирование абдоминального болевого синдрома при применении в комплексной терапии препарата Закофальк у пациентов с СРК, очевидно, связано со снижением ВГЧ под влиянием масляной кислоты и ее противовоспалительными свойствами. Основными механизмами снижения ВГЧ на фоне терапии масляной кислотой являются увеличение высвобождения 5-гидрокситриптамина, инактивация масляной кислотой активности TRPV1-рецепторов в слизистой оболочке толстой кишки, а также ингибирование гистондезацетилазы (НDaС) [17–19].
Исследование S. A. Vanhouten и соавт. с участием здоровых добровольцев продемонстрировало дозозависимый эффект влияния бутирата на ВГЧ [20].
Снижение ВГЧ непосредственно связано с противовоспалительными свойствами бутирата. Так, было показано, что масляная кислота оказывает прямое противовоспалительное действие как in vitro, так и in vivo, местно ингибируя медиаторы воспаления в эпителии кишечника. Была зарегистрирована способность бутирата уменьшать концентрацию провоспалительных цитокинов, таких как ИЛ-8 и ФНО-α, а также оксида азота, интерферона-гамма, ИЛ-2, ИЛ-12, в то же время повышается активность противовоспалительного цитокина ИЛ-10 [21, 22].
В ряде исследований продемонстрировано антиоксидантное свойство масляной кислоты. Было показано, что локальное введение масляной кислоты в физиологических концентрациях здоровым добровольцам увеличивает уровень ключевого фермента, подавляющего оксидативный стресс, — восстановленного глутатиона [23].
В эксперименте на животных был уточнен механизм антиоксидантного действия масляной кислоты: снижение активности миелопероксидазы, восстановление концентрации антиоксиданта глутатиона в колоноцитах и усиление активности глутатион-S-трансферазы [24].
Снижая ВГЧ, бутират уменьшает внутрикишечное давление. Он улучшает перистальтику кишечника и усиливает сократимость циркулярного мышечного слоя [25].
Масляная кислота непосредственно влияет на желудочно-кишечную микрофлору. Присутствие бутират-синтезирующих видов бактерий в кишечнике подавляет рост кишечной палочки, Campylobacter spp., Salmonella spp. и Shigella spp. [26]. Бутират является мощным индуктором человеческого кателицидина LL-37, одного из антимикробных белков, которые являются частью защиты хозяина [27].
Продемонстрированную эффективность применения препарата Закофальк при СРК с диареей можно объяснить антисекреторным действием масляной кислоты [14].
Применение препаратов масляной кислоты является обоснованным еще в связи с тем, что у пациентов с СРК, как показано в недавно проведенных исследованиях, относительное содержание бутират-продуцирующих бактерий значительно ниже по сравнению со здоровыми лицами контрольной группы, в частности, у пациентов с СРК с преобладанием диареи и СРК со смешанным вариантом, не получавших какого-либо лечения [28].
Описаны также другие многочисленные механизмы, обусловливающие как противовоспалительный эффект действия масляной кислоты, регенераторный (трофический) эффект на пролиферацию клеток кишечника, так и влияющие на ВГЧ, иммунную систему, усиливающие апоптоз [14, 24, 25, 29, 30].
Заключение
Таким образом, препарат Закофальк является патогенетически обоснованным средством лечения пациентов с СРК в связи с воздействием на основные патофизиологические звенья, участвующие в развитии СРК. Полученные данные свидетельствуют об эффективности применения комплексного препарата масляной кислоты Закофальк у пациентов с СРК наряду со стандартной терапией для купирования болевого синдрома и нормализации стула при СРК с диареей. Продолжительность настоящего исследования относительно коротка (1 месяц), учитывая, что СРК — хроническое заболевание, в дальнейшем необходимы исследования, более продолжительные по времени, что является целью наших будущих исследований. В перспективе подтверждение эффективности и безопасности препарата Закофальк требует широкомасштабных многоцентровых исследований.
Выводы
- Препарат Закофальк, применяемый в комбинации со стандартной терапией пациентов с СРК, эффективнее (в 3 раза) купирует болевой синдром при вариантах СРК как с преобладанием диареи, так и запоров в сравнении с только стандартной терапией.
- При СРК с диареей препарат Закофальк, применяемый в комплексной терапии, нормализует стул (уменьшает частоту и нормализует консистенцию), по сравнению с контрольной группой пациентов, получающих стандартную терапию.
- Препарат Закофальк хорошо переносится, побочные действия при применении препарата отсутствовали.
- Рекомендуется включение препарата Закофальк как патогенетически обоснованного средства в комплексную схему лечения пациентов с СРК с целью купирования болевого синдрома (при всех вариантах СРК) и нормализации стула (при варианте СРК с преобладанием диареи).
Литература
- Canavan C., West J., Card T. The epidemiology of irritable bowel syndrome // Clin Epidemiol. 2014; 6: 71–80.
- Drossman D. A. The functional gastrointestinal disorders and the Rome III process // Gastroenterology. 2006; 130 (5): 1377–1390.
- Drossman D. A. The functional Gastrointestinal Disorders: History, Pathophysiology, Clinical Features and Rome IV // Gastroenterology. 2016; 150 (6): 1262–1279.
- Drossman D. A., Hasler W. L. Rome IV — Functional GI Disorders of Gut-Brain Interaction // Gastroenterology. 2016; 150 (6): 1257–1261.
- Farzaei M. H., Bahramsoltani R., Abdollahi M., Rahimi R. The role of visceral hypersensitivity in irritable bowel syndrome: pharmacological targets and novel treatments // Neurogastroenterol Motil. 2016; 22 (4): 558–574.
- Qi Q., Chen F., Zhang W., Wang P. et al. Colonic N-methyl-D-aspartate receptor contributes to visceral hypersensitivity in irritable bowel syndrome // Gastroenterol Hepatol 2016, Aug 30. Epub 2016 Aug 30.
- El-Salhy M., Hausken T., Gilja O. H. et al. The possible role of gastrointestinal endocrine cells in the pathophysiology of irritable bowel syndrome // Expert Rev Gastroenterol Hepatol. 2016, Dec 14: 1–10.
- Martin-Viñas J. J., Quigley E. M. Immune response in irritable bowel syndrome: A systematic review of systemic and mucosal inflammatory mediators // Dig Dis. 2016 Sep; 17 (9): 572–581.
- Mete R., Tulubas F., Oran M., Yilmaz A. The role of oxidants and reactive nitrogen species in irritable bowel syndrome: a potential etiological explanation // Med Sci Monit. 2013, Sep 13; 19: 762–766.
- Raskov H., Burcharth J., Pommergaard H. C., Rosenberg J. Irritable bowel syndrome, the microbiota and the gut-brain axis // Gut Microbes. 2016; Jul 29: 1–19.
- Ringel-Kulka T., Choi C. H., Temas D. et al. Altered colonic bacterial fermentation as a potential pathophysiological factor in irritable bowel syndrome // Am. J. Gastroenterol. 2015 Sep; 110 (9): 1339–1346.
- Ивашкин В. Т., Шелыгин Ю. А., Баранская Е. К. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации, Ассоциации колопроктологов России по диагностике и лечению больных синдромом раздраженного кишечника // Российский ЖГГК. 2014; 2: 92–101.
- Маев И. В., Кучерявый Ю. А., Черёмушкин С. В. Эволюция представлений о синдроме разражённого кишечника. Метод. рекомендации для врачей. М., 2013, 80 с.
- Zaleski A., Banaszkiewicz A., Walkowiak J. Butyric acid in irritable bowel syndrome // Prz Gastroenterol. 2013; 8 (6): 350–353.
- Topping D. L., Clifton P. M. Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides // Physiol Rev. 2001; 81: 31–64.
- Hold G. L., Schwiertz A., Aminov R. I. et al. Oligonucleotide probes that detect quantitatively significant groups of butyrate-producing bacteria in human feces // Appl Environ Microbiol. 2003; 69: 4320–4324.
- Ruepert T., Quartero А., de Wit N. et al. Bulking agents, antispasmodics and antidepressants for the treatment of irritаblе bowel syndrome // Cochrane Database Syst Rev. 2011; 8: CD 003460.
- Kannampalli P., Shaker R., Sengupta J. N. Colonic Butyrate- algesic or analgesic? // Neurogastroenterol Motil. 2011; 23 (11): 975–979.
- Felice C., Lewis A., Armuzzi A. et al. Review article: selective histone deacetylase isoforms as potential therapeutic targets in inflammatory bowel diseases // Aliment Pharmacol Ther. 2015; 41 (1): 26–38.
- Vanhoutvin S. A., Troost F. J., Kilkens T. O. et al. The effects of butyrate enemas on visceral perception in healthy volunteers // Neurogastroenterol. Motil. 2009; 21 (9): 952–976.
- Hamer Н., Jonkers D., Venema K. et al. Review article: the role of butyrate on colonic function // Aliment. Pharmacol. Ther. 2008; 27: 104–119.
- Säemann M. D., Böhmig G. A., Zlabinger G. J. Short-chain fatty acids: bacterial mediators of a balanced host-microbial relationship in the human gut // Wien Klin Wochenschr. 2002; 114 (8–9): 289–300.
- Hamer H. M., Jonkers D. M., Bast A. et al. Butyrate modulates oxidative stress in the colonic mucosa of healthy humans // Clin Nutr. 2009; 28: 88–93.
- Toden S., Bird A. R., Topping D. L. et al. Dose-dependent reduction of dietary protein-induced colonocyte DNA damage by resistant starch in rats correlates more highly with caecal butyrate than with other short chain fatty acids // Cancer Biol Ther. 2007; 6: 253–258.
- Banasiewicz T., Kaczmarek E., Maik J. et al. Quality of life and the clinical symptoms at the patients with irritable bowel syndrome treated complementary with protected sodium butyrate // Gastroenterol Prakt. 2011; 5: 45–53.
- Chen C. C., Walker W. A. Probiotics and prebiotics: role in clinical disease states // Adv Pediatr. 2005; 52: 77–113.
- Van der Does A. M., Bergman P., Agerberth B. et al. Induction of the human cathelicidin LL-37 as a novel treatment against bacterial infections // Leukoc Biol. 2012 Oct; 92 (4): 735–742.
- Pozuelo M., Panda S., Santiago A. et al. Reduction of butyrate- and methane-producing microorganisms in patients with Irritable Bowel Syndrome // Sci Rep. 2015 Aug 4; 5: 12693.
- Deiteren A., de Wit A., van der Linden L. et al. Irritable bowel syndrome and visceral hypersensitivity: risk factors and pathophysiological mechanisms // Acta Gastroenterol Belg. 2016; 79 (1): 29–38.
- Canani R. B., Costanzo M. D., Leone L. еt al. Potential beneficial effects of butyrate in intestinal and extraintestinal diseases // World J. Gastroenterol. 2011, 17 (12): 1519–1528.
Н. М. Козлова1, доктор медицинских наук, профессор
Н. И. Меринова, кандидат медицинских наук
ФГБОУ ВО ИГМУ МЗ РФ, Иркутск
1 Контактная информация: natkova@yandex.ru
Описание биологически активной добавки Закофальк® NMX (таблетки 1.36 г) основано на официальной инструкции, утверждено компанией-производителем в 2017 году
Дата согласования: 05.07.2017

05.07.2017
Содержание
- Группа
- Нозологическая классификация (МКБ-10)
- Состав
- Действие на организм
- Характеристика
- Противопоказания
- Способ применения и дозы
- Особые указания
- Форма выпуска
- Производитель
- Условия хранения препарата
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Группа
Нозологическая классификация (МКБ-10)
Состав
| Таблетки | 1 табл. |
| активные вещества: | |
| кальция бутират | 307 мг |
| (соответствует 250 мг масляной кислоты) | |
| инулин | 250 мг |
| вспомогательные вещества: мальтодекстрин; сорбитол; гидроксипропилметилцеллюлоза; МКЦ; кукурузный крахмал; регулятор кислотности — лимонная кислота; антислеживающий агент — магния стеарат; стабилизатор — стеариновая кислота; антиокислитель — лецитин | |
| оболочка таблетки: агент антислеживающий — тальк; глазирователь — шеллак; краситель — титана диоксид; стабилизатор — гидроксипропилцеллюлоза; носители (триэтилцитрат, гидроксипропилметилцеллюлоза); ароматизатор — ванилин |
Действие на организм
Фармакологическое действие
— восполняющее дефицит масляной кислоты и инулина.
Характеристика
БАД к пище.
Противопоказания
индивидуальная непереносимость компонентов продукта;
беременность;
кормление грудью.
Способ применения и дозы
Внутрь, до еды, не разжевывая. Взрослым — по 3–4 табл. в день. Длительность приема не менее 30 дней. В зависимости от исходного уровня дефицита масляной кислоты и инулина, возможно уменьшение количества принимаемых таблеток до 1–2 в день.
Особые указания
Закофальк® NMX не содержит лактозы, казеина и глютена.
Содержит подсластитель. При чрезмерном употреблении может оказывать слабительное действие.
Перед применением рекомендуется проконсультироваться с врачом.
Форма выпуска
Таблетки, 1,36 г. 30 табл. в упаковке.
Производитель
COSMO S.p.A., Via Cristoforo Colombo, 1, 20020 Lainate, Milano.
Организация-импортер, принимающая претензии от потребителей: представительство компании Доктор Фальк Фарма ГмбХ (Германия). 127055, Москва, ул. Бутырский вал, 68/70, стр. 4, 5.
Тел/факс: (495) 933-99-04.
www.drfalkpharma.ru.
www.zacofalk.ru.
Условия хранения препарата
В сухом, прохладном месте.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Заказ в аптеках Москвы
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в соответствие со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 N 61-ФЗ.
Отзывы


или
В этой статье продолжаем разговор о заболеваниях различных отделов желудочно-кишечного тракта, возникающих в ходе лечения препаратами группы нестероидных противовоспалительных средств (НПВП). Лекарственные поражения тонкой и толстой кишок — тема настоящей статьи.
При длительном приеме НПВП, особенно в возрасте старше 65 лет, у 60-70 % больных развивается бессимптомное поражение слизистой оболочки тонкой кишки (энтеропатия), которое сопровождается кровопотерей и потерей белка, что в свою очередь приводит к снижению гемоглобина крови (железодефицитной анемии) и альбумина.
Хотя известно, что тонкая кишка является органом, где проходят последние этапы пищеварения и всасывание пищевых ингредиентов, но она является и областью хронической кровопотери у больных, принимающих НПВП. Потеря крови может быть от 1 до 10 мл в сутки, что нарушает обмен железа и приводит к развитию анемии. Не менее часто такие осложнения возникают при приеме малых доз аспирина, назначаемых с целью профилактики сердечно-сосудистых и церебральных заболеваний.
Ранее было показано, что аспирин-индуцированные энтеропатии могут развиться при краткосрочном приема аспирина в течение 1-2 недель, в том числе и в кишечнорастворимой форме его и в виде свечей. Такие повреждения слизистой как петехии (точечные кровоизлияния), эрозии встречаются в 20-60% случаев и более серьезные – язвы до 10%.
Причины повреждения
В настоящее время предложена теория многофакторного повреждения слизистой тонкой и толстой кишки (энтероколопатии).
Первым повреждающим фактором являются сами препараты НПВП и аспирина и их метаболитов, которые могут непосредственно действовать на клетки слизистой тонкой и толстой кишок (энтероциты и колоноциты) и нарушать барьерную функцию слизистой и повышать ее проницаемость для бактерий и токсинов. Считается, что развитие анемии является маркером повышенной проницаемости слизистой и воспаления тонкой кишки у больных, длительно принимающих НПВП.
Токсины являются вторым повреждающим фактором, вызывающим местный воспалительный процесс, который усугубляется агрессивным действием желчи и ферментов, пищей и бактериями, находящимися в просвете кишечника. Местное воспаление способствует повышению кишечной проницаемости для желчных кислот и метаболитов НПВП, что повреждает клетки слизистой оболочки кишечника.
Важным фактором повреждения слизистой является изменения микробиоты (микрофлоры) кишечника. Показано, что грамм-отрицательные микроорганизмы усиливают неблагоприятное эффект НПВП на слизистую, а пробиотики (лактобациллы и бифидобактерии) защищают слизистую. Кроме того, некоторые микроорганизмы в процессе своей жизнедеятельности выделяют фермент глюкуронидазу, под воздействием которой разрушаются НПВП и их метаболиты и, всасываясь, увеличивают неблагоприятный эффект воздействия на слизистую кишечника.
Важным является тот факт, что применение антисекреторных препаратов, снижающих кислотность желудочного сока (ИПП, Н2блокаторы гистамина), которые назначаются часто одновременно с НПВП, способствуют избыточному росту, изменению состава и качества микроорганизмов в просвете кишечника. Применение этих препаратов при поражении нижних отделов желудочно-кишечного тракта не только не предотвращают, но поддерживают неблагоприятное воздействие НПВП на слизистую кишечника.
У людей старше 65 лет поражение кишечника при приеме НПВП увеличивается в 4 раза, при приеме Н2 блокаторов гистамина – в 4 раза, ИПП – в 5 раз, избыточный рост в кишечнике грамм-отрицательной флоры увеличивает риск в 6.5 раз.
В развитии энтеропатии могут иметь значение снижение защиты слизистой тонкой кишки и прежде всего простагландинов (о которых мы подробно говорили в статье «Лекарственные поражения желудка«), а также сосудистые поражения тонкой кишки.
Клинические проявления
Длительный приём НПВП и аспирина или их сочетание может сопровождаться диареей (поносами), снижением массы тела, слабостью, недомоганием, болями в животе, снижением аппетита, связанными с нарушениями всасывания железа, низким гемоглобином и недостатком витамина В12. Но чаще случаи энтеропатий протекают бессимптомно или невыраженными клиническими проявлениями (в 60-70 % случаев).
Несколько слов о причинах развитии дефицита железа при НПВП-энтеропатиях. Известно, что часто при назначении НПВП как защита слизистой назначаются антисекреторные препараты (чаще ингибиторы протонной помпы — ИПП), которые снижают кислотность желудочного сока и тем самым затрудняют переход 3-валентного железа, содержащегося в пище в 2-валентное, которое во много раз быстрее всасывается в тонкой кишке. Возникает недостаток всасывания железа в кишечнике при его дефиците. У пациентов с энтеропатиями снижается аппетит вследствие активного воспаления в слизистой тонкой кишки или нарушений в желудке и как результат уменьшение приема пищи.
Диагностика НПВП и аспирин-индуцированной энтеропатии
Общий алгоритм
- Анамнез пациента – прием НПВП или аспирина более 2 недель.
- Исключение лечения антибиотиками.
- Клинические проявления.
- Результаты лабораторно-инструментального обследования:
- анализ крови клинический (на выявление железа — и В12-дефицитной анемии) — гемоглобин, эритроциты, железо, ферритин, В12, гомоцистеин),
- белки и белковые фракции (альбумин!),
- анализ кала на скрытую кровь,
- кальпротектин в кале, повышение которого может быть выявлено уже через 7 суток после приема НПВП и аспирина,
- водородный тест с глюкозой для исключения синдрома избыточного бактериального роста в тонкой кишке,
- микробиологический анализ кала.
- Рентгеноскопия желудочно-кишечного тракта – продвижение (пассаж) бария по тонкой кишке.
- Видеокапсульная эндоскопия (выявление петехий, эрозий, язв, источника кровотечения, спаек) в кишечном тракте.
Проведение обычных гастродуоденоскопии и колоноскопии выявляет источник кровотечения около 5% случаев.
Видеокапсульная эндоскопия
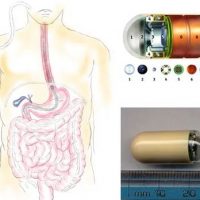
Согласно современным данным при лечении НПВП и аспирином наблюдаются повреждения кишечного тракта в виде изъязвлений у 30-40% случаев, кровотечения и анемия – у 1/3 больных и воспалительные повреждения слизистой оболочки кишки более чем у 2/3 пациентов. У пациентов, принимавших НПВП на протяжении 3 месяцев, повреждение слизистой оболочки кишечника наблюдается более чем в 50% случаев (по данным капсульной эндоскопии).
На сегодняшний день число кровотечений из верхних отделов желудочно-кишечного тракта за последнее десятилетие уменьшилось в два раза, но количество кишечных кровотечений возросло в два раза. До 40% кровотечений в желудочно-кишечном тракте приходится на кишечник, к которым приводят даже короткие курсы приема НПВП и малые дозы аспирина. При сочетании приема НПВП и ацетилсалициловой кислоты (аспирина) чаще возникают кишечные кровотечения, чем желудочные.
Профилактика и лечение НПВП/аспирин – энтероколопатий
В настоящее время обсуждаются различные подходы к профилактике НПВП поражений слизистой кишечника. Испытываются препараты различных групп:
- антибактериальные средства (Метринидазол, Трихопол, Рифаксимин), которые уменьшают количество грамм-отрицательных бактерий в кишечнике,
- 5-аминосалициловой кислоты (сульфасалазина, салафалька),
- противовирусные препараты (алиспоривир),
- блокаторы бактериальной глюкуронидазы,
- пробиотики и др.
Исследования продолжаются.
Ребамипид (Ребагит)
Одним из немногих препаратов, доказавших свою клиническую эффективность в предупреждении НПВП поражения как верхних отделов желудочно-кишечного тракта, так и нижних отделов, является Ребамипид (Ребагит) – индуктор синтеза эндогенных простагландинов, стимулятор функции защиты слизистой желудочно-кишечного тракта (ЖКТ).
Свойства Ребагита
Клинические и собственные результаты использования этого препарата позволяют еще раз обратить внимание на положительные свойства его для предупреждения и лечения НПВП/аспирин индуцированных поражений слизистой кишечника (энтеро- и колопатий):
- повышает синтез простагландинов в слизистой желудочно-кишечного тракта, что сопровождается повышением синтеза защитной слизи и бикарбонатов, стимуляцией кровообращения,
- под воздействием его увеличивается число грамм-положительных лактобацилл и уменьшается количество грамм-отрицательных бактероидов и клостридий в кишечнике,
- уменьшается выраженность воспаления в поврежденной слизистой оболочке ЖКТ, восстанавливает поврежденную слизистую кишечника (цитопротективный эффект).
С помощью капсульной видеоэндоскопии доказана способность в 4 раза уменьшить риск развития повреждений слизистой тонкой кишки у добровольцев, принимающих Диклофенак (Вольтарен) + ИПП.
Исследования подтвердили способность препарата предупреждать повреждения кишечника при проведении монотерапии НПВП, при частом использовании в клинической практике НПВП+ ИПП, НПВП/аспирин+ИПП.
Результаты исследований по данным капсульной эндоскопии показали, что препарат достоверно способствует заживлению повреждений при НПВП-индуцированной энтеропатии, профилактизирует появление новых повреждений, улучшает обменные (метаболические) процессы в слизистой оболочке кишечника, повышая уровень белка.
Результаты исследований
Интересны исследования, проведенные зарубежными учеными в последние годы. Не была доказана способность ИПП (в частности, лансопразола) профилактизировать НПВП-индуцированные поражения кишечника.
В 2013 году было установлено, что омепразол (ИПП) не оказывает протективного действия на слизистую оболочку тонкой кишки при приеме НПВП.

Еще одно исследование: изучалось профилактическое действие Ребамипида при одновременном назначении его с НПВП. Группа А – Диклофенак 75мг/сутки +Омепразол 20 мг+ плацебо (пустышка), Группа Б – Диклофенак 75 мг/сутки+ омепразол 20мг + Ребамипид 100 мгХ3 раза/сутки. Курс 14 дней. Оценка повреждений слизистой кишечника проводилась капсульной эндоскопией до и после 2-х недель приема лекарств. Результаты исследования показали, что в группе с пустышкой среднее количество повреждений на одного человека составило 25, а в группе принимающих Ребамипид – 8,9, т.е. добавление к лечению Ребамипида способствовало трехкратному снижению количества повреждений слизистой оболочки кишечника.
Закофальк
Масляная кислота – основной продукт бактериального обмена и важнейший энергетический источник для клеток толстой кишки (колоноцитов), регулятор моторной функции кишечника, снижающий воспаление, улучшающий защитный барьер и уменьшающий проницаемость слизистой оболочки толстой кишки. Причем основными продуцентами масляной кислоты являются не бифидобактерии и лактобациллы, а другие группы бактерий, например, эубактерии, фузобактерии, непатогенные клостридии и др.
Закофальк, принимаемый перед едой 3-4 раза в день, обеспечивает постепенное высвобождение компонентов на протяжении всей кишки в течение 24 часов. Курс лечения 30 дней.
Лекарственные поражения тонкой и толстой кишок. Заключение
Любые НПВП и низкие дозы аспирина у большинства больных вызывают повреждения слизистой оболочки кишечника.
Назначения антисекреторных препаратов (ИПП, Н2блокаторов гистамина) в клинической практике не только не защищают, но и усиливают повреждение кишечника, в отличие от верхних отделов ЖКТ.
Единственным доступным препаратом, способным не только предупреждать, но и лечить НПВП-энтероколопатии и НПВП-гастропатии, является Ребамипид.
О фитотерапии лекарственного поражения желудочно-кишечного тракта см. в разделе фитотерапия.