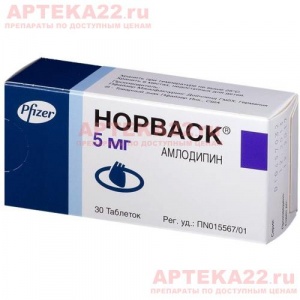
Таблетки белого с серым или желтым оттенком цвета, плоскоцилиндрические, с фаской. Допускается мраморность.
Одна таблетка содержит: действующего вещества – гликлазида –30 мг; вспомогательные вещества – гидроксипропилметилцеллюлоза, натрия лаурилсульфат, магния стеарат, целлюлоза микрокристаллическая.
Средства для лечения сахарного диабета. Гипогликемические средства, исключая инсулины.
Код АТХ: A10BB09.
Фармакодинамика
Гликлазид является пероральным гипогликемизирующим средством из группы производных сульфонилмочевины, который отличается от аналогичных препаратов наличием N-содержащего ароматического гетероциклического кольца. Гликлазид снижает уровень глюкозы, стимулируя секрецию инсулина β-клетками островков Лангерганса. Повышение секреции инсулина и С-пептида постпрандиально сохраняется в течение 2 лет при его регулярном применении.
Помимо гипогликемизирующего действия обладает гемоваскулярными эффектами.
Влияние на высвобождение инсулина. При сахарном диабете 2 типа восстанавливает пик ранней секреции инсулина в ответ на поступление глюкозы и усиливает вторую фазу его секреции. Значительно повышает постпрандиальную стимулированную секрецию инсулина и секрецию инсулина в ответ на введение глюкозы или приёмом пищи.
Гемоваскулярные эффекты. Гликлазид снижает риск тромбозов мелких сосудов, оказывая воздействие на 2 механизма, вовлеченные в развитие данных осложнений сахарного диабета: 1) частично ингибирует агрегацию и адгезию тромбоцитов за счет снижения образования факторов их активации (β-тромбо-глобулина и тромбоксана В2); 2) восстанавливает фибринолитическую активность эндотелия за счет повышения активности тканевого активатора плазминогена.
Фармакокинетика
Полностью абсорбируется, содержание в плазме прогрессивно возрастает в течение первых 6 часов после приёма и достигает плато, которое сохраняется с 6-го до 12-ый час. Прием пищи не влияет на всасывание. Взаимосвязь между принятой дозой (до 120 мг) и концентрацией препарата в плазме представляет собой линейную зависимость. Связь с белками плазмы – около 95 %, объем распределения – около 30 литров. Css в крови достигается через 4 сут. T½ – 12–20 ч. Метаболизируется в печени, при этом образуется до 8 метаболитов. Количество основного метаболита, встречающегося в крови – 2–3 % от всего количества принятого препарата, он не имеет гипогликемических свойств, однако обладает влиянием на микроциркуляцию. Выводится почками – 70 % в виде метаболитов, менее 1 % в неизмененном виде; кишечником – 12 % в виде метаболитов. Не отмечено клинически значимого изменения параметров фармакокинетики у лиц пожилого возраста.
Инсулиннезависимый сахарный диабет (тип 2) у взрослых, когда диета, физические упражнения и снижение веса сами по себе не достаточны для достижения гликемического контроля.
Для перорального применения. Назначается только взрослым. Суточная доза варьирует от 1 до 4 таблеток в сутки (30–120 мг в сутки). Суточную дозу принимать однократно во время завтрака. Таблетку(и) рекомендуется глотать целыми (не раздавливать, не разжевывать).
Если больной забыл принять лекарственное средство, не следует повышать дозу на следующий день.
Как и при приеме иных сахароснижающих средств, необходим индивидуальный подбор дозы в зависимости от индивидуального ответа пациента на лечение (уровень глюкозы в крови и гликозилированного гемоглобина HbАlc).
Начальная доза
Рекомендуемая начальная доза – 30 мг в сутки. В случае эффективного контроля гликемии ее можно использовать в качестве поддерживающей. Если адекватный контроль гликемии не достигается, то дозу можно поэтапно увеличивать до 60, 90 или 120 мг/сут. Интервал между последовательными повышениями дозы должен составлять не менее 1 месяца, за исключением случаев, когда после двух недель терапии уровень глюкозы в крови не снижается. В таких случаях дозу можно увеличивать уже через две недели после начала лечения. Максимальная рекомендуемая суточная доза составляет 120 мг.
Переход с таблетки гликлазида 80 мг (с немедленным высвобождением) на таблетки с модифицированным высвобождением 30 мг
Одна таблетка гликлазида 80 мг с немедленным высвобождением сравнима с одной таблеткой гликлазида 30 мг с модифицированным высвобождением. Переход может быть выполнен под контролем тщательного мониторинга концентрации глюкозы в крови.
Переход с других пероральных противодиабетических препаратов на Гликлазид МR: Гликлазид МR можно использовать для замены других пероральных противодиабетических средств. При переходе следует принимать во внимание дозировку и период полувыведения ранее применявшегося антидиабетического средства. Обычно переходного периода времени не требуется. Если больной до этого получал терапию производными сульфонилмочевины с длительным периодом полувыведения, может потребоваться приостановка терапии на несколько дней во избежание усиления действия двух препаратов, которое может привести к развитию гипогликемии.
Схему, описанную для подбора дозы в начале лечения, следует также использовать при переходе на лечение Гликлазидом MR с модифицированным высвобождением 30 мг, то есть в начальной дозе 30 мг/сут, а затем ступенчато увеличивать дозу, в зависимости от метаболического ответа.
Комбинированное применение с другими пероральными противодиабетическими средствами: Гликлазид МR может приниматься в комбинации с бигуанидами, ингибиторами α-глюкозидазы или инсулином.
Пациентам, у которых уровень глюкозы в крови не достаточно контролируется приемом Гликлазида МR, может назначаться терапия инсулином под медицинским надзором.
Пациентам пожилого возраста Гликлазид МR следует назначать в тех же режимах дозирования, которые рекомендуются для пациентов в возрасте до 65 лет.
У пациентов с лёгкой и умеренной почечной недостаточностью может быть использован тот же режим дозирования, что и у пациентов с нормальной функцией почек, под тщательным наблюдением врача.
Пациенты с риском развития гипогликемии:
— недостаточное или нерациональное питание;
— тяжелые или плохо компенсированные эндокринные нарушения (гипопитуитаризм, гипотиреоз, адренокортикотропная недостаточность);
— отмена кортикостероидов после длительного лечения и /или высоких доз;
— тяжелые сосудистые заболевания (тяжелая ишемическая болезнь сердца, тяжелые нарушения проходимости сонной артерии, диффузные сосудистые заболевания).
Рекомендуется начинать лечение с минимальный суточной дозы 30 мг.
Применение у детей
Безопасность и эффективность применения Гликлазида MR с модифицированным высвобождением 30 мг у детей и подростков не установлены. Доступные данные отсутствуют.
Гиперчувствительность к гликлазиду или одному из вспомогательных веществ, другим препаратам группы сульфонилмочевины, сульфаниламидам; сахарный диабет типа 1, диабетический кетоацидоз, диабетическая гиперосмолярная прекома и кома, тяжелая печеночная и/или почечная недостаточность (в этих случаях рекомендуется применение инсулина), сопутствующая терапия миконазолом, беременность, период лактации, возраст до 18 лет.
Гипогликемия. Лечение может назначаться только тем пациентам, которые гарантированно регулярно принимают пищу (включая завтрак). Важность регулярного потребления углеводов обусловлена повышенным риском наступления гипогликемии в случае задержки приема пищи, при ее недостаточном количестве или при низком содержании углеводов в пищевом рационе. Риск возникновения гипогликемии выше на фоне низкокалорийных диет, после длительной или чрезмерной физической нагрузки, употребления алкоголя или в случае комбинированного применения других гипогликемических средств.
Иногда, гипогликемия, наступающая после приема Гликлазида МR, носит тяжелый и затяжной характер. В этом случае требуется госпитализировать больного и в течение нескольких дней вводить ему глюкозу.
Для снижения риска гипогликемических приступов необходим тщательный отбор пациентов, правильный выбор дозы препарата и четкие рекомендации пациентам по его приему.
Факторы, повышающие риск наступления гипогликемии:
— отказ или (особенно у пациентов пожилого возраста) неспособность выполнить указания врача;
— недостаточное или нерациональное питание, нерегулярный прием или пропуск приемов пищи, периоды голодания или изменения в диете;
— несбалансированность физических нагрузок и потребления углеводов;
— почечная недостаточность;
— тяжелая печеночная недостаточность;
— передозировка Гликлазида МR;
— эндокринные нарушения: нарушение функции щитовидной железы, гипопитуитаризм и недостаточность функции надпочечников;
— одновременный прием некоторых других лекарственных препаратов (см. раздел «Взаимодействие с другими лекарственными средствами»).
Почечная и печеночная недостаточность. У пациентов с печеночной недостаточностью или тяжелой почечной недостаточностью могут значительно меняться фармакокинетические и/или фармакодинамические параметры Гликлазида MR. У таких пациентов эпизоды гипогликемии могут быть более продолжительными, что требует принятия адекватных мер по их лечению.
Информирование пациентов. Пациентам и членам их семей необходимо разъяснить опасность гипогликемии, рассказать о ее симптомах, способах лечения и факторах, предрасполагающих к развитию этого осложнения.
Пациенты должны быть проинформированы о важности соблюдения диеты, регулярного выполнения физических упражнений и регулярного проведения мониторинга уровня глюкозы в крови.
Недостаточная эффективность контроля уровня глюкозы в крови может зависеть от следующих факторов: повышенная температура тела, сопутствующее применение препаратов зверобоя, травма, инфекция или хирургическое вмешательство. В этих случаях может потребоваться дополнительное введение инсулина.
У многих пациентов гипогликемическая эффективность любого перорального антидиабетического средства, в том числе Гликлазида МR, снижается после продолжительного периода времени. Это может быть обусловлено прогрессированием заболевания или ослаблением ответа на препарат. Это явление известно как вторичная лекарственная резистентность, которую необходимо отличать от первичной, когда первичное назначение препарата не дает ожидаемого эффекта. Прежде чем диагностировать у пациента вторичную недостаточность лекарственной терапии, необходимо оценить адекватность подбора дозы и соблюдение больным предписанной диеты.
Дисгликемия
У пациентов, получавших сопутствующую терапию фторхинолонами, особенно пожилого возраста, наблюдались случаи изменения концентрации глюкозы в крови, включая гипо- и гипергликемию. Поэтому у пациентов, получающих одновременно гликлазид и фторхинолоны, рекомендуется тщательно контролировать концентрацию глюкозы в крови.
Лабораторные анализы. Для оценки качества контроля уровня глюкозы в крови рекомендуется определять уровень гликозилированого гемоглобина, а также осуществлять самоконтроль уровня глюкозы в крови.
Назначение препаратов сульфонилмочевины пациентам с дефицитом глюкозы-6-фосфатадегидрогеназы (G6PD) может привести к гемолитической анемии. Поскольку Гликлазид МR принадлежит к классу препаратов сульфонилмочевины, следует соблюдать осторожность при его назначении пациентам с дефицитом G6PD и рассмотреть альтернативные возможности лечения препаратами других классов.
Препараты на основе зверобоя продырявленного (Hypericum perforatum)
Препараты на основе зверобоя продырявленного уменьшают фармакологическое действие гликлазида. Поэтому при совместном применении рекомендуется тщательный контроль концентрации глюкозы в крови.
Независимо от сахарного диабета типа 1 или типа 2 (в том числе обусловленного беременностью), должна проводиться только инсулинотерапия. Во всех случаях рекомендуется заменить прием пероральных гипогликемических препаратов введением инсулина – как в случае планируемой беременности, так и в том случае, когда беременность установлена уже во время приема препарата. В последнем случае нет определенных оснований для прерывания беременности, но требуется осторожное проведение терапии и особенно внимательный перинатальный контроль. Также рекомендуется проведение неонатального мониторинга содержания глюкозы в крови.
Не известно, выделяется ли гликлазид или его метаболиты с грудным молоком. Учитывая риск гипогликемии у новорожденных, продукт противопоказан кормящим женщинам.
Гликлазид МR не влияет на способность к управлению автотранспортными средствами и другими механизмами. Тем не менее, пациент должен быть предупрежден о возможном нарушении сознания вследствие эпизодов гипогликемии, особенно в начале терапии Гликлазидом МR и соблюдать осторожность при управлении автотранспортными средствами и другими механизмами.
Средства, повышающие риск развития гипогликемии
Противопоказанная комбинация. Миконазол (как при его системном введении, так и при нанесении на слизистую ротовой полости в форме геля): усиливает гипогликемический эффект, возможно появление симптомов гипогликемии и даже гипогликемической комы.
Нерекомендуемые комбинации:
— фенилбутазон (системное введение): усиливает гипогликемический эффект производных сульфонилмочевины (вытесняет их из комплексов с белками плазмы крови и/или замедляет их выведение). Предпочтительно назначить другое противовоспалительное средство, а также предупредить пациента и разъяснить ему важность самоконтроля лабораторных показателей крови. В случае необходимости следует провести корректировку дозы на время и после завершения терапии противовоспалительным препаратом;
— алкоголь: усиливает гипогликемизирующее действие (путем ингибирования компенсаторных реакций), что может привести к наступлению гипогликемической комы. Следует отказаться от приема алкоголя и препаратов, содержащих спирт.
Комбинации, требующие особой предосторожности: прием других гипогликемизирующих средств (инсулин, акарбоза, метформин, тиазолидиндионы, ингибиторы дипептидилпептидазы-4, агонисты рецепторов GLP-1), β адреноблокаторов, флуконазола, ингибиторов ангиотензинпревращающего фермента (АПФ) (каптоприл, эналаприл и др.), блокаторов Н2-рецепторов, ингибиторов моноаминооксидазы (МАО), сульфаниламидов, кларитромицина, нестероидных противовоспалительных средств.
Средства, которые могут вызвать повышение концентрации глюкозы в крови
Комбинации, которые не рекомендуются
Комбинация гликлазида с даназолом не рекомендуется. В случае невозможности отказа от даназола, необходимо объяснить пациенту важность контроля уровня глюкозы в крови и моче, откорректировать дозу гликлазида на время и после завершения приема диназола.
Комбинации, требующие особой осторожности
Хлорпромазин в высоких дозах (более 100 мг/сут) увеличивает содержание глюкозы в крови, снижая секрецию инсулина. Необходим контроль глюкозы крови и коррекция дозы гликлазида как во время приёма хлорпромазина, так и после его отмены.
Глюкокортикостероиды (системное, внутрисуставное, наружное, ректальное применение) и тетракозактид – повышают уровень глюкозы с возможным развитием кетоацидоза (за счет снижения толерантности к углеводам). Необходимо объяснить пациенту важность контроля уровня глюкозы в крови и моче, откорректировать дозу Гликлазида МR на время и после завершения приема этих средств.
Ритодрин, сальбутамол, тербуталин (внутривенное введение) – повышают содержание глюкозы крови за счет влияния на β2-адренорецепторы. Рекомендуется контроль глюкозы крови и при необходимости перевод пациента на терапию инсулином.
Препараты на основе зверобоя продырявленного (Hypericum perforatum)
Препараты на основе зверобоя продырявленного уменьшают фармакологическое действие гликлазида. Поэтому при совместном применении рекомендуется тщательный контроль концентрации глюкозы в крови.
Лекарственные средства, которые могут приводить к дисгликемии
Комбинации, требующие особой осторожности в случае применения
Фторхинолоны: в случае совместного применения гликлазида и фторхинолонов существует риск дисгликемии, поэтому рекомендуется тщательный мониторинг концентрации глюкозы в крови.
Комбинации, которые следует учитывать.
Гликлазид МR может привести к усилению действия антикоагулянтов непрямого действия (варфарин, фенилин), поэтому может потребоваться коррекция дозы этих лекарственных средств.
Нарушения со стороны желудочно-кишечного тракта: диспепсия (тошнота, рвота, диарея, абдоминальная боль, запор) – выраженность снижается при приеме во время еды;
Нарушения со стороны печени и желчевыводящих путей: повышение активности печеночных ферментов (ACT, АЛТ, щелочной фосфатазы), гепатит, холестатическая желтуха. В случае холестатической желтухи лечение следует прекратить. Как правило, эти симптомы исчезают после прекращения лечения.
Нарушения со стороны органов кроветворения: угнетение костномозгового кроветворения (анемия, тромбоцитопения, лейкопения, гранулоцитопения).
Нарушения со стороны кожных покровов: кожный зуд, крапивница, ангионевротический отек, сыпь, лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром), макулопапулезная сыпь и буллёзные реакции (включая синдром Стивенса-Джонсона и токсический эпидермальный некролиз), эритема, аллергический васкулит.
Нарушения со стороны обмена веществ и питания: гипогликемия.
Проявления гипогликемии: головокружение, тошнота, рвота, усталость, сонливость, головная боль и потливость, слабость, нервозность, дрожь, парестезии. Другие возможные симптомы гипогликемии: голод, нарушения сна, возбуждение, агрессивность, плохая концентрация, замедление реакций, депрессия, спутанность сознания, зрительные и речевые расстройства, афазия, парезы, сенсорные расстройства, чувство бессилия, потеря самоконтроля, делирий, судороги, частое дыхание, брадикардия, сонливость и потеря сознания, что может привести к коме и смертельному исходу.
Кроме того, возможно развитие таких признаков адренергической контррегуляции, как потение, липкая кожа, чувство тревоги, тахикардия, повышенное кровяное давление, учащенное сердцебиение, стенокардия и сердечная аритмия. Обычно эти клинические проявления исчезают после приема углеводов (сахара). Искусственные подсластители не имеют никакого эффекта при купировании гипогликемии. Опыт применения других препаратов сульфонилмочевины свидетельствует о возможности рецидивов гипогликемии даже в тех случаях, когда принятые для ее устранения меры вначале казались эффективными. При тяжелых и затяжных приступах гипогликемии и даже, если ее удается временно устранить приемом сахара, необходима срочная помощь врача или госпитализация.
Нарушения со стороны органов зрения: возможны преходящие нарушения зрения, особенно в начале лечения, в связи с изменениями уровня глюкозы в крови.
Нежелательные эффекты, характерные для всех производных сульфонилмочевины: возможно появление эритроцитопении, агранулоцитоза, гемолитической анемии, панцитопении, гипонатриемии, аллергического васкулита. Отмечались случаи повышения активности печеночных ферментов и нарушения функции печени (холестаз, желтуха), а также гепатита. Прекращение приема лекарственного средства приводило к регрессии эффектов и только несколько случаев привели к печеночной недостаточности угрожающей жизни.
Проявляется гипогликемией. При умеренной гипогликемии, которая не сопровождается потерей сознания или иными неврологическими симптомами, достаточно принять углеводы, откорректировать дозу и/или изменить диету. При этом необходимо осуществлять тщательный мониторинг состояния пациента до стабильного.
При тяжелых гипогликемических реакциях с комой и судорогами, других неврологических проявлениях необходимо оказание скорой медицинской помощи и немедленная госпитализация. При подозрении на кому или при коме ввести 50 мл 20–30 % раствора декстрозы, затем внутривенно капельно 10 % раствор декстрозы до достижения концентрации глюкозы в крови 5,55 ммоль/л. В зависимости от состояния пациента в дальнейшем решить вопрос о продолжительности мониторинга. Диализ неэффективен ввиду интенсивного связывания гликлазида с белками крови.
10 таблеток в контурной ячейковой упаковке. 3 или 6 контурных ячейковых упаковок вместе с листком-вкладышем помещают в пачку из картона (№10х3, №10х6).
В защищенном от света и влаги месте, при температуре не выше 25 ºС. Хранить в недоступном для детей месте.
2 года. Не использовать после окончания срока годности.
По рецепту.
Информация о производителе
Открытое акционерное общество «Борисовский завод медицинских препаратов», Республика Беларусь, Минская обл., г. Борисов, ул. Чапаева 64, тел/факс +375(177)735612, 731156.
Номидес — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-003504
Торговое наименование препарата:
Номидес
Международное непатентованное наименование:
Осельтамивир (Oseltamivir)
Лекарственная форма:
капсулы.
Состав:
активное вещество:
| Осельтамивира фосфата: | 39,40 мг | 59,10 мг | 98,50 мг |
| что соответствует содержанию Осельтамивира: |
30,00 мг | 45,00 мг | 75,00 мг |
вспомогательные вещества:
Кремния диоксид коллоидный (аэросил) — 6,00 мг/9,00 мг/15,00 мг; коповидон -3,60 мг/5,40 мг/9,00 мг; крахмал прежелатинизированный — 65,60 мг/98,40 мг/164,00 мг; кроскармеллоза натрия — 1,840 мг/2,760 мг/4,60 мг; натрия стеарилфумарат -0,920 мг/1,380 мг/2,30 мг; тальк — 2,640 мг/3,960 мг/6,60 мг.
Состав твердых желатиновых капсул:
Для дозировки 30мг:
корпус капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,12 мг, титана диоксид — 2,0500 мг, желатин — до 100 мг;
крышечка капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,12 мг, титана диоксид — 2,0500 мг, желатин — до 100 мг.
Для дозировки 45 мг:
корпус капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,08 мг, титана диоксид — 0,97524 мг, краситель бриллиантовый голубой — 0,2626 мг, желатин — до 100 мг;
крышечка капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,08 мг, титана диоксид — 0,97524 мг, краситель бриллиантовый голубой — 0,2626 мг, желатин — до 100 мг.
Для дозировки 75 мг:
корпус капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,12 мг, титана диоксид — 1,50038 мг, желатин — до 100 мг;
крышечка капсулы: вода очищенная — 14-15 мг, натрия лаурилсульфат — 0,12 мг, титана диоксид — 1,50038 мг; краситель солнечный закат желтый Е 110 — 1,2753 мг, краситель пунцовый [Понсо 4R] Е 124 — 0,2401 мг, желатин — до 100 мг.
Описание:
Для дозировки 30 мг: твердые желатиновые капсулы № «3», корпус белого цвета, крышечка белого цвета.
Для дозировки 45 мг: твердые желатиновые капсулы № «2», корпус голубого цвета, крышечка голубого цвета.
Для дозировки 75 мг: твердые желатиновые капсулы № «1», корпус белого цвета, крышечка оранжевого.
Содержимое капсул — белый или белый с желтоватым оттенком порошок.
Фармакотерапевтическая группа:
противовирусное средство.
Код АТХ:
J05AH02.
Фармакологические свойства
Фармакодинамика
Противовирусный препарат, осельтамивира фосфат является пролекарством, его активный метаболит (осельтамивира карбоксилат, ОК) — эффективный и селективный ингибитор нейраминидазы вирусов гриппа типа А и В — фермента, катализирующего процесс высвобождения вновь образованных вирусных частиц из инфицированных клеток, их проникновение в клетки эпителия дыхательных путей и дальнейшего распространения вируса в организме. Тормозит рост вируса гриппа in vitro и подавляет репликацию вируса и его патогенность in vivo, уменьшает выделение вирусов гриппа А и В из организма.
Исследования клинических изолятов вируса гриппа показали, что концентрация ОК, необходимая для ингибирования нейраминидазы на 50 % (IC50), составляет 0,1-1,3 нМ для вируса гриппа А и 2,6 нМ для вируса гриппа В. Согласно данным опубликованных исследований медиана значение IC50 для вируса гриппа В несколько выше и составляет 8,5 нМ.
Резистентность
Клинические исследования
Риск появления вирусов гриппа со сниженной чувствительностью или резистентностью к препарату изучался в клинических исследованиях. У всех пациентов-носителей ОК-резистентного вируса носительство имело временный характер, не влияло на элиминацию вируса и не вызывало ухудшения клинического состояния.
| Популяция пациентов | Пациенты с мутациями, приводящими к резистентности | |
| Фенотипирование* | Гено-и фенотипирование* | |
| Взрослые и подростки | 4/1245 (0,32 %) | 5/1245 (0,4 %) |
| Дети (1-12 лет) | 19/464 (4,1 %) | 25/464 (5,4 %) |
* Полное генотипирование не было проведено ни в одном из исследований.
При приеме осельтамивира с целью постконтактной профилактики (7 дней), профилактики контактировавших в семье (10 дней) и сезонной профилактики (42 дня) у лиц с нормальной функцией иммунной системы случаев резистентности к препарату не отмечено. В 12-недельном исследовании по сезонной профилактике у лиц с ослабленным иммунитетом случаев возникновения резистентности также не наблюдалось.Данные отдельных клинических случаев и наблюдательных исследований
У пациентов, не получавших осельтамивир, обнаружены возникающие в природных условиях мутации вирусов гриппа А и В, которые обладали сниженной чувствительностью к осельтамивиру. В 2008 году мутация по типу замены H275Y, приводящая к резистентности, была обнаружена более чем у 99 % штаммов вируса 2008 H1N1, циркулирующих в Европе. Вирус гриппа 2009 H1N1 («свиной грипп») в большинстве случаев был чувствителен к осельтамивиру. Устойчивые к осельтамивиру штаммы обнаружены у лиц с нормальной функцией иммунной системы и лиц с ослабленным иммунитетом, принимавших осельтамивир. Степень снижения чувствительности к осельтамивиру и частота встречаемости подобных вирусов может отличаться в зависимости от сезона и региона. Устойчивость к осельтамивиру обнаружена у пациентов с пандемическим гриппом H1N1, получавших препарат как для лечения, гак и для профилактики.
Частота встречаемости резистентности может быть выше у более молодых пациентов и пациентов с ослабленным иммунитетом. Устойчивые к осельтамивиру лабораторные штаммы вирусов гриппа и вирусы гриппа от пациентов, получавших терапию осельтамивиром, несут мутации нейраминидазы N1 и N2. Мутации, приводящие к устойчивости, часто являются специфическими для подтипа нейраминидазы. При принятии решения о применении осельтамивира следует учитывать сезонную чувствительность вируса гриппа к препарату (последнюю информацию можно найти на сайте ВОЗ).
Доклинические данные
Доклинические данные, полученные на основании стандартных исследований по изучению фармакологической безопасности, генотоксичности и хронической токсичности, не выявили особой опасности для человека.
Канцерогенность: результаты 3 исследований по выявлению канцерогенного потенциала (2-летних исследований на крысах и мышах для осельтамивира и одного 6-месячного исследования на трансгенных мышах Tg:AC для активного метаболита) были отрицательными.
Мутагенность: стандартные генотоксические тесты для осельтамивира и активного метаболита были отрицательными.
Влияние на фертильность: осельтамивир в дозе 1500 мг/кг/сут не влиял на репродуктивную функцию самцов и самок крыс.
Тератогенность: в исследованиях по изучению тератогенности осельтамивира в дозе до 1500 мг/кг/сут (на крысах) и до 500 мг/кг/сут (на кроликах) влияния на эмбриональное развитие не обнаружено. В исследованиях по изучению антенатального и постнатального периодов развития у крыс при введении осельтамивира в дозе 1500 мг/кг/сут наблюдалось увеличение периода родов: предел безопасности между экспозицией для человека и максимальной не оказывающей эффекта дозой у крыс (500 мг/кг/сут) для осельтамивира выше в 480 раз, а для его активного метаболита — в 44 раза. Экспозиция у плода I составляла 15-20 % от таковой у матери.
Прочее: осельтамивир и активный метаболит проникают в молоко лактирующих крыс. Согласно ограниченным данным осельтамивир и его активный метаболит проникают в грудное молоко человека. По результатам экстраполяции данных, полученных в исследованиях у животных, их количество в грудном молоке может составлять 0,01 мг/сут и 0,3 мг/сут, соответственно.
Примерно у 50 % протестированных морских свинок при введении максимальных доз активной субстанции осельтамивира наблюдалась сенсибилизация кожи в виде эритемы. Также выявлено обратимое раздражение глаз у кроликов.
В то время как очень высокие пероральные однократные дозы (657 мг/кг и выше) осельтамивира фосфата не оказывали влияния на взрослых крыс, данные дозы оказывали токсическое действие на незрелых 7-дневных детенышей крыс, в т.ч. приводили к гибели животных. Нежелательных эффектов не наблюдалось при хроническом введении в дозе 500 мг/кг/сут с 7 по 21 день постнатального периода.
Фармакокинетика.
Абсорбция
Осельтамивира фосфат легко всасывается в желудочно-кишечном тракте и в высокой степени превращается в активный метаболит под действием печеночных и кишечных эстераз. Концентрация активного метаболита в плазме определяется в пределах 30 мин, время достижения максимальной концентрации 2-3 ч, и более чем в 20 раз превышают концентрацию пролекарства. Не менее 75 % принятой внутрь дозы попадает в системный кроваток в виде активного метаболита, менее 5 % — в виде исходного препарата. Плазменные концентрации как пролекарства, так и активного метаболита пропорциональны дозе и не зависят от приема пищи.
Распределение
Объем распределения (Vss) активного метаболита — 23 л.
По данным исследований, проведенных на животных, после приема внутрь осельтамивира фосфата его активный метаболит обнаруживался во всех основных очагах инфекции (легких, промывных водах бронхов, слизистой оболочки полости носа, среднем ухе и трахее) в концентрациях, обеспечивающих противовирусный эффект.
Связь активного метаболита с белками плазмы — 3 %. Связь пролекарства с белками плазмы 42 %, что недостаточно, чтобы служить причиной существенных лекарственных взаимодействий.
Метаболизм
Осельтамивира фосфат в высокой степени превращается в активный метаболит под действием эстераз, находящихся преимущественно в печени. Ни осельтамивира фосфат, ни активный метаболит не являются субстратами или ингибиторами изоферментов системы цитохрома Р450.
Выведение
Выводится (>90 %) в виде активного метаболита преимущественно почками. Активный метаболит не подвергается дальнейшей трансформации и выводится почками (>99 %) путем клубочковой фильтрации и канальцевой секреции. Почечный клиренс (18,8 л/ч) превышает скорость клубочковой фильтрации (7,5 л/ч), что указывает на то, что препарат выводится еще и путем канальцевой секреции. Через кишечник выводится менее 20 % приятного препарата.Период полувыведения активного метаболита 6-10 ч.
Фармакокинетика в особых группах пациентов
Больные с поражением почек
При применение осельтамивира (100 мг два раза в сутки в течение 5 дней) у больных с различной степенью поражения почек площадь под кривой «концентрация активного метаболита в плазме — время» (AUC осельтамивира карбоксилата) обратно пропорциональна снижению функции почек.
Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточности (с клиренсом креагинина <10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Больные с поражением печени
Полученные in vitro и в исследованиях на животных данные об отсутствии значительного повышения AUC осельтамивира фосфата при нарушении функции печени легкой и средней степени тяжести были подтверждены и в клинических исследованиях. Безопасность и фармакокинетика осельтамивира фосфата у пациентов с тяжелым нарушением функции печени не изучалась.
Больные пожилого и старческого возраста
У больных пожилого и старческого возраста (65-78 лет) экспозиция метаболита в равновесном состоянии на 25-35 % выше, чем у более молодых пациентов при назначении аналогичных доз осельтамивира. Период полувыведения препарата у больных пожилого и старческого возраста существенно не отличался от такового у более молодых пациентов. С учетом данных по экспозиции препарата и его переносимости больными пожилого и старческого возраста коррекции дозы при лечении и профилактике гриппа не требуется.
Дети
У детей младшего возраста выведение пролекарства и активного метаболита происходит быстрее, чем у взрослых, что приводит к более низким AUC по отношение к конкретной дозе. Прием препарата в дозе 2 мг/кг обеспечивает такую же AUC осельтамивира карбоксилата, какая достигается у взрослых после однократного приема капсулы с 75 мг препарата (что эквивалентно примерно 1 мг/кг). Фармакокинетика осельтамивира у детей старше 12 лет такая же, как у взрослых.
Показания к применению
Лечение гриппа у взрослых и детей в возрасте старше 3 лет.
Профилактика гриппа у взрослых и подростков в возрасте старше 12 лет, находящихся в группах повышенного риска инфицирования вирусом (в больших коллективах, у ослабленных больных).
Профилактика гриппа у детей старше 3 лет.
Противопоказания
Повышенная чувствительность к осельтамивира фосфату или любому компоненту препарата, терминальная стадия почечной недостаточности (клиренс креатинина <10 мл/мин), тяжелая печеночная недостаточность, детский возраст до 3 лет.
С осторожностью:
Беременность, период грудного вскармливания.
Применение при беременности и в период грудного вскармливания
Контролируемых исследований у беременных женщин не проводилось. Однако результаты постмаркетинговых и наблюдательных исследований продемонстрировали пользу предлагаемого стандартного режима дозирования для данной популяции пациентов. Результаты фармакокинетического анализа показали более низкую экспозицию активного метаболита (приблизительно на 30 % в течение всех триместров беременности) у беременных женщин по сравнению с не беременными. Тем не менее, значение расчетной экспозиции остается выше ингибирующих концентраций (значение IC95) и терапевтических значений для многих штаммов вируса гриппа. Изменение режима дозирования у беременных женщин при проведении терапии или профилактики не рекомендуется. Не обнаружено прямого или опосредованного неблагоприятного влияния препарата на беременность, эмбрио-фетальное или постнатальное развитие (см. «Доклинические данные»). При назначении осельтамивира беременным женщинам следует учитывать как данные по безопасности, так и течение беременности и патогенность циркулирующего штамма вируса гриппа.
Во время доклинических исследований осельтамивир и активный метаболит проникали в молоко лактирующих крыс. Данные по экскреции осельтамивира с грудным молоком у человека и применению осельтамивира кормящими женщинами ограничены. Осельтамивир и его активный метаболит в небольших количествах проникают в грудное молоко (см. «Доклинические данные»), создавая субтерапевтические концентрации в крови грудного ребенка. При назначении осельтамивира кормящим женщинам следует также учитывать сопутствующее заболевание и патогенность циркулирующего штамма вируса гриппа.
При беременности и в период грудного вскармливания осельтамивир применяют только в случае, если предполагаемая польза для матери превышает потенциальный риск для плода и ребенка.
Способ применения и дозы
Препарат осельтамивир принимается внутрь, независимо от приема пищи или во время еды.
Лечение
Прием препарата необходимо начинать не позднее 2 суток с момента развития симптомов заболевания.
Взрослые и подростки в возрасте >12 лет
Рекомендуемая суточная доза составляет 150 мг. Препарат назначают в дозе 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки внутрь в течение 5 дней.
Дети с массой тела более 40 кг или в возрасте >8 лет
Дети, которые умеют проглатывать капсулы, также могут получать лечение, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки в течение 5 дней.
Дети в возрасте >3 лет
Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг.
| Масса тела | Рекомендованная доза в течение 5 дней |
| <15 кг | 30 мг два раза в сутки |
| >15-23 кг | 45 мг два раза в сутки |
| >23-40 кг | 60 мг два раза в сутки |
Профилактика
Прием препарата необходимо начинать не позднее 2 суток после контакта с больными.
Взрослые и подростки в возрасте >12 лет
По 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки внутрь в течение не менее 10 дней после контакта с больным. Во время сезонной эпидемии гриппа — по 75 мг 1 раз в сутки в течение 6 недель. Профилактическое действие продолжается столько, сколько длится прием препарата.
Дети с массой тела более 40 кг или в возрасте >8 лет
Дети, которые могут проглатывать капсулы, также могут получать профилактическую терапию, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки в течение 10 дней.
Дети в возрасте >3 лет
Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг.
| Масса тела | Рекомендованная доза в течение 10 дней |
| <15 кг | 30 мг 1 раз в сутки |
| >15-23 кг | 45 мг 1 раз в сутки |
| >23-40 кг | 60 мг 1 раз в сутки |
Дозирование в особых случаях
Пациенты с нарушением функции почек:
Лечение
Больным с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У больных с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг два раза в сутки в течение 5 дней.
У больных с клиренсом креатинина от 10 до 30 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки в течение 5 дней. Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа, если симптомы гриппа появились в течение 48 ч между сеансами диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого сеанса диализа. Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 5 дней.
Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина <10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Профилактика
Больным с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У больных с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки. У больных с клиренсом креатинина от 10 до 30 мл/мин рекомендуется уменьшить дозу осельтамивира до 30 мг через день. Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого последующего нечетного сеанса диализа. Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 7 дней. Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина менее 10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Пациенты с нарушением функции печени
Коррекции дозы при лечении и профилактике гриппа у пациентов с нарушением функции печени легкой и средней степени тяжести не требуется. Безопасность и фармакокинетика осельтамивира у пациентов с тяжелыми нарушениями функции печени не изучалась. Больные пожилого и старческого возраста
Коррекции дозы для профилактики или лечения гриппа не требуется.
Больные с ослабленным иммунитетом (после трансплантации)
Для сезонной профилактики гриппа у больных с ослабленным иммунитетом в возрасте >3 лет — в течение 12 недель, коррекции дозы не требуется.
Побочное действие
В исследованиях по лечению гриппа у взрослых/пациентов подросткового возраста самыми частыми нежелательными реакциями (HP) были тошнота, рвота и головная боль. Большинство HP возникали в первый или второй день лечения и проходили самостоятельно в течение 1-2 дней. В исследованиях по профилактике гриппа у взрослых и подростков самыми частыми HP были тошнота, рвота, головная боль и боль. У детей наиболее часто встречалась рвота. Описанные HP в большинстве случаев не требовали отмены препарата.
Лечение и профилактика гриппа у взрослых и подростков
В таблице 1 представлены HP, возникавшие наиболее часто (>1 %) при приеме рекомендованной дозы осельтамивира в исследованиях по профилактике и лечению гриппа у взрослых и подростков (75 мг 2 раза в сутки в течение 5 дней для лечения и 75 мг 1 раз в сутки до 6 недель для профилактики), и частота которых как минимум на 1% выше по сравнению с плацебо. В исследования по лечению гриппа вошли взрослые/подростки без сопутствующей патологии и больные группы риска, т.е. пациенты с высоким риском развития осложнений гриппа (пациенты пожилого и старческого возраста, пациенты с хроническими заболеваниями сердца или органов дыхания). В целом профиль безопасности у пациентов группы риска соответствовал таковому у взрослых/пациентов подросткового возраста без сопутствующей патологии.
В исследованиях по профилактике гриппа профиль безопасности у пациентов, получавших рекомендованную дозу препарата (75 мг 1 раз в сутки до 6 недель), не отличался от такового в исследованиях по лечению гриппа, несмотря на более длительный прием препарата.
Таблица 1. Процент взрослых/подростков с HP, возникавшими с частотой >1% в группе осельтамивира в исследованиях по лечению и профилактике гриппозной инфекции (различие с плацебо >1 %).
| Системно-органный класс Нежелательная реакция |
Лечение | Профилактика | Категория частоты* | ||
| Осельтамивир (75 мг 2 раза/сут) N=2647 |
Плацебо N=1977 |
Осельтамивир (75 мг 1 раз/сут) N=1945 |
Плацебо N=1588 |
||
| Нарушения со стороны желудочно-кишечного тракта | |||||
| Тошнота | 0% | 6% | 8% | 4% | очень часто |
| Рвота | 8% | 3% | 2% | 1% | часто |
| Нарушения со стороны нервной системы | |||||
| Головная боль | 2% | 1% | 17% | 16% | очень часто |
| Общие расстройства | |||||
| Боль | <1% | <1% | 4% | 3% | часто |
*Категория частоты представлена только для группы осельтамивира. Для оценки частоты HP использованы следующие категории частоты: очень часто (>1/10); часто (>1/100, <1/10).Далее представлены нежелательные явления, которые возникали с частотой >1% у взрослых и подростков, получавших осельтамивир в качестве терапии и профилактики гриппозной инфекции. Данные нежелательные явления либо более часто наблюдались у пациентов, получавших плацебо, либо различия в частоте между группами осельтамивира и плацебо составили менее 1%.
Нарушения со стороны желудочно-кишечного тракта (осельтамивир против плацебо):
лечение — диарея (6% против 7%), боль в животе (включая боль в верхней части живота, 2% против 3%);
профилактика — диарея (3% против 4%), боль в верхней части живота (2 % против 2 %), диспепсия (1% против 1%).
Инфекции и инвазии (осельтамивир против плацебо):
лечение — бронхит (3% против 4%), синусит (1% против 1%), простой герпес (1% против 1%);
профилактика — назофарингит (4% против 4%), инфекции верхних дыхательных путей (3% против 3%), гриппозная инфекция (2% против 3%).
Общие расстройства (осельтамивир против плацебо):
лечение — головокружение (включая вертиго, 2% против 3%);
профилактика — усталость (7% против 7%), пирексия (2% против 2%), гриппоподобное заболевание (1% против 2%), головокружение (1% против 1%), боль в конечности (1% против 1%).
Нарушения со стороны нервной системы (осельтамивир против плацебо):
лечение — бессонница (1% против 1%);
профилактика-бессонница (1% против 1%).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения (осельтамивир против плацебо):
лечение — кашель (2% против 2%), заложенность носа (1% против 1%);
профилактика — заложенность носа (7% против 7%), ангина (5% против 5%), кашель (5% против 6%), ринорея (1% против 1%).
Нарушения со стороны скелетно-мышечной и соединительной ткани (осельтамивир против плацебо):
профилактика — боль в спине (2% против 3%), артралгия (1% против 2%), миалгия (1% против 1%).
Нарушения со стороны половых органов и молочной железы (осельтамивир против плацебо): профилактика — дисменорея (3% против 3%).
Лечение и профилактика гриппозной инфекции лиц пожилого и старческого возраста
Профиль безопасности у 942 пациентов пожилого и старческого возраста, получавших осельтамивир или плацебо, клинически не отличался от такового у лиц более молодого возраста (до 65 лет).
Профилактика гриппозной инфекции у пациентов с ослабленным иммунитетом
В 12-недельном исследовании по профилактике гриппа с участием 475 пациентов с ослабленным иммунитетом (включая 18 детей в возрасте от 1 до 12 лет), у пациентов, принимавших осельтамивир (п = 238), профиль безопасности соответствовал описанному ранее в исследованиях по профилактике гриппа.
Лечение и профилактика гриппозной инфекции у детей без сопутствующих заболеваний в возрасте 1-12 лет и пациентов с бронхиальной астмой
В исследованиях по лечению естественной гриппозной инфекции у детей в возрасте от 1 года до 12 лет HP при применении осельтамивира (n=858), отмеченной с частотой >1% и как минимум на 1% чаще по сравнению с плацебо (n=622), была рвота. У детей, получавших рекомендованную дозу препарата 1 раз в сутки в качестве постконтактной профилактики в домашних условиях, наиболее часто встречалась рвота (8% в группе осельтамивира против 2% в группе, не получавшей профилактическое лечение). Осельтамивир хорошо переносился, зарегистрированные нежелательные явления соответствовали описанным ранее при проведении лечения гриппа у детей. Далее представлены нежелательные явления, отмеченные у детей с частотой >1 % в исследованиях по лечению гриппа (n=858) или с частотой >5 % в исследованиях по профилактике гриппа (n=148). Данные нежелательные явления более часто наблюдались в группе плацебо/отсутствие профилактики, различия между группами осельтамивира и плацебо/отсутствие профилактики составили менее 1%.
Нарушения со стороны желудочно-кишечного тракта (осельтамивир против плацебо):
лечение — диарея (9% против 9%), тошнота (4% против 4%), боль в животе (включая боль в верхней части живота, 3% против 3%).
Инфекции и инвазии (осельтамивир против плацебо):
лечение — средний отит (5% против 8%), бронхит (2% против 3%), пневмония (1% против 3%), синусит (1% против 2%).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения (осельтамивир против плацебо):
лечение — астма (включая обострение, 3% против 4%), носовое кровотечение (2% против 2%);
профилактика — кашель (12% против 26%), заложенность носа (11% против 20%).
Нарушения со стороны кожи и подкожных тканей (осельтамивир против плацебо):
лечение — дерматит (включая аллергический и атопический дерматит, 1% против 2%).
Нарушения со стороны органа слуха и лабиринтные нарушения (осельтамивир против плацебо):
лечение — боль в ухе (1% против 1%).
Нарушения со стороны органа зрения (осельтамивир против плацебо):
лечение — конъюнктивит (включая покраснение глаз, выделения из глаза и боль в глазах, 1% против <1%).
Дополнительные нежелательные явления, отмеченные при проведении лечения гриппа у детей, не соответствовавшие описанным выше критериям.
Нарушения со стороны крови и лимфатической системы (осельтамивир против плацебо):
лечение — лимфоаденопатия (<1% против 1%).
Нарушения со стороны органа слуха и лабиринтные нарушения (осельтамивир против плацебо):
лечение — повреждение барабанной перепонки (<1% против 1%).
Постмаркет инговое наблюдение
Далее представлены нежелательные явления при применении осельтамивира, которые наблюдались в период постмаркетингового наблюдения. Частота данных нежелательных явлений и/или причинно-следственная связь с применением препарата не может быть установлена, так как не известен истинный размер популяции в виду добровольного характера сообщений.
Нарушения со стороны кожи и подкожных тканей:
реакции гиперчувствительности -дерматит, кожная сыпь, экзема, крапивница, мультиформная экссудативная эритема, синдром Стивенса-Джонсона и токсический эпидермальный некролиз, аллергия, анафилактические и анафилактоидные реакции, отек Квинке.
Нарушения со стороны печени и желчевыводящих путей:
гепатит, увеличение активности «печеночных» ферментов у пациентов с гриппоподобными симптомами, получавших осельтамивир; фульминантный гепатит (в том числе с фатальным исходом), печеночная недостаточность, желтуха.
Нарушения со стороны нервно-психической сферы
Гриппозная инфекция может ассоциироваться с различными неврологическими симптомами и изменениями поведения, включая такие симптомы, как галлюцинации, бред и анормальное поведение. В некоторых случаях они могут привести к смертельному исходу. Такие явления могут возникать как на фоне развития энцефалопатии или энцефалита, так и без проявления данных заболеваний.
У пациентов (в основном у детей и подростков), принимавших осельтамивир с целью лечения гриппа, были зарегистрированы судороги и делирий (включая такие симптомы, как нарушение сознания, дезориентация во времени и пространстве, анормальное поведение, бред, галлюцинации, возбуждение, тревога, ночные кошмары). Эти случаи редко сопровождались опасными для жизни действиями. Роль осельтамивира в развитии этих явлений неизвестна. Подобные психоневрологические нарушения так же отмечены у пациентов с гриппом, не получавших осельтамивир.
Нарушения со стороны желудочно-кишечного тракта:
желудочно-кишечные кровотечения после приема осельтамивира (в частности, нельзя исключить связь между явлениями геморрагического колита и приемом осельтамивира, поскольку указанные явления исчезали как после выздоровления пациента от гриппа, так и после отмены препарата).
Нарушения со стороны органа зрения: нарушение зрения.
Нарушения со стороны сердца: аритмия.
Передозировка
В большинстве случаев передозировка в ходе клинических исследований и при постмаркетинговом применении осельтамивира не сопровождалась какими-либо нежелательными явлениями. В остальных случаях симптомы передозировки соответствовали нежелательным явлениям, представленным в разделе «Побочное действие».
Взаимодействие с другими лекарственными средствами
Клинически значимые лекарственные взаимодействия маловероятны по данным фармакологических и фармакокинетических исследований. Осельтамивира фосфат в высокой степени превращается в активный метаболит под действием эстераз, в основном расположенных в печени. Лекарственные взаимодействия, обусловленные конкуренцией за связывание с активными центрами эстераз, в литературных источниках широко не представлены. Низкая степень связывания осельтамивира и активного метаболита с белками плазмы не дают оснований предполагать наличие взаимодействий, связанных с вытеснением лекарственных средств из связи с белками.
Исследования in vitro показывают, что ни осельтамивира фосфат, ни его активный метаболит не являются предпочтительным субстратом для полифункциональных оксидаз системы цитохрома Р450 или для глюкуронилтрансфераз. Оснований для взаимодействия с пероральными контрацептивами нет.
Циметидин, неспецифический ингибитор изофермента системы цитохрома Р450 и конкурирующий в процессе канальцевой секреции с препаратами щелочного типа и катионами, не влияет на плазменные концентрации осельтамивира и его активного метаболита.
Маловероятны клинически значимые межлекарственные взаимодействия, связанные с конкуренцией за канальцевую секрецию, принимая во внимание резерв безопасности для большинства подобных препаратов, пути выведения активного метаболита осельтамивира (клубочковая фильтрация и анионная канальцевая секреция), а также выводящую способность каждого из путей.
Пробенецид приводит к увеличению AUC активного метаболита осельтамивира примерно в 2 раза (за счет снижения активной канальцевой секреции в почках). Однако коррекции дозы при одновременном применении с пробенецидом не требуется, учитывая резерв безопасности активного метаболита.
Одновременный прием с амоксициллином не влияет на плазменные концентрации осельтамивира и его компонентов, демонстрируя слабую конкуренцию за выведение путем анионной канальцевой секреции.
Одновременный прием с парацетамолом не влияет на плазменные концентрации осельтамивира и его активного метаболита или парацетамола.
Фармакокинетических взаимодействий между осельтамивиром, его основным метаболитом не обнаружено при одновременном приеме с парацетамолом, ацетилсалициловой кислотой, циметидином или антацидными средствами (магния и алюминия гидроксид, кальция карбонат), варфарином, римантадином или амантадином.
При использовании осальтемивира с часто применяемыми препаратами, такими как ингибиторы ангиотензинпревращающего фермента (эналаприл, каптоприл), тиазидные диуретики (бендрофлуметиазид), антибиотики (пенициллин, цефалоспорины азитромицин, эритромицин и доксициклин), блокаторы Н2-гистаминовых рецепторов (ранитидин, циметидин), бета-адреноблокаторы (пропранолол), ксантины (теофиллин), симпатомиметики (псевдоэфедрин), опиаты (кодеин), глюкокортикостероиды, ингаляционные бронхолитики и ненаркотические анальгетики (ацетилсалициловая кислота, ибупрофен и парацетамол), изменений характера или частоты нежелательных явлений не наблюдалось.
Применять осельтамивир в комбинации с препаратами, имеющими узкую широту терапевтического действия (например, хлорпропамид, метотрексат, бутадион), необходимо с осторожностью.
Особые указания
Нарушения психики
У пациентов (в основном у детей и подростков), принимавших осельтамивир с целью лечения гриппа, были зарегистрированы судороги и делирий-подобные психоневрологические нарушения. Эти случаи редко сопровождались опасными для жизни действиями. Роль осельтамивира в развитии этих явлений неизвестна. Подобные психоневрологические нарушения так же отмечены у пациентов с гриппом, не получавших осельтамивир. Риск развития психоневрологических нарушений у пациентов, получающих осельтамивир, не превышает таковой у пациентов с гриппом, не получающих противовирусные препараты.
Рекомендуется тщательное наблюдение за состоянием и поведением пациентов, особенно детей и подростков, с целью выявления признаков анормального поведения и оценки риска продолжения приема препарата при развитии данных явлений.
Данных по эффективности осельтамивира при любых заболеваниях, вызванных другими возбудителями, кроме вирусов гриппа А и В, нет.
Осельтамивир не является заменой вакцинации.
Профилактический прием препарата возможен по эпидемиологическим показаниям. Рекомендации по коррекции дозы у больных с поражением почек представлены в подразделе «Дозирование в особых случаях» (также см. «Фармакокинетика в особых группах пациентов»).
Влияние на способность управлять транспортными средствами и механизмами
Исследования по изучению влияния препарата на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не проводились. Исходя из профиля безопасности, влияние осельтамивира на данные виды деятельности маловероятно.
Форма выпуска
Капсулы по 30 мг; 45 мг; 75 мг.
Первичная упаковка лекарственного препарата.
По 5 или 10 капсул в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 20, 30 капсул в банку полимерную с крышкой натягиваемой с контролем первого вскрытия. Свободное пространство заполняют ватой медицинской. На банки наклеивают этикетки из бумаги этикеточной или писчей или из полимерных материалов, самоклеящиеся.
Вторичная упаковка лекарственного препарата.
По 1 или 2 контурной ячейковой упаковке вместе с инструкцией по применению помещают в пачку из картона для потребительской тары. Пачки помещают в групповую упаковку.
По 1 банке вместе с инструкцией по применению помещают в пачку из картона для потребительской тары. Пачки помещают в групповую упаковку.
Условия хранения
Хранить в оригинальной упаковке производителя при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности
3 года. Не использовать по истечении срока, указанного на упаковке.
Условия отпуска
Отпускается по рецепту.
Производитель
АО «Фармасинтез», Россия.
Юридический адрес:
Россия, 664007, г. Иркутск, ул. Красногвардейская, д. 23, оф. 3.
Адрес производственной площадки:
Россия, 664040, г. Иркутск, ул. Р. Люксембург, д. 184.
Претензии потребителей направлять по адресу:
АО «Фармасинтез», Россия, 664040, г. Иркутск, ул. Р. Люксембург, д. 184,
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Миртазапин Канон (Mirtazapine Canon)
💊 Состав препарата Миртазапин Канон
✅ Применение препарата Миртазапин Канон
Описание активных компонентов препарата
Миртазапин Канон
(Mirtazapine Canon)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.05.04
Владелец регистрационного удостоверения:
Код ATX:
N06AX11
(Миртазапин)
Лекарственная форма
| Миртазапин Канон |
Таб., покр. пленочной оболочкой, 30 мг: 10, 20, 30 или 60 шт. рег. №: ЛП-002195 |
Форма выпуска, упаковка и состав
препарата Миртазапин Канон
10 шт. — упаковки ячейковые контурные (1) — пачки картонные.
10 шт. — упаковки ячейковые контурные (2) — пачки картонные.
10 шт. — упаковки ячейковые контурные (3) — пачки картонные.
10 шт. — упаковки ячейковые контурные (6) — пачки картонные.
30 шт. — упаковки ячейковые контурные (1) — пачки картонные.
30 шт. — упаковки ячейковые контурные (2) — пачки картонные.
Фармакологическое действие
Антидепрессант тетрациклической структуры. Усиливает центральную адренергическую и серотонинергическую передачу. Блокирует серотониновые 5-HT2— и 5-НТ3-рецепторы, в связи с этим усиление серотонинергической передачи реализуется только через серотониновые 5-HT1-рецепторы. В проявлении антидепрессивной активности участвуют оба пространственных энантиомера: S(+)-энантиомер блокирует α2-адренорецепторы и серотониновые 5-HT2-рецепторы. Умеренно блокирует гистаминовые Н1-рецепторы, оказывает седативное действие.
Мало влияет на α1-адренорецепторы и холинорецепторы; в терапевтических дозах не оказывает существенного влияния на сердечно-сосудистую систему.
В клинических условиях проявляется также анксиолитическое и снотворное действие, поэтому миртазапин наиболее эффективен при тревожных депрессиях разного генеза. Благодаря умеренному седативному действию в процессе лечения не актуализирует суицидальные мысли.
Фармакокинетика
Миртазапин после приема внутрь быстро абсорбируется из ЖКТ. Биодоступность составляет 50%. Cmax в плазме крови достигается через 2 ч.
Css в плазме крови устанавливается через 3-4 дня постоянного приема. Связывание с белками плазмы составляет 85%.
Активно метаболизируется в печени путем деметилирования и окисления с последующей конъюгацией. Диметил-миртазапин так же фармакологически активен, как и исходное вещество.
Миртазапин выводится почками и через кишечник. T1/2 составляет 20-40 ч.
При почечной и печеночной недостаточности возможно уменьшение клиренса миртазапина.
Показания активных веществ препарата
Миртазапин Канон
Депрессивные состояния (в т.ч. ангедония, психомоторная заторможенность, бессонница, раннее пробуждение, снижение массы тела, потеря интереса к жизни, суицидальные мысли и лабильность настроения).
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
При приеме внутрь эффективная доза для взрослых составляет 15-45 мг/сут преимущественно 1 раз/сут перед сном. Дозу постепенно увеличивают до 30-45 мг/сут. Антидепрессивный эффект развивается постепенно, обычно через 2-3 недели от начала лечения, однако прием следует продолжать еще в течение 4-6 месяцев. Если в течение 6-8 недель лечения терапевтического эффекта не отмечается, лечение следует прекратить.
Отмену миртазапина проводят постепенно.
Побочное действие
Со стороны ЦНС и периферической нервной системы: сонливость, заторможенность, эмоциональная лабильность, изменения ментальности, ажитация, тревожность, апатия, галлюцинации, деперсонализация, враждебность, мания, эпилептические припадки, головокружение, вертиго, гиперестезия, судороги, тремор, миоклонус, гиперкинез, гипокинезия.
Со стороны органов кроветворения: угнетение кроветворения — гранулоцитопения, агранулоцитоз, нейтропения, эозинофилия, апластическая анемия, тромбоцитопения.
Со стороны обмена веществ: небольшое повышение аппетита и увеличение массы тела; в единичных случаях — отеки.
Со стороны сердечно-сосудистой системы: редко — ортостатическая гипотензия.
Со стороны пищеварительной системы: тошнота, рвота, запоры, повышение аппетита, увеличение массы тела, сухость во рту, жажда, боли в животе; в единичных случаях — повышение активности трансаминаз печени.
Со стороны половой системы: снижение потенции, дисменорея.
Прочие: кожные высыпания, крапивница, гриппоподобный синдром, удушье, отечный синдром, миалгия, боли в спине дизурия.
Противопоказания к применению
Почечная и печеночная недостаточность, беременность, лактация, повышенная чувствительность к миртазапину.
Применение при беременности и кормлении грудью
Противопоказан к применению при беременности и в период лактации.
Применение при нарушениях функции печени
С осторожностью применяют у пациентов с нарушениями функции печени.
Применение при нарушениях функции почек
С осторожностью применяют у пациентов с нарушениями функции почек.
Применение у детей
Миртазапин не применяют у детей в связи с отсутствием данных об эффективности и безопасности его применения в педиатрической практике.
Особые указания
С осторожностью применяют у пациентов с эпилепсией и органическими поражениями мозга, с нарушениями функции печени и/или почек, острыми сердечно-сосудистыми заболеваниями, с артериальной гипотензией, при нарушении мочеиспускания, обусловленном доброкачественной гиперплазией предстательной железы, при закрытоугольной глаукоме, при сахарном диабете.
У пациентов с шизофренией миртазапин может вызвать усиление бреда, галлюцинаций. При лечении депрессивной фазы маниакально-депрессивного психоза это состояние может перейти в маниакальную фазу.
Внезапное прекращение приема миртазапина после длительного лечения может вызвать тошноту, головную боль, ухудшение самочувствия.
Следует иметь в виду, что при появлении в период лечения таких симптомов как повышение температуры тела, боль в горле, стоматит лечение следует прекратить и сделать клинический анализ крови.
При появлении желтухи прием миртазапина следует прекратить.
Не следует применять одновременно с ингибиторами МАО и в течение 2 недель после их отмены.
Возможно развитие лекарственной зависимости, синдрома отмены.
В период лечения пациентам следует воздерживаться от употребления алкоголя.
Миртазапин не применяют у детей в связи с отсутствием данных об эффективности и безопасности его применения в педиатрической практике.
Влияние на способность к управлению транспортными средствами и механизмами
С осторожностью применять у пациентов, деятельность которых связана с необходимостью высокой концентрации внимания и быстроты психомоторных реакций.
Лекарственное взаимодействие
При одновременном применении миртазапин усиливает седативный эффект производных бензодиазепина.
Описан случай развития гипертонического криза при одновременном применении с клонидином.
При одновременном применении с леводопой описан случай развития тяжелого психоза; с сертралином — случай развития гипомании.
При одновременном применении с этанолом возможно усиление угнетающего влияния на ЦНС этанола и этанолсодержащих препаратов.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Мирзатен® (30 мг)
МНН: Миртазапин
Производитель: КРКА, д.д., Ново Место
Анатомо-терапевтическо-химическая классификация: Mirtazapine
Номер регистрации в РК:
№ РК-ЛС-5№021298
Информация о регистрации в РК:
17.09.2020 — 17.09.2030
Номер регистрации в РБ:
8528/08/13/19
Информация о регистрации в РБ:
12.09.2019 — бессрочно
- Скачать инструкцию медикамента
Торговое название
Мирзатен®
Международное непатентованное название
Миртазапин
Лекарственная форма
Таблетки, покрытые пленочной оболочкой, 30 мг и 45 мг
Состав
Одна таблетка содержит
активное вещество — миртазапин 30 мг или 45 мг,
вспомогательные вещества: целлактоза (состоит из альфа-лактозы моногидрата и порошка целлюлозы), натрия крахмала гликолят, крахмал
прежелатинизированный, кремния диоксид коллоидный безводный, магния стеарат,
оболочка (для дозировки 30 мг): гипромеллоза, титана диоксид
(Е 171), железа оксид красный (Е172), железа оксид желтый (Е172), тальк, макрогол 6000,
оболочка (для дозировки 45 мг): гипромеллоза, титана диоксид
(Е 171), тальк, макрогол 6000.
Описание
Таблетки овальной формы, покрытые пленочной оболочкой оранжево-коричневого цвета, двояковыпуклые, с риской на одной стороне (для дозировки 30 мг).
Таблетки овальной формы, покрытые пленочной оболочкой белого цвета, двояковыпуклые (для дозировки 45 мг).
Фармакотерапевтическая группа
Психоаналептики. Антидепрессанты. Антидепрессанты другие. Миртазапин.
Код АТХ N06AX11
Фармакологические свойства
Фармакокинетика
После перорального приема миртазапин быстро всасывается (биодоступность около 50%), достигая максимальной концентрации в плазме крови приблизительно через 2 ч. Около 85% миртазапина связывается с белками плазмы. Средний период полувыведения составляет от 20 до 40 ч (редко до 65 час). Более короткий период полувыведения наблюдается у молодых людей. Равновесная концентрация устанавливается через 3-5 дней. В рекомендуемом диапазоне доз фармакокинетические показатели миртазапина имеют линейную зависимость от введенной дозы препарата. Прием пищи не оказывает влияние на фармакокинетику миртазапина.
Миртазапин активно метаболизируется и выводится с мочой и калом в течение нескольких дней. Основными путями его метаболизма в организме являются деметилирование и окисление с последующей конъюгацией. Цитохром Р450-зависимые ферменты CYP2D6 и CYP1A2 участвуют в образовании 8-гидрокси-метаболита миртазапина, в то время, как CYP3A4 предположительно определяет образование N-деметилированных и N-окисленных метаболитов. Образовавшийся метаболитдеметил-миртазапин фармакологически активен и, по-видимому, фармакокинетически подобен исходному соединению. Клиренс миртазапина снижается при почечной или печеночной недостаточности.
Фармакодинамика
Мирзатен® препарат из группы тетрациклических антидепрессантов, является антагонистом пресинаптических и постсинаптических α2-адренорецепторов в центральной нервной системе и усиливает центральную норадренергическую и серотонинергическую (5-НТ1-рецепторы) передачу нервных импульсов. Миртазапин также блокирует 5-НТ2 и 5-НТ3-рецепторы.
Седативные свойства миртазапина обусловлены его антагонистической активностью по отношению к H1-гистаминовым рецепторам.
В терапевтических дозах практически не оказывает антихолинергического действия и практически не влияет на сердечно-сосудистую систему.
Мирзатен® обладает также анксиолитическим и снотворным свойствами, поэтому наиболее эффективен при тревожных депрессиях разного генеза. Антидепрессивный эффект проявляется через 1-2 недели лечения.
Показания к применению
— эпизоды большой депрессии
Способ применения и дозы
Таблетки следует применять внутрь, глотать, не разжевывая, запивая небольшим количеством воды, вне зависимости от приема пищи.
Взрослые
Начальная доза 15 или 30 мг, предпочтительно вечером перед сном. Поддерживающая суточная доза обычно составляет 15 – 45 мг.
Пациенты пожилого возраста
Рекомендованная суточная доза аналогична той, что и для взрослых. С целью достижения удовлетворительного и безопасного результата, дозы для пациентов пожилого возраста повышают под строгим контролем врача.
Дети и подростки в возрасте младше 18 лет
Мирзатен® не следует применять у детей и подростков в возрасте до 18 лет, так как его эффективность в клинических исследованиях не доказана, а также возможны угрозы безопасности.
Почечная недостаточность
Клиренс миртазапина может снижаться у пациентов с почечной недостаточностью умеренной или тяжелой степени (клиренс креатинина <40 мл/мин). Это следует учитывать при назначении препарата Мирзатен® у данной категории пациентов.
Печеночная недостаточность
Клиренс миртазапина может также снижаться у пациентов с печеночной недостаточностью, что необходимо учитывать, назначая Мирзатен®
для этой категории пациентов, особенно при печеночной недостаточности тяжелой степени.
Период полувыведения миртазапина составляет 20-40 часов, поэтому его можно применять один раз в сутки. Желательно применять однократную дозу препарата на ночь перед сном. Суточную дозу препарата можно разделить на два приема (утром и вечером; большую дозу следует принимать на ночь) до полного исчезновения симптомов.
Мирзатен® начинает оказывать действие после 1–2 недель лечения. Терапия адекватной дозой должна привести к положительному ответу в течение 2–4 недель. При недостаточной реакции, дозу можно повысить до максимальной. Если на протяжении следующих 2–4 недель лечения в максимальной дозе положительного ответа не будет, терапию следует отменить.
После получения оптимального клинического эффекта лечение следует продолжать в течение 4 — 6 месяцев.
Прекращать лечение миртазапином рекомендуется постепенно, во избежание развития симптомов отмены.
Побочные действия
Очень часто (≥1/10):
-
увеличение массы тела1, повышение аппетита1
-
сонливость1, седация1,4, головная боль2
-
сухость во рту
Часто (≥1/100 дo <1/10):
-
нарушение сна, спутанность сознания, беспокойство2,5, бессонница3,5
-
летаргия1, головокружение, тремор
-
ортостатическая гипотензия
-
тошнота3, рвота2
-
диарея2
-
экзантема
-
артралгия, миалгия, боль в спине1
-
периферические отеки1, утомляемость
Нечасто (≥1/1 000 дo <1/100):
-
ночные кошмары2, мания, ажитация2, галлюцинации, психомоторное возбуждение (в том числе акатизия, гиперкинезия)
-
парестезия, утомляемость ног, обморок
-
артериальная гипотензия2
-
гипестезия слизистой оболочки полости рта
Редко (≥1/10 000 дo<1/1 000):
-
агрессия
-
миоклония
-
пакреатит
-
повышение активности трансаминаз в сыворотке крови
Частота неизвестна:
-
подавление функции костного мозга (гранулоцитопения, агранулоцитоз, апластическая анемия, тромбоцитопения), эозинофилия
-
нарушение секреции антидиуретического гормона
-
гипонатриемия
-
суицидальные мысли6, суицидальное поведение6
-
судороги (кровоизлияния), серотониновый синдром, дизартрия
-
отек слизистой оболочки полости рта, повышенное слюноотделение
-
временное повышение уровня трансаминаз и гамма-глутамилтрансферазы
-
синдром Стивенса-Джонсона, буллезный дерматит, мультиформная эритема, токсический эпидермальный некролиз
-
задержка мочевыделения
1В клинических испытаниях эти действия происходили статистически значительно чаще
во время лечения с миртазапином, чем с плацебо.
2В клинических испытаниях эти действия происходили чаще во время лечения с плацебо,
чем миртазапином, однако достоверность частоты статистически не доказана.3В клинических испытаниях эти действия происходили статистически значительно чаще
во время лечения с плацебо, чем миртазапином.
4Обратите внимание: снижение дозы обычно не приводит к снижению сонливости/седации, но может поставить под угрозу антидепрессантную эффективность.5 При применении антидепрессантов, обычно могут развиваться или обостряться тревога и бессонница (которые могут быть симптомами депрессии). После лечения миртазапином развития или обострения тревоги и бессонницы не наступало.6Случаи суицидальных мыслей и суицидального поведения были зарегистрированы во время лечения миртазапином или сразу после прекращения лечения.
Противопоказания
-
повышенная чувствительность к миртазапину или другим компонентам
препарата
-
беременность и период лактации
-
одновременный прием ингибиторов моноаминооксидазы (МАО)
Лекарственные взаимодействия
Фармакодинамические взаимодействия
Миртазапин не следует принимать одновременно с ингибиторами МАО или на протяжении двух недель после прекращения терапии ингибиторами МАО. Также после завершения лечения миртазапином должно пройти около двух недель, прежде чем пациенты смогут применять ингибиторы МАО.
Как и с СИОЗС, одновременный прием миртазапина с другими серотонинергическимии активными веществами (L-триптофан, триптан, трамадол, линезолид, СИОЗС, венлафаксин, литий и препараты, содержащие зверобой — Hypericum perforatum) может привести к возникновению эффектов, обусловленных серотонином (серотониновый синдром). При комбинированном применении их с миртазапином рекомендуется соблюдать осторожность и пациенты должны находиться под строгим медицинским наблюдением.
Миртазапин может усиливать седативные свойства бензодиазепинов и других седативных препаратов (в частности, большинства антипсихотиков, антигистаминных препаратов антагонистов H1-рецепторов, опиоидов). При одновременном назначении этих препаратов с миртазапином рекомендуется соблюдать осторожность.
Миртазапин может усиливать депрессивное действие алкоголя на ЦНС. Поэтому пациентам следует воздержаться от употребления алкоголя на период лечения препаратом миртазапин.
Миртазапин в дозе 30 мг один раз в сутки вызывает небольшое, но статистически значимое увеличение международного нормализованного индекса (МНИ) у пациентов, которых лечили варфарином. Так как не исключен более выраженный эффект при приеме более высоких доз миртазапина, рекомендуется контролировать МНИ в случае сопутствующего применения варфарина с миртазапином.
Фармакокинетические взаимодействия
Карбамазепин и фенитоин, индукторы CYP3A4 увеличивают клиренс миртазапина приблизительно в два раза и, как следствие, концентрация миртазапина в плазме крови уменьшается на 60 и 45%, соответственно. Когда карбамазепин или любой другой индуктор печеночного метаболизма (например, рифампицин) добавляют к терапии миртазапином, дозу последнего следует повысить. Если лечение таким препаратом прекращается, может возникнуть необходимость в снижении дозы миртазапина.
Сопутствующее применение сильного ингибитора CYP3A4 — кетоконазола – приводило к повышению максимальной концентрации препарата в плазме крови и AUC миртазапина приблизительно на 40% и 50%, соответственно.
При применении циметидина (слабого ингибитора CYP1A2, CYP2D6 и CYP3A4) с миртазапином, средние плазменные концентрации миртазапина могут повышаться более чем на 50%. Следует снизить дозу при сочетанном применении миртазапина с мощными ингибиторами CYP3A4, ингибиторами ВИЧ-протеазы, азольными противогрибковыми средствами, эритромицином, циметидином или нефазодоном.
Исследования лекарственного взаимодействия не выявили какого-либо клинически значимого фармакокинетического взаимодействия при одновременном применении миртазапина с пароксетином, амитриптилином, рисперидоном или литием.
Особые указания
Суицид, суицидальные мысли и клиническое ухудшение
Депрессия связана с повышенным риском суицидальных мыслей, нанесением себе вреда и суицидом (события, связанные с суицидом). Этот риск наблюдается до возникновения выраженной ремиссии. Поскольку улучшение может не наступить на протяжении первых недель лечения или более, пациенты должны находиться под строгим контролем врача до наступления улучшения. Согласно общему клиническому опыту, риск суицида может повышаться на ранних стадиях выздоровления. Известно, что пациенты с суицидальными попытками в анамнезе или пациенты, которые проявляют выраженную степень суицидального мышления еще до начала терапии имеют высокий риск возникновения суицидальных мыслей или попыток самоубийства и должны находиться под строгим контролем на протяжении всего лечения. Установлено, что у взрослых с психическими расстройствами, риск развития суицидального поведения при приеме антидепрессантов выше по сравнению с пациентами в возрасте младше 25 лет, которые получали плацебо.
Во время терапии антидепрессантами необходим строгий контроль пациентов с высоким риском суицидального поведения, особенно в начале терапии и после изменения дозирования. Пациентов (и лиц, осуществляющих уход за пациентами) следует предупреждать о необходимости обращать внимание на любые клинические проявления, суицидальное поведение или мысли и непривычные изменения в поведении и обращаться за медицинскими рекомендациями немедленно, если такие симптомы возникли.
Принимая во внимание возможность самоубийства, особенно в начале лечения, пациенту необходимо дать минимально необходимое количество таблеток.
Подавление функции костного мозга
Во время лечения миртазапином сообщалось о подавлении деятельности костного мозга, что обычно проявляется гранулоцитопенией или агранулоцитозом. Этот эффект обычно наблюдается после 4 — 6 недель лечения, но, как правило, исчезает после прекращения лечения.
Сообщалось о редких обратимых случаях агранулоцитоза в клинических исследованиях. В постмаркетинговом периоде при приеме миртазапина наблюдались очень редкие случаи агранулоцитоза, в основном они были обратимы, но иногда со смертельным исходом. Летальные случаи преимущественно наблюдались у пациентов в возрасте старше 65 лет. Врач должен обращать внимание на такие симптомы, как лихорадка, боль в горле, стоматит или другие признаки инфекции. Когда возникают такие симптомы, лечение следует прекратить и сделать анализ крови.
Желтуха
При появлении желтухи лечение необходимо прекратить.Состояния, при которых необходим строгий контроль врача
Осторожное дозирование, а также регулярное и тщательное наблюдение необходимы пациентам со следующими состояниями:
-
эпилепсия и органические поражения головного мозга: как и другие антидепрессанты, миртазапин следует применять с особой осторожностью пациентам с эпилептическими приступами в анамнезе. Лечение следует прекратить пациентам, у которых развиваются эпилептические приступы, или, когда отмечают повышение частоты эпилептических приступов;
-
печеночная недостаточность: после применения однократной дозы 15 мг миртазапина внутрь, его клиренс уменьшался приблизительно на 35% у больных с печеночной недостаточностью легкой или умеренной степени тяжести по сравнению с пациентами с нормальной функцией печени. Средняя плазменная концентрация миртазапина увеличивалась приблизительно на 55%;
-
почечная недостаточность: после применения однократной дозы 15 мг миртазапина внутрь, у пациентов с почечной недостаточностью умеренной степени (клиренс креатинина <40 мл/мин) или тяжелой степени (клиренс креатинина <10 мл/мин) клиренс миртазапина снижался приблизительно на 30 и 50% соответственно, по сравнению со здоровыми пациентами. Средняя концентрация миртазапина в плазме крови повышалась на 55 и 115%, соответственно. Значительных отличий у пациентов с почечной недостаточностью легкой степени (клиренс креатинина <80 мл/мин) по сравнению с контрольной группой не наблюдалось;
-
заболевания сердца: при нарушении проводимости, стенокардии и недавно перенесенном инфаркте миокарда, принимать препарат и назначать сопутствующую терапию следует с осторожностью;
-
низкое артериальное давление;
-
сахарный диабет: у пациентов с сахарным диабетом антидепрессанты могут влиять на контроль уровень глюкозы в крови. Может возникнуть необходимость в коррекции дозы инсулина и/или пероральных гипогликемических препаратов и рекомендуется тщательное наблюдение.
Как и при применении других антидепрессантов, необходимо принять во внимание следующее:
-
у пациентов с шизофренией или другими психическими расстройствами могут обостряться психотические симптомы; могут стать более интенсивными параноидальные мысли;
-
при лечении депрессивной фазы биполярного расстройства, она может перейти в маниакальную фазу. Необходимо тщательно наблюдать пациентов с маниакальными или гипоманиакальными проявлениями в анамнезе. Применение миртазапина следует прекратить, если пациент входит в маниакальную фазу;
-
хотя зависимость к препарату не возникает, постмаркетинговый опыт применения показывает, что внезапное прекращение лечения после продолжительного применения может иногда приводить к появлению симптомов отмены. Большинство реакций отмены проявляются незначительными клиническими симптомами и проходят сами. Среди разных симптомов отмены, о которых сообщалось, наиболее частыми были головокружение, возбуждение, беспокойство, головная боль и тошнота. Хотя о них сообщалось как о симптомах отмены, следует помнить, что они могут быть связаны с течением основного заболевания. Лечение миртазапином рекомендуется прекращать постепенно;
-
необходима осторожность при лечении пациентов с расстройствами мочевыделения, таких как гипертрофия предстательной железы, и у пациентов с острой закрытоугольной глаукомой и повышенным внутриглазным давлением (однако влияние миртазапина маловероятно из-за его очень низкой антихолинергической активности);
-
акатизия/психомоторное возбуждение: применение антидепрессантов связано с развитием акатизии, что характеризовалась субъективно неприятным или тревожным возбуждением и необходимостью часто двигаться вместе с невозможностью спокойно сидеть или стоять. Вероятнее всего, эти симптомы могут возникнуть на протяжении первых нескольких недель лечения. У пациентов, у которых развиваются эти симптомы, повышение дозы может вредить здоровью.
Гипонатриемия
Сообщалось о редких случаях гипонатриемии при применении миртазапина, что вероятно связано с неадекватной секрецией антидиуретического гормона (SIADH). Пациенты, находящиеся в группе высокого риска, такие как лица пожилого возраста или лица, применяющие сопутствующую терапию, которая может вызвать гипонатриемию, требуют особого контроля.
Серотониновый синдром
Серотониновый синдром может возникнуть, когда селективные ингибиторы обратного захвата серотонина (СИОЗС) применяют одновременно с другими серотонинергическими активными веществами. Симптомами серотонинового синдрома могут быть гипертермия, ригидность, миоклония, автономная нестабильность с возможными быстрыми колебаниями жизненно важных показателей, изменения психического состояния включают спутанность сознания, раздражительность и высокое возбуждение, которое прогрессирует до делирия и комы. При одновременном применении этих активных веществ с миртазапином необходимо соблюдать осторожность и рекомендуется строгое наблюдение врача. При возникновении таких симптомов лечение миртазапином следует прекратить и начать поддерживающее симптоматическое лечение. Постмаркетинговый опыт показывает, что серотониновый синдром встречается крайне редко у пациентов, получавших только миртазапин.
Пациенты пожилого возраста
Пациенты пожилого возраста часто более чувствительны, особенно если это касается нежелательных эффектов, которые проявляются на фоне применения антидепрессантов. Во время клинических исследований при приеме миртазапина возникновение побочных реакций у лиц пожилого возраста отмечали не чаще, чем у пациентов других возрастных групп.
Специальная информация о некоторых ингредиентах
Мирзатен® содержит лактозу, поэтому препарат не следует назначать пациентам с редкими наследственными формами непереносимости галактозы, дефицитом лактазы или синдромом глюкозо-галактозной мальабсорбции
Применение у детей и подростков в возрасте младше 18 лет
Мирзатен® не следует применять для лечения детей и подростков в возрасте младше 18 лет.
Суицидальные поведения (попытка самоубийства и суицидальные мысли) и враждебность (преимущественно агрессия, оппозиционное поведение и гнев) чаще отмечались в клинических исследованиях среди детей и подростков, получавших антидепрессанты, по сравнению с пациентами, получавшими плацебо. Долгосрочные данные по безопасности у детей и подростков, касающихся роста, созревания и когнитивного и поведенческого развития ограничены.
Беременность и лактация
Эпидемиологические данные позволяют предположить, что использование СИОЗС во время беременности, особенно на поздних сроках беременности, может увеличивать риск стойкой легочной гипертензии у новорожденных (СЛГН). Хотя исследования связи СЛГН и лечения миртазапином не проводились, этот потенциальный риск не может быть исключен, учитывая установленный механизм действия (увеличение концентрации серотонина).
Нет достаточных данных об использовании миртазапина у беременных женщин. Исследования на животных не показали тератогенного действия или репродуктивную токсичность клинической значимости. Потенциальный риск для человека неизвестен. Миртазапин не следует использовать во время беременности.
Хотя эксперименты на животных показывают, что миртазапин выводится только в очень небольших количествах в молоке, использование миртазапина кормящим матерям не рекомендуется. Данные для человека отсутствуют.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Миртазапин может умеренно снижать концентрацию внимания и бдительность, особенно в начале лечения. Это следует учитывать перед выполнением работ, требующих особого внимания и концентрации, например, вождения и эксплуатации опасных машин.
Передозировка
Симптомы: угнетение центральной нервной системы с нарушением ориентации в пространстве, продолжительным седативным эффектом, галлюцинации, тахикардия, умеренное повышение или снижение артериального давления. Однако, возможны более тяжелые последствия (включая летальные) при применении доз, намного выше терапевтической,
особенно при смешанных передозировках.
При передозировке пациентам следует проводить соответствующую симптоматическую терапию и поддерживать жизненные функции организма.
Лечение: промывание желудка, активированный уголь, симптоматическая терапия и поддержание жизненных функций организма.
Форма выпуска и упаковка
По 10 таблеток помещают в контурную ячейковую упаковку из пленки белой поливинилхлоридной/поливинилдихлоридной и фольги алюминиевой.
По 3, 6, 9 контурных ячейковых упаковок вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона.
Условия хранения
Хранить при температуре не выше 25°С.
Хранить в недоступном для детей месте!
Срок хранения
5 лет
Не применять по истечении срока годности
Условия отпуска из аптек
По рецепту
Производитель
КРКА, д.д., Ново место,
Шмарьешка цеста, 6, Словения
Владелец регистрационного удостоверения
КРКА, д.д., Ново место, Словения
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
ТОО «КРКА Казахстан», РК, 050059, г. Алматы, пр. Аль-Фараби 19,
корпус 1б, 2-й этаж, 207 офис
тел.: +7 (727) 311 08 09
факс: +7 (727) 311 08 12
info.kz@krka.biz
| 893441851477976543_ru.doc | 126.5 кб |
| 245197991477977714_kz.doc | 159.5 кб |
| 8528_08_13_19_p.pdf | 0.64 кб |
| 8528_08_13_19_s.pdf | 1.02 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники. «Центр экспертиз и испытаний в здравоохранении» МЗ РБ
порошок для приготовления суспензии для приема внутрь
Один грамм порошка для приготовления суспензии для приема внутрь содержит:
Действующее вещество: осельтамивира фосфат (в пересчете на осельтамивир) — 39,4 мг (30,0 мг);
Вспомогательные вещества: мальтитол — 841,0 мг, кальция гидрофосфат — 15,0 мг, натрия бензоат — 2,5 мг, повидон К17 — 15,1 мг, камедь ксантановая — 15,0 мг, натрия цитрат — 55,0 мг, натрия сахаринат — 2,0 мг, ароматизатор земляничный — 12,0 мг, ароматизатор цитрусовый — 3,0 мг.
Порошок: мелкий гранулированный порошок от белого до светло-желтого цвета, с фруктовым запахом. Допускается комкование.
Суспензия: непрозрачная суспензия от белого до светло-желтого цвета, с фруктовым запахом.
Противовирусное средство
АТХ J05AH02 Осельтамивир
Фармакодинамика
Механизм действия
Противовирусный препарат. Осельтамивир является пролекарством, его активный метаболит (осельтамивира карбоксилат, ОК) — эффективный и селективный ингибитор нейраминидазы вирусов гриппа типа А и В — фермента, катализирующего процесс высвобождения вновь образованных вирусных частиц из инфицированных клеток, их проникновения в неинфицированные клетки эпителия дыхательных путей и дальнейшего распространения вируса в организме. Тормозит рост вируса гриппа in vitro и подавляет репликацию вируса и его патогенность in vivo, уменьшает выделение вирусов гриппа А и В из организма. Концентрации ОК, необходимая для ингибирования нейраминидазы на 50% (IC50), составляет 0,1-1,3 нМ для вируса гриппа А и 2,6 нМ для вируса гриппа В. Медиана значений IC50 для вируса гриппа В несколько выше и составляет 8,5 нМ.
Клиническая эффективность
В проведенных исследованиях осельтамивир не оказывал влияния на образование противогриппозных антител, в том числе на выработку антител в ответ на введение инактивированной вакцины против гриппа.
Исследования естественной гриппозной инфекции
В клинических исследованиях, проведенных во время сезонной инфекции гриппа, пациенты начинали получать осельтамивир не позднее 40 ч после появления первых симптомов гриппозной инфекции. 97% пациентов были инфицированы вирусом гриппа А и 3% пациентов — вирусов гриппа В. Осельтамивир значительно сокращал период клинических проявлений гриппозной инфекции (на 32 ч). У пациентов с подтвержденным диагнозом гриппа, принимавших осельтамивир, тяжесть заболевания, выраженная как площадь под кривой для суммарного индекса симптомов, была на 38% меньше по сравнению с пациентами, получавшими плацебо. Более того, у молодых пациентов без сопутствующих заболеваний осельтамивир снижал примерно на 50% частоту развития осложнений гриппа, требующих применения антибиотиков (бронхита, пневмонии, синусита, среднего отита). Были получены доказательства эффективности препарата в отношении вторичных критериев эффективности, относящихся к антивирусной активности: осельтамивир вызывал как укорочение времени выделения вируса из организма, так и уменьшение площади под кривой «вирусные титры — время».
Данные, полученные в исследовании по терапии осельтамивиром у пациентов пожилого и старческого возраста, показывают, что прием осельтамивира в дозе 75 мг 2 раза в сутки в течение 5 дней сопровождался клинически значимым уменьшением медианы периода клинических проявлений гриппозной инфекции, аналогичным таковому у взрослых пациентов более молодого возраста, однако различия не достигали статистической значимости. В другом исследовании пациенты с гриппом старше 13 лет, имевшие сопутствующие хронические заболевания сердечно-сосудистой и/или дыхательной систем, получали осельтамивир в том же режиме дозирования или плацебо. Отличий в медиане периода до уменьшения клинических проявлений гриппозной инфекции в группах пациентов, получавших осельтамивир и плацебо не было, однако период повышения температуры при приеме осельтамивира сокращался примерно на 1 день. Доля пациентов, выделяющих вирус на 2-ой и 4-ый день, становилась значительно меньше. Профиль безопасности осельтамивира у пациентов группы риска не отличался от такового в общей популяции взрослых пациентов.
Лечение гриппа у беременных женщин
Контролируемых исследований у беременных женщин не проводилось. Однако результаты постмаркетинговых и ретроспективных наблюдательных исследований продемонстрировали пользу предлагаемого режима дозирования для данной популяции пациентов в отношении снижения заболеваемости/смертности. Результаты фармакокинетического анализа показали более низкую экспозицию активного метаболита, тем не менее, изменение режима дозирования у беременных женщин при проведении терапии или профилактики не рекомендуется (см. раздел «Фармакологические свойства», подраздел «Фармакокинетика в особых группах пациентов», пункт «Беременные женщины»).
Лечение гриппа у детей
У детей в возрасте 1-12 лет (средний возраст 5,3 года), имевших лихорадку (> 37,8 °С) и один из симптомов со стороны дыхательной системы (кашель и ринит) в период циркуляции вируса гриппа среди населения, было проведено двойное слепое плацебоконтролируемое исследование. 67% пациентов были инфицированы вирусом гриппа А и 33% пациентов — вирусом гриппа В. Осельтамивир (при приеме не позднее 48 ч после появления первых симптомов гриппозной инфекции) значительно снижал продолжительность заболевания (на 35,8 ч) по сравнению с плацебо. Продолжительность заболевания определялась как время до купирования кашля, заложенности носа, исчезновения лихорадки, возвращения к обычной активности. В группе детей, получавших осельтамивир, частота острого среднего отита снижалась на 40% по сравнению с группой плацебо. Выздоровление и возвращение к обычной активности наступало почти на 2 дня раньше у детей, получавших осельтамивир, по сравнению с группой плацебо.
В другом исследовании участвовали дети в возрасте 6-12 лет, страдающие бронхиальной астмой; 53,6% пациентов имели гриппозную инфекцию, подтвержденную серологически и/или в культуре. Медиана продолжительности заболевания в группе пациентов, получавших осельтамивир, значительно не снижалась. Но к последнему 6-му дню терапии осельтамивиром объем форсированного выхода за 1 сек (ОФВ1) повышался на 10,8% по сравнению с 4,7% у пациентов, получавших плацебо (р=0,0148).
Профилактика гриппа у взрослых и подростков
Профилактическая эффективность осельтамивира при естественной гриппозной инфекции А и В была доказана в 3 отдельных клинических исследованиях III фазы. На фоне приема осельтамивира гриппом заболели около 1% пациентов. Осельтамивир значительно уменьшал частоту выделения вируса и предотвращал передачу вируса от одного члена семьи к другому.
Взрослые и подростки, которые были в контакте с заболевшим членом семьи, начинали прием осельтамивира в течение двух дней после возникновения симптомов гриппа у членов семьи и продолжали его в течение 7 дней, что достоверно уменьшало частоту случаев гриппа у контактировавших лиц на 92%.
У непривитых и в целом здоровых взрослых в возрасте 18-65 лет прием осельтамивира во время эпидемии гриппа существенно снижал заболеваемость гриппом (на 76%). Пациенты принимали осельтамивир в течение 42 дней.
У лиц пожилого и старческого возраста, находившихся в домах престарелых, 80% из которых были привиты перед сезоном, когда проводилось исследование, осельтамивир достоверно снижал заболеваемость гриппом на 92%. В том же исследовании осельтамивир достоверно (на 86%) уменьшал частоту осложнений гриппа: бронхита, пневмонии, синусита. Пациенты принимали осельтамивир в течение 42 дней.
Профилактика гриппа у детей
Профилактическая эффективность осельтамивира при естественной гриппозной инфекции была продемонстрирована у детей от 1 года до 12 лет после контакта с заболевшим членом семьи или с кем-то из постоянного окружения. Основным параметром эффективности была частота лабораторно подтвержденной гриппозной инфекции.
Профилактика гриппа у лиц с ослабленным иммунитетом
У лиц с ослабленным иммунитетом при сезонной гриппозной инфекции и при отсутствии вирусовыделения исходно, профилактическое применение осельтамивира приводило к снижению частоты лабораторно подтвержденной гриппозной инфекции, сопровождающейся клинической симптоматикой, до 0,4% (1/232) по сравнению с 3% (7/231) в группе плацебо. Лабораторно подтвержденная гриппозная инфекция, сопровождающаяся клинической симптоматикой, диагностировалась при наличии температуры в полости рта выше 37,2 °С, кашля и/или острого ринита (все зарегистрированные в один и тот же день во время приема осельтамивира/плацебо), а также положительного результата обратно-транскриптазной полимеразной цепной реакции на РНК вируса гриппа.
Лечение гриппа у взрослых пациентов с ослабленным иммунитетом
В рандомизированном двойном слепом исследовании оценки профиля безопасности осельтамивира и его влияния на развитие резистентности вируса гриппа (первичный анализ) у пациентов с ослабленным иммунитетом и гриппозной инфекцией принимал участие 151 пациент. Эти пациенты (n=151) были пригодны также и для оценки эффективности осельтамивира (вторичный небустерный анализ).
В исследование были также включены пациенты после трансплантации солидных органов, гематопоэтических стволовых клеток, ВИЧ+ пациенты с числом CD4+ клеток <500 клеток/мм3, пациенты, получавшие иммуносупрессивную терапию, а также пациенты со злокачественным гемобластозом.
Пациенты были рандомизированы в группу лечения осельтамивиром на протяжении 10 дней (группа стандартной дозы — 73 пациента, группа двойной дозы — 78 пациентов) в течение 96 часов с момента развития симптомов гриппа.
Среднее время разрешения симптомов гриппа было сопоставимо в группе стандартной дозы (103 часа, 90% доверительный интервал 75,4-110,0) и в группе двойной дозы (104 часа, 90% доверительный интервал 65,8-131,0). Соотношение пациентов с вторичными инфекциями было также сопоставимо (8,2% в группе стандартной дозы и 5,1% в группе двойной дозы).
Резистентность
Клинические исследования
Риск появления вирусов гриппа со сниженной чувствительностью или явной резистентностью к осельтамивиру изучался в клинических исследованиях.
Появление резистентности вируса к осельтамивиру чаще наблюдалось у детей чем у взрослых пациентов (18% у младенцев в возрасте <1 года и <1% у взрослых пациентов).
У детей с резистентным к осельтамивиру вирусом носительство, как правило, имело более продолжительный характер по сравнению с субъектами с вирусом, обладающим чувствительностью. Однако вызванная терапией резистентность к осельтамивиру не влияла на терапевтический ответ и не вызывала продления симптомов гриппа.
У взрослых пациентов с ослабленным иммунитетом, получавших осельтамивир в стандартной дозе (14,9%, 10 пациентов из 67) или двойной дозе (2,8%, 2/71) на протяжении 10 дней, частота развития резистентности к осельтамивиру, в среднем, была выше чем у взрослых пациентов с нормальным иммунитетом, также получавших осельтамивир. Большинство пациентов с резистентностью перенесли трансплантацию (8/10 пациентов в группе стандартной дозы и 2/2 пациента в группе двойной дозы).
Большая часть пациентов-носителей осельтамивир-резистентного вируса была инфицирована вирусом гриппа типа А; носительство имело продолжительный характер. Частота развития резистентности к осельтамивиру в клинических исследованиях.
| Популяция пациентов | Пациенты с мутациями, приводящими к резистентности | |
| Фенотипирование* | Гено-и фенотипирование* | |
| Взрослые и подростки | 21/2377 (0,88%) | 27/2391 (1,12%) |
| Дети (1-12 лет) | 66/1698 (3,89%) | 72/1698 (4,24%) |
| Младенцы (<1 года) | 13/71 (18,31%) | 13/71 (18,31%) |
*Полное генотипирование не было проведено ни в одном из исследований.
Профилактика гриппа
При приеме осельтамивира с целью постконтактной профилактики (7 дней), профилактики контактировавших в семье (10 дней) и сезонной профилактики (42 дня) улиц с нормальной функцией иммунной системы случаев резистентности не отмечено.
В 12-недельном исследовании по сезонной профилактике у лиц с ослабленным иммунитетом случаев возникновения резистентности также не наблюдалось.
Данные отдельных клинических случаев и наблюдательных исследований
У пациентов, не получавших осельтамивир, обнаружены возникающие в природных условиях мутации вирусов гриппа А и В, которые обладали сниженной чувствительностью к осельтамивиру. В 2008 году мутация по типу замены H275Y, приводящая к резистентности, была обнаружена более чем у 99 % штаммов вируса 2008 H1N1, циркулирующих в Европе. Вирус гриппа 2009 H1N1 («свиной грипп») в большинстве случаев был чувствителен к осельтамивиру. Устойчивые к осельтамивиру штаммы вируса гриппа обнаружены у лиц с нормальной функцией иммунной системы и лиц с ослабленным иммунитетом, принимавших осельтамивир. Степень снижения чувствительности к осельтамивиру и частота встречаемости подобных вирусов может отличаться в зависимости от сезона и региона. Устойчивость к осельтамивиру обнаружена у пациентов с пандемическим гриппом H1N1, получавших осельтамивир как для лечения, так и для профилактики.
Частота встречаемости резистентности может быть выше у более молодых пациентов и пациентов с ослабленным иммунитетом. Устойчивые к осельтамивиру лабораторные штаммы вирусов гриппа и вирусы гриппа от пациентов, получавших терапию осельтамивиром, несут мутации нейраминидазы N1 и N2. Мутации, приводящие к устойчивости, часто являются специфическими для подтипа нейраминидазы.
При принятии решения о применении осельтамивира следует учитывать сезонную чувствительность вируса гриппа к препарату (последнюю информацию можно найти на сайте ВОЗ).
Доклинические данные
Доклинические данные, полученные на основании стандартных исследований по изучению фармакологической безопасности, генотоксичности и хронической токсичности, не выявили особой опасности для человека.
Канцерогенность: результаты 3-х исследований по выявлению канцерогенного потенциала (двух 2-х летних исследований на крысах и мышах для осельтамивира и одного 6-ти месячного исследования на трансгенных мышах Tg:AC для активного метаболита) были отрицательными.
Мутагенность: стандартные генотоксические тесты для осельтамивира и его активного метаболита были отрицательными.
Влияние на фертильность: осельтамивир в дозе 1500 мг/кг/сут не влиял на генеративную функцию самцов и самок крыс.
Тератогенность: в исследованиях по изучению тератогенности осельтамивира в дозе до 1500 мг/кг/сут (на крысах) и до 500 мг/кг/сут (на кроликах) влияния на эмбриофетальное развитие не обнаружено. В исследованиях по изучению антенатального и постнатального периодов развития у крыс при введении осельтамивира в дозе 1500 мг/кг/сут наблюдалось увеличение периода родов: предел безопасности между экспозицией для человека и максимальной не оказывающей эффекта дозой у крыс (500 мг/кг/сут) для осельтамивира выше в 480 раз, а для его активного метаболита — в 44 раза. Экспозиция у плода составляла 15-20% от таковой у матери.
Прочее: осельтамивир и активный метаболит проникают в молоко лактирующих крыс. Согласно ограниченным данным осельтамивир и его активный метаболит проникают в грудное молоко человека. По результатам экстраполяции данных, полученных в исследованиях у животных, их количество в грудном молоке может составлять 0,01 мг/сутки и 0,3 мг/сутки, соответственно.
Примерно у 50% протестированных морских свинок при введении максимальных доз активной субстанции осельтамивира наблюдалась сенсибилизация кожи в виде эритемы. Также выявлено обратимое раздражение глаз у кроликов. В то время как очень высокие пероральные однократные дозы (657 мг/кг и выше) осельтамивира не оказали влияния на взрослых крыс, данные дозы оказывали токсическое действие на незрелых 7-дневных детенышей крыс, в том числе приводили к гибели животных. Нежелательных эффектов не наблюдалось при хроническом введении в дозе 500 мг/кг/сут с 7 по 21 день постнатального периода.
Фармакокинетика
Всасывание
Осельтамивир легко всасывается в желудочно-кишечном тракте и экстенсивно превращается в активный метаболит под действием печеночных и кишечных эстераз. Концентрация активного метаболита в плазме определяются в пределах 30 мин, время достижения максимальной концентрации 2-3 ч, и более чем в 20 раз превышают концентрации пролекарства. Не менее 75% принятой внутрь дозы попадает в системный кровоток в виде активного метаболита, менее 5% — в виде исходного препарата. Плазменные концентрации как пролекарства, так и активного метаболита пропорциональны дозе и не зависят от приема пищи.
Распределение
Объем распределения (Vss) активного метаболита — 23 л.
По данным исследований, проведенных на животных, после приема внутрь осельтамивира его активный метаболит обнаруживался во всех основных очагах инфекции (легких, промывных водах бронхов, слизистой оболочке полости носа, среднем ухе и трахее) в концентрациях, обеспечивающих противовирусный эффект.
Связь активного метаболита с белками плазмы крови — 3%. Связь пролекарства с белками плазмы крови — 42%, что недостаточно, чтобы служить причиной существенных лекарственных взаимодействий.
Метаболизм
Осельтамивир экстенсивно превращается в активный метаболит под действием эстераз, находящихся преимущественно в печени. Ни осельтамивир, ни активный метаболит не являются субстратами или ингибиторами изоферментов системы цитохрома Р450.
Выведение
Выводится (>90%) в виде активного метаболита преимущественно почками. Активный метаболит не подвергается дальнейшей трансформации и выводится почками (>99%) путем клубочковой фильтрации и канальцевой секреции. Почечный клиренс (18,8 л/ч) превышает скорость клубочковой фильтрации (7,5 л/ч), что указывает на то, что препарат выводится еще и путем канальцевой секреции. Через кишечник выводится менее 20% принятого осельтамивира. Период полувыведения активного метаболита 6-10 ч.
Фармакокинетика в особых группах пациентов
Пациенты с поражением почек
При применении осельтамивира (100 мг два раза в сутки в течение 5 дней) у пациентов с различной степенью поражения почек площадь под кривой «концентрация активного метаболита в плазме — время» (AUC осельтамивира карбоксилата) обратно пропорциональна снижению функции почек.
Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточностью (с клиренсом креатинина < 10 мл/мин), не находящихся на диализе, не изучалась.
Пациенты с поражением печени
Полученные in vitro и в исследованиях на животных данные об отсутствии значительного повышения AUC осельтамивира или его активного метаболита при нарушении функции печени легкой и средней степени тяжести были подтверждены и в клинических исследованиях (см. «Дозирование в особых случаях»). Безопасность и фармакокинетика осельтамивира у пациентов с тяжелым нарушением функции печени не изучалась.
Пациенты пожилого и старческого возраста
У пациентов пожилого и старческого возраста (65-78 лет) экспозиция активного метаболита в равновесном состоянии на 25-35% выше, чем у более молодых пациентов при назначении аналогичных доз осельтамивира. Период полувыведения препарата у пациентов пожилого и старческого возраста существенно не отличался от такового у более молодых пациентов. С учетом данных по экспозиции препарата и его переносимости пациентами пожилого и старческого возраста коррекции дозы при лечении и профилактике гриппа не требуется.
Дети в возрасте от 1 года до 8 лет и подростки
Фармакокинетику осельтамивира изучали у детей от 1 до 16 лет в фармакокинетическом исследовании с однократным приемом препарата и в клиническом исследовании по изучению многократного приема препарата у небольшого числа детей в возрасте 3-12 лет. Скорость выведения активного метаболита с поправкой на массу тела у детей младшего возраста выше, чем у взрослых, что приводит к более низким AUC по отношению к конкретной дозе. Прием препарата в дозе 2 мг/кг и однократных доз 30 мг или 45 мг в соответствии с рекомендациями по дозированию для детей и экстемпоральному приготовлению суспензии, приведенными в разделе «Способ применения и дозы», обеспечивает такую же AUC осельтамивира карбоксилата, какая достигается у взрослых после однократного приема капсулы 75 мг препарата (что эквивалентно примерно 1 мг/кг). Фармакокинетика осельтамивира у детей старше 12 лет такая же, как у взрослых.
Беременные женщины
В ходе объединенного анализа популяционной фармакокинетики было выявлено, что применение препарата в дозе, указанной в разделе «Способ применения и дозы», приводит к более низкой экспозиции активного метаболита (в среднем на 30% в течение всех триместров беременности) у беременных женщин по сравнению с небеременными женщинами. Наименьшая расчетная экспозиция, тем не менее, остается выше ингибирующих концентраций (значения IC95), одновременно находясь на уровне терапевтического воздействия для ряда штаммов вируса гриппа. Кроме того, результаты наблюдательных исследований выявляют пользу существующего режима дозирования в указанной популяции пациентов. Таким образом, изменение режима дозирования у беременных женщин при проведении терапии или профилактики гриппа не рекомендуется (см. раздел «Фармакологические свойства», подраздел «Фармакодинамика», пункт «Лечение гриппа у беременных женщин»).
Пациенты с ослабленным иммунитетом
Анализ популяционной фармакокинетики указывает на увеличение экспозиции (до 50 %) активного метаболита осельтамивира у взрослых пациентов с ослабленным иммунитетом по сравнению с пациентами с нормальным иммунитетом (как указано в разделе «Способ применения и дозы»). При этом клиренс креатинина в этих группах остается сопоставимым. Наличие сниженного иммунитета у взрослых пациентов не требует коррекции дозы осельтамивира, благодаря высокому пределу безопасности активного метаболита. Тем не менее, у взрослых пациентов с поражением почек дозы необходимо корректировать в соответствии с информацией, представленной в разделе «Способ применения и дозы».
— Лечение гриппа у взрослых и детей в возрасте старше 1 года.
— Профилактика гриппа у взрослых и подростков в возрасте старше 12 лет, находящихся в группах повышенного риска инфицирования вирусом (в воинских частях и больших производственных коллективах, у ослабленных пациентов).
— Профилактика гриппа у детей старше 1 года.
— Повышенная чувствительность к осельтамивиру или любому компоненту препарата.
— Терминальная стадия почечной недостаточности (клиренс креатинина < 10 мл/мин).
— Детский возраст до 1 года.
— Тяжелая печеночная недостаточность.
— Беременность.
— Период грудного вскармливания.
— Применение в комбинации с препаратами, имеющими узкую широту терапевтического действия (например, хлорпропамид, метотрексат, бутадион).
Беременность
Неблагоприятный исход беременности и аномалии развития плода, а также риск серьезных врожденных пороков развития, в том числе врожденных пороков сердца, связаны с заболеванием гриппом.
Большое количество данных о воздействии осельтамивира у беременных женщин в ходе постмаркетингового применения и наблюдательных исследований (более 1000 пациентов на первом триместре беременности) не указывают ни на пороки развития, ни на фето/неонатальную токсичность осельтамивира.
Однако в одном наблюдательном исследовании результаты оценки риска развития тяжелых врожденных пороков сердца, диагностированных в течение 12 месяцев после рождения, не были однозначными, хотя общий риск пороков развития и не был увеличен.
В данном исследовании частота развития тяжелых врожденных пороков сердца после применения осельтамивира в течение первого триместра беременности составляла 1,76% (7 младенцев из 397 беременностей) по сравнению с 1,01% при беременности в общей популяции без применения осельтамивира (отношение рисков 1,75, 95% доверительный интервал 0,51 до 5,98).
Клиническое значение данного результата до конца не ясно, так как исследование имело ограниченную мощность.
Кроме того, исследование было недостаточно объемным, чтобы провести достоверную оценку отдельных категорий тяжелых пороков развития; при этом данные у женщин, принимавших и не принимавших осельтамивир, не могли быть полностью сопоставимы, независимо от того, болели ли они гриппом.
Исследования на животных не указывают на репродуктивную токсичность осельтамивира (см. раздел «Фармакологические свойства», подраздел «Доклинические данные»). Применение препарата при беременности возможно в случае необходимости и после оценки имеющейся информации о безопасности и пользе (информацию о пользе применения препарата у беременных женщин см. в подразделе «Фармакодинамика», пункт «Лечение гриппа у беременных женщин»), а также патогенности циркулирующего штамма вируса гриппа.
Грудное вскармливание
Во время доклинических исследований осельтамивир и активный метаболит проникали в молоко лактирующих крыс. Данные по экскреции осельтамивира с грудным молоком у человека и применению осельтамивира кормящими женщинами ограничены. Ограниченные данные показывают, что осельтамивир и его активный метаболит в небольших количествах проникают в грудное молоко, создавая субтерапевтические концентрации в крови грудного ребенка. При назначении осельтамивира кормящим женщинам следует также учитывать их сопутствующие заболевания и патогенность циркулирующего штамма вируса гриппа. При беременности и в период грудного вскармливания осельтамивир применяют только в случае, если ожидаемая явная польза для кормящей матери превышает риск для ребенка.
Внутрь, во время еды или независимо от приема пищи.
Переносимость осельтамивира можно улучшить, если принимать его во время еды.
Желательно, чтобы приготовлением суспензии занимался фармацевт или провизор.
Приготовление суспензии
1. Осторожно несколько раз постучать пальцем по закрытому флакону с тем, чтобы порошок распределился на дне флакона.
2. Отмерить 55 мл воды. Используя мерный стаканчик. Заполняя его до указанного уровня.
3. Добавить 55 мл воды во флакон, закрыть колпачком и хорошо встряхивать в течение 15 секунд.
4. Снять колпачок и вставить в горлышко флакона адаптер.
5. Плотно завинтить флакон колпачком для обеспечения правильного расположения адаптера.
На этикетке флакона следует указать дату приготовления суспензии. Перед применением флакон с приготовленной суспензией необходимо взбалтывать. Для дозировки суспензии прилагается дозирующий шприц с метками, указывающими уровни доз 30 мг, 45 мг, 60 мг и 75 мг (см. раздел «Форма выпуска и упаковка»).
Стандартный режим дозирования
Лечение
Прием препарата необходимо начинать не позднее 2 суток с момента развития симптомов заболевания.
Взрослые и дети в возрасте >8 лет
По 75 мг 2 раза в сутки внутрь в течение 5 дней. Увеличение дозы более 150 мг/сутки не приводит к усилению эффекта.
Дети в возрасте от 1 года до 8 лет
Рекомендованный режим дозирования осельтамивира:
| Масса тела | Рекомендованная доза в течение 5 дней | Количество суспензии |
| ≤15 кг | 30 мг два раза в сутки | 2,50 мл |
| >15-23 кг | 45 мг два раза в сутки | 3,75 мл |
| >23-40 кг | 60 мг два раза в сутки | 5,00 мл |
| >40 кг | 75 мг два раза в сутки | 6,25 мл |
Для дозирования суспензии использовать прилагающийся шприц. Необходимое количество суспензии отобрать из флакона дозирующим шприцем, перенести в мерный стаканчик и принимать внутрь.
Профилактика
Прием препарата необходимо начинать не позднее 2 суток после контакта с заболевшим человеком.
Взрослые и подростки в возрасте >12 лет
По 75 мг 1 раз в сутки внутрь в течение не менее 10 дней после контакта с заболевшими лицами. Во время сезонной эпидемии гриппа — 75 мг 1 раз в сутки в течение 6 недель.
Профилактическое действие продолжается столько, сколько длится прием препарата.
Дети в возрасте от 8 до 12 лет
По 75 мг 1 раз в сутки внутрь в течение 10 дней
Дети в возрасте от 1 года до 8 лет
Рекомендованный режим дозирования осельтамивира:
| Масса тела | Рекомендованная доза в течение 10 дней | Количество суспензии |
| ≤15 кг | 30 мг один раз в сутки | 2,50 мл |
| >15-23 кг | 45 мг один раз в сутки | 3,75 мл |
| >23-40 кг | 60 мг один раз в сутки | 5,00 мл |
| >40 кг | 75 мг один раз в сутки | 6,25 мл |
Для дозирования суспензии использовать прилагающийся шприц с метками. Необходимое количество суспензии отобрать из флакона дозирующим шприцем, перенести в мерный стаканчик и принимать внутрь.
Дозирование в особых случаях
Пациенты с поражением почек
Лечение
Пациентам с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется.
У пациентов с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг два раза в сутки в течение 5 дней.
У пациентов с клиренсом креатинина от 10 до 30 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки в течение 5 дней.
Пациентам, находящимся на постоянном гемодиализе, осельтамивир
в первоначальной дозе 30 мг можно принять до начала диализа, если симптомы гриппа появились в течение 48 ч между сеансами диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого сеанса диализа.
Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 5 дней.
Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточности (с клиренсом креатинина < 10 мл/мин), не находящихся на диализе не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Профилактика
Пациентам с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется.
У пациентов с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки.
У пациентов с клиренсом креатинина от 10 до 30 мл/мин рекомендуется уменьшить дозу осельтамивира до 30 мг через день.
Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа («1-й сеанс»). Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого последующего нечетного сеанса диализа.
Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 7 дней.
Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточности (с клиренсом креатинина < 10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Пациенты с поражением печени
Коррекции дозы осельтамивира при лечении и профилактике гриппа у пациентов с нарушениями функции печени легкой и средней степеней тяжести не требуется.
Безопасность и фармакокинетика осельтамивира у пациентов с тяжелыми нарушениями функции печени не изучалась.
Пациенты пожилого и старческого возраста
Коррекции дозы для профилактики или лечения гриппа не требуется.
Пациенты с ослабленным иммунитетом (после трансплантации)
Лечение
Рекомендованная доза осельтамивира составляет 75 мг 2 раза в сутки внутрь у взрослых пациентов (см. разделы «Особые указания», «Побочное действие» и «Фармакологические свойства»). Прием препарата необходимо начинать не позднее 2 суток с момента развития симптомов заболевания.
Сезонная профилактика
Для сезонной профилактики гриппа у пациентов с ослабленным иммунитетом в возрасте >1 года — в течение 12 недель, коррекция дозы не требуется.
Дети
Осельтамивир не следует назначать детям до 1 года.
Обзор профиля безопасности
Общий профиль безопасности осельтамивира основан на данных 6049 взрослых пациентов/подростков и 1473 детей с гриппом, получавших осельтамивир
или плацебо, а также на данных 3990 взрослых пациентов/подростков и 253 детей, получающих осельтамивир или плацебо/не получавших терапии в клинических исследованиях по профилактике гриппа.
Кроме того, 199 взрослых пациентов с ослабленным иммунитетом получили осельтамивир для лечения гриппа, и 475 пациентов с ослабленным иммунитетом (в том числе 18 детей, 10 из которых получали осельтамивир и 8 — плацебо) получили осельтамивир или плацебо для профилактики гриппа.
У взрослых пациентов/подростков наиболее частыми нежелательными реакциями (HP) в ходе клинических исследований лечения гриппа были тошнота и рвота, а в ходе исследований по профилактике — тошнота.
Большинство указанных HP были зарегистрированы однократно в первый или второй день терапии и спонтанно разрешались в течение последующих 1-2 дней.
У детей наиболее часто встречающейся HP была рвота.
У большинства пациентов данные HP не приводили к отмене терапии осельтамивиром. Серьезные HP, перечисленные ниже, редко отмечались с момента выхода осельтамивира на рынок: анафилактические и анафилактоидные реакции, нарушения со стороны печени (фульминантный гепатит, нарушение функции печени и желтуха), ангионевротический отек, синдром Стивенса-Джонсона и токсический эпидермальный некролиз, желудочно- кишечное кровотечение и нарушения со стороны нервной системы и психики (см. раздел «Особые указания»).
Список нежелательных реакций представлен в табличном формате ниже.
Для описания частоты нежелательных реакций используется следующая классификация: очень частые (≥1/10), частые (≥1/100 и <1/10), нечастые (≥1/1000 и <1/100), редкие (≥1/10000 и <1/1000) очень редкие (<1 /10000). Соответствующая категория присваивается нежелательным реакциям на основании объединенного анализа клинических исследований.
Лечение и профилактика гриппа у взрослых и подростков
В таблице 1 представлены HP, возникавшие наиболее часто при приеме рекомендованной дозы осельтамивира в исследованиях по профилактике и лечению гриппа у взрослых и подростков (75 мг 2 раза в сутки в течение 5 дней для лечения и 75 мг 1 раз в сутки до 6 недель для профилактики).
В исследованиях по профилактике гриппа профиль безопасности у пациентов, получавших рекомендованную дозу осельтамивира (75 мг 1 раз в сутки до 6 недель), качественно не отличался от такового в исследованиях по лечению гриппа, несмотря на более длительный прием препарата.
Таблица 1. Нежелательные реакции, выявленные в ходе клинических исследований по профилактике и лечению гриппа осельтамивиром у взрослых пациентов и подростков или в ходе постмаркетингового наблюдения
| Класс систем органов | Нежелательные реакции, распределенные согласно частоте выявления | |||
| Очень часто | Часто | Нечасто | Редко | |
| Инфекционные и паразитарные заболевания | Бронхит, Herpes simplex, назофарингит, инфекции верхних дыхательных путей, синусит | |||
| Нарушения со стороны крови и лимфатической системы | Тромбоцитопения | |||
| Нарушения со стороны иммунной системы | Реакции гиперчувствительности | Анафилактические реакции, анафилактоидные реакции | ||
| Нарушения психики | Беспокойство, анормальное поведение, тревожность, спутанность сознания, бред, делирий, галлюцинации, ночные кошмары, причинение себе телесного повреждения | |||
| Нарушения со стороны нервной системы | Головная боль | Бессонница | Изменение сознания, судороги | |
| Нарушения со стороны органа зрения | Нарушение зрения | |||
| Нарушения со стороны сердца | Аритмия | |||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Кашель, боль в горле, ринорея | |||
| Нарушения со стороны желудочно- кишечного тракта | Тошнота | Рвота, боль в животе (включая боль в верхней части живота), диспепсия | Желудочно-кишечные кровотечения, геморрагический колит | |
| Нарушения со стороны печени и желчевыводящих путей | Повышение активности «печеночных» ферментов | Фульминантный гепатит, печеночная недостаточность, гепатит | ||
| Нарушения со стороны кожи и подкожных тканей | Экзема, дерматит, сыпь, крапивница | Ангионевротический отек, мультиформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз | ||
| Общие расстройства и нарушения в месте введения | Боль, головокружение (включая вертиго), утомляемость, лихорадка, боль в конечностях |
Лечение и профилактика гриппа у детей
В клинических исследованиях осельтамивира при лечении гриппа принимали участие 1473 ребенка (включая в целом здоровых детей в возрасте от 1 до 12 лет и детей с астмой в возрасте от 6 до 12 лет). Из них 851 ребенок получал терапию осельтамивиром в лекарственной форме «суспензия». Всего 158 детей получали рекомендованную дозу осельтамивира 1 раз в сутки в исследованиях постконтактной профилактики в домашних условиях (n=99), в 6-недельных исследованиях сезонной профилактики (n=49) и 12- недельных исследованиях сезонной профилактики у пациентов с ослабленным иммунитетом (n=10).
В таблице 2 представлены HP, наиболее часто сообщаемые в ходе клинических исследований у детей.
Таблица 2. Нежелательные реакции, выявленные в ходе клинических исследований по профилактике и лечению гриппа осельтамивиром у детей (доза от 30 мг до 75 мг в зависимости от возраста/веса)
| Класс систем органов | Нежелательные реакции, распределенные согласно частоте выявления | |||
| Очень часто | Часто | Нечасто | Редко | |
| Инфекционные и паразитарные заболевания | Средний отит | |||
| Нарушения со стороны нервной системы | Головная боль | |||
| Нарушения со стороны органа зрения | Конъюнктивит (включая покраснения глаз, выделения и боль) | |||
| Нарушения со стороны органа слуха и лабиринтные нарушения | Боль в ухе | Нарушения со стороны барабанной перепонки | ||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Кашель, заложенность носа | Ринорея | ||
| Нарушения со стороны желудочно- кишечного тракта | Рвота | Боль в животе (включая боль в верхней части живота), диспепсия, тошнота | ||
| Нарушения со стороны кожи и подкожных тканей | Дерматит (включая аллергический и атопический дерматит) |
Описание отдельных нежелательных реакций
Нарушения со стороны нервной системы и психики
Гриппозная инфекция может ассоциироваться с различными неврологическими симптомами и изменениями поведения, включая такие симптомы, как галлюцинации, делирий, и анормальное поведение. В некоторых случаях они могут привести к смертельному исходу.
Данные явления могут возникать как на фоне развития энцефалопатии или энцефалита, так и отдельно, без явного тяжелого заболевания.
В постмаркетинговых сообщениях у пациентов, которые получали осельтамивир для лечения гриппа, отмечались судороги и делирий (включая такие симптомы, как нарушение сознания, спутанность сознания, анормальное поведение, бред, галлюцинации, беспокойство, тревожность, ночные кошмары). Эти случаи редко сопровождались опасными для жизни активностями или летальным исходом. Данные явления были зарегистрированы в основном среди детей и подростков и часто имели внезапное начало и быстрое разрешение.
Роль осельтамивира в развитии данных явлений неизвестна. Указанные психоневрологические нарушения также были зарегистрированы у пациентов с гриппом, не получавших осельтамивир.
Нарушения со стороны печени и желчевыводящих путей
Нарушения со стороны печени и желчевыводящих путей, включая гепатит и повышение активности «печеночных» ферментов, отмечались у пациентов с гриппоподобным заболеванием. Указанные явления также включали фульминантный гепатит/печеночную недостаточность с фатальным исходом.
Прочие особые популяции пациентов
Дети (до 1 года)
В двух исследованиях фармакокинетики, фармакодинамики и профиля безопасности осельтамивира, в которых принимали участие 135 детей в возрасте до 1 года с гриппом, профиль безопасности препарата был сопоставим в различных возрастных группах. Наиболее часто сообщаемыми нежелательными явлениями при этом были рвота, диарея и опрелость (см. раздел «Фармакологические свойства», подраздел «Фармакокинетика»). Данные о детях в постконцептуальном возрасте до 36 недель недостаточны.
Данные по безопасности применения осельтамивира при лечении у детей в возрасте до 1 года получены из проспективных и ретроспективных наблюдательных исследований (включали более 2400 детей данного возраста), исследований эпидемиологических баз данных и постмаркетингового наблюдения. Профиль безопасности у детей до 1 года сопоставим с известным профилем безопасности у детей в возрасте 1 года и старше.
Пожилые пациенты и пациенты с хронической сердечной и/или дыхательной недостаточностью
Популяция, включенная в исследования по лечению гриппа, состояла из в целом здоровых взрослых/подростков и пациентов группы риска (риск развития осложнений гриппа, например, популяция пожилых пациентов и пациентов с хронической сердечной или дыхательной недостаточностью). В целом профиль безопасности препарата у пациентов группы риска был сопоставим с таковым у в целом здоровых взрослых/подростков.
Пациенты с ослабленным иммунитетом
В двойном слепом исследовании 199 взрослых пациентов с ослабленным иммунитетом (которые отвечали критериям для оценки профиля безопасности) были рандомизированы для получения осельтамивира на протяжении 10 дней для лечения гриппа: 98 пациентов получали стандартную дозу (75 мг 2 раза в сутки) и 101 пациент получал двойную дозу (150 мг 2 раза в сутки). Профиль безопасности препарата, наблюдаемый в данном исследовании, был сопоставим с таковым в предыдущих клинических исследованиях, в которых осельтамивир применялся для лечения пациентов с нормальным иммунитетом (здоровые пациенты или пациенты из группы риска, например, с дыхательной и/или сердечной недостаточностью). Соотношение пациентов, у которых отмечались нежелательные явления, было ниже в группе стандартной дозы по сравнению с группой двойной дозы (49,0% и 59,4%, соответственно) (см. раздел «Фармакологические свойства», подраздел «Фармакодинамика»).
В ходе 12-недельного исследования по профилактике гриппа у 475 пациентов с ослабленным иммунитетом (включая 18 детей в возрасте от 1 до 12 лет и старше) профиль безопасности в группе осельтамивира (238 пациентов) был сопоставим с ранее наблюдаемым профилем осельтамивира в клинических исследованиях по профилактике.
Дети с бронхиальной астмой в анамнезе
В целом профиль нежелательных реакций у детей с бронхиальной астмой в анамнезе был сопоставим с таковым в целом у здоровых детей.
В большинстве случаев передозировка в ходе клинических исследований и при постмаркетинговом применении осельтамивира не сопровождалась какими-либо нежелательными явлениями. В остальных случаях симптомы передозировки соответствовали нежелательным явлениям, предоставленным в разделе «Побочное действие».
Фармакокинетические свойства осельтамивира, такие как его низкая степень связывания с белками и метаболизм, не зависимый от изофермента CYP450 и системы глюкуронидаз (см. раздел «Фармакологические свойства», подраздел «Фармакокинетика»), не дают оснований предполагать наличие клинически значимых взаимодействий по указанным механизмам.
Пробенецид
Коррекция дозы при одновременном применении с пробенецидом у пациентов с нормальной функцией почек не требуется. Одновременное применение с пробенецидом, мощным ингибитором анионной канальцевой секреции в почках, приводит к 2-кратному увеличению экспозиции активного метаболита осельтамивира.
Амоксициллин
Кинетическое взаимодействие осельтамивира и амоксициллина (выводящегося тем же путем, что и осельтамивир) отсутствует. Предполагается, что конкуренция осельтамивира за выделение почками слабая.
Выведение с мочой
Маловероятны клинически значимые межлекарственные взаимодействия, связанные с конкуренцией за канальцевую секрецию, принимая во внимание резерв безопасности для большинства подобных препаратов, пути выведения активного метаболита осельтамивира (клубочковая фильтрация и анионная канальцевая секреция), а также выводящую способность каждого из путей. Однако, применять осельтамивир в комбинации с препаратами, имеющими узкую широту терапевтического действия (например, хлорпропамид, метотрексат, бутадион), необходимо с осторожностью.
Дополнительная информация
Не обнаружено фармакокинетических взаимодействий между осельтамивиром или его основным метаболитом при одновременном приеме с парацетамолом, ацетилсалициловой кислотой, циметидином, антацидными средствами (магния и алюминия гидроксид, кальция карбонат), римантадином или варфарином (у пациентов без гриппа, стабильных на варфарине).
Осельтамивир эффективен только в отношении заболевания, вызванного вирусом гриппа. Данные об эффективности осельтамивира при терапии заболеваний, вызванных иными агентами, отсутствуют (см. раздел «Фармакологические свойства», подраздел «Фармакодинамика»).
Осельтамивир не является заменой вакцинации.
Использование осельтамивира не должно влиять на оценку пациентов при проведении ежегодной вакцинации против гриппа.
Защита от гриппа длится только до тех пор, пока применяется осельтамивир.
Препарат следует использовать только для лечения и профилактики гриппа и только в случае, если достоверные эпидемиологические данные указывают на то, что вирус гриппа циркулирует в общей популяции.
Чувствительность циркулирующих штаммов вируса гриппа к осельтамивиру может сильно варьировать (см. раздел «Фармакологические свойства», подраздел «Фармакодинамика», пункт «Резистентность»).
Таким образом, при назначении препарата необходимо учитывать самую последнюю доступную информацию о чувствительности циркулирующего вируса к осельтамивиру.
Тяжелое сопутствующее заболевание
Данные о безопасности и эффективности применения осельтамивира у пациентов с достаточно тяжелым сопутствующим заболеванием или нестабильным состоянием, предполагающим госпитализацию, отсутствуют.
Пациенты с ослабленным иммунитетом
Эффективность осельтамивира при лечении или профилактике гриппа у пациентов с ослабленным иммунитетом четко не установлены (см. раздел «Фармакологические свойства»), подраздел «Фармакодинамика»). Однако у взрослых пациентов с ослабленным иммунитетом лечение гриппа следует проводить на протяжении 10 дней, так как клинические исследования при более коротком курсе терапии не проводились.
Сердечная/дыхательная недостаточность
Эффективность осельтамивира при лечении или профилактике гриппа у пациентов с хронической сердечной и/или дыхательной недостаточностью не установлена. В данной популяции пациентов частота возникновения осложнений была сопоставима в группе лечения и группе плацебо.
Дети
Данные для определения дозы у недоношенных детей (постконцептуальный возраст <36 недель) отсутствуют.
Почечная недостаточность тяжелой степени тяжести
У взрослых пациентов и подростков (13-17 лет) с тяжелой степенью почечной недостаточности при лечении и профилактике гриппа рекомендуется коррекция дозы.
Клинические данные для коррекции дозы у младенцев и детей (в возрасте от 1 года и старше) с почечной недостаточностью отсутствуют (см. разделы «Способ применения и дозы» и «Фармакологические свойства», подраздел «Фармакокинетика»).
Психоневрологические нарушения
У пациентов (в основном у детей и подростков), принимавших осельтамивир, были зарегистрированы психоневрологические нарушения. Подробные психоневрологические нарушения так же отмечены у пациентов с гриппом, не получавших осельтамивир.
Следует тщательно мониторировать пациентов на предмет изменений в поведении, риск и польза продолжения терапии должны быть оценены для каждого пациента индивидуально (см. раздел «Побочное действие»).
Исследования по изучению влияния препарата на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не проводились. Исходя из профиля безопасности, влияние осельтамивира на данные виды деятельности маловероятно.
Порошок для приготовления суспензии для приема внутрь, 12 мг/мл.
Первичная упаковка лекарственного препарата
30 г препарата во флакон светозащитного стекла типа III (USP/Ph.Eur), вместимостью 100 мл, укупоренный полипропиленовой или полиэтиленовой крышкой винтовой, обеспечивающей контроль первого вскрытия и защиту от вскрытия флакона детьми. Способ открытия флакона приведен в виде схемы. На каждый флакон наклеивают этикетки.
Вторичная упаковка лекарственного препарата
По 1 флакону вместе с адаптером для шприца из полиэтилена низкой плотности, шприцем- дозатором, состоящим из полипропиленового корпуса и поршня из полиэтилена низкой плотности (помещенные в герметичную упаковку из полиэтилена), полипропиленовым мерным стаканчиком и инструкцией по применению помещают в пачку из картона. Пачки помещают в групповую упаковку.
При температуре не выше 25°С.
После приготовления суспензию хранить при температуре 2-8°С в течение 17 дней или при температуре не выше 25°С в течение 10 дней.
Хранить в недоступном для детей месте.
2 года.
Не применять по истечении срока годности.
По рецепту
Регистрационный номер
ЛП-006702
Дата регистрации
2021-01-14
Владелец регистрационного удостоверения
ФАРМАСИНТЕЗ АО (ИРКУТСК)
Россия
Производитель
ФАРМАСИНТЕЗ АО (ИРКУТСК)
Россия
Представительство
ФАРМАСИНТЕЗ АО (ИРКУТСК)
Россия
Состав
В состав капсул входит 20 мг действующего вещества омепразола и дополнительные компоненты: двуосновный фосфат натрия, сахароза, лаурилсульфат натрия, очищенная вода.
Препарат также выпускается в виде лиофилизированного порошка, который используется для приготовления раствора. В него также входит 40 мг действующего вещества омепразола и вспомогательный компонент безводный карбонат натрия.
Форма выпуска
Существуют следующие формы выпуска препарата: капсулы, капсулы кишечнорастворимые и лиофилизат для приготовления раствора для инфузий.
Капсулы из желатина твердые, корпус капсулы – прозрачный, крышка имеет розовый цвет. Надпись «OMEZ» есть на обеих частях капсулы. Капсулу наполняют белые гранулы. В упаковке вмещается 10 или 30 капсул.
Также выпускается в виде лиофилизированного порошка, из которого готовится раствор для инфузий (Омез в/в). Флакон вмещает 40 мг препарата.
Фармакологическое действие
Как свидетельствует аннотация, это лекарство является противоязвенным препаратом, который относится к группе ингибиторов протонной помпы. Активное вещество омепразол, которое вмещают капсулы, ингибирует секрецию соляной кислоты, оказывая специфическое воздействие на фермент натрий-калиевую аденозинтрифосфатазу клеток желудка. Как следствие, под его воздействием блокируется последняя стадия синтеза соляной кислоты. В итоге, вне зависимости от типа раздражителя, снижается уровень базальной и стимулированной секреции.
Фармакодинамика и фармакокинетика
Применение лекарства внутренне приводит к быстрому развитию эффекта: он проявляется в течение 1 часа. Далее таблетки Омез действуют 24 часа.
После того, как прием лекарства прекращается, секреторная активность экзокринных желез желудка восстанавливается примерно через 3-5 суток. Для омепразола характерно быстрое всасывание из кишечника. Так как активное вещество в препарате содержится в гранулах, устойчивых к кислоте, они растворяются только в кишечнике. В плазме наивысшая концентрация отмечается спустя 30-60 минут. Уровень биодоступности омепразола — 40%. Связь препарата с белками плазмы — 90%. Метаболизируется в печени.
Выводится через почки.
При введении внутривенно отмечается дозозависимое ингибирование секреции желудка. Время полувыведения омепразола после введения внутривенно равняется примерно 40 минутам.
Показания к применению Омеза
Показания к применению Омеза следующие:
- язвенная болезнь желудка и двенадцатиперстной кишки;
- гастроэзофагеальная рефлюксная болезнь (ГЭРБ);
- эрадикация Helicobacter pylori;
- язвенные процессы, которые связаны с лечением нестероидными противовоспалительными препаратами;
- язва, связанная со стрессом;
- пептические рецидивирующие язвы желудочной или дуоденальной локализации;
- синдром Золлингера-Эллисона;
- панкреатит;
- гастроэзофагеальная рефлюксная болезнь;
- системный мастоцитоз.
Если нет возможности приема препарата внутрь, но есть показания к применению, средство может вводиться внутривенно.
Противопоказания на Омез
Существуют следующие противопоказания:
- повышенная чувствительность;
- беременность и кормление;
- детский возраст.
Осторожно капсулы следует принимать людям с почечной и печеночной недостаточностью. Способ применения препарата и дозировку в таком случае определять должен только специалист.
Побочные действия Омеза
В основном побочные действия при лечении данным ЛС проявляются редко. Возможны следующие побочные эффекты:
- Пищеварительная система: боль в животе, тошнота, метеоризм, нарушения вкуса, повышенная активность ферментов печени.
- Органы кроветворения: тромбоцитопения, лейкопения, агранулоцитоз.
- Нервная система: головная боль, головокружение, депрессия.
- Опорно-двигательный аппарат: миастения, артралгия, миалгия.
- Кожные покровы: сыпь, зуд кожи, фотосенсибилизация.
- Аллергические проявления: крапивница, лихорадка, бронхоспазм.
- Кроме того, в редких случаях могут наблюдаться нарушения зрения, недомогание, сильное потоотделение.
Инструкция по применению Омеза (Способ и дозировка)
Пациент должен глотать капсулы, не открывая и не разжевывая. Когда пить таблетки Омез? Утром, перед едой.
Если при пептической язве и рефлюкс-эзофагите назначаются таблетки Омез, инструкция по применению предусматривает, что лекарство применяется в дозе 20 мг в сутки, утром, на голодный желудок. Препарат следует принимать 14 дней. Если пептическая язва на протяжении периода лечения так и не зарубцевалась, лечение может продолжаться еще две недели. Как правило, при приеме средства рубцевание пептической язвы двенадцатиперстной кишки происходит через 4 недели.
Лечение синдрома Золлингера-Эллисона предусматривает прием в сутки 60 мг препарат. О том, как пить — до или после еды, в инструкции также есть указание: препарат принимают перед едой. Поддерживающие дозы далее назначает врач.
При гастрите лечение длится от 1 до 2 недель. Лечение гастрита направленно на устранение симптомов раздраженного желудка. В этом случае назначается по 1 капсуле в день. Дополнительно о том, как принимать Омез при гастрите, расскажет лечащий врач после установления диагноза.
При панкреатите назначается в составе комплексного лечения. Предполагается, что такое лечение помогает избавить пациента от изжоги, уменьшить боль и нагрузку на поджелудочную железу. Длительность лечения зависит от выраженности симптомов. Изначально в сутки назначается по две капсулы, далее практикуется поддерживающая терапия – по 1 капсуле в сутки. При изжоге не следует применять без предварительного одобрения такого лечения врачом.
Введение внутривенно, в зависимости от заболевания, проводится в дозе от 40 мг 80 мг в сутки. Если доза составляет от 60 мг, ее можно разделить на два введения. После снятия острых симптомов практикуется переход на пероральный прием средства. Приготовленный раствор годен в течение суток.
Передозировка
Передозировка препарата не приводит к угрожающим жизни симптомам. В таком случае может проявиться нечеткость зрения, сухость во рту, сонливость, головные боли, тахикардия. Применяется симптоматическая терапия. Гемодиализ не является достаточно эффективным.
Взаимодействие
При одновременном приеме может уменьшить уровень всасывания эфиров Ампициллина, солей железа, Кетоконазола, Итраконазола.
Омепразол увеличивает концентрацию и снижает активность выведения Диазепама, антикоагулянтов непрямого действия, фенитоина.
При совместном применении перорально омепразола и Кларитромицина увеличивается концентрация этих веществ в плазме крови.
Условия продажи
В аптеке Омез можно приобрести по рецепту врача.
Условия хранения
Хранить средство нужно в сухом и темном месте, при температуре воздуха, не превышающей 25 °С.
Срок годности
Срок хранения капсул — 3 года.
Особые указания
Возможен прием капсул одновременно с пищей, от чего лекарство не теряет своей эффективности.
Перед тем, как начать принимать капсулы или вводить Омез внутривенно, следует исключить злокачественные процессы, так как терапия может маскировать симптомы, тем самым, осложняя диагностику.
Иногда существуют обстоятельства, когда необходимо избежать проглатывания целой капсулы, для чего ЛС применяется следующим способом: капсула вскрывается, а ее содержимое смешивается с мягким пюре из яблок (1 столовая ложка). Другими способами принимать содержимое капсулы нельзя.
Маловероятно влияние препарата на способность управлять транспортом.
Аналоги Омеза
Совпадения по коду АТХ 4-го уровня:
Существуют импортные и российские аналоги Омеза, но самостоятельно подбирать заменитель не рекомендуется. Аналогичное воздействие на организм оказывают препараты:
- Омепразол
- Лосек МАПС
- Ультоп
- Ортанол
- Омизак
- Гастрозол
- Промез
- Омитокс
- Ромесек
- Цисагаст
- Плеом-20
- Демепразол
- Крисмел
- Зероцид
- Омекапс
- Омезол
Цена аналогов зависит от производителя и других факторов.
Нольпаза или Омез — что лучше?
Средство Нольпаза оказывает похожее воздействие, снижая уровень соляной кислоты и избавляя от симптомов заболеваний ЖКТ. В состав Нольпаза входит активный компонент пантопразол. Это лекарство иногда действует более быстро.
Омез или Ранитидин — что лучше?
Ранитидин содержит действующее вещество ранитидина гидрохлорид и применяется при тех же состояниях и заболеваниях, что и Омез. Какой препарат предпочесть, зависит от назначения врача.
Что лучше: Омез или Ультоп?
В состав средства Ультоп также входит активный ингредиент омепразол. Его действие основано на угнетении активности желудочного сока. Какой из препаратов следует выбрать, необходимо спрашивать у специалиста и при этом учитывать диагноз.
Ортанол или Омез — что лучше?
Ортанол – еще один препарат, активным веществом которого является омепразол. Как и Омез, это лекарственное средство назначается при язвенной болезни, гиперсекреторных состояниях и др.
Что лучше: Омез или Париет?
Париет вмещает активный ингредиент рабепразол. Однако, показания к применению у этого лекарства такие же, как у капсул Омез.
Что лучше: Омез или Де-Нол?
Де-Нол – противоязвенное средство, которое содержит висмута субцитрат. Как принимать Омез и Де-Нол, зависит от тяжести и особенностей заболевания. Но это следует делать по схеме, назначенной врачом.
Что лучше: Омез или Омез Д?
Многих пациентов интересует разница Омез и Омез Д. Разница между этими препаратами в том, что Омез Д содержит в качестве активного вещества не только омепразол, но и домперидон.
Детям
Лекарство не назначается детям до 12-летнего возраста, так как достаточной информации о его влиянии на организм малолетних пациентов нет.
С алкоголем
Совместимость с алкоголем: несмотря на то, что в инструкции нет информации о том, что алкоголь при лечении омепразолом запрещен, по мнению врачей, при лечении препаратом нельзя употреблять спиртное.
Омез при беременности и лактации
При беременности и кормлении грудным молоком ребенка лечение этим ЛС не практикуется.
Отзывы об Омезе
Встречаются многочисленные положительные отзывы об Омезе. Отзывы принимающих это средство свидетельствуют, что оно эффективно лечит язвенную болезнь, помогает преодолеть приступы изжоги, устраняет симптомы острого гастрита.
Отзывы об Омезе на формах также позитивные. Люди отмечают, что его можно принимать в любое время, и действует он одинаково эффективно. Кроме того, препарат улучшает состояние ЖКТ при лечении другими препаратами, которые действуют на желудок и кишечник раздражающе. В качестве недостатков часто упоминается, что средство достаточно дорогое.
Цена Омеза, где купить
Цена таблеток Омез 10 мг составляет в среднем 70 рублей за 10 капсул. Цена Омез 20 мг – от 150 рублей за упаковку 30 капсул. Цена Омеза в Москве и в других городах России аналогична.
Купить Омез 20 мг в Украине можно в среднем за 70 гривен (упаковка 30 шт.) Стоимость упаковки 10 мг 30 шт. – в среднем от 50 гривен.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Омез капсулы 20мг 30штDr. Reddy’s lab.
-
Омез капсулы кишечнораств. 40мг 28штDr. Reddy’s lab.
-
Омез капсулы кишечнорастворимые 20мг 30штLaboratorios Liconsa, S.A.
-
Омез капсулы кишечнораствор. 10мг 10штDr. Reddy’s lab.
Аптека Диалог
-
Омез капсулы 20мг №30Dr. Reddy’s
-
Омез (капс. 40мг №28)Д-р Редди`с Лабораторис Лтд
Ригла
-
Омез капс.киш.раст. 40мг №30Dr.Reddy’s lab.
показать еще
05.03.2022
Артериальное давление считается одним из главных показателей состояния организма, так как оно отражает работу сердечно-сосудистой, эндокринной и нервной системы, почек, кроветворения. Повышение давления может быть эпизодическим или стойким. Универсальных лекарств от высокого давления у пожилых людей не бывает — препараты должны назначаться врачом, с учетом клинической картины и индивидуальных особенностей пациента.
Гипертония бывает:
-
первичной, когда она высокое давление является ведущим симптомом;
-
вторичной, когда она сопровождает заболевания почек, эндокринной и нервной системы. В этом случае повышенное давление — один из симптомов.
Гипертония относится к числу хронических заболеваний, которые могут прогрессировать, поэтому требует постоянной терапии. Чтобы поддерживать давление в пределах нормы, нужен хороший препарат. Выбрать его можно только после диагностики, по рекомендациям специалиста.
Причины повышенного давления у пожилых
Чаще всего гипертония развивается при заболеваниях:
-
почек и надпочечников;
-
щитовидной железы;
-
стенозе (коарктации) аорты и атеросклерозе.
Факторами риска считаются также употребление большого количества соли, нервные перегрузки, наследственность, вредные привычки.
Пациентам старше 60 лет рекомендуется обращаться к врачу, если есть хотя бы один из следующих симптомов:
-
головная боль, локализованная в области затылка и сопровождающаяся головокружением;
-
чувствительность к перемене погоды;
-
нарушения сна;
-
гул в ушах;
-
повышенная утомляемость, общая слабость, нарушения памяти;
-
ощущение удушья, боли в груди;
-
повторяющиеся приступы тошноты.
Виды препаратов
Лекарства от повышенного давления для пожилых людей можно разделить на:
-
бета-блокаторы;
-
антагонисты кальция;
-
диуретики;
-
ингибиторы.
Антагонисты кальция
Артериальные сосуды сохраняют тонус в норме, благодаря ионам кальция. Средства с их содержанием способствуют расслаблению сосудистых стенок, из-за чего снижается артериальное давление. Из побочных действий отмечается учащенное сердцебиение, периодическое головокружение.
Дилтиазем
Препарат назначается при диагностировании серьезных патологий сердца, вызванных прогрессирующей гипертонией.
Показания:
-
наличие артериальной гипертензии;
-
профилактические меры при загрудинных болях (приступы стенокардии);
-
предупреждение развития аритмии, представленной наджелудочковыми пароксизмами, экстрасистолией, трепетаниями и мерцаниями предсердий.
|
|
ДИЛТИАЗЕМ ЛАННАХЕР ТАБ. П/П/О ПРОЛОНГ.ВЫСВ. 180МГ №30 |
|
|
ДИЛТИАЗЕМ ЛАННАХЕР ТАБ. П/П/О ПРОЛОНГ.ВЫСВ. 90МГ №20 |
|
|
ДИЛТИАЗЕМ РЕТАРД КАПС. ПРОЛОНГ. ДЕЙСТ. 180МГ №30 |
|
|
ДИЛТИАЗЕМ ТАБ. 60МГ №30 |
|
|
ДИЛТИАЗЕМ ТАБ. ПРОЛОНГ. ВЫСВ. 90МГ №30 |
Верапамил
Лекарственное средство относится к кальциевым антагонистам. Обычно выпускается по рецепту.
Применение показано в таких случаях:
-
терапия артериальной гипертензии;
-
предупреждение наджелудочковой аритмии;
-
недопущение стенокардических приступов, выражающихся сердечными болями.
|
|
ВЕРАПАМИЛ ТАБ. П/О 40МГ №30 |
|
|
ВЕРАПАМИЛ ТАБ. П/О 80МГ №30 |
|
|
ВЕРАПАМИЛ ТАБ. П/П/О 40МГ №50 |
|
|
ВЕРАПАМИЛ ТАБ. П/П/О 80МГ №50 |
|
|
ВЕРАПАМИЛ ТАБ. П/П/О ПРОЛОНГ.ВЫСВ. 240МГ №20 |
|
|
ВЕРАПАМИЛ-ЛЕКТ ТАБ. П/П/О 80МГ №50 |
Лозап
Основной действующий компонент — лозартан калия. Препарат является патофизиологическим звеном при АД и сильным вазоконстриктором. Основное действие направлено на нейтрализацию обратной отрицательной связи. В результате подавляется рениновая секреция, отвечающая за регулирование кровяного давления.
|
|
ЛОЗАП АМ ТАБ. П/П/О 5МГ+100МГ №30 |
|
|
ЛОЗАП АМ ТАБ. П/П/О 5МГ+50МГ №30 |
|
|
ЛОЗАП ПЛЮС ТАБ. П/П/О 50МГ+12.5МГ №30 |
|
|
ЛОЗАП ПЛЮС ТАБ. П/П/О 50МГ+12.5МГ №60 |
|
|
ЛОЗАП ПЛЮС ТАБ. П/П/О 50МГ+12.5МГ №90 |
|
|
ЛОЗАП ТАБ. П/П/О 100МГ №30 |
|
|
ЛОЗАП ТАБ. П/П/О 100МГ №60 |
|
|
ЛОЗАП ТАБ. П/П/О 100МГ №90 |
|
|
ЛОЗАП ТАБ. П/П/О 50МГ №30 |
|
|
ЛОЗАП ТАБ. П/П/О 50МГ №60 |
Норваск
Препарат проявляет антиангинальное и антигипертензивное действие. Вследствие приема кальциевые ионы медленнее транспортируются к гладкомышечным сосудистым клеткам.
У пациентов отмечается снижение приступов стенокардии, значительно улучшается физическая выносливость.
|
|
НОРВАСК ТАБ. 10МГ №30 |
|
|
НОРВАСК ТАБ. 5МГ №30 |
Мочегонные препараты
Используются для выведения лишней воды из организма, в результате чего показатель кровяного давления снижается.
Побочным действием являются перебои сердечной сократимости. У некоторых пациентов отмечается онемение пальцев на фоне потери солей, судороги, головокружение с тошнотой.
Верошпирон
Распространенный мочегонный препарат калий-сберегающего типа. Его применение не ведет к вымыванию минерала, поддерживающего нормальную работу сердца. Действие основывается на функционировании альдостерона. Этот гормон вырабатывается надпочечниками и задерживает жидкость.
Средство назначается в таких случаях:
-
терапия на основе комбинированных схем артериальной гипертензии;
-
нейтрализация отечности;
-
нарушенная работа надпочечников;
-
устранение отеков, которые образовались при сбое в работе почек, печени.
|
|
ВЕРОШПИРОН КАПС. 100МГ №30 |
|
|
ВЕРОШПИРОН КАПС. 50МГ №30 |
|
|
ВЕРОШПИРОН ТАБ. 25МГ №20 |
Индапамид
Медикамент способствует выведению ионов натрия и хлорида с мочой, удалению из организма лишней воды. Он расслабляет сосуды, снижает нагрузку на миокард.
Показание – лечение гипертонии.
|
|
ИНДАПАМИД КАНОН ТАБ. П/П/О 2.5МГ №30 |
|
|
ИНДАПАМИД МВ ШТАДА ТАБ. П/П/О ПРОЛОНГ.ВЫСВ. 1.5МГ №30 |
|
|
ИНДАПАМИД РЕТАРД ТАБ. ПРОЛОНГ. ДЕЙСТ. П/П/О 1,5МГ №30 |
|
|
ИНДАПАМИД РЕТАРД-АЛСИ ТАБ. К/Р П/П/О 1.5МГ №30 |
|
|
ИНДАПАМИД РЕТАРД-ТЕВА ТАБ. П/П/О ПРОЛОНГ.ВЫСВ. 1.5МГ №30 |
|
|
ИНДАПАМИД ТАБ. П/О 2.5МГ №30 |
|
|
ИНДАПАМИД-АЛСИ ТАБ. П/П/О 2.5МГ №30 |
|
|
ИНДАПАМИД-ВЕРТЕКС КАПС. 2.5МГ №30 |
|
|
ИНДАПАМИД-ТЕВА КАПС. 2.5МГ №30 |
Триампур
Является диуретиком комбинированного действия, содержит две составляющих тиазидного и калийсберегающего действия. При употреблении препарата ионы активно выводятся из организма, снижается отечность. Из показаний:
-
устранение отеков, которые сопровождают поражение печени и почек;
-
терапия АД (комбинированное лечение).
|
|
ТРИАМПУР КОМПОЗИТУМ ТАБ. 12.5МГ+25МГ №50 |
Эдарби
Лекарство относится к специфическим антагонистам, оказывающим действие на рецепторы ангиотензина II. Действующее вещество — азилсартан медоксомила.
Эффективное действие ощущается на протяжении 14 дней от начала лечения. Устойчивый результат терапии наступает по истечению месяца после применения лекарства.
|
|
ЭДАРБИ КЛО ТАБ. П/П/О 40МГ+12.5МГ №28 |
|
|
ЭДАРБИ КЛО ТАБ. П/П/О 40МГ+25МГ №28 |
|
|
ЭДАРБИ ТАБ. 40МГ №28 |
|
|
ЭДАРБИ ТАБ. 80МГ №28 |
Фуросемид
Мочегонный мощный препарат с кратковременным эффектом. Противопоказание – наличие почечной недостаточности.
|
|
ФУРОСЕМИД ТАБ. 40МГ №50 |
|
|
ФУРОСЕМИД ТАБ. 40МГ №50 |
|
|
ФУРОСЕМИД ТАБ. 40МГ №56 |
Ингибиторы АПФ
У человека с диагностированной гипертонией вырабатывается ангиотензин. Он спазмирует сосуды с последующей задержкой крови, из-за этого повышается АД. Препараты блокируют функцию ферментов, синтезирующих этот гормон.
Зокардис
Прием лекарства направлен на снижение давления, т.к. подавляется выделение ангиотензина, снижающего в свою очередь выработку альдостерона (антидиуретический гормон). Результат:
-
расширение артерии с сохранением нормальной частоты СС;
-
снижение сердечных нагрузок;
-
минимизация диастолического и систолического давления.
-
Показание представлено умеренной и мягкой гипертонией, острым инфарктом миокарда в случае нормального кровообращения и отсутствия приема тромболитиков.
|
|
ЗОКАРДИС 30 ТАБ. П/П/О 30МГ №28 |
|
|
ЗОКАРДИС 7,5 ТАБ. П/П/О 7.5МГ №28 |
Каптоприл (Капотен)
Эти лекарства снижают выработку ангиотензина. В результате предотвращается артериальный спазм, снимается нагрузка с сосудов, сердца, падает давление в малом и большом кругах.
Из показаний:
-
сердечная недостаточность в хронической форме;
-
АД, с почечным происхождением в том числе;
-
нефропатия — сбой в работе почек при сахарном диабете;
-
нарушение сердечных сокращений после инфаркта.
|
|
ГИДРОХЛОРОТИАЗИД+КАПТОПРИЛ ТАБ. 25МГ+50МГ №30 |
|
|
КАПТОПРИЛ ВЕЛФАРМ ТАБ. 50МГ №20 |
|
|
КАПТОПРИЛ ВЕЛФАРМ ТАБ. 50МГ №40 |
|
|
КАПТОПРИЛ ТАБ. 50МГ №20 |
|
|
КАПТОПРИЛ ТАБ. 50МГ №20 |
|
|
КАПТОПРИЛ ТАБ. 50МГ №40 |
|
|
КАПТОПРИЛ-АКОС ТАБ. 25МГ №40 |
|
|
КАПОТЕН ТАБ. 25МГ №28 |
|
|
КАПОТЕН ТАБ. 25МГ №40 |
|
|
КАПОТЕН ТАБ. 25МГ №56 |
Престариум
Препарат ведет к блокаде ангиотензина, который вызывает усиленную сердечную нагрузку и артериальный спазм. Частота сокращений миокарда не нарушается. Обеспечивается положительное действие на циркуляцию крови в головном мозге. Из показаний:
-
терапия АД;
-
лечение ИБС комбинированного типа;
-
сердечная хроническая недостаточность;
-
недопущение повторных инсультов.
|
|
ПРЕСТАРИУМ А ТАБ. ДИСПЕРГ. В ПОЛОСТИ РТА 10МГ №30 |
|
|
ПРЕСТАРИУМ А ТАБ. ДИСПЕРГ. В ПОЛОСТИ РТА 5МГ №30 |
|
|
ПРЕСТАРИУМ А ТАБ. П/П/О 10МГ №30 |
|
|
ПРЕСТАРИУМ А ТАБ. П/П/О 5МГ №30 |
Бета-блокаторы
Препараты используются с целью понижения давления по принципу снижения частоты сердечных сокращений (ЧСС). При таком состоянии кровь перекачивается в меньшем количестве, она поступает в сосуды под сниженным давлением. Средство имеет и побочное действие в виде кожных высыпаний, недомогания и слабости на фоне замедленного пульса.
Бисопролол
Основное действие заключается в снижении ЧСС и кислородной потребности миокарда. С меньшей вероятностью проявляется аритмия, стенокардия, снижается АД. Из показаний:
-
назначение лечения ИБС, предупреждение приступов стенокардии;
-
терапия АД.
|
|
БИСОПРОЛОЛ ТАБ. П/П/О 2.5МГ №30 |
|
|
БИСОПРОЛОЛ ТАБ. П/П/О 5МГ №30 |
|
|
БИСОПРОЛОЛ ТАБ. П/П/О 5МГ №30 |
|
|
БИСОПРОЛОЛ ТАБ. П/П/О 5МГ №50 |
|
|
БИСОПРОЛОЛ-ВЕРТЕКС ТАБ. П/П/О 10МГ №30 |
|
|
БИСОПРОЛОЛ-ВЕРТЕКС ТАБ. П/П/О 2.5МГ №30 |
|
|
БИСОПРОЛОЛ-ВЕРТЕКС ТАБ. П/П/О 5МГ №30 |
|
|
БИСОПРОЛОЛ-ВЕРТЕКС ТАБ. П/П/О 5МГ №60 |
|
|
БИСОПРОЛОЛ-СЗ ТАБ. П/П/О 10МГ №50 |
|
|
БИСОПРОЛОЛ-ТЕВА ТАБ. П/П/О 10МГ №30 |
|
|
БИСОПРОЛОЛ-ТЕВА ТАБ. П/П/О 10МГ №50 |
|
|
БИСОПРОЛОЛ-ТЕВА ТАБ. П/П/О 5МГ №30 |
Атенолол
Прием ведет к снижению ЧСС, из-за чего не так сильно страдает от нагрузок сердечная мышца, устраняется аритмия. Из показаний:
-
профилактика стенокардии;
-
терапия АД;
-
предупреждение экстрасистолии, тахикардии.
|
|
АТЕНОЛОЛ ТАБ. 50МГ №30 |
|
|
АТЕНОЛОЛ ТАБ. П/П/О 25МГ №30 |
Метопролол
Препарат снижает ЧСС, основную нагрузку на сердце с последующей нормализацией ритма. Из показаний:
-
терапия артериальной гипертензии;
-
предотвращение сердечной недостаточности в хронической форме;
-
борьба с мигренозными приступами, тахикардией;
-
лечение и действенная профилактика ИБС.
|
|
МЕТОПРОЛОЛ ОРГАНИКА ТАБ. 50МГ №60 |
|
|
МЕТОПРОЛОЛ РЕТАРД-АКРИХИН ТАБ. ПРОЛОНГ. ДЕЙСТ. П/П/О 25МГ №30 |
|
|
МЕТОПРОЛОЛ РЕТАРД-АКРИХИН ТАБ. ПРОЛОНГ. ДЕЙСТ. П/П/О 50МГ №30 |
|
|
МЕТОПРОЛОЛ ТАБ. 100МГ №30 |
|
|
МЕТОПРОЛОЛ ТАБ. 25МГ №60 |
|
|
МЕТОПРОЛОЛ ТАБ. 50МГ №50 |
Небилет
Лекарство оказывает вазодилатирующее действие. После 1-2 недель приема отмечается стойкий гипотензивный эффект. Заметно снижается численность приступов стенокардии, их тяжесть. Легче переносятся умеренные физические нагрузки.
|
|
НЕБИЛЕТ ТАБ. 5МГ №14 |
|
|
НЕБИЛЕТ ТАБ. 5МГ №28 |
Небиволол-Тева
Основное преимущество заключается в сосудорасширяющем мягком действии с последующей нормализацией АД, ЧСС при небольших нагрузках. Нормализуется диастолическая функция, повышается фибрация выброса.
|
|
НЕБИВОЛОЛ-ТЕВА ТАБ. 5МГ №28 |
Физиотенз
Эффект лекарства сказывается на центральной нервной системе, рецепторы в головном мозге стимулируются селективно. В симпатической системе уменьшается активность, на фоне чего снижается кровяное давление.
|
|
ФИЗИОТЕНЗ ТАБ. П/П/О 0.2МГ №14 |
|
|
ФИЗИОТЕНЗ ТАБ. П/П/О 0.2МГ №28 |
|
|
ФИЗИОТЕНЗ ТАБ. П/П/О 0.4МГ №14 |
|
|
ФИЗИОТЕНЗ ТАБ. П/П/О 0.4МГ №28 |
Блокаторы рецепторов ангиотензина (сартаны)
Препараты же снижают работу гормона ангиотензина, активно связываются с его рецепторами. Среди побочных действий — тошнота, головокружение, резкое снижение АД, сосудистого тонуса.
Валсартан
Медикамент действует на ангиотензин, блокируя его активность. Побочные эффекты отсутствуют, ЧСС остается прежней. Из показаний:
-
терапия АД;
-
нормализация сердечной недостаточности (1-2 стадия);
-
поддержка сердца после перенесенного инфаркта.
|
|
ВАЛСАРТАН ТАБ. П/П/О 160МГ №30 |
|
|
ВАЛСАРТАН ТАБ. П/П/О 160МГ №30 |
|
|
ВАЛСАРТАН ТАБ. П/П/О 40МГ №30 |
|
|
ВАЛСАРТАН ТАБ. П/П/О 80МГ №30 |
|
|
ВАЛСАРТАН ТАБ. П/П/О 80МГ №30 |
|
|
ВАЛСАРТАН ТАБ. П/П/О 80МГ №30 |
|
|
ВАЛСАРТАН-СЗ ТАБ. П/П/О 160МГ №30 |
|
|
ВАЛСАРТАН-СЗ ТАБ. П/П/О 80МГ №30 |
Лозартан
Препарат показан при диагностированной первичной гипертензии, высоком АД, застойной недостаточности сердца. Продолжительное действие достигает 24 часов.
Недопустим прием такого лекарства параллельно с медикаментами сахароснижающего действия, ингибиторами АПФ, когда имеют место такие диагнозы:
-
непереносимость лактозы;
-
нарушение функции почек.
|
|
ЛОЗАРТАН КАНОН ТАБ. П/П/О 100МГ №30 |
|
|
ЛОЗАРТАН КАНОН ТАБ. П/П/О 50МГ №30 |
|
|
ЛОЗАРТАН Н ТАБ. П/П/О 12.5МГ+50МГ №30 |
|
|
ЛОЗАРТАН ТАБ. П/П/О 100МГ №30 |
|
|
ЛОЗАРТАН ТАБ. П/П/О 100МГ №60 |
|
|
ЛОЗАРТАН ТАБ. П/П/О 12.5МГ №30 |
|
|
ЛОЗАРТАН-ВЕРТЕКС ТАБ. П/П/О 100МГ №30 |
|
|
ЛОЗАРТАН-ВЕРТЕКС ТАБ. П/П/О 25МГ №30 |
|
|
ЛОЗАРТАН-ВЕРТЕКС ТАБ. П/П/О 50МГ №30 |
|
|
ЛОЗАРТАН-Н КАНОН ТАБ. П/П/О 12,5МГ+50МГ №30 |
|
|
ЛОЗАРТАН-Н КАНОН ТАБ. П/П/О 25МГ+100МГ №30 |
|
|
ЛОЗАРТАН-ТЕВА ТАБ. П/П/О 50МГ №30 |
Кардосал
Лекарство относится к сартанам, отпускается только на рецептурной основе, представлено разными дозировками. Эффективно в отношении высокого АД, снижает нагрузку на миокард, улучшает его питание. Основное показание — лечение гипертонии.
|
|
КАРДОСАЛ 10 ТАБ. П/П/О 10МГ №28 |
|
|
КАРДОСАЛ 20 ТАБ. П/П/О 20МГ №28 |
|
|
КАРДОСАЛ 40 ТАБ. П/П/О 40МГ №28 |
|
|
КАРДОСАЛ ПЛЮС ТАБ. П/П/О 12.5МГ+20МГ №28 |
Предложение не является офертой, представленные препараты являются лекарственным средством, необходима консультация специалиста.