В полном объеме документ доступен для просмотра в электронных читальных залах библиотек-участников НЭБ
Портал НЭБ предлагает вам читать онлайн в Электронном Читальном Зале (ЭЧЗ) книгу «Руководство по электростимуляции сердца», автора Жданов Андрей Михайлович. Книга была издана в 2008 году.
Выражаем благодарность библиотеке «Российская государственная библиотека (РГБ)» за предоставленный материал.
ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России
Сафиуллина А.А.
ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России
Терещенко С.Н.
ФГБУ «Национальный медицинский исследовательский центр кардиологии им. акад. Е.И. Чазова» Минздрава России
- ORCID:
0000-0001-9234-6129
Имплантация модулятора сердечной сократимости. Анализ осложнений. (По результатам 24-месячного наблюдения)
Авторы:
Аманатова В.А., Сафиуллина А.А., Ускач Т.М., Гришин И.Р., Сапельников О.В., Терещенко С.Н.
Как цитировать:
Аманатова В.А., Сафиуллина А.А., Ускач Т.М., Гришин И.Р., Сапельников О.В., Терещенко С.Н. Имплантация модулятора сердечной сократимости. Анализ осложнений. (По результатам 24-месячного наблюдения). Кардиологический вестник.
2023;18(1):65‑72.
Amanatova VA, Safiullina AA, Uskach TM, Grishin IR, Sapelnikov OV, Tereshchenko SN. Implantation of cardiac contractility modulation device. (Analysis of complications in a 24-month follow-up). Russian Cardiology Bulletin. 2023;18(1):65‑72. (In Russ.)
https://doi.org/10.17116/Cardiobulletin20231801165

Введение
Модуляция сердечной сократимости (МСС) является одним из современных методов лечения хронической сердечной недостаточности (ХСН) с систолической дисфункцией левого желудочка. Устройства для проведения данной терапии имплантируются с 2004 г. Несмотря на значительное количество исследований, посвященных клинической эффективности этого метода, в настоящий момент сведения об осложнениях, возникших в связи с имплантацией устройства МСС, крайне ограничены или практически отсутствуют. Что же касается общемировой практики, большинство литературных данных описывают осложнения, связанные с имплантацией кардиовертеров-дефибрилляторов (КВД) и электрокардиостимуляторов (ЭКС). Так, например, из имплантированных (2,25 млн ЭКС и 415 780 КВД) в течение 12 лет устройств в США 17 323 устройства (8834 ЭКС и 8489 КВД) были деимплантированы в связи с их подтвержденной дисфункцией. Из них 23,6% составили проблемы с источниками питания и 27,1% — неполадки электрических цепей устройств [1, 2].
Количество осложнений зависит от числа имплантируемых электродов. По результатам исследования FIX-HF-5C2, в которых сравнивались МСС-устройства с 3 и 2 электродами, статистически значимых различий в эффективности работы системы не получено. Однако количество осложнений было значимо меньше в группе приборов с 2 электродами (0% против 8%; p=0,03) [3, 4]. В связи с полученными данными в настоящее время применяются устройства с 2 электродами. В отличие от устройств с 3 электродами они могут быть имплантированы пациентам с фибрилляцией предсердий, что расширяет число показаний для применения.
Ряд проблем, возникающих с имплантированными устройствами, в том числе и с МСС, представляется возможным решить путем изменения настроек согласно индивидуальным потребностям каждого пациента. Однако некоторые нарушения функционирования систем могут быть связаны с непосредственным повреждением целостности системы на разных уровнях, инфекцией, а также особенностями этого вида терапии.
Основные осложнения, связанные с имплантируемыми устройствами, можно подразделить на две группы: неэлектрические и электрические [5] (рис. 1).

Рис. 1. Общая классификация осложнений, связанных с имплантированными устройствами.
Неэлектрические осложнения
Осложнения, связанные с венозным доступом, например, с пункцией подключичной вены связаны с техникой пункции и зависят от навыков оперирующего хирурга. Такие осложнения, как пневмоторакс, гемоторакс, воздушная эмболия возникают достаточно редко и чаще всего связаны с анатомическими особенностями развития. Наиболее распространенным осложнением является венозный тромбоз, лечение которого в большинстве случаев консервативное. Консультация сосудистого хирурга требуется при развитии синдрома верхней полой вены, так как осложнение протекает достаточной тяжело.
Осложнения, связанные с электродами, могут быть как электрическими, так и неэлектрическими. Электрод считается самым слабым звеном в системах стимуляции. Проявления неисправности электрода могут быть различными, в связи с чем иногда можно легко определить, что причиной является неисправность электрода, но иногда такие проблемы обнаружить крайне трудно. У пациентов с анатомическими особенностями электроды могут быть изначально неверно позиционированы.
Также наличие электродов оказывает влияние на клапанный аппарат правых отделов сердца, в частности на трикуспидальный клапан (ТК). Электроды могут перфорировать створки клапана. При длительном нахождении и плотном соприкосновении может происходить дисфункция створок клапана, сращение электрода со створкой, что может вызывать или усугублять клапанную недостаточность, что неблагоприятно отражается на состоянии тяжелых пациентов с сердечной недостаточностью. Такое состояние нередко требует радикальной хирургической коррекции на открытом сердце сопровождающейся пластикой или протезированием ТК и одномоментной деимплантацией системы.
Дислокация электрода — самое часто осложнение, возникающее в первые сутки после имплантации устройства, однако регистрируются поздние дислокации, сроком до нескольких месяцев [6]. Дислокация может быть связана как с интраоперационными действиями, так и с несоблюдением пациентов режима после оперативного вмешательства. Также к дисфункции электрода могут приводить дефекты изоляции, которые могут быть связаны со слишком тугими швами на муфте, отсутствием муфты для фиксации электрода или случайным повреждением во время операции [5].
Осложнения, связанные с ложем генератора импульсов — обширная группа осложнений, которые могут быть как неинфекционными, так и инфекционными. К неинфекционным можно отнести серомы, гематомы и пролежни ложа. Серомы, содержащие серозную жидкость в большом объеме, требуют пункции и медикаментозное лечение. Чаще всего возникновение серомы происходит вследствие замены генератора импульсов, который в своих размерах меньше предыдущего. Гематомы ложа встречаются относительно часто. Лечение гематомы, как правило, консервативное, однако при появлении признаков напряженности (припухлость, болезненность, напряжение кожных покровов, местные трофические изменения, местная потеря чувствительности) может возникнуть необходимость в эвакуации содержимого или ревизии раны. Возникновение гематомы может быть связано с нарушенным режимом дозирования антикоагулянтных препаратов в периоперационном периоде. Пролежень ложа аппарата характеризуется полной деструкцией ткани ввиду трофических изменений в месте максимального давления аппарата на ткани и образованием свищевого отверстия между ложем аппарата и наружной средой. Факторами риска возникновения пролежней являются слишком маленькое ложе с натяжением вышележащих тканей, поверхностная или латеральная имплантация у худых пациентов [5].
Все вышеперечисленные осложнения могут переходить в группу инфекционных при определенных условиях. Наличие инфекции требует полного удаления системы, в то время как частичное удаление может быть связано с высоким риском рецидивов [7—10]. Проявления инфекции ложа генератора импульсов могу быть как местными (покраснение, болезненность, припухлость, формирование абсцесса вокруг устройства), так и системными (развитие сепсиса). Ранние инфекции обычно вызваны золотистым стафилококком (Staphylococcus aureus), в то время как поздние — эпидермальным стафилококком (Staphylococcus epidermidis), они протекают более медленно и могут проявляться через месяцы после имплантации.
Электрические осложнения
Основные компоненты систем стимуляции — корпус аппарата и электроды. Понятие «неисправность системы» подразумевает поиск проблем на всех возмождных уровнях, к котороым относятся корпус прибора, коннекторная часть, проблема на уровне «электрод-миокард» [2].
Нарушения на уровне «электрод-миокард» возникают в зоне контакта дистального полюса эндокардиального электрода с миокардом предсердия или желудочка и могут проявляться повышением порога стимуляции или же нарушением восприятия спонтанных сигналов сердца (P- или R-волн). Нарушения на этом уровне также могут проявлятсья недостатком восприятия (андерсенсингом) или, напротив, избытком восприятия (оверсенсингом) [5, 11].
Такие осложнения, как пенетрация и перфорация стенок камер сердца, могут возникать у пациентов с некомпактным миокардом, эндокардитом и эндокардитом в анамнезе, а также вследствие чрезмерного усилия при фиксации электрода. Пенетрация характеризуется повышением порога стимуляции и снижением чувствительности. Существуют риски перфорации стенок камер сердца, о чем может говорить полное отсутствие чувствительности и стимуляции. Также при перфорации может возникать болезненная диафрагмальная стимуляция. Прежде всего перфорация свободной стенки миокарда опасна развитием тампонады [12—14]. Как правило, перфорация электродом не требует открытой хирургической коррекции. Решается путем простой репозиции электрода и динамическим наблюдением в условиях операционной. Процент хирургической коррекции перфорации электродом достаточно мал.
Нарушение на уровне коннекторной части системы — месте соединения эндокардиального электрода и корпуса аппарата — может также проявляться повышением порога стимуляции, нарушениями чуствивтельности и изменением сопростивления электрода. Причинами этих нарушений чаще всего является механическое повреждение коннекторной части.
Нарушение в генераторе импульсов могут быть обусловленны истощением элементов питания, дефектами интегральных систем, включающий программируемые микропроцессоры, осцилляторы, усилители, считывающие элелементы, а также неадекватно установленные режимы или параметры стимуляции.
Целью настоящего анализа было выявление осложнений, связанных с имплантацией устройства МСС, у пациентов с ХСН и фибрилляцией предсердий (ФП) в течение 24 мес наблюдения.
Материал и методы
Данное исследование зарегистрировано в системе ClinicalTrials.gov Identifier: NCT05550792. Все пациенты, включенные в исследование, подписали информированное добровольное согласие. В исследование вошли 100 пациентов, которым проводилась имплантация устройства для модуляции сердечной сократимости. Критерии включения: подтвержденная ХСН в течение как минимум 3 мес, ФВ ЛЖ 20—40%, II—III функциональный класс (ФК) сердечной недостаточности по NYHA, продолжительность комплекса QRS до 130 мсек, стабильное состояние более 1 мес. Все включенные пациенты имели ФП, пароксизмальную или постоянную. Критерии исключения: обратимые причины сердечной недостаточности, затруднение венозного доступа, препятствующее имплантации устройства, пациенты в активном листе трансплантации сердца, ХСН IV ФК, недавнее хирургическое вмешательство. Имплантация устройства проводилась в срок с 2018 по 2019 г. Техника операции была стандартная для данного вида вмешательств. Срок наблюдения составил 24 мес. Среднее время пребывания пациента в стационаре составило 10,3±4,9 сут.
Статистический анализ данных осуществляли с помощью пакета прикладных программ Excel 2010 и статистических программ STATISTICA 10 (StatSoft Inc., США). Качественные величины представлены как абсолютные значения и проценты. Использовались следующие методы статистического анализа: U-критерий Манна—Уитни. Выборочные параметры, приводимые в таблице, представлены в виде M (sd) и Me [Lq; Uq], где M — среднее, sd — стандартное отклонение, Me — медиана, Lq; Uq — межквартильный размах. Уровень различий считался достоверным при p<0,05, значения 0,05<p<0,10 интерпретировались как тенденция. Оценивались частота интраоперационных, ранних и поздних осложнений, связанных с имплантацией устройства МСС-терапии. Ранние осложнения трактовались нами как осложнения, которые возникли в течение периода госпитализации пациента.
Результаты
У 15 (15%) пациентов ранее были имплантированы трансвенозные КВД, что требовало проведения специальной процедуры программирования — crosstalk-теста для исключения перекрестного восприятия сигналов МСС кардиовертером-дефибриллятором, которое может приводить к активации антитахикардитической стимуяции.
Всего было зарегистрировано 11 осложнений (рис. 2).

Рис. 2. Структура осложнений в ходе исследования.
Интраоперационные осложнения
Всего было проведено 102 оперативных вмешательства.
Зарегистрировано 3 интраоперационных осложнения.
В двух случаях во время оперативного вмешательства в момент проведения электрода в полость правого желудочка при контакте с трикуспидальным клапаном инициировался устойчивый пароксизм мономорфной желудочковой тахикардии (ЖТ) с ЧСЖ до 240 уд/мин, сопровождающейся гипотонией. Многократные попытки перепозиционирования электрода также приводили к развитию ЖТ ввиду высокой аритмогенности ТК. Этим пациентам приборы не имплантированы, и они были исключены их исследования.
В одном случае при имплантации устройства МСС-терапии возник эпизод частой желудочковой экстрасистолии, купировавшийся самостоятельно. В остальных 99 случаях успешной имплантации приборов интраоперационных осложнений не зарегистрировано.
У 100 пациентов, которым были имплантированы МСС-устройства, послеоперационные осложнения возникли в 8% случаев.
В основном это были ранние неинфекционные (4%) послеоперационные осложнения в первые сутки после вмешательства. Они включали в себя развитие пневмоторакса, гематомы ложа МСС и нарушений ритма различного генеза. В структуре поздних осложнений также преобладали неинфекционные (2%), к ним относилась дислокация электрода и развитие тяжелой трикуспидальной недостаточности вследствие компрессии сворки желудочковым электродом с периодом сепарации створок ~0,7 см и развитием недостаточности тяжелой степени с забросом в печеночные вены.
Экстракция систем МСС-терапии была выполнена у 3 (3%) пациентов. В двух случаях по причине имплант-ассоциированой инфекции, и в одном случае по причине дисфункции створки ТК и развитием тяжелой ТР. Все случаи удаления систем были отнесены к поздним послеоперационным осложнениям, они были произведены в сроки от 2 до 24 мес после имплантации.
Желудочковая тахикардия, вызванная стимуляцией МСС
Пациент Ш., 73 года. Этиологическим фактором развития сердечной недостаточности (ФВ ЛЖ 30—32%) в данном случае явилась ишемическая болезнь сердца. Исходно при проведении ХМ-ЭКГ перед имплантацией регистрировалась постоянная фибрилляция предсердий, минимальная желудочковая эктопическая активность (1118 ЖЭС/сут). Пробежки желудочковой тахикардии (ЖТ) не регистрировались. Указания на ЖТ в анамнезе также не было. Пациенту была проведена имплантация МСС-устройства. В первые сутки после оперативного вмешательства, при нахождении в палате реанимации и интенсивной терапии по прикроватному монитору регистрировалась пробежка ЖТ, состоящая из 10 комплексов (рис. 3).

Рис. 3. Пробежка желудочковой тахикардии, вызванная стимулом МСС. (Архив ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России).
На представленном рис. 3 видно, что эта пробежка возникла из-за нанесения стимула МСС-устройства в период относительной рефрактерности желудочков, что повлекло за собой возникновение аритмии. Пациенту была произведена коррекция параметров стимуляции. При контрольном ХМ-ЭКГ нарушений в работе МСС-устройства не регистрировалось.
Также подобное явление может возникнуть при нанесении стимула МСС на комплекс QRS, представляющем желудочковую экстрасистолу. При регистрации подобных явлений при ХМ-ЭКГ требуется обязательная процедура интеррогирования и коррекция параметров стимуляции. На рис. 4 показано нанесение стимула МСС на комплексы QRS основного ритма, также мы видим ЖЭС без стимула.

Рис. 4. Комплексы QRS собственного ритма и ЖЭС без спайка МСС. (Архив ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России).
Данная картина является демонстрацией нормальной и правильной работы МСС-устройства.
Послеоперационные осложнения
Пневмоторакс в раннем послеоперационном периоде. Дислокация электрода в позднем послеоперационном периоде
Пациент Е., 68 лет. Осложнений во время проведения имплантации не зарегистрировано. В первые сутки после операции, по данным рентгенографии органов грудной клетки (ОГК), в левой плевральной полости определялось небольшое количество свободного воздуха, верхушка легкого отстояла на 3 см, по задней поверхности легкое отстояло на 27 мм, воздух был расположен преимущественно в задних отделах, частично осумкован и тонким слоем парамедиастинально. С учетом стабильного состояния пациента была выбрана наблюдательная тактика. При повторных рентгенологических исследованиях в динамике, увеличения объема воздуха в плевральной полости не регистрировалось. Дренирование плевральной полости не производилось. Далее явления левостороннего пневмоторакса регрессировали. Пациент был выписан. При плановой проверке работы МСС-устройства через 2 мес после имплантации, отмечалось значительное повышение сопротивления (свыше 2000 Ом) на одном из электродов (LS-электрод). Было проведено рентгенологическое исследование ОГК и выявлена дислокация желудочкового электрода (рис. 5).

Рис. 5. Рентгенограмма ОГК пациента Е.
а — после имплантации МСС-устройства; б — спустя 2 мес после имплантации. Выявлена дислокация желудочкового электрода. (Архив ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России).
Пациент был повторно госпитализирован. Проведено оперативное вмешательство по коррекции положения желудочкового электрода. Оперативное вмешательство прошло успешно. Послеоперационный период без особенностей. В дальнейшем в течение всего периода наблюдения осложнений и нарушений в работе прибора МСС выявлено не было.
Инфекция ложа МСС. Развитие вторичного иммунодефицита после имплантации МСС
Пациентка С., 71 года. Оперативное вмешательство прошло без осложнений. Ранний послеоперационный период протекал без особенностей. Пациентка была выписана в удовлетворительном состоянии. Однако спустя 2 мес вновь отметила появление одышки при физической нагрузке, эпизоды снижения АД до 90/60 мм рт.ст.
При контрольном обследовании признаков декомпенсации явлений ХСН у пациентки выявлено не было, объективно — выраженная тенденция к гипотонии (снижение АД до 80/40—90/60 на фоне отмены терапии юперио и бета-блокаторами, ранее хорошо переносимой). Также обращало внимание наличие серозно-геморрагического отделяемого в зоне послеоперационного шва. В анализах крови отмечалось повышение СРБ до 29 мг/дл и СОЭ до 50 мм/час, положительный анализ на прокальцитонин (0,13 нг/мл). При осмотре послеоперационной раны визуализируется дефект в пределах подкожной жировой клетчатки размерами 10´35´8 мм. Стенки и дно раны частично покрыты фибринозным налетом. По данным ЭхоКГ, в полости правого предсердия на желудочком электроде определялись дополнительные подвижные образования (d ~5—7 мм), в динамике при проведении чреспищеводного ЭхоКГ (ЧпЭхоКГ) данные образования также были выявлены, однако нельзя было дифференцировать их между вегетациями и фибрином. Предполагалась имплант-ассоциированная инфекция. В области электродов МСС на клапанах сердца при ЧпЭхоКГ дополнительных наложений не выявлено, но наличие положительного прокальцитонина, местные проявления в ложе МСС не исключали инфекции, предположительно вызванной стафилококком. У пациентки были взяты посевы крови и раневого отделяемого, начата антибактериальная терапия линезолидом 600 мг 2р/сут капельно. Отмечалась положительная динамика МСС-терапии (трехкратное снижение уровня NT-proBNP, уменьшение клинических проявлений ХСН, прирост ФВ ЛЖ). Было принято решение продолжить консервативное лечение, двухкомпонентную антибиотикотерапию, контроль маркеров воспаления. По результатам бактериологического исследования (посева раневого отделяемого на микрофлору) был выделен Staphylococcus aureus, резистентный к пенициллинам, чувствительный к цефалоспоринам. У пациентки был взят повторный бактериологический посев крови (роста нет). В динамике при проведении ЧпЭхоКГ у пациентки отмечалось постепенное уменьшение размера флотирующих структур, в лабораторных исследованиях было выявлено угнетение эритро- и лейкопоэза, сохранялась тенденция к гипотонии. Для исключения вторичного иммунодефицитного состояния проведено исследование иммунного статуса с определением субпопуляций Т- и В-лимфоцитов, показателей фагоцитоза, иммуноглобулинов A, M, G, так как невозможно было исключить реакцию отторжения имплантированного устройства МСС (содержит металлический сплав, силикон). После получения результатов иммунного статуса была констатирована имплант-ассоциированная инфекция (установка МСС). Вторичное иммунодефицитное состояние комбинированного типа с преобладанием угнетения гуморального звена. В связи с полученными данными было проведено удаление системы МСС.
Инфекция ложа МСС спустя 12 мес после имплантации
Пациентка А., 60 лет. В 2016 г. пациентке имплантировано устройство для ресинхронизирующей терапии. Однако, несмотря на проводимое лечение, сохранялись признаки СН, а также отмечалось снижение ФВ ЛЖ до 22%. Пациентке была проведена имплантация МСС-устройства. Скорректированы параметры ресинхронизирующей терапии, а также МСС-терапии. Оба устройства осуществляли стимуляцию. Рентгенография ОГК данной пациентки в послеоперационном периоде представлена на рис. 6, а.

Рис. 6. Пациентка А. а — рентгенограмма ОГК после имплантации МСС-устройства б — визуальные признаки воспаления в проекции ложа МСС-устройства.
На протяжении 12-месячного периода наблюдения состояние пациентки оставалось стабильным. Отмечалась положительная динамика в виде повышения толерантности к физическим нагрузкам. Однако спустя год после имплантации она отметила припухлость в области ложа МСС, повышение локальной температуры, болезненность (см. рис. 6, б).
Была начата терапия цефтриаксоном, при ЭхоКГ выявлены флотирующие элементы на электродах. Инфекция ложа МСС-устройства явилась показаниями к срочному оперативному вмешательству. Проведена операция по удалению устройства МСС и электродной системы, из ложа устройства эвакуировано 30 мл гнойного отделяемого. В послеоперационном периоде состояние пациентки было стабильным, при перевязках гнойного отделяемого не было, температура тела не повышалась. По данным ЧПЭхоКГ визуализировались флотирующие структуры на электродах CRT-D. Учитывая отсутствие лейкоцитоза, нормальную температуру тела, наличие вегетаций маловероятно. По всей видимости, эти флотирующие структуры являлись нитями фибрина, что является показанием для проведения антикоагулянтной терапии. По завершении лечения пациентка была выписана.
Обсуждение
В целом имплантация МСС не сопровождается жизнеугрожающими осложнениями. Вмешательство занимает достаточно небольшой промежуток времени. По данным зарубежных авторов, среднее время оперативного вмешательства составляло 80±34 мин, что соответствует данным нашего исследования — 82,5±21,2 мин) [15].
Дислокация электрода является самым частым случаем, по данным зарубежных авторов, которые оценивали результаты имплантации системы МСС-терапии. В нашей клинике также наблюдался 1 случай дислокации электрода, что потребовало его коррекции. По данным W.T. Abraham и соавт., дисклокация электрода возникла в 5 случаях из 109 [16].
В нашем исследовании возникло 3 случая инфекции ложа устройства. В 1 случае пациент находился на консервативной терапии и был успешно вылечен, в 2 других наблюдениях потребовалась экстракция МСС-системы. По данным M.M. Borggrefe и соавт., инфекция ложа устройства возникла в 5 случаях из 166 [17].Тяжелая дисфункция ТК наблюдалась у одного пациента, что потребовало экстракции системы для МСС-терапии. В зарубежных источниках литературы частота тяжелой ТР при проведении МСС-терапии не описывается. Осложнения, связанные со стимуляцией, возникли однократно. При нанесении импульса на комплекс желудочковой экстрасистолы, возникла пробежка желудочковой тахикардии, однако такое осложнение не было жизнеугрожающим и было скорректировано путем изменения настроек работы прибора.
В нашем исследовании больший процент осложнений (6%) возник в первые месяцы имплантации прибора, в дальнейшем, по мере накопления опыта хирурга и ассистента по настройке параметров, количество осложнений значительно снизилось.
Заключение
Модуляция сердечной сократимости является перспективным методом лечения пациентов с хронической сердечной недостаточностью. Однако как и любое оперативное вмешательство, имплантация данного устройства требует высокой квалификации оперирующего хирурга, а также команды, которая занимается послеоперационным ведением пациентов и программированием устройств. Учитывая наш клинический опыт, стоит отметить, что с увеличением количества подобных оперативных вмешательств возрастает опыт имплантации и программирования данных систем. Отдаленные результаты имплантации данных систем требуют дальнейшего изучения.
Авторы заявляют об отсутствии конфликта интересов.
Регистрационный номер клинического исследования: ClinicalTrials.gov Identifier: NCT05550792.
Clinical Trial Registration Number: ClinicalTrials.gov Identifier: NCT05550792.
1. Рекомендации по электрокардиостимуляции и сердечной ресинхронизирующей терапии. ESC 2013. // Российский кардиологический журнал 2014, 4 (108): 5-63.
2. Бокерия, Л.А. Электрокардиостимуляция при бра-диаритмиях / Л.А. Бокерия, А.Ш. Ревишвили, К.В. Давтян // Руководство по нарушениям ритма сердца. Под ред. Е.И. Чазова, С.П. Голицына. — М.: ГЭОТАР-Медиа, 2008. — 307 с.
3. Бокерия, Л.А. Состояние электрокардиостимуляции в России в 2010 году / Л. А. Бокерия, А. Ш. Ревишвили, И. А. Дубровский // Вестник аритмологии. — 2012. — № 68. — с. 77-8
4. Гордеев, О.Л. Основы послеоперационного динамического контроля и лечения пациентов с имплантированными электрокардиостимуляторами: автореф. дис. д-ра мед. наук.: 14.00.44 / Гордеев Олег Леонидович — С.-Петербург, 2005. — 36 с.
5. Жданов, А.М. Руководство по элекгрокардиостимуляции сердца / А.М. Жданов, О.Н. Ганеева — М.: Издательство «Медицина»: «Шико», 2008. — 200 с.
6. Свиридова, А. А. Клиническое применение электрокардиостимуляторов с функцией автоматического определения порога стимуляции и автоматическим регулированием амплитуды стимулирующего импульса: автореф. дис. канд. мед. наук: 14.00.44 / Анна Александровна Свиридова. — М., 2001 г. — 34 с.
7. Эспинозо, Р. Новый алгоритм захвата, введенный в частотоадаптивный двухкамерный кардиостимулятор: первые клинические результаты / Р. Эспинозо, Х.Р. Хернандес Гарсия, М. Сассара, Е.В. Скаббиа, К.С. Скодачек, К. Де Метц, Е.Д. Бирхфельд // Progress in Biomedical Research. — 2002. — № 2. — с. 61-70.
8. Senaratne, J. Pacemaker Longevity: Are We Getting What We Are Promised / J. Senaratne, E. Marleen, еt al. // PACE. — October 2006. — Vol. 29.
9. St.Jude Medical Company. Microny Clinical Report. Executive summary. — Pacesetter AB A -S-171 95 SOLNA. -Sweden. — Ordering No. 63 59 835 E502E. — P. 1.
10. Guerola, M. Evoced R wave and lead polarization. New pacing parameters / M. Guerola // Arhives des maladies du coeur et des vaisseaux. — 1998. — Tome 91. — No special III. — Vol. 18. — PW 23. — P. 47.
11. St.Jude Medical Company. Introduction to AutoCapture. — Pacesetter AB A -S-171 95 SOLNA. — Sweden. -Ordering No. 63 22 536 E508E. — P. 9.
12. Medtronic, Inc. Medtronic Kappa Generation of pacing systems. Capture Management. — UC9704296 EE. -Inc. — 1988. — P. 1-6.
13. Peck, B. Ventricular capture management operating details. Technical concept paper / B. Peck. — UC9704831 EE. — Medtronic, Inc. — 1998. — P. 1-3.
14. Lucas, S. The Impact of Automatic Threshold Tracking on Pulse Generator Longetivity in Patients with Different Chronic Stimulation Thresholds / S. Lucas, F. Duru, M. Fluri, H. R. Jenzer, M. Rahn, R. Candinas // PACE. — November 2000. — Vol. 23. — Part II. — P. 1788-1791.
15. Blaise, C. Active fixation screw-in leads and Auto-Capture -compartability assessement — results JP. Chabert CHU. / C. Blaise // Arhives des maladies du coeur et des vaisseaux. — 1998. — tome 91. — No special III. — Vol. 18-PW21. — P. 46.
16. Lau, C. A Cardiac Evoked Response Algorithm Providing Threshold Tracking: A North American Multicenter Study / C. Lau, D.A. Cameron, S.C. Nishimura, T. Ahern, R. A. Freedman, K. Elenbogen, S. Greenberg, J. Baker, D. Meacham // PACE. — 2000. — Vol. 23. — P. 953-959.
17. Clarke, M. Automatic adjustment of pacemaker stimu lation output correlated with continuously monitored capture thresholds: A multicenter study. European Microny Study Group / M. Clarke, B. Liu, H. Schuller, et al. // PACE. — 1998. — Vol. 21. — P. 1567-1575.
18. Libero, L. Safety and reability of Membrane E™ leads used in conjunction with AutoCapture function / L. Libero, M.R. Brusin, G. Gobbi, et. al. // Arhives des maladies du coeur et des vaisseaux. — 1998. — Tome 91. — No special III. -18-PW15 — P. 45.
19. Sorin Group. Implant manual. Ventricular Autothreshold — p. 2-20 (https://www.sorinmanuals.com/PDFUSERS/ CRM/O980E.pdf).
20. Lau, C. Intraoperative Study of Polarization and Evoked response Signals in Different Endocardial Electrode Designs. / C. Lau, S.C. Nishimura, Yee Raymond, C. Lefeuvre, F. Philippon, D.A. Cameron. // PACE. — 2001; 24; 1055-60.
21. Kam, Ruth. Automatic Capture Verification in Pacemakers (AutoCapture ) — Utility and Problems. / R. Kam. // Indian Pacing and Electrophysiology Journal. — 2004; 4(2):73-78.
22. Kenny, T. The nuts and bolts of implantable device therapy pacemakers / Tom Kenny // Library of Congress Cataloging-in-Publication Data. — 2015. — p. 334.
23. Benezet-Mazuecos, J. Limitations of the AutoCapture ™ Pacing System in patients with cardiac stimulation devices / J. Benezet-Mazuecos, J. Antonio Iglesias, J. Manuel Rubio, M. Cortes, E. de la Cruz, J. Jose de la Vieja, S. Calle, J. Farre Europace // First published online. — 2014. — Vol. 16 (10). — P. 1469-1475.
24. Biffi, M. Evolution of pacing for bradycardia: Auto-Capture / M. Biffi, J. Sperzel, C. Martignani, A. Branzi, G. Boriani // Eur Heart J. — 2007. — Vol. 9. — P. I23-I32.
Обзоры и лекции
© В. Б. СИМОНЕНКО, В. И. СТЕКЛОВ, 2012 УДК 616.12-008.318-085.844
ЭЛЕКТРИЧЕСКАЯ СТИМУЛЯЦИЯ СЕРДЦА: ИСТОРИЯ, СОВРЕМЕННОЕ СОСТОЯНИЕ И ПЕРСПЕКТИВА РАЗВИТИЯ
В. Б. Симоненко, В. И. Стеклов
ФГКУ Медицинский учебно-научный клинический центр им. П. В. Мандрыка Минобороны России, Москва
Обзор посвящен историческим аспектам развития как временной так и постоянной электрической стимуляции (ЭС) сердца. Освещены наиболее важные и самые современные технические достижения и концепции электротерапии брадиаритмий. К их числу относятся двухкамерные и частотно-адаптивные системы. Рассмотрены алгоритмы подбора оптимальных режимов ЭС сердца в зависимости от вида брадиаритмии. Рассматриваются современные представления о физиологической ЭС сердца. Представлен собственный опыт авторов по применению режимов ЭС сердца.
Ключевые слова: электрическая стимуляция сердца, электрокардиостимулятор, атриовентрикулярная блокада, брадиаритмия, нарушение сердечного ритма, синдром слабости синусового узла, фибрилляция предсердий, частотно-адаптивная электрокардиостимуляция, алгоритм
ELECTRICAL STIMULATION OF THE HEART: HISTORY, CURRENT TRENDS AND PROSPECTS V.B. Simonenko, V.I. Steklov
P.V. Mandryka Medical Training and Scientific Centre, Russian Ministry of Defense
Part 1 of this review is devoted to the history of development of temporary and continuous electric stimulation (ES) of the heart. Up-to-date concepts of bradyarrhythmia are considered along with the most important techniques for its management with the use of two-chamber and frequency-adaptive systems. Algorithms for the choice of optimal ES regimes taking account of the type of bradyarrhythmia are discussed. Current concepts ofphysiological ES of the heart are considered. The authors describe their own experience with the application of ES of the heart.
Key words: electrical stimulation of the heart, electrocardiostimulator, atrioventricular block, bradyarrhythmia, heart rhythm disorder, sick sinus syndrome, atrial fibrillation, frequency-adaptive electrical cardiostimulation, algorithm
Среди большого количества нарушений сердечного ритма (НРС) особое место занимают брадиаритмии, приводящие нередко к развитию тяжелой сердечной недостаточности и внезапной смерти. Фармакологические антиаритмические препараты при гемодинамически значимых брадисистолических формах НРС и проводимости в большинстве случаев неэффективны [1—7]. Так, до внедрения в клиническую практику методов электрической стимуляции (ЭС) сердца ежегодная смертность у больных с приобретенной полной предсердно-желу-дочковой блокадой превышала 50% [8—14]. В последние десятилетия получены значительные достижения в области ЭС сердца, ставшей одним из важнейших методов восстановления нормального кровообращения у больных с симптомными брадиаритмиями [3, 15—19]. Миллионы людей в настоящее время живы благодаря имплантированным электрокардиостимуляторам (ЭКС) и кардиовертерам-дефибрилляторам.
Целью настоящей публикации являются систематизация сведений по истории электрических методов лечения НРС и проводимости, а также обзор последних научных и клинических разработок в области ЭС сердца.
История временной электрической стимуляции сердца
Начало клинической ЭС сердца обычно связывают с именем американского доктора A. Hyman, который совместно с сотрудниками в 1930 г. начал работу по созданию наружного ЭКС. В 1931 г. он разработал этот прибор, позволявший выполнить ЭС сердца при
помощи трансторакальной иглы. A. Hyman назвал свой аппарат artificial pacemaker — искусственный водитель ритма. Этот термин получил всемирное распространение и признание. В 1932 г., используя созданный пейс-мекер, A. Hyman с сотрудниками сумели в течение 24— 48 ч поддерживать жизнь двух пациентов с асистолией. В течение года они выполнили ЭС сердца в 43 случаях при различных брадиаритмиях, однако всего лишь в 14 случаях из 43 этот метод оказался удачным [20]. В те годы отрицательно относились к разработкам по искусственному продлению человеческой жизни, а эксперименты на людях рассматривали как кощунственные вмешательства. Поэтому вследствие наличия большого количества противников «излишней технизации» медицины A. Hyman не торопился делать подробные сообщения о своих исследованиях на пациентах. В своих работах он ссылался на более ранние исследования в этом направлении.
Так, еще 1926 г. в Сиднее в акушерско-гинекологиче-ской клинике врачи, пожелавшие остаться неизвестными, успешно реанимировали новорожденного при помощи созданного им электрического прибора. Через 3 года, в 1929 г., M. Lidwill и E. Booth разработали аппарат для ЭС сердца и представили результаты исследований, которые проводились на мертворожденных младенцах. В одном случае, когда обычные реанимационные мероприятия были безуспешны, ЭС желудочков позволила реанимировать младенца и он выжил [21]. По-видимому, именно этот случай можно считать первым положительным клиническим опытом применения ЭС сердца.
Современная эра ЭС сердца относится к началу 50-х годов XX века. Большой вклад в развитие электрических методов лечения НРС и проводимости сердца (как ЭС сердца, так и дефибрилляции) внес американский врач P. Zoll. В экспериментах на животных, а затем и в клинике он доказал эффективность ЭС желудочков сердца через накожные и чреспищеводные электроды [22].
Серьезным недостатком метода были часто возникающие при ЭС сердца болевые ощущения, ожоги тканей под электродами и вынужденное ограничение подвижности пациента, поэтому методика накожной ЭС сердца не получила широкого распространения. Позднее стали использовать кожные электроды с большей площадью и большей продолжительностью импульсов, позволившие сделать применение электрического разряда менее болезненным.
Дальнейшее развитие метод ЭС сердца получил в 1953 г., когда J. Damman с сотрудниками разработали прибор, способный выявлять спонтанные желудочковые потенциалы, а при их отсутствии наносить импульсы на сердце. Этот принцип работы был положен в основу класса ЭКС, функционирующих «по требованию» и получивших название demand. В последующем они применили методику наружной ЭС сердца в течение 62 ч у больного с полной атриовентрикулярной (АВ) блокадой, возникшей после протезирования клапанов сердца [10, 23].
Через 4 года, в 1957 г., C. Lillehei и соавт. представили разработанный ими портативный прибор, позволяющий осуществлять методику временной ЭС [21]. При развитии синдрома Морганьи—Адамса—Стокса (MAC) авторы выполняли ЭС правого желудочка активным электродом, введенным в миокард правого желудочка пункцион-но через кожу, а пассивный электрод фиксировали к коже. Они доказали возможность проведения длительной и надежной ЭС сердца при небольшом напряжении импульсов (2—3 В). Основным недостатком этого метода было чрезмерное повышение порога стимуляции.
В 1958 г. S. Furman и G. Robinson [14] впервые осуществили временную ЭС правого желудочка при помощи активного электрода, введенного в правый желудочек через локтевую вену под контролем флюороскопии. ЭС сердца проводили трансвенозным способом без осложнений на протяжении 96 дней [13].
В последующие годы для временной эндокардиальной ЭС стали использовать другие трансвенозные доступы (головная и яремные вены), что позволило увеличивать время ЭС сердца. Так, в 1959 г. J. Schwedel и соавт. [23], используя автономный наружный ЭКС 902М (фирмы Atroniks, США), на протяжении трех лет осуществляли временную эндокардиальную ЭС у 67-летнего больного с постоянной АВ-блокадой высокой степени с клинической картиной рецидивирующих приступов МАС. При временном отключении ЭКС развивалась асистолия. В течение длительного времени ЭС сердца инфекционные осложнения не развились. Постоянный ЭКС был имплантирован через 41 мес временной ЭС сердца.
Советские ученые внесли существенный вклад в развитие ЭС сердца. Сотрудники НИИ экспериментальной хирургической аппаратуры и инструментов Н. С. Джавадян и В. Н. Ростовцев в конце 50-х годов прошлого века разработали наружный стационарный ЭКС с питанием от сети. В дальнейшем они разработали и выпустили серийный выпуск портативного ЭКС-2. В 1961 г. вышла в свет первая монография по ЭС сердца, в которой авторы представили первую успешную временную ЭС в клинике [24].
Большой вклад в развитие этой проблемы внесли сотрудники Каунасского медицинского института, где в 1960 г. был разработан портативный ЭКС (масса 1,5 кг) с автономным источником питания, позволявший проводить как наружную, так и прямую ЭС сердца. Электро-
ды собственной конструкции авторы вводили в сердце как пункционным, так и открытым способом [2, 25].
Таким образом, временная ЭС сердца является методом выбора неотложной терапии при внезапно возникших гемодинамически значимых брадиаритмиях. Это послужило толчком для разработки метода, обеспечивающего постоянную ЭС при хронических брадиаритмиях.
История постоянной электрической стимуляции сердца
Первый ЭКС был разработан шведским инженером Я. Elmqvist [26] и имплантирован доктором А. 8епш^ в 1958 г. Эта дата стала точкой отсчета клинического внедрения высокоэффективного и спасающего жизнь метода лечения больных с брадиаритмиями [26].
В СССР первый серийный имплантируемый ЭКС был разработан и имплантирован в 1962 г. в клинике факультетской хирургии II Московского медицинского института им. Н. И. Пирогова В. С. Савельевым под руководством акад. А. Н. Бакулева [9, 27].
В 1966 г. С. С. Григоров в нашей стране впервые выполнил имплантацию эндокардиального электрода через плечеголовную вену. С этого времени постоянная ЭС сердца получила широкое применение в клинической практике [10].
В кратчайшие сроки после начала применения постоянной ЭС сердца было выявлено, что этот метод является относительно безопасным, позволяющим существенно снизить летальность, уменьшить число госпитализаций, устранить симптомы болезни и значительно улучшить качество жизни больных с гемодинамически значимыми брадиаритмиями. Следовательно, постоянная ЭС сердца превратилась в средство выбора при лечении гемодинамически значимых брадисистолических форм НРС и проводимости [2, 16, 18, 28—33].
Учитывая высокую эффективность метода постоянной ЭС сердца, в СССР начали исследования по этому направлению в известных клиниках страны [3, 6, 10, 34, 35].
Первые модели ЭКС не мониторировали собственную активность сердца, поэтому работали в асинхронном режиме (УОО) и проводили стимуляцию желудочков с фиксированной частотой. Асинхронный режим ЭС сердца допускал интерференцию между ритмом ЭКС и собственным ритмом сердца [2, 8, 16, 36]. Так работала первая отечественная модель имплантируемого ЭКС-2, срок действия которого ограничивался 2,5—3 годами. Полная независимость ЭКС от работы сердца создавала много помех при преходящих брадиаритмиях. Интерференция искусственного и собственного ритмов приводила порой к развитию фибрилляции желудочков.
В 1965 г. появились первые модели ЭКС, способные определять собственную деятельность сердца и работать в режиме «по требованию» (УУ1), т. е. выключающийся при восстановлении собственного ритма больного и вновь включающийся при отсутствии естественных желудочковых комплексов [7, 16, 25, 27, 37]. Такой тип устройства требовал соответствующих схем дополнительного усиления ЭКГ и детекцию активаций желудочков и предсердий. Эти ЭКС выполняли на дискретных транзисторах, что ограничивало их функциональные возможности. В СССР такой аппарат выпускали под названием ЭКС-222 и он неплохо зарекомендовал себя, тем более что срок службы его составлял до 8—10 лет.
Внедрение в начале 70-х годов ХХ века интегральных схем обеспечило создание программируемых устройств. Программируемость значительно облегчила ведение больных на протяжении всего срока службы ЭКС. Примерно в то же время благодаря появлению литий-йодных батарей увеличился срок службы ЭКС. В СССР был выпущен пейсмекер следующей модели — ЭКС-500 в различных вариантах. ЭКС-500 был надежным и долговечным. Не-
Примечание. А — предсердие (atrium); V — желудочек (ventricle); D — предсердие и желудочек (dual); 0 — без функции детекции, синхронизирования или программирования (none); Т — стимуляция происходит синхронно с сигналом от сердца (triggered); I — стимуляция запрещается сигналом от сердца (inhibited); D — сочетание запрещаемого и триггерного режимов, в предсердии триггерный режим, в желудочке — ингибированный (dual); R — автоматическая подстройка частоты импульсов при физической и эмоциональной нагрузке (rate modulation, rate responsive); M — мультипрограммируемый (multiprogrammable); С — программировние с двусторонней диалоговой связью (œmmunicating); Р — антитахикардитическая электрокардиостимуляция (pacing antitachyarrythmia); S — кардиоверсия, дефибрилляция (shock).
Стимулируемая камера Камера, воспринимающая управляющий сигнал Вид реакции стимулятора на воспринимаемый сигнал Программируемость, частотная модуляция Антитахикардитические функции
0 А I 0 0
A V Т R P
V D D M S
D 0 0 C D (PS)
достатком его явились только фиксированная частота ЭС, развитие синдрома кардиостимулятора при ЭС правого желудочка у больных с АВ-блокадой с сохраненной функцией синоатриального узла (САУ) [9, 15, 16, 25, 38].
Следующее поколение ЭКС обеспечило физиологический характер ЭС (режимы VAT, VDD, AAI и DDD) за счет автоматического контроля частоты и/или увеличения степени наполнения желудочков сердца в результате синхронного сокращения предсердий и желудочков [37, 39]. Первые устройства работали в режиме VAT, стимулируя желудочки вслед за электрической активностью, выявленной в предсердиях [30, 41—44]. Для пациентов с АВ-блокадой и нормальной функцией САУ это означало существенное улучшение качества жизни, однако ЭКС, работавшие в то время в режиме VAT, не обладали способностью определять желудочковую активность, поэтому желудочковая экстрасистола вполне могла привести к желудочковой ЭС в уязвимый период. Для исключения возможных проблем, связанных с ЭКС в режиме VAT, создали более совершенные ЭКС, работавшие в режиме VDD. Недостаток такого режима ЭС заключался в невозможности стимуляции предсердий при отсутствии его активности [45].
Современное состояние электрической стимуляции сердца
Сегодня техника ЭС сердца ушла далеко вперед и разработка приборов ведется в основном в двух направлениях: создание двухкамерных (секвенциальных) моделей, при работе которых сохраняется синхронность сокращения предсердий и желудочков, и разработка различных вариантов частотно-зависимых аппаратов, в которых режим ЭС изменяется в зависимости от энергетических потребностей организма. Следовательно, очередным шагом вперед стало создание устройств, обеспечивающих предсердную и желудочковую ЭС по требованию, включаемой волной активации предсердий (DDD). Пейсмекеры этого класса позволяют сохранить предсердно-желудочковую синхронизацию при уреже-нии ритма сердца ниже установленного предела [29, 42, 46]. Недостатком этих ЭКС является ограничение их возможности при хронотропной дисфункции сердца, как правило при синдроме слабости синоатриального узла (СССУ) вследствие невозможности спонтанного учащения сердечного ритма в ответ на физиологическую нагрузку. Это потребовало дальнейшего совершенствования систем ЭКС [8, 9, 47—51].
В последних моделях ЭКС благодаря включению в электронную систему ЭКС специальных детекторов (сенсоров), улавливающих различные сигналы, отличные от Р-волны и увеличивается соответственно частота ЭС в ответ на нагрузку [17, 32, 42, 52—55]. Для обозначения частотно-адаптивной функции к соответствующему трехбуквенному коду добавляют позицию IV — R
(AAIR, VVIR, VDDR, DDDR и др.).
Выделяют следующие классы сенсоров для автоматической частотной адаптации ЭКС:
• прямые метаболические сенсоры определяют рН центральной венозной крови, насыщение кислородом венозной крови;
• непрямые метаболические сенсоры определяют частоту дыхания, минутную вентиляцию легких, температуру венозной крови, симпатическую активность;
• неметаболические физиологические сенсоры определяют интервал стимул—зубец Т, амплитуду зубца Т, градиент желудочковой деполяризации, ударный объем, сердечный выброс, давление в правом желудочке;
• прямые сенсоры активности — движения, акселерометр, гравиметр.
Появление ЭКС с двумя сенсорами в одном устройстве позволило уменьшить недостатки односенсорно-го аппарата и добиться оптимальной частоты ритма в любую фазу нагрузки у пациентов с СССУ [18, 32]. Кроме этого, в моделях ЭКС, работающих в режиме DDD/DDDR, имеется возможность определять наличие у больного наджелудочковой тахикардии. Они автоматически переключаются на другой безопасный и частотно-приспосабливающийся (желудочковый) режим стимуляции (VVIR) — функция switch mode [1, 55]. В результате этого исключается возможность поддержания высокой частоты желудочковых сокращений при наджелудочковой тахиаритмии.
Развитие ЭС сердца неразрывно связано с совершенствованием электродов для ЭКС. При имплантации ЭКС чаще всего используют чрезвенозные эндокардиальные электроды, реже — эпикардиальные. В последние годы шире применяют электроды биполярной конфигурации. В отличие от униполярных биполярные электроды позволяют избежать возникновения миопотенциального ингибирования и стимуляции скелетных мышц. Кроме этого, они совместимы с имплантируемыми кардиовер-терами-дефибрилляторами.
В последние годы было выявлено, что отрицательным фактором, влияющим на отдаленные результаты постоянной ЭС, является не только нарушение адекватной предсердно-желудочковой синхронизации, но и нарушение адекватной межжелудочковой синхронизации [56, 57]. При ЭС верхушки правого желудочка у больных со сниженной фракцией выброса нередко возникает внутри- и межжелудочковая диссинхрония. В первую очередь она приводит к снижению сердечного выброса за счет некоординированного сокращения желудочков сердца. Благодаря внедрению в клиническую практику эндокардиальных электродов с активной фиксацией появилась возможность стимуляции межжелудочковой перегородки, выводного, приточного тракта правого желудочка. При ЭС межжелудочковой перегородки либо выводного тракта правого желудочка в отличие от
Позиция буквы в номенклатуре кода
I II III IV V
функциональное значение буквы в номенклатуре кода
Стимулируемая Камера, из которой восприни- Вид реакции стимулятора Возможность частот- Многокамерная
камера мается управляющий сигнал на воспринимаемый сигнал ной модуляции стимуляция
0 — нет 0 — нет 0 — нет 0 — нет 0 — нет
А — предсердия А — предсердия Т — триггерный Р — модуляция А — предсердия
V — желудочки V — желудочки I — ингибирующий Р — модуляция частоты V — желудочки
й — обе камеры й — обе камеры (А + V) й — оба механизма (Т + I) й — обе камеры (А + V)
в — однокамерная (А или V) в — однокамерная (А или V)
ЭС верхушечной области в меньшей степени возникает правожелудочковая и межжелудочковая диссинхрония [57—59]. Электроды с активной фиксацией по сравнению с пассивными удаляются значительно легче. Основным недостатком их является нарастание хронического порога стимуляции. Использование электродов со стероидным покрытием в последнее время позволило решить и эту проблему.
Необходимо отметить, что большое влияние на изменение показаний к ЭС сердца наряду с совершенствованием ЭКС и электродов оказали сами способы имплантации приборов. Торакотомия, производившаяся с этой целью в 60-е годы, уступила свое место сначала медиа-стинотомии с иссечением мечевидного отростка грудины, а затем — чрезвенозной имплантации электродов. Это обезопасило операцию, сделав ее доступной даже для больных старше 80—90 лет, обремененных массой сопутствующих заболеваний. Следует помнить, что постоянная ЭС сердца не только увеличивает продолжительность жизни больного, но и существенно улучшает качество жизни.
Таким образом, если за долгую историю медицины понятия «хирургия» и «аритмия» были не только несовместимыми, но и взаимоисключающими, то в последние 50 лет хирургия все активнее вмешивается в эту область внутренней медицины. Это обусловлено практической необходимостью и базировалось на достижениях современной клинической электрофизиологии, микроэлектроники, электрохимии, материаловедения.
Для характеристики и классификации имплантируемых ЭКС используется международный буквенный код (табл. 1). В последние годы для обозначения новых моделей ЭКС кардиовертеров-дефибрилляторов стали применять пятибуквенный код, рекомендованный Севе-
роамериканским обществом по электрокардиостимуляции и электрофизиологии (ЫА8РБ) и Британской группой электрофизиологов (БрБв).
Буква в позиции I в номенклатуре кода указывает на камеру сердца, из которой поступают стимулированные импульсы, буква в позиции II — камеру, от которой приходят биоэлектрические сигналы к ЭКС. Буква в позиции III — камеру, в которой система ЭКС отвечает на самопроизвольную электрическую активность сердца. Позиция IV характеризует возможности наружного (неинвазивного) программирования работы ЭКС при помощи программаторов, а также наличие в системе ЭКС частотно-адаптивной функции. Буква в позиции V свидетельствует о наличии в системе ЭКС противотахи-кардитических устройств, включая кардиоверсию или дефибрилляцию.
В 2001 г. рабочими группами КА8РБ и БРБв предложена обновленная версия пятибуквенного номенклатурного кода для имплантируемых ЭКС (табл. 2).
Как правило, для обозначения вида и режима ЭС сердца используются первые три буквы кода (например, ААБ БББ), а буква Я (позиция IV) используется для обозначения программируемых ЭКС с функцией частотной адаптации сердечного ритма (например, УУШ, ААЖ, БББЯ). Под частотной адаптацией, или модуляцией, следует понимать способность устройства увеличивать или уменьшать частоту ЭС в пределах запрограммированных величин при активации сенсора нагрузок во время нарастания или прекращения физической активности пациента.
Выбор показаний к имплантации ЭКС требует тщательного анализа НРС и клинической картины основного заболевания у каждого конкретного пациента. Целями постоянной ЭС сердца пациентов с брадисистоличе-
Адекватная хронотропная функция при нагрузке
Есть Нет
Нарушение АВ-проведения
Нет Есть
1 1
Брадикардия в покое Брадикардия в покое
Есть Нет Есть Нет
т
АА1170
т
АА150
т
т 000/1
Нарушение АВ-проведения
Нет Есть
ААИЧ
ОООР
Рис. 1 Выбор режима ЭС при СССУ.
VDD/DDD DDDR Wl WIR
Рис. 2. Выбор режима ЭС при АВ-блокадах.
скими формами аритмий являются не только сохранение жизни больного, но и профилактика внезапной сердечной смерти, увеличение продолжительности жизни, профилактика сердечной недостаточности, тромбоэм-болических осложнений, лечение и профилактика НРС, а также повышение работоспособности и улучшение качества жизни пациента.
В 1984 г. Объединенная рабочая группа Американской кардиологической коллегии и Американской ассоциации сердца разработала и предложила показания к применению имплантируемых ЭКС с отражением их в соответствующих практических рекомендациях. В течение последних десятилетий накопилось много новой информации, что потребовало внесения поправок в руководстве от 1984 г. В 2009 г. рабочей группой Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции опубликованы новые пересмотренные и переработанные клинические рекомендации по применению имплантируемых антиаритмических устройств.
Алгоритмы подбора систем для постоянной электрокардиостимуляции
Все показания к ЭС сердца распределены на 3 класса. Первый класс предусматривает условия, при которых, по общему мнению, следует имплантировать постоянные ЭКС или антитахикардитические устройства. Показание к имплантации ЭКС становится несомненным при брадикардии, которая вызывает синкопальные состояния, сердечную недостаточность, недостаточность кровоснабжения головного мозга и другие проявления синдрома малого сердечного выброса.
После решения вопроса о необходимости имплантации ЭКС следует выбрать оптимальные режимы постоянной ЭС сердца. В современной кардиологической практике принята концепция физиологической ЭС, ко-
%
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Синдром MAC Эквиваленты Одышка Брадикардия синдрома MAC
—♦— АВ-блокада -—■— СССУ фибрилляция
предсердий
Рис. 3. Клинические проявления брадиаритмии перед имплантацией ЭКС.
ТаблицаЗ. Клиническая характеристика больных
Характер аритмии Средний возраст, годы (M±m) Количество больных
абс. %
АВ-блокада II—III степени 79,3 ± 9,6 6 39,9
СССУ 77,8 ± 7,2 55 35,9
Брадисистолическая фибрилляция предсердий 74,7 ± 12,3 37 24,2
Итого… 77,3 ± 9,4 153 100
торая включает в себя сохранение или восстановление адекватной предсердно-желудочковой синхронизации и уменьшение, при возможности, доли навязанного ЭКС ритма сердца. В настоящее время разработаны и внедрены в повседневную клиническую практику алгоритмы оптимального выбора видов и режимов постоянной ЭС у пациентов с брадиаритмиями.
На рис. 1 представлен алгоритм выбора режимов ЭС у пациентов с СССУ У пациентов с СССУ без признаков нарушения АВ-проводимости целесообразны однокамерные предсердные системы ЭС. При сохраненной хронотропной функции САУ с изолированными преходящими синоатриальными блокадами и/или посттахи-кардитической депрессией САУ предпочтение следует отдавать однокамерным предсердным системам ЭС в режиме demand (AAI) с низкой базовой частотой ЭС (около 50 в минуту). Если у больного имеется клинически значимая брадикардия в покое с сохраненной хроно-тропной функцией САУ и АВ-проводимости, то выбор должен быть сделан в пользу системы в режиме AAI с достаточно высокой частотой (более 60 имп/мин), а не в режиме VVI. При признаках хронотропной недостаточности методом выбора является режим AAIR.
При сочетании СССУ с признаками нарушения АВ-проводимости (антеградная точка Венкебаха менее 120 имп/мин) показана имплантация двухкамерных ЭКС. При сохраненной хронотропной функции возможна ЭС режиме DDD. Наличие признаков хронотропной недостаточности у этой категории больных требует имплантации двухкамерных частотно-адаптивных ЭКС в режиме DDDR.
Алгоритм выбора режима стимуляции при нарушениях АВ-проводимости представлен на рис. 2. При АВ-блокаде без СССУ предпочтение необходимо отдавать режиму ЭС сердца DDD. Для нашей страны остается актуальной ситуация с пациентами, у которых при полной АВ-блокаде был установлен ЭКС в режиме ЭС VVI. Для них переход на двухкамерную ЭС, бесспорно, является оптимальным. Если отсутствует ретроградное возбуждение предсердий, то позитивный гемодинамический эффект может дать и система VVIR.
Если АВ-блокада сочетается с СССУ, проявляющимся неадекватным приростом частоты сердечных сокращений в ответ на нагрузку, режим ЭС сердца DDDR (частотно-адаптивная) является методом выбора.
В практической работе определенные сложности возникают при выборе режима ЭС у больных с бради-аритмической формой мерцания предсердий. Основными показаниями к имплантации к ЭКС у этой категории больных являются: снижение частоты желудочковых сокращений в покое ниже критического уровня и неспособность к адекватному приросту частоты ритма при нагрузке. В первом случае оптимальной может явиться система VVI, а частотно-адаптивные системы ЭКС (VVIR) позволяют компенсировать неадекватность частоты сердечных сокращений при нагрузке во втором случае.
При синдроме гиперчувствительности каротидного синуса наиболее эффективным видом является ЭС в ре-
АВ-блокада II-III степени (/7=61) СССУ (/7=55) Брадисистолическая форма перманентной фибрилляции предсердий (л=37)
Хронотропная дисфункция Нарушение АВ проведения Хронотропная дисфункция
Нет Есть Нет Есть Нет Есть
VDD/DDD {/7=3/31)
DDDR
(п=29)
AAI (AAIR) (Л=4/5)
DDD (DDDR) (/7=11/35)
WI (/7=22)
WIR (Л=15)
Рис. 4. Режимы постоянной ЭС в зависимости от характера аритмии.
жиме DDI, установленная на низкую частоту включения (~ 50 имп/мин) с использованием функции гистерезиса. ЭС в режиме AAI в подобных ситуациях менее целесообразна, так как наряду с подавлением синусного ритма у больных может развиться преходящая АВ-блокада.
Клинический опыт рентгенохирургического отделения интервенционной аритмологии и кардиостимуляции ФГКУ «МУНКЦ им. П. В. Мандрыка» можно рассматривать как свидетельство справедливости приведенных алгоритмов выбора способов и режимов ЭС при различных брадиаритмиях. С 2007 г. по настоящее время у 153 больных с клинически значимыми брадиаритмиями выполнена первичная имплантация ЭКС. Среди оперированных было 107 (69,9%) мужчин (средний возраст 79,4 ± 7,9 года) и 46 (30,1%) женщин (средний возраст 75,7 ± 10,6 года). Клиническая характеристика больных представлена в табл. 3.
Как видно из табл. 3, больные были в основном пожилого и старческого возраста. У 61 (39,0%) больного имелась АВ-блокада II—III степени, у 55 (39,5%) больных диагностировалась СССАУ, у 37 (24,2%) — брадисистолическая форма пермаментной фибрилляции предсердий.
Основными клиническими симптомами аритмии до имплантации ЭКС явились синдром МАС и брадикар-дия. Кроме того, значительное число пациентов жаловались на одышку в покое и при незначительных физических нагрузках. Эквиваленты синдрома МАС в виде периодического головокружения, немотивированной общей слабости, предобморочных состояний возникали у 15—25% больных (рис. 3).
Режимы постоянной ЭС, использованные в клинике, представлены на рис. 4.
Выбор режима ЭС в каждом конкретном случае основывался на принятой в кардиологической практике концепции физиологической ЭС сердца [59]. В основе этой концепции лежит необходимость сохранения или
восстановления АВ-синхронизации и уменьшение, по-возможности, доли стимулированных комплексов сердца, в первую очередь верхушки правого желудочка. Кроме того, при принятии решения о выборе вида ЭС сердца нами учитывалась хронотропная функция. При наличии хронотропной дисфункции имплантировали частотно-адаптивные режимы постоянной ЭС сердца с целью обеспечения адекватной адаптации сердечного ритма к нагрузке.
Таким образом, качественный скачок в совершенствовании имплантируемых устройств привел к значительному расширению их использования и появлению новых возможностей электротерапии. Так, технология имплантируемых устройств, помимо терапии брадиаритмий, сегодня развивается по трем основным направлениям:
• имплантируемые кардиовертеры-дефибрилляторы для электротерапии желудочковых тахиаритмий и профилактики внезапной смерти;
• имплантируемые устройства для лечения сердечной недостаточности;
• устройства для профилактики и лечения предсерд-ных тахиаритмий.
Создаются также и комбинированные устройства, сочетающие в себе возможности нескольких видов электротерапии.
Сегодня технологическое совершенствование имплантируемых устройств позволяет клиницистам все шире использовать возможности электротерапии в лечении как бради-, так и тахиаритмий, сердечной недостаточности, а также в первичной и вторичной профилактике внезапной смерти [5, 19, 42, 56—61]. Вне зависимости от характера гемодинамически значимой брадисистолии основной задачей постоянной ЭС сердца является восстановление или сохранение адекватной предсердно-желудочковой синхронизации.
Сведения об авторах:
ФГКУ Медицинский учебно-научный клинический центр им. П. В. Мандрыка, Москва
Симоненко Владимир Борисович — д-р мед наук., проф., начальник центра.
Стеклов Владимир Иванович — канд. мед. наук, гл. аритмолог Минобороны, начальник рентгенохирургического отделения (интервенционной аритмологии и электрокардиостимуляции).
ЛИТЕРАТУРА
1. Руководство по интервенционной аритмологии / Бокерия Л. А., Ре-вишвили А. Ш., Поздняков Ю. М. и др. М.: ИД «Синергия; 2007.
2. Бредикис Ю. Ю. Электрическая стимуляция сердца в клинической практике. М.: Медицина; 1967.
3. Ревишвили А. Ш. (ред.). Временная электрокардиостимуляция: Руководство. М.: ГЭОТАР-Медиа; 2009.
4. Кушаковский М. С. Аритмии сердца. СПб.: Фолиант; 1998.
5. Ревишвили А. Ш. (ред.). Постоянная электрокардиостимуляция и дефибрилляция в клинической практике. М.: Медпрактика-М; 2007.
6. Ратнер Г. Л. (ред.). Электротерапия сердечных аритмий. Куйбышев; 1976.
7. Bartecchi C. E. Temporary cardiac pacing. Precept Press. Postgrad-uated Medicine 1987.
8. Lamas G. A., Lee K., Sweeney M. et al. The Mode Selection Trial (MOST) in sinus node dysfunction: design, rationale, and baseline characteristics of the first 1000 patients. Am. Heart J. 2000; 140: 541—551.
9. Рекомендации имплантации электрокардиостимуляторов при брадикардиях / Бокерия Л. А., Ревишвили А. Ш., Левант А. Д. и др. Грудная и серд.-сосуд. хир. 1993; 5: 36—43.
10. Григоров С. С., Вотчал Ф. Б., Костылева О. В. Электрокарди-
ограмма при искусственном водителе ритма сердца. М.: Медицина; 1990.
11. Егоров Д. Ф., Гордеев O. Л. Естественное течение полной атри-овентрикулярной блокады. Тер. арх. 1991; 9: 50—52.
12. Королев Б. А., Каров В. В., Медынский Е. М. Осложнения и выживаемость больных при электрокардиостимуляции. Вест. хир. 1990; 5: 15—20.
13. Furman S., Robinson G. The use of an intracardiac pacemaker in the correction of total heart block. Surg. Forum 1958; 9 (1): 245.
14. Ардашев В. Н., Ардашев А. В., Стеклов В. И. Лечение нарушений сердечного ритма. 2-е изд. М.: Медпрактика-М; 2005.
15. Бредикис Ю. Ю., Дрогайцев А. Д., Стирбис П. П. Физиологическая электростимуляция сердца: Обзор. Кардиология 1983; 9: 114—118.
16. Григоров С. С., Вотчал Ф. Б., Костылева О. В. 20-летний опыт применения постоянной эндо- кардиальной стимуляции сердца. Кардиология 1987; 11: 26—29.
17. Колесников О. Е., Головин В. Г., Ханаков А. И. Результаты многолетнего наблюдения за больными с постоянной электрокардиостимуляцией. В кн.: Кардиостим-98: Тезисы докладов. СПб; 1998. 65.
18. Recommendations for pacemaker prescription for symptomatic bradycardia: report of a working party of the British Pacing and Electro-physiology Group. Br. Heart J. 1991; 66: 185—191.
19. Akhtar M., Garan H., Lehmann M. H., Troup P. J. Sudden cardiac death: management of high-risk patients. Ann. Intern. Med. 1991; 114: 499—512.
20. Hyman A. S. Resuscitation of the stopped heart by intracardial therapy. II. Experimental use of an artificial pacemaker. Arch. Intern. Med. 1932; 50: 283—305.
21. Thalen H. J. Th. History of cardiac pacing. In: Thalen H., Meere C. C., eds. Fundamentals of cardiac pacing. The Hague: Martinus Nijhoff Publishers; 1979. 14—18.
22. Zoll P. M. Resuscitation of the heart in ventricular standstill by external electric stimulation. N. Engl. J. Med. 1952; 247: 768—771.
23. Schwedel J. B., Furman S., Escher D. J. W. Use of an intracardiac pacemaker in the treatment of Stokes—Adams seizures. Progr. Car-diovasc. Dis. 1960; 3 (2): 170—177.
24. Бабский Е. Б., Ульянинский JI. C. Электрическая стимуляция сердца. М.: Медицина; 1961.
25. Бредикис Ю. Ю. У истоков электрокардиостимуляции в стране. Вестн. аритмол. 1993; 1: 7—14.
26. Elmquist R., Senning A. Implantable pacemaker for the heart. In: Proceeding Section. International Conference on Medical Electronics. Paris; 1959.
27. Бельгов В. С., Рихтер А. А., Савельев В. С, Савчук Б. Д. Имплантируемый электрокардиостимулятор. А. с. 169141, 5.04.65 СССР.
28. Савельев B. C., Костенко И. Г., Савчук Б. Д. Блокада сердца. М.: Медицина; 1967.
29. Дрогайцев А. Д. Сравнительная оценка различных способов постоянной электростимуляции сердца при брадикардии. Кардиология 1990; 2: 5—12.
30. Дрогайцев А. Д., Полежаев В. В., Алушков М. В. Ретроградная деполяризация предсердий при «Р-синхронизированной» желудочковой электростимуляции сердца. Кардиология 1986; 8: 91.
31. Lagergren H. How it happened: my recollection of early pacing. Pace 1978; 1 (1): 140—143.
32. Epstein A., DiMarco J., Ellenbogen K. et al. ACC/AHA/HRS 2008 guidelines for device-based therapy of cardiac rhythm abnormalities: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2008; 117: 2820—2840.
33. Hayes D. L., Naccarelli G. V., Furman S. et al. Report of the NASPE policy conference on training requirements for permanent pacemaker selection, implantation, and follow-up. Pace 1994; 17: 6—12.
34. Пекарский В. В. Управление ритмом сердца с помощью электрической стимуляции парными, тройными и кардиосинхронизиро-ванными импульсами: Aвтореф. дис. … д-ра мед. наук. Томск; 1971.
35. Поляков В. П. Клинические аспекты применения парной стимуляции сердца. Клин. мед. 1973; 3: 87—90.
36. Mond H. G., Sloman J. G., Edwards R. H. The first pacemaker. Pace 1982; 5 (2): 278—282.
37. Hayes D. L., Barold S. S., Camm A. J. et al. Evolving indications for permanent cardiac pacing: an appraisal of the 1998 American College of Cardiology/American Heart Association Guidelines. Am. J. Cardiol. 1998; 82: 1082—1086.
38. Бредикис Ю. Ю., Стирбис П. П., Дрогайцев А. Д. Синдром кардиостимулятора. Кардиология 1988; 2: 104—106.
39. Ахмедов Ш. Д., Гимрих Э. О., Волкова Т. Г. Осложнения электрокардиостимуляции в режиме VVI у больных с синдромом
слабости синусового узла в отдаленном периоде. Кардиология 1988; 2: 28—31.
40. Gregoratos G., Cheitlin M. D., Conill A. et al. ACC/AHA guidelines for implantation of cardiac pacemakers and antiarrhythmia devices. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/NASPE Committee on Pacemaker Implantation). Circulation 2002; 97: 1325—1335.
41. Григоров С. С., Вотчал Ф. Б., Костылева О. В. Физиологическая электростимуляция сердца (применение различных типов имплантируемых стимуляторов, показания и противопоказания). Кардиология 1986; 4: 99—102.
42. Егоров Д. Ф., Яшин С. М., Домашенко А. А. Физиологическая электрокардиостимуляция желудочков при нарушении атрио-вентрикулярного проведения. Грудная и серд.-сосуд. хир. 1990; 4: 18—21.
43. Bernstein A. D., Camm A. J., Eletcher R. D. et al. The NASPE/ BPEG generic pacemaker code for antibradyarrhythmia and adaptive-rate pacing and antitachyarrythmia devices. Pace 1987; 10: 794—799.
44. Макеев В. В., Тумилович Б. В., Лученок А. И. Применение различных режимов постоянной стимуляции сердца при брадиарит-миях. В кн.: Кардиостим-98: Тезисы докладов. СПб.; 1998. 64.
45. Rosenthal E., Bostock J., Qureshi S. et al. Single pass VDD pacing in children and adolescents. Pace 1997; 20: 1975—1982.
46. Furman S., Hurzeler Ph., De Caprio V. The vertricular endocardial electrogram and pacemaker sensing. J. Thorac. Cardiovasc. Surg. 1977; 73: 258—266.
47. Кольк Р. А., Лаане П. Г.-Э., Роозе И. Н. Отдаленные результаты постоянной предсердной электростимуляции при синдроме слабости синусового узла. Кардиология 1994; 7: 5—7.
48. Егоров Д. Ф., Домашенко А. А. Опыт первых 100 операций постоянной электростимуляции сердца при синдроме слабости синусового узла: достижения, проблемы, перспективы. Тер. арх. 1989; 1: 61—63.
49. Искендеров Б. Г., Латышев Д. С. Течение и исходы синдрома слабости синусового узла на фоне постоянной электрокардиостимуляции. Кардиология 1999; 11: 27—30.
50. Fraser J. D., Gillis A. M., Irwin M. E. et al. Guidelines for pacemaker follow-up in Canada: a consensus statement of the Canadian Working Group on Cardiac Pacing. Can. J. Cardiol. 2000; 16: 355—376.
51. Камшилова Е. А. Клинико-электрокардиографические сопоставления при многолетней кардиостимуляции у лиц с постоянной и транзиторной поперечной блокадой сердца. Кардиология 1994; 9: 12—15.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
52. Бокерия Л. А., Ревишвили А.Ш., и др. Клинические рекомендации no проведению электрофизиологических исследований, катетерной аблации и применению имплантируемых антиаритмических устройств. М.: Асконлайн; 2009.
53. Ковалев С. А., Кузнецов А. И., Ливенцев В. В. Использование физиологической и частотно- адаптивной кардиостимуляции в лечении различных видов брадиаритмий. В кн.: Кардиостим-98: Тезисы докладов. СПб.; 1998. 67.
54. Чазов Е. И., Голицын С. П. (ред.) Руководство по нарушениям ритма сердца. М.: ГЭОТАР-Медиа; 2008.
55. Черкасов В. А., Протопопов В. В., Молодых С. В. Выбор режима защиты двухкамерной электростимуляции сердца от па-роксизмальных наджелудочковых тахикардий. Кардиология 2003; 4: 43—51.
56. Лебедев Д. С., Осадчий А. М., Маринин В. А., Пышный М. В.
Динамика клинико-функционального статуса пациентов при коррекции брадиаритмий постоянной электрокардиостимуляцией в зависимости от положения желудочкового электрода. Вестн. аритмол. 2010; 58: 5—10.
57. Sweeney M.O., Hellkamp A.S., Ellenbogen K.A. et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation 2003; 107: 2932—2937.
58. Kimmel M. W., Skadsberg N. D., Byrd C. L. et al. Single-site ventricular and biventricular pacing: investigation of latest depolarization strategy. Europace 2007; 9 (12): 1163-1170.
59. Диденко М. В., Шорохов К. Н., Хубулава Г. Г. Современные принципы физиологической электрокардиостимуляции. Вестн. аритмол. 2007; 18: 58—65.
60. Гуков А. О., Жданов A. M. Возможности постоянной кардиостимуляции в профилактики фибрилляции и трепетания предсердий. Вестн. аритмол. 2000; 16: 78—84.
61. Klein H., Auricchio A., Reek S. et al. New primary prevention trials of sudden cardiac death in patients with left ventricular dysfunction: SCD-HEFT and MADIT-II. Am. J. Cardiol. 1999; 83: 91D—97D.
Поступила 29.11.11
Ключевые слова:
гипертрофическая кардиомиопатия,
временная
электрокардиостимуляция.
В статье представлены результаты
временной двухкамерной
электрокардиостимуляции у 9
больных гипертрофической
кардиомиопатией. Сделаны выводы о
целесообразности предварительного
проведения временной
электрокардиостимуляции с оценкой
гемодинамических параметров в
покое и при нагрузке для
прогнозирования результатов
постоянной
электрокардиостимуляции.
The paper presents the outcomes of dual chambered pacing in 9
patients with hypertrophic cardiomyopathy. It is concluded that
is very important temporary pacing, by estimating hemodynamic
parameters at rest and during exercise for prediction of the
outcomes of permanent pacing.
Key words: Hypertrophic cardiomyopathy,
temporary pacing.
Н. А. Мазур.
Доктор мед. наук,
профессор, зав. кафедрой
кардиологии Российской
медицинской академии
последипломного образования,
Москва.
А.М.Жданов.
Доктор мед.
наук,руководитель отделения
хирургии нарушений проводимости и
ритма сердца Института хирургии
им.А.В.Вишневского РАМН,
Московского центра
электрокардиостимуляции.
В. В. Чигинева, С. А.
Термосесов.
Кафедра кардиологии
Российской медицинской академии
последипломного образования,
Москва.
Отделение хирургии
нарушений проводимости и ритма
сердца Института хирургии им.
А. В. Вишневского РАМН,
Московский центр
электрокардиостимуляции.
Prof. N.A. Mazur.
Head, Department of Cardiology, Russian Medical Academy of
Postgraduate Training;
A.M. Zhdanov.
Head, Department of Surgery for Cardiac
Conduction and Rhythm Disturbances, A.V. Vishnevsky Institute of
Surgery, Russian Academy of Medical Sciences, Moscow Cardiac
Pacing Center.
V.V. Chigineva, S.A. Termosesov
Department of Cardiology, Russian Medical Academy of Postgraduate
Training, Moscow.
Department of Surgery for Cardiac Conduction and Rhythm
Disturbances, A.V. Vishnevsky Institute of Surgery, Russian
Academy of Medical Sciences, Moscow Cardiac Pacing Center.
Correspondence to: V.V. Chigineva, Department of Cardiology,
Russian Cardiology Research and Production Center, 3rd
Cherepkovskaya St. 15a, Build. 9, Moscow 121552, Tel. 414-68-58
Введение
Обструкция выносящего тракта
левого желудочка (ЛЖ) — один из
важнейших механизмов, ведущих к
появлению различных симптомов
заболевания и ограничивающих
физическую активность, встречается
у 25% пациентов с гипертрофической
кардиомиопатией (ГКМП) [1]. Н. Newman и
соавт. [2] доказали, что наличие
обструкции выносящего тракта в
покое, превышающее 20 мм рт. ст.,
является предвестником
прогрессирования симптомов
заболевания, но не влияет на
частоту внезапной смерти в этой
группе больных.
Для уменьшения симптомов
заболевания, таких как одышка при
физической нагрузке, боли в левой
половине грудной клетки, обмороки
или предобморочные состояния, в
течение более 30 лет применяют
b-блокаторы, верапамил, дилтиазем,
дизопирамид и амиодарон. Несмотря
на это, некоторые больные все же
остаются рефрактерными к
проводимой терапии или у них
наблюдаются побочные реакции на
данные препараты. В подобных
случаях альтернативной является
миосептэктомия или имплантация
митрального клапана (МК) с целью
уменьшения градиента давления. По
данным разных авторов летальность
во время операции составляет от 1,3 —
2 до 14 — 17% [3 — 5]. После операции у
части больных наблюдаются такие
осложнения, как полная
предсердно-желудочковая блокада,
блокада левой ножки пучка Гиса,
перфорация межжелудочковой
перегородки (МЖП). Некоторые
больные отказываются от проведения
операции на «открытом» сердце.
Поэтому требуются другие подходы к
их лечению.
В 1975 г. Р. Hassenstein и соавт. впервые
опубликовали результаты
проведения
электрокардиостимуляции (ЭКС) у
пациентов с обструктивной формой
ГКМП. Позже в целом ряде других
работ было показано, что
двухкамерная ЭКС может уменьшать
градиент давления в выносящем
тракте ЛЖ и таким образом улучшать
самочувствие больных [6 — 16]. Такой
подход основывается на мнении, что
возбуждение МЖП при проведении
Р-синхронизированной ЭКС правого
желудочка или последовательной
предсердно-желудочковой ЭКС
вызывает парадоксальное движение
МЖП в сторону от задней стенки ЛЖ во
время систолы, в результате чего
размеры выносящего тракта ЛЖ
увелчиваются и скорость кровотока
в нем снижается. Учитывая
вышеизложенное, нами была
проведена временная ЭКС больным
гипертрофической кардиомиопатией
для оценки влияния ее на показатели
гемодинамики в течение короткого
курса.
Пациенты и методы. В исследование
было включено 9 пациентов с ГКМП (5
мужчин и 4 женщины), средний возраст
пациентов составил 38,2 года (от 14 — до
59 лет). Диагноз ГКМП был установлен
на основании обнаружения утолщения
МЖП или свободной стенки ЛЖ при
нормальных размерах ЛЖ и
отсутствии у пациентов
артериальной гипертензии,
приобретенных или врожденных
пороков сердца, а также других
заболеваний, которые могли бы
привести к гипертрофии миокарда ЛЖ.
У 5 пациентов для установления
точного диагноза и исключения
сопутствующей патологии была
проведена
коронаровентрикулография, при
которой были обнаружены
непораженные коронарные артерии.
Большинство пациентов относились к
III и IV функциональному классу (ФК) по
NYHA. Обструкция выносящего тракта ЛЖ
с градиентом давления в выносящем
тракте ЛЖ в покое более 30 мм рт. ст.
наблюдалась у 5 пациентов и
составляла в среднем 50,3 + 28,0 мм рт.
ст., у 4 пациентов обструкции в покое
не было. Средняя длительность
заболевания до проведения
манипуляции составила 15,3 + 9 лет. У
половины пациентов заболевание
было выявлено случайно — при
медицинском осмотре был обнаружен
шум; 2 пациента из-за наличия на ЭКГ
изменений по типу «рубцовых»
были направлены для дальнейшего
обследования; у 3 больных дебютом
явилось возникновение загрудинных
болей при ходьбе.
У всех пациентов имеются
родственники, больные ГКМП, причем
у 6 пациентов в семьях были случаи
внезапной смерти в молодом
возрасте.
При поступлении в стационар все
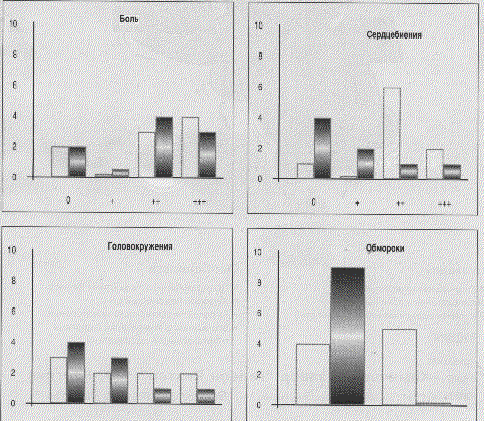
пациенты жаловались на одышку при
физической нагрузке, у 7 больных
наблюдались перебои в работе
сердца и приступы сердцебиений, у
половины были обмороки. При
объективном осмотре у всех
выслушивался грубый систолический
шум изгнания с максимумом в 5-й
точке. При холтеровском
мониторировании были выявлены
следующие нарушения ритма сердца: у
7 больных — желудочковая
экстрасистолия, причем у 2
пациентов куплеты; у 1 пациентки —
пробежки неустойчивой
желудочковой тахикардии, у 1 —
пароксизмы мерцательной аритмии.
При эхокардиографическом (ЭхоКГ)
исследовании толщина МЖП в среднем
составила 2,5 + 0,7 см, задней стенки ЛЖ
(ЗСЛЖ) — 1,3 + 0,2 см, соотношение
МЖП/ЗСЛЖ равнялось 2; митральная
регургитация наблюдалась у 8
больных, пролапс — митрального
клапана у 3, ни у одного пациента не
было кальциноза митрального
клапана и обструкции выносящего
тракта правого желудочка. Фракция
выброса по данным ЭхоКГ в среднем
составила 79,6 + 6,9 % (табл. 1).
До поступления в стационар
большинство пациентов в течение 3,8 +
2,5 года получали анаприлин в
средней дозе 102 + 27,1 мг/день (от 60 до
120 мг); часть больных получала
верапамил в дозе 360 + 214,1 мг/день (от
120 до 640 мг) в течение 5,3 + 3,3 года; 1
пациентка принимала ранитек по 5
мг/день; все больные отмечали
неэффективность терапии.
Показанием к проведению временной
ЭКС было сохранение высокого
градиента в выносящем тракте ЛЖ,
несмотря на последовательное
применение максимально
переносимых доз атенолола,
верапамила и ритмилена, а у 4
пациентов с необструктивной формой
ГКМП — наличие сопутствующей
предсердно-желудочковой блокады I —
II степени, степень которой
нарастала при назначении даже
малых, неэффективных доз данных
препаратов. До начала ЭКС все
лекарства были отменены на срок,
равный 5 периодам полувыведения.
Пациенты прошли общеклиническое
обследование, у них регистрировали
ЭКГ в 12 отведениях, проводили
24-часовое холтеровское
мониторирование ЭКГ,
велоэргометрию (ВЭМ) и ЭхоКГ до
оперативного лечения без приема
медикаментов; в конце курса ЭКС, в
1-й день установки параметров
стимуляции, проводились
контрольные электро- и
эхокардиографическое
исследования. Все пациенты дали
информированное согласие на
проведение манипуляции.
Больные оценивали каждый симптом
заболевания (боль, одышка,
сердцебиения, головокружения) по
4-балльной шкале: 0 — полное
отсутствие симптома; 1 — слабая
степень выраженности, т. е. симптом
не появляется при обычной
физической активности, а возникая,
протекает легко, не вызывая
изменений в общем состоянии
пациента; 2 — умеренная
выраженность, т. е. обычная
физическая нагрузка вызывает
появление симптомов, из-за которых
состояние пациента ухудшается; 3 —
значительная выраженность
симптома, т.е. любая физическая
активность вызывает
дискомфорт,симптомы появляются
даже в покое.
ВЭМ. Для оценки толерантности к
физической нагрузке проводили ВЭМ
в положении лежа на спине,
использовался протокол непрерывно
возрастающих нагрузок [17], нагрузки
прекращались при появлении
приступа стенокардии, повышении
диастолического АД более 120 мм рт.
ст., депрессии сегмента ST [18], а также
при появлении слабости,
головокружения, нарастании одышки,
гипотонии.
Таблица 1. Клинические
характеристика больных ГКМП
Число больных
| Жалобы: | |
| одышка | 9 |
| сердцебиения и перебои в работе сердца |
7 |
| обмороки | 5 |
| боли за грудиной | 7 |
| слабость | 3 |
| ФК по NYHA | 2,7± 0,7 |
| НРС: | |
| желудочковая экстрасистолия |
7 |
| пробежки ЖТ | 1 |
| пароксизмы МА | 1 |
| ПЖБ I — III степени | 4 |
| ЭхоКГ: | |
| обструкция выносящего тракта ЛЖ |
5 |
| наличие митральной регургитации |
8 |
| пролапс МК | 3 |
П р и м е ч а н и е . НРС — нарушения
ритма сердца,
ЖТ — желудочковая тахикардия, МА —
мерцательная аритмия,
МК — митральный клапан; ПЖБ —
предсердно-желудочковая блокада.
Таблица 2. Параметры
ЭКС
| Средняя минимальная частота |
55 импульсов |
| стимуляции предсердий | в минуту |
| Средний порог стимуляции желудочков, мВ |
0,7 |
| Средняя амплитуда импульсов желудочков, В |
5 |
| Средний порог стимуляции предсердий, мВ |
0,9 |
| Средняя амплитуда импульсов предсердий, В |
4,4 |
| Средняя продолжительность P — Q, мс |
236 |
| Средняя продолжительность предсердно-желудочковой задержки, мс |
166 |
Таблица 3. Динамика показателей
на временной ЭКС
| Уровень | Изменения, % | ||
| исходный | на временный ЭКС | ||
| Градиент давления у больных с обструкцией, n = 5 |
50 | 46 | -8* |
| Средняя скорость кровотока в выносящем тракте ЛЖ по всей группе, n = 9 |
2,5 (1,1) | 2,3 (1,2) | -13** |
| Средняя скорость кровотока в выносящем тракте ЛЖ у больных с предсердно желудочковой задержкой более 160 мс, n = 5 |
1,7 (0,6) | 1,3 (0,5) | -36** |
| ФК по NYHA, средние значения | 2,7 | 2,3 |
p<0,01;** p<0,05.
ЭхоКГ. Исследование проводили на
аппарате 70 А-SAL фирмы «Toshiba» в
режиме реального времени
ультразвуковым датчиком 2,5 МГц. При
исследовании из апикальной позиции
определяли скорость кровотока в
выносящем тракте на подклапанном
уровне. Градиент в выносящем тракте
рассчитывали по модифицированной
формуле Бернулли [19].
Рис. 1. Динамика клинических
симптомов на фоне временной ЭКС, 0-
отсутствиесимптомов, +- слабая
выраженность симптома, +++-
значительная выраженность
симптома.
Временная ЭКС. Для проведения ЭКС
использовали временный
двухкамерный кардиостимулятор
модели 3070 фирмы «Pacesetter» (США),
позволяющий навязывать ритм в
режиме DDD. Под местной анестезией по
методике Seldinger проводили пункцию
подключичной вены, через просвет
которой под рентгеновским
контролем вводили два электрода.
Электрод ПЭЭФ (электрод с активной
фиксацией, типа
«буравчик»,производства
Украины) фиксировали в области ушка
правого предсердия. Второй
электрод LES 165 (производства Чехии)
устанавливали в области верхушки
правого желудочка. Стимуляцию
проводили в монополярном режиме,
при этом индифферентные электроды
в виде булавок укрепляли на коже
пациента в подключичной области.
Особенность процедуры состояла в
том, что для временной стимуляции
были использованы электроды для
постоянной стимуляции. Это было
обусловлено тем, что требовалось
объективно оценить изменение
физических возможностей пациента
через 5 — 7 дней, в течение которых
пациенты вели активный образ жизни,
а в конце срока наблюдения всем
проводилась ВЭМ.
Порог стимуляции и амплитуду
внутрисердечного сигнала
определяли с помощью прибора ЕRА-20
фирмы «Biotronic» (Германия).
Задаваемые параметры стимуляции
были следующими: режим — DDD
(универсальный сенквециальный
режим или двух-камерная стимуляция
сердца); минимальная частота
стимуляции от 50 до 55 имп/мин;
средняя амплитуда импульсов по
желудочкам составила 5 В,
длительность стимулирующего
импульса — 0,5 мс; средняя амплитуда
импульсов по предсердиям — 5 В,
длительность стимулирующего
импульса — 0,5 мс, рефрактерный
период по предсердиям — 250 мс,
рефрактерный период по желудочкам —
325 мс, гистерезис — 0.
Предсердно-желудочковая задержка
программировалась в зависимости от
исходной величины интервала Р — Q,
который в среднем составил 236,8 мс,
причем минимальное значение ее
было 112 мс, максимальное — 400 мс.
Предсердно-желудочковый интервал
подбирали опытным путем, он
соответствовал максимально
возможному по величине интервалу,
вызывающему предвозбуждение
желудочков без появления сливных
сокращений; на ЭКГ при этом после
стимула появлялся уширеный
комплекс QRS, напоминающий по виду
блокаду левой ножки пучка Гиса. Он
составил в среднем 166 мс, т.е. 70% от
исходной длительности PQ (табл.
2).
Статистическую обработку данных
производили с помощью пакета
программ «Supercalc 5.0»,
использовали критерий Стьюдента.
Для средних величин в скобках
указана величина стандартного
отклонения.
Результаты. За время наблюдения в
течение 6,3 + 1,7 дня (от 8 ч до 8 сут)
только у 1 пациента субъективно
отмечалось ухудшение самочувствия
— усилились сердцебиение и одышка; у
него ЭКС была досрочно прекращена
на 3-й день. Другой пациентке по
экстренным показаниям была
выполнена имплантация постоянного
ЭКС из-за остро развившейся
предсердно-желудочковой блокады III
степени с приступом МЭС через 8 ч
наблюдения. Остальные пациенты
отметили улучшение самочувствия:
уменьшилась одышка, у 5 пациентов
уменьшился болевой синдром, за
время наблюдения не было
зарегистрировано ни одного
обморока, 4 пациента отметили
уменьшение головокружений (рис. 1).
Однако 2 пациента обратили внимание
на усиление болевых ощущений в
левой половине грудной клетки. ФК
по NYHA улучшился на 1 ступень у 5
пациентов, остался без изменения у 3
и у 1 возрос до IV (у него ЭКС была
досрочно прекращена). В среднем по
группе ФК по NYHA уменьшился с 2,7 до 2,3
(рис. 2).Скорость кровотока в
выносящем тракте ЛЖ по данным
допплерографии снизилась у 7
пациентов, у 2 осталась на прежнем
уровне; в среднем по группе
отмечалось достоверное снижение на
13% от исходного уровня,в подгруппе
пациентов с обструкцией на 8%. У
пациентов с величиной
предсердно-желудочковой задержки
более 160 мс, отмечалось более
значительное снижение скорости
кровотока по сравнению с
остальными (на 36%; табл. 3).
Ограничения в увеличении
предсердно-желудочковой задержки
были связаны с тем, что у
большинства пациентов интервал P — Q
исходно составлял менее 150 мс и для
проведения эффективной ЭКС
приходилось программировать
предсердно-желудочковую задержку
на величину, в среднем на 30% меньшую
исходного P — Q, что в свою очередь
приводило к укорочению систолы
предсердий.
При проведении ВЭМ не было выявлено
достоверного прироста пороговой
мощности и времени нагрузки, не
было различий в частоте
возникновения болевого синдрома
при нагрузке, появления
желудочковых экстрасистол как во
время нагрузки, так и в
восстановительном периоде. Однако
при одинаковом уровне пороговой
мощности на фоне проведения ЭКС
максимальная частота сердечных
сокращений (ЧСС) была достоверно
ниже, но и время ее восстановления
было достоверно продолжительнее.
При суточном мониторировании ЭКГ
было отмечено уменьшение
количества желудочковых
экстрасистол в среднем на 61% по
сравнению с исходным уровнем.
По результатам временной
стимуляции 4 пациентам была
выполнена имплантация двух
камерных аппаратов Synchrony III фирмы
«Pacesetter».
Обсуждение. Опыт проведения ЭКС у
больных ГКМП показал, что при ЭКС
происходит достоверное снижение
градиента давления в выносящем
тракте ЛЖ по сравнению с исходным
уровнем без изменения ЧСС. Эффект
снижения градиента был тем
значительнее, чем больше по
величине была
предсердно-желудочковая задержка,
что в свою очередь зависело от
исходной длительности интервала P —
Q. В то же время при ЭКС необходимо
добиваться достаточного
предвозбуждения желудочков с
появлением уширенного комплекса QRS
по типу блокады левой ножки пучка
Гиса при отсутствии «сливных»
комплексов, что обеспечивает
наибольшее снижение градиента за
счет парадоксального движения МЖП.
Это важно и потому, что значение
величины градиента прямо
пропорционально времени контакта
створок митрального клапана с МЖП
[20]. Таким образом,чем более будет
выражено парадоксальное движение
МЖП, тем дальше отойдут створки МК
от МЖП. В то же время значительное
уменьшение
предсердно-желудочковой задержки
при двухкамерной стимуляции ведет
к укорочению систолы предсердий и
уменьшению вклада предсердий в
наполнение ЛЖ [21]. Так, в
исследовании L. Fananapazir и соавт. [22]
наблюдалось ухудшение
самочувствия у пациентов с
необструктивной формой ГКМП в
отдаленные сроки после имплантации
ЭКС, потребовавшее дополнительного
назначения лекарственных средств,
что может быть связано с нарушением
диастолической функции ЛЖ. Для
предотвращения этого
рекомендуется удлинение интервала
P — Q с помощью лекарственных средств
[23].
Ряд авторов [11,14,15] наблюдали
достоверное увеличение времени
нагрузки на тредмиле по сравнению с
исходным уровнем. В нашей подгруппе
при проведении ВЭМ в положении лежа
подобных изменений не наблюдалось,
однако при одинаковой выполненой
пороговой нагрузке при ЭКС
наблюдалось достоверное снижение
ЧСС на высоте нагрузки по сравнению
с исследованием без применения
медикаментов.
Рис 2. Изменения ФК по NYHA при
проведении временной
электрокардиостимуляции у больных
ГКМП (цифры в прямоугольниках —
число ,больных перешедших из одного
ФК в другой.
Как и другие авторы [11,12,14,15], мы
отмечали значительное уменьшение
одышки и головокружений при ЭКС. У
части больных появились неприятные
болевые ощущения в левой половине
грудной клетки. Подобные ощущения
обычно появляются в первые недели
после имплантации
кардиостимулятора из-за
травматизации миокарда головками
электродов, после их инкапсуляции
симптомы исчезают.
Вопрос о показаниях к имплантации
ЭКС при ГКМП до сих пор однозначно
не решен. Наблюдаемое нами, а также
другими авторами снижение
градиента не достигало критической
величины 30 мм рт. ст. В то же время R.
Morh [3] было показано, что остаточный
градиент выше 15 мм рт. ст. после
миосептэктомии является
предвестником смертности после
операции. Таким образом, необходимы
длительные исследования для
изучения этого вопроса в отношении
как ЭКС, так и основных применяемых
при ГКМП лекарственных средств, тем
более что и при медикаментозной
терапии часто не наблюдается
значительного (менее 30 мм рт. ст.)
снижения градиента.
Выводы. 1.Целесообразно
предварительное проведение
временной ЭКС с оценкой
гемодинамических параметров в
покое и при нагрузке для
прогнозорования результатов
постоянной ЭКС.
2. Наилучшие ближайшие
положительные результаты
наблюдаются у больных, у которых
интервал P — Q больше 160 мс.
3. У больных с исходно коротким
интервалом P — Q или в тех случаях,
когда имеет место эффективная
стимуляция при
предсердно-желудочковой задержке
менее 160 мс, рекомендуется
обеспечить удлинение интервала P — Q
с помощью лекарственных
препаратов.
Литература:
1. Pierce GE, Morrow BJ, Braunwald E. Idiopatic hypertrophic
subaortic stenosis. Circulation 1964;30 (suppl 4): IV-152-IV-213.
2. NewmanH, Sugrue D, Oakley CM, et al. Relation of left
ventricular function and prognosis in hypertrophic
cardiomyopathy: an angiographic study. J Am Coll Cardiol
1985;5:1064-74.
3. Mohr R, Schaff HV, Danielson GK, et al. The outcome of cal
treatment of hypertrophic obstructive cardiomyopathy. J Thorac
Cardiovasc Surg 1989;97:666-74.
4. Roberts WC. Operative treatment of hypertrophic obstructive
cardiomyopathy: The case against mitral valve replacement. Am J
Cardiol 1973;32:377-81.
5. Seiler C, Hess OM, Schoenberh M, et al. Long-term follow-up of
medical versus surgical therapy for hypertrophic cardiomyopathy:
A retrospective study. J Am Coll Cardiol 1991;17:634-42.
6. Hassenstein P, Walther H, Dittrich J. Haemodynamische
Veranderungen durch einfach und gekoppelte Stimulation bei
Patienten mit obstruktiver Kardiomyopathie. Verh Dtsch Ges Inn
Med 1975;81:170-3.
7. Hassenstein P, Storch HH, Schmitz W. Erfahrungen mit der
Schrittmacherdauerbehandlung bei Patienten mit obstrucktiver
Kardiomyopathie. Thoraxchirurgie 1975;23:496-9
8. Jonson AD, Daily PO. Hypertrophic subaortic stenosis
complicated by high degree heart block: Successful treatment with
atrial synchronous ventricular pacemaker. Chest 1975;67:491-4.
9. Duck HJ, Hutschemeiter W, Paneau H, Trenckmann H.
Atrioventricular stimulation with reduced AV-delay time as a
therapeutic principle in hypertrophic obstructive cardiomyopathy.
Z Gesamte Inn Med 1984;39:437-47.
10. Jusgen W. Therapie der hypertroph-obstruktiven
Kardiomyopathie mit AV-sequentiellen Herzschrittmachersystemen,
in Weiki A (ed): Physiologische Stimulation des Herzens. Perimed,
Erlangen, 1984.
11. McDonald K, McWilliams E, O’Keeffe B, Maurer B. Functional
assessment of patients treated with permanent dual chamber pacing
as a primary treatment for hypertrophic cardiomyopathy. Eur Heart
J 1988;9:893-8.
12. Fananapazir L, Winkler J, Schenke B, et al. Reducing left
ventricular outflow tract obstruction in patients with
hypertrophic cardiomyopathy by pacing-induced interventricular
septal preexcitation (abstract). J Am Coll Cardiol 1989;13:117A.
13. Richter T, Cserhalmi M, Lengyel M, et al. Changes in left
ventricular hemodynamics of hypertrophic obstructive
cardiomyopathy (HOCM) patients treated with VAT sequential
pacing, in Baroldi G, Camerini F, Goodwin JF (eds): Advances in
Cardiomyopathies. New York, Springer-Verlag, 1990;168-74.
14. Fananapazir L, Cannon RO III, Tripodi D, Panza JA. Impact of
dual-chamber permanent pacing in patients with obstructive
hypertrophic cardiomyopathy with symptoms refractory to verapamil
and b-adrenergic blocker therapy. Circulation 1992;85:2149-61.
15. Jeanremaud X, Goy J-J, Kappenberger L. Effect of dual-chamber
pacing in hypertrophic obstructive cardiomyopathy. Lancet
1992;339:1318-23.
16. Tascon J, Albarran A, Perez-Carasa MA, et al. The treatment
of hypertrophic obstructive cardiomyopathy refractory to medical
treatment by DDD pacing. Rev Esp Cardiol 1994;47 (5):294-302.
17. Counihan P.J., Frenneaux M.P., Webb D.J., Mc Kenna W.J.
Abnormal vascular responses to supine exercise in hypertrophic
cardiomyopathy. Circulation 1991;84:686-96.
18. Aронов Д.М., Лупанов В.П., Михеева
Т.Г. Функциональные пробы в
кардиологии. Лекции III, IV.
Кардиология. — 1995. — № 12. — C. 83-93.
19. Hatle L, Andelsen B: Doppler ultrasound in cardiology.
Physical principles and clinical applications. Philadelphia, Lea
& Febiger, 1985;205-17.
20. Pollich C., Rakowcki H, Wigle E.D.. Muscular subaortic
stenosis: the quantitative relationship between systolic anterior
motion and the pressure gradient. Circulation 1984;69:43-9.
21. В.В. Желнов, И.Ф. Павлова, В.И.
Симонов, и др.
Доплер-эхокардиографическое
исследование диастолической
фукции левого желудочка у больных
ишемической болезнью сердца при
временной одно- и двукамерной
электрокардиостимуляции.
Кардиология. — 1995. — № 6. — С. 43-45.
22. Cannon RD III, Tripodi D, Dilsizian V, Panza JA, Fananapazir
L: Result of permanent dual-chamber pacing in symptomatic
nonobstructive hypertrophic cardiomyopathy. Am J Cardiol
1994;73:571-6.
23. Gras D, de Place C, Le Breton H, et al. Importance of
atrioventricular synchrony in hypertrophic obstructive
cardiomyopathy treated by cardiac pacing. Arch Mal Coeur Vaiss
1995;88 (2):215-23.