Зинфоро® (Zinforo®) инструкция по применению
📜 Инструкция по применению Зинфоро®
💊 Состав препарата Зинфоро®
✅ Применение препарата Зинфоро®
📅 Условия хранения Зинфоро®
⏳ Срок годности Зинфоро®
Описание лекарственного препарата
Зинфоро®
(Zinforo®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2015
года, дата обновления: 2021.07.23
Владелец регистрационного удостоверения:
Код ATX:
J01DI02
(Цефтаролина фосамил)
Лекарственная форма
| Зинфоро® |
Порошок д/пригот. концентрата д/пригот. р-ра д/инфузий 600 мг: фл. 1 или 10 шт. рег. №: ЛП-001912 |
Форма выпуска, упаковка и состав
препарата Зинфоро®
Порошок для приготовления концентрата для приготовления раствора для инфузий от желтовато-белого до светло-желтого цвета.
Вспомогательные вещества: L-аргинин — 395 мг.
Флаконы стеклянные вместимостью 20 мл (1) — пачки картонные с контролем первого вскрытия.
Флаконы стеклянные вместимостью 20 мл (10) — пачки картонные с контролем первого вскрытия.
Фармакологическое действие
Антибиотик группы цефалоспоринов V поколения. После в/в введения про-лекарство цефтаролина фосамил быстро превращается в активный цефтаролин.
Цефтаролин — антибиотик класса цефалоспоринов с активностью в отношении грамположительных и грамотрицательных микроорганизмов. В исследованиях in vitro показано бактерицидное действие цефтаролина, обусловленное ингибированием биосинтеза клеточной стенки бактерий за счет связывания с пенициллинсвязывающими белками (ПСБ). Цефтаролин проявляет бактерицидную активность в отношении Staphylococcus aureus (MRSA) и в отношении пенициллин-нечувствительного Streptococcus pneumoniae (PNSP) в связи с его высоким сродством к измененным ПСБ этих микроорганизмов.
Антимикробная активность цефтаролина, также как и других бета-лактамных антибиотиков, лучше всего коррелирует с интервалом времени, в течение которого концентрации препарата остаются выше минимальной подавляющей концентрации (МПК) инфицирующего микроорганизма (%Т>МПК).
Цефтаролин не активен в отношении штаммов Enterobacteriaceae, продуцирующих β-лактамазы расширенного спектра действия (БЛРС) семейств ТЕМ, SHV или СТХ-М, сериновые карбапенемазы (такие как КРС), металло-β-лактамазы класса В или класса С (цефалоспориназы AmpC). Резистентность также может быть связана с нарушением проницаемости клеточной стенки бактерий или с активным выведением антибиотика (эффлюкс). Микроорганизм может обладать одним или несколькими механизмами резистентности.
Несмотря на возможное развитие перекрестной резистентности, некоторые штаммы, резистентные к другим цефалоспоринам, могут быть чувствительны к цефатролину. Микроорганизмы, обладающие природной резистентностью: Chlamydophila spp., Legionella spp., Mycoplasma spp., Proteus spp., Pseudomonas aeruginosa.
Исследования in vitro не выявили антагонизма при применении цефтаролина в комбинации с другими часто назначаемыми антимикробными препаратами (такими как амикацин, азитромицин, азтреонам, даптомицин, левофлоксацин, линезолид, меропенем, тигециклин и ванкомицин).
Чувствительность антибиотиков in vitro меняется в зависимости от географического региона и с течением времени, поэтому при выборе антибактериальной терапии необходимо учитывать местную информацию о резистентности. Если локальная резистентность такова, что эффективность препарата в отношении некоторых инфекций становится сомнительной, необходимо обратиться за консультацией к эксперту.
Чувствительность к цефатролину следует определять с помощью стандартных методов. Интерпретацию результатов следует проводить в соответствии с локальными руководствами.
Клиническая эффективность в отношении отдельных патогенных микроорганизмов
Ниже перечислены патогенные микроорганизмы (по показаниям к применению), чувствительные к цефатролину in vitro, в отношении которых в клинических исследованиях была показана эффективность цефтаролина.
Осложненные инфекции кожи и мягких тканей: грамположительные микроорганизмы — Staphylococcus aureus (включая метициллинрезистентные штаммы), Streptococcus pyogenes, Streptococcus agalactiae, группа Streptococcus anginosus (включает S. anginosus, S. intermedius и S. constellatus), Streptococcus dysgalactiae; грамотрицательные микроорганизмы — Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Morganella morganii.
Внебольничная пневмония: грамположительные микроорганизмы — Streptococcus pneumoniae (включая случаи, сопровождающиеся бактериемией), Staphylococcus aureus (включая метициллин-чувствительные штаммы); грамотрицательные микроорганизмы — Escherichia coli, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae.
Клиническая эффективность цефтаролина в отношении перечисленных ниже патогенных микроорганизмов не была установлена, однако результаты исследований in vitro позволяют предполагать, что они чувствительны к цефатролину в отсутствие приобретенных механизмов резистентности: грамположительные анаэробы (Peptostreptococcus spp.), грамотрицательные анаэробы (Fusobacterium spp.).
Фармакокинетика
Всасывание
Cmax и AUC цефтаролина увеличиваются почти пропорционально дозе при однократном введении препарата в диапазоне доз от 50 до 1000 мг. Не наблюдалось заметной кумуляции цефтаролина после многократного в/в введения препарата в дозе 600 мг в течение 60 мин каждые 12 ч в течение 14 дней здоровым добровольцам с нормальной функцией почек.
Распределение
Степень связывания цефтаролина с белками плазмы низкая (примерно 20%), препарат не проникает в эритроциты. Медиана Vd в равновесном состоянии у здоровых взрослых мужчин после однократного в/в введения 600 мг цефтаролина фосамила, меченного изотопом, составила 20.3 л, почти как и объем внеклеточной жидкости.
Метаболизм
В плазме крови под действием фосфатаз про-лекарство цефтаролина фосамил быстро преобразуется в активный цефтаролин; концентрации пролекарства поддаются измерению в плазме, преимущественно, во время в/в инфузии. При гидролизе бета-лактамного кольца цефтаролина образуется микробиологически неактивный метаболит, цефтаролин М-1. Соотношение средних значений AUC цефтаролина М-1 к цефатролину в плазме крови после однократного в/в введения 600 мг цефтаролина фосамила здоровым добровольцам составляет примерно 20-30%.
Метаболизм цефтаролина протекает без участия ферментов системы цитохрома Р450.
Выведение
Цефтаролин выводится, преимущественно, почками. Почечный клиренс цефтаролина примерно равен или немного ниже скорости клубочковой фильтрации в почках, исследования транспортеров in vitro показывают, что активная секреция не способствует почечной элиминации цефтаролина. Средний T1/2 цефтаролина у здоровых взрослых людей составляет примерно 2.5 ч. После однократного в/в введения 600 мг меченного изотопом цефтаролина фосамила здоровым взрослым мужчинам примерно 88% радиоактивности обнаруживалось в моче и 6% — в фекалиях.
Фармакокинетика у особых групп пациентов
После однократной в/в инфузии 600 мг цефтаролина фосамила в течение 60 мин Cmax цефтаролина в плазме составила 28.4±6.9 мкг/мл, 28.2±5.4 мкг/мл и 30.8±4.9 мкг/мл у пациентов с нормальной функцией почек, почечной недостаточностью легкой и средней степени тяжести, соответственно. Cmax цефтаролина достигалась приблизительно через 60 мин после начала инфузии. AUC цефтаролина увеличивалась пропорционально степени почечной недостаточности и составила 75.6±9.7 мкг×ч/мл, 92.3±25.3 мкг×ч/мл и 114.8±14.1 мкг×ч/мл у пациентов с нормальной функцией почек, почечной недостаточностью легкой и средней степени тяжести, соответственно. Коррекция дозы требуется только у пациентов с почечной недостаточностью средней степени тяжести (КК 30-50 мл/мин). Недостаточно данных для рекомендаций по коррекции дозы у пациентов с почечной недостаточностью тяжелой степени (КК ≤30 мл/мин) и терминальной стадией почечной недостаточности, включая пациентов, находящихся на гемодиализе.
Исследования фармакокинетики цефтаролина у пациентов с печеночной недостаточностью не проводили. Т.к. цефтаролин не подвергается печеночному метаболизму в значительной степени, не ожидается, что печеночная недостаточность будет существенно влиять на системный клиренс цефтаролина. Поэтому не рекомендуется корректировать дозу препарата у пациентов с печеночной недостаточностью.
После однократного в/в введения 600 мг цефтаролина фосамила параметры фармакокинетики препарата были схожими у здоровых пожилых людей (≥65 лет) и здоровых молодых пациентов (18-45 лет). У добровольцев пожилого возраста отмечено небольшое увеличение AUC0-∞ (на 33%), что обусловлено, главным образом, возрастными изменениями функции почек. Не требуется коррекции дозы препарата у пациентов пожилого возраста с КК >50 мл/мин.
Безопасность и эффективность препарата Зинфоро® у детей и подростков в возрасте до 18 лет не установлены.
Параметры фармакокинетики цефтаролина были схожими у мужчин и женщин. Не требуется коррекции дозы в зависимости от пола пациента.
Не наблюдалось существенных различий параметров фармакокинетики цефтаролина у пациентов, принадлежащих разным этническим группам. Не требуется корректировать дозу препарата в зависимости от расы пациента.
Показания препарата
Зинфоро®
Лечение у взрослых следующих инфекций:
- осложненные инфекции кожи и мягких тканей, вызванные чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Staphylococcus aureus (включая метициллинрезистентные штаммы), Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus anginosus, Streptococcus dysgalactiae, Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca и Morganella morganii;
- внебольничная пневмония, вызванная чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Streptococcus pneumoniae (включая случаи, сопровождающиеся бактериемией), Staphylococcus aureus (только метициллин-чувствительные штаммы), Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae и Escherichia coli.
Режим дозирования
Препарат Зинфоро® вводится в/в в виде инфузии в течение 60 мин.
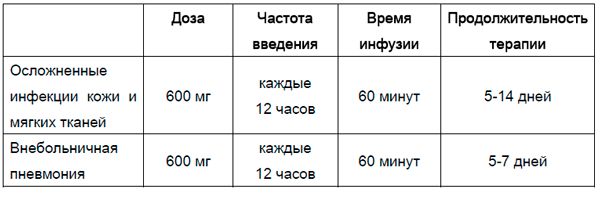
Продолжительность терапии следует устанавливать в зависимости от типа и тяжести инфекции, ответа пациента на терапию. Рекомендуется следующий режим дозирования:
Особые группы пациентов
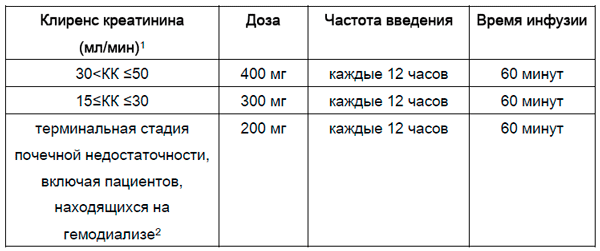
У пациентов с почечной недостаточностью тяжелой степени (КК ≤30 мл/мин), терминальной стадией почечной недостаточности и пациентов, находящихся на гемодиализе, применение препарата противопоказано.
При КК 30-50 мл/мин, дозу следует скорректировать следующим образом:
Нет необходимости корректировать дозу препарата у пациентов с печеночной недостаточностью.
Нет необходимости корректировать дозу препарата у пациентов пожилого возраста (≥65 лет) с КК >50 мл/мин.
Безопасность и эффективность препарата Зинфоро® у детей и подростков в возрасте до 18 лет не установлены.
Правила приготовления раствора для инфузии
При приготовлении и введении препарата необходимо соблюдать стандартные правила асептики. Каждый флакон предназначен только для однократного применения.
Зинфоро® порошок для приготовления концентрата для приготовления раствора для инфузии следует растворить в 20 мл стерильной воды для инъекций. 1 мл концентрата содержит 30 мг цефтаролина фосамила. Полученный концентрат представляет собой раствор бледно-желтого цвета, свободный от видимых частиц. Концентрат необходимо немедленно использовать, не хранить (время от начала растворения порошка до полного приготовления раствора для в/в инфузии не должно превышать 30 мин).
Для приготовления раствора для инфузии полученный концентрат встряхивают и переносят в инфузионный флакон, содержащий одну из перечисленных ниже совместимых инфузионных жидкостей: 0.9% раствор натрия хлорида, 5% раствор декстрозы, 0.45% раствор натрия хлорида и 2.5% раствор декстрозы, раствор Рингера лактат.
При применении препарата в дозе 600 мг во флакон с совместимой инфузионной жидкостью переносят весь полученный концентрат (20 мл), при применении в дозе 400 мг — 14 мл концентрата.
Раствор для инфузии можно приготовить путем добавления концентрата во флакон с инфузионной жидкостью объемом 50 мл, 100 мл или 250 мл.
Раствор для инфузии следует использовать в течение 6 ч с момента приготовления. Приготовленный раствор для инфузии сохраняет стабильность в течение 24 ч при хранении в холодильнике (2-8°С). После извлечения из холодильника раствор для инфузии необходимо использовать в течение 6 ч при комнатной температуре.
Неиспользованный препарат или отходы необходимо утилизировать в соответствии с местными требованиями.
Побочное действие
Наиболее частыми нежелательными реакциями, развившимися у ≥3% пациентов, получавших цефтаролин, были диарея, головная боль, тошнота и зуд, и были обычно слабо или умеренно выраженными.
Ниже представлены нежелательные реакции, отмечавшиеся в объединенных клинических исследованиях фазы 3 по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония (1305 взрослых пациентов в группе терапии Зинфоро®). Частота нежелательных реакций представлена в виде следующей градации: очень часто (≥1/10), часто (≥1/100,<1/10), нечасто (≥1/1000, <1/100), редко (≥1/10 000,<1/1000).
Частота развития нежелательных реакций по классу системы органов
1 см. раздел «Особые указания»
2 см. раздел «Противопоказания»
Противопоказания к применению
- почечная недостаточность тяжелой степени (КК ≤30 мл/мин), терминальная стадия почечной недостаточности и пациенты, находящиеся на гемодиализе;
- детский и подростковый возраст до 18 лет;
- повышенная чувствительность к цефтаролина фосамилу или L-аргинину;
- повышенная чувствительность к цефалоспоринам;
- тяжелые реакции повышенной чувствительности немедленного типа (например, анафилактическая реакция) на любое другое антибактериальное средство, имеющее бета-лактамную структуру (например, пенициллины или карбапенемы).
С осторожностью следует назначать препарат пациентам с судорожным синдромом в анамнезе.
Применение при беременности и кормлении грудью
Клинические данные о применении цефтаролина фосамила у беременных женщин отсутствуют. Экспериментальные исследования на животных не выявили неблагоприятного воздействия цефтаролина фосамила на фертильность, беременность, роды или послеродовое развитие.
Препарат Зинфоро® не следует применять при беременности, за исключением случаев, когда потенциальная польза для матери превышает возможный риск для плода.
Данные о проникновении цефтаролина в грудное молоко отсутствуют. Однако, в связи с тем, что многие бета-лактамные антибиотики выделяются с грудным молоком, в случае необходимости терапии препаратом Зинфоро®, рекомендуется прекращение грудного вскармливания.
Применение при нарушениях функции печени
Нет необходимости корректировать дозу препарата у пациентов с печеночной недостаточностью.
Применение при нарушениях функции почек
У пациентов с почечной недостаточностью тяжелой степени (КК ≤30 мл/мин), терминальной стадией почечной недостаточности и пациентов, находящихся на гемодиализе, применение препарата противопоказано.
При КК 30-50 мл/мин, дозу следует скорректировать следующим образом:
Применение у детей
Противопоказано применение препарата Зинфоро® у детей и подростков в возрасте до 18 лет, т.к. безопасность и эффективность не установлены.
Применение у пожилых пациентов
Нет необходимости корректировать дозу препарата у пациентов пожилого возраста (≥65 лет) с КК >50 мл/мин.
Особые указания
При применении препарата необходимо руководствоваться официальными рекомендациями по надлежащему использованию антибактериальных препаратов.
Реакции гиперчувствительности
Как и при применении всех бета-лактамных антибиотиков возможно развитие серьезных реакций гиперчувствительности (иногда с летальным исходом).
У пациентов с гиперчувствительностью к цефалоспоринам, пенициллинам или другим бета-лактамным антибиотикам в анамнезе, может также развиться аллергическая реакция к цефтаролина фосамилу. Перед началом терапии препаратом Зинфоро® следует тщательно изучить данные пациента на предмет выявления реакций гиперчувствительности к бета-лактамным антибиотикам. Препарат противопоказан пациентам с повышенной чувствительностью к цефалоспоринам в анамнезе. Также препарат противопоказан пациентам, у которых ранее отмечались тяжелые реакции повышенной чувствительности немедленного типа (например, анафилактическая реакция) на любое другое антибактериальное средство, имеющее бета-лактамную структуру (например, пенициллины или карбапенемы).
При развитии тяжелой аллергической реакции необходимо прекратить введение лекарственного препарата и принять соответствующие меры.
Диарея, ассоциированная с Clostridium difficile
При применении почти всех антибактериальных препаратов, в т.ч. препарата Зинфоро®, сообщалось о развитии антибиотикоассоциированного колита и псевдомембранозного колита, которые могут варьировать по тяжести от легких до угрожающих жизни форм. Следует принимать во внимание возможность развития колита при возникновении диареи на фоне применения цефтаролина фосамила. В этом случае необходимо прекратить терапию препаратом Зинфоро®, проводить поддерживающие мероприятия и назначить специфическое лечение Clostridium difficile.
Пациенты с судорожным синдромом в анамнезе
Как и при применении других цефалоспоринов, в исследованиях токсичности цефтаролина наблюдалось развитие судорог при приеме препарата в дозах, превышающих Cmax в 7-25 раз. Опыт применения цефтаролина у пациентов с судорожным синдромом в анамнезе ограничен, в связи с чем следует соблюдать осторожность при применении препарата Зинфоро® у этой группы пациентов.
Почечная недостаточность
Опыт применения цефтаролина у пациентов с почечной недостаточностью тяжелой степени и терминальной стадией почечной недостаточности и у пациентов, находящихся на гемодиализе, ограничен. Поэтому применение препарата Зинфоро® у этой популяции больных противопоказано.
Прямой антиглобулиновый тест (проба Кумбса)
Положительный прямой антиглобулиновый тест (ПАТ) может быть получен на фоне применения цефалоспоринов. Частота положительного ПАТ у пациентов, получавших цефтаролина фосамил, составила 10.7% в объединенных исследованиях фазы 3. Ни у одного пациента с положительным ПАТ на фоне применения цефтаролина не выявлены признаки гемолиза.
Нечувствительные микроорганизмы
При применении цефтаролина фосамила, как и других антибиотиков, может развиться суперинфекция.
Влияние на способность к управлению транспортными средствами и механизмами
Не проводилось исследований по изучению влияния препарата Зинфоро® на способность к вождению автотранспорта и управлению иными механизмами. Во время терапии может возникать головокружение, поэтому следует соблюдать осторожность при управлении транспортными средствами и при занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. При появлении головокружения следует воздержаться от выполнения указанных видов деятельности.
Передозировка
Данные о передозировке ограничены. Вероятность передозировки выше у пациентов с нарушением функции почек. При применении препарата в дозах выше рекомендованных наблюдались такие же нежелательные реакции, как и при применении препарата в рекомендованных дозах.
Лечение: симптоматическое. Цефтаролин частично выводится с помощью гемодиализа.
Лекарственное взаимодействие
Клинические исследования по изучению лекарственного взаимодействия с цефтаролином не проводились.
В исследованиях in vitro цефтаролин не ингибировал изоферменты цитохрома Р450 CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4 и не индуцировал изоферменты CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, или CYP3A4/5. В связи с этим вероятность взаимодействия цефтаролина с препаратами, которые метаболизируются под действием изоферментов системы цитохрома Р450, низка. Цефтаролин не метаболизируется под действием изоферментов цитохрома Р450 in vitro, поэтому, маловероятно влияние на параметры фармакокинетики цефтаролина при совместном применении с индукторами или ингибиторами изоферментов цитохрома Р450.
In vitro цефтаролин не переносится эффлюксными транспортерами P-gp или BCRP. Цефтаролин не ингибирует P-gp, следовательно, взаимодействие с субстратами, такими как дигоксин, не ожидается. Цефтаролин является слабым ингибитором BCRP, но данный эффект не имеет клинической значимости.
Исследования in vitro показали, что цефтаролин не является субстратом, и не ингибировал транспортеры органических катионов (ОСТ2) и анионов (OAT1, ОАТ3) в почках; поэтому, маловероятно взаимодействие с препаратами, которые ингибируют активную почечную секрецию (например, пробенецид) или с препаратами, которые являются субстратами этих транспортеров.
Взаимодействие с другими антибактериальными препаратами
Тесты in vitro не выявили антагонизма при совместном применении цефтаролина и других часто используемых антибактериальных препаратов (например, амикацина, азитромицина, азтреонама, даптомицина, левофлоксацина, линезолида, меропенема, тигециклина и ванкомицина).
Условия хранения препарата Зинфоро®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Зинфоро®
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Обобщенные научные материалы по действующему веществу препарата Зинфоро® (порошок для приготовления концентрата для приготовления раствора для инфузий, 600 мг)
Дата последней актуализации: 23.08.2016
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Владелец РУ
- Условия хранения
- Срок годности
- Источники информации
- Фармакологическая группа
- Характеристика
- Фармакология
- Показания к применению
- Противопоказания
- Ограничения к применению
- Применение при беременности и кормлении грудью
- Побочные действия
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Владелец РУ
Пфайзер Инк.
Условия хранения
При температуре не выше 30 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2012–2015.
Фармакологическая группа
Характеристика
Антибиотик класса цефалоспоринов.
Фармакология
Фармакодинамика
После в/в введения пролекарство цефтаролина фосамил быстро превращается в активный цефтаролин.
Механизм действия
Цефтаролина фосамил обладает активностью в отношении грамположительных и грамотрицательных микроорганизмов.
В исследованиях in vitro показано бактерицидное действие цефтаролина, обусловленное ингибированием биосинтеза клеточной стенки бактерий за счет связывания с пенициллинсвязывающими белками (ПСБ). Цефтаролина фосамил проявляет бактерицидную активность в отношении метициллинрезистентного Staphylococcus aureus (MRSA) и пенициллиннечувствительного Streptococcus pneumoniae (PNSP) в связи с его высоким сродством к измененным ПСБ этих микроорганизмов.
Связь фармакокинетики и фармакодинамики
Антимикробная активность цефтаролина фосамила, также как и других бета-лактамных антибиотиков, лучше всего коррелирует с интервалом времени, в течение которого концентрация остается выше МПК инфицирующего микроорганизма (%Т >МПК).
Механизм резистентности
Цефтаролина фосамил неактивен в отношении штаммов Enterobacteriaceae, продуцирующих бета-лактамазы расширенного спектра (БЛРС) семейств ТЕМ, SHV или СТХ-М, сериновые карбапенемазы (такие как КРС), металло-бета-лактамазы класса В или С (цефалоспориназы AmpC). Резистентность также может быть связана с нарушением проницаемости клеточной стенки бактерий или с активным выведением антибиотика (эффлюкс). Микроорганизм может обладать одним или несколькими механизмами резистентности.
Перекрестная резистентность
Несмотря на возможное развитие перекрестной резистентности, некоторые штаммы, резистентные к другим цефалоспоринам, могут быть чувствительны к цефтаролина фосамилу.
Микроорганизмы, обладающие природной резистентностью: Chlamydophila spp., Legionella spp., Mycoplasma spp., Proteus spp., Pseudomonas aeruginosa.
Взаимодействие с другими антимикробными ЛС
Исследования in vitro не выявили антагонизма при применении цефтаролина фосамила в комбинации с другими часто назначаемыми антимикробными ЛС (такими как амикацин, азитромицин, азтреонам, даптомицин, левофлоксацин, линезолид, меропенем, тигециклин и ванкомицин).
Чувствительность
Чувствительность антибиотиков in vitro меняется в зависимости от географического региона и с течением времени, поэтому при выборе антибактериальной терапии необходимо учитывать местную информацию о резистентности.
Если локальная резистентность такова, что эффективность антибиотика в отношении некоторых инфекций становится сомнительной, необходимо обратиться за консультацией к эксперту. Чувствительность к цефтаролина фосамилу должна определяться с помощью стандартных методов. Интерпретацию результатов следует проводить в соответствии с локальными руководствами.
Клиническая эффективность в отношении отдельных патогенных микроорганизмов
Ниже перечислены патогенные микроорганизмы (по показаниям к применению), чувствительные к цефтаролина фосамилу in vitro, в отношении которых в клинических исследованиях была показана эффективность цефтаролина фосамила.
Осложненные инфекции кожи и мягких тканей
Грамположительные микроорганизмы: Staphylococcus aureus (включая метициллинрезистентные штаммы), Streptococcus pyogenes, Streptococcus agalactiae, группа Streptococcus anginosus (включает S. anginosus, S. intermedius и S. constellatus), Streptococcus dysgalactiae.
Грамотрицательные микроорганизмы: Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Morganella morganii.
Внебольничная пневмония
Грамположительные микроорганизмы: Streptococcus pneumoniae (включая случаи, сопровождающиеся бактериемией), Staphylococcus aureus (только метициллинчувствительные штаммы).
Грамотрицательные микроорганизмы: Escherichia coli, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae.
Эффективность в отношении других значимых патогенных микроорганизмов
Клиническая эффективность цефтаролина фосамила в отношении перечисленных ниже патогенных микроорганизмов не была установлена, однако результаты исследований in vitro позволяют предполагать, что они чувствительны к цефтаролину в отсутствие приобретенных механизмов резистентности.
Грамположительные анаэробы: Peptostreptococcus spp.
Грамотрицательные анаэробы: Fusobacterium spp.
Фармакокинетика
Сmax и AUC цефтаролина фосамила увеличиваются почти пропорционально дозе при однократном введении в диапазоне доз от 50 до 1000 мг. Не наблюдалось заметной кумуляции цефтаролина фосамила после многократного в/в введения в дозе 600 мг в течение 60 мин каждые 12 ч в течение 14 дней здоровым добровольцам с нормальной функцией почек.
Распределение. Степень связывания цефтаролина фосамила с белками плазмы низкая (примерно 20%), он не проникает в эритроциты. Медиана Vss у здоровых взрослых мужчин после однократного в/в введения 600 мг цефтаролина фосамила, меченного изотопом, составляет 20,3 л и практически соответствует объему внеклеточной жидкости.
Метаболизм. В плазме крови под действием фосфатаз пролекарство цефтаролина фосамил быстро преобразуется в активный цефтаролин; концентрации пролекарства поддаются измерению в плазме преимущественно во время в/в инфузии. При гидролизе бета-лактамного кольца цефтаролина фосамила образуется микробиологически неактивный метаболит, цефтаролин М-1. Соотношение средних значений AUC цефтаролина М-1 к цефтаролина фосамилу в плазме крови после однократного в/в введения 600 мг цефтаролина фосамила здоровым добровольцам составляет примерно 20–30%.
Метаболизм цефтаролина фосамила протекает без участия изоферментов системы цитохрома Р450.
Экскреция. Цефтаролина фосамил выводится преимущественно почками. Почечный клиренс цефтаролина фосамила примерно равен или немного ниже СКФ в почках. Исследования транспортеров in vitro показывают, что активная секреция не способствует почечной элиминации цефтаролина фосамила. Средний T1/2 цефтаролина фосамила у здоровых взрослых людей составляет примерно 2,5 ч. После однократного в/в введения 600 мг меченного изотопом цефтаролина фосамила здоровым взрослым мужчинам примерно 88% радиоактивности обнаруживалось в моче и 6% — в фекалиях.
Особые группы пациентов
Почечная недостаточность. После однократной в/в инфузии 600 мг цефтаролина фосамила в течение 60 мин Сmax в плазме составила (28,4 ±6,9), (28,2 ±5,4) и (30,8 ±4,9) мкг/мл у пациентов с нормальной функцией почек, легкой почечной недостаточностью и почечной недостаточностью средней степени тяжести соответственно. Сmax цефтаролина фосамила достигалась приблизительно через 60 мин после начала инфузии. AUC цефтаролина увеличивалась пропорционально степени почечной недостаточности и составила (75,6 ±9,7), (92,3 ±25,3) и (114,8 ±14,1) мкг·ч/мл у пациентов с нормальной функцией почек, легкой почечной недостаточностью и почечной недостаточностью средней степени тяжести соответственно.
Пациентам с почечной недостаточностью средней и тяжелой степени, терминальной стадией почечной недостаточности, включая пациентов, находящихся на гемодиализе, требуется коррекция дозы.
Печеночная недостаточность. Исследования фармакокинетики цефтаролина фосамила у пациентов с печеночной недостаточностью не проводили. Так как цефтаролина фосамил не подвергается печеночному метаболизму в значительной степени, не ожидается, что печеночная недостаточность будет существенно влиять на системный клиренс цефтаролина. Поэтому не рекомендуется корректировать дозу у пациентов с печеночной недостаточностью.
Пожилые пациенты (≥65 лет). После однократного в/в введения 600 мг цефтаролина фосамила параметры фармакокинетики были схожими у здоровых пожилых людей (≥65 лет) и молодых пациентов (18–45 лет). У пожилых добровольцев отмечено небольшое увеличение AUC0–∞ (на 33%), что обусловлено главным образом возрастными изменениями функции почек. Не требуется коррекция дозы у пожилых пациентов с Cl креатинина >50 мл/мин.
Дети. Безопасность и эффективность цефтаролина фосамила у детей в возрасте до 18 лет не установлены.
Пол. Параметры фармакокинетики цефтаролина фосамила были схожими у мужчин и женщин. Не требуется коррекция дозы в зависимости от пола пациента.
Раса. Не наблюдались существенные различия параметров фармакокинетики цефтаролина фосамила у пациентов, принадлежащих к разным этническим группам. Не требуется корректировать дозу в зависимости от расы пациента.
Показания к применению
Осложненные инфекции кожи и мягких тканей, вызванные чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Staphylococcus aureus (включая метициллинрезистентные), Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus anginosus, Streptococcus dysgalactiae, Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca и Morganella morganii; внебольничная пневмония, вызванная чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Streptococcus pneumoniae (включая случаи, сопровождающиеся бактериемией), Staphylococcus aureus (только метициллинчувствительные), Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae и Escherichia coli.
Противопоказания
Повышенная чувствительность к цефтаролина фосамилу или L-аргинину; повышенная чувствительность к цефалоспоринам; тяжелые реакции повышенной чувствительности немедленного типа (например анафилактическая реакция) на любое другое антибактериальное средство, имеющее бета-лактамную структуру (например пенициллины или карбапенемы); детский возраст до 18 лет.
Ограничения к применению
Судорожный синдром в анамнезе.
Применение при беременности и кормлении грудью
Категория действия на плод по FDA — B.
Клинические данные о применении цефтаролина фосамила у беременных женщин отсутствуют. Исследования на животных не выявили неблагоприятное воздействие цефтаролина фосамила на фертильность, беременность, роды или послеродовое развитие. Цефтаролина фосамил не следует применять во время беременности, за исключением случаев, когда потенциальная польза для матери превышает возможный риск для плода.
Данные о проникновении цефтаролина фосамила в грудное молоко отсутствуют. Однако в связи с тем, что многие бета-лактамные антибиотики выделяются с грудным молоком, в случае необходимости терапии цефтаролина фосамилом рекомендуется прекращение грудного вскармливания.
Побочные действия
Объединенные исследования фазы 3
В четырех клинических исследованиях по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония с участием 1305 взрослых пациентов, цефторалина фосамил назначался в дозе 600 мг в виде в/в инфузии продолжительностью 60 мин каждые 12 ч.
Наиболее частыми нежелательными реакциями, развившимися у ≥3% больных, получавших цефтаролина фосамил, были диарея, головная боль, тошнота и зуд, которые были обычно слабо или умеренно выраженными.
Дополнительные исследования фазы 3
В исследовании по показанию внебольничная пневмония, которое проводилось в азиатских странах с участием 381 взрослого пациента, профиль безопасности цефтаролина фосамила (600 мг в виде в/в инфузии продолжительностью 60 мин каждые 12 ч) соответствовал профилю безопасности в объединенных клинических исследованиях фазы 3 по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония.
В исследовании по показанию осложненные инфекции кожи и мягких тканей с участием 506 взрослых пациентов цефтаролина фосамил назначался в дозе 600 мг в виде в/в инфузии продолжительностью 120 мин каждые 8 ч (см. «Меры предосторожности»).
Ниже представлены нежелательные реакции, отмечавшиеся в объединенных клинических исследованиях фазы 3 по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония (1305 взрослых пациентов в группе терапии цефтаролина фосамилом). Частота нежелательных реакций по органам и системам представлена в виде следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000).
Отклонения лабораторных показателей: очень часто — положительная прямая проба Кумбса (см. «Меры предосторожности»); нечасто — удлинение ПВ, АЧТВ, МНО.
Со стороны ЖКТ: часто — диарея, тошнота, рвота, боль в животе, запор.
Со стороны нервной системы: часто — головная боль, головокружение; нечасто — судороги.
Со стороны кожи и подкожных тканей: часто — сыпь, зуд; нечасто — крапивница.
Со стороны печени и желчевыводящих путей: часто — повышение активности трансаминаз; нечасто — гепатит.
Со стороны ССС: часто — флебит, брадикардия; нечасто — ощущение сердецбиения.
Со стороны обмена веществ и нарушения питания: часто — гипергликемия, гипокалиемия; нечасто — гиперкалиемия.
Общие расстройства и реакции в месте введения: часто — лихорадка, реакции в месте введения (эритема, флебит, боль).
Со стороны крови и лимфатической системы: нечасто — анемия, лейкопения, нейтропения, тромбоцитопения; редко — эозинофилия.
Со стороны иммунной системы: нечасто — гиперчувствительность/анафилаксия (см. «Меры предосторожности», «Противопоказания»), отек губ и лица.
Инфекции и инвазии: нечасто — колит, вызванный Clostridium difficile (см. «Меры предосторожности»).
Со стороны почек и мочевыводящих путей: нечасто — нарушение функции почек (повышение концентрации креатинина в крови).
Описание отдельных нежелательных реакций
Сыпь. Сыпь часто отмечалась у пациентов с осложненными инфекциями кожи и мягких тканей, получавших цефтаролина фосамил в дозе 600 мг как в виде в/в инфузии продолжительностью 60 мин каждые 12 ч (в объединенных исследованиях фазы 3), так и в виде в/в инфузии продолжительностью 120 мин каждые 8 ч. Однако в подгруппе пациентов монголоидной расы, получавших цефтаролина фосамил каждые 8 ч, сыпь отмечалась очень часто (18,5%).
Взаимодействие
Клинические исследования по изучению лекарственного взаимодействия с цефтаролина фосамилом не проводились.
В исследованиях in vitro цефтаролина фосамил не ингибировал изоферменты цитохрома Р450 CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4 и не индуцировал изоферменты CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 или CYP3A4/5. В связи с этим вероятность взаимодействия цефтаролина фосамил с ЛС, которые метаболизируются под действием изоферментов системы цитохрома Р450, низка. Цефтаролина фосамил не метаболизируется под действием изоферментов цитохрома Р450 in vitro, поэтому маловероятно влияние на параметры фармакокинетики цефтаролина фосамила при совместном применении с индукторами или ингибиторами изоферментов цитохрома Р450.
In vitro цефтаролина фосамил не переносится эффлюксными транспортерами P-gp или BCRP. Цефтаролина фосамил не ингибирует P-gp, следовательно взаимодействие с его субстратами, такими как дигоксин, не ожидается. Цефтаролина фосамил является слабым ингибитором BCRP, но данный эффект не имеет клинической значимости.
Исследования in vitro показали, что цефтаролина фосамил не является субстратом и не ингибирует транспортеры органических катионов (ОСТ2) и анионов (ОАТ1, ОАТ3) в почках, поэтому маловероятно взаимодействие с ЛС, которые ингибируют активную почечную секрецию (например пробенецид) или являются субстратами этих транспортеров.
Взаимодействие с другими антибактериальными ЛС. Тесты in vitro не выявили антагонизма при совместном применении цефтаролина фосамила и амикацина, азитромицина, азтреонама, даптомицина, левофлоксацина, линезолида, меропенема, тигециклина и ванкомицина.
Передозировка
Данные о передозировке ограничены. Вероятность передозировки выше у пациентов с нарушением функции почек. При применении цефтаролина фосамила в дозах выше рекомендованных наблюдались схожие нежелательные реакции, как и применении в рекомендованных дозах.
Лечение: симптоматическое.
Цефтаролина фосамил частично выводится с помощью гемодиализа.
Способ применения и дозы
В/в, в виде инфузии в течение 60 мин. Доза и продолжительность терапии устанавливаются в зависимости от типа и тяжести инфекции и ответа пациента на терапию.
Меры предосторожности
При применении цефтаролина фосамила необходимо руководствоваться официальными рекомендациями по надлежащему использованию антибактериальных ЛС.
Реакции гиперчувствительности
Как и при применении других бета-лактамных антибиотиков, возможно развитие серьезных реакций гиперчувствительности (иногда с летальным исходом).
У пациентов с гиперчувствительностью к цефалоспоринам, пенициллинам или другим бета-лактамным антибиотикам в анамнезе может также развиться аллергическая реакция на цефтаролина фосамил. Перед началом терапии следует тщательно изучить данные пациента на предмет выявления реакций гиперчувствительности к бета-лактамным антибиотикам. Цефтаролина фосамил противопоказан пациентам с повышенной чувствительностью к цефалоспоринам в анамнезе. Также он противопоказан пациентам, у которых ранее отмечались тяжелые реакции повышенной чувствительности немедленного типа (например анафилактическая реакция) на любое другое антибактериальное средство, имеющее бета-лактамную структуру (например пенициллины или карбапенемы).
При развитии тяжелой аллергической реакции необходимо прекратить введение цефтаролина фосамила и принять соответствующие меры.
Диарея, ассоциированная с Clostridium difficile
При применении почти всех антибактериальных ЛС, в т.ч. цефтаролина фосамила, сообщалось о развитии антнбиотикассоциированного колита и псевдомембранозного колита, которые могут варьировать по тяжести от легких до угрожающих жизни форм. Следует принимать во внимание возможность развития колита при возникновении диареи на фоне применения цефтаролина фосамила. В этом случае необходимо прекратить терапию, проводить поддерживающие мероприятия и назначить специфическое лечение Clostridium difficile.
Пациенты с судорожным синдромом в анамнезе
Как и при применении других цефалоспоринов, в исследованиях токсичности цефтаролина фосамила наблюдалось развитие судорог при приеме в дозах, превышающих Сmax в 7–25 раз. Опыт применения цефтаролина фосамила у пациентов с судорожным синдромом в анамнезе ограничен, в связи с чем следует соблюдать осторожность при его применении у этой группы пациентов.
Прямой антиглобулиновый тест (проба Кумбса)
Положительный прямой антиглобулиновый тест (ПАТ) может быть получен на фоне применения цефалоспоринов. Частота положительного ПАТ у пациентов, получавших цефтаролина фосамил в дозе 600 мг в виде в/в инфузии продолжительностью 60 мин каждые 12 ч, составила 10,7% в объединенных исследованиях фазы 3 и 32,3% в исследовании, где цефтаролина фосамил назначали в дозе 600 мг в виде в/в инфузии продолжительностью 120 мин каждые 8 ч. Ни у одного пациента с положительным ПАТ на фоне применения цефтаролина фосамила не выявлены признаки гемолиза.
Нечувствительные микроорганизмы
При применении цефтаролина фосамила, как и других антибиотиков, может развиться суперинфекция.
Влияние на способность управлять транспортными средствами и работать с механизмами. Не проводились исследования по изучению влияния цефтаролина фосамила на способность к вождению автотранспорта и управлению иными механизмами. Во время терапии может возникать головокружение, поэтому следует соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. При появлении описанного выше нежелательного явления следует воздержаться от выполнения указанных видов деятельности.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Зинфоро — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-001912
Торговое название:
Зинфоро® (Zinforo®)
Международное непатентованное название:
цефтаролина фосамил
Лекарственная форма:
порошок для приготовления концентрата для приготовления раствора для инфузий
СОСТАВ
В 1 флаконе содержится:
Активное вещество: цефтаролина фосамила ацетат моногидрат 668,4 мг,эквивалентный цефтаролину фосамилу 600,0 мг.
Вспомогательное вещество: L-аргинин 395,0 мг
ОПИСАНИЕ
Порошок от желтовато-белого до светло-желтого цвета
Фармакотерапевтическая группа:
Антибиотик, цефалоспорин
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
После внутривенного введения пролекарство цефтаролина фосамил быстро превращается в активный цефтаролин.
Механизм действия
Цефтаролин – антибиотик класса цефалоспоринов с активностью в отношении грамположительных и грамотрицательных микроорганизмов. В исследованиях in vitro показано бактерицидное действие цефтаролина, обусловленное ингибированием биосинтеза клеточной стенки бактерий за счет связывания с пенициллинсвязывающими белками (ПСБ). Цефтаролин проявляет бактерицидную активность в отношении метициллин-резистентного Staphylococcus aureus (MRSA) и в отношении пенициллин-нечувствительного Streptococcus pneumoniae (PNSP) в связи с его высоким сродством к измененным ПСБ этих микроорганизмов.
Связь фармакокинетики и фармакодинамики
Антимикробная активность цефтаролина, также как и других бета-лактамных антибиотиков, лучше всего коррелирует с интервалом времени, в течение которого концентрация препарата остается выше минимальной подавляющей концентрации (МПК) инфицирующего микроорганизма (%T > МПК).
Механизм резистентности
Цефтаролин не активен в отношении штаммов Enterobacteriaceae, продуцирующих бета-лактамазы расширенного спектра (БЛРС) семейств TEM, SHV или CTX-M, сериновые карбапенемазы (такие как KPC), металло-бета-лактамазы класса В или класса С (цефалоспориназы AmpC). Резистентность также может быть связана с нарушением проницаемости клеточной стенки бактерий или с активным выведением антибиотика (эффлюкс). Микроорганизм может обладать одним или несколькими механизмами резистентности.
Перекрестная резистентность
Несмотря на возможное развитие перекрестной резистентности, некоторые штаммы, резистентные к другим цефалоспоринам, могут быть чувствительны к цефтаролину.
Микроорганизмы, обладающие природной резистентностью: Chlamydophila spp. Legionella spp. Mycoplasma spp. Proteus spp. Pseudomonas aeruginosa
Взаимодействие с другими антимикробными препаратами
Исследования in vitro не выявили антагонизма при применении цефтаролина в комбинации с другими часто назначаемыми антимикробными препаратами (такими как амикацин, азитромицин, азтреонам, даптомицин, левофлоксацин, линезолид, меропенем, тигециклин и ванкомицин).
Чувствительность
Чувствительность антибиотиков in vitro меняется в зависимости от географического региона и с течением времени, поэтому при выборе антибактериальной терапии необходимо учитывать местную информацию о резистентности. Если локальная резистентность такова, что эффективность препарата в отношении некоторых инфекций становится сомнительной, необходимо обратиться за консультацией к эксперту. Чувствительность к цефтаролину должна определяться с помощью стандартных методов. Интерпретацию результатов следует проводить в соответствии с локальными руководствами. Клиническая эффективность в отношении отдельных патогенных микроорганизмов Ниже перечислены патогенные микроорганизмы (по показаниям к применению), чувствительные к цефтаролину in vitro, в отношении которых в клинических исследованиях была показана эффективность цефтаролина.
Осложненные инфекции кожи и мягких тканей
Грамположительные микроорганизмы
Staphylococcus aureus (включая метициллин-резистентные штаммы)
Streptococcus pyogenes
Streptococcus agalactiae
Группа Streptococcus anginosus (включает S. anginosus, S. intermedius и S. constellatus) Streptococcus dysgalactiae
Грамотрицательные микроорганизмы
Escherichia coli
Klebsiella pneumoniae
Klebsiella oxytoca
Morganella morganii
Внебольничная пневмония
Грамположительные микроорганизмы
Streptococcus pneumoniaе (включая случаи, сопровождающиеся бактериемией) Staphylococcus aureus (только метициллин-чувствительные штаммы)
Грамотрицательные микроорганизмы
Escherichia coli
Haemophilus influenzae
Haemophilus parainfluenzae
Klebsiella pneumoniae
Эффективность в отношении других значимых патогенных микроорганизмов Клиническая эффективность цефтаролина в отношении перечисленных ниже патогенных микроорганизмов не была установлена, однако результаты исследований in vitro позволяют предполагать, что они чувствительны к цефтаролину в отсутствие приобретенных механизмов резистентности.
Грамположительные анаэробы Peptostreptococcus spp.
Грамотрицательные анаэробы Fusobacterium spp.
Фармакокинетика
Максимальная концентрация (Cmax) и площадь под кривой «концентрация-время» (AUC) цефтаролина увеличиваются почти пропорционально дозе при однократном введении препарата в диапазоне доз от 50 до 1000 мг. Не наблюдалось заметной кумуляции цефтаролина после многократного внутривенного введения препарата в дозе 600 мг в течение 60 минут каждые 12 часов в течение 14 дней здоровым добровольцам с нормальной функцией почек.
Распределение
Степень связывания цефтаролина с белками плазмы низкая (примерно 20%), препарат не проникает в эритроциты. Медиана объема распределения в равновесном состоянии у здоровых взрослых мужчин после однократного внутривенного введения 600 мг цефтаролина фосамила, меченного изотопом, составила 20,3 л, почти как и объем внеклеточной жидкости.
Метаболизм
В плазме крови под действием фосфатаз пролекарство цефтаролина фосамил быстро преобразуется в активный цефтаролин; концентрации пролекарства поддаются измерению в плазме, преимущественно, во время внутривенной инфузии. При гидролизе бета-лактамного кольца цефтаролина образуется микробиологически неактивный метаболит, цефтаролин М-1. Соотношение средних значений AUC цефтаролина М-1 к цефтаролину в плазме крови после однократного внутривенного введения 600 мг цефтаролина фосамила здоровым добровольцам составляет примерно 20-30%. Метаболизм цефтаролина протекает без участия изоферментов системы цитохрома P450.
Экскреция
Цефтаролин выводится, преимущественно, почками. Почечный клиренс цефтаролина примерно равен или немного ниже скорости клубочковой фильтрации в почках. Исследования транспортеров in vitro показывают, что активная секреция не способствует почечной элиминации цефтаролина. Средний период полувыведения цефтаролина у здоровых взрослых людей составляет примерно 2,5 часа. После однократного внутривенного введения 600 мг меченного изотопом цефтаролина фосамила здоровым взрослым мужчинам примерно 88% радиоактивности обнаруживалось в моче и 6% – в фекалиях.
Особые группы пациентов
Почечная недостаточность
После однократной внутривенной инфузии 600 мг цефтаролина фосамила в течение 60 минут Cmax цефтаролина в плазме составила 28,4 ± 6,9 мкг/мл, 28,2 ± 5,4 мкг/мл и 30,8 ± 4,9 мкг/мл у пациентов с нормальной функцией почек, легкой почечной недостаточностью и почечной недостаточностью средней степени тяжести, соответственно. Cmax цефтаролина достигалась приблизительно через 60 минут после начала инфузии. AUC цефтаролина увеличивалась пропорционально степени почечной недостаточности и составила 75,6 ± 9,7 мкг×ч/мл, 92,3 ± 25,3 мкг×ч/мл и 114,8 ± 14,1 мкг×ч/мл у пациентов с нормальной функцией почек, легкой почечной недостаточностью и почечной недостаточностью средней степени тяжести, соответственно. Пациентам с почечной недостаточностью средней и тяжелой степени, терминальной стадией почечной недостаточности, включая пациентов, находящихся на гемодиализе, требуется коррекция дозы (см. раздел «Способ применения и дозы»).
Печеночная недостаточность
Исследования фармакокинетики цефтаролина у пациентов с печеночной недостаточностью не проводили. Так как цефтаролин не подвергается печеночному метаболизму в значительной степени, не ожидается, что печеночная недостаточность будет существенно влиять на системный клиренс цефтаролина. Поэтому не рекомендуется корректировать дозу препарата у пациентов с печеночной недостаточностью.
Пожилые пациенты (≥ 65 лет)
После однократного внутривенного введения 600 мг цефтаролина фосамила параметры фармакокинетики препарата были схожими у здоровых пожилых людей (≥ 65 лет) и здоровых молодых пациентов (18-45 лет). У пожилых добровольцев отмечено небольшое увеличение AUC0-∞ (на 33%), что обусловлено, главным образом, возрастными изменениями функции почек. Не требуется коррекции дозы препарата у пожилых пациентов с клиренсом креатинина выше 50 мл/мин.
Дети
Безопасность и эффективность препарата Зинфоро® у детей в возрасте до 18 лет не установлены.
Пол
Параметры фармакокинетики цефтаролина были схожими у мужчин и женщин. Не требуется коррекции дозы в зависимости от пола пациента.
Раса
Не наблюдалось существенных различий параметров фармакокинетики цефтаролина у пациентов, принадлежащих к разным этническим группам. Не требуется корректировать дозу препарата в зависимости от расы пациента.
ПОКАЗАНИЯ
Препарат Зинфоро® показан для лечения у взрослых следующих инфекций:
• осложненные инфекции кожи и мягких тканей, вызванные чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Staphylococcus aureus (включая метициллин-резистентные штаммы), Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus anginosus, Streptococcus dysgalactiae, Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca и Morganella morganii;
• внебольничная пневмония, вызванная чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Streptococcus pneumoniae (включая случаи, сопровождающиеся бактериемией), Staphylococcus aureus (только метициллин-чувствительные штаммы), Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae и Escherichia coli
ПРОТИВОПОКАЗАНИЯ
- Повышенная чувствительность к цефтаролина фосамилу или L-аргинину.
- Повышенная чувствительность к цефалоспоринам.
- Тяжелые реакции повышенной чувствительности немедленного типа (например, анафилактическая реакция) на любое другое антибактериальное средство, имеющее бета-лактамную структуру (например, пенициллины или карбапенемы).
- Детский возраст до 18 лет.
С ОСТОРОЖНОСТЬЮ: судорожный синдром в анамнезе.
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ
Беременность
Клинические данные о применении цефтаролина фосамила у беременных женщин отсутствуют. Исследования на животных не выявили неблагоприятного воздействия цефтаролина фосамила на фертильность, беременность, роды или послеродовое развитие. Препарат Зинфоро® не следует применять во время беременности, за исключением случаев, когда потенциальная польза для матери превышает возможный риск для плода.
Период грудного вскармливания
Данные о проникновении цефтаролина в грудное молоко отсутствуют. Однако, в связи с тем, что многие бета-лактамные антибиотики выделяются с грудным молоком, в случае необходимости терапии препаратом Зинфоро® рекомендуется прекращение грудного вскармливания.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Зинфоро® вводится внутривенно в виде инфузии в течение 60 минут (см. «Приготовление раствора для инфузий»).
Продолжительность терапии должна устанавливаться в зависимости от типа и тяжести инфекции, ответа пациента на терапию.
Рекомендуется следующий режим дозирования:
Применение у особых групп пациентов
Почечная недостаточность
Если клиренс креатинина (КК) ≤ 50 мл/мин, дозу препарата следует корректировать следующим образом:
1. Рассчитывается по формуле Кокрофта-Голта.
2. Цефтаролин удаляется при гемодиализе. Препарат следует вводить по окончании процедуры гемодиализа в дни её проведения.
Печеночная недостаточность
Нет необходимости корректировать дозу препарата у пациентов с печеночной недостаточностью.
Пожилые пациенты (≥ 65 лет)
Нет необходимости корректировать дозу препарата у пожилых пациентов с КК > 50 мл/мин.
Дети
Безопасность и эффективность препарата Зинфоро® у детей в возрасте до 18 лет не установлены.
Приготовление раствора для инфузий
При приготовлении и введении препарата необходимо соблюдать стандартные правила асептики. Каждый флакон предназначен только для однократного применения.
Зинфоро® порошок для приготовления концентрата для приготовления раствора для инфузий следует растворить в 20 мл стерильной воды для инъекций. Один мл концентрата содержит 30 мг цефтаролина фосамила. Полученный концентрат представляет собой раствор бледно-желтого цвета, свободный от видимых частиц. Концентрат необходимо немедленно использовать, не хранить (время от начала растворения порошка до полного приготовления раствора для внутривенных инфузий не должно превышать 30 минут).
Для приготовления раствора для инфузий полученный концентрат встряхивают и переносят в инфузионный флакон, содержащий одну из перечисленных ниже совместимых инфузионных жидкостей:
- 0,9% раствор натрия хлорида,
- 5% раствор декстрозы,
- 0,45% раствор натрия хлорида и 2,5% раствор декстрозы,
- раствор Рингер лактат.
При применении дозы препарата 600 мг во флакон с совместимой инфузионной жидкостью переносят весь полученный концентрат (20 мл), при применении дозы 400 мг — 14 мл концентрата. Для применения дозы 300 мг следует перенести 10 мл концентрата, а для дозы 200 мг — 7 мл концентрата. Раствор для инфузий можно приготовить путем добавления концентрата во флакон с инфузионной жидкостью объемом 50 мл, 100 мл или 250 мл. После приготовления раствора для инфузий его следует использовать в течение 6 часов с момента приготовления. Приготовленный раствор для инфузий сохраняет стабильность в течение 24 часов при хранении в холодильнике (2-8°С).
После извлечения из холодильника раствор для инфузий необходимо использовать в течение 6 часов при комнатной температуре.
Неиспользованный препарат или отходы необходимо утилизировать в соответствии с местными требованиями.
ПОБОЧНОЕ ДЕЙСТВИЕ
Объединенные исследования фазы 3
В четырех клинических исследованиях по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония с участием 1305 взрослых пациентов, препарат Зинфоро® назначался в дозе 600 мг в виде внутривенной инфузии продолжительностью 60 минут каждые 12 часов.
Наиболее частыми нежелательными реакциями, развившимися у ≥ 3% больных, получавших цефтаролин, были диарея, головная боль, тошнота и зуд, которые были обычно слабо или умеренно выраженными.
Дополнительные исследования фазы 3
В исследовании по показанию внебольничная пневмония, которое проводилось в азиатских странах с участием 381 взрослого пациента, профиль безопасности препарата Зинфоро® (600 мг в виде внутривенной инфузии продолжительностью 60 минут каждые 12 часов) соответствовал профилю безопасности в объединенных клинических исследованиях фазы 3 по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония.
В исследовании по показанию осложненные инфекции кожи и мягких тканей с участием 506 взрослых пациентов препарат Зинфоро® назначался в дозе 600 мг в виде внутривенной инфузии продолжительностью 120 минут каждые 8 часов (см. далее по тексту раздела и раздел «Особые указания»).
Ниже представлены нежелательные реакции, отмечавшиеся в объединенных клинических исследованиях фазы 3 по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония (1305 взрослых пациентов в группе терапии Зинфоро®). Частота нежелательных реакций представлена в виде следующей градации: очень часто (≥ 1/10), часто (≥ 1/100, < 1/10), нечасто (≥ 1/1000, < 1/100), редко (≥ 1/10000, < 1/1000).
Частота развития нежелательных реакций по классу системы органов
|
Органы и системы |
Нежелательная реакция |
|
Лабораторные показатели |
Очень часто: положительная прямая проба Кумбса1 |
|
Нечасто: удлинение протромбинового времени, |
|
|
удлинение активированного частичного тромбопластинового времени, увеличение международного нормализованного отношения |
|
|
Желудочно-кишечный тракт |
Часто: диарея, тошнота, рвота, боль в животе, запор |
|
Нервная система |
Часто: головная боль, головокружение |
|
Нечасто: судороги |
|
|
Кожа и подкожные ткани |
Часто: сыпь, зуд |
|
Нечасто: крапивница |
|
|
Печень и желчевыводящие пути |
Часто: повышение активности трансаминаз |
|
Нечасто: гепатит |
|
|
Сердечно-сосудистая система |
Часто: флебит, брадикардия |
|
Нечасто: ощущение сердцебиения |
|
|
Обмен веществ и питание |
Часто: гипергликемия, гипокалиемия |
|
Нечасто: гиперкалиемия |
|
|
Общие расстройства и реакции в месте введения |
Часто: лихорадка, реакции в месте инфузии (эритема, флебит, боль) |
|
Кровь и лимфатическая система |
Нечасто: анемия, лейкопения, нейтропения, тромбоцитопения |
|
Редко: эозинофилия |
|
|
Иммунная система |
Нечасто: гиперчувствительность / анафилаксия1,2, отек губ и лица |
|
Инфекции и инвазии |
Нечасто: колит, вызванный Clostridium difficile1 |
|
Почки и мочевыводящие пути |
Нечасто: нарушение функции почек (повышение концентрации креатинина крови) |
1. См. раздел «Особые указания».
2. См. раздел «Противопоказания».
Описание отдельных нежелательных реакций
Сыпь
Сыпь часто отмечалась у пациентов с осложненными инфекциями кожи и мягких тканей, получавших цефтаролина фосамил в дозе 600 мг как в виде внутривенной инфузии продолжительностью 60 минут каждые 12 часов (в объединенных исследованиях фазы 3), так и в виде внутривенной инфузии продолжительностью 120 минут каждые 8 часов. Однако в подгруппе пациентов монголоидной расы, получавших цефтаролина фосамил каждые 8 часов, сыпь отмечалась очень часто (18,5%).
ПЕРЕДОЗИРОВКА
Данные о передозировке ограничены. Вероятность передозировки выше у пациентов с нарушением функции почек. При применении препарата в дозах выше рекомендованных наблюдались схожие нежелательные реакции, как и при применении препарата в рекомендованных дозах.
Лечение: симптоматическое. Цефтаролин частично выводится с помощью гемодиализа.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ И ДРУГИЕ ВИДЫ ЛЕКАРСТВЕННОГО ВЗАИМОДЕЙСТВИЯ
Клинические исследования по изучению лекарственного взаимодействия с цефтаролином не проводились.
В исследованиях in vitro цефтаролин не ингибировал изоферменты цитохрома P450 CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4 и не индуцировал изоферменты CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, или CYP3A4/5. В связи с этим вероятность взаимодействия цефтаролина с препаратами, которые метаболизируются под действием изоферментов системы цитохрома Р450, низка.
Цефтаролин не метаболизируется под действием изоферментов цитохрома P450 in vitro, поэтому, маловероятно влияние на параметры фармакокинетики цефтаролина при совместном применении с индукторами или ингибиторами изоферментов цитохрома P450. In vitro цефтаролин не переносится эффлюксными транспортерами P-gp или BCRP. Цефтаролин не ингибирует P-gp, следовательно, взаимодействие с субстратами, такими как дигоксин, не ожидается. Цефтаролин является слабым ингибитором BCRP, но данный эффект не имеет клинической значимости. Исследования in vitro показали, что цефтаролин не является субстратом, и не ингибировал транспортеры органических катионов (OCT2) и анионов (OAT1, OAT3) в почках; поэтому, маловероятно взаимодействие с препаратами, которые ингибируют активную почечную секрецию (например, пробенецид) или с препаратами, которые являются субстратами этих транспортеров.
Взаимодействие с другими антибактериальными препаратами
Тесты in vitro не выявили антагонизма при совместном применении цефтаролина и других часто используемых антибактериальных препаратов (например, амикацина, азитромицина, азтреонама, даптомицина, левофлоксацина, линезолида, меропенема, тигециклина и ванкомицина).
ОСОБЫЕ УКАЗАНИЯ
При применении препарата необходимо руководствоваться официальными рекомендациями по надлежащему использованию антибактериальных препаратов.
Реакции гиперчувствительности
Как и при применении всех бета-лактамных антибиотиков, возможно развитие серьёзных реакций гиперчувствительности (иногда с летальным исходом).
У пациентов с гиперчувствительностью к цефалоспоринам, пенициллинам или другим бета-лактамным антибиотикам в анамнезе может также развиться аллергическая реакция на цефтаролина фосамил. Перед началом терапии препаратом Зинфоро® следует тщательно изучить данные пациента на предмет выявления реакций гиперчувствительности к бета-лактамным антибиотикам.
Препарат противопоказан пациентам с повышенной чувствительностью к цефалоспоринам в анамнезе. Также препарат противопоказан пациентам, у которых ранее отмечались тяжелые реакции повышенной чувствительности немедленного типа (например, анафилактическая реакция) на любое другое антибактериальное средство, имеющее бета-лактамную структуру (например, пенициллины или карбапенемы). При развитии тяжелой аллергической реакции необходимо прекратить введение лекарственного препарата и принять соответствующие меры.
Диарея, ассоциированная с Clostridium difficile
При применении почти всех антибактериальных препаратов, в том числе препарата Зинфоро®, сообщалось о развитии антибиотикоассоциированного колита и псевдомембранозного колита, которые могут варьировать по тяжести от легких до угрожающих жизни форм. Следует принимать во внимание возможность развития колита при возникновении диареи на фоне применения цефтаролина фосамила. В этом случае необходимо прекратить терапию препаратом Зинфоро®, проводить поддерживающие мероприятия и назначить специфическое лечение Clostridium difficile.
Пациенты с судорожным синдромом в анамнезе
Как и при применении других цефалоспоринов, в исследованиях токсичности цефтаролина наблюдалось развитие судорог при приеме препарата в дозах, превышающих Сmax в 7-25 раз. Опыт применения цефтаролина у пациентов с судорожным синдромом в анамнезе ограничен, в связи с чем следует соблюдать осторожность при применении препарата Зинфоро® у этой группы пациентов.
Прямой антиглобулиновый тест (проба Кумбса) Положительный прямой антиглобулиновый тест (ПАТ) может быть получен на фоне применения цефалоспоринов. Частота положительного ПАТ у пациентов, получавших цефтаролина фосамил в дозе 600 мг в виде внутривенной инфузии продолжительностью 60 минут каждые 12 часов, составила 10,7% в объединенных исследованиях фазы 3 и 32,3% в исследовании, где цефтаролина фосамил назначался в дозе 600 мг в виде внутривенной инфузии продолжительностью 120 минут каждые 8 часов. Ни у одного пациента с положительным ПАТ на фоне применения цефтаролина фосамила не выявлены признаки гемолиза.
Нечувствительные микроорганизмы
При применении цефтаролина фосамила, как и других антибиотиков, может развиться суперинфекция.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Не проводилось исследований по изучению влияния препарата Зинфоро® на способность к вождению автотранспорта и управлению иными механизмами. Во время терапии может возникать головокружение, поэтому следует соблюдать осторожность при управлении транспортными средствами и при занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. При появлении описанного выше нежелательного явления следует воздержаться от выполнения указанных видов деятельности.
ФОРМА ВЫПУСКА
Порошок для приготовления концентрата для приготовления раствора для инфузий, 600 мг.
По 600 мг активного вещества в прозрачные стеклянные флаконы вместимостью 20 мл (тип I Евр.Фарм.) закрытые бромбутиловой резиновой пробкой с покрытием из фторированного полимера, закрытой сверху алюминиевым колпачком c полипропиленовой крышкой (“флип-офф”). По 1 или 10 флаконов с инструкцией по применению в картонную пачку с контролем первого вскрытия.
УСЛОВИЯ ХРАНЕНИЯ
При температуре не выше 30 °С. Хранить в местах, недоступных для детей.
СРОК ГОДНОСТИ
3 года. Не применять по истечении срока годности, указанного на упаковке.
УСЛОВИЯ ОТПУСКА
По рецепту.
НАИМЕНОВАНИЕ И АДРЕС ЮРИДИЧЕСКОГО ЛИЦА, НА ИМЯ КОТОРОГО ВЫДАНО РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ
АстраЗенека ЮК Лимитед, Великобритания 2 Кингдом Стрит, Лондон W2 6BD, Великобритания AstraZeneca UK Limited, United Kingdom 2 Kingdom Street, London W2 6BD, United Kingdom
ПРОИЗВОДИТЕЛЬ
ЭйСиЭс Добфар С.п.А. Виале Аддетта 4/12, 20067 Трибиано, Милан, Италия ACS Dobfar S.p.A. Viale Addetta, 4/12, 20067 Tribiano, Milano, Italy
ФАСОВЩИК (ПЕРВИЧНАЯ УПАКОВКА), УПАКОВЩИК (ВТОРИЧНАЯ (ПОТРЕБИТЕЛЬСКАЯ) УПАКОВКА), ВЫПУСКАЮЩИЙ КОНТРОЛЬ КАЧЕСТВА
Факта Фармачеутичи С.п.А.
Нуклео Индастриале С. Атто, 64100 Терамо, Италия
Facta Farmaceutici S.p.A
Nucleo Industriale S. Atto, 64100 Teramo, Italy
Дальнейшая информация предоставляется по требованию:
Представительство АстраЗенека ЮК Лимитед Великобритания в г. Москве и ООО АстраЗенека Фармасьютикалз:
125284 Москва, ул. Беговая д. 3, стр. 1
Купить Зинфоро в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Порошок для приготовления раствора для инфузий, 600 мг
Один флакон содержит
активное вещество — цефтаролина фосамила ацетат моногидрат 668,4 мг, эквивалентный цефтаролину фосамилу 600,0 мг
вспомогательное вещество — L-аргинин 395,0 мг
Порошок от бледного желтовато-белого до светло-желтого цвета
Антибактериальные препараты для системного использования. Бета-лактамные антибактериальные препараты, прочие. Другие цефалоспорины и пенемы. Цефтаролина фосамил
Код АТХ J01DI02
Фармакокинетика
Максимальная концентрация (Cmax) и площадь под кривой «концентрация-время» (AUC) цефтаролина увеличиваются почти пропорционально дозировке при однократном введении препарата в диапазоне доз от 50 до 1000 мг. Не наблюдалось заметной кумуляции цефтаролина после многократного внутривенного введения препарата в дозе 600 мг в течение 60 минут каждые 12 часов в течение 14 дней здоровым добровольцам с нормальной функцией почек.
Распределение
Степень связывания цефтаролина с белками плазмы низкая (примерно 20%), препарат не проникает в эритроциты. Медиана объема распределения в равновесном состоянии у здоровых взрослых мужчин после однократного внутривенного введения 600 мг цефтаролина фосамила, меченного изотопом, составила 20,3 л, почти как и объем внеклеточной жидкости.
Метаболизм
В плазме крови под действием фосфатаз пролекарство цефтаролина фосамил быстро преобразуется в активный цефтаролин, концентрации пролекарства поддаются измерению в плазме, преимущественно, во время внутривенной инфузии. При гидролизе бета-лактамного кольца цефтаролина образуется микробиологически неактивный метаболит, цефтаролин М-1. Соотношение средних значений AUC цефтаролина М-1 к цефтаролину в плазме крови после однократного внутривенного введения 600 мг цефтаролина фосамила здоровым добровольцам составляет примерно 20‑30%.
Метаболизм цефтаролина протекает без участия ферментов системы цитохрома P450.
Экскреция
Цефтаролин выводится, преимущественно, почками. Почечный клиренс цефтаролина примерно равен или немного ниже скорости клубочковой фильтрации в почках, исследования транспортеров in vitro показывают, что активная секреция не способствует почечной элиминации цефтаролина. Средний период полувыведения цефтаролина у здоровых взрослых людей составляет примерно 2,5 часа. После однократного внутривенного введения 600 мг меченного изотопом цефтаролина фосамила здоровым взрослым мужчинам, примерно 88% радиоактивности обнаруживалось в моче и 6% — в фекалиях.
Особые группы пациентов
Почечная недостаточность
После однократной внутривенной инфузии 600 мг цефтаролина фосамила в течение 60 минут Cmax цефтаролина в плазме составила 28,4 ± 6,9 мкг/мл, 28,2 ± 5,4 мкг/мл и 30,8 ± 4,9 мкг/мл у пациентов с нормальной функцией почек, легкой и умеренной почечной недостаточностью, соответственно. Cmax цефтаролина достигалась приблизительно через 60 минут после начала инфузии. AUC цефтаролина увеличивалась пропорционально степени почечной недостаточности и составила 75,6 ± 9,7 мкг×ч/мл, 92,3 ± 25,3 мкг×ч/мл и 114,8 ± 14,1 мкг×ч/мл у пациентов с нормальной функцией почек, легкой и умеренной почечной недостаточностью, соответственно.
Коррекция дозы требуется только у пациентов с умеренной почечной недостаточностью (клиренс креатинина (КК) 30 < КК ≤ 50 мл/мин) (см. раздел «Способ применения и дозы»).
Недостаточно данных для рекомендаций по коррекции дозы у пациентов с тяжелой почечной недостаточностью (КК ≤ 30 мл/мин) и терминальной стадией почечной недостаточности, включая больных, находящихся на гемодиализе.
Печеночная недостаточность
Исследования фармакокинетики цефтаролина у пациентов с печеночной недостаточностью не проводили. Так как цефтаролин не подвергается печеночному метаболизму в значительной степени, не ожидается, что печеночная недостаточность будет существенно влиять на системный клиренс цефтаролина. Поэтому, не рекомендуется корректировать дозу препарата у пациентов с печеночной недостаточностью.
Пожилые пациенты (≥ 65 лет)
После однократного внутривенного введения 600 мг цефтаролина фосамила параметры фармакокинетики препарата были схожими у здоровых пожилых людей (≥ 65 лет) и здоровых молодых пациентов (18‑45 лет). У пожилых добровольцев отмечено небольшое увеличение AUC0-∞ (на 33%), что обусловлено, главным образом, возрастными изменениями функции почек. Не требуется коррекции дозы препарата у пожилых пациентов с клиренсом креатинина выше 50 мл/мин.
Дети
Безопасность и эффективность препарата Зинфоро™ у детей в возрасте до 18 лет не установлены.
Пол
Параметры фармакокинетики цефтаролина были схожими у мужчин и женщин. Не требуется коррекции дозы в зависимости от пола пациента.
Раса
Не наблюдалось существенных различий параметров фармакокинетики цефтаролина у пациентов, принадлежащих к разным этническим группам. Не требуется корректировать дозу препарата в зависимости от расы пациента.
Фармакодинамика
После внутривенного введения Зинфоротм цефтаролина фосамил быстро превращается в активный цефтаролин.
Механизм действия
Цефтаролин – антибиотик класса цефалоспоринов с in vitro активностью в отношении грамположительных и грамотрицательных микроорганизмов. Бактерицидное действие цефтаролина приводит к ингибированию биосинтеза клеточной стенки бактерий, за счет связывания с пенициллинсвязывающими белками (ПСБ). Цефтаролин проявляет бактерицидную активность в отношении Staphylococcus aureus за счет высокой аффинности к ПСБ2a и в отношении Streptococcus pneumoniae из-за своего высокого сродства к ПСБ2x.
Связь фармакокинетики и фармакодинамики
Антимикробная активность цефтаролина, также как и других бета-лактамных антибиотиков, хорошо коррелирует с периодом времени, в течение которого концентрации препарата остаются выше минимальной ингибирующей концентрации (МИК) для инфицирующего микроорганизма (%T > МИК).
Механизм резистентности
Цефтаролин не активен в отношении штаммов Enterobacteriaceae, продуцирующих бета-лактамазы расширенного спектра действия (ESBLs) семейств TEM, SHV или CTX-M, сериновые карбапенемазы (такие как KPC), металло-бета-лактамазы класса В или класса С (цефалоспориназы AmpC). Несмотря на возможное развитие перекрестной резистентности, некоторые штаммы, резистентные к другим цефалоспоринам, могут быть чувствительны к цефтаролину.
Чувствительность
Распространенность приобретенной резистентности к антибиотикам у определенных микроорганизмов может варьировать в зависимости от региона и времени. Рекомендуется учитывать локальные сведения о резистентности, особенно при лечении тяжелых инфекций. Если локальная резистентность такова, что эффективность препарата в отношении некоторых инфекций становится сомнительной, необходимо обратиться за консультацией к эксперту.
Чувствительность к цефтаролину должна определяться с помощью стандартных методов. Интерпретацию результатов следует проводить в соответствии с локальными руководствами.
|
|
|
Staphylococcus aureus* (метициллин-чувствительный и метициллин-резистентный) Streptococcus agalactiae* Группа Streptococcus anginosus (включает S. anginosus, S. intermedius и S. constellatus)* Streptococcus dysgalactiae* Streptococcus pneumoniae* Streptococcus pyogenes* |
|
Грамотрицательные микроорганизмы Haemophilus influenzae* Haemophilus parainfluenzae* |
|
Анаэробы Fusobacterium spp. Peptostreptococcus spp. Prevotella spp. Propionibacterium acnes |
|
Микроорганизмы, для которых актуальна проблема приобретенной резистентности
|
|
Citrobacter freundii Citrobacter koseri Enterobacter aerogenes Enterobacter cloacae Escherichia coli* Klebsiella oxytoca* Klebsiella pneumoniae* Morganella morganii* |
|
Микроорганизмы, обладающие природной резистентностью |
|
Chlamydophila spp. Legionella spp. Mycoplasma spp. Pseudomonas aeruginosa Proteus spp. |
* возбудители, в отношении которых в клинических исследованиях была продемонстрирована удовлетворительная эффективность.
— осложненные инфекции кожи и мягких тканей, вызванные чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Staphylococcus aureus (включая метициллин-чувствительные и метициллин-резистентные штаммы), Streptococcus pyogenes, Streptococcus agalactiae, Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca и Morganella morganii;
— внебольничная пневмония, вызванная чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Streptococcus pneumoniae (включая случаи, сопровождающиеся бактериемией), Staphylococcus aureus (только метициллин-чувствительные штаммы), Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae, Klebsiella oxytoca и Escherichia coli
Зинфоро™ вводится внутривенно в виде инфузии в течение 60 минут (см. «Приготовление раствора для инфузий»).
Продолжительность терапии должна устанавливаться в зависимости от типа и тяжести инфекции, ответа пациента на терапию.
Рекомендуется следующий режим дозирования:
|
|
|
|
|
|
|
Осложненные инфекции кожи и мягких тканей |
600 мг |
каждые 12 часов |
60 минут |
5-14 дней |
|
Внебольничная пневмония |
600 мг |
каждые 12 часов |
60 минут |
5-7 дней |
Применение у особых групп пациентов
Почечная недостаточность
У пациентов с тяжелой почечной недостаточностью (КК ≤ 30) или терминальной стадией почечной недостаточности применение препарата противопоказано.
Если клиренс креатинина составляет 30 < КК ≤ 50 мл/мин, доза должна быть скорректирована следующим образом:
|
Клиренс креатинина
|
|
|
|
|
30 < КК ≤ 50 |
400 мг |
каждые 12 часов |
60 минут |
Печеночная недостаточность
Нет необходимости корректировать дозу препарата у пациентов с печеночной недостаточностью.
Пожилые пациенты (≥ 65 лет)
Нет необходимости корректировать дозу препарата у пожилых пациентов с КК > 50 мл/мин.
Дети
Безопасность и эффективность препарата Зинфоро™ у детей в возрасте до 18 лет не установлены.
Приготовление раствора для инфузий
При приготовлении и введении препарата необходимо соблюдать стандартные правила асептики. Каждый флакон предназначен только для однократного применения.
Зинфоро™ порошок для приготовления концентрата для приготовления раствора для инфузий следует растворить в 20 мл стерильной воды для инъекций. Один мл концентрата содержит 30 мг цефтаролина фосамила. Полученный концентрат необходимо немедленно использовать, не хранить (время от начала растворения порошка до полного приготовления раствора для внутривенных инфузий не должно превышать 30 минут).
Для приготовления раствора для инфузий полученный концентрат встряхивают и переносят в инфузионный флакон, содержащий одну из перечисленных ниже совместимых инфузионных жидкостей:
· раствор натрия хлорида 9 мг/мл (0,9%) для инъекций,
· раствор декстрозы 50 мг/мл (5%) для инъекций,
· раствор натрия хлорида 4,5 мг/мл и раствор декстрозы 25 мг/мл для инъекций (0,45% раствор натрия хлорида и 2,5% раствор декстрозы),
· раствор Рингера лактата.
При применении дозы препарата 600 мг во флакон с совместимой инфузионной жидкостью переносят весь полученный концентрат (20 мл), при применении дозы 400 мг – 14 мл концентрата.
Раствор для инфузий можно приготовить путем добавления концентрата во флакон с инфузионной жидкостью объемом 50 мл, 100 мл или 250 мл.
После приготовления раствора для инфузий, его следует использовать в течение 6 часов с момента приготовления. Приготовленный раствор для инфузий сохраняет стабильность в течение 24 часов при хранении в холодильнике (2-8°С). После извлечения из холодильника раствор для инфузий необходимо использовать в течение 6 часов при комнатной температуре.
Неиспользованный препарат или отходы необходимо утилизировать в соответствии с местными требованиями.
Ниже представлены нежелательные реакции, отмечавшиеся в объединенных клинических исследованиях фазы 3 по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония (1305 взрослых пациентов в группе терапии Зинфоро™). Частота нежелательных реакций представлена в виде следующей градации: очень часто (≥ 1/10), часто (≥ 1/100,< 1/10), нечасто (≥ 1/1000, < 1/100), редко (≥ 1/10000,< 1/1000).
Очень часто
— положительная прямая проба Кумбса
Часто
— диарея
— тошнота
— рвота
— боль в животе
— запор
— головная боль
— головокружение
— сыпь
— зуд
— повышение активности трансаминаз
— флебит
— брадикардия
— гипергликемия
— гипокалиемия
— лихорадка
Нечасто
— удлинение протромбинового времени (ПТВ), увеличение международного нормализованного отношения (МНО)
— судороги
— крапивница
— реакции в месте инфузий
— анемия
— тромбоцитопения
— гиперчувствительность
— колит, вызванный Clostridium difficile1
— нарушение функции почек (повышение концентрации креатинина крови)
Редко
— анафилактическая реакция, ангионевротический отек
— повышенная чувствительность к цефтаролина фосамилу или L-аргинину
— повышенная чувствительность к любому антибактериальному средству, имеющему бета-лактамную структуру (например, цефалоспоринам, пенициллинам или карбапенемам)
— тяжелая почечная недостаточность (клиренс креатинина (КК) ≤ 30 мл/мин) или терминальная стадия почечной недостаточности
— детский возраст до 18 лет
С осторожностью: судорожный синдром в анамнезе
Клинические исследования по изучению лекарственного взаимодействия с цефтаролином не проводились.
В исследованиях in vitro цефтаролин не ингибировал изоферменты цитохрома P450 CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4 и не индуцировал изоферменты CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, или CYP3A4/5. В связи с этим вероятность взаимодействия цефтаролина с препаратами, которые метаболизируются под действием изоферментов системы цитохрома Р450, низка. Цефтаролин не метаболизируется под действием изоферментов цитохрома P450 in vitro, поэтому, маловероятно влияние на параметры фармакокинетики цефтаролина при совместном применении с индукторами или ингибиторами изоферментов цитохрома P450.
In vitro цефтаролин не переносится эффлюксными транспортерами P‑gp или BCRP. Цефтаролин не ингибирует P‑gp, следовательно, взаимодействие с субстратами, такими как дигоксин, не ожидается. Цефтаролин является слабым ингибитором BCRP, но данный эффект не имееет клинической значимости. Исследования in vitro показали, что цефтаролин не является субстратом, и не ингибировал транспортеры органических катионов (OCT2) и анионов (OAT1, OAT3) в почках; поэтому, маловероятно взаимодействие с препаратами, которые ингибируют активную почечную секрецию (например, пробенецид) или с препаратами, которые являются субстратами этих транспортеров.
Взаимодействие с другими антибактериальными препаратами
Тесты in vitro не выявили антагонизма при совместном применении цефтаролина и других часто используемых антибактериальных препаратов (например, амикацина, азитромицина, азтреонама, даптомицина, левофлоксацина, линезолида, меропенема, тигециклина и ванкомицина).
При применении препарата необходимо руководствоваться официальными рекомендациями по надлежащему использованию антибактериальных препаратов.
Реакции гиперчувствительности
Как и при применении всех бета-лактамных антибиотиков возможно развитие серьёзных реакций гиперчувствительности (иногда с летальным исходом).
У пациентов с гиперчувствительностью к цефалоспоринам, пенициллинам или другим бета-лактамным антибиотикам в анамнезе, может также развиться аллергическая реакция к цефтаролину. Перед началом терапии препаратом Зинфоро™ следует провести тщательное обследование пациента на предмет выявления реакций гиперчувствительности к бета-лактамным антибиотикам.
При развитии тяжелой аллергической реакции необходимо прекратить введение лекарственного препарата и принять соответствующие меры.
Диарея, ассоциированная с Clostridium difficile
При применении почти всех антибактериальных препаратов, в том числе препарата Зинфоро™, сообщалось о развитии антибиотикоассоциированного колита и псевдомембранозного колита, которые могут варьировать по тяжести от легких до угрожающих жизни форм. Следует принимать во внимание возможность развития колита при возникновении диареи на фоне применения цефтаролина фосамила. В этом случае необходимо прекратить терапию препаратом Зинфоро™, проводить поддерживающие мероприятия и назначить специфическое лечение Clostridium difficile.
Пациенты с судорожным синдромом в анамнезе
Как и при применении других цефалоспоринов, в исследованиях токсичности цефтаролина наблюдалось развитие судорог при приеме препарата в дозах, превышающих Смах в 7-25 раз. Опыт применения цефтаролина у пациентов с судорожным синдромом в анамнезе ограничен, в связи с чем следует соблюдать осторожность при применении препарата Зинфоро™ у этой группы пациентов.
Почечная недостаточность
Опыт применения цефтаролина у пациентов с тяжелой почечной недостаточностью и терминальной стадией почечной недостаточности ограничен. Поэтому применение препарата Зинфоро™ у этой популяции больных противопоказано.
Прямой антиглобулиновый тест (проба Кумбса)
Положительный прямой антиглобулиновый тест (ПАТ) может быть получен на фоне применения цефалоспоринов. Частота положительного ПАТ у пациентов, получавших цефтаролин, составила 10,7% в объединенных исследованиях фазы 3. Ни у одного пациента с положительным ПАТ на фоне применения цефтаролина не выявлены признаки гемолиза.
Беременность и лактация
Клинические данные о применении цефтаролина у беременных женщин отсутсвуют или ограничены. Исследования на животных не выявили неблагоприятного воздействия цефтаролина фосамила на фертильность, беременность, роды или послеродовое развитие. Препарат Зинфоро™ не следует применять во время беременности, за исключением случаев, когда потенциальная польза для матери превышает возможный риск для плода.
Данные о проникновении цефтаролина в грудное молоко отсутствуют. Однако, в связи с тем, что многие бета-лактамные антибиотики выделяются с грудным молоком, в случае необходимости терапии препаратом Зинфоро™, рекомендуется прекращение грудного вскармливания.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Не проводилось исследований по изучению влияния препарата Зинфоро™ на способность к вождению автотранспорта и управлению иными механизмами. Следует соблюдать осторожность при управлении транспортным средством или потенциально опасными механизмами учитывая развитие возможных побочных эффектов.
Данные о передозировке ограничены. Вероятность передозировки выше у пациентов с нарушением функции почек. При применении препарата в дозах выше рекомендованных наблюдались схожие нежелательные реакции, как и при применении препарата в рекомендованных дозах.
Лечение: поддерживающее и симптоматическое.
Цефтаролин частично выводится с помощью гемодиализа.
Препарат помещают во флаконы из бесцветного стекла вместимостью 20 мл, укупоренные пробками резиновыми серого цвета и обжатые алюминиевыми колпачками с пластмассовыми крышками белого цвета.
По 1 флакону или 10 флаконов вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку картонную.
Хранить при температуре не выше 30°С.
Хранить в местах недоступных для детей!
2 года
Не применять по истечении срока годности, указанного на упаковке.
Факта Фармачеутичи С.п.А., Италия, Терамо
действующее вещество: ceftaroline fosamil;
один флакон содержит 668,4 мг цефтаролину фосамилу моноацетату моногидрата, что соответствует 600 мг цефтаролину фосамилу;
вспомогательные вещества: L-аргинин.
Порошок для приготовления концентрата для приготовления раствора для инфузий.
Антибактериальные препараты для системного применения. Другие цефалоспорины. Цефтаролину фосамил. Код АТС J01D I02.
Лечение следующих инфекций у взрослых
- осложненные инфекции кожи и мягких тканей;
- внебольничная пневмония.
Повышенная чувствительность к активному веществу или к любому из вспомогательных веществ препарата.
Повышенная чувствительность к антибактериальным препаратам цефалоспоринового ряда.
Повышенная чувствительность немедленного типа и тяжелой степени (например, анафилактическая реакция) к любому другому виду бета-лактамного антибактериального препарата (например пенициллинам или карбапенемов).
В случае лечения осложненных инфекций кожи и мягких тканей и внебольничной пневмонии у пациентов в возрасте 18 лет или старше рекомендуемая доза составляет 600 мг, которую вводят каждые 12:00 путем внутривенной инфузии продолжительностью 60 минут. Рекомендуемая продолжительность лечения осложненных инфекций кожи и мягких тканей составляет от 5 до 14 дней, а внебольничной пневмонии от 5 до 7 дней.
особые популяции
Пациенты с нарушением функции почек
Корректировка дозы препарата необходимо для пациентов с клиренсом креатинина (КК) ≤ 50 мл / мин, как показано ниже.
Таблица 1.
Дозировка препарата Зинфоро для пациентов с нарушенной функцией почек
|
КК (мл / мин) |
режим дозирования |
частота |
|
Вид> 30 до ≤50 |
400 мг (в течение 1:00) |
Каждые 12:00 |
Имеющиеся данные недостаточны для того, чтобы дать конкретные рекомендации по коррекции дозы для пациентов с тяжелой почечной недостаточностью (клиренс креатинина ≤30 мл / мин) и с терминальной стадией почечной болезни, включая пациентов, находящихся на гемодиализе.
Пациенты с нарушением функции печени
Нет необходимости в коррекции дозы для пациентов с нарушениями функции печени.
Пациенты пожилого возраста (≥ 65 лет)
Нет необходимости в коррекции дозы для пациентов пожилого возраста с уровнем клиренса
креатинина> 50 мл / мин.
метод применения
Раствор Зинфоро вводят внутривенно капельно в течение 1:00.
Зинфоро, порошок, нужно разводить водой для инъекций. Приготовленный концентрат нужно разводить непосредственно перед проведением инфузии.
Готовый раствор представляет собой прозрачную жидкость бледно-желтого цвета, свободную от любых частиц.
Для приготовления и введения инфузионного раствора нужно выполнять стандартные процедуры асептики.
Зинфоро, порошок, нужно растворить 20 мл стерильной воды для инъекций. Полученный раствор необходимо встряхнуть перед переносом его в мешок или бутылки для внутривенного введения препарата, содержащие или натрия хлорид 9 мг / мл (0,9%) раствор для инъекций, декстрозу 50 мг / мл (5%) раствор для ‘ инъекций, натрия хлорид 4,5 мг / мл и декстрозу 25 мг / мл раствор для инъекций (0,45% натрия хлорид и 2,5% декстроза), или раствор Рингера с лактатом. Общий интервал времени между началом приготовления препарата и завершением подготовки к инфузии не должен превышать 30 минут.
1 флакон предназначен только для одноразового использования.
1 мл восстановленного раствора содержит 30 мг цефтаролину фосамилу.
Любые остатки неиспользованного препарата продукт или отходы утилизировать в соответствии с местными требованиями.
В четырех базовых клинических исследованиях 1305 взрослых пациентов получали лечение препаратом Зинфоро (препарат в дозе 600 мг вводили в течение 1:00 каждые 12:00).
Резюме профиля безопасности
Наиболее частыми нежелательными реакциями, которые развились в ≥ 3% пациентов, получавших лечение препаратом Зинфоро, были диарея, головная боль, тошнота, зуд.
Как правило, эти нежелательные реакции были легкой и средней степени тяжести.
Во время клинических исследований с применением Зинфоро были определены нижеследующие нежелательные реакции. Нежелательные реакции классифицируют в зависимости от класса системы органов и частоты. Категории частоты определяют согласно следующим правилам: очень часто (≥1 / 10), часто (от ≥1 / 100 до <1/10), нечасто (от ≥1 / 1000 до <1/100), редко (от 1 / 10000 до <1/1000).
Таблица 1.
Частота нежелательных реакций по классам системы органов
|
Системы органов |
очень часто |
часто |
нечасто |
|
Инфекции и инвазии |
Колит, вызванный Clostridium difficile |
||
|
Со стороны крови и лимфатической системы |
Анемия, лейкопения, тромбоцитопения, удлиненный протромбиновое время (ПВ), удлиненный активированное частичное тромбопластиновое время (АЧТВ), увеличенное международное нормализованное отношение (МНО) |
||
|
Со стороны иммунной системы |
Сыпь, зуд |
Анафилаксия, повышенная чувствительность (например крапивница, отек губ и лица) |
|
|
Со стороны нервной системы |
Головная боль, головокружение |
||
|
Со стороны сосудов |
флебит |
||
|
Со стороны желудочно-кишечного тракта |
Диарея, тошнота, рвота, боль в животе |
||
|
Со стороны печени и желчевыводящих путей |
Повышенный уровень трансаминаз |
||
|
Со стороны почек и мочевыводящих путей |
Повышенный уровень креатинина крови |
||
|
Общие нарушения и реакции в месте введения препарата |
Лихорадка, реакции в месте инъекций (эритема, флебит, боль) |
||
|
Данные, полученные в результате лабораторных и инструментальных исследований |
Положительный результат прямого теста Кумбса |
Ограниченные данные, полученные с участием пациентов, которым применяли более высокие, чем рекомендовано, дозы Зинфоро, указывают на появление нежелательных реакций, как и у пациентов, аналогичных таким, которые получают рекомендуемые дозы препарата. Относительная передозировка препаратом может возникнуть у пациентов с умеренным нарушением функции почек. При лечении случаев передозировки необходимо проводить симптоматическую терапию.
Цефтаролин выводится из организма путем гемодиализа; 21,6% дозы было выведено из организма путем гемодиализа продолжительностью 4:00.
беременность
Данные по применению цефтаролину беременным женщинам отсутствуют или ограничены.
В качестве меры пресечения желательно избегать применения препарата Зинфоро во время беременности, кроме случаев, когда клиническое состояние женщины требует лечения антибиотиками, имеют профиль антибактериального действия Зинфоро.
кормление грудью
Неизвестно, выводится цефтаролину фосамил в грудное молоко. Для женщины, которая кормит ребенка грудью, при назначении лечения следует принять решение о необходимости прекращения кормления грудью или прекращении / удержание от терапии препаратом Зинфоро, учитывая пользу от лечения.
фертильность
Влияние цефтаролину на фертильность у людей не изучен.
Безопасность и эффективность применения препарата Зинфоро детям (<18 лет) не установлены.
Реакции повышенной чувствительности
Как и для всех других бета-лактамных антибактериальных препаратов, для препарата является возможное развитие серьезных, а иногда и летальных реакций повышенной чувствительности (анафилактические реакции).
Пациенты, у которых в истории болезни отмечается повышенная чувствительность к цефалоспоринам, пенициллинам или другим бета-лактамным препаратов, могут иметь повышенную чувствительность к цефтаролину фосамилу. Цефтаролину фосамил не следует применять, если у пациента ранее наблюдались реакции повышенной чувствительности тяжелой степени и немедленного типа (например анафилактические реакции) к любому другому виду бета-лактамным антибактериальным препаратам.
Зинфоро следует применять с осторожностью у пациентов, у которых в истории болезни отмечается любой другой вид реакции повышенной чувствительности к пенициллинам или карбапенемов.
При возникновении острой реакции повышенной чувствительности тяжелой степени необходимо немедленно прекратить применение лекарственного средства и срочно начать соответствующее лечение.
Диарея, вызванная Clostridium difficile
Случаи диареи, вызванной Clostridium difficile, с тяжестью состояния, которое может варьировать от диареи легкой степени до опасного для жизни псевдомембранозного колита, были зарегистрированы при применении цефтаролину. Поэтому у всех пациентов, у которых диарея возникает во время или после применения цефтаролину фосамилу, важно рассмотреть возможность развития диареи, вызванной Clostridium difficile . Если этот диагноз подозревается или подтверждается, лечение цефтаролином необходимо прекратить. По клиническим показаниям необходимо начать соответствующее лечение и назначить специфическую терапию антибактериальными препаратами, направленную против C. difficile .
устойчивые микроорганизмы
Как и в случае с другими антибактериальными препаратами, во время приема данного препарата возможно повторное инфицирование организма человека.
Пациенты с уже существующей эпилепсией
В ходе исследований токсикологии цефтаролину фосамилу были случаи судом при применении препарата в концентрациях, в 7-25 раз превышали уровни С max препарата у человека. Опыт клинических исследований влияния цефтаролину фосамилу на пациентов с уже существующей эпилепсией очень ограничен. Таким образом, цефтаролину фосамил необходимо применять с осторожностью этой группе пациентов.
Нарушение функции почек
Данные, которые существуют, недостаточны для того, чтобы дать конкретные рекомендации по коррекции дозы
препарата для пациентов с тяжелым нарушением функции почек (клиренс креатинина ≤30 мл / мин.) и с терминальной стадией почечной болезни, включая пациентов, находящихся на гемодиализе. Таким образом, применять Зинфоро в этой группе пациентов не рекомендуется.
Сероконверсия прямого антиглобулиновая теста (теста Кумбса) и потенциальный риск развития гемолитической анемии
Во время лечения цефалоспоринами возможно развитие положительного прямого антиглобулиновая теста. Частота случаев сероконверсии прямого антиглобулиновая теста у пациентов, получающих цефтаролин фосамил, в ходе объединенных базовых исследований составляла 10,7%. В ходе проведения клинических исследований не было найдено никаких доказательств гемолиза у пациентов, у которых в результате лечения развился положительный прямой антиглобулиновая тест. Однако нельзя исключить вероятность развития гемолитической анемии в результате применения цефалоспоринов, включая лечения Зинфоро. Пациентов, у которых во время или после лечения Зинфоро развилась анемия, следует обследовать относительно этой возможности.
Ограничения клинических данных
Опыт лечения цефтаролином внебольничной пневмонии отсутствует в таких группах пациентов: с ослабленным иммунитетом, с тяжелым сепсисом / септическим шоком, тяжелым основным заболеванием легких, с риском шкалы PORT (Pneumonia Outcomes research Team) класса V и / или негоспитальной пневмонией, при проявлении требует проведения вентиляции, с негоспитальной пневмонией из-за появления метициллин-резистентного S. аureus или у пациентов, нуждающихся в проведении интенсивной терапии. При лечении таких пациентов рекомендуется соблюдать осторожность.
Опыт лечения цефтаролином осложненных инфекций кожи и мягких тканей отсутствует в таких группах пациентов: с ослабленным иммунитетом, с тяжелым сепсисом / септическим шоком, некротизирующим фасцитом, периректальные абсцессом и у пациентов с ожогами третьей степени и обширными ожогами. Опыт лечения пациентов с инфекциями диабетической стопы ограничен. При лечении таких пациентов рекомендуется соблюдать осторожность.
Никаких исследований о влиянии цефтаролину на способность управлять транспортными средствами или работать с механизмами не проводилось. При применении препарата может возникнуть головокружение, что может повлиять на способность управлять транспортными средствами или работать с другими механизмами.
Клинические исследования лекарственного взаимодействия с цефтаролином фосамилом не проводились.
Потенциал взаимодействия цефтаролину или цефтаролину фосамилу с лекарственными средствами, которые метаболизируются при участии ферментов Р450, как ожидается, будет низкий, поскольку они не являются ингибиторами или индукторами ферментов Р450 в условиях in vitro . Ферменты 450 не участвуют в метаболизме цефтаролину или цефтаролину фосамилу в условиях in vitro, поэтому одновременное применение с индукторами или ингибиторами ферментов Р450 вряд ли влиять на фармакокинетику цефтаролину.
Цефтаролин не является ни субстратом, ни ингибитором переносчиков, осуществляющих обратный захват в почках (OCT2, OAT1 и OAT3) в условиях in vitro. Таким образом, взаимодействия цефтаролину с лекарственными средствами, являются субстратами или ингибиторами (например с пробенецидом) этих переносчиков, вероятно, не ожидается.
Взаимодействие с другими противомикробными препаратами
Исследования в условиях иn vitro не выявили какого-либо антагонизма между цефтаролином в сочетании с другими широко применяемыми антибактериальными препаратами (например амикацином, азитромицином, азтреонамом, даптомицином, левофлоксацином, линезолидом, меропенемом, тигециклином и ванкомицин).
Фармакологические.
Активный компонент препарата Зинфоро — цефтаролин.
Исследования в условиях in vitro показали, что цефтаролину свойственны бактерицидное действие и способность ингибирования синтеза стенки бактериальных клеток в метициллин-резистентного Staphylococcus aureus и пеницилиннечутливого Streptococcus pneumoniae благодаря их родства с измененными пенициллинсвязывающими белками, найденными в этих микроорганизмах. В результате минимальные ингибирующие концентрации (МИК) цефтаролину против доли этих исследованных микроорганизмов попадают в диапазон чувствительности (см. Раздел «Резистентность»).
резистентность
Цефтаролин не проявляет активности против штаммов Enterobacteriaceae , продуцирующие бета-лактамазы расширенного спектра действия, относящихся к группам ферментов TEM, SHV или CTX-M, серин-карбапенемаз (такие как КРС), металло-бета-лактамаз класса или цефалоспориназ класса (AmpC). Микроорганизмы, экспрессирующих эти ферменты и, таким образом, резистентных к цефтаролину, наблюдаются с очень вариабельной частотой как в разных странах, да и в медицинских учреждениях внутри одной страны. Если лечение цефтаролином начинают до получения результатов чувствительности, то следует принять во внимание местную информацию относительно риска обнаружения микроорганизмов, которые экспрессируют эти ферменты. Резистентность может также быть опосредована механизмом непроницаемости клеточной стенки бактерий или ефлюксним механизмом резистентности к препарату. Один или несколько из этих механизмов может сосуществовать в одной бактерии.
Определение предельных значений чувствительности микроорганизмов
Предельные значения чувствительности микроорганизмов по данным Европейского комитета по тестированию противомикробной чувствительности (EUCAST) представлены ниже.
|
микроорганизмы |
Предельные значения для МИК (мг / л) |
|
|
Чувствительный (≤S) |
Устойчивый (R>) |
|
|
Staphylococcus aureus |
1 |
1 |
|
Streptococcus pneumoniae |
0,25 |
0,25 |
|
Streptococcus , группы А, В, С, G |
примечание 1 |
примечание 1 |
|
Haemophilus influenzae |
0,03 |
0,03 |
|
Enterobacteriaceae |
0,5 |
0,5 |
|
Предельные значения для других видов микроорганизмов, о которых упоминается выше 2 |
0,5 |
0,5 |
Примечания:
1 Ожидаемая чувствительность микроорганизмов, исходя из данных о чувствительности микроорганизмов к пенициллину.
2 На основании заданной ФК / ФД для грамотрицательных микроорганизмов.
Связь ФК / ФД
Как и для других бета-лактамных противомикробных лекарственных средств, было показано, что процентный время, выше МПК (МИК) инфицирующего микроорганизма в течение интервала дозирования (% Т> МИК), является параметром, который наилучшим образом коррелирует с эффективностью цефтаролину.
Клиническая эффективность против конкретных патогенных микроорганизмов
В ходе клинических исследований было продемонстрировано эффективность применения препарата против патогенных, указанных в соответствии с каждого показания, микроорганизмов, которые были чувствительны к цефтаролину в условиях in vitro .
Осложненные инфекции кожи и мягких тканей
Грамположительные микроорганизмы:
- Staphylococcus aureus (включая метициллин штаммы)
- Streptococcus pyogenes;
- Streptococcus agalactiae;
- группа Streptococcus anginosus (включая S. anginosus , S. intermedius и S. constellatus )
- Streptococcus dysgalactiae;
Грамотрицательные микроорганизмы:
- Escherichia coli;
- Klebsiella pneumonia;
- Klebsiella oxytoca;
- Morganella morganii.
внебольничная пневмония
В ходе проведения исследований ни одного случая внебольничной пневмонии через метициллин-резистентный Staphylococcus aureus зарегистрировано не было.
Имеющиеся клинические данные не могут обосновать эффективность применения препарата против пенициллин-нечувствительных штаммов S. pneumoniae .
Грам-положительные микроорганизмы:
- Streptococcus pneumoniae;
- Staphylococcus aureus (только метицилинчутливи штаммы).
Грамотрицательные микроорганизмы:
- Escherichia coli;
- Haemophilus influenza;
- Haemophilus parainfluenzae;
- Klebsiella pneumoniae.
Антибактериальная активность против других соответствующих патогенных микроорганизмов
Клиническая эффективность в отношении нижеперечисленных патогенных микроорганизмов не была установлена, хотя исследования в условиях in vitro указывают на то, что эти микроорганизмы могут быть чувствительными к препарату цефтаролину при отсутствии приобретенных механизмов резистентности.
анаэробные микроорганизмы
грамположительные микроорганизмы:
- Peptostreptococcus spp.
грамотрицательные микроорганизмы:
- Fusobacterium spp.
Данные, полученные в условиях in vitro , указывают на то, что такие виды микроорганизмов нечувствительны к действию цефтаролину:
- Chlamydophila spp .;
- Legionella spp .;
- Mycoplasma spp .;
- Proteus spp .;
- Pseudomonas aeruginosa.
Фармакокинетика
C max и AUC цефтаролину увеличиваются примерно пропорционально дозе в пределах диапазона разовой дозы от 50 до 1000 мг. У здоровых взрослых людей с нормальной функцией почек после многократных внутривенных инфузий препарата в дозе 600 мг, вводимых в течение 60 минут каждые 12:00 до 14 дней, заметного накопления цефтаролину не наблюдалось.
распределение
Связывание цефтаролину с белками плазмы крови низкое (около 20%), и цефтаролин не разделяется в эритроцитах. Средний равновесный объем распределения цефтаролину, подобный объема внеклеточной жидкости в организме, у здоровых мужчин после введения однократной дозы 600 мг радиоактивно меченого цефтаролину фосамилу составлял 20,3 л.
Метаболизм
Цефтаролину фосамил (предшественник) превращается в активный цефтаролин в плазме крови при участии ферментов фосфатазы; концентрации предшественника определяются в плазме крови, главным образом, во время инфузии. Гидролиз бета-лактамного кольца цефтаролину происходит в метаболита с открытым кольцом, который является микробиологически неактивным, цефтаролину М-1. Среднее значение соотношения AUC цефтаролину М-1 в цефтаролину в плазме крови после однократной инфузии цефтаролину фосамилу в дозе 600 мг у здоровых добровольцев составляет примерно 20-30%.
В пуле микросом печени человека метаболический обмен цефтаролину был низким, указывая на то, что цефтаролин не метаболизируется печеночными ферментами цитохрома Р450.
вывод
Цефтаролин, в первую очередь выводится почками. Почечный клиренс цефтаролину примерно переносчиков препарата, проведенные в условиях in vitro, показывают, что активная секреция не способствует выведению цефтаролину почками.
Среднее значение окончательного периода полувыведения цефтаролину у здоровых взрослых составляет примерно 2,5 часа.
После введения разовой дозы 600 мг радиоактивно меченого цефтаролину фосамилу у здоровых взрослых мужчин около 88% радиоактивности было обнаружено в моче и 6% в кале.
порошок от бледно желтовато-белого до светло-желтого цвета.
Это лекарственное средство не следует смешивать с другими лекарственными средствами, за исключением указанных в разделе «Способ применения и дозы».
2 года. После приготовления флакон с восстановленным раствором следует использовать немедленно.
Хранить в недоступном для детей месте. Хранить при температуре не выше 30 °С.
Хранить в оригинальной упаковке для защиты от света.
Если раствор для внутривенного введения готовится с рекомендованными растворителями, его следует использовать в течение 6:00 после приготовления. Химическая и физическая стабильность препарата после вскрытия упаковки сохраняется в течение 24 часов при температуре от 2 до 8 в С.
После извлечения из холодильника в случае хранения при комнатной температуре разведенный препарат нужно использовать в течение 6:00.
С микробиологической точки зрения препарат должен следует использовать немедленно. Если препарат не используется немедленно, срока и условий хранения препарата после вскрытия упаковки соответствует пользователь. Как правило, время не должно превышать 24 часа, а температура 2 — 8 в С при условии, что восстановление/разведения препарата были выполнены в контролируемых и валидизированных асептических условиях.
Порошок помещают в одноразовый стеклянный флакон (Тип 1), емкостью 20 мл, закрытом резиновой пробкой и алюминиевым колпачком системы flip-off.
По 10 флаконов в картонной коробке.
Факта Фармасеутичи С.П.А., Италия